|
Copyright (c) Vladimir DARIC
Permission is granted to copy, distribute and/or modify this
document under the terms of the GNU Free Documentation License, Version 1.2 or
any later version published by the Free Software Foundation;
with no Invariant Sections, no Front-Cover Texts, and no
Back-Cover Texts. A copy of the license is included in the section entitled
"GNU
Free Documentation License".

UNIVERSITE PARIS VII
DEPARTEMENT DES SCIENCES DE LA NATURE ET DE LA
VIE
Tour 24-34, 2éme
étage
STAGE: Initiation à la recherche
BC 169 - BC 269
Daric Vladimir
Mise en évidence d'échangeurs
Cl-/HCO3- dans la branche large ascen-
dante médullaire du rein chez le rat
Soutenu : 03/1998
Stage effectué à l'Institut des Cordeliers,
Laboratoire de physiologie et endo-
crinologie cellulaire et
moléculaire rénale, INSERM U356
Dire cteur:
Profe sseur Michel PAILLARD
Responsable de stage:
Professeur Pascal HOUILLIER Dr Anne BLANCHARD
SOMMAIRE
|
L e rein
|
.4
|
|
Structure et fonctions
|
.4
|
|
Glomérule
|
.6
|
|
Tubule rénal
|
7
|
|
Tubule proximal
|
.7
|
|
Tubule intermédiaire
|
7
|
|
Anse de Henle
|
7
|
|
Tubule distal
|
.8
|
|
Tubule contourné distal
|
.9
|
|
Tubule connecteur et collecteur initial.
|
.9
|
|
Canaux collecteurs
|
10
|
|
Canal collecteur cortical
|
10
|
|
Canal collecteur médullaire externe
|
10
|
|
Canal collecteur médullaire interne
|
11
|
|
Le système à contre-courant.
|
.11
|
L a branche large ascendante, mécanismes des
transports ioniques.....12
|
Introduction
|
.12
|
|
La microperfusion in vitro
|
.13
|
|
Résumé
|
.13
|
|
Les avantages et les limites de la méthode.
|
14
|
|
Le matériel et méthodes
|
14
|
|
Protocole
|
16
|
|
Résultats
|
.18
|
|
Discussion
|
.20
|
Mise en évidence et caractérisation
d'échangeurs Cl-/HCO3- sur les vésicules
|
des membranes plasmiques luminales et
basolatérales.
|
.21
|
|
Résumé
|
.21
|
|
Les avantages et les limites de la méthode
|
.21
|
|
Méthode
|
.22
|
|
Les mesures des transports ioniques
|
.22
|
|
La filtration rapide
|
.23
|
|
Résultats
|
.23
|
|
Interpretation des résultats
|
.24
|
Le rein
Structure et fonctions
Le rôle du rein est de maintenir stable la composition
du milieu intérieur. On pourrait même dire que la composition de
ce milieu n'est pas déterminée par ce qu'on mange mais par ce que
le rein retient et élimine. En filtrant le sang pour le libérer
des produits du métabolisme tout en empêchant une trop grande
fuite d'eau et d'ions de l'organisme, le rein joue un rôle très
important dans le système de régulation de la composition du
milieu intérieur. Il assure, donc, de bonnes conditions pour le
fonctionnement des autres organes.
Les reins sont entourés d'une fine capsule protectrice
fibreuse. Leur forme rappelle celle d'un haricot. Sur la coupe transversale du
rein on distingue trois zones: à l'extérieur le cortex
qui entoure la médullaire de laquelle se
dégage le calice regroupant l'ensemble des tubes
collecteurs par lesquels s'écoule l'urine définitive.
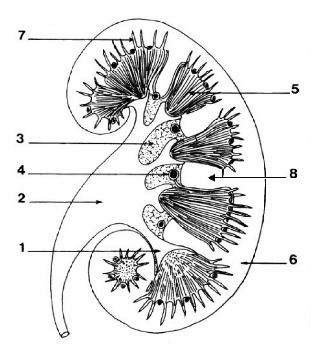
Figure 1: Coupe transversale d'un rein.
1, calice
2, bassinet
3, graisse du sinus
4, artère intralobulaire
5, pyramide de Malphigi
6, cortex
7, rayon médullaire
8, colonne de Bertin
La majorité des études a été faite
sur des reins animaux, plus faciles à obtenir donc mieux connus. Le rein
humain a une médullaire composé de 4 à 18 cônes ou
pyramides de Malphigi tandis que le rein du rat correspondrait
à un rein formé par une seule pyramide de Malphigi et par le
cortex qui l'entoure; le rein de ce type est dit unipapillaire. Du
pourtour des pyramides vers la périphérie du cortex qui les
entoure s'étendent les rayons médullaires. Le parenchyme
cortical situé entre les rayons médullaires forme le
labyrinthe.
Le rein humain est composé d'environ 1 300 000
unités fonctionnelles, ou néphrons. Les néphrons
sont enrobés de tissu interstitiel où cheminent vaisseaux et
nerfs. Chaque néphron est com-
posé d'un glomérule et d'un tubule qui lui fait
suite. Le tubule urinifère comporte chez les
mammifères au moins 12 segments successifs différents
morphologiquement et fonctionnellement: Partie proximale qui
comprend le tubule proximal avec ces trois segments ( S1,S2,S3 ).
Partie intermédiaire comprend la
branche fine descendante et la branche fine ascendante de l'anse de Henle.
Partie distale comprend la branche large
ascendante médullaire et corticale de l'anse de Henle, le tubule
contourné distal et les canaux collecteurs ( avec successivement le
tubule connecteur, le canal collecteur cortical, le canal collecteur
médullaire externe et le canal collecteur médullaire interne
).
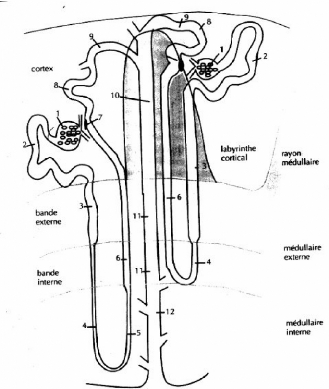

Figure 2. Répartition et segmentation de deux
types de néphrons: superficiel ou cortical à anse de Henle
courte, profond ou juxtamédullaire à anse de Henle
longue.
1, Glomérule
2, tube contourné proximal
3, tube droit proximal
4, branche descendante fine
5, branche ascendante fine
6, branche large ascendante
7, macula densa
8, tube contourné distal
9, tube connecteur et collecteur initial
10, canal collecteur cortical
11, canal collecteur médullaire externe
12, canal collecteur médullaire interne
De plus les néphrons se repartissent en trois groupes
en fonction de l'emplacement de leur glomérule. On a donc des
néphrons superficiels, corticaux moyens et juxtamédullaires.
Cette classification se fait selon la position du glomérule et la
profondeur de l'anse de Henle. Il n'est pas moins vrai que cette classification
reste schématique car les néphrons quelle que soit la situation
de leur glomérule, peuvent avoir une anse de Henle courte ou longue.
Ces différents segments des néphrons occupent une
place particulière dans le lobe rénal.
Dans le labyrinthe on trouve les glomérules. Les tubes
contournés proximaux et distaux se trouvent autour et au-dessus du
glomérule dont ils sont issus.
Les rayons médullaires contiennent la partie initiale des
tubes droits proximaux, la partie terminale des tubes droits distaux des
néphrons superficiels et moyens et le canal collecteur cortical.
Les tubes droits proximaux et distaux des néphrons se
trouvent dans la couche externe médullaire.
La portion descendante des tubes intermédiaires, la partie
initiale des tubes droits distaux se trouvent dans la couche interne de la
médullaire externe.
La médullaire interne contient les tubes de Bellini (
canaux collecteurs ), la partie fine descendante et ascendantes tubes
intermédiaires des néphrons à anse longue.
Les canaux collecteurs traversent tout le lobe rénal. Dans
la zone des rayons médullaires le tube contourné distal se jette
dans un tube collecteur qui, traversant la medulla, rejoint la papille.
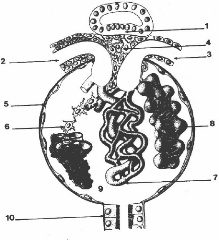
Glomérule
Le glomérule ( ou corpuscule rénal ) est une
sphère de diamètre de 150 à 250 um qui possède un
pôle vasculaire où pénètre l'artériole
afférente et sort l'artériole efférente, et un pôle
urinaire d'où sort le tube contourné proximal. Le
glomérule filtre le plasma sanguin. Le produit de cette filtration,
l'urine primitive contient peu de protéines car la
barrière glomerulaire est sélectivement imperméable aux
grosses molécules. Dans l'urine primitive la concentration en
molécules dont le poids est inférieur à 50 kDa1
et en ions est identique à celle du sang ( à l'équilibre
de Donnan près2 ) , elle ne contient de grandes
molécules ( >68 kDa ) qu'en quantités
infinitésimales.
Figure3: Disposition schématique du
glomérule rénal. 1, la macula densa 2,
l'artériole afférente 3, le
mésangium extraglomérulaire 4, la capsule de
Bowman
5, Trois lobules du flocculus sont
schématisées: 6, dans le lobule de gauche est
représenté le mésangium intraglomérulaire
7, le lobule du centre représente le trajet
des capillaires 8, lobule tel qu'il peut
être observé en
1 Dalton - 1/16 de la masse d'un atome d'oxygène, soit
envir 66 10-24g
microscopie à balayage, montrant la disposition des
2 Équilibre de Donnan: répartition inégale
des ions diffu de p t et d' t d'une m mb n rai d p és c
podocytes9, espace urinaire 10,
tube contourné proximal
d'une protéine chargée dans un des
compartiments.
Tubule rénal
Le tubule rénal fait suite au glomérule, son
rôle est de réabsorber la majeure partie de l'eau et des
substances dissoutes de manière adaptée au maintien de la
composition du milieu intérieur. Ainsi, l'urine primitive est
concentrée: un énorme gaspillage est évité.
Le glomérule filtre quelques 180 L d'eau par 24 h.
Seulement 1 à 2 L d'urine seront excrétées. Il en est de
même pour les 25 000 mmol de sodium dont plus de 99% seront
restituées à l'organisme.
Le tubule rénal doit aussi permettre
l'élimination des produits de dégradation du métabolisme
et éventuellement de substances étrangères à
l'organisme, par exemple, en limitant leur réabsorption.
Le tubule rénal est constitué d'une couche de
cellules épithéliales reposant sur une lame basale. Les
différences dans la structure correspondent à des
différences fonctionnelles des différents segments du tubule
rénal.
Tubule proximal
Le tubule proximal réabsorbe les substances dissoutes
ultrafiltrées par le glomérule ( électrolytes tels que
sodium, potassium, chlore, bicarbonate, phosphate, mais aussi substances
organiques telles que acides aminés, glucose, certains acides organiques
du cycle de Krebs, etc. ). Il réabsorbe, par les
phénomènes d'endocytose, les protéines qui ont
traversé la membrane glomérulaire en faible quantité.
Il doit également favoriser l'élimination de
produits de dégradation du métabolisme, en limitant leur
réabsorption tubulaire ou en les sécrétant.
Aussi le tubule proximal synthétise et secrète le
principal métabolite actif de la vitamine D la 1 ,25(OH2)D3
(3), ce qui constitue la fonction endocrine du tubule
proximal du rein.
Tubule intermédiaire Anse de
Henle
L'anse de Henle comporte trois segments: la branche fine
descendante, ascendante et la branche large ascendante. Les branches fines sont
situées dans la partie interne de la médullaire externe et dans
médullaire externe du rein.
Branche fine descendante
Les branches fines descendantes courtes de l'anse de Henle sont
constituées de cellules épithèliales plates reliées
entre elles par des jonctions serrées profondes. Ces
caractéristiques structu-
rales concordent avec les caractéristiques fonctionnelles
de la branche fine descendante des néphrons superficiels. Cet
épithélium est très perméable à l'eau et
relativement peu perméable aux
solutés. L'urine pourrait, en principe, y être
concentrée uniquement par la sortie d'eau dans la médullaire
externe hypertonique.
3 Erythropoïetine - hormone, joue un rôle dans la
maturation d'érythrocytes
Les branches fines descendantes des anses longues sont plus
complexes. On y distingue une partie supérieure situé dans la
médullaire externe et s'avançant plus ou moins
profondément dans la médullaire interne en fonction de la
longueur de l'anse et une partie inférieure, terminant la branche fine
descendante. De plus, d'importantes différences entre les espèces
ont été constatées:
- dans les espèces à haut pouvoir de
concentration de l'urine ( rat, hamster, souris ... ) les cellules
épithéliales sont hautes, riches en mitochondries et ont des
microvillosités apicales. Cet épithélium est très
perméable à l'eau et assez perméable aux cations ( sodium,
potassium, ammonium ). De cette façon il est probable que
l'équilibre osmotique entre le fluide tubulaire et l'interstitium
médullaire hypertonique se produise aussi bien par sortie d'eau que par
entrée des solutés.
- dans les espèces à faible pouvoir de
concentration ( lapin, singe et l'homme ) l'épithélium est plat
et peu différencié. La perméabilité à l'eau
y est assez élevée et les perméabilités aux
solutés sont faibles, comparables à celles des anses courtes.
Enfin, la partie inférieure des branches fines
descendantes des anses longues ont, quelque soit l'espèce, un
épithélium plat, la perméabilité à l'eau y
est forte et la perméabilité aux solutés y est faible (
sauf pour l'urée ).
Les résultats obtenus par la microponction directe de
la papille chez le rat montrent qu'il se produit dans la branche fine
descendante:
· une absorption d'eau
· une sécrétion nette d'urée, de
potassium et d'ammonium
· une sécrétion de chlore et de sodium
dans certaines conditions expérimentales
Ainsi le fluide tubulaire pourrait être
concentré par une combinaison ( variable selon les conditions
expérimentales et les espèces ) de sortie d'eau et
d'entrée des solutés.
Branche fine ascendante
Ce segment est situé dans la médullaire
interne; par conséquent, il ne peut exister que dans les néphrons
à anse longue. Les résultats des expériences in vitro
sur le lapin, le rat et le hamster montrent que la membrane luminale de la
branche fine ascendante de l'anse de Henle est imperméable à
l'eau, alors qu'elle est très perméable à diverses
substances comme par exemple le chlore, le sodium et l'urée. Ceci a pour
conséquence une décroissance progressive de l'osmolalité
du fluide tubulaire dans la branche fine ascendante.
Tubule distal
Branche large ascendante
C'est le premier segment du néphron distal. Elle est
située dans la médullaire externe et s'étend plus ou moins
loin dans le cortex selon la localisation du glomérule. Dans ce segment
les cellules épithéliales sont assez hautes. Dans sa partie
médullaire la membrane apicale est plate et la mémbrane
basolatérale comporte de nombreuses et profondes invaginations enserrant
de nombreuses mitochondries. Dans le segment cortical la membrane
basolatérale est moins développée, tandis que la membrane
apicale envoie de nombreuses microprojections dans la lumière
tubulaire.
Les principales fonctions de le branche ascendante large
sont:
· en réabsorbant d'importantes quantités
de NaCl, de NaHCO3, de calcium et de magnésium, de participer à
la régulation des bilans de ces substances. Le potassium, selon les
circonstances, peut être sécrété ou
réabsorbé.
· de diluer le fluide tubulaire, contribuant ainsi
à la dilution de l'urine en état de diurèse aqueuse (
lorsque l'apport hydrique dans l'organisme est important ). La membrane
luminale est imperméable à l'eau, permettant, par soustraction
des solutés, cette importante dilution.
· de participer, par le mécanisme de
multiplication de concentration à contre-courant, par son segment
médullaire, à l'établissement des gradients
cortico-papillaires osmolaires, de NaCl, d'urée et d'ammoniac, qui sont
importants dans le mécanisme de concentration de l'urine et dans
l'excrétion de protons sous forme d'ions ammonium.
Tubule contourné distal
Le tubule contourné distal fait suite à la
branche large ascendante de l'anse de Henle. C'est un segment accessible
à la microponction, ainsi ses fonctions sont mieux connues que celles
des segments profonds. Il est composé d'un seul type de cellules
épithéliales, la lame basale est très
développée, la membrane basolatérale est
développée et la membrane luminale envoie de nombreuses
microprojections dans la lumière tubulaire.
Comme dans les segment précédents, le principal
système de transport actif dans le tubule contourné distal est la
pompe Na+/K+ ATPase basolatérale, dont
l'activité spontanée, très élevée, maintient
une concentration intracellulaire de sodium basse, de potassium
élevée et une différence de potentiel transmembranaire
cellule-négative. Un autre mécanisme de transport de NaCl existe
sur la membrane luminale, ce transport se fait par le cotransport simple
Na+/Cl-. Les cellules tubu-
laires distales ne sécrètent pas de potassium
mais réabsorbent du calcium lorsque le tubule est
microperfusé in vivo chez le rat par une solution
artificielle de composition semblable à celle du
fluide tubulaire en amont du tubule distal. L'activité de
la Ca2+/Mg2+ ATPase, qui est probablement
localisée dans la membrane basolatérale des cellules, est
très forte dans ce segment.
Tubule connecteur et collecteur initial
Les tubules connecteur et collecteur initial sont
interposés entre le tubule contourné distal et le canal
collecteur cortical dont le début est marqué par la jonction de
deux néphrons. Ces deux segments sont accessibles à la
microponction. Le tubule connecteur et le tubule collecteur initial ne sont
bien distincts que chez le lapin et le cobaye; dans d'autres espèces la
deuxième partie du tubule distal est forme d'un mélange des
cellules du type "tubule connecteur", de cellules intercalaires et des cellules
du type "tubule collecteur initial"; les cellules du type "tubule connecteur"
se raréfient progressivement.
Les cellules de tubule connecteur et les cellules principales
du tubule collecteur initial sont responsables des transports de sodium et de
potassium et synthétisent la kallicréine, enzyme assurant la
transformation du kininogène en bradykinine et lysilbradykinine. Les
cellules intercalaires sont impliquées dans les transports de protons et
de bicarbonate.
Le tubule connecteur n'absorbe pas d'eau, même en
présence d'AVP. Le tubule collecteur initial est dans les conditions
d'antidiurèse ( concentration circulante élevée d'hormone
antidiurétique ), le siège d'une réabsorption d'eau de
l'ordre de 50% du débit d'eau délivré. En l'absence
d'hormone antidiurétique, la réabsorption d'eau est très
faible et le fluide tubulaire reste hypoto-
nique tout au long du tubule distal.
Le tubule connecteur et le tubule collecteur initial
réabsorbent également du calcium et du magnésium ( moins
de 5% de la charge filtrée ).
À l'état normal, le tubule distal
réabsorbe activement environ 50% de la charge en bicarbonate qui lui est
délivrée. Également, les cellules intercalaires sont
capables de sécréter soit des ions H+ soit des ions bicarbonates
( HCO3- ) selon l'état acido-basique de l'organisme et
diverses influences hormonales. En effet, l'acidose métabolique stimule
la réabsorption de bicarbonate ( sécrétion de protons ),
alors qu'une sécrétion nette de bicarbonate est observée
en état d'alcalose métabolique.
Canaux collecteurs
Canal collecteur cortical
Les canaux collecteurs font suite aux tubules connecteurs
initiaux. Ils collectent le liquide provenant de plusieurs néphrons. Le
canal collecteur est composé de deux types cellulaires, les cellules
principales ( 60% ) et les cellules intercalaires ( 40% ). Leur rôle
est:
· de régler finalement les bilans de sodium et de
potassium sous l'influence prépondérante de
l'aldostérone;
· de réguler le bilan d'eau sous l'influence de
l'hormone antidiurétique qui, agissant sur la perméabilité
à l'eau et à l'urée, détermine l'état de
concentration ( présence d'ADH ) ou de dilution ( absence d'ADH ) finale
d'urine;
· d'assurer à l'état normal
l'acidification de l'urine, qui permet l'élimination de la charge acide
sous forme d'ions ammonium et d'acidité titrable et donc le maintien
d'un état acidobasique normal.
Les cellules principales sont responsables du transport du
sodium, se potassium et d'eau. Elles ont une activité de la
Na+/K+ ATPase basolatérale importante qui
maintient une concentration intracellulaire de sodium basse et de potassium
élevée.
Il existe deux types de cellules intercalaires. Les cellules
intercalaires du type A sécrètent les protons du
côté luminal et absorbent permettent ainsi la réabsorption
du bicarbonate présent dans le fluide luminal. Les cellules
intercalaires du type B ont une polarité inversée, elles ont une
sécrétion basolatérale de protons et une
sécrétion luminale de bicarbonate.
Canal collecteur médullaire externe
Ce segment est également composé de deux types
de cellules: les cellules principales, dont l'ultrastructure est proche de
celle des cellules principales du canal collecteur cortical, et les cellules
intercalaires. Les cellules intercalaires sont de type A, c'est-à-dire
sécrétrices de protons, les cellules de type B étant rares
dans ce segment.
En fait, on peut distinguer deux segments dans le canal
collecteur médullaire externe. Un segment externe situé dans la
couche externe de la médullaire externe et un segment interne
situé dans la couche interne de la médullaire externe.
Partie externe
Ce segment fait suite au canal collecteur cortical. Il est
constitué de cellules principales (60 à 70% ) et de cellules
intercalaires de type A ( 30 à 40% ). La membrane basolatérale
des cellules
principales contient une forte conductance au potassium. Leur
membrane luminale contient une forte conductance au sodium qui peut être
inhibé par l'amiloride et une plus faible conductance au potassium. Ces
cellules ressemblent fonctionnellement aux cellules principales du canal
collecteur cortical et il est probable qu'elles puissent absorber activement le
sodium et sécréter le potassium.
Partie interne
Ce segment est aussi composé de deux types cellulaires
mais leur proportion varie selon l'espèce. Les cellules principales de
la partie interne du canal collecteur médullaire externe sont
fonctionnellement très différentes des cellules principales des
segments précédents: leur membrane ba-
solatérale présente une forte conductance
presque exclusivement au chlore et leur membrane luminale est
imperméable aux ions Na+, K+, Cl-.
Elles possèdent également un contretransport HCO3-/
Cl- basolatéral et peuvent activement sécréter
des protons.
Canal collecteur médullaire interne
Ce segment joue un rôle majeur dans la concentration de
l'urine en état d'antidiurèse et dans l'acidification finale de
l'urine. Il est également capable d'absorber activement le sodium et
d'établir des gradients transépithéliaux de sodium
importants. On distingue dans ce segment deux types cellulaires, les cellules
principales et les cellules intercalaires. Chez certaines espèces les
cellules intercalaires sont très peu représentées et
parfois même inexistantes. L'ultrastructure des cellules principales du
canal collecteur médullaire interne est proche de celle des cellules
principales des segments d'amont. De plus, la taille des cellules augmente
progressivement ( d'un facteur 3 à 10 selon les espèces )
jusqu'à la papille. ( Ce segment a été relativement peu
étudié in vitro, il n'est pas possible dans
l'état actuel des connaissances d'indiquer un schéma
précis des mécanismes de transports transmembranaires des
cellules du canal collecteur médullaire interne.)
Le système à
contre-courant
L'organisation architecturale du néphron permet la
régulation indépendante de l'excrétion de l'eau et des
substances dissoutes. Ainsi le rein peut répondre à des
situations aussi extrêmes que l'état diurétique et
l'état antidiurétique. Ceci est possible grâce au
système à contre-courant stimulant les échanges entre le
liquide tubulaire et l'interstitium. L'architecture particulière du
néphron permet l'établissement d'un gradient cortico-papillaire
interstitiel croissant du cortex vers la medulla. C'est l'existence de ce
gradient osmotique cortico-papillaire interstitiel qui constitue un
élément majeur du pouvoir de concentration de l'urine par le rein
et qui lui permet soit d'éliminer la charge osmotique quotidienne dans
une grande quantité d'eau lorsque les apports hydriques sont importants,
soit de l'éliminer dans une très faible quantité d'eau
lorsque les apports hydriques sont faibles.
La branche large ascendante, mécanismes des
transports ioniques
Introduction
Comme il a été dit précédemment,
la branche ascendante large est le premier segment du néphron distal.
Elle est située dans la médullaire externe et dans le cortex. Le
rôle de la branche large ascendante est de réabsorber le NaCl, le
NaHCO3, le calcium et le magnésium. Elle participe ainsi à la
régulation du bilan de ces différentes substances. La branche
large ascendante joue un rôle important dans le processus de dilution de
l'urine en état de diurèse aqueuse4. Lorsque les
apports hydriques sont importants, il est indispensable que l'excès
d'eau soit éliminé sans modifier l'excrétion des autres
solutés ( NaCl, K+ ... ) . Cependant en situation de
restriction hydrique, l'urine émise doit être concentrée (
état d'antidiurèse ) grâce à une réabsorption
d'eau pure. La branche large ascendante contribue à ces fonctions en
absorbant du NaCl qui, accumulé dans l'interstitium par contre-courant,
va contribuer à la constitution du gradient osmotique. Cette
réabsorption de NaCl, du fait de la faible perméabilité
à l'eau, permet de diminuer l'osmolarité du fluide tubulaire. Un
fluide hypotonique au plasma est délivré au tube distal.
L'ADH5, en modulant la perméabilité à l'eau du
canal collecteur, règle l'équilibre osmotique entre
l'interstitium et la lumière du canal collecteur et ainsi la
réabsorption d'eau dans ce segment. En l'absence d'ADH, la
perméabilité à l'eau est faible, l'urine est hypotonique,
la diurèse élevé. En présence d'ADH
l'osmolarité de l'urine est élevé, la diurèse est
faible.
La branche large ascendante réabsorbe le chlorure de
sodium à un débit très élevé. Le plus
important système de transport actif de la branche large ascendante est
la pompe Na+/K+ ATPase présente dans la membrane
basolatérale. L'activité de cette pompe maintient une
concentration intracellulaire de sodium basse et de potassium
élevée. Du côte apical le cotransport électroneutre
1Na+/1K+(NH4+)/2Cl- assure la
majeure partie du transport du NaCl. Les inhibiteurs spécifiques de
cette protéine sont le furosémide et le bumétanide. Ce
cotransport est secondairement activé par la concentration de sodium
intracellulaire basse qui est établie par l'activité la
Na+/K+-ATPase basolatérale. La réabsorption
du NaCl dans la branche large ascendante permet une accumulation de
solutés dans l'interstitium ce qui contribue à créer un
gradient osmotique croissant du cortex vers la papille.
Une fonction importante des cellules de la branche large
ascendante médullaire est d'absorber en quantités importantes
l'ion bicarbonate. Cette réabsorption contribue également
à la régulation du pH de l'interstitium qui contrôle
l'acidification finale de l'urine par le biais des cellules du
4 Si la sécrétion d'ADH est supprimée (par
exemple par des apports hydriques importants qui tendent à diminuer
l'osmolarité sérique), la réabsorption d'eau sera
supprimée et le rein excrétera beaucoup d'urine ( par exemple 15
L par 24 h) de faible
osmolarité (50 mOsm/L). On a alors une dilution maximale
de l'urine et on parle de diurèse aqueuse.
Si au contraire la sécrétion d'ADH est
stimulée de façon maximale (par exemple par une
déshydratation qui tendrait à augmenter l'osmolarité
sérique), la réabsorption d'eau sera stimulée et le rein
excrétera peu d'urine (p. ex. 0,6 L/24 h) d'osmolarité
élevée (1250 mOsm/L). On a alors une concentration maximale de
l'urine et on parle d'antidiurèse.
5 ADH - Hormone antidiurétique
canal collecteur médullaire. Il est admis que la
réabsorption des HCO3- à travers la membrane apicale
se fait essentiellement via un échangeur Na+/H+
mais la voie d'efflux basolatérale n'est pas connue.
Enfin, les cellules de la branche large ascendante
réabsorbent, grâce au cotransport Na+/K+
(NH4+)/2Cl-, la majorité du NH4+ ( qui est transporté
à la place de K+ ), produit par la cellule du tubule
proximal. En s'accumulant dans l'interstitium, le NH3 par le système de
concentration à contre-courant peut diffuser dans la lumière du
canal collecteur médullaire et permettre une sécrétion
élevée d'H+ dans le canal collecteur médullaire
externe et, donc, une acidification efficace de l'urine définitive.
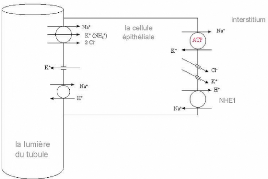
Figure 4. Modèle classique des transferts de
solutés dans la branche ascendante large de Henle.
De ce modèle, on pourrait conclure que les
différentes fonctions, la régulation du bilan d'eau et de
l'état acide-base, sont dépendantes. Cependant, les cellules de
la branche large ascendante sont capables d'absorber une grande quantité
de Na+ et de Cl- sans modification notable de
l'état acide-base, c'est à dire sans modification apparente des
réabsorptions de HCO3 et NH4+. Cette observation a
amené à supposer l'existence d'un échangeur
Cl-/HCO3- sur la membrane apicale. Deux équipes de
l'unité INSERM U 356, celle de R-A. Podevin et celle de P. Houillier
travaillent sur ce sujet en utilisant deux techniques d'approche
différentes mais complémentaires. La technique de microperfusion
in vitro est utilisé par P. Houillier. L'équipe de R-A.
Podevin utilise les vésicules de membranes plasmiques luminales et
basolatérales, hautement purifiées et séparées
simultanément.
La microperfusion in vitro
Résumé
La technique de la microperfusion in vitro est faite
sur des segments de tubule isolés du rein.
Lorsque, par la microdissection, le tubule est extrait du
rein, il est fixé sur un dispositif permettant d'isoler le milieu
intratubulaire du milieu extratubulaire, et de faire s'écouler par le
tubule un liquide de composition connue. Il est possible de recueillir le
liquide sortant du tubule à l'autre extrémité. La
composition exacte de ce liquide peut être déterminée. Il
est donc possible, en comparant la composition du liquide "de perfusion" et du
liquide collecté, d'en déduire le flux de transport
transépithèlial de différents solutés. Cette
analyse peut être couplée avec les mesures du potentiel
transépithèlial et/ou avec la technique de la fluorescence
intracellulaire ( permettant de me-surer le pH intracellulaire ). Ainsi les
renseignements plus complets sur les transporteurs ioniques peuvent être
obtenus.
Les avantages et les limites de la
méthode
Cette méthode est utilisée pour étudier
précisément les activités de transport de certains
segments du néphron. Contrairement aux techniques in vivo (
microperfusion et microponction ), les conditions expérimentales sont
parfaitement contrôlables car le tubule n'est plus soumis aux
différentes influences complexes, en particulier hormonales.
L'importance de cette technique réside dans le fait qu'il est possible
de mesurer sur un même tubule simultanément le flux ionique, la
différence de potentiel transépithèliale et, dans
certaines conditions, le potentiel transmembranaire des cellules et la
conductance de l'épithélium. Il est ainsi possible
d'étudier et de définir la régulation des
mécanismes impliqués dans les transports tubulaires rénaux
et, de ce fait la régulation de la composition du milieu
intérieur.
Cependant le fait que cette méthode utilise un segment
isolé in vitro représente une limite. En effet, dans le
rein, de nombreuses fonctions demandent une action coordonnée de
différents segments et sont soumis aux influences des hormones.
Le matériel et méthodes
Un microscope inversé est
indispensable. Sa construction ( la source lumineuse est au des-sous de la
chambre de perfusion et l'objectif est au-dessus ) permet de travailler sur un
tubule en suspension et facilite l'accès des pipettes.
La chambre de perfusion ( plaque en
matière plastique ) permet de garder le tubule dans un bain, et loge
l'électrode et le thermomètre.
Le système de microperfusion est
composé de deux blocs, l'un assurant la perfusion et l'autre la
collection.
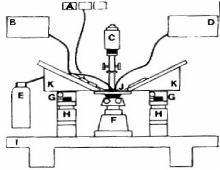
Figure 5. Le montage utilisé pour la
microperfusion in vitro.
Le réservoir contenant le perfusât la pompe
la source de la lumière
le thermomètre
l'arrivé du carbogaz ( O2/CO2
à 5% )
le microscope inverse
et H. micromanipulateur et sa base
la base très stable
la chambre de perfusion
système de maintien des micropipettes permettant leur
coulissement
A. Le système de perfusion :
B. C. Comporte quatre pipettes concentriques montées sur
trois chariots
de façon qu'on puisse les déplacer les unes par
rapport aux autres à l'aide de moteurs.
La pipette de soutien est
connectée à une seringue ce qui permet d'aspirer le tubule et
d'immobiliser ainsi une de ses extrémités.
La pipette de perfusion se trouve
à l'intérieur de la pipette de soutien. Étant très
fine, on la fait rentrer à l'intérieur du tubule lorsqu'il est
maintenu par la pipette de soutien afin de faire s'écouler le liquide de
perfusion par la lumière du tubule.
La pipette d'échange arrive
jusqu'à la partie large de la pipette de perfusion et permet un
changement rapide de liquide de perfusion.
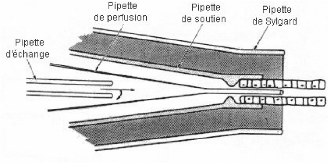
La pipette de Sylgard est la plus
grande, elle contient les autres pipettes. On la remplit de liquide de Sylgard
pour assurer l'étanchéité une fois que le tubule est
perfusé. De plus le liquide de Sylgard est un liquide
diélectrique ce qui permet les mesures du potentiel
transépithèlial.
Figure 6. Le système de
B. Le système de collection : est
composé de trois pipettes montées de la même façon
que celles du système de perfusion.
La pipette soutien-collection ressemble
à la soutien-perfusion, elle est également connectée
à une seringue permettant de placer le tubule à
l'intérieur de la pipette et de l'immobiliser.
La pipette de Sylgard identique
à la Sylgard-perfusion; l'importance de
l'étanchéité y est encore plus grande que du coté
de la pipette de perfusion.
La pipette de collection très
fine, amovible; a une constriction à proximité de l'ouverture ce
qui permet de faire des prélèvements ayant toujours un volume
identique. Ceci permet de calculer le débit, tout simplement en mesurant
le temps nécessaire pour que ce volume se remplisse.
|
Figure 7. Système de collection
|
|
Sur les deux systèmes c'est la pipette de soutien qui est
fixe, les deux autres peuvent coulis-
ser, donc s'éloigner ou s'approcher de celle-ci. Dans le
système de perfusion la pipette de perfusion et la pipette
échange sont solidaires.
Les mesures du potentiel
transépithèlial
La chambre de perfusion est construite de telle façon
qu'elle puisse loger une électrode qui reste constamment en contact avec
le bain dans le-quel est plongé le tubule. Cette électrode
me-sure le potentiel extratubulaire. Une autre électrode est en contact
avec le liquide de perfusion, elle mesure, donc, le potentiel intratubulaire.
Un dispositif relié à ces deux électrodes permet la mesure
de différence de ces deux potentiels, ce qui donne la valeur de la
différence des potentiels électriques
transépithèliaux.
Avant que la tubule soit perfusé, on plonge la pipette de
perfusion dans le bain et on me-sure le potentiel "à vide". Ceci nous
permet de régler le zéro électrique.
Titration de l'ion Cl- dans les petits
volumes
On dépose de petites quantités de la solution
à titrer sous une couche d'huile saturée en eau. Cette
précaution doit être prise car les solutions manipulées
peuvent avoir des concentrations très faibles ( de l'ordre de 1
0-4M ) donc toute évaporation est susceptible de
modifier sensiblement la concentration. A l'aide d'une micropipette on
dépose de petites gouttes ( 10-3ì L ) sur une plaque
d'argent. Grâce à une constriction à
l'extrémité de la pipette les gouttes déposées ont
un volume reproductible à #177;3%. Ensuite une électrode est
plongée dans la microgoutte. Cette électrode est relié par
un pont agar à une solution de NaNO3 (1 M) qui à son
tour est relié par un autre pont agar à une solution
d'AgNO3 (1M) dans laquelle plonge un fil d'argent relié au titrateur.
L'autre borne du titrateur est reliée à la plaque d'argent sur
laquelle est posée la goutte. Lorsqu'on établit un courant les
ions Ag+ sont libérés de la plaque d'argent et ils
réagissent avec les ions Cl- présents dans la goutte.
Les molécules d'AgCl précipitent. Grâce aux deux
électrodes on peut enregistrer
une baisse de potentiel. Si on inclut un condensateur dans le
circuit et si on le charge lors de la titration, la charge de ce
condensateur est proportionnelle à la quantité du courant qui est
passé dans
le circuit pendant la titration.
Pour obtenir les valeurs de concentration du liquide
collecté on dépose d'abord des gouttes de la gamme de la
façon décrite. On utilise trois solutions 50, 100 et 150 mM.
Lorsqu'on titre ces trois solutions, les résultats obtenus peuvent
être placés sur une droite pour laquelle on connaît la
concentration en NaCl et la charge du condensateur correspondante pour trois
points. Les concentrations inconnues des gouttes déposées
à partir du liquide collecté sont déterminées par
rapport à ces trois points.
Protocole
Uniquement les rats de la souche Sprague Dawley
sont utilisés, ainsi on essaye de contourner un des grands
problèmes dans l'expérimentation en biologie; comme jamais deux
êtres vivants ne sont identiques il est impossible de
répéter la même expérience dans exactement les
mêmes conditions. En prenant des animaux d'une même souche stable
et établie on travaille autant que
possible dans des conditions semblables. Pour cette même
raison on n'utilise que des rats mâles, car leurs taux hormonaux sont
relativement stables tandis que ceux d'une femelle varient en cours du
cycle.
Les rats sont élevés en milieu stérile et
sont soumis à un régime alimentaire standard stérile, ils
ont libre accès à l'eau et ne sont sortis de l'enceinte
stérile que peu avant l'expérience. Ceci a pour but
d'éviter au maximum le développement d'une fibrose
interstitielle. Pour éviter l'accumulation du collagène dans
l'interstitium qui survient avec l'âge on utilise uniquement de jeunes
rats pesant de 60 à 80 g. Ces précautions ont pour but de
faciliter la microdissection.
Lorsque toutes les préparations ont été
faites, on injecte au rat par voie péritonéale 2 mg de
furosémide (Lasilix) qui est un inhibiteur de
transporteur NaiK+/2Cl- qui se trouve sur la membrane
apicale de la branche large ascendante. Ce transporteur est
électriquement neutre6 et secondairement activé. Il
est activé par le gradient produit par l'action de la
Na+/K+-ATPase. Lorsque le transporteur Na/K/2Cl est
inhibé, la concentration en Na+ dans le cytosol baisse
considérablement jusqu'à inhiber le fonctionnement de la
Na+/K+-ATPase par défaut de substrat. Or comme la
Na+/K+-ATPase est un des principaux consommateurs de
l'énergie dans la cellule, lorsque l'activité de ce transporteur
est réduite la consommation énergétique de la cellule est
également réduite. Ceci nous permet de maintenir les tubules plus
longtemps en vie pendant la dissection.
Dix minutes après l'injection de Lasilix on injecte,
toujours par la voie intrapéritonéale, un anesthésique (
Pentobarbital de sodium à 50 mg/kg ). Lorsque le rat est
complètement insensible à la douleur et inconscient, on ouvre le
péritoine et on y verse du Ringer froid. Les reins sont rapidement
prélevés et constamment gardés dans du Ringer
glacé. Pour préparer la microdissection on enlève la
capsule et on découpe des tranches coronales de moins de 1 mm
d'épaisseur.
La microdissection s'effectue sous une loupe binoculaire ( 25
) dans une boîte de Pétri remplie du Ringer
réfrigéré, maintenu à 4°C. Pour isoler un seul
tubule on écarte le tissu, avec des pinces fines, en commençant
toujours par la medulla. Assez souvent quelques tubules isolés se
dé-
tachent, on les sectionne à l'aide d'une aiguille fine
et on transfère le tubule avec très peu de liquide
dans la chambre de perfusion. Pour éviter que les tissus adhèrent
aux parois de la boîte de
Pétri on ajoute une petite quantité de BSA (
bovine serum albumin ) dans le bain de dissection. On considère
généralement que la viabilité des tubules ne
dépasse pas 30 min., au-delà le risque que le tubule meure
rapidement au cours de la perfusion est trop grand; donc si après 30
min. de dissection aucun tubule n'est isolé, la dissection est
interrompue et un autre rat est sacrifié.
Dans la chambre de perfusion le tubule est d'abord
examiné à fort grossissement pour déceler
d'éventuelles discontinuités dans l'épithélium ou
des opacités anormales. Toute irrégularité peut être
le signe d'une rupture de la membrane basale ou de la mort des cellules
épithéliales qui a pu survenir lors de la dissection. Tout tubule
suspect de traumatisme est écarté.
Lorsque le tubule est dans la chambre de perfusion on approche la
pipette de soutien-perfusion et par une légère aspiration on
engage une de ses extrémités à l'intérieur de la
pipette. Ensuite on introduit la pipette de perfusion à
l'intérieur du tubule. L'autre extrémité du tubule est
aspirée avec précaution dans la pipette soutien-collection. Les
deux pipettes de Sylgard sont avancées pour recouvrir les deux
extrémités du tubule avec le liquide de Sylgard; ainsi le milieu
intratubullaire est complètement isolé du bain, on est sûr
que le liquide collecté est bien celui provenant du tubule. Un montage
relié à la pipette de soutien-perfusion fournit une pression
hydrostatique assurant un écoulement régulier du liquide de
perfusion à travers le tubule. On règle cette pression
hydrostatique de façon que le débit d'écoulement du
liquide dans le tubule soit de l'ordre de 4 à
6 Échange deux anions contre deux cations
5 nL/min.
|
Figure 8. Aspect du tubule lorsqu'il est
perfusé
|
|
Collection
Le liquide de bain qui a été aspiré dans
la pipette soutien-collection lors de la mise en position du tubule doit
être enlevé avant qu'on commence la collection.
L'extrémité de la pipette soutien-collection est remplie de
l'huile saturée en eau; ainsi, lorsque le liquide collecté rentre
dans la pipette de soutien, son niveau est facilement repérable
grâce au ménisque séparant l'huile et le collectât.
Lors des prélèvements, on mesure le temps nécessaire pour
le remplissage de la pipette de collection ( dont le volume est connu ), ce
sont des périodes et elles ne sont pas toutes identiques car le
débit peut varier au cours du temps.
Lorsqu'on veut changer la composition du perfusât, la
pipette d'échange nous permet de changer le liquide dans la pipette de
perfusion sans déranger le fonctionnement du tubule. Il faut attendre
quelques minutes pour que le système se stabilise et la collection de
deuxième perfusât peut commencer. Cela nous permet d'effectuer
plusieurs observations ( le comportement du tubule en présence de
différents perfusâts ) sur le même tubule.
Résultats
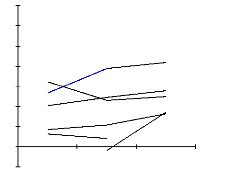
Les premières expériences consistaient à
perfuser un tubule d'abord avec du Ringer ne contenant aucun inhibiteur ni
hormone ( Témoin ) puis le liquide de perfusion est
remplacé par du Ringer dans lequel on ajoute du barium ( 10 mM ). Dans
le troisième perfusât il y a du barium (10 mM ) et on ajoute
également de l'arginine vasopressine ( AVP )7 dans le
Ringer-bain ( 10-9 M ). Selon les connaissances actuelles sur les
transporteurs membranaires dans la branche large ascendante on s'attend
à voir une baisse de flux transépithèlial de chlore
lorsqu'on passe de premier perfusât au deuxième. Ceci s'explique
par le fait que les canaux sélectifs au potassium sont inhibés
par la barium. Comme la concentration de potassium dans le perfusât est
initialement basse, et comme il n'y a pas de rétrodiffusion de
K+ à travers la membrane luminale, l'échangeur
Na+/K+ (NH4+)/2Cl- est
inhibé par manque de substrat. Ces résultats sont
cohérents avec les connaissances actuelles sur les transporteurs
membranaires. Cependant, lorsqu'on perfuse le même tubule avec du Ringer
au quel on a ajouté du Barium, en le plongeant dans un bain auquel on a
ajouté de l'AVP on observe que le transport du chlore augmente.
7 La composition exacte des Ringers différents; en
document annexe
|
Figure 9. Les résultats montrant
l'évolution du transport du chlore en
présence du barium
|
|
L'AVP est une hormone pour laquelle il a été
démontré qu'elle stimule l'absorption de NaCl dans la branche
large ascendante. Or comme le liquide de perfusion contient du barium le
transport de chlore devrait rester inhibé malgré l'action d'AVP.
Si l'échangeur Na+/K+/2Cl- est le seul
transporteur de chlore ce transport serait interrompu tant que les canaux
à potassium restent inhibés par le barium. Le
rétablissement du transport transépithèlial a conduit
à supposer l'existence d'un autre système de transport de chlore
sur la membrane luminale de la branche large ascendante. D'autres
recherches8 ont démontré l'existence d'une
protéine sur la membrane luminale et basolatérale des cellules
épithéliales de la branche large ascendante dont le rôle
serait le transport de chlore et de bicarbonate. Si l'activité de cet
échangeur est suffisamment importante, elle suffirait à expliquer
la reprise du transport du chlore, car c'est l'échangeur
Cl-/HCO3- qui serait stimulé par l'AVP, les canaux
K+ restant inhibés par barium. Il reste, cependant, à
démontrer que l'échangeur Cl-/HCO3- joue
réellement un rôle dans la branche large ascendante. Afin de
démontrer ceci, un deuxième protocole à été
mis au point.
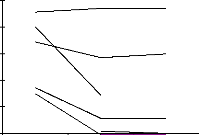
Le segment du tubule est perfusé avec trois
perfusâts différents. Le premier contient du barium, le
deuxième et le troisième du barium et du
4,4'-diisothiocyanatestilbène-2,2'-disulfonate ( DIDS ). Lorsqu'on
perfuse avec le troisième perfusât on ajoute de l'AVP dans le
bain. Le DIDS est un inhibiteur de tous les transporteurs d'anions. Il inhibe,
ainsi, l'échangeur Cl-/HCO3-; ceci a
été démontré sur d'autres segments. Cet
échangeur est déjà connu; le premier avait
été observé dans les érythrocytes. La
présence du barium doit maintenir les canaux K+,
et par conséquent les transporteurs Na+/K+/2Cl-, inhibés;
donc si un transport de chlore est perceptible, il est forcement dû
à d'autres mécanismes de transport que l'échangeur
Na+/K+/2Cl-. Lorsqu'on ajoute du DIDS on note que le transport de chlore est
quasiment nul ( ou certainement considérablement réduit ) ce qui
nous permet de conclure que c'est bien le Cl-/HCO3- qui
est responsable de ce transport. Lorsqu'on ajoute de l'AVP on n'observe aucune
augmentation du transport de chlore ce qui veut dire ou que tous les
transporteurs de chlore ont été inhibés, l'un par le
barium, l'autre par DIDS.
8 Il s'agit de résultats de l'équipe de R.A.
Podevin qui ont démontré l'existence de ce transporteur sur les
deux membranes de la branche large ascendante. L'expérience de P.
Houillier vise à démontrer que cette protéine joue un
rôle non négligeable dans les transports
transépithèliaux dans la branche large ascendante
70
60
50
40
30
20
10
0
Ba++ Ba+ DIDS Ba+DIDS
AVP
-10
5
4
3
2
1
0
-1
Le flux transmembranaire Potentiel
transépithelial
Ba++ Ba+ DIDS Ba+DIDS
AVP
Figure 10. Les résultats montrant
l'évolution du transport du chlore et du potentiel
transépithèlial en présence du barium, du barium + dids et
du barium+dids+avp
Discussion
L'objectif de ce travail est de démontrer que les
échangeurs Cl-/HCO3- présents dans la
branche large ascendante médullaire de l'anse de Henle du rat jouent un
rôle important dans le transport de chlore. La technique de
microperfusion in vitro est la seule qui permette de mesurer le flux
transépithèlial d'un soluté dans des conditions
différentes. Cette technique prend beaucoup de temps car il faut
effectuer un nombre important de manipulations pour avoir un nombre suffisant
de manipulations complètes; il arrive souvent qu'une manipulation soit
interrompue à cause de la mort prématurée du tubule et que
ses résultats ne soient pas exploitables. Jusqu'à la fin de mon
stage, seulement trois manipulations complètes ont été
obtenues, donc les explications données dans cet exposé doivent
être prises en tant qu'hypothèses car il faudrait au moins cinq
manipulations cohérentes pour confirmer ces hypothèses.
Néanmoins les données obtenues suggèrent que le
transporteur Cl-/HCO3- apical joue un rôle
important dans le transport de chlore dans la branche large ascendante
indépendant du cotransport Na+/K+(NH4+)/2Cl-. Ainsi l'opération
couplée de l'échangeur Cl-/HCO3- avec
l'échangeur Na+/H+ représente un
modèle permettant d'expliquer la régulation indépendante
de la réabsorption de NaCl et de la réabsorption de
NH4+, et donc de réguler séparément
l'excrétion rénale d'acide et la concentration des urines.
Mise en évidence et caractérisation
d'échangeurs Cl-/HCO3- sur les vésicules des membranes plasmiques
luminales et basolatérales
Résumé
La branche ascendante large de Henle réabsorbe une
proportion significative (environ 20%) de bicarbonate filtré par le
glomérule. Les mécanismes impliqués dans cette
réabsorption dans la partie médullaire de ce segment tubulaire
sont seulement partiellement connus: c'est un échangeur
Na+/H+ de type NHE3 qui est responsable de la
sécrétion luminale de protons. En revanche, la voie d'efflux
basolatérale de HCO3- reste indéterminée. Les
expériences en cours dans l'équipe de R-A Podevin ont
déjà permis de démonter l'existence d'échangeurs
anioniques de type Cl-/HCO3-, présents sur les
deux types de membrane plasmique, luminale et basolatérale, des cellules
épithèliales de la branche large ascendante du rat. L'approche
expérimentale repose sur la préparation simultanée de
vésicules de membranes plasmiques hautement purifiées,
orientées dans le sens physiologique.
Les avantages et les limites de la méthode
Le principal avantage de cette méthode est de permettre
l'étude séparée des membranes luminales et
basolatérales de l'épithélium de la branche large
ascendante médullaire, dans des conditions qui permettent,
contrairement aux modèles utilisant des systèmes intacts
(suspensions et
cultures cellulaires, tubules) de contrôler les
caractéristiques du milieu intravésiculaire et
extravésiculaire. Ainsi, il est possible d'inactiver certains
systèmes de transport qui pourraient interférer avec
l'activité du transporteur étudié. On peut utiliser, par
exemple, des milieux sans NaCl, pour inactiver les échangeurs
Na+/H+. Les transporteurs peuvent être
localisés fonctionnellement par l'étude des transports (technique
de filtration rapide) mais également par des techniques
d'immunoempreinte qui permettent d'identifier les différentes isoformes
des protéines de transport sur chaque membrane.
Dans le cas pré sent, des isoformes distinctes
d'échangeurs anioniques ( AE ) ont été identifiées
sur les membranes basolatérales et luminales : la membrane
basolatérale contient un polypeptide de 165 kDa de type AE2 ainsi que
plusieurs polypeptides de poids moléculaire proches de 100 kDa de type
AE1, tandis que la membrane luminale contient uniquement un polypeptide de type
AE1, dont la migration sur le gel diffère légèrement des
échangeurs anioniques de type AE1 basolatéraux, suggérant
la possibilité d'une isoforme spécifique.
Les expériences actuelles visent à
différencier les isoformes présentes aux deux pôles de la
cellule à l'aide des caractéristiques fonctionnelles : ainsi, il
a pu être démontré une sensibilité différente
au DIDS, un inhibiteur des échangeurs anioniques, puisque la valeur
d'IC509 est d'environ 3 uM pour les vésicules membranaires
basolatérales et 15 uM pour les vésicules membranaires luminales.
L'expérience suivie au cours du stage visait à déterminer
une sensibilité différente des échangeurs au pH intra
vésiculaire.
9 Concentration donnant 50% d'inhibition
Méthode
Animaux :
Dix rats mâles Sprague-Dawley à
jeun depuis 12 heures, de 250 à 300 g, sont sacrifiés
après anesthésie par injection intra-peritonéale de 50
mg/kg de pentobarbital de sodium, pour la préparation des
suspensions de tubules de la branche ascendante large médullaire comme
cela est déjà décrit (ref. 8 ). En résumé,
les reins prélevés à 4°C sont
décapsulés, et tranchés dans le plan sagittal. Les
tranches sont transférées rapidement dans une solution de
Hancks10 glacée, puis la bande interne de la
médullaire externe (caractérisée par sa coloration rouge)
est disséquée sous microscope binoculaire. Les fragments obtenus
sont soumis à un traitement à la collagénase (40 mg/100
ml), afin de digérer les segments tubulaires les moins résistants
à la collagénase (partie descendante de l'anse de Henle, tubule
collecteur) , pour ne
laisser intact que les segments de la branche large ascendante
médullaire qui seront récupérés par centrifugation
à basse vitesse. Cette suspension tubulaire, est rincée deux fois
dans une solution tampon de saccharose 250 mM, pH 7.4 contenant un inhibiteur
des protéases (ABSF). Les tubules ainsi traités sont alors
homogénéisés à l'aide d'un Dounce puis d'un Waring
Blendor à la vitesse maximale pendant une minute afin de rompre les
cellules. L'homogénat obtenu est constitué d'un mélange de
membranes et différents organites. L'ajout de CaCl2 au mélange
(concentration finale de 10 mM) permet de complexer l'ensemble des membranes
sauf les membranes luminales. Après 20 minutes d'incubation à
froid avec le CaCl2, les membranes luminales sont isolées par
centrifugation (6000 g pendant 15 minutes) des autres membranes,
intracellulaires et basolatérales, qui vont sédimenter ( P1 ). Le
surnageant ( S1 ) contenant les membranes luminales est centrifugé
à 48000 g pendant 8 minutes et le surnageant obtenu ( S2' ) est
centrifugé à 400 000 g pendant 60 minutes. Le dépôt
obtenu est composé à plus de 95% de membranes apicales.
Les membranes basolatérales sont isolées
à partir du P1 par centrifugation (3300 g pendant 15 minutes) dans une
solution d'EGTA (qui permet d'éliminer le surplus de Ca2+).
Cette centrifugation permet de sédimenter les membranes
intracellulaires, tandis que le surnageant (S2 ) est centrifugé à
48 000 g pendant 25 minutes pour obtenir un culot enrichi en membranes
basolatérales. Ce culot (P3) est homogénéisé,
repris dans 6 ml de la solution tampon de saccharose, puis déposé
sur un gradient discontinu de saccharose ( on utilise les solutions de 44, 52
et 65% ). Une ultracentrifugation (250 000 g pendant 50 minutes) permet de
séparer sur le gradients plusieurs bandes : la deuxième bande,
composée de membranes basolatérales à plus de 95%, est
reprise à la pipette pasteur, et soumise à une
ultracentrifugation finale permettant de sédimenter la
préparation des membranes basolatérales qui est reprise dans un
faible volume de milieu expérimental. La composition du milieu de
reprise détermine donc le milieu intravésiculaire pour les
études du transport transmembranaire.
Les mesures des transports ioniques
10 Solution physiologique tampon dont la composition est: ( en mM
) 112 NaCl; 5,4 KCl; 25 NaHCO3; 0,3 Na2HPO4; 0,4 K2HPO4; 0,4 MgSO4; 1,2 CaCl2;
5 D-glucose; 5 alanine; 10 Tris/Hepes pH 7,4; 1 % albumine; et bullée
avec 95% O2-5%
CO2
La filtration rapide
En créant un gradient sortant de HCO3- dans
un milieu ne contenant pas de Na+ ( pour inhiber la
Na+/K+-ATPase et les échangeurs
Na+/K+ ) on favorise l'entrée de
36Cl-,par l'échangeur Cl-/
HCO3-, à l'intérieur des vésicules. Et c'est le
36Cl- capturé dans les vésicules à
différents temps et dans les différentes conditions qui permet de
caractériser les transports ioniques sur la membrane luminale et
basolatérale. L'échangeur Cl-/HCO3- peut
être étudié également sous le mode d'échange
36Cl-/Cl-.
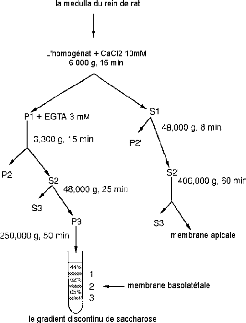
Procédure:
Le principe de la mesure est le suivant: à T0 10uL de
vésicules ( luminales ou basolatérales ) sont injectés
dans le milieu expérimental contenant du 36Cl- qui
va être transporté par l'échangeur
Cl-/HCO3- et s'accumuler dans les vésicules. Le
transport est arrêté 9 secondes plus tard par l'ajout de 1.5 ml de
solution STOP11 glacé. Ce mélange est rapidement
filtré sur un filtre en cellulose ( 0.45 um - donc retenant les
vésicules ) puis rincé avec encore 15 ml de solution STOP
glacé. Les filtres, sur lesquels sont retenues les vésicules
contenant le 36Clcapturé, sont dissous dans 3 ml de scintillant et la
radioactivité est mesurée à l'aide d'un compteur de
particules â. Cette radioactivité reflète l'activité
du transporteur du Cl- dans les vésicules.
|
Résultats
|
Figure 11. Protocole permettant de
préparer simultanément les vésicules de membranes
luminales et basolatérales séparées, hautement
purifiées et orientées dans le sens physiologique.
|
Les premières expériences effectuées
avaient pour but de démontrer l'existence de échangeurs
Cl-/HCO3- sur la membrane basolatérale et luminale
et leur sensibilité au DIDS ( un inhibiteur puissant des
échangeurs Cl-/HCO3- ). Il a été
conclu à une sensibilité différente au DIDS pour les deux
membranes (les valeurs d'IC50 étant de 3.2 #177; 0.94 uM pour les
vésicules membranaires basolatérales et de 15.2 #177; 5.15 uM
pour les vésicules membranaires luminales ).
La deuxième expérience visait à
déterminer la dépendance de l'activité des
échangeurs au différents pH intravésiculaires ( pHi ).
Pour les deux membranes le transport a été étudié
à pHi allant de 6,1 à 8, tandis que le pH extravésiculaire
était constant à 5,5. Chaque me sure a été faite
en
11 Solution STOP - 20 mM de Tris/Hepes pH 7.4 et une
quantité du K-gluconate nécessaire pour maintenir
l'osmolalité constante
présence et en absence du DIDS. La différence
des transferts ioniques mesurés dans ces deux conditions permet
d'estimer le transport ionique médié par l'échangeur
Cl-/HCO3- seul ( transport inhibé par le DIDS
).
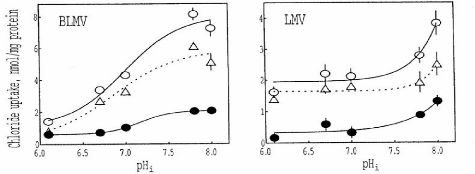
Figure 11: BLMV - Transport transmembranaire du
chlore* à travers la membrane basolatérale et
LMV - Transport transmembranaire du chlore* à
travers la membrane luminale mesuré dans les vésicules
membranaires
O - transport en conditions "normales"
- transport en présence du dids
Ä - transport dû aux transporteurs non inhibés
par dids, il s'agit vraisemblablement du échangeur Cl-/HCO3 -
Les résultats obtenus montrent que le transporteur
Cl-/HCO3- basolatéral est stimulé par des
petites variations du pH intravésiculaire tandis que le transporteur
Cl-/HCO3- luminal reste insensible aux variations du
pHi12.
Interpretation des résultats
Ces r?suétats d?montrent qu'une activit? d'?change
Cl-/HCO3- est pr?sente sur les deux membranes, luminale
et basolat?rale. L'?changeur Cl-/HCO3- basolat?ral est
stimul? par l'augmentation du pH intrav?siculaire sugg?rant l'existence d'un
site allost?riquë3. Des travaux compl?- mentaires ont permis de
caract?riser les diff?rents isoformes: ainsi une isoforme de type AE-2 est
pr?sente sur la membrane basolat?rale, alors qu'une isoforme du type AE- 1 est
pr?sente sur les deux membranes mais il est beaucoup plus abondant sur le
membrane basolat?rale.
Les donn?es d'exp?riences sur l'ovocyte de xenope confortent
les conclusions des ?tudes fonctionnelles de l'exp?rience puisque on sait que
l'isoforme AE 2 exprim? dans l'ovocyte de xenope est stimul?e par l'alcalose
intracellulaire, contrairement ? l'isoforme AE 1.
Conclusion
Il est maintenant quasiment certain que le transporteur
Cl-/HCO3- existe sur les membranes basolat?rale et
luminale de la branche ascendante large. Il a ?galement ?t? d?montr? qu'il
existe
12 sauf pour les pHi tr?s grands. Lesquels, de toutes fa?ons, ne
sont pas observ?s dans les conditions physiologiques.
13 Site allost?rique - un site sensible ? la pr?sence d'un ligand
( ici protons ) modifiant l'activit? enzymatique de la prot?ine.
deux prot?ines effectuant cette fonction. Les travaux sur la
caract?risation de ces deux prot?ines continuent.
Au moment de mon stage dans le laboratoire les r?sultats ne
permettaient touj ours pas de
dire si le transporteur Cl-/HCO3- ?tait
responsable du transport du Cl- mis en ?vidence. En ce moment, le
Professeur Houiller travaille en appliquant le mê?m protocole, mais c
'est le HCO3 - qui est dos?, et non le Cl- comme dans l'exp?rience
d?crite. La comparaison des r?sultats de ces deux exp?riences pourrait nous
permettre d'attribuer ce transport au transporteur
Cl-/HCO3-.
Le progr?s des connaissances sur le fonctionnement du rein
demande de comprendre d'abord le fonctionnement des segments isol?s. C'est
seulement ensuite, en examinant, ensemble, la situation spatiale des segments
et leur fonctionnement individuel qu'on pourra ?lucider les diff?- rents
aspects de leurs interactions ce qui nous permettra d'expliquer les modes de
r?gulation de diff?rentes substances dans le rein.
Annexe 1. Composition des Ringers
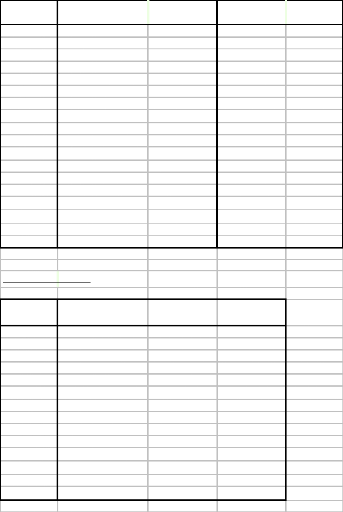
pour 100g
pour 100g
mM
mM
g
g
N aCl
116
0,678
96
0,56 1
Ca lactate
2
0,0 22
2
0,022
glucose
5,5
0,099
5,5
0,099
NaHCO3
23
0,193
23
0,193
mannitol
0
0
10
0,182
Ba Cl2
0
0
10
0,244
ml
ml
HEPES
10
0,5
10
0,5
C a C l2
1
0,5
1
0,5
MgCl2
1 ,2
0,5
1 ,2
0,5
Na citrate
1
0,5
1
0,5
KC l
4
0,5
4
0,5
pour 4 L
pour 5L
mM
g
g
N aCl
116
27,116
33,9
Ca lacetate
2
0,8 72
1,1
glucose
3,96
4,95
5,5
NaHCO3
23
7,72
9,65
alan in e
5
1 ,7 8
2,225
ml
ml
HEPES
10
20
25
C a C l2
1
20
25
MgCl2
1 ,2
20
25
Na citrate
1
20
25
KH2PO4
4
20
25
Ringer du bain
Ringer sans
NH4Cl
Lumière sans Barium ( Ba- )
Lumière avec Barium ( Ba+ )
26/27
Bibliographie
1. AMEL ATTMANE-ELAKEB, R?GINE CHAMBREY, MICHEL TSIMARTOS,
FRAN?OISE LEVIEL, ANNE BLANCHARD, DAVID G. WARNOCK, MICHEL PAILLARD, and
REN?-ALEXANDRE PODEVIN: Isolation
and characterization of luminal and basolateral plasma membrane
vesicles from the medullary thick ascending loop of Henle. Kidney
International, Vol. 50 (1996), pp. 1051- 1057
2. DOMINIQUE ELADARI, ANNE BLANCHARD FRANCOISE LEVIEL, MICHEL
PAILLARD, ALAN K. STUARTTIELLY, SETH L. ALPER, ET REN?-ALEXANDRE PODEVIN:
Cl-/HCO3- exchangers in the medullary
thick ascending limb. Kidney Int. 1997. ( in press )
3. DOMINIQUE ELADARI: Mise en ?vidence d'?changeurs
Cl-/HCO3- dans l'anse de Henle m?- dullaire de rein de
rat: Caract?risation fonctionnelle et mol?culaire. M?moire soutenu en
octobre 1997
4. J. A. RAMSAY, R. H J. BROWN and P. C. CROGHAN: Electrometric
titration of chloride in small volumes. Journal of experimental biology
Vol. 32 (1 955) pp. 822-829
5. MAURICE B. BURG and MARK A. KNEPPER: Single tubule perfusion
techniques. Kidney International. Vol. 30 (1989) pp.1
66-170
6. MAURICE B. BURG: Perfusion of Isolated Renal Tubules.
Yale Journal Of Biology and Medicine Vol.45 (1972) pp. 321-326
7. JEAN BARIETY, MAURICE BICHARA, PASCALE BORENSTIEN, PATRICE
CAILLARD, MICHEL DELAHOUSSE, JEAN-PAUL GARDIN, PASCAL HOUILLER, FRAN?OISE
LEVIEL , FRAN?OISE PAILLARD, MICHEL PAILLARD, JOSIANNE PAGGIOLLI AND ALAIN
PRIGNET: Physiologie r?nale et d?sordres
hydro?lectrolytiques. Hermann, ?diteurs des scinces et des
arts (1992)
8. TRINH-TRANG-TAN MM, BOUBY N, COUTAUD C, BANKIR L: Quick
isolation of rat medullary thick ascending limbs: Enzymatic and metabolic
characterization. Pfl?gers Arch. 407:228-234, 1986
GNU Free Documentation License Version 1.2 November
2002
Copyright (C) 2000,2001,2002 Free Software Foundation, Inc.
59 Temple Place, Suite 330, Boston, MA 02111-1307 USA Everyone is
permitted to copy and distribute verbatim copies of this license document, but
changing it is not allowed.
0. PREAMBLE
The purpose of this License is to make a manual, textbook, or
other functional and useful document "free" in the sense of freedom: to assure
everyone the effective freedom to copy and redistribute it, with or without
modifying it, either commercially or noncommercially. Secondarily, this License
preserves for the author and publisher a way to get credit for their work,
while not being considered responsible for modifications made by others.
This License is a kind of "copyleft", which means that
derivative
works of the document must themselves be free in the same sense.
It complements the GNU General Public License, which is a copyleft license
designed for free software.
We have designed this License in order to use it for manuals for
free software, because free software needs free documentation: a free program
should come with manuals providing the same freedoms that the software does.
But this License is not limited to software manuals; it can be used for any
textual work, regardless of subject matter or whether it is published as a
printed book. We recommend this License principally for works whose purpose is
instruction or reference.
1. APPLICABILITY AND DEFINITIONS
This License applies to any manual or other work, in any medium,
that contains a notice placed by the copyright holder saying it can be
distributed under the terms of this License. Such a notice grants a world-wide,
royalty-free license, unlimited in duration, to use that work under the
conditions stated herein. The "Document", below, refers to any such manual or
work. Any member of the public is a licensee, and is addressed as "you". You
accept the license if you copy, modify or distribute the work in a way
requiring permission under copyright law.
A "Modified Version" of the Document means any work containing
the Document or a portion of it, either copied verbatim, or with
modifications and/or translated into another language.
A "Secondary Section" is a named appendix or a front-matter
section of the Document that deals exclusively with the relationship of the
publishers or authors of the Document to the Document's overall subject (or to
related matters) and contains nothing that could fall directly within that
overall subject. (Thus, if the Document is in part a textbook of mathematics, a
Secondary Section may not explain any mathematics.) The relationship could be a
matter of historical connection with the subject or with related matters, or of
legal, commercial, philosophical, ethical or political position regarding
them.
The "Invariant Sections" are certain Secondary Sections whose
titles are designated, as being those of Invariant Sections, in the notice that
says that the Document is released under this License. If a section does not
fit the above definition of Secondary then it is not allowed to be designated
as Invariant. The Document may contain zero Invariant Sections. If the Document
does not identify any Invariant Sections then there are none.
The "Cover Texts" are certain short passages of text that are
listed,
as Front-Cover Texts or Back-Cover Texts, in the notice that
says that the Document is released under this License. A Front-Cover Text may
be at most 5 words, and a Back-Cover Text may be at most 25 words.
A "Transparent" copy of the Document means a machine-readable
copy, represented in a format whose specification is available to the general
public, that is suitable for revising the document
straightforwardly with generic text editors or (for images
composed of pixels) generic paint programs or (for drawings) some widely
available drawing editor, and that is suitable for input to text formatters or
for automatic translation to a variety of formats suitable for input to text
formatters. A copy made in an otherwise Transparent file
format whose markup, or absence of markup, has been arranged to
thwart or discourage subsequent modification by readers is not Transparent. An
image format is not Transparent if used for any substantial amount of text. A
copy that is not "Transparent" is called "Opaque".
Examples of suitable formats for Transparent copies include plain
ASCII without markup, Texinfo input format, LaTeX input format, SGML or XML
using a publicly available DTD, and standard-conforming simple HTML, PostScript
or PDF designed for human modification. Examples of transparent image formats
include PNG, XCF and JPG. Opaque formats
include proprietary formats that can be read and edited only by
proprietary word processors, SGML or XML for which the DTD and/or processing
tools are not generally available, and the
machine-generated HTML, PostScript or PDF produced by some word
processors for output purposes only.
The "Title Page" means, for a printed book, the title page
itself,
plus such following pages as are needed to hold, legibly, the
material this License requires to appear in the title page. For works in
formats which do not have any title page as such, "Title Page"
means the text near the most prominent appearance of the work's title,
preceding the beginning of the body of the text.
A section "Entitled XYZ" means a named subunit of the Document
whose title either is precisely XYZ or contains XYZ in parentheses following
text that translates XYZ in another language. (Here XYZ stands for a specific
section name mentioned below, such as "Acknowledgements", "Dedications",
"Endorsements", or "History".) To "Preserve the Title"
of such a section when you modify the Document means that it
remains a section "Entitled XYZ" according to this definition.
The Document may include Warranty Disclaimers next to the notice
which states that this License applies to the Document. These Warranty
Disclaimers are considered to be included by reference in this License, but
only as regards disclaiming warranties: any other implication that these
Warranty Disclaimers may have is void and has no effect on the meaning of this
License.
2. VERBATIM COPYING
You may copy and distribute the Document in any medium, either
commercially or noncommercially, provided that this License, the copyright
notices, and the license notice saying this License applies
to the Document are reproduced in all copies, and that you add no
other conditions whatsoever to those of this License. You may not use technical
measures to obstruct or control the reading or further copying of the copies
you make or distribute. However, you may accept compensation in exchange for
copies. If you distribute a large enough number of copies you must also follow
the conditions in section 3.
You may also lend copies, under the same conditions stated above,
and you may publicly display copies.
If you publish printed copies (or copies in media that commonly
have printed covers) of the Document, numbering more than 100, and the
Document's license notice requires Cover Texts, you must enclose the copies in
covers that carry, clearly and legibly, all these Cover Texts: Front-Cover
Texts on the front cover, and Back-Cover Texts on the back cover. Both covers
must also clearly and legibly identify you as the publisher of these copies.
The front cover must present the full title with all words of the title equally
prominent and visible. You may add other material on the covers in addition.
Copying with changes limited to the covers, as long as they preserve the title
of the Document and satisfy these conditions, can be treated as verbatim
copying in other respects.
If the required texts for either cover are too voluminous to fit
legibly, you should put the first ones listed (as many as fit reasonably) on
the actual cover, and continue the rest onto adjacent pages.
If you publish or distribute Opaque copies of the Document
numbering more than 100, you must either include a machine-readable Transparent
copy along with each Opaque copy, or state in or with each Opaque copy a
computer-network location from which the general network-using public has
access to download using public-standard network protocols a complete
Transparent copy of the Document, free of added material. If you use the latter
option, you must take reasonably prudent steps, when you begin distribution of
Opaque copies in quantity, to ensure that this Transparent copy will remain
thus accessible at the stated location until at least one year after the last
time you distribute an Opaque copy (directly or through your agents or
retailers) of that edition to the public.
It is requested, but not required, that you contact the authors
of the Document well before redistributing any large number of copies, to give
them a chance to provide you with an updated version of the Document.
4. MODIFICATIONS
You may copy and distribute a Modified Version of the Document
under the conditions of sections 2 and 3 above, provided that you release the
Modified Version under precisely this License, with the Modified Version
filling the role of the Document, thus licensing distribution and modification
of the Modified Version to whoever possesses a copy of it. In addition, you
must do these things in the Modified Version:
A. Use in the Title Page (and on the covers, if any) a title
distinct from that of the Document, and from those of previous versions (which
should, if there were any, be listed in the History section of the Document).
You may use the same title as a previous version if the original publisher of
that version gives permission.
B. List on the Title Page, as authors, one or more persons or
entities responsible for authorship of the modifications in the Modified
Version, together with at least five of the principal authors of the Document
(all of its principal authors, if it has fewer than five), unless they release
you from this requirement.
C. State on the Title page the name of the publisher of the
Modified Version, as the publisher.
D. Preserve all the copyright notices of the Document.
E. Add an appropriate copyright notice for your modifications
adjacent to the other copyright notices.
F. Include, immediately after the copyright notices, a license
notice giving the public permission to use the Modified Version under the terms
of this License, in the form shown in the Addendum below.
G. Preserve in that license notice the full lists of Invariant
Sections and required Cover Texts given in the Document's license notice.
H. Include an unaltered copy of this License.
I. Preserve the section Entitled "History", Preserve its Title,
and add to it an item stating at least the title, year, new authors, and
publisher of the Modified Version as given on the Title Page. If there is no
section Entitled "History" in the Document, create one stating the title, year,
authors, and publisher of the Document as given on its Title Page, then add an
item describing the Modified Version as stated in the previous sentence.
J. Preserve the network location, if any, given in the Document
for public access to a Transparent copy of the Document, and likewise the
network locations given in the Document for previous versions it was based on.
These may be placed in the "History" section. You may omit a network location
for a work that was published at least four years before the Document itself,
or if the original publisher of the version it refers to gives permission.
K. For any section Entitled "Acknowledgements" or "Dedications",
Preserve the Title of the section, and preserve in the section all the
substance and tone of each of the contributor acknowledgements and/or
dedications given therein.
L. Preserve all the Invariant Sections of the Document,
unaltered in their text and in their titles. Section numbers or the equivalent
are not considered part of the section titles.
M. Delete any section Entitled "Endorsements". Such a section
may not be included in the Modified Version.
N. Do not retitle any existing section to be Entitled
"Endorsements" or to conflict in title with any Invariant Section.
O. Preserve any Warranty Disclaimers.
If the Modified Version includes new front-matter sections or
appendices that qualify as Secondary Sections and contain no
material copied from the Document, you may at your option designate some or all
of these sections as invariant. To do this, add their titles to the list of
Invariant Sections in the Modified Version's license notice. These titles must
be distinct from any other section titles.
You may add a section Entitled "Endorsements", provided it
contains nothing but endorsements of your Modified Version by various
parties--for example, statements of peer review or that the text has been
approved by an organization as the authoritative definition of a standard.
You may add a passage of up to five words as a Front-Cover Text,
and a passage of up to 25 words as a Back-Cover Text, to the end of the list of
Cover Texts in the Modified Version. Only one passage of Front-Cover Text and
one of Back-Cover Text may be added by (or through arrangements made by) any
one entity. If the Document already includes a cover text for the same cover,
previously added by you or by arrangement made by the same entity you are
acting on behalf of, you may not add another; but you may replace the old one,
on explicit permission from the previous publisher that added the old one.
The author(s) and publisher(s) of the Document do not by this
License give permission to use their names for publicity for or to assert or
imply endorsement of any Modified Version.
5. COMBINING DOCUMENTS
You may combine the Document with other documents released under
this License, under the terms defined in section 4 above for modified versions,
provided that you include in the combination all of the Invariant Sections of
all of the original documents, unmodified, and list them all as Invariant
Sections of your combined work in its license notice, and that you preserve all
their Warranty Disclaimers.
The combined work need only contain one copy of this License, and
multiple identical Invariant Sections may be replaced with a single copy. If
there are multiple Invariant Sections with the same name but different
contents, make the title of each such section unique by adding at the end of
it, in parentheses, the name of the original author or publisher of that
section if known, or else a unique number. Make the same adjustment to the
section titles in the list of
Invariant Sections in the license notice of the combined work.
In the combination, you must combine any sections Entitled
"History" in the various original documents, forming one section Entitled
"History"; likewise combine any sections Entitled "Acknowledgements", and any
sections Entitled "Dedications". You must delete all sections Entitled
"Endorsements".
6. COLLECTIONS OF DOCUMENTS
You may make a collection consisting of the Document and other
documents released under this License, and replace the individual copies of
this License in the various documents with a single copy that is included in
the collection, provided that you follow the rules of this License for verbatim
copying of each of the documents in all other respects.
You may extract a single document from such a collection, and
distribute it individually under this License, provided you insert a copy of
this License into the extracted document, and follow this License in all other
respects regarding verbatim copying of that document.
7. AGGREGATION WITH INDEPENDENT WORKS
A compilation of the Document or its derivatives with other
separate and independent documents or works, in or on a volume of a storage or
distribution medium, is called an "aggregate" if the copyright resulting from
the compilation is not used to limit the legal rights of the compilation's
users beyond what the individual works permit. When the Document is included in
an aggregate, this License does not apply to the other works in the aggregate
which are not themselves derivative works of the Document.
If the Cover Text requirement of section 3 is applicable to these
copies of the Document, then if the Document is less than one half of the
entire aggregate, the Document's Cover Texts may be placed on covers that
bracket the Document within the aggregate, or the electronic equivalent of
covers if the Document is in electronic form. Otherwise they must appear on
printed covers that bracket the whole aggregate.
8. TRANSLATION
Translation is considered a kind of modification, so you may
distribute translations of the Document under the terms of
section 4. Replacing Invariant Sections with translations requires special
permission from their copyright holders, but you may include translations of
some or all Invariant Sections in addition to the original versions of these
Invariant Sections. You may include a translation of this License, and all the
license notices in the
Document, and any Warranty Disclaimers, provided that you also
include the original English version of this License and the original versions
of those notices and disclaimers. In case of a disagreement between the
translation and the original version of this License or a notice or disclaimer,
the original version will prevail.
If a section in the Document is Entitled "Acknowledgements",
"Dedications", or "History", the requirement (section 4) to Preserve its Title
(section 1) will typically require changing the actual title.
9. TERMINATION
You may not copy, modify, sublicense, or distribute the Document
except as expressly provided for under this License. Any other attempt to copy,
modify, sublicense or distribute the Document is void, and will automatically
terminate your rights under this License. However, parties who have received
copies, or rights, from you under this License will not have their licenses
terminated so long as such parties remain in full compliance.
10. FUTURE REVISIONS OF THIS LICENSE
The Free Software Foundation may publish new, revised versions
of the GNU Free Documentation License from time to time. Such new
versions will be similar in spirit to the present version, but may differ in
detail to address new problems or concerns. See
http://www.gnu.org/copyleft/.
Each version of the License is given a distinguishing version
number. If the Document specifies that a particular numbered version of this
License "or any later version" applies to it, you have the option of following
the terms and conditions either of that specified version or of any later
version that has been published (not as a draft) by the Free Software
Foundation. If the Document does not specify a version number of this License,
you may choose any version ever published (not as a draft) by the Free Software
Foundation.
| 


