|
Copyright (c) Vladimir DARIC
Permission is granted to copy, distribute and/or modify this
document under the terms of the GNU Free Documentation License, Version 1.2 or
any later version published by the Free Software Foundation;
with no Invariant Sections, no Front-Cover Texts, and no
Back-Cover Texts. A copy of the license is included in the section entitled
"GNU
Free Documentation License".
Stage en laboratoire :
Etude des voies nociceptives mises en
jeu
pendant la parturition, étude
par
immunomarquage de la protéine c-Fos
sur
les coupes de la moelle épinière de la
rate
Sommaire
Stage en laboratoire : Etude des voies nociceptives mises
en jeu pendant la parturition, étude par immunomarquage de la
protéine c-Fos sur les coupes de
la moelle épinière de la rate
Introduction 4
Rôle physiologique de la Douleur 4
Physiologie de la douleur 4
Les voies périphériques 4
La moelle épinière 5
Voies ascendantes 6
Les centres supérieurs 7
Parturition 7
Origine de la douleur 8
Les voies de la douleur et la distribution lombaire des neurones
nociceptifs. 9
Changements physiologiques chez la mère et chez le
foetus: pendant la gestation et pendant
l'accouchement 10
Anesthésie et analgésie, fonctionnement,
méthodes actuelles, difficultés. 12
Matériel et méthodes .15
c-fos 15
La protéine c-Fos, est-elle un bon marqueur de
l'activité nociceptive ? 16
Avantages et inconvénients de la méthode. 16
Induction du c-fos 18
Expression spinale de la protéine
c-Fos lors de la parturition chez le rat, mise en évidence par
l'immuno-marquage 19
Etude préliminaire - Expression neuronale de la
protéine c-Fos dans la moelle épinière lors de
la parturition chez la rate primipare et multipare. 19
Expression neuronale de la protéine c-Fos dans la moelle
épinière chez la rate. 19
Animaux .20
Protocole expérimental .20
Perfusion 21
Coupes frontales de moelle épinière 21
Immunohistochimie sur coupes flottantes 21
Analyses des résultats et statistiques. 22
Résultats 24
Conclusion : 24
Epilogue .26
Etude comportementale 26
Immunohistochimie de la protéine c-Fos .27
Effets de l'ocytocine en sous-cutané sur le comportement
accompagnant la parturition. 27
Etude des effets pharmacologiques de la
morphine administrée en péridurale sur la parturition...
27
Les contrôles préliminaires 27
Etude des effets
pharmacologiques de la morphine administrée en péridurale sur la
parturition...
28
Discussion et conclusion. .29
Appendice .31
Introduction
Rôle physiologique de la Douleur
Chez l'animal la douleur joue un rôle d'alarme dans
l'adaptation. Même chez l'homme, dire cela n'est pas toujours faux.
L'expérience de la douleur va conduire, normalement, vers un
comportement qui éloignera le corps de la source du mal. La sensation
douloureuse après un traumatisme peut induire certains comportements qui
favorisent le rétablissement et la guérison : le sommeil, le fait
de se nourrir et de boire ; chez l'animal le toilettage, le léchage
etc.
Physiologie de la douleur
Chez l'homme le mot « douleur » soulève une
multitude d'aspects ; sensoriel, psychologique etc. ... Nous ne nous
intéressons ici qu'à l'aspect neurologique de la douleur,
c'est-à-dire la perception du stimulus douloureux, son transport et son
intégration par le système nerveux central.
Ainsi, on définit la douleur comme la sensation ou la
perception d'effets irritants, pénibles, lancinants ou insupportables
venant d'une partie du corps, alors que la nociception constitue le processus
sensoriel à l'origine des signaux nerveux qui la déclenchent. Les
systèmes de modulation et d'intégration, qui seront
brièvement décrits par la suite, assurent le lien entre ces deux
phénomènes. Cela veut donc dire que la nociception peut exister
sans que la douleur soit perçue. De même lorsque il y a
dysfonctionnement de ces systèmes la douleur peut apparaître
spontanément, en absence de tout stimulus nociceptif.
Les premières considérations envisageaient la
douleur comme un message sensoriel de très forte intensité. Cette
idée est en partie fausse. Lorsque les circuits spécifiques de la
nociception, et les systèmes de contrôle qui modulent en
permanence le transfert de l'information aux différents niveaux du
circuit de la douleur, ont été caractérisés, on a
commencé à envisager le message nociceptif comme étant
distinct du message sensoriel classique.
Les voies périphériques
Le message nociceptif prend naissance à la
périphérie. En 1980 Perl démontre qu'il existe plusieurs
populations de fibres périphériques qui répondent à
une stimulation douloureuse. Il est généralement admis qu'il n'y
a pas de structure bien spécifique, histologiquement bien
individualisée, pouvant être qualifiée de récepteur
nociceptif. Le message nociceptif résulte de la mise en jeu de
terminaisons libres amyéliniques constituant des arborisations
plexiformes dans les tissus cutanés, musculaires, articulaires, ainsi
que dans les parois des viscères. Les fibres qui véhiculent ce
message sont à conduction lente, et en général ils
appartiennent aux deux groupes :
Fibres Aä - faiblement myélinisées
(diamètre de 1 à 5 microns). Ces fibres sont
responsables de
la perception de la douleur rapide, bien localisée ; de type
piqûre
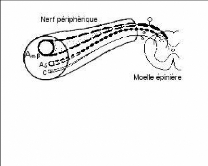
Fig 1. Fibres afférentes primaires Fibres
Aá et â - véhiculent le
message sensitif
Fibres ä et C transportent le
message nociceptif
Fibres C - non myélinisées (diamètre 0,3
à 1,5 microns), responsables de la douleur tardive, plus diffuse ; de
type brûlure
Plusieurs sous-types de ces fibres existent, mais on ne
détaillera pas leur particularités ici.
Les corps cellulaires des fibres afférentes primaires
forment les ganglions des racines dorsales ( ganglions rachidiens). Ces
neurones ont une morphologie particulière, ils n'ont pas de
prolongements dendritiques, mais seulement un axone divisé en deux
branches (neurones en T).
C'est donc au niveau du ganglion rachidien que sont
synthétisées les molécules qui transmettent le message
nociceptif au niveau de la première synapse. Pour illustrer la
diversité de neuromédiateurs existants, on peut citer :
les acides aminés excitateurs : glutamate,
aspartate
les peptides, telle la substance P, la neurokinine A, CGRP, la
galanine,
l'omatostatine, le polypeptide vaso-intestinal (VIP), la
bombesine, la neurotensine
Il est aujourd'hui banal de voir des clichés obtenus
par double marquage immunologique montrant une co-localisation de ces
molécules à l'intérieur du même neurone. Les
neuromédiateurs sont excrétés non seulement au niveau de
la moelle épinière (voie orthodromique), mais aussi au niveau des
terminaisons périphériques des fibres afférentes par le
réflexe d'axone (voie antidromique). Ainsi, on a une relation bivalente,
le stimulus nociceptif évoque un message nerveux, mais à son tour
la fibre nerveuse agit au niveau du tissu périphérique pour
éventuellement moduler le phénomène qui est à la
source du message nociceptif.
Après sa sortie du ganglion rachidien, la racine
dorsale envoie une collatérale vers le bulbe rachidien, et avant
d'entrer dans la moelle elle projette des faisceaux dans plusieurs segments
voisins, en amont et en aval de leur segment d'entré.
|
La moelle épinière
La moelle épinière a été l'objet
de nombreuses études anatomiques. Elle est formée par la
substance blanche - composée en majorité par les fibres nerveuses
- qui entoure la substance grise - constituée par les somas des
neurones. La substance grise à été subdivisée en
dix couches définies chez le chat, selon les critères
cyto-architectoniques (couches de Rexed, en 1965). La corne dorsale comprend
les couches I à VI, tandis que les couches VII à X composent la
corne ventrale (voir schéma ci-contre). Les
|
|
|
Fig 2. Couches de Rexed
Schémas représentent la subdivision de la
moelle épinière de chat, en 10 couches cellulaires distinctes (I
à X), établie par Rexed. A gauche : segment C5, au centre : le
segment T4 et à droite : le segment L7.
|
|
|
|
|
études physiologiques de la moelle confirment sans
cesse que cette division selon les critères cyto-architectoniques, a
aussi des bases fonctionnelles.
Les études anatomiques ont démontré que
les fibres afférentes primaires, C et Aä, se terminent
majoritairement dans les couches I et II. Les fibres Aä, en particulier,
projettent en général dans les couches IV-VI. La plupart des
fibres Aâ et Aä non nociceptives envoient leurs terminaisons vers
les couches III-V.
Il existe deux types de cellules qui constituent le relais
pour le message nociceptif au niveau spinal : les neurones nociceptifs
spécifiques et les neurones non spécifiques
( nommés
aussi neurones convergents ou neurones polymodaux ou encore les neurones
à large gamme réceptive - « wide dynamic range neurones
» - WDR ).
Les neurones nociceptifs spécifiques sont le
constituant majeur des couches I et II. Ces neurones sont activés
exclusivement par des fibre afférentes fines C et Aä. Pour la
stimulation cutanée, ces fibres répondent uniquement aux
stimulations mécaniques ou thermiques intenses provenant d'un champ de
récepteurs restreint. Leur réponse s'accroît avec
l'intensité de la stimulation, ce qui leur permet de coder
l'intensité du stimulus nociceptif. Néanmoins, les couches
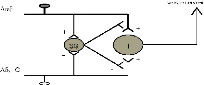
Fig 3. Gate control
Schéma de la théorie du gate control (ou
portillon) G - fibres de gros diamètre
P - fibres de petit diamètre
SG correspond a la couche de II de Rexed
T - une cellule de transmission
Ce schème permet d'expliquer comment une
stimulation sensitive permet de diminuer la sensation de douleur dans le
même zone
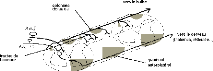
Fig 4. Voies ascendantes
:Représentation schématique de la distribution des fibres
afférentes primaires lors de leur arrivée dans la corne
postérieure et principales voies ascendantes empruntées par le
message nociceptif après relais dans la corne postérieure au
niveau des couches I, II et V.
superficielles sont formées pour une part non
négligeable par des neurones nociceptifs non spécifiques.
Les neurones nociceptifs non
spécifiques sont principalement localisés
dans les couches V-VI et autour du canal central (couche X), mais aussi, comme
il a été mentionné plus haut, dans la couche I.
Ces neurones sont activés par des
stimulations provenant de champs récepteurs assez
étendus, ils répondent à la fois à des stimulations
nociceptives et non nociceptives arrivant par des fibres Aâ, Aä et
C. Enfin, quelques neurones nociceptifs
spécifiques sont aussi présents dans
les
couches V-VI.
Il existe également des interneurones, qui communiquent
l'information, dans les deux sens, entre les couches superficielles et les
couches V-VI.
Voies ascendantes
Plusieurs observations ont très
tôt
suggéré que la douleur emprunte des voies
spécifiques dans la moelle pour atteindre les
structures supraspinales. Les patients souffrant de douleurs chroniques ont pu
être soulagés par des incisions pratiquées dans la moelle
(section du quadrant antérolatéral cf. Fig.4).
En effet deux voies spinales principales conduisent
l'informations nociceptives vers le cerveau : les voies spino-thalamique et
spinoréticulaire. Les projections collatérales que ces voies
distribuent dans des structures bulbaires mésencéphaliques et
diencéphaliques sont très nombreuses.
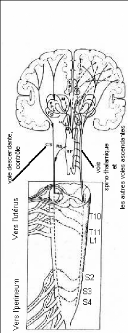
Fig 5. Voie emprunte par le message nociceptif
jusqu'aux centres supérieurs
| 


