IV.5.5 Préparation des fragments
d'immunoglobulines
IV.5.5.1 Digestion à la pepsine : fragments
F(ab')2
- Diluer ou dialyser les immunoglobulines dans du tampon
acétate de sodium 0,1 M pH 4,5 de façon à obtenir une
concentration en immunoglobulines de l'ordre de 10 mg/ml ou plus.
- Incuber 8 heures dans un bain-marie à 37 °C la so
lution d'immunoglobulines avec de la pepsine dans un rapport en poids 50:1.
- Neutraliser à pH 8 pour inactiver l'enzyme.
- Précipiter les F(ab')2 à température
ambiante : à un volume du mélange contenant les Ig, ajouter 2-3
volumes de solution de sulfate de sodium 0,25 g/ml. Centrifuger et
éliminer le surnageant.
- Laver le précipité 1 ou 2 fois avec du sulfate de
Na 0,18 g/ml.
- Dissoudre le précipité dans un petit volume de
tampon et dialyser à froid dans ce tampon : le tampon peut être du
PBS.
IV.5.5.2 Réduction des ponts disulfure : fragments
F(ab')
Elle consiste à :
- Dialyser les F(ab')2 dans du tampon acétate de sodium
0,1 M pH 5,0.
- Ajouter 0,01 à 0,015 M de mercaptoéthylamine-HCl
(ou un autre réducteur des ponts disulfure : mercaptoéthanol,
dithiothréitol, etc.).
- Incuber pendant 75-90 min à 37°C.
- Neutraliser et dialyser.
IV.5.5.3 Digestion à la papaïne : fragments
Fab
Incuber 2 heures ou plus dans un bain-marie à 37°C le
mélange suivant : Immunoglobulines, solution à 20 mg/ml dans
du tampon phosphate 0,1M à pH 7,5 : 5 ml (soit 100 mg
d'Ig)
EDTA 0,1 M : 0,12 ml (0,002 M)
L-cystéine, 0,1 M dans du tampon phosphate 0,1 M à
pH 7,5 : 0,58 ml (0,01 M) Suspension de papaïne diluée dans l'eau
à 5 mg/ml : 0,10 ml (0,5 mg)
La digestion peut être arrêtée par addition
d'iodoacétate, d'iodoacétamide, de Néthylmaléimide,
de p-chloromercuribenzoate ou d'o-iodosobenzoate à une concentration
molaire finale supérieure à celle de l'agent réducteur
utilisé (cystéine ou autre).
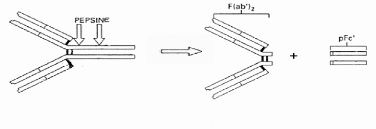
Figure 12. Représentation
schématique du clivage d'une immunoglobuline par la pepsine.
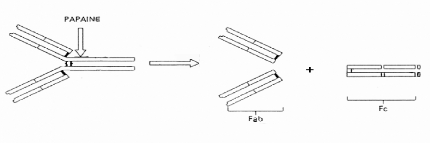
Figure 13. Représentation
schématique du clivage d'une immunoglobuline par la papaïne.
| 


