|
Ministère de l'enseignement
supérieur
Université de monastir
Institut Supérieur de Biotechnologie de
Monastir

Mémoire bibliographique
Mastère Biologie et Santé
|
La Dépression
Saisonnière:
Mécanisme et
Approches thérapeutiques
|
Présenté par:
Nawel CHAFTAR
Sujet proposé par: Pr. Naceur
BOUGHATTAS
Laboratoire de pharmacologie
Faculté de Médecine de Monastir
Année universitaire : 200 7-2008
Sommaire
Introduction
I. Définition et caractéristiques de la SAD
II. Mécanismes de changements saisonniers en SAD
1. Contribution possible de mélatonine en SAD
2. L'hypothèse de changements de phases
3. L'hypothèse de sérotonine
4. Rôle des catécholamines
5. Approche génétique
III. Approches thérapeutiques
1. Photothérapie
1.1. Simulation artificielle de l'aube 1.2. Lumière
infrarouge
2. Chimiothérapie
2.1. Tryptophane
2.2. Antidépresseurs
3. Hormonothérapie: mélatonine
4. Phytothérapie : Hypericum perforatum
Conclusion
Références bibliographiques
Liste des Abréviations
AA-NAT : Aryl-Acrylamine N- acétyl
transférase
AMPT : á-méthyl-para-tyrosine
BFR: Blind Free-Runners
DA : Dopamine
GABA : Acide gamma-aminobutyrique HIOMT
: Hydroxyindole-O-méthyltransférase
5-HT : 5-Hydroxytryptamine ou
sérotonine
5-HIAA : Acide
5-hydroxy-indolylacétique
HVA : Homovanillic acid
IR: Infra-rouge
ISRS : Inhibiteur sélectif de la
recapture de sérotonine
LCR: Liquide céphalo rachidien
MHPG: 3 -Méthoxy-4-hydroxy-phényl
éthylèneglycol
NE : Norépinephrine
NSC : Noyaux suprachiasmatiques PSH
: Phase-Shift Hypothesis SAD: Seasonal affective
disorder
SIGH-SAD: Structured Interview Guide for the
Hamilton Depression Rating-Seasonal Affective Disorder
TAS : Trouble affectif saisonnier
Trp: Tryptophane
TSH: Thyroïd stimulating hormon
INTRODUCTION
La dépression saisonnière ou «trouble
affectif saisonnier: TAS» ou «Seasonal Affective Disorder: SAD»
ou encore «bleus de l'hiver» est caractérisée par des
épisodes récurrentes d'un trouble affectif.
Le début et la rémission de ces épisodes
coïncident avec une période particulière de l'année.
Les épisodes dépressifs de SAD surviennent souvent durant
l'hiver. Ils ont des symptômes caractéristiques : fatigue,
hypersomnie, augmentation de la consommation des glucides...
Les patients sont généralement en bon état
pendant l'Eté, mais on peut noter des symptômes de manie chez
quelques uns.
De point de vue étiologie, le raccourcissement de la
photopériode pourrait être la cause de l'apparition des
symptômes au cours de l'Automne (Partonen et al.,
1997).
On se propose dans ce travail de recherche bibliographique
d'étudier dans une première partie les mécanismes de
changements saisonniers dans la dépression saisonnière, et de
déterminer dans la seconde partie les approches thérapeutiques de
cette pathologie.
I. Définition et caractéristiques de la
SAD
La dépression saisonnière est le trouble le
plus courant qui apparaît lors d'un échec d'adaptation aux
variations de l'environnement. Elle est caractérisée par des
symptômes dépressifs qui ont lieu durant la même
période de chaque année: en Automne et en Hiver (Septembre et
Octobre).
Ces symptômes font généralement leur
disparition au Printemps (en Avril ou Mai). Les symptômes
fréquemment présents sont l'humeur dépressive,
l'anxiété, le manque d'énergie, la tendance à
l'hypersomnie, une augmentation de l'appétit (avec un goût
marqué pour les hydrates de carbone: pain, pâte,
pâtisserie), un gain de poids, une difficulté de concentration,
une diminution de la libido et l'irritabilité.
Pour porter le diagnostic, les symptômes doivent
être présentes au moins pendant deux Hivers consécutifs
avec rémission (guérison) complète à
l'Eté.
Il a été suggéré que la
mélatonine, hormone circadienne, est impliquée dans le
développement de la SAD (McClung, 2007).
Les études épidémiologiques des
individus déprimés montrent que l'incidence de la SAD est de 4
à 10 % dans la population générale. Les femmes sont plus
susceptibles d'être atteintes de la dépression saisonnière
que les hommes (Miller, 2005).
II. Mécanismes de changements saisonniers en
SAD
Les modifications saisonnières de la lumière de
jour semblent influencer les changements de comportements dans la
dépression saisonnière. Plusieurs mécanismes sont mis en
jeu dans le changement saisonnier de SAD dont l'hypothèse de changement
de phase, l'implication de certaines hormones (la mélatonine, la
sérotonine et les catécholamines) et l'intervention possible d'un
facteur génétique.
Mais le mécanisme exact par lequel les symptômes de
SAD apparaissent n'est pas encore bien connu (Miller,
2005).
1. Contribution possible de mélatonine en SAD
D'après la littérature, les individus atteints
de SAD ont une période plus longue de synthèse de
mélatonine durant la nuit en Hiver. En plus, le taux de
mélatonine pendant le jour chez les individus souffrant de SAD est
élevé par rapport aux individus sains.
La synthèse de mélatonine peut aussi être
supprimé par l'application de la photothérapie pendant la
journée. Ceci peut soulager les symptômes de SAD (figure 1).
Cette information a poussé les chercheurs à penser
que la synthèse anormale de mélatonine pourrait être une
des causes de SAD (Miller, 2005).
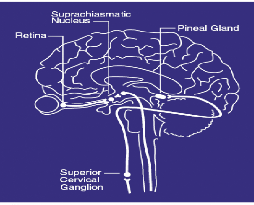
Figure 1 : Les voies nerveuses de la régulation de
synthèse de mélatonine (Miller, 2005).
La mélatonine est synthétisée dans
l'épiphyse (ou glande pinéale) par acétylation puis
méthylation de la sérotonine (figure2). Elle est
secrétée essentiellement en période nocturne.
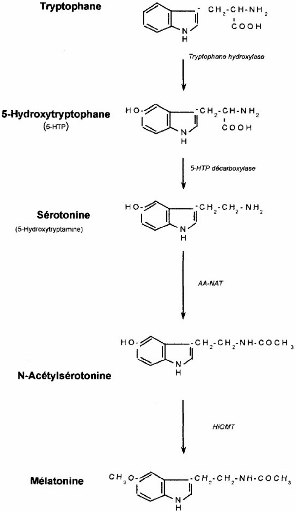
Figure 2 : Biosynthèse de la mélatonine
(Thèse : Tritschler L, 2006).
La présence de la lumière est captée par
la rétine qui transmet l'information par les voies
rétino-hypothalamiques aux noyaux suprachiasmatiques (NSC) de
l'hypothalamus, structure considérée comme l'horloge interne ou
«pacemaker» générant la rythmicité des fonctions
biologiques notamment les rythmes circadiens. Des voies noradrénergiques
projettent ensuite via le ganglion cervical supérieur vers
l'épiphyse. La mélatonine est secrétée selon un
rythme circadien. Son taux plasmatique commence à s'élever en fin
de journée, atteint son pic en milieu de nuit, puis diminue et reste
très faible dans la journée. On lui attribue un rôle dans
la synchronisation des rythmes circadiens (Even, 2001 ; Pandi-Perumal
et al., 2007).
Chez les patients atteints de SAD, on note un retard dans la
sécrétion de mélatonine pendant la nuit. Wehr et al. ont
trouvé que la période nocturne de sécrétion de
mélatonine chez les femmes déprimées est augmentée
pendant l'Hiver par rapport à celle de l'Eté. Par contre les
femmes normales (sans SAD) n'ont pas cette variation saisonnière de la
synthèse de mélatonine.
Le mécanisme par lequel ce changement circadien
provoque les symptômes de SAD n'est pas encore bien connu
(Miller, 2005).
2. L'hypothèse de changement de phase (PSH)
Les NSC de l'hypothalamus contrôlent les rythmes
circadiens de l'organisme. On a montré que le début de
sécrétion de mélatonine peut être retardé
chez les patients déprimés par rapport aux contrôles. Il se
peut que les patients atteints de SAD ont une autre réponse hormonale ou
une réaction négative inconnues vis à vis ce changement
normal de phases.
Lewy et Sack sont les premiers à émettre
l'hypothèse de changement de phase dans la dépression
saisonnière.
Avery et al. ont étudié le rythme circadien de
température, de cortisol et de TSH (thyroïd stimulating hormon)
chez 6 patients atteints de SAD et 6 contrôles avant et après
traitement par photothérapie le matin. Le minimum de la
température du corps durant la nuit était retardé chez le
groupe atteints de SAD par rapport aux contrôles (5 :42 am au lieu de 3
:16 am), mais il a été corrigé après le traitement
par la photothérapie.
De même le creux de cortisol durant la nuit était
en retard de phase; le traitement par la photothérapie le corrige aussi.
Par contre le taux de TSH ne présente pas de différence
significative avant et après la photothérapie.
En plus de la mélatonine, il apparaît donc que la
température nocturne de l'organisme et d'autres hormones (cortisol) sont
aussi en retard de phase dans la dépression saisonnière
(Miller, 2005).
3. L'hypothèse de sérotonine
Outre l'approche de la mélatonine et de PSH, des
recherches ont été réalisées dans un but de
déterminer la variation des taux de sérotonine (5-HT) chez les
sujets déprimés et les sujets normaux.
Comme la sérotonine est un précurseur de la
mélatonine et est en plus impliquée dans le fonctionnement
cérébral, il est donc plausible qu'un taux faible de
sérotonine dans le cerveau participe à l'apparition des
symptômes de la SAD. De plus, les patients atteints de SAD ont tendance
à exprimer une hyperphagie avec un besoin pathologique de consommation
des carbohydrates. Ce sont des symptômes typiques engendrés par
une insuffisance de sérotonine dans le cerveau.
On a suggéré que la consommation
élevée de carbohydrates chez les patients atteints de SAD peut
être un mécanisme pour stimuler la synthèse et la
libération de sérotonine (Neumeister, 1998;
Miller, 2005).
Il existe une méthode de recherche pour
déterminer si la sérotonine est impliquée dans la
dépression saisonnière : c'est la déplétion de
tryptophane (Miller, 2005). Il s'agit d'un régime
très pauvre en tryptophane (trp), il conduit à une diminution
marquée de la synthèse de sérotonine centrale et donc de
la neurotransmission sérotoninergique (Even, 2001).
Les études réalisées chez l'animal et
l'Homme montrent que la diminution de précurseur de la
sérotonine, en l'occurrence le trp, entraîne des changements de
comportement typiques à celle de diminution de sérotonine
(dépression, anxiété, augmentation de besoin de
carbohydrates, hypersomnie...)
De ce fait, Neumeister et al. ont conclu que le soulagement
des symptômes de SAD par photothérapie et pendant l'Eté
doit être le résultat d'une activité du système
sérotoninergique.
Un autre cofacteur de la synthèse de sérotonine
peut être impliqué dans la dépression saisonnière.
Hoekstra et al. ont étudié l'effet de la photothérapie sur
le trp, la bioptérine, et la néoptérine chez 19
patients.
La bioptérine est un cofacteur indispensable pour la
conversion de trp en sérotonine par la tryptophane hydroxylase. Quant
à la néoptérine, c'est un marqueur de cellules
immunitaires.
Cette étude a trouvé un taux significativement
bas de trp et de bioptérine dans le plasma et un taux
élevé de néoptérine chez les déprimés
par rapport aux contrôles.
Après traitement par photothérapie, le taux de
bioptérine devient normal mais diminue encore pendant l'Eté. Le
niveau de néoptérine ne change pas après
photothérapie tandis que le taux de trp n'atteint pas son niveau
normal.
Les auteurs ont suggéré que le taux bas de
bioptérine et le niveau important de néoptérine
prédisposent les patients pour une rechute pendant l'Hiver suivant
(Miller, 2005).
4. Rôle des catécholamines
Comme pour les autres formes de dépression, il se peut
qu'il y ait un dysfonctionnement du système catécholaminergique
chez les patients atteints de SAD. L'implication des catécholamines
n'est pas encore bien établie comme celle de mélatonine ou de
sérotonine. Mais on a trouvé des taux faibles de
norépinephrine (NE ou noradrénaline) chez les sujets atteints de
SAD. D'après les travaux de Neumeister, l'administration d'un inhibiteur
de la tyrosine hydroxylase, qui bloque la synthèse de
catécholamines, a entrainé la réapparition de
symptômes de la SAD chez les patients déjà traités
par photothérapie et guéris (Miller, 2005). La
réduction de dysfonctionnement dopaminergique dans le SAD est
supportée par la présence de taux anormalement
élevés de prolactine dans le sérum pendant l'Hiver et
l'Eté, et par la diminution de réponse aux changements de chaleur
en Hiver. La diminution de la vitesse de clignement des yeux est aussi un signe
de diminution de taux de dopamine (DA). Les patients atteints de SAD
présentent un taux faible de NE par rapport aux contrôles; le taux
de NE augmente après le traitement par photothérapie (Lam
et al.,2001).
Le taux des catécholamines peut être
manipulé expérimentalement par
l'á-méthyl-paratyrosine (AMPT).
L'AMPT réduit la synthèse de NE et de DA en
inhibant de manière réversible l'enzyme limitante, la tyrosine
hydroxylase, et bloquant ainsi la conversion de tyrosine en L-dopa. Une dose de
3g/jour d'AMPT peut diminuer le taux de
3-méthoxy-4-hydroxy-phényl éthylèneglycol (MHPG: un
métabolite de NE) dans l'urine jusqu'à 70% et le taux de l'acide
homovanillique (HVA: métabolite de DA) dans le liquide
céphalorachidien (LCR) jusqu'à 60%, mais sans aucun effet sur le
taux de l'acide 5-hydroxy-indolylacétique (5-HIAA : un métabolite
de 5-HT) dans le LCR.
La réduction des catécholamines est maximale
après administration d'AMPT pendant 2 à 3 jours; les
concentrations se normalisent au bout de 2 à 3 jours après
l'arrêt de l'AMPT (Lam et al., 2001).
La dépletion de trp et des catécholamines permet
d'évaluer le rôle des systèmes sérotoninergiques et
catécholaminergiques, respectivement, dans la
pathogénicité de la depression et dans les mécanismes de
traitements par les antidépresseurs.
Les 2 systèmes sérotoninergique et
catécholaminergique interfèrent l'un avec l'autre. En effet, il y
a une interconnection anatomique et fonctionnelle entre la region
sérotoninergique et la region catécholaminergique. Les
études physiologiques ont montré que la transmission
sérotoninergique est contrôlée partiellement par le
système catécholaminergique. On a noté la présence
des troubles dans les intéractions des deux systèmes chez les
patients atteints de SAD. Il est possible que la photothérapie agit en
rétablissant les intéractions entre ces deux systèmes. Ces
études montrent qu'il n'est pas exclu la possibilité
d'implication d'autres systèmes neurobiologiques ( Neumeister et
al., 1998 ; Lam et al.,2001).
5. Approche génétique
La présence des symptômes psychiatriques chez les
membres d'une famille fait appel à un questionnaire de diagnostic et de
recherche des antécédents familiaux. Ceci permet d'établir
des rapports psychiatriques appropriés. 65 % des patients atteints de
SAD avaient des membres de la famille avec des désordres psychiatriques
et 27 % avaient des parents avec des troubles de l'humeur.
Les limitations de cette étude sont la petite taille du
groupe d'étude et le manque d'informations sur les membres de la famille
des patients.
La sérotonine est impliquée dans la
pathogénicité de la SAD. Donc les récepteurs de la
sérotonine sont d'une importance potentielle dans le mécanisme de
la SAD. Ozaki (en 1996) a étudié les récepteurs 5-HT dont
les gènes ont été clonés. Il s'agit de 5-HT2A,
5-HT1A, 5- HT1B, 5-HT1D, 5-HT1E et 5-HT2C. Il a effectué un
dépistage «screening » par l'analyse de polymorphisme des
gènes des récepteurs de la sérotonine.
Il n'y avait aucune différence significative dans les
fréquences de n'importe quel allèle étudié ou des
génotypes entre les patients atteints de SAD et les contrôles
(Sher L, 1999).
Plusieurs études génétiques sur l'Homme
ont montré l'implication des gènes spécifiques qui
régulent l'horloge moléculaire en cas de troubles mentaux. Par
exemple la substitution d'un acide aminé sur la protéine Npas2
(471 Leu/Ser) est associée avec le développement de SAD
(McClung, 2007).
III. Approches thérapeutiques
1. Photothérapie
La photothérapie a été utilisée
depuis plus de 20 ans pour le traitement de SAD, avec une efficacité
comparable aux antidépresseurs (McClung, 2007).
La théorie originale sur laquelle était
basée cette méthode est que: la photothérapie peut
provoquer une normalisation de changements de phases (retard de phase) produits
chez les patients déprimés. On a pensé de prolonger la
photopériode pendant l'Hiver. La photothérapie a
été aussi utilisée afin de supprimer la
sécrétion de mélatonine par la glande pinéale.
Quelque soit le mécanisme d'action de la
photothérapie, il a été montré qu'il s'agit d'une
méthode efficace pour le traitement de la SAD. Cette méthode
présente 70% de réponses positives avec des effets secondaires
très rares (Miller, 2005).
On pense que la photothérapie agit en modifiant
l'expression du gène circadien «CLOCK»; l'application de la
photothérapie le matin produira une avance de phase des rythmes, tandis
que l'exposition à la lumière le soir engendre un retard de
phase.
La puissance de la photothérapie comme étant un
traitement efficace pour un large spectre de troubles dépressifs se
résume en 4 caractères : il s'agit d'une méthode qui ne
présente pas de risques, avec peu d'effets indésirables,
relativement facile à utiliser, et non invasive (McClung, 2007;
Miller, 2005).
Le traitement par photothérapie standard exige une
exposition à une lumière de 10.000 lux le matin après le
réveil pendant 30 à 90 min. La réponse au traitement
s'observe après 2 à 4 semaines de photothérapie (figure
3).

Figure 3 : Photothérapie (http ://
www.solvital.fr/index.asp?ID=440&IDF=8).
Des études indiquent que certaines longueurs d'ondes de
la lumière sont plus efficaces que d'autres dans la réponse
thérapeutique avec moins d'effets secondaires. Ceci peut être
dû aux capacités de certaines longueurs d'ondes de la
lumière de contrôler les rythmes circadiens.
Des études récentes montrent que le spectre bleu
de lumière (446 - 477nm) a plus d'effets sur la suppression de
mélatonine (McClung, 2007).
La photothérapie avec une intensité importante
de lumière (Bright light therapy) à 2500 lux pendant 2 heures (de
6 à 8h du matin) règule la température corporelle, le
cortisol et l'humeur durant une étude de 4 semaines (Miller,
2005).
Pour de nombreux patients, le fait de s'asseoir devant une
lampe de photothérapie pour 30 min à 2h chaque jour est un
problème. Des chercheurs à Basel, Switzeland, ont
étudié les effets de lumière artificielle (de 2800 lux
×30 min/jour) et celle d'une marche pendant une heure sous la
lumière naturelle chaque jour. Le groupe de la lumière naturelle
a un résultat meilleur par rapport à celui du groupe de la
lumière artificielle selon SIGH-SAD après une semaine. Le groupe
de marche reste moins de temps dans la chambre, se réveille plus
tôt et diminue les besoins en carbohydrates (Miller,
2005).
Le SIGH-SAD (Structured Interview Guide from Hamilton
Depression Rating for Seasonal Affective Disorder) est une version de
l'échelle de Hamilton adaptée aux dépressions
saisonnières. Il a été développé et est
aujourd'hui l'instrument le plus utilisé pour l'évaluation des
taux de rémissions. Cet instrument adapté de l'échelle de
Hamilton a 21 items auxquels sont associés 8 items évaluant les
symptômes atypiques (Even, 2001).
1.1. Simulation artificielle de l'aube
Un autre aspect de la photothérapie, c'est le
«down simulation » ou simulation artificielle de l'aube. C'est un
autre moyen de remédier, sans médicaments, aux troubles
évoqués.
Le simulateur de l'aube recrée les conditions
naturelles du réveil, en éclairant de façon graduelle la
chambre à coucher, par imitation du lever de soleil. L'horloge
biologique entre généralement en régulation avec l'aube.
Le simulateur recrée donc artificiellement ce "signal de l'aube" (figure
4).

Figure 4: simulateur de l'aube
(http
://
www.solvital.fr/index.asp?ID=439&F1=Simulateur%20d'aube).
A l'heure H moins 15, 30 ou 45 minutes selon l'option choisie,
le simulateur commence à éclairer la chambre d'une très
faible lumière orangée, imitant le lever du soleil.
Cette lumière est suffisante pour transmettre au
cerveau l'information que le jour est en train de se lever et organiser la
transition hors du sommeil. La production de mélatonine
décroît dans les minutes qui suivent.
Quand la lumière augmente encore un peu,
l'activité spécifique du cerveau qui caractérise le
sommeil entame elle aussi sa transition vers le mode du sommeil léger,
puis du réveil complet. Le réveil se fait naturellement, et en
douceur.
Pour le soir, le simulateur de l'aube produit l'effet inverse.
Il simule le crépuscule, la lumière diminuant progressivement,
pour atteindre finalement l'obscurité totale. Le simulateur de l'aube
assure donc une bonne synchronisation de l'horloge biologique, une transition
synchronisée d'un état vers l'autre, entre le sommeil et
l'éveil.
Son effet sur la dépression saisonnière a
été prouvé. D'anciennes études faisaient
état de son efficacité dans le traitement de la dépression
saisonnière, l'augmentation de l'énergie, l'amélioration
de l'humeur (Miller, 2005).
Lors de l'étude menée par Avery en 2001 aux
États-Unis, un total de 95 patients a été réparti
en trois groupes. 31 patients se sont réveillés avec un
simulateur de l'aube (luminosité croissante jusqu'à 250 lux), 33
patients ont reçu le matin une photothérapie classique d'une
durée de 30 minutes (luminosité de 10.000 lux) et 31 patients ont
été exposés à un placebo (une faible lumière
rouge de 0,5 lux) durant six semaines. Le groupe soumis à la simulation
de l'aube a obtenu la plus grande réduction des symptômes de
dépression, et les plus forts indices de rémission
(Miller, 2005).
Une autre étude montre une amélioration du
réveil et réduction de la somnolence le matin avec la simulation
artificielle de l'aube chez 55 sujets atteints de SAD (Avery et al.,
2002).
1.2. Lumière infrarouge
Le rayonnement infrarouge (IR) est à côté
de la lumière visible dans le spectre électromagnétique du
soleil. La lumière visible a une longueur d'onde de 0.4 à 0.75
ìm, celle du rayonnement IR est de 0.75 à 1000 ìm. Inoue
et kabaya (1989) ont considéré que la lumière IR est
biologiquement active si la longueur d'onde est de 4 à 16ìm, car
ce
rayonnement peut faciliter la croissance, réguler le
sommeil, et assurer la fluidité (exemple: la circulation sanguine) chez
le Rat.
De plus, il a été montré que le
rayonnement IR facilite la guérison des blessures, supprime la
croissance des tumeurs, et peut soulager certains types de douleurs. Etant
donné que les douleurs chroniques et psychogéniques
étaient en rapport avec les dépressions, il est nécessaire
de voir si les rayonnements IR sont efficaces dans le traitement des
dépressions.
Dans le test de la natation forcée (forced swim test)
développé par Porsolt et al. (1977) et pratiqué chez la
Souris, le temps de l'immobilité (the immobility time) de la souris
était considéré comme la mesure de la
dépression.
L'immobilité indique que l'animal ne fait plus d'effort
pour échapper à l'eau et que c'est le signe de
«désespoir comportemental » ou «impuissance ».
Le temps de l'immobilité dans ce test était
réduit par différents types d'antidépresseurs.
Cet effet spécifique des antidépresseurs montre
la validité du model animal dans la dépression; ce test de
sélection ou « screening » était largement
utilisé pour évaluer l'effet de plusieurs
antidépresseurs.
Il a été noté que l'exposition
journalière aux rayonnements IR pendant 60 min durant 4 semaines en
Hiver réduit le temps d'immobilité dans le test forcé de
natation. Ceci suggère que les rayonnements IR ont un effet
antidépresseur potentiel.
L'effet antidépresseur de l'IR a été
comparable à celui de la photothérapie et des médicaments
antidépresseurs.
Ce résultat encourage des études ultérieures
pour l'application de l'IR en tant que traitement antidépresseur chez
l'Homme (Tsai et al., 2007).
2. Chimiothérapie
2.1. Tryptophane
Dans une étude, l'effet du traitement par trp (2 g X
2/jour, ou 2 g X 3/jour s'il n'y a pas de réponse) a été
comparé à celui de la photothérapie (10.000 lux, 30
min/jour, le matin).
Vers la fin de la 7ème semaine, les
réponses étaient similaires dans les deux groupes, sans aucune
différence significative entre eux. Par contre, quand la
photothérapie est interrompue, les patients rechutent rapidement, tandis
que ceux traités par trp ont des pourcentages faibles de rechute
(Miller, 2005).
2.2. Antidépresseurs
Deux inhibiteurs sélectifs de la recapture de la
sérotonine (ISRS), la fluoxétine et la sertraline, ont
démontré leur efficacité dans la dépression
saisonnière lors d'essais contrôlés, randomisés en
double aveugle versus placebo. La fluoxétine s'est montrée aussi
efficace que la photothérapie à 5 semaines lors d'une
étude comparant directement ces deux traitements. Ces médicaments
constituent l'alternative thérapeutique en cas d'échec de la
photothérapie dans la dépression saisonnière
(Even, 2001).
Le bupropion est un antidépresseur qui agit sur les
systèmes dopaminergiques et noradrénergique, il présente
quelques bénéfices pour les patients de SAD (Lam et al.,
2001).
L'agomélatine est un agoniste puissant de
récepteur de mélatonine et un antagoniste de récepteur de
sérotonine 5-HT2C. L'agomélatine est efficace dans le
modèle animal de dépression, et dans d'autres essais cliniques
impliquant des sujets déprimés. L'agomélatine semble avoir
le moins d'effets secondaires par rapport aux antidépresseurs. Il permet
de soulager les troubles de sommeil associés à la
dépression et qui peuvent être aggravés par certains types
d'ISRS. Grâce à ses propriétés pharmacologiques,
l'agomélatine est capable de resynchroniser les rythmes circadiens de la
température centrale, du cortisol, et d'autres hormones chez l'animal et
chez l'Homme; ce qui permet de montrer quelques aspects de son effet
thérapeutique.
L'agomélatine est plus efficace que la
mélatonine dans l'amélioration de l'humeur dépressive chez
les animaux; ceci suggère que l'action thérapeutique de
l'agomélatine n'est pas due seulement à son action sur les
récepteurs de la mélatonine.
L'agomélatine semble ne pas avoir un effet sur la
transmission centrale de sérotonine ou sur la densité et le
fonctionnement de récepteur 5-HT1A.
Par contre ses effets sur les récepteurs 5-HT2C
augmentent la transmission dopaminergique et noradrénergique au niveau
mésolimbique, un effet observé également avec les ISRS.
De plus, administré chroniquement, l'agomélatine
implique une neurogenèse au niveau de l'hippocampe, comme les autres
antidépresseurs.
L'action thérapeutique de l'agomélatine dans le
traitement de la dépression reste incertaine et peut impliquer les
récepteurs 5-HT2C et les récepteurs de la mélatonine
(McClung, 2007; Hamon, 2006).
3. Hormonothérapie: Mélatonine
La dépression saisonnière est un désordre
psychiatrique dû à la désynchronisation de la
rythmicité circadienne de plusieurs marqueurs physiologiques (tels que
le cortisol, la température et la mélatonine); d'où
l'apparition de l'hypothèse de changement de phase (PSH).
La mélatonine est idéale dans la
resynchronisation de ces marqueurs, car son rythme circadien est maintenu par
la photopériode. En effet, plusieurs études ont montré que
l'administration de la mélatonine le matin ou le soir chez les patients
atteints de SAD ne présente pas d'effets thérapeutiques
bénéfiques, mais peut induire un changement de phase.
Pour accomplir ce but, la mélatonine doit être
prise à la moitié opposée de la photopériode
où la photothérapie est prévue: en conséquence, la
plupart des patients atteints de SAD (qui sont en retard de phase) doivent
préférentiellement répondre à l'administration de
mélatonine l'après-midi ou le soir (qui cause des avances de
phase) ( Lewy et al., 2006b).
Les recherches de Lewy et al. ont mis en évidence
l'efficacité de la mélatonine dans l'entraînement des
rythmes biologiques chez des aveugles en libre cours (BFR: Blind
FreeRunners).En effet, des faibles doses de mélatonine (0.3 - 0.5 mg)
sont efficaces pour l'entraînement des BFR.
L'efficacité de changement de phase à partir de
très faibles doses est augmentée s'il y a une continuité
(un chevauchement) entre les niveaux de mélatonine exogènes et
endogènes.
Le principe de chevauchement repose sur le fait que le taux de
mélatonine exogènes devrait être continu avec le
début ou avec la fin du profil de mélatonine endogène,
ainsi un signal de mélatonine est fourni chaque jour aux
récepteurs de NSC.
Par exemple, l'administration d'une faible dose 8 h
après le temps de réveil habituel produit un signal
précoce de la production de mélatonine. Cependant, il devrait
être suivi par 1 à 3 doses semblables données tous les 2 h
pour fournir des niveaux de mélatonine continuellement
élevés qui chevauchent avec ceux du début de
mélatonine endogène (Lewy et al.,2006a).
Bien que plus d'études soient nécessaires, ces
données suggèrent que la plupart des patients atteints de SAD
puissent profiter d'une faible dose appropriée de mélatonine
prise l'après-midi ( Lewy et al., 2006b).
4. Phytothérapie : Hypericum perforatum
L 'Hypericum perforatum, appelée encore Herbe
aux mille trous, ou Herbe percée, ou Barbe de Saint Jean (St.John's
Wort: SJW). Connue en France sous le nom de millepertuis, du fait de ses
feuilles qui, par transparence apparaissent comme percées de minuscules
petits trous. Abandonné au XIX ème siècle, le millepertuis
est actuellement réhabilité grâce à la recherche qui
a démontré son efficacité dans diverses pathologies
(figure 5). Le millepertuis a été utilisé avec
succès dans plusieurs études de traitement de la
dépression. Dans une étude, un extrait (900 mg/jour) a
été combiné avec la photothérapie (soit 300 ou 3000
lux × 2h/j) chez 20 patients. Une réponse antidépresseur
significative a été notée chez les deux groupes avec
amélioration des symptômes qui accompagnent la maladie tels que :
fatigue, dépression, anxiété, léthargie,
appétit, libido et troubles de sommeil; ceci témoigne de l'effet
antidépresseur efficace de cet extrait végétal chez les
sujets atteints de SAD (Miller, 2005).

Figure 5 : Hypericum
perforatum
(
http://fr.wikipedia.org/wiki/Millepertuis
perfor%C3%A9)
Le millepertuis était utilisé tout seul dans le
cadre d'une étude durant 4 semaines en utilisant 900 mg d'un extrait
standardisé/jour. Son utilisation était associée avec une
amélioration dans le score de Hamilton (Kasper,
1997).
Aucun effet supplémentaire après addition de la
photothérapie n'a été observé au cours du
traitement.
Quand le millepertuis était comparé à la
fluoxetine, les résultats étaient similaires.
Wheatstone a étudié le millepertuis (300 mg
d'extrait standardisé × 3 fois/jour) chez 168
patients atteints
de SAD; il a comparé les résultats à ceux de l'extrait
végétal couplé à la
photothérapie. Il a noté une réduction
significative dans le score de Hamilton dans les deux groupes, sans aucune
différence entre les deux méthodes. En Allemagne, par exemple, le
millepertuis est l'antidépresseur le plus consommé. Son mode
d'action dans ce domaine est remarquable ; alors que les antidépresseurs
chimiques n'agissent que sur une voie biochimique. Le millepertuis agit non
seulement sur la régulation de la sérotonine, comme la plupart
des substances chimiques, mais également sur d'autres neurotransmetteurs
: la noradrénaline, la dopamine et l'acide gamma-aminobutirique (GABA).
L'effet se manifeste assez rapidement, 10 à 15 jours seulement
après le début du traitement (Miller, 2005).
Conclusion
Un pourcentage important de la population scandinave et
américaine, surtout dans les latitudes nordiques, est affecté
négativement par le raccourcissement des jours pendant l'Hiver. Quelques
uns sont affectés moyennement, tandis que d'autres sont
sérieusement touchés par ces changements saisonniers, qui
engendrent la dépression, l'hypersomnie, l'hyperphagie, la prise de
poids et la perte de libido.
La SAD est caractérisée par une
désynchronisation des rythmes biologiques (retard de phase). Le
changement de la photo phase est responsable de l'apparition des
symptômes de ce désordre psychologique.
Plusieurs hypothèses existent et concernent le mauvais
fonctionnement neuro-endocrinien et biochimique qui apparaît chez les
patients atteints de SAD.
Quelques soit les causes biochimiques de SAD, il existe des
remèdes naturels et bien développés.
En effet, la dépression saisonnière est l'un des
troubles dans lequel le traitement de choix est naturel et non invasif: c'est
la photothérapie.
La photothérapie est facilement administrée,
efficace, et sans effets secondaires.
Les individus qui ne répondent pas totalement à
la photothérapie, ou pour ceux qui trouvent que la photothérapie
est lourde ou inefficace, le traitement par le millepertuis a été
montré efficace pris tout seul ou associé à la
photothérapie.
Il est à noter que le millepertuis peut intéragir
avec de nombreux médicaments; c'est pour quoi il faut prendre en
considération tout autre traitement médicamenteux.
La sérotonine pourrait aussi soulager les patients
atteints de SAD mais cela reste à prouver par la recherche.
Le traitement par la mélatonine n'est pas très
développé et doit être utilisé avec prudence.
Références bibliographiques
A
Avery DH, Kouri ME, Monaghan K, Bolte MA, Hellekson C, Eder D.
Is dawn simulation effective in ameliorating the difficulty awakening in
seasonal affective disorder associated with hypersomnia? J Affect Disord
2002; 69 : 231-236.
E
Even C. Photothérapie.Encycl Med Chir 2001
;37-480-A-10: 1-6.
H
Hamon M and Millan MJ. Agomelatine, a novel pharmacological
approach to treating depression. European Neuropsychopharmacology
2006; 16: Pages S337-S338.
K
Kasper S. Treatment of seasonal affective
disorder (SAD) with hypericum extract. Pharmacopsychiatry 1997;
30 Suppl 2 : 89-93.
L
Lam RW, Tam EM, Grewal A, and Yatham LN. Effects of
Alpha-Methyl-Para-TyrosineInduced Catecholamine Depletion in Patients with
Seasonal Affective Disorder in Summer Remission. Neuropsychopharmacology
2001 ; 25 :S5.
Lewy A, Emens J, Jackman A, and Yuhas K. Circadian uses of
melatonin in humans. Chronobiology International 2006a; 23
:403-412.
LewyA, Lefler BJ, Emens JS, and Bauer VK. The circadian basis of
winter depression. PNAS 2006b; 103 : 7414-7419.
M
McClung CA. Circadian genes, rythms and the biology of mood
disorders. Pharmacology and Therapeutics. 2007; 114 : 222-232.
Miller AL. Epidemiology, Etiology, and Natural Treatment of
Seasonal Affective Disorder. Alternative Medicine Review 2005; 10:
5-13.
N
Neumeister A; Turner EH; Matthews JR; Postolache TT; Barnett
RL; Rauh M; Vetticad RG; Kasper S; Rosenthal NE. Effects of Tryptophan
Depletion vs Catecholamine Depletion in Patients With Seasonal Affective
Disorder in Remission With Light Therapy. Arch Gen Psychiatry 1998 ;
55 : 524- 530.
P
Pandi-Perumal R S, Smits M, Spence W, Srinivasan V, Cardinali
DP, Lowe AD, Kayumov L. Dim light melatonin onset (DLMO): a tool for the
analysis of circadian phase in human sleep and chronobiological disorders.
Progress in Neuro-Psychopharmacology & Biological Psychiatry 2007
; 31: 1-11.
Partonen T, Vakkuri O, and Lö nnqvist J. Suppression of
melatonin secretion by bright light in seasonal affective disorder. Boil
Psychiatry 1997 ; 42 : 509-513.
S
Sher L, Goldman D, Ozaki N, Rosenthal NE. The role of genetic
factors in the etiology of seasonal affective disorder and seasonality.
Journal of Affective Disorders 1999 ; 53: 203- 210.
T
Tritschler L. Comprendre le fonctionnement de l'horloge
circadienne par l'étude de trois de ses sorties : les rythmes de
sécrétion de mélatonine et de corticostérone, et le
rythme d'activité locomotrice 2006. Thèse pour l'obtention du
titre de Docteur d'université en Neurosciences de l'Université
Louis Pasteur de Strasbourg Faculté des Sciences de la Vie.
Tsai JF, Hsiao S, Wang SY. Infrared irradiation has potential
antidepressant effect. Progress in NeuroPsychopharmacology and Biological
Psychiatry 2007 ; 31:1 379-1400.
Références
électroniques
Figure 3 :
http://www.solvital.fr/index.asp?ID=440&IDF=8
Figure 4 :
http://www.solvital.fr/index.asp?ID=439&F1=Simulateur%20d'aube
Figure 5 :http ://
fr.wikipedia.org/wiki/Millepertuis
perfor%C3%A9
| 


