CHAPITRE III. MATERIEL ET METHODES
III.1 SITE ET PROGRAMME D'ECHANTILLONNAGE
Notre étude a été menée au lac
Kivu dans le bassin Est au large de Kibuye. La prise des échantillons
régulière a couvert la période allant du 12/04/2005 au
25/10/2005. Elle a été effectuée à un rythme
bimensuel, soit 2 fois par mois entre 11h et 13h. Deux cycles de 24h ont
également été réalisés en
échantillonnage ponctuel le 25/10/2005, en période de pleine
lune, et le 08/11/2005, en période de nuit sans lune. Le site
d'échantillonnage a été choisi dans la zone
pélagique aux cordonnées suivantes : 02°03'10,7» de
latitude Sud et 29°18'50,7» de longitude Est. Les différentes
dates de nos sorties sur le terrain et les types d'échantillons
collectés sont repris dans l'annexe 10.
III. 2 LE MATERIEL
Le matériel utilisé est composé de :
· Filet à plancton (100u de maille) ;
· Disque de Secchi ;
· Bouteille de Van Dorn de 4 L
· Profileur multisonde (Hydrolab ® datasonde 4A) ;
· Microscope optique (marque WARD'S) ;
· Bouteilles en verre de 250 ml ;
· Flacons en plastique de 20ml ;
· Pipette pasteur graduée ;
· Cellule à numération (fabrication locale)
;
· Seringue
· GPS
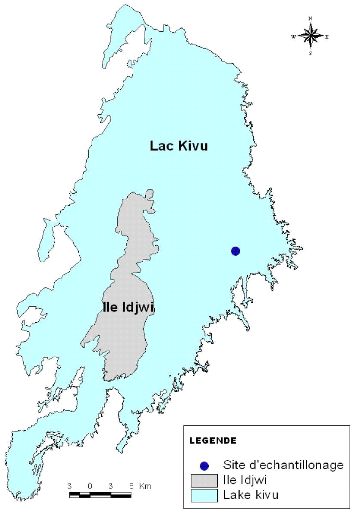
Figure VI : Localisation du site
d'échantillonnage (centre GIS, 2005)
III. 3 METHODOLOGIE
III. 3. 1 TECHNIQUES D'ECHANTILLONNAGE III.3.1.1 LE
ZOOPLANCTON
a) Echantillonnage de routine
A chaque sortie, un trait au filet à plancton (maille
de 100um, surface d'ouverture de 0,18 m2) a été
effectué verticalement sur une colonne d'eau de 60m de hauteur. Cette
colonne d'eau a été subdivisée en trois strates de 20 m
chacune (c'est-à-dire 0-20 m, 20- 40 m, 40-60 m). De cette façon,
la strate supérieure (0-20 m) correspond toujours à la zone de
mélange, la strate intermédiaire (20-40 m) correspond au
métalimnion durant la saison des pluies ou couvre une partie de la zone
de mélange durant la saison sèche, la strate profonde est
rarement incluse dans la zone de mélange (ISUMBISHO et al.,
2006). Lors de chaque prélèvement, un volume de 3,62
m3 était filtré.
En effet :
· L'ouverture du filet (diamètre ; D) est de 0,48
m
· La surface ainsi décrite est égale à
: S = (D/2)2 x 3, 14 = 0,180864 m2 La hauteur d'eau parcourue (h)
est de 20 m pour chaque strate
· Le volume filtré est donc égal à : V
= S x h = 0,180864 m2 x 20 m = 3, 61728 m3 L'échantillon
était recueilli dans un pot de 250ml.
Pour prélever le zooplancton, le filet était
descendu verticalement à l'aide d'une corde graduée, l'ouverture
vers le haut, jusqu'à la profondeur voulue. Nous le relevions ensuite
jusqu'à balayer une couche de 20m de hauteur. A cette deuxième
profondeur, un messager était envoyé pour fermer le filet qui
était ensuite remonté jusqu'à la surface de l'eau (dans la
pirogue). Après rinçage de la toile du filet,
l'échantillon contenu dans le collecteur (environ 150 ml) était
recueilli dans une bouteille en verre bien étiquetée (date et
strate de provenance) puis nous y ajoutions du formol 40% jusqu'à une
concentration finale de 4%, comme proposé par HANEY et HALL (1973), pour
la conservation.
Ainsi, à chaque sortie 3 échantillons de
zooplancton, correspondant aux trois strates de la colonne d'eau,
étaient collectés pour être analysés
ultérieurement au laboratoire sous le microscope.
b) cycles de 24h
A part l'échantillonnage régulier, deux cycles
de 24h ont été réalisés pour caractériser le
rythme de migration verticale du zooplancton au cours du
nycthémère, pendant la pleine lune et à l'obscurité
totale (respectivement à la fin du mois d'octobre et au début de
novembre). Cette fois ci, les strates échantillonnées par sortie
sont : 0-10m, 10-20m, 20-30m, 30-40m, 40-50m et 50-60m. Nous avons fait au
total quatre prélèvements au cours de chaque cycle de 24 heures
avec un intervalle de six heures entre deux prélèvements
successifs (par exemple à 12h00, à 18h00, à 24h00 et
à 6h00) ce qui fait au total 24 échantillons par cycle.
III. 3.1.2 LA LIMNOLOGIE
La transparence de l'eau a été mesurée
à l'aide d'un disque de Secchi. Ce dernier est un disque en
métal, de 20cm de diamètre, peint en cadrans noirs et blancs
alternatifs.
Pour mesurer la transparence de l'eau, ce disque est descendu
dans l'eau en position verticale à l'aide d'un fil calibré. On
note la moyenne entre la profondeur de la disparition et la profondeur de
réapparition à la remontée du disque. Les
échantillons d'eau pour l'analyse de la chlorophylle a ont
été pris également au même site. Cette fois ci nous
avons échantillonné sur une colonne d'eau de 90m à l'aide
d'une bouteille de Van Dorn de 4 L. Les échantillons étaient
collectés tous les 10 m et occasionnellement à une profondeur de
5m pour obtenir les détails de la distribution verticale des algues.
Le phytoplancton dans l'eau du lac est concentré par
filtration à travers un filtre en membrane de cellulose. Un volume d'eau
du lac, entre 3 et 4 litres, était filtré pour chaque profondeur
échantillonnée. Les pigments contenus dans le phytoplancton sont
extraits dans une solution d'acétone à 90%. Après une
double sonication de 15 minutes séparées par une nuit
entière, l'extrait était conservé au congélateur
avant d'être transporter en Belgique pour analyse en HPLC (dans le cadre
du projet ECOSYKI).
La température, la conductivité,
l'oxygène dissout et le pH de l'eau ont été mesurés
le long d'un profil de 100 m de profondeur à l'aide du profileur
multisonde HYDROLAB ® DATASONDE 4A.
III. 3. 2 TECHNIQUES D'ANALYSE
III. 3. 2. 1 PREPARATION DES ECHANTILLONS
Au laboratoire, les échantillons de zooplancton
étaient déposés sur une surface plane pour
décantation pendant au moins 48 heures avant l'aspiration du surnageant
au moyen d'un tuyau en plastique ou l'ajout du formol à 4% de
concentration pour ne garder que 100 ml de l'échantillon
concentré.
III. 3. 2. 2 PROFONDEUR DE LA ZONE EUPHOTIQUE
La limite de la zone euphotique est estimée en utilisant
la calibration faite par SARMENTO et al., (2006).
Zeu= =
Zeu : la profondeur euphotique
ZDs : la profondeur de Secchi.
å : Coefficient d'extinction ou coefficient
d'atténuation vertical de la lumière
III. 3. 2. 3 COMPTAGE DU ZOOPLANCTON ET CALCUL DES DENSITES
Après homogénéisation de
l'échantillon par agitation, 3 sous-échantillons de 1 ml chacun
ont été prélevés et observés
séparément et entièrement sur la cellule à
numération sous microscope optique (marque WARD'S) au grossissement
100x. Chaque individu rencontré a été identifié et
comptabilisé. Vu le nombre important d'échantillons à
observer, nous nous sommes limités aux grands groupes ou taxa.
La densité zooplanctonique de chaque strate a
été calculée à partir de la moyenne
arithmétique du nombre d'individus rencontrés dans les 3
sous-échantillons : cette moyenne est multipliée par 100 pour
donner le nombre d'individus de la strate, soit dans 3,61728 m3.
Pour toute la colonne d'eau (60 m de hauteur), nous avons additionné les
nombres d'individus observés dans les 3 strates; ce qui nous donne le
nombre d'individus contenus dans 10,85184 m3. La densité est
exprimée par unité de surface en divisant le nombre d'individus
ainsi obtenu par la surface d'ouverture du filet qui est de 0,180864m2.
III. 3. 2. 4 CALCUL DES BIOMASSES
La biomasse (en ug de poids sec) du zooplancton a
été estimée en utilisant la relation poids-longueur
tiré de DUMONT et al., (1975) cité par FOURNIRET (1992).
La longueur du corps des individus zooplanctoniques a été
mesurée en utilisant le microscope à oculaire gradué du
laboratoire de Biologie de l'UNR. Les individus mesurés se
répartissent comme suit : 300 Copépodes dont 100 Adultes, 100
Nauplii et 100 Copépodites; 200 Cladocères dont 50
Diaphanosoma excisum, 50 Alona rectangula et 100 Moina
micrura. Les Rotifères n'ont pas été mesurés
à cause de leur petite taille. Les relations poids-longueur
utilisées sont les suivantes :
Cyclopoïdes adultes (femelles ovigères incluses): W =
4, 9 x 10-8 L 2, 75
Avec L= longueur en um
W= poids en ug
Copépodites et Nauplii : W=1, 17 x 10-6 L 2,
20
Avec L= longueur en um
W= poids en ug
Diaphanosoma excisum : W = 1, 76 x 10 -6 L
2,11
Avec W = poids en ug
L = longueur en um
Moina micrura : W = 6, 61 L 2,37
Avec W = poids en ug
L = longueur en mm
III. 3. 2. 5 IDENTIFICATION DU ZOOPLANCTON
La détermination des espèces et
différents stades de développement des Copépodes a
été basée sur des caractères morphologiques
spécifiques observables. Pour l'identification du zooplancton,
différentes clés de détermination ont été
utilisées : (KORINEK, 1999), (AMOROS, 1984), (PONTIN, 1978), (DUSSART,
1982) et (DUSSART, 1967b).
III.3.3 DONNEES METEOROLOGIQUE
Les données météorologiques ont
été collectées à la station
météorologique du Ministère des
Infrastructures station
de Gisenyi puisque la station du projet ECOSYKI qui se trouve
à
Kibuye n'était pas encore opérationnelle. Il s'agit
de données de température de l'air (en °C),
pluviosité (en mm), fréquence des vents forts (en %
d'observations) et d'humidité relative (en % d'observations).
| 


