|
N° d'ordre 208
UNIVERSITE CHEIKH ANTA DIOP DE
DAKAR
Faculté des Sciences et Techniques

MEMOIRE DE D.E.A DE BIOLOGIE ANIMALE
Présenté par :
Hampâté Bâ
Faune anophélienne du nord de la Mauritanie et
sensibilité d'An.
gambiae s.l. à la
perméthrine (0,75%) et à la deltaméthrine (0,05%)
dans
les sites sentinelles du Programme National de Lutte contre le
Paludisme.
Soutenu le 29 juillet 2005 devant la commission
d'examen :
Président : Bhen Sikina TOGUEBAYE
Membres : Ibrahima DIA
Karamoko DIARRA
Lassana KONATE
Mady NDIAYE
REMERCIEMENTS
A mon père,
Le tout puissant t'a arraché de notre affection. Nous
aurions bien voulu vous avoir à nos côtés aujourd'hui car
ce travail est le résultat de tant de sacrifices pour la réussite
de vos enfants. Que la terre de Nouakchott te soit légère.
A ma mère,
Je n'oublierai jamais tout ce que tu as sacrifié pour
notre réussite. L'éducation que tu nous as inculquée nous
comble de fierté et de sécurité dans un monde où
les dérives font loi. Nous prions DIEU de ne jamais te
décevoir.
A mon épouse,
J'admire votre courage et compréhension. Sans vous ce
travail n'aura pas vue le jour.
A mes frères
Sékou Touré Bâ, Abdoul Wahab Bâ, Merci
pour tout.
A mes soeurs :
Ramatoulaye Niang, Bintat Ibra Niang, Coumba younouss Niang,
Mariane Niang et Aminata Niang.
A mes amis,
Ambroise Dioum Ahouidi, Abdoulaye diop Dieng & Awa, John
Logbo, Abdoulaye Ba, Mamadou Ousmane Ndiatt & Marie, Diao Diallo, Badara
Samb, Daouda Seck.
A mes compagnons de tous les jours,
A tous ceux qui de prés ou de loin ont
participé à la réalisation de ce travail.
AU Dr Lassana KonatéC'est
l'occasion pour nous de vous exprimer tout le respect que nous portons à
votre
personne et l'excellent cadre de travail du laboratoire
d'Ecologie Vectorielle et Parasitaire de l'UCAD que vous dirigé avec
brio. Votre disponibilité indéfectible ainsi que votre rigueur
scientifique ont beaucoup contribué dans notre formation universitaire.
Tous nos remerciements pour avoir accepté de diriger ce travail.
AU Dr Ibrahima Dia et Dr Mawlouth Diallo
Les mots nous manquent pour vous remercier. Vos grandes
qualités humaines et surtout intellectuelles, vos esprits d'ouverture
font de vous des hommes qui inspirent l'estime et l'admiration. Nous garderons
de vous l'image de chercheurs modèle.
A notre maître, le Professeur Bhen sikina
TOGUEBAYE
Merci pour la qualité des enseignements que vous nous
avez donnés et également d'avoir accepté de
présider le jury d'examen. Nous garderons de vous l'image d'un homme
toujours disponible, qui a su donner au département de Biologie Animale
ces lettres de noblesse.
A notre maître, le Professeur Ousmane
FAYE
L'homme qui a sus cultiver en nous l'amour de l'entomologie.
Ma présence au LEVP de l'UCAD fait suite à la collaboration que
vous avez établie entre le LEVP et l'INRSP (ex CNH). Nous avons pu
apprécier tout au long de ces années votre sens profond du
devoir, votre disponibilité et votre humanisme. Mon cher GAMOU, merci
pour les conseils...
AU Dr Mady Ndiaye
Tous nos remerciements pour avoir accepté sans
hésitation de juger ce travail. Nous avons pu mesurer depuis la
première année (SN1) votre rigueur scientifique qui a fortement
contribué dans notre formation universitaire. Trouvez ici l'expression
de notre profonde gratitude.
AU Dr Karamoko DIARRA
Vous vous êtes toujours comporté comme un
aîné. Merci d'avoir accepté de faire partie du jury.
SOMMAIRE
|
1er Partie
|
|
|
|
INTRODUCTION
|
2
|
|
|
CHAPITRE I : GENERALITES
|
|
|
|
I- Présentation sommaire de la République
Islamique de Mauritanie
|
4
|
|
1. Situation géographique
|
4
|
|
2. Relief
|
4
|
|
3. Hydrographie
|
4
|
|
4. Population
|
|
4
|
|
|
|
II- Situation actuelle du paludisme en
Mauritanie6
|
|
|
|
1. Vecteurs
|
|
6
|
|
2. Morbidité
|
|
6
|
|
3. Faciès épidémiologiques
|
|
8
|
|
4. Espèces plasmodiales
|
|
8
|
|
5. Prise en charge des accès
|
|
8
|
|
6. Lutte antivectorielle
|
|
9
|
|
CHAPITRE II : MATERIELS ET METHODES
|
|
|
|
I- Sites d'étude
|
|
11
|
1. Akjoujt
|
|
11
|
2. Atar
|
|
11
|
3. Tergite
|
|
11
|
4. Zouerate
|
|
13
|
5. Nouadhibou
|
|
13
|
|
|
II- Méthodes d'étude
|
|
15
|
|
1- Echantillonnages des imagos de moustiques
|
|
15
|
|
1-1. Captures par pièges lumineux avec dormeurs
|
|
15
|
|
1-2. Récolte de la faune résiduelle matinale
|
|
15
|
|
2- Echantillonnage des larves de moustique
|
|
16
|
|
3. Traitement du matériel biologique
|
|
16
|
|
3.1 Traitement sur le terrain
|
|
16
|
|
3.1.1. Identification des imagos de moustiques
|
|
16
|
|
3.1.2. Conservation des imagos de moustiques
|
|
16
|
|
3.1.3. Conservation des larves de moustiques
|
|
16
|
|
3.2 Traitement au laboratoire
|
|
16
|
|
3.2.1. Montage des larves de moustique
|
|
16
|
|
3.2.2. Identification des Larves de moustiques
|
|
17
|
CHAPITRE III : RESULTATS
I- Etude Larvaire 19
1. Description des gîtes larvaires 19
2. Distribution des différents types de gîtes
prospectés selon les localités 19
3. Proportion de gîtes positifs 21
4. Proportion des différents types de gîtes dans le
nombre total de gîtes positifs 21
5. Les stades larvaires de moustiques 21
II- Les moustiques adultes
1. Richesse et abondance spécifique de la faune
culicidienne 21
2. Variation de l'abondance et de la richesse spécifique
22
2-1. selon les sites 22
2-2. selon la méthode d'échantillonnage 22
Culex quinquefasciatus 22
Aedes vexans 22
An. rhodesiensis 22
2-3. Selon les périodes de captures 24
Culex quinquefasciatus 24
Ae. vexans 25
An. rhodesiensis 25
3. Densités culicidiennes comparées 25
3-1. Densités moyennes 25
3-2. Densité moyenne par espèces 25
3-2-1. Culex quinquefasciatus 25
3-2-2. Ae vexans 27
3-2-3 An. rhodesiensis 27
3-2. Ratios des densités culicidiennes 29
CHAPITRE IV : DISCUSSION 30
2éme Partie. INTRODUCTION 34
CHAPITRE I : MATERIELS ET METHODES
I- Sites d'études 37
1-1. Boghé, Rosso et Sélibaby 37
1-2. Kankossa et Aoïun 37
II- Méthode d'étude 38
1. Récolte du matériel biologique 39
2. Papiers imprégnés 39
3. Matériels de test 39
4. Réalisation du test 40
5. Espèces testées et Nombre de répliques
40
III- Traitement des moustiques après le test
41
1. Traitement sur le terrain 41
1.1. Identification des moustiques 41
1.2. Conservation des moustiques 41
2. Traitement au laboratoire 41
2.1.1.1. Principe de la technique ELISA 41
2.1.2.1. Principe de l'identification du complexe An.
gambiae par PCR 42
2.1.5. Identification des formes moléculaires et de la
fréquence du gène Knock Down (Kdr) au sein d'Anopheles
gambiae s.s 42
CHAPITRE II : RESULTATS
I- Faune anophèlienne 44
II- Sensibiité à la perméthrine et
la deltaméthrine 45
1- Température et humidité relative pendant les
tests 45
2- Taux de mortalité 45
2.1. Taux de mortalité à la perméthrine
45
2.1.1 An. gambiae 45
2.1.2 An. pharoensis 45
2.2. Taux de mortalité à la deltaméthrine
45
3. Temps de Knock Down 47
3.1. An. gambiae 48
3.1.1 Temps de Knock Down 50% 48
3.1.2 Temps de Knock Down 95% 48
3.2 An. pharoensis 48
3.3 Ratio des temps de Knock Down 49
CHAPITRE III : DISCUSSION 50
BIBLIOGRAPHIE 53
Liste des abréviations utilisées dans le texte :
ASECNA : Agence de Sécurité pour
la Navigation Aérienne
FPN : nombre moyen de femelle de moustiques par
piège-nuit
FRC : nombre moyen de femelle de moustiques par
chambres traités
KDT50 : temps pour lequel 50% des
spécimens présente une paralysie ou sont morts
KDT95 : temps pour lequel 95% des spécimens
présente une paralysie ou sont morts MSAS :
Ministère de la Santé et de Affaires Sociales
ONS : Office National de Statistique
PNLP : Programme National de Lutte contre le
Paludisme
R.I.M : République Islamique de
Mauritanie
WHO : Organisation Mondiale de la
Santé
PREMIERE PARTIE :
Faune anophélienne du nord de la
Mauritanie.
INTRODUCTION
L'épidémiologie du paludisme dans le Sahara
algérien et nigérien, milieu désertique, a
été bien étudiée (BENZEROUG & JANSSENS
1985 ; DEVELOUX et al., 1994). Par contre, très peu
d'études ont été conduite sur le paludisme dans le Sahara
mauritanien. Dans ces milieux saharo-saheliens le faciès
épidémiologique du paludisme peut être très
différent d'une année à l'autre. Il est assujetti aux
importantes variations écologiques du milieu. Coincée entre
l'Afrique du Nord et l'Afrique sub-saharienne, la partie nord de la Mauritanie
se trouve à la lisière de la faune paléarctique Nord et de
la faune afrotropicale Sud (MONOD, 1932 in EDWARS, 1941).
Sur les 400 espèces d'anophèles connues, environ
une vingtaine sont vectrices du paludisme (MOUCHET & CARNEVALE,
1991). Malgré les nombreuses affections à transmission
vectorielle rencontrées en Mauritanie, peu d'études
entomologiques y ont été conduites. Les seules études
entomologiques publiées datent des années 1960 (HAMON
et al., 1964 ; Maffi, 1964). Ces enquêtes ont
principalement porté sur l'inventaire faunistique des vecteurs
potentiels du paludisme.
Dans les régions du sud et du sud-est du pays, An.
arabiensis, An. gambiae s.s et An. funestus (HAMON et
al., 1964 ; MOLEZ & FAYE, 1996 ; PETRARCA et al., 1987 ; DIA
et al., 2003 soumis) ont été
récoltés à la suite d'enquêtes transversales.
Cependant les modalités de la transmission du paludisme n'ont pas encore
été étudiées. Seul An. gambiae s.l. a
été incriminé dans la transmission du paludisme
(DIA et al., soumis). L'absence de données sur les
limites de répartition de ces vecteurs rend énigmatique
l'interprétation de certains cas de paludisme et de fièvres
hémorragiques (SALUZZO et al., 1987 ; ZELLER et
al 1995 ; NABETH et al., 2001 ; DIALLO et
al.,2005) fréquemment signalés
dans le pays.
Des cas présumés de paludisme sont
rapportés dans toutes les structures sanitaires du nord de la Mauritanie
(MSAS, 2002). En l'absence de toute donnée sur la
transmission de Plasmodium, l'analyse et l'interprétation de
certains cas de paludisme posent problème du fait que les vecteurs
classiques sont supposés être absents de ces zones (CORTES
et al., 2003). En effet, du fait de la rareté
d'études entomologiques, la réponse à cette interrogation
reste difficile dans le contexte nord mauritanien. C'est dans ce cadre que le
Programme National de Lutte contre le Paludisme a entrepris d'effectuer deux
études entomologiques ; l'une dans le nord et l'autre dans le sud de la
Mauritanie. L'objectif de l'étude menée dans le nord est de voir
si le Sahara mauritanien renfermait les vecteurs classiques du paludisme du
Sahara central et septentrional et/ou de l'Afrique sud-saharien.
L'étude effectuée dans le sud avait pour
objectif la détermination du statut des populations anophéliennes
vis-à-vis de la perméthrine et de la deltaméthrine dans
les sites sentinelles du Programme National de Lutte contre le Paludisme, en
vue de l'élaboration d'une bonne politique des insecticides au niveau
national.
Dans ce travail, nous présenterons en première
partie les résultats des enquêtes entomologiques menées
dans le nord du pays et en seconde partie, ceux de la sensibilité
d'An. gambiae s.l. aux insecticides dans les sites
sentinelles du Programme National de Lutte contre le Paludisme de la
Mauritanie.
I- Présentation de la République Islamique de
Mauritanie
1. Situation géographique.
La République Islamique de Mauritanie s'étend
du 5ème au 17ème degré de longitude
ouest et du 15ème au 27ème degré de
latitude nord et couvre une superficie de 1.030.700 km2. Elle est
limitée au sud par le Sénégal et le Mali, à l'Est
par le Mali, au Nord par l'Algérie, et le Sahara Occidental
(nord-ouest). A l'Ouest, l'Océan Atlantique forme un littoral long de
700 km (figure 1).
2. Relief.
Le relief est constitué des massifs montagneux de
l'Adrar et du Tagant (400 à 800 mètres d'altitude).
Au-delà de la plaine alluviale du fleuve Sénégal, le pays
est couvert d'alignements dunaires recouverts de pâturages quand il
pleut. Ces dunes sont coupées selon un axe nord-sud par les massifs
rocheux tabulaires et ruiniformes de l'Adrar au nord, du Tagant au centre, de
l'Affolé et de l'Assaba au sud.
3. Hydrographie.
Le seul cours d'eau permanent est le fleuve
Sénégal qui reçoit sur la rive mauritanienne divers
affluents à régime temporaire dont les plus importants sont le
Gorgol et le Karakoro. Dans le reste du pays, les rares pluies alimentent des
Oueds temporaires qui disparaissent par infiltration et évaporation.
Excepté dans l'extrême sud, les eaux permanentes de surfaces sont
très rares, bien que chaque massif rocheux du nord recèle des
sources permanentes.
4. Population
La population totale résidente en novembre 2000 est de
2.508.159 habitants. Un des phénomènes les plus significatifs des
changements profonds intervenus dans le pays est celui de la
sédentarisation. En effet, la proportion de nomades qui était de
33% en 1977, est passée à 12% en 1988 pour tomber à 5% en
2000 (ONS, 2000). La répartition de la population est
très inégale. La densité de la population est de 1
habitant au km2 dans le Nord et le centre du pays. Elle est de 8
à 11 habitants au km2 dans le sud du pays.
N
MAROC
MALI
Figure 1 :
Carte de la République
Islamique de Mauritanie montrant les différentes zones
géo-
climatiques et l'emplacement des sites
d'études. (Source, Programme National de Lutte
contre le
Paludisme)
II- Situation actuelle du paludisme en Mauritanie.
1. Les vecteurs
Avant 1962, seules 4 espèces anophèliennes
étaient signalées en Mauritanie : An. funestus, An. gambiae
s.l., An. pharoensis et An. rufipes (SAUTEL
et al., 1948). Par la suite, HOSTEIN
et al. (1962) signalent la
présence de An. melas et An. dhtali. En plus de ces
espèces, la présence d'An. rhodesiensis (MAFFI,
1964) ainsi que celle de An. coustani, An. ziemmani, An. funestus,
An. pretoriensis, An. squamosus et An. demilloni (HAMON et
al., 1964) ont été signalées. Au total, la
présence de 12 espèces anophèliennes a été
notée en Mauritanie (BRUNHES et al., 1998). Il
s'agit de : An. arabiensis, An. dhtali, An. flavicosta, An. funestus, An.
gambiae, An. melas, An. pharoensis, An. pretoriensis, An. rhodesiensis
rhodesiensis, An. rufipes rufipes, An. squamosus et An. ziemanni. Des
prospections entomologiques effectuées le long d'un transect
vallée du fleuve /plateau du Tagant ont permis de noter des similitudes
dans la composition de la faune anophèlienne sur les deux rives du
fleuve Sénégal (MOLEZ & FAYE, 1996). Cette
enquête a montré la présence saisonnière d'An.
rhodesiensis dans le Tagant. Toutes les études antérieures
ont révélé une diminution de l'abondance et de la
variété de la faune anophèlienne du Sud vers le Nord du
pays. Cependant, aucune d'entre elles n'a eu à étudier les
modalités de la transmission anophèlienne. Une enquête
récente effectuée au cours des mois d'octobre et de novembre 2003
(DIA, et al soumis) dans les Wilayas (régions
administratives) du Trarza, du Brakna, de l'Assaba et du Tagant a montré
qu'An. gambiae s.s et An. arabiensis étaient
présents dans la majorité des localités
prospectées. En revanche, la présence d'An. funestus n'a
été signalée que dans le Trarza, (delta du fleuve
Sénégal).
2. MorbiditéLe paludisme sévit
sous forme d'épidémies apparaissant en période de
transmission et
pouvant toucher la quasi-totalité de la population du
sud et du sud-est du pays où il représente la première
cause de morbidité et de mortalité (MSAS, 1998).
Dans une enquête conduite en 1987, GASQUET a
trouvé un taux moyen de splénomégalie de 12,7% dans la
région du fleuve, s'élèvant à 24,4% chez les
enfants âgés de 1 à 9 ans. Le nombre de cas de paludisme
diagnostiqués est très variable selon les années
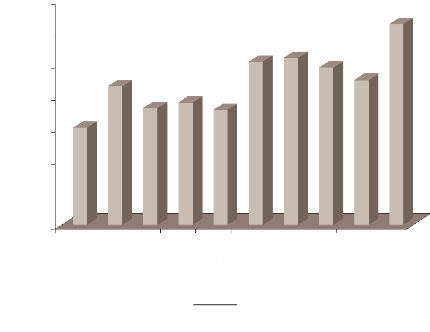
(Figure 2). La morbidité proportionnelle a
été évaluée à 16,5% (ANONYME,
1999).
350000
300000
250000
200000
150000
100000
50000
0
1994 1995 1996 1997 1998 1999 2000 2001 2002 2003
ANNEES
Figure 2
Nombre de cas annuels de paludisme
(présumés et confirmés) enregistrés dans
les
centres de santé de la Mauritanie. (MSAS, 2002).
NOMBRE DE CM
Des flambées épidémiques de
fièvres supposées d'origine palustre avec 30 à 40% de cas
d'accès graves et un taux de létalité de 15% ont
été notées ces dernières années dans
plusieurs régions du sud du pays, faisant ainsi du paludisme un
véritable problème de santé publique.
3. Faciès
épidémiologiques
En Mauritanie, le paludisme est de type instable
(MOUCHET et al., 1993) avec une transmission
saisonnière très courte et des années sans transmission.
Trois zones géoclimatiques en rapport avec le faciès
épidémiologique ont été définies en
Mauritanie :
- Zone soudanienne, où le paludisme est stable.
- Zone sahélienne, où le paludisme est
instable.
- Zone saharienne, transmission anophélienne non
documentée mais supposée faible et irrégulière.
4. Espèces plasmodiales
Les quatre espèces plasmodiales responsables du
paludisme humain (P. falciparum, P. malariae, P. vivax et P. ovale)
sont rencontrées en Mauritanie, avec une large prédominance de
P. falciparum (SAUTEL et al., 1948 ; BARBIER &
TIMBILA, 1964 ; MONJOUR et al., 1984 ; ABDALLAHI, 2001)
responsable de plus de 90% des cas de paludisme (SAUTEL et
al., 1948). Cependant, P. vivax est rencontré
dans certains localités du sud-est (COLLINS et al.,
1999 ; ABDALLAHI, 2001).
5. Prise en charge des accès
En République Islamique de Mauritanie, le traitement de
première intention des accès palustres simples repose sur
l'administration de la chloroquine à la dose totale de 25 mg/kg,
répartie sur trois jours à raison de 10 mg/kg le premier et
deuxième jour et 5mg/kg le troisième jour. La chimioprophylaxie
avec la chloroquine est réservée aux seules femmes enceintes. En
cas d'intolérance ou d'échec thérapeutique, la chloroquine
est remplacée par la sulphadoxine/pyriméthamine (Fansidar®).
Les sels de quinines sont réservés aux accès graves et
compliqués. GUIGUEMDE et al., (1990)
écrivaient : « tous les pays de l'OCCGE sont atteints par la
chloroquinorésistance de P. falciparum, exceptée la
Mauritanie, pays où le paludisme est rare...». Depuis cette date,
deux études sur la chloroquino-résistance in vivo de P.
falciparum ont été réalisées en Mauritanie.
Elles ont révélé un taux d'échec
thérapeutique inférieur à 10% à Boghé, dans
le sud du pays (région du Brakna) (GASQUET et al.,
1994) et 33% (PENALI et al., 1998) à
Aïoun, dans le sud-est du pays (région du Hodh el garbi).
En 2001 à Aïoun une étude centrée
sur la recherche de gènes mutant de la dihydrofolate reductase (DHFR) et
la dihydropteroate synthetase (DHPS) responsable de la résistance de
P. falciparum à la sulphadoxine/pyriméthamine montre une
prévalence de 41,97% (EBERL et al., 2001).
6. Lutte antivectorielle
L'introduction de moustiquaires imprégnées
d'insecticides conduits par le Programme National de Lutte contre le Paludisme
date de 1995 dans la région du Guidimakha et de l'Assaba et de 1997 dans
la région du Hodh el Garbi et le Trarza (COULIBALY,
1999). Elle est largement répandue dans tout le sud et sud-est
du pays où les résultats sur la sensibilité des vecteurs
de paludisme aux insecticides seront présentés dans la seconde
partie de ce travail.
Chapitre II :
MATERIEL ET METHODES.
I- Sites d'étude
La figure 2 montre l'emplacement des sites d'étude qui
sont tous situés au nord de Nouakchott la capitale, en zone saharienne
et oasienne. Le climat, de type saharien, est caractérisé par de
grands écarts entre les températures moyennes mensuelles
minimales et maximales (Figure 4a et 4b). Les sites
d'étude sont : Akjoujt, Atar, Tergîte, Nouadhibou et
Zouérate. EMBERGER et al., en 1963 distinguent
quatre zones bioclimatiques en Mauritanie. Ils classent les localités
étudiées dans la "zone à climat désertique, avec
300 à 355 jours biologiquement secs par an".
1. Akjoujt.
La localité de Akjoujt est située à 265
km au nord de Nouakchott. Sa population est de 7904 habitants (ONS,
2000), elle est composée à majorité
d'autochtones. L'élevage de dromadaires est la principale
activité. Sa pluviométrie moyenne annuelle en 2002 est de 65,2 mm
en 8 jours de pluies (Tableau 1), survenus essentiellement
pendant le mois de Septembre (Figure 3). L'humidité
relative est toujours très faible. Elle est maximale (50%) en janvier et
minimale (18%) en mai. La végétation est essentiellement
composée de Calotropis procera, Balanites aegyptica et Zyziphus
mauritiana.
2. Atar.
Située au centre nord du pays, à 450 km de
Nouakchott, sa population est de 24 021 habitants. La pluviométrie, peu
abondante, s'étale sur les mois d'Août, Septembre et Octobre
(Figure 3). La présence de la chaîne de l'Adrar
(zone montagneuse) confère à ce site un microclimat particulier
pour une zone désertique. La température moyenne à Atar
est de 28,2°C le maximum absolu étant de 48°C (au mois
d'avril) et le minimum de 15°C. L'humidité relative est maximale
(55%) aux mois de Septembre Octobre et Novembre. Elle est minimale (22%) au
mois de Juin. La végétation est peu abondante.
Les graminées qui constituent le fond de la végétation
n'existent que durant les quelques mois de la saison des pluies. La
végétation arborée basse et généralement
espacée est constituée principalement par des Acacia et
des Commiphora.
3. Tergite.
Tergîte présente les mêmes
caractéristiques climatiques qu'Atar dont il n'est distant que de 40 km.
Tergîte abrite la plus grande palmeraie et l'oasis le plus visité
de la Mauritanie. Environ 100 personnes vivent à Tergîte et
s'adonnent aux activités maraîchères et touristiques de
l'oasis.
Akjoujt Atar Nouadhibou Zouérat

pluviometrie (mm).
40
60
50
30
20
10
0
jan fev mars avril mai juin juil août sept oct nov dec
Année 2002.
Figure 3:
Pluviométrie moyenne
mensuelle à Atar, Akjoujt, Nouadhibou et Tergîte.
Source
Asecna- Mauritanie 2002.
Tableau 1 :
Pluviométrie moyenne
annuelle et nombre de jours de pluie dans les
localités
d'étude en 2002.
|
Régions
|
Localités
|
Pluviométrie
|
Nbre de jours
|
|
Inchiri
|
Akjoujt
|
65,2
|
8
|
|
Adrar
|
Atar et Tergîte
|
54,5
|
13
|
|
Nouadhibou
|
Nouadhibou
|
27,5
|
7
|
|
Tiris-Zemmour
|
Zouérate
|
11,9
|
2
|
4. Zouerate.
Ville minière, Zouerate est à 900 km au nord de
Nouakchott. Sa population est de 33 929 habitants, venant des quatre coins de
la Mauritanie, à la recherche de travail dans l'industrie minière
qui exporte chaque année 200 000 tonnes de minerai de fer. En 2002, 11,9
mm de pluie ont été enregistrés en 2 jours de pluies
à Zouérate (Figure 3 et Tableau 1).
L'humidité relative minimale est de 10%. Sa
valeur maximale n'excède guère 50%. A
Zouérate la végétation herbacée très
éphémère, apparaît à la suite de très
rares averses, dans le lit des oueds temporaires.
5. Nouadhibou.
Nouadhibou est situé à 700 km au nord de
Nouakchott sur le littoral. Nouadhibou abrite les ports de pêche et
minéralier ainsi que la quasi-totalité des usines de
transformation des produits halieutiques. Sa population est de 72 337
habitants, venus pour la plupart de l'intérieur du pays et même de
la sous-région, à la recherche de travail. La pluviométrie
annuelle à Nouadhibou en 2002 est de 27,5 mm (Figure
3). La rareté des pluies est compensée par une
humidité relative très élevée dont la valeur
minimale est de 60%. Réduite à quelques
Euphorbiacées sur le littoral, la végétation est
très rare.
5
0
45
40
35
30
25
20
15
10
T°C
35
10
5
0
jan fev mars avril mai juin juil août sept oct nov dec
mois
jan fev mars avril mai juin juil août sept oct nov dec
mois
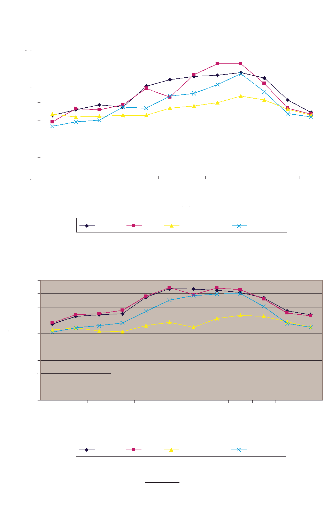
Figure 4:
Variation de la température
(T°C) moyenne mensuelle minimale (a) et maximale (b) au
cours de
l'année 2002 à Akjoujt, Atar, Nouadhibou et
Zouérate.(Source, ASECNA
Mauritanie 2002).
b
TCC
30
25
20
15
a
21
Akjoujt Atar Nouadhibou Zouérate
Akjoujt Atar Nouadhibou Zouérate
II- Méthodes d'étude
Deux enquêtes de terrain ont été
effectuées en février et en septembre 2002.
1- Echantillonnage des moustiques adultes
Deux techniques d'échantillonnage de moustiques adultes
ont été utilisées: la capture aux pièges lumineux
et la collecte de la faune au repos dans les habitations humaines.
1-1. Captures aux pièges lumineux
En raison d'un phototactisme positif, l'échantillonnage
des populations de moustiques peut être effectué à partir
de captures aux pièges lumineux. Des pièges de type CDC (Center
of Disease Control, Atlanta) associés avec un dormeur sous moustiquaire
ont été utilisés. Les moustiques attirés par la
lumière et/ou le dormeur, sont aspirés par un ventilateur et
expulsés dans une cage en tulle. Les pièges ont fonctionné
de 19 heures à 6 heures du matin. Le piège est composé
d'une nasse en tulle moustiquaire. L'ouverture de la nasse est reliée
à un système d'aspiration muni d'une source lumineuse. L'ensemble
est alimenté par une batterie de six volts. Les pièges ont
été placés à 1,50 m du sol, au dessus de la
tête du dormeur sous moustiquaire. Dans chaque localité, 18
pièges ont été utilisés par nuit et ont permis de
collecter les moustiques au cours de 3 séances consécutives de
capture durant chaque enquête, soit un total de 36 pièges-nuits
pour les deux enquêtes effectuées dans chaque localité au
cours de l'étude.
1-2. Récolte de la faune matinale
résiduelle
Cette méthode d'échantillonnage consiste
à collecter les moustiques dans leurs lieux de repos, tôt le matin
avant l'ouverture des portes et fenêtres des chambres et salons
sélectionnés la veille. La technique utilisée est celle
des récoltes après pulvérisation de pyrèthre.
Après avoir recouvert le plancher de draps blancs et fermé toutes
les issues de la pièce, on procède à une
pulvérisation de pyréthrinoïdes (YOTOX®). Au
bout de 10 minutes d'attente, les moustiques tombés sont
prélevés à l'aide de pinces souples dans des boîtes
de pétri. Sur chaque boîte sont reportés un numéro
et un indice correspondant respectivement à la localité et
à la chambre. Dans chaque localité, 10 chambres ont
été prospectées lors de chacune des deux enquêtes,
soit un total de 20 chambres prospectées par site pendant les deux
enquêtes.
2. Echantillonnage des stades pré-imaginaux de
moustiques
La méthode du "dipping" a été
utilisée pour la récolte des larves et nymphes de moustiques.
Elle a consisté à donner 50 coups de bac (0,75 litre d'eau) dont
25 au bord et 25 au milieu du gîte larvaire. Les larves et nymphes
récoltées ont été dénombrées en
fonction du genre (Anopheles, Culex et Aedes) et des
stades.
3. Traitement et conservation du matériel
récolté3-1. Traitement sur le terrain
3-1-1. Identification des moustiques adultes
Sur le terrain, les moustiques capturés ont
été identifiés morphologiquement sous la loupe binoculaire
à partir de clés de détermination (GILLIES &
DE MEILLON, 1968 ; GILLIES & COETZEE, 1987 ; HUANG, 2001).
3-1-2. Conservation des moustiques adultes
Après identification, les moustiques adultes
récoltés ont été placés individuellement
dans des tubes numérotés contenant du silicagel.
3-1-3. Conservation des stades
pré-imaginaux
Pour chaque gîte, les larves de moustiques
récoltées au cours des séances de prospection larvaire ont
été conservées dans des tubes à hémolyse
bouchés contenant de l'alcool 70°. Le lieu et la date de capture
des larves ont été indiqués sur les tubes. Les larves
d'Anophelinae ont été séparées de celles
de Culicinae.
3-2. Traitement au laboratoire
Les larves de moustiques de stade 3 et 4 ont été
montées au laboratoire entre lame et lamelle et
déterminées sous le microscope.
3-2-1. Montage des larves de moustique
- Sur une lame porte objet, déposer une goutte de PVA
(Polyvinylalcool). - Prélever une larve de stade 3 ou de stade 4.
- Déposer la larve à disséquer sur la goutte
de PVA.
- Couper au niveau du dessus du peigne siphonal.
- Disposer les peignes en exergue.
- Recouvrir la larve d'une lamelle.
- Inscrire au crayon sur la plage polie de la lame le lieu, la
date et le gîte prospecté. - Garder dans une étuve à
30 ou 35°C pendant 72 heures.
- Identifier au microscope.
3-2-2. Identification des Larves de
moustiques
Les larves montées entre lame et lamelle ont
été morphologiquement identifiés (genre et espèce)
sous la loupe binoculaire à partir de clés de
détermination (GILLIES & DE MEILLON, 1968 ; GILLIES &
COETZEE, 1987 ; HUANG, 2001).
Chapitre III :
RESULTATS
I- Etude Larvaire
1. Gîtes larvaires prospectés
Six types de gîtes larvaires différents ont
été observés dans les localités visitées. A
chaque type de gîte décrit, nous avons attribué la lettre G
suivie d'un indice allant de 1 a 6.
· (G1). Gîtes larvaires
constitués par une collection d'eau usée domestique. Cette eau
qui arrive par les égouts, est ensuite distribuée dans les
palmeraies grâce a un système de canalisation creusé a
même le sol. Elle est stockée dans des puisards a ciel ouvert.
Cette eau est destinée au maraîchage et parfois a l'arrosage des
palmiers dattiers. Dans ces puisards, une véritable flore
constituée d'algues et de champignons se développe a la surface
de l'eau.
· (G2). Gîtes larvaires
constitués par une collection d'eau claire, réservée aux
activités maraîchères. Cette eau provient du système
d'alimentation en eau de la ville. Dans les palmeraies et les jardins
maraîchers, elle est stockée dans des bassins a bords
cimentés. Elle est destinée aux activités
maraîchères.
· (G3). Gîtes larvaires
constitués par une eau potable exclusivement réservée a la
consommation humaine. Ce sont les réservoirs métalliques
situés sur les toits de toutes les maisons. Ces réservoirs sont
plus ou moins bien couverts (fermés).
· (G4). Ce sont les fosses septiques.
Elles sont devant les maisons ou parfois a l'intérieur des cours. Elles
sont munies d'un tuyau en plastique de diamètre 10 a 15 cm,
dirigé vers le haut et servant d'aération.
· (G5). Source d'eau coulant en
permanence d'un rocher vers la localité de Tergîte qu'elle
traverse. Cette collection d'eau forme une mare dans cette localité.
L'eau est claire, très peu profonde et pourvue de quelques poissons
appartenant au genre Gambusia
· (G6).Cette eau est souvent
récupérée et stockée dans des bassines et bidons en
plastique destinée a la consommation
2. Distribution des différents types de
gîtes prospectés selon les localités
Aucune des localités visitées n'a
présenté a la fois les six types de gîtes décrits
ci-dessus. Au total, 68 gîtes larvaires ont été
prospectés, 11 a Akjoujt, 26 a Zouerate, 10 a Nouadhibou, 8 a Atar et 13
a Tergîte (Tableau 2).
Tableau 2 :
Nature et nombre de gîtes
prospectés par localité visitée. Mauritanie
2002.
|
Types de gîtes
rencontrés
|
Zouérate
|
Nouadhibou Akjoujt
|
Atar
|
Tergîte
|
|
G1, G2,
G3, G4
|
G1
G2
|
G2 G4
|
G2, G3
G4
|
G2, G5
G6
|
|
Nombre de gîtes
prospectés
|
11G1, 5G2,
5G3, 5G4
|
5G1 5G2
|
6G2
5G4
|
4G2, 2G3,
2G4
|
2G2, 1G5
10G6
|
|
TOTAL
|
26
|
10
|
11
|
8
|
13
|
Tableau 3 :
Nombre de gîtes larvaires prospectés et
proportion de gîtes positifs selon la localité
visitée.
Mauritanie 2002.
|
localités
|
Gîtes prospectés
|
positifs
|
%
|
|
Zouérate
|
26
|
0
|
0,0
|
|
Nouadhibou
|
10
|
3
|
30,0%
|
|
Akjoujt
|
11
|
1
|
9,1%
|
|
Atar
|
8
|
1
|
12,5%
|
|
Tergîte
|
13
|
1
|
7,7%
|
|
TOTAL
|
68
|
6
|
8,8%
|
3. Proportion de gîtes positifs
Parmi les 68 gîtes larvaires prospectés, 6
renfermaient des larves de moustiques, soit un taux de positivité de
8,8%. A l'exception de Zouérate où aucun gîte positif n'a
été trouvé, le taux de positivité a
été respectivement de 30,0%, 9,1%, 12,5% et 7,7% à
Nouadhibou, Akjoujt, Atar et Tergîte (Tableau 3). Des 6
gîtes trouvés positifs en larves de moustiques, 2 étaient
de type G1 (tous 2 à Nouadhibou), 3 de type G2 (1 à Atar, 1
à Akjoujt et 1 à Tergîte) et 1 de type G5
(Tergîte).
4. Les stades larvaires de moustiques
Au total, 248 larves et 37 nymphes de moustiques ont
été collectées dans les 6 gîtes trouvés
positifs. Le montage et la détermination des larves a permis
d'identifier 198 (79,8%) larves de Culicinae et 50 (20,2%) larves
d'Anophelinae (Tableau 4). Toutes les larves
d'Anophèles ont été récoltées à
Tergîte. Les 198 larves de Culicinae ont été
collectées à partir 3 différents types de gîtes :
G1, G2 et G5 (Tableau 4). A Tergite, les larves d'anophèles
représentent 37,9% des collectes de stade pré-imaginaux de
moustiques (50/147).
Tableau 4 :
Nombre de larves et de nymphes récoltés
dans chaque type de gîte, selon la localité.
|
Gîtes larvaires
|
|
Récoltes larvaires
|
TOTAL
|
|
localités
|
Nbre de gîtes
positifs
|
Type de gîte
positif
|
larves de
culicidés
|
larves
Anophélinés
|
nymphes
|
|
Zouérate
|
0
|
_
|
0
|
0
|
0
|
0
|
|
Nouadhibou
|
2
|
G1
|
16
|
0
|
4
|
20
|
|
Akjoujt
|
1
|
G2
|
68
|
0
|
18
|
86
|
|
Atar
|
1
|
G2
|
32
|
0
|
0
|
32
|
|
Tergîte
|
2
|
G2, G5
|
82
|
50
|
15
|
147
|
|
TOTAL
|
6
|
|
198
|
50
|
37
|
285
|
II- Les moustiques adultes
1. Richesse et abondance spécifique de la faune
culicidienne
Les deux méthodes d'échantillonnage
utilisées ont permis de récolter un total de 1016 moustiques
appartenant à 3 genres (Aedes, Anopheles et
Culex). Le genre Anopheles, représenté par
An. rhodesiensis, a constitué 16,3% (166/1016) des
collectes. Les genres Culex et Aedes étaient
respectivement représentés par Culex quinquefasciatus et
Aedes vexans et correspondaient à 78,9% (801/1016) et 4,8%
(49/1016) des collectes.
2. Variation de l'abondance et de la richesse
spécifique.
2-1. Selon les sites
A Atar, 246 Culex quinquefasciatus, 50 Anopheles
rhodesiensis et 17 Aedes vexans ont été
capturés. A Tergîte, les valeurs correspondantes ont
été de 34, 116 et 32 respectivement pour Culex
quinquefasciatus, Anopheles rhodesiensis et Aedes
vexans. Seul Culex quinquefasciatus a été
collecté à Akjoujt (46), Nouadhibou (279) et Zouérate
(196) (Tableau 5).
Tableau 5 :
Richesse spécifique et
abondance des espèces capturées selon les sites
d'étude.
|
Atar
|
Tergîte
|
Akjoujt Nouadhibou
|
Zouérate
|
TOTAL
|
|
Cx. quinquefasciatus
|
246 (30,7)
|
34 (4,2)
|
46 (5,7) 279 (34,8)
|
196 (24,4)
|
801
|
|
An. rhodesiensis
|
50 (30,1)
|
116 (69,8)
|
_ _
|
_
|
166
|
|
Ae. vexans
|
17 (34,7)
|
32 (65,3)
|
_ _
|
_
|
49
|
2-2. Selon la méthode
d'échantillonnage
Des 1016 moustiques collectés, 696 ont
été récoltés en faune résiduelle
(Zouérate : 130; Nouadhibou : 250; Atar : 214 et Tergîte : 102) et
320 capturés aux pièges lumineux (Akjoujt : 46; Zouérate :
66; Nouadhibou : 29; Atar : 90 et Tergîte : 88) (Tableau
6).
Culex quinquefasciatus
A Akjoujt, Nouadhibou et Zouérate, Cx.
quinquefasciatus a représenté 100% des collectes de
moustiques à la fois dans les récoltes de la faune matinale
résiduelle et dans les captures aux pièges lumineux. A Atar, la
proportion de Cx. quinquefasciatus dans les captures aux
pièges lumineux et dans les récoltes de la faune au repos a
été respectivement de 62,2% et 88,7%. A Tergîte, les
valeurs correspondantes ont été de 9,1% et 24,5% (Tableau
6).
Aedes vexans
La proportion de Aedes vexans à Atar dans les
captures aux pièges lumineux et dans les récoltes de la faune au
repos a été respectivement de 8,8% et 0,0%. A Tergîte les
proportions correspondantes ont été de 22,4% et 20,6%
(Tableau 6).
Anopheles rhodesiensis
A Atar, la proportion de An. rhodesiensis dans les
captures aux pièges lumineux et dans les récoltes de la faune au
repos a été respectivement de 28,8% et 11,2%. A Tergîte,
les valeurs correspondantes ont été de 67,4% et 55%
(Tableau 6).
Tableau 6 :
Richesse spécifique et abondance
relative d'An. rhodesiensis, Cx quinquefasciatus et Ae.
Vexans selon la méthode de collecte.
|
|
Piége lumineux
|
|
|
Faune au repos
|
|
|
Localités
|
Cx.
quinquefasciatus
|
An.
rhodesiensis
|
Ae.
vexans
|
Cx.
quinquefasciatus
|
An.
rhodesiensis
|
Ae.
vexans
|
|
Atar
|
56 (62,2)
|
26 (28,8)
|
8 (8,8)
|
190 (88,7)
|
24 (11,2)
|
0
|
|
Tergîte
|
9 (10,1)
|
60 (67,4)
|
20 (22,4)
|
25 (24,5)
|
56 (54,9)
|
21 (20,6)
|
|
Akjoujt
|
46 (100)
|
0
|
0
|
0
|
0
|
0
|
|
Zouérate
|
66 (100)
|
0
|
0
|
130 (100)
|
0
|
0
|
|
Nouadhibou
|
29 (100)
|
0
|
0
|
250 (100)
|
0
|
0
|
|
Effectif/espéces
|
206
|
86
|
28
|
595
|
80
|
21
|
|
Total
|
|
320
|
|
|
696
|
|
2-3. Selon la période de capture
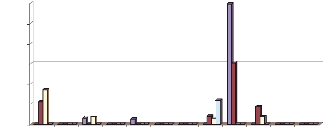
Sur les 1016 espèces culicidiennes capturées
durant cette étude, 671 (66,04%) l'ont été en
février 2002 et 345 (33,95%) en septembre 2002. En février 2002,
Cx. quinquefasciatus, An. rhodesiensis et Ae. vexans
ont représenté respectivement 93,7%, 4,2% et 2,1%
(Tableau 7). Les proportions étaient respectivement de
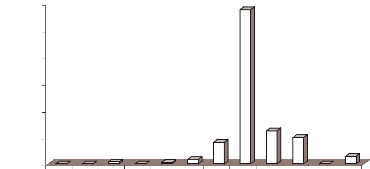
50,0%, 40,0% et 10,0% en septembre 2002 (Figure 5).
févr-02 sept-02

|
pourcentage
(%)
|
100,00% 80,00% 60,00% 40,00% 20,00%
0,00%
|
|
Culex An. Ae. vexans
quinquefasciatus rhodesiensis
Espéces capturés
Figure 5 :
Variations saisonnières (toutes
localités confondues) de l'abondance relative de
An.
rhodesiensis, Cx. quinquefasciatus et
Ae. vexans.
A Akjoujt, Nouadhibou et Zouérate, seules les captures
effectuées en fin de saison des pluies (octobre 2001) ont
été productives (Tableau 7). Des 314 moustiques
collectés à Atar, 122 (38,8%) et 192 (61,2%) l'ont
été respectivement en février et en septembre. A
Tergîte, 28 (15,5%) et 153 (84,5%) moustiques ont été
collectés respectivement durant les même période
(Tableau 7). A Tergîte et à Atar les captures de
septembre ont été plus productives.
Culex quinquefasciatus
Cx. quinquefasciatus a représenté 100%
des captures en février à Akjoujt, Nouadhibou et Zouérate.
A Atar, Cx. quinquefasciatus a représenté 85,2% et 74,5%
des moustiques collectés respectivement en février et en
septembre. A Tergîte, les proportions de Cx. quinquefasciatus en
février et septembre étaient respectivement de 14,3% et 19,0%
(Tableau 7).
32
Ae. vexans
A Atar, Ae. vexans a représenté
respectivement 8,2% et 3,6% des moustiques collectés en février
et septembre. A Tergîte, cette espèce a représenté
14,3% et 18,3% des moustiques collectés au même période
(Tableau 7).
An. rhodesiensis
A Atar, An. rhodesiensis a représenté
6,6% et 21,9% des moustiques collectés respectivement en février
et septembre. A Tergîte, les proportions correspondantes ont
été aux mêmes périodes de 71,4% et 62,7%
(Tableau 7).
3. Densités culicidiennes
comparées
3-1. Densités moyennes
Pour les 36 pièges-nuits et les 20 chambres
traitées, le nombre moyen de femelle de moustiques par piège-nuit
(FPN) et par chambre prospectée (FRC) a été respectivement
de 8,9 FPN et 34,8 FRC. Le ratio FRC/FPN est 3,9.
3-2 Densité moyenne par espèce
3-2-1. Culex quinquefasciatus
Le nombre moyen de femelle de Culex quinquefasciatus
par piège-nuit et par chambre prospectée était
respectivement de 5,7 FPN et 29,7 FRC. A Akjoujt, Nouadhibou, Zouérate,
le nombre moyen de femelles par piège-nuit a été
respectivement de 1,2 FPN, 0,8 FPN et 1,8 FPN. Le nombre moyen de femelles par
chambre prospectée a été de 0,0 FRC, 12,5 FRC et 6,5 FRC.
A Atar et Tergîte, le nombre moyen de femelles par piège-nuit a
été respectivement de 6,8 FPN et 0,9 FPN et le nombre moyen de
femelles au repos par chambre prospectée a été 12,3 FRC et
1,6 FRC (Tableau 10). Les variations du nombre de femelles
d'An. rhodesiensis par piège-nuit et par chambre
prospectée en février et septembre sont indiquées dans le
(Tableau 8).
Tableau 7 :
Abondance relative de Cx.
quinquefasciatus, An. rhodesiensis et Ae. Vexans selon la localité et la
période de capture des moustiques.
|
|
Février
|
|
TOTAL
|
|
Septembre
|
|
TOTAL
|
|
Cx.
quinquefasciatus
|
An.
rhodesiensis
|
Ae.
vexans
|
|
Cx.
quinquefasciatus
|
An.
rhodesiensis
|
Ae.
vexans
|
|
|
Atar
|
104 (85,2)
|
8 (6,6)
|
10 (8,2)
|
122
|
143 (74,5)
|
42 (21,9)
|
7 (3,6)
|
192
|
|
Tergîte
|
4 (14,3)
|
20 (71,4)
|
4 (114,3)
|
28
|
29 (19,0)
|
96 (62,7)
|
28 (18,3)
|
153
|
|
Akjoujt
|
46 (100)
|
0
|
0
|
46
|
0
|
0
|
0
|
0
|
|
Nouadhibou
|
279 (100)
|
0
|
0
|
279
|
0
|
0
|
0
|
0
|
|
Zouérate
|
196 (100)
|
0
|
0
|
196
|
0
|
0
|
0
|
0
|
|
TOTAL
|
629
|
28
|
14
|
671
|
172
|
138
|
35
|
346
|
3-2-2. Ae vexans
Le nombre moyen de femelles d'Ae. vexans par
piège-nuit et par chambre prospectée pour toutes localités
confondues a été respectivement de 0,7 FPN et 0,6 FRC A Atar, les
valeurs correspondantes ont été respectivement de 0,2 FPN et 0,4
FRC. A Tergîte les valeurs correspondantes ont été
respectivement de 1,1 FPN et 2,0 FRC (Tableau 10). La
variation du nombre de femelles d'An. rhodesiensis par
piège-nuit et par chambre traitée lors de chaque sortie est
indiquée dans le tableau 8.
3-2-3 An. rhodesiensis
Le nombre moyen de femelles par piège-nuit et par
chambre prospectée a été respectivement de 2,4 FPN et 4
FRC. A Atar, le nombre moyen de femelles par piège-nuit et par chambre
prospectée a été respectivement de 1,4 FPN et 2,5 FRC. A
Tergîte, les valeurs correspondantes ont été de 3,2 FPN et
5,8 FRC (Tableau 10). La variation du nombre de femelles
d'An. rhodesiensis par piège-nuit et par chambres
traitées lors de chaque sortie est indiquée dans le tableau 9.
35
Tableau 8 :
Variation du nombre moyen de femelles de Cx.
quinquefasciatus par piège-nuit et par
chambre traitée
selon la localité et la période de collecte des
moustiques.
|
Faune matinale résiduelle
|
|
Pièges lumineux
|
|
|
février
|
septembre
|
TOTAL
|
février
|
septembre
|
TOTAL
|
|
Atar
|
86 (8,6)
|
109 (10,9)
|
195 (9,75)
|
18(1,0)
|
34 (1,8)
|
52 (1,4)
|
|
Tergîte
|
4 (0,4)
|
20(2,0)
|
24 (1,2)
|
0 (0,0)
|
9 (0,5)
|
9 (0,6)
|
|
Akjoujt
|
0 (0,0)
|
0 (0,0)
|
0 (0,0)
|
46 (2,5)
|
0 (0,0)
|
46 (1,3)
|
|
Zouérate
|
130 (13,0)
|
0 (0,0)
|
130 (6,5)
|
66 (3,6)
|
0 (0,0)
|
66 (1,8)
|
|
Nouadhibou
|
250 (25,0)
|
0 (0,0)
|
250 (12,5)
|
29 (1,6)
|
0 (0,0)
|
29 (0,8)
|
Tableau 9 :
Variation du nombre moyen de femelles d' Ae.
vexans par piège-nuit et par chambre
traitée selon la
localité et la période de capture des moustiques.
Faune matinale résiduelle Pièges
lumineux
février septembre TOTAL février
septembre TOTAL
Atar 0 0 0 3 (0,2) 5 (0,3)
8 (0,2)
Tergîte 7 (0,7) 14 (1,4)
21(1,1) 7 (0,4) 13 (0,7) 20 (0,5)
Tableau 10 :
Variation du nombre moyen de femelles d'An.
rhodesiensis par piège-nuit et par
chambre traitée selon
la localité et la période de capture des moustiques.
Faunes matinales résiduelles Pièges
lumineux
|
février
|
septembre
|
TOTAL
|
février
|
septembre
|
TOTAL
|
|
Atar
Tergîte
|
13
21
|
(1,3)
(2,1)
|
11
35
|
(1,1)
(3,5)
|
24
56
|
(1,2)
(2,8)
|
18
28
|
(1,0)
(1,5)
|
8
32
|
(0,4)
(1,7)
|
26
60
|
(0,7)
(1,6)
|
36
3-3. Ratios des densités culicidiennes
A Akjoujt, Nouadhibou et Zouérate où une seule
espèce culicidienne Cx. quinquefasciatus a été
capturée, le ratio faune matinale/pièges lumineux est
respectivement de 0, 15,6 et 3,6. A Atar ce ratio a été de 1,8,
1,7, et 2 pour respectivement Cx. quinquefasciatus, An. rhodesiensis et Ae.
Vexans. A Tergîte, les valeurs correspondant étaient 1,8, 1,8
et 1,8 (Tableau 11).
Tableau 11 :
Comparaison des densités moyenne des femelles
d'An. rhodesiensiss, d'Ae. vexans et de
Cx. quinquefasciatus par
pièges lumineux et par chambres selon la localité
d'étude.
localités Atar Tergîte Akjoujt Nouadhibou
Zouérate
Espèces FPN FRC FPN FRC FPN FRC FPN FRC
FPN FRC
Cx.
quinquefasciatus 6,8 12,3 0,9 1,7 1,2 0
0,8 12,5 1,8 6,5
An. rhodesiensis 1,4 2,5 3,2 5,8 _
_ _ _ _ _
Ae. Vexans 0,2 0,4 1,1 2,05 _
_ _ _ _ _
FPN : nombre moyen de femelle par pièges
et par nuit. FRC : nombre moyen de femelle au repos par
chambres traitées
Tableau 12 :
Ratio des densités moyennes d'An.
rhodesiensiss, d'Ae. vexans et de Cx. quinquefasciatus
à Atar et
Tergîte.
|
localité Cx.
Quinquefasciatus
|
An.
rhodésiens
|
Ae.
Vexans
|
Atar 1,8 1,7 2
Tergîte 1,8 1,8 1,8
DISCUSSION
Les cas de paludisme enregistrés dans les centres de
santé du nord de la Mauritanie posent la question de leur origine
autochtone ou allochtone. En effet, puisqu'il est admis que le paludisme sans
anophélisme n'existe pas, seules des investigations entomologiques
pourraient aider à élucider cette situation. Le travail
présenté dans ce mémoire s'inscrit dans cette optique. Le
recours à la combinaison pièges lumineux/dormeur sous
moustiquaire a été préféré à la
classique méthode de captures sur homme adulte volontaire d'une part
pour des raisons éthiques (exposition aux piqûres infectantes des
moustiques) et d'autre part, des études comparatives récentes ont
montré une bonne corrélation entre ces deux techniques
d'échantillonnage. La méthode de récoltes après
pulvérisation intradomiciliaire de pyréthrinoïdes permet de
mieux cibler les espèces endophiles. La prospection des gîtes
larvaires potentiels a été réalisée dans le but de
mieux décrire, inventorier et établir une relation entre le type
de gîte et le genre de larve de moustique qui y est rencontré.
Cette relation pourra être utile dans la perspective de la mise en place
d'une politique de lutte antilarvaire à grande échelle en milieu
désertique de la Mauritanie. D'ailleurs, une telle lutte à petite
échelle a déjà été initiée par la GTZ
(Coopération Allemande) dans le sud-est du pays, en utilisant la poudre
de Neem (Azadirachta indica, Meliaceae). Cette intervention
dont les résultats ont été très nuancés n'a
pas été précédée d'études de terrain
détaillées sur les potentiels gîtes larvaires de
moustiques.
Gîtes larvaires et stades
préimaginaux
Six types de gîtes larvaires ont été
décrits dans cette étude. Une attention particulière a
été portée aux réservoirs métalliques d'eau
et aux bassins des jardins maraîchers qui sont dans certains pays,
d'excellents gîtes larvaires pour les anophèles. En effet,
L'urbanisation galopante observée dans les régions tropicales
attire l'attention sur le paludisme urbain. Ainsi en Inde, il existe un
paludisme urbain alors que la campagne environnante en est indemne. Le vecteur
de ce paludisme urbain est An. stephensi dont les larves se
développent dans les citernes d'eau des maisons (MOUCHET &
BELLEC, 1990). Au Sénégal, les céanes (puits sans
margelle utilisés pour les activités maraîchères) de
la région de Dakar constituent des gîtes hébergeant les
stades préimaginaux d'An. arabiensis (AWONO-AMBENE,
1996). Au cours de ces prospections, aucune des localités
visitées n'a renfermé à la fois les six types de
gîtes larvaires décrits. Le taux de positivité des
gîtes larvaires n'a été que de 8,8%. La productivité
moyenne des gîtes larvaires (nombre moyen de larves
récoltées par coup de bac) la plus faible a été
enregistrée à Nouadhibou (0,4 larve/coup de bac) et la plus
élevée à
Akjoujt (1,7 larves/coup de bac). Une explication possible
à ces observations serait la prédominance de gîtes
larvaires défavorables au développement larvaire en milieu
désertique où seuls quelques rares gîtes sont
colonisés par les larves de moustiques. En effet, des 6 types de
gîtes décrits, seuls 3 renfermaient des gîtes larvaires
positifs avec un taux de positivité d'environ 1/8. Toutes les larves
d'anophèle proviennent d'un seul et même gîte de type G5
où aucune larve de Culicinae n'a été
prélevée. Les gîtes de type G2 ont été plus
productifs que les gîtes de types G1 (92% des larves proviennent de
gîtes de type G2 contre seulement 8% de gîte de type G1). Ces deux
types de gîtes (G1 et G2) sont quelque fois rencontrés dans les
mêmes milieux. Leur différence de productivité pourrait
être due à la présence de flore constituée d'algues
et de champignons observés à la surface des gîtes de type
G1. L'analyse de la qualité (physico-chimique) de l'eau de ces deux
types de gîtes fournirait de plus amples informations.
Richesse spécifique
Jusqu'en 1962, seul An. dthali était connu
à Atar. HAMON et al., (1964) signalent la
présence An. pharoensi et An. squamosus. Les moustiques
récoltés durant ces investigations appartenaient à 3
genres, chaque genre étant représenté par une
espèce. De 3 espèces à Atar et Tergîte, la richesse
spécifique est tombée à une espèce à
Akjoujt, Nouadhibou et Zouérate. La pauvreté spécifique de
la faune culicidienne des régions du nord de la Mauritanie pourrait
être due en partie à l'aridité du climat saharien qui y
sévit. Les températures trop élevées,
l'humidité relative très basse pendant une bonne partie de
l'année et l'irrégularité de la pluviométrie
constituent entre autres, les principaux facteurs limitants la colonisation de
ces milieux. Cette pauvreté spécifique avait été
révélée par MOLEZ & FAYE (1996) qui
avaient noté une diminution de l'abondance et de la biodiversité
culicidienne le long d'un transect allant de la vallée du fleuve
Sénégal au plateau du Tagant, région située au sud
de l'Adrar. Culex quinquefasciatus dont la présence semble
être liée aux activités humaines, a été
récolté dans toutes les localités. A Akjoujt, cette
espèce n'a pas été récoltée en faune
matinale alors qu'elle a été capturée par piège
lumineux. An. rhodesiensis, Ae. vexans et Cx.
quinquefasciatus coexistent à Atar et Tergîte. Ces
prospections qui n'ont pas permis de retrouver An. dthali, An.
pharoensis et An. squamosus, ont néanmoins confirmé
la présence d'An. rhodesiensis dans l'Adrar, présence
qui avait été personnellement communiquée à HAMON
par Maffi (HAMON et al., 1964). Cependant, Hamon
et al (1964) situaient la limite nord d'An.
rhodesiensis dans le Tagant, région limitrophe de l'Adrar. Le
nord de la Mauritanie serait ainsi caractérisé par l'absence
à la fois des vecteurs classiques de
Plasmodium du Sahara central et septentrional
(An. hispaniola Theobald, An. multicolor cambouliu
et An. sergenti Theobald) et de ceux de l'Afrique subsaharien
(An. arabiensis, An. gambiae s.s et An. funestus) et surtout
par la présence d'une population d'An. rhodesiensis. C'est
probablement l'absence des classiques vecteurs du Sahara central et
septentrional qui explique la faiblesse de l'endémicité palustre
dans les régions désertiques du nord de la Mauritanie. Dans le
contexte géo-climatique nord mauritanien, l'existence d'une transmission
anophélienne de Plasmodiums humains par An. rhodesiensis,
seule espèce trouvée dans l'Adrar, n'est pas à
exclure.
Abondance spécifique et densité
moyenne
Avec 68,5% des spécimens collectés dans la faune
matinale résiduelle contre 31,5% capturés aux pièges
lumineux, le rendement a varié avec la méthode
d'échantillonnage. La tendance endophile des moustiques du nord de la
Mauritanie est manifeste à partir de ces résultats. En effet, le
ratio FRC/FPN est d'environ 4. Cette forte densité de moustiques
endophiles en milieu désertique peut s'expliquer par la recherche
d'humidité et de fraîcheur dans les habitations humaines. Ce
comportement peut être une forme d'adaptation écologique propre
aux espèces de ce milieu aride. Le caractère endophile des
moustiques du nord de la Mauritanie pourrait justifier une politique de lutte
antivectorielle par pulvérisation intradomiciliaire d'insecticide.
L'abondance des moustiques a varié selon les périodes de capture.
Le maximum de moustiques a été récolté en
février mais An. rhodesiensis et Ae. vexans ont
été plus abondants en septembre. Une justification possible de
cette observation est que le mois de février fait suite aux pluies
tardives de janvier tandis que le mois de septembre, correspond à la
saison des pluies dans l'Adrar où, contrairement au sud de la
Mauritanie, il n'est pas aisé de délimiter dans le temps la
saison sèche de la saison des pluies.
DEUXIEME PARTIE
Sensibilité d'An. gambiae s.l à
la perméthrine
(0,75%) et à la deltaméthrine (0,05%)
dans les
sites sentinelles du Programme National de
Lutte contre le Paludisme.
Introduction
En dépit des efforts consentis depuis les travaux de
ROSS (1897) et de MANSON (1898) sur la
transmission vectorielle, le paludisme demeure un problème de
santé publique avec 300 à 500 millions de cas cliniques dont 1,5
à 2,7 millions de décès annuels. Il constitue aussi un
obstacle au développement des pays endémiques. L'estimation des
pertes directes ou indirectes dues au paludisme en Afrique est de 2000 millions
de dollars (WHO, 2000). La lutte pour son éradication a
jadis ciblé la destruction de l'agent pathogène et la suppression
du vecteur. L'apparition de la résistance de P. falciparum aux
antimalariques (CHARMOT et al., 1991) ainsi que celle
des vecteurs au DDT et à la dieldrine (COOSEMANS &
CARNEVALE, 1995) ont rendu difficile l'atteinte de cet objectif.
Toutefois, la découverte de nouveaux médicaments
(Artheméther et Pyronaridine) a redonné de l'espoir dans la
chimiothérapie du paludisme. Le contrôle des vecteurs à
travers la réduction du contact homme/vecteur est aujourd'hui une
composante importante de la stratégie de lutte contre le paludisme. Le
recours à un insecticide efficace permet un tel contrôle comme en
témoigne les campagnes de lutte contre l'invasion du Brésil par
An. gambiae s.l (KILLEEN et al., 2002) et
contre l'onchocercose en Afrique de l'Ouest (DADZIE et al.,
1990). Cependant l'utilisation croissante des
pyréthrinoïdes s'est heurtée à des
phénomènes de résistance du vecteur dont les
premières observations ont été faites en Côte
d'Ivoire et au Kenya (ELISSA et al., 1993; VULULE et al.,
1994). Par la suite, la résistance d'An. gambiae
s.l. aux pyréthrinoides a été notée dans d'autres
pays d'Afrique de l'Ouest, notamment au Burkina Faso et au Bénin
(CHANDRE et al., 1999 ; AKOGBETO & YAKOUBOU,
1999). Au Sénégal, on note une relative baisse de
rapidité d'action des pyréthrinoïdes sur An. gambiae
s.l, plus marquée pour la deltaméthrine (KONATE
et al., 2002). L'extension de cette résistance
à d'autre pays n'est pas à exclure en raison de la pression de
sélection induite par les pesticides en agriculture (CHANDRE
et al., 2001) d'une part et d'autre part, de la survenue
à plus ou moins long terme d'une résistance des cibles aux
insecticides utilisés dans tout programme de lutte antivectorielle
basé sur des applications répétées
d'insecticides.
La stratégie de lutte antivectorielle du Programme
National de Lutte contre le Paludisme (PNLP) est basée sur l'utilisation
des moustiquaires imprégnées de pyréthrinoïdes. Les
campagnes de vulgarisation de cet outil ont été lancées
depuis 1995 dans les cinq sites sentinelles du PNLP où le paludisme est
stable et où aucune étude n'a été
réalisée à ce jour sur la sensibilité des vecteurs
du paludisme aux insecticides. Ceci a conduit le PNLP à procéder
à l'évaluation de la sensibilité des vecteurs du paludisme
à la dose diagnostique de la perméthrine (0,75%) et de la
deltaméthrine 0,05%) dans ses sites sentinelles. La
détermination
de la susceptibilité des vecteurs aux produits promus
et vulgarisés ainsi que celle des implications opérationnelles
qui l'accompagnent sont nécessaires à l'élaboration d'une
bonne politique des insecticides. C'est dans ce cadre que s'inscrit la
présente étude.
CHAPITRE I :
MATERIEL ET METHODES.
I- Sites d'étude.
Boghé, Sélibaby, Kankossa, Aïoun et Rosso
(Figure 2) sont les cinq sites sentinelles du PNLP de la
Mauritanie et ont été choisis pour cette raison.
1-Boghé, Rosso et Sélibaby.
Boghé, Rosso et Sélibaby sont respectivement
à 280 km, 205 km et 700 km au sud de Nouakchott, en zone de paludisme
stable. Il n'existe pas de station météorologique à
Sélibaby. La pluviométrie moyenne annuelle à Boghé
et Rosso était de 300 - 800 mm avant les années de
sécheresse. En 2002, année de l'étude, elle était
respectivement de 120,3 mm et 156,3 mm pour 9 et 18 jours de pluies à
Boghé et Rosso (Figure 1a). Boghé est dans la
moyenne vallée du fleuve Sénégal tandis que Rosso
situé à 75 km du barrage de Diama, est dans le delta du fleuve
Sénégal. A Boghé et Rosso la riziculture irriguée
est dominante tandis que la polyculture vivrière sous pluies
prédomine à Sélibaby situé sur la frontière
mauritanomalienne.
1-2. Kankossa et Aïoun.
Kankossa et Aoïun sont respectivement à 750 km et
850 km au sud-est de Nouakchott, loin du fleuve Sénégal. Ces
sites sont situés en zone sahélienne. La pluviométrie
moyenne annuelle variait de 100 à 300 mm à Aïoun avant les
années de sécheresse. Il n'existe pas de station
météorologique à Kankossa qui est traversé par le
Karakoro, un affluent du fleuve Sénégal en Mauritanie. A
Aïoun, la pluviométrie moyenne annuelle en 2002 était de
187,6 mm (Figure 1b). Cette quantité d'eau est
tombée en 26 jours. C'est une zone de pâturage où on
pratique l'élevage et l'agriculture sous pluie.
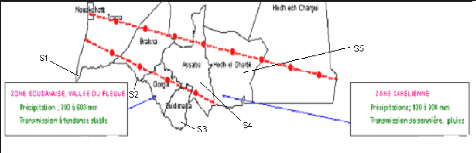
Figure 2.
Carte montrant les sites d'étude et les
différentes zones bioclimatiques du Sud et sud-est
de la Mauritanie.
S1 : Rosso, S2 : Boghé, S3 : Sélibaby, S4 : Kankossa et S5 :
Aïoun.

pluviometrie (mm).
50
40
30
20
80
70
60
10
0
jan mars mai juil sept nov
mois.
a
Boghé Rosso

pluviometrie (mm).
120
100
40
20
80
60
0
jan mars mai juil sept nov
mois.
b

Aïoun
Figure 1 :
Variation de la
pluviométrie moyenne mensuelle à Boghé et Rosso (a) et
à Aïoun (b).
Source ASECNA Mauritanie, 2002.
II- Méthode d'étude
1. Récolte des moustiques
Les moustiques ont été récoltés
tôt le matin par aspirateur à bouche dans les habitations. Le
récolteur muni d'un aspirateur et d'une lampe torche, éclaire les
coins, les dessous de tables, de lits, les rebords des objets accrochés
dans les chambres à coucher et vérandas. À la vue d'un
moustique, il l'éblouit avec la lumière et approche
l'extrémité du tube de l'aspirateur. Une fois celui-ci bien
ajusté, il aspire. Ainsi le moustique se retrouve emprisonné dans
un gobelet dont l'ouverture est recouverte d'un tulle.
2. Papiers imprégnés
Les papiers utilisés pour les tests étaient
pré-imprégnés à la dose diagnostique de la
perméthrine (0,75%) et de la deltaméthrine (0,05%). Les papiers
(Papiers filtre Whatman n°1) ont été fournis par l'OMS/AFRO
par le biais du réseau ANVR (Réseau Africain sur la
Résistance des Vecteurs).
3. Matériel de test
Les kits de l'OMS ont été utilisés pour la
réalisation des tests de sensibilité. Ce kit est composé
de :
· 12 tubes en plastiques de 125 mm de long et 44 mm de
diamètre : 5 tubes avec pastille rouge utilisés pour l'exposition
des moustiques à l'insecticide, 5 tubes avec pastilles vertes
utilisés comme tube de transfert et d'observation avant et après
exposition et 2 tubes avec pastilles vertes utilisés pour les lots
témoins.
· 6 lames de fermeture de tube avec un trou de 20 mm
permettant le transfert des moustiques d'un tube à l'autre.
· 40 pièces de papier (12cmx15cm) pour couvrir les
tubes d'observation.
· Anneaux de métal pour tenir en place les papiers
sur la paroi interne des tubes. - anneaux en acier utilisés uniquement
pour les tubes d'observations et tubes témoins - anneaux en bronze pour
les tubes d'exposition.
· 2 tubes aspirateurs de 12 mm de diamètre avec un
cordon de 60 cm .
· 1 rouleau de scotch.
· Les fiches d'instructions
- fiches de rapport
- papiers de log-probit pour le tracé des droites de
régression.
4. Réalisation du test.
Lors du test, les cylindre-tests OMS ont été
maintenus en position verticale. Les moustiques récoltés sur le
terrain ont été regroupés dans une cage cubique de 50 cm
de côté recouverte de tulle. Après identification à
l'aide d'une loupe à main, les moustiques à tester ont
été prélevés délicatement avec un aspirateur
à bouche et transférés dans le tube d'attente
dépourvu de papier imprégné pour une période de 1
à 2 heures (période de pré-test), ce qui permet de ne
prendre en compte que les spécimens aptes au test. Ces derniers sont
répartis par lots de 25 femelles exposées pendant 60 mn à
un papier imprégné placé dans un tube. Quatre papiers de
perméthrine ont été utilisés dans chaque site. Les
tests avec la deltaméthrine ont été effectués
à Boghé et Rosso. Après 10 mm d'exposition, les tubes sont
délicatement soulevés pour compter le nombre de spécimens
knock down (KD) qui sont au fond du tube. Le décompte des femelles KD a
été effectué après 10, 15, 20, 30, 40, 50 et 60 mm
d'exposition. A la fin de l'exposition, les moustiques sont
transférés dans les tubes d'observation où ils restent
pendant 24 heures (période d'observation). Au cas ou il y'a moins de 80%
de KD à la fin des 60 mm d'exposition, un autre décompte de KD
est effectué 20 mm après le début de l'observation (soit
80 mm après le début de l'exposition). Le décompte du KD
à différentes périodes a permis de déterminer la
droite de régression sur papier log-probit et de déterminer
graphiquement les KDT50 et KDT95 qui indiquent
le temps pour lequel 50% et 95% des moustiques testés sont
respectivement abattus.
6. Espèces testées et nombre de
répliques
Les tests de perméthrine ont portés sur des
échantillons d'An. gambiae dans tous les sites sauf à
Kankossa en raison d'un effectif insuffisant. Pour An. pharoensis les
tests de perméthrine ont été effectués sur des
femelles capturées à Boghé et Rosso. Les tests de
deltaméthrine ont été réalisés sur des
femelles d'An. pharoensis récoltées à
Boghé. Pour An. gambiae s.l le nombre de répliques avec
la perméthrine a été de 4 à Boghé et Rosso,
et 5 à Sélibaby et Aïoun. Pour An. pharoensis, il a
été de 4 répliques par site. Le nombre de répliques
effectuées avec la deltaméthrine a été de 3
répliques à Boghé. Tous les tests de sensibilité
ont été réalisés sur le terrain où un lot de
25 moustiques de la même espèce que ceux testés a servi de
témoin.
III- Traitement des moustiques.
1. Traitement sur le terrain
1.1. Identification des moustiques
Sur le terrain les moustiques à tester sont
identifiés sous la loupe binoculaire, à partir de la clé
de détermination de DIAGNE et al, (1994).
1.2. Conservation des moustiques
A l'issue du test, chaque moustique mort est individuellement
conservé dans un tube eppendorf de 1,5 ml, numéroté et
contenant du silicagel (dessiccateur). Les moustiques vivants à l'issue
des 24 heures d'observation ont été assommés et
individuellement conservés dans de l'alcool 70%, dans des tubes
eppendorf de 1,5 ml numérotés.
2. Traitement au laboratoire
La détermination des espèces du complexe
Anopheles gambiae, la fréquence des formes moléculaires
M et S et la recherche du gène Knock down résistance (kdr) chez
An. gambiae s.s ont été effectuées. Par ailleurs,
la recherche d'infection chez les spécimens d'An. gambiae s.l.
testés a été effectuée par ELISA-CSP.
2.1. Principe de la technique ELISA.
La recherche d'infection a été effectuée
par la technique ELISA selon le protocole décrit par BURKOT
et al., (1984) et modifié par WIRTZ et
al., (1987). Cette technique consiste a bloquer l'antigéne
circumsporozoïtique (CSP) entre un anticorps monoclonal de capture antiCSP
et un autre anticorps monoclonal anti-CSP conjugué à la
peroxydase. L'identification est faite en deux phases. La première est
un screen qui permet d'identifier les moustiques infestés sans tenir
compte de l'espèce plasmodiale. La seconde dite monospécifique,
permet de confirmer l'infestation et d'identifier l'espèce plasmodiale
en cause. En raison de la présence probable de P. vivax en
Mauritanie, la recherche de la CSP a été faite pour P.
falciparum, P. malariae, P. vivax et P. ovale. Trois
étapes sont nécessaires pour la mise en évidence de cette
protéine :
- cottage des plaques avec le broyat à tester
- faire agir les monoclonaux
- révélation de la réaction par addition
d'un substrat péroxydase.
2.2. Principe de l'identification des espèces du
complexe Anopheles gambiae par PCR
La détermination spécifique des membres du
complexe An. gambiae a été effectuée par PCR
(réaction de polymérisation en chaîne) selon le protocole
décrit par SCOTT et al., (1993). Cette
technique consiste à copier jusqu'à un milliard de fois le
fragment de génome que l'on désire étudier en utilisant le
principe de la duplication observé in vivo dans la cellule :
la
duplication de l'ADN dans le cellule a lieu juste avant la
mitose sous l'action d'une enzyme ; l'ADN polymérase. Après
séparation des deux brins complémentaires (dénaturation),
les fragments d'ARN ou amorces s'apparient à leur séquence
complémentaire au niveau de chaque brin d'ADN. L'ADN polymérase
ajoute des nucléotides à chaque amorce, aboutissant à la
formation d'une copie complémentaire de chaque brin d'ADN. On obtient
ainsi deux nouvelles molécules d'ADN identique à la
molécule initiale : on parle de polymérisation.
La PCR utilisée repose sur le même principe,
à la différence qu'elle utilise deux amorces sous formes de brin
simple d'ADN. Cette technique comprend trois étapes principales :
- la dénaturation de l'ADN qui se fait à des
températures variant entre 90 et 97°C pendant 15 à 30
secondes.
- l'hybridation des amorces qui a lieu entre 50 et 70°C,
- l'extension des amorces sous l'action des ADN
polymérases. Au cours de cette phase, la température est
portée à 72°C. Cette température favorise l'ouverture
de la double hélice d'ADN. l'ADN polymérase thermostable : la taq
polymérase ajoute des nucléotides. Cette enzyme est tirée
d'une bactérie Archéobactérie, Thermus aquaticus vivant
dans les sources thermales entre 80 et 90°C (KAPLAN & DELPECH,
1993).
2.3. Identification des formes moléculaires et
recherche du gène Knock Down (Kdr) au sein d'Anopheles gambiae
s.s.
Dans le cadre d'une collaboration entre le PNLP de la
Mauritanie et le Malaria Research and Training Cennter (MRTC, Bamako, Mali),
les échantillons d'An. gambiae s.l ont été
analysés à Bamako. Les résultats des analyses pour la
forme moléculaire et la recherche du gène Kdr nous ont
été envoyés.
CHAPITRE II:
RESULTATS
I- Faune anophélienne
Seul An. gambiae s.l a été capturé
dans tous les sites. A Rosso et à Boghé, il était
associé à An. pharoensis (tableau
1).
Tableau 1 :
Composition et proportion
respective des différentes espèces dans
l'échantillon
d'anophèles capturés et testés
dans chaque localité.
|
Espèces
Localités
|
An. gambiae s.l
|
An pharoensis
|
Total
|
|
effectif
|
pourcentage
|
Effectif
|
pourcentage
|
|
Sélibaby
|
125
|
100
|
0
|
0
|
125
|
|
Rosso
|
100
|
36,4
|
175
|
63,6
|
275
|
|
Boghé
|
100
|
50
|
100
|
50
|
200
|
|
Aioun
|
125
|
100
|
0
|
0
|
125
|
|
Kankossa
|
11
|
100
|
0
|
0
|
11
|
|
Total
|
461
|
62,6
|
275
|
37,4
|
736
|
Aucune infection n'a été notée chez les
461 femelles d'An. gambiae sl récoltés qui ont toutes
été testées en PCR pour la détermination des
espèces qui composent ce complexe. An. arabiensis a
représenté 97,2% (448/461) des spécimens dans les
échantillons testés contre seulement 2,8%(13/461) pour An.
gambiae s.s. (tableau 2). Avec 10 des 13 spécimens
(77%) récoltés à Boghé contre seulement 3
récoltés à Aioun, An. gambiae s.s. est
concentré dans la vallée du fleuve Sénégal. Seule
la forme moléculaire M homozygote S/S (absence du gène kdr)
d'An. gambiae s.s. a été trouvée.
Tableau 2 :
Résultats de la PCR des
461 An. gambiae sl récoltés dans les cinq sites
d'étude.
Fréquence d'An. arabiensis et An.
gambiae ss touts sites confondues et pour chaque
sites
d'étude.
|
Sites
|
Sélibaby
|
Rosso
|
Boghé
|
Aïoun
|
Kankossa
|
|
Nombre An. gambiae s.l capturés
|
125
|
100
|
100
|
125
|
11
|
|
Nombre An. gambiae s.l testés
|
125
|
100
|
100
|
125
|
11
|
|
Nombre An. gambiae s.s identifiés
|
|
|
10
|
3
|
|
|
Nombre An. arabiensis identifies
|
125
|
100
|
90
|
122
|
11
|
|
% An. gambiae s.s
|
|
|
10%
|
2,4%
|
|
|
% An. arabiensis
|
100
|
100
|
90
|
97,6
|
100
|
II. Sensibilité à la perméthrine
(0,75%) et à la deltaméthrine (0,05%)
1. Température et humidité relative pendant
les tests.
La température et l'humidité relative ayant
prévalu dans chaque site pendant les tests sont
représentées dans le tableau 3. A Sélibaby, une
augmentation de 3°C de la température a été
notée au cours de la période d'observation (tableau
3).
Tableau 3:
Variation de la
température et de l'humidité relative au cours de l'exposition et
de la
période d'observation des femelles d'An. gambiae sl et
d'An. pharoensis. Octobre 2002.
Mauritanie.
|
période d'exposition
|
période d'observation
|
|
Température
|
Humidité relative
|
Température
|
Humidité relative
|
|
Boghé
|
31°C
|
80%
|
31°C
|
78%
|
|
Sélibaby
|
30°C
|
78%
|
33°C
|
81%
|
|
Rosso
|
30°C
|
81%
|
30°C
|
80%
|
|
Aïoun
|
30°C
|
78%
|
30°C
|
80%
|
2- Taux de mortalité.
2.1. Taux de mortalité à la
perméthrine 0,75%.
2.1.1. An. gambiae s.l.
A la dose discriminante de 0,75% la mortalité a
été totale pour tous les spécimens d'An. gambiae
s.l. exposés à la perméthrine, excepté
à Boghé où sur les 100 femelles testées, une
était vivante après 24 heures d'observation.(Tableau
4).
2.1.2. An. pharoensis
A Boghé et Rosso, la mortalité était totale
pour les femelles d'An. pharoensis testées. (Tableau
4).
2.2. Taux de mortalité à la
deltaméthrine 0,05%.
Les tests à la deltaméthrine ont
été effectués seulement à Rosso. Ils ont
porté sur les seules femelles d'An. pharoensis dont la
mortalité a été totale à la dose discriminante de
0,05% (Tableau 5).
Tableau 4 :
Taux de mortalité
d'An. gambiae sl et d'An. pharoensis obtenus 24 heures
après une
heure d'exposition à la perméthrine 0,75%,
à Boghé, Sélibaby, Aïoun et Rosso. Octobre
2002
Mauritanie.
Permèthrine 0,75%
|
|
An. gambiae sl
|
|
An. pharoensis
|
|
Boghé
|
Sélibaby
|
Aioun
|
Rosso
|
Boghé
|
Rosso
|
|
Témoins
Morts
Vivants Mortalité % Effectif
testé
KD après :
|
25 0 25 0% 100
|
25
0
25
0%
125
|
25 0 25 0% 125
|
25 0 25 0% 100
|
25 0 25 0% 100
|
25
0
25
0%
100
|
|
10 mm
|
55
|
42
|
23
|
49
|
55
|
47
|
|
15 mm
|
73
|
95
|
71
|
82
|
69
|
70
|
|
20 mm
|
95
|
116
|
112
|
93
|
96
|
99
|
|
30 mm
|
97
|
121
|
122
|
98
|
100
|
100
|
|
40 mm
|
99
|
125
|
125
|
100
|
100
|
100
|
|
50 mm
|
99
|
125
|
125
|
100
|
100
|
100
|
|
60 mm
|
99
|
125
|
125
|
100
|
100
|
100
|
|
Morts après 24 heures
|
99
|
125
|
125
|
100
|
100
|
100
|
|
Vivants après 24 heures
|
1
|
0
|
0
|
0
|
0
|
0
|
|
Mortalité %
|
99%
|
100%
|
100%
|
100%
|
100
|
100%
|
|
Mortalité corrigée %
|
NR*
|
NR*
|
NR*
|
NR*
|
NR*
|
NR*
|
3. Temps de Knock Down.
Les temps de Knock Down (KDT) ont été
déterminés à partir de la droite de régression
obtenue sur papier log probit. Les KDT50 et
KDT95 correspondent respectivement au temps pour lequel 50% et 95% des
spécimens sont abattus (Knocked down).
Tableau 5 :
Taux de mortalité d'An.
pharoensis,obtenus 24 heures après une heure d'exposition à
la
deltaméthrine 0,05%, à Rosso. Octobre 2002
Mauritanie.
Deltaméthrine 0,05%
|
An. pharoensis
|
|
Rosso
|
|
Témoins
|
25
|
|
Morts
|
0
|
|
Vivants
|
25
|
|
Mortalité %
|
0%
|
|
Total testé
|
75
|
|
KD après :
|
|
|
10 mm
|
52
|
|
15 mm
|
75
|
|
20 mm
|
75
|
|
30 mm
|
75
|
|
40 mm
|
75
|
|
50 mm
|
75
|
|
60 mm
|
75
|
|
Morts après 24 heures
|
75
|
|
Vivants après 24 heures
|
0
|
|
Mortalité %
|
100
|
|
Mortalité corrigée %
|
NR*
|
3.1. An. gambiae s.l.
3.1.1 Temps de Knock Down 50% (KDT50).
Le KDT50 minimum obtenu avec la perméthrine était
de 10 mn à Boghé. Il était de 15 mn dans les autres sites
(Tableau 6).
3.1.2. Temps de Knock Down 95% (KDT95).
La valeur du KDT95 a été le double de
celle obtenue pour le KDT50 dans chaque site.
Tableau 6 :
Temps de Knock Down et taux de mortalité d'An.
gambiae sl obtenus avec la perméthrine 0,75% selon la
localité d'origine des femelles. Octobre 2002 Mauritanie.
Perméthrine 0,75%
|
Localités
|
|
An. gambiae sl
|
|
|
KDT 50
|
KDT 95
|
%Mortalité
|
|
Boghé
|
10
|
20
|
99
|
|
Sélibaby
|
15
|
30
|
100
|
|
Aioun
|
15
|
30
|
100
|
|
Rosso
|
15
|
30
|
100
|
3.2. An. pharoensis
Le KDT50 obtenu avec la perméthrine a
été relativement plus faible à Boghé (10 mn)
qu'à Rosso (15 mn) où le KDT50 obtenu avec la
deltaméthrine a été de 10 mn (Tableau 7).
Dans chacun des deux sites, la valeur du KDT95 a
été supérieure de 5 mn à celle du KDT50 obtenue.
Tableau 7 :
Temps de Knock Down et taux de
mortalité d'An. pharoensis obtenus avec
la
perméthrine 0,75% (Boghé et Rosso) et la
deltaméthrine 0,05% (Rosso), Octobre 2002,
Mauritanie.
Perméthrine 0,75%
Deltaméthrine 0,05%
Localités KDT 50 KDT 95
%Mortalité
KDT 50 KDT 95 %Mortalité
Boghé 10 15 100
Rosso 15 20 100
10 15 100
An. pharoensis
3.3. Ratio des temps de Knock Down.
Pour la perméthrine, le ratio KDT 95/KDT50 a
été de 2 pour An. gambiae s.l. dans tous les sites
étudiés. Les valeurs correspondantes pour An. pharoensis
ont été de 1,5 et 1,3 respectivement à Boghé et
Rosso (Tableau 8).
Tableau 8
Ratio KDT95 / KDT50 d'An.
gambiae sl et An. pharoensis selon l'insecticide et la
localitéd'origine des femelles.
Perméthrine 0,75%
An. gambiae sl An. pharoensis
Boghé 2 1,5
Rosso 2 1,3
Sélibaby 2 TNR*
Aïoun 2 TNR*
* TNR : Test Non Réalisé.
DISCUSSION
La sensibilité aux insecticides peut être
étudiée sur les larves ou les adultes des vecteurs
anophéliens. En raison du faible recours aux mesures de lutte
antilarvaire en Mauritanie (un seul site pilote à Aïoun), le choix
a été porté sur les moustiques adultes sauvages
récoltés sur le terrain. Pour ces tests, les kits de l'OMS ont
été préférés à la bouteille d'essai
mise au point par le CDC d'Atlanta (Center for Disease Control). Les deux
insecticides testés dans cette étude sont des
pyréthrinoïdes de synthèse. Un seul des deux aurait pu
servir pour les tests, du fait que toute résistance constatée
avec un insecticide induit en général une résistance
croisée avec tous les insecticides de la même famille et/ou
agissant sur le même site (CHANDRE et al.,
1999b). La connaissance du statut de chaque vecteur vis-à-vis
des différents insecticides est nécessaire à
l'élaboration d'une bonne politique des insecticides par le PNLP. La
nécessité de cette connaissance explique la réalisation
des tests avec les deux insecticides.
La faune anophèlienne
La technique de capture directe à l'aide d'aspirateur
à bouche utilisée lors de cette étude ne cible que les
moustiques endophiles. Seuls An. gambiae sl et An. pharoensis
ont été récoltés. An. funestus dont le
retour dans la vallée du fleuve a été signalé
(KONATE et al., 2001) n'a pas été
récolté. Cependant sa présence a été
notée dans le Trarza (DIA et al., soumis).
Deux (An. gambiae ss et An. arabiensis) des trois
espèces ouest Africaines du complexe An. gambiae ont
été pour la première fois formellement identifiées
dans les sites sentinelles de la Mauritanie. Ces deux vecteurs majeurs du
paludisme en Afrique de l'ouest (MOUCHET & CARNEVALE, 1991, FAYE
et al., 1993, 1994, 1995 ; KONATE et al., 1994 ; FONTENILLE
et al., 1997a,b) ont présenté une
répartition spatiale hétérogène.
Présent dans tous les sites, An. arabiensis couvre
ainsi le sud et le sud-est du pays. Par contre, An. gambiae s.s,
représenté par la forme M, semble être confiné
à l'extrême sud du pays (Boghé). La zone de recouvrement de
ces deux espèces ne semble pas être importante en Mauritanie.
Cependant, selon COZ (1973), la zone de recouvrement de ces
deux vecteurs est très importante et on les trouve souvent en sympatrie.
La prédominance d'An. arabiensis au sein du complexe An.
gambiae était attendue en Mauritanie (bordure du Sahara). Elle
confirme les observations faites sur la distribution des espèces du
complexe An. gambiae (COETZEE et al.,
2000).
Taux d'infection des femelles testées
Aucune femelle infectée n'a été
trouvée. En 1963 l'indice sporozoïtique d'An. gambiae s.l
;, dans le Hodh el Garbi (région englobant le site d'Aïoun)
était de 0,45% (2/444). Son évaluation avait été
faite après dissection des glandes salivaires des femelles
(HAMON et al., 1964). En 2003 DIA et
al trouvent dans l'Assaba (région englobant le site de
Kankossa) un indice de 0,42% (1/239) après des tests d'Elisa-csp,
l'unique espèce anophèlienne positive à P.
falciparum était An. arabiensis. L'évaluation
fiable des indices sporozoïtique dans les sites du PNLP (bordure du
Sahara) où la transmission du paludisme est supposée être
saisonnière courte nécessite d'une part de tester un grand
effectif d'An. gambiae s.l. collecté à différant
moment et par différentes techniques et d'autre part de vérifier
l'hypothèse de l'existence d'une transmission anophélienne de
Plasmodiums humains par des espèces d'Anopheles autres
que les classiques vecteurs par exemple An. pharoensis ou An.
rhodesiensis. La prédominance d'An. pharoensis dans
les récoltes de femelles endophiles dans le delta (63,6% des captures de
Rosso) et la moyenne vallée (50% des captures de Boghé),
confirment les observations faites sur la rive sénégalaise
(FAYE et al., 1995 ; CARNEVALE et al.,
1999). La probable implication d'An. pharoensis dans la
transmission de P. falciparum dans le delta (CARRARA et
al., 1990) explique la détermination de sa
sensibilité par rapport aux insecticides testés.
Sensibilité d'An. gambiae s.l. et
d'An. pharoensis à la perméthrine et à la
deltaméthrine Avant cette étude, le seul cas de
résistance à un insecticide documenté en Mauritanie est
celui d'An. gambiae sl à la dieldrine à Kaedi
(HAMON et al 1964). Les échantillons
testées ont présenté une bonne sensibilité tant
à la perméthrine qu'à la deltaméthrine. Dans tous
les sites, le taux de mortalité obtenu avec les deux insecticides a
été quasi-totale, sauf à Boghé où 24 h
après exposition à la perméthrine, un spécimen
d'An. gambiae sl (An. gambiae ss) a survécu. En raison
de l'absence de la mutation kdr chez les tous les spécimens, ce dernier
n'a probablement pas été suffisamment en contact avec
l'insecticide pour être resté au repos sur l'une des deux parois
horizontales du tube. En effet, en position verticale, le papier
imprégné d'insecticide est accolé à la paroi
verticale du tube.
En zone endémique d'Afrique, l'efficacité
expérimentale de la perméthrine et de la deltaméthrine sur
papiers imprégnés, en prélude à
l'imprégnation des moustiquaires pour la réduction du contact
homme vecteur, a été fréquemment démontrée
(COOSEMANS et al 2001, KONATE et
al., 2002 et BERZOSA et al., 2002).
Les populations d'An. gambaie s.l et d'An.
pharoensis de Boghé, testées ont présenté une
plus grande sensibilité que ceux de Sélibaby, Aïoun et Rosso
par rapport à la perméthrine 0,75%. Dans l'ensemble, les
populations d'An. gambiae s.l. de Boghé ont
présenté les KDT50 et KDT95 les plus faibles.
Cependant, à mortalité égal, le KDT95 des
populations d'An. pharoensis est plus faible que celui d'An.
gambiae s.l. Il apparaît ainsi que les populations
anophèliennes de Boghé sont plus sensibles aux insecticides
utilisés d'une part et d'autre part, que les populations d'An.
pharoensis sont relativement plus sensibles que celles d'An. gambiae
sl à la perméthrine 0,75%.CHANDRE et al.,
(1999) ont trouvé que le temps de Knock down est un bon
indicateur pour la détection précoce de la résistance. Il
augmente significativement avant l'observation de changement dans le taux de
mortalité. Cette observation nécessite la mise en place d'une
surveillance de routine dans les sites sentinelles. Néanmoins, les taux
de mortalités élevés ainsi que l'absence de la mutation
kdr chez An. gambiae s.l. observés au cours de cette
étude sont en faveur de la continuation de la stratégie de lutte
antivectorielle du Programme National de Lutte contre le Paludisme basée
sur l'utilisation de moustiquaires imprégnées de
perméthrine et deltaméthrine. Cependant les coûts
d'acquisition et de réimprégnation des moustiquaires
imprégnées ainsi que le refus de certaines populations à
dormir sous moustiquaire constituent des obstacles à la bonne mise en
oeuvre de cette stratégie de contrôle du vecteur. Le suivi de la
sensibilité des vecteurs ainsi que de leur comportement de piqûre
et de repos sont également nécessaires à
l'élaboration d'une bonne politique d'insecticides.
BIBLIOGRAPHIE
Abdallahi O.M., 2001- Investigations entomologiques,
parasitologiques et morbidité palustre dans deux zones de transition
climatique : la zone sahélo-saharienne (région du Brakna) et la
zone saharo-sahélienne (Oasis du plateau du Tagant). Mémoire de
DEA de Biologie Animale. Université Cheikh Anta DIOP de Dakar
Sénégal. 56 pages.
Akogbeto M. & Yakoubou S., 1999 - Résistance des
vecteurs du paludisme vis-à-vis des pyréthrinoïdes
utilisés pour l'imprégnation des moustiquaires au Bénin,
Afrique de l'Ouest.Bull Soc Pathol Exot. 92 (2) : 123-130.
Anonyme, 1999 - Ministère de la Santé et des
Affaires Sociales, Mauritanie. Programme National de Lutte contre le Paludisme
2000-2002. Doc. Plan triennal de lutte contre le paludisme.
Awono-Ambene H.P., 1996 - Bioécologie
préimaginale d'Anopheles arabiensis (Diptera :
Culicidae)
dans les céanes (puits maraîchers) de Dakar,
Sénégal. Mémoire de DEA. Universitéde Dakar
Sénégal, 83 pages.
Beier J.C., Perkins P.V., Wirtz R.A., Koros J., Diggs D.,
Gargan T.P. II & Koech D.K., 1987 - Bloodmeal identification by direct
enzyme-linked immunosorbent assay (ELISA), tested on Anopheles
(Diptera: Culicidae) in Kenya. J. Med. Entomol. 25
(1): 9-16.
Benzerroug EH & Janssens PG., 1985 - Surveillance of malaria
in the Algerian Sahara. Bull Soc Pathol Exot Filiales 78 (5 Pt
2):859-67.
Berzosa P.J, Cano J, Roche J, Rubio J.M, Moyano E, Guerra A,
Mateos J.C, Petrarca V, Do Rosario V & Benito A., 2002 - Malaria vectors in
Bioko Island (Equatorial Guinea): PCR determination of the members of Anopheles
gambiae Giles complex (Diptera :Culicidae) and pyrethroid Knockdown resistance
(Kdr) in An. gambiae sensu stricto. Journal of Vector Ecology
27(1): 102-106
Carnevale P, Guillet P, Robert V, Fonteneille D, Doannio J., 1999
- Diversity of malaria in rice growing areas of the Afrotropical region.
Parasitologia 41: 273-276.
Carrara G.C., Petrarca V., Niang M. & Coluzzi M., 1990 -
Anopheles pharoensis and transmission of Plasmodium
falciparum in the Senegal River delta, West Africa. Medical and
Veterinary Entomology 4 (4), 421-424.
Chandre F, Darriet F, Manguin S, Brengues C, Carnevale P &
Guillet P., 1999b - Pyrethroid cross-resistance spectrum among populations of
Anopheles gambiae from Côte d'Ivoire. J. Am. Mosq. Cont. Assos.
15, 53-59.
Chandre F., Baldet T., Carnevale P., Akogbeto M., Darriet F.,
Koffi A., Diabate A., Guillet P.& Hougard J.M., 2001 - Traitements
agricoles et résistance des anophèles en Afrique. Bull. Soc.
Française Parasitol., Tome 19
Charmot G., Amat-Roze J.M., Rodhain F., Lebras J. &
Coulaud J.P., 1991 - Abord géographique de l'épidémiologie
de la chloroquino-résistance de Plasmodium falciparum en
Afrique tropicale. Ann. Soc. Belge Med.Trop. 71, 187-197.
Coetzee M., Craig M. & le Sueur D., 2000 - Distribution of
African malaria mosquitoes belonging to the Anopheles gambiae complex.
Parasitology Today 16 (2), 74-77.
Collins F.H., Petrarca V., Mpofu S., Brandling-Bennett A. D.,
Were J.B.O., Rasmussen M. O. & Finnerty V., 1988 - Comparison of DNA probe
and cytogenetic methods for identifying field collected Anopheles gambiae
complex mosquitoes. Am. J. Trop. Med. Hyg, 39 (6), 545- 550.
Collins W.E, Nguyen-Dinh P, Sullivan JS, Morris CL, Galland
GG, Richardson BB, and Nesby S., 1998 - adaptation of the strain of plasmodium
vivax from Mauritania to new word monkeys and anopheline mosquitoes. J.
Parasitol. 84 (3) 619-21
Coosemans M & Carnevale P., 1995 - Malaria vector control: a
critical review on chemical methods and insecticides. Ann Soc Belge
Méd Trop. 75: 13-31.
Coosemans M. & D'Alessandro U., 2001 - Plaidoyer pour les
moustiquaires imprégnées dans les programme de lutte contre le
paludisme. Bull. Soc. Path. Ex. 94, (2bis), 169-173.
Cortes H., Morillas-Marquez F. & Valero A., 2003 - Malaria in
Mauritania: the first cases of malaria endemic to Nouakchott. Trop Med and
Inter Health 8 (4), 297-300.
Coulibaly I., 1999 - Rapport de consultation sur l'utilisation
des pyréthrinoïdes pour l'imprégnation des moustiquaires en
Mauritanie. Archives Programme national de lutte contre le paludisme,
Mauritanie.
Couvy V., 1925 - Le fonctionnement du service de défense
contre le paludisme à Madagascar (1923-1924). Ann. Méd.
Pharm. Coloniales, 23, p. 238-264.
Coz J., 1973 - Contribution à l'étude du complexe
An. gambiae. Répartition géographique et
saisonnière en Afrique de l'Ouest. Cah. ORSTOM, Sér. Ent.
Méd. Parasitol., 11, (1), 3-31
Dadzie K.Y., Remme J. & De Sole G., 1990 - Epidemiologycal
impact of vector control II. Change in ocular onchocerciasis. Proc. of the
Symp. On Ochocerciasis. Acta Leidensia., 59 (1, 2) : 127- 139.
Davidson I. H., 1990 - Sandflies of Africa south of the
Sahara. Taxonomy and Systematics of the genus Sergentomyia. Johannesburg : The
south African Institute For Medical Research. 75p.
Develoux M, Chegou A, Prual A, Olivar M., 1994 - Malaria in the
oasis of Bilma, Republic of Niger. Trans R Soc Trop Med Hyg. 88 (6), 644.
Dia I., Diop T., Rakotoarivony I., Kengne P. & Fontenille
D., 2003 - Bionomics of An. gambiae Giles, An. arabiensis
Patton, An. funestus Giles and An. nili (Theobald)
(Diptera: Culicidae) and transmission of Plasmodium
falciparum in a sudano-guinean zone (Ngari, Senegal). J. Med. Entomol.
40 (3), 279-283.
Dia I., Ba H., Mohamed S.A.O, Diallo D., Lo B. & Diallo M.,-
First report on the distribution, anthropophilic and infection rates of malaria
vectors in Mauritania. Soumis.
Diagne N, Fontenille D, Konate L, Faye. O, Lamizana M.T,
Legros F, Molez JF & Trape JF 1994 - Les anophèles du
Sénégal : liste commentée et illustrée. Bull.
Soc. Path. Ex. 87 (4), 267-277.
Diallo M., Nabeth P., Ba K., Sall A.A., Ba Y., Mondo M.,
Girault L., Abdelahi O.M., & Mathiot C., 2005 - Mosquito vectors of the
1998-1999 rift valley fever (rvf) outbreak, and others arboviruses (Bagaza,
Sanar, West Nile & Wesselsbron), in Mauritania & Sénégal,
Med Vet. Entomol. 19, 119-126.
Eberl K.J., Jelinek T., Aida A.O., Peyerl-Hoffmann G.,
Heuschkel C., el Valy A.O., Christophel E.M.., 2001 - Prevalence of
polymorphisms in the dihydrofolate reductase and dihydropteroate synthetase
genes of Plasmodium falciparum isolates from southern Mauritania.
Trop. Med. Int. Health. 6 (10), 756-60.
Edwards F.W, 1941- Mosquitos of the Ethiopian Region III.
Culicine adults and pupae. Brit. Mus (Nat. Hist.) edit., Londres.
Elissa N., Mouchet J., Riviere F., Meunier J.Y. & Yao K.,
1993 - Resistance of Anopheles gambiae s.s. to pyrethroids in
Cote d'Ivoire. Ann. Soc. Belg. Méd. Trop.73 (4), 291-294.
Emberger L, Gaussen H, Kassas M & De Phillipis A., 1963 -
Recherches sur la zone aride. XXI Etude écologique de la zone
méditerranéenne. Carte bioclimatique de la zone
méditerranéenne. U. N.E.S.C.O / F.A.O éd., Paris-Rome
Favia G., Lanfrancotti A., Spanos L., Siden-Kiamos I. &
Louis C., 2001 - Molecular characterization of ribosomal DNA polymorphism
discriminating among molecular forms of An. gambiae s.s. Insect
Mol. Biol. 10 (1), 19-23.
Faye O., Fontenille, D., Herve, J.P., Diack, P.A., Diallo, S.,
Mouchet, J., 1993 - Malaria in the sahelian zone of Senegal. Entomological data
concerning transmission. Ann. Soc. Belg. Med.Trop. 73, 21-30.
Fontenille D. Wanji S. Dkouaka R. & Awono-Ambene H.P., 2000 -
Anopheles hancocki, vecteur secondaire du paludisme au Cameroun.
Bull. liais. Doc. OCEAC 33 (2), 23-26.
Fontenille D., Lochouarn L., Diagne N., Sokhna C., Lemasson
J.J., Diatta M., Konate L., Faye F., Rogier C. & Trape J.F.. 1997a. - High
annual and seasonal variations in malaria transmission by anophelines and
vector species composition in Dielmo, a holoendemic area in Senegal. Am. J.
Trop. Med. Hyg. 56 (3), 247- 253.
Fontenille D., Lochouarn L., Diatta M., Sokhna C., Dia I.,
Diagne N., Lemasson J.J., Ba K., Tall A., Rogier C. & Trape J.F., 1997b -
Four years entomological study of the transmission of seasonal malaria in
Senegal and the bionomics of Anopheles gambiae and An. arabiensis.
Trans. R. Soc. Trop. Med. Hyg. 91, 647- 652.
Gillies M.T. & Coetzee M., 1987 - A supplement to the
Anophelinae of Africa South Africa of the Sahara. A supplement to the
Anophelinae of Africa South of the Sahara. Publication of the South African
Institut for Medical Research, 55, 143.
Gillies M.T. & De Meillon B., 1968 -The Anophelinae of Africa
South of the Sahara. Publ. South Afr Inst Med Res., 55, 143
Guiguemde T.R., Gbary A.R., Ouedraogo J.B., Gayibor A.,
Lamizana L., Maiga A.S., Boureima H.S., Comlanvi C.E., Faye O. & Niang
S.D., 1991 - Current aspects of malarial chemoresistance of subjects
autochtonous in the OCCGE countries (West Africa). Ann. Soc. belge Med.
trop. 1991 ; 71 : 199-207.
Hamon J. & Mouchet M., 1961- Les vecteurs secondaires du
paludisme humain en Afrique. Méd. Trop. 21 643-660.
Hamon J., Maffi M., Ouedraogo C.S. & Djimé D., 1964
- Notes sur les moustiques de la République Islamique de Mauritanie
(Diptera : Culicidae) (1ère partie). Bull. Soc. Entomol. France
69, 233-253.
Holstein MH., 1951 - Epidemiology of malaria in French West
Africa. Bull. World Health Organisation. 4(3): 463-73
Huang Y.M., 2001 - A pictorial key for the identification of
the subfamilies of culicidae, genera of culicinae, and subgenre of AEDES
mosquitoes of the Afrotropical region (Diptera: Culicidae) Proc. Entomol. Soc.
WASH. 103(1), 1-53.
Jouan A., Le Guenno B., Digoutte J.P., Philippe B., Riou O. &
Adam F., 1988 - A Rift valley fever epidemic in southern Mauritania. Ann.
Viro.l 139, 307-308
Kaplan J.C. & Delpech M., 1993 - Biologie Moléculaire
et Médecine (2e éd.). Flammarion, 755 p.
Killeen G., Fillinger U., Kiche I., Gouagne L.C., & Knols
B.G.J., 2002 - Eradication of Anopheles gambiae from Brazil: lessons
for malaria control in Africa. Lancet Infectious Dis. 2, 616-627.
Konaté L., Diop A., Sy N. & Faye N. 2002 - Rapport
d'étude sur la sensibilité d'An. gambiae s.l
à la perméthrine (1%), deltaméthrine (0,05%) et au DDT
(4%) en imprégnation sur papiers au Sénégal.
Konate L., Diop A., SY N., Faye M.N., Izri A., Dieng Y., Faye O.
& Mouchet J., 2001 - Comeback of Anopheles funestus in sahelian
senegal. Lancet, 358 (927), 336.
Konate L., Diagne N., Brahimi K., Faye O., Legros F., Rogier C.,
Petrarca V. & Trape J.F.,
- 1994. Biologie des vecteurs et transmission de Plasmodium
falciparum, P. malariae et P. ovale dans un village de
savane d'Afrique de l'Ouest. Parasite 1, 325-333.
Manson P., 1898 - An exposition of the mosquito - malaria theory
and its recent development. J. Trop. Med. 1, 4-8.
Martinez-Torres D., Chandre F., Williamson M.S., Darriet F.,
Berge J.B., Devonshire A.L., Guillet P., Pasteur N. & Pauron D., 1998 -
Molecular characterization of pyrethroid knockdown resistance (kdr) in the
major malaria vector Anopheles gambiae s.s. Ins. Mol. Biol. 7
(2), 179-184.
Molez J.F. & Faye O.. 1996 - Transect Sud-Nord Fleuve / Oasis
: vecteurs du paludisme et incidence palustre. Document ORSTOM Dakar
n°21/97-MZ/DK, 1996. 27 pages.
Monjour L., Richard-Lenoble D., Palminteri R., Daniel Ribeiro
C., Alfred C., Gentilini M., 1984 - A sero-epidemiological survey of malaria in
desert and semi-desert regions of Mauritania. Ann. Trop. Med.
Parasitol. 78 : 71-73.
Mouchet J. & Bellec C., 1990 - Entomologie médicale
et lutte antivectorielle : Acquisitions nouvelles et perspectives.
7ème Congrès International de Parasitologie - ICOPA -
20/24 Août 1990 Paris.
Mouchet J. & Carnevale P., 1991 - Les vecteurs et la
transmission du paludisme. Etudes Médicales, 53, 35-59.
Mouchet J., Carnevale P., Coosemans M., Fontenille D.,
Ravaonjanahary C., Richard A & Robert V.1993 - Typologie du paludisme en
Afrique. Cahiers Santé 3, 220-238.
MSAS 2002 - Ministère de la Santé et des Affaires
Sociales, Direction des statistiques. Rapport annuel 2002-2003.
Nabeth P, Kane Y., Abdelahi M.O., Diallo M., Ndiaye K.,
Schneegans F., Sall A.A. & Mathiot C., 2001 - Rift valley fever outbreak,
Mauritania 1998: Seroepidemiologic, virologic, entomologic and zoologic
investigations. Em. Infect. Dis.7 (6), 1052-1054.
Faye O., Fontenille D., Herve J. P., Diack P. A., Diallo S.
& Mouchet J., 1993 - Le paludisme en zone sahélienne du
Sénégal. 1. Données entomologiques sur la transmission.
Ann. Soc. Belge Méd. Trop. 73, 21-30.
Faye O., Konate L., Gaye O., Fontenille D., Sy N., Diop A.,
Diagne M. & Molez J.F., 1998 - Impact de l'utilisation des moustiquaires
pré imprégnées de perméthrine sur la transmission
du paludisme dans un village hyperendemique du Sénégal.
Méd Trop. 58. 355-360.
Faye O., Gaye O., Fontenille D., Sy N., Konate L., Hebrard G.,
Herve J.P., Trouillet J., Diallo S. & Mouchet J., 1995 - Comparaison de la
transmission du paludisme dans deux faciès
épidémiologiques au Sénégal : la zone
côtière sahélienne et la zone méridionale
soudanienne. Dakar Méd. 40, 201- 207.
Faye O., Gaye O., Faye O. & Diallo S., 1994 - La
transmission du paludisme dans des villages éloignés ou
situés en bordure de la mangrove au Sénégal. Bull.
Soc. Path. Ex. 87, 157-163.
Petrarca V., Vercruysse J. & Coluzzi M., 1987 - Observations
on the Anopheles gambiae complex in the Senegal River Basin, West Africa.
Med. Vet. Entomol. 1 (3), 303-312.
Ross R., 1897 - One some peculiar pigmented cells found in two
mosquitoes fed on malarial blood. Brit. Med. J.
Saluzzo J.F., Digoutte J.P., Chartier C., Martinez D., Bada R.,
1987 - Focus of Rift Valley fever virus transmission in southern Mauritania.
Lancet 28, 504.
Sautet J., Ranque. J. & Vuillet J., 1948 - Quelques notes
parasitologiques sur le paludisme et l'anophélisme en Mauritanie.
Méd. Trop 8, 34-39.
Scott J.A., Brogdon W.G. & Collins F.H., 1993 -
Identification of single specimens of the Anopheles gambiae complex by the
polymerase chain reaction. Am. J. Trop. Med. Hyg. 49 (4), 520-529.
Touré, Y.T., Petrarca, V., Traoré, S.F.,
Coulibaly, A., Maiga, H.M., Sankaré, O., Sow, M., Di Deco, M.A.,
Coluzzi, M., 1998. The distribution and inversion polymorphism of chromosomally
recognized taxa of the Anopheles gambiae complex in Mali, West Africa.
Parassitologia 40, 477-511.
Vulule J.M., Beach R.F., Atieli F.K., Roberts J.M., Mount
D.L., Mwangi R.W., 1994 Reduced susceptibility of Anopheles gambiae to
permethrin associated with the use of permethrin-impregnated bednets and
curtains in Kenya. Med. Vet. Entomol. 8 (1), 71-75.
Wirtz R.A., Zavala F., Charoenvit Y., Campbell G.H., Burkot
T.R., Scneider I., Esser K.M., Beaudoin R.L. & Andre R.G., 1987 -
Comparative testing of monoclonal antibodies against Plasmodium
falciparum sporozoites for ELISA development. Bull. WHO 65,
39-45.
World health organisation (WHO). 2000 - WHO Expert committee on
malaria, twentieth report. WHO, Geneva (
http://mosquito.who.int/docs).
Zeller H.G., Akakpo A.J., Ba M.M., 1995 - Rift Valley fever
epizootic in small ruminants in southern Mauritania (October 1993): risk of
extensive outbreaks. Ann. Soc. Belg. Med. Trop., 75 (2), 135-140.
Titre : Faune anophèlienne du Nord de la
Mauritanie et sensibilité d'An. gambiae s.l. à
la perméthrine (0,75%) et à la
deltaméthrine (0,05%) dans les sites sentinelles du Programme
National de Lutte contre le Paludisme.
Nom et prénom du candidat : Bâ
Hampâté
Nature du mémoire : Diplôme d'Etudes Approfondies
(D.E.A) de Biologie Animale
Jury Président Bhen Sikna TOGUEBAYE
Membres Ibrahima Dia
Karamoko DIARRA
Lassana KONATE
Mady NDIAYE
Soutenu le 29 juillet 2005 à 10H dans la salle des travaux
pratiques de Biologie Animale
Résume
A la suite du signalement de nombreux cas de paludisme dans
les régions du Nord de la Mauritanie, un inventaire de la faune
culidienne y a été réalisé. Trois espèces de
moustiques non encore incriminées dans la transmission du paludisme ont
été récoltées. Il s'agit d'An. rhodesiensis,
d'Ae. vexans et Cx. quinquefasciatus. Les gîtes
larvaires, peu nombreux et peu productifs, sont constitués de bassins
maraîchers et de marelles alimentées par l'eau de sources ou de
pluies. Malgré son caractère d'espace transitionnel, le Nord de
la Mauritanie serait ainsi caractérisé par l'absence à la
fois des vecteurs classiques de Plasmodium du Sahara central et
septentrional (An. hispaniola, An. multicolor et An.
sergenti) et de l'Afrique sud saharienne (An. arabiensis, An.
gambiae s.s. et An. funestus).
Dans les régions du sud et sud-est abritant les sites
sentinelles du PNLP, An. arabiensis et An gambiae s.s. ont
été les espèces identifiées au sein du complexe
An. gambiae. La détermination du taux d'infection n'a
révélé aucune infection. An. arabiensis
présente une large répartition tandis que An.
gambiae s.s., représenté par la forme moléculaire
M, est principalement confiné dans l'extrême sud du pays. An.
gambiae s.l., vecteur majeur du paludisme dans ces sites, a
présenté un taux de mortalité quasi-totale à la
perméthrine (0,75%) et la deltaméthrine (0,05%). La
caractérisation moléculaire de la mutation Kdr montre
que la population d'Anopheles gambiae s.s. est sensible (S/S).
L'absence de toute mutation kdr justifie la vulgarisation des
moustiquaires imprégnées de pyréthrinoïdes par le
PNLP.
Mots clés : An. rhodesiensis, An.
gambiae s.l., Sensibilité (Kdr),
Pyréthrinoïdes, Sites sentinelles, Mauritanie.
| 


