REMERCIEMENTS
Ce travail n'a pu être réalisé que
grâce à l'intervention de plusieurs personnes que je me dois de
remercier. Il s'agit :
- de mes parents, BAYIHA Valentin et NGAMBI Marie Rose,
à qui je suis reconnaissant pour le soutien tant moral que financier
qu'ils m'ont octroyé jusqu'à présent ;
- du Pr KAMTCHOUING Pierre qui a bien voulu m'intégrer
dans son unité de recherche et diriger ce travail ;
- du Dr DZEUFIET DJOMENI Paul
Désiré, dont l'assistance personnelle a été plus
qu'essentielle tout au long de ce travail ;
- du corps enseignant du département de Biologie et
Physiologie Animales de l'Université de Yaoundé I pour les
connaissances prodiguées ;
- de mes aînés de laboratoire, en
particulier : KADA SANDA Antoine, ATSANG A Kiki Gisèle, TEMDIE
Romeo Joël, ABOUBAKAR O. Bibi-farouck, BELLA NDZANA Martin Thierry, NDAYOU
Zacharie Achille et KEMETA AZAMBOU David ;
- de tous mes camarades de promotion ;
- du reste de ma famille, en particulier mes soeurs NGAMBI
BAYIHA Marie Charlène et BAYIHA Françoise Chaveli ;
et de tous ceux qui ont participé de près ou de
loin à la réalisation de ce travail et dont les noms auraient
involontairement été omis. Qu'ils voient dans ce travail
l'expression de ma sincère reconnaissance.
SOMMAIRE
|
Remerciements............................................................................................
|
i
|
|
Sommaire..................................................................................................
|
ii
|
|
Listes des
figures.............................................................................................
|
iii
|
|
Liste des
tableaux.........................................................................................
|
iii
|
|
Liste des
abréviations....................................................................................
|
iv
|
|
Résume.....................................................................................................
|
v
|
|
Abstract....................................................................................................
|
vi
|
|
INTRODUCTION.......................................................................................
|
1
|
|
CHAPITRE I : REVUE DE LA
LITTERATURE.................................................
|
3
|
|
I.1. Les plantes
d'essai...............................................................................
|
4
|
|
I.1.1. Aframomum melegueta K. Schuman
(Zingiberacées).................................
|
4
|
|
I.1.2. Mondia whitei (Hook. F.) Skeels
(Periplolacées).....................................
|
5
|
|
I.1.3. Piper guineense Schum. et Thonn
(Piperacées).......................................
|
6
|
|
I.1.4. Zingiber officinale Roscoe
(Zingiberacées)............................................
|
8
|
|
I.2. Principes de
toxicologie.................................................................................
|
10
|
|
I.2.1. Notion de
toxicologie....................................................................
|
10
|
|
I.2.2. Les voies d'exposition aux produits
toxiques..........................................
|
10
|
|
I.2.3. Le cheminement d'un toxique dans
l'organisme......................................
|
12
|
|
I.2.4. L'effet
toxique............................................................................
|
14
|
|
I.2.5. Les manifestations toxiques :
description par quelques organes cibles............
|
17
|
|
I.2.6. L'évaluation des effets
toxiques........................................................
|
19
|
|
CHAPITRE II : MATERIEL ET
METHODES...................................................
|
23
|
|
II.1. Le matériel
végétal.............................................................................
|
24
|
|
II.1.1. Préparation de
l'extrait.....................................................................
|
24
|
|
II.1.2. Préparation des solutions
d'essai..........................................................
|
25
|
|
II.2. Les
animaux....................................................................................
|
26
|
|
II.3. Protocole
expérimental........................................................................
|
26
|
|
II.3.1. Toxicité orale
aiguë.........................................................................
|
26
|
|
II.3.2. Toxicité orale
subchronique.........................................................................
|
28
|
|
CHAPITRE III :
RESULTATS........................................................................
|
42
|
|
III.1. Toxicité orale
aiguë...........................................................................
|
43
|
|
III.1.1. Effets de l'extrait sur l'aspect
général, le comportement, et la mortalité des animaux
...........................................................................................................
|
43
|
|
III.1.2. Effets de l'extrait sur le poids
corporel..............................................
|
43
|
|
III.1.3. Autopsie
générale........................................................................
|
44
|
|
III.2. Toxicité orale
subchronique.....................................................................
|
44
|
|
III.2.1. Effets de l'extrait sur la
mortalité, l'aspect général, et le comportement des
animaux...................................................................................................
|
44
|
|
III.2.2. Effets de l'extrait sur le poids
corporel................................................
|
45
|
|
III.2.3. Effets de l'extrait sur quelques
paramètres hématologiques et biochimiques...
|
47
|
|
III.2.4.
Pathologie...................................................................................
|
48
|
|
CHAPITRE IV :
DISCUSSION.....................................................................
|
54
|
|
CONCLUSION..........................................................................................
|
60
|
|
Références................................................................................................
|
62
|
|
Annexe.......................................................................................................
|
69
|
LISTE DES FIGURES
|
Figure 1 : Feuilles
(a), fruits (b) et Graines (c) de Aframomum
melegueta.....................
|
4
|
|
Figure 2 : Feuilles
(a), inflorescences (b), et racines (c) de Mondia
whitei.....................
|
5
|
|
Figure 3 : Feuilles (a)
et graines (b) de Piper
guineense...........................................
|
7
|
|
Figure 4 : Plante
entière (a), et rhizome (b) de Zingiber
officinale................................
|
8
|
|
Figure 5 :
Schéma du procédé utilisé pour l'extraction aqueuse
du mélange de Aframomum melegueta, Mondia whitei,
Piper guineense, et Zingiber
officinale...............................
|
25
|
|
Figure 6 : Courbe
d'étalonnage du dosage des protéines par la méthode de
Biuret............
|
37
|
|
Figure 7 : Courbe
d'étalonnage de l'activité
ALAT................................................
|
38
|
|
Figure 8: Courbe d'étalonnage de
l'activité ASAT...............................................
|
39
|
|
Figure 9 : Evolution
des poids corporels en essai
aiguë...........................................
|
44
|
|
Figure 10 : Evolution
des poids corporels chez les survivants mâles (A) et femelles (B) en
essai
subchronique.......................................................................................
|
45
|
|
Figure 11 : Microphotographies des
coupes de foie normal (Témoin) (a), de foie avec congestions vasculaires
(100 mg/kg) (b), de foie légèrement enflammé + dilatation
des capillaires sinusoïdes (200 mg/kg) (c), de foie enflammé
(Toutes les doses) (d)...............
|
50
|
|
Figure 12 : Microphotographies de coupes
de rein normal (Témoin) (a), de rein présentant une clarification
tubulaire (200 mg/kg) (b) ou une inflammation (400 mg/kg) (c).............
|
51
|
|
Figure 13 : Microphotographie de coupes
d'un poumon enflammé (Toutes les doses).......
|
52
|
|
Figure 14 : Microphotographie de coupe
d'un ovaire normal.................................
|
52
|
|
Figure 15 : Microphotographie de coupe
de testicule présentant un grand nombre de cellules rondes (Toutes les
doses)......................................................................
|
53
|
LISTE DES TABLEAUX
|
Tableau I : Principaux effets toxiques
observés sur le foie..........................................
|
17
|
|
Tableau II : Les formes
d'intoxication...............................................................
|
19
|
|
Tableau III: Protocole de dosage des
protéines......................................................
|
37
|
|
Tableau IV : Observations en essai
aigue..................................................................
|
43
|
|
Tableau V: Observations en essai
subchronique.....................................................
|
46
|
|
Tableau VI: Effets de l'extrait sur
quelques paramètres hématologiques.........................
|
47
|
|
Tableau VII : Effets de l'extrait sur
quelques paramètres biochimiques..........................
|
48
|
|
Tableau VIII : Effets de l'extrait
sur le poids relatif de quelques organes........................
|
49
|
LISTE DES ABREVIATIONS
ALAT : Alanine
Aminotransférase
ASAT: Aspartate aminotransférase
DL50/LD50: Dose
Létale 50/Letal Dose 50
ECVAM: European Center for the Validation
of Alternative Methods
HDL:High Density Lipoprotein
ICCVAM:Interagency Coordinating Committee
on the Validation of Alternative Methods
ICH :International Conference on
Harmonisation
ICPS :International Programme on
Chemical Safety
JaCVAM:Japanese Center for the Validation
of Alternative Methods
LDL:Low Density Lipoprotein
NFS: Numération Formule Sanguine
OCDE/OECD : Organisation de
Coopération et de Développement Economique/ Organisation of
Economic Corporation and Development
OMS : Organisation Mondiale de la
Santé
REACH:Registration, Evaluation,
Autorisation and Restriction of Chemicals
UE : Union Européenne
RESUME
Le mélange des plantes Aframomum melegueta,Mondia
whitei, Piper guineense et Zingiber officinale est
traditionnellement utilisé pour la prise en charge de
l'infertilité masculine et de l'impuissance sexuelle. Afin de
déterminer les risques pour la santé humaine associés
à cette utilisation, une évaluation de la toxicité de
l'extrait aqueux du mélange en prises unique et quotidiennes a
été réalisée chez le rat conformément aux
lignes directrices 423 et 407 de l'OCDE pour les essais de produits chimiques.
En prise unique, une dose de 2000 mg/kg de la substance a été
testée uniquement chez les femelles, plus sensibles à la
létalité des substances. En prises quotidiennes (33 jours), 3
doses (100, 200, et 400 mg/kg) et un groupe témoin ont été
employés, la dose de 100 mg/kg représentant la dose
thérapeutique estimée chez le Rat. Pour chaque dose, 10 animaux
(5 par sexe) étaient utilisés. En essai aiguë, aucun
changement majeur lié au traitement n'a été observé
sur toute la durée d'observation. La DL50 a été
estimée supérieure à 2,5 g/kg, ce qui a permis de classer
l'extrait comme substance faiblement toxique. En essai subchronique, 4 animaux
(2 mâles et 2 femelles) sur 28 sont morts des suites du traitement (200
et 400 mg/kg) durant la période d'essai. Les animaux concernés
présentaient avant leur décès de la léthargie, de
la tachypnée, de la maigreur, et une fourrure hérissée.
Une des femelles survivantes (400 mg/kg) présentait en plus des
symptômes sus-cités une réduction des facultés
nociceptive, auditive, et préhensile. L'autopsie des animaux a
révélé des atteintes sur le foie dans les deux sexes (200
et 400 mg/kg). Une réduction du poids relatif des poumons (400 mg/kg) a
été notée chez les femelles. Les analyses
hématologiques et sériques à la fin de l'essai ont
révélé une réduction de la concentration moyenne en
hémoglobine corpusculaire (400 mg/kg), une réduction du
cholestérol sérique total (200 et 400 mg/kg), et une augmentation
dose-dépendante du taux d'ASAT sérique chez les femelles. Les
analyses histopathologiques quant à elles ont
révélé des inflammations hépatiques et pulmonaires
liés au traitement à toutes les doses chez les femelles. En
conclusion, la consommation quotidienne de l'extrait aqueux du mélange
des quatre plantes d'essai à dose thérapeutique ne semble pas
présenter de risques important pour la santé masculine, soutenant
ainsi l'utilisation traditionnelle de l'extrait. Cependant, une
éventuelle utilisation quotidienne à des doses plus
élevées exposerait le mâle à des affections
sérieuses, notamment hépatiques et nerveuses.
Mots clés :Aframomum
melegueta, Mondia whitei, Piper guineense, Zingiber
officinale, toxicité, OCDE.
ABSTRACT
The mixture of Aframomum melegueta, Mondia whitei, Piper
guineense and Zingiber officinale is traditionally used for the
management of male infertility and erectile dysfunction. To determine the
risk to human health associated with the use of this substance, an assessment
of the toxicity of the aqueous extract of the mixture taken in single and daily
doses was performed in rats according to the OECD guidelines 423 and 407
for the testing of chemicals. In single dose, the test substance was
tested only in females, more susceptible to substances lethality. In daily
doses (33 days), 3 doses (100, 200, and 400 mg / kg) and a control group were
used, the dose of 100 mg/kg being the therapeutic dose estimated in rats. For
each dose, 10 animals (5 per sex) were used. In acute test, no major
changes related to treatment were observed throughout the observation
period. The LD50 was estimated above 2.5 g/kg, which was used
to classify the extract as a slightly toxic substance. In subchronic test,
4 animals (2 males and 2 females) of 28 died as a result of treatment (200 and
400 mg/kg) during the test period. The animals concerned presented
symptoms of toxicity like lethargy, tachypnea, thinness, and bristling fur
prior to death. One of the surviving females also exhibited the symptoms
mentioned above, associated with a reduction of nociceptive, auditory, and
prehensile capacities (400 mg/kg). Autopsy of animals showed liver damage
in both sexes (200 and 400 mg/kg). A reduction in the relative lung weight
(400 mg/kg) was noted in females. The blood and serum at the end of the
trial showed a reduction in mean corpuscular hemoglobin concentration (400
mg/kg), reduced serum total cholesterol (200 and 400 mg/kg) and a
dose-dependent increased on serum AST levels in females. The
histopathology revealed liver and lung inflammations related to treatment at
all doses in females. In conclusion, the daily consumption of the aqueous
extract of the mixture of the four test plants in therapeutic doses does not
seem to have significant health risks for male, supporting the traditional use
of the extract. However, any daily use at higher dose exposes male to
serious ailments, including liver and nervous ones.
Keywords:Aframomum melegueta, Mondia
whitei, Piper guineense, Zingiber officinale, toxicity, OECD.

L'intérêt des populations pour la
phytothérapie n'a cessé de croitre au fil des années. Ceci
se comprend quand on considère les nombreux aspects positifs qu'elle
présente. On peut citer : sa diversité,sa souplesse, sa
disponibilitédans de nombreuses parties du monde, son faible coût,
son faible niveau de participation technologique, et son importance
économique grandissante(OMS, 2002). Cet engouement manifeste pour la
phytothérapie ne tient cependant pas compte de certains aspectsde
celle-ci qui apparaissent encorepour la communauté scientifiquecomme des
défis à surmonter. C'est le caspar exemplede son innocuité
etde son efficacité. En effet,les preuvesrecueilliesqui soutiennent ces
2 aspects, comme par exemple le recours au long des siècles à
grand nombre de pratiques préconisées par la médecine
traditionnelle en général et l'expérience transmise de
génération en génération,sont jugées trop
insuffisantes tant sur le plan quantitatif que qualitatif pour répondre
aux critères requis dans le but d'en soutenir l'usageà
l'échelle mondiale.Des recherches scientifiques sont toujours
nécessaires pour étayer ces constatations(OMS, 2000). C'est dans
ce contexte que le Laboratoire de Physiologie Animale de l'Université de
Yaoundé I s'est spécialisé dans l'étude des
propriétés pharmacologiques et toxicologiques des plantes
médicinales.
Aframomum melegueta, Mondia whitei,
Piper guineense, et Zingiber officinale sont 4 exemples de
plantes médicinales, traditionnellement utilisées comme
aphrodisiaques. Des études antérieures onteu à justifier
cet usage traditionnel (Kamtchouing et al., 2002a ; Kamtchouing
et al., 2002b ; Watcho et al., 2005) et à
évaluer la toxicité de chaque plante (Nebojsa et al.,
2010; Raji et al., 2003; Mascolo et al., 1989; Watcho et
al., 2005;...). Ces 4 plantes en mélange sont aussi
utiliséespour traiter les infertilités masculines et
l'impuissance sexuelle. Des études ont déjà eu à
justifierles propriétés pharmacologiques présumées
de ce mélange (Dokou-gaïn, 2010),mais aucune donnée sur la
toxicité du mélange n'est disponible. Ce manquement a
suscité la mise en oeuvre de ce travail qui consistait à
étudier la toxicité de l'extrait aqueux du mélange chez le
rat,avec pour objectif principal de mettre en évidence les dangers
potentiels pour la santé humaine associés à sa
consommation.Plus spécifiquement, il s'agissait de classer l'extrait
dans une gamme de toxicité via un essai de toxicité aiguë
chez les femelles, plus sensibles à la létalité des
substances ;et d'obtenir des informations sur les effets nocifs
éventuels dus à la consommation quotidienne du produit via un
essai de toxicité subchronique dans les deux sexes.

I.1.LES PLANTES D'ESSAI
I.1.1.Aframomum melegueta K. Schum.
(Zingibéracées)
Aframomum melegueta K. Schum (Fig. 1) est une
épice originaire de l'Afrique tropicale de l'ouest (Iwu, 1993),
localisée principalement dans les régions tropicales. Au
Cameroun, elle est rencontrée dans les régions du centre, du sud,
de l'est, de l'ouest, et du littoral (Noumi et al., 1998). Elle est
communément appelée « maniguette ».
  
(a) (b)
(c)
Figure 1 : Feuilles (a), fruits (b) et
graines (c) de Aframomum melegueta (photos issues desfiches de
PROTABASE, 2011)
I.1.1.1.Phytochimie
Il a été rapporté
queAframomum melegueta contient des alcaloïdes (piperine), des
huiles essentielles, et des résines (Lachman-White et al.,
1992). L'analyse chimique des graines a montré que les extraits
méthanolique et hexanique sont riches en 6-paradol, 6-gingérol,
et 6-shogaols (Ghana Herbal Pharmacopeia, 1992 ; Escoubas et al.,
1995 ; Juliani et al., 2007). Le gingerdione a aussi
été isolé (Tane et al., 2005).
I.1.1.2. Usages traditionnels
En Afrique de l'ouest et en Afrique centrale en
général, les fruits frais sont utilisés comme
aphrodisiaques, et la décoction de racine est utilisée par les
mères nourricières pour contrôler la lactation et
l'hémorragie postpartum (Iwu, 1993). Les rhizomes sont utilisés
dans le traitement de la dysenterie et de la diarrhée (Dokosi, 1998),
tandis que les graines sont mâchées pour soigner la dysenterie,
comme sédatif contre les maux de dents, pour se protéger du
rhumatisme et des migraines, et pour soigner la fièvre (Simon et
al., 2007).
I.1.1.3. Données pharmacologiques et
toxicologiques
L'extrait aqueux des graines deAframomum
melegueta est un stimulant sexuel chez le rat (Kamtchouing et
al., 2002b). Aframomum melegueta a présenté une
activité anti-diarrhéique (Umukoro et Ashorobi, 2003) et
anti-inflammatoire (Umukoro et Ashorobi, 2005 ; Okoli et al.,
2007). Les graines de Aframomum melegueta auraient une activité
hypotensive chez l'Humain (Lawal et al., 2007). L'extrait
à l'éthanol des graines serait hypoglycémiant chez le rat
(Nebojsa et al., 2010).
I.1.2. Mondia whitei (Hook. F.) Skeels
(Périplocacées)
Cette plante (Fig. 2)est connue sous les dénominations
de racine tonique, ou white ginger. Elle est largement
distribuée en Afrique tropicale.Au Cameroun, elle est surtout
retrouvée dans les régions du sud et de l'est (Watcho et
al., 2005).
  
(a) (b) (c)
Figure 2 : Feuilles (a), inflorescences
(b), et racines (c) de Mondia whitei(Acquaye et al., 1999)
I.1.2.1. Phytochimie
Des études chimiques sur des extraits
de racines de Mondia whiteiont montré un alcaloïde inconnu
et le 2-hydroxy-4-méthoxybenzaldehyde (Kubo et Kinst-Hori, 1999). La
5-chloropropacine a aussi été retrouvé dans les racines
(Patnam et al., 2005). Dans la fraction organique de l'extrait brut au
méthanol des racines, les composés suivants ont également
été isolés : squalène,
â-sitostérol, 6-méthoxy-7-hydroxycoumarine,
6-méthoxy-7,8-dihydroxycoumarine, propacine (Lamidi et Bourobou
Bourobou, 2010).
I.1.2.2. Usages traditionnels
Dans toute l'Afrique, les racines sont très
appréciées comme aphrodisiaque, pour traiter les dysfonctions
sexuelles, prévenir l'éjaculation précoce et augmenter la
production de sperme. La décoction ou l'infusion de racine ou
d'écorce de racine se prend couramment pour traiter les affections
gastro-intestinales, maux d'estomac et indigestions (Lamidi et Bourobou
bourobou, 2010)
I.1.2.3. Données pharmacologiques et
toxicologiques
Les extraits à l'hexane et au méthanol
ontmontré une activité anti-inflammatoire(Lamidi et Bourobou
Bourobou, 2010). L'extrait aqueux de l'écorce des racines à 400
mg/kg/jour administré par voie orale pendant 8 jours a augmenté
la production de testostérone et la fertilité de rats mâles
(Watcho et al., 2004). Dans une étude in vitro,
l'extrait à l'hexane de la racine a fait ressortir un effet relaxant sur
les contractions du spermiducte de rat induites à l'adrénaline et
au KCl(Lamidi et Bourobou Bourobou, 2010). Une étude in vivo
des effets de l'extrait à l'hexane à des doses de 500 et 1000
mg/kg/jour sur la concentration intratesticulaire en cholestérol, sur
les caractéristiques hématologiques et sur la sensibilité
à la norépinéphrine du canal déférent
isolé de rat a montré un effet androgènique
réversible (Watcho et al., 2005). Des spermatozoïdes
humains ont été incubés in vitro avec l'extrait
aqueux des racines et on a découvert que l'extrait stimulait aussi bien
la motilité totale que la motilité progressive(Lamidi et Bourobou
Bourobou, 2010).
La DL50 de l'extrait aqueux des racines est
supérieure à 15 g/kg pour les souris. Une administration par voie
orale d'un extrait d'écorce de racine à 400 mg/kg/jour pendant 55
jours a provoqué des lésions testiculaires donnant lieu à
un arrêt de la spermatogenèse, des modifications
dégénératives dans les tubules séminifères
et l'épididyme. Ce traitement a également eu pour
conséquence un effet contraceptif partiel. Après une
période de rétablissement, la spermatogenèse et la
fécondité étaient normales, ce qui fait penser que les
effets antispermatogène et contraceptif sont réversibles. L'huile
volatile des racines entraîne une inflammation et une rougeur de la peau,
une irritation des muqueuses et relâche les muscles lisses dans les
intestins des mammifères (Lamidi et Bourobou Bourobou, 2010).
I.1.3. Piper guineense Schum. et Thonn
(Pipéracées).
Cette plante (Fig. 3) est communément appelée
poivre de guinée, poivre ashanti, poivre noir d'Afrique de l'Ouest, ou
poivre noir tout court. C'est une espèce des forêts denses
humides, dispersée de la Guinée en Ouganda (Adjanahoun et
al., 1996). Au Cameroun, Piper guineense se retrouve dans les
régions du Centre, du Littoral, de l'Ouest et de l'Est (Noumi et
al., 1998).
 
(a) (b)
Figure 3 : Feuilles (a) et graines (b) de
Piper guineense(Photos prises par Karlostachys, 2009)
I.1.3.1. Phytochimie
L'huile essentielle serait constituée de myristicine,
sarisan, safrone, et elemicine comme constituants majeurs, et de 51 mono et
sesquiterpenoïdes comme composant mineurs (Ekundayo et al.,
1988). Le goût piquant des fruits serait dû à la
présence de résines variées, en particulier la chavicine
et un alcaloïde jaune, la pipérine, qui constitue 5-8% du poids du
poivre noir (Rehn et Espig, 1991 ; Lale, 1992). Onyenekwe et al.
(1997) ont isolé de l'huile volatile des fruits de Piper guineense
45 composant dont les plus dominants étaient le â-caryophellene,
le germacrene-D, l'á-ylangene, le limonene et le myrcene.
I.1.3.2. Usages traditionnels
Au Cameroun, Les feuilles de Piper guineense sont
utilisées pour le traitement des maladies respiratoires et la correction
des problèmes d'infertilité féminine. Les graines sont
utilisées comme aphrodisiaques (Noumi et al., 1998 ;
Mbongue et al., 2005). Au Nigéria, les graines sont
consommées par les femme après l'accouchement pour amplifier les
contractions utérines pour l'expulsion du placenta (Udoh et
al., 1999), comme adjuvant dans le traitement des douleurs
rhumatismales, comme antiasthmatique (Sofowora, 1982), contre le vomissement,
les angines, et les douleurs d'estomac (Ndukwu et Ben-Nwadibia, 2005).
I.1.3.3. Données pharmacologiques et
toxicologiques
Une activité anti-convulsivante de Piper
guineense a été rapportée (Abila et al.,
1993). Les extraits de feuilles et des graines ont montré une
activité dépolarisante neuromusculaire (Udoh et al.,
1999). Il a été rapporté que les extraits du poivre noir
stimulaient la digestion des aliments en stimulant la sécrétion
d'enzymes digestives : l'amylase pancréatique, la trypsine, et la
chymotrypsine (Platel et Srinivasan, 2000). Il a été
montré que l'extrait aqueux de Piper guineense est un stimulant
sexuel chez le rat (Kamtchouing et al., 2002b). L'extrait aqueux des
fruits stimulerait les sécrétions des testicules, de
l'épididyme, et des vésicules séminales (Mbongue et
al., 2005). Les grains de poivre noir contracte les muscles lisses
gastro-intestinaux du Cochon d'Inde (Saba et Tomori, 2007).
L'extrait à l'éthanol des fruits a
présenté une DL50 de 1122 mg/kg par voie orale chez le
rat ainsi que des ulcères gastriques (Raji et al., 2003).
L'extrait aqueux des fruits de Piper guineense réduit de 20% la
fertilité des rats mâles après 55 jours de traitement
à la dose 122.5 mg/kg (Mbongue et al., 2005). L'extrait
à l'éthanol des graines de Piper guineense semble
inhiber la mise en place de la gravidité chez les souris, et provoque
des inflammations testiculaires et ovariennes (Ekanem et al., 2010).
I.1.4. Zingiber officinale Roscoe
(Zingibéracées)
Cette plante (Fig. 4) est encore connue sous l'appellation de
gingembre. La culture de cette plante a commencée en Asie du sud, puis
s'est étendue à l'Afrique de l'est et aux Caraïbes. Au
Cameroun elle est retrouvée dans les régions du Nord, du Centre,
du Littoral, de l'Ouest, du Nord-ouest, et de l'Est (Noumi et al.,
1998).
 
(a) (b)
Figure 4 : Plante entière (a), et
rhizome (b) de Zingiber officinale (photos issues deIBIS
médical, 2011)
I.1.4.1. Phytochimie
Plus de 50 composés de l'huile
volatile ont été caractérisés. Ce sont
principalement des monoterpenoïdes [b-phellandrène, (+)-camphene,
cineole, geraniol, curcumene, citral, terpineol, borneol] et des
sesquiterpenoïdes [a-zingiberene (30-70 %), b-sesquiphellandrene (15-20
%), b-bisabolene (10-15 %), (E-E)-a-farnesene, arcurcumene, zingiberol]. Le
goût piquant du gingembre frais est dû essentiellement aux
gingérols, dont le plus abondant est le 6-gingérol. Le goût
piquant du gingembre sec résulte principalement des shogaols (Ali et
al., 2008).
I.1.4.2. Usages traditionnels
Le gingembre est l'une des épices les
plus utilisées dans le monde, spécialement dans les pays sud-est
asiatiques. C'est aussi une plante médicinale qui a été
largement utilisée dans les médicaments chinois et
ayurvédiques, depuis l'antiquité, pour un large ensemble de maux
tels que les constipations, les indigestions, l'hypertension, et les
helminthiases. (Dedov et al., 2002; Jiang et al., 2006; Ali
et al., 2008).Au Cameroun, Zingiber officinale est souvent
utilisé comme aphrodisiaque et comme stimulant sexuel chez l'homme
(Noumi et al., 1998).
I.1.4.3. Données pharmacologiques et
toxicologiques
L'extrait à l'acétone du
gingembre améliore le transit intestinal du repas au charbon chez des
souris (Yamahara et al., 1990). L'extrait aqueux du gingembre aurait
des propriétés androgéniques chez le rat (Kamtchouing,
2002a). L'extrait aqueux du gingembre administré oralement à la
dose 50 mg/kg pendant 4 semaines chez des rats aurait une activité
anti-thrombotique et anti-inflammatoire (Thomson et al., 2002).
L'extrait brut induit une chute de la pression artérielle
dose-dépendante chez le rat anesthésié, montre une
activité cardiodépressive sur la fréquence et la force
des contractions chez le cobaye, et relâche la contraction de l'aorte
thoracique de lapin et de rat induite par la phényléphrine
(Ghayur et Gilani, 2005). L'extraitau méthanol des rhizomes secs du
gingembre produit une réduction significative des taux
élevé de l'hyperlipidémie fructose-induite, du poids
corporel, de l'hyperglycémie, et de l'hyperinsulinémie chez le
rat (Kadnur et Goyal, 2005). Les mêmes extraits administrés
à des souris pendant 8 semaines réduisaient les taux
élevés de glucose et d'insuline, suggérant ainsi une
activité insulinosensibilisante du gingembre (Goyal et Kadnur, 2006).
L'extrait aqueux des rhizomes de Zingiber officinale
possèderait des propriétés pro-fertilisante chez les
rats mâles (Morakinyo et al., 2008).
La DL50 de l'huile de gingembre chez le rat est
supérieure 5 g/kg (Mascolo et al., 1989).Le gingembre peut
causer des brûlures d'estomac et, à des doses supérieures
à 6 g, peut être un irritant gastrique (Desai et al.,
1990). L'exposition in utero au thé de gingembre chez le rat (15, 20, 50
g/l) entraine une élévation des pertes précoces d'embryon
avec une élévation de la croissance chez les foetus survivants
(Wilkinson, 2000). Chez l'Homme, le gingembre peut entrainer des reflux
gastriques (Anonymous, 2003).Zingiber officinale, à de fortes
doses, peut entrainer des arythmies cardiaques et une dépression du
système nerveux central (Gruenwald, 2004). L'inhalation de la poudre de
gingembre peut produire une allergie Ig-E médiée (Chrubasik et
al., 2005). L'administration orale de 400 mg de gingembre 3 fois par
jour pendant 2 semaines chez 12 volontaires humains sains a montré une
légère diarrhée (1/12) pendant les 2 premiers jours de
traitement (Ali et al., 2008).
I.2.PRINCIPES DE TOXICOLOGIE
I.2.1. Notion de toxicologie
La toxicologie est l'étude des substances toxiques et,
plus précisément, l'identification et l'évaluation
quantitative des conséquences néfastes liées à
l'exposition à des agents physiques, chimiques ou de toute autre nature
(Silbergeld, 2000). Comme telle, elle fait appel, tant pour ses connaissances
que pour sa démarche de recherche ou ses méthodes, à la
plupart des sciences biologiques fondamentales, aux disciplines
médicales, à l'épidémiologie et à divers
domaines de la chimie et de la physique. Elle s'étend de la recherche
fondamentale sur le mécanisme d'action des agents toxiques à la
mise au point et à l'interprétation de tests normalisés
permettant de caractériser les propriétés toxiques de ces
agents. Elle fournit à la médecine et à
l'épidémiologie des informations indispensables pour comprendre
l'étiologie et établir le lien entre les expositions, y compris
professionnelles, et les pathologies observées.
I.2.2. Les voies d'exposition aux produits toxiques
L'organisme doit être exposé à un produit
toxique pour qu'un effet nocif se manifeste. Dans ce cas, le produit peut agir
au point de contact (effet local) ou pénétrer dans l'organisme
(effet systémique). Un produit peut être absorbé par
plusieurs voies (Lapointe, 2004) :
I.2.2.1. La voie respiratoire
Les alvéoles respiratoires constituent le principal
site d'absorptiondes voies respiratoires, en particulier pour les gaz (monoxyde
de carbone, oxydes d'azote, dioxydes de soufre) et les vapeurs de liquides
volatils (benzène, tétrachlorure de carbone). L'absorption est
d'autant plus rapide que le gaz est soluble dans le sang. Les particules
atmosphériques quant à elles sont différemment
absorbées et éliminées en fonction de leur dimension.
Selon leur taille, les particules peuvent atteindre différents niveaux
de l'arbre respiratoire, les plus grosses sont rapidement
éliminées au niveau du tractus supérieur, alors que les
plus petites sont soit aspirées vers le haut et éliminées
par la toux, soit absorbées dans les voies lymphatiques ou le sang (Tron
et al., 2002).
I.2.2.2. La voie cutanée
La peau est une barrière qui recouvre la surface du
corps et qui le protège. Cette enveloppe protectrice fait obstacle
à la pénétration de nombreux contaminants. Toutefois,
cette barrière n'offre pas une protection complète, car elle
présente des failles, dont la base des poils et les pores. C'est un
passage important, puisque plusieurs toxiques peuvent pénétrer
dans l'organisme en traversant la peau à la suite d'un contact avec un
liquide, un solide ou des vapeurs. L'absorption cutanée est
influencée par de nombreux facteurs tant physico-chimiques (ex. :
pureté, grosseur de la molécule, solubilité)
qu'individuels (ex. : hydratation de la peau, présence de lésions
cutanées) et anatomiques (ex. : endroit du corps mis en contact avec le
toxique) (Lapointe, 2004).
I.2.2.3. La voie digestive
En général les toxiques
pénètrent dans le tube digestif avec l'eau, les aliments ou
isolément. En dehors de produits particulièrement caustiques, les
effets ne se produisent qu'après absorption. Au niveau du tube digestif
ce sont l'estomac et l'intestin(duodénum, intestin grêle) qui sont
les sites d'absorptionprincipaux. Dans l'estomac les acides faibles, à
l'inverse des bases faibles, sont facilement diffusibles. Dans l'intestin ce
sont les bases faibles qui sont les plus facilement absorbées. D'autre
part à ce niveau, des phénomènes de transport actif
peuvent intervenir pour certains toxiques (thallium, plomb)(Tron et
al., 2002).
I.2.2.4. Les autres voies
Il existe d'autres voies d'entrée appelées
parentérales, d'une importance généralement moindre :
les injections intraveineuses (IV), sous-cutanées (SC),
intra-péritonéales (IP) et intramusculaires (IM). D'une
façon générale, ces voies parentérales permettent
une absorption plus rapide et plus complète des substances, surtout dans
le cas de la voie intraveineuse. On obtient alors des pics de concentration de
courte durée, mais élevés, à l'origine d'une plus
forte toxicité de la dose administrée(Holmberg et al.,
2000).
I.2.3. Le cheminement d'un toxique dans l'organisme
Un produit qui pénètre dans
l'organisme peut avoir des effets bénéfiques ou néfastes.
Inversement, l'organisme peut agir sur ce produit : c'est ce qu'on appelle le
métabolisme. Plusieurs facteurs interviennent dans les processus
d'action toxique, notamment les phases toxicodynamiques et
toxicocinétiques (Lapointe, 2004) :
· La toxicodynamie s'intéresse à
l'influence qu'exerce un toxique sur l'organisme et aux facteurs qui
interviennent dans la réponse toxique.
· La toxicocinétiques'intéresse à
l'influence qu'exerce l'organisme sur un toxique. Cette influence
découle des processus (l'absorption, la distribution, le
métabolisme, l'élimination) qui gouvernent le cheminement du
toxique dans l'organisme.
I.2.3.1. L'absorption
On appelle absorption le processus de
pénétrationd'un produit dans l'organisme. Il s'agit d'une
étapeimportante, car, tant qu'il n'a pas pénétré
dans lacirculation sanguine, un produit ne peut causerd'action toxique
systémique.L'absorption peut se dérouler sur 3 sites
principaux : le tube digestif, essentiellement au niveau de l'estomac et
de l'intestin ; les poumons au niveau des alvéoles
pulmonaires ; etla peau au niveau de l'épiderme et du derme (Tron
et al., 2002).
I.2.3.2. La distribution
Après avoir atteint la circulation sanguine, le
produit peut être transporté dans tout l'organisme. C'est ce qu'on
appelle la distribution. En plus de l'oxygène, de divers
éléments nutritifs essentiels au fonctionnement de l'organisme et
des déchets, le sang transporte aussi des toxiques. Ceux-ci peuvent
alors entrer en contact avec des cellules et se fixer dans certains tissus ou
organes. Ainsi, les pesticides organochlorés comme le DDT se concentrent
dans les tissus adipeux. Ils peuvent y rester emmagasinés sans causer
d'effets toxiques pendant une période plus ou moins longue. En revanche,
ils peuvent causer des effets toxiques dans d'autres tissus ou organes
où ils sont présents en quantités moindres. La nature,
l'intensité et la localisation de ces perturbations dans l'organisme
diffèrent d'un produit à l'autre et dépendent souvent de
la dose.Lors de leur transport sanguin, les toxiques peuvent être
liées aux hématies, aux composants plasmatiques, ou se trouver
à l'état libre non liées dans le sang. Le monoxyde de
carbone, l'arsenic, le mercure organique et le chrome hexavalent ont une forte
affinité pour les hématies, alors que le mercure inorganique et
le chrome trivalent montrent une prédilection pour les protéines
plasmatiques. De nombreuses autres substances sont également
liées aux protéines plasmatiques. Seule la fraction libre est
disponible pour la filtration et la diffusion vers les organes
d'élimination. Ainsi, la liaison sanguine peut faire augmenter la
durée du séjour dans l'organisme et diminuer la captation
tissulaire au niveau des organes cibles(Lapointe, 2004 ; Holmberg et
al., 2000).
I.2.3.3. La biotransformation (métabolisme)
Pendant ou après son transport dans le sang, le
toxique peut entrer en contact avec différentes cellules de l'organisme
qui ont la capacité de le transformer. L'ensemble des réactions
de la transformation métabolique est appelée biotransformation,
tandis que les produits de la biotransformation sont appelés
métabolites. Deux types de réactions sont observés :
· Réactions de phase 1 : oxydation,
réduction et hydrolyse
· Réactions de phase 2 : production d'un
conjuguéou d'un métaboliteà partir du toxique d'origine.
Il peut en résulter un produit moins toxique
(détoxification) ou plus toxique (activation), l'accumulation ou
l'élimination du produit et de ses métabolites.La transformation
des toxiques est surtout effectuée par le foie, véritable
laboratoire chimique de l'organisme, qui contient une multitude d'enzymes. Il
enrichit le sang d'éléments nutritifs et le purifie en
concentrant et en éliminant beaucoup de substances. D'autres organes
tels que les poumons et les reins peuvent aussi transformer des toxiques
grâce aux enzymes métabolisant les toxiques(Lapointe, 2004 ;
Tron et al., 2002).
I.2.3.4. L'excrétion
Ce processus consiste à rejeter le produit
inchangé ou ses métabolites à l'extérieur de
l'organisme. L'excrétionpeut se faire par voie rénale (l'urine),
gastro-intestinale (les selles), pulmonaire (l'air expiré),
cutanée (la sueur) ou lactée (le lait) (Lapointe, 2004).
I.2.4. L'effet toxique
I.2.4.1. Notion d'effet toxique
Lorsqu'un individu absorbe des produits chimiques, divers
effets biologiques peuvent se produire et se révéler
bénéfiques ou néfastes. La notion d'effet toxique suppose
des conséquences nocives pour l'organisme. L'absorption d'une substance
en faible quantité peut s'avérer très toxique et provoquer
des lésions graves, tandis que l'absorption en grande quantité
d'une autre substance peu toxique peut produire un effet bénin. L'effet
toxique est ainsi lié à la notion de toxicité. Il s'agit
de la capacité inhérente à une substance chimique de
produire des effets nocifs chez un organisme vivant et qui en font une
substance dangereuse.
L'effet néfaste est lié à la dose,
à la voie d'absorption, au type et à la gravité des
lésions ainsi qu'au temps nécessaire à l'apparition d'une
lésion. Un effet aigu se fait sentir dans un temps relativement court,
tandis qu'un effet chronique ne se manifeste qu'après un temps
d'exposition relativement long et de façon permanente(Lapointe,
2004).
I.2.4.2. Comment survient et évolue un effet
toxique
Ø L'atteinte toxique : Les
organismes fonctionnent dans des conditions relativement constantes (pH,
oxygène, autres). C'est ce que l'on appelle l'homéostasie ou la
constance du milieu intérieur. Les organismes vivants cherchent à
maintenir cet équilibre afin de conserver un degré optimal de
fonctionnement. Le corps humain est un ensemble de systèmes finement
rodés qui peut s'adapter à de nombreuses situations d'agression,
tant biologiques que physiques ou chimiques. Les processus d'adaptation de
l'organisme fonctionnent continuellement pour veiller à maintenir cet
équilibre. Quand cet équilibre est perturbé, cela
entraîne un dysfonctionnement, c'est l'effet toxique. Il y a alors
mobilisation d'une partie de l'organisme et parfois de tout l'organisme ; des
réactions diverses sont déclenchées pour répondre
à l'agression et rétablir l'équilibre rompu. L'organisme
peut résister à une agression toxique en autant qu'elle
s'effectue à l'intérieur des limites de ses mécanismes de
détoxication, d'homéostasie et de réparation. Au
delà, les mécanismes de compensation ne peuvent suffire à
la tâche. Le système de défense ne peut alors contrer les
effets toxiques et des manifestations, réversibles ou non, peuvent
s'ensuivre (Lapointe, 2004).
Ø Les effets fonctionnels et
lésionnels : Les effets causés par un toxique
peuvent se traduire en changements fonctionnels ou lésionnels. Les
premiers touchent l'atteinte transitoire d'une fonction de l'organisme ou d'un
organe sans créer de lésions et ils sont
généralement réversibles. Les seconds causent une
lésion à un ou à plusieurs tissus ou organes sans que le
sujet présente des signes cliniques et sont souvent
irréversibles. Enfin, des altérations biochimiques peuvent
également se produire sans être accompagnées de changements
morphologiques apparents (Lapointe, 2004).
Ø La réversibilité et
l'irréversibilité : Certains effets toxiques sont
réversibles tandis que d'autres sont irréversibles. Des
changements adaptatifs causés par un produit chimique dans un tissu ou
un organe peuvent être accompagnés de changements fonctionnels et
morphologiques. De tels changements peuvent être réversibles si on
prévient ou arrête l'exposition. Cependant, dans certains cas,
l'interruption de l'exposition n'est pas suivie d'une
récupération. Il s'agit alors de changements
irréversibles. Ainsi, pour un tissu tel que celui du foie, qui a une
importante capacité de régénération, la
majorité des atteintes sont réversibles ; au contraire, elles
sont généralement irréversibles lorsqu'il s'agit d'une
atteinte du système nerveux central, les neurones ne pouvant pas
être facilement remplacés (Lapointe, 2004).
I.2.4.3. La dose et ses relations avec les effets
toxiques
Un principe important en toxicologie veut
que toutes les substances chimiques soient toxiques, car il existe toujours une
dose pouvant causer un effet nocif. La dose est la quantité d'une
substance à laquelle un organisme est exposé. Des doses
croissantes résultent généralement en une augmentation de
l'intensité et de la diversité des effets toxiques. C'est ce
qu'on appelle la relation dose-effet ou exposition-effet. La notion de seuil
toxique est importante, car elle peut servir à fixer des normes. La
valeur seuil représente la quantité minimale sous laquelle il ne
se produit pas d'effet. Au-dessus de ce seuil, l'effet observé
dépend de la dose, et ce, bien qu'il y ait théoriquement des
exceptions. Ce seuil s'explique par le fait que le corps humain est
constitué d'un grand nombre de cellules, de tissus et d'organes ayant
une sensibilité variable et qu'il possède des mécanismes
de défense ou d'adaptation. Le même principe s'applique à
une population d'individus, car l'effet ou les nombreux effets possibles
peuvent se manifester différemment chez plusieurs personnes
exposées à une même dose d'un toxique. C'est la
relationdose-réponse, ou la relation entre l'exposition et le nombre
d'individus qui présentent un effet donné(Lapointe, 2004).
I.2.4.4. Facteurs influençant les effets
toxiques
Ø La toxicité : Les
toxiques ne présentent pas tous le même degré de
toxicité. Certains ont une faible toxicité, même si on les
absorbe en grande quantité, par exemple le sel de table, tandis que
d'autres ont une forte toxicité, même si on en absorbe de faibles
quantités, notamment les dioxines. On peut en partie expliquer de telles
variations par les différences qui existent entre la structure chimique
des substances. Ces différences peuvent affecter la capacité des
substances à perturber le fonctionnement de l'organisme. De plus, les
caractéristiques physico-chimiques, par exemple la grosseur des
poussières, la volatilité et la solubilité dans l'eau,
interviennent également dans la réponse toxique (Lapointe,
2004).
Ø L'individu :Deux principales
catégories de facteurs individuels contribuent à expliquer la
nature et l'intensité des effets toxiques (Lapointe, 2004):
-Facteurs génétiques :Des
différences génétiques peuvent intervenir dansla
capacité des individus à transformer des toxiques.
- Facteurs physiopathologiques :
· L'âge : La sensibilité aux effets
toxiques est habituellement plus grande chez les enfants et les personnes
âgées.
· Le sexe : Il existe des différences entre
les hommes et les femmes, notamment en ce qui concerne le métabolisme
des toxiques.
· L'état nutritionnel : La toxicité
peut être influencée par la masse de tissus adipeux, la
déshydratation, etc.
· L'état de santé : Les individus en
bonne santé sont plus résistants, car ils métabolisent et
éliminent les toxiques plus facilement que ceux qui souffrent de
maladies hépatiques ou rénales.
· La grossesse : Il se produit des modifications de
l'activité métabolique des toxiques au cours de la grossesse.
Ø L'environnement : Certains
facteurs environnementaux, peuvent influencer la toxicité. La
lumière et la température peuvent notamment modifier les effets
d'un toxique. Mentionnons comme exemple la réaction photoallergique au
cours de laquelle la peau exposée à l'éthylène
diamine peut devenir plus sensible à la lumière. L'exposition
simultanée ou séquentielle à plusieurs produits peut
entraîner des conséquences imprévues qui peuvent
différer de la somme des réponses causées par chacun des
composants du mélange. C'est ce que l'on appelle une interaction
toxicologique. Il existe différents termes pour décrire les
interactions toxicologiques (Lapointe, 2004) :
· Addition (additivité) : la réponse est
égale à la somme des réponses des substances prises
individuellement, il n'y a pas d'interaction.
· Synergie : la réponse est supérieure
à la somme des réponses des substances prises
individuellement.
· Potentialisation : elle se produit lorsqu'une substance
ayant peu ou pas de toxicité augmente la réponse d'une autre
substance.
· Antagonisme : la réponse est inférieure
à la somme des réponses des substances prises
individuellement.
I.2.5. Les manifestations toxiques :
descriptionparquelques organes cibles
I.2.5.1. L'hépatotoxicité
C'est une atteinte du foie. Le foie est un
organevital, tout comme le coeur et les poumons. Il remplitde multiples
fonctions et son rôle est très importantdans le maintien de
l'équilibre général. Il participeà la digestion,
à l'emmagasinage des aliments ainsiqu'à la détoxication,
en aidant l'organisme à sedébarrasser de ses poisons, et à
l'élimination. Ila un rôle important dans la transformation
dessubstances circulant dans le sang, dont lessubstances toxiques qui y sont
véhiculées et quidans plusieurs cas peuvent y être
neutralisées (Lapointe, 2004).
Les atteintes du foie sont complexes et diverses.Le tableau I
ci-après résume les principaux effets toxiques
observés.
Tableau I : Principaux effets toxiques
observés sur le foie(Lu, 1992)
|
Lésions hépatiques
|
Caractéristiques
|
|
Stéatose
|
Elle correspond à l'envahissement du tissu par des
graisses. Les toxiques agissent en bloquant l'élimination des
triglycérides hépatiques dans le sang
|
|
Nécrose
|
Elle suppose la destruction des hépatocytes et
correspond généralement à lésion aiguë
|
|
Cholestase
|
Diminution ou arrêt de l'écoulement de la bile
par modification de l'excrétion biliaire
|
|
Cirrhose
|
Présence d'infiltrations de collagène dans la
masse hépatique
|
|
Hépatite
|
Manifestations cliniques de l'inflammation du foie
|
|
Cancérogénèse
|
Tumeurs primitives malignes du foie
|
I.2.5.2. La nephrotoxicité
C'est un effet toxique sur le rein. Le rein
est l'organed'élimination responsable de la sécrétion de
l'urine.Il joue un rôle dans la régulation de l'équilibre
desliquides du corps et contribue à débarrasser le sangde ses
impuretés, et notamment de certains toxiques(Lapointe, 2004).
Les atteintes rénalesconcernent principalement le
glomérule en diminuant la filtration, mais également les tubules
proximaux qui concentrent les toxiques du fait de leur forte activité
d'absorptionet de sécrétion. D'autre part leur forte teneur en
cytochrome P450 leur permet de détoxifier ou d'activer les
toxiques. Les principaux néphrotoxiques sont les métaux lourds,
les antibiotiques, les analgésiques et certains hydrocarbures
halogénés (dérivés chlorés) (Lu, 1992).
I.2.5.3. La toxicité de l'appareil
respiratoire
L'appareil respiratoire est constitué des
voiesaériennes supérieures (nez, pharynx ou gorge),de la
trachée, des bronches, des bronchioles etdes alvéoles
pulmonaires. L'humain est exposé parinhalation à divers agents
qui existent sousplusieurs formes (gaz, vapeur, gouttelettes, finesparticules)
et en diverses tailles et qui ont leurtoxicité et leurs
caractéristiques physiques propres (Lapointe, 2004).
Les principaux effets toxiques sur l'appareil respiratoire
sont (Lu, 1992) :
· Irritation locale : Les gaz
irritants par exemple, l'ammoniac et le chlore entraînent des effets
locaux de type bronchoconstriction, oedème et dyspnée.
· Lésions cellulaires et
oedème : Ces effets surviennent après inhalation de
toxiques sous forme de particules de petite taille (dérivés du
béryllium, du bore, et du nickel). Des solvants organiques après
absorption sont distribués dans différentes parties du corps,
biotransformés dans le foie pour regagner le poumon par le sang
où ils causent des lésions cellulaires et de l'oedème.
· Fibrose et emphysème : La
fibrose pulmonaireest occasionnée par des formes cristallines (quartz),
des fibres minérales (amiante) et d'autres substances fibrogènes
(kaolin, talc, aluminium...). L'aluminium, l'oxyde de cadmium, les oxydes
d'azote et l'ozone peuvent occasionner l'emphysèmepulmonaire.
· Allergie : Certains toxiques en
se liant aux protéines sanguines et pulmonaires forment des
antigènes qui entraînent la formation d'anticorps. L'asthme est la
principale réponse. Les expositions prolongées peuvent induire
bronchite chronique ou fibrose.
· Cancer du poumon : Arsenic,
chromates, nickel, uranium, amiante augmentent l'incidence des cancers du
poumon.
· Effets sur les voies respiratoires
supérieures : Les particules de grandes tailles
déposées dans les fosses nasales peuvent entraîner des
lésions locales : congestion, métaplasie, hyperplasie,
ulcérations, carcinomes. Le larynx, la trachée, les bronches
peuvent être irritées par l'inhalation de vapeurs toxiques.
· Effets après exposition par d'autres
voies : Certains toxiques, comme le paraquat (herbicide), peuvent
entraîner des lésions pulmonaires secondaires.
I.2.6. L'évaluation des effets toxiques
L'évaluation de la toxicité
s'appuie sur des études qualitatives ou quantitatives adéquates.
Il existe plusieurs types d'études qui nous permettent d'évaluer
les effets d'un toxique. On peut les classer dans quatre catégories
(Lapointe, 2004) :
- Les études épidémiologiques, qui
comparent plusieurs groupes d'individus ou les études de cas;
- les études expérimentales in vivo,
qui utilisent des animaux ;
- les études in vitro,
effectuées sur des cultures de tissus ou des cellules et ;
- les études théoriques par
modélisation.
On utilise fréquemment une terminologie pratique mais
arbitraire pour désigner les diverses formes d'intoxication selon la
fréquence et la durée de l'exposition (tableau II).
Tableau II : les formes
d'intoxication
|
Forme d'intoxication
|
Fréquence d'administration
|
Durée de l'exposition (Rongeurs)
|
|
Aiguë
|
Unique
|
< 24 heures
|
|
Répétée à court terme*
|
Répétée
|
= 1 mois
|
|
Subchronique
|
Répétée
|
De 1 à 3 mois
|
|
Chronique
|
Répétée
|
> 3 mois
|
*On parle souvent
d'intoxicationsubaiguë, mais ce terme est considéré comme
sémantiquement incorrect (OCDE, 1979)
I.2.6.1. La toxicité aigue
La toxicité aiguë est habituellement
définie comme l'ensemble des effets néfastes se produisant
immédiatement ou peu de temps après une exposition unique ou
répétée sur une période de moins de 24 heures
à une ou plusieurs substances (Walum, 1998). Le terme toxicité
orale aiguë est plus souvent utilisé en liaison avec les
déterminations de la létalité et de la DL50. La
DL50 est un terme qui a été introduit et
développé par Trevan en 1927. Elle est définie comme la
dose déterminée statistiquement qui, lorsqu'elle est
administrée dans un test de toxicité aiguë, est susceptible
de causer la mort de 50% des animaux traités sur une période
donnée (Oliver, 1986).
La méthode classique d'étude de la
toxicité orale aiguë d'une substance (Trévan, 1927) consiste
en une administration de ladite substance à différentes doses,
par voie orale, à plusieurs groupes d'animaux d'expérience
(généralement des rats ou des souris des deux sexes), à
raison d'une dose par groupe. Les animaux traités sont observés
de près durant les premières 24 heures et ensuite quotidiennement
pendant 2 semaines et les éventuels changements de l'apparence et du
comportement, ainsi que la létalité (DL50) sont
notés. Des questions se posent encore concernant l'utilisation de
l'évaluation pathologique élargie en tant que partie d'une
étude de toxicité aiguë. Cependant, l'autopsie macroscopique
est le minimum requis par la plupart des corps de régulations
gouvernementaux, comme le sont les déterminations du poids corporel peu
de temps avant le traitement et après une, puis deux semaines (Walum,
1998).
La valeur absolue de la DL50 d'un composé
varie beaucoup entre les laboratoires, et ces variations ont été
attribuées aux différences, par exemple, dans les détails
protocolaires, les souches animales, l'encagement, et la source de la substance
chimique d'essai. La DL50 et des méthodes alternatives pour
l'évaluation de la toxicité aiguë ont été
considérablement discutées dans différents forum
internationaux au cours des années 80 et 90 (Rhodes et al.,
1993 ; Oliver, 1986 ; Clark et al., 1991 ; Fielder,
1995 ; Lindgren et al., 1983 ; Seibert et al.,
1996). Le résultat de ces discussions intensives est qu'aujourd'hui les
autorités ne demandent habituellement pas des tests de DL50
classiques impliquant un grand nombre d'animaux. Au contraire, les lignes
directrices n° 420 (OCDE, 2001a), 423 (OCDE, 2001b), et 425 (OCDE, 2008b)
de l'OCDE décrivent des méthodes alternatives bien
établies et validées qui réduisent les souffrances des
animaux et/ou utilisent beaucoup moins d'animaux que la méthode
classique de Trevan. Cette dernière a été officiellement
abrogée en décembre 2002 par l'OCDE, l'Union Européenne et
les États-Unis d'Amérique (Schlede et al., 2005).
I.2.6.2. Toxicité a court terme avec
administration de doses répétées et
toxicitésubchronique
Alors que la toxicité aiguë concerne les effets
nocifs dus à des doses uniques, une forme plus commune de l'exposition
humaine à de nombreux produits chimiques se fait par la
répétition de doses qui ne produisent pas d'effets toxiques
immédiats. Des effets tardifs peuvent survenir à cause de
l'accumulation du produit dans les tissus ou à cause d'autres
mécanismes, et il est important d'identifier toute possibilité de
ce genre par des études subchroniques. La limite distinguant les
régimes subchroniques et chroniques d'administration des doses est
souvent prise comme égale à 10% de la durée de vie des
animaux d'expérience. Des périodes d'administration de doses
s'étendant entre une simple dose et 10% de la durée de vie sont
souvent qualifiées de mode d'administration subaiguë. Ce terme est
considéré comme sémantiquement incorrect et par
conséquent, pour distinguer de telles périodes des
périodes décrites classiquement comme subchroniques on doit les
décrire comme « études à court terme avec
administration de doses répétées ». Ceci
s'applique aux études portant sur 14, 21 et 28 jours. Les durées
d'étude réalisées ont été principalement de
14, 28 et 90 jours. D'autres durées d'étude ont été
utilisées en Toxicologie, mais on considère que le choix de ces
trois durées principales qui ont le soutient de l'expérience ou
pour lesquelles il existe des prescriptions en matière de
réglementation, représente une approche raisonnable(OCDE, 1979).
La substance à tester est administrée
quotidiennement à différents niveaux de dose à plusieurs
groupes d'animaux, à raison d'un niveau de dose par groupe. De
manière générale, au moins trois groupes d'essai et un
groupe témoin doivent être utilisés. La dose la plus
élevée doit provoquer des effets toxiques, sans être
létale ou causer de sévères souffrances. Une
séquence de doses décroissantes doit ensuite être
sélectionnée en vue de mettre en évidence tout effet
lié à la dose ainsi qu'une concentration sans effet nocif
observé à la dose la plus faible(OCDE, 2008a).
I.2.6.3. La toxicité chronique
Le but d'une étude de toxicité chronique est de
déterminer les effets d'une substance d'essai, chez une espèce de
Mammifère donnée, à la suite d'une exposition
prolongée et répétée(OCDE, 1979).
La substance d'essai est administrée quotidiennement
à plusieurs groupes d'animaux d'expérience à des doses
progressives, en général pendant une période de 12 mois,
bien quedes durées plus longues ou plus courtes puissent aussi
être choisies, en fonction des exigences réglementaires. Cette
durée est assez longue pour permettre aux effets de toxicité
cumulée de se manifester, tout en évitant les effets
perturbateurs des changements liés au vieillissement. Il convient
d'utiliser au moins trois doses et un groupe témoin. À moins de
contraintes dues à la nature physico-chimique ou aux effets biologiques
de la substance d'essai, le niveau de dose le plus élevé est
choisi de manière à permettre d'identifier les principaux organes
cibles et les effets toxiques de la substance, tout en évitant la
souffrance, une toxicité sévère ou une forte
morbidité ou létalité chez les animaux
testés(OCDE, 2009).
I.2.6.4. Méthodes substitutives à
l'expérimentation animale
Des progrès scientifiques considérables ont
permis le développement de modèles in vitro pertinents
pour évaluer les effets toxiques des médicaments ou produits
chimiques sur la santé humaine et la qualité de l'environnement.
Cependant, dans l'état actuel de nos connaissances, les méthodes
alternatives ne peuvent pas se substituer à l'animal lorsque les
études portent sur l'organisme entier. En effet, les méthodes
in vitro, même utilisées en batterie
complémentaire, ne peuvent reproduire les mécanismes de
régulation complexes et d'interactions entre cellules et organes. En
revanche, la mise en place de stratégies dites «
intelligentes » intégrant le principe des 3R
(Réduction, Raffinement et
Remplacement), telles que celles proposées dans le
programme européen REACH (Registration,
Evaluation, Authorisation and restriction of
Chemicals), permettront de réduire de
manière significative l'expérimentation animale. Des
collaborations plus efficaces au niveau international doivent maintenant se
mettre en place aussi bien au niveau des structures de validation, ECVAM
(European Center for the Validation of Alternatives Methods), ICCVAM
(Interagency Coordinating Committee on the validation of alternative
methods), JaCVAM (Japanese center for the validation of alternative
methods) qu'au niveau des autorités réglementaires que sont
l'UE (Union européenne), l'OCDE (Organisation de Coopération et
de Développement Economique), l'ICH (International Conference on
Harmonisation), pour que les méthodes validées soient
réellement appliquées. Enfin, la collaboration entre les
différents secteurs industriels, de la chimie, du médicament, du
produit cosmétique, doit être encouragée afin
d'éviter la répétition des efforts de recherche, de
favoriser le partage des données sur les substances mais
également le partage de l'expérience acquise sur les
méthodes alternatives à l'expérimentation animale (Fabre,
2008).

II.1.LE MATÉRIEL VÉGÉTAL
II.1.1. Préparation de l'extrait(Figure 5)
Les graines sèches de A. melegueta et de
P. guineense, les rhizomes frais de Z. officinale, et les
racines fraiches de M. whitei ont été acheté au
marché Mokolo de Yaoundé (Cameroun). Les racines fraiches de
M. withei etles rhizomes frais de Z. officinale ont
été découpés en petits morceaux et
séchés à l'étuve (45° C) pendant 5 à 6
jours. Les racines, rhizomes et graines ont été broyés
séparément à l'aide d'un moulin à écraser.
Une masse de 100g de la poudre obtenue de chacune des plantes (soit 400g de
poudre) a été introduit dans 3 litres d'eau distillée. Le
mélange a été homogénéisé pendant
plusieurs minutes à l'aide d'une grande baguette propre en bois puis
laissé reposer pendant 24 heures. Le macérât brut obtenu a
ensuite été séparé de la poudre résiduelle
par essorage, puis a été filtré à l'aide d'un
papier filtre Wattman N°3. Le filtrat obtenu a été
évaporé à l'étuve pendant 2 à 3 jours
(50-55°C), et l'extrait aqueux fluide de texture pâteuse et de
couleur brun-noirâtre a été obtenu.
· Calcul du rendement
Un volume de 167 ml de filtrat ont permis d'obtenir 4 g
d'extrait aqueux. La concentration du macérât aqueux
étaitdonc de 24 mg/ml. Ceci suggère que les 3 litres du
macérât obtenu contenait 72 g d'extrait aqueux, soit un rendement
(r) de :
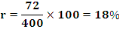
A. melegueta (graines) + M. whitei (racines)
+ P. guineense (graines) + Z. officinale (rhizomes)
|
- Découpage + Séchage (Racines et Rhizomes)
- Broyage (Graines, Racines, et Rhizomes)
|
Poudre ( 3 kg)
|
- Macération de 400 g de poudre
dans 3 litres d'eau distillée (24 h)
|
Macérât
|
- Filtration
|
|
- Evaporation du filtrat (50 à 55°C)
|
Poudre résiduelle
Pate fluide brun-noirâtre (extrait aqueux). Rendement =
18 %
Figure 5 : Schéma du
procédé utilisé pour l'extraction aqueuse du
mélange de Aframomum melegueta, Mondia whitei,
Piper guineense, et Zingiber officinale.
II.1.2. Préparation des solutions d'essai
L'extrait à été dissous dans de l'eau
distillée, puis le mélange a été
homogénéisé par agitation (5-10mn) à l'aide d'un
agitateur magnétique. La solution obtenue était conservé
dans un bocal en plastique fermé et placé dans un
réfrigérateur après chaque séance d'administration
orale de l'extrait aux animaux. Le volume de solution à administrer aux
animaux à été calculé par la formule
ci-après :
|
- V = volume de solution à administrer (ml)
|
|
- D = dose (mg/kg)
|
|
- P = poids de l'animal (kg)
|
|
- C = concentration de la solution à administrer
(mg/ml)
|
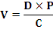
Le volume maximal de liquide qui pouvait être
administré en une seule fois était Vmax = 2ml/100g de
poids corporel (OCDE, 2001b). Ainsi, la concentration minimale
(Cmin) des solutions qui pouvaient être administrées
aux animaux était calculée par la formule ci-après
:
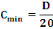
II.2.LES ANIMAUX
L'espèce animale choisie pour cette
étudeétait le rat (Rattus norvegicus) albinos de la
souche Wistar. Les rats étaient élevés au sein de
l'Animalerie du Laboratoire de Physiologie Animale de la Faculté des
Sciences de l'Université de Yaoundé I à température
ambiante. Les conditions d'aération étaientbonnes, et
l'éclairage était naturel. Les animaux recevaient de la provende
en guise de nourriture et de l'eau potable en guise de boissonad
libitum. Parmi les animaux d'élevage, 60 jeunes rats des deux sexes
(essai aigu : 9-10 semaines, 98-110 g ;
essai subchronique : 6-7 semaines, 84-113 g
femelles, 105-134 g mâles) et apparemment sains ont été
sélectionnés, et répartis au hasard dans les
différents groupes témoins et essais. Les femelles
sélectionnées étaient nullipares et non gravides. Aucun de
ces animaux n'avait été sujet à des expériences
antérieures.
II.3.PROTOCOLE EXPÉRIMENTAL
II.3.1. Toxicité orale aiguë
La toxicité orale aiguë de l'extrait aqueux du
mélange de A. melegueta, de M. whitei, de P.
guineense, et de Z. officinale à été
évaluée chez le rat conformément à la ligne
directrice n° 423 de l'OCDE pour les essais des substances chimiques
adoptée le 17 décembre 2001.
II.3.1.1. Principe de l'essai
Le principe de cet essai est qu'avec un processus
séquentiel, utilisant un nombre minimum d'animaux par étape, des
informations suffisantes sur la toxicité aiguë de la substance
peuvent être obtenues pour permettre sa classification. Une dose
déterminée de la substance est administrée par voie orale
à un groupe d'animaux. La substance est testée dans un processus
séquentiel dans lequel trois animaux d'un seul sexe (le plus sensible)
sont utilisés à chaque étape. L'absence ou la
manifestation de mortalité liée à la substance dans un
groupe ayant reçu une dose à une étape donnée
détermine l'étape suivante, c'est-à-dire :
1) Arrêt de l'essai,
2) Administration de la même dose à trois animaux
supplémentaires,
3) Administration de la dose immédiatement
supérieure ou inférieure à trois animaux
supplémentaires.
Des détails concernant le mode opératoire pour
la dose initiale de 2000 mg/kg choisie pour cette étude sont
décrits en annexe (page 69). Uniquement des femelles (âge :
9-10 semaines ; poids : 98-110 g) ont été
utilisées pour ce test (OCDE, 2000). L'analyse des publications sur les
essais classiques de détermination de la DL50 montre en effet
que, bien que la différence de sensibilité entre les deux sexes
soit généralement faible, dans les cas où l'on constate
une différence, les femelles sont généralement un peu plus
sensibles (Lipnick et al., 1995).
II.3.1.2. Administration de la substance d'essai
Les animaux étaient privés de nourriture mais
pas d'eau pendant la nuit précédant l'essai. Après le
jeûne, les animaux étaient pesés et la substance d'essai
leur était administrée oralement par gavage à l'aide d'une
sonde oesophagienne. Après l'administration de la substance, les animaux
étaient à nouveau privés de nourriture, pendant 3 à
4 heures. L'intervalle de temps entre l'administration de chaque niveau de dose
a été fixé à 48 heures. Néanmoins, cette
période pouvait varier en fonction du moment de l'apparition d'effets
toxiques éventuels, de leur durée et de leur
sévérité. Le cas échéant, l'administration
de la dose suivante devait être retardée jusqu'à ce qu'on
ait obtenu la certitude que les animaux précédemment soumis au
traitement survivraient.
II.3.1.3. Observations
Après traitement, les animaux étaient
observés individuellement au moins une fois pendant les premières
30 minutes et régulièrement pendant les premières 24
heures après le traitement, avec une attention particulière
pendant les premières 4 heures. Ils étaient ensuite
observés quotidiennement pendant 14 jours après l'administration
de la substance. Les observations portaient sur les modifications de la peau,
des poils, de l'activité somato-motrice et du comportement. L'attention
se portait en particuliersur l'observation des diverses manifestations de
tremblement, convulsion, salivation, diarrhée, léthargie,sommeil
et coma.
II.3.1.4. Poids corporels
Le poids individuel de chaque animal a été
déterminé peu de temps avant l'administration de la substance
d'essai, puis tous les 2 jours après administration de la substance
d'essai pendant 14 jours. Les gains pondéraux sur 2 jours ont
été calculés, enregistrés et comparés le
2e, 8e et 14e jour après le traitement.
La formule ci-dessous a été utilisée pour le
calcul :
|
- GP = gain pondéral (%)
|
|
- Pn = nième mesure du poids
corporel
|
|
- Pn-1 = (n-1)ième mesure du poids
corporel
|
|
- n est une valeur entière ; 1 = n = 8
|
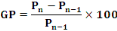
II.3.1.5. Autopsie générale
Tous les animaux d'essai ont été
euthanasiés et soumis à une autopsie à l'échelle
macroscopique à la fin du traitement. L'attention était
portée sur les reins, le foie, le coeur, les poumons, la rate, et le
tube digestif.
II.3.2. Toxicité orale subchronique
La toxicité orale subchronique de l'extrait aqueux du
mélange de A. melegueta, de M. whitei, de P.
guineense, et de Z. officinale à été
évaluée chez le rat conformément à la ligne
directrice n° 407 de l'OCDE pour les essais de produits chimiques
adoptée le 3 octobre 2008.
II.3.2.1. Nombre et sexe des animaux
10 animaux (5 par sexe) (poids : 84-113 g pour les
femelles et 105-134 g pour les mâles ; âge : 6-7
semaines) ont été utilisés pour chaque dose.
II.3.2.2. Dosage
Trois doses (100, 200, 400mg/kg) et un groupe témoin
ont été utilisés. Les doses ont été choisies
sur la base de l'estimation de la dose thérapeutique chez l'Homme. Le
traitement chez l'Homme préconise l'ingestion du macérât
aqueux d'environ 11 g de poudre du mélange de plantes par jour pendant 8
jours. En considérant que le poids biologique moyen d'un être
humain est de 70 kg, et que la quantité d'extrait aqueux que l'on peut
théoriquement obtenir par macération à partir de ces 11 g
de poudre est d'environ 2 g (rendement 18 %), le traitement chez l'Homme
consiste en l'ingestion quotidienne d'un peu moins de 30 mg/kg de poids
corporel d'extrait aqueux pendant 8 jours. Cette valeur à
été multiplié par 3 pour pallier à une
différence de biodisponibilité éventuelle existant entre
l'Homme et les rats de laboratoires, soit une valeur obtenue d'environ 90
mg/kg. La valeur de 100 mg/kg à finalement été choisi
comme dose minimale, correspondant à l'estimation maximale de la dose
pharmacologique chez le rat. Cette valeur a été multipliée
par 2, puis par 4, pour trouver respectivement la dose intermédiaire et
la dose maximale.
II.3.2.3. Administration de la substance d'essai
Les animaux ont reçu par gavage à l'aide d'une
sonde oesophagienne une dose quotidienne de la substance d'essai pendant 33
jours conformément aux recommandations de l'OMS sur la durée des
études de toxicité d'une substance chez l'animal en fonction de
l'administration clinique prévue (OMS, 2000). Les séances de
gavage étaient menées au même moment de la journée.
Les quantités d'extrait à administrer étaient
régulièrement ajustées pour rester constante par rapport
au poids de l'animal. Le groupe témoin recevait le plus grand volume
d'eau distillée utilisé.
II.3.2.4. Observations
La période d'observation a duré 33 jours. Deux
fois par jour au minimum, au début et à la fin de chaque
journée, un examen de tous les animaux avait lieu, afin d'y
déceler des symptômes de morbidité et de mortalité.
Des observations ont été faites sur tous les animaux au moins une
fois avant la première exposition (pour pouvoir effectuer des
comparaisons sur un même individu), et ensuite une fois par semaine. Les
symptômes relevés incluaient, de façon non limitative, les
changements affectant la peau, la fourrure, la respiration, la démarche,
de stéréotypes (par exemple, soins corporels excessifs, animaux
tournant en rond de façon répétitive) et de comportements
bizarres (par exemple, automutilation, marche à reculons). A partir de
la quatrième semaine d'exposition, la réactivité
sensorielle à des stimuli auditifs et proprioceptifs, la force de
préhension, et l'activité motrice ont été
évaluées quotidiennement :
· l'audition était évaluée en
appréciant la réaction des animaux à un claquement
brusque des mains ;
· la proprioception en appréciant leur
réaction à une piqure de leurs pattes ;
· la force de préhension en appréciant leur
capacité à s'agripper aux bords de la cage lorsqu'on essayait de
les en sortir.
II.3.2.5. Poids corporels
Tous les animaux ont été pesés peu de
temps avant le début du traitement, puis tous les 7 jours, et enfin le
jour du sacrifice. Les variations pondérales hebdomadaires
étaient calculées et enregistrés. La formule
utilisée pour le calcul était :
|
- GP = gain pondéral (%)
|
|
- Pn = nième mesure du poids
corporel
|
|
- Pn-1 = (n-1)ième mesure du poids
corporel
|
|
- n est une valeur entière ; 1 = n = 5
|
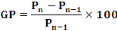
II.3.2.6. Hématologie et biochimie clinique
Les animaux ont été mis à jeun durant la
nuit qui a précédé la prise de sang. A la fin de la
période d'essai, des échantillons de sang arteroveineux ont
été prélevés au cours du sacrifice des animaux, une
partie dans des tubes à héparine, et l'autre partie dans des
tubes secs de 5 ml. Le sang contenu dans ces derniers a été
centrifugé pour obtenir le sérum. Avec le sang contenu dans les
tubes à héparine, les examens hématologiques de
Numération Formule Sanguine (NFS) ont été
effectués : hématocrite, concentration d'hémoglobine,
numération des érythrocytes et des réticulocytes,
numération et formule leucocytaire, numération des plaquettes. Le
sérum obtenu a été utilisé pour des dosages
biochimiques, effectués conformément aux protocoles fournis
avec les kits commerciaux Fortress
Diagnostics révisés en octobre 2007. Il s'agit:du
cholestérol total, du HDL-cholestérol, des triglycérides,
de la créatinine, de la bilirubine totale, de l'alanine
aminotransférase (ALAT), et de l'aspartate aminotransférase
(ASAT). Les protéines totales ont aussi été dosées,
à l'aide de la méthode du Biuret décrite par Gornall et
al., (1949).
Ø Dosage du cholestérol
total
-Principe du test : Le cholestérol est
présent dans le sérum sous la forme d'esters de
cholestérol et de cholestérol libre. Les esters de
cholestérol présents dans le sérum sont hydrolysés
par la cholestérol-esterase puis le cholestérol est mesuré
en l'oxydant avec la cholestérol-oxydase pour produire du peroxyde
d'hydrogène. Le peroxyde d'hydrogène à son tour
réagit avec le phénol et le 4-amino-antipyrine en présence
de la peroxydase pour produire la quinoneimine à coloration rouge.
L'intensité de la coloration produite est directement proportionnelle
à la concentration de cholestérol dans l'échantillon.
- Réactifs
|
Tampon :
|
50 mmol/l
|
|
Cholestérol oxydase :
|
> 100 UI
|
|
Cholestérol Estérase :
|
> 150 UI
|
|
4-aminoantipyrine :
|
0,3 mmol/l
|
|
Péroxydase :
|
> 800 UI
|
|
Phénol :
|
6,0 mmol/l
|
|
Standard Cholestérol :
|
200 mg/dl
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit :
|
|
Réactif blanc
|
Standard/Echantillon
|
|
Eau distillée
|
10 ul
|
-
|
|
Standard/Echantillon
|
-
|
10 ul
|
|
Réactif
|
1000 ul
|
1000 ul
|
|
Les préparations ont été
homogénéisées puis incubées pendant 10 minutes
à 20-25°C. Puis l'absorbance des standard et échantillons a
été lue contre celle du réactif blanc.
|
- Calcul de la concentration de cholestérol:
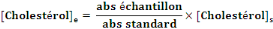
- [cholestérol]e : Concentration de
cholestérol dans l'échantillon
- [Cholestérol]s : Concentration de
cholestérol dans le standard
- abs : mesure de l'absorbance
Ø Dosage du HDL-cholestérol
- Principe du test :Les LDL sont
précipités par addition de l'acide phosphotungstique en
présence des ions magnésium. La fraction HDL reste dans le
surnageant et est déterminée par le dosage du
cholestérol.
- Réactifs :
|
Précipitant :
|
Acide phosphotungstique
|
0,55 mmol/l
|
|
Chlorure de Magnésium
|
25 mmol/l
|
|
Standard :
|
Cholestérol
|
1,29 mmol/l (50 mg/dl)
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit :
|
|
Macro
|
Semi Micro
|
|
Échantillon
|
500 ul
|
200 ul
|
|
Précipitant HDL
|
1000 ul
|
-
|
|
Précipitant dilué
|
-
|
500 ul
|
|
Les préparations ont été
homogénéisées puis incubées pendant 10 minutes
à température ambiante. Elles ont ensuite été
centrifugées à 4000 trs/mn. Le contenu en cholestérol a
été déterminé dans le surnageant clair dans les 2
heures qui suivaient, par la méthode CHOD-PAP.
|
|
PROCEDURE DU CHOD-PAP CHOLESTEROL : Un seul
réactif blanc a été utilisé par série. Le
Pipetage s'est fait dans les tubes d'essai comme suit :
|
|
Réactif blanc
|
Standard
|
échantillon
|
|
Eau distillée
|
100 ul
|
-
|
-
|
|
Surnageant
|
-
|
-
|
100 ul
|
|
Standard
|
-
|
100 ul
|
-
|
|
Réactif
|
1 ml
|
1 ml
|
1 ml
|
|
Les préparations ont été
homogénéisées puis incubées 10 minutes à
température ambiante. Puis l'absorbance du standard et des
échantillons a été lue contre celle du réactif
blanc dans l'heure.
|
- Calcul de la concentration de HDL :
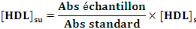
- [HDL]su : Concentration de HDL dans le
surnageant
- [HDL]s : Concentration de HDL dans le
standard
- Abs : mesure de l'absorbance
Ø Dosage des triglycérides
- Principe du test :Les triglycérides sont
hydrolysés par la lipoprotéine lipase pour donner le
glycérol et des acides gras. Puis, par l'action successive de la
glycérol kinase en présence de Mg2+ et de la
glycérol phosphatase en présence d'ATP, le glycérol est
convertit en dihydroxyacétone phosphate et peroxyde d'hydrogène.
Le peroxyde d'hydrogène à son tour réagit avec le
chlorophénol et le 4-amino-antipyrine en présence de la
peroxydase pour produire le 4-(p-benzoquinone-monoimino)-phenazone
coloré. L'intensité de la coloration produite est directement
proportionnelle à la concentration de triglycérides dans
l'échantillon.
- Réactifs
|
Tampon :
|
Tampon pH 7.8
|
50 mmol/l
|
|
p-chlorophénol
|
2 mmol/l
|
|
Lipoprotéine Lipase
|
150000 U/l
|
|
Glycérolkinase
|
800 U/l
|
|
Glycérol-3-P-oxydase
|
4000 U/l
|
|
Peroxydase
|
440 U/l
|
|
4-aminoantipyrine
|
0,7 mmol/l
|
|
ATP
|
0,3 mmol/l
|
|
Mg2+
|
40 mmol/l
|
|
Na-cholate
|
0,20 mmol/l
|
|
Potassium-Hexacyanoferrate(II)
|
1 umol/l
|
|
Standard :
|
Concentration de triglycérides de 200 mg/dl
|
2,24 mmol/l
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit :
|
|
Réactif blanc
|
Standard/échantillon
|
|
Eau distillée
|
10 ul
|
-
|
|
Standard/Echantillon
|
-
|
10 ul
|
|
Réactif
|
1000 ul
|
1000 ul
|
|
Les préparations ont été
homogénéisées puis incubées pendant 10 minutes
à 20-25°C. Puis l'absorbance des standard et échantillons a
été lue contre celle du réactif blanc.
|
- Calcul de la concentration de
triglycérides
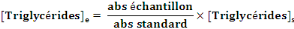
- [triglycérides]e : Concentration de
cholestérol dans l'échantillon
- [triglycérides]s : Concentration de
cholestérol dans le standard
- abs : mesure de l'absorbance
Ø Dosage de la créatinine
- Principe du test :La créatinine
réagit avec l'acide picrique en milieu alcalin pour former un complexe
jaune intense. La quantité de complexe formé est directement
proportionnelle au taux de créatine dans l'échantillon.
- Réactifs
|
Hydroxyde de sodium :
|
0,32 mol/l
|
|
Acide picrique :
|
35 mmol/l
|
|
Standard :
|
177 umol/l (2 mg/dl)
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit :
|
|
Standard/échantillon
|
|
Standard/échantillon
|
100 ul
|
|
Réactif de travail
|
1 ml
|
|
Les préparations ont été
homogénéisées. Puis l'absorbance des standard et
échantillons a été lue après 30 secondes puis
encore après exactement 120 secondes.
|
- Calcul de la concentration de
créatinine
Le changement dans l'absorbance de
l'échantillon/standard (Äabs) = abs. à 150 secondes - abs.
à 30 secondes.
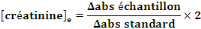
- [créatinine]e : Concentration de
cholestérol dans l'échantillon (mg/dl)
- abs : mesure de l'absorbance
Ø Dosage de la bilirubine totale
- Principe du test :La bilirubine totale
réagit avec le 2,4-dichloroaniline pour former l'azobilirubine. La
bilirubine liée à l'albumine est libérée par un
détergent.
- Réactifs
|
Réactif DCA :
|
Détergent
|
58 g/l
|
|
HCl
|
80 mmol/l
|
|
2,4-dichloroaniline
|
3.0 mmol/l
|
|
Nitrite de sodium :
|
|
2.5 mmol/l
|
|
Réactif blanc :
|
Détergent
|
29 g/l
|
|
HCl
|
40 mmol/l
|
|
2,4-dichloroaniline
|
1.5 mmol/l
|
- Réactif de travail :
Le réactif DCA (dichloroaniline) est
mélangé à égal volume avec le réactif
nitrite.
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit :
|
|
échantillon
|
échantillon blanc
|
|
échantillon
|
100 ul
|
100 ul
|
|
Réactif de travail
|
1000 ul
|
-
|
|
Réactif à blanc
|
-
|
1000 ul
|
|
Les préparations ont été
homogénéisées et laissées pendant 10 minutes
à température ambiante, à l'abri de la lumière.
Puis l'absorbance des échantillons a été lue contre celle
de l'échantillon blanc dans les 60 minutes.
|
- Calcul de la bilirubine totale
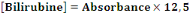
- [Bilirubine] : concentration de bilirubine (mg/dl)
Ø Dosage des protéines
totales
La méthode du Biuret décrite par Gornall et
al., (1949) a été utilisée pour doser les
protéines sériques.
- Principe : En milieu basique, le tartrate forme
avec le sel cuivrique un complexe soluble. L'addition d'une protéine
déplace le cuivre complexé pour former un autre complexe
cuivro-protéique de couleur violette. L'intensité de coloration
est proportionnelle à la concentration des protéines dans la
solution à doser.
- Protocole de dosage
Les tubes utilisés pour le dosage des protéines
ont été préparés et complétés avec
les différents réactifs suivant l'ordre présenté
dans le tableau IIIci-après.
Tableau III: protocole de dosage des
protéines
|
N° tube
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
X1
|
...
|
Xn
|
|
SAB (5 mg/mL)
|
0
|
0,25
|
0,5
|
0,75
|
1
|
1,25
|
1,75
|
0
|
...
|
0
|
|
Eau distillée (mL)
|
3
|
2,75
|
2,5
|
2,25
|
2
|
1,75
|
1,25
|
2,95
|
...
|
2,95
|
|
Réactif de Biuret (mL)
|
2
|
2
|
2
|
2
|
2
|
2
|
2
|
2
|
...
|
2
|
|
Sérum (uL)
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
50
|
...
|
50
|
|
Quantité de protéines (mg)
|
0
|
1,25
|
2,5
|
3,75
|
5
|
6,25
|
7,5
|
?
|
...
|
?
|
Tube 0 : tube blanc ; Tube 1 à 5 : tubes
étalons ; Tubes X1 à Xn : tubes échantillons
Dans une série des tubes à essai a
été introduit successivement 50 uL de sérum puis 2 ml de
la solution de Biuret. L'ensemble a été
homogénéisé par le vortex et incubé pendant 20
minutes à température ambiante. Dans le tube témoin, le
sérum a été remplacé par l'eau distillée.
L'absorbance est lue à 540 nm à l'aide d'un
spectrophotomètre (type Genesis) contre le témoin. La
concentration des protéines dans les différents tubes
échantillons a été déterminée à
partir de la courbe d'étalonnage réalisé avec une solution
de SAB (Figure 6).
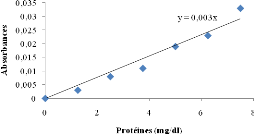
Figure 6 : Courbe d'étalonnage du
dosage des protéines par la méthode de Biuret
Ø Dosage de l'ALAT
- Principe du test :Le dosage repose sur le
transfert enzymatique médié parL'ALAT d'un groupement amine de la
L-alanine au á-oxoglutarate pour obtenir le L-glutamate et le
pyruvate.
- Réactifs
|
Tampon :
|
Tampon phosphate
|
100 mmol/l
|
|
L-alanine
|
200 mmol/l
|
|
á-oxoglutarate
|
2,0 mmol/l
|
|
Réactif coloré :
|
2,4-dinitrophenyl hydrazine
|
2,0 mmol/l
|
|
Standard pyruvate :
|
Pyruvate
|
2,0 mmol/l
|
|
Hydroxyde de sodium :
|
|
4,0 mol/l
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit (37°C):
|
|
Réactif blanc
|
Test
|
|
Echantillon
|
-
|
100 ul
|
|
Tampon ALAT (R1)
|
500 ul
|
500 ul
|
|
Eau distillée
|
100 ul
|
-
|
|
Les préparations ont été
homogénéisées et incubées pendant exactement 30
minutes à 37°C dans un bain-marie.
|
|
Réactif coloré ALAT (R2)
|
500 ul
|
500 ul
|
|
Les préparations ont été
homogénéiséeset incubées pendant exactement 20
minutes à température ambiante.
|
|
NaOH (dilué)
|
5,0 ml
|
5,0 ml
|
|
Les solutions ont été
homogénéiséespuis l'absorbance a été lue
contre le réactif blanc après 5 minutes. L'activité de
l'ALAT correspondante à la densité optique lue s'est faite via la
courbe d'étalonnage de (Figure 7).
|
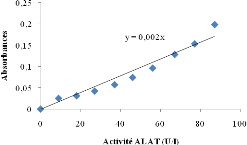
Figure 7 : Courbe
d'étalonnage de l'activité ALAT
Ø Dosage de l'ASAT
- Principe du test :Le dosage repose sur le
transfert enzymatique médié par l'ASATd'un groupement amine de la
L-aspartate au á-oxoglutarate pour obtenir le L-glutamate et
l'oxaloacétate.
- Réactifs
|
Tampon :
|
Tampon phosphate
|
100 mmol/l
|
|
L-aspartate
|
200 mmol/l
|
|
á-oxoglutarate
|
2,0 mmol/l
|
|
Réactif coloré :
|
2,4-dinitrophenyl hydrazine
|
2,0 mmol/l
|
|
Standard pyruvate :
|
Pyruvate
|
2,0 mmol/l
|
|
Hydroxyde de sodium :
|
|
4,0 mol/l
|
- Procédure manuelle
|
Le Pipetage s'est fait dans les tubes à essai
comme suit (37°C):
|
|
Réactif blanc
|
Test
|
|
Echantillon
|
-
|
100 ul
|
|
Tampon ASAT (R1)
|
500 ul
|
500 ul
|
|
Eau distillée
|
100 ul
|
-
|
|
Les préparations ont été
homogénéiséeset incubées pendant exactement 30
minutes à 37°C dans un bain-marie.
|
|
Réactif coloré ASAT (R2)
|
500 ul
|
500 ul
|
|
Les préparations ont été
homogénéisées et incubées pendant 20 minutes
à température ambiante.
|
|
NaOH (dilué)
|
5,0 ml
|
5,0 ml
|
|
Les solutions ont été
homogénéisées puis l'absorbance a été lu
contre le réactif blanc après 5 minutes. L'activité de
l'ASAT correspondante à la densité optique lue s'est faite via la
courbe d'étalonnage (Figure 8).
|
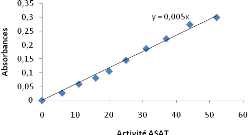
Figure 8: Courbe d'étalonnage de
l'activité ASAT
II.3.2.7. Pathologie
Ø Autopsie générale :
Tous les animaux de l'étude ont fait l'objet d'une autopsie
générale. Le foie, les reins, les poumons, la rate, les gonades
et le coeur de tous les animaux (à l'exception des animaux
sacrifiés ou mort avant la fin de l'essai) ont été
débarrassés de tout tissu adhérent et pesés
à l'état frais aussitôt après la dissection, afin
d'éviter leur dessiccation. Après la pesée, ces organes
ont été conservés dans du liquide de Bouin aqueux fort
pour les examens histopathologiques. Le poids relatif du foie, des reins, des
poumons, de la rate, des gonades, et du coeur a été
déterminé par la formule :
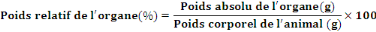
Ø Histopathologie : Les organes
d'intérêts ont été conservés dans du Bouin
aqueux fort pour y être fixés. Le liquide de Bouin aqueux fort a
été obtenu après mélange
homogénéisé des substances suivantes : Acide
acétique glacial (1 volume), Formol pur du commerce (5 volumes), Acide
picrique à saturation dans l'eau (15 volumes). Le mode
opératoire suivant a ensuite été employé pour la
réalisation des coupes histologiques :
1)- « Trimming » : des
tranches fines et régulières de chaque organe fixé ont
été prélevées à l'aide d'un bistouri, puis
rangées dans des cassettes.
2)- Déshydratation :les cassettes ont
ensuite été passées dans des bains d'éthanol de
concentration croissante : éthanol 50° (1h) ? éthanol
70° (1h) ? éthanol 95° n°1 (1h) ? éthanol 95°
n°2 (1h30mn) ? éthanol 100° n°1 (1h) ? éthanol
100°n°2 (1h30mn) ? éthanol 100°n°3 (2h) ; les
cassettes ont ensuite été passées dans 2 bains de
xylènes respectivement 1h et 2h ; les cassettes ont enfin
été passées dans 3 bains de paraffine à 60°C
respectivement 1h, 1h30 et 2h.
3)- Inclusion :les tissus ont ensuite
été placés dans des moules remplis de paraffine en fusion
qui a ensuite été mise à solidifier sur une surface froide
après orientation appropriée du tissu dans le bloc.
4)- Coupes :des coupes de 5 um des blocs ont
été réalisée à l'aide d'un microtome. Une
fois coupées, les sections ont été mises à
déplissées dans un bain-marie (environ 40°C) puis
récupérées sur des lames. Les lames ont ensuite
été laissées 24h à l'étuve (45°C) avant
la coloration.
5)- Coloration :les coupes ont ensuite
été passées dans une batterie de déparaffinage
constituée d'une série de bains de 5 à 10 mn chacun selon
la séquence suivante : xylène n°1 ? xylène
n°2 ? xylène n°3 ? éthanol à 100° n°1
? éthanol à 100° n°2 ? éthanol à
100° n°3 ? éthanol à 95° ? éthanol à
70° ? eau distillée. Les coupes ont ensuite été
immergées 10 mn dans un bac contenant de l'hématoxyline de Mayer,
puis rincées pendant 10 mn à l'eau du robinet courante. Les
coupes ont ensuite été passées dans un bain
d'éthanol 95° pendant 5 mn, puis elles ont été
immergées 5 mn dans de l'éosine alcoolique 0,5% + 40 ul d'acide
acétique par 100 ml de solution. Les coupes ont ensuite
été déshydratées dans de l'éthanol 100°
(3 × 5 mn), éclaircies dans du xylène (3 × 5 mn).
6)- Montage :une fois sortie du xylène,
quelques gouttes de résine ont été déposées
sur les coupes, puis ces dernières ont été recouvertes
d'une lamelle de verre pour l'observation au microscope.
II.3.2.8. Traitement statistique des
résultats
L'analyse des résultats s'est faite
à l'aide du logiciel GraphPad Instat® Version 3.05.
Toutes les données ont été exprimées sous forme de
moyenne #177; erreur standard sur la moyenne (ESM). La significativité
des différences entre les groupes traités et témoins a
été évaluée par le test t de student. Les
différences étaient considérées comme
significatives pour p < 0,05.

III.1.TOXICITÉ ORALE AIGUE
III.1.1. Effets de l'extrait sur l'aspect
général, le comportement, et la mortalité des animaux
Le résumé des observations
effectuées sur les animaux en essai aiguë est
présenté dans le tableau IV. Les animaux n'ont montré
aucun changement dans l'apparence physique générale et dans la
somatomotricité durant la période d'observation. Aucune
manifestation de tremblements, convulsions, salivation, diarrhée, coma,
ou de comportements anormaux tels que l'automutilation ou la marche à
reculons n'a été observé. Des manifestations de sommeil
ont été observées chez les témoins et les
traités les 30 premières minutes après le gavage. Ce
sommeil était fugace chez les témoins, mais n'était
réversible qu'après quelques heures chez les traités. Une
léthargie transitoire s'observait chez les animaux traités
quelques heures après le gavage. Aucune autre modification liée
au traitement, ni aucune morbidité/mortalité, n'a
été observée chez les animaux sur la période de 14
jours suivant l'administration oral d'une dose unique d'extrait à la
dose 2000 mg/kg. La DL50 a donc été estimée
supérieure à 2,5 g/kg comme décrit dans le schéma
de l'annexe (page 69).
Tableau IV : Observations en essai
aigue
|
0 min - 30 min
|
30 min - 4 h
|
4 h - 24 h
|
24 h - 48 h
|
2 j - 14 j
|
|
Témoin
|
sommeil
|
RAS
|
RAS
|
RAS
|
RAS
|
|
2000 mg/kg
|
sommeil
|
sommeil, léthargie
|
RAS
|
RAS
|
RAS
|
RAS=Rien à Signaler
III.1.2. Effets de l'extrait sur le poids corporel
La figure 9 présente l'évolution des poids
corporels des animaux d'essai pendant la période d'observation.
L'analyse de ce graphe montre une augmentation significative
du poids corporels chez les animaux traités comparativement aux
témoins le 8e (p < 0,05) et le 14e jour (p <
0,05).
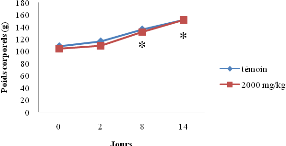
Figure 9 : Variations des poids
corporels en essai aiguë. Les points représentent les poids moyens
#177; ESM (n=3). *p<0,05 : différence significative par rapport
au témoin
III.1.3. Autopsie générale
L'autopsie des animaux d'essai n'a
révélé aucune anomalie liée au traitement.
III.2.TOXICITÉ ORALE SUBCHRONIQUE
III.2.1. Effets de l'extrait surla mortalité,
l'aspect général, et le comportement des animaux
Des 40 animaux initialement sélectionnées, 34
ont survécu sur toute la période d'observation, soit 6
décès :
· 1 des 6décès (mâle-200 mg/kg)
résultait d'une euthanasie car l'animal en question présentait
des signes de morbidité attribués à une anomalie
fréquemment observée chez les animaux pendant l'élevage
(torticolis ; tourne en rond de façon continu).
· 1 des 6 décès (mâle-100 mg/kg) a
probablement été la conséquence d'un étouffement
nocturne. En effet, le jour précédant celui de la
découverte de la dépouille, l'animal présentait les
symptômes du rhume des foins (éternuement et écoulement
nasal), avec une légère maigreur et une fourrure
légèrement hérissée.
· Dans 4 des 6 décès, les animaux avaient
en commun 4 symptômes d'intoxication avant la mort (fourrure
hérissée + maigreur + léthargie + tachypnée) :
3 animaux à la dose 400 mg/kg (1 mâle, 2 femelles), et 1 animal
à la dose 200 mg/kg (mâle).
Lors de la dernière semaine de traitements, seule une
femelle (400 mg/kg) présentait une réduction des facultés
nociceptive, motrice, et préhensile. Toutes les modifications
observées sont résumées dans le tableau V.
III.2.2. Effets de l'extrait sur le poids corporel
La figure 10 présente l'évolution des poids
corporels des animaux mâles (A) et femelles (B) ayant survécue
jusqu'à la fin de la période d'observation.
Aucune différence significative n'a été
notée dans les gains pondéraux moyens chez les mâles et les
femelles traités comparativement à leurs témoins
respectifs.
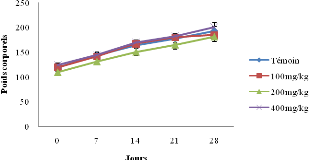 (A) (A)
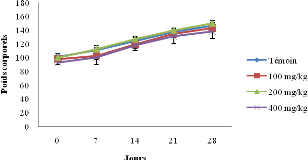 (B) (B)
Figure 10 :Evolution des poids corporels
chez les survivants mâles (A) et femelles (B) en essai subchronique. Les
points représentent les poids moyens #177; ESM (n=5, sauf aux
doses : 100 mg/kg et 400 mg/kg mâles où n=4, 200 mg/kg
mâles et 400 mg/kg femelles où n=3).
Tableau V: Observations en essai
subchronique
|
Semaine 1
|
Semaine 2
|
Semaine 3
|
Semaine 4
|
|
Nombre d'animaux présentant des signes de
toxicité et nature de ces signes
|
Morbidité ou Mortalité
|
Nombre d'animaux présentant des signes de
toxicité et nature de ces signes
|
Morbidité ou Mortalité
|
Nombre d'animaux présentant des signes de
toxicité et nature de ces signes
|
Morbidité ou Mortalité
|
Nombre d'animaux présentant des signes de
toxicité et nature de ces signes
|
Morbidité ou Mortalité
|
|
Mâles
|
Témoin
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
|
100 mg/kg
|
0/5
|
0/5
|
1/5 : rhume, maigreur, fourrure hérissée
|
1/5
|
0/4
|
0/4
|
0/4
|
0/4
|
|
200 mg/kg
|
1/5 : léthargie, maigreur, tachypnée,
fourrure hérissée
|
1/5
|
1/4 : insensibilité des pattes latérales
gauches, torticolis poussé, tourne en rond sur lui-même de
façon répétitive
|
1/4
|
0/3
|
0/3
|
0/3
|
0/3
|
|
400 mg/kg
|
1/5 : léthargie, maigreur, tachypnée,
fourrure hérissée
|
1/5
|
0/4
|
0/4
|
0/4
|
0/4
|
0/4
|
0/4
|
|
Femelles
|
Témoin
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
|
100 mg/kg
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
|
200 mg/kg
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
0/5
|
|
400 mg/kg
|
1/5 : maigreur
|
0/5
|
2/5 : léthargie ; maigreur ;
tachypnée ; fourrure hérissée ;
insensibilité des pattes avant (1/5)
|
1/5
|
1/4 : légère léthargie
|
1/4
|
1/3 : léthargie, tachypnée, maigreur,
fourrure hérissée
|
0/3
|
III.2.3. Effets sur quelques paramètres
hématologiques et biochimiques
L'effet de l'extrait aqueux du mélange de A.
melegueta, M. whitei, P. guineense, et Z.
officinale sur quelques paramètres hématologiques est
présenté dans le tableau VI. Chez les mâles, aucune
différence significative n'a été notée entre les
taux moyens des différents paramètres hématologiques
évalués chez les animaux survivants des groupes traités et
leurs valeurs dans les groupes témoins correspondants. Chez les femelles
survivantes par contre, la concentration moyenne en hémoglobine
corpusculaire était significativement réduite de 14% (p <
0,05)dans le groupe traité à la dose 400 mg/kg par rapport au
témoin.
Tableau VI:Effets de l'extrait sur
quelques paramètres hématologiques
|
MALES
|
|
Témoin
|
100 mg/kg
|
200 mg/kg
|
400 mg/kg
|
|
Globules blancs (103/uL)
|
7,0 #177; 1,0(4)
|
9,0 #177; 2,0(4)
|
6,9 #177; 1,4(3)
|
6,0 #177; 1,0(4)
|
|
Lymphocytes (%)
|
78,9 #177; 4,4(4)
|
69,1 #177; 3,8(4)
|
72,0 #177; 3,0(3)
|
74,2 #177; 4,8(4)
|
|
Monocytes (%)
|
13,1 #177; 2,6(4)
|
17,9 #177; 1,6(4)
|
17,2 #177; 2,4(3)
|
14,7 #177; 2,2(4)
|
|
Granulocytes (%)
|
8,0 #177; 1,9(4)
|
13,1 #177; 2,8(4)
|
11,0 #177; 0.90(3)
|
11,1 #177; 2,8(4)
|
|
Globules rouges (103/uL)
|
9,8 #177; 0,76(4)
|
9,6 #177; 1,1(4)
|
8,0 #177; 0,72(3)
|
8,4 #177; 1,2(4)
|
|
Hématocrite (%)
|
44,7 #177; 2,9(4)
|
46,0 #177; 6,0(4)
|
39,0 #177; 2,0(3)
|
41,2 #177; 6,3(4)
|
|
Volume corpusculaire moyen (fL)
|
49,0 #177; 2,0(4)
|
50,0 #177; 0,80(4)
|
48,0 #177; 0,60(3)
|
67,0 #177; 15,0(4)
|
|
Hémoglobine corpusculaire moyen (pg)
|
19,0 #177; 0,30(4)
|
18,0 #177; 0,90(4)
|
19,1 #177; 0,87(3)
|
29,8 #177; 11,5(4)
|
|
Hémoglobine corpusculaire moyen (g/dl)
|
41,0 #177; 1,0(4)
|
37,0 #177; 2,0(4)
|
38,8 #177; 1,1(3)
|
60,2 #177; 22,5(4)
|
|
Concentration d'hémoglobine (g/dL)
|
18,0 #177; 1,0(4)
|
17,0 #177; 2,2(4)
|
15,3 #177; 0,88(3)
|
29,0 #177; 16,0(4)
|
|
FEMELLES
|
|
Témoin
|
100 mg/kg
|
200 mg/kg
|
400 mg/kg
|
|
Globules blancs (103/uL)
|
8,0 #177; 2,0(5)
|
7,7 #177; 2,0(5)
|
5,1 #177; 0,88(5)
|
9,0 #177; 7,0(3)
|
|
Lymphocytes (%)
|
71,7 #177; 4,4(5)
|
71,7 #177; 5,4(5)
|
69,0 #177; 1,0(5)
|
50,1 #177; 19,7(3)
|
|
Monocytes (%)
|
15,5 #177; 1,6(5)
|
16,6 #177; 2,6(5)
|
18,2 #177; 1,1(5)
|
20 #177; 8,0(3)
|
|
Granulocytes (%)
|
12,8 #177; 3,1(5)
|
12,0 #177; 3,0(5)
|
13,0 #177; 0,20(5)
|
30,0 #177; 13,0(3)
|
|
Globules rouges (103/uL)
|
8,0 #177;1,0(5)
|
8,0 #177;0,836(5)
|
7,0 #177;0,60(5)
|
4,3#177;2,1(3)
|
|
Hématocrite (%)
|
37,1 #177; 1,2(5)
|
40,3 #177; 4,4(5)
|
35,0 #177; 3,0(5)
|
27,9 #177; 11,9(3)
|
|
Volume corpusculaire moyen (fL)
|
49,0 #177; 2,0(5)
|
50,0 #177; 0,80(5)
|
48,0 #177; 0,60(5)
|
67,0 #177; 15,0(3)
|
|
Hémoglobine corpusculaire moyen (pg)
|
18,9 #177; 0,17(5)
|
19,0 #177; 0,50(5)
|
18,0 #177; 0,50(5)
|
22,5 #177; 5,3(3)
|
|
Hémoglobine corpusculaire moyen (g/dl)
|
39,0 #177; 1,0(5)
|
37,2 #177; 0,88(5)
|
37,9 #177; 1,0(5)
|
33,4 #177; 1,4*(3)
|
|
Concentration d'hémoglobine (g/dL)
|
14,0 #177; 0,20(5)
|
15,0 #177; 1,0(5)
|
13,0 #177; 0,87(5)
|
9,7 #177; 4,2(3)
|
(3)n=3 ; (4)n=4 ;
(5)n=5 ; Les valeurs représentent les moyennes #177;
ESM ;*p<0,05 :différences significatives par rapport aux
témoins
L'effet de l'extrait aqueux du mélange de A.
melegueta, M. whitei, P. guineense, et Z.
officinale sur quelques paramètres biochimiques est
présenté dans le tableau VII.Chez les mâles, aucune
différence significative n'a été notée entre les
taux moyens des différents paramètres biochimiques
évalués chez les animaux survivants des groupes traités et
leurs valeurs dans les groupes témoins correspondants. Chez les femelles
survivantes par contre, dans le groupe traité à la dose 200 et
400 mg/kg, le taux moyen de cholestérol total sérique
était significativement réduit respectivement de 73,79% (p <
0,01) et de 64,11% (p < 0,01) par rapport au témoin; le taux
moyen d'ASAT augmentait significativement de 37,74% à la dose 100 mg/kg
(p < 0,05), de 62,98% à la dose 200 mg/kg (p < 0,01), et de 84,94%
à la dose 400 mg/kg (p < 0,01) par rapport au témoin; le
taux moyen d'ALAT diminuait significativement à la dose 100 (p <
0,001) et 200 mg/kg (p < 0,001) respectivement de 91,45% et de 92,8% par
rapport au témoin.
Tableau VII :Effets de l'extrait
sur quelques paramètres biochimiques
|
MALES
|
|
Témoin
|
100 mg/kg
|
200 mg/kg
|
400 mg/kg
|
|
Cholestérol Total (mg/dl)
|
34,07 #177; 11,48(3)
|
21,46 #177; 3,03(3)
|
31,49 #177; 12,64(2)
|
39,62 #177; 14,48(2)
|
|
Triglycérides (mg/dl)
|
39,39 #177; 9,96(5)
|
83,17 #177; 31,68(4)
|
78,09 #177; 22,41(3)
|
54,65 #177; 9,46(4)
|
|
HDL-cholestérol (mg/dl)
|
12,03 #177; 0,239(5)
|
13,11 #177; 0,727(4)
|
13,89 #177; 1,43(3)
|
15,81 #177; 2,72(4)
|
|
Protéines Totales (mg/dl)
|
47,79 #177; 4,98(5)
|
41,28 #177; 5,02(4)
|
47,69 #177; 1,63(3)
|
45,58 #177; 7,54(4)
|
|
Bilirubine (mg/dl)
|
1,54 #177; 0,720(4)
|
2,00 #177; 0,600(4)
|
2,03 #177; 0,188(2)
|
1,41 #177; 0,390(4)
|
|
Créatinine (mg/dl)
|
0,440 #177; 0,0510(4)
|
0,290 #177; 0,0420(4)
|
0,730 #177; 0,140(3)
|
0,370 #177; 0,0650(4)
|
|
ASAT (U/l)
|
27,83 #177; 2,33(5)
|
23,60 #177; 0,297
|
24,07 #177; 0,339(3)
|
29,62 #177; 4,71(4)
|
|
ALAT (U/l)
|
109,50 #177; 50,84(4)
|
425,13 #177; 121,54(4)
|
381,83 #177; 238,16(3)
|
182,50 #177; 16,68(4)
|
|
FEMELLES
|
|
Témoin
|
100 mg/kg
|
200 mg/kg
|
400 mg/kg
|
|
Cholestérol Total (mg/dl)
|
82,00 #177; 7,00(5)
|
87,96 #177; 9,49(5)
|
21,49#177; 9,14**(4)
|
29,43 #177; 4,44**(2)
|
|
Triglycérides (mg/dl)
|
107,39 #177; 27,80(5)
|
81,50 #177; 40,84(5)
|
56,18 #177; 12,48(5)
|
36,54 #177; 1,46(3)
|
|
HDL-cholestérol (mg/dl)
|
12,71 #177; 7,00(3)
|
10,53 #177; 1,81(5)
|
14,92 #177; 1,77(5)
|
11,64 #177; 0,623(3)
|
|
Protéines Totales (mg/dl)
|
43,08 #177; 6,92(5)
|
60,00 #177; 4,38(5)
|
51,59 #177; 5,79(5)
|
35,38 #177; 2,06(3)
|
|
Bilirubine (mg/dl)
|
0,894 #177; 0,769(2)
|
1,23 #177; 0,510(4)
|
0,900 #177; 0,400(4)
|
1,80 #177; 0,539(3)
|
|
Créatinine (mg/dl)
|
0,310 #177; 0,0960(5)
|
0,450 #177; 0,0610(5)
|
0,480 #177; 0,0940(5)
|
0,290 #177; 0,120(2)
|
|
ASAT (U/l)
|
11,53 #177; 1,63(3)
|
16,44 #177; 1,12*(5)
|
19,73 #177; 0,789**(5)
|
22,60 #177; 1,27**(3)
|
|
ALAT (U/l)
|
148,10 #177; 8,63(5)
|
6,7 #177; 2,86***(5)
|
4,7 #177; 1,43***(5)
|
143,33 #177; 1,72(3)
|
(2)n=2 ; (3)n=3 ;
(4)n=4 ; (5)n=5 ; Les valeurs
représentent les moyennes #177;
ESM ;*p<0,05 ; **p<0,01 ; ***p<0,001 :
différences significatives par rapport aux témoins
III.2.4. Pathologie
III.2.4.1. Autopsie générale
L'autopsie des 6 animaux
morts/euthanasiés au cours de l'étude a montré une
rugosité et compacité du foie à la dose 400 mg/kg chez les
mâles (1/6) avec une teinte sombre à toutes les doses aussi bien
chez les mâles (2/6) que chez les femelles (1/6). Une compacité du
colon proximal et de l'intestin grêle avec une teinte jaunâtre de
ce dernierà la dose 400 mg/kg a aussi été observée
chez les mâles (1/6). Un appareil digestif translucide était
souvent observé aussi chez les mâles (2/6) à la dose 100 et
200 mg/kg. L'autopsie des animaux ayant survécu jusqu'à la fin de
la période d'observation a montré un assombrissement
général du foie et des reins chez les animaux traités par
rapport aux témoins. L'examen de la cage thoracique d'une des femelles
survivantes de la dose 400 mg/kg n'a pas permis d'individualiser les poumons,
qui étaient dans un état inflammatoire avancé avec
destruction tissulaire.
Ø Effets de l'extrait sur le poids relatif des
organes
Le tableau VIII présente l'effet de l'extrait aqueux
du mélange de A. melegueta, M. whitei, P.
guineense, et Z. officinale sur le poids relatif (%) de quelques
organes. Aucune différence significative n'a été
observée chez les mâles traités comparés aux
mâles témoins. Chez les femelles, les poids relatifs moyens de la
rate à la dose 200 mg/kg et des poumons à la dose 400 mg/kg
étaient significativement réduits de 12,3% et 37,5% (p < 0,05
et p < 0,001) respectivement par rapport aux témoins.
Tableau VIII : Effets de l'extrait
sur le poids relatifs de quelques organes (% du poids corporel)
|
MALES
|
|
Témoin
|
100 mg/kg
|
200 mg/kg
|
400 mg/kg
|
|
Foie
|
3 #177;0,07(5)
|
3 #177;0,07(4)
|
3 #177;0,2(3)
|
3 #177;0,1(4)
|
|
Rein
|
0,3 #177;0,01(5)
|
0,3 #177;0,02(4)
|
0,3 #177;0,01(3)
|
0,3 #177;0,007(4)
|
|
Poumons
|
0,8#177;0,08(5)
|
0,8 #177;0,1(4)
|
0,6 #177;0,04(3)
|
0,7 #177;0,05(4)
|
|
Testicules
|
0,7#177;0,04(5)
|
0,7 #177;0,04(4)
|
0,7 #177;0,02(3)
|
0,6 #177;0,03(4)
|
|
Rate
|
0,2 #177;0,01(5)
|
0,3 #177;0,03(4)
|
0,2 #177;0,02(3)
|
0,4 #177;0,09(4)
|
|
Coeur
|
0,4#177;0,02(5)
|
0,4 #177;0,02(4)
|
0,3 #177;0,001(3)
|
0,3 #177;0,01(4)
|
|
FEMELLES
|
|
Témoin
|
100 mg/kg
|
200 mg/kg
|
400mg/kg
|
|
Foie
|
3 #177; 0,2(5)
|
3 #177; 0,1(5)
|
3 #177; 0,1(5)
|
3 #177; 0,2(3)
|
|
Rein
|
0,3 #177; 0,01(5)
|
0,3 #177; 0,006(5)
|
0,3 #177; 0,01(5)
|
0,4 #177; 0,05(3)
|
|
Poumons
|
0,7 #177; 0,02(5)
|
0,9 #177; 0,1(5)
|
0,8 #177; 0,1(5)
|
0,6 #177; 0,04*(2)
|
|
Ovaires
|
0,06 #177; 0,006(5)
|
0,05 #177; 0,006(4)
|
0,07 #177; 0,01(5)
|
0,08 #177; 0,01(3)
|
|
Rate
|
0,4 #177; 0,03(5)
|
0,5 #177; 0,1(5)
|
0,3 #177; 0,01***(5)
|
0,4 #177; 0,2(3)
|
|
Coeur
|
0,4 #177; 0,019(5)
|
0,4 #177; 0,009(5)
|
0,4 #177; 0,02(5)
|
0,5 #177; 0,09(3)
|
(2)n=2 ; (3)n=3 ;
(4)n=4 ; (5)n=5 ; Les valeurs
représentent les moyennes #177; ESM ;*p<0,05 ;
***p<0,001 : différences significatives par rapport au
témoin
III.2.4.2. Histopathologie
Ø Le foie
La figure 11 présente des microphotographies de coupes
de foie obtenues des animaux ayant survécus jusqu'à la fin de la
période d'observation.Chez les femelles, des inflammations similaires
à celle de la figure 11d ont été observées dans
tous les groupes traitées à l'extrait. A la dose 100 mg/kg, on
observait une congestion vasculaire (Fig. 11b). A la dose 200 mg/kg, on
observait une dilatation des capillaires sinusoïdes (Fig. 11c).Chez les
mâles, des inflammations très légères ont
été observées aussi bien dans les groupes traités
à toutes les doses que dans le groupe témoin. A la dose 100
mg/kg, on observait parfois une congestion vasculaire (Fig. 11b).
Hp
VCL
Sn
(a)
VCL+Cn
(b)
Sn
I
EP
(c)
I
I
VCL
I
Figure 11 : Microphotographies des
coupes de foie normal (Témoin)(a), de foie avec congestions vasculaires
(100 mg/kg)(b), de foie légèrement enflammé + dilatation
des capillaires sinusoïdes (200 mg/kg)(c), de foie enflammé (Toutes
les doses)(d). Cn = congestion ; Hp = hépatocytes ; Sn =
sinusoïdes ; I = foyer inflammatoire ; VCL = veine
centrolobulaire ; EP = espace porte (HE×400).
Ø Le rein
La figure 12 présente des microphotographies de coupes
de reins obtenues des animaux ayant survécus jusqu'à la fin de la
période d'observation.Chez les femelles, une clarification tubulaire
était observée à la dose 200 mg/kg (Fig. 12b). Chez les
mâles, une clarification tubulaire était observée à
la dose 200 mg/kg (Fig. 12b). En outre, une légère inflammation a
été observée à la dose 400 mg/kg (Fig. 12c).
Gl
(a)
Gl
Gl
CT
(b)
I
Gl
(c)
Figure 12 : Microphotographies de coupes
de rein normal (témoin) (a), de rein présentant une clarification
tubulaire (200 mg/kg)(b) ou une inflammation (400 mg/kg)(c). Gl =
glomérule ; CT = clarification tubulaire ; I = foyer
inflammatoire (HE×400).
Ø Le poumon
La figure 13 présente une microphotographie de coupe
de poumon obtenue des animaux ayant survécus jusqu'à la fin de la
période d'observation.Chez les femelles, des inflammations ont
été observées dans tous les groupes traités (Fig
13).Chez les mâles, des inflammations ont été
observées aussi bien dans tous les groupes traités que chez le
témoin (Fig 13).
I
Av
Av
Av
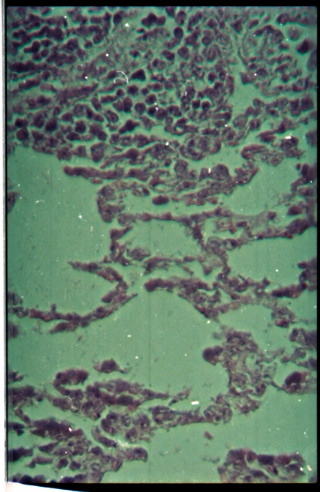
Figure 13 : Microphotographies de coupes
d'un poumon enflammé (Toutes les doses). Av = alvéole
pulmonaire ; I = foyer inflammatoire. (HE×400)
Ø Les ovaires
La figure 14 présente unemicrophotographie de coupe
d'ovaire obtenue des animaux femelles ayant survécus jusqu'à la
fin de la période d'observation.Aucun signe de toxicité
liée au traitementn'a été observé.
Ov
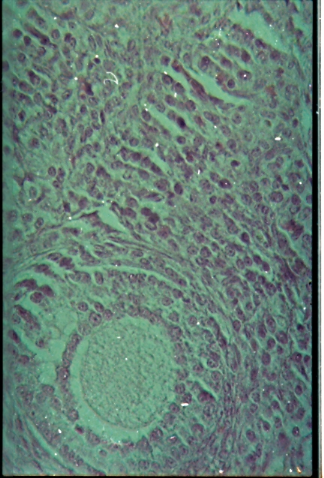
Figure 14 : Microphotographies de coupes
d'un ovaire normal. Ov = Ovocyte(HE×400).
Ø Les testicules
La figure 15 présente une microphotographie de coupe de
testicule obtenues des mâles ayant survécus jusqu'à la fin
de la période d'observation.De nombreuses cellules rondes immatures
étaient observées dans la paroi des tubes
séminifère de la membrane basale vers la lumière, aussi
bien dans tous les groupes traités que dans celui du témoin (Fig.
15).
Vers
la lumière
MB
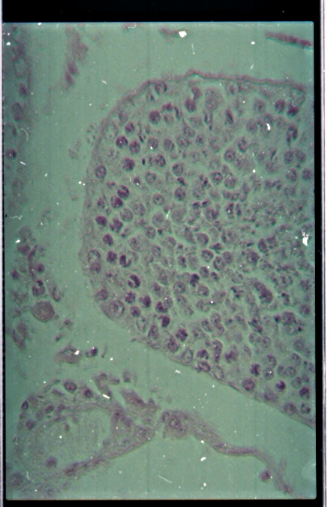
EI
Figure 15 : Microphotographies de coupe
d'un testicule présentant un grand nombre de cellules rondes (Toutes
les doses). EI = espace interstitiel, MB = membrane basale, (HE×400).

Les données obtenues après un essai de
toxicité orale aiguë chez l'animal peuvent être
utilisées pour satisfaire à des besoins de classification du
danger par le biais de la DL50, et pour l'évaluation des
risques pour la santé humaine et/ou pour l'environnement (OECD, 2001).
C'est sur cette base qu'une évaluation de la toxicité orale
aiguë chez le rat de l'extrait aqueux du mélange de A.
melegueta, M. whitei, P. guineense, et Z.
officinale, utilisée en médecine traditionnelle pour traiter
les faiblesses sexuelles et l'asthénie chez l'homme a été
réalisée. Une DL50 orale estimée
supérieure à 2,5 g/kg a été obtenue. Cette valeur
de la DL50 a permis de classer la toxicité de cet extrait
dans la catégorie 5 du système de classification globalement
harmonisé des substances chimiques, catégorie
caractérisant les substances faiblement toxiques (OECD, 2001). Les seuls
changements liés au traitement ont été observés les
2 premières heures après administration de l'extrait : les
animaux présentaient des manifestations de sommeil et de
léthargie, mais ces symptômes étaient fugaces. Aucun autre
changement lié au traitement n'a été observé sur
tout le reste de la durée d'observation, ni aucune diminution de la
prise de poids. Ces résultats suggèrent donc que cet extrait
présente de très faibles risques pour la santé en
administration unique.
Pour identifier les risques pour la santé humaine
d'une exposition répétée à l'extrait, un test de
toxicité subchronique a été réalisé. Lors de
l'administration orale répétée de l'extrait aux doses 100,
200, et 400 mg/kg pendant 33 jours, sur les 40 animaux initialement
sélectionnées pour l'étude de la toxicité
subchronique de l'extrait, 34 ont survécu, soit 6 décès.
L'un des 6 décès (1 mâle à la dose 200 mg/kg)
résultait de l'euthanasie d'un animal parce qu'il présentait des
signes de morbidité (torticolis, tournait en rond sur lui-même de
façon répétitive). Ces symptômes étaient
fréquemment observés chez les animaux lors de l'élevage,
suggérant ainsi l'éventualité que la pathologie
observée ne soit pas due au traitement. Par la suite, 4 des 6
décès, (3 animaux à la dose 400 mg/kg : 1 mâle
+ 2 femelles ; et 1 animal à la dose 200 mg/kg : 1 mâle)
et les symptômes d'intoxication associés semblaient liés au
traitement car :
· Les animaux témoins n'ont montré aucun
signe d'intoxication sur toute la période d'observation, ce qui
excluait fortement les conditions de manipulation comme causes des
décès.
· Ces 4 animaux décédés
manifestaient communément avant leur décès 4
symptômes d'intoxication (fourrure hérissée + maigreur +
léthargie + tachypnée).
Le dernier des 6 décès (1 mâle à la
dose 100 mg/kg) a probablement été la conséquence d'un
étouffement nocturne. En effet, le jour précédent la
découverte de la dépouille, l'animal présentait les
symptômes du rhume des foins (éternuement et écoulement
nasal). Les causes de ce rhume n'ont pas pu être indubitablement
reliées au traitement, mais l'hypothèse de liaison reste
envisageable. En effet, il a été montré que Zingiber
officinale pouvait être un irritant gastrique (Desai et
al., 1990), provoquer des reflux gastriques (Anonymous, 2003) et des
allergies (Chrubasik et al., 2005). Les reflux gastriques
éventuels après gavage auraient pu irriter les parois des voies
respiratoires chez l'animal et provoquer une réaction allergique.
Les symptômes sus cités (fourrure
hérissée + maigreur + léthargie + tachypnée) ont
été aussi observés chez un animal survivant (1 femelle
à la dose 400 mg/kg) lors de la dernière semaine d'observation,
associés à une réduction des facultés nociceptive,
motrice, et préhensile. Une insensibilité des pattes a aussi
été observée chez l'animal euthanasié et chez l'un
des animaux décédé (1 femelle à la dose 400 mg/kg)
peu de temps avant leur décès. Ceci suggère une
activité neurotoxique de l'extrait à dose élevée.
Ces résultats peuvent être soutenus par les travaux de Gruenwald
(2004), quimontrentqueZingiber officinale peut entrainer une
dépression du système nerveux central.
L'autopsie des animaux mort/euthanasiés en cours
d'étude a montré des foies sombres, rugueux et compact, des
intestins compacts et jaunâtres, et des appareils digestifs translucides
(400 mg/kg essentiellement).Les observations faites sur le foie
suggéraient clairement une activité hépatotoxique de
l'extrait à dose élevée. La teinte jaunâtre prise
par les intestins pouvait traduire un ictère. En effet, les
ictères ont pour signe clinique majeur le jaunissement des muqueuses, de
la peau, et des yeux, et sont généralement la résultante
d'une affectionhépatique, ce qui rend cette hypothèse d'autant
plus plausible.La rigidité des intestins pourraient être
uneréaction en réponse à une irritation de ces derniers
causée par l'extrait à dose élevée.En effet, il a
été rapporté que M. whitei et Z.
officinale pouvaient être des irritants digestifs (Lamidi et
Bourobou Bourobou, 2010 ; Desai et al., 1990).
Excepté l'animal survivant signalé plus haut
(femelle à la dose 400 mg/kg), aucune modification susceptible
d'être reliée au traitement n'a été observée
chez les animaux survivant sur toute la période d'observation. Ainsi,
sur 28 animaux traités (l'animal euthanasié et l'animal
enrhumé ont été exclu car leur décès n'a pas
été strictement relié au traitement), 24 survivants ont
été noté, soit 85,71% des
animaux : 23 ont survécu et ont assez bien supporté le
traitement soit 82,14% des animaux, 1 animal survivant
manifestait des signes de toxicité liés au traitement, soit
3,57% des animaux. 4 décès liés au
traitement ont été observés, soit 14,29%
des animaux : 3 animaux à la dose 400 mg/kg (1 mâle + 2
femelles) soit 10,71% des animaux ; 1 animal
à la dose 200 mg/kg (mâle) soit 3,57% des
animaux. El-Thaher et al. (2001) ont eu un résultat similaire
lors de l'étude de la toxicité subchronique d'un aphrodisiaque,
Ferula harmonis, chez le rat. Ils ont recensé 6
décès sur 30 animaux traités à l'aphrodisiaque,
dont 1/6 décès n'était pas lié au traitement.
Le système hématopoïétique est parmi
les cibles les plus sensibles des toxiques, ce qui fait des affections de ce
système un bon indice de toxicité d'une substance, comme l'est la
diminution du poids corporel (Adeneye et al., 2006). L'extrait n'a
entrainé aucune modification significative des paramètres
hématologiques évalués chez les mâles, mais a
entrainé une baisse significative de 14% de la concentration moyenne en
hémoglobine corpusculaire chez les femelles à la dose 400 mg/kg
comparativement aux témoins. Bien qu'étant non significative, une
baisse de 46% du taux d'hématie par rapport au témoin (p = 7,30%)
a aussi été observée chez les femelles à la dose
400 mg/kg. Ces observations suggèrent un effet anémiant de
l'extrait à dose élevée, du moins chez les femelles. Ces
résultats peuvent être soutenus par les travaux de Nebojsa et
al., (2010) sur la toxicité de l'extrait à
l'éthanol des graines de Aframomum melegueta chez le rat, qui
ontrévéléune réduction(quoique
dose-indépendante) des paramètres hématologiques de masse
(hématocrite, hémoglobine, hématies) liée au
traitement.El-Thaher et al. (2001) ont aussi obtenu des
résultats similaires sur l'action del'aphrodisiaque Ferula
harmonissur quelques paramètres hématologiques chez le rat.
L'anémie pourraitrésulter des affections dues à la
substance d'essai observées au niveau du foie. En effet des
hépatopathies avancées peuvent être à l'origine
d'anémie (Teeter et Franciscus, 2004).L'anémie pourrait aussi
résulter d'une hémolyse ou de l'inhibition de la production des
hématies au niveau de la moelle osseuse. Dans ce cas,l'extrait
contiendrait des composésquià dose élevée, seuls
où en interaction, ont une action délétère sur le
système hématopoïétique.
L'extrait n'a entrainé aucune modification
significative des paramètres biochimiques évalués chez les
mâles. Chez les femelles, une baisse significative du taux de
cholestérol total aux doses 200 et 400 mg/kg et une augmentation du taux
d'ASAT aux doses 100, 200, et 400 mg/kg a été observée.
L'activité hypocholesterolémiante manifeste de l'extrait à
dose élevée est semblable à celle observée par
El-Thaher et al. (2001) dans leur étude de la toxicité
subchronique de Ferula harmonis chez le rat. Selon eux,
l'activité oestrogénique de Ferula harmonis (Cotran et
al., 1999), en inhibant la synthèse de cholestérol,
pourrait être à l'origine de l'hypocholestérolémie.
Cette hypothèse pourrait bien s'employer dans le cas de l'extrait aqueux
du mélange de A. melegueta, M. whitei, P.
guineense, et Z. officinale. En effet, P. guineense et
A. melegueta sont utilisés en médecine traditionnelle
pour le traitement des infertilités féminines (Noumi et
al., 1998 ; Tane et al., 2005), ce qui laisse
sous-entendre un potentiel effet oestrogénique de l'extrait, bien
qu'aucune étude scientifique n'ait été retrouvée
dans la littérature pour étayer ce propos.
L'hypocholestérolémie peut aussi s'expliquer par
l'activité hypolipémiante de Z. officinale (Kadnur et
Goyal, 2005). L'hypocholestérolémie pourrait aussi être la
conséquence de l'hépatotoxicité de l'extrait. En effet, le
foie est le siège essentiel de la synthèse du cholestérol
sanguin. Toute atteinte de la fonction hépatique pourrait donc inhiber
cette synthèse et par la suite réduire les taux de
cholestérol sanguin. L'augmentation du taux d'ASAT sérique peut
traduire une atteinte cardiaque, des hépatopathies, des dystrophies
musculaires, et des dommages aux organes internes. Les résultats des
coupes histologiques suggèrent l'implication des affections
hépatiques et pulmonaires dans cette augmentation. En effet, le foie et
les poumons des femelles traités à toutes les doses manifestaient
des inflammations liées au traitement. Ce résultat est
renforcé par la valeur du poids relatif des poumons chez les femelles
à la dose 400 mg/kg qui était significativement réduite de
12,3% par rapport au témoin.
Sur le plan histopathologique, comme il a été
signalé plus haut, les foies chez les femelles à toutes les doses
pouvaient être le siège d'inflammations, associées à
des congestions vasculaires ou des dilatations des capillaires sinusoïdes,
liées au traitement. Les congestions et dilatations vasculaires
semblaient cependant bénignes. De très légères
inflammations ont été observées chez les mâles, mais
elles ne permettaient pas de conclure qu'elles étaient liée au
traitement vu leur présence dans le groupe témoin. Une congestion
vasculaire bénigne a été observéeet semblait
liée au traitement. Il semble alors possible de conclure à
unehépatotoxicité de l'extrait, du moins chez les femelles. Au
niveau des reins, une clarification tubulaire bénignea été
observée chez les femelles (200 mg/kg), de même que chez les
mâles (200 mg/kg) avec une légère inflammation chez ces
derniers (400 mg/kg), toutes liées au traitement. Ces résultats
suggèrent une faible néphrotoxicité de l'extrait. Au
niveau des poumons, des inflammations liées au traitement ont
été observées chez les femelles (toutes les doses). Chez
les mâles, les inflammations observées ne permettaient pas de
conclure à un lien avec le traitement à cause de leur
présence dans le groupe témoin. Ces résultats
suggèrent alors une forte activité toxique de l'extrait sur les
poumons, du moins chez les femelles. Cette conclusion peut être soutenue
par l'observation faite lors de l'autopsie d'une femelle survivante chez
laquelle les poumons semblaient avoir atteint un état inflammatoire
avancé avec destruction de la structure tissulaire. Au niveau des
ovaires, aucune affection liée à l'extrait n'a été
mis en évidence. Au niveau des testicules, la présence de
nombreuses cellules rondes en allant vers la lumière des tubes
séminifèresa été observée dansles groupes
traités et témoin, empêchant ainsi de conclure à une
liaison avec le traitement. Ces résultats suggèrent une faible
gonadotoxicité de l'extrait, du moins chez les femelles.

Il était question dans ce travail d'identifier les
dangers potentiels pour la santé humaine que représente le
traitement à l'extrait aqueux du mélange de Aframomum
melegueta, Mondia whitei, Piper guineense, et Zingiber
officinale, utilisé en médecine traditionnelle pour traiter
les infertilités masculines et l'impuissance sexuelle. Le test de
toxicité orale aiguë chez le rat à permis d'obtenir une
DL50 > 2,5 g/kg, caractéristique des substances à
très faible toxicité. Aucun signe d'intoxication majeur
lié au traitement n'a été observé sur toute la
durée d'observation. Le test de toxicité orale subchronique (33
jours) aux doses 100, 200, et 400 mg/kg à entrainé le
décès lié au traitement d'environ 14,29% des animaux
traités, décès dont 75% appartenaient à la dose 400
mg/kg. L'extrait semblait présenter des
propriétésneurotoxique, anémiant,
hypocholestérolémiant, hépatotoxique, et de
toxicité pulmonaire, essentiellement chez les femelles.
Ces résultats suggèrent que la consommation de
l'extrait aqueux du mélange de Aframomum melegueta, Mondia whitei,
Piper guineense, et Zingiber officinaleà dose
thérapeutiqueprésente de faibles risques pour la santé
masculine, soutenantainsi l'utilisation de ce produit dans le traitement des
infertilités masculines et de l'impuissance sexuelle. Cependant, une
éventuelle prise quotidienne à des doses plus
élevéesexposeraitle mâleà de sérieuses
affections, notamment hépatique et nerveuse, ce qui rend
impératif le respect des doses prescrites lors du traitement
traditionnel.
Au terme de cette étude, il semble approprié
pour l'avenir :
1) d'apprécier la persistance ou la
réversibilité des effets toxiques après arrêt du
traitement ;
2) d'évaluer la toxicité sur une période
plus longue afin de mettre en évidence les effets nocifs après
untraitement plus long ;
3) d'étendre l'évaluation des risques potentiels
pour la santé à d'autres espèces de Mammifères,
pour mettre en évidence les éventuels risques potentiels pour la
santé qui ne se manifesterait pas chez le Rat.
REFERENCES
- Abila, B. ; Richens, A. ; Davies, J. A.
(1993). Anticonvulsant effects of extracts of the West African black pepper,
Piper guineense. J. Ethnopharmacol., 39 : 113-117.
- Acquaye, D. ; Quansah C. ; Asare E. (1999).
Feasibility study on Lippia, Cryptolepis, Desmodium, Cassia alata and
Mondia. Compiled by ASNPP, Ghana. 3 p.
- Adeneye, A. A.; Ajagbonna, O. P.;
Adeleke,T. I.; Bello, S. O.(2006). Preliminary toxicity and phytochemical
studies of the stem bark aqueous extract of Musanga cecropioides in
rats.J. Ethnopharmacol., 105: 374-379.
- Adjanohoun, J. E. ; Aboubakar, N. ; Dramane,
K. ; Ebot, M. E. ; Ekpere, J. A. ; Enow-Orock, E. G. ;
Focho, D. ; Gbile, Z. O. ; Kamanyi, A. ; Kamsu Kom, J. ;
Keita, A. ; Mbenkum, T. ; Mbi, C. N. ; Mbiele, A. L. ;
Mbome, L. L. ; Mubiru, N. K. ; Nancy, W. L. ; Nkongmeneck,
B. ; Satabie, B. ; Sofowora, A. ; Tamze, V. ; Wirmum, C. K.
(1996). Traditionnal Medicine and Pharmacopeia. Contribution to
Ethnobotanical and Floristic Studies in Cameroon. Scientific, Technical
and Research Comission of the Organisation of African Unity, Lagos. 641 p.
- Ali, B. H. ; Blunden, G. ; Tanira, M. O. ; Nemmar,
A. (2008). Some phytochemical, pharmacological and toxicological properties of
ginger (Zingiber officinale Roscoe): A review of recent research.
Food and Chem. Tox., 46 : 409-420.
- Anonymous. (2003). Zingiberis rhizoma, ESCOP
Monographs. Stuttgart, New York: Thieme; Press pp.547-553.
- Chrubasik, S. ; Pittler, M. H. ; Roufogalis, B. D.
(2005). Zingiberis rhizoma: a comprehensive review on the ginger effect and
efficacy profiles. Phytomed., 12 : 684-701.
- Clark, D. G.; Fielder, R.; Joseph, C.; Gardner, J.; Smith,
M. (1991). The future for acute oral toxicity testing. In: Animals and
Alternatives in Toxicology (Balls M, Bridges J, Southee J, eds). London:
Macmillan Academic and Professional Ltd :pp.1-21.
- Cotran, R. S.; Kumar, V.; Collins, T. (1999). Robbins
Pathologic Basis of Disease, 6th edn. WB Saunders Co: Philadelphia, p 1016.
- Dedov, V. N. ; Tran, V. H. ; Duke, C. C. ;
Connor, M. ; Christie, M. J. ; Mandadi, S. ; Roufogalis, B.D.
(2002). Gingerols : a novel class of vanilloid receptor (VR1) agonists.
Brit. J. Pharmacol., 137 : 793-798.
- Desai, H. G. ; Kalro, R. H. ; Choksi, A. P.
(1990). Effect of ginger & garlic on DNA content of gastric aspirate.
Indian J. Med. Research, 92 : 139-141.
- Dokosi, O.B. (1998). Herbs of Ghana. Ghana Universities
Press, Accra. 3 p.
- Dokou-Gaïn, L. (2010). Propriétés
androgéniques et aphrodisiaques du mélange des plantes
Aframomum melegueta, Mondia whitei, Piper guineense et Zingiber
officinale. Mémoire de Master. Université de Yaoundé
I, Yaoundé (Cameroun). 60 p.
- Ekanem, A. P. ; Udoh, F. V. ; Oku, E. E. (2010).
Effects of ethanol extract of Piper guineense seeds (Schum. and Thonn)
on the conception of mice (Mus Musculus). Afr. J. Pharm.
Pharmacol., 4(6) : 362-367.
- Ekundayo, O. ; Laasko, I. ; Adegbola, R. ;
Oguntimein, B. M. ; Sofowora, A. ; Raimo, H. (1988). Essential oil
constituents of ashanti pepper (Piper guineense) fruits (Berries).
J. Agr. and Food Chem., 36 : 880-882.
- El-Thaher, T. S.; Matalka, K. Z.; Taha, H. A.; Badwan, A. A.
(2001). Ferula harmonis `zallouh' and enhancing erectile function in
rats: efficacy and toxicity study. International J. of Impotence
Research, 13 : 247-251
- Escoubas, P. ; Lajide, L. ; Mizutani, J. (1995).
Termite antifeedant activity in Aframomum melegueta.
Phytochem., 40 : 1097-1099.
- Fabre, I. (2008). Méthodes Substitutives à
L'expérimentation Animale : Aspects Réglementaires,
État de L'art et Perspectives. Bull. Acad. Vét. France,
Tome 161, N°5 : 403-407
- Fielder, R. J. (1995). The fixed dose procedure as an
alternative to the classical LD50 test: acceptance by the EEC and OECD. In
Alternative Methods in Toxicology and the Life Sciences. Vol 11
(edited by A. M. Goldberg and L. F. M. van Zutphen)Mary Ann Liebert, New
York.pp 269-274.
- Ghana Herbal Pharmacopoeia. (1992). The Advent
Press, PO Box 0102, Osu, Accra. 3 p.
- Ghayur, M. N. ; Gilani, A. H. (2005). Ginger lowers
blood pressure through blockade of voltage-dependent calcium channels. J.
Cardiovasc. Pharmacol., 45 : 74-80.
- Gornall, A. G.; Bardawill, C. J.; David, M.
M.(1949). Détermination of serum proteins by means of
buiret reactions. J. Biol. Chem., Baltimore, v. 177: 751-766.
- Goyal, R. K. ; Kadnur, S. V. (2006). Beneficial effects
of Zingiber officinale on goldthioglucose induced obesity.
Fitoterapia, 77 : 160-163.
- Gruenwald, J. (2004). PDR for Herbal Medicine 3rd
ed.Montvale, NJ: Thomson PDR.13pp
- Holmberg B. ; Högberg J. ; Johanson G.
(2000). La Toxicologie. Définitions et Concepts. In
Encyclopédie de Sécurité et de Santé au
Travail.Vol 1 (edited by J. M. Stellman), pp 33.3-33.8. Organisation
Internationale du Travail, Genève.
- Iwu, M. M. (1993). Handbook of African medicinal plants.
CRC Press, 257 p.
- Jiang, H. ; Xie, Z.; Koo, H. J.; McLaughlin, S. P.;
Timmermann, B. N.; Gang, D. R. (2006). Metabolic profiling and phylogenetic
analysis of medicinal Zingiber species: tools for authentication of
ginger (Zingiber officinale Rosc.). Phytochem., 67:
232-244.
- Juliani, H. R. ; Welch, C. ;
Asante-Dartey, J. ; Wang, M. ; Simon, J. E. (2007). Chemistry,
quality and functional properties of grains of paradise (Aframomum
melegueta), a rediscovered spice. In Dietary supplements (edited
by C. T. ; Y. Shao ; J. E. Simon). Am. Chem. Soc. Symp. Ser. American
Chemical Society, Washington, D.C. USA. 4 p.
- Kadnur, S. V. ; Goyal, R. K. (2005). Beneficial effects
of Zingiber officinale Roscoe on fructose induced hyperlipidemia and
hyperinsulinemia in rats. Indian J. of Experimental Biol., 43 :
1161-1164.
- Kamtchouing, P. ; Mbongue Fandio, G. Y. ; Dimo,
T. ; Jatsa, H. B. (2002a). Evaluation of androgenic activity of
Zingiber officinale and Pentadiplandra brazzeana in male
rats. Asian J. of Andrology, 4 : 299-301.
- Kamtchouing, P. ; Mbongue, G. Y. F. ; Dimo,
T. ; Watcho, P. ; Jatsa, H. B. ; Sokeng, S. D. (2002b). Effects
of Aframomum melegueta and Piper guineense on sexual
behaviour of male rats. Behaviour Pharmacol., 13 : 243.
- Kubo, I. ; Kinst-Hori, I. (1999).
2-hydroxy-4-methoxybenzaldehyde: A potent tyrosinase inhibitor from African
medicinal plants. Planta Med., 65 : 19-22.
- Lachman-White, D. A. ; Adams, C. D. ; Trotz Ulric
O. D. (1992). A guide to the medicinal plants of coastal Guyanna.
Commonwealth Science Council, London. 311-318.
- Lale, N. E. S. (1992). A laboratory study of the comparative
toxicity of products from three species to the maize weevil. Post Harv Biol
Technol, 2 : 61-64.
- Lamidi, M. ; Bourobou Bourobou, H. (2010). Mondia
whitei (Hook.f.) Skeels.Fiche de Protabase (edited by Schmelzer,
G.H. & Gurib-Fakim, A.). PROTA (Plant Resources of Tropical Africa /
Ressources végétales de l'Afrique tropicale), Wageningen, Pays
Bas. 1 p.
- Lapointe, G. (2004). Notions de Toxicologie.
Commission de la Santé et de la Sécurité du Travail du
Québec, Québec. 67 p.
- Lawal, B. A. S. ; Aderibigbe, A. O. ; Essiet, G.
A. ; Essien, A. D. (2007). Hypotensive and Antihypertensive Effects of
Aframomum melegueta Seeds in Humans. International J. of pharmacol.,
3(4) : 311-318.
- Lindgren, P. ; Thelestam, M. ; Lindquist, N.
G. (1983). First CFN symposium on LD50 and possible
alternatives. Acta Pharmacol Toxicol,52 (Suppl II).
- Lipnick, R. L.; Cotruvo, J. A.; Hill, R. N.; Bruce, R. D.;
Stitzel, K. A.; Walker, A. P.; Chu, I.; Goddard, M.; Segal, L.; Springer, J.
A.; Myers, R. C. (1995). Comparison of the Up-and Down, Conventional LD50, and
Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol, 33:
223-231.
- Lu, F. C. (1992). Toxicologie : Données
générales, procédures d'évaluation, organes cibles,
évaluation du risque. MASSON, Paris.360 p.
- Mascolo, N. ; Jain, R. ; Jain, S. C. ;
Capasso, F. (1989). Ethnopharmacologic investigation of ginger (Zingiber
officinale). J. Ethnopharmacol, 27 : 129-140.
- Mbongue, F. G. Y. ; Kamtchouing, P. ; Essame, O.
J. L. ; Yewah, P. M. ; Dimo, T. ; Lontsi, D. (2005). Effect of
the aqueous extract of dry fruits of Piperguineense on the
reproductive function of adult male rats, Indian. J. Pharmacol., 7:
30-32.
- Morakinyo, A. O. ; Adeniyi, O. S. ; Arikawe, A. P.
(2008). Effects of Zingiber Officinale on Reproductive Functions in
the Male Rat. Afr. J. of Biomed. Research, 11 : 329-334.
- Ndukwu, B.C. ; Ben-Nwadibia, N.B. (2005).
Ethnomedicinal Aspects of Plants Used as Spices and Condiments in the Niger
Delta Area of Nigeria. Ethnobotanical Leaflets, Vol. 2005: Iss. 1,
Article 10. 9 p.
- Nebojsa, I. ; Schmidt, B. M. ; Poulev, A. ;
Raskin, I. (2010). Toxicological evaluation of Grains of Paradise
(Aframomum melegueta) [Roscoe] K. Schum. J. Ethnopharmacol.,
127 : 352-356.
- Noumi, E. ; Amvam, Z. P. H. ; Lontsi, D. (1998).
Aphrodisiac plants used in Cameroon. Fitoterapia (LXIX) 69:125-134.
- OCDE. (1979). Résumé des considérations
du rapport des groupes d'experts de l'OCDE sur la toxicologie à court et
à long terme. In Lignes directrice de l'OCDE pour les essais de
produits chimiques Vol 1, number 4, pp 1-15. OCDE, Paris.
- OCDE. (2001a). Toxicité orale aiguë -
Méthode de la dose prédéterminée. In Lignes
directrice de l'OCDE pour les essais de produits chimiques Vol 1, number
4, pp 1-15. OCDE, Paris.
- OCDE. (2001b). Toxicité orale aiguë -
Méthode par classe de toxicité aiguë. In Lignes
directrice de l'OCDE pour les essais de produits chimiques Vol 1, number
4, pp 1-14. OCDE, Paris.
- OCDE. (2008a). Étude de toxicité orale
à dose répétée pendant 28 jours sur les rongeurs.
In Lignes directrice de l'OCDE pour les essais de produits chimiques
Vol 1, number 4, pp 1-14. OCDE, Paris.
- OCDE. (2008b). Toxicité orale aiguë -
Méthode de l'ajustement des doses. In Lignes directrice de l'OCDE
pour les essais de produits chimiques Vol 1, number 4, pp 1-29. OCDE,
Paris.
- OCDE. (2009). Études de toxicité chronique. In
Lignes directrice de l'OCDE pour les essais de produits chimiques, Vol
1, number 4, pp 1-16. OCDE, Paris.
- OECD. (2001). Harmonized Integrated Hazard Classification
System for Human Health and Environmental Effects of Chemical Substances,Part
2, pp. 20-24. OECD, Paris.
- Okoli, C. O. ; Akah, P. A.; Nwafor, S. V.; Ihemelandu,
U. U.; Amadife, C. (2007). Anti-inflammatory activity of seed extracts of
Aframomum melegueta. J. herbs, spices and medicinal plants,
13 (1): 11-21.
- Oliver J. A. (1986). Opportunities for using fewer animals
in acute toxicity studies. In Chemicals Testing and Animal Welfare
(The National Chemicals Inspectorate), pp 119-142. Solna, Sweden.
- OMS. (2000). principes méthodologiques
généraux pour la recherche et l'évaluation relative
à la médecine traditionnelle. Organisation Mondiale de la
Santé, Genève.79 p.
- OMS. (2002). Stratégies de l'OMS pour la
médecine traditionnelle pour 2002-2005.Organisation Mondiale de la
Santé, Genève.65p.
- Onyenekwe, P. C. ; Ogbadu, G. H. ; Hashimoto, S.
(1997). The effect of gamma radiation on the microflora and essential oil of
Ashanti Pepper (Piper guineense) berries. Posthavest Biol.
Technol., 10 : 161-167.
- Patnam, R. ; Kadali, S. S.; Koumaglo, K. H. ;
Roy, R. (2005). A chlorinated coumarinolignan from the African medicinal plant,
Mondia whitei. Phytochem., 66 : 683-686.
- Platel, K. ; Srinivasan, K. (2000). Influence of
digestive spices and their active principles on pancreatic digestive enzymes in
albino rats. Nahrung., 44 : 42-46.
- Raji, Y. ; Udoh, U. S. ; Ojo, O. O. (2003).
Gastric ulcerogenic activities of Piper guineense extract in Rats.
Nigerian J. of physiol. sciences, 18 (1-2) : 27-30.
- Rehn, S. ; Espig, G. (1991). The cultivated plants of
the tropics and subtropics. Cultivation, Economic value, Utilization,
Verlag, Josef, Margraf Scientific books CTA.522 p.
- Rhodes, C. ; Thomas, M. ; Athis J. (1993).
Principles of testing for acute toxic effects. In General and Applied
Toxicology. Vol 1 (edited by B. Ballantyne, T. Marrs, P. Turner), Stockton
Press, New York.pp 49-87.
- Saba, A. B. ; Tomori, O. A. (2007). The Contractile
Effect of Ethanolic Extract of West African Black Pepper (Piper
guineense) on Isolated Guinea Pig Ileum. Pakistan J. of
Nutrition, 6 (4): 366-369.
- Schlede, E. ; Genschow, E. ; Spielmann, H. ;
Stropp, G. ; Kayser, D. (2005). Oral acute toxic class method: A
successful alternative to the oral LD50 test. Reg. Tox. and Pharm.,
42 : 15-23.
- Seibert, H. ; Balls, M. ; Fentem, J. H. ;
Bianchi, V. ; Clothier, R. H. ; Dierickx, P. J. ; Ekwall,
B. ; Garle, M. J. ; Gomez-Lechon, M. J. ; Gribaldo, L. et al.
(1996). Acute toxicity testing in vitro and the dassification and labelling of
chemicals. ATLA, 24 : 499-510.
- Silbergeld, E. K. (2000). La Toxicologie :
Introduction. In Encyclopédie de Sécurité et de
Santé au Travail.Vol 1 (edited by J. M. Stellman). Organisation
Internationale du Travail, Genève.pp 33.2-33.3.
- Simon, J. E. ; Koroch, A. R. ; Acquaye, D. ;
Jefthas, E. ; Juliani, R. ; Govindasamy, R. (2007). Medicinal crops
of Africa. InIssues in new crops and new uses (edited by J. Janick and
A. Whipkey).ASHS Press, Alexandria, VA.pp 322-331.
- Sofowora, A. (1982). Medicinal plant and traditional
medicine in Africa. John Wiley and sons, New York. p. 44.
- Tane, P. ; Tatsimo, S. D. ; Ayimele, G. A. ;
Connolly, J. D. (2005). Bioactive metabolites from Aframomum species.
11th NAPRECA Symposium Book of Proceedings, Antananarivo,
Madagascar : 214-223.
- Teeter, T ; Franciscus, A. (2004). Comment
interpréter un rapport de laboratoire : notions
élémentaires. Fiche de renseignement.HCSP(Hepatitis C
support project), San Francisco.3p
- Thomson, M. ; Al-Qattan, K. K. ; Al-Sawan, S.
M. ; Alnaqeeb, M. A. ; Khan, I. ; Ali, M. (2002). The use of
ginger (Zingiber officinale Rosc.) as a potential anti-inflammatory
and antithrombotic agent. Prostaglandins Leukot. Essent. Fatty Acid,
67 : 475-478.
- Trevan, J. (1927). The error of determination of toxicity.
Proc. Roy. Soc., 101B : 483-514.
- Tron, I. ; Piquet, O. ; Baert, A. ; Mouton,
C. (2002). Toxon Manuel de Toxicologie. Guide technique. ADEME,
Angers. 128p
- Udoh, F. V. ; Theodore, Y. L. ; Braide, V. B.
(1999). Effects of extract of seed and leaf of Piper guineense on
skeletal muscle activity in rat and frog. Phytother. Res., p.110.
- Umukoro, S. ; Ashorobi, R. B. (2003). Pharmalogical
evaluation of the antidiarrheal activity of Aframomum melegueta seed.
West Afr. J. Pharmacol. Drug Res, 19 : 51-54.
- Umukoro, S. ; Ashorobi, R. B. (2005). Further
evaluation of the anti-inflammatory activity of Aframomum melegueta
seed extract and its possible mechanism of action. Nigerian J. Health
Biomed. Sci., 4 : 35-39.
- Walum, E. (1998). Acute Oral Toxicity. Env. Health
Persp., 106 : 497-503.
- Watcho, P. ; Donfack, M. M. ; Zelefack, F. ;
Nguelefack, T. B. ; Wansi, S. ; Ngoula, F. ; Kamtchouing,
P. ; Tsamo, E ; Kamanyi, A. (2005). Effects of the hexane extract of
Mondia whitei on the reproductive organs of male rat.Afr. J. Trad.
CAM, 2 (3):302-311.
- Watcho, P. ; Kamtchouing, P. ; Sokeng, S.
D. ; Moundipa, P. F. ; Tantchou, J. ; Essame, J. L. ;
Koueta, N. (2004). Androgenic effect of Mondia whitei roots in male rats.
Asian J. Androl., 6(3): 269-272.
- Wilkinson, J. M. (2000). Effect of ginger tea on the fetal
development of Sprague-Dawley rats. Reprod. Toxicol., 14 :
507-512.
- Yamahara, J. ; Huang, Q. R. ; Li, Y. H. ; Xu,
L. ; Fujimura, H. (1990). Gastrointestinal motility enhancing effect of
ginger and its active constituents. Chem. Pharm. Bull. (Tokyo),
38 : 430-431.
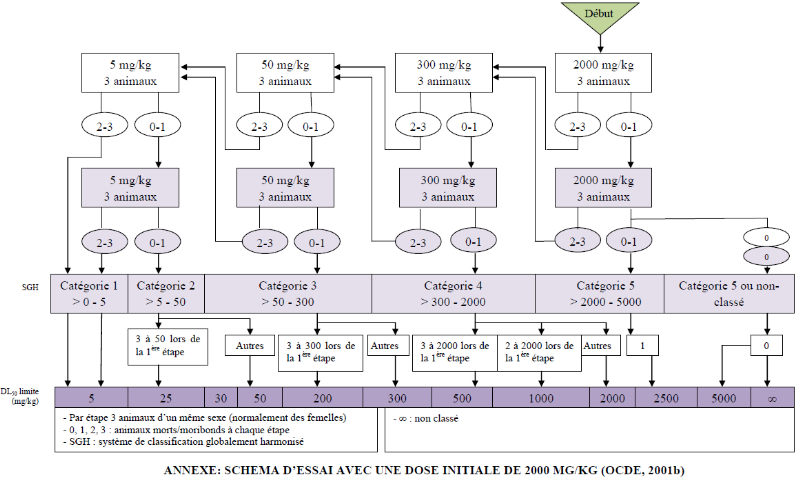
|
|



