III.2.4.2. Histopathologie
Ø Le foie
La figure 11 présente des microphotographies de coupes
de foie obtenues des animaux ayant survécus jusqu'à la fin de la
période d'observation.Chez les femelles, des inflammations similaires
à celle de la figure 11d ont été observées dans
tous les groupes traitées à l'extrait. A la dose 100 mg/kg, on
observait une congestion vasculaire (Fig. 11b). A la dose 200 mg/kg, on
observait une dilatation des capillaires sinusoïdes (Fig. 11c).Chez les
mâles, des inflammations très légères ont
été observées aussi bien dans les groupes traités
à toutes les doses que dans le groupe témoin. A la dose 100
mg/kg, on observait parfois une congestion vasculaire (Fig. 11b).
Hp
VCL
Sn
(a)
VCL+Cn
(b)
Sn
I
EP
(c)
I
I
VCL
I
Figure 11 : Microphotographies des
coupes de foie normal (Témoin)(a), de foie avec congestions vasculaires
(100 mg/kg)(b), de foie légèrement enflammé + dilatation
des capillaires sinusoïdes (200 mg/kg)(c), de foie enflammé (Toutes
les doses)(d). Cn = congestion ; Hp = hépatocytes ; Sn =
sinusoïdes ; I = foyer inflammatoire ; VCL = veine
centrolobulaire ; EP = espace porte (HE×400).
Ø Le rein
La figure 12 présente des microphotographies de coupes
de reins obtenues des animaux ayant survécus jusqu'à la fin de la
période d'observation.Chez les femelles, une clarification tubulaire
était observée à la dose 200 mg/kg (Fig. 12b). Chez les
mâles, une clarification tubulaire était observée à
la dose 200 mg/kg (Fig. 12b). En outre, une légère inflammation a
été observée à la dose 400 mg/kg (Fig. 12c).
Gl
(a)
Gl
Gl
CT
(b)
I
Gl
(c)
Figure 12 : Microphotographies de coupes
de rein normal (témoin) (a), de rein présentant une clarification
tubulaire (200 mg/kg)(b) ou une inflammation (400 mg/kg)(c). Gl =
glomérule ; CT = clarification tubulaire ; I = foyer
inflammatoire (HE×400).
Ø Le poumon
La figure 13 présente une microphotographie de coupe
de poumon obtenue des animaux ayant survécus jusqu'à la fin de la
période d'observation.Chez les femelles, des inflammations ont
été observées dans tous les groupes traités (Fig
13).Chez les mâles, des inflammations ont été
observées aussi bien dans tous les groupes traités que chez le
témoin (Fig 13).
I
Av
Av
Av
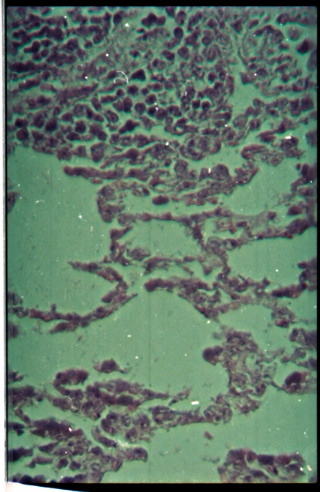
Figure 13 : Microphotographies de coupes
d'un poumon enflammé (Toutes les doses). Av = alvéole
pulmonaire ; I = foyer inflammatoire. (HE×400)
Ø Les ovaires
La figure 14 présente unemicrophotographie de coupe
d'ovaire obtenue des animaux femelles ayant survécus jusqu'à la
fin de la période d'observation.Aucun signe de toxicité
liée au traitementn'a été observé.
Ov
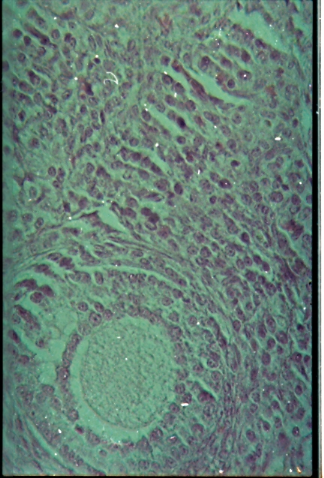
Figure 14 : Microphotographies de coupes
d'un ovaire normal. Ov = Ovocyte(HE×400).
Ø Les testicules
La figure 15 présente une microphotographie de coupe de
testicule obtenues des mâles ayant survécus jusqu'à la fin
de la période d'observation.De nombreuses cellules rondes immatures
étaient observées dans la paroi des tubes
séminifère de la membrane basale vers la lumière, aussi
bien dans tous les groupes traités que dans celui du témoin (Fig.
15).
Vers
la lumière
MB
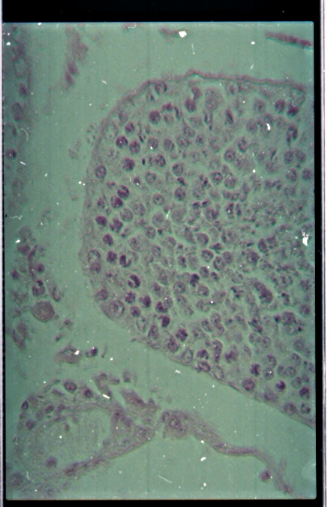
EI
Figure 15 : Microphotographies de coupe
d'un testicule présentant un grand nombre de cellules rondes (Toutes
les doses). EI = espace interstitiel, MB = membrane basale, (HE×400).

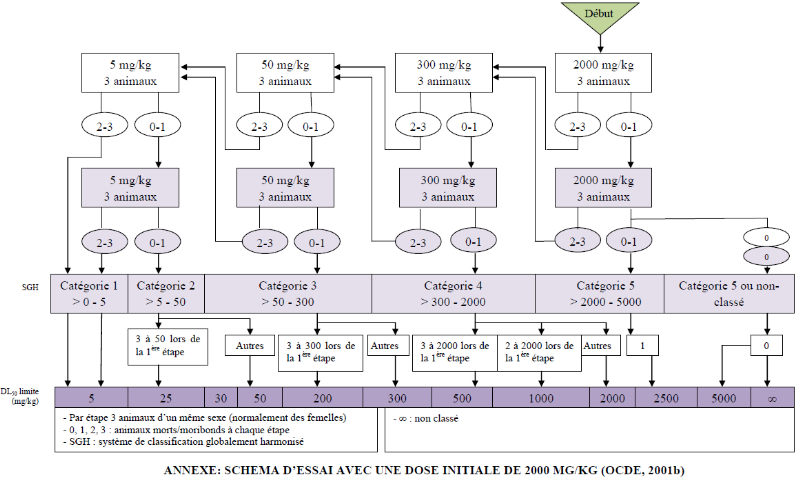
Les données obtenues après un essai de
toxicité orale aiguë chez l'animal peuvent être
utilisées pour satisfaire à des besoins de classification du
danger par le biais de la DL50, et pour l'évaluation des
risques pour la santé humaine et/ou pour l'environnement (OECD, 2001).
C'est sur cette base qu'une évaluation de la toxicité orale
aiguë chez le rat de l'extrait aqueux du mélange de A.
melegueta, M. whitei, P. guineense, et Z.
officinale, utilisée en médecine traditionnelle pour traiter
les faiblesses sexuelles et l'asthénie chez l'homme a été
réalisée. Une DL50 orale estimée
supérieure à 2,5 g/kg a été obtenue. Cette valeur
de la DL50 a permis de classer la toxicité de cet extrait
dans la catégorie 5 du système de classification globalement
harmonisé des substances chimiques, catégorie
caractérisant les substances faiblement toxiques (OECD, 2001). Les seuls
changements liés au traitement ont été observés les
2 premières heures après administration de l'extrait : les
animaux présentaient des manifestations de sommeil et de
léthargie, mais ces symptômes étaient fugaces. Aucun autre
changement lié au traitement n'a été observé sur
tout le reste de la durée d'observation, ni aucune diminution de la
prise de poids. Ces résultats suggèrent donc que cet extrait
présente de très faibles risques pour la santé en
administration unique.
Pour identifier les risques pour la santé humaine
d'une exposition répétée à l'extrait, un test de
toxicité subchronique a été réalisé. Lors de
l'administration orale répétée de l'extrait aux doses 100,
200, et 400 mg/kg pendant 33 jours, sur les 40 animaux initialement
sélectionnées pour l'étude de la toxicité
subchronique de l'extrait, 34 ont survécu, soit 6 décès.
L'un des 6 décès (1 mâle à la dose 200 mg/kg)
résultait de l'euthanasie d'un animal parce qu'il présentait des
signes de morbidité (torticolis, tournait en rond sur lui-même de
façon répétitive). Ces symptômes étaient
fréquemment observés chez les animaux lors de l'élevage,
suggérant ainsi l'éventualité que la pathologie
observée ne soit pas due au traitement. Par la suite, 4 des 6
décès, (3 animaux à la dose 400 mg/kg : 1 mâle
+ 2 femelles ; et 1 animal à la dose 200 mg/kg : 1 mâle)
et les symptômes d'intoxication associés semblaient liés au
traitement car :
· Les animaux témoins n'ont montré aucun
signe d'intoxication sur toute la période d'observation, ce qui
excluait fortement les conditions de manipulation comme causes des
décès.
· Ces 4 animaux décédés
manifestaient communément avant leur décès 4
symptômes d'intoxication (fourrure hérissée + maigreur +
léthargie + tachypnée).
Le dernier des 6 décès (1 mâle à la
dose 100 mg/kg) a probablement été la conséquence d'un
étouffement nocturne. En effet, le jour précédent la
découverte de la dépouille, l'animal présentait les
symptômes du rhume des foins (éternuement et écoulement
nasal). Les causes de ce rhume n'ont pas pu être indubitablement
reliées au traitement, mais l'hypothèse de liaison reste
envisageable. En effet, il a été montré que Zingiber
officinale pouvait être un irritant gastrique (Desai et
al., 1990), provoquer des reflux gastriques (Anonymous, 2003) et des
allergies (Chrubasik et al., 2005). Les reflux gastriques
éventuels après gavage auraient pu irriter les parois des voies
respiratoires chez l'animal et provoquer une réaction allergique.
Les symptômes sus cités (fourrure
hérissée + maigreur + léthargie + tachypnée) ont
été aussi observés chez un animal survivant (1 femelle
à la dose 400 mg/kg) lors de la dernière semaine d'observation,
associés à une réduction des facultés nociceptive,
motrice, et préhensile. Une insensibilité des pattes a aussi
été observée chez l'animal euthanasié et chez l'un
des animaux décédé (1 femelle à la dose 400 mg/kg)
peu de temps avant leur décès. Ceci suggère une
activité neurotoxique de l'extrait à dose élevée.
Ces résultats peuvent être soutenus par les travaux de Gruenwald
(2004), quimontrentqueZingiber officinale peut entrainer une
dépression du système nerveux central.
L'autopsie des animaux mort/euthanasiés en cours
d'étude a montré des foies sombres, rugueux et compact, des
intestins compacts et jaunâtres, et des appareils digestifs translucides
(400 mg/kg essentiellement).Les observations faites sur le foie
suggéraient clairement une activité hépatotoxique de
l'extrait à dose élevée. La teinte jaunâtre prise
par les intestins pouvait traduire un ictère. En effet, les
ictères ont pour signe clinique majeur le jaunissement des muqueuses, de
la peau, et des yeux, et sont généralement la résultante
d'une affectionhépatique, ce qui rend cette hypothèse d'autant
plus plausible.La rigidité des intestins pourraient être
uneréaction en réponse à une irritation de ces derniers
causée par l'extrait à dose élevée.En effet, il a
été rapporté que M. whitei et Z.
officinale pouvaient être des irritants digestifs (Lamidi et
Bourobou Bourobou, 2010 ; Desai et al., 1990).
Excepté l'animal survivant signalé plus haut
(femelle à la dose 400 mg/kg), aucune modification susceptible
d'être reliée au traitement n'a été observée
chez les animaux survivant sur toute la période d'observation. Ainsi,
sur 28 animaux traités (l'animal euthanasié et l'animal
enrhumé ont été exclu car leur décès n'a pas
été strictement relié au traitement), 24 survivants ont
été noté, soit 85,71% des
animaux : 23 ont survécu et ont assez bien supporté le
traitement soit 82,14% des animaux, 1 animal survivant
manifestait des signes de toxicité liés au traitement, soit
3,57% des animaux. 4 décès liés au
traitement ont été observés, soit 14,29%
des animaux : 3 animaux à la dose 400 mg/kg (1 mâle + 2
femelles) soit 10,71% des animaux ; 1 animal
à la dose 200 mg/kg (mâle) soit 3,57% des
animaux. El-Thaher et al. (2001) ont eu un résultat similaire
lors de l'étude de la toxicité subchronique d'un aphrodisiaque,
Ferula harmonis, chez le rat. Ils ont recensé 6
décès sur 30 animaux traités à l'aphrodisiaque,
dont 1/6 décès n'était pas lié au traitement.
Le système hématopoïétique est parmi
les cibles les plus sensibles des toxiques, ce qui fait des affections de ce
système un bon indice de toxicité d'une substance, comme l'est la
diminution du poids corporel (Adeneye et al., 2006). L'extrait n'a
entrainé aucune modification significative des paramètres
hématologiques évalués chez les mâles, mais a
entrainé une baisse significative de 14% de la concentration moyenne en
hémoglobine corpusculaire chez les femelles à la dose 400 mg/kg
comparativement aux témoins. Bien qu'étant non significative, une
baisse de 46% du taux d'hématie par rapport au témoin (p = 7,30%)
a aussi été observée chez les femelles à la dose
400 mg/kg. Ces observations suggèrent un effet anémiant de
l'extrait à dose élevée, du moins chez les femelles. Ces
résultats peuvent être soutenus par les travaux de Nebojsa et
al., (2010) sur la toxicité de l'extrait à
l'éthanol des graines de Aframomum melegueta chez le rat, qui
ontrévéléune réduction(quoique
dose-indépendante) des paramètres hématologiques de masse
(hématocrite, hémoglobine, hématies) liée au
traitement.El-Thaher et al. (2001) ont aussi obtenu des
résultats similaires sur l'action del'aphrodisiaque Ferula
harmonissur quelques paramètres hématologiques chez le rat.
L'anémie pourraitrésulter des affections dues à la
substance d'essai observées au niveau du foie. En effet des
hépatopathies avancées peuvent être à l'origine
d'anémie (Teeter et Franciscus, 2004).L'anémie pourrait aussi
résulter d'une hémolyse ou de l'inhibition de la production des
hématies au niveau de la moelle osseuse. Dans ce cas,l'extrait
contiendrait des composésquià dose élevée, seuls
où en interaction, ont une action délétère sur le
système hématopoïétique.
L'extrait n'a entrainé aucune modification
significative des paramètres biochimiques évalués chez les
mâles. Chez les femelles, une baisse significative du taux de
cholestérol total aux doses 200 et 400 mg/kg et une augmentation du taux
d'ASAT aux doses 100, 200, et 400 mg/kg a été observée.
L'activité hypocholesterolémiante manifeste de l'extrait à
dose élevée est semblable à celle observée par
El-Thaher et al. (2001) dans leur étude de la toxicité
subchronique de Ferula harmonis chez le rat. Selon eux,
l'activité oestrogénique de Ferula harmonis (Cotran et
al., 1999), en inhibant la synthèse de cholestérol,
pourrait être à l'origine de l'hypocholestérolémie.
Cette hypothèse pourrait bien s'employer dans le cas de l'extrait aqueux
du mélange de A. melegueta, M. whitei, P.
guineense, et Z. officinale. En effet, P. guineense et
A. melegueta sont utilisés en médecine traditionnelle
pour le traitement des infertilités féminines (Noumi et
al., 1998 ; Tane et al., 2005), ce qui laisse
sous-entendre un potentiel effet oestrogénique de l'extrait, bien
qu'aucune étude scientifique n'ait été retrouvée
dans la littérature pour étayer ce propos.
L'hypocholestérolémie peut aussi s'expliquer par
l'activité hypolipémiante de Z. officinale (Kadnur et
Goyal, 2005). L'hypocholestérolémie pourrait aussi être la
conséquence de l'hépatotoxicité de l'extrait. En effet, le
foie est le siège essentiel de la synthèse du cholestérol
sanguin. Toute atteinte de la fonction hépatique pourrait donc inhiber
cette synthèse et par la suite réduire les taux de
cholestérol sanguin. L'augmentation du taux d'ASAT sérique peut
traduire une atteinte cardiaque, des hépatopathies, des dystrophies
musculaires, et des dommages aux organes internes. Les résultats des
coupes histologiques suggèrent l'implication des affections
hépatiques et pulmonaires dans cette augmentation. En effet, le foie et
les poumons des femelles traités à toutes les doses manifestaient
des inflammations liées au traitement. Ce résultat est
renforcé par la valeur du poids relatif des poumons chez les femelles
à la dose 400 mg/kg qui était significativement réduite de
12,3% par rapport au témoin.
Sur le plan histopathologique, comme il a été
signalé plus haut, les foies chez les femelles à toutes les doses
pouvaient être le siège d'inflammations, associées à
des congestions vasculaires ou des dilatations des capillaires sinusoïdes,
liées au traitement. Les congestions et dilatations vasculaires
semblaient cependant bénignes. De très légères
inflammations ont été observées chez les mâles, mais
elles ne permettaient pas de conclure qu'elles étaient liée au
traitement vu leur présence dans le groupe témoin. Une congestion
vasculaire bénigne a été observéeet semblait
liée au traitement. Il semble alors possible de conclure à
unehépatotoxicité de l'extrait, du moins chez les femelles. Au
niveau des reins, une clarification tubulaire bénignea été
observée chez les femelles (200 mg/kg), de même que chez les
mâles (200 mg/kg) avec une légère inflammation chez ces
derniers (400 mg/kg), toutes liées au traitement. Ces résultats
suggèrent une faible néphrotoxicité de l'extrait. Au
niveau des poumons, des inflammations liées au traitement ont
été observées chez les femelles (toutes les doses). Chez
les mâles, les inflammations observées ne permettaient pas de
conclure à un lien avec le traitement à cause de leur
présence dans le groupe témoin. Ces résultats
suggèrent alors une forte activité toxique de l'extrait sur les
poumons, du moins chez les femelles. Cette conclusion peut être soutenue
par l'observation faite lors de l'autopsie d'une femelle survivante chez
laquelle les poumons semblaient avoir atteint un état inflammatoire
avancé avec destruction de la structure tissulaire. Au niveau des
ovaires, aucune affection liée à l'extrait n'a été
mis en évidence. Au niveau des testicules, la présence de
nombreuses cellules rondes en allant vers la lumière des tubes
séminifèresa été observée dansles groupes
traités et témoin, empêchant ainsi de conclure à une
liaison avec le traitement. Ces résultats suggèrent une faible
gonadotoxicité de l'extrait, du moins chez les femelles.

Il était question dans ce travail d'identifier les
dangers potentiels pour la santé humaine que représente le
traitement à l'extrait aqueux du mélange de Aframomum
melegueta, Mondia whitei, Piper guineense, et Zingiber
officinale, utilisé en médecine traditionnelle pour traiter
les infertilités masculines et l'impuissance sexuelle. Le test de
toxicité orale aiguë chez le rat à permis d'obtenir une
DL50 > 2,5 g/kg, caractéristique des substances à
très faible toxicité. Aucun signe d'intoxication majeur
lié au traitement n'a été observé sur toute la
durée d'observation. Le test de toxicité orale subchronique (33
jours) aux doses 100, 200, et 400 mg/kg à entrainé le
décès lié au traitement d'environ 14,29% des animaux
traités, décès dont 75% appartenaient à la dose 400
mg/kg. L'extrait semblait présenter des
propriétésneurotoxique, anémiant,
hypocholestérolémiant, hépatotoxique, et de
toxicité pulmonaire, essentiellement chez les femelles.
Ces résultats suggèrent que la consommation de
l'extrait aqueux du mélange de Aframomum melegueta, Mondia whitei,
Piper guineense, et Zingiber officinaleà dose
thérapeutiqueprésente de faibles risques pour la santé
masculine, soutenantainsi l'utilisation de ce produit dans le traitement des
infertilités masculines et de l'impuissance sexuelle. Cependant, une
éventuelle prise quotidienne à des doses plus
élevéesexposeraitle mâleà de sérieuses
affections, notamment hépatique et nerveuse, ce qui rend
impératif le respect des doses prescrites lors du traitement
traditionnel.
Au terme de cette étude, il semble approprié
pour l'avenir :
1) d'apprécier la persistance ou la
réversibilité des effets toxiques après arrêt du
traitement ;
2) d'évaluer la toxicité sur une période
plus longue afin de mettre en évidence les effets nocifs après
untraitement plus long ;
3) d'étendre l'évaluation des risques potentiels
pour la santé à d'autres espèces de Mammifères,
pour mettre en évidence les éventuels risques potentiels pour la
santé qui ne se manifesterait pas chez le Rat.
REFERENCES
- Abila, B. ; Richens, A. ; Davies, J. A.
(1993). Anticonvulsant effects of extracts of the West African black pepper,
Piper guineense. J. Ethnopharmacol., 39 : 113-117.
- Acquaye, D. ; Quansah C. ; Asare E. (1999).
Feasibility study on Lippia, Cryptolepis, Desmodium, Cassia alata and
Mondia. Compiled by ASNPP, Ghana. 3 p.
- Adeneye, A. A.; Ajagbonna, O. P.;
Adeleke,T. I.; Bello, S. O.(2006). Preliminary toxicity and phytochemical
studies of the stem bark aqueous extract of Musanga cecropioides in
rats.J. Ethnopharmacol., 105: 374-379.
- Adjanohoun, J. E. ; Aboubakar, N. ; Dramane,
K. ; Ebot, M. E. ; Ekpere, J. A. ; Enow-Orock, E. G. ;
Focho, D. ; Gbile, Z. O. ; Kamanyi, A. ; Kamsu Kom, J. ;
Keita, A. ; Mbenkum, T. ; Mbi, C. N. ; Mbiele, A. L. ;
Mbome, L. L. ; Mubiru, N. K. ; Nancy, W. L. ; Nkongmeneck,
B. ; Satabie, B. ; Sofowora, A. ; Tamze, V. ; Wirmum, C. K.
(1996). Traditionnal Medicine and Pharmacopeia. Contribution to
Ethnobotanical and Floristic Studies in Cameroon. Scientific, Technical
and Research Comission of the Organisation of African Unity, Lagos. 641 p.
- Ali, B. H. ; Blunden, G. ; Tanira, M. O. ; Nemmar,
A. (2008). Some phytochemical, pharmacological and toxicological properties of
ginger (Zingiber officinale Roscoe): A review of recent research.
Food and Chem. Tox., 46 : 409-420.
- Anonymous. (2003). Zingiberis rhizoma, ESCOP
Monographs. Stuttgart, New York: Thieme; Press pp.547-553.
- Chrubasik, S. ; Pittler, M. H. ; Roufogalis, B. D.
(2005). Zingiberis rhizoma: a comprehensive review on the ginger effect and
efficacy profiles. Phytomed., 12 : 684-701.
- Clark, D. G.; Fielder, R.; Joseph, C.; Gardner, J.; Smith,
M. (1991). The future for acute oral toxicity testing. In: Animals and
Alternatives in Toxicology (Balls M, Bridges J, Southee J, eds). London:
Macmillan Academic and Professional Ltd :pp.1-21.
- Cotran, R. S.; Kumar, V.; Collins, T. (1999). Robbins
Pathologic Basis of Disease, 6th edn. WB Saunders Co: Philadelphia, p 1016.
- Dedov, V. N. ; Tran, V. H. ; Duke, C. C. ;
Connor, M. ; Christie, M. J. ; Mandadi, S. ; Roufogalis, B.D.
(2002). Gingerols : a novel class of vanilloid receptor (VR1) agonists.
Brit. J. Pharmacol., 137 : 793-798.
- Desai, H. G. ; Kalro, R. H. ; Choksi, A. P.
(1990). Effect of ginger & garlic on DNA content of gastric aspirate.
Indian J. Med. Research, 92 : 139-141.
- Dokosi, O.B. (1998). Herbs of Ghana. Ghana Universities
Press, Accra. 3 p.
- Dokou-Gaïn, L. (2010). Propriétés
androgéniques et aphrodisiaques du mélange des plantes
Aframomum melegueta, Mondia whitei, Piper guineense et Zingiber
officinale. Mémoire de Master. Université de Yaoundé
I, Yaoundé (Cameroun). 60 p.
- Ekanem, A. P. ; Udoh, F. V. ; Oku, E. E. (2010).
Effects of ethanol extract of Piper guineense seeds (Schum. and Thonn)
on the conception of mice (Mus Musculus). Afr. J. Pharm.
Pharmacol., 4(6) : 362-367.
- Ekundayo, O. ; Laasko, I. ; Adegbola, R. ;
Oguntimein, B. M. ; Sofowora, A. ; Raimo, H. (1988). Essential oil
constituents of ashanti pepper (Piper guineense) fruits (Berries).
J. Agr. and Food Chem., 36 : 880-882.
- El-Thaher, T. S.; Matalka, K. Z.; Taha, H. A.; Badwan, A. A.
(2001). Ferula harmonis `zallouh' and enhancing erectile function in
rats: efficacy and toxicity study. International J. of Impotence
Research, 13 : 247-251
- Escoubas, P. ; Lajide, L. ; Mizutani, J. (1995).
Termite antifeedant activity in Aframomum melegueta.
Phytochem., 40 : 1097-1099.
- Fabre, I. (2008). Méthodes Substitutives à
L'expérimentation Animale : Aspects Réglementaires,
État de L'art et Perspectives. Bull. Acad. Vét. France,
Tome 161, N°5 : 403-407
- Fielder, R. J. (1995). The fixed dose procedure as an
alternative to the classical LD50 test: acceptance by the EEC and OECD. In
Alternative Methods in Toxicology and the Life Sciences. Vol 11
(edited by A. M. Goldberg and L. F. M. van Zutphen)Mary Ann Liebert, New
York.pp 269-274.
- Ghana Herbal Pharmacopoeia. (1992). The Advent
Press, PO Box 0102, Osu, Accra. 3 p.
- Ghayur, M. N. ; Gilani, A. H. (2005). Ginger lowers
blood pressure through blockade of voltage-dependent calcium channels. J.
Cardiovasc. Pharmacol., 45 : 74-80.
- Gornall, A. G.; Bardawill, C. J.; David, M.
M.(1949). Détermination of serum proteins by means of
buiret reactions. J. Biol. Chem., Baltimore, v. 177: 751-766.
- Goyal, R. K. ; Kadnur, S. V. (2006). Beneficial effects
of Zingiber officinale on goldthioglucose induced obesity.
Fitoterapia, 77 : 160-163.
- Gruenwald, J. (2004). PDR for Herbal Medicine 3rd
ed.Montvale, NJ: Thomson PDR.13pp
- Holmberg B. ; Högberg J. ; Johanson G.
(2000). La Toxicologie. Définitions et Concepts. In
Encyclopédie de Sécurité et de Santé au
Travail.Vol 1 (edited by J. M. Stellman), pp 33.3-33.8. Organisation
Internationale du Travail, Genève.
- Iwu, M. M. (1993). Handbook of African medicinal plants.
CRC Press, 257 p.
- Jiang, H. ; Xie, Z.; Koo, H. J.; McLaughlin, S. P.;
Timmermann, B. N.; Gang, D. R. (2006). Metabolic profiling and phylogenetic
analysis of medicinal Zingiber species: tools for authentication of
ginger (Zingiber officinale Rosc.). Phytochem., 67:
232-244.
- Juliani, H. R. ; Welch, C. ;
Asante-Dartey, J. ; Wang, M. ; Simon, J. E. (2007). Chemistry,
quality and functional properties of grains of paradise (Aframomum
melegueta), a rediscovered spice. In Dietary supplements (edited
by C. T. ; Y. Shao ; J. E. Simon). Am. Chem. Soc. Symp. Ser. American
Chemical Society, Washington, D.C. USA. 4 p.
- Kadnur, S. V. ; Goyal, R. K. (2005). Beneficial effects
of Zingiber officinale Roscoe on fructose induced hyperlipidemia and
hyperinsulinemia in rats. Indian J. of Experimental Biol., 43 :
1161-1164.
- Kamtchouing, P. ; Mbongue Fandio, G. Y. ; Dimo,
T. ; Jatsa, H. B. (2002a). Evaluation of androgenic activity of
Zingiber officinale and Pentadiplandra brazzeana in male
rats. Asian J. of Andrology, 4 : 299-301.
- Kamtchouing, P. ; Mbongue, G. Y. F. ; Dimo,
T. ; Watcho, P. ; Jatsa, H. B. ; Sokeng, S. D. (2002b). Effects
of Aframomum melegueta and Piper guineense on sexual
behaviour of male rats. Behaviour Pharmacol., 13 : 243.
- Kubo, I. ; Kinst-Hori, I. (1999).
2-hydroxy-4-methoxybenzaldehyde: A potent tyrosinase inhibitor from African
medicinal plants. Planta Med., 65 : 19-22.
- Lachman-White, D. A. ; Adams, C. D. ; Trotz Ulric
O. D. (1992). A guide to the medicinal plants of coastal Guyanna.
Commonwealth Science Council, London. 311-318.
- Lale, N. E. S. (1992). A laboratory study of the comparative
toxicity of products from three species to the maize weevil. Post Harv Biol
Technol, 2 : 61-64.
- Lamidi, M. ; Bourobou Bourobou, H. (2010). Mondia
whitei (Hook.f.) Skeels.Fiche de Protabase (edited by Schmelzer,
G.H. & Gurib-Fakim, A.). PROTA (Plant Resources of Tropical Africa /
Ressources végétales de l'Afrique tropicale), Wageningen, Pays
Bas. 1 p.
- Lapointe, G. (2004). Notions de Toxicologie.
Commission de la Santé et de la Sécurité du Travail du
Québec, Québec. 67 p.
- Lawal, B. A. S. ; Aderibigbe, A. O. ; Essiet, G.
A. ; Essien, A. D. (2007). Hypotensive and Antihypertensive Effects of
Aframomum melegueta Seeds in Humans. International J. of pharmacol.,
3(4) : 311-318.
- Lindgren, P. ; Thelestam, M. ; Lindquist, N.
G. (1983). First CFN symposium on LD50 and possible
alternatives. Acta Pharmacol Toxicol,52 (Suppl II).
- Lipnick, R. L.; Cotruvo, J. A.; Hill, R. N.; Bruce, R. D.;
Stitzel, K. A.; Walker, A. P.; Chu, I.; Goddard, M.; Segal, L.; Springer, J.
A.; Myers, R. C. (1995). Comparison of the Up-and Down, Conventional LD50, and
Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol, 33:
223-231.
- Lu, F. C. (1992). Toxicologie : Données
générales, procédures d'évaluation, organes cibles,
évaluation du risque. MASSON, Paris.360 p.
- Mascolo, N. ; Jain, R. ; Jain, S. C. ;
Capasso, F. (1989). Ethnopharmacologic investigation of ginger (Zingiber
officinale). J. Ethnopharmacol, 27 : 129-140.
- Mbongue, F. G. Y. ; Kamtchouing, P. ; Essame, O.
J. L. ; Yewah, P. M. ; Dimo, T. ; Lontsi, D. (2005). Effect of
the aqueous extract of dry fruits of Piperguineense on the
reproductive function of adult male rats, Indian. J. Pharmacol., 7:
30-32.
- Morakinyo, A. O. ; Adeniyi, O. S. ; Arikawe, A. P.
(2008). Effects of Zingiber Officinale on Reproductive Functions in
the Male Rat. Afr. J. of Biomed. Research, 11 : 329-334.
- Ndukwu, B.C. ; Ben-Nwadibia, N.B. (2005).
Ethnomedicinal Aspects of Plants Used as Spices and Condiments in the Niger
Delta Area of Nigeria. Ethnobotanical Leaflets, Vol. 2005: Iss. 1,
Article 10. 9 p.
- Nebojsa, I. ; Schmidt, B. M. ; Poulev, A. ;
Raskin, I. (2010). Toxicological evaluation of Grains of Paradise
(Aframomum melegueta) [Roscoe] K. Schum. J. Ethnopharmacol.,
127 : 352-356.
- Noumi, E. ; Amvam, Z. P. H. ; Lontsi, D. (1998).
Aphrodisiac plants used in Cameroon. Fitoterapia (LXIX) 69:125-134.
- OCDE. (1979). Résumé des considérations
du rapport des groupes d'experts de l'OCDE sur la toxicologie à court et
à long terme. In Lignes directrice de l'OCDE pour les essais de
produits chimiques Vol 1, number 4, pp 1-15. OCDE, Paris.
- OCDE. (2001a). Toxicité orale aiguë -
Méthode de la dose prédéterminée. In Lignes
directrice de l'OCDE pour les essais de produits chimiques Vol 1, number
4, pp 1-15. OCDE, Paris.
- OCDE. (2001b). Toxicité orale aiguë -
Méthode par classe de toxicité aiguë. In Lignes
directrice de l'OCDE pour les essais de produits chimiques Vol 1, number
4, pp 1-14. OCDE, Paris.
- OCDE. (2008a). Étude de toxicité orale
à dose répétée pendant 28 jours sur les rongeurs.
In Lignes directrice de l'OCDE pour les essais de produits chimiques
Vol 1, number 4, pp 1-14. OCDE, Paris.
- OCDE. (2008b). Toxicité orale aiguë -
Méthode de l'ajustement des doses. In Lignes directrice de l'OCDE
pour les essais de produits chimiques Vol 1, number 4, pp 1-29. OCDE,
Paris.
- OCDE. (2009). Études de toxicité chronique. In
Lignes directrice de l'OCDE pour les essais de produits chimiques, Vol
1, number 4, pp 1-16. OCDE, Paris.
- OECD. (2001). Harmonized Integrated Hazard Classification
System for Human Health and Environmental Effects of Chemical Substances,Part
2, pp. 20-24. OECD, Paris.
- Okoli, C. O. ; Akah, P. A.; Nwafor, S. V.; Ihemelandu,
U. U.; Amadife, C. (2007). Anti-inflammatory activity of seed extracts of
Aframomum melegueta. J. herbs, spices and medicinal plants,
13 (1): 11-21.
- Oliver J. A. (1986). Opportunities for using fewer animals
in acute toxicity studies. In Chemicals Testing and Animal Welfare
(The National Chemicals Inspectorate), pp 119-142. Solna, Sweden.
- OMS. (2000). principes méthodologiques
généraux pour la recherche et l'évaluation relative
à la médecine traditionnelle. Organisation Mondiale de la
Santé, Genève.79 p.
- OMS. (2002). Stratégies de l'OMS pour la
médecine traditionnelle pour 2002-2005.Organisation Mondiale de la
Santé, Genève.65p.
- Onyenekwe, P. C. ; Ogbadu, G. H. ; Hashimoto, S.
(1997). The effect of gamma radiation on the microflora and essential oil of
Ashanti Pepper (Piper guineense) berries. Posthavest Biol.
Technol., 10 : 161-167.
- Patnam, R. ; Kadali, S. S.; Koumaglo, K. H. ;
Roy, R. (2005). A chlorinated coumarinolignan from the African medicinal plant,
Mondia whitei. Phytochem., 66 : 683-686.
- Platel, K. ; Srinivasan, K. (2000). Influence of
digestive spices and their active principles on pancreatic digestive enzymes in
albino rats. Nahrung., 44 : 42-46.
- Raji, Y. ; Udoh, U. S. ; Ojo, O. O. (2003).
Gastric ulcerogenic activities of Piper guineense extract in Rats.
Nigerian J. of physiol. sciences, 18 (1-2) : 27-30.
- Rehn, S. ; Espig, G. (1991). The cultivated plants of
the tropics and subtropics. Cultivation, Economic value, Utilization,
Verlag, Josef, Margraf Scientific books CTA.522 p.
- Rhodes, C. ; Thomas, M. ; Athis J. (1993).
Principles of testing for acute toxic effects. In General and Applied
Toxicology. Vol 1 (edited by B. Ballantyne, T. Marrs, P. Turner), Stockton
Press, New York.pp 49-87.
- Saba, A. B. ; Tomori, O. A. (2007). The Contractile
Effect of Ethanolic Extract of West African Black Pepper (Piper
guineense) on Isolated Guinea Pig Ileum. Pakistan J. of
Nutrition, 6 (4): 366-369.
- Schlede, E. ; Genschow, E. ; Spielmann, H. ;
Stropp, G. ; Kayser, D. (2005). Oral acute toxic class method: A
successful alternative to the oral LD50 test. Reg. Tox. and Pharm.,
42 : 15-23.
- Seibert, H. ; Balls, M. ; Fentem, J. H. ;
Bianchi, V. ; Clothier, R. H. ; Dierickx, P. J. ; Ekwall,
B. ; Garle, M. J. ; Gomez-Lechon, M. J. ; Gribaldo, L. et al.
(1996). Acute toxicity testing in vitro and the dassification and labelling of
chemicals. ATLA, 24 : 499-510.
- Silbergeld, E. K. (2000). La Toxicologie :
Introduction. In Encyclopédie de Sécurité et de
Santé au Travail.Vol 1 (edited by J. M. Stellman). Organisation
Internationale du Travail, Genève.pp 33.2-33.3.
- Simon, J. E. ; Koroch, A. R. ; Acquaye, D. ;
Jefthas, E. ; Juliani, R. ; Govindasamy, R. (2007). Medicinal crops
of Africa. InIssues in new crops and new uses (edited by J. Janick and
A. Whipkey).ASHS Press, Alexandria, VA.pp 322-331.
- Sofowora, A. (1982). Medicinal plant and traditional
medicine in Africa. John Wiley and sons, New York. p. 44.
- Tane, P. ; Tatsimo, S. D. ; Ayimele, G. A. ;
Connolly, J. D. (2005). Bioactive metabolites from Aframomum species.
11th NAPRECA Symposium Book of Proceedings, Antananarivo,
Madagascar : 214-223.
- Teeter, T ; Franciscus, A. (2004). Comment
interpréter un rapport de laboratoire : notions
élémentaires. Fiche de renseignement.HCSP(Hepatitis C
support project), San Francisco.3p
- Thomson, M. ; Al-Qattan, K. K. ; Al-Sawan, S.
M. ; Alnaqeeb, M. A. ; Khan, I. ; Ali, M. (2002). The use of
ginger (Zingiber officinale Rosc.) as a potential anti-inflammatory
and antithrombotic agent. Prostaglandins Leukot. Essent. Fatty Acid,
67 : 475-478.
- Trevan, J. (1927). The error of determination of toxicity.
Proc. Roy. Soc., 101B : 483-514.
- Tron, I. ; Piquet, O. ; Baert, A. ; Mouton,
C. (2002). Toxon Manuel de Toxicologie. Guide technique. ADEME,
Angers. 128p
- Udoh, F. V. ; Theodore, Y. L. ; Braide, V. B.
(1999). Effects of extract of seed and leaf of Piper guineense on
skeletal muscle activity in rat and frog. Phytother. Res., p.110.
- Umukoro, S. ; Ashorobi, R. B. (2003). Pharmalogical
evaluation of the antidiarrheal activity of Aframomum melegueta seed.
West Afr. J. Pharmacol. Drug Res, 19 : 51-54.
- Umukoro, S. ; Ashorobi, R. B. (2005). Further
evaluation of the anti-inflammatory activity of Aframomum melegueta
seed extract and its possible mechanism of action. Nigerian J. Health
Biomed. Sci., 4 : 35-39.
- Walum, E. (1998). Acute Oral Toxicity. Env. Health
Persp., 106 : 497-503.
- Watcho, P. ; Donfack, M. M. ; Zelefack, F. ;
Nguelefack, T. B. ; Wansi, S. ; Ngoula, F. ; Kamtchouing,
P. ; Tsamo, E ; Kamanyi, A. (2005). Effects of the hexane extract of
Mondia whitei on the reproductive organs of male rat.Afr. J. Trad.
CAM, 2 (3):302-311.
- Watcho, P. ; Kamtchouing, P. ; Sokeng, S.
D. ; Moundipa, P. F. ; Tantchou, J. ; Essame, J. L. ;
Koueta, N. (2004). Androgenic effect of Mondia whitei roots in male rats.
Asian J. Androl., 6(3): 269-272.
- Wilkinson, J. M. (2000). Effect of ginger tea on the fetal
development of Sprague-Dawley rats. Reprod. Toxicol., 14 :
507-512.
- Yamahara, J. ; Huang, Q. R. ; Li, Y. H. ; Xu,
L. ; Fujimura, H. (1990). Gastrointestinal motility enhancing effect of
ginger and its active constituents. Chem. Pharm. Bull. (Tokyo),
38 : 430-431.
|
|



