|

UNIVERSITE D'ABOMEY-CALAVI
ECOLE POLYTECHNIQUE D'ABOMEY-CALAVI
--------------
DEPARTEMENT DE GENIE DE L'ENVIRONNEMENT
--------------------
MEMOIRE DE FIN DE FORMATION
POUR L'OBTENTION DU DIPLOME
D'INGENIEUR DE CONCEPTION
Thème :
Présenté et soutenu par .
·
Aimé AGBIZOUNON
Sous la direction de .
·
Dr. Daniel C. CHOUGOUROU Dr. Raphael K.
N'GUESSAN
Entomologiste agricole Entomologiste médicale
Maitre assistant (CAMES) Responsable du Laboratoire LSHTM/CREC
Devant le Jury composé de :
Président : Professeur Joachim D.
GBENOU Membres : - Docteur Raphaël K.
N'GUESSAN
- Docteur Daniel C. CHOUGOUROU
- Monsieur Abou TOGOLA
1ère Promotion
Année académique 2009-2010
1
Dédicaces
A
- la mémoire d'Emmanuel C. AGBIZOUNON mon
respecté feu père,
- Rosaline TOUYABA
ma tendre mère,
pour tous les sacrifices consentis pour mon éducation
et ma formation.
2
Remerciements
Le présent travail n'aurait pas connu son
aboutissement sans l'aide de nombreuses personnes tant physiques que morales
à qui j'exprime ici ma profonde reconnaissance. Je veux nommer :
- Le professeur Mohamed SOUMANOU responsable de l'Unité
de Recherche en Génie Enzymatique et Alimentaire (URGEA) du Laboratoire
d'Etude et de Recherche en Chimie Appliquée pour ses sages conseils et
ses nombreuses orientations ;
- Le docteur Julien SEGBO Chef de Département de
Génie de la Biologie et Humaine (GBH) pour ses conseils et son aide ;
- Monsieur Abou TOGOLA, entomologiste Chercheur à
Africa Rice pour son ouverture et ses sages conseils ;
- Tout le personnel du laboratoire London School of Hygiene
and Tropical Medicine (LSHTM) notamment Pélagie BOKO, Hermione ADJE,
Hermione KOUDAKOSSI BOKO, Abibatou ODJO, Estelle VIGNINOU et Armand KLOTOE pour
l'accueil et le soutien multiforme qu'elles m'ont accordés. L'ambiance
m'est véritablement inoubliable. Soyez-en remercier ;
- Tout le personnel du CREC en particulier, messieurs Gil
PADONOU, Anges YADOULETON, Olivier OUSSOU, Razaki OSSE, Rock AÏKPON,
Roseric AZONDEKON, les responsables de l'insectarium : Saka ALABI, et ICHIAKA
pour leur assistance et conseils ;
- Les étudiants de master en Entomologie
Appliquée, Renaud, Virgile, Arthur, Ramziath, Roseline, et
Kéfilath pour leur soutien moral ;
- Messieurs Fidèle ASSOGBA et Camille HOUNDJO, pour
leur franche collaboration et leur aide pour les travaux d'extraction des
différentes huiles végétales ;
- Madame AGBIZOUNON SILY Geneviève, pour tous les
sacrifices consentis pour mon éducation ;
- Mes tantes Pascaline, Victoire et Marguerite AGBIZOUNON
d'une part ; Lydia et Françoise TOUYABA d'autre part et leurs
époux ; mes oncles Jean-Marie AGBIZOUNON, Paul AVOUTOU,
Barthélemy TOUYABA et leurs épouses, pour leur amour, leur
soutien matériel, financier et moral ;
3
- Mes frères et soeur Martial, Euloge, Fructueux, Olga,
Jorès et Serge AGBIZOUNON pour le soutien inexprimable qu'ils m'ont
toujours apporté. Retrouver ici le fruit de l'amour fraternel qui nous a
toujours unis ;
- La famille GODONOU pour le soutien ;
- Les pères Serge Yvon HOUNSOU et Bruno HOUNKONNOU
religieux caméliens, le frère Jean-Pierre HOUNDAGBA et
l'abbé Christ HOUNMENOU pour leurs prières ;
- La famille TROUKOU pour leur générosité
et leur amour. Ce travail est l'expression de ma profonde gratitude ;
- Messieurs Parfait DOVONOU, Gontran MEGNIGBETO, Symphorien
AHOMONDJI et leurs épouses, Déo Gratias HOUNGNI, Maxime FAMONMY,
Eric KOSSOU, Wilfrid BONOU et Boris CACHON pour les multiples conseils et
soutien intellectuel ;
- Mes amis Suzanne HONVO, Adeline HOUNNOU, Anne-Marie
AHANDESSI, Jean et Jeannine ABILE et tous les membres de la communauté
Emmaüs de l'EPAC pour vos soutiens moral, spirituel et intellectuel ;
- Mes camarades de la 1ére promotion
d'obtention du diplôme d'ingénieur de conception en Génie
de l'Environnement pour ses cinq (5) années bravées ensembles qui
ont connu certainement des joies et des peines ;
- Tous les enseignants du Département de Génie
de l'Environnement de l'EPAC pour leur contribution à mon éveil
intellectuel ;
- la mémoire de Francine SOBABE, plus qu'une camarade,
une soeur. Paix et repos éternel.
Hommages
Je rends un hommage mérité au :
+ Dr. Daniel CHOUGOUROU, Chef du
département de Génie de l'Environnement (D.GEn) de l'EPAC,
enseignant-chercheur à l'EPAC/UAC notre superviseur pour ses nombreux
conseils, son engagement et sa détermination à notre égard
pour la réalisation de ce modeste document ;
+ Dr. Raphaël N'GUESSAN, responsable du
laboratoire de recherche de la London School of Hygiene and Tropical Medicine
(LSHTM) sise au CREC pour nous avoir accepté dans son laboratoire et mis
à notre disposition ses compétences scientifiques pour la
réalisation de cette étude ;
+ Dr. Bienvenu TOLLO, chercheur au CREC pour
ses sages conseils et ses diverses orientations ;
+ Prof. Martin AKOGBETO, Enseignant Chercheur
à la FAST, Directeur du CREC, pour avoir accepté notre stage dans
son centre pour la réalisation de cette étude ;
+ Prof. Mansourou MOUDACHIROU Enseignant
Chercheur à la FAST, directeur du Laboratoire de pharmacognosie et
d'extraction des huiles essentielles de l'ISBA, pour nous avoir autorisé
à faire les extractions d'huiles végétales dans son
laboratoire ;
+ Prof. Joachim GBENOU de la FAST,
co-directeur du Laboratoire de pharmacognosie et d'extraction des huiles
essentielles de l'ISBA, pour ses sages conseils et ses brillantes orientations
pour l'extraction des huiles végétales ;
4
+ Jury pour avoir accepté juger de la qualité de
ce modeste document scientifique.
5
Liste des tableaux
Tableau 1 : Composition de l'huile
végétale Azadirachta indica
Tableau 2 : Présentation des
espèces végétales d'étude Tableau 3 :
Rendement d'extraction des huiles végétales
Tableau 4 : Doses létales et ratio d'Azadirachta
indica Tableau 5 : Doses létales et ratio du
Ricinus communis Tableau 6 : Doses létales et
ratio de Thevetia peruviana Tableau 7 : Doses
létales et ratio du Jatropha curcas
Liste des figures
Figure 1 : Différences entre
Anophelinae et Culicinae Figure 2 :
Principales parties d'un moustique adulte Figure 3 :
Schéma du système digestif d'un moustique Figure
4 : Cycle biologique d'un moustique
Figure 5 : Différences entre femelle et
mâle du moustique à partir de la tête.
Figure 6 : Taux de survie de Anopheles
gambiae kisumu après exposition par ingestion à 2% des
huiles végétales
Figure 7 : Taux de survie de Culex
quinquefasciatus après exposition par ingestion à 2% des
huiles végétales
Figure 8 : Taux de mortalité de
Anopheles gambiae après exposition aux huiles
végétales par contact tarsique
Liste des photos
Photo 1 : Feuilles et fruits d'A.
indica
Photo 2 : Graines mûres du J.
curcas
Photo 3 : Graines du Ricinus communis
L.
Photo 4 : Fruit en coupe longitudinale et graine
séchée du T. peruviana (Pers.) K. Schum.
Photo 5 : Insectariums des larves de moustiques
et leurs adultes
Photo 6 : Broyeur
Photo 7 : Amandes broyées
conditionnées en bouteilles
Photo 8 : Dispositif d'extraction
Photo 9 : Dispositif d'évaporation
Photo 10 : Dispositif de
récupération des huiles Photo 11 : Huiles
végétales obtenues
Photo 12 : Vue des tests en cage
Photo 13 : Gobelets contenant les moustiques
Liste des sigles et abréviations
An. : Anopheles
CAME : Centre d'Achat des Médicaments
Essentiels CDMS : Centre de Documentation du Ministère
de la Santé
6
CIRAD : Centre de coopération
Internationale en Recherche Agronomique pour le
Développement
CNRA : Centre National de Recherches
Agricoles
CREC : Centre de Recherche Entomologique de
Cotonou
CTA : Combinaisons Thérapeutiques
à base Artémisinine
Cx. : Culex
D.GEn : Département de Génie de
l'Environnement
DDT:
Dichloro-Diphényl-Trichloroéthane
DEPA:
Diéthylphénylacétamide
DMP: Diméthylphtalate
EHD: 2-éthyl-1,3-hexane diol
ELISA: Enzyme Linked Immuno- Sorbent
ENSA : Ecole Nationale des Sciences
Appliquées
EPAC : Ecole Polytechnique d'Abomey-
Calavi
FASS : Famille des Amis du Serviteur
Souffrant
FAST : Faculté des Sciences et
Techniques
FSS : Faculté des Sciences de la
santé
GEn : Génie de l'Environnement
HCH : Hexachlorocyclohexane
IND : Indolone
INSAE : Institut National de la Statistique
et de l'Analyse Economique
IRD : Institut de Recherche pour le
Développement
IRSP : Institut Régional de
Santé Publique
ISBA : Institut des Sciences
Biomédicales Appliquées
ISRA : Institut Sénégalais de
Recherches Agricoles
J. curcas : Jatropha curcas
Km2 : Kilomètre
carré
LSHTM : London School of Hygiene and Tropical
Medecine
MS : Ministère de la Santé
OCCGE : Organisation de Coopération et
de Coordination pour la lutte contre les Grandes
Endémies
OMS : Organisation Mondiale de la
Santé
P. : Plasmodium
PCR : Protein Chain Réaction
PNUD : Programme des Nations Unies pour le
Développement
Q.B.C: Quantitative Buffy Coat Malaria
Test
RBM : Roll Back Malaria
Th. P. : Thevetia
peruviana
UAC : Université d'Abomey-Calavi
UNICEF : Fond des Nations Unies pour
l'Enfance
VIH-SIDA : Virus Immunodéficience
Humaine- Syndrome d'immunodéficience acquise
7
Résumé
Suite aux problèmes de résistance posés
par certains insecticides de synthèse, la science est à la
recherche d'autres produits naturels à caractère insecticide pour
une meilleure éradication des maladies vectorielles en
général et du paludisme en particulier. Pour cela, certaines
plantes locales béninoises (Azadirachta indica, Jatropha curcas,
Thevetia peruviana et Ricinus communis) soupçonnées
pour leurs activités insecticides (biocides) ont été
testées sur les moustiques. Extraite en laboratoire par la
méthode soxhlet, ces huiles végétales ont
été testée pour connaitre leurs effets biocides sur
l'Anopheles gambiae (Giles) et Culex quinquefasciatus
(Say).
Trois différents tests inspirés du protocole de
l'OMS, les tests larvaires, les tests par ingestion et les tests en tube, ont
été réalisés sur Anopheles gambiae
Kisumu, Anopheles gambiae Ladji et Culex quiquefasciatus
Ladji.
Les traitements larvaires ont révélé que
les huiles végétales de Thevetia peruviana, Jatropha curcas
et Azadirachta indica sont les plus efficaces avec des DL50 de
0,4% ; 0,2% et 0,1% respectives. La DL50 du Ricinus communis,
est plus élevée (1,2%).
Par ingestion, presque toutes les huiles se sont
révélées efficaces à une dose de 2% avec 100% de
mortalité entre 6 à 9 jours d'exposition. Seule l'huile
végétale de Ricinus communis à la même dose
(2%), génère encore 25% de survivants pour An. gambiae
et 35% de survivants pour Cx. quinquefasciatus après 10
jours d'exposition.
Quant aux tests de sensibilité en cylindre, ils ont
montré un effet de toxicité faible sur Anopheles gambiae
Kisumu. Quelle que soit l'huile végétale testée les
mortalités observées sont négligeables. 54% à la
dose 250 mg/m2 pour Thevetia peruviana a été
la mortalité la plus élevée obtenue.
En conclusion, les huiles végétales de
Thevetia peruviana, Jatropha curcas et Azadirachta indica
disposent de propriété biocide et pourraient servir de
pistes pour la lutte anti vectorielle.
Mots clés : Ricinus
communis, Thevetia peruviana, Azadirachta indica, Jatropha curcas,
DL50.
8
Abstract
The resistance to synthetic insecticide is a major threat to
the control of vector-borne diseases, especially to the eradication of malaria.
Seeking alternatives to the common insecticides is becoming more urgent. Our
study has focused on the use of local plants such as Azadirachta indica,
Jatropha curcas, Thevetia peruviana and Ricinus communis in order
to control the development of mosquitoes. Therefore the efficacy of vegetable
oil extracted from those plants by the Soxhlet method was tested against
Anopheles gambiae (Giles) and Culex quinquefasciatus (Say).
Three tests selected in accordance with WHO protocols were performed on females
of Anopheles gambiae Kisumu, Anopheles gambiae Ladji and
Culex quinquefasciatus Ladji: larvae, ingestion and cylinder tests.
The vegetable oils of Thevetia peruviana, Jatropha curcas
and Azadirachta indica have shown a significant effect on larvae
at 0.4%; 0.2% and 0.1% LD50 respectively. The vegetable oil of
Ricinus communis has been less efficient with a higher LD50
(1.2%).
An ingestion dosage of 2% vegetable oil of Thevetia
peruviana, Jatropha curcas and Azadirachta indica has induced
100% mortality of all mosquitoes between 6 to 9 days exposure while 25%
(Anopheles gambiae Kisumu) and 35% (Culex quinquefasciatus
Ladji) of females were still alive after 10 days when tested against
Ricinus communis.
In the cylinder test, the vegetable oils have revealed low
toxicity on Anopheles gambiae Kisumu with insignificant mortality: the
highest mortality of 54.11% being observed at 250mg/m2 of
Thevetia peruviana.
The vegetable oils of Thevetia peruviana, Jatropha curcas
and Azadirachta indica could become an important vector control
tool because of their biocide proprieties.
Key words: Ricinus communis,
Thevetia peruviana, Azadirachta indica, Jatropha curcas, LD50.
9
INTRODUCTION
10
Introduction
Les pays en développement doivent faire face au double
enjeu de la croissance économique et de la santé des populations.
L'économie béninoise étant essentiellement agricole, elle
a besoin des hommes en bonne santé pour la promouvoir. Or, ces derniers
sont exposés à diverses maladies d'origines vectorielles, dont le
paludisme ; encore appelé malaria. Il constitue l'endémie
première tuant plus d'un million de personnes par an dans le monde (OMS,
2008). L'Organisation Mondiale de la Santé (OMS), estime que 40% de
l'humanité est exposé à la maladie, essentiellement dans
les pays les plus pauvres. L'Afrique est durement touchée par ce
fléau du fait que quatre-vingt-dix pour cent (90%) des
décès dus au paludisme surviennent principalement en Afrique au
sud du Sahara (IRD, 2009a) et plus de trois mille (3 000) enfants, surtout de
moins de cinq ans en meurent tous les jours. Trois mille (3000) enfants dans
une région déjà en proie au VIH-SIDA et à la
tuberculose (OMS., 2008).
En République du Bénin, des six (6) maladies
prioritaires (paludisme, rougeole, tétanos, poliomyélite,
coqueluche, tuberculose pulmonaire), le paludisme est de loin la
première cause des premières consultations avec 39,7% des motifs
de recours aux soins et la première raison d'hospitalisation (24,7%)
dans les structures sanitaires (PNLP, 2007a). Le paludisme est la plus
importante cause de mortalité infantile, des accouchements
prématurés et de nombreux cas d'absence sur les lieux de travail
(Seïdou, 1987). Le nombre de personnes qui ont accès à des
services de prévention et de traitement du paludisme est en constante
augmentation, ce qui laisse augurer une baisse prochaine de la morbidité
et la mortalité relatives au paludisme. La maladie du paludisme est
transmise par les piqûres de moustiques infectés par des parasites
de l'espèce Plasmodium. Il existe quatre types de plasmodium humain,
mais le Plasmodium falciparum (Welch) est de loin le parasite le plus
répandu et le plus
11
pathogénique (OMS., 2008). Comme l'indique le Rapport
mondial sur le paludisme (OMS, 2009), il reste des défis à
relever pour réduire la charge d'une maladie qui provoque encore un
million de décès chaque année. Pour ce faire, des
progrès ont été accomplis en matière de
prévention et de traitement du paludisme.
Davantage de pays introduisent les derniers médicaments
antipaludiques adoptés par l'OMS, les Combinaisons Thérapeutiques
à base d'Artémisinine (CTA) (OMS., 2008) ; bon nombre de familles
reçoivent des moustiquaires imprégnées d'Insecticides
à Longue Durée d'action et plus d'un aussi pratique la
pulvérisation intradomiciliaire dans le cadre de programmes novateurs
(OMS & UNICEF., 2005 ; PNLP, 2007b). Malgré les lourds efforts
matériels, financiers et humains consentis à travers les
campagnes de sensibilisations, de préventions et d'éradications
menées depuis les années cinquante, le paludisme demeure
d'actualité. La persistance de la maladie dans nos régions
provient de certains facteurs importants au nombre desquels : la
résistance des anophèles vecteurs aux insecticides de
synthèse (Djogbénou et al., 2008 ; IRD, 2009b);
l'apparition dans certaines régions du monde, des souches de
Plasmodium falciparum résistantes aux antipaludiques (IRD,
2009b) et l'existence du problème d'accès aux soins de
santé primaires compte tenu de la cherté des produits
antipaludiques synthétisés (OMS, 2008). Il urge donc d'envisager
d'autres outils de luttes anti vectorielles. Au Bénin, la richesse de la
flore et la connaissance des plantes médicinales sont susceptibles,
comme ce fut le cas de l'artémisinine, d'ouvrir de nouvelles voies pour
la recherche de nouveaux médicaments (Adjobimey et al., 2004)
et de nouveaux biocides.
A l'instar des extraits de quatre plantes médicinales
de la pharmacopée traditionnelle béninoise Argemone mexicana
(L.), Cassia rotundifolia, actuellement appelé
Chamaecrista rotuhdifolia(pers) (Greene) Phyllanthus
12
amarus (Schum & Thonn.) et de Thalia
geniculata (L.) qui ont inhibé de façon significative la
croissance de la souche chloroquino-sensible de Plasmodium falciparum
(Adjobimey et al., 2004), il a été
nécessaire d'étendre sur d'autres plantes béninoises
locales dont les premiers tests de criblage ont prouvé dans certaines
études des effets insecticides sur des larves d'Anopheles gambiae
(Giles). Les extraits de plantes sont non bio-accumulables. Ils sont
exploitables pour les populations et très efficaces sur les moustiques
actuels (Howard et al., 2009). Ce qui justifie le bien fondé de
la présente étude dont le thème s'intitule : «Tests
d'efficacité d'extraits d'huiles végétales sur
Anopheles gambiae (Giles) et Culex quinquefasciatus (Say)
résistants aux pyréthrinoïdes».
1.1. Objectifs
L'objectif général de cette étude est de
contribuer à développer un insecticide biologique efficace contre
les moustiques quelque soit leur stade de développement.
Plus spécifiquement, il s'agit :
- de tester la toxicité des extraits d'huiles
végétales sur les larves d'Anopheles gambiae sensibles
et résistants et Culex quinquefasciatus exhibant plusieurs
mécanismes de résistance aux pyréthrinoïdes ;
- d'apprécier l'efficacité insecticide des
huiles végétales extraites sur des moustiques Anopheles
gambiae (Giles) et Culex quinquefasciatus (Say) ;
- de tester la toxicité par contact et par ingestion
des huiles sur des adultes d'Anopheles gambiae et Culex
quinquefasciatus ;
- de proposer des concentrations efficaces des huiles pour une
lutte biologique, écologiquement durable contre les larves et les
adultes de moustiques devenus résistants aux insecticides
synthétiques.
13
1.2. Hypothèses
Les hypothèses élaborées s'articulent comme
suit :
- Les extraits d'huiles végétales sont efficaces
sur les larves de moustiques et permettent d'obtenir près de 100% de
mortalité 24 heures après application.
- Les huiles végétales sont plus actives par
contact que par ingestion sur les adultes.
CHAPITRE 1 :
14
GENERALITES
15
1. Généralités
1.1. Les moustiques
Dans le cadre de cette étude, selon la
systématique qui s'occupe de la nomination des espèces, les
moustiques appartiennent à la famille des Culicidae subdivisée en
deux sous-familles :
- les Anophelinae et,
- les Culicinae.
Pour l'étude, deux espèces provenant des
sous-familles ont été utilisées dont l'Anopheles
gambiae dans la famille des Anophelinae et le Culex quiquefasciatus
dans la famille des Culicinae (Harbach, 2007). Elles se
différencient par la position à la phase aquatique (larvaire) et
la position à la phase aérienne (adulte). Les femelles
d'Anopheles adoptent la position oblique à leur support au repos, mais
celles du genre Culex se tiennent parallèlement au support.
(Figure 1)
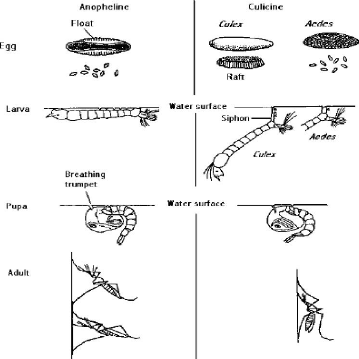
16
Légende en français :
Egg = OEuf Larva = Larve Water surface = eau de surface
Pupa = Nymphe Adult = Adulte Raft = OEuf en radeau
Figure 1: Différences entre
Anophelinae et Culicinae
Source: (OMS, 2003)
La morphologie du moustique évolue selon le stade de
maturité.
Les moustiques diffèrent des autres diptères,
comme les mouches, par la présence de petites écailles sur la
plupart des nervures des ailes. Le moustique adulte a le corps divisé en
trois parties distinctes: la tête, le thorax et l'abdomen avec chacune,
ses éléments constitutifs (Figure 2).
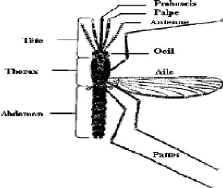
17
Figure 2: Principales parties d'un moustique
adulte
Source:
http://www.anti-moustique.info/anatomie-moustique
(OMS, 2003) 2.1.4 Cycle de développement du
moustique
Le cycle de développement des moustiques dure environ
douze (12) à vingt (20)
jours (Adisso et Alia, 2005) et comprend quatre (4) stades:
- le stade zygotique ou embryonnaire (l'oeuf) ;
- le stade larvaire (la larve) ;
- le stade pupaire (nymphe) et enfin,
- le stade imaginal (adulte).
Comme tout insecte à métamorphose complète
(holométabole), le
développement du moustique se caractérise par deux
phases distinctes (Rodhain
et Perez., 1985) :
- la phase aquatique regroupant les trois premiers stades
ci-dessus et,
- la phase aérienne qui concerne l'adulte ailé ou
imago (dernier stade).
1.1.1.1. Phase aquatique
Quelques jours après la fécondation, suivant les
espèces, les oeufs de diverses formes (fusiformes, allongés,
renflés dans leur milieu et parfois munis de minuscules flotteurs
latéraux) sont pondus par la femelle dans différents milieux. La
ponte est souvent de l'ordre de 100 à 400 oeufs et le stade ovulaire
dure deux (2) à trois (3) jours lorsque les conditions :
température du milieu, pH
18
de l'eau, nature et abondance de la végétation
aquatique de même que la faune associée (Kpondjo, 2008) sont
favorables à l'éclosion ; celle-ci peut être
retardée, en cas d'abaissement de la température par exemple. La
taille d'un oeuf est d'environ 0,5 mm (Rodhain et Perez, 1985).
A maturité, les oeufs éclosent et donnent des
larves de stade 1 (1 à 2 mm) qui, jusqu'au stade 4 (1,5 cm) se
nourrissent de matières organiques, de microorganismes et même des
proies vivantes (pour les espèces carnassières). Malgré
leur évolution aquatique, les larves de moustiques ont une respiration
aérienne qui se fait à l'aide de stigmates respiratoires ou d'un
siphon (Rodhain et Perez., 1985). La larve de stade 4 est bien visible à
l'oeil nu par sa taille. Elle a une tête, qui porte latéralement
les taches oculaires et les deux antennes. Viennent ensuite le thorax et
l'abdomen.
Au bout de six (6) à dix (10) jours et plus, selon la
température de l'eau et la disponibilité en nourriture, la
quatrième mue donne naissance à une nymphe: c'est la nymphose
(Guillaumot, 2006). Généralement sous forme de virgule ou d'un
point d'interrogation, la nymphe mobile ne se nourrit pas durant tout le stade
nymphal (phase de métamorphose) qui dure un (1) à deux (2) jours.
Elle remonte de temps à autre à la surface de l'eau pour respirer
et plonge vers le fond, dès qu'elle est dérangée. A la fin
de ce stade, la nymphe s'étire, son tégument se fend dorsalement
et, très lentement, le moustique adulte (imago) s'extirpe de l'exuvie :
c'est l'émergence, qui dure environ quinze (15) minutes au cours
desquelles l'insecte se trouve exposé sans défense face à
de nombreux prédateurs de surface (Rodhain et Perez, 1985).
19
1.1.1.2. Phase aérienne
Les sujets des deux (2) sexes s'accouplent en vol ou dans la
végétation et ont une distance de vol de un (1) à deux (2)
km. Grâce aux longs poils dressés sur leurs antennes, les
mâles peuvent percevoir le bourdonnement produit par le battement rapide
des ailes des femelles, qui s'approchent des essaims lors du vol nuptial. A ce
moment, le mâle féconde la femelle en lui laissant un stock de sa
semence. La femelle dotée d'un caractère particulier, celui du
maintien en vie jusqu'à la mort des spermatozoïdes, conserve la
semence du mâle dans une ampoule globulaire ou vésicule
d'entreposage (spermatique). Elle ne s'accouple donc qu'une seule fois
(Darriet, 1998).
Les adultes mâles et femelles se nourrissent de jus
sucrés, de nectars et d'autres secrétions
végétales. Pourtant, une fois fécondées, les
femelles partent en quête d'un repas sanguin duquel, elles retirent les
protéines et leurs acides aminés, nécessaires pour la
maturation des oeufs. Ce repas sanguin prélevé sur un
vertébré (mammifère, amphibien, oiseau), est ensuite
digéré dans un endroit abrité (Guillaumot,
2006).
Dès que la femelle est gravide, elle se met en
quête d'un gîte de ponte adéquat pour le
développement de ses larves. La ponte a lieu généralement
au crépuscule. Le gîte larvaire est une eau stagnante ou à
faible courant, douce ou salée (Ayitchedji, 1990).
Selon (Iroko, 1994), le sang, l'eau et une température d'au moins
18°C sont les trois conditions nécessaires, pour la reproduction et
le développement de certains moustiques d'Afrique noire. Le cycle de
développement du moustique est schématisé dans la figure
à la page suivante (figure 3).
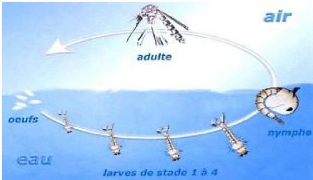
20
Figure 3 : cycle biologique du moustique
Source :
http://svt.ocean-indien.pagesperso-orange.fr/cyclemoustique/cycle
moustique.htm
Pour les tests adultes, seule la femelle de chaque
espèce a été utilisée. Les adultes mâles ne
constituent pas des facteurs vectoriels de maladies car ils ne piquent pas. La
trompe de la femelle sert non seulement à extraire le sang, elle permet
aussi de tirer le sucre, tel que le nectar de fleurs, qui lui donnera
l'énergie pour voler. Quant au mâle, il ne s'alimente pas de sang
parce qu'il ne possède pas les stylets acérés pour percer
la peau; il obtient son énergie en s'alimentant de sucre seulement.
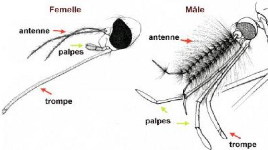
Figure 4 : différences entre femelle et
mâle du moustique à partir de la tête.
Source :
http://www.health.gov.on.ca/french/publicf/pubf/pubhealthf/west
nilef/wnv mosquitof.html.
21
1.2. Les huiles végétales
Les huiles végétales sont des corps lipidiques
extraits des graines ou des fruits oléagineux. Ce sont des
molécules organiques insolubles dans l'eau et solubles dans les solvants
organiques apolaires comme benzène, chloroforme, éther de
pétrole, l'hexane, etc.
Elles sont caractérisées par la présence
dans la molécule d'au-moins un acide gras ou chaîne grasse. Elles
apportent à la fois vitamines, protéines, minéraux, acides
gras essentiels, insaponifiables et autres substances organiques indispensables
à l'élasticité et à la fermeté des
tissus.
1.2.1 Caractéristiques chimiques des huiles
végétales
Toutes les huiles végétales sont composées,
en proportions variables, de trois
types d'acides gras : saturés, mono-insaturés et
polyinsaturés. On les classe selon les acides gras prédominants.
Pour cette étude, les huiles utilisées sont :
- l'huile d'Azadirachta indica ; - l'huile de
Jatropha curcas L. ; - l'huile de Ricinus communis et, -
l'huile de Thevetia peruviana.
Toutes les huiles végétales sont hydrophobes au
naturel. Elles doivent être formulées avec des agents
tensio-actifs appropriés afin de les émulsionner dans l'eau pour
application.
1.2.2. Huile d'Azadirachta indica Juss.
Communément appelé Acacia d'Egypte, arbre à
chapelets, Lilas des Indes (à ne
pas confondre avec le Lagestroemia) le Neem est aussi connu sous
le nom
scientifique Melia azadirachta Linn., M. indica
(A. Juss.) Brandis.
En langues locales du Bénin, il est appelé :
- Kininuti (fon) ;
- Koribu (bariba) ;
- Dogonyaro/ Egui Lili (Yoruba et Nago)
22
Originaire du sous-continent indien, les
propriétés médicinales et insecticides de la plante sont
connues depuis des millénaires (Mishra et al., 1995). Au
début du XXè siècle, il est introduit dans
plusieurs pays en développement et particulièrement en Afrique.
C'est ainsi qu'il est massivement planté au Bénin pour fixer le
bord des routes et comme source de médicaments antipaludiques, mais
surtout comme source de reboisement des zones arides. Le fruit est une drupe
ovoïde, lisse de 1,5-1,8 x 1,2-1,4 cm, jaune à maturité, ne
contenant généralement qu'une graine noyée dans une pulpe
visqueuse et plus ou moins sucrée.

Photo1 : feuilles et fruits d'Azadirachta
indica
Source : cliché AGBIZOUNON, 2010
Selon la croyance populaire dans plusieurs pays tropicaux,
l'Azadirachta indica est fréquemment utilisée pour sa
valeur médicinale. Différentes parties de la plante sont
utilisées pour le traitement de diverses affections :
? Feuilles : paludisme, ictère, variole, stomatite,
gastrite, asthénie et la lutte contre les vers intestinaux.
? Ecorce : fièvre, lèpre, dermatose et la
piqûre de scorpion.
? Graines : (huile), vermifuge, blessure, gale et dermatose.
? Fleurs : stimulantes, toniques et stomachiques (Arbonnier,
2002).
23
L'huile est généralement légère,
amère et brune avec une odeur plutôt forte. Elle comporte
principalement des triglycérides et de grandes quantités
de triterpénoïdes composés, qui sont responsables du
goût amer. (Mourguer, 1961).
L'huile de Neem contient également des
stéroïdes (campestérol, beta sitostérol,
stigmastérol) et une pléthore de
triterpénoïdes dont l'Azadirachtin est le plus bien
connu et étudié. La teneur en Azadirachtin de l'huile de Neem
change de 300ppm à 2500ppm fini selon la technologie d'extraction et la
qualité des graines de Neem écrasées.
Tableau 1 : composition de l'huile
végétale Azadirachta indica
Composition moyenne d'huile de Neem en acides
gras
|
Nom commun Nom acide Chaîne de
composition
|
Omega-6 Acide linoléique
6-16%
Omega-9 Acide oléique
25-54%
Acide palmitique Acide de
Hexadecanoic 16-33%
Acide stéarique Acide
octadécanoïque 9-24%
Omega-3 acide
Alpha-linoléique % (traces)
Acide palmitoléique acide
9-Hexadecenoic % (traces)
1.1.1. Huile de Jatropha curcas L.
Yikpotiin ou Gbaguidi kpotiin (Fon et Gun),
Gboci ou Gbodogwi (Adja), Iyalode
ou Ewe ayaba (Yoruba) ; Olobontuje ou
Kiti-kpo-kpo (Nago) et Babati en Mina, le Jatropha est aussi
appelé pourghère ou pignon d'inde.
Il viendrait du Mexique ou des régions voisines
d'Amérique centrale. Il est devenu une culture d'exportation au
Cap-Vert, où il a été introduit par les navigateurs
portugais, avant de se répandre dans toutes les régions
tropicales et subtropicales puis dans le monde (Weiss, 1983). La plante est
réputée comme toxique interne et vulnéraire externe. C'est
donc avec précaution et sous surveillance qu'elle est prescrite en usage
interne. Le fruit est de forme ovoïde,
24
plus ou moins trilobé ou anguleux, de 3,5 x 3 cm, de
couleur verte devenant noirâtre à maturité (Stirpe,
1976).

Photo 2 : Graines matures du J.
curca
Source : cliché AGBIZOUNON, 2010
Son action sur les maladies est spécifique à chaque
partie dont elle est
constituée :
? Racine : Blennorragie, Syphilis, dysenterie, stomatite et la
gingivite ;
? Feuille : douleur et rhumatisme, fièvre, paludisme,
ictère, coliques, my-
cose, oedème, plaie et gale, gingivite ;
? Graine : vermifuge, constipation, gastrite, infections
rénales ;
? Latex : plaie, herpès, gingivite, carie dentaire et
morsure du serpent ;
? Huile (issue des graines) : savon, éclairage,
insecticide contre les saute-
relles et les termites (Arbonnier, 2002)
Les huiles non conventionnelles extraites des graines
mûres de Jatropha curcas récoltées dans huit
localités du Bénin ont été étudiées
par Kpoviessi et al. (2004). Les potentiels lipidiques varient entre
40 et 60 %. Toutes les localités présentent une huile liquide
à température ambiante, de type insaturé et avec une
prédominance des acides gras oléique (43-53 %), linoléique
(20-32 %) et palmitique (13-15 %). La teneur en insaponifiables reste
inférieure à 4 %, sauf à Bohicon (5,5 %) et Akiza (8,4 %)
(Kpoviessi et al., 2004).
Une étude faite par Djènontin et al.
(2006) sur la caractérisation physico-chimique de l'huile
végétale extraite de graines de Jatropha curcas
25
(Euphorbiaceae) récoltées dans le sud du
Bénin a permis de remarquer que les acides gras insaturés sont
majoritaires avec la prédominance des acides oléique et
linoléique (42,3 et 36,6% respectivement). L'étude de la fraction
insaponifiable (0,8%p) a permis de révéler que l'huile de
Jatropha curcas contient 130 mg/l00g de stérols (dont 86,1% de
â-sitostérol) et 19,9 mg/l00g de tocophérols (dont 76,9% de
y-tocophérol). Les phospholipides (0,6g/100g) ont été
quantifiés sur la base de la teneur en phosphore. Ces données
physicochimiques de l'huile ont été comparées à
celles d'autres huiles végétales conventionnelles de grande
consommation au Bénin (Kpoviessi et al., 2004).
1.2.3. Huile de Ricinus communis L.
Le ricin est doté d'une diversité de noms au
plan local. Gogozokwinon ou Gogozoe ou encore Dagbazo
en Fon, Myion Myion en Gun, Lapkalakpa, Adete Lara, Ilara
en Yoruba et Nago, Kasuwe/Kawse en Mina, Dagbazama en
Adja, Montiusu en Bariba, Kpiipi Koroobu en Waama.

Photo 3: Graines de ricin
(décortiquées et enrobées)
Source : cliché
AGBIZOUNON, 2010
L'huile de ricin est constituée majoritairement de
triacylglycérol dont l'acide gras en C18 (insaturé et
hydroxylé) : l'acide ricinoléique (Maroyi, 2007). L'huile de
ricin se présente comme un liquide visqueux, incolore mais tendant
parfois légèrement sur le jaune avec un très faible
arôme.
C'est un purgatif drastique longtemps utilisé comme
laxatif, mais c'est surtout une huile industrielle : lubrifiant des moteurs
tournant à très haut régime,
26
matière première dans l'industrie des
polymères (RILSAN) et source d'acide undécylénique
(substance antifungique et industrielle) selon les données du site web
:
http://www.phytomania.com/ricin.htm.
L'huile végétale du ricin est composée :
- d'acides gras essentiels poly-insaturés (AGPI ou
AGE) ou vitamine F : acide linoléique (oméga6 : 4,5%) ;
- d'acides gras mono-insaturés (AGMI) : acide
ricinoléique (87,9%), acide oléique (3,9%) ;
- d'acides gras saturés (AGS) : acide
palmitique (1.0%), acide stéarique (1,1%) (Maroyi, 2007).
Ces acides gras insaturés possèdent des
propriétés reconnues dans le cosmétique. Ils nourrissent,
protègent, adoucissent, assouplissent, régénèrent,
redonnent éclat et souplesse et préservent d'un vieillissement
prématuré de la peau.
1.2.4. Huile de Thevetia peruviana K. Schum
Connu sous les noms de :
- Laurier jaune des Indes, Chapeau de Napoléon, Bois
à lait (Français) ;
- Yellow oleander, lucky nut tree, trumpet flower, milk bush,
(Anglais) ;
- Tantohu (Fon) ; Olomiojo (Yoruba et Nagot) ; Batonè
(Bariba), le thevetia est connu sous deux formes diverses : la forme
Thevetia neriifolia Juss. ex Steud. (1841) et le Cascabela
thevetia (L.) Lippold (1980). Il est originaire d'Amérique Latine
et est largement cultivé à travers les tropiques comme plante
ornementale (
www.lesarbres.fr/thevetia.html
consulté le 05/01/11).

27
Photo 4 : Graines de Thevetia, vue
complète, transversale et graine séchée
Source :
cliché AGBIZOUNON, 2010
Thevetia peruviana est utilisé à
travers les tropiques comme plante médicinale, en dépit de sa
toxicité. Une décoction d'écorce ou de feuilles est
absorbée comme laxatif et comme émétique, et elle est
réputée efficace pour soigner les fièvres intermittentes
(Arbonnier, 2002).
L'huile extraite des graines a montré une forte action
antibactérienne. Différents extraits de feuilles et extraits de
graines ont montré un fort effet anti-appétitif sur les limaces
et certains insectes dont les termites lorsque pulvérisés sur les
cultures (Schmelzer et Gurib-Fakim, 2006).
Les graines contiennent 57À63% d'huile, qui
après purification se compose principalement d'acide oléique
(60%), d'acide palmitique (16%), d'acide stéarique (11%), d'acide
linoléique (7%) et d'acide linoléique (5%). L'huile peut
être détoxifiée et pourrait servir d'huile
végétale à usage domestique (Schmelzer et Gurib-Fakim,
2006).
28
CHAPITRE 2 :
CADRE D'ETUDE
29
2. Cadre de l'Etude
Ce chapitre présente le site de prospection larvaire
des moustiques et les laboratoires où les travaux
d'expérimentation et d'extraction ont été
réalisés.
2.1. Le site de prospection larvaire
Le site de Ladji, situé dans le 6ème
arrondissement de la ville de Cotonou a été le site
privilégié de prospections larvaires.
Ce quartier de la capitale économique est situé
aux abords du lac Nokoué. Ce site a été choisi pour deux
raisons essentielles :
- il dispose de gites larvaires permanents et
- abrite les An. gambiae et Culex
quinquefasciatus fortement résistants aux
pyréthrinoïdes (Corbel et al., 2007 ; N'Guessan et
al., 2007 ; Dabire et al., 2008).
2.2. Laboratoires
Notre étude s'est déroulée
simultanément dans deux (02) laboratoires :
- le laboratoire de Pharmacognosie et des Huiles Essentielles
(LAPHE) du Professeur Mansourou Moudachirou sis à l'ISBA (Institut des
Sciences Biomédicales Appliquées). Ce laboratoire s'occupe d'une
part de l'extraction des huiles essentielles et végétales, et
d'autre part de la détermination des composés chimiques des
extraits.
- le Centre de Recherche Entomologique de Cotonou (CREC) qui
dispose de plusieurs laboratoires dont celui de la LSHTM (London School of
Hygiene and Tropicale Medicine) où s'est effectué notre stage. Ce
laboratoire est dirigé par le Docteur Raphaël K. N'Guessan.
Le CREC dispose aussi d'un insectarium où plusieurs
30
souches de moustiques sont séparément
élevées : des souches résis-
tantes de terrain et des souches sensibles de laboratoire.
La photo ci-après montre les insectariums où
sont élevés les larves et les adultes de moustiques.

Photo 5 : Insectariums des larves de moustiques
et leurs adultes
Source : cliché AGBIZOUNON, 2010
CHAPITRE 3 :
31
MATERIEL ET METHODES
32
3. Matériel et Méthodes
Plusieurs matériels ont fait l'objet de la
réalisation de cette étude.
3.1. Matériel végétal
Le matériel végétal est constitué
des graines de Az. indica, Ri. communis, Th. peruviana et Ja. curcas.
Les spécimens ont été identifiés à l'Herbier
National du Bénin de l'Université d'Ab-Calavi. Lesdites graines
ont été récoltées dans la période d'octobre
2009 à Août 2010 dans différentes localités et
présentées dans le tableau 2.
Tableau 2 : Présentation des
espèces végétales d'étude
Espèce Végétale Famille botanique
Lieu de récolte
Azadirachta indica
Méliacées Atchakpa (Savè)
Ricinus communis Euphorbiacées
Environ UAC/Tankpè
Thevetia peruviana Apocynacées
Bohicon, Zê, Tankpè
Jatropha curcas Euphorbiacées
Hêvié
3.2. Matériel animal
Trois souches de moustiques ont été testées
:
la souche sensible de référence est l'Anopheles
gambiae Kisumu, originaire du Kenya. Cette souche est élevée
à l'insectarium du CREC ; Anopheles gambiae Ladji, populations
naturelles résistantes aux pyréthri-noïdes et DDT dont la
fréquence allélique Kdr est supérieure 90% (Corbel et
al., 2007 ; N'Guessan et al. 2007).
le Culex quinquefasciatus Ladji,
multi-résistants aux pyréthrinoïdes, DDT,
Organophosphorés et aux Carbamates (Corbel et al., 2007).
3.3. Matériel physique
3.3.1. Matériels d'extraction des huiles
végétales :
Pour le broyage des amandes nous avons utilisé un
broyeur de graine de marque Marlex (IS4250) (Photo 6).

Photo 6 : Broyeur au repos
Photo7: amandes broyées conditionnées
dans des bouteilles
Source : cliché AGBIZOUNON, 2010
L'extraction des huiles végétales a
été faite avec le dispositif du Soxhlet (photo 8) et le
dispositif d'évaporation d'un bain-marie + rotavapor (photo 9).

Photo 8: Dispositif d'extraction Photo
9: Dispositif d'évaporation du
solvant
Source : cliché AGBIZOUNON, 2010
Dans le cas où l'huile s'extrait à froid, comme
c'est le cas du Jatropha, les graines sont récoltées,
décortiquées, triées, broyées et l'extraction faite
à l'aide d'un pressoir de modèle 95ZX-10 d'une puissance de 7,5kw
avec une production de 3 à 5 tonnes en 24h
33
Photo 10 : Dispositif de
récupération Photo 11 : Huiles
végétales
34
d'huile obtenues
Source : cliché AGBIZOUNON, 2010
3.3.2. Matériels pour l'élevage des larves et
les adultes d'Anopheles gambiae (Giles) et de Culex quinquefasciatus (Say)
Il s'agit :
w' Des farines de croquettes de chat et du jus sucré :
ils ont servi respecti-
vement à nourrir les larves et les adultes des
moustiques d'études ; w' Des bacs voilés de moustiquaire
contenant l'eau pour l'élevage des
larves d'études ;
w' Des cages couvertes de moustiquaire pour l'élevage des
adultes
3.4. Méthodes
3.4.1. Méthode d'extraction des huiles
végétales
La méthode Soxhlet est la méthode de
référence utilisée pour l'extraction des huiles
végétales à partir des amandes solides
déshydratées. C'est une méthode gravimétrique,
puisqu'on pèse l'échantillon au début et la matière
grasse à la fin de l'extraction (Chandre, 1998).
3.4.1.1. Principe de la méthode par le
Soxhlet
Les amandes solides préalablement séchées
à la température ambiante au Laboratoire de Pharmacognosie et des
Huiles Essentielles de l'ISBA sont pesées et placées dans une
moulinette pour être broyées. L'échantillon broyé
(broyat) est entassé dans une cartouche qui est déposée
dans le soxhlet avec 1L de solvant pour chaque extraction. 75cl de solvant sont
versés directement sur le broyat et les 25cl restants versés dans
le ballon dans le quel sont déposés au préalable quelques
grains de pierres ponces. Le tout est porté à ébullition
dans le thermostat. L'ensemble est donc prêt pour l'extraction. Celle-ci
a été réalisée à l'aide de l'éther de
pétrole 60-80 à ébullition qui dissout graduellement
l'huile
35
végétale. Le solvant contenant l'huile
végétale retourne dans le ballon par déversements
successifs causés par un effet de siphon dans le coude latéral.
La matière grasse s'accumule dans le ballon jusqu'à ce que
l'extraction soit complète. Une fois l'extraction terminée,
l'éther de pétrole est évaporé,
généralement sur un évaporateur rotatif.
L'huile de Jatropha curcas, a été
obtenue par l'extraction à froid, c'est-à-dire par simple presse
de l'amande.
3.4.1.2. Principe de la méthode d'extraction
à froid
La matière végétale (graines) est
récoltée, décortiquée, triée, broyée
et pressée à
l'aide du pressoir à huile (annexe1).
Pour chaque extraction, le rendement est calculé selon la
formule suivante :
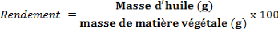
3.4.2. Méthode de dilution des huiles
végétales
Les différentes dilutions ont été faites
sur la base de la conservation de quantité de matière dans le
solvant. On fait des dilutions successives dans l'éthanol pour les tests
larvaires, dans l'acétone pour les tests en tubes OMS puis dans du jus
sucré pour les tests d'ingestion.
Ainsi ni=nf où (ni=ci×vi)
représente la quantité de matière à l'état
initial c'est-à-dire avant la dilution (huiles végétales
pures) et (nf=cf×vf) représente celle à l'état final
c'est-à-dire après la dilution (huiles végétales
diluée) ce qui permettra de déduire le volume de l'huile
végétale pure dans la solution diluée à l'aide de
la formule suivante :
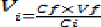
Vi = Volume d'huile végétale pure
à prélever en millilitre ;
36
Ci = Concentration de l'huile
végétale pure en pourcentage ; on suppose par convention que
quand l'huile végétale est pure, sa concentration est
égale à 100% donc 1
Cf = Concentration de l'huile
végétale diluée exprimée en pourcentage,
Vf = Volume final de la solution
diluée en millilitre ; nous avons supposé qu'il est égal
à 100ml pour toutes les dilutions.
3.4.3. Les Tests larvaires
Les tests ont consisté à évaluer la
mortalité des larves d'Anopheles et Culex en
présence des solutions diluées d'huiles végétales
suivant une méthodologie inspirée du protocole de l'Organisation
Mondiale de la Santé (OMS, 2005). Des expériences
préliminaires ont permis de retenir une gamme de concentrations devant
servir aux tests proprement dits. Les expérimentations ont
été réalisées dans des gobelets avec 20 larves de
moustiques au 3ème stade. Dans chaque gobelet a
été versé, un mélange d'eau distillée et
d'huile végétale. Le volume du mélange d'eau
distillée additionnée avec de l'huile végétale est
de 100ml par gobelet exception faite du contrôle qui ne contient
uniquement que l'eau distillée et le solvant. Chaque expérience
à été répétée 5 fois. Les
différentes doses expérimentées sont les suivantes :
Thevetia peruviana: 0,125% ; 0,25% ; 0,5% ; 1% ; 2% ; 3%
et 4% Azadirachta Indica : 0,0625% ; 0,125% ; 0,25% ; 0,5% et 1%
Ricinus. Communis : 0,5% ; 1% ; 2% ; 4% et 6%
Jatropha curcas : 0,03125% ; 0,0625% ; 0,125% ; 0,25% ;
0,5% et 1%
Le temps d'exposition des larves aux différentes
concentrations est de 24h. Après 24h d'exposition, l'efficacité
de chaque dose a été déterminée en relevant dans
chaque gobelet le nombre de larves mortes.
37
3.4.2.1. Test en cage par ingestion
Cinquante à 60 moustiques femelles âgées de 3
jours ont été introduit à l'aide
d'un aspirateur dans une cage. Du coton imbibé d'un
mélange de jus sucré et d'huile végétale est
placé au dessus de la cage en fonction des doses désirées
(Photo 12). Les morts sont comptés et retirés des cages tous les
jours. Les doses appliquées sur les adultes en cage ont
été :
Thevetia peruviana: 0,5% ; 1% ; 2% ; 3% et 4%
Azadirachta Indica : 0,125% ; 0,25% ; 0,5% ; 1% et 2% Ricinus.
Communis : 0,5% ; 1% ; 2% ; 4% et 6% Jatropha curcas : 0,125% ;
0,25% ; 0,5% ; 1% et 2%

Photo 12 : Disposition des cages lors des
expérimentations
Source : cliché AGBIZOUNON, 2010
3.4.2.2. Test de sensibilité ou test en tubes
OMS
? Imprégnation des papiers
L'imprégnation des papiers Whattman n°1 s'est fait
selon le protocole adopté par N'Guessan et al., 2003, 2007 et
Corbel et al., 2007. Quatre papiers de 12cm X 15cm sont
imprégnés chacun de 2ml du mélange huile
végétale + acétone + huile de silicone. Après
séchage à la température ambiante pendant 24 heures, les
papiers sont emballés dans de papier aluminium, puis conservés au
réfrigérateur (OMS, 2009).
38
? Déroulement du
test
Environ 100 femelles âgées de 3 à 5 jours
sont exposées pendant 1 heure dans les tubes tests contenant les papiers
imprégnés. Pendant le temps d'exposition, on décompte,
toutes les cinq minutes, le nombre de moustique ayant subit un effet KD (Knock
Down) ; c'est-à-dire qui tombe sur le dos ou sur le côté.
Après l'exposition les femelles sont transvasées dans les tubes
d'observation et la mortalité est dénombrée 24h, 48h et
72h après. Les doses appliquées contre les adultes lors des tests
OMS sont de 100mg/m2, 250mg/m2, 500mg/m2 et
1000mg/m2 pour toutes les huiles.

Photo 13 : Gobelets contenant les
moustiques
Source : cliché AGBIZOUNON, 2010
3.5. Analyses statistiques
Les données des tests larvaires ont été
analysées en utilisant la régression probit avec Polo-Plus
(Polo-PC, LeOra Software, Berkeley, CA) ; les résultats des tests
d'ingestion ont été analysées par le test de survie de
Kaplan-Meier (STATA 9 software) et les données des tests de contact (ou
tube OMS) ont été analysées suivant le test de
Khi-Carré en utilisant le logiciel Minitab 14.
39
CHAPITRE 4 :
RESULTATS ET
DISCUSSIONS
40
4.1. Résultats
4.1.1. Rendement en huile végétale des
graines étudiées selon la méthode
d'extraction
Les résultats obtenus à partir de l'extraction,
ont montré que les graines étudiées ont des rendements en
huiles végétales considérables (tableau 4).
Tableau 3 : Rendement en huile
végétale des graines étudiées
Nom scientifique Famille botanique Rendement (%)
Azadirachta indica Juss Meliaceae 41,36
Jatropha curcas L. Euphorbiaceae 38,63
Ricinus communis L Euphorbiaceae 38,81
Thevetia peruviana K. Schum Apocynaceae 68,39
Le rendement en huile le plus élevé est obtenu
avec les graines de Thevetia peruviana à 68,4%. Le plus faible
rendement obtenu avec Jatropha curcas est de 38,6%. Il est à
observer que les deux euphorbiacées, Jatropha curcas et
Ricinus communis, ont un rendement presque identique et inferieur
à celui de Thevetia peruviana.
4.1.2. Efficacité des huiles végétales
sur les larves
On observe une évolution du taux de mortalité en
fonction des différentes doses appliquées.
4.1.2.1. Effet larvicide d'Azadirachta indica
L'effet larvicide des huiles végétales par
rapport à Azadirachta indica a été
évalué avec plusieurs paramètres dont :
- L'intervalle de confiance (IC) à 95%, c'est un
intervalle de valeurs qui a 95% de chance de contenir la vraie valeur du
paramètre estimé;
41
- la DL50 qui est la dose qui tue 50% de la
population testée et,
- le ratio de résistance RR50 qui exprime :
? l'absence de résistance lorsque RR = 1 ;
? la tolérance lorsque 1< RR = 10 ;
? la résistance lorsque RR > 10.
Le tableau 4 révèle qu'avec l'huile
d'Azadirachta indica, la DL50 chez An. gambiae
Kisumu a été de 0,2% (IC=0,2-0,3), tandis qu'elle a
été de 0,3% (0,20,3) pour la population résistante de
An. gambiae Ladji ; avec un RR50 estimé à 1,2
(IC=1,1-1,4). Ce qui suggère une sensibilité de la population
résistante à cette huile.
De même, chez Cx. quinquefasciatus, la
DL50 a été de 0,3% (IC=0,2-0,3) avec un
RR50 estimé de 1,1 (IC=1,0-1,3) ce qui traduit une
sensibilité des Cx. quinquefasciatus à la même
huile végétale.
Tableau 4 : Doses létales
DL50 et DL95 et Ratio de Résistance
RR50 et RR95 d'Azadirachta indica sur des larves
L3 de An. gambiae Kisumu, An. gambiae Ladji et Cx.
quiquefasciatus Ladji.
|
Souches
|
Pente
(E.S.)
|
DL50 (%)
(95% I.C.)
|
DL95 (%)
(95%I.C.)
|
RR50
(95% I.C.)
|
RR95
(95% I.C.)
|
|
An. gambiae Kisumu (s)
An. gambiae Ladji (kdr)
Cx. quinquefasciatus Ladji (Kdr,
Acer-R)
|
4,0
(0,3)
3,0
(0,2)
3,2
(0,2)
|
0,2
(0,2 - 0,3)
0,3
(0,2 - 0,3)
0,3
(0,2 - 0,3)
|
0,6
(0,5 - 0,8)
1,1
(0,9 - 1,5)
0,9
(0,7 - 1,2)
|
-
1,2
(1,1 - 1,4)
1,1
(1,0 - 1,3)
|
-
1,7
(1,3 - 2,3)
1,4
(1,1 - 1,8)
|
I.C. = Intervalle de Confiance. E.S.= Erreur Standard. S=
Sensible Kdr =Knock down resistant; Acer-R=
Acétylcholinestérase-Résistant ; DL (exprimée en %)
; RR = DL résistant / DL sensible
42
4.1.2.2. Effet larvicide de Ricinus communis
Tableau 5 : Doses létales
DL50 et DL95 et Ratio de Résistance
RR50 et RR95 de Ricinus communis sur
des larves L3 de An. gambiae Kisumu, An. gambiae Ladji et
Cx. quiquefasciatus Ladji.
|
Souches
|
Pente
(E.S.)
|
DL50 (%)
(95% I.C.)
|
DL95 (%)
(95%I.C.)
|
RR50
(95% I.C.)
|
RR95
(95% I.C.)
|
|
An. gambiae Kisumu (s)
An. gambiae Ladji (kdr)
Cx. quinquefasciatus Ladji (Kdr,
Acer-R)
|
3,2
(0,3)
3,1
(0,2)
2,7
(0,2)
|
1,2
(1,0 - 1,4)
1,2
(1,0 - 1,4)
1,1
(0,9 - 1,5)
|
3,8
(2,9 - 5,8)
4,1
(3,3 - 5,7)
4,7
(3,3 - 8,7)
|
-
1,0
(0,9 - 1,2)
1,0
(0,8 - 1,1)
|
-
1,1
(0,8 - 1,4)
1,2
(0,9 - 1,6)
|
I.C. : intervalle de confiance E.S.= Erreur Standard. S= Sensible
Kdr = Knock down resistant Acer-R=
Acétylcholinestérase-Résistant ; DL (exprimée en %)
; RR = DL résistant / DL sensible
De ce tableau 5 on retient que, pour l'huile
végétale de Ricinus communis, la dose qui tue 50% des
larves An. gambiae Kisumu et Ladji a été de 1,2%
(IC=1,0-1,4), avec un RR50 estimé de 1,0 (IC=0,9-1,2). Ce qui
explique une sensibilité de la souche résistante vis-à-vis
de l'huile testée. De même, la DL50 sur Cx. quinquefasciatus
a été de 1,1% (IC=0,9-1,5) avec un RR50 de 1,0
(IC=0,8-1,1).
43
4.1.2.3. Effet larvicide de Thevetia peruviana
Tableau 6 : Doses létales
DL50 et DL95 et Ratio de Résistance
RR50 et RR95 de Thevetia peruviana
sur des larves L3 de An. gambiae Kisumu, An. gambiae
Ladji et Cx. quiquefasciatus Ladji.
|
Souches
|
Pente
(E.S.)
|
DL50 (%)
(95% I.C.)
|
DL95 (%)
(95%I.C.)
|
RR50
(95% I.C.)
|
RR95
(95% I.C.)
|
|
An. gambiae Kisumu (s)
An. gambiae Ladji (kdr)
Cx quinquefasciatus
Ladji (Kdr,
Acer-R)
|
2,1
(0,1)
2,2
(0,1)
1,8
(0,1)
|
0,4
(0,3 - 0,5)
0,5
(0,4 - 0,6)
0,6
(0,4 - 0,8)
|
2,6
(2,0 - 3,9)
2,9
(2,3 - 3,9)
4,6
(3,1 - 8,4)
|
-
1,2
(1,0 - 1,5)
1,3
(1,1 - 1,6)
|
-
1,1
(0,8 - 1,5)
1,7
(1,2 - 2,5)
|
I.C. : intervalle de confiance E.S.= Erreur Standard. S=
Sensible Kdr = Knock down resistant; Acer-R=
Acétylcholinestérase-Résistant ; DL (exprimée en %)
; RR = DL résistant / DL sensible
Le tableau 6, montre que pour tuer 50% des larves d'An.
gambiae Kisumu, il a fallu une DL50 de 0,4% (IC=0,3-0,5). Avec
la population résistante de An. gambiae Ladji, elle a
été de 0,5% (IC=0,4-0,6). Le RR50 estimé a
été de 1,2 (IC=1,0-1,5) ce qui démontre une
sensibilité de la souche résistante à l'huile de
Thevetia peruviana. En revanche, chez Cx. quinquefasciatus
Ladji la DL50 a été de 0,6% (IC=0,4 - 0,8) avec
un RR50 estimé qui a été de 1,3 (IC=1,1-1,6).
Ce qui explique une sensibilité de la souche Cx. quinquefasciatus
à cette huile.
44
4.1.2.4. Effet larvicide de Jatropa curcas
Tableau 7 : Doses létales
DL50 et DL95 et Ratio de Résistance
RR50 et RR95 de Jatropha curcas sur
des larves L3 de An. gambiae Kisumu, An. gambiae Ladji et
Cx. quiquefasciatus Ladji.
|
souches
|
Pente
(E.S.)
|
DL50 (%)
(95% I.C.)
|
DL95 (%)
(95%I.C.)
|
RR50
(95% I.C.)
|
RR95
(95% I.C.)
|
|
An. gambiae
|
2,2
|
0,1
|
0,3
|
-
|
-
|
|
Kisumu (s)
|
(0,2)
|
(0,0 - 0,1)
|
(0,2 - 0,6)
|
|
|
|
An. gambiae Ladji
|
2,3
|
0,2
|
0,8
|
2,6
|
2,4
|
|
(kdr)
|
(0,2)
|
(0,1 - 0,2)
|
(0,6 - 1,3)
|
(2,1 - 3,2)
|
(1,7 - 3,5)
|
|
Cx quinquefasciatus
|
2,9
|
0,1
|
0,4
|
2,0
|
1,3
|
|
Ladji (Kdr, Acer-R)
|
(0,2)
|
(0,0 - 0,1)
|
(0,3 - 0,6)
|
(1,7 - 2,4)
|
(1,0 - 1,8)
|
I.C. : intervalle de confiance E.S.= Erreur Standard. S= Sensible
Kdr = Knock down resistant;
Acer-R= Acétylcholinestérase-Résistant ; DL
(exprimée en %) ; RR= DL résistant / DL sensible
L'effet toxique de l'huile de Jatropha curcas est mis
en évidence dans le tableau 7. La DL50 chez An. gambiae
sensible a été de 0,1% (IC=0,0-0,1) tandis qu'elle a
été de 0,2% (IC=0,1-0,2) chez la souche résistante
d'An. gambiae Ladji. Le RR50 estimé a été de 2,6
(IC=2,1-3,2).
Ces résultats mettent en évidence une
tolérance de la souche résistante à l'huile
végétale de Jatropha curcas. De la même
manière chez Cx. quinquefasciatus, une DL50 de 0,1%
(IC=0,0-0,1) a été obtenue avec un RR50 de 2,0
(IC=1,7-2,4) ; ce qui implique la même tolérance de Cx.
quinquefasciatus à cette huile végétale.
Des tableaux 4 à 7, on pourrait déduire que
toutes les huiles végétales ont été efficaces sur
les différentes souches de larves à l'exception de l'huile de
Jatropha curcas pour laquelle les effets larvicides sont faibles.
45
4.1.3. Effet adulticide des huiles végétales
sur An. gambiae Kisumu
Les taux de survie illustrés sur la figure 14 varient
en fonction de l'huile végétale et du nombre de jours.
Toutes les huiles végétales testées
entrainent des taux de survie variant de 100% à 0% entre le Jour
zéro et le 10è jour à l'exception du
contrôle. Ce taux de survie est de 0% à partir du
5è jour pour le Thevetia peruviana,
6è jour pour le Jatropha curcas et
l'Azadirachta indica et enfin au 9è jour pour le
Ricinus communis. L'analyse statistique des données de survie
selon Kaplan-Meier a montré une survie dans le temps significativement
plus élevé de Ricinus. communis par rapport à
l'huile végétale de Thevetia peruviana (P<0,001) ;
mais non significativement différente entre le Thevetia peruviana
et l'Azadirachta indica (P>0,05). Le fort taux de survie a
été obtenu avec l'huile de Ricinus communis.
Ces observations sont identiques avec les populations
naturelles de Anopheles gambiae.
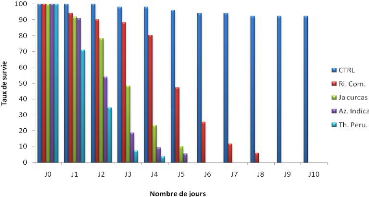
Figure 14 : Taux de survie de Anopheles
gambiae kisumu après exposition par ingestion à 2% des
huiles végétales de Ricinus communis, Jatropha curcas,
Azadirachta indica, et Thevetia peruviana
46
4.1.4. Effet adulticide des huiles végétales
sur Cx. quinquefasciatus
Les extraits d'huiles végétales ont eu un effet
semblable sur les culex que sur les Anopheles gambiae. Mais ici,
l'analyse des données selon Kaplan-Meier a montré une survie dans
le temps hautement significative de l'huile de Ricinus communis par
rapport à celle d'Azadirachta indica (P<0,001). Le taux de
survie le plus élevé a été obtenu avec l'huile de
Ricinus communis.
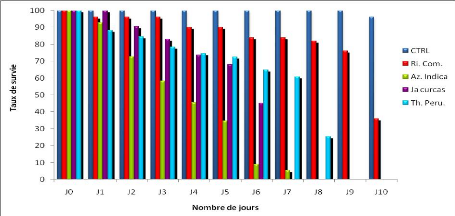
Figure 15 : Taux de survie de Culex
quinquefasciatus Ladji après exposition par ingestion à 2%
des huiles végétales de Ricinus communis, Jatropha curcas,
Azadirachta indica, et Thevetia peruviana
4.1.5. Efficacité des tests adulticides par contact
tarsique sur Kisumu
Les résultats des tests en cylindre, sont
présentés sur la figure 16, traduisant la variation du taux de
mortalité en fonction des différentes doses des huiles
végétales.
La mortalité de An. gambiae exposé aux
papiers imprégnés d'extrait d'huile végétale en
tube est très faible quelque soit l'huile utilisé et ne
dépasse pas 54,1% pour Thevetia peruviana à
250mg/m2 au bout de 72h. Celle-ci est significativement
différente des autres mortalités obtenues avec les doses
47
100mg/m2 ; 500mg/m2 et 1000mg/m2
(P<0,05), 72h après l'installation de l'expérience.
Comparée entre elle, la mortalité de An.
gambiae 72h après le début des expériences, n'a pas
permis d'obtenir une différence significative entre les huiles
(P>0,05).
L'action par contact des extraits d'huiles
végétales est donc négligeable sur An. gambiae
Kisumu.
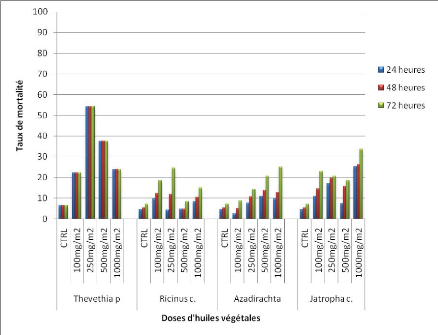
Figure 16 : Taux de mortalité de
Anopheles gambiae kisumu après exposition aux huiles
végétales par contact tarsique
48
4.2. Discussions
Les rendements en huiles végétales obtenus
à partir des graines d'études sont largement supérieurs
ont confirmé les observations de Moudachirou et al., en 1999 et Ayedoun
en 1995 et qui montrent qu'il pourrait y avoir une différence entre les
deux types d'huiles en ce qui concerne le rendement. Le rendement en huile
végétale de Azadirachta indica 41,36% similaire au
rendement obtenu par Carlos et al., (2010) (39,7%) confirme la
qualité de l'extraction. Il en est de même lorsqu'on compare le
rendement en huile végétale de Thevetia peruviana obtenu
par Schmelzer et al., (2006) et celui obtenu lors de nos
extractions.
Le RR50 sensiblement égal à
1(1,0-1,4) obtenus entre la souche de référence sensible Kisumu
et celle des populations sauvages de An. gambiae et Cx.
quinquefasciatus résistantes aux pyréthrinoïdes montre
une sensibilité de ces populations à l'huile d'Azadirachta
indica. La DL50 évaluée dans le présent
test s'est aussi révélé efficacité dans
l'inhibition des larves de stade 3 d'An. gambiae stricto
(Howard et al., 2009). Dans une étude précédente
contre des larves de Culex sp. l'Azadirachta indica s'est
montré efficace à la même dose de 0,3% avec des taux de
mortalités de 100% (Scott et al., 2000). L'huile
végétale de Azadirachta indica a donc un effet larvicide
qui pourrait être utilisé pour contrôler les moustiques
résistants y compris An. gambiae, principal vecteur du
paludisme au Bénin. Quelle que soit l'huile végétale
utilisée dans nos travaux, les RR50 faibles ont
été observés à l'exception de celle du Jatropha
curcas (RR50=2,6). Ces huiles ont donc un potentiel dans le contrôle
des populations résistantes de An. gambiae et Cx. quiquefasciatus
évaluées.
Le RR50 de 2,6 obtenu avec l'Huile
Végétale du Jatropha curcas ne pourrait s'expliquer par
une réelle résistance à cette huile mais plutôt par
une tolérance due à l'expression naturelle d'enzyme de
maintenance. Une hypothèse similaire a été formulée
suite à un ratio de résistance similaire obtenu avec un
insecticides alternatives aux pyréthrinoïdes tel que Chlorfenapyr
(N'Guessan et al., 2007).
49
A Maroua, ville soudano-sahélienne du nord-Cameroun, il
a été observé sur des populations résistantes de
An. gambiae des niveaux de sensibilité similaires à ceux
observés dans nos travaux sur les souches de Ladji (Baldet, 1995). Vu le
développement de la résistance aux insecticides chimiques, nos
huiles végétales constitueraient une alternative de lutte
efficace, contre les An. gambiae et Cx. quinquefasciatus (Gomez et
al., 1997, chandre et al., 1999).
On ne saurait parler de résistance de Cx.
quinquefasciatus à ces huiles dans notre étude, car par
ailleurs cette espèce à montrer des taux de résistance de
176 fois au DDT, 20,4 fois au perméthrine et 20 fois au
Deltaméthrine ont été obtenues (Ouedraogo et al.,
2005).
Il a été observé une faible
toxicité par contact (taux de mortalité<35%) alors que
l'action simultanée par contact et ingestion a été
très marquée (taux de mortalité avoisinant 100% dès
les premiers jours). Il semblerait que la voie par ingestion soit la plus
toxique. Il n'est cependant pas à exclure qu'une synergie
contact-ingestion se soit produit.
Les adultes des populations naturelles nourris au
mélange du jus sucré et des huiles végétales
(Az. Indica, Ja. curcars et Th. peruviana) mourant tous avant
le 10ème jour suggère que l'épandage de ces
huiles pourrait écourter la survie de ces populations. Des taux de
survie similaires ont été obtenus dans des travaux
précédents évaluant de nouveaux insecticides
synthétiques, tel que le chlorantraniliprole (Boko, 2009). La maturation
du parasite du paludisme durant 8-12 jours chez An. gambiae (Detinova
et al., 1964), la pulvérisation de ces huiles
végétales éliminerait non seulement les larves mais aussi
les adultes infectés du parasite du paludisme résistants aux
insecticides synthétiques.
50
CONCLUSION ET
PERSPECTIVES
51
Conclusion
Nos résultats bien que préliminaires,
témoignent d'une bonne activité larvicide et par ingestion des
extraits d'huiles végétales. Ainsi les huiles
végétales de Thevetia peruviana, Jatropha curcas et
Azadirachta indica constituent des larvicides prometteurs pour la
lutte contre les moustiques sensibles et résistants aux insecticides
synthétiques. L'effet toxique obtenu après ingestion de ces
mêmes huiles suggère qu'on pourrait les utiliser comme un outil de
lutte anti vectorielle efficace dans le management de la résistance des
anophèles vecteurs du parasite du paludisme ainsi que dans le
contrôle de Cx. quinquefasciatus nuisant et devenu
résistant à toutes les formulations d'insecticides
synthétiques couramment utilisés en santé publique.
Perspectives
Au terme de cette étude, nous espérons poursuivre
:
· Les tests en cône avec imprégnation des
moustiquaires avec les huiles végétales ;
· Les tests en tunnels pour voir l'effet répulsif
de nos huiles végétales ;
· L'étude des synergies entre les constituants de
chacune des huiles végétales ;
· L'identification des mécanismes et des sites
d'action des huiles végétales ;
· La vulgarisation de ces huiles végétales
par la fabrication et le test des crèmes dermatologiques.
· Les tests sur d'autres insectes piqueurs et suceurs
avec les huiles
52
REFERENCES BIBLIOGRAPHIQUES
Abdu-Aguye I, Sannusi A, Alafiya-Tayo RA, Bhusnurmath
SR. 1986 Acute toxicity studies with Jatropha curcas L. Hum. Toxicol.
(5), 269-274.
Adisso D. & Alia R. 2005. Impact des
fréquences de lavage sur l'efficacité et la durabilité des
moustiquaires à longue durée d'action de types Olyset Net et
Permanet dans les conditions de terrain. Mémoire de fin de formation en.
ABM-DITEPAC-UAC, Cotonou. 79p.
Adjobimey T., Edayé I., Lagnika L., Gbenou J.,
Moudachirou M., Sanni A., 2004. Activités antiplasmodiales in
vitro de quelques plantes antipaludiques de la pharmacopée
béninoise compte rendu chimie Vol.7 numéro 10-11 P. 1023-1027
Akogbéto M., Yacoubou S.1999.
Résistance des vecteurs du paludisme vis-à-vis des
pyréthrinoïdes utilisés pour l'imprégnation des
moustiquaires au Bénin, Afrique de l'Ouest. Bulletin de la
société de pathologie exotique. (92) : 123-130.
Aliero, B.L., 2003. Larvaecidal effects of
aqueous extracts of Azadirachta indica (neem) on the larvae of Anopheles
mosquito. Af. J. of Biotech., 2 (9): 325-327.
Andersag H, Breitner S, Jung
H. 1934. Quinoline compound and process making the
same. US patent n°2233970.
Aplin PJ, Eliseo T. 1997. Ingestion of castor
oil plant seeds. Med J Aust ; 167 : 260-1.
Arbonnier, M. 2002. Arbres, arbustes et
lianes des zones sèches d'Afrique de l'Ouest. CIRAD, MNHN, UICN. 573
pp.
Ayedoun M., Sohounhloué D.,
Menut C., Lamaty G. et Bessiere J., 1997. Composition
chimique des huiles essentielles de deux espèces de cymbopogon du
Bénin exploitables industriellement, Bulletin africain Bio
Ressources. Energie. Développement. Environnement. p.8.
Ayitchedji, A.M. 1990. Bioécologie de
Anopheles melas et de Anopheles gambiae s.s. Comportement des adultes
vis-à-vis de la transmission du paludisme en zone côtière
lagunaire, République du Bénin. Mémoire de fin de
formation en TLM-DETS-CPU-UNB, Cotonou. 76p.
Baldet T. 1995. Etude comparative de deux
stratégie de lutte contre Anaphelesgambiae et Culex quinquefasciatus
Say, par Bacillus sphaericus Neide, dans la ville de Maroua (Nord Cameroun).
Thèse Université des Sciences et Technique du Languedoc,
Montpellier II
Bang Y. H, Sabuni I. B, et Tonn R. J.1975.
Integrated control of urban mosquitoes in Dares Salaam using community
sanitation supplemented by larviciding. E Afr Med. J, p.52.
Boiteau P., et Allorge-Boiteau L. 1986.
Précis de matière médicale Malgache ; plantes
médicinales de Madagascar. pp.12, 13, 49, 83, 85, 91,93 et 107.
Boko P., 2009. Evaluation de
l'Efficacité d'un nouvel insecticide: le chlorantraniliprole
(E2Y45° sur Anopheles gambiae Kisumu. Master d'entomologie
Appliquée /UAC. p.26
Bourassa, 2000. Le moustique. Les
Editions du Boréal, Montréal. 244 p.
53
Carlos M., André M., Giraldo M., Eugenio C.,
Herminia D. & Juan C. 2010. Fractional characterisation of
jatropha, neem, moringa trisperma, castor and candlenut seeds as potential
feedstocks for biodiesel production in Cuba. p 533-538.
Chandre F.1998. Résistance
d'Anopheles gambiae Giles et de Culex pipiens quinquefasciatus
Say aux insecticides en Afrique de l'Ouest et implications
opérationnelles. Thèse de Doctorat. Université de Paris
XII, 112pages.
Chisti Y. 2007. Biodiesel from microalgae,
biotechnology Advances, Palmerston North, New Zealand (25) p. 294-306.
Clem J.R., Havemann D.F., &
Raebel M.A. insect repellent (N, N-diethyl-m-toluamide)
cardiovascular toxicity. In an adult. Ann. Pharmacother. 27 : 289-293.
Cooper W. C., Myatt A. V., Hernandez
T., Jeffrey G. M, Coatney GR. 1953. Studies in human
malariaI. Comparaison of primaquine, isopentaquine, SN-3883 and pamaquine as
curative agents against chesson strains vivax malaria. Am J Trop Med Hyg, 2:
949-951. Corbel V, N'guessan R, Brengues C, Chandre F, Djogbenou L,
Akogbéto M, Hougard J.M, Rowland M. 2007. Multiple insecticide
resistance mecanisms in Anopheles gambiae and culex quinquefasciatus
from Benin, west Africa. Acta Tropica. 101: 207-216.
Dabire K. R., Diabate A., Djogbenou L., Ouari
A., N'Guessan R., Ouedraogo J. B., Hougard J-M., Chandre F.et Baldet T.
2008. Dynamics of multiple insecticide resistance in the malaria
vector Anopheles gambiae in a rice griwing area in south-western burkina Faso.
Malaria Journal, (7), 188. Darriet, F. 1998. La lutte
contre les moustiques nuisants et vecteurs de maladies, Khartala- orstom,
Paris. 91 p.
Detinova & Gilles. 1964. Observations on
the determination of the age composition and epidemiolocal importance of
populations of Anopheles gambiae Giles and Anopheles funestus
Giles in Tanganyika
Bull. Org.
mond.-Santé, 30, 23-28
Djènontin S. T. ; Dangou J. ;
Wotto D. V. ; Sohounhloué K. C. D. ; Lozano P. Pioch
D., 2006. Composition en acides gras, stérols et
tocophérols de l'huile végétale non conventionnelle
extraite des graines de Jatropha curcas (Euphorbiaceae) du Bénin.
Journal de la Société ouest-africaine de chimie, p. 59 -
67
Djogbénou L., 2009. Lutte
antivectorielle contre le paludisme et résistance des vecteurs aux
insecticides en Afrique. Revue de l'IRSP., Ouidah, Bénin, Med. Trop
; 69 : 160-164.
Djogbénou L., Baldet T., Pasteur N., Weill M.,
Akogbéto M. & Chandre F., 2008. Impact des
activités humaines sur la dynamique de la résistance chez
Anopheles gambiae : Cas du Bénin
Gomez P., Cubillo D., Mora G. A., Hilje L.
1997. Evaluacion de posiblies repelentes de Bemisia tabaci.
II. Extractos vegetales. Manejo Integrado de Plagas (Costa Rica)
29, p. 17-25.
Gry J., 1972. Techniques d'essais
insecticides par traitement individuel et détermination des dl50.
Fascicules n°2 et 3. INA-PG/ORSAY (France)
54
Guillaumot L. 2006. Les moustiques et la
dengue. Institut Pasteur de
Nouvelle Caledonie. 15p. Article. Site:
Institut Pasteur. Hyperlien(url) :
http://www.institutpasteur.nc/article.php3?id_article=78
consulté le 13.09.10.
Harbach R. E., 2007. The Culicidae (Diptera):
a review of taxonomy, classification and phylogeny. Zootaxa
1668:591À638.
Hastings I. M, Watkins W. M White J. 2002.
The evolution of drug- resistant malaria: the role of drug elimination
half-life. Phil Trans R Soc Lond B, 357: 505-519.
Henning, R. K., & Mkamilo
H.A.M, 2007. médicinales Jatropha curcas Wageningen, Pays Bas,
48 p. Howard A. F.V., Adongo E., Hassanili A., Omlin F., Wanjoya A.,
Zhou G., Vulule J.. 2009. Laboratory evaluation of the aqueous extract
of Azadirachta indica (neem) wood chippings on Anopheles gambiae s.s. (Diptera:
Culicidae) mosquitoes. Journal of Medical Entomology 46: 107-114.
INSAE. Projection de la population de l'ensemble du
Bénin de 1997 à 2032, Cotonou, octobre 1999
IRD., 2009a. Journée mondiale de lutte
contre le paludisme : Conférence sur la résistance des vecteurs
du paludisme aux insecticides Nairobi.
IRD., 2009b. Rapport d'activité de
Septembre 2003 À Août 2009 au Bénin. P.3.
Iroko, F. A. 1994. Une histoire des hommes et
des moustiques en Afrique. Côte des esclaves (XVIe - XIXe siècle).
L'harmattan, 1994. Racines du présent. 169 p.
ISRA/CNRA, 1997. Rapport d'activités
de l'Unité ISRA-CNBA, Campagne 95-96. Bambey, Sénégal, 95
p.
Kpondjo, N. M. 2008. Développement des
larves de moustiques dans un Ecosystème particulier : Milieu
sous-jacinthe d'eau Eichhornia crassipes (Mart) Solms-Laubauch,
République du Bénin. Mémoire de fin de formation
en Licence Professionnelle-EPAC,/UAC Abomey-Calavi. 52 p. Kpoviessi D.
S. S., Accrombessi G. C., Kossouoh C., Soumanou M. M. &
Moudachirou M., 2004. Propriétés
physico-chimiques et composition de l'huile non conventionnelle de
pourghère (Jatropha curcas) de différentes
régions du Bénin Comptes rendus. Chimie, (7) p.1007 À
1012
Maroyi, A., 2007. Ricinus communis L.
In: van der Vossen, H.A.M. & Mkamilo, G.S. (Editeurs). Prota 14 :
Vegetable oils/Oléagineux. Wageningen, Pays Bas.
Mishra A. K, Singh N, Sharma V. P, 1995
« utilisation d'huile de neem comme révulsif de moustique dans les
villages tribaux de la zone de mandla, pradesh de madhya », J indien
Malarial, sept ; 32 (3) : 99-103 Pubmed
Moudachirou M., Gbénou J.,
Chalchat J., Chabard J. et Lartique C. 1999. Chemical
composition of essential oils of Eucalyptus from Benin : Eucalyptus citriodora
and E. and E. calmadulensis. Influence of location, hervest time, storage of
plants and time of steam distillation, J. Essent. Oil Res., 11,
109-118.
55
Mouffok, B., Raffy E., Urruty N. &
Zicola J. 2008. Le neem, un insecticide biologique efficace.
France, 14 p.
Mourguer M., 1961. Study of the toxicity and
localisation of the toxalbumin (Curcin) of the seed of J. curcas. Bull.
Soc. Chim. 43, 505- 516.
N'guessan R, Darriet F, Guillet P,
Carnevale P, Lamizana M.T, Corbel V, Koffi A.A & Chandre F.
2003. Resistance to carbosulfan in Anopheles gambiae
from côte d'ivoire based on reduced sensitivity of
actylcholinesterase. Medical and Veterinary Entomology, 17:19-25.
N'guessan R., Boko P., Odjo A., Akogbéto M.,
& Rowland M. 2007. Chlorfenapyr : A pyrrole
insecticide for the control of pyrethroid or DDT resistant Anopheles gambiae
(Diptera : Culicidea) mosquitoes Acta Tropica 102 (2007) 69-78.
Nguyen-Pouplin J., Tran H., Phan T. A., Dolecek C.,
Farrar J., Carron P., Bodo B., & Grellier P.
2007. Antimalarial and cytotoxic activities of ethnopharmacologically
selected medicinal plants from south Vietnam, journal of
Ethnopharmacology, (109), 417- 427.
OMS & UNICEF., 2005. Premier rapport
mondial sur les efforts pour faire reculer le paludisme : point des
progrès accomplis et des défis à relever. P.1-2.
OMS. 1995. Lutte contre les vecteurs du
paludisme et autres maladies transmises par les moustiques. Fasc. N°
857.
OMS, 2003. Entomologie du paludisme et
contrôle des vecteurs: Guide du stagiaire. Provisoire, OMS,
Genève. 102 p.
OMS. 2005. Guidelines for laboratory and
field testing of mosquito larvicides, www.who/cds/whopes/gcdpp/2005.13
consulté le 15/07/10
OMS., 2008. Paludisme : maladie de la
pauvreté et cause de pauvreté.
OMS.2009. Guidelines for efficacy testing of
insecticides for indoor and outdoor ground-applied space spray applications,
www.who/htm/ntd/whopes/2009.2 consulté le 15/07/10
Ouedraogo A., Baldet T., Skovmand O., Kabre G. &
Guiguemde R. 2005. Sensibilité de Culex quiquefasciatus aux
insecticides à Bobo-Dioulasso (Burkina Faso) p.406-410.
PNLP., 2007a. Plan stratégique de
lutte contre le paludisme au Bénin 2006-2010 : annuaire des statistiques
sanitaires 2006.
PNLP., 2007b. Plan stratégique de
lutte contre le paludisme au Bénin 2006-2010
Pradel J., Rey D., Foussadier R. &
Bicoud D., 2007. Etude écologique des moustiques
(Diptera, culicidae) Àvecteurs potentiels d'arboviroses À dans la
région Rhône-Alpes. Bulletin de l'Association pour l'Etude de
l'Epidémiologie des Maladies Animales, in press.
Prasad C., Shukla R., Ashok K;
et Dubey N. 2008; in vitro and in vivo antifungal
activity of essential oils of Cymbopogon martini and Chenopodium ambrosoides
and their synergism against dermatophytes, Mycoses, 53: 123-129.
Rodhain F., Perez C., 1985.
Précis d'Entomologie Médicale et Vétérinaire.
Maloine, s.a. 114 p.
56
Schäfer M. L., Lundström J. O., Pfeffer M.,
Lundkvist E. & Landin J.,2004. Biological
diversity versus risk for mosquito nuisance and disease transmission in
constructed wetlands in southem Sweden. Medical and veterinary
Entomology, 18: 256-267.
Schmelzer, G.H. & Gurib-Fakim, A.,
2006. Thevetia peruviana (Pers.) K.Schum. Plantes
médicinales1. Prota 11(1): Wageningen, Pays Bas.
Scott I.M., Kaushik N.K. 2000. The toxicity of
à neem insecticide to populations of culicidae and other aquatic
invertebrates as assessed in situ microcosms; Contam. And Toxicol. 39(3):
329-336. Seïdou A., 1987. Contribution à
l'étude de la transmission du paludisme urbain à Cotonou.
Mémoire DIT., Bénin, UAC, 56p.
Stirpe F., 1976. Study on the proteins from the
seeds of Croton tiglium and of Jatropha curcas. Biochim. Journal.,
156, S. 1-6.
Weiss E. A., 1983. Tropical oilseed crops.
Tropical Agricultural Series, longman group limited, New York., 32-37.
White N. J & Pongtavornpinyo
W. 2003. The de novo selection of
drug-resistant malaria parasites. Proc Biol Sci 270: 545
WHO. 2006. Guidelines for testing mosquito
adulticides for indoor residual spraying and treatement of mosquito nets,
www.who/cds/whopes/gcdpp/2005.13
Wikipedia. Site : wikipédia. Date de
consultation : 23.06.2010. Hyperlien (url) :
http://fr.wikipedia.org/wiki/Culicidae
World Health Organization (WHO), 1985. Bioassay
method for titration of Bacillus sphaericus: consultation on the developpement
of Bacillus sphaericus as microbial larvicide. World Health Organ, 3,
85-95.
57
ANNEXES

Annexe1 : pressoir à huile
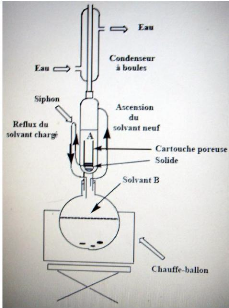
58
Annexe 2 : Schéma annoté d'un Soxhlet
59
TABLE DE MATIERES
Dédicaces 1
Remerciements 2
Hommages 4
Liste des tableaux 5
Liste des figures 5
Liste des photos 5
Liste des sigles et abréviations 5
Résumé : 7
Abstract 8
INTRODUCTION 9
1. Objectifs 12
2. Hypothèses 13
CHAPITRE 1 : GENERALITES 14
1.1. Les moustiques 15
1.1.1. Cycle de développement du moustique 17
1.1.1.1. Phase aquatique 17
1.1.1.2. Phase aérienne 19
1.2. Les huiles végétales 21
1.2.1 Caractéristiques chimiques des huiles
végétales 21
1.2.2. Huile d'Azadirachta indica Juss. 21
1.1.1. Huile de Jatropha curcas L. 23
1.2.3. Huile de Ricinus communis L. 25
1.2.4. Huile de Thevetia peruviana K. Schum 26
CHAPITRE 2 : CADRE D'ETUDE 28
2.1. Le site de prospection larvaire 29
2.2. Laboratoires 29
CHAPITRE 3 : MATERIEL ET METHODES D'ETUDE
31
3.1. Matériel végétal 32
3.2. Matériel animal 32
3.3. Matériel physique 32
3.3.1. Matériels d'extraction des huiles
végétales 32
3.3.2. Matériels pour l'élevage des larves et
les adultes d'Anopheles gambiae et de Culex
quinquefasciatus (Say) 34
3.4. Méthodes 34
3.4.1. Méthode d'extraction des huiles
végétales 34
3.4.1.1. Principe de la méthode par le Soxhlet 34
3.4.1.2. Principe de la méthode d'extraction à
froid 35
3.4.2. Méthode de dilution des huiles
végétales 35
3.4.2.1. Test en cage par ingestion 37
3.4.2.2. Test de sensibilité ou test en tubes OMS 37
3.5. Analyses statistiques 38
CHAPITRE 4 : RESULTATS ET DISCUSSIONS 39
4.1. Résultats 40
4.1.1. Rendement en huile végétale des graines
étudiées selon la méthode d'extraction 40
4.1.2. Efficacité des huiles végétales
sur les larves 40
4.1.2.1. Effet larvicide d'Azadirachta indica 40
4.1.2.2. Effet larvicide de Ricinus communis 42
4.1.2.3. Effet larvicide de Thevetia peruviana 43
4.1.2.4. Effet larvicide de Jatropa curcas 44
4.1.3. Effet adulticide des huiles végétales sur
An. gambiae Kisumu 45
4.1.4. Effet adulticide des huiles végétales sur
Cx. quinquefasciatus 46
60
4.1.5. Efficacité des tests adulticides par contact
tarsique sur Kisumu 46
4.2. Discussions 48
CONCLUSION ET PERSPECTIVES 50
Conclusion 51
Perspectives 51
REFERENCES BIBLIOGRAPHIQUES 52
ANNEXES 57
| 


