DOSOGE DES PHOSPHATES « PO4-3 »
« METHODE DU REACTIFS ULFOMOLY
BDIQUE »
Introduction :
Le chiffre 11% avancé par « prayon-
Rupel »est sous estimé. De plus, l'apport en phosphates dans
les eaux de surface à plusieurs origines et l'importance relative de la
contribution de ces différent tes sous ces varie d'une région
à l'autre. En zone urbanisée, les activités des
ménages peuvent constituer l'apport principal en phosphate. Une moyenne
sur le territoire européen n'a pas beaucoup de sens car le
problème doit être envisagé à l'échelle de
chaque bassin.
L'épuration des eaux ne peut remplacer la
prévention « prayon- Rupel » déclare qu'il
est inutile d'interdire les phosphates dans les détergents, car la
législation européenne rend obligatoire la déphosphatation
des eaux usées dans l'ensemble des zones sensibles. Ace sujet, il est
déplorable que la Belgique ait pris un tel retard dans l'application
de cette directive.
Actuellement, la plupart des filières d'épuration
en service en Belgique ne traitent pas les phosphates. Il existe des solutions
techniques qui permettent de réduire le taux de phosphate des effluents
domestiques (traitement tertiaire), mais elle sont rarement appliquées
Ainsi la Région Bruxelloise n'est équipée que depuis peu
d'une 1ere station d'épuration, en amont de la capitale.
Celle-ci est du point de vue de traitement tertiaire. La station aval (Bxlnord)
qui devrait mettre en oeuvre un tel traitement, ne sera opérationnelle
qu'en 2005. Cette inexistence actuelle de filière de traitement rend
plus importantes encore les mesures de prévention. De toutes
façons, la prévention doit toujours prévaloir, vu le
coût des frais curatifs, à charge de la collectivité. De
plus, en moyenne les lessives sans phosphates ne coûtent pas plus cher,
d'après nos relevés de prix effectués en 2000.
Pour lutter efficacement contre l'eutrophisation
des eaux, il est nécessaire de conjuguer ces deux action :
diminution à la source des rejets domestiques, et traitement des
phosphates au niveau des stations d'épuration. L'expérience du
lac Léman en est la démonstration la plus connue. Il existe
même des exemples où une réduction de la teneur en
phosphates des lessives permet la réduction, voir l'arrêt du
traitement d'épuration tertiaire, ce que permet de réduire les
coût du traitement de l'eau.
Définition :
Le phosphate c'est un élément essentiel à la
vie aquatique les fortes concentration en phosphate rencontrées dans
l'estuaire indiquent un enrichissement d'origine domestique et agricole
provenant du bassin versant, ainsi que l'existence d'apports directs venant des
activités industrielle.
Les phosphates peuvent être d'origine
organique ou minérale, le plus souvent, leur teneur dans les eaux
naturelles résulte de leur utilisation en agriculture, de leur emploi
comme additifs dans les détergents et comme agents de traitement des
eaux de chaudières. Leur présence dans les eaux de certains
puits, à la compagne, indique la proximité de fumiers, de fosses
septiques ou la possibilité d'infiltration d'eaux de ruissellement
agricoles, riches en engrais.
Elles sont considérées comme responsables du
phénomène d'eutrophisation en rivière. Au moment du
développement du plancton végétal printanier, le phosphore
sous forme de phosphates Po4-3 est consommé puis
que comme les nitrates, c'est un sel nutritif. Sa teneur dans l'eau peut alors
de seconde en dessous de la limite de détection des méthodes
d'analyse courantes.
Dans les eaux saumâtres turbides, la teneur en phosphore
est sous l'influence de la nature et de la concentration en particules fines,
en raison des phénomènes d'adsorption. C'est ce qu'on constate
dans l'embouchure de la seine où dans la bouchon vaseux la teneur en
Po4-3 est proportionnelle à la concentration en
matières en suspension (MES).
But :
Le but de cette manipulation est l'acquisition de la
concentration et la teneur en phosphore et en phosphates d'un
échantillon par le tracé de la courbe d'étalonnage
CPO4 = f (A).
Il est nécessaire de filtrer les échantillons d'eau
avant les mesures, car ce dosage peut être troublé par la
présence des MES.
Principe :
En milieu acide et en présence de molybdate
d'ammonium les orthophosphates donnent un complexe phosphomolybdique qui
réduit par l'acide ascorbique développe une coloration bleu,
susceptible d'un dosage colorimétrique. Certaines formes organiques
pouvaient être hydrolyse au cours de l'établissement de la
coloration et donner des athophosphates, le développement de la
coloration est accéléré par un catalyseur,
l'émétique, tartrate double d'autre moine et de potassium.
Réactifs :
Réactif sulfomolybdique ;
Acide ascorbique cristallisé ;
Dihidroçeno phosphate de potassium cristallisé.
Mode opératoire :
Établissement de la courbe
d'étalonnage :
Introduire dans une série de
fioles jaugées de 25 ml :
|
Numéro de fioles
|
T
|
1
|
2
|
3
|
4
|
5
|
|
Solution étalon de P à (1 mg/l) (ml) 1 ppm
|
0
|
1
|
5
|
10
|
15
|
20
|
|
Eau distillée ( ml)
|
20
|
19
|
15
|
10
|
5
|
0
|
|
Correspondance en ( mg/l) de P
|
0
|
0,05
|
0.25
|
0.5
|
0.75
|
1
|
|
Réactif sulfomolybdique en (ml)
|
4
|
4
|
4
|
4
|
4
|
4
|
|
Acide ascorbique en (g)
|
0.1
|
0.1
|
0.1
|
0.1
|
0.1
|
0.1
|
Ensuite on mélange chaque fiole et on les porte à
l'ébullition pendant 1mn ; on laisse refroidir puis on effectue les
lectures.
On effectue la lecture de l'absorption à une longueur
d'onde ë = 6.8nm à l'aide d'un spectromètre (la
température est compris entre 20 et 25°C.)
Présentation de la solution fille à
partir de la solution mère :
La solution mère des ions PO-34 0.5
g/l. Pour avoir une solution fille de 0.01 g/l =10mg/l. on dilue 1/50
fois.
50ml de solution 0.01 gr/l correspond à 1mll de solution
mère 0.5 gr/l 49mll d'eau distillée.
Expression des résultats:
Après avoir effectuer la lecture au spectromètre,
on obtient les résultats suivants
|
Numéro de capsule
|
T
|
1
|
2
|
3
|
4
|
5
|
E
|
|
Absorbance
|
0
|
0,019
|
0,083
|
0.184
|
0.262
|
0.345
|
0.165
|
La teneur en phosphate en (mg/l) est donné
comme suit:
D'après la relation C1V1 =
C2V2 on tire :
C = Volume de la solution de phosphate * N /
20
N : normalité de la solution de phosphate = 1 mg/l
CT = 0/20 * 1 = 0
C1 = 1 / 20 * 1 = 0.05 mg/l
C2= 5 / 20 * 1 = 0.25 mg/l
C3 = 10 /20 * 1 = 0.5 mg/l
C4= 15 / 20 * 1 = 0.75 mg/l
C5= 20 / 20 * 1 = 1 mg/l
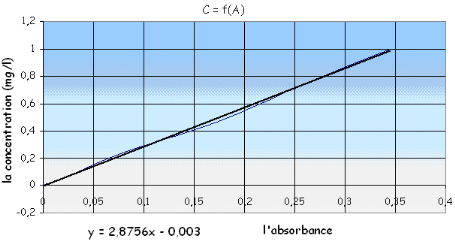
![]() En trace la courbe d'étalonnage
A= f(c) a fin de déterminer la valeur de la concentration de l'eau
à analyser en phosphate (mg/l) En trace la courbe d'étalonnage
A= f(c) a fin de déterminer la valeur de la concentration de l'eau
à analyser en phosphate (mg/l)
3)
D'après la courbe d'étalonnage qu'on a
présentée sous forme de droite on peut déterminer
Cx :
Sachant que l'absorbance A = 0.165 et l'équation de la
droite
Cx = y = 2.8756 x - 0.003 avec :
Y : la concentration
X : l'absorbance
Cx = 2.8756 * 0.165 - 0.003
Cx = 0,471474
mg/l
La teneur en phosphates X :
La masse molaire du phosphate = MPO43- =
94.97g/mole
La masse molaire du phosphore = 30.97g/mole
Un ion gramme de phosphate, contient un atome gramme de
phosphore, alors un cherche combien de mg en PO43-
contient 0.8107 mg/l
94.97g ð 30.97g de P
X = (94.97 * 0,471474) / 30.97
X g ð 0,471474
ð XPO4- =1,445 mg/l
Interprétation :
Le phosphate joue un rôle très
important dans le développement des algues, il est susceptible de
favoriser leurs multiplication dans les réservoirs, les gosses
canalisation et les eaux des lacs, où il contribue à
l'eutrophisation, phénomène auquel le milieu s'enrichit en
matières nutritives d'une manière excessive dons en algues et
plancton, il en résulte une véritable dégradation qui peut
devenir irréversible.
L'origine des phosphates :
Les phosphates font partie des anions facilement fixés par
le sol, leur présence dans les eaux naturelles est liée à
la nature des terrains traversés et à la décomposition de
la matière organique, dans les zones phosphatières, souvent
associés à des fluorures. Dans le cas du traitement des eaux
brutes, les phosphates peuvent perturber l'efficacité de la coagulation
et l'adoucissement.
Dans les eaux de puits, la présence de phosphate peut
avoir pour origine une infiltration en provenance des fosses d'aisance ou de
dépôt du fumier. Les eaux de surface ou de nappes peuvent
être contaminées par les rejets industriels et domestiques ou par
lessivage des terres cultivées referment des engrais phosphatés
ou traité par certains pesticides.
Les phosphates peuvent aussi provenir des traitements de
vaccination des eaux industrielles contre la corrosion et l'entartrage ou des
adjuvants actifs ajoutés aux détergents, ceux-ci participent
à la diminution de la dureté de l'eau.
Les phosphates s'échappent en majeure partie (80%) au
traitement des stations d'épurations biologique classique et de ce fait,
se retrouvent dans les rejets.
Cependant, la diphosphatation biologique par ajout d'une zone
anaérobiènne tête d'un système à boues
activées est en cours de développement. Les traitement
physico-chimique de caprification peuvent éliminer de 80 à 85% de
phosphate suivant le réactif utilisé et le PH. Donc les apports
de phosphore sont d'origine :
Ø Agricole (utilisation d'engrais) ;
Ø Industrielle (détergents) ;
Ø Domestique (un habitant rejette en moyenne 4 g de
phosphate par jour), une moitié due aux détergents, l'autre au
phosphore métabolique.
Ø Conclusion :
L'ion phosphate PO4-3 et l'anion de
l'acide orthopédique H3PO4 acide de force moyenne.
En tant que de triacide il est susceptible de former trois services de sel.
Phosphates neutre Na3
PO4, Ca(PO4)2 de hydrogènophosphates,
Na2HPO4 et ditry
Hogenophosphates , NaH2 PO4
Ca
(HPO4)2 et C
Le réactif molybdique c'est à dire la solution. De
molybdate d'ammonium (NH4)2MbO4 forme avec le
phosphate une solution jeune.
PO4-3 + 3
NH4+ + 12 Mo O4- + 24 H+
= (NH4) H4 [P (Mo2
O7)6]+ 10 H2O
La réduction de cet acide peut entre effectuée sous
l'action de l'acide ascorbique.
D'après nos résultats on remarque que concentration
des faibles par rapport phosphate dans l'eau à analyser est la plus
faible par rapport aux autres échantillons.
Cette valeur est due au faible teneur des est due au faible
teneur des phosphates de notre eau. De plus, a l'état soluble est
assimilable le phosphore est relativement moins disponible que les autres
éléments essentiels comme l'azote et le nitrate à cause de
faibles sources industrielles qui peut provenir.
On effet, au Canada les poly phosphates sont ajoutes à
l'eau potable pour combattre la corrosion des réseaux de distribution.
6°/ un détergent est une préparation se
présentant sous forme de poudre, de liquide ou de pâte dissoute
à des doses convenables dans l'eau, elle constitue un bain de nature
à faciliter le nettoyage, par un moyen mécanique
approprié, des surfaces solides, fibreuses, comme les textiles ou
continues, par exemple : l'épiderme, la vaisselle, qui y sont
plongées.
Néanmoins, les détergents deviendront une
nuisance : contrairement aux savons, ils ne sont ni solubles ni
biodégradable (PO43- est très
mobile, il s'adsorbe facilement sur les particules).
En effet, une fois mélangés à l'eau, ils
restent dans la solution et ne se réduisent pas en molécules
moins complexes et de solubilité supérieur.
| 


