|
UNIVERSITÉ DES ANTILLES ET DE LA
GUYANE
FACULTÉ DES SCIENCES EXACTES ET NATURELLES

MASTER RECHERCHE EN SCIENCES ET TECHNOLOGIES
BIODIVERSITÉ
TROPICALE
Spécialité: Écosystèmes Naturels et
Exploités
Analyse de la diversité des champignons
ectomycorhiziens et des
ectomycorhizes du Raisinier bord de mer
(Coccoloba uvifera L.) le
long d'un gradient de salinité en
forêt littorale
Raymond Avril

Directeur de stage : Amadou B%o
Laboratoire de Biologie et Physiologie
Végétales (LSTM-UMR113), UFR Sciences Exactes et
Naturelles,
Université des Antilles et de la Guyane, BP. 592, 97159,
Pointe-à-Pitre,
Guadeloupe
Soutenu le : 25 juin 2009
REMERCIEMENTS
Ce stage s'est déroulé au Laboratoire de
Biologie et de Physiologie Végétales (LSTM-UMR113) de
l'Université des Antilles et de la Guyane. Ce travail de recherche a pu
se réaliser gr%oce au soutien de personnes que je tiens à
remercier en particulier :
Monsieur Amadou B%o , professeur à l'UAG, d'avoir
encadré ce travail avec enthousiasme et de m'avoir fait découvert
le monde fascinant des symbioses ectomycorhiziennes.
Mademoiselle Isabelle Boulogne, technicienne au laboratoire, pour
son soutien moral mais aussi pour son amabilité et son aide.
Mademoiselle Sandrine Bessard, doctorante au laboratoire,
surnommée grande sÏur, pour son aide.
Madame Clémence Chaintreuil, ingénieure de
recherche à l'IRD de Montpellier, d'avoir bien voulu nous apporter son
aide pour le séquençage de l'ADN.
Mademoiselle Fadul Ra
·ma, stagiaire en M1 au
laboratoire, pour ses encouragements, sa gentillesse et son amitié.
Mes camarades de promotion, Lisa Vidil, Pierre-Antoine Faddoul et
Anaël Ssosse, pour leur accueil, leur amitié et leur
encouragement.
Monsieur Harry-Ozier Lafontaine, directeur de recherche à
l'INRA, d'avoir bien voulu faire un rapport sur mon mémoire de stage.
Toute l'équipe du laboratoire de Biologie Marine pour
son accueil, en particulier Madame Soazig Lemoine, maître de
conférences à l'UAG, qui a aimablement mis à ma
disposition l'équipement de biologie moléculaire.
L'AUF Cara
·be pour son soutien financier à
travers la bourse de mobilité sans laquelle ce travail n'aurait pas vu
le jour. Que les responsables trouvent, ici, l'expression de ma reconnaissance,
particulièrement Mme Katty Saint-Louis, pour son attention et son
dévouement.
LISTE DES TABLEAUX ET FIGURES
Tableau 1. Les différents types de
mycorhizes 4
Figure 1. Principaux types d'associations
symbiotiques entre des champignons 5
(en bleu) du sol et des racines de végétaux
Figure 2. Représentation
schématique de l'ITS (ITS1, ITS2 et 5.8S) de l'unité 9
répétée de l'ADN ribosomique chez les
champignons
Tableau 2. Classification botanique de
Coccoloba uvifera 12
Figure 3. Fruits verts immatures, Fruits rouge
violacé matures 12
Figure 4. Fleurs m%oles, Graines sans la pulpe
13
Figure 5. Coccoloba uvifera en bordure
de mer sur la plage de Bois Jolan 15
Tableau 3. Champignons ectomycorhiziens
associés à C. uvifera aux Antilles 16
Figure 6. Plantules de Coccoloba uvifera
et sporophores de Russula cremeolilacina 16
sous le houppier d'un arbre-mère
Figure 7. Représentation
schématique (vue de profil) des six arbres -mères de
Coccoloba 17
uvifera échantillonnés le long d'un
gradient de salinité sur la plage de Bois Jolan
Figure 8. Représentation
schématique (vue de face) de la position des six 18
arbres-mères de Coccoloba uvifera
échantillonnés le long d'un gradient de
salinité sur la plage de Bois Jolan
Figure 9. Fructifications de Scleroderma
bermudense matures ouvertes en étoile .23
libérant la sporée et immatures fermées
Figure 10. Nombre de sporophores
récoltés sous Coccoloba uvifera pendant 24
8 mois en milieu peu salé
Tableau 4. Description des neuf morphotypes
ectomycorhiziens sur quelques .25
caractères macroscopiques et microscopiques
Figure 11. Morphotypes des arbres-mères
et de leurs plantules en milieu peu salé 25
Figure 12. Fréquence des morphotypes des
arbres-mères et leurs plantules en milieu peu saléÉ 26
Figure 13. Fréquence des morphotypes des
arbres-mères en milieu salé 26
Figure 14. Produits de l'amplification par PCR
de la région ITS de l'ADNr des morphotypesÉ 27
Figure 15. Produits de digestion par
HinfI de la région ITS de l'ADNr des morphotypes 28
Tableau 5. Polymorphisme de longueur des
fragments de restriction de la région ITS .29
(digestion par HinfI) des sporophores et des morphotypes
ectomycorhiziens
d'arbres-mères et de plantules de Coccoloba
uvifera
Figure 16. Fréquence des six ribotypes
(F, E, A, B, D et C) des arbres-mères et de leurs 30
plantules en milieu peu salé.
Figure 17. Fréquence de trois ribotypes
(A, B et F) des arbres en milieu salé 31
Figure 18. Arbre phylogénétique
basé sur le séquençage de l'ITS des huit taxons 32
fongiques (I à VIII en rouge) de C. uvifera,
comparé à des séquences de référence
dans GenBank (en noir)
SOMMAIRE
INTRODUCTION 1
SYNTHESE BIBLIOGRAPHIQUE 3
1. Symbiose mycorhizienne 3
2. Symbiose ectomycorhizienne 6
2.1. Diversité des champignons ectomycorhiziens 6
2.2. Diversité des ECM 7
2.3. Caractérisation moléculaire de la
diversité fongique 8
2.4. Les ECM en milieu salé 10
2.5. Importance des réseaux ectomycorhiziens 10
3. Coccoloba uvifera L 11
3.1. Classification et description botanique 11
3.2. Origine et aire de distribution 13
3.3. Quelques usages de C. uvifera 13
3.4. C. uvifera et ses symbiotes 14
MATERIELS ET METHODES 16
1. Description du site 16
2. Plan d'échantillonnage 18
3. Morphotypage, fréquence et conservation des ECM 19
4. Extraction de l'ADN 19
5. Amplification de l'ITS par la réaction de
polymérase en cha»ne 20
6. Polymorphisme de longueur des fragments de restriction de
l'ITS 21
7. Séquençage de l'ITS 22
8. Analyse statistique 22
RÉSULTATS ET DISCUSSION 23
1. Diversité des sporophores 23
2. Diversité des morphotypes 24
3. Caractérisation moléculaire des MT et des
sporophores 27
CONCLUSIONS ET PERSPECTIVES 33
BIBLIOGRAPHIE 34
ANNEXES 41
INTRODUCTION
La symbiose ectomycorhizienne, une association mutualiste
entre les racines fines des arbres et des champignons du sol, se traduit par la
formation d'un organe mixte dénommé ectomycorhize (ECM), et par
l'apparition d'organes sporofères appelés sporophores ou
carpophores visibles à proximité de la plante hôte (Smith
& Read, 2008). L'ECM assure une bonne alimentation en eau,
macroéléments (p.ex. P, N, K) et oligo -éléments
(p.ex. Zn, Cu) de la plante hôte (Diédhiou et al., 2004;
Bandou et al., 2006; Quoreshi & Khasa, 2008). Elle
développe, pour ce faire, un réseau mycélien qui explore
un grand volume de sol, au-delà de la zone d'épuisement, et
mobilise ainsi les nutriments essentiels. En retour, la plante autotrophe
fournit au champignon hétérotrophe des photosynthétats
nécessaires à son métabolisme.
La symbiose ectomycorhizienne est surtout localisée
sous les latitudes tempérées et boréales, et concerne
environ 90% des espèces d'arbres de ces régions (Smith &
Read, 2008). Beaucoup d'arbres appartenant à la famille des
Pinaceae, Fagaceae, Betulaceae, Tiliaceae
et Salicaceae sont associés à une
diversité d'environ 15000 espèces de champignons ectomycorhiziens
appartenant à des Basidiomycota et Ascomycota. En
revanche, beaucoup moins d'arbres sont associés à des ECM dans
les régions tropicales et subtropicales (B%o et al., 2008; B%o
et al., 2009). Il s'agit de familles d'arbres originaires d'Australie
(p. ex. Myrtaceae, Casuarinaceae, Acaciaea), d'Afrique (p.ex.
Caesalpinioideae, Phyllanthaceae), d'Asie (p. ex.
Dipterocarpaceae, Caesalpinioideae) et d'Amérique du Sud (p.ex.
Caesalpinioideae, Nyctaginaceae, Polygonaceae).
Dans les écosystèmes forestiers, des champignons
sont capables de coloniser à la fois les racines des plantules et des
arbres-mères de la même espèce ou d'espèces
différentes, et d'établir ainsi des réseaux
ectomycorhiziens communs (Read & Smith, 2008). Par le biais des
réseaux ectomycorhiziens, les arbres établis peuvent aider les
plantules de deux façons : (1) les champignons déjà
nourris par les adultes représentent un inoculum peu couteux en
photosynthétats pour les plantules dont ils assurent la
régénération et la survie (Onguene & Kuyper, 2002;
McGuire, 2007), (2) des transferts d'eau, de substrats carbonés et
azotés sont possibles entre arbres matures et plantules en
régénération (Tedersoo et al., 2007 ; Warren
et al., 2008) ; de tels échanges sont bien établis chez
certaines plantes de sous-bois non chlorophylliennes dites
mycohétérotrophes ou des plantes mixotrophes qui, en plus de leur
photosynthèse, s'alimentent en C et N issus de plantes
photosynthétiques (Julou et al., 2005 ; Selosse et
al., 2006 ; Tedersoo et al., 2007).
Parmi les arbres des forêts néotropicales,
Coccoloba uvifera (L) est l'une des rares espèces à ECM
qui fait l'objet de plantations ornementales (p.ex. haies -vives) en bordure de
route et de plage sur les côtes atlantiques, caribéennes et
pacifiques de l'Amérique tropicale et subtropicale (Parrota, 1994;
Bandou, 2005). Cet arbre appartient à la famille des
Polygonaceae et doit son nom de Raisinier bord de mer (en anglais
Ç seagrape È) à son fruit comestible ressemblant à
des grappes de raisins. Il pousse souvent sur des sols salés et pauvres
en éléments minéraux. Il est associé à
plusieurs espèces de champignons ectomycorhiziens (Pegler, 1983 ; Miller
et al., 2000 ; Guzman et al., 2003; Bandou, 2005 ; Bessard
et al., 2008) avec lesquels ses racines forment des ECM, une
association symbiotique vitale pour la nutrition des plantes (Bandou et
al., 2006). En effet, les ECM jouent un rôle majeur sur la
croissance et l'adaptation des plantules de C. uvifera aux stress
salin et hydrique (Bandou et al., 2006). Un inventaire des sporophores
fructifiant sous le houppier de C. uvifera a été
réalisé en Guadeloupe (Bandou, 2005). Cet inventaire mycologique
devait être complété par un inventaire des ECM pour avoir
une bonne image de la diversité des communautés de champignons
ectomycorhiziens de C. uvifera. De plus, sous le houppier des
arbres-mères de cette espèce prolifèrent des plantules
issues de semis qui pourraient se lier aux réseaux ectomycorhiziens
préexistants. L'existence de réseaux ectomycorhiziens communs aux
arbres - mères et plantules pourrait contribuer à la
régénération naturelle par semis.
Notre étude avait pour but (i) d'évaluer
l'impact de la salinité sur les communautés de champignons
ectomycorhiziens des arbres-mères et des plantules de C.
uvifera, (ii) de déterminer à quel point les
arbres-mères et leurs plantules partagent un cortège
ectomycorhizien commun.
SYNTHESE BIBLIOGRAPHIQUE
1. Symbiose mycorhiñenne
Le terme de mycorhize vient de l'association de deux mots
grecs, Ç mykes È qui signifie champignon et
ÇrhizaÈ qui signifie racine (Gagné, 2005). Il fut
créé par Franck en 1885 pour définir l'organe mixte
plante-champignon. Les mycorhizes se définissent comme des associations
durables impliquant des échanges à bénéfices
réciproques, au sein de structures spécifiquement mises en place
par les partenaires de la symbiose au niveau des racines des
végétaux (Smith & Read, 2008). Elles favorisent l'absorption
par les racines des éléments minéraux de la
mycorhizosphère et améliorent ainsi la nutrition de la plupart
des espèces végétales. En retour, le végétal
fournit le carbone nécessaire sous forme de sucres issus de la
photosynthèse, à son partenaire fongique
hétérotrophe (Gagné, 2005). Dans la nature, l'état
de mycorhization est la règle et celui de la nonmycorhization est
l'exception (Strullu, 1991).
Les mycorhizes à arbuscules (MA) et les ECM sont les
principaux types de mycorhizes des écosystèmes forestiers et
cultivés (B%o, 2008). Elles se distinguent par leur structure et leur
morphologie (Tableau 1; Figure 1). Les MA ne sont pas visibles à l'oeil
nu. Elles sont éclaircies et colorées pour révéler
deux structures typiques observées en microscopie photonique : les
vésicules et les arbuscules. Les vésicules sont un lieu de
stockage des lipides nécessaires au métabolisme du champignon
alors que les arbuscules sont le lieu d'échanges entre les deux
partenaires de la symbiose. Les vésicules peuvent être
intraracinaires et extraracinaires. Les arbuscules sont intraracinaires
logées dans l'espace périplasmique de la cellule. Les ECM sont,
en revanche, visibles à l'oeil nu gr%oce à la couleur du manteau
fongique qui recouvre la racine (Figure 1). Les hyphes pénétrent
entre les cellules corticales pour former le réseau de Hartig, lieu
d'échanges bidirectionnels entre les deux partenaires.
Les MA, apparues en même temps que les
végétaux terrestres, concernent plus de 80% des taxons
végétaux. Les champignons sont des symbiotes obligatoires,
ubiquistes et rattachés au phylum des Glomeromycota. Les ECM,
d'apparition plus récente, sont associées à environ 5% des
plantes vasculaires. Les champignons sont des Basidiomycota et des
Ascomycota apparus plusieurs fois indépendamment à
partir des phylums de saprophytes (Hibbett et al., 2000). En
général, les forêts boréales sont dominées
par les arbres à ECM, les forêts tempérées par les
arbres à MA et
ECM, et les forêts tropicales humides par les arbres
à MA. Cependant, on trouve des peuplements d'arbres à ECM
dominants dans les forêts tropicales humides d'Asie du Sud-Est, d'Afrique
et d'Amérique du Sud (Torti et al., 2001 ; McGuire, 2007 ;
Rivière et al., 2007). Ces arbres sont des légumineuses
(Caesalpinioideae) associées également aux MA. Les ECM,
à cause de leur origine saprophyte, participeraient à la
décomposition de la matière organique et seraient donc plus
efficaces que les MA pour mobiliser les nutriments des sols pauvres (Smith
& Read, 2008).
Tableau 1. Les différents types de
mycorhizes
|
MA
|
ECM Ectendo-
mycorhizes
|
Mycorhizes arbuto
·des
|
Mycorhizes monotropo
·des
|
Mycorhizes érico
·des
|
Mycorhizes
orchido
·des
|
|
Champignons Hyphes
|
|
|
|
|
|
|
|
cloisons
|
-
|
+ +
|
+
|
+
|
+
|
+
|
|
Arbuscules
|
+
|
- -
|
-
|
-
|
-
|
-
|
|
Vésicules
|
+ ou -
|
- -
|
-
|
-
|
-
|
-
|
|
Pelotons
|
-
|
- +
|
+
|
+
|
+
|
+
|
|
Manteau
|
-
|
+ + ou -
|
+ ou -
|
+
|
-
|
-
|
|
Réseau de Hartig
|
-
|
+ +
|
+
|
+
|
-
|
-
|
|
Taxonomie
|
Glom.
|
Basidio. Basidio.
|
Basidio.
|
Basidio.
|
Asco.
|
Basidio.
|
|
|
Asco. Asco.
|
|
|
|
Asco.
|
|
|
Zygo.
|
|
|
|
|
|
Plantes hôtes
|
Bryo.
|
Gymno. Gymno.
|
Erica.
|
Monotropa.
|
Erica.
|
Orchida.
|
|
Pterido.
|
Angio. Angio.
|
|
|
Bryo.
|
|
|
Gymno.
|
|
|
|
|
|
|
Angio.
|
|
|
|
|
|
Photosynthèse + + + + ou - - + + ou -
MA= Mycorhizes à arbuscules; ECM= Ectomycorhizes; - =
absent; + = présent; + ou - = présent ou absent; Glom.=
Glomeromycota; Basidio.= Basidiomycota; Asco.= Ascomycota; Zygo. = Zygomycota;
Bryo. = Bryophyte; Pterido. = Pteridophyte; Gymno. = Gymnosperme; Angio. =
Angiosperme; Erica. = Ericaceae; Monotropa. = Monotropaceae; Orchida. =
Orchidaceae. (Smith & Read, 2008).
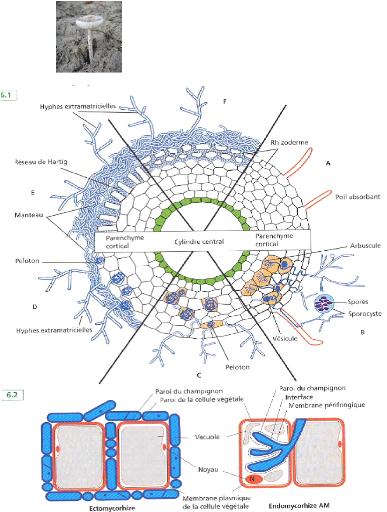
Sporophore
Figure 1. Principaux types d'associations
symbiotiques entre des champignons (en bleu) du sol et des racines de
végétaux; (A) racine sans mycorhize, (B) endomycorhizes à
vésicules et à arbuscules, (C) endomycorhizes à pelotons,
(D) ectendomycorhizes, (E) ectomycorhizes chez les Angiospermes, (F)
ectomycorhizes chez les Gymnospermes (Duhoux & Nicole, 2004).
2. Symbiose ectomycorhizienne
2.1. Diversité des champignons
ectomycorhiziens
Les champignons ectomycorhiziens sont présents dans le
sol sous forme de propagules de conservation et de dissémination (p.ex.
spores, vieilles mycorhizes, cordons mycéliens) (Bâ et
al., 1991). C'est sous ces différentes formes que les champignons
se maintiennent dans le sol à l'état de vie ralentie en
période sèche notamment. Quand les conditions sont favorables en
période humide, les propagules produisent des hyphes qui poussent et se
ramifient pour donner un mycélium capable de coloniser le système
racinaire pour former des ECM. La germination des propagules marque le
début du cycle de développement des Basidiomycota
auxquels appartient la plupart des champignons ectomycorhiziens. Ce cycle
se résume en deux phases principales: une phase végétative
comprenant la formation et le développement du mycélium ou thalle
à partir de la germination des spores, et une phase fructifère
marquée par l'apparition de sporophores épigés ou
hypogés, et la production de spores.
Chez les champignons supérieurs, le sporophore est la
partie visible de l'organisme que l'on appelle couramment Ç champignon
È. Il est constitué de filaments ou d'hyphes groupées en
amas ou mycélium. La présence de sporophores est associée
automatiquement à la présence de mycélium à la base
du pied, mais l'absence de sporophores ne signifie pas nécessairement
l'absence de mycélium dans le sol. Le sporophore, constitué d'un
chapeau et d'un pied, est un organe éphémère oü se
déroule la reproduction sexuée.
Les champignons ectomycorhiziens sont des symbiotes
obligatoires qui bouclent leur cycle de développement en fructifiant
notamment grâce aux ECM qu'ils contractent avec la plante hôte. La
formation de sporophores requiert donc la présence d'ECM alors
qu'à l'inverse on peut observer des ECM sans sporophores correspondants.
En effet, des champignons comme Thelephora et Cenoccocum
forment des ECM avec peu ou pas de fructifications et sont souvent
dominants sur les racines de leurs plantes hôtes (Henkel et al.,
2002 ; Diédhiou et al., 2004). La fructification des
champignons est un processus complexe et coüteux en énergie pour la
plante, qui dépend de l'espèce de champignon, de facteurs
climatiques, de l'âge des peuplements et de traitements sylvicoles (p.ex.
fertilisation, éclaircies). La formation de sporophores, difficile
à obtenir en conditions contrôlées, dépend du
champignon impliqué, de la qualité du substrat, des conditions de
culture (p.ex. humidité, lumière, température) et de la
production de métabolites par la plante hôte.
Hebeloma cylindrosporum en symbiose avec Pinus
pinaster, fructifie in vitro sur un milieu de culture
approprié et dans des conditions de lumière et de
température bien définies (Débaud & Gay, 1987).
Dans la nature, les sporophores épigés sont la
manifestation visible de la présence d'une espèce donnée
en symbiose avec une ou plusieurs plantes hôtes. Dans la plupart des cas,
les sporophores sont d'apparition fugace de quelques heures à quelques
jours, rarement davantage. Leur apparition fluctue d'une année à
une autre selon l'état hydrique du sol et l a périodicité
des cycles biologiques des champignons souvent méconnus. L'inventaire
des sporophores hypogés pose davantage de problèmes que les
épigés dans la mesure oü ils sont souterrains et non
visibles. Ils sont en général sous -évalués dans
les inventaires mycologiques. Pour avoir un inventaire exhaustif de la fonge
d'un biotope donné, il faut compter plusieurs récoltes
étalées sur 7 à 10 ans au moins (Guinberteau &
Courtecuisse, 1997).
Dans les régions boréales et
tempérées, de nombreuses communautés de champignons
ectomycorhiziens ont été décrites sur la base
d'inventaires de sporophores (Ferris et al., 2000). L'avantage de
cette approche réside dans la simplicité d'échantillonnage
avec peu de perturbation du milieu et dans l'identification de l'espèce
fongique à partir de la description du sporophore. Elle a cependant
l'inconvénient de nécessiter plusieurs récoltes dans
l'année, et d'une année à une autre pour prendre en compte
les champignons résupinés peu visibles dans les
écosystèmes forestiers (Erland & Taylor, 1999). Malgré
tout, on estime que la diversité des sporophores de champignons
ectomycorhiziens est comprise entre 10000 et 15000 espèces (Smith &
Read, 2008). Ce chiffre est loin d'être exhaustif car il ne prend pas en
compte la diversité encore peu connue des champignons des régions
tropicales. Les champignons sont le plus souvent des Basidiomycota
(p.ex. Russules, Lactaires, Amanites, Bolets, Girolles) et plus rarement
des Ascomycota (p.ex. Truffes, Cenoccocum). Certains
champignons sont comestibles et à forte valeur ajoutée (p.ex.
Truffes, Matsutake).
| 


