INTRODUCTION
I. INTRODUCTION
Selon l'Institut Nationale (Français) de Santé
et de Recherche Médicale (INSERM) le paludisme est en 2007 le
problème de santé publique le plus grave malgré
l'existence des mesures préventives et curatives. L'ampleur du
problème que pose cette parasitose mondiale est
régulièrement l'objet de publications de l'Organisation Mondiale
de la Santé (OMS). C'est ainsi qu'en 2009, la directive OMS sur le
paludisme dans le Monde estime qu'entre 300 à 500 millions de cas sont
enregistrés chaque année, causant entre 1,5 et 2,7 millions de
morts ; soit un rythme d'un mort toutes les 30 secondes. C'est un
véritable fléau des régions tropicales chaudes d'Afrique,
d'Amérique et d'Asie où la maladie sévit de façon
quasi-permanente. Selon l'OMS, en 2009, le paludisme est endémique dans
109 pays. Ces pays se trouvent également être parmi les plus
pauvres de la planète «Ceinture de la pauvreté »
(Gentilini et al, 1995). Quarante-cinq (45) de ces 109 pays sont
situés en Afrique sub-saharienne et concentrent à eux seuls
près de 90% de l'incidence palustre total (OMS, 2009). Le paludisme
représente un lourd fardeau économique pour les populations des
régions affectées et par conséquent, constitue un obstacle
au développement de ces pays. Le plus lourd tribut de cette maladie
toujours selon l'OMS (2006) est payé par les enfants de moins de 5 ans
(environs un million de décès annuel).
Au Cameroun, cette maladie demeure un
problème majeur de santé publique. En effet, en 2010, il
était encore responsable de 40,1% de la morbidité
hospitalière générale et de 40% de mortalité chez
les < 5ans. Deux millions de cas sont enregistrés dans les formations
sanitaires chaque année mais on estime que 80% de ces cas n'arrivent pas
dans les formations hospitalières (MSP, 2010). Elle représentait
40% des dépenses des ménages pour la santé et 1,3% de
perte sur le taux de croissance en 2007, selon le Ministère de la
santé publique (MSP). Ici, plus de 90 % des cas de paludisme, sont dus
à P. falciparum, (MSP, 2007). Dans la région Ouest du
pays, où la transmission du paludisme est certes permanente mais
inconstante, on estime qu'entre 91,5% et 96% des cas sont dus à P.
falciparum (www.impact-malaria.com). La stratégie de prise en
charge du paludisme est calquée sur les recommandations de l'OMS. A
l'origine, elle s'appuyait essentiellement sur un diagnostic basé
avant tout sur les symptômes cliniques, notamment la fièvre
même si la confirmation au laboratoire restait souhaitée (Lallo et
Naraqi, 1992 ; Zurovac et al, 2006). Mais cette stratégie
étale ses limites avec l'apparition de la chloroquino-résistance
dans la plupart des pays où sévit P. falciparum dont le
Cameroun. Au début des années 2000, avec l'introduction des
combinaisons thérapeutiques à base d'arthémisinine (ACT)
plus chères et la part de plus en plus croissante des affections
fébriles non palustres (Sayang et al, 2009 ; Munier
et al, 2009), l'OMS revoit sa stratégie. Dans ses
directives 2006 et 2010, elle recommande la confirmation parasitologique rapide
de tout cas clinique avant mise sous traitement sauf là où cela
n'est pas possible. Cette confirmation au laboratoire devient une exigence
alors même que la difficulté à rendre disponible une
microscopie de qualité (examen de référence) demeure. En
effet, cette microscopie de qualité est relativement contraignante. Ce
qui en limite l'accès (Msellen et al, 2009) comme par exemple
au Cameroun où plus de la moitié des cas déclarés
ne sont pas confirmés biologiquement et où on note une forte
tendance des populations à l'automédication (MSP, 2010). Par
ailleurs des études faites par Durrheim et al (1997) ont
montré que quand bien même les laboratoires sont correctement
équipés et les techniciens bien formés, les
résultats des examens microscopiques diffèrent de façon
significative. Mais, avec le développement des tests de diagnostic
rapides (TDR) au début des années 90, l'OMS recommande dans
certaines circonstances particulières, leur usage comme alternative
crédible à la microscopie classique (WHO, 2004 ; WHO,
2006 ; Wonsrichanalai et al, 2007 ; WHO, 2008 ; Lubell
et al, 2008)
A ce jour, de nombreuses études ont été
publiées sur l'évaluation des performances des TDR à
travers le monde avec des résultats très variables selon les
fabricants, les contextes, les régions et les populations
d'études. Pour ne prendre que le cas des TDR ciblant la HRP2, le
tableau en annexe 8 résume une
série de résultats d'études des performances du
TDR-Paracheck®-Pf dans différentes conditions de terrain. La
dispersion des résultats publiés pour ces tests pourtant produits
par une seule et même firme en dit long sur la complexité qu'il y
a à faire le choix d'un TDR du paludisme parmi des très nombreux
existants produits par différentes firmes. En effet, les performances de
ces tests sont outre les conditions environnementales influencées par la
variabilité génétique de la HRP2 utilisée dans sa
mise au point (Baker et al, 2005). La HRP2 présente chez
différentes souches de P. falciparum est polymorphe et donc pas
identiques dans toutes les régions. Par exemple, dans l'étude
réalisée par Koïta en 2000, 2,5% des espèces de
P. falciparum présentes au Mali n'ont pas la HRP2 ciblée
par le TDR-Parasight® (AMOS, 2005). D'autres raisons telles que la
présence des facteurs rhumatoïdes, la présence des certains
anticorps (Ac) peuvent influencer les résultats de ces tests.
De la dizaine de TDR en circulation sur le marché
Camerounais, celles ciblant la HRP2, à l'instar du
Diaspot®-Malaria-pf sont les plus disponibles par rapport
à ceux ayant pour cible la pLDH (spécifique à toutes les
espèces plasmodiales). S'ils ont le défaut majeur de ne pouvoir
détecter que P. falciparum seul, ils sont en
général réputés relativement plus sensibles et
moins coûteux (Swartout et al, 2007 ; WHO, 2006) que ces
derniers.
Quelques études sont disponibles sur
l'évaluation des TDR au Cameroun par rapport au « gold
standard » qu'est la GE. Bechem et al en 1999 ont
trouvé une sensibilité de 98% et une spécificité
de 88,8% par rapport à la goutte épaisse (GE) dans une
étude ayant évalué un TDR (HRP2) sur une population
d'enfants. Une autre étude réalisée à
Yaoundé par Sayang et al (2009) a attribué au
Diaspot®-Malaria-Pf (HRP2) une sensibilité de 71,12% et
une spécificité de 82,2% avec des Valeurs prédictives
positives (VPP) et négatives (VPN) de 73,8% et 80,4% respectivement.
Quant à l'étude menée par Wanji et al en 2008 au
Mont-Cameroun, elle a établi que Hexagon®-(pLDH) avait une
sensibilité de 85,3% et une spécificité de 95,5%. Il faut
noter que ces études ont généralement évalué
des TDR produits par différentes firmes avec des antigènes (Ag)
cibles différents, tout comme les populations cibles et les tailles
d'échantillon utilisées. A notre connaissance, aucune
étude évaluant les performances d'un TDR (HRP2) en l'occurrence
le Diaspot®-Malaria-Pf n'a encore été menée
à Bafoussam.
La présente étude a été
conçue pour comparer les performances du
Diaspot®-Malaria-Pf dans le diagnostic biologique du paludisme
à Bafoussam par rapport à la GE classique réalisée
dans les conditions standards. Une sensibilité > 95% est
exigée par l'OMS (2000) pour juger un TDR satisfaisant.
Plus spécifiquement, il s'est agi de :
Déterminer la Prévalence du Paludisme dans
notre population d'étude.
- Faire une comparaison opérationnelle des deux
méthodes de diagnostic (GE et Diaspot®-Malaria-Pf)
- Déterminer les caractéristiques
intrinsèques du Diaspot®-Malaria-Pf par rapport à
la GE à savoir : la sensibilité (Se) et
spécificité (Sp)
- Déterminer les caractéristiques
conditionnelles du Diaspot®-Malaria-Pf par rapport à la GE
savoir : la valeur prédictive positive (VPP) et la valeur
prédictive négative (VPN).
REVUE DE LA LITTERATURE
II. REVUE DE LA LITTERATURE
1. Définition et historique
Le paludisme (du latin Paludis =
« Marrais » en français) encore
appelé malaria (anglo-saxons) est la
maladie
infectieuse à transmission vectorielle la plus rependue et la plus
meurtrière au monde (Poinsignon, 2008). Elle est essentiellement
présente dans les régions chaudes tropicales d'Afrique,
d'Amérique latine et d'Asie où les conditions climatiques et
environnementales sont favorables au développement des moustiques,
notamment les anophèles femelles, uniques vecteurs du Plasmodium
spp. C'est avant tout une affection humaine. Cependant, les
Plasmodium infectent également les oiseaux, les reptiles, les
singes, les chimpanzés et les rongeurs (animaux à sang chaud)
(Escalante et Ayala, 1994 ; Cox-Sigh et al,
2008).
La cause de la maladie a été découverte
en
1880 à
Constantine (
Algérie) par un
médecin de l'armée française,
Alphonse
Laveran, qui reçut le
prix Nobel de
médecine et de physiologie en
1907 (Petithoty et
Ardoin-Guidon, 2001). L'anglais
Ronald Ross prouva en
1897 que les moustiques anophèles étaient les vecteurs de la
malaria (jusqu'à cette date, le mauvais air émanant des
marécages était tenu responsable de la propagation de la maladie)
(Petithoty et Ardoin-Guidon, 2001 ; INSERM, 2007).
2. Epidémiologie
1.1. Agents pathogènes.
Le Plasmodium, agent du paludisme est un protozoaire
très petit (1 à 2
uL selon les formes).
Après coloration au
Giemsa, il se
présente sous la forme d'un
cytoplasme bleu
pâle entourant une
vacuole nutritive incolore
et contenant un noyau rouge la plupart du temps annulaire (Bague de chaton).
Des espèces à ce jours responsables du paludisme humain, P.
knowlesi ; de découverte assez récente, est en fait une
espèce simienne capable cependant d'infester l'Homme (Escalante et
Ayala, 1994). Les 5 espèces de Plasmodiums humains sont :
§ Plasmodium falciparum ; premier agent
causal du paludisme à être découvert. Il est
également l'espèce la plus rependue dans les régions
chaudes et humides seulement et surtout le plus redoutable et le seul
véritablement meurtrier. Des grands singes d'Afrique centrale, notamment
certains Gorilles en seraient des réservoirs (Liu et al,
2010)
§ Plasmodium malaria, agent de la fièvre
quarte, a une distribution clairsemée et coexiste souvent avec P.
falciparum sous les tropiques.
§ Plasmodium ovale est responsable de la
fièvre tièrce bénigne, très proche de P.
vivax avec lequel il a été longtemps confondu.
§ Plasmodium vivax est plus largement rependue
que P. falciparum mais moins en densité (OMS.2006)
§ P. knowlesi, affectant originellement les
singes, il est responsable de fièvre quartane chez l'homme avec des
manifestations relativement graves du fait de son cycle de
développement court. Sa ressemblance avec P. malariae justifie
le fait qu'il ait été longtemps confondu avec ce dernier et que
sa découverte en Asie du Sud-est (Malaisie, Thaïlande,
Philippines, etc.) soit assez récente (Cox Singh et al, 2008).
Au Cameroun, la distribution des différentes
espèces de Plasmodium varie selon les faciès
épidémiologiques (Tableau 1). P.
falciparum domine le tableau (plus de 90%) alors que P. malariae
et P. ovale se rencontrent dans moins de 10% des cas. (MSP,
2008 ; Impact-malaria).
Tableau 1. Distribution et fréquence
des 3 espèces de Plasmodium au Cameroun
|
Faciès épidémiologiques
|
P. falciparum
(%)
|
P. malariae
(%)
|
P. ovale
(%)
|
|
Faciès sahélien
|
100
|
0
|
0
|
|
Adamaoua
|
93,6 - 98,7
|
0 - 6,4
|
0 - 1,3
|
|
Transition savane - forêt
|
89,8 - 100
|
4,3 - 8,4
|
0 - 1,8
|
|
Faciès forestier
|
62,0 - 96,3
|
0,6 - 3,0
|
1,1 - 35,0
|
|
Faciès d'altitude
|
91,5 - 96,0
|
1,7 - 7,0
|
0 - 6,8
|
|
Faciès littoral
|
97,7 - 100
|
0 - 0,7
|
0 - 2,30
|
Sources : (www.impact-malaria.com,
2010)
1.2. Agents vecteurs et modes de
transmission.
1.2.1. Les agents vecteurs
Le paludisme est transmis par un arthropode du genre
Anophelus (Figure 1), dont la
classification anatomique selon Amos (2005) est la suivante :
- Ordre : Diptera
- Famille : Culicidae
- Sous- famille : Anophelinae
- Genre : Anophelus
Plus de 500 espèces dont une soixantaine ont la
capacité de transmettre le paludisme humain. Elles sont dites «
compétentes ». (www.impact-malaria.com). Les
espèces les plus redoutables sont anthropophiles. La reproduction des
anophèles exigent du sang, de l'eau et de la chaleur. Leur cycle
gonotrophique (qui va du repas sanguin à la ponte puis à la
recherche d'un nouvel hôte) dure 48 à 72 heures en moyenne dans
les régions tropicales. Seules les femelles sont hématophages et
mènent une activité nocturne avec pour certain des pics de
piqures entre 23 heures et 3 heures du matin (Poinsignon, 2009). Leur
distribution spatiale dépend des facteurs environnementaux ou
artificiels. Elle se superpose très logiquement à la distribution
du paludisme dans le monde. Tous n'ont pas la même capacité
vectorielle (capacité à transmettre l'agent causal du paludisme).
Il existe des espèces endophages et endophiles (ont la
préférence de piquer dans les maisons). Les principaux
anophèles vecteurs rencontrés dans les régions de forte
endémicité palustres et au Cameroun en particulier sont : An.
gambiae ss, An. arabiensis, An. funestus, An. moucheti, An. nili et An.
pharoensis. Ils sont responsables de la grande majorité des
transmissions palustres. (www.impac-malaria.com)
1.2.2. Modes de transmission.
Le principal mode de transmission du paludisme est le fait du
vecteur biologique (Anophèle femelle infesté) qui inocule par
piqure (Figure 1.) et ce, pendant son repas sanguin les
Plasmodiums (sporozoïtes) à une personne saine.

Figure 1. : Anophèle femelle prenant son
repas sanguin
Source : (Photo : Institut Pasteur)
http://www.rfi.fr/actufr/articles/052/article_27474.asp
D'autres formes de transmissions moins importantes mais
suffisantes pour être signalées existent notamment :
- Par transfusion du sang d'un donneur infesté
à un receveur sain. Les manifestations cliniques ici surviennent assez
rapidement car la phase hépatique est shuntée !
- La transmission verticale par voie trans-placentaire d'une
mère impaludée vers son enfant. On parlera dans ce cas de
paludisme congénital.
- Les autres formes notamment par accident d'exposition au
sang (AES) ainsi que chez les toxicomanes sont exceptionnelles (Petithory et
Ardoin-Guidon, 2001)
1.3. Cycle parasitaire.
C'est un cycle qui comporte trois étapes dont deux chez
l'Homme et une chez l'Anophèle femelle (CDC, 2010)
www.dpd.cdc.gov (Figure
2)
Ø Chez l'Homme
On note ici deux stades :
Le stade tissulaire ou schizogonie
hépatique ou cycle exo-érythrocytaire : ici le
moustique va injecter les sporozoïtes contenus dans ses
glandes salivaires dans le système circulatoire de l'Homme. Ceux-ci vont
se développer dans le foie jusqu'au stade
mérozoïtes.
Le stade sanguin ou Schizogonie
érythrocytaire : Les
mérozoïtes libérés par
hépatolyse vont infecter les hématies, se transformant alors en
trophozoïte lesquels se multiplieront dans les globules
rouges (GR) en passant par plusieurs stades (Schizontes,
rosaces) rouges jusqu'à éclatement de ces
derniers. C'est d'ailleurs l'éclatement synchrone des hématies
bourrées (Rosaces) qui explique l'aspect fébrile et les frissons
à ce stade. Après plusieurs cycles, il y a formation des
gamétocytes (formes sexuées qui infesteront le
moustique).
Ø Chez l'Anophèle femelle (Cycle
sporogonique)
En prenant son repas sanguin chez l'Homme infesté par
les gamétocytes mâle et femelle,
l'anophèle ingère avec ses GR et les autres formes parasitaires,
les formes infestantes de Plasmodium spp. Seuls ces derniers
poursuivront leur développement dans l'intestin de celui-ci jusqu'au
stade sporozoïte infestant pour l'Homme en 18 jours.
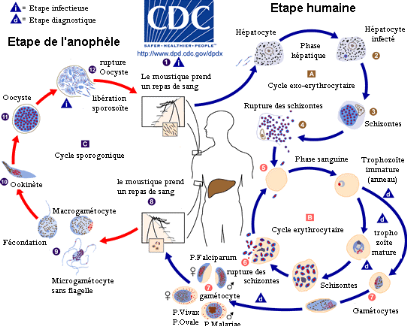
Figure 2 : Cycle Biologique de
Plasmodium spp
Source : (
www.dpd.cdc.gov/dpdx)
2.4. Répartition
géographique.
Le paludisme est une affection cosmopolite, Cependant, c'est
une endémie majeure dans les zones tropicales chaudes et humides de
l'Afrique, d'Amérique et d'Asie (Gentillini et al, 1995). La
figure 3, représente la cartographie de la distribution
globale du paludisme dans le monde en 2006 selon l'OMS.
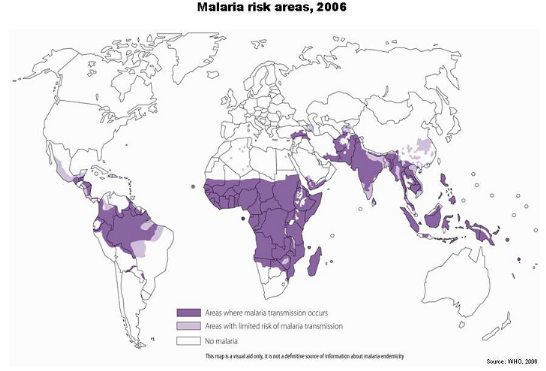
Figure 3 : Répartition mondiale du
paludisme
Source : (WHO, 2006)
3. Clinique du Paludisme.
Cliniquement, on distingue de façon globale le
paludisme simple et le paludisme grave ou compliqué.
3.1. Le paludisme simple.
Le type classique est celui décrit dans la
physiopathologie du paludisme simple avec la triade successive frissons -
chaleur - sueur accompagnés de fièvres périodiques.
(Tierce ou quarte). En absence de traitement deux évolution sont
possibles : Splénomégalie et anémies ou alors en cas
de P. falciparum, le passage vers un tableau critique : le
paludisme grave. (ANOFEL, 2002).
Dans la pratique, le paludisme simple ne manifeste pas
toujours de façon classique. Ses principaux signes en plus de la
fièvre sont :
|
§ Frissons
§ Céphalées
§ Courbatures
§ Arthralgies
|
§ Myalgies
§ Douleurs abdominales particulièrement chez
l'enfant
§ Troubles digestifs.
|
3.2. Le paludisme grave
Selon l'OMS (2006), On parle de paludisme grave lorsqu'un
malade avec une parasitémie des formes asexuées de P.
falciparum, présente une ou plusieurs caractéristiques
cliniques ou biologiques suivantes
|
Manifestations cliniques
|
Signes biologiques
|
o Prostration
o Troubles de conscience
o Détresse respiratoire (Acidose)
o Convulsions multiples
o Collapsuscardio-vasculaire
o OEdème pulmonaire
o Saignement anormal
o Ictère
o Hémoglobiurie
|
o Anémie sévère
o Hypoglycémie
o Acidose
o Insuffisance rénale
o Hyperlactatémie
o Hyperparasitémie.
|
Source : (OMS, 2006)
3.3. Autres particularités du
paludisme
Le paludisme viscéral
évolutif ; de la fièvre bilieuse
hémoglobinurique sont des formes particulières assez
graves de Paludisme à P. falciparum mais non classées
comme paludisme grave (ANOFEL, 2002). La néphrite
quartane est une néphropathie glomérulaire chronique
d'origine palustre survenant chez l'enfant avec syndrome néphrotique.
Elle est le fait de P. malariae, (ANOFEL, 2002)
Les enfants < 5ans et les femmes enceintes sont les deux
groupes les plus vulnérables au paludisme en zone
d'endémicité palustre. Ceci s'explique pour les premiers par le
fait que le paludisme profite de la disparition de la protection du
nouveau-né par les anticorps maternels vers l'âge de 3 mois.
L'enfant doit alors se défendre avec ses propres armes. Il lui faut
alors du temps pour élaborer ces armes et pendant ce temps la maladie
fait des dégâts. S'il ne meurt pas, il acquiert progressivement
une immunité labile et incomplète, au prix de nombreux
accès palustres graves. Le traitement de cette tranche d'âge est
urgent et vital (OMS, 2006).
En ce qui concerne la femme enceinte, elle est exposé
au risques de paludisme grave surtout vers le 3ème trimestre
de la grossesse avec des risques sérieux d'avortement, d'accouchements
prématurées, de mort in utéro et de bébé de
faible poids à la naissance.
Le paludisme et l'infection à VIH/SIDA sont deux
problèmes majeurs de santé publique, notamment en Afrique
subsaharienne. L'infection par le VIH augmente l'incidence des accès
palustres d'autant que l'immunodépression est profonde (OMS, 2006)
4. DIAGNOSTIC BIOLOGIQUE DU PALUDISME.
Pour souligner l'importance de cette partie, rappelons cette
citation d'un imminent spécialiste des maladies tropicales,
le Professeur Pierre Aubry (2010) :
« Nos connaissances sur le paludisme doivent être simples
mais leur application doit être rigoureuse. Il n'existe pas de signe
pathognomonique du paludisme. Il n'existe pas de manifestations cliniques du
paludisme sans parasitémie. ». C'est dire si le
diagnostic de certitude du paludisme est avant tout parasitologique !
Les arguments indirects basé sur les variables
cliniques (fièvre...) et biologiques (anémie, hyperleucocytose,
thrombopénie, hypoglycémie ...), n'ont qu'une valeur orientative
même si dans certains cas (enfants < 5ans et cas graves en
région de forte endémicité), on doit s'y fier (WHO,
2004 : WHO, 2006 ; WHO, 2008)
Le diagnostic du paludisme commence d'abord et avant tout par
une symptomatologie clinique fortement évocatrice qui conduit vers la
recherche de l'agent causal qui est le Plasmodium.
Cinq méthodes ou techniques sont aujourd'hui
utilisées dans le domaine de la recherche ou en diagnostic de routine
pour la détection des différentes espèces
de Plasmodium dans le sang.
4.1. La Méthode microscopique
classique.
C'est la méthode de référence selon
l'OMS. Elle implique la réalisation de 2 techniques
complémentaires dans l'idéal à savoir la Goutte
épaisse (GE) et le Frottis mince (FM). Dans les deux cas, une goutte de
sang est étalée sur une lame (goutte plus fine pour le FM). Les
étalements sont colorés ensuite selon des méthodes
codifiées et validées et après séchage, ils sont
examinés au microscope à fort grossissement. Différentes
espèces de Plasmodium peuvent ainsi être
identifiées et quantifiés à différents stades de
leur développement (trophozoïtes, schizontes, gamétocytes)
par un microscopiste formé (OMS, 1994)
4.2. Les techniques immunochromatographiques ou Tests
de Diagnostic Rapides (TDR).
Elles sont basées sur la détection des
antigènes (Ag) spécifiques de Plasmodium spp dans le
sang à partir des anticorps (Ac) monoclonaux spécifiques d'une ou
plusieurs espèces de Plasmodium. Trois protéines
spécifiques de certaines formes parasitaires de plasmodium
appelées Ag pour la circonstance sont détectées par les
TDR avec en général apparition de deux bandes rouges (P.
falciparum seul) ou trois bandes rouges (P. falciparum et autres
Plasmodiums) selon les tests, témoignant ainsi de la
présence d'une ou de plusieurs espèces de plasmodium dans le sang
à tester.
Ces tests ont l'avantage d'être simple d'usage,
permettent de rendre les résultats dans un délai relativement
court (moins de 20 minutes), permettent une meilleure standardisation des
résultats. Leur sensibilité varie selon fabricants et les
études mais certains ont une sensibilité et une
spécificité que l'OMS (2006) juge acceptables (> 95%). Mais
ils ne sont pas quantitatifs et ont des caractéristiques liées
aux types d'Ag ciblés dont on devrait tenir compte au moment du choix du
type de TDR.
4.3. Les techniques utilisant la microscopie à
fluorescence
Les exemples les plus connus sont le QBC® (Quantity
Buffy Coat) et plus récemment le Cyscope®.
Le QBC® fonctionne sur le principe suivant : Le
sang est prélevé dans un tube micro-hématocrite contenant
un fluorochrome (acridine orange) et un flotteur. L'acridine se fixe alors sur
l'ADN des différents Plasmodiums. Après une
centrifugation à grande vitesse, ce flotteur qui se trouve dans la zone
de densité correspondant à celle des hématies
parasitées ne laisse qu'un film d'hématies entre lui-même
et la paroi du tube, ce qui permet d'examiner cette zone à l'aide d'un
dispositif adapté comme le microscope à fluorescence
Sa sensibilité est bonne ; elle
permet de poser le diagnostic d'espèce. Mais il
nécessite un appareillage (microscopes et réactifs) coûteux
et demande un certain entrainement du technicien.
4.4. Les technique de biologie
moléculaire / Polymerise Chain Reaction (PCR)
Elle consiste à amplifier l'ADN du Plasmodium
spp à partir d'un échantillon de sang prélevé
afin de le rendre détectable. Ce sont donc des méthodes
très sensibles et très spécifiques mais leur mise en place
est limitée par leur coût élevé et la
nécessité des compétences particulières des
techniciens (Snounou et al, 1993).
4.5. Les Méthodes
sérologiques
Elles consistent à rechercher les anticorps
spécifiques des espèces plasmodiales par différentes
techniques telles que l'ELISA, l'Immunofluorescence Indirecte (IFI) etc. Elles
peuvent avoir un intérêt épidémiologique dans les
régions où le paludisme est sporadique mais ne sont pas d'usage
dans les régions d'endémicité où la plupart des
habitants sont relativement immunisés.
5. TRAITEMENT ET PROPHYLAXIE DU PALUDISME.
Ø Le traitement du paludisme simple au
Cameroun comme dans la plupart des pays touchés par le paludisme,
notamment celui à P. falciparum est calqué sur les
recommandations de l'OMS (2006). Il préconise l'utilisation des
différentes combinaisons d'Artemisinin based Combination Therapy (ACT)
en trois jours de prise en association avec un antipyrétique
(Paracétamol® ou Aspirine®) à des doses convenables
(OMS, 2006 ; MSP, 2007). Quatre ACT sont actuellement
recommandées.
· artéméther+luméfantrine,
· artésunate + amodiaquine,
· artésunate + méfloquine,
· artésunate +
sulfadoxine-pyriméthamine.
Ø La prise en charge du paludisme
grave est une urgence. Le traitement de choix ici l'administration de
la quinine par voix parentérale (généralement en
perfusions de glucosée 5% ou 10%). Les dérivés de
l'artémisinine (Paluther®) par voie injectable aussi sont
recommandés surtout quand le patient est allergique à la
quinine.
Il faut noter que les monothérapies
antipaludéennes à base de chloroquine, de
Sulfadoxine-Pyriméthamine (n'est pas considéré par l'OMS
comme une bi-thérapie), et bien d'autres restent d'usage dans certaines
régions.
Ø Faute de vaccins disponibles, la prophylaxie
antipaludéenne associe à la fois des actions individuelles et
collectives notamment, la lutte anti-vectorielle, l'utilisation des
moustiquaires imprégnées d'insecticides (MII) et des
répulsifs, le traitement préventif intermittent (TPI),
réservé aux femmes enceintes, l'assainissement de l'environnement
y compris la destruction des gîtes larvaires et la prévention chez
les voyageurs par une chimio-prophylaxie appropriée et l'utilisation des
répulsifs. (OMS, 2006 ; MSP, 2007).
6. PROTOCOLES DU DIAGNOSTIC PARASITOLOGIQUE DU
PALUDISME EN ROUTINE
Les deux méthodes en usage pour le diagnostic
parasitologique du paludisme sont l'examen au microscope optique classique et
les tests de diagnostic rapide (TDR) (Wongsrichanalai et al, 2008).
L'examen microscopique a l'avantage d'être peu
coûteux, très sensible et très spécifique lorsqu'il
est utilisé par un personnel rompu à son usage et dans les
conditions idéales.
Les TDR qui servent à la détection des
antigènes parasitaires sont généralement plus
coûteux, mais les prix de certains de ces produits ont récemment
baissé dans des proportions qui font que leur déploiement est
rentable dans certaines situations. Leur
sensibilité et leur spécificité sont variables et leur
vulnérabilité aux températures élevées et
à l'humidité est un inconvénient important (WHO, 2008)
6.1. Protocole du diagnostic microscopique classique
6.1.1. Prélèvement.
Le prélèvement doit se faire au moment de
l'acmé thermique dans la mesure du possible soit par ponction capillaire
(Pulpe du doigt, gros orteil etc.) avec confection immédiate du frottis
mince (FM) et de la goutte épaisse (GE), soit par ponction veineuse sur
anticoagulant approprié (par exemple l'EDTA) et réalisation
secondaire des étalements sur lames. C'est acte de soins et à ce
titre sa pratique doit respecter les règles de bonnes pratiques de
prélèvements notamment en ce qui concerne les mesures à
prendre pour éviter tout accident d'exposition au sang (AES) . Les
plus importantes sont le port équipements de protection personnelle
(gant et blouse) et l'utilisation d'un matériel à usage
unique.
6.1.2. La confection des étalements sanguins
(GE et FM) et Coloration.
Ø Confection d'une GE.
o Prélever une grosse goutte de
sang capillaire ou veineux sur EDTA.
o Étaler une grosse goutte de sang au centre d'une lame
propre
o A l'aide du coin de la deuxième lame, étaler
la goutte sur 1 cm de diamètre en tournant pendant quelques secondes
(Figure 4, à droite)
o Etiqueter et laisser sécher à l'abri des
poussières et de la chaleur, ne jamais
fixer. Ce séchage peut prendre plusieurs heures
sauf si on ne dispose pas d'une étuve
Ø Confection d'un frottis mince.
o Prélever une goutte de sang mais plus petite que
précédemment
o Déposer la au milieu du premier 1/3 d'une lame bien
propre et dégraissée déposée sur un plan
horizontal.
o Glissez une seconde lame aux bords rodés (ou une
lamelle) faisant une inclinaison d'environs 45 degrés avec la lame
première, sur la première, laisser le sang s'étaler sur la
largeur puis tirer d'un coup sec. (le résultat c'est que nous obtenons
un étalement de sang qui, épais au début du frottis
s'aminci au fur et à mesure qu'on arrive vers la queue.)
o Tenant la lame par la queue du frottis, secouer la
vigoureusement à l'air (ainsi le FM sèche rapidement). Puis
à l'aide d'un crayon à mine, étiqueter le FM sur sa partie
la plus épaisse (Figure 4, à gauche).

Figure 4. : Etalements sanguins prêts pour la
coloration.
Source :
www.bioltrop.org
Ø Coloration des GE :
(Annexe 5)
Ø Coloration des FM :
(Annexe 4)
La coloration de référence des FM est celle au
May Grünwald-Giemsa (MGG)
6.1.3. Lecture des étalements
sanguins
6.1.3.1. Lecture des GE.
La lecture de la GE se fait à l'objectif 100 et
à immersion. Les hématies ayant été presque toutes
détruites, on observe surtout les plaquettes et les leucocytes
ratatinés. Les différentes formes plasmodiales (trophozoïtes
surtout) auront l'aspect de points rouges plus ou moins entourés de
demi-anneaux bleus ! (Figure 5 ; au centre). C'est
une technique de concentration pour la
recherche de parasites dans le sang.
En routine, il faut lire au moins 100 champs (MSP,
2006) ; mais en cas de négativité, l'idéal voudrait
qu'on aille jusqu'à 400 champs (OMS, 1991), ce qui est vraiment
fastidieux. La lecture des GE prend du temps et comme le FM une expertise est
requise. (20 minutes sont recommandées par l'OMS pour la lecture par un
microscopiste expert d'un frottis avant de le rendre négatif).
Elle est qualitative (permet de faire difficilement le
diagnostic d'espèce) et quantitative. La parasitémie peut
s'estimer ici alors en pourcentage de parasites comptés par rapport aux
globules blancs (GB). Ce qui permet par simple règle de trois de
déterminer la parasitémie/uL, si l'on connait le nombre de GB/uL
(Numération Formule Sanguine).
Mais en général de nombreuses
littératures s'accordent à calculer cette parasitémie sur
la base de 8000GB/uL pour les adultes (Moody, 2002 ; WHO, 2008). La valeur
sera alors moins précise que celle obtenue sur FM.
§ La lecture de la GE exige un effort de concentration et
un minimum d'expertise technique car la confection de la GE a entrainé
la destruction de la quasi-totalité des GR ainsi que la
déformation des plaquettes, des GB et des Plasmodiums. Tout ce qui
complique un peu le diagnostic d'espèce. De plus, la coloration des
cellules sur GE dépend du pH du liquide de dilution du Giemsa qui doit
être de préférence neutre. Ainsi, à l'observation
microscopique à l'objectif x100, on peut observer sur fond
légèrement bleu des leucocytes, des plaquettes
éventuellement et surtout des trophozoïtes de
Plasmodium spp. se présentant sous la forme de noyaux
rouges pourpre entourés chacun d'un cytoplasme bleu (Figure
5, au centre). Un liquide de dilution acide, favorise la domination
des colorants acidophiles (figure 5, à gauche) tandis
qu'un liquide basique, favorise la domination des colorants basophiles
(Figure 5, à droite).
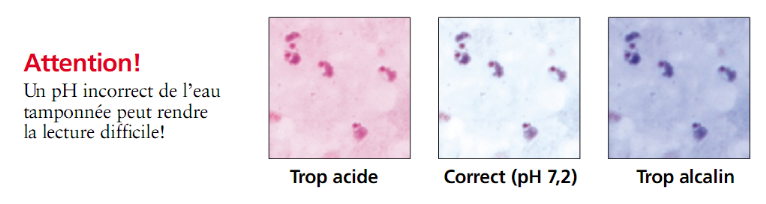
§ La durée d'exécution des GE est plus
longue en absence de dispositif de séchage
Figure 5 : Différents aspects microscopiques
d'une GE en fonction du pH de l'eau de dilution du Giemsa. (obj.x100)
Source : (PNLP, RD-CONGO, 2008)
6.1.3.2. Lecture des Frottis minces (FM)
§ Pour de diagnostic du paludisme, la lecture durera 20
minutes au minimum (OMS)
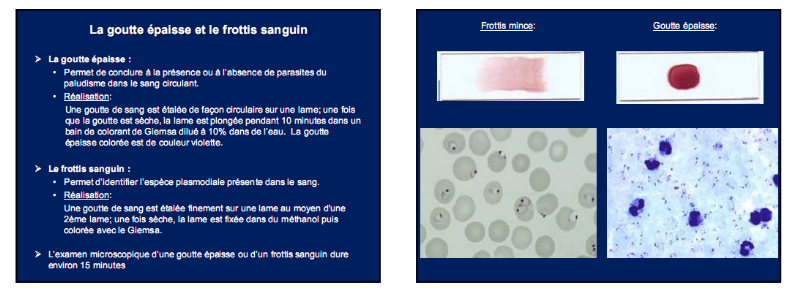
§ Elle permet d'observer tous les éléments
figurés du sang (hématies, leucocytes, Plaquettes) y compris les
éventuelles hémoparasites comme les Plasmodiums (forme
trophozoïte surtout ; mais aussi gamétocytes ...). A
l'observation microscopique (Objectif x100), les trophozoïtes sont
intra-érythrocytaires et se présentent en bague de chaton (Noyau
rouge excentré et cytoplasme bleu) (Figure 6.)
Figure 6 : Trophozoïtes
intra-érythrocytaires de P. falciparum sur FM
Source : (ANOFEL, 2002)
§ On peut déterminer la charge parasitaire en
estimant la proportion des globules rouges (GR) parasités pour 1000 GR
si on connaît le nombre de GR/uL de sang.
§ Si cette estimation donne par exemple 20 GR
parasités pour 1000. et que le patient a 4000 000 de GR/uL (NFS), La
parasitémie pour le plasmodium en cause sera = 4000 000x20 /1000=
80 000/uL.
§ 1. Trophozoïte jeune
2. Trophozoïtes avec pigment malarien
R : Rosace (Rares)
G : Gamétocytes
Le fait que les hématies soient restées intactes
permet d'observer les différentes formes parasitaires ainsi que
caractéristiques des hématies parasitées qui orienteront
le diagnostic d'espèce.




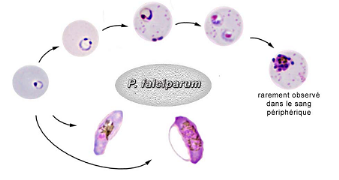
Figure 7 : Différentes formes de P.
falciparum sur FM
Source : (ANOFEL, 2002)
6.2. Protocoles du diagnostic du Paludisme par les
Tests de Diagnostic Rapides
6.2.1. Principe :
Il est basé sur la détection d'antigènes
(Ag) ou d'anticorps (Ac) de Plasmodium sp dans le sang
(hématies ou plasma) du sujet examiné (WHO, 2000).
En général, il s'agit de membranes en plastique
sur lesquelles ont été fixés les Ac spécifique des
Ag à détecter (zone de réaction). Les Ag lorsqu'ils sont
présents dans le sang, se fixent sur des Ac combinés à une
poudre colorée (Conjugué) avant d'être entrainée
grâce à un tampon le long de la membrane en plastique. Au passage
sur la zone de réaction (T), les complexes Ag-Conjugué se fixent
aux Ac spécifiques. D'où l'apparition d'un trait rouge.
L'excédent de conjugué poursuit son parcours jusqu'à la
zone contrôle(C) où, il se fixe formant un deuxième trait
rouge (Figure 8).

Figure 8. Principales étapes (1,
2 et 3) de réaction d'un TDR
Source : (OMS, 2008)
Trois (03) groupes d'antigènes plasmodiaux
détectés par les TDR disponibles dans le commerce:
- la protéine HRP2 (histidine-rich protein 2),
spécifique de P. falciparum ;
- la pLDH (Plasmodium Lactate Déshydrogenase), enzymes
spécifiques des 4 espèces plasmodiales (P. falciparum
et les 3 autres à l'exception de P. knowlesi)
- l'Aldolase, enzyme spécifique
(pan-spécifique).
6.2.2. Matériel et
réactifs (En général, il est fourni avec le coffret de
tests)
o Matériel de prélèvement pour recueillir
du sang veineux prélevé sous EDTA ou sang capillaire. (aiguilles,
tubes-EDTA, tampon d'alcool, gants, garrot)
o Matériel de désinfection
o Buffer ou tampon (fourni avec le TDR)
o Micropipettes ou pipettes compte-gouttes
o Notice d'utilisation.
o Chronomètre
o TDR (Cassette, savonnettes ou bandelettes)
6.2.3. Mode opératoire.
Si les tests sont au freezeur, les ramener à
température ambiante. Mais en général, les TDR disponibles
se conservent entre 15 et 30°C (température ambiante en
général). Le test peut se réaliser sur le champ ou en
différé de 2 jours maximum (sauf si conservation à
2-8°).
§ Observer bien que le test n'est pas encore
périmé
§ Déballer le TDR et le déposer sur une
surface plane, horizontale et propre.
§ En général, le mode opératoire
diffèrera un peu selon les fabricants. (Dans tous les cas, se
référer à la notice du fabricant à
l'intérieur du coffret !).
6.2.4. Résultats et
Interprétation (Figure 9)
Il faut savoir que l'interprétation des TDR
dépend du type (détection d'une ou plusieurs
espèces) :
§ S'il est capable d'identifier une seule espèce,
en général, il s'agira de P. falciparum, il y a un seul
trait rouge possible à la zone de réaction (T) et un trait dans
la zone contrôle (C), soit 2 traits au total en cas de
positivité. Seul le trait (C) apparait en cas de
négativité.
§ Si le test est capable de détecter au moins 2
espèces plasmodiales, il y a 2 traits possibles à la zone de
réaction (T) et par conséquent 3 traits possibles (dont
un trait dans la zone (C) en cas de positivité.
v RESULTATS POSITIFS
|
Positif
|
Faiblement Positif
|
|
|
Apparition d'un trait rouge à la zone de
contrôle(C) en plus du trait rouge à (T)
|
|
v RESULTAT NEGATIF
|
|
|
Apparition d'un trait rouge seulement à la zone
de contrôle(C)
|
|
v RESULTATS INVALIDES
|
|
|
Pas de trait rouge à la zone contrôle
(C) :
Refaire le test en utilisant une autre
savonnette ou cassette.
|
Figure 9. : Interprétation des
résultats d'un TDR (HRP2) identifiant P. falciparum seul
Source : (OMS, 2008)
Les TDR ont l'avantage d'être simple
d'usage, permettent de rendre les résultats dans un délai
relativement court (moins de 20 minutes), permettent une
meilleure standardisation des résultats et surtout,
chacun peut interpréter le résultat (patient,
prescripteur, technicien de laboratoire) ; ce qui renforce la
crédibilité du résultat. Leur sensibilité varie
selon fabricants et les études mais certains ont une sensibilité
et une spécificité que l'OMS juge acceptables (> 95%). Mais
ils ne sont pas quantitatifs et ont des caractéristiques liées
aux types d'Ag ciblés dont on devrait tenir compte au moment du choix du
type de TDR (WHO, 2009)
6.2.5. Limites des TDR. (HRP2)
Les limites des TDR sont fonction du type de TDR choisi.
§ Les TDR (HRP2) sont en général plus
sensibles que les TDR (pLDH) et les TDR (Aldolase). De plus, ils sont
relativement moins coûteux (Swartout et al, 2007). Par contre,
ils ne sont pas adaptés au suivi du traitement des patients en raison de
la persistance de la HRP2 dans le sang jusqu'à 35 jours après le
traitement (OMS, 2005) et ne peuvent détecter que P.
falciparum. D'autres paramètres tels que le respect des
procédures opératoires, le respect des conditions d'emballage, de
transport et de conservation et les caractéristiques propres au test
(sensibilité, spécificité), conditionnent les performances
des TDR. En général et des TDR(HRP2) en particulier.
METHODOLOGIE
III. METHODOLOGIE :
1. Type d'étude :
Il s'est agi d'une étude transversale et prospective
2. Période d'étude :
Elle s'est déroulée sur deux mois ; soit du
14 juillet au 13 Septembre 2011
3. Cadre et lieu d'étude :
3.1. Cadre d'étude :
Notre étude a été menée à
Bafoussam, chef-lieu de la région de l'Ouest ; plus exactement dans
l'unité de laboratoire de l'Hôpital Régional (HRB).
Située en plein centre de la région, la ville
de Bafoussam comprend 03 communes ou arrondissements à savoir :
Bafoussam I ; Bafoussam II et Bafoussam III. Sa population
constituée essentiellement de l'ethnie Bamiléké est
estimée en 2008 à environs 347 000 habitants avec une
densité de 128,5Hbts/km2 (BUCREP, 2010). Cette population est
majoritaires constituée de personnes exerçant les
activités agro-pastorales et le petit commerce (
http://www.bafoussam.fr/bafoussam_geographie.htm).
De par son faciès épidémiologique dit
d'altitude et des hauts plateaux, la transmission du paludisme ici est
permanente tout au long de l'année avec cependant des variations
saisonnières (www. Impact-malaria.com)
Au niveau de la pyramide sanitaire du pays, l'HRB se situe au
niveau intermédiaire. Il est la structure de référence
pour toutes les autres formations sanitaires de la Région de
l'Ouest; notamment tous les hôpitaux de District et les CMA y compris les
formations sanitaires privées. Il est dirigé par un Directeur
assisté d'un Conseiller médical. Cette structure d'après
les sources de la Direction emploie à ce jour (Novembre 2010) plus de
300 personnels dont 10 médecins spécialistes, 01 pharmacien et
une quinzaine de médecins généralistes, répartis
dans les différents services administratifs et techniques. Comme
services techniques on a les services de Médecine A, B et C, de
Chirurgie A et B, de Gynécologie, de maternité, de
Pédiatrie, de néonatologie, d'Ophtalmologie,
d'Oto-rhino-laryngologie (ORL), de Stomatologie de la morgue et l'unité
de Laboratoire.
3.2. Lieu de l'Etude
L'unité de laboratoire de l'HRB avec un plateau
technique unique en son genre à l'Ouest emploie à temps plein
plus de 25 professionnels de laboratoire. Elle a à sa tête un
Médecin-Biologiste (Chef d'unité), assisté d'un
Ingénieur des Techniques Médico-Sanitaires
(Bactériologiste, chef de service).
Le nombre moyen de patients reçu par jour dans cette
unité est de 60, avec une moyenne par patients de 4 examens, pour
environs 240 examens par jour. Le poste de Parasitologie exécute en
moyenne de 10 recherches d'Hémoparasites (Gouttes épaisses) par
jour (moyenne calculée à partir des chiffres de l'année
2010)
4. Population d'étude
Ø Critères d'inclusion :
· Avoir été reçu en consultation
à l'HRB par un médecin ou un infirmier et envoyé au
laboratoire pour confirmation du paludisme (Goute épaisse) durant la
période allant du 14 juillet au 13 Septembre 2011.
· Etre âgé d'au moins 1 an
· Avoir accepté de participer à
l'étude (pour les enfants, l'accord des parents ou accompagnateur majeur
sera nécessaire).
Ø Critères de non
inclusion : N'ont pas été inclus dans la
présente partie de cette étude :
- Les malades non consultés par un médecin ou
infirmier de l'HRB ;
- les patients de moins d'un an ;
- les patients venus au laboratoire pour contrôle post
traitement de paludisme ;
- les femmes enceintes sous TPI (traitement préventif
intermittent) ;
- les patients ayant refusé de participer à
l'étude ou leur ayant droit ;
- les patients dont l'état général est
très altéré et les patients se sachant atteints d'une
affection chronique (TB, Diabète, etc...) ;
- les malades ayant commencé un traitement
antipaludéen y compris la une cycline (Antibiotique) au plus 24 heures
avant la consultation.
5. Echantillonnage
Nous avons procédé à un
échantillonnage par convenance. En effet, nous avons
systématiquement recruté, tous les patients qui remplissaient les
critères d'inclusion pendant la durée de collecte. Soit au total
336 personnes des deux sexes âgées d'au moins un
an.
6- Technique de collecte des
données
Les patients en consultation externe ont été
reçus au service de prélèvement du Laboratoire tandis que
ceux hospitalisés ont été reçus par les
infirmières de service concernés.
Après avoir pris connaissance de la demande d'examen
formulée par un consultant de l'Hôpital Régional (carnet de
consultation ou bulletin d'examen), le technicien-préleveur ou
l'infirmière de service s'est chargé d'expliquer à chaque
patient (ou accompagnateur) les buts et objectifs de l'étude, il lui a
été ensuite remis un formulaire de consentement
éclairé (Pour les mineurs, leur ayant droit était
sollicité). Après accord de celui-ci manifesté par la
signature du formulaire de consentement, Si le patient remplissait alors les
conditions requises, un numéro d'identification lui était alors
attribué et le cas échéant et la fiche de collecte
était remplie suivi du recueil au niveau du pli du coude de 2,5 ml de
sang sous tubes EDTA (anticoagulant) comme d'ailleurs c'est le cas en routine
dans ce laboratoire. Le respect strict des règles de bonnes pratiques
des prélèvements sanguins (OMS, 1994) était de rigueur.
Les données sociodémographiques et cliniques
recueillis ont été acheminées en même temps que les
échantillons collectés au Laboratoire de l'Hôpital
Régional (Poste de parasitologie) dans les 10 minutes suivant la
collecte. Les échantillons de sang ont aussitôt été
analysés simultanément mais en aveugle par 2 techniciens
différents. La Goutte épaisse (GE) sera considérée
comme « gold standard ». Les performances du
Diaspot®-Malaria-Pf seront alors évaluées par
rapport à elle.
7. Considérations éthiques
Pour réaliser la présente étude, nous
avons au préalable sollicité et obtenu auprès de Madame la
Directrice de l'HRB (Annexe 1), l'autorisation de
réaliser nos travaux de recherche au laboratoire de l'Hôpital
Régional, notamment le recrutement des patients et la réalisation
des différentes analyses. Par la suite nous avons sollicité et
obtenu la clairance éthique (Annexe 2) auprès du
comité national d'éthique (CNE). Nous avons aussi
sollicité et obtenu par signature, le consentement éclairé
de Chaque participant ou mandataire qui, par ailleurs était libre de
participer à l'étude. Le questionnaire auquel chacun était
soumis était anonyme et les examens ont été
exécutés selon les règles de bonnes pratiques de
laboratoire (OMS, 1994). Les positifs confirmés ont tous
été pris en charge conformément à la
procédure en vigueur à l'HRB.
8. Techniques d'analyses.
8.1. Variables
sociodémographiques (2): Age et sexe
8.2. Variables cliniques (5) :
Céphalées, courbatures, frissons, fatigue
généralisée et fièvre (T° axillaire >
37,5° ou > 37° pour la T° rectale) ont été
recueillies par questionnaire soit par interrogatoire, soit à partir du
carnet de consultation. Il s'est agi des signes/symptômes
présentes au moment du prélèvement ou dans la semaine
précédant la consultation.
8.3. Variables biologiques :
8.3.1. Réalisation de la goutte
épaisse
v Confection de la GE
La lame porte objet était étiquetée
du numéro patient ; identique à celui inscrit à la fois
sur le tube de sang et dans les fiches questionnaires. Une goutte de sang
était déposée au centre. A l'aide d'une seconde
lame, on procède à la défibrination mécanique
par des mouvements circulaires de sorte à avoir un
diamètre d'environ 1 cm.(Figure 4). Les lames
étaient ensuite séchées à l'abri des
poussières et des mouches.
v Préparation du Giemsa (solution d'emploi).
Dans une éprouvette en plastique de 100 ml: ajouter 5
ml de Giemsa-Rapide pour 45 ml d'eau distillée tamponnée
(quantité suffisante pour 25 lames). Agiter le mélange
très doucement. Cette quantité de 50 ml permet de colorer un
nombre important de lames.
v Coloration des lames (OMS, 1994)
Recouvrir chaque lame sèche de Giemsa fraichement
préparé et laisser agir 30 minutes
Rincer délicatement à l'eau du robinet
puis sécher à l'abri des poussières. Dans les pays
anglosaxons, le Giemsa est souvent remplacée par le Colorant de Wright
(Annexe 6)
v Lecture de la goutte épaisse (GE)
colorée et séchée.
La lecture des gouttes a été
effectuées au poste de parasitologie du laboratoire de l'HRB
à l'aide d'un microscope optique (Nikon Eclipse E400, Japon ;
Olympus Optical co, Japon) à l'objectif 100 (à immersion) et
selon les procédures recommandées (OMS, 1994) par le responsable
du poste, un technicien expérimenté avec 17 ans
d'expériences (Figure 10)
La parasitémie a été quantifiée
selon la formule suivante (Moody, 2002 ; WHO, 2005 ; Payne, 1988): P = (X
/ Y) 8000 parasites par mm3 de sang où X est le nombre de parasites
comptés au microscope, Y le nombre de leucocytes comptés en
même temps (200 leucocytes) et 8000, le chiffre consensuel du nombre de
GB/mm3 chez l'Homme . La lecture de 200 champs microscopiques était
nécessaire pour rendre une rendre un résultat négatif.
Les résultats des GE ont notés en même
temps dans le cahier de paillasse et dans la fiche des résultats. Les
densités parasitaires étaient groupées en 3 classes :
< 500/ul (faiblement positif) ; 501 -
5 000/ul (positif) ; > 5000/ul (Fortement
positif (Figure 11)).
NB. : La réalisation d'un frottis n'a
été nécessaire qu'en cas de difficulté
réelle à confirmer un diagnostic d'espèce sur GE. Leur
réalisation (confection frottis, coloration et lecture) a
été faite comme indiquée au paragraphe 6.1.)
En fin de journée, le Médecin-Biologiste Chef de
laboratoire choisissait au hasard 02 lames positives (éventuellement)
et 02 lames négatives pour valider les résultats de la
microscopie
|
Figure 10 : Microscopiste faisant la
lecture d'une GE.
|
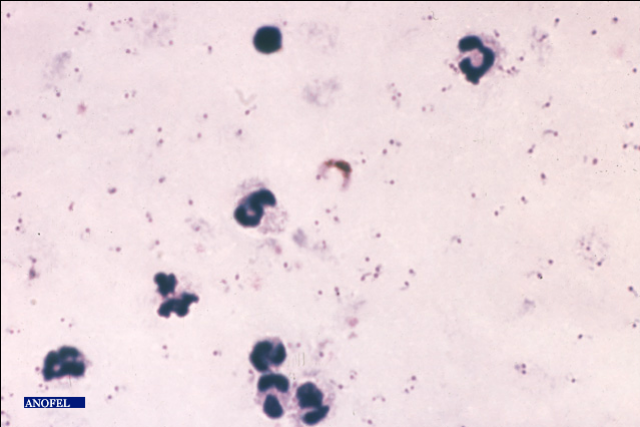
Figure 11 : Vue microscopique d'une GE colorée
au Giemsa (x 100). (On y observe 7 GB et des trophozoïtes de P.
falciparum)
|
|
Source : (Laboratoire HRB, 2011)
|
8.3.2. Réalisation du
Diaspot®-Malaria-Pf
Sans consulter les registres de paillasse, l'investigateur a
réalisé sur les mêmes échantillons de chaque
journée un TDR (Diaspot®-Malaria-Pf), dans le respect
strict des procédures dictées dans la notice contenue dans le
coffret (Annexe 7).
v Description du
Diaspot®-Malaria-Pf
Le Diaspot®-Malaria-Pf se présente sous
forme d'un coffret blanc contenant 40 tests
unitaires en forme de savonnettes emballées
individuellement avec un dessicant ; 2 flacons d'1 ml chacun de tampons
(buffer) ; 40 pipettes compte-gouttes et une notice du test. Tant que
l'emballage individuel n'est pas altéré, il peut être
conservé entre 8 et 30° et donc à température
ambiante, jusqu'à la date d'expiration indiquée sur le coffret et
sur chaque emballage de même que le numéro de lot. Pour la
présente étude, nous avons eu besoin de 9 coffrets
de de Diaspot®-Malaria-Pf, soit 360 tests
unitaires.
v Principe du TDR
Diaspot®-Malaria-Pf
C'est un test immunochromatographique qui permet de
détecter la HRP2 de P. falciparum dans le
sang total d'un patient à l'aide d' anticorps monoclonaux
spécifique fixés sur une membrane en plastique.
v Matériels et réactifs
(Figure 12)
Outre le sang prélevé sous EDTA, Nous avons eu
besoin des cassettes de Diaspot®-Malaria-Pf, la solution tampon
(buffer), des pipettes compte-goutte (10 uL), tous fournis par le fabricant.
Figure 12 : Echantillons sanguins
prélevés sur EDTA, prêts à être
analysés avec Diaspot®-Malaria-Pf
(laboratoire HRB, 2011)
v Mode opératoire: (Annexe
7)
· Respecter les précautions universelles en
matière de manipulation des produits biologiques (port des gants,
blouses...) (OMS, 1994)
· Vérifier la non altération du sachet
d'emballage du test
· Vérifier la date de péremption
· Sortir la cassette de son emballage
· Etiqueter au numéro qui correspond à
celui de l'échantillon à analyser
· Mélanger le sang par retournement du tube et,
à l'aide de la pipette compte-goutte ou d'une micropipette,
prélever environ, 10ul de sang total puis verser dans le puis (S).
· Ajouter aussitôt 3 gouttes (environs 120 ul) de
tampon en maintenant le tube verticalement. (éviter la formation des
bulles d'air)
· Attendre au plus 15 minutes la migration du
mélange le long de la membrane du test, puis lire la réaction et
interpréter le résultat.
v Interprétation des
résultats.
- Résultats Valides : Apparition d'un trait
rouge à la zone de contrôle (C)
- Test Positif (+): En plus
du trait (C) apparition d'un trait intensité (faible à fort)
dans la zone (T) ; soit 2 traits (Figure 13 : 264/24
et 263/11)
- Test Négatif (-):
seulement le trait (C) apparait (Figure 13 : 279/28 et
279/21)
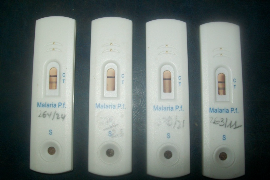
- Résultats invalides : Pas de trait rouge
à la zone contrôle (C) quel que soit ce qui se passe dans la zone
(T) : Refaire le test en utilisant une autre cassette.
Figure 13 : Résultats sur 4 savonnettes de
Diaspot®-Malaria-Pf
Source : (Laboratoire-HRB, 2011)
v Limites.
· Ne détecte que P. falciparum
· Peut rester positif après traitement
réussi
· N'est pas conseillé pour les régions
où il existe de fortes proportions de cas de paludismes à P.
non falciparum.
· Peut ; même si c'est rare, être
faussement positif (facteurs rhumatoïdes, post traitement)
· Ne peut être correctement
interprété qu'en association avec la clinique.
· Peut-être faussement négatif
(délétion possible de HRP2 chez certaines souches de P.
falciparum, Ig anti-HRP2 chez le patient, [HRP2] < seuil du test)
Les résultats des
Diaspot®-Malaria-Pf ont été
consignés quotidiennement sur la fiche de collecte et dans un registre
particulier.
9. Analyses statistiques des
données.
L'ensemble des paramètres individuels à
savoir :
- les données
sociodémographiques (Age et sexe)
- les données cliniques
(Fièvre, courbatures, céphalées, frissons et fatigue)
- les données biologiques
(résultats de TDR et GE) ont été enregistrées
quotidiennement dans un ordinateur jusqu'à la fin de la période
de collecte.
Les données biologiques (résultats de GE et des
Diaspot®-Malaria-Pf), nous ont permis d'obtenir des variables tels que les
Vrais Positifs (VP)= Positifs en GE et au Diaspot®
-Malaria-Pf ; les Faux Positifs (FP)= Positifs uniquement au
Diaspot®-Malaria-Pf ; les Vrais Négatifs (VN)=
Négatifs au Diaspot®-Malaria-Pf et à la GE ; et les
Faux Négatifs (FN)= négatifs uniquement
Diaspot®-Malaria-Pf. Ces variables mises dans un tableau 2x2 nous
ont permis de calculer les caractéristiques du
Diaspot®-Malaria-Pf tels que la sensibilité, la
spécificité et les valeurs prédictives (positives et
négatives).
Les analyses ont été réalisées
avec les logiciels Epi-Info version 6.04 (Centers for Disease Control and
Prévention, Atlanta, USA) et Excel 2010. Le seuil de
significativité pour comparer deux proportions a été
fixé à une valeur P <0,05.
Les résultats ont été
présentés sous formes de tableaux et de graphiques.
10. Définition et détermination des
variables statistiques (Amos, 2005)
· Prévalence (P) :
Proportion des malades(M) dans une population
(N) à un moment donné.
· P (%) = M*100/N
Avec M= Total des cas
confirmés positifs et N= Total des cas
testés (population d'étude)
· Sensibilité (Se) :
Capacité du Diaspot®-Malaria-Pf à pouvoir
détecter les sujets atteints de paludisme (Sujets GE+) dans notre
population d'étude. Elle mesure ainsi l'aptitude du test à
éliminer les faux négatifs (FN).
· Se (%) = VP*100/VP+FN
· Spécificité (Sp):
Capacité Diaspot®-Malaria-Pf à détecter
des sujets indemnes de Paludisme (GE-) dans notre population
d'étude. Elle mesure ainsi l'aptitude du test à éliminer
les faux positifs (FP).
· Sp (%) = VN*100/FP+VN
· Valeur Prédictive Positive (VPP)
: Probabilité qu'un patient ait réellement le
paludisme (GE+) lorsque son test Diaspot®-Malaria-Pf est
positif.
· VPP (%) = VP*100/VP+FP
· Valeur Prédictive Négative
(VPN) : Probabilité pour qu'un patient soit vraiment
indemne lorsque son test Diaspot®-Malaria-Pf est
négatif.
· VPN (%) = VN*100/VN+FN
RESULTATS
IV. RESULTATS.
La présente étude a vu la participation de
336 patients. Nous avons réalisé en tout
336 gouttes épaisses (GE) contre 377
Diaspot®-Malaria-Pf en effets, les 2 méthodes ayant
été exécutées parallèlement et en aveugle
sur les mêmes échantillons, nous avons dû reprendre 1 TDR
sur un échantillon initialement invalide, et qui par la suite a
été confirmé négatif.
1. Caractéristiques
sociodémographiques.
· Sexe des sujets de notre
population:
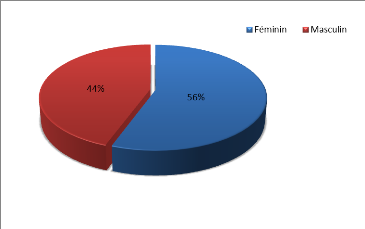
Figure 14: proportion des sujets de l'étude par
sexe.
La présente étude a impliqué 56%
(187/336) de sujets de sexe féminin contre 44% (149/336) de sexe
masculin; soit un sex-ratio (F/M) de 1,3
· Age des sujets
Les participants étaient âgés entre 1
à 79 ans avec une moyenne d'âge des participants qui était
de 26,0 #177;37,2 ans. Par ailleurs, 25% de notre population d'étude
avaient moins de 9 ans ; La tranche d'âge la plus
représentée était celle de 1 - 5 ans avec 54 sujets sur
336 ; soit 16,1 %, et la tranche la moins nombreuse était celle des
plus de 65 ans avec 4 personnes/336 soit 1,2 %.
La tranche pédiatrique (= 15 ans) représentait
plus du tiers de l'effectif avec 124 sujets/336 (37%).
· Sexe et âge des sujets
Excepté les tranches d'âge [6-10] et [31-35],
les patients de sexe féminin étaient majoritaires dans toutes les
tranches comme on peut le voir ci-dessous.
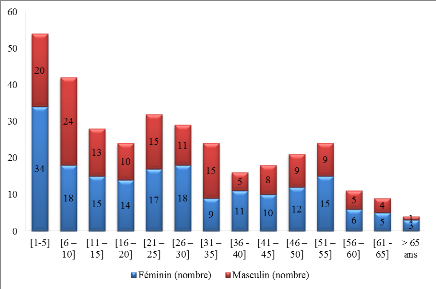
Figure 15 : Répartition des sujets par sexe et
par âge
2. Prévalence du paludisme dans la
population d'étude :
Le tableau ci-dessous représente les prévalences
du paludisme selon chaque test.
Tableau 2 : Prévalence du
paludisme d'après chaque test. (GE et
Diaspot®-Malaria-Pf)
|
Nombre de positifs (n)
|
Prévalences
|
IC95%
|
|
Goutte épaisse
|
94(336)
|
28,0%
|
[23,3 - 33,2]
|
|
Diaspot®-Malaria-Pf
|
100(336)
|
29,8%
|
[25,0 - 35,0]
|
La prévalence du paludisme confirmé par la GE
était de 28,0% (94/336) alors qu'avec le
Diaspot®-Malaria-Pf elle a était de 29,8% (100/336).
Le tableau qui suit représente les prévalences
par tranche d'âge dans la population d'étude.
Tableau 3 : Prévalences par sexe
et par tranche d'âge pour chacun des deux tests.
|
Classe d'âge
|
Prévalences du paludisme (n)
|
|
Goutte épaisse (GE)
|
Diaspot®-Malaria-Pf
|
|
Masculin(n)
|
Féminin(n)
|
Mixte(n)
|
Masculin(n)
|
Féminin(n)
|
Mixte(n)
|
|
[1-5] ans
|
70(20)
|
47,1(34)
|
55,5(54)
|
70(20)
|
47,1(34)
|
55,5(54)
|
|
[6-10] ans
|
25(24)
|
50(18)
|
35,7(42)
|
25(24)
|
44,4(18)
|
33,3(42)
|
|
[11-15] ans
|
23,1(13)
|
40(15)
|
32,1(28)
|
23,1(13)
|
46,7(15)
|
35,7(28)
|
|
> 15 ans
|
17,4(92)
|
20(120)
|
16,5(212)
|
20,7(92)
|
22,5(120)
|
19,8(212)
|
|
Total
|
24,8(149)
|
27,8(187)
|
28(336)
|
28,2(149)
|
31(187)
|
29,8(336)
|
o Par rapport à la GE, la
prévalence maximale (70%) se retrouvait chez les garçons de la
tranche [1-5] ans alors que la minimale (17,4%) se retrouvait dans la tranche
> 15 ans toujours chez les garçons.
· Chez les [1-5] ans, les garçons étaient
plus touchés (70%) que les filles (47,1%) alors dans les autres tranches
d'âge, cette tendance est inversée.
· En général, la prévalence la plus
élevée (55,5%) a été retrouvé chez les [1-5]
ans et la plus basse (16,5%) chez les > 15 ans
o Par rapport au
Diaspot®-Malaria-Pf, la prévalence
maximale (70%) se retrouvait chez les garçons de la tranche [1-5] ans
alors que la minimale (20,7%) se retrouvait dans la tranche > 15 ans
toujours chez les garçons.
· Chez les [1-5] ans, les garçons étaient
plus touchés (70%) que les filles (47,1%) alors dans les autres tranches
d'âge, cette tendance est inversée.
· En général, la prévalence la plus
élevée (55,5%) a été retrouvé chez les 1-5
ans et la plus basse (19,8%) chez les > 15 ans.
o Les prévalences ont été dans l'ensemble
plus élevées avec les Diaspot®-Malaria-Pf qu'avec
la GE.
- Par rapport à l'association avec les principaux
signes/symptômes cliniques du paludisme
Tableau 4 : Association entre les
résultats de GE/ Diaspot®-Malaria-Pf et la
fièvre
|
Goutte épaisse
|
Diaspot®-Malaria-Pf
|
|
Positive (%)
|
Négative(%)
|
Positif (%)
|
Négatif(%)
|
|
Fièvre
|
|
|
|
|
|
Oui
|
61(64,9)
|
146(60,3)
|
64(64,0)
|
143(60,6)
|
|
Non
|
33(35,1)
|
96(39,7)
|
36(36,0)
|
93(39,4)
|
|
Total
|
94(100)
|
242(100)
|
100(100,0)
|
236(100)
|
Nous avons pu dire que l'état fébrile des
patients n'était ni lié au résultat de la goutte
épaisse (p= 0,44), ni lié à celui du
Diaspot®-Malaria-Pf (p = 0,56).
Tableau 5 : Association entre
résultats (GE/ Diaspot®-Malaria-Pf) et
céphalées.
|
Goutte épaisse
|
Diaspot®-Malaria-Pf
|
|
Positive (%)
|
Négative(%)
|
Positif (%)
|
Négatif(%)
|
|
Céphalées
|
|
|
|
|
|
Oui
|
63(67,0)
|
146(60,3)
|
68(68,0)
|
141(59,7)
|
|
Non
|
31(33,0)
|
96(39,7)
|
32(32,0)
|
95(40,3)
|
|
Total
|
94(100)
|
242(100)
|
100(100,0)
|
236(100)
|
Nous avons pu dire que la présence des
céphalées chez les patients n'était ni liée au
résultat de la goutte épaisse (p= 0,26), ni liée à
celui du Diaspot®-Malaria-Pf (p = 0,15).
Tableau 6 : Association entre
résultats (GE/ Diaspot®-Malaria-Pf) et courbatures
|
Goutte épaisse
|
Diaspot®-Malaria-Pf
|
|
Positive (%)
|
Négative(%)
|
Positif (%)
|
Négatif(%)
|
|
Courbatures
|
|
|
|
|
|
Oui
|
60(63,8)
|
148(61,2)
|
62(62,0)
|
146(61,9)
|
|
Non
|
34(36,2)
|
94(38,8)
|
38(38,0)
|
90(38,1)
|
|
Total
|
94(100)
|
242(100)
|
100(100,0)
|
236(100)
|
Nous avons pu dire que la présence des courbatures chez
les patients n'était liée au résultat de la goutte
épaisse (p= 0,65), ni liée à celui du
Diaspot®-Malaria-Pf (p = 0,98).
Tableau 7 : Association entre
résultats (GE/ Diaspot®-Malaria-Pf) et fatigue
|
Goutte épaisse
|
Diaspot®-Malaria-Pf
|
|
Positive (%)
|
Négative(%)
|
Positif (%)
|
Négatif(%)
|
|
Fatigue
|
|
|
|
|
|
Oui
|
57(60,6)
|
146(60,3)
|
61(61,0)
|
155(65,7)
|
|
Non
|
37(39,4)
|
84(34,3)
|
39(39,0)
|
81(34,3)
|
|
Total
|
94(100)
|
242(100)
|
100(100,0)
|
236(100)
|
Nous avons pu dire que la présence de la fatigue
généralisée chez les patients n'était pas
lié au résultat de la goutte épaisse (p= 0,38). De
même qu'à celui du Diaspot®-Malaria-Pf (p = 0,41).
Tableau 8 : Association entre
résultats (GE/ Diaspot®-Malaria-Pf) et frissons.
|
Goutte épaisse
|
Diaspot®-Malaria-Pf
|
|
Positive (%)
|
Négative(%)
|
Positif (%)
|
Négatif(%)
|
|
Frissons
|
|
|
|
|
|
Oui
|
48(51,1)
|
88(36,4)
|
48(48,0)
|
88(37,3)
|
|
Non
|
46(48,9)
|
154(63,6)
|
52(52,0)
|
148(62,7)
|
|
Total
|
94(100)
|
242(100)
|
100(100,0)
|
236(100)
|
Nous avons pu dire que la présence des frissons chez
les patients était liée au résultat de la goutte
épaisse (p= 0,01). Par contre, la présence des frissons n'est pas
liée au résultat du Diaspot®-Malaria-Pf (p =
0,06).
3. Performances diagnostiques du
Diaspot®-Malaria-Pf par rapport à la GE
(gold)
Tableau 9 : Résultats
croisés du Diaspot®-Malaria-Pf par rapport à la
GE
|
TESTS
|
|
Goute Epaisse (Gold)
|
|
Diaspot®-Malaria
Pf
|
|
Positif
|
Négatif
|
Total
|
|
Positif
|
89
|
11
|
100
|
|
Négatif
|
5
|
231
|
236
|
|
Total
|
94
|
242
|
336
|
Par rapport à la GE considérée comme
référence, nous avons observé 11
FP (Diaspt®+/GE-) et 5 FN (Diaspot®-Malaria-Pf
-/GE+).
Tableau 10 : Performances diagnostiques du
Diaspot®-Malaria-Pf
|
Paramètres de performance du
Diaspot®-Malaria-Pf
|
Formules
|
Résultats
|
IC 95%
|
|
· Sensibilité (Se)
|
89*100/94
|
94,7%
|
[88,0-98,3]
|
|
· Spécificité (Sp)
|
231*100/242
|
95,5%
|
[92,0-97,7]
|
|
· Valeur Prédictive Positive (VPP)*
|
89*100/100
|
89,0 %
|
[81,2-94,4]
|
|
· Valeur Prédictive Négative (VPN)*
|
231*100/236
|
97,9%
|
[95,1-99,3]
|
Les caractéristiques propres au
Diaspot®-Malaria-Pf sont respectivement de 94,7% et de 95,5%
pour la sensibilité et la spécificité et les valeurs
prédictives positives et négatives sont respectivement de 89,0%
et 97,9%. Toutes fois, pour la capacité du
Diaspot®-Malaria-Pf à détecter de P.
falciparum seul, sa sensibilité est de 97,8% (89/91) IC.95%
[91,4-99,7]
Tableau 11 : Sensibilité du
Diaspot®-Malaria-Pf par rapport à la parasitémie
de la GE
|
Diaspot®-Malaria-Pf
|
|
Parasitémie GE
|
Positif GE
|
Positifs Diaspot®
|
Sensibilité (%)
|
IC95%
|
|
< 500/ul
|
27
|
23
|
85,2
|
[72,2-98,2]
|
|
500-5000/ul
|
28
|
27
|
96,4
|
[89,5-100]
|
|
>5000/ul
|
39
|
39
|
100
|
[98,2- 100]
|
|
Total
|
94
|
89
|
94,7
|
[88,0-98,3]
|
A une parasitémie < 500/ul, la sensibilité
du Diaspot®-Malaria-Pf était de
85,2% ; entre 501 et 5000/ul, elle était de
96,4% alors qu'à plus de 5000/ul, elle a atteint
100%
DISCUSSIONS ET LIMITES
I. DISCUSSIONS
v Méthodologie :
Cette étude comparative du
Diaspot®-Malaria-Pf avec la GE (référence) est la
première réalisée à Bafoussam dans la
région de l'Ouest du Cameroun, Elle fait néanmoins suite à
celle réalisé par Sayang et al (2009) à
Yaoundé qui a comparé le même
Diaspot®-Malaria-Pf avec la GE mais sur une population
pédiatrique. Nous avons tenu à réaliser cette
étude ici compte tenu du fait que Yaoundé et Bafoussam abritent
des faciès épidémiologiques différents. De plus,
avec la diversité génétique de la HRP2 chez le Plasmodium,
ainsi que d'autres contraintes opérationnelles (WHO, 2009 et Sayang,
2010), il n'est pas évident qu'un TDR (HRP2) évalué et
validé ailleurs garde sa validité diagnostique ici. Or pour aller
dans le même sens que l'OMS qui recommande les TDR dans les situations
particulières, il faut être sûr de ses performances sur le
terrain et donc, il faut l'évaluer.
Notre population d'étude était constituée
par un échantillon exhaustif de 336 patients. Cette taille était
semblable à celle des études similaires réalisées
en RDC par Swarthout (2007) ; soit 358 patients. Par contre cette taille
est largement en deçà de celle des études faites par
Tarekegn (2008) au Kenya soit 78 454 patients. Cependant, au Cameroun,
Sayang (2010) réalisa son étude sur 153 patients. Notre
étude s'est déroulée en pleine saison des pluies
mêmes, changements climatiques oblige, cette pluviométrie
n'atteint plus aujourd'hui les niveaux connus dans la littérature. Pour
être plus complet, une pareille étude aurait pu se tenir
également en saison sèche pour observer l'impact des saisons sur
la prévalence du paludisme et sur les performances du test
Diaspot®-Malaria-Pf. Paradoxalement, il existe très peu de
données sur la prévalence (microscopique) du paludisme au
Cameroun en général. Les données disponibles au niveau du
Programme National de Lutte contre le Paludisme (PNLP) et dans la
délégation régionale de la santé de l'Ouest
à Bafoussam concernant la morbidité palustre sont
généralement recueillies sur la base d'un diagnostic avant tout
clinique. Cette tendance est la même à l'échelle de tout le
pays. Du coup, il ne nous a pas été possible de les exploiter
pour calculer la taille de notre échantillonnage. Face à cette
difficulté, nous avons choisi pour la présente étude de
réaliser un échantillonnage par convenance. C'est une
méthode non probabiliste avec l'inconvénient que les
résultats obtenus ne peuvent pas de façon logique être
extrapolés à l'échelle de la population cible. Pour
l'analyse de la fréquence de la maladie dans notre population
d'étude, nous avons expressément défini quatre (4) classes
d'âges. La classe [1 - 5] ans qui est la plus vulnérable
(OMS, 2008 ; OMS, 2009 ; MSP, 2007 et MSP, 2010) ; la classe [6
- 10] , la classe [11 - 15] (toutes les 3 classes précédentes
appartiennent à la tranche pédiatrique) et la classe > 15 qui
regroupe adolescents et adultes .
v Caractéristiques
sociodémographiques de notre population
d'étude.
- Sexe et âge de notre population
d'étude :
Dans cette étude, 56% (187/336) de sujets
étaient de sexe féminin contre 44% (149/336) de sexe masculin;
soit un sex-ratio (Féminin/Masculin) de 1,3 (Figure
14). Contrairement à une étude similaire faite par Amos
(2006) au Mali où le sex ratio (H/F) était de 1,05. La tranche
d'âge la plus représentée était celle de [1-5] ans
avec environs 15% (54/336) alors que la moins représentée
était celle de >65 ans. Plus du tiers de l'effectif (124/336)
était constitué des < 15 ans (Consultations
pédiatriques). Cette sur représentativité de la tranche
pédiatrique dans cette étude pourrait s'expliquer par le fait que
les parents seraient plus enclin à les amener dès l'apparition
des symptômes en consultation, par contre, ils
préfèreraient se tourner vers d'autres solutions
(automédication...) pour les plus grands et eux même. D'autre
part, excepté dans les classes d'âge [6-10] et [31-35], les filles
étaient majoritaires dans toutes les classes d'âge (Figure
15). Ces caractéristiques de notre population d'étude
notamment en ce qui concerne les < 5ans et les femmes ont
généralement été observées dans les
études similaires à l'instar de celles de Bechem et al
(1999) et Wanji et al (2008).
v Prévalence du paludisme dans notre
population d'étude.
- Prévalence générale
Rappelons-nous que notre population d'étude
était constituée uniquement de cas suspects de paludisme venus au
laboratoire pour un diagnostic de confirmation. Il s'est agi donc ici de
prévalence hospitalière. En effet nous savons aujourd'hui que la
majorité des cas de paludisme en Afrique n'arrivent pas à
l'hôpital pour des raisons diverse (OMS, 2003 ; MSP, 2005). Au
final, seulement 94 cas de paludisme ont été confirmées
par la GE soit une prévalence de 28%, tandis que le
Diaspot®-Malaria-Pf a confirmé 100 cas pour une
prévalence estimée à 29,8% (Tableau 2).
En considérant la GE comme référence, la vraie
prévalence était la première (28%) encore que la
différence entre celle-ci et celle avec
Diaspot®-Malaria-Pf n'a pas été jugée
statistiquement significative (P=0,75). Ce qui revient à dire que 242
personnes auraient donc eu une parasitémie nulle malgré la
présomption clinique. Personnes qui non seulement devraient suivre un
traitement abusif à base d'ACT, mais dont le diagnostic réel des
motifs de consultation serait retardé (Shillcutt et al, 2007
Tarekegn et al, 2008 et WHO, 2008). En tant que test de
référence, nous avons considéré que la
spécificité de la GE était par définition absolue.
Cette référence est valide en ce qui concerne la comparaison avec
les TDR (WHO, 2008). Elle peut être discutée pour affirmer le
diagnostic de paludisme, en raison de l'existence de porteurs asymptomatiques
de P. falciparum (Munier et al, 2009). Compte tenu du fait
que notre étude s'est déroulée au mois de juillet,
(période de haute transmission), il est possible que cette
prévalence soit encore plus faible en saison sèche
(période de faible transmission.). Il serait intéressant
d'envisager une étude de ce genre pendant les deux périodes
(saison sèche et saison des pluies) afin de mieux apprécier les
variations saisonnières du paludisme et leur impact sur les TDR.
P. falciparum a été retrouvé
chez 91 sujets parmi les 94 testés positifs à la GE soit 96,8%.
Par contre P. malaria a été rencontré seulement 3
fois, soit 3,2%. Et malgré que P.ovale n'aie pas
été détecté dans notre population d'étude,
ces chiffres sont en concordance avec les données d'Impact-malaria
et du MSP (2010) qui estiment les proportions des différentes
espèces plasmodiales dans le faciès d'altitude au Cameroun entre
91,5 % et 96% pour P. falciparum ; 1,7% et 7,0% pour P.
malaria et entre 0 et 6,8% pour P. ovale. Cette
forte proportion de P. falciparum dans notre population d'étude
crédibilise d'avantage le choix que nous avons porté sur le TDR
Diaspot®-Malaria-Pf qui est un TDR(HRP2) détectant P.
falciparum seul. D'autant plus qu'il a l'avantage sur les autres types de
TDR d'être plus sensible, plus stable aux variations de
température et moins coûteux (OMS, 2003).
- Prévalences par rapport au sexe et aux classes
d'âge pour les deux tests (Tableau 3)
Dans la tranche [1-5] ans, on a remarqué une parfaite
concordance entre les valeurs de prévalences selon la GE et le
Diaspot®-Malaria-Pf et ceci tant dans la population mixte
(55,5%), que dans chacun des deux sexes (70% chez les garçons contre
47,5% chez les filles). Cette absence de discordance nous suggère qu'il
n'y aurait eu ni de faux positifs, ni de faux négatifs dans cette
tranche. L'absence des faux positifs ici s'expliquerait par un suivi plus
rigoureux des parents qui s'abstiendraient de pratiquer l'automédication
de leurs enfants et quand ce serait le cas, ils l'avoueraient plus volontiers
en consultation. D'autre part, la présence des facteurs rhumatoïdes
responsables de certains FP est exceptionnelle dans cette tranche d'âge
(Meyer , 1989). L'absence des FN serait le fait d'un système
immunitaire encore jeune, par encore à même de produire des Ac
monoclonaux anti-HRP2 (Lee et al, 2006). Par ailleurs, ces
résultats montrent que dans cette tranche d'âge, les
garçons sont de loin plus affectés que les filles. Simple
coïncidence ou particularité établie ? La
littérature n'est pas prolifique pour expliquer cela.
Dans toutes les autres classes d'âge on a noté
que de légères discordances commençaient à
apparaitre entre les prévalences à la GE et au
Diaspot®-Malaria-Pf . En général, les
prévalences au Diaspot®-Malaria-Pf étaient plus
élevées que celles données par la GE ; sauf dans la
classe [6-10] où cette prévalence était estimée
à 35,7% pour la GE contre 33,3% pour le
Diaspot®-Malaria-Pf . Une prévalence par rapport
au Diaspot®-Malaria-Pf supérieure celle à la GE
comme dans la tranche d'âge > 10 ans, suggère l'existence de
faux positifs dans cette tranche. Par contre, les faux négatifs de notre
population d'étude ont été répertoriés dans
la classe [6-10] ans. Par ailleurs, on a remarqué que dans la tranche
des > 5 ans, les filles étaient plus touchées que les
garçons. Alors que c'est exactement l'inverse dans la tranche < 5
ans. Des études ultérieures devraient être menées
pour essayer d'expliquer ce constat.
En général pour les deux tests la
prévalence diminuait avec l'âge (tableau 3)
passant de 55% chez les [1-5] ans pour la GE et le
Diaspot®-Malaria-Pf à 16,5% et 19,8% chez les > 15 ans
pour la GE et le Diaspot®-Malaria-Pf respectivement. Ces
observations ont été faites dans plusieurs études
similaires notamment celle de Wanji et al ( 2008), dans la
région du Sud-Ouest-Cameroun qui montrait que la classe d'âge
de 0 à 9 ans était la plus infectée avec 51% de
prévalence contre 15% seulement chez les sujets de plus de 20
ans. Seulement, il faut signaler qu'il s'agissait d'une population de personnes
cliniquement asymptomatique. Cette baisse de la prévalence avec
l'âge pourrait s'expliquer par la mise en place graduelle chez les
populations exposées en permanence aux infections palustres à
répétition, d'une certaine immunité (Aubry et
Jaffar-Bendjee, 2001 ; McKenzie et al, 2003).
v Comparaison des deux méthodes de
diagnostic (GE et Diaspot®-Malaria-Pf)
- Par rapport aux cibles.
ü Les deux méthodes de diagnostic n'exploraient
pas les mêmes caractéristiques du Plasmodium. L'une (la GE) a
consisté en la détection par observation microscopique des
caractéristiques morphologiques du Plasmodium et l'autre (TDR) agissant
par réaction immunochromatographique détectait la HRP2, Ag
libéré pendant le développement de P. falciparum
dont il est spécifique.
- Par rapport à leur exécution
pratique
ü La GE nous a permis de pouvoir identifier deux
espèces Plasmodiales. Permettant à la même occasion de
détecter chez deux patients une association de formes parasitaires
(trophozoïtes + gamétocytes). Elle nous a permis également
d'estimer avec une relative précision la parasitéme.
Contraintes rencontrées : Un entretien
quotidien rigoureux du microscope au était de mise car sa performance en
dépendait. Ce microscope servait également pour le diagnostic des
autres maladies infectieuses et parasitaires. Il n'était pas toujours
évident de confirmer certains cas malgré l'expérience du
technicien microscopiste (17 ans). En effet, pour 13 lames, nous avons dû
re confectionner et re colorer les GE alors que pour 2 lames, un frottis mince
a été nécessaire pour trancher sur l'espèce
parasitaire. Le temps minimum pour réaliser une GE était
d'environ 45 minutes quand la lame était fortement positive alors que le
maximum était d'environ 120 minutes (lames mal colorées et/ou
avec parasitémie très faible). Ce délai de
réalisation ne tient pas compte des éventuelles coupures
d'électricité assez fréquentes au laboratoire pendant
notre étude. Le tout sans oublier l'expertise du
Médecin-Biologiste pour le contrôle de qualité
journalier.
ü L'outil pour la réalisation des
Diaspot®-Malaria-Pf était simple (pas d'appareillage
supplémentaire car tout était dans la trousse). Le test
était relativement facile à exécuter (Annexe
7) et le temps de rendu des résultats variait entre 5 et 25
minutes.
Contraintes rencontrées : Nous avons
dû reprendre un test dont le résultat était invalide.
.
- Par rapport à la recherche entre d'association
entre les résultats des tests (Diaspot®-Malaria-Pf / GE)
et chacun des cinq principaux symptômes du paludisme.
Notre étude a montré que :
- L'état fébrile n'était associé,
ni au résultat de la GE (P=0,44), ni au résultat du
Diaspot®-Malaria-Pf (P=0,56) comme nous pouvons le voir dans le
tableau 4. Et pourtant la fièvre est et a toujours
été considéré comme signe majeur du paludisme. Sans
être une contradiction, ceci nous permet de comprendre que le diagnostic
de cette maladie ne saurait être basé sur ce seul signe, fusse - t
- il une signe jugé majeur. Surtout que la fièvre est commune
à de nombres autres pathologies dans notre contexte (Sayang et
al, 2000 ; Dicko et al, 2005 et Lubell et al,
2007).
- Les associations entre chacun des deux tests (GE et
Diaspot®-Malaria-Pf) et chacun des symptômes suivants
à savoir : les céphalées, les courbatures et la
fatigue (Tableaux 5, 6 et 7) n'ont pas été
jugées significatives pour l'un comme pour l'autre test ; aucune
des valeurs P n'ayant été inférieures à 0,05. Comme
avec la fièvre, et dans un contexte de maladies émergentes et
réémergences (SIDA, arboviroses, tuberculose, salmonelloses,
etc...), tous ces signes/symptômes pris isolément ne suffisent
plus pour prédire de façon isolée le paludisme. Cette
thèse renforce encore plus s'il en était encore besoin, la
nécessité d'un diagnostic biologique pour confirmer
systématiquement tout paludisme clinique que ce soit par goutte
épaisse ou par un TDR aux performances avérées. L'enjeu
ici est double : Ne mettre sous traitement que des cas réellement
confirmés (économies d'ACT et d'autres antipaludéens) et
Prendre en charge correctement et rapidement tous les cas infirmés parce
qu'on réoriente le diagnostic vers d'autres affections possibles. (OMS,
2006 ; Lubell et al, 2007 ; Drakeley et al, 2009 et
Msllem et al, 2009)
- Par contre, nous avons pu trouver une association
statistiquement significative (P=0,01) entre la GE et les frissons
(Tableau 8) ce qui suggère qu'en présence des
frissons, on a plus de chance d'avoir une GE positive (souffrir de paludisme).
Mais cette association cesse d'être significative lorsqu'il s'agit du
Diaspot®-Malaria-Pf (P=0,06) ! Cette légère
discordance statistique peut à notre avis s'expliquer par le fait que
par rapport à la GE, un nombre plus élevés de positif
aurait été retrouvée chez les des personnes ne
présentant pas de frissons, probablement des faux positifs.
v Performances diagnostiques du
Diaspot®-Malaria-Pf par rapport à la GE
(gold)
Des données du tableau 9, deux ont
retenu notre attention : Les 11 faux positifs et les 5
faux négatifs. Par ailleurs le tableau 10 nous donne
avec leurs intervalles de confiance 95% les paramètres de
validité du Diaspot®-Malaria-Pf par rapport à la
GE.
· Sensibilité et Spécificité
(valeurs intrinsèques du Diaspot®-Malaria-Pf
)
Ces deux paramètres mesurent la validité
intrinsèque d'un test par rapport à une référence.
Si la sensibilité mesure la capacité d'un test à
détecter les vrais positifs et par conséquent à exclure
les faux négatifs, la spécificité (Sp) quant à elle
mesure la capacité d'un test à détecter les vrais
négatifs et donc à exclure les faux positifs.
La Sensibilité du
Diaspot®-Malaria-Pf a été estimée dans la
présente étude à 94,7% avec un intervalle de confiance
à 95% (IC 95%) de [88,0 - 98,3]. Elle se situe donc entre les bornes
d'acceptabilité recommandées par l'OMS pour un TDR (> 95%).
Cette valeur indique que dans la pratique sur 100 GE positives, le
Diaspot®-Malaria-Pf sera capable d'en
confirmer environs 95 ! En d'autres
termes il ne sera pas capable de confirmer 5 cas positifs à la GE.
D'où les 5 faux négatifs obtenus sur les 98 GE positifs. Cette
sensibilité est légèrement inférieure à
celle trouvée à Yaoundé par Bechem et al (1999)
qui était de 98%, avec le Paracheck® (HRP2). Par contre elle est
supérieure à celle trouvée par Sayang et al en
2009 à Yaoundé (71,1%) avec le Diaspot®-Malaria-Pf.
La variation des données de sensibilité obtenues des trois
études précédemment citées ayant pourtant toutes
été réalisées au Cameroun nous interpellent. Si la
littérature s'accorde à reconnaitre qu'en général
les TDR (HRP2) ont des meilleures sensibilités (WHO, 2003) et que par
conséquent, ils donnent relativement moins de faux négatifs.
Qu'est ce qui peut expliquer que sur le terrain on trouve parfois des
sensibilités si variables pour des TDR ciblant pourtant le même Ag
(la HRP2) ? Les essais d'explication évoquées sont : La
possible variété génétique de la HRP2 (Kilian
et al, 1997 ; Beker et al, 2005
et Amos, 2005), la production des anticorps anti-HRP2 qui chez
certains patients seraient à l'origine de la neutralisation de la HRP2
produite par des Plasmodiums (Biswas et al, 2005 ; Lee
et al, 2006), et enfin les très faibles
parasitémies. Cette dernière option nous a semblé
très peu plausible dans un contexte comme le nôtre où, avec
l'exposition régulière aux infestations Plasmodiales, une franche
importante de la population tolèrerait une certaine parasitémie
(resterait asymptomatique). Il faudrait donc un taux de parasites sanguin plus
élevé, généralement au-dessus du seuil de
détection des TDR à base de HRP2 pour tomber malade (Munier
et al, 2009). Sayang et al (2009) avaient déjà
essayé de justifier le faible niveau de sensibilité du
Diaspot®-Malaria-Pf évalué à Yaoundé
(71,1%) par les conditions de température qui aurait été
régulièrement supérieure à 30° (Son
étude ayant été réalisée en saison
sèche). Cela nous a semblé acceptable car, à Bafoussam,
les températures au moment de notre étude (juillet) atteignaient
exceptionnellement les 30° (température maximale
recommandée pour la conservation des
Diaspot®-Malaria-Pf). La concordance relative entre les
sensibilités obtenues par Bechem et al (1999) avec la
Paracheck® et dans la présente étude avec le
Diaspot®-Malaria-Pf, dilue notre conviction par rapport à
un problème de polymorphisme de la HRP2 à moins que les
populations de Plasmodium de Yaoundé diffèrent
génétiquement de celles de Bafoussam en ce qui concerne la HRP2.
Par contre le problème d'existence d'Ac anti-HRP2 reste à
éclaircir. Par ailleurs, nous avons noté dans la présente
étude une augmentation de la Sensibilité de
Diaspot®-Malaria avec la parasitémie (Tableau
11). Cette situation a été également
retrouvée dans certaines études publiées (Iqball et
al, 2000 ; Wanji et al, 2006 et Wonsrichanalai,
2007). Enfin, rappelons que le
Diaspot®-Malaria-Pf n'a pu détecter que P.
falciparum seul. Or dans la présente étude, nous avons pu
identifier 3 fois P. malaria grâce à la GE. Ce qui
revient à dire que la sensibilité spécifique de notre test
par rapport à la détection de P. falciparum seul est de
97,8% (89/91) avec un IC95% de [91,4-99,7]. C'est dire que la
sensibilité du Diaspot®-Malaria-Pf ainsi trouvée
peut encore être améliorée avec la diminution de la
proportion des autres espèces non P. falciparum dans la
population.
La spécificité du
Diaspot®-Malaria-Pf a été chiffrée dans la
présente étude à 95,5% avec un IC95% de [92,0-97,7]. Ce
qui signifie en d'autres termes que sur 100 sujets réellement
négatifs (GE négatif), le Diaspot®-Malaria-Pf n'a
pas été capable d'en confirmer entre 4 et 5 sujets. D'où
les 11 faux positifs enregistrés sur les 242 négatifs à la
GE. Cette valeur est supérieure aux 88,8% de spécificité
qu'avaient obtenue Bechem et al (1999) lors de l'évaluation du
Paracheck®(HRP2) à Yaoundé, ainsi qu'à celle
trouvée par Sayang et al en 2009 (82,2%). Par contre cette
spécificité est comparable à celles qu'avaient obtenues
Grobusch et al (1999) pour deux TDR détectant la
protéine HRP2 (ParaSight-F® et ICT Malaria®) et dont les
spécificités étaient de 97,1% et 99,2% respectivement.
Wanji et al (2006) avaient aussi trouvé une
spécificité quasi-semblable (95,5%) avec Hexagon®, un TDR
(pLDH) et pourtant, en général, ces TDR (pLDH) sont
réputés en général plus spécifiques que les
TDR(HRP2). De nombreuses explications sur cette propension des TDR(HRP2)
à donner des taux relativement élevés de faux positifs
vont de la présence des facteurs rhumatoïdes chez les malades,
(Grobusch et al, 1999 ; Iqbal et al, 2000) à la
persistance de la HRP2 dans le sang plusieurs jours après la
clairance des Plasmodium (Wonsrichanalai, 2007 ; Rakotonirina,
2008 et WHO, 2008). Nous avons tenu compte de ce
problème dans la présente étude en excluant
systématiquement de notre échantillon tous les patients sous
traitement antipaludique dans la semaine précédant la demande
d'analyse. Seulement, dans un contexte d'automédication ambiant
dans notre région, il n'est pas sûr que ce filtrage clinique des
cas ayant commencé un traitement antipaludique avant la consultation ou
ayant dans un passé assez récent traité à domicile
un paludisme clinique ait été efficace à 100% ; les
malades ne disant toujours pas la vérité pendant les
consultations. Donc certains faux positifs retrouvés dans la
présente étude pourraient bien malgré tout être le
fait de la rémanence de la HRP2. Cette éventualité est
plus plausible chez les > 11 ans où la prévalence selon
Diaspot®-Malaria-Pf était toujours supérieure
à celle donnée par la GE. L'hypothèse des faux positifs
dus aux facteurs rhumatoïdes n'est pas à écarter aussi.
· Valeurs Prédictives Positive et
Négatives (VPP et VPN) (valeurs dépendantes de la
prévalence)
Les valeurs prédictives sont également les
paramètres de performances d'un test mais ces valeurs sont
étroitement liées à la prévalence de la maladie
dans la région où le test est utilisé. Elles sont d'un
intérêt plus important pour le clinicien/prescripteur ou
l'utilisateur du résultat du test.
La valeur prédictive positive (VPP),
qui mesure la probabilité qu'un patient testé au
Diaspot®-Malaria-Pf ait le Paludisme (GE positive) quand le
résultat est positif a été estimée dans la
présente étude à 89,0% avec un IC95% de [81,2-94,4].
Cette valeur est relativement faible car, elle signifie en d'autre terme que 11
fois sur 100, dans la présente étude, une personne dont le
Diaspot®-Malaria-Pf était positif n'avait pas le Paludisme
(avait une GE négative). Ce qui est un problème assez
préoccupant pour l'utilisateur des résultats
(Prescripteur/Patient) qui en s'y fiant non seulement prendra la
décision de traiter inutilement ledit patient (dépenses inutiles)
mais aussi et surtout négligera un poursuite d'investigation qui aurait
peut-être permis de diagnostiquer une autre maladie. Cette VPP
était semblable à celle trouvée par Munier et al
(2009) à Dakar lors d'une évaluation du Core®
Malaria-Pf (HRP2) avec une VPP de 90%. Elle était encore meilleure que
celle trouvée pour le même Diaspot®-Malaria-Pf
à Yaoundé par Sayang et al en 2009 (73,8%).
La discussion sur les valeurs prédictives (VPP et VPN)
est délicate à faire par ce que, ces valeurs dépendent
toujours de la prévalence de la maladie dans la localité
d'étude. En effet, pour un test ayant une sensibilité et une
spécificité donnée, il y aura autant de valeurs
prédictives (VPP et VPN) que les différentes prévalences
dans la population d'étude (MacMarrow, 2008).
La Valeur Prédictive Négative
(VPN) qui est la probabilité qu'un patient n'ait pas le
Paludisme (GE négatif) quand le Diaspot®-Malaria-Pf est
négatif, a été de 97,9% avec un IC95% de [85,1-99,3].
Cette valeur indique que sur 100 patients testés négatifs au
Diaspot®-Malaria-Pf, environs 98 étaient effectivement
indemne de Paludisme (GE négative). En d'autre terme, pour un
clinicien/utilisateur se fiant aux résultats des
Diaspot®-Malaria-Pf, sur 100 patients se présentant avec un
résultat négatif, il sera induit en erreur 2 fois
seulement, c'est-à-dire qu'il ne prescrira pas à tort
d'antipaludéens chez deux patients seulement. Ceci est très
intéressant pour le clinicien dans un contexte où dans la
présente étude, sur les 336 patients suspects, 236 ne devraient
pas d'après les résultats du Diaspot®-Malaria-Pf
bénéficier d'un traitement antipaludéen dont 5 à
tort. Autant de médicaments économisés avec des
perspectives de recherche d'autres causes de maladies. Seulement, pour les 5
patients qui ne seront pas traités à tort, il y a un risque
réel de décès dû au Paludisme qu'il faudrait
chercher à éliminer en améliorant les performances du
Diaspot®-Malaria-Pf .
Cette VPN de 97,9% était inférieure à
celle trouvé par Sayang et al en 2009 à Yaoundé
pour le même Diaspot®-Malaria-Pf qui était de 80,4%
avec une prévalence dans la population d'étude estimée
à 31,3%. A la même prévalence, notre VPN aurait
été plus faible que celle que nous avons trouvée.
II. LIMITES
Les limites de notre étude
étaient relatives:
- Au fait qu'en prenant pour Gold-standard la
GE, nous avons assumé d'emblée que les
résultats de ce test concordent toujours avec la réalité
(Absence ou présence du paludisme). Dans ce cas, ce serait alors un test
parfait ! (Se=100% ; Sp=100%). Or des études ont prouvé
que La PCR avait des performances diagnostiques supérieures à la
microscopie (Berry et al, 2005). Par ailleurs, aucune méthode
diagnostique n'est fiable à 100%.
- Au fait que compte tenue de la variation
saisonnière des prévalences du paludisme, il aurait
été souhaitable de réaliser cette étude sur deux
périodes distinctes (Périodes de forte transmission et
périodes de faible transmission). Ceci aurait aidé à avoir
une idée plus vraisemblable de la prévalence palustre de notre
population d'étude ainsi que des VPP et VPN. De plus, un
échantillonnage de plus grande taille aurait crédibilisé
d'avantage nos résultats. Or le coût relativement
élevé des TDR ainsi que les contraintes académiques ne
nous ont pas permis de faire face à ces insuffisances.
- Au fait qu'ayant réalisé un
échantillonnage non probabiliste (échantillonnage de convenance)
et avec les nombreux biais de sélection (patients
sélectionnés sur la base d'un diagnostic de présomption),
l'intervalle de confiance à 95% (IC95%) donné pour encadrer nos
données à l'échelle la population générale
ne peut qu'être très approximative.
- Au fait que Diaspot®-Malaria-Pf est
conçu pour le diagnostic exclusif du Paludisme à P.
falciparum (détection de l'Ag HRP2). Or deux autres espèces
de Plasmodium (P. malaria et P. ovale) cohabitent de
façon marginale dans la région d'étude même si la
présente étude n'a pu mettre en évidence que l'une
d'elles. Une meilleure étude comparative entre GE et TDR devrait donc
impliquer ici, les TDR recherchant les autres espèces plasmodiales
présentes (détection de pLDH et/ ou de l'Aldolase).
- Au fait qu'une évaluation des coûts du
Diaspot®-Malaria-Pf est nécessaire pour vérifier leur
accessibilité financière à la grande majorité des
formations sanitaires au-delà de la validité de ses performances
diagnostiques.
CONCLUSION ET RECOMMANDATIONS
I. CONCLUSIONS
Au terme de la présente étude, nous avons
trouvé que la prévalence du paludisme dans notre population
d'étude était de 28% avec P. falciparum comme
l'espèce ultra majoritaire rencontré dans 96,8% des cas. Les
performances du Diaspot®-Malaria-Pf comparées à
celles de la goutte épaisse ont été jugées
satisfaisantes (d'après les critères OMS, Se > 95%) surtout
avec une très bonne capacité à détecter P.
falciparum (Se* : 97,8%), une Spécificité de
95,5% et une VPN de 97,9%. De plus, ils sont simples d'utilisation,
d'interprétation relativement facile et surtout, un rendu des
résultats est possible en moins de 25 minutes ! Vu sous cet angle,
nous pouvons suggérer leur utilisation à l'Hôpital
Régional de Bafoussam soit pour gérer les situations d'urgence,
soit pour faire face à une surcharge d'activités au laboratoire.
Les formations sanitaires périphériques où les conditions
ne sont pas toujours optimales pour la réalisation d'un diagnostic
microscopique fiable trouveront en ceux-ci une alternative crédible et
salutaire. Mais, pour un meilleur rendement des
Diaspot®-Malaria-Pf comme pour la plupart des TDR
évalués, ils doivent être choisis, conservés et
manipulés conformément aux directives spécifiques. De
plus, ils doivent être accessibles financièrement.
II. RECOMMANDATIONS
La présente étude comparative
réalisée à l'HRB a attesté l'efficacité du
Diaspot®-Malaria-Pf sous réserve des meilleures conditions
de sa mise en oeuvre ; d'où les recommandations suivantes que nous
formulons à l'endroit :
v Des Fabricants/fournisseurs des
Diaspot®-Malaria-Pf. (Diaspot(c) company Ltd, USA)
· Initier et/ou financer des études locales visant
à évaluer les tests Diaspot®-Malaria-Pf avant leur
mise sur le marché et même périodiquement, après
leur mise sur le marché. Ceci pour avoir des données fiables pour
crédibiliser leurs produits et améliorer continuellement leurs
performances.
· Réduire les coûts unitaires du
Diaspot®-Malaria-Pf pour favoriser leur plus large
accessibilité.
v Du Ministère de la Santé Publique et
du PNLP
· Conditionner la délivrance des ACT à la
présentation des résultats d'un test de confirmation
positif (GE ou TDR validé) dans toutes les
formations sanitaires du pays, y compris dans les pharmacies. sauf exceptions
particulières.
· Mettre en place un laboratoire national de
référence du paludisme chargé entre autre du
contrôle de qualité et de la validation des TDR du paludisme en
circulation sur le marché Camerounais.
· Sortir du marché des réactifs tous les
TDR non évalués et non validés localement.
· Apporter un appui aux études visant à
évaluer les performances des TDR qui font partie aujourd'hui du paquet
de prise en charge du paludisme avec les ACT.
· Instruire dans les formations sanitaires où les
conditions de microscopie idéales ne sont pas remplies l'utilisation des
TDR évalués et validés.
· Subventionner fortement les TDR validés à
la suite des ACT afin de les rendre accessibles dans toutes les formations
sanitaires du pays et pourquoi pas à certains groupes formés.
v Des Responsables de l'HRB
· Mettre à la disposition du laboratoire de l'HRB
des TDR (HRP2) validés, à l'exemple du
Diaspot®-Malaria-Pf.
· Réserver les TDR validés localement (y
compris Diaspot®-Malaria-Pf ) pour les situations d'urgence
médicale, de surcharge de travail ou de déficit en personnel de
laboratoire. Mais par contre, avoir recours à la microscopie (GE) en
situation normale, en cas de contrôle post traitement. Ou si la
nécessité d'identifier l'espèce parasitaire et la
parasitémie s'imposent.
· Former le personnel de son laboratoire à
l'utilisation des TDR en général et du
Diaspot®-Malaria-Pf.
· Des responsables des formations sanitaires
périphériques.
· Pouvoir les formations sanitaires en TDR
évalués et validés y compris
Diaspot®-Malaria-Pf. Ceci en vue de pallier aux insuffisances
liées au diagnostic microscopique tout en améliorant leurs
capacités diagnostic (délai et qualité).
REFERENCES BIBLIOGRAPHIQUES
IX. REFERENCES BIBLIOGRAPHIQUES.
1. Amos F. (2005). Performances
diagnostiques du test rapide Optimal-IT: Place de la Biologie
moléculaire dans l'évaluation du polymorphisme
génétique de la lactate déshydrogénase (LDH) de P.
falciparum. Thèse de doctorat en pharmacie, Université de
Bamako, Mali. 144p.
2. ANOFEL (2002). Association Nationale
(Française) de Parasitologie-Mycologie,
Parasitologie-Mycologie, Collection
références, 7ème édition, Angers,
France, pp 103-122
3. Aubry P. et Jaffar-bendjee M. C.,
(2010). Le paludisme. Diplôme de
Médecine Tropicale des pays de l'Océan Indien, Université
de Bordeaux, France, pp 6.
4. Baker J. (2005). Genetic diversity of
P. falciparum Histidine Rich Protein-II (PfHRPII) and its effect on the
performance of PfHRP-II based Rapid Diagnostic Test. The Journal of
infectious diseases.192: 870-877.
5. Bechem N.N., Leke R.F.G., Tietche F. and Taylor
D.W. (1999) Evaluation of a rapid test for
histidine rich protein 2 for diagnosis of Plasmodium falciparum infection in
Cameroonian children. Trans R Soc Trop Med Hyg; 93: 46.
6. Berry A., Fabre R., Benoit-Vical F., Cassaing S.,
Magnaval J-F. (2005), Contribution of PCR-Based Method to
Diagnosis and Management of imported Malaria. Med Trop; 65 : 176-183
7. Biswas S, Tomar D, Rao DN, (2005).
Investigation of the kinetics of histidine-rich protein 2 and of the
antibody responses to this antigen, in a group of malaria patients from
India. Ann Trop Med Parasitology 99: 553-562
8. BUCREP (2010). Bureau Central de
Recensement et d'Etude de la Population au Cameroun : 3e
Recensement Général de la Population et de l'Habitat :
Rapport de présentation des résultats définitifs.
Yaoundé ; le 30.03.2010.
www.bucrep.org consulté le
17.10.2010
9. Cox-Singh (2008) :
Le paludisme à P. knowlesi est largement répendu et
potentiellement mortel
[Abstract].CID.(Malaisie/Australie/London School) 46 :165-171
10. Dicko A, Mantel C, Kouriba B, Sagara I, Thera MA,
Doumbia S, Diallo M, Poudiougou B, Diakite M, Doumbo OK, (2005).
Season, fever prevalence and pyrogenic threshold for malaria disease
definition in an endemic area of Mali. Trop Med Int Health
10: 550-556
11. Drakeley C. et Reyburn H. (2009). Out
with the old, in with the new: The utility of Rapid diagnostic test for malaria
diagnosis in Africa. Transactions of Royal Society of Tropical Medicine
and Hygiene.103:333-337
12. Durand F., Faure O, Brion J.P. et Pelloux
H. (2005). Invalid result of Plasmodium falciparum malaria
detection with the Binax-Now Malaria rapid diagnostic test. Jour. Med.
Microbiol 54: 1115
13. Durrheim D.N., Becker P.J. Billinghurst K. et
Brink A., (1997). Diagnostic disagreement - the lessons learnt
from malaria diagnosis in Mpumalanga. S Afr Med J 87: 609-611
14. Escalante A. et Ayala F. (1994)
« Phylogeny of the malarial genus Plasmodium, derived from rRNA
gene sequences », in Proc Natl Acad Sci U S A, vol.
91, n° 24, pp. 11373-7
15. Gentillini M. (1993) Maladies
Parasitaires : Le Paludisme. In : Médecine
Tropicale. Flammarion Médecine Science, Paris, pp. 91-122.
16. Grobusch M. P., Alpermann U., Schwenke S.,
Jelinek T. and Warhurst D. C. (1999) False-positive rapid test for
malaria in patients with rheumoid factor. Lancet; 353: 297.
17. Impact malaria. Le paludisme au
Cameroun :
www.impac-malaria.com;
Consulté le 22/12/2010
18. INSERM (2007). Institut National de la
Santé et de Recherche Médicale. Le
Paludisme; INSERM-Actualités 205:2-9
19. Iqbal J., Sher A. and Rab (2000),
Plasmodium falciparum histidin Rich protein base immunocapture diagnostic
assay for malaria: Cross reactivity with rheumatoïd factor. Journal
Clinical Microbiology, 38:1184-1186
20. Iqball J., Khalid N. et Hira P. R.
(2002): Comparison of two commercial assays with expert microscopy for
confirmation of symptomatically diagnosed malaria. Journal Clin.
Microbiology. 12 : 4675-4678
21. Kilian A., Mughusu B., Kabagambe and Von
Sonnenburg F. (1997). Comparison of two rapid HPR-2 based
diagnostic test for P. falciparum. Trans. Roy. Society of Tropical
Medecine and Hygene. 91 :666-667
22. Lalloo D. et Naraqi S. (1992). The
diagnosis of malaria: traditional and contemporary approaches. P N G Med
Journ 35: 243-248
23. Lee N., Baker J., Andrews K.T. (2006)
Effect of sequence variation in Plasmodium falciparum histidine-rich
protein 2 on binding of specific monoclonal antibodies: implications for rapid
diagnostic tests for malaria. Journ Clin Microbiol; 44: 2773-8.
24.
Liu
W.,
Li
Y.,
Learn
G. H.,
Rudicell
R. S.,
Robertson
J. D.,
Keele
B. F.,
Ndjango
J.B. N.,
Sanz
C. M.,
Morgan
D. B.,
Locatelli
S.,
Gonder
M. K.,
Kranzusch
P. J.,
Walsh P. D.,
Delaporte
E.,
Mpoudi-Ngole
E.,
Georgiev
A. V.,
Muller
M. N.,
Shaw
G. M.,
Peeters
M.,
Sharp
P. M.,
Rayner
J. C. and
Hahn
B. H.; (2010): Origin of the human malaria parasite Plasmodium
falciparum in gorillas. J. Nature
467,420-425 (23 septembre 2010) doi:10.1038/nature09442
www.nature.com
25. Lubell Y., Reyburn H., Mbakilwa H., Mwangi R.,
Chonya B., Whitty J M. and Mills A.(2007). The cost-effectiveness
of parasitological Diagostic of Malaria for Malaria-suspected patients in an
Era of combination therapy. Am. J. Trop. Med. Hyg 77(suppl 6):128-132
26. Mac Morrow M. (2008). Challenges in
routine implimentation and quality contrôle of rapid diagnostic test for
malaria. Rufji District, Tanzania. American Journal of Trop. Med. Hyg,
79(3)385-390
27. Malaria R and D Alliance (2005).
Malaria Research and Developmenty. An Assessment of global Investment.
November 2005.
www.malariaalliance.org
28. McKenzie F. E., Sirichaisinthop J., Miller R. S.,
Gasser R.A. Jr, Wongsrichanalai C., (2003). Dependence of malaria
detection and species diagnosis by microscopy on parasite density. Am J
Trop Med Hyg 69: 372-376.
29. Meyer O., (1989) Comment
interpréter les résultats des examens immuno-rhumatologiques?
Feuillets de Biologie 30, (171) 57-64
30. Moody A. (2002). Rapid Diagnostic Test
for malaria Parasites. Journal of Clinical Microbiology,1: 66-68
31. Msellem M.I. , Martensson A. , Rotllant G. ,
Bhattarai A , Stromberg J , Kahigwa E., Garcia M., Petzold M., Olumese P., Ali
A. and Björkman A. (2009). Influence of Rapid Malaria
Diagnostic Tests on Treatment and Health Outcome in Fever Patients Zanzibar-A
Cross over Validation Study. PLoSMed 6(4):Journal.pmed.1000070
32. Munier A., Diallo A., Sokhna C. et Chippaux
J.P. (2009) Evaluation d'un test de diagnostic rapide du paludisme
dans les postes de santé ruraux au Sénégal, Med Trop;
69 : 496-500
33. MSP (2008). Ministère de la
Santé Publique du Cameroun. Guide du diagnostic du paludisme chez
l'Homme. 72p.
34. MSP (2007). Ministère de la
Santé Publique du Cameroun. Plan Stratégique National de
Lutte contre le Paludisme au Cameroun 2007-2010. The Global Fund Draft,
non publié, 2007; 145p.
35. MSP (2010). Ministère de la
Santé Publique du Cameroun. Directives pour la gestion et
l'utilisation rationnelle des combinaisons thérapeutiques à base
d'artémisinine (ACT) au Cameroun, Mars 2010 ; 40p.
36. OMS (2000). Comité d'experts
du paludisme. Vingtième rapport, Genève, série de
rapports techniques n° 892)
37. OMS (1994) Manuel des Techniques de
Base pour laboratoires tropicaux, Bibliothèque de l'OMS,
Genève, 488 P.
38. OMS (2006) Directives OMS pour le
traitement du paludisme. WHO/HTM/MAL/1108
39. OMS (2009). World Malaria
Report. WHO library Catalogue in Publications data. Geneva, 78 P.
40. Payne D, (1988). Use and limitations
of light microscopy for diagnosing malaria at the primary health care
level. Bull World Health Organ 66: 621-626
41. Petithory JC. et Ardoin-guidon F.
(2001). Les parasites sanguins : Diagnostic biologique in
BIOFORMA (cahiers de formation : Biologie Médicale. Cahier
n°23. Décembre 2001.
42. Poinsignon A. (2008), Etude de la
relation Homme-Vecteur. De l'identification à la validation des
protéines salivaires comme marqueur immunologique d'exposition aux
piqures d'An. Spp et Glossina spp. Thèse de
Doctorat de Parasitologie, Université de Montpellier I, France, 228p
43. PNLP (2008), Programme National de Lutte contre
le Paludisme de la RD-Congo. Planches pour le diagnostic
microscopique du paludisme. Ministère de la
Santé publique
44. Rakotonirina H., Barnadas C., Raherigafy R.,
Andrianantenaina H., ratsimbasoa A., Randrianasolo L., Jahevitra M.,
Andriantsoanirina V. and Médnard D. (2008) Accuracy and
Reliability of Malaria Diagnostic techniques for Guiding febrile outpatient
treatment in Malaria-endemic countries. Am. J. Trop. Med.Hyg. 578
(2)217-221
45. Reyburn H, Ruanda J, Mwerinde O, Drakeley
C, (2006). The contribution of microscopy to targeting
antimalarial treatment in a low transmission area of Tanzania. Malaria
Journ. 5: 4.
46. Sayang C., Soula G., Tahar R., Basco L., gazin
P., moyou-Somo R. and Delmont J. (2009) Use of Histidine Rich
protein 2- based Rapid Diagnostic test for Malaria by Health personnel during
routine consultations of febrile out patients in a peripheral health facility
in Yaoundé, Cameroon. American Journal of Trop. Med. Hyg. 2009.
82(2)343-347
47. Sayang C. (2010).
Intérêt de l'utilisation des Tests de Diagnostic Rapide du
Paludisme sur le coût et l'efficacité de la prise en charge des
patients fébriles à Yaoundé, Cameroun. Thèse
de Doctorat en santé publique, Université de Marseille,
Marseille, France. pp 162
48. Samuel Shillcutt, Chantal Morel, Catherine
Goodman, Paul Coleman, David Bell, Christopher JM Whittyd & A
Millsc (2007); Cost-effectiveness of malaria diagnostic methods in
sub-Saharan Africa in an era of combination therapy; Bulletin of the World
Health Organization; Article ID: 07-042259; Article DOI:
10.2471/BLT.07.042259
49. Snounou G, Viriyakosol S, Jarra W, Thaithong S,
Brown K.N. (1993). Identification of the four human malaria
parasite species in field samples by the polymerase chain reaction and
detection of a high prevalence of mixed infections. Mol Biochem Parasitol
58: 283-292.
50. Swartout TD., Counihan R., Kabangwa R.;
VandenBroek I. (2007): Accuracy and recently treated Plasmodium
falciparum infections: Is there a risk of over-diagnosis? Malaria Journal,
6:58doi:10.1186/1475-2875-6-58
51. Tarekegn A., Mojca K., Caroline J., James B.,
DirkH Mueller, Michael Okia, Beth Rapuoda , Brian Greenwood and Jonathan
Cox (2008). Determinants of the accuracy of rapid diagnostic tests
in malaria case management: evidence from low and moderate transmission
settings in the East African highlands. Malaria Journal.7:202.
52. Van den Broek I. (2006). Evaluation
of three Rapid Tests for diagnosis of P. falciparum and P. vivax malaria in
Colombia. American Journal of Medecin and Hyg. 75:1209-1215
53. Wandji S., Kimbi K., Eyong J., Tendonfor N. and
Ndamukong J. (2008). Performance and usefulness of hexagon rapid
diagnostic test in children with asymptomatic malaria living in the Mounth
Cameroon Region. Malaria Journal, 7:89
54. WHO (2004) Malaria Rapid Diagnostic
Test. Geneva. Roll Back Malaria, Regional Officer for Western Pacific and
UNDP/World Bank/WHO/UNICEF special Program for Research and Training in
Tropical Diseases.
55. WHO (2004) Role of Parasitological
diagnosis in malaria case management in areas of high transmission.
Summary of the outcomes of a WHO Technical Consultation Held
in Geneva 25 - 28 October 2004, Geneva. World Health organization
56. WHO (2006). The role of Laboratory
diagnosis to support malaria case management fucus on the use of rapid
diagnostic test in areas of high transmission. Report of a WHO technical
Consultation. 25-26 Octobre 2004. 40 P.
57. WHO (2008). Malaria Rapid Diagnostic
Test performance. Result of WHO product testing of malaria: Round 1.
58. WHO (2005), World Health
Organization Technical Consultation to review the role of parasitological
diagnosis to support malaria disease management: Focus on the use of RDTs in
areas of high transmission deploying ACT treatment, WHO: Geneva.
59. WHO (2009): World Malaria
Report. Global Malaria Programm: WHO Library Catalogue in Publications
data. Geneva, 78 P.
60. World Health Organization, (1988).
Malaria diagnosis: Memorandum from a WHO Meeting. Bull World Health
Organ 66: 575- 594
61. World Health Organization, (1991).
Basic Malaria Microscopy. Geneva: WHO
62. Wonsrichanalai C., Mazie J. Barcus, Muth S.,
Sutamihardja A. and Werndorfer (2007):
Microscopy and Rapid Diagnostic Test (RDT). Am. J. Trop. Med. Hyg. 77
(6suppl),.119-127
63.
www.bafoussam.fr/bafoussam_geographie.htm:
Géographie de Bafoussam. Consulté le 11.02.201
64.
www.bioltrop.org: La biologie
tropicale sur le net. Consulté le 17.07.2009
65.
www.dpd.cdc.gov : Cycle
biologique du Plasmodium spp: Consulté le 12.05. 2010
66.
www.rfi.fr/actufr/articles/052/article_27474.asp
67. Zurovac D, Midia B, Ochola SA, English M, Snow
RW, (2006). Microscopy and outpatient malaria case management
among older children and adults in Kenya. Trop Med Int Health 11:
432-440
ANNEXES
X. ANNEXES
ANNEXE.1
TANKE DONGMO Norbert
Master II,
Parasitologie
Faculté des sciences/Université de Dschang
Bafoussam, le 2011
A
Monsieur le président
du Comité National d'Ethique.
Objet : Demande de clairance
éthique.
Monsieur,
J'ai l'honneur de venir auprès de votre service
solliciter l'obtention d'une clairance éthique pour mes travaux de
recherche en vue de la rédaction d'une thèse de Master en
parasitologie. Est joint à cette demande un exemplaire du protocole de
recherche.
Dans l'attente d'une suite favorable, veuillez agréer,
monsieur l'expression de mon respect.
TANKE DONGMO Norbert.
ANNEXE.2
TANKE DONGMO Norbert
Master II,
Parasitologie
Faculté des sciences/Université de Dschang
Bafoussam, le 2010
A
Madame
le Directeur de l'Hôpital Régional de Bafoussam
Objet : autorisation pour travail de
recherche.
Madame le Directrice,
J'ai l'honneur de venir auprès de votre bienveillance
solliciter l'autorisation de mener une recherche dans le laboratoire de votre
hôpital sur le thème `'Etude comparative de deux
méthodes de diagnostic biologique du paludisme : TDR et GE. Cas des
patients reçus à l'hôpital régional de
Bafoussam'', en vue de l'obtention du Master of Science
« parasitologie ».
Sont joints à la présente demande, un exemplaire
du protocole de recherche et un exemplaire de la demande de clairance
éthique.
Dans l'attente d'une suite favorable, veuillez agréer,
madame le Directeur l'expression de mon profond respect
TANKE DONGMO Norbert
ANNEXE.3
Fiche de collecte des données (N*
______)
· Titre : Etude comparative d'un
Tests de Diagnostic Rapide (Diaspot®) avec la Goutte
épaisse (GE) à l'Hôpital Régional de Bafoussam
· Identification
Nom et prénom :
_______________________ Age : ___ ans
Sexe: M F
· Clinique : (le même jour ou dans la
semaine précédant le prélèvement)
Non Oui
- Fièvre :
- Céphalées :
- Courbature :
- Frissons :
- Fatigue généralisée
· Diagnostic Biologique
|
Type d'analyses
|
Résultats
|
Espèce et forme
|
Parasitémie
estimée
(Pour 200 GB)*
|
(Pas de parasitémie estimée pour les
TDR)*
|
|
GE
|
|
|
|
|
|
TDR (Diaspot)
|
|
P. f
|
|
|
*Parasitémie GE/uL = Plasmodiums
comptés x 8 000 / 200 (MSP, 2007 ; Moody,
2002).
** Pas de quantification pour le
Diaspot
Bafoussam ; le ________________
ANNEXE.4
Fiche technique de
Coloration au May Grünwald-Giemsa (MGG)
Indication : C'est la coloration
par excellence des FM en vue d'examens de cyto-hématologie et de
Parasitologie sanguine.
Matériel :
Lames
étalées (FM), cuves et colorants (May-Grünwald et Giemsa),
eau tamponnée, éprouvette
Mode opératoire :
· Recouvrir entièrement le frottis de la solution
de May-Grunwald et laisser agir 3 minutes.(Fixation du FM)
· Diluer en y ajoutant une égale quantité
d'eau (tamponnée) et laisser agir 2 minutes
· Rincer à l'eau du robinet (Coloration au MG)
· Recouvrir le FM d'une solution de Giemsa dilué
préparé extemporanément (1 vol. De Giemsa + 9 vol. d'eau
tamponnée) et laisser agir 15 à 20 minutes
· Rincer abondamment à l'eau du robinet,
égoutter et sécher à l'abri des poussières.
ANNEXE.5
Fiche technique de Coloration au Giemsa (OMS,
1994)
Indications : Le Giemsa est en
général utilisé dans la pratique pour la coloration des GE
des FM fixés préalablement en vue d'examens parasitologiques et
de cytohématologie.
Matériel : Lames à
colorer, Giemsa-R (solution mère), eau tamponnée,
éprouvette, pipettes compte-gouttes.
Mode opératoire :
§ Recouvrir les lames à colorer de Giemsa
(solution de travail) diluée
extemporanément
§ Laisser agir pendant 15 à 20 à
minutes
§ Rincer délicatement à l'eau
du robinet, égoutter et sécher à l'abri des
poussières.
§ Dans le cas de frottis pour recherche de
plasmodium, les noyaux leucocytaires sont violet foncé, la
chromatine du plasmodium est rouge foncé et son cytoplasme bleu
pâle.
Ø Préparation de Giemsa (solution de
travail)
Selon qu'on ait à faire au Giemsa Rapide ou au Giemsa
Lent, la solution mère sera diluée au 1/10e ou au
1/20e de préférence dans de l'eau
tamponnée (pH 7 - 7,2). Bien mélanger. A utiliser dans
la même journée. En pratique, pour une dilution au 1/10, prendra
2ml de Giemsa pour 18 ml d'eau tamponnée ; soit 20 ml de Giemsa
prêt à l'emploi. Ce qui correspond à la coloration de 5
lames.
ANNEXE.6
Fiche technique de préparation des
Réactifs et Colorants pour Diagnostic Microscopique du
Paludisme
1. May-Grünwald (MG) (OMS, 1994 ;
www.bioltrop.org)
a. Formule
§ Poudre de May-Grunwald : 5g
§ Méthanol : qsp 1000 ml
b. Préparation solution de
MG
§ Dans un flacon propre contenant des billes, introduire
la poudre et le méthanol.
§ Mélanger pour dissoudre toute la poudre.
Conserver le colorant à l'abri de la lumière, de la chaleur et
de l'humidité en le mélangeant régulièrement. Noter
la date de préparation : durée
conservation : 2 semaines au moins
2. Le Giemsa
C'est un mélange de poudre d'azur II -éosine
avec de petites quantités d'azur I et de bleu de méthylène
dissous dans un mélange de méthanol et de glycérol servant
à la fois de solvants et de conservateur. Sa dilution avec de l'eau
entraine une dissociation partielle de ces colorants responsables des
colorations basophiles et acidophiles des différents compartiments
cellulaires. D'où sa préparation extemporanée et son
instabilité après dilution à l'eau. Il existe 2 variantes
du Giemsa : le Giemsa rapide (responsable d'une coloration intense en peu
de temps) et le Giemsa lent qui colore moins rapidement.
a. Formule (solution
mère) (OMS, 1994; www.bioltrop.org)
· Colorant de Giemsa en poudre 0,75 g
· Méthanol (CH3OH) 65 ml
· Glycérine 35 ml
b. Préparation (solution mère)
(OMS, 1994)
· Commencer par verser le méthanol dans un flacon
contenant des billes de verre (ou des petits galets très propres) puis
ajouter la poudre et la laisser doucement se déposer au fond du flacon.
· Agiter ensuite pendant 3 minutes de manière
circulaire.
· Ajouter enfin le glycérol et mélanger de la
même manière. Remuer ensuite, toujours de cette manière 3
fois par jour, pendant 4 jours consécutifs.
· Filtrer. Noter la date de
fabrication.
Une solution mère se conserve environs trois mois
à l'abri de l'air (bien boucher), de la lumière (en flacon
opaque) et de l'humidité.
3. La technique de Wright. (BIOFORMA,
2001 ; OMS, 1994)
C'est une variante semblable au Giemsa utilisée au
Etats-Unis pour colorer les cellules.
a. Formule :
- Poudre de Wright : 0,3 g
- Glycérine : 3 ml
- Méthanol : 97ml
4. Préparation eau tamponnée (OMS,
1994)
§ Phosphate disodique (Na2HPO4, 2H2O) : 3,76 g
§ Phosphate monopotassique (KH2PO4) anhydre : 2,1g
§ Eau distillée : qsp. 1000 ml
NB. : Contrôler le pH à l'aide de
papiers indicateurs et il doit être compris entre 7,0 et 7,2
ANNEXE.7
Source : (Sayang , 2010)



DIASPOT -
DIASPOT
DIASPOT
DIASPOT
DIASPOT
DIASPOT
DIASPOT
DIASPOT
DIASPOT

| 


