UNIVERSITE
CHEIKH ANTA DIOP DE DAKAR
ECOLE INTER - ETATS DES SCIENCES ET MEDECINE
VETERINAIRES
(E.I.S.M.V.)

ANNEE : 2005
N°32
EVALUATION DU DIAGNOSTIC PAR PCR DIRECTE ET PCR-ELISA
SUR LES ITS DES TRYPANOSOMES PATHOGENES DU BETAIL
1
THESE
Présentée et soutenue publiquement le 18
Juillet 2005
devant la Faculté de Médecine, de Pharmacie et
d'Odonto-Stomatologie de Dakar
pour obtenir le grade de
DOCTEUR EN MEDECINE VETERINAIRE
(Diplôme d'Etat)
Par
BACHIR SOULEY KOUATO
Né le 15 Octobre 1975 à Niamey (Niger)
JURY :
Président :
M. Fafa CISSE
Professeur à la Faculté de Médecine, de
Pharmacie et d'Odonto-Stomatologie de Dakar
Directeur et Rapporteur de
Thèse : M. Ayayi Justin
AKAKPO
Professeur à l'E.I.S.M.V. de Dakar
Membres :
M. Yalacé Yamba KABORET
Professeur à l'E.I.S.M.V. de Dakar
Mme Rianatou Bada Alembedji
Maître de Conférences Agrégé à l'E.I.S.M.V.
de Dakar
Co-directeur de Thèse :
M. Marc DESQUESNES
Chercheur au CIRDES de Bobo-Dioulasso


COMITE DE DIRECTION
LE DIRECTEUR
Professeur François Adébayo
ABIOLA
LES COORDONNATEURS
Professeur
Moussa ASSANE Coordonnateur des Etudes
Professeur Malang SEYDI
Coordonnateur des Stages et
de la Formation Post-Universitaires
Professeur Germain Jérôme
SAWADOGO
Coordonnateur Recherches et
Développement
Année Universitaire
2004-2005
PERSONNEL ENSEIGNANT
PERSONNEL ENSEIGNANT EISMV
PERSONNEL VACATAIRE (PREVU)
PERSONNEL EN MISSION (PREVU)
PERSONNEL ENSEIGNANT CPEV (PREVU)
PERSONNEL ENSEIGANT DEA- PA
PERSONNEL ENSEIGNANT
DEPARTEMENT DES SCIENCES
BIOLOGIQUES ET PRODUCTIONS ANIMALES
CHEF DE DEPARTEMENT : Professeur
Cheikh LY
SERVICE
ANATOMIE-HISTOLOGIE-EMBRYOLOGIE
Serge N. BAKOU Maître - Assistant
ISMAIL SY Docteur Vétérinaire Vacataire
Moustapha AHAMET Docteur Vétérinaire Vacataire
Galbert Simon NTEME ELLA Docteur Vétérinaire
Vacataire
SERVICE CHIRURGIE -
REPRODUCTION
Papa El Hassane DIOP Professeur
Alain Richi KAMGA WALADJO Assistant
Mlle Nicole Edwige NEZZI Monitrice
SERVICE ECONOMIE RURALE ET
GESTION
Cheikh LY Maître de Conférences
agrégé
Kora Brice LAFIA Moniteur
SERVICE
PHYSIOLOGIE-PHARMACODYNAMIE-THERAPEUTIQUE
Moussa ASSANE Professeur
Rock Allister LAPO Assistant
Ibrahim Mahmat SALLE Moniteur
SERVICE PHYSIQUE ET CHIMIE
BIOLOGIQUES ET MEDICALES
Germain Jérôme SAWADOGO Professeur
Yaméogo NONGASIDA Assistant
Papa Serigne SECK Moniteur
Alpha Amadou DIALLO Moniteur
SERVICE
ZOOTECHNIE-ALIMENTATION
Ayao MISSOHOU Maître de Conférences
Agrégé
Arsène ROSSILET Assistant
Joachim TONONGBE Moniteur
DEPARTEMENT DE SANTE PUBLIQUE
ET ENVIRONNEMENT
CHEF DE DEPARTEMENT : Professeur LOUIS JOSEPH PANGUI
1.SERVICE HYGIENE ET
INDUSTRIE DES DENREES ALIMENTAIRES D'ORIGINE ANIMALE (HIDAOA)
Malang SEYDI Professeur
Mlle Bellancille MUSABYEMARIYA Assistante
Khalifa Babacar SYLLA Attaché de
recherche
Sam Patrice MADJIKAM Docteur
Vétérinaire Vacataire
Olivier BAHORO-SARANZI Moniteur
2. SERVICE
MICROBIOLOGIE-IMMUNOLOGIE-PATHOLOGIE INFECTIEUSE
Justin Ayayi AKAKPO Professeur
Mme Rianatou ALAMBEDJI Maître de Conférences
Agrégée
Mlle Nadège DJOUPA MANFOUMBY Docteur
Vétérinaire Vacataire
Charles Olivier GOMSU DADA Moniteur
3. SERVICE
PARASITOLOGIE-MALADIES PARASITAIRES-ZOOLOGIE APPLIQUEE
Louis Joseph PANGUI Professeur
Oubri Bassa GBATI Assistant
Gael Darren MAGANGA Moniteur
4. SERVICE PATHOLOGIE
MEDICALE-ANATOMIE PATHOLOGIQUE-CLINIQUE AMBULANTE
Yalacé Yamba KABORET Professeur
Yacouba KANE Assistant
Mme Mireille KADJA WONOU Assistante
Gana PENE Docteur Vétérinaire Vacataire
Omar FALL Docteur Vétérinaire Vacataire
Charles Benoît DIENG Docteur Vétérinaire
Vacataire
Mlle Ndéye Sokhna KEITA Monitrice
Boubacar OUEDRAOGO Moniteur
5. SERVICE
PHARMACIE-TOXICOLOGIE
François Adébayo ABIOLA Professeur
Félix Cyprien BIAOU Maître - Assistant
Assiongbon TEKO AGBO Attaché de recherche
Basile MIDINHOUEVI Moniteur
DEPARTEMENT
COMMUNICATION
CHEF DE DEPARTEMENT : Professeur YALACE YAMBA KABORET
SERVICES
BIBLIOTHEQUE
Mariam DIOUF Documentaliste
SERVICE
AUDIO-VISUEL
Bouré SARR Technicien
OBSERVATOIRE DES METIERS DE
L'ELEVAGE
Yao AKPO Docteur Vétérinaire Vacataire
Arsène MEBA MEFOUA Moniteur
DEPARTEMENT SCOLARITE
El Hadj Mamadou DIENG Vacataire
Franckline ENEDE Monitrice
PERSONNEL VACATAIRE (Prévu)
BIOPHYSIQUE
Mme Sylvie SECK GASSAMA Maître de Conférences
Agrégée
Faculté de Médecine et de Pharmacie
UCAD
BOTANIQUE
Antoine NONGONIERMA Professeur
IFAN - UCAD
AGRO-PEDOLOGIE
Modou SENE Directeur de Recherche
Ecole Nationale Supérieure d'Agronomie
(ENSA THIES)
ZOOTECHNIE
Abdoulaye DIENG Docteur Ingénieur
Enseignant à ENSA - THIES
Léonard Elie AKPO
Maître de Conférences
Faculté des Sciences et Techniques
UCAD
Kalidou BA Docteur Vétérinaire
(Ferme NIALCOULRAB)
H I D A O A
NORMALISATION ET ASSURANCE QUALITE
Mme Mame S. MBODJ NDIAYE Chef de la division
Agro-Alimentaire
de l'Association Sénégalais
de Normalisation
PERSONNEL EN MISSION (Prévu)
ANATOMIE
Mohamed OUASSAT Professeur
I.A.V. Hassan II (Rabat)
(Maroc)
TOXICOLOGIE
CLINIQUE
A. EL HRAIKI Professeur
I.A.V. Hassan II (Rabat)
(Maroc)
PATHOLOGIE
MEDICALE
Marc KPODEKON Maître de Conférences
Agrégé
Université d'ABOMEY-CALAVI
(Bénin)
PARASITOLOGIE
Sahidou SALIFOU Maître de Conférences
Agrégé
Université d'ABOMEY-CALAVI
(Bénin)
BIOCHIMIE
Georges Anicet OUEDRAOGO Professeur
Université de BOBO-DIOULASSO
(Burkina Faso)
HYDRAULIQUE
PASTORALE
Oumarou DAWA Docteur Vétérinaire
Inspecteur Général à Yaounde
(Cameroun)
PATHOLOGIE
INFECTIEUSE
Mohamed BOUSLIKHANE Institut Agronomique et
Vétérinaire
(I.A.V.) Rabat
(Maroc)
REPRODUCTION
Hamidou BOLY Institut de
Recherche Agronomique
Ouagadougou
(Burkina Faso)
PERSONNEL ENSEIGNANT CPEV (Prévu)
MATHEMATIQUES
Sada Sory THIAM Maître-Assistant
Faculté des Sciences et Techniques UCAD
PHYSIQUE
Issakha YOUM Maître de Conférences
Faculté des Sciences et Techniques UCAD
Travaux Pratiques
André. FICKOU Maître-Assistant
Faculté des Sciences et Techniques
UCAD
CHIMIE ORGANIQUE
Abdoulaye SAMB Professeur
Faculté des Sciences et Techniques
UCAD
CHIMIE PHYSIQUE
Serigne Amadou NDIAYE Maître de Conférences
Faculté des Sciences et Techniques
UCAD
T.P. CHIMIE
Rock Allister LAPO Assistant
EISMV - DAKAR
BIOLOGIE VEGETALE
Kandiourab NOBA Maître-Assistant
Faculté des Sciences et Techniques
UCAD
BIOLOGIE
CELLULAIRE
Serge N. BAKOU Maître -
Assistant
EISMV - DAKAR
EMBRYOLOGIE ET
ZOOLOGIE
Karamoko DIARRA Maître de Conférences
Faculté des Sciences et Techniques UCAD
PHYSIOLOGIE
ANIMALE
Moussa ASSANE Professeur
EISMV - DAKAR
ANATOMIE COMPAREE DES
VERTEBRES
Cheikh T. BA Professeur
Faculté des Sciences et Techniques
UCAD
BIOLOGIE ANIMALE
(T.P.)
Serge N. BAKOU Maître - Assistant
EISMV - DAKAR
Oubri Bassa GBATI Assistant
EISMV - DAKAR
GEOLOGIE
FORMATIONS SEDIMENTAIRES
Raphaël SARR Maître de Conférences
Faculté des Sciences et Techniques UCAD
HYDROGEOLOGIE
Abdoulaye FAYE Maître de Conférences
Faculté des Sciences et Techniques
UCAD
TRAVAUX PRATIQUES
Mlle Franckline ENEDE Monitrice
PERSONNEL ENSEIGNANT du D.E.A. - P.A.
Coordination des stages et formation post -
universitaires.
Responsable du D.E.A. - PA : Professeur
Malang SEYDI
MODULES
1- ZOOTECHNIE - ALIMENTATION
Responsable :
Ayao MISSOHOU Maître de Conférences
EISMV-Dakar
Intervenants :
François A. ABIOLA Professeur
EISMV - Dakar
Moussa ASSANE Professeur
EISMV - Dakar
Yamba Y. KABORET Professeur
EISMV - Dakar
Germain J. SAWADOGO Professeur
EISMV - Dakar
Ayaho MISSOHOU Maître de Conférences
EISMV - Daka
Serge N. BAKOU Maître - Assistant
EISMV - Dakar
Arsène ROSSILET Assistant
EISMV - Dakar
Abdoulaye DIENG Ingénieur
ENSA- Thiès
Alpha BA Docteur Vétérinaire
Ferme NIACOULRAB
Gana PENE Docteur Vétérinaire Vacataire
2. SYSTEME DE PRODUCTION - ENVIRONNEMENT
Responsable :
Yamba Y. KABORET Professeur
EISMV - Dakar
Intervenants :
Moussa ASSANE Professeur
EISMV Dakar
Yamba Y. KABORET Professeur
EISMV - Dakar
Léonard Elie AKPO Maître de Conférences
Faculté de Sciences et Techniques
UCAD
Ayaho MISSOHOU Maître de Conférences
EISMV - Dakar
Abdoulaye DIENG Ingénieur
ENSA- Thiès
Oumarou DAWA Docteur Vétérinaire
Inspecteur Général
MINEPIA à Yaoundé (Cameroun)
Moussa FALL Docteur Vétérinaire
Lamine GUEYE Docteur Vétérinaire
3- REPRODUCTION - AMELIORATION GENETIQUE
Responsable :
Papa El Hassan DIOP Professeur
EISMV- Dakar
Intervenants :
Moussa ASSANE Professeur
EISMV Dakar
Papa El Hassan DIOP Professeur
EISMV - Dakar
Serge N. BAKOU Maître - Assistant
EISMV - Dakar
Alain Richi KAMGA WALADJO Assistant
EISMV - Dakar
Racine SOW Chercheur à I.S.R.A. Dakar
4. ECONOMIE - STATISTIQUES- EPIDEMIOLOGIE
Responsable :
Cheikh LY Maître de Conférences
EISMV - Dakar
Intervenants :
Cheikh LY Maître de Conférences
EISMV - Dakar
Justin Ayayi AKAKPO Professeur
EISMV - Dakar
Mohamed BOUSLIKHANE Professeur
IAV - Rabat
Adrien MANKOR Docteur Vétérinaire Chercheur
5.
HYGIENE ET INDUSTRIE DES DENREES ALIMENTAIRES D'ORIGINE ANIMALE (HIDAOA)
Responsable :
Malang SEYDI Professeur
EISMV - Dakar
Intervenants :
Malang SEYDI Professeur
EISMV - Dakar
Rianatou BADA ALAMBEDJI Maître de Conférences
EISMV - Dakar
Youssouf KONE Maître de Conférences
Université Nouakchott
Issakha YOUM Maître de Conférences
Faculté de Sciences et Techniques
UCAD
Bellancille MUSABYEMARIA Assistante
EISMV - Dakar
Serigne K. H. A. SYLLA Docteur Vétérinaire
Attaché de Recherche
EISMV - Dakar
Adboulaye DIAWARA Ingénieurs de la Direction
Ousseynou Niang DIALLO de l'Elevage. Dakar
Mme Bénédicte SISSOKO : Consultante Cabinet
Afrique Management Conseil (AMC)
Dédicaces
A Allah, le Tout Miséricordieux, le Très
Miséricordieux, Gloire à Toi, pour l'immense grâce dont Tu
nous a comblé
Au Prophète Mouhammad, Salut et
Bénédiction sur lui
A la mémoire de mon grand père Moundio
DIAWARA, il y a une vingtaine d'années vous nous avez faire part de
votre souhait de nous voir terminer nos études avec un diplôme de
vétérinaire, Allah en a décidé autrement en vous
rappelant à lui le 18 septembre 1995. 10 ans après, votre
souhait est en voie de se réaliser grâce à vos sages
conseils. Qu'Allah vous Accepte dans Son Immense paradis.
A mon père et ma mère, vos prières,
vos conseils, vos encouragements, Votre soutien, votre confiance nous ont
beaucoup aidé et nous aiderons toujours. Je vous dédie ce modeste
travail en témoignage d'amour filial et de reconnaissance
sincère. Que le bon Dieu vous accorde santé et longue
vie.
A Aïssa Salifou, vous êtes pour moi plus qu'une
tante, mais plutôt une maman. Trouvez à travers ce travail
l'expression de toute mon affection et ma profonde reconnaissance
A ma grand mère Hadjia Ata, tu restes ma
chérie de tout le temps
A la famille KOUATO Ibrahim
A la famille Moundio DIAWARA
A mes oncles et tantes
A mes frères et soeurs, cousins et
cousines
A mes neveux et nièces
A la famille CHEFFOU Amadou
A la famille WANE Bintou
A la famille Abdoulmouni ISSAKA dit
Maïnassara
A notre Parrain Ndiaga GUEYE
A notre Professeur accompagnateur Papa El Hassan DIOP, et
à tous les enseignants qui ont contribué à ma
formation.
A mes condisciples de la Promotion Ndiaga GUEYE , nous avons
partagé des moments de peine, de stress mais également de
Joie.
A mes amis d'enfance
A tous mes amis
A l'Union des Scolaires Nigériens à
Dakar
A l'Amicale des Etudiants Vétérinaires
Nigériens à Dakar
A l'Amicale des Etudiants Vétérinaires
à Dakar
Au Niger, ma patrie
Au Sénégal et au Burkina Faso, mes pays
hôtes
Remerciements
Au Directeur et à tout le corps enseignant de
l'EISMV de Dakar
Au Directeur Général, au Directeur
scientifique du CIRDES et au Coordonnateur du PROCORDEL, pour nous avoir
octroyé la bourse de stage et nous avoir permis de réaliser nos
recherches dans des bonnes conditions.
Au Dr. Marc DESQUESNES, pour la constante
disponibilité, le soutien et surtout pour l'encadrement quasi quotidien
A M. Adrien ZOUNGRANA , pour l'encadrement technique et
également pour les week end sacrifiés à la
PCR-ELISA
A mes aînés de l'Ecole
Vétérinaire de Dakar au CIRDES : Dr. Talaki, Adakal, Sow,
Dao
Aux Docteurs Dia, Bengaly, Sophie, Belemsaga, Seyni,
Jéremy pour vos judicieux conseils
A Mlle Aurélie DESCHAMPS pour son précieux
aide et également pour avoir initié cet travail
A Mathias, Biton, Sylla, Léopold, Bila,
Sakandé, Laurent Sawadogo, Youl
A mes camarades stagiaires du CIRDES : Mariam
traoré, Léon, Aïcha, Vitouley, Dao, Dabiré, Kam...
pour les bons moments passés ensemble.
A Lafia, Saïdou Alzouma, Aboulamali (mon petit),
Saadou Moussa , Dr SY, Marie Barma, Hama Hama,... pour votre aide
précieuse aide dans la mise en forme de ce document, infiniment
merci !
A tous ceux qui ont de près ou de loin, nous
aidé et soutenu
A nos maîtres et juges
A notre Maître et
Président de jury, Monsieur Moussa Fafa CISSE
Professeur à la Faculté de Médecine et
de Pharmacie et d'Odontostomatologie de Dakar ;
Nous sommes très
sensibles à l'honneur que vous nous faites en acceptant la
présidence de cette thèse.
Veuillez trouver ici
l'expression de notre sincère gratitude et de notre profond respect.
A notre Maître,
Directeur et rapporteur de thèse, Monsieur Justin Ayayi AKAKPO
Professeur à l'EISMV de Dakar ;
Vous avez accepté
d'encadrer ce travail malgré vos multiples occupations. Nous retiendrons
de vous votre simplicité, votre rigueur scientifique et surtout votre
dévouement au travail toujours bien fait.
Veuillez trouver ici,
l'assurance de notre sincère reconnaissance et de notre profonde
admiration. Hommages respectueux.
A notre Co-Directeur de thèse, Monsieur Marc
DESQUESNES
Chercheur au CIRDES de Bobo-Dioulasso ;
Ce travail est le vôtre, vous nous avez assisté
de près et guidé avec rigueur. Vos qualités
intellectuelles et humaines, votre amour du travail bien fait sera le souvenir
le plus vivant que nous garderons de vous.
Sincères remerciement et profonde gratitude.
A notre Maître et juge, Louis Joseph
PANGUI,
Professeur à l'EISMV de Dakar,
Votre humour paternel et surtout vos qualités d'homme
de science suscitent autour de vous l'estime et le respect de tous. C'est alors
un immense honneur que vous nous faites en acceptant de juger notre
travail.
Sincères remerciements.
A notre maître et juge, Monsieur Yalacé
Yamba KABORET
Professeur à l'EISMV de Dakar ;
C'est avec plaisir et spontanéité que vous avez
accepté de juger ce travail. Vos qualités humaines et
professionnelles nous servirons de guide.
Recevez ici toute notre gratitude et notre grande
considération. Hommages respectueux.
A notre maître et juge, Madame Rianatou
BADA ALAMBEDJI
Professeur à l'EISMV de Dakar ;
Vos multiples occupations ne vous ont empêché de
répondre spontanément à notre sollicitation. En vous
choisissant pour être le juge de ce travail, nous voulons saluer
l'exemple que vous êtes en matière de rigueur scientifique et de
qualités humaines.
Profonde gratitude.
« Par délibération, la Faculté
de Médecine, de Pharmacie, d'Odonto-stomatologie et l'Ecole Inter-Etats
des Sciences et Médecine vétérinaires de Dakar ont
décidé que les opinions émises dans les dissertations qui
leur sont présentées, doivent être
considérées comme propres à leurs auteurs et qu'elles
n'entendent leur donner aucune approbation. »
Liste des Abréviations
ABTS® :
[2-2'-Azino-bis-(3-ethyBenzaThiazoline-6-Sulfonic acid)]
ADN : Acide
Désoxyribonucléique
ARN : Acide Ribonucléique
BCM: Buffy Coat Method
BET : Bromure d'Ethidium
BLAST : Basic Local Alignement Sequences
Tools
BSA: Bovine Serum Albumine
CATT : Card Agglutination Trypanosomiasis
Test
CIRDES : Centre International de
Recherche-Développement sur l'Elevage en zone
Subhumide
CRTA : Centre de Recherches sur la
Trypanosomose Animale
dATP : désoxy Adénine
Triphosphate
dCTP : désoxy Cytosine
Triphosphate
DEAE-cellulose: DiEthyl Amino-Ethyl-cellulose
dGTP : désoxy Guanine
Triphosphate
Dig-dUTP :
digoxigénine-11-2'-désoxyuridine
DMSO : Diméthylsulfoxyde
dNTP : désoxy Nucléotide
Triphosphate
dTTP : désoxy Thymine
Triphosphate
ELISA : Enzyme Liked Immuno Sorbent
Assay
FAO : Food and Agriculture Organization
GVS : Glycoprotéines Variables de
Surface
HCT: Hematocrit Centrifuge Technique
Ig G : Immunoglobuline G
Ig M : Immunoglobuline M
ILRAD : International Livestock Research
for Animals Diseases
ITS : Internal Transcribed Spacer
OIE : Office International des
Epizooties
OMS : Organisation Mondiale de la
Santé
PATTEC : Pan African Tsetse and
Trypanosomosis Eradication Campaign
PCR : Polymerase Chain Reaction
PLTA : Programme de Lutte contre la
Trypanosomose Animale
PSG: Phosphate Sodium Glucose
SSu-rDNA : Small Subunit ribosomal
DesoxyriboNucleic Acid
TAA : Trypanosomose Animale Africaine
Tb : Trypanosoma brucei
TBE : Tris Borate EDTA
Tcf : Trypanosoma congolense type
forêt
Tcs : Trypanosoma congolense type
savane
Tm : melting Temperature
Tv : Trypanosoma vivax
LISTE DES ANNEXES
Annexe 1 : Les souches de
trypanosomes utilisées.
Annexe 2 : Amorces
monospécifiques utilisées dans la PCR classique
Annexe 3 :
Caractéristiques des amorces Tryp 4R et Tryp 4S
Annexe 4 :
Caractéristiques des sondes retenues candidates pour le test
ELISA
Annexe 5 : Concentrations
et volumes des réactifs pour la PCR classique
Annexe 6 : Concentrations et
volumes des réactifs pour la PCR avec les
amorces Tryp 4R et Tryp 4S
Annexe 7 : Concentrations
et volumes des réactifs pour la PCR-ELISA
Annexe 8 : Epreuve ELISA pour la
révélation des produits d'amplification
LISTE DES FIGURES
Pages
Figure 1.1 : Schéma d'un
trypanosome 6
Figure 1.2 : Différents
stades morphologiques des Trypanosomatidae 6
Figure 2 : Ultrastructure
des Trypanosomatidae 8
Figure 3 : Classification
des principaux trypanosomes des mammifères 9
Figure 4 : Trypanosama
congolense 11
Figure 5: Trypanosoma vivax
12
Figure 6: Trypanosoma
brucei 13
Figure 7 : Cycle Biologique des
trypanosoma brucei sp 16
Figure 8 : Aire de
répartition des glossines en Afrique 20
Figure 9 : Structure de l'ADN
38
Figure 10 : Schéma de
l'amplification par PCR nested de l'IST1 de l'ADN
Ribosomal 41
Figure 11 : Pièges et
écrans pour la lutte contre les glossines 51
Figure 12 : Localisation du CIRDES
matérialisé par son logo sur la carte du
Burkina Faso 54
Figure 13 : Schéma d'une
unité de transcription de l'ADNr 57
Figure 14 : Schéma des
ITS1des principaux trypanosomes pathogènes 58
Figure 15 : Les étapes de
la PCR et cycle thermique 66
Figure 16 : Symboles
utilisés pour expliquer le principe de la
PCR- ELISA 73
Figure 17 : Résultats
obtenus avec les amorces monospécifiques 78
Figure 18 : Résultats
obtenus avec les amorces Tryp 4R et Tryp 4S 81
Figure 19 : Cas d'infections
à T.v et T.c.s détectées par les trois
test de
diagnostic 81
Figure 20 : Résultats
comparés PCR classique / PCR-ITS 87
Figure 21 :
Révélation sur gel d'agarose des produits PCR des
échantillons
d'ADN de référence 89
Figure 22 :
Révélation par ELISA des produits PCR des échantillons
d'ADN de référence 89
Figure 23a : Photo d'un gel
d'agarose 94
Figure 23b : Photo d'un gel
d'agarose 94
LISTE DES TABLEAUX
Pages
Tableau I : Programme
d'amplification de la PCR monospécifique 67
Tableau II : Températures
d'hybridation des sondes utilisées pour la
PCR-ELISA 76
Tableau III : Résultas
positifs obtenus avec les organes de mouche en
PCR classique 79
Tableau IV :
Prélèvements sanguins de bovins positifs aux tests de
diagnostic 82
Tableau V : Résultas positifs
obtenus avec les organes de mouche en
PCR-ITS 83
Tableau VI : Organes de
mouches positifs en PCR classique et
PCR-ITS 83
Tableau VII :
Récapitulatif des résultats obtenus en PCR classique
PCR-ITS 84
Tableau VIII : Estimation du
coût de l'analyse en PCR-ELISA pour une
plaque 99
Tableau IX : Estimation du
coût de l'analyse d'un échantillon en PCR-ITS 100
Table des matières
Pages
Introduction 1
Première partie : Etude bibliographique
4
Chapitre 1 :Caractères
généraux des trypanosomes du bétail en Afrique.........
5
1.
Trypanosomatidae.............................................................................
5
1-1.
Morphologie..............................................................................5
1-2. Structure et
physiologie.................................................................7
1-3.
Classification............................................................................
8
2. Principaux trypanosomes pathogènes du
bétail en Afrique........................10
2-1. Sous genre
Nannomonas.....................................................................10
2-1-1. Trypanosoma (Nannomonas)
congolense........................................10
2-1-2. Trypanosoma (Nannomonas)
simiae..............................................11
2-2. Sous genre Duttonella : Trypanosoma
vivax............................................11
2-3. Sous genre
Trypanozoon.....................................................................12
2-3-1. Trypanosoma (Trypanozoon)
brucei..............................................12
2-3-2. Trypanosoma (Trypanozoon)
evansi..............................................13
2-3-3. Trypanosoma (Trypanozoon)
equiperdum.......................................14
2-4. Sous genre Pycnomonas : Trypanosoma
suis..........................................14
3. Cycle évolutif
................................................................................14
3-1. Chez la
glossine........................................................................14
3-2. Chez l'hôte
mammifère...............................................................15
4. Vecteurs et modes de
transmission......................................................17
4-1. Vecteurs à transmission
mécanique.................................................17
4-1-1.
Tabanidés........................................................................17
4-1-2.
Stomoxyinés.....................................................................18
4-1-3.
Hippoboscidés...................................................................18
4-2. Vecteurs à transmission cyclique : Les
glossines....................................18
5.
Pathogénie....................................................................................21
6. Génome des
trypanosomes................................................................22
6-1. ADN
nucléaire.........................................................................22
6-2. ADN kinétoplastique
(ADNk).......................................................23
7. Propriétés
antigéniques.....................................................................23
7-1. Antigènes
invariants.....................................................................24
7-2. Antigènes variables de
surface........................................................24
7-3. Variation
antigénique..................................................................24
Chapitre 2 : Trypanosomose des animaux
domestiques....................................26
1.
Importance....................................................................................26
2. Etude
clinique.................................................................................27
2-1.
Symptômes..............................................................................27
2-2.
Lésions...................................................................................29
3.
Epidémiologie.................................................................................30
4.
Diagnostic.....................................................................................32
4-1. Diagnostic sur le
terrain...............................................................32
4-1-1. Diagnostic
épidémiologique...................................................32
4-1-2. Diagnostic clinique et diagnostic
différentiel................................33
4-2. Diagnostic au
laboratoire..............................................................33
4-2-1. Diagnostic chez l'hôte
mammifère............................................34
4-2-1-1. Méthodes
directes.........................................................34
4-2-1-1-1. Méthodes
parasitologiques.......................................34
4-2-1-1-1-1. Examens microscopiques
directs..........................34
4-2-1-1-1-2. Examens microscopiques après
concentration..........35
4-2-1-1-1-3. Inoculation à des animaux de
laboratoire................36
4-2-1-1-2. Méthodes
moléculaires............................................37
4-2-1-1-2-1. Rappel sur la structure de
l'ADN.........................37
4-2-1-1-2-2. Technique d'hybridation
moléculaire....................38
4-2-1-1-2-3. Amplification en chaîne par polymérase
ou PCR......39
4-2-1-1-2-3-1. Définition, principe et
réalisation..................39
4-2-1-1-2-3-2. Autres techniques de
PCR...........................41
4-2-1-1-2-3-3. Sensibilité et spécificité
.............................42
4-2-1-1-2-3-4. Avantages et champs
d'application................42
4-2-1-1-2-3-5.
Limites.................................................43
4-2-1-2. Méthodes indirectes ou
séro-immunologiques........................43
4-2-1-2-1. Test
d'agglutination................................................44
4-2-1-2-2. Réaction de fixation du
complément............................44
4-2-1-2-3. Test d'Immunofluorescence indirecte
(IFI).....................45
4-2-1-2-4. Test
ELISA.........................................................45
4-2-2. Diagnostic chez le
vecteur......................................................46
4-2-2-1. Chez les insectes hématophages vecteurs
mécaniques...............46
4-2-2-2. Chez les
glossines.........................................................46
5. Moyens de
lutte..............................................................................47
5-1. Chimiothérapie et
chimioprophylaxie...............................................48
5-1-1.
Chimiothérapie..................................................................48
5-1-2.
Chimioprophyalxie.............................................................48
5-2. Lutte
antivectorielle....................................................................49
5-3. Lutte génétique par gestion des
troupeaux..........................................50
Deuxième partie : Etude
expérimentale........................................................52
Chapitre 1 : Présentation du cadre
d'étude...................................................53
Chapitre 2 : Matériel et
méthodes................................................
..............55
1.
Matériel........................................................................................55
1-1. Matériel de
laboratoire...............................................................55
1-2. Matériel
biologique...................................................
...............56
1-2-1. Souches de trypanosomes témoins (ADN
purifiés)......... ...........56
1-2-2. Echantillons de
terrain.......................................... ...........56
1-2-2-1. Couches de globules blancs du sang des bovins (buffy
coats) 56
1-2-2-2. Organes de mouches..............................
..................56
1-2-2-3. Fragment cible : les ITS des trypanosomes.........
..............57
1-3. Réactifs et solutions de
travail.....................................................59
1-3-1. Pour la PCR
directe...........................................................59
1-3-1-1. Nucléotides
(dNTP).......................................... ........59
1-3-1-2. Oligonucléotides
(amorces).................................... .....59
1-3-1-3. Tampon de la
PCR........................................................60
1-3-1-4. Taq
polymérase............................................................60
1-3-1-5. Diméthylsulfoxyde
(DMSO)............................................61
1-3-2. Pour la révélation par
ELISA...............................................61
1-3-2-1. dNTP et
Digoxigénine....................................................61
1-3-2-2. Anticorps anti-digoxigénine conjugués
à la peroxydase.............61
1-3-2-3. Sondes marquées à la biotine et solution
d'hybridation..............62
1-3-2-4.
Streptavidine...............................................................64
1-3-2-5. Solution de lavage et tampon de
blocage..............................64
2.
Méthodes......................................................................................64
2-1. Préparation des
échantillons.......................................................64
2-1-1. Echantillons d'ADN
purifiés..................................................64
2-1-2. Traitement au chelex® des échantillons de
terrain.........................65
2-2. Principe de la
PCR...................................................................65
2-3. Protocole de PCR
classique........................................................66
2-3-1. Réalisation du mélange
réactionnel...........................................66
2-3-2. Programme
d'amplification....................................................67
2-3-3. Electrophorèse et visualisation des produits
PCR...........................68
2-4. Protocole de PCR-ITS avec les amorces Tryp 4R et
Tryp 4S...............68
2-4-1. Réalisation du mélange
réactionnel...........................................68
2-4-2. Programme
d'amplification....................................................69
2-4-3. Electrophorèse, visualisation et
interprétation des produits PCR.........70
2-5.
PCR-ELISA...........................................................................70
2-5-1. Principe et
méthodes..........................................................70
2-5-2. Protocole de
PCR-ELISA....................................................73
2-5-2-1. Réalisation du mélange
réactionnel....................................73
2-5-2-2. Programme
d'amplification.............................................74
2-5-2-3. Détection des produits PCR sur gel
d'agarose........................74
2-5-2-4. Révélation des produits d'amplification
par ELISA.................74
2-5-3. Choix des
sondes...............................................................74
2-5-4. Evaluation des
sondes.........................................................74
2-5-5. Optimisation de la
technique................................................75
Chapitre 3 : Résultats et
discussion........................................................77
1.
Résultas........................................................................................77
1-1. Méthodes
parasitologiques..........................................................77
1-2. PCR
classique..........................................................................77
1-2-1. Echantillons sanguins de
bovins...............................................78
1-2-2. Organes de mouches...........................
................................79
1-3.
PCR-ITS................................................................................80
1-3-1. Echantillons sanguins de
bovins...............................................80
1-3-2. Organes de mouches.................................
..........................82
1-4. Analyse comparative des résultats PCR
classique / PCR-ITS...............84
1-4-1. Cas d'infections à Trypanosoma
vivax......................................84
1-4-1-1. Buffy coats de bovins.................................
..................84
1-4-1-2. Organes de mouches....................................
..............85
1-4-2. Cas d'infections au genre Nannomonas
(Trypanosoma congolense)86
1-4-2-1. Buffy coat de
bovins......................................................86
1-4-2-2. Organes de
mouche.......................................................86
1-4-3. Cas d'infections au genre Trypanozoon
(T. brucei)......................87
1-5. PCR
ELISA............................................................................88
1-5-1. Résultats de l'évaluation des
sondes....................................... 88
1-5-1-1. Sur des ADN
purifiés.................................................... 88
1-5-1-2. Sur des échantillons de terrain
..........................................90
2.
Discussion.....................................................................................91
2-1. Evaluation comparative PCR-ITS / PCR
classique...........................91
2-1-1.
Sensibilité........................................................................91
2-1-2.
Spécificité........................................................................93
2-2. Spécificité et sensibilité des
sondes nucléiques pour la PCR-ELISA.......95
2-2-1.
Spécificité........................................................................95
2-2-2.
Sensibilité.........................................................................96
2-3. Etude de
coût...........................................................................97
2-4. Avantages de la PCR directe et de la PCR-ELISA sur
les ITS............100
Conclusion et
recommandations...............................................................102
Références bibliographiques
..................................................................105
Annexes
Introduction
La trypanosomose animale africaine (TAA) est une
maladie parasitaire responsable d'une morbidité élevée et
souvent d'une mortalité non moins importante chez le bétail.
Cette maladie est à l'origine de pertes économiques
considérables, elle entraîne notamment une forte chute de
production de lait et de viande. De par ses conséquences
néfastes, cette pathologie aggrave la pauvreté et
l'insécurité alimentaire dans les pays où elle
sévit de façon endémique. Particulièrement dans les
zones subhumides d'Afrique au sud du Sahara, la trypanosomose animale transmise
par les glossines est un des obstacles majeurs au développement de
l'élevage1(*).
L'enjeu de la lutte contre la TAA est de ce fait de taille, mais il existe un
préalable : le diagnostic.
L'absence de signes pathognomoniques confère au
diagnostic clinique, un caractère de simple suspicion. Le diagnostic de
certitude de la trypanosomose requiert forcement des techniques de laboratoire.
De nos jours, le diagnostic de laboratoire de la TAA repose sur trois ensembles
de techniques : parasitologiques, séro-immunologiques et
moléculaires. Les techniques parasitologiques, qui en
révélant le parasite dans les liquides biologiques de
l'hôte sont des diagnostics de certitude, mais se heurtent à une
insuffisance de sensibilité et de spécificité. Les
méthodes sérologiques, qui en mettant en évidence le plus
souvent des anticorps sont plutôt des diagnostics de présomption,
car ces tests ne différencient pas les infections passées et
guéries et les infections présentes.
Dans ce contexte, les outils de la biologie
moléculaire ont apporté une révolution notoire dans les
tests d'identification précise des trypanosomes. Il s'agit des sondes
nucléiques et de l'amplification en chaîne par polymérase
(ACP = PCR en anglais). La technique d'hybridation moléculaire par les
sondes nucléiques a été appliquée chez les
glossines (Gibson et al., 1988 ; Masiga D. K. et al., 1996
) et les bovins (Nyeko et al., 1990). Elle tend
à être remplacée par la technique de PCR.
Depuis les travaux précurseurs de
Mooser et al. (1989), la PCR est de plus en plus
utilisée pour le diagnostic des TAA. Comparativement aux méthodes
parasitologiques et séro-immunologiques, cette technique
bénéficie d'un gain substantiel en spécificité,
sensibilité et rapidité (Solano et al., 1997 ;
Desquesnes et Davilà, 2002). Dans cette technique, plusieurs
régions de l'ADN ont servi de marqueurs moléculaires dont entre
autre les séquences de l'ADN satellite (Moser et al.,
1989 ; Masiga et al., 1992 ; Lefrançois et al.,
1999), les mini exons de l'ADN nucléaire (Desquesnes et
Davilà, 2002), la petite sous unité de l'ADNr (SSU-rDNA)
(Geysen et al., 2002) et les espaceurs internes transcrits de
l'ADNr (ITS) (Mc Laughlin et al., 1996 ; Desquesnes et al.,
2001 ; Desquesnes et al., 2002 ; Guèye, 2003).
Excepté les séquences de l'ADN
ribosomal, les autres marqueurs moléculaires ont permis le
développement d'une PCR basée sur l'utilisation de couple
d'amorces spécifiques d'espèces. Avec ces dernières, la
PCR demeure encore délicate à être utilisée comme
outil de diagnostic de routine. Le coût de la PCR est en effet
élevé (1$ US par réaction) et la diversité des
espèces pathogènes peut conduire chez les bovins par exemple
à la réalisation de cinq réactions différentes pour
un même échantillon. Pour lever cette contrainte économique
de la PCR, l'utilisation des amorces polyspécifiques amplifiant l'ITS1
est actuellement l'une des options les plus explorées. Ainsi, à
l'aide d'un couple unique d'amorces, la PCR permet l'identification et la
distinction de toutes les espèces pathogènes de trypanosomes du
bétail1(*).
Au CIRDES, des amorces (Tryp 4R et Tryp 4S) pour la
PCR directe sur les ITS de l'ADNr des trypanosomes, ont été mises
au point et nécessitent d'être évaluées et
validées. D'autre part pour la PCR-ELISA, des sondes d'ADN
spécifiques aux ITS des principales espèces pathogènes ont
été dessinées. Il conviendra d'adapter la technique de PCR
sur les ITS à la PCR-ELISA, puis de l'évaluer et
éventuellement de la valider pour le diagnostic.
Il résulte donc de nos travaux,
l'évaluation de deux nouvelles techniques de diagnostic, à savoir
la PCR directe et la PCR-ELISA sur les ITS des trypanosomes. Nous avons
présenté dans une première partie, une revue
bibliographique portant sur les généralités des
trypanosomoses animales. Dans cette partie, nous avons évoqué
dans un premier chapitre les caractères généraux des
trypanosomes du bétail en Afrique. Le second chapitre de la
synthèse bibliographique traite de la trypanosomose des animaux
domestiques, particulièrement en Afrique. Nous avons d'une part
abordé dans ce chapitre l'importance de la maladie et son étude
épidémio-clinique, d'autre part nous avons décrit les
méthodes de diagnostic de la trypanosomose animale, avant de
présenter les différentes composantes des moyens de lutte contre
cette maladie. La deuxième partie intitulée «
étude expérimentale » est consacrée à la
présentation des protocoles de travail utilisés. Les
résultats qui en découlent seront discutés afin d'aboutir
à des recommandations pour l'amélioration et l'utilisation
optimale de ces nouvelles techniques de diagnostic.
Première partie : Etude bibliographique
Chapitre 1 : Caractères
généraux des trypanosomes du bétail en Afrique
Les trypanosomes sont des protozoaires
flagellés qui vivent dans le plasma sanguin, la lymphe et divers tissus
de leurs hôtes. Ils se présentent sous une grande
variété de forme et de taille suivant les genres. Ils sont
principalement transmis par des insectes piqueurs, vecteurs à
transmission cyclique (glossines) ou mécaniques (taons, stomoxes, etc.).
Les trypanosomes appartiennent à la grande famille des
Trypanosomatidae qui comporte plusieurs genres de parasites.
1. Trypanosomatidae
1-1. Morphologie
La forme la plus connue des Trypanosomatidae
est celle des trypanosomes qui est illustrée par la figure 1.1. Les
trypanosomes se présentent sous la forme d'une cellule plate,
élancée et fusiforme avec une membrane ondulante plus ou moins
enroulée autour du corps, d'où le nom de trypanosoma qui
signifie « corps en vrille ». La membrane ondulante
comporte à sa marge externe un filament constituant le flagelle qui chez
certaines espèces se prolonge au-delà du corps en
« flagelle libre ». La position du flagelle
caractérise la variation de forme au cours du cycle évolutif
pendant lequel le protozoaire passe par différents stades (fig. 1.2).
La taille des Trypanosomatidae varie de 2-3 um pour
les plus petits tels que les Leishmania à 120 um chez certains
trypanosomes de reptiles ou de mammifères.
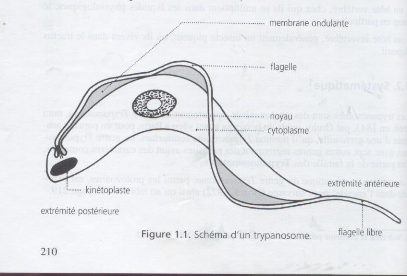
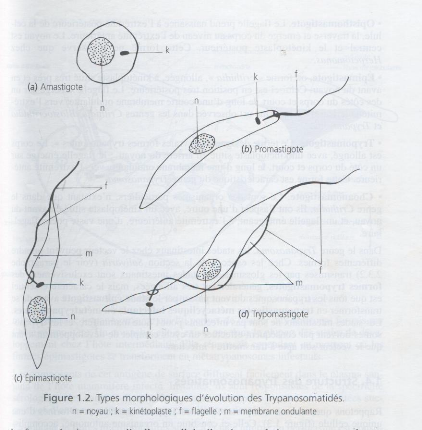
Figure 1.2 : Différents stades
morphologiques des Trypanosomatidae (Itard, 2000)
k : Kinétoplaste, n : Noyau, m :
Membrane ondulante, f : Flagelle.
1-2. Structure et
physiologie
Comme tous les protozoaires, les
trypanosomatidae sont des êtres vivants unicellulaires
autonomes. Le corps cellulaire comprend une masse de cytoplasme qui contient
des organites et des inclusions variés (fig. 2). La
périphérie du cytoplasme est limitée par une paroi
cellulaire. La microscopie électronique a permis d'affiner les
connaissances sur la structure des trypanosomatidae.
Le noyau est entouré d'une double membrane
perforée, il apparaît au microscope optique comme une
vésicule sphérique ou ellipsoïde. Il renferme le karyosome
ou nucléole et des granules de chromatine doublant la face interne de la
membrane. La position du noyau est variable selon les formes ou stades
évolutifs du parasite. Dans les formes trypomastigotes, il est
situé au centre ou dans la moitié antérieure. Le noyau
contient de l'acide désoxyribonucléique (ADN) qui contrôle
l'activité métabolique et les caractères morphologiques du
parasite. On reconnaît en plus d'autres structures classiques telles que
l'appareil de golgi, le réticulum endoplasmique, les lysosomes.
Dans la cellule des Trypanosomatidae, on a
aussi des structures particulières telles que :
· la membrane ou périplasme constituée de
trois couches dont l'interne et l'externe sont plus denses que la
médiane ;
· le kinétoplaste situé près du
corps basal du flagelle et est à l'intérieure d'une grande
mitochondrie. Il s'étend sur toute la longueur du corps du
parasite ;
· le flagelle servant à la locomotion, est
formé d'un axonème avec 9 paires de microtubules
périhériques entourant deux microtubules centraux et d'un
bâtonnet para-axial formé d'un réseau de filaments.
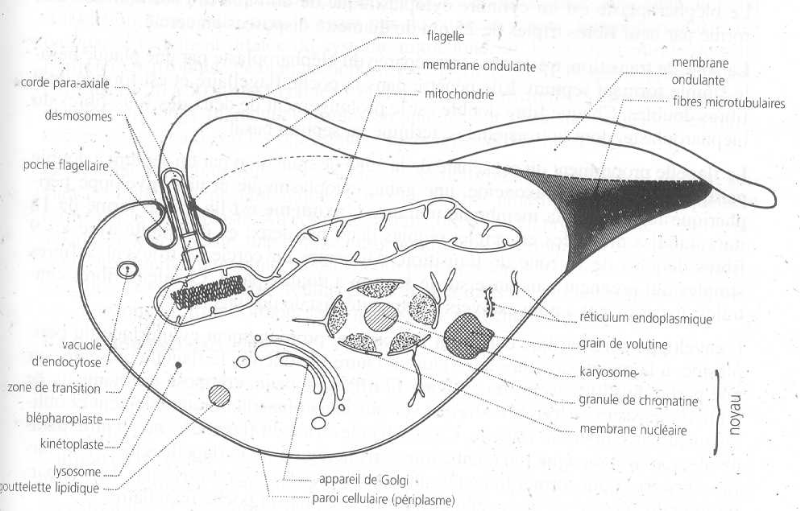
Figure 2 : Ultrastructure des
Trypanosomatidae (Itard, 2000)
La nutrition des Trypanosomatidae s'effectue
suivant un processus commun à de nombreuses cellules :
l'endocytose. La reproduction se fait presque exclusivement par division
asexuée ou scissiparité.
1-3. Classification
La famille des
Trypanosomatidae appartient au sous règne des Protozoa, à
l'embranchement des Sarcomastigophora, à la classe des Zoomastigophora
et à l'ordre des Kinetoplastida. Le genre Trypanosoma est l'un des
principaux représentants de cette famille subdivisée en deux
sections : Stercoraria et Salivaria. (Hoare, 1972) (fig. 3).
Les trypanosomes de la section des Salivaria
(pour la plupart pathogènes du bétail) ont une évolution
antérograde, c'est à dire qu'ils accomplissent leur cycle
évolutif dans les portions antérieures du tube digestif
(proboscis, glandes salivaires et intestin moyen) de leurs vecteurs. Leur
transmission se fait cycliquement par inoculation avec la salive lors de la
piqûre par les glossines. Par contre les trypanosomes de la section des
Stercoraria ont une évolution postérograde. Leur cycle
évolutif s'effectue dans les portions postérieures de l'intestin
du vecteur où se retrouvent les épimastigotes et les
métatrypanosomes infectants. Par conséquent, leur transmission se
fait par contamination par les souillures fécales et parfois
cycliquement par les Tabanidae. A l'exception du trypanosome
américain responsable de la maladie de Chagas (T.
cruzi), les trypanosomes de la section des Stercoraria sont
en majorité peu ou non pathogènes, en particulier pour le
bétail, c'est le cas du sous genre Megatrypanum (T.
theileri) qui interfère très souvent dans le diagnostic
des trypanosomes.
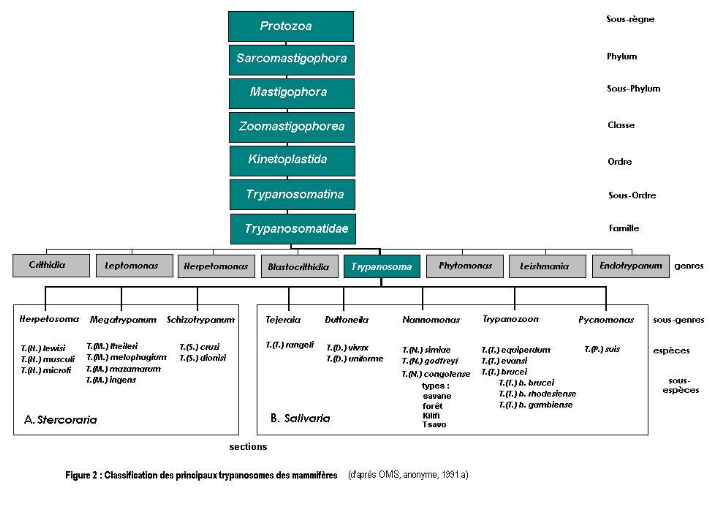
Figure 3 : Classification des principaux
trypanosomes des mammifères. Source : OMS
(1991)
2. Principaux trypanosomes pathogènes du
bétail en Afrique
La trypanosomose est une maladie dont
l'étiologie est souvent complexe, du fait qu'elle est causée par
plusieurs espèces de trypanosomes appartenant à la section des
Salivaria. En Afrique au sud du Sahara, les parasites
fréquemment rencontrés sont ceux des sous genres
Nannomonas pour T. congolense et T.
simiae, Duttonella pour T. vivax,
Trypanozoon pour T. brucei, T.
evansi et T. equiperdum et du sous genre
Pycnomonas pour T. suis.
2-1. Sous genre Nannomonas (Hoare, 1964)
2-1-1. Trypanosoma (Nannomonas)
congolense (Broden, 1904)
Trypanosoma congolense est l'agent principal
de la Nagana, par sa fréquence, sa pathogénicité et ses
conséquences sur la productivité (Sidibé,
1996). IL est présent de façon endémique dans
toute la zone de répartition des glossines confinées en Afrique
(Moolo et al., 1999). Ce parasite a été
découvert par Broden en 1904 dans du sang de mouton et d'âne
à Léopolville en République Démocratique du Congo.
T. congolense est un petit
trypanosome monomorphe et sans flagelle libre dans le sang des hôtes
mammifères. Les outils de la biologie moléculaire ont permis de
distinguer différents types de T. congolense
(Majiwa et al., 1985), il s'agit du
type « savane » rencontré dans les
régions sèches d'Afrique de l'ouest et de l'est ; le
type « forêt » rencontré dans les
régions humides ou forestières ; le
type « kilifi » (Kenya et Ouganda) et le
type « tsavo » isolé au Kenya. La
pathogénicité de ces parasites est variable selon
l'espèce, voire le groupe de trypanosome rencontré
(Bengaly, 2003).
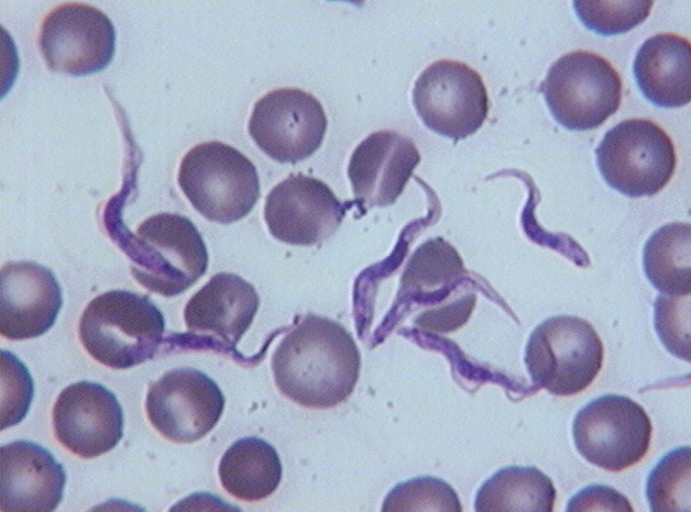
Figure 4 : Trypanosoma congolense
(cliché : I. Sidibé)
2-1-2. Trypanosoma (Nannomonas)
simiae (Bruce, 1912).
Isolé pour la première fois chez un
singe au Nyassaland en 1912 par Bruce (Hoare, 1972),
T. simiae a une morphologie proche de T.
congolense, mais il est pléomorphe. C'est le parasite
spécifique aux Suidae, avec une pathogénicité
très élevée pour le porc chez lequel la maladie est fatale
en général. Le dromadaire est aussi très sensible à
ce parasite.
2-2. Sous genre Duttonella (Chalmers, 1918) :
Trypanosoma vivax
Trypanosoma vivax fut pour la première
fois décrit en Afrique par Ziemann en 1905, chez une chèvre au
Cameroun. Il est de taille moyenne et est reconnu en Afrique comme
étant le plus virulent des trypanosomes pathogènes du bovin
(Itard, 2000). Trypanosoma vivax est largement
répandu en Afrique tropicale dans toute l'aire de répartition des
glossines. Il peut être transmis cycliquement et mécaniquement par
les glossines et mécaniquement par d'autres insectes piqueurs comme les
tabanidés, les stomoxes (Solano et al., 1997 ; Desquesnes
et al., 2005). Chez les bovins, il est à l'origine d'une
infection asymptomatique ou chronique, aiguë ou suraiguë.
On rencontre également dans le sous genre
Duttonella, Trypanosoma uniforme très semblable
à T. vivax, mais il est plus que court. Il est contrairement
à T. vivax peu fréquent et moins virulent.
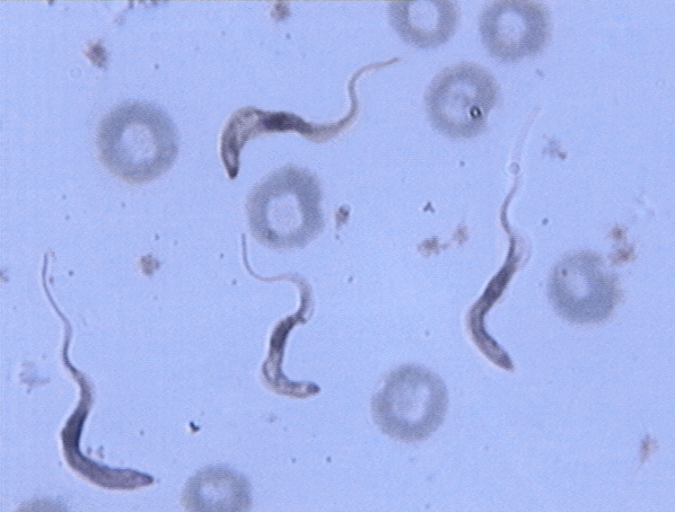
Figure 5 : Trypanosoma vivax
(cliché : I. Sidibé)
2-3. Sous genre Trypanozoon (Lühe, 1906)
2-3-1. Trypanosoma (Trypanozoon)
brucei (Plimmer et Bradford, 1899)
Trypanosoma brucei est extrêmement
polymorphe et se présente sous une forme courte dépourvue de
flagelle, une forme intermédiaire avec un flagelle court et une forme
longue à flagelle libre (la plus fréquente). T.
brucei est actuellement subdivisé en trois sous espèces
qui sont morphologiquement très proches :
· T. brucei brucei est l'agent de la
nagana, il est non pathogène pour l'homme, les équidés
sont les hôtes les plus sensibles. Son importance pathologique est
relativement moindre chez le bétail en comparaison avec T.
vivax et T. congolense. Il infecte facilement les
rongeurs de laboratoire.
· T. brucei gambiense est
pathogène pour l'homme en Afrique occidentale et centrale où il
sévit généralement de façon chronique.
Contrairement à T. brucei brucei, il infecte
difficilement les rongeurs de laboratoire.
· T. brucei rhodesiense est l'agent de
la maladie du sommeil chez l'homme en Afrique orientale et australe. Il
provoque une infection plus virulente et plus aiguë que T.
brucei gambiense. Il est aussi facilement infectant pour les rongeurs
de laboratoire.
Les sous espèces de T. brucei sont
toutes transmises cycliquement par les glossines.
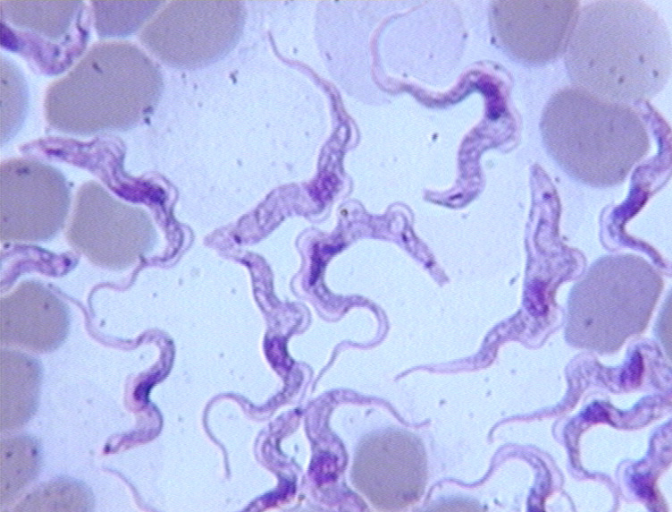
Figure 6 : Trypanosoma brucei
(cliché : D. Cuisance)
2-3-2. Trypanosoma (Trypanozoon)
evansi (Steel, 1885 ; Balbiani, 1888).
Trypanosoma evansi est le premier trypanosome
pathogène à être découvert chez les
équidés et les camélidés. Il est responsable chez
ces espèces d'une maladie dénommée
« surra ». Il possède la plus large distribution
géographique de tous les trypanosomes pathogènes
(Oumanwara et al., 1999). T. evansi est uniquement
transmis mécaniquement par des insectes piqueurs (taons le plus souvent,
stomoxes...) autres que les glossines. Ceci serait du à l'absence de
maxicercles au niveau de l'ADN kinétoplastique de T.
evansi et qui le rend incapable de se développer cycliquement
chez un insecte vecteur (Ventura et al., 1997).
2-3-3. Trypanosoma (Trypanozoon)
equiperdum (Doflein, 1901).
T. equiperdum est naturellement un parasite
des équidés, principalement des chevaux. Il est à
l'origine d'une maladie vénérienne appelée la dourine.
Cette maladie existe depuis plusieurs centaines d'années en Afrique du
nord qui constitue vraisemblablement son berceau d'origine (Itard,
2000). La dourine est la seule affection à trypanosome à
être transmise directement (par le coït) d'un équidé
malade à un équidé sain, sans intervention d'un insecte
vecteur.
2-4. Sous genre Pycnomonas (Hoare, 1964) : Trypanosoma
suis
Ce sous genre ne comprend qu'une seule espèce
qui est Trypanosoma (Pycnomonas) suis. Il n'a
été signalé jusqu'à présent que chez les
Suidae domestiques et sauvages et uniquement en Afrique tropicale de
l'est (Tanzanie et Burundi) (Itard, 2000). Chez le porc
domestique, T. suis provoque une infection chronique chez
l'adulte, et une infection aiguë chez le jeune. Il est transmis par les
glossines et son cycle de transmission est tout à fait comparable
à celui de T. brucei.
3. Cycle évolutif
3-1. Chez la glossine
La contamination des glossines se fait lors d'un
repas sanguin sur un hôte infecté, repas au cours duquel les
glossines absorbent des formes trypomastigotes courtes. Ces dernières
subissent des transformations et des réplications au niveau de
l'appareil digestif de la mouche, pour donner des formes allongées
(trypomastigotes procycliques). Si l'on prend l'exemple de T.
brucei, celles ci subissent à leur tour des transformations en
perdant notamment leur membrane de glycoprotéine. Elles migrent par la
suite vers les glandes salivaires de la mouche par un mécanisme qui
n'est pas encore très bien connu. A ce niveau les trypomastigotes
procycliques se fixent sur les parois du labre par leur flagelle, et se
transforment en épimastigotes. Ensuite, les épimastigotes se
transforment à leur tour en trypomastigotes métacycliques avec
l'apparition du manteau antigénique de nature glycoprotéique. Ces
formes infectantes matures se détachent des cellules
épithéliales salivaires et restent dans la salive par laquelle
elles seront transmises à l'hôte lors du prochain repas sanguin.
(fig. 7)
Chez la glossine, la durée et le siège
du cycle évolutif sont variables d'un trypanosome à l'autre.
? Dans le cas de T. congolense, la
durée du cycle est en moyenne de 12 à 14 jours, il commence au
niveau de l'intestin moyen de la mouche pour finir au niveau des pièces
buccales (trompe puis hypopharynx).
? Chez T. vivax, le cycle dure 5
à 13 jours, il se déroule essentiellement au niveau du proboscis.
La méthode d'identification actuelle de T. vivax chez
une glossine repose sur la mise en évidence d'une infestation uniquement
localisée au niveau du proboscis. Il a été toutefois mis
en évidence la présence de ce parasite dans le proboscis, mais
aussi dans l'intestin de glossine par Nyeko et al.
(1990). Moolo et Gray (1989) ont
également observé T. vivax dans la
région oesophagienne des glossines. Par conséquent, le diagnostic
parasitologique d'espèce par localisation des trypanosomes n'est pas un
diagnostic de certitude (CIRDES, 2001).
? Le cycle de T. brucei est le plus complexe
et sa durée est relativement longue, elle varie de 20 jours à 1
mois. Une fois ingérées, les formes trypomastigotes se retrouvent
dans l'intestin moyen, puis le cycle de développement continue au niveau
de la trompe, de l'hypopharynx et s'achève dans les glandes salivaires.
On retrouve alors, dans les glandes salivaires, les métatrypanosomes ou
trypomastigotes métacycliques qui restent dans la salive, jusqu'au repas
sanguin infectant l'hôte.
3-2. Chez l'hôte mammifère
Les trypanosomes pathogènes africains sont
transmis par la salive des vecteurs, d'où leur appartenance au groupe
des Salivaria. Lors du repas sanguin, la glossine injecte à
l'hôte des formes métacycliques présentes dans ses
pièces buccales. Les trypomastigotes métacycliques se multiplient
au point d'inoculation pendant plusieurs jours. Ils sont par cette action,
à l'origine d'une réaction inflammatoire appelée chancre
d'inoculation. Puis, les trypanosomes migrent vers le ganglion de drainage en
empruntant la voie lymphatique avant d'être dans la circulation
générale.
La période prépatente varie de 1
à 3 semaines. Cette durée est fonction de l'espèce et de
la souche de trypanosome, du nombre de trypanosomes injectés et de
certaines conditions favorisantes comme l'état immunitaire de
l'hôte (Clausen et al., 1993). Dans le cas de la
trypanosomose, la parasitémie évolue chez l'animal infecté
par « vagues ».
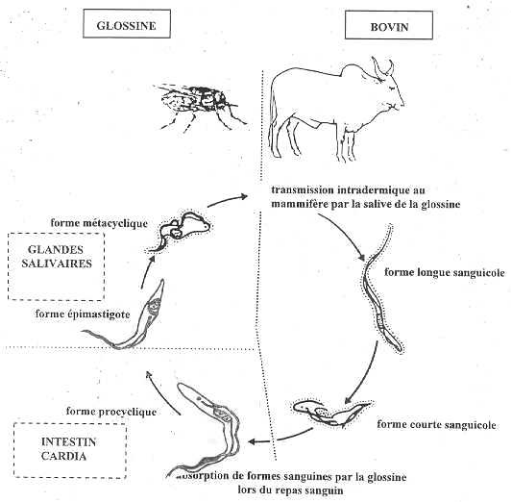
Figure 7 : cycle biologique de
Trypanosoma brucei sp.
4. Vecteurs et modes de transmission
Les trypanosomoses, à l'exception de la
dourine, sont des maladies à transmission vectorielle. Leur transmission
se fait soit cycliquement par le biais d'un vecteur cyclique (les glossines),
soit mécaniquement par l'intervention d'un insecte hématophage
autre que les glossines.
4-1. Vecteurs à transmission mécanique
Les vecteurs les plus fréquemment
incriminés sont des tabanidés et des stomoxyinés, plus
rarement des hippoboscidés. Cette transmission mécanique est
surtout connue pour T. vivax et T. evansi
qui se retrouvent parfois dans les zones situées hors de l'aire de
répartition des glossines (Itard, 2000 ; Desquesnes et Dia,
2003). La transmission a lieu à la faveur d'un repas interrompu
sur un hôte infecté et achevé dans les instants qui suivent
sur un hôte non infecté. Le parasite ne peut survivre chez ce
vecteur qu'un temps très court (quelques secondes à quelques
minutes), il est donc nécessaire que l'intervalle entre ces deux repas
soit le plus bref possible (Desquesnes et Dia, 2004).
4-1-1. Tabanidés (taons)
Les tabanidés appartiennent à l'ordre
des diptères. A la différence des glossines, seules les femelles
des taons sont hématophages. Ils constituent une famille très
importante, tant du point de vue numérique (plus de 4000 espèces
connues) que du point de vue médical et vétérinaire
(Itard, 2000). Ils mesurent entre 5 et 25 mm de longueur et
sont de couleur variable selon le genre. Il existe de très nombreuses
espèces de tabanidés qui ont été classées en
trois sous familles (Pangoniinae, Chrysopsinae et
Tabaninae) divisées en tribus, genres et sous genres. Les
genres Tabanus, Chrysops, Atylotus et
Hematopota sont les 4 principaux ayant un intérêt
vétérinaire (Itard, 1981). Les taons ont une
répartition mondiale. Ils assurent la transmission mécanique de
T. evansi et de T. vivax et sont aussi
responsables de la transmission cyclique de T theileri
(Desquesnes et al., 2005). L'importance économique et
médicale résulte d'une part de la quantité de sang
prélevé par piqûre et de la considérable diminution
du temps de pâture provoquée par leur harcèlement et
d'autre part de la transmission d'agents pathogènes (trypanosomes, et
autres comme certains arbovirus, bactéries, helminthes, etc.)
4-1-2. Stomoxyinés
Ce sont des diptères, ayant l'aspect de la
mouche domestique, mais dont les pièces buccales sont adaptées
à la piqûre. Comme les glossines, les deux sexes sont
hématophages. Ils mesurent entre 3 et 10 mm de longueur. La plupart des
stomoxyinés sont particulièrement abondants dans les
régions chaudes et humides soudano-sahéliennes. Ils constituent
une sous famille dont les principaux genres sont : les Stomoxys,
Haematobia et Haematobosca. En Afrique subsaharienne, ils
assurent le relais de la transmission de la trypanosomose (T.
evansi et T. vivax en particulier) et d'autres
pathologies comme l'habronémose, la fièvre charbonneuse, la
dermatophilose, etc.
4-1-3. Hippoboscidés
Appartenant également à l'ordre des
diptères, les hippoboscidés sont des parasites externes,
hématophages dans les deux sexes. Ils sont caractérisés
morphologiquement par un corps élargi dorso- ventralement, un
tégument épais et élastique, des pattes
étalées avec des épines fortes. Melophagus ovinus
(parasite des ovins, permanent en régions tempérées) et
Hippobosca equi (parasite des équidés) sont les
représentants connus de cette famille. Les hippoboscidés sont
relativement peu impliqués dans la transmission mécanique de la
trypanosomose (Itard, 2000). Ils peuvent par ailleurs
provoquer une forte irritation chez leur hôte en cas d'abondance et comme
tous les insectes hématophages, ils peuvent aussi transmettre des agents
pathogènes.
4-2. Vecteurs à transmission cyclique : les
glossines
Les glossines ou mouches tsé-tsé sont
des insectes hématophages (mâle et femelle), appartenant à
l'ordre des diptères, à la famille des Muscidés, à
la sous famille des Glossininae et à l'unique genre
Glossina. Ils vivent exclusivement dans la zone intertropicale
africaine notamment entre le 15°N et le 30°S de latitude
(Itard, 2000). (Fig. 8). Les glossines occupent une superficie
d'environ 10 millions de Km² et affectent plus de 37 pays (OIE,
2000). Leur morphologie générale est celle des mouches.
Elles diffèrent cependant de la plupart des autres Muscidés par
l'adaptation de leurs pièces buccales à la piqûre. Une
mouche tsé-tsé mesure entre 6 et 16 mm de longueur, en excluant
la trompe (proboscis) et en général le mâle est plus petit
que la femelle. Ces mouches sont de couleur variable : du marron au
jaunâtre jusqu'au gris, mais jamais métallique (Itard,
2000).
Les glossines rencontrées en Afrique
occidentale appartiennent aux 3 grands groupes connus qui sont :
· le sous genre Austenina (groupe
Fusca) (Towsend, 1921), ce sont des glossines de grande taille (11
à 16 mm). Les espèces de ce groupe ont une importance
économique mineure, car ils ont une répartition
généralement en dehors des zones à vocation
pastorale ;
· le sous genre Nemorhina (groupe
Palpalis) (Robineau-Desvoidy, 1830) qui regroupe les glossines de
taille moyenne (8 à 11 mm) ou petite (6 à 8 mm). Elles vivent
dans les végétations situées à proximité des
points d'eau. Elles sont également connues sous le nom de
tsé-tsé riveraines ;
· le sous genre Glossina s. str. (groupe
Morsitans) (Zempt, 1935) rassemble les espèces de taille
moyenne (8 à 11 mm). Ces espèces fréquentent
préférentiellement les régions de savanes d'où leur
nom de tsé-tsé des savanes. Ces glossines jouent un rôle
important dans la transmission des trypanosomoses animales.
Les glossines se comportent comme de
véritables hôtes intermédiaires et revêtent de ce
fait une importance capitale dans l'épidémiologie des
trypanosomoses en Afrique. Elles assurent exclusivement la transmission des
trypanosomes typiquement africains. Le degré d'infestation au sein
d'une population de glossines varie en fonction de plusieurs facteurs :
les espèces de trypanosomes et de glossines en présence, le
nombre de repas, l'âge et le sexe des glossines en présence et la
saison (Itard, 1981). En Afrique de l'ouest, les glossines du
sous genre Nemorhina (palpalis) sont les plus
impliquées dans la transmission de T. vivax
comparativement aux infections à T. brucei gambiense.
Par contre, T. congolense est le plus souvent transmis par
les glossines des savanes (sous genre Glossina s. str.). Ces relations
entre les trypanosomes et les glossines témoignent de l'existence d'une
différence de capacité vectorielle (nombre de nouvelles
infections qu'un insecte peut disséminer quotidiennement chez un
hôte).
Mis à part la transmission cyclique et
mécanique, il existe d'autres modes de transmission dont l'importance
est variable selon les conditions épidémiologiques et la
présence ou l'abondance des différents types de vecteurs. On peut
ainsi avoir une transmission par les mouches suceuses, une transmission
iatrogène par piqûre et une transmission in utero ou
congénitale. La transmission vénérienne est le principal
mode de transmission de T. equiperdum. Quant à la
transmission oro-digestive, elle concerne principalement les trypanosomes du
sous genre Trypanozoon.
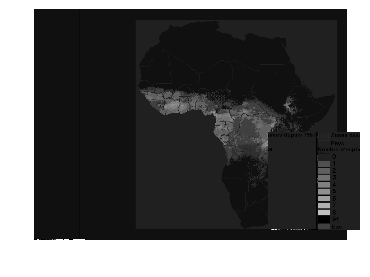
Figure 8 : Aire de répartition des
glossines en Afrique
Source : FAO / PATT (1998)
5. Pathogénie
La pénétration des trypanosomes chez
l'hôte mammifère est à l'origine de la formation au point
d'inoculation d'un trypanome. Le trypanome est une réaction
inflammatoire sous la forme d'un furoncle suivi d'une ulcération :
c'est le chancre d'inoculation observé plus visiblement chez l'homme. La
pathologie liée à la présence du parasite est
principalement due à une action inflammatoire, nécrotique,
toxique, anémiante et hémolytique et une action
immunodépressive.
Ainsi, après la disparition du chancre
d'inoculation au bout de 3 à 15 jours (Itard, 2000) les
trypanosomes passent dans la circulation générale. Les facteurs
parasitaires sont sécrétés par les trypanosomes vivants ou
libérés par la lyse massive des parasites qui fait suite à
chaque vague de parasitémie. Il y a alors libération de
catabolites toxiques tels que le tryptophol (produit de dégradation du
tryptophane et qui est très toxique), l'indole-éthanol, etc. La
présence des parasites dans l'organisme induit chez l'hôte
mammifère une carence de substances (glucose, pyruvate, acides
aminés) utilisées par les trypanosomes. Leur présence dans
les vaisseaux sanguins provoque une inflammation vasculaire, notamment avec
T. congolense, tandis que T. brucei provoque des
lésions nécrotiques dans les tissus conjonctifs et
parenchymateux. En outre, les parasites produisent des substances très
anémiantes qui sont des toxines hémolytiques associant
l'indole-éthanol à des phospholipases. L'interaction initiale
entre le parasite et le système immunitaire de l'hôte trouble
l'équilibre du réseau des cytokines, entraînant des
phénomènes d'hypersensibilité de type III. Les kinines
libérés après la lyse des trypanosomes ont une action sur
la perméabilité vasculaire et sont impliqués dans le
déterminisme des oedèmes. On signale également un
état sévère d'immunodépression qui a des origines
multiples dont entre autres des facteurs toxiques et des facteurs immunitaires
(par exemple les immuns complexes bloquant l'activité des macrophages).
Cette immunodépression est responsable d'une plus grande
sensibilité des animaux aux affections intercurrentes. Aux
périodes avancées de la maladie, les trypanosomes franchissent la
barrière méningée et passent dans le liquide
céphalo-rachidien, provoquant ainsi des symptômes nerveux
observés le plus fréquemment chez l'homme. Enfin la mort survient
en l'absence de traitement et suite à une défaillance du
système immunitaire de l'animal.
La pathogénicité des trypanosomes est
variable selon l'espèce de trypanosome. D'après des études
menées par Sidibé et al. (2002), T.
congolense est le plus pathogène pour le bétail en
Afrique et plus précisément T. congolense type
savane qui possède une pathogénicité supérieure aux
autres types. Le type forêt a une pathogénicité moindre
avec élimination du parasite 3 mois après l'infection. Le type
kilifi est par contre non pathogène pour le bétail
(Bengaly, 2003).
6. Génome des trypanosomes
L'organisation du génome des trypanosomes a pu
être étudiée par l'analyse électrophorétique
en champ pulsé (Pulse Field Gel Electrophoresis =PFGE) du
matériel génomique (Sidibé, 1996). Le
matériel génétique des trypanosomes porté par l'ADN
est localisé dans le noyau (ADN nucléaire) et dans le
kinétoplaste (ADN kinétoplastique).
6-1. ADN nucléaire
Les chromosomes observés dans le noyau se
répartissent en 3 catégories selon la taille.
ü Les mini-chromosomes sont les plus nombreux (une
centaine) et leur taille varie de 50 et 250 Kb. Selon Garside et al. (1994)
(in Sidibé, 1996), dans le sous genre
Nannomonas, T. simiae possède les plus petits
mini-chromosomes (50 à 100 Kb), suivi par les types savane et
forêt de T. congolense. Le type kilifi en
possède les plus gros (100 à 250 Kb).
ü Les chromosomes intermédiaires au nombre de 20
à 50 sont de taille comprise entre 250 et 700 Kb.
ü Les gros chromosomes dont la taille est
supérieure à 1000 Kb, sont au nombre de 15 à 20.
Selon Michels et al. (1991) (in
Sidibé, 1996) le génome d'une cellule haploïde des
trypanosomes est de 3,7.107 Pb. Près de 12% des ADN sont
formés de séquences hautement répétées, 20%
de séquences moyennement répétées et enfin 68% de
séquences non répétées.
6-2. ADN kinétoplastique (ADNk)
Le kinétoplaste, partie fortement
dilatée du système mitochondrial, est très riche en ADN
qui se présente sous la forme de 20 à 50 maxicercles et d'une
dizaine de minicercles. Ils sont disposés en longs filaments
enroulés en spirales sur plusieurs rangées, et
représentent deux types d'ADN différents (Itard,
2000).
ü Les minicercles, d'une taille d'environ 1 Kb, sont
formés d'une région conservée de 100 à 150 Pb et
d'une région variable de 850 à 900 Pb. Une séquence de 12
nucléotides présente sur la région conservée est
hautement préservée d'une espèce à l'autre, voire
d'un genre de kinetoplastidae à l'autre. Certains auteurs
(N'Tambi et Englun, 1985 cités par Sidibé, 1996)
ont montré que cette séquence est à l'origine de la
réplication des minicercles et l'ont appelée « la
séquence universelle des minicercles ». Les minicercles sont
néanmoins très variables au sein d'une même espèce
et varient même au sein d'un stock.
ü Les maxicercles, d'une taille en moyenne 20 fois
supérieure à celle des minicercles, mais d'un nombre
réduit (20 à 50), se retrouvent chez tous les trypanosomes de la
section des Salivaria, à l'exception de T.
evansi (Simpson, 1987 in Sidibé, 1996). Ils
sont formés d'une région variable de 3 à 6 Kb et d'une
région conservée de 17 Kb. Cette dernière porte les
gènes codant pour les ARN ribosomiques des mitochondries et les
gènes codant pour certaines protéines impliquées dans les
phénomènes d'oxydation mitochondriale. Les maxicercles sont d'un
intérêt non moins important, car ils peuvent être
utilisés comme outil de diagnostic.
7. Propriétés antigéniques
Chez les formes sanguines des trypanosomes des
mammifères, la couche externe du périplasme est composée
de glycoprotéines constituant les antigènes de surface. Outre ces
antigènes de surface, les trypanosomes possèdent des
antigènes internes ou antigènes somatiques. En plus, chez les
trypanosomes, il existe une grande variation antigénique.
7-1. Antigènes invariants
Les antigènes somatiques dits invariants
ou « communs » sont constitués par les
protéines de structure (protéines du cytosquelette, de la
membrane) ou des molécules impliquées dans le métabolisme
du parasite telles que les enzymes. Ces antigènes sont communs à
tous les stades du cycle parasitaire, à toutes les souches d'une
même espèce et même pour quelques-uns à toutes les
espèces de trypanosomes. Libérés dans le plasma, ils
peuvent par formation d'immuns complexes, exercer des effets pathogènes
chez l'animal infecté. Cette réaction antigène-anticorps,
trouve une large application dans le diagnostic sérologique de la
trypanosomose (tests d'agglutination direct, de précipitation, de
fixation du complément, etc.).
7-2. Antigènes variables de surface
Les glycoprotéines variables de surface (GVS)
forment une enveloppe ou manteau. Ces molécules sont toutes identiques
chez un organisme donné, ainsi que chez tous les parasites issus d'un
même clone ; mais différentes chez deux variants issus du
même organisme. Leur apparition est observée dès le stade
métacyclique chez la glossine et se maintient tout au long du processus
infectieux chez l'hôte mammifère. La chaîne protéique
d'une glycoprotéine de surface, dont le poids moléculaire est
d'environ 65000 daltons est constituée d'environ 500 acides
aminés. Cette chaîne polypeptidique est formée d'un peptide
signal, d'une région variable (d'environ 360 acides aminés)
suivie d'une région d'homologie. La GVS est la seule structure
antigénique exposée à la surface des trypanosomes sanguins
et des métacycliques. C'est donc contre elle que sont dirigés
les anticorps qui sont neutralisants, donc protecteurs (Itard,
2000).
7-3. Variation antigénique
Les séquences des acides aminés qui
constituent la chaîne protéique d'une GVS sont codées par
des gènes différents d'un variant à l'autre. Les
régions hypervariables sont situées dans les deux tiers
N-terminaux de la molécule correspondant à sa partie externe. On
distingue globalement des types antigéniques dominants variants
«majeurs » qui s'expriment en début d'infection et des
variants tardifs dits « mineurs » qui apparaissent
ultérieurement. Chez l'animal infecté, chaque vague de
parasitémie est due à l'émergence d'un variant
différent.
Au tout début d'une infection par le
trypanosome, les lymphocytes B du mammifère produisent des anticorps
capables de se lier aux GVS particulières qu'ils reconnaissent sur
l'enveloppe de surface de cette première population de parasites. Ces
anticorps tuent environ 99 % de cette population initiale. Mais quelques
individus qui ont activé un gène codant une GVS différente
échappent à la destruction. La multiplication de ce nouveau
variant aboutit à l'émergence d'une nouvelle population de
parasites antigéniquement distincte de la première.
L'apparition séquentielle des variants
antigéniques au cours du processus infectieux, permet continuellement au
trypanosome d'échapper au système immunitaire de l'hôte.
C'est ce phénomène de variation antigénique qui rend
illusoire la mise au point d'un vaccin contre les formes sanguines des
trypanosomes africains. Par contre, chez les formes métacycliques du
vecteur, le nombre de variants antigéniques exprimés est
relativement limité. On a espéré pouvoir, à partir
de ce répertoire antigénique plus restreint, produire un vaccin
contre les variants exprimés par la population de métacycliques
qui forme la première vague de parasitémie chez le
mammifère infecté. Cette protection s'est malheureusement
révélée relative et partielle, donc non effective
(Itard, 2000).
Chapitre 2 : Trypanosomose des animaux
domestiques
Après une présentation
générale des trypanosomes, nous aborderons dans ce chapitre une
étude de la maladie due à ces protozoaires chez les animaux
domestiques, particulièrement en Afrique. Il conviendra de rappeler
d'abord l'importance de la maladie avant d'entamer une étude
épidémio-clinique de la trypanosomose animale. Nous passerons en
revue les méthodes de diagnostic de la trypanosomose tant sur le terrain
qu'au laboratoire en mettant un accent particulier sur les outils de la
biologie moléculaire (technique d'hybridation moléculaire et
PCR). Enfin, dans ce chapitre nous ferons un exposé des
différentes composantes des moyens de lutte contre cette parasitose.
1. Importance
Les trypanosomoses sont des maladies parasitaires dont
l'importance médicale et socio-économique est
considérable. Nous distinguons des répercussions directes
liées à l'incidence de la maladie et aussi des
répercussions indirectes imputables aux trypanosomoses.
Les répercussions directes sont en rapport
avec :
Ø la mortalité qui survient très souvent
en phase aiguë de la maladie ;
Ø la morbidité surtout élevée dans
les zones subhumides (liée à la présence des
glossines) ;
Ø le nombre d'espèces affectées, toutes
les espèces animales sont sensibles, y compris l'homme. En Afrique, la
trypanosomose humaine touche entre 300 et 500 mille personnes et l'issue est en
général fatale en l'absence de traitement. Les mortalités
annuelles (chez l'homme) sont estimées à environ 10%
(FAO, 2002).
Ø On note en plus, une énorme chute de
production chez le bétail infecté, la trypanosomose occasionne 10
à 40 % de perte en production laitière et 5 à 30% de perte
en production de viande (Sidibé, 2001).
Les répercussions indirectes provoquées
par cette maladie sont essentiellement d'ordre économique. La FAO estime
que les pertes économiques dues aux trypanosomoses seraient de l'ordre
de 1 à 1,5 milliards de dollars US par an. Elles représentent
à elles seules le ¼ des pertes économiques attribuées
aux pathologies animales en Afrique. Le coût des opérations de
lutte demeure considérable. Selon Abiola
(2001), les ventes de trypanocides correspondent
à 20-25% (selon les pays) des produits vétérinaires
commercialisés. Le coût du traitement chez l'homme est
estimé à environ 38,5 millions de dollars US (Pangui,
2001). En outre, il faut noter les conséquences néfastes
de la maladie sur l'élevage, par exemple la présence de la
trypanosomose rend difficile l'introduction des races améliorées
(très sensibles) dans les pays infestés. Les répercussions
sont également défavorables sur l'agriculture, la maladie du
sommeil chez l'homme en est une illustration. Elle touche essentiellement le
monde rural et de ce fait conduit à une diminution de la main d'oeuvre
agricole.
Au regard de l'importance médicale et
socio-économique indéniable de la trypanosomose, il est
nécessaire de bien connaître la maladie, à travers d'une
part ses symptômes et lésions et son épidémiologie
et d'autre part à travers son diagnostic tant sur le terrain qu'au
laboratoire.
2. Etude clinique
2-1. Symptômes
Les trypanosomoses sont des affections à
évolution généralement chronique, la durée et la
symptomatologie sont variables suivant l'espèce de mammifère
affectée et l'agent pathogène en cause. Les formes classiques
sont la nagana qui regroupe les affections dues aux
trypanosomes « animaux » typiquement africains, le
surra et la dourine.
La Nagana
C'est l'ensemble des trypanosomoses des animaux
domestiques dues aux principaux trypanosomes pathogènes à savoir
T. congolense, T. vivax, T.
brucei, T. simiae et T. suis, tous transmis
par les glossines. La maladie se caractérise par une évolution
par accès ou « crises » après une
période d'incubation variable d'une à quelques semaines.
L'évolution est en étroite relation avec les parasitémies
successives.
Dans la forme chronique qui est la plus courante, les
accès se manifestent par des poussées fébriles
correspondant aux vagues de parasitémie élevée. Ces
accès sont séparés par des intervalles d'apyrexie durant
la période de faible parasitémie. La forme chronique se
caractérise surtout par des crises plus atténuées et plus
espacées, pouvant conduire à une auto-stérilisation
apparente (Itard, 2000). En plus de l'hyperthermie, les
symptômes observés sont l'anémie avec un
hématocrite très souvent inférieur à 25% ; une
hypertrophie des noeuds lymphatiques (pré scapulaires, pré
cruraux) ; des oedèmes ; une conjonctivite purulente ou
parfois une opacification de la cornée associée à une
kératite ; des symptômes nerveux rencontrés surtout
chez les équidés et se traduisent par l'affaiblissement du train
postérieur, la parésie voire la paralysie. Dans cette forme,
l'amaigrissement est un symptôme presque constant à une
période avancée de la maladie. Dans la phase ultime de la
maladie, l'animal meurt en état de cachexie profonde. On observe en plus
dans les formes chroniques, des avortements et une chute voire un tarissement
de la sécrétion lactée chez les femelles ; une
stérilité chez les mâles ; des retards de croissance
chez les jeunes ; les animaux apparaissent en général
fatigués avec des poils piqués, une altération
complète de l'état général précède
très souvent la mort en l'absence de traitement. Parfois la
guérison survient après une longue convalescence.
Les formes aiguës et suraiguës rarement
observées, sont caractérisées par une évolution
rapide. Dans la forme suraiguë, le premier accès est mortel. On a
dans la forme aiguë plusieurs accès de 3 à 6 jours
séparés par des phases de rémissions d'une semaine, la
mort survient en 7 à 8 semaines.
Le Surra
C'est une trypanosomose due à T.
evansi. La virulence de ce dernier est surtout marquée pour les
camélidés et les équidés. Les jeunes sujets et les
femelles gestantes font une maladie aiguë qui se manifeste par une
asthénie, une fièvre, un amaigrissement précédant
la dégradation de l'état général avec une chute de
poils et des larmoiements. Des avortements et parfois des oedèmes sont
aussi observés. L'évolution de la maladie est rapide vers une
cachexie suivie de la mort après une prostration prolongée. La
forme chronique survient chez les adultes et se manifeste par une fièvre
intermittente, une anémie et un amaigrissement progressif.
La Dourine
Elle ne sévit naturellement que chez les
équidés et elle est due à T. equiperdum.
C'est une maladie vénérienne uniquement transmise par le
coït d'où les noms de « mal de coït » ou
de « syphilis du cheval » parfois employés. Elle
évolue le plus souvent sous une forme chronique qui se
caractérise deux semaines après l'infestation par des
oedèmes chauds et douloureux localisés au fourreau et au scrotum
chez l'étalon et à la vulve chez la jument. La fièvre est
modérée, mais les symptômes cutanés, ganglionnaires
et nerveux apparaissent en moyenne un mois après le coït infestant.
En phase terminale de la maladie, on note un amaigrissement prononcé,
des oedèmes en régions déclives et la mort survient suite
à des complications respiratoires.
La dourine peut rarement se présenter chez le
cheval sous une forme aiguë d'évolution rapide, ou sous une forme
atypique dans laquelle la phase des plaques cutanées et celle des
oedèmes sont très discrètes.
2-2. Lésions
On distingue des lésions
générales qui sont celles de l'anémie et de la cachexie
surtout observées dans les formes chroniques. Dans les formes
aiguës, on a des phénomènes congestifs et
hémorragiques sous forme de pétéchies et d'ecchymoses
diffuses.
Les lésions locales intéressent presque
tous les organes. On note une hypertrophie ganglionnaire se présentant
sous la forme d'une hyperplasie réticulaire avec des nodules
hémorragiques. Au niveau du foie et de la rate, on a une
hépato-splénomégalie. Des lésions de myocardite
avec des foyers de nécrose sont également décrites. Les
poumons, le foie, les reins, le coeur sont infiltrés par des
macrophages, des neutrophiles ou des lymphocytes. Les lésions de la
moelle osseuse se caractérisent par une hypertrophie du tissu
érythropoïétique et une prolifération des globules
rouges. Les lésions oculaires sous formes de kératite,
d'uvéite et parfois de conjonctivite purulente sont également
fréquentes.
Il n'existe donc pas de lésions
caractéristiques de la trypanosomose et ces lésions sont en
général de type inflammatoire, souvent accompagnées de
phénomènes de dégénérescence et de
nécrose.
3. Epidémiologie
La trypanosomose est une maladie qui frappe le
bétail, mais aussi la faune de mammifères sauvages qui constitue
un immense réservoir des trois principaux trypanosomes (T.
congolense, T. vivax et T.
brucei). Ainsi, certains animaux réceptifs (faune sauvage et
bétail trypanotolérant) présentent une moindre
sensibilité à la nagana et jouent le rôle de
réservoir. La réceptivité du réservoir sauvage
influence le maintien d'une espèce de trypanosome et sa
prévalence chez le bétail dans une région donnée.
Ce phénomène constitue un obstacle majeur aux opérations
de lutte. Les sources d'infection sont donc les animaux domestiques ou sauvages
cliniquement malades de trypanosomose ou les porteurs sains.
Les trypanosomoses dues aux trypanosomes typiquement
africains sont enzootiques à l'intérieur de l'aire de
distribution des glossines. La prévalence des infections est
particulièrement élevée chez les bovins (supérieure
à 70%), les adultes sont régulièrement infectés,
tandis que les jeunes s'infectent entre 6 mois et 2 ans (Desquesnes,
2003). Par ailleurs, la prévalence et l'incidence sont toujours
plus élevées chez les bovins de races trypanosensibles
(Zébus : Bos indicus) que chez les animaux
trypanotolérants (Taurins : Bos taurus) exposés
à la même
« pression glossinienne »1(*) (Clausen et al.,
1993). Chez les animaux exotiques provenant des pays du nord, le taux
de prévalence parasitaire peut atteindre 100% si aucun traitement
trypanocide n'est administré (Bengaly, 2003). Il faut
aussi noter, que dans les régions où les trois trypanosomes
pathogènes des bovins sont présents, T. congolense
prédomine chez les adultes, mais sa prévalence est faible
chez les jeunes animaux (Desquesnes et al., 1999). On note
cependant des variations saisonnières qui peuvent être dues, d'une
part à l'augmentation du contact hôte / vecteurs et d'autre part
à certaines conditions favorisantes telles que l'insuffisance de
l'abreuvement et de l'alimentation, le stress et les maladies intercurrentes.
Ces facteurs engendrent une élévation des incidences des
infections et des cas cliniques. En revanche, la capacité vectorielle
des glossines pour les trypanosomes demeure constante, d'où une relative
stabilité des situations enzootiques.
Les épizooties de trypanosomose ne peuvent
être rencontrées que dans des populations majoritairement
très sensibles à l'agent pathogène. Il s'agit par exemple
le cas d'une brutale mise en contact d'hôtes indemnes avec des vecteurs
très compétents. Ces cas sont à l'origine de l'apparition
des flambées épizootiques localisées.
On peut aussi rencontrer d'autres situations
épidémiologiques de la trypanosomose, telles que des situations
enzoo- épizootiques (cas de la trypanosomose hémorragique due
à T. vivax) ; des cas sporadiques qui sont
rares ; mais également des foyers indemnes observés dans les
régions défavorables à l'ensemble des vecteurs des
trypanosomes (cas des zones désertiques ou arides).
Contrairement à la transmission cyclique, la
transmission mécanique de la trypanosomose est très fragile du
point de vue épidémiologique (Desquesnes, 2003).
La promiscuité des individus et ou des espèces dans un
élevage ou à un point d'abreuvement est la condition
nécessaire à la transmission mécanique des trypanosomes
par les insectes hématophages. La probabilité de transmission est
plus ou moins élevée selon divers paramètres concernant
l'hôte infectant, le vecteur potentiel, l'hôte réceptif et
les relations entre hôtes et vecteurs. Les trypanosomoses transmises
mécaniquement varient également selon les saisons. Mais les
foyers de trypanosomoses transmises par les insectes autres que les glossines,
peuvent connaître des incidences de 100 % en quelques jours, même
lorsque l'abondance des vecteurs mécaniques est modérée
(Desquesnes et al., 2005). Il est donc important de souligner
le rôle multiple des insectes piqueurs (autres que les glossines) dans
l'épidémiologie des trypanosomoses. Leurs effets directs (comme
les lésions cutanées, la spoliation sanguine, le stress)
provoquent une immunodépression du bétail qui
révèle une réapparition clinique de la maladie et
accroît la réceptivité et la sensibilité des animaux
sains. Leurs effets indirects est principalement la transmission
mécanique des trypanosomoses.
Nous retiendrons, que les situations
épidémiologiques des trypanosomoses du bétail varient
essentiellement selon « la pression glossinienne »,
les interactions hôtes / vecteurs, la présence et ou l'abondance
des insectes hématophages, la race bovine et la présence de
réservoir sauvage ou domestique.
4. Diagnostic
4-1. Diagnostic sur le terrain
4-1-1. Diagnostic
épidémiologique
La trypanosomose est une maladie qui frappe le
bétail et la faune de mammifères domestiques et sauvages. Elle
touche principalement les bovins, en particulier les zébus, les taurins
trypanotolérants (N'Dama, Baoulé, etc.) supportent mieux
l'infection et développent des formes chroniques. Les ovins et les
caprins sont souvent moins touchés que les bovins.
La présence des glossines (qui sont les
principaux vecteurs) renforce la suspicion de cette maladie à
caractère enzootique dans ces zones infestées. Dans les
régions où les glossines sont absentes, la trypanosomose animale
peut être transmise par des insectes hématophages vecteurs
mécaniques, dont la densité fluctue avec les variations
saisonnières.
4-1-2. Diagnostic clinique et diagnostic
différentiel
Sur le terrain, le diagnostic est difficile et
aléatoire, en raison de l'absence des signes caractéristiques de
la maladie. Il convient néanmoins de penser à la trypanosomose
lorsqu'en zone d'enzootie, on observe chez un animal de l'hyperthermie, de
l'anémie, des oedèmes, des hypertrophies ganglionnaires, de la
conjonctivite ou de la kératite, de l'amaigrissement, lorsque l'animal
présente des poils piqués, de l'abattement, une augmentation du
pouls et du rythme respiratoire. En phase finale d'infection chronique,
l'animal est cachectique.
L'ensemble des signes cliniques des trypanosomoses
peut être confondu avec ceux d'autres hémoparasitoses et certaines
helminthoses. Un diagnostic différentiel est donc nécessaire.
Ainsi, la trypanosomose doit être distinguée :
chez les bovins des microfilarioses, des theilérioses
pathogènes, des piroplasmoses (babésioses), des helminthoses
gastro-intestinales, de la cowdriose, du charbon bactéridien, de
certaines carences nutritionnelles ;
chez les équidés de l'anémie
infectieuse, de l'exanthème vésiculeux, de l'anarsaque,
etc. ;
chez le dromadaire des strongyloidoses gastro-intestinales,
de l'echinococcose, de la fièvre charbonneuse... ;
chez le porc des fièvres septicémiques virales
ou bactériennes, des helminthoses.
Il est aussi utile, pour une forte présomption
de distinguer les symptômes propres à chaque espèce animale
et à chaque trypanosome. Mais le diagnostic de certitude ne pourra
être établi qu'après des examens complémentaires de
laboratoire.
4-2. Diagnostic au laboratoire
Le diagnostic au laboratoire est le seul moyen
sûr de détection des trypanosomes, il constitue de ce fait une
étape primordiale, voire indispensable à toute stratégie
de lutte contre la trypanosomose animale. On distingue d'une part, des
techniques directes (techniques parasitologiques et moléculaire) qui
visent la mise en évidence du parasite, de son pouvoir pathogène
et de l'une des composantes du parasite (ADN, antigènes). D'autre part,
on dispose des techniques indirectes basées sur la recherche des
témoins (anticorps) qui traduisent la présence des trypanosomes
dans l'organisme. Pour permettre la réalisation des enquêtes
épidémiologiques, il est nécessaire d'effectuer le
diagnostic aussi bien chez l'hôte mammifère que chez les
vecteurs.
4-2-1. Diagnostic chez l'hôte
mammifère
4-2-1-1. Méthodes directes
4-2-1-1-1. Méthodes parasitologiques
Le principe général de ces techniques
est la mise en évidence des parasites dans un liquide biologique de
l'hôte. Le diagnostic peut porter sur un prélèvement de
sang, de ganglion lymphatique, de liquide céphalo-rachidien (forme
nerveuse de la maladie), de sécrétions génitales, sur un
calque d'organe. Les prélèvements sont réalisés
selon les cas, à l'état frais ou sur du matériel
biologique fixé ou ayant été congelé. La
récolte des prélèvements doit être effectuée
aussi proprement possible, en évitant au maximum les souillures.
4-2-1-1-1-1. Examens microscopiques
directs
Il s'agit de rechercher les parasites à
l'état frais ou après fixation, soit directement dans le sang (le
plus souvent), soit après enrichissement. L'observation microscopique
immédiate d'une goutte de sang est la méthode classique, mais de
nos jours elle est peu employée du fait de sa faible sensibilité.
L'etalement sanguin fixé au méthanol et coloré au giemsa
permet d'identifier sur la base des critères de morphologie et de
morphométrie, le sous genre auquel appartiennent les trypanosomes. Selon
le contexte épidémiologique en examen de routine, le diagnostic
d'espèce peut être déduit. La méthode de coloration
la plus usitée est la méthode panoptique qui associe deux
colorants: le May-Grünwald et le Giemsa (Itard, 2000).
L'etalement sanguin peut être également coloré au Giemsa
dilué après fixation au méthanol. Cette technique permet
des études morphologiques détaillées et l'identification
des différentes espèces de trypanosomes (OIE,
2000).
4-2-1-1-1-2. Examens microscopiques après
concentration
Ces examens regroupent un ensemble de méthodes
plus sensibles que l'observation directe des parasites et repose sur le
principe de la concentration des parasites avant l'examen microscopique. En
effet, la concentration des trypanosomes facilite grandement leur recherche,
surtout lorsque la parasitémie est faible. Elle est obtenue soit par
centrifugation d'un volume donné de sang total, soit après
filtration des trypanosomes, soit après la lyse des hématies.
? La technique qui donne pour une application pratique sur le
terrain les meilleurs résultats est la centrifugation
différentielle en micro tubes à hématocrite de l'interface
globules / plasma : il s'agit de la technique de centrifugation
hématocrite (HCT ou test de WOO) (Woo, 1970). Elle est
rapide et économique, de plus elle fournit une évaluation de
l'état d'anémie de l'animal. La sensibilité est variable
selon l'espèce, par exemple pour T. vivax on a
jusqu'à 1250 trypanosomes / ml de sang (Desquesnes et Tresse,
1996). Par ailleurs, une double micro centrifugation améliore
considérablement la sensibilité de cette méthode en
permettant de déceler des infections très légères
(CIRDES, 2001).
La méthode de MURRAY (BCM= Buffy Coat Method)
est aussi une variante de la technique de centrifugation hématocrite, on
coupe le tube capillaire par une pointe diamant ½ mm au-dessous de la
couche leucocytaire appelée buffy coat où se concentrent les
trypanosomes constituant l'interface entre le plasma au-dessus et les
hématies en dessous. Un examen exhaustif de ce matériel est
réalisé à l'état frais (ou après fixation et
coloration) entre lame et lamelle au microscope à fond noir
(Murray et al., 1977) ou à contraste de phase. A partir
des critères de morphologie et de morphométrie, on arrive
toujours à identifier le sous genre auquel appartient le parasite.
Toutefois, la sensibilité relative des
méthodes de Woo et de Murray est assez controversée selon les
auteurs et les espèces parasitaires, elles sont
généralement voisines et sont de l'ordre de 100 à 1000
parasites / ml de sang (Desquesnes, 2003).
? La lyse des globules rouges par un détergent
(Dodécyl Sulfate de Sodium) nécessite des manipulations
nombreuses et des temps d'incubation et de centrifugation relativement longs,
pour un faible gain de sensibilité. Elle est aussi difficilement
réalisable sur le terrain. Elle n'est donc pas couramment
utilisée.
? La séparation des trypanosomes par filtration du sang
sur colonne de DEAE (Diethyl amino-ethyl)-Cellulose repose sur les
propriétés électrostatiques de la DEAE cellulose à
un pH choisi de fixer les cellules sanguines et non les trypanosomes
(Lanhan et Godfrey, 1970). C'est une technique très
sensible, très utile au laboratoire pour préparer de grandes
quantités de trypanosomes. Mais elle est difficilement applicable au
diagnostic sur le terrain (Itard, 2000). En revanche, la
technique dite « miniature anion exchange centrifugation
technique » (mAECT) permet de réaliser des diagnostics avec
une sensibilité plus élevée que celle de l'HCT, mais elle
est plus longue que cette dernière.
4-2-1-1-1-3. Inoculation à des animaux de
laboratoire
Pour la culture in vivo, la technique la plus
couramment utilisée est l'inoculation intra péritonéale ou
en sous cutané de matériel biologique infecté à des
animaux sensibles. L'animal de choix est la souris sûrement indemne
d'infection. L'inoculation par voie scrotale chez le lapin permet de faire le
diagnostic de la dourine. La culture in vivo est une méthode
très sensible, surtout pour le sous genre Trypanozoon, elle est
par contre inopérante avec T. vivax qui n'infecte pas
les rongeurs. La culture du parasite in vivo ne peut être
pratiquée de façon courante sur le terrain, en raison du nombre
d'animaux et du matériel nécessaires à sa mise en
application.
La culture in vitro n'a pas d'application
pratique pour le diagnostic des trypanosomes animaux, sauf pour la mise en
évidence de T. theileri. Le diagnostic est rarement
effectué car le parasite est peu pathogène.
4-2-1-1-2. Méthodes
moléculaires
Le diagnostic des trypanosomes auparavant basé
sur différentes observations microscopiques et sérologiques chez
l'hôte mammifère ou chez le vecteur, a été depuis
les années 1980 amélioré avec les outils de la biologie
moléculaire basés sur la détection de l'ADN
(Desquesnes et Davilà, 2002). Ces nouvelles techniques
de détection et d'identification offrent en effet, une
sensibilité et une spécificité jusqu'à
présent inégalables. Des sondes d'ADN spécifiques
d'espèces de trypanosomes ont été élaborées
et utilisées dans les tests de diagnostic de la trypanosomose
(Kukla B. A et al., 1987 ; Dickin S. K et al.,
1989). De nos jours, la technique d'hybridation moléculaire par
les sondes nucléiques tend à être supplantée par la
technique de PCR. Cette dernière considérée comme la plus
sensible et la plus spécifique, fut mise en place au CIRDES en 1993 afin
de pouvoir diagnostiquer de manière fiable les trypanosomes
pathogènes du bétail, aussi bien chez l'hôte
mammifère que chez les glossines vectrices (Duvallet et al.,
1994 ; Desquesnes et Tresse, 1996).
4-2-1-1-2-1. Rappel sur la structure de
l'ADN
L'ADN, acronyme d'acide
désoxyribonucléique, est une longue molécule que l'on
retrouve chez tous les organismes. Cette molécule est formée de
deux chaînes parallèles de nucléotides enroulées en
hélice et reliées par leurs bases azotées. Chaque
nucléotide renferme un groupement phosphoré, un sucre
(désoxyribose) et une base azotée. Quatre bases ont
été identifiées : l'Adénine (A) et la Guanine
(G) appartiennent à la famille des Purines; la Thymine (T) et la
Cytosine (C) sont de la famille des Pyrimidines. Un brin d'ADN est formé
de la répétition ordonnée de ces quatre bases. Deux brins
anti- parallèle d'ADN sont dits complémentaires car toujours
étroitement reliés entre eux par des liaisons faibles (de type
hydrogène) formées entre les bases complémentaires. Il y a
deux liaisons entre A et T et trois liaisons entre G et C. Ainsi, une
molécule double brin composée uniquement (ou en majorité)
de G-C nécessitera plus d'énergie pour être ouverte, qu'un
ADN de même taille composé de A-T. Ceci explique pourquoi la
température de fusion (Tm) de l'ADN varie en fonction de sa taille
(exprimée en nombre de bases, généralement en Kilobase Kb
ou en Mégabase Mb) et de son rapport (A+T) / (C+G).
Figure 9 : structure de l'ADN
4-2-1-1-2-2. Technique d'hybridation
moléculaire
Deux chaînes monocaténaires d'acides
nucléiques peuvent former un duplex, grâce à
l'établissement de liaisons hydrogène entre des paires de bases
purines -pyrimidines (A-T ou A-U ; C-G). Cette association surtout quand elle
s'opère in vitro est dite hybridation et n'est possible que si
les séquences des 2 chaînes sont complémentaires. Tel est
le principe de la technique du diagnostic par les sondes nucléiques.
Une sonde nucléique est un fragment d'acides
nucléiques (ADN ou ARN) capable de reconnaître dans une
préparation, une séquence nucléotidique spécifique
complémentaire à la sienne et de former avec celle ci une
molécule double brin ou duplex stable au cours d'une réaction
dite d'hybridation. La spécificité de la réaction
d'hybridation est fonction de la séquence nucléotidique choisie
comme sonde (Kodjo et al., 1993). On distingue, d'une part les
sondes radioactives ou sondes chaudes qui sont des acides nucléiques
marqués avec des isotopes radioactifs (P² et
H). D'autre part, on a les sondes dites froides car ne comportant
aucun élément radioactif. Le système de détection
est alors basé sur une enzyme qui s'est révélée par
sa capacité à transformer un substrat (incolore en
général) en un produit facilement détectable (le plus
souvent coloré). La phosphatase alcaline est l'enzyme la plus
utilisée. De nos jours, on emploie de plus en plus les
oligonucléotides comme sondes. Ce sont de simples brins d'acides
nucléiques d'une longueur de 15 à 35 nucléotides
synthétisés par des machines suivant la séquence du
gène à chercher. Ils sont marqués soit à l'une
des extrémités avec un nucléotide modifié, soit
directement avec l'enzyme servant à la détection.
L'hybridation moléculaire est utilisée
depuis longtemps en recherche fondamentale, afin de déterminer le
degré de parenté entre les génomes d'êtres
biologiques, isoler des gènes, établir leurs séquences ou
analyser leur fonctionnement. Ces outils ont été adaptés
pour permettre de faire des distinctions très fines dans les populations
de parasites. Pour les trypanosomes, les travaux de l'ILRAD et de
l'Université de Bristol, ont principalement permis de développer
des sondes reconnaissant les différentes espèces ou sous
espèces (Itard, 2000).
4-2-1-1-2-3. Amplification en chaîne par
polymérase ou PCR
4-2-1-1-2-3-1. Définition, principe et
réalisation
La PCR est une technique permettant l'amplification
sélective in vitro des séquences d'ADN. Elle fut
découverte en avril 1983 par Kary Mullis et développée par
Henri A. Herlich et ses collaborateurs de la compagnie CETUS (Californie, USA)
en décembre 1985 (Larzul, 1993). Cette nouvelle
technique de diagnostic permet d'amplifier en quelques temps (quelques heures)
un fragment connu d'ADN : le recopier en plusieurs millions d'exemplaires.
La PCR rend ainsi possible la détection d'une molécule d'ADN
aussi petite que 100 paires de nucléotides présente à un
seul exemplaire dans un prélèvement biologique même en
quantité infime.
Le principe de la PCR se fonde sur l'utilisation de
manière répétitive de la propriété des ADN
polymérase de pouvoir synthétiser un brin d'acide
nucléique complémentaire qu'à partir d'un couple d'amorces
(Etienne, 1996). La PCR est en effet dérivée de
la technique dite « d'extension des amorces », au cours de
laquelle des courtes séquences d'ADN (oligonucléotides) sont
utilisées comme des amorces par l'enzyme de réplication. Cette
enzyme permet de repérer le fragment d'ADN ou de gène
précis, puis de le multiplier rapidement (Higuchi,
1989).
Cette polymérisation est artificiellement
obtenue en imposant des cycles thermiques à un mélange
constitué de l'ADN matriciel (issu de l'échantillon à
tester), des dNTP (désoxynucléotides triphosphate, c'est à
dire les dATP, dCTP, dGTP et dTTP), d'un tampon adéquat, d'un couple
d'amorces et de la Taq polymérase1(*). La PCR est en fait, la
répétition de 3 étapes thermiques réalisées
successivement dans un même tube. Les étapes d'un cycle thermique
sont :
Ø une étape de dénaturation des acides
nucléiques, au cours de laquelle on a la séparation des deux
simples brins de l'ADN;
Ø une étape d'hybridation, pendant laquelle les
amorces oligonucléotidiques viennent s'hybrider sur leur
séquences complémentaires;
Ø enfin, une étape d'élongation durant
laquelle, il y a extension des amorces (dans le sens 5'?3') par l'ADN
polymérase en enfilant les dNTP pour constituer le brin
complémentaire.
A la fin du premier cycle d'amplification, le nombre
de brins d'ADN a doublé, à partir de 2 brins d'ADN initiaux on
obtient 4 séquences après un cycle, 8 après 2 cycles,
2n après n cycles. Après 20 cycles une seule
séquence cible d'ADN est amplifiée plus d'un million de fois.
Cette valeur est purement théorique et correspond à un rendement
idéal de 100 % pour chaque réaction. Le rendement initialement
décrit pour les réactions d'élongation était de
l'ordre de 50 à 60 % (Saiki et al., 1985).
4-2-1-1-2-3-2. Autres techniques de PCR
Pour le diagnostic de la trypanosomose animale, la
PCR utilisant les amorces spécifiques d'espèces décrites
par Masiga et al. (1992) constitue la technique de PCR
classique encore appelée PCR monospécifique. Dans cette
dernière, ce sont les ADN satellites qui sont les séquences
cibles à amplifier. Par contre, la PCR utilisant des couples d'amorces
polyspécifiques amplifiant les espaceurs internes transcrits (ITS) de
l'ADNr est appelée PCR multispécifique ou PCR
plurispécifique ou encore PCR-ITS.
De nos jours la PCR a considérablement
évolué et de nouveaux types de PCR ont été mis au
point pour améliorer la sensibilité et la
spécificité de cette nouvelle technique, il s'agit entre autre
de :
la PCR dite « Nested PCR », elle fait
intervenir une seconde PCR réalisée en utilisant des nouvelles
amorces situées à l'intérieur du fragment
nucléotidique obtenu avec le premier couple d'amorces. Le fragment
à amplifier lors de la seconde PCR est plus court, ce qui réduit
par conséquent les hybridations non spécifiques
(Guèye, 2003) (fig. 10);
Figure 10 :
Schéma de l'amplification par PCR nested de l'ITS 1 de l'ADN
Ribosomal
la PCR ELISA est une technique dont les produits
d'amplification sont révélés par un test ELISA à la
place d'une électrophorèse sur gel d'agarose. Cette
méthode a été mise au point pour identifier les
trypanosomes à la suite d'une amplification des ADN satellites
(Kosum et al.; 2002 ; Masaké et al.,
2002; Sow, 2004).
4-2-1-1-2-3-3. Sensibilité et
spécificité de la PCR
La PCR offre une extrême sensibilité
permettant de détecter une molécule d'ADN aussi petite que 100
paires de nucléotides présente à un seul exemplaire dans
un prélèvement biologique. Cette sensibilité dépend
de plusieurs paramètres, dont la répétitivité de la
séquence amplifiée et les techniques de préparation des
échantillons. Cependant, la sensibilité de la PCR reste
limitée, voire insuffisante par essence, lorsque les agents infectieux
ne circulent pas ou circulent à des taux unitaires inférieures au
volume de l'échantillon traité. Le cas est fréquent pour
les trypanosomes pour lesquels les périodes aparasitémiques
constituent une limite biologique à l'application de la PCR sur le sang
frais ou ses dérivés.
En dehors de sa sensibilité, la PCR se
distingue des autres techniques de diagnostic par sa grande
spécificité d'espèce. Cette dernière dépend
de la stabilité du complexe d'hybridation entre l'amorce et l'ADN cible.
Différents facteurs s'associent pour former cette stabilité,
parmi lesquels on la taille des amorces, la température de fusion et
d'hybridation des amorces, la durée de l'étape d'hybridation et
la concentration des réactifs. Au cours de la PCR, la synthèse
des produits spécifiques entre en compétition avec la
synthèse des produits non spécifiques. Ces produits parasites
générés au cours d'étapes d'hybridation / extension
à basse température sont nuisibles à l'amplification des
séquences spécifiques (Saiki, 1989).
4-2-1-1-2-3-4. Avantages et champs d'application
La PCR est une technique qui possède de
nombreux atouts. Tout d'abord une quantité très faible de
matériel initial est nécessaire pour sa réalisation. La
purification des séquences nucléiques n'est pas
nécessaire, la PCR pouvant être effectuée sur un lysat
cellulaire. (Larzul, 1993). L'amplification s'effectuant sur
des courtes régions d'ADN, cette technique peut s'appliquer à
l'ADN partiellement dégradé. Il faut en plus noter la
simplicité et la rapidité de la technique.
Décrite dans la publication initiale pour le
diagnostic d'une anomalie génétique (Saiki et al.,
1985), la PCR a vu son champ d'application s'étendre de
manière considérable tant pour le diagnostic qu'en recherche
fondamentale. Comme le matériel de départ peut être
pratiquement amplifié à l'infini, toutes les méthodes
d'analyse de l'ADN peuvent être envisagées. Il peut s'agir de
séquençage après clonage des produits amplifiés
(Saiki et al., 1985); de séquençage direct des
produits PCR. L'utilisation d'amorces appropriées (qui sont physiquement
incorporées dans la séquence cible) permet d'effectuer des
substitutions de nucléotides, des insertions, des
délétions sur le produit d'amplification, facilitant ainsi les
études de mutagenèse. Par conséquent, de par sa
capacité à amplifier et à modifier une séquence
d'ADN, la PCR est devenue l'outil de base des laboratoires de
génétique moléculaire.
4-2-1-1-2-3-5. Limites de la PCR
Paradoxalement les limites de la PCR sont dues
à son extrême sensibilité. Par ses qualités
exceptionnelles, la PCR pose des problèmes méthodologiques
importants. La réaction produit donc de manière exponentielle des
produits d'amplification qui sont autant de contaminants potentiels. Seule
l'observation de conditions de travail extrêmement rigoureuses
décrites par Kwok et Higuchi permettent de minimiser les risques de faux
positifs (Higuchi., 1989). Par ailleurs, des problèmes
de reproductibilité pour un même échantillon d'une PCR
à l'autre ont été rapportés, surtout lorsqu'il
s'agit d'une séquence rare. Une PCR dite
« anémique » a aussi été
évoquée (Mullis et al., 1986). Il s'agit d'une
PCR au cours de laquelle la synthèse des séquences
spécifiques entre en compétition avec celle des produits non
spécifiques.
4-2-1-2. Méthodes indirectes ou
séro-immunologiques
Les tests sérologiques utilisent la
réponse immunitaire des animaux infectés qui élaborent des
anticorps selon les mêmes modalités que dans les infections
bactériennes ou virales. Les immunoglobulines M (Ig M) sont
précoces et correspondent à la première
parasitémie. Par contre les immunoglobulines G (Ig G) sont plus tardives
et persistent plusieurs mois en l'absence de traitement, et leur recherche est
le but des méthodes de diagnostic sérologiques. Ces techniques,
en dépit de leur manque de sensibilité et de
spécificité, constituent néanmoins un bon outil
épidémiologique pour l'évaluation de la présence
des trypanosomes dans une zone donnée.
4-2-1-2-1. Test d'agglutination
Il consiste à mettre en présence dans un
tube capillaire, le sérum suspect et une suspension de parasites
lysés, puis à observer les micro agglutinations à l'oeil
nu ou au microscope. Le diagnostic est réalisable sur le terrain, mais
l'antigène est très instable (Desquesnes, 2003).
Cette méthode est utilisée pour les infections à
T. brucei, il a donné de mauvais résultats avec
T. congolense et T. vivax (Itard;
1981).
Le test d'agglutination sur carte (CATT= Card
Agglutination Trypanosomiasis Test) est une variante du test d'agglutination
utilisant des parasites entiers et colorés. Il est initialement mis au
point pour le diagnostic de la maladie du sommeil chez l'homme (à
T. brucei gambiense). Ce test a été
adapté par la suite à la détection de T.
evansi (chez les ruminants et le porc), avec une sensibilité
comparable au test de fixation du complément (Bajyana Songa et
al., 1987). L'hémagglutination indirecte est une méthode
décrite par Gill (1971), c'est un test pratique pour des diagnostics
individuels, mais elle présente quelques inconvénients dont la
conservation des hématies tannées, et l'existence
fréquente de faux positifs.
4-2-1-2-2. Réaction de fixation du
complément
Initialement mise au point pour le diagnostic de la
dourine et du surra (Itard, 1981), la réaction de
fixation du complément a été adaptée aux autres
trypanosomes animaux comme T. congolense, T. brucei
et T. vivax. La technique est lourde, peu spécifique
d'espèce et donne parfois des réponses interspécifiques
(ou hétérologues) plus fortes que les réponses
intraspécifiques (ou homologues), notamment en cas d'infections
successives par les diverses espèces présentes en Afrique
(Staack et Lohding, 1979). En plus, la réaction de
fixation de complément ne permet pas de distinguer les infections dues
à T. equiperdum et à T.
evansi (Gardiner et Mahmoud, 1990). Pour toutes ces
raisons, la réaction de fixation du complément est de moins en
moins pratiquée sur le terrain pour le diagnostic des trypanosomes
(Desquesnes et al., 2001).
4-2-1-2-3. Test d'Immunofluorescence Indirect
(IFI)
La réaction d'immunofluorescence indirecte
très employée pour le diagnostic de la trypanosomose humaine,
s'est ajoutée plus récemment aux méthodes de diagnostic
des trypanosomoses animales. Le test d'immunofluorescence indirecte est
très intéressant pour les enquêtes épizootiologiques
de masse (en raison de sa commodité et sa rapidité
d'exécution), et la détection des cas chroniques ou des porteurs
asymptomatiques. On reproche à cette méthode, outre les
difficultés de lecture, sa faible sensibilité. Il est difficile
avec ce test de faire la différence entre les espèces de
trypanosomes, les titres antigéniques homologues n'étant pas
toujours nettement plus élevés que les antigènes
hétérologues, on constate en plus des réactions
croisées entre les différents trypanosomes des mammifères.
4-2-1-2-4. Test ELISA (Enzyme Linked Immuno Sorbent
Assay)
La méthode immuno-enzymatique de dosage des
anticorps ou ELISA a été adaptée et employée au
diagnostic de nombreuses maladies infectieuses et parasitaires. Dans le cas des
trypanosomoses animales, l'ELISA indirecte a apporté une grande
amélioration pour la sensibilité du diagnostic. Cette technique
consiste en une reconnaissance et une liaison entre les Ig G et les
antigènes. L'ELISA indirecte pour la détection des anticorps
dirigés contre les trypanosomes constitue un bon outil pour les
surveillances séro-épidémiologiques (Desquesnes,
1997). Les tests ELISA par détection d'antigènes,
à travers le récent développement des anticorps
monoclonaux (au détriment d'anticorps polyclonaux), ouvraient une
nouvelle voie pour un diagnostic sensible et spécifique des trypanosomes
africains. Mais ils n'ont pas abouti à des tests fiables. Seule l'ELISA
indirecte est donc largement utilisée pour les enquêtes
épidémiologiques.
Cependant, les tests immuno enzymatiques ne permettent
pas de faire la différence entre une infection parasitaire active et une
infection passée, à cause de la persistance des anticorps
plusieurs mois après le traitement (Geysen et al.,
2002). Ces tests sont aussi peu spécifiques et donnent parfois
des réactions faussement positives, en raison de très fortes
réactions croisées qui sont notées par exemple entre
antigènes de Trypanozoon et les anticorps dirigés contre
T. congolense et T. vivax (Desquesnes et
al., 1999).
4-2-2. Diagnostic chez le vecteur
4-2-2-1. Chez les insectes hématophages
vecteurs mécaniques
Le diagnostic de la présence de trypanosomes
chez les insectes hématophages peut être réalisé par
examen parasitologique. Cet examen s'est révélé
très peu spécifique et sensible (Hoare, 1972).
Un diagnostic plus spécifique et sensible peut être
réalisé par PCR sur les pièces buccales ou l'intestin des
taons (Solano et al., 1996).
L'étude de la transmission mécanique par
les insectes hématophages montre qu'ils transmettent les trypanosomes
immédiatement après leur contamination. Alors, seule la mise en
évidence de trypanosomes (ou d'ADN de trypanosomes) dans les
pièces buccales d'un insecte capturé au moment du changement
d'hôte indiquerait « insecte infectant » et
aurait une signification épidémiologique. En définitive,
le diagnostic de la présence de trypanosomes chez les insectes vecteurs
mécaniques présente un intérêt limité en
raison de la difficulté de capture des insectes et également du
coût élevé.
4-2-2-2. Chez les glossines
Le diagnostic parasitologique chez les glossines a
longtemps été réalisé par examen microscopique
(Desquesnes, 2003). La technique de salivation sur lame permet
d'identifier rapidement les mouches porteuses de trypanosomes salivaires. Elle
est facile à mettre en oeuvre, mais ne permet pas d'identifier
précisément l'espèce de trypanosomes en cause
(Itard, 2000). La dissection des organes où
s'effectuent la multiplication et la transformation des trypanosomes (intestin
moyen, glandes salivaires, proboscis) permet d'identifier les mouches
infestées et avec une bonne précision les espèces de
trypanosomes. La diagnose des trypanosomes sera effectuée en se basant
sur leur présence dans l'un ou l'autre des organes
disséqués. Ainsi les trypanosomes découverts uniquement au
niveau du proboscis sont du sous genre Duttonella (T.
vivax) ; s'ils sont trouvés dans l'intestin moyen et le
proboscis, ils appartiennent au sous genre Nannomonas (T.
congolense) et s'ils sont trouvés en plus dans les glandes
salivaires, ils sont du sous genre Trypanozoon (T.
brucei). Des trypanosomes trouvés uniquement dans l'intestin
moyen sont dits immatures, mais il peut aussi s'agir de
T.grayi ou T.varani respectivement parasite
du crocodile et du varan (Itard, 1981). On note cependant de
nombreuses exceptions telles que les infestations mixtes, les infestations
anciennes avec disparition des formes intestinales, les infestations
très récentes avec seulement des trypomastigotes intestinaux.
Le diagnostic parasitologique chez les glossines s'est
révélé peu spécifique d'espèce
(Lefrançois et al., 1998), il est alors
préférable de réaliser ces examens par PCR avec des
amorces spécifiques (Majiwa et al., 1994 ;
Solano et al. , 1996). En effet, les outils de la biologie
moléculaire ont apporté une caractérisation
spécifique et une sensibilité inégalables (Solano
et al., 1999). La dissection des mouches et leur analyse par PCR
permettent d'évaluer la situation épidémiologique dans
les régions où elles sont capturées
(Lefrançois et al., 1998). Des études
menées par Solano et al. (1995) en Côte d'ivoire
ont permis de caractériser par PCR les différentes espèces
et sous espèces de Nannomonas chez le vecteur Glossina
longipalpis ainsi que les infestations mixtes et immatures dont
l'identification était difficile, voire impossible avec les
méthodes parasitologiques.
5. Moyens de lutte
Devant l'importance socio-économique et
médicale des trypanosomoses animales, l'enjeu de la lutte contre ces
maladies est considérable. Les moyens de lutte s'articulent sur trois
éléments qui découlent de l'épizootiologie des
trypanosomoses, il s'agit des parasites, des hôtes mammifères et
des vecteurs. La chimiothérapie et la chimioprophylaxie, la lutte
antivectorielle et enfin l'élevage du bétail
trypanotolérant sont les composantes de la lutte contre ces
parasitoses.
5-1. Chimiothérapie et
chimioprophylaxie
5-1-1. Chimiothérapie
Ce traitement vise à détruire les
trypanosomes chez l'animal malade et de ce fait à réduire le
risque de propagation de la maladie à l'échelle du troupeau. Le
dépistage précoce de ces maladies se révèle alors
d'une importance fondamentale. Cette méthode repose sur l'emploi des
médicaments trypanocides. En médecine vétérinaire,
cinq familles chimiques différentes de médicaments trypanocides
sont utilisées de façon plus ou moins intensive (Itard,
2000). Ce sont la Suramine, la Mélarsamine, les sels de
Phénanthridine, l'Acéturate de Diminazène et les sels de
la Quinapyramine. Notons qu'en Afrique subsaharienne, le marché des
trypanocides est évalué à plus de 10 milliards de Fcfa
(Biaou et al., 2002). En Afrique de l'ouest les principaux
trypanocides utilisés chez les ruminants sont le
Bérénil® (Acéturate de diminazène) qui est
surtout curatif, le Trypamidium® (Chlorure d'isométamidium)
réputé trypanocide de « longue action » et
est préventif, et dans une moindre mesure le Vériben®, le
Véridium®, et autres.
Toutefois, mis à part le problème de
chimiorésistance, l'administration de ces produits chimiques qui se fait
par voie parentérale, est parfois à l'origine de troubles
généraux ou locaux de gravité et d'importance variables
selon le produit utilisé et l'état général de
l'animal.
En outre, dans la chimiothérapie des
trypanosomoses, on utilise en Afrique la phytothérapie, c'est à
dire l'utilisation de certaines plantes ayant des propriétés
trypanocides, c'est le cas par exemple de Cassia siberiana, mais
l'efficacité de ces médicaments n'est pas encore confirmée
du fait des travaux d'expérimentation en cours.
5-1-2. Chimioprophylaxie
A défaut d'une méthode de protection
faisant intervenir des phénomènes immunitaires (l'emploi des
vaccins), la chimioprophylaxie des trypanosomoses consiste à l'emploi
des médicaments trypanocides à activité préventive
en vue de la protection pendant une certaine durée des animaux
exposés à l'affection. La durée de protection varie
essentiellement en fonction de l'espèce animale à traiter, du
produit utilisé et de la dose à administrer.
Cependant, ces mesures de chimioprophylaxie
connaissent des limites surtout dans les conditions d'élevage africain
traditionnel. En effet, les traitements préventifs ont tendance en
général, à sélectionner des souches
résistantes du fait de leur élimination lente. Il est donc
très important, voire impératif de respecter l'intervalle entre
deux traitements et de faire suivre ces traitements, d'un traitement curatif
à l'aide d'un trypanocide d'une autre catégorie chimique
différente (on utilise à cet effet, le plus souvent
l'acétutrate de diminazène).
5-2. Lutte antivectorielle
Cette lutte est principalement destinée
à interrompre le cycle de transmission des trypanosomes. Elle se
justifie non seulement par le nombre d'espèces animales sensibles, mais
aussi par la présence et l'importance des populations de
réservoir sauvages ou domestiques souvent incontrôlables
(De La Rocque et Dia, 2001). En plus, l'existence de souches
de trypanosomes chimiorésistantes vis à vis des trypanocides
usuels a redonné à la lutte contre les vecteurs toute son
importance. Cette lutte est surtout dirigée contre les glossines qui en
sont les vecteurs majeurs.
Ainsi, outre les barrières d'isolement
(méthodes abandonnées pour leur nocivité sur
l'environnement) destinées à empêcher la réinvasion
par des glossines immigrantes des régions assainies, la lutte contre les
glossines se distingue en deux grandes catégories :
Ø La lutte indirecte, qui vise la modification du
milieu où vivent les glossines et à le rendre impropre à
leur survie. Cette lutte repose sur :
· l'action sur l'habitat de glossines à travers
l'éclaircissement forestier (appelé également prophylaxie
agronomique ou lutte écologique) ;
· l'action sur les hôtes nourriciers par
destruction du gibier, donc de supprimer les réservoirs de
trypanosomes.
Ces méthodes de lutte ne sont plus utilisées
à cause de leur inefficacité, de leurs inconvénients
multiples sur l'environnement et de leur coût élevé.
Ø La lutte directe, vise à détruire
directement l'insecte à l'aide de moyens:
· chimiques, par pulvérisation d'insecticides
(tels que le DDT autrefois utilisés, l'endosulfan, les
pyréthrinoides de synthèse) par voie terrestre ou
aérienne, l'imprégnation du pelage des animaux domestiques
hôtes par des insecticides ;
· mécaniques, par pose de pièges de capture
(comme le piège biconique de Challier et Laveissière, le
piège monoconique ou Vavoua de Challier et Laveissière, le
piège NZI de Mihok et le piège Tetra), par pose de pièges
et d'écrans imprégnés d'insecticides (fig. 11) ;
· biologiques, par l'utilisation des prédateurs et
des hyperparasites des glossines ;
· génétiques, par perturbation des
mécanismes physiologiques fondamentaux, en particulier celui de la
reproduction [on peut par exemple, introduire dans la population de glossines,
des individus mâles préalablement stérilisés par
l'action d'agents physiques (rayonnements gamma) ou chimiques, qui entreront en
compétition, pour l'accouplement avec les mâles normaux de
l'espèce correspondante].
5-3. Lutte par gestion des troupeaux
Il s'agit de l'élevage du bétail
trypanotolérant. Ce bétail est composé de certaines races
bovines d'Afrique occidentale qui sont aptes à vivre et à se
multiplier dans des régions infestées de glossines. Ce
phénomène de trypanotolérance s'observe chez les taurins
(Bos taurus taurus) avec comme exemple la race N'Dama, Kouri,
Baoulé, lagune, Somba, etc. ; et chez les petits ruminants de
petite taille. Cette méthode se heurte malheureusement à des
limites majeures, telles que le risque d'introduction des maladies contagieuses
(peste bovine, PPCB, etc.) ou de rendre sensibles aux souches locales de
trypanosomes les animaux transplantés. Mais, surtout c'est leur petite
taille et leur faible productivité qui freinent leur utilisation par les
éleveurs.
Dans les situations de très forte
« pression glossinienne », on peut préconiser la
gestion quotidienne des parcours pendant les moments où
l'activité des glossines est nulle où elles sont au repos, pour
éviter le contact entre hôtes et vecteurs (Dia,
2003).

Figure 11 : Pièges et
écrans pour la lutte contre les glossines (clichés :
M. Desquesnes)
Deuxième partie : Etude
expérimentale
Chapitre 1 :
Présentation du cadre d'étude
Nos travaux se sont déroulés au Centre
International de Recherche Développement sur l'Elevage en zone Subhumide
(CIRDES) de Bobo-Dioulasso. Bobo-Dioulasso est la deuxième ville du
Burkina Faso et est le chef lieu de la province de Houet située au sud
ouest du pays. Cette ville est dans la zone subhumide avec un climat de type
soudanien. On y trouve une végétation favorable au
développement des glossines qui sont les principaux vecteurs de la
trypanosomose animale.
Le CIRDES est une institution sous-régionale qui
compte six pays membres : le Bénin, le Burkina Faso, la Côte
d'ivoire, le Mali, le Niger et le Togo. Il a pour mandat de mener des
activités de recherche-développement pour améliorer la
santé des animaux domestiques et accroître leur
productivité, en vue de satisfaire aux besoins croissants des
populations, notamment en lait et en viande. Le centre s'investit à
atteindre ses objectifs en accordant une importance particulière aux
maladies à transmission vectorielle, à savoir la trypanosomose
animale et la cowdriose, à la conservation des ressources
génétiques animales, à la préservation de
l'environnement et enfin à la formation des cadres. Ces activités
se déroulent aux seins de trois unités de recherches et une
cellule de formation :
Ø l'unité de recherche sur la production animale
(URPAN) ;
Ø l'unité de recherche sur l'élevage et
l'environnement (UREEN) ;
Ø l'unité de recherche sur les bases biologiques
de la lutte intégrée
(URBIO) ;
Ø la cellule de communication et de formation
(CCFOR).
L'URBIO, unité héritière de
presque l'ensemble des activités du CRTA, constitue la pièce
maîtresse du centre. C'est au sein de cette unité que nous avons
entrepris nos travaux durant 9 mois, d'août 2004 en mai 2005.
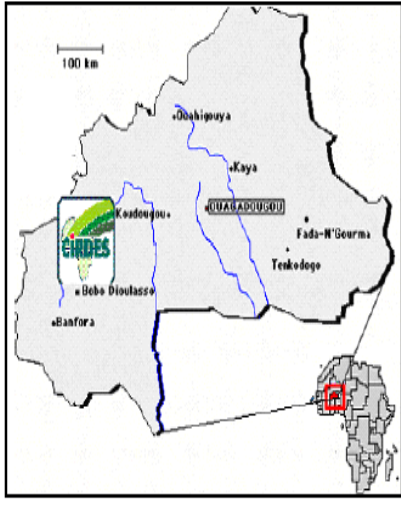
Figure 12 : Localisation du CIRDES
matérialisé par son logo sur la carte du Burkina
Faso
Chapitre 2 :
Matériel et Méthodes
1. Matériel
1-1. Matériel de laboratoire
Pour les besoin du diagnostic par PCR, le CIRDES est
équipé d'un laboratoire où l'on retrouve en plus des
autres salles, une salle de préparation du mélange
réactionnel, une salle d'amplification de l'ADN, une salle
d'électrophorèse et une salle de visualisation du gel. Le
matériel nécessaire à la PCR y est retrouvé :
· Des pipettes à volume variable (10 ul à
1000 ul), des pipettes multicanaux, des tubes eppendorf et des embouts
jetables ;
· un vortex et des microcentrifugeuses ;
· des balances, pH mètre, bain maries, et diverses
verreries de laboratoires ;
· des hottes aspirantes ;
· des thermocycleurs (M J Research Inc, PTC
200TM, M J Research Inc, PTC 500TM machine à
gradient Biometra® ) ;
· des cuves à électrophorèse et un
four micro-onde de 900 Watts micrologic® ;
· une caméra à lampe UV couplée
à un moniteur muni d'une imprimante.
Lors de la révélation par ELISA, l'on
dispose en plus des matériels ci dessus, des microplaques ELISA
(Maxisorp®), un incubateur et un spectrophotomètre (lecteur de
plaques ELISA) Labsystem Multiskan® MCC/340.
1-2. Matériel biologique
1-2-1. Souches de trypanosomes témoins (ADN
purifiés)
Pour la PCR, les témoins positifs sont
constitués des ADN purifiés des différentes souches de
trypanosomes pathogènes (T. vivax, T.
congolense type savane, T. congolense type
forêt et T. brucei) (annexe 1). Pour la mise au point
de la PCR ELISA, les tests de spécificité et de
sensibilité des sondes nucléiques sont d'abord
réalisés avec ces échantillons d'ADN de
référence.
1-2-2. Echantillons de terrain
1-2-2-1 Couche de globules blancs du sang des bovins
(Buffy Coat)
Sur le terrain, des prélèvements de sang
sont effectués chez les animaux suspectés de trypanosomose. Un
animal est suspect lorsque son hématocrite est inférieur ou
égal à 25 % ou lorsqu'il présente les signes cliniques. Le
sang est prélevé dans des tubes à hématocrite
héparinés. Après centrifugation différentielle
(Murray et al., 1977), le buffy coat est collecté dans
des tubes eppendorfTM (de 0,5 ml ou 1,5 ml) contenant 30 ul d'eau
distillée. Ces tubes portent une étiquette mentionnant le
numéro de l'animal et la date du prélèvement. Une fiche
indiquant les résultats de la parasitologie accompagne également
ces échantillons.
1-2-2-2. Organes de mouches
Les mouches sont capturées dans les zones
infestées de glossines, à l'aide de pièges monoconiques ou
biconiques. Au laboratoire, ces mouches sont disséquées sous
loupe binoculaire pour la récolte des organes qui sont le proboscis, les
glandes salivaires et l'intestin moyen. Ces organes sont introduits dans des
tubes eppendorfTM contenant 30 ul d'eau distillée pour les
proboscis et les glandes salivaires et 50 ul pour les intestins moyens. Ces
tubes sont bien étiquetés avec mention de la date, d'un
numéro et du nom de l'organe.
Au total, 425 échantillons de
terrain, dont 311 buffy coats de bovins et 114 organes de mouches (71
proboscis, 11 glandes salivaires et 32 intestins moyens) ont été
analysés en PCR classique et en PCR directe amplifiant les espaceurs
internes transcrits de l'ADNr. La mise au point de la PCR ELISA a
été faite avec d'une part des échantillons d'ADN de
référence et d'autre part avec des échantillons de terrain
positifs à la PCR utilisant le couple d'amorces Tryp 4R et Tryp 4S.
1-2-2-3. Fragment cible : les ITS des
trypanosomes
Dans la PCR multispécifique, les segments
à amplifier sont les espaceurs internes transcrits (Internal Transcribed
Spacer : ITS) de l'ADN ribosomal (ADNr) des trypanosomes. L'ADN ribosomal
est une séquence d'ADN codant pour l'ARN ribosomal (qui
représente 80 % de l'ARN) et les segments de l'ADN séparant les
différents gènes d'ADN ribosomaux. C'est
généralement un locus étendu et complexe composé
d'un grand nombre d'unités de répétition
séparées l'une de l'autre par un espaceur interne transcrit. Chez
les Kinetoplastidae en général et en particulier chez
les trypanosomes, l'unité de transcription de l'ADNr est composée
à gauche des gènes 18S et à droite des gènes 28S
avec au milieu l'ITS1 et l'ITS2 séparés par le gène 5.8S
(absent chez les procaryotes) .
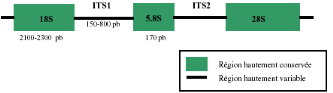
Figure 13 : Schéma d'une
unité de transcription de l'ADNr
La particularité de cette portion du
génome tient à la haute conservation des gènes 18S et 5.8S
parmi les Kinetoplastidae et à la stabilité intra
spécifique de l'ITS1. Les ITS sont alors des régions transcrites
non codantes séparant les composantes individuelles des unités
d'ADN ribosomaux. Ils sont spécifiques d'une espèce de
trypanosome et présentent une forte variabilité
interspécifique. A partir d'un unique couple d'amorces, les ITS1
seront amplifiés et la taille des produits obtenus permettra de
distinguer les différentes espèces de trypanosomes (fig. 14)
(Desquesnes et al., 2001).
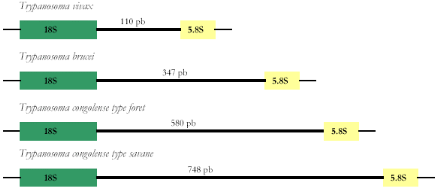
Figure 14 : Schémas des ITS1 des
principaux trypanosomes pathogènes
1-3. Réactifs et solutions de
travail
1-3-1. Pour la PCR directe
1-3-1-1. Nucléotides (dNTP)
Ce sont les quatre désoxynucléotides
triphosphate (dATP, dCTP, dGTP, dTTP). Ils sont en large excès molaire
dans le mélange réactionnel ou <<master mix>>. Ils
sont disponibles de manière individuelle à une concentration de
200 uM. La reconstitution des dNTP pour avoir la solution de travail, se fait
en prenant 90 ul d'eau distillée auxquels on ajoute 2,5 ul de chacun des
4 nucléotides.
1-3-1-2. Oligonucléotides (amorces)
Certaines indications président au choix du
couple d'amorces pour la réaction PCR. Ainsi, les amorces doivent
être rigoureusement spécifiques à la séquence d'ADN
encadrant la région cible à amplifier. Les amorces ne doivent ni
s'hybrider entre elles, ni s'autohybrider, d'où l'importance de la
vérification des amorces pour leur complémentarité. La
longueur d'une amorce doit être comprise entre 18 et 30
nucléotides et la composition en bases GC entre 45 et 60 %. Les amorces
composant un couple doivent avoir des températures de fusion (Tm)
voisines ou égales et leur taille doit être égale ou
voisine avec à peu près le même pourcentage GC.
Pour la PCR monospécifique, des amorces ont
été dessinées (Masiga et al., 1992) pour
les principales espèces de trypanosomes pathogènes du
bétail. Nous avons utilisé lors de nos travaux les couples
d'amorces inscrits au tableau de l'annexe 2.
L'amplification des ITS des trypanosomes par PCR, est
faite à l'aide du couple d'amorces Tryp 4R (Reverse) et Tryp 4S (Sens)
(Annexe 3). Ces amorces présentent les caractéristiques de
s'hybrider avec une homologie de 100% à l'ADN des trypanosomes
pathogènes du bétail (Desquesnes et al. 2001).
Les séquences des amorces choisies sont
envoyées à un laboratoire (Eurogentec) chargé de les
synthétiser. Elles sont livrées sous forme lyophilisée
avec des références comme la Tm, la quantité, le nombre de
moles, la densité optique (DO). Ces amorces sont reconstituées
pour avoir une solution de stock (à 500 uM), à partir de laquelle
on réalise une dilution avec du Tris EDTA pour obtenir une solution de
travail à 200 uM.
1-3-1-3. Tampon de la PCR
Le tampon habituellement utilisé est une
solution commerciale (PCR Buffer, Quiagen®) composée de Tris
à 10 mM, 1,5 mM de MgCl2 et 50 mM de KCl. Il constitue le
1/10e du volume individuel final pour chaque réaction.
Le Tris sert à tamponner le milieu
réactionnel au niveau optimal pour l'activité de la Taq
polymérase. L'ion Mg2+ est un cofacteur essentiel de la Taq
polymérase. Ce cation bivalent interagit également avec les
charges négatives de la chaîne d'ADN, limitant ainsi les forces de
répulsion entre brin d'ADN et favorisant donc la stabilité de
l'hybridation. Plus la concentration en MgCl2 est importante, plus
l'hybridation est facilitée que celle ci soit spécifique ou non.
Une trop forte concentration peut alors conduire à une augmentation des
signaux non spécifiques. Enfin les ions K+ sont
également des cations monovalents capables d'interagir avec les liaisons
hydrogène de l'ADN. Cette interaction va
« piéger » les liaisons H2 faibles
présentes dans les zones de mésappariements et ainsi
défavoriser les hybridations non spécifiques.
1-3-1-4. Taq polymérase
On utilisait autrefois le fragment Klenow de l'ADN
polymérase I d'E. coli pour la réaction PCR. Mais cette
enzyme présente un inconvénient majeur du fait qu'on doit la
renouveler à chaque cycle d'amplification (l'enzyme étant
détruite à haute température lors de la
dénaturation). De nos jours, on utilise la Taq polymérase qui est
une enzyme provenant d'une bactérie thermophile : Thermus
aquaticus. La Taq polymérase présente en effet l'avantage de
faire plusieurs cycles d'amplification à la fois. Le tampon et la Taq
polymérase (à 5 U/ ul) proviennent du même fournisseur qui
est Quiagen®.
1-3-1-5. Diméthylsulfoxyde (DMSO)
Le DMSO aide à dépelotonner l'ADN et
à le rendre ainsi plus accessible aux amorces. Il n'est pas
utilisé dans le protocole d'amplification des ADN satellites des
trypanosomes. Par contre le DMSO à 5% s'avère nécessaire
au protocole de PCR sur les ITS des trypanosomes. D'après des
comparaisons faites entre le protocole ITS avec le DMSO et celui
dépourvu de ce dernier et sans modifier les autres paramètres, il
en ressort que les meilleurs résultats avec une sensibilité plus
élevée ont été obtenus avec le protocole pourvu du
DMSO à 5% du volume du mélange réactionnel
(Guèye, 2003).
1-3-2. Pour la révélation par ELISA
1-3-2-1. dNTP et Digoxigénine
Pour la PCR-ELISA, les dNTP sont marqués avec
de la digoxigénine, sous forme de Digoxigénine-11-2'
desoxyuridine-5' Triphosphate (DIG-dUTP) qui est incorporé aux
dNTP. Il s'agit d'un mélange de dNTP connu sous le nom de DIG-labeling
mix, qui contient le dATP, le dCTP, le dGTP à une molarité de 2
mM ; le dTTP mélangé au DIG-dUTP avec respectivement 1,9 mM
et 0,1mM. Ces dNTP sont dilués dans un tampon identique à celui
de la PCR classique.
1-3-2-2. Anticorps anti-digoxigénine
conjugués à la peroxydase
(Anti-Dig-Pod)
La détection des produits PCR contenant les
dNTP marqués à la digoxigénine se fait à l'aide des
anticorps anti-digoxigénine conjugués à la peroxydase
connus sous l'appellation d'anti-DIG-POD. La révélation de cette
réaction digoxigénine-anti-DIG-POD se fait par l'ajout d'un
substrat chromogène [ABTS® ou TMB substrate péroxydase +
Péroxidase Solution B (H2O2)], qui donne une
coloration verte pour un échantillon positif.
Ces anticorps sous forme lyophilisée sont
d'abord reconstitués dans 250ul d'eau distillée dans un tube.
Cette solution, sans être agitée, est laissée à la
température ambiante pendant 15 minutes, puis diluée au
1/100e avec le tampon de dilution du conjugué.
1-3-2-3. Sondes marquées à la biotine et
solution d'hybridation
Pour la mise au point de la PCR-ELISA, des sondes ont
été dessinées à partir des ITS des principaux
trypanosomes pathogènes du bétail (T. vivax,
T. congolense type savane, T. congolense
type forêt, et T. brucei). Des travaux
antérieurs sur la recherche des sondes ont été
réalisés au CIRDES. Le support de travail pour dessiner les
sondes est le logiciel bioinformatique (DNAsis) correspondant à
l'alignement (en utilisant le BLAST1(*)) des échantillons d'une espèce et de la
séquence disponible dans la banque de donnée Genbank. Comme pour
les amorces, plusieurs conditions sont à respecter lors du choix des
sondes :
d'abord le dessin des sondes doit se faire à
l'intérieur des zones intra taxon ;
la sonde ne doit pas s'autohybrider, c'est à dire
que les trois bases à l'extrémité 3' ne doivent pas
s'hybrider sur une autre partie de la sonde ;
les bases extrêmes ne doivent pas être
complémentaires, en raison d'un appariement possible ;
les ITS étant des séquences polymorphes, on
y trouve de nombreux microsatellites (par exemple CACACA) et des
séquences répétées (comme CCCCC), lors de
l'élaboration des sondes, ces zones sont à éviter à
cause de leur capacité d'hybridation non spécifique. Autrement
dit, la différence d'une séquence à l'autre, peut
être d'une répétition et cela engendre une mauvaise
hybridation ;
le pourcentage GC1(*) doit être supérieur à 60 %, afin
d'assurer une hybridation plus stable ;
l'homologie entre la sonde spécifique d'une
espèce et les ITS des autres espèces doit être
inférieure à 80 % ;
la taille des sondes doit être comprise entre 20 et
30 bases.
enfin, un dernier contrôle qui consiste à
l'alignement des 7 bases en position 3' de la sonde d'une espèce
donnée avec les différents ITS d'autres espèces a
été réalisé à l'aide toujours du logiciel
DNAsis. Les sondes présentant un alignement incomplet ou
présentant un alignement total mais dont l'homologie ne se prolonge pas,
sont retenues candidates pour le test ELISA.
Ainsi, pour les 4 espèces de trypanosomes
pathogènes, 3 sondes par espèce ont été choisies,
il s'agit des sondes STV1, STV2, STV3 pour T. vivax ; STCS1,
STCS2, STCS3 pour T. congolense type savane ; STCF1,
STCF2, STCF3 pour T. congolense type forêt ; et
STB1, STB2, STB3 pour T. brucei (Annexe 4). Ces sondes
marquées à la biotine en position 5' ont été
synthétisées par la société PROLIGO Primers &
Probes.
La solution d'hybridation pour une sonde donnée
se prépare à partir du tampon d'hybridation et de la sonde
marquée à la biotine à une concentration de 7,5 pmol / ml.
Le tampon d'hybridation utilisé (Masaké et al.,
2002) est composé de : 6 x SSPE (Saline Sodium
Phosphate-EDTA) avec 0,9 M Nacl, 60 mM
NaH2PO4.H2O, 6 mM EDTA ; 5 x
Denhardt'solution (1 g / l de chacun des produits suivants : ficoll,
polyvinyle pyrolidone et sérum d'albumine bovin ); 0,1% de
N-Lauroyl sarcosine (Sodium sarcosine) ; 0,02% de SDS (Sodium Dodecyl
Sulfate).
1-3-2-4. Streptavidine
La streptavidine est une protéine de poids
moléculaire d'environ 60000 Kd, isolée à partir d'une
bactérie appelée Streptomyces avidini. Elle a une haute
affinité pour la biotine. C'est cette interaction streptavidine /
biotine qui est mise à profit pour la fixation des produits PCR dans les
plaques ELISA.
1-3-2-5. Solution de lavage et tampon de
blocage
La solution de lavage est composée d'un tampon
PBS avec 1 ml de Tween-20 par litre de tampon. Le tampon de blocage est aussi
composé de PBS-Tween-20 à 0,5 % et du BSA à 0,2 %. Le pH
des tampons doit être vérifié et corrigé au besoin
avant leur utilisation.
2. Méthodes
2-1. Préparation des
échantillons
La préparation des échantillons est une
étape préalable au bon déroulement de la réaction
PCR, elle conditionne très souvent la sensibilité de cette
réaction.
2-1-1. Echantillons d'ADN purifiés
On procède d'abord à la culture des
trypanosomes sur des hôtes mammifères sensibles. Sont
habituellement utilisées des souris irradiées pour fragiliser
leur système immunitaire et favoriser ainsi la multiplication rapide des
parasites. Les prélèvements de sang s'effectuent à
parasitémie très élevée. Le sang
récolté est mélangé avec un tampon PSG (Phosphate
Sodium Glucose), puis filtré sur une mini-colonne de DEAE-cellulose
(Lahan et Godfrey, 1970). Le DEAE-cellulose ne laisse passer
que les trypanosomes qui sont ensuite concentrés par centrifugation.
Puis, les parasites sont lysés par congélation et traités
au chelex-100. Enfin, pour confirmer l'espèce, on teste ces
échantillons avec des amorces monospécifiques.
2-1-2. Traitement au chelex-100®
Dans notre protocole de PCR, il n'y a pas d'extraction
d'ADN à partir des échantillons de terrain. Les
échantillons sont traités au chelex-100 à 5 %. Le
rôle du chelex est ici de fixer les inhibiteurs de la PCR, en effet, les
billes de chelex entraînent au fond du tube des éléments
nuisibles à la réaction d'amplification.
Le traitement consiste à triturer d'abord
soigneusement les échantillons, puis à introduire dans les tubes
les mêmes volumes respectifs (30 ul) de chelex-100 à 5 %. Ces
tubes sont agités avec le vortex, avant d'être chauffés
à l'aide d'une plaque chauffante à 56°C pendant une heure et
à 94°C durant 30 minutes. Les échantillons, une fois
refroidis à 4°C sont conservés à -20°C
jusqu'à leur utilisation en PCR.
2-2. Principe de la PCR
La PCR permet d'amplifier par une réaction
enzymatique répétée, un fragment cible d'ADN balisé
par un couple d'amorces, une pour chaque brin. Cette réaction repose
donc sur les propriétés de l'ADN polymérase favorisant
l'extension de nouveaux brins d'ADN formés. Le procédé
nécessite la succession de nombreux cycles avec 3 étapes, chacune
se déroulant pendant un certain temps (en général
très court) et à une température bien précise. Les
3 étapes sont :
Ø la dénaturation de l'ADN par ouverture de sa
double hélice, l'ADN se trouve alors sous forme de simples brins
(à environ 94°C) ;
Ø l'hybridation des amorces sur l'ADN simple brin (de
part et d'autre du fragment cible), l'une avec une séquence
située en 3' sur un brin, l'autre avec une séquence
également située en 3' sur l'autre brin (à environ
55°C) ;
Ø l'élongation au cour de laquelle, la Taq
polymérase catalyse (à environ 72°C) à partir de
chaque amorce la synthèse d'un brin d'ADN (dans le sens 5'?3') en
respectant la complémentarité des bases.
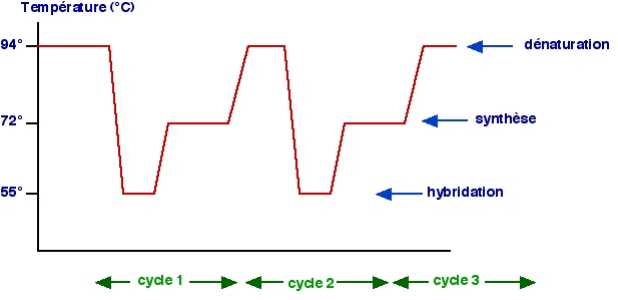
Figure
15 : Les étapes de la PCR et cycles thermiques
2-3. Protocole de PCR classique
2-3-1. Réalisation du mélange
réactionnel
Le mélange des différents
réactifs de la PCR est appelé « master mix »
ou mélange réactionnel, à ce mélange est
ajouté l'échantillon à tester. Le volume des
différents constituants le mélange réactionnel
dépend du nombre de réactions à effectuer. En PCR
classique, un volume final de 10 ul de mélange réactionnel est
reparti dans des tubes eppendorf de 0,2 ml, on y ajoute 1ul de
l'échantillon à amplifier. La concentration et le volume
individuel des différents réactifs sont inscrits dans le tableau
de l'annexe 5. Le volume total d'un réactif donné est obtenu en
multipliant son volume individuel par le nombre de réactions. Pour
palier l'incertitude sur le pipetage, on prépare une quantité de
mix légèrement supérieure au nombre de réactions.
Il est utile de rappeler que la Taq polymérase est ajoutée en
dernière position (juste avant de distribuer le mélange
réactionnel), en outre, une fois le mélange
réalisé, les tubes sont brièvement agités avec le
vortex.
2-3-1. Programme d'amplification
L'amplification se fait l'aide d'une machine
appelée « Thermocycleur » programmable à
différentes températures. Le protocole de la PCR classique
utilise le thermocycleur MJ Research Inc, PTC 200TM (qui peut
contenir les tubes eppendorf de 0,2 ml). Le programme d'amplification
initialement dénommé « programme Diag »,
conformément aux étapes de la PCR est composé : d'une
étape de préchauffage à 94°C pendant 30
secondes ; suivie d'un cycle composé d'une étape de
dénaturation à 94°C pendant 30 secondes, une phase
d'hybridation à 55°C pendant un minute et une phase
d'élongation à 72°C pendant une minute. Ce cycle est
répété 30 fois et se termine par une élongation
finale à 72°C pendant 10 minutes et une phase de
réfrigération à 4°C.
Dans l'objectif de réduire les hybridations non
spécifiques, une optimisation de ce programme a été
réalisée sur la base de la température d'hybridation des
amorces qui sont spécifiques d'espèce. En faisant la moyenne de
la température de fusion des 2 amorces, des programmes d'amplification
propres à chaque espèce ont été conçus pour
les principaux trypanosomes pathogènes du bétail
fréquemment rencontrés. Il s'agit des programmes
« NRP» pour T. brucei,
« TV » pour T. vivax, et
« TCS » pour T. congolense type savane
(Tableau I).
Tableau I : Programmes d'amplification
de la PCR monospécifique
|
Programmes
|
TV
|
NRP
|
TCS
|
|
|
Etapes
|
|
|
|
|
Préchauffage
|
94°C, 30 secondes
|
94°C
3 minutes
|
|
Dénaturation
|
94°C, 30 secondes
|
X 30
|
|
Hybridation
|
63°C
30 secondes
|
64°C
30 secondes
|
57°C
30 secondes
|
|
Elongation
|
72°C, 30 secondes
|
|
Elongation finale
|
72°C, 5 minutes
|
|
|
Réfrigération
|
4°C
|
2-3-1. Electrophorèse et visualisation des
produits PCR
Les produits PCR obtenus, sont migrés sur un
gel d'agarose 1,5 %. On pèse 1,875 g d'agarose qui est dissout dans 125
ml de tampon TBE (Tris Borate-EDTA), puis chauffé pendant 2 minutes dans
un four micro-onde. On laisse refroidir et on y ajoute 2,5 ul (10 mg / ml) de
BET (Bromure d'Ethidium). Le mélange est coulé pour
polymériser dans une cuve sur laquelle sont placés des peignes,
dont les empreintes sur le gel constitueront les puits de dépôt
des échantillons. Un ul de tampon de charge2(*) (Loading buffer) est
mélangé à 10 ul de produits PCR et déposé
dans un puits du gel. De part et d'autre du gel, on dépose 3ul de
marqueur de poids SL 1003(*)
(Step Ladder 100, promega®) dont la taille des fragments d'ADN croit de100
à 100 bases et va jusqu'à 2000 bases. La migration se fait dans
une cuve remplie de TBE (on y rajoute après le dépôt du
BET), à 120 V pendant une heure. La visualisation des produits PCR se
fait sous lampe UV reliée à un dispositif photographique en
liaison avec un ordinateur permettant de sauvegarder l'image sur disquette.
2-4. Protocole de PCR-ITS avec les amorces Tryp 4R et
Tryp 4S
2-4-1. Réalisation du mélange
réactionnel
Comme pour la PCR classique, le volume final des
différents réactifs du master mix dépend du nombre de
réactions à effectuer. Par contre, dans le protocole de PCR-ITS,
un volume de 11 ul de mélange réactionnel est reparti dans des
tubes de 0,5 ml. Le master mix ajouté à un volume de 3 ul
d'échantillon, constitue le mélange réactionnel prêt
pour l'amplification, soit donc un volume final de 14 ul. En plus, à la
différence de la PCR monospécifique, ici on met dans le
mélange réactionnel, le DMSO à 5% du volume total, le
contrôle positif est constitué de 1 ul d'ADN associé au
master mix. Afin d'optimiser les résultats de l'amplification, certains
paramètres ont été variés. Ainsi, une concentration
de 0,3 uM pour chacune des 2 amorces et une concentration de 0,4 UI / 10 ul
pour la Taq polymérase ont donné les meilleurs résultats
(Annexe 6).
2-4-1. Programme d'amplification
Pour l'amplification des ITS, c'est le thermocycleur
MJ Research Inc, PTC 500TM pouvant contenir les tubes de 0,5 ml qui
est utilisé. Le programme d'amplification auparavant mis en oeuvre est
le programme T50. Ce dernier comporte une étape de préchauffage
à 94°C pendant 2 minutes, un cycle composé d'une
étape de dénaturation à 94°C durant 20 secondes,
d'une étape d'hybridation des amorces à 50°C pendant 45
secondes, suivie d'une étape d'extension se déroulant à
72°C pendant 30 secondes. On effectue 38 cycles au bout desquels il y a
une élongation finale à 72°C pendant 2 minutes et enfin une
phase de réfrigération à 4°C.
Dans le but d'améliorer la sensibilité,
mais aussi et surtout la spécificité de la réaction PCR
avec les amorces Tryp 4R et Tryp 4S, l'optimisation du programme
d'amplification a conduit à une variation en gradient de la
température d'hybridation. Ainsi le programme intitulé
T4RS a été finalement retenu et appliqué
aux amorces Tryp 4R et Tryp 4S. Ce programme est composé d'abord d'une
étape de préchauffage à 94°C pendant 2 minutes et de
40 cycles. Un cycle d'amplification comprend une étape de
dénaturation à 94°C pendant 30 secondes, suivie d'une
étape d'hybridation (à température variable) qui dure 45
secondes, puis une étape d'élongation à 72°C pendant
30 secondes. Les températures d'hybridation vont de 42°C à
50°C et croissent de 2 à 2°C, le nombre de cycles augmente
avec l'augmentation de la température d'hybridation. On a pour 42°C
et 44°C 2 cycles d'amplification, 6 cycles pour 46°C, 8 cycles avec
une température d'hybridation de 48°C et enfin 22 cycles pour
50°C. A la fin des 40 cycles on a une étape d'élongation
finale (à 72°C pendant 2 minutes) précédant une phase
de réfrigération à 4°C.
2-4-1. Electrophorèse, visualisation et
interprétation des produits PCR
Les produits PCR obtenus à la suite de
l'amplification avec les amorces Tryp 4R et Tryp 4S sont migrés sur un
gel d'agarose selon un processus analogue à celui de la PCR classique.
Il existe néanmoins quelques différences, le gel d'agarose est
dans ce cas de 2%. On pèse donc 2,5 g d'agarose dissout comme pour la
PCR monospécifique dans 125 ml de tampon TBE. La migration par
électrophorèse, se fait aussi à 120V, mais avec une
durée un peu plus longue qui est en moyenne d'une heure 30 minutes. La
visualisation des produits d'amplification sur gel d'agarose est identique
à tous les protocoles de PCR.
L'interprétation des résultats est
rendue possible par le marqueur de poids SL 100 déposé aux deux
extrémités du gel. Les tailles des produits PCR avec les amorces
Tryp 4R et Tryp 4S des principaux trypanosomes pathogènes du
bétail sont au préalable connues (voir annexe 3). En effet, le SL
100 permet non seulement de connaître et ou de confirmer la taille des
produits PCR, mais aussi d'identifier les témoins positifs (ADN des
différentes espèces). Le résultat positif d'un
échantillon donné se traduit par l'apparition d'une bande ou d'un
signal au même niveau que le témoin positif d'une espèce
donnée. On aura donc selon les cas une ou plusieurs bandes apparaissant
à différents niveaux.
2-5. PCR ELISA
2-5-1. Principe et méthodes
La PCR-ELISA est une méthode d'amplification d'une
séquence d'ADN cible qui repose sur les mêmes principes de la PCR,
mais utilisant pour sa révélation l'hybridation d'une sonde d'ADN
couplée à une réaction enzymatique. Le principe
général du marquage (ici non radioactif) se fonde sur la fixation
d'une molécule marqueur sur l'ADN sonde selon des modalités
proches de celles utilisées pour le marquage immuno-enzymatique
(Kodjo et al., 1993). Deux méthodes sont habituellement
utilisées pour les analyses de PCR-ELISA.
Ø Dans la première méthode, les produits
d'amplification obtenus avec des amorces marquées à la biotine,
sont directement fixés au fond de la microplaque préalablement
sensibilisée à la streptavidine. Puis les produits PCR sont
hybridés par une sonde spécifique marquée à la
digoxigénine ou à la fluorescéine. La présence de
cette sonde est ensuite détectée par des anticorps
anti-digoxigénine ou anti-fluorescéine, conjugués à
l'enzyme d'un chromogène telle que la peroxydase ou la phosphatase
alcaline. Après l'ajout du substrat (peroxyde pour la peroxydase et
NADPH pour la phosphatase alcaline), il apparaît une coloration
caractéristique pour les échantillons positifs.
Ø La deuxième méthode utilisée
dans la présente étude, consiste à hybrider les produits
PCR marqués à la digoxigénine avec une sonde d'ADN
spécifique (à l'ITS d'une espèce de trypanosome)
marquée à la biotine et se trouvant fixée au fond d'une
microplaque sensibilisée à la streptavidine. La
révélation des produits PCR se fait à l'aide d'anticorps
anti-digoxigénine conjugués à la peroxydase, après
l'ajout du substrat (ABTS® ou TMB peroxydase+ H2O2).
Cette méthode fait intervenir quatre étapes principales :
1). La première étape
consiste au marquage des produits PCR avec la digoxigénine pendant la
réaction d'amplification.
2). Dans la deuxième étape, les
produits PCR sont dénaturés et hybridés avec une sonde
spécifique marquée à la biotine. La sonde fixe
spécifiquement une séquence interne de l'ADN cible.
3). A la 3ème étape,
l'ensemble sonde spécifique marquée à la biotine
hybridée avec la séquence cible d'ADN, est immobilisé dans
une microplaque sensibilisée à la streptavidine.
4). Enfin à la quatrième
étape, les produits PCR marqués à la digoxigénine,
hybridés et immobilisés dans la microplaque, sont
détectés grâce à des anticorps
anti-digoxigénine conjugués à la peroxydase
(Anti-DIG-POD). La révélation se fait par l'ajout du substrat
(ABTS® ou TMB peroxydase+H2O2). La
lecture des microplaques se fait à 450 nm au
spectrophotomètre.
vert
Digoxigénine (DIG-DUTP)
Sonde marquée à la biotine
Anticorps anti-digoxigénine (Anti-DIG-POD)
Microplaque sensibilisée à la streptavidine
Figure 16 : Symboles
utilisés pour expliquer le principe de la PCR-ELISA
2-5-2. Protocole de PCR-ELISA
La détection des trypanosomes dans les
échantillons biologiques (ADN et échantillons de terrain) par
PCR-ELISA s'effectue suivant une méthode qui comporte les étapes
suivantes : la réalisation du mélange réactionnel,
l'amplification de ce mélange, et enfin la révélation par
ELISA des produits PCR hybridés avec les sondes. Afin de vérifier
la taille attendue des produits PCR, la révélation par ELISA est
précédée d'une détection des produits
d'amplification sur gel électrophorétique. Cette étape est
facultative dans le protocole de la PCR ELISA, elle n'est utilisée que
pendant la phase expérimentale.
2-5-2-1. Réalisation du mélange
réactionnel
A la différence de la PCR directe, le
mélange réactionnel de la PCR-ELISA contient des dNTP
marqués avec de la digoxigénine sous forme de
2'-desoyuridine-5'triphosphate (DIG-dUTP). Les dTTP et les DIG-dUTP sont
mélangés dans des proportions 19 / 1, avec 1,9 mM pour les dTTP
et 0,1 mM pour les DIG-dUTP. Les dATP, dCTP et dGTP gardent la même
molarité (0,2 mM) comme dans les autres protocoles de PCR.
2-5-2-2. Programme d'amplification
Les tubes contenant le mélange (master mix et
échantillon) sont agités brièvement avec le vortex, puis
placés dans le thermocycleur (MJ Research Inc, PTC 500™).
L'amplification se fait selon le programme T4RS décrit plus haut (cf.
programme d'amplification pour la PCR-ITS).
2-5-2-3. Détection des produits PCR sur gel
d'agarose
C'est une étape qui n'est pas indispensable
dans le protocole de la PCR ELISA, mais elle est nécessaire, car elle
permet de vérifier la taille attendue des produits d'amplification, elle
permet en plus de détecter les éventuelles contaminations
susceptibles d'interférer avec la révélation ELISA.
L'électrophorèse est réalisée avec un gel d'agarose
à 2 % dans les mêmes conditions décrites pour la PCR
directe.
2-5-2-4. Révélation des produits
d'amplification par ELISA
La détection des produits PCR marqués
à la digoxigénine et hybridés avec les sondes se
déroule suivant un protocole analogue à celui de la technique
ELISA. Pour chaque échantillon à tester, on prévoit deux
puits de la microplaque Maxisorp® sensibilisée à la
streptavidine. Les étapes de cette opération sont décrites
au niveau de l'annexe 8.
2-5-3. Choix des sondes
Dans un premier temps, on vérifie la
capacité d'hybridation des sondes en testant 3 sondes d'une
espèce donnée avec l'ADN de cette même espèce. Puis
cette hybridation est effectuée avec un ensemble d'échantillons
constitués d'ADN, de buffy coat et d'organes de mouches testés
positifs à l'espèce correspondante aux 3 sondes. On
réalise deux fois ces tests à l'issue desquels, les sondes
présentant les meilleurs résultats sont choisies pour la suite
des travaux. Les résultats doivent se traduire par une bonne
sensibilité, c'est-à-dire le maximum d'échantillons
révélés positifs, mais également des
densités optiques relativement élevées à la lecture
au spectrophotomètre. A l'issue de ces premiers essais les sondes STV2,
STCS1 et STCS2, STCF1 et STB2 ont été retenues pour
respectivement T. vivax, T. congolense type
savane, T. congolense type forêt et T.
brucei.
2-5-4. Evaluation des sondes
Avant l'utilisation des sondes retenues candidates
pour le test ELISA, il convient de vérifier une fois encore leur
efficacité. Il s'agit de procéder au contrôle de la
spécificité et de la sensibilité des sondes sur des ADN
purifiés et sur des échantillons de terrain.
On réalise une PCR plurispécifique
(utilisant le couple d'amorces Tryp 4R et Tryp 4S) amplifiant au total 10
échantillons d'ADN purifiés des principales espèces de
trypanosomes pathogènes (4 ADN pour T. vivax, 4 pour
T. congolense type savane, 1 pour T.
congolense type forêt et 1 pour T. brucei).
Les produits d'amplification sont hybridés avec toutes les sondes
choisies et révélés par la technique ELISA. Ce test est
ensuite effectué sur des prélèvements sanguins de bovins
et des organes de mouches testés positifs (pour chacune des
espèces de trypanosomes) à la PCR utilisant les amorces Tryp 4R
et Tryp 4S.
Le signal à la révélation ELISA
ne doit être positif que lorsque la sonde correspond à l'ADN de
l'espèce pour laquelle elle a été dessinée ou
à l'échantillon de terrain infecté par cette
espèce. La sensibilité de la sonde est appréciée en
fonction du nombre d'échantillons détectés positifs par la
technique ELISA et aussi en fonction de la valeur de la densité optique.
2-5-5. Optimisation de la technique
Dans le but d'améliorer la
spécificité, mais aussi la sensibilité du test ELISA,
certains paramètres, dont entre autre la température
d'hybridation et le volume des produits d'amplification ont été
variés.
La température optimale d'hybridation varie en
fonction de la température de fusion (Tm), qui elle-même varie en
fonction de la sonde. La température d'hybridation optimale doit
être inférieure à au moins 5 à 10°C de la Tm.
En dessous de ces valeurs, on observe fréquemment des hybridations non
spécifiques qui sont à l'origine des faux positifs à la
révélation ELISA. A l'étape d'hybridation du protocole de
révélation des produits PCR, nous avons appliqué des
températures allant de 37 à 63°C en fonction de
l'espèce de trypanosome à détecter.
Tableau II : Températures
d'hybridation des sondes utilisées pour la PCR ELISA
|
Sondes
|
Espèces
|
Tm
|
Température d'hybridation
|
|
STB2
|
T. brucei
|
62°C
|
52°C à 57°C
|
|
STCF1
|
T. congolense type forêt
|
|
STCS1
|
T. congolense type savane
|
66°C
|
56°C à 61°C
|
|
STCS2
|
|
STV2
|
T. vivax
|
73°C
|
63°C à 68°C
|
NB : Les meilleurs
résultats ont été obtenus avec une température de
60°C retenue pour toutes les sondes.
Par ailleurs, le volume des produits PCR s'est
avéré comme un paramètre déterminant la
sensibilité de la technique de révélation ELISA. Ainsi,
pour T. vivax le volume des amplifiats est passé de 5
à 7 ul, pour les autres taxons de trypanosomes le volume reste
égal à 5 ul. Enfin, la fixation de la sonde marquée
à la biotine (avec le tampon d'hybridation porté à une
température de 60°C) dans la plaque avant d'y rajouter le
mélange produit PCR / NaOH a considérablement
amélioré les résultats du test.
Chapitre 3 :
Résultats et discussion
1. Résultats
1-1. Méthodes parasitologiques
Pour les techniques parasitologiques, nous ne
disposons que des résultats des prélèvements sanguins de
bovins (buffy coat). Sur les 311 buffy coat analysés, 308
résultats ont été fournis. Cette méthode totalise
106 cas positifs, soit 31,41 (#177;5,30) % d'infection par les trypanosomes
(T. vivax et T. congolense type savane).
Ainsi pour T. vivax 25 cas
d'infections ont été détectés, soit 8,11
(#177;3,05) %. 81 se sont révélés positifs à
T. congolense type savane, soit un taux d'infection de 26,30
(#177;4,96) %. La méthode de buffy coat n'a pu identifier aucune
infection en dehors de ces deux taxons, et aucune infection mixte n'a
été mise en évidence. (Tableau IV, page 82)
1-2. PCR classique
Sur les 425 échantillons de terrain, la PCR
monospécifique a identifié au total 168 signaux positifs, soit
39,53 (#177;4,65) %. Parmi ces échantillons positifs, 51 signaux
positifs sont rapportés à T. vivax, ce qui correspond
à une prévalence de 12 (#177;3,09) %. La prévalence de
T. congolense type savane est de 23,29 (#177;4,02) %, soit 99
échantillons positifs. Pour T. congolense type forêt et
T. brucei, on a observé respectivement 5 cas positifs (1,17 %)
et 4 cas positifs (0,94 %). Les infections mixtes détectées sont
au nombre de 9, dont 6 infections mixtes à T. vivax et T.
congolense type savane, 2 infections mixtes à T. vivax et
T. brucei et un cas d'infection par les 3 espèces de
trypanosomes (T. vivax, T. congolense type savane et T.
brucei). (Tableau VII, page 84)
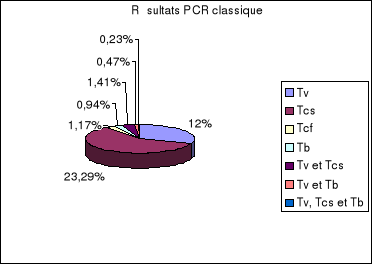
Figure 17 :
Résultats obtenus avec les amorces monospécifiques
T v : T. vivax, T c s : T.
congolense type savane, T c f : T. congolense type
forêt, T b : T. brucei
1-2-1. Echantillons sanguins de bovins
L'analyse en PCR classique de la couche des globules
blancs du sang des bovins utilise 3 couples d'amorces spécifiques
à 3 espèces de trypanosomes pathogènes (T.
vivax, T. congolense type savane, T.
brucei). Sur les 311 buffy coat testés, la PCR
monospécifique a détecté 129 cas positifs, soit un taux
d'infection de 41,48 (#177;5,47) %.
Pour T. vivax on a 27 signaux
positifs soit 8,68 (#177;3,12)%; avec les amorces classiques de T.
congolense type savane on a 94 cas positifs, soit une
prévalence de 30,22 (#177;5,10) % ; 1 seul cas (0,32 %) d'infection
à T. brucei a été observé. On
note en plus 6 cas d'infections mixtes à T. vivax et
T. congolense type savane et 1 cas de triple infection
parasitaire (à T. vivax, T.
congolense type savane et T. brucei). (Tableau IV,
page 82).
1-2-2. Organes de mouches
La PCR classique a révélé sur les
114 organes de mouches, 39 cas positifs, soit 34,21 (#177;8,71) %. Parmi ces
organes, on compte 71 proboscis dont 26 ont donné des signaux positifs
(soit 38,03 % du nombre de proboscis et 23,68 % de l'ensemble des organes de
mouches). Sur les 32 intestins moyens, 12 sont révélés
positifs et parmi les 11 glandes salivaires, 1 cas est détecté
positif (tableau III).
Pour T. vivax, la PCR classique a
identifié 24 cas positifs qui correspond à 21,05 (#177;7,48) %
sur les 114 organes de mouches, dont 19 cas positifs dans les proboscis et 5
cas d'infections intestinales. On observe 5 signaux positifs à
T. congolense type savane, dont 4 au niveau des proboscis et
1 dans les intestins moyens. Pour T. congolense type
forêt et T. brucei, il y a respectivement 5 cas
positifs (4,38 %) et 3 cas positifs (2,63 %). Deux cas d'infections mixtes
(à T. vivax et T. brucei) ont
été observés sur les mouches.
Tableau III : Résultats
positifs obtenus avec les organes de mouches en PCR classique
|
Organes de mouches positifs
en PCR classique
|
|
|
Proboscis
|
Intestins moyens
|
Glandes
salivaires
|
Total
|
%
|
|
T. vivax
|
19
|
5
|
0
|
24
|
21,05
|
|
T c s
|
4
|
1
|
0
|
5
|
4,38
|
|
T c f
|
2
|
3
|
0
|
5
|
4,38
|
|
T. brucei
|
1
|
1
|
1
|
3
|
2,63
|
|
T v et T b
|
1
|
1
|
0
|
2
|
1,75
|
|
Total
|
26
|
12
|
1
|
39
|
34,21
|
1-3. PCR (ITS) avec les amorces Tryp 4R et Tryp
4S
La PCR utilisant le couple d'amorces Tryp 4R et Tryp
4S, vise la mise en évidence de 4 espèces de trypanosomes qui
sont T. vivax, T. congolense type savane,
T. congolense type forêt et T.
brucei. Sur le total des échantillons de terrain
analysés, la PCR plurispécifique a permis l'identification de 127
signaux positifs, soit donc 29,88 (#177;4,35) %. Pour T.
vivax, on totalise 97 cas positifs soit 22,82(#177;3,99) % ; 23
échantillons sont révélés positifs à
T. congolense type savane, soit 5,41 (#177;2,15) % de
prévalence ; 1 signal positif a été observé
pour T. congolense type forêt ; et pour T.
brucei on compte 3 signaux positifs. On a également
observé 3 cas d'infections mixtes, dont 1 infection à T.
vivax et T. congolense type forêt et 2
infections à T. vivax et T.
congolense type savane. (Tableau VII, page 84)
1-3-1. Echantillons sanguins de bovins
Parmi les 311 buffy coats de bovins, la PCR-ITS a
révélé toutes espèces de trypanosomes confondues 90
cas positifs, soit 28,94 (#177;5,04) %. Les infections à T.
vivax détectées par les amorces Tryp 4R et Tryp 4S sont
de 66 cas, soit une prévalence de 21,22 (#177;4,54) %. Ces amorces ont
permis l'identification de 21 échantillons positifs à T.
congolense type savane, soit 6,75 (#177;2,78) % de l'ensemble des
buffy coats ; une seule infection à T. brucei a
pu être détectée ; aucune infection à
T. congolense type forêt n'a pu être
révélée dans ces prélèvements sanguins de
bovins. En revanche, 2 cas d'infections mixtes (à T.
vivax et T. congolense type savane) ont
été identifiés. (Tableau IV, page 82)
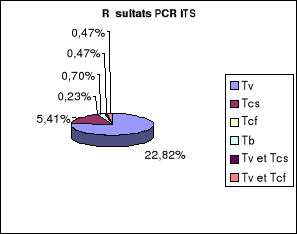
Figure 18 :
Résultats obtenus avec les amorces Tryp 4R et Tryp4S
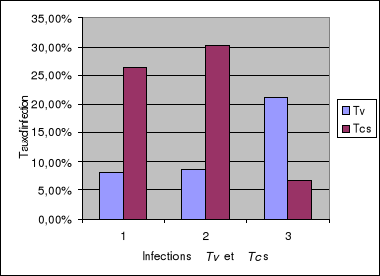
Figure 19 : Cas
d'infections à T v et à T c s
détectées par les 3 tests de diagnostic
1 : Méthodes Parasitologiques, 2 : PCR
classique, 3 : PCR-ITS
1-3-2. Organes de mouches
Les amorces Tryp 4R et Tryp 4S ont
révélé sur les 114 organes de mouches, 37 cas positifs,
soit 32, 45 (#177;8,59) %. Parmi les 71 proboscis, on observe 30 signaux
positifs ; 7 cas se sont révélés positifs parmi les
32 intestins moyens ; aucun signal n'a été observé
parmi les 11 glandes salivaires avec la PCR -ITS. On note une seule infection
mixte à T. vivax et à T.
congolense type forêt.
Pour T. vivax, on a 31 cas
détectés, soit 27,19 (#177;8,16) % de prévalence, dont 27
signaux avec les proboscis et 4 cas d'infection intestinale. Pour les
trypanosomes du genre Nannomonas, la prévalence est
respectivement de 1,75 % pour T. congolense type savane (2
cas positifs), et de 0,32 % pour T. congolense type
forêt. Pour le genre Trypanozoon (T. brucei), on a 2
signaux positifs (1,75 %). (Tableau V)
Tableau IV :
Prélèvements sanguins de bovins positifs aux tests de
diagnostic
|
Echantillons positifs
|
|
Méthodes
Parasitologiques
|
%
|
PCR
classique
|
%
|
PCR
(ITS)
|
%
|
Khi2
(PCR classique / PCR-ITS)
|
|
T. vivax
|
25
|
8, 11
|
27
|
8, 68
|
66
|
21, 22
|
19,23*
|
|
T c s
|
81
|
26, 30
|
94
|
30, 21
|
21
|
6, 75
|
56,84*
|
|
T c f
|
0
|
|
0
|
|
0
|
|
|
|
T. brucei
|
0
|
|
1
|
0, 32
|
1
|
0, 32
|
|
|
T v et T c s
|
0
|
|
6
|
1, 93
|
2
|
0, 64
|
|
|
T v et T b
|
0
|
|
0
|
|
0
|
|
|
|
T v, T c s et T b
|
0
|
|
1
|
0, 32
|
0
|
|
|
|
Total
|
106
|
34, 41
|
129
|
41, 48
|
90
|
28, 94
|
10,72*
|
* Différences significatives (p<0,01)
Tableau V : Résultats
obtenus avec les organes de mouches en PCR-ITS
|
Organes de mouche positifs avec les amorces Tryp 4R et
Tryp 4S
|
|
|
Proboscis
|
Intestins moyens
|
Glandes
salivaires
|
Total
|
%
|
|
T. vivax
|
27
|
4
|
0
|
31
|
27,19 %
|
|
T c s
|
1
|
1
|
0
|
2
|
1,75 %
|
|
T c f
|
1
|
0
|
0
|
1
|
0,32 %
|
|
T. brucei
|
0
|
2
|
0
|
2
|
1,75 %
|
|
T v et T c f
|
1
|
0
|
0
|
1
|
0,32 %
|
|
Total
|
30
|
7
|
0
|
37
|
32,45 %
|
Tableau VI : Organes de mouches
positifs en PCR classique et PCR-ITS
|
Echantillons positifs
|
Khi 2
|
|
PCR classique
|
|
PCR-ITS
|
|
|
T. vivax
|
24
|
21,05%
|
|
31
|
27,19%
|
1,17
|
|
T c s
|
5
|
4,38%
|
|
2
|
1,75%
|
|
|
T c f
|
5
|
4,38%
|
|
1
|
0,32%
|
|
|
T. brucei
|
3
|
2,63%
|
|
2
|
1,75%
|
|
|
T v et T c f
|
0
|
|
|
1
|
0,32%
|
|
|
T v et T b
|
2
|
1,75%
|
|
0
|
|
|
|
Total
|
39
|
34,21%
|
|
37
|
32,45%
|
1,31
|
Tableau VII : Récapitulatif
des résultats obtenus en PCR classique et en PCR-ITS
|
1 Echantillons positifs
|
Khi 2
|
|
PCR classique
|
PCR -ITS
|
|
|
T vivax
|
51
|
12%
|
97
|
22,82%
|
17,31*
|
|
T c s
|
99
|
23,29%
|
23
|
5,41%
|
17,31*
|
|
T c f
|
5
|
1,17%
|
1
|
0,23%
|
|
|
T. brucei
|
4
|
0,94%
|
3
|
0,70%
|
|
|
T v et T c s
|
6
|
1,41%
|
2
|
0,47%
|
|
|
Tv et T c f
|
0
|
|
1
|
0,23%
|
|
|
T v et T b
|
2
|
0,47%
|
0
|
|
|
|
T v, T c s et T b
|
1
|
0,23%
|
0
|
|
|
|
Total
|
168
|
39,53%
|
127
|
29,88%
|
8,72*
|
1-4. Analyse comparative des résultats PCR
classique / PCR-ITS
1-4-1. Cas d'infections à Trypanosoma
vivax
1-4-1-1. Buffy coat de bovins
Sur les 25 cas d'infections à T.
vivax détectés par les méthodes parasitologiques,
12 échantillons sont révélés positifs à la
fois en PCR monospécifique, et en PCR-ITS. La PCR classique a permis la
confirmation de 13 échantillons parasitologiquement positifs
à T. vivax ; les amorces Tryp 4R et Tryp 4S en
ont confirmé 14, dont 2 identifiés en infection mixte avec
T. congolense type savane en PCR classique. Ces amorces
polyspécifiques ont identifié 52 signaux positifs à
T. vivax parmi les échantillons négatifs par
les techniques parasitologiques ; les amorces monospécifiques en ont
détecté 10 échantillons (associés à 5 cas
d'infections mixtes avec T. congolense type savane et 1 cas
d'infection mixte avec T. congolense type savane et
T. brucei) et enfin 6 de ces échantillons ont
été révélé positifs à la fois en PCR
classique, et en PCR-ITS.
Sur les 27 infections du type Duttonella
(T. vivax) identifiées en PCR classique, 18 ont pu
être confirmées avec les amorces Tryp 4R et Tryp 4S. Parmi les 6
cas d'infections mixtes détectés en PCR classique, on a en
PCR-ITS 3 signaux positifs à T. vivax ; 1 signal
positif à T. congolense type savane et 2
négatifs. En outre, parmi les échantillons négatifs
à T. vivax avec les amorces TVW 1 et 2, la PCR-ITS a
révélé 45 signaux positifs (mis à part les
infections mixtes) à cette espèce, cependant en PCR classique, 19
d'entre eux étaient positifs à T. congolense
type savane.
1-4-1-2. Organes de mouches
Sur les 19 échantillons positifs à
T. vivax au niveau des proboscis en PCR classique, 17 ont
été confirmés positifs avec les amorces Tryp 4R et Tryp
4S. La même observation est faite pour les intestins moyens, car sur les
5 échantillons positifs à T. vivax avec les
amorces monospécifiques, 3 ont également donné des signaux
positifs en PCR-ITS.
Parmi les échantillons négatifs à
T. vivax en PCR classique, 10 sont
révélés positifs en PCR-ITS. Par contre, 4
échantillons ont donné des signaux positifs avec les amorces
spécifiques à T. vivax, tandis qu'ils sont
négatifs en PCR sur les ITS. On a observé en PCR classique, 2
cas d'infections mixtes (à T. vivax et T.
brucei), en PCR-ITS l'un a donné un signal positif à
T. vivax et l'autre un signal positif à T.
brucei. Un seul échantillon présentant une infection
mixte (à T. vivax et à T.
congolense type forêt) avec les amorces polyspécifiques,
a été identifié positif à T.
congolense type forêt en PCR monospécifique.
1-4-2. Cas d'infections au genre Nanomonnas
(Trypanosoma congolense)
1-4-2-1. Buffy coat de bovins
Dans les cas d'infections à T.
congolense type savane, parmi les 81 identifiés par la
technique de buffy coat, 10 échantillons ont été
confirmés positifs en PCR classique et en PCR-ITS. Sur ces mêmes
échantillons positifs par les tests parasitologiques, 48 ont
donné des signaux positifs avec les amorces TCS 1 et 2 , contre 12 avec
les amorces Tryp 4R et Tryp 4S. Parmi les échantillons négatifs
à T. congolense type savane par la méthode de
buffy coat, 41 sont testés positifs en PCR classique (sur ces
échantillons, 12 sont positifs à T. vivax avec
les amorces Tryp 4R et Tryp 4S) ; 9 en PCR-ITS et 7 à la fois en
PCR classique et en PCR-ITS. Les 2 cas d'infections mixtes (à
T. congolense type savane et T. vivax)
observés en PCR-ITS, sont identifiés positifs à
T. congolense type savane en PCR classique et par les
méthodes parasitologiques.
Les amorces spécifiques de T.
congolense type savane ont identifié 94 échantillons
positifs à cette espèce de trypanosome, seulement 17 parmi ces
échantillons ont également donné des signaux positifs en
PCR plurispécifique. Parmi les échantillons qui n'ont
donné aucun signal à T. congolense type savane
en PCR classique, seulement 2 sont positifs en PCR-ITS. Inversement, parmi les
échantillons négatifs à T. congolense
type savane1(*)' en PCR-ITS,
les amorces TCS 1 et 2 ont identifié 72 signaux positifs.
Aucune infection à T. congolense
type forêt n'a été détectée dans les
prélèvements sanguins de bovins lors de cette étude.
1-4-2-2. Organes de mouches
Sur les 5 infections à T.
congolense type savane révélées par la PCR
monospécifique, aucune d'entre elles n'a été
confirmée par les amorces polyspécifiques. Il en est de
même pour les 5 signaux positifs à T. congolense
type forêt. Toutefois, un cas d'infection mixte (à
T. congolense type forêt et T. vivax)
identifié par les amorces Tryp 4R et Tryp 4S a donné un signal
positif à T. congolense type forêt en PCR
classique.
1-4-3. Cas d'infections au genre Trypanozoon
(T. brucei)
Seulement 2 échantillons de terrain de bovins
ont été différemment testés positifs à
T. brucei, l'un par les amorces spécifiques au genre
Trypanozoon et l'autre par les amorces polyspécifiques. En
revanche, parmi les 3 organes de mouches, qui ont donné des signaux
positifs à T. brucei en PCR classique, 1 a
été confirmé par les amorces Tryp 4R et Tryp4S. Par
ailleurs, sur les 2 cas d'infections mixtes (à T.
brucei et T. vivax) identifiés par les
amorces monospécifiques, 1 échantillon (organe de mouche) a
donné un signal positif à T. brucei en PCR-ITS.
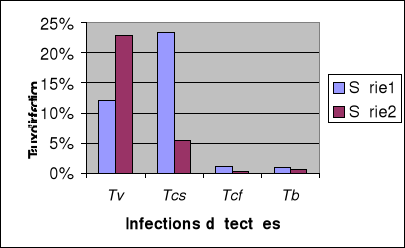
Figure
20 : Résultats comparés PCR classique / PCR-ITS
Série 1 : PCR classique, Série
2 : PCR-ITS
1-5. PCR-ELISA
La PCR-ELISA n'a pas fait l'objet d'une
évaluation à grande échelle comme la PCR directe. Par
conséquent, ces résultats sont essentiellement ceux de
l'évaluation des sondes aussi bien sur des ADN de
référence des principaux trypanosomes pathogènes que sur
des échantillons de terrain.
1-5-1. Résultats de l'évaluation des
sondes
1-5-1-1. Sur des ADN purifiés
Le test préliminaire pour le choix des sondes
a porté surtout sur la sensibilité des sondes à
révéler les produits d'amplification par la technique ELISA. Par
contre, la première évaluation de ces sondes sur des ADN de
référence a mis en évidence outre la sensibilité,
la spécificité de ces oligonucléotides. C'est ainsi que
les 10 échantillons d'ADN purifiés ont été
révélés de façon spécifique par les 5 sondes
choisies (fig. 22).
Néanmoins, à des températures
d'hybridation inférieures à 56°C des réactions
croisées sont observées entre les sondes dessinées pour le
genre Nannomonas (T. congolense). Ces hybridations
non spécifiques se traduisent par le fait que des sondes de T.
congolense type savane donnent des signaux positifs avec l'ADN de
T. congolense type forêt et réciproquement, la
sonde de T. congolense type forêt donne des
résultats positifs avec les ADN de T. congolense type
savane. Aucune réaction non spécifique n'a été
observée avec les sondes de T. vivax et de T.
brucei.
A1 & A2 : blanc, B1 & B2 : Tv
Kanfiala, C1 & : T v Sat 87 /CRTA, D1 &
D2 : T v Folonzo, A5 & A6 et D7 &
D8 : T c s Sat 87/ CRTA, B5 & B6 et E7 &
E8 : T c s : Kigoni
C5 & C6 et F7 & F8 : T c s Kar
83/CRTA /66, D5 & D6 et G7 & G8 : T c s B 317
E9 & E10 : T c f Komoé,
C11 & C12 : T b Folonzo
Figure 21 : révélation sur
gel d'agarose des produits PCR des échantillons d'ADN de
référence
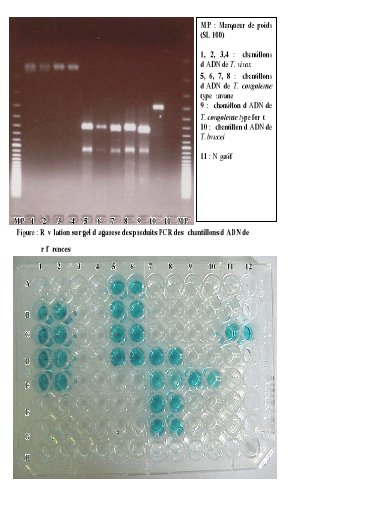
Figure 22 : révélation ELISA
des échantillons d'ADN de référence
1-5-1-2. Sur des échantillons de
terrain
L'évaluation de la performance des sondes sur
des échantillons de terrain a été comparativement à
la précédente moins satisfaisante. En effet, la
sensibilité de détection des trypanosomes dans les
prélèvements sanguins de bovins et les organes de mouches s'est
avérée inférieure au taux de détection par
révélation sur gel d'agarose .
La sensibilité de la PCR-ELISA sur les ITS est
selon les résultats des tests relative à l'espèce de
trypanosome. Les plus faibles taux de révélation ont
été obtenus avec des échantillons positifs à
T. vivax, les échantillons de T.
congolense sont moyennement révélés positifs par
l'ELISA, la sonde STB2 de T. brucei donne
régulièrement des signaux positifs (avec des densités
optiques élevées) avec les échantillons de T.
brucei testés. Enfin, on note la capacité des sondes
à détecter des cas d'infections mixtes. Par ailleurs, les sondes
se sont révélées très sensibles à des cas de
contaminations des échantillons. Ainsi, au cours de nos manipulations,
une contamination de l'échantillon négatif par T.
vivax observée par le biais de la révélation sur
gel d'agarose a conduit à un signal du témoin négatif avec
la sonde STV2 spécifique à T. vivax.
La spécificité des sondes sur les
échantillons de terrain a été comme sur les ADN de
référence améliorée en augmentant la
température pendant l'étape d'hybridation du protocole de
révélation ELISA. Une température de 60°C (pour
toutes les sondes) associée aux autres conditions de l'optimisation a en
effet fournit des résultats satisfaisants.
2. Discussion
2-1. Evaluation comparative PCR classique /
PCR-ITS
2-1-1. Sensibilité
Le calcul du Khi 2 pour le total des
échantillons positifs en PCR-ITS par comparaison au total des cas
positifs détectés en PCR classique (tableau VII, page 84), montre
qu'il y a bel et bien une différence entre ces deux techniques et la
différence est significative au risque d'erreur 1%. Il ressort donc, au
vu de ces résultats que les amorces monospécifiques sont
globalement plus sensibles que le couple d'amorces Tryp 4R et Tryp 4S. Une des
hypothèses que l'on peut avancer, est la faible répétition
des séquences ITS1 dans le génome parasitaire (environ 200
exemplaires) relativement au nombre élevé de copies (un a
plusieurs millier) de séquences d'ADN satellite. Par contre, selon les
travaux de Desquesnes et al. (2001), la sensibilité de
la PCR utilisant les amorces Tryp 4R et Tryp 4S était très
voisine de celle obtenue avec les amorces monospécifiques en conditions
comparables, mais seulement sur un nombre limité d'échantillons
de terrain. Nous avons d'autre part observé que la sensibilité du
diagnostic par PCR-ITS sur les buffy coats de bovins s'est avérée
inférieure à celle observée avec les techniques
parasitologiques (Tableau IV, page 82). Toutefois, les amorces
polyspécifiques offrent une sensibilité qui est relative à
l'espèce de trypanosome détectée.
Ainsi pour les infections de type Duttonella
(T. vivax), des meilleurs résultats ont été
obtenus avec les amorces polyspécifiques. En effet, les cas positifs
à T. vivax représentent presque les 3 / 4 des
signaux positifs détectés avec les amorces Tryp 4R et Tryp 4S.
Avec les amorces monospécifiques TVW 1&2, la proportion des signaux
positifs à T. vivax ne représentent que moins
du 1 / 3 des échantillons positifs. Cette sensibilité des amorces
polyspécifiques est d'autant plus élevée pour T.
vivax que le test de Khi 2 montre des différences
significatives entre la détection de cette espèce par la PCR
classique et par la PCR-ITS (tableau VII, page 84). Cependant, sur les organes
de mouches analysés, le nombre de signaux positifs à T.
vivax avec les amorces TVW 1&2 n'est que légèrement
inférieur à celui obtenu avec les amorces polyspécifiques.
Cette différence est du point de vu statistique non significative
(tableau VI, page 83). Contrairement aux amorces Tryp 4R et Tryp 4S, la
sensibilité des amorces polyspécifiques Kin 1 et Kin 2 pour la
détection de T. vivax est assez faible, car leurs
séquences ne présentent que 80 % d'homologie avec celles du
parasite (Desquesnes et al., 2001).
Pour les infections à T.
congolense type savane, les amorces Tryp 4R et Tryp 4S ont
donné approximativement le 1 / 4 des résultats obtenus avec le
couple d'amorces TCS 1&2 (23 signaux positifs en PCR-ITS contre 99 en PCR
classique). Les différences très significatives données
par le test de Khi 2 (tableau VII, page 84) traduisent une faiblesse notoire
des amorces Tryp 4R et Tryp 4S dans la détection de T.
congolense type savane. La technique parasitologique reste donc plus
sensible que la PCR-ITS, car la méthode de buffy coat totalise 81 cas
d'infections à T. congolense type savane sur 308
prélèvements sanguins de bovins. Toutefois, avec les amorces Kin
1 & 2, la détection de T. congolense type savane est assez
bonne. Il faudrait donc envisager, que les amorces Tryp 4R et Tryp 4S ne
présentent pas 100 % d`homologie avec toutes les souches de T.
congolense type savane. Il y aurait ainsi une différence entre
les séquences des souches de T. congolense type savane ayant
servi au dessin de ces amorces avec celles des souches présentes sur le
terrain.
Les résultats des analyses en PCR classique et
en PCR-ITS, nous amènent à faire le constat selon lequel, un
nombre assez important d'échantillons (21 buffy coats de bovins)
positifs à T. vivax en PCR-ITS ont donné des
signaux positifs à T. congolense type savane avec les
amorces TCS 1et 2. En somme, les amorces Tryp 4R et Tryp 4S présentent
un avantage comparatif en gain de sensibilité pour la détection
des infections à T. vivax, par contre, la
sensibilité relative à la détection de T.
congolense type savane de ce couple d'amorces est largement en dessous
de celle donnée par les amorces classiques TCS 1& 2.
L'interprétation des résultats
concernant T. congolense type forêt et T.
brucei semble être réservée du fait des faibles
taux de détection des infections à ces espèces tant en PCR
classique qu'en PCR-ITS. Cela peut s'expliquer par la faible prévalence
de ces parasites dans les zones de prélèvements des
échantillons. Dans ces zones de suivi du bétail, comme partout
ailleurs la présence de T. brucei et de T.
congolense type forêt chez les bovins est rarement
signalée. Toutefois, la sensibilité des amorces
spécifiques de T. congolense type forêt (TCF
1&2) est au regard des résultats obtenus 5 fois supérieure
à celle obtenue avec les amorces polyspécifiques. Les taux de
détection de T. brucei avec les amorces classiques NRP
1&2 avoisinent légèrement ceux obtenus avec les amorces Tryp
4R et Tryp 4S. Enfin, Les résultats de la PCR classique obtenus dans la
présente étude sont comparables et concordent avec plusieurs
autres travaux, notamment ceux de Solano et al. (1999).
2-1-2. Spécificité
L'un des objectifs primordiaux de l'utilisation des
amorces polyspécifiques est de pouvoir distinguer et identifier
simultanément les principales espèces de trypanosomes
pathogènes du bétail. En effet, les produits d'amplification de
l'ADN de ces parasites peuvent être aisément distingués sur
un gel d'agarose à 2 % et la taille de ces produits s'est
révélée constante et est en accord avec les tailles
attendues (Desquesnes et al., 2001). Pour T.
vivax, la taille en paires de bases des produits PCR se situe entre
240 et 250 pb, pour les espèces du sous genre Trypanozoon
(T. brucei) elle est d'environ 480 pb et enfin pour
T. congolense type savane et T. congolense
type forêt, les tailles sont respectivement de 680 et 720 pb. Ces tailles
sont en dessous de celles observées avec le couple d'amorces Kin 1 et
Kin 2 (Desquesnes et al., 2001). Cependant, avec le couple
d'amorces Tryp 4R et Tryp 4S on note souvent l'existence de quelques produits
non spécifiques dont la taille se situe aux environs de 500 pb, les
résultats des PCR avec l'ADN de T. theileri infirment
la suspicion selon laquelle ces produits émaneraient d'une infection par
cette espèce. Mais la présence de ces produits non
spécifiques ne gène aucunement pas la lecture des
résultats.
Les oligonucléotides classiques offrent une
spécificité totale, car aucune réaction croisée
entre les trypanosomes n'a été signalée et en plus
l'apparition des signaux non spécifiques est relativement moins
fréquente.
250 pb
480 pb
620 pb
680 pb
MP 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
16 17 18 19 20 21 22 23 24 MP
Figure 23a : Photo d'un gel d'agarose
MP : Marqueur de poids, 21 : Témoin positif
à T. vivax, 22 : Témoin positif à T. c.
s
23 : Témoin positif à T c f,
24 : Témoin positif à T. brucei.
2, 3, 4, 6 et 7 : échantillons positifs à
T. vivax
250 pb
480 pb
620 pb
680 pb
MP 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
16 17 18 19 20 21 22 23 24 MP

Figure 23b : Photo d'un gel d'agarose
MP : Marqueur de poids, 21 : Témoin positif
à T. vivax, 22 : Témoin positif à T. c.
s
23 : Témoin positif à T c f,
24 : Témoin positif à T. brucei.
Entourés bleu : produits non spécifiques.
2-2. Spécificité et sensibilité
des sondes nucléiques pour la PCR-ELISA
Il est d'abord utile de rappeler que l'une des
difficultés de l'application de la PCR-ELISA est indéniablement
la recherche des sondes spécifiques aux ITS1 des trypanosomes. Le dessin
de ces sondes implique au préalable la connaissance de la
séquence du fragment cible. L'obtention des sondes spécifiques
aux ITS1 a été ainsi l'aboutissement d'un long processus allant
du séquençage des produits d'amplification (avec des amorces
polyspécifiques) à l'alignement inter espèces des
séquences ITS1 identifiées.
2-2-1. Spécificité
Les résultats de l'évaluation des sondes
sur des ADN purifiés ont mis en évidence surtout la
spécificité complète des oligonucléotides choisis
pour le test ELISA. Deux caractéristiques illustrent la stabilité
de l'hybridation de ces sondes avec leurs séquences cibles, il s'agit du
pourcentage moyen (pour les 5 sondes retenues) de bases GC qui est de 64,48 %
(> 60 %) et de la taille moyenne des sondes de l'ordre de 21 pb (> 20 et
< 30 pb).
Nos résultats sur la spécificité
des sondes sont similaires à ceux obtenus avec des sondes
dessinées pour la détection des ADN satellites de T.
congolense type savane (Sow, 2004), mais aussi avec
les résultats des tests de spécificité des sondes pour la
détection de T. brucei et de T.
vivax (Masaké et al., 2002). Toutefois, dans
le cas de notre travail, la spécificité totale des sondes n'a
été observée qu'après optimisation de certains
paramètres comme la température d'hybridation. Ainsi, pour des
températures d'hybridation inférieures à 56°C, des
réactions croisées sont observées entre les sondes
dessinées pour les trypanosomes de l'espèce T.
congolense. Ces hybridations non spécifiques peuvent
probablement s'expliquer par le fait qu'en dessous de la température
d'hybridation, une sonde a la capacité de s'hybrider avec une autre
séquence ITS1 présente dans le milieu réactionnel. Cette
hypothèse paraît certainement insuffisante pour justifier à
elle seule ce phénomène d'hybridation non spécifique. La
vérification de l'homologie entre les sondes d'une espèce
donnée et les séquences ITS1 d'une autre espèce
s'avère intéressante. Pour éviter ces cas d'hybridations
non spécifiques, l'homologie entre un oligonucléotide
donné et les séquences des ITS1 des autres espèces doit
normalement être inférieure à 80 %.
2-2-2. Sensibilité
La sensibilité des sondes à
détecter les produits d'amplification des échantillons de terrain
est contrairement à toute attente en dessous de celle de la PCR directe,
car l'objectif principal de la mise au point et de l'application de la
PCR-ELISA est l'amélioration de la sensibilité du test
d'identification des trypanosomes par PCR. L'évaluation de la
sensibilité des sondes étant réalisée avec des
échantillons dont le statut est connu par la révélation
sur gel d'agarose, la détection de ces produits PCR par la technique
ELISA devrait être théoriquement de 100 %.
Par ailleurs, l'on note une différence de
sensibilité des oligonucléotides selon l'espèce de
parasite à révéler. L'hypothèse la plus plausible
qui expliquerait cette sensibilité relative au taxon de trypanosome
s'appuie sur un des principes de la PCR-ELISA, à savoir le marquage des
produits PCR.
En effet, pour la PCR-ELISA, les produits
d'amplification sont au préalable marqués avec la
digoxigénine (sous forme de digoxigénine-11-2'-dUTP). La
digoxigénine est incorporée aux dNTP dans un mélange connu
sous le nom de dig-labeling mix qui contient outre les dATP, dCTP et dGTP, les
dTTP associés aux dig-dUTP dans une proportion de 19 / 1 (respectivement
de dTTP et dig-dUTP), soit un mélange à 5 % de dig-dUTP. Ces
derniers vont par le principe de la complémentarité des bases se
lier aux bases AT de la séquence ITS1 cible. Ce sont donc, ces complexes
qui vont être révélés par le conjugué
anti-dig-pod après l'ajout du substrat chromogène. Il faut en
plus, notifier que le nombre de bases AT est variable selon la séquence
ITS1. Par exemple pour T. vivax dont le produit PCR est le
plus court (240 à 250 pb), le nombre de bases AT calculé à
l'aide du logiciel FREQSQ est en moyenne égal à 47, ce qui
correspond à environ deux Uridine pouvant se fixer. Ceci explique fort
probablement la faible sensibilité de la détection des
échantillons positifs à cette espèce de trypanosome par
ELISA. Par contre, pour T. congolense type savane et
T. brucei, on a respectivement 8 (160 bases AT) et 7 (153
bases AT) dig-dUTP pouvant être révélés, d'où
leur sensibilité de détection relativement grande par rapport
à celle de T. vivax.
2-3. Etude de coût2(*)
Pour la réalisation de la PCR-ELISA, il faut un
ensemble de réactifs qui serviront d'une part à l'amplification
des échantillons et d'autre part à la révélation
ELISA. Le coût et la quantité de réactifs seront en premier
lieu évalués en fonction du nombre de plaques ELISA
utilisées, ce qui conduira au calcul du coût des réactifs
par plaque. La plaque ELISA (Maxisorp®) pouvant permettre l'analyse de 45
échantillons (avec un blanc, un négatif et un positif), le
coût par plaque ELISA sera divisé par 45 pour obtenir le
coût d'analyse d'un échantillon pour une valence
(c'est-à-dire la révélation d'une espèce de
trypanosome). Avec les amorces Tryp 4R et Tryp 4S, 4 valences sont en jeu,
à savoir T. vivax, T. congolense
type savane, T. congolense type forêt et T.
brucei, pour avoir ainsi le coût d'un diagnostic par PCR-ELISA
sur les ITS, on multiplie par 4 le coût d'analyse d'un échantillon
sanguin de bovin.
Pour la PCR directe, on estime d'abord les prix
individuels par unité de consommable à partir des prix unitaires
par conditionnement. Puis, on calcule la quantité ou le volume de
réactif utilisé pour un gel d'agarose à 2 % sur lequel on
peut avoir 39 échantillons amplifiés (avec 2 marqueurs de poids
par portion de gel, 4 témoins positifs également par portion de
gel et 1 témoins négatif pour le gel entier). Le coût par
gel d'agarose d'un réactif donné est obtenu en multipliant son
prix individuel / unité par la quantité ou le volume
utilisé / gel. Le coût total par gel d'agarose divisé par
39 donne ainsi le prix approximatif de l'analyse d'un échantillon par
PCR-ITS directe. Cette technique permettant d'identifier simultanément
les 4 espèces de trypanosomes, le coût d'analyse d'un
échantillon (buffy coat de bovin) équivaut au coût d'un
diagnostic pour 4 valences, par contre pour la PCR classique ce coût est
multiplié par 4 comme pour la PCR-ELISA.
Certains réactifs dont le prix de revient est
très négligeable, n'ont pas été pris en compte dans
cette estimation du coût, c'est le cas par exemple du DMSO, du tampon de
charge, du marqueur de poids (SL 100), du TBE et du tampon d'hybridation.
Ceux-ci sont reconstitués à partir du mélange d'autres
réactifs disponibles au laboratoire. Le tampon utilisé en PCR est
vendu avec la Taq polymérase (Quiagen®). Enfin, le coût
à l'achat des produits comporte également le prix du transport
qui représente 25 % du coût du consommable.
Ainsi, l'analyse d'un échantillon par PCR-ELISA
avec les amorces Tryp 4R et Tryp 4S coûte approximativement 0,45 €
soit environ 295,18 Fcfa pour une valence. Le diagnostic chez les bovins avec 4
valences coûterait 1,8 € soit 1180,72 Fcfa. Il en résulte que
ce coût est relativement moins onéreux, car dans les mêmes
conditions le coût de l'analyse d'un échantillon par PCR-ELISA
pour la détection de l'ADN de T. congolense type savane
(Sow, 2004) a été estimé à 1993,
29 Fcfa, d'où une réduction de 812,57 Fcfa permise par la
PCR-ELISA sur les ITS. Mais cette réduction du coût de la
PCR-ELISA, se justifie entre autre par le fait que pour le besoin de notre
étude, les réactifs sont achetés séparément.
Par contre, dans le cas des travaux de Sow (2004), deux Kits
PCR-ELISA (Dig-labeling et Dig-detection 5' Pack) qui sont des produits
très chers ont été achetés. Toute chose
égale par ailleurs, la PCR-ELISA sur les ITS des trypanosomes offre un
avantage du point de vue coût par rapport à la PCR-ELISA pour la
détection des ADN satellites, car à la différence de cette
dernière, la PCR-ITS permet l'identification simultanée des
principaux trypanosomes pathogènes du bétail.
L'appréciation du tableau VIII, permet de
déduire que le coût de la PCR-ELISA peut être davantage
réduit, en diminuant la quantité utilisée de certains
consommables comme les tubes eppendorf et les embouts jetables. En effet, si
l'on prend l'exemple des tubes eppendorf pour une plaque, ils reviennent plus
chers que l'ensemble des six premiers réactifs (la streptavidine, le
conjugué anti-dig-pod, le dig-labeling mix, les sondes, le substrat
chromogène et les amorces). Par conséquent, pour la
révélation ELISA, avec l'utilisation des mêmes tubes ayant
servi pour l'amplification et avec une réduction de moitié des
embouts jetables, on aboutirait à un coût de 15,33 € par
plaque soit donc 0,34 € (223 Fcfa) pour un échantillon
analysé. Le coût global du diagnostic chez les bovins avec les 4
valences serait de 1,36 € soit environ 892 Fcfa.
Tableau VIII : Estimation du
coût de l'analyse en PCR-ELISA pour une plaque
|
Produits
|
Quantité à l'achat
|
Coût à l'achat (€)
|
Nbre de plaques
ELISA
|
Coût / plaque ELISA (€)
|
|
Streptavidine
|
5 mg / tube
|
537,5
|
200
|
2,68
|
|
Conjugué anti-dig-pod
|
50 U / tube
|
292,5
|
500
|
0,58
|
|
Dig-labeling mix
|
250 ul / tube (2 tubes)
|
397,5
|
250
|
1,59
|
|
Sonde oligonucléotidique
(exemple sonde STV1)
|
89,14 ul (après reconstitution)
|
37,5
|
331
|
0,11
|
|
TMB péroxydase+ H2O2
|
50 comprimés (1 mg / comprimé)
|
97,5
|
500
|
0,20
|
|
Amorces
|
200 ul / amorce (après reconstitution)
|
17,5
|
186
|
0,09
|
|
Taq polymérase
|
50 ul
|
53,35
|
11
|
4,85
|
|
Tubes eppendorf 0,5 ml
|
500 tubes
|
43,375
|
5
|
8,67
|
|
Embouts jetables
|
500 embouts
|
7,31
|
5
|
1,46
|
|
Gants à usage unique
|
100 paires
|
5,73
|
50
|
0,11
|
|
Chelex-100®
|
500 g
|
347,87
|
5555
|
0,06
|
|
Total
|
|
|
|
20,4
|
Pour la PCR directe avec le couple d'amorces
polyspécifiques (Tryp 4R et Tryp 4S), le coût de l'analyse d'un
échantillon est estimé à 0,72 € soit 472,30 Fcfa. Le
coût de la PCR monospécifique a été estimé
à 0,8 € (Kasbari, 2001). Pour un diagnostic chez
les bovins avec 4 valences, la PCR classique serait plus de 4 fois plus
coûteuse que la PCR-ITS. Par ailleurs, la PCR-ELISA sur les ITS est 2,5
fois plus chère que la PCR-ITS directe. De ce fait, pour un diagnostic
de routine, la PCR-ITS directe constitue une alternative qui doit être
privilégiée par rapport à la PCR-ELISA.
Tableau IX : Estimation du
coût de l'analyse d'un échantillon en PCR-ITS
|
Produits
|
Prix unitaire (€) par conditionnement
|
Prix individuel (€) / unité
|
Qté ou volume utilisé / gel
d'agarose
|
Coût total /gel d'agarose (€)
|
|
couple d'amorces
|
17,5 /200 ul (20 uM)
|
0,0875 / ul
|
16,8 ul
|
1,47
|
|
4 dNTP
|
270,536 /1000 ul
(2500uM)
|
0,27 / ul
|
44,8 ul
|
12,10
|
|
Taq polymérase
|
53,35 /50 ul
(250 UI)
|
1,067 / ul
|
3,2 ul
|
3,41
|
|
Agarose
|
1249 / 500 g
|
2,5 / g
|
2,5 g
|
6,25
|
|
Tubes eppendorf 0,5 ml
|
43,375 / 500 tubes
|
0,086 7 / tube
|
40 tubes
|
3,47
|
|
Embouts jetables
|
7,31 / 500 embouts
|
0,0146 / embout
|
97 embouts
|
1,41
|
|
Gants à usage unique
|
5,73 / 100 paires
|
0,057 / paire
|
2 paires
|
0,11
|
|
Chelex-100®
|
347,87 / 500 g
|
0,697 / g
|
0,078 g
|
0,05
|
|
Total
|
|
|
|
28,27
|
2-4. Avantages de la PCR directe et de la PCR-ELISA
sur les ITS
L'intérêt premier des amorces
polyspécifiques est sans aucun doute leur capacité à
détecter et à identifier simultanément les principales
espèces de trypanosomes. De cet avantage découlent d'autres
arguments qui militent en faveur de ce nouveau moyen de diagnostic.
Ainsi, la réduction du nombre de
réactions limite considérablement les cas de contamination,
surtout dans les laboratoires moins ou modestement équipés. Cette
catégorie de laboratoires est malheureusement caractéristique des
pays sous développés où la trypanosomose animale
sévit de façon endémique. Du fait de la diversité
des espèces de trypanosomes, pour réaliser un diagnostic final
avec la PCR monospécifique, il est nécessaire d'effectuer autant
de réactions que de nombre d'espèce à identifier. Au
demeurant, le coût de la PCR reste onéreux et limite son usage
à des fins de diagnostic de routine. La mise au point d'une PCR unique
par l'amplification des ITS1 présente alors un avantage tant du point de
vue pratique qu'économique. La PCR-ITS favorise entre autres l'analyse
d'un plus grand nombre d'échantillons, à moindre coût et en
un temps réduit. En outre, les amorces polyspécifiques tiennent
une importance de choix dans la connaissance épidémiologique des
trypanosomoses animales en permettant d'une part la détection par
exemple chez les insectes vecteurs (principalement les glossines) d'autres
espèces de trypanosomes autres que les plus fréquemment
rencontrées, d'autre part ces amorces constituent des outils les mieux
adaptés à la détection des cas d'infections mixtes.
Quant à la PCR-ELISA sur les ITS, elle offre
les mêmes avantages que la PCR-ITS directe. La particularité de la
PCR-ELISA est qu'elle associe deux méthodes de diagnostic à
savoir la PCR et la technique ELISA. Elle constitue de ce fait un excellent
moyen pour l'amélioration de la sensibilité et de la
spécificité des tests de détection des trypanosomes. Cette
performance de la PCR-ELISA est illustrée par des travaux
effectués sur les ADN satellites (Kosum et al., 2002 ;
Masaké et al., 2002 ; Sow, 2004). En outre, cette
technique rend la lecture des résultats plus objective et plus
aisée grâce à l'utilisation du spectrophotomètre,
comparativement à la révélation sur gel d'agarose
où l'apparition des bandes est parfois moins nette voire illisible. La
détection des produits d'amplification par ELISA est une technique
facile à mettre en oeuvre dans les laboratoires où l'on pratique
conjointement la PCR et l'ELISA, elle ne nécessite donc aucun
investissement supplémentaire. Contrairement à la
révélation sur gel d'agarose, dans la PCR-ELISA aucun
réactif cancérigène comme le BET n'est utilisé.
Conclusion
Les techniques d'amplification en chaîne par
polymérase ou PCR occupent de nos jours une importance capitale dans le
contrôle et le diagnostic de la trypanosomose animale africaine (TAA).
Toutefois, en dépit de sa bonne sensibilité et
spécificité, la PCR basée sur l'utilisation des couples
d'amorces spécifiques d'espèces présente un sérieux
handicap à cause de son coût élevé. Ceci
réduit par conséquent son usage et affaiblit ainsi les efforts de
lutte. Le développement d'une PCR unique amplifiant les espaceurs
internes transcrits (ITS) de l'ADN ribosomal des trypanosomes est une option
prometteuse pour trouver un compromis entre un diagnostic sensible et
spécifique d'une part et d'autre part un diagnostic accessible pour un
coût raisonnable. Notre travail s'intègre dans cette dynamique et
a consisté dans un premier temps à l'évaluation des
amorces polyspécifiques (Tryp 4R et Tryp 4S) pour la PCR directe et dans
un second temps à l'étude de la PCR-ELISA sur les ITS des
trypanosomes.
Ainsi, pour la PCR directe, 425 échantillons de
terrain dont 311 couches de globules blancs du sang de bovins (buffy coats) et
114 organes de mouches ont été analysés en PCR
monospécifique et en PCR-ITS. Les amorces polyspécifiques ont
détectés sur les 425 échantillons, 127 signaux positifs
soit 29,88 %.Par contre, les amorces spécifiques d'espèce ont
identifié 168 cas positifs soit 39,53 %. Pour les infections à
Trypanosoma vivax, le couple d'amorces Tryp 4R et Tryp 4S totalise 97
cas positifs sur l'ensemble des échantillons, soit une prévalence
de 22,82 %, tandis que les amorces TVW 1 et 2 ont identifié 51 cas
positifs soit 12 %. Avec les amorces TCS 1 & 2, 99 cas positifs, soit
23,29 % de l'ensemble des échantillons sont rapportés à
Trypanosoma congolense type savane, contre seulement 5,41 %
représentant 23 échantillons révélés
positifs à cette espèce en PCR-ITS.
Au regard de ces résultats, la PCR utilisant le
couple d'amorces polyspécifiques demeure globalement moins sensible que
la PCR monospécifique. Cette faible sensibilité est
particulièrement observée dans la détection des
trypanosomes du sous genre Nannomonas (T.
congolense). En revanche, sur des ADN purifiés, aucune
différence de sensibilité n'a été notée
entre les amorces amplifiant les ITS1 et les amorces monospécifiques. En
plus, malgré la présence limitée du segment ITS1 dans le
génome parasitaire comparativement à l'ADN satellite, la PCR-ITS
bénéficie d'un gain de sensibilité dans la
détection de Trypanosoma vivax. Ce qui constitue un
avantage assez important, car T. vivax est une espèce
non seulement transmise par la voie cyclique, mais aussi par la voie
mécanique (Desquesnes et Dia, 2004), elle est de ce
fait l'une des espèces la plus largement répandue en Afrique
tropicale.
Pour la PCR-ELISA, les cinq sondes
oligonucléotidiques spécifiques aux ITS1 ont identifié
avec une spécificité totale les échantillons d'ADN de
référence. Mais la sensibilité de cette technique sur des
échantillons de terrain s'est avérée inférieure
à celle observée avec la révélation sur gel
d'agarose. Par conséquent, la PCR-ELISA n'a pas fait l'objet d'une large
évaluation sur des prélèvements sanguins de bovins et des
organes de mouches.
Par ailleurs, l'application de la PCR-ELISA dans nos
conditions reste limitée par son coût élevé. En
effet, le coût de l'analyse d'un échantillon par PCR-ELISA sur les
ITS a été estimé à 1,8 € (environ 1180 Fcfa)
pour 4 espèces de trypanosomes détectées. Ce coût
représente plus du double de celui de la PCR-ITS directe estimé
à 0,72 € soit 472,30 Fcfa. Par conséquent, la PCR-ITS
directe constitue une méthode de choix et à privilégier
pour un diagnostic de routine.
Au vu de ce qui précède, il conviendra
pour améliorer davantage les résultats des tests de PCR directe
sur les ITS des trypanosomes :
Ø de poursuivre la recherche d'amorces plus
adaptées à la détection des trypanosomes du sous genre
Nannomonas (Trypanosoma congolense), ou à
défaut ;
Ø d'associer le couple d'amorces Tryp 4R et Tryp 4S et
le couple d'amorces TCS1&2, afin d'avoir un diagnostic plus sensible et
hautement spécifique de Trypanosoma congolense type
savane ;
Ø d'améliorer le programme d'amplification en
augmentant par exemple le temps d'élongation, ce qui permettra
l'amplification des segments les plus longs tels que ceux de
Trypanosoma congolense.
En outre, dans le but de réduire davantage le
coût de l'analyse par PCR-ELISA, mais aussi d'augmenter sa
sensibilité, il serait important :
Ø d'envisager la réduction du volume du
mélange réactionnel, d'effectuer avec plus de précautions
les tests de révélation dans un seul puits de la plaque ELISA et
d'utiliser pour la révélation des produits PCR les mêmes
tubes ayant servi pour l'amplification des échantillons ;
Ø d'essayer la technique de PCR-ELISA avec d'autres
modes de préparation d'échantillons, mais pour un coût
raisonnable ;
Ø de poursuivre l'évaluation de la PCR-ELISA sur
les ITS des trypanosomes avec un plus grand nombre d'échantillons.
Références bibliographiques
1. Abiola F. A., 2001.
Le marché mondial des médicaments
vétérinaires (145-149). In : Utilisation des trypanocides en
Afrique Sub-saharienne .Actes du séminaires sous régional
tenu du 06 au 09 février 2001.-Dakar : EISMV.-170p.
2. Bajyana Songa E., Hamers-Casterman Hammers R.,
Pholpark M. et al., 1987.
The use of card agglutination test for detection of T.
evansi infection: a comparison with other trypanosomiasis diagnostic tests
under field conditions in Thaïland. Ann. Soc. Belge Med. Trop.
67 :137-148.
3. Bengaly Z., 2003.
Pathogénicité comparée de trois types
phylogénétiques distincts de l'espèce de Trypanosoma
congolense. Thèse Doct. 3e cycle :
Parasitologie : université de Ouagadougou.
4. Biaou C. F., Teko-Agbo A., Faure P. et Abiola F.
A., 2002.
Le marché des médicaments
vétérinaires en Afrique de l'Ouest : Particularités
et réglementations. Animalis.
1 :(3) : 34-39.
5. Clausen P. H., Sidibé I., Bassinga A.,
Richard X., Bauer B. et Pohilt H., 1993 Comparison of various tests
for the serological diagnosis of Trypanosoma equiperdum infection in
the horse. Comp. Immun. Microbiol. Infect. Dis.
4: 243-246.
6. CIRDES, 2001.
Diagnostic et contrôle des hémoparasitoses
animales et leurs vecteurs. Cours
international tenu du 05 au 17 novembre 2001 au CIRDES,
Bobo-Dioulasso,
Burkina Faso.
7. Cuisance D., 1989.
Le piégeage des tsé-tsé.-
Montpellier : CIRAD.-172p.-(Etude et synthèse de l'IEMVT).
8. De La Rocque S. et Dia, M. L., 2001.
Les moyens de lutte contre la trypanosomose animale.(38-44) In
Utilisation des trypanocides en Afrique Sub-saharienne. Actes du
séminaires sous régional tenu du 06 au 09 février
2001.-Dakar : EISMV.-170p.
9. Desquesnes M., 2003.
Revue des techniques de diagnostic des trypanosomoses. In
Etudes épidémiologiques des trypanosomoses bovines et
suivi-évaluation des campagnes de lutte, cours international de
formation du 31 mars au 17 avril 2003.- 141p.
10. Desquesnes M., 1997.
Evaluation of simple PCR technique for the diagnostic of
Trypanosoma vivax in serum of cattle in comparison to parasitological
techniques and antigen-enzyme linked immunosorbent assay (Ag- ELISA). Acta
tropica. 65: 139-141.
11. Desquesnes, M. et Dia M. L., 2004
Mechanical transmission of Trypanosoma vivax in
cattle by African tabanid Atylotus fuscipes. Vet. Par.
119 (1), 9-19.
12. Desquesnes M., et Dia M. L., 2003.
Trypanosoma vivax : Mechanical transmission in cattle by
one of the most common African tabanids, Atylotus agrestis. Exp.
Parasitol.-103 (1-2): 35-43.
13. Desquesnes M. et Dávila A.R.M., 2002.
Application of PCR-based tools for detection and
identification of animal trypanosomes: a review and prospectives. Elsevier
Veterinary Parasitology. 109 : 213-231.
14. Desquesnes M. et Tresse L., 1996
Evaluation de la sensibilité de la PCR pour la
détection de l'ADN de Trypanosoma vivax selon divers modes de
préparation des échantillons sanguins. Rev. Elev. Med. Vet. Pays
trop. 49 : 322-327
15. Desquesnes M., Ravel S. et Cuny G.,
2002.
PCR identification of Trypanosoma lewisi, a common
parasite of laboratory rats. Kinetoplastid Biology and Disease.-BioMed
Central.ed. 1
Accès Internet:
http://www.kinetoplastid.com/content/1/1/12
16. Desquesnes M., Dia M. L., Acapovi G., Yoni W.,
2005.
Les vecteurs mécaniques des trypanosomoses
animales.-CIRDES.-Bobo-Dioulasso, Burkina Faso.
17. Desquenes M., Mc Lauglin G., Zoungrana A.,
Dávila A.R.M., 2001.
Detection and identification of Trypanosoma of African
livestock through a single PCR based on internal transcribed spacer 1 of rDNA.
International journal of Parasitology 31:
610-614.
18. Desquesnes M., Michel J. F., De La Rocque S.,
Solano P., Millogo L., Bengaly Z. et Sidibé I., 1999.
Enquête parasitologique et sérologique (ELISA
indirecte) sur les trypanosomoses des bovins dans la zone de
Sidéradougou, Burkina Faso. Rev. Elev. Med. Vet. Pays. Trop.
52 : 3-4.
19. Dia M. L., 2003.
Point sur la lutte contre les trypanosomoses animales
africaine. In atelier de conseils et formation en appui à la production
laitière, CIRDES, Bobo-dioulasso, Burkina Faso, 7-18 juin
2003.-Bobo-Dioulasso : CIRDES.-14p.
20. Dia M. L., 1997
Epidémiologie de la trypanosomose cameline à
Trypanosoma evansi en Mauritanie. Thèse doct. :
Parasitologie : Université de Montpellier I.
21. Dickin S. K. et Gibson W. C., 1989.
Hybridisation with a repetitive DNA probe reveals the presence
of small chromosomes in Trypanosoma vivax. Molecular and Biochemichal
Parasitology, 33 : 135-142.
22. Duvallet G., Bengaly Z., Reifenberg J. M. et
Argiro L., 1994.
De nouveaux outils pour le diagnostic et
l'épidémiologie de la trypanosomose animale africaine.
Biotechnologies du diagnostic et de la prévention des maladies animales.
Paris : Ed. John libbey Eurotext ; AUPELF-UREF.- pp 19-29
.
23. Etienne J., 1996.
Biochimie génétique et biologie
moléculaire.-3ème ed.- Paris : Ed. Masson.- 482p.
24. FAO, 2002.
Twenty-second Regional Conference for Africa. Programme
Against African Trypanosomiasis (PAAT), Cairo, Egypt, 4-8 February 2002.
Accès Internet:
www.fao.org/DOCREP/MEETING/004/Y06057f.htm
25. Gardiner P. R. et Mahmoud M. M., 1990.
Salivarian trypanosomes causing disease in livestock
outside Sub-saharan Africa (1-66). In : Parasitic protozoa, New York: Academic
Press.
26. Geysen G., Delespaux V. et Geerts S., 2002.
PCR-RFLP using Ssu-rDNA amplification as easy method for
species-specific diagnosis of Trypanosoma species in cattle. Veterinary
Parasitology, 2449 : 1-10
27. Gibson W. C., Dukes P. et Gashumba J.K., 1988.
Species-specific DNA probes fort he identification of African
Trypanosomes in tsetse flies. Parasitology,
97: 1-11.
28. Gueye D. A., 2003.
Mise au point d'amorces polyspécifiques amplifiant
l'ITS1 de l'ADN ribosomal par une PCR nested unique pour la détection
des principaux trypanosomes africains pathogènes du bétail.
DEA : Biologie Animale : Université Cheikh Anta Diop de
Dakar.
29. Higuchi R., 1989.
PCR technology (31-37). In principles and applications for DNA
amplification.-Stockton: Stockton Press.
30. Hoare C. A., 1972.
The trypanosomes of mammals. A Zoological Monograph.-Oxford:
Blackwell Scientific Publications.-749 p.
31. Itard J., 2000
Trypanosomoses animales africaines. In Précis de
parasitologie vétérinaire tropicale. Londres, New York,
Paris. : Ed. TEC & DOC.-Ed. med. Int.-773p.
32. Itard, J., 1981
Les trypanosomoses animales africaines. In Précis de
parasitologie vétérinaire tropicale. Paris :
Ministère de la coopération et du développement,
IEMVT.-717p.
33. Kasbari M., 2001.
Intérêts et limites de la PCR pour l'étude
diagnostique et épidémiologique des trypanosomoses animales
africaines. Thèse : Méd. Vét. : Lyon.
34. Kodjo A., Richard Y., Guérin V. et Sangller
J. J., 1993.
Principe de l'hybridation moléculaire, application au
diagnostic microbiologique en médecine vétérinaire.
Actualités scientifiques : L'information du biotechnicien
1, (3) : 9p.
35. Kosum C., Sintawee K. et Nopporn S.,
2002.
PCR-ELISA for diagnostic of Trypanosoma evansi in
animals and vector. Molecular and cellular probes.
16 : 173-177.
36. Kukla B. A., Majiwa P. A. O., Young J. R., Moolo
S. K., et Olé-Moiyoi O. K., 1987.
Use a specific DNA probes for detection and identification of
trypanosomes infection in tsetse flies. Parasitology.
95 : 1-16.
37. Lanhan S. M. et Gdofrey D. G., 1970.
Isolation of salivarian trypanosomes from man and
other mammals using DEAE-cellulose. Exp. Parasitol.
28: 521-534.
38. Larzul, D., 1993
La PCR, un procède de réplication in
vitro.-Paris.-Lavoisier.-387p.
39. Lefrançois T., Solano P., Bauer B.,
Kaboré I., Touré S. M., Cuny G., et Duvallet, G.,
1999.
Polymerase chain reaction characterization of trypanosomes in
Glossina morsitans submorsitans and G. tachinoides collested
on the game ranch of Nazinga, Burkina Faso. Acta Tropica.
72: 65-77.
40. Lefrançois T., Solano P., De La Rocque S.,
Bengaly Z., Reifenberg J. M., Kaboré I., et Cuisance D., 1998.
New epidemiological features on animal trypanosomosis by
molecular analysis in pastoral zone of Sidéradougou, Burkina Faso :
Molecular Ecology. 7 : 897-904.
41. Majiwa P. A. O., Masaké R. A. ,
Nantulya V. M. , Hamers R. et Mathyssens G., 1985.
Trypanosoma (Nannomonas)
congolense: identification of two karyotype groups. Embo. Journal. 4,
12: 3307-3315.
42. Majiwa P.A.O., Thatthi R., Moolo S. K., Nyeko
J.P.H., Otieno L.H., et Maloo S., 1994.
Detection of trypanosome infections in the saliva of tsetse
flies and buffy coat samples from antigenic but aparasitaemic cattle.
Parasitology. 108 : 1-10.
43. Masake R.A., Njuguna J.T., Brown C.C. et Majiwa
P.A.O., 2002.
The application of PCR-ELISA of the detection Trypanosoma
brucei and T. vivax infections in livestock. ElsevierVeterinary
Parasitology, 105 : 179-189.
44. Masiga D.K., McNamara J.J. et Gibson W.C., 1996.
A repetitive DNA sequence specific for Trypanosoma
(Nannomonas) godfreyi. Veterinary Parasitology.
62: 27-33
45. Masiga D. K., Smyth A. J., Hayes P., Bromidge T.
J. et Gibson W. C., 1992.
Sensitive detection of trypanosomes in tsetse flies by DNA
amplification. Int. j. Parasitol. 22:
909-918.
46. Mc Laughlin G. L., Ssenyonga S. S., Nanteza E. et
al., 1996.
PCR based detection and typing of parasites (261-287). In
Parasitology for the 21st Century CAB International. - Wallingford: CAB.
47. Moolo S. K. et Gray M. A., 1989.
New observations on the cyclical development of
Trypanosoma vivax in Glossina. Acta Tropica.
4: 167-172.
48. Moolo S. K., Kabata J. M. et Giitre N. M., 1999.
Study on the mechanical transmission by tsetse fly
Glossina morsitans centralis of Trypanosoma vivax,
Trypanosoma congolense, and Trypanosoma brucei brucei to
goats. Acta Tropica. 74: 105-108.
49. Mooser D. R., Cook G. A., Ochs D. E., Bailey C.
P., Mckane M. R. et Donelson J. E., 1989.
Detection of Trypanosoma congolense and
Trypanosoma brucei subspecies by DNA amplification using the
polymerase chain reaction. Parasitology. 99:
57-66.
50. Mullis K., Faloona F., Scharf S., Saiki R., Horn
G. et Erlich H., 1986.
Specific enzymatic amplification of DNA in vitro: the
polymerase chain reaction. Cold spring Harb. Symp. Quant. Biol.
51: 263-273.
51. Murray M., Murray P. K, et McIntyre W. I. M.,
1977.
An improved parasitological technique for the diagnostic of
African trypanosomosis. Trans. Royal Soc. Trop. Med. Hyg.
71: 325-326.
52. Nyeko J. H. P., Ole-Moiyoi O. K. , Majiwa P.
A. O., Otieno L. H. et Ociba P. M., 1990.
Charaterisation of trypanosomes isolates from cattle in Uganda
by species-specific DNA probes reveals predominance of mixed infections.
Insect. Sci. Appl., 11, 3, 271-280.
53. OIE, 2000.
Trypanosomosis (Tsetse-borne). Classified as an OIE List B
(B113).
Accès Internet:
http://www.oie.int/
54. Oumanwara S. R., Basagoudanavar J. R., S. H.,
Singh R. K. et Butchaiach G., 1999.
A simple and highly sensitive method to detect Trypanosoma
evansi by DNA amplification from crude blood samples collected on filter
papers. Journal of veterinary Parasitology.
13: 27-29.
55. Pangui L. J., 2001.
La trypanosomose, une contrainte majeure de l'élevage
en Afrique Sub-saharienne (30-33). In Utilisation des trypanocides en Afrique
Sub-saharienne, Actes du séminaire sous régional tenu du 06 au 09
février 2001, Dakar, Sénégal.-Dakar : EISMV.-170p.
56. Saïki R. K. , 1989.
Amplification of genomic DNA. In: A guide to methods and
application. Harcourt. - Academic Press.-482p.
57. Saïki R. K., Scharf S., Faloona F., Mullis K.
B., Horn G.T., Elirch H.A., et Arnheim N., 1985
Enzymatic amplification of â-globin genomic sequences
and restruction site analysis for diagnosis of sickle cell anemia. Journal of
Science. 230: 1350-1354.
58. Sidibé I., 1996.
Variabilité génétique de Trypanosoma
congolense, agent de la trypanosomose animale : Implications
taxonomiques et épidémiologiques. Thèse Doct. :
Parasitologie : Université de Montpellier II.
59. Sidibé I., Bengaly Z., Boly H., Ganaba R.,
Desquesnes M. et Sawadogo L., 2002.
Differential pathogenicity of Trypanosoma congolense
subgroups: Implication for the Strategic control of Trypanosomosis. Newsletter
on Intergrated Control of phylogenic Trypanosomes and their vectors (6).
60. Sidibé S., 2001.
Impact économique des maladies sur l'élevage en
Afrique subsaharienne (18-27). In Utilisation des trypanocides en Afrique
subsaharienne. Actes du séminaire sous régional tenu du 06 au 09
février 2001, Dakar, Sénégal.-Dakar : EISMV.-170p.
61. Solano P., Argiro L., Reifenberg J.M., Yao Y. et
Duvallet G., 1995.
Field application of the polymerase chain reaction (PCR) to
the detection and characterization of trypanosomes in Glossina
longipalis (diptera: Glossinidae) in Côte
d'ivoire. Molecular Ecology. 4: 781-785.
62. Solano P., Reifenberg J. M., Delafosse-Amsler S.,
Kaboré I., Cuisance D. et Duvallet G., 1996.
Trypanosome characterization by polymerase chain reaction in
Glossina palpalis gambiensis and G. tachinoides from Burkina
Faso. Med. Vet. Entomol. 10: 354-358.
63. Solano P., Cuny G., Duvallet G., Cuisance D.,
Ravel S., Sidibé I. et Touré S. M., 1997.
Les techniques de génétique moléculaire
au service de l'épidémiologie des trypanosomoses.
Intérêt de l'étude du polymorphisme des microsatellites des
glossines. Rev. Elev. Méd. Vét. Pays Trop.
50, (4) : 297-301.
64. Solano P., Michel J. F., Lefrançois T., De
La Rocque S. Sidibé I. Zoungrana A. et Cuisance D., 1999.
Polymeras chain reaction as a diagnosis tool for detecting
trypanosomes in naturally infected cattle in Burkina Faso. Vet. Parasitol.
86 : 95-103.
65. Sow A. 2004.
Mise au point et validation de la PCR-ELISA pour la
détection de l'ADN de Trypanosoma congolense type savane (TCS).
DEA : Biologie animale : Université Cheikh Anta Diop de
Dakar.
66. Staack C., et Lohding A., 1979.
The complement fixation test and African trypanosomiasis:
Experimental infection and re-infection in cattle before after treatment. Trop.
Med. Parasitol. 30: 13-18.
67. Ventura R. M., Gentilda F. T. et Marta M. G. T.,
1997.
Molecular markers for characterization and identification of
Trypanosoma evansi. FAO animal Production and health Paper.
135: 25-18.
68. Woo P. T. K., 1970.
The haematocrit centrifuge technique for the diagnosis of
African trypanosomiasis. Acta Tropica. 27:
384-386.
ANNEXES
Annexe 1 :
Les souches de trypanosomes utilisées
|
Espèces
|
Code souches utilisées
|
Hôte et lieu d'isolement
|
|
T. vivax
|
TV. Folonzo/02/CIRDES/02
|
Bovin, Burkina Faso
|
|
TV. Zaria 486
|
Bovin, Nigeria
|
|
TV. Sat/87/CRTA/133.3
|
Bovin, Burkina Faso
|
|
T V. Kanfiala
|
Bovin, Burkina Faso
|
|
T. congolense
Type savane
|
TCS Kigoni/ILRAD/776
|
Bovin, Kenya
|
|
TCS Sat/87/CRTA/125.1
|
Bovin, Burkina Faso
|
|
TCS Folonzo/02/CIRDES/01.2
|
Bovin, Burkina Faso
|
|
TCS Kar 83/CRTA/66
|
Bovin, Burkina Faso
|
|
T. congolense type forêt
|
TCF Komoé/87/CRTA/153
|
Bovin, Burkina Faso
|
|
T. brucei
|
T B Folonzo*
|
Bovin, Burkina Faso
|
* T B folonzo est dilué au 1/10e avec de
l'eau distillée.
Annexe 2: Amorces
monospécifiques utilisées dans la PCR classique
|
Nom
|
Séquences
|
Nombre de bases
|
Taille des
Produits PCR (pb)
|
Spécificité
|
Référence
|
|
TVW1
|
5'CTGAGTGCTCCATGTGCCAC-3'
|
20
|
150
|
T. vivax
|
Masiga et al.
(1992)
|
|
TVW2
|
5'CCACCAGAACACCAACCTGA-3'
|
20
|
|
TCS1
|
5'CGAGCGAGAACGGGCAC-3'
|
17
|
316
|
T. congolense
Type savane
|
Masiga et al.
(1992)
|
|
TCS2
|
5'GGGACAAACAAATCCCGC-3'
|
18
|
|
TCF1
|
5'GGACACGCCAGAAGGTACTT-3'
|
20
|
350
|
T. congolense
Type forêt
|
Masiga et al.
(1992)
|
|
TCF2
|
5'GTTCTCGCACCAAATCCAAC-3'
|
20
|
|
NRP1
|
5'CGAATGAATATTAAACAATGCGCAGT-3'
|
26
|
177
|
Trypanozoon
(T. brucei)
|
Moser et al.
(1989)
|
|
NRP2
|
5'AGAACCATTTATTAGCTTTGTTGC-3'
|
24
|
Source : Desquesnes et Davilà
(2002)
Annexe 3 :
Caractéristiques des amorces Tryp 4R et Tryp 4S
|
Amorce
|
Nbre
De base
|
Séquences
|
Tm
°C
|
Taille des produits PCR en pb
|
|
|
|
|
T. vivax
|
T. brucei
T. evansi
T. equiperdum
|
T. congolense type
|
|
savane
|
forêt
|
Kilifi
|
|
Tryp
4R
|
18
|
5'GCTGCGTTCTTCAACGAA-3'
|
46,60
|
|
|
|
|
|
|
Tryp
4S
|
16
|
5'AAGTTCACCGATATTG-3'
|
39,47
|
250
|
480
|
620
|
680
|
720
|
|
Source : Desquesnes et al.
(2002)
|
Annexe 4:
Caractéristiques des sondes retenues candidates pour le test ELISA
|
Espèce
|
Nom
|
Séquences
|
Taille
en nbre de bases
|
T m
°C
|
|
|
T. vivax
|
STV1
|
5'-bTCGCGCCCGTCTCCCGGCCA-3'
|
21
|
73
|
|
STV2
|
5'-bGGCCACCGGGGCGGGACAGCA-3'
|
21
|
73
|
|
STV3
|
5'-bCCGCGCCCCGCGCGCAGGTGGA-3'
|
23
|
80
|
|
T. congolense
Type savane
|
STCS1
|
5'-b TTGTGTGCTCGTGTGCGTACGGT -3'
|
23
|
62
|
|
STCS2
|
5'-bCCGCACGTGGTGGGGTGCT-3'
|
19
|
66
|
|
STCS3
|
5'-bCCGCCCGACGCTTATTGTGT-3'
|
20
|
64
|
|
T. congolense
Type forêt
|
STCF1
|
5'-bACGCGTCTCCATGTCGCTG-3'
|
19
|
62
|
|
STCF2
|
5'-bGTGTGCGCACCGGCTCGGCTCA-3'
|
22
|
71
|
|
STCF3
|
5'-bGTGTTGGGAGAGGACAGAGGGCA-3'
|
23
|
61
|
|
T. brucei
|
STB1
|
5'-bGCCGTTTGACATGGGAGATGAG-3'
|
22
|
58
|
|
STB2
|
5'-bTATTTTCTCCCTGTTGACCACGGCT-3'
|
25
|
61
|
|
STB3
|
5'-bTGTATGTGTTTCTATATGCCGT-3'
|
23
|
47
|
Annexe 5: Concentrations et volumes des
réactifs pour la PCR classique
|
Réactifs et
Echantillon
|
Volume
Individuel (ul)
|
Concentration
|
Concentration
Finale
|
|
Eau distillée
|
6,81
|
-
|
-
|
|
Tampon (10 mM Tris,
1,5 Mm Mgcl2,
50 mM cl)
|
1,10
|
10 X
|
1X
|
|
DNTP
|
0,88
|
2500 uMoles
|
200 uM
|
|
Amorce 1
|
0,55
|
20 uM
|
1 uM
|
|
Amorce 2
|
0,55
|
20 uM
|
1 uM
|
|
Taq polymérase
|
0,11
|
5 UI / ul
|
0,5 UI / ul
|
|
Volume
Master mix
|
10
|
|
|
|
Echantillon / ADN
|
1
|
|
|
|
Volume final
|
11
|
|
|
Annexe 6 : Concentration et volumes des
réactifs pour la PCR avec les amorces Tryp 4R
et Tryp 4S
|
Réactifs et échantillon
|
Volume individuel (ul)
|
Concentration
|
Concentration finale
|
|
Eau distillée
|
7,28
|
-
|
-
|
|
Tampon (10 Tris, 1,5 mM Mgcl2, 50 Mm Kcl)
|
1,40
|
10X
|
1X
|
|
DNTP
|
1,12
|
2500 uMole
|
200 uM
|
|
Amorce 1 (Tryp 4R)
|
0,21
|
20uM
|
0,3 uM
|
|
Amorce 2 (Tryp 4 S)
|
0,21
|
20uM
|
0,3 uM
|
|
DMSO
|
0,70
|
Pur
|
5%
|
|
Taq Polymérase
|
0,08
|
5 UI / ul
|
0,4 UI / 10ul
|
|
Volume Master mix
|
11
|
|
|
|
Echantillon
|
3
|
|
|
|
Volume final
|
14
|
|
|
Annexe 7 : Concentration et volume des
réactifs pour la PCR ELISA
|
Réactifs et échantillon
|
Volume individuel (ul)
|
Concentration
|
Concentration finale
|
|
Eau distillée
|
24,8
|
-
|
-
|
|
Tampon (10 Tris, 1,5 mM Mgcl2, 50 Mm Kcl)
|
4
|
10X
|
1X
|
|
dNTP(DIG-Labeling mix)
|
4
|
2500 uMole
|
200 uM (dATP, dCTP et dGTP)
190 uM (dTTP)
10 uM (DIG-dUTP)
|
|
Amorce 1 (Tryp 4R)
|
0,5
|
20uM
|
0,3 uM
|
|
Amorce 2 (Tryp 4 S)
|
0,5
|
20uM
|
0,3 uM
|
|
DMSO
|
2
|
Pur
|
5%
|
|
Taq Polymérase
|
0,2
|
5 UI / ul
|
0,4 UI / 10ul
|
|
Volume Master mix
|
36
|
|
|
|
Echantillon
(ADN)
|
4
(2)
|
|
|
|
Volume final
|
40
|
|
|
Annexe 8 : Epreuve ELISA pour la
révélation des produits d'amplification
Sensibilisation des
microplaques :
ü Préparer une solution de 1 ug / ul par dilution
de la streptavidine dans le tampon de sensibilisation (35 mM de Na H
CO3, 15 mM de Na2CO3 à pH = 9,6);
ü Introduire dans chaque puits de la plaque
Maxisorp® 100 ul de cette solution;
ü Agiter et incuber la plaque à 37°C pendant
deux heures ou laisser en chambre froide jusqu'au lendemain;
ü Vider le contenu des puits et conserver à
4°C pour une utilisation rapide et à - 20°C pour une longue
conservation.
Blocage des sites
libres :
ü Sortir la plaque du réfrigérateur ou du
congélateur et laisser à la température ambiante;
ü Répartir 100 ul / puits le tampon de blocage;
ü Incuber à 37°C pendant 30 minutes sous
agitation permanente.
Etape d'hybridation :
ü Introduire dans un tube stérile de 250
ul :
· 5 ul de produit PCR
· 20 ul de la solution de dénaturation (NaOH 1 N),
agiter brièvement les tubes avec le vortex et laisser pendant 10 minutes
à 37°C.
· Faire le mélange sonde et tampon d'hybridation,
bien agiter cette solution d'hybridation avec le vortex, repartir 87 ul / puits
de ce mélange et enfin chauffer à 60°C pendant une dizaine
de minutes.
· Ajouter dans les puits de la plaque 12 à 13 ul
du mélange produits PCR et NaOH.
ü Incuber la plaque à 60°C pendant une heure
30 minutes.
Lavage :
ü Vider le contenu de la microplaque,
ü Laver 4 fois avec la solution de lavage,
ü Tapoter légèrement la microplaque sur un
linge sec et stérile afin d'absorber complètement le liquide de
lavage. Casser les bulles d'air formés et bien essuyer la plaque.
Etape du conjugué :
ü Repartir dans chaque puits de la plaque 100 ul de la
solution d'anticorps anti-DIG-POD,
ü Incuber à nouveau sous agitation à
37°C durant 30 minutes.
Lavage :
ü Verser le contenu de la plaque,
ü Laver comme précédemment.
Ajout du substrat :
ü Introduire dans chaque puits 100 ul de substrat
(solution à volume égal de TMB peroxydase et de
H2O2 ou une solution d'ABTS®),
ü Incuber à 37°C pendant 10 à 15
minutes à l'abri de la lumière et avec agitation.
Lecture :
ü Mettre le spectrophotomètre en marche 15 minutes
environ avant la lecture et sélectionner le programme de lecture.
ü Pour arrêter la réaction (non
indispensable), on reparti 100 ul / puits de l'acide sulfurique
(H2SO4 2 N),
ü La lecture se fait à 450 nm et à l'aide
du logiciel PROCOMM.
SERMENT DES VETERINAIRES DIPLOMES DE DAKAR
« Fidèlement attaché aux directives de
Claude BOURGELAT, fondateur de l'enseignement vétérinaire dans le
monde, je promets et je jure devant mes maîtres et mes
aînés :
- d'avoir en tous moments et en tous lieux le souci de la
dignité et de l'honneur de la profession
vétérinaire ;
- d'observer en toutes circonstances les principes de
correction et de droiture fixés par le code de déontologie de mon
pays ;
- de prouver par ma conduite, ma conviction, que la fortune
consiste moins dans le bien que l'on a, que dans celui que l'on peut
faire ;
- de ne point mettre à trop haut prix le savoir que je
dois à la générosité de ma patrie et à la
sollicitude de tous ceux qui m'ont permis de réaliser ma vocation.
Que toute confiance me soit retirée s'il
advient que je me parjure. »
LE (LA) CANDIDAT (E)
VU
LE PROFESSEUR RESPONSABLE
DE L'ECOLE INTER-ETATS DES SCIENCES ET MEDECINE
VETERINAIRES DE DAKAR
VU
LE DIRECTEUR
DE L'ECOLE INTER-ETATS
DES SCIENCES ET MEDECINE VETERINAIRES DE
DAKAR
LE PRESIDENT
DU JURY
VU
LE DOYEN
DE LA FACULTE DE MEDECINE
ET DE PHARMACIE
DE L'UNVERSITE CHEIKH ANTA DIOP
DE DAKAR
VU ET PERMIS D'IMPRIMER____________________
DAKAR, LE__________________________________
LE RECTEUR, PRESIDENT DE L'ASSEMBLEE
DE L'UNIVERSITE CHEIKH ANTA DIOP
DE DAKAR
* 1 On estime que cette maladie
menace plus de 48 millions de bovins dans les pays infestés par les
glossines, le petit nombre de zones exemptes de glossines est surpeuplé
par plus de 170 millions de bovins (FAO, 2002)
* 1 Sans toutefois pouvoir
distinguer les espèces à l'intérieur du sous genre
Trypanozoon (Desquesnes et al., 2001).
* 1 La pression glossinienne est
le produit de la densité apparente des glossines et du taux
d'infestation chez ces glossines.
* 1 La découverte d'une
eubactérie thermophile vivant dans les sources chaudes (70-75°C) du
Yellowstone National Park, Thermus aquaticus et l'utilisation par la
suite de sa polymérase : la Taq polymérase, stable
jusqu'à des températures proches de 100°C, sont à
l'origine du développement de cette technique (Tagu,
1999).
* 1 Le Basic Local Alignement
Search Tool (BLAST) est accessible sur le site Web :
http://www.nbci.nlm.nih.gov
* 1 Le pourcentage GC est
calculé à l'aide du logiciel « Freqsq »
sur Infobiogen.
* 2 Le tampon de charge ou
tampon de dépôt est constitué de glycérol et d'un
colorant (Xylène et bromophénol). Le glycérol
entraîne l'échantillon au fond du puits et le colorant permet de
visualiser le front de migration pendant l'électrophorèse.
* 3 Le SL 100 permet de
connaître la taille des produits obtenus pendant la lecture du gel.
* 1' Parmi ces
échantillons, on a 20 signaux positifs à T vivax et 1
signal positif à T. brucei avec les amorces Tryp4RS
* 2 Il s'agit ici d'une
estimation à minima du coût de la PCR directe et de la PCR-ELISA
sur les ITS, sont donc exclues de cette estimation les différentes
charges fixes de la PCR. L'objectif de cette étude de coût est
d'avoir un aperçu sur une diminution attendue du coût de la PCR
-ITS par rapport à celui de la PCR amplifiant les ADN satellites.



