|







æÒÇÑÉ
ÇáÊÚáíã
ÇáÚÇáí æ
ÇáÈÍË
ÇáÚáãí

ÌÜÇãÚÉ
ÈÜÇÌí ãÎÊÇÑ-
ÚäÇÈÉ
UNIVERSTÉ BADJ MOKHTAR ANNABA
FACULTE DES SCIENCES
DOMAINE SCIENCES DE LA NATURE ET DE LA VIE
DEPARTEMENT DE BIOCHIMIE
LABORATOIRE DE BIOCHIMIE ET MICROBIOLOGIE APPLIQUEES
MEMOIRE DE MASTER
Filière : Biochimie
Spécialité : Biochimie
Option : Biochimie analytique
Contribution à l'étude phytochimique et
biochimique d'un extrait d'ail (Allium sativum) chez le lapin
hyperthyroïdien
Présenté par:
Sofiane BEKKAI & Sofiane MAZOUZI
JURY DE SOUTENANCE:
DRECTRICE DE MÉMOIRE
Lilia DOUAOUYA (CC, Département de Biologie
Moléculaire et Cellulaire, Centre
Universitaire de Khenchela).
PRÉSDENT
Zine KECHERID (Pr, Laboratoire de Biochimie et Microbiologie
Appliquées, Université Badji Mokhtar, Annaba).
ÉXAMNATEUR
Mahfoud MESSARAH (MC, Laboratoire de Recherche en
Eco-physiologie Animale, Université Badji Mokhtar, Annaba).
NVTÉ D'HONNEUR
Noureddine BOUZERNA (Pr, Laboratoire de Biochimie et
Microbiologie Appliquées, Université Badji Mokhtar, Annaba).
PROMOTION : 2010/2011
REMERCIEMENTS
Au nom d'Allah, le Tout Miséricordieux, le
Très Miséricordieux.
<< Gloire à Toi ! Nous n'avons de savoir que
Tu nous as appris. Certes, c'est Toi l'Omniscient, le Sage >>.
Sourate 2 verset 32
O Allah ! Envoie la paix et la bénédiction
sur Abraham, Ismaël, Isaac, Jacob, Moïse, Jésus, sur Mohamed
le sceau des prophètes, ses compagnons, sa famille et tous ceux qui les
suivent sur le bon chemin jusqu'au jour dernier.
Amen.
Gloire à Dieu Tout Puissant qui nous a guidé
par sa grandeur et fait en sorte que nos promesses deviennent une
réalité par ce modeste travail.
Au terme de cette recherche nous sommes très
heureux de pouvoir remercier tous ceux et celles qui nous ont accompagné
et soutenu tout au long de cette aventure.
Nous voudrons tout d'abord remercier notre encadreur,
Melle DOUAOYA Lilia de nous avoir donné la possibilité
de réaliser ce travail, nous vous remercions pour vos conseils
pratiques, techniques et scientifiques tout au long de ce travail.
Nous tenons également à remercier
très vivement Monsieur le Professeur BOUZERNA N, qui nous a accueilli
avec amabilité au sein de son laboratoire de Biochimie et Microbiologie
Appliquée.
Nous tenons à adresser nos sincères
remerciements à Mr KECHRID Z, Professeur au département de
Biochimie qui nous a honorés en acceptant d'être président
de ce jury.
Nos remerciements s'adressent à Monsieur MESSARAH
M, Maître de Conférence au département de Biochimie qui a
accepté de critiquer et d'analyser ce travail.
.
Nos plus vifs remerciements vont également au
Docteur LAOUAR du service d'anatomie pathologique Hôpital IBN ROCHD
Annaba pour son aide.
Tous ceux qui de près ou de loin, ont
contribué directement ou indirectement à la réalisation de
ce modeste travail, que nous n'avons pas pu nommer, trouvent ici nos sentiments
de profonde gratitude.
Un grand Merci à tous nos amis pour les
sympathiques moments qu'on a passés ensemble.
En fin, à nos très chers parents et
frères, Vos encouragements, vos prières et recommandations nous
ont accompagnés tout au long de nos études. Ce modeste travail
est le témoignage de notre reconnaissance et de notre profonde
affection. Nous vous aimons énormément.
RESUME
L'objectif de notre travail est d'étudier l'effet
antithyrotoxique des deux espèces d'Allium sativum locale et
chinoise chez les lapins de la souche locale (Oryctolagus cuniculus
domesticus).
L'étude a été faite sur 20 lapins
mâles répartis en 4 groupes de 5 individus chacun, un groupe
témoin, 3 groupes rendus malades par injection intraperitonéale
de la L-thyroxine sodique à raison de 200 ug/Kg du poids corporel, dont
2 groupes sont traités par l'administration orale de l'extrait de chaque
espèce d'ail séparément à raison de 500mg/kg du
poids corporel.
Après 21 jours de traitement, les lapins sont
sacrifiés, et les différents paramètres sont
déterminés.
A partir des résultats obtenus, on a observé une
chute du poids corporel chez les lapins malades suite à une perturbation
bien claire du métabolisme après l'injection de la thyroxine.
Cela se traduit par une hyperglycémie, une
hypocholestérolémie avec une augmentation hautement significative
de la teneur plasmatique en lipides totaux, par contre la concentration en
protéines totales a diminué.
Concernant les enzymes hépatiques, on a constaté
une augmentation de l'activité enzymatique des transaminases, ainsi que
la PAL, qui s'accompagne avec une élévation du poids relatif du
foie. De plus, l'injection de la thyroxine a montré une diminution du
poids relatif de la glande thyroïde suite à une inhibition de sa
fonction.
Par ailleurs, le traitement des lapins malades par
l'homogénat d'ail notamment l'espèce locale, a restauré
les valeurs de certains paramètres sanguins aux normes.
L'étude phytochimique a montré la richesse d'ail
surtout de l'espèce locale en métabolites secondaires
(saponosides, flavonoïdes, terpènes et stérols) qui lui
confère ses propriétés pharmacologiques.
ABSTRACT
The objective of our work is to study the antithyrotoxic effect
of both sorts (species) of local and Chinese Allium sativum to the
rabbits of the local origin (stump) (Oryctolagus cuniculus
domesticus).
The study was made on 20 male rabbits distributed in 4 groups of
5 individuals each, a group witness (baton), 3 groups made patients by
intraperitonéal injection of sodic L-thyroxin at the rate of 200 ug / kg
of the physical weight, among which 2 groups are treated (handled) by the oral
administration of the extract of every sort (species) of garlic separately for
reason 500mg / kg of the physical weight.
After 21 days of treatment, rabbits are sacrificed, and the
various parameters are determined.
From the obtained results, we observed a fall of the physical
weight to the sick rabbits further to a very clear disturbance of the
metabolism after the injection of the thyroxin. It is translated by a
hyperglycemia, a hypocholesterol level with a highly significant increase of
the plasmatic content in total lipids, on the other hand the concentration in
total proteins decreased.
Concerning the hepatic enzymes, we noticed an increase of the
enzymatic activity of transaminases, as well as ALP, which comes along with a
rise of the relative weight of the liver.
Furthermore, the injection of the thyroxin showed a decrease of
the relative weight of the thyroid gland further to an inhibition of its
function (office).
Besides, the treatment of the sick rabbits by the homogenate of
garlic in particular the local sort (species), restored the values of certain
blood parameters in the standards.
The phytochemical study showed the wealth of garlic especially of
the local sort of secondary metabolites (saponosides, flavonoïdes,
terpenes and sterols) which confers it its pharmacological properties.
Key words: Allium sativum, thyroxin, thyroid,
biochemical parameters, rabbit.
ãáÎÕ
ÇáåÏ ãä
ÚãáäÇ åæ
ÏÑÇÓÉ
ÇáÊËíÑ
ÇáãÖÇÏ
ááÇÑÇØ
ÇáÏÑÞí
áäæÚíä ãä
ÇáËæã
ÇáãÍáí æ
ÇáÕíäí áÏì
ÇáÑÇäÈ ÐÇÊ
ÇáÕá
ÇáãÍáí. æ ÞÏ
ÇÌÑíÊ
ÇáÏÑÇÓÉ Úáì
20 ãä ÐßæÑ
ÇáÑÇäÈ
ãÞÓãÉ Åáì
ÑÈÚ ãÌãæÚÇÊ
ãä ÎãÓ ÅÑÇÏ.
ãÌãæÚÉ
ÇáÑÇäÈ
ÇáÔæÇåÏ
ÈÇáÅÖÇÉ Åáì
ËáÇË
ãÌãæÚÇÊ
ãÚÇãáÉ Úä
ØÑíÞ ÇáÍÞä
ÏÇÎá ÇáÕÇÞ
áãÇÏÉ
ÇáËíÑæßÓíä
ÇáÕæÏí
ÈÌÑÚÉ 200
ãíßÑæÛÑÇã/ßáÛ
ãä ÇáæÒä
ÇáÌÓãí ãäåÇ
ãÌãæÚÊÇä
ÊÚÇáÌÇä Úä
ØÑíÞ Çáã
ÈãÓÊÎáÕ ßá
ãä ÇáËæã
ÇáãÍáí æ
ÇáÕíäí Úáì
ÍÏÉ ÈÌÑÚÉ
500ãÛ/ßÛ ãä
ÇáæÒä
ÇáÌÓãí.
ÈÚÏ 21 íæãÇ
ãä ÇáÚáÇÌ
íÊã ÐÈÍ
ÇáÑÇäÈ
áÊÍÏíÏ ÈÚÖ
ÇáãÚÇííÑ
ÇáÈíæßíãíÇÆíÉ.
ãä
ÇáäÊÇÆÌ :
ßÇä åäÇß
ÇäÎÇÖ í æÒä
ÇáÌÓã ÚÞÈ
ÇáÇÖØÑÇÈÇÊ
ÇáãÑÖíÉ
ááíÖ æÇÖÍÉ
ÌÏÇ ÈÚÏ ÍÞä
åÑãæä ÇáÛÏÉ
ÇáÏÑÞíÉ ÍíË
ÙåÑÊ
ÇáäÊÇÆÌ
äÞÕÇ í ÊÑßíÒ
ÇáßæáíÓÊíÑæá
ÇÑÊÇÚ äÓÈÉ
ÇáÓßÑ í ÇáÏã
ãÚ ÒíÇÏÉ
ßÈíÑÉ
ááÛÇíÉ ãä
ÅÌãÇáí
ãÍÊæì
ÇáÈáÇÒãÇ ãä
ÇáÏåæä
æÇäÎÇÖ
ÊÑßíÒ
ÇáÈÑæÊíä
Çáßáí.
í ãÇ íÎÕ
ÅäÒíãÇÊ
ÇáßÈÏ ßÇäÊ
åäÇß ÒíÇÏÉ í
ÇáäÔÇØ
ÇáÅäÒíãí
ááTGOæ TGP ÖáÇ Úä
ÇáæÓÇÊÇÒ
ÇáÞÇÚÏí
ÇáÐí íÊÑÇÞ
ãÚ ÒíÇÏÉ í
ÇáæÒä
ÇáäÓÈí
ÇáßÈÏ.
ÈÇáÅÖÇÉ Åáì
Ðáß ÙåÑ ÍÞä
åÑãæä ÇáÛÏÉ
ÇáÏÑÞíÉ
ÇäÎÇÖ í
ÇáæÒä
ÇáäÓÈí í
ÇáÛÏÉ
ÇáÏÑÞíÉ ÈÚÏ
ÊËÈíØ
æÙíÊåÇ.
æÚáÇæÉ Úáì
Ðáß ÚÇÏ ÚáÇÌ
ÇáÑÇäÈ
ÈãÓÊÎáÕ
ÇáËæã ÎÇÕÉ
ÇáäæÚ
ÇáãÍáí
ÇáãÚÇííÑ
ÇáÈíæßíãíÇÆíÉ
ááÞíã
ÇáÞíÇÓíÉ.
æÙåÑÊ
ÇáÏÑÇÓÉ
ÇáßíãíÇÆíÉ
ÇáäÈÇÊíÉ
ËÑÇÁ ÇáËæã
ÈãÚÙã
ÇáíÖÇÊ
ÇáËÇäæíÉ
(ÇáÕÇÈæäíä
ÇááÇæäæíÏ
ÊÑÈíä
æÇáÌÇãÏÉ)
ÇáÊí ÊÚØí
ÎÕÇÆÕå
ÇáÏæÇÆíÉ.
ßáãÇÊ
ÏÇáÉ :, Allium sativum
ËíÑæßÓíä,
ÇáÛÏÉ
ÇáÏÑÞíÉ,
ÇáãÚÇííÑ
ÇáÈíæßíãíÇÆíÉ,
ÇÑäÈ .
Liste des figures
|
N°
|
Figure
|
Page
|
|
1
|
Diagnostic étiologique d'une
thyrotoxicose
|
10
|
|
2
|
Allium sativum
|
20
|
|
3
|
Schéma récapitulatif du protocole
expérimental
|
31
|
|
4
|
CCM de l'Allium sativum
|
42
|
|
5
|
Variation du poids corporel
|
45
|
|
6
|
L'effet du traitement sur la variation de la concentration
plasmatique du glucose, des protéines totales, des triglycérides
et des lipides totaux entre les lots expérimentaux (*P = 0,05 ;**P
=0,01 ;***P=0,001)
|
48
|
|
7
|
L'effet du traitement sur
l'activité enzymatique des transaminases plasmatiques (TGO/TGP/PAL)
(* : P= 0.05,)
|
49
|
|
8
|
L'effet du traitement sur l'activité enzymatique de la
phosphatase alcaline (PAL) plasmatique chez les lots expérimentaux
(** : P= 0,01)
|
50
|
|
9
|
L'effet du traitement sur la teneur
sérique en fT4 chez les lots expérimentaux (*** : P=
0,001)
|
51
|
|
10
|
L'effet du traitement sur le poids relatif du foie et de la
thyroïde chez les lots expérimentaux (* : P=0.05, ** :
P=0.01, *** : P= 0,001)
|
52
|
Liste des tableaux
|
N°
|
Tableau
|
Page
|
|
1
|
Screening phytochimique des deux espèces d'ail
|
42
|
|
2
|
Comparaison entre les moyennes du lot T et du lot MNT (M#177;s; n
= 5) test
«t» de Student.
|
43
|
|
3
|
L'effet du traitement sur la variation de la concentration
plasmatique du glucose, du cholestérol, des triglycérides,
protéines totales et des lipides totaux entre les lots
expérimentaux (M#177;s; n= 5)
|
45
|
|
4
|
L'effet du traitement sur l'activité enzymatique des
transaminases (TGO,TGP) et de la phosphatase alcaline (PAL) chez les lots
expérimentaux (M#177;s; n=5)
|
49
|
|
5
|
L'effet du traitement sur la concentration sérique de la
fT4 chez les lots expérimentaux (M#177;s; n=5)
|
50
|
|
6
|
L'effet du traitement sur les poids relatifs du foie et de la
thyroïde chez les lots expérimentaux (M#177;s, n=5)
|
51
|
SOMMAIRE
Résumé (Français)
Résumé (Arabe)
Abstract
Liste des tableaux
Liste des figures
Liste des abréviations
Introduction......... 01
Chapitre 1 : La glande thyroïde et
l'hyperthyroïdie
1. La glande
thyroïde................................................................................02
1.1.
Généralités.....................................................................................................02
1.1.1. Rappels
anatomopathologiques.............................................................
02
1.1.2. Structure des hormones
thyroïdiennes.....................................................02
1.2.
Hormonosynthèse................................................................................02
1.2.1.
Sécrétion.......................................................................................02
1.2.2. Distribution et métabolisme des hormones
thyroïdiennes..............................02
1.2.3. Origine et de durée de vie des hormones
thyroïdiennes.................................03
1.3. Régulation de la fonction
thyroïdienne........................................................03
1.4. Mécanismes d'action des hormones
thyroïdiennes...........................................04
1.5. Effets biologiques des hormones
thyroïdiennes..............................................05
A. Effets sur la croissance et le
développement.................................................05
B. Effets
métaboliques..............................................................................05
C. Effets
tissulaires.................................................................................05
1.6. Dysfonctionnement de la
thyroïde..............................................................05
1.6.1. Dépistage d'un problème
thyroïdien.......................................................05
1.6.2. Pathologies de la
thyroïde...................................................................06
1.6.3.
Hypothyroïdie.................................................................................06
1.6.4.
Hyperthyroïdie................................................................................06
2.
Hyperthyroïdie.....................................................................................07
2.1. Le syndrome de
thyrotoxicose..................................................................07
2.1.1. Bases
physiopathologiques..................................................................07
2.1.2. Manifestation
cliniques......................................................................08
2.1.3. Examens
complémentaires..................................................................08
2.1.3.1. Retentissement de la
thyrotoxicose...................................................08
2.1.3.2. Confirmation de la
thyrotoxicose.....................................................08
2.2. Etiologie des
hyperthyroidies...................................................................09
3. Traitement de la
thyrotoxicose..................................................................11
3.1. Crise aiguë
thyrotoxique..............................................................................................11
3.2.
Orbitopathie........................................................................................11
3.3. Hyperthyroïdie chez la femme
enceinte........................................................11
3.3.1. Thyrotoxicose gestationnelle
transitoire...................................................11
3.3.2. Maladie de
Basedow.........................................................................12
Chaqpitre 2 : Les plantes médicinales
1. La
phytothérapie...................................................................................13
1.1.
Historique.....................................................................................................................13
1.2. Avantages de la
phytothérapie..................................................................14
2. Méthodes d'utilisation et
fabrication...........................................................15
2.1.
Tisane...............................................................................................15
2.2. Poudres et
gélules................................................................................16
2.3. Extraits hydro alcooliques de plantes fraiches ou
alcoolatures..............................16
2.4.
Autres..............................................................................................17
3. Les plantes
médicinales..........................................................................18
3.1. Importance de l'utilisation des plantes
médicinales.........................................18
Chapitre 3 : L'ail (Allium sativum)
1.
Généralités........................................................................................19
1.1. Position
systématique............................................................................19
1.2. Description
botaniques...........................................................................20
1.3. Sous-espèce et
variétés.................................................................................................20
1.4.
Origine..............................................................................................20
2. Conditions de
culture.............................................................................21
3. Récolte et
conditionnement...........................................................................................21
3.1.
Récolte..............................................................................................21
3.2.
Conditionnement..................................................................................22
3.3.
Transformation....................................................................................23
3.4. Emballage et
entreposage........................................................................23
3.5. Contrôle de la
qualité...................................................................................................23
4. Composition et principes
actifs..................................................................24
5.
Utilisation......................................................................................................................24
Matériel et méthodes
1. Etude
phytochimique.............................................................................26
1.1. Origine du matériel
végétal......................................................................26
1.2. Tests préliminaires de la composition
chimique..........................................................26
1.3. Identification par chromatographie sur couche mince
(CCM).....................................28
2. Etude
biologique.................................................................................29
2.1.
Animaux...........................................................................................29
2.2. Enceinte
d'élevage................................................................................29
2.3.
Méthodes...........................................................................................29
2.3.1. Préparation de l'extrait
d'ail.................................................................29
2.3.2. Induction de
l'hyperthyroïdie...............................................................29
2.3.3. Mode de
traitement...........................................................................30
2.3.4. Préparation des
prélèvements..................................................................................30
2.3.5. Dosages biochimiques
sanguins............................................................32
2.3.5.1. Dosage de
glucose.......................................................................32
2.3.5.2. Dosage des
triglycérides...............................................................33
2.3.5.3. Dosage des protéines
totales...........................................................34
2.3.5.4. Dosage des lipides
totaux.............................................................35
2.3.5.5. Dosage de
cholestérol..................................................................36
2.3.5.6. Dosage de la phosphatase alcaline
(PAL)............................................37
2.3.5.7. Dosage de
TGO..........................................................................38
2.3.5.8. Dosage de
TGP.................................................................................................39
2.3.5.9. Dosage de
fT4............................................................................40
3. Etude
statistique...................................................................................41
Résultats et interprétation
1. Etude
phytochimique.............................................................................42
1.1. Tests préliminaires de la composition
chimique..............................................42
1.2. Chromatographie sur couche mince
(CCM)...................................................42
2. Etude
biologique...................................................................................43
2.1. Caractérisation des
paramètres..................................................................43
2.1.1. L'effet de la thyroxine sur les paramètres
étudiés........................................43
2.1.2. Variation du poids
corporel.................................................................45
2.2. L'effet du traitement par l'extrait
d'ail........................................................46
2.2.1. L'effet du traitement sur les paramètres
biochimiques..................................46
2.2.2. L'effet du traitement sur les enzymes
hépatiques.........................................49
2.2.3. L'effet du traitement sur la teneur sérique en
fT4........................................50
2.2.4. L'effet du traitement sur les poids relatifs du foie et
de la thyroïde...................51
Discussion.................................................................................................53
Conclusion et
perspectives..............................................................................57
Références bibliographiques
Liste des abréviations
A: Absorbance
ANOVA : Analyse de la variance à un
critère de classification
ATS : Antithyroïdien
synthétique
CCM: Chromatographie sur couche mince
CRP: Proteine C reactive
fT4: Free T4 (T4 libre)
IV : Intraveineuse
MC : Malade traité par l'extrait
d'ail chinois
ML : Malade traité par l'extrait
d'ail local
MNT : malade non traité
NFS : Numeration et formule du sang
NIS : Na, I symporteur
NMZ : Néomercazole
RF : Rapport frontal
RTSH : Recepteur membranaire de la
TSH
PTU : Propythiouracil
T : Témoin
T4 : tetraiodothyronine
T3: triiodothyronine
Tg : Thyroglobuline
TPO: thyroperoxidase
TSH: Thyroid stimulating hormone
INTRODUCTION
L'hyperthyroïdie est le syndrome clinique qui traduit
l'élévation de la concentration des hormones thyroïdiennes
libres, elle est fréquentes chez les personnes âgées de 20
à 40 ans, plus particulièrement les femmes. Cette maladie peut
engendrer des complications organiques et métaboliques graves.
L'utilisation des médicaments antithyroïdiens dans
le traitement de cette maladie présente un risque pour les patients
suite à leurs effets indésirables.
De ce fait, la recherche des nouvelles substances ayant des
effets antithyrtoxiques devient irréprochable. Pour cela la
phytothérapie constitue une solution intéressante.
Dans notre travail, nous avons visé à
étudier l'ail (Allium sativum) voire ses multiples
propriétés pharmaceutiques dues à sa richesse en
substances bioactives.
Ce travail est subdivisé essentiellement en deux
parties : une partie bibliographique comprenant trois chapitres. Dans le
premier nous avons présenté quelques connaissances sur
l'hyperthyroïdie, le deuxième chapitre détaille la
phytothérapie et son utilisation et le dernier présente la plante
choisie et sa composition en molécules pharmacologiquement actives.
La deuxième partie est pratique où nous allons
nous intéresser à la détermination de la composition
chimique et l'effet antithyrotoxique des deux espèces d'Allium
sativum (locale et chinoise) chez des lapins mâles de la souche
locale Oryctolagus cuniculus domesticus en suivant :
ü Le poids corporel.
ü L'évolution des paramètres biochimiques.
ü Le poids relatif du foie et de la thyroïde.
ü La variation de la concentration sérique de la
fT4.
Et en fin une discussion des résultats obtenus.
1. 1. La glande thyroïde :
1.1.
Généralités :
1.1.1. Rappels anatomopathologiques :
La thyroïde est une glande endocrine située dans
la région cervicale médiane basse, formée de deux lobes
reliés par un isthme, pesant entre 15 et 30 g.
Elle est organisée en follicules d'un diamètre
moyen de l'ordre de 200 micromètres (50 à 500). Les follicules
sont formés par un épithélium simple de cellules
folliculaires (thyréocytes) délimitant une cavité -
l'espace folliculaire - contenant la substance colloïde. Les
thyréocytes, responsables de la synthèse des hormones
thyroïdiennes, représentent plus de 99 % des cellules de la
glande.
Il s'agit de cellules bipolaires (pôle basal et
pôle apical) à double fonctionnement : exocrine vers la
qualité folliculaire et endocrine vers la circulation sanguine.
La thyroïde comporte par ailleurs des cellules claires ou
para folliculaires responsables de la synthèse de thyrocalcitonine
(1).
1.1.2. Structure des hormones
thyroïdiennes :
Les hormones thyroïdiennes possèdent une
même structure organique : la thyronine, formée par deux noyaux
aromatiques reliés par un pont éther. Les hormones se
différencient entre elles par le nombre et la place variables des atomes
d'iode qu'elles portent.
1.2. Hormonosynthèse :
1.2.1. Sécrétion :
Hormones thyroïdiennes :
mono-iodo-tyrosine (MIT) et des di-iodo-tyrosine (DIT). L'iodation de la Tg se
fait au pôle apical, dans la substance colloïde.
La thyroperoxydase intervient également dans le
couplage des précurseurs. La thyroglobuline porteuse d'hormones
thyroïdiennes est alors stockée dans la cavité colloïde
(réserves thyroïdiennes en hormones pour environ deux mois,
permettant de pallier aux variations des apports), la
récupération se faisant par pinocytose en fonction des besoins
périphériques. La sécrétion des hormones
thyroïdiennes se fait après hydrolyse lysosomiale.
1.2.2. Distribution et métabolisme des hormones
thyroïdiennes :
Les hormones thyroïdiennes sont
hydrophobes et se lient donc à des protéines de transport : - non
spécifique : albumine (pour une petite partie), - spécifiques :
TBG - Thyroxin Binding Globulin (pour environ 60 à 75 %) et TBPA -
Thyroxin Binding Pre- Albumin.
Il est important de rappeler que seule la fraction libre,
même très minoritaire (0,01 à 0,03 % de la T4 et 0,1
à 0,4 % de la T3) est active.
La totalité de la T4 circulante provient de la
production thyroïdienne, tandis que la plus grande partie de la T3 est
issue de la conversion périphérique de T4 en T3
1.2.3. Origine et de durée de vie des hormones
thyroïdiennes :
La désiodation périphérique est le fait
d'enzymes :
ü la 5' désiodase qui permet la conversion de T4
en T3 et dont il existe plusieurs types. La 5' désiodase de type 1,
retrouvée dans le foie, le rein, la thyroïde et de nombreux autres
tissus périphériques, est fortement modulée par
l'état nutritionnel.
ü La 5' désiodase de type 2 est présente
dans le système nerveux central, l'hypophyse et la thyroïde. Son
activité est majorée en cas d'hypothyroïdie de façon
à couvrir les besoins du nerveux central en hormones actives.
ü la 5 désiodase transforme la T4 en T3 reverse,
inactive.
La transformation de la T4 en T3 se fait par une
opération appelée monodésiodation qui aboutit à la
production de la T3 active ou d'une forme inactive reverse T3 (rT3) selon
l'enzyme qui en est responsable. La désiodase de type I hépatique
est la principale source de T3. Son inhibition au cours du jeûne est en
grande partie responsable de la diminution de la concentration sérique
en T3. Les désiodases sont des sélénoprotéines. Des
déficiences en sélénium peuvent donc perturber son
fonctionnement et, par suite, favoriser une hypothyroïdie. Chez des sujets
âgés, on observe fréquemment une diminution de la
conversion de T4 en T3 dans les tissus périphériques, avec un
ratio T3/T4 plus faible et une hypothyroïdie manifeste (2).
1.3. Régulation de la fonction
thyroïdienne :
Normalement, la thyroïde maintient les concentrations
hormonales voulues pour que le taux métabolique reste satisfaisant.
À mesure que l'organisme utilise les hormones, la thyroïde les
remplace. Le taux sanguin d'hormones thyroïdiennes est
régulé par une glande, l'hypophyse, située au centre du
crâne, à la base du cerveau. Lorsqu'elle perçoit que le
taux d'hormones thyroïdiennes est trop bas ou trop élevé,
elle ajuste le taux de thyréostimuline (TSH), indiquant ainsi à
la thyroïde la quantité d'hormones qu'elle doit produire. La TSH
stimule la production de T3 (T4) par un récepteur spécifique par
l'intermédiaire d'une augmentation de l'AMPc (2).
Par ailleurs, le statut nutritionnel influence
également la fonction thyroïdienne et en particulier le catabolisme
des hormones.
La TSH agit à différents niveaux :
ü Elle contrôle et stimule les différentes
étapes de l'hormono-synthèse : capture de l'iode, iodation de la
thyroglobuline, pinocytose, hydrolyse de la thyroglobuline et
sécrétion hormonale ;
ü Elle entretient le phénotype des
thyréocytes en régulant l'expression et la synthèse de
thyroglobuline, des pompes à iodures et de la thyroperoxydase ;
ü Enfin, la TSH est un facteur de croissance pour la
thyroïde.
L'axe thyréotrope :
L'autorégulation thyroïdienne correspond à
des mécanismes transitoires permettant :
ü Un blocage de l'iodation et de la
sécrétion en cas d'excès d'iode (effet Wollf-Chaikoff)
ü Une plus grande sensibilité des
thyréocytes à l'action de la TSH en cas de carence en iode.
ü Enfin, la captation d'iode est d'autant plus forte et
plus prolongée que la glande est pauvre en iode et inversement.
L'état nutritionnel conditionne le niveau de
désiodation périphérique. En cas de jeûne, de
dénutrition ou d'hypercatabolisme, la 5' désiodase est
inhibée avec diminution des taux sanguins de T3 et augmentation de ceux
de T3 reverse.
1.4. Mécanismes d'action des hormones
thyroïdiennes :
Après passage transmembranaire, (et
éventuellement conversion de T4 en T3), les hormones thyroïdiennes
vont agir à différents niveaux :
· Sites d'actions nucléaires :
La T3 se lie à un récepteur cytosolique
nucléotrope ; le complexe entre dans le noyau et participe à la
régulation de l'expression génique ;
· Sites d'actions extra nucléaires :
La T3 exerce des actions membranaires avec un effet
facilitateur du métabolisme cellulaire (potentialisation des
récepteurs adrénergiques et des pompes ioniques, facilitation du
passage du substrat énergétiques tels que le glucose et les
acides aminés).
Elle exerce également des effets au niveau de la
mitochondrie avec augmentation de la calorigénèse et de la VO2
(1).
1.5. Effets biologiques des hormones
thyroïdiennes :
A. Effets sur la croissance et le
développement :
· Croissance et développement du système
nerveux central.
· Croissance et développement du
squelette.
B. Effets métaboliques :
· Métabolisme basal.
· Métabolisme glucidique.
· Métabolisme lipidique.
· Métabolisme protéique.
· Métabolisme hydro minéral.
C. Effets tissulaires :
· Au niveau cardiaque : les HT
exercent un effet chronotrope positif et inotrope positif,
l'hypothyroïdien est bradycarde tandis que le l'hyperthyroïdien est
tachycarde.
· Au niveau musculaire : les HT contrôlent la
contraction et le métabolisme de la créatine. La carence en HT
s'accompagne d'une augmentation de volume des muscles squelettiques
(infiltrés par des substances mucoïdes).
· Sur le type digestif :
Ø Les hormones thyroïdiennes favorisent le
transit.
Ø Les HT participent à la régulation de
l'hématopoïèse et du métabolisme du fer,
l'hypothyroïdie s'accompagnant d'une u anémie.
1.6. Dysfonctionnement de la
thyroïde :
La thyroïde présente fréquemment des
dysfonctions, et les symptômes sont souvent subtils.
1.6.1. Dépistage d'un problème
thyroïdien :
La première étape consiste à doser une
TSH. A l'exception de cas très rares, une TSH
normale exclut une hyper ou hypothyroïdie, et la mesure des T3,
T4 n'est pas nécessaire. Les techniques de mesure de la TSH
sont chez nous sensibles et ne posent guère de problème
d'interprétation.
En cas de TSH élevée, une mise
au point supplémentaire est nécessaire. Cette mise au point
tourne essentiellement autour des différentes hypothyroïdies.
En cas de TSH abaissée, une mise au
point supplémentaire est nécessaire. Cette mise au point tourne
essentiellement autour des différentes hyperthyroïdies.
La mesure unique d'une TSH permet dans 99%
des cas une orientation clinique correcte vers:
· Une euthyroïdie.
· Une hyperthyroïdie.
· Une hypothyroïdie.
En cas d'une TSH anormal et /ou d'un examen
palpatoire de la thyroïde anormal, la mise au point par analyses se
poursuit (3).
1.6.2. Pathologies de la
thyroïde :
· Fonctionnement de la thyroïde :
ü Hypo hyper.
· Morphologie thyroïdienne :
ü Goitre.
ü Nodules bénins.
ü Cancers.
1.6.3. Hypothyroïdie :
ü Fréquence 1 à 2 % de population.
ü 15 % des femmes de + 65 ans.
ü Apparition progressive.
· Diagnostic:
ü TSH.
ü T4 (et T3) parfois encore normale.
1.6.4. Hyperthyroïdie :
· 1 % de la population.
· Signes cliniques + francs.
· Risques cardiaques.
· Diagnostic:
ü Dosage de la TSH.
ü T4 (et T3).
2. Hyperthyroïdie :
Définition :
Ensemble des troubles liés à l'excès
d'hormones thyroïdiennes au niveau des tissus cibles:
Syndrome de thyrotoxicose-auquel s'associent des troubles
variés selon l'étiologie (5).
2.1. Le syndrome de thyrotoxicose :
2.1.1. Bases physiopathologiques :
La thyroïde est sous le contrôle de l'hormone
hypophysaire TSH (Thyroid Stimulating hormone) qui stimule, par
l'intermédiaire d'un récepteur membranaire (RTSH) toutes les
étapes de la biosynthèse des hormones thyroïdiennes ainsi
que la croissance de la glande (6).
La biosynthèse des hormones thyroïdiennes requiert
les étapes suivantes
ü Captage de l'iodure par un transporteur
spécifique (NIS: Na, I symporteur).
ü Organification de l'iodure par la
thyropéroxydase (TPO).
ü Biosynthèse des hormones dans la cavité
colloïde des vésicules thyroïdiennes à partir de
l'iodure et de la thyroglobuline (Tg), protéine spécifique
produite par la thyroïde. Cette biosynthèse s'effectue sous
l'influence de la TPO.
Chacune des protéines RTSH, TPO, Tg et peut-être
NIS est susceptible de se comporter comme un auto antigène et être
à l'origine du développement des maladies thyroïdiennes
auto-immunes.
Les hormones thyroïdiennes ont des effets multiples par
liaison de la T3 à son récepteur nucléaire (action
génomique):
ü Effets généraux: augmentation de la
production de chaleur, d'énergie, de la consommation en O2 avec
élévation du métabolisme de base.
ü Effets tissu-spécifiques
ü Cardiovasculaire: vasodilatation (récepteurs
musculaires lisses), augmentation de la contractilité cardiaque et de la
fréquence, d'où augmentation du débit cardiaque (8).
ü Système nerveux: effet certain sur le
développement neuronal du foetus, mécanisme mal connu chez
l'adulte.
ü Muscle squelettique (modulation de la concentration en
calcium du réticulum sarcoplasmique).
ü Augmentation du remodelage osseux au profit de
l'ostéoclasie.
ü Stimulation de la lipogenèse et de la lipolyse
au profit de cette dernière.
ü Stimulation de la néoglucogenèse et de la
glycolyse.
ü Effet hypophysaire: diminution de la transcription du
gène de la TSH.
2.1.2. Manifestation cliniques :
· Leur intensité dépend du degré de
la thyrotoxicose, de sa durée, du terrain.
· C'est l'association de plusieurs troubles qui fait
évoquer le diagnostic
Par ordre de fréquence décroissant
· Troubles cardiovasculaires
· Troubles neuropsychiques
· Thermophobie
· Amaigrissement
· Polydipsie
· Amyotrophie
· Augmentation de la fréquence des selles
· Rétraction de la paupière
supérieure découvrant l'iris avec asynergie
oculopalpébrale
· Gynécomastie chez l'homme, rarement troubles des
règles (de tous types) chez la femme, mais la fertilité est
habituellement conservée (9).
2.1.3. Examens
complémentaires :
2.1.3.1. Retentissement de la
thyrotoxicose :
Perturbations non spécifiques et non constantes, mais
pouvant révéler la maladie:
ü Leuconeutropénie avec lymphocytose relative.
ü Élévation des enzymes
hépatiques.
ü Diminution du cholestérol et des
triglycérides (fonction des chiffres antérieurs).
ü Hypercalcémie pouvant être importante
(12).
ü Discrète hyperglycémie parfois, surtout
aggravation d'un diabète associé.
2.1.3.2. Confirmation de la thyrotoxicose :
ü TSH effondrée, sauf dans certaines
étiologies - rares- (5).
ü L'élévation de la T4 libre et/ou de la T3
libre (il existe des hyperthyroïdies à T3 seule
élevée) permet d'apprécier l'importance de la
thyrotoxicose. Ces dosages sont demandés en 2ème intention en
fonction du résultat de la TSH et du contexte clinique.
2.2. Etiologie des hyperthyroidies :
Une fois le diagnostic de thyrotoxicose posé, se pose
la question de son origine et les causes en sont nombreuses. Parfois le
diagnostic est évident cliniquement (présence d'une orbitopathie
par exemple) dans d'autres cas le diagnostic s'appuie sur les examens
complémentaires (8).
Les causes les plus fréquentes sont:
ü La maladie de Basedow.
ü Le goitre multinodulaire toxique.
ü L'adénome toxique.
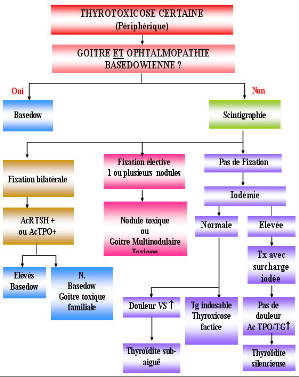
Figure 1: diagnostic étiologique d'une
thyrotoxicose (9).
3. Traitement de la thyrotoxicose :
· Indispensable.
· Antithyroïdiens de synthèse au
début.
· Puis de préférence traitement
définitif par radioiode en raison de la gravité de la
complication et du terrain, en attendant sa pleine action sous couvert
d'ATS.
3.1. Crise aiguë thyrotoxique :
ü Hospitalisation en unité de soins intensifs
ü Mesures générales de
réanimation
ü ATS à forte doses par sonde gastrique
ü Propranolol par voie veineuse
ü Corticoïdes par voie veineuse
ü Voire échanges plasmatiques
Ces traitements doivent être menés en milieu
spécialisé
3.2. Orbitopathie :
Le traitement antithyroïdien n'a aucun effet direct sur
l'orbitopathie qui n'est pas due à la thyrotoxicose, mais l'obtention de
l'euthyroïdie en évitant le passage en hypothyroïdie peut
améliorer l'état orbitaire. L'iode 131 serait susceptible
d'aggraver l'orbitopathie (cf supra).
ü Orbitopathie simple: petits moyens: collyres
protecteurs, port de verres teintés, conseil de dormir la tête
surélevée.
ü Orbitopathie maligne: décision
thérapeutique en milieu spécialisé. On dispose de:
Ø Corticothérapie à forte dose (1-2
mg/kg) puis dose dégressive. Le traitement peut être initié
par des bolus de corticoïdes I V.
Ø Radiothérapie rétro orbitaire.
Ø Chirurgie de décompression.
Ø Chirurgie plastique et reconstructive en cas de
séquelles importantes et après l'épisode inflammatoire.
3.3. Hyperthyroïdie chez la femme
enceinte :
Doit être traitée et surveillée en milieu
spécialisé
3.3.1. Thyrotoxicose gestationnelle
transitoire :
Repos au calme, éventuellement béta bloquants en
attendant la régression spontanée
3.3.2. Maladie de Basedow :
Les ATS passent la barrière placentaire et la
thyroïde foetale est fonctionnelle à partir de la 20ème
semaine.
- Formes mineures: moyens adjuvants (repos) en attendant une
rémission spontanée qui se produit souvent en 2ème partie
de grossesse
- Forme plus importante: on peut employer les ATS à
faible dose de façon à maintenir la femme à la limite de
l'hyperthyroïdie. Le PTU est classiquement préféré au
Néomercazole: il passe autant la barrière placentaire mais il n'a
jamais été décrit de malformation avec ce produit
(très rares aplasies du scalp et malformations oesophagiennes et des
choanes avec le NMZ.
- Forme grave: la thyroïdectomie est possible à
partir du 2ème trimestre après préparation
médicale. Elle est exceptionnellement indiquée.
- Dans tous les cas:
- Surveillance rapprochée de la mère (3
semaines): dosage des hormones, des anticorps.
- Surveillance rapprochée du foetus par
échographie pour dépister une hyperthyroïdie foetale
(tachycardie, goitre, avance de maturation osseuse) par passage
transplacentaire d'anticorps ou un goitre foetal par passage transplacentaire
d'ATS.
- Après l'accouchement:
- Surveillance de la mère: risque de rebond de
l'hyperthyroïdie.
- Surveillance du nouveau né: thyrotoxicose
néonatale ou hypothyroïdie iatrogène.
- Les ATS sont secrétés dans le lait (le PTU
moins que le NMZ), mais à faibles doses, l'allaitement est possible sans
dommage. Son autorisation doit être soumise à un avis
spécialisé (9).
1. La phytothérapie :
La phytothérapie, c'est l'emploi de médicaments
végétaux pour soigner les différents maux dont vous pouvez
être victime.
A travers les siècles, les hommes ont su
développer la connaissance des plantes et de leurs
propriétés thérapeutiques.
Aujourd'hui, l'efficacité prouvée et les
bienfaits incontestables de la phytothérapie pour notre sante lui ont
permis d'entrer dans nos vies de tous les jours (14).
1.1 Historique :
La plante est utilisée comme moyen de guérison
depuis l'antiquité, toutes les populations primitives ont utilisé
de nombreux produits végétaux comme purgatifs, vomitifs,
stomachiques, narcotiques, adoucissants, sucrants..., cela conduisait a des
connaissances qui, transmises d'une génération en
génération, subsistent aujourd'hui dans la médecine
populaire. Bie plus, la pharmacopée moderne elle-même est
redevable de maintes médications de valeur certaine a nos plus lointains
ancêtres
Chez les anciens égyptiens, la matière
médicale était extraordinairement riche en principes d'origine
végétale. Dés les temps homériques, l'Egypte
apparaissait comme une merveilleuse contrée où foisonnaient
plantes médicinales et plantes vénéneuses, on y utilisait
l'oxymel de scille comme vomitif, l'huile de ricin comme purgatif, la grenade
comme vermifuge, l'opium, la mandragore, le benjoin, le styrax, la
résine, etc. C'est aussi par le fameux papyrus Elbers
(XVIe s. av. J-C) que nous connaissons la phytothérapie
de l'antique Egypte.
Celle des indo-européens était très
développée et s'est maintenue surtout chez les hindous, le fameux
soma, qui correspondait à l'ambroisie des Hellènes,
liqueur d'immortalité, se préparait avec le suc d'une plante des
hautes montagnes, du lait, de beurre et de la farine et constituait une boisson
enivrante. Dés ces temps lointains, on trouve pratiquée
allopathie et homéopathie.
Le livre de Caraka, qui semble représenter
l'un des textes médicaux les plus anciens de l'inde,
énumère 500 plantes, et celui de susruta, dont les
origines sont très lointaines, en connait 760, partagées en 68
classes selon la nature des maladies qu'elles peuvent guérir. Aucune de
ces espèces n'est d'origine européenne, ce qui démontre
l'originalité de le phytothérapie hindoue.
On peut presque en dire autant de celle des chinois, qui ne
compte guère qu'une demi-douzaine d'empruntes à
l'étranger, la légende attribue à l'empereur shinon,
qui aurait vécu vers 2800 av. J-C., le plus ancien livre
de la médecine chinoise, où était cité plus de 100
plantes. Le fameux pen-tsao ; qui repose originairement sur ce
livre vénérable, en mentionne plus de 1000, avec
indication de leurs stations préférées, de leur
préparation et de leurs emplois. On sait à quel prix fabuleux se
payait la racine de ginseng, cette panacée aujourd'hui presque
éteinte à l'état sauvage.
Chez les grecs également, on constate, dés les
périodes les plus anciennes l'emploi des espèces
médicinales. La colchide était célèbre
pour sa richesse eb simples et eb plantes vénéneuses, dans
l'Hiade on voit soigner les blessures en y appliquant les herbes
écrasées ou pilées et des racines amères. Dans la
pratique d'hippocrate (460-355 av. J-C) et de son école, les plantes
tiennent une grande place, tant les indigènes que celles
importées de l'inde et de l'égypte, et exclusivement sous forme
de boissons. Théophraste (vers 372-287 av. J-C),
l'élève d'Aristote, peut à juste titre être
considéré comme le fondeur de la phytothérapie
scientifique, il a décrit quelque 500 plantes médicinales et
indiqué leurs propriétés. Chacun sait que Mithridale
VI Eupator, le roi du pont (123-63 av. J-C) se livra à
l'étude des poisons en vue de s'immuniser à l'aide de doses
croissantes.
Aux VIIIe, IXe, Xe
siècles, brille d'un grand éclat la médecine arabe, Jean
damacsène dit Méusé (Iachiâ Ibn Masawâch,
875), Sérapion (Abou séraphioun), Rhazès (Abou Beker
Mohammed Ibn Zacharias, 850-923), Avienne (Ali Ibn el Abès, 994),
Mésué le jeune (VIIe s), Sérapion le jeune
(VIIe s), firent une très large place dans leurs
écrits à la phytothérapie. Ibn el Beïthar
(VIIIe s.), n'a pas décrit moins de 1400 plantes, que pour la
plupart il connaissait personnellement (15).
1.2. Avantages de la
phytothérapie :
L'ethnobotanique est une discipline scientifique dont le but
est de mieux connaitre les pharmacopées traditionnelles
utilisées dans certaines régions. L'inventaire partiel
établi dans divers pays par l'organisation mondiale de la sante
répertorie environ 20 000 plantes médicinales. Parmi les 250 000
espèces de plantes que compte actuellement notre planète, moins
de 10% ont fait l'objet d'analyses chimiques fines pour détecter
d'éventuels principes actifs. Une étude plus systématique
des plantes médicinales pourrait se traduire par la découverte de
nouveaux médicaments utilisables.
Tous les organes d'une plante médicinale ne sont pas
forcement actifs ; suivant les espèces, on utilise les fleurs, les
feuilles, les fruits, les tiges, les écorces ou les racines.
L'époque et le moment de la cueillette ont une grande influence sur
l'activité thérapeutique, car les phénomènes
biochimiques qui ont lieu dans les cellules végétales
dépendent de la photosynthèse et de phénomènes
hormonaux qui dépendent du rythme solaire.
Les substances contenues dans les plantes sont de nature
chimique variée ; certaines sont solubles dans l'eau, d'autres dans
l'alcool éthylique, d'autres encore dans l'huile. A partir des plantes
médicinales, on peut obtenir différentes préparations :
infusions, décoction, macération dans l'alcool (teinture) ou dans
l'huile (extraction huileuse, plus rare), etc. Les plantes peuvent aussi
être consommées entières, fraiches ou sèches,
réduites en débris plus ou moins fins, éventuellement
conditionnées en gélules. Les sèves et secrétions
sont également utilisées dans certains cas. Il est enfin possible
d'en extraire chimiquement des principes actifs en vue de leur utilisation
thérapeutique.
Certaines plantes sont inoffensives, mais d'autres, tilts
nombreuses (digitale, belladone, colchique, etc.), sont toxiques et ne sont
utilisées que sous des formes bien contrôlées,
exclusivement commercialisées en pharmacie. L'emploi
inconsidéré de plantes cueilles dans la nature peut aboutir a des
intoxications graves, voir mortelles (14).
2. Méthodes d'utilisation et
fabrication :
2.1. Tisane :
En phytothérapie traditionnelle, les plantes peuvent
être utilisées fraîches ou, beaucoup plus
fréquemment, sèches. C'est en général une partie
bien précise de la plante qui est employée, en conformité
avec les préconisations des
Pharmacopées
(racine, feuille, fleurs, etc.), la composition chimique d'une plante
étant rarement uniforme (voir :
plantes
médicinales). Ces parties de plantes, entières ou finement
broyées dans un sachet-dose (alias infusette), sont
utilisées pour l'obtention d'une
tisane que l'on peut
préparer par
infusion (on verse de l'eau
chaude sur la plante), par
macération
(la plante est laissée plus ou moins longtemps au contact de l'eau
froide), ou par
décoction (la
plante est laissée plus ou moins longtemps au contact de l'eau
portée à ébullition) (16).
2.2. Poudres et gélules
Des procédés plus récents permettent de
fabriquer des formes plus « modernes », en particulier des
poudres, qu'elles soient obtenues par un broyage classique ou par
cryobroyage.
Ces poudres totales, qui peuvent ensuite être conditionnées sous
la forme de
gélule, ou autre
forme, sont présentées par leurs adeptes comme
représentant « l'intégralité » le « totem
» du végétal. Cela n'est pas faux, mais cela doit être
pris en compte en termes de sécurité : leur composition
diffère de celle des tisanes traditionnelles (qui ne comportent en
principe que les substances hydrosolubles de la plante), et l'on
s'écarte donc de « l'usage traditionnel bien
établi ». On ne peut donc pas exclure qu'elles conduisent
à l'absorption de substances toxiques (ou à des concentrations
trop élevées en actifs). C'est, entre autres, pour cette raison
que la réglementation en vigueur en France demande, dans le cas des
médicaments à base de plante (alias
phytomédicaments, ou médicaments de phytothérapie)
enregistrés auprès de l'Afssaps, que soit réalisée
une expertise toxicologique minimale (16).
2.3.Extraits hydro alcooliques de plantes fraiches ou
alcoolatures :
Un autre procédé, l'
extraction,
permet l'obtention d'une forme pulvérulente (
extrait sec, atomisat),
pâteuse (extrait mou) ou liquide (extrait fluide,
teinture,
teinture-mère)
concentrée en principes actifs. Après le broyage de la plante, la
poudre obtenue est traitée par un solvant, par simple contact ou par
lixiviation. On utilise
généralement de l'eau ou un alcool, ou un mélange
hydro-alcoolique de titre variable, le plus souvent à chaud. Le solvant
est choisi en fonction de la solubilité des principes actifs
recherchés. Cette extraction permet d'isoler tous les actifs et de
conserver leur éventuelle synergie d'action. Le liquide (soluté)
ainsi obtenu est ensuite filtré afin d'éliminer le résidu
insoluble (marc). Puis une phase d'évaporation
généralement sous vide pour éviter une
élévation trop forte de la température - élimine
tout ou partie du solvant. La forme ainsi obtenue :
· est une forme concentrée en principes
actifs ;
· peut être ajustée à une teneur fixe
en principe actif (pour assurer une reproductibilité de
l'action) ;
· peut être incorporée dans une
forme
galénique permettant un usage aisé, y compris en ambulatoire
(gélules, comprimés, solutions, etc.). buvables) ;
Bien entendu, les plantes utilisées pour ces
préparations doivent être de bonne qualité (en
général conforme aux standards de la Pharmacopée).
L'extraction peut en effet, selon la nature du solvant utilisé,
éliminer une partie des contaminants (ex. : pesticide) ou au
contraire les concentrer ...
Lorsque l'extrait est un extrait
hydro-alcoolique de titre élevé, il est
généralement nécessaire que la toxicité du «
médicament de phytothérapie » qu'il permet d'obtenir soit
évaluée avant sa commercialisation.
Pour les plantes ne figurant pas sur la liste de celles qui
peuvent conduire à l'élaboration de ces phytomédicaments,
les médicaments qui en contiennent des extraits -- on n'est plus dans le
strict domaine de la phytothérapie -- doivent satisfaire aux exigences
de l'
autorisation
de mise sur le marché (AMM) standard obligatoire pour tout
médicament ; le cas échéant, ils peuvent être
soumis à une contrainte de délivrance, voire de renouvellement (
ordonnance
médicale)(16) .
2.4. Autres :
On dénombre encore les teintures mères
homéopathiques,
les macéras glycérinés de bourgeons, les
ampoules
buvables et les
huiles
essentielles qui constituent une discipline distincte, l'
aromathérapie.
3. Les plantes médicinales :
En botanique et en pharmacie, les plantes médicinales
sont reconnues pour offrir, par leur administration, un effet bienfaisant et
thérapeutique sur l'organisme. Employées depuis la plus haute
antiquité, souvent en relation avec des pratiques magiques, leurs
propriétés réelles ont, a toute époque,
été exagérées, ou niées, ou
déformées selon les croyances en vigueur. A l'époque
moderne, les projets de la biochimie et de l'analyse organique, ainsi que ceux
de la physiologie végétale, ont permis de commencer un tri
scientifique dans la masse des actions attribuées aux simples,
détruisant certaines légendes, mais établissant solidement
certains usages empiriques anciens. Il est assure que, pour obtenir des
résultats utiles, it convient de se documenter au moyen d'ouvrages
sérieux en vue de l'identification botanique des plantes choisies et de
la vérification de leurs propriétés : certaines
espèces ont des actions parfois différentes, et même
contraires de celles qui leur avaient été attribuées
traditionnellement. Même pour les plantes médicinales qui
répondent bien a leur renommée, le choix des
variétés, celui du terrain sur lequel elles poussent, de la
saison ou de l'heure du jour oïl on les cueille, sont des facteurs tilts
importants, pouvant modifier jusqu'a 100 p. 100 la teneur en principes actifs
physiologiquement (14).
3.1. Importance de l'utilisation des plantes
médicinales :
Il est acquit que les plantes médicinales sont en
mesure de soigner des maladies simples comme le rhume, ou d'en prévenir
de plus importantes comme l'ulcère, la migraine, l'infarctus en plus de
certaines allergies ou affections. Si l'on y ajoute leurs vertus
réparatrices, tonifiantes, sédatives, revitalisantes ou
immunologiques, on mesure mieux l'aide précieuse qu'elles sont
susceptibles de nous apporter au quotidien (14).
1. 1. Généralités :
1.1 Position systématique
(17) :
Classification classique
Règne : Plantae
Sous- Règne : Tracheobionta
Division : Magnoliophyta
Classe : Liliopsida
Sous- Classe : Liliidae
Ordre : Liliales
Famille : Liliaceae
Genre : Allium
Espèce : sativum L
Classification
phylogénétique
Ordre : Asparagales
Famille : Alliaceae
Non scientifique : Allium sativum L
Nom commun : Ail, ail cultivé,
ail à tige tendre, thériaque des pauvres.
Nom vernaculaire arabe :
Ëæã
Parties utilisés : Bulbes.
Les liliaceae sont des monocotylédones cosmopolites,
comprenant plusieurs milliers d'espèces. Vivaces le plus souvent
caractérisées par un rhizome ou par une bulbe, surtout dans les
pays tempérés (ex : tulipe, jacinthe, muguet, oignon, ail,
scille), elles sont parfois un port d'arbre ou de liane dans les pays chauds
(ex : aloès, yucca, dragonnier).
Le genre Allium comprend plusieurs centaines d'espèces
(ex : poireau, oignon, ciboule) originaire de l'hémisphère
Nord.
1.2. Description
botaniques :
L'ail est une plante vivace par son bulbe formé de
caïeux, il ne dépasse pas une cinquantaine de centimètres de
hauteur. Les fleurs blanches ou rosées en ombelle, sont
renfermées avant la floraison dans une spathe membraneuse munie d'une
pointe très longue, les feuilles allongées et plates (18).


 
Figure 02 : Allium sativum
1.3. Sous-espèce et variétés
:
L'ail est une plante herbacée à bulbe
formé de 3 à 15 gousses appelées aussi caïeux, et qui
sont en fait des bourgeons tubérisés par lesquels se fait la
multiplication de la plante. L'ail cultivé se divise en deux
sous-espèces connues sous le nom d'ail à tige dure
(ophioscorodon) et ail à tige molle (sativum).
La première est résistante au froid et
s'acclimate bien à une culture dans les régions plus nordiques.
La seconde est mieux adaptée aux régions chaudes et ne produit
pas de fleurs, sauf en conditions de stress (19).
1.4. Origine :
L'ail provient à l'origine d'Asie centrale. Il y a
environ 10 000 ans, il s'est répandu progressivement en Extrême-,
en Arabie, en Égypte et dans le Bassin méditerranéen,
transporté par les marchands au gré des routes commerciales. Ce
bulbe est sans doute l'un des légumes les plus anciennement
cultivés par l'homme qui l'utilisait autant pour son alimentation que
pour sa santé.
Un lointain ancêtre, Allium longicuspis,
croît encore dans les steppes sauvages en Afghanistan et en Iran. L'ail
des bois ou trilobé, Allium tricoccum, une espèce
indigène en Amérique du Nord, pousse en colonies dans les
érablières et les sous-bois. À la suite d'une
récolte commerciale intensive, il est devenu de plus en plus rare. Au
Québec, il bénéficie d'une protection juridique, à
titre d'espèce vulnérable. Du côté de l'Europe et de
l'Asie, l'ail des ours, Allium ursinum, se rencontre aussi à
l'état sauvage. Cependant, l'ail cultivé, Allium
sativum, ne dérive pas directement des espèces sauvages,
mais plutôt d'une très lente évolution
génétique issue d'un travail de sélection par l'homme. Son
nom viendrait du mot celtique « all » qui signifie chaud,
brûlant (19).
2. Conditions de culture :
La culture de l'ail se fait dans une large gamme de sols, mais
préférablement des sols légers, bien drainés,
riches en matière organique et qui possèdent une bonne
capacité à retenir les éléments nutritifs ainsi que
l'humidité. Les sols lourds ne sont pas recommandés puisqu'ils
ont tendance à durcir lors des périodes sèches et à
limiter l'expansion des bulbes qui prennent une forme
irrégulière. Les sols sableux et trop légers exigent une
régie de culture plus rigoureuse afin d'assurer le maintien de la
fertilité des sols et l'humidité nécessaire. La grosseur
des bulbes est directement liée à la croissance
végétative de la plante : plus la tige sera grande et
développée avant l'initiation du développement du bulbe et
des gousses, plus les rendements seront élevés (Oregon State
University, 2004). Le pH idéal se situe entre 6,5 et 7,0 et le chau lage
doit être ajusté avant la plantation(20).
3. Récolte et
conditionnement :
3.1. Récolte :
La récolte des bulbes se fait de la mi-juillet à
la mi-août, lorsque les feuilles inférieures commencent à
faner et à pointer vers le bas et qu'il reste 5 ou 6 feuilles vertes sur
la tige qui en compte généralement 8 à 10 pour la
variété `Music' utilisée dans les essais. Au-delà
de ce stade, les membranes qui entourent et protègent le bulbe risquent
d'être désagrégées et craquelées, ce qui
nuira à la conservation des bulbes qui risquent de pourrir. Les bulbes
doivent être déterrés pour juger de leur maturité.
Ils doivent être complètement formés et les membranes
doivent mouler le bulbe. À chaque feuille verte qui demeure sur la tige
correspond une membrane intacte sur le bulbe qui le protégera durant la
récolte et l'entreposage. Une récolte plus hâtive est
préférable à une récolte tardive, car elle peut
être compensée par des conditions de séchage et de triage
appropriées. Cependant, les bulbes trop immatures risquent de ratatiner
durant le séchage (19).
3.2. Conditionnement :
La maturation des bulbes prend 7 à 10 jours. Il faut
laisser les bulbes entiers afin de permettre la translocation des sucres de la
tige vers le bulbe. Un premier fanage est effectué en laissant les
plants sur le sol, en les protégeant des intempéries par les
tiges des autres bulbes. Après quelques jours, on peut disposer les
bulbes soit en bottes suspendues ou sur des claies ou treillis dans un endroit
sec, chaud et bien ventilé (20). On peut sécher
les bulbes avec ou sans les tiges. Selon un producteur, les bulbes
séchés avec la tige seront plus fermes et de meilleure
qualité.
Après la récolte, les racines des bulbes ont
été coupées au-dessus du plateau racinaire et leurs tiges
ont été coupées à 5 cm, avant d'être
placées dans des filets à oignons d'un format de 25 kg pour
être séchées dans un silo à grain ventilé.
Cette technique de séchage a donné de très bons
résultats et à peu de frais. Il est important cependant de ne pas
compacter les bulbes (pas plus de 10 ou 12 cm d'épaisseur lorsque le sac
est étalé à plat sur l'aire de ventilation) pour permettre
une bonne ventilation. Dans le silo, le séchage des bulbes entiers prend
environ 15 jours en plus d'une centaine d'heures de ventilation
réparties pendant les périodes chaudes et sèches. Cette
période pourrait être raccourcie si on disposait d'une source de
chaleur localisée à l'admission d'air du silo. Il ne faut pas
laver les bulbes, sous peine d'en affecter la maturation et la conservation.
Les bulbes malades ou endommagés doivent être
séparés immédiatement des bulbes sains.
Lorsque les bulbes sont secs, que les cols sont scellés
et que les membranes sont sèches et cassantes, l'excédent de
terre ainsi que les membranes endommagées doivent être
enlevés par brossage léger ou en supprimant quelques pelures.
Cette étape peut être effectuée juste avant la vente, en
enlevant ces parties avec un aspirateur tout en brassant les bulbes. Il est
important de conserver le plus de membranes intactes possible (19).
3.3. Transformation :
L'ail destiné au marché médicinal doit
être transformé rapidement après le séchage des
bulbes, afin de conserver la teneur en principes actifs. En effectuant cette
transformation rapidement, on limite également les impacts que
l'évolution physiologique de l'ail pourrait avoir sur l'apparence du
produit fini. En effet, le marché recherche une poudre d'ail blanche qui
pourrait être difficile à obtenir si l'ail a commencé
à germer avant la transformation.
Il y existe une grande variation dans la teneur en principes
actifs entre l'ail frais et l'ail transformé en fonction des techniques
de transformation et de l'endroit où l'ail a été
cultivé. Les suppléments d'ail retrouvés sur le
marché sont à base d'ail frais, déshydraté,
lyophilisé ou d'huile (19).
3.4. Emballage et entreposage :
Les bulbes d'ail doivent être entreposés dans un
endroit dont le taux d'humidité se situe entre 50 et 60 % et dont la
température est de 18 à 21° C. L'ail `Music' se conserve
bien d'une récolte à l'autre. Il faut éviter de laisser
les bulbes au froid sauf s'ils servent à l'implantation d'une nouvelle
production (20).
Conserver les bulbes dans un milieu trop humide est propice
à la sporulation des moisissures de l'espèce Penicillium
qui présente une couleur bleu-vert entourée de
mycélium et une humidité trop faible causera la
déshydratation des bulbes. Il est important de maintenir la
température et le taux d'humidité toujours constants afin
d'éviter l'induction de la germination. Une bonne circulation d'air
entre les bulbes favorise la durée de la conservation. Les sacs
d'oignons ajourés sont idéals pour l'entreposage.
3.5. Contrôle de la
qualité :
Le contrôle de la qualité est en premier lieu
organoleptique : l'arôme, la saveur, et la couleur du produit frais ou
transformé font foi des bonnes pratiques qui ont été
appliquées de la récolte jusqu'à la vente du produit
final.
Toute odeur, trace ou présence d'insectes ou de
moisissures peut évidemment disqualifier le produit auprès des
acheteurs. La détection visuelle de corps étrangers et de
matériel végétal douteux peut entraîner le refus
d'un lot par l'acheteur. En ce qui concerne les bulbes d'ail, la qualité
du produit séché est très importante pour assurer la mise
en marché. Les résultats des analyses microbiologiques doivent
respecter les normes.
La propreté et les conditions d'hygiène lors de
la culture, de la récolte et de toutes les étapes de
transformation subséquentes sont très importantes, d'autant plus
que le produit est destiné à la consommation humaine pour le
maintien de la santé. Le meilleur moyen de prévenir les refus de
produits et les atteintes à la réputation, qui peuvent
anéantir des années d'efforts, est d'implanter un système
rigoureux et complet de gestion de la qualité, de l'utiliser et de le
tenir à jour.
Les ennemis du maintien de la qualité durant le
transport sont la rupture des emballages, l'humidité et les odeurs
étrangères. Les emballages de transit doivent aussi
protéger la matière première de toute contamination.
Ainsi, les transporteurs doivent se porter garants de la
propreté des véhicules pour l'intégrité des
produits, à l'aide de connaissements de livraison.
L'exposition au gel ou à des excès
d'humidité peut permettre l'entrée de vapeur d'eau dans les
emballages et occasionner de la condensation à l'intérieur. Il
est donc préférable durant la saison froide que les transporteurs
utilisent des boîtes de transport tempérées et
isolées.
Chaque récolte doit faire l'objet d'une analyse
microbiologique comprenant les paramètres suivants : compte total;
levures et moisissures; E.coli; Staphylococcus aureus; Pseudomonas
aeruginosa; Salmonella spp. Selon la quantité
récoltée, il peut être nécessaire de prélever
plusieurs échantillons dans des lots différents (20).
4. Composition et principes actifs :
Toute la plante contient une huile essentielle à action
antibiotique composée d'allicine, de sulfides, diallyle, d'une
enzyme : l'alliinase, de divers ferments, de vitamines A1, B1, B2
et de nicotylamid (15). comme l'oignon l'ail est riche en fructanes
(jusqu'à 75% du poids sec) et pour cette raison diurétique (18).
5. Utilisation :
L'ail est cultivé depuis des milliers d'années
autant pour une utilisation culinaire que médicinale. Il compte parmi
les plantes médicinales les plus anciennes. Durant la Première
guerre mondiale, l'ail a été utilisé pour combattre le
typhus et la dysenterie, ainsi que comme désinfectant pour les plaies.
On utilisait même le jus d'ail cru dilué afin d'éviter la
gangrène. Durant la Seconde Guerre mondiale, les Russes, à court
d'antibiotiques, utilisaient massivement l'ail, qui fut alors appelé
« pénicilline russe ».
De nombreuses études scientifiques ont porté
sur les différents effets thérapeutiques attribués
à l'ail. Les recherches ont permis de démontrer que l'allicine
est l'un des principaux composants responsables de certains de ses effets
thérapeutiques. Lorsque l'ail est broyé ou haché,
l'alliine, un composé inactif et sans odeur, est transformé par
une enzyme, l'allinase, en allicine qui serait plutôt un composé
transitoire rapidement transformé en d'autres composés
sulfurés qui, eux, sont actifs dans l'organisme (21).
Cette distinction est importante, car les produits à base d'extraits
d'ail qui sont offerts sur le marché affichent une teneur en allicine
standardisée. Pour le producteur, la possibilité de faire
analyser la teneur en ingrédients actifs de ses produits peut
s'avérer importante afin de répondre aux exigences d'un
éventuel acheteur.
Parmi ses nombreuses vertus médicinales, le bulbe d'ail
et ses produits dérivés peuvent contribuer à faire baisser
le taux de lipide sanguin (cholestérol) (22), et la pression
artérielle, ainsi qu'à prévenir les troubles circulatoires
(23). Selon les recherches, il abaisse le taux de sucre sanguin et
empêche la formation de caillots en fluidifiant le sang
(24). L'ail possède également des
propriétés antibiotiques et antioxydantes (25).
Il entre dans la composition de remèdes contre les affections
respiratoires et bronchiques.
Sur les organes digestifs, l'ail agit comme antiseptique tuant
certaines bactéries, transformant par là la flore intestinale en
faisant prédominer les espèces banales sur les formes
pathogènes. C'est ainsi ses excellents effets contre la diarrhée,
et son action antidiurétique dans les hydropisies (15).
Les usages culinaires de l'ail sont nombreux. Aujourd'hui, les
bulbes sont utilisés frais mais aussi séchés, en granules
ou en poudre comme condiment. Les gousses entières peuvent être
cuites à la vapeur ou au four. Le sel d'ail est très
utilisé pour aromatiser les aliments.
Depuis quelques années, on trouve sur le marché,
des fleurs d'ail qui sont en fait les hampes florales coupées dès
leur apparition. Elles sont consommées cuites ou marinées et sont
particulièrement appréciées par les Orientaux.
Au jardin, l'ail est utilisé comme fongicide,
insecticide et répulsif général. Il peut être
associé au chou, à l'aubergine et à la tomate. Par contre,
il ne doit pas être planté près de légumineuses
comme les pois et les haricots.
1. 1. Etude phytochimique :
1.1. Origine du matériel
végétal :
Le matériel végétal est constitué
d'une racine à bulbe d'une espèce locale (algérienne)
cette dernière est récoltée de la région de
Chefachefa de la wilaya d'El-Taref le mois de juin en 2010, La plante
fraichement récoltée est conservée à l'ombre dans
un endroit sec et aéré, et d'une racine à bulbe d'une
espèce étrangère (chinoise) vendue sur le marché
algérien.
1.2. Tests préliminaires de la composition
chimique :
Dans ce travail, nous avons appliqué les tests
préliminaires sur les deux espèces d'ail (Algérien et
chinois).
Ø Quinones libres :
Un gramme de matériel végétal sec et
broyé est placé dans un tube avec 15 à 30 ml
d'éther de pétrole. Après agitation et un repos de 24 h,
les extraits sont filtrés et concentrés au rotavapor. La
présence de quinones libres est confirmée par l'ajout de quelques
gouttes de NaOH 1/10, lorsque la phase aqueuse vire au jaune, rouge ou violet
(26).
Ø Alcaloïdes :
Préparation d'extraits
méthanoliques :
Deux grammes de matériel végétal, sec et
broyé, sont ajoutés à 100 ml de méthanol 50 %.
Après une sonication de 15 min et agitation toute la nuit, les extraits
sont filtrés et évaporés à sec à l'aide d'un
évaporateur rotatif. Les résidus sont repris dans quelques ml de
méthanol pur. Ces extraits sont soumis aux deux tests suivants.
Test de Mayer :
À 0,5 g de matériel végétal en
poudre, on ajoute 15 ml d'EtOH 70 %. Après une sonication de 15 min et
une agitation de 20 h, on laisse reposer l'extrait jusqu'à
décantation complète, suivie d'une filtration et d'une
évaporation à sec. Le résidu est repris dans quelques ml
d'HCl 32 %.
La formation d'un précipité jaune, après
ajout de quelques gouttes du réactif de Mayer (mercuritétraiodure
de potassium), témoigne de la présence d'alcaloïdes (26).
Ø Terpénoïdes :
À un gramme de poudre ajouter 20 ml d'éther et
laisser macérer 24 heures puis filtrer. Prélever 10 ml du filtrat
précédant que l'on évapore à sec, dissoudre le
résidu dans un
ml d'anhydride acétique puis ajouter un ml de
dichlorométhane et repartir la solution entre deux tubes à essai.
A l'aide d'une pipette ajouter un ml de H2SO4 concentré au fond du tube
sans agiter. La formation d'un anneau rouge brunâtre à la zone de
contact des deux liquides et une coloration violette de la couche surnageante
revèlent la présence de stérols et
triterpènes : c'est la réaction de Liebermann Buchard
(27).
Ø Saponosides
Leur présence est déterminée
quantitativement par le calcul de l'indice de mousse, degré de dilution
d'un décocté aqueux donnant une mousse persistante dans des
conditions déterminées. Deux grammes de matériel
végétal sec broyé à tester sont utilisés
pour préparer une décoction avec 100 ml d'eau. On porte à
ébullition pendant 30 min. Après refroidissement et filtration,
on réajuste le volume à 100 ml. À partir de cette solution
mère, on prépare 10 tubes (1,3 cm de diamètre interne)
avec 1, 2, ... 10 ml, le volume final étant réajusté
à 10 ml avec de l'eau distillée.
Chacun des tubes est agité avec énergie en
position horizontale pendant 15 secondes. Après un repos de 15 min en
position verticale, on relève la hauteur de la mousse persistante en cm.
Si elle est proche de 1 cm dans le Xème tube, alors l'indice de mousse
est calculé par la formule suivante : I= hx . 5/0.0X
I : indice de mousse
hx : hauteur de mousse (en cm) dans le
X
X : position de tube
La présence de saponines dans la plante est
confirmée avec un indice supérieur à 100 (26).
Ø Coumarines
Test de détection : 2 g de matériel
végétal en poudre sont mélangés à
10 ml de CHCl3. Après un chauffage de quelques min et
une filtration, les extraits chloroformiques sont soumis à une CCM1, le
solvant étant le mélange toluène / AcEt (93:10). La
visualisation du chromatogramme, après migration, se fait à 365
nm en absence et en présence de NH3.
Test de confirmation : 1 g de poudre
végétale est placé dans un tube, en présence de
quelques gouttes d'eau. Les tubes sont recouverts avec du papier imbibé
de NaOH dilué et sont portés à ébullition. Toute
fluorescence jaune témoigne de la présence de coumarines
après examen sous UV (26).
Ø Flavonoïdes
a. Préparation des extraits :
100 ml de n- hexane sont ajoutés à 20 g de
poudre dans une fiole. La mixture est mélangée, couverte et
laissée reposer pendant 24h, puis filtrée sur papier filtre
Wattman stérile. Le filtrat jaune obtenu est concentré à
10 ml dans un bain-marie.
L'extrait concentré est refroidi et conservé au
réfrigérateur. Répéter la même
opération avec de l'éthyle acétate et de l'eau
distillée.
L'extrait aqueux est jaune pâle. L'extrait
acétate d'éthyle est vert foncé.
b. Un ml de NaOH à 10% est
ajouté à 3 ml d'extraits (aqueux, hexanique et acétate
d'éthyle précédemment préparés).
L'observation d'une coloration jaune dans l'extrait acétate indique la
présence de flavonoïdes (27).
Ø Tanins
1,5 g de matériel végétal sec sont
placés dans 10 ml de MeOH 80 %. Après 15 minutes d'agitation, les
extraits sont filtrés et mis dans des tubes. L'ajout de FeCl3 1 % permet
de détecter la présence ou non de tanins. La couleur vire au bleu
noir en présence de tanins galliques et au brun verdâtre en
présence de tanins catéchiques (26).
1.3. Identification de l'Alliine par chromatographie
sur couche mince (CCM) (15) :
Support : Gel de silice 60 F254
(séché à Lair) (Merk ; 5x10, feuille).
Solution à examiner :
Mélanger 1 g de la poudre d'ail avec 5 ml de
méthanol, agiter environ 1 min et filtrer. Le filtrat obtenu sert de
solution à examiner.
Solution de référence :
Dissoudre en chauffant 5 mg d'alanine dans 5 ml de
méthanol et avec quelques gouttes d'eau.
Dépôts :
20 ul de chaque solution à examiner et 10 ul de
solution de référence.
Solvants d'élution :
Ethanol- isopropanol- eau- acide acétique glacial
(8 : 4 : 4 :4) (cuve saturée)
Développement : 8 cm
Durée : 60 min environ
Détection :
Après évaporation complète du solvant
(sous courant d'air chaud) pulvériser une solution à 0,2% de
ninhydrine dans un mélange isopropanol - acide acétique
(95 : 5) et chauffer pendant 5 min à 120°C.
2. Etude biologique :
2.1. Animaux :
Nous avons travaillé sur 20 lapins mâles de
la souche locale Oryctolagus cuniculus domesticus (43), provenant de
la région de morsott (Tébessa). A leur arrivée, ces lapins
pesaient entre 600 et 700 g.
2.2. Enceinte d'élevage :
Les lapins sont élevés dans des
cages collectives métalliques grillagées munie par une mangeoire
et d'un flacon d'eau. Ces cages ont été nettoyées chaque
jour. Les lapins sont acclimatés pendant une semaine aux conditions de
l'animalerie (université d'Annaba). Ces animaux ont libre accès
à la nourriture et à l'eau.
2.3. Méthodes :
2.3.1. Préparation de l'extrait
d'ail :
La poudre est préparée en fragmentant
rapidement l'ail (flocons d'environ 5 mm d'épaisseur) et en le
séchant immédiatement à environ 60°C, la poudre
à été suspendue dans l'eau distillée pour obtenir
l'homogénat. La concentration de l'extrait
préparé est de 0,2 mg/ml qui correspond à 500 mg /
kg du poids corporel (42).
2.3.2. Induction de l'hyperthyroïdie
:
L'hyperthyroïdie a était induite chez les lapins
par injection intra-péritonéale journalière d'une
solution de L-thyroxine à raison de 200 ug/kg du poids corporel
dissoute dans l'eau physiologique, pendant une semaine(28).
2.3.3. Mode de traitement :
Dans la présente étude; 20 lapins mâles
(15 malades et 5 normaux) ont été répartis en 4 lots de 5
lapins chacun aussi homogènes que possible en fonction de leurs poids.
L'extrait d'ail a été administré aux lapins par voie orale
d'une façon quotidienne à un temps fixe (10.00h matin) pendant 21
jours.
· Lot T : Témoin sain
reçoit l'eau distillée.
· Lot MNT : Malade non
traité reçoit l'eau distillée.
· Lot ML: Malade
traité ; reçoit l'extrait d'ail local.
· Lot MC : Malade traité ;
reçoit l'extrait d'ail chinois.
Le poids corporel des lapins a
été pris avant chaque prise du traitement.
2.3.4. Prélèvements :
Après 21 jours du traitement, les
lapins sont sacrifiés le matin. Le sang est immédiatement
recueilli dans 2 tubes, un entre eux contenant l'héparine qui subit une
centrifugation 3000 tours/ min pendant 15 minutes. Le plasma obtenu a servi au
dosage des paramètres biochimiques, et un autre étant sec qui a
subi également une centrifugation, le sérum a servi au dosage de
FT4.
Après décapitation et dissection des lapins, le
foie et la thyroïde sont prélevés, débarrassés
de leurs tissus adipeux, rincés dans une solution de chlorure de sodium
(Na Cl) à 0.9% puis pesés.
20 lapins mâles répartis en 4
lots
(5 lapins/ lot)
Induction de l'hyperthyroïdie par L-thyroxine 200
ug/kg
Après adaptation
Lot T Lot MNT
Lot MC Lot ML
Reçoit l'eau distillée
Traité par l'extrait d'ail chinois
(500 mg/kg)
Traité par l'extrait d'ail local
(500 mg/kg)
Reçoit l'eau distillé
Traité par l'extrait d'ai Traité 'ail 500 mg/kg (P.C)
Durée du traitement
(21jours)
Décapitation
Récupération du sang
Extraction des organes
Tube sec tubes à
héparine (Foie) (thyroïde)
Dosage de FT4 Dosage des
calcul du poids calcul du poids
Paramètres relatif relatif
Biochimiques
Figure 3 : Schéma
récapitulatif du protocole expérimental
2.3.5. Dosages biochimiques
sanguins :
2.3.5.1. Dosage de glucose : selon la
fiche technique Spinreact
a- Principe :  
Le glucose est mesuré après une oxydation
enzymatique en présence du glucose oxydase. Le peroxyde
d'hydrogène formé réagit grâce à l'action
catalytique d'une peroxydase, avec un phénol et la 4- amino-
phénazone pour former un composé rouge violet de
quinonéimine qui sert d'indicateur coloré, selon les
réactions suivantes (29,30) :
GOD
   B-D- Glucose + O2 + H2O
Acide gluconique + H2O2 B-D- Glucose + O2 + H2O
Acide gluconique + H2O2
POD
2H2O2+ phénol + 4-
aminophénazone Quinonéimine
+ 4 H2O
b- Echantillon : Plasma.
c- Les réactifs
utilisés :
|
Réactifs
|
Composition
|
Concentration
|
|
Réactif (R1)
Tampon
|
TRIS pH 7,4
phénol
|
92 m mol/ L
0,3 m mol/ L
|
|
Réactif (R2)
Enzymes
|
Glucose oxydase (GOD)
Peroxydase (POD)
4- aminophénazone (4- AP)
|
15000 U/L
1000 U/L
2,6 m mol/ L
|
|
Etalon
|
Glucose
|
100 mg/dl
|
d- Mode
opératoire :
|
Blanc
|
Etalon
|
Echantillon
|
|
Réactif (ml)
|
1,0
|
1,0
|
1,0
|
|
Etalon (ul)
|
-
|
10
|
-
|
|
Echantillon (ul)
|
-
|
-
|
10
|
-Mélanger et incuber pendant 10 min à
37°C.
-Lire l'absorbance optique à 500 nm de l'étalon
et de l'échantillon contre le blanc dans les 30 minutes.
e- Calcul :
La concentration du glucose plasmatique est calculée
par la formule suivante :
[Glucose] (mg/dl) = 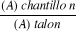 x 100 (concentration de l'étalon). x 100 (concentration de l'étalon).
2.3.5.2. Dosage des
triglycérides : selon la fiche technique Spinreact.
a- Principe :
Les triglycérides sont déterminés
après une hydrolyse enzymatique par les lipases. L'indicateur est une
quinone formée d'après les quatre réactions suivantes
(31,32) :
Lipoprotéine
lipase
Triglycérides + H2O Glycérol+
Acide gras libres
Glycérol kinase
Glycerol + ATP Gl
Glycérol -3- phosphate + ADP
Glycérol-3-P
oxydase
Glycerol -3-P+O2
Dihydroxyacétone- P+ H2O2
POD
H2O2 + 4-AP+ P- Chlorophénol
Quinone + H2O
b- Echantillon : Plasma.
c- Les réactifs
utilisés :
|
Réactifs
|
Composition
|
Concentration
|
|
R1
Tampon
|
GOOD pH 7,5
P- chlorophénol
|
50 m mol/L
2 m mol/ L
|
|
R2
Enzymes
|
Lipoprotéine Lipase (LPL)
Glycérol kinase (GK)
Glycérol-3- P- Oxydase (GPO)
Peroxydase
4-Aminophénazone (4-AP)
ATP
|
150000 U/L
500 U/L
2500 U/L
440U/L
0,1 m mol/ L
0,1 m mol/ L
|
|
Etalon
|
Triglycérides
|
200 m mol/L
|
· Préparation du réactif de
travail (RT) :
- Dissoudre le contenu du réactif R2 dans la fiole de
réactif R1.
- Mélanger bien la solution jusqu'elle devient
homogène. Ce réactif est stable pendant 6 semaines à
2-8°C ou une semaine à la température ambiante.
d- Mode opératoire :
|
Blanc
|
Etalon
|
Echantillon
|
|
RT (ml)
|
1,0
|
1,0
|
1,0
|
|
Etalon (ul)
|
-
|
10
|
-
|
|
Echantillon (ul)
|
-
|
-
|
10
|
- mélanger et incuber les tubes pendant 10 min à
15-25°C.
- Lire l'absorbance (A) de l'échantillon et de l'talon
contre le blanc à 505 nm dans les 30 minutes.
e- Calcul :
[Triglycérides]
(mg/dl) = 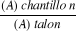 x 200 x 200
2.3.5.3. Dosage des protéines
totales : selon la fiche technique Spinreact.
a- Principe :
Les ions cuivriques, dans un milieu alcalin, interagissent
avec les liaisons peptidiques des protéines formant un complexe bleu
violet où l'intensité de la couleur est proportionnelle à
la quantité des protéines plasmatiques (33,34).
b- Echantillon : Plasma.
c- Les réactifs
utilisés :
|
Réactifs
|
Composition
|
Concentration
|
|
R
Biuret
|
Sodium potassium tartrate
Sodium iodique
Potassium iodique
Cuivre de sulfate
|
15 m mol/ L
100 m mol/ L
5 m mol/ L
19 m mol/L
|
|
Etalon
|
Sérum bovine albumine
|
7 g/ dl
|
d- Mode opératoire :
|
Blanc
|
Etalon
|
Echantillon
|
|
R (ml)
|
1,0
|
1,0
|
1,0
|
|
Etalon (ul)
|
-
|
25
|
-
|
|
Echantillon (ul)
|
-
|
-
|
25
|
- Agiter bien les tubes et les incuber 10 min à la
température ambiante.
- Lire l'absorbance (A) de l'échantillon et de
l'étalon contre le blanc à la longueur d'onde 540 nm.
e- Calcul :
[Protéines totales]
(g/dl) =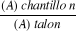 x 7 (concentration de l'étalon) x 7 (concentration de l'étalon)
2.3.5.4. Dosage des lipides totaux :
selon la fiche technique Spinreact
a- Principe :
Les lipides totaux forment avec le phosphovainilline et en
présence de l'acide sulfurique un complexe coloré,
l'intensité de sa couleur est proportionnelle à la concentration
des lipides totaux dans les échantillons (35,36).
b- Echantillon :
Plasma.
c- Les réactifs
utilisés :
|
Réactifs
|
Composition
|
Concentration
|
|
R
|
Phosphovainilline
|
235 m mol/ L
|
|
Etalon
|
Lipides totaux
|
750 mg/ dl
|
|
Réactif optionnel
|
Acide sulfurique
|
80%
|
d- Mode opératoire :
|
Blanc
|
Etalon
|
Echantillon
|
|
H2SO4 (ml)
|
2,5
|
2,5
|
2,5
|
|
Etalon (ul)
|
-
|
100
|
-
|
|
Echantillon (ul)
|
-
|
-
|
100
|
-Mélanger bien et incuber les tubes à essai
pendant 10 min dans un bain marie à 100 °C.
|
Blanc
|
Etalon
|
Echantillon
|
|
H2SO4 (ml)
|
1,0
|
1,0
|
1,0
|
|
Etalon (ul)
|
-
|
-
|
50
|
|
Echantillon (ul)
|
-
|
50
|
-
|
-Lire l'absorbance (A) des échantillons à 520 nm
après une incubation pendant 15 min à 37°C.
e- Calcul :
[Lipides totaux] (mg/dl)
=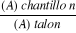 x 750 x 750
2.3.5.5. Dosage de cholestérol :
selon la fiche technique Spinreact
a- Principe :
Le cholestérol présent dans
l'échantillon forme un complexe coloré selon les réactions
suivantes (115,116) :
Cholestérol
estérase
Cholestérol ester + H2O
Cholestérol + Acides gras
Cholestérol
oxydase
Cholestérol + O2 4-
Cholésténone + H2O2
POD
2H2O2 + Phénol + 4-
Aminophénazone Quinoneimine + 4 H2O
b- Echantillon : Plasma.
c- Les réactifs
utilisés :
|
Réactifs
|
Composition
|
Concentration
|
|
R1
Tampon
|
PIPES pH 6,9
Phénol
|
90 m mol/ L
26 m mol /L
|
|
R2
Enzymes
|
Cholestérol estérase (CHE)
Cholestérol oxydase (CHOD)
Peroxydase (POD)
4- Aminophénazone (4- AP)
|
300 U/L
300 U/L
1250 U/L
0,4 m mol/ L
|
|
Etalon
|
Cholestérol
|
200 mg/ dl
|
· Préparation du réactif de
travail (RT) :
- Dissoudre le contenu du réactif R2 dans la fiole du
réactif R1.
- Mélanger bien et doucement jusqu'à la
dissolution complète. Ce réactif est stable 4 mois à
2-8°C ou 40 jours à 15-25°C.
d- Mode opératoire :
|
Blanc
|
Etalon
|
Echantillon
|
|
RT (ml)
|
1,0
|
1,0
|
1,0
|
|
Etalon (ul)
|
-
|
10
|
-
|
|
Echantillon (ul)
|
-
|
-
|
10
|
-Mélanger et incuber les tubes pendant 10 min à
la température ambiante.
-Lire l'absorbance (A) de l'échantillon et de
l'étalon à 505 nm contre le blanc, la couleur est stable pendant
une heure.
e- Calcul :
[Cholestérol] (mg/dl) = x 200 (concentration de l'étalon). x 200 (concentration de l'étalon).
2.3.5.6. Dosage de la phosphatase alcaline
(PAL) : selon la fiche technique Spinreact.
a- Principe :
L'activité enzymatique de la PAL et
déterminée selon la réaction suivante (37,38) :
PAL
pH 10,4
P- Nitrophénylphosphate + H2O
P-Nitrophénol+ phosphate
b- Echantillon : Plasma.
c- Les réactifs
utilisés
|
Réactifs
|
Composition
|
Concentration
|
|
R1
Tampon
|
-Diethanolamine (DEA) pH 10,4
-Chlorite du magnésium
|
1 m mol / L
0,5 m mol/ L
|
|
R2
Substrat
|
P-Nitrophénylphosphate (pNPP)
|
10 m mol/L
|
· Préparation du réactif de
travail (RT) :
- Dissoudre un comprimé du R2 dans une fiole du
R1.
- Mélanger doucement jusqu'à la dissolution
complète. Ce réactif est stable pendant 21 jours à
2-8°C ou 5 jours à la température ambiante.
d- Mode opératoire :
|
Réactif de travail (ml)
|
1,2
|
|
Echantillon (ul)
|
50
|
- Mélanger et incuber les tubes pendant 1 min.
- Lire l'absorbance initiale (A) des échantillons
à 405 nm avec trois répétitions (chaque 1 minute
d'incubation).
e- Calcul :
Activité PAL (U/L)
= ÄA/ min x 3300
ÄA/ min : la valeur moyenne des trois lectures par
minute.
2.3.5.7. Dosage de TGO : selon la fiche
technique spinréact
a-Principe :
L'aspartate aminotransférase (AST) appelée aussi
L'oxaloacétate de glutamate (GOT) catalyse le transfert
réversible d'un groupe aminé à partir de l'aspartate au
á-cétoglutarate formant le glutamate et l'oxaloacétate.
L'oxaloacétate est réduit au malate par la malate
déshydrogénase (MDH) et le NADH,H+ (39,40):
AST
Aspartate + á-cétoglutarate glutamate
+ oxaloacétate
MDH
Oxaloacétate + NADH+H+ malate +
NAD+
b-Echantillon : Plasma.
c-Réactif utilisés :
|
Réactifs
|
Composition
|
Concentration
|
|
R1
Tampon
|
-Tris pH 7.8
-L- Aspartate
|
80 mmol/L
200 mmol/L
|
|
R2
Substrat
|
-NADH
-Lactate déhydrogenase (LDH)
-Malate déhydrogenase (MDH)
-á-cétoglutarate
|
0.18 mmol/L
800 U/L
600 U/L
12 mmol/L
|
· Préparation du
réactif :
Dissoudre un comprimé de R2 dans un flacon de R1. Ce
réactif est stable 21 jours à 2-8°C ou 72 heures à
15-25°C.
d-Mode opératoire :
|
Réactif de travail (ml)
|
1.0
|
|
Echantillon (ul)
|
100
|
Mélanger, incuber pendant une minute. Lire à 340
l'absorbance (A) initiale et démarrer le chronomètre
simultanément. Lire à nouveau après 1, 2 et 3 minutes.
e-Calcul :
La concentration de TGO est calculée par la formule
suivante :
Activité TGO (U/L) = ÄA/min X
1750
ÄA/ min : la valeur moyenne des trois lectures par
minute.
2.3.5.8. Dosage de TGP : selon la fiche
technique spinréact
a-Principe :
Le principe est présenté selon la
réaction suivante :
ALT
á-cétoglutarate + L- Alanine glytamate
+ pyruvate
LDH
Pyruvate + NADH+H+ L-laclate +
NAD+
La diminution de la concentration en NADH est directement
proportionnelle à l'activité enzymatique d'alanine
aminotransférase dans l'échantillon (39,40).
b-Echantillon : Plasma.
c-Réactif utilisés :
|
Réactifs
|
Composition
|
Concentration
|
|
R1
Tampon
|
-Tris pH 7.8
-L- Alanine
|
100 mmol/L
500 mmol/L
|
|
R2
Substrat
|
-NADH
-Lactate déhydrogenase (LDH)
- Oxoglutarate
|
0.18 mmol/L
1200 U/L
15 mmol/L
|
· Préparation du
réactif :
Dissoudre le contenant du R2 dans le flacon de R1. Ce
réactif est stable 2 semaines à 2-8°C.
d-Mode opératoire :
|
Réactif de travail (ml)
|
1.0
|
|
Echantillon (ul)
|
100
|
Mélanger, incuber pendant une minute à
température ambiante et lire l'absorbance initiale à 340 nm. Lire
à nouveau après 1, 2 et 3 minutes. Déterminer la moyenne
des absorbances par minutes (Ä Abs/min) pour l'utiliser dans les
calculs.
e-Calcul :
La concentration de TGO est calculée par la formule
suivante :
Activité TGP (U/L) = ÄA/min X
1750
2.3.5.9. Dosage de FT4 :
a-Principe
Enzyme compétitive Immunoassay
Les réactifs essentiels exigés pour une enzyme
de phase ferme immunoassay incluent l'anticorps immobilisé,
l'enzyme-antigène conjugué et l'antigène natif.
Après le mélange de l'anticorps
immobilisé, l'antigène-enzyme conjugué et un sérum
contenant l'antigène natif, une réaction de compétition
résulte entre l'antigène natif et l'antigène-enzyme
conjugué pour un nombre limité de sites de liaison insolubles
(41).
3. Etude statistique
Ø Description des données : Grâce aux
statistiques élémentaires, nous avons déterminé
pour chaque lot expérimental les paramètres statistiques de base
pondérale, biochimiques et hépatiques.
Ø A l'aide du test t du Student, nous avons
comparé les moyennes des paramètres étudiés du lot
témoin vis-à-vis celles du lot malade non traité.
Ø En outre, nous avons évalué l'effet du
traitement par l'extrait d'ail sur tous les variables des lots traités
par rapport au lot MNT, en appliquant en premier lieu l'analyse de la variance
à un critère ANOVA (comparaison inter-lots) suivis par le test de
Dunnett.
Les résultats sont représentés sous
la forme (moyenne #177; écart type) et les différences ont
été considérées significatives à P=0,05.
Ces calculs ont été effectués
à l'aide du logiciel MINITAB d'analyse et de traitement statistique des
données (Version13.31).
1. Etude phytochimique :
1.1. Tests préliminaires de la composition
chimique :
Les résultats du screening sont illustrés dans
le tableau suivant :
Tableau 1 : screening phytochimique des
deux espèces d'ail
|
Composés
|
Quinones libres
|
Alcaloïdes
|
coumarines
|
tanins
|
Terpènoïdes
|
Saponosides
|
flavonoides
|
|
observation
|
Ail local
|
+++
|
++
|
-
|
-
|
+++
|
+
|
+++
|
|
Ail chinois
|
++
|
+++
|
-
|
-
|
++
|
++
|
+
|
(-) : absence ; (+) : présence en faible quantité ;
(++) : présence en quantité moyenne ;
(+++) : présence en quantité importante.
Les tests de la composition chimique réalisés
sur la poudre des deux espèces d'ail (locale et chinoise)
révèlent la présence des quinones libres, des
flavonoïdes et des terpènoïdes et des saponosides en grande
quantité dans l'espèce locale. Par contre la quantité des
alcaloïdes et les saponosides est importante dans l'espèce
chinoise. Les coumarines et les tanins sont absents dans les deux
espèces.
1.2. Chromatographie sur couche mince
(CCM) :
3
2
1

1- Extrait d'ail chinois.
2- Solution de référence
3- Extrait d'ail local
Figure 4: CCM de l'Allium sativum
Après révélation de la plaque CCM par le
biais d'une solution ninhydrinique, le chromatogramme montre pour la solution
du référence (alanine) ; une tache rouge violet avec RF=
0,55 alors que les solutions à examiner sont caractérisée
par des taches rougeâtres (l'alliine) avec RF1 = 0,57 et RF3= 0,54
accompagnées d'autres zones moins intenses.
2. Etude biologique :
2.1. Caractérisation des
paramètres :
Pour déterminer les caractéristiques des poids
relatifs du foie et de la thyroïde, des paramètres biochimiques
sanguins ainsi que la concentration sérique en
fT4 ; nous avons calculé pour chaque lot
expérimental quelques paramètres statistiques de base tel que la
moyenne arithmétique (M), l'écart type (s), la valeur minimale (X
min) et la valeur maximale (X max).
2.1.1. L'effet de la thyroxine sur les
paramètres étudiés :
L'induction de l'hyperthyroïdie par la thyroxine chez
les lapins, a comme effet les modifications des paramètres
physiologiques et métaboliques.
Tableau 2 : Comparaison entre les
moyennes du lot T et du lot MNT (M#177;s; n = 5)
test «t» de Student.
|
Variables
|
M #177; s
|
t obs
|
P
|
|
T
|
MNT
|
|
Paramètres biochimiques
|
Glucose (mg/dl)
|
110.09#177;3.53
|
127.73#177;6.77
|
5.17
|
0,001***
|
|
Triglycérides (mg/dl)
|
92.7#177;26.1
|
177.0#177;35.6
|
4.27
|
0,003**
|
|
Lipides totaux
(mg/dl)
|
443.1#177;158.2
|
802.4#177;156.1
|
3.61
|
0,007**
|
|
Cholestérol (mg/dl)
|
74.3#177;27.5
|
50.1#177;23.3
|
1.50
|
0.173
NS
|
|
Protéines totales (g/dl)
|
5.35#177;0.39
|
5.82#177;0.48
|
1.68
|
0.132 NS
|
|
Paramètres enzymatiques
|
TGO (U/L)
|
30.75#177;5.36
|
35.14#177;9.33
|
0.91
|
0,388 NS
|
|
TGP (U/L)
|
49.38#177;12.82
|
57.86#177;3.77
|
1.42
|
0,194 NS
|
|
PAL (U/L)
|
172.7#177;43.1
|
283.2#177;22.5
|
5.08
|
0,001***
|
|
Hormone thyroïdienne
|
fT4
|
0.62#177;0.05
|
0.94#177;0.08
|
7.49
|
0.000***
|
|
Poids
relatifs
|
Thyroïde (mg)
|
0.026#177;0.012
|
0.0069#177;0.0021
|
3.40
|
0.009**
|
|
Foie (g)
|
0.032#177;0.0036
|
0.038#177;0.0029
|
2.86
|
0.021*
|
T : Témoin
MNT : Malade non traité
P : seuil de signification
NS : Différence non significative
* : Différence significative (P= 0,05)
** : Différence hautement significative
(P=0,01)
*** : Différence très hautement
significative (P= 0,001)
Nos résultats montrent une variation importante pour la
plus part des paramètres étudiés entre le lot
témoin et le lot malade non traité où l'injection des
lapins par la thyroxine à raison de 200 ug/Kg du poids corporel provoque
une augmentation très hautement significative de la teneur plasmatique
en glucose et la PAL et également de la teneur sérique en fT4.
Notons aussi que la concentration sérique en triglycérides et en
lipides totaux, ainsi que le poids relatif de la thyroïde augmente d'une
façon statistiquement hautement significative. Le poids relatif du foie
augmente de façon significative en comparaison avec le témoin. En
revanche, la thyroxine semble sans effet significatif sur la concentration
plasmatique des protéines totales, et l'activité enzymatique des
transaminases (TGO/ TGP).
2.1.2. Variation du poids corporel :
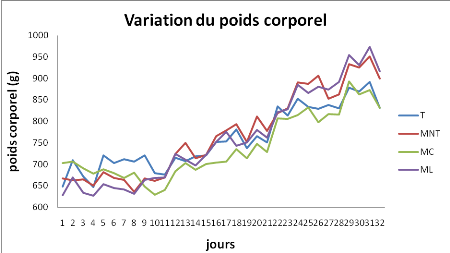
Figure 5 : variation du poids
T : témoin
ML : traité à l'extrait d'ail
local
MNT : malade non traité
MC : traité à l'extrait d'ail
chinois
D'après la figure, on a costaté que pendant la
periode de l'injection de la L-thyroxine (1er jour -
7eme jour) il y a eu une chute du poids
corporel chez les lots injectés par rapport au lot témoin.
A partir de 10eme jour (début du
traitement), on a assisté à une prise du poids chez tous les lots
mais à des fréquences différentes.
Le traitement par l'extrait d'ail local a
amélioré la prise du poids corporel en comparaison avec le lot
malade non traité (MNT). En revanche, chez le lot malade traité
par l'extrait de l'ail chinois il y avait une amélioration par rapport
au lot malade non traité (MNT).
2.2. L'effet du traitement par l'extrait
d'ail :
L'effet du traitement des lapins par l'extrait d'Allium
sativum est évalué par la comparaison entre les lots
traités (ML-MC) et le lot malade non traité (MNT) en appliquant
l'analyse de la variance à un critère (ANOVA).
2.2.1. L'effet du traitement sur les paramètres
biochimiques :
Tableau 3 : L'effet du traitement sur la
variation de la concentration plasmatique du glucose, du cholestérol,
des triglycérides, protéines totales et des lipides totaux entre
les lots expérimentaux (M#177;s; n= 5).
|
Paramètres
|
T
|
lots
MC
|
MNT
|
ML
|
|
Glucose (mg/dl)
|
110.09#177;3.53
|
118.16*#177;4.87
|
127.73#177;6.77
|
114.06**#177;4.39
|
|
Protéines totales
(g/dl)
|
5.35#177;0.39
|
5.68#177;0.19
|
5.82#177;0.48
|
4.94**#177;0.07
|
|
Triglycérides (mg/dl)
|
92.7#177;26.1
|
40.97***#177;17.72
|
177.0#177;35.6
|
76.72**#177;9.28
|
|
Cholestérol
(mg/dl)
|
74.3#177;27.5
|
29.41#177;14.6
|
50.1#177;23.3
|
32.36#177;18.90
|
|
Lipides totaux
(mg/dl)
|
443.1#177;158.2
|
379.1***#177;59.9
|
802.4#177;156.1
|
370.3***#177;41.4
|
* : Différence significative par rapport au
MNT (P= 0,05)
** : Différence significative par rapport au
MNT (P=0,01)
*** : Différence très hautement
significative par rapport au MNT (P= 0,001).
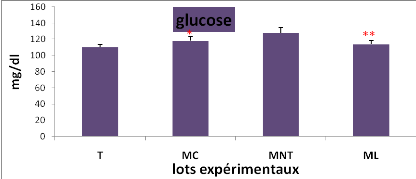
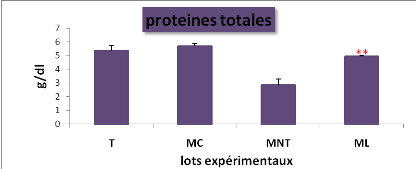
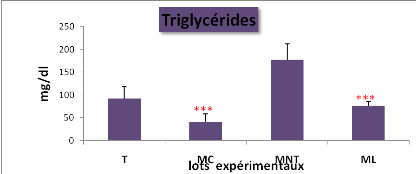
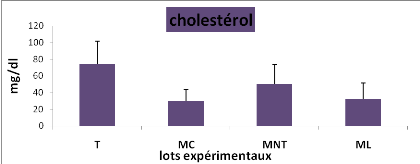
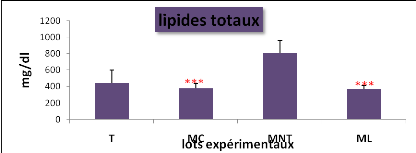
Figure 6 : L'effet du traitement sur la
variation de la concentration plasmatique du glucose, des protéines
totales, des triglycérides et des lipides totaux entre les lots
expérimentaux (*P = 0,05 ;**P =0,01 ;***P=0,001).
Les résultats obtenus révèlent que
l'administration de l'extrait d'ail local aux lapins malades pendant 21 jours
du traitement diminue très significativement la concentration
plasmatique du glucose par rapport aux lapins malades non traités alors
que la l'extrait d'ail chinois montre une diminution significative.
Notons aussi, que la triglycéridémie et la
lipidémie des lapins traités subissent une diminution très
hautement significative pour les deux extraits par rapport au MNT.
La teneur plasmatique en protéines totales chez les
lapins traités par l'extrait d'ail local augmente d'une façon
hautement significative contrairement à celle des lapins traités
par l'extrait d'ail chinois, elle augmente d'une façon non
significative.
2.2.2. L'effet du traitement sur les enzymes
hépatiques :
Tableau 4 : L'effet du
traitement sur l'activité enzymatique des transaminases (TGO, TGP) et de
la phosphatase alcaline (PAL) chez les lots expérimentaux (M#177;s;
n=5).
|
Paramètres
|
T
|
lots
MC
|
MNT
|
ML
|
|
TGO (U/L)
|
30.75#177;5.36
|
25.08*#177;2.83
|
35.14#177;9.33
|
29.36#177;0.47
|
|
TGP (U/L)
|
49.38#177;12.82
|
50.45*#177;1.77
|
57.86#177;3.77
|
50.11#177;9.29
|
|
PAL (U/L)
|
172.7#177;43.1
|
175.5**#177;33.8
|
283.2#177;22.5
|
260.3#177;67.5
|
* : Différence significative par rapport au
MNT (P= 0,05)
** : Différence hautement significative par
rapport au MNT (P=0,01)
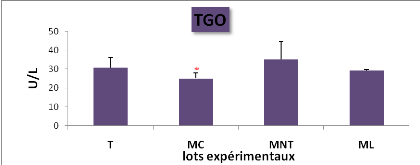
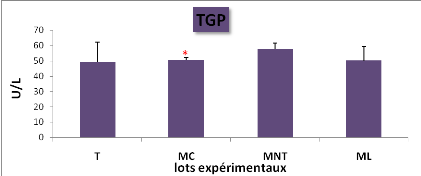
Figure 7 :L'effet du traitement sur
l'activité enzymatique des transaminases plasmatiques (TGO/TGP/PAL)
(* : P= 0.05,).
Les résultats illustrés, montrent que
l'activité enzymatique des transaminases plasmatiques (TGO/ TGP) diminue
d'une façon statistiquement significative chez le lot traité par
l'extrait d'ail chinois.et non significative chez le lot traité par
l'extrait d'ail local par rapport à celui non traité.
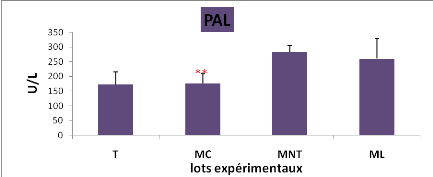
Figure 8 : L'effet du traitement sur
l'activité enzymatique de la phosphatase alcaline (PAL) plasmatique chez
les lots expérimentaux (** : P= 0,01).
D'autre part, l'activité enzymatique de la phosphatase
alcaline subit une diminution hautement significative chez les lots
traités par l'extrait d'ail chinois et non significative chez les lots
traités par l'extrait d'ail local par rapport au lot MNT.
2.2.3. L'effet du traitement sur la teneur
sérique en FT4 :
Tableau 5 : L'effet du traitement sur la
concentration sérique de la FT4 chez les lots expérimentaux
(M#177;s; n=5).
|
Paramètres
|
T
|
Lots
MC
|
MNT
|
ML
|
|
FT4
|
0.62#177;0.05
|
0.59***#177;0.07
|
0.94#177;0.08
|
0.48***#177;0.12
|
*** : Différence très hautement
significative par rapport au MNT.
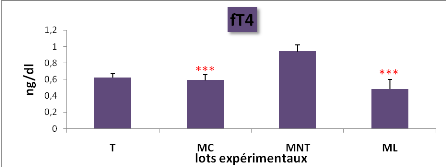
Figure 9 : l'effet du
traitement sur la teneur sérique en fT4 chez les lots
expérimentaux
(*** : P= 0,001).
Nos résultats révèlent que le traitement
des lapins malades par l'extrait d'ail a diminué la teneur
sérique en fT4 d'une façon très hautement significative
pour les deux extraits en comparaison avec les lapins malades non
traités.
2.2.4. L'effet du traitement sur les poids relatifs
du foie et de la thyroïde :
Tableau 6 : L'effet du traitement sur les
poids relatifs du foie et de la thyroïde chez les lots
expérimentaux (M#177;s, n=5).
|
Paramètres
|
T
|
Lots
MC
|
MNT
|
ML
|
|
Poids relatif du foie (g)
|
0.032#177;0.0036
|
0.030***#177;0.0004
|
0.038#177;0.0029
|
0.030***#177;0.0014
|
|
Poids relatif de la thyroïde (g)
|
0.026#177;0.012
|
0.033*#177;0.03
|
0.0069#177;0.021
|
0.018**#177;0.004
|
* : Différence significative par rapport au
MNT (P= 0,05)
** : Différence hautement significative par
rapport au MNT (P=0,01)
*** : Différence trés hautement
significative par rapport au MNT (P=0,001)
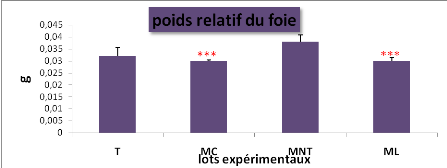
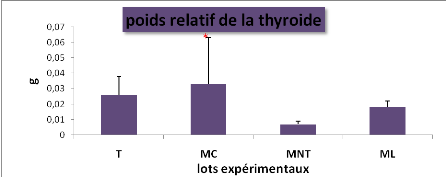
Figure 10 : l'effet du traitement sur le
poids relatif du foie et de la thyroïde chez les lots expérimentaux
(* : P=0.05, ** : P=0.01, *** : P= 0,001).
D'après les résultats obtenus, on constate que le
traitement a diminué le poids relatif du foie d'une façon
très hautement significative pour les deux extraits d'ail chez les lots
expérimentaux.
Du plus, le traitement par l'extrait d'ail chinois a
augmenté significativement le poids relatif de la thyroïde en
comparaison avec le lot malade non traité.
Aujourd'hui, la thérapeutique continue de recourir aux
plantes de deux façons :
Pour l'extraction industrielle de substances naturelles pures,
destinées le plus souvent à des indications thérapeutiques
en nature ou sous la forme de médications familiales simples ou plus
innovantes (poudres, extraits, etc.), généralement
utilisées dans les pathologies mineures ou en thérapeutique
d'appoint : c'est le champ actuel de la
phytothérapie.
« Médecine douce » pour les uns, «
placébothérapie » pour les autres, elle connaît un
large succès.
Après évaluation clinique, et sous
réserve que la balance bénéfices-risques soit favorable,
divers médicaments de phytothérapie constituent une
possibilité parmi d'autres de prise en charge de certaines de ces
pathologies du quotidien.
De ce fait, plusieurs travaux ont été
réalisés pour l'évaluation des secrets des plantes
médicinales dont la présente étude qui est
consacrée à la recherche d'éventuels effets
antithyrotoxiques à partir d'un extrait d'une espèce locale, et
chinoise d'Allium sativum.
Notre étude nous a permis en premier lieu d'identifier
les principaux groupes chimiques présents dans l'ail à travers
les réactions de caractérisation qui révèlent que
la plante constitue un ensemble riche en substances actives. Les
résultats obtenus peuvent être, ardemment, attribués
à un des composés ou une conjugaison de substances, aux
saponosides surtout que la plante est en très riche, aux
alcaloïdes, aux flavonoïdes, aux stérols et triterpènes
ou à une autre famille de composés présente dans
l'Allium sativum. En plus la chromatographie sur couche mince que nous
avons effectuée sur la poudre d'ail nous a permis de confirmer la
présence de l'alliine ; précurseur de l'allicine qui sont
caractérisés par leurs propriétés pharmacologiques
(44.45).
La voie d'administration choisie est la voie orale par ce que
c'est une voie d'administration physiologique, elle offre certain nombre de
critères, d'efficacité et de commodité. De plus elle ne
nécessite aucun matériel particulier. De point de vue
pharmacologique, la voie orale est la plus couramment utilisée (70
à 80% des médicaments sont administrés per os).
Cette voie est, généralement, bien acceptée par les
patients (46).
Parmi les méthodes utilisées pour produire chez
l'animale un état d'hyperthyroïdie, nous avons choisi l'injection
intrapéritonéale de la L-thyroxine sodique (47.48), qui entraine
un effet thyrotoxique en accélérant le métabolisme basal
(49.50), et un effet hépatotoxique par le biais de
générations des radicaux superoxides (51.52).
Dans nos conditions expérimentales on a
enregistré une perte pondérale chez les lapins malades dès
le 3eme jour jusqu'au 10eme jour, par rapport aux lapins
témoins, cela est probablement dû à
l'accélération du métabolisme protéique et
lipidique sous l'effet de la thyroxine (53.54).
Puis on a constaté une prise fréquente du poids
corporel des malades traités et témoins, d'une façon
normale mais avec un rythme très élevé chez les lapins
malades, et ceux traités par l'extrait d'ail local, cela peut être
expliqué par une adaptation avec la maladie et la compensation des
sources d'énergie par apport exogène (alimentation).en plus, les
animaux étaient en pleine phase de croissance.
Après l'administration de la L-thyroxine chez les
lapins pendants 7 jours, et après leur sacrifice, l'analyse des
résultats a montré une augmentation hautement significative de la
concentration plasmatique du glucose chez les lapins malades, qui peut
être expliqué par le fait que la thyroxine a un effet
hyperglycémiant en activant certaines enzymes de la
néoglucogenèse (55.56) ce qui justifie aussi la diminution du
taux des protéines totales.
Par contre on a observé une diminution significative de
la glycémie chez les lapins traités par l'extrait d'ail chinois,
et hautement significative chez les traités par l'extrait d'ail local,
cela confirme l'effet hypoglycémiant de l'Allium sativum
(57.58), probablement dû à l'alliine (molécule
bioactive dans l'ail) qui inhibe certaines enzymes de la
néoglucogenèse et active celles de la glycolyse d'une part
(59.60), et à d'autres composés soufrés stimulant la
sécrétion de l'insuline d'autre part (61.62), notons aussi que
l'alliine active la G-6-Pase hépatique qui empêche la
libération du glucose dans la circulation sanguine (55).
Les résultats obtenus révèlent une
augmentation hautement significative du taux des lipides totaux chez les lapins
malades par rapport aux témoins, cette augmentation peut s'expliquer par
la dégradation intense des composés lipidiques des tissus adipeux
pour assurer l'énergie nécessaire aux fonctions vitales de
l'organisme. En revanche on a constaté une diminution très
hautement significative des lipides totaux chez les lapins traités par
l'extrait d'ail local et chinois, probablement dû aux
propriétés hypolipémiantes de l'ail (63).
Nous avons bien constaté chez les lapins malades une
augmentation non significative du taux des TG plasmatiques, ce constat est en
accord avec une étude menée sur des patients souffrant d'une
hyperthyroïdie (51).
En outre, l'administration de l'homogénat d'ail a
diminué d'une manière très hautement significative la
concentration plasmatique des triglycérides chez les lapins
traités par rapport aux témoins malades suite de l'effet
hypolipémiant de l'ail (62.63).
Pour la cholestérolémie, on a observé une
diminution non significative de celle-ci chez les lapins malades en comparaison
avec les témoins, cela peut s'expliquer par le fait que la thyroxine
augmente l'élimination du cholestérol dans la bile, et inhibe la
HMG-coA réductase l'enzyme clé de la synthèse de ce
dernier (64.65).
Les résultats montrent aussi une
élévation hautement significative du taux des protéines
totales chez les lapins traités par l'extrait d'ail locale, due
à l'effet hypoglycémiant de l'ail en inhibant la
néoglucogenèse, voire la dégradation des composés
protéiques du corps (55.56).
En ce qui concerne les enzymes hépatiques, nous avons
constaté une augmentation non significative des taux plasmatiques des
TGO, TGP chez les lapins malades par rapport aux témoins, cela peut
confirmer les résultats obtenus précédemment qui montrent
que la thyroxine augmente les concentrations plasmatiques des acides
aminés glucoformateurs (aspartate, alanine, et glutamate).
Concernant la PAL, les résultats montrent une
élévation très hautement significative du taux plasmatique
de ce dernier, que l'on peut expliquer comme réponse à la
formation des superoxides suite à la dégradation des lipides sous
l'effet de la thyroxine (66.67).et l'accélération de la
production des radicaux libres par augmentation du métabolisme basal
(53.54).
Par ailleurs, l'administration de l'homogénat d'ail
chinois a diminué les taux plasmatiques des transaminases (59.60).
L'augmentation de l'activité enzymatique de la phosphatase
alcaline chez le lot MNT confirme l'atteinte du tissu hépatique. Cette
augmentation peut être due à la fuite de cette enzyme du cytosol
du foie dans la circulation sanguine (77).
L'effet antioxydant de l'ail notamment l'extrait local peut
confirmer la diminution d'une manière hautement significative du taux de
la PAL chez les lapins traités comparant aux malades (68.69). De plus,
ce résultat peut être expliqué par la richesse de l'ail en
sélénium (75.76).
Une autre étude montre que l'alliine joue un rôle
important dans l'inhibition de certaines enzymes hépatiques y compris
les transaminases et la PAL (59.60).
L'administration d'extrait d'ail a rétablit d'une
manière très hautement significative le poids relatif du foie
(55.56).
Pour la FT4 (tétraïodothyronine libre), nos
résultats montrent une augmentation très hautement significative
de la concentration sérique de celle-ci chez les lapins malades en
comparant aux témoins (28.47.70.71.72) due à l'apport
exogène de la thyroxine.
D'autre part, on a constaté une diminution
très hautement significative de la concentration sérique de la
FT4 concernant les lapins traités par l'extrait d'ail locale ainsi que
le chinois comparant aux malades, cela on peut l'interpréter par l'effet
antithyrotoxique, de l'Allium sativum en améliorant le statut
antioxydant (28).
Par conséquent, on a observé une diminution
hautement significative du poids relatif de la glande thyroïde des lapins
malades par rapport aux témoins (73), probablement suite à
l'altération de la fonction thyroïdienne (atrophie) par
retro-inhibition de la TSH par la T4 libre (74).
On peut dire que le traitement par l'extrait d'ail peut
restaurer la fonction thyroïdienne après avoir observé une
augmentation significative du poids relatif de la thyroïde chez les
lapins traités par l'extrait d'ail chinois en comparant aux malades.
CONCLUSION ET PERSPECTIVES
Nous pouvons mettre l'accent sur les
intérêts multiples de l'utilisation potentielle des plantes telle
que l'Allium sativum comme antithyrotoxique, antioxydants,
hypoglycémiant et hypolipémiant. Un exemple type se situe dans le
domaine alimentaire ou l'on a maintenant tendance à
préférer aux dérivés de synthèse.
La présente étude a
consisté à réaliser un criblage phytochimique de deux
espèces d'ail, locale et chinoise, et la recherche d'activité
antithyrotoxique, et à la lumière des résultats obtenus,
on peut conclure que:
Ø Lors de l'analyse du
matériel végétal par CCM et par réactions de
caractérisation, l'Alliine (principal constituant pharmacologiquement
actif), les métabolites secondaires qui y sont contenus notamment les
flavonoïdes, stérols et terpènes, tanins, saponines,
alcaloïdes, et les quinones ont été identifiés. Avec
des quantités très élevées dans la poudre d'ail
local.
Ø L'injection
intrapéritonéale de la L-thyroxine à 200 ug/kg de poids
corporel chez les lapins mâles a induit des perturbations du
métabolisme glucidique, lipidique et protéique, procès
accompagné par un déficit pondéral remarquable.
Ø L'administration orale
régulière de l'extrait d'ail à raison 500 mg/kg aux lapins
malades pendant 21 jours a maintenu voire améliorer la croissance
pondérale.
Ø En ce qui concerne
l'étude des paramètres biochimiques :
Nos résultats
montrent que le traitement des lapins malades par l'homogénat
d'ail, notamment d'espèce locale induit :
ü Une restauration de la
glycémie aux normes comparant aux témoins malades.
ü Une diminution du taux du
cholestérol, et les lipides totaux.
ü Une
restauration l'activité des transaminases (TGO et TGP),
ainsi que la PAL.
ü Un effet antithyrotoxique,
qui a rétablit les valeurs de la concentration sérique de la fT4
aux normes, avec restauration de l'activité thyroïdienne.
En perspectives, nous pensons
montrer à travers le travail initié sur les plantes locales que
des usages thérapeutiques empiriques dans un domaine précis ne
limitent pas l'ouverture des recherches vers de nouvelles applications
potentielles. De ce point de vue, les médecines traditionnelles
constituent un réservoir très intéressant pour la
recherche dans le futur.
Allium sativum
apparaît donc être une plante riche en métabolites
secondaires, largement utilisée en médecine traditionnelle en
Algérie pour combattre et guérir différentes maladies. Une
exploitation de ses propriétés pharmacologiques implique une
recherche plus poussée de ses principes actifs, actuellement en
cours.
REFERENCES BIBLIOGRAPHIQUES
1- Antonia Pérez-Martin MCU-PH, Pr
Dauzat.( 2006-2007). Régulation hormonale et Chronobiologie -
Physiologie des hormones - Physiologie de la glande thyroïde.
Département de Physiologie - Faculté de Médecine
Montpellier - Service d'Exploration et Médecine Vasculaire.CHU de
Nîmes.
2- Natura news, science, nutrition
prévention et santé, juillet 2009 p11
3- Conseil scientifique, domaine de la
santé, Examen de la thyroïde, version1.1, 16/04/2008, pp1, 2
4- Véronique Kerlan, Dr Pascal Monguillon, Dr
Gaël potard.(2005) .Les pathologies de la thyroïde.
5-Collège des Enseignants
d'Endocrinologie, Diabète et Maladies
Métaboliques.L'hyperthyroidie. Mise à jour décembre 2004(
www.endocrino.net)
6- R J Langill, Clinique
vétérinaire Liesse, Quebec .
7 -Schlienger JL, Sapin
R.(1999).Difficultés d'interprétation du bilan
thyroïdien. Conditions physiopathologiques particulières.
Immunoanal Biol Spec; 14: 47-51.
8-Agence Nationale d'Accréditation et
d'Évaluation en Santé (ANAES) Service Communication et
Diffusion, Diagnostic et surveillance biologiques de
l'hyperthyroïdie de l'adulte, 159, rue Nationale - 75640 Paris Cedex 13 -
2000.
9- Olivier CHABRE .(2003). Corpus
Médical - Faculté de Médecine de Grenoble
Hyperthyroïdie (246) (Mise à jour février 2005).
10-Fondation canadienne de la Thyroïde.
Maladies thyroïdiennes - L'hyperthyroïdie, La Fondation canadienne de
la Thyroïde. [Consulté le 30 novembre 2010].
www.thyroid.ca
11- Stockigt JR.( 1996).Guidelines for
diagnosis and monitoring of thyroid disease : nonthyroidal illness. Clin Chem;
42 :(1) 188-92.
12- Natural Standard (Ed). Medical Conditions
- Hypothyroidism and related conditions, Nature Medicine Quality Standards.
www.naturalstandard.com.
[Consulté le 30 novembre 2010].
13- Galofre JC, Fernandez-Calvet L,
et al. (1994),
Increased
incidence of thyrotoxicosis after iodine supplementation in an iodine
sufficient area. J Endocrinol Invest. Jan;17(1):23-7.
14- K Benarous., (2006), Effets des extraits
de quelques plantes medicinales locales sur les enzymes alpha amylase,
trypsine et lipase, université Amar Telidji Laghouat,
Algérie, (mémoire de fin d'étude).
15- P.FEURIER. Dictionnaire des
plantes médicinales et vénéneuses de la Franc.
ed : connaissance et mémoires européens. 1999.
16- Agence du médicament., (1998).
Médicaments à base de plantes - Les cahiers de l'Agence n°3,
81 p. Saint-Denis
17- Callery et Emma, (1998).Le grand Livre
des herbes « le guide pratique de la culture, du séchage et
des vertus de plus de 50 herbes ».
18- Henri LECLEC. Plantes
médicinales des régions tempérées. maloine s.a
Editeu.1980. p50.51
19- Guide de production sous régie
biologique, filière des plantes médicinales biologiques de
Québec, 2009
20- LE PETIT MAS (2009). Guide et culture de
l'ail, Québec. [En ligne]
http://lepetitmas.ca [consulté
le 13 février 2011].
21- PASSEPORT SANTÉ., (2009).
L'ail, section « Approches complémentaires ». [En
ligne]
http://www.passeportsante.net/fr/Solutions/PlantesSupplements/Fiche.aspx?doc=ail_ps
[consulté le 13 février 2011].
22- R. Aouadi MS, A. Aouidet PhD, A. Elkadhi DTH,
Med. C. Ben Rayana DTH,H. Jaafoura MD, B. Tritar PhD & K. Nagati
MD., (2000,. effect of fresh garlic (allium sativum) on lipid
metabolism in male rats R. Elsevier
23- K.K. Al-Qattana, I. Khanb, A. Alnaqeeba, M.
Ali., (2003). Mechanism of garlic (Allium sativum) induced reductionof
hypertension in 2K-1C rats: a possible mediation of Na/H Exchanger isoform-1.
217-222
24- A . Bordia, S. K. Verma, K. C.
Srivastava., (1998). Effect of garlic (Allium sativum) on blood
lipids, blood sugar, fibrinogen and fibrinolytic activity in patients with
coronary artery disease.
25- Mei-chin Yin, Wen-shen Cheng., (2002).
Antioxidant and antimicrobial effects of four garlic derived organosulfur
compounds in ground beef. Meat Science 63, 23.28
26- N. Dohou, k. yamni, S. Tahrouch, L.M. Idrissi
Hassani, A. Badoc, N. Gmira., (2003). screening phytochimique
d'uneendémique ibéro-marocaine,thymelaea lythroides. bull. soc.
pharm. bordeaux, 142, 66-70.
27- Arima Ousmane Mamadou., (2005).
étude phytochimique et de l'activité antipaludique in vivo et in
vitro de momordica balsamina linn. (cucurbitaceae). université de
BAMAKO. Faculté de médecine, de pharmacie et
d'odonto-stomatologie. 48-49-50.
28- M. Jiang, A. Xu, S. Tokmakejian and N.
Narayanan., (2000), Thyroid hormone-induced over expression of
functional ryanodine receptors in the rabbit heart; 278:H1429-H1438
29- Kaplan L.A.Glucose. Kaplan A.,
(1984).Clin Chem the C.V Mosby CO. St Louis.
Toronto. Princelon; 1032-1036.
30- Trinder P., (1969). Ann Clin Biochem.
6:24-33.
31- Buccolo G., (1973).Quantitative
determination of serum triglycerides by use of enzymes. Clin Chem;
19(5):476-482.
32- Fossati P., (1982). Clin Chem;
28(10):2077-2080.
33- Koller A. Totl serum protein. Kaplan A.,
(1984). Clin Chem; 1316-1324 and 418.
34- Young DS., (1995).Effect of drugs on
Clinical Lab. Tests, 4 th ed AACC Press.
35- Kaplan A. Lipids. (1984). Clin Chem;
918-919.
36- Collet M.J., (1965).Dosage des lipides
sériques par la méthode sulfo-phospho- vanillique (1) de E.
Chabrol et R. Charonnat. Académie nationale de médecine;
149:331-338.
37- Wenger C., Alkaline phosphatase. Kaplan
A., (1984).Clin Chem the C.V; 1094-1098.
38- Rosalki S., (1993).Clin Chem;
39/4:648-652.
39- Murray R. Aspartate aminotransferase.
Kaplan A et al. Clin Chem The C.V. Mosby Co. St Louis. Toronto. Princeton 1984;
1112-116.
40- Reitman, S., (1957). Frankel S. J.Clin
Path. 28-56.
41- Total thyroxine (t4) enzyme immunoassay
test kit catalog number: 6107215.
42- Banerjee, S.K., Dinda, A.K., Manchanda, S.C., and
Maulik, S.K., (2002).Chronic garlic administration
protects heart against oxidative stress induced by ischemic reperfusion injury.
BMC Phamacol; 2: 2-16
43- K. Othmani-Mecif,Y. Benazzoug., (2005),
caracterisation de certains parametres biochimiques plasmatiques et
histologiques (tractus genital femelle) chez la population locale de lapin
(oryctolagus cuniculus) non gestante et au cours de la gestation, pp.
91-96.
44- Vinay K Singh, Dinesh K
Singh, Pharmacological Effects of Garlic (Allium sativum L.).
(2008). Annual Review of Biomedical Sciences. 10:6-26.
45-Lawson LD. (1998).Garlic a review of its
medicinal effects and indicated active compounds. In: Lawson LD,Bauer
R, editors. Phytomedicines of Europe. Washington: American Chemical
Society. (Chemistry and biological activity series, n. 691).p.176-9.
46-Bourin, M et Jolliet, P. (1999).
Pharmacologie générale et pratique. Ed ellipse,
Paris. 142p.
47- P. Venditti, R. Pamplona V, Ayala, R. De Rosa, G.
Caldarone and S. Di Meo. (2005).
Differential effects of experimental and cold-induced hyperthyroidism
on factors inducing rat liver oxidative damage. The Journal of Experimental
Biology 209, 817-825.
48- Pamplona R, Portero-Otin, M Riba, D Ruiz, C Prat,
J Bellmunt, M. J. and Barja G.(1989). Mitochondrial membrane
peroxidizability index is inversely related to maximum life span in mammals.
J. Lipid Res. 9.
49-Gregory A, Brent, Franklin H.
(1993).The molecular basis of thyroid hormone action, Journal of Endo,
Vol 331 No 13.
50- Lazar MA. (1993).Thyroid
hormone receptors, Endoc Rev,14:93-184.
51- J. Sewerynek, J. Wiktorska, 1D.
Nowak, A. Lewinski.(2000). Methimazole protection against oxidative
stress Induced by hyperthyroidism in graves Disease, ENDOCRINE
REGULATIONS, Vol. 34, 83. 890.
52- Verditti P, Deleo T, Dimeo S
(1997).Vitamin E administration attenuates the
tri iodothyronine-induced of heart electrical activity in the rat. J Exp
Biol 200,909- 914.
53-Paola Venditti, Teodoro De Leo And Sergio Di
Meo.(1997).Vitamin E Administration Attenuates The
Tri-Iodothyronineinduced Modification Of Heart Electrical Activity In The Rat,
The Journal Of Experimental Biology 200, 909-914.
54- Asayama, K., Dobashi, K.,
Hayashibe, H. And kato, K. (1989).Vitamin E protects against
thyroxine-induced acceleration of lipid peroxidation in cardiac and skeletal
muscles in rats. J. nutr. Sci. Vitaminol.
35, 407-418.
55-Manfred James Mãoel Lerand Hans joachim
Seitz.(2000), Starvation-Induced Changes of Hepatic Glucose Metabolism
in Hypo- and Hyperthyroid Rats in Vivo, Institut Physiologische Chemie,
Universitts-Krankenhaus Eppendorf, Martinistr.p 52.
56-Dunn, A., Chenoweth, M. & Schaeffer,
L.D. (1967) .Estimation of glucose turnover and the cori cycle using
gIucose-6-t-'4C. Biochemistry 6, 6-11.
57-Kishu Tripathi. (2009) .A
Review -Garlic, the Spice of Life-(Part -I), Asian J.
Research Chem. 2(1).
58-Laura Shane-McWhorter.( 2001).Diabetes
Spectrum 14:199-208.
59- E. D.
Wills.(1956).Enzyme Inhibition by Allicin, the Active Principle of
Garlic, Department of Biochemistry and Chemistry, Medical College of St
Bartholonew's Hospital, London, E.C. 1.p518
60- Small, L. D., Bailey, J. H. &
Cavallito, C. J. (1947).J. Amer. chem. Soc. 69, 1710.
61- Augusti, K.T and Sheela, C.G.
(1996).Antiperoxide effect of S-allyl cysteine
sulfoxide, an insulin secretagogue, in diabetic rats.
Experientia; 52:115-120.
62-Adesh k. Jain, M.D., Ramon Vargas, M.D., Sandra
Gotzkowsky,( 1993).Can Garlic Reduce Levels of Serum Lipids?A
Controlled Clinical Study, The American Journal of Medlclne Volume 94,
632-634.
63- Lau BHS. Adetumbi MA, Sanchez A.( 1983).
Allium sativum and atherosclerosis: a review. Nutr Res; 3:
119-28.
64- Murphy BE, et al.
(1964).Determinations of thyroxine utilizing the property of protein-binding. J
Clin Endocrinol Metab.;24:187-196.
65-Norma, et al.,( 1976).Polarographic method
for rapid micodetermination of cholesterol with cholesterol esterase and
cholesterol oxidase; 22:336-340.
66- Johnson MA, Turnbull
DM(1984).Mitochondrial oxidative enzyme activity in individual fiber
types in hypo and hyperthyroid rat skeletal muscles. Quarterly J Exp
Physiol 69,257-66.
67-Chiovato L, Santini F, Pinchera
A.(1995).Treatment of hyperthyroidism.Thyroid Intern 2,1-20.
68- Zhihua Wei, M.D., M.S. and
Benjamin H.S. Lau', M.D., Ph.D.(1998).GARLIC INHIBITS FREE RADICAL
Generation And Augments Antioxidant Enzyme Activity In Vascular Endothelial
Cells, Nuuition Research, Vol. 18, No. 1, pp. 61-70.1
69- McCord JM.( 1985)
.Oxygen-derived free radicals in postischemic tissue injury. N Engl J Med;
312:159-163.
70- Edwin J W Geven, Folkert Verkaar, Gert Flik and
Peter H M Klaren.(2006).Experimental hyperthyroidism and central
mediatorsof stress axis and thyroid axis activity in common carp (Cyprinus
carpio L.), Journal of Molecular Endocrinology 37, 443-452.
71-By Kazuyoshi Kawa And Kunihiko Obata.
(1982), Altered Developmental Changes Of Neuromuscular Junction In Hypo- And
Hyperthyroid Rats, J. Phygiol, 329, pp. 143-161.
72-Gönül Simsek, Yesari Karter, Seval
Aydýn, and Hafize Uzun, (2003), Osteoporotic Cytokines and Bone
Metabolism on Rats with Induced Hyperthyroidism; Changes as a Result of
Reversal to Euthyroidism, Chinese Journal of Physiology 46(4): 181-186.
73-Abdalla Mohamed Abdelatif and Intisar H.
Saeed .(2009) .Effect of Altered Thyroid Status in the
Domestic Rabbit (Lepus cuniculus) on Thermoregulation, Heart Rate and
Immune Responses, Global Veterinaria 3 (6): 447-456.
74-FOOTE Robert H,(2002). Effect of
high-dose liothyronine on semen quality and recovery following withdrawal in
rabbits,
Journal
of andrology,
vol. 23, no6, pp. 839-844.
75- Ip, C and Lisk, D.J. (1996).The
attributes of selenium-enriched garlic in cancer prevention. Adv Exp Med
Biol; 401:179-87.
76- Yang, W., Yang, X and Xia, Y.
(1997).Active anticarcinogenic chemical components in ordinary garlic
and selenium enriched garlic. Chung Hua Yu Fang I Hsueh
Tsa Chih; 31: 304-6.
77-Navarro, C.M., Montilla, P.M., Martin, A., Jimenez, J
and Utrilla, P.M. (1993).Free radicals scavenger and antihepatotoxic
activity of Rosmarinus, Plant Medicine;
59:312-314.
| 


