Chapitre V :
HYDROCHIMIE
50
V.1 INTRODUCTION :
L'étude de la chimie des eaux souterraines apporte
à l'hydrogéologie une somme considérable de renseignements
utiles à la compréhension des phénomènes se
produisant dans les systèmes aquifères. C'est-à-dire dans
les échanges possibles entre l'eau et la roche, sachant que la
minéralisation des eaux souterraines peut provenir de l'acquisition des
éléments chimiques par la dissolution et l'altération des
minéraux du réservoir.
L'étude de la chimie des eaux souterraines, elle permet
aussi de suivre l'évolution spatiale des différents
éléments dissous et d'estimer leur origine, d'estimer la
profondeur de circulation des eaux, et d'apprécier la qualité des
eaux vis-à-vis de la potabilité et à l'irrigation.
C'est dans ce but que ce chapitre a été
consacré, où on a utilisé certain nombre de diagrammes
avec les différentes cartes qui ont été tracés pour
l'ensemble des éléments chimiques. Une analyse statistique a
été effectuée aussi sur les principaux paramètres
caractérisant le chimisme des eaux de l'aquifère.
V.2 ECHANTILLONNAGE ET ANALYSE HYDROCHIMIQUE:
Nous avons effectué deux compagne de
prélèvement d'eau en Octobre 2014 et Avril 2015, où on a
sélectionné lors de l'inventaire des points d'eau, 27 points
d'eau, en nous basant sur leur répartition spatiale et l'aquifère
capté. (Fig. 30)
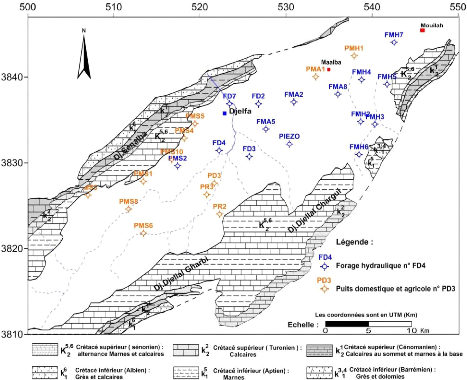
Figure 30 : Carte d'inventaire des points
d'eau échantillonnés
51
V.2.1 Méthodes d'analyse :
V.2.1.1 Mesures in situ :
Trois paramètres physico-chimiques (T°, pH,
conductivité électrique) ont été mesurés in
situ, immédiatement après le prélèvement de
l'échantillon à l'aide d'un pH mètre pHep (HANNA), et un
Conductivimètre de terrain du type Delta OHM HD 3406.2.
V.2.1.2 Analyses aux laboratoires :
Les analyses d'eau ont été effectuées au
laboratoire d'hydrogéologie de l'université de Tébessa
pour la première compagne Octobre 2014, et laboratoire de l'Agence
National des Ressources Hydraulique (ANRH) pour la deuxième compagne
Avril 2015. Elles ont porté sur les éléments majeurs
(Ca2+, Mg2+, Na+, K+,
Cl-, SO4 2-, HCO3 -, No3 -).
Les méthodes utilisées sont :
-Méthode volumétrique pour les
éléments (Ca2+, Mg2+, Cl-,
HCO3-)
-Méthode de spectrophotométrie d'absorption
atomique (en utilisant un spectrophotomètre Hi 83200 (HANNA)) pour les
éléments (Na+, K+, SO42-, No3
-).
Pour la fiabilité des résultats d'analyse, on a
procédé à l'application de la méthode de la balance
ionique et une erreur de 10 % a été acceptée.
V.3 ETUDE DES PARAMETRES PHYSIQUES :
Le récapitulatif des résultats de mesures des
paramètres physiques des eaux de la nappe Mio-Plio-Quaternaire du
synclinal de Djelfa sont donnés sur le tableau 12
|
Période des basses eaux
|
Période des hautes eaux
|
|
paramètre
|
Min
|
Moy
|
Max
|
Ecart-type
|
Min
|
Moy
|
Max
|
Ecart-type
|
|
T°C
|
16
|
18.37
|
21.5
|
1.86
|
17
|
20.38
|
22.5
|
1.39
|
|
pH
|
7.49
|
7.75
|
8.1
|
0.16
|
7.58
|
7.87
|
8.2
|
0.17
|
|
CN us/cm
|
594.55
|
1339.60
|
4925.16
|
928.45
|
550.28
|
1320.12
|
5310.67
|
1054.12
|
Tableau 12 : Variation des paramètres
physiques des eaux souterraines.
V.3.1 Température :
La température des eaux prélevées dans la
région étudiée, varie de 16 à 22.5 °C, elle ne
dépasse pas les normes fixées par l'O.M.S (25 °C). Cette
variation de température des eaux souterraines peut être fonction
de la profondeur de l'aquifère.
V.3.2 Potentiel hydrogène (pH) :
Le pH exprime la concentration en ion H+ d'une
solution. C'est un paramètre physique qui détermine
l'acidité ou l'alcalinité. Les mesures du pH montrent que tous
les puits se trouvent dans l'intervalle de norme de potabilité
(d'après l'Organisation Mondiale de la Santé (OMS)). Dans la
période des hautes eaux le pH varie entre 7.58 et 8.2, alors qu'en
période des basses eaux les valeurs variées entre 7.49 et 8.1.
52
V.3.3 La conductivité électrique (CE):(Fig.
31 et 32)
La conductivité traduit globalement la teneur d'une eau
en sels dissous, elle est d'autant plus élevée que la
minéralisation est importante. Les valeurs mesurées ont
été ramenées à 20°C, à l'aide de la
relation suivante :
CE20 = CETmes x F Avec :
CE20 : conductivité à une température de 20
°C .
CETmes : conductivité lue sur l'appareil à une
température mesurée.
F : facteur de correction , varie de 0.885 à 1.490 selon
la température mesurée .
La gamme de variation de la conductivité des eaux de la
nappe du Mio-Plio-Quaternaire pendant toutes les compagnes, varie de 550.28
uS/cm à 5310.67 uS/cm, où la
cartographie de ce paramètre montre que les grandes valeurs se
localisent dans la partie Nord ouest du synclinal en contact avec les
piémonts des massifs à l'Ouest des cartes de 1600 à 5310
us/cm, Ces fortes concentrations peuvent se traduire par des apports d'eau qui
sont chargés venus des piémonts des massifs (surtout à
partir des formations marno-calcaires du Sénonien) et en relation avec
les formations triasiques par l'intermédiaire des failles. On remarque
également un accroissement de la conductivité suivant le sens
d'écoulement des eaux souterraines c'est-à-dire du Sud-Ouest vers
le Nord-Est , débute de 400 à 1800 us/cm.
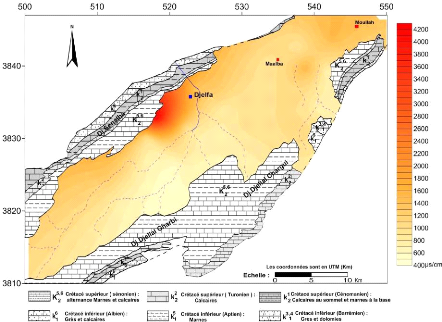
Figure 31 : carte des conductivités
octobre 2014.
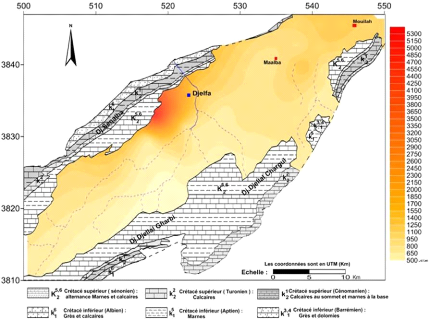
53
Figure 32 : carte des conductivités
Avril 2015.
V.4 ETUDE DES PARAMETRES CHIMIQUES :
Le récapitulatif des résultats d'analyse
chimique des eaux de la nappe Mio-Plio-Quaternaire du synclinal de Djelfa sont
donnés sur le tableau 13
|
Eléments
|
Période des basses eaux
|
|
Période des hautes eaux
|
|
|
|
Min
|
Moy
|
Max
|
Ecart-type
|
Min
|
Moy
|
Max
|
Ecart-type
|
|
Ca2+ (mg/l)
|
41.40
|
107.48
|
188.60
|
40.21
|
32.75
|
105.09
|
188.67
|
45.91
|
|
Mg2+(mg/l)
|
19.72
|
72.48
|
285.12
|
68.14
|
19.27
|
81.51
|
325.64
|
82.17
|
|
Na+ (mg/l)
|
20.14
|
54.42
|
118.35
|
24.29
|
20.13
|
49.88
|
112.52
|
22.45
|
|
K+ (mg/l)
|
0.5
|
2.64
|
14
|
2.65
|
0.5
|
4.04
|
12
|
2.40
|
|
So42- (mg/l)
|
65
|
254.46
|
920
|
220.17
|
45
|
255.93
|
990
|
239.44
|
|
Cl- (mg/l)
|
32.61
|
91.92
|
236.84
|
46.16
|
22.17
|
84.47
|
252.67
|
52.97
|
|
Hco3 -(mg/l)
|
124.20
|
296.31
|
531.60
|
96.21
|
106.62
|
280.81
|
537.22
|
101.89
|
|
No3- (mg/l)
|
8.61
|
23.35
|
42.07
|
9.85
|
6.75
|
25.52
|
41.75
|
10.84
|
Tableau 13 : Variation des paramètres
chimiques des eaux souterraines.
54
V.4.1 Cartographie hydrochimique :
Afin de montrer la répartition spatiale des
éléments chimiques, nous avons choisi l'outil cartographique qui
constitué un outil très appréciable dans la vision de
l'évolution spatiale d'un constituant chimique quelconque.
La cartographie hydrochimique a été
illustrée par interpolation triangulaire, en utilisant le logiciel
Surfer 10 (Golden software, 2011).
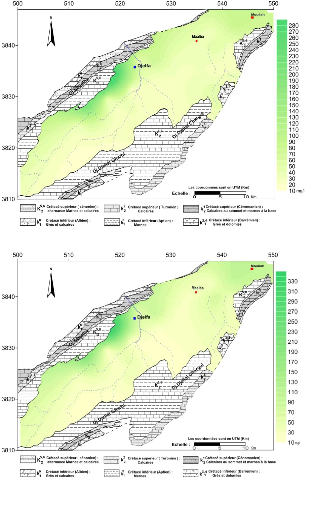
V.4.1.1 Cartes du calcium :(Fig.33 et 34)
Les teneurs en calcium oscillent en général
entre 40 et 190 mg/l, L'examen des deux cartes montre que les concentrations
sont importantes dans la partie Nord-ouest du synclinal, au piémont Sud
du flanc Nord, c'est-à-dire en bordure des formations carbonatées
et des marnes avec des lentilles de gypse d'âge Sénonien, donc ces
fortes concentrations proviennent essentiellement de la dissolution des
formations carbonatées ( CaCO3 ) de bordure, et des gypses contenus dans
les marnes.
Les ions Ca2+ proviennent de la dissolution des
formations carbonatées (CaCO3) et des gypses selon les équations
d'équilibre suivantes:
CaCO3 = Ca2+ + CO32-
CaSO4, 2H2O = Ca2+ + SO42- + 2H2O
On remarque également que les teneurs croissent dans le
sens de l'écoulement c'est-à-dire du Sud-Ouest vers le Nord-Est,
débute de 32.75 à 188.67 pour la période des hautes eaux
et de 41.35 à 169.82 pour la période des basses eaux.
V.4.1.2 Carte du magnésium :(Fig. 35 et
36)
Les concentrations en magnésium, varient de 19 à
330 mg/l. On note que les teneurs élevées sont observées
dans la parité Nord-Ouest du synclinal au piémont sud du flanc
nord. Les ions (Mg2+) proviennent, comme les ions (Ca2+),
de la dissolution des formations carbonatées riches en magnésium
(dolomites), comme peuvent se traduire également par la dissolution des
formations salifères. Les fortes concentrations sont enregistrées
pendant la période des hautes eaux ceci montre l'importance du lessivage
des formations géologiques. Les teneurs inférieures à 50
mg/l sont observées dans la partie Sud-Ouest et la partie centrale de la
nappe.
V.4.1.3 Cartes du sodium :(Fig.37 et 38)
Le Sodium est toujours présent dans les eaux naturelles
en proportions variables, il provient essentiellement du lessivage des
formations riches en NaCl (argiles et marnes) et des eaux usées
d'origine industrielle et domestique.
Les concentrations varient entre 20 et 120 mg/l. L'observation
des deux cartes montre que les concentrations sont importantes dans la zone
Nord-Ouest de la plaine au piémont sud du flanc nord qui
dépassent 100 mg/l, ces concentration peuvent se traduire par la
dissolution des formation salifères contenues dans la bordure, les
teneurs faibles se localisent au Sud Ouest (en amont de la nappe), là
où les eaux souterraines sont au début de leur cheminement,
c'est-à-dire ne sont pas encore trop minéralisées, et
augment progressivement lorsque en allant vers le Nord-Est, débute de
20.14à 118.35 pendant la période des basses eaux et 20.13
à 112.52 pendant la période des hautes eaux.
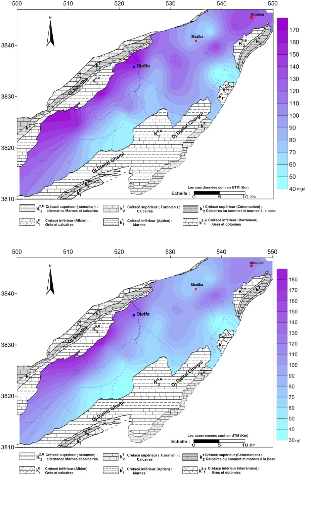
55
Figure 33 : Carte des calcium ( Ca2+
) , Octobre 2014
Figure 34 : Carte des calcium ( Ca2+
) , Avril 2015
56
Figure 35 : Carte des magnésiums (
Mg2+ ) , Octobre 2014
Figure 36 : Carte des magnésiums (
Mg2+ ) , Avril 2015
57
Figure 37 : Carte des sodiums ( Na+ )
, Octobre 2014
Figure 38 : Carte des sodiums ( Na+ )
, Avril 2015
58
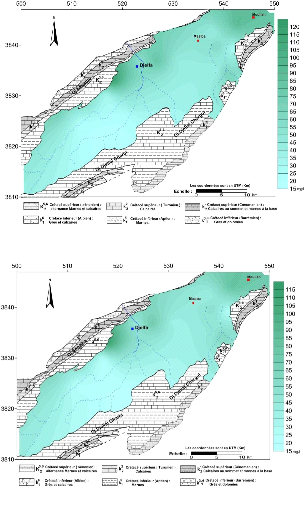
V.4.1.4 Cartes du Bicarbonate :(Fig.39 et 40)
Les teneurs en bicarbonates variées entre 120 à
560 mg/l. L'examen des deux cartes montre que les teneures sont relativement
faibles dans la partie Sud-Est de la nappe où les eaux sont au
début de leur cheminement dans la nappe. Les concentrations les plus
importantes sont observées; dans la partie centre Nord et plus à
l'Ouest en bordure du flanc Nord, donc ces fortes concentrations peuvent se
traduire par la dissolution des calcaires de la bordure par les pluies acides
surtout pendant la période des hautes eaux selon la réaction
suivante:
CO2 + H2O + CaCO3 ? Ca2+ +
2HCO3 -
On note également que les cailloutis calcaires qui
existent dans les formations de la nappe peuvent influencées sur la
concentration en cet élément.
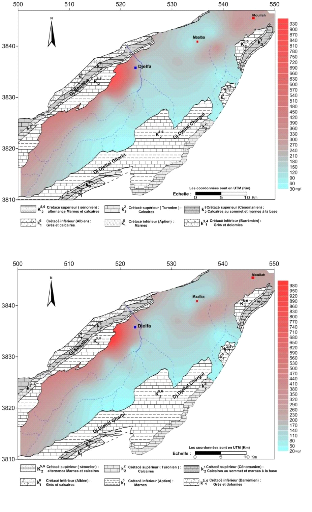
V.4.1.5 Cartes du chlorure :(Fig.41 et 42)
Les teneurs en chlorures variées entre 32 à 260
mg/l, la cartographie de cet élément monter une
élévation remarquable dans la partie Nord-Ouest au piémont
sud du flanc Nord de synclinal.
Ces fortes concentrations peuvent se traduire par la
dissolution des formations gypsifères dans la bordure. Les
activités anthropiques contribuent également à
l'augmentation des teneurs en chlorures. Les teneurs faibles sont
enregistrées dans la partie Sud-Ouest et augments progrissivemet lorsque
on allant vers la partie Sud-Est . Le rapprochement des valeurs des
concentrations durant les deux (02) périodes des hautes eaux et basses
eaux met en évidence l'effet du lessivage des formations
traversées.
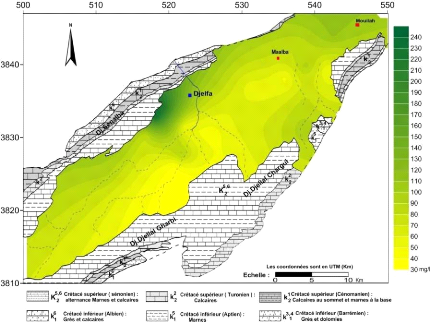
V.4.1.6 Cartes du sulfate :(Fig.43 et 44)
Les concentrations, en général, oscillent entre
50 et 990 mg/l. Les fortes concentrations sont enregistrées dans la
partie Nord Ouest de la nappe au piémont Sud du flanc Nord du synclinal
surtout durant la période des hautes eaux avec des valeurs qui
dépassent les 500 mg/l (990 mg/l) comme valeur maximale observée
au niveau du puits (PMS4), ces fortes valeurs peuvent s'expliquer par la
dissolution des sels minéraux (gypses) contenus dans les formations
Sénoniennes au bordure.
On remarque un accroissement des tenures suivant le sens de
l'écoulement c'est-à-dire de Sud-Ouest vers le Nord-Est,
débute de 45 à 400 mg/l, l'augmentation des teneurs peut se
traduire par le lessivage des formations gypsifères.

Figure 39 : Carte des bicarbonates ( HCO3 - ) ,
Octobre 2014
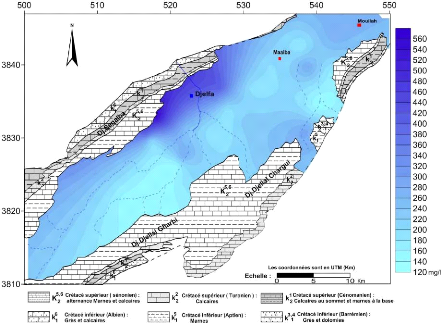
Figure 40 : Carte des bicarbonates ( HCO3 - ) ,
Avril 2015
59
60
Figure 41 : Carte des chlorures (
Cl- ) , Octobre 2014
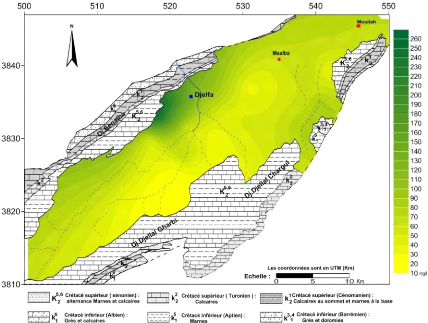
Figure 42 : Carte des chlorures (
Cl- ) , Avril 2015
61
Figure 43 : Carte des sulfates (
SO42- ) , Octobre 2014
Figure 44 : Carte des sulfates (
SO42- ) , Avril 2015
62
V.4.1.7 Cartes du nitrate :(Fig.46 et 47)
Les nitrates (NO3-) constituent le stade final
d'oxydation de l'azote organique. Les nitrates sont abondamment répandus
dans le sol, dans la plupart des eaux et des plantes où ils sont
nécessaires à la synthèse des végétaux.
Soluble dans l'eau, ils se retrouvent naturellement en faible concentration
dans les eaux souterraines et les eaux de surface.
Les sources d'azote peuvent être :
- La matière organique du sol par la minéralisation
;
- Les amendements organiques comme le fumier et les autres
déchets ;
- Les engrais azotés.
Ces derniers donnent naissance aux nitrates par les processus de
nitrification qui correspondent à l'oxydation biologique de l'azote
ammoniacal en azote nitrique NO3- (Fig.45) .Les étapes
successives de la nitrification se font par l'intermédiaire de deux
familles de bactéries principalement présentes dans les sols:
Nitrosomonas pour la nitritation (transformation de NH4+ en NO2 -) et
Nitrobacter pour la nitratation (transformation de NO2- en
NO3 -).
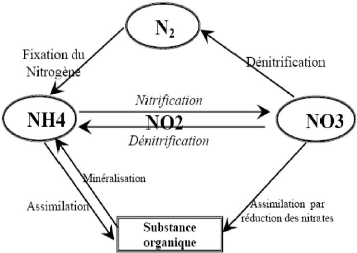
Figure 45 : le cycle de l'azote dans le sol
(Hill, 1991)
En général, les teneurs en nitrates dans les
eaux souterraines de la nappe Mio-Plio-Quaternaire sont faibles, sauf dans la
partie Nord Est de la nappe où on a enregistré des valeurs
variées entre 30 et 42, mais elles restent inferieur à la norme
fixée par l'OMS 50 mg/l.
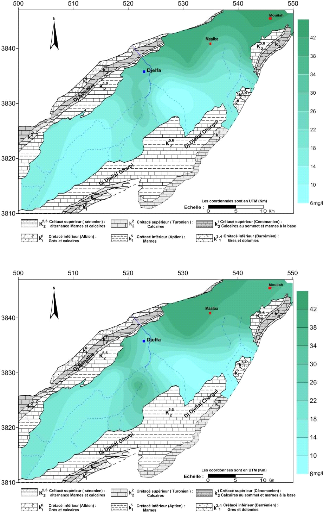
Figure 46 : carte des nitrates (NO3 -) , Octobre
2014
63
Figure 47 : carte des nitrates (NO3 -) , Avril
2015
64
V.4.2 Classification chimique des eaux :
Plusieurs méthodes ont été définies
par divers auteurs pour classer et connaître les différents
faciès chimiques des eaux naturelles.
Dans le cadre de notre étude, nous avons utilisé
les méthodes principales les plus utilisées: la classification de
Stabler, de Schoeller-Berkaloff et celle de Piper. Toutes ces classifications
sont basées essentiellement sur la composition chimique.
V.4.2.1 Classification des eaux d'après Stabler :
( Tab. 14 )
Cette classification permet de connaitre les différents
faciès chimiques des eaux, où nous avons convertir les masses
pondérales de chaque élément en (mé/l), puis on
réduit ces derniers en pourcentage (%) du nombre total du (mé/l).
On classe par ordre de grandeur, d'abord les anions suivis des cations.
De ce classement, nous définissons les eaux de la nappe
du Mio-Plio-Quaternaire en cinq familles (Tab. 14).
|
Bicarbonaté
calcique %
|
Bicarbonaté
magnésien %
|
Sulfaté
magnésien %
|
Sulfaté
calcique %
|
Chloruré calcique
|
|
La nappe MPQ
|
37.03
|
11.11
|
18.51
|
25.92
|
7.40
|
Tableau 14 : Faciès chimiques des eaux
souterraines .
On observe qu'il y'a deux facies dominant qui sont le
bicarbonatée calcique et sulfatée calcique, ce qui confirme
l'influence de la lithologie sur le chimisme des eaux (Fig. 48). On observe que
le facies sulfatée magnésienne apparaît au Nord Ouest de la
nappe au piémont sud du flanc Nord, les formations marneuses riche en
gypse et les calcaires riche en magnésium d'âge Sénonien
qui y sont présentes dans la bordure doivent donc être à
l'origine de ce faciès, la conductivité des eaux dans cette
partie est très élevée dépasse 1600 et qui peut
atteinte 5000 dans certains puits. Le facies sulfaté calcique
apparaît en aval à l'extrême Nord Est où les
affleurements sénonienne dans cette partie doivent être
également à l'origine de ce faciès. Les facies
bicarbonatés calciques et bicarbonatés magnésiennes se
localisent au Sud Ouest, au centre et au Nord Est, donc les formations
calcaires sont à l'origine de ces faciès.
Seuls les points FMH2 et FMH3 à l'extrême Sud Est
(chlorurée calcique) indiquent un mélange probable d'eau de
faciès différents. En effet, ces deux points sont situés
au Nord d'une faille E-W traversant une partie du synclinal et aussi à
proximité d'un affleurement triasique (voir la carte géologique,
chapitre II).
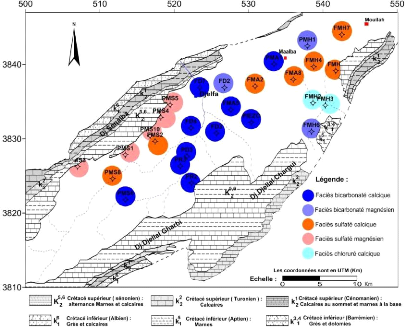
65
Figure 48 : carte de répartition des
faciès chimiques de la nappe Mio-Plio-Quaternaire
du synclinal de
Djelfa .
V.4.2.2 Classification des eaux d'après Piper
:(Fig. 49 et 50 )
Le diagramme de Piper permet de représenter plusieurs
échantillons d'eau simultanément. Il est composé de deux
triangles, permettant de représenter le faciès cationique et le
faciès anionique, et d'un losange synthétisant le faciès
global. Le principe consiste à représenter dans chaque triangle
équilatéral les quantités en réaction par rapport
à la concentration totale des anions et des cations, on obtient ainsi
deux points représentatifs indiquant la dominance d'un anion ou d'un
cation.
La composition de l'eau peut être figurée sur le
losange par un point unique correspondant à l'intersection des
parallèles depuis ces deux points aux côtés du losange qui
représente la nature chimique de l'échantillon.
La représentation des point d'eau sur le diagramme
triangulaire de PIPER pour les deux périodes Octobre 2014 et Avril 2015,
montre la tendance vers le pole magnésien et le pole calcique dans le
sous triangle des cations, alors que les anions montrent une dominance
bicarbonatée pour certains points, et des autres points montrent la
tendance vers le pole Sulfatée. Le diagramme global fait ressortir les
faciès suivants: le sulfatée calcique, sulfatée
magnésienne, bicarbonaté calcique et bicarbonatée
magnésienne.

Figure 49 : Diagramme de Piper , campagne
Octobre 2014
Figure 50 : Diagramme de Piper , campagne Avril
2015
66
V.4.2.3 Classification des eaux d'après
Schoeller-Berkaloff :
Le diagramme de Schoëller-Berkaloff permet de
représenter le faciès chimique de plusieurs échantillons
d'eaux. Chaque échantillon est représenté par une ligne
brisée. La concentration de chaque élément chimique est
figurée par une ligne verticale en échelle logarithmique. La
ligne brisée est formée en reliant tous les points qui
représentent les différents éléments chimiques.
Les diagrammes tracés pour les deux périodes
Octobre 2014 et Avril 2015 (Fig.51 et 52), confirment la prédominance
des facies bicarbonatée calcique et sulfatée calcique, permettant
de dire que la minéralisation des eaux est liée essentiellement
aux ions Hco3 -, So42- et Ca2+. D'une manière
générale les eaux sont évoluées, de la
1ère au 2ème stade d'évolution
chimique.
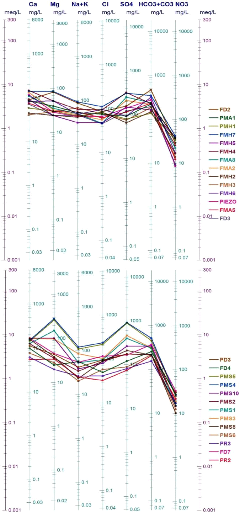
67
Figure 51 : Diagrammes de Schoeller-Berkaloff ,
Octobre 2014
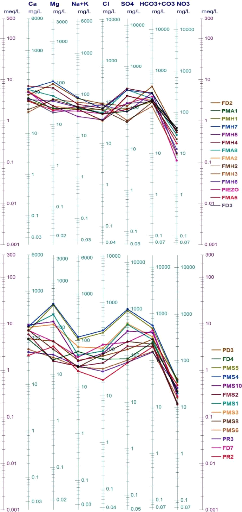
68
Figure 52 : Diagrammes de Schoeller-Berkaloff ,
Avril 2015
69
V.5 L'ORIGINE DU CHIMISME DES EAUX SOUTERRAINES
:
En se basant sur les mesures et les analyses chimiques de toutes
les campagnes, on va essayer de déterminer l'origine probable de tous
les ions.
V.5.1 Les éléments Ca2+ -
HCO3- - SO42- :
La figure 53 A montre l'évolution du calcium en fonction
des bicarbonates. Les points se positionnant sur la droite de pente 1 indiquent
l'origine carbonatée des ions du calcium. Les autres points montrent un
excès du calcium suite à la dissolution du gypse.
L'analyse de graphe 53 B montre que 85 % de l'ensemble des
échantillons ont une origine carbonatée.
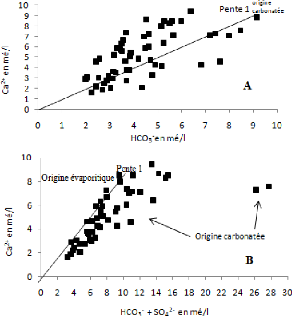
Figure 53: Evolution du calcium
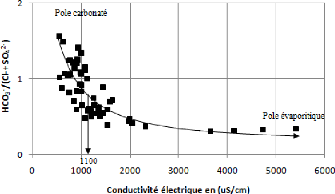
V.5.2 Rapport HCO3- / (Cl- +
SO42-) - Conductivité électrique :
La réalisation de ce diagramme a montré la
présence de deux pôles : le premier est carbonaté et
représente 35 % des Point d'eau, il se caractérise par une
dominance des ions HCO3- pour des conductivités
inférieures à 1100 uS/cm. Le second,
gypsifère, représente 65% des Point d'eau, les ions
Cl- et SO42- y dominent. Ce pôle est
accompagné d'une conductivité plus importante qui peut atteint
5427 uS/cm (Fig. 54).
L'examen de la figure confirme donc que la conductivité
électrique de l'eau est due aux sulfates et aux chlorures.
70
Figure 54: Origine de la salinité en
fonction des rapports
caractéristiques.
V.5.3 Couple Ca2+ / Mg2+ -
Conductivité :
L'influence de ces deux éléments sur la
conductivité électrique de l'eau a été
vérifiée à l'aide de la figure 55. On note que pour les
valeurs de conductivité supérieures à 1200
uS/cm, la conductivité n'est influencée que par
le magnésium. La représentation graphique montre que 60 % des
points analysés présentent un rapport supérieur à
1, indiquant une dominance des ions du calcium par rapport aux ions
magnésiens (40 % des points analysés).
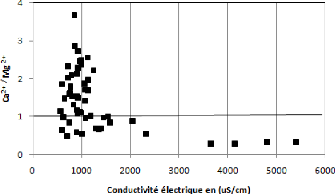
Figure 55: Relation
Ca2+/Mg2+ - conductivité.
V.5.4 Couple Mg2+ - Cl-
:
Le graphe 56 montre l'évolution du magnésium en
fonction des chlorures. Le graphe montre une dispersion des points indiquant
une évolution proportionnelle des deux éléments, cette
relation traduit la dissolution d'un chlorure de magnésium d'origine
salifère. Des autres points présentent un excès en
magnésium qui peut être due à la dissolution des formations
carbonatée riche en magnésium (dolomites).
Figure 56: Relation Mg2+ -
Cl-.
V.5.5 Couple Mg2+ - SO42-
:
L'examen de cette relation montre une évolution
proportionnelle des sulfates et du magnésium (Fig. 57). Cette relation
traduit la dissolution d'un sulfate de magnésium d'origine
salifère. Cette relation confirme aussi l'existence du faciès
sulfaté magnésien.
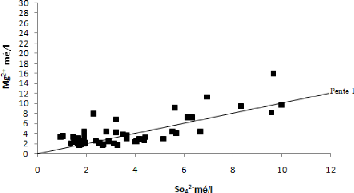
71
Figure 57: Relation Mg2+ - SO4
2-.
72
V.5.6 Couple SO42--
Cl-:
Ces deux ions sont issus de deux formations
différentes, le SO42- provient du gypse et le
Cl-provient de la dissolution de l'halite et probablement d'une
pollution anthropique. Le graphe 09 montre l'évolution du chlorure en
fonction des sulfates. Le graphe montre une dispersion des points indiquant une
dominance des ions du Sulfate par rapport aux ions chlorurés. Cela
traduit la dominance du faciès Sulfaté sur le faciès
chlorure. (Fig. 58).
V.5.7 Couple SO42-/Cl- -
Conductivité :
Ce rapport permet de déterminer la manière selon
laquelle évolue la mise en solution des ions évaporitiques en
fonction de la conductivité électrique. D'une autre
manière l'influence de ces ions sur la conductivité
électrique de l'eau a été vérifiée à
l'aide du graphe (Fig. 59). On note que pour les valeurs de conductivité
supérieures à 1300 uS/cm, la conductivité
n'est influencée que par le sulfate.
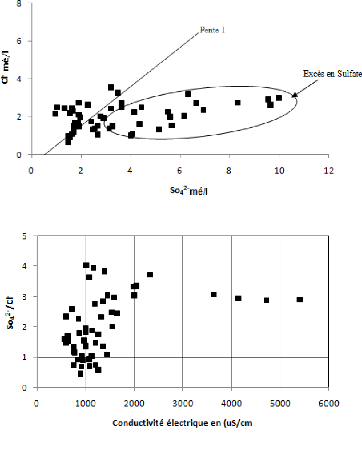
Figure 58: Relation SO42- -
Cl-.
Figure 59: Relation SO42- /
Cl- - conductivité.
La représentation graphique montre que 80 % des points
analysés présentent un rapport supérieur à 1,
indiquant une dominance des ions du gypse par rapport aux ions chlorurés
(20 % des points analysés).
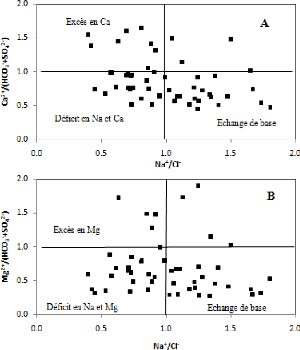
V.5.8 Diagramme Ca2+ / (HCO3 - + SO4
2-) - Na+ / Cl- :
Le report de tous les points d'eau sur le diagramme montre que
37 % des points d'eau ont subit un échange de base, 28 % des points
présentent un déficit en Na+ et en Ca2+, et
33 % des points présentent un excès en Ca2+ par
rapport aux ions HCO3- et SO42-. L'excès en
Na+ qui s'accompagne par un déficit en Ca2+
témoigne la responsabilité de l'échange de base dans
l'augmentation des teneurs en Na+ (Fig. 60A).
V.5.9 Diagramme Mg2+ / (HCO3- +
SO42-) - Na+ / Cl-:
Le report de tous les points d'eau sur le diagramme montre
qu'également 37 % des points d'eau ont subit un échange de base,
et 36 % des points présentent un déficit en Na+ et en
Mg2+, et 18 % des points présentent un excès en
Mg2+ par rapport aux ions HCO3- et SO42-.
L'excès en Na+ qui s'accompagne par un déficit en
Mg2+ témoigne la responsabilité de l'échange de
base dans l'augmentation des teneurs en Na+ (Fig. 60B).
Au cours de leurs trajets souterrains, les eaux entrent en
contact avec différentes formations géologiques qui ont la
propriété d'échanger leurs ions contre ceux contenus dans
les eaux. Ici, l'échange des alcalins Na+ et K+ de
ces formations s'est réalisé contre les alcalino-terreux de l'eau
à des proportions égales (37 % des points d'eau
analysés).
73
Figure 60: Echange de base.
74
V.6 ANALYSE STATISTIQUE (A.C.P) :
Pour comprendre les mécanismes régissant la
qualité des eaux de la région, nous avons utilisé l'outil
statistique particulièrement l'analyse en composantes principales. Cette
dernière met en évidence les liens qui semblent exister entre les
éléments chimiques (Travi et Mudry, 1997).
L'étude statistique a englobé les 27
échantillons prélevés dans chaque campagne Octobre 2014 et
Avril 2015 , Le nombre de variables de base retenues pour l'A.C.P est de 09 qui
sont : Ca2+, Mg2+, (Na+ + IC+) ,
Cl- , HCO3 -, SO42-, No3- , p.H , et la
conductivité CN.
Le traitement de nos données par analyse en composantes
principales (ACP) a donc été réalisé à
l'aide de logiciel IBM SPSS Statistics v21. Cette analyse a été
poussée jusqu'à 2 facteurs et 76.86% de la variance ont pu
être exprimés.
V.6.1 Matrice de corrélation :
Selon Mangin A. (1974), pour 27 individus, le coefficient de
corrélation critique est de 0,658. L'examen des deux tableaux (15 et 16)
montre que, il existe une forte corrélation entre la conductivité
électrique et les sulfates, les chlorures, les magnésiums, Ces
corrélations montrent que les variations des charges ioniques dissoutes
sont entièrement ou en partie liées à des variations de
teneurs de ces différents ions. Ceci indique également que ces
différents paramètres ont tendance à évoluer
concomitamment, par concentration sous l'effet de la lithologie.
Une corrélation faible entre les alcalino-terreux
(Ca2+ et Mg2+). Ca2+ est fortement
corrélé avec les ions Hco3 -(0,85), par contre l'ion
Mg2+ est bien corrélé avec les ions
Cl-(0.94), SO4 2-(0.96) Na+(0,79). Ces
derniers sont également bien corrélés entre eux, ces
liaisons témoignent de l'influence salifère sur le chimisme de
l'eau de la région.
|
Ca
|
Mg
|
Cl
|
So4
|
hco3
|
No3
|
Na+K
|
CN
|
PH
|
|
Ca
|
1.00
|
|
|
|
|
|
|
|
|
|
Mg
|
0.59
|
1.00
|
|
|
|
|
|
|
|
|
Cl
|
0.53
|
0.91
|
1.00
|
|
|
|
|
|
|
|
So4
|
0.67
|
0.95
|
0.88
|
1.00
|
|
|
|
|
|
|
hco3
|
0.89
|
0.61
|
0.64
|
0.64
|
1.00
|
|
|
|
|
|
No3
|
0.14
|
0.07
|
0.12
|
0.10
|
0.15
|
1.00
|
|
|
|
|
Na+K
|
0.36
|
0.76
|
0.79
|
0.74
|
0.55
|
0.27
|
1.00
|
|
|
|
CN
|
0.64
|
0.97
|
0.92
|
0.98
|
0.63
|
0.08
|
0.77
|
1.00
|
|
|
PH
|
0.09
|
-0.17
|
-0.19
|
-0.09
|
0.08
|
-0.16
|
-0.13
|
-0.11
|
1.00
|
Tableau.15: Matrice de corrélation
entre les variables. Octobre 2014
|
Ca
|
Mg
|
Cl
|
So4
|
Hco3
|
No3
|
Na+K
|
CN
|
PH
|
|
Ca
|
1.00
|
|
|
|
|
|
|
|
|
|
Mg
|
0.60
|
1.00
|
|
|
|
|
|
|
|
|
Cl
|
0.55
|
0.91
|
1.00
|
|
|
|
|
|
|
|
So4
|
0.67
|
0.95
|
0.87
|
1.00
|
|
|
|
|
|
|
Hco3
|
0.80
|
0.64
|
0.63
|
0.65
|
1.00
|
|
|
|
|
|
No3
|
0.10
|
0.29
|
0.16
|
0.29
|
0.16
|
1.00
|
|
|
|
|
Na+K
|
0.32
|
0.77
|
0.80
|
0.71
|
0.55
|
0.30
|
1.00
|
|
|
|
CN
|
0.64
|
0.95
|
0.93
|
0.98
|
0.65
|
0.31
|
0.79
|
1.00
|
|
|
PH
|
-0.01
|
-0.12
|
-0.13
|
-0.16
|
0.00
|
-0.17
|
-0.04
|
-0.09
|
1.00
|
Tableau.16: Matrice de corrélation entre
les variables. Avril 2015
75
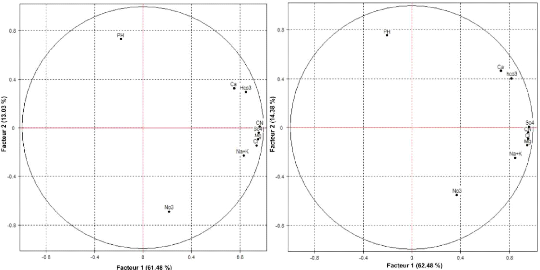
V.6.2 Analyse des plans factoriels F1xF2:
· Analyse de l'espace des variables
L'analyse du plan factoriel 1-2 montre que plus de 75% de la
variance totale sont exprimés. (Fig. 61). L'examen des deux plans montre
une opposition entre les eaux fortement minéralisées et les eaux
faiblement minéralisées.
Le facteur F1 représente plus de 61 % de la variance
et il est déterminé principalement par toutes les
éléments chimiques, et la conductivité électrique
CN, donc ce axe peut être interprété comme axe de
minéralisation.
Selon l'axe F2, les eaux riches en nitrates et sodium,
accompagnées par les sulfates, les magnésiums, et les chlorures,
s'opposent aux eaux riches en Ca et Hco3. Cette distribution indique une
opposition entre deux minéralisations, l'une liée aux formations
carbonatées, cette minéralisation représentée par
les eaux les moins chargées, et l'autre liée aux formations
salifères, représentée par les eaux les plus
chargées.
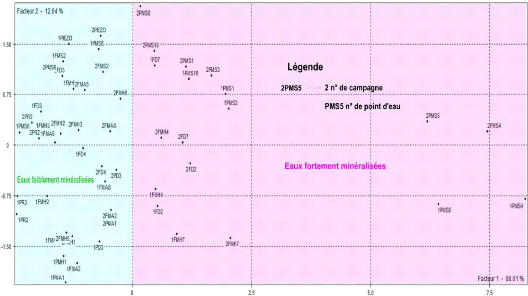
· Projection dans l'espace des individus
:
À l'observation de la projection des individus sur le
plan factoriel F1×F2 (figure 62), nous pouvons regrouper les points d'eau
en deux familles :
- Famille 1 est constituée des eaux fortement
minéralisées et ayant des teneurs très
élevées en Sulfates (supérieures à la norme OMS),
chlorures et magnésiums. Cette famille regroupe 18 points d'eau
c'est-à-dire 33,3% du total des points d'eau
échantillonnés; Ces points d'eau se localisent au Nord Ouest et
à l'extrême Nord Est de la nappe.
- La famille 2 est constituée des eaux faiblement
minéralisées et ayant des teneurs élevées en
bicarbonates, ces eaux proviennent de 36 points d'eau c'est-à-dire 66,6%
du total des points d'eau échantillonnés. Ces points d'eau se
localisent au Sud Ouest et au centre de la nappe
Octobre 2014 Avril 2015
Figure 61 : Espace des variables du plan
factoriel F1×F2
76
Figure 62: Espace des individus.
V.7 QUALITE CHIMIQUE DES EAUX : V.7.1 Potabilité
des eaux :
Pour définir la potabilité des eaux
étudiées, nous allons baser sur les normes qui ont
été établies par l'Organisation Mondiale de la
Santé (O.M.S). (Tab. 17).
Ces normes définissent deux types de concentrations
maximales, traduisant les limites de potabilité :
- Une concentration maximale acceptable à partir de
laquelle une eau peut provoquer une certaine réticence chez le
consommateur.
- Une concentration maximale admissible correspondant à la
quantité maximale de substance à tolérer et dont la teneur
supérieure peut être dangereuse pour la santé.
|
Eléments
|
Concentration maximale
acceptable (mg/l)
|
Concentration maximale admissible
(mg/l)
|
|
Ca++
|
75
|
200
|
|
Mg++
|
50
|
150
|
|
So4 --
|
200
|
400
|
|
Cl-
|
200
|
600
|
|
pH
|
7 à 8,5
|
6,5 à 9,2
|
Tableau 17 : Normes applicables aux eaux
destinées à l'alimentation humaine d'après
l'O.M.S
77
Eléments
|
Pourcentage des échantillons
d'eau à concentration inférieure à la
concentration
maximale admissible
|
Pourcentage des échantillons
d'eau à concentration inférieure à la
concentration
maximale acceptable
|
|
Octobre 2014
|
Avril 2015
|
Octobre 2014
|
Avril 2015
|
|
Ca++
|
29,62
|
37,04
|
92,59
|
92,59
|
|
Mg++
|
66,66
|
62,96
|
88,88
|
81,48
|
|
So4 --
|
62,96
|
66,66
|
85,18
|
85,18
|
|
Cl-
|
92,59
|
92,59
|
100
|
100
|
|
pH
|
100
|
100
|
100
|
100
|
Tableau 18 : Pourcentage des
échantillons d'eau à concentrations inférieures aux
normes
fixées par l'OMS
Le tableau 18 montre que les normes maximales admissibles sont
dépassées par 38 % des échantillons. On note
également que 90 % des échantillons ont des concentrations
inférieures aux concentrations maximales acceptables.
V.7.2 Aptitude des eaux à l'irrigation
:
La qualité chimique des eaux influe directement sur le
rendement des terres agricoles et sur la préservation des sols. A cet
effet et étant donné que la zone d'étude est à
vocation agricole, une étude chimique des eaux pour l'irrigation est
indispensable pour mettre en évidence le danger que peut
présenter certains éléments chimiques pour les plantes et
pour les sols.
Afin d'apprécier la valeur agricole d'une solution,
Wilcox (1948) a proposé le premier diagramme délimitant des
classes basées sur la minéralisation totale et le pourcentage du
sodium absorbé par l'eau; puis en 1954 le laboratoire de
salinité du département de l'agriculture en USA
(Richards) a proposé un deuxième diagramme délimitant
aussi des classes fondées sur la minéralisation totale et le
sodium absorbé par le sol (S.A.R).
V.7.2.1 Classification des eaux par la méthode de
Richards :
Cette classification a été proposée par
Richards. Elle est très utile et fiable pour caractériser une eau
d'irrigation. Une eau chargée en sels peut provoquer un risque pour
l'irrigation. Ce risque est déterminé à l'aide de la
valeur du sodium absorbable (Sodium Absorption Ratio, SAR). Ce paramètre
comme étant une détermination du pouvoir d'échange des
ions Ca2+, Mg2+, par le Na+ dans les argiles
et les colloïdes. (Tab. 19a et 19b, en annexe).
Le taux de sodium absorbé par le sol (S.A.R) est
donné par la formule suivante :
rNa+
(rCa2++rMg2+
2
S.A.R =
78
Cette classification se fait donc, en reportant sur le
diagramme les conductivités électriques en
(uS/cm) à 20 °C, en fonction du taux d'absorption
du sodium (S.A.R).
La classification de Richards basée sur la
conductivité et le S.A.R, permet de définir plusieurs classes
d'eau, présentant chacune un danger de salinisation et d'alcalinisation
variable (Tab.21).
|
Degré
|
Qualité
|
Classe
|
L'état d'utilisation
|
|
1ère
|
Excellente
|
C1S1
|
Eaux utilisables sans danger pour l'irrigation pour la plus part
des cultures, sur la plus part des sols.
|
|
2ème
|
Bonne
|
C2S1
C1S2
|
En général, eau pouvant être
utilisée sans contrôle en particulier pour l'irrigation des
plantes moyennement tolérantes aux sels sur sol.
|
|
3ème
|
Admissible
|
C3S1
C2S3
C3S2
|
En général, eau convenant à l'irrigation des
cultures tolérantes aux sels sur sol bien drainés.
L'évolution de la salinité doit cependant être
contrôlée.
|
|
4ème
|
Médiocre
|
C4S1
C4S2
C3S3
|
Eau fortement minéralisée pouvant convenir à
l'irrigation de certaines espèces bien tolérantes aux sels sur
sol et bien drainées.
|
|
5ème
|
Mauvaise
|
C3S4
C4S3
C4S4
|
Eau ne convenant pas généralement à
l'irrigation mais pouvant être utilisée sous certaines conditions
: sol très perméable, bien lessivé, plantes
tolérantes aux sels.
|
Tableau 19 : Classification des eaux
d'irrigation en fonction de la C.E et du S.A.R
(Méthode de
Richards)
La représentation des échantillons
analysés sur le diagramme de Richards (Fig. 63 et 64),
montre que les eaux de la nappe du Mio-Plio-Quaternaire appartiennent aux 3
classes : C2S1, C3S1, C4S1, mais la plupart des points d'eaux 81.48 %
appartiennent au classe C3S1. Elles se manifestent par un faible
danger d'alcalinisation et par une salinisation moyenne. En
général ces eaux sont convenables à l'irrigation de
culture tolérante aux sels sur des sols bien drainés,
l'évolution de la salinité doit être
contrôlée. La salinisation est causée par la dissolution
des gypses et la forte évaporation des eaux, due au climat semi-aride de
la région.

Figure 63 : Diagramme de classification des eaux
d'irrigation (méthode de Richards) , Octobre 2014
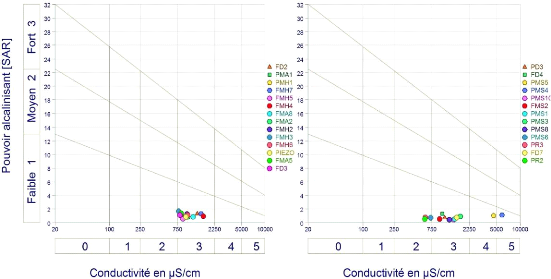
79
Figure 64 : Diagramme de classification des
eaux d'irrigation (méthode de Richards) , Avril 2015
V.7.2.2 Classification des eaux par la méthode de
Wilcox :
Généralement, les plantes supportent mal les
sols saturés en sodium. La classification de Wilcox fondée sur la
conductivité électrique et la teneur en sodium dans l'eau
exprimée en pourcentage. La représentation des différents
échantillons sur ce diagramme permet la caractérisation des eaux
pour leur aptitude à l'irrigation. (Fig. 65)
Le pourcentage du sodium est défini par la formule
suivante :
NaU
% Na+ = CaUU+ MgUU+NaU+KU X 100 , tous les ions sont
exprimés en méq/l
La représentation des différents
échantillons analysés sur le diagramme de Wilcox montre que les
eaux de la nappe du Mio-Plio-Quaternaire appartiennent aux quatre classes;
excellentes, bonnes médiocres et mauvaise. La classe excellent
représentée par 11.11 % des points d'eaux, et la classe bonne
représentée par la plupart des points d'eaux 74.08 % correspond
à celles `admissible' dans la méthode de Richards, la classe
médiocre et mauvaise 14.81 % des points d'eaux.
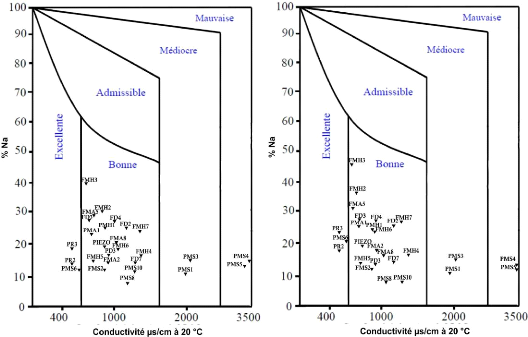
Octobre 2014 Avril 2015
80
Figure 65 : Diagramme de classification des
eaux d'irrigation (méthode de Wilcox )
81
V.8 CONCLUSION:
L'étude hydrochimique de la nappe du
Mio-Plio-Quaternaire du synclinal de Djelfa permet de dire que :
-La majorité des échantillons analysés
présentent des valeurs de conductivité moyenne et admissibles,
une moyenne de l'ordre de 900 us/cm, à l'exception de deux zones,
l'extrême Nord Est et la zone Nord Ouest où la conductivité
dépasse le 1600 us/cm.
-L'interprétation des cartes hydrochimiques, montre une
forte concentration en éléments chimiques dans la partie
Nord-Ouest de la nappe, c'est-à-dire au piémont Sud du flanc Nord
du synclinal (Djebel Senalba), donc l'influence de la lithologie des formations
sur l'acquisition de la minéralisation et sur les types de
faciès. Les failles peut joue également un rôle
intermédiaire dans la remonté des eaux profondes avec un
lessivage des formations triasiques qui augmente la minéralisation des
eaux dans cette partie.
-L'interprétation des classifications de Stabler,
Schoeller-Berkaloff et Piper, a montré que les faciès chimiques
dominants sont celles bicarbonatés calciques et sulfatés
calciques. En effet, les formations carbonatées et les formations
marneuses du Crétacé supérieur bordant la nappe sont
à l'origine du ces faciès qui sont les prédominants sur
l'ensemble de la nappe, confirmant ainsi l'alimentation latérale de la
nappe, à partir les bordures du synclinal, comme nous l'a montré
la carte piézométrique (fig. 22).
-Les différentes relations entre les
éléments chimique avec la conductivité des eaux, a
montré que l'augmentation de la conductivité des eaux
souterraines due essentiellement aux trois éléments chimique, le
Sulfate, le magnésium et le chlorure. L'analyse en composante principale
a confirmé cette tendance, où les eaux les moins chargées
au Sud Ouest et au centre de la nappe caractérisée par un
faciès bicarbonatés calciques avec des valeurs du
conductivité inferieurs 1100 us/cm, par contre les eaux les plus
chargées au Nord Ouest et à l'extrême Nord Est de la nappe
caractérisée par les facies; sulfaté
magnésien et sulfaté calcique avec des conductivité
dépassent 1600 us/cm . Deux point au Sud Est présentent
un faciès chlorurée calcique indiquent un mélange probable
d'eau de faciès différents. En effet, ces deux points sont
situés au Nord d'une faille E-W traversant une partie du synclinal et
aussi à proximité d'un affleurement triasique (voir la carte
géologique, chapitre II). -L'utilisation de ces eaux à
l'irrigation, sont convenable à l'irrigation de culture tolérante
aux sels sur des sols bien drainés, l'évolution de la
salinité doit être contrôlée.
| 


