EPIGRAPHIE
« L'azote, ni trop, ni trop peu, la bonne
dose, au bon moment»
L'auteur
DEDICACE
A mon cher père, MATABA MPONGATE Roger, si
dévoué, qui m'a toujours fait aimer la voie du savoir ;
A ma gracieuse mère FAMPANA MBOMBO Brigitte pour
qui je prie Dieu de la bénir et la protéger de tout
mal ;
A mes chères frères et soeurs et à
l'honorable famille MATABA et BOZEME, ainsi qu'à
Ir N'KIERE MBO WASSA et à tous ceux qui m'ont
illuminé la voie de la science,
Je dédie ce travail. REMERCIEMENTS
L'élaboration de ce travail scientifique nous aura mis
en face de nombreuses difficultés. Les unes techniques, les autres
financières. Pour les surmonter nous avons
bénéficié du concours multiforme de certaines personnes
physiques. Ainsi, nous nous faisons l'obligation de leur rendre, ici, l'hommage
qu'elles méritent.
Qu'il nous soit d'abord permis de dire un grand merci au corps
académique et scientifique de la faculté des Sciences
Agronomiques pour les efforts fournis, les sacrifices consentis, la discipline,
la rigueur et les privations qu'ils se sont imposés pour nous assurer
une formation que nous pensons être de qualité dans un
environnement socio-économique difficile qui incite à l'abandon.
Nous tenons fortement à dire un grand merci au
professeur Christophe LUMPUNGU KABAMBA pour avoir accepté de nous
guider, pas à pas, dans la réalisation de ce travail.
Malgré ses lourdes charges, il a toujours témoigné une
disponibilité permanente pour nous écouter et nous apporter le
point de vue d'un enseignant. Son savoir faire et ses qualités de
scientifique nous ont été très bénéfiques.
A nos amis et collègues de l'auditoire qui, dans des
situations difficiles, nous ont toujours encouragé, prodigué de
bons conseils et nous ont toujours poussé à faire un travail de
qualité, nous disons merci. Il s'agit de : junior KALONJI,
Hervé TSHIALA, Ladislas-Josué KABONGO, Charlène N'SODIE et
Ruth MUAKANA. Qu'ils trouvent tous, ici, l'expression de notre profonde
gratitude.
A nos très chers oncles et tantes qui, malgré
leurs charges, se sont aussi préoccupés des nos études en
nous poussant toujours au travail et au travail bien fait, qu'Ils daignent
accepter l'expression de notre reconnaissance. Il s'agit de Maman Caroline
MUSELE, Wivine BOZEME, Couple Alain BOZEME, Nanou BOZEME, Couple Hyppo FAMPANA,
couple Faustin FAMPANA, couple Frédérique FAMPANA, Rigo FAMPANA,
Brigitte MATABA, la famille MAKOMO et les autres.
Nous exprimons notre reconnaissance aux autorités et
amis du centre culturel Loango, ainsi qu'au personnel du Laboratoire du prof
MUSIBONO de la faculté des sciences de l'université de Kinshasa
pour l'esprit amical dont ils ont fait montre à notre égard.
Nous disons aussi merci à Jean Paul KAHAMBA,
José KABEYA, Charles MPUTI, Papy ADEGE, KABONGO ANKA, Jean LELE, Erick
LUFUNGULA, Matty TSHUMBU, Nodi BOTSHELE, Papy TSHIYOYO, Emmanuel SEMA,
Joël MBOLE, junior KOMISER, Patou LOKOLANZA, Franklin KANUMBI, Edmond MBU,
Pitshou NGABU2, Serge BUELUSA, Charles MPUTI, Rocky KASIAMA, Junior
MBELA2, Clarisse YERSONG, Jaurès BIKIOMO, Mimi MAYIMBI,
Solange EVESIRE, Nicha SONA, Théthé TUYINDULA, Niclette MAKA,
Dedette MANGONO, Gisèle MANGABU, Bibiche MASSAMBA et tous ceux
là, trop nombreux pour l'esprit amical dans lequel ils ont
collaboré à la réalisation de ce travail.
Que tous daignent accepter nos remerciements les
plus chaleureux et qu'ils sachent combien nous leur sommes reconnaissant, non
seulement pour l'aide apportée, mais aussi et surtout pour l'esprit
amical dans lequel ils ont collaboré à la réalisation de
cet travail.
Nous nous réjouissons de penser que ce travail, plaisir
pour les uns, peine pour les autres et, devoir pour nous, ne sera,
peut-être, pas entièrement perdu pour ceux à qui nous
devons les fruits de nos veilles.
Table des matières
EPIGRAPHIE
i
DEDICACE
ii
REMERCIEMENTS
iii
INTRODUCTION
1
Ière PARTIE : ETUDE
BIBLIOGRAPHIQUE
3
Chapitre I : l'azote
3
I.1. Origine et Définition
3
I.2. Carte d`identité de l'azote
3
I.2.1. Informations Générales
3
I.3. Etat de l'azote
5
I.3.1. Azote Libre
5
I.3.2. Azote Combiné
5
I.3.2.1. Azote organique (Norg)
5
I.3.2.2. Azote minérale
5
Chapitre II. Cycle de l'azote
7
II.1. Fixation Biologique
7
II. 2. Minéralisation de l'azote
organique
7
II.2.1. Ammonification
8
II.2.2. Nitrification
8
II.2.2.1. Définition
8
II.2.2.2. Etapes de la nitrification
8
II.2.2.3. Organismes de la nitrification
8
II.2.2.4. Facteurs influençant la
nitrification
10
II.3. Perte d'azote
12
II.3.1. Perte par volatilisation ammoniacale
12
II.3.2. Perte par lixiviation
13
II.3.3. Perte par dénitrification
13
II.3.4. L'immobilisation de l'azote
14
IIème PARTIE : ESSAI EXPERMENTALE
17
Chapitre I. Matériels et Méthode
17
I.1. Matériels
17
I.1.1. sol
17
I.1.2. Matériel d'analyse
17
II.2. Méthode
18
II.2.1. Dispositif expérimental
18
II.2.2. Apport de l'urée et arrosage
18
II.2.2. Analyse
18
II.2.2.2. Dosage
19
Chapitre III : Résultats et
Discussion
21
III.1. Sol Travaillé
21
III.2. Sol non travaillé
22
Conclusion
23
BIBLIOGRAPHIE
24
INTRODUCTION
De tous les éléments chimiques prenant part
à la nutrition de la plante, l'azote est le plus important pour la
croissance des cultures et les niveaux de rendement. Cet élément
existe sous des formes organiques relativement stables (acides humiques
contenant 3 à 5 % d'azote par exemple), sous des formes organiques
aisément minéralisables (acides aminés, hexosamines), ou
sous des formes minérales (nitrates, nitrites et azote ammoniacal). On
distinguera aussi l'ammonium libre, faiblement lié, fortement lié
et fixé non échangeable (ADAMS 1963-1964, BLANCHET et al
1963).
L'étude de l'azote dévoile un double
intérêt : économique et environnemental. Sur le plan
économique, la connaissance et la maitrise de la distribution de l'azote
entre les différents compartiments du sol, permet de raisonner la
fertilisation azotée. Sur le plan environnemental, l'étude du
bilan quantitatif de l'azote évite les pertes par lixiviation qui
peuvent contaminer les nappes phréatiques ou bien rejoindre le
réseau hydrographique (DRIDI et al, 2006). Une quantité optimale
d'azote dans le sol stimule l'absorption des autres éléments
nutritifs et favorise le développement de la plante et des racines et,
il faut savoir aussi qu'un excès d'azote peut conduire à des
baisses de rendement, favoriser les infestations de maladies et d'insectes et
augmenter la pollution des cours d'eau et des nappes souterraines (N'DAYEGAMIYE
, 2006).
Face à ces préoccupations économiques et
environnementales les recherches sur l'azote constituent des thèmes
d'actualité et des axes de recherches prioritaires. En effet, parmi les
problèmes multiples et complexes posés par l'utilisation de
l'azote en agriculture, la dynamique et les différentes transformations
que subis l'azote dans le sol constitue une problématique
environnementale à résoudre. Ces transformations sont sous la
dépendance, dans les conditions naturelles, des très nombreux
facteurs : climat (la température, la pluie, l'humidité
relative, ...), façons culturales (aération, drainage, ...),
propriétés physico-chimiques des sols et nature des plantes
cultives. Néanmoins, malgré la diversité des études
portant sur ce sujet, de nombreuses interrogations subsistent encore. S'il est
possible d'apprécier, dans les sols cultivés et fertilisés
les réserves en P, K, Ca, Mg pouvant être rapidement mises
à la disposition de la plante, grâce à des analyses
saisonnières, il n'en est pas de même pour l'azote, à cause
de variations considérables intervenant au cours de l'année,
notamment sous l'influence des microorganismes. Toutefois, cet azote se trouve
principalement sous forme organique et doit être minéralisé
par les micro-organismes du sol avant de devenir disponible pour les plantes.
On ne peut connaitre avec certitude les quantités et les formes d'azote
mises à la disposition de la plante, mais lorsque les niveaux sont
élevés, on peut être presque certain que l'alimentation
azotée est suffisante ou parfois trop importante.
L'objet essentiel du présent travail est d'observer les
transformations que subit l'urée dans un sol de Kinshasa.
La démarche de notre étude s'est divisée
en un apport documentaire, une analyse au laboratoire et enfin une discussion
des résultats des analyses.
Couverte d'une introduction et bouclée par une
conclusion et perspectives, la présente étude est formulée
en trois parties, dont la première concerne la revue de
littérature, la seconde étale le matériel et les
méthodes d'analyse du sol utilisés et la dernière
présente les résultats et leur discussion.
Ière PARTIE : ETUDE BIBLIOGRAPHIQUE
Chapitre I : l'azote
I.1.
Origine et Définition
Du nom latin
« nitrogenium » provenant du grec
« nitron gennan », ce qui signifie
« formateur de salpêtre » (nitrate de potassium).
L'azote a pour symbole chimique N.
En français, l'appellation azote est la plus
fréquente. Cette appellation, composé de a- (privatif)
et du radical grec æùô-,
« vivant » signifiant « privé de
vie », du fait que contrairement à l'oxygène, il
n'entretient pas la vie des animaux, a été
choisie par Antoine LAVOISIER.
Il est le 34e élément constituant la
croûte terrestre par ordre d'importance.
Dans la nature, les
« minéraux » contenant de l'azote sont
essentiellement les nitrates (nitrate de potassium KNO3, constituant
du salpêtre ou « nitre » qui servait
autrefois à faire des poudres explosives, nitrate de sodium
NaNO3, constituant du salpêtre du Chili).
Dans le langage courant, l'azote désigne le gaz
diatomique di-azote (N2), constituant majoritaire de
l'atmosphère terrestre, représentant presque les 4/5e
de l'air (78.06 %, en volume).
I.2.
Carte d`identité de l'azote
I.2.1. Informations
Générales
Tableau n°1 : Information général sur
l'azote (DAVID, 2009)
|
Nom, Symbole, Numéro
|
Azote, N, 7
|
|
Série Chimique
|
Non-métaux
|
|
Masse Volumique
|
1,2506g/l
|
|
Masse atomique
|
14,0067#177;0,0002 uma
|
|
Coloration
|
Incolore
|
|
Odeur
|
Inodore
|
|
Saveur
|
Insipide
|
Figure 1 : Tableau périodique des
éléments chimique
I.3. Etat de l'azote
L'azote est le seul élément nutritif qui n'est
pas issu de la roche mère. On le trouve dans la nature sous deux
états : à l'état libre où il constitue 80% de
l'atmosphère terrestre et à l'état combiné, sous la
forme organique ou minérale (DENIS, 2000).
I.3.1. Azote Libre
L'azote de l'atmosphère est la principale source de
l'azote utilisé par les plantes. Ce gaz inerte représente 78% des
gaz de l'atmosphère et est fixé biologiquement pour former
l'ammoniac.
I.3.2. Azote
Combiné
On appelle azote combiné, l'azote sous toutes ses
formes, à l'exception de l'azote moléculaire N2. Il
s'agit de l'azote organique et/ou de l'azote minéral.
I.3.2.1. Azote organique
(Norg)
L'azote organique est celle combiné à des atomes
de carbone qui constitue la matière organique. Cette forme n'est pas
assimilable par la plante. Elle est la source d'approvisionnement en azote des
végétaux provenant de la population microbienne du sol et de
l'accumulation des différents déchets (végétaux et
animaux) dans le sol (DENIS, 2000).
Sous forme organique, L'azote constitue les réserves du
sol. Cette forme organique évolue, passe par différents stades
pour aboutir à la minéralisation. Lorsque les déchets
végétaux sont enfouis, ils sont attaqués par des
micro-organismes (champignons, levures, bactéries) qui vont les
transformer en produits de plus en plus simples.
Pour PAGNI (1998), l'azote organique est l'azote qui est
lié au carbone pour former des molécules complexes. Dans les
êtres vivants, l'azote organique se trouve principalement sous forme de
protéines, d'acides nucléiques (ADN, ARN).
I.3.2.2. Azote
minérale
C'est le produit de la décomposition de l'azote
organique par la flore et la faune du sol notamment par la microflore
bactérienne et fongique.
Pour KACHAKA (2009) l'azote minéral proviennent aussi,
pour une part non négligeable, de l'azote ammoniacal fixé sur les
argiles.
Il existe trois formes d'azote minéral. Il s'agit
de : l'azote Ammoniacal ou ammonium, nitrique et nitrite.
a. Azote ammoniacal ou ammonium (NH4+)
L'azote ammoniacal résulte de la combinaison de l'azote
(N) et de l'hydrogène (H). Sa formule chimique
NH4+ est très proche de celle du gaz ammoniac
(NH3) d'où elle dérive et qui se volatilise dans
l'air. C'est une forme essentiellement transitoire et est le première
résultat de transformation dans le sol de l'azote organique
(ammonification). Il est soluble dans l'eau mais bien retenu par le pouvoir
sorbant du sol.
Les ions NH4+, issus de
l'ammonification, sont retenus sur le complexe sorbant grâce à
leurs charges positives, ce qui limite le risque d'entrainement en profondeur,
mais aussi la disponibilité instantanée pour les plantes.
L'ammonium étant fixé par le sol, il ne peut se
déplacer dans le sol. Aussi l'absorption par la plante ne peut
s'effectuer que dans un périmètre proche de la zone racinaire.
Certains de ces ions sont fixés plus ou moins
durablement entre les feuillets d'argile (la montmorillonite), mais la plupart
sont oxydés par les bactéries nitrifiantes (Nitrobacter,
Nitrosomonas), et transformés en nitrates.
b. Azote nitrique ou nitrate (NO3-)
Il se forme naturellement par combinaison de l'azote (N) et de
l'oxygène (O) du sol. Sa formule chimique est
NO3-. C'est la forme la plus disponible pour les plantes
qui provient de la transformation de l'azote ammoniacal (Nitrification).
Les nitrates, très solubles dans l'eau ne sont pas
retenus par le pouvoir sorbant du sol. Ils suivent l'eau dans ses
déplacements et peuvent descendre, par vagues successives, à une
vitesse qui dépend de l'état physique du sol et de la
quantité d'eau infiltrée. Ils peuvent également, s'ils
n'ont pas migré à trop grande profondeur, remonter dans le profil
du sol par capillarité, en période sèche.
Elle est la seule forme la plus mobile dans le sol qui est
assimilée de façon importante par les plantes, et cela même
par temps froid et humide.
Les nitrates sont présents dans le sol soit directement
par l'apport d'engrais contenant des nitrates (exemple : ammonitrate,
nitrate de potasse, nitrate de chaux) soit indirectement par l'activité
biochimique grâce à la microflore du sol.
Pour ZOLLER (1994), confirmé par SOUDI (1995), l'azote
nitrique est l'élément qui pose le plus de problèmes en
agriculture. Les nitrates très solubles et mobiles dans la solution du
sol sont facilement lixiviés vers les eaux souterraines et constituent
ainsi une source potentielle de pollution de la nappe phréatique.
c. Azote nitrite ou (NO2-)
Polluants chimiques les plus répandus, les nitrites
sont produits par l'oxydation de l'ammoniaque ou proviennent de déchets
agricoles, urbains et industriels.
Les nitrites sont extrêmement toxiques et leur
toxicité ne dépend pas du pH (PAGNI, 1998).
Chapitre II. Cycle de l'azote
L'azote du sol, dont la source principale est
l'atmosphère, présente plusieurs voies d'évolution: La
fixation biologique, La minéralisation (ammonification et
nitrification), la dénitrification, la volatilisation ammoniacale et
immobilisation.
Dans le cadre de ce travail nous allons beaucoup mettre
l'accent sur la nitrification, car elle fait l'objet de notre étude.
II.1. Fixation Biologique
La fixation biologique de l'azote est la transformation du
N2 de l'atmosphère en ammoniac et son intégration
directe dans le métabolisme de la plante.
Pour POSTGATE (1998), il s'agit d'un processus par lequel
l'azote est pris de sa forme moléculaire normale et relativement inerte
(N2) dans
l'atmosphère
et converti en composés d'azote (comme
ammoniaque,
nitrate et bioxyde d'azote).
C'est un processus qui permet aux organismes (les
végétaux et microorganismes) de fabriquer des substances
protéiques à partir de l'azote gazeux présent dans
l'atmosphère et l'environnement.
Deux groupes de microorganismes sont responsables de la
fixation et, partant d'eux, il existe deux types ou modes de fixation.
· Fixation symbiotique, dont le rhizobium, comme
organisme symbiotique, agit dans les racines des plantes ;
· Fixation non symbiotique, apanage des
Clostridium (anaérobique), Azotobacter
(aérobie), ...
Après fixation, l'azote moléculaire aboutit
à la formation de substances azotées organiques qui, une fois au
sol, subissent la minéralisation.
II.
2. Minéralisation de l'azote organique
La minéralisation est la réaction biologique
conduisant à la formation de l'azote minérale (Nitrique et
Ammoniacal) à partir de l'azote organique.
Cette renaissance de l'azote minéral se produit en
trois étapes : l'ammonification, l'oxydation de l'ammonium et
l'oxydation du nitrite ; les deux dernières étapes sont
combinées dans ce qu'on appelle la nitrification.
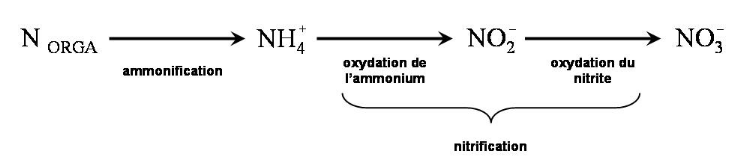
Figure 2: Processus de minéralisation de
l'azote
II.2.1. Ammonification
L'ammonification est la transformation de l'azote organique en
ammonium (NH4+) sous l'action de micro-organismes
hétérotrophes qui utilisent des substrats carbonés comme
source d'énergie (VALE, 2006) car, elles n'ont pas la capacité
d'oxyder le NO2- en NO3-. Cette
forme est transitoire et sera transformé ensuite en azote nitrique.
Vu la diversité des micro-organismes ammonifiantes,
l'ammonification est un processus sans exigence écologique
particulière, car quelles que soient les conditions de l'environnement,
il se trouve toujours dans les sols des espèces microbiennes
ammonifiantes adaptées à ces conditions, sauf bien sûre
s'il s'agit de conditions incompatibles avec la vie.
II.2.2. Nitrification
II.2.2.1.
Définition
La nitrification est la conversion biologique de l'azote
minéral réduit (NH4+) en azote
minéral oxydé sous forme de NO3- en passant
par le NO2-.
C'est un processus contrôlé par certains
micro-organismes spécifiques, qui conduit la transformation de l'ion
ammonium en nitrite puis celle de nitrite en nitrate (BARBAULT, 2009).
II.2.2.2. Etapes de la
nitrification
La nitrification s'opère en deux étapes
dont :
Ø la Nitritation ou nitrosation et
Ø la Nitratation
A. Nitrosation ou Nitritation
C'est l`oxydation de l'ammonium en nitrite qui se
réalise grâce aux bactéries dites nitreuses (les
nitrosomonas) qui, oxydent l'ammonium en nitrite selon la
réaction :
NH4+ + 3/2
O2 -------->
NO2- + H2O + 2 H+ +
E
B. Nitratation
La nitratation est l'oxydation du nitrite en nitrate
réalisée par des bactéries nitriques (les
nitrobacters).
NO2- + ½ O2 ?
NO3- + E
II.2.2.3. Organismes de la
nitrification
Dans le sol, il existe deux genres des bactéries qui
assurent la nitrification : les Nitrosomonas (Bactéries nitreuses)
et le Nitrobacter (Bactéries nitrique). Ils sont des chemoautotrophes
obligatoires ou stricts, c'est-à-dire leur énergie est
limitée à l'oxydation inorganique d'un seul groupe de
composés minéraux et le CO2 comme unique source de
carbone.
Ces bactéries apparaissent dans les sols à des
pH entre 4,5 - 10, mais elles préfèrent des conditions de pH
neutre.
Tableau 2 : Caractéristique des bactéries
nitrifiantes
|
espèce
|
Morphologie cellulaire
Taille
|
Reproduction
|
Mobilité
|
Cytomembranes
|
Habitats
|
|
Nitrosomonas
|
Bacille ;
0,8-1,0 x 1,0-2,0 um
|
Scission binaire
|
#177;1 ou 2 flagelles
subpolaires
|
Périphériques,
lamellaires
|
Sols, égouts, eaux douces, marines
|
|
Nitrobacter
|
Bacille ;
0,6-0,8 x 1,0-2,0 um
|
bourgeonnement
|
#177;1 flagelle polaire
|
Calotte polaire et vésicules aplaties à la
périphérie de la cellule
|
Sols, eaux douces, marines
|
Source : Prescott, Hartley, Klein :
Microbiologie, éditions De Boeck Université
Les bactéries nitrifiantes (les Nitrosomonas et les
Nitrobacter) présentent des exigences écologiques très
strictes : in vitro, elles sont aérobies et neutrophiles ;
mais dans le sol, l'interaction de divers processus physico-chimiques et
biologiques leur permet de se développer à des pH moyens
inferieurs à 6,0 ou même 5,0.
L'activité de bactéries nitrifiantes est
proportionnelle à la concentration en azote ammoniacal, et inversement
proportionnelle à celle de nitrite (rétrocontrôle). Cette
activité est fortement ralentie en dessous de 5° C et optimale
entre 30 et 35° C (Van Burg et al, 1982).
Dans les sols acides, la nitrification peut être
réalisée par des organismes hétérotrophes
(champignons, actinomycètes et autres bactéries comme
l'Aspergillus flavus). On parle de nitrification hétérotrophe.
Ces organismes oxydent les composés azotés réduits
(incluant l'azote organique) en NO3-. Ces organismes ont
des exigences écologiques moins stricts que les autotrophes, mais le
rendement est bien inférieur.
II.2.2.4. Facteurs
influençant la nitrification
Les bactéries nitrifiantes sont très sensibles
aux conditions du milieu dans les quelles ils vivent. Leur croissance et les
enzymes qu'ils produisent pour catalyser chaque stade de la séquence de
nitrification de l'azote, subissent l'influence des facteurs du milieu.
Les quelques facteurs, parmi ceux qui conditionnent la vie des
bactéries nitrifiantes que nous avons citées dans ce travail ne
constituent pas une liste exhaustive.
a. Aération (l'oxygène)
La nitrification est un processus d'oxydation enzymatique. Les
organismes nitrifiants ont fortement besoin d'oxygène (O2)
pour leur vie (ils sont aérobies). En effet, l'oxygène est
exploité comme accepteur ultime d'électrons, par les
bactéries nitrifiantes, pour réaliser les réactions de la
nitrification.
Nous pensons qu'un labour à des moments favorables
pourrait offrir de bonnes conditions pour l'activité des microorganismes
nitrifiants et c'est également le moyen de doper l'horizon
travaillé en éléments minéraux.
b. Disponibilité de l'ammonium
(NH4+)
L'assimilation microbienne d'ion NH4+
diminue la disponibilité de ce dernier pour les nitrifiants et donc
réduit la nitrification. La disponibilité des ions ammoniums
dépend, pour ANDRIANARISOA (2009), de l'assimilation microbienne ou
racinaire (qui consomme de l'ion NH4+), alors que la
production d'azote ammonium dans un sol donné est fortement liée
aux teneurs de ce sol en azote.
c. Température
La température joue un double rôle, sur la
croissance des microorganismes et sur les enzymes qu'ils produisent.
Pour HAYNES (1986) cité par ANDRIANARISOA (2009), la
nitrification est sensible à la température. Elle se produit, la
plupart du temps, entre 5 et 40°C, son optimum se situant entre 25 et
35°C.
Il est a noté que la nitrification
hétérotrophe, peut aller jusqu'à 50 voire 60°C.
d. Structure et Teneur en eau du sol
La quantité d'eau présente dans le sol constitue
un facteur important pour la nitrification de l'azote. A l'absence de l'eau,
la nitrification est inhibée.
Il faut signaler que l'eau du sol qui ne se trouve pas
à l'état libre, y est soumise aux forces de rétention
suivantes : forces matricielles (qui provient de l'attraction des
molécules d'eau sur les particules solides et du phénomène
de capillarité) et forces osmotiques (résultant de la
présence dans l'eau du sol de substances dissoutes). La combinaison de
ces deux forces s'appelle « Potentiel Hydrique ».
Selon MALHI et McGILL (1982), le maximum de nitrification se
manifeste à un potentiel hydrique de -10 à -30kPa (pF 2 à
2.5). À 0 kPa, la nitrification est absente ou très faible
à cause de l'absence d'oxygène causée par l'excès
d'eau.
La nitrification diminue quand le potentiel hydrique diminue.
En dessous d'un potentiel hydrique de -15000kPa (très sec),
l'activité des organismes nitrifiantes est inhibée.
Quand le sol est réhumidifié, il y a une
augmentation soudaine de la minéralisation et de la nitrification.
e. pH
Le pH du sol est un facteur capital qui affecte la
nitrification. Le pH optimal donné dans la littérature pour la
nitrification varie entre 7 et 9 (BOUGARD, 2004).
Plusieurs études prouvent que la nitrification
s'amplifier quand le pH du sol croit (Tacon, 1976 ; Li et al, 2007 ;
Pietri et Brookes, 2008) cités par Andrianariaoa (2009).
Il a été généralement
rapporté que la nitrification est faible à pH acide car, les
bactéries nitrifiantes sont sensibles à l'acidité (DE BOER
et KOWALCHUK, 2001).
f. Composés toxiques
La nitrification est inhibée par une large
variété de composés. Martin (1979) cite
spécialement les métaux lourds (le cuivre, le nickel, le cobalt,
le zinc et le chrome), les amines, les phénols, les composés
cycliques azotés et les composés contenant le groupe SCN.
L'auteur souligne cependant, que tous ces composés ne
sont pas inhibiteurs aux mêmes concentrations et il faut noter que les
micro-organismes nitrifiants possèdent une forte capacité
d'adaptation.
g. Les engrais
Les engrais apportés au sol procurent à ce
dernier des sels de tous genres et même des oligoéléments,
ce qui active la nitrification. C'est pourquoi, l'apport surabondant d'un
élément entre N, P et K, au détriment des autres, risque
de compromettre les autres phases de la minéralisation de l'azote.
BUCKMAN et BRADY cités par ABDALA, 1979 ne renseignent que l'application
des quantités considérables d'azote ammoniacal sur des sols
basiques à pour effet de retarder la deuxième phase de la
nitrification. Dans ce type de sol, les effets nuisibles peuvent
également résulter de l'application d'un composé tel que
l'urée qui apporte des ions NH4+ dans le sol par
hydrolyse.
II.3. Perte d'azote
L'azote est le premier élément minéral
limitant le niveau de production de nombreux systèmes de productions
agricoles dans le monde. C'est paradoxal que cet élément, qui
représente une charge importante pour l'agriculteur, échappe au
système et vienne polluer les cours d'eau, les nappes souterraines et
l'atmosphère. Les pertes d'azotes est une question des plus
préoccupantes.
Dans le cadre de ce travail, nous nous sommes servis de
l'urée (CO(NH2)2) car, c'est l'engrais
azoté les plus concentré (46% N) et le plus utilisé dans
la pratique agricole.
Nonobstant sa concentration la plus élevée en
azote, l'application de l'urée demande cependant certaines
précautions à cause de pertes en azote que peuvent subir
l'élément dans les sols agricoles.
Il existe trois formes des pertes :
II.3.1. Perte par
volatilisation ammoniacale
C'est la transformation de l'azote sous forme d'ammonium en
ammoniac qui est volatilisé. Voici la réaction:
NH4+
+ OH- ---> NH3 + H2O
La volatilisation est souvent la principale voie de perte
d'azote lorsque des amendements riches en azote comme l'urée sont
appliqués au sol. Elle se produit lorsqu'il a accumulation d'azote
ammoniacal [NH3 (gaz) et NH4+ (solide)]
près de la surface du sol.
Rochette (2008), souligne que c'est pendant les 5 premiers
jours d'application de l'urée que les risques de la volatilisation
d'ammoniac sont grands, mais, selon Lumpungu (1980), cela peut largement varier
d'un sol à un autre et selon divers facteurs, comme :
· Le pH du sol,
· La température,
· Mode d'apport de l'engrais (en couverture ou
enfouissement),
· La vitesse du vent,
· L'humidité du sol
II.3.2. Perte par
lixiviation
La lixiviation représente l'entraînement
d'éléments minéraux dissous dans l'eau du sol. Pour l'ion
nitrate NO3-, très soluble dans l'eau, on parlera
donc de lixiviation et non de lessivage, qui représente
l'entraînement de particules (argile, matière organique, ...)
(FERRUGIA, 2001).
Elle est provoquée par le drainage naturel, car l'ion
nitrate, très soluble, a une grande affinité pour l'eau.
Les paramètres influant sur ce phénomène
de lixiviation sont la quantité d'azote minéral
(NO3-), sa répartition dans le profil et la
quantité d'eau drainée. A cela il faut ajouter l'effet de la
matrice du sol, qui dans certains sols tropicaux a pour effet de retenir les
nitrates dans les horizons superficiels lorsque la filtration de l'eau dans ce
sol n'est pas possible si non difficile.
La menace de lixiviation est plus élevée dans
les sols sableux, dont la texture favorise l'égouttement rapide de
l'eau.
L'urée est facilement lixiviable et donc doit
être employée en agriculture par un couplage le plus précis
possible entre besoins et fournitures.
II.3.3. Perte par
dénitrification
La dénitrification est un processus de réduction
microbienne par le quel les nitrates (et accessoirement les nitrites) sont
réduit à l'état de produits gazeux (azote
moléculaire, les oxyde d'azote gazeux) qui sont ainsi perdus pour le
sol.
Il s'agit d'une succession de réductions des oxydes
d'azote (NO3-, NO2-,
N2O, NO) jusqu'au stade de l'azote moléculaire
(N2).
La dénitrification est effectuée par un nombre
restreint de genres bactériens (Pseudomonas, Agrobactérium,
Spirillum, Bacillus, bactéries hétérotrophes), il s'agit
de bactéries anaérobies très répandus dans les
sols, dont la présence n'est pas limitant.
Les étapes de la dénitrification sont
schématisées comme suit :
NO3- NAR NO2-
NIR NO NOR N2O
N2OR N2
Nitrate Nitrite Oxyde nitrique
Oxyde nitreux Azote Gazeux
Chaque étape est catalysée par une enzyme
spécifique: nitrate réductase (NAR), nitrite réductase
(NIR), oxyde nitrique réductase (NOR) et enfin oxyde nitreux
réductase (N2OR) (BOUGARD, 2004).
Les facteurs régulant ces transformations sont
(FERRUGIA, 2001) :
Ø La faible teneur du milieu en oxygène,
Ø La présence d'azote sous forme nitrique ou
nitreuse utilisée comme accepteur final d'électrons dans la
chaîne respiratoire à la place de l'oxygène manquant;
Ø La présence d'un substrat carboné
assimilable,
Ø Les conditions de pH : la dénitrification
maximale est atteinte entre 6 et 8, un pH plus acide entraînant un
dégagement important de protoxyde d'azote (N2O),
Ø La température, qui régule non
seulement les transformations décrites ci-dessus, mais également
les réactions consommatrices d'oxygène,
Ø La présence des substances donatrices
d'électrons en quantité suffisante (la matière organique
fraiche métabolisable),
Ø La teneur en eau élevée (sol pauvre en
O2 : anaérobie)
Ø La teneur en carbone organique élevée,
car les bactéries ont besoin du carbone organique pour leur
respiration.
Le phénomène de dénitrification n'est
plus possible dès que l'oxygène est disponible car, de
très nombreuses bactéries capables de "respiration nitrate" sont,
généralement, aussi capables de "respiration oxygène" et
elles s'abstiennent de respirer le nitrate dès que de l'oxygène
devient disponible, parce qu'il est énergétiquement plus rentable
de respirer sur l'oxygène que sur le nitrate.
A ces pertes, nous associons le phénomène
d'organisation de l'azote qui consiste à l'assimilation de
l'élément azote par les microorganismes du sol pendant
l'oxydation de substrats carbonés. Ce phénomène est aussi
appelé immobilisation, car les plantes étant moins
compétitrices que les microorganismes ne peuvent accéder a
l'azote incorporé dans la biomasse microbienne.
II.3.4. L'immobilisation de
l'azote
L'immobilisation s'opère simultanément avec la
minéralisation. C'est une forme de perte temporaire pour les cultures
où les microorganismes consomment l'azote minérale.
C'est un processus par lequel les micro-organismes du sol
assimilent l'azote pour leurs propres besoins de renouvellement et de
croissance. L'immobilisation ou la réorganisation est d'autant plus
importante que le sol a une forte activité biologique.
Selon GAGNON (2009), l'immobilisation et la
minéralisation sont deux phénomènes qui opèrent
simultanément et dépendent du rapport carbone-azote.
En effet, si le rapport carbone azote est :
· < 30 : Minéralisation > Immobilisation, la
minéralisation est plus soutenu que l'immobilisation
· > 30 : Immobilisation > Minéralisation,
l'immobilisation est plus contracté.
L'immobilisation ou la réorganisation ne doit pas
être considérée comme une perte pour le système sol
plante, mais elle représente une immobilisation de l'engrais dans le
compartiment organique du sol
Elle arrive souvent lorsque, stimulés par un apport
excessif en carbone facilement assimilable, les micro-organismes du sol
prolifèrent, ils risquent de consommer tout l'azote disponible ; l'azote
"immobilisé" dans les cellules bactériennes est alors hors de
portée des plantes pour un temps.
Dès l'apport d'engrais azoté (cas de
l'urée) dans le sol, une compétition s'engage entre les
micro-organismes du sol et la culture pour la consommation de cet azote.
L'urée n'est pas sujette à une réorganisation
spécifique, mais elle est plutôt immobilisée via la
réaction biologique entre forme ammoniacale et micro-organismes (Recous,
1987; Le Souder & Taureau, 1997), cités par MERIGOUT (2006)
Lixiviation
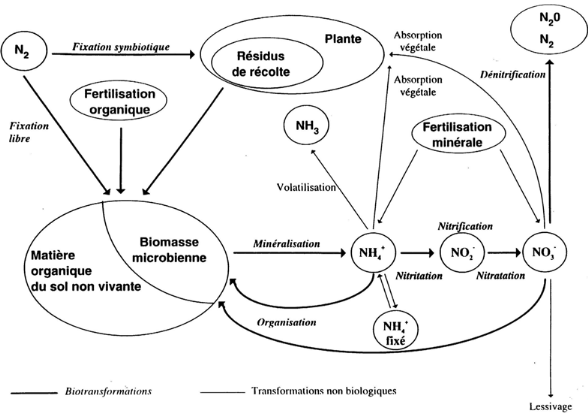
Cycle de l'azote
Figure n°3 : Transformations biologiques et non
biologiques affectant le devenir de l'azote dans le sol (d'après
Nicolardot et al. 1997 cité par M Mattieu
IIème PARTIE : ESSAI
EXPERMENTALE
Notre essai a consisté à suivre, au laboratoire,
la nitrification à partir de l'azote uréique, dans un sol de
Kinshasa. Pour ce faire, nous avons analysé l'azote ammoniacal et
nitrique par la méthode spectrophotométrique, à 0, 4 et 12
jours. L'azote nitreux étant une forme passager et instable, nous
l'avons incluse dans la forme nitrique.
Chapitre I. Matériel
et Méthodes
I.1. Matériel
Afin de mener à bien notre expérimentation, nous
avons utilisé un certain nombre de matériel, dont:
I.1.1. sol
Le sol utilisé dans cet essai provient du site de
l'Ecole Supérieur Régionale Postuniversitaire
d'Aménagement et de Gestion Intégrés des Forêts et
Territoires Tropicaux (ERAIFT en sigle), située au le mont-Amba sur le
site de l'Université de Kinshasa.
Pour notre essai, nous avons utilisé deux
échantillons, l'un issu d'un sol non travaillé et l'autre d'un
sol travaillé.
Ces échantillons de sol qui ont été
prélevés dans l'horizon 0-30 cm en utilisant une tarière,
ont été gardés dans des bocaux en plastique jusqu'au
laboratoire.
I.1.2. Matériel
d'analyse
Pour analyser les sols au laboratoire, nous avons utilisé
notamment :
· Une balance de précision de 0.0000g pour peser
les quantités des sols voulues ;
· Des erlenmeyers de 250ml, pour préparer les
solutions,
· Une burette de précisions ; pour les
différentes mesures ;
· Des entonnoirs et papiers filtrent Whatman n° 42,
pour filtrer les mélanges,
· Des tubes à essai,
· Des pieds gradués,
· Agitateur et barreau magnétique, pour
l'extraction,
· Un bécher de 1000ml,
· Un homogénéisateur, pour
mélangé les solutions hétérogènes,
· Un spectrophotomètre portable de marque HACH,
série DR/2400, qui a servi d'outil de base pour les analyses.
II.2. Méthodes
II.2.1. Dispositif
expérimental
Le suivi de la
nitrification, pour chaque type de sol, a été
réalisé en trois temps :
T0 : avant apport
de l'urée, comme de témoin ;
T1 : quatre jours
après application de l'urée, et
T2 : douze jours
après application de l'urée.
Pour ce, nous avons
disposée, par type d'échantillon, de trois bocaux.
T2
T1
T0
T1
T2
T0
Bloc de sol travaillé Bloc
de sol non travaillé
II.2.2. Apport de
l'urée et arrosage
En vue de suivre la nitrification de l'urée dans notre
sol, 5g d'urée soit 2,3g d'azote ont été apportés
le jour même de l'échantillonnage aux traitements T1 et
T2.
Ils ont été bien mélangés avec
500g de sol dans chaque bocal.
Après, nous avons arrosé avec de l'eau
distillée jusqu'à 70% de la capacité de rétention
du sol soit.
II.2.2. Analyse
Le dosage de l'azote ammoniacal et nitrique a
été fait au spectrophotomètre à la longueur d'onde
de 655 pour NH4+et 430 nm pour
NO3-, après leur extraction.
L'extraction de l'azote du sol avec le chlorure de potassium
2M a été faite comme suit :
· Peser 10g d'échantillon du sol dans un
erlenmeyer de 250ml,
· Ajouter 100ml de KCl 2M et agiter pendant une heure
à l'aide d'un agitateur magnétique ;
· Après agitation, laisser décanter afin
d'avoir un surnageant limpide.
· Filtrer sur filtre Wahtman N° 42.
II.2.2.2. Dosage
Les dosages se sont déroulés dans des conditions
de température ambiante
Nous avons eu a dosé l'ammonium et le nitrate
II.2.2.2.1. Lecture de la teneur en ammonium au
spectrophotomètre
Pour lire l'ammonium présent dans les
échantillons des nos sols, nous avons procédé de la
manière suivante :
· Activer le programme HACH du
spectrophotomètre ;
· Sélectionner le programme 385 pour doser l'ammonium
(NH4+);
· Appuyer sur Démarrer ;
· Remplir les tube du spectrophotomètre avec 10 ml de
solution filtrant;
· Remplir un autre tube de 10 ml de l'eau distillé
(qui va servir du blanc) ;
· Ajouter le contenue d'une gélule en poudre de
Salicylate d'ammonium dans 10ml du filtrant. Fermer et secouer pour dissoudre
la poudre ;
· Activé le chronomètre pour afficher le temps
nécessaire que doit faire le mélange (3 minutes pour qu'il ait
réaction entre le salicylate d'ammonium et
l'échantillon) ;
· Après le bipe du chronomètre, ajouter une
gélule en poudre de Cyanurâtes d'Ammonium dans le tube. Fermer le
bouchons du tube et secouer pour dissoudre le réactifs ;
· Activer le chronomètre pendant le temps de
réaction requise entre le cyanurâtes d'ammonium et
l'échantillon (15 minutes), la couleur verte se développera ceci
témoigne la présence d'ammonium de l'échantillon ;
· Quand le chronomètre va biper, placer le blanc dans
le spectrophotomètre et appuyer sur zéro pour calibrer.
L'appareille affichera : 0.00mg/Kg NH4+ ;
· Essuyer les tube contenant l'échantillon, placer
les dans le spectrophotomètre et appuyer lire
· Les résultats s'affichent sur l'écran du
spectrophotomètre
II.2.2.2.2. Lecture de la teneur en nitrate au
spectrophotomètre
Pour lire la concentration du nitrate présent dans les
échantillons, nous avons procédé de la manière
suivante :
· Activer le programme HACH ;
· Sélectionner le programme 355 N ;
· Appuyer sur démarrer ;
· Remplir le tube du spectrophotomètre avec 25ml
de échantillon à analyser (filtrant);
· Ajouter le contenue d'une gélule en poudre
Nitraver 5 (c'est la solution préparer) ;
· Activer le chronomètre et l'icône affiche
OK ;
Après une minute, la période de réaction
va commercer. Secouer le tube vigoureusement jusqu'à ce que le
chronomètre va biper ;
· Quant le chronomètre bipe, activer le
chronomètre du temps qui affiche OK ;
A 5 minutes, le période de réaction va
débutée. Une couleur sombre va se développer si est
seulement si le nitrate est présent ;
· Après le bipe du chronomètre, remplir un
tube de 10 ml de l'eau de l'échantillon (c'est le blanc) ;
· Essuyer les tubes contenant le blanc et placer les dans
le spectrophotomètre ;
· Appuyer sur zéro pour calibrer le
spectrophotomètre
L'écran affichera 0.00mg/Kg de
NO3- ;
· Enlever le blanc et placer les échantillons un
à un et appuyer sur lire ;
· Les résultats s'affichent sur l'écran du
spectrophotomètre.
Chapitre III :
Résultats et Discussion
III.1. Sol
Travaillé
Les résultats des analyses réalisées sur
le sol travaillé, sont présentés dans la figure n° 3
(les tableaux de résultats chiffrés sont placés en
annexe).
Au T0 le pH était de 7,04 et les teneurs en
azote ammoniacal (NH4+-N) et nitrique
(NO3--N) étaient respectivement de 0,31 et
13,15mg. Au 4ème jour, le pH était monté, dans
le sol ayant reçu l'urée à 9,23. Ce qui dénote une
production de NH3 qui s'est fort probablement volatilisé dans
ce sol sableux. Les faibles teneurs en NH4+ -N et en
NO3--N retrouvées dans le sol plaident
aussi pour cette hypothèse.
Au 12ème jour, la diminution de la
production de l'ammoniac se manifeste par la réduction du pH qui est
descendu à 8,87 et l'accroissement de NH4+-N et
NO3--N du sol.
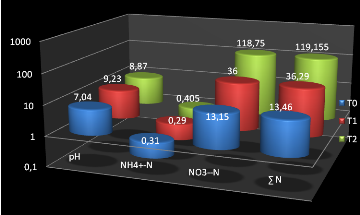
De 2,3 g d'azote apportés au sol, si on tient compte
des quantités retrouvées dans le traitement témoin, seuls
22,8 et 105,7mg d'azote ont été retrouvés, respectivement
pour T1 (4 jours après application de l'urée) et
T2 (12 jours après application de l'urée). La
différence doit avoir été perdue par volatilisation et par
bio fixation par les microorganismes.
Figure n°4 : Résultat d'analyse du sol
travaillé
III.2. Sol non
travaillé
Les résultats des analyses réalisées sur
le sol non travaillé, sont présentés dans la figure
n°4 (les tableaux de résultats chiffrés sont placés
en annexe).
Dans le sol non travaillé, la tendance était la
même que dans le sol travaillé. On observe une forte production de
l'ammoniac dans les 4 premiers jours. Elle se réduit au douzième
jour avec un accroissement concomitant de la teneur en
NH4+-N et NO3--N du sol.
Le total de NH4+-N et
NO3--N dans T1 et T2 étaient
respectivement de 49,67 à 4 jours et 144,74 mg à 12 jours, alors
que l'azote nitrique était passé de 49,5 à 4 jours
à 143,75 à 12 jours, ce qui démontre que la nitrification
est un processus progressif.
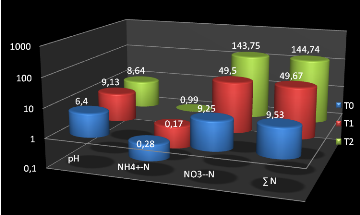
Sur les 2,3 g d'azote apportés avec l'urée,
seuls 40,14mg d'azote pour T1 et 135,26 mg d'azote pour
T2 ont été, pendant ce laps de temps, convertis en
NH4+-N et NO3- - N. La
différence entre la quantité apporté et celle
retrouvée, soit 2259,86mg pour T1 et 2164,74mg pour
T2 serait perdu soit par volatilisation soit par bio fixation par
les microorganismes.
Figure n°5 : Résultats d'analyse du sol
non travaillé
Conclusion
A travers ce travail, notre intention était
d'évaluer la capacité de nitrification de deux
échantillons de sol utilisés. Pour ce faire, nous avons
dosé et comparé l'azote (ammoniacal et nitrique) au
départ, 4 jours et 12 jours après incubations dans les conditions
ambiantes de laboratoire.
En observant les résultats obtenus dans les sols
travaillé et non travaillé, l'allure du pH, de
NH4+-N et NO3- -N, au fil de temps,
semble être la même.
On observe une monté du pH, pendant les 4 premiers
jours, jusqu'à 9,23, ce qui correspond à une forte volatilisation
de NH3. Celle-ci amorce la diminution au 12ème
jour. Alors que NH4+-N reste relativement bas dans les
deux sols, les processus de nitrification, observé par
l'évolution des quantités de NO3- -N,
s'accroit avec le temps.
Entre le 4ème et le 12ème
jour, l'azote nitrique, dans le sol non travaillé avait
augmenté de 462% et dans le sol travaillé, il n'avait
augmenté que de 330,8%.
En comparant les deux, la nitrification semble être
plus active dans le sol non travaillé par rapport au sol
travaillé, mais la capacité de nitrification de ce sol est
très faible, car seulement 5,88% de l'azote appliqué ont
été convertis en NO3--N, après 12
jours d'incubation. Lumpungu (1980) signale une convertion de 100%, en trois
jours dans un sol tunisien.
BIBLIOGRAPHIE
1. ABDALA KULELEMBA Tata Bin, (1979) : Etude de
nitrification dans un sol de Kisangani, Travail de fin de premier cycle
d'ingénieur, Faculté des Sciences Agronomiques, Université
Nationale du Zaïre, Yangambi-Zaïre.
2. ADAMS (R.S.) et STEVENSON (F.J.), (1964): Ammonium Sorption
and Realease from Rocks and Mineral. 5. SC. Soc. Amer. Proceeding, 28, 3,
p.345-351,
3. ADAMS (R.S.), (1963): Ammonium Sorption and Release by
Soil/-forming Rocks and Mineral, These University Illinois,
4. ANDRAINARISOA K.S, (2009) : Minéralisation de
l'azote et nitrification dans les écosystèmes forestiers : effet
du type de sol et de l'essence forestière, thèse de doctorat,
université Henri Poincaré, Nancy I
5. BARBAULT Robert, (2009) : Ecologie
Générale : structure et fonctionnement de la
biosphère, 5ème édition, p32, ed. Dunod
6. BLANCHET (R.), STUDER (R.), CHAUMONT (C.), LE BLEVENAC (L.)
(1963) : Principaux facteurs influençant la rétrogradation
de l'Ammonium dans les conditions naturelles des sols. C.A. Acad. Sci. Fr.,
256, 10, p.2223-2225,
7. BOUGARD Daisy, (2004) : traitement biologique
d'effluents azotés avec arrêt de la nitrification au stade
nitrite, Thèse de Doctorat, Ecole Nationale Supérieure
Agronomique de Montpellier.
8. BREMNER JM and KROMEIER (1989) Evidence that the adverse
effect of urea fertilizer on seed germination in soil is due to ammonia formed
through hydrolysis of urea by soil urease. Proc Natl Acad Sci 86: 8185-8188
9. DAVID R, (2009): handbook of chemistry and physics, crc
press inc, , 90e éd., relié, 2804 p
10. DE BOER and KOWALCHUK, (2001): Nitrification in acid
soils: micro-organisms and mechanisms. 33, 853-866.
11. DENIS J.F, (2000) : la fertilisation de
l'olivier : 1- l'Azote, Comité économique Agricole de
l'Olivier.
12. DRIDI I et GALLALI. T, (2006) : Distribution de
l'Azote et caractérisation des sols de la Tunisie du Nord, Unité
de Recherche de Pédologie, Département de Géologie,
Faculté des Sciences de Tunis, Campus Universitaire, 2092 Tunis,
Tunisie.
13. FERRUGIA A., (2001) : Détermination de la
valeur azotée d'effluents Agro-industriels et urbains, conditions de
l'expression de la minéralisation de l'azote organique dans des
émissions d'ammoniac gazeux, Mémoire de fin d'études,
Ecole Supérieure d'Agriculture de Purpan,
14. GAGNON J. (2009) : Impact des différentes
formes d'azote (Urée, NH4+,
NO3-) sur la croissance des plants et sur le lessivage
des engrais, Session de formation sur la nutrition minérale des plants
forestiers, Ministère des Forêts, Direction de la recherche.
Rapport interne n° 349. 20p.
15. KACHAKA, (2008) : cours de biologie du sol,
Faculté des Sciences Agronomiques, université de Kinshasa,
2008-2009
16. KILLHAM, (1900): Nitrification in coniferous forest soil.
Plant and soil 128, 31-
17. LUMPUNGU. K. (1980): La perte en azote et la
phytotoxicité de l'urée dans le sol. Annale de Gembloux,
2ème trimestre, 89ème année,
Association des Ingénieurs issus de la faculté des Sciences
Agronomiques de l'Etat des Gembloux (Belgique)
18. MALHI, S.S. and McGILL W.B., (1982): Nitrification in
three Alberta soils: effect of temperature, moisture and substrate
concentration. Soil Biology and Biochemistry 14, 393-399.
19. MARCO PAGNI, (1998) : Les mécanismes de
transformation de l'azote dans le sol. Perspectives Agricoles 115: 100-105
20. MARTIN G., (1979): Le problème de l'azote dans les
eaux. Technique et Documentation, éd France-Agricole.
21. MÉRIGOUT Patricia (2006) Étude du
métabolisme de la plante en réponse à l'apport de
différents fertilisants et adjuvants culturaux. Influence des
phytohormones sur le métabolisme azoté. Thèse de doctorat,
école doctoral Abies, Institut National Agronomique Paris-Grignon.
22. N'DAYEGAMIYE A, (2006) : sol comme important source
d'azote, le producteur de lait québécois novembre 2006.
23. POSTGATE J. (1998) : Fixation de l'azote, 3ème
édition. Pression d'université de Cambridge, Cambridge
R-U.
24. ROCHETTE P. (2008) : Gestion des engrais
minéraux et organiques : Volatilisation de l'ammoniac, Colloque en
agroenvironnement, le respect de l'environnement : tout simplement, Centre
de référence en agriculture et agroalimentaire du Québec,
Drummondville Québec-Canada.
25. SOUDI. B, J.C. MULLER et J. DECROUX (1995) : Mise en
place des réseaux de suivi de la nappe phréatique et de la
qualité des sols et des eaux du périmètre de Tadla Rapport
M.R.T N° 608-0213-3-20014.
26. VALE Matthieu M., (2006) : Quantification et
prédiction de la minéralisation nette de l'azote du sol in situ,
sous divers pédoclimats et systèmes de culture français,
thèse n° 2367, INRA-France
27. VAN BURG, P.F.J., DILZ, K., S, W.H., (1982): Agricultural
value of various nitrogen fertilizers. Netherlands Nitrogen Technical Bulletin
13. Agricultural Bureau of the Netherlands Fertilizer Industry, The Hague.
28. ZOLLER. I, (1994): Non-ionic surfactants in reused water:
are active sludge/soil aquifer treatments sufficient. Wat. Res. 28 (7), pp:
1625-1629,
annexes
I. Résultats d'analyse
I.1 Résultats d'analyse du sol travaillé
|
pH
|
NH4+-N
|
NO3--N
|
? N
|
|
T0
|
7,04
|
0,31
|
13,15
|
13,46
|
|
T1
|
9,23
|
0,29
|
36
|
36,29
|
|
T2
|
8,87
|
0,405
|
118,75
|
119,155
|
I.2. Résultats analyses sol non travaillé
|
pH
|
NH4+-N
|
NO3--N
|
? N
|
|
T0
|
6,4
|
0,28
|
9,25
|
9,53
|
|
T1
|
9,13
|
0,17
|
49,5
|
49,67
|
|
T2
|
8,64
|
0,99
|
143,75
|
144,74
|
Quelques photos :


Tarière et des bocaux balance de précision


Spectrophotomètre portable de marque HACH un
homogénéisateur
Série DR/2400
| 


