|
Tépu6lique de Cote d'Ivoire
Vnion-
Oiscipline-Travail
alinistere de l'cEnseignement Supérieur et
de
la ~echerche Scienti#ique
Université d'Abobo-Adjamé
Année
Universitaire
2008-2009
MESE
Pour I'obtention du grade de
Docteur
Numéro d'ordre
51
DE
L'UNIVERSITE D'ABOBO-ADJAME
EN SCIENCES ET TE
CHNOLOGIE DES ALIMENTS
Option : Biochimie et Technologie des
Aliments
Presentee par
YAM Assel T ll Dodd P trice
THEME :
CARACTERISATION !DOMINIQUE ET APPLICATIONS
POTENTIELLES DES CLUCOSIDASES ET DE LA 13-
GMACTOSIDASE DU SUC DIGESTIF DE LA LARVE
DE
RRYNCROPROHIS~ 11 111 LCURCULIONIDAEI
Soutenue publiquement
le 29 juillet
2009
Bev n' le Jury :
M. AMANI N'guess n Georges, Prolossour linhforsite dAbobe-Adl me
Presiden%
M. AKE Seven, Prolossour Universite Coco* r ggetteur
M. T o DATIE, Prolossour Universite Coco* Ex min tour
M. DIE Kolli M rconi', M itre de conferences linhforsite
d'Abobe-Adl me Ex min tour
M. KOUAME Lucien P trice, M itre de conferences linhiersite
dAbobe-AM me Directeur de Those
RESUME
La larve de Rhynchophorus palmarum possède
dans son tube digestif une variété d'activités
osidasiques. Les activités á-glucosidasique,
â-glucosidasique et
â-galactosidasique sont les plus élevées.
Elles sont l'oeuvre de 3 enzymes : une á-glucosidase,
une â-glucosidase et une
â-galactosidase. Ces biocatalyseurs sont acides,
mésophiles et monomériques. Ils sont stables à 37 °C
pendant au moins 120 min dans le tampon acétate 100 mM pH 5 ou 5,6. La
â-glucosidase a une grande affinité pour le
cellobiose et serait aussi impliquée dans la digestion des
cellodextrines issues de la dégradation de la cellulose. Elle a une
spécificité stricte vis-à-vis du résidu glucosyle
et de l'anomerie â. Cette enzyme a une activité
transférasique élevée par rapport à celle de la
â-galactosidase. En effet, ce biocatalyseur
spécifique du résidu galactosyle dégrade les disaccharides
et les oligosaccharides provenant de l'hydrolyse des hémicelluloses et
possédant des liaisons â(1,3),
â(1,4) et â(1,6). Quant à
l'á-glucosidase, elle reconnaît seulement le
résidu glucosyle et est spécifique de la liaison osidique
á(1-2) et á(1-4). C'est
pourquoi, elle hydrolyse fortement le saccharose, le maltose et les
oligosaccharides. Elle possède une activité transférasique
supérieure à celles des sources enzymatiques conventionnelles.
Mots clés : larve, charançon,
Rhynchophorus palmarum, á-glucosidase,
âglucosidase, â-galactosidase,
activité transférasique.
REMERCIEMENTS
Ce travail a été réalisé en
Côte d'Ivoire, à l'Unité de Formation et de Recherche des
Sciences et Technologie des Aliments de l'Université
d'Abobo-Adjamé, dans le Laboratoire de Biochimie et Technologie des
Aliments.
Je tiens à remercier le Professeur Patrice
KOUAME, Doyen de l'Unité de Formation et de Recherche des
Sciences et Technologie des Aliments de l'Université
d'Abobo-Adjamé (Abidjan), Directeur scientifique de ce travail, sans qui
ce mémoire n'aurait jamais pu voir le jour. Il m'a fait
bénéficier d'un cadre idéal de travail. Malgré ses
nombreuses tâches universitaires, il n'a pas hésité
à consacrer une partie de son temps à orienter et enrichir ce
travail. Je dois dire que j'ai beaucoup appris auprès de lui. Qu'il
trouve ici le témoignage de mon profond respect, de ma sincère
admiration et de mon fidèle attachement;
Je remercie le Professeur AMANI N'guessan
Georges, Professeur titulaire à l'Unité de Formation et
de Recherche des Sciences et Technologie des Aliments de l'Université
d'Abobo-Adjamé (Abidjan) pour son appui à la recherche. Je suis
particulièrement sensible à l'honneur qu'il me fait en acceptant
de présider ce jury, malgré ses nombreuses occupations
administratives et universitaires.
Je suis sensible à l'honneur que me fait le professeur
DJE Koffi Marcellin, Président du conseil scientifique
de l'Unité de Formation et de Recherche des Sciences et Technologie des
Aliments (UFR-STA) de l'Université d'Abobo-Adjamé (Abidjan) en
acceptant de faire partie de ce jury et l'assure de mes sincères
remerciements. Sa présence dans ce jury montre une fois encore son amour
pour le travail bien fait.
Je tiens à remercier le Professeur AKE
Sévérin, Professeur titulaire à l'Unité de
Formation et de Recherche Biosciences de l'Université de Cocody
(Abidjan) pour sa contribution à l'amélioration de ce travail.
C'est un réel plaisir pour moi de le retrouver comme membre de ce
jury.
Je remercie le professeur Yao DATTE,
Professeur titulaire à l'Unité de Formation et de Recherche
Biosciences de l'Université de Cocody (Abidjan) pour la sollicitude
qu'il m'a témoigné. Je suis particulièrement sensible
à l'honneur qu'il me fait en acceptant d'être membre de ce
jury.
Je remercie également le Professeur DJE
Yao, Maître de conférences à l'Unité de
Formation et de Recherche des Sciences de la Nature et de l'Environnement de
l'Université d'Abobo-Adjamé (Abidjan) pour la sollicitude qu'il
m'a témoigné. Je suis particulièrement sensible à
l'honneur qu'il me fait en acceptant d'être rapporteur de cette
thèse
Au Professeur Alphonse KAMENAN, Doyen
honoraire de l'Unité de Formation et de Recherche des Sciences et
Technologie des Aliments de l'Université d'Abobo-Adjamé (Abidjan)
et Directeur du laboratoire de Biochimie et Technologie des Aliments, je lui
exprime toute ma reconnaissance et ma gratitude pour tout ce qu'il a fait pour
moi dans le cadre de ma formation universitaire.
Je voudrais remercier sincèrement du fond de mon coeur le
Professeur Sébastien NIAMKE pour la sollicitude qu'il
m'a témoigné.
Je n'oublie pas tous les enseignants-chercheurs et chercheurs
de l'Unité de Formation et de Recherche des Sciences et Technologie des
Aliments (UFR-STA) de l'Université d'Abobo-Adjamé à qui je
dis merci pour les encouragements et soutiens.
Je voudrais remercier également tous les membres de
l'équipe "Biocatalyse" du Laboratoire de Biochimie et Technologie des
Aliments de l'Université d'Abobo-Adjamé qui ont participé
activement à la réalisation de ce mémoire.
Mes vifs remerciements vont à toutes les personnes dont
les compétences scientifiques et techniques m'ont aidé à
réaliser ce travail.
DEDICACE
Je dédie ce travail scientifique à
:
-mon père,
Je te remercie pour la grande et solide confiance que tu as
placée en moi. Aujourd'hui accepte cette thèse comme le
couronnement de tous tes sacrifices.
-ma mère,
Je te remercie infiniment pour les sacrifices énormes
que tu as bien voulu consentir pour moi. Que le seigneur te garde longtemps en
bonne santé sur cette terre. Ce travail n'est qu'un modeste
témoignage de ton amour filial et de ma reconnaissance.
-ma fiancée,
Je te dédie ce mémoire pour ton
abnégation, ta patience et tes encouragements incessants. Ton soutien
indéfectible m'a permis de réaliser ce travail dans les
meilleures conditions. Je t'en suis reconnaissant. Je n'ai aucun mot pour
traduire la profondeur de mes sentiments à ton égard.
-mon fils,
Que ce travail soit un gage sincère de mon immense
amour.
-mes frères et soeurs,
En témoignage de mon profond amour.
-tous mes cousins et cousines,
Ce mémoire est le votre.
-ma grande famile,
Je remercie tout le monde pour les encouragements et
conseils.
-tous mes amis,
Je dis Merci pour leur soutien moral et encouragement.
TABLE DES MATIERES
REMERCIEMENTS II
DEDICACE III
TABLES DES MATIERES VI
LISTE DES FIGURES ... XII
LISTE DES TABLEAUX
XVII
ABREVIATION ET SYMBOLES .. XX
INTRODUCTION ..... 1
Chapitre 1 REVUE BIBLIOGRAPHIQUE 4
I-Généralités sur le
charançon 4
1- Systématique du charançon du palmier
4
2- Cycle de vie .. 4
3- Dommages causés . 5
II-Glycosidases . 7
1-Réaction d'hydrolyse 7
1-1-Mécanismes d'action 7
1-1-1-Inversion de configuration anomérique
7
1-1-2-Rétention de configuration anomérique
.. 7
1-1-3-Quelques cas particuliers .. 8
1-2-Relation entre les glycosidases de mécanisme
d'inversion de configuration anomérique hydrolysant les liaisons alpha
et beta 10
1-3-Relation entre des alpha- et beta-glycosidases avec
des mécanismes de configuration anomérique opposés .
10
1-4-Classifications des glycosidases 12
1-4-1-Classification traditionnelle 12
1-4-2-Classification structurale 12
1-4-2-1-Principe et classification 12
1-4-2-2-Division des familles des glycosides
hydrolases
en sous familles 18
2-Réactions de synthèses 22
3-Propriétés de quelques glycosidases des
insectes 24
3-1-Enzymes amylolytiques 24
3-1-1-Amylases 24
3-1-2-Alpha-glucosidases .. 25
3-2-Enzymes cellulolytiques 27
3-2-1-Cellulases 28
3-2-2-beta-Glucosidases 29
3-3-Enzymes hémicellulolytiques 31
3-3-1-Xylanases, laminarinases et lichenases
31
3-3-2-beta-Galactosidases 31
3-3-3-beta-Xylosidases 32
3-4-beta-Fructosidases 32
4-Applications industrielles de quelques glycosidases
32
4-1-beta-Galactosidases 32
4-1-1-Applications médicales .. 32
4-1-2-Applications pharmaceutiques 33
4-1-3-Applications nutritionnelles . 34
4-1-4-Applications en industrie agroalimentaire .
34
4-2-Enzymes amylolytiques 35
4-2-1-Production de sirop de glucose et de fructose
35
4-2-2-Amélioration de la solubilité de
l'amidon 35
4-3-Enzymes cellulolytiques et hémicellulolytiques
. 36
Chapitre 2 MATERIEL ET METHODES 38
I- Matériel 38
1-Provenance des produits chimiques 38
2- Origine du matériel biologique ..
38
II- Méthodes . 39
1-Préparation des extraits bruts enzymatiques
39
2-Techniques de dosage .. 39
2-1- Dosage de l'activité polysaccharidasique ..
39
2-1-1-Préparation de la solution de DNS
40
2-1-2- Techniques de dosage 40
2-2-Dosage de l'activité olisaccharidasique
40
2-2-1- Préparation du réactif glucose
oxydase-péroxydase 40
2-2-2- Technique de dosage 41
2-3- Dosage de l'activité
pNP-glycosidasique 41
2-4- Dosage des protéines 42
2-4-1- Méthode de Lowry et al. (1951)
42
2-4-1-1- Réactif utilisés . 42
2-4-1-2- Technique de dosage . 42
2-4-2- Méthode de Bradford (1976) 43
2-4-2-1- Réactif utilisés 43
2-4-2-2- Technique de dosage . 43
2-5- Purification des enzymes . 43
2-5-1- Chromatographie d'échange d'anion sur D.E.A
E
Sepharose CL-6B . 44
2-5-2- Fractionnement au sulfate d'ammonium
44
2-5-3-Chromatographie d'exclusion moléculaire sur
gel de Sephacryl S-100 HR 44
2-5-4-Chromatographie d'interaction hydrophobe
sur gel de
Phényl-Sepharose CL-4B 45
2-6-Détermination des propriétés
moléculaires 45
2-6-1- Détermination des poids moléculaires
par gel filtration 45 2-6-2-Détermination des poids moléculaires
par
électrophorèse sur gel de polyacrylamide
en présence de SDS 46
2-7- Influence du pH sur les activités
glycosidasiques . 47
2-7-1- Détermination du pH optimum d'hydrolyse .
47
2-7-2-Détermination de la stabilité au pH .
47
2-7-3-Influence de la force ionique 47
2-8-Influence de la température sur les
activités glycosidasiques 47
2-8-1-Détermination de la température
optimale
d'hydrolyse, du Q10 et de l'énergie d'activation
.. 47
2-8-2-Inactivation thermique . 48
2-8-3-Dénaturation thermique 48
2-9-Détermination de quelques paramètres
cinétiques 48
2-10-Actions des agents chimiques sur l'activité
hydrolytique 48
2-11-Réactions de transglycosylation
49
2-11-1-Milieu réactionnel 49
2-11-2-Analyse chromatographe des produits de
transglycosylation 49
2-11-3-Calcul du pourcentage de transglycosylation
49
Chapitre 3 RESULTATS ET DISCUSSION . 52
I- RECHERCHE ET DETERMINATION DES CONDITIONS OPTIMALES
D'HYDROLYSE DES GLYCOSIDASES DE LA LARVE DE Rhynchophorus palmarum
52
1-Résultats 52
1-1-Activités glycosidasiques .. 52
1-1-1-Activités exo-glycosidasiques
52
1-1-2-Activités endo-glycosidasiques .
54
1-2-Détermination des températures et pH
optima d'hydrolyse 54
1-2-1-Activités á-exo-glycosidasiques
54
1-2-2-Activités â-exo-glycosidasiques
54
1-2-3-Activités endo-glycosidasiques
54
2-Discussion .. 57
Conclusion 59
II-PURIFICATION ET CARACTERISATION PHYSICO-CHIMIQUE DE
L'áGLUCOSIDASE DU SUC DIGESTIF DE LA LARVE DE
Rhynchophorus palmarum 60
1-Résultats 60
1-1- Stratégie de purification . 60
1-1-1- Chromatographie échangeuse d'anion sur gel
de
D.E.A.E-Sepharose CL-6B 60
1-1-2- Fractionnement au sulfate d'ammonium
60
1-1-3-Chromatographie d'exclusion moléculaire sur
gel de Sephacryl S-100 HR 61
1-1-4-Chromatographie d'interaction hydrophobe
sur gel de
Phényl- Sepharose CL-4B .. 61
1-2-Critère de pureté . 64
1-3-Poids moléculaires de l'á-glucosidase .
64
1-4-Influence du pH sur l'activité de
l'á-glucosidase 66
1-4-1-pH optimum d'hydrolyse .. 66
1-4-2-Stabilité au pH 66
1-4-3-Influence de la force ionique du tampon .
66
1-5-Influence de la température sur
l'á-glucosidase 68
1-5-1- Température optimale d'hydrolyse,
énergie
d'activation et Q10 68
1-5-2- Inactivation thermique 68
1-5-3-Dénaturation thermique 68
1-5-4-Conservation au froid 72
1-6-Spécificité de substrat ..
72
1-6-1-Activité sur les
p-nitrophényl-D-glycosides . 72
1-6-2-Activité sur les oligosaccharides et
polysaccharides 72
1-7-Paramètres cinétiques .. 75
1-8-Action des agents chimiques 75
1-9-Réactions de transglucosylation
catalysées par l'á-glucosidase 78
1-9-1-Influence du pH 78
1-9-2-Influence du temps d'incubation . 78
1-9-3-Influence de la concentration de l'accepteur sur
l'activité de transglucosylation .. 78
1-9-4-Influence de la
concentration du donneur sur l'activité
de transglucosylation .. 78
2- Discussion 82
Conclusion 85
III-PURIFICATION ET CARACTERISATION PHYSICO-CHIMIQUE
DE LA â-GLUCOSIDASE DU SUC DIGESTIF DE LA LARVE DE Rhynchophorus
palmarum 86
1-Résultats 86
1-1-Stratégie de purification 86
1-1-1-Chromatographie échangeuse d'anion sur gel
de
DEAE-Sepharose CL 6B 86
1-1-2-Fractionnement au sulfate d'ammonium
86
1-1-3-Chromatographie d'exclusion moléculaire sur
gel de Sephacryl-100 HR 86
1-1-4-Chromatographie d'interaction hydrophobe
sur gel de
Phényl-Sepharose CL-4B 86
1-2-Critère de pureté 89
1
1-3-Poids moléculaires de la â-glucosidase
89
1-4-Influence du pH sur la â-glucosidase ..
91
1-4-1-pH optimum d'hydrolyse .. 91
1-4-2-Stabilité au pH .. 91
1-4-3- Influence de la force ionique du tampon
91
1-5- Influence de la température sur la
â-glucosidase . 93
1-5-1-Température optimale d'hydrolyse,
énergie
d'activation et le Q10 93
1-5-2-Inactivation thermique . 93
1-5-3-Dénaturation thermique 93
1-5-4-Conservation au froid 93
1-6-Spécificité du substrat ..
97
1-6-1-Activité sur les
p-nitrophényl-D-glycosides 97
1-6-2-Activité sur les oligosaccharides et
polysaccharides 97
1-7-Paramètres cinétiques .. 99
1-8-Action des agents chimiques 101
1-9-Réaction de transglucosylation
catalysée par la â-glucosidase 103
1-9-1-Influence du pH sur l'activité de
transglucosylation 103
1-9-2-Influence du temps d'incubation sur
l'activité de transglucosylation 103
1-9-3-Influence de la concentration de l'accepteur ..
103
1-9-4-Influence de la concentration du donneur .
103
2-Discussion .. 107
Conclusion 109
IV- PURIFICATION ET CARACTERISATION PHYSICO-CHIMIQUE DE
LA â-GALACTOSIDASE DU SUC DIGESTIF DE LA LARVE DE Rhynchophorus
palmarum .. 110
1-Résultats 110
1-1-Stratégie de purification 110
1-1-1-Chromatographie échangeuse d'anion sur gel
de DEAE-Sepharose CL 6B 110 1-1-2-Fractionnement au sulfate d'ammonium
110
1-1-3-Chromatographie d'exclusion moléculaire sur
gel de Sephacryl-100 HR 110
1-1-4-Chromatographie d'interaction hydrophobe
sur gel de
Phényl-Sepharose CL-4B 110
1-2-Critère de pureté 113
1-3-Détermination des poids moléculaires de
la â-galactosidase 113
1-4-Influence du pH sur la â-galactosidase ..
115
1-4-1-pH optimum d'hydrolyse .. 115
1-4-2-Stabilité au pH .. 115
1-4-3- Influence de la force ionique du tampon
115
1-5- Influence de la température sur la
â-galactosidase . 117
1-5-1-Température optimale d'hydrolyse,
énergie
d'activation et le Q10 117
1-5-2-Inactivation thermique . 117
1-5-3-Dénaturation thermique 117
1-5-4-Conservation au froid 117
1-6-Spécificité du substrat ..
121
1-6-1-Activité sur les
p-nitrophényl-D-glycosides 121
1-6-2-Activité sur les oligosaccharides et
polysaccharides 121
1-7-Paramètres cinétiques ..
123
1-8-Action des agents chimiques 125
1-9-Réaction de transglucosylation
catalysée par la â-galactosidase 127
1-9-1-Influence du pH sur l'activité de
transglucosylation 127
1-9-2-Influence du temps d'incubation sur
l'activité de
transglucosylation 127
1-9-3-Influence de la concentration de l'accepteur .
127
1-9-4-Influence de la concentration du donneur .
127
2-Discussion . 131
Conclusion 133
CONCLUSIONS GENERALES ET PERSPECTIVES 134
REFERENCES BIBLIOGRAPHIQUES . 135
XII
LISTE DES FIGURES
Figure 1 : Cycle de vie du charançon
Rhynchophorus palmarum 6
Figure 2 : Mécanisme d'inversion de configuration
anomérique des glycosidases 9
Figure 3 : Mécanisme de rétention de
configuration anomérique des glycosidases 9
Figure 4 : Similarités mécanistiques chez
diverses familles de glycosidases . .. 11
Figure 5 : Similarités dans l'orientation des
liaisons dans des enzymes de mécanismes opposés 11
Figure 6 :
Structure tridimensionnelle de l'endocellulase (famille 5 des glycosidases)
de
Thermus caldophilus (A) et de son site actif (B)
liant le cellotétraose . 15
Figure 7 : Comparaison entre la structure
d'une endoglucanase et celle d'une cellobiohydrolase de la famille GH7
21
Figure 8 : Schémas des réactions
catalysées par les glycosidases . 51
Figure 9 : Activités á-exo-glycosidasiques
des extraits bruts enzymatiques des glandes salivaires, du tube et du suc
digestifs de la larve de Rhynchophorus palmarum 53
Figure 10 : Activités â-exo-glycosidasiques
des extraits bruts enzymatiques des glandes salivaires, du tube et du suc
digestifs de la larve de Rhynchophorus
palmarum
53
Figure 11 : Activités endo-glycosidasiques des
extraits bruts enzymatiques des glandes salivaires du tube digestif et du suc
digestif de la larve de Rhynchophorus palmarum 55
Figure 12 : Profil chromatographique d'échange
d'anion de l'a-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum sur gel de D.E.A.E-Sepharose CL-6B 62
Figure 13 : Profil chromatographique d'exclusion
moléculaire de l'a-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum sur gel de Sephacryl S-100 HR 62
Figure 14 : Profil chromatographique d'interaction
hydrophobe de l'a-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum sur gel de Phényl-Sepharose CL-4B 63
Figure 15 : Electrophorèse sur gel de
polyacrylamide en présence de SDS et de betamercaptoéthanol de
l'a-glucosidase du suc digestif de la larve de Rhynchophorus palmarum. ....
65
Figure 16 : Détermination du pH optimum
d'hydrolyse de l'a-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum 67
Figure 17 : Stabilité au pH de l'a-glucosidase
du suc digestif de la larve de Rhynchophorus palmarum 67
Figure 18 : Détermination de la température
optimale d'hydrolyse de l'a-glucosidase
du suc digestif de la larve de Rhynchophorus palmarum
69
Figure 19 : Inactivation thermique de l'a-glucosidase du
suc digestif de la larve de Rhynchophorus palmarum à 37°C
et à 45°C 69
Figure 20 : Dénaturation thermique de
l'a-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
70
Figure 21 : Effet de la congélation sur de
l'á-glucosidase du suc digestif de la larve de 70
Rhynchophorus palmarum dans le tampon acétate 100 mM à
pH5,6 .
Figure 22 : Influence du pH sur les réactions de
transglucosylation catalysées par l'aglucosidase du suc digestif de la
lave de Rhynchophorus palmarum . 79
Figure 23 : Influence du temps d'incubation sur les
réactions de transglucosylation catalysées par l' a-glucosidase
du suc digestif de la larve de Rhynchophorus 79 palmarum
Figure 24 : Influence de la concentration de
l'accepteur de glucosyle (2-phényléthanol) sur les
réactions de transglucosylation catalysées par l'a-glucosidase du
suc digestif de la larve de Rhynchophorus palmarum 80
XIV
Figure 25 : Influence de la concentration du donneur de
glucosyle sur les réactions de transglucosylation catalysées par
l'á-glucosidase de suc digestif de la larve de 80
Rhynchophorus
palmarum
Figure 26 : Profil chromatographique d'échange
d'anion de la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum sur gel de D.E.A.E-Sepharose CL 6B
87
Figure 27 : Profil chromatographique d'exclusion
moléculaire de la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum sur gel de Sephacryl-100 HR 87
Figure 28 : Profil chromatographique d'interaction
hydrophobe de la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum sur gel de Phényl-Sepharose CL-4B .
88
Figure 29 : Electrophorèse sur gel de
polyacrylamide en présence de SDS et de betamercaptoéthanol de la
béta-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum 90
Figure 30 : Déterminations du pH optimum
d'hydrolyse de la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum 92
Figure 31 : Stabilité au pH de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
. 92
Figure 32 : Détermination de la température
optimale d'hydrolyse de la â-glucosidase
du suc digestif de la larve de Rhynchophorus palmarum
94
Figure 33 : Inactivation thermique de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
. 94
Figure 34 : Dénaturation thermique de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
. 95
|
Figure 35 : Effet de la congélation de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
dans le tampon acétate 100 mM à pH5,0 .
|
95
|
Figure 36 : Influence du pH sur la réaction de
transglucosylation catalysée par la âglucosidase du suc digestif
de la larve de Rhynchophorus palmarum . 104
Figure 37 : Influence du temps d'incubation sur la
réaction de transglucosylation catalysée par la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
104
Figure 38 : Influence de la concentration de
l'accepteur (2-phényléthanol) sur la réaction de
transglucosylation catalysée par la â-glucosidase du suc digestif
de la larve de Rhynchophorus palmarum . 105
Figure 39 : Influence de la concentration du donneur
de glucosyle (cellobiose) sur la réaction de transglucosylation
catalysée par la â-glucosidase purifiée du suc digestif de
la larve de Rhynchophorus palmarum . 105
Figure 40 : Profil chromatographique d'échange
d'anion de la â-galactosidase du suc digestif de la larve de
Rhynchophorus palmarum sur gel de D.E.A.E-Sepharose CL-6B
111
Figure 41 : Profil chromatographique d'exclusion
moléculaire de la â-galactosidase du suc digestif de la larve de
Rhynchophorus palmarum sur gel de Sephacryl S-100 HR 111
Figure 42 : Profil chromatographique d'interaction
hydrophobe de la â-galactosidase du suc digestif de la larve de
Rhynchophorus palmarum sur gel de Phényl-Sepharose CL-4B
112
Figure 43 : Electrophorèse sur gel de
polyacrylamide en présence de SDS et de âmercaptoéthanol de
â-galactosidase du suc digestif de la larve de Rhynchophorus palmarum
114
Figure 44 : Détermination du pH optimum
d'hydrolyse de la â-galactosidase du suc digestif de la larve de
Rhynchophorus palmarum 116
Figure 45 : Stabilité au pH de la
â-galactosidase du suc digestif de la larve de Rhynchophorus palmarum
. 116
Figure 46 : Détermination de la température
optimale d'hydrolyse de la â-galactosidase
du suc digestif de la larve de Rhynchophorus palmarum
.... 118
Figure 47 : Inactivation thermique de la
â-galactosidase du suc digestif de la larve de Rhynchophorus palmarum
à 37 °C et à 55 °C . . 118
Figure 48 : Dénaturation thermique de la
â-galactosidase du suc digestif de la larve de Rhynchophorus palmarum
119
Figure 49 : Effet de la congélation de la
â-galactosidase du suc digestif de la larve de Rhynchophorus palmarum
dans le tampon acétate 100 mM à pH5,0 . 119
Figure 50 : Influence du pH sur la réaction de
transgalactosylation catalysée par la â-
galactosidase du suc digestif de la larve de
Rhynchophorus palmarum ... 128
Figure 51 : Influence du temps d'incubation sur la
réaction de transgalactosylation catalysée par la
â-galactosidase du suc digestif de la larve de Rhynchophorus palmarum
128
Figure 52 : Influence de la concentration de
l'accepteur sur la réaction de transgalactosylation catalysée par
la â-galactosidase du suc digestif de la larve de Rhynchophorus
palmarum . . 129
Figure 53 : Influence de la concentration du donneur
de galactosyle (lactose) sur la réaction de transgalactosylation
catalysée par la â-galactosidase du suc digestif de la larve de
Rhynchophorus palmarum 129
LISTE DES TABLEAUX
Tableau 1 : Mécanismes réactionnels et
acides aminés impliqués dans la catalyse enzymatique des familles
des glycosidases rangées en clans 16
Tableau 2 : Mécanismes réactionnels et
acides aminés impliqués dans la catalyse enzymatique des familles
des glycosidases non rangées en clans . 17
Tableau 3a : Division de la famille GH13 en sous familles
19
Tableau 3b : Division de la famille GH13 en sous familles
20
Tableau 4 : Températures et pH optima
d'hydrolyse des activités a-exoglycosidasiques des extraits bruts
enzymatiques des glandes salivaires et du suc et tube digestifs de la larve de
Rhynchophorus palmarum . .. 55
Tableau 5 : Températures et pH optima
d'hydrolyse des activités â-exoglycosidasiques des extraits bruts
enzymatiques des glandes salivaires et du suc et tube digestifs de la larve de
Rhynchophorus palmarum . .. 56
Tableau 6 : Températures et pH optima
d'hydrolyse des activités endoglycosidasiques des extraits bruts
enzymatiques des glandes salivaires et du suc et tube digestifs de la larve de
Rhynchophorus palmarum . 56
Tableau 7 : Bilan global de la purification de
l'a-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
. 63
Tableau 8 : Poids moléculaires de l'a-glucosidase
du suc digestif de la larve du Rhynchophorus palmarum .
65
Tableau 9 : Quelques propriétés physiques
de l'a-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
71
Tableau 10 : Activité de l'a-glucosidase sur les
p-nitrophényl-glycosides 73
Tableau 11 : Spécificité de substrat de
l'a-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
sur les oligosaccharides et les polysaccharides ..... 74
Tableau 12 : Quelques paramètres cinétiques
de l'a-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
. 76
Tableau 13 : Effet de quelques agents chimiques sur
l'activité de l'a-glucosidase du
suc digestif de la larve de Rhynchophorus palmarum
. 77
Tableau 14 : Récapitulatif des
paramètres physico-chimiques des réactions de transglucosylation
catalysées par l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum . 81
Tableau 15 : Bilan global de purification de la
â-glucosidase du suc digestif de la larve
de Rhynchophorus palmarum 88
Tableau 16 : Poids moléculaires de la
â-glucosidase du suc digestif de la larve du Rhynchophorus palmarum
. 90
Tableau 17 : Quelques propriétés physiques
de la â-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum . 96
Tableau 18 : Activité de la â-glucosidase
sur les p-nitrophényl-D-glycosides .. 98
Tableau 19 : Spécificité de substrat
(oligosaccharides et polysaccharides) de la âglucosidase du suc digestif
de la larve de Rhynchophorus palmarum 98
Tableau 20 : Quelques paramètres cinétiques
de la â-glucosidase du suc digestif de la
larve de Rhynchophorus palmarum .
100
Tableau 21 : Effet de quelques agents chimiques sur la
â-glucosidase du suc digestif
de la larve de Rhynchophorus palmarum . .
102
Tableau 22 : Récapitulatif des
paramètres physico-chimiques des réactions de transglucosylation
catalysées par la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum 106
Tableau 23 : Bilan global de la purification de la
â-galactosidase du suc digestif de la larve de Rhynchophorus palmarum
. 112
Tableau 24 : Poids moléculaires et
sous-unité de la â-galactosidase du suc digestif de
la larve de Rhynchophorus palmarum .
114
Tableau 25 : Quelques propriétés physiques
de la â-galactosidase du suc digestif de la
larve de Rhynchophorus palmarum . .
120
Tableau 26 : Activité de la â-galactosidase
sur les p-nitrophényl-D-glycosides 122
Tableau 27 : Spécificité de substrat
(oligosaccharides et polysaccharides) de la â-
galactosidase du suc digestif de la larve de
Rhynchophorus palmarum . 122
Tableau 28 : Quelques paramètres cinétiques
de â-galactosidase du suc digestif de la larve de Rhynchophorus
palmarum 124
Tableau 29 : Effet de quelques agents chimiques sur
l'activité de la â-galactosidase du
suc digestif de la larve de Rhynchophorus palmarum
126
Tableau 30 : Récapitulatif des
paramètres physico-chimiques des réactions de
transgalactosylation catalysées par la â-galactosidase
purifiée du suc digestif de la larve de Rhynchophorus palmarum
. 130
SYMBOLES ET ABREVIATIONS
AMPc : adénosine monophosphate
cyclique
ATP : adénosine-5'- triphosphate
CCM : chromatographie sur couche mince
CLHP : chromatographie liquide haute
performance
CM : c arboxyméthyle
D.O : Absorbance
Da : dalton
DEAE : diéthylaminoéthyle
DTNB : acide
2,2'-dinitro-5,5'dithio-dibenzoïque
Ea : énergie d'activation
EC : enzyme commission
EDTA : éthylène diamine
tétra-acétate
kDa : kilodalton
kJ : kilojoule
KM : constante de Michaelis-Menten
M : molaire
mA : milliampère
nm : nanomètre
p/v : p oids/volume
pCMB :
para-chloromercuribenzoate de sodium
pH : potentiel d'hydrogène
pNP :
para-nitrophénol
pNPP : para-nitrophényl
phosphate
PP : pyrophosphate de sodium
R : constante des gaz parfaits
Rf : référence frontale
RMN : résonance magnétique
nucléaire
SAB : sérum albumine bovine
SDS : sodium dodécyle sulfate
PAGE : PolyAcrylamide Gel Electrophoresis
SN1 : substitution nucléophile d'ordre
1
SN2 : substitution nucléophile d'ordre
2
Trs : tours
UE : unité enzymatique
UI : unité internationale
Vmax : vitesse maximale
INTRODUCTION
Les glycosidases sont des biocatalyseurs de réactions
biochimiques au sein des organismes vivants. Elles sont utilisées en
biotechnologie pour catalyser les réactions de
dépolymérisation des macromolécules et de synthèse
à cause de leur spécificité et de leur efficacité
(Potus et Drapon, 1997). Les glycosidases thermophiles et/ou
thermostables sont devenues des enzymes pouvant donner une nouvelle dimension
à la biocatalyse. Ainsi, leur utilisation a permis de réduire le
risque de contamination en industrie laitière, notamment lors de la
dégradation du lactose, et en alimentation animale au cours de
l'hydrolyse des fibres (Bauer et al., 1996). En
effet, une catalyse à haute température permet de détruire
les microorganismes présents dans ces aliments. En industrie
papetière, les xylanases thermophiles de Thermotoga sont
utilisées pour hydrolyser le xylane afin de permettre la
libération du tanin et de la lignine responsables de la coloration du
papier. L'intervention de ces enzymes va donc permettre d'éviter
l'emploi de l'acide chlorhydrique dans le blanchiment du papier et par
conséquent d'éviter la pollution de l'environnement (Saul
et al., 1995 ; Chen et al., 1997). Les enzymes
thermophiles sont utilisées pour réduire la viscosité des
polymères naturels. L'hémicellulase de T. neapolitina
est capable de diminuer la viscosité d'une solution de galactomanane.
Elles sont aussi utilisées dans la clarification des jus de fruits
(Bauer et al., 1996). Ces glycosidases sont donc
très importantes en biotechnologie. Mais, la plupart d'entre elles,
distribuées dans le commerce, ne sont pas très stables et
possèdent de larges spécificités.
La réaction de transglycosylation est une
réaction de synthèse au cours de laquelle un ou plusieurs
monomère(s) d'un substrat (donneur) est (sont) transféré
(s) sur une molécule nucléophile (acceptrice) pour
synthétiser un néoglycosyle conjugué
(néoglycoconjugué). Elle peut se faire par divers
procédés. Il y a :
-les procédés chimiques qui exigent des
dispositions rigoureuses de protection et de déprotection (Kohki
et al., 1995) ;
-la méthode chimio-enzymatique qui parait être le
meilleur procédé car elle permet l'élimination des
inconvénients dûs aux procédés chimiques et
d'augmenter la quantité des substances néoformées
(néoglycoconjugués);
-enfin, l'approche enzymatique qui est de plus en plus
valorisée (Toone et al., 1989 ; Cote et Tao, 1990 ;
Ishikawa et al., 1993) car elle permet de remédier
à tous les problèmes
causés par les méthodes chimiques. Elle a
consisté d'abord en l'utilisation de glycosyltranférases qui
catalysent les transferts régiospécifiques et
stéréospécifiques d'un monosaccharide à partir d'un
substrat donneur (nucléotide glycosyle) vers un substrat accepteur.
Contrairement à certaines enzymes, l'action des transférases est
moins dépendante des conditions de la réaction. La
spécificité et la sélectivité pour le substrat
accepteur et les hauts rendements sont aussi des avantages pour ces
catalyseurs. De telles applications nécessitent l'utilisation de
substrats abondants et peu coûteux tels que le saccharose et l'amidon.
Cependant, les glycosyltransférases qui peuvent utiliser les sucres
simples comme donneurs sont limitées et il existe seulement quelques
glycosyltransférases commerciales actuellement disponibles
(Playne et Crittenden, 1996). Pour éviter ces
problèmes, les glycosidases sont souvent préférées
aux glycosyltransférases car, en plus de leur activité
hydrolytique réversible, elles catalysent des réactions de
transfert de glycosyles à des accepteurs autre que l'eau. Les avantages
techniques de ces enzymes sont multiples. Elles savent comme les autres enzymes
reconnaître les formes énantiomériques de molécules
complexes et permettent de mettre au point de nouvelles voies de
synthèse chirale industriellement compétitives (Cote et
Tao, 1990 ; Ishikawa et al., 1993). Leur
régiosélectivité permet également de supprimer de
nombreuses étapes de protection/déprotection requises par les
procédés chimiques. Le gain de productivité et de
qualité est considérable, de même que la réduction
des quantités de produits secondaires et de déchets, souvent
toxiques, qu'il faut finalement éliminer à grands frais.
Grâce à leur chémo-, régio- et
énantio-spécificité, les enzymes donnent la
possibilité d'améliorer à la fois la productivité,
le bilan énergétique environnemental (Salvatore et
al., 2001). C'est pourquoi, ces dernières années,
la biocatalyse s'est vue totalement modernisée par des techniques
sophistiquées de « criblage » et d'évolution
dirigée des protéines. Celles-ci permettent de modifier les
enzymes naturelles, dont les ressources sont extrêmement diverses, de
manière à les adapter très précisément aux
procédés industriels. En chimie industrielle, une croissance
accélérée de la biocatalyse est observée, tout
particulièrement dans des domaines comme la synthèse de produits
pour la pharmacie (Ajisaka et al., 1987) et pour la
cosmétique (Baldo et Roger, 2002). Aussi, ces enzymes
sont-elles largement utilisées pour les préparations d'une grande
variété de transglycosides. Dans la lutte contre le
diabète, la recherche d'inhibiteurs de
l'á-glucosidase représente une nouvelle approche
dans la thérapeutique de cette maladie. Ainsi, en inhibant de
façon compétitive et réversible les
á-glucosidases intestinales, l'acarbose
synthétisé réduit l'absorption digestive des carbohydrates
(Hilmar, 1995). L'acarbose a donc la possibilité de
ralentir ou de prévenir la survenue des complications
diabétiques. Ajisaka et al.
(1987) ont synthétisé à partir du D-fructose
à l'aide de la â-Dgalactosidase de la
bactérie Escherichia coli, l'allolactose et le lactulose. Le
lactulose est un disaccharide utilisé dans le traitement
d'encéphalopathies, de la constipation et des salmonelloses. La
galatosylation du D-xylose par une â-D-galactosidase
donne un mélange de disaccharides â(1-4),
â(1-3), â(1-2)-galactosyl-xylose
(Aragon et al., 1996). Ces produits peuvent
être utilisés pour l'évaluation de l'activité de la
lactase intestinale in vitro, ce qui donne lieu à une nouvelle
méthode de diagnostic de déficience en lactase. De plus, il est
important de noter que ce procédé enzymatique est moins cher et
moins risqué qu'une synthèse chimique de galacto-oligosaccharides
impliquant sept étapes réactionnelles (RiveraSagredo
et al., 1992). Malgré ces avantages, les rendements
obtenus restent toujours faibles en milieu aqueux puisque les réactions
catalysées par les glycosidases se déroulent toujours dans le
sens de l'hydrolyse. Pour améliorer l'activité de
transglycosylation des glycosidases, des dispositifs expérimentaux
peuvent être envisagés comme par exemple, l'utilisation des
systèmes réactionnels constitués de milieux
aqueux-organiques (Finch et Yoon, 1997 ; Becker et Khul, 1999)
comportant des concentrations élevées de l'accepteur de
glycosyles autre que l'eau (Vulfson et al., 1990).
L'utilisation des solvants organiques non aqueux n'ayant aucun effet de
dénaturation sur l'enzyme permet d'améliorer le rendement de la
transglycosylation. Par ailleurs, les rendements dépendent aussi de la
nature et de l'origine de l'enzyme utilisée (Leparoux et
al., 1994 ; Yoon et Ajisaka, 1996).
L'objectif général de ce travail a
été de rechercher une nouvelle source originale de glycosidases
avec des activités de transglycosylation élevées, une
spécificité très stricte du résidu glycosyle
douée d'une bonne stabilité. La source enzymatique retenue pour
ce travail est la larve de Rhynchophorus palmarum. En effet, à
cause de son équipement enzymatique, la larve de cet insecte est capable
d'infester et de détruire rapidement le palmier Elaeis
guineensis (Weissling et al., 1994). Les
objectifs spécifiques ont consisté à faire l'inventaire
des activités glycosidasiques, à déterminer les conditions
optimales d'hydrolyse, à purifier à
homogénéité électrophorétique les enzymes
responsables de fortes activités hydrolytiques, à
caractériser et à évaluer les potentialités
transglycosidasiques de ces glycosidases.
Chapitre 1
REVUE BIBLIOGRAPHIQUE
I-Généralités sur le
charançon
1- Systématique du charançon du
palmier
La position systématique du charançon du palmier
est la suivante :
Règne : Animal
Embranchement : Arthropode
Classe : Insecte
Ordre : Coléoptère
Famille : Curculionidae Genre : Rhynchophorus
Espèce : R. palmarum (Griffith, 1987).
2- Cycle de vie
Le cycle de vie du Rhynchophorus palmarum
(Curculionidae) se décompose en 4 étapes comprenant l'oeuf, la
larve, la nymphe et l'imago (le charançon adulte). Les oeufs sont pondus
(207 en moyenne) dans les palmes, les blessures de palme et à la base
des palmiers morts, par la femelle. Les oeufs pondus durent environ 3 jours
avant d'éclore. Les larves issues de l'éclosion commencent
à s'alimenter du tissu de palme (Hagley, 1965). Les
larves ont un appétit de plus en plus grand. Elles s'alimentent
principalement dans le tissu mou entourant le méristème apical.
Celles qui sont mûres émigrent à la
périphérie de la tige ou des pétioles et préparent
un cocon de fibres de palme. Les larves de charançon sont
crémeuses et de couleur jaunâtre. Elles ont une tête ronde.
Leur masse peut atteindre environ 6 g. Après s'être
entourées de cocons, les larves passent de l'étape
prépulpale à l'étape pulpale. Quelques semaines
après, un adulte émerge de l'étape pulpale et peut
immédiatement se débarrasser de son cocon ou attendre dans le
cocon plusieurs jours avant l'émergence. Le cycle de vie entier, de
l'oeuf jusqu'à l'adulte, dure environ 84 jours. Les adultes peuvent
vivre jusqu'à 26 semaines (Weissling et al.,
1994). Ils sont devenus ainsi des insectes adultes très actifs.
Lorsqu'ils ne volent pas à la recherche d'une palme, ils se cachent
entre les bases des feuilles et des tiges de palmes saines pour
conserver l'eau dans leur corps (Weissling et
Giblin-Davis, 1993). A l'âge adulte, le charançon change
de couleur. Il passe du noir plein presque totalement au rouge (Fig.
1).
3- Dommages causés
Les mâles de Rhynchophorus
palmarum(Curculionidae) sont des vecteurs de la maladie de l'anneau rouge
(Gerber et Giblin, 1990). Cette maladie a un impact
économique sur la culture des palmiers en Amérique du Sud et du
Centre. Les symptômes de l'infestation du palmier par le charançon
sont généralement associés à un déclin des
jeunes parties des palmiers. Les vieilles parties du palmier commencent
à tomber dès le début de l'infestation et s'effondrent
rapidement. Quand l'infestation progresse, les dommages d'alimentation larvaire
et la putréfaction associée sont si graves que
l'intégrité de la couronne est compromise. La couronne du palmier
finit par chuter. Cet état se nomme « cou sauté ». La
détection de l'infestation par le charançon est tardive et le
traitement aux premières heures de l'infestation peut être trop
tardif pour sauver l'arbre (Weissling et al.,
1994).
4-Equipement enzymatique de la larve de Rhynchophorus
palmarum (Curculionidae)
Contrairement aux insectes tels que les termites
Macrotermes belicosus (Matoub, 1993), M.
subyalinus (Kouamé et al., 2006) et
M. mulleri (Rouland, 1986), l'abeille Apis mellifera
(Lee et al., 2001), la mouche Drosophilia
melanogaster (Doane, 1969), la blatte Periplaneta
americana (Kouamé et al., 2005a), etc.,
l'équipement enzymatique de la larve du Rhynchophorus palmarum
n'a pas encore fait l'objet d'étude au moment où nous
réalisons la présente recherche. Le palmier est une source
important de carbohydrate au sein du quel se développe la larve de
Rhynchophorus palmarum, les travaux de cette étude ont permis
de faire pour la première fois un criblage des glycosidases de la larve
de cet insecte.
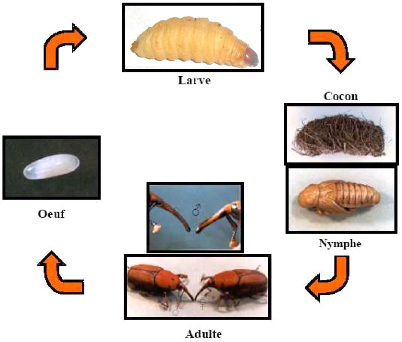
Figure 1 : Cycle de vie du Rhynchophorus
palmarum (Curculionidae) (D'après Wattanapongsiri,
1966).
II-Glycosidases
1-Réaction d'hydrolyse
Les glycosidases sont des enzymes qui hydrolysent les liaisons
osidiques des glycosides afin de libérer le glucide et son substituant.
Elles sont divisées en deux groupes :
-les á-glycosidases ;
-les â-glycosidases.
1-1-Mécanismes d'action
Le mécanisme d'hydrolyse enzymatique des liaisons
glycosidiques le plus commun s'opère par une catalyse au cours de
laquelle une paire d'acide carboxylique intervient. Dans ce cas, un acide
aminé joue le rôle du donneur de proton acide/base et l'autre agit
en tant que base/nucléophile. Les glycosidases peuvent alors agir avec
deux modes d'actions distincts proposés par Koshland et
al. (1953). Il s'agit des mécanismes d'inversion
(Fig. 2) et de rétention de configuration
anomérique (Fig. 3). Ces deux mécanismes sont
retrouvés majoritairement chez les glycosidases.
1-1-1-Inversion de configuration anomérique
Les enzymes qui libèrent un sucre de configuration
opposée, agissent avec inversion de configuration anomérique (par
simple substitution). Elles utilisent un mécanisme catalytique
non-covalent pour exploiter la catalyse acido-basique
générale.
Une molécule d'eau est activée par un acide
carboxylique déprotonné (Asp ou Glu) de l'enzyme afin de
générer un hydroxyle qui attaque le carbone anomérique.
Selon ce mécanisme de type Sn2, il y a inversion de la configuration
anomérique (Fig. 2) (Sinnott, 1990 ; Mccarter et Withers, 1994 ;
Davies et Henrissat, 1995).
1-1-2-Rétention de configuration
anomérique
Les enzymes agissant avec rétention de configuration
anomérique, libèrent un produit dont la
stéréochimie du carbone anomérique est la même que
celle du substrat (après deux inversions successives). Dans ce cas, le
nucléophile effectuant la première attaque sur le carbone
anomérique est l'acide carboxylique déprotoné de l'enzyme
(Asp ou Glu), formant un intermédiaire covalent. Par conséquent,
le substituant du glucoside est relâché à cette
première étape. Par la suite, un deuxième résidu
acide active une molécule d'eau qui, en
attaquant le carbone anomérique, libère le
glucide de l'enzyme. Deux étapes de type Sn2 se suivent donc, il y a
rétention de la configuration du carbone anomérique (Fig.
3) (Sinnott, 1990 ; Mccarter et Withers, 1994 ; Davies et
Henrissat, 1995).
1-1-3-Quelques cas particuliers
Il existe néanmoins quelques exemples de glycosidases
possédant des mécanismes différents de ceux
mentionnés ci-dessus. Il s'agit des cas particuliers où l'acide
catalytique peut être remplacé par un phosphate inorganique.
Différents groupes chimiques peuvent intervenir dans ce mécanisme
et être à l'origine de la similarité de certaines
glycosidases avec des enzymes présentant des activités
apparemment très distinctes, comme par exemple : la maltose
phosphorylase (EC 2.4.1.8, famille GH65), la sucrose phosphorylase (EC 2.4.1.7,
famille GH13), ou la cellobiose phosphorylase (EC 2.4.1.20, famille GH94)
(Vasella et al., 2002 ; Davies et al.,
2003). Certaines glycosidases comme les myrosinases, les chitinases et
les endoN-acétylglucosaminidases présentent un mécanisme
moléculaire d'hydrolyse n'impliquant l'intervention que d'un seul acide
aminé catalytique (Rye et Withers, 2000). D'autres
impliquent des mécanismes d'oxydoréduction et/ou
d'élimination (Yip et al., 2004).
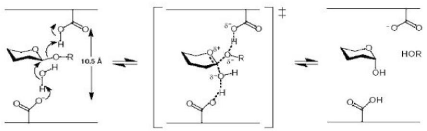
Figure 2 : Mécanisme d'inversion de configuration
anomérique des glycosidases (D'après Davies et Henrissat,
1995)
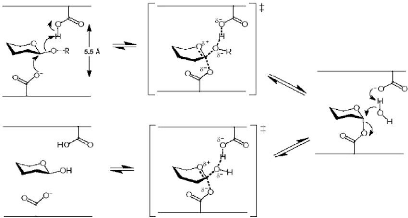
Figure 3 : Mécanisme de rétention de
configuration anomérique des glycosidases (D'après Davies et
Henrissat, 1995)
1-2-Relation entre les glycosidases de mécanisme
d'inversion de configuration anomérique hydrolysant les liaisons alpha
et beta
Au niveau moléculaire, les mécanismes
d'inversion et de rétention de configuration anomérique font
intervenir 4 états de transition possibles de type ion oxocarbonium
(Vasella et al., 2002 ; Davies et al.,
2003). Parmi les â-glycosidases de
mécanisme de rétention de configuration anomérique, les
conformères 4H3, 2,5B et
B2,5 ont été observés respectivement
chez les familles GH5 et GH7 (Sulzenbacher et al., 1996 ;
Varrot et al., 2003), GH11 (Sabini et al.,
1999) et enfin GH26 (Ducros et al., 2002).
Pour les â-glycosidases de mécanisme d'inversion
de configuration anomérique, c'est la transition en conformère de
type 2,5B qui est observée chez les familles GH6, GH8 et GH48
(Guerin et al., 2002 ; Varrot et al., 2003).
Chez les glycosidases agissant sur les liaisons â, ces
complexes de Michaelis correspondent à des distorsions de la forme
cyclique nécessaire pour amener la liaison glycosidique dans une
position pseudo axiale (Stam et al., 2005). Cette
orientation favorise une attaque nucléophile directe
(Sulzenbacher et al., 1996). Il faut noter que de
telles distorsions du cycle accompagnant la formation du complexe de Michaelis
sont inutiles pour les glucoamylases et leurs homologues de la famille GH15
(Stam et al., 2005). En effet, la liaison
glycosidique est déjà dans une position axiale facilitant
l'attaque nucléophile (Aleshin et al., 1996).
En fait, le mécanisme moléculaire d'inversion des glycosidases
agissant sur des liaisons á- passe par une attaque
nucléophile réalisée par une molécule d'eau
(Stam et al., 2005). Cette molécule d'eau,
préalablement activée par un résidu basique, va attaquer
le carbone anomérique du glycoside non distordu, avec, dans le
même temps, rupture de la liaison glycosidique axiale (Fig.
4) (Rye et Withers, 2000 ; Zechel et Withers, 2000 ; Vasella
et al., 2002).
1-3-Relation entre des alpha- et beta-glycosidases avec
des mécanismes de configuration anomérique
opposés
Des similarités, telles que celles vues
précédemment, nécessitent une distorsion du substrat dans
le site actif d'une â-glycosidase, possédant un
mécanisme d'inversion de configuration anomérique. Une telle
distorsion place la liaison glucosidique dans une orientation axiale
(Fig. 6) similaire à celle d'une liaison
á dans le site actif d'une glycosidase avec un
mécanisme d'inversion de configuration anomérique (Fig.
5) (Stam et al., 2005).
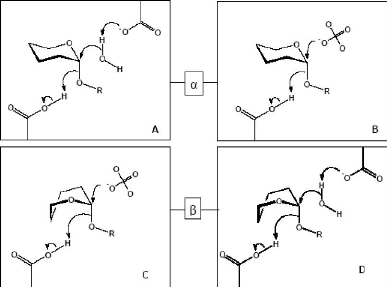
Figure 4 : Similarités des mécanismes chez
diverses familles de glycosidases
(A) Mécanisme des GHs hydrolysant des liaisons
á chez les familles GH15, GH37, GH63, GH78, GH92 et
GH95. (B) Mécanisme des phosphorylases de la famille GH65. (C)
Mécanisme des phosphorylases de la famille GH94 hydrolysant des liaisons
â. (D) Mécanisme des enzymes des familles GH8,
GH9 et GH48 hydrolysant des liaisons â
(D'après Stam et al., 2005).
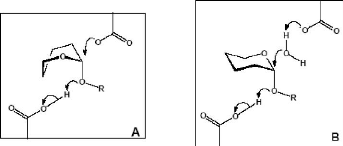
Figure 5 : Similarités dans l'orientation des
liaisons dans des enzymes de mécanismes opposés
(A) Similarité entre l'étape de glycosylation des
enzymes appartenant au clan GH-A et (B) le mécanisme à simple
déplacement des â-amylases
(D'après Stam et al., 2005).
1-4-Classifications des glycosidases 1-4-1-Classification
traditionnelle
Dans la nomenclature de l'Union Internationale de Biochimie et
de Biologie Moléculaire (IUB-MB) basée sur le type de
réaction catalysée et la spécificité de substrat,
les glycosidases possèdent un numéro du type EC 3.2.1.x. Les
trois premiers chiffres indiquent qu'elles hydrolysent des liaisons
O-glycosidiques, le dernier (x) est variable et dépend du substrat
transformé (Placier, 1999). Cette classification
systématique permet de nommer précisément la
spécificité de substrat d'une enzyme et possède en outre,
l'avantage de pouvoir classer rapidement une enzyme. Cependant, ce
système ne tient pas compte des similarités de séquence
protéique et donc de la structure tridimensionnelle. De plus, cette
classification n'est pas systématique quant au mécanisme d'action
des enzymes. Elle paraît mal adaptée aux glycosidases qui peuvent
agir sur différents substrats et ne reflète pas les aspects
structuraux des enzymes (Fourage, 2000). C'est notamment le
cas de la â-glucosidase BglA, de Pyrococcus furiosus
DSM 3638. Elle est annotée avec le numéro EC 3.2.1.21, on
pourrait penser qu'elle n'a que cette activité, or elle montre des
activités â-galactosidasique (EC 3.2.1.23) et
â-xylosidasique (EC 3.2.1.37) (Kengen et
al., 1993). Ou encore, il peut se trouver que deux numéros
EC différents décrivent la même activité. C'est le
cas des numéros EC 3.2.1.10 (oligo-1,6-glucosidase) et EC 3.2.1.70
(glucan 1,6-á-glucosidase). Sur le site de l'Enzyme
Commission, la définition de ces deux activités est quasiment
similaire. Ce qui est encore plus préoccupant, est le fait que plusieurs
activités, qui sont pourtant connues depuis plusieurs années,
n'ont aucun numéro EC associé, ou alors un numéro
incomplet du type 3.2.1.-, où la spécificité n'est pas
indiquée (Green et Karp, 2005). Ce fait
révèle un manque de réactivité de l'Enzyme
Commission face à la découverte de nouvelles activités.
Devant cette situation, une autre classification a été
proposée. Il s'agit de la classification structurale.
1-4-2-Classification structurale 1-4-2-1-Principe et
classification
Les polysaccharides sont la principale forme de stockage de
glucides, dont l'oxydation permet de récupérer de
l'énergie. Ils entrent aussi dans la composition
d'éléments de structures de la plupart des organismes : le
peptidoglycane des bactéries, la carapace chitineuse des insectes, la
paroi cellulaire des plantes, etc (Biely, 1985 ; Subramaniyan et Prema,
2000). Une hydrolyse sélective des liaisons glucosidiques est
donc nécessaire pour récupérer l'énergie via
différentes voies oxydatives et libérer des monomères pour
construire
des parois cellulaires. Les enzymes qui modifient,
créent ou lysent les liaisons glucosidiques des polysaccharides sont
désignées sous le terme « Carbohydrate-Active Enzymes, ou
CAZymes ». La diversité des carbohydrates entraîne donc une
grande diversité chez les enzymes (glycosidases ou glycosides
hydrolases, GH) dégradant les glucides par hydrolyse. Ces enzymes sont
retrouvées chez des organismes provenant de tous les domaines : virus,
bactéries, archéobactéries et eucaryotes, et sont
impliquées dans de nombreuses voies métaboliques. Ces enzymes ont
pendant leur évolution subi des mutations qui leur ont permis de se
perfectionner et d'accroître leur spécificité de substrat
et ainsi donner un avantage aux organismes qui les portent. De ce fait, les
glycosidases couvrent un large panel de fonctions biologiques. Certaines
enzymes des GHs présentent même des variations subtiles du
mécanisme catalytique conduisant à des activités de type
transglycosylase ou lyase, ce qui illustre l'extrême souplesse de leur
reconnaissance de substrat et activité enzymatique (Stam,
2006). Les glycosidases sont les plus étudiées. Avec
l'accumulation de séquences de ces enzymes, une nouvelle classification
était incontournable car la diversité de propriétés
et le comportement de certaines enzymes étaient inexplicables par
rapport à la seule référence EC. Ces raisons ont
amené Bernard Henrissat, à partir de 1989, à chercher une
autre alternative pour classer ces enzymes selon des propriétés
structurales qui leur sont propres. Il a donc créé une
classification, basée sur la similarité de séquences en
acides aminés, à partir d'analyses de clusters hydrophobes, ou
`hydrophobic cluster analysis', HCA (Gaboriaud et
al., 1987) de séquences protéiques de cellulases
(Henrissat et al., 1989). Elle est basée sur
la détection de segments structuraux constituant le coeur hydrophobe des
protéines globulaires (Fig. 6). Grâce à
cette approche, des similarités dans le repliement tridimensionnel
peuvent être détectées entre des protéines
possédant des identités de séquences très basses
(< 20 %). Les séquences ayant une forte similarité entre elles
ont été classées dans les mêmes familles. A
l'origine, seules 6 familles de cellulases ont été
créées et les informations étaient enregistrées
sous un simple format tabulaire. En 1991, un effort a été fourni
pour approfondir ce début de classification (Henrissat,
1991), car plusieurs des familles obtenues par similarité de
séquence, présentaient des enzymes ayant des activités sur
d'autres substrats que la cellulose (Stam, 2006). Cette
classification diffère de la classification de l'IUB-MB par le fait que
des enzymes de spécificité différente peuvent appartenir
à la même famille. Elle permet de prendre en considération
la structure tridimensionnelle ainsi que le mécanisme moléculaire
d'action des glycosidases. Elles sont ainsi regroupées en familles
(notées GH) en fonction des similarités dans leur séquence
d'acides aminés. Certaines glycosidases sont multifonctionnelles. Elles
contiennent des domaines catalytiques qui appartiennent à
différentes familles des glycosidases. Puisqu'il existe
une relation directe entre similarités de séquence en acides
aminés et similarités de repliement (Chothia et Lesk,
1986), il peut être admis que les membres d'une même
famille possèdent des repliements similaires. Cette situation permet de
prédire les structures tridimensionnelles générales des
sites actifs des membres de chaque famille, si cette information est connue
pour un ou plusieurs de ses représentants (Chothia et Lesk,
1986).
Le mécanisme d'action d'une enzyme étant
dicté par la structure du site actif et par la position des
différents groupes fonctionnels, le mécanisme et la
stéréochimie de la réaction seront conservés dans
une famille (exception faite de la famille GH4). Toutes les glycosidases
agissent généralement par un mécanisme qui implique deux
résidus importants. Chez ces enzymes, les acides aminés
catalytiques sont le plus souvent des aspartates et/ou des glutamates
(Tableaux I et II) (Davies et al., 1995).
Cet effort a abouti à la classification de 291
séquences en acides aminés en 35 familles de GHs
différentes (Henrissat, 1991), dont plusieurs ont
été déjà polyspécifiques. Cette courte liste
de familles a été, par la suite, mise à jour plusieurs
fois (Henrissat et Bairoch, 1993 ; Henrissat et Bairoch,
1996). A l'heure actuelle, 112 familles de glycosidases
différentes sont répertoriées et peuvent être
consultées sur internet (
http://afmb.cnrs-rs.fr/CAZY/org.html).
Par ailleurs, beaucoup de ces familles, présentant des
similarités dans le repliement tridimensionnel des enzymes qu'elles
contiennent, ont été regroupées pour former des clans ou
super-familles (Henrissat et al., 1995). On
dénombre actuellement 14 clans (Clan GH : Clan des GlycosylHydrolases)
appelés A, B, C, D, E, F, G, H, I, J, K, L, M et N (Tableau I
). Quatre familles d'enzymes ont été supprimées,
ce sont les familles 21, 40, 41 et 60. Certaines familles d'enzymes n'ont pas
été rangées en clans ou dans des clans (Tableau
II).
Des enzymes dont les structures ont été
identifiées n'ont pas été à leur tour
classées en familles. Réactualisée en permanence
(Henrissat et Bairoch, 1993 ; Henrissat et al.,
1996), la classification CAZy (Carbohydrate-Active enZymes) est
maintenant étendue à d'autres classes d'enzymes actives sur les
sucres qui sont les glycosyltransférases (91 familles), les
polysaccharides lyases (18 familles), leurs modules non-catalytiques et les
carbohydrates estérases (15 familles).
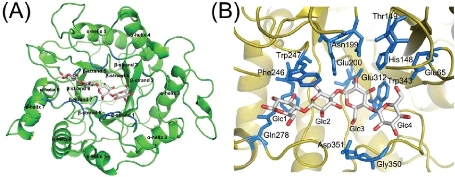
39
Figure 6 : Structure tridimensionnelle de
l'endocellulase (famille 5 des glycosidases) de Thermus caldophilus
(A) et de son site actif (B) liant le cellotétraose (D'après Kim
et al., 2006)
Tableau I : Mécanismes réactionnels et
acides aminés impliqués dans la catalyse enzymatique des familles
des glycosidases rangées en clans
a = le premier groupement cité est le composé
nucléophile/base, le second est celui du donneur de proton
|
Clan de
glycosidases
|
Famille de glycosidases
|
Nombre de Mécanisme familles
réactionnel
|
Acides aminés
impliqués dans
la
catalyse
enzymatiquea
|
|
GH-A
|
1, 2 , 5,
42, 50,
|
10,
51,
|
17,
53,
|
26,
59,
|
30, 35
72, 79,
|
39,
86.
|
17
|
rétention
|
Glu
Glu
|
|
GH-B
|
7, 16
|
|
|
|
|
|
2
|
rétention
|
Glu
Glu
|
|
GH-C
|
11, 12
|
|
|
|
|
|
2
|
rétention
|
Glu
Glu
|
|
GH-D
|
27, 31,
|
36
|
|
|
|
|
3
|
rétention
|
Asp
Asp
|
|
GH-E
|
33, 34,
|
83
|
|
|
|
|
3
|
rétention
|
Tyr+Glu
non connu
|
|
GH-F
|
43, 62
|
|
|
|
|
|
2
|
inversion
|
non connu
non connu
|
|
GH-G
|
37, 63
|
|
|
|
|
|
2
|
inversion
|
non connu
non connu
|
|
GH-H
|
13, 70,
|
77
|
|
|
|
|
3
|
rétention
|
Asp
Glu
|
|
GH-I
|
24, 46,
|
80
|
|
|
|
|
3
|
inversion
|
non connu ou Asp
non connu ou Glu
|
|
GH-J
|
32, 68
|
|
|
|
|
|
2
|
rétention
|
Asp
Glu
|
|
GH-K
|
18, 20,
|
85
|
|
|
|
|
3
|
rétention
|
oxygène carbonyle
Glu
|
|
GH-L
|
15, 65
|
|
|
|
|
|
2
|
inversion
|
Glu ou phosphate
Glu
|
|
GH-M
|
8, 48
|
|
|
|
|
|
2
|
inversion
|
Asp ou non connu
Glu
|
|
GH-N
|
28, 49
|
|
|
|
|
|
2
|
inversion
|
Asp
Asp
|
41
Tableau II : Mécanismes réactionnels et
acides aminés impliqués dans la catalyse enzymatique des familles
des glycosidases non rangées en clans
Familles de glycosidase Mécanisme Acides
aminés impliqués dans la
réactionnel catalyse
enzymatique
Nucléophile/Base Donneur de
proton
3 rétention Asp Glu
4 rétention non applicable non connu
6, 45, 74 inversion Asp Asp
9, 25, 75 inversion Asp Glu
19, 64, 71, 78, 81 inversion non connu non connu
14 inversion Glu Glu
109 rétention non applicable non connu
29 rétention Asp non connu
44 rétention Glu Glu
112 inversion non connu Asp
47, 67 inversion non connu Glu
54, 93, 101 rétention non connu non connu
55, 58, 61, 73, 76, 87, 88, 89, 92, non connu non connu non
connu
96, 97, 98, 99, 100, 105, 106, 107,
110,112
56, 103 rétention oxygène du carbonyl Glu
57 rétention Glu non connu
66 rétention Asp Asp
84 rétention oxygène du carbonyl Asp
90 inversion Glu et Asp Asp
91 inversion Glu non connu
94 inversion phosphate Asp
95 inversion Asn activé par Asp Glu
108 non connu non connu Glu
42
1-4-2-2-Division des familles des glycosides hydrolases
en sous familles
Les familles de protéines définies dans CAZy
permettent d'avoir un certain pouvoir prédictif : le même
repliement, le même mécanisme d'action, et les mêmes
résidus catalytiques sont conservés à l'intérieur
d'une même famille. Or depuis quelques années, l'équipe
CAZy participe à des projets de séquençages de
génomes, intervenant au niveau de l'identification et de l'annotation
fonctionnelle des gènes de CAZymes (Stam, 2006).
Les centres de génomique sont conscients de
l'accumulation d'erreurs et des limitations de la méthode « best
BLAST hit ». Ils se tournent donc vers des équipes
spécialisées capables d'apporter la meilleure annotation
possible. Etant accessible en ligne depuis 8 ans, CAZy est devenue une des
principales références en ce qui concerne les CAZymes. Bien que
l'assignement d'une enzyme à une famille particulière permet de
prédire plusieurs caractéristiques structurales et
mécanistiques, il n'était pas toujours possible de fournir une
prédiction précise sur la fonction de cette enzyme (Stam,
2006).
Pour répondre à ce problème et
améliorer les procédures d'annotation de séquences
génomiques, Stam et al. (2006) ont fourni un
effort de division des familles de GHs en sousfamilles suivant l'idée
communément acceptée que des enzymes possédant des
séquences très similaires doivent partager des
propriétés biochimiques très proches (Fig.
7). La famille GH 13, qui regroupe beaucoup de glycosidases a
été subdivisée en 40 sous-familles (Tableau
III) (Stam et al., 2006). Des
á-amylases (EC 3.2.1.1) appartenant à cette même famille
ont été rangées dans 13 sous familles qui sont GH13_1,
GH13_2, GH13_5, GH13_6, GH13_7, GH13_15, GH13_19, GH13_24, GH13_27, GH13_28,
GH13_32, GH13_36 et GH13_39. Quant aux á-glucosidases (EC 3.2.1.20),
elles se retrouvent dans des sous familles différentes de celles des
á-amylases. Il s'agit des sous-familles GH13_17, GH13_21, GH13_30 et
GH13_40 (Tableau III).
Tableau IIIa : Division de la famille GH13 en sous
familles
|
Sous-
familles
|
Numéros
EC
|
Activités enzymatiques
|
Taxonomie
|
|
GH 13_1
|
3.2.1.1
|
á-amylase
|
Fungi
|
|
GH 13_2
|
3.2.1.1
2.4.1.19
3.2.1.133
|
á-amylase
cyclodextrin glucanotransferase maltogenic
á-amylase
|
Bacteria, Archaea
|
|
GH 13 _3
|
-
|
Activité inconnue
|
Bacteria, Archaea
|
|
GH 13_4
|
2.4.1.4
3.2.1.-
|
Amylosurase Sucrose hydrolase
|
Bacteria
|
|
GH 13_5
|
3.2.1.1
|
á-amylase
|
Bacteria, Eukaryota
|
|
GH 13_6
|
3.2.1.1
|
á-amylase
|
Bacteria, Viridiplantea
|
|
GH 13_7
|
3.2.1.1
|
á-amylase
|
Euryarchaeota
|
|
GH 13_8
|
2.4.1.8
|
1,4-á-glucan branching enzyme
|
Eukaryota, Bacteria
|
|
GH 13_9
|
2.4.1.8
|
1,4-á-glucan branching enzyme
|
Bacteria,
Eukaryota, Archaea
|
|
GH 13_10
|
3.2.1.141
|
4-á-(1,4-á-glucano)
trehalose trehalohydrolase
|
Bacteria, Archaea
|
|
GH 13_11
|
3.2.1.68
|
isoamylase
|
Bacteria,
Archaea , Eukaryota
|
|
GH 13_12
|
3.2.1.41
|
pullulanase
|
Firmicutes
|
|
GH 13_13
|
3.2.1.41
|
pullulanase
|
Bacteria, Eukaryota
|
|
GH 13_14
|
3.2.1.41
|
pullulanase
|
Bacteria
|
|
GH 13_15
|
3.2.1.1
|
á-amylase
|
Metazoa, Bacteria
|
|
GH 13_16
|
5.4.99.16
|
malto á-glucosyltransférase
|
Bacteria, Archaea
|
|
GH 13_17
|
3.2.1.20
|
á-glucosidase
|
Metazoa
|
|
GH 13_18
|
2.4.1.7
|
sucrose phosphorylase
|
Bacteria
|
|
3.2.1.1
|
á-amylase
|
|
|
GH 13_19
|
3.2.1.38
|
maltohexaose-forming á-amylase
|
Bacteria
|
|
3.2.1.-
|
maltopentaose-forming á-amylase
|
|
|
3.2.1.54
|
cyclomaltodextrinase
|
|
|
GH 13_20
|
3.2.1.133
|
maltogenic á-amylase
|
Bacteria
|
|
3.2.1.135
|
neopullulanase
|
|
|
GH 13_21
|
3.2.1.20
|
á-glucosidase
|
Proteobacteria
|
D'après Stam, 2006.
44
Tableau IIIb : Division de la famille GH13 en sous
familles (suite et fin)
|
Sous
familles
|
Numéros
EC
|
Activités enzymatiques
|
Taxonomie
|
|
|
|
Deinococcus-
Thermus
|
|
GH13_22
|
2.4.1.183
|
a-1,3-glucan synthase
|
Fungi
|
|
GH13_23
|
nd
|
activité inconnue
|
Proteobacteria
|
|
GH13_24
|
3.2.1.1
|
a-amylase
|
Metazoa
|
|
GH13_25
|
3.2.1.33
|
amylo-a-1,6-glucvosidase
|
Eukaryota
|
|
GH13_26
|
5.4.99.15
|
(1,4)-a-glucan
1-a-glucosymutase
|
Bacteria, Archea,
Eukaryota
|
|
GH13_27
|
3.2.1.1
|
a-amylase
|
Proteobacteria
|
|
GH13_28
|
3.2.1.1
|
a-amylase
|
Firmicutes, Actinobacteria
|
|
GH13_29
|
3.2.1.93
|
a-phosphotrehalase
|
Bacteria
|
|
GH13_30
|
3.2.1.20
|
a-glucosidase
|
Actinobacteria, Eukaryota
|
|
GH13_31
|
3.2.1.70
3.2.1.10
|
glucan1,6-a-glucosidase oligo-1.6-glucosidase
|
Bacteria
|
|
GH13_32
|
3.2.1.1
|
a-amylase
|
Bacteria
|
|
GH13_33
|
5.4.99.16
|
trehalose synthase
|
Bacteria
|
|
GH13_34
|
|
amino acid transproter
|
Eukaryota
|
|
GH13_35
|
|
amino acid transproter â-amylase
|
Eukaryota
|
|
GH13_36
|
3.2.1.1
|
a-amylase
|
Bacteria
|
|
GH13_37
|
nd
|
activité inconnue
|
Bacteria
|
|
GH13_38
|
nd
|
activité inconnue
|
Bacteria
|
|
GH13_39
|
3.2.1.1
3.2.1.41
|
a-amylase pullulanase
|
Bacteria
|
|
GH13_40
|
3.2.1.20
|
a-glucosidase
|
Eukaryota
|
D'après Stam, 2006.
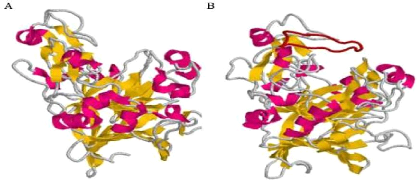
Figure 7 : Comparaison entre la structure d'une
endoglucanase et celle d'une cellobiohydrolase de la famille GH7. Structure
d'une cellobiohydrolase (A), et d'une endoglucanase (B) de la famille GH7,
représentative des sous-familles GH7_2 et GH7_1, respectivement
(D'après Stam, 2006).
Les hélices á sont en violet,
les feuillets â en jaune. La boucle
supplémentaire présente chez les cellobiohydrolases est en rouge.
Figure réalisée avec Rasmol (Sayle et Milner-White, 1995)
à partir des structures PDB 1DYM et 7CEL 5
2-Réactions de synthèse
L'utilisation d'enzymes pour la synthèse de sucres
complexes offre plusieurs avantages par rapport à la méthode
chimique. Une catalyse très efficace peut être effectuée
sans protection des groupements hydroxyles avec un large éventail
possible de réactions régiospécifiques et
stéréospécifiques. Ces réactions se faisant dans
des conditions douces, les utilisations de solvants organiques et de produits
chimiques dangereux peuvent être éliminées. La
synthèse enzymatique d'oligosaccharides peut se faire à l'aide
d'enzymes libres ou à l'aide d'enzymes immobilisées
(Harju, 1987 ; Gekas et Lopez-Leiva, 1985). Il existe trois
approches pour synthétiser des oligosaccharides à l'aide
d'enzymes.
La première approche consiste à utiliser les
glycosidases qui catalysent les réactions inverses de l'hydrolyse. Ces
enzymes peuvent transférer la partie glycosylée d'un substrat
à des accepteurs autres que l'eau. L'équilibre de la
réaction favorise généralement l'hydrolyse. Pour
accroître le rendement de synthèse des oses, diverses
stratégies doivent donc être employées : une augmentation
de la concentration du substrat, une diminution de l'eau ou une
élimination du produit final. Par ce procédé, divers types
d'oses ont été synthétisés. C'est le cas des
gluco-oligosaccharides (Laroute et Willemot, 1992 ; Rastall et
al., 1992 : Ajisaka et Fujimoto, 1990), des mannose-disaccharides
(Johansson et al., 1986) et des
galactooligosaccharides (Ajisaka et Fujimoto, 1990). Les
inconvénients de l'utilisation des glycosidases dans la réaction
de condensation entraînent un faible rendement de synthèse. Cette
situation est causée par l'équilibre thermodynamique non
favorable, l'obtention d'un mélange d'isomères difficiles
à séparer, de longs temps de réaction et de hautes
concentrations d'enzymes nécessaires à l'activité
limitée des glycosidases dans des solutions concentrées de sucre
(Monsan et al., 1989 ; Nilsson, 1988). Cependant, les
glycosidases sont facilement disponibles et démontrent une excellente
stabilité à la température.
La deuxième approche consiste en l'utilisation de
glycosyltransférases qui catalysent les transferts
régiospécifiques et stéréospécifiques d'un
monosaccharide à partir d'un substrat donneur (nucléotide
glycosyle) vers un substrat accepteur. Contrairement à certaines
enzymes, l'action des transférases est moins dépendante des
conditions de la réaction. La spécificité et la grande
sélectivité pour le substrat accepteur et les hauts rendements
sont aussi des avantages pour ces catalyseurs. De telles applications
nécessitent l'utilisation de substrats abondants et peu coûteux
tels que le saccharose et l'amidon. Cependant, les glycosyltransférases
qui peuvent utiliser des sucres simples comme donneurs sont limitées et
il n'existe seulement quelques glycosyltransférases commerciales
actuellement disponibles.
La production industrielle enzymatique de cyclodextrines par
la cyclodextrineglycosyltransférase (EC 2.4.1.19 ; CGTase) est un
procédé actuellement utilisé qui fait appel à ce
type de réaction. Les cyclodextrines sont particulièrement
utilisées pour leur propriété stabilisante (Playne
et Crittenden, 1996).
Enfin, la dernière approche utilise l'activité
transférasique des glycosidases. Ces enzymes peuvent catalyser le
transfert d'une partie chimique à un accepteur autre qu'une
molécule d'eau. Le mécanisme de la réaction implique
généralement une étape intermédiaire
enzymesubstrat. L'efficacité de ce type de réaction peut
être améliorée par plusieurs facteurs : l'utilisation d'une
molécule acceptrice appropriée, l'augmentation de la
concentration des donneurs et des accepteurs de glycosyles, la diminution de
l'activité de l'eau et la récupération du produit final.
Les glycosides ayant des aglycones aromatiques sont particulièrement
utilisés comme donneurs de glycosyle à cause de leur haute
réactivité (Fortun et Colas, 1991).
Les oligosaccharides naturels sont des composés de
structures moléculaires diverses. Ils jouent des rôles biologiques
variés tel que le processus de communication cellulaire en servant de
site récepteur des bactéries et des particules virales. Les
oligosaccharides des glycoprotéines sont aussi impliqués dans la
stabilité des protéines et dans les mécanismes d'inversion
tumorale (Wang et al., 1998).
Différents composés, suivant l'accepteur
nucléophile utilisé, sont susceptibles d'être
synthétisés par transglycosylation. Nunoura et
al. (1996) ont montré que le
fucosylglucose, synthétisé par transglycosylation, est un
disaccharide exclusivement assimilé par les bifidobactéries. Il
peut ainsi favoriser l'implantation de ces microorganismes dans la flore
intestinale. Un autre oligosaccharide est l'objet de nombreuses études :
Galá1-3Galâ1- 4GlcNAc. Ce
trisaccharide est connu comme étant responsable du rejet hyper aigü
de greffe lors de la transplantation d'un organe porcin à l'homme. En
effet, environ 1 % des IgG humaines sont capables de reconnaître ce motif
trisaccharidique. L'utilisation de gel d'affinité sur lequel se trouve
greffé la partie terminale
(Galá1-3Galâ) du trisaccharide
pourra permettre de`'filtrer» le sang du receveur. Cette technique
biologique est une approche pour diminuer le risque de rejet. Ce trisaccharide
soluble est un excellent inhibiteur de la fixation des anticorps humains sur
les cellules porcines. De nombreuses études en transglycosylation sont
actuellement menées pour effectuer la synthèse de ce
trisaccharide (Nilson, 1997).
Pour les réactions de transglycosylation, divers
accepteurs de glycosyles sont utilisés. Les plus importants sont les
alcools (Vanderjagt et al., 1994; Takegawa et al.,
1993 ;
Kouamé, 2006), les sucres (Nilson
et Scigelova, 1994 ), les acides aminés (Leparoux
et al., 1994, 1996 ; Becker et Kuhl, 1999) et les
nucléotides (Binder et al., 1995).
3-Propriétés de quelques glycosidases des
insectes 3-1-Enzymes amylolytiques
3-1-1-Amylases
Trois enzymes sont capables de dégrader l'amidon et le
glycogène. Il s'agit de l'áamylase, de la â-amylase et de
la glucoamylase. L'á-amylase (EC 3.2.1.1) coupe la liaison osidique
á (1?4) au hasard à l'intérieur de la chaîne
á-glucane. Elle libère généralement de
l'á-maltose et des á-maltodextrines limites. La â-amylase
(EC 3.2.1.2) dégrade l'amidon ou le glycogène à partir de
l'extrémité non réductrice pour donner essentiellement du
â-maltose. Quant à la glucoamylase (EC 3.2.1.3), elle
libère du glucose à partir de l'extrémité non
réductrice de l'amidon et du glycogène. Ces différentes
amylases peuvent être distinguées les unes des autres par
l'identification de leurs produits d'hydrolyse (Robyt et French,
1967). Seule l'á-amylase a été mise en
évidence chez les insectes. Les autres enzymes amylolytiques n'existent
pas dans l'appareil digestif de ceux-ci. L'activité glucoamylasique mise
en évidence la première fois chez les insectes par Terra
et Jordão (1989) dans l'intestin moyen de la larve de Musca
domestica a été par la suite révélée
comme étant la résultante de l'action combinée d'une
á-amylase et d'une á-glucosidase par les mêmes auteurs en
1991.
Les séquences en acides aminés des amylases des
insectes Drosophila melanogaster (Boer et Hickey,
1986) et Tribolium castaneum (Hickey et al.,
1987) sont connues. Elles ressemblent à celles des
á-amylases déjà séquencées. Cette analogie
structurale montre que ces enzymes proviendraient d'une même
séquence ancestrale (Hickey et al., 1987). La
plupart des amylases des insectes ont des masses moléculaires qui se
situent entre 48 et 68 kDa (Baker, 1989, 1991 ; Kanekatsu,
1978). Les points isoélectriques sont acides et se situent
entre 3,5 et 4. Les constantes de Michaelis et Menten déterminées
lorsque l'amidon soluble est utilisé comme substrat ne dépassent
pas 0,4 % (p /v). Les pH optima d'hydrolyse correspondent
généralement aux pH des intestins moyens dans lesquels les
amylases ont été isolées.
L'ion calcium active les amylases des insectes Sitophilus
oryzae (Baker et Woo, 1985 ; Baker, 1987), S.
granarius (Baker et Woo, 1985 ; Baker, 1987) et
Rhyzopertha dominica
(Baker, 1991). Il reste cependant sans effet
sur celles de Pheropsophus aequinoctialis (Ferreira et Terra,
1989), de Anagasta muehniella (Baker, 1989),
de Erinnyis ello (Santos et Terra, 1985) et de
Spodopera fugiperda (Ferreira et al., 1994).
Cet ion peut affecter la thermostabilité de certaines amylases
d'insectes. C'est le cas des amylases des espèces de
Sitophilus (Baker, 1983) et de Bombyx mori
(Kanekatsu, 1978). Il protège les amylases de
Tenebrio molitor (Buonocore et al., 1976) et
de Rhynchosciaria americana (Terra et al.,
1977) contre l'inactivation thermique au cours de la dialyse contre le
tampon. La plupart des amylases des insectes sont des enzymes calcium
dépendantes (Thomas et al., 1971). La
présence de chlorure et de certains anions dans le milieu
réactionnel des amylases d'insectes entraîne un changement de pH
optimum d'hydrolyse et des paramètres cinétiques de ces enzymes.
Les premiers constats ont été faits chez les amylases des
Hemiptera (Hori, 1972). Les ions chlorures augmentent
34 fois la vitesse maximale de la réaction mais n'affectent pas la
constante de Michaelis-Menten de l'amylase de Rhynchosciaria
americana. Ils entraînent un changement de pH optimum d'hydrolyse de
cette enzyme passant de 6,8 à 8,0. Ce biocatalyseur est aussi
activé par le bromure et le nitrate (Terra et al.,
1977). Ce comportement cinétique est en accord avec celui des
amylases des mammifères, ce qui suggère que ces enzymes ont des
mécanismes d'action similaires qui se traduiraient par la modification
de la conformation de l'enzyme suite au changement de l'état
d'ionisation des résidus d'acides aminés impliqués dans la
catalyse de ces enzymes. Ce changement induirait une augmentation des valeurs
de pKa des groupes protonés, entraînant ainsi un changement du pH
optimum d'hydrolyse de la réaction de l'enzyme et une augmentation de sa
vitesse maximale (Wakim et al., 1969 ; Levitzki et Steer,
1974). D'autres exemples d'activation d'amylases d'insecte par les
chlorures existent. C'est le cas des amylases de l'adulte de la larve de
Phoracantha semipunctata (Weber et al.,
1985) et de l'adulte de Drosophila melanogaster
(Doane, 1969).
3-1-2-alpha-Glucosidases
Les á-glucosidases (EC 3.2.1.20)
catalysent l'hydrolyse de la liaison glucosidique á
(1-4) contenue dans les arylglucosides, les disaccharides et les
oligosaccharides à partir de l'extrémité non
réductrice. Elles sont généralement appelées
maltases ou saccharases. En effet, une saccharase est une glycosidase qui
hydrolyse le saccharose en glucose et fructose. Elle peut être donc une
á-glucosidase ou une
â-fructosidase. Le terme « saccharase » ne
saurait désigner seulement l'á-glucosidase. Chez
les champignons, la â-fructosidase est
appelée invertase. Ce terme est de nos jours
utilisé pour désigner toutes les
f3-fructosidases animales, végétales et
microbiennes (Terra et Ferreira, 1994).
L'abeille adulte Apis mellifera contient dans son
extrait brut enzymatique deux aglucosidases de masse
moléculaires différentes (Huber et Mathison, 1976 ;
Huber, 1975) tout comme l'adulte de la drosophile Drosophila
melanogaster (Tanimura et al., 1979) et les
larves de Saptotrigona bipunctata (Schumaker et al.,
1993) et de Musca domestica (Terra et Jordão,
1989). Les masses moléculaires caractéristiques des deux
á-glucosidases sont de 82 kDa et de 100 kDa. Celle de masse
moléculaire de 82 kDa serait secrétée par les glandes
hypopharingeales. Elle est fortement inhibée par le Tris et se
retrouverait dans le miel (Huber et Mathison, 1976). Cette
enzyme, dans l'estomac, convertit le saccharose du nectar en glucose et
fructose (Barker et Lehner, 1972). Il s'agit d'une enzyme
glycosylée dont le rapport acide aminé sucre est de 14 %. Les
acides aminés constitutifs majeurs sont l'acide aspartique, le
tryptophane et l'acide glutamique. Elle possède une activité
transglucosidasique et une faible affinité pour le substrat
chromogénique
p-nitrophényl-a-D-glucopyranoside
(Huber et Mathison, 1976). C'est une enzyme
légèrement acide comme les a-glucosidases de
Musca domestica (Terra et Jordão, 1989). Quant
à l'a-glucosidase de masse moléculaire 100 kDa,
elle présente quelques caractéristiques identiques à
celles de masse moléculaire de 82 kDa. En effet, cette enzyme acide
possède aussi une activité transglucosidasique. Elle est
glycosylée et est inhibée par le Tris. Le rapport acide
aminé sucre est de 5,4 %. Les acides aminés majeurs sont l'acide
aspartique, l'alanine et la thréonine. Cette enzyme est localisée
dans la partie abdominale de l'insecte (Huber, 1975). Son
rôle physiologique est de dégrader les
a-glucosides contenus dans l'intestin moyen comme les
á-glucosidases de Drosophila melanogaster (Tanimura
et al., 1979) et de Taumetapoea pityocampa
(Pratviel-Sosa et al., 1987).
La membrane cellulaire de l'intestin moyen de l'insecte
Dysdercus peruvianus contient une a-glucosidase
glycosylée dont le pH optimum d'hydrolyse est de 5,0. L'enzyme
présente des masses moléculaires très différentes
selon les techniques de détermination. Les masses moléculaires
déterminées sont de 61 kDa en électrophorèse sur
gel de polyacrylamide en présence de SDS (conditions
dénaturantes), de 120 kDa en gel filtration, de 30 kDa en
ultracentrifugation et de 431 kDa en électrophorèse en conditions
natives. Ces résultats suggèrent que cette
a-glucosidase apparaît dimérique ou
octamérique selon son milieu (Silva et Terra, 1995).
Des comportements similaires ont été observés au niveau
des a-glucosidases des intestins moyens de Erinnyis
ello (Santos et Terra, 1986), de Pheropsophus
acquinoctialis (Ferreira et Terra, 1989) et de
Sitophilus zeamais (Baker, 1991). L'enzyme
50
est plus active sur le maltose que sur le saccharose. Elle
n'hydrolyse pas le tréhalose. Cependant, elle préfère les
maltodextrines de masses moléculaires inférieurs au
maltotétraose (Silva et Terra, 1995). Ce comportement
cinétique est contraire à ceux des
á-glucosidases des insectes Sitophilus
zeamais (Baker, 1991), Aedes aegypti
(Marinotti et James, 1990) et Thaumetopoea pityocampa
(Pratviel-Sosa et al., 1987). En effet, ces enzymes
hydrolysent efficacement les maltooligosaccharides de masses
moléculaires supérieurs à celui du maltopentose.
La larve de l'insecte Musca domestica contient trois
á-glucosidases dont deux sont solubles et une
liée à la membrane cellulaire de l'intestin moyen. Ces enzymes
ont des pH optima très proches (6,3 ; 6,1 ; 6,6) et sont fortement
inhibées par le Tris. Elles ont des masses moléculaires
très différentes. Ainsi, l'á-glucosidase
de masse moléculaire de 72,7 kDa et celle de la membrane cellulaire de
l'intestin moyen (240 kDa) hydrolysent de façon
préférentielle les maltooligosaccharides de masses
moléculaires supérieurs à celui du maltotétraose.
Cependant, celle de masse moléculaire de 330 kDa hydrolyse plus
efficacement le maltose et le maltotriose que les autres maltodextrines
(Terra et Jordão, 1989).
Les pH optima d'hydrolyse des
á-glucosidases des insectes se situent
généralement entre 5 et 6,5 à l'exception de celui de
Rhodnius prolixus qui est de 4,5 (Terra et al.,
1988).
3-2-Enzymes cellulolytiques
La sensibilité de la cellulose à l'hydrolyse
enzymatique dépend de trois caractéristiques qui dérivent
de l'état du substrat : le degré de polymérisation, le
degré de cristallinité et la surface spécifique accessible
aux enzymes (Sinitsyn et al., 1989). Chez les
insectes, le broyage effectué par les mandibules et la grande
alcalinité de l'intestin moyen de beaucoup d'espèces
entraînent la levée de ces obstacles de digestion de la cellulose
ingérée (Martin, 1991). La
caractérisation des enzymes assurant la digestion de la cellulose est
très complexe à cause de la diversité d'origine de celles
présentes dans l'intestin des insectes. En effet, les enzymes des tubes
digestifs ne sont pas toutes secrétées par les insectes
eux-mêmes. La plupart d'entre elles sont produites par des
microorganismes symbiotiques qui sont des protozoaires, des bactéries et
des champignons (Martin, 1983).
Malgré le caractère homogène de la
cellulose, plusieurs familles d'enzymes regroupées sous le terme de
cellulases, interviennent dans sa dégradation. Ces enzymes sont
secrétées sous la forme d'un complexe cellulasique qui renferme
trois principaux types d'activités
enzymatiques que l'on différencie selon leur mode d'action
et leur substrat préférentiel. Ce sont :
-l'endo-â-D-glucanase ;
-l'exo-â-D-glucanase ;
-la â-glucosidase (Martin, 1991).
3-2-1-Cellulases
Les cellulases sont les enzymes qui hydrolysent la cellulose.
Ce groupe de biocatalyseurs est constitué de l'endo-â-D-glucanase
(1,4-â-glucane-4-glucanohydrolase EC 3.2.1.4) et de
l'exo-â-D-glucanase
(1,4-â-glucane-4-cellobiohydrolase EC 3.2.1.91). Les
enzymes qui obéissent à un mécanisme endo sont celles qui
hydrolysent les liaisons glucosidiques internes d'une chaîne de
cellulose. Les liaisons internes étant plus accessibles dans les zones
amorphes que dans les zones cristallines, la réactivité de la
cellulose aux endoâ-D-glucanases évolue inversement à son
indice de cristallinité. Les enzymes qui agissent selon un
mécanisme exo sont celles qui attaquent la cellulose à partir de
son extrémité non réductrice (Martin,
1983).
Les glandes salivaires et l'intestin postérieur du
termite Macrotermes darwiniensis dégradent la
carboxyméthylcellulose et la cellulose cristalline. L'hydrolyse du
deuxième substrat cité produit des cellodextrines et du
cellobiose tandis que l'intestin postérieur libère du glucose, du
cellobiose et des cellodextrines (Veiver et al.,
1982). Les intestins postérieur, moyen et antérieur du
termite Nasutitermes exitiosus contiennent respectivement 19, 59 et 8
% d'activité cellulasique (O'brien et al.,
1979). Beaucoup de cellulases d'insecte ont été
purifiées et caractérisées. Le complexe cellulasique de la
larve de l'insecte Ergates faber est constitué de trois enzymes
nommées enzymes 1, 2 et 3. L'enzyme 1 a une masse moléculaire de
25 kDa et un pH optimum d'hydrolyse de 4,5. C'est une exo-â-D-glucanase.
Les enzymes 2 et 3 ont les mêmes pH optima d'hydrolyse tandis que les
masses moléculaires sont différentes (57 kDa et 70 kDa). L'enzyme
2 est une exo-â-D-glucanase tandis que l'enzyme 3 est capable
d'hydrolyser une variété de substrat dont le cellobiose, la
carboxyméthylcellulose et la cellulose microcristalline
(Chararas et al., 1983). Une exo-â-D-1,4-glucanase a
été purifiée à homogénéité
électrophorétique sur gel de polyacrylamide à partir du
champignon symbiotique du termite Macrotermes mulleri (Rouland
et al., 1988). Cette enzyme a une masse moléculaire de
52 kDa et un pH optimum d'hydrolyse de 4,5. Elle est très active sur
la
53
carboxyméthylcellulose et agit de façon synergique
avec d'autres enzymes pour dégrader totalement la cellulose en
glucose (Slaytor, 1992).
3-2-2-beta-Glucosidases
En se basant sur la spécificité de substrat, les
â-glucosidases des insectes peuvent être
subdivisées en trois classes : les classes 1, 2 et 3 (Terra et
Ferreira, 1994).
La classe 1 regroupe les
glycosyl-â-glycosidases et les
aryl-â-glycosidases. Ce sont des enzymes capables
d'hydrolyser aisément le cellobiose, le
p-nitrophényl-â-Dglucopyranoside, le
p-nitrophényl-â-D-galactopyranoside, le
p-nitrophényl-â-Dfucopyranoside et le
lactose (Terra et Ferreira, 1994). Les meilleures enzymes
décrites appartenant à la classe 1 sont les
â-glucosidases de Erinnyis ello (Santos
et Terra, 1985) et de Rhynchosciara americana
(Ferreira et Terra, 1983). La â-glucosidase de
l'intestin moyen de Erinnyis ello hydrolyse le
â-D-glucoside, le â-D-galactoside
et le â-D-fucoside avec le même site actif. Celle
de l'intestin moyen de l'insecte Rhynchosciara americana,
contrairement aux autres â-glucosidases de l'intestin
moyen des autres insectes, est intégrée dans la partie hydrophobe
de la membrane cellulaire (Ferreira et Terra, 1983). Les
propriétés cinétiques et le mécanisme
réactionnel de cette enzyme sont similaires à ceux de la
â-glucosidase de Erinnyis ello.
La classe 2 est composée uniquement des
glycosyl-â-glycosidases c'est-à-dire des enzymes
qui hydrolysent avec efficacité seulement le cellobiose et le lactose.
Les âglucosidases des insectes adultes Abracris
flavolineata (Marana et al., 1995) et
Sitophilus oryzae (Baker et Woo, 1992) appartiennent
à cette classe d'enzymes. Celle de Abracris flavolineata
possède une masse moléculaire de 82 kDa et un pH optimum
d'hydrolyse de 5,5 qui sont différents de ceux des
â-glucosidases de la classe 2 des insectes adultes de
Locusta migratoria et de Sitophilus oryzae. En effet, les
â-glucosidases de ces insectes ont un même pH
optimum d'hydrolyse (5,5). Les masses moléculaires sont respectivement
de 110 kDa et 170 kDa (Baker et Woo, 1992).
Les â-glucosidases de la classe 3 sont
celles qui sont capables de dégrader fortement le
p-nitrophényl-â-D-glucopyranoside et les
substrats similaires. La plupart de ces enzymes sont aussi actives sur le
p-nitrophényl-â-D-galactopyranoside. Ces
enzymes sont appelées alkyl ou
aryl-â-glycosidases. Les insectes Abracris
flavolineata (Marana et al., 1994),
Sitophilus oryzae (Baker et Woo, 1992),
Thaumetopoea pityoampa (Pratriel-Sosa et al.,
1987), Diatraea saccharalis et Calliphora
erythrocephala (Evans, 1956) en contiennent. Trois
â-
glycosidases appelées J3Gly1, J3Gly 2 et J3Gly 3 ont
été isolées de l'intestin moyen de l'insecte Diatraea
saccharalis. Ces trois enzymes ont à peu près les
mêmes masses moléculaires (58 ; 61 et 61 kDa), points
isoélectriques (7,5 ; 7,4 et 7,4) et pH optima d'hydrolyse (6,7 6,3 et
7,2). Ces enzymes sont plus spécifiques les J3-glucosides qu'aux
J3-galactosides et hydrolysent plus la liaison
â-(1-3)glucosidique que les liaisons J3-(1-4) et
J3-(1-6)glucosidiques. Le rôle physiologique des J3Gly1 et J3Gly 3 est
d'assurer la digestion des oligo et disaccharides provenant de la
dégradation des hémicelluloses tandis que celui de la J3Gly 2 est
de dégrader les glycolipides. Les glandes salivaires de l'ouvrier du
termite Macrotermes mulleri contiennent une J3-glucosidase acide de
masse moléculaire de 120 kDa. C'est une protéine
homodimérique (Rouland, 1986 ;
Rouland et al., 1988) qui est
différente de celles du termite Macrotermes subhyalinus qui ont
été largement étudiées par Kouamé
et al. (2005b). En effet, ces
J3-glycosidases n'hydrolysent pas les saccharides tels que le mélibiose,
le saccharose, le lactose, le xylobiose, le mélizitose, le stachyose, le
raffinose, la laminarine, l'arabinogalactane, la carboxyméthylcellulose,
l'inuline, le lichenane et l'amidon. Cependant, elles dégradent
fortement le p-nitrophényl-J3-D-glucopyranoside, le
p-nitrophényl-J3-Dfucopyranoside, le cellobiose et les
cellodextrines. Le rôle physiologique de ces deux enzymes est d'assurer
la digestion des oligo et disaccharides provenant de la dégradation des
hémicelluloses et des celluloses.
En se référant aux spécificités de
substrats, les enzymes des classes 1 et 2 hydrolysent avec efficacité le
cellobiose et d'autres disaccharides. Ce sont de "vrai"
â-glucosidases (E.C 3.2.1.21). Elles peuvent encore
être appelées cellobiases. Les cellobiases sont des enzymes qui
assurent la dégradation du cellobiose issu de la dégradation de
la cellulose chez quelques insectes ayant une cellulase. Chez les insectes, la
cellobiase est probablement aussi l'enzyme responsable de la finition de la
dégradation de l'hémicellulose ou de la partie glucidique des
glycoprotéines. Cette assertion est beaucoup plus soutenue par le fait
que les enzymes de la classe 3 libèrent préférentiellement
les monosaccharides liés à l'aglycone hydrophobique. Il est donc
possible que leur substrat naturel soit les glycolipides tels que les
glycosylcéramides. Les â-glucosidases de la
classe 3 des insectes sont donc des glycosylcéramidases (EC 3.2.1.62)
encore appelées phlozine hydrolases (Leese et Semenza,
1973). Des âglucosidases d'insectes de la
classe 1 ayant les mêmes caractéristiques cinétiques que
celles des classes 2 et 3 ont été observées chez les
insectes Abracris flavolineata (Marana et al., 1995)
et Sitophilus oryzae (Baker et Woo,
1992).
3-3-Enzymes hémicellulolytiques
Les hémicellulases sont les enzymes qui
dégradent les polysaccharides du groupe des hemicelluloses
(Dekker et Richards, 1976). Celles des insectes n'ont pas
été beaucoup étudiées malgré la
présence des hémicelluloses dans les aliments de ceux-ci
(Terra et al. 1987).
3-3-1-Xylanases, laminarinases et lichenases
Dans le tube digestif de l'ouvrier du termite Macrotermes
subhyalinus, il existe trois xylanases qui ont des masses
moléculaires très voisines compris entre 60 et 66 kDa. Elles ont
une activité hydrolytique maximale dans le tampon acétate aux pH
compris entre 4,6-5,0 et aux températures se situant entre 55-66
°C. Ces enzymes sont dépourvues d'activité cellulasique et
hydrolysent seulement le xylane non méthylé. Ce sont des
endo-â-1,4-Dxylanases strictes (Faulet, 2006).
Deux laminarinases sont sécrétées par
l'intestin moyen de la larve de Rhagium inquisitor. Seule la
laminarinase 1 a été purifiée et
caractérisée. Cette enzyme a une masse moléculaire compris
entre 95-100 kDa et un pH optimum d'hydrolyse de 5,5. Il s'agit d'une endo-
â-1,3-glucanase. L'enzyme est inactive sur le lichenane.
L'activité lichenasique (endoâ-1,3;1,4-glucanase EC 3.2.1.73) a
été mise en évidence chez Rhagium inquisitor
(Chipoulet et Chararas, 1985).
3-3-2-beta-Galactosidases
Les â-galactosidases des insectes possèdent
généralement une activité â-
glucosidasique qui les distingue des â-glucosidases et
des glycosylcéramidases (Santos et Terra, 1985). Ces
â-galactosidases ont été déjà mises en
évidence dans les intestins moyens des adultes de Locusta
migratoria, Abracris flavolineata et la larve de Tenebrio
molitor (Patchett et al., 1987). Celles de
Locusta migratoria et de Abracris flavolineata ont
respectivement des pH optima d'hydrolyse de 5,5 et de 4,5. Les masses
moléculaires sont de 65 kDa et de 72 kDa. Ces enzymes hydrolysent
fortement le p-nitrophényl- â-D-galactoside et sont
pratiquement inactives sur le lactose et les â-glucosides. Les substrats
naturels de ces âgalactosidases sont des galactolipides (Harwood,
1980).
3-3-3-beta-Xylosidases
Très peu de travaux ont été
effectués sur les â-xylosidases d'insecte. Kouamé
(2006) a montré que l'ouvrier du termite Macrotermes
subhyalinus possède dans son tube digestif, une â-xylosidase
hétérodimérique, acide et thermophile très
spécifique du résidu xylosyle. Cette enzyme est différente
de celle de son champignon symbiotique Termitomyces sp. La
âxylosidase de l'ouvrier du termite Macrotermes subhyalinus
serait donc secrétée soit par le termite lui même soit par
ses bactéries symbiotiques.
3-4-beta-Fructosidases
Les â-fructosidases ont été
caractérisées à cause de leur action hydrolytique sur le
saccharose et le raffinose. Dans les intestins moyens des insectes, la
dégradation du saccharose est plus l'oeuvre des á-glucosidases
que des â-fructosidases. Les biocatalyseurs tels que les
â- fructosidases sont donc rares dans les tubes
digestifs des insectes. Quelques unes ont été mises en
évidence. Il s'agit des â-fructosidases de la mouche
(Evans, 1956), de la blatte (Bank, 1963), de
l'abeille (Chinnery, 1971) et du papillon (Burton
et al., 1977). La mieux caractérisée d'entre
elles est celle de l'insecte Erinnyis ello. En effet, l'intestin moyen
de cet insecte (quel que soit le niveau d'évolution) contient une
â-fructosidase dont le pH optimum d'hydrolyse et la masse
moléculaire sont respectivement de 6,0 et de 78 kDa. Son rôle
physiologique dans le tube digestif du lépidoptère est d'achever
la dégradation du saccharose contenu dans les feuilles (pour la larve)
ou dans le nectar (pour l'adulte) dont l'hydrolyse a été
entamée par l'á-glucosidase du même milieu (Terra
et al., 1987).
4-Applications industrielles de quelques glycosidases
4-1-beta-Galactosidase
4-1-1-Applications médicales
Dans le cas des intolérances aux disaccharides,
l'hydrolyse du lactose est réalisée à l'aide de
â-D-galactosidases ingérées et produites
à l'échelle industrielle
(â-D-galactosidases de Escherichia, de
Aspergillus, etc.). Pour les autres déficiences impliquant les
activités de
type â-D-galactosidasique, il existe
quelques modèles d'animaux représentatifs de ces maladies. Dans
le cas de la galactosialidose, Zhou et al. (1995) ont
montré l'existence d'un modèle de souris. Pour la maladie de
Krabbe, Duchen et al. (1980), ont décrit une
leucodystrophie autosomale récessive chez la souris « Twitcher
». Cette souris est un modèle enzymatique pour la leucodystrophie
des cellules globoïdes humaines (Kobayashi et al., 1980)
comme le sont les maladies autosomales récessives chez le
mouton. D'autre part, le chien (West Highland White terrier et le Cairn
terrier) présente une forme naturelle de la maladie de Krabbe
(Wenger et al., 1999). Ainsi, des tentatives de
thérapies ont été faites à l'aide de ces
modèles. O'brien et al. (1990) ont
réalisé une transplantation de moelle épinière
allogénique tôt dans la vie d'un chien atteint par une
Gm1-gangliosidose. Malgré le succès de la greffe, aucun
résultat positif n'a été observé.
Hoogerbrugge et al. (1988) ont réalisé
une transplantation de moelle épinière chez la souris «
Twicher ». Bien qu'ils aient observé une augmentation de
l'activité galactosylcéramidase, une augmentation de
l'activité galactosylcéramidasique dans le système nerveux
central et une augmentation de la durée de vie de 30 à 40 jours
voire plus de 100 jours dans quelques cas, les résultats semblent peu
convaincants. Krivit et al. (1998) ont
rapporté leur expérience en utilisant la transplantation de
lignées cellulaires allogéniques dans le traitement de la maladie
de Krabbe. Les atteintes du système nerveux central ont
pu être éliminées. Ainsi, malgré quelques
réussites partielles aucune thérapie n'est actuellement possible.
L'utilité de ces modèles reste évidente et
renforcée avec la découverte d'une mutation induisant la
leucodystrophie des cellules globoïdes chez le macaque (Luzi
et al., 1997). L'existence de différences dans le
développement du cerveau et des voies métaboliques entre les
espèces rendent cependant plus difficiles les possibilités de
traitement puisque le but ultime est une application sur les patients humains.
Après tout, la « souris » n'est pas l'Homme (Suzuki et
Mansson, 1998). Des diagnostiques in vitro
sont proposés lorsque l'existence de la mutation est connue au sein
de la famille ; l'avortement du foetus peut être
envisagé, ces maladies lysosomales étant
généralement mortelles.
4-1-2-Applications pharmaceutiques
Ajisaka et al. (1987) ont
synthétisé à partir du D-fructose à l'aide de la
â-Dgalactosidase de Escherichia coli,
l'allolactose et le lactulose. Le lactulose est un disaccharide
utilisé dans le traitement d'encéphalopathies, la constipation et
les salmonelloses. Toujours dans le cas d'application pharmaceutique, les
alcaloïdes d'ergots sont galactosylés à l'aide de
â-D-galactosidase avec des rendements de 40 %
(Kren et al.,
1992). La galactosylation du D-xylose par une
â-D-galactosidase donne un mélange de
disaccharides (â(1?4),
â(1?3),
â(1?2)-galactosyl-xylose) avec un
rendement de 50 % (Aragon et al., 1996). Ces produits
peuvent être utilisés pour l'évaluation de
l'activité de la lactase intestinale in vivo, ce qui donne lieu
à une nouvelle méthode de diagnostic de déficience en
lactase. De plus, il est remarquable de noter que ce procédé
enzymatique est moins cher et moins risqué qu'une synthèse
chimique de galacto-oligoccharides impliquant sept étapes
réactionnelles (Rivera-Sagredo et al.,
1992).
4-1-3-Applications nutritionnelles
Les oligosaccharides à usage nutritionnel connaissent
un développement important en raison de leurs aptitudes à
favoriser la croissance de la flore bactérienne intestinale humaine ou
animale. Au Japon, les galactooligosides sont utilisés dans la
formulation de nombreux produits alimentaires (confiserie, gommes, boissons).
Ces oligosides sont obtenus soit par extraction de sources
végétales, soit par hydrolyse de polyosides, soit par
synthèse enzymatique. On peut aussi produire des galactooligosaccharides
à partir du lactose qui joue le rôle de donneur et d'accepteur de
résidu â-D-galactosyle. Ainsi, Burvall
et al. (1980) ontils synthétisé, à
l'aide de la lactase de Saccharomyces lactif, le
â-D-galactosyl(1-6) lactose, galactooligoside stimulant
la croissance des bifidobactéries.
4-1-4-Applications en industrie agroalimentaire
La â-D-galactosidase peut
nécessiter des purifications poussées et coûteuses mais
elle présente l'avantage de réaliser des réactions
spécifiques qui ne nécessitent pas l'utilisation de co-solvants
organiques moins bien tolérés par les appareillages industriels.
Les sources de âD-galactosidases utilisées en
agroalimentaires sont très variées et incluent les plantes comme
l'amande, la pêche, l'abricot, les champignons comme Aspergillus
niger (Greenberg et Mahoney, 1981) les levures comme
Saccharomyces lactis, les bactéries comme Escherichia
coli et les organes d'animaux comme l'intestin et les tissus de
peau (Cheetham, 1995 ; Law et Goodenough, 1995). Parmi les
lactases, celles d'origine bactérienne ont donné lieu à
des applications brevetées et notamment les enzymes extraites des
microorganismes thermostables comme Streptomyces coelicolor
(Collinge et al., 1974), Bacillus
stearothermophilus (Fabricius, 1980), Bacillus
circulans (Iiada et al., 1980)
et plus
récemment avec Pyrococcus furiosus
(Shimada et al., 1994). Chez les levures, la
â-Dgalactosidase de Saccharomyces fragilis est
la mieux caractérisée. Elle se développe bien sur le petit
lait issu de la fabrication des fromages (Young et Healey,
1957).
4-2-Enzymes amylolytiques
4-2-1-Production de sirop de glucose et de
fructose
Le terme de saccharification s'applique à
l'opération d'hydrolyse permettant de transformer les maltodextrines en
glucose et en petits oligosaccharides du type maltose et maltotriose par les
enzymes amylolytiques. Selon le degré final d'hydrolyse, la
dextrinisation conduit à des sirops de glucose et/ou de fructose
(Buléon et al., 1990).
Les propriétés résultant de la structure
d'oligomère de glucose (1 à 3 unités de glucose), telles
que le pouvoir sucrant, le caractère plastifiant, le rôle de
régulateur de pression osmotique et la fermentescibilité sont
utilisées dans la conception de divers aliments (confiserie,
pâtisserie, biscuiterie) et dans les industries de fermentation
(brasserie, antibiotique) (Buléon et al.,
1990). Ces mêmes propriétés interviennent dans
l'industrie pharmaceutique comme excipient stabilisant ou précurseur de
réactions chimiques et enzymatiques (vitamine C, D-mannitol
hexanitrate). Elles interviennent aussi dans les industries pharmaceutiques et
en cosmétologie en tant qu'émolliant, émulsifiant ou
rétenteur d'eau. Le sorbitol est utilisé comme produit de base
des pâtes et gels dentifrices. Il est aussi utilisé dans les
industries chimiques comme plastifiant ou comme réactif polyalcool
hexafonctionnel pour les réactions d'estérification (polyesters,
esters d'acide gras) (Buléon et al., 1990).
4-2-2-Amélioration de la solubilité de
l'amidon
La liquéfaction de l'amidon par les amylases conduit
principalement aux maltodextrines qui correspondent à des
oligosaccharides linéaires ou ramifiés de 5 à 10
unités glucose. Cette étape de dextrinisation vise principalement
à améliorer le facteur solubilité des molécules
natives d'amylose et d'amylopectine et à augmenter la solubilité
des solutions obtenues aux températures modérées (60
°C) (Buléon et al., 1990). Ainsi,
l'introduction d'enzymes amylolytiques dans les bouillies infantiles permet non
seulement d'augmenter leurs densités énergétiques mais
aussi de diminuer leurs viscosités (Bruyeron et al.,
2006).
4-3-Enzymes cellulolytiques et
hémicellulolytiques
Les applications industrielles des enzymes cellulolytiques et
hémicellulolytiques sont multiples. Le complexe xylanolytique est
utilisé dans les phénomènes de bioblanchiment de
pâtes à papier, de biomécanique de pulpage et de
biomodification des fibres. En effet, dans l'industrie papetière, la
dégradation du xylane contenu dans les pâtes à papier par
un complexe xylanolytique permet de libérer non seulement le xylose et
les xylodextrines mais aussi le tanin et la lignine responsables de la
coloration sombre du papier. Ce traitement enzymatique permet de blanchir les
pâtes à papier et de réduire la consommation (Beq
et al., 2001 ; Viikari et al., 1994)
d'organochlorés dont le déversement dans la nature entraîne
la pollution de l'environnement (Shoham et al. 1992 ;
Sa-Pereira et al., 2003). Ces enzymes facilitent le processus
de pulpage et permettent de réduire l'emploi de méthodes
mécaniques de pulpage et par conséquent la consommation
d'énergie (Bhat, 2000). Elles améliorent les
propriétés de fibrillation et de drainage des pâtes, par
conséquent l'amélioration de l'efficacité du traitement et
de la rigidité du papier (Bhat, 2000). Dans l'industrie
du textile, des tiges séchées de ramie (herbe ou gazon de Chine)
sont incubées avec le complexe xylanolytique pour favoriser la
libération de longues chaînes de fibre de cellulose. La xylanase
du complexe xylanolytique utilisée en industrie papetière et
textile doit être dépourvue de toute activité cellulasique
afin d'éviter la dégradation de la cellulose (Csiszar
et al., 2001 ; Bruhlmann et al., 2000). Elles
réduisent ou remplacent les méthodes chimiques de rouissage du
lin, du jute, du chanvre, etc. (Beq et al., 2001 ; Prade,
1995). En boulangerie et biscuiterie, la xylanase est utilisée
pour améliorer les propriétés technologiques des
pâtes de farines telles que la capacité de rétention de
l'eau, l'élasticité et la consistance tout en permettant une
meilleure panification et une amélioration de la texture, la structure
et la couleur de la mie (Bhat, 2000 ; Maat et al.,
1992). Les enzymes cellulolytiques et hémicellulolytiques sont
employées en industrie des boissons (jus de fruits, nectars et
purées, et vins) pour améliorer la macération, la
clarification des jus, le rendement d'extraction, la filtration, la performance
du processus et la qualité du production. Pour la production du jus de
fruit, elles permettent de réduire la viscosité, le maintien en
suspension des pulpes et la dissolution des précipités. En
vinification, elles interviennent aussi pour accélérer le jutage
(Larreta-Garde, 1997 ; Subramaniyan et Pema, 2002). Ces
enzymes en association avec des protéases et d'autres enzymes, sont
utilisées pour produire des suppléments diététiques
ou pour améliorer la digestibilité (Polizeli et
al., 2005). En effet, la dégradation enzymatique du xylane
par le complexe
xylanolytique entraîne la libération du xylose.
Le xylose est converti par hydrogénation catalytique en xylitol dont les
applications sont nombreuses en diététique grâce à
ses propriétés humectantes, édulcorantes et à son
effet « rafraîchissant » (Parajo et al.,
1998). Il est recommandé médicalement pour
prévenir l'ostéoporose, certaines infections respiratoires, le
désordre métabolique des lipides, les lésions
rénales et parentérales (Larreta-Garde, 1997).
Les enzymes cellulolytiques et hémicellulolytiques sont utilisées
dans le traitement et le recyclage des déchets agricoles, dans la
production des substances fermentescibles et de combustibles renouvelables
(bioéthanol) (Mielenz, 2001 ; Saha, 2003). En effet,
ces enzymes vont hydrolyser la cellulose et les hémicelluloses pour
donner des sucres fermentescibles. Ces derniers, par bioconversion, vont
être transformés en carburant ou comestibles.
Dans la nutrition animale (aliments pour monogastrique et
ruminant), ces biocatalyseurs permettent de diminuer la quantité de
polysaccharides non amylolytiques réduisant ainsi la viscosité
intestinale et entraînant l'amélioration de l'utilisation des
protéines et de l'amidon. Elles améliorent la performance de
l'animal, augmente la digestibilité et la valeur nutritive d'aliments
faiblement dégradables tels que l'orge et le blé
(Mathlouthi et al., 2002, 2003).
Chapitre 2
MATERIEL ET METHODES
I- Matériel
1-Provenance des produits chimiques
Les substrats [amidon soluble, oligosaccharides contenant le
résidu galactosyle, pNPglycoside,
pNP-â-N-acétyl-glucosaminide,
pNP-â-N-acétyl-galactosaminide,
carboxyméthylcellulose, maltodextrines, cellodextrines, saccharose,
gentiobiose, sophorose, laminaribiose, cellobiose, tréhalose,
nigérose, kojibiose, lactose, stachyose, mélibiose,
mélizitose, cellulose microcristalline, cellulose triacétate
microcristalline, pullulane, arabinogalactane, inuline] et les monosacharides
[glucose et xylose] sont des produits chimiques provenant de Sigma Chemical
Company (St. Louis, MO, USA).
Les produits de chromatographie [DEAE-Sepharose CL-6B,
phényl-éthyl-â-Dgalactoside et Sephacryl
S-100 HR] sont des produits chimiques provenant de PHARMACIALKB Biotech
(Uppsala, Sweden).
Les produits pour l'électrophorèse [acrylamide,
N,N'-méthylène-bis acrylamide, Tris, dodécyl sulfate de
sodium, N,N,N',N'tétraméthyléthylènediamine
(T.E.M.E.D), âmercaptoéthanol, glycérol,
bromophénol, glycine, bleu de Coomassie R-250 et persulfate d'ammonium]
ont été fourmis par BIO-RAD (Milan, Italy).
2-Origine du matériel biologique
Les larves de Rhynchophorus palmarum (Curculionidae)
du palmier Elaeis guineensis ont été
récoltées des palmiers déterrés ou abattus en voie
de putréfaction du Campus de l'Université d'Abobo-Adjamé
(Abidjan, Côte d'Ivoire).
II- Méthodes
1-Préparation de l'extrait brut
enzymatique
La larve de Rhynchophorus palmarum (Curculionidae) a
été rincée à l'eau distillée et
essorée sur du papier filtre. Le tube digestif a été
isolé du reste du corps dans une solution de chlorure de potassium (0,9
%, m/v) à l'aide d'une pince puis vidé de son contenu. Le suc
digestif ainsi obtenu a été dilué (1/1 ; v/v) dans une
solution de chlorure de potassium (0,9 %, m/v), puis centrifugé à
6000 trs/min pendant 30 min à 4 °C, à l'aide d'une
centrifugeuse réfrigérée (UNICEN ALRESA).
Le surnageant obtenu a été dilué (1/1 ; v/v) dans le
tampon acétate 100 mM pH 5,6 et recentrifugé dans les mêmes
conditions à 10000 trs/min. Le nouveau surnageant recueilli a
constitué l'extrait brut enzymatique issu du suc digestif.
Le tube digestif, vidé de son contenu, a
été abondamment lavé respectivement dans de l'eau
distillée et dans une solution de chlorure de potassium (0,9 %, m/v).
Ensuite, il a été placé dans un récipient
disposé dans un bac à glace tout comme les glandes salivaires qui
ont soigneusement été isolées des têtes des larves.
Ces différents tissus ont été ensuite broyés
séparément dans une solution de chlorure de potassium (0,9 %,
m/v) à l'aide d'un microbroyeur Ultra-turax (type T 25). Les broyats
totaux ont été centrifugés à 10000 trs/min pendant
30 min à 4 °C, à l'aide d'une centrifugeuse
réfrigérée (UNICEN ALRESA). Les
surnageants obtenus ont été dilués (1/1 ; v/v) dans le
tampon acétate 100 mM pH 5,6 et ont constitué les extraits bruts
enzymatiques issus des tissus du tube digestif et des glandes salivaires de la
larve de Rhynchophorus palmarum (Curculionidae).
2- Techniques de dosage
2-1- Dosage de l'activité
polysaccharidasique
L'hydrolyse enzymatique des polysaccharides libère des
sucres réducteurs qui peuvent être dosés selon la
méthode de Bernfeld (1955) utilisant l'acide
3,5-dinitro-salycilique (DNS).
2-1-1- Préparation de la solution de DNS
Deux (2) g de DNS et 3,2 g de soude ont été
dissous dans 70 ml d'eau distillée. Ensuite, 60 g de tartrate double de
sodium-potassium ont été progressivement ajoutés à
ce mélange sous chauffage et agitation. Le volume de ce mélange a
été complété à 100 ml avec de l'eau
distillée.
2-1-2- Technique de dosage
Dans les conditions standard, l'activité
polysaccharidasique a été mesurée dans 0,8 ml de tampon
acétate de sodium 100 mM pH 5,0 ou pH 5,6 contenant 1 % (m/v) de
polysaccharide et 100 ul de solution enzymatique.
Le milieu réactionnel a été incubé
à 37 °C pendant 30 min dans un bain-marie. Ensuite, 500 ul de
solution de DNS y ont été ajoutés. Le mélange a
été homogénéisé et chauffé au
bain-marie bouillant pendant 5 min. La densité optique a
été mesurée au spectrophotomètre à 540 nm
contre un témoin contenant les réactifs à l'exception de
la solution enzymatique. La quantité de sucres réducteurs
libérés a été déterminée à
l'aide d'une courbe d'étalonnage réalisée dans les
conditions expérimentales. L'activité enzymatique se
définit comme étant la quantité d'enzyme catalysant
l'hydrolyse d'une micromole de substrat par min dans les conditions standards.
L'activité spécifique a été exprimée en
unité enzymatique par mg de protéine (UE/mg).
2-2- Dosage de l'activité oligosaccharidasique
Certains oligosaccharides sous l'action des enzymes
fournissent du glucose. La quantité de glucose libéré peut
être dosée selon la méthode de Kunst et
al. (1984) utilisant le réactif glucose
oxydase-péroxydase.
2-2-1- Préparation du réactif glucose
oxydase-péroxydase
Ce réactif a été constitué d'un
mélange de deux solutions A et B préparées
extemporanément. La solution A a été obtenue par
dissolution de 0,6 mg de glucose oxydase et 0,24 mg de péroxydase dans
60 ml de tampon phosphate 100 mM pH 7,0. La solution B a
été constituée d'o-dianisidine (6,6
mg/ml) préparée dans 0,6 ml de tampon phosphate 100 mM pH 7,0.
2-2-2- Technique de dosage
Pour le dosage de l'activité oligosaccharidasique,
l'essai standard contient 10 mM d'oligosaccharide et 50 ul de solution
enzymatique dans un volume final de 250 ul de tampon acétate 100 mM pH
5,0 ou pH 5,6. Le mélange réactionnel a été
incubé pendant 10 min à 37 °C. La réaction
enzymatique est arrêtée par chauffage du milieu réactionnel
pendant 5 min au bain marie bouillant. Trois (3 ml) du réactif glucose
oxydase-péroxydase ont été ajoutés au milieu
réactionnel pour doser la quantité de glucose
libéré. Le nouveau mélange, bien
homogénéisé, a été placé à
l'obscurité (à la température ambiante) pendant 30 min.
L'intensité de la coloration a été mesurée au
spectrophotomètre à 436 nm contre un témoin ne contenant
pas d'enzyme. Une courbe d'étalonnage obtenue dans les mêmes
conditions a permis de convertir les densités optiques en micromoles de
glucose.
Pour déterminer la quantité de xylose
libérée dans le milieu réactionnel, la méthode
chromatographique a été utilisée.
L'activité enzymatique se définit comme
étant la quantité d'enzyme catalysant l'hydrolyse d'une micromole
de substrat par min dans les conditions standards. L'activité
spécifique a été exprimée en unité
enzymatique par mg de protéine (UE/mg).
2-3- Dosage de l'activité pNP-glycosidasique
Dans les conditions standard, l'activité
pNP-glycosidasique a été mesurée dans 275 ul de
tampon acétate 100 mM pH 5,6 ou pH 5,0 contenant 1,25 mM de
pNP-glycoside et 50 ul de solution enzymatique. Le mélange
réactionnel a été incubé dans un bain marie
à 37 °C pendant 10 min. La réaction a été
arrêtée par alcalinisation du milieu réactionnel avec 3 ml
de carbonate de sodium 1 M. La quantité de
p-nitrophénolate libéré a été
mesurée au spectrophotomètre à 410 nm avec pour
témoin une solution ne contenant pas d'enzyme. L'activité
enzymatique a été exprimée en micromole de
p-nitrophénolate libéré par min.
L'activité spécifique est exprimée en unité
enzymatique par mg de protéine (UE/mg).
2-4- Dosage des protéines
Deux méthodes ont été utilisées pour
déterminer les teneurs en protéine. Il s'agit de celles
décrites par Lowry et al. (1951) et
Bradford (1976).
2-4-1- Méthode de Lowry et al.
(1951)
Les teneurs en protéine des solutions enzymatiques ont
été dosées selon la méthode de Lowry et
al. (1951). Les protéines réagissent avec le
réactif de Folin-Ciocalteus (un mélange de tungstate et de
molybdate de sodium en solution dans l'acide phosphorique et l'acide
chlorhydrique) pour donner des complexes colorés. La couleur ainsi
formée est due à la réaction du phosphomolybdate par la
tyrosine et le tryptophane. L'intensité de la coloration dépend
donc de la quantité d'acides aminés aromatiques présents
et varie selon les protéines. Les densités optiques sont
mesurées à 600 nm avec pour témoin une solution contenant
tous les réactifs exceptées les protéines. Cette
méthode permet de doser des concentrations de protéine qui
varient de 5 à 100 ug.ml-1 (Pelmont,
1995).
2-4-1-1- Réactif utilisés
Solution A : réactif de Folin-Ciocalteus dilué de
moitié dans la soude 0,1N ;
Solution B : carbonate de sodium (2 %, m/v) préparé
dans la soude 0,1N ;
Solution C1 : sulfate de cuivre (0,5 % , m/v)
préparé dans de l'eau distillée ;
Solution C2 : tartrate double de sodium et de potassium (1% ,
m/v) préparé dans de l'eau distillée ;
Solution D : préparée extemporanément
à partir de 100 ul de solution C1, 100 ul de solution C2 et 10 ml de
solution B.
2-4-1-2- Technique de dosage
Deux cent (200) ul de préparation protéique ont
été dilués dans 2 ml de solution D. Ensuite, 200 ul de
solution A ont été ajoutés à ce mélange. Le
milieu réactionnel a été agité et laissé
reposer pendant 30 min à l'obscurité pour permettre le
développement de la coloration. La densité optique de l'essai a
été mesurée à 600 nm avec pour témoin une
solution ne contenant pas de solution protéique. La densité
optique obtenue a été ensuite convertie en mg
426
de protéine grâce à une droite
d'étalonnage préparée dans les mêmes conditions. Le
sérum albumine bovine a été utilisé comme
protéine de référence.
2-4-2- Méthode de Bradford (1976)
La technique de Bradford (1976) a
été utilisée pour doser les faibles quantités de
protéine dans la solution enzymatique. Elle utilise du bleu de Coomassie
G250 dont la forme leuco (brun orange) est convertie en forme bleue
caractéristique du complexe formé entre les groupements
NH3+ des protéines et ce réactif. Elle permet de doser
des quantités de protéine de l'ordre du microgramme.
2-4-2-1- Réactif utilisés
Le réactif de Bradford est un mélange
homogène de bleu de Coomassie G 250 (0,060 g), d'acide perchlorique (3
g), de chlorure de sodium (2,92 g), et d'eau distillée psp (100 ml).
2-4-2-2- Technique de dosage
L'extrait protéique contenant une quantité de
protéine comprise entre 2 à 25 ug a été
dilué dans le réactif de Bradford selon le
rapport (1:1, v/v). Après le mélange, l'intensité de la
coloration a été déterminée au
spectrophotomètre à 595 nm avec pour témoin une solution
contenant tous les réactifs excepté l'extrait protéique.
La droite d'étalonnage obtenue dans les mêmes conditions a permis
de convertir la densité optique en quantité de protéine.
Le sérum albumine bovine a été utilisé comme
protéine de référence.
2-5- Purification des enzymes
Trois enzymes ont été purifiées. Ce sont
: l'á-glucosidase, la
â-glucosidase et la
âgalactosidase de la larve de charançon
Rhynchophorus palmarum (Curculionidae) du palmier Elaeis
guinensis. Dans chacun des cas, la purification a été faite
en trois étapes chromatographiques comportant une chromatographie
échangeuse d'anion, un fractionnement sur gel d'exclusion
moléculaire et une chromatographie d'interaction hydrophobe.
2-5-1- Chromatographie d'échange d'anion sur
D.E.A.E Sepharose CL-6B
Le gel DEAE (diéthylaminoéthyle) Sepharose CL-6B
est un échangeur anionique. Il a été coulé dans une
colonne en verre (2,4 x 6,5 cm) et équilibré dans un tampon
acétate 100 mM pH 5,6. Le débit chromatographique a
été de 14 ml/h et maintenu constant par l'intermédiaire
d'une pompe péristaltique de type GILSON. Le gel est lavé avec
120 ml du même tampon. Les protéines retenues par le gel ont
été décrochées par un gradient en palier croissant
de KCl préparé dans le tampon acétate de sodium 100 mM pH
5,6. Des fractions de 4 ml sont collectées et les plus actives ont
ensuite été « poolées » pour la suite de la
purification.
2-5-2- Fractionnement au sulfate d'ammonium
A l'extrait enzymatique obtenu après chromatographie
sur DEAE Sepharose CL-6B, une quantité correspondante de sulfate
d'ammonium a été lentement ajoutée selon la méthode
de Dawson et al. (1969) sous agitation
mécanique à 4 °C de sorte à obtenir une saturation
à 80 %. Après 12 h de précipitation des protéines,
ce mélange a été centrifugé à 6000 trs/min
pendant 30 min à 4 °C dans une centrifugeuse
réfrigérée (UNICEN ALRESA). Le culot
obtenu a été resuspendu dans 1 ml de tampon acétate 100 mM
pH 5,6 ou pH 5,0.
2-5-3-Chromatographie d'exclusion moléculaire sur
gel de Sephacryl S-100 HR
Cette chromatographie permet la séparation des
molécules en fonction de leur poids moléculaire et de leur volume
hydrodynamique. Le gel Sephacryl S-100-HR permet de séparer les
macromolécules globulaires ayant des poids moléculaires compris
entre 10 et 100 kDa. Il a été coulé dans une colonne en
verre (1,6 x 64 cm) et ensuite équilibré avec du tampon
acétate 100 mM pH 5,6 ou pH 5,0. Les protéines ont
été éluées avec ce même tampon après
le dépôt de l'extrait brut enzymatique (1 ml) issu de la
précipitation au sulfate d'ammonium à 80 % de saturation. Le
débit de la chromatographie a été de 15 ml/h et maintenu
constant grâce à une pompe péristaltique de marque GILSON.
Des fractions de 1 ml ont été collectées et les plus
actives « poolées » pour la suite de la purification.
69
2-5-4-Chromatographie d'interaction hydrophobe sur gel de
Phényl-Sepharose CL-4B
La chromatographie d'interaction hydrophobe permet de
séparer les molécules en fonction de leur hydrophobie et de leur
caractère amphiphile. La colonne a un diamètre de 1,4 cm pour une
hauteur de 5 cm. Le débit d'élution de 14 ml/h a
été fixé par l'intermédiaire d'une pompe
péristaltique de marque GILSON. Des fractions de 1 ml ont
été recueillies. La solution enzymatique, saturée avec du
thiosulfate de sodium (1,7 M), a été déposée sur la
colonne Phényl-Sepharose CL 4B préalablement
équilibrée avec du tampon acétate 100 mM pH 5,6 ou pH 5,0
contenant du thiosulfate de sodium 1,7 M. Après avoir lavé 3 fois
la colonne avec ce même tampon, les protéines retenues ont
été éluées par application d'un gradient en palier
décroissant de thiosulfate de sodium (1,7 ; 1 ; 0,5 ; 0,3 ; 0,2 ; 0,1 ;
0 M ) préparé dans le tampon acétate 100 mM au pH optimum
correspondant à chaque activité glycosidasique (pH 5,6 pour les
activités á-glucosidasiques et
â-galactosidasique et pH 5,0 pour l'activité
â-glucosidasique). Dans chaque cas, les fractions les
plus actives ont été « poolées». Les solutions
obtenues contenant les enzymes purifiées à
homogénéité électrophorétique ont
été dialysées contre le tampon acétate 100 mM pH
5,6 ou pH 5,0 pendant plus de 12 h.
2-6-Détermination des propriétés
moléculaires
2-6-1- Détermination des masses
moléculaires par gel filtration
Pour la détermination des masses moléculaires
des glycosidases purifiées à homogénéité
électrophorétique, des protéines de
référence ont été utilisées. Ce sont : la
âamylase (MM= 200 kDa), le sérum albumine bovine (MM= 66 kDa),
l'ovalbumine (MM= 45 kDa) et le cytochrome C (MM= 12,4 kDa). Ces
protéines ont été chargées séparément
sur la colonne TSK (7,8 mm × 15 cm). La phase mobile utilisée a
été le tampon acétate de sodium 100 mM contenant de
l'azide de sodium (0,5 % , m/v). Le débit de la chromatographie a
été de 30 ml/h. Il a été maintenu constant
grâce à une pompe péristaltique de marque GILSON. Des
fractions de 1 ml ont été collectées. Le temps
d'élution de chaque protéine a été inscrit sur le
chromatogramme. Connaissant les masses moléculaires des
différentes protéines de
référence et leur temps d'élution, la
courbe des masses moléculaires en fonction des temps d'élution a
pu être tracée. Cette courbe d'étalonnage a permis de
déterminer les masses moléculaires de
l'á-glucosidase, de la
â-glucosidase et de la
â-galactosidase de la larve du charançon
Rhynchophorus palmarum (Curculionidae) connaissant leurs temps
d'élution.
2-6-2- Détermination des masses moléculaires
par électrophorèse
sur gel de polyacrylamide en présence de
SDS
L'électrophorèse sur gel de polyacrylamide en
présence de dodécyle sulfate de sodium (SDS-PAGE) a
été réalisée selon la méthode de
Laemmli (1970). Les enzymes, dans un tampon Tris-HCl 125 mM pH
6,8 contenant du SDS (10 %, m/v), du â-mercaptoéthanol (1 %, v/v),
du glycérol (20 %, m/v) et du bleu de bromophénol (0,025 %, m/v),
ont été dénaturées par un traitement thermique
à l'eau bouillante (5 min). Dans ces conditions, les protéines se
dissocient en leurs sous-unités en fixant de grandes quantités de
détergent (environ 1,4 g de détergent par gramme de
protéine), ce qui masque complètement la charge naturelle de la
sous-unité protéique et lui confère une charge nette
négative. Plus les molécules sont volumineuses, plus la charge en
SDS est importante, ce qui signifie que la mobilité
électrophorétique d'une molécule dépend de sa
taille (poids moléculaire). L'électrophorèse sur gel de
polyacrylamide en conditions dénaturantes (SDS-PAGE) des trois enzymes
purifiées à partir de la larve du charançon
Rhynchophorus palmarum (Curculionidae) a été
réalisée sur des plaques de gel d'acrylamide (7 x 8 cm).
L'épaisseur du gel a été de 1,5 mm. Il contient 12 %
d'acrylamide, du tampon Tris-HCl 375 mM (pH 8,8) et du S.D.S (10 %, m/v). Une
fois polymérisée, le gel a été
transféré sur un dispositif HOEFFER SCIENTIFIC INSTRUMENT (Mighty
Small II Unit) et refroidi par une circulation d'eau.
L'électrophorèse a été réalisée avec
un courant électrique de 15 mA dans le tampon de migration Tris (25
mM)/glycine (192 mM) contenant du S.D.S (0,1 %, m/v). Des marqueurs Bio-Rad de
faibles poids moléculaires [Phosphorylase B (91.000 Da), le sérum
albumine bovine (66 kDa), l'ovalbumine (49,9 kDa), l'anhydrase carbonique (35,1
kDa), l'inhibiteur trypsique de soja (28,4 kDa) et le lysozyme (20,8 kDa)] ont
été utilisés.
Les protéines ont été
révélées au nitrate d'argent (Blum et
al., 1987) ou au bleu de Coomassie R-250, (0,1 % , m/v) ;
solution contenant du méthanol (40 %, v/v) et de l'acide acétique
(10 %, v/v). La décoloration a été réalisée
par lavages successifs dans le mélange méthanol/ acide
acétique/ glycérol/eau (20/7/3/70, v/v/v/v).
71
2-7- Influence du pH sur les activités
glycosidasiques
2-7-1- Détermination du pH optimum
d'hydrolyse
Les pH optima d'hydrolyse des
p-nitrophényl-glycosides ont été
déterminés dans les tampons acétate 100 mM (pH 3,6
à 5,6) et phosphate 100 mM (pH 5,6 à 8,0). Les activités
enzymatiques ont été déterminées dans les
conditions standard.
2-7-2-Détermination de la stabilité au pH
La stabilité au pH des enzymes a été
testée en préincubant chaque préparation enzymatique
pendant 2 h à 37 °C dans les tampons acétate et phosphate
100 mM pour des valeurs de pH comprises entre 3,6 et 8,0. Les activités
glycosidasiques ont été déterminées dans les
conditions standard.
2-7-3-Influence de la force ionique
L'influence de la force ionique sur les activités des
glycosidases a été mesurée dans les conditions standard.
Les forces ioniques testées ont été celles des tampons
acétate 20 mM, 50 mM et 100 mM contenant du KCl 300 mM.
2-8-Influence de la température sur les
activités glycosidasiques
2-8-1-Détermination de la température
optimale d'hydrolyse, du Q10 et de l'énergie d'activation
L'effet de la température sur les activités
catalytiques des glycosidases a été déterminé
à différentes températures (35 à 80 °C) dans
le tampon acétate 100 mM pH 5 ou pH 5,6. Le Q10 a été
déterminé entre 30 et 40 °C pour
l'á-glucosidase et entre 40 et 50 °C pour la
âgalactosidase et la â-glucosidase. Le graphe
d'Arrhénius a été obtenu dans l'intervalle de 25- 40
°C pour l'á-glucosidase et 30-50 °C pour la
â-glucosidase et la
â-galactosidase.
2-8-2-Inactivation thermique
Pour évaluer le degré de stabilité de
chaque enzyme, celle-ci a été pré-incubée à
37 °C ou à sa température optimale d'hydrolyse dans le
tampon acétate 100 mM au pH optimum d'hydrolyse de l'enzyme
étudiée. A chaque 10 min, une partie aliquote de 50 ul a
été prélevée et refroidie à la
température ambiante pendant 10 min. Elle a été
utilisée pour le déclenchement de la réaction dans les
conditions standard.
2-8-3-Dénaturation thermique
Les différentes solutions enzymatiques diluées
dans un tampon acétate 100 mM (pH optimum d'hydrolyse de la glycosidase
étudiée) ont été pré-incubées pendant
10 min aux températures allant de 30 à 80 °C, puis
refroidies à la température ambiante. Les activités
résiduelles ont été déterminées dans les
conditions standard.
2-9-Détermination de quelques paramètres
cinétiques
Pour la détermination des constantes de
Michaelis et Menten (KM) et des vitesses maximales
(Vmax) des enzymes purifiées
(á-glucosidase, â-glucosidase et
â-galactosidase), la méthode de
Lineweaver et Burk (1934) a été utilisée.
Les concentrations des substrats chromophores
p-nitrophényl-D-glycosides se sont situées entre 0,1 et 20
mM tandis que celles des di et oligosaccharides ont varié entre 0,1 et
20 mM. Les valeurs de KM et Vmax obtenues ont permis de calculer les
efficacités catalytiques (KM/Vmax) des enzymes.
2-10-Actions des agents chimiques sur l'activité
hydrolytique
L'enzyme a été pré-incubée pendant
10 min à 37 °C dans un milieu réactionnel de 175 ul de
tampon acétate 100 mM (pH optimum d'hydrolyse de la glycosidase
étudiée) contenant 1 mM ou 0,1 % (m/v) d'agent chimique.
Après cette pré-incubation, 75 ul de pNP-gycoside 5 mM y
ont été ajoutés pour une incubation de 10 min à 37
°C au bain marie. La réaction a été
arrêtée par ajout de carbonate de sodium 1 M. L'intensité
de la coloration du milieu réactionnel a été
mesurée au spectrophotomètre à 410 nm par rapport à
une solution témoin contenant tous les produits exceptée
l'enzyme. Dans chaque cas, l'activité enzymatique a été
exprimée en pourcentage de l'activité obtenue en l'absence de
produits chimiques.
7
2-11-Réactions de transglycosylation
2-11-1-Milieu réactionnel
Les réactions de synthèse enzymatique de
néoglycoconjugués ont été réalisées
à 37 °C dans 2 ml d'un mélange réactionnel contenant
du tampon acétate 100 mM ou phosphate 100 mM, et une quantité
appropriée de solution enzymatique (12 UI), des concentrations variables
de donneurs (50 à 800 mM) de glycosyle (maltose, saccharose, cellobiose
et lactose) et d'accepteurs de glycosyle (25 à 600 mM)
(phényléthanol). Les cinétiques de réactions de
synthèse ont été suivies à différents temps
entre 1 et 48 h par prélèvement de 0,2 ml de parties aliquotes.
La réaction a été arrêtée par chauffage des
parties aliquotes prélevées au bain-marie bouillant pendant 5
min.
2-11-2-Analyse chromatographe des produits de
transglycosylation
Les parties aliquotes prélevées ont
été filtrées sur une membrane hydrophile 0,2 um
(Sartorius). Les produits issus des réactions de transglycosylation ont
été analysés quantitativement et qualitativement par
chromatographie liquide à haute performance (Spectra system)
après injection de 20 ul du filtrat.
L'analyse des sucres a été
réalisée grâce à un détecteur
refractomètre et une colonne Supelcosyl LC-NH2 5 um (0,46 × 25 cm)
de Supelco. La phase mobile a été un mélange
acétronitrile/eau (75/25 ; v/v). Le débit d'écoulement a
été maintenu à 0,75 ml/min. Le xylose est utilisé
comme étalon interne. Quant aux hétérosides
(néoglycoconjugués synthétisés), leur analyse a
été suivie grâce à un détecteur (spectra
system) UV à 257 nm. La phase mobile a été le
mélange méthanol/eau (35/65, v/v). Un débit
d'écoulement de 0,45 ml/min a été appliqué. La
colonne utilisée a été l'Hypersil 5 um (0,46 × 25 cm)
de Shandom. La tyrosine a été utilisée comme étalon
interne.
2-11-3-Calcul du pourcentage de transglycosylation
La méthode de calcul du pourcentage de
transglycosylation est celle décrite par Kouaméet
al. (2005a). Elle est basée sur les schémas
réactionnels de la figure 8. Le premier
monosaccharide
X-OH libéré traduit l'activité totale de
l'hydrolyse. Soient a, b et
c les
concentrations molaires respectives du premier monosaccharide
(X-O-H), du deuxième monosaccharide
(Gly-OH) et du néoglycoconjugué
(Gly-O-Z). On peut poser que a = b + c. Soit
T, le pourcentage de transglycosylation :
T = (c/a) × 100
ou
T = [100 - (b/a)] × 100
1er monosaccharide libéré
X-O-H
(donneur de glycosyle)
Gly-O-X + E-H Gly-O-E
glycosidase libre

glycosidase liée au glysosyle
H2O (eau)
2è monosaccharide
libéré
Gly-OH + EH
glycosidase
libre
|
Z-OH
accepteur de glycosyle
|
|
glycosidase libre
|
Gly-O-Z + E-H
néoglycoconjugué
Figure 8 : Schémas des réactions
catalysées par les glycosidases (D'après Kouamé et
al., 2006)
Chapitre 3
RESULTATS ET DISCUSSION
I- RECHERCHE ET DETERMINATION DES CONDITIONS OPTIMALES
D'HYDROLYSE DES GLYCOSIDASES DE LA LARVE DE Rhynchophorus palmarum
(Curculionidae)
1-Résultats
1-1-Activités glycosidasiques
1-1-1-Activités exo-glycosidasiques
Les extraits bruts enzymatiques des glandes salivaires, du
tube et du suc digestifs de la larve de Rhynchophorus palmarum
(Curculionidae) ont possédé des activités
exoglycosidasiques très variées. Les activités
spécifiques les plus élevées se sont retrouvées
dans le suc digestif (Fig. 9 et 10).
Ce sont les activités a-glucosidasique
(0,49 UI/mg de protéine), f3-glucosidasique (0,69 UI/mg
de protéine) et f3-galactosidasique (0,60 UI/mg de
protéine). Les activités a-mannosidasique,
a-xylosidasique, f3-mannosidasique,
f3-fucosidasique et invertasique ont été
faibles. Quant aux autres activités enzymatiques testées, elles
ont été très faibles. Les extraits bruts enzymatiques des
glandes salivaires et du tube digestif n'ont pas présenté
d'activité a-xylosidasique (Fig. 9 et
10).
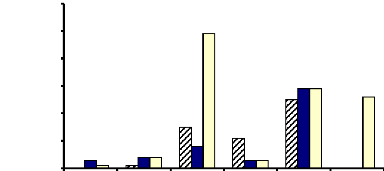
Activite specifique
(UI/mg de profane)
0,6
0,5
0,4
0,3
0,2
0,1
0
a-Ara a-Gal
a-Glc a-Fuc a-Man
a-xyl

Álpha-exo-glycosidasique

Glande salivaire Tube digestif Suc digestif
Figure 9 : Activités á-exo-glycosidasiques
des extraits bruts enzymatiques des glandes salivaires, du tube et du suc
digestifs de la larve de Rhynchophorus palmarum
(Curculionidae)

0,8
|
0,7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,6
|
|
|
|
|
|
|
|
A ctivite specifique
(UI/mg de profane)
|
0,5
|
|
|
|
|
|
|
0,4
|
|
|
|
|
|
|
0,3
|
|
|
|
|
|
|
|
0,2
|
|
|
|
0,1
0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13-Ara 13-Gal
13-Glu 13-Fuc 13-Man
Sacch.

Béta-exo-glycosidasique
Glande salivaire Tube digestif Suc digestif
Figure 10 : Activités
â-exo-glycosidasiques des extraits bruts enzymatiques des glandes
salivaires, du tube et du suc digestifs de la larve de Rhynchophorus
palmarum (Curculionidae).
1-1-2-Activités endo-glycosidasiques
Parmi les substrats testés, seuls la
carboxyméthylcellulose et l'amidon ont été
hydrolysés par le suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae). L'amidon a été aussi clivé par les
glandes salivaires du même insecte. L'activité spécifique
obtenue a été plus élevée que celle du suc
digestif. Les tissus du tube digestif de la larve de Rhynchophorus
palmarum (Curculionidae) ont seulement dégradé la
carboxyméthylcellulose. Cette activité spécifique a
été très faible. Aucune activité xylanasique et
pullulanasique n'a été détectée dans les extraits
bruts enzymatiques des glandes salivaires, du tube et du suc digestif
(Fig. 11).
1-2- Températures et pH optima d'hydrolyse
1-2-1-Activités á-exo-glycosidasiques
Les pH optima d'hydrolyse des activités
á-exo-glycosidasiques des extraits bruts enzymatiques
des glandes salivaires, du suc et du tube digestif de la larve de
Rhyncophorus palmarum (Curculionidae) ont été
dosés entre 4,6 et 6,0 et les températures optimales d'hydrolyse
entre 40 et 55 °C (Tableau 4). Les
á-exo-glycosidases des différents extraits bruts
enzymatiques testés ont été acides et
mésophiles.
1-2-2-Activités â-exo-glycosidasiques
Les activités
â-exo-glycosidasiques des extraits bruts enzymatiques du
suc digestif, du tube digestif et des glandes salivaires de la larve de
Rhyncophorus palmarum (Curculionidae) sont mésophiles et
acides. Les pH optima se sont situés entre 4,0 et 5,6. Quant aux
températures optimales d'hydrolyse, elles ont varié entre 45 et
55 °C (Tableau 5).
1-2-3-Activités endo-glycosidasiques
Les activités endo-glycosidasiques de la larve de
Rhynchophorus palmarum (activités amylasique et cellulasique)
ont toutes eu le même pH optimum (4,6) et la même
température optimale (55 °C) (Tableau 6).



79
0,45 0,4 0,35
|
Activite specifique
(UI/mg de profane)
|
0,3
|
|
|
0,25
0,2
|
|
|
0,15
|
|
|
0,1
|
|
|
0,05
0
|
|
|
|
|
|
|

Xylanase Cellulose Amidon Pullulane
Endo-glycosidasique

Glande salivaire Tube digestif Suc digestif
Figure 11 : Activités endo-glycosidasiques des
extraits bruts enzymatiques des glandes salivaires du tube digestif et du suc
digestif de la larve de Rhynchophorus palmarum (Curculionidae)
Tableau 4 : Températures et pH optima
d'hydrolyse des activités á-exoglycosidasiques des extraits bruts
enzymatiques des glandes salivaires et du suc et tube digestifs de la larve de
Rhynchophorus palmarum (Curculionidae)
|
Enzyme
|
Substrat
|
Glandes
salivaires
|
Tube
digestif
|
Suc digestif
|
|
|
(5 mM)
|
|
|
|
|
|
|
|
|
T °C
|
pH
|
T°C
|
pH
|
T°C
|
pH
|
|
a-Arabinosidase
|
pNPaAra
|
50
|
5,0
|
50
|
5,0
|
50
|
5,0
|
|
a-Galactosidase
|
pNPaGal
|
45-50
|
5,0
|
50
|
5,0
|
50
|
5,0
|
|
a-Glucosidase
|
pNPaGlc
|
45-50
|
5,0
|
45
|
5,6
|
45
|
5,6
|
|
a-Fucosidase
|
pNPaFuc
|
50-55
|
5,6
|
55
|
6,0
|
55
|
6,0
|
|
a-Mannosidase
|
pNPaMan
|
50
|
4,0
|
40
|
4,0
|
40
|
4,0
|
|
a-Xylosidase
|
pNPaXyl
|
55
|
5,0-5,6
|
55
|
5,6
|
55
|
5,6
|
Tableau 5 : Températures et pH optima
d'hydrolyse des activités â-exoglycosidasiques des extraits bruts
enzymatiques des glandes salivaires et du suc et tube digestifs de la larve de
Rhynchophorus palmarum (Curculionidae)
Glandes
Enzyme Substrat salivaires Tube digestif Suc
digestif
|
(5 mM)
|
|
|
|
|
|
|
|
T °C
|
pH
|
T °C
|
pH
|
T °C
|
pH
|
|
f3-Arabinosidase
|
pNPf3Ara
|
45-50
|
5,0
|
55
|
5,0
|
55
|
5,0
|
|
f3-Galactosidase
|
pNPf3Gal
|
55
|
5,6
|
55
|
5,0
|
55
|
5,6
|
|
f3-Glucosidase
|
pNPf3Glc
|
45-50
|
5,0
|
50-55
|
5,6
|
50
|
5,6
|
|
f3-Fucosidase
|
pNPf3Fuc
|
55
|
5,6
|
55
|
4,0
|
55
|
4,0
|
|
f3-Mannosidase
|
pNPf3Man
|
45-50
|
5,0
|
50
|
4,6-5,0
|
45
|
4,6
|
|
f3-Xylosidase
|
pNPf3xyl
|
55
|
5,0-5,6
|
55
|
5,6
|
55
|
5,6
|
Tableau 6 : Températures et pH optima
d'hydrolyse des activités endo-glycosidasiques des extraits bruts
enzymatiques des glandes salivaires et du suc et tube digestifs de la larve de
Rhynchophorus palmarum
|
Enzyme Substrat
(5 mM)
|
Glandes
salivaires
|
Tube
digestif
|
Suc
digestif
|
|
|
|
T °C pH T °C pH T °C pH
Amylase Amidon 55 4,6 - - 55 4,6
Cellulase Cellulose - - 55 4,6 55 4,6
2-Discussion
L'étude de la dégradation des osides par le suc
digestif, les broyats totaux des tissus du tube digestif et des glandes
salivaires de la larve de Rhynchophorus palmarum (Curculionidae) a
montré que toutes les activités osidasiques présentes dans
le suc digestif se sont retrouvées dans les extraits cellulaires des
glandes salivaires et du tube digestif. Ce comportement enzymatique
suggère que ces activités sont sécrétées par
les glandes digestives ou par les microorganismes symbiotiques de cet insecte.
Cette situation a été aussi observée chez les termites
Macrotermes mulleri (Rouland, 1986) et M.
bellicosus (Matoub, 1993). L'amidon est le polysaccharide
le plus hydrolysé par les glandes salivaires et le suc digestif, ce qui
montre que la (ou les) enzymes responsable (s) de cette activité
hydrolytique est (sont) sécrétée (s) par les glandes
salivaires pour être déversée (s) par la suite dans le suc
digestif. Ce résultat laisse penser que celle-ci peut être
sécrétée soit par les glandes digestives soit par les
microorganismes présents dans le tube digestif de cette larve comme cela
a été révélé chez les castes neutres du
termite Macrotermes subhyalinus (Kouamé et
al., 2005b) et M. bellicosus (Matoub,
1993). La présence de fortes activités amylolytiques
dans le suc digestif de la larve du Rhynchophorus palmarum
(Curculionidae) est en accord avec les résultats obtenus avec la plupart
des coléoptères. En effet, ces insectes se nourrissent
essentiellement d'aliments riches en amidon. Ce sont donc des
coléoptères amylolytiques dont l'activité
endoglycosidasique la plus élevée est
l'a-amylase (Ishimoto et Katamura, 1989 ; Lemos et
al., 1990 ; Grossi de Sa et Chrispeel, 1997 ; Silva et al., 1999
; Titarenko et Chripeel, 2000 ; Cristofoletti et al., 2001 ; Silva
et al., 2006).
L'hydrolyse du saccharose est assurée par deux types
d'enzymes appelées aglucosidase et
f3-fructosidase. Le suc digestif contient une forte
activité a-glucosidasique qui prendrait une part active
ou assurerait la dégradation de cette substance. Cette
possibilité est en accord avec les travaux de Silva et
al. (2004). En effet, selon ces auteurs, l'insecte Diatraea
saccharalis assurerait la dégradation du saccharose par trois
saccharose hydrolases dont une a-glucosidase (EC 3.2.1.20),
une f3-fructosidase (EC 3.2.1.26) qui dégrade à
la fois le saccharose, le raffinose et le fructosyl-trisaccharide isokestose et
dont le substrat essentiel est le dernier cité et une saccharase qui
n'agit seulement que sur le saccharose. Toutes ces enzymes sont
sécrétées par les cellules de l'intestin moyen de
l'insecte. Chez l'abeille européenne Apis mellifera, la
dégradation du saccharose est assurée par une
a-glucosidase (Nishimoto et al., 2001 ;
Kubota et al., 2004).
82
Par rapport à l'amidon, la cellulose a
été faiblement hydrolysée dans le suc digestif. Par
contre, son activité hydrolytique a été trois fois
supérieure à celle du tube digestif. Les glandes salivaires n'en
possèdent pas. Ces résultats montrent que l'activité
cellulasique de la larve de Rhynchophorus palmarum (Curculionidae)
n'est pas sécrétée par les glandes salivaires de
l'insecte. Elle peut être synthétisée soit par les tissus
du tube digestif, soit par les tissus d'autres glandes, soit par des
microorganismes contenus dans le suc digestif de l'animal. Quant à
l'activité f3-glucosidasique synergique de celle de la
cellulase pour dégrader la cellulose en glucose, son activité
hydrolytique a été très élevée dans le suc
digestif et faible dans les tissus des glandes salivaires et du tube digestif.
Cette situation ne permet pas d'expliquer clairement la provenance de cette
forte activité f3-glucosidasique. Est-elle d'origine
microbienne comme cela a été évoqué par plusieurs
auteurs chez les insectes ? En effet, chez ces derniers, la
caractérisation des enzymes assurant la digestion de la cellulose est
très complexe à cause de la diversité d'origine de celles
présentes dans l'intestin des insectes. Les enzymes des tubes digestifs
sont produites par des microorganismes symbiotiques (Martin, 1983 ;
1987) qui sont des protozoaires (Cleveland, 1923 ; Trager,
1932 et 1934 ; Yamin, 1978 ; Yamin et Trager, 1979), des
bacteries (Beckwith et Rose, 1929 ; French et Bland, 1975) et
des champions (Abo-khatwa, 1978 ; Martin et Martin, 1978 ; 1979 :
Rouland et al., 1988). Une faible activité
cellulasique pour une faible que l'activité f3-
glucosidasique a été obtenue. Cette situation enzymatique laisse
penser que la ou les enzyme (s) responsable (s) de l'activité
f3-glucosidasique peut (peuvent) avoir d'autres rôles
importants notamment dans la digestion des glycoprotéines, des
glycolipides et des oligosaccharides résultant de la dégradation
des hémicelluloses. L'activité
f3-galactosidasique a aussi une origine difficile à
définir à partir de notre travail. Elle a été
très élevée alors que la larve de Rhynchophorus
palmarum (Curculionidae) ne consomme pas de lait dont le sucre essentiel
est le lactose. Cette activité enzymatique pourrait donc avoir pour
rôle la dégradation des oligosaccharides provenant de la digestion
de certaines hémicelluloses tels que les galactanes et les
arabino-galactanes.
Le suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae) n'a pas hydrolysé le pullulane et le xylane, ce qui
montre que cet insecte n'est pas xylanolytique comme certains insectes tels que
les termites M. subhyalinus (Kouamé, 2006) et
M. bellicosus (Matoub, 1993). Il a
révélé la présence d'une activité
a-xylosidasique qui n'a été
sécrétée ni dans les glandes salivaires, ni dans les
tissus du tube digestif. Cette activité peut avoir été
produite par d'autres glandes digestives ou par des microorganismes
symbiotiques.
Les températures et pH optima d'hydrolyse des
glycosidases ont varié respectivement de 40-55 °C et de 4,0-5,6. Ce
résultat suggère qu'il n'existe pas dans l'appareil digestif de
la larve de glycosidases thermophiles. Ces enzymes sont toutes acides et
mésophiles. Ce résultat est en accord avec ceux obtenus avec la
blatte Periplaneta americana (Kouamé et al.,
2005) et différents de ceux de M. bellicosus
(Matoub, 1993) et de M. subhyalinus
(Kouamé, 2006). En effet, chez les insectes, les enzymes
responsables de la dégradation du xylane en xylobiose sont thermophiles
et acides.
Conclusion
La larve de Rhynchophorus palmarum (Curculionidae)
possède dans son suc digestif une variété de glycosidases
acides et mésophiles sécrétées par les glandes
digestives, par l'insecte lui-même ou par des microorganismes. Les
activités enzymatiques les plus élevées sont celles des
glucosidases et de la â-galactosidase. Les glandes
salivaires sécrètent une forte activité amylasique.
Pour la suite de ce travail, les activités osidasiques
les plus élevées dans le suc digestif seront purifiées et
caractérisées afin de déterminer leur rôle
précis dans le tube digestif et envisager leur éventuelle
utilisation dans le domaine industriel.
II- PURIFICATION ET CARACTERISATION PHYSICO-CHIMIQUE
DE L'á-GLUCOSIDASE DU SUC DIGESTIF DE LA LARVE DE
Rhynchophorus palmarum (Curculionidae)
1-Résultats
1-1- Stratégie de purification
La stratégie de purification utilisée pour
isoler à homogénéité
électrophorétique l'áglucosidase du suc
digestif de la larve de Rhynchophorus palmarum (Curculionidae),
a été la suivante :
- chromatographie échangeuse d'anion sur gel de
D.E.A.E-Sepharose CL-6B ;
- fractionnement de la solution enzymatique issue de la
chromatographie échangeuse d'anion au sulfate d'ammonium ;
- chromatographie d'exclusion moléculaire sur gel de
Sephacryl S-100 HR ;
- chromatographie d'interaction hydrophobe sur gel de
Phényl-Sepharose CL-4B.
1-1-1- Chromatographie échangeuse d'anion sur gel
de D.E.A.E-Sepharose CL-6B
L'extrait brut enzymatique résultant du suc digestif de
la larve de Rhynchophorus palmarum (Curculionidae) est un milieu
visqueux contenant de nombreux pigments et est riche en activités
glycosidasiques. La chromatographie échangeuse d'anion sur gel de
D.E.A.E-Sepharose CL-6B a permis non seulement d'éliminer une bonne
partie de ces pigments mais aussi de retenir une seule activité
á-glucosidasique sur le gel de D.E.A.ESepharose CL-6B.
Cette activité a été éluée à la
concentration de 0,3 M de KCl (Fig. 12). L'activité
spécifique de cette enzyme a été de 1,26 UE /mg. Le
rendement et le facteur de purification ont été respectivement de
81,62 % et 2,57 (Tableau 7).
1-1-2- Fractionnement au sulfate d'ammonium
Cette étape a permis d'améliorer le facteur de
purification passant de 2,57 à 3,04. Le rendement obtenu est de 75,64 %
(Tableau 7).
1-1-3-Chromatographie d'exclusion moléculaire sur
gel de Sephacryl S-100 HR
Cette étape chromatographique a permis non seulement
d'obtenir un seul pic d'activité
á-glucosidasique mais aussi d'éliminer le reste
des pigments contenus dans la solution enzymatique (Fig. 13).
L'enzyme responsable de l'hydrolyse du
p-nitrophényl-á-D-glucoside a une
activité spécifique de 32,23 UE/mg de protéine. Le facteur
de purification et le rendement ont été respectivement de 65,77
et 34,43 % (Tableau 7).
1-1-4-Chromatographie d'interaction hydrophobe sur gel de
Phényl Sepharose CL-4B
Cette étape de chromatographie a permis d'isoler une
seule á-glucosidase (Fig. 14). Elle a
été éluée par du thiosulfate de sodium 0,3 M
préparé dans le tampon acétate 100 mM pH 5,6. Son
activité spécifique a été de 94,16 UE/mg. Le
facteur de purification et le rendement ont été respectivement de
20,12 et 19,18 % (Tableau 7).
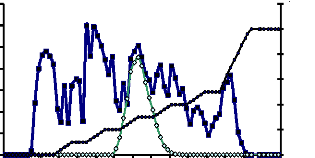
0,8
0,6
0,4
0,2
0
1,2
1
KC1(M)
3,5
Activite relative (DO 410 nm))
(Protein DO 280
nm)
3
2,5
2
1,5
1
0,5
0
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150
Nombre de fraction
|
DO 280 nm DO 410 nm KCl (M)
|
Figure 12 : Profil chromatographique d'échange
d'anion de l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de D.E.A.ESepharose
CL-6B
La colonne (2,4 × 6,5 cm) a été
équilibrée dans le tampon acétate 100 mM pH 5,6. Le
débit chromatographique a été de 14ml/ h. Les
protéines retenues ont été décrochées par un
gradient en palier croissant de KCl préparé dans le tampon
acétate 100 mM pH 5,6. Des fractions de 4 ml ont été
collectées.
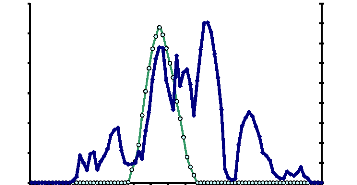
Proteine (DO 280 nm)
Activite relative (DO 410 nm)
3
2,5
2
1,5
1
0,5
0
0,45
0,4
0,35
0,3
0,25
0,2
0,15
0,1
0,05
0
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160
Nombre de fraction
DO 410 nm DO 280 nm


Figure 13 : Profil chromatographique d'exclusion
moléculaire de l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de Sephacryl S100
HR
La colonne (1,6 × 64 cm) a été
équilibrée dans le tampon acétate 100 mM pH 5,6. Le
débit chromatographique a été de 15ml /h. Les
protéines ont été éluées par le tampon
acétate 100 mM pH 5,6. Des fractions de 1 ml ont été
collectées.
|
Activite relative (DO 410)
|
0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1
0
|
|
0,6 0,5 0,4 0,3 0,2 0,1 0
|
Proteine (DO 660 nm)
Thiosulfate de sodium
(M)
|
-1 9 19 29 39 49 59 69 79 89
Nombre de fraction

DO 660 nm DO 410 nm thiosulfate de sodium (M)
Figure 14 : Profil chromatographique d'interaction
hydrophobe de l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de
PhénylSepharose CL-4B
La colonne (1,4 × 5cm) a été
équilibrée dans le tampon acétate 100 mM pH 5,6 contenant
du thiosulfate de sodium 1,7 mM. Le débit chromatographique a
été de 14 ml/h. Les protéines retenues par le gel ont
été décrochées par un gradient en palier
décroissant de thiosulfate de sodium préparé dans le
tampon acétate 100 mM pH 5,6. Des fractions de 1ml ont été
collectées.
Tableau 7 : Bilan global de la purification de
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
|
Etape de purification
|
Activité
totale
(U.E.)
|
Protéine
(mg)
|
Activité
Spécifique
(UE
/mg)
|
Facteur de
purification
|
Rendement
(%)
|
|
Extrait brut enzymatique
|
28,08
|
57,36
|
0,49
|
1
|
100
|
|
D.E.A.E. Sepharose CL-6B
|
22,92
|
18,18
|
1,26
|
2,57
|
81,62
|
|
Précipitation au sulfate
d'ammonium (80 % de
saturation)
|
21, 24
|
14,24
|
1,49
|
3,04
|
75,64
|
|
Sephacryl S-100 HR
|
9, 67
|
0,3
|
32,23
|
65,77
|
34,43
|
|
Phényl-Sepharose CL-4B
|
5, 65
|
0,06
|
94,16
|
20,12
|
19,12
|
UE= 1 micromole de p-nitrophénolate
libéré par min
1-2-Critère de
pureté
L'électrophorèse sur gel de polyacrylamide en
présence de SDS et de â-mercaptoéthanol a
permis d'observer une seule bande protéique, traduisant une
pureté satisfaisante de l'á-glucosidase du suc
digestif de la larve de Rhynchophorus palmarum (Curculionidae)
(Fig. 15).
1-3-Masses moléculaires de
l'á-glucosidase
Les masses moléculaires de
l'á-glucosidase déterminées en gel de
filtration sur la colonne TSK et en électrophorèse sur gel de
polyacrylamide en présence de SDS et de
âmercaptoéthanol ont été
respectivement de 60 kDa et 55 kDa. Cette similarité de masse
moléculaire montre que l'enzyme est monomérique (Tableau
8).
2 1
|
97,4 kDa 66,2 kDa
35,1 kDa 28,4 kDa
|
|
Figure 15 : á-glucosidase du suc digestif de la
larve de Rhynchophorus palmarum (Curculionidae) purifiée par
électrophorèse
Gel de polyacrylamide en présence de SDS et de
beta-mercapto-éthanol. Ligne 2, Protéines de
référence. ligne 1, á-glucosidase.
Tableau 8 : Masses moléculaires de
l'á-glucosidase du suc digestif de la larve du Rhynchophorus
palmarum (Curculionidae)
|
Masse
Méthode de détermination de la masse
moléculaire moléculaire
(kDa)
|
Nombre de
sous unité
|
Gel filtration 60
1
Electrophorèse sur gel de polyacrylamide en
présence de 55
SDS et de beta-mercapto-éthanol
1-4-Influence du pH sur l'activité de
l'á-glucosidase
1-4-1-pH optimum d'hydrolyse
L'á-glucosidase a
présenté un maximum d'activité hydrolytique dans le tampon
acétate 100 mM pH 5,6 (Tableau 9). Elle a
conservé plus de 80 % de cette activité hydrolytique dans le
domaine de pH allant de 5,0 à 6,0. Aux pH compris entre 7,6 et 8,0 ;
l'enzyme a présenté une activité catalytique faible ne
dépassant pas 35 % d'activité (Fig. 16).
1-4-2-Stabilité au pH
L'á-glucosidase a été
stable pendant 2 h dans le tampon acétate 100 mM aux pH compris entre
4,0 et 5,6 (Fig. 17).
1-4-3-Influence de la force ionique du tampon
La force ionique du tampon n'a exercé aucune influence
sur les valeurs des pH optima d'hydrolyse de
l'á-glucosidase purifiée du suc digestif de la
larve de Rhynchophorus palmarum (Curculionidae) (Tableau
9).





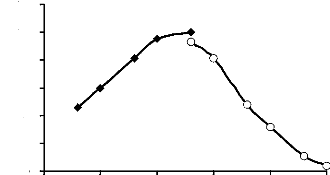
120
100
Aelivite relative (%)
80
60
40
20
0
|
Activite relative (%)
|
100 80 60 40 20 0
|
3 4 5 6 7 8
pH
|
Tampon acétate 100 mM (pH3,6 - 5,6) Tampon phosphate 100
mM (pH5,6 - 8)
|
Figure 16 : pH optimum d'hydrolyse de
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
Le pH optimum d'hydrolyse du
p-nitrophényl-á-glucoside a
été déterminé dans les tampons acétate 100
mM (pH 3,6 à 5,6) et phosphate 100 mM (pH 5,6 à 8,0).
L'activité enzymatique a été déterminée dans
les conditions standard.
120

3 4 5 6 7 8 9
pH
Figure 17 : Stabilité au pH de
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
L'enzyme a été pré-incubée pendant
2 h à 37 °C dans les tampons acétate et phosphate 100 mM
pour des valeurs de pH comprises entre 3,6 et 8,0. L'activité
résiduelle a été déterminée dans les
conditions standard.
1-5-Influence de la température sur
l'á-glucosidase
1-5-1- Température optimale d'hydrolyse,
énergie d'activation et Q10
L'a-glucosidase a eu une température
optimale d'hydrolyse de 45 °C dans le tampon acétate 100 mM pH 5,6.
De 30 à 50 °C, elle a conservé plus de 60 % de son
activité hydrolytique (Fig. 18). Le Q10 de
l'a-glucosidase, déterminé entre 30 °C et
40 °C selon Arrhenius a été de 1,31.
L'énergie d'activation (Ea) de l'a-glucosidase a
été de 36,67 kJ/mole (Tableau 9).
1-5-2- Inactivation thermique
L'étude de l'inactivation thermique de
l'a-glucosidase a permis de mettre en évidence une
baisse importante de l'activité hydrolytique de cette enzyme à
partir de la 40ème min de pré-incubation dans le
tampon acétate 100 mM pH 5,6 à 45 °C (Fig.
19). La demi-vie de cette enzyme à 45 °C a
été de 50 min (Tableau 9). A 37 °C,
l'a-glucosidase a conservé toute son activité
hydrolytique dans le même tampon acétate 100 mM pH 5,6 pendant
plus de 140 min soit plus de 2 h 30 min de temps de pré-incubation.
1-5-3-Dénaturation thermique
L'a-glucosidase a conservé 100 % de
son activité hydrolytique aux températures comprises entre 30 et
45 °C dans les conditions expérimentales.
Au-delà de 50 °C, la chute brutale de
l'activité enzymatique traduit une importante dénaturation de
l'a-glucosidase (Fig. 20).
1-5-4-Conservation au froid
Une conservation prolongée par congélation de
l'a-glucosidase purifiée du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) contenue dans le tampon
acétate 100 mM pH 5,6 n'a pas modifié l'activité de
celle-ci, même au bout d'un an (Fig. 21).
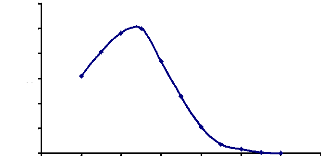
Activite relative(%)
120
100
40
20
80
60
0
20 30 40 50 60 70 80 90
Température (°C)
Figure 18 : Température optimale d'hydrolyse de
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
La température optimale d'hydrolyse du
p-nitrophényl-á-glucoside a
été déterminée à différentes
températures (35 à 80 °C) dans le tampon acétate 100
mM pH 5,6. L'activité enzymatique a été
déterminée dans les conditions standard.
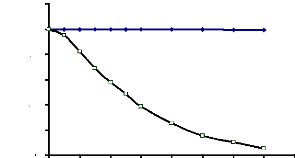
Activite relative (%)
120
100
40
20
60
80
0
0 20 40 60 80 100 120 140 160

Temps (min)
37°C 45°C
Figure 19 : Inactivation thermique de
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae) à 37 °C et à 45
°C
L'enzyme est pré-incubée aux températures de
37 et 45 °C pendant des temps compris entre 0 et 140 min.
L'activité résiduelle a été
déterminée dans les conditions standard.

120
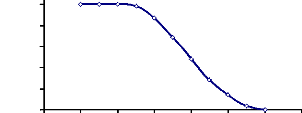
Activite relative (%)
100
40
20
60
80
0
20 30 40 50 60 70 80 90
Température (°C)
Figure 20 : Dénaturation thermique de
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
L'enzyme a été pré-incubée pendant
10 min à des températures comprises entre 30 et 80
°C, puis refroidie à la température
ambiante. L'activité résiduelle a été
déterminée dans les conditions standard.





120
100
|
Activite relative (%)
|
80
60
40
|
20
0
0 1 2 3 4 5 6 7 8 9 10 11 12
Durée de congelation à 0°C
(mois)
Figure 21 : Effet de la congélation sur de
l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) dans le tampon acétate
100 mM à pH5,6
Tableau 9 : Quelques caractéristiques de
l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae)
Caractéristiques Valeurs
pH optimum d'hydrolyse 5,6
Force ionique Sans effet
Stabilité au pH 5,0 - 5,6
Température optimale d'hydrolyse (°C) 45
1/2 vie à 45 °C (min) 50
Energie d'activation (kj/mole) 36,67
Q10 1,31
1-6-Spécificité de substrat
1-6-1-Activité sur les
p-nitrophényl-D-glycosides
La spécificité de substrat de
l'á-glucosidase a été testée sur
un grand nombre de pnitrophényl-glycosides. Seul le substrat
pNP-á-D-glucopyranoside a été
hydrolysé par l'enzyme. Ce biocatalyseur possède donc une
spécificité stricte vis-à-vis du résidu glucosyle
en position á (Tableau 10).
1-6-2-Activité sur les oligosaccharides et
polysaccharides
L'á-glucosidase n'a pas
hydrolysé pas le xylobiose, le cellobiose, le lactose, le
mélibiose, le mélizitose, l'arabino-galactane, la
carboxyméthylcellulose, l'inuline, le xylane, le lichenane et l'amidon.
Cependant, elle a dégradé les maltodextrines, le
tréhalose, le kojibiose, le nigérose et le saccharose. Les
maltodextines (sauf l'isomaltose), le kojibiose et le saccharose ont
été les oligosaccharides les plus hydrolysés.
La vitesse d'hydrolyse des maltodextrines par
l'á-glucosidase augmente lorsque la chaîne de
glucose s'allonge jusqu'à 5 unités de glucose. Au-delà de
5 unités, la vitesse de la réaction diminue (Tableau
11).
Tableau 10 : Activité hydrolytique de
l'á-glucosidase sur les
p-nitrophényl-glycosides
Substrat Activité
p-nitrophényl-á-glucoside
D
p-nitrophényl-â-glucoside
ND
p-nitrophényl-á-mannoside
ND
p-nitrophényl-â-mannoside ND
p-nitrophényl-â-galactoside
ND
p-nitrophényl-á-galactoside
ND
p-nitrophényl-á-fucoside
ND
p-nitrophényl-â-fucoside
ND
p-nitrophényl-á-arabinoside
ND
p-nitrophényl-â-arabinoside
ND
p-nitrophényl-â-xyloside
ND
p-nitrophényl-á-xyloside
ND
D : Hydrolysé N.D : Non
hydrolysé
Tableau 11 : Spécificité de substrat de
l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae)
|
Substrats
(oligosaccharide et polysaccharide)
|
Activité
Structure de substrat relative (%)
|
Maltose Glcá(1-4)Glc 100
Maltotriose Glcá(1-4)Glcá(1-4)Glc 142
Maltotétraose
Glcá(1-4)Glcá(1-4)Glcá(1-4)Glc 156
Maltopentaose
Glcá(1-4)Glcá(1-4)Glcá(1-4)Glcá(1-4)Glc 186
Maltohexaose
Glcá(1-4)Glcá(1-4)Glcá(1-4)Glcá(1-4)
Glcá(1-4)Glc 105
Maltoheptaose
Glcá(1-4)Glcá(1-4)Glcá(1-4)Glcá(1-4)
Glcá(1-4) Glcá(1-4)Glc 96
Tréhalose Glcá(1-1)Glc 12
Kojibiose Glcá(1-2)Glc 120
Nigérose Glcá(1-3)Glc 8
Isomaltose Glcá(1-6)Glc 6
Saccharose Glcá(1-2)Fru 146
Xylobiose Xylâ(1-4)Xyl 0
Cellobiose Glcâ(1-4)Glc 0
Laminaribiose Polymère de Glc 0
Arabino-galactane Polymère de Ara et de Gal 0
Carboxyméthylcellulose
[Glcâ(1-4)Glc-]n 0
Inuline [-Fru â(1-2)Fru-]n 0
Lichenane Polymère de Glc 0
Xylane Polymère de xyl 0
Amidon Polymère de Glc 0
1-7-Paramètres cinétiques
Selon la représentation de Lineweaver et Burk
(1934), la valeur de KM de l'áglucosidase
obtenue avec le pNP-á-D-glucopyranoside a
été de 0,30 mM tandis que la vitesse maximale (Vmax) a
été de 142,20 UE /mg de protéine. Avec le maltose, le
saccharose et le kojibiose, les valeurs de KM ont été
respectivement de 1,31 ; 0,42 et 0,57 mM, avec des vitesses maximales
respectives de 48,23 ; 77,54 et 62,23 UE/mg de protéine. Les
efficacités catalytiques (Vmax/KM) des substrats naturels
tels que le maltose, le kojibiose et le saccharose montrent que
l'á-glucosidase a eu un meilleur pouvoir catalytique
pour le saccharose (Tableau 12).
1-8-Action des agents chimiques
Les ions métalliques K+ et Na+ et
le triton X-100 n'ont pas exercé d'effet sur
l'áglucosidase. Tous les autres agents chimiques
testés sont des inhibiteurs. Les ions métalliques Zn2+
et Cu2+ ont complètement inhibé l'activité de
l'á-glucosidase. Le DTNB et l'ion Fe3+ ont
fortement inhibé cette activité (Tableau 13).
Tableau 12 : Quelques paramètres cinétiques
de l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
|
Substrat
|
KM
|
Vmax
|
Vmax/ KM
|
|
(mM)
|
(U/mg)
|
(U/mM x mg)
|
|
p-nitrophényl-á-D-glucopyranoside
|
0,30
|
142,20
|
474,00
|
|
Maltose
|
1,31
|
48,23
|
36,81
|
|
Saccharose
|
0,42
|
77,54
|
184,61
|
|
Kojibiose
|
0,57
|
62,23
|
109,17
|
Tableau 13 : Effet de quelques agents chimiques sur
l'activité de l'á-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae)
|
Agents chimiques
|
Concentration
(mM ou %)
|
Activité relative (%)
|
|
Témoin
|
1
|
100
|
|
Ba2+
|
1
|
56
|
|
Mg2+
|
1
|
76
|
|
Mn2+
|
1
|
50
|
|
Sr2+
|
1
|
81
|
|
Ca2+
|
1
|
82
|
|
Ions
|
Cu2+
|
1
|
0
|
|
Zn2+
|
1
|
0
|
|
Na+
|
1
|
100
|
|
K+
|
1
|
100
|
|
EDTA
|
1
|
82
|
|
Fe3+
|
1
|
7
|
|
Tris
|
1
|
10
|
|
â-mercaptoéthanol
|
0,1
|
86
|
|
Réducteurs
|
pCMB
|
0,1
|
73
|
|
DTNB
|
0,1
|
2
|
|
Triton X-100
|
0,1
|
100
|
|
Tween 80
|
0,1
|
90
|
|
Détergents
|
SDS
|
0,1
|
44
|
|
Urée
|
0,1
|
88
|
|
Guanidine
|
0,1
|
78
|
1-9-Réactions de transglucosylation
catalysées par l'á-glucosidase
1-9-1-Influence du pH
Les pH optima de transglucosylation de
l'á-glucosidase lorsque le saccharose et le maltose ont
été utilisés comme donneurs de glucosyle et le
2-phényléthanol comme accepteur de glucosyle ont
été identiques. La valeur a été de 5,0
(Fig. 21).
1-9-2-Influence du temps d'incubation
Les pourcentages maxima de synthèse de
phényléthylglucoside ont été obtenus en 12 h de
réaction quel que soit le donneur de glucosyle utilisé. Les deux
valeurs sont identiques (62 %). Après 12 h de réaction, les
pourcentages de transglucosylation ont considérablement
diminué (Fig. 22).
1-9-3-Influence de la concentration de l'accepteur sur
l'activité de transglucosylation
Les rendements d'activité de transglucosylation ont
été meilleurs pour une concentration d'accepteur de 100 mM quel
que soit le donneur utilisé. Entre 400 et 600 mM, les pourcentages de
transglucosylation ont été très faibles. Il en a
été de même pour les concentrations comprises entre 25 et
50 mM (Fig. 23).
L'ensemble des paramètres physico-chimiques des
réactions catalysées par l'áglucosidase
du suc digestif de la larve de Rhynchophorus palmarum (Curculionidae)
est repris dans le tableau 14.
1-9-4-Influence de la concentration du donneur sur
l'activité de transglucosylation
Le meilleur pourcentage de transglucosylation a
été obtenu avec des concentrations de donneur de glucosyle de 400
mM. Au-delà de cette concentration, les pourcentages de
transglucosylation ont considérablement diminué (Fig.
24).
Le Tableau 14 récapitule les donnés relatif
à la détermination des conditions optimales de
transglycosylation
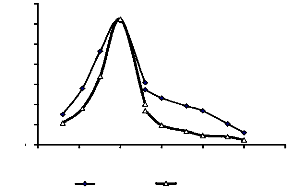
3 4 5 6 7 8 9
pH
Maltose Saccharose
70
60
Transg,lucosylalion (%)
50
40
30
20
10
0
Figure 22 : Influence du pH sur les réactions de
transglucosylation catalysées par l'áglucosidase du suc digestif
de la larve de Rhynchophorus palmarum (Curculionidae) Donneur
de glucosyle : saccharose ou maltose 400 mM. Accepteur de glucosyle : 2-
phényléthanol 100 mM. Tampon acétate 100 mM (pH 3,6-5,4)
phosphate 100 mM (pH 5,4-8). Enzyme 12 UE. Temps d'incubation : 12 h.






70
60
|
Transglueosylalion CY()
|
50 40 30 20 10
|
0
0 10 20 30 40

Temps d'incubation (h) Maltose Sucrose
Figure 23 : Influence du temps d'incubation sur les
réactions de transglucosylation catalysées par
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
Donneur de glucosyle : saccharose ou maltose 400 mM. Accepteur
de glucosyle: 2 phényléthonal 100 mM. Tampon acétate 100
mM pH 5,0. Enzyme 12 UE. Temps d'incubation : 0 à 36 h.
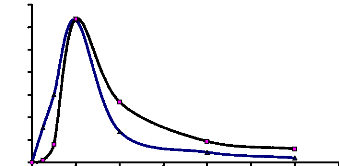
Transglucolylation (%)
40
20
70
60
50
30
10
0
0 100 200 300 400 500 600 700

2-Phényléthanol (mM)
Maltose Saccharose
Figure 24 : Influence de la concentration de
l'accepteur de glucosyle (2-phényléthanol) sur les
réactions de transglucosylation catalysées par l'
á-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
Donneur de glucosyle : saccharose ou maltose 400 mM. Accepteur
de glucosyle: 2- phényléthanol (100 à 600 mM). Tampon
acétate 100 Mm pH 5,0. Enzyme 12 UE. Temps d'incubation : 12 h.
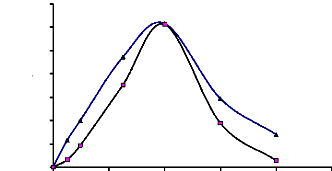
Transglucosylation (%)
40
20
70
60
50
30
10
0
0 200 400 600 800 1000
Saccharose ou maltose (mM)
Figure 25 : Influence de la concentration du donneur
de glucosyle sur les réactions de transglucosylation catalysées
par l'á-glucosidase de suc digestif de la larve Rhynchophorus
palmarum (Curculionidae)
Donneur de glucosyle : saccharose ou maltose (0 à 800
mM). Accepteur de glucosyle: 2- phényléthanol (100 à 600
mM). Tampon acétate 100 Mm pH 5,0. Enzyme 12 UE. Temps d'incubation : 12
h.
Tableau 14 : Récapitulatif des conditions
optimales des réactions de transglycosylation catalysées par
l'á-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae) et le meilleur pourcentage de
transglucosylation.
|
Paramètre physicochimique
|
Valeur
|
|
|
Saccharose
|
Maltose
|
|
pH optimum de transglucosylation
Temps d'obtention du meilleur pourcentage de transglucosylation
(h)
Concentration du donneur pour l'obtention du meilleur pourcentage
de transglucosylation (mM)
Concentration de l'accepteur pour l'obtention du meilleur
pourcentage de transglucosylation (mM)
|
5,0
12
400
100
|
5,0 12 400 100
|
|
Meilleur pourcentage de transglucosylation
(%)
|
62
|
62
|
2- Discussion
La purification à homogénéité
électrophorétique de l'á-glucosidase du
suc digestif de la larve de Rhynchophorus palmarum (Curculionidae) du
palmier Elaeis guineensis a nécessité l'utilisation de
trois étapes chromatographiques à basse pression. Ce sont les
chromatographies d'échangeuse d'anion, d'exclusion moléculaire et
d'interaction hydrophobe.
La courbe de variation d'activité en fonction de la
température de l'enzyme purifiée a donné une
température optimale d'hydrolyse de 45 °C indiquant que
l'á-glucosidase est un biocatalyseur mésophile.
Cette valeur de température optimale est identique à celle de
l'áglucosidase du microorganisme Xanthophyllomyces
dendrorhous (Marin et al., 2006) et
différente de celles des á-glucosidases de la
fraction insoluble du cristallin de bovin (50 °C) (Kamei et
Fujiyama, 1995) et des microorganismes Candida albicans (37
°C) (TorreBouscoulet et al., 2004) et
Thermomonospora curvata (54 °C) (Janda et al.,
1997).
Le pH optimum d'hydrolyse de
l'á-glucosidase est de 5,6. Il s'agit donc d'une enzyme
acide. Lorsque ce pH optimum d'hydrolyse est comparé à ceux des
á-glucosidases du muscle de lapin (pH 4,5)
(Matsui et al., 1984), du foie du lapin (pH 4,7)
(Onodera et al., 1989) et de Pichia pastoris
(pH 3,5-4,5), cette enzyme parait moins acide mais elle est plus acide
lorsqu'elle est comparée à ceux des
á-glucosidases du tube digestif de l'insecte
Rhynchosciara americana ( pH 6,0) (Terra et al.,
1977), des organes reproducteurs et du plasma du taureau (6,5-7)
(Jauhiainen et vanha-Perttula, 1985), des microorganismes
Torulaspora pretoriensis YK-1 (pH 6,8) (Oda et al.,
1993) et Thermotoga maritima (pH 7,5) (Raasch et
al., 2000).
L'á-glucosidase du suc digestif de la
larve de Rhynchophorus palmarum (Curculionidae) est une
protéine monomérique. Cette situation est identique à
celles des áglucosidases de l'insecte Drosophila
melanogaster (á-glucosidase II and III)
(Tanimura et al., 1979), de l'abeille Apis
mellifera (Nishimoto et al., 2001 ; Lee et al.,
2001) et de l'intestin de rat (Sasajima et al.,
1975), mais différente de celles des
á-glucosidases du foie de porc (Tashiro et
al., 1986), du cortex rénal de lapin (Pereira et
sivakami, 1989) et du microorganisme Sulfolobus solfutaricus
98/2 (Suzuki et al., 1987 ; Nakao et al., 1994 ;
Rolfsmeier et Blum, 1995) qui sont oligomériques.
L'á-glucosidase est inhibée par
le DTNB et le pCMB, ce qui indique la présence de groupement(s)
sulfhydryle(s) dans le site actif de l'enzyme. Ce résultat est en accord
avec ceux trouvés par Sasajima et al. (1975) et Yoshiki
et al. (2005) respectivement sur les
á-
82
glucosidases de la muqueuse de l'intestin de rat et des grains de
mil. Il est différent de celui de Prakash et al.
(1983) avec l' a-glucosidase de l'intestin de
pigeon.
L'a-glucosidase est inactive sur les
polymères de poids moléculaires élevés comme le
lichenane, le xylane, la carboxyméthylcellulose, l'inuline, l'amidon,
l'arabino-galactane. Ce résultat a été déjà
observé avec les a-glucosidases de la graine
d'épinard Spinacia oleracea (Sugimoto et al.,
1995), de Thermomonospora curvata (Janda et
al., 1997), des champignons Aspergillus niger et A.
oryzae (Kita et al., 1991). Cette enzyme ne
possède aucune activité glycosidasique contaminante telles que
les activités a-galactosidasique,
a-fucosidasique, amanosidasique,
a-arabinosidasique a-xylosidasique. Ce
comportement cinétique montre que cette enzyme est hautement
spécifique du résidu glucosyle. Elle hydrolyse de
préférence les liaisons a-(1-2) et
a-(1-4). La détermination des paramètres
cinétiques a permis d'obtenir une constante de Michaelis-Menten de 0,30
mM lorsque le
p-nitrophényl-a-D-glucopyranoside est
utilisé comme substrat. Ce résultat est identique à celui
rapporté par Kita et al. (1991), dont les
travaux ont porté sur l'étude de la spécificité de
l'a-glucosidase du champignon Aspergillus niger. Il
est différent des études réalisées par
Suzuki et al. (1997) sur
l'aglucosidase de la bactérie Bacillus
Thermoamylotiquefaciens dont la constante déterminée est de
0,56 mM. Les constantes de Michaelis Menten
déterminées avec l'a-glucosidase de la larve de
Rhynchopholorus palmarum (Curculionidae) utilisant comme substrat le
saccharose, le maltose, et le kojibiose sont respectivement de 0,42 ; 1,31 et
0,57 mM. Ces valeurs sont plus faibles que celles des
a-glucosidases du foie de rat (Lavrenova et Presnova,
1994), de l'insecte Drosophila melanogaster (Tanimura
et al., 1979) et du muscle de lapin (Matsui et
al., 1984). Les valeurs des efficacités catalytiques
(Vmax/KM) permettent de dire que l'enzyme purifiée hydrolyse
efficacement le saccharose. Cette situation laisse penser que le rôle
biologique principal de l'a-glucosidase la larve de
Rhynchophorus palmarum (Curculionidae) est la dégradation du
saccharose contenu dans la sève du palmier. Il s'agit d'une saccharase.
En plus de cette action principale, l'a-glucosidase peut
assurer efficacement la digestion du maltose et des maltodextrines (sauf
l'isomaltose) qui sont des produits d'hydrolyse de l'amidon.
La capacité de l'a-glucosidase de la
larve de Rhynchophorus palmarum (Curculionidae) à catalyser des
réactions de transglucosylation a été testée. Le
saccharose et le maltose ont été utilisés comme donneurs
de glucosyle et le 2-phényléthanol comme accepteur de
glucosyle.
L'intérêt du choix de ces substrats comme donneurs
de glucosyle est dû à leur capacité à
être
facilement hydrolysés par l'a-glucosidase
du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae). Quant à l'accepteur
de glucosyle, il présente également des avantages. En effet, le
phényléthanol est un composé insoluble dans l'eau. Cette
propriété est caractéristique de la plupart des
macromolécules naturelles. Les produits
(phényléthylglucoside) des réactions de transglucosylation
sont facilement quantifiables par absorbance UV. Pour cette facilité de
détection, le phényléthanol a été
déjà utilisé pour étudier les activités de
transglycosylation de glycosidases du champignon Aspergillus
oryzae (Fortun et Colas, 1991), de l'escargot
géant Achatina achatina (Leparoux et al.,
1997), de la bactérie Thermus
thermophilus (Dion et al., 1999) et de
Macrotermes subhyalinus (Kouamé et al., 2001,
2005a). Les conditions expérimentales de transglucosylation ont
été optimisées au niveau de certains facteurs capables
d'influencer le taux de transglucosylation. Le pH optimum de transglucosylation
de l'a-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) est de 5,0. Cette valeur est
différente du pH optimum d'hydrolyse (5,6). Pour expliquer cette
différence de pH, Huber et al. (1983) ont
suggéré l'existence d'un groupement ionique avec une grande
valeur de pKa au niveau du site actif, ce qui affecterait l'hydrolyse mais pas
la transglycosylation. Aussi, cette différence pourrait-elle s'expliquer
par le taux d'hydrolyse de la liaison glycosidique qui décroît
avec une augmentation du pH de manière à induire le changement
observé (Huber et al., 1983). Dans le cas de
l'a-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae), la différence de pH
optimum des réactions d'hydrolyse et de transglucosylation n'est pas
significative, ce qui ne permet pas de conduire à des réactions
de synthèse à cause de l'hydrolyse rapide des produits de
transglucosylation formés. Ainsi, le taux de transglucosylation est plus
important que celui de l'hydrolyse du produit formé. Le temps de
réaction apparaît comme un paramètre important car certains
produits formés durant les réactions de transglucosylation
peuvent être utilisés comme substrats et être
hydrolysés. Pour l'a-glucosidase étudiée,
un taux maximum de transglucosylation a été obtenu dans un temps
relativement court (environ 12 h) sans qu'il n'y ait eu hydrolyse des produits
formés au cours de la transglucosylation. Apres 12 h de réaction,
le pourcentage de transglucosylation a diminué. Le produit formé
au cours de la réaction de transglucosylation pourrait être le
phényléthyl-a-D-glucoside. Ce résultat
suggère que l'a-glucosidase hydrolyse le produit
formé par son extrémité non réducteur en
libérant l'a-glucose. Ce comportement montre que
l'a-glucosidase purifiée a opéré par
rétention de configuration anomérique. Le taux de
transglucosylation obtenu avec le 2-phényléthanol (62 %) est plus
élevé que ceux rapportés dans la littérature avec
les sources conventionnelles de glycosidases (E.coli, A. oryza).
Conclusion
La larve de Rhynchophorus palmarum (Curculionidae)
possède dans son suc digestif une á-glucosidase
acide mésophile qui a été purifiée à
homogénéité électrophorétique. Cette enzyme
semble être différente des á-glucosidases
des autres sources enzymatiques jusque là rapportées par les
travaux des différents auteurs lorsqu'on tient compte de la
spécificité de substrat, des constantes de Michaelis et
Menten et des activités transglucosidasiques
élevées. Cette enzyme est une saccharase. Son rôle
biologique principal dans le suc digestif de la larve est d'hydrolyser le
saccharose. Cependant, elle dégrade efficacement le maltose et les
maltodextrines. Cette enzyme pourrait être utilisée comme outil de
choix dans l'analyse structurale des chaînes d'oligosaccharides, de
polysaccharides, de glycoprotéines et de glycolipides. Elle peut aussi
être utilisée pour la synthèse des
glycoconjugués.
III- PURIFICATION ET CARACTERISATION PHYSICO-CHIMIQUE
DE LA â-GLUCOSIDASE DU SUC DIGESTIF DE LA LARVE DE
Rhynchophorus palmarum (Curculionidae)
1-Résultats
1-1-Stratégie de purification
La stratégie de purification utilisée pour
isoler à homogénéité
électrophorétique la âglucosidase du suc
digestif de la larve de Rhynchophorus palmarum (Curculionidae) est
identique à celle décrite précédemment.
1-1-1-Chromatographie échangeuse d'anion sur gel
de DEAE-Sepharose CL 6B
Cette étape chromatographique a permis non seulement
d'éliminer une bonne partie des pigments mais aussi de retenir une seule
activité â-glucosidasique sur le gel
DEAESepharose CL 6B. Cette activité a été
éluée à la concentration de 0,2 M de KCl (Fig.
26). L'activité spécifique de cette enzyme a
été de 4,53 UE/mg. Le rendement et le facteur de purification ont
été respectivement de 60,00 % et 6,56 % (Tableau
15).
1-1-2-Fractionnement au sulfate d'ammonium
Cette étape a permis d'améliorer le facteur de
purification passant de 6,57 à 10,14. Le rendement obtenu a
été de 38,77 % (Tableau 15).
1-1-3-Chromatographie d'exclusion moléculaire sur
gel de Sephacryl-100 HR
Cette étape chromatographique a permis non seulement
d'obtenir un seul pic d'activité â-glucosidasique
mais aussi d'éliminer le reste des pigments contenus, dans la solution
enzymatique (Fig. 27). L'enzyme responsable de l'hydrolyse du
p-nitrophenyl-â-D-glucoside a eu une
activité spécifique de 9,37 UE/mg de protéine. Le facteur
de purification et le rendement ont été respectivement de 13,58
et 16,2 % (Tableau 15).
1-1-4-Chromatographie d'interaction hydrophobe sur gel de
Phényl-Sepharose CL-4B
Une seule â-glucosidase a
été isolée (Fig. 28). Elle a
été éluée par le thiosulfate de sodium 0,2 M
préparé dans le tampon acétate 100 mM pH 5,6. Son
activité spécifique a été de 25,10 UE/mg. Le
facteur de purification et le rendement ont été respectivement de
36,38 et 4,47 % (Tableau 15).
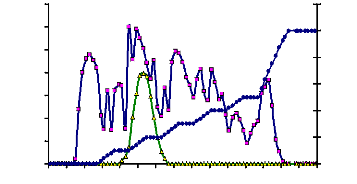
Activite relative (DO 410
nm)
KC1(M)
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150
1,2
1
0,8
0,6
0,4
0,2
0
3,5
3
2,5
2
1,5
1
0,5
0
Nombre de fraction
DO 280 nm DO 410 nm KCl (M)


Figure 26 : Profil chromatographique d'échange
d'anion de la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de D.E.A.ESepharose CL
6B.
La colonne (2,4 x 6,5 cm) a été
équilibrée dans le tampon acétate 100 mM pH 5,6. Le
débit chromatographique a été de 14 ml/h. Les
protéines retenues par le gel sont décrochées par un
gradient en palier croissant de KCl préparé dans le tampon
acétate 100 mM pH 5,6. Des fractions de 4 ml ont été
collectées.
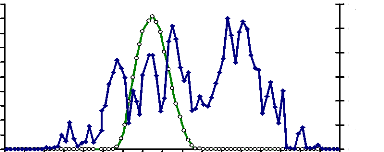
0,6
0,5
0,4
0,3
0,2
0,1
0
Protein (D0280 mn)
2
1,8
Activite relative (D0410 mn)
1,6
1,4
1,2
1
0,8
0,6
0,4
0,2
0
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160 170
Nombre de fraction
DO 410 nm DO 280 nm


Figure 27 : Profil chromatographique d'exclusion
moléculaire de la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de Sephacryl100
HR.
La colonne (1,6 x 64) a été
équilibrée dans le tampon acétate 100 mM pH 5,6. Le
débit chromatographique a été de 15 ml/h. Les
protéines ont été éluées par le tampon
acétate 100 mM pH 5,6. Des fractions de 1 ml ont été
collectées.
Thiosulfate de sodium (M)
|
Activite relative (DO 410 nm)
Protein (DO 660
nm)
|
2,5 2 1,5 1 0,5 0
|
|
0,5 0,4 0,3 0,2 0,1 0
|
|
0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80
|
Nombre de fraction
|
DO 660 nm DO 410nm thiosulfate de sodium
(M))
|
Figure 28 : Profil chromatographique d'interaction
hydrophobe de la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de
PhénylSepharose CL-4B
La colonne (1,4 x 5 cm) a été
équilibrée dans le tampon acétate 100 mM pH 5,6 contenant
du thiosulfate de sodium 1,7 mM. Le débit chromatographique a
été de 14 ml/h. les protéines retenues par le gel ont
été décrochées par un gradient en palier
décroissant de thiosulfate de sodium préparé dans le
tampon acétate 100 mM pH 5,6. Des fractions de 1 ml ont
été collectées.
Tableau 15 : Bilan global de purification de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
|
Etape de purification
|
Activité totale (U.E.)
|
Protéine (mg)
|
Activité spécifique (U.E/mg)
|
Facteur de purification
|
Rendement (%)
|
|
Extrait brut enzymatique
|
39,30
|
57,36
|
0,69
|
1
|
100
|
|
D.E.A.E Sepharose CL-
|
22,40
|
4,15
|
4,53
|
6,56
|
60,00
|
|
6B
|
|
|
|
|
|
|
Précipitation au sulfate
d'ammonium (80% de
saturation)
|
15,24
|
0,75
|
7,00
|
10,14
|
38,77
|
|
Sephacryl S-100 HR
|
6,37
|
0,68
|
9,37
|
13,58
|
16,21
|
|
Phényl-Sepharose CL-4B
|
1,75
|
0,07
|
25,10
|
36,38
|
4,47
|
UE= 1 micromole de p-nitrophénolate par min
1-2-Critère de pureté
L'électrophorèse sur gel de polyacrylamide en
présence de SDS et de â-mercaptoéthanol a
permis d'observer une seule bande protéique, traduisant une
pureté satisfaisante de la â-glucosidase du suc
digestif de la larve Rhynchophorus palmarum (Curculionidae)
(Fig. 29).
1-3-Masses moléculaires de la
â-glucosidase
Les masses moléculaires de la
â-glucosidase déterminées en gel de filtration sur
la colonne TSK et en électrophorèse sur gel de polyacrylamide en
présence de SDS et de âmercapto-éthanol
ont été respectivement de 60 et de 58 kDa. Cette
similarité de masse moléculaire montre que l'enzyme est
monomérique (Tableau 16).
116,25 kDa
66,2 kDa
200 kDa
97,4 kDa
45 kDa

2 1
Figure 29 : â-glucosidase du suc
digestif de la larve de Rhynchophorus palmarum (Curculionidae)
purifiée par électrophorèse palmarum.
Ligne 2, protéines de référence. ligne 1,
beta-glucosidase.
Tableau 16 : Masses moléculaires de la
â-glucosidase du suc digestif de la larve du Rhynchophorus palmarum
(Curculionidae)
Masses Nombre de
Méthode de détermination de la masse
moléculaire moléculaire sous-unité
(kDa)
Gel de filtration sur la colonne TSK 60 1
Electrophorèse sur gel de polyacrylamide en
présence de SDS et de
â-mercaptoéthanol 58
1-4-Influence du pH sur la â-glucosidase 1-4-1-pH
optimum d'hydrolyse
La â-glucosidase a
présenté son activité maximale dans le tampon
acétate 100 mM pH 5,0 (Tableau 17). Elle a
conservé plus de 70 % de son activité hydrolytique dans un
domaine de pH allant de 4,6 à 6,0. Aux pH compris entre 6,6 et 8,0,
l'enzyme a présenté une faible activité ne
dépassant pas 40 % (Fig. 30).
1-4-2-Stabilité au pH
La â-glucosidase du suc digestif de la
larve de Rhynchophorus palmarum (Curculionidae) a été
stable pendant 2 h dans le tampon acétate 100 mM aux pH compris entre
5,0 et 6,0 (Fig. 31).
1-4-3- Influence de la force ionique du
tampon
La force ionique n'a exercé aucune influence sur les
valeurs des pH optima d'hydrolyse de la â-glucosidase
purifiée du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae) (Tableau 17).
Activite relative (%)
100
40
20
60
80
0
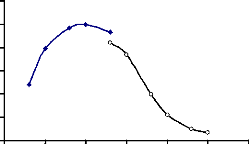
100
Activite relative (%)
40
20
60
80
0
3 4 5 6 7 8 9

pH
Tampon acétate 100 mM (pH 3,6 - 5,6) Tampon phosphate 100
mM (pH 5,6 - 8,0)
Figure 30 : pH optimum d'hydrolyse de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae).
Le pH optimum d'hydrolyse du
p-nitrophényl-â-D-glucoside a
été déterminé dans les tampons acétate 100
mM (pH 3,6 à 5,6) et phosphate 100 mM (pH 5,6 à 8,0).
L'activité enzymatique a été déterminée dans
les conditions standard.
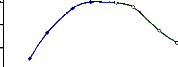


3 4 5 pH6 7 8

Tampon acétate Tampon phosphate
Figure 31 : Stabilité au pH de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
L'enzyme a été pré-incubée pendant
2 h à 37 °C dans les tampons acétate et phosphate 100 mM
pour des valeurs de pH comprises entre 3,6 et 8,0. L'activité
enzymatique a été déterminée dans les conditions
standard.
1-5- Influence de la température sur la
â-glucosidase
1-5-1-Température optimale d'hydrolyse,
énergie d'activation et le Q10
La â-glucosidase a eu une
température optimale d'hydrolyse de 55 °C dans le tampon
acétate 100 mM pH 5,0. Aux températures comprises entre 40
°C et 60 °C, elle a conservé plus de 60 % de son
activité hydrolytique (Fig. 32). Le Q10 de
la â-glucosidase, déterminé selon
Arrhenius entre 40 et 50 °C a été de 1,90.
L'énergie d'activation (Ea) de l'enzyme a été de 68,77
Kj/mol (Tableau 17).
1-5-2-Inactivation thermique
A 55 °C, la â-glucosidase s'est
rapidement dégradé. Son activité résiduelle a
été de 50 % après 45 min de pré-incubation dans le
tampon acétate 100 mM pH 5,0 (Tableau 17). En 2 h 20
min de pré-incubation dans ce même tampon, elle a totalement perdu
son activité hydrolytique (Fig. 33). A 37 °C, la
â-glucosidase a conservé toute son
activité dans le même tampon pendant plus de 2 h de temps de
pré-incubation.
1-5-3-Dénaturation thermique
La â-glucosidase a été
stable entre 30 et 55 °C pendant 10 min de pré-incubation dans le
tampon acétate 100 mM pH 5,0. Au-delà de 55 °C,
l'activité a brutalement chuté pour traduire une importante
dénaturation de la â-glucosidase (Fig.
34).
1-5-4-Conservation au froid
Une conservation prolongée par congélation de la
â-glucosidase purifiée du suc digestif de la
larve de Rhynchophorus palmarum (Curculionidae) contenu dans le tampon
acétate 100 mM pH 5,0 n'a pas modifié l'activité
hydrolytique du biocatalyseur pendant un an (Fig. 35).

|
100
|
|
|
|
|
Activite relative (%)
|
80
|
|
|
|
60
|
|
|
|
40
|
|
|
|
20
0
|
|
|
|
|
|
|
|
|
|
|
|
20 30 40 50 60 70 80 90
Température (°C)
Figure 32 : Température optimale d'hydrolyse de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
La température optimale d'hydrolyse du
p-nitrophényl-â-glucoside a
été déterminée à différentes
températures (35 à 80 °C) dans le tampon acétate 100
mM pH 5,6. L'activité enzymatique a été
déterminée dans les conditions standard.
|
Activite residuelle (%)
|
120 100 80 60 40 20
0
|
|
0 20 40 60 80 100 120 140 160

Temps (min)
T (37 °C) T (55 °C)
Figure 33 : Inactivation thermique de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
L'enzyme a été pré-incubée aux
températures de 35 et 55 °C pendant des temps compris entre 0 et
140 min. L'activité enzymatique a été
déterminée dans les conditions standard.
|
Activite residuelle (%)
|
120 100 80 60 40 20
0
|
|
|
|
|
30 40 50 60 70 80 90
Température de pré-incubation
(°C)
Figure 34 : Dénaturation thermique de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
L'enzyme a été pré-incubée pendant
10 min à des températures comprises entre 30 et 80 °C, puis
refroidie à la température ambiante. L'activité
résiduelle a été déterminée dans les
conditions standard.





120
100
Activite relative (%)
80
60
40
20
0
0 1 2 3 4 5 6 7 8 9 10 11 12
Durée de
congélation à 0 °C (mois)
Figure 35 : Effet de la congélation de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae) dans le tampon acétate 100 mM à pH
5,0
Tableau 17 : Quelques caractéristiques de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
Caractéristiques Résultat
pH optimum d'hydrolyse 5,0
Force ionique non
Stabilité au pH 5,6 - 6,0
Température optimale d'hydrolyse 55 °C
1/2 vie à 55 °C (min) 45
Energie d'activation (Kj/mole) 68,77
Q10 1,90
1-6-Spécificité du substrat
1-6-1-Activité sur les
p-nitrophényl-D-glycosides
La spécificité de substrat de la
f3-glucosidase a été testée sur un grand
nombre de pnitrophényl-D-glycosides. Elle n'a seulement
hydrolysé que le pNP-f3-D-glucopyranoside. Ce
biocatalyseur possède donc une spécificité stricte
vis-à-vis du résidu glucosyle en position f3
(Tableau 18).
1-6-2-Activité sur les oligosaccharides et
polysaccharides
La vitesse d'hydrolyse de la f3-glucosidase
augmente lorsque la chaîne de glucose des cellodextrines s'allonge
jusqu'à 3 unités de glucose. Au-delà de 3 unités,
la vitesse de la réaction diminue. Les liaisons
f3(1-2), f3(1-3) et f3(1-6)
ont été faiblement hydrolysées (Tableau
19). La f3-glucosidase n'a pas hydrolysé le
lactose, le saccharose, le xylobiose et le maltose. Il en a été
de même pour les polysaccharides tels que l'arabino-galactane, la
carboxyméthylcellulose, l'inuline, le lichenane, la laminarine, le
xylane et l'amidon
(Tableau 19).
Tableau 18 : Activité hydrolytique de la
fi-glucosidase sur les p-nitrophényl-D-glycosides
Substrats Activité
p-nitrophényl-â-glucoside
D
p-nitrophényl-á-glucoside
ND
p-nitrophényl-á-mannoside ND
p-nitrophényl-â-mannoside ND
p-nitrophényl-á-mannoside
ND
p-nitrophényl-â-galactoside
ND
p-nitrophényl-á-galactoside
ND
p-nitrophényl-á-fucoside
ND
p-nitrophényl-â-fucoside
ND
p-nitrophényl-á-arabinoside
ND
p-nitrophényl-â-arabinoside
ND
p-nitrophényl-â-xyloside
ND
p-nitrophényl-á-xyloside
ND
D : Dégradé N.D : Non
dégradé
Tableau 19 : Spécificité de substrat
(oligosaccharides et polysaccharides) de la fglucosidase du suc digestif de la
larve de Rhynchophorus palmarum (Curculionidae)
Substrats
(oligosaccharides et Structure de substrat
Activité (%)
polysaccharides)
Cellobiose Glcâ(1-4)Glc 100
Cellotriose
Glcâ(1-4)Glcâ(1-4)Glc 130
Cellotetraose
Glcâ(1-4)Glcâ(1-4)Glcâ
(1-4)Glc 120
Cellopentaose
Glcâ(1-4)Glcâ(1-4)Glcâ
(1-4)Glcâ(1-4)Glc 91
Sophorose Glcâ(1-2)Glc 42
Laminaribiose Glcâ(1-3)Glc 12
Gentiobiose Glcâ(1-6)Glc 7
Lactose Galâ(1-4)Glc 0
Saccharose Glcá(1-2)Fru 0
Xylobiose Xylâ(1-4)Xyl 0
Maltose Glcá(1-4)Glc 0
Arabino-galactane Polymère de Ara et de Gal 0
Carboxyméthylcellulose
[Glcâ(1-4)Glc-]n 0
Inuline [-Fru â(1-2)Fru-]n 0
Lichenane Polymère de Glc 0
Laminarine Polymère de Glc 0
Xylane Polymère de xyl 0
Amidon Polymère de Glc 0
n = nombre entier naturel très supérieur à
10
1-7-Paramètres cinétiques
Les valeurs de la constante de Michaelis-Menten (KM) et de la
vitesse maximale (Vmax) d'hydrolyse de
pNP-â-D-glucopyranoside ont été
respectivement de 0,25 mM et de 62,20 UE/mg de protéine. Avec le
cellobiose, les valeurs de KM et de Vmax ont respectivement
été de 0,31 mM et 43,23 UE/mg de protéine.
L'efficacité catalytique donnée par le rapport Vmax/KM a
été plus élevée avec le
pNP-â-glucopyranoside qu'avec le cellobiose
(Tableau 20).
Tableau 20 : Quelques paramètres cinétiques
de la â-glucosidase du suc digestif de la larve de Rhynchophorus
palmarum (Curculionidae)
Substrats KM (mM) Vmax (UI/mg) Vmax/ KM (UI/mg x
mM)
|
pNP-â-glucopyranoside
|
0,25
|
62,20
|
248,80
|
|
Cellobiose
|
0,31
|
43,23
|
139,45
|
1-8-Action des agents chimiques
Les ions métalliques K+ et Na+
ont exercé un léger effet activateur sur la
âglucosidase, tandis que les agents chimiques
Cu2+, Zn2+, Fe3+, DTNB (5,5-dithio-bis(2-
nitrobenzoate)), pCMB (para-chloromercuribenzoate), EDTA et
SDS ont inhibé son activité. Les ions divalents Ba2+,
Mg2+, Sr2+, Ca2+ n'ont eu aucun effet sur la
même activité enzymatique (Tableau 21).
Tableau 21 : Effet de quelques agents chimiques sur la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
|
Agent chimique
|
Concentration
(% ou mM)
|
Activité relative
(%)
|
|
Témoin
|
1
|
100
|
|
Ba2+
|
1
|
100
|
|
Mg2+
|
1
|
100
|
|
Mn2+
|
1
|
100
|
|
Sr2+
|
1
|
100
|
|
Ca2+
|
1
|
100
|
|
Ions
|
Cu2+
|
1
|
13
|
|
Zn2+
|
1
|
67
|
|
Na+
|
1
|
110
|
|
K+
|
1
|
119
|
|
EDTA
|
1
|
82
|
|
Fe3+
|
1
|
71
|
|
Tris
|
1
|
100
|
|
â-mercapto-éthanol
|
0,1
|
86
|
|
pCMB
|
0,1
|
56
|
|
Réducteurs
|
|
|
|
|
DTNB
|
0,1
|
8
|
|
L-cystéine
|
0,1
|
95
|
|
Triton X-100
|
0,1
|
100
|
|
Tween 80
|
0,1
|
100
|
|
Détergents
|
SDS
|
0,1
|
58
|
|
Urée
|
0,1
|
94
|
|
Guanidine
|
0,1
|
100
|
1-9-Réactions de transglucosylation
catalysées par la â-glucosidase 1-9-1-Influence du pH sur
l'activité de transglucosylation
Lorsque le cellobiose et le 2-phényléthanol ont
été utilisés respectivement comme donneur et accepteur de
glucosyle dans la réaction de transglucosylation catalysée par la
âglucosidase, le pH optimum a été de 6,6
(Fig. 36).
1-9-2-Influence du temps d'incubation sur
l'activité de transglucosylation
Le pourcentage maximum de synthèse du
phényléthylglucoside a été obtenu en 16 h de
réaction. Cette valeur a été de 20 %. Après 16 h de
réaction, le pourcentage de transglucosylation a considérablement
diminué pour atteindre 8 % (Fig. 37) en 36 h de
réaction.
1-9-3-Influence de la concentration de l'accepteur
Le meilleur pourcentage de transglucosylation a
été obtenu pour une concentration d'accepteur de glucosyle
(2-phényléthanol) de 100 mM lorsque la concentration du donneur
de glucosyle (cellobiose) a été de 400 mM. Entre 0 et 50 mM, les
pourcentages de transglucosylation ont été très faibles et
n'ont pas dépassé 7 % (Fig. 38).
1-9-4-Influence de la concentration du donneur
Le meilleur pourcentage de transglucosylation a
été obtenu avec une concentration de donneur de glucosyle de 400
mM. Au-delà de cette concentration, ce pourcentage a
considérablement diminué pour atteindre 1 % à 800 mM
(Fig. 39).
Le Tableau XXII récapitule les donnés relatif
à la détermination des conditions optimales de
transglycosylation.
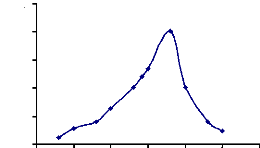
Transglucosylation (%)
25
20
15
10
0
5
3 4 5 6 7 8 9
pH
Figure 36 : Influence du pH sur la réaction de
transglucosylation catalysée par la âglucosidase du suc digestif
de la larve de Rhynchophorus palmarum (Curculionidae) Donneur
de glucosyle : cellobiose 400 mM. Accepteur de glucosyle:
2-phényléthanol 100 mM. Tampon acétate 100 mM (pH 3,6-5,6)
phosphate 100 mM (pH 5,6-8). Enzyme 12 UE. Temps d'incubation : 16 h.
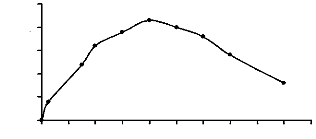
0 4 8 12 16 20 24 28 32 36 40
Transglucosylation (%)
25
20
15
10
0
5
Temps d'incubation (h)
Figure 37 : Influence du temps d'incubation sur la
réaction de transglucosylation catalysée par la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
Donneur de glucosyle : cellobiose 400 mM. Accepteur de glucosyle:
2-phényléthanol 100 mM. Tampon phosphate 100 mM pH 6,6. Enzyme 12
UE. Temps d'incubation : 16 h.
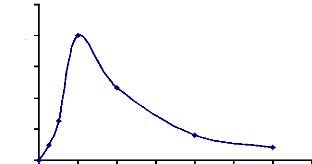
Tansglucosylation (%)
25
20
15
10
0
5
0 100 200 300 400 500 600 700
2-Phényléthanol (mM)
Figure 38 : Influence de la concentration de
l'accepteur (2-phényléthanol) sur la réaction de
transglucosylation catalysée par la â-glucosidase du suc digestif
de la larve de Rhynchophorus palmarum (Curculionidae)
Donneurs de glucosyle : cellobiose 400 mM. Accepteur de
glucosyle: 2-phényléthanol (0 à 600 mM). Tampon phosphate
100 mM pH 6,6. Enzyme 12 UE. Temps d'incubation : 16 h.
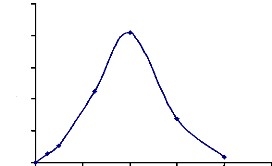
Transg,lucosilation (%)
25
20
15
10
0
5
0 200 400 600 800 1000
Cellobiose (mM)
Figure 39 : Influence de la concentration du donneur
de glucosyle (cellobiose) sur la réaction de transglucosylation
catalysée par la â-glucosidase purifiée du suc digestif de
la larve de Rhynchophorus palmarum (Curculionidae)
Donneurs de glucosyle : cellobiose (0 à 800 mM). Accepteur
de glucosyle: 2-phényléthanol 100 mM. Tampon phosphate 100 mM pH
6,6. Enzyme 12 UE. Temps d'incubation : 16 h.
Tableau 22 : Récapitulatif des conditions
optimales des réactions de transglycosylation catalysées par la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae) et le meilleur pourcentage de
transglucosylation.
Paramètre physicochimique Valeur
pH optimum de transglucosylation 6,6
Temps d'obtention du meilleur pourcentage de transglucosylation
(h) 16
Concentration du donneur pour l'obtention du meilleur 400
pourcentage de transglucosylation (mM)
Concentration de l'accepteur pour l'obtention du meilleur 100
pourcentage de transglucosylation (mM)
Meilleur pourcentage de transglucosylation (%)
20
131
2-Discussion
La â-glucosidase du suc digestif de la
larve de Rhynchophorus palmarum (Curculionidae) a été
purifiée à homogénéité
électrophorétique selon un protocole de purification comprenant
trois étapes chromatographiques. Ce sont la chromatographie
d'échange d'anion, la chromatographie sur gel filtration et la
chromatographie d'interaction hydrophobe. Le facteur de purification obtenu
à la fin de la purification de la â-glucosidase a
été inférieur à ceux obtenus avec les
â-glucosidases de la larve de Tenebrio
molitor (Ferreira et al., 2001), des petites
foreuses de la canne à sucre, Diatraea
saccharalis (Azevedo et al., 2003) et des
ouvriers du termite Macrotermes subhyalinus. Cependant, ce facteur de
purification a été plus élevé que ceux des
â-glucosidases de l'ouvrier du termite Macrotermes
mulleri (Rouland et al., 1992), de la
bactérie anaérobique intestinale humaine Fusobacterium
K-60 (Park et al., 2001) et de la larve de lumen de
Tenebrio molitor (Ferreira et al., 2003).
La similitude de poids moléculaire
déterminés sur gel de polyacrylamide en présence de SDS et
beta-mercapto-éthanol et sur gel de filtration suggère que la
â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) est monomérique comme
celle du foie humain (Mutoh et al., 1988) et du
microorganisme Thermus spIB-21 (Kang et al.,
2005).
L'enzyme a été inhibée par le DTNB et le
pCMB. Ceci peut s'expliquer par la présence de groupement(s)
sulfhydryle(s) dans le site actif de l'enzyme. Des résultats identiques
ont été rapportés par Ogawa (1990) et
Taniguchi et Takano (2004) respectivement avec les
â-glucosidases d'Actinidia chinensis,
Leuconostoc mesenteroides et de l'intestin de tilapia.
L'étude de l'hydrolyse de différents glycosides
a permis de tester leur capacité à servir comme substrat. Ainsi,
la â-glucosidase du suc digestif de la larve de
charançon Rhynchophorus palmarum (Curculionidae) est
restée inactive sur les polysaccharides tels que le lichenane, le
xylane, la carboxylméthylcellulose, l'inuline, l'amidon,
l'arabino-galactane et la laminarine. Aucune activité glycosidasique
contaminante telles que les activités
âgalactosidasique,
â-fucosidasique,
â-mannosidasique,
â-arabinosidasique et
â-xylosidasique n'a été signalée.
Les seuls substrats qui ont été hydrolysés par l'enzyme
sont le cellobiose, les cellodextrines, le sophorose, le gentiobiose et le
p-nitrophényl-â-D-glucopyranoside. Ces
résultats montrent que la â-glucosidase est une
exoglucosidase avec une spécificité stricte pour la configuration
anomérique â et du résidu glucosyle. Ce
comportement semble refléter ceux des
â-glucosidases des champignons microscopiques
Sclerotium rolfsii (Shewale et
Sadana, 1981) et Aspergillus
niger (Watanabe et al., 1992). Il est
néanmoins différent de ceux trouvés chez la plupart des
â-glucosidases des insectes.
La constante de Michaelis-Menten (KM) pour le cellobiose (un
produit clé d'hydrolyse de la cellulose par l'exo- et
l'endo-â-D-glucanase) est inférieure à
celles rapportées dans la littérature (Sternberg et
al., 1977 ; Workman et Day, 1982 ; Wase et al., 1985).
La faible valeur de KM obtenue, suggère que cette enzyme purifiée
a une grande affinité pour le cellobiose et pourrait être
utilisée dans le processus de saccharification industrielle de la
cellulose. Le rôle physiologique de la
â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) serait la digestion de di et
d'oligo-saccharides issus de la dégradation de la cellulose ou de
l'hémicellulose.
La capacité de la â-glucosidase
du suc digestif de la larve de Rhynchophorus palmarum (Curculionidae)
à catalyser des réactions de transglucosylation a
été testée avec le cellobiose et le
2-phényléthanol comme respectivement donneur et accepteur de
glucosyle. Le 2-phényléthanol a été utilisée
pour étudier les activités de transglycosylation de la
âglucosidase d'Aspergillus oryzae
(Fortun et Colas, 1991), d'Achatina achatina
(Leparoux et al., 1997), de Thermus
thermophilus (Dion et al., 1999) et de
Macrotermes subhyalinus (Kouamé et al., 2001,
2005a, 2005b) en raison de la facile quantification par absorbance
dans l'UV des produits de transglycosylation
(phényléthylglycosides). Les conditions expérimentales ont
été optimisées par rapport aux facteurs capables d'avoir
une influence sur le taux de transglucosylation. La
â-glucosidase a un pH optimum de transglucosylation (pH
6,6) différent de celui de la réaction d'hydrolyse (pH 5,0). Pour
expliquer cette différence, Huber et al.
(1983) ont suggéré qu'il existe un groupement avec une
valeur de pKa élevée au niveau du site actif qui affecterait
l'hydrolyse mais pas la transglycosylation. Une autre hypothèse serait
que le taux d'hydrolyse de la liaison glycosidique décroît avec
une augmentation du pH de manière à induire le changement
observé (Huber et al., 1983). Dans le cas de
la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae), la variation observée
entre les pH optima d'hydrolyse et la transglycosylation n'a pas
été significative et n'a présenté aucune
opportunité pour favoriser la réaction de synthèse sans
une hydrolyse rapide des produits formés par transglucosylation.
Après 16 h de réaction, les produits formés ont
été hydrolysés par la â-glucosidase
du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae). L'enzyme ne reconnaissant que le résidu
glucosyle et l'anomérie â, le produit
formé au cours de la réaction de transglucosylation ne peut
être que le phényléthyl-â-glucoside.
Ce résultat suggère que la âglucosidase
hydrolyse le cellobiose à partir de son extrémité
non-réductrice pour libérer le â-
133
glucose. Ce mécanisme réactionnel indique que
cette enzyme a opéré par mécanisme de rétention de
configuration anomérique comme c'est le cas des enzymes appartenant aux
familles 1 et 3 des glycosides hydrolases (Henrissat, 1991, 1998 ;
Henrissat et Bairoch, 1993). Le rendement de transglucosylation (20 %)
obtenus avec le 2-phényléthanol et le cellobiose comme
respectivement accepteur et donneur de glucosyle est inférieur à
ceux rapportés par certains auteurs sur d'autres sources de
â-glucosidase (A.oryzae, E. coli).
Conclusion
En tenant compte de sa spécificité de substrat
et de sa grande affinité pour le cellobiose, la
â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) semble être
différente de celles des autres sources enzymatiques
étudiées jusqu'ici. Le rôle physiologique de cette enzyme
est la digestion du cellobiose et des cellodextrines issue de la
dégradation de la cellulose et des hémicelluloses du palmier.
L'enzyme pourrait être utilisée comme outil de choix dans
l'analyse structurale des oligosaccharides, des polysaccharides, des
glycoprotéines et des glycolipides.
REFERENCES BIBLIOGRAPHIQUES
Abo-khatwa N (1978). Cellulase of fungus growing
termites: a new hypothesis on its origin. Experientia. 34
: 559-560.
Ajisaka K, Nichida H, Fujimoto H (1987). Use
of an activated carbon column for the synthesis of disaccharides by use of
reversed hydrolysis activity of â-galactosidase.
Biotechnol. Lett. 9 : 387-392.
Ajisaka K, Fujimoto H (1990). Regioselective
syntheses of trehalose-containing
trisaccharides using various glycohydrolases. Carbohydr.
Res. 199 : 227-234.
Aleshin AE, Stoffer B, Firsov L.M, Svensson B,
Honzatko RB (1996). Crystallographic complexes of glucoamylase with
maltooligosaccharide analogs: relationship of stereochemical distortions at the
nonreducing end to the catalytic mechanism. Biochemistry
35 : 8319-8328.

Aragón JJ,
Cañada FJ, Fernández-Mayoralas
A, López R, Martín-Lomas
M, Villanueva D (1996). A direct
enzymatic synthesis of beta-D-galactopyranosyl-D-xylopyranosides and their use
to evaluate rat intestinal lactase activity in vivo. Carbohydr.
Res. 290 : 209-2016.
Azevedo TR, Terra WR, Ferreira C (2003).
Purification and characterization of three betaglycosidases from midgut of the
sugar cane borer, Diatrea saccharalis. Insect Biochem. Mol. Biol.
33 : 81-92.
Baker JE (1983). Properties of amylase from
midguts of larvae of Sitophilus zeamais and Sitophilus
granaries. Insect Biochem. 13 : 421-428.
Baker JE (1987). Purification of isoamylase
from the rice weevil, Sitophilus oryzae (L.) (Coleoptera:
Curculionidae), by high-performance liquid chromatography and their
interaction with partially-purified amylase inhibitors from wheat. Insect
Biochem. 17 : 37-44.
Baker JE (1989). Interaction of
partially-purified amylase from larval Anagasta kuehniella
(Lepidoptera: Pyralidae) with amylase inhibitors from wheat. Comp.
Biochem. Physiol. 93B: 239-246.
Baker JE (1991). Properties of glycosidases from
the maize weevil, Sitophilus zeamais. Insect Biochem.
21: 615-621.
Baker JE, Woo SM (1985). Purification and
partial characterization and postembryonic levels of amylases from
Sitophilus oryzae and Sitophilus granaries. Arch.
Insect Biochem. Physiol. 12: 415-428.
135
Baker JE, Woo SM (1992).
â-glucosidases in the rice weevil, Sitophilus
oryzae: purification, properties, and activity levels in wheat and
legume-feeding strains. Insect Biochem. Mol. Biol. 22
: 495-504.
Baldo F, Roger V (2002). Topical composition
containing a hydroxystilbene and a polyol. EP Patent 1
: 234-571.
Bank WM (1963). Carbohydrate digestion in the
cockroach. Science 141: 1191-1192. Barker RJ,
Lehner Y (1972). A look at honey bee gut functions. Am. Bee
J. 112: 336-338.
Barnett JE (1971). An acid-galactosidase from
the albumen gland of Helix aspersa. Comp. Biochem. Physiol.
40 B : 585-592.
Bauer MW, Halio SB, Kelly RM (1996). Proteases
and glycosyl hydrolases from hyperthermophilic micro-organisms. Adv.
Protein Chem. 48 : 271-310.
Becker KC, Khul P (1999). Synthesis of
O-â-galactopyranosyl-L-Serine derivatives using
â-galactosidase in aqueous-organic reaction system.
J. Carbohydr. Chem. 18 : 121-129.
Beq QK, Kapoor K, Mahajan L, Hoondal GS (2001).
Microbial xylanases and their industrial applications: a review. Appl.
Microbiol. Biotechnol. 56: 326-338.
Bernfeld P (1995). Amylase
â and á (Assay Method), in
methods in enzymologie I, Colowick and Kaplan, Ed., Academic press, New
York, pp. 149-154.
Bhat MK (2000). Cellulases and related enzymes
in biotechnology. Biotechnol. Adv. 18: 355- 383.
Biely P (1985). Microbial xylanolytic system.
Trends Biotechnol. 3: 286-290.
Binder WH, Kählig H, Schmid W (1995).
Galactosylation by use of beta-galactosidase : enzymatic synthesis of
disaccharides nucleosides. Tetrahedron: Asymmetry.
6: 1703-1710.
Blum H, Beier H, Gross HJ (1987). Improved
silver staining of plant proteins, RNA, and DNA in polyacrilamide gels.
Electrophoresis. 8: 93-99.
Boer PH, Hickey DA (1986). The alpha-amylase
gene in Drosophila melanogaster: nucleotide sequence, gene structure
and expression motifs. Nucleic Acids Res. 14:
8399-8411.
Bradford MM (1976). A rapid and sensitive method
for the quantification of microgram quantities of protein utilizing the
principe of protein-dye binding. Anal. Chem. 72 :
248-254.
Bruhlmann F, Leupin M, Erismann KH, Fiechter A
(2000). Enzymatic degumming of ramie bast fibers. J.
Biotechnol. 76: 43-50.
Bruyeron O, Khan NC, Berger J, Salvignol B, Monvoy ,
Tréche A (2006). Alimentation infantile. Gret Eds.
175p.
Buleon A, Colonna P, Leloup V (1990). Les
amidons et leurs dérivés dans les industries de
céréales. Actualités des industries alimentaires et
agroalimentaires 6 : 515-532.
Buonocore V, Poerio E, Silano V, Tomasi M
(1976). Physical and catalytic properties of
áamylase from Tenebrio molitor L. larvae.
Biochem J. 153: 621-625.
Burton RL, Starks KJ, Sauer JR (1977).
Carbohydrate digestion by larval midgut of Heliothis zea. Ann.
Entomol. Soc. Am. 70: 477-480.
Burvall A, Asp NG, Dalhqvist A (1980).
Oligosaccharide formation during hydrolysis of lactose with Saccharomyces
lactis lactase (Maxilact): Part 3. Digestibility by human intestinal
enzymes in vitro. Food Chem. 5: 189 -194.
Chararas C, Eberhard R, Courtois JE, Petek F
(1983). Purification of three cellulases from the xylophageous larvae
of Ergaster faber (Coleoptera: erambycidae). Insect Biochem.
13 : 213-318.
Cheetham PSJ (1995). Principles of industrial
biocatalysis and bioprocessing. Hand. Enzy. Biotech. 88p.
Chen JM, Dando PM, Rawlings ND, Brown MA, Young NE,
Stevens RA, Hewitt E, Watts C, Barrett AJ (1997). Cloning, isolation,
and characterization of mammalian legumain, an asparaginyl endopeptidase.
J. Biol. Chem. 272 : 8090-8098.
Chinnery JAB (1971). Carbohydrases of the midgut
of the leather beetle Dermestes maculates. J. Insect Physiol.
17: 47-61.
Chipoulet JM, Chararas C (1985). Purification
and partial characterization of a cellobiase from the larvae of Rhagium
inquisitor. Comp. Biochem. Physiol. 82B:
327-332.
Chothia C, Lesk AM (1986). The relationship
between the divergence of sequence and structure in proteins. EMBO J.
5: 823-826.
Cleveland LR (1923). Symbiosis
between termites and their intestinal protozoa. Proc. Nat. Acad.
Sc. U. S A. 9 : 424-428.
Colas B, Attias J (1975). Caractérisation
de quelques activités hydrolasiques du suc digestif d'Achatina
balteata. Biochimie 57 : 1019-1027.
Colas B, Attias J (1977). Purification of two
beta-glucosidases from the digestive juice of Achatina achatina.
Biochimie 59 : 577-585.
Collinge AE, Neubeck CE, Udinsky JR (1974).
Thermostable lactase. U.S. Patent. 3: 816 259.
Cote GL, Tao BY (1990). Oligosaccharide
synthesis by enzymatic transglycosylation. Glycoconjugate J.
7: 145-162.
Cristofoletti PT, Ribeiro AF, Terra WR
(2001). Apocrine secretion of amylase and exocytosis of trypsin along
the midgut of Tenebrio molitor larvae. J. Insect Physiol.
47: 143- 155.
Csiszar E, Urbanszki K, Szakas G (2001).
Biotreatment of desized cotton fabric by commercial cellulose and xylanase
enzymes. J. Mol. Catal. B. Enzym. 11:
1065-1072.
Davies G, Henrissat B (1995). Structures and
mechanisms of glycosyl hydrolases. Structure 3: 853 -
859.
Davies GJ, Tolley SP, Henrissat B, Hjort C,
Schülein M. (1995). Structures of oligosaccharide-bound forms
of the endoglucanase V from Humicola insolens at 1.9 A resolution.
Biochemistry 34 :16210-16220.
Davies JH, Evans BA, Jenney ME, Gregory JW
(2003). Effects of chemotherapeutic agents on the function of
primary human osteoblast-like cells derived from children. J. Clin.
Endocrinol. Metab. 88 : 6088-6097.
Dawson RMC, Elliot WH, Elliot DC, Jones KM
(1969). Purification procedures. Biochemical Research. London
Oxford University Press. p 290-295.
Dion M, Fourage L., Hallet JN, Colas B
(1999). Cloning and expression of a betaglycosidase gene from
Thermus thermophilus. Sequence and biochemical characterization of the
encoded enzyme. Glycoconjugate J. 16: 27-37.
Doane WW (1969). Amylase variants in
Drosophila melanogaster: linkage studies and characterization of
enzyme extracts. J. Exp. Zool. 171: 321-342.
Droba M, Broba B (1987). Purification and
properties of beta-galactosidase fom chicken seminal plasma. Comp. Biochem.
Physiol. 87B : 379-384.
Duchen LW, Gale AN, Gomez S (1980). Motor
end-plate morphology and neuromuscular transmission in the mutant trembler
mose. J. Physiol. 308: 18p.
Ducros VMA, Zechel DL, Murshudou GN, Gilbert HJ, Szabo
L, Stoll D, Withers SG, Davies GJ (2002). Substrate distortion by a
beta-mannase: snapshots of the Michaelis and ovalent-intermediate complexes
suggest a B2,5 conformation for the transition state. Angew.
Chem. Int. Ed. Engl. 41: 2824-2827.
Evans WAL (1956). Studies on the digestive
enzymes of the blowfly Calliphora erythrocephala-I. Carbohydrases.
Exp. Parasitol. 5 : 191-206.
Fabricius H (1980). Microorganisms for the
production of microbial Beta-galactosidase, method for production thereof and
application thereof. U.K. Patent. 4 2038- 837.
Faulet MB (2006). Purification,
caractérisation physico-chimique et moléculaire des
xylanases
de l'ouvrier du termite Macrotermes subhyalinus et de son
champignon
symbiotique Termitomyces sp..
Thèse de Doctorat ès Sciences. Université
d'Abobo-Adjamé. P 180.
Fernandes S, Geueke B, Delgado O, Coleman J,
Hatti-kaul R (2002). Beta-galactosidase from a cold-adapted bacterium:
purification, characterization and application for lactose hydrolysis.
Appl. Microbiol. Biotechnol. 58: 313-321.
Ferreira AH, Marana SR, Terra WR, Ferreira C
(2001). Purification, molecular cloning, and properties of a
beta-glycosidase isolated from midgut lumen of Tenebrio molitor
(Coleoptera) larvae. Insect Biochem. Mol. Biol.
31: 1065-1076.
Ferreira AH, Terra WR, Ferreira C (2003).
Characterization of a beta-glycosidase highly active on disaccharides and of a
beta-galactosidase from Tenebrio molitor midgut lumen. Insect
Biochem. Mol. Biol. 33 : 253-256.
Ferreira C, Capella AN, Sitnik R,Terra WR
(1994). Properties of the digestive enzymes and the permeability of
the peritrophic membrane of Spodoptera frugiperda
(Lepidoptera) larvae. Comp. Biochem. Physiol.
107A : 631-640.
Ferreira C, Terra WR (1983). Physical and
kinetic properties of a plasma-membrane-bound
â-D-glucosidase (cellobiase) from midgut cells of an
insect (Rhynchosciara americana larvae). Biochem. J.
213 : 43-51.
Ferreira C, Terra WR (1989). Spatial
organization of digestion, secretory mechanisms and digestive enzyme properties
in Pheropsophus aequinoctialis (Coleoptera: Carabidae).
Insect Biochem. 19: 383-391.
Finch P, Yoon J H (1997). The effects of organic
solvents on the synthesis of galactose disaccharides using
â-galactosidases. Carbohydr.Res. 303
: 339-345.
Fokina NA, Velikodvorskaia GA (1997). Cloning
and expression of the gene for thermostable beta-galactosidase from
Thermoanaerobacter ethaolicus in Escherichia coli:
Purification and properties of the product. Mol. Gen. 2
: 34-36.
Fortun Y, Colas B (1991). Lithium chloride
effect on phenyl-ethyl-â-D-galactoside synthesis by
Aspergillus oryzae â-D-galactosidase in the
presence of high lactose concentration. Biotechnol. Lett.
13: 863-866.
Fourage L (2000). Caractérisation
biochimique et structurale d'une beta-glycosidase de Thermus
thermophilus surexprimée chez E. coli. Thèse
Université Nantes. 187p.
French JRJ, Bland DE (1975). Lignin
degradation in the termites Coptotermes lacteus and Nasutitermes
exitiosus. Mat. Org.
10: 281-286.
Gaboriaud C, Bissery V, Benchetrit T, Mornon JP
(1987). Hydrophobic cluster analysis and efficient new to compare and
analyse aminoacid sequences. FEBS Lett. 224:
149-155.
Gekas V, Lopez-Leiva M (1985). Hydrolysis of
lactose. Process Biochem. 20 : 2-12.
Gerber K, Giblin-Davis RM (1990). Association
of the red ring nematode, Rhadinaphelenchus cocophilus, and other
nematode species with Rhynchophorus palmarum (Coleoptera:
Curculionidae). J. Nematol. 22: 143-149.
Green ML, Karp PD (2005). Genome Annotation
Errors in Pathway Databases Due to Semantic Ambiguity in Partial EC Numbers.
Nucleic Acids Res. 33: 4035-4039
Greenberg NA, Mahoney RR (1981). Rapid
purification of beta-galactosidase (Aspergillus niger) from a
commercial preparation. J. Food Sci. 46: 684-687.
Griffth R (1987). Red ring disease of coconut
Palm. Plant Disease 71: 193-196.
Grossi de Sa' MF, Chrispeels MJ (1997).
Molecular cloning of bruchid (Zabrotes subfasciatus) alpha-amylase
cDNA and interactions of the expressed enzyme with bean amylase inhibitors.
Insect Biochem. Mol. Biol. 27 : 271-281.
Guerin DM, Lascombe MB, Costabel M, Souchon H, Lamzin
V, Beguin P, Guimaraes BG, Souchon H, Lytle BL, David Wu JH, Alzari PM
(2002). Atomic resolution structure of an inverting glycosides in
complex with substrate. J.Mol.Biol. 316 :
1061-1069.
Harju M (1987). Production of
â-galactosidase by Streptococcus salivarius subsp
thermophilus. J. Ind. Microbiol. Biotechnol. 20:
215-219
Harwood JL (1980). Plant acyl lipids.
Structure, distribution and analysis. In The Biochemistry of plants: A
Comprehensive Treatise, Vol. 4, Lipids: structure and function
(Edited by Stumpf P. K.),. Academic press, New York. pp. 1-56.
Henrissat B, Bairoch A (1993). New
families in the classification of glycosyl hydrolases based on amino acid
sequence similarities. Biochem J. 293 : 781-788.
Henrissat B, Callebaut I, Fabrega S, Lehn P, Mornon
JP, Davies G (1996). Conserved catalytic machinery and the
prediction of a common fold for several families of glycosyl hydrolases.
Proc. Natl. Acad. Sci. USA 93 : 9302.
Henrissat B, Heffron SE, Yoder MD, Lietzke SE,
Jurnak F (1995). Functional implications of structure-based
sequence alignment of proteins in the extracellular pectate lyase superfamily.
Plant Physiol. 107: 963-76.
Henrissat B (1991). A classification of glycosyl
hydrolases based on amino acid sequence similarities. Biochem. J.
280 : 309-316.
Henrissat B (1998). Glycosidase families.
Biochem. Soc. Trans. 26 : 153-156.
Henrissat B, Bairoch A (1996) Updating the
sequence-based classification of glycosyl hydrolases. Biochem. J.
316 : 695-696.
Henrissat B, Claeyssens M, Tomme P, Lemesle L, Mornon JP
(1989). Cellulase families revealed by hydrophobic cluster analysis.
Gene 81 : 83-95.
Hickey D, Benkel BF, Boer PH, Genest Y, Abukashawa S,
Ben-David G (1987). Enzyme coding genes as molecular clocks: the
molecular evolution of animal alpha-amylase. J. Molec. Evol.
26: 252-256.
Hilmar B (1995). The mechanism of
alpha-glucosidase inhibition in the management of diabetes. Clin. Invest.
Med. 18 : 303-311.
Hinz SW, Van den Brock LA, Beldman G, Vincken JP,
Voragen AG (2004). Betagalactosidase from Bifidobacterium
adolescentis DSM 20083 prefers beta(1,4)-galactosides over lactose.
Appl. Microbiol. Biotechnol. 66: 276-284.
Hoogerbrugge PM, Suzuki K, Suzuki K, Poorthuis BJ,
Kobayashi T, Wagemaker G, van Bekkum DW (1988). Donor-derived cells in
the central nervous system of twitcher mice after bone marrow transplantation.
Science. 239: 1035 - 1038.
Hori K (1972). Comparative study of a property
of salivary amylase among various heteropterous insects. Comp. Biochem.
Physiol. 42B: 501-508.
Huber RE (1975). The purification and study of a
honey bee abdominal sucrase exhibiting unusual solubility and kinetic
properties. Arch. Biochem. Biophys. 168: 198-209.
Huber RE, Gaunt MT, Sept RL, Babiak MJ
(1983). Differences in the effects of pH on the hydrolytic and
transgalactosylic reactions of beta-galactosidases (Escherichia coli).
Can. J. Biochem. Cell. Biol. 61: 198-206.
Huber RE, Mathison RD (1976). Physical, chemical
and enzymatic studies on the major sucrase of honey bee (Apis
mellifera). Can. J. Biochem. 54 : 153-164.
Iiada R, Ozaki S, Kotaka T (1980). Novel
lactase. U.S. Patent. 4: 237-230.
Ishikawa K, Kimura S, Kanaya S, Morikawa K, Nakamura H
(1993). Structural study of mutants of Escherichia coli
ribonuclease HI with enhanced thermostability. Protein Eng.
6: 85-91.
Ishimoto M, Kitamura K, (1989). Growth
inhibitory effects of an á-amylase inhibitor from
kidney bean, Phaseolus vulgaris (L.) on three species of bruchids
(Coleoptera: Bruchidae). Appl. Entomol. Zool.
24 : 281-286.
Janda L, Pavelka T, Tichy P, Spizek J, Petricek M
(1997). Production and properties of alpha-glucosidase from the
thermotolerant bacterium Thermomonospora curvata. J. Appl.
Microbiol. 83: 470-476.
Jauhiainen A, Vanha-Perttula T (1985). Acid and
neutral á-glucosidase in the reproductive organs and
plasma seminal of the bull. J. Reprod. Fertil. 74:
669-685.
Johansson J, Tore CV, and Hans J (1986).
Surfactant Protein B: Disulfide Bridges, Structural Properties, and Kringle
Similarities. Biochem. 30: 6917-6921.
Jordao BP, Terra WR (1991). Regional
distribution and substrate specificity of digestive enzymes involved in
terminal digestion in Musca domestica hind-midguts. Arch Insect
Biochem. Physiol. 17: 157-168.
Kamei A, Fujiyama O (1995). Characterization of
partially purified alpha-glucosidase in the insoluble fraction of bovine
crystalline lens. Biol. Pharm. Bull. 18: 1133-7.
Kanekatsu R (1978). Studies on further
properties for an alkaline amylase in the digestive juice of the silkworm.
Bombyx mori. J. Fac. Text. Sci. Technol. 76:
1-21.
Kaneko S, Kobayashi H (2003). Purification
and characterization of extracellular betagalactosidase secreted by supension
cultured rice (Oryza sativa L.). Cells. Biosc. Biotechnol.
Biochem. 67: 627-630.
Kang SR, Cho KK, Ahu JK, Bok JD, Kang SH, Woo JH, Lee
HG, You SK, Choi YJ (2005). Three forms of thermostable
lactose-hydrolase from sp. IB-21: cloning expression and enzyme
characterization. Biotechnol. 116: 337-346.
Kengen SW, Luesink EJ, Stams AJ, Zehnder AJ
(1993). Purification and characterization of an extremely thermostable
â-glucosidase from hyperthermophilic archaeon
Pyrococcus furiosus. Eur. J. Biochem. 213:
305-312.
Kim D, Park BH, Jung B-W, Kim M-k, Hong S-I, Lee D-S
(2006). Identification and molecular modeling of a family 5
endocellulase from Thermus caldophilus GK24, a cellulolytic strain of
Thermus thermophilus. Int. J. Mol. Sci. 7:
571-589.
Kita A, Matsui H, Somoto A, Kimura A, Takata M, Chiba
S (1991). Substrate specificity and subsite affinities of crystalline
alpha-glucosidase from Aspergillus niger. Agric. Biol. Chem.
55: 2327-2335.
Kobayashi T, Yamanaka T, Jacobs JM, Teixeira F, Suzuki
K (1980). The twitcher mouse: an enzymatically authentic model of
human globoid cell leukodystrophy (Krabbe disease). Brain Res.
202: 479 - 483.
Kohki A, Kazuyoshi K, Akio K (1995). A novel
method for chemo-enzymatic of elicitor-active chitosan oligomers and partially
N-deacetylated chitin oligomers using N-acetylated
chitotrioses as substrates in a lysozyme-catalysed transglycosylation reaction
system. Carbohyd. Res. 279: 151-160.
Koshland DE (1953). Stereochemistry band the
mechanism of Enzymatic Reactions. Biol. Rev.
90: 1171-1202.
Kouamé LP, Dué AE, Niamke SL
Kouamé AF, et Kamenan A (2005a) Synthèses enzymatiques
de néoglycoconjugés catalysées par
l'á-glucosidase purifié de la blatte
Periplaneta americana (Linnaeus). Biotechnol. Agro. Soc.
Environ. 9 : 35-42.
Kouamé LP (2006). Identification de
protéases du termite Macrotermes subhyalinus
(Rambur) et de
son champignon symbiotique Termitomyces sp. Caractérisation des
exo-
142
glycosidases Thermophiles ou possédant une bonne
activité de transglycosylation. Thèse de Doctorat d'Etat
ès Sciences. Université d'Abobo-Adjamé. P 187.
Kouamé LP, Kouamé AF, Niamke SL, Faulet
BM, Kamenan A (2005b). Biochemical and catalytic properties of two
beta-glycosidases purified from workers of the termite Macrotermes
subhyalinus (Isoptera: Termitidae). Int. Trop. Insect Sci.
25 : 103-113.
Kouamé LP, Niamke S, Diopoh J, Colas B
(2001). Transglycosylation reactions by exoglycosidases from the
termite Macrotermes subhyalinus. Biotechnol. Lett. 23
: 1575-1581.
Krén V, Sedmera P, Havlícek V,
Físerová A (1992). Enzymatic galactosylation of ergot
alkaloids. Tetrahedron Lett. 33: 72-33.
Krivit W, Shapiro EG, Peters C, Wagner JE, Cornu G,
Kurtzberg J, Wenger DA, Kolodny EH, Vanier MT, Loes DJ, Dusenbery K, Lockman LA
(1998). Hematopoietic stem-cell transplantation in globoid-cell
leukodystrophy. N. Engl. J. Med. 338: 1119-1126.
Kubota M, Tsuji M, Nishimoto M, Wongchawalit J,
Okuyama M, Mori H, Matsui H,
Surarit R, Svasti J, Kimura
A, Chiba S (2004). Localization
of alpha-glucosidases I, II, and III in organs of European honeybees, Apis
mellifera L., and the origin of alpha-glucosidase in honey. Biosci.
Biotechnol. Biochem. 68: 2346-2352.
Kunst A, Draeger B, Ziegenhorn J (1984).
Colorimetric methods with glucose oxidase and peroxidase. In: Bergmeyer HU, ed.
Methods of Enzymatic Analysis, Vol. 6. pp. 178- 185.Weinheim:
Verlag Chemie.
Laemmli UK (1970) Cleavage of structural
proteins during the assembly of the head of bacteriophage T4. Nature
(London) 227: 680-685.
Larreta-Garde V (1997). Enzymes en
agroalimentaire. (Ed.), Tech. Doc. Lavoisier, Paris. pp. 132.
Laroute V, Willemot R-M (1992). Glucoside
synthesis by glucoamylase or â-glucosidase in organic
solvents. Biotechnol. Lett. 14: 169-174.
Lavrenova TP, Presnova VN (1994). Rat Liver
neutral alpha-glucosidase: isolation and characterization. Biochem. Mol.
Int. 32: 6716-6719.
Law BA, Goodenough PW (1995). Enzymes in milk
and cheese production. Enzy. Food. Process. p114-143.
Lee JH, Tsuji M, Nakamura M, Nishimoto M, Okuyama M,
Mori H, Kimura A, Matsui H. Chiba S (2001). Purification and
identification of the essential ionizable groups of honeybee, Apis
mellifera L., trehalase. Biosci. Biotechnol. Biochem.
65: 2657-2665.
Leese JH, Semenza G (1973). On the identity
between the small intestinal phlorizin hydrolase and glycosylceramidase. J.
Biol. Chem. 248: 8170-8173.
Lemos FJA, Campos FAP, Silva CP, Xavier-Filho J
(1990). Proteinases and amylases of larval midgut of Zabrotes
subfasciatus eared on cowpea (Vigna unguiculata) seeds. J.
App. Entomol. 56: 219-227.
Leparoux S, Fortun Y, Colas B (1994).
Synthesis of beta-galactosyl-(hydroxy amino acid) derivatives using
beta-galactosidase activity of Achatina achatina digestive juice.
Biotechnol. Lett. 16: 677-682.
Leparoux S, Padrines M, Fortun Y, Colas B
(1996). O-glycosylation of dipeptides using
âgalactosidase activity of Achatina achatina
digestive juice. Biotechnol. Lett. 18: 135-138.
Leparoux S, Padrines M, Placier G, Colas B (1997)
Characterization of a strictly specific acid
â-galactosidase from Achatina achatina.
Biochem. Biophys. Acta 1336 : 525-532.
Letunova EV, Tikhomirova AS, Shiian SD, Markin VA,
Khorlin A (1981). Purification and properties of beta-galactosidase
from alternaria tenius. Biokhimiia 46:
911-919.
Levitzki A, Steer ML (1974). The allosteric
activation of mammalian á-amylase by chloride. Eur.
J. Biochem. 41: 171-180.
Lineweaver H, Burk D (1934). The determination
of enzyme dissociation constants. J. Am. Chem. Soc.
56: 658-666.
Littman A, Hammond JB (1965). Diarrhea in adults
caused by deficiency in intestinal disaccharidase.
Gastroenterology 48: 237-245.
Lowry O, Roserbrouh NJ, Farr AL.,
Randall R.J (1951). Protein measurement with FOLIN Phenol
reagent. J. Biochem. 193: 265-275.
Luzi P, Rafi MA, Victoria T, Baskin GB, Wenger DA
(1997). Characterization of the Rhesus monkey galactocerebrosidase
(GALC) cDNA and gene and identification of the mutation causing globoïd
cell leukodystrophy (Krabbe disease) in this primate. Genomics
42: 319-324.
Maat J, Roza M, Verbakel J, Stam H, Da Silva MJS,
Egmond MR, Hagenans MDL, Van Garcom RFM, Hessing JGM, Van Dehondel CAMJJ, Van
Roterdam C (1992). Xylanases and their application in baking. In:
Xylan and Xylanases. Visser J., Beldman G., Van Someren M. A. K. and Voragen A.
G. J. (Eds.), Elsevier, Amsterdam, pp. 349-360.
Marana SR, Terra WR, Ferreira C (1995).
Midgut â-D-glucosidases from Abracris
flavolineata (Orthoptera: Acrididae). Physical properties,
substrate specificities and function Insect. Biochem. Mol. Boil.
25: 835-843
Marin D, Linde D, Lobato MF (2006). Purification
and biochemical characterization of an alpha-glucosidase from
Xanthophyllomyces dendrorhous. Yeast. 23
:117-25.
Marinotti 0, James A (1990). An
alpha-glucosidase in the salivary glands of the vector mosquito, Aedes
aegypti. Insect Biochem. 20: 619-623.
144
Martin MM (1983). Cellulose digestion in
digestion in insects. Comp. Biochem. Physiol. 75A:
313-324.
Martin MM (1991). The evolution of cellulose
digestion in insects. Phil. Trans. R. Soc. Lond. B
333: 281-288.
Martin MM, Martin JS (1978).
Cellulose digestion in the midgut of the fungus growing termite
Macrotermes natalensis: The role of acquired digestive enzymes.
Science. 199: 1453- 1455.
Martin MM, Martin JS (1979). The
distribution and origins of cellulolytic enzymes of the higher termite
Macrotermes natalensis. Physiol. Zool.
52:11-21.
Mathlouthi N, Juin H, Larbier M (2003).
Effect of xylanase and â-glucanase supplementation of
wheat- or/and barley-based diets on the performance of male turkeys. Br.
Poult. Sci. 44: 291-298.
Mathlouthi N, Lalles JP, Lepercq P, Larbier M
(2002). Xylanase and â-glucanase
supplementation improve conjugated bile acid fraction in intestinal contents
and increase villus size of small intestine wall in broiler chickens fed a
rye-based diet. J. Anim. Sci. 80: 2773-2779.
Matoub M (1993). La symbiose termite-champignon
chez Macrotermes bellicosus. Thèse de Doctorat ès
Sciences. Univ Paris XII Val-De-Marne. 150 p.
Matsui H, Sasaki M, Takemasa E, Kaneta T, Chiba S
(1984). Kinetic studies on the substrate specificity and active site
of rabbit muscle acid alpha-glucosidase. J. Biochem (Tokyo)
96 : 993-1004.
McCarter JD, Withers SG (1994). Mechanisms of
enzymatic glycoside hydrolysis. Curr Opin. Struct. Biol 4
: 885-892.
Mielenz JR (2001). Ethanol production from
biomass: Technology and commercialization status. Curr. Opin.
Microbiol. 4: 324-329.
Monsan P, Pelenc Vincent P, Paul Francois MB
(1989). Methods for the production of esters of .alpha.-glucosides and
uses thereof. United State Paten. 5: 462- 669.
Moore KK (1977). Xylitol: Uncut gem among
sweeteners. For. Prod. Dev. 11: 66-70.
Mutoh T, Naoi M, Nagatsu T (1988).
Purification and characterization of human liver betagalactosidase from a
patient with the adult form of GM1 gangliosidosis and a normal control.
Biochim. Biophys. Acta. 964: 244-253.
Nagy Z, Kiss T, Szentirmai A, Biro S (2001).
Â-galactosidase of Penicillium chrysogenum: production,
purification and characterization of the enzyme. Protein. Express.
Purif. 21: 24- 29.
Nakao M, Nakayama T, Kakudo A, Inohara M, Harada M,
Omura F, Shibano Y (1994). Structure and expression of a gene coding
for thermostable alpha-glucosidase with a broad substrate specificity from
Bacillus sp. SAM1606. J . Biochem. 220 :
Nilsson KGI (1988). Enzymatic synthetis of
oligosaccharides. Trends Biotechnol. 6: 256-546.
Nilsson KGI (1997). Glycosidase-catalysed
synthesis of di- and trisaccharide derivatives related to antigens involved in
the hyperacute rejection of xenotransplants. Tetrahedron. Lett.
38 : 133-136.
Nilsson KGI, Scigelova M (1994). Synthesis of
glycosylated serine and threonine derivatives employing glycosidases.
Biotechnol Lett. 16: 671-676.
Nishimoto M, Kubota M, Tsuji M, Mori H, Kimura A,
Matsui H, Chiba S (2001). Purification and substrate specificity of
honeybee, Apis mellifera L., alpha-glucosidase III. Biosci.
Biotechnol. Biochem. 65: 1610-1616.
Nunoura N, Odan K, Tanaka K, Tamaki H, Yano T, Inui M,
Yukawa H, Yamamoto K, Kumagai H (1996). Cloning and nucleotide
sequence of the â-D-glucosidase activity in
Esherichia oli. Biosci. Biotechnol. Biochem. 60:
2011-2018.
O'Brien GW, Veivers PC, McEwen SE, Slaytor M, O'Brien
RW (1979). The origin and distribution of cellulase in the
termites, Nasutitermes exitiosus and Coptotermes lacteus.
Insect Biochem. 9: 619-625
O'Brien JS, Storb R, Raff RF, Harding J, Appelbaum F,
Morimoto S, Kishimoto Y, Graham T, Ahern-Rindell A, O'Brien SL (1990)
Bone marrow transplantation in canine GM1 gangliosidosis. Clin.
Genet. 38 : 274-280.
Oda Y, Iwamoto H, Hiromi K, Tonomura K
(1993). Purification and characterization of alpha-glucosidase from
Torulaspora pretoriensis YK-1. Biosci. Biotechno.l Biochem.
57 : 1902-1905.
Ogawa H (1990). Purification and
characterization of beta-galactosidase from Kiwifruit. J. Soc.
Food Sci. Technol. 37: 298-305.
Oliveira FW, Chavante SF, Santos EA, Dietrich CP,
Nader HB (1994). Appearance and fate of a beta-galactanase, alpha,
beta-galactosidase, heparin sulphate and chondroitin sulphate degrading enzymes
during embryonic development of the mollusc Pomacea sp. Biochim.
Biophys. Acta 1200: 241-246.
Onishi N, Tanaka T (1995). Purification and
properties of a novel thermostable galactooligosaccharide-producing
beta-galactosidase from Sterigmatomyces elviae. Appl. Environ. Microbiol.
61: 4026-4030.
Onodera S, Matsui H, Chiba S (1989). Single
active site mechanism of rabbit liver acid alpha-glucosidase. J.
Biochem. 105: 611-618.
Parajo JC, Domingues H, Domingues JM (1998).
Biotechnological production of xylitol. Part I, interest of xylitol and
fundamentals of its biosynthesis. Bioresour. Technol.
65: 191- 201.
Park SY, Bae EA, Sung JH, Lee SK, Kim DH
(2001). Purification and characterization of ginsenoside
Rb1-metabolizing beta-glucosidase from Fusobacterium K-60, a human
intestinal anaerobic bacterium. Biosci. Biotechnol. Biochem.
65: 1163-1169.
Patchett ML, Daniel RM, Morgan Hw (1987).
Purificatin and properties of a betagalactoidase from extremely thermophilic
anaerobic bacterim. Biochem. J. 243: 79-787.
Pereira B., Sivakami S. (1989). Neutral
maltase/glucoamylase from rabbit renal cortex. Biochem. J.
261: 43-47.
Placier G (1999) Caractérisation d'une
â-D-galactosidase acide d'Achatine strictement
spécifique du seul résidu â-D-galactosyle.
Applications potentielles. Thèse nouveau doctorat. Université de
Nantes, France 193p.
Playne M, Crittenden R (1996). Purification of
food-grade oligosaccharides using immobilised cells of Zymomonas mobilis.
Appl. Microbiol. Biotechnol. 58 : 297-302.
Polizeli MLTM, Rizzatti ACS, Monti R, Terenzi HF,
Jorge JA, Amorim DS (2005). Xylanases fron fungi:
Properties and industrial applications. Appl. Microbiol. Biotechnol.
67: 577-591.
Potus J, Drapon R (1997). Enzymes en
Agro-alimentaires : les enzymes dans les industries de cuisson des
céréales. Paris : Lavoisier tec Doc. P. 380.
Prade RA (1995). Xylanase: From biology to
biotechnology. Biotech. Genet. Eng. Rev. 13:
101-131.
Prakash K, Patil SD, Hegde SN (1983). Studies
on the intestinal disaccharidases of the pigeon III. Separation, purification
and propertie of sucrase-isomaltase and maltaseglucoamylase. Arch. Int.
Physiol. Biochim. 91: 379-90.
Pratviel-Sosa F, Clermont S, Percheron F, Chararas C
(1987). Studies on glycosidases and glucanases in Thaumetopoea
Pityocampa larvae. II. Purification and some properties of broad
specificity â-D-glucosidases. Comp. Biochem.
Physiol. 89B: 173-178.
Raasch C, Streit W, Shanzer J, Bidel M, Gosslar U,
Liebel W (2000). Thermotoga maritime Agl A, an
extremely thermostable NAD+ , Mn2+, and thiol dependant
á-glucosidase. Extremophiles
4: 189-200.
Ramirez Mao, Rivas N. (2003). Production and
partial characterization of beta-galactosidase from Kluyveromyces
lactis grown in deproteinited whey. Arch. Latinoam Nutr.
53: 194-201.
Rastall RA, Pikett SF, Adlard MW, Bucke C (1992).
Synthesis of oligosaccharides by reversal of a fungal
â-glucanase. Biotechnol. Lett.
14: 373-378.
Rivera-Sagredo A, Canada FJ, Nieto O, Jimenza J,
Barbero M, Martin-Lomas M (1992). Substrate specificity of
small-intestinal lactase. Assessment of the role of the substrate hydroxyl
groups. Eur. J. Biochem. 209: 415-422.
Robyt JF, French D (1967). Multiple attack
hypothesis of á-amylases. Arch. Bioch.
Biophys. 122: 8-16.
Rolfsmeier M, Blum P (1995). Purification and
Characterization of a Maltase from the Extremely Thermophilic Crenarchaeote
Sulfolobus solfataricus. J. Bacteriol. 482-485.
Rouland C (1986). Contribution à
l'étude des osidases digestives de plusieurs espèces de termites
africains. Thèse Doct. Es Sc. Univ. Paris Val-De-Marne 210 p.
Rouland C, Matoub M, Mora P, Petek F (1992).
Properties of two beta-glucosidases purified from the termite Macrotermes
mulleri and from its symbiotic fungus Termitomyces sp.
Carbohydr. Res. 233 : 237-245.
Rouland C, Renoux J, Petek F (1988).
Purification and properties of two xylanases from Macrotermes mulleri
(Termitidae, Macrotermitinae) and its symbiotic fungus
Termitomyces sp. Insect. Biochem. 18 :
709-715.
Rye CS, Withers SG (2000). Glycosidase
mechanisms. Curr. Opin. Chem. Biol. 4: 573-580.
Saha BC (2003). Hemicellulose bioconversion. J. Ind.
Microbiol. Biotechnol. 30: 279-291.
Sabini E, Sulzenbacher G, Dauter M, Dauter Z.,
Jorgensen PL, Schulein M, Dupont C, Davies GJ, Wilson KS (1996).
Catalysis and specificity in enzymatic glycoside Sachs disease. Nat.
Struct. Biol. 3: 638-48.
Salvatore P, Belcker C, Brohée J-C, Mbampara A,
Lognay G, Deroanne C, Paquot M, Marlier M (2001). Les esters de
sucres: voies de synthèse et potentialités d'utilisation.
Biotechnol. Agron. Soc. Environ. 5 : 209-219.
Sa-Pereira P, Paveia H, Costa-Ferreira M, Aires-Barros M
(2003). A new look at xylanases: An overview of purification
strategies. Mol. Biotechnol. Jul. 24:
257-281.
Santos CD, Terra WR (1986). Midgut
alpha-glucosidase and beta-fructosidase from Erinnyis ello larvae and
imagoes. Physical and kinetic properties. Insect Biochem.
16 : 819- 824.
Santos CD, Terra WR (1985). Physical
properties substrate specificities and a probable mechanism for a
â-D-glucosidases (cellobiase) from midgut cells of the
cassava hornworm (Erinnyis ello). Biochem. Biophys. Acta.
831: 179-185.
Sasajima K, Kawachi T, Sato S, Sugimura T
(1975). Purification and properties of alphatrehalase from the mucosa
of rat small intestine. Biochim. Biophys. Acta. 405:
139-46.
Saul DJ, Williams LC, Reevers RA, Gibbs MD, Bergquist G
(1995) Sequence and
expression of a xylanase gene from the
hyperthermophile Thermotoga sp. and
characterization of the recombinant enzyme and its activity on
kraft pulp. Appl. Environ. Microbiol. 61 :
4110-4113.
Savaiano DA, Levitt MD (1987). Milk intolerance
and microbe-containing dairy foods. J. Dairy Sci. 70:
397-404.
Sayle, R.A. and Milner-White, E.J.: RASMOL
(1995): Biomolecular graphics for all. Trends. Biochem. Sci.
20: 374-376.
Schumaker TTS, Cristofoletti PT, Terra WR
(1993). Properties and compartmentalization of digestive carbohydrases
and proteases in Scaptotrigona bipunctafa (Apidae: Meliponinae)
larvae. Apidologie 2 : 3-17.
Shewale JG, Sadana JC (1981). Purification,
characterization, and properties of betaglucosidase enzymes from Sclerotium
rolfsii. Arch. Biochem. Biophys. 207:
185-196.
Shimada A, Odate M, Koyama N, Hashino K, Asada K, Kato
I (1994). Hyperthermostable ß-galactosidase gene, enzyme encoded
thereby, and process for production. U.S. Patent. 5:
744-345.
Shoham Y, Schwartz Z, Khasin A, Gat O, Zosim Z,
Rosenberg E (1992). Delignification of wood pulp by
thermostable xylanase from Bacillus stearothermophilus strain T-6.
Biodegradation. 3: 207-218.
Silva CP, Carneiro
CN, Isejima EM, Samuels
RI (2004). Sucrose hydrolases from the midgut of
the sugarcane stalk borer Diatraea saccharalis. J. Insect
Physiol. 50 : 1093-101
Silva CP, Terra WR (1995). An
alpha-glucosidase from perimicrovillar membranes of Dysdercus
peruvianus (Hemiptera: Pyrrhocoridae) midgut cells. Purification
and properties. Insect Biochem. Molec. Biol. 25 :
487-494.
Silva FCBL, Alcazar A, Macedo L.LP, Oliveira AS,
Macedo FP, Abreu LRD, Santos E A, Sales MP (2006). Digestive enzymes
during development of Ceratitis capitata (Diptera:Tephritidae) and
effects of SBTI on its digestive serine proteinase targets. Insect
Biochem. Mol. Biol. 36: 561-569.
Silva CP, Terra WR, Xavier-Filho J, Grossi-de-Sa' MF,
Lopes AR, Pontes EG (1999). Digestion in larvae of Callosobruchus
maculatus and Zabrotes subfasciatus á-amylases and
oligosaccaridases. Insect Biochem. Mol. Biol. 29 :
355-366.
Sinitsyn AP, Mitkevitch OV, Gusakov AV, Klyosov AA
(1989). Decrease in reactivity and change of physicochemical
parameters of cellulose in the course of enzymatic hydrolysis. Carbohydr.
Polym. 10 : 1-14.
Sinnott ML (1990). Catalytic mechanisms of
enzymic glycosyl transfer. Chem. Rev. 90:
117l-l202.
Slaytor M (1992). Cellulose digestion in
termites and cockroaches: What role do symbionts play? Comp. Biochem.
Physiol. 103 B: 775-784.
Stam MR (2006). Evolution et prédiction
des activités des glycosides hydrolases Thèse de doctorat de
l'université Aix-Marseille1 167P.
Stam MR, Blanc E, Coutinho PM, Henrissat B.
(2005) Evolutionary and mechanistic relationships between glycosidases
acting on á- and â-bonds Carbohydr. Res.
340 : 2728- 2734.
Stam MR, Danchin E GJ, Rancurel C, Coutinho PM,
Henrissat B (2006). Dividing the large glycoside hydrolase family 13
into subfamilies: towards improved functional annotations of a-amylase-related
proteins. Prot. Engineering Design Selection 19 :
555-562
Sternberg D, Vijay Kumar P, Reese ET (1977).
Beta-Glucosidase: microbial production and effect on enzymatic hydrolysis of
cellulose. Can. J. Microbiol. 23: 139-147.
Subramaniyan S, Prema P (2000). Cellulase-free
xylanases from Bacillus and other microorganisms. FEMS Microbiol.
Lett. 183: 1-7.
Sugimoto M, Furui S, Suzuki Y (1995). Multiple
molecular forms of alpha-glucosidase from spinach seeds, Spinacia
oleracea L. Biosci. Biotechnol. Biochem. 59 :
673-677.
Sulzenbacher G, Driguez H, Henrissat B, Schulein M,
Davies GJ (1996). Structure of the Fusarium oxysporum
endoglucanase I with a nonhydrolyzable substrate analogue: Substrate
distortion gives rise to the preferred axial orientation for the leaving group.
Biochemistry 35: 15280-15287.
Suzuki K, Månsson J-E (1998). Animal
models of lysosomal disease : an overview. J. Inher. Metab. Dis.
21: 540-547.
Suzuki Y, Nobiki M, Matsuda M, Sawai T
(1997). Bacillus thermoamyloliquefaciens KP1071
alpha-glucosidase II is a thermostable M, 540 000 homohexameric
alpha-glucosidase with both exo-alpha-1,4-glucosidase and oligo-1,6-glucosidase
activities. Eur. J. Biochem. 245: 129-136.
Suzuki Y, Fujii H, Uemura H, Suzuki M (1987).
Purification and characterization of extremely thermostable
exo-oligo-1,6-glucosidase from a caldoactive Bacillus sp. KP1228.
Starch 39: 17-23.
Takegawa K, Kondo A, Kato I (1993). Manifacture
of carbohydrates or glycoconjugates with endoglycosidase. Japan Kokai
Tokkyo Koho. Paent. JP 05064594. 6pp.
Taniguchi AY, Takano K (2004). Purification and
properties of beta-galactosidase from Tilapia intestine: Digestive
enzyme of Tilapia-X. Fisheries Sci. 70:
688-694.
Tanimura T, Kitamura K, Fukuda T, Kikuchi T
(1979). Purification and partial characterization of three forms of
alpha-glucosidase from the fruit fly Drosophila melanogaster. J.
Biochem. 85: 123-30.
150
Tashiro K, Iwamasa T, Kato H, Ogata S, Anai M
(1986). Purification and characterization of acid alpha-glucosidase
from pig liver. J Biochem (Tokyo) 99: 693-701.
Terra WR, Ferreira C, Bastos F (1985).
Phylogenetic considerations of insect digestion. Disaccharidases and the
spatial organization of digestion in the Tenebrio molitor larvae.
Insect Biochem. 15:
443-449.
Terra WR, Ferreira C (1994). Insect digestive
enzymes: properties, compartmentalization and function. Comp. Biochem.
Physiol. 109B: l-62.
Terra WR, Ferreira C, Garcia ES (1988). Origin,
properties and functions of the major Rhodnius prolixus midgut
hydrolases. Insect Biochem. 18:
423-434.
Terra WR, Jordao BP (1989). Final digestion
of starch in Musca domestica larvae. Distribution and properties of
midgut a-o-glucosidases and glucoamylase. Insect Biochem.
19: 285-292.
Terra WR, Ferreira C, De-Bianchi AG (1977).
Action pattern, kinetical properties and electrophoretical studies on an
alpha-amylase present in midgut homogenates from Rynchosciara americana
(Diptera) larvae. Comp. Biochem. Physiol. 56B:
201-209.
Terra WR, Espinoza-Fuentes EP, Ferreira C
(1988). Midgut amylase lysozyme, aminopeptidase, and trehalase from
larvae and adults of Musca domestica. Arch. Biochem. Physiol.
9 : 283-297.
Terra WR, Valentin A, Santos CD (1987).
Utilization of sugars, hemicellulose, starch, protein, fat and minerals by
Erinnyis ello larvae and the digestive role of their midgut
hydrolases. Insect Biochem. 17: 1143-1147.
Thomas JA, Spradlin JE, Dygert S (1971). Plant
and animal amylases. In the enzymes (Edited by boyer P. D.). Academic press,
New York. 3rd edn, Vol 5, pp. 115-119.
Titarenko E, Chrispeels MJ (2000). cDNA
cloning, biochemical characterization and inhibition by plant inhibitors of the
á-amylases of the Western corn rootworm, Diabrotica virgifera
virgifera. Insect Biochem. Mol. Biol. 30: 979-990.
Toone EJ, Simon ES, Bednarski MD, Whitesides GM
(1989). Enzyme-catalysed synthesis of carbohydrates.
Tetrahedron 45: 5365-5422.
Torre-Bouscoulet ME, López-Romero E,
Balcázar-Orozco R, Calvo-Méndez C, FloresCarreón
(2004). A. Partial purification and biochemical characterization of a
soluble alphaglucosidase II-like activity from Candida albicans. FEMS
Microbiol. Lett. 236: 123-128.
Trager W (1932). A cellulase from the symbiotic
intestinal flagellates of termites and the roach Cryptocercus
panctulatus. Biochem. J. 26 :
287-296.
Trager W (1934). The cultivation of cellulose
digesting flagellate Trichomonas termopsidis and of certain other
termite protozoa. Biol. Bull. Mar. Biol. Lab. Woods hol 66
: 182-190.
151
Vanderjagt DJ, Fry DE, Glew RH (1994). Human
gluoerebrosidase catalyses transgluosylation between glucocerebroside and
retino. Biochem. J. 300: 309-315.
Van-Zutphen LF, den Bieman MG, Fox RR (1983).
Separation of beta-D-galactosidases in rabbit tissues: genetics of neutral
beta-D-galactosidase. Biochem. Gen. 21: 177-189.
Varrot A, Macdonald J, Stick RV, Pell G, Gilbert HJ,
Davies GJ (2003). Distortion of a cellobio-derived isofagomine
highlights the potential conformational itinerary of inverting
beta-glucosidases. Chem. Commun. 47:
946-947.
Vasella A, Davies GJ, Bohm M (2002). Glycosidase
mechanisms. Curr. Opin. Chem. Biol. 6: 619-629.
Veivers PC, Musca AM, O'Brien RW, Slaytor M
(1982). Digestive enzymes of the salivary glands and gut of
Mastotermes darwiniensis. Insect Biochem. 12: 35-40.
Viikari L, Kantelinen A, Sundquist J, Linko M
(1994). Xylanases in bleaching: From an idea to industry. FEMS
Microbiol. Rev. 13: 335-350.
Vulfson EN, Patel R, Beecher JE, Andrews AT, Law BA
(1990). Glycosidfases in solvents: I. Alkyl-â-glucoside
synthesis in a water-organic two-phase system. Enzyme Microbiol. Tech.
12 : 950-954.
Wakim J, Robinson M, Thoma JA (1969). The active
site of porcine pancreatic alpha amylase: factors contributing to catalysis.
Carbohydr. Res. 10: 487-503.
Wang B, Brand MJ, Veagh PMC (1998).
Protein-bound sialic acid concentration in human milk and commercial infant for
mulas. Proceedings of the Nutrition Society of Australia.
22: 245-251.
Wase DAJ, Raymahasay S, Wang CW (1985).
Production of beta-glucosidase, endo-1,4- beta-D-glucanase and D-xylanase from
straw by Aspergillus fumigatus IMI 255091. Enzyme Microb. Technol.
7: 225-229.
Watanabe T, Sato T, Yoshioka S, Koshuima C, Kuwahara M
(1992). Purification and properties of Aspergillus niger
beta-glucosidase. Eur. J.Biochem. 209: 651-659.
Wattanapongsiri A (1966). A revision of the
genera Rhynchophorus and Dynamis (Coleoptera :
Curculionidae). Department of Agriculture Science Bulletin. p
328.
Weber M, Darzens D, Coulombel C, Foglietti MJ,
Chararas C (1985). Purification and some properties of two amylases
from Phoracantha semipunctata larvae. Comp. Biochem. Physiol.
80B: 57-60.
Weissling TJ, Giblin-Davis RM (1993). Waterloss
dynamics and humidity preference of Rhynchophorus cruentatus
(Coleoptera: Curcuulionidae) adults. Environ. Entomol.
22: 93-98.
Weissling TJ, Giblin-Davis RM, Gries RAL, Perez HD,
Oehlschlager AC (1994). Aggregation phenomone of palmetto weevil
Rhychophorus cruentatus (Coleoptera: Curculionidae). J. Chem.
20: 505-515.
Wenger DA, Victoria T, Rafi MA, Luzi P, Vanier MT,
Vite C, Patterson DF, Haskins M H (1999). Globoid cell leukodystrophy
in Cairn and West Highland white terriers. J. Hered.
90: 138-142.
Workman WE, Day DF (1982). Purification and
properties of beta-glucosidase from Aspergillus terreus. Appl.
Environ. Microbiol. 44: 1289- 1295.
Yamin MA (1978). Axenic cultivation
of the cellulolytic flagellate Trichomitopsis termopsidis from the termite
zootermopsis. J. Protozool. 25: 535-538.
Yamin MA, Tager W (1979).
Cellulolytic activity of axenically-cultivated termite flagellate
Trichomonas thermopsis. J. General. Microbiol. 113:
417-420.
Yip VLY, Varrot A, Davies GJ, Rajan SS, Yang X,
Thompson J, Anderson WF, Withers SG (2004). An unusual mechanism of
glycoside hydrolysis involving redox and elimination-steps by a family 4
Â-glycosidase from Thermatoga maritima. J.
Am. Chem. Soc. 126: 8354- 8355.
Yoon JH, Ajisaka K (1996). The synthesis of
galactopyranosyl derivatives with âgalactosidases of
different origins. Carbohydr. Res. 292: 153-163.
Yoshiki Y, Mikio F, Junji K, Haruyoshi K
(2005). Purification and characterization of an alpha-glucosidase from
germinating millet seeds. Ethnob. phytochem. Pharmacol. Uncaria
66: 851.
Young H, Healey RP (1957). Production of
Saccharomyces fragilis with an optimum yeld of lactase. U.S.
Patent. 2: 776- 928.
Zechel DL, Withers SG (2000). Glycosidase
mechanisms: anatomy of a finely tuned catalyst. Acc. Chem Res
33: 11-8.
Zhou XY, Morreau H, Rottier R, Davis D, Bonten E,
Gillemans N, Wenger D, Grosveld FG, Doherty P, Suzuki K, Grosveld GC, D'Azzo A
(1995). Mouse model for the lysosomal disorder galactosialidosis and
correction of the phenotype with overexpressing erythroid precursor cells.
Genes. Dev. 9: 2623-2634.
| 


