Chapitre 3
RESULTATS ET DISCUSSION
I- RECHERCHE ET DETERMINATION DES CONDITIONS OPTIMALES
D'HYDROLYSE DES GLYCOSIDASES DE LA LARVE DE Rhynchophorus palmarum
(Curculionidae)
1-Résultats
1-1-Activités glycosidasiques
1-1-1-Activités exo-glycosidasiques
Les extraits bruts enzymatiques des glandes salivaires, du
tube et du suc digestifs de la larve de Rhynchophorus palmarum
(Curculionidae) ont possédé des activités
exoglycosidasiques très variées. Les activités
spécifiques les plus élevées se sont retrouvées
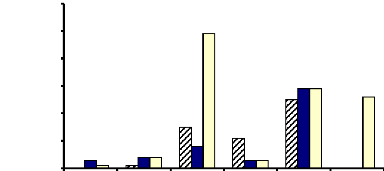
dans le suc digestif (Fig. 9 et 10).
Ce sont les activités a-glucosidasique
(0,49 UI/mg de protéine), f3-glucosidasique (0,69 UI/mg
de protéine) et f3-galactosidasique (0,60 UI/mg de
protéine). Les activités a-mannosidasique,
a-xylosidasique, f3-mannosidasique,
f3-fucosidasique et invertasique ont été
faibles. Quant aux autres activités enzymatiques testées, elles
ont été très faibles. Les extraits bruts enzymatiques des
glandes salivaires et du tube digestif n'ont pas présenté
d'activité a-xylosidasique (Fig. 9 et
10).
Activite specifique
(UI/mg de profane)
0,6
0,5
0,4
0,3
0,2
0,1
0
a-Ara a-Gal
a-Glc a-Fuc a-Man
a-xyl

Álpha-exo-glycosidasique

Glande salivaire Tube digestif Suc digestif
Figure 9 : Activités á-exo-glycosidasiques
des extraits bruts enzymatiques des glandes salivaires, du tube et du suc
digestifs de la larve de Rhynchophorus palmarum
(Curculionidae)

0,8
|
0,7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,6
|
|
|
|
|
|
|
|
A ctivite specifique
(UI/mg de profane)
|
0,5
|
|
|
|
|
|
|
0,4
|
|
|
|
|
|
|
0,3
|
|
|
|
|
|
|
|
0,2
|
|
|
|
0,1
0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13-Ara 13-Gal
13-Glu 13-Fuc 13-Man
Sacch.

Béta-exo-glycosidasique
Glande salivaire Tube digestif Suc digestif
Figure 10 : Activités
â-exo-glycosidasiques des extraits bruts enzymatiques des glandes
salivaires, du tube et du suc digestifs de la larve de Rhynchophorus
palmarum (Curculionidae).
1-1-2-Activités endo-glycosidasiques
Parmi les substrats testés, seuls la
carboxyméthylcellulose et l'amidon ont été
hydrolysés par le suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae). L'amidon a été aussi clivé par les
glandes salivaires du même insecte. L'activité spécifique
obtenue a été plus élevée que celle du suc
digestif. Les tissus du tube digestif de la larve de Rhynchophorus
palmarum (Curculionidae) ont seulement dégradé la
carboxyméthylcellulose. Cette activité spécifique a
été très faible. Aucune activité xylanasique et
pullulanasique n'a été détectée dans les extraits
bruts enzymatiques des glandes salivaires, du tube et du suc digestif
(Fig. 11).
1-2- Températures et pH optima d'hydrolyse
1-2-1-Activités á-exo-glycosidasiques
Les pH optima d'hydrolyse des activités
á-exo-glycosidasiques des extraits bruts enzymatiques
des glandes salivaires, du suc et du tube digestif de la larve de
Rhyncophorus palmarum (Curculionidae) ont été
dosés entre 4,6 et 6,0 et les températures optimales d'hydrolyse
entre 40 et 55 °C (Tableau 4). Les
á-exo-glycosidases des différents extraits bruts
enzymatiques testés ont été acides et
mésophiles.
| 


