Conclusion
La larve de Rhynchophorus palmarum (Curculionidae)
possède dans son suc digestif une á-glucosidase
acide mésophile qui a été purifiée à
homogénéité électrophorétique. Cette enzyme
semble être différente des á-glucosidases
des autres sources enzymatiques jusque là rapportées par les
travaux des différents auteurs lorsqu'on tient compte de la
spécificité de substrat, des constantes de Michaelis et
Menten et des activités transglucosidasiques
élevées. Cette enzyme est une saccharase. Son rôle
biologique principal dans le suc digestif de la larve est d'hydrolyser le
saccharose. Cependant, elle dégrade efficacement le maltose et les
maltodextrines. Cette enzyme pourrait être utilisée comme outil de
choix dans l'analyse structurale des chaînes d'oligosaccharides, de
polysaccharides, de glycoprotéines et de glycolipides. Elle peut aussi
être utilisée pour la synthèse des
glycoconjugués.
III- PURIFICATION ET CARACTERISATION PHYSICO-CHIMIQUE
DE LA â-GLUCOSIDASE DU SUC DIGESTIF DE LA LARVE DE
Rhynchophorus palmarum (Curculionidae)
1-Résultats
1-1-Stratégie de purification
La stratégie de purification utilisée pour
isoler à homogénéité
électrophorétique la âglucosidase du suc
digestif de la larve de Rhynchophorus palmarum (Curculionidae) est
identique à celle décrite précédemment.
1-1-1-Chromatographie échangeuse d'anion sur gel
de DEAE-Sepharose CL 6B
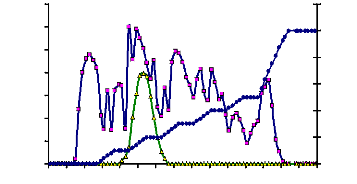
Cette étape chromatographique a permis non seulement
d'éliminer une bonne partie des pigments mais aussi de retenir une seule
activité â-glucosidasique sur le gel
DEAESepharose CL 6B. Cette activité a été
éluée à la concentration de 0,2 M de KCl (Fig.
26). L'activité spécifique de cette enzyme a
été de 4,53 UE/mg. Le rendement et le facteur de purification ont
été respectivement de 60,00 % et 6,56 % (Tableau
15).
1-1-2-Fractionnement au sulfate d'ammonium
Cette étape a permis d'améliorer le facteur de
purification passant de 6,57 à 10,14. Le rendement obtenu a
été de 38,77 % (Tableau 15).
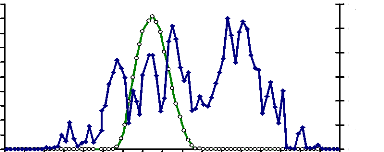
1-1-3-Chromatographie d'exclusion moléculaire sur
gel de Sephacryl-100 HR
Cette étape chromatographique a permis non seulement
d'obtenir un seul pic d'activité â-glucosidasique
mais aussi d'éliminer le reste des pigments contenus, dans la solution
enzymatique (Fig. 27). L'enzyme responsable de l'hydrolyse du
p-nitrophenyl-â-D-glucoside a eu une
activité spécifique de 9,37 UE/mg de protéine. Le facteur
de purification et le rendement ont été respectivement de 13,58
et 16,2 % (Tableau 15).
1-1-4-Chromatographie d'interaction hydrophobe sur gel de
Phényl-Sepharose CL-4B
Une seule â-glucosidase a
été isolée (Fig. 28). Elle a
été éluée par le thiosulfate de sodium 0,2 M
préparé dans le tampon acétate 100 mM pH 5,6. Son
activité spécifique a été de 25,10 UE/mg. Le
facteur de purification et le rendement ont été respectivement de
36,38 et 4,47 % (Tableau 15).
Activite relative (DO 410
nm)
KC1(M)
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150
1,2
1
0,8
0,6
0,4
0,2
0
3,5
3
2,5
2
1,5
1
0,5
0
Nombre de fraction
DO 280 nm DO 410 nm KCl (M)


Figure 26 : Profil chromatographique d'échange
d'anion de la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de D.E.A.ESepharose CL
6B.
La colonne (2,4 x 6,5 cm) a été
équilibrée dans le tampon acétate 100 mM pH 5,6. Le
débit chromatographique a été de 14 ml/h. Les
protéines retenues par le gel sont décrochées par un
gradient en palier croissant de KCl préparé dans le tampon
acétate 100 mM pH 5,6. Des fractions de 4 ml ont été
collectées.
0,6
0,5
0,4
0,3
0,2
0,1
0
Protein (D0280 mn)
2
1,8
Activite relative (D0410 mn)
1,6
1,4
1,2
1
0,8
0,6
0,4
0,2
0
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160 170
Nombre de fraction
DO 410 nm DO 280 nm


Figure 27 : Profil chromatographique d'exclusion
moléculaire de la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de Sephacryl100
HR.
La colonne (1,6 x 64) a été
équilibrée dans le tampon acétate 100 mM pH 5,6. Le
débit chromatographique a été de 15 ml/h. Les
protéines ont été éluées par le tampon
acétate 100 mM pH 5,6. Des fractions de 1 ml ont été
collectées.
Thiosulfate de sodium (M)
|
Activite relative (DO 410 nm)
Protein (DO 660
nm)
|
2,5 2 1,5 1 0,5 0
|
|
0,5 0,4 0,3 0,2 0,1 0
|
|
0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80
|
Nombre de fraction
|
DO 660 nm DO 410nm thiosulfate de sodium
(M))
|
Figure 28 : Profil chromatographique d'interaction
hydrophobe de la â-glucosidase du suc digestif de la larve de
Rhynchophorus palmarum (Curculionidae) sur gel de
PhénylSepharose CL-4B
La colonne (1,4 x 5 cm) a été
équilibrée dans le tampon acétate 100 mM pH 5,6 contenant
du thiosulfate de sodium 1,7 mM. Le débit chromatographique a
été de 14 ml/h. les protéines retenues par le gel ont
été décrochées par un gradient en palier
décroissant de thiosulfate de sodium préparé dans le
tampon acétate 100 mM pH 5,6. Des fractions de 1 ml ont
été collectées.
Tableau 15 : Bilan global de purification de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
|
Etape de purification
|
Activité totale (U.E.)
|
Protéine (mg)
|
Activité spécifique (U.E/mg)
|
Facteur de purification
|
Rendement (%)
|
|
Extrait brut enzymatique
|
39,30
|
57,36
|
0,69
|
1
|
100
|
|
D.E.A.E Sepharose CL-
|
22,40
|
4,15
|
4,53
|
6,56
|
60,00
|
|
6B
|
|
|
|
|
|
|
Précipitation au sulfate
d'ammonium (80% de
saturation)
|
15,24
|
0,75
|
7,00
|
10,14
|
38,77
|
|
Sephacryl S-100 HR
|
6,37
|
0,68
|
9,37
|
13,58
|
16,21
|
|
Phényl-Sepharose CL-4B
|
1,75
|
0,07
|
25,10
|
36,38
|
4,47
|
UE= 1 micromole de p-nitrophénolate par min
1-2-Critère de pureté
L'électrophorèse sur gel de polyacrylamide en
présence de SDS et de â-mercaptoéthanol a
permis d'observer une seule bande protéique, traduisant une
pureté satisfaisante de la â-glucosidase du suc
digestif de la larve Rhynchophorus palmarum (Curculionidae)
(Fig. 29).
1-3-Masses moléculaires de la
â-glucosidase
Les masses moléculaires de la
â-glucosidase déterminées en gel de filtration sur
la colonne TSK et en électrophorèse sur gel de polyacrylamide en
présence de SDS et de âmercapto-éthanol
ont été respectivement de 60 et de 58 kDa. Cette
similarité de masse moléculaire montre que l'enzyme est
monomérique (Tableau 16).
116,25 kDa
66,2 kDa
200 kDa
97,4 kDa
45 kDa

2 1
Figure 29 : â-glucosidase du suc
digestif de la larve de Rhynchophorus palmarum (Curculionidae)
purifiée par électrophorèse palmarum.
Ligne 2, protéines de référence. ligne 1,
beta-glucosidase.
Tableau 16 : Masses moléculaires de la
â-glucosidase du suc digestif de la larve du Rhynchophorus palmarum
(Curculionidae)
Masses Nombre de
Méthode de détermination de la masse
moléculaire moléculaire sous-unité
(kDa)
Gel de filtration sur la colonne TSK 60 1
Electrophorèse sur gel de polyacrylamide en
présence de SDS et de
â-mercaptoéthanol 58
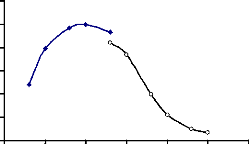
1-4-Influence du pH sur la â-glucosidase 1-4-1-pH
optimum d'hydrolyse
La â-glucosidase a
présenté son activité maximale dans le tampon
acétate 100 mM pH 5,0 (Tableau 17). Elle a
conservé plus de 70 % de son activité hydrolytique dans un
domaine de pH allant de 4,6 à 6,0. Aux pH compris entre 6,6 et 8,0,
l'enzyme a présenté une faible activité ne
dépassant pas 40 % (Fig. 30).
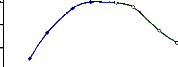
1-4-2-Stabilité au pH
La â-glucosidase du suc digestif de la
larve de Rhynchophorus palmarum (Curculionidae) a été
stable pendant 2 h dans le tampon acétate 100 mM aux pH compris entre
5,0 et 6,0 (Fig. 31).
1-4-3- Influence de la force ionique du
tampon
La force ionique n'a exercé aucune influence sur les
valeurs des pH optima d'hydrolyse de la â-glucosidase
purifiée du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae) (Tableau 17).
Activite relative (%)
100
40
20
60
80
0
100
Activite relative (%)
40
20
60
80
0
3 4 5 6 7 8 9

pH
Tampon acétate 100 mM (pH 3,6 - 5,6) Tampon phosphate 100
mM (pH 5,6 - 8,0)
Figure 30 : pH optimum d'hydrolyse de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae).
Le pH optimum d'hydrolyse du
p-nitrophényl-â-D-glucoside a
été déterminé dans les tampons acétate 100
mM (pH 3,6 à 5,6) et phosphate 100 mM (pH 5,6 à 8,0).
L'activité enzymatique a été déterminée dans
les conditions standard.


3 4 5 pH6 7 8

Tampon acétate Tampon phosphate
Figure 31 : Stabilité au pH de la
â-glucosidase du suc digestif de la larve de Rhynchophorus palmarum
(Curculionidae)
L'enzyme a été pré-incubée pendant
2 h à 37 °C dans les tampons acétate et phosphate 100 mM
pour des valeurs de pH comprises entre 3,6 et 8,0. L'activité
enzymatique a été déterminée dans les conditions
standard.
| 


