|


UNIVERSITE DE LUBUMBASHI
FACULTE DE MEDECINE
DEPARTEMENT DE PEDIATRIE
B.P. 1825
LUBUMBASHI


EVALUATION DE L'ETAT NUTRITIONNEL DES ENFANTS DE 0 à 5
ANS ATTEINTS DE PALUDISME GRAVE
(à propos de 174 patients soignés
dans le service de Pédiatrie de l'HGR Kampemba, entre 2012 et
2015)

Par : NDUMBI TSHIKONGA
Clément
Gradué en Sciences
Biomédicales
Mémoire présenté et défendu en
vue de l'obtention du Grade de Docteur en Médecine
Directeur : Prof. Dr LUBOYA NUMBI
Oscar
Promotion : G1 SBM

JUILLET 2016
Année académique :
2015-2016
EPIGRAPHE
"Les répercussions de cette maladie, le paludisme,
sont assez incroyables... Le parasite tue des enfants et affaiblit des
populations entières depuis des dizaines de milliers d'années...
Désormais, nous pouvons trouver une solution pour y
remédier."
Bill Gates lors de la journée mondiale contre le
paludisme, le 25 avril 2014

DEDICACE
A l'Eternel Dieu des Armées ;
A mes très chers parents ;
A mon unique frère et mes soeurs ;
A mes oncles et tantes ;
A mes cousins et cousines ;
A mes neveux et nièces ;
A mes amis et connaissances ;
A mes maîtres ;
A tous mes malades, particulièrement les
enfants ;
A mes compagnons de lutte ;
A ma future compagne de vie ;
A ma future progéniture ;
A tous et à toutes,
Je dédie ce travail
NDUMBI TSHIKONGAClément
AVANT-PROPOS
Le présent mémoire, oeuvre humaine qui ne se
prétend pas parfaite, vient couronner le terme de notre parcours
académique en médecine, auquel plusieurs pionniers ont
contribué et, il est de notre devoir de leur témoigner ici notre
profonde gratitude.
A tout seigneur, tout honneur, nous gratifions l'Eternel Dieu
des Armées, l'Omniscient, l'Omnipotent et l'Omniprésent, pour le
souffle de vie qu'il nous a donné jusqu'à ce jour, ainsi que pour
la science et les potentialités qu'il nous a transmises. Honneur et
gloire lui soient rendus.
Nos remerciements s'adressent très sincèrement
au Professeur Docteur Luboya NumbiOscar, Directeur du
présent mémoire, dont la contribution à la
rédaction de ce travail a été d'une excellence remarquable
et d'un apport indispensable. Cher maître, vous avez toujours
été et resterez toujours pour nous un modèle à
suivre ; « c'est le rôle essentiel du professeur
d'éveiller la joie de travailler et de connaître »,
dixit Albert Einstein.
Nous gratifions également le guide incontournable de ce
mémoire, notre co-directeur et maître, le Chef des travaux
Docteur MUTOMBO MULANGU Augustin, pour sa disponibilité tout au
long de notre rédaction ; ses conseils, sages et
éprouvés, nous ont permis non seulement d'avoir un acquis
nécessaire dans la pratique pédiatrique mais, aussi et surtout,
d'arriver au résultat de ce jour, qui est la rédaction d'un
travail conduit de main d'expert qu'il est. Très cher maître, nous
resterons à jamais attachés à vous.
Nous disons également grand merci au corps
scientifique et administratif de l'Université de Lubumbashi en
général, particulièrement ceux de la faculté de
Médecine et, plus particulièrement ceux du département de
Pédiatrie, pour leur velléité
éprouvée à contribuer avec grand intérêt
à notre formation académique, scientifique et sociale.
Un remerciement particulier est adressé à nos
maîtres de stage, particulièrement aux chefs de travaux
Docteur Toni Lubala, Docteur Jacques Musung, Docteur Richard Mukendi,
Docteur Wakung'a Erick, sans oublier Docteur Milolo, Docteur N'dua, Docteur
Ngongo et Docteur Madila ainsi qu'à tous nos compagnons de
lutte. Chers maîtres et chers amis, aucun mot ne saurait décrire
le niveau de reconnaissance que nous avons envers vous ; que Dieu vous
bénisse richement ; une pensée nous vient à l'esprit
en votre reconnaissance : « La valeur d'un homme tient dans sa
capacité à donner et non dans sa capacité à
recevoir » (Albert Einstein).
Puissent toute notre famille et tous les nôtres, sans
oublier tous ceux qui, de loin ou de près, ont contribué à
la réalisation de ce travail, par leur contribution directe ou
indirecte. Vous aviez toujours été et resterez précieux
à nos yeux et à notre coeur.
TABLE DES MATIERES
EPIGRAPHE
DEDICACE
II
AVANT-PROPOS
III
TABLE DES MATIERES
IV
LISTE DES TABLEAUX
VII
LISTE DES FIGURES
VIII
LISTE DES ABREVIATIONS
IX
RESUME
XI
ABSTRACT
XII
INTRODUCTION
1
1. ETAT DE LA QUESTION
1
2. PROBLEMATIQUE
2
3. CHOIX ET INTERET DU SUJET
3
4. OBJECTIFS DU TRAVAIL
3
4.1. OBJECTIF GENERAL
3
4.2. OBJECTIFS SPECIFIQUES
3
5. SUBDIVISION DU TRAVAIL
3
EVALUATION DE L'ETAT NUTRITIONNEL DES ENFANTS AGES
DE 0 à 5 ANS ATTEINTS DE PALUDISME GRAVE
4
PREMIERE PARTIE :
4
APPROCHE THEORIQUE
4
CHAPITRE I. GENERALITES SUR LE PALUDISME GRAVE
5
I.1. DEFINITION
5
I.2. ETIOLOGIE
5
I.2.1. Agent causal
5
I.2.2. Vecteurs
6
I.3. PHYSIOPATHOLOGIE
6
I.3.1. Cycle du plasmodium
6
I.3.2. Mécanismes physiopathologiques du
paludisme grave [28-34]
8
I.4. DIAGNOSTIC CLINIQUE ET BIOLOGIQUE
10
I.4.1. Diagnostic clinique [2, 35-37]
10
I.4.2. Diagnostic biologique et parasitologique
[35,37-39]
14
I.5. COMPLICATIONS ET PRISE EN CHARGE
16
I.5.1. COMPLICATIONS [2]
16
I.5.2. PRISE EN CHARGE
16
CHAPITRE II. ETAT NUTRITIONNEL ET PALUDISME
GRAVE
19
II.1. RAPPELS SUR L'EVALUATION DE L'ETAT
NUTRITIONNEL
19
II.1.1. GENERALITES
19
II.1.2. INDICES ANTHROPOMETRIQUES
20
II.1.3. CLASSIFICATION CLINIQUE DE LA
MALNUTRITION
23
II.2. INTERACTIONS ENTRE LE PALUDISME ET L'ETAT
NUTRITIONNEL
25
II.3. IMPACT DE LA MALNUTRITION SUR LE
PALUDISME
26
II.3. IMPACT DU PALUDISME SUR L'ETAT
NUTRITIONNEL
26
EVALUATION DE L'ETAT NUTRITIONNEL DES ENFANTS AGES
DE 0 à 5 ANS ATTEINTS DE PALUDISME GRAVE
27
DEUXIEME PARTIE :
27
APPROCHE PRATIQUE
27
CHAPITRE III : METHODOLOGIE DU TRAVAIL
28
III.1. LIEU D'ETUDE
28
III.1.1. SITUATION GEOGRAPHIQUE
28
III.1.2. HISTORIQUE
28
III.2. ASPECTS METHODOLOGIQUES
28
III.2.1. TYPE ET PERIODE D'ETUDE
28
III.2.2. POPULATION D'ETUDE
29
III.2.3. POPULATION-CIBLE
29
III.2.4. ECHANTILLONNAGE
29
III.2.4.1. Technique d'échantillonnage et
taille d'échantillon
29
III.2.4.2. Critères d'inclusion
29
III.2.4.3. Critères de non-inclusion
29
III.2.5. VARIABLES D'ETUDE
29
III.2.6. ANALYSE DES DONNEES ET PRESENTATION
DES RESULTATS
30
III.2.7. LIMITES DE L'ETUDE ET DIFFICULTES
RENCONTREES
30
CHAPITRE IV. PRESENTATION DES RESULTATS
31
IV.1. ANALYSES MONOVARIEES
31
IV.1.1. PREVALENCE DU PALUDISME GRAVE
31
IV.1.2. DONNEES SOCIODEMOGRAPHIQUES
32
IV.1.3. DONNEES CLINIQUES
34
IV.1.4. DONNEES ANTHROPOMETRIQUES
38
IV.1.5. DONNEES BIOLOGIQUES ET IMMUNOLOGIQUES
41
IV.1.6. DONNEES THERAPEUTIQUES ET EVOLUTIVES
43
IV.2. ANALYSES BIVARIEES
46
IV.2.1. FORMES CLINIQUES ET AGE
46
IV.2.2. FORMES CLINIQUES ET SEXE
47
IV.2.3. FORMES CLINIQUES ET ETAT NUTRITIONNEL
(z-score P/A, P/T et T/A)
48
IV.2.4. FORMES CLINIQUES ET EVOLUTION
51
CHAPITRE V. DISCUSSION
52
V.1.1. Prévalence du paludisme grave
52
V.1.2. Données
sociodémographiques
52
V.1.3. Données cliniques
54
IV.1.4. Données anthropométriques
55
IV.1.5. Données biologiques et
immunologiques
56
IV.1.6. Données thérapeutiques et
évolutives
57
IV.2. Analyses bivariées
58
IV.2.1. Formes cliniques et âge
58
IV.2.2. Formes cliniques et sexe
58
IV.2.3. Formes cliniques et état
nutritionnel (z-score P/A, P/T et T/A)
59
IV.2.4. Formes cliniques et évolution
60
CONCLUSION ET RECOMMANDATIONS
61
BIBLIOGRAPHIE
64
ANNEXE: FICHE DE RECOLTE DES DONNEES
70
LISTE DES TABLEAUX
Tableau I : Echelle pédiatrique des
stades comateux (Echelle de Blantyre)
2
Tableau II. Répartition des malades par
années d'étude
32
Tableau III. Répartition des enfants
atteints de paludisme grave selon l'âge
32
Tableau IV. Répartition des malades selon le
temps écoulé entre le début des symptômes et la
consultation
34
Tableau V. Répartition des malades selon les
signes cliniques
35
Tableau VI. Répartition des malades selon
les formes cliniques de paludisme grave
36
Tableau VII. Répartition des malades selon
les diagnostics associés
37
Tableau VIII. Répartition des malades selon
le z-score poids/taille
38
Tableau IX. Répartition des malades selon
le z-score poids/âge
39
Tableau X. Répartition des malades selon
les diagnostics associés
40
Tableau XI. Répartition des malades selon
les résultats de la goutte épaisse
41
Tableau XII. Répartition des malades selon
les résultats du Test de diagnostic rapide
41
Tableau XIII. Répartition des malades selon
le taux d'hémoglobine
42
Tableau XIV. Répartition des malades selon
le groupe érythrocytaire et rhésus
42
Tableau XV. Répartition des malades selon le
type de traitement reçu avant hospitalisation
43
Tableau XVI. Répartition des malades selon
les diagnostics associés
45
Tableau XVII. Répartition des malades selon
le séjour hospitalier
45
Tableau XVIII. Répartition des malades selon
les formes cliniques en fonction de l'âge
46
Tableau XIX. Répartition des malades selon
les formes cliniques par sexe
47
Tableau XX. Répartition des malades selon
les formes cliniques en fonction z-score P/A
48
Tableau XXI. Répartition des malades selon
les formes cliniques en fonction z-score P/T
49
Tableau XXII. Répartition des malades selon
les formes cliniques en fonction z-score T/A
50
Tableau XXIII. Répartition des malades selon
les formes cliniques en fonction de l'évolution
51
LISTE DES FIGURES
Figure 1. Cycle biologique du Plasmodium
2
Figure 2. Théorie
mécanique de la physiopathologie
8
Figure 3. Théorie humorale
9
Figure 4. Prévalence cumulée du
paludisme grave
31
Figure 5. Répartition des enfants atteints
de paludisme grave selon le sexe
33
Figure 6. Répartition des enfants atteints
de paludisme grave selon la résidence
33
Figure 7. Répartition des malades selon le
z-score poids/taille
38
Figure 8 . Répartition des malades selon le
z-score poids/âge
39
Figure 9. Répartition des malades selon les
diagnostics associés
40
Figure 10. Répartition des malades selon la
molécule antipaludéenne reçue en hospitalisation
44
LISTE DES ABREVIATIONS
% : Pourcentage ou Pourcent
< : Inférieur à
>: Supérieur à
= : Inférieur ou égal à
= : Supérieur ou égal à
°C : degrés celsius
umol/L: micromoles/litre
ACT : ArtemisininCombinationTherapeurtic ou Association
thérapeutique à base d'artémisinine
ADN : Acide désoxyribonucléique
CD36 : 36ème classe de différenciation
CD4 : 4ème classe de différenciation
CHU : Centre Hospitalier Universitaire
CIVD : Coagulation intravasculaire disséminée
DR : Détresse respiratoire
ET : écart-type
FBH : Fièvre bilieuse hémoglobinurique
g/dl : gramme par décilitre
HRP : Histidine RichProtein
Ht : Hématocrite
IC : Intervalle de confiance
IFN : Interféron
IL6 : Interleukine 6
IM : Intramusculaire
IV : Intraveineux
mg/dl : milligramme par décilitre
mg/kg : milligrammes par kilogramme
mg : milligramme
MIF : Macrophage Migration Inhibitory Factor
mL/kg/24h: millilitre par kilogramme et par 24 heures
ml/kg : millilitres par kilogramme
mmHg : millimètres de mercure
mmol/l : millimoles par litre
OMS : Organisation Mondiale de la Santé
OR : Odds-ratio ou Rapport de risque
P/A : Poids pour âge
P/T : Poids pour taille
P : p-value ou valeur de p
PABA : Acide para-aminobenzoïque
PF/PV : Plasmodium falciparum/Plasmodium vivax
pH : potentiel d'hydrogène
Q1 : 1ère quartile
Q3 : 3ème quartile
QBC : Quantitative Buffy Coat
RESA : Ring Infected Erythrocyte Surface
s : seconde
SDRA : Syndrome de détresse respiratoire aiguë
StdDev : Standard Deviation ou Déviation
standard
T/A : Taille pour âge
TAS : Tension artérielle systolique
TDR : Test de diagnostic rapide
TNF-á : Tumor Necrosis Factor alpha ou Facteur de
nécrose tumorale alpha
WHO : World HealthOrganization
RESUME
Le paludisme grave et la malnutrition demeurent des
problèmes clés de santé publique pour les enfants en
Afrique subsaharienne. La relation de causalité entre ces deux
pathologies est sujette à des nombreuses controverses : certains
auteurs avaient trouvé que la malnutrition favoriserait la
morbi-mortalité palustre alors que d'autres soutiennent que la
malnutrition protègerait contre le paludisme grave, là où
les autres pensent, enfin, qu'il n'existerait aucune relation de
causalité statistiquement prouvée.
Pour cela, nous avons mené une étude descriptive
transversale à visée analytique portant sur l'évaluation
de l'état nutritionnel des enfants de 0 à 5 ans atteints de
paludisme grave, au cours d'une période de 4 ans, de 2012 à 2015,
à l'Hôpital Général de Kampemba et, dont les
objectifs étaient de décrire les caractéristiques
épidémiologiques, sociodémographiques, cliniques et
paracliniques des enfants atteints de paludisme grave, d'étudier le lien
entre le paludisme grave et l'état nutritionnel et de décrire
leur évolution clinique.
Nos résultats se sont présentés comme
suit : le paludisme grave était prévalent à 14,91%
en Pédiatrie, avec une prévalence annuelle moyenne de 43
cas ; l'âge moyen des malades était de 28,58#177;17,59 mois,
avec une prédominance masculine des cas dont lesex-ratio était de
1,17 et 87,80% de malades résidaient dans la zone de santé
étudiée. L'anémie sévère, le neuropaludisme
et la fièvre bilieuse hémoglobinurique étaient les formes
cliniques prépondérantes avec respectivement 63,22%, 35,63% et
9,77%. La malnutrition aiguë représentait 21,84% alors que
l'insuffisance pondérale était prévalent à 18,39%
et le retard de croissance à 11,49%. La goutte épaisse
était triplement positive chez 86,11% de malades et le test de
diagnostic rapide était positif chez 94,94% de malades.La quinine
était la principale molécule utilisée en hospitalisation
chez 94,25% de malades, avec un taux de guérison de 74,71% des
patients pour un séjour moyen de 5,67#177;3,26 jours. Par ailleurs,
nous avons trouvé une association statistiquement significative entre
les formes cliniques (notamment la fièvre bilieuse
hémoglobinurique et la détresse respiratoire) et
l'évolution et, aucun lien statistiquement significatif n'a
été noté entre le paludisme grave et l'état
nutritionnel.
Au regard de ces résultats, le paludisme grave et la
malnutrition constituent encore des problèmes de santé publique
dans notre milieu chez les enfants de 0 à 5 ans, partant de la
morbimortalité qu'il est susceptible d'entraîner. Quant à
la relation de causalité entre ces deux pathologies, des études
poussées devront être entreprises.
Mots-clés :
évaluation, état nutritionnel, paludisme grave, enfants
ABSTRACT
Severe malaria and malnutrition remain the key public health
problems for children in sub-Saharan Africa. The causality relationship between
these two conditions is subject to much controversy, some authors arguing that
malnutrition would favor the paludalmorbi-mortality whereas others sustain that
malnutrition would protect against severe malaria, where others, finally,found
that there is not a statistically proven causality relationship.
For this, we conducted a cross-sectional descriptive to
analytic aim study referred to the assessment of the nutritional status of
children 0 to 5 years old with severe malaria,during one period of 4 years, of
2012 to 2015, to the General hospital of Kampemba and,whose objectives were to
describe the epidemiological, sociodemographic, clinical and laboratory
features of children with severe malaria, to study the link between severe
malaria and nutritional status and to describe their clinical evolution.
Our results are presented as follows: thesevere malaria was
prevail to 14.91% in Pediatrics, with an average annual prevalence of 43 cases;
the average age of patients was 28.58 #177; 17.59 months, with a male
predominance of cases in which the sex ratio is 1.17, and 87.80% of patients
residing in the studied health zone. Severe anemia, cerebral malaria and
blackwater fever were the most found clinical forms with 63.22%, 35.63% and
9.77% respectively. Acute malnutrition represented 21.84% while the underweight
was ruling at 18.39% and stunting to 11.49%. The thick blood was triply
positive in 86.11% of patients and TDR was positive in 94.94% of patients;
Quinine was the mainmolecule in hospitalization in 94.25% of patients, with a
cure rate of 74.71% of the patients for an average stay of 5.67 #177; 3.26
days. Furthermore, we found a statistically significant association between
clinical forms (including blackwater fever and respiratory distress) and
evolution,whereas no statistically meaningful association was found between
severe malaria and nutritional status.
According to these results, severe malaria and malnutrition
constitute public health problems in our countries for children of 0 to 5
years old, leaving from the morbimortality that it is susceptible to drag. For
the causality relationship between these two pathologies, some advanced studies
should be undertaken.
Keywords: assessment, nutritional
status, severe malaria, children
INTRODUCTION
1. ETAT DE LA QUESTION
Le paludisme (fièvre des marais ou malaria) est une
maladie parasitaire due à l'infestation par des hématozoaires, du
genre Plasmodium, dont il existe à ce jour six espèces
pathogènes pour l'homme: Plasmodium falciparum, Plasmodium
vivax, Plasmodium ovale, Plasmodium malariae, Plasmodium knowlesi et Plasmodium
cynomolgi [1].
Le paludisme grave se définit par la mise en
évidence clinique ou paraclinique du dysfonctionnement d'un organe vital
lié à la présence des formes asexuées de
Plasmodium dans le sang. Le Plasmodium falciparum est
l'hématozoaire le plus principalement incriminé, bien que le
Plasmodium vivax et le Plasmodium knowlesi peuvent aussi en
être la cause, ce qui fait qu'un accès palustre simple dû
à ces espèces devrait bénéficier d'une prise en
charge rapide. Chez les enfants si souvent, le paludisme à
Plasmodium falciparum évolue tellement rapidement qu'il est
impossible de le traiter au stade de paludisme simple [2,3].
Selon le rapport mondial sur la malaria, le paludisme reste le
principal problème de santé publique dans des nombreux pays du
monde, particulièrement les pays pauvres, dont la République
Démocratique du Congo et il a été estimé à
247 millions de cas de malaria dont 86% vivaient en Afrique dont 80%
étaient distribués dans 13 pays Africains dont le Nigeria, la
République Démocratique du Congo, l'Ethiopie, la Tanzanie et le
Kenya. Des 3,3 milliards de personnes à risque, 2,1 milliards
étaient à risque faible dont 97% vivaient en dehors des
régions africaines alors que sur les 1,3 milliards à haut risque,
49% vivaient en Afrique et 37% en Asie Orientale. La létalité
palustre était estimée à 881 000 dont 91%, soit
801 000 était en Afrique et 85% concernait les enfants de moins de
5 ans.Selon le même rapport, en République Démocratique du
Congo, en 2006, sur un total de 60 643 888 enquêtés,
5 008 956 personnes étaient atteintes de paludisme et 24 347
personnes en étaient décédées [4].
Quant à la malnutrition, considérée comme
étant un état pathologique résultant de la carence
ou de l'excès relatif d'un ou plusieurs nutriments essentiels,
que cet état se manifeste cliniquement ou ne soit
décelable que par des analyses biochimiques,
anthropométriques ou physiologiques, elle affecte 2 milliards de
personnes dans le monde en 2011 souffrant de carences en sels minéraux
et en vitamines, pouvant provoquer des maladies mortelles et, en 2005, on
estimait à 56% la proportion des décès d'enfants de moins
de 5 ans liés à la malnutrition [6].
Dans leur étude sur les facteurs de risque de
décès au cours du paludisme grave chez l'enfant au Centre
hospitalier universitaire pédiatrique Charles de Gaulle de Ouagadougou
(Burkina Faso), Kouéta et al [7] avaient trouvé qu'un niveau
socio-économique faible (odds ratio, OR = 5,4), le retard de la prise en
charge (OR = 15,5), le mauvais état nutritionnel (OR = 7,9) et une
parasitémie supérieure ou égale à 5 % (OR = 2,8)
étaient associés à une augmentation significative du
risque de décès.
Entre 2001 et 2010, la situation de malnutrition aiguë en
RDC a connu une amélioration sensible. En effet, la prévalence de
la malnutrition aiguë globale au niveau national est passée de 16 %
en 2001 à 11 % en 2010 ; à l'opposé de la
malnutrition aiguë, la malnutrition chronique connaît une
stagnation au niveau national. La prévalence de cette forme de
malnutrition était de 38% en 2001 et demeure au même niveau en
2010. Les provinces les plus affectées sont : le Nord Kivu (53%), le
Kasaï Occidental (47 %) et le Sud Kivu (44%). Au total, plus de 5 millions
d'enfants de moins de 5 ans sont affectés par cette forme de
malnutrition en RDC [8].
Plusieurs auteurs ont travaillé sur le lien entre le
paludisme et la malnutrition et, leurs résultats restent sujets à
controverses : certains auteurs affirment que la malnutrition favorise la
survenue du paludisme [9-12], alors que d'autres soutiennent que la
malnutrition protège contre la survenue du paludisme [13] et celle du
paludisme grave [14-16]. Enfin quelques auteurs n'ont observé aucune
association entre la malnutrition et la morbidité liée au
paludisme [17, 18, 19]. En ce qui concerne la mortalité liée au
paludisme, la majorité des auteurs soutiennent qu'elle est
favorisée par une malnutrition [15,17, 20,21].
2. PROBLEMATIQUE
Etant donné le taux de mortalité engendré
tout aussi bien par la malnutrition que par le paludisme, leur lien a toujours
demeuré une situation préoccupation, une curiosité
scientifique et en même temps un véritable de problème de
santé publique, qu'il convient de combattre et nous tâcherons,
à travers ce travail, de savoir à notre tour s'il existe un lien
entre le paludisme grave et la malnutrition.
3. CHOIX ET INTERET DU SUJET
Dans le cadre de notre rédaction scientifique de fin
d'études, nous avons opté de travailler sur
« l'évaluation de l'état nutritionnel des enfants de 0
à 59 mois atteints de paludisme grave ». Ce choix se justifie
par l'endémicité de ces deux grandes pathologies, étant
donné qu'elles sont des pathologies de la pauvreté,
caractéristique principale da notre milieu.
L'intérêt que notre travail présente, se
situe à deux niveaux : au niveau personnel, il nous permettra
d'approfondir nos connaissances sur le paludisme et la malnutrition qui sont
des réels problèmes de santé publique dans nos milieux, en
vue de mieux les combattre ; au niveau scientifique, ce travail
constituera une base pour les futurs chercheurs en cette matière et une
source de documentation et d'orientation.
4. OBJECTIFS DU TRAVAIL
4.1. OBJECTIF GENERAL
L'objectif général de notre travail vise
à évaluer l'état nutritionnel des enfants atteints de
paludisme grave, âgés de 0 à 59 mois.
4.2. OBJECTIFS SPECIFIQUES
Spécifiquement, nous tâcherons de :
- Décrire les paramètres
sociodémographiques, cliniques et paracliniques des enfants atteints de
paludisme grave ;
- Etudier le lien entre le paludisme grave et l'état
nutritionnel des enfants de 0 à 59 mois.
- Décrire l'évolution clinique de ces
enfants.
5. SUBDIVISION DU TRAVAIL
Notre travail sera subdivisé en deux grandes parties,
hormis l'introduction générale et la conclusion : la
première partie sera théorique et subdivisée en deux
chapitres dont le premier parlera des généralités sur le
paludisme grave et le second sur les facteurs associés à la
gravité du paludisme et, la deuxième partie se basera sur
l'approche pratique et comprendra trois chapitres dont le premier sera en
rapport avec la méthodologie du travail, le deuxième traitera des
résultats et le dernier sera consacré à la discussion.
EVALUATION DE L'ETAT NUTRITIONNEL
DES ENFANTS AGES DE 0 à 5 ANS ATTEINTS DE PALUDISME GRAVE
PREMIERE PARTIE :
APPROCHE THEORIQUE
CHAPITRE I. GENERALITES SUR LE
PALUDISME GRAVE
I.1. DEFINITION
L'actuelle définition opérationnelle du
paludisme grave, fournie par Warrel DA en 1990 et adoptée actuellement
par l'Organisation Mondiale de la Santé considère le paludisme
grave comme étant la présence d'hématozoaires au stade
asexué dans le sang associé à au moins un critère
clinique ou biologique de gravité, à savoir : troubles de la
conscience (Score de Glasgow modifié = 9chez l'adulte et enfant de
plus de 5 ans ou Score de Blantyre = 2chez le petit enfant), convulsions
répétées (= 2 / 24 heures malgré la correction
de l'hyperthermie) ; prostration (extrême faiblesse ou chez l'enfant
: «impossibilité, de tenir assis pour un enfant en âge de le
faire, ou de boire pour un enfant trop jeune pour tenir assis »),
détresse respiratoire (respiration profonde et acidosique) ;
ictere (clinique ou biologique avec bilirubine > 50 umol/L) ;
hémoglobinurie macroscopique (urines rouges foncées ou
noires ou hémoglobinurie ou myoglobinurie à la bandelette avec
Absence d'hématurie microscopique), collapsus circulatoire (TAS
< 50 mmHg chez l'enfant) ; OEdème
pulmonaire (définition radiologique) ; saignements
anormaux (définition clinique); anémie
grave (Hémoglobine < 5 g/dl ou Hématocrite <
15%) ; hypoglycémie (glycémie < 2,2 mmol/l ou <
40 mg/dl) ; acidose métabolique (pH < 7,35 ou bicarbonates
< 15 mmol/l) ; hyperlactatémie (lactates plasmatiques >
5 mmol/l) ; hyperparasitémie ( > 4% chez un sujet non
immun) ; insuffisance rénale (créatininémie >
265 umol/l après réhydratation ou diurèse < 12mL/kg/24h
chez l'enfant) [2, 21, 22].
I.2. ETIOLOGIE
I.2.1. Agent causal
L'agent causal du paludisme est un protozoaire du genre
Plasmodium, dont il existe, à l'heure actuelle, six
espèces responsables de la pathologie chez l'homme, à savoir, le
Plasmodium falciparum, le Plasmodium vivax, le Plasmodium
knowlesi, le Plasmodium ovale, le Plasmodium malariae et
le Plasmodium knowlesi. Des six espèces actuellement reconnues,
trois sont à la base du paludisme, à savoir : le
Plasmodium falciparum, le Plasmodium vivax et le
Plasmodium knowlesi. Hormis ces six espèces, d'autres
Plasmodiumssimieques sont potentiellement réputés
d'être à la base du paludisme chez l'homme et sont encore à
l'étude : Plasmodium inui, Plasmodium simiovale, Plasmodium
brazilianum, Plasmodium schwetzi et Plasmodium simium[2, 23-25].
I.2.2. Vecteurs
La transmission du paludisme se fait par piqûre d'un
insecte hématophage, l'anophèle femelle dont il existe plusieurs
espèces vectrices de Plasmodium, entre autres : Anopheles
gambiae, Anopheles funestus, Anopheles nili, Anopheles moucheti, etc
[23,26].
I.3. PHYSIOPATHOLOGIE
I.3.1. Cycle du plasmodium
Le cycle parasitaire se développe successivement chez
l'homme (cycle asexué ou schizogonique) et chez l'anophèle (cycle
sexué ou sporogonique) [23,27].
I.3.1.1. Cycle asexué ou schizogonique ou
étape humaine du cycle plasmodial
La schizogonie se déroule en deux grandes
étapes : une étape hépatique ou
exo-érythrocytaire et une étape sanguine ou
endo-érythrocytaire.
I.3.1.1.1. Etape hépatique ou
exoérythrocytaire ou pré-érythrocytaire de la
schizogonie
Le cycle parasitaire débute par une piqûre
infectante d'une anophèle femelle à travers laquelle le moustique
injecte avec sa salive dans un capillaire sanguin des centaines de parasites
sous forme de sporozoïtes qui gagnent le foie en moins de 30 minutes.
S'effectue alors le cycle exo-érythrocytaire ou
pré-érythrocytaire avec multiplication des parasites dans les
hépatocytes pendant 1 à 3 semaines environ. L'éclatement
des hépatocytes parasités conduit à la libération
dans la circulation sanguine de milliers de mérozoïtes. En cas
d'infection par Plasmodium vivax ou Plasmodium ovale, les
parasites intrahépatocytaires peuvent rester quiescents sous forme
d'hypnozoïtes pendant plusieurs mois à plusieurs années, et
les passages sanguins de ces parasites peuvent se répéter
à des intervalles de plusieurs mois, étant alors
àl'origine des accès de reviviscence palustre.
I.3.1.1.2. Etape sanguine ou
endoérythrocytaire
Les mérozoïtes pénètrent dans les
hématies puis se transforment en trophozoïtes. Dans
l'hématie parasitée, le trophozoïte grossit, son noyau se
divise pour aboutir à la formation d'un schizonte, puis d'un schizonte
mûr ou corps en rosace. Ensuite, le corps en rosace éclate,
libérant des mérozoïtes qui vont coloniser de nouvelles
hématies vierges et effectuer de nouveaux cycles
schizogoniquesendo-érythrocytaires. La durée du cycle
endo-érythrocytaire varie selon l'espèce plasmodiale ; elle est
de 48 h pour Plasmodium falciparum, Plasmodium vivax et
Plasmodium ovale, et de 72 h pour Plasmodium malariae, cela
explique la périodicité des accès fébriles qui
surviennent lors de la rupture d'un grand nombre d'hématies
parasitées : fièvre tierce pour Plasmodium falciparum,
Plasmodium vivax et Plasmodium ovale, et fièvre quarte
pour Plasmodium malariae.
I.3.1.2. Cycle sexué ou sporogonique ou
anophélien du Plasmodium
Après plusieurs cycles schizogoniques, des
gamétocytes mâles et femelles vont apparaître dans les
hématies. Ils vont être ingérés avec les autres
éléments sanguins par l'anophèle femelle lors d'un repas
sanguin sur un patient paludéen. Les gamétocytes vont ensuite se
transformer en gamètes dans l'estomac du moustique. La
fécondation du gamète femelle par un gamète mâle
aboutit à la formation de l'ookinète, qui va traverser la paroi
de l'estomac et se transformer en oocyste. Les sporozoïtes vont ensuite
se développer dans l'oocyste, être libérés par
éclatement, puis gagner les glandes salivaires du moustique. Le cycle
sexué dure 10 à 40 jours selon la température ambiante.
Ce cycle peut être représenté de la
manière suivante :
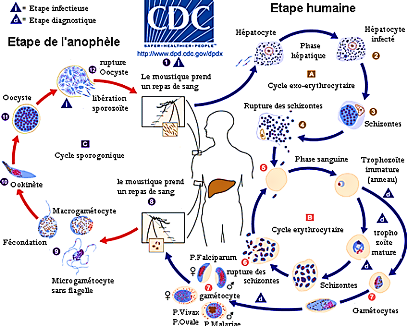
Figure
1. Cycle biologique du Plasmodium[27]
I.3.2. Mécanismes
physiopathologiques du paludisme grave [28-34]
Bien que non encore complètement
élucidée, la physiopathologie du paludisme grave repose
actuellement sur deux grandes théories qui convergent en certains
points : d'une part, la théorie mécanique et d'autre part,
la théorie humorale.
I.3.2.1. Théorie mécanique ou non
immunologique
Séquestration des hématies
Cette théorie peut être illustrée comme
suit :
Présence des knobs ligands (protéines) au
niveau des hématies parasitées
Agglomération des hématies saines avec
des hématies parasitées
Adhésion des hématies parasitées
sur les récepteurs de l'endothélium capillaire
=CYTOADHERENCE
Formation des rosettes
Formation d'un bouchon
Reins
Vaisseaux
Séquestration des hématies
Hémolyse
Anémie Ischémie
Séquestration des hématies
Hémoglobinurie Ischémie
Séquestration des hématies
Nécrose tubulaire aiguë
Ischémie
Séquestration des hématies
Stase vasculaire
Séquestration des hématies
Insuffisance rénale
Séquestration des hématies
Lésions endothéliales
Séquestration des hématies
Augmentation de la pression hydrostatique
Séquestration des hématies
Hypoxie circulatoire
Séquestration des hématies
Libération des phospholipides
Séquestration des hématies
Infiltrats hémorragiques
périvasculaires
Séquestration des hématies
Acidose
Séquestration des hématies
OEdème
Séquestration des hématies
Transsudation
Séquestration des hématies
Figure
2. Théorie mécanique
CIVD
Séquestration des hématies
Elle est basée sur la cytoadhérence des
hématies parasitées sur les cellules endothéliales,
à la base de l'obstruction de la microcirculation capillaire. En effet,
la cytoadhérence est le fruit de l'interaction entre les
adhésinesplasmodiales, qui sont des exoantigènes qui
s'individualisent à partir des Plasmodiums
intraérythrocytaires pour se fixer à la surface des
hématies (RESA ou Ring Infected Erythrocyte Surface) et les
récepteurs cellulaires dont la thrombospondine, les
glycoprotéines, le CD36, l'ICAM-1, l'ELAM-1, le VCAM-1, la
chondroïtine sulfate, qui sont sécrétées par des
cellules endothéliales, les macrophages et les plaquettes sanguines.
L'activation des cellules par les TNF á augmente les
sécrétions des récepteurs endothéliaux. Cette
théorie explique la coagulation intravasculaire
disséminée, l'acidose, les oedèmes,
l'hémoglobinurie et l'anémie ; cette dernière
constitue le carrefour entre les deux théories.
I.3.2.2. Théorie humorale ou immunologique
Action des toxines de Plasmodium sur les cellules
immunocompétentes (Macrophages et Lymphocytes T)
Séquestration des hématies
Cette théorie permet d'expliquer l'anémie,
l'hyperthermie, l'acidose, les convulsions, le coma, l'hypoglycémie,
l'insuffisance rénale ainsi que le choc. Sa base est la
sécrétion des cytokines, dont le tumor necrosis factor,
l'interleukine-1 et l'interleukine-6, qui sont sécrétées
par les macrophages et les lymphocytes T CD4. C'est le taux sanguin du tumor
necrosis factor qui est le sous-bassement de la mortalité et de la
gravité du paludisme.
Sécrétion de Tumor Necrosis
Factor
Séquestration des hématies
Action sur le Tube digestif
Action sur le muscle strié
Action sur la circulation
Dérèglement du centre
thermorégulateur
Séquestration des hématies
Action sur la moelle osseuse
Rhabdomyolyse
Séquestration des hématies
Diarrhée et vomissements
Libération de la myoglobine
Séquestration des hématies
Hyperthermie
Séquestration des hématies
Dysérythropoïèse
Séquestration des hématies
Libération de monoxyde d'azote
Augmentation des radicaux libres
Augmentation des CPK et diminution de la
néoglucogenèse
Anémie
Séquestration des hématies
Oligurie
Myoglobinurie
Coma
Séquestration des hématies
Convulsions
Séquestration des hématies
Troubles hydroélectrolytiques
Séquestration des hématies
Insuffisance rénale
Séquestration des hématies
Hypoglycémie
Séquestration des hématies
Vasodilatation
Séquestration des hématies
Souffrance cérébrale
Séquestration des hématies
Figure 3. Théorie humorale
Acidose
Séquestration des hématies
Choc
Séquestration des hématies
gure 3. Théorie
humorale
Dans le neuropaludisme, en dehors du TNF, d'autres
médiateurs comme le Pan les PGN ainsi que le monoxyde d'azote jouent un
rôle capital et, parmi eux, le monoxyde d'azote est très toxique
pour le cerveau et peut conduire à un coma ou à la mort.
I.3.2.3.Facteurs adjuvants
Les facteurs adjuvants dans la physiopathologie du paludisme
grave, sont d'une part, les facteurs parasitaires comme la sensibilité
de la souche aux antipaludéens, l'importanjce de l'incoculum et la
virulence de la souche et, d'autre part, les facteurs de l'hôte
comprennant des facteurs génétiques, immunologiques et
nutritionnels ; ces derniers seront exploités dans le
deuxième chapitre
I.4. DIAGNOSTIC CLINIQUE ET
BIOLOGIQUE
Le diagnostic du paludisme grave est basée sur les
critères cliniques et biologiques de l'Organisation Mondiale de la
Santé, lesquels éléments peuvent s'accompagner ou non de
la fièvre et, dans ce dernier cas, l'évolution est dangereuse.
I.4.1. Diagnostic clinique [2,
35-37]
I.1.4.1. L'hypoglycémie
L'hypoglycémie palustre se définit par un taux
de glucose sanguin inférieur à 2,2 mmol /l ou 40mg/dl. En
raison de l'augmentation des besoins métaboliques et des réserves
limitées en glycogène, l'hypoglycémie est
particulièrement fréquente chez les enfants de moins de trois
ans, en particulier ceux chez qui l'anthropométrie met en
évidence un état de sous-nutrition, ceux qui sont dans le coma,
ont une acidose métabolique (détresse respiratoire) ou des
troubles circulatoires. La mortalité augmente avec une glycémie
< 2,2 mmol/l. On envisagera aussi une hypoglycémie chez les enfants
présentant des convulsions ou une hyperparasitémie. Cliniquement,
elle passe facilement inaperçue, ses manifestations pouvant être
semblables à celles du neuropaludisme. Les enfants auxquels on
administre une transfusion sanguine ou qui sont incapables de boire sont
exposés à un risque accru d'hypoglycémie et doivent faire
l'objet d'un suivi attentif. Cette hypoglycémie est associée
à des taux abaissés d'insuline et de c-peptide, elle est
essentiellement attribuée au paludisme et non à la quinine.
I.4.1.2. Neuropaludisme
Egalement appelé Paludisme grave forme neurologique,
accès pernicieux ou Malaria cérébral, cette forme de
paludisme associe les éléments suivants : la fièvre
(37,5 - 41 °C) est en général le premier symptôme du
neuropaludisme chez l'enfant ; suivent ensuite, un refus de s'alimenter et de
boire. Les vomissements et la toux sont fréquents, la diarrhée
rare. La période symptômatique précédant le coma
peut être de courte durée : un à deux jours en
général. Chez l'enfant, la perte de conscience après des
convulsions fébriles ne conduit à envisager le neuropaludisme que
si le coma persiste plus de 30 minutes après la crise convulsive. La
profondeur du coma peut être évaluée avec l'échelle
de Blantyre (voir tableau I ci-dessous).
Tableau I : Echelle pédiatrique des stades
comateux (Echelle de Blantyre)
|
Type de réponse
|
Réponse
|
Score
|
|
Meilleure réponse motrice
|
Localisation du stimulus douloureux
|
2
|
|
Retrait du membre en réponse à la douleur
|
1
|
|
Réponse non spécifique ou absence de
réponse
|
0
|
|
Meilleure réponse verbale
|
Pleurs appropriés
|
2
|
|
Gémissements ou pleurs inappropriés
|
1
|
|
Aucune
|
0
|
|
Mouvements des yeux
|
Dirigés (suivent le visage de la mère par
exemple)
|
1
|
|
Non dirigés
|
0
|
|
Total
|
|
5
|
I.4.1.3. L'acidose métabolique
Cette forme de paludisme grave est définie par Elle est
définie par un taux plasmatiques de bicarbonate inferieur à
15mmol /l ou à un excès de base supérieur à
-10mmol/l .Elle peut s'accompagner ou non d'une acidemie (pH capillaire ou
artériel inférieur à 7,35). Elle est essentiellement
liée à une hyperlactémie définie par un taux de
lactate plasmatique supérieur à 5mmol/l, qui constituée
aussi un indicateur de paludisme grave.
I.4.1.4. Anémie grave
Reconnaissable par la pâleur des téguments et
définie par un taux d'hémoglobine inférieur à 5%
(5 g/dl) ou d'hématocrite inférieur à15% ; la
nouvelle définition n'exclut pas les anémies microcytaires, il
faudra rechercher les signes d' intolérance d' une insuffisance
cardiaque droite puis globale et au maximum d' un collapsus ou des troubles de
conscience fait redouter une évolution fatale possible et impose une
transfusion dans les meilleurs délais.
I.4.1.5. Insuffisance rénale
Elle se définie par une diurèse inferieure
à 12ml/kg/24h ou par une créatininémie restant
élevée par rapport à l'âge malgré la
réhydratation initiale ; elle est rare chez l'enfant, une
protéinurie du type tubulaire surtout, plus rarement glomérulaire
est fréquemment constituée.
I.4.1.6. Trouble de conscience sans coma
Ils sont définis par un score de Glasgow
modifié, compris entre 9 et 14 ou un score de Blantyre entre 2 et 5.
I.4.1.7. Prostration
La prostration se définit comme l'incapacité
pour l'enfant à s'assoir sans aide (pour un enfant en âge de le
faire) ou se nourrir (pour le nourrisson).
I.4.1.8. Syndrome de détresse respiratoire
En faveur de ce critère, il y a la respiration
profonde, avec tirage intercostal dans la partie inférieure de la cage
thoracique et absence de signes de localisation au niveau thoracique,
évoquant l'acidose métabolique, avec une dyspnée de type
Kussmaul. Le tirage intercostal seul est un signe moins utile. L'acidose
accompagne souvent un neuropaludisme, une anémie sévère et
une insuffisance de perfusion tissulaire.
I.4.1.9. Convulsions multiples
A partir de deux convulsions dans les 24h quel que soit leur
caractère généralisé ou local, il s'agit d'un
paludisme grave. Ce critère est beaucoup plus fréquent chez
l'enfant. En zone d'endémie palustre, la survenue d'une convulsion lors
d'un état fébrile est très évocatrice d'un
paludisme, mais elle ne suffit pas à définir la gravité.
Au cours d'un accès palustre, une crise convulsive peut être
attribuée seulement à la fièvre. Cependant il ne faut pas
la banaliser, les convulsions fébriles du paludisme survenant plus
fréquemment à un âge plus tardif que lors des autres
affections fébriles. C'est pourquoi sa constatations doit faire craindre
un paludisme cérébral débutant.
I.4.1.10. Collapsus circulatoire
Les signes de troubles circulatoires sont fréquents
(temps de remplissage capillaire > 2 s, froideur des mains et/ou des pieds).
Une hypotension modérée (tension artérielle systolique
< 70 mm Hg chez le nourrisson < 1 an et < 80 mm Hg chez l'enfant >
1 an) est présente dans 10 % des cas, tandis que l'hypotension
sévère (tension artérielle systolique < 50 mm Hg) est
rare (< 2 % des enfants atteints de paludisme grave).
I.4.1.11. OEdème pulmonaire
L'oedème pulmonaire est rare chez l'enfant, il
répond maintenant à une définition radiologique. Son
évolution est volontaires retardée des quelques jours, en
relation fréquente avec une réhydration excessive.
I.4.1.12. Saignements anormaux
Le saignement peuvent être cutanés ou muqueux,
ils sont rare chez l'enfant et sont le plus souvent rapportés à
une coagulation intravasculaire disséminée (CIVD) bien que
celle-ci ne permette pas de parler de paludisme grave en l'absence
d'hémorragie.
I.4.1.13. Ictère
Sa définition actuelle est clinique, il est moins
fréquente chez l'enfant que chez l'adulte.sa constatation suffit
à caractériser la gravité chez le nouveau-né en
zone d'endémie, il peut prendre la marque d'un ictère
néonatal de diagnostic délirant.
I.4.1.14. L'hémoglobinurie
Seul son caractère macroscopique avec constatation
d'urines rouge porto ou noire est un critère de gravité. Devant
ce tableau, il faut également évoquer une fièvre bilieuse
hémoglobinurie, dont le diagnostic repose sur le contraste entre la
sévérité du tableau clinique de la constatation de
parasité mie faibles ou absentes. Cette complication rare mais
redoutable du paludisme à plasmodium falciparum est en effet
définie cliniquement par l'association d'une fièvre et d'une
hémoglobinurie macroscopique (Black Water Fever des anglo-saxons). Elle
résulte d'une hémolyse intra vasculaire pouvant entrainer une
insuffisance rénale.
I.4.1.15. Hyper-parasitémie
La relation entre le parasite mies et la gravité du
paludisme, varie selon le niveau et l'Age chez les enfants non immuns vivant en
zone de paludisme instable, un parasite mie supérieure à 4%
représente un critère de gravité. En zone de transmission
holo ou hyper endémique, une densité parasitaire
supérieure à 20% est requise pour indiquer un paludisme grave.
I.4.2. Diagnostic biologique et
parasitologique [35,37-39]
Le diagnostic biologique et parasitologique du paludisme grave
comprend un arsenal d'examens de laboratoire et d'imagerie médicale que
nous pouvons scinder en deux groupes : les examens à visée
détective du plasmodium et les autres examens paracliniques.
I.4.2.1. Examens à visée détective du
Plasmodium
Ces examens peuvent être classés en
méthodes directes et méthodes indirectes :
I.4.2.1.1. Méthodes directes
Il s'agit essentiellement de la goutte épaisse et du
frottis sanguin. La goutte épaisse est la technique de diagnostic de
référence du paludisme. Il s'agit d'une technique de
concentration des parasites sur lame à partir d'une goutte de sang
capillaire suivie de coloration au Giemsa et de l'observation au microscope
alors que le frottis sanguin est la technique de référence pour
le diagnostic de l'espèce, car elle permet non seulement de voir les
parasites mais aussi d'apprécier la forme des globules rouges
parasités.
I.4.2.1.2. Méthodes indirectes
Ces méthodes comprennent des tests sérologiques
et des méthodes immunoenzymatiques : Aucune de ces techniques n'est
cependant totalement satisfaisante, et leur place n'apparaît qu'en
deuxième ligne en cas de doute diagnostique ou de traitement
préalable dans un contexte clinique évocateur. Le test «
Quantitative Buffy Coat » (QBC) permet d'affirmer la présence de
Plasmodium mais ne permet pas d'identifier l'espèce. La détection
de l'antigénémie HRP-2 (Histidine RichProtein 2) est
spécifique de P. falciparum(elle est donc négative en cas de
paludisme causé par une autre espèce). La détection
d'antigène parasitaire : test sur bandelettes réactives
contenant un anticorps monoclonal. Le parasite et l'ICT malaria Pf test
détecte l'antigène HRP-L (Histidinrichprotéine) et sont
spécifiques du plasmodium falciparum ; Le test ICT malaria PF/PV
détecte l'antigène HRP-2 de plasmodium falciparum, celui de
plasmodium vivax et probablement celui de de plasmodium ovale. Le test optimal
détecte la PCDH (parasite lactate déshydrogénase de
plasmodium falciparum et de l'ensemble de plasmodium.
Les tests sérologiques reposent sur
l''immunofluorescence, l'hémoglobination, l'immuno-transfert et l'ELISA,
sans oublier les Tests diagnostics rapides.
I.4.2.2. Autres examens
- Glycémie.
- Hématocrite (Ht).
- Ponction lombaire pour éliminer une méningite.
- Créatinine plasmatique; l'urée est une
alternative, mais il n'est pas nécessaire de mesurer les deux, compte
tenu du fait que la créatinine est plus utile.
- Electrolytes, ceux-ci peuvent de temps en temps
révéler une anomalie qui peut être corrigée comme
l'hyponatrémie. La créatinine et les électrolytes sont
d'un grand intérêt quand il y a un risque d'insuffisance
rénale aiguë ou que celle-ci se constitue.
- Hémoculture, parce qu'une septicémie peut
compliquer un paludisme grave à Plasmodium falciparum et causer un
état de choc ou une fièvre d'origine inconnue.
- Numération globulaire complète et formule
leucocytaire. Elles indiquent parfois la possibilité d'un diagnostic
supplémentaire, ex. /grosseosinophilie, ou une complication, par ex.
thrombopénie majeure.
- Gaz du sang, pH et trou anionique : Ils aident à
identifier une acidose et le syndrome de détresse respiratoire de
l'adulte (SDRA).
- Radiographie thoracique. Elle peut identifier un
oedème pulmonaire ou une condensation lobaire.
- Concentrations en lactates du plasma et du liquide
céphalorachidien. Celles-ci sont élevées dans l'acidose
lactique : des taux élevés (>6 mmol/litre ou plus) sont
associés à un mauvais pronostic.
- Les tests des fonctions hépatiques peuvent être
utiles pour distinguer un paludisme grave à Plasmodium falciparum d'une
hépatite aiguë.
I.5. COMPLICATIONS ET PRISE EN
CHARGE
I.5.1. COMPLICATIONS [2]
Les complications du paludisme grave comprennent le
neuropaludisme, l'anémie grave, l'hypoglycémie, la
détresse respiratoire, l'acidose métabolique,
l'hémoglobinurie et l'hyperthermie.
I.5.2. PRISE EN CHARGE
I.5.2.1. PRISE EN CHARGE CURATIVE [2, 22, 37]
En cas de paludisme grave, la prise en charge curative peut
faire recours à :
· L'artésunate 2,4 mg/kg de poids corporel
administrés par voie intraveineuse (IV) ou intramusculaire (IM) à
l'admission (t = 0), puis 12 h et 24 h plus tard et, par la suite, une fois par
jour jusqu'à ce que le patient puisse prendre ses médicaments par
voie orale.
· Si l'on n'a pas d'artésunate injectable, il peut
être remplacé par l'artéméther ou la quinine :
ü artéméther : 3,2 mg/kg de poids corporel
à l'admission puis 1,6 mg/kg par jour ou
ü Dichlorhydrate de quinine : 20 mg de sel de quinine/kg
(dose de charge) à l'admission, puis 10 mg/kg toutes les 8 h. Chaque
dose est administrée en perfusion intraveineuse, diluée dans 10
ml/kg de soluté salin isotonique, en 2 à 4 heures avec une
vitesse de perfusion ne dépassant pas 5 mg de sel de quinine/kg par
heure. Si l'on ne peut pas administrer la quinine en perfusion IV, on peut
pratiquer une injection IM à la même posologie sur la face
antérieure de la cuisse. Chaque dose pour l'injection IM doit être
diluée dans un soluté salin normal à une concentration de
60-100 mg de sel/ml puis injectée en deux sites afin d'éviter
d'administrer un trop grand volume au niveau d'un seul site.
I.5.2.2. PRISE EN CHARGE PALLIATIVE OU SYMPTOMATIQUE
Comme son nom le dit, la prise en charge symptomatique va
s'attaquer aux différents symptômes que peut présenter le
patient ; c'est le cas par exemple :
o Des convulsions, qui seront traités en administrant
le diazépam en bolus intraveineux à la dose de 0,3 mg/kg en 2
minutes ou 0,5 mg/kg par voie intra rectale. Une seconde dose de
diazépam peut être administrée si les convulsions n'ont pas
cessé au bout de 10 minutes. On peut utiliser le midazolam (à la
même dose) au lieu du diazépam, soit par voie intraveineuse, soit
par voie orale. Si persistance des convulsions malgré l'administration
des deux doses de diazépam, on considèrera que ces patients sont
dans un état de mal épileptique et leur donner de la
phénytoïne (dose de charge de 18 mg/kg, puis une dose d'entretien
de 5 mg/kg par jour pendant 48 heures). Si ce médicament n'est pas
disponible ou s'il n'enraye pas les convulsions, administrer du
phénobarbital (dose de charge de 15 mg/kg par voie intramusculaire ou
par voie intraveineuse lente, puis dose d'entretien de 5 mg/kg par jour pendant
48 heures). Lorsqu'on utilise du phénobarbital, surveiller attentivement
la respiration du patient. Le phénobarbital à forte dose (20
mg/kg) peut entraîner une dépression respiratoire et augmenter le
risque de décès.
o La détresse respiratoire nécessitera une
oxygénothérapie et corriger toute cause réversible
d'acidose, en particulier la déshydratation et l'anémie
sévère. La perfusion intraveineuse est la méthode de
choix, par la voie périphérique la plus accessible. En cas
d'impossibilité, pratiquer une perfusion intra-osseuse. Veiller à
ne pas administrer trop de liquide, ce qui risquerait de hâter la
survenue d'un oedème pulmonaire.
o La fièvre pourra être attaquée par des
antipyrétiques ;
o L'hypoglycémie (seuil d'intervention de < 3
mmol/l) sera corrigée en administrant 500 mg/kg de glucose. On utilisera
du dextrose sous forme parentérale en administrant immédiatement
5 ml/kg de dextrose à 10 % par une voie périphérique,
suivi d'une perfusion intraveineuse de 5 ml/kg de dextrose à 10 % ou de
10 ml/kg de dextrose à 5 % par heure pour éviter la
récurrence de l'hypoglycémie. Si l'on ne peut pas avoir recours
à la voie intraveineuse, on doit tenter la voie intra-osseuse.
o En cas d'anémie, on évaluera avec le plus
grand soin la nécessité d'une transfusion sanguine. Outre
l'hématocrite (volume érythrocytaire) ou le taux
d'hémoglobine, il faut aussi prendre en compte la densité
parasitaire et l'état clinique du patient. En général,
dans les zones de forte transmission, un hématocrite = 12 % ou un taux
d'hémoglobine = 4 g/dl est une indication pour une transfusion sanguine,
quel que soit l'état clinique de l'enfant. En zone de faible
transmission, on recommande un seuil de 20 % pour l'hématocrite ou de 7
g/dl pour l'hémoglobinémie pour pratiquer une transfusion
sanguine (10 ml de concentré globulaire ou 20 ml de sang total par
kilogramme de poids corporel en 4 heures). Chez l'enfant avec une anémie
moins sévère (hématocrite à 13-18 %, taux
d'hémoglobine à 4-6 g/dl), la transfusion sera envisagée
si l'enfant présente l'un des signes cliniques suivants :
détresse respiratoire (acidose), trouble de la conscience,
hyperparasitémie (> 20 %), collapsus circulatoire ou insuffisance
cardiaque.
I.5.2.3. PRISE EN CHARGE PREVENTIVE [39,40]
A l'intérieur de la maison :
o Utiliser des moustiquaires de lit imprégnées
de produits chimiques ;
o Rendre la maison impénétrable aux insectes :
gardez les portes et les fenêtres toujours fermées ; mettre des
moustiquaires aux fenêtres ; utiliser les spirales insecticides, les
diffuseurs électriques, voir la climatisation.
A l'extérieur de la maison :
o Porter des vêtements appropriés,de couleur
claire, à manches longues, etc.
o Lutter contre les gîtes larvaires ;
o Appliquer des sprays, des crèmes ou des lotions
répulsives ;
o Se coucher dans un hamac ou sousmoustiquaire fermée !
Penser également à imprégner régulièrement
le hamac et la moustiquaire ;
o Faire une chimioprophylaxieavant,pendant et après les
voyages en zone d'endémie palustre;
o Faire le traitement symptomatique chez les enfants de moins
de 5 ans.
CHAPITRE II. ETAT NUTRITIONNEL ET
PALUDISME GRAVE
II.1. RAPPELS SUR L'EVALUATION DE
L'ETAT NUTRITIONNEL
II.1.1. GENERALITES
Témoin d'un bon niveau social d'un pays, l'état
nutritionnel de l'enfant est un secteur de grand intérêt pour
l'Organisation Mondiale de la Santé, qui définit la malnutrition
comme étant un état pathologique résultant de
l'insuffisance ou des excès relatifs ou absolus d'un ou de plusieurs
nutriments essentiels, que cet état se manifeste cliniquement, où
qu'il ne soit décelable que par les analyses biologiques,
anthropométriques ou physiologiques. Cette définition exclut
les troubles nutritionnels liés à des erreurs de
métabolisme une malabsorption [41,42].
Pour évaluer l'état nutritionnel des enfants,
plusieurs indices et mesures ont été mis en place par
l'Organisation Mondiale de la Santé dont l'expression peut se faire
sous-forme de z-score, de percentile ou de pourcentage de la médiane et
cela comparativement à la population de référence de l'OMS
dont la dernière mise à jour remonte à l'année
2006 : [43, 44].
o Le z-score ou écart-réduit ou encore
unités d'écart-type est l'écart entre une valeur
individuelle et la médiane de la population de référence,
divisé par l'écart-type de la population de
référence. La formule suivante est utilisée :
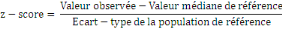
o Le percentile indique la place d'un individu dans une
distribution de référence donnée, exprimée en
pourcentage de la distribution auquel la valeur individuelle est égale
ou supérieure. Ainsi, un enfant d'âge donné dont le poids
se situe dans le 10ème percentile a le même poids (ou un poids
supérieur) que 10% des enfants de la population de
référence de même âge.
o Le pourcentage de la médiane est le rapport d'une
valeur mesurée chez un individu, le poids par exemple, à la
valeur médiane des données de référence pour le
même âge ou la même taille, exprimé en pourcentage. Le
principal inconvénient de cette méthode est l'absence de
correspondance exacte avec un point fixe de la distribution aux
différents âges et tailles. Il est calculé selon la formule
suivante :
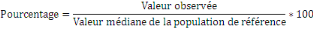
II.1.2. INDICES
ANTHROPOMETRIQUES
II.1.2.1. DEFINITION ET IMPORTANCE
L'anthropométrie est la seule et unique méthode
à la fois universellement applicable, bon marché et non invasive,
permettant d'apprécier la corpulence, les proportions et la composition
du corps humain et, étant donné que la croissance de l'enfant et
ses dimensions corporelles, quel que soit l'âge, soit une traduction de
l'état global et de bien-être des individus, comme des
populations, l'anthropométrie peut donc être utilisée pour
prévoir les aptitudes, l'état de santé et la survie
[44].
Les indices anthropométriques sont des associations de
mesures dont les pivots sont l'âge, le sexe, le poids et la taille et
dont l'expression se fait, comme mentionné ci-haut, sous forme de
z-score, de pourcentage de la médiane ou de percentile. Chez l'enfant,
les indices anthropométriques utilisés sont : l'indice
poids/âge ou PPA, l'indice taille/âge ou TPA et l'indice
poids/taille ou PPT. Il est à noter qu'en dehors du poids et de la
taille comme mesures anthropométriques, le périmètre
brachial et les oedèmes sont également très importants
dans l'évaluation de l'état nutritionnel des enfants [44].
L'interprétation des différents indices
anthropométriques en fonction de z-scores se fait de la manière
suivante selon l'OMS [45] :
o Si le rapport P/T, P/A ou T/A < - 3 Z score, malnutrition
sévère ;
o Si le rapport P/T, P/A ou T/A < - 2 et =-3 Z score,
malnutrition modérée ;
o Si le rapport P/T, P/A ou T/A compris entre - 2 et - 1 Z
score, il y a risque de malnutrition ou malnutrition légère ;
o Si le rapport P/T, P/A ou T/A compris entre - 1 et 1 Z
score, l'état nutritionnel est normal ;
o Si le rapport P/T, P/A ou T/A compris entre 1 et 2 Z score,
il y risque d'obésité ;
o Si le rapport P/T, P/A ou T/A est > 2 Z score, il y a
obésité sévère ou hypernutrition.
Les z-scores sont rapportés par rapport aux courbes de
références de l'Organisation Mondiale de la Santé sur les
indices anthropométriques [46].
Les déficits touchant un ou plusieurs indices
anthropométriques, traduits par une valeur inférieure au
10ème percentile ou à - 2 déviations standards
de valeurs de référence, sont souvent considérés
comme une preuve de malnutrition, cependant, ils ne sont pas uniquement le
résultat d'une carence en nutriments ou en apports
énergétiques (souvent liée à une consommation
insuffisance de nourriture) ; lorsque significatifs, ils peuvent
être dus à un manque de nourriture, à un taux
élevé d'utilisation des nutriments (comme c'est le cas dans des
pathologies infectieuses) mais aussi à une mauvaise absorption ou
à une mauvaise assimilation [44,45].
II.1.2.2. INDICE POIDS POUR AGE
C'est le rapport de la masse corporelle à l'âge
chronologique (a) ; cet indice offre l'avantage de refléter
à la fois la sous-alimentation passée (chronique) et/ou
présente (aiguë) tout en ne permettant pas de distinguer les deux.
Cet indice est ainsi utilisé pour évaluer l'état
nutritionnel de façon globale dont le déficit traduit une
malnutrition globale ou insuffisance pondérale [43,47].
L'insuffisance pondérale est une mesure composite du
rabougrissement et de l'émaciation et c'est un indicateur
recommandé pour évaluer les changements dans l'amplitude de la
malnutrition dans le temps [44].
II.1.2.3. INDICE TAILLE POUR AGE
Egalement appelé longueur pour âge (pour les
enfants de moins de 24 mois) ou stature pour âge (pour ceux de 24 mois et
plus), cet indice reflète la croissance linéaire passée
par rapport à l'âge chronologique [44]. Son déficit
désigne une sous-alimentation passée ou une malnutrition
chronique ou rabougrissement ou encore retard de croissance. Cet indice ne nous
permet pas de mesurer des changements à court terme dans la malnutrition
[47].
Le rabougrissement traduit une faible longueur-pour-âge,
venant d'un ralentissement de croissance du foetus et de l'enfant et faisant
que la longueur souhaitée ne soit pas atteinte, par rapport à un
enfant en bonne santé et bien nourri du même âge. Il est un
indicateur de retard de croissance passée ou retard de croissance
chronique et est lié à un certain nombre de facteurs à
long terme dont l'apport protéino-énergétique insuffisant
et chronique, des infections fréquentes, des pratiques d'alimentation
inadéquates pendant longtemps et la pauvreté [44].
II.1.2.4. INDICE POIDS POUR TAILLE
Communément appelé « indice poids pour
longueur » (chez les enfants de moins de 24 mois) ou
« indice poids pour stature » (chez ceux âgés
de 24 mois et plus), cet indice a l'avantage de ne pas nécessiter la
connaissance de l'âge (qui peut être difficile à
déterminer). Son déficit permet d'identifier les enfants
souffrant de sous-alimentation actuelle ou aiguë ou d'une maigreur ou
encore d'une émaciation. Le terme
« émaciation » est largement utilisé pour
décrire une perte de poids récente et prononcée qui est
généralement la conséquence d'une privation aiguë de
nourriture et/ou d'une maladie grave alors que la maigreur traduit le
résultat d'un déficit alimentaire ou d'une maladie chronique. Le
poids-pour-longueur (chez les enfants de moins de 2 ans) ou le
poids-pour-taille (chez les enfants de plus de 2 ans) permet d'examiner les
effets à court terme, par exemple, les changements saisonniers dans
l'approvisionnement alimentaire ou le manque nutritionnel à court terme
suite à une maladie [43].
II.1.2.5. OEDEMES NUTRITIONNELS ET PERIMETRE BRACHIAL
L'oedème est la présence de quantités
excessives de liquide dans les tissus intracellulaires. On diagnostique
l'oedème en appliquant une légère pression avec le pouce
derrière le pied ousur la cheville. L'impression du pouce restera
pendant un certain temps en présence d'unoedème. On
établit le diagnostic de l'oedème que si les deux pieds indiquent
l'impression dupouce pendant un laps de temps. Signe clinique de grave
malnutrition, il faut reconnaître laprésence de l'oedème
lorsqu'on utilise des indicateurs à court terme, tels que
l'émaciation. Onnotera la présence de l'oedème chez les
individus lorsqu'on utilise le poids-pour-taille auxfins de surveillance ou de
dépistage. Lorsqu'un enfant a un oedème, il doit être
inclusautomatiquement avec les enfants dans les catégories de ceux
souffrant de gravemalnutrition, quel que soit son état du point de vue
émaciation, rabougrissement ou poidsinsuffisant. En effet, il existe une
corrélation importante entre l'oedème et la
mortalité.L'oedème est une infection rare et n'est
diagnostiqué qu'aux fins de dépistage et desurveillance et non
pas aux fins d'évaluation [47].
Relativement facile à mesurer, le
périmètre brachial est un bon indice prédicateur du risque
immédiat de décès. Il est utilisé pour le
dépistage rapide de la malnutrition aiguë à partir de la
fourchette d'âge 6-59 mois (le périmètre brachial
sous-estime les taux de malnutrition dans le groupe d'âge 6 à 12
mois). Le périmètre brachial est utilisé pour le
dépistage dans les situations d'urgence, mais il n'est pas
utilisé généralement aux fins d'évaluation. Cette
mesure est recommandée pour évaluer la sous-alimentation adulte
aiguë et pour estimer la prévalence de la sous-alimentation au
niveau de la population [47].
II.1.3. CLASSIFICATION CLINIQUE
DE LA MALNUTRITION
Au point de vue clinique, la malnutrition revêt les
formes suivantes : la malnutrition aiguë oul'émaciation, la
malnutrition chronique ou retard de croissance, la malnutrition globale
oul'insuffisance pondérale ainsi que les carences en micro nutriments
tels que la vitamine A, fer,iode, zinc et acide folique [48].
Dans notre cas, nous ne nous limiterons qu'aux trois premiers
aspects cliniques.
II.1.3.1. MALNUTRITION AIGUË OU EMACIATION
Parfois considérée comme malnutrition
protéino-énergétique, elle est due à unmanque
d'apport alimentaire entraînant des pertes récentes et rapides de
poids avec unamaigrissement extrême, sans déficit en vitamines.
Elle traduit une situation conjoncturelle et constitue lemeilleur indicateur
d'interprétation d'une insécurité alimentaire. Selon la
classification del'OMS, un taux de prévalence de l'émaciation
compris entre 5 et 9% est jugé moyen, entre10et 14% élevé
et au-delà de 15% très élevé [45]
Les causes sont les suivantes: apport alimentaire insuffisant,
mauvaises pratiques d'alimentation, maladies et infections ou souvent, une
combinaison de ces facteurs [44].
La malnutrition aiguë sévère peut
être divisée en trois grandes entités cliniques: le
marasme, le kwashiorkor, et le kwashiorkor?marasmique (forme mixte) dont les
descriptions cliniques respectives dont les suivantes [49,50]:
o L'enfant qui souffre d'un marasme perd du poids de
façon évidente, ses côtes et zygomatiques sont visibles,
ainsi que des articulations très apparentes. Il présente une
fonte musculaire massive, particulièrement à la racine des
membres (épaules et fesses) et il ne lui reste pratiquement plus de
graisse sous cutanée. La peau est fine et atrophique, semble trop grande
pour l'enfant présente de nombreux plis.
o Le terme de kwashiorkor (un terme issu de la langue Ga du
Ghana, désignant l'enfant sevré à la suite de la naissance
d'un enfant plus jeune) a été utilisé pour la
première fois pour désigner un type particulier de malnutrition
sévère associé à des oedèmes par Cicely
Williams en 1933. Le cas le plus typique est celui d'un enfant de 1 à 2
ans ayant des cheveux fins et friables qui développe des oedèmes
associés à des lésions cutanées et à une
hépatomégalie. L'enfant est apathique mais devient vite irritable
dès que l'on essaie de
le manipuler. Le kwashiorkor est une maladie
aiguë apparaissant de façon brutale. L'interrogatoire
révèle que les oedèmes, la perte de l'appétit et
les changements d'humeur se sont installés en quelques jours. Il existe
parfois une histoire d'épisodes d'oedèmes disparaissant
spontanément, mais ceci est plutôt rare. Cliniquement,
lekwashiorkor se distingue des autres types de malnutrition par son
caractère aigue. Ces patients ont une rétention
généralisée de sodium.
o En cas de kwashiorkor-marasmique: (forme mixte), l'enfant
est à la fois amaigri et gonflé d'oedème. Cette forme
clinique combine les
caractéristiques cliniques du marasme et du
kwashiorkor : un retard de croissance sévère à la fois
pondéral et statural, la présence d'oedème, une perte de
tissus musculaires et de la graisse sous-cutanée et des lésions
cutanées plus ou moins importantes.
II.1.3.2. LA MALNUTRITION CHRONIQUE OU RETARD DE
CROISSANCE
Elle traduit un problème alimentaire et/ou nutritionnel
chronique en particulier pendant la période de développement
foetal. Il traduit une situation structurelle et donc n'estpas influencé
par une amélioration conjoncturelle de la situation nutritionnelle des
enfants ; ilconstitue le meilleur indicateur de suivi de l'état
nutritionnel des enfants dans une populationdonnée et traduit le niveau
de développement socio-économique de la population. Selon
laclassification de l'OMS, un taux de prévalence du retard de croissance
compris entre 10 et19% est jugé moyen, entre 20 et 29%
élevé et au-delà de 30% très élevé.
Elle peut êtrecausée par un déficit chronique in utero, des
infections multiples [45].
II.1.3.3. LA MALNUTRITION GLOBALE OU INSUFFISANCE
PONDERALE
Définie par un poids d'un enfant pour l'âge
inférieur à deux écarts-types au poidsmédian pour
l'âge de la population de référence. L'OMS classe ce taux
comme, normal s'il est inférieur à 10% ; moyen de10 à 19%
; élevé à20% et très élevé s'il est
supérieur à 30% [45].
II.2. INTERACTIONS ENTRE LE
PALUDISME ET L'ETAT NUTRITIONNEL
Encore sujet des controverses, les interactions entre le
paludisme et l'état nutritionnel demeurent à l'étape
hypothétique. En effet, alors que Shiff et al. rapportent une baisse de
morbidité et un gain de poids de 150 grammes avec l'âge en moyenne
supérieur chez des enfants protégés du paludisme par des
moustiquaires imprégnées, certaines études ont
évoqué le rôle protecteur de la malnutrition dans la
survenue d'accès graves, mais ce point reste encore très
controversé, d'autres encore à l'exemple de Chevalier et al.
évoquent une légère influence de la malnutrition sur la
morbidité palustre alors que Mitangala trouve dans le Sud-Kivu, une
relation inverse entre la malnutrition et la prévalence du paludisme
grave [51-53].
D'autres facteurs liés au mode de vie de l'enfant vont
avoir un rôle dans la survenue des infections palustres. L`allaitement
maternel, le plus souvent exclusif en Afrique pendant les premiers mois de la
vie, protège l'enfant. En effet, l'absence d'acide
para-aminobenzoïque (PABA) dans le lait matemel, limite le
développement du parasite qui en a besoin pour la synthèse de son
ADN [54].
Des facteurs plus difficiles à apprécier
peuvent également avoir un rôle dans la protection antipalustre
comme la moindre exposition des nouveau-nés aux moustiques comme le port
de vêtements ou la plus grande affinité des moustiques pour les
adultes que pour les enfants. Enfin, les nouveau-nés et les très
jeunes enfants sont l'objet .de soins attentifs. Ils vont parfois
bénéficier de moustiquaire ou de chimioprophylaxie. Ces moyens de
protection sont le plus souvent rapidement abandonnés dès que
l'enfant devient autonome [55].
II.3. IMPACT DE LA MALNUTRITION
SUR LE PALUDISME
En cas de malnutrition, il existe une atteinte des tissus
lymphoïdes associés (peau, amygdales, bronches et intestin)
caractérisée par une diminution de la réaction
inflammatoire et une atrophie des amygdales et des plaques de Peyer. Le plus
important en terme de conséquences est l'atrophie du thymus,
considéré comme un organe essentiel de l'immunité. Au
niveau humoral, il existe une baisse du complément, essentiellement la
fraction C3, et de substances comme le lysozyme. Parmi les immunoglobulines,
seules les immunoglobulines sécrétoires sont diminuées,
d'où le maintien d'une bonne réponse vaccinale. Au niveau
cellulaire, la phagocytose ne semble pas affectée mais l'activité
bactéricide est diminuée. En ce qui concerne les populations
lymphocytaires, les lymphocytes B ne sont pas modifiés, il existe une
diminution significative des lymphocytes T et plus spécifiquement des
auxiliaires ou «helpers» (CD4) parallèlement à une
augmentation des cellules «nulles» correspondant à des
lymphocytes T immatures. Les monokines comme l'interféron (IFN) et les
interleukines 1 et 6 (El, IL6) présentent une baisse significative,
alors que les lymphokines telles le MIF (Macrophage Migration Inhibitory
Factor) et l'interleukine 2 (IL2) ne sont pas affectées. L'ensemble
de ces processus correspond à une immunodéficience acquise
secondaire à la malnutrition qui entraîne une chute du potentiel
de défense et donc une moindre résistance aux infections [53,56].
II.3. IMPACT DU PALUDISME SUR
L'ETAT NUTRITIONNEL
Chaque fois que les barrières immunitaires sont
franchies, divers processus biochimiques, métaboliques et hormonaux
produisent un effet déléière sur l'état
nutritionnel en modifiant l'équilibre entre apports et besoins.
L'anorexie provoque une diminution des ingestats et la malabsorption
réduit encore la quantité de nutriments absorbés.
Parallèlement, les besoins sont augmentés suite à la
synthèse accrue de protéines spécifiques (inflammatoires,
immunoglobulines etc ...) et à l'hyperthermie qui augmente le
métabolisme basal. Cette baisse des apports et l'augmentation des
besoins entraînent une balance azotée négative suivie d'un
déficit de la plupart des nutriments [56].
EVALUATION DE L'ETAT NUTRITIONNEL
DES ENFANTS AGES DE 0 à 5 ANS ATTEINTS DE PALUDISME GRAVE
DEUXIEME PARTIE :
APPROCHE PRATIQUE
CHAPITRE III : METHODOLOGIE
DU TRAVAIL
III.1. LIEU D'ETUDE
Nous avons mené notre étude à
l'Hôpital Général de Référence de
Kampemba.
III.1.1. SITUATION
GEOGRAPHIQUE
L'hôpital Général de
Référence de Kampemba est situé au numéro 8 de
l'avenue des abricotiers, quartier Bel'air, Commune de Kampemba, ville de
Lubumbashi, en République Démocratique du Congo.
III.1.2. HISTORIQUE
L'histoire de cette structure hospitalière commence par
un dispensaire qui fonctionnait dans l'aile gauche du bâtiment de
l'actuel hôpital sous la supervision de la soeur Victoria et d'un
médecin consultant en la personne du Docteur Kabuya. Quelques
années plus tard, ce dispensaire devenu centre de santé,
était déplacé au numéro 1076 de l'avenue des
Plaines dans la maison du Général Singa, alors gouverneur du
Katanga et, pendant cette période, Docteur Kabuya était
succédé par le Docteur Azama qui donna une main forte aux
religieuses.
En 1989, la hiérarchie sanitaire de la province
décida de transformer ce centre en zone de santé et y nomma un
médecin chef de zone de santé en la personne du Docteur
KayembeNgongo et c'est sous sa supervision que le centre de santé connut
son véritable épanouissement.
En 1991, la vente de la maison qui abritait ce centre, devenu
alors Hôpital Général de Référence de
Kampemba sera délocalisé de nouveau au numéro 8 de
l'avenue des Abricotiers où il se trouve jusqu'à ce jour sous la
direction du Docteur Hugues KATOMPA.
III.2. ASPECTS
METHODOLOGIQUES
III.2.1. TYPE ET PERIODE
D'ETUDE
Notre étude était descriptive transversale
à visée analytique et s'est déroulé au cours d'une
période de 4 ans, allant du 1er janvier 2012 au 31
décembre 2015.
III.2.2. POPULATION D'ETUDE
Notre population d'étude était constituée
de tous les enfants admis et pris en charge dans le service de Pédiatrie
de l'Hôpital Général de Référence de Kampemba
pour pathologies diverses.
III.2.3. POPULATION-CIBLE
La population-cible de notre étude était
constituée de tous les enfants de 0 à 5 ans chez qui a
été diagnostiquée au moins une forme grave du paludisme
avec test de diagnostic rapide et/ou goutte épaisse positifs et
traités dans le service de Pédiatrie de l'Hôpital
Général de Référence de Kampemba.
III.2.4. ECHANTILLONNAGE
III.2.4.1. Technique
d'échantillonnage et taille d'échantillon
Pour notre étude, nous avons procédé
à un échantillonnage non probabiliste de convenance et notre
taille d'échantillon était de 174 patients.
III.2.4.2. Critères
d'inclusion
Les enfants âgés de 0 à 5 ans, admis et
traités dans le service de Pédiatrie de l'Hôpital
Général de Référence de Kampemba pour paludisme
grave diagnostiqué sur base de l'association des critères de
gravité de l'OMS [2] à la positivité de la goutte
épaisse et/ou du test de diagnostic rapide et dont les fiches
étaient complètement remplies.
III.2.4.3. Critères de
non-inclusion
Ont été exclus de notre étude, tous les
enfants de plus de 5 ans ainsi que ceux âgés de 0 à 5 ans
chez qui il a été diagnostiqué toute pathologie autre que
le paludisme grave, de même que tous ceux dont les données
étaient incomplètes sur les fiches.
III.2.5. VARIABLES D'ETUDE
Nos variables d'étude comprenaient :
- Des variables socio-démographiques :
année, âge, sexe, résidence ;
- Des variables cliniques : temps entre le début
des symptômes et la consultation, les signes cliniques, le diagnostic
retenu (formes cliniques de paludisme grave), les diagnostics
associés ;
- Des variables nutritionnelles : les z-scores
poids/âge, poids/taille et taille/âge ;
- Des variables biologiques et paracliniques : taux
d'hémoglobine, groupe sanguin et rhésus, goutte épaisse,
test de diagnostic rapide ;
- Des variables thérapeutiques : traitement avant
hospitalisation, molécule antipaludéenne reçue en
hospitalisation ;
- Des variables évolutives : évolution des
malades, séjour hospitalier.
III.2.6. ANALYSE DES DONNEES
ET PRESENTATION DES RESULTATS
Nos données ont été analysées
à l'aide des logiciels Epi-info 7.2 (mars 2016), ENA for Smart 2011
(juin 2015) et Microsoft Office Excel 2013 et des utilitaires Open Epi 3.03
(septembre 2014) et Epinut 3.5.3 (juillet 2008), lesquels nous ont permis de
déterminer :
- Des mesures de fréquences, à savoir les
fréquences absolues (effectifs) et relatives (pourcentage) ;
- Des paramètres de position, comme la moyenne et la
médiane ;
- Des paramètres de dispersion, à l'exemple de
l'écart-type et des extrêmes.
L'évaluation de l'association entre variables et leur
force a été réalisée grâce à la
détermination des odds-ratio et de leurs intervalles de confiance ainsi
que grâce au calcul de p-value dont le seuil de signification
était fixée à 5%.
Les z-scores ont été déterminées
comparativement à la population de référence de l'OMS de
2006, incorporée dans le logiciel ENA for SMART 2011.
Les résultats sont présentés sous forme
des tableaux, des graphiques (histogrammes et diagrammes de Camembert) ainsi
que sous forme des courbes de Gauss (pour les données
nutritionnelles).
III.2.7. LIMITES DE L'ETUDE ET
DIFFICULTES RENCONTREES
Le fait que notre récolte des données se soit
faite de façon rétrospective nous amis devant un certain nombre
de difficultés dont le manque de certaines données
nécessaires sur les fiches, notamment le score de Blantyre en cas de
coma, le périmètre brachial, etc, ayant fait que ces variables ne
soient pas intégrées dans nos analyses.
CHAPITRE IV. PRESENTATION DES
RESULTATS
IV.1. ANALYSES MONOVARIEES
IV.1.1. PREVALENCE DU PALUDISME
GRAVE
IV.1.1.1. Prévalence cumulée du paludisme
grave
Sur un total de 1167 enfants reçus dans le service de
Pédiatrie de l'Hôpital Général de
Référence de Kampemba pendant notre période
d'étude, 408 l'étaient pour paludisme dont 174 cas de paludisme
grave, soit une prévalence de 42,65% par rapport au paludisme et de
14,91% par rapport au service de Pédiatrie, tel que
présenté à la figure 1 ci-dessous.
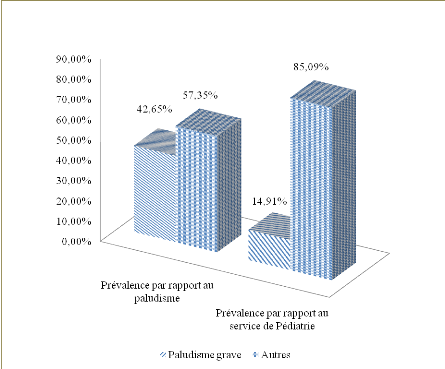
Figure 4. Prévalence cumulée du paludisme
grave
IV.1.1.2. Prévalence annuelle du paludisme
grave
Tableau II. Répartition des malades par années
d'étude
|
Année
|
Effectif
|
Pourcentage
|
Moyenne annuelle
|
|
2012
|
42
|
24,14
|
|
|
2013
|
38
|
21,84
|
|
|
2014
|
49
|
28,16
|
|
|
2015
|
45
|
25,86
|
|
|
Total
|
174
|
100,00
|
43,5
|
Il ressort de ce tableau que l'année 2014 a connu
28,16% des cas, suivie de l'année 2015 avec 25,86%, puis vient
l'année 2012 avec 24,14% et enfin l'année 2013 avec 21,84%. La
moyenne de prévalence annuelle était de 43,5 malades/an.
IV.1.2. DONNEES
SOCIODEMOGRAPHIQUES
IV.1.2.1. Age
Tableau III. Répartition des enfants atteints de
paludisme grave selon l'âge
|
Age (mois)
|
Effectif
|
Pourcentage
|
Moyenne #177; StdDev
|
|
0-6
|
14
|
8,05
|
|
|
7-12
|
28
|
16,09
|
|
|
13-24
|
50
|
28,74
|
|
|
25-36
|
32
|
18,39
|
|
|
37-48
|
29
|
16,67
|
|
|
49-60
|
21
|
12,07
|
|
|
Total
|
174
|
100,00
|
28,58#177;17,59 mois
|
Il ressort de ce tableau que 28,74%
des patients étaient âgés entre 13 et 24 ans, suivis de
ceux âgés de 25 à 36 mois avec 18,39%, puis de 37 à
48 mois avec 16,67% ; la tranche la moins touchée était
celle de 0 à 6 mois avec 8,05%. L'âge moyen des malades
était de 28,58#177;17,59 mois, le médian était de 24 mois
(Q1-Q3 = 13-48), pour les extrêmes de 2 et 60 mois.
IV.1.2.2. Sexe

Figure 5. Répartition des enfants atteints de
paludisme grave selon le sexe
Au regard de cette figure, la majorité de nos patients
étaient de sexe masculin avec 54,02% contre 45,98% de sexe
féminin, le sex-ratio étant de 1,17 en faveur du sexe
masculin.
IV.1.2.3. Résidence
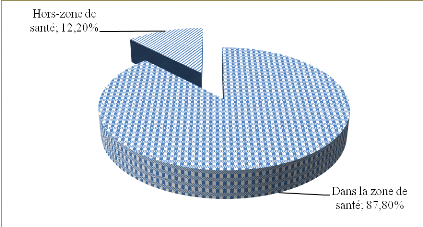
Figure 6. Répartition des enfants atteints de
paludisme grave selon la résidence
Cette figure montre que 87,80% des patients résidaient
dans la zone de santé contre 12,20% qui résidaient en dehors de
la zone de santé de Kampemba.
IV.1.3. DONNEES CLINIQUES
IV.1.3.1. Temps écoulé entre le début
des symptômes et la consultation
Tableau IV. Répartition des malades selon le temps
écoulé entre le début des symptômes et la
consultation
|
Temps écoulé avant la consultation (jours)
|
Effectif
|
Pourcentage
|
|
< 7
|
137
|
90,73
|
|
= 7
|
14
|
9,27
|
|
Total
|
151
|
100,00
|
Il est évident sur ce tableau que 90,73% de malades
avaient fait moins de 7 jours avant de consulter contre 9,27% qui avaient fait
au moins 7 jours. Le temps moyen était de 3,84#177;3,38 jours, la
médiane était de 3 jours (Q1-Q3 : 2-4 jours), pour les
extrêmes de 1 et 15 jours.
IV.1.3.2. Signes cliniques
Tableau V. Répartition des malades selon les signes
cliniques
|
Signes cliniques
|
Effectif (n=174)
|
Pourcentage
|
|
Fièvre
|
160
|
91,95
|
|
Pâleur
|
98
|
56,32
|
|
Tachycardie
|
59
|
33,91
|
|
Convulsions
|
59
|
33,91
|
|
Vomissements
|
54
|
31,03
|
|
Splénomégalie
|
48
|
27,59
|
|
Anorexie
|
44
|
25,29
|
|
Polypnée
|
43
|
24,71
|
|
Douleurs abdominales
|
43
|
24,71
|
|
Battement des ailes du nez
|
18
|
10,34
|
|
Urines coca cola
|
17
|
9,77
|
|
Regard plafonné
|
17
|
9,77
|
|
Raideur de nuque
|
15
|
8,62
|
|
Pleurs incessants
|
14
|
8,05
|
|
Ictère
|
14
|
8,05
|
|
Hématurie
|
13
|
7,47
|
|
Diarrhée
|
12
|
6,90
|
|
Coma
|
12
|
6,90
|
|
Céphalées
|
6
|
3,45
|
|
Constipation
|
3
|
1,72
|
Ce tableau nous montre que la fièvre était le
signe clinique le plus fréquent, noté dans 91,95% des cas, suivie
de la pâleur dans 56,32% des cas, puis de la tachycardie dans 33,09% des
cas. La constipation était le signe clinique le moins noté dans
1,72% des cas.
IV.1.3.3. Formes cliniques du paludisme grave
Tableau VI. Répartition des malades selon les formes
cliniques de paludisme grave
|
Formes cliniques de paludisme grave
|
Effectif (n=174)
|
Pourcentage
|
|
Anémie sévère
|
110
|
63,22
|
|
Neuropaludisme
|
62
|
35,63
|
|
Fièvre bilieuse hémoglobinurique
|
17
|
9,77
|
|
Détresse respiratoire
|
15
|
8,62
|
|
Ictère
|
11
|
6,32
|
|
Hypoglycémie
|
5
|
2,87
|
|
Hyperparasitémie
|
3
|
1,72
|
|
Convulsions à répétition
|
1
|
0,57
|
Nous remarquons sur ce tableau que l'anémie
sévère était notée chez 63,22% des patients, suivie
du neuropaludisme avec 35,63% des malades, puis de la fièvre bilieuse
hémoglobinurique avec 9,77% des cas. Les convulsions à
répétition n'étaient notées que chez 0,57% des
malades.
IV.1.3.4. Diagnostics associés
Tableau VII. Répartition des malades selon les
diagnostics associés
|
Diagnostics associés
|
Effectif
|
Pourcentage
|
|
Méningite
|
20
|
28,99
|
|
Verminoses
|
7
|
10,14
|
|
Fièvre typhoïde
|
6
|
8,70
|
|
Pneumopathie
|
5
|
7,25
|
|
Malnutrition
|
4
|
5,80
|
|
Amygdalite
|
3
|
4,35
|
|
Bronchite
|
3
|
4,35
|
|
Anémie légère
|
3
|
4,35
|
|
Bronchopneumopathie
|
3
|
4,35
|
|
Rhinopharyngite
|
3
|
4,35
|
|
Deshydratation
|
2
|
2,90
|
|
Gastroentérite aiguë fébrile
|
2
|
2,90
|
|
Intoxication médicamenteuse
|
2
|
2,90
|
|
Total
|
69
|
100,00
|
Il ressort de ce tableau que la méningite était
le diagnostic le plus associé avec 28,99% des cas, suivie des verminoses
avec 10,14% des cas, puis de la fièvre typhoïdes avec 8,70% des
cas ; l'intoxication médicamenteuse, la gastroentérite
aiguë fébrile ainsi que la déshydratation étaient
associés au paludisme grave dans 2,90% des cas chacune.
IV.1.4. DONNEES
ANTHROPOMETRIQUES
IV.1.4.1. Z-score Poids/Taille
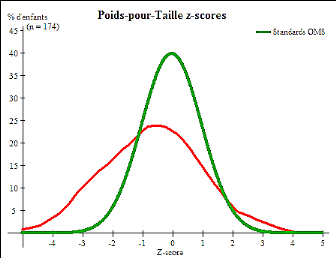
|
z-score P/T
|
Effectif
|
Pourcentage
|
|
< -3ET
|
13
|
7,47
|
|
]-2ET, -3 ET]
|
25
|
14,37
|
|
= - 2 ET
|
136
|
78,16
|
|
Total
|
174
|
100,00
|
Figure 7 et Tableau VIII. Répartition des malades
selon le z-score poids/taille
A la lumière de cette figure couplée au tableau,
la malnutrition aiguë sévère était enregistrée
pour 7,47% des malades, la modérée était notée chez
14,37% de malades atteints de paludisme, soit une prévalence globale de
la malnutrition aiguë de 21,84%. Un bon état nutritionnel
était noté chez 78,16% des malades. Le z-score P/T moyen
était de -0,66#177;1,59, pour une médiane de -0,63 (Q1-Q3 :
-1,71-0,39) et les extrêmes de -4,76 et 3,17.
IV.1.4.2. Z-score Poids/Age
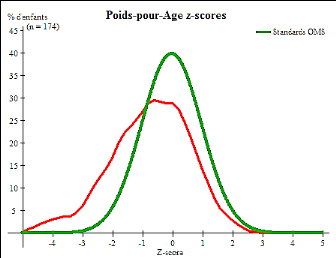
|
z-score P/A
|
Effectif
|
Pourcentage
|
|
< -3ET
|
9
|
5,17
|
|
]-2ET, -3 ET]
|
23
|
13,22
|
|
= - 2 ET
|
142
|
81,61
|
|
Total
|
174
|
100,00
|
Figure 8 et Tableau IX. Répartition des malades selon
le z-score poids/âge
Ce tableau et cette figure montrent que 5,17% de patients
avaient une malnutrition globale sévère alors que 13,22% avaient
une malnutrition globale modérée, ce qui donne une
prévalence globale de malnutrition globale de 18,39% ; 81,61% des
malades avaient un bon état nutritionnel. Le z-score P/A moyen
était de -0,74#177;1,28, le médian étant de -0,56
(Q1-Q3 : -1,51-0,17) pour des extrêmes de -4,22 à 2,07
IV.1.4.3. Z-score Taille/Age
|
z-score T/A
|
Effectif
|
Pourcentage
|
|
< -3ET
|
9
|
5,17
|
|
]-2ET, -3 ET]
|
11
|
6,32
|
|
= - 2 ET
|
154
|
88,51
|
|
Total
|
174
|
100,00
|
Figure 9 et Tableau X. Répartition des malades selon
les diagnostics associés
Nous remarquons sur ce tableau et cette figure que la
malnutrition chronique sévère était présente chez
5,17% des malades, la malnutrition chronique modérée
l'était chez 6,32% des malades, donnant une prévalence globale la
malnutrition chronique de 11,49% et, un bon état nutritionnel
était enregistré chez 88,51% des malades atteints de paludisme
grave. Le z-score T/A moyen était de -0,52#177;1,18, pour une
médiane de -0,37 (Q1-Q3 : -1,17-2,03) et des extrêmes de
-3,79 à 2,03.
IV.1.5. DONNEES BIOLOGIQUES ET
IMMUNOLOGIQUES
IV.1.5.1. Goutte épaisse
Tableau XI. Répartition des malades selon les
résultats de la goutte épaisse
|
Goutte épaisse
|
Effectif
|
Pourcentage
|
|
++
|
12
|
11,11
|
|
+++
|
93
|
86,11
|
|
++++
|
3
|
2,78
|
|
Total
|
108
|
100,00
|
|
Taux de réalisation
|
|
75,00
|
Il est évident sur ce tableau que la goutte
épaisse était triplement positive (3 croix) chez 86,11% des
patients alors qu'elle l'était doublement (deux croix) chez 11,11% pour
un taux de réalisation de 75,00% des malades.
IV.1.5.2. Test de diagnostic rapide (TDR)
Tableau XII. Répartition des malades selon les
résultats du Test de diagnostic rapide
|
Test de diagnostic rapide
|
Effectif
|
Pourcentage
|
|
Négatif
|
4
|
5,06
|
|
Positif
|
75
|
94,94
|
|
Total
|
79
|
100,00
|
|
Taux de réalisation
|
|
45,40
|
Ce tableau montre que le test de diagnostic rapide
était positif chez 94,94% des patients alors qu'il était
négatif chez 5,06% et, le taux de réalisation était de
45,40
IV.1.5.3. Hémoglobinémie
Tableau XIII. Répartition des malades selon le taux
d'hémoglobine
|
Taux d'hémoglobine (g%)
|
Effectif
|
Pourcentage
|
|
<5
|
38
|
32,20
|
|
=5
|
80
|
67,80
|
|
Total
|
133
|
100,00
|
A la lumière de ce tableau, 32,20% des patients avaient
une hémoglobinémie inférieure à 5g% contre 67,80%
qui avaient une hémoglobinémie supérieure ou égale
à 5g%. Le taux moyen était de 6,16#177;3,07 g% pour une
médiane de 5 g% (Q1-Q3 : 4,00-7,80g%) et les extrêmes de 3
et 14g%.
IV.1.5.3. Groupe sanguin érythrocytaire et
rhésus
Tableau XIV. Répartition des malades selon le groupe
érythrocytaire et rhésus
|
Groupe érythrocytaire et rhésus
|
Effectif
|
Pourcentage
|
|
A-
|
14
|
10,77
|
|
A+
|
33
|
25,38
|
|
B-
|
14
|
10,77
|
|
B+
|
44
|
33,85
|
|
O-
|
17
|
13,08
|
|
O+
|
8
|
6,15
|
|
Total
|
130
|
100,00
|
A la lumière de ce tableau, 33,85% des malades
étaient du groupe sanguin B positif, suivis de 25,38% qui étaient
du groupe sanguin A positif, puis de ceux du groupe sanguin O négatif
avec 13,08%. Le groupe sanguin O positif n'était retrouvé que
chez 6,15% des malades. Dans l'ensemble, les cas de paludisme grave
étaient plus retrouvés chez les sujets des groupes sanguins A et
B pour le Rhésus positif ou négatif.
IV.1.6. DONNEES THERAPEUTIQUES ET
EVOLUTIVES
IV.1.6.1. Type de traitement reçu avant
hospitalisation
Tableau XV. Répartition des malades selon le type de
traitement reçu avant hospitalisation
|
Type de traitement reçu avant hospitalisation
|
Effectif
|
Pourcentage
|
|
Mixte (Traditionnel et Moderne)
|
2
|
1,15
|
|
Moderne
|
71
|
40,80
|
|
Aucun
|
101
|
58,05
|
|
Total
|
174
|
100,00
|
Au regard de ce tableau, 101 patients n'avaient reçus
aucun traitement avant hospitalisation alors que 40,80% des malades avaient
reçus un traitement de type moderne et 1,15% avaient
mélangé un traitement traditionnel à un traitement
moderne.
IV.1.6.2. Traitement antipaludéen instauré
en hospitalisation
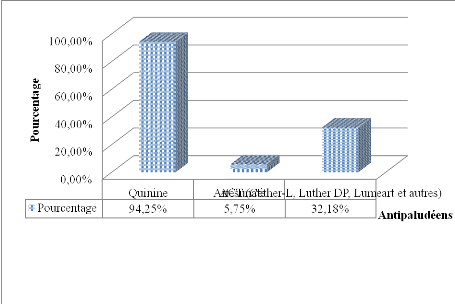
Figure 10. Répartition des malades selon la
molécule antipaludéenne reçue en hospitalisation
Il est remarquable sur cette figure que 94,25% des malades
avaient reçu la quinine, suivis de 32,18% qui avaient reçus les
ACT alors que seulement 5,75% des malades avaient reçus
l'artésunate.
IV.1.6.3. Evolution des malades
Tableau XVI. Répartition des malades selon les
diagnostics associés
|
Evolution
|
Effectif
|
Pourcentage
|
|
Décès
|
32
|
18,39
|
|
Guérison/Sortie
|
130
|
74,71
|
|
Perdu de vue*
|
12
|
6,90
|
|
Total
|
174
|
100,00
|
* Perdu de vue signifie sortie sur demande ou fuite
Ce tableau montre que l'évolution s'est faite vers la
guérison dans 74,71% alors que les décès étaient
enregistrés dans 18,39% des cas et 6,90% des cas étaient perdus
de vus.
IV.1.6.4. Séjour hospitalier
Tableau XVII. Répartition des malades selon le
séjour hospitalier
|
Séjour hospitalier (jours)
|
Effectif
|
Pourcentage
|
|
<7
|
100
|
57,47
|
|
7-14
|
71
|
40,80
|
|
> 14
|
3
|
1,72
|
|
Total
|
174
|
100,00
|
La lecture de ce tableau montre que 57,47% des patients
avaient fait moins de 7 jours en hospitalisation, suivis de 40,80% qui avaient
fait entre 7 et 14 jours alors que seulement 1,72% des malades avaient fait
plus de 14 jours. Le séjour moyen était de 5,67#177;3,26 jours,
pour les extrêmes de 0 et 15 jours. Le séjour médian
était de 5 jours (Q1-Q3 : 3-8 jours).
IV.2. ANALYSES BIVARIEES
IV.2.1. FORMES CLINIQUES ET
AGE
|
|
Age (mois)
|
|
|
|
Formes cliniques
|
0-6
|
7-12
|
13-24
|
>24
|
Total
|
p*
|
|
Anémie sévère
|
10 (9,09%)
|
16 (14,55%)
|
31 (28,18%)
|
53 (48,18%)
|
110 (100,00%)
|
0,813
|
|
Neuropaludisme
|
4 (6,45%)
|
9 (14,52%)
|
18 (29,03%)
|
31 (50,00%)
|
62 (100,00%)
|
0,891
|
|
FBH
|
2 (11,76%)
|
4 (23,53%)
|
7 (41,18%)
|
4 (23,53%)
|
17 (100,00%)
|
0,239
|
|
DR
|
2 (13,33%)
|
1 (6,67%)
|
5 (33,33%)
|
7 (46,67%)
|
15 (100,00%)
|
0,659
|
|
Ictère
|
0 (0,00%)
|
0 (0,00%)
|
4 (36,36%)
|
7 (63,64%)
|
11 (100,00%)
|
0,289
|
|
Hypoglycémie
|
0 (0,00%)
|
1 (20,00%)
|
2 (40,00%)
|
2 (40,00%)
|
5 (100,00%)
|
0,862
|
|
Hyperparasitémie
|
0 (0,00%)
|
1 (33,33%)
|
2 (66,67%)
|
0 (0,00%)
|
3 (100,00%)
|
0,286
|
|
Convulsions
|
0 (0,00%)
|
0 (0,00%)
|
0 (0,00%)
|
1 (100,00%)
|
1 (100,00%)
|
0,770
|
Tableau XVIII.
Répartition des malades selon les formes cliniques en fonction de
l'âge
*chi-carré
Ce tableau montre que la majorité d'enfants avec
ictère (63,64%), neuropaludisme (50,00%) ; anémie
sévère (48,18%) et détresse respiratoire (46,67%)
étaient âgés de plus de 24 mois, alors que la
majorité de ceux avec fièvre bilieuse hémoglobinurique
(41,18%) et hyperparasitémie (66,67%) étaient âgés
entre 13 et 24 mois. Les formes cliniques et l'âge n'avaient pas
d'association statistiquement significative (p>0,05).
IV.2.2. FORMES CLINIQUES ET SEXE
|
Formes cliniques
|
Sexe
|
|
|
|
|
Féminin
|
Masculin
|
Total
|
p*
|
OR (IC95%)
|
|
Anémie sévère
|
45 (40,91%)
|
65 (59,09%)
|
110 (100,00%)
|
0,109
|
1,74(0,94-3,25)
|
|
Neuropaludisme
|
32 (51,61%)
|
30 (48,39%)
|
62 (100,00%)
|
0,342
|
0,70(0,38-1,31)
|
|
FBH
|
6 (35,29%)
|
11 (64,71%)
|
17 (100,00%)
|
0,500
|
1,63(0,58-4,64)
|
|
DR
|
7 (46,67%)
|
8 (53,33%)
|
15 (100,00%)
|
1,000
|
0,97(0,34-2,80)
|
|
Ictère
|
5 (45,45%)
|
6 (54,55%)
|
11 (100,00%)
|
1,000
|
1,02(0,30-3,49)
|
|
Hypoglycémie
|
4 (80,00%)
|
1 (20,00%)
|
5 (100,00%)
|
0,274
|
0,20(0,02-1,87)
|
|
Hyperparasitémie
|
1 (33,33%)
|
2 (66,67%)
|
3 (100,00%)
|
1,000
|
1,71(0,15-19,30)
|
|
Convulsions
|
1 (100,00%)
|
0 (0,00%)
|
1 (100,00%)
|
0,935
|
0,00(-)
|
Tableau XIX.
Répartition des malades selon les formes cliniques par sexe
*chi-carré
Ce tableau montre que l'anémie
sévère, la fièvre bilieuse hémoglobinurique, la
détresse respiratoire, l'ictère et l'hyperparasitémie
étaient plus enregistrés chez les enfants de sexe masculin alors
que le neuropaludisme, l'hypoglycémie et les convulsions
l'étaient plus chez ceux de sexe féminin. Il n'y a aucune
association statistiquement forte entre le sexe et les formes cliniques
(p>0,05).
IV.2.3. FORMES CLINIQUES ET ETAT
NUTRITIONNEL (z-score P/A, P/T et T/A)
Tableau XX. Répartition des malades selon les formes
cliniques en fonction z-score P/A
|
|
z-score P/A
|
|
|
|
|
Formes cliniques
|
< - 2 ET
|
= - 2 ET
|
Total
|
p*
|
OR(IC95%)
|
|
Anémie sévère
|
16 (14,55%)
|
94 (85,45%)
|
110 (100,00%)
|
0,1301
|
0,51(0,24-1,11)
|
|
Neuropaludisme
|
15 (24,19%)
|
47 (75,81%)
|
62 (100,00%)
|
0,2056
|
1,78(0,82-3,88)
|
|
FBH
|
3 (17,65%)
|
14 (82,35%)
|
17 (100,00%)
|
1,0000
|
0,95(0,26-3,51)
|
|
DR
|
2 (13,33%)
|
13 (86,67%)
|
15 (100,00%)
|
0,8569
|
0,66(0,14-3,09)
|
|
Ictère
|
3 (27,27%)
|
8 (72,73%)
|
11 (100,00%)
|
0,7013
|
1,73(0,43-6,93)
|
|
Hypoglycémie
|
3 (60,00%)
|
2 (40,00%)
|
5 (100,00%)
|
0,0641
|
7,24(1,16-45,29)
|
|
Hyperparasitémie
|
0 (0,00%)
|
3 (100,00%)
|
3 (100,00%)
|
0,9380
|
0,00 (-)
|
|
Convulsions
|
0 (0,00%)
|
1 (100,00%)
|
1 (100,00%)
|
1,0000
|
0,00 (-)
|
|
|
|
|
*chi-carré
Il est notable
sur ce tableau que l'insuffisance pondérale était présente
chez 60,00% des patients avec hypoglycémie, 27,27% de ceux avec
ictère et 24,19% de ceux avec neuropaludisme. Il n'y a pas d'association
statistiquement significative entre les formes cliniques et l'état
nutritionnel (p>0,05).
Tableau XXI. Répartition des malades selon les formes
cliniques en fonction z-score P/T
|
|
z-score P/T
|
|
|
|
|
Formes cliniques
|
< - 2 ET
|
= - 2 ET
|
Total
|
p*
|
OR( IC95%)
|
|
Anémie sévère
|
22 (20,00%)
|
88 (80,00%)
|
110 (100,00%)
|
0,5622
|
0,75(0,36-1,56)
|
|
Neuropaludisme
|
14 (22,58%)
|
48 (77,42%)
|
62 (100,00%)
|
1,0000
|
1,07(0,51-2,26)
|
|
FBH
|
6 (35,29%)
|
11 (64,71%)
|
17 (100,00%)
|
0,2693
|
2,13(0,73-6,20)
|
|
DR
|
2 (13,33%)
|
13 (86,67%)
|
15 (100,00%)
|
0,6120
|
0,53(0,11-2,44)
|
|
Ictère
|
3 (27,27%)
|
8 (72,73%)
|
11 (100,00%)
|
0,9413
|
1,37(0,35-5,44)
|
|
Hypoglycémie
|
2 (40,00%)
|
3 (60,00%)
|
5 (100,00%)
|
0,6540
|
2,46(0,40-15,30)
|
|
Hyperparasitémie
|
0 (0,00%)
|
3 (100,00%)
|
3 (100,00%)
|
0,8269
|
0,00 (-)
|
|
Convulsions
|
0 (0,00%)
|
1 (100,00%)
|
1 (100,00%)
|
1,0000
|
0,00 (-)
|
*chi-carré
Nous remarquons sur ce tableau que la malnutrition aiguë
était enregistrée chez 40,00% de patients en hypoglycémie,
de même que chez 35,29% de ceux avec fièvre bilieuse
hémoglobinurique, 27,27% de ceux avec ictère et 22,58% de ceux
avec neuropaludisme. Il n'y a pas d'association statistiquement significative
entre les formes cliniques du paludisme grave et la malnutrition aiguë
(p>0,05).
Tableau XXII. Répartition des malades selon les formes
cliniques en fonction z-score T/A
|
|
z-score T/A
|
|
|
|
|
Formes cliniques
|
< - 2 ET
|
= - 2 ET
|
Total
|
p*
|
OR( IC95%)
|
|
Anémie sévère
|
13 (11,82%)
|
97 (88,18%)
|
110 (100,00%)
|
1,0000
|
1,09(0,41-2,89)
|
|
Neuropaludisme
|
7 (11,29%)
|
55 (88,71%)
|
62 (100,00%)
|
1,0000
|
0,97(0,37-2,57)
|
|
FBH
|
2 (11,76%)
|
15 (88,24%)
|
17 (100,00%)
|
1,0000
|
1,03(0,22-4,88)
|
|
DR
|
2 (13,33%)
|
13 (86,67%)
|
15 (100,00%)
|
1,0000
|
1,21(0,25-5,78)
|
|
Ictère
|
2 (18,18%)
|
9 (81,82%)
|
11 (100,00%)
|
0,8180
|
1,79(0,36-8,94)
|
|
Hypoglycémie
|
2 (40,00%)
|
3 (60,00%)
|
5 (100,00%)
|
0,1880
|
5,59(0,88-35,74)
|
|
Hyperparasitémie
|
1 (33,33%)
|
2 (66,67%)
|
3 (100,00%)
|
0,7769
|
4,00(0,35-46,23)
|
|
Convulsions
|
0 (0,00%)
|
1 (100,00%)
|
1 (100,00%)
|
1,0000
|
0,00 (-)
|
*chi-carré
Il est évident sur ce tableau que le retard de
croissance était noté chez 40,00% des patients avec
hypoglycémie, chez 33,33% de ceux avec hyperparasitémie, 18,18%
de ceux avec ictère, 13,33% de ceux avec détresse respiratoire,
11,82% de ceux avec anémie sévère, 11,76% de ceux avec
fièvre bilieuse hémoglobinurique, sans lien statistiquement
significatif entre le retard de croissance et les formes cliniques de paludisme
grave (p>0,05).
IV.2.4. FORMES CLINIQUES ET EVOLUTION
Tableau XXIII. Répartition des malades selon les
formes cliniques en fonction de l'évolution
|
|
Evolution
|
|
|
|
|
Formes cliniques
|
Décès
|
Guérison
|
Total
|
p*
|
OR ( IC95%)
|
|
Anémie sévère
|
19 (18,45%)
|
84 (81,55%)
|
103 (100,00%)
|
0,6106
|
0,75(0,34-1,66)
|
|
Neuropaludisme
|
11 (20,37%)
|
43 (79,63%)
|
54 (100,00%)
|
1,0000
|
1,02(0,45-2,32)
|
|
FBH
|
10 (58,82%)
|
7 (41,18%)
|
17 (100,00%)
|
0,00009
|
7,79(2,68-22,66)
|
|
DR
|
7 (53,85%)
|
6 (46,15%)
|
13 (100,00%)
|
0,00505
|
5,65(1,75-18,24)
|
|
Ictère
|
3 (27,27%)
|
8 (72,73%)
|
11 (100,00%)
|
0,8235
|
1,54(0,38-6,16)
|
|
Hypoglycémie
|
0 (0,00%)
|
5 (100,00%)
|
5 (100,00%)
|
0,5661
|
0,00(-)
|
|
Hyperparasitémie
|
0 (0,00%)
|
3 (100,00%)
|
3 (100,00%)
|
0,8801
|
0,00(-)
|
|
Convulsions
|
0 (0,00%)
|
1 (100,00%)
|
1 (100,00%)
|
1,0000
|
0,00(-)
|
*chi-carré
Nous remarquons sur ce tableau que le décès
était enregistré chez 58,82% des patients avec fièvre
bilieuse hémoglobinurique et 53,85% de ceux avec détresse
respiratoire et, une association statistiquement significative (p<0,05) est
notée entre la fièvre bilieuse hémoglobinurique (environ 8
fois) et l'évolution, de même qu'entre la détresse
respiratoire (environ 6 fois) et l'évolution.
CHAPITRE V. DISCUSSION
V.1.1. Prévalence du
paludisme grave
Au cours de notre période d'étude, nous avons
trouvé une prévalence de 14,91% de paludisme grave par rapport au
service de Pédiatrie, ce qui est similaire à celle
rapportée au CHU de Brazzaville en 2010, à savoir une
prévalence de 14,7% [57]. Cependant, notre prévalence est
supérieure à celles rapportées dans plusieurs
études : 9,4% à Yaounde en 1999 [58]; 9,14% au CHU Gabriel
Touré en 2006 [59]; 7,8% au Mali en 2013 [60] ; 6,8% à
Lubumbashi en 2011 [20] et 0,8% à Antananarivo en 2000 [61]. En outre,
notre fréquence est basse par rapport à celle trouvée par
à Bouaké en 2003 [62] à savoir 26% ainsi qu'à celle
trouvée Bouar en 2006 (42%) [63].
Par ailleurs, notre prévalence par rapport au paludisme
(42,65%) est proche de celle trouvée à Lubumbashi en 2011 (41,7%)
[20] mais, est supérieur à celle mentionnée dans plusieurs
études: 35,26% en 2006 au Mali [59], 28,8% à Yaoundé en
1999 et al [58] et seulement 2,9% à Antananarivo en 2000 [61].
Les divergences constatées entre notre résultat
et ceux de certains auteurs pourraient s'expliquer par la différence
dans la méthodologie utilisée intégrant le type
d'étude mené, la taille d'échantillon, la population-cible
et, d'autre part, elles pourraient s'expliquer par le degré
d'endémicité variable entre différentes régions de
la planète, la qualité du personnel ainsi que le plateau
technique de différents laboratoires.
V.1.2. Données
sociodémographiques
V.1.2.1. Age
Notre étude a intéressé les enfants de 0
à 60 mois révolues et a révélé que la
majorité d'entre eux (28,74%) étaient âgés entre 13
et 24 mois, ce qui est identique à une étude menée
à Lubumbashi en 2011 [20] qui fait mention de la prédominance
des cas dans la tranche de 13 à 24 mois, avec 25,3% des cas alors qu'au
Mali en 2013, il a été constaté une prédominance
des cas dans la tranche d'âge de 24 à 35 mois avec 34,6% des cas
[60]. Toutefois, la majorité d'autres études concentrées
sur les enfants de 0 à 15 ans, avaient trouvé une
prédominance des cas chez les enfants de 0 à 48 mois, notamment
à Ouagadougou en 1997 [64] et à Dakar en 2003 [65] alors
qu'à Libreville en 1999 [66] et au Togo en 1998 [67], il a
été constaté une prédominance des cas entre 6 mois
et 5 ans.
Dans notre série, la tranche d'âge de 0 à
6 mois était la moins touchée avec 8,05%, ce qui pourrait
s'expliquer par des densités parasitaires faibles et des accès
palustres rares avant 4 mois et cela pour plusieurs raisons : le fort
pourcentage d'hémoglobine foetale, l'allaitement maternel exclusif
jusqu'à 6 mois, le passage des anticorps antipalustres maternels vers le
foetus dans la vie intrautérine, la moindre exposition des
nouveau-nés aux moustiques par le port des vêtements couvrant tout
le corps ainsi que le fait que les nouveau-nés bénéficient
des soins attentifs qui sont abandonnés une fois que l'enfant devient
autonome [48,68].
Quant à la moyenne d'âge, elle était de
28,58#177;17,59 mois pour notre série, avec une médiane de 24
mois (Q1-Q3 = 13-48 mois) et les extrêmes de 2 et 60 mois. Notre moyenne
se rapproche de celle trouvée à Sikasso en 2008 [69], à
savoir 30,72 mois alors qu'elle est supérieure à celle
trouvée à Koutiala en 2013 [60], qui était de 21,64mois.
Des moyennes nettement supérieures à la nôtre ont
été notées par d'autres auteurs : 42 mois
(extrêmes : 2 mois-14 ans) en 2000 à Antananarivo [61];
45,5#177;32,9 mois (extrêmes : 2-132 mois) à Lubumbashi en
2011 [20].
Les différences constatées entre nos
résultats par rapport à l'âge pourraient s'expliquer par la
différence d'âges d'inclusion des patients, la majorité
d'auteurs ayant concentré leurs études sur les enfants de 0
à 15 ans.
V.1.2.2. Sexe
La majorité de nos patients étaient de sexe
masculin avec 54,02% et un sex-ratio étant de 1,17 en leur faveur. Cette
prédominance de cas pour le sexe masculin a été
également retrouvée par la majorité d'autres
auteurs : 58,6% (sex-ratio : 1,41) au Mali en 2006 [59]; 57,8%
(sex-ratio : 1,3) en 2011 à Lubumbashi [20]; 55,2%
(sex-ratio : 1,26) en 1997 à Ouagadougou [64]; 55,1%
(sex-ratio : 1,23) au Kivu en 2008 [51]; 55% (sex-ratio : 1,22)
à Sikasso en 2008 [69]; 51% (sex-ratio : 1,04) à
Yaoundé en 1999 [58]. Par contre, une prédominance
féminine a été trouvée dans une étude
gabonaise datant de 1999 [66]. La raison de la moindre atteinte du sexe
féminin pourrait s'expliquer par le fait que les filles auraient des
taux élevés d'IgM qui les protégeraient contre les
pathologies parasitaires en général, tel que l'a
évoqué Letoutourier, cité par Mutombo [20].
V.1.2.3. Résidence
Il est ressorti de notre étude que 87,80% des patients
résidaient dans la zone de santé, résultat qui pourrait
s'expliquer par le fait que l'accessibilité géographique est un
facteur très indispensable dans le recours à une structure des
soins.
V.1.3. Données
cliniques
V.1.3.1. Temps écoulé entre le début
des symptômes et la consultation
Notre étude a montré que 90,73% de malades
avaient fait moins de 7 jours avant de consulter contre 9,27% qui avaient fait
au moins 7 jours. Le temps moyen était de 3,84#177;3,38 jours, la
médiane était de 3 jours (Q1-Q3 : 2-4 jours), pour les
extrêmes de 1 et 15 jours. Notre médiane est la même que
celle rapportée à Dakar en 2003, à savoir 3 jours avec Q1
= 2 jours et Q3 = 6 jours [65] ; toutefois notre délai moyen est
différent de celui rapporté à Brazzaville en 2012 [70],
qui était de 6 jours pour des extrêmes de 2 et 12 jours. Cette
différence des moyennes pourrait s'expliquer par le fait que nos
prédécesseurs avaient travaillé sur le paludisme en
général, incluant tout aussi bien les formes simples et les
formes graves.
IV.1.3.2. Signes cliniques
En rapport avec le tableau clinique présenté, la
fièvre était notée chez 91,95% des malades, suivie de la
pâleur dans 56,32% des cas. Cette prédominance de la fièvre
rejoint les données de la littérature qui considère la
fièvre comme étant le signe quasi constant dans le paludisme
[2,35-37] et a été rapportée également par d'autres
auteurs : à 93% à Brazzaville en 1999 [57] et à 47,8%
associée aux convulsions et à 25% associée au coma en 2006
au Mali [59].
IV.1.3.3. Formes cliniques du paludisme grave
L'anémie sévère était la forme
clinique la plus notée chez 63,22% des patients, suivie du
neuropaludisme avec 35,63% des malades, puis de la fièvre bilieuse
hémoglobinurique avec 9,77% des cas. Les convulsions à
répétition n'étaient notées que chez 0,57% des
malades. Plusieurs auteurs avaient trouvé cette
supériorité numérique de l'anémie
sévère : à 38,6% en 2011 à Lubumbashi [20],
à Bouaké en 2003 [62], au Togo en 1998 [67], à Brazzaville
en 2005 [71] et au Togo en 2006 [72]; cependant, beaucoup d'autres
avaient trouvé que le neuropaludisme était le plus
fréquent : à 57,9% au Mali en 2006 [59], à 52,4%
à Ouagadougou en 1997 [64] et à 35% en 2003 à Dakar [65].
Au Mali en 2008, De son côté, le neuropaludisme et l'anémie
sévère représentaient 80% [69]. Tous ces résultats
pourraient s'expliquer par le fait que les jeunes enfants étant non
prémunis contre le paludisme, en cas d'infestation par le Plasmodium
falciparum, l'état clinique pourrait rapidement s'aggraver pour
évoluer vers le paludisme neurologique ou une anémie
sévère, responsables de la forte mortalité due au
paludisme [68].
IV.1.3.4. Diagnostics associés
Le diagnostic associé le plus fréquent
était la méningite avec 28,99% des cas, suivie des verminoses
avec 10,14% des cas, puis de la fièvre typhoïdes avec 8,70% des
cas, résultat qui est similaire à celui trouvé au Mali en
2006 [59], rapportant que le paludisme grave était associée
beaucoup plus à la méningite et à la salmonellose et ce,
dans 10,9% des cas.
IV.1.4. Données
anthropométriques
IV.1.4.1. Z-score Poids/Taille
La prévalence globale de la malnutrition aiguë de
21,84% avec 7,47% pour la forme sévère et 14,37% pour la
modérée. Un bon état nutritionnel était noté
chez 78,16% des malades. Alors que notre prévalence de la malnutrition
aiguë sévère est basse par rapport à celle des autres
auteurs : 13,25% à Lubumbashi en 2011 [20] et 29,6% au Kivu en 2008
[45] ; celle de la malnutrition aiguë sévère se
rapproche des leurs : 15,66% et 17,6%, respectivement à Lubumbashi
[20] et dans le Kivu [45]. La différence de prévalences de la
malnutrition aiguë sévère pourrait s'expliquer par le fait
que les autres auteurs ont inclus les oedèmes alors que dans notre cas,
ce critère était exclu vu qu'il n'était pas
retrouvé sur les dossiers des malades.
Le z-score P/T moyen était de -0,66#177;1,59, pour une
médiane de -0,63 (Q1-Q3 : -1,71-0,39) et les extrêmes de
-4,76 et 3,17, ce qui montre un faible décalage vers la droite par
rapport aux résultats trouvés à Lubumbashi en 2011 [20],
à savoir une moyenne de -0,97#177;2,05 et une médiane de -0,88
(Q1-Q3 : -2,17--0,88). Cela pourrait s'expliquer par la différence
de prévalence de malnutrition aiguë constatée dans nos
études.
IV.1.4.2. Z-score Poids/Age
La malnutrition globale sévère a
présenté une prévalence de 5,17% contre 13,22% pour une
malnutrition globale modérée, soit une prévalence globale
18,39% ; 81,61% des malades avaient un bon état nutritionnel. Nos
prévalences sont superposables à celles trouvées à
Lubumbashi en 2011, qui avaient trouvé 7,23% pour la malnutrition
globale sévère et 13,25% pour la forme modérée
[20].
Le z-score P/A moyen était de -0,74#177;1,28, le
médian étant de -0,56 (Q1-Q3 : -1,51-0,17) pour des
extrêmes de -4,22 à 2,07 ; un très faible
décalage vers la droite est noté entre nos résultats et
ceux de notre prédécesseur [20], qui étaient : la
moyenne de -0,86#177;1,31 avec une médiane de -0,735 (Q1-Q3 :
-1,58-0,05).
IV.1.4.3. Z-score Taille/Age
La prévalence de la malnutrition chronique
sévère était de 5,17% des malades contre 6,32% pour la
malnutrition chronique modéré, soit une prévalence globale
la malnutrition chronique de 11,49% et, un bon état nutritionnel
était enregistré chez 88,51% des malades atteints de paludisme
grave. Une prévalence proche de la nôtre en rapport avec la
malnutrition chronique sévère (3,61%) à deux écarts
près a été rapportée à Lubumbashi en 2011
[20].
Le z-score T/A moyen était de -0,52#177;1,18, pour une
médiane de -0,37 (Q1-Q3 : -1,17-2,03) et des extrêmes de
-3,79 à 2,03. Notre moyenne présente une légère
déviation vers la gauche par rapport à celle trouvée
à Lubumbashi en 2011 à savoir -0,339#177;1,63 alors que notre
médiane est légèrement déviée à
droite (-0,56 avec Q1-Q3 : -1,37- -0,81) [20].
IV.1.5. Données
biologiques et immunologiques
IV.1.5.1. Goutte épaisse
Réalisée chez 75,00% des malades, positive chez
tous ces malades, la goutte épaisse était triplement positive (3
croix) dans 86,11% des cas. Notre taux de positivité de la goutte
épaisse était supérieur à ceux des autres
auteurs : 80,5% à Sikasso en 2008 [69], 72,5% au Mali en 2006 [59]
et 54,5% à Bamako en 2012 [70]. Ces différences pourraient
s'expliquer par la différence des critères d'inclusion,
étant donné que nous n'avons inclus que les patients dont la
goutte épaisse et/ou le test de diagnostic rapide étaient
positifs alors que les autres auteurs ne se sont basés que sur les
critères cliniques.
IV.1.5.2. Test de diagnostic rapide (TDR)
Le test de diagnostic rapide était
réalisé chez 45,40% des patients et était positif chez
94,94% des patients, fréquence qui est largement supérieure
à celle rapportée en 2012 à Bamako [70], soit une
positivité à 54,5%. Ces divergences pourraient s'expliquer par le
fait des différences de méthodologies comme expliqué pour
la goutte épaisse ; cependant, il y a lieu de songer
également à la différence de spécificités et
de sensibilités entre les tests de diagnostic rapide utilisés.
IV.1.5.3. Hémoglobinémie
Tableau XII. Répartition des malades selon le
taux d'hémoglobine
Notre étude a révélé que 32,20%
des patients avaient une hémoglobinémie inférieure
à 5g%. Le taux moyen était de 6,16#177;3,07 g% pour une
médiane de 5 g% (Q1-Q3 : 4,00-7,80g%) et les extrêmes de 3
et 14g%. Dans une étude menée à Ouagadougou en 1997, il a
été rapporté une fréquence de 16,6% pour une
hémoglobinémie inférieure à 5g%, équivalent
à près de la moitié de notre fréquence ;
cependant, la moyenne trouvée (7,6g%) est très proche de la
nôtre [64].
IV.1.6. Données
thérapeutiques et évolutives
IV.1.6.1. Type de traitement reçu avant
hospitalisation
Nous avons remarqué que 58,05% de patients n'avaient
reçus aucun traitement avant hospitalisation, ce qui est une
fréquence supérieure à celle de l'étude
camérounaise de 1999 [58] qui avait trouvé que 41,95% des
malades n'avaient pas bénéficié d'un traitement avant
hospitalisation.
IV.1.6.2. Traitement antipaludéen instauré
en hospitalisation
La quinine était la molécule la plus
utilisée en hospitalisation chez 94,25% des malades, suivie des ACT chez
32,18% des cas alors que seulement 5,75% des malades avaient reçus
l'artésunate. Notre constat est similaire à celui
rapportée au Mali en 2006: 57,8% des patients avaient
bénéficié de la quinine en hospitalisation contre 42,2%
qui avaient reçu des dérivés de l'artémisinine
[59].
Tous ces résultats réjoignent les
recommandations de l'Organisation Mondiale de la santé sur la prise en
charge du paludisme grave, devant recourir soit aux sels de quinine, soit
à l'artésunate, avec un relai per os de la quinine ou des ACT
[2].
IV.1.6.3. Evolution des malades
Tableau XV. Répartition des malades selon les
diagnostics associés
L'évolution était marquée par la
guérison chez 74,71% des malades alors que les décès
étaient enregistrés dans 18,39% des cas et 6,90% des cas
étaient perdus de vus. Notre fréquence des décès
est similaire à celle trouvée en République
Centr'africaine en 2006 [63] et au Togo en 1998 [67], respectivement 18% et
18,94% ; il est supérieur par rapport à celui des autres
auteurs :14,3% au Mali en 2006 [59], 14,16% à Sikasso en 2008
[69], 13% en 2003 à Bouaké [62], 12,9% à Ouagadougou
en 1997 [64], 9,7% au Togo en 2006 [72], 9% à Dakar en 2003 [65], 8,4%
à Lubumbashi en 2011 [20], 5,09% à Kinshasa en 2015 [73],
3,05% au Gabon en 1999 [66] et, un taux trop élevé était
rapporté en 2010 à Brazzaville [57].
IV.1.6.4. Séjour hospitalier
La durée d'hospitalisation était de moins de 7
jours pour 57,47% des patients, entre 7 et 14 jours pour 40,80 et 1,72% des
malades avaient fait plus de 14 jours. Un constat similaire a été
fait au Mali en 2006 : 76,3% des malades avaient fait moins de 7 jours
contre 23,7% qui avaient fait plus de 7 jours [59].
Notre séjour moyen était de 5,67#177;3,26 jours,
pour les extrêmes de 0 et 15 jours. Le séjour médian
était de 5 (3-8) jours, résultat similaire à celui de
l'étude malienne [59] qui avait trouvé une moyenne de 5,55 pour
des extrêmes de 3 et 32 jours et proche de ceux de plsieurs autres
études, notamment : à Brazzaville en 2010 et à Dakar
en 2003, respectivement une moyenne de 4 jours (extrêmes de 2 à 4
jours) et de 3,8 jours (1-26 jours).
IV.2. Analyses
bivariées
IV.2.1. Formes cliniques et
âge
La majorité d'enfants avec ictère (63,64%),
neuropaludisme (50,00%) ; anémie sévère (48,18%) et
détresse respiratoire (46,67%) étaient âgés de plus
de 24 mois, alors que la majorité de ceux avec fièvre bilieuse
hémoglobinurique (41,18%) et hyperparasitémie (66,67%)
étaient âgés entre 13 et 24 mois. Les formes cliniques et
l'âge n'avaient pas d'association statistiquement significative
(p<0,05). En 2006, au Mali, une association statistiquement significative
(p=0,002) a été trouvée entre le neuropaludisme et
l'âge [59]; cependant, d'autres auteurs n'avaient noté aucun
lien statistiquement significatif : au Mali en 2007 [74] et au Cameroun en
1994 [75].
IV.2.2. Formes cliniques et
sexe
Tableau XVI. Répartition des malades selon les
formes cliniques par sexe
L'anémie sévère, la fièvre
bilieuse hémoglobinurique, la détresse respiratoire,
l'ictère et l'hyperparasitémie étaient plus
enregistrés chez les enfants de sexe masculin alors que le
neuropaludisme, l'hypoglycémie et les convulsions l'étaient plus
chez ceux de sexe féminin. Il n'y a aucune association statistiquement
forte entre le sexe et les formes cliniques (p>0,05), ce dernier constat
rejoint celui rapporté dans une étude Lushoise de 2011 qui
avaient signifié qu'il n'y a pas de relation entre le paludisme et le
sexe, avec existence d'égalité des risques [20] ; cependant,
au Mali en 2007, il a été rapporté que le neuropaludisme
était plus associé au sexe masculin [74].
IV.2.3. Formes cliniques et
état nutritionnel (z-score P/A, P/T et T/A)
La malnutrition globale était présente chez
60,00% des patients avec hypoglycémie, 27,27% de ceux avec ictère
et 24,19% de ceux avec neuropaludisme. Il n'y a pas d'association
statistiquement significative entre les formes cliniques et l'état
nutritionnel (p>0,05).
Quant à la malnutrition aiguë, elle était
enregistrée chez 40,00% de patients en hypoglycémie, de
même que chez 35,29% de ceux avec fièvre bilieuse
hémoglobinurique, 27,27% de ceux avec ictère et 22,58% de ceux
avec neuropaludisme. Il n'y a pas d'association statistiquement significative
entre les formes cliniques du paludisme grave et la malnutrition aiguë
(p>0,05).
En rapport avec la malnutrition chronique, elle était
noté chez 40,00% des patients avec hypoglycémie, chez 33,33% de
ceux avec hyperparasitémie, 18,18% de ceux avec ictère, 13,33% de
ceux avec détresse respiratoire, 11,82% de ceux avec anémie
sévère, 11,76% de ceux avec fièvre bilieuse
hémoglobinurique, sans lien statistiquement significatif entre le retard
de croissance et les formes cliniques de paludisme grave (p>0,05).
Dans une étude datant de 1971 à Ibadan Ibadan,
il a été révélé qu'une forte
parasitémie était associée à un z-score P/A
inférieur au 10ème percentile [76]. En 2008, au Kivu,
il avait été trouvé que la morbidité palustre
augmentait avec l'indice P/T (OR : 1,5 pour la malnutriton
modérée et 1 pour la sévère) [45]. En 2006, dans
une étude sur les enfants africains, il est ressorti que avaient
constaté que l'anémie était associée à la
malnutrition (OR : 1,68) et que la malnutrition était
indépendamment associée au paludisme (OR : 1,67) [77]. A
Antananarivo en 1995, 59,5% d'enfants atteints de paludisme présentaient
une malnutrition modérée ou sévère ;
cependant, le seuil de signification de ces résultats n'avait pas
été étudié [78]. Cependant en 2013 à
Koutiala, aucun lien n'a été trouvé entre le paludisme et
la malnutrition [60], alors que d'autres auteurs avaient même
trouvé que la malnutrition protégerait contre le paludisme [13].
Nous comprenons par tout ceci que le lien entre le paludisme et la malnutrition
reste variable et, cela d'un endroit à un autre, d'une période
à une autre et cela dépendant des facteurs alimentaires d'une
population à une autre [45].
IV.2.4. Formes cliniques et
évolution
Le décès était enregistré chez
58,82% des patients avec fièvre bilieuse hémoglobinurique et
53,85% de ceux avec détresse respiratoire et, une association
statistiquement significative (p>0,05) est notée entre la
fièvre bilieuse hémoglobinurique (environ 8 fois) et
l'évolution, de même qu'entre la détresse respiratoire
(environ 6 fois) et l'évolution. A ce propos, au Mali en 2006, une
étude a mentionné qu'il existait une différence
statistiquement significative dans l'association du taux de décès
à la forme clinique [59]. A Versailles en 2006, un auteur avait
trouvé que le décès était associée de
manière significative (p<0,0001) au coma, à l'oedème
pulmonaire et à l'acidose [79] alors que, comme nous, à Kinshasa
en 2015, une association statistique entre la létalité palustre
et la détresse respiratoire (OR : 1,9) était décrite
[73]. En 2003, au Sénégal, une étude avait trouvé
une association entre le décès et le neuropaludisme (OR :
50,7), la détresse respiratoire (OR : 7,9), convulsions (OR :
3,5), acidose métabolique (OR : 4,0), Hypoglycémie
(OR : 3,0). Il y a lieu de comprendre que le lien entre les formes
cliniques et le décès est très variable d'un lieu à
l'autre et d'un moment à l'autre [65].
CONCLUSION ET RECOMMANDATIONS
Nous avons mené une étude descriptive
transversale à visée analytique sur l'évaluation de
l'état nutritionnel des enfants de 0 à 5 ans atteints de
paludisme grave dont les objectifs étaient de décrire les
paramètres sociodémographiques, cliniques et paracliniques des
enfants atteints de paludisme grave, d'étudier le lien entre le
paludisme grave et l'état nutritionnel des enfants de 0 à 59 mois
et, enfin, de décrire l'évolution clinique de ces enfants.
A l'issue de notre étude, nous avons trouvé les
résultats suivants :
- La prévalence globale du paludisme grave était
de 14,91% pour le service de Pédiatrie et de 42,65% par rapport aux cas
de paludisme et, la prévalence annuelle moyenne était de 43
cas ;
- La tranche d'âge majoritairement atteinte était
de plus de 24 mois, avec 47,13% ; l'âge moyen des malades
était de 28,58#177;17,59 mois, le médian était de 24 mois,
pour les extrêmes de 2 et 60 mois ;
- Les patients étaient majoritairement de sexe masculin
avec 54,02%, soit un sex-ratio de 1,17 et, la grande partie des malades
(87,80%) résidaient dans la zone de santé
étudiée ;
- L'anémie sévère, le neuropaludisme et
la fièvre bilieuse hémoglobinurique étaient les formes
cliniques les plus retrouvées avec respectivement 63,22%, 35,63% et
9,77%. Les diagnostics associés les plus enregistrés
étaient la méningite, les verminoses et la fièvre
typhoïde avec respectivement 28,99%, 10,14% et 8,70%.
- La prévalence globale de la malnutrition aiguë
chez nos patients était de 21,84%, avec 7,47% de malnutrition aiguë
sévère et 14,37% de malnutrition aiguë
modérée.
- L'insuffisance pondérale était
prévalente à 18,39%, soit 5,17% d'insuffisance pondérale
sévère et 13,22% d'insuffisance pondérale
modérée.
- Le retard de croissance avait une prévalence globale
de 11,49%, soit 5,17% pour la forme sévère et 6,32% pour la forme
modérée.
- La goutte épaisse était triplement positive
chez 86,11% de nos patients et, le test de diagnostic rapide était
positif chez 94,94% des patients.
- Bon nombre de malades (33,85%) étaient du groupe
sanguin B rhésus positif ;
- La quinine était la molécule la plus
utilisée en hospitalisation avec 94,25% et, la guérison
était notée chez 74,71% des patients avec un séjour
moyen de 5,67#177;3,26 jours, pour les extrêmes de 0 et 15 jours. Le
séjour médian était de 5 jours.
Par ailleurs, nous avons observé une association
statistiquement significative entre les formes cliniques (près de 8
fois pour la fièvre bilieuse hémoglobinurique et 6 fois pour la
détresse respiratoire) et l'évolution des patients et, aucune
association statistiquement significative n'a été trouvée
entre les formes cliniques et l'âge, le sexe et l'état
nutritionnel.
Partant de tous ces résultats, il y a lieu de
considérer que le paludisme grave demeure un véritable
problème de santé publique dans notre milieu, susceptible
d'entraîner non seulement la mortalité chez les enfants de 0
à 5 ans mais, aussi la morbidité, dont fait partie la
malnutrition, dont les retombées pourraient favoriser
l'endémicité du paludisme dans notre milieu ; ce qui conduit
à un cercle vicieux bien évident dans nos milieux ; pour
cela, il convient pour nous de produire les recommandations :
- Aux décideurs (autorités
politicoadministratives et autorités sanitaires), de veiller à
l'assurance de la santé de la population en général et des
enfants en particulier en :
· disponibilisant les moustiquaires
imprégnées d'insecticides à toute la population et en
vulgarisant son usage et la lutte contre les moustiques et leurs gîtes
larvaires ;
· disponibilisant des moyens diagnostiques et
thérapeutiques conséquents dans les hôpitaux en vue de
rendre accessible à faible coût, sinon gratuit, la prise en charge
des malades atteintes de paludisme grave, particulièrement les enfants
de 0 à 5 ans ;
· élaborant des politiques idéalistes
pouvant cadrer avec l'objectif « Roll Back Malaria »
prôné par l'Organisation Mondiale de la Santé.
- Au personnel de santé :
o De prendre en charge les malades de façon holistique,
particulièrement les enfants atteints de paludisme grave, pouvant
s'accompagner d'une malnutrition silencieuse l'aggravant encore
davantage ;
o D'intégrer la politique de la prise en charge du
paludisme, tel que mentionné par l'Organisation Mondiale de la
Santé et surtout se basé sur l'effet
risque/bénéfice dans leur applicabilité.
- A la population :
· De s'impliquer dans la lutte contre le paludisme,
notamment en appliquant les mesures prophylactiques telles que la lutte contre
les moustiques par usage des moustiquaires imprégnées
d'insecticides et/ou d'insecticides, destruction des gîtes larvaires
potentielles que sont les flaques d'eau ;
· De veiller à consulter rapidement une structure
sanitaire dès apparition de la fièvre chez l'enfant et
d'éviter de s'hasarder à donner des médicaments non
prescrits par le médecin ou tout autre personnel soignant
recommandé.
BIBLIOGRAPHIE
1. Morin Y., Wainsten J.-P, Lemaire V. et
al., Larousse Médical Electronique : Paludisme,
Edition Larousse, 2006.
2. OMS, Guide pratique pour la prise en
charge du paludisme grave, 3ème édition,
Genève, 2013
3. Kantele A, Jokiranta S, Review of
cases with the emerging fifth human malaria parasite, Plasmodium knowlesi,
Clinical Infectious Diseases, 2011, 52:1356-1362.
4. WHO, World malaria report 2008,
ISBN 978 92 4 156369 7, Genève, 2008
5. Cellule de la planification et statistiques,
direction nationale de la sante, Nutrition au Mali : Investissons
aujourd'hui pour un développement durable ; Ministère de la
santé. Policy project-USAID, Mali, 2005, 34p.WHO, World malaria report
2009, ISBN 978 92 4 156390 1, Genève, 2009
6. Koueta F, Dao L, Ye D, Zoungrana A, Kabore A et
Sawadogo A, Facteurs de risque de décès au cours du
paludisme grave chez l'enfant au Centre hospitalier universitaire
pédiatrique Charles de Gaulle de Ouagadougou (Burkina Faso), in
Cahiers Santé vol. 17, n° 4, octobre-novembre-décembre 2007,
pp.195-197
7. Ministère de la santé
publique, Protocole national de prise en charge
intégrée de la malnutrition aiguë, Kinshasa, Avril
2012.
8. Shankar AH, Nutritional modulation of
malaria morbidity and mortality, J Infect Dis 2000; 182 Suppl1 :
S37-53.
9. Takakura M, Uza M, Sasaki Y et al.,The
relationship between anthropometric indicators of nutritional status and
malaria infection among youths in Khammouane Province, Lao PDR. Southeast
Asian J Trop Med Public Health 2001; 32 : 262-7.
10. Deen JL, Walraven GE, Von Seidlein L,
Increased risk for malaria in chronically malnourished children under 5
years of age in rural Gambia. J Trop Pediatr2002 ; 48 : 78-83.
11. Friedman JF, Kwena AM, Mirel LB et al.,
Malaria and nutritional status among pre-school children: Results from
cross-sectional surveys in western Kenya, Am J Trop Med Hyg 2005; 3 :
698-704.
12. Murray MJ, Murray AB, Murray MB, Murray
CJ, Somali food shelters in Ogaden famine and their impact on
health, Lancet 1976; 1 : 1283-5.
13. Murray MJ, Murray AB, Murray NJ, Murray
MB, Diet and cerebral malaria: The effect of famine and
refeeding, Am J ClinNutr, 1978; 31: 57-61.
14. Olumese PE, Sodeinde O, Ademowo OG, Walker
O, Protein energy malnutrition and cerebral malaria in Nigerian
childrenJTropPediatr 1997;43 : 217-9.
15. Nacher M, Singhasivanon P, Treeprasertsuk S et
al., Intestinal helminths and malnutrition are independently
associated with protection from cerebral malaria in Thailand. Annals Trop
Med Parasitol, 2002; 96 : 5-13.
16. Muller O, Garenne M, Kouyate B, Becher
H, The association between protein-energy malnutrition, malaria
morbidity and all-cause mortality in West African children. Trop Med Int,
Health 2003; 8 : 507-11.
17. Tshikuka JG, Gray-Donald K, Scott M, Olela
KN, Relationship of childhood protein-energy malnutrition and
parasite infections in an urban African setting. Trop Med Int Health1997;
2 : 374-82.
18. Van Den Broeck J, Eeckels R, Vuylsteke J,
Influence of nutritional status on child mortality in rural Zaire.
Lancet 1993; 341: 1491-5.
19. Caulfield LE, Richard SA, Black RE,
Undernutrition as an underlying cause of malaria morbidity and mortality in
children less than five years old. Am J Trop Med Hyg 2004; 71 Suppl2 :
55-63.
20. Mutombo M, Lubala KT, Kabuya SM, Mukuku O, Ilunga
MP, Mutoke G, Luboya NO, Profil nutritionnel de l'enfant au cours
du paludisme grave, 83 cas observés à l'hôpital Jason
Sendwe de Lubumbashi en RD Congo, 2011.
21. Warrell DA, Pathophysiologie du
paludisme grave, Cahier de santé 1993, 276-279.
22. Boher E, Bruneel F, Buffet P, Camus D, Debord Tet
al, Place de l'artésunate injectable dans le traitement du
paludisme grave chez l'adulte et l'enfant, Haut Commissariat de
Santé Publique, 2013.
23. Aubry P et Gauzere BA,
Paludisme : Actualités 2015, dans Médecine
Tropicale, 2015
24. Staudt AE, Un Vaccin contre le
Paludisme : obstacles, espoirs et avancées, Thèse,
Faculté de Pharmacie, Université Henri Poincaré-Nancy 1,
2009
25. Boutrolle C, Découverte d'un
nouveau vecteur du paludisme en Afrique, Fiche scientifique IRD
n°207, juillet 2004
26. Verdrager J, L'OMS et le paludisme:
mémoires d'un médecin spécialiste de la malaria,
L'Harmattan, coll. « Acteurs de la science », Paris, 2005.
27. Dondorp AM,Pathophysiology, clinical
presentation and treatment of cerebral malaria, Review Articles, Neurology
Asia 2005; 10 : 67 - 77
28. Argy N et Houze S, Paludisme
grave : de la physiopathologie aux nouveautés
thérapeutiques, Extrait du Journal des Anti-infectieux, Volume 16,
2014 : 13-17.
29. Bruneel F, Paludisme grave:
Physiopathologie et Prise en charge, Séminaire DESC, 2013.
30. Dorothée F, Fatima EA, Marie-Christine A,
Thierry F, Valéry C, Georges EG, Platelet-endothelial cell
interactions in cerebral malaria: The end of a cordial understanding,
Schattauer GmbH, Stuttgart, 2009.
31. Newton CRJC, Taylor TE, Whitten O,
Pathophysiology of fatal falciparum malaria in african children, Am.
J. Trop. Med. Hyg.,58(5), 1998, pp. 673-683
32. Nicholas PJD, Tran TH, Tineke S, Pham PL, Ly VC,
Tran THC, May H et al., The Prognostic and Pathophysiologic Role
of Pro- and Antiinflammatory Cytokines in Severe Malaria, The Journal of
Infectious Diseases, 1999.
33. Ringwald P, Physiopathologie de
l'accès pernicieux, Med. Trop., 1995.
34. Traore OB, Paludisme : La
cytoadhérence et la maladie, Atelier, Paludisme, 2008.
35. OMS, Diagnostic et prise en charge du
paludisme grave à falciparum, Genève, 2000.
36. UMVF, Paludisme, 2014
37. Foucault C, Delmont J, Brouqui P,
Paludisme, Revue du Praticien, 2002.
38. Cavallo J.P., Hernandez E.Diagnostic
biologique. Dans : Saïssy J.M. Paludisme grave, Paris :
ArnetteBlackwell ; 2001.
39. OMS.Guide du stagiaire. Entomologie
du paludisme et contrôle des vecteurs, 2003.
40. Tabachnick W.J.Reflexions on the
Anopheles gambiae genome sequence, transgenic mosquitoes and the prospect
for controlling malaria and other vector borne diseases. J. Med.
Entomology 2003: 40(5): 597-606.
41. Agiknane A, Bah R, Ouattara F, Cissé A,
Eléments de base en nutrition humaine,volume 1,
editionl'Harmattan, La sahélienne, décembre 2011
42. Fadouba B K.Contribution à
l'étude de la malnutrition proteino-calorique en milieu
rural. Thèse de Médecine 8 février 1981.
43. Clark B., Évaluation
nutritionnelle en situation d'urgence, Directives pour agents de terrain,
The Save the ChildrenFund 2004
44. OMS, Utilisation et
interprétation de l'anthropométrie, Genève, 1995
45. UNICEF, Faire reculer la
malnutrition, c'est faire avancer le droit des enfants, Genève,
octobre 2008
46. WHO, Reference curves, Geneve,
2006
47. Cogil B., Guide de Mesure des
Indicateurs Anthropométriques, Washington, Mars 2003
48. UNICEF, Les différentes formes
de malnutrition, Paris, Août 2011
49. Traoré N, Etude de la
malnutrition aiguë sévère chez les enfants de 0 à 5
ans dans le service de Pédiatrie de NianankoroFoumba de
Ségou, Thèse Méd., Bamako, 2009
50. Koita A et Diallo E, Etat
nutritionnel des enfants séropositifs sous traitement
antirétroviral au service de Pédiatrie de l'Hôpital Gabriel
Touré, à propos de 47 cas, Thèse Med., Bamako,
2006
51. Mitangala NP, Hennart P, Alessandro U, Donnen P,
Porignon D, Bisimwa BG, Dramaix WM, Malnutrition
protéino-énergétique et morbidité liée au
paludisme chez les enfants de 0-59 mois dans la région du Kivu,
République Démocratique du Congo, Article original, Med
Trop, 2008, 68 :51-57
52. Shiff C.,Checkley W., Winch P. et al.,
Changes in weight gain and anaemia attributable to malaria in Tanzanian
children living under holoendemic conditions. Trans. R. Soc. Trop. Med.
Hyg.1996; 90:262-265.
53. Chevalier P, Delpeuch E et Maire B,
Le complexe «malnutrition-infection» : premier problème de
santé publique chez les populations défavorisées,
Méd Mal Infect. 1996 ; 26 : 366-70
54. Maegraith BG, Deegan T, Sherwood, Jones
E, Suppression of malaria, Plasmodium berghei, by milk. Br.
Med. J. 1 9 5 2;2 :1382-1384
55. Carnevale P, Frezil J.L., Besseno M.F. et
al. Etude de l'agressivité d'Anopheles gambiae en fonction
de l'âge et du sexe des sujets humains. Bull. WHO 1978 ;
56:147-154
56. Strobel M, De Mol P., Malnutrition et
Infection, 2005
57. Moyen G, Mbika AC, Kambourou J, Oko A, Mouko A,
Obengui. Paludisme grave de l'enfant à Brazzaville.
MédAfr Noire 2010 ; 57 (2) : 113-116.
58. Tchokoteu PF, Bitchong-Ekono C, Tietche F, Tapko
JB, Ekobo A, Douala-Mouteng V, Moukoudi A, Juimo AG, Mbede J, Nkoulou
H.Les formes graves du paludisme de l'enfant dans un service de
pédiatrie générale à Yaoundé, Cameroun.
Parasitologie 1999 ; 2005.
59. Sall AH, Incidence et
modalités de prise en charge du paludisme grave et compliqué
dans le service de Pédiatrie du CHU Gabriel-Touré,
Thèse, Université de Bamako, 2006
60. Djuidja K, Evaluation des
activités conjointes de dépistage nutritionnel et de
chimioprévention du paludisme saisonnier dans le district sanitaire de
Koutiala en 2013, Thèse, Université de Techniques et des
Technologies de Bamako, 2014
61. Raobijaona H, Randrianotahina CH, Razanamparany
M, Le paludisme grave de l'enfant observé au service de
Pédiatrie au Centre Hospitalier de Befelatanana à
Antananarivo, ArchInst Pasteur, Madagascar, 2000 ; 66 :23-25
62. Asse KV, Brouhy, Plo
KJ. Paludisme grave de l'enfant au centre hospitalier
universitaire (CHU) de Bouaké en République de Côte
d'Ivoire. ArchPéd 2003 ; 10 (1) : 62.
63. Bobossi-Serengbe G, Ndoyo J, Mukeshimana T, Fioboy
RI, Ayivi B. Le paludisme grave de l'enfant à
l'hôpital préfectoral de Bouar (Centrafrique). Med Afr Noire
2006 ; 53 (4) : 219-223.
64. Sanou I, Pare J, Traoré S, Modiano D, Kam
KL, Kabore J et al, Formes cliniques du paludisme grave en milieu
hospitalier pédiatrique à Ouagadougou, Etude originale,
Cahiers Santé, 1997 ; 7 : 13-7
65. Imbert P, Gerardin P, Rogier C, Jouvencel P,
Brousse V, Guyon P et Ka DS, Pertinence des critères OMS
2000 de paludisme grave chez l'enfant non immun à Dakar,
Sénégal, Bull. Soc. Pathol. Exot., 2003 ; 96,3,156-160
66. Koko J, Dufillot D, Zima-Ebeyard AM, Duong T H,
Gahouma D, Kombila M.Aspects cliniques et approche
épidémiologique du paludisme de l'enfant à Libreville,
Gabon. Med Afr Noire, 1999, 46 (1) :10-14.
67. Assimadi JK, Gbadoe AD, Atakouma DY, Agbhowossi K,
Lawson-Evi K, gayibor A, Kassankogno Y, Paludisme
sévère de l'enfant au Togo. ArchPediatr1998 ; 5 : 13 IO-5 Q
Elsevier, Paris.
68. Lehesran J-Y, Les
particularités du paludisme chez l'enfant, Revue
Générale, Médecine Tropicale, 2000 : 60.1
69. Dicko MI, Amélioration de la
prise en charge du paludisme grave dans le service de Pédiatrie de
l'Hôpital Régional de Sikasso, Thèse, Univ. Bamako,
2008
70. Chaka,Prise en charge des cas de
paludisme chez les enfants de 0 à 5 ans et perception des mères
dans un service de Pédiatrie à Bamako, Article original,
Mali Medical, Tome XXVII, n°3, 2012
71. Mabiala-Babela JR, Loubove H, Bansimba T, Ntsila
KR, Mouko A, Senga P. Le paludisme chez l'enfant de plus de 5 ans
au CHU de Brazzaville. Med Afr Noire 2005 ; 52(6) : 325-327.
72. Gbadoe AD, Kini-Caussi M,
Koffi S, Traore H, Atakouma DY, Tatagan-Agbi K, Assimadi JK.
Évolution du paludisme grave de l'enfant au Togo
de 2000 à 2002. Med Mal Infect 2006 ; 36 (1):52 - 54.
73. Ilunga I, Leveque A, Donnen P, Dramaix M,
Caractéristiques des ménages des enfants hospitalisés
pour paludisme grave et facteurs associés à la
létalité palustre à Kinshasa (République
Démocratique du Congo), Médecine et Santé Tropicales,
2015 : 25 : 75-81
74. Ouattara B, Prise en charge des cas
de neuropaludisme chez les enfants de 0 à 15 ans à
l'hôpital NianankoroFomba de Ségou, Thèse,
Université de Bamako, 2007
75. Tchokoteu PF, Poka D, Ekobo AS, Ngogang J, Kago I,
Tietche F et al, Le neuropaludisme de l'enfant à
Yaoundé, Cameroun : Aspects cliniques, paracliniques et
évolutifs, Ann. Soc. Belge Med. Trop., 1994, 74,193, 202
76. Hendrickse RG, Hasan AH, Olumide LO, Akinkunmi
A.Malaria in early childhood. An investigation of five hundred
seriously ill children in whom a «clinical» diagnosis of malaria was
made on admission to the children's emergency room at University College
Hospital, Ibadan. Ann Trop Med Parasitol1971; 65: 1-20.
77. Ehrhardts, Burchard D, Mantel C, Cramer JP, Kaiser
S, Kubo M et al,Malaria, anemia and malnutrition in African
Children-Defining Intervention Priorities, JID, 2006 :194
78. Razamparany MS, Randriamiharispa FA, Razamparany
NJD et Ramoalimanana V, L'épidémie de paludisme
à Antananarivo de 1983 à 1994, vue à travers le service de
Pédiatrie A de l'hôpital Général de
Befelatanana, Cahiers Santé, 1995 ; 5-382-5
79. Wolff M et Bruneel F, Paludisme
grave, Hôpital Bichat-Claude Bernard, Paris 7 et Centre Hospitalier
de Versailles,
ANNEXE: FICHE DE RECOLTE DES
DONNEES

|
|



