|

REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET
POPULAIRE
..~".Ç ..~Ç.~--4Ç
A7.5Ç.4Ç A-Ñ9+4~~Ç
MINISTERE DE L'ENSEIGNEMENT SUPERIEURE ET DE LA RECHERCHE
SCIENTIFIQUE
4-10Ç a.~~Ç æ
4163Ç ~46-11Ç
ÉÑÇÒæ
ECOLE NATIONALE SUPERIEURE VETERINAIRE
D'ALGER
J5Ç.4Ç
~~Ñ~~~Ç
- É. 9,11 ~.~0Ç -.!0.1Ç
MEMOIRE DE MAGISTERE EN SCIENCES VETERINAIRES
OPTION : ELEVAGE ET PATHOLOGIE
AVICOLE & CUNICOLE
Intitulé
Niveau de contamination microbienne du
couvoir et son influence sur la qualite du
poussin dans la filiere chair
Présenté par : DIAFI KADI
Soutenu publiquement le 3 mars 2010 devant le jury :
Président: AISSI Miriem, Pr, E.N.S.V
d'Alger
Rapporteur: KARAM Nour-Eddine, Pr, Université
d'Oran
Co-rapporteur: HARHOURA Khaled, M.A classe A, E.N.S.V
d'Alger
Examinateurs: AIN BAZIZ Hacina, Pr, E.N.S.V
d'Alger
BENDEDDOUCHE Badis, M.C, E.N.S.V d'Alger BOUKHORS Karima-Thamina,
M.C, E.N.S.V d'Alger AZZAG Nawal, M.A classe A, E.N.S.V d'Alger
ANNEE UNIVERSITAIRE : 2009-2010

REAIERCIEAIENTS
Le merite et la reussite de ce travail reviennent a toutes
les personnes et etablissements qui ont
participe a sa realisation.
J'exprime ma sincere reconnaissance et mes vifs
remerciements en particulier a mon encadreur
le professeur N.E.KARAM, eta
mon co-encadreur le docteur Kh .HARHOURA.
Je tiens a remercier les membres examinateurs de mon(ury de
memoire :
- Au Dr AISSI M. Professeur a l'E.N.S.V-
Alger
- Au Dr AIN BAA2I2 .H
Professeur a l'E.N.S.V- Alger
- Au Dr BENDEDDOU0HE .B M.0
a l'E.N.S.V- Alger
- Au Dr BOUHKORS K.T. M.0 a l'E.N.S.V-
Alger
- Au Dr A22AG N. M.A a l'E.N.S.V-
Alger
Mes sinceres reconnaissances au directeur general de l'INMV,
ainsi qu'au directeur du laboratoire vétérinaire regional de
Tlemcen, a l'inspection vétérinaire de Tlemcen et aux
responsables des couvoirs des wilayates de Sidi Bel Abbes et de
Tlemcen.

DEDI~~E
JEDEOJE c ~~ FL MES PARENT! MA FEMMEETMES
ENFAN15 QUIM~~NT
EFFJCACEMENTSOUTENIJET ~O~~LES~~ENS

Résumé

Le but de cette étude est d'évaluer
l'efficacité des mesures d'hygiène dans nos couvoirs producteurs
de poussin chair et les répercussions sur la qualité
microbiologique de ce poussin ainsi que sur les performances zootechniques.
Le travail a porté sur la recherche et l'identification
des bactéries contaminantes depuis la
phase de désinfection des établissements
d'accouvaison jusqu'au stade éclosion ainsi que
sur une étude zootechnique, basée sur le taux de
mortalité embryonnaire, le taux d'éclosion, le poids des OAC
et le poids des poussins à la naissance.

Les résultats obtenus ont mis en évidence
l'insuffisance de la qualité de désinfection de nos couvoirs et
son influence négative sur la qualité microbiologique du poussin,
sur l'élévation du taux de mortalité embryonnaire et par
conséquence sur la diminution du taux d'éclosion dans les 3
couvoirs étudiés (A ,B et C) à la période du 13
janvier au 7 juin 2009.

contamination.
Mots clés : Contamination microbienne - Couvoir
-Désinfection - Mortalité embryonnaire - Poussin chair.
Par contre le poids du poussin à l'éclosion n'est
en aucun cas sous l'influence de ce niveau de

Abstract
The aim of this study is to value the efficiency of hygienic
measures in our hatcheries

The results showed an insufficiency of disinfection of our
hatcheries and negative influence on the microbiological quality of the chick,
on the increase embryonic death rate and as a consequence on a decrease
hatching rate in the 3 studied hatcheries (A, B and C) at the period of January
13 to June 7, 2009.
On the other side there was not a relation between chick weight
and contamination level.
Key words: Microbial contamination - Hatchery- Disinfection -
Embryonic death - Chick flesh.
producers of chick flesh and the repercussions on the
microbiological quality of this chick as well as on zootechnical
performances.
Work was carried to identify bacterial contamination in
hatcheries houses since disinfection,
the contamination of eggs, and of chicks at hatching, and also to
determine some
zootechnical parameters as embryonic death rate, hatching
rate, and weight of eggs and
chicks at hatch.

.
"3-.Ç (A Ìæ ~Ç .11a
Õ.-.Ç äÒæ æ Ó~~I-MÇ L
äÒæ 63.51-11Ç
j.c..4
&'~~ '44fi.,.Ç 211,1Ç
Lola ti
·1.11.1Ç ì~% æ
ã~~~~Ç 0~Â~~Â Ì1.-Å cri 55$%
Ê7~!% 9~:~~~~
-.;~~~Ç #5< ~~ÇÑ Lola
Ç'Â æ *~Â~~,~Ç
.
J44 11Ç CsÒ 314
Ç:åæ ÌtuCÇ ~~~~* áÇ.1
.f914~Ç ~~(ÇJ.~Ç ~~*~- ..:2- æ '~41Ç
á~? Úy-.-1Ç Ñ5--5 á~~% ~LILLN.Ç
Ê~~4~~Ç Zw,1 cci 0E+ ~~!~;~+ ~~ÇÑÏ
)~Å Ö"6 ~~Â ~:~~~Ç ÓA~I-Ç La=
ÎI~~
441.2Ç ~å~(S+
æ co.mill 1251111 .4i~C1Ç '.1.a cci #~!~Ç
Ñ~~TÅ 9% ~~~~* Q5~Ç R~~~!~Ç
0!,+
cci Öli:.Ç
Lola 41:114 æ '.414Ç
Ê411Ç D- cci
Ú~I+ÑVÇ Lola Õ~5~~
~~%~(~~~Ç ZILN.Ç Lola
7 cIÅ ):124
13 cy. &~~~~~Ç
É~~~Ç 4
(
)
~~æÑ.~1Ç ÎÑ~I%
ËNf~Ç ì~.L4 Lola Ó~~I-MÇ
á~~%
2009 .3:3-3....94
.
Õ~5~Ç äÒæ æ
ÎI~~ ~%~(~~~Ç Ë3.:~Ç ìj1.4 au" :ON.a 44
c:jo ~~ ~~ÇÑ.1Ç baå äti
Çl,1 LiN<
. ã~~~ Õ_4 - ~~!~!; Ê~~4æ - ~~~
+ - ÎI% - ~og1y Ë_13. :
~~Ç~~Ç ÊL41,~Ç
.
Sommaire
Pages
1 INTRODUCTION 1
1.1 IMPLANTATION DU COUVOIR ET SA GESTION HYGIENIQUE ET
SANITAIRE 4
1.1.1 IMPLANTATION ET LA CONCEPTION DE L'ETABLISSEMENT 4
1.1.2 AGENCEMENT DU COUVOIR 4
1.1.2.1 Secteur propres et secteur souillé 4
1.1.2.2 Déchets du couvoir 5
1.1.2.3 Marche en avant 5
1.1.2.4 Ventilation 6
1.1.2.5 Sols, parois et plafonds 7
1.1.2.6 Approvisionnement en eau 7
1.2 MICROFLORE DOMINANTE DE L'ENVIRONNEMENT D'UN COUVOIR 7
1.2.1 GERMES PATHOGENES 7
1.2.1.1 Salmonelles 7
1.2.1.2 Colibacilles 8
1.2.1.3 Mycoplasmes 10
1.2.2 GERMES OPPORTUNISTES 11
1.2.2.1 Campylobacter 12
1.2.2.2 Staphylocoques 12
1.2.2.3 Entérocoques et Streptocoques 13
1.2.2.4 Pseudomonas 13
1.2.3 AUTRES GERMES 13
1.3 CONSTITUTION DE L'OEUF ET INSTALLATION DE LA FLORE
DIGESTIVE
DUPOULET 14
1.3.1 CONSTITUTION DE L'OEUF 14
1.3.1.1 Définition de l'oeuf à couver 14
1.3.1.2 Composition anatomique de l'OAC 14
1.3.1.3 Constituants organiques de l'OAC 16
1.3.1.4 Etapes de formation de l'OAC 18
1.3.1.5 Principales anomalies de l'OAC 19
1.3.2 RAPPELS SUR L'INSTALLATION DE LA FLORE DIGESTIVE CHEZ LE
POULET 20
1.3.2.1 Cinétique de l'implantation des microorganismes
20
1.3.2.2 Impact anatomo-physiologique du développement
microbien sur le tube digestif
du poulet 21
1.3.2.3 Répartition de la microflore sur le TD du poulet
22
1.4 HYGIENE DE L'OEUF A COUVER AUPRES DES CENTRES DE
PRODUCTION
ET DU COUVOIR 22
1.4.1 COLLECTE DES OAC 22
1.4.1.1 Ramassage des OAC 22
1.4.1.2 Stockage des OAC 23
1.4.1.3 Désinfection des OAC 23
1.4.2 TRANSPORT DES OAC 24
1.4.3 GESTION DES OAC AUX COUVOIRS 24
1.4.3.1 Traçabilité 24
1.4.3.2 Maitrise d'acquisition des OAC 25
1.4.3.3 Identification des risques sanitaires et
détermination des points sensibles 25
1.5 DEVELOPPEMENT EMBRYONNAIRE DU POULET DE CHAIR 27
1.5.1 GENERALITES 27
1.5.2 ETAPES DE LA CROISSANCE EMBRYONNAIRE 27
1.5.3 PERIODES CRITIQUES ET PARAMETRES DETERMINANTS L'EMRYOGENESE
28
1.5.3.1 Température 29
1.5.3.2 Humidité et âge de la poulette 29
1.5.3.3 Retournement 30
1.5.3.4 Ventilation et niveau de CO2 30
1.5.3.5 Microbisme de la coquille 31
1.6 DESINFECTION DU COUVOIR 31
1.6.1 GENERALITES 31
1.6.2 PROTOCOLE DE DESINFECTION (ITAVI, 2003 et OIE ,2008) 31
1.6.3 ETAPES SUCCESSIVES DE LA DESINFECTION DU COUVOIR 32
1.6.3.1 Rangement du matériel 32
1.6.3.2 Décontamination 33
1.6.3.3 Nettoyage chimique 33
1.6.3.4 Désinfection finale 33
1.6.4 LES CRITERES DE L'EFFICACITE DE LA DESINFECTION 34
2 MATERIEL ET METHODES 35
2.1 Matériel 36
2.1.1 CONDITIONS DE L'ETUDE 36
2.1.2 MATERIEL BIOLOGIQUE 36
2.1.2.1 OEufs à couver 36
2.1.2.2 Poussins 37
2.1.3 MATERIEL NON BIOLOGIQUE 37
2.1.4 COUVOIRS ETUDIES 38
2.2 Méthodes 40
2.2.1 PROTOCOLES DE DESINFECTION ET METHODES DE PRELEVEMENTS
40
2.2.1.1 Série A 40
A/ Protocole de désinfection 40
B/ Prélèvements effectués 41
2.2.1.2 Série B 41
A/ Protocole de désinfection recommandé 41
B/ Prélèvements effectués 42
C/ Techniques de prélèvement 43
2.2.2 METHODES BACTERIOLOGIQUES 45
2.2.2.1 Traitement des chiffonnettes et des écouvillons
45
2.2.2.2 Traitement des oeufs 45
2.2.2.3 Traitement des poussins 45
2.2.2.4 Identification bactérienne 46
2.2.3 PARAMETRES ET ANALYSES 47
2.2.3.1 Paramètres d'hygiène 47
2.2.3.2 Paramètres zootechniques 48
2.2.3.3 Analyse statistique 48
3. RESULTATS ET DISCUSSION 49
3.1 ANALYSES MICROBIOLOGIQUES 50
3.1.1 SERIE A 50
3.1.1.1 Sous série 1 : J0 50
3.1.1.2 Sous série 2 : J8 51
3.1.1.3 Sous série 3 : J19 52
3.1.1.4 Sous série 4 : J21 52
3.1.2 SERIE B 54
3.1.2.1 Sous série 1 : J0 54
3.1.2.2 Sous série 2 : J8 55
3.1.2.3 Sous série 3 : J19 56
3.1.2.4 Sous série 4 : J21 56
3.2 ANALYSES ZOOTECHNIQUES 68

INTRODUCTION
La filière chair dans l'espèce Gallus gallus en
Algérie a connu une évolution certaine dans tous les segments de
la production pour la mise en place d'un modèle intensif durant toutes
les phases et les plans de restructurations qu'a vécu le pays pour
pallier à un déficit de protéines animales. Selon les
statistiques de la FAO (2009), l'Algérie est arrivée à des
consommations de 7,7 kg par habitant en 1990 et 8,4 kg par habitant en 2008.
Ces taux restent en deçà de la moyenne mondiale qui est de 12,9
kg/habitant et du taux des plus grands consommateurs de volaille dans le monde
que sont les U.S.A ( 52,3 kg ), le Brésil ( 38,1 kg ) et l'union
européenne des 27 (23,4 kg )(FAO, 2007).
La croissance de 3-4% observée ces 10 dernières
années reste insuffisante et doit être améliorée.
Cela passe automatiquement par une remise à niveau de nos
élevages intensifs et une grande maitrise sanitaire des produits
avicoles dès la naissance du poussin pour rattraper le retard.
La production du poussin d'une qualité
irréprochable nécessite un énorme effort d'équipe
impliquant tous les acteurs concernés par la filière depuis la
gestion des reproducteurs. Ceci se fait par une bonne conduite sanitaire et
hygiénique à chaque stade d'élevage et de production,
consolidée par un maniement correct des OAC depuis les nids
jusqu'à l'incubateur pour pouvoir maintenir un niveau acceptable de
l'environnement du couvoir et de réduire l'exposition à la
contamination (Afssa, 2000). En effet, durant la production, les couvoirs
passent à travers un cycle de contamination qui peut se produire
très tôt dès l'arrivée des OAC des fermes ou
lorsqu'ils sont placés dans les incubateurs. Lors du transfert,
l'environnement devient contaminé aussitôt que les oeufs sont
retournés, à l'éclosion et lorsque les poussins sont
manipulés (vaccinations - mise en carton - livraison) (Itavi, 2003).
L'environnement des couvoirs est directement concerné par une large
population de microorganismes, représentée par des virus, des
champignons et surtout des bactéries. Si certains sont des agents
pathogènes spécifiques à l'espèce aviaire,
plusieurs sont des contaminants communs à la végétation,
au sol, à l'eau et à l'atmosphère. Certains micro-
organismes sont considérés comme non pathogènes en dehors
de l'oeuf, mais dès qu'ils franchissent la barrière
coquillère vont se localiser au niveau des différents
constituants, notamment l'albumen et le vitellus qui sont
détériorés, et deviennent des toxines capables de tuer
l'embryon déjà en développement ou agir
ultérieurement en affectant la viabilité du poussin
éclos. C'est la cause de la mort en coquille, des
rejets et plus particulièrement de la mort précoce des poussins
(Casa et al., 2008).
A la naissance, les poussins possèdent un
système immunitaire immature qui les prédispose pendant les
premiers jours de leur vie à une colonisation rapide (6-12 heures),
complète (15 jours) et permanente (durant toute la vie de l'oiseau) par
divers micro-organismes, commensaux ou pathogènes(Humbert et
al.,1986).
A cause des rythmes intensifs de leur production, les
volailles ne disposent à l'état naturel que d'une immunité
limitée et sont donc d'une résistance fragile à toutes les
étapes de production entraînant une conséquence directe sur
les paramètres zootechniques du poulet (un faible GMQ pour un I.C
élevé) (Gabriel et al., 2005).
De plus l'utilisation abusive des antibiotiques, à
titre curatif ou préventif, dans les différents
écosystèmes conduit à la sélection de souches
bactériennes résistantes par l'élimination de la
population sensible dans chacun de ces écosystèmes ou une
résistance par sélection croisée (Miranda et
al., 2008). L'émergence est observée
quel que soit l'antibiotique et quels que soient le mécanisme
biochimique et le support génétique de résistance
(chromosomique ou plasmidique). Si beaucoup de travaux suscitent un
intérêt quant à l'utilisation des probiotiques surtout en
perspectives d'élimination totale des antibiotiques en tant que
substances additives dans l'alimentation des volailles, la plus grande des
garanties ne peut venir qu'en une application stricte et rigoureuse d'une
hygiène sanitaire à tous les stades de la production du poulet.
Il est nécessaire d'établir un programme de salubrité
basé sur une charte commune impliquant ces différentes
étapes de production du poussin d'un jour dont l'élément
fondamental est bien le couvoir.
Dans cette optique, nous nous sommes fixés comme
objectifs l'étude, le contrôle, le suivi de la qualité
hygiénique et le niveau de désinfection de 3 couvoirs dans la
région de Tlemcen et de Sidi bel Abbés, ainsi que l'analyse de
certains paramètres zootechniques liés à ces 3
établissements d'accouvaison caractérisés par le calcul
des taux d'éclosion et de mortalités embryonnaires et la
détermination du poids moyen des OAC et des poussins à la
naissance.
Après une brève revue bibliographique sur ce
thème, nous décrirons nos résultats.
1.1 IMPLANTATION DU COUVOIR ET GESTION HYGIENIQUE ET
SANITAIRE
1.1.1 IMPLANTATION ET CONCEPTION DE L'ETABLISSEMENT
Le choix d'isolement de l'emplacement d'un
établissement d'accouvaison tend à faciliter l'application
rigoureuse et efficace des différentes mesures de
biosécurité tout en combinant à cette séparation
physique à une séparation fonctionnelle à tous les niveaux
de la chaine de production qu'il soit une production d'OAC au sein des
élevages de reproducteurs ou une production de poussin d'un jour dans le
couvoir (Afssa, 2000). Il est de règle pour une meilleure
prévention hygiénique et sanitaire ainsi qu'une bonne maitrise
des risques potentiels liés à la présence et à la
circulation du personnel, d'animaux, de produits d'animaux et des objets
pouvant entrainer un problème d'ordre sanitaire à
l'établissement d'accouvaison et/ou aux voisinages immédiats ou
lointains, soit d'une manière momentanée ou durable, le plus
souvent nécessitant de gros moyens pour ramener la situation à la
normale ; que le couvoir doit être:
· Isolé de toute habitation ou bâtiment
d'élevage en particulier des volailles et du bétail.
· Clôturé et sécurisé par des
accès permettant une surveillance permanente des entrées et
sorties.
· Doté de systèmes de désinfection des
accès (autoluve-rotoluve-pédiluve).
· Toutes les ouvertures (fenêtres),
protégées pour exclure la circulation d'animaux sauvages ou
domestiques ainsi que les oiseaux sauvages.
· Alimenté en eau de qualité potable.
· Equipé d'une source d'énergie de secours en
prévision d'une panne du réseau électrique publique.
· Muni d'un système d'évacuation des eaux
usées et de traitement des déchets.
· Conçu de façon à faciliter le
principe de la marche en avant entre les différents secteurs.
1.1.2 AGENCEMENT DU COUVOIR
1.1.2.1 Secteur propres et secteur souillé
A l'éclosion, le nombre de germe est le plus
élevé car la zone « éclosion » du couvoir est le
siège de multiplication et de dissémination éventuelle des
germes. De ce fait le couvoir est sectorisé en trois zones (ITAVI, 2003)
:
La zone propre, composée des salles de tri des
oeufs, aires de stockage des oeufs, aires de préchauffage et la partie
incubation.
La zone souillée, qui englobe les parties
éclosions, salles de tri et d'expédition du poussin et les aires
de lavage et de désinfection du matériel.
La zone intermédiaire dite de transfert,
considérée alternativement comme zone propre puis souillée
et jouant un rôle de tampon car après son statut de zone sale
pendant toute la durée du transfert, la salle est nettoyée pour
lui faire réintégrer le statut de zone propre. 1.1.2.2
Déchets du couvoir
Ils sont constitués essentiellement des oeufs non
incubés, des oeufs clairs éliminés après 18 jours
d'incubation sous forme d'oeufs coquilles (entier) ou sous forme de
coulé (fractions liquides de l'oeuf), de coquilles, des oeufs
embryonnés non éclos (éliminés après
éclosion) et des cadavres, le duvet et les poussins non valorisés
« écartés après éclosion ». Après
les avoir isolés et stockés dans un sas au niveau d'une zone
spécifique, on veillera à une extrême restriction d'y
accéder avant de les éliminer.
1.1.2.3 Marche en avant
Ce principe respecte le sens unique « du secteur propre au
secteur souillé » sans possibilité d'entrecroisement (figure
1et 2) et doit tendre à s'appliquer :
Au personnel spécialisé
Avec un changement de tenues vestimentaires entres les zones. Ces
postes sont conçus de façon à limiter le nombre de
changement au cours des opérations.
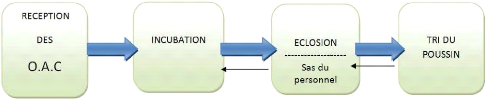
Figure 1 : représentation schématique des
mouvements du personnel (ITAVI, 2003)
A la circulation des oeufs entre les différentes
étapes depuis la production de l'oeuf jusqu'à la production du
poussin et son expédition et l'évacuation des déchets.
Aux matériels : Ce mode de mouvement est
appliqué aussi à la totalité du matériel
utilisé ou
non de manière à éviter tout
entrecroisement entre les objets désinfectés et autres
souillés.
A la circulation de l'air et de l'eau : il est
fondamentalement nécessaire que la conception du couvoir permet le
même principe de la circulation des personnes, du matériel et des
oeufs pour le mouvement de l'air à l'intérieur du couvoir ainsi
que pour l'alimentation en eau des différents compartiments.
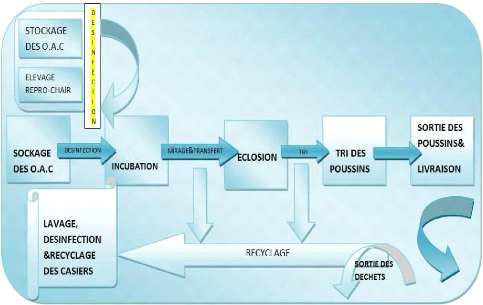
Figure 2 : représentation schématique du
circuit des O.A.C (ITAVI,2003)
1.1.2.4 Ventilation
Lorsqu'ils ne sont pas contrôlés, les germes
circulants dans l'air peuvent constituer une source très importante
d'agents pathogènes. C'est pourquoi, il est capital de procéder
à la vérification de la pression d'air entre les
différents compartiments qui doivent assurer un différentiel afin
de permettre un mouvement d'air des secteurs propres vers les secteurs
souillés quelque soit le mode de ventilation utilisé.
La ventilation statique : ce type de gestion de
ventilation dont la hiérarchie des secteurs est basée sur
l'existence de portes fermées ne permet pas de guider l'air.
La ventilation dynamique : elle est basée sur
l'utilisation d'extracteurs avec systèmes de filtration d'air
d'entrée (souhaitable). Le matériel d'extraction doit être
installé de façon à éviter le recyclage de l'air
vicié et de permettre aisément son nettoyage et son entretien.
La ventilation mixte : Ce mode de ventilation qui
applique une admission d'air statique et une extraction dynamique avec une
dépression hiérarchisée est le système le plus
couramment utilisé.
1.1.2.5 Sols, parois et plafonds
Les sols, les parois et les plafonds doivent être
conçus de matériaux faciles à nettoyer et à
désinfecter de façon à faciliter une
décontamination efficace et durable. Les sols doivent être
carrelés ou enduits en ciment lisse (ciment de quartz) et les murs
lisses avec un raccordement par arrondis (des murs entre eux, entre les murs et
le sol et les murs et le plafond). Aucune eau stagnante n'est
tolérée au niveau des sols d'où la nécessité
d'une adéquate installation et d'un entretien rigoureux des siphons et
canaux d'évacuation des eaux usées.
1.1.2.6 Approvisionnement en eau
L'eau utilisée pour l'hygiène du personnel et le
nettoyage des différents secteurs du couvoir ainsi que du
matériel doit être impérativement d'une qualité
microbiologique irréprochable et conforme aux critères de
potabilité tout le long du circuit. Cette eau doit répondre aux
paramètres microbiologiques précisés par la directive
CEE(1995), (annexe 2).
La périodicité des prises d'échantillons
pour le contrôle bactériologique de l'eau en usage dans le couvoir
doit tenir compte des données épidémiologiques.
L'indicateur des données épidémiologiques prendra en
considération la taille du couvoir, le type et l'état du circuit
et l'espèce à produire pour décider du nombre d'analyse
à faire durant l'année. Il y a un minimum à respecter :
une fois par an lorsque l'approvisionnement se fait en eau potable du
réseau public, ou une fois tous les six mois si l'alimentation est
assurée par une eau de puits ou de forage.
1.2 MICROFLORE DOMINANTE DE L'ENVIRONNEMENT D'UN
COUVOIR
1.2.1GERMESPATHOGES
1.2.1.1 Salmonelles
gallinarum ») et à
l'émergence des cas en santé publique «
Salmonella enterica enteritidis » (Korsan
et al., 2004 ; Chalghoumi et
al., 2008 et Pieskus et al., 2008). Il
s'agit de la première cause de toxi-infection d'origine alimentaire avec
l'apparition de salmonelles multi résistantes aux antibiotiques comme
Salmonella enterica thyphimurium DT104 (Picoux, 2004
; Clavijo et al., 2006 ; Musgrove et
al., 2006 ; Musgrove et al., 2008).
Ceci place les salmonelles en tête du tableau des microorganismes
pathogènes dans la filière avicole d'autant plus que ces
bactéries ont un large pouvoir de diffusion dans l'environnement. Une
évaluation des risques, effectuée par la F.A.O et par l'O.M.S
(2002 et 2007), a fait ressortir qu'il existe une relation linéaire
entre l'incidence des salmonelles transmises par les volailles et la
prévalence de Salmonella observée chez
cette espèce, et que la réduction de moitié de la
prévalence de Salmonella chez la volaille
devrait faire chuter de 50% l'incidence des salmonelloses humaines.
Les salmonelles sont des entérobactéries
appartenant à la famille des Enterobacteriaceae
: ce sont des bacilles droits, gram négatif, qui mesurent
2.0 à 5 micromètres de long pour 0.7 à 1.5
micromètres de large, oxydase négative, anaérobies
facultatives, douées de mobilité grâce aux flagelles sauf
pour Salmonella pullorum gallinarum (immobile),
produisant des acides et des gaz à partir du glucose, n'utilisent pas
les citrates comme source de carbone et se multiplient aux températures
ambiantes (8-45°C) avec un optimum à 35-37°C .
Selon la dernière classification de l'O.I.E (2005), le
genre Salmonella comprend deux espèces
(Salmonella enterica avec 06 sous espèces,
dont enterica est la plus fréquemment
impliquée dans les infections mixtes humaines et animales,
et Salmonella bongori) (annexe 3) et quelque deux
mille cinq cent serovars. Un classement en nette coordination avec le
schéma de KAUFFMAN-WHITE ; diversification basée sur les
modifications des antigènes somatiques « O » (de nature
lipoplysaccharidique), capsulaires « K » « Vi »
(glycolipides) et flagellaires protéiques « H ».
Cette classification récente a aussi conduit à
une nomenclature plus courte : à titre d'exemple Salmonella
thyphimurium au lieu de Salmonella
enterica subsp enterica serovar
thyphimurium.
1.2.1.2 Colibacilles
Les colibacilles considérés comme
bactéries pathogènes secondaires « agents de
surinfection
» (Nakamura et al, 1992) restent la principale
cause d'énormes pertes
économiques en élevage aviaire (Edens
et al., 1997 ; Stordeur et Mainil, 2002 ; Manil,
2003b et 2004). La fréquence des infections
bactériennes à Escherichia coli place
cette pathologie en tête de liste des pathologies dominantes en
élevage avicole, essentiellement celui du poulet de chair
(Zahraei-Salehi et al., 2006) surtout avec
l'émergence de nouveaux sérotypes « non typables »(
Edens et al., 1997 ) à coté des
sérotypes déjà identifiés comme hautement
pathogènes pour l'espèce (O1K1 ,O2K1 , O78K80) ainsi que d'autres
sérotypes représentés de manière significative (O8
, O5 , O18 , O35 , O88 , O1O9 , O115 et O116) (Dho-Moulin et
al., 1990 ; Dho-Moulin, 1993; Dho-Moulin et Fairbrother, 1999 ;
Joerger et Ross, 2005) .
Les souches d'Escherichia coli
pathogènes aviaires (APEC) font partie du groupe
pathogène extra-intestinal (ExPEC), qui est associé aux
infections respiratoires et à la septicémie chez la volaille
(Caza et al., 2008). Ces souches présentent de
plus en plus de problèmes d'antibiorésistance (Miranda
et al., 2008).
Si la transmission se fait , surtout, par voie respiratoire
(106 colibaciles par gramme de
poussière présente dans l'environnement des volailles), y compris
les sérotypes identiques à ceux trouvés dans les
lésions (Gross, 1994), le véhicule des APEC via l'oeuf est aussi
fréquent et se fait essentiellement à la faveur d'une
contamination fécale de la surface de l'oeuf lors de l'oviposition avec
une dissémination rapide à l'ensemble du lot lors de
l'éclosion ( Jordan et Pattison, 1996 ; Dho-Moulin et Fairbrother,
1999). L'expression de la maladie due aux différents sérotypes
d'APEC est variable en fonction de l'âge des poulets.
Mortalités embryonnaires et du jeune
poussin
Signant une infection du sac vitellin et une omphalite. La mort
survient juste avant l'éclosion lorsqu'il s'agit d'une mortalité
embryonnaire et sur les poussins âgés de moins d'une semaine. Si
les animaux échappent à la mort, la réduction du GMQ reste
la seule manifestation (Jordan et Pattison, 1996).
Septicémie et complexe respiratoire chronique
(CRD)
Observés chez des oiseaux âgés de plus de
deux semaines avec des pertes importantes vers 4-9 semaines (Edens
et al., 1997 ; Dho-Moulin et Fairbrother, 1999) C'est
l'expression principale de la pathologie colibacillaire avec un taux de
mortalité pouvant atteindre 30-50 % mais les pertes économiques
les plus significatives sont dues aux saisies d'abattoir et la forte
réduction de la croissance (Yogaratnam, 1995).
Maladie de la tête enflée (SHD)
La cellulite périorbitaire est une infection à
Escherichia coli qui est le plus souvent une
infection secondaire causée par des agents prédisposant
généralement viraux ou suite à des agressions chimiques
« taux d'ammoniac élevé » (White et
al, 1990) et si la morbidité est faible la
mortalité le plus souvent l'ultime évolution (Parriera
et al., 1998).
Maladie génitale
L'ovarite salpingite est d'évolution le plus souvent
chronique, faisant suite à une atteinte du sac aérien abdominal
gauche « propagation par contigüité » (Gross, 1994).
Dermatite nécrotique
C'est une cellulite de la région abdominale ventrale et
sous les cuisses motivant
d'importantes saisies aux abattoirs.
Granulome à Escherichia coli
« HJARRE'S disease » C'est une coligranulomatose de
faible fréquence.
Ces APEC sont des bacilles à extrémité
arrondie, asporulés, gram négatif, mobiles, aérobies
appartenant à la famille des Enterobacteriaceae,
genre Escherichia qui pendant
très longtemps ne renfermait qu'une seule espèce E.
coli à laquelle sont venues s'ajouter d'autres
espèces selon Euzebi (2004): E. blattae
(1973), E. ermanii(1982), E.
vulneris (1982), E. fergusonii (1985).
De plus, et selon les critères modernes de taxonomie bactérienne,
les genres Shigella et
Escherichia sont identiques et les quatre
espèces du genre Shigella devraient être
inclues dans le genre Escherichia.
1.2.1.3 Mycoplasmes
Les maladies aviaires causées par les
mycoplasmes entrainent des mortalités embryonnaires et
engendrent de lourdes pertes économiques dues essentiellement à
des retards de croissance avec un indice de consommation élevé et
à des saisies multiples au niveau des abattoirs, même si les
différents programmes de prophylaxies ont contribué à une
diminution de l'intensité de la maladie notamment les programmes
d'éradication dans les cheptels reproducteurs (Kempf, 2006 ; Gautier et
al., 2008 ).
La dissémination des
mycoplasmes se fait verticalement par l'oeuf suite
à la contamination de l'oviducte « M.
meleagridis et M. iowae » ou par
contigüité de l'oviducte aux sacs aériens contaminés
« M. gallisepticum et M. synoviae
» (Mac Owan et al., 1984 et Kempf,
1997) et horizontalement par voie respiratoire et/ou conjonctivale lors du
contact direct entre les animaux ou indirectement par le biais des
différents supports contaminés.
Après adhésion des
mycoplasmes aux cellules épithéliales
par l'intermédiaire de cellules spécialisées (Lee
et al., 2008) et une période d'incubation en
général de 1-3 semaines, l'expression clinique est très
variable, et est fonction de l'espèce, de la virulence de la souche, de
l'environnement « stress-surinfections » (Kempf, 1997). Les
colibacilles semblent jouer un rôle important dans l'aggravation du taux
de mortalité.
La maladie respiratoire chronique chez le
poulet et la sinusite infectieuse chez la dinde sont
provoquées par M. gallisepticum avec des
lésions inflammatoires catarrhales des voies respiratoires
supérieures, des bronches et des sacs aériens (Kempf, 1997 ;
Gautier et al., 2008) avec une sensibilité
plus marquée chez les jeunes.
La synovite infectieuse « articulations
des ailes et des pates » est l'oeuvre de M. synoviae
avec boiterie (Kempf, 2006) et une diminution des performances
zootechniques de la pondeuse. La morbidité est extrêmement
élevée « 90-100% » mais la mortalité reste
faible bien que les pertes économiques dues aux saisies d'abattoir
restent importantes (Kempf, 2006). Le poulet âgé de 4-12 semaines
et le dindon de 10-20 semaines sont les plus vulnérables.
L'ostéomyélite déformante des
vertèbres cervicales, due à M.
meleagridis chez la dinde sont à l'origine du torticolis
(Kempf ,2006) et les infections des voies respiratoires supérieures
restent le plus souvent d'évolution subclinique et on constate la chute
de l'éclosabilité et un retard de croissance des petits «
turkey syndrom 65 ».
La mortalité embryonnaire tardive
comme seule manifestation clinique (Kleven, 2003) est la
réponse à une infection à M.
iowae. Les mycoplasmes sont des bactéries de petite
taille, génome très réduit, ne possédant pas de
paroi d'où leur résistance aux betas lactamines mais sensibles
à une large gamme d'antibiotique essentiellement les fluoroquinolones.
Les
désinfectants usuels sont très efficaces sur les
différentes espèces de mycoplasmes qui sont très
nombreuses et de pathogènecité variables (Kleven,
2003a) dont les plus importantes de l'espèce aviaire sont
M. gallisepticum, M.
synoviae, M. meleagridis
(spécifique à la dinde) et M. iowae.
Bien que considérés comme fragiles dans le
milieu extérieur ils peuvent survivre pendant plusieurs jours à
température ambiante.
1.2.2 GERMES OPPORTUNISTES
A coté de la gamme des microorganismes hautement
pathogènes et spécifiques ou non à l'espèce aviaire
on dénombre une multitude de bactéries dites opportunistes et
invasives. Ces microorganismes peuvent avoir des conséquences
fâcheuses en élevage et sur la santé publique.
1.2.2.1 Campylobacter
Campylobacter jejuni est une
espèce bactérienne zoonotique (WHO, 2000) qui prend une
importance de plus en plus croissante chez l'homme en matière de T.I.A.C
« gastro-entérites sporadique les plus sévères »
après les salmonelles (Wilson et al., 2008 ;
Colles et al., 2008 et Picoux, 2004). C'est un
hôte naturel du tube digestif des oiseaux, en particulier du poulet, du
bétail et du mouton. 97% des cas de maladies humaines sont
attribuées aux animaux « viandes et volailles » ou la
fréquence de la campylobactériose humaine coïncide avec
l'augmentation de la contamination des carcasses de volaille avec
Campylobacter jejuni, impliquant la chaine
alimentaire surtout avec les nouvelles méthodes de cuisson «
microonde » où le poulet prend une place très significative
(Picoux , 2004 ; Wilson et al., 2008 ) (figure 3).
L'environnement et les animaux sauvages sont impliqués à 3%,
seulement (Wilson et al., 2008).
Campylobacter est une
bactérie définie comme un genre appartenant à la famille
des Campylobacteriaceae englobant 16 espèces
dont l'espèce jejuni est la plus redoutée,
à-côté d'autres espèces dites thermo
tolérantes « C. coli et C.
lari » (Afssa, 2006), bactérie spiralée,
incurvée, Gram-, micro aérobie, mobile grâce
à leurs flagelles (1-2) polaires, mésophile adaptée
à la vie dans le mucus du tube digestif de l'homme et des animaux y
compris les oiseaux et n'utilisant pas le sucre.
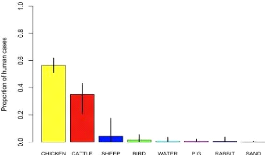
|
Figure 3 : Les proportions estim ées
d
|
e campylobactériose humaine attribuée a
ux a
|
nimaux et
|
|
|
|
|
à l'en viro
|
nnement (WILSON et al, 2008)
|
|
1.2.2.2 Staphylocoques
Ce sont des germes opportuni stes communs
à l'homme et aux animaux p ouv ant causer
d'énormes pertes économiqu es dans l'industrie
des volailles (Zhou e t a l., 2007),
particulièrement dans la filière pou let de
chair entre 6-12 semaines d'âge. Prof itant de la
rupture de l'intégrité tégumen taire pour
envahir différentes parties de l'o rga nisme du poulet,
les Staphylocoques se man ifestent surtout à la faveur
d'une hygiène dé fectueuse sous forme
d'omphalite, de der mit e, d'abcès, d'arthrite septique
et même d e la septicémie (Villate, 2001 et Zhou
et al., 2007).
En dépit d'une antibiothérap ie
efficace, les mortalités liées aux com plic
ations de Staphylococcus aureus peuvent
être considérables (Nawaz et
al., 1999) et at teind re 3-20 % (Zhou, 2007).
En élevage avicole , les arthrites de ces Coccis,
peuvent servir d e mo dèle pour l'étude de
maladies humaines, v ues leur similitude (Alderson
et al., 1986).
Les staphylocoques appartienn ent à la
famille des Micrococcaceae, Gram+
, a naérobies aérobies facultatifs, 0.5-1 um de
dia mètre (Devriese et al.,
2005), fermentent le gl ucose sans produire de gaz,
transforment le nit rate en nitrite, asporulés et on en
dénom bre 3 5 espèces (Afssa, 2006). Le
critère de leu r cla ssification est la production de
coagulas e qu e seuls S. aureus,
S. hyicus et S. intermedius
Produisent.
1.2.2.3 Entérocoques et Strepto coques
L'importance de la présence des entérocoques et
surtout liée à leur pou voir
émergent
comme agents pathogènes nos ocom
iales dans les deux dernières décennie s, do
ués d'une
antibiorésistance d'autant plus que la fréquence
d'infection par ces germes est en croissance continue et se distinguent des
streptocoques par leur capacité de se multiplier à une
température de 10-45°C et à pH égale à 9,6.
Les streptocoques, notamment du groupe D de Lancefield, sont
des germes de sortie qui signent une mauvaise désinfection ou un
nettoyage inefficace du matériel et des bâtiments (Villate, 2001)
ainsi que de la qualité de l'eau utilisée (Villate, 2001).
1.2.2.4 Pseudomonas
Pseudomonas aeruginosa est un
élément normal de la flore digestive et cutanée, germe
tellurique et ubiquiste et suite à de lourdes fautes hygiéniques
il peut être la cause des infections vitellines et de septicémies
(Villate, 2001).
P. aeruginosa, bacille le plus commun
du groupe Pseudomonas, famille des
Pseudomonadaceae, est mobile grâce à son
flagelle simple, Gram- et aérobie stricte.
1.2.3 AUTRES GERMES
D'autres bactéries peuvent aussi jouer un rôle comme
Klebsiella, Citrobacter et
Listeria monocytogenes qui est la bactérie la
plus dangereuse de l'espèce Listeria (Villate,
2001).
1.3 CONSTITUTION DE L'OEUF ET INSTALLATION DE LA FLORE
DIGESTIVE DU POULET
1.3.1 CONSTITUTION DE L'OEUF
1.3.1.1 Définition de l'oeuf à couver
Dans la filière chair, l'oeuf, d'une manière
générale et l'oeuf à couver en particulier, est un oeuf
fécond produit par des reproducteurs sains, ayant une maturité
sexuelle correcte conditionnée par de très bonnes conditions
d'élevage et spécialement une très bonne adaptation du
programme lumineux. L'oeuf produit, dès la vingt sixième semaine
d'âge, d'une caractéristique nuancée par l'espèce
d'oiseau (Wolanski et al., 2007) , par la souche (du
blanc au blanc légèrement teinté et jusqu'au foncé
extra roux), d'un poids variable (50- 65 grammes) en fonction non seulement de
la souche mais aussi de l'âge de la poule (Peebles et
al., 2004 ; Fasenko, 2007 ; Yalcin et
al., 2008).
Les dimensions moyennes sont de huit centimètres de long
et de cinquante cinq millimètres
de diamètre. Il existe une
corrélation positive entre la taille de l'oeuf et une suplementation
alimentaire (Yassin et al., 2008).
Cette taille des oeufs peut avoir une influence sur les performances des
progénitures (Peebles et al., 2001).
1.3.1.2 Composition anatomique de l'OAC
La taille et la composition des oeufs sont liées
à des facteurs génétiques et d'autres non
génétiques (Yassin et al., 2008). La
structure anatomique d'un oeuf (figure 4, 5 et 6) est composée (Renoux,
1971) de l'extérieur vers l'intérieur comme suit :
La coquille
Elle donne la couleur de l'oeuf en fonction des facteurs
génétiques. Sa structure physique semi-perméable lui
procure un rôle de protection contre les chocs et l'évaporation,
laissant passer l'oxygène et le gaz carbonique (respiration de
l'embryon) à travers les pores en nombre de millier (Evearaert
et al., 2007) et empêche la
pénétration des germes. Grâce à la cuticule et avec
la membrane coquillère, elle constitue la première
barrière contre l'agression des micro-organismes (Nakano et
al., 2003). Son épaisseur peut être un facteur
important dans l'éclosabilité (Pedroso et
al., 2005 ; Yassin et al., 2008).
L'intégrité de la cuticule reste un excellent indicateur de la
pratique d'élevage observée sous l'effet des U.V.
La membrane coquillère
Elle est dédoublée en membrane coquillère
externe fortement adhérente à la coquille et en
membrane coquilère interne très
rapprochée de l'externe jusqu'au bord arrondi de l'oeuf laissant place
à la chambre à air sous la membrane externe.
La chambre à air
Elle est quasiment absente au moment de la ponte. Elle
commence à se former lors du refroidissement de l'oeuf et forme une
poche d'air entre les deux membranes coquillères du coté du bord
arrondi de l'oeuf.
L'albumen=blanc d'oeuf
Constitué de deux sortes d'albumen, un albumen externe
et interne de consistance
relativement fluide (40% d'albumen) et un albumen
médian plus visqueux (57% d'albumen)
et qui entourent le vitellus
(figure 5). Son poids total est en fonction de l'âge de la poule, et
est plus élevé avec les bandes plus
âgées (Yalcin et al., 2008) mais sa
qualité se trouve diminuée (Tona et
al., 2004).
L'albumen en entier sert d'amortisseur de choc pour le
vitellus avec les chalazes et lors du développement embryonnaire il est
source d'eau et de protéine. Il assure un vrai rôle
antibactérien par ses caractéristiques bactéricides et
bactériostatiques.
Les chalazes
C'est une paire de cordons d'albumen (3% d'albumen). Il s'agit
de chalaze sénestre (située sur le coté droit de
l'embryon) et de chalaze dextre (sur son coté gauche), enroulés.
Elles fixent solidement le vitellus et son contenu au centre de l'oeuf.
Le vitellus=jaune d'oeuf
Il est entouré d'une membrane vitelline
constituée de disques jaunes (vitellus jaune, de synthèse diurne)
et de disques blancs (vitellus blanc, de synthèse nocturne) formant le
jaune d'oeuf d'un diamètre de trois centimètres. La masse
centrale du vitellus, la plus anciennement formée est formée par
la latebra qui constitue le col et le noyau de pander qui marquent le chemin de
la migration de la cicatricule (le disque germinatif) d'un diamètre de
trois millimètres vers la surface et qui commence à se
développer dès le premier jour à 37,5°C (Pedroso
et al., 2005). Le noyau de pander est
constitué de telle manière que son poids spécifique le
fait tourner vers le haut qu'elle que soit la position de l'oeuf.
Il existe un rapport jaune-blanc d'oeuf qui varie en fonction des
souches et des lignées (Peebles et al, 2001)
ainsi que de la taille de l'oeuf.
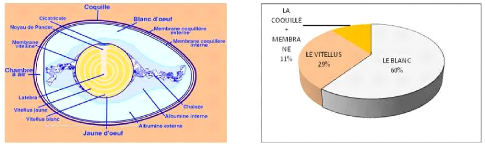
Figure 4 : Constituants anatomiques d'un oeuf Figure 5 :
Proportions des différents
constituants
(D'après RENOUX, 1971)
|
|
1. pore
2. cuticule
3. couche cristallite=coquille calcaire
4. membrane coquillère externe
5. membrane coquillère interne
Epaisseur = 0.32-0.40 mm
|
|
Figure 6: Composition schématique de la coquille (selon
GLOOR et al)
1.3.1.3 Constituants organiques de l'OAC
La coquille : elle renferme la trame
protéique kératinisée, des cristaux d'hydroxy-apatite, du
carbonate de calcium, des pigments de coloration : la porphyrine, des
dérivés des sels biliaires et de l'hémoglobine et d'autres
sels minéraux.
Le blanc : Composé essentiellement de
protéines :
Ovalbumine constitue la protéine majeure du
blanc d'oeuf. Elle est un nutriment essentiel pour l'embryon. Il ne
possède aucune activité inhibitrice de protéase, sauf dans
certaines conditions très particulières.
Ovotransferrine : Protéine
chélatrice de fer ayant une triple action sur les micro-organismes :
· Action antimicrobienne par concurrence au fer
disponible et nécessaire pour le développement microbien, action
démontrée vis-à-vis de Pseudomonas
spp, Staphylococcus aureus,
Escherichia coli (souche entéroxique),
Streptococcus mutans (Valenti et al.,
1983), Salmonella enteritidis
(Baron, 1998).
· Action de potentialiser les effets des antibiotiques
vis-à-vis des bactéries en secrétant la â-lactamase
(Babini et Livermore, 2000).
· Action directe sur le pathogène, en
perméabilisant la membrane externe de certaines bactéries comme
Escherichia coli (Ibrahim et al.,
2000).
Ovomucoide : interagit avec une toxine de type SHIGA
d'où son activité antimicrobienne contre certaines souches
d'Escherichia coli enterotoxiques (Miyake et
al., 2000).
Ovo mucine : glycoprotéine constituée de
deux sous unités (alpha et beta) insoluble en solution diluée et
qui confère au blanc son aspect gélatineux. Elle peut se lier
à Escherichia coli O157 :H7 par l'un de ses
peptides (Kobayashi et al., 2004)
Avidine et flavoproteine : ont une forte
affinité pour la biotine (vitamine B8) et la riboflavine (vitamine B2)
entrainant ainsi une diminution de leur biodisponibilité donc une action
antimicrobienne dont la croissance nécessite la présence de ces
vitamines.
Lysozyme : ses activités antimicrobiennes
peuvent être soit en action seule ou liée contre certaines
bactéries, telle Pseudomonas et
Escherichia coli par activité d'une nuramidase (Decker
et al., 2008).
Phosvitine : c'est l'une des protéines les plus
phosphorylée qui emmagasine le Ca++ et le fer pour l'embryon
et agit par concomitance entre sa propriété de chélateur
d'ions métalliques et son action sur les surfaces de bactéries
sur les souches enterotoxiques d'Escherichia coli
(Sattar Khan et al., 2000).
Le vitellus : dont les formations essentielles
sont :
§ Des lipides : Triglycérides et Phospholipides
§ Du cholestérol
§ Des protéines
§ De l'acide phosphorique
§ Des vitamines et des minervaux (vit A, vit D, choline,
phosphore, ZN)
§ Immunoglobulines maternelles : les IgY équivalent
des IgG chez les mammifères sont
transmis de la poule à l'embryon via le jaune d'oeuf
(Villate, 2001). Après une
immunisation par un antigène, le jaune d'oeuf peut
contenir jusqu'à 135 mg d'IgY (Ruan
et al., 2007) dont 2-10% sont des
anticorps spécifiques (Chalghouni et al.,
2008).
Ces immunoglobulines empêchent l'adhésion des
pathogènes et facilitent ainsi leur élimination comme c'est le
cas pour Helicobacter pylori (Shin et
al., 2002), Escherichia coli (Giraud
et al., 2001) ou des salmonelles
(S. enteritidis et
S. thyphimurium) (Barman et al.,
2005).
D'une manière globale un oeuf de 60 grammes est
composé en grande partie d'eau (75%) et de matière sèche
(25%) comme indiqué dans le tableau 1.
Tableau 1: Principaux constituants d'un oeuf (oeuf de 60
grammes)
2) Matière sèche 25%
Protéines 8,1 gr
Lipides 6.5 gr
Cholestérol 250 mg
|
1.3.1.4 Etapes de formation de l'OAC
Le parcours de l'oeuf, de la cavité coelomique (lieu de
l'ovulation) jusqu'au cloaque (urodaeum) est l'oviducte. Chez la poule, seul
l'oviducte gauche reste fonctionnel, c'est un milieu naturel où une
série d'événements chronologiques et séquentiels se
produisent aboutissant à la formation de l'oeuf entier (Villate,
2001).
Pour assurer le développement autonome de l'embryon
dans un milieu externe, la poule doit participer durant 21 jours (Rehault
et al., 2007), avant même l'ovulation, par la
mobilisation d'un ensemble de nutriments et des systèmes
régulateurs et de protection, nutriments nécessaires à la
croissance embryonnaire qui s'effectue en dehors du corps maternel.
Le cytoplasme actif contient les chromosomes maternels
concentrés en une petite zone du vitellus appelée blastodisque
qui est identifié comme une petite tache blanche de 2-3 mm de
diamètre (Villate, 2001).
Infundibulum : pavillon permettant la réception
de l'ovule (jaune d'oeuf), sa fécondation en présence d'un
spermatozoïde et sa consolidation par la membrane vitelline. Il est, en
moyenne, de 0.9 cm de longueur. La durée de passage est de 18 mn
(Villate, 2001).
Magnum : c'est la plus longue fraction de l'oviducte.
D'une longueur de 33 cm. Elle est caractérisée aussi par des
parois très épaisses. C'est dans le magnum qu'ont lieu les
sécrétions des 40-50% de l'albumen (blanc d'oeuf). La
durée de passage est de 3h (Villate, 2001).
Isthme : lieu de sécrétion de l'albumine et
des membranes coquillères, il mesure 10 cm de long. La durée de
passage est de 1h (Villate, 2001).
Utérus : c'est le lieu où le temps de
séjour de l'oeuf dans l'oviducte est le plus long (20-22
heures)
permettant l'achèvement de la formation du reste de l'albumen (60-50%)
par le
phénomène du `'plumbing» (enrichissement en eau et
en sels minéraux à travers les
membranes coquillères par pression oncotique) et le
dépôt de calcium nécessaire à la formation de la
coquille. C'est la chambre à coquille. Il mesure 11 cm (Villate,
2001).
Vagin : d'une longueur de 12 cm (Villate, 2001), il
permet le séjour de l'oeuf pour la formation de la cuticule et
l'oviposition en vue de son expulsion. La durée de passage est de
quelques mn.
1.3.1.5 Principales anomalies de l'OAC
OEufs souillés : C'est la traduction
d'une hygiène défectueuse de la litière en particulier au
niveau des nids et/ou une collecte peu fréquente. C'est le Principal
problème des OAC.
Absence de coquille et coquille molle :
l'absence totale de la coquille ou une coquille fine ou molle de
l'oeuf peut être observée sporadiquement sans aucune
étiologie mais parfois sa fréquence signe un état de
stress nocturne ou une déficience calcique et/ou vitaminique (vit D)
mais surtout une perturbation du rapport phosphocalcique (Lim et
al., 2003) dans l'alimentation des reproductrices et dans
certaines pathologies graves telles que la bronchite infectieuse et la Laryngo
Trachéite Infectieuse (Villate, 2001).
Coquille rugueuse : Anomalie attribuée
à la génétique mais peut aussi être observée
à la faveur d'un phénomène pathologique comme l'expression
d'une atteinte de l'oviducte lors de la maladie de bronchite infectieuse
(Chousalkar et al., 2006) ou le résultat d'une
surconsommation d'antibiotique ou de calcium surtout en âge avancé
des poules (Gordon et al., 1997).
Coquille craquelée : Défaut de
coquille observé à la faveur d'un surpeuplement ou d'une mal
conception des nids ou parfois lors d'un stress lié à une forte
élévation de température.
Taches de sang : Phénomène
observé sur le blanc ou le jaune d'oeuf, pouvant survenir lors d'un
grand stress à une demi-heure avant l'ovulation ou suite à des
variations d'ambiance marquées par forte fluctuation de
température, un éclairage continu ou suite à une
utilisation prolongée de sulfamides. Les carences en vit K et en vit A
semblent jouer un rôle dans ce type d'anomalie, et l'origine du sang est
le follicule ovarien (Villate, 2001).
Liquéfaction du blanc : Le blanc d'un
oeuf fraichement pondu est de consistance aqueuse et sa consistance visqueuse
est acquise lors de son refroidissement. Une liquéfaction anormale est
synonyme d'un contact important avec l'ammoniac atmosphérique (Benton et
Brake, 2000).
1.3.2 RAPPELS SUR L'INSTALLATION DE LA FLORE DIGESTIVE CHEZ LE
POULET
1.3.2.1 Cinétique de l'implantation des microorganismes
A l'éclosion, les poussins incubés dans des
conditions et un environnement d'hygiène optimale, possèdent un
tube digestif totalement stérile (Yegani et Korver, 2008).
L'implantation et la colonisation des microorganismes dans la muqueuse, qu'ils
soient pathogènes ou commensaux, commencent dès les premiers
instants de la vie de l'oiseau pour s'intensifier avec les prises alimentaires,
et ceci par leur présence dans la lumière intestinale et/ou par
leur adhésion aux sites de fixation qui tapissent la muqueuse des
entérocytes. Ceci a été démontré avec la
paroi du caeca par plusieurs auteurs, notamment par Barrow et
al., 1987 et Rao et Chauhan, 1987.
Il existe une compétition pour ces sites
d'adhésion entre les microorganismes pathogènes et commensaux et
l'implantation précoce au niveau des sites par la microflore
bénéfique, protège l'animal contre des infections
salmonelliques ultérieures (Humbert et al,
1989). Cette occupation, qui commence dès les
premières heures (tableau 2), semble atteindre son optimum vers
l'âge de 15 jours et perdure durant toute la vie de l'oiseau (Humbert
et al., 1989). Lors d'une ingestion orale de
salmonelles, la colonisation intestinale est la première étape de
l'infection, provoquant une excrétion persistante dans les fientes pour
atteindre ensuite le foie, la rate. Le site principal de multiplication reste
le caecum (Hudault et al., 1985).
Au moment de l'éclosion de l'oeuf, l'environnement va
jouer un rôle capital. l'environnement définit l'ordre dans lequel
les oiseaux sont exposés aux microorganismes et de leurs aptitudes
à coloniser l'intestin (besoin en nutriments, lieu de
développement et interactions entre ces microorganismes) (Gabriel
et al., 2003 et 2005 ; Zhou et
al., 2007 ; et Yegani et Korver, 2008) d'autant plus que
l'immaturité du système immunitaire des poussins les
prédispose dès leur naissance.
Tableau 2: Chronologie d'apparition des bactéries
chez le poulet EOPS
(Humbert, 1989)
Age (en jours) Bactéries du tractus
digestif
|
6 Coccis +quelques bacilles
|
8 Les bacilles sont en abondance
|
11 Diversification de la flore et apparition des
spirales
|
15 Feutrage bactérien
|
117 La même densité et morphologie
que j. 15
|
1.3.2.2 Impact anatomo-physiologique du développement
microbien sur le tube digestif du poulet
Bien que le tube digestif (TD) du poussin soit anatomiquement
complet à l'éclosion (Sklan, 2001) la microflore du TD du poulet
lui confère une anatomie particulière par le fait que les
intestins sont plus lourds et plus longs, comparativement aux oiseaux
axéniques dont la paroi est moins épaisse. Cette
propriété est due à la richesse en tissus connectifs
(Karcher et Applegate, 2008) particulièrement la lamina
propria, et aussi à l'augmentation de la taille des tissus
lymphoïdes (plaques de PAYER). C'est ainsi qu'on peut constater, chez un
poulet dont l'installation de la flore digestive est arrivée à
son niveau optimal, que les villosités intestinales sont plus hautes, de
formes irrégulières et que les cryptes sont plus profondes car ce
système gastro-intestinal doit assurer la fonction de nutrition du
poussin après épuisement des réserves de l'oeuf (Yegani et
Korver, 2008).
Uni et al., en 1999 et en 2003
démontrent que ce sont les entérocytes, par leurs
villosités (figure 7), qui vont assurer la fonction d'absorption
digestive et que cette mosaïque d'entérocytes existe à la
naissance, mais un délai de 1-2 jours est nécessaire pour une
utilisation efficace du début de l'alimentation (Sklan, 2003).
La prolifération de cette muqueuse, résultat
d'une hyperplasie cellulaire, est en faveur d'une grande optimisation de la
surface d'absorption, en concomitance avec une augmentation du poids de
l'intestin.
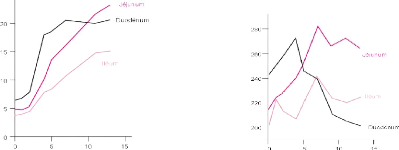
Age (jours) Age (jours)
Figure 7 : Volume des villosités
intestinales et Nombre d'entérocytes par
villosité chez un
poussin (selon Uni et al, 1999)
1.3.2.3 Répartition de la microflore sur le TD du
poulet
Le poulet renferme quelque 29 genres bactériens qui
représentent 200 différents types métaboliques (Gabriel
et al., 2003 et 2005). Cette multitude de
microorganismes peut être répartie en trois grands groupes :
Une flore dominante :
représentée par les anaérobies stricts et
spécifiques de l'espèce aviaire avec une densité de
107germes/g et où on trouve Lactobacillus
et Enterobacter. Une flore
sous dominante : avec une densité de
105-107 germes/g et qui est surtout
dominée par les streptocoques et des
entérobactéries moins spécifiques de l'espèce
avicole. Une flore transitoire : d'une densité
inferieure à 105 germes /g renfermant surtout des
anaérobies stricts.
1.4 HYGIENE DE L'OEUF A COUVER AUPRES DES CENTRES DE
PRODUCTION ET DU COUVOIR
1.4.1 COLLECTE DES OAC 1.4.1.1 Ramassage des
OAC
Pour bien conserver la bonne qualité hygiénique
des OAC, il est impératif de bien veiller à l'application d'un
certain nombre de mesures lors de leur ramassage, mesures qui consistent
à :
§ Multiplier la fréquence de ramassage à
intervalles réguliers (au minimum 2 fois par jour) et utiliser des
récipients propres et désinfectés (Itavi, 2003 ; O.I.E,
2008). Il existe une corrélation entre le taux
d'éclosabilité et la fréquence de ramassage des OAC
(Fasenko et al., 2008 ; Fasenko, 2007 ; et Heier et
Jarp, 2001).
§ Faire subir un premier tri à chaque lot d'OAC
dès les premiers instants du ramassage au niveau des élevages
reproducteurs, en veillant à mettre de côté tous les oeufs
sales, cassés, fêlés et présentant des fuites ou des
irrégularités (bosses) pour les écarter du lot à
couver (Itavi, 2003 et O.I.E, 2008).
1.4.1.2 Stockage et traitement des OAC
Une fois collectés, les OAC doivent être
stockés à une température fraiche (15-20°C en
général, 13-15°C selon O.I.E, 2008) et une humidité
relative de 75-80 % (Fasenko, 2007) dans des salles conçues à cet
usage (Itavi, 2003). En effet, un bon stockage est synonyme d'un taux
d'éclosion optimal. La qualité des poussins éclos est
tributaire du poids des OAC et surtout de la qualité de la coquille
(Christensen et al., 2006) . Plus l'oeuf est
léger et moins le poussin est de bonne qualité et moins
l'éclosion est à son optimum (Fasenko et
al., 2008 ., Fasenko, 2007), d'où la
nécessité de limiter la durée de stockage des OAC à
moins de 7 jours (Christensen et al., 2003 ; Fasenko,
2007) pour limiter la déperdition d'eau par évaporation et ainsi
minimiser l'influence négative sur la qualité des OAC et par
conséquence sur les poussins (Christensen, 2001 ;Tona et
al., 2003).
1.4.1.3 Désinfection des OAC
Une désinfection primaire des OAC doit se
réaliser immédiatement dès leur collecte (Heier et Jarp,
2001) dans les centres de production et conformément au code sanitaire
pour les animaux terrestres relatif aux procédures d'hygiène et
de sécurité sanitaire dans les élevages de volailles
reproductrices et les couvoirs (O.I.E, 2008). Il faut veiller à
soumettre les OAC à une fumigation au formaldéhyde, ou appliquer
une solution de désinfectant pour coquilles d'oeufs par
pulvérisation ou par immersion, ou encore toute autre méthode
d'hygiène jugée utile par l'autorité
vétérinaire.
La fumigation doit se faire dans une chambre spéciale ou
à défaut une pièce ou un local
construit en
matériaux imperméables et pouvant être rendu aussi
étanche à l'air que
possible. La ventilation est
nécessaire pour faire circuler le gaz pendant l'opération et
l'expulser une fois la désinfection achevée. La
maitrise de la capacité totale de la pièce est capitale pour
s'assurer de l'efficacité de la désinfection.
Méthode 1
L'opération doit se réaliser en une vingtaine de
minutes en présence d'une source de chaleur pour maintenir une
température de 24-38°C. On place la solution de désinfectant
dans un ou plusieurs (de préférence) récipients en
matériaux ininflammables (métal, feuilles de métal,
argile, émail, ) en commençant par le KMnO4 puis le formol. Les
fumigations (vapeur de formol) sont utilisées seules ou en association
avec les permanganates de potassium depuis de nombreuses années pour la
fumigation des OAC et des équipements. Les avis ne sont pas unanimes sur
les concentrations. Ainsi, l'O.I.E. (2008) a proposé deux
méthodes pour trois concentrations :
Concentration A : 53 ml de formol (solution
à 37.5%) +35 g de KMnO4/m3 de volume
d'air
Concentration B : 43 ml de formol (solution à
37.5%) +21 g de KMnO4/m3 de volume d'air
Concentration C : 45 ml de formol (solution
à 40%) + 30 g de KMnO4/m3 de volume d'air Méthode 2
Elle consiste à placer une quantité requise (10
g/m3) de poudre ou de pastille de paraformaldéhyde sur une
plaque préchauffée tout en maintenant un taux d'humidité
suffisamment élevée (60-80%).
1.4.2 TRANSPORT DES OAC
L'acheminement des OAC depuis les centres de production vers
les établissements d'accouvaison doit être réalisé
dans des emballages neufs et propres, dans des véhicules propres et
désinfectés (O.I.E, 2008), avant et après le transport
(Itavi, 2003) en veillant au respect de la continuité des conditions de
stockage (température essentiellement) afin d'éviter tout
phénomène de condensation à la surface de la coquille des
oeufs ; phénomène qui est à l'origine du passage des
germes à travers la coquille pour atteindre les constituants de l'oeufs
(Itavi, 2003).
1.4.3 GESTION DES OAC AUX COUVOIRS
1.4.3.1 Traçabilité
Pour une maitrise aussi convenable que possible d'une bonne et
satisfaisante traçabilité,
l'accouveur doit veiller à
l'identification des lots d'OAC et de leur emplacement exacte à tous
les niveaux de l'établissement ainsi qu'à la
bonne gestion épidémiologique de ces différents lots
(Itavi, 2003). L'identification est réalisée par un marquage des
oeufs (Itavi, 2003). Dans le cas de l'Algérie, ce numéro est
composé de six chiffres suivi de la lettre C et du numéro de
bâtiment (bt ) (DSV, 2004) et est constitué comme suit : les 2
premières lettres indiquent le code de la wilaya où se trouve le
troupeau reproducteur, la 3ème et 4ème lettres indiquent le code
de l'aviculture (15), les 2 derniers chiffres représentent le
numéro de série et la lettre C pour la filière chair et Bt
avec un chiffre indique l'identification numérique du bâtiment.
Exemple : premier bâtiment d'un premier
élevage de la wilaya de Sidi Bel Abbès :
221501Cbt1
La date de production n'est pas sans importance pour la maitrise
des dates de mise en incubation. Cependant, il existe deux principaux obstacles
quant à la gestion, à la fois économique et sanitaire du
flux par lot. Pour une meilleure gestion économique de l'investissement,
il faut occuper l'ensemble des machines et rassembler un stock d'OAC suffisant,
mais tout en veillant à la notion de l'âge de l'oeuf, car le
stockage est devenu une pratique nécessaire dans les modes de production
intensifs et rationnels (Chistensen et al., 2003 ;
Tona et al., 2003 ., Christensen, 2007).
1.4.3.2 Maitrise d'acquisition des OAC
L'accouveur doit surveiller en permanence les
différents contrôles expérimentaux (bactériologique
et mycologique) effectués sur les reproducteurs, que ce soit de son
propre élevage ou des OAC provenant d'autres troupeaux fournisseurs,
pour s'assurer continuellement du statut sanitaire de ces élevages et
éventuellement intervenir pour mieux gérer un, voire plusieurs,
lots suspects (Itavi, 2003).
1.4.3.3 Identification des risques sanitaires et
détermination des points sensibles
Selon l'Itavi (2003), cette opération doit être
faite à tous les niveaux de la manipulation des oeufs depuis leur
arrivée à l'établissement d'accouvaison, suivant le
système HACCP (tableau 3).

Tableau 3 : Représentation des différents
risques sanitaires selon Itavi (2003).
Risques sanitaires Points critiques
- Contrôle myco-bactériologique de
la salle, du matériel et des oeufs (1 fois/2mois)
Pour l'eau, 1 (réseau) à 2 fois (puits)/an
- Identification des lots, des lots
importés et des lots suspects par date et troupeau de production
- Contrôle du camion, avant et
après transport
- Traçabilité correcte du produit (N° de
troupeau, date de production et le nombre) - Incubation
isolée des OAC suspects et
d'importation
- Contrôle visuel et/ou myco
-bactériologique des salles et du matériel
- Désinfection des suceuses
- Identification des casiers par lot et date de
production
- Accès réservé, tenue
vestimentaire spécifique au secteur « propre » et respect du
vide sanitaire « fréquence »
- Contrôle visuel et
bactériologique 1-2 fois/2 mois
- Localisation des lots d'OAC/troupeau
- Contrôle expérimental de la salle
et des machines 1 fois/mois
- Désinfection des suceuses
- Respect de manipulation et de l'identification
des lots
- Manipulation des poussins du moins vers le
plus contaminé&interruption entre les lots
- Contrôle mensuel
myco-bactériologique de la salle, machines et lingette
-Tenue vestimentaire spécifique «
secteur souillé »
- Présence de poussin d'âge différent
- Emballage à usage unique
- Contrôle mensuel
myco-bactériologiques de la salle et du matériel, recherche des
germes pathogènes et des germes spécifiques « lot suspect
» (salmonelles&mycoplasme
- Propreté défectueuse au
débarquement des OAC et/ou de la salle de réception
- Perte de la traçabilité des
différents lots
- Non désinfection des OAC
- Non application des mesures d'hygiène
aux OAC d'importation
-Mauvaise identification
- Mélange et contamination des
différents lots (sains, suspects et importés)
- Incubation des OAC ne répondant pas aux
normes d'hygiène et de calibrage
- Manque d'hygiène des salles, du
matériel
- Propreté corporelle et vestimentaire du
personnel
- Non respect du circuit du sens unique
- Hygiène défectueuse de la salle et des
machines .Fréquence insuffisante des vides sanitaire
- Non identification des lots
- Non respect de l'hygiène du
personnel
- Présence des poussins «
communication avec la salle d'éclosion »
- Non respect de la marche en avant
- Mélange des lots et dispersion des
lots
suspects dans les caisses d'éclosion
- Non respect de la chronologie du
transfert
- Perte de l'identification des lots à la
sortie - Hygiène défectueuse de la salle, des
machines et du personnel
- Non maitrise des flux d'air à la sortie
d'éclosion « risque du duvet »
- Insuffisance d'hygiène du local,
matériel et des personnes ainsi que du camion d'expédition du
poussin
- Perte de l'identification des poussins
- Retour d'emballage
Le stockage et la gestion du stock
des
OAC
La programmation des
incubations
La mise en plateaux
et
préchauffage
La mise en incubation
Le transfert
L'éclosion
Le tri, vaccination et expédition
des
poussins
1.5 DEVELOPPEMENT EMBRYONNAIRE DU POULET DE CHAIR
1.5.1 GENERALITES
La croissance embryonnaire commence tôt durant la
constitution de l'oeuf jusqu'à son acheminement dans l'oviducte
aboutissant à la différenciation cellulaire (Fasenko, 2007). La
distinction entre OAC fertiles et OAC infertiles est quasiment impossible sans
les détruire ; ce qui est fort préjudiciable pour l'incubation.
La fertilité d'un troupeau est généralement jugée
acceptable aux alentours de 90% durant une grande partie de la période
de ponte avec une moyenne pour la production de poussin de l'ordre de 83%
(Jordan et Pattison,1996) alors que certaines études des sciences
avicoles ont montré des taux, d'éclosion des oeufs fertiles de
97.3% et de fertilité de 94% (Yalcin et al.,
2008). Dans les conditions optimales le développement embryonnaire
durant l'incubation, est normal et l'éclosion s'effectue en 21 jours
(Fasenko, 2007).
1.5.2 ETAPES DE LA CROISSANCE EMBRYONNAIRE
En réalité le développement embryonnaire
a lieu avant même le début de l'incubation même, avant
l'oviposition, si la fécondation a lieu. Durant les 24-26h de la
formation de l'oeuf, le blastodisque subit une série de changements
morphogénétiques (méiose-mitose) à
l'intérieur de l'oviducte, entrainant une différenciation
cellulaire (Fasenko, 2007). De ce fait le développement embryonnaire
précoce commence dès le passage du vitellus dans l'oviducte en
concomitance avec l'achèvement de la formation de l'oeuf. La
fécondation a lieu dès l'ovulation et la réception de
l'ovocyte par l'infundibulum, puis juste après vient la deuxième
division méiotique lors du passage de l'ovule au niveau du magnum. Alors
que les secrétions coquillères ont déjà
commencé, la première division mitotique a lieu 3-5h après
la fécondation (Olsen, 1942). La division du blastodisque unicellulaire
implique de nombreuses divisions mitotiques produisant un embryon avec des
milliers de cellules génétiquement identiques (Fasenko, 2007).
Après le développement du premier sillon (environ 11h), l'embryon
est dit blastoderme : c'est un disque circulaire de 5-6 cellules
épaisses au centre, entourées de 1-2 cellule(s)
périphérique(s) (Bellairs, 1971). Quand l'ovule arrive au niveau
de l'utérus, le premier événement
morphogénétique de l'embryon survient, impliquant la perte
cellulaire de la région centrale du blastoderme (Eyal-Giladi et Kochav ,
1976). De ce fait, et à partir de ce stade et jusqu'à
l'oviposition (la ponte), la région centrale du blastoderme est
constituée de 1-2 couches cellulaires épaisses entourées
de plusieurs couches périphériques.
La région translucide centrale du blastoderme est dite
zone pellucide. Quand les anneaux cellulaires périphériques
viennent en contact avec le vitellus, ils sont dits zone opaque. Le
résultat de ce développement embryonnaire précoce est que
juste avant l'oviposition, il existe approximativement entre 40.000 et 60.000
cellules pour le cas du poulet de chair (Eyad-Giladi et Kochav, 1976 ; Fasenko,
2007), avec une certaine influence de la densité d'élevage et de
l'âge de la reproductrice. Cette maturité de développement
embryonnaire précoce à la ponte reste plus élevée
que chez d'autres espèces comme la dinde (Gupta et Bakst, 1993).
Les différents processus embryologiques aboutissant
à la formation d'un futur poussin à partir d'une cellule
fécondée sont complexes et peuvent être classés en
trois étapes (Le Douarin, 2004) :
Etape 1 : de différenciation,
elle correspond à la formation et à la mise en place des
différents tissus et organes à partir d'une cellule mère
(ovule x spermatozoïde).
Etape 2 : de croissance, elle est
caractérisée par un important développement de tous les
organes et s'achève vers le 16ème jour.
§ Au 4eme jour de l'incubation, il y a formation des
vaisseaux sanguins et du coeur.
§ Au 7eme jour, tous les organes vitaux sont en place. C'est
l'âge où il est très utile de mirer les oeufs pour
éviter les non fécondés (oeufs clairs).
§ Au 11ème jour, le corps, la tête, le cou,
le bec et les membres du futur poussin sont bien distincts bien que la taille
des yeux est toujours disproportionnée.
§ Au 14ème jour, s'achève la formation des
plumes. C'est l'âge du 2eme mirage pour contrôler le bon
développement de la chambre à air, qui est vitale pour la survie
du poussin (adapter le taux d'humidité).
Etape 3 : de maturation des
systèmes physiologiques qui a lieu la dernière semaine de
l'incubation (17-20 jours) et se poursuit la première semaine
post-éclosion (Christensen et al., 2001).
Cette maturation s'achemine vers la préparation du poussin à la
sortie de l'oeuf. La chambre à air est totalement absente car sans cet
espace supplémentaire, le poussin n'a aucune chance de bouger, de piquer
la coquille et de clore. Au 21ème jour et à la faveur de quelques
heures d'efforts, le poussin s'extrait de la coquille, épuisé et
humide.
1.5.3 PERIODES CRITIQUES ET PARAMETRES DETERMINANT
L'EMRYOGENESE
Pour réussir un bon développement embryonnaire
et une éclosion vers le 21ème Jour (Fasenko, 2007)
dans des conditions les plus proches de la normale, il faut respecter un
certain nombre de paramètres comme la température,
l'humidité, le retournement, les échanges gazeux et autres
facteurs (Leksrisompong et al., 2007 et 2009).
1.5.3.1 Température
Les embryons de poulet sont des poïkilothermes dont la
croissance et le maintien des fonctions métaboliques dépendent de
sources externes de chaleur (poule-incubateur) de l'ordre de 37.5-38°C
(Joseph et al., 2006). Ce paramètre est aussi
déterminant pour un meilleur développement de l'embryon et une
éclosion optimale que pour une croissance correcte du poussin
après éclosion avec une moyenne de 37.8°C (Leksrisompong
et al., 2007 et 2009), (température de la
coquille d'oeuf qui reste le seul moyen efficace de mesure de la
température de l'oeuf (Lourens, 2005 et 2006), avec une fluctuation
observée en fonction de la position de l'oeuf dans les machines du stade
de développement embryonnaire, plus basse (36,7°C) le premier tiers
de l'incubation et plus élevée (38,9°C) à la
troisième semaine (Joseph et al., 2006).
L'effet positif de la température optimale de
37,8°C est exprimé par la taille (longueur) de l'embryon, son poids
et celui du jaune d'oeuf libre (Collin et al., 2005).
D'une manière globale et durant l'incubation, on distingue deux phases :
une première (0-7 jours), dite endothermique où les embryons ont
besoin de chaleur qu'ils absorbent, et une deuxième (8- 17 jours)
qualifiée d'exothermique où la croissance embryonnaire
dégage de la chaleur (French, 1997).
1.5.3.2 Humidité et âge de poulette
L'humidité relative doit être adaptée aux
conditions de développement embryonnaire et au dégagement de la
chaleur et les meilleurs scores sont réalisés avec un taux d' HR
de 53% (soit 84 % pour un hygromètre à bulbe humide)
(Leksrisompong et al., 2007) entre 0-16 jours
(Bruzual et al., 2000), pour être
ramenée selon l'âge de la poule à 88%-92% entre 19-21 jours
(Kirk et al., 1980).
L'âge de la bande joue un rôle très
significatif dans le développement embryonnaire et le
taux
d'éclosabilité où de meilleurs chiffres sont
enregistrés avec des poules reproductrices
âgées de 30 semaines par rapport à celles
âgées de 26 semaines (Bruzual et al.,
2000 ; Peebles, 2004). En effet, le taux de mortalité embryonnaire est
plus élevé chez les jeunes bandes , de même que sur la
qualité du poussin éclos où il existe une
corrélation linéaire entre l'âge de la poule et le poids
à l'éclosion entre 29-47 semaines (Suarez et
al., 1997).
1.5.3.3 Retournement
Les mouvements de retournement à angle de 45°, des
oeufs durant l'incubation est un facteur essentiel pour le développement
des membranes extra-embryonnaires (Deeming, 1989 et Wilson et al.,
2003) et pour une orientation adéquate de l'embryon dans
l'oeuf avant éclosion, du fait que 1-4% des embryons âgés
de 18 jours sont mal positionnés (Wilson et
al., 2003). Le retournement n'a en aucune
manière une influence sur le degré de contamination des oeufs
(Elibol et Brake, 2006 et 2008). La fréquence de retournement optimal
est de 96/jour (Elibol et Brake, 2003). De bons résultats sont obtenus
avec une fréquence de retournement de 1/30 mn (Leksrisompong
et al., 2007).
1.5.3.4 Ventilation et niveau de CO2
Bien qu'il ne se manifeste que très tard en fin
d'élevage des souches sélectionnées chair, un des
problèmes où le couvoir est impliqué est l'ascite. En
effet, l'ascite est source d'énormes pertes en industrie de la volaille
(Hassanzadeh et al., 2004) et où le niveau de
CO2 dans les machines, issu du métabolisme de l'embryon, joue un
rôle sur les performances des embryons et des poussins après
l'éclosion (Tona et al., 2005). Une
élévation graduelle de 0.70% de la concentration de CO2 les 10
premiers jours, par une réduction de la ventilation, entraine un
développement embryonnaire plus rapide et donc une éclosion
précoce (De Smit et al., 2008). Il a
été remarqué que les sujets éclos plus tard sont
plus sensibles à l'ascite (Tona et al., 2005)
que ceux éclos plutôt. Ces derniers présentent une certaine
résistance à la pathologie.
La concentration de CO2 dans l'incubateur, indicatrice d'un
métabolisme embryonnaire actif (Tona, 2004), commence à augmenter
des le 3ème jour pour atteindre une phase de plateau vers J4-J5, puis
continue jusqu'à J10 (Tona et al., 2007 ; De
Smit et al., 2008). Les plus hauts niveaux de
corticostérone et des taux plasmatiques des hormones thyroïdiennes
T3-T4 sont enregistrés chez les sujet à éclosion
précoce qu'avec les tardifs à thyroïde embryonnaire
déprimée (Christensen et
al., 2002). Mais un taux trop élevé de CO2
supérieur à 4% (Everaert et al., 2007)
et de chaleur entre J14-J17 entraine des effets négatifs sur le poids du
poussin par diminution du poids des organes (gésier, proventricule,
intestin grêle et surtout le coeur) (Leksrisompong et
al., 2007 ; Wineland et al., 2006). Un
taux d'oxygène insuffisant durant un métabolisme embryonnaire
accru est à l'origine du même syndrome (Decuypere et
al., 2000).
1.5.3.5 Microbisme de la coquille
La présence des microorganismes sur les coquilles
d'oeufs est presque de règle, 96% des oeufs pondus en possèdent
sur leur surface (Cook et al., 2003). C'est aussi un
facteur impliqué dans la diminution de la viabilité des oeufs par
passage tans-coquillère à la faveur des conditions d'ambiance,
température et humidité (Bruce et Drysdale, 1994 ; Stoleson et
Beissinger, 1999). La contamination de l'oeuf par des microorganismes (y
compris les saprophytes) à partir de la coquille durant l'incubation a
un effet bien démontré sur l'augmentation du taux de
mortalité embryonnaire (Bruce et Drysdale, 1994).
Certaines bactéries digèrent la cuticule
protègeant l'extérieur de l'oeuf et augmentent ainsi le risque de
pénétration des microorganismes (Board et
al., 1979). En milieu d'humidité favorable, les germes
peuvent atteindre la membrane coquillère à J1, pour atteindre le
jaune d'oeuf après 5 jours dans 60% d'HR et en 7 jours dans 70% d'HR
(Cook et al., 2003).
1.6 DESINFECTION DU COUVOIR
1.6.1 GENERALITES
La qualité sanitaire du couvoir et de son environnement
est déterminante pour la chaine de production du poulet de grille
(centre névralgique) et toutes les mesures de désinfection visent
à réduire la charge de la totalité des germes
pathogènes très tôt dans le couvoir du fait de la grande
difficulté à réaliser cela plus tard au niveau des
élevages. Ceci reste toujours un des problèmes majeurs dans
l'industrie aviaire (Coufal et al., 2003).
Les mesures de décontamination et de
désinfection ciblent non seulement les OAC mais aussi la totalité
des salles, des machines, et matériels (OIE, 2003 et 2008 ; Fasenko
et al., 2009).
Pour être efficace, cette désinfection doit
intéresser des microorganismes pathogènes cibles comme
Salmonella enteritidis (Gradel et
al., 2004) car le couvoir est le point de départ de
contamination des poussins sains à partir des poussins contaminés
par une multitude de germes pathogènes, tels S.
enteritidis, E. coli et
Listeria monocytogenes (Venkitanarayanan
et al., 1999).
1.6.2 PROTOCOLE DE DESINFECTION
Les salles : toutes les salles doivent être
lavées et désinfectées au rythme d'une fois par semaine
à l'exception de la salle d'éclosion qui doit subir une
désinfection totale à chaque sortie des poussins (ITAVI, 2003 ;
OIE ,2008).
L'éclosoir : c'est la machine la plus
exposée à la contamination et à la dissémination
des microorganismes. La remise en service après éclosion est
subordonnée à une rigoureuse désinfection et un
séchage de la machine et des chariots. (ITAVI, 2003 ; OIE ,2008).
Les incubateurs : pour des raisons économiques,
un programme de prophylaxie est effectué pour réaliser des vides
sanitaires périodiques et une révision du système de
fonctionnement des machines avec un système de roulement en fonction des
disponibilités de ces derniers. (ITAVI, 2003 ; OIE ,2008).
Le procédé le plus pratique et le moins couteux
est l'utilisation de la combinaison de formol et de permanganate de potassium
(OIE, 2008) selon les mêmes dosages utilisés pour la
désinfection des OAC.
Après avoir fermé toutes les ouvertures, on
dépose la quantité de permanganate de potassium dans un
récipient ininflammable et on ajoute la concentration de formol
nécessaire. On ferme les portes et on actionne les ventilateurs pendant
au moins 3 heures (l'idéal est toute la nuit), puis on ouvre les
aérations bouchées tout en maintenant la ventilation pour
expédier les gaz.
Une température de 24-38°C et une HR de 60-80%
assurent une efficacité certaine du produit ; efficacité qui peut
être vérifiée par un examen visuel et des
prélèvements de surface pour un contrôle
bactériologique. Le rythme des prélèvements est fonction
de la situation épidémiologique et des capacités du
couvoir.
Pour éviter les accidents, un écriteau doit
être en permanence sur tous les accès mentionnant la
dangerosité des produits.
1.6.3 ETAPES SUCCESSIVES DE LA DESINFECTION DU COUVOIR
Selon ITAVI (2003) et OIE (2008), ces étapes doivent comporter:
1.6.3.1 Rangement du matériel
Opération très aisée mais capitale pour
le reste des étapes, car tout objet non rangé peut être
source de contamination à partir de poussière et de duvet
accumulés. C'est pourquoi et pour la bonne gestion de
l'établissement, il est indispensable de prévoir une aire fixe et
habituelle pour l'ensemble des ustensiles utilisés au couvoir y compris
le rangement des cartons des poussins.
1.6.3.2 Décontamination
Une grande partie des déchets et des souillures des
surfaces doivent être enlevées à chaque fois avant de
procéder à la désinfection chimique, de
préférence sans utilisation de balai, sinon faire un balayage sur
sol humide pour éviter la dissémination des germes par
éparpillement des poussières et du duvet.
1.6.3.3 Nettoyage chimique
Cette opération n'a pas pour but d'éliminer les
microorganismes mais de préparer les différentes surfaces
à l'action des solutions qui vont être utilisées pour la
désinfection finale. L'usage d'eau de qualité microbiologique
irréprochable et de détergents éliminera le reste des
débris organiques et minéraux sur les murs, les sols des salles
que sur toutes les surfaces des caisses et plateaux qui apparaissent nettes,
propres et rénovées suite à un rinçage sous une
moyenne ou haute pression.
Des techniques plus récentes utilisant l'eau oxydante
hydrolysée ont montré une nette efficacité contre les
germes pathogènes comme S. typhimurium
-Staphylococcus aureus - Listeria
monocytogenes et E. coli (Russell,
2003).
1.6.3.4 Désinfection finale
Elle fait appel à plusieurs gammes de produits : les
ammoniums quaternaires, les phénols et dérivés
phénoliques, les halogènes, les peroxydes et les aldéhydes
formiques (tableau 4).
TABLEAU 4: Propriétés, utilisations et
toxicité des désinfectants au couvoir (OIE, 2008)
|
Propriétés
|
Chlore
|
Iode
|
Phénols
|
Ammonium
quaternaire
|
Formol
|
|
Bactéricide
|
+
|
+
|
+
|
+
|
+
|
|
Bactériostatique
|
_
|
_
|
+
|
+
|
+
|
|
Fongicide
|
_
|
+
|
+
|
+/_
|
+
|
|
Virucide
|
+/_
|
+
|
+
|
+/_
|
+
|
|
Action sur les matières
organiques
|
++++
|
++
|
+
|
+++
|
+
|
|
Utilisations
|
|
|
|
|
|
|
Equipements du couvoir
|
+
|
+
|
+
|
+
|
+/_
|
|
OEufs
|
+
|
_
|
_
|
+
|
+
|
|
Salles
|
+/_
|
+
|
+/_
|
+
|
+
|
|
Planchers
|
_
|
_
|
+
|
+
|
+
|
|
Pédiluves
|
_
|
_
|
+
|
+
|
_
|
|
Désinfection de l'eau
|
+
|
+
|
_
|
+
|
_
|
|
Personnel
|
+
|
+
|
_
|
+
|
_
|
|
Toxicité
|
+
|
_
|
+
|
_
|
+
|
Cette ultime étape à pour objet de
réduire au maximum toute la flore microbienne et ainsi la diminution de
la charge microbienne de la coquille des OAC lors des différents
traitements. La charge microbienne est à l'origine de mortalité
embryonnaire et d'éclosabilité réduite, à la faveur
d'un passage trans-coquillère des germes (Fasenko et
al., 2009) avec et surtout une croissance insuffisante lors de
l'élevage par contamination des poussins lors de l'éclosion en
contacte avec du matériel contaminé.
1.6.4 CRITERES DE L'EFFICACITE DE LA DESINFECTION
Pour pouvoir optimiser l'état d'hygiène et de
désinfection, il faut respecter un ensemble de règles (ITAVI,
2003 ; OIE, 2008)
§ La désinfection doit être
exécutée aussi rapidement que possible § La
décontamination doit être la plus profonde possible
§ Respecter les concentrations de(s) désinfectants(s)
utilisé(s)
Le temps de contact doit être suffisamment long pour
ramener la charge microbienne à son plus bas niveau.
L'utilisation d'eau chaude est d'un intérêt certain
tout en respectant les modes d'utilisation préconisés par les
fabricants des produits désinfectants.

MATERIELS ET METHODES
2.1 Matériel
2.1.1 CONDITIONS DE L'ETUDE
Pour des fins d'analyse, les prélèvements ont
commencé, avec la première série le 13 janvier 2009, avec
le couvoir A pour se terminer avec le dernier de la seconde série au
niveau du couvoir C le 07 Juin 2009.
2.1.2 MATERIEL BIOLOGIQUE
2.1.2.1 OEufs à couver
Le couvoir A : l'alimentation en OAC
se fait à partir de son propre élevage de reproductrices. Cet
élevage est agrée par les services vétérinaires
officiels de la wilaya de Tlemcen. Il s'agit de la souche ISA 15,
âgée de 37 semaines en date du 13/01/2009 et de 47 semaines
à la date de la seconde série entamée le 17/3/2009. Les
OAC sont arrivés tous les matins (à 9h) à partir des
bâtiments d'élevage dans des alvéoles pour être
triés à la salle de réception puis placés dans les
plateaux et dirigés vers la salle de préchauffage (figure 8). La
« mise en machine des oeufs » se fait le soir pour démarrer
l'incubation le jour suivant sans aucune désinfection
préalable.
Figure 8 : OAC du couvoir B (à gauche) et du couvoir
A (à droite)
Le couvoir B : Les OAC proviennent
d'un élevage de reproducteur agrée par les services
vétérinaires officiels de la wilaya d'origine. La souche ISA 15
est âgée de 27 semaines à la date de la première
série des prélèvements le 02/02/2009 et de 41 semaines
lors de la seconde série effectuée le 7/5/2009. Les OAC arrivent
tous le mardi après midi vers 15h de la wilaya de Mascara, lieu des
bâtiments de production des oeufs appartenant à la même
entreprise pour être triés et préparés à
l'incubation qui s'effectuent en général tous les mercredi matin
sans désinfection des OAC.
Le couvoir C : ses oeufs sont produits
par des reproducteurs dont l'accouveur est le propriétaire. Il s'agit
toujours de la souche ISA 15, âgée de 37 semaines en date du
17/03/2009 et de 45 semaines au début de la deuxième
série, le 12/O5/2009. Les OAC proviennent du bâtiment de
production tous les jours à 16h pour être stockés dans la
salle de réception jusqu'au jour de l'incubation qui s'effectue en
général les samedi matin.
Seuls les OAC du couvoir B sont identifiés (comme le
prévoit les recommandations de l'Itavi, l'O.I.E et la législation
vétérinaire algérienne ce qui facilite la
traçabilité et la gestion des lots au niveau du couvoir (Figure
8).
2.1.2.2 Poussins
Après la mise en boite de commercialisation, tous les
poussins éclos sont comptés pour établir un taux
d'éclosion et un échantillon de 30 sujets est
prélevé pour des analyses bactériologiques après
les avoir pesés pour établir un poids moyen (figure 9 et 10). Les
oeufs non éclos sont comptés. Nous avons procédé
à une séparation des oeufs clairs pour calculer le taux des
mortalités embryonnaires.

Figure 9 : Poussin d'un jour à l'éclosion
couvoir B Figure 10 : Balance du LVRT
2.1.3 MATERIEL NON BIOLOGIQUE
L'utilisation de chiffonnettes et d'écouvillons pour
les prélèvements de surface des différents secteurs du
couvoir et des écouvillons pour les prélèvements de
surface des coquilles d'oeuf. Une solution isotonique de Na Cl-Peptone à
0,1%0 à été utilisée pour imbiber les
écouvillons et permettre une récupération maximale de
bactéries (Humbert et al., 1998) (figure 11) .
Les OAC et les oeufs embryonnés sont prélevés dans des
sacs alimentaires stériles de prélèvement (figure 12).

Figure 11 : Chiffonnettes et écouvillons Figure 12:
Prélèvement d'OAC
2.1.4 COUVOIRS ETUDIES
L'étude a concerné trois couvoirs chair, dont
deux dans la wilaya de Tlemcen et dont le statut est privé, et un
troisième dans la wilaya de Sidi bel Abbés dont la gestion est
étatique (figure 13 et 14). A titre indicatif, dans la wilaya de
Tlemcen, sept couvoirs étaient fonctionnels à la date de
l'étude sur un total de quinze agréés par les services
vétérinaires officiels de la DSA de la wilaya de Tlemcen, alors
qu'au niveau de la wilaya de Sidi bel Abbés, seuls deux couvoirs sur un
total de cinq établissements d'accouvaison agréés par
l'inspection vétérinaire de la DSA de Sidi bel Abbés
fonctionnaient au début des prélèvements.
La fiche technique des 03 couvoirs est rapportée dans le
tableau 05

Figure 13 : machines d'incubation du couvoir B (1) et
couvoir A (2)

Figure 14 : opération de transfert (couvoir A)
|
Tableau
|
5 : fiche technique des couvoirs étudiés
|
|
|
|
Couvoir A
|
Couvoir B
|
Couvoir C
|
|
Capacité instantanée
|
54000
|
201600
|
64000
|
|
Nombre d'incubateur
|
2
|
12
|
1
|
|
Incubateurs fonctionnels
|
2
|
6
|
1
|
|
Nombre d'éclosoirs
|
1
|
2
|
2
|
|
Rythme de mise en
incubation
|
2/semaine
Dimanche et mardi
|
1/semaine
dimanche
|
1/semaine
samedi
|
|
Pratique du mirage
|
Non
|
non
|
non
|
|
Maitrise des paramètres de
température
et d'humidité
relative
|
Oui
Automatique
« 37,8-37,5°C et 84-85%
à 90-92% HR
»
|
Oui
Automatique
« 37,8-37,5°C et 84-85%
à 90-92% HR
»
|
Oui
Automatique
« 37,8-37,5°C et 84-85%
à 90-92% HR
»
|
|
Séparation des deux
secteurs
(souille-propre)
|
Non
|
Non
|
Non
|
|
Désinfection des oeufs
|
Non
|
Non
|
Non
|
|
Hygiène vestimentaire
|
Non
|
Non
|
Non
|
|
Produits utilisés pour la
désinfection
des salles et
machines
|
Ammonium
quaternaire « Chlorur
es d'alkyl
diméthyle
benzyle ammonium »
(QUATERSALR)
|
combinaison
d'ammonium
quaternaires (45g/l) et
de 2
aldéhyde
glutarique et formique
(150g/l)
(DESOGERME
AGRICHOCR)
|
produit à base d'iode
(BIOCIDR)
|
2.2 Méthodes
2.2.1 PROTOCOLES DE DESINFECTION et METHODES DE
PRELEVEMENTS
Pour chaque grande série et pour chaque couvoir objet de
notre étude, nous avons opté pour 04 sous séries de
prélèvement:
2.2.1.1 Série A
Tous les prélèvements sont
réalisés la première fois au hasard, sans aucune mesure
particulière. Nous avons insisté auprès des accouveurs
pour qu'ils agissent de façon routinière, comme si nous faisions
partie du personnel avec le même protocole utilisé
habituellement.
A/Protocole de désinfection
Couvoir A
La désinfection est réalisée après un
léger nettoyage à sec (balayage à sec : erreur) à
l'aide d'un ammonium quaternaire (produit cité dans le tableau 5)
à la dose de 1 ml/litre d'eau (une eau issue de la bâche à
eau utilisée pour le circuit des machines).
Le procédé utilisé est une aspersion sur
toutes les surfaces des salles, des machines et du matériel à
l'aide d'un pulvérisateur manuel.
Le rinçage est effectué avec la même eau par
un tuyau de 15-20 mn de diamètre.
Aucun rangement du matériel n'est effectué au
préalable. Les tenues vestimentaires et la marche en avant ne sont pas
respectées.
Couvoir B
Apres un nettoyage superficiel, la désinfection est
effectuée par nébulisation (utilisation
d'un pulvérisateur manuel) d'un produit cité dans
le tableau 5 et qui est la combinaison d'un ammonium quaternaire et d'un
aldéhyde glutarique et formique à la dose de 1.5 ml/m3
sur l'ensemble des surfaces.
Après une durée de contact de 1-2 heures (le
fabriquant préconise 3 heures), l'ensemble est rincé avec une eau
provenant d'un abattoir avicole de voisinage et appartenant à la
même entreprise (risque de contamination).
Le rangement du matériel est certes effectué mais
d'une manière non ordonnée et l'utilisation des tenues
vestimentaires distinguant les deux secteurs (propre et souillé) ainsi
que la marche en avant ne sont pas des habitudes du personnel.
Couvoir C
Au préalable un rangement insuffisant du matériel
ayant servi à l'incubation et à l'éclosion.
L'entrecroisement du matériel et du personnel entre les deux secteurs
(secteur propresecteur souillé) est très habituel faisant fi
à un des principes fondamentaux de la gestion du couvoir, qui est la
marche en avant.
Le nettoyage se fait à l'aide d'une eau de source au sceau
et au tuyau.
La désinfection est pratiquée, à l'issue du
nettoyage à l'eau, au moyen d'un pulvérisateur manuel en
utilisant un produit iodé indiqué dans le tableau 5 à la
dose 1.5 l/litre d'eau.
Le rinçage est la dernière étape du
protocole.
B/Prélèvements effectués
· Les premiers prélèvements ont
été effectués avant la mise en place des OAC dans les
machines (J0) et intéressent le degré de
l'efficacité de la désinfection opérée
habituellement par l'accouveur. Un échantillon d'OAC (n=60) est pris au
hasard à la réception pour analyser leur contenu.
· A J8 de l'incubation, un second
prélèvement concernant la surface des coquilles et le contenu des
oeufs embryonnés fut effectué pour lire l'évolution de la
contamination.
· Un troisième prélèvement (la
surface des coquilles + contenu des oeufs) est effectué à la date
du transfert à J19 après manipulation des oeufs
par le personnel afin de lire l'évolution de la contamination.
· Un dernier prélèvement est
réalisé à la sortie du poussin à l'éclosion
effectué à partir du duvet des poussins éclos à
J21 avec un échantillon de poussins (n=30) pour
analyser certain organes (TD -foie- coeur-poumons).
Nous avons ainsi pu suivre le développement embryonnaire
jusqu'à l'éclosion (figure 21).
2.2.1.2 Série B
Après l'obtention des résultats de la
première série, on a sollicité les différents
accouveurs à renforcer les mesures de désinfection et
d'hygiène avec des recommandations précises.
A/Protocole de désinfection
recommandéS'agissant d'une étude
d'évaluation de la désinfection pratiquée par les couvoirs
et non pas
une étude comparative entre les produits
désinfectants utilisés, nous avons préconisé :
- Aux 3 couvoirs (A, B et C) d'utiliser les mêmes types de
désinfectant en respectant scrupuleusement les dosages
préconisés par les fabriquant.
- Pour le couvoir C (présence de salmonelles), de
réaliser une seconde désinfection selon le protocole de
désinfection des oeufs et du matériel préconisé par
OIE dans le code sanitaire pour les animaux terrestres (2008) à l'aide
d'une association de 53 ml de formol (solution à 37.5%) et de 35 g de
KMnO4 /m3.
- En se basant sur les directives de la direction des services
vétérinaires (Note 747/14 du 8 novembre 2004, nous avons
insisté auprès des accouveurs pour effectuer le protocole suivant
:
- Enlèvement de la totalité des déchets
aussi rapidement que possible et après chaque opération dans le
couvoir.
- Rangement de la totalité du matériel avant son
nettoyage et sa désinfection. - Balayage humide pour éviter la
dispersion du duvet.
- Lavage à l'eau avec utilisation de détergeant
pour améliorer la qualité du lavage
et préparer convenablement les surfaces à une
désinfection efficace.
- Désinfection des bâches à eau à
l'aide de l'eau de javel commerciale.
- Réaliser une désinfection par
pulvérisation des mêmes produits sur des
surfaces
propres et selon les dosages recommandés pour les
différents produits :
1. couvoir A : 15 ml/litre d'eau
2. couvoir B : 1.5 ml/m3 pendant 3 heures de
contacte
3. couvoir C : 1.7 ml/litre d'eau
- Réaliser une seconde désinfection pour le couvoir
C (formol +KMnO4) - Rincer et laisser sécher.
NB : Malgré notre insistance, nous n'avons
enregistré aucun changement des habitudes du personnel pour la marche en
avant et le respect des secteurs ainsi que pour les tenues vestimentaires.
NB/Les paramètres de température et
d'hygrométrie sont restés inchangés le long de
l'étude.
B/Prélèvements effectués
Les mêmes prélèvements sont
réalisés comme dans la série A à J0 -J 8 - J19 et
J21.
C/Techniques de prélèvement
· Méthode non destructive
Le nombre 60 de prélèvements par
échantillon a été choisi pour constituer un
échantillon statistiquement représentatif et nécessaire
pour détecter avec une probabilité de 95% un
prélèvement positif si l'infection est présente dans la
population à un taux de 5% ceci conformément aux recommandations
de l'O.I.E (2008) et conformément à la directive
européenne 2160/2003 du 17 novembre 2003 relative au contrôle des
salmonelles et d'autres agents zoonotiques spécifiques présents
dans la chaine alimentaire.
Des frottements énergiques sont effectués
horizontalement et verticalement (10-12 passages) (figure 15 et 16) et les
écouvillons sont constitués en pools (5 unités par pool).
Les oeufs (à couver ou embryonnés) sont mis en sac stérile
et identifiés. Le tout est acheminé sous froid
(température de réfrigération) dans une glacière en
1 à 3 heures après le prélèvement (en fonction de
la distance) au LVRT, laboratoire de l'INMV.
Figure 15 : Prélèvements de surface des
machines et murs

Figure16 : écouvillonnage des oeufs (Couvoir A) et
prélèvement d'eau (couvoir B)
· Méthode destructive
Pour l'analyse du contenu des oeufs à couver et des
oeufs embryonnés, nous avons procédé aseptiquement
à une ouverture par le grand bout de l'oeuf et à l'aide d'une
pipette nous avons récolté le contenu.
Analyse des organes: après sacrifice des
poussins dans la salle d'autopsie du LVRT, les organes (foie, intestin,
estomac, coeur et poumons) ont été prélevés (figure
17) et mis en pool de 5 dans des boites de Pétri stériles pour
être analysés au niveau du service de microbiologie.
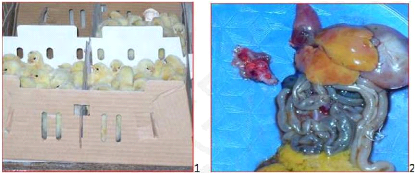
Figure 17 : Prélèvements de poussin (1) et
d'organes après autopsie (2)
Prélèvements d'eau
· Pour être analysée, l'eau utilisée
dans le couvoir a été prélevée en début et
en fin de circuit dans des flacons stériles de 100 ml (figure 16) pour
juger de sa qualité en prenant une série de mesures
hygiéniques (se laver et se désinfecter rigoureusement les mains
sont de règle) :
· Le robinet a été aseptisé à
la flamme d'un briquet ordinaire puis on a laissé couler l'eau une
à deux minutes.
· Remplir à ras bord et en prenant soin de ne pas
toucher le flacon stérile de 100 ml avec l'extrémité du
robinet.
· Refermer soigneusement le flacon d'échantillon
d'eau à analyser.
· Acheminer au laboratoire d'analyse sous une
température de réfrigération dans les
quelques heures
qui suivent le moment du prélèvement (au maximum en 3 heures).
2.2.2 METHODES BACTERIOLOGIQUES
2.2.2.1 Traitement des chiffonnettes et des
écouvillons
Les pools des chiffonnettes et écouvillons sont
séparés et divisés en deux pour réaliser un
enrichissement.
Figure 18 : Enrichissement et mise en culture à
37°C
Nous avons opté pour deux milieux de culture:
Un milieu non sélectif : le bouillon T.S.B
qui permet la croissance de la flore totale, c'est à dire
la plus grande majorité des germes aérobies ou anaérobies
(dont les exigeants) sans avoir recours à des substances nutritives
complémentaires.
Un milieu sélectif (Rapapport de
Vassiliadis) pour les Salmonelles, selon
la norme ISO 6579 (2002) recommandées par les laboratoires de
référence.
L'incubation dans une étuve microbiologique pendant 24
heures réglée à 37°C (figure 18).
2.2.2.2 Traitement des oeufs
Les OAC sont pesés à l'aide d'une balance de
précision (figure 10) puis groupés en lot de 12 pools de 5 oeufs
par pool. Après mise en suspension dans un milieu TSE le contenu est
analysé (flore totale et Salmonelles).
2.2.2.3 Traitement des poussins
Avec la même balance, le poids des poussins est pris
à l'âge de J1 au niveau du LVRT. Les
animaux sont
sacrifiés dans la salle d'autopsie pour extraire le TD, le foie,
l'estomac, le coeur
et les poumons. Ces organes sont groupé en lot de 5 par
pool afin d'analyser d'éventuelle contamination.
2.2.2.4 Identification bactérienne
Au bout de 24 heures d'incubation des écouvillons et
des chiffonnettes, à l'aide d'une anse en platine iridium, on a
réalisé des ensemencements sur gélose nutritive
(GN) pour pouvoir réaliser ensuite la catalase et sur
gélose Hektoen pour les Entérobactéries
et les Pseudomonas (figure 19). On a
réalisé un étuvage de 24 heures puis un repiquage pour les
colonies non pures suivi d'un étuvage de 24 heures pour obtenir une
culture pure et pouvoir réaliser une identification à partir des
différents caractères biochimiques.
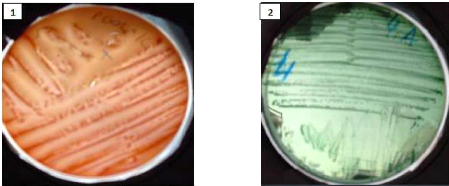
Figure 19 : boite de petri GN (1) et HECTOEN (2)
Après étalement sur lame, séchage
naturel et fixation par passage sur la flamme du bec Bunsen, on réalise
une coloration de Gram qui consiste à appliquer du violet de gentiane
pendant une minute puis du lugol pendant 20 secondes (mordançage) avant
de rincer à l'eau, réaliser une décoloration à
l'alcool pendant 1 minute, recolorer avec de la fuchsine durant 1 minute puis
laver et sécher la préparation.
L'identification des bactéries
Gram+ ou Gram- se fait
par observation au microscope optique, à l'immersion (grossissement
final X 1000).
A partir des Gram+ : on
différencie les Micrococcaceae
(catalase+) qui comprennent les aeroaerobies
facultatifs coagulase+ (staphylocoques
pathogènes), et les streptocoques
(catalase-) qui renferment les streptocoques D.
A partir des Gram- : le test de
l'oxydase permet de distinguer les entérobactéries
(oxydase-).
Identification des entérobactéries à
l'aide d'une galerie biochimique: Cette galerie (figure 20) comporte les
tests suivants :
Gélose T.S.I (gélose
glucose-lactose-saccharose-H2S): utilisation des sucres et production de
gaz.
Milieu mannitol-mobilité-nitrate :
utilisé pour la différenciation rapide des
entérobactéries, en recherchant la mobilité, l'utilisation
du mannitol et la réduction des nitrates.
Milieu au citrate de sodium (milieu de
Simmons) : milieu solide utilisé pour l'identification
des bacilles GRAM négatif.
Milieu urée-indole : Eau physiologique+
disque O.N.P.G
Milieux O.D.C-A.D.H et
L.D.H

Figure 20 : Galerie des
entérobactéries+salmonelles
2.2.3 PARAMETRES ET ANALYSES
Pour une meilleure analyse de la situation dans les couvoirs
où nous avons pu mener notre étude et à coté de
l'état d'hygiène, il nous a paru judicieux de clarifier certains
paramètres zootechniques et essayer d'établir une
corrélation avec les normes de la souche étudiée.
2.2.3.1 Paramètres d'hygiène :
La recherche a été orientée surtout vers
les germes pathogènes (salmonelles, E. coli,
et autres Enterobacteriaceae) (Stock et
al, 2004 ; Russell, 2003 ; Coufal, 2003 et ITAVI,
2003).
· Recherche des salmonelles
· Recherche des E. coli
·
Recherche de staphylocoques pathogènes
· Recherche des streptocoques
D
· Recherche d'autres germes
2.2.3.2 Paramètres zootechniques
Ce sont essentiellement :
· Le poids des OAC
· L'âge de L'OAC
· Le taux d'éclosion
· Le taux de mortalité embryonnaire
· Le taux des oeufs clairs
· Le poids des poussins à la naissance
2.2.3.3 Analyse statistique
Le logiciel statBox version 7.1 (annexe 1) a été
utilisé pour comparer les différences entre les proportions
obtenues dans cette étude.

RESULTATS ET DISCUSSION
3.1 ANALYSES MICROBIOLOGIQUES
Nous avons effectué des analyses microbiologiques à
partir des trois couvoirs, selon des
séries comprenant les différents
prélèvements effectués en fonction du temps. Les
résultats obtenus sont présentés par série.
3.1.1 SERIE A
3.1.1.1 Sous série 1 : J0
Résultats d'analyse des prélèvements de
surface, des prélèvements d'eau et des contenus des OAC (tableaux
6,7 et 8).
Tableau 6 : Analyse des prélèvements de
surface
|
SITE
DES CHIFONN-
PRELEVEMENTS ETTE
|
Couvoir
A
|
Couvoir
B
|
Couvoir
C
|
ECOUV-
ILLONS
|
Couvoir
A
|
Couvoir
B
|
Couvoir
C
|
|
SALLE DE C1-
|
Klebsiella
|
Citrobacter
|
Klebsiella
|
Pool 1
|
Proteus
|
E. coli
|
Strep D
|
|
RECEPTION DES
|
Staph C -
|
|
Strep D
|
|
|
|
|
|
O.A.C
|
|
|
|
|
|
|
S.enteritidis
|
|
SALLE DE C3-C4
PRECHAUFFAGE
|
Enterobact
er
|
E. coli
|
E. coli
|
Pool 2
|
Pseudomon
as
|
E. coli
|
E. coli
|
|
SALLE C5-C6
|
E. coli
|
Citrobacter
|
E. coli
|
Pool 3
|
E. coli
|
E. coli
|
E. coli
|
|
D'INCUBATION
|
|
|
|
|
|
Strep D
|
|
|
PLATEAUX /
|
/
|
/
|
/
|
Pool 4
|
E. coli
|
E. coli
|
Klebsiella
|
|
|
|
|
|
|
Staph c+
|
|
|
INCUBATEURS C7-C8
|
E. coli
|
Pseudomona
s
|
E. coli
|
Pool 5
|
E. coli
|
E. Coli-
Pseudomon
as
|
S.enteritidis
|
|
|
Microcoque
|
|
|
|
|
|
|
SALLE D'ECLOSION C9-C10
|
Enterobact
er
|
E. coli
|
Strep D
|
Pool 6
|
E. coli
|
E. coli
|
E. coli
|
|
ECLOSOIR C11-C12
|
Enterobact
er
|
E. coli
|
E. coli
|
Pool 7
|
E. coli
|
Pseudomon
as
|
S.enteritidis
|
|
CAISSES DE /
|
/
|
/
|
/
|
Pool 8
|
E. coli
|
E. coli
|
E. coli
|
|
TRANSFERT
|
|
|
|
|
|
|
Strep D
|
Tableau 7 : Analyse de l'eau
|
Couvoir A
|
Couvoir B
|
Couvoir C
|
|
Germes totaux à 37°C /24 Heures
|
> 2700 UFC
|
980
|
520
|
|
Coliformes totaux
|
> 161 UFC
|
3
|
4
|
|
Salmonelles
|
absence
|
absence
|
absence
|
|
Streptocoques fécaux
|
Non effectué
|
absence
|
absence
|
Tableau 8 : Analyse du contenu des O.A.C
Pools Couvoir A Couvoir B Couvoir C
|
P1
|
P2
|
P3
|
P4
|
P5
|
P6
|
P7
|
P8
|
P9
|
P10
|
P11
|
P12
|
|
Culture
négative(_)
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
|
Culture
négative(_)
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
|
Culture
négative(_)
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
3.1.1.2 Sous série 2 : J8
Résultats d'analyse de la surface des coquilles et du
contenu des oeufs embryonnés (tableaux 9 et 10)
Tableau 9 : Analyse de coquille des oeufs
embryonnés
|
pools
|
P1
|
P2
|
P3
|
P4
|
P5
|
P6
|
P7
|
P8
|
P9
|
P10
|
P11
|
P12
|
|
Couvoir
A
|
E. coli
|
Citrobacter
|
Enterobacter
|
E. coli
|
E. coli
|
E. coli
|
Pseudomon
as
|
E. coli
|
E. coli
|
Enterobacter
|
E. coli
|
E. coli
|
|
Couvoir
B
|
Entero
bacter
|
Strep D-
E
.coli
|
Staph c+
|
Microc
oque
|
E. coli
|
E. coli
|
Microcoque
|
E. coli
|
Culture
_
|
Strep
D
|
_
|
E. coli
|
|
Couvoir
C
|
Staph
c _
|
Staph
c _
|
Strep D
|
E. coli
|
S.enter
itidis
|
Culture
_
|
Strep D
|
E. coli
|
E. coli
|
Klebsiella
|
E. coli
|
E. coli
|
Tableau 10 : Analyse du contenu des oeufs
embryonnés
|
Contenu des oeufs
embryonnés
|
Pools
|
P1
|
P2
|
P3
|
P4
|
P5
|
P6
|
|
Couvoir A
|
Strep D
|
Culture
négative(j
|
_
|
_
|
_
|
Strep D
|
|
Couvoir B
|
Culture
négative(j
|
_
|
_
|
_
|
_
|
_
|
|
Couvoir C
|
Culture
négative(j
|
_
|
_
|
_
|
_
|
_
|
3.1.1.3 Sous série 3 : J19
Résultats d'analyse de la surface des coquilles et du
contenu des oeufs embryonnés (tableaux 11 et 12)
Tableau 11 : Analyse de coquille des oeufs
embryonnés
|
|
pools
|
P1
|
P2
|
P3
|
P4
|
P5
|
P6
|
P7
|
P8
|
P9
|
P10
|
P11
|
P12
|
|
Couvoir A
|
E. coli
|
Strep D
|
Staph C -
Strep D
|
Citrobact
er
|
E. coli
|
E. coli
|
Klebsiella
|
E. coli
|
Citrobact
er
|
Microcoque
Citrobacter
|
E. coli
|
E. coli
|
|
Couvoir B
|
E. coli
|
E. coli-
Strep D
|
E. coli
Strep D
|
E. coli
|
culture
négative
(_)
|
_
|
E. coli
|
E. coli
|
Staph c+
|
E. coli
|
E. coli
|
Microc
oque
|
|
Couvoir C
|
Strep D
|
E. coli
|
E. coli
|
Strep D
|
Staph c+
E. coli
|
S.ente
ritidis
|
E. coli
|
culture
négative
|
E. coli
|
_
|
E. coli
|
_
|
(_)
Tableau 12 : Analyse du contenu des oeufs
embryonnés
|
|
Contenu des oeufs
embryonnés
|
Pools
|
P1
|
P2
|
P3
|
P4
|
P5
|
P6
|
|
Couvoir A
|
Strep D
|
Culture négative(_)
|
_
|
_
|
Proteus- Strep D
|
_
|
|
Couvoir B
|
E. coli
|
Culture négative(_)
|
_
|
E. coli
|
_
|
_
|
|
Couvoir C
|
E. coli
|
culture négative(_)
|
_
|
_
|
E. coli
|
_
|
3.1.1.4 Sous série 4 : J21
Résultats d'analyse du duvet et des organes de poussins
(tableaux 13 et 14)
Tableau 13 : Analyse du duvet
|
pools
|
P1
|
P2
|
P3
|
P4
|
P5
|
P6
|
P7
|
P8
|
P9
|
P10
|
P11
|
P12
|
|
Couvoir
A
|
E. coli
|
Klebsiella
|
Enterobacter
|
E. coli
|
E. coli
|
E. coli
|
E. coli
|
E. coli
|
Culture
négative
|
Klebsiella
|
E .COLI
|
E .COLI
|
|
Couvoir
B
|
Strep D
|
Strep D
|
E. coli
Klebsiella
|
E.
coli
|
E. coli
Citroba
cter
|
Culture
_
|
_
|
_
|
_
|
E.
coli
|
E.
coli
|
E.
coli
|
|
Couvoir
C
|
Klebsi
ella
E. coli
|
Klebsiell
a
E. coli
|
E. coli
|
S.ente
ritidis
|
S.enteri
tidis
|
E. coli
|
E. coli
|
E. coli
|
E. coli
Strep D
|
E. coli
|
_
|
E. coli
|
Tableau 14 : Analyse des organes de poussin
|
Pools
|
P1
|
P2
|
P3
|
P4
|
P5
|
|
Couvoir A
|
Enterobacter (foie)
|
Culture négative(j
|
_
|
_
|
Enterobacter (foie)
|
|
Couvoir B
|
culture
négative(j
|
_
|
_
|
E. coli (foie)
|
_
|
|
Couvoir C
|
E. coli (foie)
|
culture négative(j
|
_
|
_
|
E. coli (foie)
|
organes
des
poussins
P6
_
_
_

% des mortalités embryonnaires /oeufs
non
éclos
% des mortalités embryonnaires
/oeufs
incubés
%des oeufs clairs /oeufs non éclos
%des oeufs clairs /oeufs incubés
Age de la poulette (semaine)
Poids du poussin (gramme)
Nombre d'oeufs incubés
Poids moyen (gramme)
Age des O.A.C (jours)
Taux d'éclosion (%)
Paramètres Couvoir
A
Eclosion
10,238 15,32 9,046
13500 16800 16000
10850 11900 13580
46.88
57.66
80.73
9,032 13,59 5,759
53.12
33.15 30.75 34.65
1-4 2 1-7
37
Couvoir
B
47.33
71.09
47
53
27
Couvoir
C
57.60
85.19
38.9
61.1
37
Tableau 15 : Paramètres zootechniques
3.1.2 SERIE B
3.1.2.1 Sous série 1 : J0
Résultats d'analyse des prélèvements de
surface, des prélèvements d'eau et des contenus des OAC (tableaux
16,17 et 18).
Tableau 16 : Analyse des prélèvements de
surface
|
SITE
DES CHIFONN-
PRELEVEMENTS ETTE
|
|
ECOUVI
-LLONS
|
|
|
Couvoir
A
|
Couvoir
B
|
Couvoir
C
|
Couvoir
A
|
Couvoir
B
|
Couvoir
C
|
|
SALLE DE C1-
RECEPTION DES
|
Klebsiella
|
E. coli
|
E. coli
|
Pool 1
|
Enterobact
er
|
E. coli
|
Culture
négative
|
|
O.A.C
|
|
|
|
|
|
|
|
|
SALLE DE C3-C4
PRECHAUFFAGE
|
Strep D
|
Enterobact
er
|
Enterobact
er
|
Pool 2
|
Culture
négative
|
E. coli
|
E. coli
|
|
SALLE C5-C6
|
Staph C -
|
Culture
|
Culture
|
Pool 3
|
E. coli
|
Culture
|
E. coli
|
|
D'INCUBATION
|
|
négative
|
négative
|
|
|
négative
|
Staph C -
|
|
PLATEAUX /
|
/
|
/
|
/
|
Pool 4
|
E. coli
|
Staph C -
|
Culture
négative
|
|
INCUBATEURS C7-C8
|
Culture
|
Culture
|
E. coli
|
Pool 5
|
Culture
|
Culture
|
Culture
|
|
négative
|
négative
|
|
|
négative
|
négative
|
négative
|
|
SALLE D'ECLOSION C9-C10
|
E. coli
|
Culture
négative
|
Culture
négative
|
Pool 6
|
E. coli
|
Strep D
|
Strep D
|
|
ECLOSOIR C11-C12
|
Culture
négative
|
E. coli
|
Culture
négative
|
Pool 7
|
E. coli +
enterobact
er
|
E. coli
|
E. coli
|
|
CAISSES DE /
TRANSFERT
|
/
|
/
|
/
|
Pool 8
|
E. coli
|
Culture
négative
|
Culture
négative
|
Tableau 17 : Analyse de l'eau
|
Couvoir A
|
Couvoir B
|
Couvoir C
|
|
Germes totaux à 37°C /24 Heures
|
1200 UFC
|
800
|
300
|
|
Coliformes totaux
|
1 UFC
|
3
|
2
|
|
Salmonelles
|
absence
|
absence
|
absence
|
|
Streptocoques fécaux
|
0
|
1
|
0
|
Tableau 18 : Analyse du contenu des O.A.C
Pools Couvoir A Couvoir B Couvoir C
|
P1
|
P2
|
P3
|
P4
|
P5
|
P6
|
P7
|
P8
|
P9
|
P10
|
P11
|
P12
|
|
Culture
négative(_)
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
|
Culture
négative(_)
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
|
Culture
négative(_)
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
_
|
3.1.2.2 Sous série 2 : J8
Résultats d'analyse de la surface des coquilles et du
contenu des oeufs embryonnés (tableaux 19 et 20)
Tableau 19 : Analyse de coquille des oeufs
embryonnés
|
pools
|
P1
|
P2
|
P3
|
P4
|
P5
|
P6
|
P7
|
P8
|
P9
|
P10
|
P11
|
P12
|
|
Couvoir
|
|
Culture
|
Strep D
|
|
Strep D
|
|
|
|
|
|
|
|
|
E. coli
|
négative
|
|
_
|
|
E.coli
|
_
|
_
|
_
|
_
|
E. coli
|
_
|
|
A
|
|
(___)
|
|
|
|
|
|
|
|
|
|
|
|
Couvoir
|
Strep D
|
Culture
|
|
|
|
|
|
|
|
|
|
|
|
|
négative
|
_
|
E. coli
|
_
|
_
|
_
|
E. coli
|
_
|
_
|
_
|
_
|
|
B
|
|
(___)
|
|
|
|
|
|
|
|
|
|
|
|
Couvoir
|
|
|
|
Culture
|
|
Citroba
|
|
|
Citroba
|
|
|
|
|
C
|
Enteroba
cter
strepD
|
E. coli
|
Klebsiella
|
négative
(___)
|
_
|
cter
|
_
|
E. coli
|
cter
|
_
|
_
|
_
|
Tableau 20 : Analyse du contenu des oeufs
embryonnés
|
Contenu des oeufs
embryonnés
|
|
Pools
|
|
P1
|
|
P2
|
|
P3
|
|
P4
|
|
P5
|
|
P6
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Couvoir A
|
|
Culture négative(j
|
|
_
|
|
_
|
|
_
|
|
_
|
|
E. coli
|
|
Couvoir B
|
|
|
|
_
|
|
|
|
_
|
|
|
|
_
|
|
|
Culture négative(j
|
|
|
_
|
|
|
_
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Couvoir C
|
|
Culture négative(j
|
|
_
|
|
_
|
|
_
|
|
_
|
|
_
|
3.1.2.3 Sous série 3 : J19
Résultats d'analyse de la surface des coquilles et du
contenu des oeufs embryonnés (tableaux 21 et 22)
Tableau 21 : Analyse de coquille des oeufs
embryonnés
|
|
pools
|
P1
|
P2
|
P3
|
P4
|
P5
|
P6
|
P7
|
P8
|
P9
|
P10
|
P11
|
P12
|
|
Couvoir
A
|
Enterobacter
|
Culture
négative
(___)
|
_
|
E. coli
|
E. coli
|
Klebsiella
|
_
|
_
|
E. coli
|
_
|
E. coli
|
_
|
|
Couvoir
B
|
E. coli
|
Culture
négative
(___)
|
Strept
D
|
_
|
_
|
_
|
E. coli
|
Citrobacter
|
_
|
_
|
E. coli
|
_
|
|
Couvoir
C
|
E. coli
|
Culture
négative
|
Klebsiella
|
Strept
D
|
E. coli
Proteus
|
_
|
_
|
E. coli
|
_
|
_
|
E. coli
|
_
|
(___)
Tableau 22 : Analyse du contenu des oeufs
embryonnés
|
|
Contenu des oeufs
embryonnés
|
Pools
|
P1
|
P2
|
P3
|
P4
|
P5
|
P6
|
|
Couvoir A
|
Culture négative(_)
|
_
|
_
|
_
|
E. coli
|
_
|
|
Couvoir B
|
Culture négative(_)
|
E. coli
|
_
|
_
|
_
|
_
|
|
Couvoir C
|
E. coli
|
Culture
négative(_)
|
_
|
_
|
_
|
_
|
3.1.2.4 Sous série 4 : J21
Résultats d'analyse du duvet et des organes de poussins
(tableaux 23 et 24)
Tableau 23 : Analyse du duvet de poussin
|
pools
|
P1
|
P2
|
P3
|
P4
|
P5
|
P6
|
P7
|
P8
|
P9
|
P10
|
P11
|
P12
|
|
Couvoir
A
|
E. coli
|
Culture
négative(_)
|
Klebsiella
|
_
|
E. coli
|
_
|
E. coli
|
Klebsiella
|
_
|
_
|
Enterobacter
|
_
|
|
Couvoir
B
|
E. coli
|
Culture
négative(_)
|
E. coli
|
_
|
Strep D
|
_
|
_
|
E. coli
|
_
|
_
|
_
|
_
|
|
Couvoir
C
|
E. coli
Strep
D
|
E. coli
Klebsiella
|
Culture
négative
(_)
|
_
|
E. coli
|
Proteus
|
_
|
Strep D
|
E. coli
|
_
|
E. coli
|
_
|
Tableau 25 : Paramètres zootechniques

% des mortalités embryonnaires /oeufs
non
éclos
% des mortalités embryonnaires
/oeufs
incubés
%des oeufs clairs /oeufs non éclos
%des oeufs clairs /oeufs incubés
Age de la poulette (semaine)
Poids du poussin (gramme)
Nombre d'oeufs incubés
Poids moyen (gramme)
Age des O.A.C (jours)
Taux d'éclosion (%)
paramètres Couvoir
A
Eclosion
13500 15690 22320
10975 12830 18240
35,8O 35,12 37,45
47,87
81,66
52,13
9,561 11,05 13,04
8,779 6,87 5,05
61,33
1-4 2-4 1-7
47
Couvoir
B
59,72
82,08
61,68
38,32
41
Couvoir
C
81,94
72,01
64,45
27,99
45
|
Tableau 24 :
|
Analyse d'organes de poussin
|
|
|
|
organes
des
poussins
|
Pools
|
P1
|
P2
|
P3
|
P4
|
P5
|
|
Couvoir A
|
Culture négative(_)
|
E. coli (foie)
|
_
|
_
|
_
|
|
Couvoir B
|
E. coli (foie)
|
Culture négative(j
|
_
|
_
|
_
|
|
Couvoir C
|
E. coli (foie)
|
Culture négative(j
|
_
|
_
|
_
|
P6
_
_
_
Tableau 26 : Identification des germes isolés dans le
couvoir A
|
COUVOIR A, SERIE A
|
|
Salmonelle
|
E. coli
|
Staph C -
|
Staph C +
|
Klebsiella
|
Proteus
|
Pseudomonas
|
Streptocoque
D
|
Enterobacter
|
Citrobacter
|
Microcoque
|
|
J0
|
0
|
38
|
2
|
0
|
2
|
5
|
5
|
0
|
6
|
0
|
0
|
|
J0'
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
J8
|
0
|
40
|
0
|
0
|
0
|
0
|
5
|
0
|
15
|
0
|
0
|
|
J8'
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
0
|
|
J19
|
0
|
30
|
5
|
0
|
5
|
0
|
0
|
10
|
0
|
15
|
5
|
|
J19'
|
0
|
0
|
0
|
0
|
0
|
5
|
0
|
10
|
0
|
0
|
0
|
|
J21
|
0
|
40
|
0
|
0
|
10
|
0
|
0
|
0
|
5
|
0
|
0
|
|
J21'
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
|
COUVOIR A, SERIE B
|
|
Salmonelle
|
E. coli
|
Staph
Coagulase -
|
Staph C +
|
Klebsiella
|
Proteus
|
Pseudomonas
|
Streptocoque
D
|
Enterobacter
|
Citrobacter
|
Microcoque
|
|
J0
|
0
|
25
|
2
|
0
|
2
|
0
|
0
|
2
|
7
|
0
|
0
|
|
J0'
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
J8
|
0
|
15
|
0
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
0
|
|
J8'
|
0
|
5
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
J19
|
0
|
20
|
0
|
0
|
5
|
0
|
0
|
0
|
5
|
0
|
0
|
|
J19'
|
0
|
5
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
J21
|
0
|
15
|
0
|
0
|
10
|
0
|
0
|
0
|
5
|
0
|
0
|
|
J21'
|
0
|
5
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
J0 , J8 , J19 pour la coquille des oeufs
J0', J8' , J19' pour le contenu des oeufs
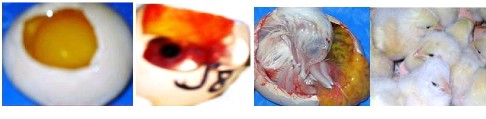
J0 J8 J19 J21
J21 pour le duvet et J21' pour les organes de poussin
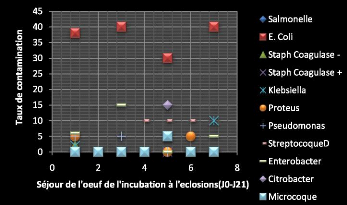
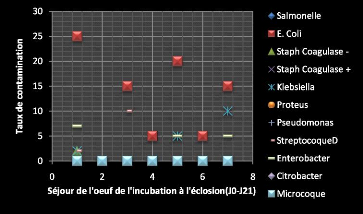
Figure 22 : N
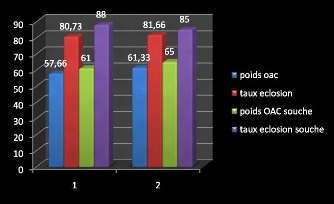
Figure 23 : Compara
Par rapport aux norm
Tableau 27 : Identific
|
|
Salmonelle
|
E. coli
|
Staph C -
|
Staph
|
|
|
|
|
|
|
|
|
J0
|
0
|
48
|
0
|
|
|
|
|
|
|
|
|
|
J0'
|
0
|
0
|
0
|
|
|
|
|
|
|
|
|
|
J8
|
0
|
25
|
0
|
O
|
|
|
|
|
|
|
|
|
J8'
|
0
|
0
|
0
|
|
|
|
|
|
|
|
|
|
J19
|
0
|
40
|
0
|
|
|
|
|
|
|
|
|
|
J19'
|
0
|
10
|
0
|
|
|
|
|
|
|
|
|
|
J21
|
0
|
30
|
0
|
|
|
|
|
|
|
|
|
|
J21'
|
0
|
5
|
5
|
|
|
|
|
|
|
|
|
|
|
Salmonelle
|
E. coli
|
Staph
Coagulase -
|
Staph
|
|
|
|
|
|
|
|
|
J0
|
0
|
19
|
0
|
|
|
|
|
|
|
|
|
|
J0'
|
0
|
0
|
0
|
|
|
|
|
|
|
|
|
|
J8
|
0
|
10
|
0
|
|
|
|
|
|
|
|
|
|
J8'
|
0
|
0
|
0
|
|
|
|
|
|
|
|
|
|
J19
|
0
|
15
|
0
|
|
|
|
|
|
|
|
|
|
J19'
|
0
|
5
|
0
|
|
|
|
|
|
|
|
|
|
J21
|
0
|
15
|
0
|
|
|
|
|
|
|
|
|
|
J21'
|
0
|
5
|
0
|
|
|
|
|
|
|
|
|
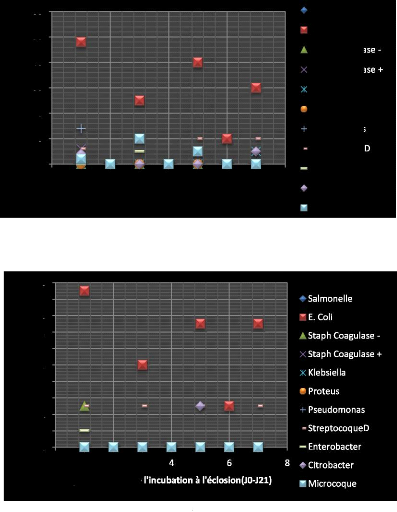
A
B
60
50
40
30
20
10
0
0 2
Taux de contamination
Séjour de l'oe uf de l'incubation à
l'éclosion(J0-J21)
4 6 8
Salmonelle
E. Coli
Staph Coagul Staph Coagul Klebsiella Proteus Pseudomona
Streptocoque Enterobacter Citrobacter Microcoque
20
18
16
14
Titre de I'axe
12
10
8
6
4
2
0
0 2
séjour de l'oeuf de
Figure 24 : Niveau de contamination couvoir B A:
série A B : série B
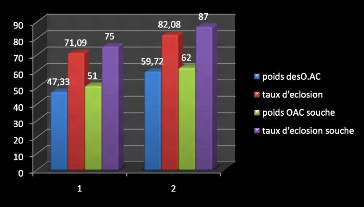
Figure 25 : compara Par rapport aux norm
Tableau 28 : Identific
|
|
Salmonelle
|
E. coli
|
Staph C -
|
Staph C
|
|
|
|
|
|
|
|
|
J0
|
15
|
32
|
0
|
0
|
|
|
|
|
|
|
|
|
JO'
|
0
|
0
|
0
|
0
|
|
|
|
|
|
|
|
|
J8
|
5
|
25
|
10
|
0
|
|
|
|
|
|
|
|
|
J8'
|
0
|
0
|
0
|
0
|
|
|
|
|
|
|
|
|
J19
|
5
|
30
|
0
|
5
|
|
|
|
|
|
|
|
|
J19'
|
0
|
10
|
0
|
0
|
|
|
|
|
|
|
|
|
J21
|
10
|
45
|
0
|
0
|
|
|
|
|
|
|
|
|
J21'
|
0
|
10
|
0
|
0
|
|
|
|
|
|
|
|
|
|
Salmonelle
|
E. coli
|
Staph C -
|
Staph C
|
|
|
|
|
|
|
|
|
J0
|
0
|
19
|
2
|
0
|
|
|
|
|
|
|
|
|
J0'
|
0
|
0
|
0
|
0
|
|
|
|
|
|
|
|
|
J8
|
0
|
10
|
0
|
0
|
|
|
|
|
|
|
|
|
J8'
|
0
|
0
|
0
|
0
|
|
|
|
|
|
|
|
|
J19
|
0
|
20
|
0
|
0
|
|
|
|
|
|
|
|
|
J19'
|
0
|
5
|
0
|
0
|
|
|
|
|
|
|
|
|
J21
|
0
|
25
|
0
|
0
|
|
|
|
|
|
|
|
|
J21'
|
0
|
5
|
0
|
0
|
|
|
|
|
|
|
|
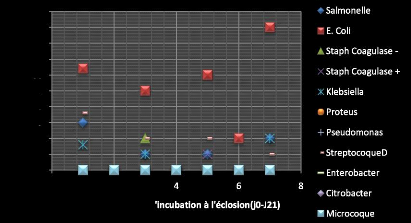
Taux de contamination
45
40
50
35
30
25
20
15
10
0
5
0 2
Séjour de l'oeuf de l
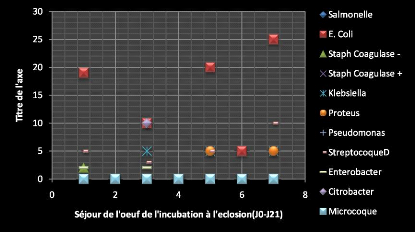
Figure 26 : N
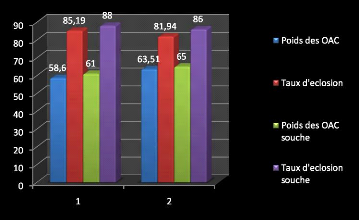
Figure 27 : Compara Par rapport aux norm
Tableau 29 : Illustration
|
couvoir A
|
|
|
|
série A
|
sé
|
|
|
|
|
|
Age de la
poulette(s)
|
37
|
|
|
|
|
|
|
Age des O.A.C (j)
|
1 à 4
|
|
|
|
|
|
|
Poids moyen OAC
(gr)
|
57,66
|
|
|
|
|
|
|
Nombre O.A.C
incubés
|
13500
|
13
|
|
|
|
|
|
Nombre de
poussins éclos *
|
10850
|
10
|
|
|
|
|
|
Taux d'éclosion
(%)
|
80,73
|
|
|
|
|
|
|
Poids du poussin
(gr)
|
33,15
|
|
|
|
|
|
|
oeufs clairs (%)
|
9,032
|
|
|
|
|
|
|
mortalitéembryonnaire(%)
|
10,238
|
|
|
|
|
|
· les 60 oeufs embryonnés prél
· Tableau 30 : les normes de la souche ISA 15( selon
le guide de la souche
|
NORMES SOUCHE
|
NORMES SOUCHE
|
NORMES SOUCHE
|
|
Age de la poulette
|
37
|
47
|
27
|
41
|
37
|
45
|
|
Age des O.A.C (J)
|
<7
|
<7
|
<7
|
<7
|
<7
|
<7
|
|
Poids moyen OAC
|
61
|
65
|
51
|
62
|
61
|
65
|
|
Taux d'éclosion
|
88
|
85
|
75
|
87
|
88
|
86
|
commerciale)
Il ressort de cette étude lors de la
première série A que les OAC utilisés par les
couvoirs A, B et C possèdent un contenu dépourvu de toute
contamination bactérienne à l'arrivée car tous les
prélèvements se sont révélés négatifs
(tableau 8). Nos résultats signifient un bon état sanitaire des
reproductrices (absence de contamination pendant la formation de l'oeuf dans
les différents segments de l'oviducte). Ceci confirme le bon état
anatomo-pathologique de cet organe comme observé (figure 28)
après les autopsies effectuées sur des cadavres et poules en
production (absence de lésions). Ces résultats confirment le
rôle antimicrobien que jouent les différents constituants de
l'oeuf et en particulier l'albumen, ce qui est en accord avec Nakano
et al. (2003).
Figure 28 : Oviducte d'une poule âgée de 38
semaines (Originale)
Pour le contrôle de la désinfection des
différents secteurs et matériel des trois couvoirs, les
prélèvements de surface montrent une contamination
bactérienne assez importante à tous les niveaux (Tableau 6),
marquée par la domination d'Escherichia coli,
Streptocoque D, Klebsiella, Enterobacter et
Citrobacter pour le couvoir A (tableau 26),
d'Escherichia coli,
Pseudomonas, Streptocoque D et
Citrobacter pour le couvoir B (tableau 27)et
Escherichia coli et Salmonella enteritidis, Streptocoque D
et Klebsiella pour le couvoir C
(tableau 28).
La qualité microbiologique de la coquille des oeufs est
aussi médiocre avec persistance de
germes jusqu'à J21,
Escherichia coli, Streptocoque D et
Enterobacter au niveau des couvoirs
A et B et Escherichia coli, Streptocoque D
et Salmonella enteritidis au niveau du
couvoir C, contamination bactérienne accentuée par une ambiance
d'humidité et de température favorable aux conditions de
développement bactérien avec apparition de germes dans le contenu
des oeufs embryonnés à J8 et J19 pour le couvoir A (Streptocoque
D) et à J19 pour les couvoirs B et C (Escherichia coli)
par passage trans-coquillère comme relaté dans
diverses études (Bruce et Drysdale, 1994 ; Stoleson et Beissinger, 1999)
et où 70% des cas de passage bactérien au vitellus sont
opérés au delà de J7 (Cook et al.,
2003).
La contamination de l'oeuf par les microorganismes (y compris
les saprophytes) à partir de la coquille durant l'incubation est
à l'origine de l'élévation du taux des mortalités
embryonnaires comme démontré par Board et al.
en 1986 et Fasenko et al. en 2009. Nous
avons enregistré des taux de mortalités embryonnaires de 10,24 %
dans le couvoir A soit 53,12 % des oeufs non éclos, de 15,32 % dans le
couvoir B soit 53% des oeufs non éclos et un taux de 9,05 % dans le
couvoir C ce qui représente 61,1 % du lot d'oeuf qui n'ont pas
éclos. Dans tous les cas, elle représente plus que la
moitié des OAC qui n'ont pas donné naissance à un poussin
à J21 puisqu'on a relevé des taux d'oeufs clairs de 9,03% pour le
couvoir A, 13,59 % au couvoir B et 5,76 % pour le couvoir C.
Ce niveau de contamination est accentué au stade
éclosion par le nombre de prélèvements identifiés
positifs pour les couvoirs A et le couvoir C mais il l'est moins pour le
couvoir B qui opère d'une façon habituelle par une fumigation au
formol juste avant le transfert des oeufs ; ce niveau de contamination
entrainera une variation certaine dans les performances du poulet en
élevage d'autant plus que les analyses du duvet à
l'éclosion ont révélé une forte présence de
germes en particulier Escherichia coli pour les
couvoirs A et B et Escherichia coli et
Salmonella enteritidis pour le couvoir C, avec
contamination des organes de poussins dès le premier jour par
Escherichia coli dans le foie des poussins issus du
couvoir
B et du couvoir C, et Enterobacter au
niveau du même organes des poussins produits dans le couvoir A.
De plus l'identification d'une salmonelle responsable de
zoonose (Salmonella enteritidis) à J0 au
niveau de l'incubateur, et à J8 et J19 sur les coquilles d'oeuf et dans
le duvet à l'éclosion (J21) sera à l'origine d'une
contamination certaine du poussin dans le poulailler. En cas d'éventuel
contrôle des services vétérinaires officiels de la
circonscription, de graves conséquences seront liées à la
destruction de toute la bande, et à la durée du vide sanitaire
(réglementé à un mois par l'autorité
vétérinaire nationale comme précisé en annexe 4)
avec un risque épidémiologique d'une contamination des
reproductrices à partir du couvoir par les moyens de transport et/ou le
personnel étant donné qu'il s'agit du même
propriétaire. A l'issue de ces résultats nous avons
demandé aux différents couvoirs de renforcer les mesures de
désinfection à tous les niveaux et même aux niveaux des
réservoirs d'eau en particulier pour celle utilisée par le
couvoir A où on a enregistré un taux de contamination trop
élevé, vu que le couvoir utilise par souci d'économie
d'eau, un circuit fermé avec récupération d'une partie de
l'eau ; pour cela et avec notre aide auprès des services
d'hygiène de l'APC , le propriétaire a fait usage de la brique
à chaux pour réduire la charge bactérienne.
Au niveau du couvoir C, pour essayer d'éliminer les
salmonelles et suivant nos conseils, l'accouveur a tenté une
désinfection renforcée avec du formol à 37% et du
permanganate de potassium comme préconisé par l'O.I.E selon la
concentration B pour les machines.
A la seconde série B, nous avons pu
obtenir la confirmation de l'absence de contamination des différents
constituants internes de l'oeuf qui signe une formation et une évolution
aseptique de ce dernier dans le tractus génital de la poule
reproductrice du fait que la totalité des pools d'écouvillons
(12x5) pour chaque couvoir ont révélé des cultures
bactériennes négatives sur les deux milieux d'enrichissement (TSB
et RAPPAPORT).
Le contrôle de la désinfection des
différents secteurs des trois couvoirs, ainsi que le matériel
qu'ils utilisent, a fait ressortir une amélioration de la situation
hygiénique par une diminution du nombre d'identification de germes au
niveau des écouvillons et des chiffonnettes et une augmentation du
nombre des cultures négatives (diminution de la charge microbienne)
essentiellement au niveau des machines (incubateurs et éclosoirs) pour
les couvoirs A, B et C (figure 22, 24 et 26°et particulièrement, la
réussite de l'élimination de Salmonelle
enteritidis au niveau du couvoir C.
Pour les cultures bactériennes positives on note
toujours une contamination dominée par Escherichia
Coli, Enterobacter, Streptocoque D et
Klebsiella au niveau du couvoir A, avec contamination
du contenu des oeufs embryonnés par des Escherichia
coli dès J8 ; Escherichia coli,
Staphylococcus, Streptocoque D et
Enterobacter au niveau du couvoir B avec apparition
d'une contamination des embryons par Escherichia coli
à J19 ; et pour le couvoir C Escherichia coli, Streptocoque
D, Klebsiella et Proteus et une
contamination des embryons vers J19 .
3.2 ANALYSES ZOOTECHNIQUES
Sur le plan zootechnique on a enregistré des niveaux
d'éclosion relativement bas en comparaison avec les normes de la souche
commerciale selon le guide d'élevage reproducteurs ISA 15, dans les
trois couvoirs en tenant compte des âges des poules reproductrices, avec
80,73 % vs 88% , soit un écart de 7,27 % pour le couvoir A (figure 23),
71,09 % vs 75%, soit un écart de 3,91 % pour le couvoir B (figure 25)et
un meilleur taux d'éclosion pour le couvoir C de 85,19 % vs 88%, soit un
écart de 2,81 % (figure 27). Une diminution de
l'éclosabilité qui pourrait être aussi expliquée par
un taux de mortalité embryonnaire relativement élevé comme
décrit par Board et al, 1986 ; Bruce et
Drysdale ,1994 et Fasenko en 2009 plus particulièrement au niveau du
couvoir B où ce taux de mortalité embryonnaire observé est
lié au jeune âge de la bande qui joue un rôle très
significatif sur le développement embryonnaire. Le taux de
l'éclosabilité est supérieur avec les bandes plus
âgées (30 semaines) comme relaté par Peebles en 2004 et
Pedroso et al. en 2005.
Le poids moyen des OAC dans les trois couvoirs est
inférieur au poids moyen de la souche commerciale pour le couvoir A
(57,66 vs 61 grammes), pour le couvoir B (47,33 vs 51 grammes) et pour le
couvoir C (58,6 vs 61 grammes) (tableau 15 et 25).
Le paramètre de l'âge de ces oeufs à
couver est conforme aux normes du fait que tous les couvoirs utilisent des OAC
âgés au maximum de 7 jours (couvoir A : 1-4 J, couvoir B : 1-2 J,
et le couvoir C : 1-7 J) pour obtenir des productions optimales comme
décrit par Christensen et al. en 2003 et
Fasenko en 2007. Ces OAC sont stockés à une température
ambiante qui oscille entre 18-20°C.
Pour le poids du poussin, bien qu'inférieur au poids
moyen de la souche, il est fonction du poids des oeufs et de l'âge des
reproducteurs. En effet pour les bandes plus âgées (couvoirs A et
C)(37 semaines) produisant des O.A.C d'un poids moyen plus élevé
(57,6 et 57,66 grammes) que ceux issus des élevages qui alimentent le
couvoir B âgés de27 semaines et qui sont en début de
production avec un poids moyen des OAC de 47,33 grammes, on a enregistré
un poids moyen de poussins qui est plus élevé dans le couvoir A
(33,15 grammes) et dans le couvoir C (34,65 gr par apport à celui du
couvoir B (30,75 grammes). Ceci est en nette concordance avec Fasenko et
al. en 2002, Peebles et al.
en 2004 et Fasenko en 2007. Ce poids moyen et cette contamination
initiale pourraient avoir des effets négatifs sur les performances du
poulet lors de la première semaine d'élevage selon Peebles et
al en 2004.
Dans la seconde partie expérimentale, les OAC mis en
incubation ont le même âge que pour la série
précédente pour le couvoir A et le couvoir C, respectivement 1
à 4 jours et 1 à 7 jours alors que pour le couvoir B il
était de 1 à 5 jours mais dans tous les cas inferieur à 7
jours et toujours stockés dans des conditions inchangeables
(température ambiante comprise entre 20°C et 23°C) dans les
salles de stockage des oeufs à cette date.
Le poids moyen de ces OAC bien qu'inferieur au poids moyen de
la souche, est nettement supérieur en comparaison avec la
première série vu l'âge des reproductrices (ce poids est
fonction de l'âge de la poulette comme décrit par Peebles
et al. en 2004 et Fasenko en 2007). On a
enregistré des poids moyens de 61,33 vs 65 grammes pour des poules
âgées de 47 semaines pour le couvoir A, de 59,72 vs 62 grammes
pour des pondeuses âgées de 41 semaines pour le couvoir B et de
63,51 vs 65 grammes avec un âge de reproductrice de 45 semaines au niveau
du couvoir C .
Le taux d'éclosion dans cette phase est toujours
inférieur en comparaison avec le taux normal de la souche ISA 15 avec
81,66 % vs 85% pour le couvoir A soit un écart de 3,34 %, 82,08 % pour
le couvoir B soit un écart de 4,92 % et 81,94 % au couvoir C soit un
écart de 4,06 %.
Dans cette série on note bien l'amélioration de
la viabilité embryonnaire dans les trois couvoirs avec un taux de
mortalité de 8,78%, 6,87% et 5,05% respectivement pour les couvoirs A, B
et C avec des écarts respectifs de 1,459%, 8,45% et 3,996%, qui explique
et confirme l'amélioration relative de la situation en matière de
désinfection des
établissements et du matériel, en raison de
l'utilisation des mêmes paramètres de température et
d'humidité des machines et des mêmes bandes reproductrices que
pour la série A . On remarque dans cette partie que si le couvoir C a
réussit à se débarrasser de la salmonelle il se trouve
confronté un autre problème qui est celui du taux d'oeufs
inféconds : il enregistre un taux de 13,01% d'oeufs clairs qui trouve
origine soit en élevage (problème de cochage) soit condition de
stockage (la température de stockage des oeufs était de
20-23°C les sept jours avant mise en machine).
Comparaison entre les deux résultats :
De ces deux séries dans les trois couvoirs on peut faire
les constatations suivantes:
1. Le degré de désinfection de nos couvoirs est
en deçà des normes requises pour la bonne gestion des couvoirs,
comme cela est recommandé par l'O.I.E (2005) impliquant une gamme
importante de micro-organismes avec une omniprésence
d'Escherichia coli et de Streptocoque
D pour les trois couvoirs et Salmonella
enteritidis pour le couvoir C dans la première
série A. Cette contamination est fortement présente à J0,
J19 et J21 comme le montrent nos résultats d'identification de
prélèvement et une désinfection relativement
poussée a fait baisser cette contamination. La fréquence des
infections colibacillaires reste bien en tête des pathologies dominantes,
occasionnant d'énormes pertes économiques en élevage
aviaire et particulièrement en élevage de poulet de chair, ce qui
est en accord avec les travaux de Zahraei Salehi et
al en 2006.
Entre les deux séries, on constate qu'au niveau du:
Couvoir A, on passe de 38 - 30 - 40
prélèvements positifs dans la série A à 25 - 20 -15
de prélèvements positifs dans la série B.
Couvoir B, on dénombre dans la
série A 48 - 40 - 30 prélèvements positifs contre 19 - 15
- 15 de prélèvements dans la série B.
Couvoir C, on enregistre un nombre de
prélèvements positifs de 32 - 30 - 45 dans la série A
contre 19 - 20 - 25 dans la série B.
Il serait intéressant de réaliser un serotypage
des souches d'Escherichia coli que
nous avons
isolées, car elles sont considérées comme potentiellement
pathogènes
de l'espèce aviaire. Elles sont aussi et surtout
des indicateurs du degré de
désinfection des couvoirs étudiés.
Actuellement, selon Musgrove et al (2006) et
Diarrassouba et al (2007) des souches
d'Escherichia coli apparemment non pathogènes,
isolées de poulet sains, possèdent certains gènes de
virulence pouvant causer des problèmes sanitaires aussi bien chez
l'homme que chez les volailles.
2. Conséquences sur le taux de mortalité
embryonnaire :
L'amélioration relative de l'état de
désinfection des trois couvoirs après la réalisation de la
première série A, a permis de nous indiquer l'influence du niveau
de contamination de l'environnement des OAC sur le taux de mortalité
embryonnaire. Il a baissé d'une façon significative dans la
seconde série B (voir analyse statistique en annexe 1) dans les couvoirs
A, B et C comme montré dans la figure 29, ce qui est en parfaite
concordance avec les travaux de Board et al en 1986
et Fasenko et al en 2009. Ce taux de mortalité
embryonnaire peut expliquer en partie pourquoi le taux d'éclosion
optimal de la souche commerciale n'est pas atteint.
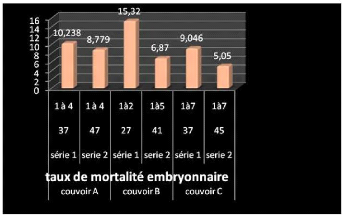
Figure 29: Comparaison entre les taux de mortalité
embryonnaire
Les résultats montrés dans la figure 30
indiquent que le taux d'éclosion est très nettement
influencé par le jeune âge de la reproductrice dans la
série A du couvoir B (27semaines) où on enregistre le plus faible
taux (71,09) et la plus haute valeur de mortalité embryonnaire (15,32%).
Ceci peut être expliqué selon Pedroso et al.
(2005)
par la présence d'un taux élevé d'OAC
infertiles, la fréquence du non viabilité des germes et par
l'épaisseur de la coquille et l'incapacité des poussins de
petites tailles à la percer et sortir à l'éclosoir.
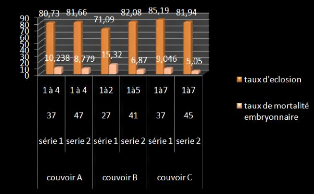
Figure 30: Illustrations des différents taux
d'éclosion et de mortalité embryonnaire 3.
Conséquences sur le poussin :
Dans cette étude nous constatons que dans les deux
séries, le poids moyen du poussin à l'éclosion est
lié essentiellement à deux paramètres, l'âge de la
reproductrice et le poids moyen des oeufs à couver (figures 31, 32 et
33).
l'âge de la reproductrice : dans les trois couvoirs et
dans les deux séries nous constatons un poids moyens des poussins
éclos plus élevé à 47 semaines (35,8 grammes)
qu'à 37 semaines (33,15 grammes) pour le couvoir A, un poids moyen
à 41 semaines meilleur qu'à 27 semaines (35,12 grammes contre
30,75 grammes) pour le couvoir B et les meilleurs moyennes sont
enregistrées au couvoir C à l'âge de 45 semaines avec 37,45
grammes contre 34,65 grammes à 37 semaines.
le poids de l'oeuf à couver : ce paramètre est
aussi vérifié ; le poids moyen du poussin à
l'éclosion est fonction du poids moyen des OAC au niveau des trois
couvoirs et dans les deux séries A et B. Au niveau du couvoir A et pour
des poids des oeufs de 57,66 et 61,33 grammes on obtient des poids moyens de
poussin respectifs de 33,15 et 35,8 grammes, dans le couvoir B , pour des OAC
de 59,72 grammes on a eu des poussins
de 35,12 grammes cont re d es poussins de
30,75 grammes pour des OAC de 47,33 grammes, ce qui est val
able aussi pour le couvoir C avec des OAC de 58,
6 et 63,51 grammes on a obtenu des p oussins de poids
moyens respectifs de 34,6 5 et 37,45
grammes.
|
80,73
|
|
81,66
|
|
|
|
|
|
61,33
|
|
57,66
|
|
|
|
|
|
33,15
|
35,8
|
|
|
|
|
|
|
|
|
|
|
1 à 4
37
|
|
1 à 4
47
|
|
90 80 70 60 50 40 30 20 10 0
poids d
es
O.A.C
taux
d'eclos ion poids du poussin

|
Figure 32 : Evolution du p
oids
|
du poussin en fonction du poids des OAC (Cou
voir
|
B)
|
|
|
|
|
Figure 31 : Evolution du po ids d
|
u poussin en fonction du poids des OAC (C
ouv
|
oir A)
|
|
|
|
90 80 70 60 50 40 30 20 10 0
Poids des OAC Taux d'ec
losion Poids du poussin

|
|
82,08
|
|
71,09
|
|
|
|
|
|
|
59,72
|
|
47,33
|
|
|
30,75
|
35,12
|
|
|
|
|
|
|
|
|
|
|
1à2
27
|
|
1à5
41
|
|
Po ids des OAC
Ta ux d'eclosion
C)
Figure 33 : Evolution du p
oids
du poussin en fonction du poids des OAC (Cou
voir
|
85 ,19
|
81,94
|
|
|
|
|
|
63,51
|
|
58,6
|
|
|
|
|
|
34 ,65
|
37,45
|
|
|
|
|
|
|
|
|
|
|
1à7
37
|
|
1à7
45
|
|
90
80
70
60
50
40
30
20
10
0
po ids des po ussins

CONCLUSION ET PERSPECTIVES
Lors de cette étude, nos observations indiquent bien
que la désinfection et la conduite hygiénique au sein de nos
couvoirs restent bien en deçà des normes recommandées pour
une meilleure maitrise sanitaire.
Nous avons trouvé des germes zoonotiques
(Salmonella enteritidis) et des germes
pathogènes et/ou opportunistes de l'espèce aviaire
(Escherichia coli- Staphylococcus- Streptococcus- Pseudomonas-
Enterobacter- Klebsiella- Proteus- Citrobacter- Microcoque) aux
différents stades de développement embryonnaire.
La charge microbienne était intense à partir de
J19 avec un passage trans-coquillière et une contamination de l'embryon,
produisant ainsi un poussin d'un jour à J21 destiné à la
filière chair d'une qualité inférieure à l'optimum
de la souche commerciale utilisée et sélectionnée à
cette fin.
Nous pensons donc que certainement et en aval, il y a une
entrave à l'extériorisation des performances sanitaires et
zootechniques, avant même l'exposition de ces poussins à des
agressions microbiennes externes dans les bâtiments d'élevages. De
plus que sur le plan des défenses immunologiques, les poussins sont
vulnérables à la naissance.
La présence de salmonelles et
d'E.coli, comme nous l'avons constaté,
constitue un risque et un danger potentiels pour la santé publique, et
in fine pour le consommateur qui constitue la fin de
la chaine. L'émergence des cas de salmonellose à
Salmonella enteritidis signe la domination de la
pathologie en matière de toxi-infection d'origine aviaire.
Dans toutes les éclosions, les différences entre
les capacités de la souche commerciale et les taux des éclosions
obtenues dans nos couvoirs sont statistiquement significatives malgré
une légère amélioration à la seconde série
d'étude, suite à des différences aussi significatives
entre les taux de mortalité embryonnaire dans les deux séries.
D'autre part l'insuffisance relevée dans la qualité
des OAC (dans toutes les séries, poids inférieurs à celui
des OAC de la souche commerciale) n'est certainement pas sans
conséquences sur les performances des différents couvoirs
étudiés et particulièrement sur le poids des poussins
à l'éclosion impliquant l'amont de la filière que nous ne
devons pas négliger.
Malgré une amélioration relative dans la
deuxième partie de l'étude, La qualité
bactériologique de l'eau en usage dans les trois couvoirs n'est conforme
ni aux normes algériennes (1998) (annexe2) et encore moins à
celles de la directive européenne (1995) (annexe 2) définissants
les critères microbiologiques d'une eau potable ce qui influe
négativement sur l'efficacité de la désinfection.
L'information à destination des aviculteurs, la
formation du personnel des couvoirs, la conception puis l'entretien et la
désinfection des locaux sont certainement les facteurs primaires qu'il
faut absolument améliorer.
Par conséquent, il serait intéressant de suivre
un échantillon d'élevage depuis le couvoir, en réalisant
notamment un serotypage des souches d'E. coli afin de
déterminer avec exactitude quelles sont les souches pathogènes
fréquemment rencontrées en élevage avicole dans notre
pays.
Il serait aussi important et intéressant de rechercher
si ces contaminants sont liés à un phénomène de
résistance vis-à-vis des anti-infectieux les plus utilisés
en médecine vétérinaire en Algérie.

REFERENCES BIBLIOGRAPHIQUES
R EFERENc'E~
Afssa, 2000a. La décontamination des p
oul H.S 2000.
Afssa, 2000b. La conduite hygiénique e
n éle
Afssa, 2006. Evolution des risques sanit
aire
muscle et technologie des viandes. 19
Alderson M., Speers D., Emslie K., and
Nad
single disease. The journal of bone and
Babini G.S., and Livermore D.M., 2000.
Eff
monobactam inhibitor of Amp c B lact
Barman T.K., Sharma V.D., and
Kumar S., 2
Salmonella toxid (vaccine).
Indian jour
Barrow P.A., Tuckey J.F., and Simpson
J.M.
with Salmonella typhimurium gram
ne
98(3): 311-322.
Baron F., 1998. Etude du comportemen t
de
Rennes, France P120.
Bellairs R., 1971. Order and adjustment
in t
processes in higher vertebrates. L OGO
Benton CE.Jr., and Brake J., 2000.
Effec ts o
breeder eggs. Poultry science,79 (
11):
Board R.G., Loseby S., and Miles V.R.,
1 979
20: 413-420.
Bruce J., and Drysdale E.M., 1994.
Tran- she
Fuller, 63-91.
Bruzual J.J., Peak S.D., Brake J., and
Pe eble
incubation and brooding tempera ture
Poultry science, 79:827-830.
Bruzual J. J., Peak S.D., Brake J., and
Pe eble
hatchability and body weight of b roile
Casa M., Lepine F., Milot S., et Dazois
C., 20
salmocheleines et la virulence de la so
immunity, vol 76, N° 8:
3539-3549.
Chalghoumi R.,Thewis A., Portelle D., a
nd
simultaneously directed against Sa lmo
Poultry science. 87:32-40.
Chousalkar K.K., and Robert J.R.,
2007. Ult
eggshell-forming regions of the ov iduct
Christensen V.L., Wineland M.J., Fasen
ko
glucose and supply and demand t issue
1729-1735.
Christensen V.L., Grimes J.L., Wineland M.
incubation following prolonged eg g st
Christensen V.L., Wineland M.J., Ort D .T.,
M
incubator humidity as factors in e mbry
science, 5(9):830-837.

he early stage of bird development. Page 69. Devel opm
S PRESS Ltd., London, UK.
f atmospheric ammonia on albumen height and pH of fr
1562-1565.
. A note on microbial growth on eggshells.
British p oult
Becken Y., 2008. Production of hen egg yolk
immun oglo
nella enteritidis and
Salmonella thyphimurium in the sa
J., and Davis G.S., 2003.
Accelerating embryonic gro wth
orage. 1 embryonic livability. Poultry
science, 82:1863 -
ann K.M., and Neely E.R., 2006.
Eggshell conduct ance
o survival and poult growth. International journal
o f po
aillers des volailles au sol, Science et techniques
avic oles, numéro
ra structural observation on effects of infectious br
onch
of the commercial laying hen. Poultry
science 86: 1915
G.M., and Donaldson W.E., 2001.
Egg storage effec t on
glycogen concentration of broiler embryo. Poultry
scie
vage, Science et techniques
avicoles, numéro H.S, 2 000
s : Campylobacter et Salmonelles. 12eme
journée des scie 7-201.
e S., 1986. Acute haematgenous osteomyelitis
and sept
joint surgery, 68(2):268-274.
ect of conalbumine DM 2000 of Syn 2190, a 1.5 dih ydro
amase. Journal antimicrobial
chemotherapy, 45: 105- 10
005. Protective efficacy of maternal
antibodies indu ced
nal of experimental biology, 43(2):
163-6.
s E.D., 2000b. Effect of relative humidity
during inc uba
r chicks from young breeder flock. Poultry
science, 7 9:1
08. Contribution des gènes IROBCDEN
pour la prod ucti uche Escherichia Coli pathogène
aviaire O78. Infec
tion
, 1987. Inhibition of colonization of the
chicken alim ent
gative facultative anaerobic bacteria. Epidemiology
and
s E.D., 2000a. Effect of relative humidity
during the last five days of on performance of broiler chicks
from young broiler breeders.
ll transmission in microbiology of the avian egg, ed
RG
Salmonella enteritidis dans le blanc d'oeuf. PhD the
sis,
during
1868.
and
ultry
ry science,
tion on
385-1391.
on des
and
Board and
itis virus in
-1919.
plasma
nce, 80:
ary tract
infection,
xy 4 pyridon 9.
by
esh broiler
.
nces du
bulin
me egg yolk.
ic arthritis- A
ENSA
ental
Clavijo R.I., Loni C., Anderson G.L., Riley L.W.,
and Sanguei lu., 2006. Identification of genes
associated with survival of Salmonella enteritidis
serovar enteritidis in chicken egg albumen. Applied and
environmental microbiology, 72:1055-1064.
Colless F.M., Dingle K.E., Cody A.J., and
Maiden M.C.J., 2008. Comparison of campylobacter population in
wild gees with those in starlings and free range poultry on the same farm.
Applied and environmental microbiology, (74):
3583-359O.
Collin A., Shinder D., Mercerand F., Tisserand S., Picard
M., and Yahav S., 2005. Les manipulations thermiques
pendant l'embryogenèse affectent la température corporelles et la
croissance du poussin. Sixième journée de recherche avicole, st
Malo .30-31.
Collin A., Picard M., and Yahav S.,
2005. The effect of duration of thermal manipulation during broiler
chick
embryogenesis on body weight temperature of post hatched chicks.
Animal research, 54:105-111.
Cook M.I., Beissinger S.R., Toranzos G., Rodriguez R.A.,
and Arendt W.J., 2003. Trans-shell infection by
pathogenic microorganisms reduces the shelf life or non incubated bird's eggs:
a constraint on the onset of incubation. Proceedings of biological
science, 270(1530):2233-2240.
Coufal C.D., Chavez C., Knape K.D., and
Carey J.B., 2003. Evaluation of method of ultraviolet light
sanitation of broiler hatching eggs. Poultry science,
82:754-759.
Decker D., Vaulint D., Callewaert L.,
Aertsen A., and Michiels C.W., 2008. Role of the
lysozyme inhibitor ivy in growth or survival of Escherichia
coli and Pseudomonas aeruginosa
bacteria in the hen egg white and in human saliva.
Applied and environmental microbiology, 4434-4439.
Decuypere E., Bryse J., and Buys S.,
2000. Ascites and broiler chickens: Exogenous and endogenous
structural and functional causal factors. World's poultry science
journal, 56: 367-377.
Deeming D.C., 1989. Characteristics of unturned
eggs: critical period, retarded embryonic growth and poor albumen
utilization. British poultry science, 30: 239-249.
De Smith L., Bruggeman V., Debonne M., Tona J.K., Kamers
B., Everaert N., Withers A., Onagbesam O., Arckens L., De-Baerdemaeker J.,
and Decuypere E., 2008. The effect of nonventilation
during early incubation on the embryonic development of chicks of two
commercial broiler strains differing in ascites susceptibility.
Poultry science, 87:551-560.
Devriese L.A., Vancnneyt M., Baele M., Vaneechoutte M.,
De Graf E., Snauwaert C., Cleenwerck I., Dawynot P., Swings J., Decostere A.,
and haesebrouck F., 2005. Staphylococcus
pseudodintemedius sp. Nov, a coagulase-positive species from
animals. International journal of systematic and evolutionary
microbiology, 55:1569-1573.
Dho-Moulin M., and Fairbrother J.M.,
1999. Pathogenic Escherichia coli (APEC).
Veterinary research, 30: 299- 216.
Dho-Moulin M., 1993. Les Escherichia
coli pathogènes des volailles. Les anales de
médecine vétérinaire, 137 :353-360.
Diarrassouba F., Dirra M.S., Bach S., Delaquis P.,
Pritchard J., Topp E., and Skura B.J., 2007.
Antibiotic resistance and virulence genes in commensally
Escherichia coli and
Salmonella isolated from commercial broiler chicken
farms. Journal of Food protection, 70: 1316-1327.
Direction des services vétérinaire(DSV).,
2004. Note 787/14, renforcement du contrôle
vétérinaire en aviculture, 6-17.
Edens F.W., Parkhurst C.R., Qureshi M.A., Casas I.A.,
and Havenstein G.B., 1997. Atypical
Escherichia coli
strains and their association with poult enteritis and mortality
syndrome. Poultry science, 76: 952-960.
Elibiol O., and Brake J., 2003. Effect of
frequency of turning from 3 to 11 days of incubation on hatchability of
broiler hatching eggs. Poultry science,
82: 357-359.
Elibiol O., and Brake J., 2006a.
Effect of flock age, cessation of egg turning, and turning frequency
through the
second week of incubation on hatchability of broiler hatching
eggs. Poultry science.85:1498-1501.
Elibiol O., and Brake J., 2006b.
Effect of turning angle and frequency during incubation on
hatchability and incidence of unhatched broiler embryos with head in the small
end of the egg. Poultry science. 85:1433- 1437.
Elibiol O., and Brake J., 2008.
Effect of egg position during three and fourteen days of storage and
turning frequency during subsequent incubation on hatchability of broiler
hatching eggs. Poultry science, 87:1237- 1241.
Everaert N., Kamers B., Witters A., De Smit L., Debonne
M., Decuypere E., and Bruggeman V., 2007. Effect of
four percent carbon dioxide during the second half of incubation of embryonic
development, hatching parameters, and post hatch growth. Poultry
science, 86:1372-1379.
Eyald-Giladi H., and Kochav S., 1976.
From cleavage to primitive streak formation: A complementary normal
table and a new look at first stages of the development of the chick. I.
General morphology. Development and biology, 49:
321-337.
Fasenko G.M., 2007. Egg Storage and the embryo.
Poultry science, 86:1020-1024.
Fasenko G.M., O'Dea E.E., 2008. Evaluating
broiler growth and mortality in chicks with minor navel conditions at hatching.
Poultry science, 87: 594-597.
Fasenko G.M., O'Dea E.E.Christopher., and
McMullen L.M., 2009. Spraying hatching eggs with microbial
load without compromising broiler production parameters. Poultry
science, 88: 1121-1127.
French N.A., 1997. Modeling incubation
temperature: the effects of incubator design, embryonic development and egg
size. Poultry science, 76: 124-133.
Gabriel I., Mallet S., et Lessir. M.,
2003. La microflore digestive : une composante oubliée de la
nutrition des volailles. INRA-station de recherche avicole.5eme journée
de recherche avicole.
Gabriel I., Mallet .S., et Sibille P.,
2005. La microflore digestive des volailles: facteurs de variation et
conséquence sur l'animal. INRA Production
Animale .18(5) :309- 322.
Gautier A.V., Bouchardon., et Kempf I.,
2008. Les mycoplasmoses aviaires, Communication 2008, Afssa.
Giraud E., Leroy-Setrin S., Flaujac G., Cloeckaert A.,
Dho-Moulin M., and Chaslus-Dancla E., 2001.
Characterization of high level fluoroquinolones resistance in
Escherichia coli O78:K80 isolated from turkey.
The journal of antimicrobial
chemotherapy, 97(3) 341-343.
Gordon R.W., and Roland D.A., 1997.
Performance of commercial laying hen fed various phosphorus levels,
with and without supplemental phytax. Poultry
science, 76: 1172-1177.
Gradel K.O., Sayers A.R., and Davies
R.H., 2004. Surface disinfection tests with Salmonella
and a putative
indicator bacterium, mimicking worst-case scenarios in poultry
houses. Poultry science, 83: 1636-1643. Gross W.G., 1994.
Diseases due to Escherichia coli in domestic animal and human.
Cab international
Wallingford, 237-259.
Gupta S.K., and Bakst
M.R., 1993. Turkey embryo staging from cleavage through hypoblast
formation. Journal of morphology, 217: 317-325.
Hassanzadeh M., Bozorgmehri Fard M.H., Buyse J.,
Bruggeman V., and Decuypere E., 2004. Effect of
chronic hypoxia during embryonic development on physiological functioning and
on hatching and post-hatching parameters related to ascites syndrome in broiler
chickens. Avian pathology, 33(6), 558-564.
Heier B.T., and Jarp J., 2001.
An epidemiological study of thee hatchability in broiler breeder flocks.
Poultry science, 80:1132-1138.
Hudault S., Bewa H., Bridonneau C., and
Ribaud P., 1985. Efficiency of various bacterial suspensions
derived from cecal floras of conventional chickens in reducing the population
level of salmonella typhimurium in gnotobiotic mice
and chicken intestines. Canadian journal of
microbiology, 31(9): 832-838.
Humbert F., Salvat G., Morin M., Colin P., Lahellec C.,
et Bennejean G., 1989. La colonisation
spontanée de la muqueuse caecale du poulet exempt d'organismes
pathogènes spécifiés d'une flore de barrière chez
le poulet conventionnel. Etude au microscope électronique à
balayage. Avian pathology, 18:577-589.
Ibrahim H.R., Sugimoto Y., and Aoki T.,
2000. Ovotransferrin antimicrobial peptide (OTAP-92) kills bacteria
through a membrane damage mechanism. Biochimica et biophysica
Acta, 1523:196-205.
Joerger R.D., and Ross T., 2005.
Genotypic diversity of Escherichia coli
isolated from cecal content and mucosa of one- to six- week- old
broilers. Poultry science, 84:1902-1907.
Jordan F.T.W., and Pattison M., 1996.
Poultry diseases W.B Sanders Company: London, 38-43.
Joseph N.S., Lourens A., and Moran
Jr.E.T., 2006. The effect of suboptimal eggshell temperature during
incubation on broiler chick quality, live performance and further processing
yield. Poultry science, 85:932- 938.
Karcher D., and Applegate T., 2008.
Survey of entérocytes morphology and tight junction formation
in the small intestine of avian embryos. Poultry
science, 87: 339-350.
Kempf I, 1997. Les mycoplasmoses aviaires.
Le point vétérinaire, 28(182):41-48.
Kempf I, 2006. Diagnostic et contrôle des
mycoplasmoses aviaires. Le nouveau praticien
vétérinaire, 3:49-53. Kirk S., Emmans G.C.,
Mc Donald.R., and Arnot D., 1980. Factors affecting
the hatchability of eggs from broiler breeder. British poultry
science, 1:37-53.
Kleven S.H,2003. Mycoplasma synoviae
infection. In: Saif Y.M., Bames H.J., Glisson J.R., Fadly A.M., Mc Dougald
L.R., and Swayne D.E. (eds), 756-766.
Kobayashi K., Hattori M., Hara-Kudo Y., Okubo T.,
Yamamoto S., Takita T., and Sugita-Konishi., 2004.
Glucopeptide derived from hen egg ovomucin has the ability to
bind enterohemorragic Escherichia
coliO157:H7. Journal of agricultural and
food chemistry, 52(8): 5740-6.
Korsan N., Klinquart A., and Daube G.,
2004. Salmonella spp. Dans les denrées alimentaires
d'origine animale : un réel problème de santé publique ?
Annales de médecine vétérinaire.
148, 174-193.
Le Douarin N.M., 2004. The avian embryo as a
model to study the development of the neural crest: a long and still ongoing
story. Mechanisms of development, 121(9):
1089-1102.
Lee S.W., Browning G.F., and Markham
P.F, 2008. Development of replicable OriC plasmid for
Mycoplasma gallisepticum and mycoplasma
imitans, and gene disruption through homologous recombination in
M. gallisepticum.
Microbiology, (154): 2571-2580.
Leksrisompong N., Romero Sanchez R., Plumstead P.W.,
Brannan K.E., and Brake J., 2007. Broiler
incubation.1. Effect of elevated temperature during late incubation on body
weight and organs of chicks. Poultry science,
86:2685-2691.
Leksrisompong N., Romero Sanchez R., Plumstead P.W.,
Brannan K.E., Yahav S., and Brake.J., 2009. 2.
Interaction of incubation and brooding temperatures on broiler
chick feed consumption and growth. Poultry science,
88:1321-1329.
Lim H.S., Namkung H., and Paik I., 2003.
Effects of phytase supplementation on the performance, egg quality
and laying hen fed different levels of deatary calcium and
nonphytate phosphorous. Poultry science,
82(1):92-99.
Lourens A., Molenar R., Van denbrand H., Heetkamp M.J.W.,
Meijerhof R., and Kemp B., 2006. Effect of egg size
on heat production and the transition of energy from egg to
hatchling. Poultry science 85:770-776.
Lourens A., Van denbrand H., Meijerthof R., and
Kemp B., 2005. Effect of eggshell temperature during
incubation on embryo development, hatchability, and post hatch
development. Poultry science 84:914- 920.
Mac Owan K.J., Atkinson J.M., Bell A.M., Brand T.F.,
Randall C.J., 1984. Egg transmission of a respiratory
isolate of mycoplasma synoviae and
infection of the chicken embryo. Avian pathology,
13:51-58.
Manil j., 2003a. Facteurs de virulence et
propriétés spécifiques des souches invasives d'E coli: I)
les adhésines
et facteurs de colonisation. Les annales de
médecine vétérinaire.147, 105-126.
Manil j., 2003b. Facteurs de virulence et
propriétés spécifiques des souches invasives d'E coli:
II)
franchissement des muqueuses et propriétés
invasives. Les annales de médecine
vétérinaire.147, 159-171. Manil j., 2004.
Facteurs de virulence et propriétés spécifiques
des souches invasives d'E coli : IV) souches
necrotoxiques. Annales de médecine
vétérinaire.148, 121-132.
Miranda J.M., Vasquez B.I., Fente C.A., Barros-Velasquez
J., Cepeda A., and Franco C.M., 2008. Evolution of
resistance in poultry intestinal Escherichia
coli during three commonly used antimicrobial therapeutic
treatments in poultry. Poultry science,
87:1643-1648.
Musgrove M.T., Northcutt J.K., Jones D.R., Cox N.A.,
and Harrison M.A., 2008. Enterobacteriaceae and
related organisms isolated from shell eggs collected during commercial
processing. Poultry science, 87:1211-1218.
Musgrove M.T., Jones D.R., Northcutt J.K., Cox N.A.,
Harrison M.A., Fedorka-Gray P.J., and Ladely S.R., 2006.
Antimicrobial resistance in salmonella and
Escherichia coli isolated from commercial shell eggs.
Poultry science, 85: 1665-1669.
Nakano T., Ikawa N.I., and Ozimzk L.,
2003. Chemical composition of chicken eggshell and shell membranes.
Poultry science, 82(3): 510-514.
Nawaz M.S., Khan A.A., Khan A.S., Paine D.D., Pothuluri
J.V., and Cerniglia C.E., 1999. Biochemical and
molecular characterization of erythromycin-resistant avian
staphylococcus spp isolated from chickens.
Poultry science, 78:1191-1197.
Nakamura K., Cook J.K., Frazier J.A., Narita M., 1992.
Escherichia coli multiplication and lesions in the
respiratory tract of chickens inoculated with infectious
bronchitis virus and/or Escherichia coli. Avian
diseases, 36:881-890.
O.I.E., 2005. Salmonelloses, chapitre 2.10.3,
Manuel terrestre de l'O.I.E, 1117-1133.
Olsen M.W., 1942. Maturation, fertilization and
early cleavage in the hen's egg. Journal of
morphology, 70: 513-533.
Parriera V.A., Arns C.W., and Yano T.,
1998. Virulence factors of avian Escherichia coli associated with
swollen head syndrome. Avian pathology,
27,148-154.
Pedroso A.A., Andrade M.A., Café B.B.,
Manten.Leandro J.F.M., and Stringhini J.H., 2005
fertility and hatchability of eggs laid in the pullet- to breeder
transition period and the initial production period. Animal
reproduction science, 90(3): 355-364.
Peebles E. D., Miller L.Sh., Whitmarch Sh., Latour M.A.,
and Gerard Patrick D., 1999. Embryo and yolk
compositional relationship in broiler hatching eggs during
incubation. Poultry science, 78:1435-1442.
Peebles E.D., Doyle S.M.,Zumwalt C.D.,Gerard P.D., Latour M.A., Boyle
C.R., and Smith T.W.,2001. Breeder
age influences embryogenesis in broiler hatching eggs.
Poultry science, 80:272-277.
Peebles E.D., Burnham M.R., Gardner C.W., Brake J.,
Bruzual J.J., and Gerard P.D., 2001. Effect of
incubational humidity and hen age on embryo composition in broiler hatching
eggs from young breeders. Poultry science,
80:1299-1304.
Peebles E.David., Keirs Robert W., Bennett Lioyd W.,
Cummings Timothey S., Whitmarsh Shron K., and Gerard P.D.,
2004. Relationship among post-hatch physiological parameters in
broiler chicks hatched from young breeder hen and subjected to delayed brooding
placement. International journal of poultry science,
3 (9):578-585.
Picoux J.B., 2004. Le monde animal,
réservoir de maladies émergeantes pour l'animal. Communication
lors d'une conférence présentée le 1 juillet 2004 (les
sciences pour vous).
Pieskus J., Pia Franciosini M., Casagrande Proietti P.,
Reich F., Kazeniauskas E., Butrimaite-Ambrozevicienne
C., Mauricas M., and Bolder N., 2008.
Preliminary investigations on salmonella
spp, incidence in meat chicken farms in Italy, Germany, Lithuania and
Netherlands. International journal of poultry
science, 7(8): 813-817.
Rao V., and Chauhan H.V., 1987.
The pathology and pathogenesis of salmonella Stanley infection in
experimental chicks. Research in veterinary science,
42(3): 287-293.
Reis L.H., Gama L.T., and Chaveiro S.,
1997. Effect of short storage conditions and broiler age on
hatchability, hatching time, and chick weight. Poultry
science, 79:827-830.
Rehault S., Anton M., Nau F., Gautron J.,
et Nys Y., 2007. Les activités biologiques de
l'oeuf. INRA productions animales, 20 : (4)
337-348.
Ruan G.P., Ma L., Menq X.J., Wang X.N., Lin Y., Wu Z.Q.,
He X.W., Wang J.F., and Zhou Y., 2007. Quantification
of antibody IgY titers in hen eggs following immunization and the use in
detecting cell surface molecules on nitro cellulose membranes.
Journal of immunoassay & immunonochimistry,
28(1): 35-45.
Russel S.M., 2003. The effect of electrolyzed
oxidative water applied using pathogenic and indicator bacteria on the surface
of eggs. Poultry science, 82:158-162.
Sattar Khan M.A., Nakamura S., Ogawa M., Akita E.,
Azakami H., and Kato A., 2000. Bacterial action of
egg yolk Phosvitine against Escherichia coli under
thermal stress. Journal of Agricultural and Food
Chemistry, 48(5): 1503-1506.
Shin J.H., Yang M., Nam S.W., Kim J.T., Myung N.H., Bang
W.G., and Roy I.H., 2002. Use of egg yolk-derived
immunoglobulin as an alternative to antibiotic treatment for
control of Helicobacter pylori infection.
Clinical and diagnostic laboratory immunology, 95(5):
1061-6.
Sklan D., 2001. Development of the digestive
tract of poultry. World's poultry science journal,
57: 415-428. Sklan D., 2003. Fat and carbohydrate use in
posthatch chicks. Poultry science, 82: 117-122.
Stoleson S.H., and Beissinger S.R.,
1999. Egg viability as a constraint on hatching synchrony at high
ambient temperature. Journal of animal and ecology,
68: 951-962.
Stordeur P., et Mainil J., 2002.
Les colibacilloses aviaires. Les annales de médecine
vétérinaire.146, 11-18.
Suarez M.E., Wilson H.R., Mather F.B., Wilcox C.J.,
and Mc Pherson B.N., 1997. Effect of strain and age
of the broiler breeder female on incubation time and chick weight.
Poultry science, 76: 1029-1036.
Tona K., Onagbesan O.M., Jego Y., Kamers B., Decuypere
E., and Bruggeman V., 2004. Comparison of embryo
physiological parameters during incubation, chick quality, and growth
performance of three lines of broiler breeders differing in genetic composition
and growth rate. Poultry science, 83:507-513.
Tona K., Bamelis F., De Ketelaere B., Bruggeman V.,
Moraes V.M., Buyse J., Onagbesan O.M., Decuypere E., 2003. Effect of
egg storage time on spread of hatch, chick quality and chick juvenile
growth. Poultry science, 82: 736-741.
Tona K., Kemps B., Bruggeman V., Bamelis F., De Smith L.,
Onagbesan., De B aerdemaeker J., and Decuypere E., 2005.
Comparison of three lines of broiler breeders differing in ascites
susceptibility or growth rate .1. Relationship between acoustic resonance data
and embryonic or hatching parameters. Poultry
science, 84:1439-1445.
Tona K., Onagbesan O.M., Jego Y., Kamers B., Decuypere
E., and Bruggeman V., 2004. Comparison of embryo
physiological parameters during incubation, chick quality, and growth
performance of three lines of broiler breeders differing in genetic composition
and growth rate. Poultry science, 83:507-513.
Uni Z., Noy Y., and Sklan D., 1999.
Post hatch development of small intestinal function in the poult.
Poultry science, 78: 215-222.
Uni Z., Smirmov A., and Sklan D., 2003.
Pre and posthatch development of goblet cells in the small intestine:
effect of delayed access to feed. Poultry science,
82: 320-327.
Valenti P., Antonini G., Von Hunolstein C., Visa P., Orsi
N., and Antonini E., 1983. Studies on the
antimicrobial activity of ovotransferrin. International journal of
Tissue Reactions, 5(1): 97-105.
Venkitanarayanam K.S., Ezeike G.O., Hung V.C.,
and Doyle M.P., 1999. Inactivation of
Escherichia coli O157:H7 and Listeria
monocytogenes on plastic chicken cutting board by electrolyzed
oxidizing water. Journal of Food protection, 62(8):
857-860.
Villate D., 2001. Maladies des volailles, 2eme
édition France agricole, 55-56 et 236-269.
White D.G., Wilson R.A., San Gabriel A., Saco M.,
and Whithttam T.S., 1990. Genetic relationships among
strains of avian Escherichia coli associated with
swollen head syndrome. Infection and immunity, 58,
3613- 3620.
Wilson D.J., Gabriel E., Leatherbarrow A.L.H.,
Cheesbrough J., Gee S., Bolton E., Fox A., Anthony Hart C., Diggle P.J.,
and Fearnhead P., 2008. Rapid evolution and the
importance of recombination to the gastro enteritic pathogen campylobacter
jejuni. Molecular biology and evolution, 26(2):
385-397.
Wilson H.R., Neuman S.L., Eldred A.R., and
Mather F.B., 2003. Embryonic malpositions in broiler chickens
and bob-white quail. Journal applied of poultry
research, 12: 14-23.
Wineland M.J., Christensen V.L., Yildrum I., Fairchild
B.D., Mann K.M., and Ort D.T., 2006. Incubator
temperature and oxygen concentration at the plateau stage in
oxygen consumption affects intestinal maturation of broiler chicks.
International journal of poultry science 5
(3):229-240.
Wineland M.J., Christensen V.L., Yildrum I., Fairchild
B.D., Ort D.T., and Mann K.M., 2006. Incubator
environment interacts with genetic line of broiler at the plateau stage to
affect embryo plasma thyroxin and triiodothyronine concentrations.
International journal of poultry science, 5(8):
714-722.
Wolanski N.J., Renema R.A., Robinson F.E., Carney V.L.,
and Fancher B.I., 2007. Relationships among egg
characteristics, chick measurements and early growth traits in ten broiler
breeder strains. Poultry science, 86:1784-1792.
Yalcin S., çabuk M., Bruggeman V., Babacanoglu E.,
Buyse J., Decuypere E., and Siegel P.B., 2008.
Acclimation to heat during incubation.1.Embryonic morphological
traits, blood biochemistry, and hatching performance. Poultry
science 87: 1219-1228.
Yassin H., Velthuis A.G.J., Boerjan M., Van Riel J.,
and Huirne R.B.M., 2008. Field study on broiler eggs
hatchability. Poultry science, 87:2408-2417.
Yegani M., and Korver D.R., 2008.
Factors affecting intestinal health in poultry. Poultry
science, 87: 2052-2063. Yogaratnam V, 1995.,
analysis of the causes of high rates of carcass rejection at a poultry
processing plant. The veterinary record, (9):
215-217.
Zahraei-Salehi T., and Farashi-Bounab
S., 2006. Antibiotics susceptibility pattern of
Escherichia coli strains isolated from chickens with
coli septicemia in Tabriz province, Iran. International journal of
poultry science, 5(7): 677-684.
Zhou H., Gong J., Brisbin J.T., Yu H., Sanei B., Sabour
P., and Sharif S., 2007. Appropriate chicken sample
size for identifying the composition of broiler intestinal microbiota affected
by dietary antibiotics, using the polymerase chain reaction - denaturing
gradient gel electrophoresis technique. Poultry
science, 86: 2541- 2549.
Zhou Q., Gu CQ., Hu X.Y., Wang D.H., Li X.M., Zhou SQ.,
and Cheng F., 2007. Role of interleukin-6 in
the
pathogenesis of avian model of Staphylococcus
Aureus arthritis. Poultry science,
86:1245-1250.
http://www.oie.int/fr/normes/mcode/frchapitre1.6.3.pdf,
O.I.E., 2008 Procédures d'hygiène et de sécurité
sanitaire dans les élevages de volailles reproductrices et les couvoirs.
Chapitre 6.3. Code sanitaire pour les animaux terrestre. Consulté le 20
Mars 2009.
http://www.asaim-europe.org/pdf/biosecurityf.pdf
Biosécurité et meilleurs pratiques de gestion aux Etats unis et
en
Europe occidentales pour la prévention et le
contrôle des maladies infectieuses dans les élevages de
reproduction et
les couvoirs .Consulté le 25 décembre 2008.
http://www.itavi.asso.fr/economie/ecofiliere/volailles.php?page=conso.
Évolution de la consommation des
volailles, ITAVI 2009. Consulté le 17 avril 2009.
http://www.office-elevage.fr/publications/marche2007/Volaille/Vol-monde.pdf
Le marché des produits avicoles
dans le monde, 2007. Consulté le 28 Novembre 2008.
www.caducee.net/breves/breve.asp?idb=3457&mots=all
la salmonelle et le campylobacter en ce qui concerne l'intoxication s ...
Source : OMS 25-28 février 2002 Première Conférence
paneuropéenne consulté le 15 novembre 2008.
http://who.int/entity/foodsafety/fsmanagement/...
programmes de lutte contre les salmonelles en fonction des risques locaux
liés à ... Une évaluation des risques conduite par la FAO
et OMS, 2007. Consulté le 15 novembre 2008
http://www.itavi.asso.fr/elevage/sanitaire/ref/charte2003.pdf
La charte de la qualité SNA dans les couvoirs
Annexes
ANNEXE 1
ANALYSE STATISTIQUE
StatBox 7.1 - Comparaison de 2 proportions - 01/07/2009
à 22:27:37
TAUX D'ECLOSION AU COUVOIR A SERIE A
Effectif 1 : 10850 / Total 1 = 13500 Effectif 2 : 11880 /
Total 2 = 13500 Test z pour 2 proportions
Test z pour 2 proportions :
Test z pour 2 proportions / Test
bilatéral
Remarque : la loi binomiale est approximée par la loi
normale
Valeur observée de la statistique z : -17,179
P-value associée : 0,000
Le test étant bilatéral, la p-value est
comparée au seuil de signification Alpha/2 : 0,025
Valeur critique de la statistique z : 1,960
Conclusion :
Au seuil de signification total Alpha : 0,050 on peut rejeter
l'hypothèse nulle d'égalité des proportions. Autrement
dit, la différence entre les proportions est significative
SERIE B
Effectif 1 : 10975 / Total 1 = 13500 Effectif 2 : 11475 /
Total 2 = 13500 Test z pour 2 proportions
Test z pour 2 proportions :
Test z pour 2 proportions / Test
bilatéral
Remarque : la loi binomiale est approximée par la loi
normale
TAUX DE MORTALITE AU COUVOIR A Effectif 1 :
1382 / Total 1 = 13500 Effectif 2 : 1185 / Total 2 = 13500 Test z pour 2
proportions
Test z pour 2 proportions / Test
bilatéral
Test z pour 2 proportions :
Remarque : la loi binomiale est approximée par la loi
normale
Valeur observée de la statistique z : 4,087
P-value associée : 21,82E-06
Le test étant bilatéral, la p-value est
comparée au seuil de signification Alpha/2 : 0,025
Valeur critique de la statistique z : 1,960
Conclusion :
Au seuil de signification total Alpha : 0,050 on peut rejeter
l'hypothèse nulle d'égalité
des proportions. Autrement dit, la différence entre les
proportions est significative
TAUX D'ECLOSION AU COUVOIR B SERIE A
Effectif 1 : 11900 / Total 1 = 16800 Effectif 2 : 12600 /
Total 2 = 16800 Test z pour 2 proportions
Test z pour 2 proportions :
Test z pour 2 proportions / Test
bilatéral
Remarque : la loi binomiale est approximée par la loi
normale
SERIE B
Effectif 1 : 12830 / Total 1 = 15690 Effectif 2 : 13650 /
Total 2 = 15690 Test z pour 2 proportions
Test z pour 2 proportions :
Test z pour 2 proportions / Test
bilatéral
Remarque : la loi binomiale est approximée par la loi
normale
Valeur observée de la statistique z : -12,752
P-value associée : 0,000
Le test étant bilatéral, la p-value est
comparée au seuil de signification Alpha/2 : 0,025
Valeur critique de la statistique z : 1,960
Conclusion :
Au seuil de signification total Alpha : 0,050 on peut rejeter
l'hypothèse nulle d'égalité
des proportions. Autrement dit, la différence entre les
proportions est significative
TAUX DE MORTALITE AU COUVOIR B Effectif 1 :
2574 / Total 1 = 16800 Effectif 2 : 1078 / Total 2 = 15690
Test z pour 2 proportions
Test z pour 2 proportions :
Test Z pour 2 proportions / Test
bilatéral
Remarque : la loi binomiale est approximée par la loi
normale
Valeur observée de la statistique z : 24,099
P-value associée : 0,000
Le test étant bilatéral, la p-value est
comparée au seuil de signification Alpha/2 : 0,025 Valeur critique de la
statistique z : 1,960
TAUX D'ECLOSION AU COUVOIR C SERIE A
Effectif 1 : 13580 / Total 1 = 16000 Effectif 2 : 14080 /
Total 2 = 16000 Test z pour 2 proportions
Test z pour 2 proportions :
Test z pour 2 proportions / Test
bilatéral
Remarque : la loi binomiale est approximée par la loi
normale
Valeur observée de la statistique z : -8,163
P-value associée : 0,000
Le test étant bilatéral, la p-value est
comparée au seuil de signification Alpha/2 : 0,025
Valeur critique de la statistique z : 1,960
Conclusion :
Au seuil de signification total Alpha : 0,050 on peut rejeter
l'hypothèse nulle d'égalité
des proportions. Autrement dit, la différence entre les
proportions est significative
SERIE B
Effectif 1 : 18240 / Total 1 = 22320 Effectif 2 : 19195 /
Total 2 = 22320 Test z pour 2 proportions
Test z pour 2 proportions :
Test z pour 2 proportions / Test
bilatéral
Remarque : la loi binomiale est approximée par la loi
normale
Valeur observée de la statistique z : -12,286
P-value associée : 0,000
Le test étant bilatéral, la p-value est
comparée au seuil de signification Alpha/2 : 0,025
Valeur critique de la statistique z : 1,960
TAUX DE MORTALITE AU COUVOIR C Effectif 1 :
1447 / Total 1 = 16000 Effectif 2 : 1127 / Total 2 = 22320 Test z pour 2
proportions
Test z pour 2 proportions :
Test z pour 2 proportions / Test
bilatéral
Remarque : la loi binomiale est approximée par la loi
normale
Valeur observée de la statistique z : 15,405
P-value associée : 0,000
Le test étant bilatéral, la p-value est
comparée au seuil de signification Alpha/2 : 0,025
Valeur critique de la statistique z : 1,960
Conclusion :
Au seuil de signification total Alpha : 0,050 on peut rejeter
l'hypothèse nulle d'égalité
des proportions. Autrement dit, la différence entre les
proportions est significative
RECOMMANDATION EUROPEENNE ET COMPARAISON AVEC L'ALGERIE
DES
NORMES MICROBIOLOGIQUES QUALIFIANT UNE EAU POTABLE.
|
GERMES
|
UNITES
|
DIRECTIVE CEE
|
NORMES
ALGERIE
|
|
Coliformes totaux
|
u/1OO ml
|
0
|
<10
|
|
Coliformes thermotolérants
|
u/100 ml
|
0
|
0
|
|
Streptocoques fécaux
|
u/100 ml
|
0
|
0 (u/50 ml)
|
|
Spores de bactéries
sulfitoréductrices
|
u/20 ml
|
-
|
<5
|
Staphylocoques pathogènes u/100 ml - -
Entérovirus u/10 l - -
Bactériophages fécaux u/50 ml -
-

Germes totaux à 37°C (24H)
à 22°C (72H)
Salmonelles u/5 l
u/ ml 100 <100
u/ml 10 <20
- -
Normes Européenne selon le décret N° 90-363 du
5 avril 1995.
Normes Algérienne selon l'arrêté
interministériel du 24 janvier 1998 modifiant et complétant
l'arrêté du 23 juillet 1994.
ILLUSTRATION DES
DIFFERENTES SOUS ESPECES DE
L'ESPECE
SALMONELLA ENTERICA
(OIE, 2005)
|
SOUS-ESPECE
|
NOM
|
ANCIENNE
NOMENCLATURE
|
NOUVELLE
NOMENCLATURE
|
|
I
|
S.enterica enterica
|
Sous espèce
|
Sous espèce
|
|
II
|
S.enterica salamae
|
Sous espèce
|
Sous espèce
|
|
III a
|
S.enterica arizonae
|
Sous espèce
|
Sous espèce
|
|
III b
|
S.enterica
diarizonae
|
Sous espèce
|
Sous espèce
|
|
IV
|
S.enterica houtenae
|
Sous espèce
|
Sous espèce
|
|
V
|
S.enterica bongori
|
Sous espèce
|
Espèce (2eme)
|
|
VI
|
S.enterica indica
|
Sous espèce
|
Sous espèce
|
JOURNAL OFFICIEL DE LA REPUBLIQUE ALGERIENNE
N° 36
7 Rabie Ethani 14248 /juin 2003
MINISTERE DE L'AGRICULTURE ET DU DEVELOPPEMENT
RURAL
Arrêté interministériel du 17 Dhou El Kaada 1423
correspondant au 20 janvier 2003 définissant les
mesures de
prévention et de lutte spécifiques aux salmonelloses aviaires
à Salmonella enteritidis,
typhimurium, typhi,
arizona, dublin, paratyphi et pullorum gallinarum.
Le ministre de la santé, de la population et de la
réforme hospitalière, Le ministre du commerce, Le ministre de
l'agriculture et du développement rural,
Vu le décret présidentiel n°02-208 du 6 Rabie
Ethani 1423 correspondant au 17 juin 2002 portant nomination des membres du
Gouvernement ;
Vu le décret exécutif n° 90-12 du 1er janvier
1990, modifié et complété, fixant les attributions du
ministre de l'agriculture ;
Vu le décret exécutif n° 94-207 du 7 Safar
1415 correspondant au 16 juillet 1994 fixant les attributions du ministre du
commerce ;
Vu le décret exécutif n° 95-66 du 22 Ramadhan
1415 correspondant au 22 février 1995, modifié et
complété, fixant la liste des maladies animales à
déclaration obligatoire et les mesures générales qui leur
sont applicables;
Vu le décret exécutif n° 96-66 du 7 Ramadhan
1416 correspondant au 27 janvier 1996 fixant les attributions du ministre de la
santé et de la population ;
Vu l'arrêté interministériel du 1er septembre
1984 portant institution d'un comité national et des comités de
wilaya de lutte contre les zoonoses ;
Vu l'arrêté interministériel du 14 Safar 1415
correspondant au 23 juillet 1994, modifié et complété,
relatif aux spécifications microbiologiques de certaines denrées
alimentaires ;
Vu l'arrêté interministériel du 25 Chaoual
1415 correspondant au 27 mars 1995 définissant les mesures
générales de prévention en élevage avicole ;
Arrêtent :
Article 1er. -- En application des dispositions de l'article 3 du
décret exécutif n° 95-66 du 22 Ramadhan
1415 correspondant au 22 février 1995, modifié
et complété, susvisé, le présent
arrêté a pour objet de fixer les mesures de prévention et
de lutte spécifiques aux salmonelloses à salmonella enteritidis,
typhimurium , typhi, arizona, dublin, paratyphi et
pullorum galinarum.
Art. 2. -- Sont reconnus atteints de salmonelloses à
salmonella enteritidis, typhimurium, typhi, arizona,
dublin,
paratyphi et pullorum
gallinarum :
a) les sujets, poussins ou adultes, sur lesquels a
été isolé l'un de ces germes, quel que soit le type de
production ;
b) les sujets adultes ayant une sérologie positive avec
une bactériologie positive de : -- la litière
(prélèvement effectué autour des abreuvoirs) ;
-- l'eau de boisson (contenue dans les abreuvoirs) ;
-- les fientes (prélèvement effectué sur
fond de cage) ;
-- le duvet des poussins à l'éclosion.
c) les oeufs sur lesquels le germe a été
isolé.
Art. 3. -- Dès la confirmation de l'une des salmonelles
citées à l'article 2 ci-dessus, le vétérinaire est
tenu d'en faire immédiatement la déclaration à
l'inspection vétérinaire de wilaya et à l'autorité
vétérinaire nationale, conformément à la
réglementation en vigueur.
Art. 4. -- A l'exception de la salmonellose à
salmonella pullorum gallinarum, dès la
confirmation de l'une des salmonelloses citées à l'article 2
ci-dessus, l'inspecteur vétérinaire de wilaya est tenu d'informer
le directeur du commerce et le directeur de la santé territorialement
compétents.
Art. 5. -- Sur proposition de l'inspecteur
vétérinaire de wilaya, le wali déclare l'infection par
arrêté et édicte les mesures sanitaires suivantes :
1) A l'égard des animaux de l'exploitation
:
-- séquestration de l'élevage ;
-- si le cheptel avicole est constitué de poussins, la
destruction et l'incinération doivent être immédiates ;
-- si le cheptel avicole est constitué de sujets adultes,
l'abattage sanitaire est ordonné et doit être effectué sous
huitaine, au niveau d'un abattoir agréé ;
-- en présence de salmonellose à salmonella
pullorum gallinarum, la viande issue de cet abattage pourra être
livrée à la consommation humaine à condition que le
transport de cette viande soit effectué en véhicule
réfrigéré, étanche et sous couvert d'un
laissez-passer délivré par l'inspecteur vétérinaire
de wilaya ou de son représentant dûment mandaté, pour
éviter toute propagation des germes.
-- en présence de salmonellose à salmonella
enteritidis, typhimirium, typhi, arizona, dublin et
paratyphi, sur demande de l'éleveur et sous
contrôle officiel, les produits issus de cet abattage ne pourront
être livrés à la consommation humaine que s'ils ont subi un
traitement thermique à une température de 65 C pendant 10 mn au
minimum et que les résultats d'analyses a posteriori
en matière de salmonelloses soient négatifs
conformément aux dispositions de l'arrêté
interministériel du 14 Safar 1415 correspondant au 23 juillet 1994,
susvisé ;
-- les véhicules ayant transporté le cheptel
avicole concerné, avant et après abattage, doivent être
désinfectés immédiatement après utilisation ;
-- la destruction de tous les oeufs issus de cet élevage
sauf en cas de présence de salmonellose à salmonella
pullorum gallinarum où les oeufs seront autorisés
à la consommation humaine.
2/ A l'égard des oeufs à couver et des
poussins éclos dans un couvoir :
-- séquestration du couvoir ;
-- arrêt de l'incubation de ces oeufs ;
-- destruction de tous les oeufs et de tous les poussins
éclos.
Art. 6. -- Une enquête épidémiologique doit
être effectuée par l'inspection vétérinaire de
wilaya afin de détecter l'origine de l'infection.
Art. 7. -- La remise en exploitation des bâtiments
d'élevage et d'accouvaison ne pourra avoir lieu que si une
désinfection des murs, du sol et de tout le matériel
d'élevage a été effectuée, que ces infrastructures
ont été
vidées pendant un (1) mois et qu'un contrôle
bactériologique de cette désinfection sur des
prélèvements de surface sur les murs et le matériel
d'élevage s'est révélé négatif.
Art. 8. -- Le traitement anti-infectieux du cheptel avicole
reconnu atteint de salmonellose à
salmonella
enteritidis, typhimurium, typhi, arizona, dublin,
parathyphi et pullorum gallinarum, est
interdit.
Art. 9. -- Lorsque toutes les mesures sanitaires prescrites ont
été effectuées, l'inspecteur vétérinaire de
wilaya ou son représentant dûment mandaté, s'assure de leur
exécution, en particulier la désinfection, le contrôle
bactériologique et l'extinction du foyer. L'inspecteur
vétérinaire de wilaya adresse un rapport au
wali et à l'autorité vétérinaire
nationale déclarant la fin de l'infection qui sera prononcée par
arrêté du wali conformément à la
réglementation en vigueur.
Art. 10. -- Le présent arrêté sera
publié au Journal officiel de la
République algérienne démocratique et populaire.
Fait à Alger, le 17 Dhou El Kaada 1423 correspondant au
20 janvier 2003.
Le ministre de la santé, de la population et de la
réforme hospitalière Le ministre de l'agriculture et du
développement
rural
Abdelhamid ABERKANE Saïd BARKAT
Le ministre du commerce
Noureddine
BOUKROUH
| 


