|

UNIVERSITE CHEIKH ANTA DIOP DE DAKAR
FACULTE DES SCIENCES ET TECHNIQUES
**********
DEPARTEMENT DE BIOLOGIE ANIMALE
Année : 2011 No : 93
Evaluation de l'effet insecticide et de la persistance
des huiles essentielles de Callistemon viminalis G Don, de Xylopia
aethiopica Dunal et de Lippia chevalieri Moldenke sur
Callosobruchus maculatus Fabricius et Sitophilus
zeamais Motchulsky , principaux ravageurs des Stocks du
niébé et du maïs.
Mémoire pour l'obtention du Diplôme de
Master II de Biologie Animale
Spécialité :
Entomologie
Soutenu le 15/ 12/2011 par Salim Mohamed Mzé
Mdjimivou
Né
Le 16/03/1987 à Djomani Mboudé
(Comores)
Devant le jury composé :
Président : Dr Malick Fall Maître Assistant
(FST/UCAD)
Membres :
Dr Cheikh Thiaw Chercheur (CERAAS) de
Thiès
Dr Dogo Seck Entomologiste des denrées
stockées
Dr Gueye Sabelle Chercheur (CERES-LOCUSTOX)
Remerciements
Ce mémoire est le fruit d'un travail mené au
Laboratoire de Biologie du centre régional de recherche en
écotoxicologie et sécurité environnementale sous la
direction du Docteur Sabelle Gueye.
Au terme de cette étude, je tiens à exprimer ma
profonde gratitude et mes sincères remerciements à:
Ma mère Chando Msaidié et mon père Mohamed
Mzé, bien qu'ils soient loin, savoir que leur soutien suffit à
mon bonheur.
Mon oncle Toihir Mohamed, je m'honore de votre estime, merci pour
votre soutien moral et financier. Qu'Allah le tout puissant vous
bénisse.
Ma femme Mariama Youssouf, merci pour ton amour et ta patience.
Tu récolteras, j'en suis sür le fruit de tes efforts. Qu'Allah te
préserve du mal.
Docteur Dogo Seck, Directeur de la fondation Ceres-locustox,
pour sa gentillesse, son accueil et aussi de m'avoir accepté dans son
centre et de juger ce travail. Et à travers sa personne, remercier tout
le personnel de la fondation Ceres-locustox.
Docteur Sabelle Gueye, chercheur au Ceres-locustox, sa
constante disponibilité, sa rigueur, son honnêteté, son
efficacité dans le travail et sa modestie font d'elle un exemple. Plus
qu'une encadreuse, elle a été pour moi une guide et une
conseillère.je voudrais lui exprimer tout mon estime et ma
sincère reconnaissance.
Docteur Malick Fall, maître assistant à l'UCAD pour
avoir accepté de présider le jury de ce travail, malgré
son emploi du temps chargé.
Docteur Cheikh Thiaw, chercheur au Ceraas de Thiès, sa
disponibilité et sa participation au jury est un réel plaisir
pour moi.
Mes frères et Surs: Benali Mohamed, Saïd Mohamed,
Foutoum Mohamed, Hadidja Mohamed, Ahmed Mohamed, Youssouf Mohamed, Bousry
Mohamed et Fatima Mohamed, c'est dans l'unité que l'on réussit
toute enterprise.
Docteur Mbacké Sembène, professeur à l'UCAD,
son affection et ses encouragements ont été pour moi un
repère dans ce travail.
Mes Collègues et amis : Chamsoudine Mohamed, Ahmada Abdou,
Nadhurata Abderemane, Akoub Ibrahim et Assoumani Ibrahim. Merci de la confiance
que vous me témoignez.
A tous les musulmans du Monde, ce travail est le vôtre.
Qu'Allah le tout puissant vous bénisse.
Liste des figures
Figure 1 : Plante de niébé 3
Figure 2 : Champ de maïs 5
Figure 3 : Mâle de la forme active de
C. maculatus avec ses élytres tachetés 7
Figure 4 : Femelle de la forme normale de C.
maculatus avec son pygidium pigmenté 7
Figure 5 : Fruits secs de X. aethiopica
14
Figure 6 : Feuilles et tiges de C. viminalis
15
Figure 7 : Feuilles et tiges de L.chevalieri
16
Figure 8 : Elevage de masse de C. maculatus
17
Figure 9 : Elevage de masse de S. zeamais
17
Figure 10 : Hydrodistillateur 18
Figure 11 : Dispositifs de test de l'effet
fumigant et persistant 19
Figure 12 : Effet fumigant de X.
aethiopica sur C. maculatus 21
Figure 13 : Effet fumigant de C.
viminalis sur C. maculatus 22
Figure 14 : Effet fumigant de L.
Chevalieri sur C.maculatus 22
Figure 15 : Effet fumigant de X.
aethiopica sur S. zeamais 23
Figure16 : Effet fumigant de C.
viminalis sur S. zeamais 23
Figure 17 : Effet fumigant de L.
Chevalieri sur S.zeamais 24
Figure 18 : Comparaison de l'effet fumigant des
huiles essentielles sur C.maculatus 25
Figure 19 : Comparaison de l'effet fumigant des
huiles essentielles sur S.zeamais 25
Figure 20 : Effet persistant de C.
viminalis sur S. zeamais 26
Figure 21 : Effet persistant des huiles
essentielles sur C. maculatus 27
Liste des tableaux
Tableau 1 : Taux d'extraction des huiles
essentielles 20
Listes des annexes
Annexe 1 : Insecticides de contacts
autorisés pour le traitement des denrées entreposées au
Sénégal.
Sommaire
Introduction 1
Chapitre1 :
Synthèse
bibliographique
1. Généralités Sur le
niébé et le maïs 3
1.1. Le niébé (Vigna unguiculata
(L).Walpers) 3
1.1.1. Taxonomie, description et écologie 3
1.1.2. Valeur alimentaire et importance économique 4
1.2. Le maïs (Zea mays
L) 4
1.2.1. Taxonomie, description et écologie 4
1.2.2. Valeur alimentaire et importance économique 5
2. Généralités sur les
Coléoptères Bruchidae et Curculionidae 6
2.1. Les coléoptères Bruchidae
6
La bruche du niébé (Caiosobruchus
maculatus Fabricius) 6
a. Systématique et Morphologie de Callosobruchus
maculatus 7
b.Biologie de Callosobruchus maculatus 7
c. Dégâts de Callosobruchus maculatus sur
le niébé 8
2.2. Les coléoptères Curculionidae
9
Le charançon du maïs (Sitophilus zeamais
Motchulsky) 9
a. Systématique et morphologie de Sitophilus zeamais
9
b.Biologie de Sitophilus zeamais 10
c. Dégâts de Sitophilus zeamais sur le
mais 11
3. Revue des méthodes de lutte 11
3.1. Lutte traditionnelle 11
3.2. La lutte chimique 11
3.2.1. Les insecticides de contact 11
3.2.2. Les fumigants 12
3.3. Les alternatives à la lutte chimique
12
3.3.1. La lutte physique 12
3.3.2. La lutte biologique 12
3.3.3. La Résistance variétale 13
3.3.4. Les phytopesticides 13
Les huiles essentielles 13
4. Présentation des plantes à tester
14
4.1. Xylopia aethiopica Dunal 14
4.2. Callistemon viminalis (G Don) 15
4.3. Lippia chevalieri (Moldenke) 15
Chapitre 2 :
Matériels et
méthodes
1. Elevage de masse des insectes 17
2. Récolte et préparation du matériel
végétal 17
3. Extraction des huiles essentielles 18
4. Test de l'effet fumigant des huiles essentielles 18
5. Mesure de la persistance de l'action des huiles essentielles
19
6. Analyse statistique 19
Chapitre 3 :
Résultats et
discussions
1. Résultats ..20
1.1. Extraction des huiles essentielles 20
1.2. Effet fumigant des huiles essentielles sur
C.maculatus 20
1.2.1. Effet fumigant de X.aethiopica sur
C.maculatus 20
1.2.2. Effet fumigant de C.viminalis sur
C.maculatus 21
1.2.3. Effet fumigant de L.chevalieri sur
C.maculatus 22
1.3. Effet fumigant des huiles essentielles sur
S.zeamais 22
1.3.1. Effet fumigant de X.aethiopica sur S.zeamais
23
1.3.2. Effet fumigant de C.viminalis sur S.zeamais
23
1.3.3. Effet fumigant de L.chevalieri sur S.zeamais
24
1.4. Comparaison de l'effet fumigant des huiles
essentielles sur C.maculatus 24
1.5. Comparaison de l'effet fumigant des huiles
essentielles sur S.zeamais 25
1.6. Effet persistant des huiles essentielles
25
1.6.1. Effet persistant de l'huile essentielle de
C.viminalis sur S.zeamais 26
1.6.2. Effet persistant des huiles essentielles sur
C.maculatus 26
2. Discussions 27
Conclusion et perspectives 28
Références bibliographiques 30
Annexes
INTRODUCTION
Le monde est confronté aux défis d'accroitre la
production vivrière pour répondre aux besoins d'une population
croissante, tout en préservant l'environnement (FAO, 2001 In
Kouakou, 2004). Dans le sahel, les céréales et les
légumineuses constituent la base de la nourriture des populations (Gueye
et al., 2011). Au Sénégal en particulier, le maïs
(Zea mays L) est la deuxième céréale majeure,
tandis que le niébé : Vigna unguiculata L. (Walp),
produit vivrière, est la principale légumineuse cultivée
dans le pays. Pour toutes ces spéculations, les rendements actuels sont
largement en deçà des attentes de la couverture nationale en
nourriture (Gueye et al., 2011). Le manque de ressources alimentaires
est comblé depuis toujours par des importations massives, notamment de
céréales. En 2008, le gouvernement du Sénégal, face
à la crise alimentaire mondiale, a lancé une grande offensive
agricole, juste pour répondre aux besoins alimentaires de sa population.
Malgré les initiatives prises de part et d'autre pour accroître la
production, le contexte d'insécurité alimentaire est toujours
marqué par des pertes post-récolte non négligeables. Les
pertes interviennent à tous les stades, de la récolte à la
consommation: d'abord chez le producteur, qu'il s'agisse de produits
destinés à l'autoconsommation, à la semence ou en attente
d'être commercialisés ; puis pendant le transport vers les lieux
de stockage et au cours du stockage enfin dans les réserves des
commerçants (Sembène, 2000). En effet, entre la récolte et
la consommation, plus de 30% de la production est perdue, cette proportion est
plus forte en région sahélienne du fait de la longue
période de stockage (Ngamo & Hance, 2007). Dans ces zones
sahéliennes, la saison sèche est longue et rude. La
période de productivité des champs est dès lors
très réduite. La consommation des céréales et des
légumineuses alimentaires se fait toute l'année. Le stockage rend
possible la disponibilité quasi permanente de ces denrées sur les
marchés et assure les semences pour les campagnes agricoles à
venir. Pendant ce stockage, les insectes et principalement certaines
espèces de Coléoptères (Bruchidae et Curculionidae)
notamment Callosobruchus maculatus Fabricius et Sitophilus
zeamais Motchulsky s'attaquent aux grains. Si aucune protection n'est
faite, après sept mois de stockage, la perte des denrées peut
être totale (Ngamo & Hance, 2007).
Face à la menace que constituent les insectes ravageurs
des stocks, les moyens de lutte sont essentiellement articulés autour de
l'utilisation de pesticides de synthèse. Dans des conditions optimales,
leur efficacité à contrôler les nuisibles des stocks est
certaine. Toutefois, ils présentent beaucoup d'inconvénients,
Parmi lesquels l'accoutumance des insectes et la sélection de souches
résistantes (Benhalima et al., 2004 In Gueye et
al., 2011), intoxications,
pollution de l'environnement et désordres
écologiques (Regnault-Roger, 2002 In Gueye et al.,
2011). Toutes ces raisons militent en faveur de la recherche de méthodes
alternatives de lutte en particulier l'utilisation des extraits de plantes
à propriétés insecticides et/ou insectifuge, qui soient
peu coûteuses et efficaces, faciles à adopter pour les producteurs
du Tiers Monde.
En effet les plantes ont été longtemps
utilisées par les paysans pour saveur des aliments ou pour
protéger les produits récoltés (Jacobson, 1989 ; Keita
et al., 2000 ; Isman, 2000 In Djossou, 2006). Les huiles
essentielles extraites de ces plantes ont été largement
utilisées dans la lutte contre les ravageurs de stocks (Hamraoui &
Regnault-Roger, 1997 ; Dunkel & Sears, 1998 ; Prates et al., 1998
; Liu & Ho, 1999 ; Golob et al., 1999 ; Tunç et
al., 2000 ; Isman, 2000 In Djossou, 2006). Leurs
propriétés insecticides, larvicides et ovicides,
stérilisantes, antiappétentes, répulsives ont fait l'objet
de plusieurs études (Ketoh et al.,1998 ; Djossou, 2006, Ngamo
et al.,2007 ;Kouninki et al.,2007 ; Ndomo et
al.,2009).
Cette présente étude a pour but d'évaluer
l'effet fumigant des huiles essentielles de Callistemon viminalis
G.Don, de Lippia chevalieri Moldenke et de Xylopia aethiopica
Dunal sur les espèces qui causent le plus de
dégâts aux stocks de niébé et du maïs notamment
Callosobruchus maculatus Fabricius et Sitophilus zeamais
Motchulsky. L'étude se propose également de tester
la persistance des huiles essentielles actives de C.viminalis, de
L.chevalieri et X.aethiopica sur la survie de ces principaux
ravageurs des stocks de niébé et du maïs.
La première partie de cette étude est
essentiellement bibliographique ; la deuxième partie fait le point sur
les matériels et les méthodes utilisés et en fin les
résultats et la discussion tout en terminant par une conclusion et des
perspectives.
Chapitre1 :
Synthèse bibliographique
1. Généralités sur le
niébé et le maïs
1.1. Le niébé (Vigna unguiculata
(L).Walpers)
1.1.1. Taxonomie, description et écologie
Le niébé, (Vigna unguiculata (L).Walpers),
appartient à la famille des Fabacées autrefois
papilionacées, ordre des Fabales, Tribu des Phaseoleae et
sous-espèce Unguiculata. C'est une plante annuelle, herbacée
principalement autogame bien que l'on ait fait état d'un certain
degré d'allogamie qui serait fonction de l'activité des insectes
assurant la pollinisation (Rachie et al., 1974 In Laleye,
2007). Originaire de l'Afrique du Sud-est, le niébé s'est
diffusé dans le monde entier. Le port peut être rampant,
érigé ou volubile, la tige a une section circulaire. Les deux(2)
premières feuilles sont opposées, sessiles et entières.
Les feuilles sont ensuite alternes, pétiolées et
trifoliolées. Chaque nud de la tige porte deux stipules
prolongées sous l'insertion, c'est qui caractérise V.
unguiculata, et trois bourgeons axillaires susceptibles de donner une tige
latérale ou une inflorescence (Kouakou, 2004). Le système
racinaire est composé d'une racine principale pivotante et des racines
secondaires portant des nodosités fixatrices d'azote (Kouakou, 2004). Le
cycle varie de 65-70 jours (pour les plus précoces) à 140-150
jours pour les variétés de contre saison (Camara, 1997) .Etant
une plante des régions tropicales et subtropicales, le
niébé supporte des températures variant entre 25 et
28°c et une pluviométrie variant entre 750 et 1000mm (Anochili,
1978 In Laleye, 2007), l'excès d'eau lui étant
préjudiciable. Du point de vue édaphique, le niébé
n'est pas très exigeant quand bien même il croit
préférentiellement sur les sols sablo-limoneux bien
drainés (Camara, 1997).

Figure 1 : plante de niébé.
(Source :
www.underwoodgardens.com)
1.1.2. Valeur alimentaire et importance
économique
Le niébé communément appelé
(viande pour pauvre) ou (viande verte) est un aliment important dans les
populations marginales du tiers monde où l'approvisionnement en
protéines animales est couteux. La graine mûre contient 23-25 % de
protéine, 50-67 % d'amidon, des vitamines B tel que l'acide folique qui
est important dans la prévention de malformation chez le
nouveau-né (Sembène & Kébé, 2011). La graine
est également riche en micro-éléments essentiels, tels que
le fer, le calcium et le zinc (Sembène & Kébé, 2011).
Le niébé joue donc un rôle important dans la subsistance de
beaucoup de familles rurales en Afrique, en Amérique latine et en Asie,
en procurant les éléments nutritifs déficients chez les
céréales (FAQ, 2003). Il est un aliment de base
apprécié en Afrique car ses feuilles, gousses vertes et graines
sèches peuvent être consommées et commercialisées.
Le fourrage sert d'aliment pour le bétail et d'engrains vert (Pasquet
& Baudoin, 1997 In Kouakou, 2004). Durant la saison sèche,
dans certaines régions d'Afrique de l'Ouest et du Centre, la valeur
monétaire des fanes de niébé stockées devient
très élevée (FAQ, 2003). Au Sénégal en
particulier, sa précocité permet à ses gousses vertes
d'être consommées et commercialisées avant les autres
spéculations pendant la période de soudure. A cette
période, le niébé peut constituer dans le nord du pays la
seule nourriture disponible (FAQ, 2003). La vente des gousses vertes
représente pour le paysan de cette localité une source de revenu
très importante, lui permettant d'acheter d'autres produits de base
telle que le riz importé (FAQ ,2003).
1.2. Le maïs (Zea mays L)
1.2.1. Taxonomie, description et écologie
Le maïs est une plante tropicale annuelle,
herbacée de la famille des Poacées, tribu des Maydeae et ordre
des cyperales. Originaire de l'Amérique centrale notamment du Mexique
(FAQ, 1993). La tige unique de gros diamètre est pleine,
lignifiée et formée de plusieurs entren~uds d'une vingtaine de
centimètres séparés par autant de nuds. Au niveau de
chaque nud est inséré une feuille alternativement d'un
côté et de l'autre côté de la tige. Contrairement aux
autres graminées, le pied de maïs ne thalle pas, toutefois on voit
parfois des tiges secondaires, de taille limitée, à la base de la
tige principale. Le système racinaire comprend un très grand
nombre de racines adventives, qui naissent sur les nuds situés à
la base de la tige. C'est une espèce à pollinisation
croisée, où les inflorescences femelles (épis) et
mâles (panicules) occupent des endroits distincts sur la plante (FAQ
,1993). La culture du maïs est rependue dans le monde, du 50e
degré de latitude nord au 50e degré de latitude sud et
du niveau de la mer à plus de 3 600 mètres d'altitude et avec des
cycles de croissance
oscillant de 3 à 13mois (FAO, 2003). Il s'agit d'une
espèce polyvalente et elle a d'énormes variabilités
génétiques, c'est qui lui permet de prospérer bien sur les
basses terres tropicales, subtropicales et tempérés (FAQ, 2003).
Le maïs préfère les sols profonds et riches mais qui peut
s'accommoder de conditions plus difficiles, comme des sols sableux ou plus
argileux, voire calcaires, sous réserve de lui assurer les apports d'eau
et d'éléments nutritifs nécessaires (FAQ, 2003).

Figure 2 : champ de maïs. (
www.flickr.com/photos/organ_printer/4897906013
1.2.2. Valeur alimentaire et importance
économique
Le maïs est une céréale importante dans
l'alimentation humaine et ceci se justifie entre autres par sa bonne
digestibilité de sa matière organique et sa valeur
énergétique relativement élevée. Le contenu
calorique moyen de tout repas à base de maïs est estimé
à 3578 calories par kilogramme (FAQ ,2003). Il contient également
de protéines (8 à 11%), de fibre alimentaire, de vitamines (A et
E) et de sels minéraux( P , K , Ca ,Mg , Na , Fe , Cu, Mn , Zn)(FAQ
,1993). Le maïs est aussi utilisé dans l'alimentation animale. En
2000, 65% de la production mondiale était destinée pour la
nourriture du bétail (FAQ, 2003). En plus de sa valeur
énergétique important, le maïs offre jadis une
opportunité alimentaire important par rapport aux autres
céréales, en raison de sa distribution mondiale et son bas prix
(FAQ, 2003). Au Sénégal, sa culture fut jusqu'à une
période très récente secondaire bien que consommé
dans toutes les régions du pays (ITA ,2008) .Il est beaucoup
consommé dans la vallée du fleuve Sénégal. Dans le
Sud et l'Est du pays, Kolda et Kédougou notamment, il est
consommé par une bonne partie de la population (ITA, 2008). Le maïs
contribue fort dans les économies des pays développés et
dans les pays en voie de développement. Selon la FAQ (2003), aux Etas
unis, le simple grain de maïs trouve une valeur économique
important comme des produits comestibles et non comestibles (caoutchouc,
plastiques, combustibles, vêtements aditifs et plusieurs autres).
2. Généralités sur les
Coléoptères Bruchidae et Curculionidae
2.1. Les Coléoptères Bruchidae
Les Bruchidae sont uniquement inféodées aux
légumineuses qu'elles contaminent généralement en plein
champ, cette famille compte environ 1300 espèces dont C. maculatus
principal ravageur du niébé sous nos tropiques. Après
1a préinfestation au champ, les larves pénètrent dans les
graines et sont transportées avec les récoltes dans les
entrepôts. Durant le stockage, elles trouvent les conditions
idéales pour compléter leur cycle et proliférer dans les
stocks ou se disséminer dans la nature. Après l'éclosion,
la larve néonate et la larve L4 (dernier stade) sont mobiles tandis que
les larves L2 et L3 sont généralement apodes. Avant d'entrer en
nymphose dans la graine, la L4 prépare un trou de sortie pour l'adulte.
Ce trou est couvert d'une fine pellicule (opercule). La nymphose peut
également se dérouler hors de la graine et parfois dans le sol
(Camara, 1997).
Selon Delobel et Tran (1993), on distingue 3 groupes suivant
l'écologie du développement :
1- les espèces qui pondent sur les fruits encore verts au
champ. Le cycle de développement se déroule dans les graines en
cours de formation avec une teneur en eau élevée.
2- les espèces dont la femelle pond dans les mêmes
conditions que précédemment, mais le développement se
poursuit et s'achève dans la graine sèche, éventuellement
dans les stocks.
3- les espèces dont l'ensemble du développement se
déroule sur les graines sèches, le développement larvaire
se déroulant entièrement à l'intérieur de la
graine. Les espèces Les plus nuisibles s'inscrivent à ce
groupe.
La Bruche du niébé (Caiosobruchus
maculatus Fabricius)
Le genre Callosobruchus est constitué d'un grand nombre
d'espèces parmi lesquelles apparaissent des formes polyvoltines. Ces
espèces se multiplient dans les graines sèches et causent
beaucoup de dommage aux stocks (Camara, 1997). C. maculatus est
l'espèce tropicale qui est la mieux adaptée aux systèmes
de stockage grace à l'existence d'un polymorphisme imaginal (Anonyme,
2008). La forme non voilière est capable de se reproduire et de se
développer dans les systèmes de stockage ; les différentes
générations qui se succèdent causant des pertes
importantes aux récoltes. La forme voilière apparait au cours du
stockage ; elle est surtout constituée d'adultes diapausants qui
survivent dans la nature (Anonyme, 2008).
a. Systématique et morphologie de
Caiosobruchus maculatus
C.maculatus appartient à la famille des
Bruchidae, sous famille des Bruchinae, genre Callosobruchus. A l'état
adulte, il existe deux formes de C. maculatus que l'on distingue par
la coloration des élytres et le pygidium, l'aptitude au vol et la
fécondité :
1- la forme non voilière ou normale est
caractérisée par un pygidium pigmenté chez la femelle et
peu tacheté chez le mâle. Les individus ayant cette forme ont un
muscle alaire atrophié et par conséquent, ils sont incapables de
voler (Ouédraogo, 1991). Selon les études, la
fécondité moyenne varie entre 100 ~ufs par femelle (Glitho et
al.,1988), 60-90 ~ufs (Delobel & Tran, 1993) et 91,2 ~ufs par femelle
(Akpovi, 1993). Les individus sont inféodés au stock de
niébé et ont une longévité faible (6-8 jours
à 30°C) (Delobel & Tran, 1993). Les adultes de cette forme sont
toujours reproducteurs.
2- La forme voilière ou active a un pygidium clair
chez la femelle et les élytres sont tachetés chez le mâle.
Les individus de cette forme sont caractérisés par une faible
fécondité (deux ~ufs en moyenne par femelle) ; leur descendance
est constituée des individus non voiliers (Glitho et al.,1988).
La longévité est d'environ un mois à 30°C (Delobel
& Tran, 1993). La teneur en eau des graines, la température,
l'humidité relative influencent l'apparition de cette forme en
élevage de masse. L'apparition des voiliers est
précédée par l'augmentation du nombre de larves par graine
dont l'activité entraîne l'élévation de la
température et de la teneur en eau des graines (Tchokossi, 1995
In Djossou, 2006).

Figure 3 : mâle de la forme active de
C.maculatus avec ses élytres tachetés
Figure4 : Femelle de la forme normale
de
C.maculatus avec son pygidium pigmenté
b. Biologie de Caiosobruchus maculatus
Le cycle de développement de C.maculatus est
fonction de la température et l'humiditérelative du
milieu. Les femelles sont réceptives dès l'émergence. Les
~ufs sont de forme
pigmeté.
ovoïde et sont déposés sur le
péricarpe (Huignard et al., 1985 ; Delobel & Tran, 1993).
Ils sont pondus et fixés par la femelle avec une substance
gélatineuse à la surface des graines et des gousses. Lors de la
ponte, une phéromone de marquage est déposée en même
temps que l'uf (Delobel & Tran, 1993), elle permet à la femelle
d'éviter les graines fortement infestées, et de réduire
ainsi la compétition inter-larvaire. L'éclosion des ~ufs survient
5 à 7 jours après la ponte dans les conditions les plus
favorables. Après éclosion, la larve qui n'a pas encore de pattes
motrices, fore la paroi externe de l'enveloppe de la gousse ou du
tégument de la graine
et rentre à l'intérieur (Lenting, 2000). A la
différence de la graine où la larve peut accéder
directement aux réserves nutritives avec plus de chance de survie ; au
niveau des gousses, la jeune larve peut échouer dans le vide (espace
inter-grain) ou déboucher, au cours de son transit trophique, sur un
petit grain à faible réserve ne pouvant lui permettre d'atteindre
le stade final de développement. Dans les derniers cas, la mort de la
larve est inévitable. C. maculatus se nymphose à
l'intérieur d'une seule graine après avoir construit une
fenêtre au niveau du tégument (Southgate, 1979). La durée
de la nymphose varie entre 7 à 28 jours. Au terme de la nymphose,
l'adulte émerge de la graine pour commencer un nouveau cycle
après avoir traversé la fenêtre de sortie
préparée par la larve. Le pourcentage le plus élevé
d'adultes s'obtient à partir des ~ufs pondus sur les graines. Avec les
pontes sur graines vertes ou mûres, la mortalité
élevée se produirait lors de la pénétration dans la
gousse (Messina, 1984).La durée de développement ~uf-adulte est
fonction des conditions atmosphériques. Dans les conditions optimales
(30-35°C ; 70-90% HR), le développement complet varie de 22 -25
jours (Rees, 1996 In Djossou, 2006).
c. Dégâts de Caiosobruchus maculatus
sur Le niébé.
C. maculatus exerce une pression permanente sur les
légumineuses ; cette menace est due à sa grande polyphagie et sa
faculté d'adaptation à des régions climatiques
variées (Utida, 1954). L'adulte de C. maculatus ne cause pas
directement de dégâts sur le niébé au champ ni en
stock ; les individus mâles et femelles vivent des grains de pollen et de
nectar (Alzouma, 1981 ; Messina, 1984). Ce sont les stades juvéniles qui
causent les ravages sur stock en consommant, avant le stade pupe une partie
importante des réserves nutritives des cotylédons de la graine du
niébé. L'activité de consommation des réserves des
graines par les larves provoque de la chaleur et de l'humidité qui
engendrent le développement des champignons comme Aspergillus,
Fusarium, Botrytis, conduisant à des pertes
quantitatives et qualitatives. C. maculatus entraîne non
seulement une réduction de poids sec, mais également une
diminution de la qualité des graines et de la viabilité des
semences compromettant leur consommation et leur semis (Singh, 1992). Lorsque
les dégâts excèdent un trou d'émergence par graine,
la valeur marchande du niébé s'en trouve substantiellement
réduite (Murdock et al., 1997). Il existe une relation
entre le nombre de trous d'émergence des bruches sur les graines et les
pertes de poids (Tchamou, 1995 In Djossou, 2006).
2.2. Les Coléoptères Curculionidae
Les Curculionidae, ou charançons, représentent la
plus grande famille de coléoptères. Cette
famille compte
plusieurs espèces dont Sitophilus zeamais, ravageur principale
du maïs. Ils se
reconnaissent facilement par leur allure
générale et particulière, leur corps souvent trapu et
surtout leurs pièces buccales transformées en
une sorte de trompe, appelée rostre. Les antennes présentent
également une forme caractéristique, coudée à angle
droit, avec un premier article (le scape) très long. Les élytres
sont contigus et peuvent parfois être soudés, rendant impossible
leur écartement (Anonyme, 2009). Les charançons présentent
une diversité extraordinaire, tant dans les formes, les couleurs, les
habitats ou la biologie des espèces. La reproduction des
charançons est directe et sexuée, mais chez certaines
espèces elle peut être parthénogénétique. Le
nombre d'ufs pondus par les femelles est d'importance très variable
(quelques-uns à plusieurs centaines) (Anonyme, 2009). La larve,
éruciforme et apode, va subir plusieurs transformations avant de se
nymphoser (insectes holométaboles). Elles peuvent s'attaquer à
toutes les parties vivantes des plantes : bois, racines, tiges, feuilles,
fruits ou graines (Anonyme, 2009).
Le charançon du maïs (Sitophilus
zeamais Motchulsky)
Le genre Sitophilus est uniquement inféodé aux
céréales qu'elle contamine généralement dans les
stocks. Il se reconnaît par la présence d'un rostre renflé
triangulairement et portant les antennes à sa base. La larve blanche et
charnue est apode et mesure de 2 à 4 mm. Parmi les trois espèces
du genre Sitophilus, seules deux (S. zeamais et S.
oryzae) sont présentes dans les régions tropicales (Seck,
2009). Elles se multiplient dans les graines sèches et causent beaucoup
de dommages aux stocks.
a. Systématique et morphologie de
Sitophilus zeamais.
Sitophilus zeamais appartient à la famille des
curculionidae, ordre des coléoptères, genre Sitophilus. Son corps
a la forme d'un cylindre. Son rostre porte des antennes en forme de massues
à sa base. L'extrémité de ce rostre est
équipée de pièces buccales de type broyeur. Chez la
femelle, le rostre est long et effilé tandis que chez le mâle, il
est plus court, plus épais et moins lisse que celui de la femelle
(Sissoko, 2010 In Aboubakry, 2010). Le corps, d'une longueur comprise
entre 3 et 4mm, est couvert d'un tégument dur et rugueux. Les larves
sont des asticots charnus pourvus de pattes rudimentaires, de mandibules
puissantes et d'yeux peu perfectionnés. Le prothorax de l'adulte est
recouvert de piqure ronde ou irrégulière. Il porte des ailes. Les
ailes antérieurs sont dures et tannées et rejoignent le long de
la ligne centrale dorsale. Quant aux postérieures, elles sont
membraneuses quelquefois absentes. Les pattes portent à leurs
extrémités des tarses à quatre(4) articles. Longtemps
considéré comme une forme de S.oryzae de grande taille
(larger strain), S.zeamais se distingue néanmoins de ce
dernier. Certains auteurs (Kranz et al., 1977 In Seck, 2009)
ont proposé des critères d'ordre éthologiques pour les
différencier. Sitophilus oryzae (2 à 5 mm) est un bon
voilier, capable d'attaquer les céréales stockées depuis
le champ. Il a une
préférence pour les grains de petite taille comme
le riz. Au contraire, S.zeamais (3 à 4mm) vole très peu
et préfère les graines de grande taille comme le maïs.
b. Biologie de Sitophilus zeamais
S.zeamais ne peut se reproduire que dans un
grain dont le taux d'humidité est supérieur à 9,5%, sur un
pelage de températures allant de 15 à 35°C. Les femelles
adultes pondent environ 200 ~ufs à une vitesse de 20 à 30 par
jours. Ces derniers sont déposés au fond de cavités
creusées dans l'endosperme du grain et rebouchées à l'aide
d'un tampon mucilagineux (Danho & Haubruge, 2003). Après 8 à
11 jours d'incubation, les ~ufs éclosent avec une gamme de
température allant de 18 à 20°C. Les larves de couleur
blanche, apodes, dures, légèrement courbées consomment
l'endoderme du grain. Elles muent quatre (4) fois pour finalement se
transformer en nymphe après 6 à 8 semaines. Le nombre d'ufs
pondus dans un site nourricier, va conditionner en fonction de la
quantité de ressources disponibles, l'intensité d'une
compétition larvaire (Tilman, 1980 In Danho & Haubruge,
2003).Cette compétition larvaire affecte le taux d'émergence des
adultes mais aussi la capacité reproductive (Klomp, 1964 ; Hawley, 1985
; Mangel et al.,1994 In Danho & Haubruge, 2003). Les
adultes émergent après 5 à 16 jours
supplémentaires. Le plus grand nombre d'individus provient des lots
contenant le plus grand nombre de grains (Danho & Haubruge ,2003). Ils
vivent environ 8 mois. En effet, les ~ufs ne sont guère affectés
par les ovicides durant les 6 jours d'incubation. Le premier stade larvaire est
vulnérable aux conditions de l'environnement (humidité relative,
oxygène, densité de la population, température) (Hardman,
1978 ; Longstaff, 1989 In Aboubakry, 2010). Il peut y avoir
jusqu'à 90% de mortalité à ce stade. Les survivants
réussissent généralement à atteindre le stade
adulte. Le cycle complet dure de 26 à 35 jours dans les zones
tropicales.
c. Dégâts de Sitophilus zeamais
sur le maïs.
L'adulte de S.zeamais ne cause pas directement de
dégâts sur le maïs au champ ni en stock. Ce sont les stades
juvéniles qui causent les ravages sur stock puisqu'ils ne vivent jamais
à l'air libre et se développent à l'intérieur du
grain consommant, avant le stade pupe une partie importante des réserves
nutritives du grain de maïs. Les dégâts sont de plus en plus
lourds à partir de la 2eme génération. En zone rurale
où les techniques de conservation des denrées agricoles sont peu
élaborés, ce ravageur peut occasionner des pertes
post-récolte pouvant atteindre 90% pendant 5 mois de stockage (Nukenine
et al., 2002; Boura, 2006 In Ngamo et al.,
2007)
3. Revue des méthodes de lutte
Face à l'ampleur des dégâts causés
par les coléoptères Bruchidae et curculionidae, une panoplie de
méthodes sont utilisées pour éradiquer le fléau ou
maintenir le niveau des attaques à un seuil économiquement
acceptable.
3.1. La lutte traditionnelle
Ces méthodes comprennent les pratiques endogènes
au milieu paysan acquises au cours de générations. Outre les
pratiques religieuses et magiques, ces méthodes comprennent les
techniques culturales, le triage de la récolte, la désinfection
des structures de stockage (Lienard & Seck, 1994). En absence d'un
programme approprié de contrôle, les cultures associées
assurent dans les fermes traditionnelles moins de perte (Kumar, 1984) en
rendant l'environnement défavorable pour les ravageurs ou en
réduisant les niveaux d'infestation au champ ou alternativement elles
fournissent un environnement favorable aux ennemis naturels. Au nombre des
méthodes préventives, on peut aussi citer l'utilisation de la
température et de l'humidité, l'addition de substances
minérales, l'addition des substances végétales et le
stockage hermétique.
3.2. Lutte Chimique
Les avancées de la chimie organique ont permis de
mettre sur le marché des Produits phytosanitaires dès les
années 1940. Ainsi, les insecticides de synthèse connurent une
utilisation massive pour la protection des cultures d'exportation (arachide,
coton. etc.). Aujourd'hui, plus de 80% des produits agrochimiques
importés sont encore appliqués sur les cultures de rente. Les
principaux produits utilisés peuvent être classés en deux
groupes suivant leur mode d'action : les insecticides de contact et les
fumigants.
3.2.1. Les insecticides de contact
Ces produits ont la particularité d'avoir une
dégradation beaucoup plus rapide en zone tropicale d'où la
nécessité de doubler la dose recommandée en climat
tempéré pour une plus Grande efficacité. Cependant, ils
donnent de bons résultats surtout chez les insectes adultes. Les
pesticides les plus couramment utilisés appartiennent aux familles
chimiques suivantes : les organochlorés, les organophosphorés,
les carbamates et les pyrethrinoides de synthèse (Annexe 1).
3.2.2. Les fumigants.
La fumigation est un traitement insecticide curatif qui consiste
à introduire un gaz dans une enceinte bien étanche et d'y
maintenir à une concentration suffisante pendant un temps donné
pour permettre la diffusion de celui-ci à travers toute la masse du
grain. Son grand pouvoir pénétrant permet d'éliminer les
formes cachées du ravageur. Au Sénégal, le Bromure de
méthyle (CH3-Br.) est très utilisé pour
la protection des stocks. Son inconvénient majeur nécessite de
disposer d'un matériel de gazage particulier et d'équipes
spécialisées. Le phosphure d'aluminium (phostoxin) est
très utilisé en Afrique sub-sahélienne. La phosphine s'est
montrée très efficace contre les ~ufs et larves de
C.maculatus (Seck, 1994). Toutefois, il est important de signaler le
caractère dangereux de ce produit qui est mortel pour l'homme. Son
utilisation est difficile dès que l'humidité de l'air devient
inférieure à 30%.
3.3. Les alternatives à la lutte chimique
Face aux nuisances de la lutte chimique nonobstant les
succès enregistrés, il a été
développé plusieurs autres formes de lutte contre les insectes.
Nous ne citerons que les principales.
3.3.1. La lutte physique
Il s'agit, par divers procédés, de jouer sur la
sensibilité des ravageurs aux radiations, aux températures
extrêmes et à la concentration de l'atmosphère des
infrastructures de stockage en gaz (oxygène, dioxyde de carbone).
L'irradiation connaît beaucoup de succès ces dernières
années. Ses principaux avantages sont l'absence de résidus et de
résistance, sa capacité de pénétration dans des
denrées même emballées et la rapidité de son
application (Ahmed, 1990 In Seck, 2009). Aux doses prescrites,
l'irradiation n'altère aucune des propriétés physiques,
chimiques et organoleptiques de la denrée (Henon, 1983 In Seck,
2009). Quant à l'atmosphère contrôlé, les
infrastructures de stockage sont enrichies en azote ou en dioxyde de carbone
dans le but de réduire la teneur en oxygène et d'asphyxier les
insectes (Storey, 1975 ; 1978 In Seck, 2009). D'une manière
générale, cette technique s'avère inapplicable en milieu
villageois compte tenu de l'équipement et des connaissances
nécessaires pour sa mise en ~uvre.
3.3.2. La lutte biologique
Le principe consiste à introduire dans le milieu de vie
du ravageur un prédateur, un parasitoïde ou un micro-organisme
pathogène pour contrarier son développement ou le tuer. Les
insectes parasites ou parasitoïdes peuvent pondre à
l'intérieur ou sur le corps des ravageurs qu'ils tuent au terme de leur
développement. Des études réalisées au Niger
révèlent que Dinarmus basalis est un très bon
agent de lutte s'il est seul et peut parasiter jusqu'à 90% des larves de
C.maculatus (Camara, 1997). Toutefois en situation de
compétition, ce parasitoïde devient inefficace en présence
Eupelmus vuilleti qui manifeste un comportement agressif et dominant
contre ce dernier (Alzouma ,1995 In Camara, 1997). Les
prédateurs ou entomophages tuent leurs proies par une attaque directe.
Les phéromones et les hormones juvéniles sont également
utilisées dans la lutte biologique pour modifier le comportement de
l'insecte. La lutte biologique est prometteuse mais son application est encore
restreinte en milieu paysan.
3.3.3. La résistance variétale
L'obtention de variétés résistantes
à l'attaque des ravageurs pourrait contribuer à minimiser
l'importance des dégâts causés aux produits de
récoltes en stocks. Le mécanisme de la résistance est de
nature physique ou biochimique. En effet, les femelles de C. maculatus
préfèrent les graines lisses pour la ponte, celles-ci sont
en conséquence plus sujettes aux attaques que les graines ridées
(Camara, 1997). Les inhibiteurs de trypsine et de protéase sont à
la base de la résistance en empêchant le développement
larvaire de l'insecte (Camara, 1997). La création de cultivars qui
comportent à la fois une résistance des gousses et celle des
graines serait un bon moyen de lutte (Seck et al., 1992). La
résistance variétale peut constituer une bonne alternative
à la lutte chimique en milieu villageois car elle est moins
coûteuse et n'occasionne pas de nuisance chez les populations et
l'environnement.
3.3.4. Les phytopesticides
L'usage des plantes indigènes dans la conservation des
récoltes a été pratiqué avant méme
l'apparition des insecticides de synthèse (Gueye et al.,2011).
Les plantes sont utilisées contre les ravageurs pour leurs effets
répulsifs, de contact ou fumigant. Il s'agit souvent de plantes
consommées dans l'alimentation humaine, par exemple comme condiment ou
épice ou des plantes à activité médicinale. Les
familles les plus prometteuses dans la protection des denrées au cours
du stockage appartiennent aux familles des Meliaceae, Annonaceae, Labiacae,
Rutaceae, Asteracae, Canellaaceae (Ngamo & Hance, 2007). Les
phytopesticides valorisables sous la forme des huiles essentielles
présente un réel avantage du fait de leur faible
rémanence, leur faible toxicité pour l'homme et de leur mode
d'action sur les ravageurs (Ngamo & Hance, 2007).
Les huiles essentielles
Les huiles essentielles des plantes font partie ces
dernières années des voies les plus explorées dans la
régulation des ravageurs (Gueye et al.,2011). Leur application
dans la protection des stocks a fait l'objet de nombreux travaux. En effet, les
constituants des huiles essentielles sont des sources potentielles
d'insecticides botaniques (Ngamo & Hance, 2007). Ils sont utilisés
pour leurs activités de contact et inhalatoire. Ce sont des extraits
volatiles et odorants que l'on extrait de certains végétaux par
distillation à la vapeur d'eau, pressage ou des végétaux
qui les contiennent. Les huiles essentielles sont des composés liquides
très complexes. Elles contiennent principalement des terpènes,
des esters, des cétones et des phénols (Benayad, 2008). Elles
sont connues par leurs propriétés antibactérienne,
antivirale, antifongique, antiparasitaire et antiseptique (Benayad, 2008).
4. Présentation des plantes à tester.
4.1. Xylopia aethiopica Dunal
X. aethiopica est un arbre très répandu
en Afrique intertropicale appartenant à la famille des
Annonacées. Il est aussi retrouvé dans les zones
forestières humides au Sénégal, au Congo Brazzaville et
dans l'île de Sao Tomé et Principe (Adjanohoun et
al.,1988). Communément appelée le poivrier du Guinée,
cette espèce héliophile peut atteindre 15m de hauteur, avec un
diamètre de 10cm environ. Les feuilles lancéolées sont
arrondies à la base. Les fleurs sont blanc-verdâtre et
parfumées. Les fruits apocarpes sont déhiscents à
maturité. Les grains sont noirs et entourés par un aryle jaune
(Adjanohoun et al.,1988). Dans certains pays, les fruits secs de
X. aethiopica sont utilisés en pharmacopée
traditionnelle contre plusieurs affections dont notamment le traitement de la
bronchite, de la dysenterie, de la stérilité chez la femme et des
aménorrhées (Adjanohoun et al.,1988). Dans
l'alimentation, les fruits ou graines de X. aethiopica sont
utilisés entiers ou écrasés comme aromatisant. Les huiles
essentielles de X.aethiopica sont principalement constituées de
monoterpènes hydrocarbonés (84,00%), de monoterpènes
oxygénés (12,9%) et de sesquiterpènes hydrocarbonés
(30,4%) (Noudjou et al.,2007).

.
4.2. Callistemon viminalis G.Don
Callistemon viminalis est un Arbuste d'origine
australien, appartenant à la famille des Myrtacées et
fréquent sous nos tropiques à cause de leur odeur aromatique
caractéristique (Ndomo et al.,2009). Cette espèce a une
croissance rapide et forte vigueur en condition favorable, d'une hauteur
pouvant atteindre 12 m de haut. Les feuilles sont plates, linéaires
à étroites, elliptiques et de couleur vert clair. Les nervures
secondaires non distinctes présentent de nombreuses glandes à
huile essentielle. Les fleurs axillaires sont réunies en longues
inflorescences de couleur rouge vif situées à
l'extrémité des axes. Selon Mahmoud et al.,2002
cité par Ndomo et al.,2009 le genre
Callistemon en général est utilisé traditionnellement
comme insecticide et également pour soigner la bronchite. Cette huile
essentielle contient principalement des monoterpènes
hydrocarbonés et des monoterpènes oxygénés (Ndomo
et al., 2009).

Figure 6 : Feuilles et tiges de C.viminalis
(Source : Photo wilane, 2001)
4.3. Lippia chevalieri Moldenke
Lippia chevalieri est une herbe aromatique ligneuse,
vivace, dressée et ramifiée, appartenant à la famille des
verbenaceae (Konaté, 2005). Elle est très répandue dans
les savanes soudanoguinéennes et guinéennes, et très
fréquentes du Sénégal au Cameroun (Arbonnier, 2002). Les
feuilles sont étroitement elliptiques, à bord denté, plus
ou moins scabres, à pubescence blanchâtre dessous, de 5-18 x
1,5-6cm, de sommet acuminé et pointu, à base
atténuée ou en coin et dégagent une odeur de camphre au
froissement. La nervure est pennée, à 6-11 nervures secondaires
très ou peu saillantes, plus ou moins sécantes du bord du limbe.
Ses fleurs regroupées en glomérules sont blanches et formes un
épi-cylindrique. Dans certains pays, les feuilles et les fleurs de
L. chevalieri sont utilisées en pharmacopée
traditionnelle contre plusieurs affections dont notamment le traitement du
foie, des règles douloureuses chez les femmes, de l' ictère, des
vomissements, de la dyspepsie, de la constipation, de la
gastro-entérite, de l' ascites, de l' hypotension, de l'entorse, des
plaie syphilitique, de l'accouchement chez les femmes, du fièvre, du
céphalée, de l' otite, du toux , du furoncle et des rhumatismes
(Arbonnier, 2002). Elles sont utilisées aussi comme étant un
antiinflammatoire, diurétiques et cholagogues (Arbonnier, 2002). Dans
l'alimentation, les feuilles de L.chevalieri sont utilisées
dans le thé comme stimulantes (Arbonnier, 2002).Les feuilles de
L.chevalieri contiennent principalement de l'huile essentielle
(thymol, carvacrol, acétate de
tymile, P-cymène), de sesquiterpènes, de tanins
galliques et catéchiques, d'oses, de polyuronides,
d'hétérosides stéroïdiques, de saponosides, de
stérols et traces d'alcaloïdes (Konaté, 2005).

Figure 7 : Feuilles et tiges de
L.chevalieri
(Source : Photo de Salim, 2011)
Chapitre 2 :
Matériels et méthodes
1. Elevage de masse des insectes
Les insectes sont élevés dans le laboratoire de
Biologie du centre régional de recherche en écotoxicologie et
sécurité environnementale (CERES-LOCUSTOX) de Dakar. Deux
élevages ont été mis en place, un élevage de masse
pour le bruche de niébé (C.maculatus) et un
élevage de masse pour le charançon du maïs
(S.zeamais). Pour l'ensemble des espèces, les souches
d'origines proviennent d'anciens élevages de masse, trouvés dans
le laboratoire de biologie de ce même centre. Les élevages de
masse sont effectués dans des bocaux en verre, à couvercle
grillagé, remplis de grains, dans lesquels sont ajoutés un nombre
suffisant d'insectes, de sexe indéterminé. Les bocaux sont
ensuite laissés à la température ambiante. Après
une ou deux semaines d'infestation, les adultes sont retirés des grains.
Les grains infestés sont laissés en incubation jusqu'à
l'apparition des nouveaux adultes. Les adultes utilisés pour les tests
sont obtenus à partir de ces élevages de masse.

Figure 8 : élevage de C.maculatus
(Source : photo de Salim, 2011)
Figure 9 : élevage de
S.zeamais
(Source : photo de Salim, 2011)
2. récolte et préparation du
matériel végétal
Les plantes sont récoltées dans des
localités différentes. En effet, C.viminalis a
été récoltée dans le jardin botanique de
l'Université Cheikh Anta Diop de Dakar ; L. chevalieri, au
centre régional de recherche en écotoxicologie et
sécurité environnementale. Les fruits secs de X.
aethiopica, sont achetés au marché de Rufisque.
Après la récolte, les feuilles de
C.viminalis et L.chevalieri sont séparées en
trois lots que nous avons extraits respectivement les huiles essentielles
à feuilles fraiches, après 7 jours de séchage et
après 15 jours de séchage. Le séchage s'effectue à
l'air libre et à l'abri du soleil. Les fruits secs de
X.aethiopica sont d'abord broyés dans un mortier avant
extraction.
3. Extraction des huiles essentielles
Les huiles essentielles sont extraites par la technique
d'hydrodistillation pendant trois (3) heures. Une masse végétale
(100 g) est complètement immergée dans l'eau, le tout est ensuite
porté à ébullition dans un ballon. La vapeur
dégagée est condensée dans une colonne de
réfrigération dans laquelle circule de l'eau en continu. Le
liquide qui s'écoule de la colonne arrive dans un ballon où
l'huile essentielle se sépare de l'eau par une différence de
densité. Ce liquide est ensuite mis dans une ampoule à
décanter, pour retirer l'huile essentielle par décantation.
L'huile essentielle obtenue, est séchée à l'aide du
sulfate de sodium anhydre. Elle est ensuite conservée au
réfrigérateur jusqu'à son utilisation.

Figure10 : Hydrodistillateur (Source : Photo de
Salim, 2011)
II.4. Test de l'effet fumigant des huiles essentielles
L'effet fumigant est testé avec des bocaux en verre.
Pour cela, 25 insectes âgés de 24H à 48H sont introduits
dans un pilulier en verre de 25ml à couvercle trouée. Ce pilulier
est ensuite mis dans un autre bocal en verre de 250ml, dans lequel est
introduit une charge unique d'huile essentielle portée par un disque de
papier filtre whatman de diamètre 5cm. Le dispositif est fermé
hermétiquement puis laissé à la température
ambiante pendant 48H.
Après les tests préliminaires, quatre
concentrations de chacune de ces trois huiles essentielles sont testées
: 0,064 ; 0,128 ; 0,256 et 0,512 ul /ml. Ce qui correspond aux prises de 16,
32,64 et 128ul par rapport au volume de l'enceinte (250ml). Un témoin
sans huile essentielle est fait pour chaque essai. Chaque concentration est
répétée quatre fois. Au bout de 48H, le nombre d'insectes
morts est compté. Les mortalités dans les différents
traitements sont exprimées selon la formule d'Abbott en
mortalités corrigées(Mc), tenant compte des mortalités
naturelles observées sur les traitements témoins (Mt) selon la
formule suivante :
Mo -Mt
Mc= × 100
100--Mt
Mc : mortalité corrigée. Mo : mortalité
observée. Mt : mortalité naturelle.
5. Mesure de la persistance de l'action des huiles
essentielles
La CL90 des huiles essentielles actives est calculée ;
elle est ensuite utilisée pour tester la persistance des huiles
essentielles. Pour cela, un petit bocal de 25ml à couvercle troué
(30 trous par couvercle) contenant 25 insectes âgés de 24H
à 48H, est introduit dans un autre bocal de 250ml, dans lequel est
ajouté une charge unique d'huile essentielle portée par un disque
de papier filtre whatman de diamètre 5cm ; le tout est fermé
hermétiquement. Chaque essai est répété quatre fois
en plus d'un témoin sans huile essentielle. Au bout de 48H, le petit
bocal portant les insectes est retiré rapidement puis remplacé
par un autre petit bocal portant 25 autres insectes âgés de 24H
à 48H. Le même procédé est
répété toutes les 48H pendant 6jours et nous comptons
à chaque fois le nombre d'insectes morts. Les mortalités obtenues
sont ensuite exprimées en mortalités corrigées selon la
formule d'Abbott.

Figure 11 : Dispositif de test de l'effet
fumigant et persistant
(Source : photos de Salim, 2011)
6. Analyse statistique
Les résultats sont soumis à une analyse de
variance (ANOVA). La comparaison des différentes concentrations a
été faite par le test de FICHER et KEULS au seuil de 5 %. Les
logiciels Excel et EPA Probit version 1.5 sont utilisés respectivement
pour tracer les histogrammes, les courbes et calculer les CL90 des huiles
essentielles actives.
Chapitre 3 :
Résultats et discussions
1. Résultats
1.1. Extraction des huiles essentielles
Tableau1 : taux d'extraction des huiles
essentielles.
|
Extraction Feuilles
|
Séchage
|
Séchage
|
|
fraiches
|
pendant
|
pendant
|
|
|
7 jours
|
15jours
|
|
|
|
|
C.viminalis
|
1,2%
|
5,1%
|
3,8%
|
|
L.chevalieri
|
Traces
|
0,08%
|
0,3%
|
|
|
Fruits
|
|
|
X.aethiopica
|
|
1,9%
|
|
Les résultats obtenus sont présentés dans
le tableau ci-dessus. En effet, C. viminalis présente le
rendement le plus élevé par rapport aux deux autres
espèces (Tabeau1). Elle donne un bon rendement lorsque les feuilles sont
séchées pendant 7 jours (5,1%). Les fruits secs de X.
aethiopica présentent aussi un bon rendement (1,9%). Les faibles
rendements sont obtenus sur L. chevalieri (tableau 1). Cette
dernière présente un rendement un peu plus élevé
lorsque les feuilles sont séchées pendant 15 jours (0,3%).
1.2. Effet fumigant des huiles essentielles sur C.
maculatus
L'efficacité des huiles essentielles est
observée à partir d'un seul paramètre : la
mortalité des adultes. Cette dernière est observée sur une
période de 2jours (48H) à compter de la date de traitement des
adultes par les huiles essentielles.
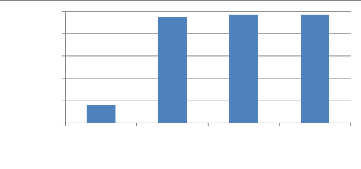
1.2.1. Effet fumigant de X. aethiopica sur C.maculatus
La figure 12 illustre l'évolution des pourcentages des
mortalités corrigés des adultes de C.maculatus en
fonction de la concentration de l'huile essentielle de fruits secs de
X.aethiopica. L'effet adulticide se manifeste
très vite, dès la plus petite concentration (0,064ul/ml) avec
16,16% de mortalité. A partir de la concentration 0,128ul/ml, une
mortalité de 94,92% est observée, et elle atteint 96,96% pour les
concentrations 0,256 et 0,512 ul/ml.
Cette analyse est confirmée par les tests statistiques.
En effet il existe une différence significative de mortalité
entre la plus faible concentration testée (0,064ul/l) et les autres
concentrations (p<0,05).
80
60
40
20
0
pourcentage de mortalite
corrige
b b b
100
0,064ul/ml 0,128ul/ml 0,256ul/ml 0,512ul/ml
concentration (ul/ml)
a
Figure 12 : effet fumigant de X.
aethiopica sur C. maculatus
Les histogrammes affectés d'une même lettre
alphabétique ne sont pas statiquement différents.
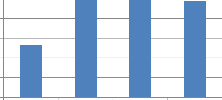
1.2.2. Effet fumigant de C. viminalis sur C.maculatus
La figure 13 montre les pourcentages des mortalités
corrigés des bruches en fonction de la concentration de l'huile
essentielle de feuilles de C.viminalis. L'effet fumigant s'observe
dès la plus faible concentration (0,064ul/ml) avec 53,24% de
mortalité. Nous avons enregistré ensuite une mortalitée de
98,48% aux concentrations 0, 128 et 0,256ul/ml ; elle est de 97,48% à la
plus grande concentration testée (0,512ul/ml). Les tests statistiques
nous ont permis de confirmer ces données. Une différence de
mortalité statistiquement significative (p<0,05) existe entre la plus
faible concentration testée (0,064ul/ml) et les 3 autres concentrations
(0,128ul/ml ; 0,256ul/ml et 0,512ul/ml). Cependant il n'existe pas une
différence de mortalité significative entre les concentrations
0,128 ; 0,256 et 0,512ul/ml.
b b b
a
0,064ul/ml 0,128ul/ml 0,256ul/ml
0,512ul/ml
concentration (ul/ml)
|
pourcentage de mortalite
corrige
|
100 80 60 40 20 0
|

C viminalis
Figure13: Effet fumigant de
C.viminalis sur C.maculatus
Les histogrammes affectés d'une même lettre
alphabétique ne sont pas statiquement différents.
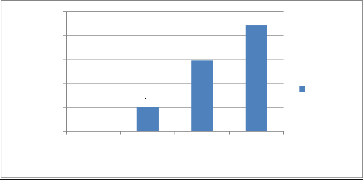
1.2.3. Effet fumigant de L. chevalieri sur C.maculatus
Les résultats sont présentés dans la
figure 14. L'effet fumigant se manifeste à partir de la
concentration 0,128ul/ml avec 20,32% de mortalité. Le maximum de
mortalité est obtenu avec les concentrations 0,256ul/ml et 0,512ul/ml
avec des pourcentages respectifs (59%) et (88,52%). En les comparant
statistiquement, une différence significative de mortalité
(p<0,05) entre les concentrations 0,064 et 0,128ul/ml avec les autres
concentrations est notée. Cependant il n'existe pas une
différence de mortalité significative entre les concentrations
0,256 et 0,512ul/ml. Cette différence de mortalité n'est pas
également significative entre la concentration 0,064 et 0,128ul/ml.
80
b
60
a
20
0
100
40
b
pourcentage de mortalite
corrige
L chevalieri
0,064ul/ml 0,128ul/ml 0,256ul/ml
0,512ul/ml
concentration (ul/ml)
a
Figure 14 : effet fumigant de
L.chevalieri sur C.maculatus
Les histogrammes affectés d'une même lettre
alphabétique ne sont pas statiquement différents.
1.3. Effet fumigant des huiles essentielles sur S. zeamais
L'efficacité des huiles essentielles est
observée à partir d'un seul paramètre : la
mortalité des adultes. Cette dernière est observée sur une
période de 2 jours (48H) à compter de la date de traitement des
adultes par les huiles essentielles.
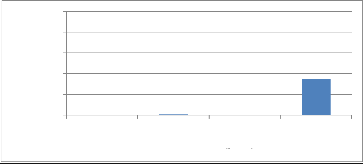
1.3.1. Effet fumigant de X. aethiopica
Les résultats sont présentés dans la
figure 15. Toutes les concentrations testées ont montré une
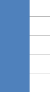
faible toxicité vis-à-vis des adultes de S.zeamais.
Toutefois, nous avons enregistré une mortalité de 35,08% à
la plus grande concentration (0 ,512ul/ml). L'analyse statistique montre qu'il
existe une différence de mortalité significative (p<0,05)
entre la concentration 0,512ul/ml et les différentes concentrations
testées.
|
100
|
|
|
|
80
|
|
|
|
|
60
|
|
|
|
|
40
|
|
|
|
|
20
|
|
|
|
|
a
|
a
|
a
|
|
0
|
0,064ul/ml
|
0,128ul/ml
|
0,256ul/ml
|
concentration (ul/ml)
pourcentage de mortalite
corrige
b
0,512ul/ml
Figure 15 : effet fumigant de
X.aethiopica sur S.zeamais.
Les histogrammes affectés d'une même lettre
alphabétique ne sont pas statiquement différents.
1.3.2. Effet fumigant de C. viminalis
Les résultats sont présentés dans la
figure 16. Aucune mortalité n'est enregistrée avec les faibles
concentrations testées (0,064ul/ml et 0,128 ul/ml) ; l'effet fumigant
s'observe à partir de la concentration 0,256ul/ml (57%), avec un maximum
de mortalité à la concentration 0,512ul/ml (97%). Cette analyse
est confirmée par les tests statistiques. En effet, il existe une
différence significative de mortalité (p<0,05) entre les
faibles concentrations (0,06 et 0,128ul/ml) et les fortes concentrations (0,256
et 0,512ul/ml); mais aussi entre ces deux dernières, le taux
mortalité est significativement différent avec p<0,05.
|
100
|
|
|
|
80
|
|
|
|
|
60
|
|
|
b
|
|
40
|
|
|
|
|
|
|
20
|
|
|
|
|
|
|
0
|
a
|
a
|
|
|
|
|
0,064ul/ml
|
0,128ul/ml
|
0,256ul/ml
|
concentration (ul/ml)
pourcentage de mortalie
corrige
c
0,512ul/ml
Figure 16 : Effet fumigant de
C.viminalis sur S.zeamais.
Les histogrammes affectés d'une même lettre
alphabétique ne sont pas statiquement différents.
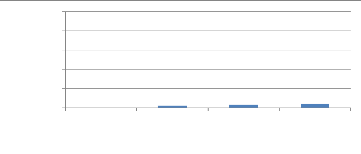
1.3.3. Effet fumigant de L. chevalieri
La figure 17 montre le taux de mortalité de
S.zeamais corrigé par rapport au témoin en
fonction des concentrations de l'huile essentielle de
L.chevalieri testées. L'huile essentielle de
L.chevalieri ne présente pas un effet fumigant avec 4% de
mortalité à la plus grande concentration (0,512ul/ml). L'analyse
statistique montre qu'il n'existe pas une différence significative de
mortalité entre les différentes concentrations testées.
80
60
40
20
0
pourcentage de mortalite
corrige
100
a a a a
0,064ul/ml 0,128ul/ml 0,256ul/ml 0,512ul/ml
concentration (ul/ml)
Figure 17 : effet fumigant de
L.chevalieri sur S.zeamais
Les histogrammes affectés d'une même lettre
alphabétique ne sont pas statiquement différents.
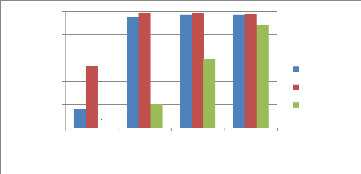
1.4. Comparaison de l'effet fumigant des huiles
essentielles sur C. maculatus
La figure 18 montre le taux de mortalité de C.
maculatus en fonction des concentrations des huiles essentielles
testées. L'activité insecticide de C.viminalis et
X.aethiopica se manifeste dès la petite concentration
(0,064ul/ml) avec des pourcentages respectifs 53,32% et 16,16%. Ce taux de
mortalité croit considérablement avec la concentration et atteint
le maximum de mortalité à la concentration 0,128ul/ml pour des
valeurs respectives de 98,48% et 94,92%. L'effet fumigant de
L.chevalieri s'observe à partir de la concentration 0,128ul/ml
avec 20,32% de mortalité. Cette mortalité croit
considérablement avec la concentration avec des mortalités
respectives de 59 et 88,52 % aux concentrations 0,256 et 0,512ul/ml.
L'analyse statistique des différents traitements montre
qu'avec la concentration 0,064ul/ml, l'huile essentielle de
C.viminalis donne une mortalité significativement (p<0,05)
plus élevée que celle de X.aethiopica et
L.chevalieri. Aux concentrations 0,128ul/ml et 0,256ul/ml, les
mortalités induites par les huiles de C.viminalis et
X.aethiopica sont statistiquement (P<0,05) plus
élevée que celle obtenue avec l'huile essentielle de
L.chevalieri. Cependant il n'existe pas une différence
significative de mortalité des insectes traités avec la
concentration 0,512ul/ml des huiles essentielles de C.viminalis,
X.aethiopica et L.chevalieri.
0,064ul/ml 0,128ul/ml 0,256ul/ml
0,512ul/ml
concentration (ul/ml)
X aethiopica C viminalis
L chevalieri
100
c c c
c c c
c
80
b
b
60
40
a
20
pourcentage de mortalite
corrige
0
a
a
Figure18 : Comparaison de l'effet fumigant des
huiles essentielles sur C maculatus.
Les histogrammes affectés d'une même lettre
alphabétique ne sont pas statiquement différents.
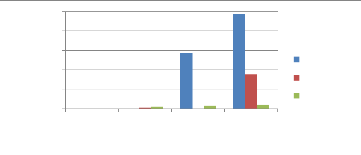
1.5. Comparaison de l'effet fumigant des huiles
essentielles sur S.zeamais
La figure 19 montre l'évolution des pourcentages des
mortalités des adultes de S. zeamais en fonction des
concentrations des huiles essentielles utilisées. Elles n'ont pas
donné le même effet fumigant vis à vis des adultes de
S.zeamais. L'huile essentielle de C.viminalis présente
un effet fumigant aux fortes concentrations (0,256ul/ml et 0,512ul/ml). Les
huiles essentielles de L.chevalieri et X .aethiopica n'ont
montré aucune toxicité à l'égard de
S.zeamais. Toutefois, l'huile essentielle de X.aethiopica
produit une mortalité de 35,08% à la plus grande concentration
(0,512ul/ml).
Aux concentrations 0,256 et 0,512ul/ml, l'huile essentielle de
C.viminalis entraine une mortalité significativement plus
élevée (p<0,05) que celles de X.aethiopica et
L.chevalieri.
|
100
|
|
|
|
|
|
80
|
|
|
|
|
|
|
60
|
|
|
|
|
|
|
40
|
|
|
|
|
|
|
20
|
|
|
|
|
|
|
0
|
a
|
a
|
a
|
a
|
a a
|
0,064ul/ml 0,128ul/ml 0,256ul/ml
0,512ul/ml
concentration (ul/ml)
pourcentage de mortalite
corrige
c
b
b
a
a
a
C viminalis X aethiopica L chevalieri
Figure19 : Comparaison de l'effet fumigant des
huiles essentielles sur S.zeamais.
Les histogrammes affectés d'une même lettre
alphabétique ne sont pas statiquement différents.
1.6. Effet persistant des huiles essentielles
La persistance des huiles essentielles est observée
à partir d'un seul paramètre : la mortalité des adultes
à chaque 48H. Cette dernière est observée sur une
période de 6 jours.
1.6.1. Effet Persistant de l'huile essentielle de C.
viminalis sur S.zeamais
La figure 20 montre l'évolution des pourcentages des
mortalités corrigés des adultes de S.zeamais en fonction
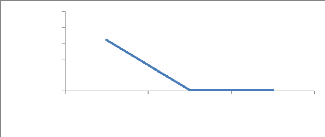
de la CL 90 (0,38 ul/ml) et de la durée. Les huiles essentielles de
C.viminalis agissent de manière significative les 2 premiers
jours. Après 48 H, le taux de mortalité diminue
considérablement et passe de 64% (48H) à 1% (96H et 144H). Une
différence significative (p<0,05) de mortalité est
notée entre le premier jour d'observation (48H) et les 2 autres
observations (96H et 144H). Mais il n'existe pas une différence de
mortalité significative à 96H et 144H.
100
48h 96h 144h
durée (H)
b b
a
80
60
40
20
pourcentage de
mortalite corrige
0
Figure 20 : effet persistant de
C.viminalis sur S.zeamais.
1.6.2 Effet persistant des huiles essentielles sur
C.maculatus
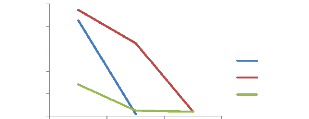
La figure 21 illustre l'évolution des pourcentages des
mortalités corrigés par rapport au témoin des adultes de
C.maculatus en fonction du temps et de la CL90 des huiles
essentielles. Les huiles essentielles de L.chevalieri agissent de
manière significative dans les 4 premiers jours. Elle occasionne une
mortalité de 94,64% et 65,12% respectivement à 48H et 96H avec
une CL90 de 0,44ul/ml. Cette mortalité décroit et atteint
à 4,04% après 96H. Les huiles essentielles de
C.viminalis et X.aethiopica ont une faible persistance ;
elles produisent une mortalité respective de 2% et 5,04% à la
deuxième observation (96H) avec des CL90 respectifs de 0,1ul/ml et
0,11ul/ml. L'analyse statistique des données montre que la persistance
de l'huile de L.chevalieri est significativement différente
(p<0,05) de celle des huiles de C.viminalis et X.aethiopica
à 96H. Elle donne également une mortalité
significativement plus élevée à 48H (94,4%) et 96H
(65,12%) qu'à 144H (4,04%). Cette différence de mortalité
est aussi observée sur C.viminalis entre 48H (85,4%) et 96H
(2%).Cependant il n'existe pas une différence de mortalité
significative entre C.viminalis
(48H) et L.chevalieri (48H et 96H). Cette
différence de mortalité n'est pas également significative
entre C.viminalis (96H), L.chevalieri (96H) et
X.aethiopica (48H, 96H et144H).
48h 96h 144h
durée (H)
C viminalis L chevalieri X aethiopica
pourcentage de mortalite
corrigee
100
40
80
60
20
0
a
a
a
b
2
b
,
b
Figure 21 : Effet persistant des huiles
essentielles sur C.maculatus
2. Discussions
La teneur en huile essentielle dépend de plusieurs
facteurs à savoir l'espèce, le milieu de récolte, la
période de récolte, les pratiques culturales et la technique
d'extraction. Le rendement en huile essentielle est meilleur pour l'ensemble de
3 espèces. C.viminalis présente le meilleur rendement
(5,1%), suivi de X.aethiopica (1,9%). Nos résultats sont
similaires avec ceux rapportés par certains auteurs qui ont mis en
évidence le rendement des huiles essentielles ; par exemple
Srivastava et al., 2003 cité par Ndomo et al.,2009 ont
obtenu un rendement de 0,45% sur C.viminalis récoltée en
Inde. En 2009, Ndomo et al., ont eu un rendement de 0,85% sur cette
même espèce récoltée au Cameroun.
Dans cette étude, les trois(3) huiles essentielles
testées ont révélé une activité insecticide
intéressante à l'égard de C.maculatus. A faible
concentration les huiles essentielles de C.viminalis et
X.aethiopica ont eu un effet très significatif sur la survie de
C.maculatus, ravageur principal du niébé ; qui devient
plus intéressant aux fortes concentrations. Quant au charançon de
maïs (S. zeamais), l'huile essentielle de C.viminalis a
montré une activité insecticide intéressante aux fortes
concentrations. Cependant, à faible concentration elle n'a aucune
toxicité vis-à-vis des adultes de S.zeamais. Les huiles
essentielles de X.aethiopica et de L.chevalieri ont
révélé une faible activité insecticide à
l'égard de S.zeamais. Toutefois, l'huile essentielle
X.aethiopica produit une mortalité assez significative à
la plus grande concentration, c'est qui nous amène à penser
qu'une éventuelle activité insecticide intéressante est
possible si on augmente la concentration.
La faible toxicité de l'huile essentielle de
L.chevalieri vis-à-vis de S. zeamais pourrait
s'expliquer par une tolérance de cette espèce à
l'égard de cette huile essentielle qui serait constituée de
thymol, carvacrol, acétate de tymile, P-cymène (Konaté,
2004). Une analyse chimique de l'huile essentielle testée pourrait
confirmer cette hypothèse. Ce phénomène de
tolérance vis-à-vis des molécules actives des plantes
insecticides a été mis en évidence par des auteurs comme
Paul et al.,2009 cité par Gueye et al.,2011 en
fournissant plusieurs exemples de plantes avec une efficacité
différente entre les feuilles entières ou réduites en
poudre et les graines dans le contrôle de C. maculatus et
Zabrotes subfasciatus. Les molécules actives des plantes
insecticides peuvent varier d'une famille à une autre, à
l'intérieur d'une famille et la sensibilité peut différer
d'une espèce à une autre et à l'intérieur d'une
espèce (Gueye et al.,2011). C'est qui peut expliquer
les différences de sensibilité obtenus sur C.maculatus
et S.zeamais à l'égard de ces 3 huiles essentielles.
Selon Kouninki et al.,2007 , les huiles essentielles
de ces 3 espèces contiennent majoritairement des monoterpènes
hydrocarbonés tel que le â-pinène dont les
propriétés insecticides ont déjà été
démontrées vis-à-vis du S.zeamais et
monoterpènes oxygénés comme le 1,8-cinéole
(eucalyptol), le linalool, l'eugénol et le cymol dont les
propriétés insecticides ont été également
déjà démontrées vis-à-vis de plusieurs
insectes, entre autres Tribolium confusum, Tribolium
castaneum, Sitophilus zeamais, Prostephanus
truncatus, Rhyzoperta dominica et
Callosobruchus maculatus (Regnault-Roger & Hamraoui , 1995 ;
Obeng-Ofori et al., 1997 ; Prates et al., 1998 ; Tapondjou ,
2005 In Ndomo et al., 2009).
L'effet persistant de 3 huiles essentielles est faible
à l'égard de C.maculatus et S.zeamais.
Toutefois l'huile essentielle de L.chevalieri révèle une
persistance de 4 jours à l'égard de C.maculatus. Dans la
littérature, les données relatives à la persistance des
huiles essentielles sont quasiment inexistantes
Il serait difficile de penser que l'activité
insecticide de ces huiles essentielles se limite uniquement à certains
de ses constituants majoritaires; elle pourrait aussi être due à
certains constituants minoritaires ou à un effet synergique de plusieurs
constituants (Ndomo et al.,2009).
Conclusion et perspectives
Cette étude avait pour objectif d'étudier
l'effet insecticide et la persistance des huiles essentielles de
Callistemon viminalis, de Xylopia aethiopica et de Lippia
chevalieri sur la survie des adultes de Sitophilus zeamais et
Callosobruchus maculatus.
Les huiles essentielles de C.viminalis, de
L.chevalieri et X.aethiopica présentent
sur
C.maculatus une mortalité maximale aux plus fortes
concentrations. L'huile essentielle de
C.viminalis présente également un effet
fumigant intéressant à la plus grande concentration 0,512ul/ml
vis-à-vis de S.zeamais. Les huiles essentielles de
L.chevalieri et de X.aethiopica ont
révélé une faible activité insecticide à
l'égard de S.zeamais.
L'effet persistant est faible dans l'ensemble des trois (3)
huiles essentielles, seule l'huile essentielle de L.chevalieri
présente une persistance de 4jours sur C.maculatus. Nos
résultats indiquent que pour les stocks de niébé, il est
possible d'utiliser les huiles essentielles de C.viminalis, de
X.aethiopica et de L.chevalieri. En outre, l'utilisation de
l'huile essentielle de C.viminalis contre S.zeamais serait
une piste prometteuse pour la protection des stocks de maïs.
L'utilisation de l'huile essentielle seule n'est pas
recommandable pour une protection à longue durée de
denrées stockées, d'où la nécessité de la
mise au point d'une méthode de stabilisation des huiles essentielles en
vue d'accroitre leur efficacité. L'effet fumigant des huiles
essentielles contre les ennemies naturelles de ces ravageurs doit être
testé ultérieurement pour qu'en fin assurer une meilleure
protection de ces denrées (niébé et maïs).Il serait
intéressant de mener une étude sur le dosage des principes
actifs, la toxicité des huiles et sur l'activité biologique des
plantes étudiées en fonction du stade phénologique, des
lieux de récolte et des organes pour mieux évaluer
l'efficacité de ces huiles essentielles. En fin, une étude en
milieu paysan doit être aussi envisagée en vue de tester les
mêmes paramètres dans les greniers traditionnels.
Références bibliographiques
.
1. Aboubakry S., 2010. Sensibilité de
quelques variétés de blé cultivés dans la
vallée du fleuve Sénégal au ravageur Sitophilus
zeamais Motchulsky. Mémoire pour l'obtention du diplôme de
Master II de Biologie Animale à l'Université Cheikh Anta Diop de
Dakar,30p.
2. Adjanohoun E. J. et al., 1988.
Contribution aux études ethnobotaniques et floristiques en
République Populaire du Congo. Collection médecine
traditionnelle et pharmacopée. ACCT. Paris. pp.21- 91.
3. Akpovi C. S., 1993.
Etude au laboratoire de l'efficacité de Dinarmus basalis
Rondani. (Hymenoptera : Pteromalidae) ectoparasite de Callosobruchus
maculatus Fabricius (Coléoptera : Bruchidae). Mémoire
d'ingénieur Agronome à l'Université Nationale du Benin
Cotonou, 98p.
4. Alzouma I., 1981. Observations of the
ecology of Bruchidius atrolineatus Pic and Callosobruchus
maculatus F. (Coléoptera: Bruchidae) in Niger. In: The Ecology
of Bruchids Attacking Legumes. Edited by Labeyrie, Sunk, The hague:
pp.205-213
5. Anonyme, 2008. Gestion des populations de
ravageurs pour un développement durable en Afrique. Résumé
de la 3ème Colloque international du REARB et ler Colloque du
COMEC/PV à l'université de Lomé, 33p.
6. Anonyme, 2009.Les invertébrés
continentaux des pays de la Loire-Gretia, document online ,18p.
7. Arbonnier M., 2002. Arbres,
arbustes et lianes des zones sèches d'Afrique de l'ouest. Editions Quae.
Paris, 573p.
8. Benayad N., 2008. Les huiles essentielles
extraites des plantes médicinales Marocaines : Moyen de lutte efficace
contre les denrées alimentaires stockées. Faculté des
sciences de Rabat, projet de recherche, 59p.
9. Camara M., 1997. Recherche sur les nouvelles
substances biocides végétales - Application au contrôle des
bruches de niébé Callosobruchus maculatus F. et de
l'arachide Caryedon serratus Ol. Mémoire de diplôme
d'ingénieur agronome à l'Ecole nationale supérieure
d'agriculture de Thiès, 72p.
10. Danho M. et Haubruge E., 2003. Comportement
de ponte et stratégie reproductive de Sitophilus zeamais
[Coléoptera : Curculionidae]. Phytoprotection.
84 (2) : 59-67.
11. Delobel A., Tran M., 1993. Les
coléoptères des denrées alimentaires entreposées
dans les régions chaudes. ORSTOM/CTA. Paris, 424p.
12. Djossou J., 2006. Etude des
possibilités d'utilisations des formulations à base de fruits
secs de Xylopia aethiopica Dunal (Annonaceae) pour la protection des
stocks de niébé contre Callosobruchus maculatus
Fabricius (Coléoptera :Bruchidae). Mémoire d'ingénieur
agronome à la Faculté des Sciences Agronomiques de Gembloux
Belgique, 27p.
13. FAO, 1993. Le maïs dans la nutrition
humaine, N0 T0395, version 25.
14. FAO, 2003. La Culture traditionnelle du
Niébé au Sénégal. Etude de cas, 46p.
15. Glitho I.A., Nuto Y., Attoh A., Sambena B.,
Kounnou K., 1988. Ecologie et biologie de la reproduction des
Bruchidae parasites des légumineuses alimentaires cultivées au
Togo et au Bénin. Rapport ABN (Biosciences), Lomé; 81p.
16. Guèye M.T., Seck D., Wathelet J-P. &
Lognay G., 2011. Lutte contre les ravageurs des stocks de
céréales et de légumineuses au Sénégal et en
Afrique occidentale : synthèse bibliographique. Biotechnol. Agron.
Soc. Environ .15(1): 183-194.
17. Huignard J., Leroi B., Alzouma I., Germain J.F..,
1985. Oviposition and development of Bruchidae atrolineatus
Pic and Callosobruchus maculatus F. (Coléoptera: Bruchidae) in
Vigna unguiculalata L. Walp cultures in Niger. Insect Sci. Applic.
6 : 691-699.
18. ITA, 2008. La protection des stocks de
maïs : enquête sur les pratiques d'utilisation des pesticides et des
plantes à effet insecticide en milieu paysan. Bulletin de
vulgarisation de la recherche et du développement agro-alimentaire au
Sénégal. (03) :6.
19. Kebe K. and Sembène M., 2011.
Cowpea (Vigna unguiculata (L.) Walp) field infestation by the bruchids
(Coléoptera: Bruchidae) in the northern Senegal: preliminary biological
and ecological data. Journal of Applied Biosciences.
41:2788 - 2796.
20. Ketoh G.K., Glitho I A., Nuto Y., Koumaglo H.K.,
1998. Effets de six huiles essentielles sur les ~ufs et les larves de
Callosobruchus maculatus F. (Coléoptera : bruchidae).
Sciences médecine, revue Cames. 00 :16-20.
21. Konaté N., 2005. Etude de la
consommation des médicaments traditionnels améliorés dans
le cercle de Kadiolo. Faculté de médecine de pharmacie et
d'odonto-stomatologie de l'Université de Bamako, thèse de
doctorat d'état, 147p.
22. Kouakou C.K., 2004. Diversité
génétique des variétés traditionnelles de
niébé (Vigna unguiculata (L.)Walp.) au Sénégal .DEA
de Biologie végétale à l'Université cheikh Anta
Diop de Dakar, 50p.
23. Kouninki H., Hance T., Noudjou F.A.., Lognay G.,
Malaisse F., Ngassoum M.B., Mapongmetsem P.M., Ngamo L.S.T. and Haubruge E.,
2007. Toxicity of some terpenoids of essential oils of Xylopia
aethiopica from Cameroon against Sitophilus zeamais Motchulsky.
Journal of Applied Entomology, document online, 8p.
24. Kumar R., 1984. Insect pest control.
Edward Arnold Ltd, New York, 298p.
25. Laleye D.W., 2007. Interaction de
Baculovirus MaviNPV et du Parasitoïde (Apanteles taragamae
(Viereck)) (Hymenoptera: Braconidae) pour le contrôle de Maruca
vitrata Fabricius (Lepidoptera : Pyralidae). Mémoire de
diplôme d'ingénieur Agronome à l'Université d'Abomey
Calavi du bénin, 20p.
26. Lenting M.I., 2000. Preferences and
performances of Callosobruchus maculatus F. (Coléoptera:
Bruchidae) on pods of various plant species towards naturals vegetation
manipulation on cowpea production in Benin. Thesis of Msc n°003. Univ.
Wageningen, 31p.
27. Lienard V., Seck D., 1994. Revue des
méthodes de lutte contre Callosobruchus maculatus F.
(Coléoptera : Bruchidae), ravageur des graines de niébé
(Vigna unguiculata L. Walp) en Afrique Tropicale. Insect Sci.
Appli. 15 (3):301-311.
28. Messina J.F., 1984. Influence of cowpea
pod maturity on the oviposition choices and larval survival of a bruchid beetle
Callosobruchus maculatus. Ent. Esp. Appli. 35:
241- 248.
29. Murdock L.L., Shade R.E., Kitch L.W., Ntourkam
G., Lowenberg-Deboer J., Huesing J.E., Moar W., Chamblis O.L., Endondo L.,
Wolfson J.L., 1997. Post-harvest storage of cowpea research.
Copublication of IITA and JIRCAS: pp. 303-312.
30. Ndomo A.F., Tapondjou A.L., Tendonkeng F.,
Tchouanguep F.M., 2009. Evaluation des propriétés
insecticides de feuilles de Callistemon viminalis (Myrtaceae) contre
les adultes d' d'Acanthoscelides obtectus (Say) (Coléoptera;
Bruchidae). Tropicultura. 27(3) : 137-143.
31. Ngamo L.S.T. & Hance T., 2007.
Diversité des ravageurs des denrées et méthodes
alternatives de lutte en milieu tropical. Tropicultura.
25 (4): 215-220.
32. Ngamo Tinkeu L. S., Goudoum A., Ngassoum M. B.,
Mapongmetsem, Lognay G., Malaisse F. and Hance T. , 2007. Chronic
toxicity of essential oils of 3 local aromatic plants towards Sitophilus
zeamais Motsch. (Coléoptera: Curculionidae). African
Journal of Agricultural Research. 2 (4):
164-167.
33. Noudjou F. and al., 2007.
Composition of Xylopia aethiopica (Dunal) A. Rich
essential oils from Cameroon and identification of a minor diterpene:
ent-13-epi manoyl oxide. Biotechnologie, agronomie, societé et
environnement.11(3) : 193-199.
34. Ouédraogo P.A., 1991. Le
déterminisme du polymorphisme imaginal chez Callosobruchus
maculatus F. (Coléoptera : Bruchidae), son importance sur la
biologie de cette bruche. Thèse de Doctorat à l'Université
de Tours (France), 197p.
35. Seck D., 2009. Stockage, conservation et
transformation des récoltes en zones tropicales. Notes de cours, 31P.
36. Seck D., 1994. Développement de
méthodes alternatives de contrôle des principaux insectes
ravageurs des denrées emmagasinées au Sénégal par
l'utilisation de plantes indigènes. Thèse de Doctorat à la
Faculté des Sciences agronomiques de Gembloux, 192 p.
37. Seck D., Gaspar CH., 1992 :
Efficacité du stockage du niébé (Vigna unguiculata (L)
Walp) en fûts métalliques hermétiques comme méthode
alternative de contrôle de Callosobruchus maculatus F.
(Coléoptères bruchidae) en Afrique Sahélienne. Med. Fac.
Landbonww. Univ. Gent. 57 (3a) : 75 l-757.
38. Sembène M., 2000.Variabilité
de l'espaceur interne transcrit(ITS1) de l'ADN ribosomique et polymorphisme des
locus microsatellites chez la bruche Caryedon serratus (olivier) :
différenciation en races d'hôtes et infestation de l'arachide au
Sénégal. Thèse de doctorat d'état es sciences
à l'Université Cheikh Anta Diop de Dakar, 180p.
39. Singh B.B., Singh S.R., 1992.
Sélection du niébé résistant aux bruches. La
recherche à l'IITA, (5) :1-5.
40. Southgate B.J., 1979. Biology of the
Bruchidae. Ann. Rev. Entomology. 24: 449-473.
41. Utida S., 1954. Phase dimorphism observed
in the laboratory population of the cowpea weevil Callosobruchus
quadrimaculatus. Oyo-Dobuts-Zasshi.18:
161-168.
Webographie
1.
http://www.fao.org/fileadmin/userupload/inpho/docs/PostHar
vest_Compendium_-_MAIZE.pdf (le 20 octobre 2011 à 15h).
2.
http://fr.wikipedia.org/wiki/Maïs
(le 30 juin 2011 à 14h30).
3.
http://fr.wikipedia.org/wiki/Xylopia_aethiopica
(le 30 juin à 15h).
4.
www.flickr.com/photos/organprinter/4897906013(le
25octobre 2011 à 12h).
5.
www.underwoodgardens.com
(le 25 octobre 2011 à 15h).
Annexe 1 : Insecticides de contacts
autorisés pour le traitement des denrées entreposées au
Sénégal
|
Matière active Spécialité commerciale
|
Concentr.En matière
active
|
Nature de
la
formulation
|
Utilisations
|
|
[BROMPOPHOS]
|
|
|
|
|
Nexion EC 36
|
360 g/l
|
EC
|
Désinsectisation des stocks de
céréales et d'arachide (8 à 12
|
|
Nexion poudre 2 %
|
2 %
|
DP
|
g/tonne)
|
|
Nexion WP 25
|
25 %
|
WP
|
|
|
[CHLORPYRIPHOS-METHYLE]
|
|
|
|
|
|
|
Désinsectisation des stocks
|
|
Reldan
|
240 g/l
|
EC
|
d'arachide (2,5 g/tonne).
|
|
[DELTAMETHRINE]
|
12,5 g/l
|
EC
|
|
|
K- othrine EC 12,5
|
|
|
|
|
25 g/l
|
EC
|
Désinsectisation des stocks
|
|
K- othrine EC 25
|
|
|
|
|
K- othrine 2,5 PM K- othrine 0 ,05 PP
|
2,5 g/l 0,05 g/l
|
WP DP
|
d'arachide, niébé, maïs, sorgho, mil (0,5
à 1 g/tonne).
|
|
[DICHLORVOS]
|
|
|
|
|
Mafu 500 SL
|
500 g/l
|
SL
|
|
|
|
|
Désinsectisation des grains
|
|
Dichlotox 1000 SL
|
1000 g/l
|
SL
|
stockés.
|
|
[FENTROTHION]
|
|
|
|
|
Folithion 1 DP
|
1 %
|
DP
|
|
|
Folithion 500 EC
|
500 g/l
|
EC
|
Désinsectisation des stocks
|
|
Folithion 1000 EC
|
1000 g/l
|
EC
|
d'arachide et de céréales.
|
|
Sumifène poudre
|
1,5 %
|
DP
|
|
|
Sumithion CE 60
|
|
|
|
|
600 g/l
|
EC
|
|
|
Sumithion 2 %
|
|
|
|
|
[MALATHION] malagrain émulsion
|
2 % 500 g/l
|
DP EC
|
Désinsectisation des
céréales (8
g/tonne).
|
|
Malagrain poudrage
|
2 %
|
DP
|
|
|
[PYRIMPHOS-METHYLE]
|
|
|
|
|
Actellic 2 PP
|
2 %
|
DP
|
Désinsectisation des grains stockés (4 g/tonne).
|
|
Actellic 25 PM
|
25 %
|
WP
|
|
|
Actellic 50 EC
|
500 g/l
|
CE
|
|
(Source : DPV du Sénégal In Seck, 2009)
| 













