
MEMOIRE DE FIN D'ETUDES
Pour l'Obtention du Diplôme de Master Sciences et
Techniques
Activités larvicides des extraits de plantes sur
les larves de moustiques vecteurs de maladies parasitaires


DEDICACES
Comme symbole d'une profonde gratitude et de dévouement je
dédie ce modeste travail en premier lieu :
A la mémoire de mon grand
père,
A la
mémoire de ma grande mère,
A la
mémoire de l'oncle Kamal.
A la mémoire de tous s'eux qui nous ont
quittés
«J'aurais tant aimée que vous soyez
parmi nous dans des moments pareilles »
· A mes chers parents
Et particulièrement à ma très
chère mère qui rien au monde ne pourra compenser tous les
sacrifices qu'elle a consentis pour notre bien et pour notre éducation,
que dieu la garde et lui donne longue vie et une prospère santé
pour qu'a mon tour je puisse la combler de tous ce qu'elle mérite.
· A mes chères soeurs et chères
frères
Qui mon toujours soutenus et mon donnés force pour
persévérer dans les pires moments, je vous aime.
· A tous mes amis et particulièrement à mon
amie d'enfance Samira.
Avec tout mon amour, et toute ma reconnaissance,
Meryem
Table des matières
Remerciements
Liste des figures
Liste des tableaux
Abréviations et symboles
|
Introduction
générale.................................................................................
|
1
|
|
Chapitre I : Généralités sur
l'utilisation des plantes dans la lutte contre les vecteurs de maladies
parasitaires.
|
|
|
I-Les maladies à transmission vectorielle
(MTV).............................................
|
3
|
|
1. Les maladies à transmission
vectorielle au
Maroc ............................................
|
5
|
|
II- Les
vecteurs.......................................................................................
|
5
|
|
1. Le
moustique........................................................................................
|
6
|
|
1.1 Cycle de développement du
moustique ......................................................
|
6
|
|
1.1.2 Phase
aérienne .................................................................................
|
6
|
|
1.1.3 Phase
aquatique ................................................................................
|
7
|
|
1.2 Classification des
moustiques...................................................................
|
8
|
|
1.3 Caractères distinctifs des genres
anophélinae et culicinae .................................
|
8
|
|
- Culex pipiens : Espèce
de la sous famille des Culicinae
......................................
|
9
|
|
- Anopheles
labranchiae : Espèce de la sous famille des
Anophelinae .........................
|
10
|
|
III- La lutte contre les maladies à
transmission vectorielle.................................
|
10
|
|
1. Lutte
anti-larvaire...................................................................................
|
11
|
|
1.1 Les différents moyens de lutte
antivectorielle................................................
|
11
|
|
a-Lutte
biologique..............................................................................
|
11
|
|
b-La lutte
physique.............................................................................
|
12
|
|
c-La lutte
chimique............................................................................
|
12
|
|
3.3.1. Les classes d'insecticides utilisés dans la
lutte antivectorielle...........................
|
12
|
|
1.3 Pollution et insecticides
.........................................................................
|
17
|
|
Iv- les
plantes.........................................................................................
|
18
|
|
1-Les huiles
essentielles..............................................................................
|
19
|
|
1-1
Généralités.........................................................................................
|
19
|
|
1-1-2
Définition........................................................................................
|
19
|
|
1-2 Histoire de leur utilisation
.......................................................................
|
20
|
|
1-3 Activité insecticide : mécanismes
d'action...................................................
|
20
|
|
2.1. Principales méthodes
d'extraction .............................................................
|
21
|
|
2.1.1. L'entraînement à la vapeur
d'eau.................................................................
|
21
|
|
2.1.2.
L'hydrodistillation..................................................................................
|
21
|
|
2.1.3. La distillation à vapeur
saturée...................................................................
|
22
|
|
2.1.4.
L'hydrodiffusion....................................................................................
|
22
|
|
2.1.5. L'expression à
froid............................................................................
|
22
|
|
2.2. Autres méthodes d'obtention des extraits volatils
..........................................
|
22
|
|
2.2.1. Extraction par
solvants........................................................................
|
22
|
|
2.2.2. Extraction par les corps
gras..................................................................
|
23
|
|
3. Préparations des extraits
aqueux....................................................................
|
23
|
|
3.1.
Infusion...........................................................................................
|
24
|
|
3.2.
Décoction............................................................................................
|
24
|
|
3.3. Macération
....................................................................................
|
24
|
|
Chapitre II : Matériel et méthodes
|
|
|
1. Lieu et période de l'étude
.........................................................................
|
25
|
|
I- Matériel végétale
...................................................................................
|
26
|
|
1. Choix des
plantes...................................................................................
|
26
|
|
2. Identification des
plantes .......................................................................
|
26
|
|
3. Récolte des plantes et extraction des huiles
essentielles.......................................
|
26
|
|
3.1 Récolte des
plantes ..............................................................................
|
26
|
|
3.2 Séchage des
plantes .............................................................................
|
26
|
|
3.3 Broyage des
plantes ..............................................................................
|
27
|
|
3.4 Extraction des huiles essentielles
.............................................................
|
28
|
|
3.5 Analyse de la composition chimique par chromatographie en
phase gazeuse et couplage chromatographie en phase gazeuse -
spectrométrie de masse ......................
|
29
|
|
II- Matériel
biologique..............................................................................
|
30
|
|
1. Choix des
larves....................................................................................
|
30
|
|
2. Prospection des
gites ..............................................................................
|
30
|
|
3. Collecte et Conservation des
larves .............................................................
|
31
|
|
3.1 Collecte des
larves ...............................................................................
|
31
|
|
3.2 Conservation des
larves ...........................................................................
|
31
|
|
4. Identification
entomologique.....................................................................
|
31
|
|
4.1 Traitement au
laboratoire.........................................................................
|
31
|
|
4.2 Identification des
larves ..........................................................................
|
31
|
|
III- Préparation des extraits des plantes
........................................................
|
32
|
|
1. Préparation des extraits
aqueux..................................................................
|
32
|
|
2. Préparation à partir des huiles
essentielles ......................................................
|
32
|
|
IV- Tests de
toxicité.................................................................................
|
32
|
|
ï Expérimentation 1:
Détermination de l'effet larvicide de 6 extraits
aqueux...............
|
32
|
|
ï Expérimentation 2:
Détermination de l'effet larvicide de 6 huiles
essentielles............
|
33
|
|
ï Expérimentation 3: Comparaison
entre l'action des extraits de plantes et des insecticides sur les larves de
moustiques.........................................................
|
33
|
|
Résultats et discussion
|
|
|
I-Matériel végétale
.................................................................................
|
35
|
|
1.1 Identification des
plantes ........................................................................
|
35
|
|
1.2 Extraction des huiles essentielles
.............................................................
|
40
|
|
1.3 Analyse de la composition chimique par chromatographie en
phase gazeuse et couplage chromatographie en phase gazeuse -
spectrométrie de masse ......................
|
40
|
|
II-Matériel
biologique.................................................................................
|
44
|
|
1. Prospection
desgites...............................................................................
|
44
|
|
2. Gîtes
étudiés........................................................................................
|
44
|
|
III-Tests de
toxicité..................................................................................
|
45
|
|
ï Expérimentation 1: Détermination de
l'effet larvicide de 6 extraits aqueux..............
|
45
|
|
ï Expérimentation 2: Détermination de
l'effet larvicide de 6 huiles essentielles............
|
50
|
|
ï Expérimentation 3: Comparaison entre l'action
des extraits de plantes et des insecticides sur les larves de
moustiques.......................................................
|
55
|
|
Discussion................................................................................................
|
57
|
|
Conclusion et
perspectives...........................................................................
|
59
|
Références bibliographiques
Annexe
Abréviations et symboles
|
°C
|
Degré Celcius
|
|
Ö
|
Diamètre
|
|
mg
|
milligramme
|
|
ìl
|
microlitre
|
|
ml
|
millilitre
|
|
g
|
gramme
|
|
mm
|
millimètre
|
|
h
|
heure
|
|
CPG
|
Chromatographie en Phase Gazeuse
|
|
Cx pipiens
|
Culex pipiens
|
|
DELM
|
Direction de l'Epidémiologie et de Lutte Contre les
Maladies
|
|
DL50
|
Dose Létale, qui tue 50 %
|
|
DL95
|
Dose Létale, qui tue 95 %
|
|
HE
|
Huiles Essentielle
|
|
H.R
|
Humidité Relative
|
|
INPMA
|
Institut National des Plantes Médicinales et
Aromatiques
|
|
GC
|
Gas Chromatography
|
|
LRDEHM
|
Laboratoire Régional de Diagnostic
Épidémiologique et d'Hygiène du Milieu
|
|
MTV
|
Maladies à Transmission Vectorielle
|
|
OMS
|
Organisation Mondiale de la Santé
|
|
R
|
Rendement
|
|
SM
|
Spectrométrie de Masse
|
|
T°
|
Température
|
|
TH
|
Taux d'Humidité
|
|
|
|
|
Liste des tableaux
|
Chapitre I : Synthèse bibliographique
|
Pages
|
|
Tableau 1
|
Maladies transmises par des moustiques et autres
diptères piqueurs (OMS, 1999).
|
4
|
|
Tableau 2
|
Classification des espèces de la famille des
culicidae.
|
8
|
|
Chapitre II : Matériel et
méthode.
|
|
Tableau 3
|
Concentration d'insecticides utilisés.
|
33
|
|
Résultats et discussion
|
|
Tableau 4
|
Identification botanique des espèces
végétales récoltées au niveau de l'INPMA.
|
35
|
|
Tableau 5
|
Taux d'humidité présent dans la poudre des
6 espèces végétales testées.
|
38
|
|
Tableau 6
|
Estimation des quantités du résidu sec des
6 espèces végétales testées.
|
38
|
|
Tableau 7
|
Rendement d'extraction et couleur des 6 huiles
essentielles.
|
40
|
|
Tableau 8
|
Composition chimique de l'HE d'Origanum majorana.
|
41
|
|
Tableau 9
|
Composition chimique de l'HE du Rosmarinus
officinalis (chemotype à á-pinène).
|
42
|
|
Tableau 10
|
Composition chimique de l'HE de Thymus vulgaris.
|
43
|
|
Tableau 11
|
Gîtes larvaires prospectés au niveau de la
ville de Fès.
|
44
|
|
Tableau 12
|
Mortalité (%) des larves de Culex pipiens en
fonction de la concentration des extraits aqueux (%) de 6 espèces
végétales après 24 heures d'exposition.
|
46
|
|
Tableau 13
|
Mortalité (%) des larves de Culex pipiens en
fonction de la concentration des extraits aqueux (%) de 6 espèces
végétales après 24 heures d'exposition.
|
47
|
|
Tableau 14
|
Moyenne de Mortalité (%) des larves de Culex
pipiens de 2 répétitions en fonction de la concentration
des extraits aqueux (%) de 6 espèces végétales
après 24 heures d'exposition.
|
48
|
|
Tableau 15
|
Mortalité (%) des larves de Culex pipiens en
fonction de la concentration des huiles essentielles (%) de 6 espèces
végétales après 24 heures d'exposition.
|
50
|
|
Tableau 16
|
Mortalité (%) des larves d'Anopheles
labranchiae en fonction de la concentration d'huile
essentielle (%) d'Eucalyptus camaldulensis L.
après 24 heures d'exposition.
|
53
|
|
Tableau 17
|
Concentrations létales CL50 et CL95 (24 h) des huiles
essentielles de 6 espèces végétales à
l'égard des larves de Culex pipiens.
|
54
|
|
Tableau 18
|
Mortalité (%) des larves de culex pipiens
en fonction de la concentration d'insecticides (mg/l) du
Téméphos et Malathion après 24 heures d'exposition.
|
55
|
|
Tableau 19
|
Concentrations létales CL50 et CL95 (24 h) des
insecticides à l'égard des larves de Culex pipiens.
|
56
|
|
Tableau 20
|
Conditions de température et d'humidité Relative
durant la réalisation des tests.
|
56
|
Liste des figures
|
Chapitre I : Synthèse bibliographique
|
Pages
|
|
Figure 1
|
Mortalité attribuée aux maladies à
transmission vectorielle (OMS, 2004).
|
4
|
|
Figure 2
|
Evolution du nombre des maladies parasitaires (DELM 2007).
|
5
|
|
Figure 3
|
Cycle de développement du Moustique.
|
7
|
|
Figure 4
|
Différences entre Anopheles et Culex
(OMS, 2003).
|
9
|
|
Figure 5
|
Structure chimique du DDT.
|
13
|
|
Figure 6
|
Structure chimique du malathion.
|
14
|
|
Figure 7
|
Structure chimique du Parathion.
|
14
|
|
Figure 8
|
Structure chimique du Temephos.
|
14
|
|
Figure 9
|
Structure chimique de l'acide carbamique.
|
15
|
|
Figure 10
|
Structure chimique de la perméthrine.
|
16
|
|
Figure 11
|
Structure chimique de la deltaméthrine.
|
16
|
|
Figure 12
|
Structure chimique du lambdacyalothrine.
|
16
|
|
Figure 13
|
Structure chimique de la Cyperméthrine.
|
17
|
|
Figure 14
|
Structure chimique de la cyfluthrine.
|
17
|
|
Chapitre II : Matériel et
méthode
|
|
Figure 15
|
Etuve à ventilation forcée.
|
27
|
|
Figure 16
|
Broyeur à tamis intégré.
|
27
|
|
Figure 17
|
Hydrodistillation par Clevenger.
|
29
|
|
Figure 18
|
Tests de sensibilités réalisés sur les
larves de moustiques.
|
34
|
|
Résultats et discussion
|
|
Figure 19
|
Gîte Ibn Al Baytar.
|
45
|
|
Figure 20
|
Gîte Charia Fès-Sais
|
45
|
|
Figure 21
|
Pourcentages de mortalité suivant les extraits aqueux
des 6 espèces végétales testés.
|
48
|
|
Figure 22
|
Effet larvicide des huiles essentielles (0,1%) de
Rosmarinus officinalis, Eucalyptus
camaldulensis et Salvia officinalis sur culex
pipiens.
|
52
|
|
Figure 23
|
Effet larvicide des huiles essentielles (0 ,5 %) de
Rosmarinus officinalis, Eucalyptus
camaldulensis, Salvia officinalis, Thymus vulgaris, Artemisia
absinthum et Origanum majorana sur culex pipiens.
|
52
|
|
Figure 24
|
Effet larvicide des huiles essentielles (2 %) de
Rosmarinus officinalis, Eucalyptus
camaldulensis,Thymus vulgaris et Artemisia absinthum sur
culex pipiens.
|
53
|
|
Figure 25
|
Effet larvicide du Téméphos et du
Malathion sur les larves de culex pipiens après 24
heures d'exposition.
|
55
|
|
Figure 26
|
Conditions de température et d'humidité
relative.
|
57
|
INTRODUCTION générale
En dehors de leur nuisance, les moustiques causent aussi des
maladies vectorielles. Les principaux genres de moustique sont :
Anopheles, Aedes, Culex et Mansonia. Dans les pays en
développement, les maladies vectorielles les plus fréquentes sont
le paludisme (malaria) et la fièvre jaune. Le moustique Culex
quinquefasciatus est le principal vecteur de la Filariose de Bancroft et
de maladies virales comme les encéphalites.
Au Maroc, le paludisme autochtone est dû au parasite
Plasmodium vivax qui est le principal vecteur signalé
au Maroc depuis 1949 par Boyd (Guy, 1976) et le responsable de la transmission
est l'Anopheles labranchiae.
Les études pratiques et statistiques, menées au
laboratoire Régional de Diagnostic Epidémiologique et
d'Hygiène de Milieu de la Direction Régionale de la Santé
à Fès , ont montré que les espèces du genre culex
et du genre Aedes sont retrouvées durant toute l'année et que
l'espèce Anopheles (Anopheles) labranchiae Fallerouni, 1926,
vecteur responsable du paludisme autochtone éliminé en 2004, est
présente également chaque année, d'autres espèces
ont été trouvées telles que Anopheles (Anopheles)
claviger Meigen, 1804 ; Anopheles (Anopheles) algeriensis
Theobald, 1903 ; Anopheles (Cellia) cinereus Theobald,
1901 et Anopheles (Cellia) sergenti Theobald, 1907.
La présence de ces espèces constitue une menace
réelle pour la région de Fès Boulemane qui a comme
particularité l'association d'un certains nombre de facteurs de
risque notamment:
- un bioclimat semi-aride,
- un régime annuel de précipitation
constitué de deux périodes distinctes ; une pluvieuse du
mois d'octobre au mois d'avril et une autre sèche du mois de juin au
mois de septembre (EL Bouhali, 2001),
- le mouvement de la population de et vers les zones
avoisinantes, jadis considérées comme vastes zones du paludisme
hyper endémique (Zone du littoral atlantique Nord, grandes plaines de
Gharb et du Sais) (province de taounat-El Houcima, de khmissat et celle de
Ouazzan) (Faraj , 2008),
- la présence dans cette région des
ressortissants de nombreux pays d'Afrique sub-saharienne touchés par le
paludisme et l'existence de risque de l'implantation de cas importés (El
Ouali Lalami et al., 2009).
C'est dans le cadre de la lutte contre les vecteurs de
ces maladies parasitaires que des quantités très importantes de
larvicides sous forme de produits chimiques de synthèse sont
utilisées pour lutter contre les larves du moustique.
Cependant, en dehors de leur toxicité, certains
produits chimiques utilisés dans cette lutte sont devenus moins
efficaces du fait de la résistance développée par certains
moustiques (OMS ,1999).
Les scientifiques tentent alors de trouver d'autres produits
accessibles, moins toxiques (produits naturels surtout qui sont connu sous le
nom de bio- insecticides) pour mener cette lutte.
Par ailleurs, la comparaison des produits naturels
avec les produits chimiques de synthèse permettrait de mieux valoriser
ces bio-insecticides naturels, même si l'utilisation de produits naturels
n'est sans risques.
C'est dans ce cadre que s'inscrit notre travail qui a
pour but évaluer l'activité larvicide des extraits aqueux de
plantes et des huiles essentielles en comparaison avec les insecticides
utilisés pour la lutte contre les larves du moustiques vecteurs de
maladies parasitaires.
Chapitre I :
Généralités sur l'utilisation des
plantes dans la lutte contre les vecteurs de maladies parasitaires
I- Les maladies à transmission vectorielle
(MTV) :
Les maladies à transmission vectorielle (Tableau
1) maladies pour lesquelles l'agent pathogène (virus, bactérie ou
parasite) est transmis d'un individu infecté (un hôte
vertébré : homme ou animal) à un autre par
l'intermédiaire d'un arthropode (insecte, tique) hématophage. Ces
maladies, notamment les maladies humaines comme le paludisme ou la dengue,
contribuent de façon majeure à l'impact global des maladies dans
le monde (Figure1) (OMS, 2004). La production animale est également
souvent sérieusement affectée par des maladies vectorielles comme
la trypanosomose animale, la fièvre de la vallée du Rift ou la
fièvre catarrhale du mouton (OIE, 2003).
Ces maladies ont ainsi des effets non seulement sur la
santé mais également sur le développement
socio-économique des pays touchés.
D'autre part, aujourd'hui, nombre de maladies
émergentes du fait notamment des changements écologiques tels le
réchauffement climatique et la modification des
écosystèmes, sont des maladies à transmission vectorielle.
En effet, ces maladies sont particulièrement sensibles aux changements
écologiques susceptibles de modifier l'aire de répartition de
certains pathogènes et/ou vecteurs et de favoriser la propagation de la
maladie. C'est le cas, par exemple, de l'émergence récente de la
fièvre catarrhale ovine dans le bassin méditerranéen
(Purse et al., 2005) ou de la fièvre du Nil occidental aux Etats-Unis
(Glaser, 2004).
Ainsi, le contrôle des maladies vectorielles
constitue aujourd'hui un enjeu majeur. Ce contrôle passe par la
compréhension des mécanismes de transmission de la maladie, qui
sont généralement complexes du fait du mode de transmission
indirect des maladies à transmission vectorielle faisant intervenir de
nombreux acteurs : plusieurs vecteurs impliqués dans le cycle de
transmission, éventuellement plusieurs hôtes, ou la
présence d'un réservoir (population, vertébrée ou
invertébrée), assurant le maintien de l'agent infectieux dans la
nature (Rodhain et al., 1985).
Tableau 1 : Maladies transmises par des
moustiques et autres diptères piqueurs (OMS, 1999).
|
Vecteurs
|
Maladies
|
|
Moustiques (Culicidés)
|
|
|
Anopheles
|
Paludisme, filariose lymphatique
|
|
Culex
|
Filariose lymphatique, encéphalite japonaise, autres
viroses
|
|
Aedes
|
Fièvre jaune, dengue, dengue hémorragique, autres
viroses, filariose lymphatique
|
|
Mansonia
|
Filariose lymphatique
|
|
Autres diptères piqueurs
|
|
|
Mouches tsé-tsé (glossines)
|
Trypanosomiase africaine (maladie du sommeil)
|
|
Simulies
|
Cécité des rivières
(onchocercose),mansonellose
(généralement asymptomatique)
|
|
Phlébotomes (Phlebotomus,Lutzomyia)
|
leishmaniose, fièvres à phlébotomes
|
|
Taons (tabanidés)
|
Loase, tularémie
|
|
Cératopogonides
|
Mansonellose (généralement asymptomatique)
|
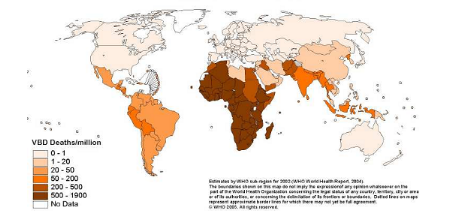
Figure 1. Mortalité attribuée aux
maladies à transmission vectorielle (OMS, 2004).
1. Les maladies à transmission
vectorielle au Maroc :
Au Maroc, la charge de morbidité due aux
maladies transmissibles reste relativement élevée et celle
liée aux maladies transmises par vecteurs (MTV) en constitue une part
non négligeable. Si certaines parmi ces dernières sont
éliminés telle que le paludisme et la bilharziose, l'incidence
des leishmanioses demeure par contre relativement importante (Azizi et Laaziri,
2006).
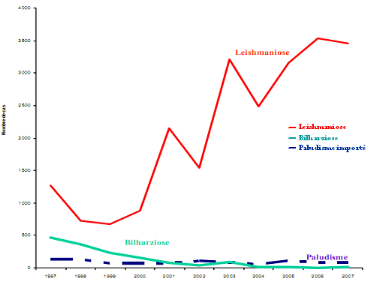
Figure 2 : Evolution du nombre des
maladies parasitaires (DELM 2007).
II-Les vecteurs
Le vecteur est par définition un arthropode
hématophage qui, à l'occasion de relations écologiques,
acquiert un agent pathogène et assure, par son comportement, la
transmission biologique active (ou mécanique) de l'agent
pathogène d'un hôte vertébré à un autre
(Rodhain , 1985). Parmi les 14600 espèces d'arthropodes
hématophages effectuant plus ou moins régulièrement
des repas de sang sur des vertébrés, y compris l'homme,
seulement 2 à 3 % seraient des vecteurs de maladies de
l'espèce humaine ou d'animaux domestiques (Ribeiro, 1995).
Les vecteurs interviennent de manière
indispensable dans le cycle des pathogènes. La distribution des
maladies à transmission vectorielle est ainsi restreinte à la
distribution spatiale des vecteurs et des hôtes (Kitron, 1998).
1. Le moustique
Les moustiques se distinguent des
autres insectes piqueurs par leur long corps grêle, leurs longues pattes
et leurs pièces buccales en forme d'aiguilles. On peut quelquefois
discerner une apparence d'écaillés au niveau des ailes. Les
imagos (insectes adultes) ont entre 2 et 12,5 mm de longueur (OMS, 1999).
1.1 Cycle de développement du
moustique :
Le cycle de développement des moustiques dure
environ douze à vingt jours (Adisso et Alia, 2005) et comprend quatre
stades: l'oeuf, la larve, la nymphe (pupe) et l'adulte. Cette
métamorphose se déroule en deux phases à savoir:
1.1.2 Phase aérienne :
Les adultes mâles et femelles se nourrissent de
jus sucrés, de nectars et d'autres secrétions
végétales. Pourtant, une fois fécondées, les
femelles partent en quête d'un repas sanguin duquel, elles retirent les
protéines et leurs acides aminés, nécessaires pour la
maturation des oeufs. Ce repas sanguin prélevé sur un
vertébré (mammifère, amphibien, oiseau), est ensuite
digéré dans un endroit abrité (Guillaumot, 2006).
Dès que la femelle est gravide, elle se met en
quête d'un gîte de ponte adéquat pour le
développement de ses larves. La ponte a lieu généralement
au crépuscule. Le gîte larvaire est une eau stagnante ou à
faible courant, douce ou salée (Ayitchedji, 1990). Selon Iroko (1994),
le sang, l'eau et une température d'au moins 18 °C sont les trois
conditions nécessaires, pour la reproduction et le développement
de certains moustiques d'Afrique du sud.
Le cycle de développement du moustique est
schématiquement représenté par la figure 3
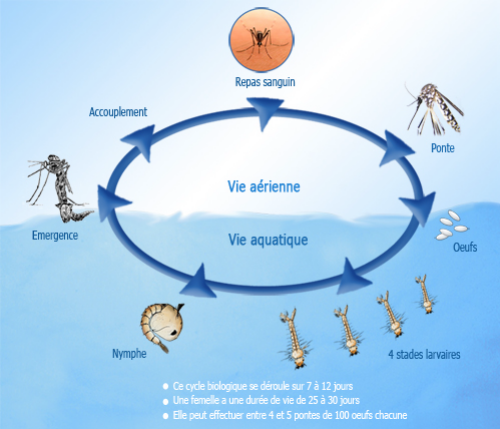
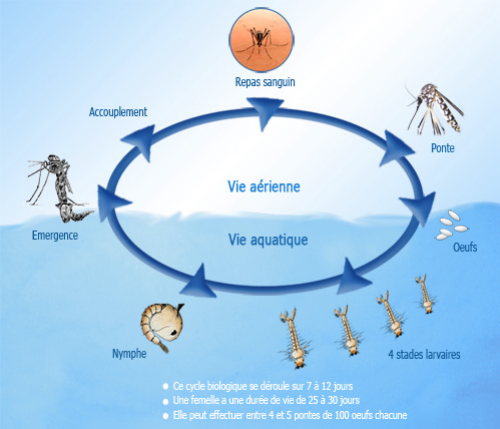 Figure 3 : Cycle de développement du
Moustique
Figure 3 : Cycle de développement du
Moustique
(http://www.ilm.pf/infomoustiques.consulté le
10/05/2010).
1.1.2 Phase aquatique :
Quelques jours après la fécondation,
suivant les espèces, les oeufs de diverses formes (fusiformes,
allongés, renflés dans leur milieu et parfois munis de minuscules
flotteurs latéraux) sont pondus par la femelle dans différents
milieux. La ponte est souvent de l'ordre de 100 à 400 oeufs et le stade
ovulaire dure deux à trois jours dans les conditions de:
température du milieu, pH de l'eau, nature et abondance de la
végétation aquatique de même que la faune associée.
La taille d'un oeuf est d'environ 0,5 mm (Rodhain et Perez, 1985).
A maturité, les oeufs s'éclosent et
donnent des larves de stade 1 (1 à 2 mm) qui, jusqu'au stade 4 (1,5 cm)
se nourrissent de matières organiques, de microorganismes et même
des proies vivantes (pour les espèces carnassières).
Malgré leur évolution aquatique, les larves de moustiques ont une
respiration aérienne qui se fait à l'aide de stigmates
respiratoires ou d'un siphon. La larve stade 4 est bien visible à l'oeil
nu par sa taille. Elle a une tête, qui porte latéralement les
taches oculaires et les deux antennes. Viennent ensuite le thorax et
l'abdomen.
Au bout de six à dix jours et plus, selon la
température de l'eau et la disponibilité en nourriture, la
quatrième mue donne naissance à une nymphe: c'est la nymphose
(Guillaumot, 2006). Généralement sous forme de virgule ou d'un
point d'interrogation, la nymphe, mobile, ne se nourrit pas durant tout le
stade nymphal (phase de métamorphose) qui dure un à cinq jours.
Elle remonte de temps à autre à la surface de l'eau pour respirer
et plonge vers le fond, dès qu'elle est dérangée.
A la fin de ce stade, la nymphe s'étire, son
tégument se fend dorsalement et, très lentement, le moustique
adulte (imago) s'extirpe de l'exuvie : c'est l'émergence, qui dure
environ quinze minutes au cours desquelles l'insecte se trouve exposé
sans défense face à de nombreux prédateurs de surface
(Rodhain et Perez, 1985).
1.2 Classification des moustiques
La classification des espèces de la famille des
culicidae est représentée dans le tableau 2 :

Tableau 2 : Classification des
espèces de la famille des culicidae.
1.3 Caractères distinctifs des genres
anophélinae et culicinae :
Les moustiques sont morphologiquement
différents les uns des autres. Il existe des différences entre
les deux sous-familles Anophelinae et Culicinae, qui portent sur les oeufs, les
larves, les nymphes, les palpes maxillaires, les antennes et la position au
repos (Figure 5).
Ainsi, selon l'OMS (2003):
- Les larves des Anophelinae respirent par des spiracles
dorsaux, ce qui leur impose la position parallèle à la surface de
l'eau, tandis que celles de Culicinae respirent par le siphon et ont de ce
fait, une position oblique à la surface de l'eau.
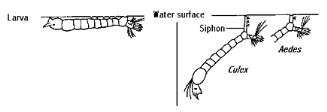
Figure 4: Différences entre Anopheles
et Culex (OMS, 2003).
- Culex pipiens : Espèce
de la sous famille des Culicinae.
Culex pipiens est le moustique le plus
fréquent dans le monde. C'est un moustique ubiquiste capable de
s'adapter à différents biotopes ; il se développe aussi
bien dans les milieux urbains que ruraux, dans les eaux polluées que
propres. Dans plusieurs régions, il est actif pendant toute
l'année et atteint son maximum de développement pendant les
saisons chaudes.
Ses préférences trophiques sont très
variables car il est plutôt ornithophile, mais il s'attaque volontiers
aux humains et aux mammifères lorsqu'ils cohabitent (Savage et Miller,
1995). Cx pipiens est connu comme étant vecteur de
plusieurs maladies notamment des arboviroses. Savage et al. le
considèrent comme l'un des principaux vecteurs du virus de
l'encéphalite de Saint-Louis (SLE) aux États-Unis. Il a
été considéré aussi comme le principal responsable
de l'épidémie du virus West Nile qui a frappé les
États-Unis en 2002 (Palmisano et al., 2005).
Au Maroc, Cx pipiens joue un grand
rôle dans la forte nuisance que connaît la majorité des
zones urbaines. Son rôle dans la transmission des épidémies
du virus West Nile qui ont touché le Maroc en 1996 (Harrack et al.,
1997 ; Murgue et al., 2001) et en 2003 (Schuffenecker et al .,2005)
est fortement suspecté sa forte densité qui coïncide dans le
temps et dans l'espace avec la date de dépistage des cas équins
fait de lui le vecteur le plus probable (INH, 2002). De ce fait, il est
primordial de connaître sa compétence et sa capacité
vectorielles dans les conditions marocaines (Detinova, 1963).
- Anopheles labranchiae :
Espèce de la sous famille des Anophelinae.
C'est le principal vecteur de paludisme dans la
région méditerranéenne et au Maroc.
Cette espèce occupe parmi les culicidés
méditerranéens une place prépondérante, due
à sa fréquence et à son importance dans la transmission du
paludisme .Elle est limitée à la partie occidentale du bassin
méditerranéen.
C'est le seul représentant des maculipennis en Afrique
du nord, Europe, Espagne, Italie, Corse, Sardaigne, Sicile...
Au Maroc, c'est un moustique très ubiquiste
qu'on retrouve sur les plaines littorale méditerranéennes et
atlantiques, jusqu'au sud d'Agadir. Son aire de distribution continentale
recouvre pratiquement tout le territoire, englobant les chaines de montagne du
Rif et du Moyen Atlas. Sa limite sud pourrait être
représentée par le versant du Haut Atlas. Il constitue
l'espèce dominante dans le nord ouest du pays et représente le
seul peuplement anophélien dans la plaine du Rharb (Himmi, 2007).
III- La lutte contre les maladies à transmission
vectorielle
La lutte contre les maladies à transmission
vectorielle nécessite une approche intégrée dirigée
à la fois contre les pathogènes et contre les vecteurs.
Aujourd'hui deux méthodes complémentaires de lutte sont
développées :
1 - la réduction de la charge parasitaire à
travers le dépistage et/ou le diagnostic afin de mettre en place un
traitement adapté chez les personnes infectées.
2 - la réduction des populations de vecteur et du
contact homme-vecteur à travers la lutte anti-vectorielle (Poinsignon,
2008).
1. Lutte anti-larvaire
La lutte anti-larvaire a été
très utilisée avant l'arrivée massive des
adulticides. Cette lutte empêche le développement des larves
en stade mature par la destruction des gîtes larvaires ou par
l'emploi de méthodes aboutissant au blocage du développement des
larves.
Diverses techniques sont employées allant des
plus rudimentaires aux plus sophistiquées : assainissement de
l'environnement, recours à des prédateurs larvicides (Fillinger
et al. 2003).
Ces diverses méthodes sont toujours utilisées
(OMS, 2006). L'application de ces techniques sur des surfaces
étendues a donné des résultats très
encourageants (éradication des populations d'Anopheles au
Brésil et en Egypte) (OMS , 2006).
1.1 Les différents moyens de lutte
antivectorielle
L'objectif principal de la lutte antivectorielle
est la diminution de la morbidité et de la mortalité
palustre grâce à l'abaissement du taux d'inoculation
entomologique. L'inoculation nécessitant la présence du
vecteur infecté, les méthodes actuelles visent principalement
la réduction du contact homme vecteur, la densité du vecteur
et la durée de vie du vecteur adulte (OMS, 2004a).
a- Lutte biologique
L'action contre les larves de moustiques par des
agents naturels consiste à détruire les larves ou à
empêcher leur développement par l'utilisation de forces naturelles
animées ou inanimées (OMS, 1974).
La lutte biologique consiste à introduire, dans le
biotope des moustiques, des espèces qui sont leurs ennemis, tels que
microorganismes ou prédateurs naturels des larves de moustiques ; les
moyens les plus répandus sont les larvicides biologiques et les poissons
larvivores.
b- La lutte physique
Par l'expression très générale
d'action physique on entend toute modification intentionnelle du milieu qui
vise soit à faire disparaitre ou réduire par des moyens physique
les nappes d'eau de surface dans lesquelles les moustiques se
développent, soit à provoquer des modifications physique du
milieu qui rendent l'eau impropre à la reproduction des moustiques.
L'action physique consiste généralement
à entreprendre des travaux de régularisation du régime des
eaux, d'aménagement de l'écoulement ou de modification physique
par d'autres moyens (OMS ,1974).
c- La lutte chimique
La lutte chimique consiste à l'utilisation de
produits chimique de synthèse pour lutter contre les larves et les
imagos de moustiques.
Les composés utilisés au début
contre les organismes nuisibles étaient des pesticides de
première génération relativement simple à base
d'arsenic, de soufre, de chaux, de dérivés du pétrole, de
substance à base de fluor ou extraite de plantes comme la nicotine. Ces
pesticides se caractérisent par leur toxicité relativement
élevée pour les organismes non visés et surtout leur
rémanence ou encore leur lente décomposition dans l'environnement
(Philogene, 1991).
Par la suite des composés synthétiques dits de
deuxième génération ont été mis en place, il
s'agit des organochlorés, des organophosphorés et des carbamates
(Philogene, 1991). Ces dits pesticides de deuxième
génération et les pyréthrinoïdes sont encore
utilisés de nos jours en agriculture et dans la lutte
antivectorielle.
1.2 Les classes d'insecticides utilisés dans la
lutte antivectorielle.
- Les organochlorés : DDT
Le dichloro-diphényl-trichloréthane
(DDT) (fig.5) est un composé qui présente une grande
solubilité dans les solvants organiques, les graisses et le
pétrole.
La combinaison de ses trois propriétés
(répulsivité, irritabilité et toxicité)
vis-à-vis des moustiques lui a valu sa place dans les programmes de
lutte contre le paludisme. L'OMS ne recommande son usage que pour la lutte
antivectorielle et sous la forme de pulvérisations intra domiciliaires
à effet rémanent (appliquées uniquement sur les murs
intérieurs des habitations) (OMS, 2004b).
Le DDT agit en perturbant l'ouverture des canaux sodium le
long de l'axone chez l'insecte qui meurt après hyperexcitation,
convulsions et paralysie.
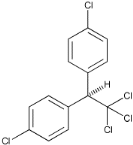
1,1, l-trichloro-Z, 2-bis (p-chlorophenyl)ethane
Figure 5 : Structure chimique du DDT
(
www.3dchem.com/molecules.asp?ID=90,
consulté le 22/05/2010).
- Les organophosphorés
Les organophosphorés agissent en inhibant
l'acétylcholinestérase, provoquant ainsi l'accumulation
d'acétylcholine et le blocage de la transmission de l'influx nerveux.
On distingue deux grands groupes d'organophosphorés
:
- les insecticides exothérapiques: le malathion
(fig.6), le parathion (fig.7) et le temephos (fig.8), ils
pénètrent directement dans l'organisme des insectes par des voies
diverses.
- les insecticides endothérapiques ou
systémiques qui ont la propriété de pénétrer
dans les végétaux et d'être transportés par la
sève. Ces insecticides subissent quelques fois des transformations
chimiques, mais restent toxiques pour les insectes qui consomment ces
végétaux. La forme oxydée de ces pesticides a la
faculté de se fixer sur l'acétylcholinestérase.
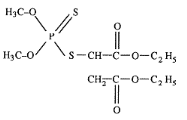
Figure 6 : Structure chimique du malathion
(http://www.ipmworld.umn.eduJchapters/ware.htm, consulté
le 22/05/2010).
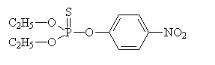
Figure 7 : Structure chimique du Parathion
(
http://www.chemistry.about.com/library/graphics/blpthion.htm,
consulté le 22/05/2010).
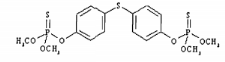
Figure 8 : Structure chimique du Temephos
(
http://www.epa.gov/oppsrrdl/REDs/temephosred.htm#IIC,
consulté le 22/05/2010).
- Les carbamates
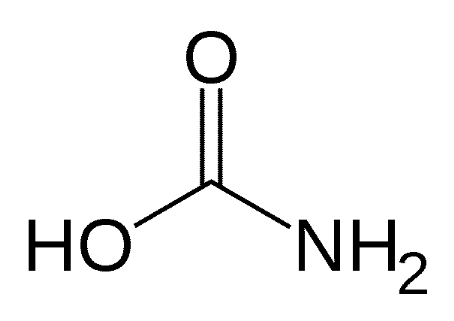
Les carbamates (NH2CO2H) sont
des esters de l'acide carbamique (fig.9).
Ce sont également des inhibiteurs de
l'acétylcholinestérase. Ils sont considérés comme
des insecticides de circonstances spéciales ou seulement utilisés
dans les cas où l'utilisation des autres insecticides se heurte à
un échec (Diabaté, 1999). Le propoxur est le plus utilisé
de ce groupe.
Figure
9: Structure chimique de l'acide carbamique
(
www.gfev.univ-tln.fr/AcidesCarbox/Acid.html,
consulté le 22/05/2010).
- Les Pyréthrinoïdes
Selon leur origine, ils ont été
classés en pyréthrinoïdes naturelles ou insecticides
botaniques extraites des plantes (Solanaceae, Compositaceae) et en
pyréthrinoïdes synthétiques (carboxylester).
Ils pénètrent facilement la cuticule des
insectes et interviennent au niveau du système nerveux de l'insecte pour
perturber l'action du neurotransmetteur GABA.
Ils ont également pour cible le canal sodium voltage
dépendant constitué par quatre domaines (I-IV) et six domaines
transmembranaires. Leur action à ce niveau contribue aussi à
perturber le signal nerveux (Hemingway et al., 2004). Les
pyréthrinoïdes sont largement utilisés dans l'agriculture
(Chandre et al., 1999; Diabaté et al., 2004) et dans
l'imprégnation des moustiquaires à cause de leur effet irritant
marqué sur les moustiques (Chandre et al., 1999). Les plus
utilisés sont : la pennéthrine (fig.10), la deltaméthrine
(fig.11), la lambdacyalothrine (fig.12), la cypennéthrine (fig.l3) et la
cytluthrine (fig.14). Parmi ces insecticides, l'alpha-cyperméthrine
confère une efficacité maximale aux moustiquaires
imprégnées contre An. gambiae (Hougard, 2003).
Figure 10 : structure chimique de la
perméthrine
(
http://www.3dchem.com/molecules.asp?ID=126#,
consulté le 22/05/2010).
Figure 11 : structure chimique de la
deltaméthrine
(
http://wapedia.mobi/fr/Fichier:Decamethrin-2D-skeletal.png,
consulté le 22/05/2010).
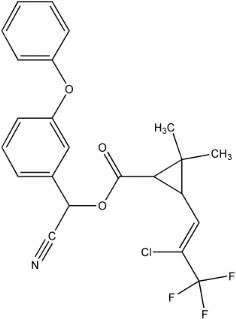
Figure 12 : structure chimique du
lambdacyalothrine.
(
http://www.pesticideinfo.org/ChemGifs/PC35463.gif,
consulté le 22/05/2010).
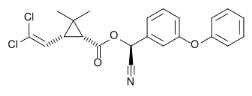
Figure 13 : structure chimique de la
Cyperméthrine
(
http://wapedia.mobi/fr/Cyfluthrine,
consulté le 22/05/2010).
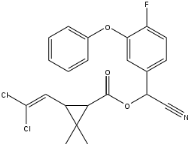
Figure
14 : Structure chimique de la cyfluthrine
(
http://wapedia.mobi/fr/Cyfluthrine,
consulté le 22/05/2010).
1.3 Pollution et insecticides
La présence de pesticides dans l'environnement
pose problème, pour la santé humaine et pour
l'équilibre des écosystèmes. Lorsqu'on en trouve dans
l'eau de consommation humaine, les risques sont particulièrement
élevés ; de même pour les écosystèmes
aquatiques, très sensibles aux pesticides, qui peuvent se concentrer
dans la chaîne trophique. De plus, les utilisations de pesticides
elles-mêmes impliquent aussi des risques sanitaires pour les utilisateurs
et les personnes amenées à fréquenter les surfaces
traitées, ce qui est courant pour les utilisations non agricoles
(boulet, 2005).
Car libérés dans l'environnement, les
pesticides vont évidemment éliminer les organismes contre
lesquels ils sont utilisés. Mais, la plupart de ces produits
vont également toucher d'autres organismes que ceux visés au
départ, de manière directe (absorption, ingestion,
respiration, etc.) ou indirecte (via un autre organisme
contaminé, de l' eau pollué, etc.). Les effets sur la
biodiversité, et notamment la flore et la faune terrestres et
aquatiques, sont donc indéniables.
Plusieurs phénomènes peuvent en effet
accroître l'impact des pesticides sur la faune et la flore sauvages.
Parmi ceux-ci, retenons notamment :
- la dispersion des produits : lors du traitement
d'une culture par des pesticides, une proportion non négligeable
de produit est disséminée dans l'environnement,
au-delà des zones traitées ;
- la non sélectivité : rares sont les
pesticides qui ont un effet sélectif, c'est-à-dire ciblé
sur une seule espèce ou un groupe d'espèces, car ils
interviennent sur des processus fondamentaux du métabolisme
(photosynthèse, croissance, reproduction, etc.) communs aux
espèces visés et aux autres espèces ;
- la toxicité de la molécule active et de ses
produits de dégradation : elle est variable d'un groupe d'espèces
à un autre ;
- la rémanence de la molécule et sa
capacité d'accumulation dans la chaîne alimentaire : certains
pesticides comme les organochlorés (le DDT ou le lindane par
exemple) sont peu ou pas dégradés dans le sol et les milieux
contaminés (eau, etc.). De ce fait, ces pesticides vont s'accumuler
dans les plantes, voire dans les graisses animales, et donc de se
concentrer tout au long de la chaîne alimentaire.
Iv- les plantes
L'histoire des plantes aromatiques et
médicinales est associée à l'évolution des
civilisations. Dans toutes les régions du monde, l'histoire des peuples
montre que ces plantes ont toujours occupé une place importante en
médecine, dans la composition des parfums et dans les
préparations culinaires.
La valorisation de ces ressources naturelles
végétales passe essentiellement par l'extraction de leurs huiles
essentielles. Ces dernières sont des produits à forte valeur
ajoutée, utilisées dans les industries pharmaceutiques,
cosmétiques et agroalimentaires. L'étude des activités
biologiques et biotechnologique des extraits de plantes est d'un grand
intérêt. Les activités antimicrobiennes des huiles
essentielles ont été rapportées dans plusieurs travaux
(Janssen et al., 1987 ; Bouzouita et al., 2005).
Dans la plupart des cas ces activités sont
attribuées aux monoterpènes oxygénés (Carson et
al., 1995). D'autre part nous savons que la conservation des denrées
entreposées est généralement assurée par des
insecticides de synthèse qui peuvent être le moyen le plus
efficace et le moins coûteux pour contrôler les insectes.
Cependant l'utilisation abusive des insecticides chimiques a des effets
négatifs. Des travaux sont effectués dans ce contexte et ont
montré une efficacité des extraits des plantes (Guarrera, 1999).
En effet les plantes constituent une source de substances naturelles qui
présente un grand potentiel d'application contre les insectes et
d'autres parasites des plantes et du monde animal.
1-Les huiles essentielles
1-1 Généralités
1-1-2 Définition
Le terme « Huiles essentielles » est un
terme générique qui désigne les composants liquides et
hautement volatiles des plantes, marqués par une forte et
caractéristique odeur. Les terpènes (principalement les
monoterpènes) représentent la majeure partie (environ 90%) de ces
composants.
Les huiles essentielles sont par définition des
métabolites secondaires produits par les plantes comme moyen de
défense contre les ravageurs phytophages. Ces extraits contiennent en
moyenne 20 à 60 composés qui sont pour la plupart des
molécules peu complexes (monoterpènes,
sesquiterpènes,...).
Il est admis que l'effet de ces composés purs peut
être différent de celui obtenu par des extraits de plantes.
Les huiles essentielles contiennent un nombre
considérable de familles biochimiques (chémotypes) incluant les
alcools, les phénols, les esters, les oxydes, les coumarines, les
sesquiterpènes, les terpénols, les cétones, les
aldéhydes, etc. On voit qu'elles ne sont pas constituées d'acides
gras, ni d'aucun autre corps gras.
Elles sont obtenues par expression (réservée aux
agrumes) ou par distillation à la vapeur d'eau. Elles sont volatiles,
solubles dans l'alcool et dans l'huile, mais pas dans l'eau. Ce sont des
substances odorantes.
1-2 Histoire de leur utilisation
Reconnues pour leurs puissantes
propriétés thérapeutiques et utilisées depuis des
millénaires en Chine, en Inde, au Moyen Orient, en Egypte, en
Grèce, en Amérique Latine (Aztèques, Mayas, Incas) et en
Afrique, les huiles essentielles tombent dans l'oubli au Moyen Age. A ce
moment, l'Europe connaît un retour à la barbarie avec un
déclin général du savoir. Il faudra attendre
l'arrivée des Arabes pour assister à un nouvel essor de la
médecine par les plantes qui retrouvent alors une place de choix dans
l'arsenal thérapeutique de l'époque.
L'utilisation des extraits de plantes comme insecticides est
connue depuis longtemps. Dans certaines régions d'Afrique noire, les
feuilles de tabac malaxées dans l'eau étaient utilisées
pour lutter contre les moustiques. Au Maroc, l'utilisation de plantes contre
les invasions de moustiques est une pratique très courante, surtout dans
les régions rurales.
1-3 Activité insecticide : mécanismes
d'action
Les huiles essentielles représentent une piste
d'avenir et les recherches sur les extraits d'huiles sont nombreuses : le
tableau de Mohan et Ramaswamy, 2007 (annexe 1) récapitule les
différentes études et les différents résultats.
Toutefois, la grande majorité de ces études
portaient sur les moustiques, que ce soit sur l'effet répulsif des
huiles essentielles ou sur leur effet larvicide (Ntonifor et al, 2006).
Le mode d'action des huiles essentielles est relativement peu
connu chez les insectes (Bekele et Hassanali, 2001) (Isman, 2000).
2. Extraction des huiles essentielles
Il existe plusieurs méthodes pour extraire les
huiles essentielles. Les principales sont basées sur
l'entraînement à la vapeur, l'expression, la solubilité et
la volatilité. Le choix de la méthode la mieux adaptée se
fait en fonction de la nature de la matière végétale
à traiter, des caractéristiques physico-chimiques de l'essence
à extraire, de l'usage de l'extrait et l'arôme du départ au
cours de l'extraction (Samate, 2001).
2.1. Principales méthodes d'extraction
Il existe plusieurs méthodes de distillation dont voici
les principales :
2.1.1. L'entraînement à la vapeur
d'eau
Les méthodes d'extraction par
l'entraînement à la vapeur d'eau sont basées sur le fait
que la plupart des composés volatils contenus dans les
végétaux sont entraînables par la vapeur d'eau, du fait de
leur point d'ébullition relativement bas et de leur caractère
hydrophobe. Sous l'action de la vapeur d'eau introduite ou formée dans
l'extracteur, l'essence se libère du tissu végétal et
entraînée par la vapeur d'eau. Le mélange de vapeurs est
condensé sur une surface froide et l'huile essentielle se sépare
par décantation (Bruneton, 1993).
En fonction de sa densité, elle peut être
recueillie à deux niveaux:
- au niveau supérieur du distillat, si elle est plus
légère que l'eau, ce qui est fréquent ;
- au niveau inférieur, si elle est plus dense que
l'eau.
Les principales variantes de l'extraction par
l'entraînement à la vapeur d'eau sont l'hydrodistillation, la
distillation à vapeur saturée et l'hydrodiffusion.
2.1.2. L'hydrodistillation
Le principe de l'hydrodistillation est celui de la
distillation des mélanges binaires non miscibles. Elle consiste à
immerger la biomasse végétale dans un alambic rempli d'eau, que
l'on porte ensuite à l'ébullition. La vapeur d'eau et l'essence
libérée par le matériel végétal forment un
mélange non miscible. Les composants d'un tel mélange se
comportent comme si chacun était tout seul à la
température du mélange, c'est à dire que la pression
partielle de la vapeur d'un composant est égale à la pression de
vapeur du corps pur.
Cette méthode est simple dans son principe et ne
nécessite pas un appareillage coûteux. Cependant, à cause
de l'eau, de l'acidité, de la température du milieu, il peut se
produire des réactions d'hydrolyse, de réarrangement, de
racémisation, d'oxydation, d'isomérisation, etc. qui peuvent
très sensiblement conduire à une dénaturation.
2.1.3. La distillation à vapeur
saturée
Dans cette variante, la
matière végétale n'est pas en contact avec l'eau. La
vapeur d'eau est injectée au travers de la masse végétale
disposée sur des plaques perforées. La distillation à
vapeur saturée est la méthode la plus utilisée à
l'heure actuelle dans l'industrie pour l'obtention des huiles essentielles
à partir de plantes aromatiques ou médicinales. En
général, elle est pratiquée à la pression
atmosphérique ou à son voisinage et à 100°C,
température d'ébullition d'eau. Son avantage est que les
altérations de l'huile essentielle recueillie sont minimisées.
2.1.4. L'hydrodiffusion
Elle consiste à pulser de la vapeur d'eau
à travers la masse végétale, du haut vers le bas. Ainsi le
flux de vapeur traversant la biomasse végétale est descendant
contrairement aux techniques classiques de distillation dont le flux de vapeur
est ascendant. L'avantage de cette technique est traduit par
l'amélioration qualitative et quantitative de l'huile
récoltée, l'économie du temps, de vapeur et
d'énergie.
2.1.5. L'expression à froid
L'extraction par expression est souvent
utilisée pour extraire les huiles essentielles des agrumes comme le
citron, l'orange, la mandarine, etc. Son principe consiste à rompre
mécaniquement les poches à essences. L'huile essentielle est
séparée par décantation ou centrifugation. D'autres
machines rompent les poches par dépression et recueillent directement
l'huile essentielle, ce qui évite les dégradations liées
à l'action de l'eau.
2.2. Autres méthodes d'obtention des extraits
volatils
2.2.1. Extraction par solvants
La méthode de cette extraction est basée
sur le fait que les essences aromatiques sont solubles dans la plupart des
solvants organiques. L'extraction se fait dans des extracteurs de construction
variée, en continu, semi-continu ou en discontinu.
Le procédé consiste à
épuiser le matériel végétal par un solvant à
bas point d'ébullition qui par la suite, sera éliminé par
distillation sous pression réduite.
L'évaporation du solvant donne un mélange
odorant de consistance pâteuse dont l'huile est extraite par l'alcool.
L'extraction par les solvants est très coûteuse à cause du
prix de l'équipement et de la grande consommation des solvants. Un autre
désavantage de cette extraction par les solvants est leur manque de
sélectivité; de ce fait, de nombreuses substances lipophiles
(huiles fixes, phospholipides, caroténoïdes, cires, coumarines,
etc.) peuvent se retrouver dans le mélange pâteux et imposer une
purification ultérieure (Brian, 1995).
2.2.2. Extraction par les corps gras
La méthode d'extraction par les corps gras est
utilisée en fleurage dans le traitement des parties fragiles de plantes
telles que les fleurs, qui sont très sensibles à l'action de la
température. Elle met à profit la liposolubilité des
composants odorants des végétaux dans les corps gras. Le principe
consiste à mettre les fleurs en contact d'un corps gras pour le saturer
en essence végétale. Le produit obtenu est une pommade florale
qui est ensuite épuisée par un solvant qu'on élimine sous
pression réduite. Dans cette technique, on peut distinguer l'enfleurage
où la saturation se fait par diffusion à la température
ambiante des arômes vers le corps gras et la digestion qui se pratique
à chaud, par immersion des organes végétaux dans le corps
gras (Brian, 1995).
Sous l'effet conjugué du chauffage
sélectif des micro-ondes et de la pression réduite de
façon séquentielle dans l'enceinte de l'extraction, l'eau de
constitution de la matière végétale fraîche entre
brutalement en ébullition. Le contenu des cellules est donc plus
aisément transféré vers l'extérieur du tissu
biologique, et l'essence est alors mise en oeuvre par la condensation, le
refroidissement des vapeurs et puis la décantation des condensats. Cette
technique présente les avantages suivants: rapidité,
économie du temps d'énergie et d'eau, extrait dépourvu de
solvant résiduel (Mompon, 1994 ; Brian, 1995).
3. Préparations des extraits aqueux :
Les trois préparations élémentaires sont
l'infusion, la décoction et la macération.
3.1. Infusion :
Elle consiste à verser de l'eau bouillante
sur les plantes (ou encore à jeter les plantes dans le
récipient contenant l'eau bouillante) au moment précis où
l'eau entre en ébullition. On couvre le récipient et on laisse
infuser le temps nécessaire. Le temps d'infusion est variable
suivant la nature de la plante : de dix minutes à une heure ; il va de
soi que celle des plantes à tissus plus épais (racines, tiges).
C'est par l'infusion que sont traitées les plantes médicinales
les plus couramment utilisées : Camomille, Menthe, Thé, Tilleul,
Verveine etc.
3.2. Décoction :
Cette préparation s'opère en faisant
bouillir les plantes, le plus souvent dans de l'eau, parfois dans du vin
(alcool). Elle convient surtout aux écorces, aux racines, tiges et
fruits. On laisse bouillir pendant un temps plus ou moins long selon les
espèces, en général de 10 à 30 minutes. Pour
extraire le plus possible de principes actifs, il faut avoir soin de
couper les plantes en menus morceaux, puis de passer la tisane en exprimant.
Par exemple, c'est par la décoction que sont
traités les racines de Patience et de Chicorée, les
feuilles et les fruits d'Epine-vinette, l'écorce de Bouleau, la
tige de Douce-amère.
3.3. Macération :
Très simple, cette préparation
s'obtient en mettant les plantes en contact, à froid, avec un liquide
quelconque. Ce liquide peut être du vin (vin de Gentiane), de l'alcool
(alcoolature d'Ail, teinture de Boldo), de l'huile (huile de Serpolet). Le
temps de contact est parfois très long. Les macérations
à l'eau, plus rarement employées, car elles ont
l'inconvénient de fermenter facilement, ne doivent pas, de toute
manière, excéder une dizaine d'heures (Gildemeister et Hoffmann,
1919).
Chapitre II :
Matériel et méthodes
1. Lieu et période de l'étude :
Nous nous sommes proposés d'étudier
l'activité larvicide des extraits aqueux de plantes et des huiles
essentielles sur les larves de moustiques vecteurs de maladies parasitaires
issues de différents gîtes surveillés de la ville de
Fès.
Ce travail d'une durée de 5 mois a été
réalisé en deux parties :
La première partie concernant l'extraction des
huiles essentielles et l'obtention de la poudre à partir des plantes,
s'est déroulée au niveau du Laboratoire de Valorisation et
Application Industrielle de l'Institut National des Plantes Médicinales
et Aromatiques de TAOUNAT(INPMA).

La deuxième partie concerne l'activité
larvicide en la comparant aux insecticides utilisés par les services du
Ministère de la Santé est réalisée à
l'Unité d'Entomologie du Paludisme du Laboratoire Régional de
Diagnostic Epidémiologique et d'Hygiène du Milieu (LRDEHM).
Ce laboratoire est situé à l'Hôpital EL
GHASSANI de Fès, disposant d'une Unité d'Entomologie
chargé de l'identification de moustiques et du suivi de la
sensibilité OMS des insectes aux pesticides. Il est la seule
entité du Ministère de la Santé opérant sur
l'identification et la surveillance des vecteurs culicidés et leurs
tests de sensibilité vis-à-vis des insecticides au niveau de la
région Fès-Boulemane.
I- Matériel végétale
1. Choix des plantes
Le choix des plantes est basé sur :
- Une recherche bibliographique ;
- Une observation de l'effet répulsif des plantes dans
leur environnement naturel vis-à-vis des insectes ;
- Utilisations traditionnelles des plantes par la population
locale.
2. Identification des plantes :
Les spécimens ont été identi?és
à l'Institut National des Plantes Médicinales et Aromatiques de
Taounate, par le Dr.
Abdeslam
Ennabili sous les numéros d'herbiers respectifs d'INP 216 à
INP 251.
3. Récolte des plantes et extraction des huiles
essentielles
3.1 Récolte des plantes :
Des échantillons de plantes ont
été récoltés dans le jardin expérimental de
l'Institut National des Plantes Médicinales et Aromatiques (INPMA) de
Taounate. Ces échantillons ont été prélevés
en mois de mars 2010.
3.2 Séchage des plantes :
La matière végétale (feuilles,
tiges et bois) de 20 plantes locales (récoltées au niveau de
l'Institut National des Plantes Médicinales et Aromatiques de Taounate),
a été séchée dans une étuve à
ventilation forcée portée à 40 °C pendant 24h
à 48 h.

Figure
15 : Etuve à ventilation forcée
3.3 Broyage des plantes :
Les feuilles des espèces végétales
ont été ensuite broyées à l'aide d'un broyeur muni
d'un tamiseur intégré de diamètre Ö < 1mm,
jusqu'à réduction en poudre.

Figure 16 : Broyeur à tamis
intégré
- Taux d'humidité :
5 g de poudre de plantes a été introduite dans une
étuve portée à 60 °C pendant 48 h, Cela permet
d'exprimer la teneur en eau.
Le Calculer du pourcentage du taux d'humidité TH est
donné selon la formule :
TH = (A/B) × 100
Où
A = perte de poids par séchage (en g) ;
B = masse initiale d'échantillon (en g).
- Estimation des quantités du résidu
sec :
Dans le but de donner une signi?cation plus logique
aux quantités de matières végétales solubles dans
les extraits aqueux, ces derniers ont été concentrés par
évaporation dans une étuve portée à 40 °C
pendant 48 h, jusqu'à l'obtention d'un résidu sec dont la
quantité est exprimée en mg. Cela permet d'exprimer les
concentrations létales des résidus secs solubles dans l'eau en
mg/l.
3.4 Extraction des huiles essentielles
Le matériel végétal est
constitué de la partie aérienne des plantes choisies, des
fractions d'environ 160 g à 200 g de feuilles de chaque plantes vont
être soumises à une hydrodistillation pendant 3 h, grâce
à un appareillage de type Clevenger modifié.
Les huiles essentielles recueillies par
décantation à la ?n de la distillation vont être
séchées sur du sulfate de sodium anhydre pour éliminer les
traces d'eau résiduelles. L'essence ainsi obtenue va être mise
dans des ?acons sombres, et le rendement d'extraction est calculé
par rapport au poids du matériel végétal avant
extraction.


Figure
17 : Hydrodistillation par Clevenger
Le rendement R en huile essentielle est calculé
à l'aide de la formule suivante :
Masse d'huile essentielle(g)
Masse du matériel végétal
utilisé(g)
R =
× 100
Un échantillon de chaque huile essentielle a
été analysé pour déterminer la composition chimique
par chromatographie en phase gazeuse couplé à la
spectrométrie de masse (CG/MS).
3.5 Analyse de la composition chimique par
chromatographie en phase gazeuse et couplage chromatographie en phase gazeuse -
spectrométrie de masse :
La composition chimique de l'huile essentielle a
été analysée par chromatographie en phase gazeuse
couplé à la spectrométrie de masse (CG/MS) ; ce qui
permet à la fois l'analyse chromatographique de chaque huile ainsi que
la détermination qualitative et quantitative des composés
majoritaires.
L'identification des constituants a été
réalisée par couplage d'un chromatographe en phase gazeuse de
marque PERKIN ELMER 8500 à un spectromètre de masse de type
FINNIGAN ITD (Ion Trap Detector), modèle 800 enregistrant à 70
eV. La colonne capillaire 5% Phényl-Méthyl-Siloxane
possède les caractéristiques suivantes : 30 m de longueur,
0.25 mm de diamètre interne, 0.25 ìm d'épaisseur du film).
Les conditions opératoires sont :
température de l'injecteur splitless (250°C), programmation de
température (de 40°C à 250°C, à raison de
6°C/min), gaz vecteur (He à 1 ml/min, vitesse linéaire
moyenne = 36 cm/s), températures de la source et du quadripôle
(230°C et 150°C respectivement), énergie d'ionisation (70 eV),
gamme de masse (35 à 400 amu).
L'identification des différents constituants est
réalisée à partir de leurs spectres de masse en
comparaison avec ceux des composés standard de la banque de
données informatisées WILEY 275.L (Adams, 2001). Pour les
hydrocarbures terpéniques divers, les confirmations sont obtenues par
comparaison des spectres de masse et de leurs indices de rétention selon
Kovats, donnés par la littérature (Joulain et König,
1998 ; Adams, 2001).
II- Matériel biologique
1. Choix des larves
Nous nous somme intéressés dans notre étude
à :
- Anopheles labranchiae vecteur du paludisme au
Maroc ;
- Culex pipiens du faite qu'il est responsable de la
nuisance.
2. Prospection des gîtes :
La prospection des
gîtes a pour but de recueillir des
informations sur la présence ou l'absence des vecteurs potentiels
de maladies parasitaires.
Il existe plus de 25 gîtes au niveau de la ville de
Fès, nous avons effectué une sortie de prospection des
gîtes pour choisir les gîtes à culex et ceux à
anophèle.
Les critères retenus pour le choix des gîtes
sont :
- Passé épidémiologique du
gîte ;
- Présence d'une forte densité de larves de
culicidés dans le gîte ;
- Mouvement de la population prés du gîte.
3. Collecte et Conservation des larves :
3.1 Collecte des larves :
La collecte des larves au niveau des gîtes
larvaires a été effectuée par l'utilisation d'un plateau
ou d'haricot, le plateau est introduit dans l'eau en inclinant son borde
à 45° sous l'effet des forces de tension, la couche superficielle
de l'eau est ainsi attirée ainsi que les spécimens qui y
surnagent.
3.2 Conservation des larves :
La conservation des larves a été faite
au niveau du terrain, les larves récoltées sont mises dans des
microtubes remplis au trois quart d'alcool à 70° (éthanol)
à l'aide d'une pipette.
4. Identification entomologique :
4.1 Traitement au laboratoire
Au laboratoire, les larves de moustiques de stade 3 et
4 ont été mises entre lame et lamelle et
déterminées sous microscope.
4.2 Identification des larves :
Un certain nombre de caractères morphologiques
sont utilisés pour l'identification des larves. Dans notre étude,
elles ont été déterminées à l'aide d'une
clé d'identi?cation des culicidés du Maroc (Himmi, 1995).
III- Préparation des extraits des plantes
1. Préparation des extraits aqueux
Après réduction en poudre. Une
quantité de 10 g de poudre de chaque plante a été
diluée dans 100 millilitre d'eau distillée préalablement
portée à ébullition, puis laissée refroidir sous
agitation magnétique pendant 30 minutes. Le mélange obtenu a
été ?ltré à l'aide du papier Whatman (125 MM). Le
?ltrat récupéré représente une solution stock
initiale à 10 g par 100 ml soit 10 %.
2. Préparation à partir des huiles
essentielles :
3. À partir des huiles essentielles extraites,
des solutions mères d'huiles essentielles de chaque échantillon
ont été préparées dans l'éthanol à
95-96°, à partir desquelles des dilutions ont été
réalisées dans l'eau de gîte pour obtenir des
concentrations expérimentales ?nales prête à être
tester.
IV- Tests de toxicité
La méthodologie de nos tests a
été inspirée de la technique des tests de
sensibilité normalisés par l'Organisation Mondiale de la
Santé, adoptée pour tester la sensibilité des larves,
vis-à-vis des insecticides utilisés en campagnes de lutte (OMS,
1963), (Aouinty et al.,2006).
Expérimentation 1:
Détermination de l'effet larvicide de 6 extraits aqueux.
- Protocole de la 1ère
expérimentation :
À partir de l'extrait initial (solution stock
10 %) de chaque plante et l'eau du gîte larvaire, des concentrations de
9 %, 8 %, 7 % , 6 % et 5 % ont été préparées.
10 larves du stade 3 et 4 ont été
prélevées à l'aide d'une pipette pasteur et mises
dans des gobelets de 5 cm du diamètre, contenant chacun 99 ml d'eau
du gîte (par introduction d'un millilitre de chaque solution ainsi
diluée dans les gobelets précédemment
préparés). Le même nombre de larves a été
placé dans un gobelet témoin contenant 100 ml d'eau du
gîte. Trois répétitions ont été
réalisées pour chaque dilution ainsi que pour le
témoin.
Expérimentation 2:
Détermination de l'effet larvicide de 6 huiles
essentielles.
- Protocole de la 2ème
expérimentation :
À partir des solutions mères d'huiles
essentielles (solution stock 0,5 %) de chaque plante, des concentrations de 0,5
%, 0,4 %, 0,3 %, 0,2 % et 0,1 % ont été préparées.
10 larves de stade 3 et 4 ont été prélevées
à l'aide d'une pipette pasteur et mises dans des gobelets du 5 cm
de diamètre, contenant chacun 99 ml d'eau du gîte (par
introduction d'un millilitre de chaque solution ainsi diluée dans les
gobelets précédemment préparés, ce qui correspond
dans tous les cas à une concentration en éthanol de 0,1 %). Trois
répétitions ont été réalisées pour
chaque dilution ainsi que pour le témoin.
Expérimentation 3: Comparaison entre
l'action des extraits de plantes et des insecticides sur les larves des
moustiques.
- Protocole de la 3ème
expérimentation :
À partir des concentrations mères
d'insecticide, des concentrations de 0,00125 mg/l, 0,0025 mg/l, 0,005 mg/l,
0,0125 mg/l, 0,025 mg/l ont été préparées (Tableau
3).
10 larves de stade 3 et 4 ont été
prélevées à l'aide d'une pipette pasteur et mises
dans des gobelets de 5 cm du diamètre, contenant chacun 99 ml
d'eau du gîte (par introduction d'un millilitre de chaque solution
ainsi diluée dans les gobelets précédemment
préparés, pour le témoin on introduit 1ml éthanol).
Trois répétitions ont été
réalisées pour chaque dilution ainsi que pour le
témoin.
Parmi les insecticides utilisés dans la lutte
antivectorielle, nous avons choisi de tester le Téméphos et le
Malathion.
Tableau 3 : Concentration d'insecticides
utilisés.
|
Solutions mères (mg /l)
|
Concentration à utiliser (mg/l)
|
V éthanol (ìl)
|
V insecticide (ìl)
|
|
1,25
|
0,00125
|
900
|
100
|
|
0,0025
|
800
|
200
|
|
0,005
|
600
|
400
|
|
0,0125
|
0
|
1000
|
|
6,25
|
0,025
|
600
|
400
|

Figure 18 : Tests de
sensibilités réalisés sur les larves de moustiques.
Après un temps de contacte de 24 h, on dénombre
les larves mortes et vivantes.
On calcule le pourcentage de mortalité chez les
témoins en utilisant la formule :
% m = NLm / (NLtotal - NNy)
%m = pourcentage de mortalité
NLm = nombre de larves mortes
NLtotal = nombre de larves total
NNy = nombre de nymphes
Le test est considéré valide si le pourcentage
de mortalité chez les témoins est inférieur à 5% ou
compris entre 5% et 20%.
Si le pourcentage de mortalité chez les témoins
est compris entre 5% et 20%, la mortalité après exposition doit
être Corrigée en utilisant la formule d'Abbott (OMS, 2004a).
% Mortalité corrigée =
(%Mort.Observée - %Mort.Témoin/100- % Mort.Témoin)
×100
Si la mortalité chez les témoins excède 20
%, le test est invalide et doit être recommencé.
RÉSULTATS ET DISCUSSION
I- Matériel végétale
1. Identification des plantes :
L'identification botanique des 20 espèces
végétales récoltées au niveau du jardin
expérimental de l'Institut National des Plantes Médicinales et
Aromatiques (INPMA) de Taounate est représentée dans le tableau
suivant :
Tableau 4. Identification botanique des
espèces végétales récoltées au niveau de
l'INPMA.
|
Code
|
Espèce végétale
|
Famille botanique
|
Date de récolte
|
|
INP 216
|
Thymus vulgaris L.
|
Lamiaceae
|
10 Mai 2010
|
|
INP 217
|
Mentha pulegium L.
|
Lamiaceae
|
11 Mai 2010
|
|
INP 219
|
Myrtus communis L.
|
Myrtaceae
|
04 Mai 2010
|
|
INP 223
|
Citrus aurantium L.
|
Rutaceae
|
05 Mai 2010
|
|
INP 225
|
Rosmarinus officinalis L.
|
Lamiaceae
|
02 Mai 2010
|
|
INP 227
|
Tamarix africana Poir.
|
Tamaricaceae
|
12 Mai 2010
|
|
INP 229
|
Olea europaea L.
|
Oleaceae
|
11 Mai 2010
|
|
INP 230
|
Argania spinosa (L.) Skeels
|
Sapotaceae
|
12 Mai 2010
|
|
INP 231
|
Ceratonia siliqua L.
|
Leguminosae
|
11 Mai 2010
|
|
INP 233
|
Mentha piperita L.
|
Lamiaceae
|
05 Mai 2010
|
|
INP 236
|
Salvia officinalis L.
|
Lamiaceae
|
09 Mai 2010
|
|
INP 238
|
Lavandula angustifolia L.
|
Lamiaceae
|
04 Mai 2010
|
|
INP 240
|
Pelargonium Graveolens
|
Geraniaceae
|
08 Mai 2010
|
|
INP 242
|
Origanum majorana L.
|
Lamiaceae
|
10 Mai 2010
|
|
INP 243
|
Artemisia absinthium L.
|
Asteraceae
|
09 Mai 2010
|
|
INP 245
|
Nerium oleander L.
|
Apocynaceae
|
08 Mai 2010
|
|
INP 246
|
Mentha suaveolens Ehrh.
|
Lamiaceae
|
08 Mai 2010
|
|
INP 248
|
Cistus ladanifer L.
|
Cistaceae
|
02 Mai 2010
|
|
INP 249
|
Eucalyptus cladocalyx F.Muell.
|
Myrtaceae
|
11 Mai 2010
|
|
INP 251
|
Eucalyptus camaldulensis
|
Myrtaceae
|
16 Mai 2010
|
- Nerium oleander L. : Laurier
Rose (Deffla)

Classification classique de Nerium oleander:
Règne : Plantae
Division : Magnliophyta
Classe : Magnoliopsida
Ordre : Gentianales
Famille : Apocynaceae
Genre : Nerium
- Artemisia absinthium
L. : Absinthe (Chiba)

Classification classique d'Artemisia absinthium L.
Régne : Plantae
Division : Magnoliophyta
Classe : Magnoliopsida
Ordre : Asterales
Famille : Asteraceae
Genre : Artemisia
- Mentha pulegium
L. : Menthe Pouliot (Flio)

Classification classique de Mentha pulegium L.
Régne : Plantae
Division : Magnoliophyta
Classe : Magnoliopsida
Ordre : Lamiales
Famille : Lamiaceae
Genre : Mentha
- Mentha piperita
L. : Menthe poivrée
(Naâna abdi)

Classification classique de Mentha piperita L.
Régne : Plantae
Division : Magnoliophyta
Classe : Magnoliopsida
Ordre : Lamiales
Famille : Lamiaceae
Genre : Mentha
- Myrtus communis
L. : Myrte commun (Arraïhane)

Classification classique de Myrtus communis L.
Régne : Plantae
Division : Magnoliophyta
Classe : Magnoliopsida
Ordre : Myrtales
Famille : Myrtceae
Genre : Myrtus
- Eucalyptus camaldulensis
L. : Eucalyptus

Classification classique d'Eucalyptus camaldulensis
L.
Régne : Plantae
Division : Magnoliophyta
Classe : Magnoliopsida
Ordre : Myrtales
Famille : Myrtaceae
Genre : Eucalyptus
- Thymus vulgaris L. : Thym
(zaitra)

Classification classique du Thymus vulgaris L.
Régne : Plantae
Division : Magnoliophyta
Classe : Magnoliopsida
Ordre : Lamiales
Famille : Lamiaceae
Genre : Thymus
- Salvia officinalis
L. : Sauge (Salmia)

Classification classique de Salvia officinalis L.
Régne : Plantae
Division : Magnoliophyta
Classe : Magnoliopsida
Ordre : Lamiales
Famille : Lamiaceae
Genre : Salvia
- Rosmarinus officinalis
L. : Romarin (Iklil alJabal, azîr)

Classification classique de Rosmarinus officinalis L.
Régne : Plantae
Division : Magnoliophyta
Classe : Magnoliopsida
Ordre : Lamiales
Famille : Lamiaceae
Genre :
Rosmarinus
- Origanum majorana
L. : Marjolaine
(Merdedûch)

Classification classique d'Origanum majorana L.
Régne : Plantae
Division : Magnoliophyta
Classe : Magnoliopsida
Ordre : Lamiales
Famille : Lamiaceae
Genre : Origanum
-Taux d'humidité :
La teneur en eau présente dans la poudre
des six espèces végétales testées :
Tableau 5. Taux
d'humidité présent dans la poudre des 6 espèces
végétales testées.
|
Espèce végétale
|
Taux d'humidité %
|
|
Nerium oleander L.
|
6,4
|
|
Artemisia absinthium L.
|
7,4
|
|
Rosmarinus officinalis L.
|
9,8
|
|
Mentha pulegium L.
|
8,4
|
|
Myrtus communis L.
|
7,6
|
|
Mentha piperita L.
|
2,8
|
Le taux d'humidité nous donne une idée sur
la dégradation des principes actifs de la plante. Les poudres
de Rosmarinus officinalis et Mentha
pulegium présente des taux d'humidité
élevés par rapport aux autres, ce qui présente un risque
de dégradation du principe actif.
- Estimation des quantités du résidu
sec :
Tableau 6.
Estimation des quantités du résidu sec des 6
espèces végétales testées.
|
Espèce végétale
|
quantités du résidu sec (mg)
|
|
Nerium oleander L.
|
2540
|
|
Artemisia absinthium L.
|
160
|
|
Rosmarinus officinalis L.
|
1720
|
|
Mentha pulegium L.
|
630
|
|
Myrtus communis L.
|
790
|
|
Mentha piperita L.
|
20
|
L'estimation des quantités du résidu sec nous
renseigne sur la quantité de poudre végétale
présente dans les extraits aqueux, les quantités du résidu
sec les plus importants sont présentes respectivement dans les extraits
aqueux du Nerium oleander et Rosmarinus officinalis.
3.4 Extraction des huiles essentielles
Tableau 7. Rendement d'extraction et couleur
des 6 huiles essentielles
|
Espèce végétale
|
Famille botanique
|
Date de récolte
|
Couleur de l'huile
|
Rendement (%)
|
|
Thymus vulgaris L.
|
Lamiaceae
|
03/03/2010
|
Jaune
|
1
|
|
Salvia officinalis L.
|
Lamiaceae
|
15/03/2010
|
Jaune pâle
|
1
|
|
Rosmarinus officinalis L.
|
Lamiaceae
|
16/03/2010
|
Jaune pâle
|
1
|
|
Eucalyptus camaldulensis
|
Myrtaceae
|
16/03/2010
|
Jaune pâle
|
1,1
|
|
Artemisia absinthium L.
|
Asteraceae
|
17/03/2010
|
bleu
|
0,7
|
|
Origanum majorana L.
|
Lamiaceae
|
18/03/2010
|
Jaune pâle
|
0,8
|
Les huiles essentielles de l'Eucalyptus camaldulensis,
Salvia officinalis, Rosmarinus officinalis et du Thymus vulgaris
présentent les rendements les plus élevés.
Ces différences dans le rendement doivent être
essentiellement dues à la différence de morphologie des
plantes
Il faut noter que le rendement et la composition
chimique des HE dépendent de plusieurs facteurs à savoir
l'espèce, le milieu de récolte, la période de
récolte, les pratiques culturales et la technique d'extraction.
3.5 Analyse de la composition chimique par chromatographie en
phase gazeuse et couplage chromatographie en phase gazeuse -
spectrométrie de masse :
- Origanum
majorana
La marjolaine douce (Origanum majorana) est
une plante pérenne et herbacée qui pousse dans son environnement
naturel qui est l'Egypte et les pays de l'Est de la Méditerranée
(Furia et Bellanca, 1971). Elle peut pousser dans les régions de
l'Europe du Nord (Hälvä, 1987).
La composition des huiles de diverses espèces d'origan
a été étudiée (Nykanen, 1986 ; Ravid et
Putievsky, 1986 ; Lawrence, 1989 ; Komaitis et al., 1992 ; Baser
et al., 1993). Elles existent sous deux formes : la première est
composée d'hydrate de sabinene et terpinén-4-ol comme
composés majoritaires, et la seconde avec le thymol et/ou carvacrol en
tant que composés prédominants.
Le tableau 8 montre la composition chimique de l'huile
essentielle d'Origanum majorana. Les hydrocarbures
monoterpéniques constituent la fraction majoritaire, suivis par les
monoterpènes oxygénés avec 44.38%. Les
sesquiterpènes qui sont tous des hydrocarbures ne représentent
que 3.68% de l'ensemble des constituants identifiés (99.76%).
Tableau 8. Composition chimique de l'HE
d'Origanum majorana.
|
Composé
|
(%)
|
|
á-thujène
|
0.65
|
|
á-pinène
|
0.76
|
|
sabinène
|
8.02
|
|
â-pinène
|
1.79
|
|
á-phellandrène
|
0.50
|
|
á-terpinène
|
12.72
|
|
p-cymène
|
0.80
|
|
â-phellandrène
|
3.83
|
|
ã-terpinène
|
18.57
|
|
p-menth-2-én-1-ol
|
1.67
|
|
terpinolène
|
4.06
|
|
Cis hydrate sabinène
|
5.63
|
|
1-terpinéol
|
1.42
|
|
trans hydrate Sabinène
|
0.95
|
|
4-terpinéol
|
28.96
|
|
á-terpinéol
|
3.32
|
|
Cis pipéritol
|
0.47
|
|
Trans dihydrocarvone
|
0.17
|
|
Trans piperitol
|
0.44
|
|
Cis hydrate sabinène acétate
|
0.26
|
|
acétate de linalyle
|
1.09
|
|
Caryophyllène
|
2.10
|
|
á-humulène
|
0.09
|
|
Valencène
|
1.48
|
- Rosmarinus
officinalis
Rosmarinus officinalis L. est une espèce de la
famille des Lamiaceae, qui est utilisée comme aromatisant alimentaire,
est aussi connue pour ses propriétés médicinales
(Oluwatuyi et al., 2004, Peng et al., 2005).
Les constituants identifiés de la composition chimique
de l'huile essentielle de Rosmarinus officinalis sont
représentés dans le tableau 9 et constituent un pourcentage de
99.67%, dont la fraction monoterpénique est la majoritaire (94.89%).
51.93% de cette fraction sont des hydrocarbures, et 41.96 % sont des
composés oxygénés. La fraction sesquiterpénique est
la plus faible avec 4.78% et constituée seulement de composés
hydrocarbonés. L'á-pinène est l'élément
majoritaire avec une teneur de 35.91%, suivi du 1,8-cinéole avec
23.64%.
Tableau 9. Composition chimique de l'HE du
Rosmarinus officinalis (chemotype à á-pinène).
|
Constituants
|
(%)
|
|
á-pinène
|
35.91
|
|
Camphène
|
5.73
|
|
Sabinène
|
4.64
|
|
3-octanone
|
0.73
|
|
â-myrcène
|
1.58
|
|
á-terpinène
|
0.86
|
|
1,8-cinéole
|
23.64
|
|
Cis - ocimène
|
0.44
|
|
ã-terpinène
|
1.37
|
|
Terpinolène
|
1.40
|
|
Linalool
|
1.67
|
|
Chrysanthenone
|
0.42
|
|
Camphre
|
5.01
|
|
Bornéol
|
2.69
|
|
á-terpineol
|
2.04
|
|
Verbénone
|
4.46
|
|
acétate de bornyle
|
2.30
|
|
Caryophyllene
|
3.51
|
|
â-humulène
|
1.27
|
- Thymus
vulgaris
Thymus vulgaris, cultivé au Maroc, donne une
huile essentielle à thymol dont le pourcentage dépasse les 40%
(Tableau 10). La fraction monoterpénique prédomine avec (97.35%)
dont 46.5% sous forme d'hydrocarbures et 50.85% sous forme de composés
oxygénés. Les hydrocarbures sesquiterpéniques ne
représentent qu'un faible pourcentage (1.7%). Les constituants de
l'huile du thym ont été identifiés avec une
totalité de 98.85%.
Tableau 10. Composition chimique de l'HE de
Thymus vulgaris.
|
Composé
|
(%)
|
|
Methyl 2-methylbutanoate
|
0.18
|
|
á-thujène
|
1.76
|
|
á-pinène
|
0.85
|
|
camphène
|
0.40
|
|
Sabinène
|
0.33
|
|
2-hexen-1-ol 2-ethyl
|
0.41
|
|
â-pinène
|
1.63
|
|
á-phellandrène
|
0.28
|
|
á-terpinène
|
3.25
|
|
p-cymène
|
15.59
|
|
ã-terpinène
|
22.25
|
|
p-menth-2-en-1-ol
|
0.65
|
|
Terpinolène
|
0.16
|
|
Linalol
|
1.79
|
|
Camphre
|
0.24
|
|
Bornéol
|
0.65
|
|
4-terpinéol
|
1.15
|
|
Thymol methyl ether
|
1.18
|
|
2-isopropyl-4-methylanisole
|
0.88
|
|
Thymol
|
41.39
|
|
Carvacrol
|
2.06
|
|
Isothymol
|
0.27
|
|
Caryophyllène
|
1.30
|
|
Germacrène D
|
0.40
|
II- Matériel biologique
1. Prospection des gîtes :
Tableau 11 : Gîtes larvaires
prospectés au niveau de la ville de Fès.
|
Nom du gîte
|
Espèce
|
Moyen de lutte
|
Date
|
Lieu
|
|
Grand canal
|
- Culex pipiens
- Anophèles labranchiae (faible densité)
|
Lutte Biologique
|
01/04/2010
|
Ville de Fès
|
|
Wed Fès
|
-
|
Lutte Biologique
|
01/04/2010
|
Ville de Fès
|
|
Merjet ouzani
|
-
|
Lutte Biologique
|
01/04/2010
|
Ville de Fès
|
|
Diamant vert
|
-
|
Lutte Biologique
|
01/04/2010
|
Ville de Fès
|
|
Ain chkef
|
Culex pipiens
|
Lutte Biologique
|
01/04/2010
|
Ville de Fès
|
Les espèces rencontrées au cours de nos
prospections sont :
- Culex pipiens ;
- Culex déserticula ;
- Anophèles labranchiae;
- Anophèles coustani.
Nous avons choisi de travailler sur le Culex pipiens
et l'Anophèles labranchiae.
2. Gîtes
étudiés :
Nous n'avons pas pu travailler sur des gîtes à
caractère permanent du faite que l'ensemble de ces gîtes sont
ensemencés par la Gambusia, poisson larvivore utilisé en
abondance dans les gîtes de Fès pour lutter contre les larves de
moustiques.
Nous nos sommes alors contenter de travailler sur des
gîtes temporaire à culex.
Les gîtes qui ont fait l'objet de ce travail
sont :
- Gîte à culex (Ibn Al
Baytar) :

Figure 19 : Gîte Ibn Al Baytar
Ce gîte est situé au centre de l'hôpital Inb
Al Baytar à Dhar Al Mehraz.
- Gîte à anophèle (Gîte fac
chariaa) :

Figure 20 : Gîte Charia
Fès-Sais
Ce gîte est situé à 500 mètre de la
Faculté Charia Fès-Sais.
IV- Tests de toxicité
ï Expérimentation 1:
Détermination de l'effet larvicide de 6 extraits
aqueux.
Répétition 1 :
Tableau 12. Mortalité (%) des larves de
Culex pipiens en fonction de la concentration des extraits aqueux (%)
de 6 espèces végétales après 24 heures
d'exposition
|
Espèce végétale
|
Doses testées %
|
Conditions de T° et H.R
|
%Mortalité après 24h
|
|
Dose %
|
Concentration
%
|
T °c
|
H.R %
|
%Mortalité Témoin
|
%Mortalité
|
|
Artemisia absinthium L.
|
10
|
5
|
30,4
|
25
|
0
|
0
|
|
6
|
0
|
|
7
|
0
|
|
8
|
0
|
|
9
|
0
|
|
Mentha piperita L.
|
10
|
5
|
30,4
|
25
|
0
|
3,7
|
|
6
|
4
|
|
7
|
0
|
|
8
|
0
|
|
9
|
11,54
|
|
Mentha pulegium L.
|
10
|
5
|
23,6
|
40
|
3,57
|
741
|
|
6
|
0
|
|
7
|
0
|
|
8
|
6,66
|
|
9
|
3,57
|
|
Nerium oleander L.
|
10
|
5
|
30,4
|
25
|
0
|
0
|
|
6
|
0
|
|
7
|
0
|
|
8
|
10,71
|
|
9
|
12,5
|
|
Rosmarinus officinalis L.
|
10
|
5
|
23,6
|
40
|
0
|
0
|
|
6
|
0
|
|
7
|
0
|
|
8
|
5,55
|
|
9
|
5,55
|
|
Myrtus communis L.
|
10
|
5
|
30,4
|
25
|
0
|
0
|
|
6
|
0
|
|
7
|
0
|
|
8
|
0
|
|
9
|
3,57
|
Répétition 2 :
Tableau 13. Mortalité (%) des larves de
Culex pipiens en fonction de la concentration des extraits aqueux (%)
de 6 espèces végétales après 24 heures
d'exposition.
|
Espèce végétale
|
Doses testées %
|
Conditions de T° et H.R
|
%Mortalité après 24h
|
|
Dose %
|
Concentration
%
|
T °c
|
H.R %
|
%Mortalité Témoin
|
%Mortalité
|
|
Artemisia absinthium L.
|
10
|
5
|
29,2
|
30
|
0
|
0
|
|
6
|
6,89
|
|
7
|
0
|
|
8
|
0
|
|
9
|
6,89
|
|
Mentha piperita L.
|
10
|
5
|
29,2
|
30
|
0
|
11,11
|
|
6
|
6,66
|
|
7
|
16
|
|
8
|
12,5
|
|
9
|
15,38
|
|
Mentha pulegium L.
|
10
|
5
|
29,2
|
30
|
0
|
0
|
|
6
|
0
|
|
7
|
0
|
|
8
|
0
|
|
9
|
8
|
|
Nerium oleander L.
|
10
|
5
|
29,2
|
30
|
0
|
0
|
|
6
|
2
|
|
7
|
26,92
|
|
8
|
21,74
|
|
9
|
44,44
|
|
Rosmarinus officinalis L.
|
10
|
5
|
29,2
|
30
|
0
|
8,33
|
|
6
|
8,33
|
|
7
|
16,66
|
|
8
|
12
|
|
9
|
28,57
|
|
Myrtus communis L.
|
10
|
5
|
29,2
|
30
|
0
|
0
|
|
6
|
0
|
|
7
|
0
|
|
8
|
0
|
|
9
|
0
|
Tableau 14. Moyenne de Mortalité (%)
des larves de Culex pipiens de 2 répétitions en
fonction de la concentration des extraits aqueux (%) de 6 espèces
végétales après 24 heures d'exposition.
|
Espèce végétale
|
5%
|
6%
|
7%
|
8%
|
9%
|
Témoin
|
|
Artemisia absinthium L.
|
0
|
3,44
|
0
|
0
|
3,44
|
0
|
|
Mentha piperita L.
|
7,40
|
5,33
|
8
|
6,25
|
13,46
|
0
|
|
Mentha pulegium L.
|
3,70
|
0
|
0
|
3,33
|
5,78
|
1,78
|
|
Nerium oleander L.
|
0
|
1
|
13,46
|
16,22
|
28,47
|
0
|
|
Rosmarinus officinalis L.
|
4,16
|
4,16
|
8,33
|
8,77
|
17,06
|
0
|
|
Myrtus communis L.
|
0
|
0
|
0
|
0
|
1,78
|
0
|
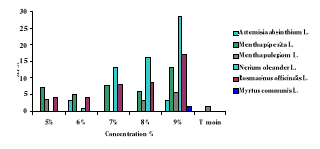
Figure 21. Pourcentages de mortalité
suivant les extraits aqueux des 6 espèces végétales
testés.
- Variation du taux de mortalité
Après avoir exposé des larves du stade 3 et 4 de
l'espèce Cx. pipiens aux différentes concentrations des
six extraits aqueux pendant 24 h, le taux de mortalité varie selon les
concentrations (Tableau 12,13 et 14). Pour tous les extraits la
mortalité des larves atteint des taux inferieur à 50%.
De l'ensemble de ces résultats un premier classement de
l'efficacité toxique des extraits testés est mis en
évidence (figure 21), ainsi les extraits les plus toxiques sont ceux des
feuilles du Nerium oleander, du Rosmarinus officinalis et
du Mentha piperita et le moins toxique celui des feuilles du
Myrtus communis.
- Concentrations létales CL50
et CL95
Les testes ont montrés que parmi les 6 extraits
testés, aucun ne s'est révélé intéressant en
terme de toxicité. Ces résultats, bien qu'ils soient
préliminaires, illustrent bien l'intérêt que
présentent les extraits aqueux des plantes dans la lutte anti-larvaire.
ï Expérimentation 2:
Détermination de l'effet larvicide de 6 huiles
essentielles.
Tableau 15. Mortalité (%) des
larves de Culex pipiens en fonction de la concentration des huiles
essentielles (%) de 6 espèces végétales après 24
heures d'exposition.
|
Espèce végétale
|
Doses testées %
|
Conditions de T° et H.R
|
%Mortalité après 24h
|
|
Dose %
|
Concentration
%
|
T °c
|
H.R %
|
%Mortalité Témoin
|
%Mortalité
|
|
Rosmarinus officinalis L.
|
2
|
0,4
|
21,9
|
42
|
7,14
|
100
|
|
0,6
|
100
|
|
0,8
|
100
|
|
1
|
100
|
|
0,1
|
0,05
|
24,1
|
41
|
9,52
|
3,29
|
|
0,06
|
3,89
|
|
0,07
|
11,58
|
|
0,08
|
47,37
|
|
0,09
|
47,14
|
|
0,5
|
0,1
|
26,7
|
32
|
13,33
|
69,23
|
|
0,2
|
96 ,14
|
|
0,3
|
96,14
|
|
0,4
|
100
|
|
0,5
|
96,14
|
|
Eucalyptus camaldulensis L.
|
2
|
0,4
|
21,9
|
42
|
3,45
|
100
|
|
0,6
|
100
|
|
0,8
|
100
|
|
1
|
100
|
|
0,1
|
0,05
|
24,1
|
41
|
13,63
|
27,63
|
|
0,06
|
62,7
|
|
0,07
|
20,78
|
|
0,08
|
93,89
|
|
0,09
|
65,69
|
|
0,5
|
0,1
|
31,5
|
28
|
4,16
|
8,33
|
|
0,2
|
9,52
|
|
0,3
|
3,84
|
|
0,4
|
7,41
|
|
0,5
|
20,83
|
|
Salvia officinalis L.
|
0,1
|
0,05
|
21,1
|
41
|
13,63
|
10,53
|
|
0,06
|
14,41
|
|
0,07
|
65,69
|
|
0,08
|
73,27
|
|
0,09
|
96,13
|
|
0,5
|
0,1
|
31,5
|
28
|
4
|
8
|
|
0,2
|
5
|
|
0,3
|
81,82
|
|
0,4
|
82,76
|
|
0,5
|
96,43
|
Tableau 15. Mortalité (%) des larves de
Culex pipiens en fonction de la concentration des huiles essentielles
(%) de 6 espèces végétales après 24 heures
d'exposition (suite).
|
Espèce végétale
|
Doses testées %
|
Conditions de T° et H.R
|
%Mortalité après 24h
|
|
Dose %
|
Concentration
%
|
T °c
|
H.R %
|
%Mortalité Témoin
|
%Mortalité
|
|
Thymus vulgaris L.
|
2
|
0,4
|
21,9
|
42
|
7,14
|
100
|
|
0,6
|
100
|
|
0,8
|
100
|
|
1
|
100
|
|
0,5
|
0,1
|
26,7
|
32
|
10
|
96,16
|
|
0,2
|
92,33
|
|
0,3
|
96,28
|
|
0,4
|
100
|
|
0,5
|
100
|
|
Artemisia absinthium L.
|
2
|
0,4
|
23,3
|
33
|
8,51
|
51,20
|
|
0,6
|
77,73
|
|
0,8
|
67,61
|
|
1
|
81,47
|
|
0,5
|
0,1
|
26,7
|
32
|
13,33
|
8,47
|
|
0,2
|
38,45
|
|
0,3
|
68,16
|
|
0,4
|
76,92
|
|
0,5
|
73,07
|
|
Origanum majorana L.
|
0,5
|
0,1
|
31,5
|
28
|
0
|
35,29
|
|
0,2
|
56
|
|
0,3
|
83,33
|
|
0,4
|
96,43
|
|
0,5
|
100
|
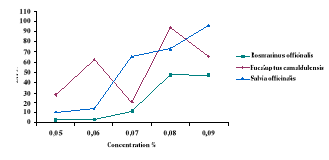
Figure 22. Effet larvicide des huiles
essentielles (0,1%) de Rosmarinus officinalis,
Eucalyptus camaldulensis et Salvia officinalis
sur culex pipiens.
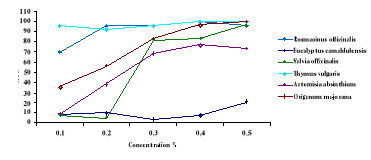
Figure 23. Effet larvicide des huiles
essentielles (0 ,5 %) de Rosmarinus officinalis,
Eucalyptus camaldulensis ,Salvia officinalis
, Thymus vulgaris ,Artemisia absinthum et Origanum majorana
sur culex pipiens .
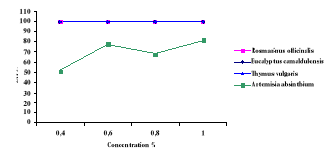
Figure 24. Effet larvicide des huiles
essentielles (2 %) de Rosmarinus officinalis,
Eucalyptus camaldulensis,Thymus vulgaris et
Artemisia absinthum sur culex pipiens .
Tableau 16. Mortalité (%) des larves
d'Anopheles labranchiae en fonction de la
concentration d'huile essentielle (%) d'Eucalyptus camaldulensis
L. après 24 heures d'exposition.
|
Espèce végétale
|
Doses testées %
|
Conditions de T° et H.R
|
%Mortalité après 24h
|
|
Dose %
|
Concentration
%
|
T °c
|
H.R %
|
%Mortalité Témoin
|
%Mortalité
|
|
Eucalyptus camaldulensis L.
|
0,2
|
0,15
|
24,4
|
54
|
3,45
|
3,45
|
|
0,17
|
6,66
|
Nous avons effectués un seul teste sur l'Anopheles
labranchiae, vecteur du paludisme au Maroc, avec seulement deux
concentration de l'huile essentielle d'Eucalyptus camaldulensis du
fait de sa présence en très faible densité dans les
gîtes étudiés.
- Variation du taux de mortalité
Les résultats des tests d'activités larvicides
réalisés sur les huiles essentielles (Figure 22, 23 et 24 et
Tableau 15) indiquent une relation directe des pourcentages de
mortalité des larves avec la concentration en huiles essentielles.
Les concentrations minimales nécessaires pour obtenir
100 % de mortalité des larves de Culex pipiens ont
été évaluées à 0,4 % pour Thymus
vulgaris, Rosmarinus officinalis et Eucalyptus camaldulensis et
à 0,5 % Origanum majorana.
Les huiles essentielles que nous avons testées sont
donc toutes larvicides, avec un effet concentration-dependant.
Tableau 17. Concentrations létales CL50
et CL95 (24 h) des huiles essentielles de 6 espèces
végétales à l'égard des larves de Culex
pipiens.
|
Espèce végétale
|
CL50
|
CL95
|
|
Rosmarinus officinalis
|
0,095
|
0,195
|
|
Eucalyptus camaldulensis
|
0,39
|
0,595
|
|
Salvia officinalis
|
0,065
|
0,49
|
|
Thymus vulgaris
|
-
|
0,25
|
|
Artemisia absinthium
|
0,24
|
-
|
|
Origanum majorana
|
0,17
|
0,37
|
- Concentrations létales CL50
et CL95
L'effet toxique des extraits analysés est clairement
mis en évidence avec les valeurs des CL50 et des CL95 : les huiles
essentielles de Salvia officinalis, Rosmarinus officinalis
et Origanum majorana demeurent les plus efficaces, avec des valeurs
respectives de 0,065 % et 0,49 %, 0,095 % et 0,195 %, 0,17 % et 0,37 %.
Ces résultats, se sont révélés
intéressants en terme de toxicité, ils illustrent
l'intérêt que présentent les huiles essentielles dans la
lutte anti-larvaire.
ï Expérimentation 3: Comparaison
entre l'action des extraits de plantes et celle des insecticides sur les larves
de moustiques.
Tableau 18. Mortalité (%) des larves
de culex pipiens en fonction de la concentration
d'insecticides (mg/l) du Téméphos et Malathion après 24
heures d'exposition.
|
Insecticide
|
Doses testées (mg/l)
|
Conditions de T° et H.R
|
%Mortalité après 24h
|
|
Dose (mg/l)
|
Concentration
(mg/l)
|
T °c
|
H R %
|
%Mortalité Témoin
|
%Mortalité
|
|
Téméphos
|
1,25
|
0,00125
|
23,6
|
40
|
0
|
80,77
|
|
0,0025
|
100
|
|
0,005
|
100
|
|
0,0125
|
100
|
|
6,25
|
0,025
|
100
|
|
Malathion
|
1,25
|
0,00125
|
23,6
|
40
|
0
|
5
|
|
0,0025
|
3,84
|
|
0,005
|
3,70
|
|
0,0125
|
36
|
|
6,25
|
0,025
|
65,38
|
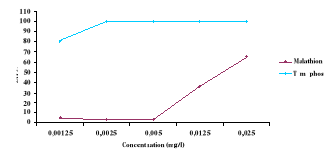
Figure 25. Effet larvicide du
Téméphos et du Malathion sur les larves de
culex pipiens après 24 heures d'exposition.
- Variation du taux de mortalité
Les résultats obtenus (Tableau 18) montrent que les
larves de Culex pipiens sont plus sensibles au Téméphos
qu'au Malathion. À partir de la concentration 0,0025 mg/l en
Téméphos nous avons obtenu 100 % de mortalité.
Tableau 19. Concentrations létales CL50
et CL95 (24 h) des insecticides à l'égard des larves de
Culex pipiens.
|
Insecticides
|
Dose (mg/l)
|
CL50
|
CL90
|
CL95
|
Taux de résistance*
|
|
Téméphos
|
1,25
|
-
|
0,00188
|
0,00219
|
0,82
|
|
Malathion
|
6,25
|
0,0185
|
-
|
-
|
-
|
* c'est le rapport entre la CL90 de la souche
testée/CL90 S-Lab (0,0023 mg/l)
- Concentrations létales CL50 et
CL95
L'effet toxique des deux insecticides testés est
clairement mis en évidence avec les valeurs des CL50 et des CL95 : le
Téméphos demeure le plus efficace avec une valeur de CL95 :
0,00219 mg/l et avec un taux de résistance de 0,82.
Tableau 20. Conditions de température
et d'humidité Relative durant la réalisation des tests.
|
Jours
|
Dates
|
Température °c
|
Humidité Relative %
|
|
J1
|
06/05/10
|
23,3
|
33
|
|
J2
|
14/05/10
|
21,9
|
42
|
|
J3
|
18/05/10
|
23,6
|
40
|
|
J4
|
20/05/10
|
30,4
|
25
|
|
J5
|
24/05/10
|
24 ,4
|
54
|
|
J6
|
26/05/10
|
24,1
|
41
|
|
J7
|
31/05/10
|
26,7
|
32
|
|
J8
|
01/06/10
|
31,5
|
28
|
|
J8
|
03/06/10
|
29,2
|
30
|
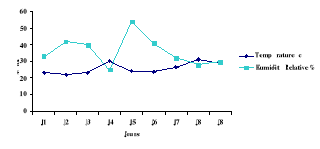
Figure 26. Conditions de température et
d'humidité relative.
Les valeurs représentées dans le tableau 20 et
figure 26 montre les variations de température et d'humidité
relative notés au cours des testes, ces deux paramètres
peuvent avoir un effet sur les larves et par conséquence sur le taux de
mortalité.
La température idéale pour la réalisation
des tests doit être de 25 à 27°c et l'humidité
relative doit être de 70 à 80 %.
DISCUSSION :
Au début de nous testes nous avons travaille avec
l'eau distillée à la place de l'eau du gîte, or les
résultats des testes était invalides. Cela peut être
expliqué par le fait que les larves on besoin l'eau dans laquelle elles
trouvent leur nourriture c'est à dire riche en particule organique.
L'eau distillée est une eau qui a subie une distillation et qui est
théoriquement ainsi exempte des minéraux et organismes que l'on
pourrait retrouver dans l'eau « naturelle ».
Les résultats obtenus en travaillant avec de l'eau du
gîte sont valides.
Parmi les testes effectues, les résultats obtenus par
les huiles essentielles montrent que celle-ci possèdent un effet
larvicide intéressant sur des larves au stade 3 et 4 et
particulièrement les huiles essentielles de Salvia
officinalis, Rosmarinus officinalis et Origanum majorana
qui demeurent les plus efficaces, avec des valeurs de CL50 et CL95 respectives
de 0,065 % et 0,49 %, 0,095 % et 0,195 %, 0,17 % et 0,37 %.
Les résultats obtenus par les extraits aqueux des
poudres végétales, ont montré qu'aucun des 6 extraits
testés ne s'est révélé intéressant en terme
de toxicité, malgré cela ces résultats illustrent bien
l'intérêt que présentent les extraits aqueux des poudres
végétales dans la lutte anti-larvaire. L'extrait de Nerium
oleander et celui de Rosmarinus officinalis présentent les
taux de mortalités les plus importants par rapport au autres extraits
avec des valeurs respectives de 28,47 % et 17,06 %.
Par ailleurs, la toxicité de l'extrait de Nerium
oleander a été étudiée sur des larves au
stade 4 de Culex pipiens dans les travaux de Aouinty et al. (2006)
les essais ont démontré une activité insecticide avec
une CL50 de 3130 mg/l.
Pour les insecticides le Téméphos reste le plus
important en terme de toxicité avec une CL95 de 0,00219 mg/l.
Les conditions de température et d'humidité
relative peuvent avoir un effet sur les résultats obtenus, ainsi que
l'émergence des larves du stade 4 en nymphes.
L'ensemble de ces résultats montre que les insecticides
utilisés dans la lutte antilarvaire se sont révélés
très efficaces contre Culex pipiens par rapport aux extraits
aqueux et aux huiles essentielles.
Néanmoins, les huiles essentielles en particuliers
celles de Salvia officinalis, Rosmarinus officinalis et
Origanum majorana, ont présentés une activité
importante vis à vis des larves.
Nous ne pouvons pas conclure quant à l'action de
l'huile essentielle de l'Eucalyptus camaldulensis sur
l'Anophèle labranchiae du faite de la faible densité
utilisé dans le test.
CONCLUSION ET PERSPECTIVES
L'utilisation des insecticides de synthèse, de plus en
plus réglementée pour la protection de l'environnement, est
à l'origine de nombreux cas de résistance chez les insectes. Dans
ce contexte, le recours à des molécules naturelles
(d'intérêt écologique et économique) aux
propriétés insecticides ou insectifuges, se révèle
être une démarche alternative à l'emploi des insecticides
de synthèse.
L'utilisation des extraits de plantes comme insecticide est
connue depuis longtemps.
Lors de cette étude, nous avons procédé
à l'extraction des huiles essentielles de six plantes cultivées
à l'Institut National des Plantes Médicinales et Aromatiques de
Taounate, à leur analyse chimique et à l'évaluation de
leur potentiel larvicide sur Culex pipiens ainsi que les extraits
aqueux des poudres végétales.
Pour les extraits aqueux les résultats obtenus bien que
préliminaires, témoignent d'une bonne activité larvicide
des extraits aqueux des poudres végétales.
Concernant les huiles essentielles, nos résultats
montrent que toutes les huiles essentielles testées possèdent un
effet larvicide significatif. Tous les échantillons ont montré
une activité sur des larves au stade 3 et 4, et
particulièrement les huiles essentielles de Salvia officinalis
, Origanum majorana et Rosmarinus officinalis.
Ces résultats ouvrent des perspectives
intéressantes pour l'application des huiles essentielles et extraits
aqueux des poudres végétales dans la production des biocides.
Nous envisageons de poursuivre cette étude a?n de
préciser la nature des composés responsables de
l'activité par un fractionnement mené en parallèle avec
les tests biologiques.
Comme nous envisageons également de travailler avec
des concentrations d'extraits aqueux plus importantes, et d'évaluer
l'activité larvicide des autres espèces végétales
récoltées.
Références bibliographiques
Adams R.P., 2001.
Identification of Essential Oil Components by Gaz Chromatography /
Quadrupole Mass Spectroscopy. Carol Stream, IL., USA: Allured Publishing Co.
Adisso D. N., Alia A.R., 2005. Impact des
fréquences de lavage sur l'efficacité et la durabilité des
moustiquaires à longue durée d'action de types Olyset Net ®
et Permanet ® dans les conditions de terrain. Mémoire de fin de
formation en. ABM-DITEPAC-UAC, Cotonou. 79p.
Aouinty B. et al., 2006. Évaluation
préliminaire de l'activité larvicide des extraits aqueux des
feuilles du ricin (Ricinus communis L.) et du bois de thuya
(Tetraclinis articulata (Vahl) Mast.) sur les larves de quatre
moustiques culicidés : Culex pipiens (Linné), Aedes
caspius (Pallas), Culiseta longiareolata (Aitken) et Anopheles
maculipennis (Meigen), Biotechnol. Agron. Soc. Environ. 10
(2), 67 - 71.
AYITCHEDJI A.M., 1990. Bioécologie
d'Anopheles melas et de Anopheles gambiae s.s. Comportement des adultes
vis-à-vis de la transmission du paludisme en zone côtière
lagunaire, République du Bénin. Mémoire de fin de
formation en TLM-DETS-CPU-UNB, Cotonou. 76p.
Baser K.H.C, Kirimer N., Tuèmen G.,
1993. Composition of the essential oil of Origanum majorana L. from Turkey.
J. Essent. Oil Res. 5: 577-579.
Bekele J. et Hassanali A., 2001. Blend
effects in the toxicity of the essential oil constituents of Ocimum
kilimandscharicum and Ocimum kenyense (Labiatae) on two
post-harvest insect pests. Phytochemestry, 57 : 385 -
391.
Boulet A., 2005. Lutte contre la pollution
des eaux par les pesticides utilisés en zones non agricoles : analyse et
synthèse des actions engagées et recommandations. Institut
National Agronomique de Paris - Grignon,p5.
Bouzouita N., Kachouri F., Hamdi M., Chaabouni MM.,
Ben Aissa R., Zgoulli S., Thonart P., Carlier A., Marlier M., Lognay G.C.,
2005. J. Essent. Oil Res. 17, 584.
Brian M.L., 1995. The
isolation of aromatic materials from plant products, R.J. Reynolds Tobacco
Company, Winston- Salem (USA), p.57-148.
Bruneton J., 1993. Pharmacognosie:
phytochimie, plantes médicinales. 2ième éd.
Tec. et Doc., Lavoisier, Paris, France.
Carson C., Riley J., 1995.J. Appol
Bact.78, 264.
Chandre F., Darriet F., Manga L., Akogbeto M., Faye
O., Mouchet J., et Guillet P., 1999. Situation de la résistance
aux pyréthrinoïdes chez Anopheles gambiae sensu lato.
Bulletin of the World Health Organization., 77(3): 230-234.
Detinova TS., 1963. Méthodes
à appliquer pour classer par groupe d'âge les Diptères
présentant une importance médi-cale, notamment certains vecteurs
du paludisme. OMS, série monogr n°47, Genève, 220
p.
Diabaté A., 1999. Evaluation de la
résistance des vecteurs du paludisme vis à vis des
pyréthrinoïdes au Burkina Faso. Thèse de Doctorat de feme
cycle en sciences biologiques appliquées, option Biologie et Ecologie
Animales. Université d'Ouagadougou, Burkina Faso l28p.
EL Bouhali., 2001. Etude physico-chimique,
bactériologique et faunistique à l'interface superficielle de
deux cours d'eau dans la vallée sud de l'Oued-Fès, thése
de doctorat.Univercité Sidi Mohamed Ben Aabd Lah Dhar El Mahraz,
Fès.
El Ouali Lalami A.et al., 2009. Le paludisme
importé dans le Centre Nord du Maroc entre 1997
à 2007. Cahiers d'études et de recherches francophones /
Santé. Volume 19, Numéro 1, 43-7.
Faraj C., Adlaoui B., Rhajaoui M. et Lyagoubi
M., 2003. Malaria transmission estimation in high-risk provinces of
Morocco. La Revue de Santé de la
Méditerranée orientale,9, 542-547.
Faraj C., Elkohli M. et Lyagoubi M., 2006.
Cycle gonotrophique de Culex pipiens (Diptera : Culicidae), vecteur
potentiel du virus West Nile, au Maroc : estimation de la durée en
laboratoire, 2006, Bull Soc Pathol Exot, 99,
2, 119-121.
Fillinger U., Knols B. G. and Becker N.,
2003. Efficacy and efficiency of new Bacillus
thuringiensis var israelensis and Bacillus sphaericus
formulations against Afrotropical anophelines in Western Kenya. Trop
Med Int Health 8(1): 37-47.
Furia TE., Bellanca N., 1971. Fenaroli's
handbook of flavor ingredients. The Chemical Rubber Co., Cleveland,
OH.
Janssen A. M., Scheffer J. J.C., Baerheim Svendsen
A., 1987. Pharm. Weekbl. 9, 193.
Joulain D., König W.A., 1998. The Atlas
of Spectral Data of Sesquiterpene Hydrocarbons. Hambourg: E.B.Verlag,
405 p.
Hälvä S., 1987. Studies on
production techniques of some herb plants. J. Agr. Sci. Fin.
59: 31-36.
Heath H. B., 1978. In In flavor technology.
Westport, Connecticut: AVI publishing company, Inc.
Harrack M.E., LE Guenno B., et LE Gounon P., 1997. Isolement
du virus West Nile au Maroc. Virologie, 1,
248-249.
Himmi O., 2007. Les culicidés
(insectes, diptères) du Maroc : systématique,
écologie et études épidémiologiques pilotes, 289
pages.
Hougard JM., Duchon S., Darriet F., Zaim M., Rogier
C., et Guillet P., 2003. Comparative performances, under laboratory
conditions, of seven pyrethroidinsecticides used for impregnation of mosquito
nets. Bulletin ofthe World Health Organization,
81:324-333.
INH, 2002. LABORATOIRE D'ENTOMOLOGIE
MÉDICALE - Enquête entomologique dans les foyers du West Nile au
Maroc. Rapport de mission, Institut National d'Hygiène, Rabat, 3p.
Iroko F.A., 1994. Une histoire des hommes et
des moustiques en Afrique. Côte des esclaves (XVIe -
XIXe siècle). L'harmattan, 1994. Racines du présent.
169 p.
Isman, 2000. Plant essential oils for pest
and disease management. Crop Protection 19 (2000) 603-608.
Gildemeister E., Hoffmann F., 1919. Les
huiles essentielles, 2e éd., Tome III, Ed. Miltitz,
p.634-635.
Glaser A., 1999. West Nile virus and North
America: An unfolding story. Revue Scientifique et Technique de l'Office
International des Epizooties, 2004, 23, 557-568.
Guarrera P. M., J.
Ethnopharmacology, 68, 183.
Guillaumot L., 2006. Les moustiques et la
dengue. Institut Pasteur de Nouvelle Caledonie. 15 p. Article. Site: Institut
Pasteur.
Guy Y., 1976. Bilan
épidémiologique du paludisme au Maroc (données
recueillies entre 1960, 1961 et 1962). Ann Parasitol Hum Comp, 1963,
38, 823-857
Kitron U., 1998. Landscape ecology and
epidemiology of vector-borne diseases: tools for spatial analysis. J Med
Entomol 35(4): 435-45.
Komaitis ME., Infanti-Papatragianni N.,
Melissari-Panagiotou E., 1992. Composition of the essential oil
Marjorana L. Food Chemistry 45: 117-118.
Lawrence BM., 1989. Progress in essential
oils. Perf. Flav. 14: 29-41.
Mohan D. et Ramaswamy M., 2007. Evaluation of
larvicidal activity of the leaf extract of a weed plant, Ageratina
adenophora, against two important species of mosquitoes, Aedes
aegypti and Culex quinquefasciatus. African Journal of
Biotechnology Vol.6(5), pp.631-638.
Mompon B., 1994. Quel avenir commercial pour
les produits obtenus par les nouvelles technologies d'extraction :
CO2, Micro-ondes, ultrasons, nouveaux solvants, 4
ième rencontres internationales de Nyons, p. 149-166.
Murgue B., Murri S., Triki H., Deubel V. et Zeller
HG., 2001. West Nile in the Mediterranean basin: 1950-2000. Ann N Y
Acad Sci, 951, 117-126.
Ntonifor NN. et al., 2006. Traditional use of
indigenous mosquito-repellents to protect humans against mosquitoes and other
insect bites in a rural community of Cameroon. East Afr Med J.
83(10):553-8.
Nykanen I., 1986. High resolution gas
chromatographic#177;mass spectrometric determination of the flavour composition
of marjoram (Origanum majorana L.) cultivated in Finland. Z.
Lebensm. Unters. Forch. 183: 172-176.
Oluwatuyi M., Kaatz G. W., et Gibbons S.,
2004. Antibacterial and resistance modifying activity of Rosmarinus
officinalis. Phytochemistry, 65, 3249-3254.
Office International des Epizooties, 2003. La
santé animale dans le monde en 2003,
http://www.oie.int/fr/info/fr_sam.htm.
OMS, 1974. Manuelle pratique de lutte
antilarvaire :division du paludisme et autre maladie parastaire,OMS,
Genève.7-17
OMS, 1996. Weekly epidemiological record:
17-22.
OMS, 1999. La lutte antivectorielle -
Méthodes à usage individuel et communautaire - Sous la direction
de Jan A. Rozendaal (OMS, 1999).
OMS, 2003. Entomologie du paludisme et
contrôle des vecteurs: Guide du stagiaire. Provisoire, OMS,
Genève. 102 p.
OMS, 2004. Organisation Mondiale de la
Santé - Global Strategic Framework for Integrated Vector Management,
Geneva, 2004.
OMS, 2004a. Lutte contre les vecteurs du
paludisme.WHO/CDS/WHOPES/2002.5Rev.1
OMS, 2004b. Questions fréquemment
posées à propos de l'utilisation du DDT pour la lutte
antivectorielle. WHO/HTMlRBMl2004.54
OMS, 2006. Paludisme: lutte anti-vectorielle
et protection personnelle.
OMS, 2008. World Malaria Report. Geneva,
WHO.
Palmisano CT., Taylor V., Caillouet K., Byrd B. et
WES-SON DM., 2005. Impact of West Nile virus outbreak upon St.
Tammany Parish Mosquito Abatement District. J Am Mosq Control Assoc,
21, 33-38.
Peng Y., Yuan J., Liu F. et Ye J., 2005.
Determination of active components in rosemary by capillary electrophoresis
with electrochemical detection. Journal of Pharmaceutical and Biomedical
Analysis, 39, 431-437.
Philogene B.J.R., 1991. L'utilisation des
produits naturels dans la lutte contre les insectes: problèmes et
perspectives. La lutte anti-acridienne. Ed. AUPELF-UREF,John Libbey Eurotext,
Paris (c) 1991, pp. 269-278.
Poinsignon A., 2008. Étude de la
relation homme-vecteur. De l'identification à la validation de
protéines salivaires comme marqueur immunologique d'exposition aux
piqûres d'Anopheles spp. et de Glossina spp.
UNIVERSITÉ MONTPELLIER I Faculté de Médecine, France.
Purse B.V. et al., 2005. Climate change and
the recent emergence of bluetongue in Europe. Nature Reviews
Microbiology, 3, 171-181.
Ravid U., Putievsky E., 1986. Carvacrol and
thymol chemotypes of East Mediterranean wild labiatae herbs. In Progress in
Essential Oil Research, EJ Brunke & W. de Gruyter Edit., Berlin.
Ribeiro J.M., 1995. Blood-feeding arthropods:
live syringes or invertebrate pharmacologists? Infect Agents Dis
4(3): 143-52.
Rodhain F. et al., 1985. Précis
d'entomologie médicale et vétérinaire, 443 pages, Ed.
Maloine, Paris.
Rodhain F., Perez C., 1985.
Précis d'Entomologie Médicale et Vétérinaire.
Maloine, s.a. 114 p.
Rogier C., Tall A., Diagne N., Fontenille D., Spiegel
A., et al., 1999. Plasmodium falciparum clinical malaria:
lessons from longitudinal studies in Senegal. Parassitologia
41(1-3): 255-9.
Samate Abdoul D., 2001. Composition chimique
d'huiles essentielles extraites de plantes aromatiques de la zone soudanienne
du Burkina Faso : Valorisation, thèse de doctorat, Univ.de
Ouagadougou, Burkina Faso.
Savage H.M. et Miller B., 1995. House
Mosquitoes of the U.S.A., Culex pipiens Complex. Wing Beats,
6, 8-9.
Schuffenecker I., Peyrefitte C.N., El harrak M., Murri
S., Leblond A. et Zeller H.G., 2005.
West Nile virus in Morocco, 2003. Emerg Infect Dis,
11, 306-309.



