
Biotechnologie Environnement
BIOMARE
Laboratoire de Marine et de l"
Universite Chouaib boukkali
Faculte Des
Sciences
El Jadida
bepartement de Biologie Filiere : Sciences de la
Vie
Memoire de Fin d'Etude
Option : Biologie Cellulaire et Moleculaire
Soutenue
le Vendredi 26/06/2009
Application de la
Nitrification-Denitrification
dans le Traitement des eaux usees
Pr&sent& par : Ayoub
MABROUK
Sous La Direction de
: Pr. Omar ASSOBHEI
jury:
·
Pr. Omar ASSOBHEI .Encadrant
Pr. Mohammed RIHANI .Examinateur
Annee Universitaire : 2008/2009
Titre :
Application de la Nitrification-Dénitrification dans le
traitement des eaux usées
Memoire de fin d'etude, Filiere Sciences de la Vie, Option
Biologie Cellulaire et Moleculaire, Universite Chouaib Doukkali, Faculte des
sciences, El Jadida ,2009.
26 Pages ,29 References.
Encadrant : Pr. ASSOBHEI Omar.
Résumé :
Notre stage de fin d'étude s'inscrit dans le cadre
général qui vise le traitement
biologique des eaux usées. Il a été
réalisé au laboratoire BIOMARE, au sein de l'équipe
de
Biotechnologie Marine et de l'Environnement de la Faculté des
Sciences d'El Jadida, sous la
direction du Professeur Monsieur Omar
ASSOBHEI.
Mon travail comporte une étude bibliographique sur les
processus de la nitrification et dénitrification, qui sont deux
étapes importantes du cycle de l'azote et qui ont une grande
importance dans les écosystèmes, puisque la
dénitrification est la voie majeure de la perte
d'azote fixé dans l'environnement, ainsi nous abordons les
techniques qui exploitent ces
processus dans l'élimination de l'azote des eaux
usées.
Ce travail comporte aussi une partie expérimentale
réalisée au laboratoire de Biotechnologies Marine et de
l'Environnement qui consiste à la comparaison entre la qualité de
l'eau usée brute et l'eau usée traitée.
Abstract :
Our end-stage study is part of the overall framework that
seeks treatment Biological wastewater. It was conducted in the laboratory
BIOMARE, within the team Marine Biotechnology and Environment, Faculty of
Sciences El Jadida, under the direction of Professor Sir Omar ASSOBHEI.
My work includes a literature review on the processes of
nitrification and denitrification, which are two important steps in the
nitrogen cycle and have a great importance in ecosystems, because
denitrification is the major route of loss fixed nitrogen in the environment,
and we discuss techniques that exploit these process in nitrogen removal from
wastewater.
This work also includes an experimental part performed in
laboratory
Marine Biotechnology and Environment, which is the comparison
between the quality of raw wastewater and treated wastewater.
Keywords: Nitrification, nitrogen,
denitrification, biomass fixed.
_e~e,~4.e~e74t
RéaCisé dans Ce cadre de stage de
fin d'étude de Ca Cicence option : BioCogie CeCCuCaire et
MoCécuCaire, ce travaiC a été effectué au
Laboratoire de BiotechnoCogies Marine et de C'Environnement (BIOMARE) sous
C'encadrement de Monsieur Omar ASSOBHEI.
Au terme de ce travaiC ,je tiens à exprimer
ma gratitude et ma reconnaissance au Pr. O. ASSOBHEI, pour son soutien et ses
précieux conseiCs dans C'éCaboration de ce
travaiC.
Je remercie Sincerement, Monsieur RIHAislI Mohammed
pour sa participation à C'évaCuation de ce
travaiC.
Mes vifs remerciements vont égaCement au
doctorant, Mr. S. MOUXHLISSI (FacuCté des sciences d'EC Jadida), qui m'a
aidé à améCiorer mon travaiC.
J'adresse mes vifs remerciements à tous Ces
étudiants du Laboratoire de BiotechnoCogies Marine et de C'Environnement
pour Ceurs soutiens. Ainsi à mes amis, Ces étudiants de Ca
facuCté.
c....9'.aa-,e
« Au nom de Dieu, Ce Tout
Itliséricordieux, Ce Tres Itliséricordieux >
Je dédie ce travaiC à ceux à qui
je dois Ce jour :
· A mon pdre qui n'a rien épargné
pour me satisfaire par sa générosité et sa
tendresse.
· A ma mere, Ca source inépuisabCe du
bonheur, C'6tre qui ne cesse de me prodiguer amour et douceur.
· A mes Freres et Sours.
· A mon OncCe Itlostapha.
· A mes cher(e)s ami(e)s.
SOMMAIRE
SYNTHESE BIBLIOGRAPHIQUE
I. INTRODUCTION GENERALE
......................................................
..............................1
II. LA NITRIFICATION
BIOLOGIQUE......................................................
.....................3
1-Définition... ... ... ...... ... ...... ...
...... 3
2- Métabolisme nitrifiant... ... ... ... .........
... ............3
3- Les types de nitrification ... ... ... ...... ...
... 4
4- Type de micro-organismes... ... ... ... ... ... ...
.......5
5-Facteurs du milieu influençant la croissance et
l'activité des bactéries nitrifiantes ...5
A- Température ... ... ...... ... ...... ...
6
B- pH ... ... ...... ... ...... ... ...7
C- Teneur en oxygène dissous ... ... ... ......
... ...7
D- Composés Toxiques...... ... ...... ... ......
8
III. LA
DENITRIFICATION
BIOLOGIQUE......................................................
...............9
1-Définition... ... ... ...... ... ...... ...
...... 9
2- Métabolisme dénitrifiant... ...... ...
...... ... ...........9
3- Les types de dénitrification ... ... .........
... ....10
4- Type de micro-organismes... ... ... ... ... ... ...
11
5-Facteurs du milieu influençant la croissance et
l'activité des bactéries dénitrifiantes... ...11
A- Température ... ... ...... ... ......
...11
B- pH ... ... ...... ... ...... ... 11
C- Teneur en oxygène dissous ... ... ... ......
... 12
D- Composés Toxiques...... ... ...... ... ......
...12
E- La nature de la source de carbone... ... ...... ...
...12
IV. LES PROCEDES DE TRAITEMENT DE L'AZOTE CONTENU DANS LES
EAUX USEES......... .13
1- les Procédés à Biomasse libre ...
... ......... ... 13
A- Les Boues activés ... ...... ... ......
.........13
B- Le Procédé LUDZACK-ETTINGER
14
2- Les procédés à biomasse fixée...
... ... ...... ... ......15
A- Le filtre à ruissellement ou lit bactérien
... ... ...... 16
B- Lits d'infiltration-percolation sur sable ...... ...... 17
MATERIEL ET
METHODES..............................................................................................19
RESULTATSET DISCUSSION
..........................................................................................20
CONCLUSION
GENERALE................................................................................................23
REFERENCES
BIBLIOGRAPHIQUES......................................................
............ 24
LISTE DES TABLEAUX
Tableau 1 : Différentes valeurs de KO2
publiée dans la littérature ..8
Tableau 2 : comparaison entre l'eau usée brute
et traitée dans un lit bactérien 20
LISTE DES FIGURES
Figure 1 : Cycle de l'Azote
.1
Figure 2 : Transformation de l'azote durant la
nitrification en absence d'inhibiteur ..6
Figure3 : Evolution des taux de croissance maximum en
fonction de la température ..6
Figure 4 : Réaction de dénitrification
9
Figure 5 : Schéma général d'une
boue activée ...14
Figure 6 : Configuration de Ludzack-Ettinger
..15
Figure 7 : Schéma de la filière lit
bactérien . .16
Figure 8: Schéma de la filière Lits
d'infiltration-percolation sur sable .. 18
Figure 9 : concentration de la DBO5 avant et
après Traitement 20
Figure 10 : concentration en NTK avant et
après Traitement ..21
Figure 11 : concentration en Nitrate avant et
après Traitement .21
Figure 12: concentration en NH4+avant et après
Traitement 22
LISTE DES NOTATIONS ET ABREVIATIONS
u Taux de croissance
HNO2 Acide nitreux
DCO Demande Chimique en Oxygène
DBO Demande Biochimique en Oxygène
KS Constante d'association
N2 Azote moléculaire
NK L'azote KJELDAHL.
N2O Protoxyde d'azote ou oxyde nitreux
NAR Nitrate réductase
NOR Oxyde nitrique réductase
NIR Nitrite réductase
NH3+ Ammoniac
NH4+ Ammonium
NO Oxyde nitrique
NO3- Nitrate
Synthese Bibliographique



I. INTRODUCTION GENERALE
L'azote représente 78% de l'atmosphère gazeux, 4
à 6 % du poids sec d'un animal. Il constitue entre 16 et 23% des
protéines cellulaires et environ 12% des acides nucléiques. Les
organismes ont besoin d'azote pour fabriquer des protéines et des acides
nucléiques. En plus, une grande partie des réactions biologiques
de croissance requiert la présence de l'élément d'azote.
Le cycle de l'azote est parfaitement connu et fait intervenir des
réactions de fixation, de nitrification et de dénitrification.

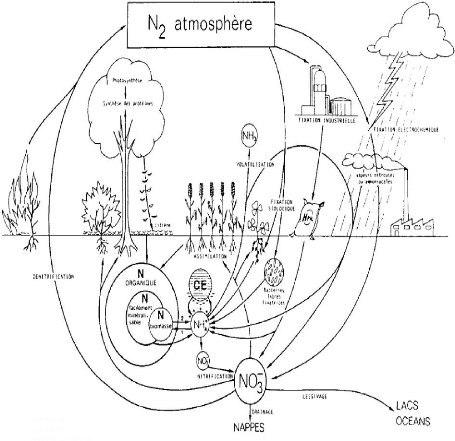
Figure 1 : Cycle de l'Azote
Document issu du site :
http://www.ggl.ulaval.ca/personnel/bourque/intro.pt/planeteterre.html

La fixation de l'azote : correspond à
la conversion de l'azote atmosphérique en azote utilisable par les
plantes et les animaux. Elle se fait par certaines bactéries qui vivent
dans les sols ou dans l'eau et qui réussissent à assimiler
l'azote moléculaire N2. Cette fixation tend à produire des
composés ammoniaqués tels l'ion ammonium NH4+ et
l'ammoniac NH3. Il s'agit ici d'une réaction qui se fait par
l'intermédiaire de substances organiques.

La nitrification : transforme les produits de
la fixation (NH4+, NH3) en ions nitrite NO2- puis en ions
nitrate NO3-. Cette réaction se produit grâce à
des bactéries présentes dans les sols et dans l'eau :
Ion ammonium Ion nitrite Ion nitrate

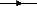




La dénitrification : l'azote retourne
à l'atmosphère sous sa forme moléculaire N2, avec comme
produits secondaires du dioxyde de carbone CO2 et de l'oxyde d'azote N2O (gaz
à effet de serre).



II. NITRIFICATION BIOLOGIQUE
1-Définition
La nitrification est un processus contrôlé par
l'action de certains micro-organismes spécifiques, qui conduit à
la transformation de l'ammoniaque ou de l'ammonium en nitrate, c'est à
dire la conversion biologique de la forme réduite, NH4+, NH3
en la forme oxydée NO3.-
Elle n'a pas d'impact sur le bilan global des
écosystèmes, puisqu'elle n'ajoute ni élimine de l'azote,
mais elle change uniquement son degré d'oxydation. C'est pour cela
qu'elle a une importance capitale dans les écosystèmes,
puisqu'elle est le lien entre les formes réduites et oxydées du
cycle de l'azote. Elle permet l'oxydation de l'ammonium (produit par les
hétérotrophes lors de la décomposition de la
matière organique), le liant ainsi à la dénitrification.
Elle est par conséquent l'intermédiaire entre la
décomposition de la matière organique et la perte d'azote
fixé dans l'écosystème.
2- Métabolisme nitrifiant
La réaction de la nitrification se fait en deux
étapes :
La nitritation qui est l'oxydation de l'ammonium
en nitrites, et la nitratation qui est l'oxydation des
nitrites en nitrates.
A. La reaction d Nitritation
La réaction de nitritation (oxydation de l'ammonium) est
réalisée par les bactéries nitritantes (Nitrosomonas,
Nitrosococcus , Nitrosopira etc.) est décrite par l'équation
suivante :
NH4+ + 1.5 O2 ?
NO2- + 2H+ + H
2O
En réalité, la nitritation proprement dite se
déroule en deux étapes au cours desquelles l'ion ammonium s'oxyde
d'abord en hydroxylamine. Cette réaction est catalysée par une
enzyme, l'ammonium monooxygénase (AMO) localisée
dans la fraction membranaire de la bactérie (Wood,
1986) , alors que la deuxième étape qui est la
Oxydation



d'hydroxylamine en nitrite est catalysée par
l'hydroxylamine oxydoréductase (HAO) enzyme
périplasmatique (Hooper and Terry, 1979).
B. La reaction d Nitratation
La réaction de nitratation (oxydation des nitrites) est
effectuée par les bactéries nitratantes (Nitrobacter,
Nitrospira), selon la réaction suivante :
NO2- + 0.5 O2
? NO3-
la formation de nitrite résulte de la mise en
série de deux réactions d'oxydoréduction, Alors que
l'oxydation du nitrite en nitrate se déroule en une seule étape
(Henze et al., 1997). Selon les travaux de (Meinck et
al. 1992), cette réaction impliquerait la
nitrite-oxydoréductase (NOR), enzyme localisée
dans le système membranaire des souches concernées.
3-Les types de nitrification
Deux types de nitrification doivent être
distingués:


La nitrification Autotrophe :
caractérisée par l'utilisation de substrats inorganiques
comme source d'énergie (donneurs d'électrons) pour
la croissance et comme source
d'azote, le dioxyde de carbone comme source de carbone et
l'oxygène comme
accepteur final d'électrons (Bock et al.,
1989).
La nitrification hétérotrophe :
les micro-organismes nitrifiants hétérotrophes utilisent le
carbone organique comme source d'énergie et oxydent des composés
azotés organiques ou inorganiques à une vitesse beaucoup plus
faible que celle observée chez les autotrophes. Certains
micro-organismes peuvent utiliser deux accepteurs d'électrons,
l'oxygène et le nitrate, et atteignent, alors une croissance plus rapide
qu'en utilisant l'oxygène seul. (Kester et al.,
1997).



4- Type de micro-organismes
Deux groupes des bactéries sont spécialisées
dans la fonction de la nitrification :


Un groupe oxyde l'ammonium en nitrite: ce sont les
bactéries nitritantes (ou
nitrosantes, ou nitreuses, ou ammonio-oxydantes), dont les noms
de genre portent
le préfixe nitroso (
Nitrosomonas, ,
Nitrosococcus ,...), (Bock et
al., 1989).
Nitrosospira
Un groupe oxyde le nitrite en nitrate : ce sont les
bactéries nitratantes (ou nitriques,
ou nitrite- oxydantes), dont les noms de genre portent le
préfixe nitro(
Nitrobacter, Nitrococcus ,
Nitrospira...),(Watson et al.,
1989).
Cependant, de nombreux genres et espèces de
bactéries nitrifiantes ont été identifiés.
Elles peuvent soit oxyder l'ammonium en nitrite (nitritation),
soit oxyder le nitrite en nitrate
(nitratation). Il n'y a pas d'organisme connu qui puisse
directement oxyder l'ammonium en
nitrate. Dans les sols, la nitritation est
généralement attribuée à Nitrosomonas
europaea et la
nitratation à Nitrobacter agilis.
5-Facteurs du milieu influencant la croissance et
l'activité des bactéries Nitrifiantes
D'une manière générale, la croissance des
bactéries nitrifiantes est contrôlée par un
certain nombre de paramètres : disponibilité du
substrat, température, oxygène dissous,
pH, pour lesquels il existe une limite de tolérance et un
optimum. Une cinétique de
nitrification réalisée dans des conditions
favorables aux micro-organismes nitrifiants est
schématisée sur la Figure suivante.
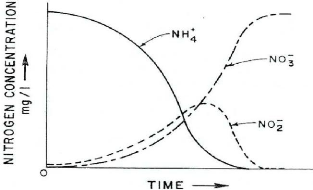



Figure 2 : Schématisation des transformation
de l'azote durant la nitrification en absence d'inhibiteur
(Anthonisen et al
., 1976)
fi. ~~mperature
La gamme des températures favorables à la
nitrification est très large. La limite inférieure
serait 5°C (Jones and Hood, 1980), alors
que la limite supérieure se situerait entre 40°C et 45°C
(Henze et al., 1997) . Dans cette large gamme,
les micro-organismes nitrifiants présentent une
température optimale qui se situe entre 25 et 36°C.
Les constantes de croissance (umax et KS)
dépendent fortement de la température. Les deux
espèces nitrifiantes sont influencées par
la température : la vitesse maximale de croissance et
l'affinité augmentent avec la
température (figure 3).
Figure 3 : Evolution des taux de croissance maximum
en fonction de la température (Knowles 1965)



Cependant, à forte température (supérieure
à 30°C), la vitesse maximale de croissance
de Nitrosomonas devienne supérieure à celle de
Nitrobacter, alors que l'inverse est observé à
moins de 30°C.
B. Le pgf
L'activité des microorganismes nitrifiants est
très sensible au pH. Dans la nature, ces bactéries peuvent
croître dans une large plage de pH. Cependant, leurs
croissances et leurs activités optimales se situent aux environs d'un pH
compris entre 7.5 et 8.5 (Josserand, 1983; Bock et al., 1989).
La vitesse de nitrification diminue avec la diminution du pH. D'après
Anthonisen et al., 1976, le pH agit via l'ammoniac (NH3) et
l'acide nitreux (HNO2) toxiques pour les micro-organismes nitrifiants et dont
les concentrations sous forme libre sont dépendantes du pH.
Ainsi à un pH élevé, la teneur en NH3 est
relativement importante du fait du déplacement
de l'équilibre NH3 par NH4+, inversement à pH
faible, c'est la teneur en HNO2 qui est forte du fait
du déplacement de l'équilibre NO2- par
HNO2. Anthonisen et al., 1976.
C. Teneur en oxyane dissous
L'oxygène dissous est utilisé comme accepteur final
d'électrons par les bactéries
nitrifiantes pour réaliser les réactions de la
nitrification. De ce fait, une carence en oxygène
dissous peut induire un ralentissement et même un
arrêt de la réaction.
Plusieurs auteurs (Henze et al., 1997), ont
établi que le taux de nitrification se maintient
à 100% pour des concentrations en oxygène dissous
supérieures ou égales à 3 mg O2.L-1. Le
Tableau suivant présente différentes valeurs des
constantes d'affinité pour l'oxygène
données dans la littérature pour chacune des deux
populations Nitritantes et Nitratantes.



Tableau 1 : Différentes valeurs de KO2
publiée dans la littérature
|
Constantes d'affinité pour l'oxygène K02 ( mg
021-1)
|
Auteurs
|
|
Nitritantes
|
0,25 - 0,3
|
Loveless (1968)
|
|
0,25 - 0,3
|
Peeters et al., (1969)
|
|
0,5 a 30°C
|
Bal melle et al (1991)
|
|
0,5 - 1
|
Henze et al (1997)
|
|
Nitratantes
|
0,3 - 0,7
|
Stenstro m (1980)
|
|
0,8 - 2,5
|
Peeters et al., (1969)
|
|
1 A 30°C
|
Bal melle et al (1991)
|
|
1 a 30°C
|
Henze et al (1997)
|
Les bactéries nitratantes sont donc plus sensibles aux
faibles concentrations en
oxygène dissous, que les bactéries nitritantes.
Cette tendance est confirmée par les
travaux d'Hanaki et al., 1990 qui ont
observé une accumulation de nitrites et une
augmentation du taux de croissance des nitritantes pour des
concentrations en oxygène
dissous d'environ 0,5 mg O2.L-1. Dans ces
conditions, la vitesse d'oxydation du nitrite décroît
plus rapidement que celle de l'ammonium.
Par ailleurs, autres chercheurs (Zhao et al.,
2006) ont montré qu'à faible concentration
en oxygène il peut y avoir une dérive
métabolique plus importante vers la production de
protoxyde d'azote (N2O), qui est un gaz totalement
indésirable (gaz à effet de serre donc
indésirable compte-tenu du réchauffement
atmosphérique).
0- Composes Toxiques
La nitrification est inhibée par une large
variété de composés. On peut citer notamment
les métaux lourds (comme le cuivre, le nickel, le
cobalt, le zinc et le chrome), les amines, les
phénols, les composés sulfurés,
chlorés et les composés cycliques azotés. Cependant, tous
ces
composés ne sont pas inhibiteurs aux mêmes
concentrations et il faut noter que les micro-
organismes nitrifiants possèdent une forte capacité
d'adaptation (Martin, 1979).




III. LA DENITRIFICATION
BIOLOGIQUE
1. Définition
Il s'agit d'un procédé biologique qui consiste
à la réduction du nitrate en azote gazeux
via la formation des composés intermédiaires tels
que le nitrite, l'oxyde nitrique et l'oxyde
nitreux en conditions anoxies.
La dénitrification est d'une grande importance
écologique, puisqu'il s'agit de la voie
majeure de la perte d'azote fixé dans l'environnement.
Elle occupe donc une place importante
dans le bilan de l'écosystème à
l'échelle globale. La dénitrification est aussi un mode
respiratoire qui permet aux bactéries anaérobies
facultatives de continuer à minéraliser du
carbone organique en l'absence d'oxygène
moléculaire. Dans cette respiration, les oxydes
d'azote sont réduits depuis la forme nitrate jusqu'aux
formes gazeuses de l'azote : N2, NO2, NO,
via le nitrite. Les bactéries dénitrifiantes
influencent donc à la fois le cycle du carbone et celui
de l'azote, et leur impact varient en fonction de la tension
locale en oxygène.
2. Métabolisme dénitrifiant
La dénitrification est un processus biologique au cours
duquel les micro-organismes
impliqués utilisent les formes oxydées de l'azote
comme accepteur finaux d'électrons dans
leur chaîne respiratoire, conduisant ainsi à la
réduction du nitrate en azote gazeux via la
formation de composés intermédiaires qui sont le
nitrite, l'oxyde nitrique et l'oxyde nitreux
(ou protoxyde d'azote). Comme illustre la figure suivante cette
réaction est catalysée par
différentes enzymes spécifiques appelées `
réductase'.

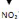
Figure 4 : Réaction de la
dénitrification


Chaque étape est catalysée par une enzyme
particulière : nitrate réductase (NAR),
nitrite réductase (NIR), oxyde nitrique réductase
(NOR) et enfin oxyde nitreux réductase
(N2OR). Les micro-organismes dénitrifiants ont besoin
d'une source de carbone externe pour
la biosynthèse et pour la génération
d'énergie (Dinçer et Kargi 2000). Cette
présence
nécessaire d'un donneur d'électrons peut se
traduire dans les procédés conventionnels de
dénitrification par un apport coûteux de
matière carbonée.
3. Types de DenitrifiCatiOn

Deux types des bactéries dénitrifiantes
doivent être distingués : Les Bactéries
dénitrifiantes Hétérotrophe :
Les bactéries dénitrifiantes
Hétérotrophe sont des micro-organismes
aérobies-
anérobie facultatives capables de réduire le
nitrate et le nitrite en azote gazeux dans des
conditions anaérobies. La particularité de ces
micro-organismes réside dans leur faculté à
utiliser soit l'oxygène, soit les formes oxydées
de l'azote comme accepteur final d'électrons
dans la chaîne respiratoire. Ces bactéries sont
donc dites : aérobie-anoxie facultatives. Ces
micro-organismes utilisent ainsi du carbone d'origine organique
comme source de carbone
(Robertson et Kuenen 1990).
|
Les Bactéries dénitrifiantes Autotrophe
:
|
Les Bactéries dénitrifiantes
Autotrophe sont des micro-organismes capables de
réduire les formes oxydées de l'azote, en utilisant
du dioxyde de carbone ou des
bicarbonates. Les bactéries du genre Paracoccus
ou encore Thiobacillus, utilisent
respectivement le dihydrogène et des composés
sulfurés réduits comme donneurs
d'électrons.
Il existe donc une très grande diversité de genres
bactériens capables de réaliser la
dénitrification. Mais dans cette étude, seules
seront considérées les bactéries
hétérotrophes aérobie-anaérobie
facultatives .



4. Types de Micro-organismes
Les micro-organismes les plus fréquemment
rencontrés dans le processus de la dénitrification sont des
bactéries qui appartiennent au genre des Pseudomonas et des
Alcaligenes. Parmi les Pseudomonas, l'espèce dominante
est Pseudomonas fluorescens. Cependant, des bactéries d'autres
genres peuvent aussi intervenir Achromobacter, Aerobacter, Bacillus,
Micrococcus, Paracoccus (Knowles, 1982).
Il est à noter que certains micro-organismes ne peuvent
réduire que le nitrite comme Alcaligenes acidovorans ou
s'arrêtent au protoxyde d'azote comme Corynebacterium nephridii,
Pseudomonas aurofaciens et Rhizobium japonicum (Kuenen et
Robertson, 1987).
Les travaux de Thomsen et al. (2004) ont fait
apparaître un nouveau genre: le genre Aquaspirillum de la
famille des Neisseriaceae. Les bactéries du genre
Aquaspirillum qui est abondant dans les stations d'épuration
d'eaux résiduaires.
5. Facteurs du milieu influencant la croissance et
l!activite des bacteries
denitrifiantes
A. T~mOerature
La dénitrification Fait intervenir des espèces
dénitrifiantes à activités différentes :
bactéries psychrophiles, mésophiles,
thermophiles .En règle générale, la réaction semble
être
réalisée par des micro-organismes
mésophiles. Mais il n'existe pas de conditions optimales de
température pour réaliser la
dénitrification.
Bien que la dénitrification semble possible entre
5°C et 75°C (Martin (1979)) du fait de
la grande Diversité des germes dénitrifiants, la
température constitue néanmoins une variable
majeure affectant la vitesse de la réaction
biologique.
B. Of
Contrairement aux micro-organismes nitrifiants, les
micro-organismes réalisant la
dénitrification sont beaucoup moins sensibles aux
fluctuations de pH. Le pH optimum semble
se situer entre 7 et 8,7. La réaction de
dénitrification est caractérisée par la consommation


des protons H+ et conduit à une
élévation de pH. Il faut donc maintenir ce paramètre
à une
valeur comprise entre 7 et 8.7, en fournissant des ions
H+ au fur et à mesure de leur
consommation (Knowles, 1982).
C. creneur en oxyaene dissous
Les micro-organismes dénitrifiants sont des
bactéries aérobies anaérobies facultatives
qui tirent leur énergie de celle libérée
lors du transfert des électrons des composés
organiques vers l'oxygène, le nitrite ou le nitrate. Le
choix de l'accepteur final se fait bien
entendu en faveur de celui qui donnera la plus grande
quantité d'énergie par unité de matière
organique oxydée. Il a été montré
que l'utilisation de l'oxygène comme accepteur d'électrons,
plutôt que le nitrite ou le nitrate, permet de produire
davantage d'énergie (Wisjnuprapto
1981). De ce fait, la réaction de
dénitrification est inhibée en présence d'oxygène,
les
rendements de dénitrification étant
affectés.
D. Composes croxiques
Il existe des composés chimiques qui peuvent perturber
le déroulement normale de la
dénitrification en agissant sur les systèmes
enzymatiques des bactéries dénitrifiantes parmi
lesquels on peut citer , l'oxygène dissous dans le
milieu, les nitrites à concentration élevée et
les métaux lourds (comme le cuivre, le nickel, le cobalt,
le zinc et le chrome ...) .
E. La nature de Ca source de carbone
La disponibilité en carbone organique est fondamental
à l'activité des bactéries
dénitrifiantes hétérotrophes, car le
substrat carboné fournit l'énergie nécessaire à
leur
métabolisme et constitue l'élément de base
de leurs synthèses cellulaires. Les faibles
performances de dénitrification biologique,
résultant en général d'une limitation des eaux
usées en carbone bioassimilable, imposent l'apport d'une
source de carbone exogène afin
d'améliorer les performances de traitement. Le
méthanol et l'acétate sont les principaux
substrats carbonés synthétiques ayant
été utilisés dans le domaine de la dénitrification
des
eaux usées.
IV - LES TECHNIQUES DU TRAITEMENT BIOLOGIQUE D'AZOTE
CONTENU DANS LES EAUX USEES
Les eaux usées sont majoritairement traitées par
voie biologique dans les stations d'épuration. Celle-ci regroupe
l'ensemble des processus qui permettent l'épuration des eaux
usées de telles façons que l'eau retrouve sa qualité
d'origine après une pollution. Ces techniques utilisent
l'activité des bactéries nitrifiantes et dénitrifiantes
pour se débarrasser de la pollution azotée. Le traitement
biologique conventionnel de l'azote des eaux usées par voie biologique
se réalise en deux étapes : oxydation de l'azote ammoniacal par
une flore nitrifiante aérobie et réduction du nitrate en azote
moléculaire par une flore dénitrifiante en conditions anoxiques.
Ces micro-organismes peuvent être utilisés soit en culture libre
(Procédés à biomasse libre ou système à
boues activées), soit en culture fixé (Procédés
à biomasse fixée).
1- Les Procédés a Biomasse Libre
Les procédés à biomasse libre ont pour
fonction d'éliminer la pollution carbonée et azotée. Les
étapes de nitrification et dénitrification ont
généralement lieu dans des bassins où co-existent à
la fois des bactéries autotrophes et hétérotrophes. La
réalisation de la nitrification et de la dénitrification par
cette culture mixte nécessite donc d'alterner des conditions
aérobie et anoxie. Par ailleurs, pour une bonne dénitrification,
il est nécessaire de disposer d'une quantité suffisante de
carbone biodégradable, qu'elle provienne de l'effluent à traiter
ou par l'ajout supplémentaire.
A. Les boues activées
L'installation des boues activées dans le traitement
des eaux usées ont tout d'abord été conçues pour
éliminer successivement les pollutions carbonées et
azotées. La boue activée est composée essentiellement de
microorganismes floculants, qui sont mélangées avec de
l'oxygène dissous et de l'eau usée. Les micro-organismes de la
boue activée entrent constamment en contact avec les polluants
organiques des eaux résiduaires, ainsi qu'avec l'oxygène, et sont
maintenus en suspension.
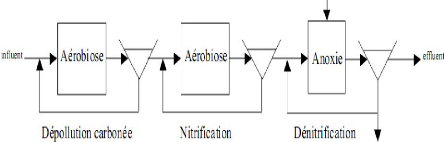
Figure 5 : schéma général
d'une boue activée (d'après Barnard et al.,
1998)
Après le passage par une zone de contact, l'eau
usée est admise dans un bassin d'aération contenant la biomasse
épuratrice en suspension (boues activées).Le bassin
d'aération est équipé d'un système
d'aération fonctionnant en discontinu (une dizaine de cycles
d'aération par jour).La nitrification s'effectue durant les phases
aérobies et la dénitrification durant les phases d'anoxie. Ce
procédé nécessite l'ajout d'une source de carbone externe
au niveau du bassin de dénitrification (méthanol ou
acétate).
Afin d'éviter l'ajout de carbone organique
coûteux, Ludzack-Ettinger ont proposé un modèle où
la dénitrification utilise le nitrate produit dans la zone
aérobie, ce qui nous permet d'éviter l'ajout de carbone
supplémentaire.
B. Le Proc~d~ Ludzack-Ettinger
Ludzack-Ettinger ont proposé un
système où la dénitrification utilise le carbone
présent dans l'effluent, qui passe successivement dans le bassin
anoxique et le bassin aérobie (Figure 6). Le nitrate produit dans la
zone aérobie est recyclé pour être dénitrifié
dans la zone anoxique.
Dans le cas où l'effluent ne présente pas un
rapport DCO/N suffisant pour réaliser une dénitrification
complète des nitrates produits, il est alors nécessaire de placer
une post-dénitrification après le bassin aérobie avec ou
sans ajout de carbone.
Figure 6 : Configuration de
Ludzack-Ettinger
Cette configuration a l'avantage d'optimiser l'utilisation de
la DCO contenue dans l'effluent et de limiter la déstabilisation de la
flore nitrifiante par la croissance des hétérotrophes. ce
modèle a été largement utilisé avec des
performances de 85 à 95% d'élimination de l'azote ammoniacal et
des concentrations finales inférieures à 10 mg
N.L-1 (Cooper et al., 1994).
2- Les procédés a biomasse
fixée
Afin d'augmenter l'activité spécifique de la
biomasse, la formation d'un biofilm à l'intérieur du
réacteur est apparue comme une solution intéressante. Le principe
repose sur l'utilisation de la capacité naturelle des micro-organismes,
à se fixer sur un support solide et à former une matrice de
polymères biologiques. Parmi les réacteurs à cultures
fixées, on distingue plusieurs catégories : le lit
bactérien, les biodisques, procédés anciens aux
performances modestes et enfin les réacteurs à lit mobile. Les
lits fixes actuellement utilisés dans le traitement azoté des
eaux usées .Malgré une phase de colonisation parfois très
lente (60 à 100 jours), les procédés à biofilm
Permettent une excellente rétention de biomasse et une concentration en
biomasse élevée. Par ailleurs, des études ont
montré une sensibilité moindre aux faibles températures
(Tanaka et al., 1996) et aux agents inhibiteurs (Hunik
et al., 1992).
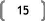
A- Le iftre a ruisseffement ou fit bacterien
C'est le système à cellules immobilisées
le plus largement utilisé. Dans ce type de réacteur, la biomasse
est fixée sur un support solide circulaire surmonté d'un
distributeur rotatif. L'effluent à traiter est introduit par le haut et
s'écoule par gravité sur le lit bactérien (Figure 7). Les
matériaux supports ont tout d'abord été constitués
de gros morceaux de pierre avec une surface relative assez limitée.
Dorénavant des supports en plastique à faible densité
(polystyrène) sont couramment utilisés et offrent des surfaces
relatives importantes .L'injection d'air pour la nitrification
se fait par le fond du lit (Andersson et al.,
1994).
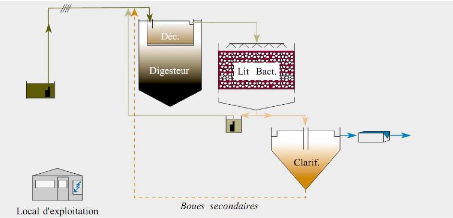
Figure 7 : Schéma de la filière lit
bactérien
L'azote des eaux usées admises sur un lit
bactérien est dégradé par ruissellement sur un
matériau inerte, traditionnel ou « plastique »,
colonisé par un biofilm. Ce biofilm est composé d'une pellicule
superficielle aérobie de faible épaisseur, riche en
bactéries provenant de l'influent et d'une pellicule plus profonde
anaérobie qui tend à s'épaissir.
L'élimination de l'azote s'effectue essentiellement via
les processus d'assimilation par les bactéries et la nitrification.
B. Lits d'infiltration-percolation sur sable
Dans les lits d'infiltration-percolation, la biomasse
épuratrice est fixée sur les grains de sable et localisée
principalement dans les trentes premiers centimètres du massif
filtrant.
Afin de préserver un équilibre fragile entre
l'efficacité de traitement, le maintien d'une conductivité
hydraulique suffisante au regard de la finesse du matériau et les
risques d'engorgement biologique, des périodes de non alimentation
doivent être ménagées. Pour ce faire, une station est
normalement constituée de trois massifs filtrants en parallèle,
dont un seul est alimenté pendant trois ou quatre jours .Alors que les
deux autres sont au repos pour une semaine. L'oxydation des composés
azotés se déroule sous deux formes :
Nitrification directe de l'azote ammoniacal au cours de la
migration dans le massif tant que l'aération le permet localement.
Nitrification décalée de l'azote réduit
préalablement absorbé sur le biofilm qui s'opère
progressivement pendant la phase de repos.
Elle se traduit par un important lessivage de nitrates avec
l'eau des premières bâchées, dont la concentration peut
largement excéder la teneur moyenne des eaux usées en azote
réduit.
Enfin de phase d'alimentation, une dénitrification
conjointe peut se produire simultanément dans des zones du massif
filtrant devenues anoxiques, sans qu'il soit cependant aisé de la
quantifier.
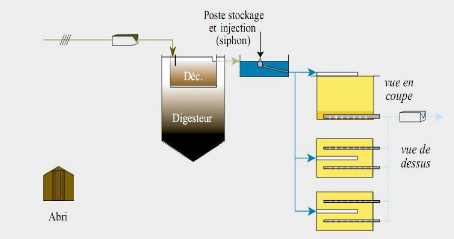
Figure 8 : Schéma de la filière Lits
d'infiltration-percolation sur sable
La contrainte majeure garantissant le bon fonctionnement d'une
station par lits d'infiltration percolation est l'alternance des phases
d'alimentation et de repos qui doit normalement s'opérer deux fois par
semaine. Il est essentiel, en effet, pour que le processus de nitrification ait
lieu, que le massif soit correctement oxygéné et par
conséquent ressuyé pendant la période de repos.
MATERIEL ET METHODES
MATERIEL ET METHODES
Cette étude consiste à analyser la
qualité physico-chimique des eaux usées brutes et traitées
par un réacteur biologique à lit bactérien fixé.
Les paramètres analysés sont : nitrates, ammonium, azote total
Kjeldahl et la matière organique biodégradable.
DETERMINATION DE LA DEMANDE BIOCHIMIQUE EN OXYGENE
DBO5
L'eau usée analysée à différentes
dilutions et après ensemencement bactérien, elle est maintenu en
incubation soit dans des flacons de Winkler, pendant 120 heures à la
température de 20°C et dans l'obscurité. Le résultat
exprimé en mg d'O2/L traduit la quantité d'oxygène
consommée par les microorganismes pour dégrader la matière
organique biodégradable contenue dans l'eau à analysée.
DOSAGE DE L'AZOTE KJELDAHL (NKT)
Dans un bloc de minéralisation, l'azote organique est
transformé en azote ammoniacal à l'aide d'une digestion à
l'acide sulfurique en présence d'un catalyseur (sulfate de cuivre,
sulfate de potassium). L'ammoniaque, déplacée par une base forte,
est distillé puis on dose l'ammoniaque par acidimétrie
après distillation et les résultats sont exprimés en
mg/L.
DOSAGE DE L'AMMONIUM NH4 ~
Après filtration, le dosage de l'azote ammoniacal en mg/L
selon la méthode colorimétrique au réactif de Nessler.
DOSAGE DES NITRATES NO3
Après filtration, dosage des nitrates exprimés en
mg/L par la méthode colorimétrique au salicylate de sodium.
Résultats et Discussion
RESULTATS ET DISCUSSION
Après passage dans le lit bactérien les
concentrations des différents paramètres ont été
diminués. Comme nous montre le tableau 2 :
Tableau 2 : comparaison entre l'eau usée brute
et traitée dans un lit bactérien
|
Paramètres en (mg/l)
|
Eaux usées Brutes
|
Eaux usées épurées
|
|
DBO5
|
810,2
|
320
|
|
NKT
|
75,6
|
53,2
|
|
NH4+
|
104,4
|
32
|
|
NO3-
|
1,9
|
0,53
|
D'après les résultats obtenus lors des essais de
traitement des eaux usées dans un réacteur à lit
bactérien immergé on constate que pour :
DBO5 en mg/L
|
1000 800 600 400 200
0
|
|
|
|
Eaux usées Brutes Eaux usées
épurées
|

DBO5 en mg/L
Figure 9 : concentration de la DBO5 avant et
après Traitement
On remarque que la DBO5 des eaux usées brutes est
importante que celle des eaux usées après traitement, donc on
peut déduire que les eaux usées brutes sont riches en
matière organique, qui est utilisée par les bactéries pour
fournir les besoins énergétique nécessaire à leur
croissance. Ainsi la diminution de la DBO5 après épuration peut
s'expliquer par la dégradation de la matière organique par les
bactéries.
Les résultats montrent qu'il ya une variation de la
concentration des différentes formes de l'azote après traitement
de l'eau usée brute.
En effet, on remarque que la concentration de l'azote total
(N-NTK) diminue en passant de l'eau usée brute vers l'eau usée
traitée.
NTK
|
80 70 60 50 40 30 20 10 0
|
|
|
|
Eaux usées Brutes Eaux usées
épurées
|
Figure 10 : concentration en NTK avant et
après Traitement
On remarque aussi que la concentration du Nitrate
(NO3-) a diminué par rapport à l'eau usée brute
.Ce qui peut être expliqué par la consommation de nitrate par la
flore dénitrifiante, qui transforme les formes oxydés de l'azote
(NO3-) en azote moléculaire N2.
NO3-en mg/L
2
1,5
1
0,5
0
Eaux usées Brutes Eaux usées
épurées
Figure 11 : concentration en Nitrate avant et
après Traitement
Ainsi on constate que la concentration de l'ammonium
(NH4+) dans l'eau usée traitée est moins importante
que celle de l'eau usée brute.
NH4+ en (mg/l)
|
120 100 80 60 40 20 0
|
|
|
|
Eaux usées Brutes Eaux usées
épurées
|
Figure 12: concentration en NH4+avant et
après Traitement
Cette diminution de la concentration de l'ammonium peut
être expliquée par sa transformation par la flore nitrifiante qui
oxyde l'ammonium NH4+ en nitrate NO3-.
Conclusion
CONCLUSION
CONCLUSION
L'épuration des composés azotés des eaux
usées est possible grâce aux processus de nitrification et de
dénitrification. Ces phénomènes sont à l'origine de
flux de matière qui permettent de transformer les formes
minérales nuisibles de l'azote en formes inertes. Cette
dépollution s'effectue par l'intermédiaire des bactéries
nitrifiantes et dénitrifiantes.
Ces deux processus sont influencés par plusieurs
facteurs et paramètres qu'on doit prendre en compte pour une bonne
élimination des composés contenus dans les eaux usées.
Lors d'une expérimentation réalisée au
laboratoire de Biotechnologie marine et de l'environnement qui consiste
à analyser la qualité physico-chimique des eaux usées
brutes et traitées par un réacteur biologique à lit
bactérien fixé. Les paramètres analysés sont :
nitrates, l'ammonium, azote total Kjeldahl et la matière organique
biodégradable. Nous avons remarqué une diminution de la
concentration de ces éléments qui est due à leurs
transformations par la flore nitrifiante-dénitrifiantes présente
dans le lit bactérien.
Références Bibliographiques


Références Bibliographiques
Andersson B, Aspegren H, Parker DS, Lutz MP.
1994
High rate nitrifying trickling filters. Water Science
and Technology.;29(10-11):47-52.
Anthonisen A.C., Loehr R.C., Prakasam T.B.S., Srinath
E.G. (1976).
Inhibition of nitrification by ammonia and nitrous acid.
J. Water Pollut. Control Fed., 48, 835-852.
Bedard C. and Knowles R. (1989)
Physiology, biochemistry, and specific inhibitors of CH4,
NH4+, methanotrophs and nitrifiers. Microbiol. Rev. 53 [1], pp
68-84.
Bock E., Koops H.P., and Harms H. (1989)
Nitrifying bacteria. Eds. HG Schlegel & B Bowien,
Autotrophic bacteria - Science Tech Publishers, Madison, Wisconsin, pp
81-96.
Bougard D., 2004
Traitement biologique d'effluents azotés avec
arret de la nitrification au stade nitrite , these de doctorat l'ecole notional
Superieur agronomique de Montpellier.
Cooper AB. 1994
Coupling wetland treatment to land treatment - An
innovative method for nitrogen stripping. Water Science and
Technology.;29(4):141-149.
Dincer Ali R. and Kargi F. (2000)
Kinetics of sequential nitrification and denitrification
processes. Enzyme and Microbial Technology 27, pp 37-42.
Document technique FNDAE no 25 (Ministere de
la péche et agriculture Francaise 2006) Traitement de l'azote dans les
stations d'épuration biologique des petites
collectivités
Faure V. (2007)
Mesure et modélisation de la
dénitrification dans les sols drainés,
Diplôme
d'Ingénieur de Ecole Nationale du Génie de l'Eau
et de l'Environnement de Strasbourg
Féray C. (2000)
Nitrification en Sédiment déeau douce:
incidence de rejets de station d'épuration sur la dynamique de
communautes nitrifiantes , these de doctorat Université
Claude-Bernard



Hanaki K., Wantawin C., and Ohgaki S. (1990)
Effects of the activity of heterotrophs on nitrification
in a suspended-growth reactor. Water Research 24, pp 289-296.
Henze M., Harremoes P., La Cour Jansen J., and Arvin E.
(1997)
Wastewater Treatment - Biological and Chemical Processes.
Springer 2nd Edition.
Hooper A. B., Terry K. R. (1979).
Hydroxylamine oxidoreductase of Nitrosomonas production
of nitric oxide from hydroxylamine. Biochim. Biophys. Acta, 571, 12 -
20.
Jones R.D., Hood M.A. (1980).
Effects of temperature, pH, salinity, and Inorganic
Nitrogen on the rate of ammonium oxidation by Nitrifiers Isolated from Wetland
Environments. Microb. Ecol., 6, 339 - 347.
Josserand A., Bardin R. (1981).
Nitrification en sol acide, I : Mise en évidence
de germes autotrophes nitrifiants (genre Nitrobacter) dans un sol forestier
sous résineux. Rev. Ecol. Biol.
Sol, 18, 435 - 455.
Kouakou E. (2007)
Etude de la nitrification partielle d'eaux ammoniacales
dans un bioréacteur membranaire
Kester RA, Meijer ME, Libochant JA, De Boer W, Laanbroek
HJ. (1997)
Contribution of nitrification and denitrification to
the NO and N O emissions of an acid forest soil, a river sediment and a
fertilized grassland soil. Soil Biology & Biochemistry.
1997;29(11-12):1655-1664. 2
Knowles G, Downing AL, Barrett MJ.
Determination of kinetic constants for nitrifying
bacteria in mixed culture, with the aid of an electronic computer. Journal of
General Microbiology. 1965;38:263-278.
Meincke M., Bock E., Kastrau D., Kroneek P.M.H.
(1992).
Nitrite oxidoreductase from Nitrobacter hamburgensis :
redox centers and their catalytic role. Arch. Microbiol., 158, 127 -
131.
Martin G. (1979)
Le problème de l'azote dans les eaux. Ed. Tech
& Doc, Lavoisier - Paris, France.


Pambrun V. (2005)
Analyse et modélisation de la nitrification
partielle et de la précipitation concomitante du phosphore dans un
réacteur à alimentation séquencée, these de
doctorat Génie des Procédés et de l'Environnement,
L'Institut National des Sciences Appliquées de Toulouse
Robertson LA, Kuenen JG. 1990
Combined heterotrophic nitrification and aerobic
denitrification in Thiosphaera pantotropha and other bacteria. Antonie van
Leeuwenhoek.;57:139-152.
Tiedje JM. (1988)
Ecology of denitrification and dissimilatory nitrate
reduction to ammonium. In: Zehnder AJB, ed. Biology of Anaerobic
Microorganisms. New York: John Wiley and sons; 179-244.
Thomsen TR, Nielsen JL, Ramsing NB, Nielsen PH.
(2004)
Micromanipulation and further identification of
FISH-labelled microcolonies of a dominant denitrifying bacterium in activated
sludge. Environmental Microbiology.;6(5):470-479.
Wisjnuprapto. (1981)
Mise au point d'un procédé biologique
compact de dépollution (Etude de l'élimination du carbone de
l'azote et du phosphore). Thèse de doctorat en Chimie Industrielle. INSA
de Toulouse. N°54.
Wood P.M. (1986).
Nitrification as a bacterial energy source. In :
Prosser J.I. (ed.), Nitrification, IRL Press, Washington, DC, 39-
62.
Watson S.W., Bock E., Harms H., Koops H.-P., Hooper A.B.
(1989).
Nitrifying bacteria. In : Bergey's manual of
systematic bacteriology, Holt J.G. et al. (ed.), Williams and Wilkins Co,
Baltimore, 1822 - 1834.
Zhao T.S. , Teng H . (2006).
An extension of Darcy's law to non-Stokes flow in
porous media. Chem. Eng. Sci., 55, 2727 - 2735.



