|
UNIVERSITE DE KINSHASA

FACULTE DES SCIENCES AGRONOMIQUES
Département de Phytotechnie
BP.117 Kinshasa XI.

Activation des bourgeons latents de différents rejets
d'ananas (Ananas comosus) pour la propagation en masse de plants en
conditions horticoles in vivo
Patrick MUKENDI KALALA
(Gradué en Agronomie)
Mémoire présenté et défendu en
vue de l'obtention du grade d'Ingénieur Agronome.
Orientation :
Phytotechnie
Directeur : Dr. Ir. Patrick MOBAMBO Kitume
Ngongo
Professeur
Ordinaire
Encadreur : Ir. Jean
Christian BANGATA Bitha nyi Mbunzu
Assistant
Année Académique 2013 - 2014
TABLE
DES MATIERES
TABLE DES
MATIERES................................................................................
i
TABLE DES
MATIERES.............................................................................................................ii
EPIGRAPHE..............................................................................................
iii
DEDICACE...............................................................................................iv
REMERCIEMENTS.....................................................................................
v
LISTE DES
ACRONYMES............................................................................vi
LISTE DES TABLEAUX ET
FIGURE..........................................................vii
RESUME
viii
INTRODUCTION
1
CHAPITRE I : REVUE DE LA LITTERATURE
SUR L'ANANAS
3
1.1. CLASSIFICATION ET ORIGINE
3
1.2. EXIGENCES CLIMATIQUES
3
1.2.1. Température
3
1.2.2. Eau
3
1.2.3. Lumière
3
1.2.4. Sol
3
1.3. LE CYCLE
4
1.4. LA PLANTATION, RECOLTE ET
RENDEMENTS
4
1.5. DESCRIPTION BOTANIQUE DE LA PLANTE
4
1.5.1. Racines
4
1.5.2. Tige
4
1.5.3. Feuilles
5
1.5.4. Fruit
5
1.5.5. Rejets
5
1.6. TECHNIQUE DE MULTIPLICATION DU
MATERIEL VEGETAL
6
1.6.1. LA MULTIPLICATION PAR FRAGMENTATION
DES TIGES
7
Chapitre II : MILIEU, MATERIEL ET
METHODES
9
2.1. PRESENTATION DU MILIEU
9
2.1.1. Site expérimental.
9
2.1.2. Période expérimentale.
9
2.2. MATERIEL
9
2.3. METHODES
10
2.3.2. Opérations culturales.
10
2.3.2.1. Préparation de boutures et mise en
châssis
10
2.3.2.2. Paramètres observés.
11
3.4. ANALYSE STATISTIQUE
12
Chapitre III : RESULTATS ET DISCUSSION
13
3.1. PRESENTATION DES RESULTATS
13
3.1.1. Résultats relatifs au premier
essai
13
3.1.2. Résultats relatifs au deuxième
essai
14
3.2. DISCUSSION
16
CONCLUSION ET SUGGESTION
18
REFERENCES BIBLIOGRAPHIQUES
19
EPIGRAPHE
« L'imagination est plus importante que le
savoir. La connaissance s'acquiert par l'expérience, tout le reste n'est
que de l'information. »
Albert Einstein
DEDICACE
A mes parents, pour avoir placé mes études
parmi leur préoccupation majeure et surtout pour leur soutien moral et
financier;
A mes frères et soeurs.
Patrick MUKENDI
KALALA
REMERCIEMENTS
De prime abord, notre gratitude suprême va à
notre Seigneur Dieu, Jésus-Christ, sans qui nous ne serions jamais
arrivés au terme de nos études universitaires et encore moins
être en vie. A lui seul la gloire, lui qui a rendu possible la
réalisation de ce travail et renouvelle notre souffle de vie.
Nous tenons à remercier tout particulièrement
les personnes, sans lesquelles nous n'aurions pu mener à bien ce
travail. Nous citons le Professeur Dr. Ir. Patrick MOBAMBO Kitume Ngongo, qui
malgré ses lourdes occupations d'enseignant et de chercheur a bien voulu
accepter la direction de ce travail.
Nous voudrions ensuite bien témoigner toute notre
reconnaissance à son assistant Jean Christian BANGATA Bitha nyi Mbunzu
pour son encadrement scientifique et sa permanente disponibilité
à nos multiples sollicitations.
Nous adressons également nos vifs remerciements aux
Professeurs, Chefs de travaux et Assistants de la Faculté des Sciences
Agronomiques en général, particulièrement ceux du
Département de Phytotechnie, qui ont bien voulu nous encadrer et nous
faire partager leurs expériences au cours de notre séjour
à l'Université de Kinshasa.
Nous témoignons toute notre sympathie et notre
gratitude à MASENGU Mukendi pour l'intérêt, l'aide et
l'encouragement qu'il nous a accordés durant notre parcours
universitaire.
Nous remercions tous les amis de la Faculté,
particulièrement ceux du Département de Phytotechnie, pour les
encouragements mutuels et pour la conscience partagée.
Nous adressons enfin, nos sincères remerciements
à tous ceux qui, de loin ou de près, nous ont assistés
dont les noms ne sont pas repris, trouvent ici l'expression de nos
remerciements les plus sincères.
Patrick MUKENDI KALALA
LISTE DES ACRONYMES
ANOVA : Analyse de la variance ;
CV : Coefficient de Variation ;
INERA : Institut National pour l'Etude et
la Recherche Agronomiques ;
PIF : Plants issus de
fragments de tige ;
PPDS (LSD) : Plus Petit Différence
Significative ;
pH : Potentiel d'Hydrogène ;
RDC : République Démocratique
du Congo ;
LISTE DES TABLEAUX ET FIGURE
Tableau 1 : Les résultats relatifs aux
paramètres végétatifs obtenus au cours du premier
essai.........................................................................................................13
Tableau 2 : Les résultats relatifs aux
paramètres végétatifs obtenus au cours du deuxième
essai.........................................................................................................15
Figure 1 : Les différents rejets
de l'ananas...........................................................6
Figure 2 : Dispositif
expérimental.....................................................................10
RESUME
L'ananas est l'une des plus importantes espèces
fruitières tropicales de culture intensive. Mais, en République
Démocratique du Congo (RDC), la production est de plus en plus faible
à cause de manque de matériel de plantation et de techniques
appropriées pour sa multiplication.
L'ananas dispose donc de plusieurs types d'organes qui peuvent
être utilisés pour la multiplication. Cependant, il est
considéré comme une plante dont la multiplication naturelle est
particulièrement lente car la multiplication de l'ananas est
obligatoirement végétative du fait que l'espèce est
autostérile. Se référant au cas du cultivar Cayenne
Lisse, PY (1979) montre qu'à la récolte
du fruit, seule la couronne est disponible comme matériel pouvant
être utilisé pour la replantation. De plus, selon la destination
du fruit, même la couronne peut être indisponible.
Quant aux cayeux, happas et bulbille, leur formation ne
débutant souvent qu'après la phase reproductive de la plante, on
n'arrive à récolter en moyenne qu'un seul rejet par pied
planté trois à sept mois après la récolte du fruit,
ce qui est très lent pour un cycle de culture de douze à vingt
mois. C'est ainsi l'approvisionnement en rejets est souvent un facteur limitant
pour l'extension et l'établissement de nouvelles plantations.
C'est la raison pour laquelle une étude a
été conduite au site du Mont-Amba en vue de déterminer le
taux de multiplication de plants formés par les explants de l'ananas en
fonction de leur origine et d'identifier le type de rejet approprié pour
la prolifération des jeunes plants d'ananas.
Suivant le dispositif complètement randomisé
avec 4 répétitions et 4 traitements, les résultats obtenus
ont montré que les E4 (explants issus de cayeu souterrain) ont
influencé de façon significative tous les paramètres de
prolifération par rapport aux autres traitements. Le résultat le
plus élevé obtenu avec le traitement E4 peut se justifier par sa
richesse en bourgeons dormants sur ses fragments par rapport aux autres.
Au regard des résultats obtenus, il apparaît de
manière claire que les explants issus de cayeu souterrain peuvent
être utilisés comme meilleurs explants pour la production des
plantules d'ananas par la méthode de macropropagation.
INTRODUCTION
1. Problématique
L'ananas (Ananas comosus) est connu principalement
pour son fruit comestible et également cultivé pour sa richesse
en Broméline, qui est une enzyme. Cet enzyme
possède de nombreux usages industriels allant de l'attendrissement des
viandes au tannage des cuirs, en passant par la stabilisation des peintures au
latex. En outre, à partir des feuilles de certaines
variétés sélectionnées à cette fin, on tire
des fibres permettant de fabriquer du codage, des filets, ainsi que des papiers
et textiles fins. Il est cultivé dans presque la totalité des
régions tropicales du monde (Leal et Ceppens, 1996).
Cette culture en Afrique, en général, et en
République Démocratique du Congo (RDC) en particulier, se
caractérise essentiellement par sa faible productivité. Celle-ci
est la résultante des nombreuses contraintes parmi lesquelles,
l'insuffisance et la difficulté d'acquisition de matériel de
plantation. Cette contrainte est considérée comme la plus
importante du fait qu'elle peut freiner l'expansion et l'amélioration de
l'ananas. Car, la propagation de l'ananas se fait par rejetonnage et
présente des inconvénients notamment : la lenteur (le nombre
de rejet par plante étant limité),
l'hétérogénéité du matériel de
propagation et enfin le matériel de propagation est lourd et volumineux,
son transport est par conséquent coûteux (Kwa, 2003).
Ainsi, la culture intensive de l'ananas est parfois
confrontée à des difficultés d'ordre pratique : il
faudra au moins 40 000 à 60 000 plants pour un hectare. Il est
remarqué que le problème est encore plus aigu dans le cas
où on cherche à diffuser un nouveau cultivar (Fournier, 2011).
Cependant, ces rejets auront de différents
comportements en champ selon l'endroit (le niveau) où ils ont
été prélevés sur la plante mère. Selon que
l'on choisit l'un ou l'autre type de rejet lors de la plantation, on obtient
les résultats différents dans : la durée de la culture, la
façon de croître de la plante et la qualité du fruit
produit. Par conséquent, il faudra planter un seul type de rejets dans
tout le champ pour avoir une récolte des fruits uniformes et moyennement
homogènes dans tout son champ (Charrier et al., 1997).
2. Hypothèse
La technique de multiplication rapide des plants (macro
propagation) par fragment des tiges permettrait d'obtenir plusieurs plants
(rejets) à la fois sains, moyennement homogènes (clones) et
conserverait entièrement les caractéristiques de la plante
mère (meilleur rendement). Ainsi, cette technique appliquée
à l'ananas constitue une voie nouvelle de production en masse de plants
du fait qu'elle est rapide, adaptable et demande peu d'investissements.
3. Objectifs
L'objectif global poursuivi par cette étude, est la
détermination du taux de prolifération de plants à partir
de différents fragments de rejets de l'ananas en fonction de leur
endroit (le niveau) où ils ont été prélevés
sur la plante mère.
Pour atteindre cet objectif global, les objectifs
spécifiques suivants sont poursuivis :
- identifier le type de rejet approprié pour la
prolifération des jeunes plants d'ananas;
- Fournir les éléments et les pratiques
facilement accessibles à tous.
4. Intérêt du
travail
La durée de production des rejets présente
l'inconvénient d'être longue; trois à sept mois
après la récolte des fruits. Ce travail peut, en effet,
être nécessaire pour obtenir du matériel de plantation dans
un laps de temps. D'autre part, de nombreux bourgeons formés sur pied
mère demeurent inexploités. C'est ainsi que la technique de
macropropagation par plants issus de fragments de tige(PIF) permet d'activer
les bourgeons latents pour régénérer des quantités
importantes de plants sains dans des délais relativement courts et
ajustables aux périodes de plantation.
Dans le cas particulier du système PIF appliqué
à l'ananas, il n'existe pas à notre connaissance de
données relatives à la ville de Kinshasa. Ainsi, cette
étude permettrait de disposer aux paysans exploitants une bonne
technique culturale qui augmenterait leur rendement et leur revenu.
5. Subdivision du
travail
Hormis l'introduction et la conclusion, ce travail est
constitué de trois chapitres. Le premier chapitre parle de la revue de
la littérature sur l'ananas. Le deuxième décrit le
milieu, le matériel et les méthodes utilisées et enfin, le
troisième chapitre présente les résultats et leur
discussion.
CHAPITRE I : REVUE DE
LA LITTERATURE SUR L'ANANAS
1.1. CLASSIFICATION ET
ORIGINE
Ananas comosus appartient à la famille des
Broméliacées. Si la plupart des bromélides sont des
plantes épiphytes, l'ananas est une plante herbacée vivace. Elle
est originaire d'Amérique du Sud : le Bassin amazonien, la Guyane et
l'Argentine. Il est produit à grande échelle par les
États-Unis (Hawaï), la côte d'Ivoire et le Costa Rica
(Kobenan et al., 2005). L'espèce Ananas comosus
comprend de nombreux cultivars. Parmi ces cultivars nous avons: Cayenne,
Spanish, Victoria, Pernambuco et Perolera. Les cultivars du groupe Cayenne sont
les plus cultivés au monde (Malard, 2007).
1.2. EXIGENCES CLIMATIQUES
1.2.1.
Température
La température est le principal facteur qui
détermine l'aire de répartition de l'ananas et influence la
ramification des rejets lors de la multiplication. Etant assez sensible aux
variations de la température, même dans la région
intertropicale, l'ananas est principalement cultivé en zones de basse
altitude.
Selon Diary (2003), des températures inférieures
à 20 °C ou supérieures à 45 °C sont
considérées comme défavorables au développement de
l'ananas et les températures inférieures à 30 °C ou
supérieures à 48 °C sont défavorables à la
prolifération des rejets lors de multiplication dans un dispositif, mais
la température optimum est de 35 à 45 °C.
1.2.2. Eau
L'ananas est peu exigeant en eau, il lui faut environ 2
à 4 mm/jour qui correspond à des précipitations de l'ordre
de 1200 à 1500 mm bien réparties tout au long de l'année.
L'excès d'eau lors de la multiplication des rejets dans un dispositif
entraine la pourriture de ce dernier.
1.2.3. Lumière
La lumière a une action très marquée sur
le rendement de l'ananas (Balandier, 1992). En effet une diminution de 20 % de
l'éclairement diminue le rendement de 10 %. La lumière a une
action directe sur la coloration des fruits.
1.2.4. Sol
À cause de son système radiculaire superficiel
et fragile l'ananas s'adapte bien sur le sol meuble, bien aérés
et perméables. Par ailleurs l'ananas demande des sols riches en azote,
en potassium, en magnésium, en calcium et en phosphore. L'ananas, en
particulier, la Cayenne lisse, préfère le sol à pH acide
de 4,5 à 5,5. Sol à pH supérieur à 7 peut avoir des
carences au fer et en manganèse (Bouffin, 1992).
1.3. LE CYCLE
La durée du cycle est fortement dépendante du
type de rejets utilisés à la plantation et de leur poids. Le
poids des rejets sélectionnés pour la plantation doit être
homogène pour être au même stade de développement au
moment de l'induction florale (qu'elle soit naturelle ou artificielle) et
produire des fruits de calibre homogène.
L'ananas nécessite douze à vingt mois de la
plantation à la récolte : six à huit mois pour la phase
végétative, et cinq à six mois pour la phase reproductive.
La durée du cycle varie selon les variétés (Malard,
2007).
1.4. LA PLANTATION, RECOLTE
ET RENDEMENTS
La densité de plantation, c'est-à-dire le nombre
de pieds installés à l'hectare, varie avec les écartements
adoptés, généralement l'écartement utilisé
est de 50 cm x 50 cm, qui donne 40000 pieds par hectare (Abousalim, 2003).
L'expérience a montré qu'il n'était pas souhaitable de
planter du matériel trop petit (moins de 150 g), de même que les
gros rejets (plus de 400 g).
Selon Kobenan et al. (2005), la période de
récolte est fixée en fonction de l'utilisation de fruit. Pour
l'exportation, on récolte lorsque les fruits commencent à jaunir
à la base. Les rendements moyens sont de l'ordre de 30 à 40
T/ha.
1.5. DESCRIPTION BOTANIQUE
DE LA PLANTE
L'espèce Ananas comosus est une
plante
herbacée terrestre pouvant atteindre 1 m à
1,50 m.
1.5.1. Racines
Le système radiculaire de l'ananas adulte est
très superficiel et fragile. Il s'étend surtout dans les 15
premiers centimètres du sol. On trouve quelques racines à 30 cm
de profondeur et exceptionnellement à 60 cm. Cela dépend surtout
de la nature du substrat. On distingue 3 sortes de racines: Les racines
primaires, les racines adventives et les racines secondaires (Anonyme,
2014).
1.5.2. Tige
La tige forme l'axe de la plante, elle est visible
extérieurement seulement lorsque les feuilles et les racines sont
enlevées (Duval et al., 1995). La tige de la plante adulte
reste très courte, mesurant 20 à 25 cm de longueur, d'un
diamètre de 2 à 3,5 cm à sa base et de 5,5 à 6,5 cm
dans la partie la plus large juste au-dessous du méristème
terminal. Elle comporte un grand nombre d'entre-noeuds très courts.
Cette tige est souvent appelée souche.
1.5.3. Feuilles
Les feuilles sont émises par le méristème
terminal, la plante adulte comporte environ70 à 80 feuilles.
Elles sont disposées autour de la tige en spirale
d'orientation droite ou gauche. En raison de leur nombre et de la petite
dimension de la tige, elles forment une rosette (caractéristique des
Broméliacées) dense de configuration spatiale
érigée, dans laquelle les jeunes feuilles sont situées au
centre (Lebeau et Ceppens, 2008).
Les feuilles ont une coloration qui varie selon le cultivar du
jaune pâle au rose mauve. Selon les cultivars les bords du limbe peuvent
être entièrement épineux ou lisses.
1.5.4. Fruit
L'ananas est une plante donnant un fruit unique. Les
pièces florales se développent pour former un fruit
parthénocarpique.
En effet, sur la face externe du fruit on trouve un grand
nombre "d'yeux " correspondant aux extrémités de la
bractée et des sépales. Au sommet du fruit se développent
une couronne.
Selon Ratinarivo (2010), les ananas sont des fruits
non-climatériques, une fois cueillis, ils ne mûriront plus, la
couleur n'est pas toujours un indicateur suffisant pour choisir le fruit, son
odeur fruitée, son poids et la fraîcheur de ses feuilles sont de
meilleurs indices.
1.5.5. Rejets
La formation des feuilles est accompagnée de la
constitution de plages de cellules qui restent méristématiques
à leur aisselle. Ces lots de cellules méristématiques
forment ultérieurement les bourgeons axillaires dans le plan
médian des feuilles axillantes, visibles extérieurement sur la
tige lorsque les feuilles sont prélevées. C'est le rapport
cytokinines et auxine qui semble régler le développement des
bourgeons axillaires. Ces bourgeons axillaires sont à l'origine de trois
types de rejets: cayeux, happas et bulbilles.
Le rejet porte un nom différent en fonction de sa
situation sur la charpente du plant-mère, le niveau où sont
formés les différents rejets sur la plante-mère est un
critère à considérer pour les techniques de culture et la
qualité des fruits.
Selon Malard (2007), On distingue au total quatre types de
rejets (Figure 1): cayeux souterraine et aérien, happas, bulbilles et
couronnes. Ces productions sont au centre de nos préoccupations car
elles ont une grande importance agronomique.
- La couronne : qui se trouve au sommet du
fruit dans un état dormant une fois plantée, reprend son
développement, mais sur le fragment de couronne le nombre de bourgeon
est faible.
- Le cayeu: Les cayeux sont des pousses
issues des bourgeons axillaires de la tige ; le nombre de bourgeons est
plus élevé par rapport à la couronne et les autres rejets.
Ils peuvent être formés sur la partie souterraine de la tige et
sont appelés cayeux souterrains; lorsqu'ils sont issus de la partie
aérienne on les dénomme simplement cayeux.
- La bulbille : qui prend naissance à
la base du fruit. Elle se développe à partir d'un bourgeon
axillaire du pédoncule. Après la récolte du fruit, son
développement s'arrête et elle tombe sur le sol.
- Le Happa : qui est un rejet
intermédiaire entre le cayeu et la bulbille. Il se développe
à partir de bourgeon axillaire, située à la jonction de la
tige et du pédoncule du fruit.
Les différents types de rejets présentent des
différences morphologiques et physiologiques qui leur confèrent
des qualités variables comme matériel de plantation.
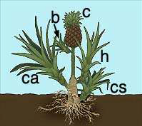
Figure 1: Les
différents rejets de l'ananas (Source: Malard, 200
7).
Légende : C : La couronne,
Ca : Le cayeu, Cs : cayeu
souterrain, B : bulbille, h : Le
happa.
1.6. TECHNIQUE DE
MULTIPLICATION DU MATERIEL VEGETAL
L'ananas dispose donc de plusieurs types d'ensembles
organiques qui peuvent être utilisés pour la multiplication. La
plantation de l'ananas se fait uniquement par rejets, c'est une multiplication
végétative au même titre que le bouturage. Il est donc
primordial de sélectionner ses rejets sur des plants sains et vigoureux
(Malard, 2007).
Selon Modeste (2007), Il existe donc plusieurs techniques
permettant d'accélérer la multiplication végétative
de l'ananas. Ces techniques varient dans leur niveau de sophistication et les
taux de prolifération des rejets. Dans leur ensemble par ces
méthodes on cherche surtout à accélérer le
démarrage des bourgeons axillaires (les âmes emprisonnés)
par suppression des effets d'inhibition exercés par le
méristème apical. On distingue: la multiplication par extraction
des bourgeons, la technique de culture in vitro, technique de
l'éclaircissage des rejets ou le rabattage des souches, la
multiplication par fragmentation des tiges.
Quoique le taux de multiplication par explant "in vitro" soit
impressionnant et incomparablement plus élevé par rapport aux
autres techniques, les auteurs reconnaissent l'extrême lenteur de la
phase d'acclimatation. A la Réunion, l'acclimatation de vitro plants de
1-2 g du cultivar Queen a duré 10 mois pour obtenir des plantules de
120-130 g (Folio, 1990). Il existe aussi un effet vitro-plant, les premiers
plants issus de culture in vitro peuvent avoir des comportements aberrants (ex
: qualité de fruit médiocre). Il faut parfois attendre plusieurs
cycles avant que ces caractéristiques de la variété ne se
stabilisent (Govindin, 2012).
Les deux premières méthodes ne pouvant
être pratiquées qu'en laboratoire par des spécialistes, et
avec un matériel adéquat. D'autre part, des techniques telles que
l'éclaircissage des rejets ou le rabattage des souches ne garantissent
pas la qualité sanitaire des plants et ne débouchent que sur de
faibles rendements tout en nécessitant des besoins en main-d'oeuvre
élevés.
1.6.1. LA MULTIPLICATION
PAR FRAGMENTATION DES TIGES
Cette technique permet de conserver entièrement les
caractéristiques de la plante mère. Il faut utiliser des tiges
qui ont déjà produit des fruits.
v Etapes de la technique de multiplication par
fragmentation des tiges
A. Déterrage, parage et fragmentation des
souches
Après la récolte de fruits, on déterre
les souches (tiges) fraîches. A l'aide d'un couteau de cuisine, on fait
le parage de la souche qui consiste à enlever les écailles de la
base du rejet, en fin de dénuder les racines. C'est une opération
capitale pour la bonne reprise des plants. Sans parage les racines ne peuvent
pas traverser les feuilles desséchées et durcies qui ne
pourriront pas (Govindin, 2012).
Après le parage on obtient une tige cylindrique et on
fait le décorticage au niveau de la tige, puis ces tiges sont
découpées en petits secteurs (fragments de 3 à 4 cm)
chacun portant au moins deux à quatre bourgeons axillaires, ces secteurs
sont sectionnée en deux.
B. Désinfestation de fragment et la mise en bac
de prolifération des explants
Désinfecter les fragments obtenus en les trempant
entièrement dans une solution de fongicide plus insecticide. Les
fragments ainsi traités doivent être disposés debout
pendant 12 heures pour une bonne répartition du produit.
Faire un dispositif ou bac de prolifération de 1 m de
haut avec un substrat riche, sur laquelle on creuse des sillons
parallèles distants de 5 cm, à l'intérieur desquels les
fragments sont mis en place.
On dispose les fragments bout à bout et à plat
dans les sillons, à des intervalles de 15 cm et on veillera à ce
que la face sectionnée soit orientée vers le substrat, ce qui
facilitera l'évolution des racines des explants. Recouvrir d'une fine
couche de substrat et arroser une fois tous les 3 jours, au bout de trois
semaines chaque fragment aura bourgeonné sur la face supérieure
et 1 mois plus tard, vos jeunes plantules auront atteints 5 à 10 cm de
haut (Modeste, 2007).
C. Sevrage des plants
La croissance des plantules qui se développent à
partir des bourgeons sur chaque secteur est généralement rapide.
Le sevrage de jeunes plantules intervient généralement
après un mois de la mise en bac. Le nombre de sevrages peut aller
jusqu'à trois sevrages et le temps entre les sevrages est de12 à
15 jours, car après le deuxième sevrage, la durée de
reprise devient très lente, même le nombre des explants
formés et leur poids chute très rapide. Dans la majorité
de cas un fragment de 3 à 4 cm donne 4 à 10 plantules et les
jeunes plants ne pèsent que 10 à 20 g (Bidima, 2007).
Chapitre II : MILIEU,
MATERIEL ET METHODES
2.1. PRESENTATION DU MILIEU
2.1.1. Site
expérimental.
Cette étude a été menée sur le
plateau du Mont-Amba au jardin expérimental du Département de
Phytotechnie de la Faculté des Sciences Agronomiques de
l'Université de Kinshasa.
L'expérience proprement dite a été
réalisée dans un propagateur construit en briques, de 4 m de long
sur 1,20 m de large, divisé en deux bacs égaux de 2 m de longueur
et 40 cm hauteur, couverte par une feuille de plastique transparente. Ceci
pour maintenir : la température élevée,
l'humidité constante, mais l'humidité peu baisse jusqu'à
40% à l'intérieur des bacs.
Le propagateur remplit les conditions pour un bon
développement des plants et pour avoir un bon nombre de plants en un
temps record. Il conditionne d'abord, progressivement, le plant avec les
conditions du milieu ambiant. Il permet ensuite de favoriser l'enracinement
pour favoriser l'autonomie des rejets. Il permet enfin la protection des rejets
contre les attaques des insectes ravageurs.
Le fond du bac était isolé du sol. On
évite de créer l'excès d'humidité lors de
l'arrosage qui favorise la pourriture des explants. La température dans
le propagateur doit être favorable à la prolifération des
âmes emprisonnées.
2.1.2. Période
expérimentale.
L'expérimentation a été
réalisée au cours de la période allant du 08 juin au 09
septembre 2014 pour le premier essai et du 05 octobre 2014 au 18 janvier 2015
pour le deuxième essai. L'expérimentation a été
répétée au cours du temps pour voir si le facteur
climatique notamment la température pourrait influencer les
résultats.
2.2. MATERIEL
Le matériel végétal ayant fait l'objet de
notre étude était constitué d'un cultivar d'ananas
(Ananas comosus) : Cayenne lisse. Ce matériel est provenu
de l'INERA-Mvuazi dans la province du Bas-Congo. Le choix a été
porté sur ce cultivar à cause de son appréciation par les
paysans cultivateurs de la contrée, par les commerçants acheteurs
et pour ses qualités organoleptiques intéressantes, ainsi
que pour son fruit de très gros calibre (plus de 2 kg).
2.3. METHODES
2.3.1. Dispositif expérimental
L'essai a été conduit suivant un dispositif
complètement randomisé avec 4 répétitions et 4
traitements, ayant pour variable aléatoire le type de matériel
(rejet). Les Quatre traitements sont répétés 2 fois dans
chaque bac de propagation. Nous avons au total 16 parcelles, pour les deux bacs
comme l'indique la figure ci-dessous.
0,20 m
0,50 m
1,20 m
0,60 m
2 m
4 m
E4
E1
E2
E3
E1
E2
E3
E4
E4
E1
E2
E3
E1
E2
E3
E4
(1erbac)
(2èmebac)
Fig 2 : Dispositif
expérimental
Légende :
- E1 : Explants issus de la
Couronne
- E2 : Explants issus de cayeu
aérien
- E3 : Explants issus de happa
- E4 : Explants issus de cayeu
souterrain
La superficie totale de l'essai était de 4,8
m2 soit 4 m de longueur et 1,20 m de largeur. Les
répétitions étaient séparées par des
séparateurs en bois mesurant 3 cm d'épaisseur et 30 cm de
largeur. La parcelle avait une superficie de 0,30 m2, soit 0,6 m de
long et 0,5 m de large et chacune d'elle comportait au total 30 explants, ce
qui donne au total 480 explants pour l'ensemble de l'essai. L'ensemencement
était fait aux écartements de 10 cm x 10 cm. L'essai
était répété, une fois, dans le temps. Il est
important de signaler que 10 échantillons sur 30 explants dans la
parcelle nous ont servi pour la récolte des données.
2.3.2. Opérations
culturales.
2.3.2.1. Préparation
des rejets et mise en châssis
Les rejets étaient soumis aux opérations
suivantes :
Ø Parage : à l'aide d'un
couteau de cuisine, on débarrasse les rejets cayeux et happas, de
toutes les racines desséchées, mais pour la couronne on ne fait
que le décorticage. Le parage permet aux racines de se développer
avant l'arrivée des symphiles (Begard,2010). Après le parage on
obtient une tige cylindrique.
Ø Décorticage et fragmentation de
tige: Le décorticage consiste à enlever les feuilles
l'une après l'autre. Les tiges sont coupées dans le sens de la
longueur, de manière à obtenir plusieurs fragments (on les a
aussi découpées en fragments de 3 à 4 cm).
Ø Désinfestation des fragments :
Nous avons trempé entièrement les fragments dans une
solution avec un fongicide (microthion 40g) et insecticide
(cyperméthrine 40 cc) dans 10 litres d'eau. Les fragments ainsi
traités sont disposés debout pendant 12 heures pour une bonne
répartition du produit.
Ø Mise en bac: elle constitue la
dernière étape. En effet, on recommande de fermer
hermétiquement le bac avec le papier plastique. Ceci pour créer
un micro climat spécifique. Les explants étaient
ensemencés dans un bac de propagation comportant la sciure de bois comme
substrat d'enracinement. Pour la mise en bac, la face sectionnée
était orientée vers le substrat et celle comprenant les
âmes emprisonnés vers le haut, ce qui facilite l'évolution
des racines et des explants. On prenait alors soin de recouvrir les explants
avec le substrat utilisé d'une épaisseur de 2 à 5 cm
au-dessus de la surface des explants. Avant la mise en bac, le bac de
propagation a été préalablement arrosé suffisamment
pendant au moins trois heures.
La fréquence d'arrosage a été en fonction
de gouttelettes d'eau trouvées sur le papier plastique
c'est-à-dire, lorsque nous remarquons que les gouttelettes diminuent sur
le papier plastique et surtout lorsque nous remarquons que les substrats ne
renferment plus d'humidité. Cette fréquence a été
de trois fois par semaine avant la reprise de
bourgeon axillaire, mais cette fréquence devient quatre
fois par semaine pendant la croissance des plantules.
La quantité d'eau apportée par fréquence
était 4 arrosoirs de 15 litres soit 60 litres par bac
c'est-à-dire chaque bac recevait 120 litres d'eau par semaine.
Ø Sevrage des plants : Au bout de
29 jours après la mise en bac, nous avons procédé au
premier sevrage des plantules qui ont atteint plus de 2 cm de hauteur et
présente plus de quatre feuilles vertes, l'opération consiste
à détacher les plants du fragment ensemencé à
l'aide d'un couteau très fin. Après sevrage, les plants sont
repiqués dans des sachets polyéthylène d'une contenance
d'environ 1Kg de terreau stérilisé, pour assurer le
développement des jeunes plants d'ananas.
2.3.2.2. Paramètres
observés.
Pour évaluer la prolifération des plants, les
observations ont été portées sur :
- La durée de reprise : Il
correspond au nombre de jours qui s'écoule de la mise en bac des
explants à la sortie de la tigelle.
- Le Nombre de Plantules Sevrées (NPS)
après 1 mois d'incubation : ceci a
été obtenu par un comptage manuel direct du nombre des explants
sevrés.
- Le poids des plantules sevrés : ceci
a été mesuré à l'aide d'une balance de
précision.
- La moyenne de nombre des plantules obtenues par
explant: ceci a été déterminé par la
sommation du nombre des rejets sevrés durant les trois sevrages, selon
les explants étiquetés à l'épuisement.
- Le diamètre au collet des plants (cm) lors du
sevrage : a été mesuré à l'aide d'un
pied à coulisse lors du sevrage.
- La hauteur des plants (cm) lors du
sevrage : elle a été mesurée à l'aide
du mètre ruban.
- Le nombre des feuilles formées lors du
sevrage : a été obtenu par un comptage manuel
direct du nombre des feuilles formées.
- Le nombre total des rejets obtenus par
traitement : a été déterminée par la
sommation du nombre des rejets obtenus par traitement.
- Le nombre des racines formées :
a été obtenu par un comptage manuel direct du nombre des racines
formées.
3.4. ANALYSE
STATISTIQUE
Pour chaque variable étudiée, les données
collectées ont été analysées selon la
méthode de l'analyse de variance ANOVA au seuil de probabilité de
5%. Lorsque des différences sont observées, l'analyse a
été complétée par le test de la plus petite
différence significative (PPDS ou LSD). Tous ces tests ont
été effectués à l'aide du logiciel Statistix
version 8.0.
Chapitre III : RESULTATS ET
DISCUSSION
3.1. PRESENTATION DES
RESULTATS
Les
résultats obtenus au cours de deux essais sont consignés dans les
tableaux ci-dessous
3.1.1. Résultats
relatifs au premier essai
Les résultats relatifs aux paramètres
végétatifs obtenus au cours du premier essai sont
présentés dans le tableau 1.
Tableau 1. Essai comparatif du taux de
prolifération des plantules issues de différents rejets sur les
paramètres végétatifs d'Ananas.
|
Traitements
|
Durée de reprise
(jour)
|
NPS
après 1 mois d'incubation
|
Diamètre au collet
(cm)
|
Hauteur des explants (cm)
|
Nbre de feuilles formées
|
Nbre de racines formées
|
Poids de plantules (gr)
|
MPOE
|
|
E1
|
17a
|
3,4b
|
1,1e
|
7,4g
|
12,2j
|
6,2k
|
9,95n
|
4,6p
|
|
E2
|
19a
|
4,3c
|
0,8f
|
4,1h
|
10,1j
|
4,8lm
|
7,85no
|
9,5q
|
|
E3
|
21a
|
3,5b
|
0,9f
|
5,4i
|
8,2j
|
3,8l
|
5,95o
|
6,7p
|
|
E4
|
19a
|
5,2d
|
0,8f
|
5,2i
|
10,3j
|
5,8km
|
8,65n
|
12,4r
|
|
Moyenne
|
19
|
4,1
|
0,9
|
5,5
|
10
|
5,15
|
8,1
|
8,3
|
|
CV
|
6,51
|
14,8
|
18
|
9,21
|
20,7
|
20,7
|
21
|
13,15
|
Les chiffres dans les colonnes suivis de mêmes
lettres ne sont pas significativement différents selon le test de la
Plus Petite Différence Significative (PPDS) à 5% de
probabilité.
Légende :
E1 : Explants issus de la Couronne;
E2 : Explants issus de cayeu aérien;
E3 : Explants issus de happa; E4 :
Explants issus de cayeu souterrain; NPS = Nombre des plantules
sevrées et MPOE = Moyenne des plantules obtenues par
explant.
Le résultat relatif à la durée de reprise
de quatre traitements indique que tous les traitements utilisés sont de
bonne qualité car leur durée de reprise est inférieure
à 3 semaines. En outre, l'analyse statistique au seuil de
probabilité 5% ne révèle aucune différence
significative entre les traitements (LSD = 2,94). Numériquement, la
durée de reprise la plus courte a été enregistrée
chez les explants issus de la Couronne (E1) (17 jours), suivi de E2 et E4 (19
jours). Le E3 a présenté une durée supérieure aux
autres traitements mis en compétition (21 jours).
Concernant le nombre des plantules sevrées après
un mois d'incubation, il ressort du tableau ci-dessus que la moyenne de
nombre de plantules sevrées par fragment, la plus élevée a
été observée chez les explants issus de cayeu souterrain
(E4) (5,2 plantules formées) et la plus faible a été
constatée chez les explants issus de la couronne (E1) (3,4 plantules
formées). L'analyse statistique au seuil de probabilité 5%
révèle de différences significatives entre les traitements
(LSD = 0,79).
Quant au diamètre au collet, il ressort du tableau 1
que le diamètre au collet le plus élevé a
été observé chez les E1 (1,1 cm), suivi des E3 (0,9 cm).
Le diamètre au collet le plus faible a été constaté
chez les E2 (0,8 cm) et E4 (0,8 cm). L'analyse statistique au seuil de
probabilité 5% a relevé qu'il ya des différences
significatives entre les différents traitements (LSD= 0,18). Il existe
une relation étroite entre le diamètre au collet et le nombre
des plantules formées, plus il y a des plantules formées, moins
sera leur diamètre au collet.
Pour ce qui est de la hauteur, les plantules issues des
explants de la couronne(E1) ont présenté une hauteur
supérieure par rapport aux autres (7,4), cela peut
être dû à leur temps de reprise le plus rapide et la hauteur
la plus faible a été constatée chez les cayeux
aériens (E2 : 4,1 cm). En outre, l'analyse statistique au seuil de
probabilité 5% révèle qu'il ya des différences
significatives entre les différents traitements (LSD = 0,82)
Par rapport au nombre de feuilles, il ressort du tableau
ci-dessus qu'il n'existe aucune différence significative entre les
quatre traitements (LSD = 6,81). Numériquement, les E1 ont le nombre des
feuilles le plus élevé que les autres.
Quant au nombre des racines formées, l'analyse
statistique au seuil de probabilité 5% révèle qu'il y a
des différences significatives entre les quatre traitements (LSD= 1,1).
Le nombre des racines le plus élevé a été
constatée chez la couronne (6,2) cela peut être dû toujours
à leur temps de reprise la plus rapide et le nombre des racines la plus
faible été constatée chez happa (3,8) cela peut être
dû à leur temps de reprise plus long.
Il ressort du tableau 1 que le poids des plantules
sevrées variait entre 5,95 à 9,95 grammes. Les données
numériques ont montré une nette différence entre les
traitements dont les plantules issues des E1 ont donné le poids
supérieur par rapport aux autres traitements (9,95 gr) et suivi des
plantules issues E4 (8,65 gr). L'analyse statistique a montré des
différences significatives entre les traitements (LSD = 2,25).
La moyenne des plantules obtenues par explant est de 8,3
plantules par explant et l'analyse statistique des données au seuil de
5% de probabilité indique des différences significatives entre
les traitements (LSD = 2,75). La moyenne des plantules obtenues chez cayeux
souterrains est de loin supérieure aux autres traitements (12,4
plantules) et la plus faible a été observée chez la
couronne (4,6 plantules).
3.1.2. Résultats
relatifs au deuxième essai
Le deuxième essai a consisté à
répéter l'expérimentation dans le même bac afin de
comparer ses résultats à ceux obtenus au premier essai. Les
résultats obtenus au cours du deuxième essai sont
consignés dans le tableau 2.
Tableau 2. Essai comparatif du taux de
prolifération des plantules issues de différents rejets sur les
paramètres végétatifs d'Ananas.
|
Traitements
|
Durée de reprise
(jour)
|
NPS
après 1 mois d'incubation
|
Diamètre au collet
(cm)
|
Hauteur des explants (cm)
|
Nbre de feuilles formées
|
Nbre de racines formées
|
Poids de plantules (gr)
|
MPOE
|
|
E1
|
13,5a
|
4,4c
|
0,9e
|
7,4g
|
10,9j
|
5,3m
|
11,96o
|
9,45r
|
|
E2
|
14,4ab
|
5,2cd
|
0,7f
|
4,8h
|
6,2k
|
4,1n
|
8,54p
|
16,40st
|
|
E3
|
15,6b
|
4,8c
|
0,8ef
|
6,2gi
|
8,4l
|
3,6n
|
10,69oq
|
14,50s
|
|
E4
|
14,5ab
|
6,1d
|
0,7f
|
5,6hi
|
7,5l
|
5,9m
|
9,24pq
|
19,75t
|
|
Moyenne
|
14,5
|
5,13
|
0,8
|
5,88
|
8,25
|
4,75
|
10,11
|
15,03
|
|
CV
|
9,36
|
12,9
|
11,15
|
8,14
|
10,25
|
12,45
|
10,7
|
11,01
|
Les chiffres dans les colonnes suivis de mêmes
lettres ne sont pas significativement différents selon le test de la
Plus Petite Différence Significative (PPDS) à 5% de
probabilité.
Légende :
E1 : Explants issus de la Couronne;
E2 : Explants issus de cayeu aérien;
E3 : Explants issus de happa; E4 :
Explants issus de cayeu souterrain; NPS = Nombre des plantules
sevrées et MPOE = Moyenne des plantules obtenues par
explant.
Il ressort du tableau 2 que la moyenne de durée de
l'essai est de 14,5 jours entre les différents traitements et la
durée la plus longue est obtenue avec les E3 (15,6 jours) et la
durée la plus courte est obtenue avec les E1 (13,5 jours), L'analyse
statistique des données au seuil de 5% de probabilité indique des
différences significatives entre les traitements (LSD= 1,22).
Par rapport au nombre des plantules sevrées
après un mois d'incubation, le tableau ci-dessus révèle
que la moyenne de nombre de plantules sevrées par fragment, la plus
élevée a été observée chez les cayeux
souterrains (6,1 plantules) et la plus faible a été
constatée chez les explants de la couronne comme dans le premier essai
(4,4 plantules) (LSD= 1,1).
Pour ce qui est de diamètre au collet, les plantules
issues de la couronne, ont toujours montré un diamètre au collet
supérieur que ceux des autres (LSD = 0,17)
Quant à la hauteur, les plantules issues de la couronne
ont présenté une hauteur supérieure que les
autres, cela peut être dû à leur avantage
par rapport à leur durée de reprise précoce. En outre,
l'analyse statistique des données au seuil de 5% de probabilité
indique des différences significatives entre les traitements (LSD =
1,31).
Concernant le nombre de feuilles, il ressort du tableau 2
ci-dessus qu'il existe des différences significatives entre les deux
traitements (LSD = 1,27). Les explants de la couronne ont donné le
nombre de feuilles le plus élevé que les autres.
Par rapport au nombre des racines formées, les
résultats de deuxième essai révèle qu'il existe des
différences significatives entre les quatre traitements (LSD = 1,1).
Numériquement le nombre des racines le plus élevé a
été constaté chez les E1(5,9) cela peut être
dû toujours à leur temps de reprise le plus rapide et le nombre
des racines le plus faible été constaté chez happa (3,6)
cela peut être dû à leur temps de reprise plus long.
Pour ce qui est du poids de plantules sevrées, les
explants de la couronne ont toujours montré un poids supérieur
que les autres. Il existe une relation étroite entre le nombre de
feuilles et le poids des plantules formées, plus il y a des feuilles sur
les plantules formées, plus le poids des plantules est plus
élevé. En plus, l'analyse statistique des données au seuil
de 5% de probabilité indique des différences significatives entre
les traitements (LSD = 1,7).
Par rapport au nombre total des plantules obtenues par
traitement, le résultat issu du tableau 2 indique des différences
significatives entre les traitements (LSD=2,54) et que le nombre des plantules
le plus élevé a été enregistré chez les
explants de cayeux souterrains, cela est dû peut être au plus grand
nombre des bourgeons chez les cayeux.
3.2. DISCUSSION
Parmi les 4 traitements utilisés au cours de l'essai,
les résultats obtenus ont montré que les E4 (explants issus de
cayeux souterrains) ont donné les résultats les plus
élevés au niveau du 1er et du 2ème
essai par rapport aux autres, suivis par les explants issus de cayeux
aériens et puis par explants issus de happa.
Les meilleurs résultats obtenus avec E4 (explants issus
de cayeux souterrains) en ce qui concerne les paramètres
étudiés se justifient par une conséquence directe ou
indirecte d'un facteur interne qu'est la richesse en bourgeons sur ses
fragments.
Le taux de prolifération le plus faible a
été enregistré chez les explants de la couronne pendant
les 2 essais. Ce taux de prolifération le plus faible est dû
à la pauvreté de ces explants en âmes emprisonnés et
à la basse température enregistrée pendant la saison
sèche.
Mais que ce soit chez les explants de la couronne, happa et
les deux cayeux, le nombre des plantules a varié de façon
croissante du premier sevrage au deuxième sevrage, et vers le
troisième sevrage ce nombre a commencé à chuter. Nous
considérons que cet effet serait dû au fait que les bourgeons
tendent vers la fin de leur capacité maximum de rejetonnage.
Nous constatons ensuite une nette différence dans la
majorité des paramètres observés entre le premier essai et
le deuxième essai, ce dernier montre un résultat plus positif que
le premier. Nous osons croire que cette différence pourrait être
dite aux facteurs climatiques notamment la température et
l'humidité accentuées au cours de la période de
deuxième essai.
Le premier essai était réalisé pendant
la saison sèche, où la température dans le propagateur
tournait autour de 27 à 30°C. Le taux d'humidité
était plus élevé ce qui a favorisé la pourriture
de certains fragments.
Le deuxième essai était mis en place pendant la
saison de pluie, où la température dans le propagateur variait
entre de 36 et 42 °C. L'humidité était plus faible, cela n'a
pas permis d'enregistrer le cas de pourriture des fragments.
Par rapport aux résultats obtenus par Bidima,2007. Les
résultats issus de notre essai (12,4 et 19,7 plantules issus de cayeux
souterrains) sont de loin supérieurs à ceux qu'il avait
trouvés en utilisant des cayeux souterrains avec une moyenne des
plantules obtenues par explant de 10 plantules.
CONCLUSION ET SUGGESTION
Notre travail avait pour objectifs de déterminer le
taux de multiplication de plants formés par les explants de l'ananas en
fonction de leur origine et d'identifier le type de rejet approprié pour
la prolifération des jeunes plants d'ananas.
Les résultats obtenus ont montré que les E4
(explants issus de cayeux souterrains) ont influencé de façon
significative tous les paramètres de prolifération par rapport
aux autres traitements. Le résultat le plus élevé obtenu
avec le traitement E4(12,4 et 19,75 plantules) peut se justifier par sa
richesse en bourgeons dormants sur ses fragments par rapport aux autres.
Au regard des résultats obtenus, il apparaît de
manière claire que les explants issus des cayeux souterrains peuvent
être utilisés comme meilleurs explants pour la production des
plantules d'Ananas par la méthode de PIF.
Ainsi, nous suggérons que les études
ultérieures soient poursuivies dans le but de déterminer la
quantité maximale des plantules que peut produire un fragment en
fonction de dimension et déterminer ainsi le meilleur substrat à
utiliser pour donner un rendement supérieur que celui obtenu.
REFERENCES
BIBLIOGRAPHIQUES
Abousalim, A. 2003. Transfert de technologie en agriculture
et développement des cultures fruitières tropicales au Maroc,
Département d'horticulture, (éd): IAV Hasan, p.15.
Anonyme, 2014. CTHT: Rapport annuel, les filières
Ananas, copyright.
Balandier, P. 1992. Etude dynamique de la croissance et du
développement des bourgeons de quelques cultivars de pèches
cultivés à diverses altitudes sous le climat tropical de l'ile de
la Réunion. Thèse de doctorat, Université Blaise Pascal,
70p.
Bégard, J. 2010.Elements téchnique sur la
culture d'ananas, 5p.
Bidima, M. 2007. Culture de l'ananas : multiplication et
conditionnements rejets, 2p.
Bouffin, J. 1992. Programmes fruitiers tropicaux, l'ananas,
(éd): Cirad, 35p.
Charrier, A., Michel, J., Hamon, S., Dominique, N. 1997.
L'amélioration des plantes tropicales; cultures de l'ananas:
multiplication et conditionnement, 23-26pp.
Collin, J. 1960. The pineapple: botany utilization,
cultivation, (éd): Londre, Royaume-uni Léonard Hill, 294p.
Diary, 2003. Cultures fruitières, fiche technique de
bases destinées aux techniciens agricoles, 4p.
Duval, M., Coppens, G., Ferreira, R., Cabral, J., Bianchetti,
L. 1995. Bilan de collectes conjointes de germophasme d'ananas au Brésil
et en Guyana française, 3p.
Foliot, M. 1990. Croissance des plants d'ananas issus de
culture in vitro, pendant la phase d'acclimatation, (éd) : Cirad
Montpellier, 9p.
Fourrier, P., Dorian, F. 2011. La culture de l'ananas à
la réunion pour l'exportation; Recueil de bonne pratiques,
(éd) : Cirad, 11p.
Govindin, J., Damien, L., Laura, D. 2012. Réseau
d'innovation et de transfert agricole dans le domaine végétal en
Guyane, 42p.
Heenkenda, 1993. Mechanical decapitation technique for rapid
multiplication of pineapple, 27p.
Kobenan, K., Assienan, A., Bernard, T., Yaon'drin, J.,
Gnonhouri, T., Goli, P., Kouassi Koffi, S. 2005. Bien cultiver l'ananas en
côte d'ivoire, Ed : Centre national de recherche Agronomique, 2p.
Kwa,M. 2003. Activation de bourgeons latents et utilisation de
fragments de tige pour la propagation en masse de plants en condition
horticoles in vivo, 56p.
Leal, F., Ceppens d'Eeeckenbrugge, G. 1996. Pineapple in fruit
breeding tree and tropical fruits, Ed Moore JN, New-york, Etat-Unis,Willey,
515p.
Lebeau, F., Imele, J.P., Teisson, Cl., Delhoe, G. 2008.
Efficacité de la technique d'induction florale d'Ananas comosus
(L). Merr. au moyen de charbon actif enrichi à
l'éthylène, (éd): Cirad, 20p.
Malard, D. 2007. Information technique sur la culture de
l'ananas, 2p.
PIP, 2014. Guide de bonnes pratiques phytosanitaires pour
l'ananas (Ananas comosus) issu de la production biologique en pays ACP
(Afrique Caraibes et Pacifique),42p.
PY, C.1979 Production accélérée de
matériel végétal de plantation. Fruits, 34p
Ratinarivo, M. 2010. Contribution à l'étude de
valorisation des fruits d'ananas, 5p.
| 


