|

Université Cheikh Anta Diop de Dakar (UCAD)
Faculté des Sciences et Techniques (FST)
Année 2012 Thèse d'Etat n°
151
Etude de la flore vasculaire, de la
végétation et des
macrophytes aquatiques proliférants
dans le Delta du fleuve
Sénégal et le Lac de Guiers
(Sénégal)
Thèse
présentée et soutenue publiquement le 24 novembre
2012 pour obtenir le grade de
Doctorat d'Etat ès Sciences
Naturelles
Par
M. Abou THIAM
Membres du jury
Président : M. Amadou Tidiane BA
Professeur titulaire, UCAD, Dakar
Rapporteurs :M. Kandioura NOBA Professeur
titulaire, UCAD, Dakar
M. Bienvenu SAMBOU Maître de
conférences, UCAD, Dakar
M. Daniel THOEN Professeur, Université de
Liège
Examinateurs: M. Koffi AKPAGANA Professeur
titulaire, Université de Lomé
Mr. Leonard AKPO Professeur titulaire, UCAD,
Dakar
Je dédie ce mémoire..
A mes grand-parents feus Absatou Thiam et El Hadj Tidiane
Touré..
pour m'avoir guidé dans la vie et montrer le
chemin
A ma mère Fanta Touré et A mon père feu
El Hadj Mamadou Thiam.
pour l'affection et l'amour
A mon épouse Fanta Sow et nos enfants Rokiatou, Djibril
et Aissata.
pour le soutien et le devouement...
i
Résumé
La mise en service des grands barrages, à la fin des
années 80, a entrainé des changements sur l'hydrologie, la
qualité des eaux dans le delta du fleuve Sénégal et le lac
de Guiers. Les nouvelles conditions ont provoqué des modifications dans
la flore et la végétation, et entrainé la
prolifération de macrophytes aquatiques comme Typha
domingensis, Potamogeton schweinfurthii, Pistia stratiotes
et Salvinia molesta. Cette nouvelle situation a eu des effets
négatifs aux plans écologique, socio-économique et
sanitaire. Le présent travail a été entrepris pour
réunir des informations qui aideraient à une meilleure
connaissance de la flore, de la végétation, de la biologie et de
l'écologie des principaux macrophytes. Ces données sont
nécessaires pour une gestion durable des macrophytes aquatiques et de
l'environnement du delta fleuve Sénégal et du lac de Guiers.
L'inventaire systématique de la flore vasculaire a
permis de recenser 151 espèces, réparties en 102 genres et 47
familles. Les monocotylédones représentent 41,7% et les
dicotylédones 56,2%. Les familles les plus représentées
sont les Poaceae, les Cyperaceae, les Fabaceae et
les Amaranthaceae. La diversité spécifique est plus
élevée dans les zones basses inondables, en raison de la forte
artificialisation et de l'hétérogénéité de
ces milieux, comparée à celles du lac de Guiers et du fleuve. La
flore est constituée environ pour moitié (55%) de
thérophytes, de phanérophytes et de chaméphytes qui
représentent la composante terrestre, et pour moitié (44,5%), de
macrophytes aquatiques parmi lesquels les hélophytes
(hélogéophytes et hélothérophytes) (27 %) sont plus
nombreux que les hydrophytes sensu stricto constitués par les
hydrogéophytes, les hydrophytes nageants, les hydrothérophytes et
hydro-hémicryptophytes (17,5 %) à des proportions variables selon
le lac, le fleuve et les zones basses inondables. Les hydrophytes sensu
stricto, bien que relativement moins importantes, constituent les
éléments floristiques remarquables avec des familles souvent
monogénériques et monospécifiques, caractéristiques
des milieux aquatiques comme les Alismataceae, Hydrocharitaceaee, Lemnaceae,
Najadaceae, Potamogetonaceaechez les monocotylédones ; Avicenniaceae,
Ceratophyllaceae, Lentibulariaceae, Menyanthaceae, Nympheaceae et
Rhyzophoraceae chez les dicotylédones. Une présentation
détaillée de 48 espèces communes des milieux humides
suivant 4 grands types a été faite : les macrophytes fixés
émergents, les macrophytes fixés flottants, les macrophytes
submergés et les macrophytes libres flottants. Cette présentation
permet de disposer d'un outil d'identification et des informations sur les
synonymies, les caractères botaniques, la distribution et
l'écologie de ces taxons. Les espèces à large
répartition géographique, pantropicales, paléotropicales
et cosmopolites représentent les 3/5 des espèces,
comparées aux taxons strictement africaines ou
guinéennes-soudano-zambéziennes et asiatiques (38%). Ces
espèces relativement homogènes sont caractéristiques et
bien adaptées au milieu aquatique qui amortit les variations
écologiques majeures comme le climat.
L'analyse de la végétation, par des transects,
montre qu'il existe une zonation de la végétation qui
dépend de la salinité, de la déclivité, de la
hauteur et de la durée de la submersion : la typhaie sur la rive, les
potamots en eau plus profonde et entre les deux, la nymphaie en avant
de la typhaie avec Phragmites autralis, à la faveur de la
direction des vents dominants, des vagues ou de particularités
mésologiques locales, des plantes flottantes comme Pistia et
Salvinia ou des plantes fixées comme Cyperus articulatus
et C. alopecuroides.
L'analyse des groupements végétaux, par la
technique du relevé phytosociologique, a permis d'identifier 9
groupements végétaux, qui se répartissent en
végétations des milieux salés et des milieux d'eau douce
et, de préciser leur composition floristique. La
végétation des milieux salés comprend les groupements
à Tamarix senegalensis et à Arthrochnemum
macrostachyum. Celle des milieux d'eau douce comporte, du large vers les
parties hautes des rives, les groupements à Azolla pinnata,
Potamogeton octandrus, Cyperus alopecuroides, C. articulatus,
Bolboschoenus maritimus, Phragmites australis, et T.
domingensis.
L'étude de quelques aspects de la biologie et de
l'écologie des macrophytiques proliférants indique que la
reproduction est essentiellement végétative chez P.
stratiotes, et P. schweinfurthii alors que chez T.
domingensis, elle est à la fois végétative et
sexuée. Ces modes donnent à T. domingensis un pouvoir de
colonisation très important. S molesta, une plante invasive
hybride présente uniquement une multiplication
végétative.
Au total, ce travail a permis de faire un état des
lieux de la flore, de la végétation et des macrophytes des rives
du fleuve, du lac de Guiers et de divers milieux humides dans le delta. Ce
référentiel est important pour le suivi scientifique de la
biodiversité et la dynamique des peuplements de la zone. Les
données sur la biologie et l'écologie des principales
espèces pourraient aider à la valorisation, à la
conception et à la mise en oeuvre de méthodes de contrôle
appropriées des macrophytes et de gestion durable des milieux humides et
aquatiques du delta du fleuve Sénégal et le lac de Guiers.
Mots-clés : flore vasculaire,
végétation, macrophytes proliférants, fleuve
Sénégal, Lac de Guiers
ii
Summary
The implementation of large dams in the late 80s, has led
changes in hydrology, water quality in the delta of the Senegal River and Lake
of Guiers. The new conditions caused changes in the flora and vegetation, and
led the proliferation of aquatic macrophytes such as Typha
domingensis, Potamogeton schweinfurthii, Pistia stratiotes
and Salvinia molesta.This new situation has had some negative
impact on ecology, people, socio-economic and health. The present work was
undertaken to gather information that can contribute to a better knowledge of
the flora, vegetation, biology and ecology of major macrophytes. These data are
essential elements for sustainable management of aquatic macrophytes and
environmental of the Senegal River delta and Lake of Guiers.
Systematic inventory of vascular flora has identified 151
species distributed in 102 genus and 47 families. Monocots represent 41.7% and
dicots 56.2%. The most represented families are Poaceae, Cyperaceae, Fabaceae
and Amaranthaceae. Species diversity is highest in low-lying areas liable to
flooding, due to strong artificial and heterogeneity of these environments,
compared to those of Lake of Guiers and the river. This flora consists
approximately half (55%) of therophytes, phanerophytes and chamaephytes
representing the land component, and half (44.5%) aquatic macrophytes including
helophytes (helogeophytes and helotherophytes) (27%) are more important than
hydrophytes sensu stricto formed by hydrogeophytes, submerged free
hydrophytes, hydrotherophytes hydrohemicryptophytes (17.5%) in varying
proportions depending on the lake, river and flood low-lying areas.These
hydrophytes sensu stricto, although relatively less important, is
nevertheless remarkable floristic elements with families and often
monogeneriques, monospecific characteristics of aquatic environments such as
Alismataceae, Hydrocharitaceaee, Lemnaceae, Najadaceae, Potamogetonaceae in
monocotyledons, Avicenniaceae, Ceratophyllaceae, Lentibulariaceae,
Menyanthaceae, Nymphaceae and Rhyzophoraceae in dicots.
A typology of 48 common species of wetland was established
following four main types: fixed emerging macrophytes, floating macrophytes
fixed, submerged macrophytes and free floating macrophytes. The presentation of
each species could be a tool for identification and information on synonyms,
botanical characters, distribution and ecology of the taxa. Species with wide
geographical distribution, pantropical, paleotropical and cosmopolitan
represent 3/5 of species, compared to strictly african taxa or
Sudano-Guinean-Zambezian and Asian (38%). These species are relatively
homogeneous characteristics and are well adapted to the aquatic environment
which absorbs major ecological changes such as climate.
The study of vegetation, with the transect method, shows that
there is a zonation of vegetation depending on salinity, slope of water level
and duration of flooding: the typhaie on shore, in deeper water pondweed and
between the two, in front of the nymphaea, Typha, direction of prevailing
winds, waves or local mesological conditions, floating plants like Pistia
and Salvinia or fixed plants as Phragmites autralis,
Cyperus articulatus and C. alopecuroides.
The analysis of plant communities, by phytosociological
technique has identified 9 plant groups, which are divided into vegetation of
salty environment and fresh water, their floristic composition were specify and
physionomy. The vegetation of saline environments includes Tamarix
senegalensis and Arthrochnemum macrostachyum. That of freshwater
has from deeper water towards upper parts of the banks, Azolla
pinnata, Potamogeton octandrus, Cyperus alopecuroides,
C. articulatus, Bolboschoenus maritimus, Phragmites
australis, and T. domingensis.
The study of some aspects of the biology and ecology of
proliferating macrophyte indicates that reproduction is primarily vegetative in
P. stratiotes, and P. schweinfurthii whereas in T.
domingensis, it is both vegetative and sexual. These modes give T.
domingensis much power for colonization. S molesta has only
vegetative multiplication.
In total, this work assess the actual situation of the
vascular flora, vegetation and macrophytes in the Senegal river, various
wetlands in the Delta and the lake of Guiers. This reference is essential for a
scientific monitoring of biodiversity and vegetation dynamics. Data on the
biology and ecology of key species could help the recovery, design and
implementation of appropriate control methods of aquatic macrophytes and
sustainable management of Senegal river delta and Lake of Guiers.
Key words: vascular flora, vegetation, macrophyte
proliferation, Senegal river, lake of Guiers.

Sommaire
Résumé i
Summary..........................................................................................................
ii
Sommaire.................................................................................
iii
Listedes
figures....................................................................................
vi
Listedes
tableaux..........................................................................................
viii
Remerciements ix
Introduction .. 1
Chapitre 1 Présentation du milieu physique
..5
1.1 Situation géographique
.........................................................................5
1.2
Climat................................................................................................9
1.2.1 Température 10
1.2.2 Humidité atmosphérique .. 10
1.2.3 Pluies 11
1.3 Géologie et
géomorphologie...................................................................12
1.4
Pédologie............................................................................................13
1.5
Hydrogéologie....................................................................................
15
1.6 Hydrographie et hydrologie 16
1.7 Incidence des barrages sur l'hydrologie et la
qualité des eaux 20
1.7.1 Brève historique des aménagements sur le
fleuve Sénégal 20
1.7.2 Barrage de Diama 21
1.7.3 Barrage de Manantali . 22
1.7.4 Endiguements 23
1.7.5 Effets des aménagements sur l'hydrologie et la
qualité des eaux
dans le Delta . .. 23
1.7.6 Effets des aménagements
sur l'hydrologie et la qualité des eaux
du lac de Guiers 25
1.8
Conclusion....................................................................................
27
Chapitre 2 Flore vasculaire des milieux humides
.29
2.1 Introduction .29
2.2 Matériels et méthodes 30
2.3 Résultats et discussion .33
2.3.1 Composition spécifique ..33
2.3.2 Spectre biologique .. 46
2.3.3 Spectre chorologique . 47
iv
2.3.4 Typologie et présentation de quelques espèces
communes 49
2.3.4.1 Macrophytes fixés émergents ..53
2.3.4.2 Macrophytes fixés à feuilles flottantes
86
2.3.4.3 Macrophytes submergés .93
2.3.4.4 Macrophytes libres flottant à la surface ..100
2.4
Conclusion........................................................................................107
Chapitre 3 Végétation et groupements
végétaux des milieux humides ..108
3.1 Introduction .. 108
3.2 Matériels et méthodes 109
3.3 Résultats et discussion 113
3.3.1 Zonation de la végétation 113
3.3.2 Groupements végétaux 121
A- Milieux humides salés 121
1. Groupement à Tamarix senegalensis 121
2. Groupement à Arthrocnemum macrostachyum
123
B- Milieux d'eau douce 124
1. Groupement à Bolboschoenus maritimus 124
2. Groupement à Cyperus alopecuroides 125
3. Groupement à Cyperus articulatus 125
4. Groupement à Phragmites australis 126
5. Groupement à Typha
domingensis.................. 127
6. Groupement à Azolla pinnata et
Ludwigia
stolonifera 129
7. Groupement à Potamogeton octandrus 130
3.4 Conclusion 134
Chapitre 4 Macrophytes aquatiques proliférants
135
4.1 Introduction 135
4.2 Multiplication et phytomasse de Typha domingensis
Pers.
dans le lac de
Guiers..............................................................................
136
4.2.1 Matériels et méthodes .139
4.2.1.1 Dispositif expérimental 139
4.2.1.2 Multiplication et croissance 139
4.2.1.3 Phytomasse 140
4.2.2 Résultats et discussion 142
4.2.2.1 Caractéristiques pédologiques du
substrat
dans les bacs de culture 142
4.2.2.2 Multiplication et croissance .142
4.2.2.3 Phytomasse 150

4.3 Multiplication et phytomasse de Pistia stratiotes
L. dans le lac de Guiers 153
4.3.1 Matériels et méthodes 157
4.3.1.1 Multiplication ..157
4.3.1.2 Phytomasse .159
4.3.2 Résultats et discussion .. 159
4.3.2.1 Multiplication ..159
4.3.2.2 Phytomasse .168
4.4 Morphologie, distribution et phytomasse de
Potamogeton schweinfurthii
A. Bennett. dans le lac de Guiers
171
4.4.1 Matériels et
méthodes.......................................... 173
4.4.1.1 Morphologie et distribution 173
4.4.2.2 Phytomasse 173
4.4.2 Résultats et discussion 173
4.4.2.1 Morphologie et distribution .173
4.4.2.2 Phytomasse 181
4.5 Invasion du Delta par Salvinia molesta
D.S. Mitchell .183
4.5.1 Matériels et
méthodes.............................................................
186
4.5.2 Résultats et discussion 186
4.5.2.1 Abondance des macrophytes 186
4.5.2.2 Systématique et distribution ..190
4.5.2.3 Ecologie et multiplication ..191
4.6
Conclusion.................................................................................
193
Chapitre 5 Discussion générale
196
5.1 Sur les problèmes du milieu 196
5.2 Sur la flore
vasculaire.....................................................................
198
5.3 Sur la végétation et les groupements
végétaux 200
5.4 Sur la prolifération des macrophytes aquatiques
202
Conclusions et perspectives . 210
Références bibliographiques 215
Annexe 234
vi
Liste des figures Page
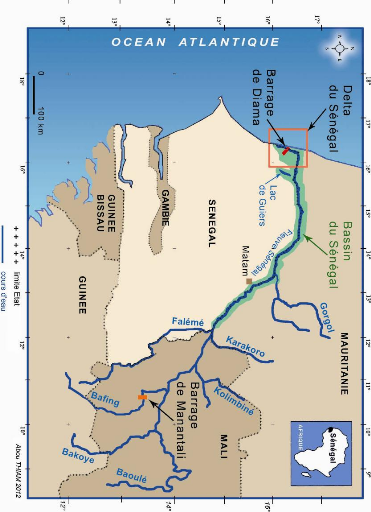
Figure 1 - Carte du Delta et du bassin du fleuve
Sénégal en Afrique de l'Ouest 6
Figure 2 - Carte du Delta du fleuve Sénégal et le
lac de Guiers . 8
Figure 3 - Diagramme ombrothermique de Saint Louis
(période: 1980-2000) . 9
Figure 4 - Température moyenne annuelle sous abri à
Saint Louis (1980-2000) 10
Figure 5 - Humidité relatives moyenne annuelle à
Saint Louis (1980-2000) 10
Figure 6 - Pluviométrie moyenne mensuelleà Saint
Louis (1981-1990 et 1991- 2000).... 11
Figure 7 - Pluviométrie annuelle et tendance de la
pluviosité à Saint Louis
(1980 et 2000) 11
Figure 8 - Carte géomorphologique du Delta du fleuve
Sénégal 14
Figure 9 - Carte du réseau hydrographique du Delta du
fleuve Sénégal 18 Figure 10 - Carte des zones humides,
inondables et cours d'eau permanents 19
Figure 11- Schéma de fonctionnement hydrologique du lac
de Guiers . 26
Figure 12 -Grands groupes systématiques de macrophytes
recensés
dans les 3 zones étudiées .. 43
Figure 13 -Nombre d'espèces recensées par type
biologique 46
Figure 14 - Type chorologique des macrophytes recensés
..48
Figure 15 - Carte de localisation des sites des transects
112
Figure 16 - Transect A, à Guembeul, août 1996 et
février 1997 113 Figure 17 - Transect B, à Savoigne (Lampsar),
août 1996 et février 1997 114 Figure 18 - Transect C, amont
barrage de Diama, août 1996 et février 1997 115
Figure 19 - Transect D, Parc du Djoudj, fleuve
Sénégal en février 1997 116
Figure 20 - Transect E, à Débi, rive gauche du
fleuve Sénégal en février 1997 . 116
Figure 21 - Transect F, à Ouassoul, rive gauche du
fleuve Sénégal, février 1997 . 117
Figure 22 -
Transect G, canal de la Taoué, février 1997 117
Figure 23 - Rideau dense de T. domingensis dans le
lac de Guiers, Ngnith, mai 1996 138
Figure 24 - Peuplement de T. domingensis,
fleuve Sénégal, mars 2002 . 138
Figure 25 - Schéma du dispositif pour l'étude de
T. domingensis 139
Figure 26 - Vue d'un bac pour le suivi de la croissance de
T. domingensis . 141
Figure 27 - T. domingensis. (a) Plante
entière; (b) Inflorescence; (c) Fruit, un akène 144
Figure 28 - Evolution de la hauteur maximale de T.
domingensis dans les bacs A et C 147
Figure 29 - Evolution moyenne du nombre de feuilles par
individu de Typha 148
Figure 30 - Evolution moyenne de la longeur maximale des
feuilles de Typha . 148
Figure 31 - Evolution de la largeur moyenne des feuilles de
Typha 149
Figure 32 - Evolution du diamètre à la
base de Typha 149
Figure 33 - Phytomasse hypogée de T.domingensis
est également très importante 152
Figure 34 - Envahissement de la région sud du lac par
P. stratiotes (mai 1992) 155
Figure 35 - Radeau flottant de P. stratiotes avec
Oxycarym cubense, Lac de Guiers,1992 155
Figure 36 - Zone de pullulation de P.
stratiotes, lac de Guiers, 1992-1994 157
Figure 37 - Schéma des bassins flottants pour
l'étude sur Pistia, 1994 . 157
Figure 38 - Vue du dispositif au démarrage de
l'étude sur Pistia, 1994 . 158
Figure 39 - Vue du dispositif, 60 jours après le
début des observations, 1994 158
Figure 40 - Evolution du nombre d'individus de Pistia
dans les bassins (juin-décembre 1994).... 160
Figure.41 - Evolution du pH de l'eau du lac de Guiers (juin-
octobre 1994) . 162
Figure 42 - Evolution de la conductivité (en mS) de
l'eau du lac de Guiers (juin-octobre 1994) 163
Figure 43 - Evolution des chlorures (Cl -) dans l'eau du lac
de Guiers (juin-octobre 1994) 163
Figure 44 - Evolution du sodium (Na +) dans l'eau du lac de
Guiers (juin- octobre 1994) 164
Figure 45 - Evolution des sulfates (SO4 -- ) dans l'eau du lac
de Guiers (juin-octobre 1994) 164
Figure 46 - Evolution des Carbonates (HCO3 -- ) le lac de
Guiers (juin-octobre 1994) 165
Figure 47 - Evolution du Calcium (Ca++ ) dans l'eau
du lac de Guiers (juin-octobre 1994) 165
Figure 48 - Evolution du Potassium (K +) dans l'eau du lac de
Guiers (juin-octobre 1994) 166
Figure 49 - Evolution du Magnésium (Mg ++) dans l'eau
du lac de Guiers (juin-octobre 1994)......... 166
Figure 50 - Evolution du nombre de feuilles de Pistia
dans les bassins (juin-décembre 1994) 168
vii
Figure 51 - Peuplements de P. schweinfurthii, Nord du
lac de Guiers, septembre 1993 172
Figure 52 - Vue de près de Potamogeton
schweinfurthii 172
Figure 53 - Largeur en fonction de la longueur des feuilles
(droite de régression) 174
Figure 54 - Nombre de fruits en fonction de la longueur des
épis (droite de régression) 174
Figure 55- P. schweinfurthii A. Bennett
(1) Plante entière; (2)
Graine (x 12) 176
Figure 56 - Principaux peuplements de P.
schweinfurthii, lac de Guiers, janvier 1993.... 180
Figure 57 - Matières sèches et eau dans
différents organes de P. schweinfurthii... 182
Figure 58 - Envahissement du barrage de Diama par S.
molesta, Novembre 1999 185
Figure 59 - Masse dense de S. molesta, barrage de
Diama, Novembre 1999 .185
Figure 60 - Enlèvement manuel de S. molesta,
Fleuve Sénégal, Novembre 2000 209
Figure 61 - Grille empêchant l'entrée de S.
molesta dans le Djoudj, Novembre 2000 209

Liste des tableaux Page
Tableau 1- Espèces recensées fleuve, lac de Guiers
et zones basses inondables 33
Tableau 2- Structure systématique de la flore 41
Tableau 3- Répartition des espèces en fonction des
familles . 41
Tableau 4- Types biologiques des espèces recensées
dans les zones étudiées 47
Tableau 5- Chorologie des espèces recensées 49
Tableau 6- Synopsis des familles des hydrophytes stricto
sensu 51
Tableau 7- Macrophytesaquatiques d'autres familles non
strictement aquatiques 52
Tableau 8- Structure systématique des types de macrophytes
106
Tableau 9- Situation et coordonnées géographiques
des transects 109
Tableau 10- Synthèse des résultats d'analyse du sol
dans les sites d'étude 119
Tableau 11- Occurrence des principaux macrophytes sur les
transects 120
Tableau 12- Groupement à Tamarix senegalensis
122
Tableau 13- Groupement à Arthrocnemum
macrostachyum.............................. 123
Tableau 14- Groupement à Bolboschoenus maritimus
124
Tableau 15- Groupement à Cyperus alopecuroides
.125
Tableau 16- Groupement à Cyperus
articulatus............................................. 126
Tableau 17- Groupement à Phragmites
australis....................................... 127
Tableau 18- Groupement à Typha domingensis 128
Tableau 19- Groupement à Azolla pinnata et
Ludwigia stolonifera . 130
Tableau 20- Groupement à Potamogeton octandrus
.131
Tableau 21- Quelques caractéristiques des groupements
végétaux des milieux humides salés et
très faiblement salés/doux .133
Tableau
22-Hauteurs minimales, moyennes et maximales de Typha dans les bacs
de culture 146
Tableau 23- Phytomasse de T. domingensis en conditions
expérimentale et naturelle 151
Tableau 24- Physico-chimie de l'eau dans quelques sites du parc
du Djoudj, mars 1993. ...... ...... 167
Tableau 25- Phytomasse de Pistia stratiotes dans le lac
de Guiers 169
Tableau 26- Biométrie de quelques organes de
Potamogeton schweinfurthii............ 173
Tableau 27- Eau et matières sèches dans quelques
organes de P. schweinfurthii.............................. 181
Tableau 28- Abondance des macrophytes dans le fleuve
Sénégal, Novembre 1999 187
Tableau 29- Physico-chimie de l'eau dans quelques sites envahis
par S. molesta 189
ix
Remerciements
Les résultats présentés dans ce travail
ont été en grande partie obtenus dans le cadre de plusieurs
projets de recherche réalisés au sein de l'Institut des Sciences
de l'Environnement (ISE) de l'Université C.A.Diop de Dakar en relation
avec la Fondation Universitaire Luxembourgeoise d'Arlon (Belgique) entre 1993
et 1998. Ces projets de recherche ont bénéficié du soutien
financier du ministère de l'Environnement de la Région Wallonne
de Belgique. Le professeur Michel Radoux de la Fondation Universitaire
Luxembourgeoise qui a assuré la coordination scientifique et
administrative de ces projets m'a apporté un concours précieux
dans l'exécution des différents programmes qui m'étaient
confiés. Je le remercie de tout coeur ainsi que la Région
Wallonne de Belgique.
Je voudrais remercier très sincèrement le
Professeur Amadou Tidiane Ba, ancien directeur de l'Institut des Sciences de
l'Environnement, pour avoir bien voulu m'aider à mener à son
terme ce travail. Il a facilité mes déplacements sur le terrain
et prodigué conseils. Il me fait l'honneur de présider le jury de
cette thèse.
La finalisation et la présentation de cette
thèse doivent beaucoup au Professeur Kandioura Noba, du
département de Biologie Végétale de la Faculté des
Sciences et Techniques de l'Université C.A. Diop de Dakar. Ses remarques
avisées et ses suggestions ont contribué à
améliorer grandement ce travail. J'ai contracté avec lui une
lourde dette de reconnaissance. Qu'il trouve ici l'expression de ma
sincère gratitude pour avoir aussi accepté de participer au jury
de cette thèse. Le Professeur Bienvenu Sambou, Directeur de l'Institut
des Sciences de l'Environnement, s'est beaucoup investi et aidé à
finaliser et présenter cette thèse. Il a accepté
également de juger ce travail. Je le remercie de tout coeur pour sa
très grande disponibilité et son soutien.
Je suis redevable au Professeur Daniel Thoen de
l'Université de Liège qui malgré son agenda très
chargé a aimablement accepté de lire et me faire des observations
sur plusieurs chapitres. Il a aussi accepté de juger ce travail. Je le
remercie du fond du coeur.
Le Professeur Koffi Akpagana de l'Université de
Lomé et le Professeur Léonard Akpo de l'Université C.A.
Diop de Dakar ont accepté de faire partie du jury de cette thèse.
Je les remercie très sincèrement pour leur
disponibilité.
François Matty, agro-pédologue, enseignant
à l'ISE m'a fait l'amitié de m'aider avec compétence et
dévouement dans l'interprétation des résultats d'analyses
pédologiques. Qu'il trouve ici l'expression de mes remerciements.

Je remercie également le Professeur François
Xavier Cogels de l'Université de Liège (Belgique) qui lorsqu'il
était chercheur à l'IRD (ex ORSTOM), m'a offert
l'opportunité de continuer les observations sur les macrophytes du lac
de Guiers après la mise en service des barrages sur le fleuve. Il m'a
encouragé à poursuivre les études sur la
végétation aquatique du Delta. Les résultats
présentés dans cette thèse lui doivent beaucoup.
Je me souviens avec beaucoup d'émotion de feu le
Professeur Emérite Constant Vanden Berghen qui m'a ouvert la riche
bibliothèque et l'herbier du jardin botanique national de Belgique
à Meise et mis à ma disposition avant publication, le volume de
la Flore du Sénégal consacré aux Poaceae qu'il
avait fini de rédiger. Le professeur Vanden Berghen m'a également
permis de rencontrer en Belgique d'éminents spécialistes de la
flore et de la limnologie africaines. Il s'agit notamment du Professeur
Emérite Jean Léonard de l'Université Catholique de
Louvain, du Professeur Émérite Jean Jacques Symoens du Vrije
Universiteit Brussels avec lesquels j'ai pu discuter de plusieurs aspects de la
flore et de la végétation de l'Afrique et obtenus de nombreuses
références bibliographiques. Tous m'ont fait
bénéficier de leurs grandes connaissances de la flore africaine.
Qu'ils trouvent ici mes sincères remerciements.
Le Professeur Aké Assi de l'Université d'Abidjan
(Côte d'Ivoire), m'a aidé à identifier certaines Cyperaceae
et Potamogetonaceae. Je le remercie de sa disponibilité et de sa
génerosité.
Le professeur Francis Rosillon et son équipe m'ont
aimablement reçu à Arlon en mars 2012 lorsque je finalisais la
préparation de mon manuscrit. Je les remercie pour leur
hospitalité et leur disponibilité.
Mes collègues enseignants, le personnel technique et
administratif de l'ISE, m'ont toujours témoigné amitié et
disponibilité. Je les remercie très sincèrement pour leur
indulgence surtout quand j'ai eu à assurer pendant sept ans les charges
de directeur des études de l'Institut des Sciences de
l'Environnement.
Je remercie également Mr Kaoussou Sambou, ancien
taxinomiste à l'IFAN et Mr Abdoul Aziz Camara en charge de l'herbier du
département de Biologie Végétale de l'UCAD pour leur
précieuse aide dans l'identification de plusieurs échantillons
botaniques.
Mr.Alassane Sarr, Melle Julienne Kuiseu et Mme Marie Suzanne
Traoré m'ont accompagné plusieurs fois sur le terrain et
aidé dans la mise en ordre et l'exploitation des nombreuses
données collectées. Je les remercie très
sincèrement pour leur concours.
MM. Séga Diouf et Karim Gangué ont
exécuté avec beaucoup de compétence et de patience les
illustrations et les cartes présentées dans ce travail.Je leur
dit un grand merci.
xi
Je remercie les autorités du département de
Biologie Végétale, de la Faculté des Sciences et
Techniques et de l'Université C.A. Diop de Dakar pour m'avoir
aidé à finaliser et présenter cette thèse.
Il m'est agréable de me remémorer de mes
maîtres les Professeurs Mahamadou Alassane Cissé, André
Doyen, François Xavier Cogels, Mike Singleton, Arthur Tibesar, Daniel
Thoen et Pierre Pol Vincke. Ils m'ont initié à la botanique, au
travail de terrain et aux études environnementales. Je les remercie
très sincèrement pour toutes les connaissances qu'ils m'ont bien
aimablement transmises.
La famille Camara à Ngnith au lac de Guiers m'a
toujours accueilli avec beaucoup d'amabilité et de
générosité lors de mes séjours dans la
région du lac.
Lynn, Sara, Karen et Marc Pallemaerts m'ont toujours
agréablement offert l'hospitalité au cours de mes
fréquents et parfois longs séjours à Bruxelles. Qu'ils
trouvent ici l'expression de mes sentiments amicaux et ma reconnaissance.
Marie Emilie Diallo, assistante administrative à PAN
Africa et Mourtada Thiam m'ont aidé dans la finalisation de ce
mémoire et son édition. Je les en remercie.
Merci à mes amis et à ma famille pour le soutien
et l'affection qu'ils m'ont toujours témoignés.
1
Introduction
Le fleuve Sénégal prend sa source dans les
massifs du Fouta Djallon en République de Guinée. Il est le
principal cours d'eau du Sénégal. Son régime se
caractérise par une importante crue annuelle qui provoque l'inondation
de la plaine alluviale et du Delta (BRGM, 1967 ; Albergel et
al.,1984). En effet, le fleuve se gonfle à la saison des pluies
(juillet-octobre) et, en saison sèche (novembre et mai-juin) les
écoulements d'eau diminuent très fortement. Pendant cette
période d'étiage, au cours de laquelle aucune
précipitation importante n'est enregistrée, les débits du
fleuve et de ses affluents baissent très fortement. Cette diminution des
débits se traduit par l'intrusion très en amont des eaux
salées de l'océan atlantique dans le lit du fleuve (Trochain,
1940 ; Adam, 1964 ; Reizer, 1974; Cogels et Gac, 1982; Cogels et al.,
1993). Certaines années, l'eau salée remontait
jusqu'à 220 km en amont de Saint Louis, et la marée se faisait
sentir jusqu'à 440 km (Brigaud, 1961). De vastes étendues des
terres du Delta étaient alors envahies par l'eau salée provenant
de l'océan atlantique. Les incertitudes sur le climat et sur les
débits des cours d'eau, la salinisation des eaux de surface et
souterraine ont constitué depuis bien longtemps des handicaps à
l'exploitation des ressources, la « mise en valeur» de la
vallée du fleuve Sénégal et de son bassin versant (Henry,
1918; Lemmet et Scordel, 1918 ; Hubert, 1918 ; Hubert, 1921). Or, la zone du
delta et le lac de Guiers jouent un rôle de premier plan dans le
développement économique et social du Sénégal.
C'est pourquoi, depuis le siècle dernier, des
investissements importants ont été réalisés pour
maîtriser les eaux, éviter leur salinisation en vue de
développer la production agricole, assurer l'alimentation en eau douce
toute l'année des centres urbains notamment Dakar et Saint Louis ainsi
que nombreux villages et hameaux.
La construction du pont barrage de Richard Toll en 1947 a
transformé le lac de Guiers en un réservoir permanent d'eau douce
pour l'irrigation des cultures pendant les périodes de l'année
où l'eau est saumâtre dans le fleuve. Ce changement du
régime des eaux a provoqué des modifications dans la flore
lacustre, notamment la pullulation de Typha domingensis dans le delta
et le lac de Guiers (Trochain, 1956). Les conséquences
socio-économiques et sanitaires liées au développement de
cet hélophyte sur les rives du lac ont été passées
en revue (Grosmaire, 1957; Adam, 1964 ; Thiam, 1983). Des essais de lutte
contre T. domingensis ont été suggérés
(Trochain, 1956).
L'Organisation pour la Mise en Valeur du fleuve
Sénégal (O.MV.S.) créée par les Etats du Mali, de
la Mauritanie et du Sénégal en 1972, a permis, dans les
années 80, la construction sur le fleuve
2
Sénégal, des barrages de Diama et de Manantali
ainsi que des digues de protection. Ces ouvrages ont complètement
modifié le régime naturel du fleuve. Ils ont permis de
régulariser les débits, partiellement en période de crue
et totalement en période sèche. La remontée des eaux
marines dans le fleuve qui intervenait sur une grande partie du delta, a
été stoppée (BDPA/Coyne et Bellier, 1999). Ainsi, des
volumes d'eau douce plus importants sont maintenant disponibles toute
l'année pour divers usages. Les barrages ont eu des impacts importants
sur le développement agricole régional et l'environnement. En
revanche, la prolifération de certaines espèces de plantes
aquatiques suite à l'adoucissement des eaux est l'une des
conséquences écologiques négatives des bouleversements
occasionnés ou amplifiés par les ouvrages.
Avant les grands ouvrages sur le fleuve, quelques plantes des
milieux humides ont été mentionnées par les prospecteurs
qui ont sillonné la zone mais les noms des plantes sont incertains et
incomplets (Adanson, 1757; Heudelot et Lelièvre, 1828; Guillemin et
al., 1830-1833). Des relevés de végétation ont
été effectués dans le delta et le lac dans les
années 30 (Trochain, 1940) et dans les années 60 (Adam, 1964 ;
Adam, 1965) ; mais les informations fournies ne permettent pas de faire une
comparaison avec la situation actuelle. Un catalogue des adventices des
rizières de Richard-Toll avec des indications sur la chorologie des
principales espèces a été présenté (Adam,
1960). La flore ligneuse de la région du lac de Guiers a
été examinée (Doyen et Thiam, 1980 ; Thiam, 1982 ; Doyen,
1983 ; Thoen et Thiam, 1990) et l'étude détaillée des
groupements végétaux aquatiques et amphibies du lac et de sa
plaine d'inondation avec des indications sur les facteurs édaphiques a
été réalisée (Thiam, 1984).
Après la mise en place des grands barrages, quelques
informations sur la flore et la végétation de la zone ont
été fournies (Kuiseu, 1997; Thiam 1998 ; Kuiseu et al.
2001 ; Faye, 2007 ; Noba et al., 2010). Une liste des adventices
des rizières irriguées du delta a été
établie (Diagne, 1991). L'extension importante de Typha a
été observée dans l'ensemble du delta et le lac de Guiers
(Cogels et al. 1993 ; Thiam et al., 1993 ; Thiam, 1998) ; des
essais de faucardage et d'enlèvement de la plante avec un bateau
équipé ont été effectués (Hellsten and
al. 1999) et des essais de valorisation de Typha comme
combustible ont été menés (GTZ, 2001). En plus, de
Typha domingensis, les nouvelles conditions hydrologiques et de la
qualité des eaux ont provoqué des pullulations de Pistia
stratiotes dans le parc National du Djoudj et le lac de Guiers en 1992
(Guiral, 1993 ; Thiam, 1993) et l'apparition massive de Potamogeton
schweinfurthii dans le lac de Guiers (Thiam et Ouattara, 1997). Des
programmes de lutte biologique contre Pistia stratiotes (Anonyme,
1994; Anonyme, 1995b) et Salvinia molesta, introduit dans le delta
à la fin des années 90 ont été mis en oeuvre
(Pieterse et al. 2003; Diop, 2006).
3
Ainsi, plusieurs études et travaux visant une meilleure
connaissance des macrophytes aquatiques de la région, leur
contrôle et les possibilités de leur valorisation ont
été réalisés. Cependant, aucune analyse floristique
d'ensemble, d'études détaillées sur la biologie et
l'écologie des macrophytes aquatiques du delta et le lac de Guiers n'ont
été menées jusqu'ici. La lutte contre certaines
espèces végétales aquatiques a été
menée sans avoir une bonne connaissance des espèces (Guiral,
1993). Or, pour mettre au point des méthodes de lutte appropriées
contre les macrophytes proliférants, il est essentiel de disposer de
données approfondies sur leur biologie et leur écologie. Des
méthodes adéquates de contrôle de l'extension de certaines
plantes permettraient d'éviter que les investissements importants
effectués par les Etats membres de l'O.MV.S. afin de maîtriser les
eaux du fleuve et favoriser le développement socio-économique
dans le bassin du fleuve Sénégal, ne soient entravés par
des conséquences inattendues liées à la
prolifération de macrophytes.
Notre travail traite de plusieurs aspects de la flore et de la
végétation des milieux humides du delta du fleuve
Sénégal et du lac de Guiers, après la mise en service des
barrages. Il contribue à une meilleure connaissance de la flore et de la
végétation des milieux humides du delta du fleuve
Sénégal et le lac de Guiers. Ces connaissances sont un
préalable indispensable pour une exploitation rationnelle des ressources
végétales, le suivi scientifique de la diversité
végétale et la dynamique des peuplements de la zone. En outre,
les données sur la croissance, la multiplication et la phytomasse des
principales espèces proliférantes peuvent aider à la
valorisation, à la conception et la mise en oeuvre de méthodes de
contrôle appropriées des macrophytes aquatiques et de gestion
durable des écosystèmes limniques du delta du fleuve.
Ce mémoire est structuré de la manière
suivante :
Le chapitre 1 présente le milieu
physique du point de vue géographique, climatique, édaphique,
hydrogéologique, hydrographique et hydrologique. Les aménagements
hydro-agricoles réalisés et leurs impacts sur l'hydrologie et la
qualité des eaux dans le delta et le lac de Guiers sont également
analysés.
Le chapitre 2 traite de la flore
vasculaire, de la typologie et de la présentation des
principaux macrophyes
Le chapitre 3 expose sur la zonation de la
végétation et les principaux groupements végétaux
des milieux humides salés et d'eau douce,
4
Le chapitre 4 aborde quelques aspects de la
biologie, de la reproduction, de la multiplication, de la phytomasse et de
l'écologie de quatre macrophytes aquatiques proliférants dans la
région: Typha domingensis, Pistia stratiotes,
Potamogeton schweinfurthii et Salivinia molesta,
Le chapitre 5 présente une discussion
et des considérations générales portant principalement sur
les problèmes du milieu, la flore, la végétation et les
groupements végétaux reconnus, les aspects de multiplication, de
croissance et les moyens de lutte contre les plantes aquatiques
proliférantes majeures.
Les conclusions et quelques perspectives
envisageables terminent notre étude.
5
Chapitre 1 Présentation du milieu physique
1.1 Situation géographique
Le Fleuve Sénégal est le second grand fleuve de
l'Afrique de l'Ouest après le Niger. Il est formé par la
jonction, à Bafoulabé (Mali), des rivières du Bafing et du
Bakoye qui prennent leur source dans le massif guinéen du Fouta Djalon
(Figure1). Le Bafing, long de 760 km a un
bassin versant de 30.000 km2 et apporte presque la
moitié du débit du fleuve (EUROCONSULT-RIN, 1990). Le Bakoye a
une longueur de 560 km.
Le Fleuve Sénégal traverse la République
du Mali, puis forme sur près de 800 km la frontière entre la
Mauritanie et le Sénégal pour enfin se jeter dans l'Océan
Atlantique à 20 km au sud de Saint-Louis, après un parcours de
1080 km. Le bassin versant du fleuve se situe entre les latitudes 10°20'
et 17°30'N et les longitudes 7° et 16°30' W. Il couvre les
États de la Guinée (10,7% de la surface du bassin), du Mali
(53,6%), du Sénégal (9,5%) et de la Mauritanie (26,1%) (O.MV.S.,
1979). L'ensemble du bassin s'étend sur plus de 343.000 km2
(Michel, 1973) et l'apport d'eau moyen annuel est de 24 milliards de
m3 (Mainguet, 1995). L'irrégularité dans les
écoulements constitue la caractéristique principale des fleuves
tropicaux et le Sénégal n'échappe à cette
règle.
Le bassin du fleuve Sénégal peut être
subdivisé en trois zones distinctes (O.MV.S., 1979) :
- le bassin supérieur ou Haut bassin correspond
à la zone où le fleuve reçoit la quasi-totalité de
ses eaux; il s'agit d'une région à pluviométrie
élevée (de 700 à 2000 mm/an);
- le bassin inférieur ou Vallée du fleuve
à 800 km de l'embouchure, inondable en période de crue;
- et le delta, vaste plaine alluvionnaire de près de
170 km en amont de l'estuaire.
Figure 1 - Carte du Delta et du bassin du fleuve Senegal en
Afrique de l'Ouest
6
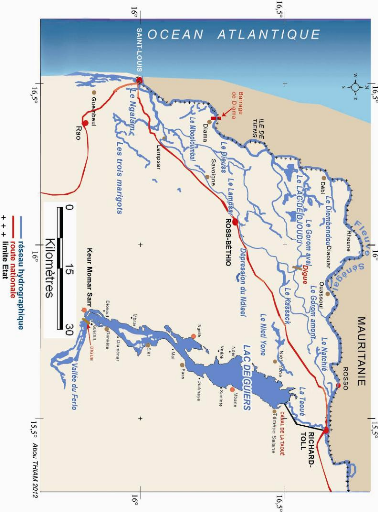
La partie terminale du fleuve Sénégal, en aval
de Dagana, est apparemment un delta mais il n'y a qu'une seule embouchure
(Figure 2). Aussi, appelle-t-on parfois cette immense zone d'inondation de
forme triangulaire, de plus de 5 000 km2, un pseudo-delta.
Le delta du fleuve se situe entre 15°44'- 16°38' N
et 15°35'-16°30 W. La pente moyenne est de 0,002 m par km (Brigaud,
1961). L'altitude est faible et ne dépasse pas 23 m (Giffard, 1974). Son
origine remonte au Dunkerquien où une lagune se forma derrière un
cordon littoral (Michel, 1973). Le delta est une immense zone inondable de 74
000 à 110 000 ha au Sénégal et 80 000 ha presque
totalement inondable en Mauritanie (Anonyme, 1998).
Au sud de Richard-Toll, en tête du delta, s'est
formé le lac de Guiers qui est le plus grand système lacustre et
la plus importante réserve d'eau douce de surface du
Sénégal. Il occupe une dépression naturelle peu profonde
(1 m en moyenne), allongée entre les alignements de dunes rouges
d'âge Ogolien (20 000 BP). Long d'environ 50 km et large au maximum de 7
km, il s'étire selon une direction SSW-NNE. Il s'inscrit dans un
quadrilatère entre 15°25 et 16° de longitude ouest, 15°40
et 16°25 de latitude Nord (Thiam, 1984). Il se situe à environ
à 50 km à vol d'oiseau de l'océan Atlantique (latitude
14°09' N; longitude 16°08' W). Son volume est estimé à
800 millions de m3 d'eau (Cogels et Gac, 1982 ; Cogels, 1984).
Le lac de Guiers est un défluent. Il est sous la
dépendance hydraulique du fleuve avec lequel il communique avec un
marigot sinueux de près de 25 km, la Taoué1.
La limite sud du lac est d'origine humaine. En effet, c'est en 1956 que la
Mission d'Aménagement du Sénégal (M.A.S) a construit la
digue de Mérinaghène aux environs de Keur Momar Sarr ; il
sépare le lac de Guiers de la Basse vallée du Ferlo. Cet
aménagement a permis d'augmenter la capacité de stockage en eau
du lac et sécurisé l'irrigation des casiers agricoles de
Richad-Toll.
7
1 En 1976, il a été creusé un
canal quasi rectiligne reliant le fleuve Sénégal à Richard
Toll au lac de Guiers pour en assurer un meilleur remplissage en eau douce
provenant du fleuve.
Figure 2 - Carte du Delta du fleuve Sénégal et du
lac de Guiers
8
9
1.2 Climat
Le Delta se situe dans une zone subdésertique et fait
partie du Sahel (mot d'origine arabe signifiant côte ou
frontière), une zone semi-aride située entre le Sahara
au nord et les régions tropicales où les pluies sont
substantielles au sud (Adam et al., 1965).
Les données recueillies au niveau des principales
stations météorologiques de la région (St Louis,
Ross-Béthio et Richard Toll) permettent de préciser les
principaux caractères du climat actuel de la zone. Les principales
données disponibles au niveau de ces stations sont: la
température, l'humidité atmosphérique et les pluies.
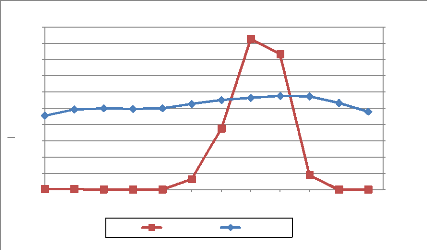
Le diagramme ombrothermique, réalisé à
partir des données de Saint Louis donne un aperçu sur le climat
dans la zone terminale du delta du fleuve Sénégal (Figure 3)
Pluies en mm
100,0
80,0
40,0
90,0
70,0
60,0
50,0
30,0
20,0
10,0
0,0
jan f€v mar avr mai jun jui aout sep oct nov
dec
Pmm T€°C
45,0
40,0
0,0
50,0
35,0
30,0
25,0
20,0
5,0
15,0
10,0
Températures (ÅC)
Figure 3 - Diagramme ombrothermique de Saint Louis
(période: 1980 à 2000)
La Figure 3 indique que la région se caractérise
par:
- une courte saison des pluies (hivernage) (juillet à
septembre);
- une longue saison sèche (octobre à juin);
- des précipitations totales annuelles faibles;
- le maximun d'eau tombe au mois d'août;
- les températures moyennes annuelles sont
élevées et se situent entre 20 et 30 oC
10
1.2.1 Température
La températuremoyenne annuelle sous abri oscille entre 25
oc et 27 °c (Figure 4). Les plus basses températures sont
enregistrées en décembre et janvier, alors que les plus
élevées sont notées en mai et juin.
Il y a des jours où les températures diurnes
atteignent plus de 45°c sous abri. Les écarts de
températures entre les jours et les nuits sont également souvent
relativement très importants (8 à 10 oc).
Température (T) en Å C
28,0
27,0
26,0
25,0
24,0
23,0
22,0
21,0
AnnÄe
Figure 4 - Température moyenne annuelle sous abri
à Saint-Louis (période: 1980-2000) 1.2.2 Humidité
atmosphérique
Humidité relative en %
100,00
40,00
90,00
80,00
70,00
60,00
50,00
30,00
20,00
10,00
0,00
Humidité
Moyenne
1981 1982 1983 1984 1985 1986 1987 1988 1989 1990 1991 1992 1993
1994 1995 1996 1997 1998 1999 2000
1
1
AnnÄe
Figure 5 - Humidité relative moyenne annuelle à
Saint Louis (période : 1980 à 2000)
11
Les moyennes annuelles de l'humidité se situent entre
60 et 70 % (Figure 5). Les variations de l'humidité relative sont
importantes au cours de l'année ainsi qu'au cours de la journée.
L'humidité relative est généralement inférieure
à 40 % pendant la période sèche, puis augmente et atteint
70 % pendant la saison des pluies. Le climat est nettement influencé par
la présence de la mer, avec une humidité plus
élevée qu'à l'intérieur du pays, et des
températures plus basses
1.2.3 Pluies
Les données pluviométriques recueillies dans les
stations météorologiques de Saint Louis (Figure 7) et
Richard-Toll indiquent que les pluies sont faibles dans la région. Elles
oscillent entre 150 et 400 mm par an.
Pluies en mm
200
150
100
-50
50
0
jan fév mar avr mai jun jui aou sep oct nov dec
Mois
Pmm de 91-00 Pmm de 81-90
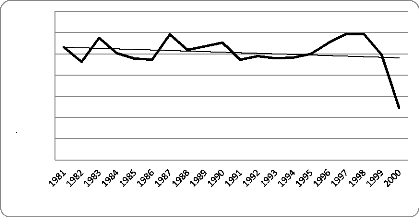
Figure 6 - Pluviométrie mensuelle moyenne à Saint
Louis (décadaires: 1981-1990 et 1991- 2000)
Pluies en mm
450
400
350
300
250
200
150
100
50
0
1981 1982 1983 1984 1985 1986 1987 1988 1989 1990 1991 1992 1993
1994 1995 1996 1997 1998 1999 2000
Année
Pmm
Moyenne Linéaire (Pmm)
Figure 7 - Pluviométrie annuelle et tendance de la
pluviosité à Saint Louis (1980 et 2000)
12
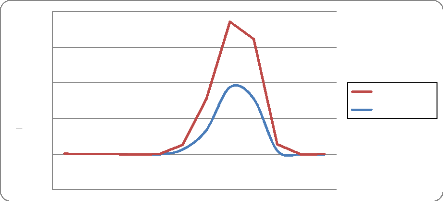
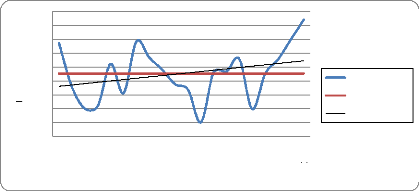
Elles sont très faibles (environ 250 mm par an ces
dernières années) et concentrées sur les mois de juillet,
d'août et mi-septembre. Les quantités de pluies qui tombent sont
très variables, discontinues dans le temps et dans l'espace.
De faibles pluies (appelées "heug"), sans grande
signification pour la végétation, tombent parfois durant les mois
de janvier, février et mars.
Ainsi, le climat du delta du fleuve Sénégal se
caractérise par une grande sécheresse du milieu due notamment
à la faiblesse des précipitations, leur
irrégularité dans l'espace et dans le temps, aux
températures et humidités relatives élevées durant
la majeure partie de l'année.
1.3 Géologie et géomorphologie
Le Sénégal septentrional se situe
entièrement dans le bassin sédimentaire
sénégalo-mauritanien. Les formations du Crétacé
n'affleurent nulle part (Michel et al., 1969).
La vallée du fleuve s'est formée à
l'ère quaternaire quand le fleuve s'est encastré dans des
terrains de l'Eocène et du Plateau Continental (Michel, 1973). Pendant
les 100.000 dernières années, les effets combinés des
variations climatiques, les fluctuations du niveau de la mer, les cycles
d'érosion fluviales et dépôts alluvionnaires, ont induit de
nombreux changements dans le cours du fleuve et dans la dynamique qui
caractérise la morphogénèse de la vallée et du
delta (Figure 8). Les glacis sableux et les terrasses ferrugineuses qui bordent
actuellement la vallée sont les témoins visibles de cette
période. Ces formations ne doivent pas être confondues avec les
dunes rouges qui datent d'une période plus récente. La structure
géologique du bassin du fleuve a été étudiée
par SEDAGRI/IRAT (1972). Selon cette étude, les unités
géomorphologiques peuvent être regroupées de la
façon suivante:
- des glacis sableux et des terrasses graveleuses qui bordent
actuellement la vallée et les bords orientaux du lac de Guiers
(Quaternaire 100.000 ans av. J.C.) : à cette époque le delta
faisait partie d'un golfe marin s'étendant du Trarza jusqu'à
Nouhadibou en Mauritanie;
- des dunes rouges (Ogolien 30.000 à 10.000 av. J.C.)
qui couvrent le Trarza et le delta ; des vestiges de ces dunes, haut de 15 m,
sont encore abondants dans la partie sénégalaise du delta; les
terrasses fluviatiles datent de cette époque ; le climat était
très sec et le niveau de la mer était 100 m plus bas
qu'actuellement;
- dépôts nouakchottiens (10.000 à 5.000
av. J.C.) formant le deuxième remblai sablo-argileux et les terrasses
marines sableuses en bordure du delta et entre les cordons littoraux; le climat
devenait beaucoup plus humide et le niveau de la mer montait
13
graduellement causant la formation des lacs entre les cordons
dunaires comme le lac de R'Kiz en Mauritanie; de cette époque datent
aussi les mouvements tectoniques qui ont entrainé un rehaussement du
delta au nord et une baisse de la partie sud. Conséquence de ces
mouvements, le fleuve a dévié son cours vers le sud-ouest,
formant l'embouchure actuelle;
- dépôts post-nouakchottiens formés par
les dunes jaunes et les cordons littoraux (5.000 à 2.000 av. J.C.) ;
c'est la période où les hautes levées, les deltas de
rupture des levées dominent les levées plus récentes de 1
à 2 m et ne sont plus jamais submergées;
- dépôts actuels et subactuels formés par
des bancs de sable, des vasières et des dunes vives bordant la plage
actuelle, ainsi que des dunes éoliennes rouges et remaniées dans
le nord du delta (2.000 av. J.C - à présent); la formation des
levées actuelles est due à l'érosion fluviale et la
sédimentation; des cuvettes de décantation couvrant à peu
près le tiers de la vallée et du delta se sont formées
pendant cette période.
La plaine alluviale et le delta sont donc d'origine assez
récente. L'embouchure du fleuve est du type estuaire. La formation
progressive des cordons littoraux peut avoir forcé le fleuve à
dévier son cours ou à former des défluents. En outre des
dépressions se sont formées entre ces cordons. Plusieurs
tributaires et affluents furent transformés pendant la période de
transgression en vasières et mangroves, parmi lesquelles, la
dépression du parc du Djoudj (Figure 8).
1.4 Pédologie
Les terres de la région sont parcourues par un
important réseau de chenaux plus ou moins marqués par la
combinaison des influences continentales et maritimes. Les bourrelets de berge
isolent des cuvettes argileuses de décantation vouées à la
culture irriguée ou à la collecte d'eau de drainage (Maymard,
1955).
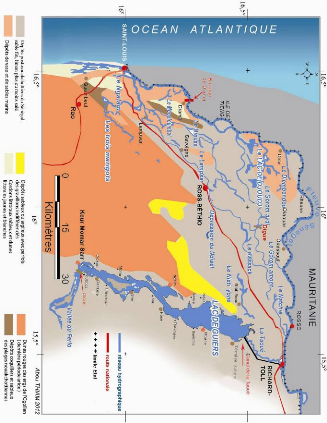
Il résulte de la morphogenèse, quatre ensembles
morphologiques dont deux renferment les principaux types de sols:
- les cuvettes de décantation: elles constituent les
angles morts de la sédimentation fluviatile constituée d'un sol
argileux brun (60%) qui se fissure profondément : c'est le
hollaldé (en langue nationale Pular) ; il est apte
à la riziculture et porte généralement des forêts
d'Acacia nilotica ;
- les levées fluvio-deltaïques : elles sont
constituées d'un sol brun rouge à fort pourcentage de sable fin,
sensible à la déflation éolienne : c'est le
fondé (constitué à 70 % de sable et 30 %
d'argile).
Figure 8 - Carte géomorphologique du Delta du fleuve
Sénégal
14
15
La présence de sel dans les formations constitue une
contrainte majeure à la mise en valeur des terres. Ce sel a une double
origine (Tricart, 1961) :
- il est d'abord résiduel et hérité d'un
régime lagunaire qui correspondrait au maximum de la transgression
nouakchottienne ;
- il est ensuite issu d'une longue évolution des sols
caractérisée par un double jeu saisonnier: intrusion de la langue
salée lors de la saison des basses eaux fluviales et mobilisation et
évacuation progressive du sel lors de la crue annuelle.
Les sols salés à divers degrés sont
relativement fréquents dans delta (Loyer, 1989 ; Ceupens et
al., 1997). On y trouve également de nombreux sols sulfaté
acides (Deckers, J. et al., 1996).
Les ouvrages de retenue construits sur différents
marigots ont permis une plus longue stagnation des eaux douces
déclenchant un processus de dessalement des sols. L'un des exemples le
plus frappant se situe au nord de Dakar-Bango sur le Djeuss, de part et d'autre
de la digue de Bifèche. A l'ouest de la digue, le sol est fortement
salé, une végétation de mangrove (Avicennia et
Rhizophora) s'y maintient tandis qu'à l'est de la digue
prospèrent des espèces d'eau douce (Vossia,
Typha, Oryza...). Incontestablement, il y a un dessalement de
surface, mais le phénomène édaphique le plus marquant est
sans nul doute la durée de l'inondation sous une côte
élevée d'eau douce (N'Diaye, 1978). Actuellement, le facteur
essentiel dans la pédogénèse du delta paraît
être la fréquence et la durée d'inondation par les eaux
douces du fleuve (Deckers, J. et al., 1996).
1.5 Hydrogéologie
La plupart des eaux souterraines sont fortement salées,
avec des taux de salinité excédant souvent ceux de l'eau de la
mer (EUROCONSULT-RIN, 1990). Elles se trouvent généralement
à plusieurs mètres de profondeur. Des eaux souterraines douces
peuvent être trouvées en dessous des terres sableuses
(céanes).
Les études hydrogéochimiques sur
l'aquifère du Delta (EUROCONSULT-RIN, 1990) ont montré que les
eaux de la nappe sont de mauvaise qualité. Elles ont
révélé que:
- ces eaux appartiennent à un faciès de type
chloruré, sodique et potassique;
- elles sont fortement minéralisées;
- les Solides Totaux Dissous (TDS) sont supérieurs
à 10 000 mg/l ; ce qui indique leur inaptitude pour l'irrigation.
Concernant la teneur en chlorures de la nappe, l'influence du
lac de Guiers ne se fait nettement sentir que dans une faible frange en bordure
du lac. Elle est plus importante sur la rive est que sur la rive ouest (Plaud,
1966).
16
La construction de digues et du barrage anti-sel a
augmenté les fluctuations de la nappe phréatique (Deckers et
al., 1996).
1.6 Hydrographie et hydrologie
Le fleuve Sénégal, après un parcours
est-ouest de 80 km environ, entre Dagana et Diamer, prend une direction
sud-ouest jusqu'à Saint Louis, puis longe le cordon littoral large de
100 à 400 m appelé la langue de Barbarie. Son issue dans
l'océan atlantique a souvent varié. La première embouchure
se situait à environ 27 km de Saint Louis.
Les rivières sont nombreux. Les plus importants sur la
rive gauche du fleuve sont:
- La Taoué, qui met en relation le fleuve et
le lac de Guiers ; dans les années 70, ce chenal sinueux a
été remplacé par un canal artificiel quasi rectiligne qui
améliore la recharge du lac avec les eaux du fleuve;
- Le Djoudj, dans la cuvette argileuse du même nom
qui se ramifie en divers marigots;
- Le Gorom, entre les cuvettes du Djoudj et
du Djeuss; des bras le relient aux marigots de Lampsar et de
Diovol;
- Le Djeuss qui rejoint le marigot de Ngalam,
en amont de Sanar;
- Le marigot de Ngalam qui a une direction sud-nord et rejoint le
Djeuss;
- Le Lampsar ou Kassak, long d'une centaine de
kilomètres et large de 30 à 100 m.
En plus de la cuvette du Djoudj, dans la boucle du
fleuve, il existe une autre dépression, le N'Diael, parfois en
eau très longtemps après de fortes crues, souvent à sec
plusieurs années de suite. Les limites de cette dépression
bordée de dunes sauf au nord sont indistinctes. Le N'Diael,
était alimenté par le marigot de Nieti-Yone, un
défluent du lac de Guiers avant que celui-ci ne fàt barré
en 1951.
Sur l'ensemble de son parcours dans le delta, la pente moyenne
du fleuve est de 0,006 %o. Cette pente quasi nulle est même par endroits
inversée. Ces particularités morphologiques sont à la base
du processus annuel de remontée saline vers l'amont du fleuve, avant la
mise en fonction du barrage de Diama.
Le régime des eaux du fleuve Sénégal se
caractérise par l'alternance annuelle d'une période de crue et de
décrue. La crue principale est alimentée par les pluies tombant
sur le massif du Fouta-Djallon. Elle débute en juin-juillet pour
s'achever en octobre-novembre
En régime naturel, le tronçon principal du
fleuve conserve, de mi-juillet (début de la saison des pluies)
jusqu'à février, les caractéristiques d'une eau
fluviatile, c'est-à-dire avec des débits
17
importants. Du début de la saison sèche
(novembre) au début de la saison des pluies (mi-juillet), le cours
inférieur du fleuve a un régime de plus en plus proche de celui
d'un estuaire, au fur et à mesure de la remontée de la langue
salée dans le lit du fleuve jusqu'à 150 km de l'embouchure et
parfois jusqu'à 200 km. L'intrusion d'eau marine débute lorsque
le débit du fleuve devient inférieur à 600
m3/s. Les écoulements fluviaux freinent la remontée
vers l'amont des eaux océaniques, tant qu'ils se maintiennent au-dessus
de 50 m3/s. Lorsque le débit fluvial devient inférieur
à 50 m3/s, la remontée salée ne dépend
plus que de la durée de la période d'étiage,
conditionnée par la date d'arrivée de la crue suivante (Rochette,
1974).
L'alternance de poches d'eau et d'assèchement dans le
lit est particulièrement observée en fin juin-début
juillet, juste avant la saison des pluies. Les débits diminuent et les
écoulements deviennent laminaires.
Figure 9 - Carte du réseau hydrographique du Delta du
fleuve Sénégal
18
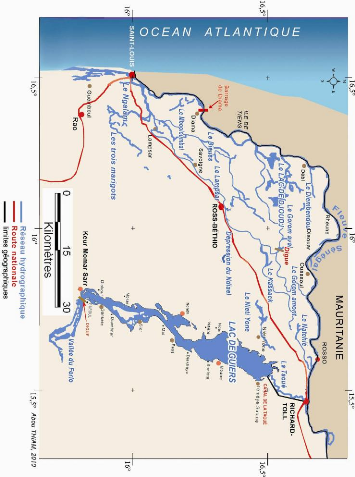
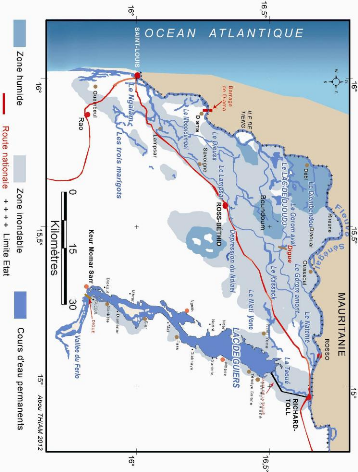
Figure 10 - Carte des zones humides, des zones inondables et
cours d'eau permanents du Delta
19
20
1.7 Incidences des barrages sur l'hydrologie et la
qualité des eaux
Depuis des siècles, la disponibilité de l'eau
douce toute l'année dans la région du Delta s'est posée
avec beaucoup d'acuité (Brasseur, 1952). Cette disponibilité a
une longue histoire.
1.7.1 Brève historique des aménagements sur
le fleuve Sénégal
L'alternance d'eau douce et d'eau salée faisait que la
ville de Saint-Louis était entourée d'eau salée sept mois
par an. Au cours du XVIII ième siècle, il arrivait qu'on aille
prélever de l'eau douce en amont de la ville. C'est ainsi qu'en
1786-1787, le Chevalier de Boufflers fit distiller l'eau pour son usage
personnel. Par la suite, il fit venir une machine à dessaler l'eau
(Tilmans, 1998). Quant aux populations, elles prélevaient chaque matin,
l'eau nécessaire à leur consommation, dans des trous
creusés dans le sable de la plage.
L'idée d'aménager le fleuve
Sénégal remonte à l'époque coloniale avec en 1824,
les essais du jardin de Richard Toll qui échoueront du fait de
l'hostilité des populations et de nombreuses contraintes techniques et
physiques (Hardy, 1921). Les recherches en vue de la mise en valeur reprennent
au début du XX ème siècle (Lemmet et Scordel, 1918 ;
Henry, 1918).
Pour constituer une réserve d'eau douce, Faidherbe
essaya, en 1859, de barrer le Kassak (Figure 10). La crue emporta ce
barrage. L'expérience renouvelée dix ans plus tard échoua
à nouveau tant l'écoulement, sur ce point, était puissant.
En 1879, Brière-de-l'Isle, parvint à amorcer l'ouvrage, qui,
complété par une conduite d'eau, fut terminé en 1886.
L'eau est puisée par une usine à vapeur, située à
18 kilomètres de Saint Louis, à Makhana. Cette politique de
barrage a été poursuivie afin de conserver l'eau douce de la crue
dans différents marigots pour alimenter la ville de Saint-Louis. Ainsi
furent construits, outre les barrages en terre, les barrages en dur suivants :
Boundoum (19031904), Dakar-Bango (1939-1940), Diaoudoun (1940) (Brigaud, 1961).
Plusieurs organisations et structures seront mises en place pour
réaliser les aménagements sur le fleuve. Il s'agit notamment de
la création en 1934, de la Mission d'Aménagement du fleuve
Sénégal (M.A.S.) qui deviendra un organe commun de mise en valeur
du fleuve au service des trois Etats autonomes, le Mali, la Mauritanie et le
Sénégal. Ces projets avaient pour but d'améliorer les
perspectives économiques de la région et d'atteindre
l'autosuffisance alimentaire des pays riverains. Dans cette dynamique,
l'Organisation pour la Mise en Valeur du Fleuve Sénégal
(O.M.V.S.) fut créée en 1972 par les trois Etats riverains en
remplacement de l'Organisation des Etats Riverains du Sénégal
(O.E.R.S.) fondée en 1968, puis dissoute en fin 1971 après le
retrait de la Guinée (Adams, 2000).
Avant la construction des grands barrages, le delta fut sujet
à l'influence des marées et à l'intrusion des eaux salines
de la mer pendant l'étiage. Les amplitudes des marées dans
cette
21
partie de l'Atlantique sont assez faibles, et varient en
moyenne entre 1,15 m pendant les hautes marées et 0,55 m pendant les
mortes eaux. Dans le fleuve, les amplitudes des marnages diminuent en fonction
des débits du fleuve. Pendant l'étiage ces amplitudes
étaient entre 80 et 30 cm à St Louis, entre 65 et 25 cm à
Dagana et entre 35 et 15 cm à Podor (EUROCONSULT-RIN, 1990). Avec
l'absence de toute pente dans la partie deltaïque du fleuve, les
intrusions des eaux salines pendant l'étiage s'étendaient
jusqu'à Podor, tandis qu'en période de crue, la langue saline
était repoussée. La date d'arrivée de la langue
salée à Débi se situait vers mi-janvier et à Dagana
vers début mai. La date de retrait avait lieu respectivement vers
début juillet et fin juillet.
Pour pallier la faiblesse de la crue fluviale et endiguer la
remontée du flot salé dans les cours d'eau, des barrages
délimitant des bassins de retenue ont été construits. Le
Lampsar et la Taoué ont été
aménagés au début de ce siècle. Le pont barrage de
Dakar-Bango sur le marigot de Djeuss est beaucoup plus récent. En 1983,
par suite d'une faiblesse exceptionnelle de la crue fluviale et de la
remontée rapide de la langue salée, une digue en terre a
été érigée sur le fleuve à Kheune. Cette
dernière réalisation a rempli son rôle pendant deux
années consécutives. Elle a été emportée par
la crue de 1985.
A partir de 1985, des aménagements de grandes
envergures furent réalisés sur le fleuve Sénégal
dans le cadre de l'Organisation pour la Mise en Valeur du fleuve
Sénégal (O.MV.S.). Il s'agit du barrage de Diama vers
l'embouchure du fleuve entre les territoires sénégalais et
mauritanien et le barrage de Manantali, construit en territoire malien.
Ces ouvrages ont été complétés par des digues sur
les rives gauche et droite du fleuve.
1.7.2 Barrage de Diama
Le barrage de Diama est situé à 27 km de la
ville de Saint Louis. Les travaux de construction de l'ouvrage ont
commencé en 1981. Il a été mis en eau en novembre 1985. Il
s'agit d'un barrage anti sel qui pendant la période de crue s'ouvre pour
assurer l'écoulement normal du fleuve et se ferme en période
d'étiage pour empêcher la remonté des eaux salines. Il
consiste en 7 vannes mobiles, ayant chacune une largeur de 20 m et une hauteur
de 11,5 m. Ces vannes, pièces maîtresses dans la modulation des
débits à Diama, sont généralement ouvertes de
manière identique. L'ouverture maximale d'une vanne est de 11,5 m
correspondant à la hauteur du pertuis. Le débit maximum alors
dérivable par l'évacuateur de crue est de 6500 m3/s
correspondant à la crue millénale du fleuve. Sur la rive gauche,
une écluse de navigation de 175 m sur 13 m permet le passage des
bateaux. Celle-ci doit permettre une navigation continue entre St Louis et
Kayes au Mali.
22
Le coût des travaux a été de 36 milliards de
FCFA.
Les principaux objectifs assignés au barrage de Diama
sont:
- arrêter définitivement la remontée de la
langue salée dans le cours inférieur du fleuve en
période de basses eaux;
- créer en amont du barrage une réserve permanente
d'eau douce pour les besoins agricoles et
autres;
- stocker si besoin en est, les débits de soutien
d'étiage lâchés par le barrage de Manantali ;
- améliorer les remplissages des dépressions
naturelles et des chenaux dans la basse vallée du
Delta;
- permettre le stockage de 250 à 500 millions de
m3 d'eau douce pour divers usages.
La retenue d'eau douce en amont de Diama se présente
ainsi:
- à la cote + 1,5 m IGN, le volume d'eau stocké est
de 250 millions de m3 ;
- à la cote + 2,5 m IGN, le volume est alors de 460
m3 ;
- la cote maximale de la retenue est de + 3,20 m IGN.
1.7.3 Barrage de Manantali
Il a été construit sur le Bafing, à 90 km
au sud-est de la ville de Bafoulabé dans la région de Kayes au
Mali (voir Figure 1, p.6). Il a été achevé en 1988. Le lac
de retenue du barrage a une capacité de 11,5 milliards de m3
d'eau sur une superficie de 477 km2avec une profondeur moyenne de
20,8 m et une profondeur maximale de 50 m. Le barrage permet de maintenir toute
l'année lorsqu'il est plein, un débit supérieur à
200 m3/s nécessaire aux besoins de l'agriculture en
irrigation contrôlée, et assure un soutien à la crue
naturelle des affluents non régularisés. Manantali assure la
maîtrise de seulement la moitié des eaux captées par le
bassin versant car le Bafing n'apporte que 48 % des eaux du fleuve.
L'ouvrage de Manantali consiste en une digue de 1460 m avec au
milieu une construction en béton d'une longueur de 493 m et une hauteur
maximale de 65 m. La chute d'eau moyenne est de 40 m.
Le barrage de Manantali vise spécifiquement à :
- normaliser le débit du fleuve et garantir un
débit minimum à Bakel de 300 m3/s pendant toute
l'année;
- permettre l'irrigation pendant toute l'année sur 375.000
ha, grâce aux possibilités conjuguées des deux barrages;
- permettre la navigation sur le fleuve;
23
- produire de l'électricité (800 GWh/an).
Afin que les barrages de Diama et de Manantali jouent
pleinement leur rôle, il a fallu construire également des digues
pour augmenter notamment les capacités de stockage des eaux dans le
fleuve, le lac de Guiers et d'autres dépressions naturelles.
1.7.4 Endiguements
En 1964, l'Organisation Autonome du Delta (O.A.D.)
relayée en 1965 par la Société d'Aménagement et
d'Exploitation des terres du Delta (S.A.E.D.), a réalisé
plusieurs ouvrages parmi lesquels la "digue rive gauche" du fleuve
Sénégal, des ouvrages de régulation et de franchissement
de divers chenaux. La digue rive gauche qui longe le cours inférieur du
fleuve s'étend de Dakhar-Bango près de Saint Louis à
Rosso, sur près de 83 km. Elle protège les terres basses du Delta
contre une submersion incontrôlée par les eaux du
Sénégal. Cette digue a été
réhabilitée en 1993 pour améliorer les conditions de
stockage des eaux dans la retenue de Diama. Les endiguements
réalisés ont une longueur totale de 175 km environ (soit 85 km en
rive droite et 90 km en rive gauche).
La digue de Keur Momar Sarr construite en 1956 sépare
le lac de Guiers proprement dit de la basse vallée du Ferlo ; elle
permet de contrôler la réserve d'eau du lac. Deux ouvrages
hydrauliques situés sur la digue, permettent l'alimentation du Bas Ferlo
avec une capacité de l'ordre de 40 m3 par seconde.
1.7.5 Effets des aménagements sur l'hydrologie et la
qualité des eaux dans le Delta
Les barrages de Diama et de Manantali, la construction de
digues sur la rive gauche et droite du fleuve dans le delta ont modifié
très sensiblement le cycle hydrologique, la qualité des eaux et
réduit les vastes étendues qui étaient jadis
régulièrement inondées. Les digues qui ceinturent le
fleuve ont modifié aussi l'habitat. En effet, les vastes zones
adjacentes au fleuve qui subissaient régulièrement des
inondations ne sont plus atteintes par l'eau. Cependant, l'humidité
quasi permanente de ces endroits, le rehaussement du niveau des nappes
souterraines, permettent encore le développement de nombreux macrophytes
aquatiques, amphibies et des plantes halophiles.
Ainsi, avec la construction d'ouvrages de prise d'eau en
plusieurs endroits, il est possible de faire rentrer l'eau et d'inonder les
dépressions et les cuvettes en fonction des besoins (zones
aménagées pour les cultures irriguées, zones de
pâturages, parcs du Djoudj, le N'Diael, approvisionnement permanent du
lac de Guiers, de la Basse vallée du Ferlo,...).
Le rôle de maîtrise des eaux de Diama est
renforcé par l'action régulatrice de crue de Manantali sur le
haut bassin et la digue rive gauche.
24
A ce jour les objectifs d'arrêt de la remontée
des eaux salées, de remplissage des chenaux, de lâchers de soutien
d'étiage compensant les pertes par évaporation, de
prélèvements pour l'irrigation sont atteints.
Les ouvrages ont modifié l'hydrologie et l'hydrochimie
des eaux du fleuve. En effet, les ouvrages ont permis la création d'un
plan d'eau en amont (retenue de Diama) qui facilite le remplissage des chenaux
et des cuvettes adjacents équipés d'ouvrages de prises.
Les remontées marines en amont du barrage de Diama sont
aujourd'hui quasiment impossibles.
La situation hydrologique en aval de Diama dépend
essentiellement des lâchers au niveau du barrage et de l'amplitude des
marées. Les lâchers ne sont effectués que pendant la
période des hautes eaux, au moment des crues fluviales. L'étude
de l'évolution de la salinité fluviale à Saint Louis de
1987 à 1993 montre un cycle bien marqué, avec 3 phases
principales (O.MV.S., 1995) :
1. une phase de dilution et d'adoucissement des eaux dont le
début est fixée par la date d'arrivée de la crue fluviale
en amont et la date d'ouverture des vannes à Diama. En 15 jours, la
salinité à Saint Louis passe de 38 %o à 0,2-0,4 %o. Cette
phase de désalinisation de l'estuaire est permanente tant que le
débit fluvial est maintenu supérieur à 600 m3/s
;
2. une phase de salinisation de l'estuaire qui commence
dès la réduction des lâchers à Diama à moins
de 600 m3/s ;
3. une phase de sursalure des eaux de l'estuaire par rapport
aux eaux océaniques sous l'effet de l'évaporation.
Ces cycles peuvent être brutalement perturbés par
les lâchers à Diama. Il peut y avoir ainsi de variations brutales
de la qualité des eaux dans la zone aval.
En amont de la retenue de Diama, en dehors de la
période de crue (janvier à juillet), la salinité est
relativement élevée (225 mg/l) et présente des variations
liées probablement aux lâchers épisodiques du barrage vers
l'aval, compensés par des apports d'eau douce venus de l'amont. Il y a
un gradient décroissant de salinité de l'aval vers l'amont.
Dès l'arrivée de l'onde de crue et l'ouverture des vannes en
continu, la salinité augmente brutalement durant une courte
période puis régresse très rapidement pour atteindre 75
mg/l et s'y stabiliser. Durant la période postérieure à la
fermeture des vannes, la salinité des eaux évolue sous
l'influence de l'évaporation et des lâchers ponctuels vers l'aval
(O.MV.S., 1995).
La Compagnie Sucrière Sénégalaise
(C.S.S.) rejette annuellement dans la retenue de Diama près de 98,91
millions de m3 d'eau de drainage. Ce volume représenterait
près de 40% du volume initial de la retenue à la cote 1,5 m IGN.
La minéralisation globale de ces eaux usées varie entre
25
0,8 et 2 g/l. Des eaux de drainage provenant d'autres
périmètres irrigués sont également rejetées
dans le fleuve. En dehors de la salinité, très peu de
données existent sur la qualité des eaux du delta.
1.7.6 Effets des aménagements sur l'hydrologie et la
qualité des eaux du lac de Guiers
La figure 11 présente le fonctionnement hydrologique
actuel du lac de Guiers. Les eaux du lac de Guiers étaient probablement
douces avant 1800 et au cours des 150 ans qui ont suivi cette date ses eaux ont
été alternativement douces et saumâtres (John, 1986). De
1976 à 1985, le lac de Guiers a été l'objet d'une
salinisation progressive de ses eaux causée par les rejets dans la
région Nord des eaux de drainage des exploitations agricoles
irriguées (sols salés). La concentration moyenne en chlorures de
ces rejets était de 300 mg/l pour un volume quotidien de l'ordre de 85
000 m3 (Cogels et Gac, 1987). L'augmentation interannuelle du taux
de chlorures dans le lac était alors très nette.
L'année hydrologique 1989-90 montre par contre une
légère diminution du taux des chlorures dissous par rapport aux
années précédentes. Cette réduction s'explique par
les lâchers d'eau annuels (depuis 1988) vers la vallée du Ferlo
qui, en évacuant les eaux très minéralisées de la
région méridionale, ont accéléré le
processus d'adoucissement du lac.
Deux modifications essentielles sont intervenues depuis 1985
dans le lac de Guiers (Cogels et al., 1993) :
1. les barrages de Diama et la régulation des
débits à Manantali (depuis 1987) permettent le maintien d'un
niveau fluvial plus élevé et plus stable à la hauteur de
la jonction du canal de la Taoué à Richard Toll. Entre 1985 et
1991, les périodes et durées de remplissage annuel du lac sont
restées plus ou moins semblables à celles d'avant 1985. Les
niveaux atteints dans le lac en fin de phase de remplissage sont cependant
nettement supérieurs à ceux de la période
précédente;
2. les pompages pour l'irrigation de la canne à sucre
à partir du lac ont été réduits. En effet, les eaux
du fleuve maintenant douces toute l'année assurent en continu
l'approvisionnement des casiers sucriers de la Compagnie Sucrière
Sénégalaise (C.S.S.) ; celle-ci peut maintenant s'approvisionner
toute l'année à partir des eaux fluviales douces.
Figure 11- Schéma de fonctionnement hydrologique du lac de
Guiers
Fleuve Sénégal
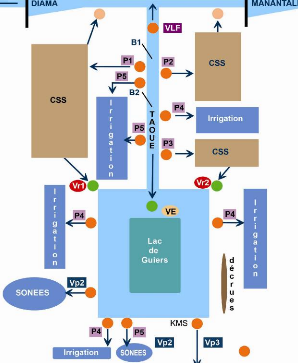
DIAMA
T
B1
\
T -->
A
P5 o
U P3
v
· VE
Lac
de
Guiers
CSS
T
123
·
v B2-
MANANTALI
Irrigation
·
Vp3
>ZOO
P4
Irrigation
FERLO
Légende
B1 : ler pont-barrage
B2 : 2eme pont-barrage
P... : prélèvements
C.S.S : Compagnie Sucrière Sénégalaise
SONEES : Société Nationale d'Exploitation des Eaux du
Sénégal
KMS : Keur Momar Sarr
|
APPORTS
|
|
SORTIES
|
|
|
VF
Vp0
Vr
|
: apports fluviaux
: apports de pluies : rejets CSS
|
VE Vpl Vp3 VLF
|
: évaporation
: pompages de la CSS : lâchers vers le Ferlo : transferts
lac/fleuve
|
+ SAED
|
26
D'après Cogels, Niang, Coly et Gac, (1994),
complété
27
Les jonctions fleuve-lac sont ainsi beaucoup plus
fréquentes depuis la mise en fonction du barrage de Diama surtout depuis
1988. Depuis cette date, les déplacements des masses d'eau dans le lac
sont beaucoup plus fréquents et dirigés dans diverses directions
: du fleuve au lac, du lac au fleuve et du lac au Ferlo.
Le développement des cultures irriguées avec
utilisation accrue de produits nocifs, les rejets effectués dans le lac
de Guiers par la Compagnie Sucrière Sénégalaise (C.S.S.)
et d'autres agro-industries constituent un problème environnemental
majeur dans le Delta; les résidus de pesticides peuvent passer dans
l'eau de drainage, porter atteinte à la population piscicole et d'autres
maillons de la chaîne trophique (Germain et Thiam, 1983 ; Sène,
1987; EUROCONSULT-RIN, 1990 ; Thiam, 1996).
1.8 Conclusion
Situés en zone sahélienne, à la
lisière du désert du Sahara, le delta du fleuve
Sénégal et le lac de Guiers subissent les rigueurs d'un climat
tropical chaud et sec adoucit cependant par l'océan atlantique au niveau
de la façade littorale. Les sécheresses sont récurrentes.
La pluviométrie est faible, imprévisible et mal répartie
dans l'espace. La température et l'humidité relative sont souvent
très élevées.
Au plan géomophologique, la plaine alluviale et le
delta sont d'origine récente. Des dépressions se sont
formées entre les cordons dunaires.
Les cuvettes de décantation avec des sols argileux sont
propices aux cultures irriguées lorsque les sols ne sont pas
salés ou très acides.
Les nappes d'eau souterraine sont souvent plus salées
que l'eau de mer. Elles ont un faciès de type chloruré, sodique
et potassique.
La faiblesse des débits du fleuve et des nombreux cours
d'eau de la région faisait que pendant les étiages le biseau
salé remontait le fleuve et salinisait les eaux et les terres dans le
Delta et le lac de Guiers gênant l'alimentation des hommes, des animaux
et les cultures irriguées.
C'est dans un tel contexte que les barrages de Diama et de
Manantali, deux ouvrages importants de retenue et de régulation du cours
du fleuve Sénégal ont été construits dans les
années 80 ; complétés par des digues pour sécuriser
l'alimentation en eaux douces des populations et développer les
productions agricoles notamment la riziculture.
Ainsi, aussi bien dans le delta du fleuve que dans le lac de
Guiers les aménagements ont occasionné de profondes modifications
du milieu. Les ouvrages permettent notamment la
28
constitution de stocks importants d'eau douce, soustraient au
sel les eaux du fleuve, du lac de Guiers et d'importantes superficies de terre
sont maintenant disponibles pour l'agriculture. Ces conditions favorables
à la mise en valeur agricole de la région sont
accompagnées en revanche par le développement important de
certains macrophytes aquatiques qui trouvent eux aussi de nouvelles conditions
favorables à leur plein épanouissement.
La baisse de la salinité des eaux, les hauteurs
limnimétriques élevées toute l'année et les faibles
marnages sont les faits marquants des nouvelles conditions du milieu à
amont des barrages. Ces facteurs ont eu des incidences sur l'environnement avec
en particulier un développement important de la végétation
aquatique dulçaquicole dans le Delta et le lac de Guiers. Celle-ci s'est
étendue vigoureusement dans plusieurs zones entravant l'usage des plans
d'eau avec comme corollaire des effets négatifs sur la vie des
communautés qui dépendent de l'eau pour leur alimentation, la
pêche, l'irrigation et d'autres activités. Le développement
excessif de la végétation dans les milieux humides augmente
également les risques pour la santé avec la formation d'aires
propices au développement de vecteurs de maladies humaines telles que le
paludisme et la schistosomiase. Le développement important de la
végétation peut également gêner la bonne marche des
pompes indispensables à l'irrigation des périmètres
rizicoles et sucriers. Compte tenu des problèmes importants
d'environnement et de développement liés à la
multiplication des macrophytes aquatiques, il est apparu intéressant
d'analyser de manière approfondie la flore vasculaire et la
végétation des milieux humides du Delta et du lac de Guiers.
29
Chapitre 2 Flore vasculaire des milieux humides
2.1 Introduction
Depuis le XVIIIe siècle, divers prospecteurs ont
sillonné la région du delta du fleuve Sénégal et du
lac de Guiers et ont rapporté des notes botaniques. Michel Adanson, sans
doute le premier naturaliste à avoir véritablement
commencé l'étude de la flore du Sénégal, herborisa
dans la zone de St Louis dans les années 1749 et 1750 et mentionna dans
le Bas Sénégal des hydrophytes tels que Jussiaea,
Sesbania, Stratiote d'Egypte (=Pistia stratiotes),
Pontederia, Utriculaires (Utricularia), Lemna,
Nénuphars (Nymphaea), Nymphoides,
Potamogeton, souchets (Cyperaceae) (Adanson, 1757). Leprieur
récolta des plantes à Saint Louis en 1824 et à Dagana en
1825 et Heudelot, entre 1830 et 1837, collecta des plantes sur la rive gauche
du fleuve Sénégal, de Saint Louis à Galam (Lebrun, 1973).
Heudelot et Lelièvre (1828), Guillemin et al. (1830-1833),
Perrottet (1833) herborisèrent dans les environs du lac de
«NGher» et signalèrent dans celui-ci Typha
latifolia2, Arundo donax3, Cyperus
articulatus, Nymphaea, Utriculaires (Utricularia), riz
naturel (Oryza). En 1838, Brunner herborisa également à
Saint Louis et à Gandiole (Lebrun, 1973). Lemmet et Scordel (1918) ont
observé dans le lac de Guiers, le grand «roseau des marais »
et Henry (1918) ajouta à la liste Andropogon squarrosus (=
Vetiveria nigritana) et Cyperus bulbosus. Ces
premières informations sur les macrophytes des milieux humides de la
zone sont dans beaucoup de cas fragmentaires et vagues.
C'est à partir du début des années 30 que
de nombreuses espèces végétales seront
récoltées et que des informations détaillées sur la
flore aquatique de la zone seront fournies (Trochain, 1940). Un catalogue des
adventices des rizières de Richard Toll avec des indications sur la
répartition géographique des principales espèces fut
publié (Adam, 1960). Adam (1964) analysa la flore et la
végétation sur la rive Est du lac de Guiers en utilisant des
transects. Thiam (1984) étudia la végétation du lac et de
sa plaine d'inondation et donna des informations sur les macrophytes
aquatiques.
La baisse de la salinité des eaux du lac de Guiers,
depuis les années 50, ainsi que les niveaux d'eau élevées
toute l'année aussi bien dans le lac que dans le fleuve, surtout depuis
la mise en service
des grands barrages sur le Sénégal, ont
occasionné d'importants changements hydrologiques et de qualité
des eaux (Cogels et Gac, 1982 ; Cogels et al., 1993 ). Pour la flore,
les modifications se sont manifestées notamment par l'apparition de
certaines espèces qui n'avaient pas été
signalées
2 Certainement Typha domingensis Pers. (=
Typha australis Schum. & Thonn.) (Trochain, 1940)
3 Probablement Phragmites australis
(Cav.)Trin.Ex.Steud.
30
auparavant et le développement important d'autres
macrophytes aquatiques (Cogels et al., 1993 ; Thiam et al.,
1993 ; Thiam et Ouattara, 1997; Thiam, 1998 ; Kuiseu et
al.,2001). L'abondance de Typha domingensis dans le delta et le
lac de Guiers a retenu l'attention de plusieurs auteurs dès le
début des années 50 (Trochain, 1956; Gromaire, 1957; Adam, 1964;
Thiam, 1983).
Après la mise en place des grands barrages, des
études sur la flore et la végétation des milieux
aquatiques et humides du delta et le lac de Guiers ont été
publiées (Kuiseu, 1997; Thiam ,1998 ; Kuiseu et al., 2001). Des
informations sur la flore du parc national des oiseaux du Djoudj ont
été fournies (Faye, 2007; Noba et al., 2010). Une liste
des adventices des rizières irriguées du delta après les
grands barrages et les aménagements a été
présentée (Diagne, 1991).
Ces divers travaux fournissent des informations
intéressantes sur la flore des milieux humides de la zone du delta et le
lac de Guiers mais ne permettent pas de comparer la situation floristique de la
période avant et après les grands barrages. De plus, il n'y a pas
eu jusqu'ici d'analyses floristiques détaillées des biotopes
humides du delta notamment du point de vue de la richesse, de la structure, de
la forme biologique et de la répartition géographique des taxons.
Une connaissance approfondie de la taxonomie des macrophytes aquatiques de la
région est essentielle pour leur étude et leur gestion.
La présente étude tente de combler certaines de
ces lacunes. Elle traite de la composition, de la structure et de la
diversité de la flore vasculaire des milieux humides du delta et du lac
après les grands aménagements réalisés sur le
fleuve Sénégal. Elle se propose notamment de :
- présenter un état des lieux en recensant les
macrophytes dans trois entités humides du delta: la rive gauche du
fleuve, le lac de Guiers et les zones basses inondables;
- analyser la structure, la diversité de la flore
vasculaire des milieux humides ainsi que les spectres biologique et
chorologique ;
- et, établir une typologie et donner des
renseignements sur les macrophytes communément rencontrés;
2.2 Matériels et méthodes
Il a été procédé à
l'inventaire des macrophytes au cours de plusieurs missions scientifiques
pendant différentes périodes de l'année (saison
sèche et saison pluvieuse) particulièrement entre 1994 et 2001.
Les observations ont été menées dans les trois types de
zones humides suivantes:
1. Les abords immédiats de la rive gauche du fleuve
2. Le lac de Guiers et son canal d'alimentation, la
Taoué
31
3. Les zones basses inondables submergées plus ou moins
longtemps par le débordement des eaux ou constamment humides à
cause de la nappe souterraine superficielle
Les échantillons de plantes récoltés ont
été séchés pour la plupart et mis en herbier.
L'identification des espèces a été faite avec les Flores
du Sénégal (Berhaut, 1967 ; Berhaut 1971-1979 ; Vanden Berghen,
1988) et d'Afrique de l'Ouest (Hutchinson et Dalziel, 19541972). Pour la
détermination de certaines espèces, les herbiers du
Département de Biologie Végétale de l'Université
Cheikh Anta Diop (Dakar), de l'Institut Fondamental d'Afrique Noire (IFAN), du
Muséum National d'Histoire Naturelle (Paris), et du Jardin Botanique
National de Belgique (Meise) ont été consultés.
La nomenclature botanique utilisée en
général est celle de Lebrun & Stork (1991-1997). Pour
Salvinia molesta D.S. Mitchell, nous avons adopté celle de
Johns (1991). Pour Azolla pinnata R.Br var. africana (Desv.)
Bak., Typha domingensis Pers, Bolboschoenus maritimus (L.)
Palla, Oxycaryum cubense Poeppig et Kunth, Schoenoplectus
Palla, Lemna aequinoctialis Welw. Nous avons suivi la
nomenclature de Vanden Berghen (1988).
Les familles sont classées dans l'ordre de la flore de
Berhaut (1967), genres et espèces se suivent dans l'ordre
alphabétique.
Pour les types biologiques, nous avons
utilisé la classification de Raunkiaer (1934) adaptée à la
zone tropicale où la saison défavorable correspond à la
saison sèche (Lebrun 1966 ; Trochain, 1966). Cette classification
distingue 6 formes biologiques de base, qui sont :
- Thérophytes (T): plantes annuelles dont seules les
semences subsistent à la mauvaise saison
- Phanérophytes (P): plantes vivaces avec des
bourgeons situés à plus de 50 cm de la surface du sol
- Chaméphytes (C) : plantes vivaces avec des bourgeons
situés à moins de 50 cm de la surface du sol
- Géophytes (G): plantes dont les bourgeons restent
enfouis dans le sol pendant la mauvaise saison
- Hémicryptophyte (H) : plantes dont les bourgeons
sont partiellement enfouis dans le sol
- Hydrophytes (Hy) : plantes aquatiques
A ces types fondamentaux, nous ajoutons à la suite de
Noba et al. (2004) :
- Parasites (Par) : pour les plantes parasites
Les plantes aquatiques, les hydrophytes, qui constituent la
grande majorité des macrophytes que nous étudions dans ce travail
sont difficiles à classer dans le système de Raunkiaer. Nous
avons
32
adapté à notre dition la nomenclature
proposée par Trochain (1966). Celle-ci se présente de la
façon suivante:
- les hélophytes (deux types) :
· Hélogéophytes (Hé gé) :
plantes dont les bourgeons sont dans la vase; l'appareil
végétatif est aérien;
· Hélothérophytes (Hé th) :
plantes amphibies annuelles; les graines subsistent dans la vase.
- les hydrophytes (quatre types):
· Hydrophytes nageants (Hyd na) : bourgeons et appareil
végétatif flottent sur ou dans l'eau;
· Hydrogéophytes (Hyd gé) : plantes
aquatiques vivaces fixées, subsistent sous forme de rhizome situé
dans le substrat et porteur de bourgeons;
· Hydrohémicryptophytes (Hyd hé) : plantes
vivaces aquatiques fixées, subsistent sous forme de souche portant des
bourgeons à la surface du substrat solide ou vaseux;
· Hydrothérophytes (Hyd th) : plantes aquatiques
fixées, subsistent sous forme de
graines ou de boutures à valeur de bourgeons.
Concernant la répartition géographique des
espèces (la chorologie), les principaux sigles proposés
par Lebrun (1969) et Vanden Berghen (1979) pour désigner
les différents groupes ont été utilisés :
- Cosm : espèces cosmopolites
- Pant : espèces pantropicales
- Pal: espèces paléotropicales
- Afr: espèces soudano- guinéo-zambéziennes
éventuellement aussi présentes en Afrique du
Nord et en Afrique australe
- As : espèces Afro-asiatiques
- Afram : espèces Afro-américaines
- Sz : espèces Soudano-zambéziennes
- Sahm : espèces Saharo-méditerranéennes
Il y a eu plusieurs tentatives de classification des plantes
aquatiques en fonction de leur forme de
vie (Hartog and Segal, 1964); une bonne révision a
été présentée par Sculthorpe (1967) et
Hutchinson (1975). Les catégorisations ont
été souvent basées soit sur la forme des plantes, le
milieu dans lequel elles grandissent ou se reproduisent, ou
encore sur les moyens de survie aux
33
conditions défavorables. Aucune des classifications
proposées n'ont eu une large acceptation, à cause probablement du
fait qu'elles comportent de nombreuses catégories et subdivisions.
Nous avons opté dans ce travail pour une typologie des
macrophytes suivant leur fixation ou non au substrat ainsi que le
développement de tout ou certains organes de la plante dans ou au-dessus
de l'eau. Elle est largement inspirée de Trochain (1966), Sculthorpe
(1967), Camefort (1996) et Cronk & Fennessy (2001).
Pour la systématique, la description, les indications
sur la répartition géographique et l'écologie des
espèces, nos principales sources d'information sont: les Flores de
Berhaut (1978 ; 19711978), de Hutchinson et Dalziel (1954-1972), la liste
énumérative de Lebrun et Stork (1991-1997), Vanden Berghen (1988
; 1991) et des résultats de différents travaux (Germain, 1965 ;
Hall B.H. and al., 1971 ; Jacobsen, 1983 ; Gopal and Sharma, 1990 ;
Cook, 1990 ; Montégut, 2003).
2.3 Résultats et discussion
2.3.1 Composition spécifique
Les espèces recensées sont
présentées dans l'ordre systématique dans les 3 zones
étudiées : fleuve Sénégal, lac de Guiers et les
zones basses inondables (tableau 1). Les espèces sont
sériées en monocotylédones, dicotylédones et
ptéridophytes. Le type biologique et la répartition
géographique de chaque taxon sont indiqués.
Tableau 1 - Espèces recensées dans le fleuve, le
lac de Guiers et dans les zones basses inondables
Fleuve Lac de Zones basses Type
Répartition
Sénégal Guiers inondables Biologique
Géographique
MONOCOTYLEDONES
ALISMATACEAE (1)
1 Limnophyton obtusifolium
(L.) Miq. + Hél th Pal
ARACEAE (1)
2 Pista stratiotes L. + + + Hy
na Pant
ARECACEAE (=PALMEAE) (1)
3 Hyphaene thebaica (L.)
Mart. + P Afr
COMMELINACEAE (1)
34
4
|
Commelina benghalensis L.
|
|
|
+
|
T
|
Pal
|
|
CYPERACEAE (23)
|
|
|
|
|
|
|
5
|
Bolboschoenus maritimus (L.) Palla
|
+
|
+
|
+
|
Hél gé
|
Cosm
|
|
6
|
Cyperus alopecuroides Rottb.
|
+
|
+
|
+
|
Hél gé
|
Pal
|
|
7
|
Cyperus articulatus L.
|
+
|
+
|
+
|
Hél gé
|
Pant
|
|
8
|
Cyperus bulbosus Vahl
|
+
|
+
|
+
|
Hél gé
|
Pal
|
|
9
|
Cyperus difformis L.
|
+
|
+
|
|
Hél th
|
Pant
|
|
10
|
Cyperus digitatus Roxb.
|
+
|
+
|
+
|
Hél gé
|
Pant
|
|
11
|
Cyperus dives Delile
|
+
|
+
|
|
Hél gé
|
Pal
|
|
12
|
Cyperus esculentus L.
|
+
|
+
|
+
|
Hél gé
|
Pant
|
|
13
|
Cyperus haspan L.
|
+
|
+
|
+
|
Hél gé
|
Pant
|
|
14
|
Cyperus iria L.
|
+
|
|
+
|
Hél th
|
Pant
|
|
15
|
Cyperus laevigatus L.
|
+
|
+
|
|
Hél gé
|
Pant
|
|
16
|
Cyperus maculatus Boeck.
|
|
+
|
|
Hél gé
|
Afr
|
|
17
|
Cyperus polystachyos (Rottb.)Beauv.
|
+
|
+
|
|
Hél gé
|
Pant
|
|
18
|
Cyperus rotondus L.
|
+
|
+
|
+
|
Hél gé
|
Pant
|
|
19
|
Fimbristylis ferruginea (L.) Vahl.
|
|
|
+
|
Hél gé
|
Pant
|
|
20
|
Fuirena ciliaris (L.) Roxb.
|
+
|
|
+
|
Hél th
|
Pal
|
|
21
|
Fuirena umbellata Rottb.
|
|
|
+
|
Hl.th
|
Pant
|
|
22
|
Juncus maritimus Lam.
|
|
|
+
|
Hél gé
|
Cosm
|
|
23
|
Oxycaryum cubense (
Poeppig.et Kunth) Lye
|
+
|
+
|
|
Hél gé
|
Afr
|
|
24
|
Pycreus macrostachyos (Lam.) J.Raynal
|
+
|
+
|
+
|
Hél.gé
|
Pant
|
|
25
|
Rhynchospora holoschoenoides (L.C.Rich.) Herter
|
|
|
+
|
Hél gé
|
Afr
|
|
26
|
Schoenoplectus litoralis (Schrader) Palla
|
+
|
+
|
+
|
Hél gé
|
Pal
|
|
27
|
Schoenoplectus senegalensis (Hochst.ex Steudel.)
Palla
|
|
|
+
|
Hél th
|
Pal
|
|
HYDROCHARITACEAE (1)
|
|
|
|
|
|
|
28
|
Vallisneria aethiopica Fenzl.
|
|
+
|
|
Hy gé
|
Afr
|
|
LEMNACEAE (1)
|
|
|
|
|
|
|
29
|
Lemna aequinoctialis Welw.
|
+
|
+
|
+
|
Hy na
|
Pant
|
35
|
NAJADACEAE (2)
|
|
|
|
|
|
|
30
|
Najas marina L.
|
+
|
+
|
|
Hy th
|
Cosm
|
|
31
|
Najas pectinata (Parl.) Magnus
|
+
|
+
|
|
Hy th
|
Afr
|
|
POACEAE (26)
|
|
|
|
|
|
|
32
|
Brachiaria lata (Schum.) Hubbard
|
+
|
+
|
+
|
T
|
Pant
|
|
33
|
Bracharia mutica (Forssk.) Stapf.
|
+
|
+
|
+
|
Hy gé
|
Pant
|
|
34
|
Chloris prieurii Kunth
|
+
|
+
|
+
|
T
|
Pal
|
|
35
|
Cynodon dactylon (L.) Pers.
|
+
|
+
|
+
|
C
|
Cosm
|
|
36
|
Dactyloctenium aegyptium (L.) Beauv.
|
+
|
+
|
+
|
T
|
Pant
|
|
37
|
Diplachne fusca (L.) Pal.Beauv.
|
+
|
+
|
+
|
Hél gé
|
Pal
|
|
38
|
Echinochloa colonum (L.) Link
|
+
|
+
|
+
|
T
|
Pant
|
|
39
|
Echinochloa pyramidalis (L.) H.et C.
|
+
|
+
|
+
|
Hél gé
|
Pal
|
|
40
|
Echinochloa stagnina (Retz.).Pal.Beauv.
|
+
|
+
|
+
|
Hél gé
|
Pal
|
|
41
|
Elytrophorus spicatus (Willd.) A. Camus
|
|
+
|
+
|
T
|
Pal
|
|
42
|
Eragrostis diplachnoides Steud
|
+
|
|
+
|
T
|
As
|
|
43
|
Eragrostis ciliaris (L.) R. Br.
|
+
|
+
|
+
|
T
|
Pant
|
|
44
|
Eragrostis tremula (Lam) Hochst. Ex. Steud.
|
+
|
+
|
+
|
T
|
Pal
|
|
45
|
Ischaemum rugosum Salisb.
|
|
|
+
|
Hél th
|
Afr
|
|
46
|
Oryza barthii A.Chev.
|
|
+
|
+
|
Hél th
|
Afr
|
|
47
|
Oryza longistaminata A. Chev. & Roehr.
|
+
|
+
|
+
|
Hél gé
|
Afr
|
|
48
|
Panicum anabaptistum Steud.
|
+
|
+
|
+
|
Hél gé
|
Afr
|
|
49
|
Panicum repens L.
|
+
|
+
|
+
|
Hél gé
|
Pant
|
|
50
|
Paspalidium geminatum (Forssk.)Stapf.
|
+
|
+
|
|
Hél gé
|
Afr
|
|
51
|
Paspalum scrobiculatum L.
|
+
|
+
|
|
Hél.gé
|
Pant
|
|
52
|
Paspalum vaginatum Sw
|
+
|
+
|
+
|
Hél gé
|
Pant
|
|
53
|
Phragmites australis (Cav.) Trin ex Steud.
|
+
|
+
|
+
|
Hél.gé
|
Cosm
|
|
54
|
Sporobolus robustus Kunth
|
+
|
+
|
+
|
C
|
Afr
|
|
55
|
Sporobolus spicatus Kunth
|
+
|
+
|
+
|
C
|
Cosm
|
|
56
|
Vetiveria nigritana (B.) Stapf
|
|
+
|
|
Hél gé
|
Pant
|
|
57
|
Vossia cuspidata (Roxb.) Griffith
|
+
|
+
|
|
Hél gé
|
Pal
|
36
PONTEDERIACEAE (3)
58 Eichhornia natans (Pal. Beauv.) Solms-Laub. + Hy
na Pant
59 Eichhornia crassipes (Mart.)
Solms-Laub. + Hy na Pant
60 Heteranthera callifolia Reichenb.ex Kunth + Hy
gé Afram
POTAMOGETONACEAE (2)
61 Potamogeton octandrus Poir. + + Hy gé
Pal
62 Potamogeton schweinfurthii A. Benn. + + Hy
gé Afr
TYPHACEAE (1)
63 Typha domingensis Pers. + + + Hél gé
Pal
|
ACANTHACEAE (1)
|
DICOTYLEDONES
|
|
|
|
|
|
64
|
Hygrophila auriculata (Schum.) Heine
|
|
|
+
|
Hél gé
|
As
|
|
AIZOACEAE (3)
|
|
|
|
|
|
|
65
|
Sesuvium portulacastrum (L.) L.
|
+
|
+
|
+
|
C
|
Cosm
|
|
66
|
Trianthema portulacastrum L.
|
+
|
+
|
+
|
T
|
Pant
|
|
67
|
Trianthema triquetra Willd.
|
|
|
+
|
T
|
As
|
|
AMARANTHACEAE (7)
|
|
|
|
|
|
|
68
|
Achyrantes argentea Lam.
|
|
|
+
|
T
|
Sz
|
|
69
|
Achyrantes aspera L.
|
|
|
+
|
C
|
Pant
|
|
70
|
Alternanthera nodiflora (L.) R. Br
|
|
+
|
+
|
T
|
Cosm
|
|
71
|
Alternanthera sessilis R. Br. Ex DC.
|
|
+
|
+
|
T
|
Cosm
|
|
72
|
Amaranthus viridis L.
|
|
|
+
|
T
|
Pant
|
|
73
|
Blutaparon vermiculare (L.) Mears
|
+
|
+
|
+
|
C
|
Afram
|
|
74
|
Centrostachys aquatica (R.Br.) Wall.
|
|
+
|
+
|
Hél gé
|
As
|
|
ASTERACEAE (= COMPOSITAE) (5)
|
|
|
|
|
|
|
75
|
Ambrosia maritima L.
|
+
|
+
|
+
|
T
|
Cosm
|
|
76
|
Eclipta alba (L.) Hassk.
|
+
|
+
|
+
|
T
|
Pant
|
|
77
|
Lactuca intybacea Jacq.
|
|
|
+
|
T
|
Afram
|
|
78
|
Sphaeranthus senegalensis DC.
|
|
|
+
|
T
|
As
|
37
79
|
Tridax procumbens L.
|
|
|
+
|
T
|
Pant
|
|
AVICENNIACEAE (1)
|
|
|
|
|
|
|
80
|
Avicennia germinans (L.) L.
|
+
|
|
+
|
P
|
Afram
|
|
BORAGINACEAE (3)
|
|
|
|
|
|
|
81
|
Coldenia procumbens L.
|
+
|
+
|
+
|
T
|
As
|
|
82
|
Heliotropium bacciferum Forssk.
|
|
|
+
|
T
|
As
|
|
83
|
Heliotropium ovalifolium Forssk.
|
|
|
+
|
C
|
As
|
|
CAPPARACEAE (= CAPPARIDACEAE) (3)
|
|
|
|
|
|
|
84
|
Boscia senegalensis (Pers.) Lam
|
|
|
+
|
P
|
Afr
|
|
85
|
Cleome tenella L.
|
|
|
+
|
T
|
Pal
|
|
86
|
Gynandropis gynandra (L.) Briq.
|
|
|
+
|
C
|
Afr
|
|
CELASTRACEAE (1)
|
|
|
|
|
|
|
87
|
Maytenus senegalensis (Lam.) Exell.
|
|
|
+
|
P
|
Pal
|
|
CERATOPHYLLACEAE (1)
|
|
|
|
|
|
|
88
|
Ceratophyllum demersum L.
|
+
|
+
|
+
|
Hy na
|
Cosm
|
|
CHENOPODIACEAE (4)
|
|
|
|
|
|
|
89
|
Arthrocnemum macrostachyum (Moic.) Moris &
Delponte
|
|
+
|
P
|
Cosm
|
|
90
|
Salicornia senegalensis A.Chev.
|
|
|
+
|
P
|
Cosm
|
|
91
|
Salsola baryosma (Schult.) Dandy
|
|
|
+
|
P
|
As
|
|
92
|
Suaeda vermiculata Forssk. Ex. J.F. Gmel.
|
|
|
+
|
P
|
Cosm
|
|
CONVOLVULACEAE (4)
|
|
|
|
|
|
|
93
|
Cressa cretica L.
|
+
|
+
|
+
|
C
|
Pant
|
|
94
|
Ipomoea aquatica Forssk.
|
+
|
+
|
+
|
Hy hém
|
Pant
|
|
95
|
Ipomoea asarifolia (Desr.) Roem.et Schult.
|
+
|
+
|
+
|
C
|
Pant
|
|
96
|
Ipomoea coptica (L.) Roth.
|
|
|
+
|
C
|
As
|
|
CUCURBITACEAE (1)
|
|
|
|
|
|
|
97
|
Colocynthis citrilus (L.) O.Kze
|
+
|
|
+
|
C
|
Pal
|
|
EUPHORBIACEAE (1)
|
|
|
|
|
|
|
98
|
Euphorbia hirta L.
|
+
|
+
|
+
|
T
|
Pant
|
38
FABACEAE4 (=LEGUMINOSAE) (23)
|
|
|
|
|
|
|
99 Acacia nilotica (L.) Willd.
|
+
|
+
|
+
|
P
|
Sz
|
|
100 Acacia senegal (L.) Willd.
|
|
|
+
|
P
|
Afr
|
|
101 Acacia seyal Del.
|
|
|
+
|
P
|
Afr
|
|
102 Acacia sieberiana DC.
|
|
+
|
+
|
P
|
Afr
|
|
103 Acacia tortilis Hayne
|
+
|
+
|
+
|
P
|
Pal
|
|
104 Aeschynomene elaphroxylon (Guill. et Perr.) Taub.
|
+
|
+
|
+
|
P
|
As
|
|
105 Aeschynomene indica L.
|
+
|
+
|
+
|
T
|
Pant
|
|
106 Bauhinia rufescens Lam.
|
|
|
+
|
P
|
Afr
|
|
107 Cassia mimosoides L.
|
|
|
+
|
P
|
Pant
|
|
108 Cassia occidentalis L.
|
|
+
|
+
|
P
|
Pant
|
|
109 Cassia obtusifolia L.
|
|
+
|
+
|
P
|
As
|
|
110 Indigofera astragalina DC.
|
|
|
+
|
T
|
Afr
|
|
111 Indigofera senegalensis Lam.
|
|
|
+
|
T
|
Afr
|
|
112 Mimosa pudica L.
|
|
+
|
|
P
|
Cosm
|
|
113 Mimosa pigra L.
|
|
+
|
+
|
P
|
Pant
|
|
114 Neptunia oleracea Lour.
|
+
|
+
|
+
|
Hy hém
|
Pant
|
|
115 Parkinsonia aculeata L.
|
+
|
+
|
+
|
P
|
Cosm
|
|
116 Piliostigma reticulatum (DC.) Hochst.
|
|
|
+
|
P
|
Afr
|
|
117 Prosopis chilensis (Mol.)Stuntz.
|
+
|
+
|
+
|
P
|
Cosm
|
|
118 Sesbania leptocarpa DC.
|
+
|
+
|
+
|
P
|
As
|
|
119 Sesbania sesban (L.) Merril.
|
+
|
+
|
+
|
T
|
Pant
|
|
120 Sesbania pachycarpa DC.
|
+
|
+
|
+
|
T
|
Afr
|
|
121 Tamarindus indica L.
|
|
|
+
|
P
|
Pant
|
|
LENTIBULARIACEAE (1)
|
|
|
|
|
|
|
122 Utricularia stellaris L.f.
|
+
|
+
|
+
|
Hy na
|
Pal
|
|
LYTHRACEAE (2)
|
|
|
|
|
|
|
123 Ammania auriculata Willd.
|
+
|
+
|
+
|
Hy gé
|
Afr
|
|
124 Lythrum hyssopifolia L.
|
|
+
|
+
|
T
|
Cosm
|
4 Suite à Spichiger (2000), nous incluons dans
la famille des Fabaceae, les 3 sous familles constituées par
les Caesalpinioideae, les Faboideae et les
Mimosoideae.
39
MENYANTHACEAE (2)
|
|
|
|
|
|
|
125 Nymphoides ezannoi Berh.
|
|
+
|
|
Hy gé
|
Sz
|
|
126 Nymphoides indica (L.) O. Kze
|
+
|
+
|
|
Hy gé
|
Pant
|
|
NYMPHAEACEAE (2)
|
|
|
|
|
|
|
127 Nymphaea lotus L.
|
+
|
+
|
+
|
Hy gé
|
Pal
|
|
128 Nymphaea micrantha Guill. & Perr.
|
+
|
+
|
+
|
Hy gé
|
Sz
|
|
OENOTHORACEAE (=ONAGRACEAE )(3)
|
|
|
|
|
|
|
129 Ludwigia erecta (L.) Hara
|
+
|
+
|
+
|
T
|
Afram
|
|
130 Ludwigia leptocarpa (N.) H.
|
+
|
+
|
|
Hy gé
|
Pant
|
|
131 Ludwigia stolonifera Guill.& Perr.
|
+
|
+
|
+
|
Hy hém
|
Pant
|
|
OROBANCHACEAE (1)
|
|
|
|
|
|
|
132 Cistanche phelipaea (L.) Cout.
|
|
|
+
|
Par
|
Sahm
|
|
POLYGONACEAE (2)
|
|
|
|
|
|
|
133 Polygonum lanigerum R. Br.
|
+
|
+
|
|
Hy gé
|
Pal
|
|
134 Polygonum senegalense Meisn
|
+
|
+
|
|
Hy gé
|
Afr
|
|
PORTULACACEAE (2)
|
|
|
|
|
|
|
135 Portulaca foliosa Ker-Gaiol.
|
+
|
+
|
+
|
C
|
Sz
|
|
136 Portulaca oleracea L.
|
+
|
+
|
+
|
C
|
Pal
|
|
RHAMANACEAE (1)
|
|
|
|
|
|
|
137 Ziziphus mauritiana Lam
|
|
|
+
|
P
|
As
|
|
RHIZOPHORACEAE (1)
|
|
|
|
|
|
|
138 Rhizophora racemosa G.-F.-W.Mey.
|
+
|
|
|
P
|
Pant
|
|
RUBIACEAE (3)
|
|
|
|
|
|
|
139 Mitracarpus scaber Zucc.
|
+
|
+
|
+
|
T
|
As
|
|
140 Mitragyna inermis (W.) O.Ktze
|
|
|
+
|
P
|
Sz
|
|
141 Spermacoce verticillata L.
|
+
|
+
|
+
|
P
|
Afram
|
|
SALVADORACEAE (1)
|
|
|
|
|
|
|
142 Salvadora persica L.
|
+
|
+
|
+
|
P
|
Sz
|
|
SCROPHULARIACEAE (1)
|
|
|
|
|
|
|
143 Scoparia dulcis L.
|
+
|
+
|
+
|
C
|
Pant
|
|
SOLANACEAE (1)
|
|
|
|
|
|
|
144 Physalis angulata L.
|
|
|
+
|
T
|
Pant
|
|
SPHENOCLEACEAE (1)
|
|
|
|
|
|
|
145 Sphenoclea zeylanica Gaertn.
|
+
|
+
|
+
|
T
|
Pant
|
|
TAMARICACEAE (1)
|
|
|
|
|
|
|
146 Tamarix senegalensis DC.
|
+
|
+
|
+
|
P
|
Afr
|
|
VERBENACEAE (1)
|
|
|
|
|
|
|
147 Phyla nodiflora (L.) Green.
|
|
|
+
|
P
|
Afram
|
|
ZYGOPHYLLACEAE (1)
|
|
|
|
|
|
|
148 Zygophyllum waterlotii Maire.
|
|
|
+
|
C
|
Sahm
|
|
PTERIDOPHYTES
|
|
|
|
|
|
|
AZOLLACEAE (1)
|
|
|
|
|
|
|
149 Azolla pinnata R.Br.var.africana (Desv.)
Bak.
|
+
|
+
|
+
|
Hy na
|
Pal
|
|
MARSILEACEAE (1)
|
|
|
|
|
|
|
150 Marsilea minuta L.
|
+
|
+
|
+
|
Hy na
|
Pant
|
|
SALVINIACEAE (1)
|
|
|
|
|
|
|
151 Salvinia molesta D.Mitch.
|
+
|
+
|
+
|
Hy na
|
Cosm
|
|
Totaux
|
91
|
100
|
129
|
|
|
40
Les investigations sur le terrain ont permis d'inventorier 151
espèces réparties dans 47 familles et
102 genres. La répartition systématique de la
flore se présente ainsi (tableau 1) :
- sur les 151 espèces, il y a 63
monocotylédones, 85 dicotylédones, 3 ptéridophytes;
- les 102 genres se répartissant en 37
monocotylédones, 62 dicotylédones, 3 ptéridophytes;
- et les 47 familles se subdivisent en 12 familles de
monocotylédones, 32 de dicotylédones, et 3 de
ptéridophytes.
La répartition des espèces dans les 3 zones
étudiées se présente ainsi (tableau 2) :
- 91 espèces dans le fleuve,
- 100 dans le lac de Guiers
- et 129 espèces dans les zones basses inondables du
delta.
41
La diversité spécifique paraît plus
élevée dans les zones basses inondables, ensuite dans le lac et
enfin dans le fleuve.
Le nombre d'espèces et de genre des dicotylédones
est plus élevé que chez les monocotylédones (tableau
2).
Les mêmes ptéridophytes sont observées dans
les 3 types de zones étudiées.
La répartition taxonomique du nombre de genres et
d'espèces par famille dans les 3 zones est présentée dans
le tableau 2.
Tableau 2 - Structure systématique de la flore
|
Fleuve Sénégal
|
Lac de Guiers
|
Zones basses inondables
|
Ensemble delta
|
|
NE
|
%
|
NE
|
%
|
NE
|
%
|
NE
|
%
|
|
Monocotylédones
|
46
|
50,6
|
48
|
48
|
47
|
36,5
|
63
|
41,7
|
|
Dicotylédones
|
42
|
46,1
|
49
|
49
|
79
|
61,2
|
85
|
56,2
|
|
Ptéridophytes
|
3
|
3,4
|
3
|
3
|
3
|
2,3
|
3
|
2,1
|
|
Total
|
91
|
99
|
100
|
100
|
129
|
100
|
151
|
100
|
Légende : NE : nombre d'espèce
Le pourcentage des espèces de dicotylédones est
plus élevé dans les zones basses inondables, ensuite dans le lac
et enfin dans le fleuve.
La proportion des monocotylédones est pratiquement
identique dans les trois milieux étudiés. Les 3
ptéridophytes ont été recensées également
dans les trois types de milieux.
Tableau 3 - Répartition des espèces en fonction des
familles
Zones basses
Fleuve Sénégal Lac de Guiers Ensemble
delta
inondables
|
FAMILLE
|
NG
|
NE
|
NG
|
NE
|
NG
|
NE
|
NG
|
NE
|
|
MONOCOTYLEDONES
|
|
|
|
|
|
|
|
|
|
POACEAE
|
18
|
22
|
17
|
24
|
15
|
22
|
17
|
26
|
|
CYPERACEAE
|
6
|
17
|
5
|
16
|
8
|
17
|
9
|
23
|
|
PONTEDRIACEAE
|
0
|
0
|
0
|
0
|
2
|
3
|
2
|
3
|
|
NAJADACEAE
|
1
|
2
|
1
|
2
|
0
|
0
|
1
|
2
|
|
POTAMOGETONACEAE
|
1
|
2
|
1
|
2
|
0
|
0
|
1
|
2
|
|
ALISMATACEAE
|
0
|
0
|
0
|
0
|
0
|
1
|
1
|
1
|
|
ARACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
42
ARECACEAE
|
0
|
0
|
0
|
0
|
1
|
1
|
1
|
1
|
|
COMMELINACEAE
|
0
|
0
|
0
|
0
|
0
|
1
|
1
|
1
|
|
HYDROCHARITACEAE
|
0
|
0
|
1
|
1
|
0
|
0
|
1
|
1
|
|
LEMNACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
TYPHACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
Sous total
|
29
|
46
|
28
|
48
|
29
|
48
|
37
|
63
|
|
DICOTYLEDONES
|
|
|
|
|
|
|
|
|
|
FABACEAE
|
7
|
10
|
8
|
15
|
12
|
22
|
12
|
23
|
|
AMARANTHACEAE
|
1
|
1
|
3
|
4
|
5
|
7
|
5
|
7
|
|
ASTERACEAE
|
2
|
2
|
2
|
2
|
5
|
5
|
5
|
5
|
|
CHENOPODIACEAE
|
0
|
0
|
0
|
0
|
4
|
4
|
4
|
4
|
|
CONVOLVULACEAE
|
2
|
3
|
2
|
3
|
2
|
4
|
2
|
4
|
|
AIZOACEAE
|
2
|
2
|
2
|
2
|
2
|
3
|
2
|
3
|
|
BORRAGINACEAE
|
1
|
1
|
1
|
1
|
2
|
3
|
2
|
3
|
|
CAPPARACEAE
|
0
|
0
|
0
|
0
|
0
|
3
|
3
|
3
|
|
OENOTHORACEAE
|
1
|
3
|
1
|
3
|
1
|
2
|
1
|
3
|
|
RUBIACEAE
|
2
|
2
|
2
|
2
|
3
|
3
|
3
|
3
|
|
LYTHRACEAE
|
1
|
1
|
2
|
2
|
2
|
2
|
2
|
2
|
|
MENYANTHACEAE
|
1
|
1
|
1
|
2
|
0
|
0
|
1
|
2
|
|
NYMPHAEACEAE
|
1
|
2
|
1
|
2
|
1
|
2
|
1
|
2
|
|
POLYGONACEAE
|
1
|
2
|
1
|
2
|
0
|
0
|
1
|
2
|
|
PORTULACACEAE
|
1
|
2
|
1
|
2
|
1
|
2
|
1
|
2
|
|
ACANTHACEAE
|
0
|
0
|
0
|
0
|
1
|
1
|
1
|
1
|
|
AVICENNIACEAE
|
1
|
1
|
0
|
0
|
1
|
1
|
1
|
1
|
|
CELASTRACEAE
|
0
|
0
|
0
|
0
|
1
|
1
|
1
|
1
|
|
CERATOPHYLLACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
CUCURBITACEAE
|
1
|
1
|
0
|
0
|
1
|
1
|
1
|
1
|
|
EUPHORBIACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
LENTIBULARIACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
OROBANCHACEAE
|
0
|
0
|
0
|
0
|
0
|
1
|
1
|
1
|
|
RHAMANACEAE
|
0
|
0
|
0
|
0
|
1
|
1
|
1
|
1
|
|
RHIZOPHORACEAE
|
1
|
1
|
0
|
0
|
0
|
0
|
1
|
1
|
|
SALVADORACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
SCROPHULARIACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
SOLANACEAE
|
0
|
0
|
0
|
0
|
1
|
1
|
1
|
1
|
|
SPHENOCLEACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
TAMARICACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
VERBENACEAE
|
0
|
0
|
0
|
0
|
1
|
1
|
1
|
1
|
|
ZYGOPHYLLACEAE
|
0
|
0
|
0
|
0
|
1
|
1
|
1
|
1
|
|
Sous total
|
33
|
42
|
34
|
49
|
55
|
78
|
62
|
85
|
|
PTERIDOPHYTES
|
|
|
|
|
|
|
|
|
|
AZOLLACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
MARSILEACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
SALVINIACEAE
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
43
Sous total
|
3
|
3
|
3
|
3
|
3
|
3
|
3
|
3
|
|
Totaux
|
65
|
91
|
65
|
100
|
87
|
129
|
102
|
151
|
Légende : NG : nombre de genres ; NE : nombre
d'espèces
Pour l'ensemble de la flore des milieux humides, la proportion
est de 41,7 % de monocotylédones, 56,2 % de dicotylédones et 2,1
% de ptéridophytes pour les espèces; 36%, 60 % et 2% pour les
genres; 25%, 68 %, 6 % pour les familles. Dans les monocotylédones, les
Poaceae et les Cyperaceae sont les plus abondantes avec
respectivement 26 et 23 espèces. Il est connu que les Cyperaceae
présentent une diversité spécifique plus importante
dans les zones rizicoles plus humides (Johnson, 1997).
Les dicotylédones sont beaucoup plus
représentées dans les zones basses inondables, ensuite dans le
lac et enfin dans le fleuve.
Le nombre d'espèces monocotylédones est
pratiquement le même dans les 3 zones étudiée soit une
quarantaine d'espèces. Il en est de même pour les
ptéridophytes (3 espèces) (Figure 12).
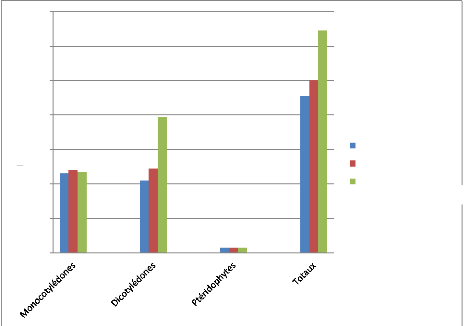
Fleuve Sénégal Lac de Guiers
Milieux humides divers Zones basses inondables
Nombre Espèces
140
120
100
40
80
60
20
0
Figure 12 - Grands groupes systématiques de macrophytes
recensés dans les 3 zones étudiées
44
Les Pontederiaceae sont représentées
par 3 espèces tandis que les Potamogetonaceae et les
Najadaceae par 2 espèces. Les autres familles de
monocotylédone : Typhaceae, Alismataceae, Araceae, Hydrocharitaceae,
Lemnaceae et Commelinaceae ne comptent chacune qu'une seule
espèce.
Dans les dicotylédones, une trentaine de famille
regroupe les 85 espèces. La famille des Fabaceae est
la plus importante avec 23 espèces, puis suivent les Amaranthaceae
(7 espèces), les Asteraceae (5 espèces), les
Chenopodiaceae et Convolvulaceae (4 espèces),
Oenothoraceae, Rubiaceae et Boraginaceae (3 espèces).
Les autres familles sont représentées par 2 ou 1
espèce.
Les 3 familles de Ptéridophytes observées sont
toutes des plantes aquatiques exclusives et unigénériques.
En comparant la flore macrophytique dans les 3 zones
étudiées, la diversité des espèces paraît
plus élevée dans les zones basses inondables (129
espèces), ensuite dans le lac de Guiers (100 espèces) et enfin
dans le fleuve Sénégal (91 espèces). Le nombre de genres
et de familles sont dans les mêmes proportions. Les différences
floristiques observées pourraient être liées en partie
à la vitesse des courants d'eau et à la salinité. Le
mouvement des eaux est moins rapide successivement dans les zones basses
inondables, ensuite dans le lac et enfin dans le fleuve. La zone amont du
barrage, dans laquelle sont situés les sites étudiés,
évolue vers un écosystème où les mouvements d'eaux
deviennent de plus en plus lents.
La plus grande diversité spécifique a
été trouvée dans les zones basses inondables ; cela n'est
pas surprenant compte tenu de la forte artificialisation et de
l'hétérogénéité des ces milieux qui sont
cultivées ou à en jachères, ensuite suivent le lac et
enfin le fleuve.
En 1933-34, dans la définition des groupements
végétaux des milieux aquatiques au Sénégal,
Trochain (1940) a effectué près de 53 relevés de la
végétation dans le delta et le lac de Guiers. L'analyse de ces
relevés révèle 79 espèces réparties dans 56
genres et 28 familles. Les Poaceae (23 espèces) et les
Cyperaceae (18 espèces) sont dominantes.
Dans un inventaire des plantes adventices des casiers de riz
nouvellement installés à Richard-Toll, Adam (1960) a
classé 29 espèces dans les plantes aquatiques, "sub-aquatiques"
et les hélophytes.
Dans les rizières de Camargues en France, Marnotte
et al. (2006) ont inventorié 178 espèces parmi
lesquelles 45 espèces sont des aquatiques. Les Poaceae et les
Cyperaceae constituent également les familles dominantes en
milieux aquatiques comme dans le delta et le lac de Guiers.
45
La végétation de la Niaye inondée aux
environs de Kayar est caractérisée par la dominance de cinq
espèces de Fougères et recèle des espèces rares et
contient un nombre total d'espèces plus réduit que la Niaye
simplement humide (Raynal, 1963).
Des 3 genres de ptéridophytes aquatiques
observés dans le lac de Guiers seul Marsilea est
mentionné dans la flore du lac Tamna et de ses environs (Raynal, 1963).
La faible représentation des ptéridophytes dans la flore a
été observée dans d'autres régions humides en
Afrique. En milieux aquatiques et humides au Niger, 4 genres et 4
espèces de ptéridophytes ont été mentionnés
(Garba, 1985). En Côte d'Ivoire, 8 genres, 8 espèces ont
été cités (Traoré, 1985). Les conditions en Afrique
soudanienne et sahélienne ne sont pas souvent favorables au
développement des ptéridophytes (Tardieu-Blot, 1953 ;
Tardieu-Blot, 1957).
Dans quelques mares temporaires du Sénégal
Oriental, dispersées dans la savane des environs de Tambacounda, la plus
part des espèces qui participent à la végétation
palustre sont annuelles et on note l'absence de Bryophytes. Ces deux
particularités caractérisent la végétation des
dépressions humides ou inondées du Sahel et du Soudan (Vanden
Berghen, 1990). L'alternance des saisons fait que ces substrats subissent, au
cours de l'année, une phase de dessèchement intense et une phase
de végétation active. Très peu d'espèces sont
communes entre la flore de ces pièces d'eau alimentées uniquement
par les eaux de pluies et se développant sur un substrat plus acide
qu'au lac de Guiers et s'asséchant plus ou moins rapidement pendant la
saison sèche.
Dans le parc du Niokolo-Koba, il a été
dénombré dans les mares, marécages et prairies humides et
savanes herbeuses des vallées, 160 espèces relevant de 106 genres
et 43 familles (Schneider et Sambou, 1975). Le nombre de genres est quasiment
le même pour les monocotylédones et les dicotylédones. Les
familles dicotylédones (26) représentent près de la
moitié du nombre total des familles (43). Il en est de même pour
le nombre d'espèces avec 76 espèces dicotylédones et 83
espèces monocotylédones et 1 espèce de
ptéridophyte.
L'inventaire des herbacées dans le complexe
écologique du Niokolo Badiar a indiqué par ailleurs 230
espèces réparties dans 131 genres appartenant à 40
familles (Sarr, 1997). Dans la florule herbacée du parc, il y a une
nette dominance des espèces graminéennes
représentées par 92 espèces regroupées dans 51
genres. Les Poaceae annuelles sont plus abondantes et sont
représentées par 51 espèces, 31 genres tandis que les
Poaceae vivaces font 23 espèces appartenant à 18 genres (Sarr,
1997).
Toutefois, si certaines espèces autochtones comme
Azolla africana peuvent être conservées et
utilisées comme engrais vert en riziculture par exemple, en revanche
d'autres comme Salvinia molesta, espèce introduite devenue
invasive dans le delta, provoquent d'importantes nuisances sur
46
les activités et les conditions de vie des hommes et
constituer un frein à l'exploitation des ressources. Aussi un
contrôle et une gestion rigoureuse d'introduction de nouvelles
espèces dans ce type de milieu particulier doivent-ils être mis en
oeuvre.
2.3.2 Spectre biologique
Le tableau 3 et la Figure 12 montrent que dans l'ensemble du
delta, les thérophytes, les hélogéophytes et les
phanérophytes sont les plus abondants et représentent ensemble 66
% des espèces. Ces types biologiques sont suivis par les
chaméphytes, hydrogéophytes qui constituent près de 10 %
tandis que les hydrohémicryptophytes, le hydrothérophytes et les
plantes parasites sont en proportion faible, moins de 6 %.
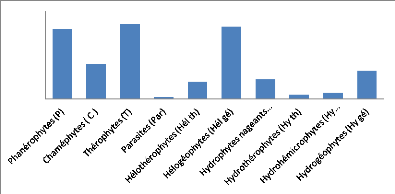
40
35
30
25
20
15
10
0
5
32
16
34
1
8
33
9
2 3
13
Figure 13 - Nombre d'espèces recensées par type
biologique
Les thérophytes, les phanérophytes et les
hélogéophytes sont beaucoup plus abondants dans les zones basses
inondables, ensuite dans le lac et enfin dans le fleuve (Figure 13). La
proportion des hélogéophytes, des hydrohémicryptophytes,
des hydrophytes nageants et des hélothérophytes parait similaire
dans la florule des 3 zones étudiées. Les thérophytes sont
plus nombreux dans les zones basses inondables, ensuite dans le lac et enfin
dans le fleuve. Les hydrogéophytes sont en proportion plus grande dans
le lac ensuite dans le fleuve et sont très peu présents dans les
zones basses inondables. La seule plante parasite (Cistanche
phelipaea) recensée en milieu humide a été
trouvée dans les zones basses inondables.
47
Tableau 4 - Types biologiques des espèces
recensées
|
Milieu
Type biologique
|
Fleuve Sénégal
|
Lac de Guiers
|
Zones basses inondables
|
Ensemble delta
|
|
NE
|
%
|
NE
|
%
|
NE
|
%
|
NE
|
%
|
|
Phanérophytes (P)
|
12
|
13
|
14
|
14
|
30
|
23
|
32
|
21
|
|
Chaméphytes (C)
|
11
|
12
|
10
|
10
|
16
|
13
|
16
|
11
|
|
Thérophytes (T)
|
18
|
20
|
21
|
21
|
33
|
26
|
34
|
23
|
|
Parasites (Par)
|
0
|
0
|
0
|
0
|
1
|
1
|
1
|
0,5
|
|
Hélothérophytes (Hél th)
|
3
|
3
|
2
|
2
|
7
|
5
|
8
|
5
|
|
Hélogéophytes (Hél gé)
|
25
|
27
|
29
|
29
|
24
|
19
|
33
|
22
|
|
Hydrophytes nageants (Hy na)
|
7
|
8
|
7
|
7
|
9
|
7
|
9
|
6
|
|
Hydrothérophytes (Hy th)
|
2
|
2
|
2
|
2
|
0
|
0
|
2
|
0,5
|
|
Hydrohémicrophytes (Hy hém)
|
3
|
3
|
3
|
3
|
3
|
2
|
3
|
2
|
|
Hydrogéophytes (Hy gé)
|
10
|
11
|
12
|
12
|
5
|
4
|
13
|
9
|
|
Total
|
91
|
99
|
100
|
100
|
129
|
100
|
151
|
100
|
|
Légende : NE : nombre d'espèce
|
|
|
|
|
|
En analysant les formes biologiques des espèces
aquatiques (tableau 3), les hélogéophytes constituent la
moitié des types biologiques (49 %), suivent les
hydrogéophytes (19 %), les hydrophytes nageants (13 %)
et les hélothérophytes (12%). Ces 4 types biologiques
constituent plus de 90 % des formes biologiques des macrophytes aquatiques. Les
hydrohémicryptophytes et les hydrothérophytes
sont les moins représentées dans la flore des milieux
humides et aquatiques.
2.3.3. Spectre chorologique
Les affinités chorologiques (Figure 14)
révèlent que les espèces pantropicales (48), les
espèces paléotropicales (26), les espèces
guinéennes-soudano-zambéziennes (26) et les espèces
cosmopolites (19) sont les plus abondantes. Elles représentent
près de 80 % des taxons recensés (tableau 4). Les espèces
Afro-asiatiques (16), Afro-américaines (7) et
Saharo-méditerranéennes (2) sont très faiblement
représentées.
48
60
|
|
|
50
|
48
|
|
40
|
|
|
|
|
30
|
|
|
26 26
|
|
19
|
|
|
|
|
|
|
|
20
|
|
|
|
|
|
|
|
|
16
|
|
|
10
|
|
|
|
|
|
|
|
|
|
|
7 7
|
|
0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cosm Pant Pal Afr As Afram Sz
|
Figure 14 - Type chorologique des macrophytes recensés
Les taxons des milieux humides du delta sont
généralement à très large répartition
géographique.
Les espèces pantropicales sont les plus nombreuses.
Elles sont suivies par les paléotropicales, les espèces
soudano-guinéenne-zambéziennes et les cosmopolites. Les taxons
des différents groupes sont dans les mêmes proportions dans les 3
milieux. Les espèces pantropicales sont plus nombreuses dans les zones
basses inondables et sont pratiquement en nombre égal dans le lac et
dans le fleuve. Quant aux espèces afro-asiatiques,
afro-américaines et soudano-zambéziennes elles sont faiblement
représentées dans la flore aquatique et des milieux humides. Les
espèces saharo-méditerranéennes n'ont été
observées ni dans le lac, ni dans le fleuve. Elles ont été
trouvées uniquement dans les zones basses inondables.
La dominance des espèces pantropicales et
paléotropicales a été observée également en
milieux humides sahéliens au Burkina Faso (Ouedraogo, 1994).
49
Tableau 5 - Chorologie des espèces recensées
|
Milieu Chorologie
|
Fleuve Sénégal
|
Lac de Guiers
|
Zones basses inondables
|
Ensemble delta
|
|
N E
|
%
|
NE
|
%
|
NE
|
%
|
NE
|
%
|
|
Cosm
|
11
|
12
|
15
|
15
|
17
|
13
|
19
|
13
|
|
Pant
|
36
|
40
|
37
|
37
|
41
|
32
|
48
|
32
|
|
Pal
|
20
|
22
|
19
|
19
|
22
|
17
|
26
|
17
|
|
Afr
|
11
|
12
|
15
|
15
|
19
|
15
|
26
|
17
|
|
As
|
5
|
5
|
6
|
6
|
15
|
12
|
16
|
11
|
|
Afram
|
3
|
3
|
3
|
3
|
7
|
5
|
7
|
4,5
|
|
Sz
|
5
|
3
|
5
|
5
|
5
|
4
|
7
|
4,5
|
|
Sahm
|
0
|
0
|
0
|
0
|
2
|
2
|
2
|
1
|
|
Total
|
91
|
99
|
100
|
100
|
129
|
100
|
151
|
100
|
Légende
Cosm : espèces cosmopolites; Pant:
espèces pantropicales ; Pal: espèces paléotropicales
; Afr: espèces guineo-soud.-zambézienne ; As :
espèces afro-asiatiques; Afram : espèces afro-américaines
; Sz : espèces guinéenne-soudano-zambéziennes; Sz:
espèces soudano-zambéziennes ; Sahm : espèces
saharo-méditerranéennes
Compte tenu de la grande diversité des formes et les
types biologiques rencontrés, il s'est avéré
intéressant d'établir une typologie des macrophytes et de
présenter avec plus de détails les principales espèces
végétales vasculaires rencontrées afin de mieux cerner
l'écologie générale de la région à travers
l'examen de la flore et rassembler des éléments pour la
préparation d'un manuel pouvant aider à identifier et à
déterminer les macrophytes des zones humides du delta du fleuve
Sénégal et le lac de Guiers en particulier et du territoire
Sénégalais en général.
2.3.4 Typologie et présentation de quelques
espèces communes
Le Delta du Sénégal et le lac de Guiers, du fait
de leur position géographique la plus septentrionale au
Sénégal, du relief plat et aussi de l'influence de la mer et des
barrages, présentent un paysage contrasté allant
d'écosystèmes terrestres semi-arides et arides aux
écosystèmes semi-aquatiques et aquatiques, salés,
saumâtres ou d'eau douce.
50
Ces caractéristiques géographiques et
écologiques leur confèrent une diversité biologique
relativement importante par rapport au statut de zone strictement
sahélienne.
Dans cette diversité biologique, les macrophytes
aquatiques, bien que relativement moins importants comparés aux autres
composantes terrestres, et peu connus présentent cependant une grande
diversité. Les plantes aquatiques sont quelquefois polymorphes et
certains genres posent des problèmes de taxonomie. Leur
variabilité morphologique marquée en rapport avec leur
attachement au substrat ainsi que le développement dans l'eau sont
souvent source de difficultés d'identification. En effet,
l'étendue des aires de répartition continues ou discontinues,
leur attachement au substrat ainsi que le niveau de développement des
plantes dans l'eau entraînent des variations morphologiques secondaires
qui compliquent leurs déterminations. A cela s'ajoutent, les
problèmes de synonymie très fréquents et le manque
d'informations scientifiques sur certaines espèces. Un manuel simple
facilitant l'identification des plantes aquatiques est essentiel pour leur
étude et leur gestion.
Il s'agit d'apporter ici une contribution à une
meilleure connaissance et à la détermination simple des
espèces de plantes aquatiques vasculaires (Ptéridophytes et
Spermaphytes) des eaux douces du nord du Sénégal. Il se propose
de :
- analyser la structure de la flore hydrophytique ;
- établir une typologie des macrophytes suivant leur
fixation ou non au substrat et le
développement des différents organes;
- préciser la position systématique des
espèces et présenter leurs principaux caractères
botaniques; - établir la distribution géographique et
l'écologie des principales espèces;
- présenter une figuration de l'espèce qui
aiderait à la reconnaitre plus facilement ; une bonne illustration
facilite souvent l'identification. Ce travail a porté sur 48 des 151
taxons inventoriés. Les espèces présentées ont
été choisie en raison de leur appartenance aux hydrophytes et
hélophytes, leur fréquence dans la zone, leur dominance ou encore
leurs particularité botanique ou écologique.
Les macrophytes aquatiques inventoriés peuvent dans un
premier temps être répartis dans 4 groupes:
- les espèces d'hydrophytes stricto sensu
répertoriées sont au nombre de 21 (3 ptéridophytes, 8
dicotylédones et 10 monocotylédones). Le nombre total des
familles est de 15 (3 ptéridophytes, 6 dicotylédones et 6
monocotylédones) et celui des genres est de 16 (3 ptéridophytes,
6 dicotylédones et 7 monocotylédones). Les quinze (15) familles
d'hydrophytes stricto sensu (tableau 6) représentent 15
51
% des taxons recensés. Dans ce groupe sont incluses les
2 espèces ligneuses de la mangrove, Avicennia germinans et
Rhizophora racemosa.
- les espèces de plantes aquatiques vasculaires
appartenant à des familles non strictement aquatiques sont au nombre de
66 (24 dicotylédones et 42 monocotylédones). Le total des
familles est de 13 (10 dicotylédones et 3 monocotylédones) et les
genres est de 39 (17 dicotylédones et 22 monocotylédones).
- treize (13) espèces recensées sont
fréquentes dans les zones salées humides avec 4 espèces de
la famille des Chenopodiaceae.
- 55 taxons sont des espèces accidentelles ou
ubiquistes de terrains humides faiblement salés ou non. Dans les
monocotylédones, le plus grand nombre de macrophytes aquatiques est
rencontré chez les Cyperaceae (23 espèces) et les
Poaceae (17 espèces) tandis que chez les dicotylédones,
les Fabaceae (8 espèces) sont les plus nombreuses, suivent les
Lythraceae, Oenothoraceae et Polygonaceae avec
chacune 2 espèces. Les autres familles, Acanthaceae,
Amaranthaceae, Asteraceae, Convolvulaceae,
Rubiaceae et Sphenocleaceae ne comportent qu'une seule
espèce (tableau 7).
Tableau 6 - Synopsis des familles des hydrophytes stricto
sensu
Famille Nbre genre Espèces
MONOCOTYLEDONES
ALISMATACEAE (1) 1
Limnophyton obtusifolium
HYDROCHARITACEAE (1) 1
Vallisneria aethiopica
LEMNACEAE (1) 1 Lemna
aequinoctialis
NAJADACEAE (2) 1 Najas
marina, Najas pectinata
PONTEDERIACEAE (3) 2
Eichhornia natans, Eichhornia
crassipes, Heteranthera
callifolia
POTAMOGETONACEAE (2) 1
Potamogeton octandrus, Potamogeton schweinfurthii
DICOTYLEDONES
AVICENNIACEAE (1) 1
Avicennia germinans
CERATOPHYLLACEAE (1) 1
Ceratophyllum demersum
LENTIBULARIACEAE (1) 1
Utricularia stellaris
MENYANTHACEAE (2) 1
Nymphoides ezannoi, Nymphoides indica
NYMPHAEACEAE (2) 1 Nymphaea
lotus, Nymphaea micrantha
RHIZOPHORACEAE (1) 1
Rhizophora racemosa
PTERIDOPHYTES
AZOLLACEAE (1) 1 Azolla
pinnata var.africana
52
MARSILEACEAE (1) 1 Marsilea
minuta
SALVINIACEAE (1) 1 Salvinia
molesta
Légende : Le nombre d'espèce est indiqué
entre parenthèses. Tableau 7 - Macrophytes aquatiques d'autres familles
non strictement aquatiques
Famille Nombre de genre Espèce
MONOCOTYLEDONES
ARACEAE (1) 1 Pista stratiotes
CYPERACEAE (23) 9 Bolboschoenus
maritimus, Cyperus alopecuroides, Cyperus
articulatus, Cyperus bulbosus, Cyperus
difformis, Cyperus digitatus, Cyperus dives, Cyperus esculentus,
Cyperus haspan, Cyperus iria, Cyperus laevigatus,
Cyperus maculatus, Cyperus polystachyos,
Cyperus rotondus, Fimbristylis ferruginea, Fuirena
ciliaris,, Fuirena umbellata, Juncus
maritimus, Oxycaryum cubense, Pycreus macrostachyos,
Rhynchospora holoschoenoides Schoenoplectus litoralis, Schoenoplectus
senegalensis
POACEAE (17) 13 Bracharia mutica,
Cynodon dactylon, Diplachne
fusca,
Echinochloa colonum, Echinochloa pyramidalis,
Echinochloa stagnina, Ischaemum rugosum, Oryza barthii, Oryza
longistaminata, Panicum repens, Panicum anabaptistum,
Paspalidium geminatum, Paspalum scrobiculatum,,
Paspalum vaginatum, Phragmites australis,
Vetiveria nigritana, Vossia cuspidata.
DICOTYLEDONES
ACANTHACEAE (1) 1 Hygrophila
auriculata
AMARANTHACEAE (1) 1 Centrostachys
aquatica
ASTERACEAE (1) 1 Ambrosia maritima
CONVOLVULACEAE (1) 1 Ipomoea
aquatica
FABACEAE (8) 5 Acacia nilotica, Acacia
sieberiana, Aeschynomene elaphroxylon,
Mimosa pigra, Neptunia oleracea, Sesbania leptocarpa,
Sesbania sesban, Sesbania pachycarpa
LYTHRACEAE (2) 2 Ammania auriculata,
Lythrum hyssopifolia
OENOTHORACEAE (2) 1
Ludwigia leptocarpa, Ludwigia stolonifera
POLYGONACEAE (2) 1 Polygonum lanigerum,
Polygonum senegalense
RUBIACEAE (1) 1 Mitragyna inermis
SPHENOCLEACEAE (1) 1 Sphenoclea
zeylanica
NB : Le nombre d'espèce est indiqué entre
parenthèses.
La structure de la fiche synoptique pour chaque espèce se
présente de la manière suivante :
· position systématique
·
53
synonymie(s)
· principaux caractères botaniques de
l'espèce (organes végétatifs et reproducteurs)
· distribution : répartition géographique
dans le Monde, en Afrique et au Sénégal
· caractéristiques écologiques
Sur la fiche est présentée également une
illustration en couleur du macrophyte parfois accompagné de dessins de
certains organes. Les illustrations ont été
réalisées à partir d'échantillons frais
récoltés et aussitôt dessinées en vue d'aider
à la reconnaissance des espèces. Pour Centrostachys aquatica
et Vetiveria nigritana il n'y a pas d'images
présentées.
Les familles sont passées en revue dans l'ordre de la
Flore du Sénégal (Berhaut, 1967), genres et espèces se
suivent dans l'ordre alphabétique.
Quarante-huit (48) espèces majeures des milieux humides
de la zone sont passées en revue par ordre alphabétique de nom de
famille en fonction de leur type : macrophytes fixés
émergents (31 espèces appartenant à 10 familles),
macrophytes fixés à feuilles flottantes (6
espèces, 4 familles), macrophytes submergés (7
espèces, 5 familles) et macrophytes libres flottants (5
espèces, 5 familles).
2.3.4.1 Les macrophytes fixés émergents
Dans ce groupe ont été classées les
espèces localisées à l'interface des milieux aquatiques et
terrestres. Ce sont des plantes enracinées ou fixées au substrat,
rhizomateuses ou stolonifères produisant des tiges
végétatives qui sortent de l'eau ou de la terre humide. Elles
sont les plus nombreuses et les plus diversifiées.
Les macrophytes fixés émergents passés en
revue sont :
1. Hygrophila auriculata Acanthaceae
2. Altenanthera sessilis Amaranthaceae
3. Centrostachys aquatica Amaranthaceae
4. Eclipta prostrata Asteraceae
5. Ipomoea aquatica Convolvulaceae
6. Cyperus alopecuroides Cyperaceae
7. Cyperus articulatus Cyperaceae
8. Cyperus difformis Cyperaceae
9. Oxycaryum cubense Cyperaceae
10. Schoenoplectus litoralis Cyperaceae
11. Bolboschoenus maritimus Cyperaceae
12. Aeschynomene elaphroxylon Fabaceae
13.
54
Aeschynomene indica Fabaceae
14. Mimosa pigra Fabaceae
15. Neptunia oleracea Fabaceae
16. Sesbania leptocarpa Fabaceae
17. Ammania auriculata Lythraceae
18. Ludwigia erecta Oenotheraceae
19. Cynodon dactylon Poaceae
20. Diplachne fusa Poaceae
21. Echinochloa colona Poaceae
22. Echinochloa pyramidalis Poaceae
23. Echinochloa stagnina Poaceae
24. Oryza longistaminata Poaceae
25. Panicum repens Poaceae
26. Paspalidium geminatum Poaceae
27. Papalum vaginatum Poaceae
28. Phragmites australis Poaceae
29. Vetiveria nigritana Poaceae
30. Vossia cuspidata Poaceae
31. Typha domingensis Typhaceae
Hygrophila auriculata (SCHUM.) HEINE
ACANTHACEAE
Synonymes : Barleria auriculata
SCHUM., Barleria longifolia LINN., Hygrophila
longifolia (LINN.) KURZ., Asteracantha longifolia (LINN.) NEES.,
Hygrophila spinosa T. ANDERS.
55
Description
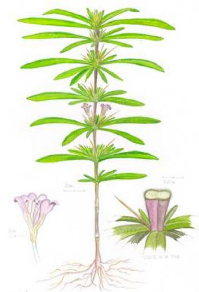
a
b
c
Hygrophila auriculata (Schum.) Heine a. plante
entière ; b. une fleur ; c. section transversale de la tige
Plante herbacée annuelle, haute de 50 à 80 cm, ou
davantage. Tige quadrangulaire. Fleurs bleu mauve, parfois
blanches, en groupe serré à l'aisselle des feuilles, et
entremêlées de bractées nombreuses vertes.
Distribution
Signalée dans plusieurs pays d'Afrique (Mali,
Guinée, Ghana, Togo, Benin, Nigeria, Cameroun, République
Centrafricaine, Congo, Ethiopie, Mozambique, Afrique du Sud). Egalement
présente en Asie tropicale (Inde, Pakistan, Sri Lanka, Thailande,
Vietnam, Malaisie). La plante est commune au Sénégal dans les
terrains marécageux, les rizières, les fossés humides.
Ecologie
Dans le Delta, ce macrophyte est fréquent dans les
rizières et les canaux d'irrigation. Elle croit après le retrait
des eaux. Elle peut former des peuplements purs dans des sols
légèrement natronés.
Alternanthera sessilis (L.) R.BR.ex DC.
AMARANTHACEAE
56
Synonymes : Alternanthera repens (L.) DC,
Achyranthes sessilis (L.) R.BR.ex DC., Alternanthera glabra
MOQ., Gomphrena sessilis L.
|
Description
Herbe annuelle ou pérenne à tiges prostrées
et à feuilles opposées. Tige crassulescente. Les feuilles sont
opposées légèrement elliptiques ou obovales avec la face
supérieure rouge à rouge-violacé. Inflorescence blanche,
dense, axillaire. Fleurs sessiles avec un réceptacle élargi
à la base de la fleur. Jeune fruit aplati, avec une graine.
Distribution
Originaire d'Asie d'après Wildeman, probablement introduit
en Amérique (Lebrun, 1947). Paléotropicale et subtropicale :
Australie tropicale; Asie tropicale ; Afrique tropicale, orientale et australe
; Région méditerranéenne, etc.
|
|
Alternanthera sessilis (L.) R.BR.ex DC
|
Ecologie
Espèce commune au Sénégal surtout dans les
milieux humides. La plante s'installe sur les grèves exondées des
mares eutrophes, les fossés vaseux desséchés. Elle
préfère un substrat riche, un éclairage intense, des
températures entre 20 et 25°C et des pH se situant entre 5,8 et 7,
00. Dans le Delta, la plante est rencontrée sur les sols sableux
fraichement exondés et dans les périmètres
irrigués.
Centrostachys aquatica (R.BR.) WALL.
AMARANTHACEAE
57
Synonyme: Achyranthes aquatica (R.BR.) MOQ.
Description
Herbe robuste pérenne se développe en milieu humide
et aquatique. Feuilles entières et opposées. Limbe ovale ou ovale
lancéolé. Surfaces pubescentes. Epi terminal sur la tige
principale. Fleurs vertes sessiles.
Distribution
Seule espèce signalée en Afrique tropicale
(Ethiopie, Soudan, Kenya, Tanzanie, Ouganda, Nigeria, Sénégal,
Mozambique, Zimbabwe, Botswana) ; En Asie tropicale (Inde, Sri Lanka,
Thailande, Indonésie, Java).
Au Sénégal, la plante a été
signalée surtout dans la région du fleuve.
Ecologie
Peu fréquente dans le delta et le lac de Guiers. Elle
s'installe dans une lame d'eau peu profonde. Se développe sur de sols
variés (sableux à argileux).
Eclipta prostrata L. ASTERACEAE
58
Synonymes: Eclipta alba
(L.)HASSK. ; Verbesina prostrata L.; Eclipta erecta
L.
|
Description
Plante pérenne pouvant être érigée ou
prostrée mesurant entre 20 et 90 cm de haut. Les feuilles sont
opposées, linéaires-lancéolées, dentées.
L'inflorescence est terminale ou axillaire. Les capitules blancs, noircissent
en séchant.
Distribution
Plante originaire d'Europe et d'Asie est devenue cosmopolite
(Bromilow, 2001). La plante est rencontrée à travers le monde:
Inde, Chine, Thaïlande, Brésil, Etats-Unis et Europe. En Afrique :
Kenya, Tanzanie, Ouganda
Ecologie
Fréquente dans les milieux humides au
Sénégal, la plante se rencontre souvent en bordure des canaux et
des parcelles irriguées du delta.
|
|
Eclipta prostrata L.
|
|
Ipomoea aquatica FORSK.
CONVOLVULACEAE
59
Synonymes : Convolvulus repens VAHL. ; Ipomoea
repens ROTH; Ipomoea reptans POIRET ; Ipomoea subdentata
MIQ.
|
Description
Plante herbacée rampante, vivace à tiges
traînantes, glabres, creuses, à sève laiteuse; s'enracinant
aux noeuds. Feuilles variables souvent triangulaires/linéaires, longues
environ 14 cm avec 2 lobes vers la base. Fleurs en entonnoir rose-pâle
à pourpres allant jusqu'à 7 cm de large (Johnson, 1997).
Distribution
Native d'Inde et du sud-est asiatique, la plante a
été cultivée et naturalisée en Asie, en Afrique, en
Australie, etc. La plante est confinée aux zones des tropiques et
sub-tropiques. Elle est présente en Mauritanie, Gambie, Guinée,
Sierra Leone, Ghana, Nigeria, Cameroun, Tchad, République
Centrafricaine, Congo, Angola, Soudan, Afrique Orientale,
|
|
Ipomoea aquatica FORSK.
|
Ecologie
Au Sénégal, elle est commune des milieux humides
et les plans d'eau. Très fréquente dans le lac de Guiers, le
fleuve et les rizières inondées du delta. La plante croit
rapidement sur les sols humides. Son développement est freiné par
des températures en dessous à 23,9 °C.
Cyperus alopecuroides ROTTB.
CYPERACEAE
60
Synonymes: Juncellus alopecuroides (ROTTB.) C.B. CLARKE;
Cyperus dives DEL.
|
Description
Herbe pérenne faiblement rhizomateuse, haute de 50
à 150 cm. Feuilles insérées sur la partie
inférieure de la tige. L'inflorescence est une pseudo-ombelle
composée avec des épis sub-cylindriques.
Distribution
Espèce paléotropicale. Yémen, Israel, Indes,
Pakistan, Sri Lanka, Indochine, Indonésie, Australie, Guadeloupe. Iles
Canaries, Egypte, Erythrée, Ethiopie, Somalie, Kenya, Tanzanie, Burkina
Faso, Ghana, Mali, Mauritanie, Niger, Nigeria, Botswana, Afrique du Sud,
Swaziland, Madagascar
Au Sénégal, dans les « Niayes », Cap
Vert, Sine Saloum, Basse et Haute Casamance.
Fréquente dans le lac de Guiers, le fleuve
Sénégal et ses affluents et dans les rizières mal
entretenues.
|
|
Cyperus alopecuroides ROTTB.
|
|
Ecologie
La plante se développe dans les eaux douces stagnantes par
pieds isolés ou en peuplements étendus sur des sols plus ou moins
argileux. Fleurie en octobre-novembre (Vanden Berghen, 1988).
Cyperus articulatus L.
CYPERACEAE
Synonymes: Cyperus borbonicus STEIJD.; Cyperus
corymbosus ROTTB.; Cyperus niloticus FORSK.
61
Description

b
a
Cyperus articulatus L.
a. plante entière, b. Epillets
Plante vivace à longs rhizomes horizontaux. Tiges
dressées avec des articles visibles notamment quand la plante est
sèche, glabres, hautes de 80- 150 cm, cylindriques, creuses. Feuilles
insérées sur la partie inférieure de la tige,
réduite à une gaine ou à limbe linéaire.
Inflorescence en forme de pseudo-ombelle simple ou composée
Distribution
Espèce pantropicale et subtropicale.
Pousse un peu partout au Sénégal (Bas
Sénégal, région des « Niayes », Sine Saloum,
Basse Casamance à l'Est).
Ecologie
La plante constitue çà et là des ilots de
végétation quelquefois denses aussi bien dans le lac de Guiers
que dans les endroits calmes du fleuve et ses affluents. La plante peut
être également observée dans les parcelles
irriguées. Hydro-géophyte poussant sur des sols
périodiquement inondés, dans les eaux stagnantes ou faiblement
courantes, souvent alternativement douces et salées. Floraison:
août-octobre. Son système radiculaire robuste rend difficile son
élimination dans les parcelles
Cyperus difformis L. CYPERACEAE
Synonymes: Cyperus complanatus FORSK., Cyperus
holoschoenoides JAN., Cyperus oryzetorum STEUD., Cyperus
protractus L.
Description
b
a
Cyperus difformis L.
a. plante entière, b. épillets
Herbe annuelle avec des inflorescences globuleuses,
encadrées par quelques bractées. La section de la tige est
triangulaire. Feuilles linéaires de 3-4 mm de large, à ligule
membraneuse. L'inflorescence est une ombelle composée, munie d'une
bractée beaucoup plus longue que les autres.
Distribution
Pantropicale et subtropicale. Connue partout en Afrique (Lebrun,
1947) ; Madagascar, Maurice et la Réunion, répandue en Europe du
Sud, Asie, Amérique du Nord et Centrale (Wild, 1961).
Ecologie
Répandue, commune et souvent dominante ; sa croissance
rapide et sa production précoce de graines font d'elle une des plus
sérieuses adventices du riz en Afrique de l'Ouest (Johnson, 1997).
Gênant dans les champs de riz à Madagascar.
62
Aux Philippines, il a été signalé que les
infestations des rizières par Cyperus difformis peuvent
régresser en augmentant la profondeur de l'eau (Wild, 1961).
Dans le Delta, on la rencontre au bord des mares vaseuses, sur
des sols humides et inondés des rizières, les fossés et
les mares à la lisière des terres salées. Plante
nitrophile.
63
Oxycaryum cubense (POEPPIG ET KUNTH) LYE
CYPERACEAE
Synonyme : Scirpus cubensis POEPPIG ET KUNTH
|
Description
Plante vivace à rhizomes longs de 5-20 cm. Tiges
dressées, enracinées aux noeuds inférieurs. Feuilles
insérées sur la partie inférieure de la tige, à
limbe longs de 40 à 90 cm. Inflorescence, un glomérule
d'épillets ou, plus fréquemment, une pseudo-ombelle
Distribution
Du Mexique au Paraguay en Amérique, et largement
répandue en Afrique Tropicale. Existe aussi à Madagascar (WiId,
1961). Oxycarym cubense est l'une des premières espèces
à coloniser Salvinia auriculata dans le lac Kariba (Zimbabwe)
et forme des radeaux. Elle est aussi connue comme une plante des radeaux
flottants dans le nord du Zimbabwe et au Zaïre (WiId, 1961).
Au Sénégal, la plante a été
signalée dans le Sine-
|
|
Oxycaryum cubense (POEPPIG ET KUNTH) LYE
|
Sl l HC
|
Ecologie
Elle est fréquente dans le fleuve, le lac de Guiers et le
Bas Sénégal dans les marécages permanents ou presque, en
eaux douces, stagnantes ou faiblement courantes. Floraison : juillet- octobre.
Dans le lac de Guiers et le fleuve, elle est souvent associée à
Pistia stratiotes et fait partie des radeaux flottants
fréquents surtout pendant la saison des pluies.
Schoenoplectus litoralis (SCHRADER) PALLA
CYPERACEAE
Synonymes: Scirpus litoralis
SCHRADER; Schoenoplectus subulatus (VAHL) LYE.
b
a
Schoenoplectus litoralis (SCHRADER) PALLA a. plante
entière, b. épillet
Description
64
Plante pérenne à rhizomes écailleux
épais. Tiges dressées solitaire ou groupées en une touffe
peu fournie. Feuilles insérées sur la partie inférieure de
la tige. L'inflorescence est une pseudo-ombelle.
Distribution
Espèce paléotropicale. Egalement dans tout le
bassin Méditerranéen.
Au Sénégal: Sine Saloum, Basse Casamance.
Fréquente dans le Bas Sénégal, dans les cuvettes de
décantation, les rizières inondées et le lac de Guiers.
Ecologie
La plante préfère des sols légers, humides ;
des eaux stagnantes faiblement à fortement saumâtres dans
lesquelles elle peut former de vastes peuplements. Floraison:
août-décembre
Bolboschoenus maritimus (L.)PALLA
CYPERACEAE
Synonymes : Scirpus maritimus L.;
Schoenoplectus maritimus (L.) LYE
b
a
65
Description
Plante pérenne, haute de 30-120 cm. Tige trigone. Feuilles
inférieures à gaine souvent brune ou brun noir. Inflorescence
habituellement une ombelle simple. Epillets inégalement
pédicellés, brun plus ou moins foncé.
Distribution
Pantropicale, subtropicales et régions
tempérées. Au Sénégal: Sine-Saloum, « Niayes
».
Ecologie
Bolboschoenus maritimus (L.) PALLA a. plante
entière, b. épillets
Dans la région du delta, la plante est une adventice des
rizières de bas-fonds, des cuvettes de sols salés, les
vasières, des marécages côtiers. Elle se développe
dans les eaux peu profondes, plus ou moins saumâtres, où la plante
peut former des peuplements étendus ; également sur des
sédiments temporairement inondés par de l'eau salée ou
saumâtre. Floraison: août-octobre. Supporte
Aeschynomene elaphroxylon (
GUILL. ET PERR.)
TAUB. FABACEAE
Synonymes : Herminiera elaphroxylon
GUILL.ET PERR.; Smithia grandidieri
BAILLON

a
b
Aeschynomene elaphroxylon (
GUILL. ET PERR.) TAUB.
a. rameau fleuri, b. gousse
Description
66
Grand arbuste atteignant plusieurs décimètres de
diamètre, à bois tendre. Les tiges sont gonflées,
aérifères. Feuilles composées. Fleurs en petites grappes,
pétales jaunes. Le fruit est une gousse allongée,
cloisonnée.
Distribution
La plante serait native de Madagascar. Elle se retrouve à
travers l'Afrique tropicale (Nigeria, Ghana, Zimbabwe,...). Elle est
caractéristique du lac Tchad.
Ecologie
Dans le delta, la plante se trouve sur les rives du fleuve
Sénégal et ses affluents aux environs de la ville de St-Louis.
Dans le lac de Guiers, elle est localisée essentiellement à
l'entrée de la Taoué dans l'extrême nord. Pendant les
hautes eaux, des individus se détachent et sont entraînés
par les
Aeschynomene indica L.
FABACEAE
Description
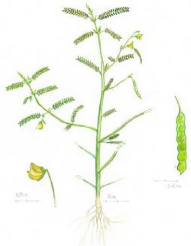
a
b
c
Herbe dressée avec des feuilles paripennées
alternes de 5 à 10 cm de long. Les folioles sont nombreuses, 15-30
paires, linéaires, oblongues, 10 -15 mm de long, arrondies à
l'extrémité. La tige est légèrement
lignifiée et très ramifiée au sommet. Fleurs jaune
pâle. Gousse linéaire, articulée.
Distribution
Originaire probablement d'Amérique. Répandue en
Afrique tropicale du Sénégal en Ethiopie et du nord de la Somalie
au sud du Transvaal et en Namibie, à travers le Sahel sud jusqu'au
Soudan et également à Sao Tomé et Madagascar. La plante
est répandue aussi en zone subtropicale et tropicale d'Asie, d'Australie
et d'Amérique du Nord.
67
Aeschynomene indica L.:
a. plante entière, b. fleur, c. gousse
Ecologie
Dans le delta, elle est fréquente dans les rizières
et les zones marécageuses. La plante préfère les zones
humides et boueuses des plaines d'inondation et le pourtour des pièces
d'eau saisonnières. Souvent croît avec Sesbania sp et
Acacia nilotica. Apparaît sur des sols argileux lourds sujets
à l'inondation et gorgés d'eau. Utilisée parfois comme
engrais vert, pourrait être employée comme fourrage vert dans la
une rotation avec le riz et servir à piéger de l'eau pour la
production de biomasse pour des engrais verts.
Mimosa pigra L.
FABACEAE
Synonyme: Mimosa asperata (WILLD.)
HUMB.et BONPL.
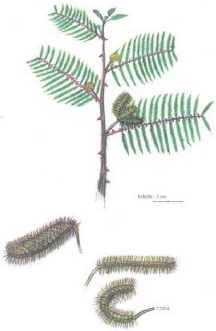
a
b
Mimosa pigra L.
a. rameau avec fleurs et fruits, b. fruits sous
différentes formes
Description
68
Espèce arbustive buissonnante, à branches
épineuses, pérenne pouvant atteindre 3 m de haut. Feuilles
alternes distiques, bipennées à folioles très nombreuses.
Fleurs roses, parfois blanches très petites, groupées en
glomérules, disposées à l'aisselle des feuilles hautes.
Fruit, longue gousse aplatie, velue.
Distribution
Originaire du Mexique, du sud Venezuela et du Bassin central de
l'Amazone (Waterhouse, 1994). Répandue en Amérique Tropicale et
Afrique Tropicale; aussi à Madagascar et Maurice (Wild, 1961).
Sénégal, Mali, Gambie, Guinée, Sierra-Léone,
Côte d'Ivoire, Ghana, Bénin, Nigeria, Cameroun, Tchad,
République centrafricaine, Congo, Angola, Afrique orientale, Afrique du
Sud, Mozambique (Berhaut, 1967).
Ecologie
Gêne les cultures de riz à Madagascar. La plante a
envahi de nombreuses mares dans le parc national du Niokolo Koba où elle
contribue fortement à accélérer la sédimentation et
la disparition progressive de ces pièces d'eau essentielles dans
l'alimentation en eau de la faune sauvage vivant dans le parc.
Dans le delta, elle se développe dans les marécages
et les cours d'eau de faible profondeur. Elle est peu fréquente dans la
région.
Neptunia oleracea LOUR.
FABACEAE
Synonymes: Mimosa natans ROXB.;
Neptunia natans (L.F.) DRUCE ; Neptunia prostrata
(LAM.)BAILL.
69
Description
a
b
Neptunia oleracea LOUR.
a. plante entière avec fleur et fruits, b. gousse
Cette Fabaceae flottante se reconnaît avec sa tige
spongieuse, rampante à la surface de l'eau, par ses noeuds portant
latéralement d'une part des racines adventives nombreuses, par une ou
deux feuilles et suivant les époques (novembre à janvier) une
fleur longuement pétiolée. Les feuilles composées
bipennées sont pourvues à la base d'une stipule membraneuse. Les
gousses sont petites, plates et noirâtres à maturité.
Distribution
Largement répandue en Afrique Tropicale et Madagascar. Il
existe au Zululand (Natal) et est aussi largement répandue en Asie
Tropicale et Amérique (Wild, 1961). Mali, Guinée, Gambie,
Sierra-Léone, Côte d'Ivoire, Ghana, Benin, Nigeria, Burkina,
Tchad, Niger, Congo, Afrique orientale (Berhaut, 1967).
Ecologie
La plante est très fréquente dans le delta du
fleuve et le lac de Guiers ainsi que dans les rizières et les plans
d'eau de faible profondeur
Sesbania leptocarpa DC.
FABACEAE
Synonymes: Sesbania filiformis
GUILL.&PERR. ; Sesbania mossambicensis KLOTZSCH. ;
Sesbania aculeata (WILLD.) PERS.
Description

Plante herbacée annuelle glabre, érigée de 1
à 1,25 mm de hauteur. Feuilles paripennées alternes. Rachis long
de 8 à 10 cm. Fleurs disposées à deux. Corolle jaune,
longue de 10 mm. Fruits : gousses linéaires dressées longues de
10 à 15
cm.
Distribution
Erythrée, Soudan, Mali, Côte d'Ivoire, Ghana,
Nigeria, Niger. La plante serait restreinte à la zone des savanes
africaines (Raynal Roques, 1980)
Ecologie
Dans la vallée du fleuve, lac de Guiers. Les mares,
rizières, bords des cours d'eau, eaux peu profondes, eutrophes.
Espèce fourragère et pouvant constituer un excellent engrais
vert.
70
Sesbania leptocarpa DC.
Ammania auriculata WILLD.
LYTHRACEAE
71
|
Description
Petite herbe annuelle dressée à feuilles
opposées, lancéolées allongées sessiles.
Inflorescence simple ou composée. Petites fleurs groupées, calice
en cloche. Petite capsule sphérique à graines nombreuses. Herbe
dressée, à tiges carrées en section.
Distribution
Originaire d'Afrique du Sud et d'Afrique Orientale. Les
espèces africaines occupent surtout la zone des savanes. Ammania
auriculata est fréquente du Sénégal à
l'Afrique Orientale
Ecologie
La plante aime beaucoup de lumière (héliophile),
des températures entre 25°C et 28°C et des pH entre 6 et 7.
Elle s'installe dans des eaux peu profondes, temporaires, souvent boueuses du
delta.
|
Ammania auriculata WILLD.
Ludwigia erecta (L.)H. HARA
OENOTHERACEAE (=ONAGRACEAE)
Synonymes: Jussiaea erecta L., Jussiaea altissima
PERR. Ex DC, Jussiaea linifolia VAHL., Oenothera virgata
RUIZ et PAV.
Description

Plante érigée, glabre, pouvant atteindre 2 m de
haut; feuilles alternes de 2-13 cm de long, lancéolées à
elliptiques ; pétiole 2-15 mm de long; fleurs solitaires; fruit, un
capsule glabre de 10-19 x 2-2.5 mm brun-pâle
Distribution
Tropiques du Nouveau Monde, à travers toute l'Afrique,
Maurice, Soudan, Angola, Botswana, Malawi, Mozambique, Zambie, Zimbabwe,
Madagascar, Seychelles. Afrique de l'Ouest (Mali).
Ecologie
Mares, bords des rizières et canaux d'irrigation, milieux
humides dans le delta du fleuve Sénégal.
72
Ludwigia erecta (L.) H. HARA
Cynodon dactylon (L.) PERS.
a. plante entière, b. épi et détail d'un
épillet
Cynodon dactylon (L.)PERS. POACEAE
Description
Herbe rampante, pluriannuelle (vivace), s'enracinant aux noeuds
en surface (stolons) ou souterrain (rhizomes). Feuilles souvent
imbriquées et distiques. Les épis sont légèrement
aplatis ; inflorescence violacée, digité.
Distribution
Originaire probablement d'Afrique de l'Est où on le trouve
du niveau de la mer jusqu'à 2160 m d'altitude. La plante peut être
trouvée à travers le monde, dans les régions
tempérées et tropicales. Sous les tropiques, la plante se
développe dans les zones à pluviométrie comprise entre 670
et 1750 m.
Ecologie
Dans la région du lac de Guiers et dans les
périmètres irrigués du delta, la plante est assez commune
et peut se développer sur des sols pauvres au bord des cours d'eau. Elle
affectionne les endroits humides et forme souvent des peuplements purs. Elle
apprécie les climats chauds, les stations sèches et les sols
sablonneux ou limoneux secs et bien éclairés. La plante est
thermophile avec une tendance xérophytique (Mamarot, 2002). Elle peut
résister à de longues sécheresses. Elle est très
compétitive et peut être une mauvaise herbe des cultures non
irriguées.

a
b
73
Diplachne fusca (L.) PAL. BEAUV.
POACEAE
74
Synonymes: Festuca fusca L.; Dip!achne ma!abrica
(L.)MERR., Leptoch!oa fusca (L.) KUNTH.
|
Description
Plante pérenne, cespiteuse aquatique ou semi aquatique,
rhizomateuse haute de 60-150 cm; touffue avec des tiges ascendantes dont la
hauteur varie entre 60 et 150 cm. Inflorescence en panicule, chaque rameau
portant des épillets sessiles disposés en 2 rangs ;
épillets longs de 10-15 mm.
Distribution
Paléotropicale et subtropicale, inclut Australie, Asie,
Kenya, Tanzanie, Ouganda
Au Sénégal, dans le Bas Sénégal et le
lac de Guiers,
Ecologie
La plante se développe sur des bancs de sable, des mares
desséchées avec des sols sablonneux à argileux, humides ou
mouillés inondés périodiquement par l'eau salée.
Parfois en peuplements étendus. Plante assez
tolérante au sel. Il est usuellement le seul macrophyte présent
dans les eaux peu profondes, les marais semi permanentes à eaux
alcalines (Denny, 1985).
|
|
Dip!achne fusca (L.) PAL. BEAUV.
|
|
Floraison : août-septembre-novembre. Des peuplements
importants étaient observés dans la région sud du le lac
de Guiers dans les années 30 (Trochain, 1940) ainsi qu'au début
des années 80 (Thiam, 1984). Ils sont actuellement fortement
réduits du fait des hauteurs d'eau élevées pendant toute
l'année et de la diminution de la salinité.
Echinochloa colona (L.) LINK.
POACEAE
Synonymes: Panicum colonum L., Echinochloa
crus-galli auct, Echinochloa verticillata BERTH.
75
Description
Echinochloa colona (L.) LINK. a. plante entière,
b. racème
a
b
Plante annuelle à tiges ascendantes dressées de 30
à 80 cm de haut, en touffes, à fort tallage. Feuilles alternes
sans ligule, à limbe parfois zoné de brun. Inflorescence
constituée de racèmes simples ascendants, courts, alternativement
disposés sur la tige qui est juteuse. La ligule absente est
remplacée par une trace blanchâtre (critère
d'identification). Epillets courtement pédicellés sans
arête. Talles nombreuses d'abord dressées puis
ultérieurement appliquées au sol.
Distribution
Elle est paléotropicale. Plante hygrophile, à
tendance silicicole, est présente dans de nombreuses régions et
sur divers types de sols, pourvu qu'ils soient suffisamment humides.
Signalée dans de nombreuses régions au Sénégal.
Ecologie
Dans le Delta, la plante est répandue dans les milieux
humides, hydromorphes et faiblement inondés, dans es rizières et
les bas-fonds.
Echinochloa pyramidalis (LAM.)
HITCHC. ET CHASE
POACEAE
Synonymes : Panicum spadiciferum PETER ; Panicum
holubii STAPF. ; Echinochloa senegalensis MEZ; Echinochloa
verticillata BERHAUT; Panicum atroviolaceum A.RICH.

Echinochloa pyramidalis (LAM.)
HITCHC.ET CHASE
Description
76
Large herbe pérenne pouvant atteindre 2m de haut. La
feuille, glauque, rigide, a plus de 70 cm de long et 1-2 cm de large. La ligule
est courte. La tige et les parties inférieures des gaines foliaires sont
jaune-vert. Le limbe est plutôt bleu vert. L'inflorescence mesure environ
30 cm, dressée et étalée en pyramide composée de
nombreux racèmes. Les épillets sont similaires à ceux de
E. stagnina mais diffère par l'absence de barbe.
Distribution
Espèce paléotropicale. Répandue à
travers l'Afrique tropicale et l'Amérique.
Ecologie
Fréquente dans la région du delta, la plante
demande une eau aérée, renouvelée. Elle
préfère des terres argileuses inondées des rives et des
terres moyennement basses. Au retrait des eaux, la plante développe de
nombreux rhizomes et s'enracine profondément.
Echinochloa stagnina (RETZ.) P.BEAUV.
POACEAE
Synonymes : E. scabra (LAM) ROEMER ET SCHULTES;
Panicum scabrum LAM. subsp.lelievrei A. CHEV.; Echinochloa
lelievrei (A.CHEV.) BERHAUT; Panicum sacabrum LAM. subsp.
oryaztorum A.CHEV.; Echinochloa oryzetorum (A.CHEV.)
A.CHEV.
77
Description

a
Echinochloa stagnina (RETZ.) P.BEAUV. a. plante
entière, b. un racème

b
Plante pérenne avec des tiges grosses et spongieuses
pouvant atteindre 2 m de haut. L'inflorescence est une panicule inclinée
avec 5- 15 racèmes, ayant chacun jusqu'à 6 cm de long. Les
épillets portent des barbes.
Distribution
Espèce paléotropicale.
Au Sénégal : Basse Casamance, Haute Casamance,
Haute Gambie.
Ecologie
Dans la région du delta du Sénégal, la
plante colonise les étangs, mares et rizières à fond
argileux, bord des rivières, dans l'eau ou sur la vase récemment
exondés. Elle forme parfois des prairies ou des radeaux flottants sur
les eaux stagnantes ou faiblement courantes ; espèce faiblement
tolérante au sel. Floraison : septembre-novembre-janvier.
Lors de la décrue des eaux, les peuplements d'E.
stagnina sont recherchés par les bergers des troupeaux nomades car
il constitue un excellent fourrage.
Oryza longistaminata
A.CHEV. ET
ROEHR. POACEAE
Synonyme: Oryza perennis AUCT.subsp.barthii
AUCT.
78
Description
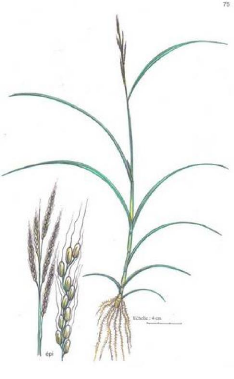
b
a
c
Herbe à tiges dressées ou flottantes pouvant
atteindre 2 m de long. Elle se propage par des rhizomes qui se
développent horizontalement. Les feuilles ont près de 80 cm de
long et 1.3 cm de large. La floraison survient seulement quand la croît
en eau profonde. L'inflorescence fait près de 30 cm de long, les
épillets ressemblent à ceux du riz cultivé excepté
qu'ils ont une barbe de 3 cm long.
Distribution
Afrique tropicale et Afrique du Sud, Madagascar; Bas
Sénégal ; régions du fleuve; Sine-Saloum ; Basse Casamance
; Afrique tropicale et du Sud ; Madagascar (Vanden Berghen, 1991). O.
longistaminata est vivace alors que O. barthii est annuelle et
spécifiquement africain (Duong-Huu-Thoi, 1950).
Ecologie
Oryza longistaminata
A.CHEV. ET ROEHR. a. plante
entière, b. un épi, c. un racème
Dans le Delta, ce macrophyte s'installe dans les mares,
rizières, eaux stagnantes, douces peu profondes (20-60 cm), parfois en
peuplements étendus mais toujours lâches, souvent adventice dans
les rizières inondées. Floraison : octobre-novembre
Panicum repens L. POACEAE

b
a
Panicum repens L.
a. plante entière, b. épi
79
Description
Herbe pérenne, à rhizomes profonds quelquefois
stolonifères, peut atteindre 1 m de haut. Tiges à partie
inférieure prostrée et enracinée aux noeuds, à
partie supérieure ascendante. Feuilles vertes, sur 2 rangées,
à limbe linéaire. Inflorescence en forme de panicule très
peu ramifiée; épillets 2,5-3 mm long.
Distribution
Espèce pantropicale. Rencontrée aussi en
Amérique du Sud, en Indochine. Elle est probablement originaire de
l'Amérique tropicale et de l'Afrique tropicale, introduite dans de
nombreux pays comme plante fourragère et devenue pantropicale.
Rencontrée au Sénégal dans la région du fleuve, les
« Niayes » et dans de nombreux marécages, mares à plan
d'eau variable, rizières inondées ou inondables.
Ecologie
La plante ne subit en général qu'une faible
submersion au maximum de la crue et préfère des terres argileuses
submergées. Supporte une légère salinité (milieu
saumâtre) (Ozenda, 2004).
La plante fournit un excellent fourrage pour le bétail
(Adam, 1962a). L'espèce est facilement multipliée
soit par les graines soit par des fragments de stolons ou de tiges
étalés sur le sol et recouvert d'un peu de terre.
Paspalidium geminatum (FORSK.) STAPF.
POACEAE
Synonymes: Panicum geminatum FORSK.; Panicum
paspaloides PERS.

c
b
Paspalidium geminatum (FORSK.) STAPF. a. plante
entière, b. inflorescence; c. racème
Description
80
Plante vivace. Tiges dressées, souvent spongieuses et
flottantes dans l'eau, à rhizomes et stolons rampants. L'inflorescence
est une panicule d'épis courts disposés alternativement sur 2
rangs ; chaque épi sessile terminé par un petit filament.
Epillets longs de 2 à 3 mm, ovoïdes.
Distribution
Pantropicale (Inde, Madagascar, Amérique Tropicale,...) Au
Sénégal, région des «Niayes», Cap Vert, Sine
Saloum, Basse Casamance.
Ecologie
Plante des stations périodiquement inondées du
Delta et le lac de Guiers. Espèce pionnière des sables et sables
argileux, habituellement humifères, inondés par une nappe d'eau
douce ou faiblement saumâtre. La plante participe parfois à la
formation de prairies flottantes. Floraison : septembre-novembre. Elle
constitue un bon fourrage.
Paspalum vaginatum SW. POACEAE

b
Paspalum vaginatum SW.
a. plante entière, b. inflorescence
Description
81
Plante vivace, recouvrant, rhizomateuse, émettant des
stolons parfois longs de plusieurs mètres. Tiges rampantes.
Distribution
Espèce pantropicale et subtropicale.
Au Sénégal: Sine-Saloum, régions des
Niayes.
Ecologie
Dans le delta et le lac de Guiers, la plante s'installe dans les
prés salés, généralement en vastes peuplements
fermés, inondés à marée haute, le cas
échéant, par de l'eau saumâtre ou salée. Floraison:
mai-août-novembre.
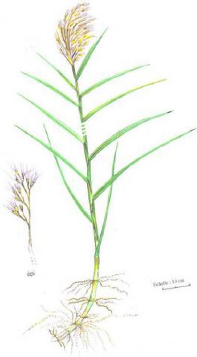
82
Phragmites australis (CAV.) TRIN ex. STEUD.
POACEAE
Synonymes : Phragmites communis TRIN
Description
Plante vivace à rhizome rampant, très
ramifié, émettant des tiges nombreuses, élevées (de
60 cm a 2m), dures et luisantes, feuilles glauques, à ligule courte et
ciliée; inflorescence grande, très étalée,
brun-jaunâtre; épillets très nombreux (1-2 cm) à
glumes très inégales
a
Distribution
Il existerait dans le Monde seulement 3 ou 4 espèces, et
toutes sont aquatiques avec une adaptation au cours d'eau permanents et aux
sols humides (Denny, 1985) Cosmopolite, bien présente dans les
régions subtropicales et tempérées-chaudes de l'Ancien
monde.
Au Sénégal : Niayes, Cap-Vert, Sine-Saloum, Basse
Casamance.
Ecologie
Phragmites australis (CAV.) TRIN ex. STEUD. a. plante
entière, b. inflorescence
b Dans le Delta, la plante s'installe dans les
eaux douces ou
faiblement saumâtres, ou alternativement douces et
saumâtres, stagnantes ou faiblement courantes, profondes jusqu'à
1m. La plante croît en peuplements ouverts ou en colonies denses et pures
(roselières). Floraison : octobre-novembre-janvier. P.australis
prend souvent un port particulier lorsqu'il croît sur des sables
salés, inondés seulement durant une courte partie de
l'année.
La plante émet dans ces stations des stolons longs de
plusieurs mètres, courant à la surface du sol, et forme des tiges
courtes. Cette forme écologique a été signalée au
Sénégal sous le nom de P. communis L; var.
pungensA. Chev. (Vanden Bergen, 1991). La plante serait
consommée parfois par des bovins selon Adam bien qu'elle soit
considérée comme dangereuse ou même toxique (Kerharo et
Adam, 1974).
Vetiveria nigritana (BENTH.) STAPF.
POACEAE
83
Synonymes: Chrysopogon
nigritanus(BENTH.) VELDKAMP. , Andropogon
nigritanusBENTH., Mandelorna insignis
STEUD., Andropogon squarrosus var
nigritana (BENTH) HACK., Vetiveria
zizanoidesvar. nigritana (BENTH.)
A.CAMUS
Description
Herbe robuste, pérenne pouvant atteindre 2,5 m de
haut.
Distribution
Sri Lanka, Malaisie, Philippines.
Afrique Tropicale : Ghana, Guinée Bissau, Burkina
faso, Mali, Mauritanie, Niger, Nigeria, Sierra Leone Au Sénégal :
Niokolo-Koba, Tambacouda, Casamance
Ecologie
Plante rustique ayant une forte amplitude
écologique. Dans la vallée du fleuve Sénégal et le
lac de Guiers, elle s'installe sur un sol argileux vaseux assez longuement
submergé. Elle est rencontrée dans les parties basses, dans les
plaines d'inondation. Elle aime les sols lourds et riches. Ce macrophyte forme
de vastes peuplements dans la plaine dans le lac de Guiers en face du village
de Nder. La faible déclivité et les sols limoneux sont des
facteurs importants à l'installation des peuplements de Vetiver. La
diminution des battements du niveau de l'eau au cours de l'année depuis
les aménagements est un facteur défavorable au maintien des
vastes peuplements dans le Delta.
Vossia cuspidata (ROXB.) GRIFF.
POACEAE
Synonyme: Ischaemum cuspidatum ROXB.
84
Description
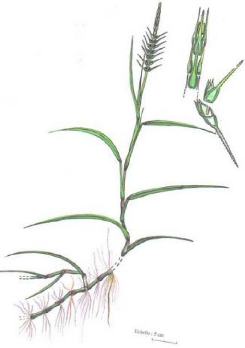
b
a
Vossia cuspida (ROXB.) GRIFF.: a. plante entière
; b. épillets
Espèce pérenne. Tige robuste spongieuse,
prostrée de 100 à 200 cm de long s'enracinant aux noeuds ;
feuilles longues de 30-100 cm et 618 mm de large. La nervure médiane de
la feuille a une couleur blanche, scabre, saillante; ligule une frange poilue;
inflorescence composée de racèmes. Epillets avec des barbes
rigides aplaties
Distribution
Afrique tropicale; du Sud et Centre du Soudan à travers
l'Afrique Tropicale Jusqu' au Zambèze Burkina Faso, Mali, Ghana, Nigeria
Sierra Leone; aussi en Inde où il a été à l'origine
décrit par ROXBURGH en Indochine (Wild, 1961).
Ecologie
Dans le Bas Sénégal et le lac de Guiers dans les
eaux douces stagnantes ou faiblement courantes, en peuplements parfois denses
dans divers plans de l'eau. La plante peut former des radeaux flottants et se
propager par des fragments de tige emportés par les eaux courantes
(Vanden Berghen, 1991).
85
Typha domingensis PERS. TYPHACEAE
Synonymes : T. australis SCHUMACHER; T. angustifolia
L. var. australis (SCHUMACHER) ROHRB.; T. angustata BORY
& CHAUD. incl. var.aethiopica
ROHRB. et var. abyssinica GRAEBN;
T. aequalis SCHNIZL.
|
Description
T. domingensis est une plante vivace, rhizomateuse
pouvant atteindre 4 m de haut dans le delta et le lac de Guiers. La tige
érigée est très courte et les feuilles très longues
(dépassant souvent 2 m) sont attachées à la base proche de
la surface du sol. L'inflorescence est cylindrique avec un diamètre
d'environ 1,5 et 50 cm de long. Il consiste en une partie femelle en dessous et
une partie mâle au-dessus qui disparaît lors de la
fructification
Distribution
Espèce pantropicale et subtropicale. La sous espèce
est distribuée depuis la région méditerranéenne et
la région saharo-sindienne jusqu'à la région du Cap,
à travers toute l'Afrique tropicale. Elle est connue également en
Asie mineure jusqu'en Mongolie. Ne paraît pas pénétrer dans
la région guinéenne (Lebrun, 1947).
Connue au Sénégal depuis les «Niayes»
près de Dakar, Kaolack, la basse vallée du Ferlo. L'espèce
est absente des mares et marécages du Parc du Niokolo-Koba (Schneider et
Sambou, 1982).
|
|
Typha domingensis PERS.
|
Ecologie
T. domingensis préfère des eaux
permanentes, profondes d'environ 1 m. Elle est modérément
tolérant au sel. Elle se développe dans divers plans d'eau,
mares, canaux d'irrigation et de drainage d'eau douce ou saumâtre,
stagnante ou faiblement courante. Elle s'installe également sur des sols
détrempés, souvent en peuplements purs. Typha domingensis
est une espèce pionnière qui se multiplie vigoureusement
dans le lac de Guiers depuis les années 50 et dans l'ensemble du delta
après la mise en eau des barrages de Diama et de Manantali sur le fleuve
Sénégal.
86
2.3.4.2 Les macrophytes fixés à feuilles
flottantes
Les macrophytes fixés à feuilles flottantes sont
enracinés ou fixés au substratum et produisent des feuilles
coriaces qui flottent à la surface de l'eau. Ils portent
également souvent quelques feuilles submergées. Les
inflorescences et les fleurs émergent usuellement de l'eau. Ces plantes
s'établissent sur les fonds submergés entre 0,25 à 3,00 m
de profondeur. Il s'agit de plantes particulièrement adaptées
à la flottaison par des mécanismes anatomiques et
morphologiques.
Sculthrope (1967) distingue dans ce groupe, deux types
principaux basés sur leur mode de reproduction végétative.
D'une part, le type rhizomateux ou bulbeux avec des feuilles flottantes
terminant de longs pétioles flexibles, représentés dans le
delta et le lac de Guiers par les Nénuphars (Nymphaea lotus,
N. micrantha) et deux Menyanthaceae (Nymphoides ezannoi et N.
indica). D'autre part, il y a également le type stolonifère
avec des tiges rampantes qui produisent des feuilles flottantes. Ce type est
représenté notamment par Ludwigia (=Jussiaea) et
diverses espèces de Polygonum.....
Nous passons en revue successivement :
1.
|
Nymphoides indica
|
Menyanthaceae
|
2.
|
Nymphaea lotus
|
Nymphaeaceae
|
3.
|
Nymphaea micrantha
|
Nymphaeaceae
|
4.
|
Ludwigia adscendens
|
Oenotheraceae
|
5.
|
Ludwigia leptocarpa
|
Oenotheraceae
|
6.
|
|
Polygonum senegalense
|
Polygonaceae
|
|
Nymphoides indica (L.) KUNTZE
MENYANTHACEAE
Synonymes: Limanthemum indicum (L.)THAIT.,
Nymphoides humboldtiana (KUNTH) KUNTZE, Menyanthes indica
L.
87
Description

Nymphoides indica (L.) KUNTZE
Plante aquatique pérenne, enracinée à
feuilles flottantes vert clair; limbe arrondi à marge entière ;
base profondément cordée à lobe se chevauchant. Fleur
érigée à 5 pétales blancs frangés, velus
à l'intérieur.
Distribution
Origine géographique: Inde, Amérique tropicale;
Tanzanie, Soudan, Cameroun.
Au Sénégal, la plante se rencontre dans les mares
permanentes, du côté de Saint Louis, au Niokolo-Koba et en
Casamance au bord des rizières (Berhaut, 1979).
Ecologie
D'importants peuplements de la plante se trouvent dans la
région nord du lac de Guiers. N. indica préfère
des eaux profondes (jusqu'à 2 m) avec une température
relativement élevée (26 à 28 °C), un fort
éclairement et une eau riche en éléments nutritifs. La
présence massive de la plante, dans les zones de déversement dans
le lac de Guiers des eaux de drainage des casiers sucriers de la CSS
s'expliquerait par la richesse de ces eaux en nutriments. La plante peut
continuer à vivre pendant quelques temps dans la boue après le
retrait de l'eau. Se développe dans des endroits qui sont à
l'abri des courants et des vagues (Duong-Huu-Thoi, 1950).
Nymphaea lotus L. NYMPHAEACEAE
88
Description

Nymphaea lotus L.
Plante facilement reconnaissable par ses larges feuilles quasi
circulaires flottant à la surface de l'eau et ses grandes fleurs
blanches. Feuille peltée à sinus très aigu. La tige est
courte et fermement fixée au substrat par des racines contenant de
larges espaces d'air. De la tige partent de longs pétioles mous,
flexibles avec des lacunes aérifères. Les fleurs ont des
étamines très nombreuses et sont ouvertes aussi la nuit. Fruits
globuleux contenant une grande quantité de petites graines
Distribution
Mali, Guinée, Gambie, Sierra Leone, Libéria,
Côte d'Ivoire, Ghana, Togo, Benin, Nigeria, Niger, Cameroun, Sao
Tomé, Gabon, ZaIre, Angola, Egypte, Ethiopie, Soudan, Afrique orientale,
Mozambique, Madagascar, et Inde.
Ecologie
C'est le nénuphar le plus répandu dans la zone. Il
se développe dans le lac de Guiers, le fleuve Sénégal et
ses dépendances là où le courant n'est pas trop rapide. La
plante peut supporter une grande profondeur d'eau (près de 2m). Graines
souvent conservées sur place. Elle est indicatrice des eaux profondes
non soumises à l'action des courants (Duong-Huu-Thoi, 1950). Plante des
milieux eutrophes.
89
Nymphaea micrantha
GUILL. ET PERR.
NYMPHAEACEAE
Synonymes: Nymphaea rufescens GUILL et PERR.,
Nymphaea guineensis
SCH.et TH., Nymphaea vivipara
LEHM., Nymphaea stellata var. bulbillifera PLANCH,
Nymphaea caerulea
GUILL. et PERR.,non SAV., Nymphaea
caerulea var albida
GUILL. ET PERR.
|
Description
Magnifique plante aux feuilles planes étalées sur
l'eau et aux fleurs bleues, blanches ou rose vif. Pétiole plus ou moins
long selon la profondeur de l'eau ; limbe légèrement pelté
; au sommet du pétiole des bulbilles prennent racine et
développent de nouveaux plants. Contrairement à N. lotus,
les fleurs de N. micrantha sont ouvertes uniquement à la
lumière du jour. Fruit globuleux avec de très nombreuses petites
graines rougeâtres ou noirâtres
Distribution
L'espèce est endémique en Afrique de l'Ouest
(Portères, 1951). Gambie, Mali, Côte d'Ivoire, Cameroun,
Guinée, Niger, Tchad, (Berhaut, 1979). La plante est répandue
dans les mares à travers tout le territoire sénégalais.
Assez fréquente dans la végétation rivulaire du lac de
Guiers et le fleuve Sénégal.
|
|
Nymphaea micrantha
GUILL.ET PERR.
|
Ecologie
Elle ne supporte pas une grande submersion (Duong-Huu-Thoi,
1950). Elle est indicatrice des eaux peu profondes et paraît moins
à la salure. Elle élimine N. lotus partout où
l'eau est peu profonde et à fond de vase organique. Elle supporte plus
facilement l'immersion prolongée. En Casamance, l'apparition de la
plante dans les rizières indique aux agriculteurs que le dessalement est
suffisamment avancé pour que le riz puisse être repiqué
(Vanden Berghen, 1982b).
Ludwigia adscendens (L.) HARA OENOTHERACEAE(=
ONAGRACEAE )
Synonyme: Jussiaoe repens L.
Ludwigia adscendens (L.) HARA
Description
90
Herbe vivace de 10 à 30 cm, strictement aquatique,
à tiges prostrées et flottant à la surface des eaux
grâce à des racines/flotteurs. La plante peut s'enraciner dans la
vase au niveau des noeuds ; feuilles opposées, ovales,
pétiolées. Fruit cylindrique, long de quelques
cm.
Distribution
Pantropicale et subtropicale; Moyen Orient; Amérique
centrale et du sud; Asie tropicale et subtropicale ; régions
méditerranéennes ; Afrique tropicale jusqu'au Transvaal (Lebrun
1947)..
Ecologie
Dans le delta et le lac de Guiers, ce macrophyte souvent
abondant, s'installe au bord des eaux ; les mares à eaux superficielles,
dans la vase. La plante se développe dans des conditions similaires
à celles d'Ipomooe aquatica.
91
Ludwigia leptocarpa (NUTTALL.) H. HARA
OENOTHERACEAE(= ONAGRACEAE)
Synonyme: Jussiaea leptocarpa
NUTTALL.
|
Description
Plante aquatique pérenne, robuste, érigée,
ramifiée, ligneuse à la base ; recouverte de poils longs pouvant
atteindre 2m de hauteur ; feuilles alternes simples ; limbe pubescent,
lancéolé, à linéaire, atténué
à la base; fleurs solitaires à 5 pétales axillaires ;
fruit, capsule portant 5 sépales.
Distribution
Caraïbes, Amérique du Nord, Afrique de l'Ouest,
Guinée Bissau, Nigeria
Au Sénégal : Niokolo-Koba, Casamance.
Ecologie
Dans le Delta et le lac de Guiers, ce macrophyte se
développe dans les milieux généralement eutrophes ; eaux
un peu saumâtres ou oligotrophes.
|
|
Ludwigia leptocarpa (NUTTALL.) H. HARA
|
Polygonum senegalense MEISN.
POLYGONACEAE
92
Synonymes: Persicaria senegalensis (MEISN.) SOJAK,
Polygonum senegalense var. usambarense DAMMER, Polygonum
sambesicum SCHUSTER,
|
Description
Plante flottante ou dressée. Dans le premier cas, les
entre-noeuds de la tige stolonifère sont gros et creux. Deux formes de
la plante sont communes dans le Delta et le lac de Guiers. Pour l'une les
feuilles sont vert foncé et peu velues pour la seconde, les feuilles
paraissent pales, tomenteuses. Inflorescence axillaire ou axillaire et
terminale.
Distribution
Répandue dans toute l'Afrique tropicale et l'Egypte, mais
ne sort pas du continent (Raynal-Roques, 1980) : Kenya, Tanzanie, Ouganda,
Egypte, Madagascar, Afrique du Sud. Nous l'avons récolté à
Niono et à Mopti au Mali.
|
|
Polygonum senegalense MEISN.
|
|
Ecologie
La plante est fréquente le long des rives de la
Taoué, le lac de Guiers et le fleuve Sénégal dans les eaux
permanentes, les milieux eutrophes, mares, fossés, rizières. Il
s'agit d'une plante de zones peu profondes. Elle peut former ou participer aux
radeaux flottants ancrés près des rives et qui s'avancent parfois
dans des eaux profondes.
93
2.3.4.3. Les macrophytes submergés
Ces macrophytes ont leurs parties végétatives
situées tout le temps en dessous de la surface de l'eau. Ils peuvent
coloniser diverses profondeurs jusqu'à une limite qui dépend le
plus souvent des conditions de luminosité. Leurs inflorescences et leurs
fleurs peuvent émerger. Certains sont enracinés ou fixés
au substratum pendant une bonne partie de leur cycle vital d'autres flottent
entre deux eaux. Ils comprennent plusieurs angiospermes:
1.
|
Ceratophyllum demersum
|
Ceratophyllaceae
|
2.
|
Utricularia stellaris
|
Lentibulariaceae
|
3.
|
Najas marina subsp. armata
|
Najadaceae
|
4.
|
Najas pectinata
|
Najadaceae
|
5.
|
Potamogeton octandrus
|
Potamogetonaceae
|
6.
|
|
Potamogeton schweinfurthii
|
Potamogetonaceae
|
|
Ceratophyllum demersum L.
CERATOPHYLLACEAE
94
|
Description
Plante monoïque entièrement submergée d'un
vert sombre, sans racines ; tiges ramifiées ; les segments foliaires
sont fortement dentés ; fleurs unisexuées, sans sépales ni
pétales (rarement observées) ; étamines nombreuses ;
ovaire solitaire, presque sessile; le fruit est une petite capsule, munie de 2
épines basilaires.
La détermination est difficile (polymorphisme) et se base
sur les caractères du fruit dont la valeur taxonomique est
insuffisamment connue.
Distribution
Plante cosmopolite (excepté des régions arctique et
antarctique). Mali, Mauritanie, Sierra Leone, Togo, Benin, Nigeria, Niger,
Afrique Centrale, Gabon, Angola, Afrique Australe, Egypte, Afrique Orientale
|
|
Ceratophyllum demersum L.
|
Ecologie
La plante préfère les eaux calmes. Elle est
obligatoirement submergée et ne supporte pas de périodes
d'émergence. Les plantes sont tout d'abord enracinées, puis elles
deviennent libres (système radiculaire très réduit) ;
elles s'amoncellent dans le fond, puis par accumulation de gaz dans leurs
tissus, montent à la surface pour flotter.
Utricularia stellaris L.
LENTIBULARIACEAE
95
Description

Utricularia stellaris L.
Plante submergée, munie de flotteurs groupés en
verticilles stellaires. Les stolons portent des feuilles serrées munies
ayant à leur base une auricule profondément divisée. Les
feuilles portent dans leur masse des utricules qui deviennent noires en
séchant. Le pédoncule floral peut atteindre 6 cm. Les
pétales sont inégaux. La corolle est jaune-clair
Distribution
Espèce paléotropicale. Mali, Mauritanie, Gambie,
Sierra-Léone, Côte d'Ivoire, Ghana, Togo, Bénin, Nigeria,
Niger, Cameroun, Tchad, République centrafricaine, Congo, Angola,
Egypte, Afrique Orientale, Afrique du sud, Mozambique, Madagascar, Asie,
Australie (Berhaut, 1967).
Ecologie
Au Sénégal, elle très commune dans les mares
et les marécages. Dans note zone d'étude on la rencontre à
différents niveaux d'eau, au bord du fleuve, du lac et dans les canaux
d'irrigation et de drainage. Elle affectionne les eaux riches en nutriments. La
plante peut se rencontrer dans les eaux profondes comme sur la terre vaseuse
exondée (Duong-Huu-Thoi, 1950).
NAJADACEAE
Famille unigénérique connue depuis
l'Oligocène (Triest et Symoens, 1983). Les Najas sont des
herbes annuelles, aquatiques, enracinées, submergées,
monoïques ou dioïques; tiges grêles, ramifiées, lisses
ou dentées, radicantes aux noeuds. Les feuilles sont sub-opposées
ou sub-alternées, sessiles, simples à base engainante,
accompagnées de 2 très petites écailles intravaginales ;
limbe linéaire, à bords dentés ou sinués.
Fleurs solitaires ou en glomérules à l'aisselle
des ramifications de la tige, sessiles ou subsessiles, unisexuées,
petites. Les fruits sont des akènes (Triest et Symoens, 1983).
Deux espèces ont été observées
dans le Delta du fleuve Sénégal et le lac de Guiers : Najas
marina et Najas pectinata.
Najas marina L. subsp. armata
(LINDB.F.)
Synonymes: Najas marina L. var. muricata
(DEL.), N. marina var. delilei (ROUY) MAIRE,
N.marina AUCT.
Najas marina L. subsp. armata (LINDB.F.)
Description
96
Herbe vivace, rhizomateuse à chaumes
généralement prostrés et radicants émettant de
nombreux rejets dressés courts et formant des gazonnements
étendus. Plante dioïque, tiges à entre-noeuds le plus
souvent aiguillonnés. Fleurs solitaires nues. Fruits ovoïdes. Herbe
submergée, rampant ou s'enracinant dans la vase, atteignant 1m de haut,
vert brunâtre
Distribution
Cosmopolite, largement distribuée dans les régions
tempérées et tropicales (Lebrun, 1947). En Afrique du Nord,
Ouganda, Congo (Zaïre), Sud du Cap et Natal, Sicile, Centre East, Asie
tropicale et Australie (Wild, 1961) ; Afrique de l'Ouest.
Au Sénégal, Basse vallée du Ferlo, lac de
Guiers et fleuve Sénégal, surtout dans les canaux
d'irrigation.
Ecologie
Préfère les eaux stagnantes ou lentes, fortement
minéralisées, voire saumâtres.
97
Najas pectinata (PARL.) MAGNUS.
NAJADACEAE
Synonymes : Najas horrida A.BR. ;
Najas marina L. subsp. armata AUCT non (LINDB.F.)
|
Description
Herbe aquatique, submergée, vivace, enracinée, de
30 à 100 cm de haut, brunâtre. Plante monoïque parfois
dioïque ; tiges lisses. Feuilles sont fermes, falciformes, portant sur
chaque bord, 4-10 dents au moins aussi longues que la largeur du limbe.
Distribution
Zaïre, Burundi, Algérie, Egypte, Mali, Guinée,
Sierra Leone, Ghana, Nigeria, Cameroun, Tchad, Soudan, Ouganda, Kenya,
Tanzanie, Zambie, Namibie, Botswana, Mozambique, Afrique du Sud, Madagascar
(Triest et Symoens, 1983).
Ecologie
Lac de Guiers, mares, marais, prairies aquatiques, rives du
fleuve Sénégal et ses affluents surtout sur
|
|
Najas pectinata (PARL.) MAGNUS.
|
Potamogeton octandrus POIR.
POTAMOGETONACEAE
98
Synonymes : Hydrogeton heterophyllus LOUR.,
Potamogeton javanicusHASSK., Potamogeton huillensis WELW.ex
SCHINZ, Potamogeton Preussii A. BENN.
|
Description
Herbe vivace submergée, sempervirente en conditions
favorables. Rarement annuelle. Aquatique, rhizome rampant. Dimorphisme foliaire
(feuilles inférieures submergées, alternes, étroitement
lancéolées à linéaires plus nombreuses, feuilles
supérieures flottantes coriaces) (hétérophyllie).
Inflorescence à pédoncule grêle. Fruits verts, bec stylaire
récurvé (Lisowski et al., 1978).
Distribution
Espèce essentiellement paléotropicale non seulement
en Afrique et à Madagascar mais également en Asie Tropicale
jusqu'au Japon et en Australie.
|
|
Potamogeton octandrus POIR.
|
En Afrique : Mali, Liberia, Sierra Léone, Côte
d'Ivoire, Ghana, Nigeria, Cameroun, Tchad, Centrafrique, Egypte, Soudan,
Ouganda, Kenya, Tanzanie, Angola, Zambie, Malawi, Zimbabwe,
Au Sénégal : Niokolo-Koba où la plante
semble avoir été récoltée pour la première
fois (Adam, 1962b).
Ecologie
L'espèce est abondante dans le delta du fleuve
Sénégal et le lac de Guiers dans des eaux faiblement courantes.
Macrophyte submergé exclusif semble résister plus à la
salinité que P. schweinfurthii. Floraison :
août-novembre.
99
Potamogeton schweinfurthii A.BENNETT.
POTAMOGETONACEAE
Synonymes : Potamogeton lucens ? L., Potamogeton
capensis SCHEELE ex. A BENN., Potamogeton repens HAGSTR.,
Potamogeton nodosus f. angustissimus HAGSTR.
|
Description
Herbe vivace, aquatique, enracinée, submergée (sauf
l'inflorescence). Atteignant 1, 2-3 m de long, vert vif à
brunâtre, rhizome rampant, ligneux à entre-noeuds de 4 à 8
cm ; tiges cylindriques ; feuilles toutes submergées, parfois les
supérieures flottantes ; limbe lancéolé, membraneux et
translucide. Inflorescences émergées, parfois à demi
submergées, vertes à vert brunâtre. Fleurs à
stigmates blanchâtres devenant brun pourpre. Fruits ovoïdes, lisses,
à côté ventral presque droit, bec stylaire court et obtus.
(Lisowski et al., 1978).
Distribution
Afrique tropicale et australe. Mali, Côte d'Ivoire,
Nigeria, Cameroun, Tchad, Egypte, Soudan, Ethiopie, Erythrée, Ouganda,
Kenya, Tanzanie, Zambie, Zimbabwe, Malawi, Mozambique, Namibie,
République Sud-Africaine, Rwanda, Burundi, Zaïre. Afrique du Nord
(Tunisie).
|
|
Potamogeton schweinfurthii A.BENNETT.
|
Ecologie
La plante a été observée dans le
Niokolo-Koba dans les rivières, dans les étangs et les mares.
Elle est abondante dans le fleuve et le Lac de Guiers depuis la mise en eau du
barrage de Diama (Thiam et Ouattara, 1998) dans les eaux faiblement courantes
pouvant être très profonde, jusqu'à 3 m dans le lac de
Guiers.
100
2.3.4.4. Les macrophytes libres flottant à la surface
Leur localisation est fortement liée aux mouvements des
eaux et à la direction des vents dominants. Les plantes de ce groupe se
rencontrent dans les endroits abrités, protégés des vents,
des vagues et des courants. Les espaces libres entre les peuplements de
Typha domingensis, de Phragmites australis sont souvent
colonisés par les plantes appartenant à ce groupe.
Il s'agit de :
1.
|
Pistia stratiotes
|
Araceae
|
2.
|
Azolla africana
|
Azollaceae
|
3.
|
Lemna aequinoctialis
|
Lemnaceae
|
4.
|
Marsilea minuta
|
Marsileaceae
|
5.
|
|
Salvinia molesta
|
Salviniaceae
|
|
Pistia stratiotes L. ARACEAE
101
|
Description
Herbe vivace, sans tige, stolonifère, flottante ou
s'enracinant faiblement dans la vase aux basses eaux. Limbes obovales, scabres,
à nervures parallèles très marquées
Distribution
Pantropicale. Répandue partout en Afrique tropicale;
(origine asiatique, selon De Wildeman, probablement Sud-Américaine
d'après Waterhouse, (1994). Il a été signalé
abondant dans des fleuves au Bénin, en Guinée, en Côte
d'Ivoire, au Mali, en Mauritanie, au Niger, au Burkina Faso (Wild, 1961).
Ecologie
La plante s'installe dans certaines anses calmes du fleuve et le
lac de Guiers. Adaptée à la flottaison la plante
préfère les eaux douces mais tolère des eaux
légèrement saumâtres (Berhaut 1988). Croîtrait mieux
dans des eaux acides à pH 4 (Waterhouse, 1994). N'augmenterait pas les
pertes d'eau par évapotranspiration (Lallana et al., 1987).
|
|
Pistia stratiotes L.
|
Pistia stratiotes est reconnu comme gênant dans le
Haut Nil et particulièrement comme un des constituants majeurs des
radeaux flottants dans le Delta du Niger. Comme la jacinthe d'eau cette plante
peut bloquer les canaux d'irrigation et est aussi importante dans la formation
des radeaux dans les deltas des grandes rivières et fleuves.
Actuellement, n'est pas aussi dangereuse que la jacinthe d'eau, probablement
parce qu'il n'est pas d'introduction récente en Afrique, mais il peut
devenir gênant avec la construction de plus larges barrages et projets
d'irrigation.
Azolla africana DESV. AZOLLACEAE
102
Synonyme : Azolla pinnata var.
africana DESV.BAK
|
Description
Petite fougère aquatique de 1,5 à 2,5 cm de
diamètre avec une forme triangulaire ; racines simples portant de
nombreux poils ; tiges alternant. Chaque feuille a 1-2 mm de long se
chevauchant deux à deux sur deux rangées ; la plante se reproduit
végétativement et sexuellement. Les sporocarpes (1-1.5 mm de
diamètre) sont formées en dessous des feuilles. La couleur des
feuilles varie de vert à marron- rouge
Distribution
Inde, Asie du Sud Est, Chine et Japon, Philippines, Nouvelle
Guinée et Australie. Largement répandue en Afrique : Madagascar,
Afrique du Sud, Angola, Mozambique, Zambie, Kenya, Ouganda, Burundi, Cameroun,
République Centrafricaine, Congo, Gabon, Rwanda, Zaire, Côte
d'Ivoire, Ghana, Guinée, Nigeria, Sierra Leone.
|
|
Azolla africana DESV. plante entière
|
Ecologie
Dans le delta du Sénégal et le lac de Guiers, la
plante s'installe dans les endroits calmes non exposés aux vents, dans
les eaux à courants faibles et dans les canaux de drainage. Cette
fougère aquatique vit en symbiose avec une Cyanobactérie
(Anabaena azollae STRASBURGER) fixatrice de l'azote
atmosphérique. C'est pourquoi, la plante est utilisée comme
engrais vert en riziculture. Le végétal peut croître dans
les eaux pauvres en azote mais se développe rapidement dans les milieux
riches en cet élément.
Lemna aequinoctialis WELW.ex.HEGELM
LEMNACEAE
Synonymes : Lemna paucicostata HEGELM., Lemna
trinervis (AUSTIN) SMALL, Lemna angolensis WELW.ex.HEGELM.,

a
b
Lemna aequinoctialis WELW.ex.HEGELM
a- vue en plongée ; b- vue en contre plongée
Description
Petite plante aquatique, très petite, réduite
à une lame verte ou « fronde » de la forme et de la grosseur
d'une lentille, portant en dessous une racine en son centre ; plante se
multipliant par bourgeonnement et ne fleurissant pratiquement jamais (Ozenda,
2004) ; peut-être envahissant dans les canaux où elle peut couvrir
toute la surface de l'eau.
Distribution
Répandue partout en Afrique tropicale, mais relativement
moins fréquente dans la région guinéenne (Lebrun, 1947).
Espèce pantropicale, subtropicale et des régions
tempérées chaudes du globe.
Au Sénégal, la plante est rencontrée dans
les Niayes, le Sine-Saloum, les Basse et Haute Casamance.
Ecologie
Dans le delta du fleuve Sénégal elle se
développe dans les eaux stagnantes et dormantes habituellement eutrophes
des mares, étangs, rizières inondées et canaux
d'irrigation et de drainage.
103
.
Marsilea minuta L. MARSILEACEAE
104
Synonymes : Marsilea crenata ; Marsilea erosus
; Marsilea diffusa ; Marsilea perrieriana ; Marsilea
senegalensis.
|
Description
Fougère aquatique ou semi-aquatique pérenne
très variable dans ses formes. Feuilles ressemblant à un
trèfle avec 4 folioles et un pétiole long de 2 à 30 cm.
Les folioles flottent à la surface de l'eau. Les sporocarpes
ovoïdes, pédicellés, apparaissent à la base du
pétiole et usuellement dans la boue ou à la surface de l'eau. La
reproduction se fait par des spores ou les rhizomes.
Distribution
La plane serait originaire d'Afrique Tropicale ou d'Asie
(Waterhouse, 1994 ; Jacobsen, 1983).
65 espèces de Marsilea ont été
répertoriées à travers les régions chaudes du
monde, M. minuta est sans doute la plus répandue.
|
|
Marsilea minuta L.
|
Ecologie
Dans le delta, ce macrophyte s'installe au bord des cours d'eau,
dans les rizières, les étangs, les eaux temporaires peu profondes
du fleuve et du lac de Guiers et également dans les canaux d'irrigation
et de drainage.
|
Salvinia molesta D.S. MITCHELL.
SALVINIACEAE
Synonyme: Salvinia auriculata AUBLET

c
a
b
Salvinia molesta D.S. MITCHELL.
a. plante entière dans sa phase « mature»;
b. vue des feuilles submergées et des sporocarpes (2 cm)
; c. détail d'un poil (trichome) à la surface d'une feuille
flottante
Description
105
Petite fougère pérenne ou annuelle flottant
librement dans des milieux aquatiques variés ; tiges horizontales sans
racines portant des feuilles opposées ovales, longues de 1 cm environ,
émergées, couvertes de poils alignés (trichome). Les
feuilles flottantes sont photosynthétiques alors que les feuilles
submergées non photosynthétiques sont finement divisées en
filaments ressemblant à des racines. Les sporocarpes naissent d'un
filament modifié des feuilles submergées et son
stériles.
Distribution
Plante quasi cosmopolite absente des régions froides.
Originaire du Brésil, S. molesta est souvent
considérée comme un hybride entre 2 espèces
américaine de Salvinia (Cook, 1996).
Ecologie
D'Introduction récente dans le delta du fleuve
Sénégal et le lac de Guiers. La plante a été
observée pour la première fois dans la région en mai 1999
dans un canal d'irrigation (Kuiseu et al. 2001). S. molesta est une
espèce stricte d'eau douce qui ne se développe pas dans les eaux
saumâtres. La plante croit rapidement dans des milieux nutritifs riches
et peut former des colonies importantes et de vastes tapis. La plante est
devenue proliférante dans le delta et le lac de Guiers au début
des années 2000.
106
En résumé, les 48 espèces communes
recensées dans les milieux humides de la zone se répartissent
ainsi:
- macrophytes fixés émergents (31 espèces
appartenant à 10 familles),
- macrophytes fixés à feuilles flottantes (6
espèces, 4 familles),
- macrophytes submergés (7
espèces, 5 familles)
- et macrophytes libres flottants (5 espèces, 5
familles).
La répartition en nombres de familles, de genres,
d'espèces et de familles dominantes suivant la typologie adoptée
pour les 48 espèces retenues est indiquée dans le tableau 8.
Poaceae et Cyperaceae dominent sur la berge, Nymphaeaceae et Oenotheraceae dans
les eaux peu profondes. Potamogetonaceae et Najadaceae sont immergées
dans les eaux pouvant être relativement profondes dans le contexte
sahélien (3 m). Aucune famille dominante n'a été
observée chez les Macrophytes libres flottant à la surface; les 5
espèces font partie de 5 genres et de 5 familles différentes.
Tableau 8 - Structure systématique des types de
macrophytes
|
Macrophytes fixés émergents
|
Macrophytes fixés à feuilles flottantes
|
Macrophytes submergés
|
Macrophytes libres flottant à la surface
|
|
Nombre de famille
|
10
|
4
|
4
|
5
|
|
Nombre de genre
|
25
|
5
|
4
|
5
|
|
Nombre d'espèces
|
31
|
6
|
6
|
5
|
|
Familles dominantes
|
Poaceae Cyperaceae
|
Nymphaeaceae Oenotheraceae
|
Potamogetonaceae Najadaceae
|
|
107
2.4. Conclusion
Du point de vue floristique, les milieux humides du Delta du
fleuve Sénégal sont relativement diversifiés
comparativement à d'autres milieux à écologie semblable en
Afrique sahélienne.
La diversité spécifique est plus
élevée dans les zones basses inondables, ensuite dans le lac et
après dans le fleuve.
Le spectre chorologique est caractérisé par
l'abondance des hélogéophytes et des hydrogéophytes. Les
taxons ont souvent une large distribution géographique pantropical et
paléotropical.
La typologie adoptée permet d'organiser, de
préciser et d'actualiser la systématique des spermaphytes et
ptéridophytes des milieux humides du Nord Sénégal. Sur les
rives, Poaceae et Cyperaceae sont dominantes alors que vers les eaux profondes,
Potamogetonaceae et Najadaceae sont les seuls macrophytes qui subsistent. Les
données sur la distribution, l'écologie des principaux
macrophytes sont rares et éparpillées dans de nombreuses
publications qui ne sont pas souvent facilement accessibles. Les efforts
doivent être poursuivis pour l'assemblage, la synthèse et
l'actualisation des informations sur les taxons. La rareté des
illustrations des espèces végétales des milieux humides du
Sénégal a amené à rassembler des
éléments en vue de la préparation d'un recueil de
référence sur les macrophytes des milieux humides. Un tel manuel
serait un outil qui rendrait d'éminents services aux enseignants des
Sciences de la Vie et de la Terre, aux botanistes, aux écologistes et
gestionnaires des milieux humides. Il s'agira de poursuivre le travail
entrepris en y ajoutant d'autres espèces et en complétant les
informations sur la biologie, l'écologie et la distribution des
macrophytes. Sans la rendre trop complexe, la diagnose des espèces
pourrait également être plus détaillée.
Après cette étude détaillée de la
flore et la présentation des principaux types de macrophytes et des
espèces communes en milieux humides, nous avons étudié la
végétation hélophytique et hydrophytique en examinant la
zonation des macrophytes sur les rives du fleuve, le canal de la Taoué
et d'autres sites humides et discerné plusieurs groupements
végétaux dans les stations humides du Delta et le lac de
Guiers.
108
Chapitre 3 Végétation et groupements
végétaux des milieux humides
3.1 Introduction
L'étude des groupements végétaux du
Sénégal en relation avec les paramètres
édapho-climatiques a été réalisée pour la
première fois dans les années 30 par Trochain (Trochain, 1940).
Dans cette étude, cet auteur a identifié les groupements
d'hydrophytes constitués par les végétations des stations
partiellement ou totalement aquatiques. Il a subdivisé ceux-ci en 3
types de végétations: la végétation des eaux douces
(limnophytie), la végétation littorale des eaux saumâtres
et des sols salins temporairement submergés (halohydrophytie et
halophytie) et la végétation des eaux acides et des sols acides
temporairement submergés (oxyhydrophytie et oxyphytie). Pour
établir la composition floristique des groupements
végétaux qu'il a classés dans ces différentes
subdivisions, Trochain a effectué près de 53 relevés de
végétation dans le delta et le lac de Guiers. Adam (1964) a
décrit la zonation de la végétation sur la rive orientale
du lac de Guiers à partir d'une douzaine de transects
réalisés en 1962 en différents points. Cette description
de la végétation rivulaire du lac de Guiers est
accompagnée de quelques observations écologiques. Au début
des années 80, une dizaine de groupements végétaux ont
été reconnus dans le lac de Guiers et dans sa plaine d'inondation
(Thiam,1984). La composition floristique de ces groupements accompagnée
d'observations sur les facteurs du sol a été
présentée par cet auteur.
Après les barrages, quelques études ont
été réalisées sur la végétation des
milieux humides du delta et ont concerné notamment les adventices des
périmètres agricoles (Diagne, 1991), Pistia stratiotes
(Guiral, 1993), Potamogeton schweinfurthii (Thiam et Ouattara,
1997) Typha domingensis ou encore des biotopes particuliers (Thiam,
1993 ; Kuiseu, 1997; Thiam, 1998; Faye, 2007).
La végétation des stations humides du delta
n'avait pas fait jusqu'ici l'objet d'études détaillées
notamment du point de vue de la zonation des macrophytes au niveau des rives du
fleuve et de la Taoué et de la composition floristique des groupements
végétaux. De plus, avec les grands aménagements sur le
fleuve, le milieu a beaucoup changé (Cogels et al., 1993). Les
nouvelles conditions hydrologique et de qualité des eaux ont eu une
incidence marquée sur la végétation en
général et certains macrophytes en particulier (Cogels et
al., 1993 ; Thiam et al.,1993 ; Guiral, 1993).
Dans ce travail, nous avons:
- étudié à l'aide de transects, la
zonation des macrophytes et analysé quelques paramètres
édaphiques au niveau de sept (7) points d'observation ;
109
- établi la composition floristique des principaux
groupements végétaux hélophytiques et hydrophytiques en
relation avec la salinité du sol.
3.2 Matériels et méthodes
La zonation de la végétation a été
étudiée en utilisant la technique des transects. Le transect
partait de la zone exondée vers la zone inondée. Lorsque le
substrat le permet, une corde graduée de 10 en 10 cm est utilisé.
Sinon un ruban métallique est employé pour mesurer les distances.
Sept (7) transects représentant différentes situations
morpho-pédologiques de la zone ont servi à étudier la
répartition des principaux groupements végétaux en
relation avec l'humidité (Figure 15). La présence de chlorure de
sodium dans le sol ou dans l'eau ou encore dans les deux à la fois,
constitue un second facteur de répartition de la
végétation dans les stations humides du delta.
Tableau 9 - Situation et coordonnées géographiques
des transects
|
Sites
|
Latitude
|
Longitude
|
Transects
|
1. Fleuve Sénégal (rive gauche amont
barrage de Diama)
|
|
|
|
Barrage Diama (amont)
|
N 1612'72"
|
W 1624'46"
|
Transect C
|
Djoudj
|
N 1624'72"
|
W 1618'31"
|
Transect D
|
Ouassoul
|
N 1628'86"
|
W 1601'64"
|
Transect F
|
2. Taoué
|
|
|
|
Taoué 1 (Richard-Toll)
|
N 16 26' 96"W 15 41' 79"Transect
|
G
|
3. Zones basses inondables
|
|
|
|
|
|
Guembeul (vasière, ancienne mangrove)
|
N 1557'10"
|
W 1628'47"
|
Transect A
|
|
Savoigne (plaine inondable)
|
N 1609'37"
|
W 1618'31"
|
Transect B
|
|
Débi (rizière abandonnée)
|
N 1630'70"
|
W 1616'20"
|
Transect E
|
En vue d'intégrer les modifications
saisonnières, deux transects ont été
réalisés respectivement en saison sèche (février et
mars) et en saison des pluies (août) au niveau de quelques sites.
Pour faciliter le repérage des points de
réalisation des transects pour l'étude ultérieure de
l'évolution du tapis végétal, des bornes fixes en
béton ont été installées au niveau des 7 sites
(tableau 9 et Figure 15).
110
Les relevés phytosociologiques ont été
effectués en fonction de la physionomie du groupement
étudié, le long des transects. Un quadrat en bois de
1m2 posé en plusieurs points sur le tapis
végétal a été utilisé. Toutes les
espèces présentes à l'intérieur du quadrat sont
notées, avec pour chacune d'elles une appréciation quantitative
suivant l'échelle classique d'abondance dominance de Braun-Blanquet
(1932) :
+ = peu abondant
1 = abondant mais avec un faible recouvrement ou assez peu
abondant mais avec un recouvrement plus grand.
2 = Très abondant ou recouvrement supérieur
à 5%
3 = Recouvrement de 25 à 50%, abondance quelconque
4 = Recouvrement de 50 à 75%, abondance quelconque
5 = Recouvrement supérieur à 75%, abondance
quelconque
Nous avons réalisé près de 160
relevés dans les différents sites étudiés.
La méthode des tableaux, détaillée par
Gounot (1969) et Vanden Berghen (1982a), a été utilisée
pour comparer les relevés et calculer les coefficients de recouvrement
des espèces.
La hauteur de la lame d'eau a été mesurée
dans les sites inondés avec un mètre ruban métallique ou
en eau profonde avec une perche graduée.
Le pH, la conductivité, la température,
l'oxygène dissous dans l'eau ont été analysés
in situ avec des appareils portatifs.
Dans certains sites, des échantillons de sol ont
été prélevés en surface (dans les 30 premiers cm).
Un échantillon moyen est préparé sur place pour chaque
site et mis dans des sachets plastiques étiquetés. Les
échantillons de sol ont été analysés par le
laboratoire du bureau pédologique de Hann à Dakar.
Les méthodes et techniques employés pour les
analyses de sols ont été les suivants :
· le pH : deux types de pH sont déterminés,
le pH (eau) et le pH (KCl) (méthode électrométrique).
Le pH eau correspond à la concentration en
hydrogène (H+) de la solution du sol. Il est appelé ainsi car il
est mesuré dans un mélange terre/eau. Le pH KCl correspond
à la concentration en hydrogène (H+) du sol obtenu
après ajout de KCl. Le KCl a pour effet de chasser les H+
fixés sur le complexe argilo-humique, ce qui permet de déterminer
l'acidité totale ou acidité de réserve du sol. Le PH KCl
est donc un pH «théorique» qui permet de connaitre
l'acidité potentielle du sol. Il correspond au pH vers lequel tendent
tous les sols à cause du processus d'acidification. Le pH KCl est
toujours inférieur au pH eau, l'écart entre les 2 varie de 0,2
à 1,5 :
Ecart < 0,5 acidité de réserve faible
Ecart < 1 acidité de réserve moyenne
Ecart > 1 acidité de réserve
élevée
·
111
la conductivité électrique traduit la
minéralisation totale de l'eau. Sa valeur varie en fonction de la
température. Elle est donnée à 20 °C. Elle est
exprimée en micro-Siemens par cm (j.tS / cm). Approximativement la
valeur en j.tS/cm correspond à la salinité en mg/l.
La norme de salinité utilisée est celle de Le
Brusq (1984) :
0,5< CE < 2 mmho: sol salé
CE >4 mmho : sol sursalé
· les matières organiques (%) : somme
hétérogène de composés carbonés d'origine
végétale et animale (débris en cours de
décomposition, humus,...). Elles stimulent l'activité biologique
du sol
· l'azote total (N) en % (méthode Kjeldahl) : le
dosage de N repose sur la transformation des composés azotés
dosables par minéralisation. L'azote Kjeldahl représente les
formes réduites de l'azote, soit l'azote organique et l'azote
ammoniacal
· le carbone organique (C) en % (méthode Anne):
l'oxydation du carbone s'effectue à chaud avec le bichromate de
potassium
· le phosphore assimilable (P) en ppm (méthode
Bray 1) :
· la granulométrie (méthode par pipette de
Robinson) : elle indique la texture du sol qui est la proportion relative des
différentes fractions solides du sol.
· les bases échangeables (méq/100g) : sont
des éléments directement disponibles pour les plantes
(méthodes à l'acétate d'ammonium à l'acétate
sodium).
· la capacité d'échange cationique T
(méq/100g) c'est la capacité pour un sol à capter les
cations (méthode de saturation NH4)
· le taux de saturation V (%) = (somme bases
échangeables (S) x 100) / T
· le bilan ionique (méthodes
spectrophotométrique et titrimétriques) : il n'a
été déterminé que lorsque le sol est salé.
Il permet de déterminer le type de salinité du sol. Le diagramme
de Piper est utilisé à cet effet.
Figure 15 - Carte de localisation des sites des transects
112
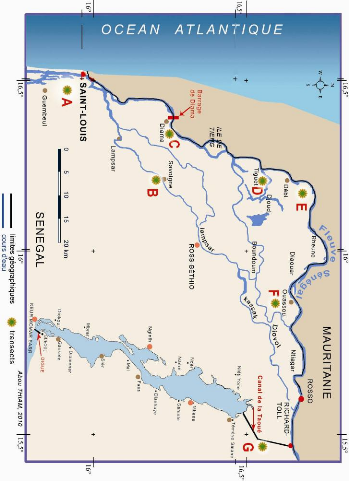
3.3 Résultats et discussion
3.3.1 Zonation de la végétation
Les Figures 16, 17, 18, 19, 20, 21 et 22 présentent les
résultats obtenus des transects A, B, C, D E, F et G, effectués
respectivement à Guembeul, Savoigne, Diama, Djoudj, Débi Ouassoul
et sur le canal de la Taoué (Figure 15).
Figure 16 - Transect A, à Guembeul, en août 1996 et
en février 1997 Août 1996
SW NW

Février 1997
SW NW
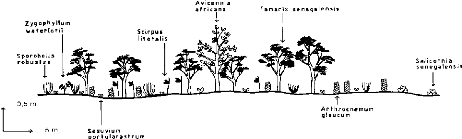
113
Il s'agit d'une ancienne mangrove avec une dominance de plantes
halophiles et sub-halophiles. Le
site est complètement asséché en
février. Cressa cretica, Salicornia senegalensis et
Blutaparon vermiculare apparaissent pendant cette période.
Le sol, salé, reste très humide en surface.
En août, l'eau dans le site a une conductivité
élevée (18000 tS) et un pH de 8,2. La végétation se
développe sur un sol sablo-argileux relativement neutre (pH = 6,5) et
pauvre en matière organique (0,84 %).
Figure 17 - Transect B, à Savoigne (Lampsar) en août
1996 et en février 1997 Août 1996
S N
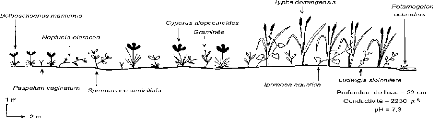
Février 1997
S N
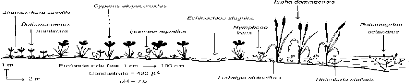
114
Echinochloa stagnina et Nymphaea lotus
apparaissent en février. Le niveau de l'eau est plus
élevé
115
qu'en août probablement à cause de
l'arrivée tardive de la crue et le maintien d'un niveau d'eau
élevé pendant une bonne partie de l'année. Les Cyperaceae
sont bien représentées pendant cette période. Le sol est
très argileux et acide (pH 4,14) avec une teneur en matière
organique relativement élevée (4,22 %). La fréquentation
par le bétail est attestée par le fort piétinement de la
végétation. Des coupes importantes de Typha domingensis
sont également effectuées par les populations.
Figure 18 - Transect C, amont barrage de Diama sur la rive
gauche du fleuve en août 1996 et en février 1997
Août 1996
N S
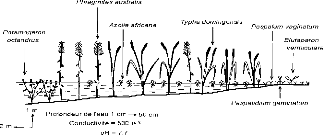
Février 1997
N S
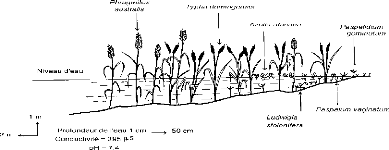
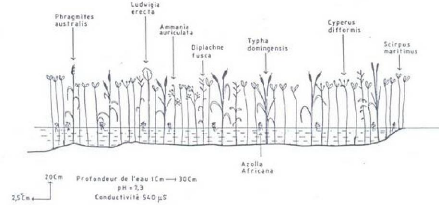
W E
116
Le sol est sableux, alcalin (pH = 8,3) avec un taux de
matière organique de 0,81 % et salé de type sulfaté
chloruré sodique. Le taux de sodium échangeable dans le complexe
absorbant est élevé (37,31 %) ce qui pourrait réduire la
perméabilité du sol. Les individus de Pistia stratiotes
qui apparaissaient tout le long du transect pendant la saison des pluies,
se cantonnent en février vers le rivage à cause principalement
des vents qui soufflent très forts en saison sèche.
Figure 19 -Transect D, Parc du Djoudj, rive gauche du fleuve
Sénégal en février 1997
NW SW
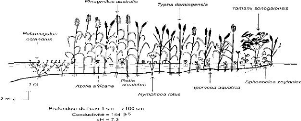
Le sol est très argileux, acide (pH = 5,8) et assez
pourvu en matière organique (2,93 %). La présence de
Sphenoclea zeylanica est remarquable dans cette zone. Typha
domingensis avec de place en place Phragmites australis forment
un rideau serré impénétrable. Ce rideau se
développe densément plus en amont tout le long de la digue rive
gauche jusqu'à Rosso Sénégal.
Figure 20 - Transect E, à Débi, rive gauche du
fleuve Sénégal en février 1997
117
Zone de culture en jachère attestée par une
très grande diversité floristique et l'abondance des
Cypéracées. Dans ces zones abandonnées Typha
s'installe rapidement et élimine les autres espèces
concurrentes. Le sol est très argileux, acide (pH = 5,6) et moyennement
pourvu en matière organique.
Figure 21 - Transect F, à Ouassoul, rive
gauche du fleuve Sénégal en février 1997
N S
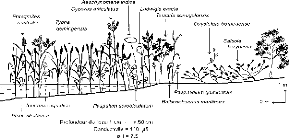
Le sol est très argileux, acide (pH = 5,6) et assez
pourvu en matière organique (2,43%). La salinité est de type
chloruré sulfaté sodique. Elle est très
élevée (CE = 13 600 tS/cm). Malgré cette salinité
plusieurs macrophytes prolifèrent à cause probablement de la
forte hétérogénéité du substrat: des
endroits peu ou pas salés se retrouvant à proximité de
sols salés. Par ailleurs, la permanence de l'eau douce amoindrirait le
taux sels.
Figure 22 -Transect G, canal de la Taoué
en février 1997
W E
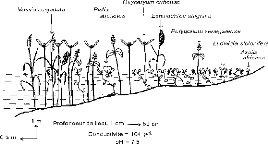
118
La végétation est très semblable à
celle des rives du fleuve malgré le caractère artificiel du canal
qui a été creusé dans les années 70. On y remarque
l'abondance de Polygonum senegalense et de Vossia
cuspidata.
Le sol est sableux avec une prédominance de sable fin,
à pH acide (5,2) et moyennement pourvu en matière organique.
La synthèse des résultats des analyses de sol
des sites des transects est présentée dans le tableau 10.
Les sols des sites de Ouassoul, de Diama et de Guembeul sont
salés. La conductivité varie de 13 600 tS dans le premier
à 6 600 tS dans le dernier en passant par 1120 tS à Diama.
De façon générale, la texture varie
d'argileuse, à sableuse et sablo-argileuse. La texture argileuse est
dominante.
En dehors du site Diama où il est nettement alcalin, le
pH du sol est souvent légèrement acide. La matière
organique est généralement faible.
La capacité d'échange la plus
élevée a été observée à Savoigne et
le taux de saturation le plus élevé a été
trouvé à Diama.
Quant à la capacité d'échange cationique,
elle a été plus élevée à Savoigne, ensuite
au Djoudj, Débi, Diama et la Taoué.
119
Tableau 10 - Synthèse des résultats des analyses de
sols dans les sites d'étude de la végétation
|
Paramètre
|
Taouey
|
Debi
|
Djoudj
|
Ouassoul
|
Diama
|
Savoigne
|
Guembeul
|
|
pH eau (1/2,5)
|
5,24
|
5,6
|
5,8
|
5,58
|
8,28
|
4,14
|
6,46
|
|
pH KCI (1/2,5)
|
4,82
|
5,06
|
5,26
|
5,4
|
8,14
|
3,64
|
6,14
|
|
Conductivité électrique (1/5) en i.tS
|
50
|
182
|
245
|
13 600
|
1 120
|
158
|
6 600
|
|
Carbone organique (%)
|
0,94
|
1,15
|
1,7
|
1,41
|
0,47
|
2,45
|
0,49
|
|
Matière organique (%)
|
1,62
|
1,98
|
2,93
|
2,43
|
0,81
|
4,22
|
0,84
|
|
Azote total (%)
|
0,07
|
0,14
|
0,13
|
0,11
|
0,04
|
0,2
|
0,04
|
|
Phosphore assimilable (ppm)
|
21,77
|
0,5
|
0,1
|
8,74
|
8,08
|
0,08
|
9,18
|
|
Bases
Echan.
(meq/100mg)
|
Ca++
|
5,96
|
7,77
|
15,87
|
7,95
|
11,54
|
12,39
|
1,89
|
|
Mg++
|
3,54
|
10,88
|
8,45
|
9,15
|
3,66
|
11,55
|
7,23
|
|
Na
|
0,35
|
2,33
|
2,55
|
2,4
|
7,5
|
0,89
|
0,45
|
|
K+
|
0,82
|
1,19
|
1,44
|
1,25
|
1,41
|
0,92
|
1,53
|
|
Somme
|
10,67
|
22,14
|
28,31
|
20,75
|
24,11
|
25,75
|
11,1
|
|
Capacité d'éch. cat. (meq/100g)
|
13,52
|
27,6
|
32,8
|
27,5
|
20,1
|
53,26
|
12,6
|
|
Taux de saturation (%)
|
|
78,92
|
80,21
|
86,31
|
75,45
|
Saturé
|
48,34
|
88,1
|
|
Granulométrie (%)
|
Argile
|
22,5
|
49,05
|
67,2
|
42
|
21,5
|
61,7
|
26,4
|
|
Limon grossier
|
3,6
|
9,53
|
3,72
|
11,91
|
3,01
|
5,7
|
1,18
|
|
Limon fin
|
1,79
|
16,92
|
20,59
|
13,78
|
1,96
|
19,29
|
3,11
|
|
Sable grossier
|
2,28
|
0,13
|
0,23
|
0
|
4,97
|
0
|
0,38
|
|
Sable moyen
|
13,27
|
0,32
|
0,94
|
0,53
|
35,88
|
0,57
|
37,93
|
|
Sable fin
|
56,56
|
24,05
|
7,32
|
31,88
|
32,68
|
12,74
|
31
|
|
Texture
|
sableuse
|
argileuse
|
argileuse
|
argileuse
|
sableuse
|
argileuse
|
sablo-argileuse
|
|
Bilan ionique
(sur sols salés uniquement)
(meq/100g)
|
Ca++
|
|
|
|
11,28
|
0,76
|
|
2,36
|
|
Mg++
|
|
|
|
13,8
|
1,14
|
|
10,91
|
|
Na
|
|
|
|
109,6
|
8,6
|
|
50,3
|
|
K+
|
|
|
|
1,3
|
0,62
|
|
2,37
|
|
Somme
|
|
|
|
135,98
|
11,12
|
|
65,97
|
|
HCO3-
|
|
|
|
0,25
|
0,75
|
|
0,5
|
|
SO4--
|
|
|
|
65,05
|
6,45
|
|
41,26
|
|
CI-
|
|
|
|
70,5
|
4
|
|
23,94
|
|
Somme
|
|
|
|
135,8
|
11,2
|
|
65,7
|
120
Tableau 11 - Occurrence des principaux macrophytes sur les
transects
Transect
|
Espèces
|
A
|
B
|
C
|
D
|
E
|
F
|
G
|
Fréquence (%)
|
|
Hydrophytes et hélophytes
|
|
|
|
|
|
|
|
|
|
Typha domingensis
|
|
+
|
+
|
+
|
+
|
+
|
|
70
|
|
Polygonum senegalense
|
|
|
|
|
|
|
+
|
14
|
|
Ludwigia adscendens
|
|
+
|
|
|
|
|
+
|
28
|
|
Potamogeton octandrus
|
|
+
|
|
+
|
|
|
|
28
|
|
Azolla pinnata
|
|
|
+
|
|
|
|
+
|
28
|
|
Phragmites australis
|
|
|
+
|
+
|
|
|
|
28
|
|
Cyperus alopecuroides
|
|
+
|
|
|
|
|
|
14
|
|
Pistia stratiotes
|
|
|
|
+
|
|
+
|
+
|
42
|
|
Nymphaea lotus
|
|
+
|
|
+
|
|
|
|
28
|
|
Neptunia oleracea
|
|
+
|
|
|
|
|
|
14
|
|
Ipomoea aquatica
|
|
+
|
|
+
|
|
+
|
|
42
|
|
Utricularia stellaris
|
|
+
|
|
|
|
|
|
14
|
|
Cyperus articulatus
|
|
|
|
|
|
+
|
|
14
|
|
Echinochloa stagnina
|
|
+
|
|
|
|
|
+
|
28
|
|
Alternanthera sessilis
|
|
+
|
|
|
|
|
|
14
|
|
Vossia cuspidata
|
|
|
|
|
|
|
+
|
14
|
|
Spermacoce verticillata
|
|
+
|
|
|
|
|
|
14
|
|
Oxycarium cubense
|
|
|
|
|
|
|
+
|
14
|
|
Aeschynomene indica
|
|
|
|
|
|
+
|
|
14
|
|
Paspalum scorbiculatum
|
|
|
|
|
|
+
|
|
14
|
|
Oxystelma bornouense
|
|
|
|
|
|
+
|
|
14
|
|
Sphenoclea zeylanica
|
|
|
|
+
|
|
|
|
14
|
|
Cyperus difformis
|
|
|
|
|
+
|
|
|
14
|
|
Ludwigia erecta
|
|
|
|
|
+
|
+
|
|
28
|
|
Subhalophytes
|
|
|
|
|
|
|
|
|
|
Schoenoplectus litoralis
|
+
|
|
|
|
|
|
|
14
|
|
Sporobolus robustus
|
+
|
|
|
|
|
|
|
14
|
|
Paspalum vaginatum
|
|
|
+
|
|
|
|
|
14
|
|
Paspalidium geminatum
|
|
|
+
|
|
|
+
|
|
28
|
|
Bolboschoenus maritimus
|
|
|
|
+
|
+
|
|
|
28
|
|
Diplachne fusca
|
|
|
|
|
+
|
|
|
14
|
|
Ammania auriculata
|
|
|
|
|
+
|
|
|
14
|
|
Halophytes
|
|
|
|
|
|
|
|
|
|
Tamarix senegalensis
|
+
|
|
|
|
|
+
|
|
28
|
|
Sesuvium portulacastrum
|
+
|
|
|
|
|
|
|
14
|
|
Arthrocnemum macrostachyum
|
+
|
|
|
|
|
|
|
14
|
|
Zygophylum waterlotii
|
+
|
|
|
|
|
|
|
14
|
|
Avicennia germinans
|
+
|
|
|
|
|
|
|
14
|
|
Salicornia senegalensis
|
+
|
|
|
|
|
|
|
14
|
|
Salsola baryosma
|
|
|
|
|
|
+
|
|
14
|
|
Blutaparon vermiculare
|
|
|
+
|
|
|
|
|
14
|
Les espèces les plus fréquentes sur les transects
sont (tableau 11) : Typha domingensis, Pistia stratiotes, Ipomoea aquatica.
En terme d'occurrence, ces espèces sont suivies par un
deuxième groupe constitué par Echinochloa stagnina,
Nymphaea lotus, Potamogeton octandrus, Azolla pinnata,
Phragmites australis, Ludwigia adscendens, Ludwigia erecta,
121
Paspalidium geminatum et Bolboschoenus maritimus et Tamarix
senegalensis. Les autres espèces n'ont été
observées que sur un seul transect et peuvent être
considérés comme moins fréquentes. Il s'agit dans les
hydrophytes de Polygonun senegalense, Neptunia oleracea, Vossia cuspidata,
Sphenoclea zeylanica,.... et d'halophytes comme Salicornia
senegalensis, Salsola baryosma, Arthrocnemum macrostachyum, Zygophyllum
waterlotii, Butapuron vermiculare,...Cependant, nombre
d'espèces mentionnées ci-dessus peuvent constituer par endroits
des peuplements relativement étendus.
Les principaux groupements reconnus après l'analyse des
relevés floristiques sont présentés ci-après.
3.3.2 Les groupements végétaux
A- Milieux salés humides
1. Groupement à Tamarix senegalensis
Tamarix senegalensis est un arbuste qui s'installe sur
les sols salés temporairement inondés à Ouassoul et
à Guembeul. Il a été également rencontré au
Djoudj à une profondeur d'eau de 10 cm. Le cortège floristique du
groupement est indiqué dans le tableau 12.
122
Tableau 12 - Groupement à Tamarix senegalensis
|
A
|
B
|
|
|
Numéro de relevé
|
3
|
11
|
15
|
39
|
103
|
|
Recouvrement en %
|
70
|
60
|
40
|
80
|
30
|
|
Hauteur du plan d'eau(cm)
|
0
|
0
|
0
|
0
|
0
|
|
Nombre des espèces
|
4
|
4
|
4
|
3
|
2
|
|
Strate haute
|
P
|
CR
|
|
Ligneux caractéristique
|
|
|
|
Tamarix senegalensis 4 3 3 5 3
|
5
|
5250
|
|
Autre ligneux
|
|
|
|
Arthrocnemum macrostachyum . + . ..
|
1
|
4
|
|
Strate basse
|
|
|
|
Chaméphyte rampant
|
|
|
|
Sesuvium portulacastrum 2 + + . .
|
3
|
308
|
|
Hémicryptophyte
|
|
|
|
Sporobolus robustus + 3 . . .
|
2
|
754
|
|
Géophyte
|
|
|
|
Cressa cretica . . + . .
|
1
|
4
|
|
Thérophytes
|
|
|
|
Salicornia senegalensis . . 1 . .
|
1
|
50
|
|
Herbacée volubile
|
|
|
|
Oxystelma bornouense . . . . 1
|
1
|
50
|
|
Hélophytes de la phase d'inondation
Schoenoplectus litoralis 2
|
1
|
300
|
|
Typha domingensis 1
|
|
50
|
|
Bolboschoenus maritimus 1
|
1
|
50
|
A : Relevés sur les sols salins, 6 mars 1997 (anciennes
mangroves). B : relevés en amont du barrage de Diama, 5 mars 1997 (sur
des sols non salins)
A Guembeul, zone anciennement occupée par une mangrove,
on rencontre également dans le groupement, Sesuvium
portulacastrum, Arthrocnemum macrostachyum, Sporobolus
robustus, Avicennia germinans, Zygophyllum waterlotii,
Cressa cretica, Blutaparon vermiculare, Salicornia
senegalensis. Ces espèces indiquent qu'il subsiste dans le sol
d'importantes quantités de sels.
123
La mangrove atteint à cette latitude son extension la
plus septentrionale en Afrique de l'ouest. Tamarix senegalensis
couvrirait actuellement les vastes surfaces qu'occupaient jadis
Avicennia à des époques plus humides (Marius, 1985).
Avicennia germinans et surtout Rhizophora racemosa sont en
régression nette.
2. Groupement à Arthrocnemum macrostachyum
Arthrocnemum macrostachyum est une plante ligneuse,
haute de 10 cm à 1 m, avec des tiges à rameaux semblant
articulés. Les articles sont les uns au bout des autres. La plante est
très fréquente dans le delta. La composition du groupement est
donnée dans le tableau 13.
Tableau 13 - Groupement à Arthrocnemum
macrostachyum
|
Numéro de relevé
|
10
|
2
|
5
|
13
|
17
|
|
|
Recouvrement en %
|
80
|
40
|
70
|
40
|
20
|
|
Hauteur du plan d'eau(cm)
|
0
|
0
|
0
|
0
|
0
|
|
Nombre des espèces
|
6
|
4
|
3
|
3
|
3
|
P
|
CR
|
|
Strate haute
Ligneux caractéristique
|
|
|
|
|
|
|
|
|
Arthrocnemum macrostachyum
|
2
|
2
|
3
|
2
|
1
|
5
|
1700
|
|
Autres ligneux
|
|
|
|
|
|
|
|
|
Tamarix senegalensis
|
1
|
.
|
.
|
+
|
1
|
3
|
104
|
|
Avicennia germinans
|
+
|
.
|
.
|
.
|
+
|
2
|
8
|
|
Strate basse
|
|
|
|
|
|
|
|
|
Chaméphyte rampant
|
|
|
|
|
|
|
|
|
Sesuvium portulacastrum
|
+
|
+
|
2
|
.
|
.
|
3
|
308
|
|
Hémicryptophyte Sporobolus
robustus
|
2
|
+
|
2
|
.
|
.
|
3
|
604
|
|
Thérophyte
|
|
|
|
|
|
|
|
|
Salicornia senegalensis
|
.
|
.
|
.
|
+
|
.
|
1
|
4
|
|
Géophyte
|
|
|
|
|
|
|
|
|
Cressa cretica
|
.
|
+
|
.
|
.
|
.
|
1
|
4
|
|
Hélophyte de la phase d'inondation
Schoenoplectus litoralis
|
3
|
.
|
.
|
.
|
.
|
1
|
750
|
Relevés sur les sols salins, ancienne mangrove
(Guembeul, 6 mars 1997) ; P = Présence et CR = Coefficient de
recouvrement.
Adam (1965) a signalé, en plus du groupement à
Arthrocnemum macrostachyum, le groupement à Sesuvium
portulacastrum qu'il considère comme très voisin.
Sesuvium portulacastrum forme effectivement de petites pelouses
discontinues surtout vers la terre ferme. Trochain (1940) a observé ce
groupement, avec quasiment la même composition, végétant
sur un sol argileux. Kassas (1977) a mentionné ce groupement dans la
région côtière de la Mer Rouge au Sahara (Schnell 1977).
124
B. Milieux d'eau douce
1. Groupement à Bolboschoenus maritimus
Bolboschoenus maritimus est une plante vivace par ses
rhizomes. Elle s'installe généralement dans les zones
marécageuses. Elle a été rencontrée à
Savoigne dans la frange externe de la végétation soumise à
une submersion temporaire. La plante a été également
observée dans une ancienne rizière à Débi où
elle paraît atteindre son développement optimal dans notre zone
d'étude. La composition du groupement est indiquée dans le
tableau 14. Le groupement s'installe dans un plan d'eau d'environ 30 cm de
profondeur.
Tableau 14 - Groupement à Bolboschoenus
maritimus
|
Numéro de relevé
|
126
|
127
|
124
|
129
|
125
|
140
|
135
|
137
|
41
|
|
|
Recouvrement en %
|
90
|
90
|
90
|
80
|
90
|
70
|
70
|
70
|
80
|
|
Hauteur du plan d'eau (cm)
|
25
|
25
|
25
|
28
|
26
|
23
|
22
|
30
|
0
|
|
Nombre des espèces
Hélophytes de la phase d'inondation
Géophytes à rhizome
|
5
|
3
|
4
|
4
|
3
|
6
|
5
|
3
|
2
|
P
|
CR
|
|
Bolboschoenus maritimus
|
5
|
5
|
5
|
4 4
|
3
|
3
|
3
|
3
|
9
|
5972
|
|
Typha domingensis
|
.
|
.
|
1
|
+ 3
|
2
|
2
|
.
|
.
|
5
|
780
|
|
Cyperusalopecuroides
|
1
|
1
|
.
|
. .
|
+
|
+
|
.
|
.
|
4
|
60
|
|
Phragmites australis
|
.
|
.
|
.
|
1 .
|
.
|
.
|
.
|
.
|
1
|
28
|
|
Chaméphytes rampants
|
|
|
|
|
|
|
|
|
|
|
|
Aeschynomene indica
|
2
|
.
|
.
|
. .
|
.
|
+
|
.
|
.
|
2
|
168
|
|
Echinochloa pyramidalis
|
|
|
|
|
|
|
|
1
|
1
|
28
|
|
Autres hélophytes
|
|
|
|
|
|
|
|
|
|
|
|
Diplachne fusca
|
.
|
.
|
.
|
. .
|
1
|
.
|
.
|
.
|
1
|
28
|
|
Ammania auriculata
|
+
|
.
|
.
|
. .
|
.
|
.
|
1.
|
|
2
|
30
|
|
Cyperus difformis
|
.
|
.
|
+
|
. .
|
+
|
.
|
.
|
.
|
2
|
4
|
|
Hydrophyte flottant en surface
|
|
|
|
|
|
|
|
|
|
|
|
Azolla pinnata
|
+
|
.+
|
|
2 +
|
.1
|
|
+
|
.
|
6
|
203
|
|
Strate Haute
|
|
|
|
|
|
|
|
|
|
|
|
Tamarix senegalensis
|
.
|
.
|
.
|
. .
|
1
|
.
|
.
|
.
|
1
|
28
|
|
Ludwigia erecta
|
.
|
1
|
.
|
. .
|
.
|
.
|
.
|
.
|
1
|
28
|
Relevés 124, 125, 126, 127, 129, 135, 137,140, 141 et
142 (Débi, 5 mars 1997). Relevé 41 (Savoigne, près de St
Louis, 4 mars 1997) ; P = Présence et CR = Coefficient de
recouvrement.
Adam (1960) a mentionné que Bolboschoenus maritimus
ne semble pas s'installer dans les rizières normalement
entretenues. L'espèce a été signalée comme
ubiquiste des stations marécageuses et faciès du groupement
à Echinochloa stagnina et Vossia cuspidata (Trochain,
1940). Cette Cyperaceae a été mentionnée dans le
groupement à Nymphaea lotus dans la région du lac de
Guiers s'installant dans la frange externe vers la terre ferme (Thiam, 1984).
Sarr (1996) a signalé ce groupement dans la basse vallée du Ferlo
récemment mise en eau.
125
2. Groupement à Cyperus alopecuroides
Cyperus alopecuroides, un macrophyte émergent,
vivace de 1 à 1,15 m de haut (Lebrun, 1947), se développe dans
une lame d'eau comprise entre 0 et 50 cm. La composition du groupement est
donnée dans le tableau 15.
Tableau 15 - Groupement à Cyperus
alopecuroides
|
Numéro de relevé
|
99
|
45
|
43
|
134
|
22
|
42
|
|
|
Recouvrement en %
|
100
|
50
|
60
|
70
|
70
|
50
|
|
Hauteur du plan d'eau(cm)
|
25
|
37
|
17
|
30
|
39
|
0
|
|
Nombre des espèces
|
8
|
4
|
5
|
5
|
4
|
2
|
P
|
CR
|
|
Strate basse
Géophytes à rhizome
|
|
|
|
|
|
|
|
|
Cyperus alopecuroides
|
3
|
3
|
3
|
3
|
3 3
|
6
|
3750
|
|
Typha domingensis
|
.
|
.
|
.
|
.
|
2 .
|
1
|
250
|
|
Bolboschoenus maritimus
|
.
|
.
|
.
|
2
|
. .
|
1
|
250
|
|
Hémicryptophyte
|
|
|
|
|
|
|
|
|
Oxycaryum cubense
|
1
|
.
|
.
|
.
|
. .
|
1
|
42
|
|
Chaméphytes rampants
|
|
|
|
|
|
|
|
|
Ludwigia stolonifera
|
2
|
1
|
+
|
.
|
. .
|
3
|
295
|
|
Vossia cuspidata
|
2
|
.
|
.
|
.
|
. .
|
1
|
250
|
|
Ipomoea aquatica
|
+
|
.
|
.
|
.1
|
.
|
2
|
45
|
|
Polygonum senegalense
|
1
|
.
|
.
|
.
|
+ .
|
2
|
45
|
|
Neptunia oleracea
|
.
|
|
1
|
.
|
. .
|
1
|
42
|
|
Echinochloa pyramidalis
|
.
|
.
|
+
|
.
|
. .
|
1
|
3
|
|
Autres Hélophytes
|
|
|
|
|
|
|
|
|
Oryza longistaminata
|
+
|
.
|
.
|
.
|
. .
|
1
|
3
|
|
Diplachne fusca
|
.
|
.
|
.
|
1
|
. .
|
1
|
42
|
|
Hydrophytes
|
|
|
|
|
|
|
|
|
Hydrophyte flottante libre
|
|
|
|
|
|
|
|
|
Azolla pinnata
|
2
|
+
|
.+
|
|
.+
|
4
|
260
|
|
Hydrophyte flottante immergée
|
|
|
|
|
|
|
|
|
Utricularia stellaris
|
|
+
|
|
+...
|
|
2
|
6
|
|
Strate Haute
|
|
|
|
|
|
|
|
|
Ludwigia erecta
|
.
|
.
|
.
|
1
|
. .
|
1
|
42
|
Relevés 42, 43, 45 (Savoigne, 4 février 1997).
Relevé 99 (Taoué, 5 mars 1997).Relevé 22 (Djoudj, 5 mars
1997).Relevé 134 (Debi, 5 mars 1997) : P = Présence et CR =
Coefficient de recouvrement.
3. Groupement à Cyperus articulatus
Cyperus articulatus est une Cyperacée à
tige cylindrique articulée ayant l'apparence et la consistance d'un
jonc, présente un aérenchyme bien développé. Son
envahissement est à éviter, surtout dans les rizières du
fait de cet aérenchyme robuste difficile à éliminer (Adam,
1960). Cyperus articulatus a été rencontré
surtout à Diama dans un plan d'eau n'excédant pas 50 cm de
profondeur. A Ouassoul, il est clairsemé dans le peuplement à
Typha domingensis. La composition du groupement est indiquée
dans le tableau 16.
126
Tableau 16 - Groupement à Cyperus articulatus
|
Numéro de relevé
|
63
|
112
|
81
|
111
|
80
|
|
|
Recouvrement en %
|
90
|
70
|
100
|
80
|
100
|
|
Hauteur du plan d'eau (cm)
|
22
|
45
|
34
|
57
|
53
|
|
Nombre d'espèces
|
6
|
5
|
5
|
4
|
4
|
P
|
CR
|
|
Strate basse
|
|
|
|
|
|
|
|
Géophytes à rhizome Cyperus
articulatus
|
3
|
3
|
3
|
3 4
|
5
|
4250
|
|
Phragmites australis
|
.
|
2
|
.
|
. +
|
2
|
304
|
|
Cyperus alopecuroides
|
.
|
2
|
.
|
2 .
|
2
|
600
|
|
Typha domingensis
|
1
|
.
|
.
|
+ .
|
2
|
754
|
|
Chaméphytes rampants
|
|
|
|
|
|
|
|
Paspalum vaginatum
|
1.
|
|
2
|
. .
|
2
|
350
|
|
Paspalidium geminatum
|
+
|
1
|
+
|
+ +
|
5
|
66
|
|
Ludwigia stolonifera
|
2
|
.
|
.
|
. .
|
1
|
300
|
|
Ipomoea aquatica
|
.
|
+
|
1
|
. .
|
2
|
54
|
|
Hydrophyte flottante libre
|
|
|
|
|
|
|
|
Azolla pinnata
|
1
|
.
|
3
|
. 3
|
3
|
1550
|
Relevés 63, 80, 81 (Diama, 2 février 1997).
Relevés 111, 112 (Ouassoul, 5 mars 1997) ; P = Présence et CR =
Coefficient de recouvrement.
Cyperus alopecuroides figure dans le cortège
floristique de l'association à Cyperus articulatus et
Asteracantha longifolia décrit par Lebrun (1947) au Zaïre,
qui la considère comme une espèce ubiquiste des régions
tropicales et caractéristique préférente du
Cypereto-Asteracanthetum.
Cyperus articulatus a été
mentionné par Trochain (1940) comme espèce compagne du groupement
à Paratheria prostrata.
4. Groupement à Phragmites australis
Phragmites australis est un hélophyte, vivace,
à rhizomes profonds, dressé et atteignant 4m de haut. Il a
été observé dans la végétation du fleuve
à une profondeur d'eau de 0,75 à 1 m. Le cortège
floristique est donné dans le tableau 17.
127
Tableau 17 - Groupement à Phragmites australis
|
Numéro de relevé
|
118
|
116
|
69
|
30
|
26
|
68
|
33
|
28
|
27
|
25
|
76
|
32
|
|
|
Recouvrement en %
|
90
|
90
|
90
|
30
|
50
|
90
|
100
|
80
|
70
|
100
|
90
|
70
|
|
Hauteur du plan d'eau (cm)
|
46
|
44
|
100
|
115
|
94
|
92
|
74
|
90
|
89
|
93
|
81
|
113
|
|
Nombre des espèces
|
6
|
4
|
4
|
5
|
4
|
3
|
3
|
3
|
3
|
3
|
3
|
2
|
P
|
CR
|
|
Strate basse
Géophytes à rhizome
|
|
|
|
Phragmites australis 4 4 4 2 3 4 5 4 3 4 5 4
|
12
|
5854
|
|
Typha domingensis 1 2 2 2 1. 2 . . 3 . +
|
8
|
856
|
|
Cyperus articulatus 2 . . . . . . . . . . .
|
1
|
125
|
|
Cyperus alopecuroides . . . . . . . . . + . .
|
1
|
3
|
|
Hémicryptophyte
|
|
|
|
Oxycarium cubense + . . . . . . . . . . .
|
1
|
2
|
|
Chaméphytes rampants
Paspalidium geminatum . . 1 . . 1 . . . . 1 .
|
3
|
62
|
|
Ipomoea aquatica . + . . . . + . . . . .
|
2
|
3
|
|
Ludwigia stolonifera 1 . . . . . . . . . . .
|
1
|
20
|
|
Herbacée volubile
|
|
|
|
Oxystelma bornouense . 1 . . . . . . . . . .
|
1
|
20
|
|
Hydrophytes
|
|
|
|
Hydrophytes flottantes libres
|
|
|
|
Azolla pinnata + . + + + + . + + . 1 .
|
8
|
32
|
|
Pistia stratiotes . . . . + . . 3 . . . .
|
2
|
314
|
|
Hydrophytes flottantes immergées
|
|
|
|
Potamogeton schweinfurthii + 1
|
2
|
22
|
|
Potamogeton octandrus . . . + . . . . . . . .
|
1
|
3
|
|
Hydrophytes feuilles flottantes en surface
|
|
|
|
Nymphaea micrantha . . . . . . . . 1 . . .
|
1
|
20
|
Relevés 116, 118 (Ouassoul, 5 mars 1997).
Relevés 33, 30, 28, 27, 26, 25, 32 (Djoudj, 5 mars 1997). Relevés
76, 69, 68 (Diama, 5 février 1997) ; P = Présence et CR =
Coefficient de recouvrement.
Thiam (1984) a décrit un groupement analogue à
Phragmites australis dans le lac de Guiers.
5. Groupement à Typha domingensis
Typha domingensis est également un
hélophyte émergent et robuste dépassant 3 m de haut sur
les rives du fleuve et des cours d'eau dans le delta. La typhaie donne une
physionomie particulière au paysage végétal. Elle occupe
de vastes étendues. La composition floristique du groupement est
donnée dans le tableau 18. Le groupement se développe dans un
plan d'eau de 0 à plus d'1 m de profondeur. L'exubérance de
l'hélophyte est tel qu'il pose des problèmes
128
d'accès à l'eau et constitue un gîte
recherché par les oiseaux granivores. Depuis quelques années, des
actions de lutte contre la plante sont mises en oeuvre dans le Delta.
Tableau 18 - Groupement à Typha domingensis
|
Numéro de relevé
|
38
|
117
|
34
|
109
|
52
|
67
|
54
|
24
|
29
|
123
|
78
|
23
|
|
|
Recouvrement en %
|
60
|
100
|
100
|
90
|
90
|
90
|
90
|
100
|
60
|
60
|
60
|
100
|
|
Hauteur du plan d'eau (cm)
|
25
|
28
|
40
|
59
|
34
|
77
|
63
|
70
|
96
|
16
|
67
|
76
|
|
Nombre des espèces Strate basse
Géophytes à rhizome
|
7
|
7
|
6
|
6
|
5
|
4
|
4
|
4
|
4
|
3
|
3
|
2
|
P
|
CR
|
|
|
Typha domingensis
|
3
|
5
|
3
|
4
|
4
|
4
|
5
|
5
|
4
|
2 3 3
|
12
|
5646
|
|
Phragmites australis
|
+
|
+
|
1
|
.
|
.
|
1
|
.
|
1
|
1
|
. . .
|
6
|
88
|
|
Cyperus alopecuroides
|
.
|
1.
|
|
2
|
2
|
.
|
.
|
.
|
.
|
. . .
|
3
|
271
|
|
Cyperus articulatus
|
.
|
1.
|
|
2
|
.
|
.
|
.
|
.
|
.
|
. . .
|
2
|
146
|
|
Bolboschoenus maritimus
|
1
|
.
|
2
|
.
|
.
|
.
|
.
|
.
|
.
|
1 . .
|
3
|
167
|
|
Hémicryptophyte
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sporobolus robustus
|
+
|
..
|
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
1
|
2
|
|
Oxycarium cubense
|
.
|
1
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
1
|
21
|
|
Chaméphytes rampants
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Paspalidium geminatum
|
.
|
.
|
.
|
1.
|
|
2
|
.
|
.
|
.
|
. 1 .
|
3
|
166
|
|
Ipomoea aquatica
|
.
|
.
|
1.
|
|
+
|
.
|
.+
|
|
.
|
. . .3
|
|
24
|
|
Ludwigia stolonifera
|
.
|
1
|
.
|
.
|
.
|
.
|
1
|
.
|
.
|
. . .
|
2
|
42
|
|
Echinochloa stagnina
|
.
|
.
|
.
|
.
|
.
|
.
|
1
|
.
|
.
|
. . .
|
1
|
21
|
|
Commelina sp
|
.
|
.
|
.
|
.
|
1.
|
|
1
|
.
|
.
|
. . .
|
2
|
42
|
|
Herbacée volubile
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oxystelma bornouense
|
.
|
.
|
|
+
|
.
|
.
|
.
|
.
|
.
|
. . .
|
1
|
2
|
|
Hydrophytes
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hydrophyte flottante libre
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Azolla pinnata
|
+
|
+
|
+
|
+
|
+
|
+.
|
|
+
|
+
|
2 2 +
|
11
|
268
|
|
Hydrophyte fixée à feuilles
flottantes
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nymphaea lotus
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
2
|
. . .
|
1
|
125
|
|
Strate haute
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tamarix senegalensis
|
2.
|
|
2
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
2
|
250
|
|
Ludwigia erecta
|
2
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
1
|
125
|
Relevés 23, 29, 24, 34, 38 (Djoudj, 5 mars 1997).
Relevés 67, 78, (Diama, 5 février 1997). Relevé 123 (Debi,
5 mars 1997). Relevés 54, 52 (Savoigne, 4 février 1997).
Relevés 117, 109 (Ouassoul, 5 mars 1997) ; P = Présence et CR =
Coefficient de recouvrement.
Le groupement à Typha domingensis a
été signalé par plusieurs auteurs en plusieurs endroits au
Sénégal et en Afrique: Trochain (1940), Adam (1964), Thiam (1984)
dans le lac de Guiers, Sarr (1996) dans la basse vallée du Ferlo
récemment mis en eau et Raynal (1963) dans le lac Tanma. Des peuplements
de Typha domingensis ont été signalés dans le Nil
(Zaharan & Willis, 2003), le delta du fleuve Niger (Wild, 1961), le Bas -
Bénin occidental (Paradis, 1981).
129
6. Groupement à Azolla pinnata et
Ludwigia stolonifera
Azolla pinnata est une petite fougère qui
flotte librement à la surface de l'eau. Ludwigia stolonifera
est une herbe vivace enracinée dans la vase ou le sable à
tiges rampantes qui flottent également à la surface de l'eau
grâce à des racines transformées en organes flotteurs
blanchâtres.
Ces deux espèces caractéristiques du groupement
préfèrent les eaux relativement calmes. La composition
floristique du groupement est donnée dans le tableau 19. Dans les zones
de Savoigne, Richard Toll, Diama et Ouassoul fréquentées par les
populations locales, il y a une importante extension d'Azolla pinnata
et de Ludwigia adscendens. Azolla pinnata constitue
ça et là un tapis flottant duquel émergent les tiges de
Ludwigia stolonifera et bien d'autres herbes de grande taille.
Cependant, Azolla africana est entraîné par le vent dans
les eaux plus profondes où il est retenu par Phragmites et
Typha domingensis formant une strate discontinue de très faible
recouvrement. Le groupement se développe dans un plan d'eau variant
entre 0 et 0,75 m de profondeur. Pistia stratiotes fait partie de ce
groupement.
Le groupement à Azolla pinnata n'avait pas
été signalé jusqu'ici dans le delta.
Lebrun (1947) mentionne au Zaïre Ludwigia stolonifera
(=Jussieua repens), une caractéristique locale de l'association
à Pistia stratiotes et Lemna paucicostata. Il a
également mentionné que cette espèce paraît bien
adaptée aux conditions synécologiques propres au
Lemno-Pistietum. Schnell (1977) a décrit une association
à Jussieua repens et Enhydra fluctuans au Zaïre.
E. fluctuans n'a pas été rencontrée dans le delta
du fleuve Sénégal. Thiam (1984) a décrit un groupement
à Pistia stratiotes et Ludwigia stolonifera dans le
lac de Guiers.
130
Tableau 19 - Groupement à Azolla pinnata et
Ludwigia stolonifera
|
Numéro de relevé
|
91
|
21
|
47
|
46
|
95
|
87
|
120
|
90
|
89
|
44
|
98
|
62
|
51
|
61
|
83
|
93
|
50
|
82
|
|
|
Recouvrement %
|
100
|
60
|
80
|
80
|
100
|
90
|
100
|
90
|
90
|
70
|
100
|
100
|
90
|
70
|
100
|
90
|
80
|
80
|
|
Hauteur du plan d'eau cm
|
8
|
15
|
65
|
61
|
25
|
130
|
24
|
24
|
47
|
25
|
7
|
16
|
66
|
68
|
69
|
8
|
73
|
23
|
|
Nombre d'espèces
|
7
|
7
|
6
|
6
|
6
|
6
|
6
|
5
|
5
|
5
|
5
|
5
|
5
|
5
|
4
|
4
|
3
|
3
|
P
|
CR
|
|
Strate basse
Chaméphytes rampants
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ludwigia stolonifera
|
1
|
1
|
3 3 2
|
3
|
3
|
3
|
3
|
3
|
2
|
2
|
5
|
3
|
3
|
3 4 2
|
18
|
3278
|
|
Vossia cuspidata
|
1
|
.
|
. . .
|
2
|
.
|
+
|
+
|
.
|
.
|
.
|
.
|
.
|
+
|
2 . 1
|
7
|
197
|
|
Ipomooe aquatica
|
.
|
1
|
1 . +
|
.
|
.
|
.
|
.
|
1
|
.
|
.
|
.
|
.
|
.
|
. . .
|
4
|
43
|
|
Echinochloa pyramidalis
|
1
|
3
|
2 . .
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
3
|
305
|
|
Echinochloa stagnina
|
.
|
.
|
. . .
|
1
|
.
|
.
|
.
|
.
|
.
|
.
|
1
|
1
|
.
|
. . .
|
3
|
42
|
|
Polygonum senegalense
|
.
|
.
|
. . 2
|
+
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
+
|
.
|
. . .
|
3
|
85
|
|
Commelina sp
|
3
|
.
|
. . .
|
.
|
.
|
+
|
+
|
.
|
.
|
.
|
+
|
.
|
.
|
. . .
|
4
|
211
|
|
Ipomooe asarifolia
|
1
|
.
|
. . .
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
1
|
14
|
|
Paspalum vaginatum
|
.
|
.
|
. . .
|
.
|
.
|
.
|
.
|
.
|
.
|
2
|
.
|
.
|
.
|
. . .
|
1
|
83
|
|
Paspalidium geminatum
|
.
|
.
|
. . .
|
.
|
.
|
.
|
.
|
.
|
.
|
+
|
.
|
.
|
.
|
. . .
|
1
|
1
|
|
Neptunia oleraoea
|
.
|
.
|
. . .
|
.
|
.
|
.
|
.
|
+
|
.
|
.
|
.
|
1
|
.
|
. . .
|
2
|
15
|
|
Hémicryptophyte Sporobolus
robustus
|
.
|
.
|
. . .
|
.
|
.
|
.
|
.
|
.
|
+
|
.
|
.
|
.
|
.
|
. . .
|
1
|
1
|
|
Oxycaryum cubense
|
+
|
.
|
. . 2
|
1
|
+ 2
|
3
|
.
|
1
|
.
|
.
|
.
|
1
|
+ . .
|
9
|
420
|
|
Thérophyte
Eragrostis gangetica
|
.
|
.
|
. . .
|
.
|
.
|
.
|
.
|
.
|
1
|
.
|
.
|
.
|
.
|
. . .
|
1
|
14
|
|
Géophytes à rhizome Cyperus
alopecuroides
|
.
|
.
|
1 1 +
|
.
|
.
|
.
|
.
|
2
|
.
|
.
|
1
|
.
|
.
|
. . .
|
5
|
126
|
|
Typha domingensis
|
.
|
+
|
. . .
|
.
|
2
|
.
|
.
|
.
|
.
|
2
|
.
|
.
|
.
|
. . .
|
3
|
167
|
|
Phragmites australis
|
.
|
.
|
. . .
|
.
|
+
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
1
|
1
|
|
Bolboschoenus maritimus
|
.
|
1
|
. . .
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
1
|
14
|
|
Cyperus articulatus
|
.
|
.
|
. . .
|
.
|
1
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
1
|
14
|
|
Hydrophytes
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hydrophyte flottant en surface
Azolla pinnata
|
3
|
2
|
1 + 4
|
3
|
3
|
3
|
1
|
+ 4
|
3
|
+ + 4
|
3 + 4
|
18
|
2753
|
|
Hydrophyte fixée à feuilles
flottantes
Nymphoides indica
|
.
|
.
|
2 .
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
1
|
83
|
|
Nymphaoe lotus
|
.
|
.
|
3 .
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
1
|
208
|
|
Hydrophytes flottantes immergée
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Utricularia stellaris
|
.
|
.
|
+ + .
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
2
|
2
|
|
Strate Haute
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tamarix senegalensis
|
.
|
2
|
. . .
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
.
|
. . .
|
1
|
83
|
Relevé 21 (Djoudj, 5 mars 1997).Relevé 62 (Diama ,
5 février 1997). Relevé120 (Ouassoul, 5 mars 1997).
Relevés 87, 93, 90, 91, 98, 95, 89, 83 et 82 (Taouey, 5 mars 1997).
Relevés 47, 46, 51, 61, 50 et 44 (Savoigne, 4 février 1997) ; P=
Présence et CR = Coefficient de recouvrement.
7. Groupement à Potamogeton octandrus
Potamogeton octandrus est une hydrophyte
immergée, avec des tiges avec des entre- noeuds et des feuilles souples
souvent très longues. Les épis sont dressés au-dessus de
l'eau.
La plante s'installe dans un plan d'eau profond dépassant
quelquefois 1,50 m dans les plaines inondées du fleuve et des marigots
dans le delta. Il peut cependant en période de décrue
131
subsister à une faible profondeur d'eau. Le
cortège floristique du groupement est donné dans le tableau
20.
Tableau 20 - Groupement à Potamogeton
octandrus
|
Numéro de relevé
|
58
|
60
|
122
|
31
|
|
|
Recouvrement en %
|
90
|
80
|
70
|
60
|
|
Hauteur du plan d'eau (cm)
|
100
|
110
|
70
|
120
|
|
Nombre des espèces
|
3
|
2
|
2
|
2
|
P
|
CR
|
|
Hydrophyte fixée immergée
|
|
|
|
Potamogeton octandrus 5 3 4 4
|
4
|
6250
|
|
Hydrophyte fixées à feuilles
flottantes
|
|
|
|
Nymphoides indica. 3 . .
|
1
|
938
|
|
Hydrophyte flottante immergée
|
|
|
|
Utricularia stellaris 1 . . .
|
1
|
62
|
|
Hélophytes de la phase d'inondation
|
|
|
|
Chaméphyte rampant
|
|
|
|
Echinochloa stagnina + . . .
|
1
|
5
|
|
Géophytes à rhizome
|
|
|
|
Typha domingensis . . 1 .
|
1
|
62
|
|
Phragmites australis . . . +
|
1
|
5
|
Relevé 31 (Djoudj, 5 mars 1997). Relevés 58, 60
(Savoigne, 4 mars 1997). Relevé 122 (Ouassoul, 5 mars 1997) ; P =
Présence et CR = Coefficient de recouvrement.
Les fragments de Potamogeton schwenfurthii ont
été observés uniquement au niveau du Djoudj. Les deux
espèces Potamogeton schwenfurthii et Potamogeton octandrus
n'ont pas été signalées par Trochain (1940 ; 1956),
Adam (1964), Thiam (1984). L'envahissement du lac de Guiers par
Potamogeton schweinfurthii a été étudié
(Thiam et Ouattara, 1997). Potamogeton schweinfurthii et
Potamogeton octandrus ont été observés dans la
basse vallée du Ferlo (Sarr, 1996). Les Potamogeton sont en
expansion rapide dans l'ensemble du delta. Ceci est à mettre en relation
avec l'adoucissement progressif des eaux et leur stabilité dans le
temps.
L'analyse des groupements végétaux des milieux
humides a permis de reconnaitre sept groupements végétaux qui se
répartissent en végétation des milieux salés et en
végétation des eaux douces. La végétation des
milieux salés comprend le groupement à Tamarix senegalensis
et à Arthrochnemum macrostachym. Le premier occupait
naguère de vastes étendues dans le delta mais subit actuellement
une régression importante dans les zones envahies par l'eau douce. La
végétation des milieux d'eaux douce comprend dans les parties
hautes des rives du fleuve le groupement à Phragmites
australis, suivent ensuite, en eau peu profonde le groupement à
Cyperus alopecuroides, le groupement à Cyperus
articulatus, le groupement à Bolboschoenus maritimus. Les
peuplements à Typha se développent à des
132
hauteurs d'eau variable pouvant aller jusqu'à 1,5 m. En
avant de la ceinture à Typha, se développe le groupement
à Azolla pinnata et Ludwigia stolonifera qui peut
être fragmenté par l'action des vents et des vagues. Ceux-ci
peuvent déplacer Azolla sur de grandes distances. Le groupement
à Potamogeton octandrus se situe vers le large. Les potamots se
développent massivement dans le fleuve et le lac et indiquent une baisse
importante de la salinité des eaux. Potamogeton octandrus
semble plus étendu dans le fleuve alors que dans le lac de Guiers,
c'est Potamogeton schweinfurthii qui est en pleine extension.
Une synthèse des principales caractéristiques des
groupements reconnus en milieu salé et en milieu faiblement salé
ou non est présentée dans le tableau 21.
Pour les groupements halophiles, le sol peut être basique
ou acide. La matière organique est relativement élevée;
les sols sont souvent lourds, riches en argile avec de faible quantité
de matière organique.
Les groupements des milieux humides faiblement salés et
doux sont les plus étendus ; il y a un dessalement progressif des sols
dans les milieux humides.
Les groupements dominés par les Cyperaceae se
développent dans les eaux peu profondes, la lame d'eau oscille entre 30
et 60 cm pour ces groupements.
Les macrophyes flottants se développent dans les eaux
douces faiblement courantes. Les espaces vides entre les peuplements
constituent les zones où s'installent ces plantes qui voguent au
gré des vents et des courants d'eau.
Les potamots sont les seuls macrophytes que l'on rencontre dans
les eaux très profondes (3m).
133
Tableau 21- Quelques caractéristiques des groupements
végétaux en milieux humides salés et très
faiblement salés/doux
|
Type de milieux
|
Groupement végétal
|
Caractéristiques écologiques
|
|
Humides et salés
|
Gr. à Tamarix senegalensis
|
Sol humide pouvant être sec. Faible lame d'eau
temporaire
|
Eau : conductivité élevée pH =8,2
Sol : sablo-argileux ; pH= 6,5 ;
matière organique =
0,84 %
|
|
Gr. à Arthrocnemum macrostachyum
|
Sol humide pouvant être sec. Faible lame d'eau,
temporaire
|
Mêmes caractéristiques que
précédemment. Substrat plus sec plus salé
|
|
Très faiblement salé/ doux
|
Gr. à Bolboschoenus maritimus
|
Hauteur d'eau environ 30 cm
|
Supporte une légère salinité.
Humidité du sol élevée et
permanente.
Lame d'eau
|
|
Gr. à Cyperus alopecuroides
|
Hauteur d'eau environ 50 cm
|
Eaux douces faiblement courantes
|
|
Gr. à Cyperus articulatus
|
Hauteur d'eau environ 60 cm
|
Eaux douces faiblement courantes
|
|
Gr. à Phragmites australis
|
Hauteur d'eau jusqu'à 1 m
|
Eaux douces. Supporte une légère salinité
|
|
Gr. à Typha domingensis
|
Hauteur d'eau jusqu'à 1,5m
|
Eaux douces. Supporte une légère salinité
|
|
Gr. à Azolla pinnata et Ludwigia
stolonifera
|
Hauteur d'eau indifférente (0 - 0,75m)
|
Eaux douces faiblement courantes
|
|
Gr. à Potamogeton octandrus
|
Hauteur d'eau jusqu'à 1,5 m
|
Eaux douces faiblement courantes
|
134
3.4 Conclusion
La zonation de la végétation dépend
fortement de la salinité du substrat, de la déclivité, de
la hauteur d'eau et de la durée de la submersion. A la typhaie
succède généralement la nymphaie ensuite les potamots en
eaux profondes. Les Cyperaceae et Poaceae peuvent être dominants de place
en place.
Quelques groupements des milieux salés humides
subsistent mais ceux des milieux faiblement salés voire doux sont en
extension rapide.
La faible pente dans le delta et sur les rives du lac ainsi
que l'abondance de l'eau douce ont été favorables à
l'extension des peuplements de Typha domingensis qui imprime sa
physionomie à la végétation des milieux humides de la
zone. Il occupe de grandes étendues au détriment d'autres
macrophytes notamment Tamarix senegalensis qui est
éliminé progressivement. L'agressivité de Typha
domingensis vis-à-vis des principaux macrophytes restent à
préciser.
L'observation des groupements végétaux des
milieux humides du delta indique que l'évolution des peuplements de
macrophytes aquatiques est sous-tendue par plusieurs facteurs qui
dépendent :
- de la dessalure du sol par avancée de la lame d'eau
et la submersion du substrat plus ou moins longuement ;
- du comblement progressif des dépressions par
sédimentation ;
- des vents et des courants d'eau ;
- de la dégradation du milieu et de la couverture
végétale suite aux interventions de l'homme.
La prépondérance de l'un ou de l'autre de ces
facteurs à un moment donné reste à établir et
à étayer avec plus de données scientifiques.
En tout état de cause, les nouvelles conditions du
milieu consécutives aux grands aménagements ont provoqué
à des périodes différentes, l'importante extension des
peuplements de Typha domingensis, Pistia stratiotes,
Potamogeton schweinfurthii, et Salvinia molesta.
Nous étudions ci-après quelques aspects de la
biologie et de l'écologie de ces macrophytes.
135
Chapitre 4 Macrophytes aquatiques
proliférants
4.1. Introduction
Le développement excessif de certaines espèces
végétales peut être source de problème plus ou moins
sérieux dans les habitats aquatiques et les milieux humides dans
plusieurs régions d'Afrique et du Monde (Holm and al., 1977 ;
Kornas, 1990; Anonyme, 1995b ; Diop et Triplet, 2000 ; Dutartre, 2004 ; Myers
and Bazely, 2005 ; Beauvais et al., 2006 ; Muller, 2006). Une
multitude de problèmes environnementaux leurs sont assiociés. Le
changement rapide des conditions environnementales entraînent
généralement une augmentation de la diversité, de
l'étendue et des impacts des espèces dites « envahissantes
», invasives, proliférantes,etc. On se heurte ici aussi comme dans
d'autres disciplines scientifiques à des problèmes de
sémantiques et de définitions. Une terminologie précise et
homogène serait nécessaire en matière d'introduction des
espèces (Beisel et Levêque, 2010). La croissance excessive des
macrophytes aquatiques entraîne également une augmentation des
risques pour la santé à travers la formation d'habitats propices
au développement de vecteurs de maladies humaines telles que le
paludisme et la schistosomiase. Par ailleurs, la prolifération des
végétaux augmente l'évapotranspiration accélerant
ainsi les pertes d'eau dans une régionsemi arideoù les
végétaux, le bétail, la faune sauvage et les hommes en ont
d'importants besoins en eau.
Nous qualifions dans ce travail de proliférant
toute espèce végétale aquatique (autochtone,
allochtone, exotique, importée,...) dont la pullulation dans les milieux
naturels ou semi-naturels, provoque ou est susceptible de provoquer des
nuisances. Nous appliquons le terme invasion à
Salvinia molesta, la fougère exotique aquatique introduite
volontairement dans la région. La prolifération des macrophytes
est un élément de changement et est susceptible d'avoir des
incidences sur la diversité biologique (espèces, populations
et/ou écosystèmes).
Les nouvelles conditions écologiques dans le Delta
depuis la mise en service des barrages ont été favorables
à la prolifératioin excessive à des dates
différentes de :
- Typha domingensis (hélophyte) sur les berges
et les rives du fleuve et du lac de Guiers, en eau peu profonde et
également dans les zones basses inondables faiblement salées
depuis le début des années 50;
- Pistia stratiotes (plante flottante libre) au
début des années 90 dans le lac de Guiers et le Parc du Djoudj
;
136
- Potamogeton schweinfurtii (plante submergée)
dans le lac de Guiers à des profondeurs d'eau de plus de 3 m ; elle est
en extension dans les différents plans d'eau également depuis le
début des années 90;
- et, Salivinia molesta, introduite dans la
région à la fin des années 90 ; elle est devenue
invasive.
En dehors de Salvinia molesta, les trois autres
espèces sont autochtones.
Des données sur la biologie, notammentla reproduction,
la multiplication, la phytomasse et l'écologie de ces macrophytes sont
nécessaires dans la mise au point de méthodes de contrôle
efficaces des plantes aquatiques proliférantes.
4.2 Multiplication et phytomasse de Typha domingensis
Pers. dans le lac de Guiers
Typha domingensis Pers. a été
signalé dans la région du delta en 1828 par Heudelot et
Lelièvre et en 1833 par Perrottet (Trochain, 1940). La plante est
très fréquente dans les différents milieux humides de la
zone. Les observations au début des années 90 indiquent une
extension importante du macrophyte dans le delta, le lac de Guiers et la Basse
vallée du Ferlo (Sarr, 1996 ; Kuiseu, 1997 ; Thiam, 1998 ; Sarr, 2003).
Les typhaies ont été estimées à 125 km2
soit 12 500 ha dans le delta dans les années 90 (Hellsten et
al., 1999). A la même période, la propagation des peuplements
de Typha a été de 8-10 % par an dans le Bas delta du
fleuve Sénégal (GTZ, 2001). Ce développement
exubérant des typhaies est consécutif à la mise en service
des barrages de Diama et de Manantali sur le fleuve Sénégal qui
ont occasionné, un adoucissement important des eaux et des hauteurs
limnimétriques élevées toute l'année (Cogels et
al., 1993 ; Kuiseu, 1997 ; Thiam, 1998 ; Kuiseu et al., 2001)
(Figure 23 et Figure 24) mais également aux potentialités
biologiques intrinsèques de reproduction et de multiplication par les
voies sexuée et asexuée du macrophyte. Ces facteurs ont
favorisé la prolifération de la plante (Cogels et al.,
1993 ; Thiam, 1998 ; GTZ, 2001).
Les typhaies produisent une phytomasse très importante
(Thiam, 1998 ; GTZ, 2001). Elles obstruent les canaux, les plans d'eau, rendent
difficile la navigation sur le fleuve et le lac et détruisent les
habitats des poissons. Les peuplements de Typha qui colonisent les
divers milieux humides de la région constituent également
d'excellents gites pour les oiseaux granivores comme le Quelea quelea
qui causent des dégâts sur les cultures ; et des vecteurs de
maladies telles que la bilharziose et le paludisme (Grosmaire, 1957 ; Busnel et
Grosmaire, 1958 ; Mullié et al., 1999 ; GTZ, 2001).
137
Ainsi, le développement massif de Typha domingensis
constitue une contrainte importante à l'exploitation et la
valorisation des ressources en eau et en sols de vastes territoires
aménagés ou aménageables du delta du fleuve et du lac de
Guiers (Trochain, 1956 ; Grosmaire, 1957 ; Thiam, 1982 ; Thiam, 1998 ; GTZ,
2001). Il est dès lors important de rechercher des moyens efficaces de
contrôle et écologiquement acceptables pour limiter les incidences
négatives liées à la prolifération de la plante.
Pour concevoir des méthodes de lutte appropriées, il est
nécessaire de disposer de connaissances approfondies sur la biologie et
l'écologie de la plante dans l'environnement particulier du delta et du
lac de Guiers. C'est pourquoi, nous avons entrepris d'étudier :
- l'importance des différents modes de
reproduction notamment à partir des graines contenues dans les
sédiments du lac (reproduction sexuée) et des rhizomes
(multiplication végétative) dans la prolifération de
Typha domingensis ;
- la dynamique de la croissance et la
phytomasse de la plante dans les conditions naturelles et expérimentales
au niveau d'un dispositif installé sur les rives du lac de Guiers.

Figure 23 - Rideau dense de Typha domingensis dans le
lac de Guiers (Ngnith, mai 1996)

138
Figure 24- Peuplement de Typha domingensis dans le
fleuve Sénégal (mars 2002)
4.2.1 Matériels et méthodes
4.2.1.1 Dispositif expérimental
Le dispositif utilisé est constitué de bacs
métalliques identiques, étanches, de dimension 1m x 1m (volume
1m3) et confectionnés à cette fin (Figure 25). Il est
installé dans un champ protégé sur les rives du lac de
Guiers aux environs du village de Ngnith dans la région centrale du lac.
Le site est dégagé et aucun obstacle ne freine l'incidence des
rayons solaires sur les bacs.
1 m

Pas de rhizome. Les individus de Typha
proviennent uniquement des graines contenues dans les
sédiments
Boutures de rhizomes de Typha
domingensis
1 m
Pas de rhizome. Les individus de Typha
proviennent uniquement des graines contenues
dans les sédiments
139
Bac A Bac B Bac C
Figure 25 - Schéma du dispositif pour l'étude de
T. domingensis.
Une couche de sédiments d'environ 15 cm
d'épaisseur préparée en mélangeant plusieurs
échantillons prélevés en divers endroits dans le lac aux
alentours du village de Ngnith est déposée au fond de chaque bac.
Un échantillon du mélange de sédiments mis dans les bacs a
été analysé au laboratoire pour déterminer la
granulométrie, la conductivité, le pH, la capacité
d'échange cationique.
Après la mise en place du substrat, il a
été apporté dans chaque bac de l'eau
prélevée dans le lac et nécessaire pour maintenir le sol
saturé d'eau. Pendant tout le déroulement des observations, les 3
bacs sont maintenus constamment saturés par apport d'eau du lac en
fonction des besoins. La lame d'eau au-dessus du sol dans les bacs était
toujours d'environ 10 cm. Aucun nutriment n'a été ajouté
dans les bacs. Les plantes ont germé et se sont
développées uniquement à partir des diaspores et des
éléments nutritifs contenus dans les sédiments ou
apportés lors des arrosages périodiques. L'eau apportée
dans les bacs au début des observations avait les
caractéristiques suivantes: Température= 26 °C;
Conductivité: 379 tS; pH = 5,91.
4.2.1.2 Multiplication et croissance
- Reproduction végétative par les
rhizomes
140
Dans le bac A, 2 rhizomes de Typha domingensis
prélevés sur des individus vivants dans le lac ont servi
d'ensemencement. Les caractéristiques des rhizomes sont les suivantes
:
- rhizome 1: 0= 22 mm; longueur = 59 cm ; poids = 96 g; 6 noeuds
- rhizome 2: 0= 30 mm; longueur = 32,5 cm; poids = 65 g; 3 noeuds
- Reproduction sexuée par les graines
Dans les bacs B et C le seul maintien en permanence de
l'humidité a provoqué la germination de graines de Typha
contenues dans les sédiments. Aucun fruit, aucune graine ou rhizome
de Typha n'ont été apportés. Tous les Typha
des bacs B et C proviennent des graines (Figure 26).
Les autres espèces sont éliminées au fur
et à mesure de leur apparition dans les bacs ; seuls les Typhas
sont maintenus.
Pour les deux formes de reproduction, les observations ont
consisté à noter environ tous les 10 jours l'apparition des
Typha et de déterminer la hauteur maximale des plants dans les
bacs.
- Croissance
Pour l'étude de la croissance, environ tous les 10
jours également, la hauteur, le nombre de feuille, la longueur, la
largeur moyenne des feuilles, le diamètre à la base et la taille
d'une dizaine d'individus retenus dès le début des observations
dans le bac B, ont été mesurés. Les individus suivis sont
identifiés au moyen d'une lettre de l'alphabet indiquée sur une
étiquette attachée à la plante avec un fil.
Un ruban métallique est utilisé pour mesurer les
hauteurs et un pied à coulisse pour déterminer la largeur des
feuilles et le diamètre à la base des tiges.
Des mesures biométriques ont été
effectuées également sur des individus dans des peuplements de
Typha se développant dans le lac. Les comptages ont
été faits dans des peuplements ouverts et accessibles ; il est
impossible de pénétrer les peuplements denses surtout en pleine
eau.
4.2.1.3 Phytomasse
Toute la matière végétale, aussi bien
aérienne que souterraine du bac C a été
récoltée après 151 jours de développement tandis
que celles des bacs A et B ont été collectées après
248 jours. La phytomasse de Typha domingensis récoltée
dans chaque bac est séparée en deux lots; le premier lot est
constitué par les feuilles et les tiges (phytomasse aérienne) et
le second par les racines et les rhizomes (phytomasse souterraine). Le poids
frais de chacun des lots est déterminé ainsi que le poids sec
après séchage dans une étuve ventilée maintenue
à la température de 85°C pendant 4
141
à 5 jours. Les poids secs obtenus permettent
d'évaluer la phytomasse produite. En comparant les phytomasses de deux
périodes, la productivité peut être estimée. En
effet, la productivité des macrophytes est communément
évaluée par la mesure des changements dans la biomasse (Westlake,
1965). Rappelons que les bacs ont été tout le temps maintenus
dans les mêmes conditions au cours des observations.
Pour l'évaluation de la phytomasse en milieu naturel
lacustre, des piquets en bois sont utilisés pour délimiter les
placettes de 1 m2 dans lesquelles sont effectuées les
évaluations de la phytomasse (aérienne et souterraine). Quinze
(15) placettes réparties sur l'ensemble du lac ont été
échatillonnées. Des comptages et des mesures biométriques
avec un ruban métallique ont été réalisés
également sur les individus dans les placettes.

Figure 26 - Vue du bac B pour le suivi de la croissance de
Typha domingensis provenant des graines.
Les individus suivis sont identifiés au moyen
d'étiquettes attachés aux plantes.
142
4.2.2 Résultats et discussion
4.2.2.1 Caractéristiques pédologiques du
substrat dans les bacs de culture
Les résultats des analyses pédologiques
indiquent que le substrat des bacs dans lesquels les Typha se sont
développés est à dominance de limon grossier. Il est
moyennement pourvu en matières organiques qui ne s'accumulent pas; la
minéralisation est rapide. Les taux élevés en Mg et Na ont
un effet dispersant sur les colloïdes (organiques et minéraux).
Le sol dans les bacs est faiblement acide à neutre. Il
est bien pourvu en bases. La capacité d'échange est faible
(texture sableuse). Il est moyennement pourvu en Ca et Mg. La teneur en
potassium est normale cependant l'absorption de cet ion peut être
entravée par l'excès relatif du Mg. En effet, la teneur en Mg
dépasse de loin la norme qui est d'environ 0,17 méq. Le taux de
sodium trouvé peut être relativement gênant pour les
plantes. La carence en phosphore est prononcée.
En définitive, le sol mis dans les bassins
d'expérimentation est à dominance de limons grossiers faiblement
acide à neutre et moyennement pourvu en matière organique,
saturé en bases. Il a une bonne saturation en Ca et K. Le sol est bien
pourvu en azote mais l'absorption de cet élément par les plantes
peut être entravée par le déficit relatif en phosphore. Il
s'agit d'un sol hydromorphe minéral sur matériau sableux
alluvionnaire.
4.2.2.2 Multiplication et croissance
Le nombre d'individus apparus est situé entre 110 et
250 plants par m2 dans les bacs. Le plus grand nombre a
été observé dans le bac où il y a eu
transplantation de rhizome. Cela confirme la rapidité et le potentiel de
la reproduction végétative par rapport à la reproduction
sexuée. Sur la base des chiffres obtenus on peut estimer la
densité potentielle du nombre d'individus par hectare entre 1 100 000 et
2 500 000. Bien entendu, dans la nature les densités sont beaucoup plus
faibles compte tenu de la compétition entre les individus
(compétition intraspécifique) et la concurrence d'autres
espèces (compétition interspécifique) la
disponibilité des nutriments et de l'eau indispensables au
développement des plantes.
Les densités varient entre trente (30) et soixante-dix
(70) individus par m2 soit 300 000 et 400 000 individus à
l'hectare dans les conditions naturelles lacustres où les peuplements
paraissent stabilisés. La densité des Typha est
très variable et dépend de la vigueur des individus qui
s'installent, de la permanence de l'humidité et de la
disponibilité des nutriments dans le sol.
143
Typha peut produire entre 70 000 et 700 000 fruits
par inflorescence (Yeo, 1964). Un akène de Typha domingensis
est présenté sur la Figure 74. La diaspore est pourvue d'un
faisceau de poils légers qui favorisent la dissémination
anémochore de la plante sur de grandes distances.
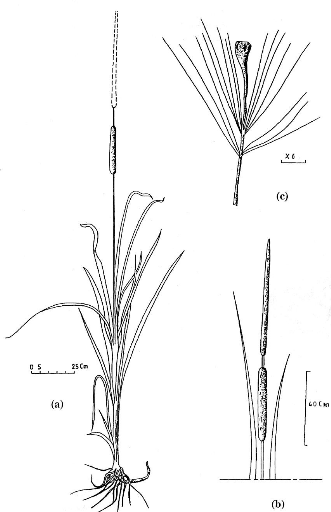
144
Figure 27 - Typha domingensis Pers.
(a) Plante entière; (b)
Inflorescence: le gynécée se trouve en
dessous de l'androcée qui disparaît à la maturité de
l'épi ; (c) Fruit : un akène
145
Evans & Etherington (1991) ont rapporté que la
moyenne du poids d'une graine de T. latifolia est de 0.03 mg. Les
petites graines de Typha produites en abondance sont dispersées
sur de grandes distances par le vent.
Les graines ont souvent un pouvoir germinatif
élevé atteignant les 100% dans les bonnes conditions
d'humidité et de luminosité (Faye, 2004). Pour germer, les
graines ont besoin d'une humidité élevée du sol, d'une
température élevée et d'une intense luminosité
(Sifton, 1959 ; Lorenzen et al., 2000). Une intensité lumineuse
supérieure à 2500 lux est nécessaire pour une bonne
germination et un bon développement de la plantule (Sharma and Gopal,
1979b). Les graines ne germent pas sous une lame d'eau de 50 cm à cause
certainement d'un déficit en lumière (Gopal, 1982). Elles peuvent
demeurer viables pendant une longue période (Bedish, 1967). La
température optimale pour la germination de Typha se situe
entre 25 et 35 oC (Sifton, 1959). L'oxygène n'est pas nécessaire
à la germination (Sifton, 1959) ; en revanche, il est indispensable
à la multiplication végétative par les rhizomes. Le
pouvoir des graines à germer en anaérobiose constitue l'une des
raisons de la dominance de Typha dans les biotopes aquatiques
dulçaquicoles. La germination commence rapidement en milieu ouvert,
aéré, ensoleillé avec une humidité
élevée. Les conditions de luminosité et de
température optimales pour une bonne germination de Typha sont
remplies quasiment toute l'année dans la région du delta et le
lac de Guiers.
Typha domingensis se propage rapidement au moyen des
graines (Sharma & Gopal, 1979a). Des plants de Typha nés
des graines ont fleuri la seconde année (Yeo, 1964). La reproduction par
les graines paraît être limitée aux premiers stades de
l'installation de la plante; ensuite, la multiplication est surtout
végétative.
La multiplication végétative à partir des
rhizomes est prépondérante dans les peuplements
déjà en place alors que la colonisation de nouveaux espaces
s'effectue en grande partie par les graines qui sont produites en abondance
dans toute la région durant la longue saison sèche et
disséminées largement par les vents et les eaux. Des observations
similaires ont été effectuées dans des typhaies aux Etats
Unis. En effet, là également, les Typha colonisent les
nouveaux sites par la dispersion des graines (Grace, 1987).
Dykyjova & Kvet (1978) ont indiqué qu'après
la germination de Typha domingensis, la plante se multiplie par
rhizomes sur des superficies atteignant 60 m2 en l'espace de 2 ans.
McNaughton (1966) et Grace (1984) ont trouvé qu'après
l'occupation complète du milieu par Typha, la germination des
graines peut être inhibée, le peuplement se maintient alors par
multiplication
végétative. Les typhaies produisent de nombreux
rhizomes et une litière très dense ; ce qui réduit
l'opportunité pour d'autres plantes de s'établir ou de survivre
dans le même espace.
Ainsi, la reproduction sexuée est essentielle pour la
colonisation de nouveaux espaces mais les peuplements se maintiennent et
s'étendent ensuite principalement par multiplication
végétative. Un sol saturé d'eau, pauvre en oxygène
ne permettra pas le développement de nouveaux rhizomes à moins
que l'oxygène soit acheminé en profondeur par les feuilles (GTZ,
2001). Pour se développer les rhizomes de T. domingensis ont
besoin d'une humidité constante et un sol inondé pendant
plusieurs mois. La plante préfère une eau calme de 1 m de
profondeur environ (Adam, 1961). L'augmentation graduelle de la profondeur
favorise le développement des rhizomes (Gopal, 1982). Dans le fleuve et
le lac, la plante est rencontrée jusqu'à des profondeurs d'eau de
1,50 m.
S'il est vrai que le macrophyte disparaît des stations
trop acides, elle résiste bien à un degré de salure des
eaux ou du sol relativement élevé pourvu que les rhizomes soient
toujours dans un sol saturé d'eau; Trochain (1940) a trouvé des
Typha dans des eaux à 5,8 pour mille de Na Cl.
Différentes espèces de Typha sont connues comme
modérément tolérant au sel (McMillan, 1959 ; Lombardi
et al., 1996).
Quand les peuplements sont bien établis, la plante
tolère de conditions écologiques plus larges. Le
développement des Typha dans le delta et le lac de Guiers se
fait activement aussi bien par voie sexuée que par la voie
végétative.
Les hauteurs minimales, moyennes et maximales des plantes sont
indiquées dans le tableau 22.
Tableau 22- Hauteurs minimales, moyennes et maximales de
Typha dans les bacs de culture
|
Bac A
(rhizome Typha)
|
Bac B
(graine Typha)
|
Bac C
(graine Typha)
|
|
Hauteur moyenne (cm)
|
90
|
94,1
|
55
|
|
Hauteur minimale (cm)
|
20
|
18
|
13,5
|
|
Hauteur maximale (cm)
|
206
|
180
|
144
|
|
Ecart type
|
36,5
|
36,4
|
23,4
|
146
147
La hauteur maximale atteinte par Typha dans
l'ensemble des bacs a été de 2 m au bout de 248 jours (Figure
28). Celle-ci est bien en deçà des 3,5- 4 m, mesurés en
milieu naturel.
Au plan de la hauteur maximale atteinte par les plantes, il
n'apparaît pas de différences significatives entre les bacs
ensemencés et non ensemencés avec Typha.
|
200 180 160 140 120 100
|
|
|
|
|
|
|
Hauteur A (cm)
Hauteur C (cm)
|
|
80 60 40 20
0
|
|
|
|
26-Fév 6-Mar 12-Mar 5-Avr 15-Avr 4-Jun 14-Jun
19-Jun
4-Jul 14-Jul 2-Aoû 10-Aoû 15-Sep 30-Sep
15-Oct
|
|
|
|
Figure 28 - Evolution de la hauteur maximale de T.
domingensis dans les bacs A et C
Durant les 8 premiers jours après la germination, les
plantes croissent peu. Il s'agit sans doute d'une période d'adaptation
aux conditions expérimentales. Jusqu'au 20ème jour la
croissance est relativement faible. A partir de cette date, les plants se
développent rapidement (près de 1 cm par jour). Elles restent
cependant chétives dans les bacs car elles se développent
uniquement à partir des réserves contenues dans le substrat qui
s'épuisent progressivement. De nombreux individus meurent avant
l'âge adulte.
Les mesures biométriques effectuées sur 10
individus suivis dans le bac C où les Typha proviennent
uniquement des graines contenues dans le substrat ont donné les
résultats présentés sur les graphiques ci-après
:
Le nombre moyen maximal de feuille par individu a
été de 9,8 (Ecart type 1,9) (Figure 29)
148
|
|
|
y = 0,0142x - 490,86
R2 = 0,6201
|
|
|
|
|
|
|
|
|
nombre de feuilles
|
|
|
|
|
|
|
|
|
|
|
|
|
|
jours
Moyenne tendance
|
|
Figure 29 - Evolution moyenne du nombre de feuilles par individu
de Typha du bac C
Il y a de grandes disparités entre les individus. La
moyenne est de 10 feuilles par individus à l'âge adulte. Elle
parait fort variable.
y = 0,7115x - 24997
R2 = 0,8653
moyenne Linéaire (moyenne)
jours
longueur moyenne des feuilles
Figure 30 - Evolution moyenne de la longeur maximale des feuilles
de Typha du bac C
La moyenne des longueurs maximales a été de 157,5
cm (Figure 30). Elle présente une bonne corrélation dans le
temps.
La largeur maximale des mêmes feuilles a été
de 8,43 mm (Ecart type 3,37) (Figure31). Elle est atteinte rapidement et
ensuite elle varie faiblement au court du temps
149
|
|
|
y = 0,0482x - 1691,3
R2 = 0,5722
|
|
|
|
largeur moyenne des feuilles
|
|
|
|
|
|
|
Moyenne tendance jours
|
|
Figure 31 - Evolution de la largeur moyenne des feuilles de
Typha du bac C
Le diamètre moyen à la base des individus de
Typha est de 26,8 mm (Ecart type 6,7) (Figure 32). Il s'accroit au fur
et à mesure du développement des plantes. Il est fortement
corrélé à l'âge de la plante.
y = 0,0935x - 3274,7 R† = 0,9486
Moyenne tendance jours
Diamètre moyenne à la base des feuilles
Figure 32 - Evolution moyenne du diamètre à la base
de Typha du bac C
De façon générale, il y a une grande
similarité dans l'évolution des paramètres de croissance
des différentes parties suivies L'accroissement le plus rapide a
été observé au niveau de la longueur des feuilles, suivie
du diamètre à la base des plantes. Les feuilles atteignent
rapidement leur largeur maximale et ensuite celle-ci varie faiblement. La
richesse du substrat en éléments
150
nutritifs et l'humidité sont des facteurs importants
qui permettent au potentiel de croissance de la plante de s'exprimer.
4.2.2.3 Phytomasse
Les résultats des mesures de phytomasse de Typha
dans les conditions expérimentales et les conditions naturelles
sont indiqués dans le tableau 23.
Les accroissements de phyomasse obtenue dans les bacs
où les Typha proviennent uniquement des graines a
été de 7 g de matières sèches par
m2/jour pendant les 5 premiers mois. La phytomasse aérienne
était alors près de 3 fois plus faible que la phytomasse
souterraine. Au 8 ème mois, les phyomasses souterraine et
aérienne sont devenues pratiquement égales et
représentaient respectivement 48% et 52%. La masse
végétale totale produite est d'environ de 12
g/m2/jour.
Le développement des Typha à partir des
rhizomes a montré une production végétale 2,5 fois plus
importante soit près de 17 g de matières
sèches/m2/jour au bout de 248 jours (8 mois). En conditions
naturelles dans le lac de Guiers, la production annuelle de Typha
domingensis a été de 82 tonnes de matières
sèches par hectare en moyenne dont 57 % est constituée par la
phytomasse aérienne et 43 % par la phytomasse souterraine.
La comparaison des phytomasses de Typha obtenues dans
les bacs B et C permet d'estimer la productivité de Typha
domingensis dans nos conditions expérimentales sur les rives du lac
de Guiers à 6590 g de matières sèches par
m2 et par an (soit 65,9 tonnes par hectare et par an).
L'estimation de la productivité des typhaies est beaucoup plus
aisée dans les pays tempérés que dans les pays tropicaux,
car dans les premiers la saison de végétation est bien
délimitée dans le temps.
Les Typha se développant à partir des
rhizomes produisent une masse végétale beaucoup plus importante
et plus rapidement.
151
Tableau 23 - Phytomasse de T. domingensis en conditions
expérimentales et naturelles
|
Poids frais
(g/m2)
|
Poids sec
(g/m2)
|
Hydratation
(% d'eau)
|
Phytomasse sèche (%)
|
|
BAC C (Typha à partir de graine)
récolte après 150 jours
|
|
|
Phytomasse aérienne (g/m2)
|
1 164
|
245
|
79
|
%
|
23,30
|
|
Phytomasse souterraine (g/m2)
|
3 580
|
809
|
77
|
%
|
76,70
|
|
Phytomasse totale (g/m2)
|
4744
|
1 054
|
78
|
%
|
100,00
|
|
Accroissement moyen journalier
|
|
|
|
|
|
|
Phytomasse (g/m2)
|
32
|
7
|
|
|
|
|
Moyenne phytomasse (g/m2)
|
11 680
|
2 555
|
|
|
|
|
Moyenne phytomasse (tonnes/ha)
|
116,8
|
25,5
|
78
|
%
|
|
|
BAC B (Typha à partir de graines,
récolte après 248 jours)
|
|
|
Phytomasse aérienne (g/m2)
|
3 909
|
1 410
|
79
|
%
|
48,28
|
|
Phytomasse souterraine (g/m2)
|
12 881
|
1 510
|
88
|
%
|
51,72
|
|
Phytomasse totale (g/m2)
|
16 790
|
2 920
|
83
|
%
|
100,00
|
|
Accroissement moyen journalier de la phytomasse
(g/m2/jour)
|
67,7
|
11,7
|
|
|
|
|
Moyenne phytomasse (g/m2/an)
|
24 820
|
4 380
|
|
|
|
|
Moyenne phytomasse (tonnes/ha)
|
248,2
|
43,8
|
83
|
%
|
|
|
BAC A (Typha à partir de rhizome,
récolte après 248 jours)
|
|
|
Phytomasse aérienne (g/m2)
|
4 393
|
1 281
|
71
|
%
|
30,80
|
|
Phytomasse souterraine (g/m2)
|
12 099
|
2 881
|
77
|
%
|
69,20
|
|
Phytomasse totale (g/m2)
|
16 492
|
4 162
|
75
|
%
|
100,00
|
|
Accroissement moyen journalier
|
|
|
|
|
|
|
Phytomasse (g/m2/jour)
|
67
|
17
|
|
|
|
|
Moyenne phytomasse (g/m2/an)
|
24 455
|
6 205
|
|
|
|
|
Moyenne phytomasse (tonnes/ha)
|
244,5
|
62,05
|
75
|
%
|
|
|
Typha en conditions naturelles dans le lac de
Guiers
|
|
|
Phytomasse aérienne (g/m2)
|
13 446
|
4 641
|
65,5 %
|
56,60
|
|
Phytomasse souterraine (g/m2)
|
15 490
|
3 563
|
77
|
%
|
43,40
|
|
Phytomasse totale (g/m2)
|
28 936
|
8 204
|
72
|
%
|
100,00
|
|
Moyenne phytomasse (tonnes/ha)
|
290
|
82
|
72
|
%
|
|

152
Figure 33 - La phytomasse hypogée in situ de
T. domingensis est également très importante
Les phytomasses mesurées en milieu naturel sont
beaucoup plus élevées que celles obtenues dans les bacs
d'expérimentation en raison certainement de la plus grande
disponibilité des nutriments dans la nature et de la densité plus
faible des individus.
L'utilisation du Système d'Information
Géographique (SIG) de la SAED a permis d'estimer sur 40 km, entre le
village de Diama et Débi-Tiguet, 7000 ha infestés entre le fleuve
Sénégal et la digue de protection. Ce qui représenterait
une phytomasse totale comprise entre 840 000 tonnes et 1 050 000 t de
matières fraiches (estimation entre 120 et 150 tonnes de matières
sèches par hectare) (GTZ 2001).
Diop (2002) a mesuré à Cambérene aux
environs de Dakar (Sénégal), une productivité de 180 t/ha/
an avec des Typha domingensis alimentés exclusivement avec des
eaux usées domestiques. Cette valeur représente près de
2,5 fois la productivité que nous avons obtenue en milieu naturel plus
au nord du pays. Typha domingensis paraît avoir une grande
capacité de fixation dans sa biomasse, des nutriments contenus dans les
eaux usées, et par ce fait, de pouvoir épurer celles-ci (Diop,
2002).
153
La biomasse de Typha domingensis a été
estimée entre 1122 et 2537 g de matières
sèches/m2 et la productivité à 1580 g de
matière sèche/m2/an en Afrique de l'Est et du Sud
(Howard Williams & Lenton, 1975).
En Inde, la biomasse aérienne de Typha angustata
L. (syn. de T. domingensis Pers.) varie entre 1468 à 4147
g/m2 dans différentes populations de Typha sous des
conditions d'humidité diverses (Gopal, 1982).
En Caroline du Sud aux Etats Unis, la productivité de
Typha australis Schumach (syn. de T. domingensis Pers.) a
été estimée à 1483 g/m2/an (Bradbury
& Grace, 1983).
Les valeurs de biomasse de Typha domingensis
trouvées dans le lac de Guiers et les productivités
estimées dans le delta, comparées à celles
signalées dans la littérature, montrent que les typhaies du delta
du fleuve Sénégal et du lac de Guiers sont parmi les plus
productives au Monde.
La prolifération de Typha domengensis dans le
delta a été accompagnée dans le parc du Djoudj et le lac
de Guiers, par celle de Pistia stratiotes, un macrophyte
libre flottant. L'étude qui suit porte sur cette espèce qui a
envahi la région sud du lac de Guiers au début des années
90.
4.3 Multiplication et phytomasse de Pistia stratiotes
L. dans le lac de Guiers
Alors qu'en 1980, Pistia stratiotes n'était
représenté que par quelques tapis dérivants (Thiam, 1984),
l'espèce couvrait en 1992 de vastes étendues et obstruait toute
l'extrémité sud du lac de Guiers (Figure 34). Le
développement du végétal a été soudain,
rapide et massif. Il est également consécutif à la mise en
place de grands barrages sur le fleuve Sénégal. La
prolifération de la plante a constitué une nuisance pour les
populations riveraines dans la région sud du lac de Guiers (Thiam et
al., 1993 ; Cogels et al.,1993). En effet, le
développement de vastes tapis de Pistia a rendu difficile
l'accès à l'eau par les populations et le bétail ainsi que
l'exercice de la pêche. De plus, d'importantes masses
végétales de la plante venaient s'échouer sur la digue de
Keur Momar Sarr et constituaient un frein au transit de l'eau vers la basse
vallée du Ferlo.
A la même période, Pistia stratiotes
s'est développé également de façon soudaine et
vigoureuse dans le parc national des oiseaux du Djoudj (Guiral, 1993 ;
Schenk et al., 1998 ; Den Hollander et al., 1999). Ce parc,
un sanctuaire pour les oiseaux, couvre 16 000 ha et correspond au site le plus
important pour l'hivernage des oiseaux migrateurs venant d'Europe. Plus de 360
espèces résidentes ou migratrices fréquentent annuellement
le parc (Tréca et al., 1992). Par cette richesse
spécifique et par l'importance des populations recensées (plus de
3
154
millions d'individus), le Djoudj occupe la troisième
place mondiale pour les oiseaux d'eau. De ce fait, il est inscrit sur la liste
de l'UNESCO des sites du patrimoine mondial de l'humanité et est
protégé par la convention internationale des Zones Humides
d'importance internationale dite convention de Ramsar (Guiral, 1993). En mars
1993, plusieurs petits marigots et des chenaux du parc étaient
obstrués par des populations de Pistia stratiotes alors que
seuls quelques tapis isolés de la plante étaient observés
pendant le même temps dans le fleuve Sénégal.
La multiplication rapide et excessive de Pistia dans
le lac de Guiers (Figure 34, Figure 35 et Figure 36) et dans le parc du Djoudj
a suscité des inquiétudes et a amené les autorités
politiques et administratives à réagir. Divers traitements furent
appliquer (ramassage, lutte biologique) ou envisagés (lutte chimique par
des herbicides-traitement par le feu après déversement
d'hydrocarbures) pour lutter contre la plante considérée comme un
véritable fléau. Ces actions ont été entreprises ou
préconisées sans connaître les caractéristiques
biologiques de l'espèce (Guiral, 1993) et en oubliant que le lac de
Guiers et le Djoudj font partie d'écosystèmes plus vastes (delta,
vallée du Sénégal....) qui peuvent être
affectés négativement par les actions de lutte mises en
oeuvre.
Cette étude a été conduite pour
comprendre quelques aspects de la biologie et de l'écologie de
l'espèce qui aideraient à mieux connaitre la plante en vue de
trouver de meilleurs moyens de contrôle de sa prolifération. Il
donne, pour la première fois pour la zone du delta et le lac de Guiers,
des informations détaillées sur:
- la biométrie de différents organes, la
multiplication végétative, les densités propices à
la pullulation de la plante,
- la qualité de l'eau au moment de la prolifération
de Pistia ;
- et la phytomasse aérienne et submergée du
macrophyte aussi bien en conditions naturelles qu'expérimentales.

155
Figure 34- Envahissement de la région sud du lac par
P. stratiotes (mai 1992)

Figure 35 - Radeau flottant de P. stratiotes avec
Oxycarym cubense (Cyperaceae), lac de
Guiers (mai1992)
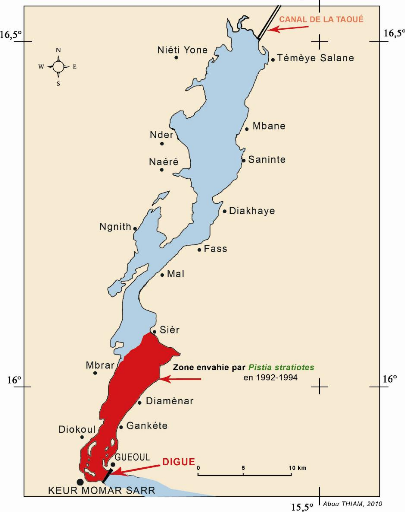
Mbane
Saninte
Nder
·
Naéré
·
5
10 km
CANAL DE LA TAOUÉ
16,5
° ~~ 16,5°
Niéti Yone
·
N
b T
· Témèye Selene
Diakhaye
Ngnith
· Fass
Mal
Sièr
Mbrar
·
Zone envahie par Pistia stratiotes
en 1992-1994
16°
16°
Diamènar
Diokoul
Gankéte
e UEOUL DIGUE
0
·
KEUR MOMAR SARR
15,5° I Abou THIAM, 2010
156
15,5°
Figure 36 -- Zone de pullulation de P.
stratiotes dans le lac de Guiers, 1992-1994
4.3.1 Matériels et Méthodes
4.3.1.1 Multiplication
La multiplication végétative par des stolons est
la plus fréquente dans le delta et le lac de Guiers.
L'étude de la multiplication végétative
de Pistia a été réalisée dans des bassins
flottants. Des chevrons en bois léger de 4 m X 4m ont servi à
confectionner 4 blocs (A, B, C et D) de 1 m2 de surface (Figure 37 et Figure
38). Le cadre est peint avec de la peinture à l'huile pour
protéger le bois en vue d'un séjour prolongé dans l'eau.
Des flotteurs en polystyrène sont placés en divers endroits en
dessous du cadre afin qu'il puisse flotter librement sur l'eau. Un grillage de
maillage moyen a été fixé tout autour du cadre afin que
les plantes ne sortent pas des bassins par vents forts ou par mouvements
brusques des eaux. La hauteur du grillage au-dessus de la surface de l'eau est
de 20 cm alors que la partie immergée est de 10 cm.
Le cadre flotte librement sur l'eau. Il est relié avec
une corde d'environ 5 m à un piquet fixé dans la vase dans le
lac. Il peut se déplacer au gré des vents et les mouvements des
eaux près du rivage et s'adapter continuellement aux variations de
niveau de l'eau. Ce dispositif simple et peu onéreux a été
installé près du village de Ngnith dans la région centrale
du lac pas très loin du rivage où ont été
installés les bacs pour les observations sur Typha
domingensis.
157
Figure 37 - Schéma des bassins flottants pour
l'étude sur Pistia, 1994

Bassins flottants à Pistia stratiotes
Peuplements submergés de Potamogeton octandrus
Figure 38- Vue du dispositif au démarrage de
l'étude sur Pistia (Lac de Guiers, 1994)

Rideau dense de Typha domingensis
Bassin flottant à Pistia stratiotes
158
Figure 39 - Vue du dispositif, 60 jours après le
début des observations (Lac de Guiers, 1994)
159
Un nombre déterminé de jeunes individus vivants
de Pistia stratiotes sont placés dans les bassins A, B, C, D.
Il est de 4 pour le bassin A, 8 pour le bassin B, 12 pour le bassin C et 16
individus pour le bassin D.
Le comptage périodique du nombre d'individus dans les
bassins permet d'apprécier la multiplication de la plante (Mitchell and
Turner, 1975). L'expérience a duré 6 mois, d'Avril à
Décembre 1994.
Des échantillons d'eau ont été
prélevés périodiquement dans le site
d'expérimentation au moment des comptages des individus de Pistia
dans les bassins flottants. Les échantillons sont conservés
dans la glace avant leur analyse au laboratoire où le pH, la
conductivité, le chlore, les sulfates, les carbonates, les phosphates,
le magnésium, le sodium et le potassium sont mesurés. Les
prélèvements et analyses d'eau ont été
réalisés d'Avril à Octobre 1994.
Lors de la prolifération de la plante dans le parc du
Djoudj en 1993, quelques paramètres physico-chimiques de l'eau ont
été mesurés dans 5 sites dans le parc en mars 1993 (saison
sèche).
4.3.1.2 Phytomasse
Le dénombrement périodique du nombre de feuille
dans les bassins A, B, C et D permet d'évaluer l'évolution de la
phytomasse aérienne dans les bassins d'expérimentation.
La phytomasse de Pistia stratiotes a
été évaluée en milieu naturel lacustre en
effectuant des prélèvements en plusieurs points dans des tapis
monospécifiques et denses de la plante dans la région sud du lac.
La profondeur de l'eau dans les sites se situait entre 40 et 60 cm. Un cadre
en bois de 1 m2 a été utilisé
pour délimiter la surface de récolte des individus de
Pistia. Le nombre d'individu a été
déterminé dans les placettes. Les récoltes sont mises dans
des sacs en
jute tarés et étiquetés. Pour chaque
placette de 1m2, les racines et les feuilles sont
séparées au laboratoire avant leur séchage dans une
étuve ventilée à 85°C pendant 4 à 6 jours.
Après séchage, les poids secs des racines et des feuilles sont
déterminés.
4.3.2 Résultats et discussion
4.3.2.1 Multiplication
La Figure 40 montre l'évolution du nombre d'individu dans
les 4 bassins.
Nombre individus
100
40
90
80
70
60
50
30
20
10
0
24-juin 24-juil. 24-août 24-sept. 24-oct. 24-nov.
24-déc.
AN
B
C N
160
Figure 40 - Evolution du nombre d'individus de Pistia
dans les bassins (juin - décembre 1994).
Les équations des courbes de tendance du nombre
d'individus dans les bassins A, B, C et D se
présentent ainsi :
|
YA= 0,3756X - 15164
|
R2A= 0,8825
|
YC= 0,4322X - 17443
|
R2 C= 0,9153
|
|
YB= 0,5096X - 20573
|
R2B= 0,8998
|
YD= 0,4398X - 17742
|
R2D= 0,9473
|
Le nombre le plus élevé d'individus de
Pistia a été observé dans le bassin B contenant
initialement 8 individus tandis que le nombre le plus faible a
été trouvé dans le bassin A contenant au départ 4
individus.
La vitesse de multiplication de Pistia stratiotes est
semblable dans les quatre bassins tant en ce qui concerne le nombre d'individus
que des feuilles (Figure 40). Elle n'est perceptible dans tous les bassins que
45 jours après le début des expériences. Les augmentations
du nombre d'individus sont relativement similaires dans tous les bassins.
Cependant, les plus importantes variations des paramètres suivis sont
observées dans les bassins où il y avait au départ 8 et 12
individus. Les droites de tendance établies montrent une forte
corrélation, entre 0,8 et 0,9.
Pendant les deux premiers mois, l'augmentation du nombre
d'individus et de feuilles dans les bassins est faible. Il s'agit sans doute
d'une période d'adaptation des plantes aux conditions
expérimentales. A partir du 3ème mois, le nombre des individus
augmente plus rapidement.
161
Les densités initiales de 8 et 12 individus sont
apparues les plus favorables à la multiplication rapide de la plante.
La densité a paru être un facteur important dans
la rapidité de prolifération de la plante. En tenant compte des
conditions de qualité d'eau du lac pendant la période, les
densités de 8 à 12 individus par m2 sont parues
favorables à la prolifération de Pistia dans le lac de
Guiers.
Les comptages d'individus effectués en milieu naturel
en Mai 1992 dans le lac de Guiers dans la zone de Keur Momar Sarr ont
donné en moyenne 119 individus par m2 (avec un écart
type de 16,1) alors que le nombre total d'individus par mètre
carré a été de 93 dans les bassins
d'expérimentation.
Les observations sur le développement de Pistia
stratiotes dans des bassins d'expérimentation dans le jardin
botanique du département de biologie végétale de
l'université C.A. Diop de Dakar en 1992 ont permis d'estimer
l'augmentation des superficies occupées par la plante à
2
environ 327 cm par jour. Le temps de doublement de surface
serait alors de 15 jours (Thiam et al., 1993). Au lac Cabora Bassa, ce
temps est de 11 jours (Dejoux, 1988). En Côte d'Ivoire, en milieu de
culture non renouvelé, constitué d'eau du fleuve Comoé, la
croissance de P. stratiotes est parue linéaire sur une dizaine
de jours, avec un taux d'accroissement constant (égal à 0,85
g/jour de biomasse fraîche) et indépendant du poids initial des
plantes testées. Le temps de doublement est ainsi de 11 jours pour de
jeunes plantes, de 19 jours pour des plantes adultes (Guiral et Etien, 1994).
Comparativement à d'autres plantes aquatiques envahissantes, Pistia
a une croissance relativement lente.
En milieu tropical où il y a suffisamment de
nutriments, Pistia stratiotes se reproduit rapidement et produit
à partir de ses stolons de nouveaux individus. La dispersion de la
plante est facilitée par l'action des oiseaux, de l'eau et des plantes
elles-mêmes. Les plantes peuvent également se reproduire à
partir des graines. Fernandez O.A., Sutton D.L. et al (1990) ont
remarqué en Amazonie que 13 à 65 % des fruits de Pistia
stratiotes ont des
2
graines et qu'il y a en moyenne 2300 graines par m de
végétation. Bien que la plante produit de nombreuses graines dans
le lac de Guiers, la multiplication végétative par les stolons
paraît y être la forme de propagation la plus fréquente et
la plus importante. Les graines de Pistia stratiotes
libérées peuvent flotter plus de deux jours avant de tomber
au fond de l'eau. La lumière est importante pour la germination des
graines (Datta and Biswas, 1969). Pieterse and al. (1981) ont
montré que les graines submergées peuvent germer quand elles sont
soumises à des intensités lumineuses élevées. La
viabilité des graines est réduite par séchage à
30°C,
162
mais certaines peuvent survivre ce qui suggère que
Pistia stratiotes a un potentiel d'endurance à la
sécheresse par l'intermédiaire de ses graines (den Hollander
et al. 1999).
Les principaux paramètres physico-chimiques de l'eau dans
le site d'expérimentation se sont présentés ainsi:
- le pH : son évolution est présentée sur la
Figure 41.
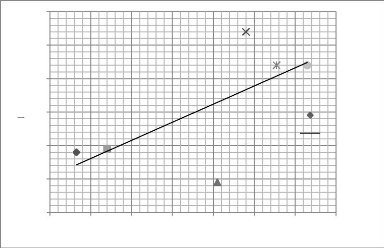
pH
7,9
7,8
7,7
7,6
7,5
7,4
8
11-juin 01-juil. 21-juil. 10-août 30-août 19-sept.
09-oct. 29-oct.
Date
pH
Linaire (pH)
Figure 41 - Evolution du pH de l'eau du lac de Guiers (juin-
octobre 1994)
L'eau du lac varie de neutre à légèrement
alcaline. Le pH n'a pas subi de variations importantes. Il est toujours
demeuré entre 7 et 8 (Figure 41).
- la conductivité: ses valeurs sont indiquées sur
la Figure 90.
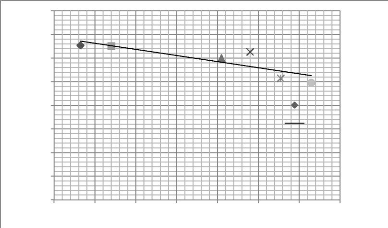
EC (mS)
0,35
0,25
0,15
0,05
0,4
0,3
0,2
0,1
0
11-juin 01-juil. 21-juil. 10-aoàt 30-aoàt 19-sept.
09-oct. 29-oct.
Date
EC (mS)
Linaire (EC (mS))
163
Figure 42 - Evolution de la conductivité (en mS) de l'eau
du lac (juin- octobre 1994)
La conductivité a également
légèrement baissé au cours du temps. Cependant, elle est
toujours restée aux environs de 300 uS/cm (Figure 89).
La baisse de la salinité est corroborée par la
diminution des ions chlorures et sodium (Figure 43 et Figure 44). Les chlorures
et le sodium ont également subi une légère baisse en
septembre probablement à cause de la saison des pluies et
l'arrivée dans le lac de l'eau moins minéralisée provenant
du fleuve Sénégal.
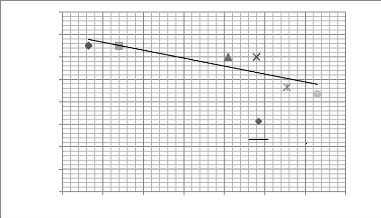
Cl- (m€q.)
0,8
0,6
0,4
0,2
1,6
1,4
1,2
0
1
11-juin 01-juil. 21-juil. 10-aoàt 30-aoàt 19-sept.
09-oct. 29-oct.
date
Cl - (mq.)
Linaire (Cl -
(mq.))
Figure 43 - Evolution des ions chlorures (Cl -) dans l'eau du
lac (juin- octobre 1994)
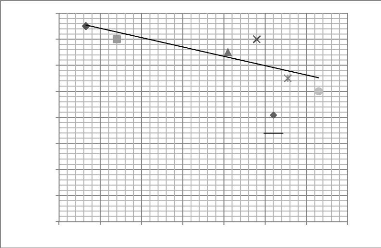
Na+ (méq.)
0,8
0,6
0,4
0,2
1,6
1,4
1,2
0
1
11-juin 01-juil. 21-juil.
10-aoûat30-août 19-sept. 09-oct. 29-oct.
De
Na+ (méq)
Linéaire (
Na+ (méq))
164
Figure 44 - Evolution des ions sodium (Na+) dans l'eau
(juin- octobre 1994)
Les sulfates, les carbonates, le calcium et le potassium ont
très faiblement varié dans l'eau au cours du temps (Figure 45,
Figure 46, 47 et Figure 48) alors que le magnésium a très
sensiblement diminué (Figure 49)
SO4--(méq.)
0,45
0,35
0,25
0,15
0,05
0,5
0,4
0,3
0,2
0,1
0
11-juin 01-juil. 21-juil. 10-août 30-août
19-sept. 09-oct. 29-oct.
Date
5O4-- (méq.)
Linéaire (5O4-- (méq.))
Figure 45 - Evolution des ions sulfates (SO42- ) dans
l'eau du lac (juin- octobre 1994)
HCO3-
1,85
1,75
1,65
1,55
1,8
1,7
1,6
11-juin 01-juil. 21-juil. 10-aoàt 30-aoàt 19-sept.
09-oct. 29-oct.
Date
HCO3-- (mq.)
Linaire (HCO3-- (mq.))
165
Figure 46 - Evolution des ions carbonates (HCO3--)
dans l'eau du lac (juin- octobre 1994)
Ca++ (m€q.)
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
1
11-juin 01-juil. 21-juil. 10-aoàt 30-aoàt 19-sept.
09-oct. 29-oct.
Date
Ca++ (m
Linaire (Ca++ (mq.))
q.)
Figure 47- Evolution des ions calcium (Ca++) dans
l'eau du lac (juin- octobre 1994)
K+ (méq.)
0,16
0,14
0,12
0,08
0,06
0,04
0,02
0,1
0
11-juin 01-juif. 21-juif. 10-août 30-août 19-sept.
09-oct. 29-oct.
Date
K+ (méq.)
Linéaire (K+
(méq.))
166
Figure 48 - Evolution des ions potassium (K +) dans l'eau du lac
(juin- octobre 1994)
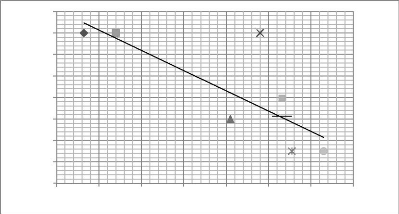
Mg++ (méq.)
0,92
0,88
0,86
0,84
0,82
0,78
0,76
0,9
0,8
11-juin 01-juif. 21-juif. 10-août 30-août 19-sept.
09-oct. 29-oct.
Date
Mg++
Linéaire
(méq.)
(Mg++ (méq.))
Figure 49 - Evolution des ions magnésium (Mg ++) dans
l'eau du lac (juin- octobre 1994)
Les résultats des analyses des eaux de surface dans
plusieurs sites du parc du Djoudj pendant la pullulation de Pistia en
1993 sont indiqués dans le tableau 24.
167
Tableau 24 - Physico-chimie de l'eau dans quelques sites du parc
du Djoudj en mars 1993
|
Stat.
|
Prof.
|
Oxy.(ppm)
|
Cond.
|
pH
|
CI
|
SO4
|
HCO3
|
CO3
|
Ca
|
Mg
|
Na
|
K
|
?
|
?
|
|
E(cm)
|
|
(jiS)
|
|
|
|
|
|
|
|
|
|
anions
|
cations
|
|
D1
|
114
|
5,5
|
244
|
6,7
|
1,0
|
0,1
|
0,8
|
0
|
0,4
|
0,5
|
0,9
|
0,0
|
1,9
|
1,8
|
|
D2
|
123
|
8,0
|
234
|
7,3
|
1,0
|
0,1
|
0,7
|
0
|
0,3
|
0,4
|
0,9
|
0,1
|
1,8
|
1,7
|
|
D3
|
40
|
8,8
|
172
|
7,3
|
0,5
|
0,1
|
0,6
|
0
|
0,3
|
0,3
|
0,5
|
0,0
|
1,3
|
1,1
|
|
D4
|
40
|
8,4
|
136
|
7,3
|
0,2
|
0,1
|
0,6
|
0
|
0,3
|
0,3
|
0,3
|
0,0
|
0,9
|
0,8
|
|
D5
|
30
|
7,9
|
143
|
7,3
|
0,3
|
0,1
|
0,6
|
0
|
0,3
|
0,3
|
0,3
|
0,0
|
1,0
|
0,9
|
|
Moyenne
|
7,7
|
185,8
|
7,2
|
0,6
|
0,1
|
0,7
|
0
|
0,3
|
0,3
|
0,6
|
0,0
|
1,4
|
1,3
|
|
Ecart Type
|
1,2
|
50,5
|
0,3
|
0,4
|
0,0
|
0,1
|
0
|
0,1
|
0,1
|
0,3
|
0,0
|
0,5
|
0,5
|
Stat..= station; Prof. E= profondeur de l'eau
Oxy.=oxygène; Cond.= conductivité
Légende: D1: Marigot de Djoudj après les
nichoirs; D2: Embarcadère du Djoudj ; D3: Fleuve Sénégal,
marigot de N'Dépélour (pas de Pistia stratiotes) ; D4:
Fleuve Sénégal, « ouvrage du crocodile » ; D5 : «
Canal du crocodile»
Dans tous les sites du Djoudj, la conductivité de l'eau
est également faible, inférieure à 250 tS (moyenne = 185
tS). L'eau y est plus douce que dans le lac de Guiers. Le pH est neutre ou
légèrement basique comme dans le lac. La teneur en oxygène
est élevée. Les ions chlorures, carbonates, sulfates, carbonates,
magnésium, calcium et potassium sont plus faibles que dans le lac de
Guiers.
Dans les secteurs du Djoudj où la conductivité
est supérieure à 2 mS/cm, P. stratiotes présente
des populations très dégradées,
caractérisées par un jaunissement important des feuilles et par
le dessèchement de la partie supérieure des limbes. La plante
meurt au-delà d'une conductivité supérieure à 3,85
mS/cm (Guiral, 1993). A une conductivité de l'eau de 7000 tS, les
individus adultes de Pistia meurent dans le parc du Djoudj (den
Hollander et al. 1999).
Ainsi, des conductivités inférieures à
200 tS et la richesse de l'eau en divers nutriments tels que le
magnésium, les carbonates et le potassium sont favorables au
développement et à l'expansion de la plante dans le lac.
Pistia se développe préférentiellement en eau
douce, mais tolère des eaux légèrement saumâtres
(Obeid and Chadwik, 1966 ; Vanden Berghen, 1988). Pistia est sensible
à de faibles taux de salinité de 2,5 pour mille (Haller et
al., 1974). La salinité relativement élevée des eaux
du lac avant 1985 et ses importantes variations dans le temps agissait
probablement comme facteur limitant le développement excessif de la
plante. Ceci est confirmé par les essais menés en 1993 dans des
bassins en terre creusés le long du lac qui ont montré que le
développement de Pistia était ralenti dans des eaux de
conductivité
168
supérieure à 2000 tS correspondant à une
minéralisation globale de 1400 mg/l environ. Si la diminution de la
salinité constitue la condition nécessaire pour la colonisation,
la richesse nutritive des eaux conditionne l'intensité du
phénomène de prolifération (Guiral, 1993). Selon Holm et
al.(1977) cité par Waterhouse (1994), Pistia stratiotes
croîtrait mieux à pH 4. Le pH neutre à
légèrement basique des eaux du lac pourrait être le facteur
qui a déclenché le déclin des populations de Pistia
dans le lac et dans le delta.
4.3.2.2 Phytomasse
L'évolution du nombre de feuille dans les bassins
d'expérimentation est présentée sur la Figure 50.
Nombre de feuille
400
900
800
700
600
500
300
200
100
0
24-juin 24-juil. 24-août 24-sept. 24-oct. 24-nov.
24-déc.
K A
L B
C
Figure 50.- Evolution du nombre de feuilles de Pistia
dans les bassins (juin-décembre 1994) Les équations des
courbes de tendance du nombre de feuilles dans les bassins A, B, C et D :
|
YA= 3,3019X - 133320
|
R2A= 0,8884
|
Yc= 3,8112X - 153803
|
R2 c= 0,9326
|
|
YB= 4,5129X - 182186
|
R2B= 0,9061
|
YD= 3,6138X - 145762
|
R2D= 0,9513
|
Les pesées de phytomasse ont donné les
résultats consignés dans le tableau 25.
169
Tableau 25 - Phytomasse de Pistia stratiotes dans le lac
de Guiers
|
Poids Frais
(en g/m2)
|
Poids Frais. F
(en g/m2)
|
Poids Frais R.
(en g/m2)
|
Poids
Sec. F.
(en g/m2)
|
Poids Sec R.
(en g/m2)
|
Eau
(en g/m2)
|
Phytomasse totale
(g/m2)
|
|
1 F
|
15 091,4
|
n.d
|
n.d
|
1 543,5
|
1 383,8
|
12 164,1
|
2 927,3
|
|
2 F
|
14 694,5
|
n.d
|
n.d
|
1 144,1
|
1 344,5
|
12 205,9
|
2 488,6
|
|
3 F
|
16 295,9
|
n.d
|
n.d
|
1 545,9
|
2 091,4
|
12 658,6
|
3 637,3
|
|
4 F
|
15 086,8
|
7 548,7
|
6 992,1
|
498,7
|
542,1
|
13 500,0
|
1 040,8
|
|
5 F
|
15 388,8
|
7 091,0
|
6 998,9
|
541,0
|
898,9
|
12 650,0
|
1 439,9
|
|
6 F
|
13 481,1
|
n.d
|
n.d
|
538,4
|
589,0
|
n.d
|
1 127,4
|
|
7 F
|
16 888,9
|
8 144,5
|
7 786,8
|
844,5
|
1 086,8
|
14 000,0
|
1 931,3
|
|
8 F
|
15 893,9
|
6 381,1
|
7 399,1
|
981,2
|
1 549,2
|
11 249,8
|
2 530,4
|
|
9 F
|
16 092,8
|
7 378,6
|
7 133,8
|
384,7
|
441,1
|
13 686,6
|
825,8
|
|
10 F
|
15 378,5
|
6 393,9
|
6 995,9
|
543,9
|
546,0
|
12 299,9
|
1 089,9
|
|
MOY.
|
15 429,3
|
7 156,3
|
7 217,8
|
856,6
|
1 047,3
|
12 712,8
|
1 903,9
|
|
MAX
|
16 888,9
|
8 144,5
|
7 786,8
|
1 545,9
|
2 091,4
|
14 000,0
|
3 637,3
|
|
MINI.
|
13 481,1
|
6 381,1
|
6 992,1
|
384,7
|
441,1
|
11 249,8
|
825,8
|
Légende: - P.F: Poids Frais; P.F.F.:
Poids Frais Feuille; P.F.R.: Poids Frais Racine ; P.S.F.: Poids Sec Feuille ;
P.S.R.: Poids Sec Racine ; n.d: non déterminé
2
La phytomasse moyenne de Pistia est de l'ordre de
1900 g de matières sèches par msoit 19 tonnes de matières
sèches par hectare. La phytomasse souterraine est
légèrement plus élevée que la phytomasse
aérienne. Elles représentent respectivement 55 % et 45 % de la
phytomasse sèche totale. Le poids sec représente en moyenne le
1/10 ème du poids frais. Petr (1968) a trouvé des valeurs de
phytomasse fraiche variant entre 169 g et 505,8 g par m2 dans le Lac
Volta. En revanche en Inde, des valeurs de phytomasses sèches de
Pistia variant entre 1198 et 1840 g/m2 ont
été rapportées (Rao and Reddy, 1984). Ces valeurs sont
proches de celles trouvées dans le lac de Guiers. Odum (1957) a
estimé à 15,3 g/m2/jour la productivité de
Pistia stratiotes à Silver Spring en Floride aux Etats Unis.
Petr (1968) a trouvé une productivité de 7,1 g/m2/jour
dans le Lac Volta
170
Très peu de données ont été
trouvées dans la littérature sur les valeurs de la phytomasse de
Pistia en milieu naturel. Celle-ci a surtout été
évaluée dans des expériences de détermination de la
valeur épuratrice des eaux usées domestiques par la plante
(Agendia et al., 1997 ; Diop 2002 ; Koné 2002). Une
productivité de 144 tonnes/ha/an pour des Pistia vivant d'eaux
usées a été trouvée à
Cambéréne aux environs de Dakar (Diop, 2002). Au Cameroun, des
Pistia stratiotes soumis à des effluents d'eaux usées
domestiques ont montré des croissances de l'ordre de 8.5 g de
matières sèches par jour et une productivité annuelle de 3
102 g de matières sèches par m2 (Fonkou et al.
2002).
Pistia stratiotes est une espèce commune des
cours d'eau tropicaux et on la trouve en abondance dans de nombreux lacs
africains (Cabora Bassa, Kariba, Volta, partie nord des lacs de Kossou, Taabo,
Buyo, Ayamé,... Elle se développe également dans les
plaines d'inondation des fleuves d'Afrique centrale et d'Afrique du Sud
(Dejoux, 1988). Des situations de développement exubérant de la
plante ont été signalées dans différentes
régions en Afrique et dans le Monde à différentes
époques. C'est ainsi, qu'une forte expansion de l'espèce a eu
lieu dans la lagune Ebrié en Côte d'Ivoire lors d'une crue
exceptionnelle du Comoé en 1933. Le niveau de la lagune se situait alors
à 1,4 m au-dessus de son niveau normal (Guiral et Etien, 1991). Le lac
Ayamé, un lac de barrage au sud-est de la Côte d'Ivoire, a
été complètement couvert par Pistia stratiotes
causant ainsi un manque d'oxygène dans l'eau et une production de
H2S (Mulligan, 1972). Au sud du Tchad dans les
années 80, Pistia s'est
beaucoup étendue et est devenue gênante dans les
canaux d'irrigation. Elle a complètement recouvert les canaux diminuant
ainsi l'écoulement des eaux. Il a été signalé des
problèmes de Pistia stratiotes et de Nymphaea sp dans
les canaux d'irrigation dans les champs de riz en Gambie (Mitchell et
al., 1990). Au Togo, la plante a envahi de nombreux plans d'eau à
la fin des années 80 (Akpagana, 1993). Le macrophyte peut
également constituer un problème sérieux de mauvaises
herbes par endroits. On la retrouve dans les champs de riz au Vietnam, en Inde,
aux Philippines (Gopal, 1990a). Pistia stratiotes est un support pour
les populations de moustiques. Selon Gangstad et Cardelli (1990), les
moustiques Mansonia, responsables de la transmission de filariose et
d'encéphalite ont des larves et des nymphes qui prélèvent
leur oxygène en piquant les flotteurs situés sur la tige et la
racine des plantes au moyen d'un tube à air spécial. Le moustique
Anophèle, responsable de la transmission du paludisme, trouve
dans les masses de Pistia un abri approprié (Dunn, 1934;
Bennett, 1975; Holm and al., 1977; Lounibos and Dewald,1989).Au
même moment, des peuplements étendus de Potamogeton
171
schweinfurthii, un macrophyte aquatique fixé
et submergé, sont également apparus massivement dans la
région centrale et nord du lac de Guiers. Nous les étudions
ci-après.
4.4 Morphologie, distribution et phytomasse de
Potamogeton schweinfurthii A. Bennett dans le lac de Guiers
En 1991-92, pendant que Pistia se développait
dans la région sud, des peuplements importants de Potamogeton
schweinfurthii sont apparus massivement dans la région centrale et
nord lac de Guiers (Figure 51).
Deux espèces de Potamogeton sont connues en
Afrique de l'Ouest : Potamogeton octandra (= P. octandrus) et
Potamogeton schweinfurthii (John, 1986).
Dans la flore du Sénégal, 1 genre et 2
espèces de Potamogeton ont été mentionnées
par Berhaut (1967) alors que Lebrun (1973) en a cité 3. Deux
espèces sont présentes dans la région du delta et le lac
de Guiers : Potamogeton octandrus et Potamogeton schweinfurthii
(Thiam, 1998). La première a été signalée
comme espèce nouvelle pour le Sénégal au début des
années 60 à partir d'un échantillon récolté
au Niokolo-Koba (Adam, 1962) alors que Potamogeton schweinfurthii a
été collecté dans le lac de Guiers depuis bien longtemps,
au moins depuis le 19 ème siècle, en 1819 par Roger et en 1826
par Leprieur (Dandy, 1937 ; Hutchinson and Dalziel, 1954-1972).
La prolifération de P. schweinfurthii est
également l'une des conséquences des nouvelles conditions
hydrologiques et de qualité des eaux à la suite de la mise en eau
des barrages sur le fleuve Sénégal (Cogels et al.,
1993). Les peuplements de P. schweinfurthii rendent difficiles la
navigation et les déplacements sur le lac et le fleuve. Ils
accélèrent également la sédimentation.
Il est apparu intéressant d'étudier :
- des aspects de la biologie de la plante en effectuant des
mesures biométriques sur différents organes de la plante,
- de suivre la distribution de Potamogeton schweinfurthii
dans le lac de Guiers
- et d'évaluer la phytomasse du macrophyte en milieu
naturel lacustre..
Des connaissances sur la biologie et l'écologie de la
plante sont nécessaires pour contrôler sa multiplication et
développer des méthodes de contrôle qui réduiraient
les gênes occasionnées par la plante.

Aeschynomene elaphroxylon
Peuplements de
Potamogeton schweinfurthii
Epi à maturité
Epi jeune
Feuille mince translucide
Figure 51 - Peuplements de P. schweinfurthii , nord lac
de Guiers, septembre1993
Figure 52 -Vue de près de Potamogeton
schweinfurthiï, 1995
172
173
4.4.1 Matériels et méthodes
4.4.1.1 Morphologie et distribution
La morphologie de P. schweinfurthii (Figure 99) a
été étudiée en effectuant des mesures de longueur
de la tige, de largeur des feuilles, des entre-noeuds de la tige, des
inflorescences et le nombre de fruits par inflorescence sur du matériel
frais récolté dans divers sites dans lac de Guiers. Pour les
inflorescences et le nombre de fruits, deux séries de 36 mesures ont
été faites. En Janvier 1993, avec un bateau à moteur, un
GPS de type Garmin, les principaux peuplements de P. schweinfurthii de
diamètres se situant entre 7 et 10 m ont été
géo-référenciés et reportés
ultérieurement sur une carte.
4.4.1.2 Phytomasse
Des prélèvements sur 1 m2 ont
été réalisés en plein eau dans différents
points du lac sur des tapis de P. schweinfurthii. Les sites
échantillonnés dans le lac ont été : en face des
villages de Mbane, de Temeye Salame sur la rive Est et les villages de Nder et
de Ngnith sur la rive Ouest.
Le poids du matériel frais après
égouttage est déterminé avant d'être mis à
déshydrater dans une étuve ventilée à la
température de 85 ° C jusqu'à stabilisation du poids (3
à 4 jours). Le poids de la matière sèche (la phytomasse
végétale) est ensuite évalué avec un peson à
ressort.
4.4.2 Résultats et discussion
4.4.2.1 Morphologie et distribution
Les résultats des mesures de tige, de feuille,
d'épi, de fruit et de plante entière de Potamogeton
schweinfurthii sont portés dans le tableau 26.
Tableau 26 - Biométrie de quelques organes de
Potamogeton schweinfurthii
|
Organes
|
Feuilles
L (cm) l (cm)
|
Entre-noeuds
(cm)
|
Epis
L (cm)
|
|
n
|
100
|
100
|
100
|
36
|
|
Moyennes
|
22,2
|
1,6
|
10,2
|
6,3
|
|
Maximum
|
40,0
|
2,3
|
48,5
|
9,0
|
|
Minimum
|
9,1
|
0,9
|
0,5
|
2,5
|
|
Ecart-type
|
6,5
|
0,3
|
11,3
|
1,4
|
n = nombre d'échantillon
Les feuilles mesurent de 9 à 40 cm (moyenne= 22 cm) de
long et de 1 à 2 cm de large (moyenne= 1,6 cm). La longueur des
entre-noeuds varie entre 0,5 à 48,5 cm (moyenne = 10,2 cm). L'épi
est cylindrique, compact et mesure en moyenne 10 cm avec des variations allant
de 0,5 à 48,5 cm. Il comporte de nombreuses graines: 167 en moyenne (72
à 264). Le pédoncule des inflorescences mesure en moyenne 7,5 cm
(3,7 à 25,2 cm). Il y a une corrélation assez significative (r =
0,56) entre la longueur et la largeur d'une feuille donnée (Figure
53).
3
y = 0,9927 + 0,0269x R =
0,56
174
0
0 10 20 30 40 50
Figure 53 - Largeur en fonction de la longueur des feuilles
(droite de régression).
Les mesures effectuées sur les épis donnent une
longueur moyenne de 6,3 cm avec des extrêmes de 2,5 et 9,0 cm. Entre la
longueur des épis et le nombre de fruits qu'ils portent, la
corrélation est plus forte (r = 0,75) (Figure 54).
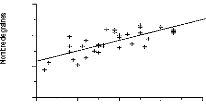
300 y = 16,2731 + 33,4423x R = 0,75
200
Longueur épis (cm)
3 4 5 6 7
100
0
Figure 54 - Nombre de fruits en fonction de la longueur des
épis (droite de régression).
175
Les tiges de Potamogeton schweinfurthii portent des
feuilles très longues, souples. La longueur de la tige varie entre 0,60
et 3,10 m. Les plus longues tiges, dans le lac de Guiers, sont
localisées à la sortie du canal de la Taoué où la
profondeur de l'eau dépasse 3 mètres. Elles sont
ramifiées.
La feuille est entière, sessile ou non, amplexicaule,
membraneuse ou coriace, linéaire, lancéolée ou oblongue ou
subarrondie au sommet à bords ondulés-denticulés
(Lemée, 1934). Les limbes sont étalés sur l'eau
(Raynal-Roques, 1980). Le limbe des feuilles est membraneux et translucide
(Figure 52).
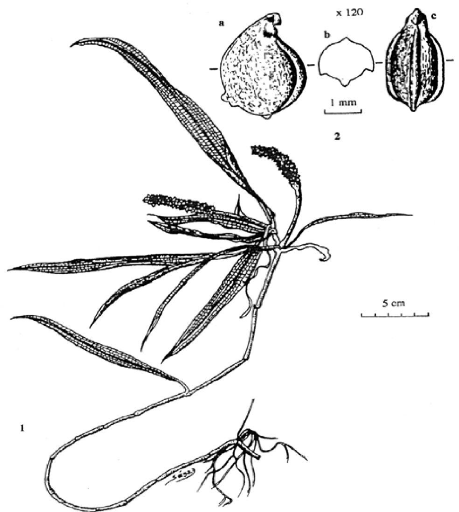
176
Figure 55- Potamogeton Schweinfurthii
A. Bennett (1) Plante entière avec feuilles, deux
inflorescences, racines et rhizome; (2) Graine (x 12) (a-vue
de face; b-coupe transversale; c-vue de profil).
177
Les feuilles sont plus abondantes au sommet des tiges si bien que
la plupart d'entre elles sont effectivement étalées sur le plan
d'eau.
Les limbes foliaires, lancéolés, sont
près de 14 fois plus longs que larges. Leur longueur varie
considérablement (9 à 40 cm), tandis que leur largeur
paraît plus homogène (0,9 à 2,3 cm) avec un
écart-type de 0,3. Les chiffres obtenus sur la longueur des feuilles
sont assez différents de ceux de Berhaut (1967) (8 - 15 cm), tandis que
ceux de la largeur semblent plus conformes à nos observations (1-2cm).
Les limbes comportent, presque invariablement, 4 nervures latérales.
Potamogeton schweinfurthii est une plante aquatique
des eaux profondes et calmes (Raynal-Roques, 1980). La colonisation de la
partie méridionale du lac se poursuivra rapidement sans doute au cours
des années à venir compte tenu des niveaux d'eau
élevés et de leur adoucissement progressif. Des peuplements ont
été observés entre 0,60 et 3,10 mètres de
profondeur. Ils forment dans le plan d'eau des plages plus ou moins
individualisées, dont l'aspect, lié au stade
végétatif de la plante, change en fonction de la période
de l'année. La plante se comporte dans le lac comme une plante
vivace.
La multiplication végétative de Potamogeton
schweinfurthii est très active par les portions de tiges que l'on
observe souvent dans le lac se déplaçant au gré des vents
et des courants d'eau.
Les essais de germination au laboratoire ont montré que
les graines maintenues dans une humidité permanente germent au bout de 4
mois.
Les Potamots sont dans leur grande majorité
des plantes d'eau douce ; aucune d'elle ne vit en milieu marin.
La plupart des espèces de Potamogeton
croissent dans les régions climatiques tempérées.
Environ une dizaine d'espèces se rencontrent en Afrique. Potamogeton
schweinfurthii est géographiquement limité à
l'Afrique tropicale selon Raynal-Roques (1980). Des travaux récents ont
signalé l'espèce en Europe (Kaplan, 2005). Pour l'ensemble du
territoire sénégalais, trois espèces du genre
Potamogeton sont signalées : Potamogeton
schweinfurthii, Potamogeton octandrus et Potamogeton nodosus
(Berhaut, 1967; Adam, 1962 ; Lebrun, 1973).
Jusqu'à la mise en place des grands barrages sur le
Sénégal, Potamogeton n'a pas été
mentionné dans le lac de Guiers par les auteurs qui ont
étudié la flore la région (Trochain, 1940 ; Trochain,
1956 ; Adam, 1964 ; Thiam, 1984). Adam (1960) a indiqué
un Potamogeton dans les rizières de Richard-Toll
malheureusement l'espèce n'a pas été identifiée.
Potamogeton schweinfurthii a été
178
récoltée dans le lac de Guiers il y a plus d'un
siècle par Roger (1819) et Leprieur (1826) (Dandy, 1937). P.
schweinfurthii a dû disparaitre par la suite à cause des eaux
saumâtres venant de la mer pendant les étiages et
pénétrant dans le lac. Il est probable que les conditions
hydrologiques et de qualité des eaux étaient similaires à
celles d'aujourd'hui. Les eaux devraient être très douces.
Quoiqu'il en soit, Potamogeton schweinfurthii et Potamogeton
octandrus sont actuellement abondantes dans le lac de Guiers et dans le
delta du fleuve Sénégal (Thiam, 1993 ; Thiam et Ouattara, 1997;
Thiam 1998).
Les observations sur la répartition et le comportement
des deux espèces montrent que P. octandrus supporte une
salinité de l'eau plus élevée que P.
schweinfurthii.
P. schweinfurthii supporte les hauteurs d'eau plus
élevées que P. octandrus. Il a été
observé à des profondeurs de plus de 3 m alors que P.
octandrusne dépasse guère 1,5 m.
En Afrique du Sud, P. schweinfurthii constitue
souvent une entrave à la navigation et représente une
première étape vers la disparition de nombreux petits cours d'eau
(Dejoux, 1988). Il en est actuellement de même dans le lac de Guiers en
ce qui concerne la navigation. Il est très difficile de se
déplacer avec un bateau à moteur sur le lac à cause des
peuplements submergés très importants surtout dans les
régions centrale et nord du lac. La plante a développé des
herbiers importants dans le lac Tchad (Dejoux et Saint-Jean, 1972).
Plusieurs missions au lac de Guiers entre 1993 et 1995 ont
permis de suivre la distribution des peuplements de Potamogeton
schweinfurthii dans le plan d'eau et de suivre leur évolution
saisonnière.
Les peuplements de Potamogeton schweinfurthii forment
des tapis immergés circulaires. Ces tapis de végétation
retiennent parfois, dans des endroits calmes, d'autres plantes aquatiques
flottantes libres, en particulier Azolla africana et Pistia
stratiotes.
La Figure 56 montre la localisation des principaux groupements
à Potamogeton schweinfurthii dans le lac de Guiers en janvier
1993. Les tapis de la plante se concentrent essentiellement dans la
moitié nord, depuis l'embouchure de la Taoué jusqu'au niveau du
village de Ngnith. Toutefois, il y a un début d'extension dans la
région méridionale, jusqu'au niveau du village de Sier. Les
superficies du lac occupées par les tapis de Potamogeton
Schweinfurthii au moment de nos observations peuvent être
estimées à 500 ha.
Les valeurs moyennes du pH et de la conductivité
électrique mesurées dans les groupements à P.
schweinfurthii dans la région Nord et centrale du lac en janvier
1993 étaient respectivement de 8,1 et de 264,1 uS/cm.
179
Pendant la même période, Potamogeton
schweinfurthii n'a pas été observé dans le canal de
la Taoué qui alimente le lac à partir du fleuve
Sénégal. Cela est probablement dû à la vitesse
rapide des courants d'eau dans le canal.
Les peuplements de Potamogeton schweinfurthii se
présentent dans le lac de Guiers sous des états différents
selon la période de l'année. La période février
à avril correspond à celle de la pleine fructification,
accompagnée d'une perte progressive du feuillage qui, très
abondant en décembre - janvier, diminue progressivement pour être
à son minimum pendant l'hivernage (juillet à septembre). La chute
des feuilles est plus marquée au centre des peuplements parce que le
développement des tapis est centrifuge, les individus les plus
âgés se trouvent au centre.
En février 1995, des groupements épars ont
également été rencontrés dans l'extrême sud
du lac, aux environs de Keur Momar Sarr et dans la basse vallée du
Ferlo, laquelle a été remise en eau au début des
années 90. L'extension de la plante dans l'ensemble du delta et la basse
vallée du Ferlo est en cours (Thiam 1998 ; Sarr et al.,
2001).
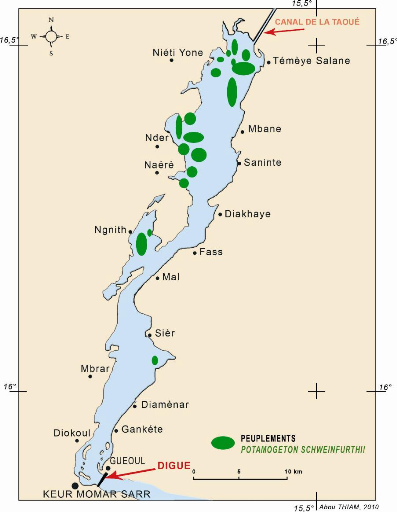
16°
16°
D
Gankéte
· PEUPLEMENTS
POTAMOGETON SCHWEINFURTHII
15,5°
N / CANAL DE LA TAOU
Niéti Yone
·
.Témèye Selene
Mbane
Saninte
Nder
·
Naéré
·
· Diakhaye
Ngnith
· Fass
Mal
Sièr
Mbrar)
·'
16,5`
16,5°
. Diamènar
Diakoul
e
ô
·
KEUR MOMAR-S,ARR
15,5° I Abou THIAM, 2010
GUEOUL
~~
DIGUE 5 10km
180
Figure 56 - P rectaux peupler ents de P.
schweinfurthii dans 1e lac de G uiers, janvier 1993
181
La présence massive des Potamots, surtout de
Potamogeton schweinfurthii dans le lac et le fleuve est sans nul doute
le signe le plus évident de l'adoucissement important des eaux
consécutivement aux barrages.
4.4.2.2 Phytomasse
Les valeurs de phytomasses obtenues sur différents organes
de la plante sont consignées dans le tableau 27.
Tableau 27- Eau et matières sèches dans quelques
organes de Potamogeton schweinfurthii
|
ECHANTILLONS
|
ORGANES
|
Poids frais
(g)
|
Poids sec
(g)
|
Eau
(g)
|
(%)
|
Matières sèches
(%)
|
|
1
|
épis
|
190
|
29
|
161
|
84,74
|
15,26
|
|
tiges
|
597
|
64
|
533
|
89,28
|
10,72
|
|
feuilles
|
1031
|
219
|
812
|
78,76
|
21,24
|
|
2
|
épis
|
288
|
39
|
249
|
86,46
|
13,54
|
|
tiges
|
491
|
65
|
426
|
86,76
|
13,24
|
|
feuilles
|
636
|
123
|
513
|
80,66
|
19,34
|
|
3
|
épis
|
243
|
30
|
213
|
87,65
|
12,35
|
|
tiges
|
871
|
87
|
784
|
90,01
|
9,99
|
|
feuilles
|
1528
|
233
|
1295
|
84,75
|
15,25
|
|
4
|
épis
|
475
|
59
|
416
|
87,58
|
12,42
|
|
tiges
|
732
|
75
|
657
|
89,75
|
10,25
|
|
feuilles
|
887
|
139
|
748
|
84,33
|
15,67
|
182
MOYENNES
|
|
|
|
|
|
|
épis
|
299
|
39,25
|
259,75
|
86,87
|
13,13
|
|
tiges
|
672,75
|
72,75
|
600
|
89,19
|
10,81
|
|
feuilles
|
1020,5
|
178,5
|
842
|
82,51
|
17,49
|
|
Total
|
1992,3
|
290,5
|
1701,8
|
85,42
|
14,58
|
La phytomasse mesurée est en moyenne de 290 g de
matière sèche au m2 soit 2,9 tonnes par ha. La
matière sèche est plus importante dans les feuilles, les
épis et ensuite dans les tiges. Comparée à Typha
et à Pistia, la phytomasse de P. schweinfurthii
est nettement plus faible.
La Figure 57 montre l'importance relative de l'eau et de la
matière sèche dans différents organes de Potamogeton
schweinfurthii.

Matières sèches Humidité
1000
|
800 600 400 200
0
|
|
Organes
|
|
épis tiges feuilles
|
Figure 57 - Matières sèches et eau dans
différents organes de P. schweinfurthii.
P. schweinfurthii est très riche en eau avec plus
de 85 % d'humidité. Les feuilles sont les organes qui en contiennent le
plus et les épis le moins d'eau.
Pendant que le développement important de Typha,
de Pistia et de Potamogeton constituait des
préoccupations majeures et a commencé à attirer
l'attention sur les macrophytes
183
aquatiques de la région, en 1999 d'importants tapis de
Salvinia molesta apparurent soudainement et envahirent d'abord le
delta ensuite le lac de Guiers.
4.5 Invasion du delta du fleuve Sénégal
par Salvinia molesta D.S. Mitchell.
Salvinia est nommé d'après Antonio
Maria Salvini (1633-1729), un professeur de grec à l'Université
de Florence qui aidait le botaniste Pier Antonio Micheli (1679-1737) dans ses
études ; molesta vient du Latin molestus qui signifie
«gênant » ou «ennuyant » et se réfère
au comportement de mauvaise herbe dans les canaux et les systèmes de
stockage de l'eau (Parsons W.T. & Cuthberson, 2001).
Salvinia molesta est originaire du sud-est du
Brésil (Forno and Harkey, 1979). Depuis 1930, la plante a
été introduite dans les régions tropicales et
subtropicales variées où elle est devenue une menace
sérieuse comme Eichhornia crassipes (la jacinthe d'eau) (Room
et al., 1981). La plante a été signalée dans plus de 20
pays dans le Monde (Olivier, 1993). Elle a été mentionnée
dans plusieurs pays en Afrique du Sud (Guillarmod, 1979). S. molesta a
eu un développement explosif dans le lac Kariba (Zimbabwe) au
début des années 60 après la mise en place de barrages
(Boughey, 1963 ; Mitchell, 1969). Depuis 1984, elle figure sur la liste des
plantes nuisibles aux Etats-Unis et il est prohibé de l'importer dans le
pays (McFarland et al., 2004).
La plante n'est pas mentionnée dans les flores
autochtones et introduites du Sénégal (Adam, 1962; Berhaut, 1967
; Berhaut, 1971-1979; Lebrun, 1973). Cette fougère aquatique de la
famille des Hydroptéridées n'a pas été citée
non plus dans les études anciennes et récentes de la flore
aquatique de la région du delta du fleuve Sénégal et le
lac de Guiers (Trochain, 1940 ; Adam, 1960 ; Adam, 1964 ; Thiam, 1984 ; Thiam
et al., 1993 ; Thiam et Ouattara, 1997; Thiam, 1998).
Au cours d'une mission botanique dans la région, nous
avons récolté le 18 mars 1999, pour la première fois,
Salvinia molesta D.S. Mitchell dans un canal d'irrigation communiquant
avec le fleuve Sénégal aux environs du village de Ronkh (N
1631'388 et W 16 06'346). A partir de ce site, la plante s'est
rapidement propagée sur de nombreux plans d'eau et bassins du delta et
le lac de Guiers. Dans les premiers mois de 2000, la situation a empiré
; toutes les surfaces d'eau en contact direct avec le fleuve ont
été infestées. En fin septembre 2000, Salvinia
est présente partout dans le delta et le lac de Guiers et menace
les périmètres hydro-agricoles, le barrage de Diama (Figures 58
& 59) et le parc national du Djoudj. L'envahissement des plans d'eau par
Salvinia molesta a notamment eu pour conséquences (Triplet
et al. 2001) :
184
- le blocage des pompes pour l'irrigation;
- l'augmentation des zones favorables au développement
des moustiques et certains mollusques vecteurs de maladies liées
à l'eau;
- l'impossibilité pour les oiseaux d'eau de se poser;
- les risques d'invasion des rizières qui sont connues
comme des zones de développement privilégiées pour
l'espèce ;
- les difficultés de navigation sur le fleuve et le lac
(Figure 59) ;
- les difficultés voire l'impossibilité de
pêcher;
- les difficultés pour le bétail d'accéder
à l'eau;
- les risques de manque d'eau potable pour les villes de Dakar et
de Saint
Louis qui dépendent grandement du fleuve et du lac de
Guiers pour leur alimentation en eau;
A ces menaces au plan local et national s'ajoutent d'autres
conséquences graves au plan mondial car le delta du fleuve
Sénégal joue un rôle irremplaçable pour de
nombreuses espèces d'oiseaux migratrices. Ce rôle a
été reconnu de longue date et a abouti à la
création dans la région en plus du Parc national des oiseaux du
Djoudj, le Parc national de la Langue de Barbarie, la réserve de faune
de Gueumbeul et la réserve de faune du Ndiael (Anonyme, 1998). En
définitive, le développement explosif de Salvinia molesta
est devenu une contrainte supplémentaire à l'exploitation
des ressources agricoles et halieutiques de la région et un frein aux
activités touristiques génératrices de revenus importants
pour les populations de la région et l'Etat sénégalais.
Face à la menace et aux nuisances provoquées par
la plante, différents moyens de lutte ont été mis en
oeuvre pour contrôler l'expansion de la fougère. Il s'est agi de
la lutte manuelle, mécanique et biologique. La lutte biologique avec
Cyrtobagous salviniae a freiné l'extension de la peste
végétale (Pieterse et al. 2003; Diop 2006).
Compte tenu des problèmes posés par la
prolifération de la fougère, nous avons étudié, au
moment de l'invasion, la présence, l'abondance de la plante et
analysé quelques paramètres de l'eau dans laquelle se
développaient les tapis de Salvinia. L'objectif visé
était d'avoir une meilleure connaissance des conditions de
qualité d'eau favorables à la pullulation de la fougère
dans le delta et le lac de Guiers.

Figure 58 - Envahissement des écluses du barrage de Diama
par S. molesta, Novembre 1999

185
Figure 59 - Masse dense de S. molesta, barrage de Diama,
Novembre 1999
186
4.5.1 Matériels et méthodes
En novembre 1999, soit six mois après la récolte
de la plante pour la première fois, nous avons remonté le fleuve
de Diama à Débi pour évaluer l'extension de la plante et
analyser quelques paramètres physico-chimiques de l'eau qui baigne les
peuplements de Salvinia. Il a été procédé
à l'inventaire et à l'estimation de l'abondance des macrophytes
aquatiques au niveau de 11 sites (Tableau 29) Deux années plus tard, en
mars 2001, nous avons de nouveau parcouru la région du delta et le lac
de Guiers. En plus des sites visités en 1999, nous avons observé
la plante au niveau de 13 autres stations situés plus en aval.
Pour l'estimation de l'abondance des macrophytes,
l'échelle suivante a été utilisée:
+++ = Très abondant (supérieur à 75 %)
++ = Abondant (entre 30 et 75 %)
+ = Peu abondant (inférieur à 30 %)
- = Rare
Les coordonnées géographiques des sites ont
été établies avec un GPS Panasonic model KX-G5500.
Le pH et la conductivité de l'eau ont été
déterminés sur place avec des appareils portatifs. Les nitrates,
les nitrites et les phosphates ont été
analysés au laboratoire sur des échantillons d'eau
prélevés et conservés dans une glacière avant
acheminement au laboratoire. Les analyses de la qualité des eaux ont
été effectuées dans les 11 sites d'observation
visités lors de la mission effectuée en 1999.
4.5.2 Résultats et discussion
4.5.2.1 Abondance des macrophytes
La synthèse des observations effectuées sur la
présence et l'abondance de Salvinia molesta et d'autres
macrophytes dans plusieurs sites sur le fleuve Sénégal sont
indiquées dans le tableau 28.
187
Tableau 28 - Abondance des macrophytes dans le fleuve
Sénégal, Novembre 1999
|
Site
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
Coordonnées N
|
16° 12'53'
|
16° 12'50'
|
16° 21'51'
|
16° 21'51'
|
16° 24'34'
|
16° 28'50'
|
16° 30'54'
|
16° 28'24'
|
16° 24'06'
|
|
Géographiques W
|
16° 25'05'
|
16° 24'50'
|
16° 16'31'
|
16° 16'31'
|
16°18'07'
|
16° 16'34'
|
16°13'56'
|
16° 02'50'
|
16° 04'34'
|
|
Macrophytes
|
|
|
|
|
|
|
|
|
|
1. Flottants
|
|
|
|
|
|
|
|
|
|
Salvinia molesta
|
+++
|
+++
|
+++
|
-
|
+++
|
+++
|
+++
|
+++
|
+++
|
Azolla africana
|
+
|
+
|
+
|
++
|
+
|
|
+
|
+
|
|
Pistia stratiotes
|
|
|
|
|
|
|
-
|
-
|
|
Utricularia stellaris
|
|
|
|
-
|
|
|
|
|
|
2. Fixés
|
|
|
|
|
|
|
|
|
|
|
|
Typha domingensis
|
|
++
|
++
|
+
|
++
|
++
|
++
|
++
|
|
|
Ludwigia adscendens
|
|
+
|
|
|
|
|
+
|
|
|
|
Ludwigia Leptocarpa
|
|
|
|
|
|
|
+
|
|
|
|
Najas pectinata
|
|
+
|
|
|
|
|
|
|
|
Légende : +++ = Très abondant ; ++
= Abondant ; + = Peu abondant ; - = rare
1: En aval du barrage de Diama (500 m) (27/11/99) ; 2. En amont
du barrage de Diama environ 1 km du barrage (27/11/99) ; 3. Parc du Djoudj
côté fleuve Sénégal au près des vannes du
pont de l'embarcadère (27/11/99); 4. Parc du Djoudj côté
parc près des vannes du pont de l'embarcadère (27/11/99) ; 5.
Embarcadère du Djoudj (27/11/99) ; 6. Village de Débi (27/11/99);
7. Près de la station de pompage de Débi (27/11/99) ; 8.
Près de la station de pompage de Diawar (27/11/99) ; 9. Aux environs de
Boundou Barrage (27/11/99).
188
Les tapis de Salvinia sont abondants dans l'ensemble
des sites visités sauf au niveau du Parc du Djoudj où les
entrées d'eau sont contrôlées par un système de
vannes qui régulent le passage de l'eau du fleuve dans le Djoudj. Tous
les espaces rivulaires inoccupés par les peuplements de Typha
domingensis sont colonisés par la plante. D'autres macrophytes
flottants tels que Pistia, Azolla sont étouffés
et progressivement éliminés par les tapis de
Salvinia.
Dans le tableau 29, les valeurs des paramètres
physico-chimiques des eaux dans lesquelles baignent les tapis denses de
Salvinia sont indiquées.
189
Tableau 29 - Physico-chimie de l'eau dans quelques sites envahis
par Salvinia molesta
|
Site
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
Moyenne
|
|
Coordonnées N
W
|
16° 12' 53"16°
|
12' 50"16°
|
21' 51"16°
|
21' 51"16°
|
24' 34"16°
|
|
28' 50"16°30'54"16°
|
28' 24"16°24'
|
06
|
|
|
16° 25' 05"16°
|
24' 50"16°
|
|
16' 31"16°16'31"16°18'
|
07"16°
|
16' 34"16°13'
|
56"16°
|
02' 50"16°
|
04'34
|
|
|
Paramètres
|
|
|
|
|
|
|
|
|
|
|
|
pH
|
6
|
6
|
6
|
7
|
6
|
6
|
7
|
6
|
6
|
6,2
|
|
Conductivité (j.tS/cm)
|
182
|
156,3
|
249
|
314
|
163,3
|
243
|
190
|
220
|
340
|
228,6
|
|
Nitrates (mg/l)
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Nitrites (mg/l)
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Phosphates (mg/l)
|
0
|
0
|
0
|
0
|
0
|
0
|
0,25
|
0,25
|
0,25
|
0,08
|
Légende
1 : En aval du barrage de Diama (500 m) (27/11/99) ; 2 : En
amont du barrage Diama à environ 1 km du barrage (27/11/99) ; 3 : Parc
du Djoudj côté fleuve Sénégal près des vannes
du pont de l'embarcadère (27/11/99) ; 4 : Parc du Djoudj
côté fleuve (27/11/99) ; 5 : Embarcadère du Djoudj
(27/11/99) ; 6. Village de Débi (27/11/99) ; 7 : Près de la
station de pompage de Débi (27/11/99) ; 8 : Près de la station de
pompage de Diawar (27/11/99) ; 9. Aux environs de Boundou Barrage
(27/11/99).
190
La conductivité de l'eau est partout très
faible. La moyenne est de 228uS. Le pH est neutre ou très
légèrement acide. L'eau est très douce. Les taux de
phosphates et de nitrates sont pratiquement nuls. Il n'y a pas de signe
d'eutrophisation.
La faible salinité, le pH neutre ajoutés
à l'ensoleillement et aux vents forts paraissent être les
conditions qui ont été favorables à l'invasion du delta
par la plante.
Les effets de la salinité sur Salvinia molesta
ont été étudiés en détail : Samuel
et al. (1975), ont montré qu'il survenait une mortalité
de 90 % des plantes placées dans l'eau de mer (3,5 %) en 24 heures.
Georges (1976) a observé la mort rapide de Salvinia molesta
dans les eaux saumâtres et de mer. Divakaran et al. (1980),
ont rapporté qu'une salinité au-dessus de 7 %o est nuisible
à Salvinia molesta; la plante est complètement
fanée à une salinité de 11 %o et au-dessus. Elle meurt
à une salinité de 34 %o et 11 %o respectivement en 30 mn et 20
heures. La température est également un facteur important au
développement de la plante ; au laboratoire la plante meurt en 2-3
heures en dessous de - 3°C et au-dessus de de 43°C (Whiteman and
Room, 1991).
4.5.2.2 Systématique et distribution
Il y a une très grande confusion dans la
systématique des Salvinia. Sur les 10 espèces que
renferme le genre, une seule espèce Salvinia nymphellula Desv.
se trouve en Afrique Occidentale (Aké Assi, 1977). Salvinia
nymphellula a été signalée à une date
récente dans la région des «Niayes » au
Sénégal (Sanokho, 1977). S. nymphellula a
été également observée en Côte d'Ivoire, au
Ghana, au Bénin, au Niger, au Nigeria, au Cameroun, au Gabon et au Congo
(Aké Assi, 1977). Salvinia nymphellula et S. hastata
sont endémiques en Afrique (Mitchell, 1985). Salvinia hastata
Desv. a été signalée à Madagascar et en
Afrique de l'Est Tropicale (Wild, 1961). Il y aurait deux centres majeurs de
distribution du genre Salvinia ; l'un en Afrique et l'autre en
Amérique centrale et du sud. Il y aurait une affinité entre
Salvinia et Azolla ; mais du fait de la différence de
plusieurs caractères, les deux plantes ne paraissent vraiment pas
proches. Leur inclusion dans le même ordre, Salviniale, a
été indiquée (Kubtziki, 1990). La dérivation
phylogénique de Salvinia est encore inconnue. Takhtazan (1953)
les suppose dériver des Hymenophyllaceae. Salvinia molesta
D.S Mitchell est la même espèce que Salvinia auriculata
Aubl. (John, 1991). Elle parait avoir une origine hybride (Mitchell, 1970
; 1972). La plante ne se multiplie que par la voie végétative.
Les sporocarpes d'environ
191
1mm de diamètre contiennent le plus souvent des
sporanges vides (Webb et al., 1988). Salvinia molesta est devenue
pantropicale par l'action de l'homme. La plante se trouve dans d'autres pays
d'Afrique de l'Ouest. J'ai récolté des individus isolés en
février 2000 sur les rives du fleuve Niger à Bamako (Mali).
Actuellement, toute la zone rizicole de l'Office du Niger dans le delta central
nigérien au Mali est infestée par la fougère. Celle-ci est
entrée en compétition avec l'autre espèce aquatique
envahissante redoutée, Eichhornia crassipes (la jacinthe
d'eau), un fléau dans de nombreux cours d'eau d'Afrique de l'Ouest
notamment le fleuve Niger.
4.5.2.3 Ecologie et multiplication
S. molesta est une espèce
étrangère invasive introduite dans la zone (Kuiseu et al. 2001).
En effet, selon les villageois interrogés, la plante a été
introduite dans la vallée du fleuve par un entrepreneur qui projetait de
produire de l'aliment de volaille avec la plante. L'entrepreneur n'a pas pu
contrôler les individus qui ont été installés dans
un canal aux environs du village de Ronkh. A partir de là les plantes
ont envahi les nombreux cours d'eau et les canaux d'irrigations dans l'ensemble
du delta et le lac de Guiers.
L'extension de l'espèce n'a pas été
freinée par le barrage de Diama. En octobre 1999, nous avons
retrouvé quelques individus isolés de la plante sur la langue de
Barbarie en aval de Saint Louis, à plus d'une vingtaine de km du village
de Ronkh où elle avait été introduite. Cependant, les
masses importantes de la plantes ne sont pas observées en aval du
barrage de Diama. Elles ne survivent sans doute pas à l'eau
saumâtre qui envahit la région aval du barrage pendant la saison
sèche. En novembre 1999, les environs immédiats du barrage de
Diama sont infestés par la plante (Figure108) dont l'extension s'est
poursuivie très rapidement vers l'aval, Rosso et Richard Toll.
L'invasion rapide du delta du fleuve Sénégal par
la plante est survenue en un laps de temps très court. Les conditions
hydrologiques et de qualité des eaux ont été
particulièrement favorables. Deux raisons possibles à l'explosion
de la plante: (a) le barrage de Diama a réduit en amont la vitesse des
courants et les eaux sont devenues très calmes. Les importants rideaux
de Typha contribuent fortement au ralentissement des mouvements des
eaux; et (b) la mise en eau des barrages a contribué à
très sensiblement à la baisse de la salinité et
l'enrichissement en nutriments des eaux du fleuve.
192
La plante a une multiplication végétative
importante et une vitesse de propagation très élevée. Les
études sur la vitesse de multiplication de Salvinia molesta par
Mitchell (1970), Gaudet (1974) ont montré que dans des conditions de
température optimale (25-30 °C), d'intensité lumineuse
élevée et de non limitation d'apport en nutriments,
l'accroissement de la population est exponentielle, et la plante est capable de
doubler en terme de nombre de feuille en 2 ou 3 jours et occasionnellement en
moins de 2 jours (Mitchell,1985).Dans le lac Kariba, situé entre la
Zambie et le Zimbabwe en Afrique du sud, la plante doublait ses feuilles tous
les 8 à 12 jours (Mitchell and Tur, 1975). Salvinia molesta est
considérée comme l'une des espèces végétales
les plus envahissantes au Monde.
La fougère aquatique montre trois formes distinctes de
multiplication (Ashton & Mitchell, 1989 ; Mitchell and Tur 1975) :
- une forme délicate et fragile « forme primaire
d'invasion» avec de longs inter-noeuds et de petites feuilles atteignant
1,5 cm et qui flottent à la surface de l'eau;
- la forme de colonisation des eaux vives avec des feuilles
qui atteignent 2 cm de large;
- une forme de tapis denses avec normalement de larges
feuilles flottantes (atteignant jusqu'à 6 cm), que l'on rencontre quand
les plantes commencent à se serrer les unes contre les autres et
constituer des masses denses étouffant toutes les autres
espèces.
Les caractéristiques écologiques qui permettent
à la plante d'être invasive sont notamment (Cronk et Fuller, 1995)
:
- plasticité morphologique, avec l'habileté de
modifier ses structures végétatives en réponse aux
conditions environnementales;
- rapidité de propagation végétative;
- potentiel élevé de multiplication et
d'accroissement;
- dispersion rapide par l'intermédiaire de
différents organes qui se détachent facilement suite à
l'action des vents, les vagues provoquées par les pirogues et les
bateaux; la dispersion sur de longues distances peut résulter du
transport de matériel de plante vers l'aval où de nouvelles
colonies peuvent démarrer.
193
La hauteur d'eau ne parait pas être un facteur limitant
le développement de la plante alors que les conditions d'humidité
et d'eutrophisation des eaux dans les rizières suite à des
apports d'engrais chimiques sont favorables à l'extension du
macrophyte.
Plusieurs facteurs sont parus importants dans la formation et
le développement de communautés stables de la plante dans le
Delta :
colonisation rapide des espaces libres disponibles;
emboîtement d'individus dans les tapis constitués
par la plante ;
eau très douce à pH proche de la
neutralité ;
température optimale entre 25 °C et 35 °C
quasiment toute l'année ;
forte luminosité pendant la majeure partie de
l'année;
et, les vents forts qui soufflent dans la région
surtout pendant la saison sèche, facilitent la dissémination de
la plante sur de grandes distances.
Les conditions écologiques résultant de
l'après barrage et le climat ont été favorables au
développement explosif de Salvinia molesta dans le Delta. La
prolifération de la plante a rendu difficile l'accès à
l'eau par les hommes et le bétail et l'exercice de la pêche. De
plus, de nombreux périmètres irrigués et les canaux
d'amenée d'eau ont été envahis par la fougère. Les
espaces libres non occupés par les peuplements de Typha ont
été rapidement occupés par Salvinia qui a
supplanté d'autres plantes flottantes telles que Pistia et
Azolla.
Salvinia molesta n'a pas été
éradiquée. Elle fait maintenant partie de la flore aquatique de
la région et est susceptible de pulluler et devenir gênant
à la faveur de nouvelles conditions favorables. Par exemple, la
diminution des peuplements de Typha pourrait libérer des
espaces qui pourraient être occupés par des tapis de Salvinia
molesta ou d'autres macrophytes et pourraient redevenir gênant.
La multiplication et l'extension rapide de Salvinia
molesta dans tout le système hydrographique du delta du fleuve
Sénégal a montré combien il peut être grave et
onéreux d'introduire les espèces exotiques dans de nouveaux
écosystèmes.
4.6 Conclusion
Les sédiments du lac de Guiers contiennent
d'importantes quantités d'akènes de Typha domingensis
avec un pouvoir germinatif élevé. La croissance de la plante
est très rapide dans les conditions du delta et le lac de Guiers ce qui
la rend envahissant. Elle peut croître de près d'1cm par jour. La
multiplication végétative à partir des rhizomes est
importante et domine dans les
194
peuplements déjà installés alors que la
colonisation des espaces vierges se fait par l'intermédiaire des grandes
quantités de fruits produits et disséminés pendant la
majeure partie de l'année particulièrement durant la longue
saison sèche.
La phytomasse produite est très élevée et
atteint plus de 80 t de matières sèches par hectare. Les
investigations devraient être poursuivies en vue d'une
modélisation des processus de croissance et de multiplication de la
plante en fonction notamment des hauteurs d'eau et de la salinité du sol
et de l'eau. Les possibilités de valorisation de l'importante phytomasse
du macrophyte devront recevoir également plus d'attention.
Une bonne connaissance de la dynamique des peuplements de
T. domingensis permettra certainement d'établir des programmes
de gestion de la plante dans les réservoirs et les milieux humides et
augmenter l'utilisation de la phytomasse tout en réduisant les effets
négatifs liés à l'accumulation de la matière
organique produite par la plante dans les plans d'eau.
La multiplication végétative est la principale
forme de reproduction de Pistia stratiotes dans le lac de Guiers. La
vitesse d'accroissement est en relation avec la densité. Les
densités de 4 à 8 individus au mètre carré sont
favorables à la pullulation de la plante. La phytomasse sèche
produite en milieu naturel est en moyenne de 1900 g de matières
sèches par m2.
Pistia ne présente pas actuellement de risques
de prolifération depuis que les niveaux sont devenus plus stables et les
eaux moins turbides. Cependant, d'autres grands ouvrages sont en chantier en
amont sur le fleuve Sénégal (barrages hydroélectriques de
Félou et de Gouina notamment). La mise en service de ces ouvrages
pourrait créer de nouvelles conditions favorables à l'extension
de la plante. Il s'agira de préciser dans l'avenir les facteurs propices
au développement de l'espèce dans le delta notamment en ce qui
concerne la qualité et la hauteur des eaux. La reproduction
sexuée de Pistia mériterait également
d'être étudiée car celle-ci joue un rôle fondamental
dans l'adaptation de la plante aux conditions écologiques changeantes de
la zone.
Les mesures biométriques de différents organes
de P. schweinfurthii ont permis d'obtenir des données
originales sur la morphologie de la plante dans le lac. Les principaux sites
d'extension du macrophyte dans le lac ont été localisés
sur une carte. Celle-ci qui pourrait aider dans le suivi du
développement des herbiers de la plante dans le lac. La phytomasse
produite est très faible, environ 290 g de matière sèche
par m2. La plante est constituée à plus de 85 % d'eau
que l'on trouve beaucoup plus dans les feuilles.
195
Il serait intéressant de suivre le développement
des tapis de P. schweinfurthii dans le lac et étudier
les effets des peuplements de P. schweinfurthii sur le processus et la
vitesse de sédimentation dans le lac de Guiers.
Le développement rapide de Salvinia molesta a
montré quelques problèmes que peuvent engendrer l'introduction
d'espèces exotiques invasive surtout lorsqu'elles sont douées
d'un important potentiel de multiplication. Certes, la lutte biologique avec
Cyrtobagous salviniae a permis de contrôler la plante.
Cependant, les conséquences de l'introduction de l'insecte n'ont pas
été évaluées. L'agent biologique a
été utilisé dans l'urgence. Il n'y a pas eu au
préalable d'études d'impacts de l'insecte sur
l'écosystème du delta. En tout état de cause, il est
impératif de suivre les populations de S. molesta dans la
zone.
La diminution de la salinité de l'eau et celle des
terres dans certains cas ainsi que les hauteurs d'eau élevées
toute l'année ont été les principaux facteurs qui ont
provoqué l'extension des macrophytes étudiés. La mise en
valeur des terres irrigables, la bonne gestion de l'eau, et l'entretien
régulier des canaux aideraient sans doute à maintenir les
macrophytes de la zone à des niveaux qui ne gênent pas trop les
activités humaines et ne posent pas de graves problèmes
environnementaux. Cela doit se faire dans un cadre politique bien
déterminé et suivi.
196
Chapitre 5 Discussion générale
Au terme de ce travail, il a paru utile de revenir sur le
contexte et la justification et de discuter les principaux résultats
obtenus de l'étude de la flore, de la végétation et des
groupements végétaux, ainsi que des aspects liés à
la prolifération des espèces majeures pour comprendre le
problème, son évolution et son impact sur l'environnement, et
dégager quelques perspectives dans le cadre de la gestion durable des
macrophytes aquatiques proliférants dans le delta et le lac de
Guiers.
5.1. Sur les problèmes du milieu
Le delta du fleuve Sénégal et le lac de Guiers
ont subi de profonds changements avec la mise en place des barrages de
Manantali et de Diama et les différents aménagements qui en ont
résulté (endiguements, aménagements de
périmètres irrigués, Parcs nationaux,...). Ces ouvrages
ont perturbé de manière très sensible les régimes
hydrauliques et le fonctionnement général des
écosystèmes aquatiques (Cogels et al., 1993; Kane,
1997). Il est bien connu, que la transformation d'un système d'eau
courante en un système d'eau dormante qui survient avec les barrages,
influe sur le peuplement végétal et peut entrainer l'extension
rapide de certaines espèces (Boughey, 1963 ; Cook, 1968 ; Gaudet, 1974 ;
Dejoux, 1988).
Les grands ouvrages sur le fleuve Sénégal ont eu
des impacts indéniables sur l'environnement, parfois positifs, mais
souvent négatifs (BDPA/Coyne et Bellier, 1999). Certains effets
prévisibles ont été cités dans différentes
études d'impacts (Gannett Fleming, 1980) ainsi que
l'étude des problèmes environnementaux et de protection des
milieux naturels (République du Sénégal, 1994; BDPA et
al., 1995b). Les principaux problèmes environnementaux posés
par les ouvrages sont une salinisation accrue des sols en aval de Diama ; en
amont avec une recharge plus importante des nappes il y a par endroits des
remontées de sels par capillarité, la baisse importante de la
production piscicole, la perturbation des pratiques traditionnelles de cultures
de décrue, la dégradation de la qualité des eaux dans les
secteurs de production intensive, la pression croissante et les conflits
liés à l'usage des eaux, les problèmes de
santé,...(BDPA et al., 1995a ; BDPA et al., 1995b).
Les incidences négatives des barrages sur les systèmes de
production traditionnels et sur les cultures irriguées ont
également été analysées (Adams, 2000 ; Dumas et
Mietton, 2006).
Malgré les nombreuses études
réalisées, certains impacts restent encore moins bien connus et
de façon générale, les effets en termes quantitatifs sont
mal évalués (Diakhaté, 1986). Il est ainsi difficile d'en
mesurer exactement les risques.
197
Il faut reconnaitre que les données de base sur la
gestion et l'impact environnemental des barrages sont très
limitées et insuffisantes pour:
- gérer les ouvrages conformément à leurs
objectifs;
- moduler ces objectifs et cette gestion dans le cadre plus
général du développement durable et économiquement
acceptable de la vallée, respecter l'environnement au sens large et
réaliser des programmes de développement compatibles avec
notamment la santé des populations (BDPA/Coyne et Bellier, 1999).
L'adoucissement important des eaux ainsi que la
stabilité des hauteurs d'eau suite aux ouvrages ont entrainé la
multiplication excessive de certaines espèces végétales
(Anonyme, 1995b). Les principaux effets négatifs suivants sont
observés :
- difficultés pour les populations humaines et les
animaux d'accéder à l'eau douce pour s'abreuver;
- entrave à l'écoulement des eaux pour les besoins
d'irrigation agricole;
- difficultés de déplacements sur les plans d'eau
envahis par la végétation aquatique; - limitation des
activités de pêche sur le fleuve, les affluents et le lac de
Guiers ;
- recrudescence de maladies liées à l'eau douce
comme le paludisme et la bilharziose ;
- augmentation des peuplements de macrophytes qui constituent
des dortoirs et des zones de nidification pratiquement inviolables pour les
oiseaux granivores néfastes aux cultures;
Il s'agit là des principaux effets négatifs. Ils
se sont manifestés ou se sont amplifiés après la
construction des barrages. Ces effets ne paraissent pas avoir été
suffisamment pris en compte dans les études d'impacts
réalisées avant la construction des ouvrages (Gannett Fleming,
1980).
Pour pallier l'insuffisance d'informations sur l'environnement
de la vallée du fleuve et de ses dépendances, l'OMVS a
préconisé la mise en place d'un Observatoire sur l'environnement
qui assurerait le suivi environnemental des zones affectées par les
barrages et permettrait aux décideurs de disposer d'informations utiles
à la mise en oeuvre d'actions d'atténuation des effets
négatifs sur l'environnement (BDPA/Coyne et Bellier, 1999 ; O.M.V.S,
2003).
Des modèles de gestion des eaux du lac de Guiers ont
été proposés (Cogels, 1997).La mise en
place en 2010
par les autorités sénégalaises de l'Office du lac de
Guiers (O.LA.G), chargée de
198
la gestion du plan d'eau constitue une décision
politique et administrative importante dans le sens d'un meilleur suivi, du
contrôle et de la protection du lac. Il faut espérer que la
structure disposera des moyens nécessaires à l'accomplissement de
sa mission.
5.2 Sur la flore vasculaire
L'inventaire des macrophytes dans les milieux humides du Delta
et le lac de Guiers a permis de recenser 151 espèces réparties
dans 47 familles et 105 genres. Dans cette flore les dicotylédones (85
espèces) sont plus importantes en nombre d'espèces que les
monocotylédones (63 espèces).
En absence de données précises à
l'échelle du delta sur la situation avant les barrages, il est
impossible de comparer la flore actuelle avec la période
antérieure. Cependant, certaines tendances peuvent être
envisagées en terme d'évolution de la flore.
Du point de vue du spectre taxonomique, le coefficient
générique, c'est-à-dire le rapport du nombre de genre
au nombre d'espèces est particulièrement élevé ; il
atteint 67 % alors qu'il est de 40 % pour la flore générale du
Sénégal sur la base des données établies par Ba et
Noba (2001). Ce coefficient est de 72 % pour le Sahara; de fortes valeurs de ce
coefficient sont caractéristiques de flores appauvries (Ozenda,
2004).
Le rapport du nombre de familles au nombre d'espèce est
également élevé; il est de 31 % tandis qu'il est de 7 %
seulement pour la flore du Sénégal (Ba et Noba, 2001). De sorte
que la grande majorité des familles dans le delta et le lac de Guiers ne
sont représentées que par un ou deux genres et la plupart des
genres par une ou deux espèces. Comparée, à la flore
vasculaire du Sénégal qui compte 182 familles, 1022 genres et
2499 espèces (Ba et Noba, 2001), la flore vasculaire recensée
dans les milieux humides et aquatiques du delta du fleuve
Sénégal, représente 25,8 % des familles, 9,9 % des genres
et 6 % des espèces répertoriées sur le territoire
sénégalais.
Cette particularité floristique du delta pourrait
être expliquée par la dominance des espèces dans les zones
basses inondables, consécutivement à la mise en place des
barrages, qui sont à l'interface des milieux aquatiques et des milieux
terrestres ainsi qu'à la forte artificialisation liée à la
multiplication des périmètres irrigués et les nombreux
troupeaux de bétails qui parcourent la région tout le long de
l'année. Les activités agricoles et le bétail participent
sans doute à la dissémination des diaspores des macrophytes (par
anthropochorie et zoochorie).
Les hydrophytes stricto sensu
répertoriées sont au nombre de 21 espèces (3
ptéridophytes, 8 dicotylédones et 10 monocotylédones). Le
nombre total des familles est de 15 (3
199
ptéridophytes, 6 dicotylédones et 6
monocotylédones) et celui des genres est de 16 (3 ptéridophytes,
6 dicotylédones et 7 monocotylédones). Les quinze (15) familles
représentent 15 % des taxons recensés.
- Les espèces de plantes aquatiques vasculaires
appartenant à des familles non strictement aquatiques sont au nombre de
66 (24 dicotylédones et 42 monocotylédones). Le total des
familles est de 13 (10 dicotylédones et 3 monocotylédones) et les
genres est de 39 (17 dicotylédones et 22 monocotylédones).
- treize (13) espèces recensées sont
fréquentes dans les zones salées humides avec 4 espèces de
la famille des Chenopodiaceae.
Cinquante-cinq (55) taxons sont des espèces
accidentelles ou ubiquistes de terrains humides faiblement salés ou non.
L'importance de ces taxons dénote d'une forte artificialisation du
milieu avec introduction d'espèces venant d'autres régions avec
le développement des transports et des échanges entre les
régions et les pays.
Quelques 2600 macrophytes d'eau douce ont été
répertoriées dans le Monde (Beisel et Lévêque,
2010). Ils ne représentent qu'entre 1% à 2% du nombre total des
plantes vasculaires connues (Cook, 1990). Les Angiospermes sont dominantes dans
les végétaux aquatiques vasculaires (Dodds, 2002). Dans ce
groupe, les espèces de plantes aquatiques ont été
trouvées dans 396 genres appartenant à 78 familles (Cook, 1990).
Du point de vue des familles, 35 % des monocotylédones ont des
espèces aquatiques tandis qu'il y a seulement 12,1 % chez les
dicotylédones (Waridel, 2003). Les monocotylédones semblent
relativement plus importantes dans les habitats aquatiques que dans les
habitats terrestres (Hutchinson, 1975).
Les hélogéophytes constituent la
moitié des types biologiques (49 %), suivent les
hydrogéophytes (19 %), les hydrophytes nageants (13 %)
et les hélothérophytes (12%). Ces 4 types biologiques
constituent plus de 90 % des formes biologiques des macrophytes aquatiques. Les
hydrohémicryptophytes et les hydrothérophytes
sont les moins représentées dans la flore des milieux
humides et aquatiques.
Compte tenu de la réduction des courants des eaux voire
leur stagnation ainsi que le développement des périmètres
irrigués, il est probable que les hélogéophytes et les
hydrogéophytes continueront à augmenter. De nombreuses Cyperaceae
font partie de ces types, ce qui pourrait poser des problèmes importants
de contrôle des adventices dans les cultures irriguées.
Au plan de la répartition géographique des
taxons, les espèces pantropicales, paléotropicales et
cosmopolites représentent ensemble près de 70 %. Les
espèces ont donc une très large
200
répartition géographique. Cela est en
concordance avec les observations effectuées par de nombreux auteurs
(Fassett, 1956 ; Sculthorpe, 1967 ; Denny, 1985 ; Cook, 1990; Cook, 1996 ;
Raynal-Roques, 1980). Les plantes aquatiques ont souvent une vaste extension
géographique car le milieu aquatique amortit bien des variations
écologiques majeures comme les éléments du climat et de ce
fait sont relativement homogènes (Raynal-Roques, 1980). En effet,
plusieurs espèces de plantes aquatiques sont largement
distribuées à travers le monde et sont relativement bien connues
dans la littérature botanique et écologique. Ces plantes ont
souvent acquis une distribution globale avec l'aide de l'homme (anthropochorie
intentionnelle ou fortuite) à travers les siècles, moteur de
dissémination par excellence de ces plantes. Certaines espèces
sont natives d'Afrique de l'Ouest, d'autres sont allochtones pour la
région. L'origine de beaucoup d'espèces n'est pas encore
clairement établie. Cook (1985) a établi la liste de 26
espèces des milieux aquatiques dont l'origine est inconnue ou douteuse.
Certaines d'entre elles sont observées dans la zone du delta et le lac
de Guiers. Il s'agit de : Ceratophyllum demersum, Eclipta
prostrata, Ipomoea aquatica, Marsilea minuta,
Nymphoides indica, Phragmites australis, Pistia
stratiotes, Bolboschenus maritimus , Vallisneria
aethiopica.
Du point de vue de la typologie, des représentants de
tous les grands groupes et catégories de macrophytes aquatiques
signalés dans plusieurs régions du monde ont été
trouvées dans le Delta et le lac de Guiers, (Aber, 1920 ; Fassett, 1956
; Sculthorpe, 1967; Cook et al., 1974; Denny, 1985; Cook, 1990 ; Cook,
1996 ; Cook, 2004). Les macrophytes fixés émergents sont
nettement dominant dans la végétation rivulaire et des zones
basses marécageuses. La diversité spécifique y est
élevée. Les macrophytes fixés submergés prennent de
plus en plus d'ampleur avec la diminution de la salinité des eaux et le
ralentissement des courants des eaux. Quant au macrophytes libres flottants, le
grand développement des hélophytes freinent souvent leur
extension dans le fleuve et le lac de Guiers.
5.3 Sur la végétation et les groupements
végétaux
En partant de la terre ferme vers le milieu des cours d'eau,
la végétation présente une répartition
dépendant de plusieurs facteurs : nature du substrat, hauteur d'eau,
action des vagues, teneur de l'eau en substances minérales, etc.
Les séquences végétales suivantes peuvent
souvent être distinguées dans les conditions actuelles :
- la typhaie, caractérisée par
Typha domingensis est parfois associée à Phragmites
australis ; cette zone peut s'avancer dans l'eau jusqu'à 1,50 m de
profondeur. La typhaie
201
constitue souvent une barrière
impénétrable et joue de ce fait un rôle important dans la
protection des rives et des digues contre l'érosion. Elle est
également un lieu de frai et de nidification pour de nombreux oiseaux et
de dortoir aux oiseaux granivores qui font beaucoup de dégâts dans
les cultures;
- la nymphaie, s'étend jusqu'à 3m de
profondeur; Nymphaea lotus est la principale
caractéristique; la nymphaie apparaît en avant
de la typhaie vers le large. Les tiges immergées des
nénuphars servent souvent de support à diverses espèces de
mollusques dont certaines transmettent la bilharziose ;
- la zone à plantes submergées
(fixées ou non) est dominée par les Potamots et est
observée entre 0,5 m jusqu'à plus de 3 m de profondeur de l'eau;
sur les deux espèces de potamots recensées dans la région,
P. schweinfurthii peut s'avancer aux plus grandes profondeurs alors
que P. octandrus se cantonne sur les berges à de faibles
niveaux d'eau; les herbiers à Ceratophyllum demersum,
Utricularia sp, Najas sp peuvent également
apparaître à de faibles profondeurs dans des eaux calmes,
faiblement chargées en éléments minéraux ;
- la zone à plantes flottantes libres
(Pistia, Salvinia,...), est fonction de la direction des
vents dominants et des vagues; les macrophytes flottants peuvent se retrouver
dans les espaces vides apparaissant dans les zones précédentes.
Si la densité des espèces flottantes devient importante et les
peuplements stables, les herbiers submergés disparaissent en dessous car
ils ne reçoivent plus assez de lumière. Cette zone constitue
également une zone de frai pour différentes espèces de
poisson et d'autres espèces animales qui y trouvent nourriture et
support.
La ceinture de végétation
présentée ci-dessus change fréquemment d'un point à
un autre en raison de particularités mésologiques locales.
D'autres macrophytes comme Phragmites australis,
Cyperus articulatus, Cyperus alopecuroides, peuvent devenir
dominant localement à la faveur de conditions particulières
surtout en ce qui concerne le substrat, la pente, le degré
d'humidité et la salinité.
Plusieurs groupement végétaux ont
été reconnus et décrits en milieux humides (Trochain, 1940
; Adam, 1964 ; Thiam, 1984). Les groupements végétaux des milieux
d'eau douce sont plus nombreux que ceux observés dans les milieux
salés du delta. Cela n'est pas surprenant compte tenu des
difficultés physiologiques que les plantes doivent surmonter pour vivre
dans des conditions imposées par le sel dans le sol et dans les eaux.
Malgré le dessalement en cours dans de nombreux sites, les groupements
halophiles occupent encore d'importantes superficies; la nappe souterraine
d'eau salée sous-jacente qui parcourt la région contribue
202
certainement à leur maintien. De plus, le dessalement
des terres, un des objectifs visés par la construction des barrages, se
poursuit en un rythme lent. Les aménagements à réaliser
pour cela demeurent encore faibles. Certaines infrastructures comme l'«
émissaire du delta », qui devraient contribuer à
éliminer vers l'aval, les sels provenant du lessivage des terres ne sont
pas encore entièrement opérationnelles. De façon
générale, la végétation des zones humides soumises
aux sels, montre que la salinité des terres demeure encore relativement
élevée. Par endroits, les Tamarix senegalensis
disparaissent et sont remplacés par Typha domingensis.
Par rapport aux écosystèmes terrestres, les
écosystèmes aquatiques présentent en général
une variation plus faible des différents paramètres de
l'environnement en raison de l'effet modérateur de l'eau en relation
avec ses propriétés particulières (chaleur
spécifique élevée et très faible
conductibilité thermique) ; ceci se traduit par un plus grand nombre
d'espèces cosmopolites.
Aujourd'hui, il est admis que les angiospermes aquatiques ont
évolué à partir des angiospermes terrestres (Cook, 1990).
L'immigration des plantes terrestres dans des milieux d'eaux douces
présentent de nombreuses barrières physiologiques. Finalement,
très peu d'angiospermes (< 1 %) et de ptéridophytes (< 2 %)
ont pu s'adapter à une submersion totale dans l'eau (Wetzel, 1983).
C'est pourquoi, certaines angiospermes émergentes croissant en continu
dans les milieux saturés en eau sont-elles bien adaptées et sont
parmi les plantes les plus productives de la biosphère.
5.4 Sur la prolifération des macrophytes
aquatiques
A la faveur de l'important adoucissement des eaux en amont du
barrage de Diama et les niveaux limnimétriques élevés et
stables toute l'année, quatre espèces végétales
aquatiques proliférantes se sont manifestées comme majeures dans
la zone :
- Typha domingensis ; - Pistia statiotes ;
- Potamogeton schweinfurthii ;
- et Salvinia molesta.
L'extension de Typha dans le delta a commencé
d'abord dans le lac de Guiers avec la construction d'un barrage en béton
sur la Taoué à Richard Toll en 1947 qui transforma le lac de
Guiers en réservoir d'eau douce (Trochain, 1956; Grosmaire, 1957). Les
typhaies ont continué leur extension jusqu'au début des
années 70 (Brigaud, 1961 ; Adam, 1964). Les peuplements de T.
domingensis du lac de Guiers souffriront des grandes sécheresses
des
203
années 1970 (Thiam, 1983 ; Thiam, 1984). L'expansion de
la plante reprendra plus tard et sera accélérée dans le
lac ainsi que quasiment dans tous les cours d'eau et milieux humides du delta
avec la mise en service des grands barrages sur le fleuve
Sénégal. Ainsi, la typhaie constitue depuis plus d'une vingtaine
d'année, la végétation aquatique proliférante
majeure des milieux humides du delta et suscite beaucoup d'inquiétudes
(Trochain, 1956 ; Adam, 1964; Thiam, 1983 ; Anonyme, 1995b).
T. domingensis montre une très grande
plasticité écologique et un potentiel d'accroissement très
élevé. La prolifération rapide du végétal
est liée à sa grande capacité de multiplication
végétative et sexuée dans différents milieux
humides. Les Typha produisent de nombreux rhizomes et une
litière très dense, ce qui réduit l'opportunité
pour d'autres plantes de s'établir ou de survivre dans le même
espace. La multiplication végétative à partir des rhizomes
est prépondérante dans les peuplements déjà en
place alors que la colonisation de nouveaux espaces s'effectue en grande partie
par les graines. Celles-ci sont produites en abondance dans la zone et
disséminées sur de grandes distances par les vents forts,
très fréquents durant la longue saison sèche. Aux Etats
Unis, les Typha colonisent également les nouveaux sites par la
dispersion anémochore des graines (Grace, 1987). Typha domingensis
est sans doute l'espèce qui produit la plus grande phytomasse
à l'hectare avec une productivité très
élevée.
Face aux importantes superficies occupées par les
peuplements de T. domingensis et les nuisances occasionnées,
des programmes de lutte et d'essais de valorisation de la phytomasse de la
plante ont été menés au cours des dernières
décennies. En 1999, des essais de contrôle mécanique avec
fauchage des parties aériennes de Typha domingensis ont
été réalisés dans le lac de Guiers ; les
résultats obtenus ont montré qu'il est possible de faucher par
heure entre 6600 kg/ha et 7260 kg/ha avec une consommation de 6 litres de
gasoil. Sur cette base, 35 heures sont nécessaires pour faucher 1 ha de
Typha. La méthode est donc limitée et peut être
intéressante pour dégager de petites voies d'eau au
bénéfice des communautés villageoises et des
pêcheurs (Hellsten et al. 1999). Sale & Wetzel (1983) ont
indiqué qu'au Michigan (Etats Unis), le fauchage des feuilles de
Typha latifolia L. et Typha angustifolia L. en dessous du
niveau de l'eau empêche le transport de l'oxygène vers la tige et
les rhizomes ; ce qui provoque une respiration en milieu anaérobie des
racines et des rhizomes. Dans ces conditions, les auteurs ont mesuré une
production d'éthanol dans les rhizomes qui a par la suite
provoqué un affaiblissement de la matière végétale
en dessous de la surface de l'eau. Les essais ont montré que trois
coupes pendant la saison de végétation ont été
suffisantes pour
204
tuer toute la biomasse sous l'eau. Dans le lac de Guiers, une
seule coupe effectuée durant la saison de floraison des épis a
suffi (Hellsten et al. 1999).
Dans le Delta, Typha fait l'objet de nombreuses
utilisations : artisanat, matériau pour l'habitat (clôture,
toiture,...). Traditionnellement en Chine, en Australie et en Amérique,
la farine extraite des rhizomes séchés est consommée. Les
jeunes pousses de Typha sont consommées fraîches ou
bouillies et les jeunes feuilles sont utilisées comme condiments
(Theuerkorn et Henning, 2005).
Des essais de valorisation de la biomasse de Typha,
notamment comme source de production d'énergie (charbon biologique) ont
été menés au Sénégal et au Mali (GTZ, 2001).
Les résultats paraissent intéressants mais les briquettes de
charbon à base de Typha ne sont pas encore disponibles sur le
marché.
Une autre technique de lutte contre la plante serait la mise
à sec des périmètres occupés par Typha
pendant une longue période pour assécher les rhizomes. Ceci
constitue certainement un moyen de lutte efficace. L'utilisation de cette
méthode parait actuellement impossible dans le Delta ; elle
nécessiterait des moyens colossaux difficilement mobilisables.
Des essais ont été menés avec le 2,4-D,
le Dalapan, le MCPA, le glyphosate, etc. sur Typha dans plusieurs
contrées à travers le monde (Wild, 1961). La lutte chimique
contre Typha ne saurait être conseillée dans le delta car
comportant beaucoup trop de risques en milieu aquatique. De plus elle est
très chère.
Aucune lutte biologique contre Typha domingensis n'a
été tentée jusqu'ici dans la zone. Celle-ci, ne sera pas
simple compte tenu de la grande plasticité de l'espèce, de son
fort enracinement, de ses rhizomes très puissants et de son installation
dans des eaux relativement profondes. Bracharia mutica, une
Poaceae, a été suggérée comme agent de
contrôle biologique de Typha en Inde (Gopal 1982).
Un contrôle efficace de la plante devrait prendre en
compte les possibilités de multiplication végétative et de
reproduction sexuée.
Pistia stratiotes fait partie de la flore autochtone
de la région. L'extraordinaire développement de l'espèce
dans la partie sud du lac au début des années 1990 est
également une manifestation des changements écologiques survenus
dans la région après les barrages. L'adoucissement des eaux,
l'orientation des vents dominants, l'existence de nombreux îlots qui
favorisent de faibles déplacements des masses d'eau, la remise en
suspension d'éléments minéraux par les fréquentes
ouverture-fermeture de la vanne de la digue de Keur Momar Sarr,
205
sont autant de facteurs qui ont permis à Pistia
stratiotes d'avoir une multiplication fulgurante au point de constituer
une nuisance pour les populations riveraines dans la zone du sud de lac de
Guiers et rendre difficile l'exercice de la pêche (Thiam et al.,
1993 ; Cogels et al., 1993). Bien que Pistia produise de
nombreuses graines dans la région, la multiplication
végétative par les stolons est la forme de reproduction la plus
fréquente. La plante a une très grande capacité de
mobilisation des ressources nutritives en suspension dans les eaux (Guiral,
1993). Ce qui expliquerait sa prolifération temporaire, très
souvent observée consécutivement à des perturbations et
des altérations récentes de l'environnement (construction de
canaux, de drains, de barrages hydroélectriques..) ou à des
enrichissements anthropiques des eaux par des usines polluantes (Hall et Okali,
1974 ; Mitchell, 1985 ; Thiam et al., 1993). Après l'invasion
« explosive » observée dans le lac de Guiers et le Parc du
Djoudj entre 1992 et 1994, les populations de Pistia ont par la suite
rapidement baissé. En fin 1998, l'espèce n'est plus
représentée que par quelques individus dérivants à
la faveur des courants et des vents. Elle ne présente pas actuellement
de risque de prolifération. Cependant, compte tenu de l'intensification
agricole en cours dans la région dont l'une des conséquences
pourrait être l'eutrophisation des eaux, les populations de Pistia
pourraient amorcer un nouveau cycle de développement explosif.
Pour lutter contre la prolifération de Pistia
stratiotes dans le lac de Guiers, l'enlèvement manuel a
été pratiqué de manière localisée par les
populations pour dégager des espaces et accéder à l'eau du
lac. Des tentatives pour faire du biogaz et du compost avec la plante ont
également eu lieu ; les résultats obtenus ont été
très mitigés. La lutte mécanique a été
fréquemment employée contre la plante. Elle est
difficile et peu efficace quand il s'agit de superficies relativement
importantes. Cependant, Varshnney et Singh (1976) considèrent qu'en
Inde, l'enlèvement manuel de Pistia stratiotes est efficace
dans 65 à 90 % des cas d'infestation (Wade, 1990).
Des tests de laboratoire menés en Côte d'Ivoire
ont démontré qu'il était possible d'éliminer
chimiquement P. stratiotes avec des herbicides utilisés en
agriculture. Les meilleurs résultats ont été obtenus avec
le glyphosate-N-phosphonométhyl-glycine, un inhibiteur de la
biosynthèse d'acides gras aromatiques et de certaines enzymes. La dose
efficace déterminée pour l'espèce a été de
0,63 g par m2 (Etien et al., 1991). Le diquat et
le paraquat sont deux herbicides qui ont été
employés à la dose de 0,6 à 1 kg/ha dans certains pays
d'Asie pour combattre Pistia stratiotes (Gopal, 1990b).
L'efficacité de ces traitements n'a pas été
indiquée par les auteurs.
206
La lutte biologique contre Pistia avec
Neohydronomus affinis, un arthropode importé d'Afrique du Sud,
a été réalisée au Nord Sénégal par la
Direction de la Protection des végétaux (Anonyme, 1994). Des
évaluations positives de ce contrôle ont été
rapportées (Anonyme, 1994 ; Anonyme ,1995a ; Diop, 2006). En plus de
Neohydronomus affinis, des essais de contrôle biologique de
Pistia stratiotes avec Proxenus hennia en Indonésie et
en Malaisie ont été rapportés (Mangoendihardjo and Nasroh,
1976 cité par Gopal 1990).
Sur la base des récoltes dans le lac de Guiers de
Potamogeton schweinfurthii par Roger et Leprieur respectivement en
1819 et en 1826 (Dandy, 1937 ; Hutchinson and Dalziel, 1954-1972), il faut
admettre que les eaux du lac devaient être au moins aussi douces
qu'actuellement. Les deux derniers siècles sont marqués par de
fréquentes sécheresses au Sénégal et en Afrique de
l'Ouest (Henry, 1918 ; Hubert, 1921 ; Hubert, 1934). A cause de ces
sécheresses et en absence de barrages à l'époque, la
salinité des eaux du fleuve et du lac devait être trop
élevée pour permettre le développement de Potamogeton
schweinfurthii.
L'envahissement du lac de Guiers par les espèces de
Potamots dès les débuts des années 90, pose de
sérieux problèmes à la navigation et à l'exercice
de la pêche (Thiam et Ouattara, 1997). Les observations récentes
confirment la poursuite du développement des peuplements de P.
schweinfurthii. Cette multiplication favorise par ailleurs la
sédimentation et contribue au comblement progressif du lac et les autres
cours d'eau affectés par la pullulation de la plante. L'extension des
Potamots se poursuivra très certainement si des mesures de gestion
adéquates des eaux et de contrôle du macrophyte ne sont pas
rapidement mises en oeuvre.
L'apparition massive de P. schweinfurthii,
après la mise en service des barrages, est une preuve de l'adoucissement
très important des eaux. La plante est un bon indicateur de la baisse
significative de la salinité des eaux et de niveaux
limnimètriques élevés et stables dans le temps.
A notre connaissance aucune tentative de lutte contre les
potamots n'a été jusqu'ici mise en oeuvre dans le delta et le lac
de Guiers. Le contrôle de cette plante ne sera pas facile compte tenu de
son immersion et de son enracinement dans des eaux pouvant être
très profondes. Dans le contexte du lac, jusqu'à plus de 3 m.
L'introduction de la fougère invasive Salvinia
molesta à la fin des années 90, a créé un
problème supplémentaire de plante proliférante dans la
zone. Il s'agit là d'une espèce exotique d'origine
sud-américaine. La qualité des eaux et les vents favorables ont
provoqué la multiplication de la plante et l'invasion rapide du delta.
S. molesta est une plante invasive très redoutée qui a
envahi depuis des décennies de nombreux fleuves, lacs et lagunes en
Afrique
207
(Boughey, 1963 ; Mitchell, 1970 et 1972 ; Anonyme, 1995b ;
Salvina Task Force USA, 1999).
Le retrait manuel de Salvinia molesta a souvent
été utilisé au moment de l'invasion du Delta. Il a
consisté à pousser les masses de Salvinia vers le
rivage, à les sortir de l'eau et à les laisser pourrir sur place
(Figure 60). L'efficacité de cette méthode est faible. Des
barrières en grillage ont été installées afin de
contenir les plantes et éviter qu'elles ne se propagent dans les
différents marigots, et en particulier dans le Parc National des Oiseaux
du Djoudj (Figure 61). Mais les oiseaux et autres animaux qui se
déplacent entre le fleuve et le parc peuvent transporter des fragments
de plantes qui pourraient favoriser leur prolifération dans le parc du
Djoudj. Le coût de la lutte manuelle a été
élevé et a nécessité la mobilisation de moyens
importants sur une période relativement longue et de façon
régulière (Triplet et al., 2001).
De nombreux pesticides chimiques ont été
employés avec succès contre Salvinia molesta, dans
plusieurs régions à travers le monde (Thomas & Room, 1986).
Dans le delta, la lutte chimique contre la plante a été exclue
d'emblée par le Comité national chargé de la lutte contre
Salvinia molesta compte tenu des risques écologiques que
présentent l'utilisation des produits chimiques de synthèse en
milieu aquatique et dans les zones humides. Cependant, un test avec le Roundup
(glyphosate) a été autorisé sur 70 m2
sous le contrôle de la Société d'Aménagement de
d'Exploitation des Terres du Delta (SAED) et de la Direction de la Protection
des Végétaux (DPV) du Sénégal. Nous n'avons pas pu
disposer des résultats de ces tests qui somme toute ont
été limités dans le temps et très
localisés.
La lutte biologique contre Salvinia molesta dans le
Delta a été menée avec un charançon importé
également d'Afrique du Sud ,Cyrtobagous salviniae. Cet insecte
est entièrement dépendant de Salvinia molesta pour sa
survie. La lutte a été un succès (Pieterse et
al., 2003 ; Diop, 2006). Dix ans après, le niveau d'infestation
reste faible. Cependant, il y a lieu de rester vigilant car à la faveur
d'autres modifications du milieu, une prolifération de la plante est
toujours possible. De nombreux exemples de réussite de la lutte avec
Cyrtobagous salviniae ont été signalés, au Ghana,
en Afrique du Sud, en Zambie, au Zimbabwe, en Inde, au Botswana, en Namibie, au
Sri Lanka, en Malaisie, en Papouasie Nouvelle Guinée, en Australie, aux
îles Fidji (USA Salvinia Task Force, 1999).
En terme de nuisance, S. molesta est souvent
comparée à Eichhornia crassipes, une «peste
végétale» très redoutée qui s'est
installée dans de nombreux plans d'eau en Afrique (Chadwick et Obeid,
1966 ; Batanouny, 1975). E. crassipes est très tolérante
en ce qui concerne les variations en nutriments et le pH de l'eau ; mais la
plante meurt à une salinité
208
supérieure à 0,06 % (Penfound and Earle, 1948).
Les conditions optimales de croissance sont pour le pH environ 7, avec une
concentration en phosphore de 20 ppm (Chadwick and Obeid, 1966 ; Haller and
Sutton, 1973) et un niveau adéquat d'azote. La température
optimale de croissance de la plante se situe entre 28 °C et 30 °C
(Knipling et al, 1970). Du point de vue du pH et de la
salinité, de la température et des nutriments, les eaux du fleuve
et du lac de Guiers sont actuellement favorables à l'installation et
à la prolifération de la jacinthe d'eau. C'est pourquoi la
présence d'E. crassipes chez les fleuristes à Saint
Louis, constitue une menace très sérieuse. Il faut éviter
à tout prix que cette autre plante à fort potentiel d'invasion ne
s'installe dans le système hydrographique du Delta et le lac de Guiers
car les conséquences pour l'environnement et le développement de
la région pourraient être désastreuses.
L'intensification de la production agricole amorcée
depuis quelques décennies avec une utilisation accrue d'intrants,
notamment les engrais chimiques, pourrait contribuer à enrichir les eaux
(eutrophisation) et favoriser la multiplication de certains macrophytes.
Le contrôle des plantes aquatiques doit être
abordé de manière globale. L'approche espèce par
espèce peut être très onéreuse avec des
résultats souvent aléatoires.
Les moyens de lutte testés ou proposés
jusqu'à présent ont certainement chacun des avantages et des
inconvénients. La difficulté réside dans la mise au point
et l'application de méthodes qui tiennent compte du contexte
écologique et du coût/bénéfice des interventions.
En tout état de cause, la lutte contre les plantes
proliférantes devrait être appliquée sous forme de mesures
de prévention en rendant moins favorables les conditions de
multiplication des végétaux aquatiques en alternant, par exemple,
le niveau des eaux. Mais ce type de gestion est difficile à mettre en
oeuvre compte tenu des besoins et des multiples usages des eaux. Très
souvent les actions de lutte contre les végétaux «
envahissants» ne commencent pas avant que la multiplication de la plante
ne soit évidente voire explosive.
L'accélération des aménagements et la
mise en culture d'importantes superficies irrigables disponibles au cours des
prochaines années pourront constituer des éléments de
contrôle non négligeable de Typha domingensis dans le
Delta et le lac de Guiers.

209
Figure 60 - Enlèvement manuel de Salvinia
molesta, Fleuve Sénégal, novembre 2000

Figure 61 - Grille installée pour empêcher
l'entrée de S. molesta dans le Parc du Djoudj, novembre 2000
210
Conclusions et perspectives
Dans les années 1980, des Etats riverains du fleuve
Sénégal dans le cadre de l'OMVS, ont construit à grand
frais des ouvrages très importants pour maitriser l'eau et promouvoir le
développement socio-économique de la vallée dans son
ensemble. Bien que les aménagements effectués à ce jour,
aient atteint certains objectifs de développement, ils ont
malheureusement eu des effets négatifs sur l'environnement, les
systèmes de production et les populations. La pullulation de certains
macrophytes aquatiques fait partie de ces conséquences négatives.
Les incidences des ouvrages sur le milieu naturel et le développement
socio-économique ne sont pas jusqu'ici suffisamment bien connues et bien
maîtrisées.
La présente étude est une contribution à
la connaissance de la flore, de la végétation et des principaux
macrophytes aquatiques du Delta du Fleuve et le lac de Guiers. Ces importantes
composantes du milieu naturel ont été très
affectées par les changements engendrés par la mise en place des
barrages.
La zone d'étude est assez complexe et présente
une grande diversité liée aux disparités des
différents milieux et écosystèmes qui la composent. En
effet, elle se situe à l'interface de l'eau salée et de l'eau
douce. Elle comporte des milieux secs voire désertiques au nord, des
zones relativement plus humides au sud et subit les influences du climat
océanique sur le littoral. Cette position influe grandement sur la
diversité des espèces végétales, la
végétation et les écosystèmes.
Au plan floristique, les milieux humides du Delta du fleuve
Sénégal et le lac de Guiers sont relativement diversifiés,
comparativement à d'autres milieux à écologie semblable en
Afrique sahélienne. Au total, 151 espèces réparties en 102
genres et 47 familles ont été recensées. Les
dicotylédones représentent 56,2%, les monocotylédones
41,7% et les ptéridophytes 2,1%. Les familles les plus
diversifiées sont les Poaceae, les Cyperaceae, les Fabaceae et les
Amaranthaceae principalement, auxquelles on peut ajouter les Asteraceae, les
Chenopodiaceae et les Convolvulaceae. Les zones basses inondables sont les plus
riches en espèces, suivent ensuite le lac et le fleuve. Cette grande
diversité est liée aux changements hydrologiques et de
qualité des eaux. Elle se manifeste souvent par l'apparition de
nouvelles espèces qui n'avaient pas été signalées
auparavant et à la prolifération des plantes aquatiques comme
Typha domingensis. La plupart de ces espèces sont de
thérophytes, des phanérophytes et des hélogéophytes
qui sont les types biologiques dominants dans la composante terrestre et
semi-aquatique (zones basses inondables). Mais cette flore est surtout
caractérisée par les
211
hydrophytes sensu stricto (18%) constitués de taxons
exclusivement aquatiques et regroupées dans les familles des
Alismataceae, Hydrocharitaceaee, Lemnaceae, Najadaceae,
Potamogetonaceae et Pontedariaceae chez les
Monocotylédones, des Avicenniaceae, Ceratophyllaceae, Lentibulariaceae,
Menyanthaceae, Nympheaceae et Rhyzophoraceae chez les dicotylédones. Il
s'agit généralement d'espèces à large
répartition géographique pantropicales, paléotropicales ou
cosmopolites bien adaptées aux écosystèmes aquatiques et
aux variations du climat.
La typologie basée sur le mode de développement
et le type de relation avec le substratum a permis d'organiser les macrophytes
aquatiques en :
- macrophytes fixés,
o émergents sur les rives, plus nombreux, avec
principalement des Poaceae et Cyperaceae,
o submergés, en eaux profondes constitués par
les Potamogetonaceae et Najadaceae,
- macrophytes flottants,
o fixés à feuilles flottantes avec les
Nympheaceae et Oenotheraceae comme composantes majeures,
o libres avec des espèces comme Pistia
stratiotes, Azolla, Lemna, Marsilea et
Salvinia molesta.
L'étude de la végétation a montré
qu'il existe une zonation qui dépend fortement de la salinité du
substrat, de la déclivité, de la hauteur d'eau et de la
durée de la submersion. A la typhaie
succède généralement la nymphaie ensuite
les potamots en eaux profondes. Neuf groupements
végétaux ont été identifiés
dont deux des milieux salés humides et sept des milieux faiblement
salés voire doux. Ces derniers sont en extension rapide. La faible pente
dans le
delta et sur les rives du lac et l'abondance de l'eau douce
ont été favorables à l'extension des peuplements de
Typha domingensis qui imprime sa physionomie à la
végétation des milieux humides. Il occupe de grandes
étendues au détriment d'autres macrophytes notamment Tamarix
senegalensis. L'agressivité de Typha domingensis
vis-à-vis des principaux macrophytes restent à
préciser.
Par manque d'information sur la période avant les
barrages, il est impossible de faire une étude diachronique des
macrophytes des milieux humides du Delta. Toutefois, les données
présentées sur la flore et la
végétation ainsi que celles sur la typologie et l'étude de
chacune des 48 espèces récensées, permettent de saisir les
grands traits de la diversité végétale et
l'écologie des milieux humides de la zone, au moins durant les deux
premières décennies
212
après les barrages. Ces données constituent un
référentiel qui peut aider dans le suivi de l'évolution
des taxons et les groupements végétaux des milieux d'eaux douces
et salées de la région. De plus, les renseignements fournis sur
les espèces végétales peuvent constituer la base pour la
réalisation d'un manuel pratique simple d'identification et de
détermination des macrophytes d'eau douce en milieux secs
sahéliens.
Concernant la biologie et l'écologie des macrophytes
aquatiques, la croissance de Typha domingensis paraît
très rapide dans les conditions actuelles dans le Delta. La
multiplication végétative à partir des rhizomes est
importante et domine dans les peuplements déjà installés
alors que la colonisation des espaces vierges humides se fait par
l'intermédiaire des grandes quantités de fruits produits et
disséminés par le vent surtout pendant la longue saison
sèche. De tous les macrophytes aquatiques de la région, Typha
produit certainement la plus grande phytomasse. Les possibilités de
valorisation de celle-ci devront recevoir plus d'attention. Des projets pilotes
soutenus devraient être mis en oeuvre afin de valoriser davantage cette
importante biomasse. Les investigations devraient être poursuivies en vue
d'une modélisation des processus de croissance et de multiplication de
la plante en fonction notamment des hauteurs d'eau et de la salinité du
sol et de l'eau.
La multiplication végétative est la principale
forme de reproduction de Pistia stratiotes dans le lac de Guiers.
Après une phase explosive juste après la mise en service des
barrages, la pullulation de la plante s'est rapidement arrêtée
avec la stabilisation des niveaux limnimètriques et des eaux moins
turbides. D'autres projets de construction de barrages importants sont en
chantier en amont sur le fleuve Sénégal (barrages
hydroélectriques de Félou et de Gouina notamment). La mise en
service de ces ouvrages pourrait créer de nouvelles conditions
favorables à l'extension de la plante. Il s'agira de préciser
dans l'avenir les facteurs propices au développement de l'espèce
dans le delta notamment en ce qui concerne la qualité de l'eau.
L'apparition et le développement massif de P.
schweinfurthii dans le lac de Guiers est sans doute la plus grande
manifestation de l'adoucissement des eaux. Des données originales sur la
morphologie de la plante dans le lac ont été obtenues et les
principaux sites d'extension du macrophyte ont été
localisés. Il serait intéressant de suivre le
développement des tapis de P. schweinfurthii dans le
lac et d'étudier les effets des peuplements de P. schweinfurthii
sur le processus et la vitesse de sédimentation.
L'invasion du Delta par Salvinia molesta a
montré en grandeur réelle les problèmes que peuvent
engendrer sur les écosystèmes, l'introduction d'espèces
douées d'un important
213
potentiel de multiplication. Cette fougère aquatique
hybride fait maintenant partie de la flore des milieux humides du Delta.
Malgré le succès de son contrôle biologique avec
Cyrtobagous salviniae, il est important de suivre la dynamique des
populations de S. molesta au regard des aménagements en cours.
Une pullulation de la plante est encore tout à fait plausible.
En plus du contrôle biologique de S. molesta et
de P. stratiotes, d'autres tentatives de lutte contre les macrophytes
aquatiques ont été menées dans la région avec des
succès mitigés.
T. domingensis, P. octandrus et P.
schweinfurthii sont actuellement les espèces qui posent le plus de
problème et pour lesquelles il est urgent de trouver de méthodes
et techniques de contrôle appropriées. Ces moyens de lutte, en
plus d'être écologiques doivent être financièrement
et économiquement supportables. La technique de contrôle
idéale ayant l'ensemble de ces caractéristiques n'est pas encore
disponible. Elle doit être recherchée et adaptée aux
réalités du Delta. Elle résultera très certainement
d'une combinaison judicieuse de différents moyens, méthodes et
approches de contrôle des macrophytes aquatiques.
Les efforts pour réunir des informations scientifiques
détaillées sur le fonctionnement et la dynamique des
écosystèmes limniques du Delta et le lac de Guiers doivent
être poursuivis. Plus spécifiquement, il serait intéressant
dans le court terme en plus des suggestions faites ci-dessus de :
- faire une cartographie précise et
détaillée des principaux peuplements de macrophytes (y compris
les macrophytes submergés) avec l'aide des photographies
aériennes et d'images satellitaires pour le suivi des peuplements. En
effet, il est indispensable, en matière de gestion, de disposer de
supports cartographiques régulièrement mis à jour;
- étudier la synécologie de T. domingensis
en conditions lacustre et fluviatile ;
- étudier la reproduction et la multiplication de
macrophytes submergés comme Potamogeton octandrus, Najas
marina et N. pectinata qui constituent par endroits des
peuplements importants et sont des zones de frai et de refuge pour de nombreux
animaux aquatiques ;
- rechercher les meilleures techniques de récolte,
d'utilisation et de valorisation de la biomasse de T. domingensis.
Au total, pour que le présent travail prenne sa pleine
signification, nous formulons le souhait qu'il soit à nouveau
réalisé d'ici 5 à 10 ans. La comparaison des deux
situations permettra alors de dire si la santé générale du
delta du fleuve Sénégal et le lac de Guiers s'est
améliorée ou s'est dégradée dans ce laps de temps.
Elle permettra sans doute, à travers le suivi de l'évolution des
espèces végétales aquatiques sensibles aux facteurs de
salinité et de pollution, de voir dans quelle mesure les efforts
déployés pour la sauvegarde ou l'amélioration de la
214
biodiversité du Delta et la promotion du
développement socio-économique de la zone auront
été ou non récompensés.
215
Références bibliograhiques
Aber A., 1920. Water plants: a study of aquatic angiosperms.
Cambridge University Press, 436 p.
Adam J.G. 1960. Quelques plantes adventices des
rizières de Richard-Toll. Bull. IFAN 22, (1) : 361-384.
Adam J.G. 1961. Eléments pour l'établissement
d'une carte des groupements végétaux de la presqu'île du
Cap Vert. 2e Note. Présence de deux espèces de
Typha dans la presqu'île du Cap Vert Typha australis
Schum. et Thonn. et Typha elephantina Roxb. Bull. IFAN
23 (1) : 399-405.
Adam J.G., 1962a. Pâturages irrigués de saison
sèche en zone sahélo-soudanaise. Composition possible avec des
plantes annuelles locales. Notes Africaines, 96 : 117-119.
Adam J.G., 1962b. Plus de cent plantes nouvelles pour le
Sénégal. Bull. IFAN 24 (1) A, n°4 : 939-954.
Adam J.G., 1964. Contribution à l'étude de la
végétation du lac de Guiers (Sénégal). Bull.
IFAN 26 (1) : 1-72.
Adam J.G., 1965. La végétation du Delta du
Sénégal en Mauritanie (Le cordon littoral et l'île de
Thiong). Bull. IFAN 27 (1) A, Dakar: 121-138.
Adam J.G., Brigaud F., Charreau C. et Fauck R. (éds),
1965. Connaissance du Sénégal.
Climat-Sols-Végétations. Etudes sénégalaises
9 (3), Centre Documentation et de la Recherche Scientifique (CDRS), Saint
Louis, Sénégal, 214 p.
Adams A., 2000. Fleuve Sénégal: gestion de la
crue et avenir de la Vallée. International Institute for Environment and
Development, Dossier n° 93, London, 27 p.
Adanson M., 1757. Histoire Naturelle du Sénégal.
Paris.
Agendia P.L, Kengne Noumsi Y.M, Fonkou T., Mefenya R. et Sonwa
J.D., 1997. Production du compost à partir de la biomasse de Pistia
stratiotes : l'épuration des eaux usées domestiques à
Yaoundé (Cameroun). Cahiers Agricultures 6 : 15-19
Aké Assi L., 1977. Salvinia nymphellula Desv.
(Salviniacées) fléau en extension vers l'ouest de l'Afrique
intertropicale. Bulletin de l'IFAN 39 (1) A, Dakar: 555- 562.
Akpagana K., 1993. Pistia stratiotes L. (Araceae),
une adventice aquatique en extension vers le nord Togo. Acta bot.
Gallica, 140 (1) Paris : 91-95.
Albergel J., Bader J.-C., Lamagat J.-P., Séguis L.,
1984. Crues et sécheresses sur un grand fleuve tropical de l'Ouest
africain: application à la gestion de la crue du fleuve
Sénégal. Sécheresse 3, vol.4 : 143-152.
216
Anonyme, 1994. Rapport technique, Projet lutte biologique,
Direction Protection des Végétaux, Ministère de
l'Agriculture, Sénégal, 42 p.
Anonyme, 1995 a. Rapport technique, Projet lutte biologique,
Direction Protection des Végétaux, Ministère de
l'Agriculture, Sénégal, 28 p.
Anonyme, 1995b. Lutte contre les végétaux flottants
dans les pays membres de la CEDEAO. Document de projet, projet de rapport
final, novembre 1995- volume 2, CEDEAO et BAD.
Anonyme, 1998. Plan de gestion de la réserve de faune du
Ndiael (1999-2003). Direction Générale des Eaux et Forêts
du Sénégal et Oiseaux Migrateurs du Paléarctique
Occidental, 21p.
Asthon P.J. & Mitchell D.S., 1989. Aquatic plants:
patterns and modes of invasion, attributes of invading species and assessment
of control programs, In: Biological Invasions: a global perspective, (ed.
J.A.Drake et al.), John Wiley & Sons, Chichester: 111-54.
Ba A.T. & Noba K., 2001. Flore et biodiversité
végétale au Sénégal. Sécheresse 12
(3) : 149-155.
Barbe J., 1984. Les végétaux aquatiques -
données biologiques et écologiques- Clé de
détermination des macrophytes de France. Bull. Français de
Pisciculture, Juin 1984, 42 p.
Batanouny K.H. El-Fiky, 1975. The water hyacinth
(Eichhornia crassipes Solms) in the Nile system, Egypt. Aquatic
Botany 1: 243-262.
BDPA/Coyne et Bellier, 1999. Etude pour la mise en place de
l'observatoire de l'Environnement du Fleuve Sénégal. OMVS,
Ministère Coopération France, 110 p.
BDPA, ORSTOM, SECA, AFID, SERADE, 1995a. Etude des
problèmes d'environnement et de protection des milieux naturels dans le
delta du fleuve Sénégal. Synthèse générale.
OMVS et Ministère de la Coopération Française.
BDPA, ORSTOM, SECA, AFID, SERADE, 1995b. Etude des
problèmes d'environnement et de protection des milieux naturels dans le
delta du fleuve Sénégal. Phase I ; i) Bilan et Diagnostic-Bilan
et analyse des causes évolutives. ii) Synthèse et
recommandations. iii) Annexes. OMVS et Ministère de la
Coopération Française.
Beadle L.C., 1974. The inland waters of tropical Africa. An
introduction to tropical limnology. Longman Group Limited, London, 365 p.
Beauvais M.-L., Coléno A. et Jourdan H., 2006. Les
espèces envahissantes dans l'archipel néo-calédonien: un
risque environnemental et économique majeur. IRD Editions, Institut de
Recherche pour le Développement, Paris, 259 p.
217
Bedish J.W.,1967. Cattail moisture requirements and their
significance to marsh management. Amer. Midland Naturalist. 78:
289-300.
Beisel J.-N. et Lévêque C., 2010. Introductions
d'espèces dans les milieux aquatiques. Faut-il avoir peur des invasions
biologiques? Ed. Quae, INRA, 78026 Versailles Cedex, 232 p.
Bennett F.D., 1975. Insects and plant pathogens for the
control of Salvinia and Pistia. pp 28-35. In: T.E. Freedman
(eds). Proceedings, Symposium on Water Quality Management and Biological
Control. Department of Environmental Engineering Sciences, Gainsville,
University of Florida, January 23-30, 166 p.
Berhaut J., 1967. Flore du Sénégal. 2è Ed.,
Clairafrique, Dakar, 485 p. Berhaut J., 1971-1979. Flore illustrée du
Sénégal. 6 tomes
Boughey A.S., 1963. The explosive development of a floatting
weed vegetation on Lake Kariba. Adansonia, 3: 49- 61.
Bromilow C., 2001. Problem plants of South Africa: a guide to
the identification and control of more than 300 invasive plants and other
weeds. Briza Publications, Pretoria, South Africa, 258 p.
Bradbury I.K. & Grace J., 1983. Primary production in
wetlands. In: Ecosystems of the World. (eds.) Gore A. J.P., Elsevier Scientific
publishing company, New York, 440 p.
Brasseur G., 1952. Le problème de l'eau au
Sénégal. Etudes Sénégalaises 4, CDRS,
Saint Louis, Sénégal, 99 p.
Braun-Blanquet J., 1932. Plant Sociology (English translation
by Fuller G.D. and Conrad H.S.). McGraw-Hill, New York, 439 p.
Brigaud F., 1961. Connaissance du Sénégal:
hydrographie. Etudes Sénégalaises 9, fascicule 2, Centre
Documentation et de la Recherche Scientifique (CDRS), Saint Louis,
Sénégal, 102 p.
BRGM, 1967. Notice explicative de la carte géologique
au 1/200 000- Saint Louis. BRGM, Dakar, 33 p.
Busnel R.G. et Grosmaire P., 1958. Enquêtes
auprès des populations du fleuve Sénégal sur leur
méthode acoustique de lutte traditionnelle contre le Quelea.
Bull. de l'IFAN 20, A (2) : 623-633.
Camefort H., 1996. Morphologie des végétaux
vasculaires- cytologie, anatomie, adaptations. Ed. Doin, Paris, 432 p.
218
Ceuppens J., Wopereis M., et Kane M., 1997. Etude de la
salinité des sols en riziculture non drainée dans le delta du
fleuve Sénégal- Zone du Gorom aval. Projet Gestion de l'Eau
Coopération Scientifique KULeuven-SAED, Bull. Technique n°13, Saint
Louis, Sénégal,
39 p.
Chadwick M.J. and Obeid M., 1966. A comparative study of the
growth of Eichhornia crassipes and Pistia stratiotes in water
culture. Journal of Ecology 54: 563-575.
Cogels F.X., 1984. Etude limnologique d'un lac sahélien
: le lac de Guiers (Sénégal). Vol. I. Thèse en Sciences de
l'Environnement FUL, Arlon - Belgique, 158 p.
Cogels F.X., 1997. Suivi et gestion de l'hydrologie et de la
qualité des eaux du lac de Guiers (Sénégal). Freshwater
Contamination (Proceedings of Rabat Symposium, April-May 1997 : 277- 286.
Cogels F.X. et Gac J.Y., 1982. Le lac de Guiers :
fonctionnement, bilans hydriques-Evaporation d'une nappe d'eau libre en zone
sahélienne (Sénégal). Cah. Orstom, sér.
Géol., XII (1): pp 41-60.
Cogels F.X. et Gac J.Y., 1987. Evolution spatio-temporelle de
la chimie des eaux du lac de Guiers (Sénégal).
Géodynamique, 1 (2) :121-134.
Cogels F.X., Thiam A., Gac J.Y., 1993. Premiers effets des
barrages de la vallée du fleuve Sénégal sur l'hydrologie,
la qualité des eaux et la végétation aquatique du lac de
Guiers. Rev. Hydrobiol. trop. 26 (2), 105-117.
Cogels F.X., Niang A., Coly A.,Gac J.Y., 1994. Le lac de
Guiers: étude du système lacustre et problématique de
gestion. Rapport ORSTOM, Dakar, 68 p.
Cook C.D.K., 1968. The vegetation of the Kainji reservoir site in
northern Nigeria. Vegetatio 15: 225-243.
Cook C.D.K., 1990.Aquatic Plant Book. SPB. Academic Publishing,
The Hague (The Netherlands), 288 p.
Cook C.D.K., 1996. Aquatic and Wetland Plants of India. Oxford
University Press, 385 p.
Cook C.D.K., 2004. Aquatic and Wetland plants of Southern Africa.
Backhuys Publishers, 281p.
Cook C.D.K., Gut, B.J., Rix E.M., Schneller J. and Seitz M.,
1974. Water Plants of the world: a manual for the identification of the genera
of freshwater macrophytes. Junk, The Hague, I -viii, 1-561.
219
Cronck J.K. & Fennessy M.S., 2001. Wetland plants: Biology
and Ecology. CRC Press, New York, USA, 462 p.
Cronk Q.C.B. & Fuller J.L. 1995. Plant invaders. Chapman
& Hall, Londres, 241p.
Dandy J.E., 1937. The genus Potamogeton L. in Tropical
Africa. J. of the Linnean Soc. of London, botany, vol.1: 507-541.
Datta S.C. and Biswas K.K. 1969. Physiology of germination in
Pistia stratiotes seeds. Biologia, Bratislava, 24 (1):
70-78
Deckers, J. et al., 1996. Evolution de l'acidité
dans les sols du delta du fleuve Sénégal sous influence
anthropogène. Etude et Gestion des Sols, 3,3, :151-166.
Dejoux C. 1988. La pollution des eaux continentales africaines.
Ed. ORSTOM, Travaux et Documents n°213, Paris, 513p.
Dejoux C et Saint-Jean L., 1972. Etude des communautés
d'invertébrés d'herbiers du lac Tchad : recherches
préliminaires. Cah. O.R.S.T.O.M., sér. Hydrobiol.,
vol.VI, n°1: 67-83.
den Hollander N.G., Schenk I.W., Diouf S., Kropff M.J. &
Pieterse A.H., 1999. Survival strategy of Pistia stratiotes L. in the
Djoudj National Park in Senegal. Hydrobiologia 415: 21-27
Denny P.,1985. (ed.) The ecology and management of African
wetland vegetation. Geobotany 6, Dr W. Junk Publishers, Netherlands,
344 p.
Diakhaté M., 1986. Le barrage de Diama : essai sur
l'évaluation de ses impacts potentiels. Revue de Géographie
de Lyon, 1986/1, Lyon France : 43-61
Diagne M., 1991. Contribution à l'étude de la
flore adventice et des pratiques de désherbage chimique dans les
rizières irriguées du delta du fleuve Sénégal. Mem.
DEA, ISE, Faculté des Sciences, Dakar, 97 p.
Diop. B.S., 2002. Les écosystèmes aquatiques et
semi-aquatiques dans l'épuration des eaux usées domestiques et
urbaines par mosaïques hiérarchisées
d'écosystèmes artificiels en Afrique tropicales sèche.
Thèse doctorat 3ème cycle, Institut des Sciences de
l'Environnement, Faculté des Sciences et Techniques, Université
C.A.Diop de Dakar (Sénégal), 197 p.
Diop M. et Triplet P., 2000. Un fléau
végétal menace le delta du fleuve Sénégal.
Bull. OMOPO.
Diop O., 2006. Management of invasive Aquatic Weeds with
Emphasis on BIological Control in Senegal. Ph.D. Thesis, Rhodes University,
South Africa, 187 p.
220
Divakaran O., Arunachalam M.,Murugan T. & Nair N.B., 1980.
Studies on the life cycle and ecology of Salvinia molesta Mitchell.
Proc.Indian Acad.Sci. 89: 519-528.
Dodds W.K., 2002. Freshwater ecology .Concepts and
environmental applications. Academic Press, Elsevier CA, USA, 569 p.
Doyen A., 1983. Forêt-Conservation-Développement.
Actes colloque ISE, Université de Dakar: Lac de Guiers :
problématique d'environnement et de développement : 147-191
Doyen A. et Thiam A., 1980. Etude du potentiel des arbres
semenciers de la région du lac de Guiers (Sénégal).
Rapport Multigra. Institut des Sciences de l'Environnement (ISE),
Faculté des Sciences, Université de Dakar,
Sénégal), 34 p.
Dumas D. et Mietton M., 2006. Fonctionnement des
hydrosystèmes et gestion de l'eau dans le bas delta du fleuve
Sénégal : ruptures et adaptations. Interactions
Natures-Société, analyse et modèles. UMR6554 LETG, la
Baule, 5 p.
Dunn L.H., 1934. Notes on water lettuce, Pistia stratiotes
L., as a nursery of insect life. Ecology 15
:329-331.
Duong-Huu-Thoi, 1950. Etude préliminaire de la
végétation du delta central nigérien. Ministério
das colonias, Junta de investigatçoes coloniais, Lisboa, 156 p.
Dutartre A., 2004. De la régulation des plantes
aquatiques envahissantes à la gestion des hydrosystèmes.
Ingénieries n° spécial : 87-100
Dykyjova D. and Kvet J., 1978. Pond littoral ecosystem. Springer,
Berlin.
Etien N., Kaba N.et Amon Kothias J.B., 1991. Doses efficaces
en glyphosate et en 2,4-D pour le contrôle chimique des laitues d'eau
(Pistia stratiotes L.) et toxicité du glyphosate
vis-à-vis des tilapias (Sarotherodon melanotheron). J.
Ivoir. Oceanol. Limnol., 1 (2): 119123.
EUROCONSULT-RIN, 1990. Profil de l'environnement de la
vallée du fleuve Sénégal. Direction Générale
de la Coopération au Développement (DGIS), Ministère des
Affaires Etrangères, Pays-Bas, 68p.
Evans, C.E. & Etherington.J.R. , 1991. The effect of soil
water potential on seedling growth of some British plants. New
Phytologist, 118:571-579,
Fassett N.C., 1956. Manual of aquatic plants. University of
Wisconsin Press, 405 p.
Faye M. N., 2007. Etude écologique des zones humides:
cas du Parc National des Oiseaux du Djoudj et de la Reserve de Biosphère
du Delta du Saloum. Thèse doctorat 3ème Cycle Biologie
Végétale, Faculté des Sciences et Techniques,
Université C.A. Diop Dakar, Sénégal, 96 p. + annexes.
221
Faye V.M., 2004. Etat actuel des peuplements de Typha
domingensis Pers. dans le delta du fleuve Sénégal et
étude au laboratoire de la germination de la plante. Mém. DEA,
ISE, Faculté des Sciences, Université C. A. Diop de Dakar, 52
p.
Fonkou T., Agendia P. Kengne I., Akoa A., Nya J., 2002.
Potential of water lettuce (Pistia stratiotes) in domestic sewage
treatment with macrophytes logoon systems in Cameroon. Proceedings of
International Symposium on Environmental Pollution Control and Waste Management
7-10 January 2002, Tunis: 709-714.
Forno I.W. and Harkey K.L.S., 1979. The occurrence of
Salvinia molesta in Brazil, Aquatic Botany 6, 185-7
Gangstad E.O. et Cardelli N.F., 1990 . The relation between
aquatic weeds and public health. In: Aquatic Weeds. The Ecology and Management
of Nuisance Aquatic vegetation. Ed. by Pieterse A and Murphy K.J. Oxford
Science Publications, Oxford, 593 p.
Gannet Fleming, Cordy and Carpentier, 1980. Evaluation des
effets sur l'environnement d'aménagements prévus dans le bassin
du fleuve Sénégal, Rapport final. OMVS.
Garba M., 1984. Contribution à l'étude de la
flore et de la végétation des milieux aquatiques et des sols
hydromorphes de l'ouest de la République du Niger, de la longitude de
Dougoudoutchi au fleuve Niger. Thèse de doctorat 3ème cycle,
Université de Bordeaux/Université de Niamey.
Gaudet J.J., 1974. The normal role of the vegetation in water.
In D.S. Mitchell (ed.), Aquatic vegetation and it's use and control: 24-37.
UNESCO, Paris.
Germain P. et Thiam A., 1983. Les pesticides au
Sénégal : une menace ? Etudes et Recherches 83-83, ENDA
Tiers Monde, Dakar, 57p.
Germain R., 1965. Les biotopes alluvionnaires herbeux et les
savanes intercalaires du Congo équatorial. Académie Royale des
Sciences d'Outre-mer, Bruxelles, 379 p.
Georges K., 1976. Studies on the chemical control of some
important aquatic weeds of Kerala, Salvinia, Ludwigia and Cyperus.
In Varshney C.K.& Rzoska J. (eds). Aquatic weeds in South East Asia.
Junk, the Hague.
Giffard P.L., 1974. L'arbre dans le paysage
sénégalais. Sylviculture en zone tropicale sèche. Centre
Technique Forestier Tropical, Dakar, 431p.
Gopal B., 1982. Ecology of Typha species in India.
Proceedings EWRS 6th Symposium on Aquatic Weeds: 20-27.
Gopal B., 1990a. Aquatic weed problems and management in Asia.
In: Aquatic Weeds. The Ecology and Management of Nuisance Aquatic vegetation.
Ed. by Pieterse A. and Murphy K.J. Oxford Science Publications, Oxford, 593
p.
222
Gopal B.,1990b. Ecology and management of aquatic vegetation
in India subcontinent. Geobotany 19, Kluwer Academia Publisher, 257
p.
Gopal B. and Sharma K.P., 1990. Ecology and population. I :
Growth. In. Gopal B. (1990). Ecology and management of aquatic vegetation in
India subcontinent. Geobotany 19, Kluwer Academia Publisher: 79-106
Gounot M. 1969. Méthodes d'étude quantitative de
la végétation. Ed. Masson & Cie, Paris, 314 p.
Grace J.B., 1984. Effects of turbificid worms on the germination
and establishment of Typha. Ecology 65: 1689-1693.
Grace J.B., 1987. The impact of preemption on the zonation of two
Typha species along lakeshores. Ecol. Monogr. 57 :
283-303.
Grosmaire P., 1957. Eléments de politique
sylvo-pastorale au Sahel sénégalais. Partie 2 : Les conditions du
milieu. Fasc. 10 A- Le milieu physique. Service des Eaux et Forêts, Saint
Louis, Sénégal, 56 p.
GTZ, 2001. Valorisation de Typha comme combustible
domestique en Afrique de l'Ouest. Rapport de synthèse. Weissenberg
(Allemagne).
Guillarmod A.J., 1979. Water weeds in Southern Africa.
Aquatic Botany 6 (1979): 377391.
Guillemin J.-A., Perrottet S. et Richard A., 1830-1833. Florae
Senegambiae Tentamen. Paris, 322 p. + pl.
Guiral D., 1993. Situation, étude et contrôle des
végétations aquatiques dans le parc national du Djoudj
(Sénégal). Rapport mission Djoudj 2 au 18 décembre 1993,
ORSTOM, Montpellier, 33 p.
Guiral D. et Etien N., 1991. Les macrophytes aquatiques des
berges lagunaires. J. Ivoir.Océanol., Abidjan vol. I, n°2,
novembre 1991: pp 25-40.
Guiral D. et Etien N., 1994. Les macrophytes. In : Environnement
et ressources aquatiques de Côte d'Ivoire. Tome II : les milieux
lagunaires (eds. Durand J.R, Dufor Ph., Guiral, D. et Zabi S. G.F.), ORSTOM,
Paris, 546 p.
Hall B.H, Pierce P.C. and Lawson G.W., 1971. Common plants of
Volta Lake. Department of Botany, University of Ghana Legon, 123 p.
Hall J.B. and Okali D.D.U., 1974. Phenology and productivity
of Pistia stratiotes L. on the Volta lake, Ghana. Journal of
Applied Ecology 11 (2): 709-725.
223
Haller W.T. and Sutton D.L., 1973. Effects of pH and high
phosphorus concentration on the growth of water hyacinth. Hyacinth Control
Journal 11: 59-67.
Haller T.H., Sutton D.L. and Barlowe W.C. 1974. Effects of
salinity on growth of several aquatic macrophytes. Ecology 55:
891-894.
Hardy G., 1921. La mise en valeur de la vallée du
Sénégal de 1817 à 1854. Ed. Larose, Paris, 376 p.
Hartog C. den and Segal S., 1964. A new classification of the
water plant communities. Acta. Bot.Neerl.13: 367-393.
Hellsten S., Dieme C., Mbengue M., den Hollander N.G. Janauer
G.A. and. Pieterse A.H., 1999. Typha control efficiency of a
weed-cutting boat in the Lac de Guiers in Senegal: a preliminary study on
mowing speed and re-growth capacity. Hydrobiologia 415: 249-255.
Henry Y., 1918. Irrigations et cultures irriguées en
Afrique Tropicale. Ed. Larose, Paris, 296 p.
Heudelot M. et Lelièvre M., 1828. Journal d'un voyage
au lac de N'ghier ou Paniéfoule. Manuscrit original des Archives
Nationales du Sénégal, 14 p.
Holm L.G., Plucknett D.L, Pancho J.V., Herberger J.P., 1977.
The World's Worst Weeds: distribution and biology. University Press of Hawaii,
Honolulu, 609 p.
Howard-Williams C & Lenton G.M., 1975. The role of the
littoral zone in the functioning of a shallow tropical lake ecosystem.
Freshwater Biology 5: 445-459.
Hubert H., 1918. Le dessèchement progressif de l'
A.O.F. Bull. Com. Et.
Hist. Sc. A.O.F.: 401-407.
Hubert H., 1921. Eaux superficielles et souterraines au
Sénégal. Ed. Larose, Paris, 30 p.
Hubert H. 1934. Etude comparative des climats des Colonies
françaises. Ann. Phy. Globe France Outre-Mer, I, n°1 :
33-62.
Hutchinson G.E., 1975. A treatise on Limnology. Vol. III
Limnological botany. John Wiley & Sons, New York-London- Sydney-Toronto,
660 p.
Hutchinson J. and Dalziel J.M., 1954-1972. Flora of West
Tropical Africa. 2nd ed., London, 3 vol.
Iltis A. and Lemoalle J.,1983. The main types of communities
and their evolution during a drought period. 5. The aquatic vegetation of Lake
Chad. In. J.P. Carmouze, J.R. Durand, and C Lévêque (Eds), Lake
Chad: Ecology and Productivity of a Shallow Tropical Ecosystem, pp. 125-143. W.
Junk, The Hague, Boston, Lancaster.
224
Jacobsen W.B.C., 1983. Ferns and Fern Allies of Southern Africa.
Durban, Butterworths, 542 p.
John David M., 1986. Aquatic vegetation. In Plant ecology in West
Africa: systems and Processes. Ed. By Geoge W. Lawson, Elsevier: 183- 194.
Johns R.J., 1991. Pteridophytes of Tropical East Africa. A
preliminary check-list of the species. Royal Botanic Gardens. Kew England, 131
p.
Johnson D.E., 1997. Les adventices en riziculture en Afrique
de l'Ouest. ADRAO/WARDA, Bouaké (Côte d'Ivoire), 312 p.
Kane A., 1997. L'Après-barrage dans la vallée du
fleuve Sénégal: modifications hydrologiques, morphologiques,
géochimiques et sédimentologiques : conséquences sur le
milieu naturel et les aménagements hydro-agricoles. Thèse
Doctorat d'Etat Géographie, Université C.A. Diop de Dakar,
551p.
Kaplan Z., 2005. Potamogeton schweinfurthii A. Benn.,
a new species for Europe. Preslia, Praha, 77:419-431.
Kerharo J. et Adam J.G., 1974. La pharmacopée
sénégalaise traditionnelle. Plantes médicinales et
toxiques. Ed. Vigot Frères, Paris, 1011 p.
Knipling E.B., West S.H. and Haller W.T. 1970. Growth
characteristics, yield potential and nutritive content of water hyacinths.
Proceedings of the Soil Science Society, Florida 30: 51-63.
Kone D., 2002. Epuration des eaux usées par lagunage
à microphytes et à macrophytes en Afrique de l'Ouest et du
Centre: état des lieux, performances épuratoires et
critères de dimensionnement. Thèse doctorat Ecole Polytechnique
Fédérale de Lausanne (Suisse) n°2653, 170 p.
Kornas J., 1990. Plant invasions in Central Europe: historical
and ecological aspects, in Di Castri F., Hansen A.J, & Debussche M (eds),
Biological invasions in Europe and the Mediterranean Bassin. Kluwer Academic
Publishers, Dordrecht: 19-36.
Kubtziki K., 1990. The Families and Genera of Vascular Plants.
I Pteridophytes and Gymnosperms. Springer-Verlag, Paris-London, 404 p.
Kuiseu J., 1997. Flore et végétation aquatiques
dans le delta du fleuve Sénégal. Mém. DEA, ISE,
Faculté des Sciences, Université de Dakar, 56 p.
Kuiseu J., Thiam A. et Ba A.T., 2001. Impacts de deux barrages
sur les végétations hélophytique et hydrophytique du delta
du fleuve Sénégal. J. Bot. Soc. bot. France 14: 85101
225
Lallana V.H., Sabbatini R.A., and Lallana M.C., 1987.
Evapotranspiration from Eichhornia crassipes, Pistia
stratiotes, Salvinia herzogii and Azolla caroliniana.
Journal of Aquatic Plant Mangement 25: 48-50.
Lebrun J., 1947. La végétation de la plaine
alluviale au Sud du lac Edouard (exploration botanique du Parc National Albert,
mission J. LEBRUN 1937-1938). Inst. Parc. Nat. Congrès Belge. Tomes 1 et
2, Bruxelles, 800 p.
Lebrun J. 1966. Les formes biologiques dans les
végétations tropicales. Bull. Soc. Bot. France:
164-176.
Lebrun J.P., 1973. Enumération des plantes vasculaires
du Sénégal. Paris, 1 Vol. miméogr. IEMVT, 209 p.
Lebrun J.P. & Stork A.L., 1991-1997. Enumération
des plantes à fleurs d'Afrique Tropicale. Vol. I (1991) 249 p. ; Vol. II
(1992) 257 p.; Vol III. (1995) 341 p. ; Vol. IV (1997) 712 p. Conservatoire
Jardin Botanique Genève.
Le Brusq J.Y., 1984. Evolution de la salinité des sols
et des eaux en relation avec la riziculture submergée dans le Delta du
fleuve Sénégal. Dakar, ORSTOM.
Lemée A., 1934. Dictionnaire descriptif et synonymique
des genres de plantes phanérogames. Tome V, BREST, 525 p.
Lemmet J. et Scordel, M., 1918. Contribution à
l'étude agrologique de la vallée du Bas
Sénégal. Bull.
Com. et Hist. Sc. AOF : 17-56.
Lisowski S., Malaisse F., Symoens J.J. and van de Velden J.
1978. Flore d'Afrique Centrale (ZaIre, Rwanda, Burindi) : Spermatophytes :
Potamogetonaceae. Jardin Botanique National de Belgique, Bruxelles.
Lombardi T., Fochette T., Bertacchi A & Onnis A., 1996.
Germination requirement in a population of Typha latifolia.
Aquatic Botany 56: 1-10
Lorenzen B., Brix H., McKee K.L., Mendelssohn I. A.et Miao S.,
2000. Seed germination of two Everglades species, Cladium
jamaicenoeand Typha domingensis. Aquatic Botany 66 (3):
169-180.
Lounibos L.P., Dewald L.B., 1989. Oviposition site selection by
Mansonia mosquitoes on water lettuce. Ecological Entomology
14: 413-422.
Loyer J.Y., 1989. Les sols salés de la basse
vallée du fleuve Sénégal. ORSTOM, Collection Etudes et
Thèses, Paris, France, 137 p.
McMillan C., 1959. Salt tolerance within Typha population.
Amer. Jour. Bot. 46 (7): 521526.
226
McNaughton S.J., 1966. Ecotype function in the Typha
community type. Ecol. Monogr., 36: 297-325.
Mainguet M., 1995. L'homme et la sécheresse. Masson
Géographie, Paris, 335 p.
Mamarot J., 2002. Mauvaises herbes des cultures. Association de
Coordination Technique Agricole (ACTA), Paris, 540 p.
Marche-Marchard J., 1967. Etude dynamique de la biologie d'une
mare temporaire de la région tropicale ouest-africaine. Notes
Africaines n°114, IFAN Dakar : 55-69
Marius C., 1985. Mangroves du Sénégal et de la
Gambie. Ecologie-Pédologie-Géochimie. Mise en valeur et
aménagement. Travaux et Documents 193, ORSTOM, Paris, 357 p.
Marnotte P., Carrara A., Dominati E. et Girardot F., 2006.
Plantes des rizières de Camargue. Parc naturel régional/CIRAD,
Montpellier, 262 p.
Maymard J., 1955. Les sols du pseudo-delta du
Sénégal. Saint-Louis, ORSTOM, 40 p.
McFarland, D.G., Nelson L.S., Grodowitz M.J., Smart R.M. &
Owens C.S., 2004. Salvinia molesta D.S. Mitchell (Giant Salvinia) in
the United-States: A Review of Species Ecology and Approches to Management.
Engineer Research and Development Center Vicksburg Ms Environmental lab, USA,
June 2004, 41 p.
Michel P. 1973. Les bassins du fleuve Sénégal et
de la Gambie. Etude géomorphologique. Mémoire ORSTOM
n° 63, Tome 1, Tome 2 et Tome 3. Paris, 752 p.
Michel P., Naegelé A. et Toupet Ch., 1969. Etude
biologique du Sénégal septentrional. 1. Le milieu naturel.
Bull. I.F.A.N. 31 A (3) : 756-839.
Mitchell D.S., 1969. The Ecology of vascular Hydrophytes on
Lake Kariba (Rhodesia). Hydrobiologia 34, Vas. 3-4: 448-464.
Mitchell D.S., 1970. Autoecological studies of Salvinia
auriculata Aubl. Ph.D. Thesis, University of London, 669 p.
Mitchell D.S., 1972. The Kariba weed: Salvinia
molesta, Bristish Fern Gazette, 10: 251-2.
Mitchell D.S. et Tur N.M., 1975. The rate of growth of
Salvinia molesta (S. auriculata auct.) in laboratory and
natural conditions. Journal of Applied Ecology, 12: 213-225.
Mitchell, D.S., 1985. African aquatics weeds and their
management. In Aquatic weed problems and management in Africa. In: Aquatic
Weeds. The Ecology and Management of Nuisance Aquatic vegetation: P. Denny
(eds). The ecology and management of African wetland vegetation. W. Junk
publication, Dordrecht: 177-202.
227
Mitchell D.S., Pieterse A.H. and Murphy K.J.,1990. Aquatic
weed problems and management in Africa. In: Aquatic Weeds. The Ecology and
Management of Nuisance Aquatic vegetation. Ed. by Pieterse A.H. and Murphy K.J.
Oxford Science Publications, Oxford, 593 p.
Montégut J., 2003. Le milieu aquatique. Tome 1, Milieu
aquatique et flore. Ed. ACTA, Paris. 2ème édition, 60 p.
Muller S. (coord.), 2006. Plantes invasives en France.
Muséum national d'Histoire naturelle, Paris, (Patrimoines naturels
62), 168 p.
Mullié W. C., Diallo A.O., Gadji B. and Ndiaye M.D.,
1999. Environmental Hazards of Mobile Ground Spraying with Cyanophos and
Fenthion for Quelea control in Senegal. Ecotoxicology and
Environment Safety. Vol.43, Issue 1 May 1999: 1-10
Mulligan H.F.,1972. Report on growth of Pistia stratiotes
in Kossou Lake (Ivoiry Coast), FAO, Rome, 7 p.
Myers J.H. and Bazely D.R., 2005. Ecology and control of
introduced plants. (Ecology, Biodiversity and Conservation), Cambridge
University Press United Kingdom, 313 p.
N'Diaye A., 1978. Les vallées du Lampsar-Djeuss
(Sénégal) : le milieu naturel dans les rapports avec
l'aménagement rural. Thèse Doctorat 3ème cycle,
Université Louis Pasteur de Strasbourg, France.
Noba K. et al., 2004. Flore adventice des cultures
vivrières dans le sud du Bassin arachidier (Sénégal).
Webbia 59 (2) : 293-308.
Noba K.et al. 2010. La flore du Parc national des
oiseaux du Djoudj-une zone humide du Sénégal.
Sécheresse 21 (1): 71-78.
Obeid M. & Charwick M.J., 1966. A comparative study of the
growth of Eichhornia crassipes Solms and Pistia stratiotes L.
in water culture. J.Ecol. 54: 563-575.
Odum H.T., 1957. Trophic structure and productivity of Silver
Springs, Florida. Ecol. Monogr. 27: 55-112.
Olivier J.D., 1993. A review of the Biology of Giant
Salvinia (Salvinia molesta Mitchell). Journal of Aquatic
Plant Management, Vol.31, N°2, July 1993: 227-231.
Olivry J.C., Choumet A., Villaume G., Lomoalle J. et Briquet
J.P., 1996. Hydrologie du lac Tchad. Monographie hydrologique n°12,
Editions ORSTOM, 266 p.
O.M.V.S., 1979. Evaluation des effets sur l'environnement
d'aménagements prévus dans le bassin du fleuve
Sénégal. Rapport O.MV.S., Dakar, 183 p.
O.M.V.S., 1995. Etude de l'Environnement du Delta du Fleuve
Sénégal. Rapport BDPA-SCETAGRI/ORSTOM/SECA/AFID/SERADE.
228
O.M.V.S., 2003. Etudes de base pour la phase initiale de mise en
place de l'Observatoire de l'Environnement. Rapport technique V.2.0. Groupe
SIEE, 295 p.
Ouedraogo R.L., 1994. Etude de la végétation
aquatique et semi-aquatique de la mare aux hippopotames et des mares d'Oursi et
de Yomboli (Burkina Faso). Thèse doctorat 3ème cycle,
Université de Ouagadougou, 191 p. + annexes.
Ozenda P., 2004. Flore et végétation du Sahara.
CNRS Editions, Paris, 660 p.
Paradis G., 1981-Ecologie et géomorphologie en climat
subéquatorial sec: la végétation côtière du
Bas-Bénin occidental. Ann. Univ. Abidjan, E,
XIV: 7-63
Parsons W.T. & Cuthberson E.G., 2001. Noxious Weeds of
Australia. C.S.I.R.O, 2nd Edition, 712 p.
Penfound W.T. and Earle T.T., 1948. The biology of water
hyacinth. Ecological Monographs, 18: 449-472.
Perrottet, 1833. Relation d'un voyage au lac de N'Gher en
Sénégambie et excursions botaniques dans les environs. Nvelles
Ann. Des Voyages, LVII: 26-88.
Petr T., 1968. Population changes in aquatic invertebrates living
in two water plants in a tropical man-made lake. Hydrobiologia
32:449-485.
Pieterse A.H., de Lange L., and Verhagen L., 1981. A study of
certain aspects of seed germination and growth of Pistia stratiotes
L. Acta Botanica Neerlandica 30: 47-57.
Pieterse A.H., Kettumen M., Diouf. S., Ndao S., Sarr K.,
Tarvainen A., Kloff S., Hellsten S., 2003. Effective biocontrol of Salvinia
molesta in the Senegal river by means of Weevil Cyrtobagous salviniae.
Ambio, vol. N° 7 (Nov., 2003): 458-462.
Plasencia Fraga J.M. and Kevet J.,1993. Production Dynamics of
Typha domingensis (Pers.) Kunt Populations in Cuba. J. Aquat.
Plant Manage. 31: 240-243.
Plaud M. 1966. Pose de piézomètres et
étude de la nappe phréatique autour du lac de Guiers
(Sénégal). B.R.G.M., Dakar, 20 p.+ annexes.
Portères R. 1951. Les variations des ceintures
hydrophytiques et gramino-hélophytiques des eaux vives du système
lagunaire de la Côte d'Ivoire. Bull. I.F.A.N. Tome XIII, n°
4, octobre 1951:1011-1028.
Rao P.N.and Reddy A.S., 1984. Studies on the population
biology of water lettuce: Pistia stratiotes L. Hydrobiolgia
119: 15-19.
Raunkiaer S., 1934. The life forms of plants and statistical
Plant Geography. Oxford, Clarendon Press, 623 p.
229
Raynal A., 1963. Flore et végétation des
environs de Kayar (Sénégal) de la côte au lac Tamna.
Extrait des Annales de la Faculté des Sciences,
Université de Dakar, Tome 9: 121231.
Raynal-Roques A., 1980. Les plantes aquatiques (plantes
à fleur et fougères). In Flore et Faune aquatiques de l'Afrique
sahélo-soudanienne, Tome 1 Ed. Durand J.R. et Lévêque C.,
ORSTOM, collection Initiations-Documentations Techniques 44, Paris,
389 p.
Reizer C., 1974. Définition d'une politique
d'aménagement des ressources halieutiques d'un écosystème
aquatique complexe par l'étude de son environnement abiotique, biotique
et anthropique. Le fleuve Sénégal moyen et inférieur.
Thèse doctorale. Fondation Universitaire Luxembourgeoise, Arlon,
Belgique, 563 p.
République du Sénégal, 1994.
Synthèse du Plan Directeur Rive Gauche (P.D.R.G.). Ministère de
l'Economie, des Finances et du Plan, 34 p.
Rochette C., 1974. Le bassin du fleuve Sénégal.
Monographies Hydrologiques n° 1, ORSTOM Paris, 325 p.+ annexes
Sale P.J.M. & Wetzel R.G., 1983. Growth and metabolism of
Typha species in relation to cutting treatments. Aquatic botany
15: 335-348.
Salvinia Task Force Action Plan Sub-Committee, USA, 1999.
Salvinia molesta, status Report and Action Plan.
Samuel S., Mathew K. and Antony, 1975) Observations on the
African weed Salvinia auriculata Aublet with special reference to
salinity tolerance. Bull. Dept. Marine Sci. Univ. Cohin 7:913-917
Sanokho A., 1977. Salvinia nymphellula Desv. au
Sénégal. Bulletin I.F.A.N. 38 A (1): 16 - 19.
Sarr A., 1996. Les groupements végétaux de la
basse vallée du Ferlo (Sénégal). Mém. DEA, Institut
des Sciences de l'Environnement, Fac. Sciences et Techniques. Université
C. A. Diop Dakar, 57 p.
Sarr A., 1997. Etude des graminées du complexe
écologique Niokolo-Badiar. Programme régional
d'aménagement des bassins versants du Haut Niger et de la Haute Gambie.
Publication n°8, Centre de Recherche Ecologique Niokolo-Badiar, Direction
des Parcs Nationaux, Sénégal, 52 p.+ annexes.
Sarr A., Thiam A. et Ba A.T., 2001. Macrophytes et groupements
végétaux aquatiques et amphibies de la basse vallée du
Ferlo. Africa Journal of Sciences and Technology (AJST) Vol. 2,
n° 1, pp.89-97.
230
Sarr D.L., 2003. Aspects socio-économiques de la
proliferation de Typha domingensis dans le delta du fleuve
Sénégal. Mém. DEA, Institut des Sciences de
l'Environnement, Fac. Sciences et Techniques, Université C.A.Diop,
Dakar, 57 p.
Schenk I.W., den Hollander N.G., Diouf S., Kropff M.J.,
Hellsten S., Janauer G.A. et Pieterse A.H., 1998. Seasonal advance and retreat
of Pistia stratiotes in the Djoudj National Park in Senegal: a race
between seed formation and increasing salt concentration. Proceedings of
the 10th International Symposium of aquatic weeds, European
Weed Research Society (EWRS), Lisbon 21-25 September 1998, 444 p.
Schneider A. et Sambou K., 1975. Prospection botanique dans
les parcs nationaux du Niokolo-Koba et de Basse Casamance. In : Recherches
scientifiques dans les Parcs nationaux du Sénégal. IFAN 92,
Dakar, 366 p.
Schnell R., 1977. Introduction à la
phytogéographie des pays tropicaux. La flore et la
végétation de l'Afrique tropicale. Paris, Gauthier - Villars,
tome 4, 378 p.
Sculthorpe C.D., 1967.The biology of aquatic vascular plants.
Edward Arnold (Publishers) Ltd. London, 610 p.
SEDAGRI/IRAT, 1972. Carte des Sols et d'utilisation des Sols,
1/50.000.Bassin du fleuve Sénégal, Bakel à Saint Louis.
SEDAGRI.
Sène F., 1987. Les pesticides utilisés par
l'agro-industrie (C.S.S. et SAED) dans la région du lac de Guiers.
Analyse de l'accumulation de la dieldrine et de la toxicité du
carbofuran et du propanil. Mémoire de DEA, Institut des Sciences de
l'Environnement, Université de Dakar, 105 p.
Sharma K.P. and Gopal B., 1979a. Effect of water regime on the
growth and establishment of Typha angustata seedlings. Int. J.
ofEcology and Env. Sc., 5, 69-74
Sharma K.P. and Gopal B., 1979b. Effect of light intensity on
seedling establishment and growth in Typha augustata Bory & Chaub.
Polskie Archiwum Hydrobiologii 26: 495-500.
Sifton H.B., 1959. The germination of light-sensitive seeds of
Typha latifolia L. Canadian Journal of Botany 64: 443-435
Spichiger R-E, Savolainen
V-V. et Figeat M., 2000. Botanique
systématique des plantes à fleurs. Une approche
phylogénétique nouvelle des Angiospermes des régions
tempérées et tropicales. Presses Polytechniques et Universitaires
Romandes, Lausanne (Suisse), 372 p.
Tardieu-Blot, 1953. Les ptéridophytes de l'Afrique
intertropicale française. Mémoires de l'IFAN 28, Dakar,
241 p.
Tardieu-Blot, 1957. Les ptéridophytes de l'Afrique
intertropicale française (suite). Mémoires de l'IFAN 50:
8-49.
231
Theurkorn W. et Henning R.K., 2005. Typha australis :
menace ou richesse ? PREDAS/CILSS et PSACD/GTZ, Ougadougou, Burkina Faso, 28
p.
Thiam A., 1982. La flore ligneuse et ses utilisations dans la
région du lac de Guiers. Mém. DEA, Dakar, Institut des Sciences
de l'Environnement, Faculté des Sciences, Université de Dakar, 73
p.
Thiam A., 1983. Typha australis Schum. Thonn.: une
contrainte au développement socio-économique des rives du lac de
Guiers ? Actes colloque ISE, Université de Dakar : Lac de Guiers:
problématique d'environnement et de développement : 133-138
Thiam A., 1984. Contribution à l'étude
phyto-écologique de la zone de décrue du lac de Guiers.
Thèse de doctorat de 3ème cycle en Sciences de
l'environnement. ISE, Faculté des Sciences, Université de Dakar,
105 p.
Thiam A., 1996. Les produits phytosanitaires dans le delta du
fleuve Sénégal. Cahiers Agricultures 5 : 112-7.
Thiam A., 1998. Flore et végétation aquatiques
et des zones inondables du delta du fleuve Sénégal et le lac de
Guiers. Ed. A.T.Ba,J.E.Madsen et B. Sambou. AAU Reports 39, Aarhus University
Press, Denmark: 245-257.
Thiam A., Ndiaye R. et Ouattara M. 1993. Macrophytes
aquatiques et zooplancton du lac de Guiers (Sénégal). Rapport
projet de recherche, ISE/FUL, Université. C. A. Diop, Dakar, 53 p.
Thiam A et Ouattara M., 1997. Un macrophyte en voie
d'envahissement du lac de Guiers (Sénégal): Potamogeton
Schweinfurthii A. Bennett (Potamogetonaceae). J. Bot. Soc. bot. France
4: 71- 78.
Thoen D. et Thiam A., 1990. Utilisations des plantes ligneuses
et subligneuses par les populations de la région sahélienne du
lac de Guiers (Sénégal). Bull. Médecine Traditionnelle
et Pharmacopée 4 (2) : 169-179.
Thomas P.A. & Room P.A., 1986. Taxonomy and control of
Salvinia molesta, Nature, 320: 581-4
Thompson K. and Hamilton A.C., 1983. Peatlands and swamps of
the African continents. In A.J.P Gore (Ed.), Ecosystem of the World. 4B. Mires
: Swamps, Bog, Fen and Moor. Regional Studies, pp.331-373. Elsevier,
Amsterdam.
Tilmans G., 1998. Makhana, la plus ancienne usine à
vapeur d'Afrique noire. C.D.R.S., Saint-Louis, numéro hors série,
63 p.
Traoré D., 1985. Etude de la végétation
des milieux hydrophytiques ouverts de la Côte d'Ivoire. Thèse
doctorat d'Etat, Université Bordeaux III, 394 p.
232
Tréca B. 1989. Les dégâts aux semis de riz
causés par les oiseaux d'eau dans le Delta du fleuve
Sénégal. Dakar. ORSTOM, 13 p.
Tréca B., Sylla S.I. et Ndiaye A., 1992. SOS Djoudj.
Prc.VIII PAN-Afr.ORN. Congr. : 503507
Tricart J., 1961. Notice explicative de la carte
géomorphologique du delta du fleuve Sénégal.
Mémoires B.R.G.M. n°8, Paris.
Triest L. et Symoens J.J., 1983. Flore d'Afrique Centrale
(ZaIre, Rwanda, Burundi) Spermatophytes, Najadaceae. Jardin botanique national
de Belgique, août 1983, 9 p.
Triplet P., Tiéga A. et Pritchard D., 2001. Rapport de
mission au parc National des Oiseaux du Djoudj, Sénégal et au
Parc National du Diawling, Mauritanie du 14 au 21 septembre 2000. Mission
consultative Ramsar : Rapport 42.
Trochain J.-L., 1940. Contribution à l'étude de
la végétation du Sénégal. Mém. IFAN
2 Dakar, 433 p. + 30 p. photos
Trochain J.-L., 1956. Rapport préliminaire de mission
botanique au Sénégal. Paragraphe I : Le problème de la
pullulation des Typha dans le lac de Guiers : 1 fasc. Miméogr,
Montpellier.
Trochain J.-L., 1957. Accord interfaricain sur la
définition des types de végétation de l'Afrique Tropicale.
Bull. Inst. Etud. Centrafr.: 139-157.
Trochain J.-L., 1966. Types biologiques chez les
végétaux intertropicaux (Angiospermes). Bull. Soc. Bot.
France: 187- 196.
Vanden Berghen C., 1979. La végétation des
sables maritimes de la Basse Casamance méridionale
(Sénégal). Bull. Jard. Bot. Nat. Belg., 49 :185-238.
Vanden Berghen C., 1982a. Initiation à l'étude
de la végétation. 3 ème édition. Jardin Botanique
National de Belgique, Meise, 263 p.
Vanden Berghen C., 1982b. Premier aperçu sur la
végétation aquatique de la Basse Casamence (Sénégal
méridional). In: Symoens, J.J., Hooper S.S. and Compère P.
(eds.), Studies on Aquatic Vascular Plants. Roy. Bot. Soc. Belgium, Brussels :
266-271.
Vanden Berghen C., 1988. Flore illustrée du
Sénégal. Tome IX. Berhaut J. (Ed.), Imp. Maisonneuve. France
Vanden Berghen C., 1990. La végétation des mares
temporaires au Sénégal oriental. Rev. Hydrobiol. Trop.
23 (2) : 95-103
Vanden Berghen C., 1991. Flore illustrée du
Sénégal. Tome X. (draft non publiée).
W
233
ade P.M., 1990. Physical control of aquatic weeds. In: Aquatic
Weeds. The Ecology and Management of Nuisance Aquatic vegetation. Ed. by
Pieterse A. and Murphy K.J. Oxford Science Publications, Oxford, 593p.
W aridel P., 2003. Investigation phytochimiques des plantes
aquatiques Potamogeton pectinatus L., P. Lucens L., P.
perfoliatus L. et P. crispus L. (Potamogetonaceae). Thèse
doctorat, Institut de Pharmacognosie et Phytochimeie, Faculté des
Sciences, Université de Lausanne, Suisse.
W aterhouse D.F. 1994. Biological control of Weeds: Southeast
Asian Prospects. ACIAR, Canberra, Australia, 302 p.
W ebb C.J., Sykes W.R.and garnock-Jones P.J., 1988. Flora of
New Zealand: naturalized pteridophytes, gymnosperms, dicotyledons, Vol. 4,
DSIR, Christchurch.
W estlake D.F., 1965. Theorical aspects of comparability of
productivity data. Mem. Ist.Ital. Idrobiol. 18 (suppl.): 229-248.
W etzel,1983. Limnology, 2nd edition,
Philadelphia: Saunders College Publishing, 860 p.
W hiteman J.B. and Room P.M., 1991. Temperature lethal to
Salvinia molesta Mitchell, Aquatic Botany, 40, 27-35.
W ild H.,1961. Harmful aquatic plants in Africa and
Madagascar. Joint CCTA/CSA Project N°14. Journal of the
Federal Herbarium 2, Salisbury Rhodesia and Nyasaland, 66 p.
Yeo R.R.,1964. Life history of common cattail. Weeds.12:
284-288.
Zahran M.A., 2009. Hydrophytes of the Nile in Egypt.
Monographiae Biologicae 89:463-4
Zahran M.A. & Willis A.J., 2003. Plant life in the river
Nile in Egypt. Mars Publishing House, Riyadh, 531p.
234
Annexe 1- Définition des principaux termes
utilisés pour désigner les « plantes
aquatiques»
- Hydrophyte: dans le sens littéral et
général, il s'agit de plante vivant dans l'eau ou dominant dans
des zones humides. Une limite exacte, franche ne les sépare pas des
plantes terrestres.
Nous les subdivisons en quatre types :
· Hydrophytes nageants (Hyd na) : bourgeons et appareil
végétatif flottent sur ou dans l'eau;
· Hydrogéophytes (Hyd gé) : plantes
aquatiques vivaces fixées, subsistent sous forme de rhizome situé
dans le substrat et porteur de bourgeons;
· Hydrohémicryptophyes (Hyd hé) : plantes
vivaces aquatiques fixées, subsistent sous forme de souche portant des
bourgeons à la surface du substrat solide ou vaseux;
· Hydrothérophytes (Hyd th) : plantes aquatiques
fixées, subsistent sous forme de graines ou de boutures à valeur
de bourgeons.
- Hélophytes : Plante développant
un appareil aérien dépassant la surface de l'eau.
Nous distinguons deux types :
· Hélogéophytes (Hé gé) :
plantes dont les bourgeons sont dans la vase; l'appareil
végétatif est aérien;
· Hélothérophytes (Hé th) :
plantes amphibies annuelles; les graines subsistent dans la vase.
-Macrophytes aquatiques: terme
général qui englobe les macrophytes d'eau douce et les plantes
marines et des eaux saumâtres (estuaires).
- Macrophytes d'eau douce: comporte les
charophytes, les bryophytes, les ptéridophytes (fougères) et des
spermaphytes dont les parties végétatives sont en permanence ou
saisonnièrement submergées et /ou émergent à la
surface des eaux douces, ou encore flottant à la surface de l'eau.
- Macrophytes émergents: ces
macrophytes aquatiques sont généralement enracinés ou
fixés au substrat et produisent des tiges végétatives qui
sortent de l'eau (sens de hélophyte).
235
-Macrophytes flottant à la surface: Il
s'agit de plantes particulièrement adaptées à la
flottaison par des mécanismes anatomiques. Leur localisation est
fortement dépendante des mouvements des eaux et de la direction des
vents.
-Macrophytes à feuilles flottantes:
ces macrophytes sont enracinés ou fixés au substratum et
produisent des feuilles coriaces qui flottent à la surface de l'eau. Ils
portent également souvent quelques feuilles submergées. Les
inflorescences et les fleurs émergent usuellement de l'eau. Exemples:
Nymphaea, Nymphoides, etc.
-Macrophytes submergés: ce sont des
macrophytes aquatiques dont les parties végétatives sont
situées tout le temps en dessous de la surface de l'eau. Leurs
inflorescences et leurs fleurs peuvent émerger. Ils peuvent être
enracinés ou fixés au substratum pendant une bonne partie de leur
cycle vital. Ils comprennent plusieurs angiospermes telles que
Ceratophyllum, Vallisneria, Najas, Potamogeton, etc. Une situation
particulière est celle de Potamogeton octandrus qui est
abondant dans notre zone d'étude. En effet, elle montre un polymorphisme
foliaire; les feuilles submergées sont filiformes de coloration
rougeâtre alors que les feuilles aériennes, plus courtes et plus
coriaces présentent un limbe lancéolé avec souvent des
taches vertes de chlorophylle. Denny (1985) a proposé le terme
d'Euhydrophytes pour désigner les plantes
complètement submergées ou accrochées à un
substratum avec des feuilles flottantes ou ayant aussi bien des feuilles
flottantes que des feuilles émergentes. Dans le cadre de ce travail,
nous avons préféré inclure ce cas particulier dans le
groupe des macrophytes submergés.
236
Annexe 2- Quelques éléments chronologiques sur
l'exploration et les aménagements dans la région du delta du
fleuve et le lac de Guiers
1686 - Reconnaissance du lac de Guiers ou Paniéfoul par
Jajolet de la Courbe.
1822 - Le jardinier Richard s'installe le long du fleuve, dans un
site qui deviendra Richard
Toll («Le jardin de Richard »). Nombreuses
introductions de plantes exotiques et indigène (cf. catalogue
publié par Monod, 1951).
1823 - Voyage au lac de N'gher du botaniste M. Perrottet
renseignant sur de nombreux aspects des sciences naturelles...
1828 - Voyage au lac de N'gher ou Paniéfoul (Walo) des
Sieurs Heudelot et Lelièvre, jardiniers du gouvernement ; nombreux
renseignements botaniques.
1839 - Voyage au lac Paniéfoul et au pays Yolof de
René Caille, Huard-Bessinière, Potin-Patterson et Paul Holle.
1861 - Une crue extraordinaire permet au vapeur « Crocodile
», commandé par le lieutenant de vaisseau le Braouëzec de
remonter le Bounoum jusqu'à N'diayène.
1870 - L'eau du lac est douce, selon Henry (1918).
1883 - Le botaniste Perrottet est dérangé dans ses
occupations par de nombreux éléphants (Loxodota
africana) qui viennent boire au lac.
1890 - Crue exceptionnelle du Fleuve Sénégal
- Avant 1890, alimentation exclusive du lac en eau douce
- Après 1890, remontée saline dans le fleuve et
possibilités de pénétration de sel dans
le lac
1892- La crue du fleuve atteint Ngoui-Diéri, à 40
km de l'E.S.E. du lac et à 20 km du NW de Linguère.
1903-1904- Construction du barrage en dur de Boundoum
1914 - Les missions Younes et Henry prospectent la région
du lac de Guiers.
1916 -Henry publie une carte de la salure du lac de Guiers.
- L'ingénieur Younes fait construire le
premier barrage en terre sur la Taoué. Ce barrage, emporté chaque
année par la crue du fleuve est reconstruit par les populations à
la décrue.
1920 - début de la politique de fixation des
éleveurs.
1920 à 1956 - Fondation des villages wolof du Diéri
; progression rapide des cultures pluviales dans les zones du Diéri.
1934- Création de la Mission d'Aménagement du
Sénégal (MAS) 1936 - La crue du Fleuve atteint Yang-Yang.
1939-1940- Construction du barrage en dur de Dakar-Bango 1940-
Construction du barrage en dur de Diaoudoun
1940 - Trochain publie un important travail sur la
végétation du Sénégal et décrit plusieurs
groupements végétaux des abords du lac.
1947 - 1948 - Construction du premier pont barrage de
Richard-Toll. La communication du fleuve et du lac est limitée à
la période de crue.
1949 - Création du casier rizicole de Richard-Toll.
1951 - Endiguement du marigot de Niet Yone (au NW du lac)
entrainant l'assèchement de la dépression du N'Diael.
- Premiers champs de riz à
Richard-Toll
1953 - Début de la lutte intensive contre les mange-mil
(Quelea quelea) par l'O.C.L.A.L.A.V.
1954 - Création des premiers forages dans la
région, notamment celui de Mbar Toubab.
1954 - Première ( ?) couverture aérienne au 1/50
000 de la région.
1955 - Les chefs de cantons fixent définitivement les
voies d'accès des troupeaux au lac de
Guiers.
237
1956 - Construction de la digue de Keur Momar Sarr qui isole le
lac du Ferlo
1956 - Trochain publie un rapport sur le développement de
la typhaie dans le lac de Guiers. Il estime à 1000 ha les superficies
occupées par les typhaies
1957- Grosmaire constate une prolifération spectaculaire
de Typha australis au lac de Guiers. 1957- Sainton publie une étude
géologique sur la région du lac. 1957 - Implantation de casiers
rizicoles à Colonat par la S.A.E.D.
1958 - Création du centre de pêche de Guidick.
1960 - Début des campagnes de pêche dans le lac pour
approvisionner Dakar.
1964- Construction des premiers éléments de la
« digue rive gauche»
1964 - Etude de la végétation des rives est du lac
par Adam.
1965 - La zone du N'Diael est classée en réserve
sylvo-pastorale.
1965 - Publication d'une carte pédologique au 1/1000 000
englobant la région du lac.
1965 -Le centre de pêche est transféré
à Mbane, considéré comme site plus favorable.
1966 - Installation de piézomètres par le
B.R.G.M.
1967 - Création du puits-forage de Diaglé,
équipé d'une pompe solaire.
1967- Publication de la carte géologique au 1/200 000,
feuille de Dagana, établie par le
B.R.G.M.
1968- Création de l'0rganisation des Etats Riverains du
Sénégal (OERS) qui sera dissoute en fin 1971 et remplacée
par l'OMVS.
1969 -1971 - Construction de l'usine de traitement des eaux
à Ngnith par la S.O.N.E.E.S. 1970 - Création d'un réseau
de pare-feux dans la région.
1970 - Transformation des casiers rizicoles de Richard-Toll en
casier de canne à sucre par la
C.S.S.
238
1972- Création de la Maison Familiale Rurale de Nder.
239
1972- La cuvette de Mbane est transformée en
rizière par la S.A.E.D. avec l'aide d'une mission chinoise de TaIwan.
1972- Création de l'Organisation pour la Mise en Valeur du
Fleuve Sénégal (OMVS) 1974 - Creusement du canal de la
Taoué
1975 à 1978 - Expérimentation de la riziculture
dans la cuvette de Nder.
1979- Installation d'un 2ème pont barrage
à Richard Toll à 500 m en aval du premier pont barrage. La
première fermeture eut lieu le 27 septembre 1979.
1981 - La C.S.S. s'étend sur près de 6 400 ha.
1982- Abaques de surface et volume du lac de Guiers
présentés par Cogels et Gac (1982).
1983-1984- Réalisation de barrage en terre à Kheune
situé à 50 km en aval de Richard Toll pour empêcher une
intrusion marine suite à un déficit d'écoulement du
Sénégal
Novembre 1985- Mise en service du barrage de Diama sur le fleuve
Sénégal
1986- Fin de la construction du barrage anti-sel de Diama
Mars 1988- Mise en eau du barrage hydro-électrique de
Manantali (capacité 11 000 Mm3) -
Finalisation de la digue rive gauche
Septembre 1988- Remise en eau du Bas-Ferlo (Vallée du
Bounoum) après 32 ans d'alimentation exclusive par les eaux de pluie
Mars 1992- Réouverture précoce de la liaison avec
le fleuve et maintien depuis lors d'un niveau élevé dans le
lac
1993- Restauration complète de la digue de Keur Momar Sarr
1994- Remise en eau de la dépression du Ndiaël
Octobre 2003- Ouverture d'une brèche sur la Langue de
Barbarie pour lutter contre les inondations dans la ville de St Louis
240
2003 à 2004 - Construction de la station de traitement des
eaux de Keur Momar Sarr d'une capacité de 65 000 m3 jour
| 


