|
République Algérienne Démocratique et
Populaire
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
Université Ibn Khaldoun -
Tiaret
Faculté des Sciences et des Sciences de
l'Ingénieur
Département de Génie
Mécanique
Laboratoire de Recherche des Technologies Industrielles
MÉMOIRE
pour obtenir le Diplôme de
Magister
Spécialité : Génie Mécanique Option :
Conversion d'Énergie
Thème
Simulation des cycles de machines
frigorifiques à
absorption
Présenté par :
Monsieur KHERRIS Sahraoui
Soutenu le : ... / / 2007
Devant le jury : MM.
|
HADDOUCHE Kamel
|
M. de Conférences
|
Université de Tiaret
|
Président
|
|
MAKHLOUF Mohamed
|
M. de Conférences
|
Université de Sidi Belabbès
|
Examinateur
|
|
SETTOU Noureddine
|
M. de Conférences
|
Université de Ouargla
|
Examinateur
|
|
SAD CHEMLOUL Noureddine
|
Chargé de Cours
|
Université de Tiaret
|
Examinateur
|
|
ASNOUN Ahmed
|
M. de Conférences
|
Université de Tiaret
|
Rapporteur
|
Remerciements
A la fin de ce modeste travail j'ai réalisé que
j'ai pu l'accomplir grâce à la contribution d'un grand nombre de
personnes, et que quoi que je dise, je ne pourrai jamais tous autant les
remercier.
Mais avant ça je remercie DIEU le tout puissant de m'avoir
accordé son infinie bonté, le courage, la force et la patience
pour réaliser cet humble travail.
Après cela, Je tiens à remercier
profondément mon directeur de mémoire Monsieur ASNOUN Ahmed pour
la confiance qu'il m'a témoignée tout au long de ce travail, pour
son soutien et ses conseils ; grâce à qui mes efforts ont pu
aboutir et avec qui j 'ai beaucoup appris.
Aussi je tiens beaucoup et avec un plaisir particulier à
remercier Monsieur HADDOUCHE Kamel pour ses conseil avisés ainsi que
pour son aide.
Un remerciement chaleureux est adressé à
Monsieur SETTOU Noureddine, Maître de Conférence, chef du
Département de Mécanique et Electronique à
l'Université de Ouargla, pour l'intérêt qu'il a bien voulu
porter à ce travail en acceptant de l'examiner et d'être membre du
jury de ce mémoire.
Mes vifs remerciements s'adressent également à
Monsieur MAKHLOUF Ahmed Maître de Conférence à
l'Université de Sidi Belabbès, Monsieur CHEMLOUL S. Noureddine
Docteur chargé de cours à l'Université de Tiaret, pour
avoir accepté de faire partie du jury et pour leur intérêt
à mon travail.
Je remercie aussi Monsieur KHIR Tahar Docteur à
l'Université de JADDAH (Arabie Saoudite) pour ses encouragements, son
aide et ses conseils.
Encore, je tiens à remercier le Professeur MICHEL Feidt
directeur du Laboratoire d'Energétique et de Mécanique
Théorique et Appliquée (France), pour m'avoir aidé
à structurer le chapitre de la propriété thermodynamiques
de la solution NH3-H2O, et Monsieur BENAOUDIA Mohamed Docteur à
l'Université Technique de Construction BUCAREST pour ses conseils et son
aide.
Sans oublier toute personne ayant participé de prés
ou de loin à la réalisation de ce mémoire.
Dédicaces
Á mes très chères parents,
Á mes frères,
Á mes amis,
Et en particulier à une personne qui m'est très
chère et qui a toujours su m'aider.
Table Des Matières
REMERCIEMENTS 2
Dédicaces 3
Table des matières 4
Nomenclature 8
???? 11
Résume 12
Abstract 13
Introduction générale 14
Chapitre I : Étude et recherche bibliographique
sur les installations frigorifiques à absorption.
Introduction 16
I.1. Bref rappel historique 16
I.1.1. L'essor de la machine à absorption 16
I.1.2. Stade Actuel des machines à absorption dans le
monde 20
I.2. Représentation schématique et
principe de fonctionnement 24
I.2.1. Principe de fonctionnement 25
I.2.2. Machine à absorption avec NH3-H2O 26
I.2.2.1. Description 26
I.4.2.2. Fonctionnement : 26
I.2.3. Machine à absorption avec H2O-LiBr 29
I.2.3.1. Description 29
I.2.3.2. Fonctionnement 29
I.2.4. Avantages et inconvénients 31
I.2.4.1. Avantages 31
I.2.4.2. Inconvénients 31
I.3. Diagrammes thermodynamiques utilisés
32
I.3.1. Diagramme de Merkel 32
I.3.2. Diagramme d'Oldham 32
I.4. Mélanges pour une machine à
absorption 35
I.4.1. Caractéristiques d'un couple binaire 35
I.4.2. Propriétés de l'agent d'absorption 36
Conclusion 36
Chapitre II :Étude thermodynamique des
propriétés de la solution binaire NH3-H2O
Introduction 37
II.1. Paramètres fondamentaux des substances
pures 38
II.2. Notion de potentiel chimique 38
II.2.1. Condition d'équilibre 39
II.3. L'équation d'état fondamentale
choisie pour NH3-H2O 40
II.3.1. L'enthalpie libre 40
II.3.1.1. Phase liquide 41
II.3.1.2. La phase vapeur 42
II.3.2. Propriétés thermodynamiques 43
II.3.2.1. Pour la phase liquide 43
II.3.2.2. Pour la phase vapeur 43
II.4. Mélange ammoniac-eau 44
II.4.1. Mélange liquide 44
II.4.2. L'enthalpie, l'entropie et le volume massique de la
solution liquide 46
II.4.3. Mélange vapeur 47
II.4.2. L'enthalpie, l'entropie et le volume massique du
mélange vapeur 47
II.5. Conditions de saturation 48
II.5.1. Point de bulle 48
II.5.1. Point de rosée 48
II.6. Propriétés de transport de la
solution NH3-H2O 50
II.6.1. Densité de la solution liquide 50
II.6.2. La viscosité dynamique de la solution liquide
51
II.6.3. La viscosité dynamique de la solution gazeuse
52
II.6.4. La conductivité thermique de la solution gazeuse
53
II.6.5. La conductivité thermique de la solution liquide
53
II.6.6. La chaleur spécifique isobare pour la solution
gazeuse 54
II.6.7. La chaleur spécifique isobare pour la solution
liquide 55
Conclusion 56
Chapitre III : Étude thermodynamique et thermique
des différents organes d'une installation frigorifique à
absorption.
Introduction 57
II.1. Optimisation et amélioration du cycle
58
III.1.1. Amélioration du cycle 58
III.1.1.1. Colonne de rectification 58
III.1.1.2. Échangeur solution riche-solution pauvre
(économiseur) 59
III.1.1.3. Échangeur vapeur froide-condensat
(échangeur Liq-Vap) 59
III.2. Calcul thermique de l'installation 60
III.2.1. Machine frigorifique à absorption à simple
étage 60
III.2.1.1. Limites de fonctionnement de l'installation 60
III.2.1.1.1. Températures limites 60
III.2.1.1.2. Le taux de dégazage limite 60
III.2.1.2. Modèle de calcul du cycle thermodynamique 61
III.2.1.3. Stabilisation des niveaux de température, de
pression et de concentration pour le fonctionnement
du cycle 61
III.2.1.4. Le calcul thermique 65
III.2.1.4.1. Le calcul des flux échangés 66
III.2.1.4.2. Le coefficient de performance de l'installation
67
III.2.2. Machine frigorifique à absorption à deux
étages : 68
III.2.2.1. Description du cycle 68
III.3. Étude et calcul du matériel
69
III.3.1. Calcul des échangeurs 69
III.3.2. Les méthodes de dimensionnement des
échangeurs 70
III.3.2.1. Méthode de NUT (nombre d'unité de
transfert) 70
III.3.2.2. Méthode de différence logarithmique
moyenne DTLM 74
III.4. Dimensionnement des principaux appareils
78
III.4.1. Dimensionnement du condenseur 78
III.4.1.1. Méthodologie de calcul du condenseur 78
III.4.1.2. Calcul de la DTLM 79
III.4.1.3. Température moyenne 79
III.4.1.4. Choix de l'appareil et calcul du coefficient de
transfert sale Us 79
III.4.1.5. Calcul du coefficient de transfert propre Up 80
III.4.1.6. Calcul de la résistance d'encrassement Rs 82
III.4.1.7. Calcul des pertes de charges 82
III.4.2. Dimensionnement de l'évaporateur 83
III.4.2.1. Méthodologie de calcul de l'évaporateur
84
III.4.2.2. Calcul de la DTLM 84
III.4.2.3. Température moyenne 84
III.4.2.4. Choix de l'appareil et calcul du coefficient de
transfert sale Us 84
III.4.2.5. Calcul du coefficient de transfert propre Up 84
III.4.2.6. Calcul de la résistance d'encrassement Rs 86
III.4.2.7. Calcul des pertes de charges 86
III.4.3. Dimensionnement du bouilleur 87
III.4.3.1. Méthodologie de calcul du bouilleur 87
III.4.3.2. Calcul du coefficient de transfert global U 88
III.4.3.2.1. Calcul de h0 côté eau 88
III.4.3.2.2. Calcul de hi côté solution binaire
89
III.4.3.2.3. Calcul du terme 89
III.4.3.3. Calcul de l'écart moyenne de température
89
III.4.3.4. Calcul de la surface d'échange
extérieure 90
III.4.3.5. Calcul du nombre de tubes Nt 90
III.4.3.6. Choix de l'appareil et calcul du coefficient de
transfert sale Us 90
III.4.3.7. Calcul des pertes de charges 91
III.4.4. Dimensionnement de l'absorbeur 91
III.4.4.1. Méthodologie de calcul de l'absorbeur 92
III.4.4.2. Calcul du débit d'eau de refroidissement 92
III.4.4.3. Calcul de l'écart moyenne de température
92
III.4.4.4. Choix de l'appareil et calcul du coefficient de
transfert sale Us 92
III.4.4.5. Calcul du coefficient de transfert propre Up 92
III.4.4.6. Calcul du coefficient global de transfert de chaleur U
94
III.4.4.7. Calcul de la surface d'échange 94
III.4.4.8. Calcul de la longueur d'un tube 94
III.4.4.9. Calcul des pertes de charges 94
III.4.5. Dimensionnement du sous-refroidisseur 94
III.4.5.1. Méthodologie de calcul du sous-refroidisseur
95
III.4.5.2. Calcul de la DTLM 95
III.4.5.3. Calcul du coefficient global de transfert de chaleur U
95
III.4.5.4. Calcul de surface d'échange 97
III.4.5.5. La longueur total des tubes 97
III.4.5.6. Le nombre total des tubes 97
III.4.5.7. Surface d'échange par épingle 97
III.4.5.8. Calcul des pertes de charges 97
III.4.6. Dimensionnement de l'économiseur 98
III.4.6.1. Méthodologie de calcul de l'économiseur
98
III.4.6.2. Calcul de la DTLM 99
III.4.6.3. Calcul du coefficient global de transfert de chaleur U
99
III.4.6.4.Calcul des pertes de charges 99
Conclusion 99
Chapitre IV : Programme de simulation des cycles de
machines frigorifiques à absorption.
Introduction 100
IV.1. La simulation des cycles à absorption
100
IV. 1.1. La simulation du cycle à simple étage
100
IV. 1.1.1. L'équilibre massique 100
IV. 1.1.2. L'équilibre énergétique 100
IV.1.2. La simulation du cycle à deux étages
101
IV.1.2.1. L'équilibre massique 101
IV. 1.2.2. L'équilibre énergétique 101
IV.2. La simulation du fonctionnement du système
par le programme "SARM" : 103
IV.3. La méthode de simulation 106
IV.3. 1. Automatisation des diagrammes 106
IV.3. 1.1. Calculs et organigrammes 107
IV.3. 1.1.1. Corrélations thermodynamiques de l'agent
d'absorption (eau) 107
IV.3. 1.1.2. Corrélations thermodynamiques du fluide
frigorigène (ammoniac) 107
IV.3. 1.1.3. Corrélations thermodynamiques du
mélange NH3-H2O 108
IV.3. 1.2. Automatisation du diagramme d'Oldham 110
IV.3.1.2.1 Organigramme de calcul 110
IV.3. 1.3. Automatisation du diagramme de Merkel 111
IV.3.1.3. Organigrammes de calcul 111
IV.3.2. Machine frigorifique à absorption à simple
étage 116
IV.3.3. Machine frigorifique à absorption à deux
étages 117
IV.4. La simulation du fonctionnement du système
par le programme "ABSIM" 118
IV.4. 1. La structure du programme 118
Conclusion 121
Chapitre V : Analyse des résultats et validation
du programme.
Introduction 122
V.1. Calculs et représentations des
paramètres 122
V. 1.1. Le tracé des deux diagrammes thermodynamique
122
V.1.1.1. Diagramme de Merkel ( h, î ) 122
V.1.1.2. Diagramme d'Oldham ( Log P, T ) et ( Log P, -1/T )
124
V.1.2. L'établissement des tables et des diagrammes
thermodynamiques 126
V.1.2.1. Tables de l'ammoniac et de l'eau saturés 126
V.1.2.2. Table de la solution NH3-H2O 127
V.1.2.3. Diagrammes de Molier (Log P, h) pour l'ammoniac et de
l'eau 127
V.1 .3. Calcul des paramètres thermodynamiques et de
transport pour l'ammoniac et de l'eau saturés 128
V. 1.4. Exemple de calcul d'un cycle à simple
étage 129
V.1.4.1.Tracé du cycle sur le diagramme d'Oldham 130
V. 1.5. Exemple de calcul d'un cycle à deux étages
131
V. 1.5.1. Tracé du cycle sur le diagramme de Merkel
132
V. 1.6. Dimensionnement d'un organe de cycle 133
V.2. Influence de certains paramètres sur la
performance des cycles 135
V.2.1. Procédé de calcul 135
V.2.2. Machine à absorption à simple étage
135
V.2.3. Machine à absorption à deux étages
139
V.3. Validation des résultats
143
V.3.1. Validation des résultats de la chaleurs latente
de vaporisation Lv , de la variation d'entropie et celle
du volume 143
V.3.1.1. Pour l'ammoniac 143
V.3.1.2. Pour l'eau 145
V.3.2. Validation du coefficient de performance d'une machine
à absorption à simple étage 147
V.3.3. Validation du coefficient de performance d'une machine
à absorption à deux étages 148
Conclusion 150
Conclusion générale et perspectives
151
Bibliographie 153
Liste des figures 158
Liste des tableaux 160
Liste des organigrammes 161
Annexes 162
Nomenclature
H : Enthalpie molaire (KJ/kmole)
h : Enthalpie massique (KJ/kg)
V : Volume molaire
: Vitesse
(m3/kmole) (m/s)
v : Volume massique (m3/Kg)
S : Entropie molaire (KJ/kmole.K)
s : Entropie massique (KJ/kg.K)
T : Température (°C, K)
Tp : Température de la paroi (°C,
K)
?T : Gradient de température (°C, K)
(bar)
(-)
P : Pression
: Coefficient - équation (III.67)
M : Masse molaire (kg/kmole)
|
u : Energie interne
u : Potentiel chimique
: Viscosité dynamique
|
(KJ)
(KJ/kmole)
(micropois)
|
F : Enthalpie libre (Helmotz) (KJ/kmole)
G : Enthalpie libre (Gibbs) (KJ/kmole)
(Kg de NH3/kg de
î : Concentration massique mélange)
?î : Taux de dégazage (-)
x : Concentration molaire de la phase liquide
mélange liquide)
y : Concentration molaire de la phase vapeur (kmole de
NH3 /kmole de
mélange vapeur)
(kmole de NH3 /kmole de
|
R : Constante des gaz
: Coefficient - équation (III.68)
|
(KJ/ kmole.K) (-)
|
Cp : Chaleur spécifique à pression
constante (KJ/kg K)
a, b, c, d : Coefficients (-)
A, B, C, D, E, F : Coefficients adimensionnelles (-)
m : Masse (Kg)
ñ : Densité (Kg/m3)
ë : Conductivité thermique (W/m.K)
fc : Facteur de circulation (-)
WP : Puissance spécifique de la pompe (KW/Kg)
ö : Flux de chaleur (KW)
q : Flux massique (KJ/Kg)
m a : Débit massique de la
vapeur d'ammoniac (Kg/s)
m~sr : Débit massique de la
solution riche (Kg/s)
m sp : Débit massique de la
solution pauvre (Kg/s)
m e : Débit massique de l'eau
de refroidissement du (Kg/s)
condenseur
m ch : Débit massique de
l'eau chaude du bouilleur (Kg/s)
m ef : Débit massique de
l'eau froide de l'évaporateur (Kg/s)
m eab : Débit massique de l'eau de
refroidissement de (Kg/s)
l'absorbeur
ç : Rendement des échangeurs (-)
COP : Coefficient de performance (-)
Cmin : Débit thermique unitaire (KW/K)
E : Efficacité de l'échangeur (-)
NUT : Nombre d'unité de transfert (-)
DTLM : Différence de température
logarithmique moyenne (K)
U : Coefficient de transfert globale
(W/m2.K)
US : Coefficient de transfert sale
(W/m2.K)
UP : Coefficient de transfert propre
(W/m2.K)
A : Surface d'échange (m2)
Am : Surface mouillée
(m2)
f : Facteur de correction (-)
nC : Nombre de calandre en série (-)
Nt : Nombre des tubes du faisceau (-)
di/d0 : Diamètre intérieur et
extérieur du tube (m)
Di /D0 (m)
: Diamètre intérieur et
extérieur du tube concentrique extérieur
atb : Section par passage côté tube
(m2)
aCl : Section par passage côté calandre
(m2)
G : Vitesse massique (Kg/s.m2)
B : Espacement entre chicanes transversales (m)
DCl : Diamètre de la calandre (m)
Deq : Diamètre équivalent (m)
et : Epaisseur du tube (m)
fr : Coefficient de friction (-)
GH (Kg/s)
: Débit de condensât par
unité de longueur de tube
horizontal
hC : Coefficient de film de condensation
(KW/m2.K)
hi : Coefficient de film interne (KW/m2.K)
hi0 : Coefficient de film externe
(KW/m2.K)
Ptb : Pas des tubes (distance centre à centre)
(m)
l : Longueur d'un tube (m)
Rs : Résistance d'encrassement
(m2.s.K/kcal)
nt : Nombre de passe côté tube (-)
?P : Perte de charge (Kg/cm2)
Re : Nombre de Reynolds (-)
Nu : Nombre de Nusselt (-)
Pr : Nombre de Prandtl (-)
Jh : Coefficient de Colburn (-)
ö : Facteur de correction, pour chauffage ou (-)
refroidissement
öpr : Flux de chaleur de la zone de
préchauffement (KW/m2.K)
övp : Flux de chaleur de la zone de vaporisation
(KW/m2.K)
ag : Nombre d'épingles (-)
LV : Chaleur latente de vaporisation (KJ/Kg)
?s : Variation d'entropie (KJ/kg.K)
Sd : Ecart-type (-)
T : Statique (test de Student) (-)
r : Coefficient de corrélation (-)
Xi : distribution relative aux résultats du R.
KUZMAN (-)
Yi : distribution relative aux nos résultats
(-)
di : distribution des différences (-)
d : moyenne empirique de di (-)
t
(-)
á - : Statique pour le seuil
(á/2) lue sur la table de Student à
n1,
(n-1) degré de liberté
2
Indices : Indices supérieurs :
c : Critique E : Excès de Gibbs
C : Condensation ml : Mélange liquide
eb : Ebullition mg : Mélange vapeur
t : Triple ? : Estimé
NH3 : Ammoniac
H2O : Eau
L : La phase liquide
g : La phase gazeuse
0 : Evaporation
: Etat de référence
B : grandeur de référence
r : Grandeur réduite
m : massique
d : point de rosée
ch : chaud
f : froid
1,2 Entrée, sortée
ec : économiseur
b : bouilleur
ab : absorbeur
cd : condenseur
srf : sous-refroidisseur
min : minimale max : maximale
i, 0 : intérieur et extérieur
i0 : intérieur, rapporté à la
surface extérieur
eq : équivalent
sp : Solution pauvre
sr : Solution riche
a : anneau
Cl : calandre
tb : tube
p : propre
s : sale ou encrassement
Tv : transversal
Lg : longitudinal
e : eau
ef : eau de refroidissement de l'évaporateur
eab : eau de refroidissement de l'absorbeur
Ltb : longueur totale des tubes
ec : L'eau de refroidissement du
condenseur
pr : préchauffement
vp : vaporisation
HP : Haute pression BP : basse pression
.
.
)
(
. (CFC)
:
NH3-H2O V,

SARM (Simulation
of Absorption Refrigeration
Machine) :
° NH3-H2O V,
(h, î) (Log P, -1/T) ? V,
:
K 515.15 213.15
( V,
: ARM
a.S. GALLAGHER æ R. KUZMAN
·:
·
NH3-H2O
· :
·
. (Modular
Simulation of Absorption
Systems)
ABSIM
.

-
Résumé
Le nombre d'installations des machines à absorption est
en nette progression ces dernières années.
Bien que le coût de son investissement est plus important
qu'une machine à compression, la machine à absorption est plus
rentable à leur terme.
La double motivation de cette étude est basée,
d'une part sur les problèmes rencontrés par les installations
frigorifiques à compression mécanique, utilisant des machines
vibrantes et grosses consommatrices d'énergie (travail) et
coûteuses, et d'autre part ces dernières ont été
reconnues comme principales sources d'effets néfastes sur la couche
d'ozone (CFC).
Le but de cette étude a été :
V' La conception d'un programme de simulation d'un
système de réfrigération à absorption (simple et
à deux étages), fonctionnant avec le couple binaire
NH3-H2O, et qu'on a baptisé SARM
(Simulation of Absorption
Refrigeration Machine) ;
V' La création d'une base de données contenant
les propriétés thermodynamiques et
physiques pour l'ammoniac,
l'eau et leurs mélanges à différentes concentrations ;
V' La conception assistée par ordinateur des deux
diagrammes thermodynamiques d'Oldham (Log P, - 1/T) et de Merkel
(h, î) à noter que dans cette étude on a
élargi la plage d'utilisation de ce dernier :
+ Pour la pression de : 0.1 jusqu'à 50 bars
;
+ Pour la température de : 213.15 jusqu'à
513.15 K ;
V' Dimensionnement des différents organes
(échangeurs mono et diphasiques) de l'installation ;
Pour la validation de notre programme de simulation, on a
confronté nos résultats :
V' D'une part, à ceux de R. KUZMAN, et ceux de J.S.
GALLAGHER, concernant les propriétés thermodynamiques du couple
binaire NH3-H2O ;
V' D'autre part, a ceux obtenu par le logiciel
ABSIM (Modular
Simulation of Absorption
Systems), concernant les performances des cycles à
absorption.
Pour les deux cas, on a obtenu des résultats
satisfaisants.
Mots clés :
Système frigorifique ; système à
absorption ; ammoniac-eau ; simulation ; solution binaire ; coefficient de
performance ; dimensionnement ; échangeurs de chaleur ; diagramme de
Merkel ; diagramme d'Oldham.
Abstract
The number of installations of the absorption machines is in
clear progression these last
years.
Although the cost of its investment is more significant than a
compression machine, the absorption machine is more profitable in their
term.
The double motivation of this study is based on one hand on
the problems encountered by the cold stores with mechanical compression (work)
and expensive, using machines vibrating and large consuming energy, and on the
other hand these last years were recognized like principal sources of harmful
effects on the layer of ozone (CFC).
The goal of this study was:
V' Design of a simulation program of a absorption
refrigeration system (simple and double stages), functioning with binary couple
NH3-H2O, and which one has baptized SARM
(Simulation of Absorption
Refrigeration Machine) ;
V' The creation of a data base containing the thermodynamic and
physical properties
of the ammonia, water and their mixtures with various
concentrations;
V' Computer aid to design of the two thermodynamic diagrams
of Oldham (Log P, -1/T) and of Merkel (h, î) to note
that in this study one widened the beach of use of this last:
+ For the pressure of : 0.1 to 50 bars;
+ For the temperature of : 213.15 up to 513.15
K.
V' Dimensioning of the various bodies (exchangers mono and
diphasic) of the installation; For the validation of our simulation program,
one confronted our results:
V' On the one hand, with those of R. KUZMAN'S, and those of
J.S. GALLAGHER'S,
concerning the thermodynamic properties of binary couple
NH3-H2O ;
V' In addition, obtained those by software ABSIM
(Modular Simulation of
Absorption
Systems), concerning the
performances of the cycles with absorption.
For the two cases, one obtained satisfactory results.
Key words:
Refrigerating system ; absorption system ; ammonia- water ;
simulation ; binary solution ;
coefficient of performance ; dimensioning ; heat exchangers ;
diagram of Oldham ; diagram of Merkel.
Introduction
générale
Il est aisé de remarquer ces derniers temps
l'importante croissance que connaît le marché de l'énergie,
ce qui ouvre les portes à une course vers de nouvelles sources
d'énergie ou de nouveaux procédés permettant d'obtenir
d'avantage d'énergie.
C'est dans le même ordre d'idée que le milieu
industriel et quelques laboratoires de recherche portent un
intérêt de plus en plus grandissant au développement des
machines frigorifiques à compression thermique qui ont de nombreux
avantages dont nous citerons de manière non éxaustive ; et qui
nécessitent une faible énergie, voire même la suppression
de la source d'énergie ; la possibilité d'utilisation dans des
milieu hostiles du fait de la diversité des sources d'énergie de
chauffage (solaire,butane....) ; la simplicité de son fonctionnement ;
sa longévité et absence de pièces mobiles (fiables et
silencieuses).
Les installations frigorifiques à absorption utilisant
la solution NH3-H2O, ont en revanche certains inconvénients tel
qu'un investissement de matériel élevé, et une
efficacité faibles en comparaison avec les systèmes frigorifiques
à compression mécanique (coefficient de performance
(20÷70 %) comparé à (80÷120 %) pour
les systèmes à compression mécanique).
Ce travail est fait dans le but de :
- Concevoir un programme de calcul pour les différents
cycles à absorption ;
- Créer une base de données
(propriétés thermodynamiques et de transport pour les solutions
binaires) ;
- Eviter le travail manuel (tables et diagrammes), qui est long
et fastidieux avec les imprécisions dans la lecture des
résultats.
Le corps du mémoire est constitué de cinq parties
:
La première partie a été
développée dans le but d'étudier les possibilités
de présenter le cycle d'une machine frigorifique à absorption
afin de faciliter l'étude des performances (étude et recherche
bibliographique sur les cycles à absorption).
L'objectif de la deuxième partie est d'étudier
plus profondément les propriétés thermodynamiques de la
solution binaire NH3-H2O.
Lors de cette troisième partie, nous ferons une
analyse thermodynamique et thermique du cycle frigorifique à absorption
avec une étude de sensibilisation des paramètres de
fonctionnement, et le dimensionnement des principaux équipements
appropriés.
L'objectif de la quatrième partie est de simuler la
machine frigorifique à absorption pour mieux comprendre son
fonctionnement et d'en déduire des actions pour améliorer ses
performances. Pour la simulation du fonctionnement stationnaire de la machine
nous avons utilisé un programme de simulation "SARM" en
parallèle avec un programme de comparaison "ABSIM".
La cinquième partie comporte l'analyse des
résultats et la validation du programme. Enfin, nous donnerons une
conclusion générale du travail.
Dans ce présent mémoire et dans le but
d'éliminer le travail ardu auquel est confronté l'utilisateur des
deux diagrammes de Merkel et d'Oldham, nous avons essayer de les automatiser,
cette automatisation des calculs doit permettre le choix et le
prédimensionnement de la machine.
Chapitre I :
Étude et recherche
bibliographique sur les
installations frigorifiques à
absorption.
Introduction
L'objectif de ce chapitre est de faire une recherche
bibliographique sur les installations frigorifiques à absorption et de
donner le stade actuel dans le monde, puis le principe de fonctionnement de ces
machines ; afin de faciliter l'étude de ses performances et de mieux
comprendre les spécificités du cycle envisagé.
I.1. Bref rappel historique
Depuis sa lointaine origine, l'histoire des machines à
absorption à connu de nombreuses péripéties, preuve en est
un article de MAIURI daté de 1935 et titré
« la renaissance de la machine frigorifique à
absorption pour la production industrielle du froid »
[01].
Bien que leur importance soit beaucoup plus réduite
que celle des systèmes à compression, ces machines connaissent
des développements importants (recherche sur l'utilisation du
rayonnement solaire et sur les économies d'énergie).
La circulation du frigorigène n'est pas due à
un compresseur mécanique mais à la circulation par pompe d'un
liquide absorbant dont la teneur en frigorigène absorbé,
dépend de la pression. Le travail mécanique nécessaire est
très réduit et le système en contrepartie consomme de la
chaleur [02].
I.1.1. L'essor de la machine à absorption
Le père de ces systèmes est le français
FERDINAND Carré [03], qui breveta en 1859 la
première machine à absorption, utilisant le couple
frigorigène ammoniac-eau. Ces machines furent presque
immédiatement opérationnelles. Leur étude thermodynamique
ne débuta qu'en 1913 avec l'Allemand EDMUND Altenkirch et se poursuivit
durant la première moitié du 20ième siècle.
Il faut aussi citer les travaux de l'Italien GUIDO Maïuri
sur ces machines et ceux des SUÉDOIS Von Platen et MUNTERS sur le cycle
à absorption-diffusion pour les réfrigérateurs à
absorption sans pompe (1920) [03].
Depuis la machine frigorifique de Carré a fait l'objet
de nombreuses études et perfectionnements de la part des
différents concepteurs et chercheurs, ainsi que de la part de
scientifiques, parmi eux ALBERT Einstein.
En 1913, le projet est complété par la
conception de la première machine frigorifique à absorption
destinée au conditionnement d'air. Le début de la seconde guerre
mondiale va retarder sa présentation commerciale jusqu'en 1946. L'essor
de cette technologie est véritablement intervenu après la
deuxième guerre mondiale.
De 1950 à 1965, l'absorption connaît un
succès commercial important, en particulier aux Etats-Unis. Deux couples
sont alors en compétition : ammoniac/eau et eau/bromure de lithium ; le
premier est préféré pour les applications de faible
puissance, le deuxième pour la climatisation de plus grande
capacité. En 1965 environ 30 % des machines de fortes puissances aux
Etats-Unis utilisaient le principe de l'absorption (15 % en 1958)
[04].
L'année 1970 marque le début de la production et
de la commercialisation des groupes à absorption KWAZAKI (machine
eau/bromure de lithium, cycle double effet avec brûleur gaz).
Aujourd'hui, plusieurs études ont été
limitées aux applications de chauffage solaire utilisant le cycle
à absorption. Dans se qui suit on donne certaines études faites
sur la simulation des cycles à absorption :
G.C Vliet et all [05] ont
développé un code sur la simulation des machines à
absorption double étages utilisant le couple binaire H2O-LiBr.
Les algorithmes utilisés pour l'équilibre liquide vapeur
étaient extraits du manuel de principes fondamentaux d'ASHRAE (1977). Le
modèle a prévu un COP approximativement de 1.12
comparé à une valeur cité de 1.01.
N.E Wijegsundera [05] a discuté
l'utilisation des cycles idéaux à absorption avec des
irrévocabilités externes de transfert thermique pour obtenir les
limites de l'exécution des cycles à absorption utilisant
l'énergie solaire.
E.A Groll [05] a effectué une vue
d'ensemble détaillée des activités de recherches pendant
les 15 dernières années sur les cycles conventionnels de
compression de vapeur, et la technologie de l'absorption continuera dans un
proche avenir pour les applications dans la réalité.
G. Grossman [05] a décrit les
tendances actuelles dans les cycles à absorption simple, double et
triple étages. Il a conclu que la technologie de cycle à
absorption de base pour la climatisation peut être exploitée avec
l'énergie solaire.
R.M Lazzarin et all [06] ont fait une
étude expérimentale d'une machine frigorifique à
absorption simple étage fonctionnant avec le couple NH3-H2O.
Cette machine est étudiée pour une gamme de température de
(250 ÷ 260 K) au niveau de l'évaporateur et pour le
circuit du chauffage du bouilleur ; ils ont utilisé le gaz naturel et
l'air pour le circuit de refroidissement. Le coefficient de performance obtenu
est de (45 ÷ 55 %).
S.A Akam et all [07] ont fait une
étude expérimentale d'une boucle frigorifique à
absorption-diffusion. Les résultats expérimentaux sont obtenus
à l'aide d'un banc d'essai pour deux modes de chauffage :
l'énergie électrique et le gaz butane. Ils ont conclu que dans
les deux modes de chauffage, le fonctionnement de la machine ne pose aucun
problème et des résultats meilleurs du COP dans le cas
du chauffage électrique par rapport au chauffage par gaz butane.
A l'université de Ouargla, T Guermit
[08] a fait une analyse et simulation thermodynamique d'une machine
à absorption à simple étage (H2O-LiBr),
couplée à l'énergie solaire. Il a utilisé la
méthode de PHIBAR-F-CHART pour la détermination de la
fraction solaire annuelle. Les résultats obtenus ont été
comparés avec des résultats de la région de
constantine.
A Dobbi [09] a fait une étude sur la
climatisation solaire, système à absorption, l'étude
consiste en : la captation solaire ; la conception d'une machine frigorifique
solaire à absorption travaillant avec le couple binaire
H2O-LiBr ; élaboration des modèles de calcul du flux
thermique et l'étude du milieu à conditionner.
Khalid A. Joudi et all [10] ont
proposé un software pour la simulation d'un cycle à absorption
à simple étage utilisant la solution binaire H2O-LiBr
comme paire de fonctionnement. Ils ont utilisé la méthode des
volumes finis pour élaborer le transfert de chaleur et de masse au
niveau de l'absorbeur. C'est un nouveau modèle de calcul
présenté. Le programme est développé d'une
manière modulaire et les résultats sont comparés à
d'autres travaux.
Y. Kaita [11] a fait une analyse de
simulation des cycles à absorption à triple effet, pour trois
genres de cycles : courant parallèle (parallel-flow), courant en serie
(series-flow), et courant inverse (reverse-flow). Cette simulation montre que
les résultats d'un cycle à absorption de courant parallèle
donne un meilleur résultat que les autres cycles.
H.T. Chua et all [12] ont
présenté un modèle de modélisation thermodynamique
d'un refroidisseur d'eau à absorption à ammoniac-eau utilisant
les équations de transfert de Colburn. Les résultats sont
comparés à d'autres travaux.
N. Ben Ezzine et all [13] ont fait une
simulation thermodynamique d'un cycle à absorption NH3-H2O
à deux étages entraîné par l'énergie solaire.
Ils ont appliqué une analyse du deuxième principe de la
thermodynamique pour mesurer l'irréversibilité de chaque
composant du cycle, les résultats obtenus montrent que l'absorbeur, les
échangeurs de solution et de vapeur froide-condensât et le
condenseur ont le plus grand potentiel pour l'amélioration de
l'efficacité énergétique du cycle.
N. Chekir et all [14] ont fait une
simulation d'une machine frigorifique à absorption fonctionnant avec des
mélanges binaires d'alcanes. Dix mélanges ont été
considérés et comparés avec deux modes de refroidissement
du condenseur et de l'absorbeur : l'air ambiant à 35 °C et
l'eau à 25 °C. Ils ont conclu que dans le cas d'un
refroidissement avec de l'air, le COP atteint une valeur de
0.37 pour le système n-butane/octane comparé
à 0.27 pour une installation au mélange NH3-H2O
sous les mêmes conditions. Pour un refroidissement avec l'eau, les
systèmes n-butane/octane et propane/octane donnent un COP
de 0.63, valeur comparable à celui des systèmes
NH3-H2O. Ils ont montré aussi que l'utilisation du n-butane
comme fluide frigorigène, l'installation fonctionne sous une
pression de condensation ne dépassant pas 5 bar.
Donc, la littérature montre qu'un code informatique
flexible de simulation sera un outil de conception puissant de recherche.
I.1.2. Stade Actuel des machines à absorption
dans le monde
Les machines frigorifiques à absorption constituent un
sujet de recherche d'actualité. Elles présentent une alternative
intéressante en raison de la pureté de la solution et elles
éliminent le problème de pollution par les composés
chlorofluorés.
En Europe, les écoles allemandes ont
développé des centres de recherche qui ont abordé ce sujet
; ainsi qu'en France. Il existe aujourd'hui plusieurs installations de
climatisation solaire à absorption. En Hollande, l'école de
l'université technique de Delft, a commencé dès les
années 80 en période de la crise pétrolière, un
programme de recherche qui a été matérialisé par
des applications concrètes plus intéressantes, dont bientôt
trois en France (Banyuls, Diren en Guadeloupe et CSTB à Sophia
Antipolis) [15].
Aux Etats-Unis, le laboratoire national de Oak Ridge (Tennessee)
est l'un des centres de recherche les plus importants au niveau mondial.
Le Japon, à cause du besoin des ressources naturelles,
a développé sous le contrôle du gouvernement un programme
de recherche dans le domaine des systèmes à absorption. Une
contribution importante a été faite par le Professeur TAKAMOTO
Saito de l'université du Tokyo (spécialement les systèmes
à absorption en solution H2O-LiBr). Les constructeurs Japonais sont les
premiers au monde dans le domaine d'absorption. Le nombre d'installations des
réfrigérateurs à absorption vendus en 1996 a
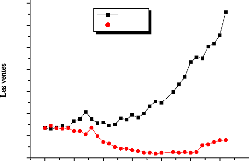
dépassé les 6600 unités ce qui représente un record
mondial, figure (I.1) [04].
7000
6000
5000
4000
JAPON USA
3000
2000
1000
0
1965 1970 1975 1980 1985 1990 1995 2000
Année
Figure I.1 Les ventes des
réfrigérateurs à absorption aux
Etats-Unies et le Japon.
La Corée est le 3ième producteur
mondial de groupe à absorption, le nombre vendu en 1996 a
dépassé les 1800 après le Japon et la Chine les 2500, ceci
pour des raisons de politique énergétique.
En Chine, grâce au développement
économique rapide du pays, la climatisation centralisée des
bâtiments est fortement demandée, et Comme la distribution
d'électricité est insuffisante et coûteuse, c'est
l'absorption qui est favorisée.
En Inde, Thermax est le premier constructeur de climatiseurs
à absorption, il a fourni plus de 300 installations en 1997, la plupart
fonctionnent à la vapeur.
Citons quelques constructeurs des machines à absorption
de différents pays [16],[17] :
USA (Carrier, York et Trane) ;
Japon (Yazaki, Sanyo, Voltas, Ebara, Mitsubishi, Toshiba,
Hitashi, Kawasaki et Takuma) ; Germany (Entropie, Hans
Güntner Gmbh absorptionskälte KG) ; Korea (LG
Machinery, Kyung won centry) ; China (Broad) ;
Netherlands (Clibri-stork).
La Colibri-Stork [18], propose des machines
pouvant aller jusqu'à -60 °C avec des cycles à
simple et double effet. La figure (I.2) présente un exemple de machine
à absorption (ARP-S) en cours de réalisation.

Figure I.2. Machine frigorifique à
absorption NH3-H2O en cours de montage (document Colibri).
Les installations frigorifiques ARP-S, sont des
machines à absorption de petites dimensions avec des capacités de
100 KW à 600 KW. Elles sont construites pour fonctionner
à des températures de : -30 °C jusqu'à
-50 °C. La capacité de réfrigération
dépend de la température d'évaporation, la
température de la source thermique et la température du fluide de
refroidissement.
L'essentiel de la gamme couverte par ce constructeur
(Colibri) est donné dans le tableau (I.1) et les performances de
processus d'absorption NH3-H2O à simple étage qu'il
annonce sont présentées dans la figure (I.3).
Modèle
|
Temperature d'évaporation
|
Capacitéfrigorifique
|
ARP-S1
|
de 0 °C jusqu'à -30 °C (-50
°C)
|
100-250 kw
|
ARP-S2
|
de 0 °C jusqu'à -30 °C (-50
°C)
|
200-400 kw
|
ARP-S3
|
de 0 °C jusqu'à -30 °C (-50
°C)
|
3 50-600 kw
|
|
Tableau I.1. Les différents types des
machines à absorption ARP-S.
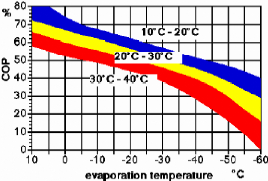
Figure I.3. Domaine d'application et
performance des machine à absorption Colibri.
En continuation, on représente un graphe pour la
sélection rapide d'un constructeur de groupes à absorption au gaz
en fonction de la puissance frigorifique figure (I.4) ; ainsi quelques
productions des machines à absorption industrielles [figures (I.5.a, b,
c, d, e, f)] :
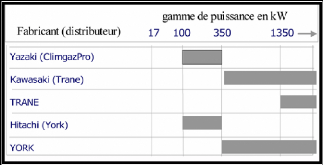
Figure I.4. La gamme de puissance en KW de
quelques fabricants dans le monde.

Figure I.5.a. Refroidisseur de liquide à
absorption à simple étage.
Série ABS-PRC005-EN 465 KW
Octobre 2004 (doc.Trane)
Figure I.5.b. Refroidisseur de liquide à
absorption à doubles étages
Série ABSC 390 à 6000
KW.
Juin 2002 (doc.Trane)

Figure I.5.c. Machine à absorption de
type YIA-ST-1A1 THRU YIA-ST-14F3 (doc.York)
Figure I.5.d. Machine à absorption de
type
YPC-F (doc.York)

Figure I.5.e. Machine à absorption de
type CH- V (doc. ClimgazPro - Yazaki)
Figure I.5.f. Machine à absorption de
type YPMC-F (doc. YORK - HITACHI)
I.2. Représentation schématique et
principe de fonctionnement
Le premier souci dans l'étude des différents
cycles de la machine à absorption est de choisir un mode de
représentation. En effet, il existe plusieurs façons de
représenter un même cycle.
L'objectif de l'étude des différentes
représentations schématiques du cycle est de distinguer parmis
toutes les représentations possibles celles qui conviennent mieux
à l'étude des cycles à changement de phase.
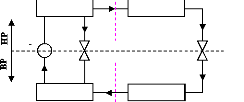
Donc, on peut représenter un cycle d'une machine
à absorption par la combinaison de deux cycles de Rankine d'une machine
thermique et une machine frigorifique en superposition et il en résulte
un cycle de machine à absorption simple étage
représenté dans la figure (I.6). La machine thermique joue le
rôle du moto-compresseur d'une machine frigorifique à
compression [19].
M. Ther
PAC
Pompe
Désorbeur
Bouilleur
Détendeur Secondaire
Evaporateur
Condenseur
Détendeur Principal

Figure I.6. Machine à absorption simple
étage par la superposition de deux cycles de Rankine d'une machine
thermique et PAC.
I.2.1. Principe de fonctionnement [20]
Le principe de fonctionnement de ces machines repose sur la
théorie et les propriétés des mélanges (ou couples)
binaires. Les mélanges utilisés dans ces machines comprennent un
« solvant » et un fluide frigorigène qui, en un certain point
du cycle est « absorbé » par le solvant d'où le nom
donné à ce type de machine ; et en un autre point est
libéré du solvant.
Afin d'obtenir ce résultat, il est nécessaire
que le solvant présente à froid une très grande
affinité pour le fluide frigorigène ; lorsque la
température du mélange s'élève, cette
affinité diminue et il y a dégagement du fluide
frigorigène du solvant.
Les deux principaux couples binaires utilisés
industriellement sont les couples suivants :
Couple
|
Solvant
|
Fluide Frigorigène
|
Ammoniac-Eau
|
Eau
|
Ammoniac
|
Eau-Bromure de lithium
|
Bromure de lithium
|
Eau
|
|
I.2.2. Machine à absorption avec
NH3-H2O
Cette machine utilise la propriété que
présente l'eau à basse température d'absorber l'ammoniac
(1000 fois son volume à 0°C) et de libérer par chauffage la
presque totalité du gaz absorbé (à 100°C)
[20]. Ces vapeurs d'ammoniac une fois condensées pourront donc
nous assurer la production de froid désirée dans un
évaporateur.
I.2.2.1. Description
Une telle machine comprend figure (I.7) :
- Un bouilleur (1) dans lequel sera chauffé la solution
ammoniacale.
- Un rectificateur-séparateur d'eau (2) libérant
l'ammoniac des gouttelettes d'eau entraînées.
- Un condenseur (3). - Un détendeur (4). - Un
évaporateur (5). - Un absorbeur (6). - Une pompe de circulation de
solution (7).
- Un échangeur thermique (8).
- Un robinet régleur de débit de solution (9).
I.4.2.2. Fonctionnement :
La solution ammoniac-eau est chauffée dans le
bouilleur (1) par le serpentin de vapeur. La solubilité de l'ammoniac
dans l'eau diminue, l'ammoniac gazeux se dégage sous une pression
très voisine de sa tension de vapeur saturante à la
température de la solution en ébullition. La solution restant
dans le bouilleur s'appauvrit en ammoniac d'où le nom de solution pauvre
qui lui est donné.
L'ammoniac gazeux se sépare des gouttelettes d'eau
entraînées mécaniquement par le fluide dans le
rectificateur-séparateur (2) et va se condenser dans le condenseur
(3).
b- Schéma technologique
(doc.
ClimgazPro).
Figure I.7. Machine à absorption
NH3-H2O.
L'ammoniac liquide est admis à travers le
détendeur (4) à l'évaporateur (5) où,
détendu, il s'y vaporise sous la pression P5 correspondant
à sa température d'évaporation T5. Les vapeurs
provenant de cette vaporisation sont acheminées vers l'absorbeur (6)
où elles rencontrent la solution pauvre venant du bouilleur et dont le
débit est réglé par le robinet de réglage (9).
L'absorbeur est maintenu à une température
très voisine de la température ambiante par une circulation
d'eau, afin de favoriser au maximum la dissolution de l'ammoniac dans la
solution pauvre, d'une part ; et d'autre part d'éliminer à
l'extérieur du système, la chaleur provenant de la dissolution de
l'ammoniac dans l'eau.
La solution ammoniacale pauvre ainsi enrichie par absorption
d'ammoniac ; d'où l'appellation de solution riche ; est prise en charge
par une pompe (7) permettant de compenser la différence de pression
existant entre l'absorbeur et le bouilleur.
Nous avons donc une circulation de deux fluides :
- L'ammoniac pratiquement pur qui, entre la sortie du bouilleur
et l'entrée à l'absorbeur, subit les transformations habituelles
d'un fluide frigorigène ;
- La solution ammoniacale, alternativement pauvre et riche qui
circule entre le bouilleur et l'absorbeur.
L'échangeur thermique (8) a pour but
d'améliorer le rendement de la machine en refroidissant la solution
pauvre avant son admission à l'absorbeur, et en réchauffant la
solution riche avant son retour au bouilleur, les deux solutions circulant
à contre-courant dans l'échangeur de chaleur.
Les détendeurs (4) et (9), ainsi que la pompe (7),
assurent la délimitation des circuits haute et basse pressions
rôle que jouait à lui seul le détendeur dans les machines
à compression mécanique.
Donc le schéma nous montre que le seul organe
mécanique de l'installation est la pompe à solution (7).
I.2.3. Machine à absorption avec
H2O-LiBr
Ce sont des machines dans lesquelles on utilise
l'affinité du bromure de lithium pour l'eau, le bromure de lithium
étant le solvant et l'eau agissant en tant que fluide
frigorigène. Les puissances frigorifiques de ces machines sont
très élevées. Leur gamme s'étend de 170 KW
à 3500 KW environ [20]. Elles sont très
utilisées en conditionnement d'air, notamment aux
U.S.A. L'innocuité du fluide frigorigène (eau) a
contribué à leur développement ainsi que certaines
simplifications de matériels rendues possibles grâce aux
caractéristiques physiques de l'eau.
I.2.3.1. Description
La machine figure (I.8) comporte toujours les organes
essentiels déjà cités, soit : bouilleur (1), condenseur
(2), évaporateur (5), absorbeur (6), échangeur (8) et pompe de
circulation de solution (7).
L'examen du schéma de principe de cette machine et
celui d'une machine réelle, nous permet de constater que le
rectificateur séparateur d'eau a disparu, sa fonction est inutile
étant donné la nature du fluide frigorigène ; par contre,
nous voyons apparaître une pompe (9) qui a pour rôle d'assurer une
circulation de l'eau à vaporiser à l'évaporateur dans des
pulvérisateurs destinés à accroître la surface de
contact entre l'eau à refroidir, et une troisième pompe (10) qui
a pour but de maintenir en (5) le vide poussé nécessaire à
la vaporisation de l'eau.
I.2.3.2. Fonctionnement
La solution eau-bromure de lithium chauffée dans le
bouilleur libère par chauffage l'eau sous forme de vapeur, la solution
restante s'enrichit donc en bromure de lithium (contrairement à la
solution ammoniac-eau qui, elle, s'appauvrit dans le bouilleur). La vapeur
d'eau libérée est condensée dans le condenseur d'où
elle est ensuite acheminée vers l'évaporateur où elle se
vaporise.
La vapeur d'eau produite est absorbée par la solution
pauvre (en provenance du bouilleur) dans l'absorbeur (5). La solution
s'enrichit en eau. La pompe (7) assure le retour de cette solution au bouilleur
pour un nouveau cycle.
a- Schéma de principe
b- Schéma technologique (doc. York).
|
|
|
Figure I.8. Machine à absorption
H2O-LiBr.
Les faibles pressions régnant au bouilleur et au
condenseur, d'une part (1,6 bar absolu en moyenne), et à
l'évaporateur et à l'absorbeur, d'autre part, quelques
millimètres de mercure, soit environ (800 Pa) ont permis de concentrer
en deux blocs sous la forme de cylindre :
- bouilleur et condenseur. - évaporateur et absorbeur.
La très faible pression régnant dans l'ensemble
évaporateur-absorbeur oblige à maintenir un vide poussé
dans cette partie de l'installation afin que la température de
vaporisation de l'eau soit proche de 0° C. Ce vide est entretenu
par la pompe (10).
La nature même du fluide frigorigène implique une
température d'évaporation minimale de 0° C et réserve
donc ces machines aux applications du conditionnement d'air.
I.2.4. Avantages et inconvénients I.2.4.1.
Avantages
9 Elles consomment essentiellement de l'énergie
calorifique ;
9 Leurs utilisations sont intéressantes si on dispose
d'une source de chaleur (chaleur gratuite perdue) ;
9 Intérêt d'avoir de l'eau comme fluide
frigorigène : pas de toxicité ;
9 Machines silencieuses et sans vibrations.
I.2.4.2. Inconvénients
9 COP faible face aux machines à compression ; 9
Puissances thermiques importantes à évacuer ; 9 Fonctionnement en
très basse pression :
> Problème de construction ;
étanchéité importante. > Cristallisation de l'eau
(panne).
I.3. Diagrammes thermodynamiques utilisés
I.3.1. Diagramme de Merkel [21]
Le diagramme de Merkel permet une étude
complète de la machine à absorption, car il fournit les bilans
thermiques des différents appareils du circuit par lecture directe des
différences d'enthalpie. L'axe des abscisses est gradué en
concentrations de la phase liquide et l'axe des ordonnées en enthalpies
figure (I.9).
Il comporte, à la partie inférieure, des
réseaux d'isothermes et d'isobares, de même que des courbes
d'égale concentration de la phase vapeur en équilibre avec la
phase liquide ; à la partie supérieure, des courbes de
référence permettent, en partant d'un point d'équilibre
déterminé dans la partie inférieure, de définir les
caractéristiques de la phase vapeur.
I.3.2. Diagramme d'Oldham [22]
C'est le diagramme le plus utilisé et le plus pratique
pour une étude d'une machine à absorption, figure (I.10). L'axe
des abscisses est gradué en (1/T) et l'axe des ordonnées
en (Log P). Dans ce système de coordonnées, les courbe
traduisant l'équilibre du système binaire dans la phase vapeur
aussi bien que dans la phase liquide sont, à très peu de chose
prés, des droites. La droite de teneur (100 %) correspond à
l'équilibre liquide-vapeur de l'ammoniac pur, la droite de teneur (0 %)
à l'équilibre liquide-vapeur de l'eau pure.
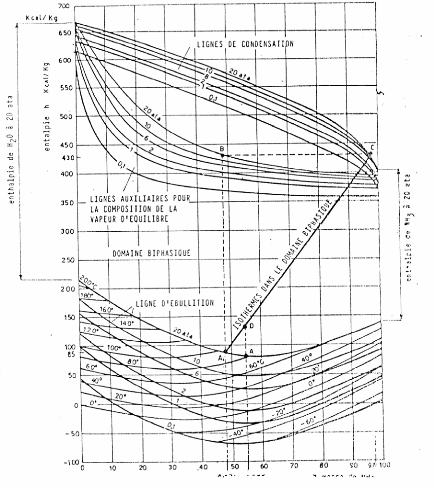
Figure I.9. diagramme de Merkel relatif au
couple NH3-H20.
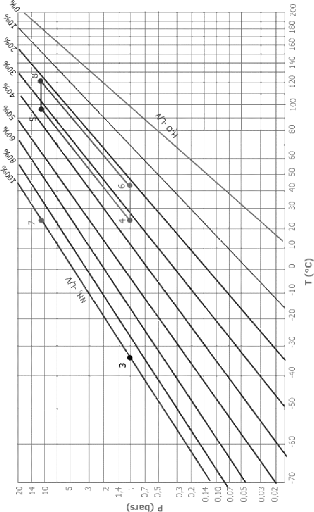
Figure I.10 diagramme d'Oldham relatif au
couple NH3-H20.
I.4. Mélanges pour une machine à
absorption
Bien que, théoriquement, il n'y ait aucune
impossibilité d'utiliser des mélanges d'ordre supérieur,
on se limite pratiquement aux mélanges binaires qui sont donc une
combinaison d'un fluide frigorigène et d'un agent d'absorption.
Le choix du fluide interne d'une machine à absorption
est d'abord dicté par le cycle choisi et l'application à laquelle
la machine est destinée. Il faut ensuite tenir compte des
réglementations concernant les fluides frigorigènes qui sont de
plus en plus contraignantes.
A l'heure actuelle, les couples ammoniac-eau et eau-bromure de
lithium sont les seuls utilisés dans les machines
commercialisées.
I.4.1. Caractéristiques d'un couple
binaire
Les deux substances fluides frigorigène-agent
absorbant qui doivent former le couple binaire ou solution dans les cycles
frigorifiques à absorption doivent avoir les caractéristiques
suivantes :
1. Absence de phase solide ;
2. L'agent absorbant doit avoir une grande affinité pour
le fluide frigorigène ;
3. Le fluide frigorigène doit être plus volatile
que l'agent absorbant ;
4. La pression de travail doit être modéré
;
5. Une bonne stabilité chimique ;
6. L'absence de corrosion ;
7. Une sécurité, non toxique, non inflammable ;
8. Une faible viscosité et conductivité thermique
élevée ;
9. Une grande chaleur latente du fluide frigorigène est
désirable.
Les couples ammoniac-eau et eau-bromure de lithium sont les
couples qui remplissent le plus de critères.
I.4.2. Propriétés de l'agent
d'absorption
L'agent d'absorption doit répondre aux
caractéristiques suivantes :
1. La tension de vapeur à la température
nécessaire dans le bouilleur doit être négligeable ou
très faible par comparaison à la tension de vapeur du fluide
frigorigène ;
2. L'agent d'absorption doit rester liquide dans tout le
cycle et ne pas donner lien à des possibilités de cristallisation
; la stabilité chimique doit être bonne et il ne doit pas
être corrosif ;
3. La chaleur massique doit être faible pour
éviter des pertes. La conductivité thermique doit être
élevée, la viscosité et la tension superficielle faible
pour favoriser la transmission de chaleur et l'absorption.
Conclusion
Nous avons présenté dans ce chapitre le
fondement théorique et les travaux de recherches réalisées
dans ce domaine. Cette partie d'étude nous a permis d'avoir une
idée sur les différentes liaisons reliant les divers
paramètres.
Donc, l'étude thermodynamique complète des
installations frigorifiques à absorption requiert la connaissance des
propriétés thermodynamiques du couple utilisé, cette
partie fera l'objet du chapitre suivant.
Chapitre II :
Étude thermodynamique
des propriétés de la
solution binaire NH3-H2O.
Introduction
Ce chapitre décrit les équations nécessaires
pour le calcul des propriétés thermodynamiques et physiques de la
solution binaire composée de l'ammoniac et l'eau.
Les modèles mathématiques de calcul et de
simulation des systèmes à absorption exigent la connaissance d'un
grand nombre de propriétés thermodynamiques et de transports des
fluides de fonctionnement. Pour atteindre ce but, un grand nombre de recherches
expérimentales a été effectué ou les
résultats ont été matérialisés dans une
série de tableaux et diagrammes avec des données utiles ; le
diagramme (h,î) est bien connu, réalisé par Merkel
et Bosniakovic [02].
Enick et al [23] ont employé
l'équation d'état du Peng-Robinson pour prévoir les
propriétés thermodynamiques du mélange. Weber
[24] a présenté un modèle pour estimer le
deuxième et le troisième coefficient de viriel du mélange
NH3-H2O. Rukes et Dooley [25] ont employé le
calcul de l'énergie libre de Helmotz des composantes pour dériver
après les propriétés thermodynamiques à la
saturation.
Beaucoup de chercheurs ont employé le calcul de
l'enthalpie libre de Gibbs pour formuler les propriétés
thermodynamiques du mélange NH3-H2O [Ziegler et Trepp
[26] ; Ibrahim et Klein [27] ; Xu et Goswami
[28] ; Jordan [29]]. Mais chaque chercheur a
formulé les conditions de l'équilibre liquide-vapeur avec
différents moyens ; Ziegler et Trepp (1984), Ibrahim et Klein (1993) et
Xu et Goswami (1999) l'ont formulé en égalisant des
fugacités des composantes dans les deux phases. D'autre part, Jordan
(1997) par égalisation des potentiels chimiques des composants. Nag et
Gupta [30] ont considéré l'équation
d'état de Peng-Robinson pour la phase liquide.
II.1. Paramètres fondamentaux des substances
pures [31]
Les valeurs des paramètres utilisées pour la
détermination des équations, sont décrites dans le tableau
suivant.
|
NH3
|
H2O
|
|
Masse molaire
|
M [kg. kmole-1]
|
17.03026
|
18.015268
|
|
Point critique
|
Température Tc [k]
|
405.4
|
647.14
|
|
Pression Pc [bar]
|
113.336
|
220.64
|
|
Masse volumique ñc
[kg.m-3]
|
225
|
322
|
|
Point d'ébullition
|
Température Teb
[k]
|
239.74
|
373.15
|
|
Pression Peb
[bar]
|
1.013325
|
1.013325
|
|
Point triple
|
Température Tt [k]
|
195.41
|
273.16
|
|
Pression Pt [bar]
|
0.06077
|
6.112 10-3
|
Tableau II.1. Les paramètres
fondamentaux des substances pures.
II.2. Notion de potentiel chimique
[32]
Considérons l'expression de la différentielle
du de l'énergie interne obtenue par application
simultanée des deux principes à un système fermé,
et si n1, n2, , ni représentent les nombres de moles
respectifs des différents composants présents dans la phase, on
peut écrire que :
? ?
uu
(II.1)
i
n n
1 i
du TdS PdV dn dn
= - + + +
1
? ?
Ou plus simplement :
? u
du TdS PdV dn
? (II.2)
i
= - + i
i i
? n
Où :
? ? ? ? ?
u
(II.3)
= u i j
,
? ? ?
n i s v n
, , j
Les quantités telles que
= u sont les potentiels chimiques des composants dans
le
i j,
? ? ?
n i s v n
, , j
? ? ? ? ?
u
système. Le potentiel chimique interne, défini par
« Gibbs », est une mesure de l'influence de l'énergie interne
de la phase considérée sur l'influence du nombre de moles du
constituant (i).
Si l'on envisage maintenant l'enthalpie, l'énergie libre
et l'enthalpie libre de la phase considérée définies
respectivement par :
H=u+PV (II.4)
F=u-TS (Helmotz) (II.5)
G = H - TS (Gibbs) (II.6)
En calculant leurs différentielles et en substituant, les
nouvelles expressions :
dH = TdS + VdP +? u dn
i i (II.7)
i
dF = - SdT - PdV+? udn
i i (II.8)
i
dG = -SdT+ VdP+? udn
i i (II.9)
i
Et par conséquent :
|
ui
|
? ? ? ? ? ? ? ? ? ? ? ?
u H F G
? ? = ? ? = ? ? = ? ? (II.10)
? ? ? ? ? ? ? ? ? ? ? ?
n n n n
i s v n i s p n i T v n i T p n j
, , j , , , , , ,
j j
|
L'enthalpie libre peut être calculée sur la base des
potentiels chimiques ui des deux composantes (NH3
et H2O) :
G=(1-x)uHO+xu N H 3
(II.11)
2
II.2.1. Condition d'équilibre
A l'équilibre de la phase, à coté de
l'égalité de la pression et de la température, il existe
en plus l'égalité entre les potentiels chimiques de toutes les
composantes des phases existantes.
u i T P x = u i T P x i = NH H O
(II.12)
g g L L
( , , ) ( , , ) 3 , 2
II.3. L'équation d'état fondamentale
choisie pour NH3-H2O
Parmi les modèles citées
précédemment on a choisi celui de MICHEL FEIDT
[33] qui combine la méthode de l'énergie libre de Gibbs
pour les propriétés thermiques et des équations qui
calculent le point de bulle et le point de rosée du mélange.
Cette méthode combine les avantages des deux et évite le besoin
de faire des itérations afin d'avoir les conditions d'équilibre
de phases. Les corrélations proposées couvrent des conditions
d'équilibre de phases à des pressions et des températures
élevées.
Le domaine de validité pour les relations qui suit est
:
· Pour les températures (k) :
230<T<600 ;
· Pour les pression (bar) :
0.2<P<110.
Ce domaine se trouve sous les points critiques de toutes les
composantes, de sorte que la détermination de l'équation
d'état pour le mélange, ne prend pas en considération les
particularités référents au domaine d'état
critique. L'équation d'état ne décrit pas l'état
dans laquelle la solution se trouve dans l'état d'agrégation
solide [33].
II.3.1. L'enthalpie libre
L'équation fondamentale de l'enthalpie libre de Gibbs est
donnée sous une forme intégrale (Ziegler et Trepp
[26], Ibrahim et Klein [27], Xu et Yogi
Goswami [28]) :
Cp
G H TS Cp dT V dP T dT
= - + ? + ? - ?
0 0 T
T P T
T P T
0 0 0
(II.13)
Cette équation est valable pour la phase gazeuse, ainsi
que liquide.
II.3.1.1. Phase liquide
Le comportement de l'état liquide du point de vue
thermique est décrit par les corrélations suivantes (Ziegler et
Trepp [26]), où le volume liquide est fonction de la
pression et de la température et CpL molaire du
liquide de la température :
(II.14) (II.15)
V = a + a P + a T + a
T
L 2
1 2 3 4
Cp = b + b T + b T
L 2
1 2 3
donc :
T P T L
Cp
G H TS Cp dT V dP T dT
L L L L L
(II.16)
= - + ? + ? - ?
0 0 T
T P T
0 0 0
Le développement de l'équation (II.16) avec
l'aide des équations (II.14) et (II.15) donne la forme réduite
:
B B ? ?
T
G H T S B T T T T T T B T B T T T
L L L 2 2 2 3 3 3
,0 ,0 1 ,0 ,0 ,0 1 2 ,0
( ) ( ) ( ) ln ( )
r
r r r r r r r r r r r
= - + - + - + - - - -
r r r
2 3 ? ?
? ?
T r ,0
B A
- - + + + - + -
3 2 2
T T T A A T A T P P P P
( ) ( )( ) ( )
2 2 2 2
r r r r r r r r r
,0 1 3 4 ,0 ,0
2 2
|
(II.17)
|
|
Les grandeurs adimensionnelles d'état sont :
· La température réduite : T r
|
T
= ;
T B
|
|
·
G
RTB ;
L'enthalpie libre molaire réduite : G r
· La pression réduite : P r
|
P
= ;
P B
|
·
H
RT B
;
L'enthalpie molaire réduite : H r
S
· L'entropie molaire réduite : r
S = ;
R
· Le volume molaire réduit : B
.
V =
r RT B
VP
Les indices utilisés sont :
· r : pour la grandeur réduite ;
· B : pour la grandeur de référence ;
· L : la phase liquide ;
· g : la phase gazeuse ;
· 0 : l'état de référence.
Les grandeurs de références sont
[33] :
TB=100k ;
PB=10bar et
R=8.3143kj/kmole.k.
II.3.1.2. La phase vapeur
Dans la phase vapeur (Ziegler et Trepp [26])
donne les corrélations qui interviennent :
g RT c cc
2 3
V c

4
= + + + +
P T T T
1 3 11 11
P2
(II.18)
P?? ?
2V
Cp d d T d T T dP
g = + + - ? ?
2 ? (II.19)
1 2 32
T
0 ? ? ?
Et :
T P T g
Cp
G H TS Cp dT V dP T dT
g g g g g
= - + ? + ? - ?
0 0 T
(II.20)
T P T
0 0 0
Après le développement on trouve :
D D ? ?
T
G H T S D T T T T T T DT
g g g
= - + - + - + - -
2 2 2 3 3 3 r
r r r r r r r r r r r
,0 ,0 1 ,0 ,0 ,0 1
( ) ( ) ( ) ln
2 3 ? ?
? ?
T r ,0
D P
? ?
- - - - + + -
D T T T T T T T C P P
3 2 2
2 ,0
r r r r r r r
( ) ( ) ln ( )
r
,0 1 ,0
r r
2 ? ?
? ?
P r ,0
?
r ?
?
? ?
P P P T P
?
r r
P P T
(II.2 1)
,0 ,0 ,0 11
2 3 3 4 3 11
4 3 12
r r r r r
+ - + + - ,0
C C +
? ?
T T T T T
? 11 12
? ?
r r r r r
,0 ,0 ? ,0 ,0
T r
C P P P T
3 3 3
?
+ - +

4 ,0 ,0
r r r r
12 11
11 11 12
3 ? ? T T T
r r r
,0 ,0
II.3.2. Propriétés
thermodynamiques
L'enthalpie, l'entropie et le volume molaires sont liés
à l'enthalpie libre de Gibbs [33] :
2 ( )
? ? ?
G T
= - ? ? ? ?? (II.22)
r r
H RT T
B r T r P r
? ? ?
G
S R
= - ? ?
r(II.23)
? ? ?
T r P r
RT G
? ? ?
B r
V = ? ? (II.24)
PP
B r T
? ? ?
r
Après le développement des équations on
trouve :
II.3.2.1. Pour la phase liquide
H RT
L = B
? B B
( ) ( ) ( ) ( )( )
T T T T T T P P A A T
2 3 2
3 3
r r r r r r r r r
- + - + - + - -
,0 ,0 ,0 ,0 1 4
2 3
2 2
H B
L
? r ,0 1
+
A P P
2 2 2
( )
r r
- ,0
2
? ? ? ?
? ? ? ?
S R S B B T T T T A A T P P
L L T r B
= ? + + - + - - + -
3 2 2
,0 1 2 ,0 ,0 3 4 ,0
ln ( ) ( ) ( 2 )( ) ?
r r (II.26)
r ? ? r r r r r
? ? ? ?
? T 2
r ,0 ?
(II.27)
(II.28)
S D D T T T T C
g T r D
? + + - + - +
ln ( ) ( ) 3
3 2 2
r ,0 1 2 ,0 ,0 2 4
? ? r r r r
? T 2 ? T
r r
? ?
P P ?
r r ,0
? - Tr + ?
4 ?
,0 ,0 ? ?
?
?
? ? ? ? ? ? ?
P P P P P
3 3
11
,0 ,0
11 ln
3 - + - -
r r
r r r
C C
? ? ? ? ? ? ?
12 12 4 12 12
? ? ? ? ? ? ?
T T T T P
3
r r r r r
,0 ,0 ,0
? ? ?
? ?
?
(II.29)
S R
g =
2
? 2 3 4
V C
g B
RT C C P T
C r r
= ? ? + + + +
P T T T
1 3 11 11 P
B r r r r
V A A P A T A T
L B
RT 2
= ? ?
? + + + ?
1 2 3 4
r r r
P B
II.3.2.2. Pour la phase vapeur
?
) ?
? D D
H D T T T T T T C P P
g + - + - + - + -
( ) ( ) ( ) (
2 2 2 3 3 3
? r r r r r r r r r
,0 1 ,0 ,0 ,0 1 ,0
2 3
H RT
g = ? ? ? ? ? ? ?
?
B P P P P P P
3 3
? + - + - + -
,0 ,0 ,0
4 12 4
C C C
r r
r r r r
2 ? ? ? ? ? ? ?
3 3 11 11 4 11 11
3
? ? ? ? ? ? ?
T T T T T T
r r r r r r
,0 ,0 ,0 ?
Mélange
|
E1
|
-41.733398
|
E2
|
0.02414
|
E3
|
6.702285
|
E4
|
-0.01 1475
|
E5
|
63.608967
|
E6
|
-62.490768
|
E7
|
1.761064
|
E8
|
0.008626
|
E9
|
0.387983
|
E10
|
0.004772
|
E11
|
-4.648107
|
E12
|
0.836376
|
E13
|
-3.553627
|
E14
|
0.000904
|
E15
|
24.361723
|
E16
|
-20.736547
|
|
|
Ammoniac
|
Eau
|
A1
|
3.971423.10-2
|
2.748796.10-2
|
A2
|
-1.790557.10-5
|
-1.016665.10-5
|
A3
|
-1.308905.10-2
|
-4.452025.10-3
|
A4
|
3.752836.10-3
|
8.389246.10-4
|
B1
|
1.634519.101
|
1.214557.101
|
B2
|
-6.508119
|
-1.898065
|
B3
|
1.448937
|
2.911966.10-1
|
C1
|
-1.049377.10-2
|
2.136131.10-2
|
C2
|
-8.288224
|
-3.169291.101
|
C3
|
-6.647257.102
|
-4.634611.104
|
C4
|
-3.045352.10 3
|
0
|
D1
|
3.673647
|
4.019170
|
D2
|
9.989629.10-2
|
-5.175550.10-2
|
D3
|
3.617622.10-2
|
1.951939.10-2
|
L
Hr ,0
|
4.878573
|
21.821141
|
g
Hr ,0
|
26.468879
|
60.965058
|
L
Sr ,0
|
1.644773
|
5.733498
|
g
Sr ,0
|
8.339026
|
13.453430
|
Tr,0
|
3.2252
|
5.0705
|
Pr,0
|
2
|
3
|
|
Tableau II.2. Les coefficients pour les
équations (II.13.17.21.22.23.24.25.26) et (II.32.33.34)
[33].
II.4. Mélange ammoniac-eau II.4.1. Mélange
liquide [33]
Selon l'analyse donnée par Ziegler et Trepp
[26], la fonction de Gibbs d'un mélange liquide de
l'ammoniac-eau est donnée par la relation idéale de
mélange de solution plus l'énergie d'excès de Gibbs
GE. Cette énergie, dont la relation est
proposée par Xu et Yogi Goswami [28], est
limitée à trois facteurs, tient compte de la déviation du
comportement idéal de solution (la solution liquide ne se comporte pas
comme une solution idéale).
Gr = x - x ? F +
F x - + F x -
E ( ) ( ) ( )2
1 1 2 2 1 3 2 1 ?? (II.31)
?
E E
5
Avec : F E E P E E P T
1 1 2 r ( 3 4 r ) r 2
= + + + ++ 6 (II.32)
T T
r r
E E
11 12
F E E P E E P T
2 7 8 9 10
= + + + + +
r ( r ) r 2
T T
r r
|
(II.33)
|
|
E E
15 16
F E E P
3 13 14 r 2
= + + + (II.34)
T T
r r
Les coefficients Ei (i=1 ....16), pour les
équations (II.32.33.34) sont indiqués dans le tableau (II.2).
L'enthalpie, l'entropie et le volume d'excès sont données
par [33] :
? ? ?
( )
H RT T
E = - B r
2
G T
E
r r
(II.35)
? ?
? ? T
? ? ?
P r x
,
r
? ? ?
G E
S R
E r
= - ? ? (II.36)
? ? ?
T r P r , x
V E B r
= ?
RT G
? ? ?
E
? (II.37)
P P
B r T
? ? ?
r , x
Après le développement on trouve :
?
?
E (1 ) ?
H RT x x
= - ?
B
?
? ?
2 3
E E ? 2 3
E E E E P x E E P
5 6 11 12
1 2
+ + + + - + + +
2 7 8
(2 1)
r ? r 2
T T
r r ? T T
r r
E E ?
2 ? 2 3
+ - ? + + +
x E E P T T
15 16
(2 1) 13 14 2
r ?
? r r ?
?
?
? ?
? ? (II.38)
?
?
? ?
S Rx x
E = -
(1
|
? E E ? ? ?
E E
2
5 6
2
? - - + + + - - - + +
11 12
E E P x E E P
3 4 r 2 3 9 10
(2 1) ? ? ?
r 2 3
? ? ?
T T T T
r r r r ?
) (II.39)
? ?
? 2 15 16
? ?
E E
2
+ - ? + ? ?
(2 1)
x
? ? ? ?
T T
2 3
? r r ?
|
|
E B
RT 2
V x x E E T x E E T x
= - + + - + + - ?
(1 ) (2 1)( ) (2 1) 14
? E (II.40)
? 2 4 8 10
r r ?
P B
Donc, l'enthalpie, l'entropie et le volume molaire du
mélange liquide NH3-H2O deviennent :
H m = xH NH + - x H H O +
H E L L L
(1 )
3 2
|
(II.41)
|
|
S m = xS NH + - x S H O +
S + S L L L E
(1 )
3 2
|
ml
|
(II.42)
|
|
V m = xV NH + - x V H O +
V L L L
(1 )
3 2
|
E
|
(II.43)
|
|
Avec : [ ln( ) (1 )ln(1 ) ]
S = - R x x + - x - x
(II.44)
ml
II.4.2. L'enthalpie, l'entropie et le volume massique de
la solution liquide
La concentration massique est le rapport entre la masse de
l'ammoniac et celle de la solution :
Où : est la masse d'ammoniac de la solution ;
mNH3
m H2 O : est la masse d'eau.
Entre la concentration massique î et celle
molaire x existe la relation approchée :
M H O î
2
x ~ (II.46)
NH 3
M+î
La masse molaire à une solution de concentration molaire
x est :
M = - x M H O + xM N H (II.47)
L (1 )
2 3
Il en résulte donc les expressions pour l'enthalpie,
l'entropie et le volume massique de la solution liquide :
H L
h L m
=
m L
M
|
(II.48)
|
|
S L
s L m
=
m L
M
VL
v L m
m L
=
M
|
(II.49) (II.50)
|
|
II.4.3. Mélange vapeur
La solution dans la phase vapeur à été
considérée comme étant une solution idéale. Cette
hypothèse est basée sur l'absence de l'énergie
d'excès de Gibbs GE. L'enthalpie, l'entropie et le
volume molaires du mélange vapeur de NH3-H2O sont
calculés par :
H m = yH NH + - y H g H
g g (1 ) (II.51)
O
3 2
S m = yS NH + - y S H O +
S mg (II.52)
g g g
(1 )
3 2
V m = yV NH + - y V H O
(II.53)
g g g
(1 )
3 2
Où : [ ln( ) (1 )ln(1 ) ]
S = - R y y + - y - y
(II.54)
mg
II.4.2. L'enthalpie, l'entropie et le volume massique du
mélange vapeur Ont pour expressions :
Hg
h g m
= (II.55)
m g
M
S g
s g m
=
m g
M
|
(II.56)
|
|
V g
v g m
= (II.57)
m g
M
Où Mg est la masse molaire de la
solution dans la phase vapeur.
M = - y M H O + yM N H (II.58)
g (1 )
2 3
II.5. Conditions de saturation
II.5.1. Point de bulle
Le point de bulle est calculé à partir de la
corrélation proposée par EL-Sayed et Tribus
[34] :
i
7 10
? ? ? ? ? ? ? ? ? ?
? ? (II.59)
,
= - ? + ( ) ln
i c m
P
T T
eb c m i ij
C x
C
, ? ? ? ? ? ? ?
i j
= 1 1
? ? ? ? ? ? ?
? ?
P
= ?
4
Avec : 2 (II.60)
T T a x
c m c i
= -? )
H O i
(
,
i=1
? ?
8
( )
b x i
? ?
i
?
P c m P c =
H O
2 1
i
= e ? ?
,
|
(II.61)
|
|
Où Tc,m : est la température critique
du mélange NH3-H2O ;
Pc,m : est la pression
critique du mélange NH3-H2O.
II.5.1. Point de rosée
Le point de rosée est calculé à partir de
la corrélation proposée par EL-Sayed et Tribus
[34] :
i
6 4
? ? ? ?
? ? ? ? ?
,
[ ]
, ? ? ? ?
ln(1.0001 ) ln
j c m
P ?
T T
d c m i ij
= - ? + -
? ? (II.62)
d A x ? ? ?
i j
= 1 1
? ? ? ?
? ?
? ? ?
P
= ?
Les équations (II.59.60.61.62) la pression en [psi] et la
température en [°F].
Les coefficients pour les équations (II.59.60.61.62) sont
indiqués dans le tableau (II.3) [33].
i
|
ai
|
bi
|
Ci
|
di
|
1
|
205.0009
|
0.368105523897
|
153.634521459
|
153.17055346
|
2
|
280.930556
|
- 3.6679548875
|
- 13.0305543892
|
- 11.7705687461
|
3
|
-317.0130009
|
46.6000470809
|
- 1.14845282991
|
- 1.78126355957
|
4
|
263.194444
|
-262.921061996
|
0.550358094447
|
0.647385455059
|
5
|
|
732.99536936
|
- 0.0753450148427
|
-0.0719950751898
|
6
|
|
- 1076.0613489
|
0.0048111668267
|
0.00285423950706
|
7
|
|
797.948078048
|
-0.000120433757177
|
|
8
|
|
- 235.903904222
|
|
|
|
Aij
|
j
|
1
|
2
|
3
|
4
|
i
|
|
|
194.793913463
|
74.236124188
|
9.84103819552
|
0.436843852745
|
2
|
- 74.3508283362
|
-33.2941879809
|
-4.78866918581
|
-0.225416733476
|
3
|
13.0175447367
|
6.1586564117
|
0.789740337141
|
0.03215 10834958
|
4
|
-0.90857587517
|
-0.356752691147
|
0.0238067275502
|
0.00495593933952
|
5
|
-0.00071863574153
|
-0.0251026383533
|
-0.0191664613304
|
-0.0017014253867
|
6
|
0.00195441702983
|
0.00280533349937
|
0.0013899436563
|
0.000116422611616
|
|
C ji
|
i
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
j
|
|
|
-462.460321366
|
421.443122208
|
-248.783804168
|
126.965580728
|
-33.5343446156
|
3.97454953787
|
-0.170806170177
|
2
|
23739.9986309
|
- 14560.354925
|
4807.07241098
|
- 2090.45270574
|
601.878586689
|
- 77.026846469
|
3.48182859299
|
3
|
- 194504.35292
|
53051.4495633
|
13565.1003309
|
1993.17101166
|
-3064.82070658
|
541.19105807
|
- 27.7957587743
|
4
|
639383.528867
|
382763.793582
|
- 466407.780832
|
100706.510396
|
71.7954752052
|
- 1696.60270972
|
113.762064546
|
5
|
- 523748.057636
|
- 3.58358986875E+6
|
2.82708344764E+6
|
- 687388.808612
|
5 1780.666659
|
1713.45942707
|
- 258.750496922
|
6
|
-2.32827147551E+6
|
1.22432653815E+7
|
-8.46971515799E+6
|
2.13241246959E+6
|
-209714.899856
|
4019.01019872
|
311.002585218
|
7
|
7.5624I853499E+6
|
-2.23079700156E+7
|
1.4459588896E+7
|
-3.69919965914E+6
|
405011. 985355
|
- 14844.7928004
|
- 123.917993454
|
8
|
- 9.66829589504E+6
|
2.28966568499E+7
|
-1.42810875331E+7
|
3.68836522546E+6
|
-428310.461566
|
19481.0094551
|
- 123.480627492
|
9
|
5.92208187086E+6
|
- 1.24833248091E+7
|
7.59640359678E+6
|
- 1.97512239296E+6
|
238153.698326
|
-12107.0794501
|
154.375042114
|
10
|
- 1.43240552125E+6
|
2.81331171633E+6
|
- 1.68400264482E+6
|
440201.446068
|
- 54497.0973336
|
2966.92804386
|
-48.5083828701
|
|
Tableau II.3. Les coefficients pour les
équations (II.59.60.61.62) [33].
II.6. Propriétés de transport de la
solution NH3-H2O [35] II.6.1. Densité de la solution liquide
Une relation semi-empirique du calcul de la densité de la
solution liquide à la saturation est la suivante :
2
= - + - + - + +
( 0.00695 1 .304 57.675 ) (0.00547 1 .0625 48.75 50)
(II.63)
T T T T T T
3 2 3 3 2
ñ î î
(0.00128 0.264 14.1 305) 8.3310 0.0206 0.817 990
T T T T T T
3 2
- + + + - + +
î - 5 3 2
Cette relation fournie les valeurs de la densité
exprimées en (Kg.m-3), le domaine de précision
satisfait pour les calculs techniques est :
· Pour les températures : 0< T < 100
[°C] ;
· Pour les concentrations : 3
0.1 < î < 0.5 ? ? kg / m
? ? .
On peut calculer la concentration massique de la solution
NH3-H2O sur la base de la connaissance des densités et des
températures :
5.5965 8.1301 2.5260 0.029266 1.099910 0.047472
+ - + - -
v v T T
2 - 4 2
vT
î = -
kg et T
? ?
|
[ ]
° C
|
(II.64)
|
|
+ + - ? ?
0.017601 1.698410 60501310 /
v T vT v T v m
2 4 2 5 2 2 3
- -
Dans le domaine de validité de l'équation
(II.63), l'erreur moyenne dans le calcul de la concentration est de 0.0012,
mais celle maximale est de 0.004.
Dans la figure (II.1) on représente le diagramme des
variations de la densité de la solution NH3-H2O en fonction de
la concentration et la température.
Figure II.1. La densité de la
solution NH3-H2O liquide.
|
|
|
II.6.2. La viscosité dynamique de la solution
liquide
Pour la viscosité dynamique de la solution liquide, il
est proposé la relation :
ln( ) ln( ) 3 (1 )ln ln( ) (1 ) ln( )
u î u î î u î u
= + - ? + ? + -
L 2 3 L
C C
L
? ?
NH 1 2
NH
3 H O
3 2
+ - ? + ?
3 (1 ) ln ln( )
î î u
2
? ?
C C
L
3 4
H O
2
|
(II.65)
|
|
Les constantes de cette relation ont pour valeurs :
C = 1.6582 C = 7.1638 C = 1.3575
C 4 = 3.6066.
1 2 3
La viscosité dynamique de l'eau liquide est :
u - ?
6 1731
L 5
= ?? - +
10 exp 6.278 5.61610 T
H O
2 T
|
2 ??
?
|
(II.66)
|
|
La viscosité dynamique de l'ammoniac liquide est :
10 exp 0.3180 5.983910
L 5
= T
NH
- ?
6 2214
? ? - +
T
2 ??
?
(II.67)
Dans les relations (II.66) et (II.67), T[k],
u[Pas.s].
La figure (II.2) présente la variation de
viscosité dynamique en fonction de la concentration massique. Le domaine
de validité de l'équation (II.65) est :
· Pour les concentrations : 0.3 < î
<0.9 ;
· Pour les températures : 10< T< 60
°C.
Dans ce domaine, l'erreur moyenne fournie par l'équation
(II.65) est de 6%, alors que celle maximale est de 12%.
Figure II.2. La viscosité dynamique de
la solution NH3-H2O liquide.
II.6.3. La viscosité dynamique de la solution
gazeuse
La solution gazeuse est considérée comme
étant une solution idéale, donc la viscosité de la
solution gazeuse est :
u = - î u H O + îu
NH (II.68)
g g g
(1 )
2 3
Avec :
u H O - T T
g = - + - - 2
31.89 41.4510 8.27210
2 6
2
|
(II.69)
|
|
g 6 2
9.372 38.9910 44.0510 -
Et : u NH - T
= - + -
2 T(II.70)
3
La relations (II.69), pour la vapeur d'eau est valable pour
l'interval de température : 0 °C <T<1 000 °C, et la
relation (II.70) est valable pour l'interval de : -200 °C <T<
1200 °C, ainsi que les valeurs calculées résultes en
micropois. La température est exprimée en k.
II.6.4. La conductivité thermique de la solution
gazeuse
Pour la solution gazeuse composée de la vapeur d'eau
et de l'ammoniac en phase gazeuse, on peut accepter l'hypothèse d'une
solution idéale composée d'un gaz parfait. Dans ces conditions,
la conductivité thermique de la solution gazeuse a l'expression :
ë = - î ë H O +
îë NH (II.71)
g g g
(1 )
2 3
Où ë H O et ë N H
représentent la conductivité thermique de l'eau en état
vapeur et la conductivité
g g
2 2
thermique d'ammoniac gazeuse, respectivement.
g = - + - 8 3
17.53 2.4210 4.310 21.7310
2 4 2 -
ë H O - T - T T
2
|
(II.72)
|
|
Cette relation est valable pour l'intervalle de : 0
°C<T<800 °C.
ë NH - T - T
g = + + -
091 12.8710 2.9310 8.6810
2 4 2
3
|
-
|
8 3
T
|
(II.73)
|
|
Cette relation est valable pour l'intervalle de : 0
°C< T< 1400 °C. Les valeurs calculées pour les deux
équations (II.72.73) résultes en (microcal/s.cm.k). La
température est exprimée en k.
II.6.5. La conductivité thermique de la solution
liquide
Pour la solution liquide, on peut accepter l'hypothèse
d'une solution idéale. Dans ces conditions la conductivité
thermique de la solution liquide a pour expression :
ë = - î ë H O +
îë NH (II.74)
L L L
(1 )
2 3
Avec :
ë H O - T - T
L = - + - 2
0.4743 5.79310 7.22210
3 6
2
|
(II.75)
|
|
La relation (II.75) est valable pour l'intervalle de : 273
k<T<373 k.
ë T T
L -
= - -
-
1.06094741 1.576510 1.228510
3 6
NH 3
|
2
|
(II.76)
|
|
La relation (II.76) est valable pour l'intervalle de : -77
°C<T<100 °C. ë en (w/m.k).
La figure (II.3), représente la variation de la
conductivité thermique de la solution NH3- H2O liquide en
fonction de la concentration et de la température.
Figure II.3. La conductivité thermique
de la solution NH3-H2O liquide.
II.6.6. La chaleur spécifique isobare pour la
solution gazeuse
En adaptant l'hypothèse de la solution idéale
dans la phase gazeuse, composée à son tour d'un gaz parfait, en
peut supposer les relations suivantes pour le calcul de la chaleur
spécifique isobare de la solution gazeuse :
Cp= - î Cp H O + î Cp N H g g
g
(1 )
2 3
La chaleur spécifique isobare pour la vapeur d'eau est
donnée par :
Cp H O T T T
g - 10 3
= + + -
1.79 0.1 110 0.5910 2.0010
- -
3 6 2
2
|
(II.77)
(II.78)
|
|
Cette relation est valable pour l'intervalle de : 10
°C<T<115 °C.
La chaleur spécifique isobare pour l'ammoniac vapeur est
donnée par :
CpNH T T T
g = + + - 3
1.604 1.410 10 6.9610
- - -
3 6 2 10
3
|
(II.79)
|
|
Cette relation est valable pour l'intervalle de : -50
°C<T<50 °C. Les valeurs calculées résultes
en (kj/kg.k), la température est exprimé en k.
II.6.7. La chaleur spécifique isobare pour la
solution liquide La chaleur spécifique isobare de la solution
liquide est donnée par la relation :
L = + + ?
4.186 1 (0.118 0.00208 )
? î T
2
Cp (II.80)
? ?
Où bien on peut le calculée à partir de la
relation :
Cp = - î Cp H O + î Cp NH L L
L
(1 )
2 3
|
(II.8 1)
|
|
Les relations de calcul pour les chaleurs spécifiques
isobares de l'ammoniac et l'eau liquide sont :
L -
= - + - +
6 2
CpNH 9 3
8.049678 0.1301846 464.227410 575.9936 10
T T T
-
3
|
(II.82)
|
|
La relation (II.82) valable pour le domaine : -77.4
°C<T<100 °C.
L 2.8217826 11.8254510 35.04100610
36.00378610 - 9 3
= + - +
- 3 - 6 2
Cp H O T T T
2
(II.83)
Cette relation est valable pour l'intervalle de : 0
°C< T<350 °C. Les valeurs calculées résultes
en (kj/kg.k), la température est exprimé en k.
La figure (II.4), présente la variation de la solution
NH3-H2O liquide en fonction de la concentration et la
température.
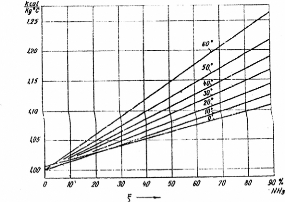
Figure II.4. La chaleur spécifique
isobare de la solution NH3-H2O liquide.
Conclusion
Le mélange ammoniac-eau a été le couple
binaire principal dans les machines frigorifiques à absorption pour
plusieurs années. Beaucoup d'études ont été faites
sur l'équilibre vapeur-liquide et sur les propriétés
thermodynamiques et de transport de ce mélange, y compris des
données P-T-x-y et des propriétés thermiques.
Aussi, une description du modèle
développé, est présentée ; une équation
d'état pour la phase vapeur et une équation décrivant la
non idéalité de la phase liquide. Ces équations
permettront la résolution du problème de l'équilibre
liquide-vapeur, quasiment nécessaire pour le calcul du cycle.
Cependant les écarts à l'idéalité
sont généralement beaucoup plus marqués en phase liquide,
en raison de sa densité, qu'en phase vapeur, et par conséquent il
est d'usage d'adopter l'hypothèse d'un équilibre entre une phase
vapeur assimilée à un mélange de gaz parfait et une phase
liquide non idéale, ce qui permet de simplifier aussi les calculs
mathématiques.
Chapitre III :
Étude thermodynamique et
thermique des différents
organes d'une
installation frigorifique à
absorption.
Introduction
Le calcul de tout cycle frigorifique doit aboutir à la
détermination des différents débits du mélange
ainsi que les conditions opératoires telles que la température,
la pression et la composition, et cela dans chaque partie du système.
Ceci permettra aussi le calcul des enthalpies des différents courants
entrants et sortants de chaque compartiment de l'installation, pour aboutir
finalement à la quantification de l'efficacité et la performance
de la machine.
La conception d'une machine frigorifique à absorption
nécessite bien évidement le dimensionnement de chacun de ces
éléments constitutifs. Ce dimensionnement repose sur la
connaissance de certains paramètres énergétiques
essentiels à savoir les quantités de chaleur à fournir
où à prélever, ainsi que les températures en chaque
point du circuit de la machine, et leurs calculs.
Le calcul du processus cyclique de l'agent de travail dans une
machine frigorifique à absorption se fait à l'aide d'une
simulation numérique sur la base de l'équation fondamentale de la
solution ammoniac-eau présentée ultérieurement (chapitre
II), ainsi que les équations pour le calcul des grandeurs d'états
thermodynamiques déterminées en fonction de l'équation
fondamentale.
Donc, l'exécution rapide des calculs pour
différentes données d'entrées, permet l'optimisation de
ces machines.
II.1. Optimisation et amélioration du
cycle
On doit mettre en évidence trois critères
d'optimisation: la puissance frigorifique maximale, le coefficient de
performance maximal et le rendement éxèrgétique maximal,
et ceci pour un aspect d'optimisation seulement. Dans la pratique, on doit
trouver un optimum économique. Ceci dépend de plusieurs
paramètres externes, par exemple : le coût des capteurs solaires
pour le chauffage d'eau et les coûts d'investissement pour l'ensemble de
l'installation.
En continuité, on présente seulement
l'optimisation du point de vue thermodynamique en prenant le critère du
coefficient de performance.
III.1.1. Amélioration du cycle
Dans le domaine de la théorie et la pratique des
machines à absorption, l'ingénieur et le savant Allemand Edmond
Altenkirch a eu un rôle très important. Ses idées ont eu un
grand succès jusqu'à nos jours. Parmi eux, on note la
récupération interne d'énergie au niveau de l'absorbeur et
le générateur de vapeur, la possibilité de valorifier la
chaleur récupérée au rectificateur
[22].
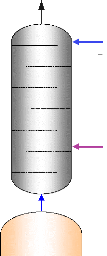
C
B
A
Bouilleur
Figure III.1. Colonne de rectification.
III.1.1.1. Colonne de rectification [21]
La présence de solvant dans la vapeur sortante du
bouilleur réduit considérablement l'efficacité de
l'évaporateur, et il y a donc intérêt à rectifier,
quand c'est nécessaire, le mélange dans une colonne de
rectification qui peut être très simple dans le cas des machines
de petite puissance, ou plus complexe dans le cas de grosses puissances.
La figure (III.1) représente, schématiquement,
une colonne de rectification à plateaux, placée au-dessus d'un
bouilleur et dans laquelle on amène en (A) tout ou partie de la solution
concentrée et en (B) une certaine quantité de fluide
frigorigène pur refluant du condenseur. La vapeur rectifiée sort
en (C).
III.1.1.2. Échangeur solution riche-solution pauvre
(économiseur)
La solution appauvrie à la
concentrationîsp sort relativement chaude du
bouilleur et la solution enrichie à la concentration
îsr sort relativement froide de l'absorbeur.
On améliore beaucoup le rendement en faisant passer les
deux solutions dans un échangeur de chaleur à contre-courant, qui
refroidit la solution pauvre et réchauffe la solution riche.
III.1.1.3. Échangeur vapeur froide-condensat
(échangeur Liq-Vap)
Le sous refroidissement du liquide sortant du condenseur
augmente la production de froid par unité de masse du fluide
frigorigène et permet donc de réduire, à puissance
frigorifique égale, le débit masse du fluide frigorigène.
Par ailleurs, l'absorption se produit à une température nettement
supérieure à la température d'évaporation.
Il s'ensuit que, le plus souvent, on améliore le
rendement on disposant d'un échangeur de chaleur entre la vapeur sortant
de l'évaporateur et le liquide sortant du condenseur.
L'amélioration est cependant nettement inférieure à celle
qui résulte de l'échangeur de chaleur entre solution riche et
solution pauvre [21].
7
Ammoniac vapeur.
8
Echangeur
Liq-Vap.
9
Détendeur
D1
10
(P cd
Condenseur
12
11
Evaporateur
(P0
(Pb
2
3
Echangeur de
solution.
4
Détendeur
D2
5
1
6
(Pab
Figure III.2. Description schématique du
cycle à absorption à simple étage.
Ammoniac liquide.
Ammoniac liquide-vapeur.
|
|
|
Solution pauvre. Solution riche.
|
|
|
|
|
|
|
III.2. Calcul thermique de l'installation
III.2.1. Machine frigorifique à absorption
à simple étage III.2.1.1. Limites de fonctionnement de
l'installation
Les machines frigorifiques à absorption
mono-étagées sont soumises à certaines conditions limites
de fonctionnement et qui, une fois dépassées, ne peuvent
atteindre la température d'évaporation désirée voir
même l'arrêt de fonctionnement.
III.2.1.1.1. Températures limites
La possibilité d'obtention de la température
d'évaporation nécessaire ou non, est dictée par des
températures limites qui se résument en:
· La température moyenne du chauffage
(Tch), qui est dans les conditions idéales de
transfert de chaleur dans le bouilleur, égale à la
température finale de la solution pauvre à la sortie du
bouilleur;
· La température d'entrée du fluide de
refroidissement (l'eau), (Te) dans les conditions de
travail idéales, égale à la température à la
fin d'absorption (T6);
· La température du fluide froid
réalisée (T0), qui dans le cas d'une surface infinie de
transfert de chaleur dans l'évaporateur égale à al
température finale de vaporisation (Tuu).
III.2.1.1.2. Le taux de dégazage
limite
· Facteur de circulation:
Il est défini comme étant le rapport des flux
massiques de la solution riche m? sr , refoulée par la
pompe, et de vapeur d'ammoniac désorber au bouilleur
m?a [21] :
fc
|
m ?
?
= =
sr gsp(III.1)
m ?
?
asrsp
|
|
Où g : la concentration de vapeur d'ammoniac
générée à la sortie du générateur est
supposée aux environs de 99.7 %;
sp: la concentration de la solution pauvre à la sortie du
bouilleur;
sr: la concentration de la solution riche à la sortie de
l'absorbeur;
Ä = sr - sp : taux de dégazage (interval de
neutralisation).
D'après les recommandations, si le facteur de
circulation fc est supérieure à 20, ceci correspond
à un taux de dégazage Äî = (2÷3) %, le
cycle n'est plus possible, car une petite variation de l'une des trois
températures du système pourrait conduire à un taux de
dégazage nul, ce qui rendrait le cycle physiquement impossible et une
machine réelle cesserait de fonctionner avant cela. Il est donc
recommandé de prendre des valeurs pour le taux de dégazage
supérieures à 5 %, néanmoins des valeurs plus importantes
ne sont pas conseillées [19].
III.2.1.2. Modèle de calcul du cycle
thermodynamique
Pour le calcul du cycle thermodynamique (à partir de
la figure (III.2)), les trois températures (TC, Te, T0), sont
souvent des données du projet. La pression de condensation (PC)
et de vaporisation (P0), doivent être choisit en fonction de ces
trois températures.
s Les données du calcul:
+ L'agent de refroidissement des appareils (l'eau): y' La
température à l'entrée Te1;
y' La température à la sortie Te2.
+ L'agent de chauffage (l'eau chaude):
y' La température à l'entrée
Tch1;
y' La température à la sortie Tch2.
+ L'agent intermédiaire à refroidir (l'eau):
y' La température à l'entrée dans
l'évaporateur Tf1; y' La température à la sortie
de l'évaporateur Tf2.
III.2.1.3. Stabilisation des niveaux de
température, de pression et de concentration pour le fonctionnement du
cycle [35], [36]
A cause de la présence d'une quantité d'eau
dans l'agent frigorifique, la vaporisation qui a eu lieu dans
l'évaporateur ne se produit pas à une température
constante mais elle varie entre la température au début et
à la fin de vaporisation. Cet interval de température de
vaporisation dépend de la pureté de l'ammoniac liquide,
c'est-à-d, du degré de la rectification de celle-ci.
· La température à la fin de la
vaporisation, est déterminée en fonction de la température
de la solution à refroidir à la sortie de
l'évaporateur.
T11 =Tf 2 --ATf ,
AT = (2 ÷ 4) °C (III.2)
· La température au début de la vaporisation
pour îg= 99.7 %. T10
=T11 -- AT0 , AT0 =
(4 ÷ 8) °C (III.3)
T11
ÄTf
T
Tf1
Tf2
ÄT0
T10
Aevap
A
Figure III.3. La variation de la
température dans l'évaporateur.
· La pression de vaporisation (P0) en fonction de
(T10) et (îg = 99.7 %), est calculé a
partir de la formule (IV.3) (voir chapitre IV) ;
· La température de condensation sera en fonction de
la température de l'eau de refroidissement à la sortie du
condenseur :
TC = Te2 +
ATC , ATC = (2÷5) °C
(III.4)
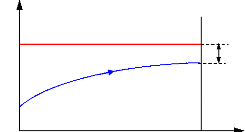
T
TC
ÄTC
Te2
Te1
Acd A
Figure III.4. La variation de la
température dans le condenseur.
· La pression de condensation (PC) en fonction de
(TC) et (îg = 99.7 %), est calculé a
partir de la formule (IV.3) (voir chapitre IV) ;
· La pression dans l'absorbeur est déterminée
en fonction de la pression dans l'évaporateur et des pertes de pression
sur le trajet entre les deux appareils :
Pab = P0 #177;
AP0 , AP0 = (0.2 ÷ 0.49)
bar (III.5)
· La température de la solution riche à la
sortie de l'absorbeur, est déterminée en fonction de la
température de l'agent de refroidissement à l'entrée de
l'absorbeur :
T6 = Te1 #177;ATe1 ,
ATe1 = (4÷12) °C (III.6)
· La température de la solution pauvre à la
sortie du bouilleur, est déterminée en fonction de la
température d'eau chaude à la sortie du bouilleur :
T3 =Tch1 #177; ATch1 , ATch
1 = (4÷1 2) °C (III.7)
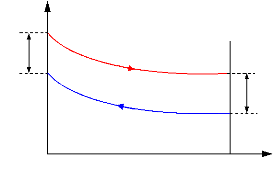
A
Ab
T
Tch1
ÄTch1
Tch2
ÄTch2
T2
T3
Figure III.5. La variation de la
température dans le bouilleur.
· La température de la solution riche à la
l'entrée du bouilleur, est déterminée en fonction de la
température d'entrée dans l'économiseur comme suit :
T2 = T1 #177; ATec1 , ATec1
= (5÷ 10) °C (III.8)
· La concentration de la solution riche à la sortie
de l'absorbeur est déterminée à l'aide de la formule (IV.1
1) (voir chapitre IV) :
4 sr = f (Pab , T6)
(III.9)
s La concentration de la solution pauvre à la sortie du
bouilleur:
? sp f(P b ,T
3 ) calculée à partir de l'équation (IV.1
1) (voir chapitre IV) (III.10)
s La vérification de l'interval de la neutralisation des
gaz:
'~ ? sr ? sp t 5 % (III.11)
· Le facteur de circulationfc:
? ?
~~
g sp
fc (III.12)
(III.13)
'~ ?
· La température de sortie dans
l'économiseur: fc
T T T T C
4 3 , (5 10)
- A '~ ~ °
( 1) ec ec
fc 11
~~ ec
· La température à l'entrée et
à la sortie du sous-refroidisseur:
T 9 T C ~~ '~ T
SL , AT SL (10~20) q C (III.14)
T 12 T 11 ~~ '~ T
SV (III.15)
1 ( )
Cp T
'~ A
T T
La 9 (III.16)
SV SL
1 Cp T
sr Va ( )
11
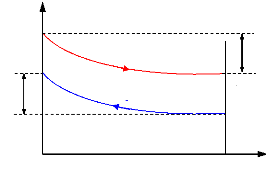
Asr
A
T
T8
ÄTSL
ÄTSV
T12
NH3 liquide
NH3 vapeur
T9
T11
Figure III.6. La variation de la
température dans le sous-refroidisseur d'ammoniac.
·
·
|
III.2.1.4. Le calcul thermique
L'enthalpie de la solution riche à la sortie de
l'absorbeur :
h6 = f ( sr,
T6, Pab)
L'enthalpie de la solution riche à la sortie de la pompe
:
h1 = f(
sr,T1, PC)
|
(III.1 7)
(III.18)
|
|
T1=f(PC ,îsr), calculée
à partir de l'équation (IV.6), (voir chapitre IV).
|
|
·
|
L'enthalpie de la solution pauvre à la sortie du
bouilleur :
|
|
|
h3 = f( sp
,T3, PC)
|
(III.19)
|
·
|
L'enthalpie de la solution riche à la sortie de
l'économiseur :
|
|
|
h2 = f ( sr, T2 ,
PC)
|
(III.20)
|
·
|
L'enthalpie de la solution pauvre à la sortie de
l'économiseur :
|
|
|
h4 = f (
sr,T4, Pab)
|
(III.21)
|
·
|
L'enthalpie de la solution pauvre à l'entrée de
l'absorbeur :
|
|
|
h5 = h4
|
(III.22)
|
·
|
L'enthalpie de la vapeur à la sortie du bouilleur :
|
|
|
h7 = f (T7 , P7)
|
(III.23)
|
|
T7 = T2
+AT7, AT7 = (4+6) °C
|
|
|
· L'enthalpie de l'ammoniac liquide saturé à
la sortie du condenseur :
h8 = f (TC , PC)
(III.24)
· L'enthalpie de l'ammoniac liquide à
l'entrée et à la sortie du sous-refroidisseur :
h11= f (T1 1 ,P0
) (III.25)
h12 = h11 + CpVa(T11)
ATSV (III.26)
h9 = h8 -- CpLa
(T8)ATSL (III.27)
h10 = h9 (III.28)
·
·
|
III.2.1.4.1. Le calcul des flux
échangés
Le flux massique échangé dans le bouilleur :
qb = (h7 -- h3)+
fc(h3-- h2)
Le flux massique échangé dans l'absorbeur :
|
(III.29)
|
|
qab = fc(h6
-- h5)+ (h5 --
h12)
|
(III.30)
|
·
|
Le flux massique échangé dans l'évaporateur
:
|
|
|
q0 = (h11 --h10)
|
(III.3 1)
|
·
|
Le flux massique échangé dans le condenseur :
|
|
|
qcd = (h7 -- h8)
|
(III.32)
|
·
|
Le flux massique échangé dans le
sous-refroidisseur :
|
|
|
qsrf = (h8 -- h9)
|
(III.33)
|
|
·
·
|
Le flux massique échangé dans l'économiseur
: qec = fc(h2 -- h1)
La puissance spécifique de la pompe de solution riche :
Wp = fc(h1 -- h6)
|
(III.34)
(III.35)
|
·
|
Le débit massique de la vapeur d'ammoniac qui circule
dans l'installation :
|
|
|
m. a=Ççe0
q0
|
(III.36)
|
·
|
Le flux de chaleur au niveau du condenseur :
|
|
|
Ççecd = m?aqcd
|
(III.37)
|
·
|
Le flux de chaleur au niveau du bouilleur :
|
|
|
Ççeb =
m?aqb
|
(III.38)
|
·
|
Le flux de chaleur au niveau de l'absorbeur :
|
|
|
Ççeab = m?aqab
|
(III.39)
|
·
|
Le flux de chaleur au niveau du sous-refroidisseur :
|
|
|
Ççesrf = m?aqsrf
|
(III.40)
|
·
|
Le flux de chaleur au niveau de l'économiseur :
|
|
|
Ççeec = ma q ec
|
(III.41)
|
|
· Les débits massiques en circulation :
y' Le débit massique de la solution riche :
m ? sr = m ? a fc
(III.42)
y' Le débit massique de la solution pauvre :
m ? sp = m ? a ( fc
_ 1) (III.43)
y' Le débit massique de l'eau de refroidissement au
condenseur :
q:;
m ? cd
? (III.44)
e Cp T T
e ec ec
( 2 1 )
_
y' Le débit massique de l'eau chaude à
l'entrée du bouilleur :
q:;
m ? b
= (III.45)
ch Cp T T
ch ch ch
( 1 2 )
_
y' Le débit massique de l'eau froide à la sortie
de l'évaporateur :
m ef ( 1 2 )
? 0 (III.46)
Cp e T T
q:;
f f
_
· Le bilan thermique:
Pour vérifier le bilan thermique de l'installation on
calcule l'erreur, celle ci doit être inférieure à (5 %):
( ) ( 0 ) 5 %
q:; q:; q:; q:;
? _ ? ?
ab cd b w P
erreur = < (III.47)
( )
q:; q:;
+
ab cd
III.2.1.4.2. Le coefficient de performance de
l'installation
()idéale COP
|
q:; 0
?
q:; b
|
(III.48)
|
()réel COP
|
|
q:; 0
|
(III.49)
|
|
q:; +
b W P
|
|
III.2.2. Machine frigorifique à absorption
à deux étages:
Dans le cas des températures très basses du
froid sollicité (T0), ou dans le cas des températures de
la source chaude (Tch) relativement hautes, la machine
frigorifique à absorption doit être réalisée en deux
étages.
Comme il est montré dans la figure (III.7), cette
machine à deux étages, comprend un condenseur, deux bouilleurs
(HP, BP), deux absorbeurs (HP, BP), un échangeur
à BP, un échangeur à pression
intermédiaire (Pi), un évaporateur, deux pompes de
solution et trois valves d'expansion.
Les calculs de ce genre de machines n'introduit aucun
principe nouveau par rapport à la machine à simple
étage.
III.2.2.1. Description du cycle
Un cycle classique d'une machine à absorption
utilisant le couple NH3-H2O à deux étages, fonctionne
avec trois pressions : la pression de condensation (PC), la pression
intermédiaire (Pi) et la pression de vaporisation
(P0), dans lesquelles le choix des trois températures, ne peut
pas être fait arbitrairement.
Pour qu'une telle machine puisse fonctionner, la
concentration en ammoniac de la solution pauvre issue de chaque bouilleur doit
être inférieure à la concentration de la solution riche
quittant l'absorbeur de chaque étage et doit vérifier
l'inégalité :

14
19
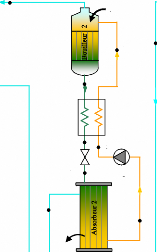
(P b2
10
11
Echangeur de
solution 2.
12
Détendeur
D2
13
9
Pompe 2
7
8
(Pab2
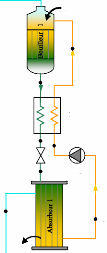
(P b1
2
3
Echangeur de
solution 1.
4
Détendeur
D1
5
1
Pompe 1
6
(Pab1
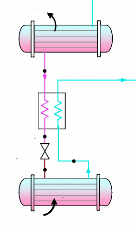
Condenseur
15
Echangeur
Liq-Vap.
16
Détendeur
D3
17
18
Evaporateur
(P0
(P cd

7
19
|
|
Ammoniac vapeur.
|
|
|
|
|
|
|
Solution pauvre. Solution riche.
|
|
|
|
Ammoniac liquide. Ammoniac liquide-vapeur.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Figure III.7. Représentation
schématique d'une machine à absorption à deux
étages.
III.3. Étude et calcul du
matériel
Les éléments de machine frigorifique à
absorption sont des échangeurs thermiques à l'exception de la
pompe.
III.3.1. Calcul des échangeurs
Dans tout calcul d'échangeur de chaleur, le but est
d'obtenir la récupération d'une certaine quantité de
chaleur dans des conditions économiques optimales qui sont un compromis
entre les frais d'investissement et les frais opératoires.
La dualité transfert de chaleur - perte de charge
domine tout le problème. En effet, les résistances au transfert
matérialisées par des films, sont d'autant plus faibles que la
vitesse de circulation et en conséquence, le nombre de Reynolds est
élevé, ce qui entraîne une réduction de la surface
d'échange à prévoir. En contre partie,
l'élévation du nombre de Reynolds provoque une augmentation de la
perte de charge qui conduit à utiliser une pompe à pression de
refoulement supérieure, donc exigeant plus d'énergie, de sorte
que ce que l'on à gagné sur la surface de l'appareil est
contrebalancé par l'accroissement des frais opératoires.
Une autre incidence indirecte de la vitesse de circulation
est l'encrassement des tubes qui se traduit par deux résistances
supplémentaires au transfert. Les dépôts sur les tubes
réduisent la quantité de chaleur transférée sur une
surface donnée.
Le calcul de tout échangeur comportera donc deux
études parallèles [37] :
- Transfert de chaleur; - Perte de charge.
De ces conditions générales, il ressort que le
calcul d'un échangeur est un problème complexe, d'autant plus
que, bien souvent, l'échangeur fait partie d'un ensemble où
chaque unité ne peut être isolement traitée.
III.3.2. Les méthodes de dimensionnement des
échangeurs
Pour le calcul des échangeurs de chaleurs, on dispose
de deux méthodes, méthode de NUT et de
DTLM [38], ces deux méthodes permettent un
dimensionnement convenable et concordant.
III.3.2.1. Méthode de NUT (nombre d'unité
de transfert) [39]
Cette méthode, plus structurée, repose sur la
définition du flux thermique maximum d'une part et de
l'efficacité de l'échangeur d'autre part.
Le flux maximal s'exprime par:
? max =m ? min Cp
min(Tch1--Tf1)=C min
(Tch1--Tf1) (III.50)
Les indices ch et f réservés
respectivement au fluide chaud et froid, alors que 1 et 2
correspondant aux conditions d'entrée et de sortie.
La notion d'efficacité est définie par le rapport
entre le flux effectivement transmis, au flux maximum transférable et
s'écrit:
( ) ( )
T T m Cp T T
ch ch f f f f
1 2 2 1
=
q: ? ?
max min min 1 1 min min 1 1
m Cp T T m Cp T T
( ) ( )
-- --
ch f ch f
E
(III.5 1)

m Cp
? ch ch
Cette efficacité prendra plusieurs formes
différentes, selon les cas:
s Pour:m? min Cp min =
m?chCpch, efficacité relative côté fluide
chaud:
Ech
|
ch --
T T
1 2
ch
|
(III.52)
|
|
|
s Pour: m? min Cp min = m?fCp
f , efficacité relative côté fluide
froid:
E f
|
|
T T
--
f f
2 1
|
(III.53)
|
|
|
Cette notion d'efficacité est particulièrement
intéressante puisqu'elle permet d'accéder directement à la
puissance échangée selon l'équation :
q: = Em ? min Cp min (Tch1
--Tf1) (III.54)
Formule qui présente l'avantage de ne faire intervenir
que les températures d'entrée des fluides. On appelle nombre
d'unité de transfert, NUTch coté fluide chaud
et NUTf côté fluide froid:
NUT ch
NUT f
|
UA m Cp
? ch ch
UA m Cp
? f f
|
(III.5 5)
(III.56)
|
|
Le nombre d'unité de transfert relatif au fluide qui
à le plus petit débit thermique unitaire possible m ?
min Cp min est habituellement désigné par
NUT :
NUT
|
UA m Cp
? min min
|
(III.57)
|
|
Le rapport des débits de capacité thermique est
noté:
Cr
m Cp
m Cp
? max max
? min min (III.58)
Le calcul des efficacités dans le cas du co-courant et
contre courant se réduit aux expressions :
· Co-courant :

-
NUT
E
1 - e
Cr
(III.59)
1+
· Contre courant :
E
Cr
e-NUT (1-Cr) -1
e-NUT (1-Cr) 1
- 1
(III.60)
La figure (III.8) [40] , présente la
variation de l'efficacité E en fonction du NUT pour
différentes valeurs de Cr et pour différentes
configurations d'échangeurs. La figure (III.1 0.C), présente
l'évolution de l'efficacité pour un échangeur à une
calandre et un multiple de passes de tube. Dans ce cas, l'expression de
E est donnée par :

2
E
2
(III.6 1)
r
- NUT 1+C
1 + e
1 + C
+ 1
r +Cr
r
2
1 - e
- NUT 1+Cr
2
(1+Cr )
La figure (III.9), représente l'allure
générale des courbes E = f(NUT) dans le cas où
Cr= 0. 75, pour différentes configurations
d'échangeurs. On observe en particulier la hiérarchie très
nette qui s'établit entre les différents modèles
d'échangeurs dès que l'on atteint des NUT de l'ordre
de 1.5. Pour NUT=4 par exemple, l'efficacité
s'étale de 0.55 (co-courant, le moins performant) à
0.8 (contre courant, le meilleur). Avec des NUT faibles le sens
de circulation des fluides n'a plus beaucoup d'importance
[39].
Figure III.8. Evolution de l'efficacité
en fonction du NUT et pour différentes valeurs de
Cr dans les cas:
(a) : d'un échangeur co-courant;
(b) : d'un échangeur contre courant;
(c) : d'un échangeur à une calandre et 2 passes
côté tube.
Figure III.9. Evolution de l'efficacité
avec le NUT (Cr = 0.75), pour différentes configurations
d'échangeurs:
(1) : contre courant;
(2) : courant croisé, fluides non brassés;
(3) : courant croisé, fluides à
Cmin brassés;
(4) : une calandre et 2 passes côté calandre;
(5) : co-courant.
ço ? ? ?
T T
A ?
T 1
ln ? ?
? A ?
T2
(III. 63 )
Donc, le calcul thermique d'un échangeur par la
méthode de NUT revient à évaluer
[39]: - Le coefficient d'échange global;
- Le rapport Cr;
- Le nombre adimensionnel NUT;
- L'efficacité de l'échangeur E;
- Le flux de chaleur échangé.
L'annexe (1), regroupe les corrélations utilisées
pour déterminer l'efficacité de l'échangeur par la
méthode NUT.
III.3.2.2. méthode de différence
logarithmique moyenne DTLM
Quel que soit le type d'appareil utilisé, si on ne
prend en considération que les conditions d'entrée et de sortie
des deux fluides, il est possible d'établir le bilan global de
l'appareil en écrivant que la quantité de chaleur ö
perdue par le fluide chaud est égale à celle prise par le
fluide froid, on négligeant les pertes thermiques:
ço=UAATm (III.62)
Avec U: coefficient d'échange global
(W/m2K);
A : surface d'échange associé à
U (m2);
ÄTm : différence de température
moyenne (K).
L'évolution de la température de chaque appareil
à partir des températures d'entrées Tch1, Tf1
conditionne directement la valeur moyenne de la température
ÄTm. Elle est en fonction:
· De la nature et des débits respectifs des deux
fluides;
· Du sens d'écoulement des fluides.
a- contre-courant pur:
L'écoulement à contre-courant pur n'est
réalisé que dans les échangeurs double-tube
[37], figure (III.10). Pour l'ensemble de l'appareil, la
quantité de chaleur échangée s'écrit:
On notera le terme:
|
L -- L
T T DTLM
1 2 =
? L ?
T 1
ln ? ?
? L ?
T2
|
(III.64)
|
DTLM : différence de température
logarithmique moyenne entre l'entrée et la sortie de
l'échangeur.
Donc la quantité de chaleur échangée, se met
ainsi sous la forme simple:
ço=UADTLM (III.65)
Avec : Ä T1= Tch1-Tf2 (extrémité
chaude) ÄT2=Tch2-Tf1 (extrémité froide)
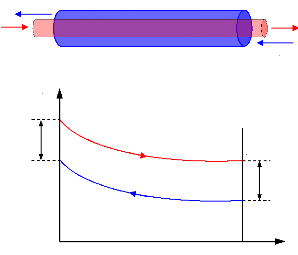
Tf2
Tch2
Tch1
T
Tch1
Tch2
Tf2
Tf1
ÄT1
ÄT2
A
Tf1
Figure III.10. Evolution des températures
d'un échangeur à contre-courant.
b- Courants parallèles:
Si dans un appareil à double-tube, on inverse le sens de
circulation de l'un des fluides en permutant l'entrée et la sortie,
l'échange s'effectue alors à courants parallèles, figure
(III.11).
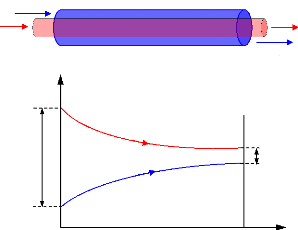
T
Tch1
Tch2
Tf2
Tf1
ÄT1
ÄT2
A
Tf1
Tch1
Tch2
Tf2
Figure III.11. Evolution des températures
d'un échangeur à courants parallèles.
On devra prendre:
Ä T1= Tch1-Tf1 (extrémité chaude)
ÄT2=Tch2-Tf2 (extrémité froide)
Ceci ne change en rien l'expression de DTLM. Dans
beaucoup de cas, où les écoulements sont complexes tels que les
écoulements croisés, l'expression du flux de chaleur devient:
ço=fUADTLM (III.66)
Où f est un facteur de correction
inférieur à 1 qui traduit l'efficacité de l'appareil par
rapport au contre-courant. Les abaques qui fournissent les valeurs du facteur
de correction f sont basés sur deux paramètres
notés P et R donnés par les relations
suivantes [40] :
P
T T
--
f f
2 1
(III.67)
T T
--
ch f
1 1
|
R
|
T T
--
ch ch
1 2
|
(III.68)
|
|
T T
--
f f
2 1
|
Quelques cas particuliers sont présentés dans
l'annexe (2).
L'estimation de la différence de température
logarithmique moyenne DTLM à partir de Ä T1 et
Ä T2 s'effectue généralement sur le diagramme
présenté à la figure (III.12) [37].

Figure III.12. Détermination de la
DTLM.
Cette méthode de calcul revient à dire que la
puissance thermique échangée est proportionnelle à la
surface d'échange et à la différence de température
logarithmique moyenne. Le coefficient de proportionnalité étant
le coefficient d'échange global. C'est elle que nous utiliserons
exclusivement dans la suite.
III.4. Dimensionnement des principaux appareils III.4.1.
Dimensionnement du condenseur
Le condenseur d'une machine frigorifique est un
échangeur de chaleur dont le rôle et d'évacuer la chaleur
soutirée au milieu à refroidir en opérant avec changement
de phase, il assure aussi le passage à l'état liquide, des
vapeurs frigorigènes issues de la compression thermique grâce
à un agent de refroidissement.
On distingue deux types de condenseurs : les condenseurs
horizontaux et les condenseurs verticaux [20]. Le condenseur
choisi est un condenseur multitubulaire horizontal, ou le frigorigène
circule dans la calandre et l'eau dans les tubes figure (III.13).
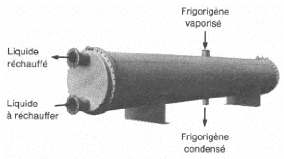
Figure III.13. Condenseur multitubulaire (3
passages) (doc. Helpman).
III.4.1.1. Méthodologie de calcul du condenseur
- Données (caractéristiques) du
condenseur:
> Puissance thermique : ç°cd;
> Température d'entrée et de sortie de l'eau de
refroidissement: Tec1 et Tec2; >
Température de condensation: TC;
> Tubes en acier de diamètre : d0/di ;
> Débit de masse de l'eau de refroidissement:
m?e ;
> Débit de masse de la vapeur d'ammoniac:
m?a.
Pour le calcul, on a choisi une méthode pour la
condensation d'une vapeur pure refroidie par eau [37].
III.4.1.2. Calcul de la DTLM
|
DTLM =
|
T T
-
ec ec
1 2
|
|
(III.69)
|
|
? ? ?
T T
C ec 2
ln ? ?
L ? ?
T T
C ec 1
|
III.4.1.3. Température moyenne T
+
T T
ec ec
1 2
= (III.70)
me2
On détermine les caractéristiques de l'eau à
Tme : p, ), Cp et p.
III.4.1.4. Choix de l'appareil et calcul du coefficient
de transfert sale Us
Estimation du coefficient de transfert
saleUàS , Annexe (3). Estimation
de la surface d'échange:
|
à
A
|
P cd
= (III.7 1)
U DTLM
à
S
|
Estimation de la surface d'échange d'un tube par
calandre:
a=2rd0l (III.72)
Avec l: longueur du tube.
Estimation du nombre de tubes par calandre:
à
N t
à A(III.73)
Où nc : nombre de calandre.
Choix du pas Pt (pas carré normal), la
disposition des tubes (nombres de passage par calandre) et l'espacement B
entre chicanes.
Choix de l'appareil (nc = 1), où des
appareils en série (voir annexe (4) : disposition des
tubes), donnant Nt le plus voisin possible
deNà t , avec un nombre de passes,
côté tubes nt: 2, 4,
6, et 8 par calandre. Alors, en obtient à partir du
tableau annexe (4): le diamètre d0; le pas des tubes Pt
; le diamètre intérieur de la calandre
Dcl; le nombre de passes par calandre et le nombre de tubes
total Nt. D'ou, le coefficient de transfert sale est
[37] :
|
à
U U
=
S S
|
à
N
N
|
t
t
|
(III.74)
|
III.4.1.5. Calcul du coefficient de transfert propre
Up
a- Côté tube:
1. Section par passage:
2
N d
?
a tb
t i (III.75)
nt
4
2. Vitesse massique:

3. Vitesse linéaire:
|
V tb
|
G tb
3.610 ( )
6 P T
e me
|
(III.77)
|
4. Calcul du coefficient de film interne hi:
On peut le calculer soit par la lecture directement sur la
figure Annexe (5), ou bien à partir de l'équation
simplifiée de Eagle et Ferguson (1930) [37], dans un
intervalle de température de (0 ~ 100 °C):
h i
0.2
900(1.352 0.02 ) tb 0.8
+ T V
d i
(III.7 8)
Où T: est la température moyenne de l'eau
en °C; Vtb: sa vitesse en (m/s);
di : le diamètre interne du tube en
mètre.
Cette formule est traduite graphiquement à la figure
annexe (5). 5. Calcul du coefficient de film externe hio
:
On choisi, en référence la surface
extérieure du tube, ce qui amène à corriger hi en
multipliant par le rapport (di/d0):
|
h h
=
i i
0
|
d d
|
i
0
|
(III.79)
|
b- Côté calandre:
1. Section par passage: On a choisi un pas
carré normal (voir Annexe (4)):
D
a P d B
= --
Cl
Cl t
( 0 )
P t
2. Vitesse massique:
|
(III.80)
|
|
|
G Cl
|
ma
aCl
|
(III.81)
|
|
3. Débit de condensation: On
définit un débit de condensation GH par unité de
longueur de tube:

Pour tenir compte du ruissellement du condensat de la vapeur
NH3 d'un tube sur un autre, on définit GH par la
formule suivante [37] :

GH
ma
lN t 0.66
(III.83)
|
4. Calcul du coefficient de film de condensation
hc : Pour le calcul du h on suit
l'algorithme suivant: - On donne une valeur à h ;
- On calcule la température de la paroi:
h
T T T T
= ? ?
i 0
p C C me
( )
h h
?
i
0
- On calcule : À.NH 3 ,PNH3
et PNH3 à TP;
- On calcule le coefficient de transfert convectif externe
par:
|
(III.84)
|
0.33 0.33
?
h O U
? \ ? \
3 2
1.5 NH NH H
g G
4
3 3 (III.85)
= ? ? ? ?
2
? ? ? ?
P P
NH NH
3 3
h h
i
0
- On calcule l'erreur entre h calculée et
h imposé jusqu'à convergence. Alors, le coefficient de
transfert propre est:
U= (III.86)
+
i
0
P h h
III.4.1.6. Calcul de la résistance d'encrassement
Rs
|
R S
|
U U
--
P S
=(III.87) U U
P S
|
Qui doit converger à la résistance admissible
(1~2) pour le couple NH3-H2O. III.4.1.7. Calcul des
pertes de charges [37]
a- Côté tube:
1. Nombre de Reynolds:
Re tb
d G
i tb
= (III.88)
.U T
e me
( )
2. Le coefficient de friction frtb:
Lecture sur Annexe (7).
3. Perte de charge:
|
n G f l
2 ? ? 2
? ? ? ? ?
t tb tb
15 2 ( / )
P Kg cm
tb 1.27110 ( )
p T d
e me i
L ?
b- Côté calandre: 1. Nombre de
Reynolds:
Re eq Cl
D G
?
Cl .UNH3
|
(III.89)
(III.90)
|
4 ( )
P 2
t -- d pas carré
0
2rd
0
(III.9 1)
D=
eq
Avec:
2. Le coefficient de friction frCl:
Lecture sur Annexe (7).
3. Perte de charge:
KERN tend à confondre les deux vitesses massiques
longitudinale et transversale (GLg GTv) et propose:
n fr G 2
c Cl Cl
? =
P Cl
( 1) ( / )
N D
+
C Cl Kg cm 2
(III.92)
2.542 10 d D
0 eq
15
Avec Nc : nombre de chicanes transversales et
nc = 1.
On vérifie que les valeurs de ces pertes de charges
ÄPtb et ÄPCl , ne
dépassent pas les normes imposées, de 1
(Kg/cm2) dans le cas d'une circulation forcée
et de la hauteur hydrostatique dans le cas d'une condensation par
gravité. Si les pertes de charge calculées sont
supérieures aux normes, on devra modifier le choix initial.
On devra donc, calculer une surface propre d'échange
Ap qui associe à un coefficient de transfert global
Up pour un échangeur neuf. Mais au bout de certain
temps de fonctionnement on observe des dépôts d'encrassement qui
engendrent la diminution du coefficient de transfert global
Up.
III.4.2. Dimensionnement de
l'évaporateur
Il constitue l'élément principal de toute
l'installation frigorifique par le biais duquel on produit du froid, il doit
donc bénéficier d'une étude plus minutieuse
[20].
L'évaporateur utilisé est de type multitubulaire
horizontal à refroidissement d'eau où saumure. Cette
dernière circule dans la calandre et l'ammoniac détendu circule
à l'intérieure des tubes, figure (III.14).

Liquide refroidi
Frigorigène vaporisé
Frigorigène détendu
Liquide à refroidir
Figure III.14. Evaporateur multitubulaire
noyé avec dôme séparateur (3 passages) (doc.
Helpman)).
III.4.2.1. Méthodologie de calcul de
l'évaporateur - Données
(caractéristiques) de l'évaporateur:
> Puissance thermique : ço0;
> Température d'entrée et de sortie de l'eau de
refroidissement: Tf1et Tf2; > Température de
vaporisation: T0;
> Tubes en acier de diamètre : d0/di ;
> Débit de masse de la vapeur d'ammoniac:
m?a ;
> Débit de masse de l'eau de refroidissement :
m? ef .
Pour le calcul de l'évaporateur on a choisi la
méthode de KERN. Il a observé que, dans les calandres
normalisées laissant un passage libre d'une hauteur égale
à environ de 25 % du diamètre intérieur de la calandre,
(GLg GTv). Il se limite ainsi à évaluer le Reynolds
à partir de la seule vitesse massique transversale et du diamètre
équivalent [37].
III.4.2.2. Calcul de la DTLM
DTLM =
? ? ?
T T
0 2
f
ln
? -- ?
? ?
T T
0 1
f
(III.93)
T T
_
1 2
f f
III.4.2.3. Température moyenne
|
Tmf
|
T T
+
f f
1 2
=(III.94) 2
|
III.4.2.4. Choix de l'appareil et calcul du coefficient
de transfert sale Us On procède de la même manière
que pour le dimensionnement du condenseur. III.4.2.5. Calcul du
coefficient de transfert propre Up
Pour calculer le coefficient de transfert propre il faut
définir les caractéristiques suivantes: a-
Côté tube (fluide froid):
2
1. Section par passage:
N d
2r
a tb
t i(III.95)
nt
4
2. Vitesse massique:
3. Caractéristiques du fluide
frigorigène:
Calcul du:
|
À. , P NH et P NH
à T 0 ;
NH 3 3 3
|
|
4. Nombre de Reynolds:
Re i tb
d G
-
tb
PNH3
5. Calcul du coefficient d'évaporation de
l'ammoniac hi:
|
(III.97)
|
Le coefficient d'évaporation de l'ammoniac que nous allons
utiliser est donné par la corrélation de KRUJILIN
[41]:
hi =
4.2(1+0.007T0)q0.7 (III.98)
Le flux unitaire q conforme aux normes pour les
évaporateurs refroidisseurs de liquide: q =[1500 ~ 2500]
(Kcal/hm2°C-, on pose q = 1900
(Kcal/hm2°C).
b- Côté calandre:
1. Section par passage: aCl même
équation (III.80).
2. Vitesse massique:

3. Caractéristiques de l'eau:
On détermine les caractéristiques de l'eau:
Pef, Cpef , O ef et Pef à
Tmf.
4. Nombre de Reynolds:
Re eq Cl
D G
= (III.100)
Cl
Pef
Avec: D eq = même équation
(III.9 1).
5. Calcul du coefficient de transfert convectif
extérieure h0:
O ef ef
Nu
h ? (III.101)
d
0
i
Le nombre de Nuselt est [41] :
Nuef 0.023Re Cl Pr
Cl (1 6 10 Re )
= -
0.8 0.4 5 1.8
- - (III.102)
Le nombre de Prandtl:
Cp P
Pr =
Cl
(III.103)
ef ef
À. ef
Donc, le coefficient de transfert propre est: h h
0 c
U = (III.104)
P h h
+
0 c
III.4.2.6. Calcul de la résistance d'encrassement
Rs Même équation (III.87).
III.4.2.7. Calcul des pertes de charges
a- Côté tube:
1. Le coefficient de friction frtb:
Lecture sur Annexe (7).
2. Perte de charge:
|
n G fr l
2 r ?
? = ? ? ?
t tb tb 2
P 15 2 ( / )
Kg cm
tb 1.27110 p d ?
NH i tb
?J
3
|
(III.105)
|
( ?
P
Avec : 3
? _ NH
tb ? ?
? ?
P NH P
3
0.14
: facteur de correction pour chauffage ou
refroidissement.
La température de la paroi T p est
donnée par [37]:
h i
T T
= -
p 0 h h
+
0 i
( )
T T
-
0 mf
(III.106)
b- Côté calandre:
1. Le coefficient de friction frCl:
Lecture sur Annexe (7).
2. Perte de charge:
n fr G 2
Cl Cl Cl
? =
C Cl Kg cm 2
P Cl 1.271 1015 P D Çb
ef eq Cl
(III.107)
( 1) ( / )
N D
?
|
Avec:
|
? Cl
|
0.14
? ?
?
= ef
i ?
? ?
? ef TP
( )
|
(III.108)
|
III.4.3. Dimensionnement du bouilleur
Le bouilleur est un échangeur de chaleur dans lequel
s'effectue la séparation des vapeurs d'ammoniac de la solution binaire,
pour que cette réaction ait lieu, nous fournissons au bouilleur de
l'énergie, par l'intermédiaire de l'eau chaude provenant des
capteurs solaires ou bien des source chaudes [20].
Les bouilleurs existant peuvent notablement différer au
point de vue construction et selon la disposition des fluides l'un par rapport
à l'autre. Celui adopté est de type calandre et tube, l'eau
chauffante circule à l'intérieur de la calandre par contre le
mélange binaire circule à l'intérieur des tubes.
III.4.3.1. Méthodologie de calcul du bouilleur
- Données (caractéristiques) du
bouilleur:
> Puissance thermique : ?b ;
> Température d'entrée et de sortie de l'eau
chaude : Tch1 et Tch2 ; > Débit massique
de la solution riche m? sr ;
> Débit massique des vapeurs NH3 : m?
a ;
> Débit massique d'eau chaude nécessaire :
m? ch
> Température d'entrée de la solution riche :
T2 ;
> Température de sortie de la solution pauvre : T3
; > Tubes en acier de diamètre : d0/di ;
> Conductivité thermique des tubes : ?tb ;
> Les tubes sont disposés en carré :
x = y = 1.5 d 0
> Les Caractéristiques physiques de la solution pauvre
(NH3-H2O) U sp , Cp sp , )
sp et P sp à la température moyenne
Tspm ;
> Les Caractéristiques physiques de l'eau P ch
, Cp ch , O ch et P ch
à la température moyenne Tchm ;
III.4.3.2. Calcul du coefficient de transfert global
U

? 1
(III.109)
? ? ? l
1 ti 1
d e
0
U = ? ? ? ? ? ?
?
? ? ) j
h d ) h
0 i i i
Où h0 : coefficient de transfert de chaleur
extérieur côté eau;
hi : coefficient de transfert de chaleur
intérieur côté solution binaire;
?
: somme de toutes les résistances thermiques. e ti O i
III.4.3.2.1. Calcul de h0 côté eau [41]
Nu O ech
h 0 ? (III.110)
D
eq
1. Le diamètre équivalent est donné
par :
4A
m
-
D eq
(III.111)
0
2Vd
2
2V d
A xy surface mouillée en m
= - 0 ( 2 ) (III.112)
(III.113)
m 4
Donc : (9 ) 0
D 2V
- d
=
eq 2V
2. La vitesse de l'eau chaude :

4
m ch
?
V ech
(III.114)
P 2V D 2
ech eq
3. Nombre de Reynolds:
V D P
Re
ech eq ech ? (III.115)
P ech
4. Nombre de Prandtl:
|
Cp P
Prech ch = O ech
|
(III.116)
|
5. Nombre de Nusselt:
Nu 0.023Re Pr
0.8 0.4 (III.117)
III.4.3.2.2. Calcul de hi côté solution
binaire
Nu À sr
h (III.118)
i
id
La même procédure que hi sauf que:
(III.119)
Re sr
4 m ?
P 2V d
sr i
Cp P
Pr
(III.120)
sr sr
O sr

:
III.4.3.2.3. Calcul du terme ti
O i
~ e
1. La résistance thermique de la paroi en
acier:
2. La résistance du tartre se déposant sur
la surface interne du tube:
|
Rtartre
|
|
etartre
O tartre
|
(III.122)
|
~~ 1
1 1
d ·~ °
Donc : U R R
0
«~ + + + (III.123)
P tartre
·~ ~ »~
L ~
h d h
0 i i
III.4.3.3. Calcul de l'écart moyenne de
température
La chaleur fournie au bouilleur sert à
préchauffer la solution riche jusqu'à atteindre la
température de début d'ébullition ensuite la chaleur
restante sera considéré comme chaleur de vaporisation figure
(III.15).
a- Zone de préchauffage ppr:
Avec : ÄT1=Tch2 - T2 ,
ÄT2=Tch1-T3 et la DTLMpr
même équation (III.64), donc la chaleur utile pour le
préchauffage:
ÇOpr m?sr Cpsp
DTLMpr (III.124)
|
Chapitre III
|
Étude thermodynamique et thermique des
différents organes d'une installation frigorifique à
absorption
|
b- Zone de vaporisation pvp :
Calculons la chaleur de vaporisation qui sera déduite
comme suite:
Pvp Pb Ppr (III.125)
Avec: ÄT1=Tch1- T3 ,
ÄT2=Tch2-T3 et laDTLM vp
même équation (III.64),
Zone de vaporisation
ÄT1
Tch2
ÄT2
Zone de préchauffage
Tch2
ÄT1
T3
T3
T3
A
A
T2
T
Tch1
T
Tch1
ÄT2
Figure III.15. Evolution de la
température dans la zone de préchauffage et de vaporisation.
III.4.3.4. Calcul de la surface d'échange
extérieure Selon l'équation de la transmission de
chaleur on à :
-
1 pr vp
(' P P ·~
A (III.126)
U DTLM DTLM
·~ ~
~ pr vp
III.4.3.5. Calcul du nombre de tubes Nt
On pose une longueur préliminaire du tube, soit l = 2
m, d'où le nombre de tube est :
III.4.3.6. Choix de l'appareil et calcul du coefficient
de transfert sale Us On procède de la même manière
que pour le dimensionnement du condenseur.
A
En recalculer la longueur réelle du tube :
N 2V d
t normalise 0
l (III.128)
III.4.3.7. Calcul des pertes de charges [37]
a- Côté tube:
1. Section par passage atb: Même
équation (III.95).
2. vitesse massique Gtb:
3.
|
4.
|
|
|
|
G tb
|
?
|
msp
a tb
|
(III.129)
|
|
Le coefficient de frictionfrtb (lecture sur Annexe (7));
nGfr l
2 r ? 2
A = ? + ?
t tb tb
15 2 ( / )
P Kg cm
tb 1.27110 P d
sr i tb
LJ
|
(III.130)
|
b- Côté calandre:
1. Section par passage acl : Même
équation (III.80).
2. vitesse massique Gtb:

Le coefficient de frictionfrCl (lecture sur Annexe
(7));
n fr G 2
c Cl Cl
A ?
C Cl Kg cm 2
P Cl 1.271 1015 P D
ech eqCl
(III.132)
( 1) ( / )
N D
+
III.4.4. Dimensionnement de l'absorbeur
Les absorbeurs existent selon plusieurs modes de construction
: à double tubes, multitubulaires verticaux avec ruissellement à
l'intérieur des tubes ou à l'extérieur, multitubulaires
horizontaux avec ruissellement ou même des réservoirs verticaux
contenant un certains nombres de serpentins en spirale
[20].
Le choix effectué vise un absorbeur vertical avec
ruissellement de la solution binaire à l'extérieur des tubes,
l'eau de refroidissement circule à l'intérieur de ceux-ci, car le
film constitué par la solution ammoniacale entoure toute la surface du
tube, d'où on dispose d'une plus grande surface d'échange que
dans le cas d'un absorbeur horizontal.
III.4.4.1. Méthodologie de calcul de
l'absorbeur
- Données (caractéristiques) de
l'absorbeur:
> Flux de chaleur dégagé par l'absorbeur :
ç°ab ;
> Température d'entrée et de sortie de l'eau
chaude : Teab1 et Teab2 ; > Débit
massique de la solution pauvre m? sp ;
> Débit massique des vapeurs NH3 : m?
a ;
> Température de NH3 vapeur : T12
;
> Température de sortie de la solution riche : T6
;
> Température d'entrée de la solution pauvre :
T5 ;
> Concentration de la solution pauvre : îsp ;
> Tubes en acier de diamètre : d0/di ;
> Conductivité thermique des tubes :
Â,tb ; > Hauteur de l'absorbeur : Hab
;
> Vitesse de l'eau dans les tubes : Ve.
III.4.4.2. Calcul du débit d'eau de
refroidissement m? eab
ç°
m ? ab
= (III.133)
eab Cp T T
eab eab eab
( 1 2 )
--
III.4.4.3. Calcul de l'écart moyenne de
température
|
DTLM
|
A T T
-- A
1 2
|
(III.134)
|
|
('A ?
T 1
ln ? ?
? A ?
T2
|
ÄT1=T5 -Teab2 etÄT2=T6 -Teab1
III.4.4.4. Choix de l'appareil et calcul du coefficient
de transfert sale Us On procède de la même manière
que pour le dimensionnement du condenseur.
III.4.4.5. Calcul du coefficient de transfert propre Up
a- Côté tube (eau):
1. Section par passage atb:
Même équation (III.95).
2. vitesse massique Gtb:
3. Caractéristiques physiques de l'eau:
Calcul du: p , Cp , ).. et P à la
température moyenne de l'eau de refroidissement.
4. Nombre de Reynolds:
Re tb i
G d
(III.136)
tb
P eab
5. Calcul du coefficient d'échange hi:
Pour un écoulement vertical de l'eau dans les tubes on utilise
la relation suivante [08]:
V 0.8
h Kcal h m C
°
2
1780 e 0 ( /
i
) (III.137)
.2
d i
b- Côté calandre (solution) :
1. Section par passage acl : Même
équation (III.80).
2. vitesse massique Gcl :

3. Caractéristiques physiques de la solution
NH3-H2O : Calcul du : p , Cp , ).. et P
à la température moyenne de la solution et à la
concentration
de la solution pauvre îsp.
4. Nombre de Reynolds :
Re cl eq
G D
(III.139)
cl
P sp
Deq : même équation (III.91).
5. Calcul du coefficient d'échange
h0:
O msol Nu
h (III.140)
0 H ab
Le nombre de Nusselt est:
0.935
·~ ~
0.5 0.15 §~ ·~
Re Pr ab
H
Nu K (III.141)
cl clH
0
Le nombre de Prandtl est:
Cp ( ) ( )
T T
/2
msol msol
( )
T msol
Pr

(III.142)
Avec K: coefficient adimensionnel, dépend de la
nature du tube, K = 137 pour l'acier; H0: hauteur de
référence.
Donc, le coefficient de transfert propre est:
h h
0 i
h h
+
0 i
UP
(III.143)
III.4.4.6. Calcul du coefficient global de transfert de
chaleur U
? 1
? r I
1 t 1 1
e d 0
U = ? + + + ? (III.144)
? ? ? ? ? ?
h ' d h h
? ?
0 tb i fe i
1
:
hfe
résistance thermique due à l'encrassement
côté eau = 0.0003 (m2 h °C/Kcal).
III.4.4.7. Calcul de la surface
d'échange
? ab
A ? (III.145)
U DTLM
III.4.4.8. Calcul de la longueur d'un tube
III.4.4.9. Calcul des pertes de charges
Même procédure que le bouilleur.
III.4.5. Dimensionnement du
sous-refroidisseur
Appelé aussi, échangeur vapeur
froide-condensât, inséré entre le condenseur et
l'évaporateur, il assure le sous refroidissement du condensat d'une part
et le refoulement des vapeurs d'ammoniac d'autre part. En
général, c'est un échangeur à double tube à
contre courant. Le condensat circulera à l'intérieur du tube
interne par contre les vapeurs circuleront dans l'espace annulaire ; pour le
calcul de cet échangeur on a utilisé la méthode de
KERN [37].
III.4.5.1. Méthodologie de calcul du
sous-refroidisseur - Données (caractéristiques)
du sous-refroidisseur:
> Puissance thermique de sous refroidisseur: çosrf
;
> Température d'entrée et de sortie des vapeurs
NH3 : T11 et T12;
> Caractéristiques physiques de la vapeur d'ammoniac
à la température moyenne Tvm (p, ?, ) et
Cp).
> Température d'entrée et de sortie du condensat
:T8 et T9;
> Caractéristiques physiques du condensat à la
température moyenne Tcm (p, ?, ) et Cp).
> Débit massique des vapeurs NH3: m?
a ;
> Tubes en acier de diamètres:
- Tube interne : d0/di ;
- Tube externe : D0/Di;
> Conductivité thermique des tubes :
Â,tb;
III.4.5.2. Calcul de la DTLM
L - L
T T
DTLM T T T et T T T
= L = - L = -
1 2 , 1 8 12 2 9 11
ln
?
L ?
T 1
? ?
? L ?
T2
(III.147)
III.4.5.3. Calcul du coefficient global de transfert de
chaleur U
a- Côté tube (condensât):
1- Section d'écoulement du condensât:
?
a tb d i 2
= (III.148)
4
2- Vitesse massique du condensat:

3- Nombre de Reynolds:
Re i tb
d G
= (III.150)
tb P condensat
4- Coefficient de transfert de hi:
0.14
? u
-- f
0.33
h J d
condensat Prcondensat
i h
= (III.151)
? ?
i p
t ?
u
Jh : coefficient de COLBURN en fonction de Reynolds
(Annexe (7)).
Puisque les différences de températures sont
modérées, on pose le rapport (u u p ) égal
à l'unité.
Le coefficient de transfert hi0 adapté
à la surface de référence est:
|
h h
=
i i
0
|
d
d
|
i
0
|
(III.152)
|
b- Côté anneau (vapeur
d'ammoniac):
1- Section d'écoulement de la vapeur:
?
aa D i d
= --
( 0 )
2 2 (III.153)
4
2- Diamètre équivalent:
?
Deq
0
( i )
D d
2 2
-- 0
d
3- Vitesse massique:

(III.154)
0.14
4- Coefficient de transfert h0:
? u
f \
= 0.33
0 Pr
NH --
3
h J D (III.156)
h NH 3 [ 1
eq p
\ )
u
Jh : coefficient de COLBURN en fonction de Reynolds
(Annexe (7)).
UP
5- Coefficient de transfert propre UP:
h h
i 0 0
h h
+
i 0 0
(III.157)
c- Calcul des résistances thermiques: 1-
Résistance thermique du tube:
|
Rthtb
|
?
|
e tb
? tb
|
(III.158)
|
2- Résistance de salissement: Même
équation (III.87).
? 1 1
U R
= ? + ? ?
? h h
0 0
i J
th ? (III.159)
?
1
Donc:
III.4.5.4. Calcul de surface d'échange
? srf
A = (III.160)
U DTLM
III.4.5.5. La longueur total des tubes
III.4.5.6. Le nombre total des tubes
III.4.5.7. Surface d'échange par
épingle
ag =22vd0l
(III.163)
(III.164)
Le nombre d'épingles: g
n =
ag
A
III.4.5.8. Calcul des pertes de charges [37]
a- Côté tube (condensât):
Le coefficient de frictionfrtb (lecture sur Annexe (7),
avec L = 2 ng l);
n fr G l
2
g tb tb
A =
P t
0.635 10
0.14
?
? ?
p ?
( / )
Kg cm 2
(III.165)
(15 /2
P condensat ? ?
b- Côté anneau:
1- Le nombre de Reynolds (vapeur): D
G
'
Re ( Re )
eq a
= défférent de (III.166)
a a
/av
Où: D?eq=Di--d0
Le coefficient de frictionfra (lecture sur
Annexe (7) en fonction de Rea? );
|
1
nGfr l
2 ? ?
? ? ? ?
1
g a a
P +
a 0.635 10 4
15 0.14
? ?
? ? ? ?
v ? ' ? ? ?
D eq
L ? ? J
pp
|
( / )
Kg cm 2
|
(III.167)
|
III.4.6. Dimensionnement de
l'économiseur
Cet échangeur inter-solution assure le refroidissement
de la solution pauvre venant du bouilleur et le préchauffement de la
solution riche. D'ordinaire c'est un échangeur à double tube
à contre courant, figure (III.16) [43].
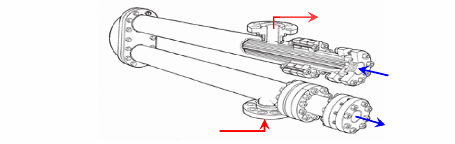
Sortie de la solution riche
Entrée de la solution pauvre
Figure III.16. Echangeur à double
tube.
(Courtesy of Brown Fintube Co.doc).
Entrée de la solution riche
Sortie de la solution pauvre
III.4.6.1. Méthodologie de calcul de
l'économiseur - Données
(caractéristiques) de l'économiseur:
> Puissance thermique de sous refroidisseur:
ç°ec;
> Température d'entrée et de sortie des vapeurs
NH3 :T3 et T4;
> Caractéristiques physiques de la solution pauvre
à la température moyenne Tmsp (p, ?, ) et
Cp).
> Température d'entrée et de sortie de la
solution riche :T1 et T2;
> Caractéristiques physiques de sortie de la solution
riche à la température moyenne Tmsr (p,
?, ) et Cp).
> Débit massique de la solution riche: m?
sr ;
> Tubes en acier de diamètres:
- Tube interne : d0/di ;
- Tube externe : D0/Di ;
> Conductivité thermique des tubes : ) tb;
III.4.6.2. Calcul de la DTLM
A -- A
T T
DTLM T T T et T T T
A -- A --
1 2 , 1 3 2 2 4 2
ln
§~
A ·~
T 1
·~ ~
L\ A ~
T2
(III.168)
III.4.6.3. Calcul du coefficient global de transfert de
chaleur U
On suit les mêmes étapes et en prend les mêmes
équations que le sous-refroidisseur sauf que la solution pauvre circule
à l'intérieur du tube interne et la solution riche circule dans
l'espace annulaire, en prenant les caractéristiques de chaque solution
dans le calcul.
III.4.6.4.Calcul des pertes de charges
a- Côté tube (solution pauvre):
Même équation (III.165).
b- Côté anneau (solution riche):
Même équation (III.167).
Conclusion
Nous avons vue à travers ce chapitre, l'étude
thermique de l'installation, la sélection, le dimensionnement des
échangeurs de la machine frigorifique à absorption. Cette
étude passe par la maîtrise d'outils tels que:
> La méthode DTLM; > La méthode de NUT.
Ces deux méthodes permettent d'aboutir au même
résultat. Cependant, la seconde utilisée également en
génie chimique pour le transfert de masse.
Chapitre IV :
Programme de simulation
des cycles de machines
frigorifiques à absorption.
Introduction
L'objectif de ce chapitre est de simuler la machine frigorifique
à absorption pour mieux comprendre son fonctionnement et d'en
déduire des actions pour améliorer ses performances.
Pour la simulation du fonctionnement stationnaire de la
machine, on a utilisé un software "SARM"
(Simulation of Absorption
Refrigeration Machine), et qu'on a
comparé à un software "ABSIM" existant.
IV.1. La simulation des cycles à absorption
La discussion de la simulation est basée sur le cycle
à absorption NH3-H2O à simple et à deux
étages.
Elle est basée sur les lois de conservation de masse et
d'énergie au niveau de chaque élément ainsi que les
équations d'équilibre du mélange NH3-H2O. Les
équations du modèle mathématique pour chaque
élément sont regroupées ci-après dans des tableaux
suivant chaque type de machine.
IV. 1.1. La simulation du cycle à simple
étage IV.1.1.1. L'équilibre massique
L'équilibre massique peut être décrit pour
chaque composante du cycle à absorption à simple étage
dans la figure (III.2) (chapitre III), comme montré dans le tableau
(IV.1).
Puisque le fluide de travail est un mélange, il est
nécessaire d'obtenir un équilibre massique pour chaque
espèce du mélange.
IV.1.1.2. L'équilibre
énergétique
L'équilibre énergétique des composantes
pour le cycle à simple étage, est donné dans le tableau
(IV.2). Les valeurs d'enthalpies doivent être obtenues à partir
des propriétés des données du fluide de travail
NH3-H2O ; elles dépendent de l'état thermodynamique qui
à son tour dépend des conditions de fonctionnement des points
d'état voisins.
|
Bouilleur
|
Absorbeur
|
Echangeur de solution
|
|
m ~ 2 =m ~ 3+m ~
7
î 2m ~ 2 = î
3m ~ 3+ î 7m
~ 7
|
m ~ 6 = m ~ 5 + m ~ 12
î 6m ~ 6
=î5m ~ 5+î 12m ~
12
|
m ~ 3 = m ~ 4 , î 3 =
î 4
m ~ 1 =m ~ 2,î 1 =
î 2
|
|
Condenseur
|
Evaporateur
|
Sous-refroidisseur
|
|
m ~ 7 = m ~ 8
î 7 = î 8
|
m ~ 11 = m ~ 10
î11 =î10
|
m ~ 8 = m ~ 9 , î
8= î 9
m ~ 11 = m ~
12,î11 =î12
|
|
Pompe de solution
|
Détendeur D1
|
Détendeur D2
|
|
m ~ 6 = m ~ 1
î 6 = î 1
|
m ~ 9 = m ~ 10
î 9=î10
|
m ~ 4 = m ~ 5
î 4= î 5
|
Tableau IV.1. L'équilibre massique pour
une machine à simple étage.
|
Bouilleur
|
Absorbeur
|
Echangeur de solution
|
|
? b = h 3 m ~ 3 + h
7 m ~ 7 - h 2 m ~ 2
|
?ab = h5m 5 +h
12 m ~ 12 - h 6 m ~ 6
|
? ec = h 3 m ~ 3 - h
4 m ~ 4
|
|
Condenseur
|
Evaporateur
|
Sous-refroidisseur
|
|
? cd =h7m ~
7-h8m ~ 8
|
? 0 =h11 m ~ 11
-h10m~1 0
|
?sr =h8m ~
8-h9m ~ 9
|
|
Pompe de solution
|
Détendeur D1
|
Détendeur D2
|
|
W P =h1m ~ 1
-h6m ~ 6
|
h9 =h10
|
h4 =h5
|
Tableau IV.2. L'équilibre
énergétique pour une machine à simple étage.
IV.1.2. La simulation du cycle à deux
étages IV.1.2.1. L'équilibre massique
L'équilibre massique est décrit pour chaque
composante du cycle à absorption à deux étages, figure
(III.8), (chapitre III), comme montré dans le tableau (IV.3).
IV.1.2.2. L'équilibre
énergétique
L'équilibre énergie des composantes pour le cycle
à deux étages est montré dans le tableau (IV.4).
|
Bouilleur 1
|
Absorbeur 1
|
Echangeur de solution 1
|
|
m ~ 2 = m ~ 3 + m ~ 7
î
2m ~ 2 =î3m ~
3+ î 7m ~ 7
|
m ~ 6 = m ~ 5 +m ~ 19
î 6m ~ 6
=î5m ~ 5+î 19m ~
19
|
m ~ 3 = m ~ 4 , î 3 =
î 4
m ~ 1 =m ~ 2 , î 1 =
î 2
|
|
Bouilleur 2
|
Absorbeur 2
|
Echangeur de solution 2
|
|
m ~ 10 = m ~ 11 + m ~ 14
î 10 m ~ 10 = î
11 m ~ 11 +î14m ~ 14
|
m ~ 8 = m ~ 13 + m ~
7
î 8m ~ 8 = î
13 m ~ 13 + î 7m ~
7
|
m ~ 11 = m ~ 12 , î 11 =
î 12
m ~ 10 = m ~ 9,î 10 =
î 9
|
|
Détendeur D1
|
Détendeur D2
|
Détendeur D3
|
|
m ~ 4 = m ~ 5
î 4 = î 5
|
m ~ 12 = m ~ 13
î12 =î13
|
m ~ 16 = m ~ 17
î16 =î17
|
|
Evaporateur
|
Condenseur
|
Sous-refroidisseur
|
|
m ~ 17 = m ~ 18
î 17 =î18
|
m ~ 14 = m ~ 15
î14 =î15
|
m ~ 15 = m ~ 16 ,î15
=î16
m ~ 18 = m ~ 19 , î18
=î19
|
|
Pompe de solution 1
|
Pompe de solution 2
|
|
m ~ 6 = m ~ 1
î 6 = î 1
|
m ~ 8 = m ~ 9
î8 = î9
|
Tableau IV.3. L'équilibre massique pour
une machine à deux étages.
|
Bouilleur 1
|
Absorbeur 1
|
Echangeur de solution 1
|
|
? b1 = h 3 m ~ 3 + h
7 m ~ 7 - h 2 ~ m2
|
? ab 1 = h 5 m ~ 5 +
h 19 m ~ 19 - h 6 m ~
6
|
? ec 1 = h 3 m ~ 3 -
h4m ~ 4
|
|
Bouilleur 2
|
Absorbeur 2
|
Echangeur de solution 2
|
|
? b2 = h11m ~ 11 + h14m
~ 14 - h10m ~ 10
|
? ab 2 = h13m ~ 13 + h
7 m ~ 7 - h 8 m ~ 8
|
?ec2 = h11m ~ 11 - h12m
~ 1
2
|
|
Détendeur D1
|
Détendeur D2
|
Détendeur D3
|
|
h4 = h5
|
h12 = h13
|
h16 = h17
|
|
Evaporateur
|
Condenseur
|
Sous-refroidisseur
|
|
? 0 = h 18 m ~ 18 -
h17m ~ 17
|
? cd = h14m ~ 14 - h15m
~ 15
|
? sr = h15m ~ 15 - h16m
~ 16
|
|
Pompe de solution 1
|
Pompe de solution 2
|
|
WP 1 = h 1 m ~ 1 -
h6m ~ 6
|
WP2 = h9m ~ 9 -
h8m ~
8
|
Tableau IV.4. L'équilibre
énergétique pour une machine à deux étages.
IV.2. La simulation du fonctionnement du système
par le programme "SARM" :
Dans le cadre de la simulation numérique du fonctionnement
du système, nous nous sommes fixés trois objectifs :
1- Automatisation des diagrammes d'Oldham et de Merkel ;
2- Dimensionnement des échangeurs ;
3- Détermination des limites de fonctionnement pour
une installation à absorption hydro-ammoniacal, (une température
de vaporisation minimale, la température de l'agent de chauffage
minimale, coefficient de performance maximal et une température de
l'agent de refroidissement maximale).
Le programme de calcul "SARM", figure (IV.1) est
composé de trois parties :
+ L'introduction des données ;
+ Le calcul ;
+ L'affichage des résultats dans une base de
données Access.
Première partie : l'introduction des
données, nécessite des informations concernant la :
1- Capacité frigorifique demandée ?0 ;
2- Température demandée par le consommateur
à la sortie de l'évaporateur, du fluide secondaire à
refroidir ;
3- Température de l'eau chaude disponible à
l'entrée du générateur ;
4- Température de l'eau de refroidissement à
l'entrée du condenseur et l'absorbeur.
Deuxième partie : le calcul, il comporte
les étapes suivantes :
1- Programmation des fonctions qui permettant la
résolution des équations d'équilibre liquide-vapeur
c'est-à-dire :
+ L'enthalpie, l'entropie et le volume des composantes pures
NH3 et H2O pour les deux phases, liquide et vapeur
saturés ;
+ L'enthalpie, l'entropie et le volume pour le mélange
NH3-H2O liquide et vapeur ; + Propriétés de transport de
la solution NH3-H2O ;
+ L'enthalpie, l'entropie et le volume pour la vapeur
surchauffée ;
+ L'enthalpie, l'entropie et le volume pour le liquide
sous-refroidi.
2- La conception des tables thermodynamiques pour l'ammoniac est
l'eau ;
3- La conception des tables pour les propriétés de
transport pour l'ammoniac est l'eau ;
4- Le calcul thermique de l'installation (simple et double
étages), figure (IV.2) ;
5- Le dimensionnement des appareils de l'installation, figure
(IV.3) ;
6- La numérisation des deux diagrammes (Oldham et Merkel)
;
7- Pour une série de paramètres d'entrée
: ?0 , T0, TC, Tch, Tf et Te le
programme exécute automatiquement les calculs pour toutes les variantes
où Tb et Tab varient avec un pas ?T=2.5
°C, les limites de Tb = (70÷90 °C), Tab=
(20÷40 °C) pour le cycle à simple étage, et de
Tb =(90÷130 °C), Tab= (30÷60 °C) ; en
choisissant une série de résultats qui vérifient les
conditions imposés suivantes :
y' ? î = î ab - î sp
= 5 % ;
y' Le bilan thermique pour l'ensemble de l'installation.
Troisième partie : l'affichage des
résultats dans une base de données Access qui contient 40 tables,
chaque table regroupe des résultats de simulation.
Figure IV.1. Le programme SARM
tel qu'il s'affiche à l'écran.
Figure IV.2. Exemple de calcul thermique d'un
cycle à deux étages.
Figure IV.3. Exemple de dimensionnement du
condenseur.
Dans le programme "SARM", le remplissage,
l'affichage et le vidage de chaque table de la base de données, ainsi
que tous les paramètres des points d'états du cycle et les flux
de chaleur échangés dans chaque appareil et le coefficient de
performance de l'installation, se font suivant des procédures bien
déterminées.
Le logiciel "SARM" contient aussi une partie
de validation du modèle d'enthalpie, d'entropie et de volume pour les
deux composantes NH3 et H2O, et le coefficient de performance
pour une machine à absorption à simple étage.
IV.3. La méthode de simulation
Pour la simulation numérique du fonctionnement en
régime stationnaire de l'installation frigorifique à absorption
NH2-H2O, à simple et à double étages, nous avons
réalisé un programme de calcul "SARM" avec le
langage DELPHI. Ce programme fonctionne dans les limites
suivantes :
> La température de vaporisation : +15 ..... -5 °C
;
> La température de l'agent de chauffage dans le
bouilleur : 75 .... 130 °C ;
> La température du fluide de refroidissement au
condenseur et l'absorbeur : 20 ..... 60 °C ; > La température de
condensation : 25 ..... 50 °C ;
> La capacité frigorifique ?0 : 50
..... 2000 Kw.
Le programme inclus des codes spécifiques pour automatiser
les deux diagrammes thermodynamiques d'Oldham et de Merkel.
Dans cette étude, on a choisi deux types de machines
frigorifiques à absorption, simple et double étages.
IV.3.1. Automatisation des diagrammes
Habituellement, l'étude de la machine frigorifique
à absorption est faite à l'aide de deux diagrammes
thermodynamiques se rapportant au mélange binaire utilisé. Le
premier est le diagramme d'Oldham en (logP, 1/T) qui permet
d'évaluer les deux pressions extrêmes du fonctionnement de la
machine, les concentrations du mélange et le cycle suivi par celui-ci.
Le second diagramme est celui de Merkel en (h,î) qui
détermine le comportement énergétique de la machine et par
conséquent permettent de dimensionner celle-ci.
La connaissance approfondie de la machine, en variant les
différentes valeurs de paramètres tel que les
températures, concentration ..., ne peut être manuelle, c'est un
travail long et fastidieux sans parler des imprécisions dans la lecture
des résultats.
Nous proposons dans ce qui suit, une automatisation de calcul
des caractéristiques de ces machines, en se basant sur la
numérisation du diagramme de Merkel et d'Oldham. Pour la
numérisation du diagramme de Merkel, nous utiliserons le mode de
Gibbs [33], quant au diagramme d'Oldham nous proposons un
modèle mathématique basé sur l'équation de
Clapeyron [44].
IV.3.1.1. Calculs et organigrammes
La simulation du cycle nécessite non seulement la
connaissance des propriétés physico- chimiques des
systèmes, mais aussi l'établissement des corrélations en
fonction de la température, la pression et la concentration, ....
IV.3.1.1.1. Corrélations thermodynamiques de l'agent
d'absorption (eau)
· Pression de saturation [45] :
5a
log ( ) i
10 1
P = ? T -
i
i
= 1
(IV.1)
Où a a a a
: 7.13727210 , 1820.059457 , 53309.1578 , 45431991.41 ,
= = = = -
1 2 3 4
a = 4602051824, P
5
|
[ ] [ ]
KPas et T K
|
.
|
|
· Température de saturation :
La température de saturation de l'eau T[K] en
fonction de la pression P[KPas], est obtenue par la résolution
de l'équation (IV.1) en utilisant l'algorithme de NEWTON-RAPHSON. Annexe
(9).
IV.3.1.1.2. Corrélations thermodynamiques du
fluide frigorigène (ammoniac)
· Pression de saturation [44] :
a a
1 2
log ( )
10 0
P a
= + +
(1.8. 491.7) (1.8. 491.7) 2
T T
+ +
|
(IV.2)
|
|
Où a a a P KPas et T C
: 6.59924 , 1721.24882 , 2 112599.5598 , .
0 1 [ ] [
= = - = - ° ]
et T C
: 0 325 .
= = °
· Température de saturation :
La température de saturation de l'ammoniac est obtenue
par la résolution de l'équation du 2ème degré
(IV.2).
IV.3.1.1.3. Corrélations thermodynamiques du
mélange NH3-H2O
· Pression de saturation du mélange NH3-H2O
[44] :
log ( ) ( ) B ( î )
P A
= î - (IV.3)
10T
avec: A( î ) = 7.44 -
1767î+ 09823 î + 0.3627 î
2 3
B( î ) = 2013.8- 2155î+
1540.9 î - 194.7 î
2 3
|
(IV.4)
(IV.5)
|
|
P[KPas] et T[K], avec î :
concentration massique de NH3 dans le mélange liquide. Le
domaine de validité de cette équation est :
> 0.01 = P = 60 bar ; > -75 = T = 240 °C.
· La température de saturation du
mélange liquide NH3-H2O :
De l'équation (IV.4), et si P et î
sont connus, on à l'expression de la température de
saturation :
T
|
|
B ()
î
|
|
|
P[KPas] et T[K] (IV.6)
|
|
( 10
A ( ) log
î -
|
( )
P
|
)
|
|
· Température de saturation du
mélange vapeur [31] :
n i
0 (1 ) ln
? ?
î ? ? ?
m 4 P 0
= - ? ? ? ? ? ? ?
i
T T a ? (IV.7)
i P
i
Où les coefficients ai, mi et ni sont
données dans le tableau (IV.5).
Le domaine de validité de cette équation est :
> 0.01 = P = 100 bar ;
> 0 = î = 1.
i
mi
|
ni
|
ai
|
1
|
0
|
0
|
+0.324 004 x 101
|
2
|
0
|
1
|
-0.395 920 x 100
|
3
|
0
|
2
|
+0.435 624 x 10-1
|
4
|
0
|
3
|
-0.218 943 x 10-2
|
5
|
1
|
0
|
-0.143 526 x 101
|
6
|
1
|
1
|
+0.105 256 x 101
|
7
|
1
|
2
|
-0.719 281 x 10-1
|
8
|
2
|
0
|
+0.122 362 x 102
|
9
|
2
|
1
|
-0.224 368 x 101
|
10
|
3
|
0
|
-0.201 780 x 102
|
11
|
3
|
1
|
+0.110 834 x 101
|
12
|
4
|
0
|
+0.145 399 x 102
|
13
|
4
|
2
|
+0.644 312 x 100
|
14
|
5
|
0
|
-0.221 246 x 101
|
15
|
5
|
2
|
-0.756 266 x 100
|
16
|
6
|
0
|
-0.135 529 x 101
|
17
|
7
|
2
|
+0.183 541 x 100
|
T0 = 100 K
|
P0 = 2 MPa
|
|
Tableau IV.5. Les coefficients de
· l'équation (IV.7)
La concentration massique du mélange NH3-H2O :
La concentration massique est donnée par l'expression :
m
î = (IV.8)
NH 3 m mélange
avec
|
: NH NH NH
m n M
=
3 3 3
|
|
m n M
H O H O H O
=
2 2 2
m m m
mélange NH H O
= +
3 2
n NH
D'où : 3
î = M
n n
H O
2
NH H O
+
3 2
M NH 3
|
(IV.9)
|
|
M H O
2
|
1.05 , on remarque que la concentration molaire de NH3
est presque identique à
|
M NH3
|
|
sa concentration massique et on peut écrire que :
(IV.10)
î ~ n NH3
n n
NH H O
+
3 2
L'équation qui donne î en fonction de
P et T est :
? ? ? ? ?
194.7 1540.9 2155
? + ? + ? - ? - ? -
0.3627 0.9823 1.767
î î î
3 2 ? ??
? ? ? ? ?
T T T
|
+
(IV.11)
|
2013.8
7.44 log ( ) 0,
- - =
P
10
T
|
P KPas et T K
[ ] [ ]
|
|
La résolution de cette équation est faite à
l'aide de la méthode de NEWTON-RAPHSON, Annexe (9).
· La concentration de l'ammoniac dans le
mélange vapeur qui est en équilibre avec la phase liquide [31]
:
? ? ? ?
m i
P
? (IV.12)
n 3
y a
= - ? - ? ? ?
1 exp ln(1 ) i
î î
i
? ? ? ? ? ?
P
i 0
Où les coefficients ai, mi et ni sont
données dans le tableau (IV.6).
Le domaine de validité de cette équation est :
> 0.01 = P = 100 bar ;
imini
|
|
ai
|
1
|
0
|
0
|
+1.980 220 17 x 101
|
2
|
0
|
1
|
-1.180 926 69 x 101
|
3
|
0
|
6
|
+2.774 799 80 x 101
|
4
|
0
|
7
|
-2.886 342 77 x 101
|
5
|
1
|
0
|
-5.916 166 08 x 101
|
6
|
2
|
1
|
+5.780 913 05 x 102
|
7
|
2
|
2
|
-6.217 367 43 x 100
|
8
|
3
|
2
|
-3.421 984 02 x 103
|
9
|
4
|
3
|
+1.194 031 27 x 104
|
10
|
5
|
4
|
-2.454 137 77 x 104
|
11
|
6
|
5
|
+2.915 918 65 x 104
|
12
|
7
|
6
|
-1.847 822 90 x 104
|
13
|
7
|
7
|
+2.348 194 34 x 101
|
14
|
8
|
7
|
+4.803 106 17 x 103
|
P0 = 2 MPa
|
|
> 0 = î = 1. Tableau IV.6. Les
coefficients de
l'équation (IV.12)
IV.3.1.2. Automatisation du diagramme
d'Oldham
A partir de l'équation (IV.3), qui donne la pression
du mélange NH3-H2O en fonction de la température et de
la concentration [44], deux paramètres (P, T),
(P,î) ou (T, î) sont suffisantes pour
déterminer l'état thermodynamique d'un point donné, en
effet :
+ Si (P, T) sont données, î
est calculée à partie de l'équation (IV. 11) ; + Si
(P, î) sont données, T est calculée
à partie de l'équation (IV.6) ; + Si (T, î) sont
données, P est calculée à partie de
l'équation (IV.3).
IV.3.1.2.1 Organigramme de calcul
On donne dans ce qui suit un organigramme pour le calcul de
la température, la pression etant de 0.016 jusqu'à 20 bar, et la
concentration varie de 0 à 1. D'où on peut tracer le diagramme
d'Oldham automatisé figures [(V.2) et (V.3)], (chapitre V).
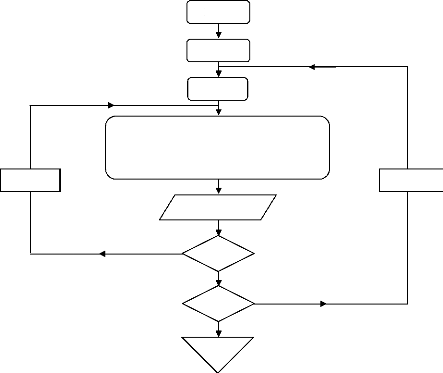
P = 0.016
Ecrire P, T, î
Oui
P =20
Non
Oui
î = 1
Non
Fin
P =P+0.5
î = î +0.05
A=f1(î) équation (IV.4)
B=f2(î) équation (IV.5)
T=B(î)/(A(î)-log(P)) équation
(IV.6)
î = 0
Début
Organigramme IV.1. Démarche de calcul
pour le diagramme d'Oldham.
IV.3.1.3. Automatisation du diagramme de
Merkel
Grâce aux deux équations (II.48) et (II.55),
(chapitre II) pour les deux phases liquide et vapeur, on peut déterminer
les enthalpies massiques du mélange NH3-H2O et ceci pour les
deux phases de ce dernier. Le diagramme de Merkel est composé de deux
parties :
· Partie inférieure (liquide) comporte
:
y' Des réseaux d'isothermes ;
y' Des réseaux d'isobares (courbes
d'ébullition).
· Partie supérieure comporte :
y' Des courbes d'égale concentration de phase vapeur en
équilibre avec la phase liquide ;
y' Des courbes de condensation (rosé).
IV.3.1.3. Organigrammes de calcul
Dans ce qui suit nous donnons des organigrammes pour le
tracé de chaque partie.
Début
a- Les réseaux d'isobares :
P = 0.1

î = 0


A=f1(î) équation (IV.4)
B=f2(î) équation (IV.5)
T=B(î)/(A(î)-log(P)) équation
(IV.6)
hm = f3(T,P, î) équation
(II.48)
L
P =P+Pas
Ecrire P, T, î , h
L
m
Oui
î =1
Non
Oui
P = 50
Non
Fin
î = î +0.01

Organigramme IV.2. Démarche de calcul
pour les réseaux d'isobares.
b- Les réseaux d'isothermes :
Début

T=273.15

î s1

î = î +0.005
T =T+20
|
A=f1(î) équation (IV.4)
B=f2(î) équation (IV.5)
P=f3(T, î) équation (IV.3)
hm = f4(T,P, î) équation
(II.48)
L
|
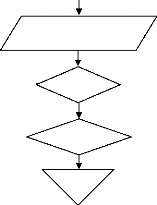
Ecrire P, T, î, hm L
Oui
î = î s2
Non
Oui
T = 515.15
Non
Fin
Organigramme IV.3. Démarche de calcul
pour les réseaux d'isothermes.
NB:

î,s1 : représente la concentration
correspondante à la température donnée, et à la
pression de 0.1 bar.
î,s2 : représente la concentration
correspondante à la température donnée, et à la
pression de 50 bar.
c- Les lignes de condensation :
Début
î = î +0.01

P = 0.1

î = 0

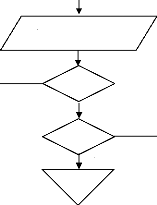
P = 50
Fin
Non
P =P+Pas
|
T=f1(P, î) équation (IV.7)
hm = f2(T,P, î) équation
(II.55)
g
|

Ecrire P, T, î , g
hm
Oui
î =1
Non
Oui
Organigramme IV.4. Démarche de calcul
pour les lignes de condensation.
d- Les courbes d'équilibre de la phase vapeur avec
la phase liquide :
Début

P = 0.1

î = 0
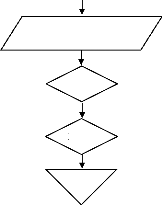
î = î +0.01
P =P+Pas
Ecrire P, T, x, y, hm L
Non
Oui
î =1
Non
Oui
P = 50
Non
Fin

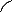
A=f1(î) équation (IV.4)
B=f2(î) équation (IV.5)
T=f1(P, î) équation (IV.7)
y=f4(P, î) équation (IV.12)
hm = f5 (T,P,y) équation (II.55)
g
Organigramme IV.5. Démarche de calcul
pour les courbes liquide-vapeur.
IV.3.2. Machine frigorifique à absorption à
simple étage
Pour le calcul des paramètres du processus de la machine
à simple étage, nous avons adapté l'organigramme suivant
:
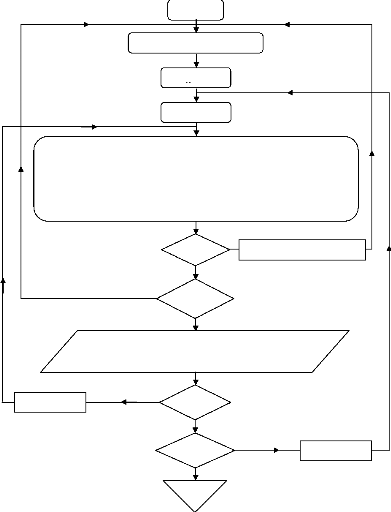
Tb = Tb+2.5
Calcul du cycle :
- Calcul des P, T, H des points d'états (7-12)
pour l'ammoniac (î=99.7 %) ; - Calcul des P, T, H, î des
points d'états (1-6) pour la solution NH3-H2O ;
- Calcul des débits de masse circulant dans l'installation
;
- Le calcul des flux de chaleur pour chaque échangeur ;
- Calcul du coefficient de performance.
- Ecrire P, T, î ,h ,?, m pour tous les
points d'états ; - COP de l'ensemble de l'installation.
Non verifier
Non
Introduction des données
Oui
Oui
Bilan
Thermique
Tab = 20
Tab =40
Tb = 70
Tb =90
?î ?5%
Début
Fin
Verifier
Oui
Non
Le cycle physiquement impossible
Non
Tab = Tab+2.5
Organigramme IV.6. Organigramme de simulation
d'une machine à absorption à simple étage.
Organigramme IV.7. Organigramme de simulation
d'une machine à absorption à deux étages.
Tab2 = Tab2+2.5
Tb2 = Tb2+2.5
Calcul du cycle :
- Calcul des P, T, H des points d'états (7-12)
pour l'ammoniac (î=99.7 %) ; - Calcul des P, T, H, î des
points d'états (1-6) pour la solution NH3-H2O ;
- Calcul des débits de masse circulant dans l'installation
;
- Le calcul des flux de chaleur pour chaque échangeur ;
- Calcul du coefficient de performance.
Non verifier
- Ecrire P, T, î ,h ,?, m pour tous les
points d'états ; - COP de l'ensemble de l'installation.
Non
Non
Introduction des données
Bilan
Thermique
Tb2= 100
Tb2 =120
Tb1 =100
Tab1 = 20
Tab2 = 40
Tab2 =60
Tab1 =40
?î ?5%
Tb1 = 75
Fin
Verifier
Oui
Oui
Oui
Oui
Oui
Non
Le cycle physiquement impossible
Non
Non
Tab1 = Tab1+2.5
Tb1 = Tb1+2.5
IV.3.3. Machine frigorifique à absorption à
deux étages

Début
IV.4. La simulation du fonctionnement du système
par le programme "ABSIM" [46], [47]
Le développement accéléré des
systèmes à absorption dans les deux dernières
décennies, à crée un grand besoin d'un programme de
simulation effectif et rentable pour prédire les performances, analyser
le comportement et améliorer les différentes études des
paramètres d'optimisations.
Le professeur Grossman GERSHON, de l'institut de
Technologie « Technion de
Haifa, Israël, a développé
un software appelé "ABSIM" figure (IV.4), sa structure
est représenté schématiquement dans la figure (IV.5).
Figure IV.4. Le programme ABSIM tel qu'il
s'affiche à l'écran.
IV.4.1. La structure du programme
Le code informatique "ABSIM" à
été développé pour simuler les systèmes
à absorption sous formes flexible et modulaire, permettant
d'étudier diverses configurations de cycle utilisant divers fluides
actifs, fondé sur un schéma de cycle utilisateur, avec un fluide
actif spécifié dans des conditions de fonctionnement
définies, le programme calcule la température, la vitesse
d'écoulement, la pression et la fraction vapeur pour chaque point
d'état du système et de bilan thermique pour chaque composant.
Introduction des données
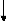
|
Programme de
résolution :
1- l'éléminations des équations rendantes
;
2- l'application des conditions aux limites ;
3- résolution du système d'équation.
|
|
Programme principal :
1- l'introduction des
données ;
2- formation du vecteur variable ;
3- lien des unités et la formation des équations
;
4- Normalisation ;
5- activation du programme
de résolution.
|
|
Les substances des
unités :
1- Absorbeur ;
2- Désorbeur ;
3- Echangeur de chaleur ;
4- Condenseur ;
5- Evaporateur ;
6- Vale d'expansion ;
7- Mixeur ;
8- Spliteur ;
9- Rectificateur ;
10- Analyseur ;
11- Compresseur ;
12- pompe.
|
|
|
|
|
|
|
|
|
|
|
Résultats.
|
|
|
|
|
|
|
|
|
|

|
Figure IV.5. Structure du code informatique
ABSIM.
|
Base de données avec
les
propriétés des substances.
|
La structure modulaire du code est fondée sur des
sous-programmes unitaires comprenant des équations gouvernant les
composants du système. Un programme principal englobant ces
sous-programmes reliés les composants selon le schéma du cycle.
Les sous-programmes gouvernant les propriétés sont contenus dans
une base de données séparée fournissant des
propriétés thermodynamiques des fluides actifs, pour assurer la
modularités et la flexibilité du programme qui permettent
à chaque unité d'une part de travailler avec différents
fluides. La base de données contient des informations pour les
substances figurant dans le tableau (IV.7).
La figure (IV. 6), représente les 12 unités
standarts qui sont connues par le programme et leurs codes numériques de
connaissance entre parenthèse.
Ces unités sont considérées suffisantes
pour créer plusieurs cycles d'absorption intéressants. Chaque
unité est traitée comme un volume de contrôle, avec des
propriétés d'entrée et de sortie, comme elle peut
être reliée avec d'autres composantes. Les équations qui
décrivent chaque unité s'appliquent pour l'unité comme un
ensemble et sont les suivant :
1- La conservation de la masse totale ;
2- La conservation de la masse de chaque substance
absorbant-réfrigérant ;
3- La conservation d'énergie ;
4- Le transfert de chaleur ;
5- L'équilibre entre les phases vapeur et liquide est
exprimé par la relation pression-température-concentration
P-T-î
Ces équations, exprimées pour chaque unité
à part, forment un système d'équation non linéaire
qui doit être résolu simultanément.
|
Code de fluide
|
Le fluide de travail
|
|
1
|
LiBr-H2O solution
|
|
2
|
NH3-H2O solution et vapeur
|
|
3
|
H2O liquide et vapeur
|
|
4
|
(60 %LiBr/40 % H2O)-NH3 solution
|
|
5
|
(28 %LiBr/72 % ZnBr2)-CH3OH solution
|
|
6
|
CH3OH liquide et vapeur
|
|
7
|
(53 % LiNO3/28 % KNO3/19 % NaNO3)-H2O solution
|
|
8
|
Na-OH-H2O solution
|
|
9
|
LiCl-H2O solution
|
|
10
|
Air
|
|
11
|
Carburant (CH4,air)
|
Tableau IV.7. Code des différents
fluides.
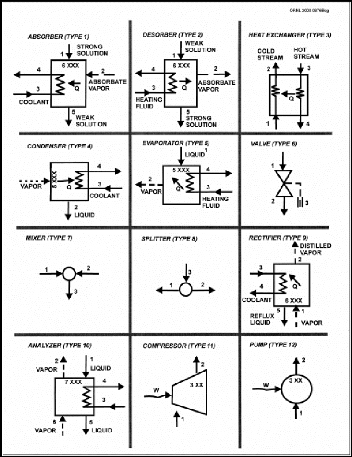
Figure IV.6. Description schématique des
unités individuelles formant le système à absorption.
Conclusion
Nous avons montré dans ce chapitre :
- Comment il est possible d'implantes sur micro-ordinateur les
relations permettant de calculer différents paramètres
thermodynamiques et de transport de la solution NH3-H2O ;
- La structure générale du logiciel
"SARM" que nous avons conçue ;
Le logiciel que nous avons crée au LRTI
(Laboratoire de Recherche des
Technologies Industrielles),
représente le premier outil de simulation des cycles à
absorption.
Chapitre V :
Analyse des résultats
et validation du
programme.
Introduction
Dans ce chapitre, on représenté les
différents résultats obtenus par notre logiciel
"SARM" (Simulation of
Absorption Refrigeration
Machine), et leur comparaisons avec d'autres
modèles.
V.1. Calculs et représentations des
paramètres
V.1.1. Le tracé des deux diagrammes
thermodynamique
Les résultats obtenus sont conformes a ceux de Merkel et
Oldham.
V.1.1.1. Diagramme de Merkel ( h, )
î
Suivant les organigrammes [(IV.2), (IV.3), (IV.4) et (IV.5)]
cités au chapitre IV, et avec l'utilisation des deux équations
(II.48) et (II.55), (chapitre II) pour les deux phases liquide et vapeur, le
logiciel "SARM" trace le diagramme de Merkel avec une simple
click, figure (V.1).
2800
2600
2400
2200
2000
1800
1600
600
400
200
0
-200
-400
-600
|
1400 1200 1000 800
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
50 bar
|
|
|
|
|
|
|
|
|
30
20
|
10
5
2
|
|
|
|
|
|
|
|
|
0.5
0.2
0.1 bar
|
|
|
|
|
|
|
50 bar
30
20
|
|
|
|
|
|
|
|
|
|
10
5
|
|
|
|
|
|
|
|
|
|
2
0.5
|
|
|
|
|
|
|
|
|
0.2
0.1 bar
|
|
|
|
|
|
51 3.15 °K
|
|
|
|
|
|
|
|
|
|
|
493.15
473.15
|
|
|
|
|
|
|
|
|
|
|
453.15
433. 15
|
|
|
|
|
|
|
|
|
|
413.15
|
393.15
|
|
|
|
|
|
|
|
|
373.15
353.15
|
|
|
|
|
50 bar
30
|
|
|
333.15
|
|
|
|
|
20
10
|
|
|
|
|
313.15
293.15
|
|
|
5
|
|
|
|
|
273.15 2
253.15
0.5
|
|
|
|
|
|
|
233.15
0.2
213.15 °K 0.1 bar
|
|
|
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
Concentration massique de l'ammoniac
Figure
V.1. Diagramme de Merkel automatisé.
V.1.1.2. Diagramme d'Oldham ( Log P, T ) et ( Log P,
-1/T )
Suivant l'organigramme (IV. 1), et avec l'utilisation des
équations (IV.4), (IV.5) et (IV.6), (chapitre IV). D'où on peut
tracer le diagramme d'Oldham par le logiciel "SARM", figures
(V.2) et (V.3).
Pression (bar)
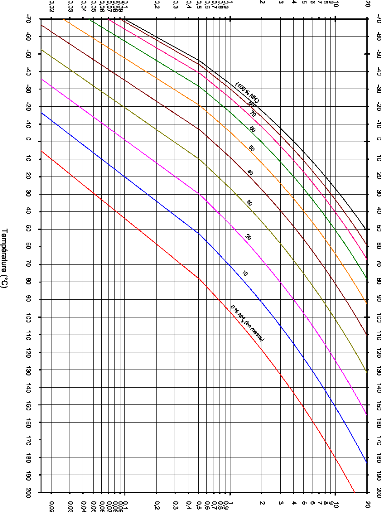
Figure V.2. Diagramme d'Oldham
automatisé, (LogP, T).
Pression ( bar)
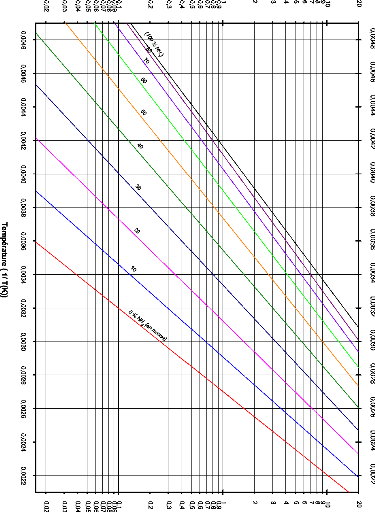
Figure V.3. Diagramme d'Oldham
automatisé, (LogP,-1/T).
Début
V.1.2. L'établissement des tables et des
diagrammes thermodynamiques V.1.2.1. Tables de l'ammoniac et de l'eau
saturés
Le logiciel "SARM" rempli automatiquement les
tables thermodynamiques de l'ammoniac pure (Annexe 11), et de l'eau pure
(Annexe 12) suivant l'organigramme (V.1) :

T = -75 °C pour (NH3)
T=0 °C pour (H2O)

Equation (IV.1) pour (H2O)
Equation (IV.2) pour (NH3)
T =T+1
LV = hg - hL
?s = sg - sL
Ecrire P, T, hL , hg , sL , sg ,vL ,
vg , LV , ?s
T =134 (NH3)
T =326 (H2O)
Non
Fin
hL équation (IV.25)
hg équation (IV.26)
sL équation (IV.27)
sg équation (II.28)
vL équation (II.29)
vg équation (II.30)
Oui

Organigramme V.1. Démarche de
remplissage des tables thermodynamiques
de l'ammoniac et de l'eau.
V.1.2.2. Table de la solution NH3-H2O
Suivant l'organigramme (IV. 1), cité au chapitre IV, le
logiciel "SARM" remplir automatiquement la table de
propriétés P-T-î. (Annexe 13)
V.1.2.3. Diagrammes de Molier (Log P, h) pour l'ammoniac
et de l'eau
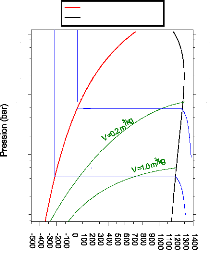
100,00
80,00
60,00
40,00
20,00
10,00
8,00
T = 10 °C
6,00
1,00
0,80
0,60
T = - 50 °C
0,40
0,20
0,10
0,08
4,00
2,00
H (Kj/Kg)
100,00
80,00
60,00
40,00
20,00
10,00
8,00
6,00
4,00
2,00
1,00
0,80
0,60
0,40
0,20
0,10
0,08
Enthalpie du liquide saturé hL
Enthalpie
du vapeur saturé hg
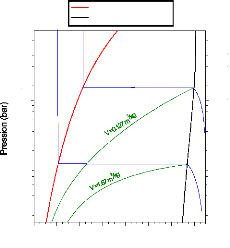
3,33
1,67
1
0,00
8,33
6,67
00,00
83,33
66,67
1
T = 200 °C
5,00
3,33
1,67
T = 100 °C
1,00
0,83
0,67
0,50
0,33
0,17
50,00
33,33
16,67
0 400 800 1200 1600 2000 2400 2800
H (Kj/Kg°K)
100,00 83,33 66,67
50,00
33,33
16,67
10,00 8,33 6,67
5,00
1,00
0,83
0,67
0,50
0,33
0,17
Entropie du liquide saturé hL
Entropie du
vapeur saturé hg
Figure V.4. Diagramme de Mollier (log P,
h) pour l'ammoniac. Figure V.5. Diagramme de
Mollier (log P, h) pour l'eau.
V.1.3. Calcul des paramètres thermodynamiques et
de transport à l'état saturée pour l'ammoniac et
l'eau
A partir de la connaissance de la pression où de la
température, le logiciel "SARM" calcule tous les
paramètres thermodynamiques et de transport pour l'ammoniac et l'eau.
Exemple :
Pour une température T=1 8 °C, on obtient les
résultats suivants :
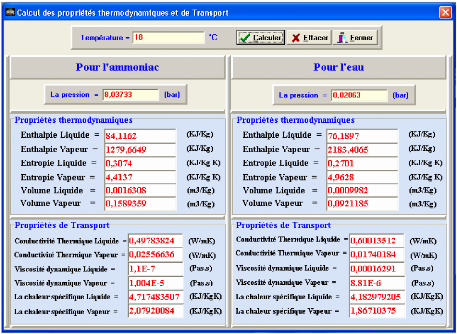
Figure V.6.Exemple de calcul des
paramètres thermodynamiques et de transport pour NH3 et
H2O.
V.1.4. Exemple de calcul d'un cycle à simple
étage
- Les données du calcul :
T C T C
11
= ° = °
5 , 25 ,
8
T C T C
6 3
= ° = °
20 , 70 ,
? KW ç ç
= =
100 , ec sr 0.8 .
=
0
- Résultat de calcul :
A partir des équations citées au chapitre III, on
abouti aux résultats suivants tableau (V. 1) :
|
Etat
|
h
|
T
|
P
|
î
|
?î
|
|
1
|
-5,27
|
50,35
|
9,46
|
0,584
|
0,135
|
|
2
|
27,06
|
57,35
|
9,46
|
0,584
|
0,135
|
|
3
|
77,79
|
70
|
9,46
|
0,449
|
0,135
|
|
4
|
18,04
|
56,73
|
9,46
|
0,449
|
0,135
|
|
5
|
18,04
|
38,4
|
3,79
|
0,449
|
0,135
|
|
6
|
-144,08
|
20
|
3,79
|
0,584
|
0,135
|
|
7
|
1376,33
|
61,35
|
9,46
|
0,997
|
0,135
|
|
8
|
117,57
|
25
|
9,46
|
0,997
|
0,135
|
|
9
|
46,57
|
10
|
9,46
|
0,997
|
0,135
|
|
10
|
46,57
|
1
|
4,19
|
0,997
|
0,135
|
|
11
|
1276,25
|
5
|
4,19
|
0,997
|
0,135
|
|
12
|
1281,39
|
7,5
|
4,19
|
0,997
|
0,135
|
|
qec
|
qsr
|
qb
|
qcd
|
qab
|
q0
|
m~a
|
|
131,25
|
70,99
|
1504,45
|
1258,75
|
1917,31
|
1229,68
|
0,081
|
|
Wp
|
? sr
|
? b
|
?cd
|
?ab
|
?ec
|
fc
|
|
45,82
|
5,75
|
121,86
|
101,95
|
155,3
|
10,63
|
4,06
|
|
COPth
|
0,817
|
COPr
|
0,594
|
Tableau V.1. Résultats de calcul d'un
cycle à simple étage
V.1.4.1.Tracé du cycle sur le diagramme
d'Oldham
Pression ( bar)
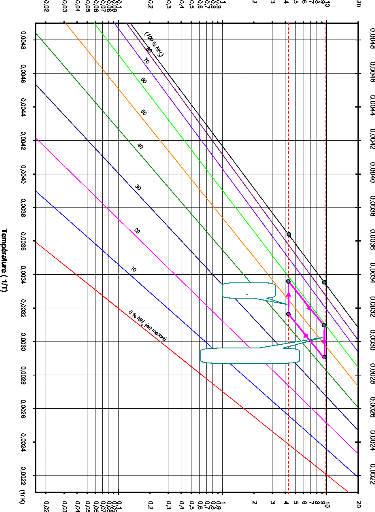
Ebullition des vapeurs pures
Absorption
5
6
11
8
2
3
Figure V.7. Représentation
schématique de l'exemple dans un diagramme (LogP,1/T)
V.1.5. Exemple de calcul d'un cycle à deux
étages
- Les données du calcul :
T C T C T C
18 15 6
= ° = ° = °
0 , 45 , 20 ,
40 , 75 , 100
° = ° =
C T C T
3 11
° C
T=
8
? KW ç ç ç
= = =
100 , ec ec sr 0.8 .
=
0 1 2
- Résultat de calcul :
|
Etat
|
h
|
T
|
P
|
î
|
fc1
|
fc2
|
?î1
|
?î2
|
|
1
|
-15,55
|
49,41
|
8,08
|
0,547
|
3,83
|
2,9
|
0,159
|
0,2
|
|
2
|
16,46
|
56,41
|
8,08
|
0,547
|
3,83
|
2,9
|
0,159
|
0,2
|
|
3
|
110,64
|
75
|
8,08
|
0,388
|
3,83
|
2,9
|
0,159
|
0,2
|
|
4
|
72,91
|
66,54
|
8,08
|
0,388
|
3,83
|
2,9
|
0,159
|
0,2
|
|
5
|
72,91
|
44,04
|
3,27
|
0,388
|
3,83
|
2,9
|
0,159
|
0,2
|
|
6
|
-149
|
20
|
3,27
|
0,547
|
3,83
|
2,9
|
0,159
|
0,2
|
|
7
|
1380,69
|
60,41
|
8,08
|
0,997
|
3,83
|
2,9
|
0,159
|
0,2
|
|
8
|
-45,37
|
40
|
7,88
|
0,616
|
3,83
|
2,9
|
0,159
|
0,2
|
|
9
|
91,6
|
69,25
|
16,98
|
0,616
|
3,83
|
2,9
|
0,159
|
0,2
|
|
10
|
125,1
|
76,25
|
16,98
|
0,616
|
3,83
|
2,9
|
0,159
|
0,2
|
|
11
|
220,33
|
100
|
16,98
|
0,416
|
3,83
|
2,9
|
0,159
|
0,2
|
|
12
|
176,01
|
90,47
|
16,98
|
0,416
|
3,83
|
2,9
|
0,159
|
0,2
|
|
13
|
176,01
|
68,96
|
7,88
|
0,416
|
3,83
|
2,9
|
0,159
|
0,2
|
|
14
|
1392,76
|
80,25
|
16,98
|
0,997
|
3,83
|
2,9
|
0,159
|
0,2
|
|
15
|
216,04
|
45
|
16,98
|
0,997
|
3,83
|
2,9
|
0,159
|
0,2
|
|
16
|
141,92
|
30
|
16,98
|
0,997
|
3,83
|
2,9
|
0,159
|
0,2
|
|
17
|
141,92
|
-4
|
3,47
|
0,997
|
3,83
|
2,9
|
0,159
|
0,2
|
|
18
|
1270,06
|
0
|
3,47
|
0,997
|
3,83
|
2,9
|
0,159
|
0,2
|
|
19
|
1295,93
|
12,5
|
3,47
|
0,997
|
3,83
|
2,9
|
0,159
|
0,2
|
|
WP1
|
WP2
|
?b1
|
?b2
|
?ab1
|
?ab2
|
Erreur du bilan
|
COPth
|
COPr
|
|
33,48
|
23,13
|
145,9
|
128,45
|
183,75
|
163,79
|
0,043
|
0,364
|
0,302
|
|
?cd
|
?ec1
|
?ec2
|
ma
|
msp1
|
msp2
|
?sr
|
|
104
|
9,47
|
7,48
|
0,089
|
0,251
|
0,169
|
6,57
|
Tableau V.2. Résultats de calcul d'un
cycle à deux étages
V.1.5.1. Tracé du cycle sur le diagramme de
Merkel
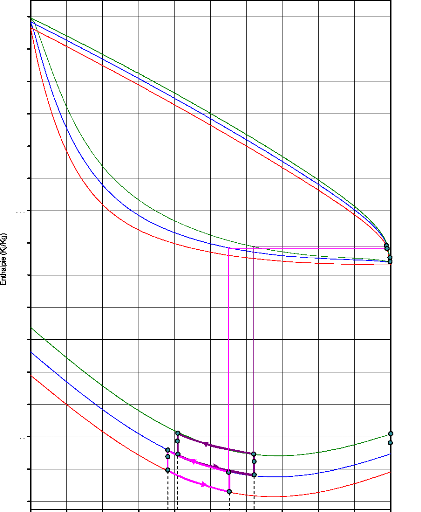
1600
1400
1200
1000
|
|
|
|
|
|
|
|
|
|
|
16.98 bar
8.08
|
|
|
|
|
|
|
|
|
|
3.47 bar
|
|
|
|
|
|
|
|
|
|
16.98 bar
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8.08
|
|
|
|
|
|
|
|
|
|
3.47 bar
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16.98 bar
|
|
|
|
|
|
|
|
|
|
|
8.08
|
|
|
|
|
|
|
|
|
|
|
3.47 bar
|
|
|
11
|
|
|
|
|
|
|
|
|
|
12
3
13
|
|
2
|
10
9
|
|
|
|
|
4
|
|
|
|
|
5
|
|
6
|
8
|
|
|
|
|
|
|
î5
|
î13
|
î6
|
î8
|
|
|
|
2800
2600
2400
2200
2000
1800
800
600
400
200
0
-200
14
7
19
18
15
16, 17
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
Concentration massique de l'ammoniac
Figure V.8. Représentation
schématique de l'exemple dans un diagramme (H,î)
V.1.6. Dimensionnement d'un organe de cycle Exemple :
dimensionnement de l'évaporateur :
- Les données du calcul :
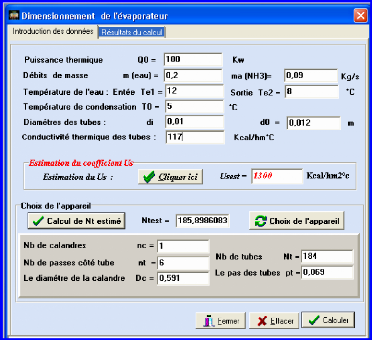
Figure V.9. Données du calcul pour le
dimensionnement de l'évaporateur
- Résultat de calcul :
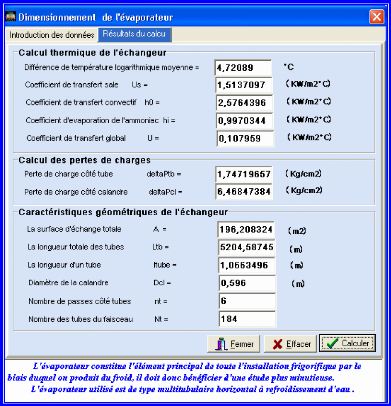
Figure V.10. Résultats du calcul de
dimensionnement de l'évaporateur
V.2. Influence de certains paramètres sur la
performance des cycles
Les calculs ont été effectués pour une
capacité de réfrigération de 100 KW au niveau de
l'évaporateur pour les deux cycles simple et à deux
étages.
V.2.1. Procédé de calcul
Pour voir l'influence de certains paramètres sur la
performance de notre système, on a tracé des courbes traduisant
les variations suivantes :
y' Variation du COP en fonction de la température du
bouilleur, avec les températures de
l'évaporateur et du condenseur constantes et la
température de l'absorbeur variante ;
y' Variation du COP en fonction de la température du
bouilleur, avec les températures de
l'évaporateur et de l'absorbeur constantes et la
température du condenseur variante ;
y' Variation du COP en fonction de la température du
condenseur, avec les températures de
l'évaporateur et du bouilleur constantes et la
température de l'absorbeur variante ;
y' Variation du COP en fonction de la température de
l'évaporateur, avec les températures
du condenseur et du bouilleur constantes et la
température de l'absorbeur variante ;
V.2.2. Machine à absorption à simple
étage
1- COP=f(Tb, Tab) avec TC et T0
constantes
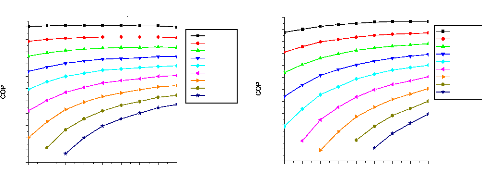
Température du condenseur TC=20 °C
Température d'évaporateur T0=5 °C
Température du condenseur TC=25 °C
Température d'évaporateur T0=5 °C
0,62
Tab=20 °C Tab=22.5 °C
Tab=25 °C Tab=27.5 °C Tab=30 °C
Tab=32.5 °C Tab=35 °C Tab=37.5
°C Tab=40 °C
0,50
70,0 72,5 75,0 77,5 80,0 82,5 85,0 87,5 90,0
0,60
0,58
0,56
0,54
0,52
0,48
0,46
0,44
0,42
0,40
0,38
70,0 72,5 75,0 77,5 80,0 82,5 85,0 87,5 90,0
Tab=20 °C Tab=22.5 °C
Tab=25 °C Tab=27.5 °C Tab=30 °C
Tab=32.5 °C Tab=35 °C Tab=37.5
°C Tab=40 °C
0,64
0,62
0,60
0,58
0,56
0,54
0,52
0,50
0,48
0,46
0,44
0,42
Tb (Bouilleur)
Figure V.11. Variation du COP= f (Tb,
Tab) avec
TC=20 °C .
T (Bouilleur)
Figure V.12. Variation du COP= f (Tb,
Tab) avec
TC=25 °C .
|
Température du condenseur TC=30 °C
Température d'évaporateur T0=5 °C
|
Température du condenseur TC=35 °C
Température d'évaporateur T0=5 °C
|
70,0 72,5 75,0 77,5 80,0 82,5 85,0 87,5 90,0 70,0 72,5 75,0 77,5
80,0 82,5 85,0 87,5 90,0
Tb (Bouilleur) Tb (Bouilleur)
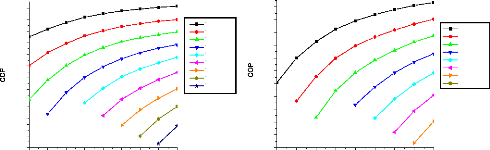
0,58
0,56
0,54
0,52
0,50
0,48
0,46
0,44
0,42
0,40
0,38
0,36
0,34
Tab=20 °C Tab=22.5 °C
Tab=25 °C Tab=27.5 °C Tab=30 °C
Tab=32.5 °C Tab=35 °C Tab=37.5
°C
0,54
0,52
0,50
0,48
0,46
0,44
0,42
0,40
0,38
0,36
0,34
0,32
Tab=20 °C Tab=22.5 °C
Tab=25 °C Tab=27.5 °C Tab=30 °C
Tab=32.5 °C Tab=35 °C Tab=37.5
°C Tab=40 °C
Figure V.13. Variation du COP= f (Tb,
Tab) avec Figure V.14. Variation du
COP= f (Tb, Tab) avec
TC=30 °C . TC=35 °C .
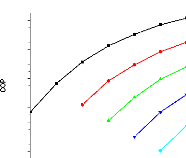
Température du condenseur TC=40 °C
Température d'évaporateur T0=5 °C
0,50
0,48
0,46
0,44
0,42
0,40
0,38
0,36
0,34
0,32

Tab=20 °C Tab=22.5 °C
Tab=25 °C Tab=27.5 °C Tab=30 °C
Tab=32.5 °C
75,0 77,5 80,0 82,5 85,0 87,5 90,0
Tb (Bouilleur)
Figure V.15. Variation du COP= f (Tb,
Tab) avec
TC=40 °C .
Les figures [(V. 11),... (V. 15)], représentent la
variation du coefficient de performance en fonction des températures du
bouilleur, du condenseur et de l'absorbeur en maintenant la température
de l'évaporateur à 5 °C.
On constate, que l'augmentation des températures du
condenseur et de l'absorbeur de (20#177;40 °C) provoque une
diminution du COP de :
> (0.643#177;0.434) pour la température du
condenseur 20 °C, figure (V.1 1) ; > (0.606#177;0.398) pour la
température du condenseur 25 °C, figure (V.12) ; >
(0.83#177;0.347) pour la température du condenseur 30 °C,
figure (V.13) ; > (0.547#177;0.327) pour la température du
condenseur 35 °C, figure (V.14) ; > (0.503#177;0.321) pour la
température du condenseur 40 °C, figure (V. 15) ;
Ces augmentations de température engendrent dans certains
cas des intervalles où la machine ne peut plus fonctionner.
2- COP=f(Tb, TC) avec Tab et T0
constantes
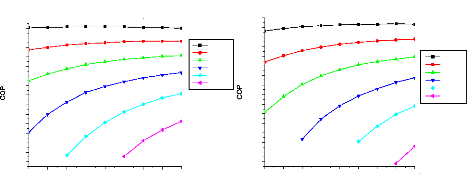
70,0 72,5 75,0 77,5 80,0 82,5 85,0 87,5 90,0
Tb (Bouilleur °C )
70,0 72,5 75,0 77,5 80,0 82,5 85,0 87,5 90,0
Tb (Bouilleur °C )
Température de l'absorbeur Tab=25 °C
Température de l'évaporateur T0=5 °C
Température de l'absorbeur Tab=20 °C
Température de l'évaporateur T0=5 °C
0,62
0,60
0,58
0,56
0,54
0,52
0,50
0,48
0,46
0,44
0,42
0,40
0,38
0,36
0,34
0,32
0,64
0,62
0,60
0,58
0,56
0,54
0,52
0,50
0,48
0,46
0,44
0,42
0,40
0,38
0,36
TC=20 °C TC=25 °C
TC=30 °C TC=35 °C TC=40
°C TC=45 °C
TC=20 °C TC=25 °C
TC=30 °C TC=35 °C TC=40 °C
TC=45 °C
Figure V.16. Variation du COP= f (Tb, TC)
avec
Tab=20 °C .
Figure V.17. Variation du COP= f (Tb, TC)
avec
Tab=25 °C .
Température de l'absorbeur Tab=30
°C
Température de l'évaporateur T0=5
°C
70,0 72,5 75,0 77,5 80,0 82,5 85,0 87,5 90,0
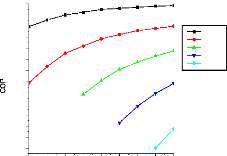
0,58
0,56
0,54
0,52
0,50
0,48
0,46
0,44
0,42
0,40
0,38
0,36
0,34
0,32
TC=20 °C TC=25 °C
TC=30 °C TC=35 °C TC=40 °C
70,0 72,5 75,0 77,5 80,0 82,5 85,0 87,5 90,0
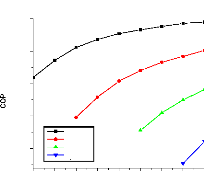
0,55
0,53
0,50
0,48
0,45
0,43
0,40
0,38
0,35
0,33
Température de l'absorbeur Tab=35
°C
Température de l'évaporateur T0=5
°C
TC=20 °C TC=25 °C
TC=30 °C TC=35 °C
Tb (Bouilleur °C )
Figure V.18. Variation du COP= f (Tb,TC)
avec
Tab=30 °C .
Tb (Bouilleur °C )
Figure V.19. Variation du COP= f (Tb,TC)
avec
Tab=35 °C .
On remarque que pour les figures [(V.16),... (V.19)], pour une
température de l'absorbeur et de l'évaporateur constante, le
coefficient de performance augmente avec l'augmentation de la
température du bouilleur, mais il diminue avec l'augmentation de la
température du condenseur.
La figure (V.19), montre que si la température du
condenseur TC =45 °C et la température de l'absorbeur
Tab=30 °C avec la température de
l'évaporateur T0 =5 °C, le cycle est pratiquement
impossible a réaliser, même remarque pour la figure (V. 19), si la
température du condenseur TC = (40÷45 °C).
3- COP=f(TC, Tab) avec Tb et T0
constantes
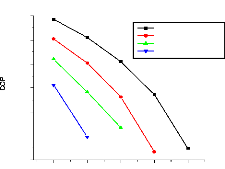
Température du bouilleur Tb=75 °C
Température de l'évaporateur T0=5
°C
0,65
0,50
0,45
0,40
0,35
20 25 30 35 40
0,60
0,55
Température Tab=20 °C
Température Tab=25 °C Température
Tab=30 °C Température Tab=35 °C
La figure (V.20), montre que la variation du coefficient de
performance est une fonction décroissante avec l'augmentation de la
température du condenseur pour chaque température de l'absorbeur,
et croissante avec la diminution de la température de l'absorbeur et
l'augmentation de la température du bouilleur.
TC (Condenseur °C)
Figure V.20. Variation du COP= f (TC,
Tab) avec
Tb=75 °C .
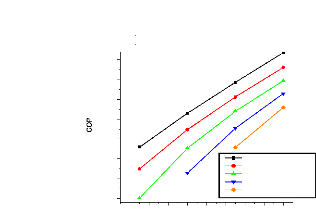
4- COP=f(T0, Tab) avec Tb et TC
constantes
Température du condenseur TC=20
°C
Température du bouilleur Tb=80 °C
0,70
0,68
0,65
0,63
0,60
0,58
0,55
0,53
0,50
0,48
Température Tab=20 °C.
Température Tab=25 °C. Température
Tab=30 °C. Température Tab=35 °C.
Température Tab=40 °C.
-6 -4 -2 0 2 4 6 8 10
0,45
0,43
0,40
0,38
0,35
T0 (Evaporateur °C)
Figure V.21. Variation du COP= f (T0,
Tab) avec
Tb=80 °C.
On remarque d'après la figure (V.21), que si :
y' La température de l'évaporateur est
supérieure à 0 °C, le coefficient de performance augmente
avec l'augmentation de la température de l'évaporateur et diminue
avec l'augmentation de la température de l'absorbeur ;
y' La température de l'évaporateur est
inférieure à 0 °C, le coefficient de performance diminue
avec la diminution de cette température.
Donc, plus la température de l'évaporateur est
basse, plus le coefficient de performance de la machine diminue.
Nous constatons d'après les résultats de
simulation d'une machine frigorifique à absorption à simple
étage illustrés par les graphes précédents, pour
obtenir un coefficient de performance maximal avec un minimum d'énergie
fournie au bouilleur, nous devons garder la température de condensation
et d'absorption les plus basses possible (20÷30 °C).
V.2.3. Machine à absorption à deux
étages
1- COP = f (T11 (bouilleur HP), T3 (bouilleur
BP), T8 (absorbeur HP)) avec T6 (absorbeur BP), TC et T0 constantes
a- T6 (absorbeur BP) = 20 °C :
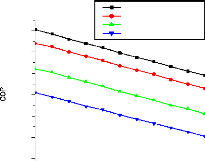
0,341
0,340
0,339
0,338
0,337
0,336
0,335
0,334
0,333
0,332
0,331
0,330
0,329
0,328
T6=20 °C (absorbeur BP) T8=40
°C (absorbeur HP) T0=5 °C (évaporateur)
TC=30 °C (condenseur)
T3=75 °C (bouilleur BP) T3=80
°C (bouilleur BP) T3=90 °C (bouilleur BP)
T3=100 °C (bouilleur BP)

0,327
T6=20 °C (absorbeur BP) T8=50
°C (absorbeur HP) T0=5 °C (évaporateur)
TC=30 °C (condenseur)
0,313
0,324
0,323
0,322
0,321
0,320
0,319
0,318
0,317
0,316
0,315
0,314
T3=75 °C (bouilleur BP) T3=80
°C (bouilleur BP) T3=90 °C (bouilleur BP)
T3=100 °C (bouilleur BP)
100 105 110 115 120 125
T11 (bouilleur HP °C)
Figure V.22. Variation du COP= f
(T11,T3) avec T8=40 °C
et T6=20 °C .
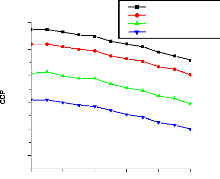
100,0 105,0 110,0 115,0 120,0 125,0
T11 (bouilleur HP °C)
Figure V.23. Variation du COP= f
(T11,T3) avec T8=50 °C
et T6=20 °C.
D'après les deux figures [(V.22) et (V.23)], on
remarque que le coefficient de performance de la machine diminue avec
l'augmentation de la température du bouilleur (HP) et augmente avec la
diminution de la température du bouilleur (BP).
La figure (V.24), montre que pour une température de
l'absorbeur (HP) de 60 °C, la performance de la machine augmente
sensiblement avec l'augmentation de la température du bouilleur (HP) et
diminue avec l'augmentation de la température du bouilleur (BP).
100 105 110 115 120 125
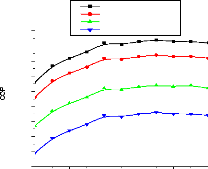
0,309
0,308
0,307
0,306
0,305
0,304
0,303
T6=20 °C (absorbeur BP) T8=60
°C (absorbeur HP) T0=5 °C (évaporateur) T
C=30 °C (condenseur)
0,300
0,302
0,301
T3=75 °C (bouilleur BP) T3=80
°C (bouilleur BP) T3=90 °C (bouilleur BP)
T3=100 °C (bouilleur BP)
T11 (bouilleur HP °C)
Figure V.24. Variation du COP= f
(T11,T3) avec T8=60 °C
et T6=20 °C .
b- T6 (absorbeur BP) = 30 °C :
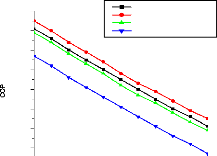
0,322
0,321
0,320
0,319
0,318
0,317
0,316
0,315
T6=30 °C (absorbeur BP) T8=40 °C
(absorbeur HP) T0=5 °C (évaporateur) TC=30
°C (condenseur)
T3=75 °C (bouilleur BP) T3=80
°C (bouilleur BP) T3=90 °C (bouilleur BP)
T3=100 °C (bouilleur BP)
0,302

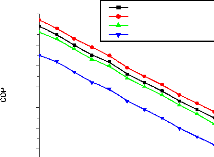
0,309
0,308
0,307
0,306
0,305
0,304
0,303
T6=30 °C (absorbeur BP) T8=50 °C
(absorbeur HP) T0=5 °C (évaporateur) TC=30
°C (condenseur)
T3=75 °C (bouilleur BP) T3=80
°C (bouilleur BP) T3=90 °C (bouilleur BP)
T3=100 °C (bouilleur BP)
0,314

100 105 110 115 120 125
T11 (bouilleur HP °C) 100 105 110 115 120 125
T11 (bouilleur HP °C)
Figure V.25. Variation du COP= f
(T11, T3) avec T8=40 °C
et T6=30 °C .
Figure V.26. Variation du COP= f
(T11, T3) avec T8=50 °C
et T6=30 °C .

0,2975
0,2970
0,2965
0,2960
0,2955
0,2950
0,2945
0,2940
0,2935
0,2930
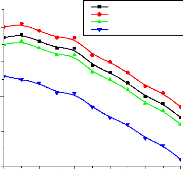
T6=30 °C (absorbeur BP) T8=60 °C
(absorbeur HP) T0=5 °C (évaporateur) TC=30
°C (condenseur)
T3=75 °C (bouilleur BP) T3=80
°C (bouilleur BP) T3=90 °C (bouilleur BP) T3=1
00 °C (bouilleur BP)
100 105 110 115 120 125
T11 (bouilleur HP °C)
Figure V.27. Variation du COP= f
(T11, T3) avec T8=60 °C
et T6=30 °C .
On remarque pour les figures [(V.25), (V.26) et (V.27)], que
le coefficient de performance diminue avec une valeur moyenne de 0.017 1, par
rapport à T6 =20 °C, lorsqu'on augmente les deux
températures des bouilleurs (HP) et (BP).
c- T6 (absorbeur BP) = 40 °C :
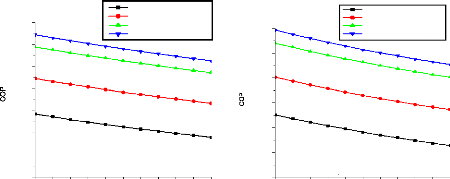
0,305
0,303
0,300
0,298
0,295
0,293
0,290
0,288
0,285
0,283
0,280
0,278
0,275
0,273
0,270
Température T6=40 °C (absorbeur BP)
Température T8=40 °C (absorbeur HP) Température
T0=5 °C (évaporateur) Température
TC=30 °C (condenseur)
T3=75 °C (bouilleur BP) T3=80
°C (bouilleur BP) T3=90 °C (bouilleur BP)
T3=100 °C (bouilleur BP)
0,295
0,293
0,290
0,288
0,285
0,283
0,280
0,278
0,275
0,273
0,270
0,268
0,265
Température T6=40 °C (absorbeur BP)
Température T8=50 °C (absorbeur HP) Température
T0=5 °C (évaporateur) Température
TC=30 °C (condenseur)
T3=80 °C (bouilleur BP) T3=85
°C (bouilleur BP) T3=90 °C (bouilleur BP)
T3=100 °C (bouilleur BP)
100 105 110 115 120 125 100 105 110 115 120 125
T11 (bouilleur HP °C) T11 (bouilleur HP °C)
Figure V.28. Variation du COP= f
(T11,T3) avec T8=40 °C
et T6=40 °C .
Figure V.29. Variation du COP= f
(T11,T3) avec T8=50 °C
et T6=40 °C .
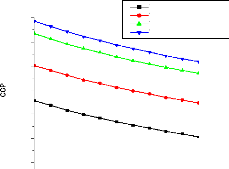
0,290
0,285
0,280
0,275
0,270
0,265
0,260
Température T6=40 °C (absorbeur BP)
Température T8=60 °C (absorbeur HP) Température
T0=5 °C (évaporateur) Température
TC=30 °C (condenseur)
T3=75 °C (bouilleur BP) T3=80
°C (bouilleur BP) T3=90 °C (bouilleur BP)
T3=100 °C (bouilleur BP)

100 105 110 115 120 125
T11 (bouilleur HP °C)
Figure V.30. Variation du COP= f
(T11, T3) avec T8=60 °C
et T6=40 °C .
Même remarque que les figures [(V.25), (V.26) et
(V.27)].
2- COP = f (T11 (bouilleur HP), TC) avec T8
(absorbeur HP), T6 (absorbeur BP), T3 (bouilleur BP) et T0
constantes
On constate d'après la
figure (V.31), que la diminution de la température du
condenseur et du bouilleur (HP) engendre une augmentation du coefficient de
performance considérable.
TC (condenseur °C)
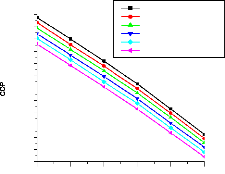
0,344
0,342
0,340
0,338
0,336
0,334
0,332
0,330
T3=90 °C (bouilleur BP) T6=20
°C (absorbeur BP) T8=40 °C (absorbeur HP) T0=5
°C (évaporateur)
0,320
20 25 30 35 40 45
0,328
0,326
0,324
0,322
T11= 100 °C (bouilleur HP) T11= 105 °C (bouilleur
HP) T11=110 °C (bouilleur HP) T11=115 °C
(bouilleur HP) T11= 120 °C (bouilleur HP) T11= 125 °C (bouilleur
HP)
Figure V.31. Variation du COP= f (TC ,
T11) avec T8=40 °C,
T3=90 °C et T6=40
°C.
3- COP = f (T0, T11 (bouilleur HP)) avec T8
(absorbeur HP), T6 (absorbeur BP), T3 (bouilleur BP) et TC
constantes

0,365
0,360
0,355
0,350
0,345
0,340
0,335
0,330
0,325
0,320
0,315
0,310
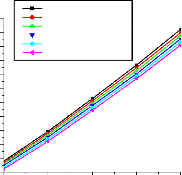
T11=100 °C (bouilleur HP) T11=105
°C (bouilleur HP) T11=110 °C (bouilleur HP)
T11=115 °C (bouilleur HP) T11= 120 °C (bouilleur HP) T11=
125 °C (bouilleur HP)
T3=90 °C (bouilleur BP) T6=20
°C (absorbeur BP) T8=40 °C (absorbeur HP) TC=30
°C (évaporateur)
La figure (V.32), montre que le coefficient de performance
augmente avec l'augmentation de la température de l'évaporateur
et diminue avec l'augmentation de la température du bouilleur (HP).
0,0 2,5 5,0 7,5 10,0
T0 (évaporateur °C)
Figure V.32. Variation du COP= f (T0 ,
T11) avec T8=40 °C,
T3=90 °C et T6=20 °C.
V.3. Validation des résultats
La validation d'un modèle, c'est la confrontation directe
de nos résultats à ceux obtenus soit par l'expérimentation
soit par d'autres modèles.
V.3.1. Validation des résultats de la chaleurs
latente de vaporisation Lv , de la variation d'entropie et celle du
volume
V.3.1.1. Pour l'ammoniac
?S (Kj/Kg.K)
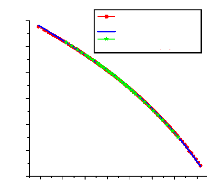
LV=hg-hL
J.S Gallagher
[50]
LV (Kj/Kg)
1500
1400
200 220 240 260 280 300 320 340
1300
1200
1100
1000
900
Résultats de
KUZMAN RAZNJEVIC [49]. Nos résultats.
Résultats de L. Haar et
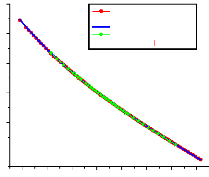
8
7
6
5
J.S Gallagher
[50]
?S=Sg-SL
4
3
200 220 240 260 280 300 320 340
Résultats de
KUZMAN RAZNJEVIC [49]. Nos résultats.
Résultats de L. Haar et
Température (K)
Figure V.33. Variation de la chaleur latente de
vaporisation de l'NH3=f(T).
Température (K)
Figure V.34. Variation de ?S de
l'NH3=f(T).
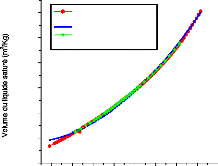
0,0013
J.S Gallagher
[50]
0,0019
0,0018
0,0017
0,0016
0,0015
0,0014
Résultats de
KUZMAN RAZNJEVIC [49]. Nos résultats.
Résultats de L. Haar et
200 220 240 260 280 300 320 340 360 Température (K)
Figure V.35. Variation du volume liquide
NH3=f(T).
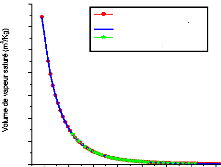
14
12
10
4
8
6
2
0
J.S Gallagher
Résultats de
KUZMAN RAZNJEVIC
Nos résultats. Résultats de L. Haar et
[50]
[49].
200 220 240 260 280 300 320 340 Température (K)
Figure V.36. Variation du volume gazeux
NH3=f(T).
Pour une pression (ou une température) donnée,
Lv (chaleur latente de vaporisation) est égale
à l'écart entre les deux courbes (phase liquide et phase vapeur)
de la figure (V.4). Cette figure montre que l'écart (Lv)
diminue lorsque la pression augmente, ce qui explique les résultats
de la figure (V.34).
La figure (V.34), montre que l'augmentation de la
température fournie une diminution du ?S (l'écart entre
l'entropie de la phase vapeur et la phase liquide). Même constation pour
le volume de la vapeur saturé figure (V.36). La figure (V.4),
représente le diagramme de Mollier (log P,h), fait une mise au
point de clarté ce que nous constatons dans la figure (V.36).
On remarque dans la figure (V.35), que l'augmentation de la
température provoque une augmentation du volume liquide
saturé.
V.3.1.2. Pour l'eau
10
LV (Kj/Kg) 2600
?S (Kj/Kg.°K)
280 320 360 400 440 480 520 560 600
2400
2200
2000
1800
1600
1400
1200
LV=hg-hL
Résultats de
KUZMAN RAZNJEVIC
Nos résultats.
Résultats de M.J MORAN et
H.N SHAPIRO
[51]
[49].
9
8
7
6
5
4
3
H.N SHAPIRO
[51]
?S=Sg-SL
2
1
280 320 360 400 440 480 520 560 600
Résultats de
KUZMAN RAZNJEVIC [49]. Nos résultats.
Résultats de M.J MORAN et
Température (K) Température (K)
Figure V.37. Variation de la chaleur latente de
vaporisation de l'H2O=f(T). Figure V.38. Variation de
?S de l' H2O=f(T).
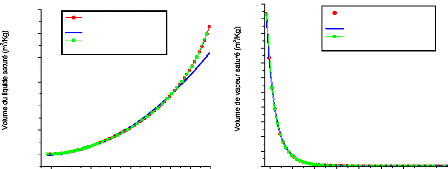
0,0016
0,0015
0,0014
0,0013
0,0012
0,0011
0,0010
Résultats de
KUZMAN RAZNJEVIC [49]. Nos résultats.
Résultats de M.J MORAN et
H.N SHAPIRO
[51]
220
200
180
160
140
120
100
40
20
80
60
0
Résultats de
KUZMAN RAZNJEVIC [49]. Nos résultats.
Résultats de M.J MORAN et
H.N SHAPIRO
[51]
280 320 360 400 440 480 520 560 600 280 320 360 400 440 480 520
560 600
Température (K) Température (K)
Figure V.39. Variation du volume liquide H2O
=f(T). Figure V.40. Variation du volume gazeux H2O
=f(T).
Pour l'eau mêmes remarques.
Nous choisissons pour la validation du modèle
d'enthalpie, d'entropie et de volume pour les deux corps NH3 et
H2O, deux tests, le test de Student et le
test du coefficient de corrélation [48]. Ils s'appliquent donc
concrètement lorsqu'on dispose de données
présentées sous forme de deux distributions numériques,
l'une correspondant par exemple au modèle de référence
[49],[50] et [51], l'autre correspondant
à nos résultats.
Si Xi, i = l... n est la distribution relative
aux résultats du KUZMAN RAéNJEVIC [49] ;
Yi , i = 1... n celle de nos résultats ;
di =Yi - Xi, i= 1... n distribution des
différences ;
d moyenne empirique de di ;
L'écart-type de cette distribution de différences
est :

=
sd
( )
d d
-
i
?
i
=
1
n
1
-
(V.1)
n
En effectuent le test et en calculant la statistique T
définie par :

T
Si T t á
: > , le modèle est invalide.
n
1,
2
Où
t á
- est la valeur lue pour le seuil de signification (á
/2) dans la table de Student à n-1
:
2
n 1,
degrés de liberté, Annexe (10).
|
Ammoniac
|
Eau
|
Remarque
|
|
T
|
t á
n - 1, 2
|
Coeff. de
Corrélation r
|
T
|
t- á
n 1,
2
|
Coeff. de
Corrélation r
|
|
Enthalpie
|
0.289
|
0.386
|
0.9999
|
0.7466
|
0.845
|
0.9977
|
Valide
|
|
Entropie
|
0.253 1
|
0.386
|
0.9999
|
0.9246
|
1.041
|
0.9997
|
Valide
|
|
Volume liquide
|
0.6088
|
0.677
|
0.9987
|
0.7 18
|
0.845
|
0.9926
|
Valide
|
|
Volume gazeux
|
0.430
|
0.526
|
0.9999
|
0.7568
|
0.845
|
0.9999
|
Valide
|
Tableau V.3. Résultats obtenues par les
deux tests de validation.
On est donc amené à conclure que les
modèles mathématiques de Michel FEIDT [33],
s'appliquent pour les propriétés thermodynamiques de la solution
binaire NH3-H2O, ils représentent une bonne concordance avec
les tables thermodynamiques du NH3 et H2O de KUMAN
RAéNJEVIC [49], et de L. HAAR et J.S. GALLAGHER
[50], et de MICHAEL.J et HOWARD.N [51].
V.3.2. Validation du coefficient de performance d'une
machine à absorption à simple étage
Pour la simulation thermodynamique d'un cycle à
absorption NH3-H2O à simple étage, nous avons choisis
des performances données par le constructeur COLIBRI
[52],[17], pour la comparaison du COP. Les conditions de
fonctionnement choisies sont :
> La température du bouilleur Tb = 120 °C ;
> La température du condenseur TC = 30 °C ; >
La température de l'absorbeur Tab =30 °C
;
> La température de l'évaporateur T0 = (0
÷ 10 °C) ; > Le rendement des échangeurs ç
= 0.8.
Le tableau (V.4), présente une comparaison entre nos
résultats et les performances données par le constructeur COLIBRI
pour le COP.
|
T
(Evaporation)
|
COP
( Nos résultats )
|
COP
(COLIBRI)
|
Erreur
%
|
|
0
|
0,497
|
0,56
|
11,25
|
|
2,5
|
0,525
|
0,58
|
9,48
|
|
5
|
0,553
|
0,59
|
6,27
|
|
7,5
|
0,581
|
0,60
|
3,16
|
|
10
|
0,611
|
0,62
|
1,45
|
|
Erreur moyenne
|
6.32
|
Tableau V.4. Comparaison du COP.
0,62
Nos résultats.
Résultats de COLIBRI [43],[17].
0,60
0,58
0,54
0,52 Température du condenseur =30 °C
Température de l'absorbeur =30 °C Température
du bouilleur = 120 °C
0,50
0,48
0,0 2,5 5,0 7,5 10,0
T (évaporateur °C)
Figure V.41. Comparaison des deux
résultats de COP (Par SARM et le constructeur COLIBRI).
On note que les résultats de la figure (V.4 1),
obtenus par le logiciel "SARM" ont une bonne concordance avec
les résultats donnés par ce constructeur.
V.3.3. Validation du coefficient de performance d'une
machine à absorption à deux étages
La température de l'absorbeur et celle du
condenseur sont maintenues à 30 °C. Nous
annonçons les résultats obtenus par les deux programmes
"SARM" et "ABSIM" du processus à deux étages
entraîné par l'eau chaude à des températures
(90÷110 °C). Par l'analyse comparative des
résultats obtenues du coefficient de performance par le programme
"ABSIM" et le programme "SARM", pour des gammes des
températures à la sortie de l'évaporateur
comprises entre (0 ÷ 10 °C), on obtient les
résultats suivants tableau (V.5).
|
T0
|
0
|
2.5
|
5
|
7.5
|
10
|
|
ABSIM
|
SARM
|
ABSIM
|
SARM
|
ABSIM
|
SARM
|
ABSIM
|
SARM
|
ABSIM
|
SARM
|
|
Tb90
|
0,348
|
0,315
|
0,347
|
0,326
|
0,345
|
0,339
|
0,347
|
0,349
|
0,349
|
0,361
|
|
95
|
0,341
|
0,314
|
0,34
|
0,325
|
0,338
|
0,336
|
0,34
|
0,347
|
0,342
|
0,358
|
|
100
|
0,334
|
0,313
|
0,333
|
0,323
|
0,332
|
0,333
|
0,334
|
0,345
|
0,335
|
0,354
|
|
105
|
0,328
|
0,311
|
0,327
|
0,321
|
0,326
|
0,331
|
0,327
|
0,343
|
0,329
|
0,352
|
|
110
|
0,322
|
0,308
|
0,321
|
0,32
|
0,319
|
0,329
|
0,321
|
0,341
|
0,323
|
0,349
|
|
Erreur
moyenne
|
6,644
|
3,123
|
1,460
|
3,410
|
5,766
|
Tableau V.5. Comparaison du COP pour les deux
programme SARM et ABSIM.
90 95 100 105 110
Figure V.42. Comparaison des résultats
obtenus par ABSIM et SARM du COP= f (Tb) avec T0=0 °C .
Tb (bouilleur °C)
90 95 100 105 110
Tb (bouilleur °C)
Figure V.43. Comparaison des résultats
obtenus par ABSIM et SARM du COP= f (Tb) avec T0=2.5 °C .
Chapitre V Analyse des résultats et validation
du programme.
0,350
0,345
0,340
0,335
0,330
0,325
0,320
0,3 15
0,3 10
0,305
0,300
Température de l'évaporateur T0=0
°C
COP par ABSIM
COP par SARM
0,350
0,348
0,345
0,343
0,340
0,338
0,335
0,333
0,330
0,328
0,325
0,323
0,320
Température de l'évaporateur T0=2.5
°C
COP par ABSIM
COP par SARM
Température de l'évaporateur T0=1 0
°C
0,363
0,320
0,360
0,358
0,355
0,353
0,350
0,348
0,345
0,343
0,340
0,338
0,335
0,333
0,330
0,328
0,325
0,323
COP par ABSIM
COP par SARM
90 95 100 105 110
Tb (bouilleur °C)
Température de l'évaporateur T0=5
°C
0,346
0,344
0,342
0,340
0,338
0,336
0,334
0,332
0,330
0,328
0,326
0,324
0,322
0,320
0,318
COP par ABSIM
COP par SARM
90 95 100 105 110
Tb (bouilleur °C)
Figure V.44. Comparaison des résultats
obtenus par ABSIM et SARM du COP= f (Tb) avec T0=5 °C .
0,350
0,348
0,345
0,343
0,340
0,338
0,335
0,333
0,330
0,328
0,325
0,323
0,320
Température de l'évaporateur T0=7.5
°C
COP par ABSIM
COP par SARM
90 95 100 105 110
Tb (bouilleur °C)
Figure V.45. Comparaison des résultats
obtenus par ABSIM et SARM du COP= f (Tb) avec T0=7.5 °C .
0,345
0,343
0,340
0,338
0,335
0,333
0,330
0,328
0,325
Température des absorbeur Tab=30
°C
Température du condenseur TC=30
°C
Température de l'évaporateur T0=5
°C
0,315
0,323
0,320
0,318
60 70 80 90 100 110 120 130 140 150
Tb (bouilleur °C)
Les figures [(V.42),... (V.46)], montre que pour une
augmentation de la température du bouilleur et pour différentes
températures de l'évaporateur, le coefficient de performances
diminue pour les deux programmes "SARM" et
"ABSIM", parce que le coefficient de performance atteint un
maximum à une température limite du bouilleur puis diminue
faiblement, il est presque linéaire figure (V.47).
Conclusion
En conclusion, on remarque que dans la méthode
analysée, l'erreur moyenne d'approximation entre le programme
"SARM" et le programme "ABSIM"
(considéré la base de calcul), est inférieur à
4.1 %.
Etant donné le fait que le programme
"ABSIM", développé par Grossman et Wilk
(1992) spécialement pour la simulation des cycles à
absorption, est un programme reconnue sur le plan mondial, on conclut que, le
programme "SARM", développé dans le cadre du
mémoire de magister au sein du Laboratoire de Recherche des Technologies
Industrielles, Département de Génie Mécanique,
Université Ibn Khalddoun- Tiaret, simule les processus thermodynamiques
qui ont lieu dans le cadre des installations frigorifiques à absorption
fonctionnant avec le couple NH3-H2O, avec satisfaction.
Donc, le coefficient de performance n'est pas un
critère suffisant à lui seul pour le choix optimal de la machine,
mais des paramètres essentiels qui influent énormément sur
la performance de la machine :
Tel que :
> La température du bouilleur Tb ;
> La température du condenseur TC ; > La
température de l'absorbeur Tab ; > La température de
l'évaporateur T0 .
Conclusion générale
et
Perspectives
La production du froid par absorption a un avenir prometteur
puisque les systèmes à compression de la vapeur hydrocabone
halogène, communément vendus sous le nom de
FREON, son appelés à disparaître de par
leur effets néfastes sur la couche d'ozone.
Cette étude, a montré que l'analyse
fonctionnelle de la machine frigorifique à absorption NH3-H2O
nécessite le choix d'un nombre important de paramètres ayant une
influence direct sur le fonctionnement de celle-ci.
Suivant le mode d'abordement du sujet traité, ce
mémoire apporte une série de contributions intéressante
tel que :
1- L'étude d'une vaste documentation ;
2- L'amélioration de nos connaissances dans le domaine de
la programmation DELPHI ;
3- L'étude des systèmes à absorption
NH3-H2O, et la modélisation numériquement des
propriétés thermodynamiques et de transport de cette solution.
Dans ce but nous avons :
a- Etabli des fonctions pour calculer les
propriétés thermodynamiques de la solution NH3-H2O ;
b- Conçu une base de données pour stocker tous les
résultats de simulation ;
c- Conçu des tables des propriétés
thermodynamiques et de transport pour NH3 et H2O ;
d- Fait la conception assisté par ordinateur des deux
diagrammes d'Oldham et de Merkel, qui permettent la détermination de
tous les paramètres thermodynamiques d'un point connaissant seulement
deux paramètres soit : (pression, température), (pression,
concentration) et (température, concentration). La nouveauté de
cette conception assistée est l'élargissement de la plage
d'utilisation pour le diagramme de Merkel :
> Pour la pression de : 0.1 jusqu'à 50 bars
;
> Pour la température de : 213.15
jusqu'à 513.15 K.
e- Crée des procédures qui sont
incorporées dans le logiciel "SARM" et qui permettent
d'introduire les données, le remplissage, le vidage de la base de
données et l'affichage des résultats ;
4- A partir de l'analyse comparative des résultats de
la simulation par "SARM", et les résultats
données par le constructeur COLIBRI [52], pour le cycle
à simple étage et ceux obtenus par la simulation sur la base du
programme "ABSIM" pour le cycle à deux étages,
on peut observer une concordance relativement bonne (l'erreur est
inférieur à 6.35 % pour le cycle à simple
étage, et est inférieur à 4.1 % pour le
cycle à deux étages). Ce qui nous mène à dire que
le logiciel de simulation "SARM", développé au
cours de cette réalisation de ce mémoire donne de bons
résultats.
Perspectives et études futures :
Par la suite, il serait intéressant de poursuivre ce
travail sur les quatre axes suivant :
1- Le fonctionnement des machines à absorption en
régime transitoire ;
2- D'autre critères d'optimisation du cycle (le rendement
éxèrgétique maximal, la puissance frigorifique maximale)
;
3- Le développement du logiciel "SARM"
par :
a- L'élargissement de la base de données des
propriétés thermodynamiques et de transport pour de nouveaux
couples binaires :
LiBr-H2O, NH3-H2O-NaOH, NH3-LiNO3,
NH3-NaSCN et les mélanges d'alcanes (n-C4H10/C5H12,
i-C4H10/C5H12, ......) ;
b- L'introduction d'autres modèles thermodynamiques qui
déterminent les propriétés des solutions binaires ;
c- Une meilleure flexibilité ;
4- La mise en place d'un prototype en site réel pour
confirmation définitive de la validité des résultats avec
obtention d'information telles que :
a- Longévité de fonctionnement ;
b- Action de l'environnement sur le système.
Enfin, nous souhaitons que cette étude soit un outil de
travail utile pour les futures promotions.
Bibliographie
Bibliographie
[1] MEUNIER.F, KOUSCHIC.S.C
Comparative thermodynamic study of sorption systems, second lan
analysis. In.J. of Refrigeration, Vol 19, 1996, GB ;
[2] PIERRE RAPIN
Formulaire du froid.
10ème Edition, DUNOD ;
[3] IIR (INTERNATIONAL INSTITUTE OF REFRIGERATION)
Aperçu sur l'Histoire du Froid
Site web : http://www.iifiir.org/ (site consulté
en novembre 2005) ;
[4] GEAROID FALAY, ROBERT DEVANT, RICHARD SWEATSER
The future of absorption technology in America.
Advanced Building Systems -2001- ;
[5] SHARIZAL SHAIK AHMEDULLAH
Integrated solar energy and absorption cooling model,
Thèse doctorat, Michigan Technological University -2005- ;
[6] R. M. LAZZARIN, A. GASPARELLA, G. A.
LONGO
Ammonia-water absorption machines for refrigeration: theoretical
and real performances. 1996 (ELSEVIER) ;
[7] S.A AKAM , N SAID, Z. OUCHICHA, B. BELLAL
Expérimentation d'une boucle à absorption NH3-H2O, (Rev.
Energ. Ren) p 17-22 -1999- ;
[8] GUERMIT TAHAR
Analyse et simulation d'une machine frigorifique à
absorption couplée à l'énergie solaire, application dans
la région de Ouargla.
Thèse de Magister -2000- Université de Ouargla
;
[9] A. DOBBI
Climatisation solaire, système à absorption.
Thèse de Magister -2000- Université de Ouargla ;
[10] KhALID.A. JOUDI, ALI.H. LAFTA
Simulation of a simple absorption refrigeration system. 2001
(PERGAMON) ;
[11] Y. KAITA
Simulation results of triple-effect absorption cycles
2002 (ELSEVIER) ;
[12] H.T. CHUA, H.K. TOH, K.C. NG
Thermodynamic modeling of an ammonia-water absorption chiller
2002 (ISEC) USA ;
[13] N.BENEZZINE, M.BARHOUMI, S.CHEMKHI, A.BELLAGI
Solar cooling with the absorption principle.
2004 (ELSEVIER) ;
[14] N. CHEKIR, KH. MEJBRI, A. BELLAGI
Simulation of an absorption chiller operating with alkane
mixtures 2006 (ELSEVIER) ;
[15] RHON-ALPES
La climatisation solaire par absorption.
Energie Environnement
Site web :
www.raee.org (site consulté en
décembre 2005) ;
[16] EUROPEAN COMISSION CHOSE
Absorption Chillers
Site web:
www.absorptionchillers.com
(site consulté en décembre 2005) ;
[17] ROBERT A. ZOGG, MICHAEL Y. FENG, DETLEF WESTPHALEN
Guide to Developing Air-Cooled LiBr Absorption for Combined
Heat and Power Applications
U.S. Departement of Energy, April 2005 ;
[18] JEAN CASTAING-LASVIGNOTTES
Aspects thermodynamiques et technico-économique des
systèmes à absorption liquide. Institut Français du froid
industriel, -2001- ;
[19] KEITH.E.HEROLD, STANDFORD Absorption
chillers and heat pumps. 1996 Crs press ;
[20] PIERRE RAPIN, PATRICK JACQUARD Technologie
des installations frigorifiques 8ème édition DUNDO -2004- ;
[21] GEORGES VRINAT
Technique de l'Ingénieur,
Production du froid - Machine frigorifique à absorption,
B 551 p1-7 -2001- ;
[22] PIERRE NEVEU
Absorption liquide machine,
Site web:
http://www.neveu.pierre.free.fr
(site consulté en novembre 2006);
[23] ENICK, R.M., DONAHEY, G.P., HOLSINGER
Modeling the high-pres sure ammonia-water system with WAT AM and
the Peng-Robinson Equation of state for Kalina cycle studies,
Ind. Eng. Chem. Res., vol. 37, p. 1644-1650 -1998- ;
[24] WEBER, L.A
Estimating the virial coefficients of the ammonia + water
mixture, Fluid Phase Equilibria, vol. 162, no. 1-2: p. 31-49 -1999-
;
[25] RUKES, B., DOOLEY, R.B
Guideline on the IAPWS formulation 2001 for the thermodynamic
properties of ammonia- water mixtures, IAPWS (The International Association for
the Properties of Water and Steam) 2001, Maryland-USA ;
[26] ZIEGLER, B., TREPP, C
Equation of state for ammonia-water mixtures,
Int. J. Refrig., vol. 7, no. 2 March: p. 101-106, -1984-
;
[27] IBRAHIM, O.M., KLEIN, S.A
Thermodynamic properties of ammonia-water mixtures, ASHRAE
Trans. Symposia, vol. 21, no. 2: p. 1495-1502, -1993- ;
[28] XU, F., YOGI GOS WAMI, D
Thermodynamic properties of ammonia-water mixtures for
power-cycle applications, Energy, vol. 24, no. 6:p. 525-536, -1999- ;
[29] JORDAN, D.P
Aqua-ammonia properties,
Department of Mechanical Engineering,
Texas Tech University, Lubbock-Texas, 19 p, -1997- ;
[30] NAG, P.K., GUPTA
Exergy analysis of the Kalina cycle,
Applied Thermal Engineering, vol. 18, no. 6: p. 427-439, -1997-
;
[31] M. CONDE
Thermophysical properties of NH3-H2O solutions for the
industrial design of absorption refrigeration equipments,
M. Conde Engineering -2004- ;
[32] PAUL ROUX, JEAN-ROBERT SEIGNE
Thermodynamique, physique et chimique Ellipses, édition
Marketing SA, -1998- ;
[33] MICHEL FEIDT, AMER HAJ TALEB, OLIVIER LOTTIN
Thermodynamic properties of ammonia-water mixtures.
Internationnal Congress of Refrigeration 2003, Washington, ICR
0113.
[34] EL-SAYED, Y.M., TRIBUS
Thermodynamic properties of water-ammonia mixtures theoretical
implementation for use in power cycles analysis.
ASME Paper AES, American Society of Mechanical Engineers, vol. 1:
p. 89-95, 1985.
[35] BENAOUDIA MOHAMED
Les contributions à l'optimisation en régime
stationnaire des installations frigorifiques à absorption avec la
solution Hidro-Ammoniacale.
Université Technique de Construction BUCAREST,
Thèse de Doctorat -2001- ;
[36] :
1999
[37] PIERR WUITHIER
Raffinage et génie chimique, tome II, 2ème Edition
Technip, Paris, -1955- ;
[38] JEAN FRANÇOIS SACADURA Initiation
aux transferts thermiques Technique et documentation, -1978- ;
[39] JACQUES PADET
Echangeurs thermiques, méthodes globales de calcul.
Edition Masson, Paris, -1993- ;
[40] JEAN CASTAING-LASVIGNOTTES
Technologie et principes de fonctionnement des échangeurs
de chaleur. Institut Français du froid industriel, -2001- ;
[41] REALD Q. KERN
Process heat transfert,
Mc gran Hill Company -1956- ;
[42] W.A. BECKHAN, S.A. KLEIN AND J.A. DUFFIE
Solar heating design,
Wiley-interscience, NEWYORK -1977- ;
[43] GAS PROCESSORS SUPPLIERS ASSOCIATION Heat
exchangers, ENGINEERING DATA BOOK Eleventh Edition -- SI -1998- ;
[44] DAE.WEN. SUN
Comparison of the performance of NH3-H2O, NH3-LiNO3
and NH3-SCN absorption refrigeration systems,
Energy Conversion, vol 39, N° 5/6, p357-368 -1998- ;
[45] D.S. KIM AND C.A. INFANTE FERREIRA
Solar absorption cooling,
Delft University of Technology
Laboratory for Refrigeration and Indoor Climate Technology 1
ère progresses report -October 2003-
[46] GERSHON GROSSMAN
ABSIM, Modular Simulation of Absorption Systems, User's guide
and reference, OAK Ridge National Laboratory, Tennesse 37831. USA, -Mars 1998-
;
[47] GERSHON GROSSMAN, ABDI ZALTASH ABSIM,
Modular Simulation of Absorption Systems, International Journal of
Refrigeration p531-543, - 2001- ;
[48] J.N BALÉO, B.BOURGES, PH. COURCOUX,
C.FAUR-BRASQUET Méthodes et outils pour les
expérimentations scientifiques,
Edition TEC&DOC -2003- ;
[49] KUZMAN. RAéNJEVIC
Tables et diagrammes thermodynamiques, Editions EYROLES -1970-
;
[50] L. HEAR, J.S. GALLAGHER
Thermodynamic properties of ammoniac,
J. Phys.Chem, Reference Data, Vol 7, -1996- ;
[51] MICHAEL J. MORAN, HOWARD N. SHAPIRO
Fundamentals of Engineering Thermodynamics, Third Edition, John Wiley
& Sons, Inc -1996- ;
[52] COLIBRI-STORK
Ammonia absorption refrigeration and cooling systems
Site web: http://www.colibri-stork.nl/ (Site
consulté en décembre 2006);
Liste des figures
Liste des tableaux
Liste des
organigrammes
Chapitre I : Étude et recherche bibliographique
sur les installations frigorifiques à absorption.
Figure I.1 Les ventes des
réfrigérateurs à absorption aux Etats-Unies et le Japon
.20
Figure I.2. Machine frigorifique à
absorption NH3-H2O en cours de montage (document Colibri) 21
Figure I.3. Domaine d'application et performance
des machine à absorption Colibri 22
Figure I.4. La gamme de puissance en KW de
quelques fabricants dans le monde ...23
Figure I.5.a. Refroidisseur de liquide à
absorption à simple étage.
Série ABS-PRC005-EN 465 KW
...23
Figure I.5.b. Refroidisseur de liquide à
absorption à doubles étages
Série ABSC 390 à 6000 KW.
..23
Figure I.5.c. Machine à absorption de
type YIA-ST-1A1 THRU YIA-ST-14F3 23
Figure I.5.d. Machine à absorption de
type YPC-F .....23
Figure I.5.e. Machine à absorption de
type CH-V ..24
Figure I.5.f. Machine à absorption de
type YPMC-F 24
Figure I.6. Machine à absorption simple
étage par la superposition de deux cycles de Rankine d'une
machine thermique et PAC. 25
Figure I.7. Machine à absorption NH3-H2O.
27
Figure I.8. Machine à absorption
H2O-LiBr. 30
Figure I.9. diagramme de Merkel relatif au
couple NH3-H20. 33
Figure I.9 diagramme d'Oldham relatif au couple
NH3-H20. 34
Chapitre II : Étude thermodynamique des
propriétés de la solution binaire NH3-H2O
Figure II.1. La densité de la
solution NH3-H2O liquide. 50
Figure II.2. La viscosité dynamique de la
solution NH3-H2O liquide. ...52
Figure II.3. La conductivité thermique de
la solution NH3-H2O liquide. ..54
Figure II.4. La chaleur spécifique
isobare de la solution NH3-H2O liquide. ..56
Chapitre III : Étude thermodynamique et
thermique des différents organes d'une installation
frigorifique
à absorption.
Figure III.1. Colonne de rectification. .58
Figure III.2. Description schématique du
cycle à absorption à simple étage. ..59
Figure III.3. La variation de la
température dans l'évaporateur. 62
Figure III.4. La variation de la
température dans le condenseur. 62
Figure III.5. La variation de la
température dans le bouilleur. 63
Figure III.6. La variation de la
température dans le sous-refroidisseur d'ammoniac 64
Figure III.7. Représentation
schématique d'une machine à deux étages. 69
Figure III.8. Evolution de l'efficacité
en fonction du NUT et pour différentes valeurs de
Cr dans les cas : 73
(a) : d'un échangeur co-courant ;
(b) : d'un échangeur contre courant ;
(c) : d'un échangeur à une calandre et 2 passes
côté tube.
Figure III.9. Evolution de l'efficacité
avec le NUT ( Cr = 0.75), pour différentes configurations
d'échangeurs : 73
(1) : contre courant ;
(2) : courant croisé, fluides non brassés;
(3) : courant croisé, fluides à
Cmin brassés;
(4) : une calandre et 2 passes côté calandre ;
(5) : co-courant.
Figure III.10. Evolution des températures
d'un échangeur à contre-courant. 75
Figure III.11. Evolution des températures
d'un échangeur à courants parallèles. 76
Figure III.12. Détermination de la DTLM.
77
Figure III.13. Condenseur multitubulaire (3
passages) (doc. Helpman). 78
Figure III.14. Evaporateur multitubulaire
noyé avec dôme séparateur (3 passages) (doc.
Helpman)) ..83
Figure III.15.Evolution de la température
dans la zone de préchauffage et de vaporisation 90
Figure III.16. Echangeur à double
tube.Courtesy of Brown Fintube Co.doc. 98
Chapitre IV : Programme de simulation des cycles de
machines frigorifiques à absorption
Figure IV.1. Le programme SARM
tel qu'il s'affiche à l'écran. 104
Figure IV.2. Exemple de calcul thermique d'un
cycle à deux étages. 105
Figure IV.3. Exemple de dimensionnement du
condenseur. 105
Figure IV.4. Le programme ABSIM tel qu'il
s'affiche à l'écran 118
Figure IV.5. Structure du code
informatique ABSIM. 119
Figure IV.9. Description schématique des
unités individuelles formant le système à absorption.
121
Chapitre V : Analyse des résultats et validation
du programme.
Figure V.1. Diagramme de Merkel
automatisé 123
Figure V.2. Diagramme d'Oldham
automatisé, (LogP,T) 124
Figure V.3. Diagramme d'Oldham
automatisé, (LogP,-1/T). 125
Figure V.4. Diagramme de Mollier (log P,
h) pour l'ammoniac 126
Figure V.5. Diagramme de Mollier (log P,
h) pour l'eau 126
Figure V.6.Exemple de calcul des
paramètres thermodynamiques et de transport pour NH3 et H2O
127
Figure V.7. Représentation
schématique de l'exemple dans un diagramme (LogP,1/T) 129
Figure V.8. Représentation
schématique de l'exemple dans un diagramme (H,î) 131
Figure V.9. Données du calcul pour le
dimensionnement de l'évaporateur 132
Figure V.10. Résultats du calcul de
dimensionnement de l'évaporateur 133
Figure V.11. Variation du COP= f
(Tb,Tab) avec TC=20 °C 134
Figure V.12. Variation du COP= f
(Tb,Tab) avec TC=25 °C 134
Figure V.13. Variation du COP= f
(Tb,Tab) avec TC=30 °C 135
Figure V.14. Variation du COP= f
(Tb,Tab) avec TC=35 °C 135
Figure V.15. Variation du COP= f
(Tb,Tab) avec TC=40 °C 135
Figure V.16. Variation du COP= f (Tb,TC)
avec Tab=20 °C 136
Figure V.17. Variation du COP= f (Tb,TC)
avec Tab=25 °C 136
Figure V.18. Variation du COP= f (Tb,TC)
avec Tab=30 °C 136
Figure V.19. Variation du COP= f (Tb,TC)
avec Tab=35 °C 136
Figure V.20. Variation du COP= f
(TC,Tab) avec Tb=75 °C 137
Figure V.21. Variation du COP= f
(T0,Tab) avec Tb=80 °C 137
Figure V.22. Variation du COP= f
(T11,T3) avec T8=40 °C et T6=20 °C ...
138
Figure V.23. Variation du COP= f
(T11,T3) avec T8=50 °C et T6=20 °C. 138
Figure V.24. Variation du COP= f
(T11,T3) avec T8=60 °C et T6=20 °C 139
Figure V.25. Variation du COP= f
(T11,T3) avec T8=40 °C et T6=30 °C 139
Figure V.26. Variation du COP= f
(T11,T3) avec T8=50 °C et T6=30 °C 139
Figure V.27. Variation du COP= f
(T11,T3) avec T8=60 °C et T6=30 °C 140
Figure V.28. Variation du COP= f
(T11,T3) avec T8=40 °C et T6=40 °C 140
Figure V.29. Variation du COP= f
(T11,T3) avec T8=50 °C et T6=40 °C 140
Figure V.30. Variation du COP= f
(T11,T3) avec T8=60 °C et T6=40 °C 141
Figure V.31. Variation du COP= f (TC
,T11) avec T8=40 °C,T3=90 °C et T6=40 °C
141
Figure V.32. Variation du COP= f (T0 , T11)
avec T8=40 °C,T3=90 °C et T6=20 °C 142
Figure V.33. Variation de la chaleur latente de
vaporisation de l'NH3=f(T) 142
Figure V.34. Variation de ?S de l'NH3=f(T)
..142
Figure V.35. Variation du volume liquide
NH3=f(T) 143
Figure V.36. Variation du volume gazeux
NH3=f(T) ..143
Figure V.37. Variation de la chaleur latente
de vaporisation de
l'H2O=f(T)...............................................144
Figure V.38. Variation de ?S de l'
H2O=f(T)......................................................................................144
Figure V.39. Variation du volume liquide H2O
=f(T)............................................................................144
Figure V.40. Variation du volume gazeux H2O
=f(T)............................................................................144
Figure V.41. Comparaison des deux
résultats de COP (Par SARM et le constructeur COLIBRI) .147
Figure V.42. Comparaison des résultats
obtenus par ABS IM et SARM du COP= f (Tb) avec T0=0 °C 148
Figure V.43. Comparaison des résultats
obtenus par ABSIM et SARM du COP= f (Tb) avec T0=2.5 °C 148
Figure V.44. Comparaison des résultats
obtenus par ABSIM et SARM du COP= f (Tb) avec T0=5 °C
...........148
Figure V.45. Comparaison des résultats
obtenus par ABSIM et SARM du COP= f (Tb) avec T0= 7.5 °C 148
Figure V.46. Comparaison des résultats
obtenus par ABSIM et SARM du COP= f (Tb) avec T0=10 °C 148
Figure V.47. Variation du COP= f (Tb) avec
T0=5 °C 148
Liste des tableaux.
Chapitre I : Étude et recherche bibliographique
sur les installations frigorifiques à absorption. Tableau I.1.
Les différents types des machines à absorption ARP-S.
22
Chapitre II : Étude thermodynamique des
propriétés de la solution binaire NH3-H2O
Tableau II.1. Les paramètres fondamentaux
des substances pures ....38
Tableau II.2. Les coefficients pour les
équations (II.13.17.21.22.23.24.25.26) et (II.32.33.34) ....44
Tableau II.3. Les coefficients pour les
équations (II.59.60.61.62) 49
Chapitre IV : Programme de simulation des cycles de
machines frigorifiques à absorption
Tableau IV.1. L'équilibre massique pour
une machine à simple étage 101
Tableau IV.2. L'équilibre
énergétique pour une machine à simple étage 101
Tableau IV.3. L'équilibre massique pour
une machine à deux étages 102
Tableau IV.4. L'équilibre
énergétique pour une machine à deux étages 102
Tableau IV.5. Les coefficients de
l'équation (IV.7) 108
Tableau IV.6. Les coefficients de
l'équation (IV.12) 109
Tableau IV.7. Code des différents fluides
120
Chapitre V : Analyse des résultats et validation
du programme.
Tableau V.1. Résultats de calcul d'un
cycle à simple étage 128
Tableau V.2. Résultats de calcul d'un
cycle à deux étages 130
Tableau V.3. Résultats obtenues par les
deux tests de validation ..145
Tableau V.4. Comparaison du COP 146
Tableau V.5. Comparaison du COP pour les deux
programme SARM et ABSIM 147
Liste des organigrammes.
Chapitre IV : Programme de simulation des cycles de
machines frigorifiques à absorption
|
Organigramme IV.1. Démarche de calcul
pour le diagramme d'Oldham
|
...110
|
|
Organigramme IV.2. Démarche de calcul
pour les réseaux d'isobares
|
...112
|
|
Organigramme IV.3. Démarche de calcul
pour les réseaux d'isothermes
|
.....113
|
|
Organigramme IV.4. Démarche de calcul
pour les lignes de condensation
|
...114
|
|
Organigramme IV.5. Démarche de calcul
pour les courbes liquide-vapeur
|
..115
|
|
Organigramme IV.6. Organigramme de simulation
d'une machine à absorption à simple étage
|
116
|
|
Organigramme IV.7. Organigramme de simulation
d'une machine à absorption à deux
|
117
|
|
Chapitre V : Analyse des résultats et validation
du programme.
|
|
|
Organigramme V.1. Démarche de remplissage
des tables thermodynamiques de l'ammoniac et de l'eau
|
.126
|
Annexes
Corrélations utilisées pour déterminer
l'efficacité de l'échangeur par la méthode de NUT
:
· Co-courant :

-
1 e
-
E
Cr
(A1-1)
1+
(1 )
+ C r
NUT
· Contre courant :

-
NUT (1 )
- C r
e
Cr
e 1
- -
NUT Cr
(1 ) -
- 1 (A1-2)
E
· Une passe de calandre - multiple de deux passes
de tubes

2
E
2
(A1-3)
r
- +
NUT C
1
1 e
+
2
2
1 1
+ +
C
r r
+ C
r
- +
NUT C
1
1 e
-
· Courants croisés - aucun fluide n'est
mixé
E e
= -
1
|
1 0.22 ? - ?
C r NUT 0.78
- NUT e - 1
C ?? ??
r
|
(A1-4)
|
|
· Courants croisés - seul le fluide à
Cmin est mixé
1
-
C r(A1-5)
E e
= -
1
( )
C r NUT
1 - e -
· Courants croisés - seul le fluide à
Cmax est mixé
1 1 ( 1 )
- NUT
? - -
Cr e ?
E e
= ?? - ? ? (A1-6)
Cr
Corrélations utilisées pour déterminer le
facteur correctif F dans la méthode DTLM :
Rappels
P
|
|
t t
s e
-
|
|
R
|
T T
e s
-
|
(A2-1)
|
|
,
|
|
t t
s e
-
|
|
Où T fait référence au fluide
chaud et t au fluide froid, e et s représentant respectivement
l'entrée et la sortie de l'échangeur.
· Une passe de calandre - multiple de deux passes
de tubes
R P
2 + ? - ?
1 1
log
R R
1 0
- ? - ?
1 1
? ?
P
2 1 1
- - + +
R R 2
- - - +
1 1
R R 2
?P
(A2-2)
?
?
log P 2
10 ?
?
· Deux passes de calandre - multiple de deux passes
de tubes
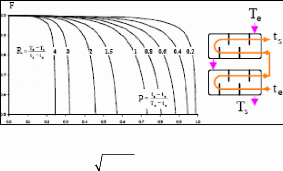
F
R P
2 + ? - ?
1 1
log
2( 1) 1
R R P
10 ? ?
- ? - ?
(A2-3)
? 2 2
- - + - - + +
R P P R R 2
1 (1 )(1 ) 1
?
log 2 2
P P
10 ?
2
? - - + - - - +
1 (1 )(1 )
R P P R R 1
? P P
Coefficients de transfert sale Us :
|
Echangeurs
|
Us
|
|
Fluide chaud
|
Fluide froid
|
Kcal/h.m2.°C
|
BTU/hr.ft2.°F
|
|
Eau
|
|
Eau
|
1250 -2500
|
250 - 500
|
|
Solutions aqueuses
|
|
Solutions aqueuses
|
1250 -2500
|
250 - 500
|
|
Hydrocarbures légers
|
|
Hydrocarbures légers
|
200 - 370
|
40 - 75
|
|
Hydrocarbures moyens
|
|
Hydrocarbures moyens
|
100 - 300
|
20 - 60
|
|
Hydrocarbures lourds
|
|
Hydrocarbures lourds
|
50 - 200
|
10 - 40
|
|
Hydrocarbures lourds
|
|
Hydrocarbures légers
|
150 - 300
|
30 - 60
|
|
Hydrocarbures légers
|
|
Hydrocarbures lourds
|
50 - 200
|
10 - 40
|
|
Réfrigérations
|
|
Eau, méthanol, ammoniac et Solutions aqueuses
|
|
Eau
|
1250 -2500
|
250 - 500
|
|
Hydrocarbures légers (1)
|
|
Eau
|
370 - 730
|
75 - 150
|
|
Hydrocarbures moyens (1)
|
|
Eau
|
250 - 610
|
50 - 125
|
|
Hydrocarbures lourds (1)
|
|
Eau
|
25 - 730
|
5 - 75
|
|
Gaz
|
|
Eau
|
10 - 250
|
2 - 50
|
|
Eau
|
|
Saumure
|
500 - 1000
|
100 - 200
|
|
Hydrocarbures légers
|
|
saumure
|
200 - 500
|
40 - 100
|
|
Réchauffeurs
|
|
Vapeur d'eau
|
Eau, méthanol, ammoniac
|
1000 - 3400
|
200 - 700
|
|
Vapeur d'eau
|
Solutions aqueuses u<2 cPo
u>2 cPo
|
1000 - 3400
500 - 2500
|
200 - 700
100 - 500
|
|
Vapeur d'eau
|
Hydrocarbures légers
|
500 - 1000
|
100 - 200
|
|
Vapeur d'eau
|
Hydrocarbures moyens
|
250 - 500
|
50 - 100
|
|
Vapeur d'eau
|
Hydrocarbures lourds
|
30 - 300
|
6 - 60
|
|
Vapeur d'eau
|
Gaz
|
25 - 250
|
5 - 50
|
Ces valeurs de Us comprennent une
résistance globale d'encrassement :
Rs = 0.0006 (h.m2. °C/Kcal)= 0.
003( hr.ft2. °F/*BTU), et correspondent à une perte
de charge : 0.35 < ?P < 0.7 (Kg/cm2).
(1) : Hydrocarbures légers : u < 0.5 cPo (ainsi que :
benzène, toluène, acétone et éthanol) ;
Hydrocarbures moyens : 0.5 < u < 1 cPo
(kérosène, gasoil chaud, huile d'absorption et bruts
légers) ;
Hydrocarbures lourds : u > 1 cPo (gasoil froid, huiles,
fuels-oils et brut réduit).
Disposition des tubes en Carré et
Triangle
1- Disposition des tubes en carré
|
Dc calandre
|
Tube : 3/4» Pas=1»
|
Tube : 1» Pas=1.1/4»
|
Tube : 1.1/4» Pas=1.9/16»
|
|
Nombre de passes : nt
|
Nombre de passes : nt
|
Nombre de passes : nt
|
|
(in)
|
(cm)
|
2
|
4
|
6
|
8
|
2
|
4
|
6
|
8
|
2
|
4
|
6
|
8
|
|
8
|
20.3
|
26
|
20
|
20
|
|
16
|
14
|
|
|
|
|
|
|
|
10
|
25.4
|
52
|
40
|
36
|
|
32
|
26
|
24
|
|
12
|
10
|
|
|
|
12
|
30.5
|
76
|
68
|
68
|
60
|
45
|
40
|
38
|
36
|
24
|
22
|
16
|
16
|
|
13
|
33.7
|
90
|
82
|
76
|
70
|
56
|
52
|
48
|
44
|
30
|
30
|
22
|
22
|
|
15
|
38.7
|
124
|
116
|
108
|
108
|
76
|
68
|
68
|
64
|
40
|
37
|
35
|
31
|
|
17
|
43.9
|
166
|
158
|
150
|
142
|
112
|
96
|
90
|
82
|
53
|
51
|
48
|
44
|
|
19
|
48.9
|
220
|
204
|
192
|
188
|
132
|
128
|
122
|
116
|
73
|
71
|
64
|
56
|
|
21
|
54.0
|
270
|
246
|
240
|
234
|
166
|
158
|
152
|
148
|
90
|
86
|
82
|
78
|
|
23
|
59.1
|
324
|
308
|
302
|
292
|
208
|
192
|
184
|
184
|
112
|
106
|
102
|
96
|
|
25
|
63.5
|
394
|
370
|
356
|
346
|
252
|
238
|
226
|
222
|
135
|
127
|
123
|
115
|
|
27
|
68.6
|
460
|
432
|
420
|
408
|
288
|
278
|
268
|
260
|
160
|
151
|
146
|
140
|
|
29
|
73.7
|
526
|
480
|
468
|
456
|
326
|
300
|
294
|
286
|
188
|
178
|
174
|
166
|
|
31
|
78.8
|
640
|
600
|
580
|
560
|
398
|
380
|
368
|
358
|
220
|
209
|
202
|
193
|
|
33
|
83.8
|
718
|
688
|
676
|
648
|
460
|
432
|
420
|
441
|
252
|
244
|
238
|
226
|
|
35
|
88.9
|
824
|
780
|
766
|
748
|
518
|
488
|
484
|
472
|
287
|
275
|
268
|
258
|
|
37
|
94.0
|
914
|
886
|
866
|
838
|
574
|
562
|
544
|
532
|
322
|
311
|
304
|
293
|
|
39
|
99.00
|
1024
|
982
|
968
|
948
|
644
|
624
|
612
|
600
|
362
|
348
|
342
|
336
|
2- Disposition des tubes en triangle
|
Dc calandre
|
Tube : 3/4» Pas=1»
|
Tube : 1» Pas=1.1/4»
|
Tube : 1.1/4» Pas=1.9/16»
|
|
Nombre de passes : nt
|
Nombre de passes : nt
|
Nombre de passes : nt
|
|
(in)
|
(cm)
|
2
|
4
|
6
|
8
|
2
|
4
|
6
|
8
|
2
|
4
|
6
|
8
|
|
8
|
20.3
|
32
|
26
|
24
|
18
|
30
|
24
|
24
|
|
16
|
16
|
14
|
|
|
10
|
25.4
|
56
|
47
|
42
|
36
|
52
|
40
|
36
|
|
32
|
26
|
24
|
|
|
12
|
30.5
|
98
|
86
|
82
|
78
|
82
|
76
|
74
|
70
|
52
|
48
|
46
|
44
|
|
13
|
33.7
|
114
|
96
|
90
|
86
|
106
|
86
|
82
|
74
|
66
|
58
|
54
|
50
|
|
15
|
38.7
|
160
|
140
|
136
|
128
|
138
|
122
|
118
|
110
|
86
|
80
|
74
|
72
|
|
17
|
43.9
|
224
|
194
|
188
|
178
|
196
|
178
|
172
|
166
|
118
|
106
|
104
|
94
|
|
19
|
48.9
|
282
|
252
|
244
|
234
|
250
|
226
|
216
|
210
|
152
|
140
|
136
|
128
|
|
21
|
54.0
|
342
|
314
|
306
|
290
|
302
|
278
|
272
|
260
|
188
|
170
|
164
|
160
|
|
23
|
59.1
|
420
|
386
|
378
|
364
|
376
|
352
|
342
|
328
|
232
|
212
|
212
|
202
|
|
25
|
63.5
|
506
|
468
|
446
|
434
|
452
|
422
|
394
|
382
|
282
|
256
|
252
|
242
|
|
28
|
68.6
|
602
|
550
|
536
|
524
|
534
|
488
|
474
|
464
|
334
|
302
|
296
|
286
|
|
29
|
73.7
|
692
|
640
|
620
|
594
|
604
|
556
|
538
|
508
|
376
|
338
|
334
|
316
|
|
31
|
78.8
|
822
|
766
|
722
|
720
|
728
|
678
|
666
|
640
|
454
|
430
|
424
|
400
|
|
33
|
83.8
|
938
|
878
|
852
|
826
|
830
|
774
|
760
|
732
|
522
|
486
|
470
|
454
|
|
35
|
88.9
|
1068
|
1004
|
988
|
958
|
938
|
882
|
864
|
848
|
592
|
562
|
546
|
532
|
|
37
|
94.0
|
1200
|
1144
|
1104
|
1072
|
1044
|
1012
|
986
|
870
|
664
|
632
|
614
|
598
|
|
39
|
99.00
|
1330
|
1258
|
1248
|
1212
|
1176
|
1128
|
1100
|
1078
|
736
|
700
|
688
|
672
|
Coefficient de transfert de l'eau à l'intérieur ou
à l'extérieur des tubes :
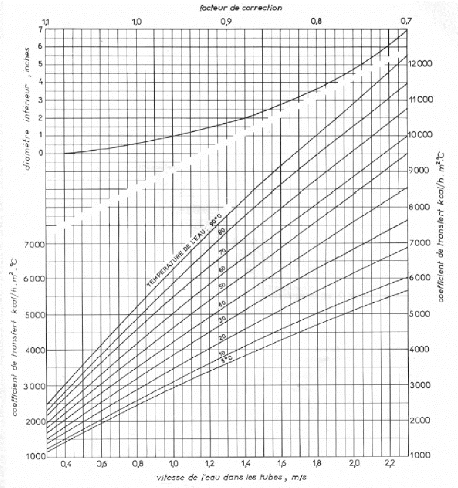
Aire de passage côté calandre
Soit B, l'espacement des chicanes, Pas le pas des
tubes et D , le diamètre inférieur de la calandre.
L'aire de passage entre deux chicanes varie selon l'arrangement des tubes. Le
tableau suivant donne les valeurs de a t, relatives aux diverses
dispositions.
|
Pas carré normal
|
Pas triangulaire
|
Pas carré renversé
|
|
Espacement entre tubes
perpendiculaires
au
courant
|
Pas
|
Pas 3
|
Pas 2
|
|
|
Distance minimale de
passage
|
Pas - d0
|
2 (Pas - d0)
|
2 (Pas - d0)
|
|
|
Aire de passage:
--
Pas d 0
= B D
|
D Pas d B
|
2 ( )
D Pas d B
--
|
2 D Pas d
|
) B
|
|
( 0 )
Pas --
|
0
3 Pas
|
( 0
Pas --
|
|
a t a
pas
|
|
Figure (6-1) Aire de passage transversal entre
deux chicanes a .
Figure (6-2) Dispositions des tubes
du
faisceau.
|
|
Coefficient de transfert et le coefficient de friction en
fonction du nombre du Reynolds, à l'intérieur des tubes:
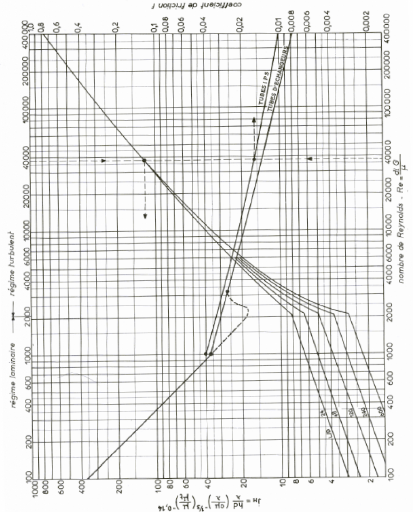
Coefficient de transfert et le coefficient de friction en
fonction du nombre du Reynolds modifier, à l'extérieur des
tubes:
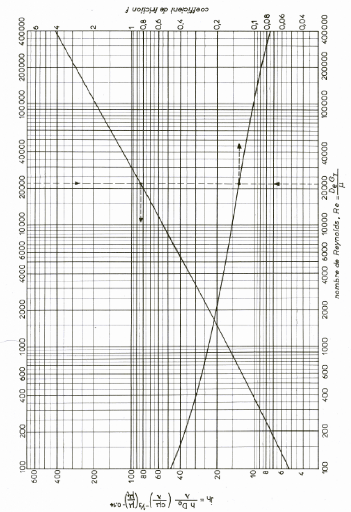
Méthode de NEWTON-RAPHSON 1- Principe:
Sif(X)est continue continûment dérivable
dans le voisinage de Xi, alors le développement en
série de Taylor autour d'un estimé X (n)
s'écrit:
? ?
( ) ( )
* ( )
n
F X f X f X X X f X
( ) ( ) ( )( ) ( ) ...
* ( ) ( ) * ( )
= + ? + ''
X X n
n n n
' ? ? +(A9-1)
? ?
2!
Si X (n) est un estimé proche de la
solution Xi de f(X)= 0, alors l'écart de
l'erreur å(n) (où å(n)=
(Xi- X (n))) et les termes de degré
supérieur sont négligeables, sachent que f(Xi)= 0,
on obtient la relation approximative:
F X + f ' X X -- X =
( ) ( )( ) 0
( ) ( ) * ( )
n n n(A9-2)
Et une approximation de l'erreur est donc:
(A9-3)
f '
å(n) = f
( )
( )
n
X
( )
X ( )
n
On peut donc considérer qu'un meilleur estimé de
Xi sera :
X (n+1)= X (n)+ å(n)
(A9-4)
Des équations (A9-3) et (A9-4), on obtient l'algorithme de
NEWTON-RAPHSON.
|
X( 1)
n + =
|
f
X ( )
n _
f'
|
( )
( )
n
X
( )
X ( )
n
|
(A9-5)
|
2- Convergence de la méthode:
D'une manière générale, la
dérivée seconde joue un rôle important dans la convergence
de la méthode. On pourrait montrer sans trop de difficulté le
théorème suivant:
Soit (a,b) un intervalle tel que: f(a).f(b) <
0
VXE[a,bJ f'(X)~0
et f'(X)~0
Alors f(X) = 0 possède une seul racine dans
[a,b] et [ J
V X (0) ? a , b la suite (A9-5)
converge
quadratiquement.
Le choix du point de départ est crucial. Pour assurer la
convergence on choisira un X (0) tel que la condition de
Fourier soit vérifiée à savoir:
f'(X ). f ( X
) > 0 .
(0) (0)
Table de STUDENT:
Propriétés d'ammoniac saturée
(NH3) (à différentes températures).
|
T (°K)
|
P (bar)
|
T (°C)
|
Enthalpie
spécifique
(KJ/Kg)
|
Chaleur de vaporisation
(KJ/Kg)
|
Entropie
spécifique
(KJ/Kg.°K)
|
?S (KJ/Kg.°K)
|
Volume
spécifique
(m3/Kg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
VL
|
VG
|
|
198,15
|
0,077408
|
-75
|
-335,5584
|
1146,5788
|
1482,1372
|
-1,4213
|
6,0422
|
7,4635
|
0,001392
|
12,4271214
|
|
199,15
|
0,083537
|
-74
|
-331,0835
|
1148,4028
|
1479,4863
|
-1,3988
|
6,0144
|
7,4131
|
0,0013929
|
11,5703907
|
|
200,15
|
0,090073
|
-73
|
-326,6122
|
1150,2232
|
1476,8354
|
-1,3764
|
5,9869
|
7,3633
|
0,0013938
|
10,781638
|
|
201,15
|
0,097039
|
-72
|
-322,1442
|
1152,04
|
1474,1842
|
-1,3541
|
5,9598
|
7,314
|
0,0013948
|
10,0548239
|
|
202,15
|
0,104456
|
-71
|
-317,6794
|
1153,853
|
1471,5324
|
-1,332
|
5,9331
|
7,2651
|
0,0013958
|
9,3844986
|
|
203,15
|
0,112348
|
-70
|
-313,2177
|
1155,6621
|
1468,8798
|
-1,31
|
5,9067
|
7,2167
|
0,0013968
|
8,76574
|
|
204,15
|
0,120739
|
-69
|
-308,7588
|
1157,4671
|
1466,2259
|
-1,2881
|
5,8807
|
7,1688
|
0,0013979
|
8,1940979
|
|
205,15
|
0,129653
|
-68
|
-304,3028
|
1159,2678
|
1463,5706
|
-1,2663
|
5,8549
|
7,1213
|
0,001399
|
7,665545
|
|
206,15
|
0,139117
|
-67
|
-299,8494
|
1161,0642
|
1460,9136
|
-1,2447
|
5,8296
|
7,0742
|
0,0014002
|
7,1764331
|
|
207,15
|
0,149157
|
-66
|
-295,3984
|
1162,8561
|
1458,2545
|
-1,2231
|
5,8045
|
7,0276
|
0,0014013
|
6,7234546
|
|
208,15
|
0,1598
|
-65
|
-290,9498
|
1164,6433
|
1455,5931
|
-1,2017
|
5,7797
|
6,9815
|
0,0014026
|
6,3036074
|
|
209,15
|
0,171076
|
-64
|
-286,5034
|
1166,4257
|
1452,9291
|
-1,1804
|
5,7553
|
6,9357
|
0,0014038
|
5,9141648
|
|
210,15
|
0,183014
|
-63
|
-282,059
|
1168,2031
|
1450,2622
|
-1,1592
|
5,7311
|
6,8904
|
0,0014051
|
5,5526476
|
|
211,15
|
0,195643
|
-62
|
-277,6166
|
1169,9754
|
1447,592
|
-1,1382
|
5,7073
|
6,8454
|
0,0014064
|
5,2168
|
|
212,15
|
0,208996
|
-61
|
-273,1759
|
1171,7424
|
1444,9183
|
-1,1172
|
5,6837
|
6,8009
|
0,0014078
|
4,9045672
|
|
213,15
|
0,223104
|
-60
|
-268,7368
|
1173,5039
|
1442,2408
|
-1,0963
|
5,6605
|
6,7568
|
0,0014092
|
4,6140764
|
|
214,15
|
0,238001
|
-59
|
-264,2993
|
1175,2598
|
1439,5591
|
-1,0756
|
5,6375
|
6,713
|
0,0014106
|
4,3436189
|
|
215,15
|
0,253721
|
-58
|
-259,863
|
1177,01
|
1436,873
|
-1,0549
|
5,6148
|
6,6697
|
0,0014121
|
4,0916344
|
|
216,15
|
0,270299
|
-57
|
-255,428
|
1178,7542
|
1434,1821
|
-1,0343
|
5,5923
|
6,6267
|
0,0014136
|
3,8566974
|
|
217,15
|
0,287772
|
-56
|
-250,994
|
1180,4923
|
1431,4862
|
-1,0139
|
5,5701
|
6,584
|
0,0014152
|
3,6375038
|
|
218,15
|
0,306176
|
-55
|
-246,5609
|
1182,2241
|
1428,7849
|
-0,9935
|
5,5482
|
6,5417
|
0,0014168
|
3,4328604
|
|
219,15
|
0,32555
|
-54
|
-242,1285
|
1183,9494
|
1426,078
|
-0,9733
|
5,5265
|
6,4998
|
0,0014184
|
3,2416737
|
|
220,15
|
0,345934
|
-53
|
-237,6968
|
1185,6682
|
1423,365
|
-0,9531
|
5,5051
|
6,4582
|
0,00142
|
3,0629418
|
|
221,15
|
0,367367
|
-52
|
-233,2656
|
1187,3801
|
1420,6457
|
-0,933
|
5,484
|
6,417
|
0,0014217
|
2,8957452
|
|
222,15
|
0,38989
|
-51
|
-228,8347
|
1189,0851
|
1417,9198
|
-0,9131
|
5,463
|
6,3761
|
0,0014235
|
2,7392398
|
|
223,15
|
0,413548
|
-50
|
-224,404
|
1190,783
|
1415,187
|
-0,8932
|
5,4424
|
6,3355
|
0,0014252
|
2,5926501
|
|
224,15
|
0,438382
|
-49
|
-219,9734
|
1192,4735
|
1412,4469
|
-0,8734
|
5,4219
|
6,2953
|
0,001427
|
2,455263
|
|
225,15
|
0,464437
|
-48
|
-215,5426
|
1194,1566
|
1409,6992
|
-0,8537
|
5,4017
|
6,2554
|
0,0014289
|
2,3264224
|
|
226,15
|
0,491759
|
-47
|
-211,1117
|
1195,832
|
1406,9437
|
-0,8341
|
5,3817
|
6,2157
|
0,0014307
|
2,2055242
|
|
T (°K)
|
P (bar)
|
T (°C)
|
Enthalpie
spécifique
(KJ/Kg)
|
Chaleur de vaporisation
(KJ/Kg)
|
Entropie
spécifique
(KJ/Kg.°K)
|
?S (KJ/Kg.°K)
|
Volume
spécifique
(m3/Kg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
VL
|
VG
|
|
227,15
|
0,520395
|
-46
|
-206,6803
|
1197,4996
|
1404,1799
|
-0,8145
|
5,3619
|
6,1764
|
0,0014326
|
2,09201 18
|
|
228,15
|
0,550392
|
-45
|
-202,2484
|
1199,1591
|
1401,4076
|
-0,7951
|
5,3423
|
6,1374
|
0,0014346
|
1,9853718
|
|
229,15
|
0,5818
|
-44
|
-197,8159
|
1200,8105
|
1398,6264
|
-0,7757
|
5,323
|
6,0987
|
0,0014366
|
1,8851307
|
|
230,15
|
0,614667
|
-43
|
-193,3826
|
1202,4536
|
1395,8361
|
-0,7564
|
5,3039
|
6,0603
|
0,0014386
|
1,7908513
|
|
231,15
|
0,649047
|
-42
|
-188,9483
|
1204,088
|
1393,0363
|
-0,7372
|
5,2849
|
6,0221
|
0,0014407
|
1,7021296
|
|
232,15
|
0,684989
|
-41
|
-184,5129
|
1205,7138
|
1390,2267
|
-0,7181
|
5,2662
|
5,9843
|
0,0014428
|
1,6185921
|
|
233,15
|
0,722548
|
-40
|
-180,0763
|
1207,3307
|
1387,407
|
-0,6991
|
5,2477
|
5,9467
|
0,0014449
|
1,5398933
|
|
234,15
|
0,761778
|
-39
|
-175,6383
|
1208,9385
|
1384,5768
|
-0,6801
|
5,2293
|
5,9094
|
0,0014471
|
1,4657134
|
|
235,15
|
0,802735
|
-38
|
-171,1988
|
1210,5371
|
1381,7358
|
-0,6612
|
5,2112
|
5,8724
|
0,0014493
|
1,3957561
|
|
236,15
|
0,845474
|
-37
|
-166,7576
|
1212,1262
|
1378,8838
|
-0,6424
|
5,1932
|
5,8356
|
0,0014515
|
1,3297469
|
|
237,15
|
0,890054
|
-36
|
-162,3146
|
1213,7057
|
1376,0204
|
-0,6236
|
5,1754
|
5,799
|
0,0014538
|
1,2674311
|
|
238,15
|
0,936533
|
-35
|
-157,8697
|
1215,2755
|
1373,1452
|
-0,6049
|
5,1578
|
5,7628
|
0,0014561
|
1,2085724
|
|
239,15
|
0,98497
|
-34
|
-153,4227
|
1216,8353
|
1370,258
|
-0,5863
|
5,1404
|
5,7268
|
0,0014584
|
1,1529513
|
|
240,15
|
1,035428
|
-33
|
-148,9735
|
1218,3849
|
1367,3584
|
-0,5678
|
5,1232
|
5,691
|
0,0014608
|
1,1003641
|
|
241,15
|
1,087968
|
-32
|
-144,5219
|
1219,9243
|
1364,4462
|
-0,5493
|
5,1061
|
5,6554
|
0,0014633
|
1,0506211
|
|
242,15
|
1,142652
|
-31
|
-140,0679
|
1221,4531
|
1361,5209
|
-0,5309
|
5,0892
|
5,6201
|
0,0014657
|
1,0035462
|
|
243,15
|
1,199546
|
-30
|
-135,6111
|
1222,9712
|
1358,5824
|
-0,5126
|
5,0724
|
5,585
|
0,0014682
|
0,9589752
|
|
244,15
|
1,258714
|
-29
|
-131,1516
|
1224,4785
|
1355,6301
|
-0,4943
|
5,0559
|
5,5502
|
0,0014707
|
0,9167555
|
|
245,15
|
1,320222
|
-28
|
-126,6892
|
1225,9748
|
1352,664
|
-0,4761
|
5,0394
|
5,5156
|
0,0014733
|
0,8767446
|
|
246,15
|
1,384139
|
-27
|
-122,2236
|
1227,4599
|
1349,6835
|
-0,458
|
5,0232
|
5,4812
|
0,0014759
|
0,83881
|
|
247,15
|
1,450532
|
-26
|
-117,7549
|
1228,9335
|
1346,6885
|
-0,4399
|
5,0071
|
5,447
|
0,0014786
|
0,8028279
|
|
248,15
|
1,51947
|
-25
|
-113,2829
|
1230,3956
|
1343,6785
|
-0,4219
|
4,9911
|
5,413
|
0,0014812
|
0,7686827
|
|
249,15
|
1,591026
|
-24
|
-108,8073
|
1231,846
|
1340,6533
|
-0,404
|
4,9753
|
5,3792
|
0,001484
|
0,7362667
|
|
250,15
|
1,665269
|
-23
|
-104,3281
|
1233,2844
|
1337,6125
|
-0,3861
|
4,9596
|
5,3457
|
0,0014867
|
0,7054791
|
|
251,15
|
1,742273
|
-22
|
-99,8452
|
1234,7107
|
1334,5559
|
-0,3682
|
4,9441
|
5,3123
|
0,0014895
|
0,6762258
|
|
252,15
|
1,822111
|
-21
|
-95,3583
|
1236,1247
|
1331,4831
|
-0,3504
|
4,9287
|
5,2791
|
0,0014923
|
0,6484188
|
|
253,15
|
1,904858
|
-20
|
-90,8675
|
1237,5263
|
1328,3938
|
-0,3327
|
4,9134
|
5,2461
|
0,0014952
|
0,6219756
|
|
254,15
|
1,99059
|
-19
|
-86,3724
|
1238,9152
|
1325,2876
|
-0,315
|
4,8983
|
5,2134
|
0,0014981
|
0,5968193
|
|
255,15
|
2,079384
|
-18
|
-81,873
|
1240,2913
|
1322,1643
|
-0,2974
|
4,8833
|
5,1808
|
0,001501
|
0,5728775
|
|
256,15
|
2,171317
|
-17
|
-77,3692
|
1241,6543
|
1319,0235
|
-0,2799
|
4,8685
|
5,1483
|
0,001504
|
0,5500827
|
|
T (°K)
|
P (bar)
|
T (°C)
|
Enthalpie
spécifique
(KJ/Kg)
|
Chaleur de vaporisation
(KJ/Kg)
|
Entropie
spécifique
(KJ/Kg.°K)
|
?S (KJ/Kg.°K)
|
Volume
spécifique
(m3/Kg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
VL
|
VG
|
|
257,15
|
2,266467
|
-16
|
-72,8607
|
1243,0042
|
1315,8649
|
-0,2623
|
4,8538
|
5,1161
|
0,001507
|
0,5283715
|
|
258,15
|
2,364915
|
-15
|
-68,3476
|
1244,3407
|
1312,6882
|
-0,2449
|
4,8392
|
5,084
|
0,00151
|
0,5076843
|
|
259,15
|
2,466741
|
-14
|
-63,8295
|
1245,6636
|
1309,4931
|
-0,2275
|
4,8247
|
5,0522
|
0,0015131
|
0,4879653
|
|
260,15
|
2,572027
|
-13
|
-59,3065
|
1246,9727
|
1306,2792
|
-0,2101
|
4,8103
|
5,0204
|
0,0015162
|
0,4691623
|
|
261,15
|
2,680856
|
-12
|
-54,7783
|
1248,268
|
1303,0463
|
-0,1928
|
4,7961
|
4,9889
|
0,0015194
|
0,4512259
|
|
262,15
|
2,79331
|
-11
|
-50,2449
|
1249,5491
|
1299,794
|
-0,1755
|
4,782
|
4,9575
|
0,0015226
|
0,4341101
|
|
263,15
|
2,909474
|
-10
|
-45,706
|
1250,8159
|
1296,5219
|
-0,1583
|
4,7679
|
4,9263
|
0,0015258
|
0,4177713
|
|
264,15
|
3,029434
|
-9
|
-41,1616
|
1252,0682
|
1293,2298
|
-0,1412
|
4,754
|
4,8952
|
0,001529
|
0,4021687
|
|
265,15
|
3,153275
|
-8
|
-36,6115
|
1253,3058
|
1289,9173
|
-0,124
|
4,7403
|
4,8643
|
0,0015323
|
0,3872638
|
|
266,15
|
3,281085
|
-7
|
-32,0556
|
1254,5285
|
1286,5842
|
-0,107
|
4,7266
|
4,8335
|
0,0015357
|
0,3730206
|
|
267,15
|
3,412952
|
-6
|
-27,4938
|
1255,7362
|
1283,23
|
-0,0899
|
4,713
|
4,8029
|
0,001539
|
0,3594049
|
|
268,15
|
3,548964
|
-5
|
-22,9259
|
1256,9285
|
1279,8544
|
-0,0729
|
4,6995
|
4,7725
|
0,0015424
|
0,3463847
|
|
269,15
|
3,689212
|
-4
|
-18,3517
|
1258,1055
|
1276,4572
|
-0,056
|
4,6862
|
4,7422
|
0,0015459
|
0,3339298
|
|
270,15
|
3,833785
|
-3
|
-13,7712
|
1259,2667
|
1273,038
|
-0,0391
|
4,6729
|
4,712
|
0,0015494
|
0,3220116
|
|
271,15
|
3,982775
|
-2
|
-9,1843
|
1260,4121
|
1269,5964
|
-0,0222
|
4,6597
|
4,6819
|
0,0015529
|
0,3106034
|
|
272,15
|
4,136275
|
-1
|
-4,5907
|
1261,5415
|
1266,1321
|
-0,0054
|
4,6466
|
4,652
|
0,0015564
|
0,2996796
|
|
273,15
|
4,294376
|
0
|
0,0096
|
1262,6545
|
1262,6449
|
0,0114
|
4,6336
|
4,6223
|
0,00156
|
0,2892165
|
|
274,15
|
4,457173
|
1
|
4,6168
|
1263,7511
|
1259,1343
|
0,0281
|
4,6207
|
4,5926
|
0,0015636
|
0,2791913
|
|
275,15
|
4,62476
|
2
|
9,2311
|
1264,8311
|
1255,6
|
0,0448
|
4,6079
|
4,5631
|
0,0015673
|
0,2695829
|
|
276,15
|
4,797232
|
3
|
13,8524
|
1265,8941
|
1252,0417
|
0,0615
|
4,5952
|
4,5337
|
0,001571
|
0,2603709
|
|
277,15
|
4,974685
|
4
|
18,481
|
1266,9401
|
1248,459
|
0,0781
|
4,5826
|
4,5045
|
0,0015747
|
0,2515364
|
|
278,15
|
5,157216
|
5
|
23,117
|
1267,9687
|
1244,8517
|
0,0947
|
4,57
|
4,4753
|
0,0015785
|
0,2430613
|
|
279,15
|
5,344922
|
6
|
27,7606
|
1268,9798
|
1241,2192
|
0,1113
|
4,5576
|
4,4463
|
0,0015823
|
0,2349286
|
|
280,15
|
5,537901
|
7
|
32,4118
|
1269,9732
|
1237,5614
|
0,1278
|
4,5452
|
4,4174
|
0,0015861
|
0,2271221
|
|
281,15
|
5,736252
|
8
|
37,0707
|
1270,9486
|
1233,8779
|
0,1443
|
4,5329
|
4,3886
|
0,00159
|
0,2196266
|
|
282,15
|
5,940073
|
9
|
41,7376
|
1271,9059
|
1230,1683
|
0,1607
|
4,5206
|
4,3599
|
0,0015939
|
0,2124275
|
|
283,15
|
6,149466
|
10
|
46,4125
|
1272,8447
|
1226,4322
|
0,1772
|
4,5085
|
4,3313
|
0,0015979
|
0,2055112
|
|
284,15
|
6,364529
|
11
|
51,0956
|
1273,7649
|
1222,6693
|
0,1935
|
4,4964
|
4,3029
|
0,0016019
|
0,1988648
|
|
285,15
|
6,585365
|
12
|
55,787
|
1274,6662
|
1218,8793
|
0,2099
|
4,4844
|
4,2745
|
0,0016059
|
0,1924758
|
|
286,15
|
6,812075
|
13
|
60,4867
|
1275,5485
|
1215,0617
|
0,2262
|
4,4724
|
4,2462
|
0,0016099
|
0,1863327
|
|
T (°K)
|
P (bar)
|
T (°C)
|
Enthalpie
spécifique
(KJ/Kg)
|
Chaleur de vaporisation
(KJ/Kg)
|
Entropie
spécifique
(KJ/Kg.°K)
|
?S (KJ/Kg.°K)
|
Volume
spécifique
(m3/Kg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
VL
|
VG
|
|
287,15
|
7,044761
|
14
|
65,1951
|
1276,4114
|
1211,2163
|
0,2425
|
4,4606
|
4,2181
|
0,001614
|
0,1804243
|
|
288,15
|
7,283527
|
15
|
69,912
|
1277,2547
|
1207,3427
|
0,2588
|
4,4488
|
4,19
|
0,0016182
|
0,1747401
|
|
289,15
|
7,528475
|
16
|
74,6378
|
1278,0783
|
1203,4405
|
0,275
|
4,437
|
4,162
|
0,0016223
|
0,1692702
|
|
290,15
|
7,779709
|
17
|
79,3725
|
1278,8817
|
1199,5093
|
0,2912
|
4,4253
|
4,1341
|
0,0016265
|
0,1640052
|
|
291,15
|
8,037334
|
18
|
84,1162
|
1279,6649
|
1195,5488
|
0,3074
|
4,4137
|
4,1063
|
0,0016308
|
0,1589359
|
|
296,15
|
9,425002
|
23
|
107,9745
|
1283,2677
|
1175,2933
|
0,3879
|
4,3565
|
3,9687
|
0,0016525
|
0,1362418
|
|
297,15
|
9,723187
|
24
|
112,7749
|
1283,9239
|
1171,149
|
0,4039
|
4,3452
|
3,9414
|
0,001657
|
0,1321819
|
|
298,15
|
10,028505
|
25
|
117,5852
|
1284,5579
|
1166,9727
|
0,4199
|
4,334
|
3,9141
|
0,0016614
|
0,1282661
|
|
299,15
|
10,341065
|
26
|
122,4055
|
1285,1696
|
1162,7641
|
0,4358
|
4,3228
|
3,887
|
0,001666
|
0,1244884
|
|
300,15
|
10,660973
|
27
|
127,236
|
1285,7587
|
1158,5227
|
0,4518
|
4,3117
|
3,8599
|
0,0016705
|
0,1208431
|
|
301,15
|
10,988338
|
28
|
132,0766
|
1286,3249
|
1154,2483
|
0,4677
|
4,3006
|
3,8329
|
0,0016751
|
0,1173246
|
|
302,15
|
11,323269
|
29
|
136,9276
|
1286,8679
|
1149,9403
|
0,4836
|
4,2896
|
3,806
|
0,0016798
|
0,1139278
|
|
303,15
|
11,665875
|
30
|
141,789
|
1287,3875
|
1145,5985
|
0,4995
|
4,2786
|
3,7791
|
0,0016844
|
0,1106478
|
|
304,15
|
12,016264
|
31
|
146,6611
|
1287,8834
|
1141,2223
|
0,5153
|
4,2677
|
3,7523
|
0,0016891
|
0,1074796
|
|
305,15
|
12,374547
|
32
|
151,5438
|
1288,3553
|
1136,8115
|
0,5311
|
4,2567
|
3,7256
|
0,0016939
|
0,104419
|
|
306,15
|
12,740832
|
33
|
156,4373
|
1288,8029
|
1132,3656
|
0,547
|
4,2459
|
3,6989
|
0,0016987
|
0,1014615
|
|
307,15
|
13,11523
|
34
|
161,3417
|
1289,226
|
1127,8843
|
0,5627
|
4,235
|
3,6723
|
0,0017035
|
0,098603
|
|
308,15
|
13,497851
|
35
|
166,2572
|
1289,6242
|
1123,367
|
0,5785
|
4,2242
|
3,6457
|
0,0017083
|
0,0958396
|
|
309,15
|
13,888805
|
36
|
171,1837
|
1289,9973
|
1118,8135
|
0,5943
|
4,2135
|
3,6192
|
0,0017132
|
0,0931676
|
|
310,15
|
14,288202
|
37
|
176,1216
|
1290,345
|
1114,2234
|
0,61
|
4,2028
|
3,5928
|
0,0017181
|
0,0905834
|
|
311,15
|
14,696152
|
38
|
181,0708
|
1290,667
|
1109,5962
|
0,6257
|
4,1921
|
3,5664
|
0,0017231
|
0,0880835
|
|
312,15
|
15,112767
|
39
|
186,0314
|
1290,963
|
1104,9315
|
0,6414
|
4,1814
|
3,54
|
0,0017281
|
0,0856648
|
|
313,15
|
15,538157
|
40
|
191,0037
|
1291,2327
|
1100,229
|
0,657
|
4,1708
|
3,5137
|
0,0017331
|
0,083324
|
|
314,15
|
15,972434
|
41
|
195,9876
|
1291,4758
|
1095,4882
|
0,6727
|
4,1602
|
3,4875
|
0,0017382
|
0,0810583
|
|
315,15
|
16,415707
|
42
|
200,9833
|
1291,692
|
1090,7087
|
0,6883
|
4,1496
|
3,4613
|
0,0017433
|
0,0788647
|
|
316,15
|
16,868088
|
43
|
205,9909
|
1291,8811
|
1085,8902
|
0,7039
|
4,139
|
3,4351
|
0,0017484
|
0,0767405
|
|
317,15
|
17,329687
|
44
|
211,0105
|
1292,0427
|
1081,0322
|
0,7195
|
4,1285
|
3,409
|
0,0017536
|
0,0746831
|
|
318,15
|
17,800617
|
45
|
216,0422
|
1292,1766
|
1076,1344
|
0,7351
|
4,118
|
3,3829
|
0,0017588
|
0,07269
|
|
319,15
|
18,280988
|
46
|
221,0861
|
1292,2824
|
1071,1963
|
0,7507
|
4,1075
|
3,3569
|
0,001764
|
0,0707588
|
|
320,15
|
18,770911
|
47
|
226,1424
|
1292,3599
|
1066,2175
|
0,7662
|
4,0971
|
3,3309
|
0,0017693
|
0,0688873
|
|
T (°K)
|
P (bar)
|
T (°C)
|
Enthalpie
spécifique
(KJ/Kg)
|
Chaleur de vaporisation
(KJ/Kg)
|
Entropie
spécifique
(KJ/Kg.°K)
|
?S (KJ/Kg.°K)
|
Volume
spécifique
(m3/Kg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
VL
|
VG
|
|
321,15
|
19,270497
|
48
|
231,2111
|
1292,4087
|
1061,1976
|
0,7818
|
4,0866
|
3,3049
|
0,0017746
|
0,0670732
|
|
322,15
|
19,779857
|
49
|
236,2922
|
1292,4286
|
1056,1363
|
0,7973
|
4,0762
|
3,279
|
0,00178
|
0,0653144
|
|
323,15
|
20,299102
|
50
|
241,3861
|
1292,4192
|
1051,0332
|
0,8128
|
4,0658
|
3,2531
|
0,0017854
|
0,063609
|
|
324,15
|
20,828344
|
51
|
246,4926
|
1292,3803
|
1045,8877
|
0,8283
|
4,0554
|
3,2272
|
0,0017908
|
0,061955
|
|
325,15
|
21,367692
|
52
|
251,612
|
1292,3116
|
1040,6997
|
0,8437
|
4,0451
|
3,2013
|
0,0017963
|
0,0603505
|
|
326,15
|
21,917257
|
53
|
256,7442
|
1292,2128
|
1035,4685
|
0,8592
|
4,0347
|
3,1755
|
0,0018017
|
0,0587938
|
|
327,15
|
22,47715
|
54
|
261,8895
|
1292,0835
|
1030,194
|
0,8746
|
4,0244
|
3,1497
|
0,0018073
|
0,0572831
|
|
328,15
|
23,047482
|
55
|
267,048
|
1291,9236
|
1024,8756
|
0,8901
|
4,014
|
3,124
|
0,0018128
|
0,055817
|
|
329,15
|
23,628363
|
56
|
272,2196
|
1291,7327
|
1019,5131
|
0,9055
|
4,0037
|
3,0982
|
0,0018184
|
0,0543937
|
|
330,15
|
24,219903
|
57
|
277,4045
|
1291,5105
|
1014,1059
|
0,9209
|
3,9934
|
3,0725
|
0,0018241
|
0,0530118
|
|
331,15
|
24,822211
|
58
|
282,6029
|
1291,2567
|
1008,6538
|
0,9363
|
3,9831
|
3,0468
|
0,0018298
|
0,0516699
|
|
332,15
|
25,435398
|
59
|
287,8148
|
1290,9711
|
1003,1564
|
0,9516
|
3,9728
|
3,0212
|
0,0018355
|
0,0503665
|
|
333,15
|
26,059574
|
60
|
293,0402
|
1290,6534
|
997,6132
|
0,967
|
3,9625
|
2,9955
|
0,0018412
|
0,0491004
|
|
334,15
|
26,694847
|
61
|
298,2794
|
1290,3033
|
992,0239
|
0,9824
|
3,9522
|
2,9699
|
0,001847
|
0,0478703
|
|
335,15
|
27,341327
|
62
|
303,5323
|
1289,9205
|
986,3882
|
0,9977
|
3,942
|
2,9443
|
0,0018528
|
0,0466749
|
|
336,15
|
27,999122
|
63
|
308,7991
|
1289,5047
|
980,7057
|
1,013
|
3,9317
|
2,9187
|
0,0018587
|
0,0455131
|
|
337,15
|
28,668342
|
64
|
314,0798
|
1289,0558
|
974,9759
|
1,0283
|
3,9214
|
2,8931
|
0,0018645
|
0,0443837
|
|
338,15
|
29,349095
|
65
|
319,3747
|
1288,5733
|
969,1987
|
1,0436
|
3,9112
|
2,8675
|
0,0018705
|
0,0432857
|
|
339,15
|
30,041488
|
66
|
324,6836
|
1288,0571
|
963,3735
|
1,0589
|
3,9009
|
2,842
|
0,0018764
|
0,0422181
|
|
340,15
|
30,745629
|
67
|
330,0068
|
1287,507
|
957,5002
|
1,0742
|
3,8906
|
2,8164
|
0,0018824
|
0,0411797
|
|
341,15
|
31,461627
|
68
|
335,3443
|
1286,9225
|
951,5782
|
1,0895
|
3,8804
|
2,7909
|
0,0018885
|
0,0401697
|
|
342,15
|
32,189588
|
69
|
340,6962
|
1286,3036
|
945,6074
|
1,1047
|
3,8701
|
2,7654
|
0,0018945
|
0,0391871
|
|
343,15
|
32,929618
|
70
|
346,0626
|
1285,6499
|
939,5873
|
1,12
|
3,8598
|
2,7398
|
0,0019006
|
0,0382311
|
|
344,15
|
33,681825
|
71
|
351,4436
|
1284,9612
|
933,5176
|
1,1352
|
3,8496
|
2,7143
|
0,0019068
|
0,0373007
|
|
345,15
|
34,446315
|
72
|
356,8392
|
1284,2373
|
927,3981
|
1,1505
|
3,8393
|
2,6888
|
0,0019129
|
0,0363952
|
|
346,15
|
35,223193
|
73
|
362,2496
|
1283,4779
|
921,2283
|
1,1657
|
3,829
|
2,6633
|
0,0019191
|
0,0355138
|
|
347,15
|
36,012564
|
74
|
367,6748
|
1282,6829
|
915,0081
|
1,1809
|
3,8187
|
2,6378
|
0,0019254
|
0,0346556
|
|
348,15
|
36,814533
|
75
|
373,115
|
1281,852
|
908,737
|
1,1961
|
3,8085
|
2,6123
|
0,0019317
|
0,03382
|
|
349,15
|
37,629206
|
76
|
378,5701
|
1280,9849
|
902,4149
|
1,2113
|
3,7982
|
2,5869
|
0,001938
|
0,0330062
|
|
350,15
|
38,456686
|
77
|
384,0402
|
1280,0816
|
896,0413
|
1,2265
|
3,7879
|
2,5614
|
0,0019443
|
0,0322136
|
|
T (°K)
|
P (bar)
|
T (°C)
|
Enthalpie
spécifique
(KJ/Kg)
|
Chaleur de vaporisation
(KJ/Kg)
|
Entropie
spécifique
(KJ/Kg.°K)
|
?S (KJ/Kg.°K)
|
Volume
spécifique
(m3/Kg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
VL
|
VG
|
|
351,15
|
39,297077
|
78
|
389,5256
|
1279,1417
|
889,6161
|
1,2417
|
3,7776
|
2,5359
|
0,0019507
|
0,0314415
|
|
352,15
|
40,150481
|
79
|
395,0261
|
1278,1651
|
883,1389
|
1,2568
|
3,7672
|
2,5104
|
0,0019571
|
0,0306892
|
|
353,15
|
41,017003
|
80
|
400,542
|
1277,1516
|
876,6096
|
1,272
|
3,7569
|
2,4849
|
0,0019636
|
0,0299563
|
|
354,15
|
41,896743
|
81
|
406,0732
|
1276,101
|
870,0277
|
1,2871
|
3,7466
|
2,4594
|
0,0019701
|
0,0292419
|
|
355,15
|
42,789805
|
82
|
411,62
|
1275,0131
|
863,3932
|
1,3023
|
3,7362
|
2,4339
|
0,0019766
|
0,0285457
|
|
356,15
|
43,696289
|
83
|
417,1822
|
1273,8879
|
856,7057
|
1,3174
|
3,7259
|
2,4085
|
0,0019832
|
0,027867
|
|
357,15
|
44,616296
|
84
|
422,7601
|
1272,725
|
849,9649
|
1,3326
|
3,7155
|
2,383
|
0,0019898
|
0,0272054
|
|
358,15
|
45,549927
|
85
|
428,3536
|
1271,5244
|
843,1708
|
1,3477
|
3,7051
|
2,3575
|
0,0019964
|
0,0265602
|
|
359,15
|
46,497282
|
86
|
433,9629
|
1270,2859
|
836,323
|
1,3628
|
3,6948
|
2,332
|
0,0020031
|
0,0259311
|
|
360,15
|
47,458459
|
87
|
439,588
|
1269,0093
|
829,4213
|
1,3779
|
3,6844
|
2,3065
|
0,0020098
|
0,0253175
|
|
361,15
|
48,433558
|
88
|
445,229
|
1267,6947
|
822,4656
|
1,393
|
3,674
|
2,281
|
0,0020165
|
0,024719
|
|
362,15
|
49,422677
|
89
|
450,886
|
1266,3417
|
815,4557
|
1,4081
|
3,6635
|
2,2555
|
0,0020233
|
0,0241351
|
|
363,15
|
50,425914
|
90
|
456,5591
|
1264,9504
|
808,3913
|
1,4232
|
3,6531
|
2,2299
|
0,0020301
|
0,0235655
|
|
364,15
|
51,443365
|
91
|
462,2482
|
1263,5205
|
801,2723
|
1,4382
|
3,6427
|
2,2044
|
0,0020369
|
0,0230096
|
|
365,15
|
52,475128
|
92
|
467,9535
|
1262,0521
|
794,0985
|
1,4533
|
3,6322
|
2,1789
|
0,0020438
|
0,0224672
|
|
366,15
|
53,521298
|
93
|
473,6751
|
1260,5449
|
786,8698
|
1,4684
|
3,6217
|
2,1534
|
0,0020507
|
0,0219378
|
|
367,15
|
54,581972
|
94
|
479,413
|
1258,9991
|
779,5861
|
1,4834
|
3,6112
|
2,1278
|
0,0020577
|
0,021421
|
|
368,15
|
55,657243
|
95
|
485,1672
|
1257,4143
|
772,2471
|
1,4985
|
3,6007
|
2,1023
|
0,0020647
|
0,0209165
|
|
369,15
|
56,747206
|
96
|
490,9379
|
1255,7907
|
764,8528
|
1,5135
|
3,5902
|
2,0767
|
0,0020717
|
0,020424
|
|
370,15
|
57,851954
|
97
|
496,7251
|
1254,1282
|
757,403
|
1,5285
|
3,5797
|
2,0511
|
0,0020788
|
0,0199431
|
|
371,15
|
58,971582
|
98
|
502,5289
|
1252,4266
|
749,8977
|
1,5436
|
3,5691
|
2,0256
|
0,0020859
|
0,0194735
|
|
372,15
|
60,10618
|
99
|
508,3493
|
1250,6861
|
742,3367
|
1,5586
|
3,5586
|
2
|
0,002093
|
0,0190148
|
|
373,15
|
61,255842
|
100
|
514,1864
|
1248,9065
|
734,72
|
1,5736
|
3,548
|
1,9744
|
0,0021002
|
0,0185668
|
|
374,15
|
62,420657
|
101
|
520,0403
|
1247,0878
|
727,0475
|
1,5886
|
3,5374
|
1,9488
|
0,0021074
|
0,0181292
|
|
375,15
|
63,600717
|
102
|
525,911
|
1245,2301
|
719,3191
|
1,6036
|
3,5268
|
1,9232
|
0,0021146
|
0,0177017
|
|
376,15
|
64,796111
|
103
|
531,7985
|
1243,3333
|
711,5348
|
1,6186
|
3,5162
|
1,8976
|
0,0021219
|
0,017284
|
|
377,15
|
66,006929
|
104
|
537,703
|
1241,3975
|
703,6944
|
1,6336
|
3,5056
|
1,872
|
0,0021292
|
0,0168758
|
|
378,15
|
67,23326
|
105
|
543,6245
|
1239,4226
|
695,7981
|
1,6486
|
3,4949
|
1,8463
|
0,0021365
|
0,016477
|
|
379,15
|
68,47519
|
106
|
549,563
|
1237,4088
|
687,8457
|
1,6636
|
3,4843
|
1,8207
|
0,0021439
|
0,0160872
|
|
380,15
|
69,732808
|
107
|
555,5186
|
1235,356
|
679,8373
|
1,6786
|
3,4736
|
1,795
|
0,0021513
|
0,0157062
|
|
T (°K)
|
P (bar)
|
T (°C)
|
Enthalpie
spécifique
(KJ/Kg)
|
Chaleur de vaporisation
(KJ/Kg)
|
Entropie
spécifique
(KJ/Kg.°K)
|
?S (KJ/Kg.°K)
|
Volume
spécifique
(m3/Kg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
VL
|
VG
|
|
381,15
|
71,006199
|
108
|
561,4914
|
1233,2643
|
671,7729
|
1,6935
|
3,4629
|
1,7694
|
0,0021587
|
0,0153337
|
|
382,15
|
72,29545
|
109
|
567,4814
|
1231,1338
|
663,6524
|
1,7085
|
3,4522
|
1,7437
|
0,0021662
|
0,0149697
|
|
383,15
|
73,600646
|
110
|
573,4887
|
1228,9646
|
655,4759
|
1,7235
|
3,4415
|
1,718
|
0,0021737
|
0,0146137
|
|
384,15
|
74,921871
|
111
|
579,5133
|
1226,7567
|
647,2434
|
1,7384
|
3,4308
|
1,6924
|
0,0021813
|
0,0142657
|
|
385,15
|
76,25921
|
112
|
585,5552
|
1224,5102
|
638,9549
|
1,7534
|
3,42
|
1,6667
|
0,0021889
|
0,0139254
|
|
386,15
|
77,612745
|
113
|
591,6146
|
1222,2252
|
630,6106
|
1,7683
|
3,4093
|
1,641
|
0,0021965
|
0,0135926
|
|
387,15
|
78,982558
|
114
|
597,6915
|
1219,902
|
622,2105
|
1,7832
|
3,3985
|
1,6153
|
0,0022042
|
0,0132671
|
|
388,15
|
80,368731
|
115
|
603,7859
|
1217,5405
|
613,7546
|
1,7982
|
3,3877
|
1,5896
|
0,0022119
|
0,0129488
|
|
389,15
|
81,771346
|
116
|
609,8978
|
1215,1409
|
605,243
|
1,8131
|
3,3769
|
1,5638
|
0,0022196
|
0,0126374
|
|
390,15
|
83,190481
|
117
|
616,0274
|
1212,7033
|
596,6759
|
1,828
|
3,3661
|
1,5381
|
0,0022273
|
0,0123328
|
|
391,15
|
84,626218
|
118
|
622,1747
|
1210,228
|
588,0533
|
1,8429
|
3,3553
|
1,5124
|
0,0022351
|
0,0120348
|
|
392,15
|
86,078634
|
119
|
628,3396
|
1207,7151
|
579,3755
|
1,8578
|
3,3445
|
1,4867
|
0,002243
|
0,0117433
|
|
393,15
|
87,547808
|
120
|
634,5224
|
1205,1647
|
570,6424
|
1,8728
|
3,3337
|
1,4609
|
0,0022508
|
0,0114581
|
|
394,15
|
89,033817
|
121
|
640,7229
|
1202,5771
|
561,8542
|
1,8877
|
3,3228
|
1,4352
|
0,0022588
|
0,0111789
|
|
395,15
|
90,536738
|
122
|
646,9413
|
1199,9524
|
553,0111
|
1,9025
|
3,312
|
1,4094
|
0,0022667
|
0,0109058
|
|
396,15
|
92,056645
|
123
|
653,1776
|
1197,2909
|
544,1133
|
1,9174
|
3,3011
|
1,3837
|
0,0022747
|
0,0106385
|
|
397,15
|
93,593615
|
124
|
659,4318
|
1194,5928
|
535,161
|
1,9323
|
3,2902
|
1,3579
|
0,0022827
|
0,0103769
|
|
398,15
|
95,147722
|
125
|
665,704
|
1191,8582
|
526,1542
|
1,9472
|
3,2793
|
1,3321
|
0,0022907
|
0,0101209
|
|
399,15
|
96,719039
|
126
|
671,9943
|
1189,0875
|
517,0933
|
1,9621
|
3,2685
|
1,3064
|
0,0022988
|
0,0098702
|
|
400,15
|
98,307639
|
127
|
678,3026
|
1186,2809
|
507,9784
|
1,9769
|
3,2576
|
1,2806
|
0,0023069
|
0,0096249
|
|
401,15
|
99,913595
|
128
|
684,629
|
1183,4386
|
498,8097
|
1,9918
|
3,2467
|
1,2548
|
0,0023151
|
0,0093847
|
|
402,15
|
101,536976
|
129
|
690,9735
|
1180,561
|
489,5875
|
2,0067
|
3,2357
|
1,2291
|
0,0023233
|
0,0091496
|
|
403,15
|
103,177855
|
130
|
697,3362
|
1177,6482
|
480,312
|
2,0215
|
3,2248
|
1,2033
|
0,0023315
|
0,0089194
|
|
404,15
|
104,836301
|
131
|
703,7172
|
1174,7006
|
470,9834
|
2,0364
|
3,2139
|
1,1775
|
0,0023397
|
0,008694
|
|
405,15
|
106,512382
|
132
|
710,1164
|
1171,7185
|
461,6021
|
2,0512
|
3,203
|
1,1518
|
0,002348
|
0,0084734
|
|
406,15
|
108,206167
|
133
|
716,5339
|
1168,7021
|
452,1682
|
2,0661
|
3,1921
|
1,126
|
0,0023563
|
0,0082573
|
|
407,15
|
109,917724
|
134
|
722,9697
|
1165,6518
|
442,6821
|
2,0809
|
3,1811
|
1,1002
|
0,0023647
|
0,0080456
|
Propriétés de la vapeur d'eau (H2O)
saturée (à différentes températures).
|
T (°C)
|
T (°K)
|
P (bar)
|
Enthalpie
spécifique
(KJ/Kg)
|
Chaleur de vaporisation
(KJ/Kg)
|
Entropie
spécifique
(KJ/Kg.°K)
|
?S
(KJ/Kg.°K)
|
Volume
spécifique
(m3/Kg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
VL
|
VG
|
|
0
|
273,15
|
0,006109
|
-0,3553
|
2501,1419
|
2501,4973
|
0,0015
|
9,1579
|
9,1564
|
0,0009962
|
206,2390778
|
|
1
|
274,15
|
0,006568
|
3,8657
|
2502,9798
|
2499,1141
|
0,017
|
9,1313
|
9,1143
|
0,0009963
|
192,546476
|
|
2
|
275,15
|
0,007056
|
8,0853
|
2504,8171
|
2496,7318
|
0,0323
|
9,1049
|
9,0726
|
0,0009964
|
179,8660705
|
|
3
|
276,15
|
0,007576
|
12,3036
|
2506,654
|
2494,3504
|
0,0476
|
9,0787
|
9,0311
|
0,0009965
|
168,1160721
|
|
4
|
277,15
|
0,008131
|
16,5206
|
2508,4903
|
2491,9697
|
0,0629
|
9,0528
|
8,9899
|
0,0009966
|
157,2218233
|
|
5
|
278,15
|
0,00872
|
20,7363
|
2510,3261
|
2489,5898
|
0,0781
|
9,0271
|
8,9491
|
0,0009966
|
147,1151336
|
|
6
|
279,15
|
0,009347
|
24,9507
|
2512,1613
|
2487,2105
|
0,0932
|
9,0017
|
8,9085
|
0,0009968
|
137,7336809
|
|
7
|
280,15
|
0,010014
|
29,164
|
2513,9959
|
2484,8319
|
0,1083
|
8,9765
|
8,8682
|
0,0009969
|
129,0204709
|
|
8
|
281,15
|
0,010722
|
33,376
|
2515,8298
|
2482,4538
|
0,1233
|
8,9515
|
8,8282
|
0,000997
|
120,9233502
|
|
9
|
282,15
|
0,01 1475
|
37,5868
|
2517,6631
|
2480,0763
|
0,1382
|
8,9267
|
8,7885
|
0,0009971
|
113,3945658
|
|
10
|
283,15
|
0,012273
|
41,7965
|
2519,4958
|
2477,6993
|
0,1531
|
8,9022
|
8,7491
|
0,0009972
|
106,3903683
|
|
11
|
284,15
|
0,01312
|
46,0051
|
2521,3277
|
2475,3226
|
0,1679
|
8,8779
|
8,71
|
0,0009974
|
99,8706517
|
|
12
|
285,15
|
0,014018
|
50,2126
|
2523,1589
|
2472,9463
|
0,1827
|
8,8538
|
8,6711
|
0,0009975
|
93,7986291
|
|
13
|
286,15
|
0,014969
|
54,419
|
2524,9893
|
2470,5704
|
0,1974
|
8,8299
|
8,6325
|
0,0009977
|
88,1405376
|
|
14
|
287,15
|
0,015977
|
58,6243
|
2526,819
|
2468,1946
|
0,2121
|
8,8063
|
8,5941
|
0,0009979
|
82,8653728
|
|
15
|
288,15
|
0,017044
|
62,8287
|
2528,6478
|
2465,8191
|
0,2267
|
8,7828
|
8,5561
|
0,000998
|
77,9446462
|
|
16
|
289,15
|
0,018173
|
67,032
|
2530,4757
|
2463,4437
|
0,2413
|
8,7596
|
8,5183
|
0,0009982
|
73,3521668
|
|
17
|
290,15
|
0,019368
|
71,2345
|
2532,3028
|
2461,0683
|
0,2558
|
8,7365
|
8,4807
|
0,0009984
|
69,0638424
|
|
18
|
291,15
|
0,02063
|
75,4359
|
2534,129
|
2458,693
|
0,2703
|
8,7137
|
8,4435
|
0,0009986
|
65,0574986
|
|
19
|
292,15
|
0,021964
|
79,6365
|
2535,9542
|
2456,3177
|
0,2847
|
8,6911
|
8,4064
|
0,0009988
|
61,3127155
|
|
20
|
293,15
|
0,023373
|
83,8362
|
2537,7784
|
2453,9422
|
0,299
|
8,6687
|
8,3696
|
0,000999
|
57,8106783
|
|
21
|
294,15
|
0,024861
|
88,035
|
2539,6016
|
2451,5665
|
0,3133
|
8,6464
|
8,3331
|
0,0009992
|
54,5340418
|
|
22
|
295,15
|
0,026431
|
92,2331
|
2541,4237
|
2449,1907
|
0,3276
|
8,6244
|
8,2968
|
0,0009995
|
51,4668073
|
|
23
|
296,15
|
0,028086
|
96,4303
|
2543,2448
|
2446,8145
|
0,3418
|
8,6026
|
8,2608
|
0,0009997
|
48,5942098
|
|
24
|
297,15
|
0,029832
|
100,6267
|
2545,0647
|
2444,438
|
0,3559
|
8,5809
|
8,225
|
0,0009999
|
45,9026163
|
|
25
|
298,15
|
0,031671
|
104,8224
|
2546,8834
|
2442,061
|
0,37
|
8,5594
|
8,1894
|
0,0010002
|
43,3794321
|
|
26
|
299,15
|
0,033609
|
109,0174
|
2548,701
|
2439,6836
|
0,384
|
8,5382
|
8,1541
|
0,0010004
|
41,0130159
|
|
27
|
300,15
|
0,035649
|
113,2118
|
2550,5173
|
2437,3055
|
0,398
|
8,5171
|
8,119
|
0,0010007
|
38,7926019
|
|
28
|
301,15
|
0,037796
|
117,4054
|
2552,3323
|
2434,9269
|
0,412
|
8,4962
|
8,0842
|
0,001001
|
36,7082294
|
|
T (°C)
|
T (°R)
|
P (bar)
|
Enthalpie
spécifique
(RJ/Rg)
|
Chaleur de vaporisation
(RJ/Rg)
|
Entropie
spécifique
(RJ/Rg.°R)
|
?S
(RJ/Rg.°R)
hL
|
Volume
spécifique
(m3/Rg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
hG
|
LV
|
|
29
|
302,15
|
0,040055
|
121,5984
|
2554,146
|
2432,5476
|
0,4259
|
8,4754
|
8,0496
|
0,0010013
|
34,7506774
|
|
30
|
303,15
|
0,04243
|
125,7908
|
2555,9583
|
2430,1675
|
0,4397
|
8,4549
|
8,0151
|
0,0010015
|
32,91 1406
|
|
31
|
304,15
|
0,044927
|
129,9827
|
2557,7693
|
2427,7866
|
0,4535
|
8,4345
|
7,981
|
0,0010018
|
31,1825018
|
|
32
|
305,15
|
0,047551
|
134,1739
|
2559,5787
|
2425,4048
|
0,4673
|
8,4143
|
7,947
|
0,0010021
|
29,5566285
|
|
33
|
306,15
|
0,050306
|
138,3647
|
2561,3867
|
2423,022
|
0,481
|
8,3943
|
7,9133
|
0,0010025
|
28,0269819
|
|
34
|
307,15
|
0,053199
|
142,555
|
2563,1931
|
2420,6382
|
0,4947
|
8,3744
|
7,8798
|
0,0010028
|
26,5872475
|
|
35
|
308,15
|
0,056235
|
146,7448
|
2564,9979
|
2418,2532
|
0,5083
|
8,3547
|
7,8464
|
0,0010031
|
25,2315632
|
|
36
|
309,15
|
0,05942
|
150,9341
|
2566,8012
|
2415,8671
|
0,5219
|
8,3352
|
7,8133
|
0,0010034
|
23,9544842
|
|
37
|
310,15
|
0,06276
|
155,123
|
2568,6027
|
2413,4796
|
0,5354
|
8,3158
|
7,7805
|
0,0010038
|
22,7509506
|
|
38
|
311,15
|
0,066261
|
159,3116
|
2570,4025
|
2411,0909
|
0,5489
|
8,2967
|
7,7478
|
0,0010041
|
21,6162585
|
|
39
|
312,15
|
0,06993
|
163,4998
|
2572,2005
|
2408,7007
|
0,5623
|
8,2776
|
7,7153
|
0,0010045
|
20,5460326
|
|
40
|
313,15
|
0,073773
|
167,6876
|
2573,9967
|
2406,3091
|
0,5757
|
8,2587
|
7,683
|
0,0010049
|
19,5362016
|
|
41
|
314,15
|
0,077796
|
171,8752
|
2575,791
|
2403,9158
|
0,589
|
8,24
|
7,651
|
0,0010052
|
18,5829753
|
|
42
|
315,15
|
0,082008
|
176,0624
|
2577,5834
|
2401,5209
|
0,6024
|
8,2215
|
7,6191
|
0,0010056
|
17,6828237
|
|
43
|
316,15
|
0,086415
|
180,2495
|
2579,3738
|
2399,1243
|
0,6156
|
8,203
|
7,5874
|
0,001006
|
16,8324577
|
|
44
|
317,15
|
0,091024
|
184,4362
|
2581,1622
|
2396,7259
|
0,6288
|
8,1848
|
7,5559
|
0,0010064
|
16,0288112
|
|
45
|
318,15
|
0,095844
|
188,6228
|
2582,9485
|
2394,3256
|
0,642
|
8,1667
|
7,5247
|
0,0010068
|
15,2690248
|
|
46
|
319,15
|
0,100881
|
192,8093
|
2584,7326
|
2391,9233
|
0,6552
|
8,1487
|
7,4936
|
0,0010072
|
14,5504311
|
|
47
|
320,15
|
0,106145
|
196,9956
|
2586,5146
|
2389,519
|
0,6683
|
8,1309
|
7,4626
|
0,0010076
|
13,8705399
|
|
48
|
321,15
|
0,111642
|
201,1817
|
2588,2943
|
2387,1125
|
0,6813
|
8,1132
|
7,4319
|
0,0010081
|
13,2270264
|
|
49
|
322,15
|
0,117383
|
205,3678
|
2590,0717
|
2384,7039
|
0,6943
|
8,0957
|
7,4014
|
0,0010085
|
12,6177188
|
|
50
|
323,15
|
0,123374
|
209,5539
|
2591,8467
|
2382,2929
|
0,7073
|
8,0783
|
7,371
|
0,0010089
|
12,0405873
|
|
51
|
324,15
|
0,129626
|
213,7399
|
2593,6194
|
2379,8795
|
0,7202
|
8,0611
|
7,3408
|
0,0010094
|
11,4937343
|
|
52
|
325,15
|
0,136148
|
217,9259
|
2595,3895
|
2377,4637
|
0,7331
|
8,044
|
7,3108
|
0,0010099
|
10,9753853
|
|
53
|
326,15
|
0,142948
|
222,1119
|
2597,1571
|
2375,0453
|
0,746
|
8,027
|
7,281
|
0,0010103
|
10,4838795
|
|
54
|
327,15
|
0,150037
|
226,2979
|
2598,9222
|
2372,6242
|
0,7588
|
8,0102
|
7,2514
|
0,0010108
|
10,0176628
|
|
55
|
328,15
|
0,157425
|
230,4841
|
2600,6846
|
2370,2005
|
0,7716
|
7,9935
|
7,2219
|
0,0010113
|
9,5752794
|
|
56
|
329,15
|
0,165121
|
234,6703
|
2602,4442
|
2367,7739
|
0,7843
|
7,9769
|
7,1926
|
0,0010118
|
9,1553661
|
|
57
|
330,15
|
0,173136
|
238,8567
|
2604,2011
|
2365,3444
|
0,797
|
7,9604
|
7,1635
|
0,0010123
|
8,7566452
|
|
58
|
331,15
|
0,181481
|
243,0433
|
2605,9552
|
2362,9119
|
0,8096
|
7,9441
|
7,1345
|
0,0010128
|
8,3779187
|
|
T (°C)
|
T (°R)
|
P (bar)
|
Enthalpie
spécifique
(RJ/Rg)
|
Chaleur de vaporisation
(RJ/Rg)
|
Entropie
spécifique
(RJ/Rg.°R)
|
?S
(RJ/Rg.°R)
hL
|
Volume
spécifique
(m3/Rg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
hG
|
LV
|
|
59
|
332,15
|
0,190166
|
247,23
|
2607,7063
|
2360,4763
|
0,8223
|
7,928
|
7,1057
|
0,0010133
|
8,0180633
|
|
60
|
333,15
|
0,199204
|
251,417
|
2609,4545
|
2358,0376
|
0,8348
|
7,9119
|
7,077
|
0,0010138
|
7,676025
|
|
61
|
334,15
|
0,208604
|
255,6041
|
2611,1997
|
2355,5955
|
0,8474
|
7,896
|
7,0486
|
0,0010143
|
7,3508147
|
|
62
|
335,15
|
0,218379
|
259,7916
|
2612,9418
|
2353,1502
|
0,8599
|
7,8802
|
7,0203
|
0,0010149
|
7,0415037
|
|
63
|
336,15
|
0,228541
|
263,9794
|
2614,6807
|
2350,7013
|
0,8724
|
7,8645
|
6,9921
|
0,0010154
|
6,7472196
|
|
64
|
337,15
|
0,239102
|
268,1675
|
2616,4164
|
2348,249
|
0,8848
|
7,8489
|
6,9641
|
0,001016
|
6,4671429
|
|
65
|
338,15
|
0,250074
|
272,3559
|
2618,1489
|
2345,7929
|
0,8972
|
7,8335
|
6,9362
|
0,0010165
|
6,2005033
|
|
66
|
339,15
|
0,261471
|
276,5447
|
2619,8779
|
2343,3332
|
0,9096
|
7,8181
|
6,9086
|
0,0010171
|
5,9465765
|
|
67
|
340,15
|
0,273306
|
280,734
|
2621,6036
|
2340,8696
|
0,9219
|
7,8029
|
6,881
|
0,0010177
|
5,7046812
|
|
68
|
341,15
|
0,285591
|
284,9236
|
2623,3258
|
2338,4022
|
0,9342
|
7,7878
|
6,8536
|
0,0010183
|
5,4741764
|
|
69
|
342,15
|
0,298341
|
289,1138
|
2625,0444
|
2335,9307
|
0,9465
|
7,7728
|
6,8264
|
0,0010188
|
5,2544588
|
|
70
|
343,15
|
0,31157
|
293,3044
|
2626,7595
|
2333,4551
|
0,9587
|
7,758
|
6,7993
|
0,0010194
|
5,0449604
|
|
71
|
344,15
|
0,325291
|
297,4955
|
2628,4708
|
2330,9753
|
0,9709
|
7,7432
|
6,7723
|
0,00102
|
4,8451461
|
|
72
|
345,15
|
0,339519
|
301,6872
|
2630,1784
|
2328,4912
|
0,983
|
7,7286
|
6,7455
|
0,0010207
|
4,6545119
|
|
73
|
346,15
|
0,35427
|
305,8795
|
2631,8822
|
2326,0027
|
0,9952
|
7,714
|
6,7189
|
0,0010213
|
4,4725825
|
|
74
|
347,15
|
0,369557
|
310,0724
|
2633,5821
|
2323,5097
|
1,0073
|
7,6996
|
6,6923
|
0,0010219
|
4,29891
|
|
75
|
348,15
|
0,385398
|
314,2659
|
2635,278
|
2321,0121
|
1,0193
|
7,6853
|
6,6659
|
0,0010225
|
4,1330719
|
|
76
|
349,15
|
0,401807
|
318,46
|
2636,9699
|
2318,5099
|
1,0313
|
7,671
|
6,6397
|
0,0010232
|
3,9746697
|
|
77
|
350,15
|
0,418801
|
322,6549
|
2638,6577
|
2316,0028
|
1,0433
|
7,6569
|
6,6136
|
0,0010238
|
3,8233272
|
|
78
|
351,15
|
0,436395
|
326,8504
|
2640,3413
|
2313,4909
|
1,0553
|
7,6429
|
6,5876
|
0,0010245
|
3,6786892
|
|
79
|
352,15
|
0,454608
|
331,0467
|
2642,0207
|
2310,974
|
1,0672
|
7,629
|
6,5618
|
0,0010252
|
3,5404204
|
|
80
|
353,15
|
0,473455
|
335,2438
|
2643,6958
|
2308,452
|
1,0791
|
7,6152
|
6,5361
|
0,0010258
|
3,408204
|
|
81
|
354,15
|
0,492954
|
339,4416
|
2645,3665
|
2305,9249
|
1,091
|
7,6015
|
6,5105
|
0,0010265
|
3,2817406
|
|
82
|
355,15
|
0,513122
|
343,6403
|
2647,0328
|
2303,3924
|
1,1028
|
7,5879
|
6,485
|
0,0010272
|
3,1607474
|
|
83
|
356,15
|
0,533979
|
347,8399
|
2648,6945
|
2300,8546
|
1,1146
|
7,5743
|
6,4597
|
0,0010279
|
3,0449567
|
|
84
|
357,15
|
0,555542
|
352,0403
|
2650,3516
|
2298,3114
|
1,1264
|
7,5609
|
6,4345
|
0,0010286
|
2,9341155
|
|
85
|
358,15
|
0,577829
|
356,2416
|
2652,0041
|
2295,7625
|
1,1381
|
7,5476
|
6,4094
|
0,0010293
|
2,8279844
|
|
86
|
359,15
|
0,60086
|
360,4438
|
2653,6518
|
2293,208
|
1,1498
|
7,5343
|
6,3845
|
0,0010301
|
2,7263369
|
|
87
|
360,15
|
0,624654
|
364,6471
|
2655,2948
|
2290,6477
|
1,1615
|
7,5212
|
6,3597
|
0,0010308
|
2,6289584
|
|
88
|
361,15
|
0,649231
|
368,8513
|
2656,9328
|
2288,0816
|
1,1732
|
7,5081
|
6,335
|
0,0010315
|
2,5356459
|
|
T (°C)
|
T (°R)
|
P (bar)
|
Enthalpie
spécifique
(RJ/Rg)
|
Chaleur de vaporisation
(RJ/Rg)
|
Entropie
spécifique
(RJ/Rg.°R)
|
?S
(RJ/Rg.°R)
hL
|
Volume
spécifique
(m3/Rg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
hG
|
LV
|
|
89
|
362,15
|
0,67461
|
373,0565
|
2658,5659
|
2285,5095
|
1,1848
|
7,4952
|
6,3104
|
0,0010323
|
2,446207
|
|
90
|
363,15
|
0,700813
|
377,2627
|
2660,194
|
2282,9313
|
1,1964
|
7,4823
|
6,2859
|
0,001033
|
2,3604594
|
|
91
|
364,15
|
0,727859
|
381,4701
|
2661,817
|
2280,3469
|
1,2079
|
7,4695
|
6,2616
|
0,0010338
|
2,2782303
|
|
92
|
365,15
|
0,75577
|
385,6785
|
2663,4348
|
2277,7563
|
1,2195
|
7,4568
|
6,2374
|
0,0010345
|
2,199356
|
|
93
|
366,15
|
0,784568
|
389,8881
|
2665,0474
|
2275,1593
|
1,231
|
7,4442
|
6,2132
|
0,0010353
|
2,1236812
|
|
94
|
367,15
|
0,814273
|
394,0988
|
2666,6547
|
2272,5558
|
1,2425
|
7,4317
|
6,1892
|
0,0010361
|
2,0510585
|
|
95
|
368,15
|
0,844908
|
398,3107
|
2668,2565
|
2269,9458
|
1,2539
|
7,4193
|
6,1654
|
0,0010369
|
1,9813481
|
|
96
|
369,15
|
0,876495
|
402,5238
|
2669,853
|
2267,3291
|
1,2653
|
7,4069
|
6,1416
|
0,0010377
|
1,9144175
|
|
97
|
370,15
|
0,909058
|
406,7382
|
2671,4439
|
2264,7057
|
1,2767
|
7,3946
|
6,1179
|
0,0010385
|
1,8501405
|
|
98
|
371,15
|
0,942618
|
410,9538
|
2673,0292
|
2262,0754
|
1,2881
|
7,3824
|
6,0944
|
0,0010393
|
1,7883978
|
|
99
|
372,15
|
0,977201
|
415,1707
|
2674,6089
|
2259,4381
|
1,2994
|
7,3703
|
6,0709
|
0,0010401
|
1,7290755
|
|
100
|
373,15
|
1,012829
|
419,389
|
2676,1828
|
2256,7938
|
1,3107
|
7,3583
|
6,0476
|
0,001041
|
1,6720658
|
|
101
|
374,15
|
1,049527
|
423,6086
|
2677,7509
|
2254,1423
|
1,322
|
7,3463
|
6,0243
|
0,0010418
|
1,6172662
|
|
102
|
375,15
|
1,087319
|
427,8295
|
2679,3131
|
2251,4835
|
1,3333
|
7,3345
|
6,0012
|
0,0010426
|
1,5645791
|
|
103
|
376,15
|
1,126231
|
432,0519
|
2680,8693
|
2248,8174
|
1,3445
|
7,3227
|
5,9782
|
0,0010435
|
1,5139117
|
|
104
|
377,15
|
1,166287
|
436,2757
|
2682,4196
|
2246,1439
|
1,3557
|
7,3109
|
5,9552
|
0,0010444
|
1,465176
|
|
105
|
378,15
|
1,207513
|
440,501
|
2683,9638
|
2243,4628
|
1,3669
|
7,2993
|
5,9324
|
0,0010452
|
1,418288
|
|
106
|
379,15
|
1,249936
|
444,7277
|
2685,5018
|
2240,774
|
1,378
|
7,2877
|
5,9097
|
0,0010461
|
1,3731678
|
|
107
|
380,15
|
1,293581
|
448,956
|
2687,0335
|
2238,0775
|
1,3892
|
7,2762
|
5,8871
|
0,001047
|
1,3297395
|
|
108
|
381,15
|
1,338475
|
453,1858
|
2688,559
|
2235,3732
|
1,4003
|
7,2648
|
5,8646
|
0,0010479
|
1,2879307
|
|
109
|
382,15
|
1,384646
|
457,4172
|
2690,0781
|
2232,6609
|
1,4113
|
7,2534
|
5,8421
|
0,0010488
|
1,2476726
|
|
110
|
383,15
|
1,432121
|
461,6501
|
2691,5908
|
2229,9406
|
1,4224
|
7,2422
|
5,8198
|
0,0010497
|
1,2088994
|
|
111
|
384,15
|
1,480927
|
465,8847
|
2693,0969
|
2227,2122
|
1,4334
|
7,231
|
5,7976
|
0,0010506
|
1,1715487
|
|
112
|
385,15
|
1,531093
|
470,121
|
2694,5965
|
2224,4755
|
1,4444
|
7,2198
|
5,7754
|
0,0010515
|
1,135561
|
|
113
|
386,15
|
1,582648
|
474,3589
|
2696,0895
|
2221,7305
|
1,4554
|
7,2087
|
5,7534
|
0,0010524
|
1,1008793
|
|
114
|
387,15
|
1,63562
|
478,5986
|
2697,5757
|
2218,9771
|
1,4663
|
7,1977
|
5,7314
|
0,0010534
|
1,0674495
|
|
115
|
388,15
|
1,690039
|
482,8399
|
2699,0552
|
2216,2152
|
1,4773
|
7,1868
|
5,7095
|
0,0010543
|
1,03522
|
|
116
|
389,15
|
1,745934
|
487,0831
|
2700,5278
|
2213,4447
|
1,4882
|
7,1759
|
5,6878
|
0,0010553
|
1,0041415
|
|
117
|
390,15
|
1,803336
|
491,328
|
2701,9936
|
2210,6655
|
1,499
|
7,1651
|
5,6661
|
0,0010562
|
0,9741671
|
|
118
|
391,15
|
1,862274
|
495,5748
|
2703,4523
|
2207,8776
|
1,5099
|
7,1544
|
5,6445
|
0,0010572
|
0,9452518
|
|
T (°C)
|
T (°R)
|
P (bar)
|
Enthalpie
spécifique
(RJ/Rg)
|
Chaleur de vaporisation
(RJ/Rg)
|
Entropie
spécifique
(RJ/Rg.°R)
|
?S
(RJ/Rg.°R)
hL
|
Volume
spécifique
(m3/Rg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
hG
|
LV
|
|
119
|
392,15
|
1,92278
|
499,8234
|
2704,9041
|
2205,0807
|
1,5207
|
7,1437
|
5,623
|
0,0010582
|
0,9173527
|
|
120
|
393,15
|
1,984885
|
504,0738
|
2706,3487
|
2202,2749
|
1,5315
|
7,1331
|
5,6015
|
0,0010592
|
0,8904292
|
|
121
|
394,15
|
2,04862
|
508,3262
|
2707,7862
|
2199,46
|
1,5423
|
7,1225
|
5,5802
|
0,0010602
|
0,864442
|
|
122
|
395,15
|
2,114018
|
512,5805
|
2709,2164
|
2196,6359
|
1,5531
|
7,112
|
5,559
|
0,0010612
|
0,8393539
|
|
123
|
396,15
|
2,181109
|
516,8367
|
2710,6394
|
2193,8027
|
1,5638
|
7,1016
|
5,5378
|
0,0010622
|
0,8151292
|
|
124
|
397,15
|
2,249928
|
521,095
|
2712,055
|
2190,96
|
1,5745
|
7,0912
|
5,5167
|
0,0010632
|
0,791734
|
|
125
|
398,15
|
2,320507
|
525,3552
|
2713,4632
|
2188,108
|
1,5852
|
7,0809
|
5,4957
|
0,0010642
|
0,7691356
|
|
126
|
399,15
|
2,392879
|
529,6175
|
2714,864
|
2185,2465
|
1,5959
|
7,0707
|
5,4748
|
0,0010652
|
0,7473029
|
|
127
|
400,15
|
2,467079
|
533,8818
|
2716,2572
|
2182,3754
|
1,6065
|
7,0605
|
5,4539
|
0,0010663
|
0,7262063
|
|
128
|
401,15
|
2,543139
|
538,1483
|
2717,6428
|
2179,4945
|
1,6172
|
7,0503
|
5,4332
|
0,0010673
|
0,7058171
|
|
129
|
402,15
|
2,621096
|
542,4168
|
2719,0208
|
2176,604
|
1,6278
|
7,0403
|
5,4125
|
0,0010684
|
0,6861082
|
|
131
|
404,15
|
2,782835
|
550,9604
|
2721,7535
|
2170,7932
|
1,6489
|
7,0203
|
5,3714
|
0,0010705
|
0,6486282
|
|
132
|
405,15
|
2,866689
|
555,2354
|
2723,1082
|
2167,8728
|
1,6595
|
7,0104
|
5,3509
|
0,0010716
|
0,6308082
|
|
133
|
406,15
|
2,95258
|
559,5127
|
2724,455
|
2164,9423
|
1,67
|
7,0005
|
5,3305
|
0,0010726
|
0,6135709
|
|
134
|
407,15
|
3,040545
|
563,7923
|
2725,7939
|
2162,0017
|
1,6805
|
6,9907
|
5,3102
|
0,0010737
|
0,5968942
|
|
135
|
408,15
|
3,13062
|
568,0741
|
2727,1248
|
2159,0507
|
1,691
|
6,981
|
5,29
|
0,0010748
|
0,5807573
|
|
136
|
409,15
|
3,222842
|
572,3582
|
2728,4477
|
2156,0894
|
1,7014
|
6,9713
|
5,2699
|
0,0010759
|
0,56514
|
|
137
|
410,15
|
3,317249
|
576,6447
|
2729,7624
|
2153,1177
|
1,7119
|
6,9617
|
5,2498
|
0,001077
|
0,5500231
|
|
138
|
411,15
|
3,413877
|
580,9335
|
2731,069
|
2150,1355
|
1,7223
|
6,9521
|
5,2298
|
0,0010782
|
0,5353882
|
|
139
|
412,15
|
3,512767
|
585,2247
|
2732,3675
|
2147,1427
|
1,7327
|
6,9425
|
5,2098
|
0,0010793
|
0,5212175
|
|
140
|
413,15
|
3,613955
|
589,5184
|
2733,6576
|
2144,1393
|
1,7431
|
6,9331
|
5,19
|
0,0010804
|
0,5074942
|
|
141
|
414,15
|
3,71748
|
593,8144
|
2734,9395
|
2141,1251
|
1,7534
|
6,9236
|
5,1702
|
0,0010816
|
0,494202
|
|
142
|
415,15
|
3,823383
|
598,113
|
2736,213
|
2138,1
|
1,7638
|
6,9142
|
5,1505
|
0,0010827
|
0,4813252
|
|
143
|
416,15
|
3,931702
|
602,414
|
2737,4782
|
2135,0641
|
1,7741
|
6,9049
|
5,1308
|
0,0010839
|
0,468849
|
|
144
|
417,15
|
4,042477
|
606,7176
|
2738,7349
|
2132,0173
|
1,7844
|
6,8956
|
5,1112
|
0,0010851
|
0,4567589
|
|
145
|
418,15
|
4,155748
|
611,0237
|
2739,9831
|
2128,9594
|
1,7947
|
6,8864
|
5,0917
|
0,0010862
|
0,4450413
|
|
146
|
419,15
|
4,271556
|
615,3324
|
2741,2227
|
2125,8903
|
1,8049
|
6,8772
|
5,0722
|
0,0010874
|
0,4336828
|
|
147
|
420,15
|
4,389943
|
619,6437
|
2742,4538
|
2122,8101
|
1,8152
|
6,868
|
5,0529
|
0,0010886
|
0,4226708
|
|
148
|
421,15
|
4,510948
|
623,9576
|
2743,6763
|
2119,7187
|
1,8254
|
6,8589
|
5,0335
|
0,0010898
|
0,4119931
|
|
149
|
422,15
|
4,634614
|
628,2742
|
2744,8901
|
2116,6159
|
1,8356
|
6,8499
|
5,0143
|
0,001091
|
0,401638
|
|
T (°C)
|
T (°K)
|
P (bar)
|
Enthalpie
spécifique
(KJ/Kg)
|
Chaleur de vaporisation
(KJ/Kg)
|
Entropie
spécifique
(KJ/Kg.°K)
|
?S
(KJ/Kg.°K)
hL
|
Volume
spécifique
(m3/Kg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
hG
|
LV
|
|
150
|
423,15
|
4,760983
|
632,5934
|
2746,0951
|
2113,5017
|
1,8458
|
6,8409
|
4,9951
|
0,0010922
|
0,3915943
|
|
151
|
424,15
|
4,890096
|
636,9154
|
2747,2915
|
2110,3761
|
1,856
|
6,8319
|
4,976
|
0,0010934
|
0,3818511
|
|
152
|
425,15
|
5,021998
|
641,2401
|
2748,479
|
2107,239
|
1,8661
|
6,823
|
4,9569
|
0,0010947
|
0,372398
|
|
153
|
426,15
|
5,156729
|
645,5675
|
2749,6577
|
2104,0902
|
1,8762
|
6,8141
|
4,9379
|
0,0010959
|
0,3632252
|
|
154
|
427,15
|
5,294335
|
649,8977
|
2750,8275
|
2100,9298
|
1,8864
|
6,8053
|
4,9189
|
0,0010971
|
0,354323
|
|
155
|
428,15
|
5,434858
|
654,2308
|
2751,9885
|
2097,7577
|
1,8965
|
6,7965
|
4,9001
|
0,0010984
|
0,3456821
|
|
156
|
429,15
|
5,578343
|
658,5667
|
2753,1404
|
2094,5737
|
1,9065
|
6,7878
|
4,8812
|
0,0010996
|
0,3372938
|
|
157
|
430,15
|
5,724833
|
662,9054
|
2754,2834
|
2091,378
|
1,9166
|
6,7791
|
4,8625
|
0,0011009
|
0,3291494
|
|
158
|
431,15
|
5,874374
|
667,2471
|
2755,4174
|
2088,1703
|
1,9266
|
6,7704
|
4,8438
|
0,0011022
|
0,3212409
|
|
159
|
432,15
|
6,02701
|
671,5916
|
2756,5423
|
2084,9507
|
1,9367
|
6,7618
|
4,8251
|
0,0011035
|
0,3135602
|
|
160
|
433,15
|
6,182787
|
675,9391
|
2757,6581
|
2081,719
|
1,9467
|
6,7532
|
4,8066
|
0,0011048
|
0,3060999
|
|
161
|
434,15
|
6,34175
|
680,2896
|
2758,7648
|
2078,4752
|
1,9567
|
6,7447
|
4,788
|
0,001106
|
0,2988525
|
|
162
|
435,15
|
6,503945
|
684,6431
|
2759,8624
|
2075,2193
|
1,9666
|
6,7362
|
4,7696
|
0,0011074
|
0,2918112
|
|
164
|
437,15
|
6,838217
|
693,3591
|
2762,0299
|
2068,6708
|
1,9865
|
6,7193
|
4,7328
|
0,00111
|
0,2783194
|
|
165
|
438,15
|
7,010387
|
697,7217
|
2763,0998
|
2065,3781
|
1,9965
|
6,711
|
4,7145
|
0,0011113
|
0,2718563
|
|
166
|
439,15
|
7,185976
|
702,0874
|
2764,1605
|
2062,0731
|
2,0064
|
6,7026
|
4,6962
|
0,0011126
|
0,2655735
|
|
167
|
440,15
|
7,365032
|
706,4562
|
2765,2118
|
2058,7556
|
2,0163
|
6,6943
|
4,6781
|
0,001114
|
0,2594653
|
|
168
|
441,15
|
7,547601
|
710,8281
|
2766,2538
|
2055,4257
|
2,0261
|
6,6861
|
4,6599
|
0,0011153
|
0,2535259
|
|
169
|
442,15
|
7,733733
|
715,2033
|
2767,2865
|
2052,0832
|
2,036
|
6,6778
|
4,6418
|
0,0011167
|
0,24775
|
|
170
|
443,15
|
7,923476
|
719,5816
|
2768,3098
|
2048,7282
|
2,0458
|
6,6696
|
4,6238
|
0,0011181
|
0,2421324
|
|
171
|
444,15
|
8,116878
|
723,9631
|
2769,3237
|
2045,3606
|
2,0557
|
6,6615
|
4,6058
|
0,0011194
|
0,2366681
|
|
172
|
445,15
|
8,313988
|
728,3479
|
2770,3282
|
2041,9803
|
2,0655
|
6,6534
|
4,5879
|
0,0011208
|
0,2313522
|
|
173
|
446,15
|
8,514856
|
732,736
|
2771,3233
|
2038,5873
|
2,0753
|
6,6453
|
4,57
|
0,0011222
|
0,22618
|
|
174
|
447,15
|
8,719531
|
737,1274
|
2772,3089
|
2035,1815
|
2,0851
|
6,6373
|
4,5522
|
0,0011236
|
0,221 147
|
|
175
|
448,15
|
8,928063
|
741,5221
|
2773,285
|
2031,7629
|
2,0948
|
6,6293
|
4,5344
|
0,001125
|
0,2162489
|
|
176
|
449,15
|
9,140502
|
745,9201
|
2774,2516
|
2028,3315
|
2,1046
|
6,6213
|
4,5167
|
0,0011264
|
0,2114816
|
|
177
|
450,15
|
9,356899
|
750,3215
|
2775,2088
|
2024,8872
|
2,1 143
|
6,6133
|
4,499
|
0,0011278
|
0,2068408
|
|
178
|
451,15
|
9,577304
|
754,7264
|
2776,1563
|
2021,43
|
2,124
|
6,6054
|
4,4814
|
0,0011292
|
0,2023229
|
|
179
|
452,15
|
9,801768
|
759,1346
|
2777,0944
|
2017,9598
|
2,1337
|
6,5976
|
4,4638
|
0,0011307
|
0,1979238
|
|
180
|
453,15
|
10,030342
|
763,5463
|
2778,0229
|
2014,4766
|
2,1434
|
6,5897
|
4,4463
|
0,0011321
|
0,1936402
|
|
T (°C)
|
T (°R)
|
P (bar)
|
Enthalpie
spécifique
(RJ/Rg)
|
Chaleur de vaporisation
(RJ/Rg)
|
Entropie
spécifique
(RJ/Rg.°R)
|
?S
(RJ/Rg.°R)
hL
|
Volume
spécifique
(m3/Rg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
hG
|
LV
|
|
181
|
454,15
|
10,263079
|
767,9614
|
2778,9418
|
2010,9804
|
2,1531
|
6,5819
|
4,4289
|
0,0011336
|
0,1894683
|
|
182
|
455,15
|
10,500029
|
772,38
|
2779,8511
|
2007,471
|
2,1627
|
6,5742
|
4,41 14
|
0,001 135
|
0,1854049
|
|
183
|
456,15
|
10,741246
|
776,8022
|
2780,7508
|
2003,9486
|
2,1724
|
6,5664
|
4,394
|
0,0011365
|
0,1814467
|
|
184
|
457,15
|
10,98678
|
781,2279
|
2781,6409
|
2000,413
|
2,182
|
6,5587
|
4,3767
|
0,0011379
|
0,1775905
|
|
185
|
458,15
|
11,236685
|
785,6572
|
2782,5214
|
1996,8642
|
2,1916
|
6,5511
|
4,3594
|
0,0011394
|
0,1738332
|
|
186
|
459,15
|
11,491013
|
790,09
|
2783,3923
|
1993,3022
|
2,2012
|
6,5434
|
4,3422
|
0,001 1409
|
0,170172
|
|
187
|
460,15
|
11,749818
|
794,5265
|
2784,2535
|
1989,727
|
2,2108
|
6,5358
|
4,325
|
0,001 1424
|
0,1666038
|
|
188
|
461,15
|
12,013153
|
798,9666
|
2785,1051
|
1986,1385
|
2,2204
|
6,5282
|
4,3078
|
0,0011439
|
0,1631261
|
|
189
|
462,15
|
12,281072
|
803,4104
|
2785,9471
|
1982,5366
|
2,23
|
6,5207
|
4,2907
|
0,001 1454
|
0,1597362
|
|
190
|
463,15
|
12,553628
|
807,8579
|
2786,7794
|
1978,9215
|
2,2395
|
6,5132
|
4,2737
|
0,001 1469
|
0,1564314
|
|
191
|
464,15
|
12,830875
|
812,3091
|
2787,602
|
1975,293
|
2,249
|
6,5057
|
4,2567
|
0,001 1484
|
0,1532092
|
|
192
|
465,15
|
13,112868
|
816,764
|
2788,415
|
1971,651
|
2,2586
|
6,4983
|
4,2397
|
0,00115
|
0,1500674
|
|
193
|
466,15
|
13,399661
|
821,2226
|
2789,2183
|
1967,9957
|
2,2681
|
6,4908
|
4,2228
|
0,0011515
|
0,1470035
|
|
194
|
467,15
|
13,691309
|
825,6851
|
2790,012
|
1964,3269
|
2,2776
|
6,4834
|
4,2059
|
0,0011531
|
0,1440152
|
|
195
|
468,15
|
13,987867
|
830,1513
|
2790,796
|
1960,6447
|
2,287
|
6,4761
|
4,189
|
0,0011546
|
0,1411006
|
|
196
|
469,15
|
14,28939
|
834,6214
|
2791,5703
|
1956,9489
|
2,2965
|
6,4687
|
4,1722
|
0,0011562
|
0,1382573
|
|
197
|
470,15
|
14,595934
|
839,0953
|
2792,335
|
1953,2397
|
2,3059
|
6,4614
|
4,1555
|
0,0011577
|
0,1354834
|
|
198
|
471,15
|
14,907555
|
843,5731
|
2793,0901
|
1949,5169
|
2,3154
|
6,4542
|
4,1388
|
0,0011593
|
0,1327769
|
|
199
|
472,15
|
15,224307
|
848,0548
|
2793,8354
|
1945,7806
|
2,3248
|
6,4469
|
4,1221
|
0,0011609
|
0,1301359
|
|
200
|
473,15
|
15,546248
|
852,5404
|
2794,5712
|
1942,0307
|
2,3342
|
6,4397
|
4,1055
|
0,0011625
|
0,1275586
|
|
201
|
474,15
|
15,873433
|
857,03
|
2795,2973
|
1938,2673
|
2,3436
|
6,4325
|
4,0889
|
0,0011641
|
0,1250432
|
|
202
|
475,15
|
16,205919
|
861,5235
|
2796,0137
|
1934,4902
|
2,353
|
6,4253
|
4,0723
|
0,0011657
|
0,1225879
|
|
203
|
476,15
|
16,543763
|
866,021
|
2796,7205
|
1930,6995
|
2,3624
|
6,4182
|
4,0558
|
0,0011673
|
0,1201911
|
|
204
|
477,15
|
16,887022
|
870,5225
|
2797,4177
|
1926,8952
|
2,3717
|
6,4111
|
4,0394
|
0,0011689
|
0,1 178511
|
|
205
|
478,15
|
17,235753
|
875,0281
|
2798,1053
|
1923,0773
|
2,3811
|
6,404
|
4,0229
|
0,0011705
|
0,1 155664
|
|
206
|
479,15
|
17,590013
|
879,5377
|
2798,7833
|
1919,2457
|
2,3904
|
6,397
|
4,0065
|
0,0011722
|
0,1 133354
|
|
207
|
480,15
|
17,949859
|
884,0513
|
2799,4517
|
1915,4004
|
2,3997
|
6,3899
|
3,9902
|
0,0011738
|
0,1111568
|
|
208
|
481,15
|
18,315349
|
888,5691
|
2800,1106
|
1911,5415
|
2,409
|
6,3829
|
3,9739
|
0,0011755
|
0,109029
|
|
209
|
482,15
|
18,686542
|
893,091
|
2800,7598
|
1907,6688
|
2,4183
|
6,376
|
3,9576
|
0,0011771
|
0,1069506
|
|
210
|
483,15
|
19,063495
|
897,617
|
2801,3995
|
1903,7825
|
2,4276
|
6,369
|
3,9414
|
0,0011788
|
0,1049204
|
|
T (°C)
|
T (°K)
|
P (bar)
|
Enthalpie
spécifique
(KJ/Kg)
|
Chaleur de vaporisation
(KJ/Kg)
|
Entropie
spécifique
(KJ/Kg.°K)
|
?S
(KJ/Kg.°K)
hL
|
Volume
spécifique
(m3/Kg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
hG
|
LV
|
|
211
|
484,15
|
19,446266
|
902,1472
|
2802,0297
|
1899,8825
|
2,4369
|
6,3621
|
3,9252
|
0,0011805
|
0,1029371
|
|
212
|
485,15
|
19,834914
|
906,6816
|
2802,6504
|
1895,9688
|
2,4462
|
6,3552
|
3,909
|
0,0011822
|
0,1009993
|
|
213
|
486,15
|
20,229498
|
911,2201
|
2803,2615
|
1892,0414
|
2,4554
|
6,3483
|
3,8929
|
0,0011838
|
0,0991058
|
|
214
|
487,15
|
20,630075
|
915,7629
|
2803,8632
|
1888,1002
|
2,4647
|
6,3415
|
3,8768
|
0,0011855
|
0,0972555
|
|
215
|
488,15
|
21,036706
|
920,31
|
2804,4553
|
1884,1454
|
2,4739
|
6,3347
|
3,8608
|
0,0011872
|
0,0954473
|
|
216
|
489,15
|
21,449448
|
924,8613
|
2805,0381
|
1880,1768
|
2,4831
|
6,3279
|
3,8448
|
0,0011889
|
0,0936799
|
|
217
|
490,15
|
21,868362
|
929,4169
|
2805,6114
|
1876,1945
|
2,4923
|
6,3211
|
3,8288
|
0,0011907
|
0,0919524
|
|
218
|
491,15
|
22,293506
|
933,9768
|
2806,1753
|
1872,1984
|
2,5015
|
6,3143
|
3,8129
|
0,0011924
|
0,0902637
|
|
219
|
492,15
|
22,72494
|
938,5411
|
2806,7298
|
1868,1887
|
2,5107
|
6,3076
|
3,797
|
0,0011941
|
0,0886127
|
|
220
|
493,15
|
23,162725
|
943,1096
|
2807,2749
|
1864,1652
|
2,5198
|
6,3009
|
3,7811
|
0,0011959
|
0,0869985
|
|
221
|
494,15
|
23,606918
|
947,6826
|
2807,8107
|
1860,1281
|
2,529
|
6,2943
|
3,7653
|
0,0011976
|
0,0854202
|
|
222
|
495,15
|
24,057581
|
952,26
|
2808,3371
|
1856,0772
|
2,5381
|
6,2876
|
3,7495
|
0,0011994
|
0,0838767
|
|
223
|
496,15
|
24,514774
|
956,8417
|
2808,8543
|
1852,0125
|
2,5473
|
6,281
|
3,7337
|
0,0012011
|
0,0823673
|
|
224
|
497,15
|
24,978556
|
961,4279
|
2809,3622
|
1847,9342
|
2,5564
|
6,2744
|
3,718
|
0,0012029
|
0,0808909
|
|
225
|
498,15
|
25,448989
|
966,0186
|
2809,8608
|
1843,8422
|
2,5655
|
6,2678
|
3,7023
|
0,0012047
|
0,0794468
|
|
226
|
499,15
|
25,926132
|
970,6137
|
2810,3502
|
1839,7365
|
2,5746
|
6,2613
|
3,6867
|
0,0012065
|
0,0780342
|
|
227
|
500,15
|
26,410046
|
975,2133
|
2810,8305
|
1835,6171
|
2,5837
|
6,2547
|
3,671
|
0,0012082
|
0,0766523
|
|
228
|
501,15
|
26,900792
|
979,8175
|
2811,3015
|
1831,4841
|
2,5928
|
6,2482
|
3,6555
|
0,00121
|
0,0753002
|
|
229
|
502,15
|
27,398431
|
984,4261
|
2811,7635
|
1827,3373
|
2,6018
|
6,2417
|
3,6399
|
0,0012118
|
0,0739772
|
|
230
|
503,15
|
27,903024
|
989,0394
|
2812,2163
|
1823,1769
|
2,6109
|
6,2353
|
3,6244
|
0,0012137
|
0,0726827
|
|
231
|
504,15
|
28,414631
|
993,6571
|
2812,6601
|
1819,0029
|
2,6199
|
6,2288
|
3,6089
|
0,0012155
|
0,0714158
|
|
232
|
505,15
|
28,933314
|
998,2795
|
2813,0948
|
1814,8153
|
2,629
|
6,2224
|
3,5935
|
0,0012173
|
0,0701759
|
|
233
|
506,15
|
29,459134
|
1002,9065
|
2813,5205
|
1810,614
|
2,638
|
6,216
|
3,5781
|
0,0012192
|
0,0689623
|
|
234
|
507,15
|
29,992153
|
1007,5381
|
2813,9372
|
1806,3991
|
2,647
|
6,2097
|
3,5627
|
0,001221
|
0,0677743
|
|
235
|
508,15
|
30,532431
|
1012,1744
|
2814,345
|
1802,1706
|
2,656
|
6,2033
|
3,5473
|
0,0012228
|
0,06661 14
|
|
236
|
509,15
|
31,080031
|
1016,8153
|
2814,7439
|
1797,9286
|
2,665
|
6,197
|
3,532
|
0,0012247
|
0,065473
|
|
237
|
510,15
|
31,635014
|
1021,4609
|
2815,1338
|
1793,673
|
2,674
|
6,1907
|
3,5167
|
0,0012266
|
0,0643583
|
|
238
|
511,15
|
32,197442
|
1026,1112
|
2815,515
|
1789,4038
|
2,683
|
6,1844
|
3,5015
|
0,0012284
|
0,0632669
|
|
239
|
512,15
|
32,767377
|
1030,7662
|
2815,8874
|
1785,1212
|
2,6919
|
6,1782
|
3,4862
|
0,0012303
|
0,0621981
|
|
240
|
513,15
|
33,34488
|
1035,4259
|
2816,251
|
1780,825
|
2,7009
|
6,1719
|
3,4711
|
0,0012322
|
0,0611515
|
|
T (°C)
|
T (°R)
|
P (bar)
|
Enthalpie
spécifique
(RJ/Rg)
|
Chaleur de vaporisation
(RJ/Rg)
|
Entropie
spécifique
(RJ/Rg.°R)
|
?S
(RJ/Rg.°R)
hL
|
Volume
spécifique
(m3/Rg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
hG
|
LV
|
|
241
|
514,15
|
33,930013
|
1040,0905
|
2816,6058
|
1776,5153
|
2,7098
|
6,1657
|
3,4559
|
0,0012341
|
0,0601264
|
|
242
|
515,15
|
34,522839
|
1044,7597
|
2816,952
|
1772,1922
|
2,7187
|
6,1595
|
3,4408
|
0,001236
|
0,0591224
|
|
243
|
516,15
|
35,12342
|
1049,4338
|
2817,2895
|
1767,8557
|
2,7277
|
6,1533
|
3,4257
|
0,0012379
|
0,058139
|
|
244
|
517,15
|
35,731818
|
1054,1127
|
2817,6184
|
1763,5057
|
2,7366
|
6,1472
|
3,4106
|
0,0012398
|
0,0571756
|
|
245
|
518,15
|
36,348094
|
1058,7964
|
2817,9388
|
1759,1423
|
2,7455
|
6,141
|
3,3956
|
0,0012418
|
0,0562318
|
|
246
|
519,15
|
36,972312
|
1063,485
|
2818,2506
|
1754,7656
|
2,7544
|
6,1349
|
3,3806
|
0,0012437
|
0,0553071
|
|
247
|
520,15
|
37,604534
|
1068,1784
|
2818,5539
|
1750,3755
|
2,7632
|
6,1288
|
3,3656
|
0,0012456
|
0,0544011
|
|
248
|
521,15
|
38,244822
|
1072,8767
|
2818,8488
|
1745,9721
|
2,7721
|
6,1228
|
3,3507
|
0,0012476
|
0,0535134
|
|
249
|
522,15
|
38,893238
|
1077,5799
|
2819,1352
|
1741,5554
|
2,781
|
6,1167
|
3,3358
|
0,0012495
|
0,0526434
|
|
250
|
523,15
|
39,549846
|
1082,288
|
2819,4134
|
1737,1254
|
2,7898
|
6,1107
|
3,3209
|
0,0012515
|
0,0517908
|
|
251
|
524,15
|
40,214707
|
1087,001
|
2819,6831
|
1732,6821
|
2,7987
|
6,1047
|
3,306
|
0,0012535
|
0,0509552
|
|
252
|
525,15
|
40,887884
|
1091,719
|
2819,9447
|
1728,2257
|
2,8075
|
6,0987
|
3,2912
|
0,0012554
|
0,0501362
|
|
253
|
526,15
|
41,56944
|
1096,4419
|
2820,198
|
1723,7561
|
2,8163
|
6,0927
|
3,2764
|
0,0012574
|
0,0493334
|
|
254
|
527,15
|
42,259438
|
1101,1698
|
2820,4431
|
1719,2733
|
2,8251
|
6,0868
|
3,2617
|
0,0012594
|
0,0485463
|
|
255
|
528,15
|
42,95794
|
1105,9027
|
2820,6801
|
1714,7774
|
2,8339
|
6,0809
|
3,2469
|
0,0012614
|
0,0477748
|
|
256
|
529,15
|
43,665008
|
1110,6406
|
2820,909
|
1710,2684
|
2,8427
|
6,075
|
3,2322
|
0,0012634
|
0,0470184
|
|
257
|
530,15
|
44,380707
|
1115,3836
|
2821,1299
|
1705,7463
|
2,8515
|
6,0691
|
3,2176
|
0,0012654
|
0,0462767
|
|
258
|
531,15
|
45,105098
|
1120,1315
|
2821,3427
|
1701,2112
|
2,8603
|
6,0632
|
3,2029
|
0,0012675
|
0,0455494
|
|
259
|
532,15
|
45,838244
|
1124,8846
|
2821,5477
|
1696,6631
|
2,869
|
6,0574
|
3,1883
|
0,0012695
|
0,0448362
|
|
260
|
533,15
|
46,580208
|
1129,6427
|
2821,7447
|
1692,102
|
2,8778
|
6,0515
|
3,1737
|
0,0012715
|
0,0441368
|
|
261
|
534,15
|
47,331054
|
1134,4058
|
2821,9339
|
1687,528
|
2,8865
|
6,0457
|
3,1592
|
0,0012736
|
0,0434509
|
|
262
|
535,15
|
48,090843
|
1139,1741
|
2822,1153
|
1682,9411
|
2,8953
|
6,0399
|
3,1447
|
0,0012756
|
0,0427781
|
|
263
|
536,15
|
48,859638
|
1143,9475
|
2822,2889
|
1678,3414
|
2,904
|
6,0342
|
3,1302
|
0,0012777
|
0,0421182
|
|
264
|
537,15
|
49,637503
|
1148,7261
|
2822,4549
|
1673,7288
|
2,9127
|
6,0284
|
3,1157
|
0,0012797
|
0,0414709
|
|
265
|
538,15
|
50,4245
|
1153,5097
|
2822,6132
|
1669,1035
|
2,9214
|
6,0227
|
3,1013
|
0,0012818
|
0,0408359
|
|
266
|
539,15
|
51,220692
|
1158,2986
|
2822,7639
|
1664,4654
|
2,9301
|
6,017
|
3,0868
|
0,0012839
|
0,0402129
|
|
267
|
540,15
|
52,026143
|
1163,0926
|
2822,9071
|
1659,8145
|
2,9388
|
6,0113
|
3,0725
|
0,001286
|
0,0396016
|
|
268
|
541,15
|
52,840914
|
1167,8918
|
2823,0428
|
1655,1511
|
2,9475
|
6,0056
|
3,0581
|
0,0012881
|
0,0390019
|
|
269
|
542,15
|
53,665068
|
1172,6962
|
2823,1711
|
1650,4749
|
2,9562
|
6
|
3,0438
|
0,0012902
|
0,0384134
|
|
270
|
543,15
|
54,498669
|
1177,5058
|
2823,292
|
1645,7862
|
2,9649
|
5,9943
|
3,0295
|
0,0012923
|
0,0378358
|
|
T (°C)
|
T (°R)
|
P (bar)
|
Enthalpie
spécifique
(RJ/Rg)
|
Chaleur de vaporisation
(RJ/Rg)
|
Entropie
spécifique
(RJ/Rg.°R)
|
?S
(RJ/Rg.°R)
hL
|
Volume
spécifique
(m3/Rg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
hG
|
LV
|
|
271
|
544,15
|
55,341779
|
1182,3206
|
2823,4056
|
1641,085
|
2,9735
|
5,9887
|
3,0152
|
0,0012944
|
0,0372691
|
|
272
|
545,15
|
56,194461
|
1187,1407
|
2823,5119
|
1636,3712
|
2,9822
|
5,9831
|
3,001
|
0,0012965
|
0,0367129
|
|
273
|
546,15
|
57,056778
|
1191,9661
|
2823,611
|
1631,6449
|
2,9908
|
5,9776
|
2,9868
|
0,0012986
|
0,0361669
|
|
274
|
547,15
|
57,928792
|
1196,7967
|
2823,703
|
1626,9063
|
2,9994
|
5,972
|
2,9726
|
0,0013008
|
0,0356311
|
|
275
|
548,15
|
58,810566
|
1201,6326
|
2823,7878
|
1622,1552
|
3,008
|
5,9665
|
2,9584
|
0,0013029
|
0,0351051
|
|
276
|
549,15
|
59,702163
|
1206,4738
|
2823,8656
|
1617,3918
|
3,0167
|
5,9609
|
2,9443
|
0,0013051
|
0,0345887
|
|
277
|
550,15
|
60,603646
|
1211,3203
|
2823,9364
|
1612,6161
|
3,0253
|
5,9554
|
2,9302
|
0,0013072
|
0,0340818
|
|
278
|
551,15
|
61,515076
|
1216,1721
|
2824,0003
|
1607,8282
|
3,0339
|
5,9499
|
2,9161
|
0,0013094
|
0,0335841
|
|
279
|
552,15
|
62,436517
|
1221,0293
|
2824,0573
|
1603,028
|
3,0424
|
5,9445
|
2,902
|
0,0013116
|
0,0330955
|
|
280
|
553,15
|
63,368031
|
1225,8918
|
2824,1075
|
1598,2157
|
3,051
|
5,939
|
2,888
|
0,0013138
|
0,0326157
|
|
281
|
554,15
|
64,30968
|
1230,7596
|
2824,1509
|
1593,3913
|
3,0596
|
5,9336
|
2,874
|
0,0013159
|
0,0321445
|
|
282
|
555,15
|
65,261527
|
1235,6328
|
2824,1877
|
1588,5548
|
3,0681
|
5,9282
|
2,86
|
0,0013181
|
0,0316819
|
|
283
|
556,15
|
66,223635
|
1240,5114
|
2824,2178
|
1583,7063
|
3,0767
|
5,9228
|
2,8461
|
0,0013203
|
0,0312275
|
|
284
|
557,15
|
67,196065
|
1245,3955
|
2824,2413
|
1578,8458
|
3,0852
|
5,9174
|
2,8322
|
0,0013225
|
0,0307813
|
|
285
|
558,15
|
68,17888
|
1250,2849
|
2824,2583
|
1573,9734
|
3,0938
|
5,9121
|
2,8183
|
0,0013248
|
0,030343
|
|
286
|
559,15
|
69,172142
|
1255,1797
|
2824,2688
|
1569,0891
|
3,1023
|
5,9067
|
2,8044
|
0,001327
|
0,0299125
|
|
287
|
560,15
|
70,175914
|
1260,0799
|
2824,273
|
1564,193
|
3,1 108
|
5,9014
|
2,7906
|
0,0013292
|
0,0294896
|
|
288
|
561,15
|
71,190256
|
1264,9856
|
2824,2708
|
1559,2851
|
3,1193
|
5,8961
|
2,7768
|
0,0013315
|
0,0290742
|
|
289
|
562,15
|
72,215232
|
1269,8968
|
2824,2623
|
1554,3655
|
3,1278
|
5,8908
|
2,763
|
0,0013337
|
0,0286661
|
|
290
|
563,15
|
73,250903
|
1274,8133
|
2824,2476
|
1549,4342
|
3,1363
|
5,8856
|
2,7492
|
0,001336
|
0,0282652
|
|
291
|
564,15
|
74,297331
|
1279,7354
|
2824,2267
|
1544,4913
|
3,1448
|
5,8803
|
2,7355
|
0,0013382
|
0,0278713
|
|
292
|
565,15
|
75,354578
|
1284,663
|
2824,1998
|
1539,5368
|
3,1533
|
5,8751
|
2,7218
|
0,0013405
|
0,0274843
|
|
293
|
566,15
|
76,422706
|
1289,596
|
2824,1668
|
1534,5708
|
3,1618
|
5,8699
|
2,7081
|
0,0013428
|
0,027104
|
|
294
|
567,15
|
77,501775
|
1294,5345
|
2824,1279
|
1529,5933
|
3,1702
|
5,8647
|
2,6945
|
0,001345
|
0,0267303
|
|
295
|
568,15
|
78,591849
|
1299,4786
|
2824,083
|
1524,6044
|
3,1787
|
5,8595
|
2,6808
|
0,0013473
|
0,026363
|
|
296
|
569,15
|
79,692988
|
1304,4282
|
2824,0323
|
1519,6041
|
3,1871
|
5,8543
|
2,6672
|
0,0013496
|
0,0260021
|
|
297
|
570,15
|
80,805253
|
1309,3833
|
2823,9758
|
1514,5926
|
3,1955
|
5,8492
|
2,6537
|
0,0013519
|
0,0256474
|
|
298
|
571,15
|
81,928707
|
1314,3439
|
2823,9136
|
1509,5697
|
3,204
|
5,8441
|
2,6401
|
0,0013543
|
0,0252988
|
|
299
|
572,15
|
83,063409
|
1319,3101
|
2823,8458
|
1504,5357
|
3,2124
|
5,839
|
2,6266
|
0,0013566
|
0,0249561
|
|
T (°C)
|
T (°R)
|
P (bar)
|
Enthalpie
spécifique
(RJ/Rg)
|
Chaleur de vaporisation
(RJ/Rg)
|
Entropie
spécifique
(RJ/Rg.°R)
|
?S
(RJ/Rg.°R)
hL
|
Volume
spécifique
(m3/Rg)
|
|
hL
|
hG
|
LV
|
SL
|
SG
|
hG
|
LV
|
|
300
|
573,15
|
84,209422
|
1324,2818
|
2823,7723
|
1499,4905
|
3,2208
|
5,8339
|
2,6131
|
0,0013589
|
0,0246193
|
|
301
|
574,15
|
85,366807
|
1329,2591
|
2823,6933
|
1494,4342
|
3,2292
|
5,8288
|
2,5996
|
0,0013612
|
0,0242882
|
|
302
|
575,15
|
86,535623
|
1334,242
|
2823,6089
|
1489,3669
|
3,2376
|
5,8238
|
2,5862
|
0,0013636
|
0,0239627
|
|
303
|
576,15
|
87,715932
|
1339,2305
|
2823,5191
|
1484,2886
|
3,246
|
5,8187
|
2,5727
|
0,0013659
|
0,0236427
|
|
304
|
577,15
|
88,907796
|
1344,2246
|
2823,4239
|
1479,1993
|
3,2544
|
5,8137
|
2,5593
|
0,0013683
|
0,0233281
|
|
305
|
578,15
|
90,111273
|
1349,2242
|
2823,3235
|
1474,0992
|
3,2627
|
5,8087
|
2,546
|
0,0013706
|
0,0230188
|
|
306
|
579,15
|
91,326426
|
1354,2295
|
2823,2178
|
1468,9883
|
3,2711
|
5,8037
|
2,5326
|
0,001373
|
0,0227146
|
|
307
|
580,15
|
92,553314
|
1359,2404
|
2823,107
|
1463,8666
|
3,2794
|
5,7988
|
2,5193
|
0,0013754
|
0,0224155
|
|
308
|
581,15
|
93,791997
|
1364,2569
|
2822,9912
|
1458,7343
|
3,2878
|
5,7938
|
2,506
|
0,0013778
|
0,0221215
|
|
309
|
582,15
|
95,042536
|
1369,2791
|
2822,8703
|
1453,5913
|
3,2961
|
5,7889
|
2,4927
|
0,0013802
|
0,0218323
|
|
310
|
583,15
|
96,304991
|
1374,3069
|
2822,7445
|
1448,4377
|
3,3045
|
5,784
|
2,4795
|
0,0013826
|
0,0215478
|
|
311
|
584,15
|
97,579421
|
1379,3403
|
2822,6139
|
1443,2736
|
3,3128
|
5,7791
|
2,4663
|
0,001385
|
0,0212681
|
|
312
|
585,15
|
98,865888
|
1384,3794
|
2822,4784
|
1438,099
|
3,3211
|
5,7742
|
2,4531
|
0,0013874
|
0,020993
|
|
313
|
586,15
|
100,164449
|
1389,4241
|
2822,3381
|
1432,914
|
3,3294
|
5,7693
|
2,4399
|
0,0013898
|
0,0207224
|
|
314
|
587,15
|
101,475165
|
1394,4745
|
2822,1932
|
1427,7187
|
3,3377
|
5,7645
|
2,4268
|
0,0013922
|
0,0204562
|
|
315
|
588,15
|
102,798096
|
1399,5306
|
2822,0437
|
1422,5131
|
3,346
|
5,7596
|
2,4136
|
0,0013946
|
0,0201944
|
|
316
|
589,15
|
104,1333
|
1404,5924
|
2821,8896
|
1417,2972
|
3,3543
|
5,7548
|
2,4006
|
0,0013971
|
0,0199368
|
|
317
|
590,15
|
105,480836
|
1409,6599
|
2821,7311
|
1412,0712
|
3,3625
|
5,75
|
2,3875
|
0,0013995
|
0,0196834
|
|
318
|
591,15
|
106,840765
|
1414,733
|
2821,5681
|
1406,8351
|
3,3708
|
5,7452
|
2,3744
|
0,001402
|
0,0194342
|
|
319
|
592,15
|
108,213144
|
1419,8119
|
2821,4008
|
1401,5889
|
3,3791
|
5,7405
|
2,3614
|
0,0014045
|
0,0191889
|
|
320
|
593,15
|
109,598033
|
1424,8964
|
2821,2292
|
1396,3328
|
3,3873
|
5,7357
|
2,3484
|
0,0014069
|
0,0189476
|
|
321
|
594,15
|
110,99549
|
1429,9867
|
2821,0534
|
1391,0667
|
3,3956
|
5,731
|
2,3354
|
0,0014094
|
0,0187101
|
|
322
|
595,15
|
112,405574
|
1435,0827
|
2820,8735
|
1385,7908
|
3,4038
|
5,7263
|
2,3225
|
0,0014119
|
0,0184765
|
|
323
|
596,15
|
113,828342
|
1440,1844
|
2820,6895
|
1380,5051
|
3,412
|
5,7216
|
2,3096
|
0,0014144
|
0,0182466
|
|
324
|
597,15
|
115,263854
|
1445,2918
|
2820,5015
|
1375,2097
|
3,4202
|
5,7169
|
2,2967
|
0,0014169
|
0,0180204
|
|
325
|
598,15
|
116,712167
|
1450,405
|
2820,3095
|
1369,9045
|
3,4285
|
5,7123
|
2,2838
|
0,0014194
|
0,0177977
|
|
326
|
599,15
|
118,17334
|
1455,5239
|
2820,1136
|
1364,5898
|
3,4367
|
5,7076
|
2,271
|
0,0014219
|
0,0175786
|
Propriétés P-T-î
|
P (bar)
|
T (°K)
|
(1/T) (°K-1)
|
î (Kg/Kg
de
mélange)
|
P (bar)
|
T (°K)
|
(1/T) (°K-1)
|
î (Kg/Kg
de
mélange)
|
|
0,016
|
278,3075
|
0,003593148
|
0
|
12,516
|
363,1641
|
0,002753576
|
0,4
|
|
2,516
|
399,6198
|
0,002502379
|
0
|
15,016
|
370,8499
|
0,002696509
|
0,4
|
|
5,016
|
424,8844
|
0,002353581
|
0
|
17,516
|
377,6079
|
0,00264825
|
0,4
|
|
7,516
|
441,2345
|
0,002266369
|
0
|
20,016
|
383,6649
|
0,002606441
|
0,4
|
|
10,016
|
453,6295
|
0,002204442
|
0
|
0,016
|
195,2631
|
0,005121295
|
0,5
|
|
12,516
|
463,7384
|
0,002156388
|
0
|
2,516
|
291,7198
|
0,003427947
|
0,5
|
|
15,016
|
472,3409
|
0,002117115
|
0
|
5,016
|
312,7982
|
0,003196949
|
0,5
|
|
17,516
|
479,8686
|
0,002083904
|
0
|
7,516
|
326,6312
|
0,003061557
|
0,5
|
|
20,016
|
486,587
|
0,002055131
|
0
|
10,016
|
337,2204
|
0,00296542
|
0,5
|
|
0,016
|
256,5309
|
0,003898166
|
0,1
|
12,516
|
345,9227
|
0,002890819
|
0,5
|
|
2,516
|
372,1717
|
0,002686932
|
0,1
|
15,016
|
353,3757
|
0,002829849
|
0,5
|
|
5,016
|
396,5576
|
0,002521702
|
0,1
|
17,516
|
359,9334
|
0,002778292
|
0,5
|
|
7,516
|
412,3954
|
0,002424857
|
0,1
|
20,016
|
365,8148
|
0,002733624
|
0,5
|
|
10,016
|
424,4317
|
0,002356092
|
0,1
|
0,016
|
186,672
|
0,00535699
|
0,6
|
|
12,516
|
434,2671
|
0,00230273
|
0,1
|
2,516
|
279,6291
|
0,003576166
|
0,6
|
|
15,016
|
442,6503
|
0,00225912
|
0,1
|
5,016
|
300,0088
|
0,003333236
|
0,6
|
|
17,516
|
449,9963
|
0,00222224
|
0,1
|
7,516
|
313,3962
|
0,003190849
|
0,6
|
|
20,016
|
456,5605
|
0,00219029
|
0,1
|
10,016
|
323,6512
|
0,003089746
|
0,6
|
|
0,016
|
237,2497
|
0,004214968
|
0,2
|
12,516
|
332,0834
|
0,003011292
|
0,6
|
|
2,516
|
347,4719
|
0,002877931
|
0,2
|
15,016
|
339,3082
|
0,002947173
|
0,6
|
|
5,016
|
370,9833
|
0,002695539
|
0,2
|
17,516
|
345,6678
|
0,002892951
|
0,6
|
|
7,516
|
386,3039
|
0,002588636
|
0,2
|
20,016
|
351,3733
|
0,002845976
|
0,6
|
|
10,016
|
397,9739
|
0,002512728
|
0,2
|
0,016
|
180,7141
|
0,005533603
|
0,7
|
|
12,516
|
407,5272
|
0,002453824
|
0,2
|
2,516
|
270,7656
|
0,003693231
|
0,7
|
|
15,016
|
415,6822
|
0,002405684
|
0,2
|
5,016
|
290,5137
|
0,003442178
|
0,7
|
|
17,516
|
422,8376
|
0,002364974
|
0,2
|
7,516
|
303,4873
|
0,003295031
|
0,7
|
|
20,016
|
429,2388
|
0,002329706
|
0,2
|
10,016
|
313,4259
|
0,003190547
|
0,7
|
|
0,016
|
220,5656
|
0,004533799
|
0,3
|
12,516
|
321,5983
|
0,003109469
|
0,7
|
|
2,516
|
325,7211
|
0,003070111
|
0,3
|
15,016
|
328,6008
|
0,003043206
|
0,7
|
|
5,016
|
348,3783
|
0,002870443
|
0,3
|
17,516
|
334,7648
|
0,002987172
|
0,7
|
|
7,516
|
363,1856
|
0,002753413
|
0,3
|
20,016
|
340,2951
|
0,002938626
|
0,7
|
|
10,016
|
374,4877
|
0,002670315
|
0,3
|
0,016
|
177,2407
|
0,005642045
|
0,8
|
|
12,516
|
383,7546
|
0,002605832
|
0,3
|
2,516
|
264,9248
|
0,003774656
|
0,8
|
|
15,016
|
391,6759
|
0,002553131
|
0,3
|
5,016
|
284,0976
|
0,003519917
|
0,8
|
|
17,516
|
398,6342
|
0,002508565
|
0,3
|
7,516
|
296,6822
|
0,00337061
|
0,8
|
|
20,016
|
404,8655
|
0,002469956
|
0,3
|
10,016
|
306,317
|
0,003264592
|
0,8
|
|
0,016
|
206,556
|
0,004841302
|
0,4
|
12,516
|
314,2358
|
0,003182324
|
0,8
|
|
2,516
|
307,0944
|
0,003256328
|
0,4
|
15,016
|
321,0182
|
0,003115088
|
0,8
|
|
5,016
|
328,9351
|
0,003040113
|
0,4
|
17,516
|
326,9864
|
0,003058231
|
0,8
|
|
7,516
|
343,2432
|
0,002913386
|
0,4
|
20,016
|
332,3394
|
0,003008972
|
0,8
|
|
10,016
|
354,1826
|
0,002823402
|
0,4
|
0,016
|
176,0437
|
0,005680408
|
0,9
|
|
P (bar)
|
T (°K)
|
(1/T) (°K-1)
|
î (Kg/Kg
de
mélange)
|
|
2,516
|
261,8029
|
0,003819667
|
0,9
|
|
5,016
|
280,4392
|
0,003565835
|
0,9
|
|
7,516
|
292,6493
|
0,00341 7059
|
0,9
|
|
10,016
|
301,9854
|
0,003311418
|
0,9
|
|
12,516
|
309,6509
|
0,003229443
|
0,9
|
|
15,016
|
316,2108
|
0,003162447
|
0,9
|
|
17,516
|
321,979
|
0,003105793
|
0,9
|
|
20,016
|
327,1492
|
0,003056709
|
0,9
|
|
0,016
|
176,8449
|
0,005654673
|
1
|
|
2,516
|
260,9756
|
0,003831776
|
1
|
|
5,016
|
279,0875
|
0,003583106
|
1
|
|
7,516
|
290,9213
|
0,003437356
|
1
|
|
10,016
|
299,9523
|
0,003333863
|
1
|
|
12,516
|
307,3561
|
0,003253555
|
1
|
|
15,016
|
313,684
|
0,003187922
|
1
|
|
17,516
|
319,2421
|
0,003132419
|
1
|
|
20,016
|
324,2191
|
0,003084334
|
1
|
|
|



