|

MEMOIRE DE FIN D'ETUDES
Présenté à la Faculté des
Sciences d'Agadir pour l'obtention du
Diplôme d'Etudes
Supérieures Approfondies
Option : Chimie Analytique

Etude comparative des
propriétés
d'adsorption de quelques micro--polluants
sur
les phosphates naturels et le charbon
actif.
Présentée par : BARKA
Noureddine.
Soutenu le 04/12/2004 devant la commission d'examen
:
Mr : M. L. TAHA : Professeur à la Faculté des
Sciences d'Agadir Président
Mr : M. ELHADEK : Professeur à la Faculté des
Sciences d'Agadir Examinateur
Mr : Y.AIT ICHOU : Professeur à la Faculté des
Sciences d'Agadir Encadrant
Mr : A. NOUNAH : Professeur à L'école
Supérieure de Technologie de Salé Encadrant
Dédicaces
Je dédie ce modeste travail
à mes chers parents
à mes frères et soeurs
à tous ce qui me sont chers

Remerciements
Remerciements
Ce travail réalisé au sein de l'équipe de
photocatalyse et environnement au laboratoire de chimie physique de la
faculté des sciences d'Agadir, est le fruit de tout un groupe de gens
qui ont bien voulu le mener jusqu'au bout par leur appuie et leur soutien, et
qui méritent toute ma reconnaissance.
Ainsi, qu'il me soit permis de remercie vivement messieurs :
Y. AIT ICHOU et A. NOUNAH pour le soin qu'ils ont pris de mon encadrement, la
confiance qu'ils m'ont toujours accordée, les conseils qu'ils n'ont
jamais cessés de me prodiguer et auprès de quels j'ai
trouvé toute l'aide et tout le soutien.
Mes vifs remerciements vont aussi a monsieur A. ASSABBANE pour
son aide précieuse, son soutien, ces discussions fructueuses, sa
sympathie, et l'intérêt qu'il a su me procurer durant ce
travail.
Je tiens également à remercier monsieur : M. L.
TAHA pour l'honneur qu'il m'a fait de bien vouloir présider le jury.
Ainsi que monsieur : M. ELHADEK qui a bien voulu examiner ce travail et
l'enrichir par ces remarques et ces critiques objectives.
Je n'oublie pas tous mes amis et collègues pour leur
soutien amical et moral, je cite particulièrement, Samir, Khalid, Nabil,
salah et Mohamed, qu'ils soient assurés de ma profonde amitié et
ma profonde sympathie.
Sommaire
REMERCIEMENTS
INTRODUCTION GENERALE 1
CHAPITRE I : RAPPELS BIBLIOGRAPHIQUES
Introduction 3
I.LES MATERIAUX ADSORBANTS 3
I.1.Les phosphates naturels 3
I.1.1.Composition du minerai de phosphates naturels 3
I.1.2.Composition de la matière phosphatée 4
I.1.3.Structure des apatites 6
I.2.Charbon actif 6
I.2.1.Propriétés physiques et chimiques 6
I.2.2.Utilisation du charbon actif 7
II. LES ADSORBATS 8
II.1. Bleu de méthylène 8
II.2.Les colorants textiles 8
III. LE PHENOMENE D'ADSORPTION 9
III.1.Généralités 9
III.2.Description du mécanisme d'adsorption 9
III.3.Isothermes d'adsorption 10
III.3.1.Classification des isothermes d'adsorption 10
III.3.2.Types d'isothermes 12
CHAPITRE II : CARACTERISATION ET PROTOCOLE
EXPERIMENTALE
I. LE CHARBON ACTIF UTILISE 14
II. CARACTERISATION DES PHOSPHATES NATURELS 14
II.1. Diffraction des rayons X 14
II.2. Spectroscopie d'absorption IR 16
II.3. Caractérisation morphologique (MEB) 16
III. DISPOSITIF EXPERIMENTAL 18
III.1. Montage 18
III.2. Méthode d'analyse 18
III.3. Calcul des quantités adsorbées 19
CHAPITRE III : RESULTATS DE L'ADSORPTION ET
DISCUSSION
1. L'étude cinétique 20
2. Effet de masse sur l'adsorption 21
3. Isothermes d'adsorption 23
4. Effet de pH 27
5. Effet de force ionique 29
CONCLUSIONS GENERALES. 31
REFERENCES BIBLIOGRAPHIQUES.
ANNEXES.


INTRODUCTION
Les innovations successives qu'a connues le monde depuis la
fin du dix-neuvième siècle ont permis de rehausser le niveau de
vie de l'homme. Cependant même si cette technologie a permis de faciliter
nos taches quotidiennes par l'invention de nouvelles molécules chimiques
et des machines en augmentant les rendements de production (agriculture,
industrie....), elle a en contre partie généré des
problèmes dont les conséquences sont néfastes pour notre
santé voire à long terme pour notre survie.
Les changements climatiques, la disparition de certaines
espèces végétales ou animales en sont les premiers signes.
Ils sont le résultat d'une pollution de plus en plus croissante qui
entraîne un déséquilibre dans notre
écosystème.
Au cours de ces dernières années, la prise de
conscience du danger que représente la pollution de notre espace de vie
est une réalité et une nécessité qui doit se
manifester par une lutte sous toutes ses formes par l'ensemble des acteurs
sociaux et industriels.
La pollution concerne tous les compartiments de notre
environnement, l'eau, l'air, et le sol. Elle est issue d'une diffusion des
contaminants organiques et inorganiques lesquels peuvent nuire à la
santé et le devenir de l'être vivant. La pollution de l'eau a pris
la grande part des préoccupations environnementales, du fait que les
ressources en eau sont limitées et que le développement
économique engendre des problèmes de pollution puisque les
volumes des eaux usées générées par les
différents secteurs d'activités deviennent de plus en plus
importants.
Parmi les industries qui utilisent de l'eau en quantité
importante, on trouve l'industrie du tannage et du textile, où elle est
utilisée essentiellement dans la teinture et la finition.
Les rejets de l'industrie du textile sont connus par leur
coloration intense, la présence des colorants est un problème
inévitable, dû au taux d'épuisement des bains de teinture
qui ne sont jamais a 100%. Un certain pourcentage reste toujours dans
l'effluent. Et puisque la moindre quantité présente dans
l'effluent est automatiquement perçue par l'oeil humain, une
décoloration totale de ces effluents avant de les rejeter dans le milieu
naturel est nécessaire.
L'objectif primordial des industriels, est de trouver un
procédé de traitement qui soit techniquement et
économiquement adapté aux moyens de l'entreprise. Plusieurs
techniques ont été employées pour l'élimination des
colorants, l'adsorption sur des solides poreux est l'une des techniques les
plus répondues.
Les phosphates de calcium, en particulier de type apatitique
qui forment la quasitotalité des minerais phosphatés, ont des
propriétés physico-chimiques et texturales très
variées. Ils sont capables d'établir des liaisons avec des
molécules organiques de différentes tailles. Des études
récentes ont montré que ces matériaux à
l'état naturel ou synthétique peuvent éliminer des
composés organiques présentes dans les eaux usées [1,
2,3].
Dans ce travail, nous avons essayé d'évaluer
l'efficacité d'élimination des colorants présents dans les
effluents des usines textiles et de la tannerie par adsorption sur les
phosphates naturels en prenant le charbon actif comme solide de
référence, L'étude a porté sur l'élimination
de trois colorants en fonction des différents facteurs susceptibles
d'affecter le rendement de cette réaction
Ainsi, notre travail comporte trois chapitres :
Le premier chapitre, est consacré à une
étude bibliographique où un bref rappel sur l'adsorption est
donné, Les matériaux adsorbants et les colorants utilisés
sont décrient.
Le protocole opératoire, la méthode d'analyse
employée ainsi que la caractérisation du matériau
phosphaté font l'objet du deuxième chapitre.
Dans le dernier chapitre sont donnés et analysés
les résultats obtenus au cours de ce
travail.
Enfin, une conclusion générale rassemble les
principaux résultats de cette étude.


Introduction
L'utilisation des solides pour extraire certaines substances
des solutions gazeuses ou liquides date des périodes bibliques. Ainsi,
l'hydroxyapatite constituant la charpente poreuse sur laquelle est
enrobé le carbone du noir animal utilisé depuis fort longtemps
dans les procédés de décoloration et
particulièrement dans la décoloration du jus de sucre [3,4]. Ce
processus, connu comme adsorption, n'implique rien davantage que le transfert
préférentiel des substances de la phase gazeuse ou liquide sur la
surface d'un substrat solide. Aujourd'hui, le phénomène
d'adsorption est devenu un outil utile pour la purification et la
séparation de toute substance indésirable. Des modèles
théoriques permettant de décrire ce phénomène sont
largement décrits dans la littérature.
I. LES MATERIAUX ADSORBANTS I.1. Les phosphates naturels
Les phosphates naturels sédimentaires tiennent leur
source des dépôts des excréments d'espèces marines
sur fond océanique, généralement formés en zone
côtière peu profonde. Les gisements exploités dans
plusieurs parties du monde, se présentent avec des
propriétés chimiques et physiques très contrastées,
et les phosphates marocains sont de loin les plus importants aussi bien en
quantité qu'en qualité [5].
I.1.1. Composition du minerai de phosphates naturels
Les phosphates naturels comportent une variabilité
texturale et structurale suivant leurs origines. Le phosphore se trouve
combiné sous différentes espèces minéralogiques
dont la plus répondue, est la fluorapatite carbonatée
cristallisée dans le système hexagonal. Cette apatite se trouve
plus ou moins substituée associée à de multiples
composés minéraux et organiques qui forment la gangue. Le tableau
(I.1) ci-dessous donne la composition minéralogique des phosphates
utilisés dans cette étude. Ils proviennent de la région de
Khouribga.
Tableau I.1 : La composition
minéralogique des phosphates de la région
de Khouribga (Maroc),[6
|
Elément
|
CaO
|
P2O5
|
F
|
CO2
|
Na2O
|
MgO
|
K2O
|
Al2o3
|
Fe2O3
|
SiO2
|
|
%
(masse)
|
52.70
|
33.60
|
4.30
|
4.00
|
0.66
|
0.28
|
0.05
|
0.45
|
0.20
|
1.20
|
La gangue peut être soit extérieure aux grains
phosphatés (éxogangue), soit incluse dans les grains
(endogangue). La taille, la nature, et la quantité de la gangue
influencent fortement les propriétés de l'apatite
phosphatée. Les minéraux les plus répondus sont :
· Les carbonates sous deux formes principales : la calcite
CaCO3 et la dolomite Ca,Mg (CO3)2.
· Les minéraux siliceux sous différentes
formes : quartz (SiO2), l'opale (SiO2, n 112O), et divers silicates d'alumine
de fer et de magnésium.
· Les sulfates représentés par le gypse
CaSO3, 2112O et l'anhydrite CaSO4.
· Le fer sous forme oxyde (Fe2O3) ou hydroxyde.
· Les matières carbonées
généralement en faible abondance 0.1 % à 0.6 %
résultant de la transformation des restes d'organismes vivant et de
débris organiques divers enfuis au moment de la sédimentation
phosphatée. Il s'agit de bitumes, d'acides humiques, fulviques,
aminés....
I.1.2. Composition de la matière
phosphatée
Parmi tous les phosphates, les apatites sont les plus
abondantes. Le composé le plus fréquent dans la nature est la
fluorapatite avec ses variétés carbonatées et
hydroxylées, Cette apatite se trouve plus ou moins substituée
avec d'autres éléments. Les substitutions les plus importantes
dans la plupart des gisements sédimentaires sont :
· Substitution des ions fluorures par les ions chlorures ou
hydroxyde pour former la chlorapatite et l'hydroxyapatite.
· Substitution des ions orthophosphates PO43-
par les carbonates CO32- pour donner une fluorapatite
carbonatée (francolite).
· Substitution de Ca2+ par Na+ et
Mg2+
Les hydroxyapatites carbonatées sont d'un
intérêt primordial pour les biologistes, car ces composés
sont les principaux constituants des os et des dents de mammifères.
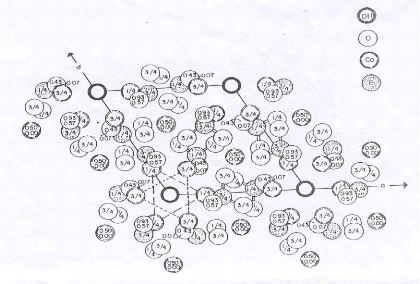
Figure I.1 : Projection de la maille
hexagonale sur le plan 001 de l'hydroxyapatite
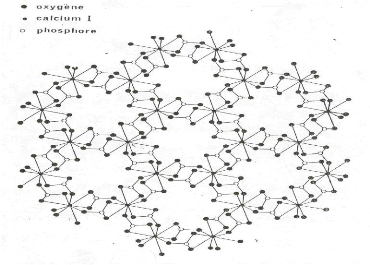
Figure I.2 : Projection sur le plan de
base 001 de la structure de l'apatite (on a retiré les ions
OH- ainsi que les ions calcium qui entourent l'axe sénaire
hélicoïdal afin de mettre en évidence les tunnels)
I.1.3. Structure des apatites
Les apatites répondent à la formule
générale Me10 (RO4)6 X2, où Me est un
métal bivalent (Ca2+,Ba2+,Ln2+......),
RO4 un anion trivalent (PO43-, AsO43-,
MnO43-......), et X est un anion monovalent (F-,
Cl-, OH- ). Ces matériaux constituent une
famille cristallographique de composés solides isomorphes qui
cristallisent dans le système hexagonal. Les figures I.1 et I.2,
représentent la projection de la maille de l'hydroxyapatite.
La stabilité du réseau apatitique est
assurée par l'assemblage des ions métalliques et les ions
RO43- indépendamment des ions X-.
I.2. Charbon actif
Le charbon actif est une dénomination
généralement utilisée pour caractériser des
matériaux inertes à structure carbonée possédant
une surface spécifique très développée et un haut
degré de porosité. Ce sont des carbones que l'on a activés
afin d'accroître leur pouvoir adsorbant [7].
Figure I.3: Structure du charbon actif
[7]. I.2.1 Propriétés physiques et chimiques
a- Propriétés physiques
Elles concernent essentiellement l'aire spécifique et
la porosité, les charbons actifs possèdent souvent une aire
spécifique élevée, ce qui implique une capacité
d'adsorption importante. L'application de l'équation de Braunauer- Emmet
et Teller ; aux isothermes d'adsorption de N2 et CO2 respectivement a -195 et
25°C sur les matériaux adsorbant, permet la détermination de
cette aire spécifique [8].
La dimension des pores, déterminée par la
technique de porosimètre à mercure sous pression croissante dans
la structure poreuse du charbon, permet de les classer en trois
catégories :
- Les macropores (d >50 nm +)
- Les mésopores (2 nm < d <
50 nm)
- Les micropores (d < 2 nm)
b- Propriétés chimiques
Les propriétés chimiques superficielles d'un
charbon actif dépendent fortement de la présence et de la nature
des complexes oxygénés. Ceux-ci sont responsables en grande
partie de ses propriétés acido-basiques superficielles.
Lesquelles jouent un rôle important dans le phénomène
d'adsorption.
Les charbons sont classés en deux types, selon leur
caractère acido-basique :
- Les charbons de type L qui présentent un
caractère acide, et qui possèdent des caractéristiques de
nature hydrophile.
- Les charbons de type H au caractère basique
possédant une surface de nature hydrophobe.
I.2.2 Utilisation du charbon actif
Les charbons actifs sont utilisés dans la plupart des
procédés industriels. Ils interviennent dans les industries
chimiques, pharmaceutiques et agro-alimentaires pour purifier les produits.
Les charbons actifs destinés à l'adsorption des
gaz, comme ceux qui sont utilisés dans les cartouches de masque à
gaz, comportent un réseau très développé de
micro-pores
Pour la récupération des solvants, les charbons
utilisés sont ceux qui ont des micro-pores plus larges. En effet,
l'adsorption a lieu en phase vapeur et les micro-pores doivent être assez
gros pour que la rétention soit faible et la désorption soit
aisée. La matière première utilisée est souvent le
bois.
Dans le cas de l'adsorption en phase liquide qui permet par
exemple de décolorer certaines solutions se sont les mésopores
les plus gros qui jouent le rôle le plus important. La nature de la
surface est également un facteur déterminant du pouvoir
adsorbant, principalement vis-à-vis des électrolytes.
II. LES ADSORBATS
II.1. Bleu de méthylène
Le bleu de méthylène, colorant cationique, est
une molécule organique appartenant à la famille des Xanthines
[9]. Elle est choisie comme modèle représentatif des polluants
organiques de taille moyenne. L'adsorption du bleu de méthylène
est utilisée depuis longtemps en vue d'évaluer les performances
du charbon actif avant son emploi dans une installation d'épuration des
eaux. C'est une molécule qui est utilisée aussi pour tester les
pouvoir adsorbants des solides [10-11], et pour déterminer leur surface
spécifique [12].
La formule développée du bleu de
méthylène est représentée dans la figure ci
dessous.
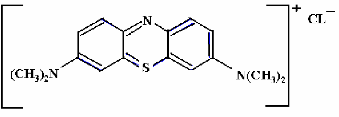
Figure I.4 : Structure chimique du bleu
de méthylène
II.2. Les colorants textiles
Les tests d'adsorption sont réalisés sur deux
colorants commerciaux largement utilisés dans l'industrie de textile et
de la tannerie, il s'agit du :
- Jaune basique : colorant cationique - JK2R :
colorant anionique
Les caractéristiques physico-chimiques notamment la
formule chimique de ces colorants ne sont pas communiqués pas le
fabricant.
III. LE PHENOMENE D'ADSORPTION III.1
Généralités
L'adsorption a l'interface soluté-solide est le
phénomène physique ou chimique par lequel des molécules
présentes dans un liquide se fixent à la surface d'un solide[13].
Ce phénomène provient de l'existence, à la surface du
solide, de forces non compensées, qui sont de nature physique ou
chimique conduisant à deux types d'adsorption :
· adsorption physique (ou physisorption) :
Elle est due à la force électrostatique entre les
molécules du soluté et la surface du
solide. il peut s'agir :
- d'interaction ou de répulsion entre espèces
chargées, - d'interaction entre dipôles
- d'interaction de type Van Der Waals,
- des liaisons hydrogène.
La physisorption est rapide, réversible et
n'entraînant pas de modification des molécules
adsorbées.
· adsorption chimique (ou chimisorption) :
Elle met en jeu une ou plusieurs liaisons chimiques covalentes
ou électrostatiques entre l'adsorbât et l'adsorbant. La
chimisorption est généralement irréversible, produisant
une modification des molécules adsorbées. Ces dernières ne
peuvent pas être accumulées sur plus d'une monocouche (couche
d'une molécule d'épaisseur).
La distinction entre les deux types d'adsorption n'est pas
toujours facile. En effet, les énergies mises en jeu dans les
physisorptions fortes rejoignent celles qui interviennent dans les
chimisorptions faibles.
III.2 Description du mécanisme d'adsorption
:
L'adsorption se produit principalement en trois étapes,
intervenant chacune dans l'expression de la vitesse totale :
1)-
diffusion extragranulaire de la matière (transfert du
soluté à travers le film liquide vers la surface des grains).
2)- transfert intragranulaire de la matière (transfert de
la matière dans la structure poreuse de la surface extérieure des
graines vers les sites actifs).
3)- réaction d'adsorption au contact des sites actifs,
une fois adsorbée, la molécule est considérée comme
immobile.
III.3 Isothermes d'adsorption
L'isotherme d'adsorption représente la quantité
adsorbée en fonction de la concentration du soluté à
l'équilibre à une température donnée.
III.3.1 Classification des isothermes d'adsorption
Tous les systèmes adsorbant-adsorbât ne se
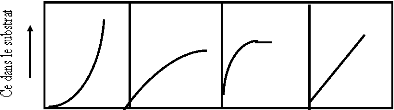
comportent pas de la même manière. Expérimentalement, on
distingue quatre classes principales nommées : S
(Sigmoïde), L (Langmuir), H (Haute
affinité) et C (partition Constante). La figure I.5
présente cette classification.
S L H C

Concentration du soluté à l'équilibre dans
la solution
Figure I.5 : Classification des
isothermes d'adsorption selon Giles et coll.[14].
Après cette description nous abordons
l'interprétation des différentes classes d'isothermes. Nous
commençons par la plus fréquente : l'isotherme de Langmuir
a - Classe L
Les isothermes de classe L présentent, aux faibles
concentrations de la solution, une concavité tournée vers le bas
qui traduit une diminution des sites libres au fur et à mesure de la
progression de l'adsorption. Ce phénomène se produit lorsque les
forces d'attraction entre les molécules adsorbées sont faibles.
Elle est souvent observée quand les molécules sont
adsorbées à plat, ce qui minimise leur attraction
latérale. Elle peut également apparaître quand les
molécules sont adsorbées verticalement et lorsque la
compétition d'adsorption entre le solvant et le soluté est
faible. Dans ce cas, l'adsorption des molécules isolées est assez
forte pour rendre négligeable les interactions latérales.
b- Classe S
Les isothermes de cette classe présentent, à
faible concentration, une concavité tournée vers le haut. Les
molécules adsorbées favorisent l'adsorption ultérieure
d'autres molécules (adsorption coopérative), Ceci est dû
aux molécules qui s'attirent par des forces de Van Der Waals, et se
regroupent en îlots dans lesquels elles se tassent les unes contres les
autres.
Ce comportement est favorisé, d'une part, quand les
molécules de soluté sont adsorbées verticalement comme
c'est le cas des molécules possédant un seul groupe fonctionnel
et d'autre part, quand les molécules se trouvent en compétition
d'adsorption forte avec le solvant[15].
c- Classe H
La partie initiale de l'isotherme est presque verticale, la
quantité adsorbée apparaît importante à
concentration quasiment nulle du soluté dans la solution. Ce
phénomène se produit lorsque les interactions entre les
molécules adsorbées et la surface du solide sont très
fortes. L'isotherme de classe H est aussi observée lors de l'adsorption
de micelles ou de polymères formées à partir des
molécules de soluté [15].
d- Classe C
Les isothermes de cette classe se caractérisent par une
partition constante entre la solution et le substrat jusqu'à un palier.
La linéarité montre que le nombre de sites libres
reste constant au cours de l'adsorption. Ceci signifie que les
sites sont crées au cours de l'adsorption. Ce qui implique que les
isothermes de cette classe sont obtenues quand les molécules de
soluté sont capables de modifier la texture du substrat en ouvrant des
pores qui n'avaient pas été ouverts préalablement par le
solvant [15].
III.3.2 Types d'isothermes
Plusieurs lois ont été proposées pour
l'étude d'adsorption, elles expriment la relation entre la
quantité adsorbée et la concentration en soluté dans un
solvant à une température donnée, nous citons ci-dessous
les deux principaux types.
*Isotherme de Langmuir
C'est le modèle le plus utilisé pour commenter les
résultats trouvés au cours de l'adsorption des composés
organique en solution aqueuse.
A une température constante, la quantité
adsorbée Q est liée à la capacité maximale
d'adsorption Qm, à la concentration à l'équilibre Ce du
soluté et à la constante d'affinité K par
l'équation :
La transformée linéaire de ce modèle a pour
équation :
Q Qm K.Qm Ce
En portant 1/Q en fonction de 1/Ce on obtient une droite de
pente 1/KQm et d'ordonnée à l'origine 1/Qm, cela permet la
détermination des deux paramètres d'équilibre de
l'équation Qm et K.
* Isotherme de Freundlich
C'est une équation empirique largement utilisée
pour la représentation pratique de l'équilibre d'adsorption. Elle
se présente sous la forme :
Q = Kf Ce 1/nf
Q : Quantité adsorbée par gramme du solide.
Ce : Concentration de l'adsorbât à
l'équilibre d'adsorption.
Kf et 1/nf : constantes de Freundlich caractéristiques de
l'efficacité d'un adsorbant donné vis-à-vis d'un
soluté donné.
La transformée linéaire permettant de
vérifier la validité de cette équation est obtenue par
passage en échelle logarithmique :
Ln Q = Ln Kf + 1/nf Ln Ce
En traçant Ln Q en fonction de Ln
Ce, on obtient une droite de pente 1/nf et
d'ordonnée à l'origine Ln Kf


I. LE CHARBON ACTIF UTILISE
Le charbon actif utilisé dans ce travail,
nommée (CL), est un produit Merck d'origine végétale sous
forme de poudre. Il a une granulométrie inférieure à 80um.
les caractéristiques physico-chimiques ont était
déjà étudiées par BELMOUDEN [15], nous citons :
- La surface spécifique : 141 m2/g. - pH de
charge nulle : pHpcn= 1.84. - Diamètres des pores : 40 à 50 A. -
Densité : 1.71.
- Indice d'iode : 506 mg/g.
- Indice de bleu de méthylène : 67 mg/g.
II. CARACTERISATION DES PHOSPHATES NATURELS.
La caractérisation du composé phosphaté a
été réalisée par la diffraction des rayons X, la
spectroscopie d'absorption infrarouge, et la microscopie électronique a
balayage (MEB).
II.1.Diffraction des rayons X
Le diffractogramme des phosphates naturels (figure II.1)
présente des raies fines. L'analyse de ce diagramme par isotypie avec
les diagrammes des références [16,17] montre que le solide
cristallise dans le système hexagonal. Il est constitué d'une
fluorapatite carbonatée, comme constituante principale,
accompagnée de calcite en quantité importante et d'une
quantité de quartz bien exprimée minéralogiquement.
Les paramètres cristallins sont beaucoup plus comparables
à ceux de la francolite qu'à ceux de la fluorapatite de type B.
la différence des paramètres peut s'interpréter en
considérant la substitution dans le réseau de l'apatite, des
cations Ca2+ par les cations Na+, K+,
Cd2+, Mg2+..., et également par la substitution
partielle des ions phosphates par les ions carbonates.
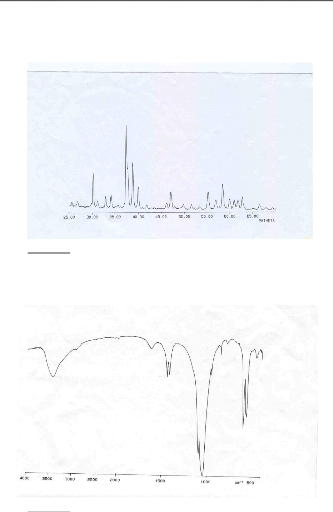
Figure II.1 : Le diffractogramme RX des
phosphates naturels
Figure II.2 : Spectre infrarouge des
phosphates naturels.
Tableau II.1: Paramètres
cristallographiques du matériau utilisé (phosphates naturels)
et
ceux des références [16,17].
|
Paramètre
|
phosphates
|
Hydroxy-Ap
|
Fluoro-Ap
|
Francolite
|
|
|
[16,17]
|
[16,17]
|
[16,17]
|
|
a
|
9.345
|
9.421
|
9.372
|
9.360
|
|
b
|
9.345
|
9.421
|
9.372
|
9.360
|
|
c
|
6.882
|
6.882
|
6.888
|
6.890
|
II.2. Spectroscopie d'absorption IR.
Le spectre d'absorption IR du matériau utilisé
(figure II.2) montre des bandes qui seraient attribuées aux groupements
d'ions signalés dans la littérature. Ces bandes sont
caractéristiques d'une apatite et plus particulièrement la
fluorapatite carbonatée de type B. Nous notons, en effet, la
présence de bandes d'absorption situées entre 1455 et 1430
cm-1. Ces nombres d'ondes sont comparables à ceux qu'on
observe dans le cas des fluorapatites phosphocalciques carbonatées de
type B, préparées selon le mode opératoire utilisé
par BONEL [18] En outre le spectre IR met en évidence,
indépendamment des bandes phosphates, des bandes situées vers
780-800 cm-1 qui pourraient parvenir de la vibration des groupements
silicates.
II.3.Caractérisation morphologique (MEB)
L'observation au microscope électronique à
balayage (MEB) montre que le phosphate naturel, de couleur beige, est
constitué essentiellement de particules phosphatées de formes
irrégulières ou arrondies (figure II.3), de débris osseux,
de débris organiques ainsi que de grains de quartz. Les nodules existant
laissent apparaître une structure concentrique, marquées par les
variations de concentration de la matière organique (figure II.3.c). A
la surface des grains (figures II.3.a et II.3.b), on observe une enveloppe
cristalline. C'est la staféitte, variété fibreuse de la
francolite. La structuration des grains laisse suggérer une
porosité faible et ainsi une surface spécifique moins importante
qu'il faut déterminer par la méthode de BET.
Ces observations semblent confirmer la structure
identifiée auparavant par diffraction des rayons X et par
spectrophotométrie d'absorption infrarouge.

Figure II.3.b
figure II.3.a
Figure II.3.c
Figure II.3 :
microscopie électronique à balayage d'un échantillon de
phosphate naturel
III. DISPOSITIF EXPERIMENTAL III.1.
Montage
L'étude de l'adsorption des colorants sur le charbon
actif, les phosphates, et de l'influence des différents
paramètres a été réalisée en régime
statique en utilisant le dispositif montré sur le schéma1
ci-dessous. Le système permet d'avoir un meilleur contact entre
adsorbât-adsorbant, en évitant toute décantation de
l'adsorbant [19]. La température est maintenue constante durant toute
l'expérience, en raison de son effet sur le phénomène
d'adsorption.
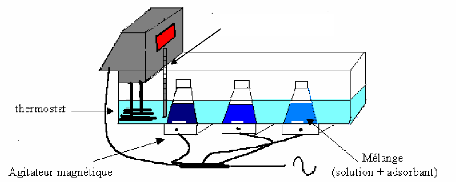
thermomètre
Schéma1: Dispositif
expérimental de l'adsorption en régime statique.
Le montage comprend un bain thermostaté dans lequel
plongent des mélanges réactionnels (solutions colorées et
l'adsorbant) contenus dans des erlens. L'ensemble est mis sous agitation
pendant un temps nécessaire pour atteindre l'équilibre. On
effectue des prélèvements de la solution que l'on filtre pour
déterminer la concentration résiduelle du colorant.
III.2. Méthode d'analyse
La détermination de la concentration des colorants est
effectuée par dosage spectrophotométrique dans le domaine du
visible, en utilisant la loi de Beer-Lambert :
A = Log I0 / I = å.C.L
Avec:
A : Absorbance
å : Coefficient d'extinction
spécifique du soluté
L : L'épaisseur de la cellule optique
C : La concentration du soluté.
Le spectromètre utilisé est un appareil (JENWAY
6405), l'étalonnage à été réalisé,
avec des concentrations en soluté variant de 0 à 20 mg/l (Annexe
II), à la longueur d'onde maximale d'absorption déterminée
auparavant (Annexe I).
III.3. Calcul des quantités
adsorbées
* Calcul des quantités adsorbées.
Qads = (C0 - Ceq) / R
* Pourcentage de décoloration.
P (%) = 100 * (C0 - Ceq) / C0
Qads : Quantité adsorbée par
gramme d'adsorbant.
C0 : Concentration initiale en mg/l.
Ceq : Concentration à l'équilibre
en mg/l.
R : masse d'adsorbant par unité de volume
de solution (g/l).

Les tests de l'adsorption réalisés dans cette
partie permettent d'évaluer les caractéristiques de chaque
matériau vis-à-vis des trois colorants. Ils concernent,
l'étude cinétique, l'effet de masse, les isothermes, l'effet de
pH et l'effet de force ionique.
1. L'étude cinétique
Les cinétiques de rétention décrivent les
vitesses de réactions qui permettent de déterminer le temps de
contact mis pour atteindre l'équilibre d'adsorption. C'est une
étape importante dans toute étude d'adsorption. Pour cela, nous
avons suivi les cinétiques d'adsorption du bleu de
méthylène, et des deux colorants textiles pour une concentration
initiale de 20 mg/l, avec des masses de 0.05g/l de charbon actif (figure
III.1), les masses de phosphates naturels sont respectivement 2g/l pour le bleu
de méthylène et jaune basique et 10g/l pour le JK2R (figure
III.2).
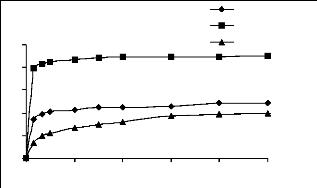
% de
décoloration
100
80
60
40
20
0
0 30 60 90 120 150
t(min)
bleu de méthylène jaune basique JK2R
Figure III.1 : Cinétique
d'adsorption du bleu de méthylène, du jaune
basique, et du JK2R sur charbon actif.
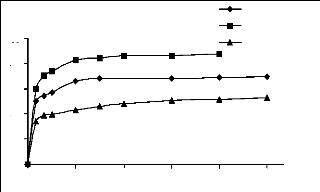
% de
décoloration
100
40
20
60
80
0
0 30 60 90 120 150
bleu de méthylène jaune basique JK2R
t (min)
Figure III.2 : Cinétique
d'adsorption du bleu de méthylène, du jaune basique, et du JK2R
sur les phosphates naturels.
Les temps d'équilibre déterminés pour les
trois colorants sont consignés dans le tableau III.1.
Tableau III.1 : Temps nécessaire
pour l'établissement de l'équilibre de l'adsorption sur les deux
matériaux.
|
Adsorbât
|
Temps d'équilibre (min)
|
|
phosphates
|
Charbon actif
|
|
Bleu de méthylène
|
30
|
15
|
|
Jaune basique
|
30
|
10
|
|
JK2R
|
90
|
90
|
Les courbes indiquent que les vitesses des réactions
d'adsorption de ces trois colorants sur les deux matériaux sont plus ou
moins rapides en début de la réaction. Néanmoins, nous
constatons deux remarques importantes :
· Les cinétiques d'adsorption sur le charbon
actif sont plus rapides que sur les phosphates, cette comparaison doit se faire
au regard de la différence de granulométrie, et du fait de
différence d'affinité des deux matériaux vis à vis
des ces trois colorants.
· Les cinétiques d'adsorption du JK2R sur les
deux matériaux sont plus lentes par rapport aux deux autres colorants.
Cela pourrait s'expliquer par le fait que les deux matériaux ont une
affinité plus grande pour les colorants cationiques (bleu de
méthylène, jaune basique) par rapport au colorant anionique
(JK2R).
2. Effet de la masse sur l'adsorption
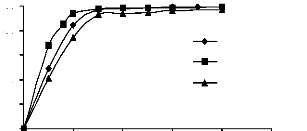
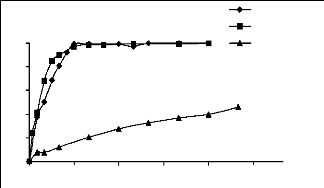
Sur les figures III.3 et III.4, nous avons
représenté respectivement les variations des quantités
adsorbées (exprimées en % de décoloration de la solution)
en fonction des masses de charbon actif et celles des phosphates naturels avec
un temps de contact de 3 heures. La concentration initiale en adsorbât
utilisée est de 20 mg/l.
Nous constatons que les % de décoloration des
solutions des trois colorants augmentent à mesure que la masse du
charbon actif augmente, jusqu'à la décoloration totale qui a lieu
vers 0.15 g/l avec un ordre de décoloration allant du jaune basique,
bleu de méthylène, au JK2R.
% de
décoloration
R(g/l)
100
80
bleu de méthylène jaune basique JK2R
60
40
20
0
0 0,1 0,2 0,3 0,4 0,5
Figure III.3: Variation des
pourcentages de décoloration en fonction de
la masse du charbon actif
(Co = 20 mg/l)
% de
décoloration
bleu de méthylène jaune basique JK2R
100
80
60
40
20
0
R(g/l)
0 3 6 9 12 15
Figure III.4: Variation des pourcentages
de décoloration en fonction de la masse des phosphates (Co = 20
mg/l).
Pour les phosphates les % de décoloration augmentent
au fur et à mesure que la masse augmente, jusqu'à la
décoloration totale des solutions de bleu de méthylène et
du jaune basique obtenue pour un rapport de 3g/l, alors que la solution du JK2R
ne se décolore pas totalement même à 70g/l (60%).
3. Isothermes d'adsorption
Les isothermes d'adsorption ont été
réalisées avec différentes concentrations initiales pour
un rapport R= 0.05g/l de charbon actif, un rapport de 1g/l pour le bleu de
méthylène et jaune basique et 10g/l pour le JK2R. Les figures
III.5, III.6, et III.7 représentent les isothermes d'adsorption sur les
phosphates des trois colorants, et les figures III.8, III.9, et III.10
représentent les isothermes d'adsorption sur charbon actif. Le temps de
contact est de 3 heures à 25°C et à pH initial.
D'après la classification de Giles et Col [14], les
isothermes d'adsorption sur le charbon actif sont de type L. La comparaison des
capacités d'adsorption est de l'ordre suivant (jaune basique > bleu
de méthylène > JK2R). Cet ordre serait attribué
à la structure moléculaire des substrats
Les isothermes d'adsorption sur les phosphates montrent que :
Pour le bleu de méthylène, la quantité
adsorbée apparaît importante à concentration quasiment
nulle du soluté dans la solution. Donc, les interactions entre les
molécules adsorbées et la surface du solide sont très
fortes. C'est une isotherme du type H.
Pour le jaune basique, l'isotherme suit parfaitement le
modèle de Langmuir. Donc, les forces d'attraction entre les
molécules adsorbées sont faibles
Pour le JK2R, la quantité adsorbée est
quasiment nulle à faible concentration du soluté en solution, au
fur et à mesure que la concentration en solution augment la
quantité adsorbée augmente rapidement. Donc, les molécules
adsorbées favorisent l'adsorption ultérieure d'autres
molécules (adsorption coopérative due aux attractions entre les
molécules du soluté par des forces de Van Der Waals). C'est une
isotherme de type S
Résultats et discussion
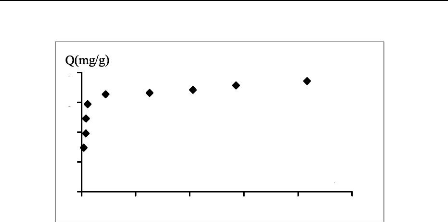
6
4
Ce(mg/l)
8
2
0
0 2 4 6 8 10
Figure III.5 : Isotherme d'adsorption du
bleu de méthylène
sur les phosphates
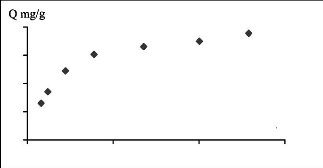
4
Ce (mg/l)
0
0 5 10 15
16
12
8
Figure III.6 : Isotherme d'adsorption du
jaune basique sur les phosphates
Q(mg/g)
1

0,4


Ce (mg/l)
0,2
0

0 5 10 15 20
Figure III.7 : Isotherme d'adsorption du
JK2R sur les phosphates
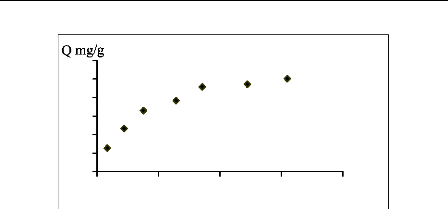
Ce
(mg/l)
0 5 10 15 20
250
200
150
50
0
100
Figure III.8 : Isotherme d'adsorption du
bleu de méthylène
sur le charbon actif.
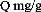
300 250 200 150



100
50
0 Ce
0 5 10 15 20 (mg/l)
Figure III.9 : Isotherme d'adsorption du
jaune basique sur le charbon actif.
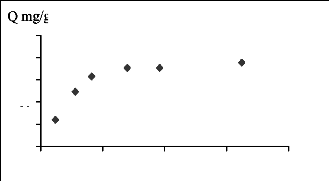
Ce
(mg/l)
0 5 10 15 20
160
120
80
40
0
200
Figure III.10 : Isotherme d'adsorption du
JK2R sur le charbon actif.
La description des isothermes d'adsorption a
été réalisée en appliquant les modèles de
Langmuir et Freundlich. Le tableau III.2, ci-dessous rassemble les constantes
Kf et 1/nf de Freundlich, K et Qm de Langmuir.
Tableau III.2 : Les constants Kf et
1/nf de Freundlich, K et Qm de Langmuir, pour les trois colorants
sur le charbon actif et les phosphates.
|
Adsorbât
|
paramètres de Langmuir
|
Paramètres de Freundlich
|
|
Qm
(mg/g)
|
R2
|
Kf
|
1/nf
|
R2
|
Charbon actif
|
Bleu de
méthylène
|
330.1
|
294.12
|
0.9961
|
77.46
|
0.4683
|
0.9638
|
|
304
|
322.6
|
0.9956
|
82.75
|
0.4579
|
0.9417
|
|
238.12
|
222.2
|
0.9716
|
55.91
|
0.4245
|
0.8275
|
phosphates
|
Bleu de
méthylène
|
8.82
|
7.46
|
0.9301
|
5.74
|
0.1518
|
0.7467
|
|
0.544
|
17.27
|
0.9972
|
6.43
|
0.365
|
0.9339
|
|
*
|
*
|
0.9645
|
*
|
*
|
0.9291
|
|
Le tableau montre que, pour le charbon actif, le
modèle le plus vérifié est celui de Langmuir (coefficient
de régression linéaire proche de 1). Donc, ce sont des isothermes
de type L, La comparaison des capacités d'adsorption maximales est dans
l'ordre cité précédemment (jaune basique, bleu de
méthylène, et JK2R).
Pour les phosphates, on remarque, d'après les
coefficients de régression linéaire, que seul l'adsorption du
jaune basique sur les phosphates suit le modèle de Langmuir, avec une
quantité maximale d'adsorption de 17.27 mg/g. la superposition des trois
isothermes donne le même ordre des capacités maximales
d'adsorption que sur charbon actif (jaune basique, bleu de
méthylène, JK2R).
4. Effet du pH
Le pH est un facteur important dans toute étude
d'adsorption, du fait qu'il peut influencer à la fois la structure
d'adsorbant et d'adsorbât ainsi que le mécanisme d'adsorption. Ce
facteur dépend de l'origine des eaux à traiter et du
procédé de leurs traitements (coagulation, floculation,
oxydation....). Donc, il est judicieux de connaître l'efficacité
d'adsorption à différents pH. Pour cela, nous avons
représenté sur les figures III.11, III.12, et III.13 les
variations de la quantité adsorbée en fonction du pH du milieu, a
partir d'une concentration initiale de colorants de 20 mg/l et un rapport de
charbon actif de 0.05g/l, 1g/l de phosphates pour le bleu de
méthylène et le jaune basique, et 10g/l pour le JK2R. Les mesures
des concentrations se font, en tenant compte de l'effet du pH sur les courbes
d'étalonnage.
Charbon actif :
Pour le bleu de méthylène, on remarque que le
pourcentage de décoloration sur le charbon actif diminue de 60 %
à pH=2, jusqu'à 42% à pH =5, puis augmente avec le pH pour
atteindre 70% à pH=10.
Pour le jaune basique le pourcentage de décoloration
augmente au fur et à mesure que le pH augmente (70% à pH=2
jusqu'à 86% à pH=10), par contre celui du JK2R diminue avec le pH
(38% à pH=2 jusqu'à 25% à pH=10).
Ces résultats peuvent être
interprétés de la manière suivante, la charge
superficielle négative du charbon actif devient de plus en plus grande
avec l'augmentation du pH. Pour les colorants cationiques (bleu de
méthylène et jaune basique), la force d'attraction augmente, par
conséquent l'adsorption augmente, par contre l'interaction
répulsive du JK2R, qui est un colorant anionique, avec le charbon actif
augmente ce qui diminue la quantité adsorbée.
L'augmentation de la quantité adsorbée du bleu
de méthylène dans les milieux acide est due au fait que la
molécule contient des groupements amines qui sont ionisables par
quaternisation avec H+, ce qui entraîne une augmentation de la
quantité adsorbée.
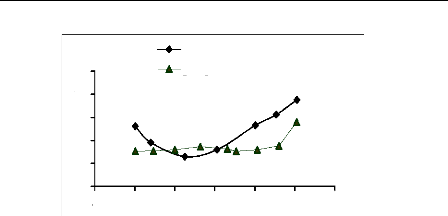
0 2 4 6 8 10 12
pH
70
60
50
40
30
% de
décoloration
80
charbon actif phosphates
Figure III.11 : Effet de pH sur
l'adsorption du bleu de méthylène
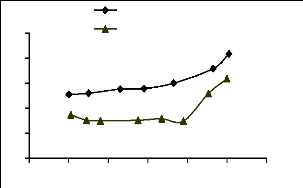
55
45
pH
85
75
65
charbon actif phosphates
% de
décoloration 95
0 2 4 6 8 10 12
Figure III.12 : Effet de pH sur
l'adsorption du jaune basique
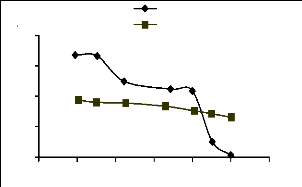
phosphates charbon actif
% de
décoloration
80
60
40
20
0
pH
0 2 4 6 8 10 12
Figure III.13 : Effet de pH su
l'adsorption du JK2R
Les phosphates :
Pour le bleu de méthylène et le jaune basique,
le pH n'a pas d'effet sur la quantité adsorbée dans les milieux
acides ou neutres, on remarque une nette augmentation de la quantité
adsorbée dans les milieux très basique au-delà de pH=9.
Pour le JK2R, la quantité adsorbée diminue
brusquement avec l'augmentation du pH, on remarque que la quantité
adsorbée s'annule dans les pH très basiques au-delà de pH
=10.
5. Effet de force ionique
Dans le but d'étudier l'effet de la force ionique sur
la quantité adsorbée, nous avons représenté sur les
figures III.14, III.15, et III.16 la variation de la quantité
adsorbée en fonction des concentrations croissantes en NaNO3. Les
mesures des concentrations se font, on tenant compte de l'effet de la force
ionique sur les courbes d'étalonnage.
Les courbes montrent que, l'ajout de NaNO3, augment nettement
la quantité adsorbée des deux colorants cationiques (bleu de
méthylène et jaune basique), alors que celle du colorant
anionique (JK2R) diminue.
L'augmentation de la quantité adsorbée des deux
colorants cationiques sur le charbon actif est très significative par
rapport aux phosphates naturels. Alors qu'on remarque l'inverse pour le
colorant anionique.
Pour interpréter ces résultats nous devons faire
appel à la théorie de Gouy-Chapman sur la double couche de
diffusion qui prévoit que l'épaisseur de cette couche serait
faible avec la force ionique ce qui facilite le rapprochement des
molécules d'adsorbât et les particules d'adsorbant [20]. Et par
conséquent augmentation de la quantité adsorbée.
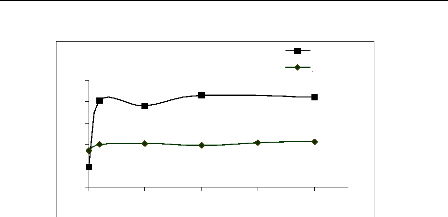
% de
décoloration
charbon actif phosphates
80
70
60
50
40
30
[NaNO3]
(mol/l)
0 0,05 0,1 0,15 0,2
Figure II.14 : Effet de force ionique sur
l'adsorption du bleu de méthylène
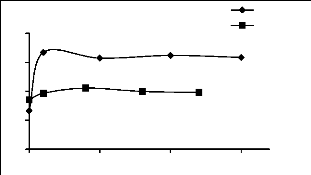
0 0,05 0,1 0,15
[NaNO3]
(mol/l)
% de
décoloration
90
80
70
60
50
charbon actif phosphates
Figure II.15 : Effet de force ionique sur
l'adsorption du jaune basique
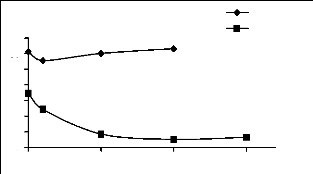
0 0,05 0,1 0,15
[NaNO3]
(mol/l)
%de
décoloration
70
60
50
40
30
20
10
0
charbon actif phosphates
Figure II.16 : Effet de force ionique sur
l'adsorption du JK2R

CONCLUSION GENERALE
Ce travail a pour objectif l'étude de la
rétention de trois colorants textiles en régime statique sur les
phosphates naturels et le charbon actif. L'étude en particulier de
l'influence de certains paramètres (pH, isothermes, force ionique) sur
la rétention de ces adsorbâts a retenu notre attention.
L'essentiel de travail peut se résumer dans les points
suivants :
· Les cinétiques d'adsorption sur le charbon actif
sont plus rapides que sur les phosphates naturels.
· Les cinétiques d'adsorption du JK2R sur les deux
matériaux sont plus lentes par rapport aux deux autres colorants.
· La masse des phosphates naturels nécessaire pour
la décoloration des solutions est beaucoup plus importante par rapport
au charbon actif,
· Les isothermes d'adsorption sur charbon actif suivent
le modèle de Langmuir, alors que sur les phosphates naturels, seul le
jaune basique suit ce modèle. Les deux autres isothermes sont de type H
pour le bleu de méthylène et S pour le JK2R.
· Les deux colorants (bleu de méthylène et
jaune basique) s'adsorbent mieux en
milieu basique, alors que l'adsorption
du JK2R est favorisée dans le milieu acide.
· L'ajout de NaNO3 augmente considérablement la
quantité adsorbée des deux colorants cationiques (bleu de
méthylène et jaune basique), sur le charbon actif. Alors que
celle du JK2R subit une diminution.
Les phosphates naturels bruts se sont avérés
comme des solides ayant une affinité d'adsorption moyenne par rapport au
charbon actif dans l'élimination des colorants utilisés.
Néanmoins, l'abondance naturelle de ce matériau peut combler
cette différence et offrir un nouveau support d'adsorption qui peut
contribuer à la dépollution des eaux usées.
En perspectives
Deux points importants seront à élucider.
· L'effet des traitements chimique et thermique des
phosphates naturels sur la capacité de leur adsorption.
· L'élaboration des phosphates par voie chimique, ce
travail nous permettra de déterminer la ou les phases actives dans les
phosphates naturels
REFERENCES BIBLIOGRAPHIQUES
[1] Aklil. A, Mouflih. M, Sebti. S, phosphate naturel : Un
nouveau adsorbant pour le traitement des eaux contenant des ions
métalliques, es du 2ème colloque du GMRE et
XXXIIème congrès du GFP.
[2] Rais. Z, Kherbeche. A, Hadji. M, Chagroune. A,
Elimination des colorants textiles par les apatites mal cristallisée,
ann. Chim. Sci. Mat, 2001, 26, pp S345- S351.
[3] Ziyad. M, Belkadi A, Adsorption des non-sucres des jus de
sucrerie par les phosphates naturels à structure apatitique, Cahier Sci.
Tech. pp 1227-1234, IAA Déc. (1990)
[4] Accorci .C.A, Decoloration and degradation products of
technical sugar juices following a hydrogen peroxide treatment, Ass. CI.T.S,
paper 18, Vienne, Mai (1989)
[5] Slansky. M, Géologie des phosphates,
Mémoire du BRGM n°: p 114, 1980.
[6] Kanazawa. T, Inorganic phosphates compounds, Materials
science monographs, 52, p 12, 1989.
[7] Stoeckli H. F, Carbon, 28, pp 1-6, 1990.
[8] Brunauer. S, Emett. P. H, Teller. T. J, J. Amer. Chem. Soc,
60, pp 309-320, 1938.
[9] Tahiri. S, Traitement et valorisation des déchets
solides industriels, Thèse de Doctorat Faculté des Sciences Ain
Choch, Casablanca.
[10] Barton. S. S, The adsorption of methylene Blue by active
carbon, Carbon, 25, pp 243-350, 1987.
[11] Aerdizzone. S, Gabrielli. G, Lazzari. P, Adsorption of
methylene blue at solid/liquid and water/air interfaces, Colloids Surface, 76,
pp 149-157, 1993.
[12] Kaewprasit. C, Hequet. E, Abidi. N, Gourlot.J.P, Quality
mesurements. Application of methylene blue adsorption to cotton fiber specific
surface area mesurements. Part I. Methodology, The Journal of Cotton Sciences,
2, pp 164-173, 1998.
[13] Montgomery. Y. J. M, Consulting engineers, INS : Water
traitement principales and designs, Ed. J. Wiley & Sons, New York. 1985.
[14] Giles. C. H, Macewan. T. H, Smith. D, Journal of Chimical
Society, Part XI, pp 3973-3993.1960.
[15] Belmouden. M, Contribution a l'étude de
l'adsorption de deux familles de polluants organiques sur charbons actifs et
sols, Thèse de Doctorat Faculté des Sciences d'Agadir, 2000.
[16] Young R.A. Coll. Int. CNRS, Paris 230, 21, 1973.
[17] Trombe J.C. Contribution a l'étude de la
décomposition et de la réactivité de certaines apatites
hydroxylées et carbonatées, Ann. Chim, 8, pp 251-269, 1973.
[18] Bonel G, Contribution à l'étude de la
carbonatation des apatites : synthèse et étude des
propriétés physico-chimiques des apatites carbonatées de
type B, Ann. Chim, 7, pp 127-144, 1972.
[19] Tamimi. M, Adsorption sur charbon actif et sol de certains
pesticides, mémoire de DESA, Faculté des Sciences d'Agadir,
2001.
[20] Rashid. M. A, Buckley. D. E, Robertson. K. R, Geoderma, 8,
pp 11-18, 1992.
Annexe I.
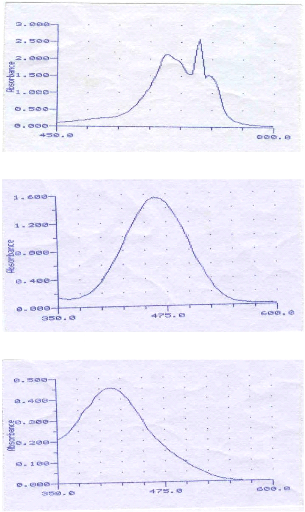
Balayage spectral du bleu de méthylène
Balayage spectral du jaune basique
Balayage spectral du Jk2r
Annexe II.

Absorbance
2
1,5
1
0,5
0
y = 0,1865x + 0,0314
R2 = 0,9986
0 2 4 6 8 10 12
Concentration (mg/l)
Courbe d'étalonnage du bleu de méthylène.
Absorbance
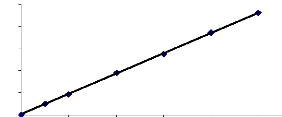
1
0,8
y = 0,0458x + 0,005
R2 = 0,9999
0,6
0,4
0,2
0
0 4 8 12 16 20
Concentration (mg/l)
Courbe d'étalonnage du jaune basique.
A bs orbance
0,5
0,4
0,3
0,2
0,1
0
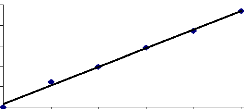
y = 0,0227x + 0,0151
R2 = 0,9955
0 4 8 12 16 20
Concentration (mg/l)
Courbe d'étalonnage du JK2R.
| 


