|
REPUBLIQUE TUNISIENNE
|
INSTITUTION DE LA RECHERCHE
ET DE
L'ENSEIGNEMENT
SUPERIEUR AGRICOLES
|
|
UNIVERSITE DE
CARTHAGE
|
INSTITUT NATIONAL AGRONOMIQUE DE TUNISIE
THESE DE DOCTORAT EN SCIENCES
AGRONOMIQUES
Discipline: Sciences de la Production
Végétale
DIVERSITES PHENOTYPIQUE ET MOLECULAIRE
DES
MICROSYMBIOTES DU SULLA DU NORD (HEDYSARUM
CORONARIUM L.) ET
SELECTION DE SOUCHES
RHIZOBIALES EFFICIENTES
Présentée et soutenue publiquement par:
Sana Dhane Fitouri
Devant le jury composé de:
Mr. Nétij Ben Méchlia
Président
Mr. Faysal Ben Jeddi Directeur de thèse Mr. Moez
Jebara Rapporteur
Mr. Mustapha Sanaa Rapporteur
Mr. Bouaziz Sifi Examinateur
Mr. Ridha Mhamdi Invité
Mr. Mongi Zouaghi Invité
DEDICACES
A la mémoire de mon cher et regretté papa
à qui je dois persévérance et
volonté,
acharnement et fierté,
à ma tendre maman qui m'a toujours aidée par
sa présence, ses conseils et ses prières,
à mon cher
époux pour ses encouragements, sa patience et sa
compréhension,
à mon adorable petite Salma devant qui je me
prosterne tant je l'ai privée de ma présence
pour être
au laboratoire,
à mes chers beaux parents pour leur gentillesse, et
leur infinie disponibilité toutes les fois que
j'ai eu besoin
d'eux,
à mes frères et soeurs Sami, Akram, Sami,
Ines et Emna qui ont tous été là pour moi,
à
tous mes amis et mes collaborateurs,
à tous mes pairs, mes
maîtres et mes professeurs
je dédie mon modeste travail qui, j'espère,
trouvera bonne réception, fera honneur et donnera
plaisir à
tous ceux qui le lisent, l'écoutent ou le discutent.
Remerciements
Ce travail de thèse a été
réalisé en collaboration entre le Laboratoire de Productions
fourragère et pastorale de l'Institut National Agronomique de Tunisie et
le Laboratoire des Interactions Légumineuses Microorganismes du Centre
de Biotechnologie de Borj Cédria.
Je remercie très fort tous ceux qui ont consenti pour
moi temps et efforts pour que ce travail voie le jour.
Je commence par Mr Faysal Ben Jeddi, mon directeur de
thèse : Maître de conférences et chef de Département
ABV à l'INAT. A Si Faysal, je dois gratitude et respect, tant pour son
encadrement, que pour son soutien tout au long de la réalisation de
cette thèse.
Mes remerciements vont aussi à Mr Ridha Mhamdi,
Professeur au CBBC qui m'a tendu la main à un moment difficile de
l'élaboration de cette thèse. Grâce à ses conseils
et son encadrement, j'ai pu finaliser et valoriser ce travail.
Je remercie également Mr Nétij Ben Mechlia,
Professeur à l'INAT, pour avoir bien voulu chapeauter le jury de ma
thèse.
Mes remerciements s'adressent aussi à Mr Bouaziz Sifi,
Maître de recherche à l'INRAT, qui a aimablement accepté de
juger ce travail.
Je suis très reconnaissante à Mr Moez Jebara
Professeur au CBBC qui m'a aimablement accueillie dans le laboratoire et qui a
en plus accepté de juger mon travail. Je profite de l'occasion pour
exprimer ma reconnaissance au Professeur Jebara et à toute
l'équipe du laboratoire LILM dont les remarques et suggestions ont
été très utiles et judicieuses pour la finalisation de
cette thèse.
Ma gratitude va à Mr Mustapha Sanaa, Maître de
conférences à l'INAT, qui a participé par ses conseils
pertinents à la correction de ce document. Ses remarques constructives
m'ont été très utiles et très enrichissantes.
Je tire ma révérence à notre cher et
respectueux maître le Professeur Mongi Zouaghi qui m'a guidée et
encouragée dès mes premiers pas dans la recherche et qui a
toujours trouvé les verbes et proverbes pour m'encourager.
Ma reconnaissance et mes vifs remerciements vont bien sûr
à Mr Mahmoud Elyes Hamza Directeur de l'INAT ainsi qu'aux enseignants et
personnel de l'INAT.
J'exprime ma grande reconnaissance à Mr Zribi Kais,
Maître assistant au CBBC qui m'a aidée, conseillée et
initiée dans le domaine de la Rhizobiologie.
Je n'oublie pas de remercier Professeur Aouani, qui a
participé par son expérience dans le domaine de la microbiologie
du sol, à m'orienter pour le choix du sujet de thèse.
Je me fais un grand plaisir de remercier Mr Salah Rezgui,
Maître de conférences à l'INAT, qui a
généreusement accepté de m'aider dans la
réalisation des analyses statistiques.
Je n'oublie pas non plus de remercier ma chère amie Mme
Sywar Haffani Ksontini, qui a également participé à la
réalisation des analyses statistiques.
Je remercie sincèrement et profondément mes
amis: Sabrine Saidi, Sabrine Chaibi, Leila, Olfa, Imène, Ines,
Manèle, Yazid, Becem et Haythem ; ainsi que tout le personnel du
Laboratoire des Interactions Légumineuses Microorganismes au CBBC Mme
Monia, Mme Jamila, Melle Faten, Melle Sameh, Mr Fethi, Mr Naceur et tous ceux
que j'ai oublié de citer. Je n'oublierais jamais le soutien moral et
l'aide qui m'ont été apportés par ces amis et en
particulier Mme Darine Trabelsi Hammami, Maître assistant au CBBC, qui
m'a beaucoup aidée dans le travail de caractérisation
moléculaire.
J'adresse mes vifs remerciements au personnel de la CCSPS en
particulier Mme Imène Amri-Ben Jemiaa, Mme Hajer Mahfoudhi et Mr
Abdelwahab Arbaoui qui m'ont aidée lors des travaux de collecte du
matériel rhizobial. Je profite de l'occasion pour leur souhaiter du
courage et du succès dans leurs carrières. J'exprime aussi ma
reconnaissance à Mr Abdelaziz Baccari qui m'a en cadré et
soutenue pendant mon expérience d'Ingénieur à la CCSPS
ainsi qu'à Mr Mohamed Babba qui s'est toujours porté volontaire
pour m'aider aussi bien en tant que responsable à la CCSPS qu'à
la DGPA.
Je n'oublie pas de remercier profondément tout le
personnel de la Direction des sols en particulier Mr Hamrouni et Mme Saida qui
m'a toujours accueilli avec le sourire. Je remercie également Mme
Kalthoum Sifaoui pour son sérieux et lui souhaite une bonne continuation
dans ses travaux de recherche.
Je salue tout le personnel de la Direction
Générale des Ressources Hydrauliques qui m'ont fourni les
données météorologiques des stations de production de
semences de sulla. Je suis sincèrement reconnaissante à
l'association Abel Granier et en particulier Mme May Granier qui offre de son
temps et de son énergie pour la réhabilitation des sols
dégradés de la Tunisie.
Je n'oublie pas de remercier mes collègues, mes
étudiants et tout le personnel de notre Laboratoire de Productions
Fourragère et Pastorale de l'INAT en particulier Jabrane, si Salah et
Salma. Je m'adresse à mes amis Sonia; Slim; Khalil; Amel; Rabeb; Sahari;
khaoula; Sarra; Seif et tous ceux que j'ai oublié de citer et je leur
souhaite à tous beaucoup de courage, de chance et de succès.
Sommaire
RESUME i
ABSTRACT ii
~~~~ iii
Liste des tableaux iv
Liste des figures vi
Liste des abréviations ix
INTRODUCTION 1
REVUE BIBLIOGRAPHIQUE 4
1. Les légumineuses 5
1. 1. Les Caesalpinoideae 5
1. 2. Les Mimosoideae 5
1. 3. Les Papilionoideae 5
1. 4. Le sulla du nord : Hedysarum coronarium L. 6
1. 4. 1. Ecologie et distribution 6
1. 4. 2. Potentiel fourrager 7
1. 4. 3. Intérêts environnementaux 7
1. 4. 4. Exportation des éléments majeurs et
fertilisation 8
2. La diversité des rhizobiums 9
2. 1 La rhizosphère 9
2. 2. Les rhizobiums 9
2. 3. Les microsymbiotes du sulla 11
2. 4. Caractérisation des rhizobiums 11
2. 4. 1. La caractérisation phénotypique 11
2. 4. 1. 1. La croissance 12
2. 4. 1. 2. Les critères symbiotiques 12
2. 4. 1. 3. Tolérance à la salinité 13
2. 4. 1. 4. Tolérance au pH 13
2. 4. 2. Caractérisation moléculaire des rhizobiums
14
2. 5. Distribution des rhizobiums et choix des sites de collecte
15
3. Symbiose Légumineuse-Rhizobium 16
3. 1. La nodulation 16
3. 1. 1. Historique de la nodulation 16
3. 1. 2. Les étapes de la nodulation 17
3. 1. 2. 1. Echange de signal d'infection 17
3. 1. 2. 2. Infection 18
3. 1. 2. 3. Développement du nodule et maturation des
bactéroïdes 18
3. 1. 3. Morphologie des nodules 19
3. 1. 4. Génétique de la nodulation 20
3. 2. Spécificité symbiotique 22
3. 3. Efficience symbiotique 23
3. 4. Facteurs qui influencent la fixation symbiotique 23
3. 4. 1. Facteurs abiotiques 24
3. 4. 1. 1. Le pH du sol 24
3. 4. 1. 2. Le stress salin 24
3. 4. 1. 3. Le stress hydrique 24
3. 4. 2. Effet des techniques culturales sur la fixation
symbiotique 25
3. 4. 2. 1. Effet de la Fertilisation chimique 25
a. L'azote 26
b. Le Phosphore 26
c. Le Potassium 27
d. Le soufre 27
3. 4. 2. 2. Effet du travail du sol 27
3. 4. 2. 3. Effet des traitements phytosanitaires 27
3. 5. Effet des bactéries amélioratrices de la
croissance des plantes 28
3. 6. Formes et qualité des inoculums 29
MATERIEL ET METHODES 31
1. Sites de collecte des rhizobiums 32
2. Conduite des cultures au niveau des champs de production de
semences 33
3. Caractérisation agronomique et symbiotique du sulla
cultivé 34
3. 1. Hauteur de végétation 34
3. 2. Biomasse sèche 35
3. 3. Semences en gousses 35
3. 4. Protéines brutes 35
3. 5. Paramètres de nodulation et collecte des rhizobiums
36
3. 6. Conservation des rhizobiums 36
3. 6. 1. Conservation des nodules par déshydratation 36
3. 6. 2. Conservation des isolats bactériens 37
3. 6. 2. 1. Isolement et purification des rhizobiums 37
3. 6. 2. 2. Conservation sur gélose inclinée 37
3. 6. 3. Conservation dans le glycérol 38
3. 7. Analyse des données 38
4. Etude de la diversité des microsymbiotes du sulla 38
4. 1. Caractérisation phénotypique 38
4. 1. 1. Infectivité des isolats 38
4. 1. 1. 1. Désinfection des graines et semis 39
4. 1. 1. 2. Inoculation des plantes et conduite de la culture
39
4. 1. 2. Critères morphologiques 40
4. 1. 2. 1. Coloration Gram 40
4. 1. 2. 2. Caractérisation morphologique des colonies
40
4. 1. 3. Critères physiologiques des colonies 41
4. 1. 3. 1. Tolérance à la salinité 41
4. 1. 3. 2. Tolérance au stress hydrique 41
4. 1. 3. 3. Tolérance au pH basique 41
4. 1. 2. 3. Tolérance au calcaire 42
4. 1. 4. Analyse numérique 42
4. 2. Caractérisation moléculaire 42
4. 2. 1. Extraction de l'ADN bactérien 42
4. 2. 2. Evaluation de la diversité
génétique des isolats de la collection par Rep-PCR 42
4. 2. 3. Identification moléculaire par PCR-RFLP de l'ADNr
16S 43
4. 2. 4. Séquençage du gène de l'ADNr 16S
45
4. 2. 5. Analyse numérique 45
5. Evaluation de l'efficience symbiotique des isolats de la
collection 46
5. 1. Conduite de l'essai 46
5. 2. Paramètres mesurés 46
6. Evaluation de l'efficience symbiotique du couple 47
Hedysarum coronarium L./R. sullae en conditions
de stress hydrique
6. 1. Installation de l'essai 47
6. 3. Conduite de l'irrigation 48
6. 4. Paramètres mesurés 48
7. Evaluation de l'activité symbiotique des souches en
plein champ 49
7. 1 Caractéristiques climatiques des sites 49
7. 2. Caractéristiques chimiques des sols 50
7. 3. Dénombrement des populations natives de rhizobium
nodulant 50
le sulla dans les stations d'essai
7. 4. Installation et conduite des essais 51
7. 5. Paramètres mesurés sur le sulla de
1ère année 53
7. 6. Paramètres mesurés sur le sulla de
2ème année 53
8. Analyses statistiques 53
RESULTATS ET DISUSSIONS 54
1. Etude de la variabilité agronomique du sulla
porte-graines en régions 55
nord dorsaliennes
1.1. Caractéristiques édapho-climatiques des sites
prospectés 55
1. 2. Caractérisation agronomique des sullas 58
1. 3. Etude de la variabilité des sullas 60
1. 4. Discussion 63
1. 5. Conclusion 66
2. Etude de la diversité des microsymbiotes du sulla
67
2. 1. Caractérisation phénotypique des rhizobiums
67
2. 1. 1. Evaluation de l'infectivité des isolats 67
2. 1. 2. Critères morphologiques 67
2. 1. 2. 1. Description des isolats 67
2.1.2.2. Tolérance à la salinité 68
2.1.2.3. Tolérance au pH basique 69
2.1.2.4. Tolérance au stress hydrique 70
2.1.2.5. Tolérance au stress calcaire 71
2. 1. 3. Analyse des critères phénotypiques par
UPGMA 73
2.2. Caractérisation moléculaire des souches
nodulant le sulla 76
2. 2. 1. Analyse de la diversité intra spécifique
par Rep-PCR 76
2.2.2. Analyse de la diversité intra spécifique par
PCR-RFLP de l'ADNr 16S 79
2.2.3. Séquençage du gène 16S 81
2.3. Discussion 81
2.4. Conclusion 83
3. Evaluation de l'efficience symbiotique des bactéries
nodulant le sulla 84
3.1. Evaluation des paramètres de croissance 84
3.2. Analyse de la nodulation du sulla 85
3.3. Evaluation des paramètres de rendement du sulla
88
3.3.1. Biomasse sèche aérienne 88
3.3.2. Teneur en protéines brutes 88
3.4. Discussion 90
3.5. Conclusion 91
4. Effet de la contrainte hydrique sur la symbiose
rhizobium/sulla 92
4.1. Effet de la contrainte hydrique sur la croissance et la
nodulation du sulla 92
4.1.1. Croissance en hauteur 93
4.1.2. Surface foliaire 93
4.1.3. Nodulation du sulla 94
4.2. Effet de la contrainte hydrique sur les rendements du sulla
inoculé 95
4.2.1 Biomasse sèche des sullas 95
4.2.2. Rapport partie racinaire sur partie aérienne du
sulla 96
4.2.3. Protéines brutes aériennes fixées
par le sulla 96
4.3. Discussion 98
4.4. Conclusion 100
5. Etude de l'efficacité symbiotique des souches
rhizobiales 101
sélectionnées au champs
5. 1. Evaluation de la densité rhizobiale autochtone
spécifique au sulla 101
dans les sites expérimentaux
5. 2. Effet de l'inoculation rhizobiale sur la culture de sulla
de 1ère année 101
dans les sites Tunis et Goubella
5. 2. 1. Croissance en hauteur du sulla première
année 101
5. 2. 2. Surface foliaire du sulla de première
année 102
5. 2. 3. Nodulation du sulla de première année
103
5. 2. 4. Biomasse sèche aérienne du sulla de
première année 103
5. 2. 5. Protéines brutes aériennes du sulla de
première année 104
5. 3. Evaluation des croissances et nodulation du sulla de
deuxième année 105
dans la station de Goubellat
5. 4. Bilan exprimé en biomasses sèche et
protéique du sulla 106
après deux années de culture à Goubellat
5.5. Discussion 107
5.6. Conclusion 108
CONCLUSIONS GENERALES ET PERSPECTIVES 109
REFERENCES BIBLIOGRAPHIQUES 111
ANNEXES 145

Résumé
Dans le but de promouvoir la diversité des ressources
génétiques rhizobiales spécifiques au sulla du nord
(Hedysarum coronarium L.), une étude prospective a
été entreprise dans 14 sites de production de semences de la
Tunisie septentrionale. L'analyse de la croissance et de la production du sulla
cultivé, a révélé une variabilité de
comportement intra-spécifique qui dépend à la fois des
paramètres édapho-climatiques, et de la population rhizobiale
autochtones. L'exploration de l'état de la nodulation du sulla dans
divers sites a révélé l'existence d'associations
symbiotiques à haut pouvoir fixateur (Oued Zarga et Tunis) ou encore la
défaillance de cette activité en raison de l'absence de souches
rhizobiales spécifiques (Goubellat). L'isolement des bactéries
des nodules de sulla a permis la constitution d'une collection de 45 isolats
présentant un test de nodulation positif.
L'analyse de la diversité génotypique de ces
souches par PCR/RFLP suivie du séquençage de l'ADNr 16S a
révélé que 71 % des souches de la collection
présentent une similarité à plus de 99% avec R. sullae
souche IS 123T. La caractérisation phénotypique
par les tests de tolérance à des stress abiotiques
(salinité, pH, sécheresse) a mis en évidence une limite de
tolérance de ces souches variant respectivement de 150 à 700 mM
pour le NaCl, de 9 à 10,5 pour le pH alcalin, et de -0,5 à -0,95
MPa pour la sécheresse simulée par le PEG 6000.
L'évaluation de l'efficience symbiotique des isolats testés en
association avec le sulla a permis d'identifier 19 souches
particulièrement efficientes. Parmi ces dernières, HC5 et HC14,
classées respectivement comme hautement et moyennement tolérantes
au stress osmotique, ont été évaluées en pots
à différents niveaux de stress hydrique en comparaison avec une
souche sensible au stress osmotique (HC1). A 100% de la réserve utile
(RU), l'inoculation du sulla par HC14 (200 mM NaCl et -0.9 MPa) a fournit le
meilleur rendement en fourrage sec (4,75 g/plante). A 75 % RU et 50 % RU, HC14
a assuré des rendements similaires à ceux enregistrés avec
la souche HC5 (400 mM NaCl et -0,95 MPa). En revanche, les plants de sulla
inoculés avec HC1 (150 mM NaCl et -0,5 MPa) ont induit les plus faibles
nodulations et rendements fourragers.
En plein champ et sous régime pluvial des deux sites
expérimentaux Tunis et Goubellat, les souches rhizobiales HC5 et HC14 se
sont montrées compétitives et efficientes. L'amélioration
des rendements en protéines brutes au stade floraison du sulla
inoculé par HC14 a varié de 40 à 277 % respectivement
à Tunis et Goubellat.
Mots clés: Hedysarum coronarium L., Rhizobium
sullae, Fixation de l'azote, Inoculation, Stress abiotique.

Summary
In order to promote the diversity of rhizobial genetic
resources specific to sulla (Hedysarum coronarium L.), a prospective
study was undertaken in 14 sites of seed production in northern Tunisia. The
analysis of growth and production of cultivated sulla revealed variability of
intra-specific behavior depends on both edapho-climatic parameters, and the
indigenous rhizobial population. The exploration of sulla's nodulation in
various sites unveiled the existence of symbiotic associations with high
fixation (Oued Zarga and Tunis) or a failure of this activity due to the
absence of specific rhizobial strains (Goubellat). Isolation of bacteria from
sulla nodules has allowed the establishment of a collection of 45 isolates
presenting a positive nodulation testing.
Analysis of the genotypic diversity of these strains by
PCR/RFLP followed by the sequencing of the ADNr16S showed that 71% of strains
have a similarity of more than 99% with R. sullae strain IS 123T.
Phenotypic characterization by tests of tolerance to abiotic stress (salinity,
pH, drought) revealed a tolerance limit varying respectively from 150 to700 mM
for NaCl; 9 to10.5 for alkaline pH and -0,5 to -0,95 MPa for drought simulated
by PEG 6000.
The assessment of symbiotic isolates efficiency tested with
sulla has identified 19 strains particularly efficient. Among these, 2 strains
HC5 and HC14, respectively classified as highly and moderately tolerant to
osmotic stress, were evaluated in pots at different levels of water stress in
comparison with sensitive strain (HC1). At 100% of useful reserves (UR),
inoculated sulla with HC14 (200 mM NaCl and -0.9 MPa) has provided the best dry
forage yield (4.75 g / plant). At 75% and 50% UR HC14 provided yields similar
to those recorded with the strain HC5 (400 mM NaCl and -0.95 MPa). By contrast,
plants inoculated with sulla HC1 (150 mM NaCl and -0.5 MPa) induced the lowest
nodulation and forage yields.
In a non-irrigated field trial Tunis and Goubellat, rhizobial
strains HC5 and HC14 provided competitive and efficient. The improvement yields
of crude protein at flowering stage of sulla inoculated with HC14 ranged from
40 to 277% respectively in Tunis and Goubellat.
Keywords: Hedysarum coronarium L., Rhizobium sullae, Nitrogen
fixation, Inoculation, Abiotic stress.

. u.4.35 á~-2
0 Ñæ:41Ç Ì~$+Å .)-4
~./~~
~~~~~ ~~~~
ÏÑÇ941Ç
Úill'
~~ø~~Ç
1:4Ø
zualÇ
5z6
,
,
%Ç+JS.1
78 Lc
:aæÑ341Ç
-~~ ß91-.Ç
Ì~$+Åæ ~~~~Ç 34
4~UA1Ç Ê1--1Çæ
,Ç(
c
LA4.6.5
.~~~~?Ç
~~~æ~~~~Ç æ
"
·4.11.i&A B/ÇJA
Ê1#4ÇÑ Ï&æ -!
CLILIS
:ø~21 :yÑ:4
·Ç
St,'~Ç :11A ÚNil,Ç
@/æ
(u4.5æ
. ( Ø"~8 )
ÁÇ/j31Ç
ì.Ç9) A.k11c
ÉÑ@/
4111Ç 114æ_4)Ç ÊG"~
Ï&æ ã@! ys,4 Ø1211Ç Ç1 3
æ
jA :ø~-11 ',Ñ(4Ç
@8.~Ç -~ ~~~~$<)~Ç á.! cisA
. c.147Å
Ç4-A z.Ñ(4.Ç
@8.~Ç
älS ~~~!
C14.955Ñ~)$>Ç
-~ ä9<11
4c'9ATN-4
Á1.:Å
45
34
5~6æ
, A~~~Ç )
(141Çæ V~4~Ç
~&ÑÏ
~~~~4~Ç ~R ~).S~Ç æQ~Ç
JAz:i Ñ~)$>Ç auØ cjc.
íj(1.1Ç 5$~Ç
W~Å
9 C.).4
4,ÑÏ 10,5
-~ : ÊG":~Ç
å(
, ã.~Ï94.Ç
@~Ñ~~<~
ás~~~~ 700
LlÅ 150
d4-N5 ìi:LA WS/ ~LÙ
W~Å
- 0, 95
0,5 C.)-4 æ
áts-1-uyA
. PEG6000
, ~~~~8~Ç ~V9Az1Ç
UØ ca Étstz. 14.~
~~ø~~Ç
.411x
,Ç1
zs
04"
-~æ
~~~>
B äÇ51sY-
:%-bL 19
4.fla
É)$~~~Ç ÊV3x11 ~~~ ~<$~Ç
ÉÁ~0<~Ç
)
.( HC1
~4V~~$~Ç ji~$~ ~
:"L,A ZbL, e4 ~+Ñ~8~ ~ ~Z~~~Ç
Ï1+4Ç -~ 0$ Ê1,.16.4
~~ø~~Ç
U~
% 100
~#~Ç~~
Ê æ @/æ
'4Ø4=Ç1Ç ÉÑ@/
~Ç
æ ã~Ï~S~Ç .4Ñ~1S
áJA:~A 200) HC14 )
)
0, 9
-
.( Ê~)+
HC14
%~@/ LAS
/ Y& 4,75
14~Ç `6.1Ç
451Ç ^~$ ~ ZI.~4A
ÊÇ@Z~!
áS4 3\ (
á~<~~~~~~~
~~"~
B
%~~~
% 75
:~Ø4=Ç1Ç %Ç
ÑÏ8~Ç
áJA:a4 400) HC5
4 ( á~<~~~~~~~ -0, 9
5 æ ã.-Ï941Ç
41.Ñ.1S
%
5 0 ~
~~ø~~Ç Ê13141
áJA~~~ 1 5 0) HC14
La) ^~Ð CiA U49-~Ç 4k-
.
( á~--111~A -0, 5 æ
ã_:Ï.4.Ç @~Ñ~6
ì.
W~Ç
@@! 41ÏÇ
. -~01x1Ç 3S4 ~Ç
? ~~Ñ(~~Ç @8.~Ç -~
,
ÊG"~ %$)]
HC5 ~~~æ~~~~Ç
ØN4 æ L.}4.95
~~)~~~$~Ç B/Ç ~~~Ç Ñ1ØÅ ~ æ
~~~.)~Ç 4cÇÑ31Ç á4- 4
277 ~
1+~ c ~~Ç~$~Ç L-
%
~~ø~~Ç
~~ø~
á1-21Ç
4.1æ.4Ñ,
:
,
~~A~$0~~Ç Ê~~~<~Ç
.í..A"~Ç Ï14#7Ç
71 ä ADNr16S
~4V~~$~Ç ~~~$~Ç
~~@$.~
ÇAS 41ÇjaiÇ
L1c. 5S
~ ~~~
,
å(
,
? HC5
HC14
-~~~ "~
ca+.1
.+Çæ ~
L/ Y ,
,U~ , -~&æ~$~~~Ç
,-4411
iii
, (Hedysarum coronarium L.)
~~ø~ ~ 4111Ç ~4ær~4
4~~~~1Ç
á~~~ ~Ç
,
. R. sullaeIS 123T
3:: 5
·6
1#177;111.' «
PCR/RFLP »
~~"~ B % 99 ci.4 J.6 .~=
1+4 ~!~~~~~Ç ÊVN. L1).4
%
~#~Ç~~ Ê0.~Ç
å(L~
~+~~~ Ç Ú~$~Ç
%AæÇ~~
HC14 )
~48~~~Ç ~~ø~~Ç
ã~~~Ç -~~æJ41Ç
ÊÇ@Z~!
c
i JA
Ñ~ÒÅ
-:4
. ~~~~. æ
~~: ~~~ É@8
?
.ØN12.
14 cc *4c"#$~Ç
~~ÇÑÏ %~~&
HC14
40 -~~
Liste des tableaux
Tableau 1: Exportation des éléments majeurs N-P-K
en kg par tonne de matière 8
produite par les différentes cultures
Tableau 2: Taxonomie des rhizobiums 10
Tableau 3: Techniques d'inoculation des légumineuses 29
Tableau 4 : Caractéristiques géographiques,
climatiques et chimiques 33
des sites de collecte des rhizobiums
Tableau 5: Quantités et réactifs utilisés
pour l'amplification de l'ADNr 16S 44
et de la séquence Rep-PCR
Tableau 6 : Cycles de variation de la température au cours
de l'amplification 45
des différents gènes
Tableau 7: Caractéristiques chimiques des sols dans les
stations d'essai 50
Tableau 8: Caractéristiques pédoclimatiques des
groupes spécifiques aux sites 57
à une distance euclidienne de 300.
Tableau 9: Variables quantitatives et qualitatives relatives
à la culture du sulla 59
dans les stations prospectées.
Tableau 10: Répartition en groupes des cultures de sulla
selon la moyenne 63
des paramètres mesurés.
Tableau 11: Coefficients de corrélation entre les
paramètres édapho-climatiques 64
et agronomiques du sulla dans les sites prospectés.
Tableau 12: Origine des souches nodulant le sulla avec leurs
limites 72
de tolérance aux stress abiotiques.
Tableau 13: Caractéristiques phénotypiques des
groupes de souches 75
nodulant le sulla selon l'analyse UPGMA.
Tableau 14: Origines géographiques et limites de
tolérance au stress osmotique 78
des souches dans chacun des groupes délimités par
l'analyse Rep-PCR.
Tableau 15: Ribotypes des souches isolées du sulla et
déterminés 80
par PCR/RFLP du gène de l'ADNr 16S
Tableau 16: Séquençage du gène de l'ADNr 16S
de quelques souches de la collection. 81
Tableau 17: Effets de l'inoculation, du sulla cultivé en
pot, par différentes souches 85
de la collection sur la croissance en hauteur et la surface
foliaire.

Tableau 18: Effet de l'inoculation, du sulla cultivé en
pot, par différentes souches 87
de la collection sur la nodulation.
Tableau 19: Effets de l'inoculation, du sulla cultivé en
pot, par différentes souches 88
de la collection sur la production de biomasse sèche et la
teneur en protéines brutes aériennes.
Tableau 20: Effet du stress hydrique sur la teneur en
protéines brutes aériennes 97
du sulla cultivé en pot et inoculé par les souches
HC1, HC5 et HC14.
Tableau 21: Effet de l'inoculation au champ du sulla avec les
souches HC14, HC5 103
sur le nombre et le poids des nodules dans les sites de Tunis et
Goubellat au stade floraison.
Tableau 22: Effet de l'inoculation rhizobiale au champ du sulla
sur sa teneur 104
en protéines brutes aériennes dans les sites de
Tunis et Goubellat au stade floraison.
Tableau 23: Effet de l'inoculation rhizobiale au champ sur la
croissance en hauteur, 105
la surface foliaire et la nodulation du sulla de
2ème année au stade bouton floral.
Tableau 24: Effet de l'inoculation rhizobiale au champ sur les
biomasses sèche 106
aérienne et protéique du sulla de
1ère et 2ème année de culture dans
les sites de Goubellat au stade bouton floral.
Liste des figures
Figure 1: Hedysarum coronarium L. (sulla) au stade
floraison. 6
Figure 2: Dialogue moléculaire entre la plante et la
bactérie lors de la mise en place 17
d'une association symbiotique
fixatrice de l'azote.
Figure 3: Structure des nodules de légumineuses 20
Figure 4 : Distribution géographique des sites de collecte
des rhizobiums du sulla. 32
Figure 5 : Conservation des nodules par déshydratation.
36
Figure 6: Ensemencement des souches sur milieu YEM. 37
Figure 7: Germination des graines sur milieu gélosé
agar-agar 0,9 %. 39
Figure 8: Test d'infectivité des souches de la collection
en association 40
avec Hedysarum coronarium L. et en conditions
contrôlées.
Figure 9: Essai d'évaluation de l'efficience symbiotique
47
des souches rhizobiales, en condition de stress hydrique, sous
serre vitrée.
Figure 10 : Variation des pluviométries et des
températures minimales et maximales 49
mensuelles durant la campagne agricole 2008-2009 dans les
stations Tunis et Goubellat.
Figure 11: Dispositif expérimental dans les stations Tunis
et Goubellat. 51
Figure 12: Dilution de la préculture rhizobiale et
inoculation du sulla au champ. 52
Figure 13: Projection plane des 2 principaux axes 1 et 2
discriminants 56
avec les sites et données pédoclimatiques
relatives.
Figure 14: Dendrogramme de similarité des sites 57
selon les paramètres pédoclimatiques.
Figure 15: Morphologie de nodules rhizobiales sur racines de
sulla 60
dans le site Oued Zarga.
Figure 16: Projections planes des deux principaux axes
discriminants 61
avec les 14 sites prospectés et les paramètres
mesurés.
Figure 17: Dendrogramme de similarité des sullas
cultivés 62
dans les stations prospectées.
Figure 18: Observation sous microscope (x 103) des
souches rhizobiales Gram-. 67
Figure 19: Aspect des colonies bactériennes sur milieu de
culture YEMA/RC. 68
Figure 20: Croissance des souches rhizobiales à des
teneurs croissantes 68
en NaCl sur milieu gélosé.
Figure 21: Cinétique de tolérance des souches
rhizobiales de sulla 69
selon la salinité (NaCl) du milieu de culture liquide.
Figure 22: Cinétique de tolérance des souches
rhizobiales de sulla 70
selon la variation du pH du milieu de culture liquide.
Figure 23: Cinétique de tolérance des souches
rhizobiales de sulla 71
selon la variation de stress osmotique du milieu de culture
liquide.
Figure 24: Croissance des souches sur milieu YEM/RC solide
enrichi en calcaire. 71
Figure 25: Dendrogramme de similarité entre les souches de
la collection 74
pour l'ensemble des caractères phénotypiques.
Figure 26: Electrophorèse des amplifias obtenus par
Rep-PCR 76
de quelques souches nodulant le sulla.
Figure 27: Dendrogramme (UPGMA) illustrant les relations
génétiques 77
estimées par l'indice de Dice résultant de
l'analyse par Rep-PCR des souches nodulant le sulla.
Figure 28: Amplification de l'ADNr 16S de quelques souches
nodulant le sulla. 79
Figure 29: Profils électrophorétiques de la
restriction 80
par RFLP de l'ADNr 16S obtenus pour quelques souches de la
collection après digestion par les endo-nucléases MspI et
NdeII.
Figure 30: Formes et tailles des nodules issues de la symbiose
86
entre quelques souches de la collection et le sulla.
Figure 31: Système racinaire d'un plant de sulla avec un
amas nodulaire inefficient. 86
Figure 32: Rendement des protéines brutes fixées
par le sulla cultivé en pot et inoculé 90 avec différentes
souches rhizobiales.
Figure 33: Effet du stress hydrique sur le développement
du sulla cultivé en pot. 92
Figure 34: Effet du stress hydrique sur la croissance du sulla
cultivé en pot 93
et inoculé par les souches HC1, HC5 et HC14.
Figure 35: Effet du stress hydrique sur la surface foliaire du du
sulla cultivé en pot 94
et inoculé par les souches HC1, HC5 et HC14.

Figure 36: Morphologie des nodules des sullas cultivés en
pot 94
et inoculés par HC14 et HC5.
Figure 37: Effet du stress hydrique sur la nodulation du sulla
cultivé en pot 95
et inoculé par les souches HC5, HC14 et HC1
exprimée en poids sec nodulaire et nombre de nodules par plant .
Figure 38: Effet du stress hydrique sur la biomasse sèche
aérienne du sulla 95
cultivé en pot et inoculé par les souches HC1, HC5
et HC14.
Figure 39: Variation du rapport PR/PA du sulla inoculé
96
selon les traitements hydriques.
Figure 40: Effet du stress hydrique sur le rendement en
protéines brutes fixées 97
du sulla cultivé en pot et inoculé avec les souches
HC1, HC5 et HC14.
Figure 41: Effet de l'inoculation rhizobiale au champ sur la
croissance en hauteur 101
du sulla de 1ère année dans les sites de
Tunis et Goubellat au stade floraison.
Figure 42: Cultures de sulla non inoculée, et
inoculée par la souche HC14 102
dans le site de Goubellat (mai 2009).
Figure 43: Effet de l'inoculation rhizobiale au champ sur la
surface foliaire 102
du sulla de 1ère année dans les sites de Tunis et
Goubellat au stade floraison.
Figure 44: Effet de l'inoculation rhizobiale au champ sur la
biomasse sèche aérienne 104
du sulla de 1ère année dans les sites de
Tunis et Goubellat au stade floraison.
Figure 45: Effet de l'inoculation rhizobiale au champ sur les
rendements 105
en protéines brutes aérienne du sulla de
1ère année dans les sites
Tunis et Goubellat au stade floraison.
Figure 46: Culture de sulla de 2ème
année inoculée par HC5 et HC14 106
comparée aux témoins sans azote (T0), et
azoté (TN) à Goubellat.
Liste des abréviations
ACP: Analyse en composantes principales
ADN: Acide Désoxyribo Nucléique BET: Bromure
d'éthidium
BSA: Biomasse sèche aérienne CE:
Conductivité électrique ADV: Densité des adventices DMSO:
Dimethyl Sulfoxide
dNTP: Désoxy adénine tri-phosphate
SUL: Densité de sulla
GPS: Global Positionning Satellite H: Hauteur des plantes
JAS: Jours après le semis
JSF: Nombre de jours entre le semis et la floraison
K2O: Potassium échangeable LPS: lipopolysaccharides
LSD: Least significant difference MO: Matière organique
MPN: Most probable number mS.cm-1: millisiemens par
centimètre
mm: millimètre
NOD: Nombre de nodules Nt: Azote total
P2O5 ass: Phosphore assimilable PB: Protéines brutes
aériennes PCR: Polymerase Chain Reaction
PEG 6000: Polyethylene Glycol 6000 PGPB: plant growth
promoting bacteria PMN: Poids Moyen d'un Nodule
PSN: Poids sec nodulaire
ppm: partie par million
RDT: Rendement en Graines
REP: Repetitive Extragenic Palindromic
RFLP: Restricion Fragment Length Polymorphism RT: Réserves
Totales
RU: Réserves Utiles
T0: Témoin non fertilisé
TN: Témoin fertilisé avec de l'azote
UPGMA: Unweighted Pair Group Method Average UV: Ultraviolet
YEM: Yeast Extract-Mannitol
Introduction
En Tunisie, l'amélioration de la production de
protéines vertes devient une nécessité suite à
l'accroissement des prix des matières premières, en particulier
les tourteaux d'oléoprotéagineuses, destinées à
l'alimentation des ruminants. Hedysarum coronarium L. est l'une des
fabacées fourragères à promouvoir pour satisfaire une
grande part des besoins protéiques des poly et monogastriques. De
même, cette espèce intervient efficacement dans la fixation
biologique des terres en pente (Slim et al., 2011),
l'amélioration de la fertilité organominérale des sols,
des rendements et valeur protéique des céréales (Ben
Jeddi, 2005). En Tunisie, Le sulla s'étend sur une emblavure très
aléatoire d'une année à l'autre, soit aux alentours de 4
000 ha. Mais, le programme stratégique de développement des
fabacées en particuliers les fourragères prévoit son
extension jusqu'à 21 000 ha en 2016 (DGPA, 2010).
Hedysarum coronarium L. bénéficie d'une
fixation biologique de l'azote atmosphérique lorsque le microsymbiote
spécifique est présent dans le sol. En conséquence, une
autonomie de croissance est signalée dans des sols déficients en
azote. Dans le cas contraire, l'inoculation est indispensable. Il a
été rapporté que l'introduction de la culture de sulla en
Australie a été obligatoirement accompagnée d'une
inoculation en raison de l'absence de rhizobium spécifique (Casella
et al., 1984). Au Maroc l'extension du sulla est entravée par
des problèmes de nodulation observés aux champs dans
différentes régions potentielles (Barnani, 1984; Thami-Alami et
Mezni, 2000).
En Tunisie, Il a été souvent noté lors
des prospections dans différentes régions du nord de la dorsale,
une faiblesse de productivité de la culture de sulla attribuée
à des échecs d'installation et de nodulation. Cet échec de
fixation symbiotique de l'azote est souvent contré par un apport de
fertilisant azoté (Dhane, 2001). Dans ces conditions, l'inoculation par
des souches bactériennes efficientes devient indiscutable (El Amri,
2001).
L'étude de la diversité biologique de
micro-organismes symbiotiques autochtones demeure une nécessité
pour toute sélection de couples symbiotiques performants
précédant toute nouvelle introduction.
Les facteurs environnementaux influencent la survie et la
persistance des souches rhizobiales introduites (Zahran, 1999; Graham et Vance,
2003). En conséquence, le succès de l'inoculation exige que la
souche sélectionnée soit hautement efficiente, compétitive
pour la formation de nodosités vis-à-vis des populations natives,
et bien adaptée aux conditions contraignantes de l'environnement
(Catroux et al., 2001; Deaker et al., 2004).
Les objectifs fixés pour la réalisation de ce
travail de recherche sont les suivants:
- exploration des interactions symbiotiques
Rhizobium/Hedysarum coronarium L. dans les stations de multiplication
de semences, et constitution d'une collection de symbiotes autochtones;
- caractérisation moléculaire et
phénotypique des souches collectées, pour une évaluation
de leurs diversités génétique et fonctionnelle et
sélection des plus performantes pour des applications potentielles;
- sélection de souches rhizobiales adaptées
à la contrainte hydrique en condition symbiotique avec le sulla; et
- évaluation de l'efficience symbiotique des souches
sélectionnées au champ dans deux stations
édaphoclimatiquement contrastées.
Ce travail se constitue de trois parties
La première partie de la thèse est
consacrée à une synthèse bibliographique dans laquelle
sont traités trois principaux thèmes:
- le premier porte sur les fabacées et
particulièrement les exigences naturelles, le potentiel fourrager, et
les particularités environnementales de l'espèce Hedysarum
Coronarium L.;
- le deuxième est consacré à la
diversité des Rhizobiums et les principales techniques de
caractérisations phénotypique et moléculaire
déployées; et
- le dernier thème traite le processus de symbiose
fixatrice de l'azote et les facteurs abiotiques influençant cette
activité.
La partie méthodologique de cette recherche commence
par la présentation des techniques utilisées pour la
caractérisation agronomique du sulla dans les parcelles porte graines et
la collecte de matériel rhizobial.
Puis, viennent les méthodes entreprises pour
l'étude des diversités phénotypique et moléculaire
des microsymbiotes du sulla. Enfin les souches les plus performantes et les
mieux adaptées aux contraintes osmotiques sont testées; à
travers l'évaluation des paramètres de croissance, de nodulation
et de rendement; en conditions hydriques contrôlées et en plein
champs.
Enfin, dans la dernière partie, sont
présentés et discutés, les principaux facteurs
responsables de la variation des rendements du sulla dans les parcelles
prospectées. La diversité des isolats collectés est
étudiée dans le but de sélectionner les souches les plus
performantes.
Revue bibliographique
REVUE BIBLIOGRAPHIQUE
Revue bibliographique
1. Les légumineuses
Les légumineuses ou Fabaceae sont classées parmi
les Angiospermes, Eudicotylédones à gousses (Sprent, 1995). Il
s'agit de la troisième plus grande famille des Angiospermes en nombre
d'espèces après les Orchidaceae et les
Asteraceae, avec 727 genres et près de 20 000 espèces
(Cronk et al., 2006). Les espèces vont des herbes naines de
l'Arctique et des montagnes aux immenses arbres des forêts tropicales
(Judd et al., 2001). Les formes arborescentes prédominent les
pays chauds tandis que les formes herbacées caractérisent les
régions tempérées (Guignard et Dupont, 2005). En se basant
sur la forme florale, cette famille est divisée en trois sous-familles,
deux sont monophylétiques (Papilionoideae,
Mimosoideae) et la troisième paraphylétique
(Caesalpinoideae) (Guignard et Dupont, 2005). Elles constituent de
loin le groupe le plus important de plantes participant à la fixation de
l'azote avec des bactéries symbiotiques (Raven et al.,
2000).
1. 1. Les Caesalpinoideae
Ce sont majoritairement des arbres ou des arbustes tropicaux
ou subtropicaux. Leur fleur irrégulière possède 5
pétales non différenciés et des étamines visibles
extérieurement (Judd et al., 2001).
1. 2. Les Mimosoideae
Ce sont pour la plupart des arbres tropicaux. Leurs fleurs
sont régulières, petites, groupées souvent sous forme de
pompons. Les étamines sont les parties les plus visibles de la fleur
(Judd et al., 2001).
1. 3. Les Papilionoideae
Cette appellation est due à la forme de la corolle qui
se présente sous forme de « papillon » (Guignard et Dupont,
2005). La sous-famille monophylétique des Papilionoideae
renferme plus des deux tiers des espèces et inclut presque toutes
les légumineuses économiquement importantes (Sprent, 1995). Elle
est cosmopolite et compte 11300 espèces réparties en 440 genres
regroupés en 31 tribus (Labat, 1996). Dans cette sous-famille, 97% des
espèces examinées peuvent être nodulées (Sprent,
1995). La majorité des espèces sont herbacées; leur fleur
est irrégulière composée de 5 pétales: un
étendard, deux ailes et deux pétales partiellement
fusionnés en une carène (Judy et al., 2001).
Revue bibliographique
Les Papilionoideae sont utilisées pour la
production des graines alimentaires comme le pois (Pisum sativum L.)
et l'haricot (Phaseolus vulgaris L.); mais aussi pour l'alimentation
du bétail, sous forme de fourrage tels que la luzerne (Medicago
sativa L.) et le sulla (Hedysarum coronarium L.).
1. 4. Le sulla du nord : Hedysarum coronarium L.
1. 4. 1. Ecologie et distribution
Hedysarum coronarium L. (sulla) (Figure 1) est une
fabacée fourragère endémique dans le bassin
méditerranéen (Gutierrez-Mas, 1983). En Tunisie, cette
espèce connue sous l'appellation sulla du nord est signalée sous
des pluviométries variant de 300 à 1000 mm/an (Le Houerou, 1965).
Ben Jeddi et Zouaghi (1995) ont signalé la présence du sulla du
nord dans l'étage sub-humide et semi-aride supérieur au nord de
la dorsale où la pluviométrie est variable entre 350 et 800 mm. A
l'état spontané, le sulla est rencontré
généralement sur les marnes et les terres argilo-calcaires et
peut se trouver à des altitudes variables de 1000 à 2000
mètres (Bentham et Hooker, 1865; Lapeyronie, 1982). La culture de sulla
est à éviter dans beaucoup de régions
méditerranéennes où les températures sont
inférieures à - 4°C (Martiniello et al., 2000) et
il n'est conseillé que dans les zones où la température
moyenne du mois le plus froid (janvier ou février) est supérieure
à 30C (Lapeyronie, 1982).

Figure 1: Hedysarum coronarium L.
(sulla) au stade floraison
Revue bibliographique
La dispersion naturelle des espèces signalées
par Ballatore (1963) sur les cartes phytoécologiques de la Tunisie
septentrionale est sensiblement réduite ces dernières
années en raison de la sécheresse des années 2001 et 2002
et du surpâturage (Ben Jeddi, 2004).
Le sulla est cultivé au nord de la Tunisie depuis plus
de 4 décennies où il a été introduit de l'Italie
dans les régions de Béja, Mateur et Ain Draham (Trifi et al.,
1989). Actuellement les superficies destinées à la culture
de sulla avoisinent les 4000 ha, ce qui représente 5,64% des superficies
cultivées en fourrages et 28,5 % des légumineuses
fourragères. Cette superficie est en continuelle croissance et son
extension est prévue jusqu'à 21 000 ha en 2016 (DGPA 2009).
1. 4. 2. Potentiel fourrager
Le sulla se caractérise par son haut potentiel de
production de fourrage dans le bassin méditerranéen (Talamucci
et al., 1998). Le Houerou (1965), obtenait en deuxième
année jusqu'à 90 t/ha de matière verte de sulla
coupé au stade floraison soit l'équivalent de 13 t/ha de
matière sèche.
La recherche a permis depuis de sélectionner des
génotypes à haut potentiel de production qui dépassent les
17 t/ha en Tunisie (Ben Jeddi et al., 1998) et 20 t/ha en Australie
(Lloyd et al., 2003). Ces nouveaux génotypes se
caractérisent par une excellente teneur en protéines
estimée à 19% de la matière sèche (Ben Jeddi,
2005).
1. 4. 3. Intérêts environnementaux
En plus de son haut potentiel de production fourragère,
le sulla offre la possibilité d'améliorer la teneur en
matière organique et de maintenir une richesse en azote du sol (Douglas
et al., 1985; Pinto et al.,1993; Stringi et al.,
1998 ; Ben Jeddi ; 2005). Cette matière organique estimée
entre 6 et 9 t/ha/an (Ben Jeddi, 1996), a un effet direct sur la stabilisation
des agrégats du sol (Watt et al., 1993) et indirect sur la
stimulation des activités microbiennes de la rhizosphère (Angers,
1989).
Grâce à son système racinaire puissant et
pivotant, le sulla offre l'avantage de protéger le sol contre
l'érosion (Watson, 1982) d'où l'intérêt de son
installation dans les terrains marneux et accidentés très
vulnérables à l'érosion (Zouaghi, 2001; Slim, 2004, Slim
et al., 2011). En effet, l'installation du sulla en association avec
l'atriplex (Atriplex halimus L.) pendant 4 ans dans un site calcaire
marginal a permis d'améliorer la porosité du sol et de
réduire les pertes de sol d'environ 7% comparativement à un sol
qui a porté une culture de blé en continu (Chisci et al.,
2001).
Revue bibliographique
Cette plante est aussi très appréciée par
les abeilles (Apis mellifera L.). L'installation de ruches d'abeilles
(environ 15/ ha) permet, non seulement la production de miel (environ 28 kg/ha
de miel), mais en plus l'accroissement de la production grainière
grâce à la pollinisation entomophile (Rondia et al.,
1985).
1. 4. 4. Exportation des éléments majeurs et
fertilisation
La fertilisation du sulla en minéraux majeurs (N, P, K)
est réalisée selon les exportations de la culture (Tableau 1) en
ces éléments et leur disponibilité dans le sol.
Les besoins en azote de la culture de sulla sont importants
comparativement au blé dur Triticum durum Desf., ainsi
qu'à d'autres fabacées (Baccouche, 1998). Les origines de l'azote
peuvent être principalement la minéralisation de la matière
organique restituée au sol, la fixation symbiotique de l'azote
atmosphérique (N2) et la fertilisation chimique (Sanaa, 1993).
Tableau 1: Exportation des
éléments majeurs N-P-K en kg par tonne de matière produite
(matière sèche fourragère, semences, pailles et fanes) par
les différentes cultures (Baccouche, 1998).
|
Espèce
|
Azote
|
Phosphore
|
Potassium
|
|
Hedysarum coronarium L.
|
25,0
|
18,7
|
25,0
|
|
Vicia faba L. var. minuta
|
|
|
|
|
(Hort. ex Alef.) Mansf.
|
22,9
|
6,6
|
31,8
|
|
Brassica napus L.
|
20,8
|
13,5
|
17,0
|
|
Triticum durum Desf.
|
12,5
|
8,0
|
12,0
|
Habituellement, le sulla cultivé ne reçoit pas
d'apport d'azote minéral car cet élément est fourni par
voie symbiotique. Selon Sulas (2009), 78,2 à 82,7 % des besoins en azote
de cette plante proviennent de la fixation atmosphérique. Cette
proportion peut dépasser 90% (Tibaoui, 1986; Ben Jeddi et al.,
1989) dans le cas de présence de rhizobium spécifique
efficient (Casella et al., 1984).
Concernant le phosphore, le sulla exporte en deux ans entre
200 et 250 kg de P205. Rondia et al. (1985) préconisent 150
kg/ha de super 45 la première année et 125 kg/ha la
deuxième année apporté à la fin de la saison
estivale (août - septembre). Quant au potassium, les exportations du
sulla en cet élément sont comparables à celles de l'azote
(Baccouche, 1998). Cette demande importante de potassium explique son bon
comportement sur des sols marneux riches en cet élément
(Semadeni, 1976). En absence d'analyse de sol, Rondia et al. (1985) a
préconisé la dose de 100 kg/ha de sulfate de potasse
apporté avant le semis.
Revue bibliographique
2. La diversité des rhizobiums
2. 1. La rhizosphère
La rhizosphère est un environnement particulier
où les flux de matières et d'énergie entre le sol et la
plante sont particulièrement intenses (Lynch, 1990). La richesse de la
rhizosphère en sucres, aminoacides, acides organiques, isoflavonoides,
régulateurs de croissance et en enzymes libérées par la
plante (Pierson et al., 2000), rend ce microenvironnement un site
d'une remarquable activité biologique et d'une richesse naturelle en
vers de terre, nématodes, protozoaires, champignons, algues et
bactéries.
Ces êtres vivants, les microorganismes en particulier,
sont requis dans le processus de décomposition et de recyclage des
nutriments de la rhizosphère de la plante (Germida et al.,
1998).
Les microorganismes rhizosphériques incluent les
symbiotes (rhizobiums, actinobactéries et champignons mycorhiziens) et
les saprophytes libres qui augmentent la disponibilité des nutriments et
la synthèse de substances de croissance des plantes et/ou suppriment les
pathogènes.
2. 2. Les rhizobiums
Les rhizobiums sont des bactéries du sol, appartenant
à la famille des Rhizobiaceae, Gram négatif, strictement
aérobies, possédant une forme de bâtonnets de 0,6 à
0,9 jnm de largeur et de 1,2 à 3 jnm
de longueur et non sporulant (Jordan, 1984). Ce sont des bactéries
mobiles grâce à un flagelle polaire ou subpolaire ou 2 à 6
flagelles péritriches (Werner, 1992). Leur croissance est optimale
à une température de 28 °C et un pH entre 6 et 7 (Burton,
1985).
La taxonomie moderne (Tableau 2) des rhizobiums inclus les
genres Rhizobium, Ensifer (Sinorhizobium), Mesorhizobium, Allorhizobium,
Azorhizobium, Bradyrhizobium, Methylobacterium et Burkholderia (Jordan
1982; Dreyfus et al., 1988; De Lajudie et al., 1994; 1998a;
1998b; Jarvis et al., 1997 Sy et al., 2001; Martens et
al., 2007, 2008; Van Berkum et al., 2006; Vinuesa et al.,
2008; Rivas et al., 2009 Ribeiro et al., 2009) qui
appartiennent à la sous classe des á
protéobactéries. Grâce aux progrès technologiques
utilisés en taxonomie qui se basent sur des critères
morphologiques, physiologiques ainsi que sur l'analyse des séquences,
d'autres genres appartenant aux â et
ã protéobactéries ont été
découverts (Chen et al., 2001; Moulin et al., 2001,
Benhizia et al., 2004; Franche et al., 2009; Masson-Boivin
et al., 2009).
Revue bibliographique
Tableau 2: Taxonomie des rhizobiums selon
Velazquez et al. (2010).
Espèces Plante hôte
Référence
Famille Rhizobiaceae, genre Rhizobium :
R. cellulosilyticum
R. etli
R. fabae
R. gallicum R. giardinii R. hainanense R. huautlense R.
leguminosarum
R. loessense R. lusitanum R. miluonense R. mongolense R.
phaseoli
R. pisi Pisum R. sullae
R. tibeticum R. tropici
R. yanglingense
Famille Rhizobiaceae, genre Ensifer (Sinorhizobium)
:
E. arboris E. fredii
E. kostiense E. meliloti E. medicae E. saheli
E. terangae
E. xinjiangensis
Famille Phyllobacteriaceae, genre Mesorhizobium
:
M. albiziae
M. amorphae
M. australicum M. caraganae
M. chacoense
M. ciceri
M. gobiense
M. huakuii
M. loti Lotus
M. mediterraneum M. metallidurans M. opportunistum M.
plurifarium
M. septentrionale M. shangrilense M. tarimense
M. temperatum M. tianshanense
Famille Hyphomicrobiaceae, genre Azorhizobium
:
A. dobereinereae A. caulinodans
Medicago Phaseolus Vicia
Phaseolus Phaseolus Desmodium Sesbania Pisum Astragalus
Phaseolus Lespedeza Medicago Phaseolus Pisum Hedysarum Medicago Phaseolus
Amphicarpaea
Acacia Glycine Acacia Medicago Medicago Acacia Acacia
Glycine
Albizia
Amorpha Biserrula Caragana Prosopis
Cicer
Chinese legumes Astralagus
Lotus
Cicer
Anthyllis Biserrula
Acacia Astragalus Caragana Chinese legumes Astragalus
Sophora
Sesbania
Sesbania
Garcýa-Fraile et al., 2007 Segovia et al.,
1993
Tian et al., 2008
Amarger et al., 1997 Amarger et al., 1997
Chen et al., 1997
Wang et al., 1998
Ramýrez-Bahena et al., 2008
Wei et al., 2003
Valverde et al., 2006 Gu et al., 2008
van Berkum et al., 1998 Ramýrez-Bahena et
al. , 2008 Ramýrez-Bahena et al., 2008
Squartini et al., 2002 Hou et al., 2009
Martý'nez-Romero et al.,1991
de Lajudie et al. 1992; Young et al., 2001 Tan et
al., 2001b
Nick et al., 1999; Young, 2003
Chen et al., 1988; Scholla & Elkan ,1984; Jarvis
et al., 1992; Young, 2003
Wei et al., 2002; Young, 2003
de Lajudie et al., 1994; Young, 2003 Rome et
al., 1996; Young, 2003
de Lajudie et al., 1994; Young, 2003 Chen et
al., 1988; Young, 2003
Wang et al., 2007
Wang et al., 1999
Nandasena et al., 2009
Guan et al., 2008
Velazquez et al., 2001
Nour et al., 1994; Jarvis et al., 1997 Han
et al., 2008
Chen et al., 1991; Jarvis et al., 1997 Jarvis
et al., 1997
Nour et al., 1995; Jarvis et al., 1997 Vidal
et al., 2009
Nandasena et al., 2009
de Lajudie et al., 1998
Gao et al., 2004
Lu et al., 2009
Han et al., 2008
Gao et al., 2004
Chen et al., 1995; Jarvis et al., 1997
Souza Moreira et al., 2006 Dreyfus et al.,
1988
Revue bibliographique
2. 3. Les microsymbiotes du sulla
Le premier isolement de bactéries à partir des
nodules de sulla remonte au 19ème siècle (Mottareale,
1898). Ces rhizobiums ont été étudiés et
décrits dans plusieurs travaux de recherche et il a été
recommandé de les nommer provisoirement Rhizobium hedysari
(Casella et al., 1984; Selenska-Pobell et al., 1996; Toffanin
et al., 1996). Par ailleurs des études plus approfondies sur
l'identification des souches isolées à partir de nodules de
Hedysarum coronarium ont montré qu'elles sont relatives
à Rhizobium etli, Rhizobium leguminosarum et Sinorhizobium
meliloti (Tighe et al., 1994). Avec le développement des
techniques moléculaires, il y a eu une meilleure caractérisation
des bactéries nodulant les légumineuses, en particulier la ARDRA
(Amplified Ribosomal DNA Restriction Analysis) de l'ADNr 16S et la
comparaison des séquences de ADNr 16S; les bactéries nodulant le
sulla ont par conséquent été baptisés R.
sullae (Squartini et al., 2002).
D'autres études plus récentes ont mis en
évidence que des bactéries du groupe Gamma
protéobactéries peuvent également noduler les
légumineuses en les isolant à partir des nodosités de
Hedysarum (Benhizia et al., 2004).
Dernièrement, de nouvelles espèces de
bactéries auxquelles on a attribué le nom Rhizobium alamii
sp. Nov. ont été isolées à partir des racines
de tournesol (Helianthus annuus L.) et des nodules de Medicago
ruthenica L.. Ces espèces qui appartiennent à la
lignée des alpha-protéobactéries sont
génétiquement les plus proches de l'espèce R.
sullae (Berge et al., 2009).
2. 4. Caractérisation des rhizobiums
Plusieurs études ont été
réalisées par les microbiologistes pour évaluer la
diversité des rhizobiums. Ces études ont permis l'analyse de
différents traits phénotypiques et génétiques qui
sont devenus par la suite une base de définition du concept de
l'espèce (Jarvis, 1983; Zhang et al., 1991; Moreira et
al., 1993; De Lajudie et al., 1994; Dupuy et al.,
1994).
2. 4. 1. Caractérisation phénotypique
La caractérisation phénotypique classique des
rhizobiums se base sur des critères morphologiques, symbiotiques,
biochimiques, et physiologiques (Graham et al., 1991). Les
critères morphologiques regroupent les caractéristiques de la
cellule bactérienne (forme, nombre et type de flagelles, coloration
Gram, présence d'endospores) et les caractéristiques de la
colonie (couleur, dimension, forme).
Revue bibliographique
Les critères symbiotiques indiquent la capacité
infective, effective et compétitive d'une souche donnée.
Les critères biochimiques évaluent la
présence et/ou l'activité de différentes enzymes telles
que glutamate déshydrogénase, glucose 6-phosphate
déshydrogénase, indole-phénol oxydase, nitrate
réductase, uréase, adénylate kinase ainsi que d'autres
enzymes impliqués dans les voies métaboliques d'assimilation des
substrats carbonés.
Les critères physiologiques regroupent le taux de
croissance de la bactérie sur le milieu YEM (Yeast Extract
Mannitol) (Vincent, 1970), la capacité d'utiliser différents
carbohydrates et différentes sources d'acides aminés, la
tolérance à différentes concentrations en sels et aux
variations du pH, la croissance à différentes
températures, la résistance aux antibiotiques, aux métaux
lourds, etc...
2. 4. 1. 1. La croissance
Parmi les critères phénotypiques les plus
importants dans la caractérisation des rhizobiums, figure la croissance
dans le milieu YEM (Vincent, 1970). La première classification des
bactéries symbiotiques fixatrices de l'azote en deux genres Rhizobium et
Bradyrhizobium s'était basée sur ce critère (Jordan, 1982,
1984). En fait, les souches à croissance rapide du genre Rhizobium
possèdent un temps de génération inférieur à
4 heures et forment des colonies circulaires convexes
généralement translucides avec un diamètre de 2 à 4
mm après 3 à 5 jours sous des conditions optimales d'incubation.
En revanche, les souches à croissance lente du genre Bradyrhizobium
possèdent un temps de génération de 6 à 8 heures et
forment des colonies circulaires convexes et rarement translucides avec un
diamètre de 1 à 2 mm après 5 à 7 jours
d'incubation.
2. 4. 1. 2. Les critères symbiotiques
Les propriétés symbiotiques ont longtemps
été la base unique de la caractérisation des rhizobiums et
de leur regroupement en « groupe d'inoculation » en fonction de la ou
des légumineuses nodulées.
L'infectivité d'un rhizobium s'exprime par sa
spécificité à travers sa capacité de noduler une ou
plusieurs légumineuses hôtes. Elle peut être facilement
évaluée par le dénombrement des nodosités
formées.
Revue bibliographique
L'efficience est la capacité de réduire
efficacement l'azote atmosphérique en ammonium. Différentes
techniques d'estimation de l'efficience sont disponibles. Trois sont les plus
utilisées, la méthode Kjeldahl qui permet de mesurer l'azote
total de la partie végétative de la plante, la méthode de
l'activité réductrice de l'acétylène (ARA) qui
permet d'évaluer l'activité de la nitrogénase par l'apport
de l'acétylène comme substrat et par la mesure de
l'éthylène dégagé comme produit de réduction
final, la troisième méthode consiste à déterminer
le poids sec de la partie végétative des plantes inoculées
par la souche à tester comparativement au témoin non
inoculé.
2. 4. 1. 3. Tolérance à la
salinité
Les rhizobiums sont généralement plus
tolérants aux stress comparativement à leurs plantes hôtes
(Zahran et al., 2003; Vriezen et al., 2006, 2007) d'où
l'intérêt de sélectionner des légumineuses pour des
régions présentant des problèmes de salinité.
La gamme de tolérance au sel des rhizobiums est
variable selon la souche et le type de sel (El Sheikh et al., 1989 a).
Certaines sont inhibées par une concentration de 100 mM de NaCl, alors
que les plus tolérantes peuvent survivre à des concentrations de
1700 mM de cet élément (Zahran et al., 1994). D'autres
comme S. meliloti sont tolérants entre 300 et 700 mM NaCl
(Mohammad et al., 1991; Muller et Pereira 1995), alors que
Rhizobium leguminosarum tolère des variations entre 150 mM NaCl
(Rai, 1983) et 350 mM NaCl (Breedveld et al., 1993). Le stress
osmotique hydrique ou salin peut modifier la synthèse de certaines
composantes cellulaires (protéines et lipopolysaccharides) des
rhizobiums (Zahran et al., 1994). Dans ce sens, Shamseldin et a.,.
(2006) ont noté, à 680 mM de NaCl, une expression
différentielle des protéines cellulaires chez Rhizobium
etli souche (EBRI 26).
2. 4. 1. 4. Tolérance au pH
Les rhizobiums sont en général neutrophiles mais
leur réponse face à une fluctuation du pH varient d'une souche
à une autre (Jordan, 1984; Glenn et Dilworth, 1994). Graham et Parker
(1964) ont montré qu'un pH bas critique pour la croissance de
Rhizobium japonicum et de Rhizobium lupini est compris entre
4 et 6.
Sinorhizobium meliloti a été
rapporté être sensible au pH acide (Brockwell et al.,
1991). Rhizobium tropici et Mesorhizobium loti sont
considérées comme des souches très tolérantes
à l'acidité (Graham et al., 1994).
Revue bibliographique
Certaines souches rhizobiales peuvent même supporter un
pH très bas de l'ordre de 3,5 (Yadav et Vyas, 1973). Les
mécanismes d'adaptation physiologiques et biochimiques des rhizobiums en
milieux acides sont nombreux (O'Hara et Glenn, 1994; Graham et al.,
1994). Ces mécanismes incluent entre autre l'exclusion et l'expulsion
des protons H+ (Chen et al., 1993a), la forte teneur en
potassium et en glutamate du cytoplasme des cellules stressées (Aaron et
Graham, 1991), le changement de la composition du LPS (Chen et al.,
1993b), et l'accumulation de polyamines (Fujihara et Yoneyama, 1993).
L'alcalinité est moins néfaste pour la survie
des rhizobiums. Jordan (1984) a montré que la majorité de ces
bactéries peuvent tolérer des pH allant jusqu'à 9.
2. 4. 2. Caractérisation moléculaire des
rhizobiums
Le génome des bactéries est constitué en
plus de l'ADN chromosomique, d'ADN plasmidique qui peut constituer
jusqu'à 50 % du génome entier. Les méthodes d'analyse
impliquent par conséquent des gènes d'origine chromosomique et
d'autres d'origine plasmidique comme les gènes symbiotiques dans le cas
des rhizobiums.
Parmi les techniques de classification des bactéries
qui visent l'ADN chromosomique, se trouvent le séquençage total
du génome et la détermination du pourcentage d'homologie
ADN/ADN.
La détermination du pourcentage d'homologie ADN/ADN par
hybridation de l'ADN de souches à identifier avec l'ADN de souches de
référence est reconnue comme la méthode standard pour
identifier les espèces (Wayne et al., 1987). Sur la base de ce
type d'analyse, le genre Mesorhizobium a été
crée. Certaines espèces initialement classées dans le
genre Rhizobium ont été renommées (Jarvis et al., 1997) et
de nouvelles espèces ont été décrites dans le genre
Rhizobium comme c'est le cas pour R. sullae (Squartini et
al., 2002).
Le développement des techniques moléculaires a
permis à travers les méthodes basées sur la
Polymérase Chain Reaction (PCR) de caractériser des
populations naturelles de rhizobiums et d'examiner les relations
phylogénétiques entre les différents isolats.
Parmi ces méthodes, on site, la RFLP (restricion
fragment length polymorphism) (Laguerre et al., 1996; Pobell
et al., 1996) ou encore l'utilisation d'amorces dérivées
de séquences palindromiques réputées très
conservées chez les bactéries: séquences REP
(repetitive extragenic palindromic) (De Bruijn, 1992).
Revue bibliographique
La séquence la plus largement utilisée chez les
rhizobiums est celle de l'ADNr 16S (Weisburg et al., 1991).
L'utilisation de la variation de la séquence de l'ADNr 16S pour un but
taxonomique suppose que l'évolution du génome progresse à
un taux constant et que les gènes soient hérités de
manière stricte d'une génération à une autre sans
aucun transfert latéral. L'étude des gènes codant pour
I'ADN ribosomique 16S a démontré la proximité
phylogénétique entre les genres Rhizobium et
Agrobacterium d'une part, et entre Bradyrhizobium,
Rhodospeudomonas et Nitrobacter d'autre part (Willems et
Collins, 1993 ; Yanagi et Yamasato, 1993; De Lajudie et al., 1994; Van
Berkum et al., 1996).
La caractérisation des rhizobiums en se basant sur les
critères génotypiques est maintenant couramment réalisable
dans plusieurs laboratoires. Le choix des techniques dépend du nombre et
du type de souches à étudier et du niveau de résolution
désiré car chaque méthode a un pouvoir de
résolution propre.
2. 5. Distribution des rhizobiums et choix des sites de
collecte
La répartition des rhizobiums détermine le
niveau de nodulation chez les fabacées. En effet, une même plante
cultivée sur deux ou plusieurs sites géographiques ne
piège pas les mêmes espèces de rhizobiums en raison de la
variabilité de l'abondance rhizobiale. Cette variabilité pourrait
être due à des facteurs biotiques et abiotiques
caractéristiques des sites géographiques. Ce fait a
déjà été démontré chez plusieurs
espèces cultivées dans différentes régions du
monde, tel que le Trifolium repens L. semé dans
différents sols de l'Angleterre (Harrison et al., 1989).
Le choix des sites de collecte est un critère
déterminant dans un travail de sélection puisqu'il conditionne
les propriétés symbiotiques ainsi que le niveau de
tolérance des rhizobiums aux facteurs environnementaux (salinité,
température, stress hydrique). Dans ce sens, Pinto et al.
(2004) ont noté un grand niveau de similarité entre les
souches collectées en relation avec l'environnement.
L'adaptation des populations rhizobiales indigènes aux
conditions environnementales locales offre de grands avantages pour la
production d'inoculum. Cette adaptation des rhizobiums indigènes
à divers milieux naturels est en même temps à l'origine
d'un haut niveau de compétence saprophytique (Zengeni et al.,
2006).
Zahran 2001 a rapporté que les rhizobiums isolés de
légumineuses spontanées pouvaient tolérer des niveaux de
stress plus importants que ceux issus de plantes cultivées.
Revue bibliographique
D'autre part la sélection de souches rhizobiales est un
moyen efficace pour l'évaluation de leurs efficience,
compétitivité (Fettell et al., 1997; Young et al.,
1998; Handley et al., 1999) et lien génétique
(Coutinho, et al., 1999 et Saleena et al., 2001). Les signaux
spécifiques (flavonoïdes) excrétés par les plantes
exercent une pression sélective impliquant ainsi la réduction de
la diversité microbienne et la sélection d'espèces ou de
souches particulières (Bertrand et al., 2000; Ann et
al., 2003).
Trabelsi et al. (2010) ont constaté une faible
biodiversité rhizobiale dans des terres agricoles comparativement
à des sols salins non cultivés. Abaidoo et al. (2007)
ont quant à eux signalé un accroissement de la diversité
rhizobiale corrélé à la fertilité des sols et
à la diversification des plantes cultivées (Zengeni et al.,
2006).
3. Symbiose Légumineuse/Rhizobium
La symbiose légumineuse/Rhizobium est un
processus indispensable à la plante pour acquérir l'azote sous
forme réduite, mais aussi aux rhizobiums pour obtenir les nutriments
nécessaires à leur développement. Le végétal
fournit des matières nutritives à la bactérie, celle-ci
capte l'azote de l'air et le donne à son hôte (Raven et
al., 2000).
Grâce à cette symbiose une importante
économie d'engrais azotés peut être réalisée.
A titre d'exemple, au Brésil l'inoculation du soja (Glycine max
L.) aux champs fournit jusqu'à 300 kg N/ha, ce qui
entraîne des économies d'engrais azotés estimés
à 3 milliards de dollars (Santos et al., 2006).
3. 1. La nodulation
La nodulation est considérée comme la
première caractéristique de l'association symbiotique qui est
strictement contrôlée par des mécanismes
d'autorégulation interne de la plante hôte (Figueiredo et al.,
2008 b; Lohar et al., 2009).
3. 1. 1. Historique de la nodulation
La présence de nodosités chez les
légumineuses est historiquement bien connue, mais leur origine
était controversée. Woronin (1866) fut le premier à
signaler l'observation des micro-organismes ressemblant aux bactéries
dans les nodosités de Lupinus mutabilis.
Revue bibliographique
Hellriegel et Wilfarth (1888) ont montré que la
formation de nodosités est le résultat d'une infection externe
chez les espèces de genres Lupinus, Phaseolus,
Ornithopus, Vicia, et Trifolium. Beyerinck (1888)
fourni la première preuve que les bactéries sont à
l'origine de la formation de nodosités, en préparant des cultures
pures d'organismes provenant de nodosités de Vicia faba L. et
en infectant avec ces mêmes cultures des plants de fève
cultivés sur un sol stérile (Beyerinck, 1888, 1890).
3. 1. 2. Les étapes de la nodulation
La formation des nodules est le résultat d'un dialogue
moléculaire entre le microsymbiote et la plante hôte (Foucher et
Kondorosi 2000; Limpens et Bisseling 2003) (Figure 2).
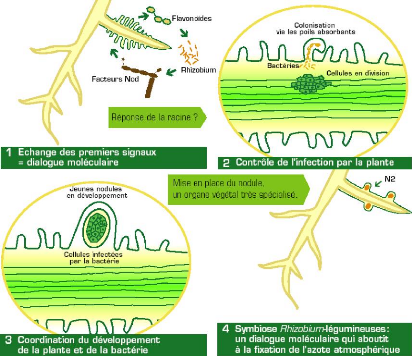
Figure 2: Dialogue moléculaire entre la
plante et la bactérie lors de la mise en place d'une association
symbiotique fixatrice de l'azote (Journet, 2004).
Revue bibliographique
3. 1. 2. 1. Echange de signal d'infection
Le processus de nodulation commence par un échange de
signaux entre la plante hôte et la bactérie. Les racines rejettent
par leur métabolisme normal, des substances qui ont des effets
attracteurs sur certains microorganismes du sol. Certaines d'entre elles
appartiennent au groupe des flavonoïdes tels que les flavones,
isoflavones, flavonone (Rasanen, 2002). Ce signal, une fois perçu par le
rhizobium, induit la production de facteurs Nod (Oldroyd, 2001). Ceux-ci sont
des signaux de nodulation ciblant le programme organogénétique de
la plante (Patriarca et al., 2004).
3. 1. 2. 2. Infection
Les bactéries s'attachent aux racines par
l'intermédiaire de la rhicadhésine ainsi que d'autres
protéines spécifiques localisées à la surface des
cellules (Dardanelli et al., 2003; Perry et al., 2004). Les
facteurs Nod émis par les rhizobiums, induisent une
dépolarisation de la membrane plasmique accompagnée d'une
oscillation du flux de Ca2+. Cette étape se poursuit par une
induction de l'expression de gènes spécifiques (Pelmont, 1995;
Gage, 2004) et une modification de la croissance polaire des poils absorbants
formant une structure dite en « crosse de berger» qui enferme les
rhizobiums (Esseling et al., 2003).
L'infection qui s'accompagne d'une digestion de la paroi
cellulaire du poil racinaire peut avoir lieu à travers les poils
absorbants, les blessures, ou l'espace intercellulaire (Rasanen, 2002).
3. 1. 2. 3. Développement du nodule et
maturation des bactéroïdes
Une fois que les parois des cellules de poils sont
digérées, une structure tubulaire appelée le fil
d'infection est formée. Elle se compose de cellules de la paroi
nouvellement synthétisée qui formeront le matériel
entourant le Rhizobium. Le centre du tube est une glycoprotéine
contenant quelques produits bactériens et quelques glycoprotéines
de la plante hôte (Gage, 2004).
Ces changements majeurs dans la forme des cellules et la
croissance dirigée sont causées par des altérations
significatives dans le cytosquelette de la plante. La
dépolymérisation de l'actine est l'un des effets observés
dans les poils absorbants suite à l'exposition au facteur Nod (Gage et
Margolin, 2000).
Les bactéries prolifèrent à
l'intérieur du cordon et vont se libérer dans le cytoplasme des
cellules corticales, via ce cordon, provoquant ainsi l'apparition du
méristème dont l'activité est à l'origine de la
formation du nodule, dans laquelle les bacilles se différencient
irréversiblement en bactéroïdes ou endosymbiose
(Lindström et al., 2002).
Revue bibliographique
Ces dernières, de forme irrégulière, ont
un volume supérieur à celui des formes libres. Ils ne se divisent
plus et ne synthétisent plus de protéines Nod, par contre les
bactéroïdes se concentrent dans la production des
nitrogénases indispensables à la fixation de l'azote
atmosphérique.
Les bactéroïdes sont séparés du
cytoplasme végétal par une membrane spéciale
«péri bactéroïdes» ou membrane de
séquestration servant de plaque d'échange entre les
bactéries et les cellules de la plante hôte. Dans cette membrane
les bactéries différenciées forment les
bactéroïdes de fixation de l'azote (Pelmont, 1995; Corbière,
2002).
Le nodule prend forme avec la multiplication des cellules du
cortex. Il se charge de pigments appelés leghémoglobine,
synthétisés à l'intérieur du cytoplasme des
cellules de la plante (Corbière, 2002). L'action de la
leghémoglobine est de maintenir l'oxygène à faible
concentration dans l'environnement de l'enzyme, compatible avec le
fonctionnement de la fixation de l'azote (Rasanen, 2002; Simms et Taylor,
2002).Les gènes de leghémoglobine sont activés chez le
soja, 7 à 8 jours après l'infection. La première
augmentation réelle de la transcription commence dans les 4 jours
apparents plus tard.
Le passage à l'état symbiotique s'accompagne
d'une forte répression des gènes du métabolisme basal et
d'une surexpression de ceux impliqués dans la fixation et l'assimilation
de l'azote (Becker et al., 2004). Quelques rares cellules
bactériennes quiescentes, de forme bacillaire, sont présentes
dans le nodule; ce sont les cellules qui survivront et se multiplieront dans le
sol après la mort de la plante. Elles pourront alors infecter les
racines des plantes introduites dans le même site (Perry et al.,
2004).
3. 1. 3. Morphologie des nodules
Dans la famille des légumineuses, la morphologie des
nodules et le type de nodosité développée est
déterminé par la plante hôte (Dart, 1975; Newcomb et
al., 1979; Newcomb et Tandom, 1981). Deux types majeurs de
nodosités (Figure 3) sont souvent distingués en se basant sur
l'existence ou non du méristème persistant:
(i) Nodosités à forme
indéterminée où l'activité
méristématique se maintient. De nouvelles cellules apicales sont
continuellement infectées. Cela résulte en une forme cylindrique
de la nodosité. Ces nodosités sont connues chez les
légumineuses des zones tempérées (sulla, pois, Vicia
sp., Medicago sativa L., etc...).
Revue bibliographique
(ii) Nodosités à croissance
déterminée où l'activité
méristématique cesse tôt. Les cellules infectées
engendrent d'autres cellules infectées et la nodosité en
grandissant par expansion acquiert une forme sphérique. Ce type de
nodosité existe seulement chez les légumineuses des zones
tropicales telles que le soja et le haricot (Hirsch et al., 2001).
Les deux types de nodosités partagent la même
organisation générale se basant sur l'existence d'un tissu
central entouré par plusieurs tissus périphériques. Le
tissu central contient à la fois les cellules infectées par les
rhizobiums et d'autres non. Les tissus périphériques sont
formés essentiellement par un cortex interne et un autre externe
séparés par l'endoderme nodulaire (Van de Wiel et al.,
1990).
Un troisième type intermédiaire a
été identifié chez les espèces du genre
Lupinus et Sesbania (Sesbania rostrata Brem.). Les
divisions cellulaires se font dans le cortex externe ou interne, conduisant
à la formation de nodosités déterminées ou
indéterminées (Hirsch et al., 2001).
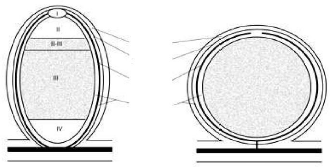
Cortex
Endoderme
Système
vasculaire
Parenchyme
A B
Figure 3: Structure des nodules de
légumineuses. A: nodule de type indéterminé. B: nodule de
type déterminé. I: zone méristématique; II: zone
d'infection; II-III: interzone II-III; IV: zone de sénescence.
(Pawlowski et Bisseling, 1996).
3. 1. 4. Génétique de la nodulation
Lors de l'étape de la reconnaissance entre les
rhizobiums et les plantes hôtes, les flavonoïdes induisent
l'activation des gènes nod et la synthèse des
lipo-chitooligosaccharides (LCOs) (Dénarié et al., 1996)
émis par la bactérie qui sont à leur tour à
l'origine de l'activation d'autres gènes végétaux ou
bactériens (Bladrgroen et Spainkc, 1998).
Revue bibliographique
Ces LCOs ont été nommés facteurs Nod et
sont responsables de changements physique et physiologique chez la plante
hôte, comme la déformation des racines, la division cellulaire et
l'organisation du primordium nodulaire. Les gènes nod sont
déterminants dans la spécificité de l'hôte
(Denarié 1992; Geurts et al., 2005; Mulder et al.,
2005; Chen et al., 2006). En effet, la longueur et la saturation
de la chaîne de l'acide gras ainsi que les différents substituants
greffés sur le squelette du LCO jouent un rôle crucial dans la
spécificité entre la bactérie et la plante (Perret et
al., 2000).
La plupart des gènes symbiotiques sont localisés
sur des méga plasmides. Les grands plasmides ne soient pas
transmissibles, mais ils sont en rapport avec d'autres plasmides très
transmissibles (Hirsch et al., 2001).
Les gènes de rhizobium essentiels pour l'infection et
la nodulation incluent les gènes nod (nod,
nol, noe), les gènes hsn (gènes de
nodulation spécifique de l'hôte) et d'autres gènes qui
codent pour l'expression et la synthèse des molécules de
structure de la surface bactérienne. Parmi ces gènes on note les
gènes ndv responsables de la synthèse des
â-glucans, les gènes exo responsables de
la synthèse des exopolysaccharides, et les gènes lps
responsables de la synthèse des lipopolysaccharides (LPS)
(Broughton et al., 2000; Spaink, 2000, 1999).
Les gènes de nodulation ne sont exprimés que par
l'action d'un activateur de transcription, le nod D. Ce dernier est
exprimé de manière constitutive (Geurts et Bisseling, 2002), il
est activé par des molécules produites par les plantes telles que
les flavonoïdes (Spaink, 1987; Zuanazzi et al., 1998).
Les gènes nod ABCIJ sont des gènes
communs très conservés chez les différentes espèces
de Rhizobium. En ce qui concerne les composants de la surface
cellulaire codés par les gènes ndv, exo et lps
se trouvent les â-glucans, exopolysaccharides et
lipopolysaccharides qui sont considérés comme d'importants
facteurs dans l'efficacité symbiotique (Breedveld et Miller, 1998). Les
â-glucans sont majoritairement des molécules du
périplasme qui permettent la croissance des bactéries sous des
conditions hypo-osmotiques (Pfeffer et al., 1994). Ils ont
également un rôle spécifique dans l'interaction symbiotique
(Breedveld et Miller, 1998). D'après Bhagwat et al. (1996), ces
molécules jouent un rôle important dans la suppression du
déclenchement du mécanisme de défense par les
phytoalexines chez l'hôte.
Revue bibliographique
3. 2. Spécificité symbiotique
L'association symbiotique est généralement
très spécifique; chaque souche n'infecte qu'une espèce de
plante ou une gamme très limitée d'hôtes (Pelmont, 1995).
D'autres espèces ont un spectre plus large comme la souche
Sinorhizobium sp. NGR 234 qui peut noduler 353 espèces de
légumineuses appartenant à 112 genres différents et elle
peut même noduler une plante non légumineuse: Parasponia
andersonii Planch. (Pueppke et Broughton, 1999).
Cette spécificité serait contrôlée
par les lectines de l'hôte qui reconnaissent certains glucides des
capsules bactériennes (Larpent, 1985; Marie et al., 2001;
Deakin and Broughton 2009). Les lipopolysaccahrides sont un des composés
minoritaires de la membrane bactérienne externe qui jouent aussi un
rôle important dans la spécificité
rhizobiumslégumineuses (Jones et al., 2007).
Les lipopolysaccharides sont formés par trois
constituants: (i) le lipide A, partie hydrophobe du LPS localisée dans
la partie externe de la double couche membranaire; (ii) le core, un
oligosaccharide dont la structure de base est similaire chez plusieurs
rhizobiums; et (iii) l'antigène O, partie hydrophile qui constitue le
composant le plus variable du LPS (Niehaus et al., 1998; Forsberg et
Carlson, 1998). La présence ou l'absence de ce dernier composant
engendre respectivement l'apparence de colonies bactériennes lisses
S-LPS (smoot LPS) ou rugueuses R-LPS (rough LPS) (Lerouge
et al., 2001).
Les associations entre la légumineuse et le
Rhizobium sont généralement sélectives. Par
exemple, Sinorhizobium meliloti peut s'associer efficacement avec les
genres Medicago, Melilotus et Trigonella, alors que Bradyrhizobium
japonicum est spécifique à Glycine max L..
Cette spécificité symbiotique est en relation
avec la composition des exsudats racinaires qui est intimement liée
à l'espèce, rendant la rhizosphère plus spécifique
et favorable à ses partenaires symbiotiques (Sharma et al.,
2004).
Cabrera et al. (1979) ont remarqué, à
partir d'essais effectués sur plusieurs légumineuses, un grand
niveau de spécificité d'hôte des rhizobiums isolés
à partir de plantes de sulla. En effet, plusieurs travaux ont
montré l'absence de la nodulation intervertie de Hedysarum
coronarium L. et de Hedysarum flexuosum L., par des
bactéries isolées de nodules de ces plantes (Glatzle et al.,
1986; Kishinevsky et al., 1996; 2003). Dans le même sens,
une nodulation croisée avec d'autres légumineuses tels que
Trifolium repens L., Pisum sativum L., Vicia faba
L., Glycine max L., ainsi que Cicer arietinum L. n'a pas
été observée (Cabrera et al., 1979).
Revue bibliographique
3. 3. Efficience symbiotique
L'efficience d'une souche est sa capacité à
produire un nodule actif, donc fixateur d'azote.
Les souches infectives mais non effectives forment de petits
nodules de couleur pâle, sans leghémoglobine. Cette
leghémoglobine est le produit exclusif de la symbiose entre la
bactérie et la plante et elle n'apparaît qu'au stade actif
fixateur de la symbiose Rhizobium/légumineuse (Gobat et
al., 1998).
Les échecs des cultures de légumineuses dans
certaines régions sont souvent le résultat d'une insuffisance ou
d'un manque d'efficience des souches de rhizobium. En effet, les souches
natives sont généralement plus efficientes que les
exogènes (Mezni et al., 2002).
Hagedon (1978) a trouvé que sur 400 souches de
Rhizobium isolées des sols de l'Oregon (USA), seulement 15%
avaient une efficience supérieure à 50 %. Amager (1974) a
trouvé que le tiers des souches de Rhizobium léguminosarum
isolées des sols français ont une efficience symbiotique
faible à nulle sur Vicia faba L..
Les souches d'un même groupe de rhizobium peuvent
toutefois se présenter avec une efficience variable pour
différentes espèces de légumineuses appartenant au
même genre (Cartoux et Lagacherie, 1977). En effet, une symbiose
effective dépend en grande partie de l'interaction entre les
génotypes de la plante et la souche de Rhizobium (Brockell et
whalley, 1962). Kishinevsky et al. (2003) ont noté une
nodulation inefficiente par des souches isolées depuis H. coronarium
L. sur les racines de H. spinosissimum L..
L'inoculation est très efficace chez le sulla si
l'espèce n'a pas été cultivée depuis longtemps sur
la même parcelle (Robson 1991). Dans ce sens, Il a été
rapporté qu'une faible fixation biologique de l'azote a
été observée quand le sulla est installé dans des
sites non conventionnels à l'espèce (Ewing et al.,
2001). Selon Casella et al.(1984), l'introduction du sulla dans des
pays tels que l'Australie, en dehors de la distribution naturelle du genre
Hedysarum, doit être obligatoirement accompagnée d'une
inoculation par des souches spécifiques pour favoriser la nodulation.
3. 4. Facteurs influençant la fixation
symbiotique
Plusieurs facteurs tels que la composition physico-chimique du
sol peuvent interférer avec les processus d'infection ou de nodulation,
ou encore influencer l'activité fixatrice de l'azote après
symbiose (Taq et al., 2004; Collavino et al., 2005; Kinkema
et al., 2006).
Revue bibliographique
3. 4. 1. Facteurs abiotiques
3. 4. 1. 1. Le pH du sol
Les pH extrêmes affectent les deux partenaires
symbiotiques. La majorité des légumineuses nécessitent des
pH neutres ou légèrement acides pour établir une symbiose
efficiente dans le sol (Bordeleau et Prévost, 1994). L'acidité
élevée du sol, influence la solubilité des
éléments minéraux et provoque des troubles dans la
nutrition minérale ce qui affecte d'une part le développement de
la plante hôte, et d'autre part l'efficience des rhizobiums et engendre
par conséquent une diminution de la nodulation (Munns, 1977). Alors que
le pH alcalin du sol a un effet négatif sur la disponibilité de
certains minéraux tels que le fer et le manganèse autant pour le
rhizobium que pour la plante hôte (Bordeleau et Prévost, 1994).
3. 4. 1. 2. Le stress salin
En symbiose, le rhizobium est plus résistant à
la salinité que son partenaire végétal (Zahran, 2001). La
tolérance de la plante hôte constitue donc un facteur
déterminant (Soussi et al., 1998).
La salinité affecte l'initiation, le
développement et le fonctionnement des nodules, de même que la
capacité photosynthétique des feuilles. Il s'avère que la
FSN (Fixation Symbiotique de l'Azote) est plus affectée par le sel que
la croissance des plantes (Rao et al., 2002).
Généralement l'activité des nodules est plus
touchée par le sel que la nodulation, mais l'étape la plus
sensible à la présence du sel est le processus infectieux
(Payakapong et al., 2006).
La symbiose rhizobium/sulla en condition saline est
étroitement liée à la souche rhizobiale. Dans ce sens,
Ghidhaoui et al. (2008) a noté qu'à 75 mM de NaCl, le
sulla inoculé par la souche SLA améliore le nombre de nodules et
la matière sèche aérienne respectivement de 5,82 et 11,93
% comparativement à celui inoculé par SMA.
3. 4. 1. 3. Le stress hydrique
Le stress hydrique affecte la fixation symbiotique de l'azote
à différents niveaux:
(i) La formation et la croissance nodulaire; (ii) le
métabolisme du carbone et de l'azote; (iii) l'activité de la
nitrogénase; (iv) la perméabilité nodulaire à
l'oxygène (Zahran et Sprent 1986; Aguirreolea et Sanchez-Dýaz
1989; Sadowsky 2005).
Revue bibliographique
La sécheresse inhibe la nodulation et la fixation
azotée même chez les plantes inoculées (Zablotowicz et
al., 1981). En effet, il existe des taux d'humidité extrêmes
tolérés au delà desquels le développement et la
survie du rhizobium sont affectés (Vincent, 1982).
Parmi les signes d'adaptation au stress hydrique, certains
auteurs tels que Saadallah et al. (2001) ont
sélectionnés des lignées de haricot qui arrivent à
maintenir une surface foliaire importante ainsi qu'un système racinaire
abondant et efficace en condition de déficit hydrique. Guckert et
Laperrière (1985) ont montré qu'il existe une relation
linéaire entre le potentiel hydrique de base et l'activité de
fixation de l'acétylène chez le Trifolium repens L., en
soulignant la corrélation étroite existant entre l'alimentation
en eau et la fixation de N2.
L'irrigation stimule la fixation symbiotique, surtout chez les
plantes non fertilisées. D'un autre côté, la fixation de
l'azote paraît très sensible à toute limitation de
l'alimentation hydrique (Deschamps, 1985).
Selon Ben Taamallah (1998), une irrigation de
complément, apporte des améliorations de production
fourragère de 125 à 170 % selon l'origine des souches. Alors
qu'en condition de pluviométrie limitante, l'inoculation par ces
mêmes souches apporte des améliorations de production
fourragère comparables entre 87 et 91 %.
3. 4. 2. Effet des techniques culturales sur la fixation
symbiotique
Dans le cas des grandes cultures, l'usage des produits
phytosanitaires de synthèse et les labours profonds et
répétés, mais aussi la fertilisation, apparaissent comme
des facteurs majeurs du déclin de la richesse spécifique et de
l'abondance de nombreux organismes. (Aubertot et al., 2005; Tscharntke
et al., 2007)
3. 4. 2. 1. Effet de la fertilisation chimique
La fertilisation chimique raisonnée des cultures se
traduit par des effets généralement positifs sur l'abondance et
la croissance des organismes vivants dans le sol et la
végétation. D'un autre côté, celle-ci tend à
diminuer la richesse spécifique de nombreux groupes (plantes,
bactéries du sol, microarthropodes...) (Klimek et al.,
2007).
Revue bibliographique
a. L'azote
L'apport de l'azote minéral par fertilisation
chimique, inhibe sa fixation à partir de l'atmosphère (El Mili,
1983; Vance et al., 1987) à travers la limitation de la
symbiose Rhizobium/légumineuse (Dazzo et al., 1884; Kijne,
1992) et la réduction de la quantité de l'azote inorganique
fixé au niveau des nodules (Beringer et al., 1988). Dans ces
conditions, un blocage de l'action de la nitrogénase a été
observé (Denarié et Truchet, 1979).
D'un autre coté, il a été rapporté
qu'une faible dose d'azote dans le sol peut stimuler la croissance de la plante
jusqu'au démarrage de la fixation symbiotique (Muller et al.,
1993) à condition que les quantités apportées soient
celles exerçant un « effet starter »; autrement, un effet
dépressif sur la nodulation et la fixation de N2 est constaté
(Kucey, 1989). Cet effet est particulièrement constaté avec les
ions NO3 - (Herdina, et al., 1989). Il a été
vérifié dans plusieurs travaux que la présence d'ions NO3
- inhibe l'infection racinaire (Abdel-Wahab et al., 1996), le
développement nodulaire (Atkins, et al., 1984; Imsande, 1986)
et l'activité nitrogénase (Arreseigor, et al., 1997;
Purcell et al., 1990; Sanginga et al ., 1996) . Dans le
même contexte, il a été démontré que
l'addition de NO3- (5-16 mM) aux milieux de croissance de plantules
de luzerne diminue considérablement l'adhésion des rhizobiums aux
racines séminales.
Avec l'apport de l'azote minéral, les rendements en
matières azotée et sèche ont été
réduits en particulier en fin de cycle végétatif du sulla
(Tibaoui et Zouaghi, 1989) suite à une baisse du taux de nodulation.
b. Le phosphore
Le phosphore améliore la fixation symbiotique de
l'azote à travers l'augmentation de la nodulation (Tibaoui et Zouaghi,
1989). Une carence en cet élément induit non seulement une
réduction de la croissance mais aussi un ensemble de modifications
physiologiques et métaboliques caractérisées par une
prolifération du système racinaire et une stimulation de
l'activité des phosphatases acides (Li et al., 2002). Selon
Christiansen et Graham (2002), la carence en phosphore affecte la croissance de
la plante mais aussi l'activité nodulaire impliquant par
conséquent la réduction de la fixation symbiotique de l'azote.
D'après Aftab et al. (2010), l'apport de cet
élément à la culture de soja améliore de 46 %
l'efficacité symbiotique de Bradyrhizobium japonicum TAL 377.
Dans le même sens, Cadisch et al.(1993) ont enregistré,
suite à une augmentation de la fertilisation phosphatée de 5
à 75 kg/ha, une amélioration de 15 % de l'azote fixé par
la voie symbiotique dans des cultures de Centrosema acutifolium Benth.
et C. macrocarpum Benth.
Revue bibliographique
Selon Zaidi et al.(2009) la libération
d'acides organiques dans la rhizosphère par les microorganismes du sol
est à l'origine de la solubilisation du phosphore minéral. Cet
effet est d'autant plus efficace dans les sols basiques (Solano et
al.,2008; Khan et al., 2010).
c. Le potassium
La fertilisation potassique est aussi favorable à la
fixation symbiotique. Bailey (1983) a signalé l'effet positif de la
fertilisation potassique sur la fixation biologique de l'azote pour une culture
de luzerne. Dans une autre étude, Cadisch et al. (1993), ont
noté une amélioration de 85 % de l'azote fixée par
Centrosema acutifolium Benth. et C. macrocarpum Benth. en
additionnant 60 Kg/ha de potassium à cette culture.
d. Le soufre
La fixation symbiotique est aussi affectée par la
carence d'autres éléments tels que le fer ou encore le soufre. La
fertilisation sulfurée stimule la fixation azotée chez la Luzerne
et le pois (Zhao et al., 1999; Varin et al., 2009), alors
qu'une carence en cet élément réduit la teneur en
leghémoglobine dans les nodules du petit pois et de la luzerne (Scherer
et al., 2008).
3. 4. 2. 2. Effet du travail du sol
La survie ainsi que le pouvoir infectif des rhizobiums sont
largement affectés par les pratiques culturales puisqu'elles agissent
indirectement sur les propriétés chimiques du sol (Slattery
et al., 2001).
Ainsi, la mécanisation cause des perturbations qui sont
la cause directe de l'oxydation rapide ainsi que de la décomposition de
la matière organique du sol, engendrant une diminution du stock de
carbone nécessaire à leur survie. Ces conditions occasionnent une
vulnérabilité de ces microorganismes aux conditions externes
(Coventry et al.,1985) et une diminution de leur diversité
(Sturz et al., 1997).
3. 4. 2. 3. Effet des traitements phytosanitaires
L'usage d'herbicides affecte la fixation biologique de l'azote
à travers les interactions produites entre les plantes et la
communauté bactérienne, particulièrement les rhizobiums
mais aussi les champignons (Fox, 2004). Il a été rapporté
que l'application d'herbicides de type bentazone et MCPA (acide 4-chloro-2
methylphennoxyacetique) à Trifolium pratense L. a
engendré une altération de la morphologie des racines ainsi
qu'une réduction du nombre de nodules et de l'activité de la
nitrogénase des plants (Lindström, 1985).
Revue bibliographique
L'application de l'herbicide dinoseb
(2-sec-butyl-4,6dintrophenol) à la même espèce a de
même réduit significativement l'activité de la
nitrogénase des plants (Lindström, 1985). Le traitement des souches
rhizobiales isolées à partir des nodules issus de plants
traités par dinoseb ont révélé une
résistance à cet herbicide. Ces mêmes souches ont par
ailleurs été incapables d'induire une symbiose efficiente avec
leur plante hôte en condition de traitement avec le dinoseb à
200ug/ml. L'auteur a ainsi suggéré que l'application foliaire du
dinoseb n'affecte pas directement les nodules mais indirectement la fixation
symbiotique suite à l'altération du système
photosynthétique de la plante. Un effet dépressif de
l'application d'herbicides a été observé sur la croissance
in vitro de Bradyrhizobium japonicum et sur la nodulation de
la culture de haricot menée en condition contrôlée (Mallik
et al., 1985 ; Mallik et al.,1993). L'application de 5
herbicides différents (sethoxydim, alachlor, fluazifop butyl et
metalachlor) aux doses recommandées, sur une culture d'haricot, n'a
nullement affecté sa fixation symbiotique et sa production des graines
(Rennie et al.1984). Par contre, Isoi et al. (1990) ont
noté un effet négatif de l'herbicide (paraquat) sur
l'activité fixatrice de l'azote chez le haricot.
3. 5. Effet des bactéries amélioratrices
de la croissance des plantes
Parmi les microorganismes du sol, certains à effet PGPB
(plant growth promoting bacteria) ont la particularité
d'améliorer la croissance des plantes directement ou indirectement (Khan
et al., 2009).
La stimulation directe consiste à fournir des
éléments nutritifs pour la plante. Parmi ces
éléments, figurent : (i) l'azote à travers
l'activité des nitrate réductase; (ii) les phytohormones (tels
que l'acide indole acétique, la zéatine, l'acide
gibbérellique et acide abscissique); (iii) le fer
séquestré par les sidérophores bactériens; (iv) le
phosphore à travers la solubilisation d'acides organiques (Zaidi et
al., 2009).
L'action indirecte inclue : (i) la prévention des
phytopathogènes; (ii) l'allélopathie; (iii) la production
d'antibiotiques; (iv) la compétition avec les agents
délétères (Egamberdiyeva et Islam 2008).
L'inoculation avec des PGPB autre que les rhizobiums peut
améliorer la nodulation par infection avec les rhizobiums à
travers la modification de l'architecture des racines ou encore la suppression
de la biosynthèse de l'éthylène au niveau racinaire. Cet
élément qui est directement responsable de la suppression de la
formation nodulaire serait inhibé par la l'ACC
(1-aminocyclopropane-1-carboxylate) deaminase libérée par
certaines rhizobactéries.
Revue bibliographique
Dans ce sens, Shaharoona et al. (2006) ont
rapporté que la coinoculation du haricot mungo (Vigna radiata
L.) avec une PGPB associée à
Bradyrhizobium améliorait la nodulation de cette fabacée
de 48 % comparativement à celle inoculée avec Bradyrhizobium
uniquement. Selon ces auteurs, cette amélioration est due à
la diminution de la synthèse de l'éthylène sous l'action
de l'ACC deaminase de la PGPB. Shahzad et al. (2008) ont aussi
montré l'effet de l'activité de l'ACC deaminase de 3 souches
rhizobactériennes sur l'amélioration de la nodulation d'une
culture de pois chiche. Ces auteurs ont enregistré une
amélioration de la nodulation de 87 % comparativement au témoin.
Dans le même sens, Belimov et al. (2009) ont rapporté une
amélioration de la croissance d'une culture de pois en condition de
stress hydrique grâce à l'activité de l`ACC deaminase de la
bactérie Variovorax paradoxus.
3. 6. Formes et qualité des inoculums
Les formes d'inoculums peuvent être poudreuse,
granuleuse, ou encore liquide (Date, 2000; Deaker et al., 2004). La
méthode la plus conventionnelle de l'inoculation est l'application
directe sur les semences.
D'autres techniques proposent l'inoculation sur des
granulés minéraux (Wadoux, 1991), ou encore sur le lit de semence
(Hynes et al., 1995). Durant cette dernière décennie, le
développement technologique a évolué dans le sens de
l'utilisation, comme support pour les rhizobiums, de sous produits à la
fois économiques et faciles à utiliser (Ben Rebah et
al., 2007; Brockwell and Bottomley, 1995; Denton et al., 2009),
(Tableau 3).
Techniques
Description
Tableau 3: Techniques d'inoculation des
légumineuses (Brockwell, 1977; Thompson, 1988).
Inoculation des graines: Saupoudrage
Boue
Granulage de chaux ou de phosphate
Imprégnation sous vide Inoculation du sol:
Inoculum liquide Inoculation granulaire
La tourbe est mélangée avec les graines sans
remouillage.
Les graines sont mélangées avec une solution
aqueuse de tourbe souvent avec l'addition d'un adhésif
Les graines sont traitées avec un inoculum de tourbe et
boue suivie d'un ajout de phosphate ou de carbonate de calcium.
La souche de Rhizobium est introduite dans ou sous le
tégument des graines sous vide.
L'inoculum liquide est ajouté à la plante en
stade jeune plantule
Des granules contenant l'inoculum sont semées
avec les graines
Revue bibliographique
Les inoculums sont produits et commercialisés dans
plusieurs pays. Leur qualité dépend du nombre, de l'efficience
ainsi que de la stabilité génétique des souches
rhizobiales contenues dans ces inoculums (Hiltbold et al., 1980;
Brockwell et Bottomley, 1995; Stephens et Rask, 2000; Amarger, 2001), mais
aussi de leur niveau de compétition avec les rhizobiums indigènes
ainsi que leur persistance dans le sol (Graham and Vance, 2003). Cette
qualité est très variable d'un pays à un autre. En effet,
il existe sur le marché des pays où les contrôles de
qualité ne sont pas pratiqués systématiquement, des
inoculums de mauvaise qualité (Catroux et al., 2001). Alors
qu'en général, les inoculums sous forme liquide ou sur support
poudreux, produits en Amérique du Nord, Europe, Australasie et certains
autres pays sont de bonne qualité.
Les inoculums de haute qualité peuvent fournir
approximativement 104 à 1011 rhizobium/g de sol.
Ce qui représente près de 1 % de la population indigène
présente dans l'horizon 0-20 cm du sol (Catroux and Amarger, 1992).
La conservation des inoculums est aussi un critère
important pour leur qualité. Boonkerd (1991) a montré que la
conservation des inoculums à des températures supérieures
à 10°C diminue considérablement leur
longévité.
MATERIEL ET METHODES
1. Sites de collecte des rhizobiums
Les prospections et collectes des couples symbiotiques
sulla/rhizobium ont été réalisées en période
de floraison des plantes durant les années 2005, 2006 et 2007; dans des
champs de production de semences de sulla variété Bikra 21 de
première année de culture. Ces derniers sont répartis dans
des stations bioclimatiques de la Tunisie septentrionale (Figure 4).
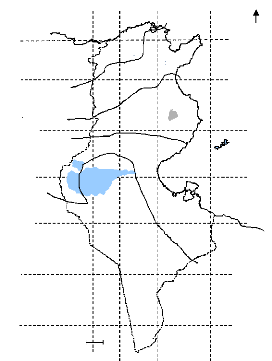
N
8E
9 10~ 11'E
7
2
3 12
10
.
5
37N
600 mm
400 mm 200 mm
A L G E R I E
13 14
6
4
1
8
9
11
36~
35'
34'
100 mm
33'
32~
31~
50 km
Figure 4: Distribution géographique des
sites de collecte des rhizobiums du sulla.
Pour chaque site, des informations
éco-géographiques utiles ainsi que des analyses chimiques ont
été effectuées:
- La position géographique (latitude, longitude et
altitude). Ces coordonnées ont été mesurées par un
GPS (global positionning satellite) de marque Garmin Etrex.
- Les cumuls pluviométriques du semis jusqu'à la
récolte des graines de sulla respectifs aux années de prospection
et collecte du matériel rhizobial.
Ces données ont été recueillies au
près de la direction des ressources en eaux à Montfleury
Tunis.
- La fertilité des sols a été
déterminée par des analyses pédologiques dans l'horizon
0-20 cm. Les dosages réalisés ont concerné le pH dans
l'eau H20 (Afnor 1981), la saturation en eau, la capacité
d'échange cationique (Metson, 1956), les teneurs en matière
organique selon la méthode de Walkley et Black (Afnor, 1983), calcaires
total et actif (Afnor, 1982), le potassium échangeable (Pauwels et
al., 1992) et phosphore assimilable selon la méthode Olsen (Afnor,
1984). L'ensemble des données collectées est résumé
dans le tableau 4.
Tableau 4: Caractéristiques
géographiques, climatiques et chimiques des sites de collecte des
rhizobiums.
|
Nom du site
|
Lat
N
|
Long
E
|
Alt
m
|
|
|
Analyses du sol
|
|
|
|
P
|
|
pH
H2O
|
SAT
%
|
CE
mS.cm-1
|
CT
|
CA
|
MO
|
C
|
P2O5
|
K20
|
mm
|
|
|
%
|
|
|
ppm
|
|
|
Medjez El Bab
|
36°4
|
9°33
|
130
|
8,2
|
48
|
0,7
|
64
|
29
|
0,9
|
0,5
|
70
|
440
|
310,8
|
|
Smadah
|
36°55
|
9°29
|
318
|
7,2
|
60
|
0,9
|
51
|
24
|
1,1
|
0,6
|
240
|
980
|
456,5
|
|
Ghzéla
|
37°05
|
9°33
|
27
|
8,2
|
52
|
1,5
|
56
|
23
|
0,7
|
0,4
|
25
|
300
|
751,3
|
|
Téboursouk
|
36°25
|
9°05
|
484
|
8,2
|
60
|
0,6
|
57
|
24
|
0,8
|
0,5
|
20
|
260
|
479,5
|
|
Tunis
|
36°49
|
10°1
|
10
|
8,5
|
48
|
0,9
|
40
|
20
|
0,5
|
0,3
|
30
|
570
|
459,0
|
|
Oued Zarga
|
36°41
|
9°25
|
140
|
7,5
|
50
|
0,3
|
59
|
21
|
4,7
|
2,7
|
194
|
470
|
559,2
|
|
Ain Chalou
|
36°76
|
9°29
|
324
|
8,2
|
58
|
1
|
45
|
19
|
1
|
0,6
|
43
|
460
|
243,0
|
|
El Fahs
|
36°22
|
9°5
|
179
|
8
|
55
|
1,4
|
35
|
16
|
0,7
|
0,4
|
15
|
290
|
384,7
|
|
Ben Arous
|
36°36
|
10°08
|
82
|
7,5
|
43
|
1,1
|
18
|
6
|
2,7
|
1,6
|
101
|
420
|
516,2
|
|
Mateur Jalta
|
36°54
|
9°26
|
270
|
7,9
|
45
|
0,9
|
33
|
20
|
2,3
|
1,4
|
66
|
450
|
1560,1
|
|
Menzel
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Bouzelfa
|
36°42
|
10°42
|
151
|
7,5
|
55
|
0,6
|
36
|
17
|
4,2
|
2,4
|
79
|
470
|
613,0
|
|
Methline
|
37°04
|
9°47
|
126
|
7,6
|
46
|
0,9
|
38
|
14
|
4,5
|
2,6
|
106
|
470
|
534,1
|
|
Badrouna
|
36°30
|
8°57
|
146
|
8,2
|
48
|
1,3
|
28
|
11
|
0,6
|
0,3
|
38
|
400
|
525,5
|
|
Goubellat
|
36°37
|
9°36
|
56
|
8,1
|
47
|
1,1
|
53
|
20
|
1
|
0,6
|
106
|
510
|
398,2
|
Lat : Latitude ; Long : Longitude ; Alt : Altitude ; SAT :
Saturation en eau ; CE: conductivité électrique en; CT : Calcaire
total; CA: Calcaire actif; MO: Matière organique; C: Carbone ; P2O5 :
Phosphore assimilable ; K2O : Potassium échangeable ; P : Cumul
pluviométrique
2. Conduite des cultures au niveau des champs de
production de semences
Une enquête au près des multiplicateurs a
été utile afin de déterminer les itinéraires
techniques et conduite culturale relatifs aux diverses parcelles. Toutes les
cultures de sulla avaient un même précédant cultural
(Céréales). Les préparations du sol ont été
de type conventionnelles et similaires à celles
préconisées pour les autres fabacées à petites
graines (un labour de 20 à 30, suivi d'un à deux
recroisements).
Les semis en gousses ont été effectués
mécaniquement en lignes à la dose de 25 kg/ha et à une
profondeur de 1 à 2 cm. La période de semis a été
échelonnée entre le 1er et le 15 octobre à
l'exception du site Mateur Jalta au mois de décembre.
La fertilisation réalisée dans les sites de
Medjez El Bab, Smadah, Oued Zarga, Ain Chalou, Methline, Badrouna, et Ben Arous
s'est limitée à un apport d'engrais phosphaté sous forme
de super 45 à une dose de 150 kg/ha (Rondia et al., 1985).
Seules les stations Ben Arous et Smadah avaient reçu en plus du
phosphore, un apport d'engrais potassique sous forme de sulfate de potasse
à raison de 100 kg/ha. Alors que, Ghezala, Téboursouk, Tunis, El
Fahs, Mateur Jalta, Menzel Bouzelfa et Goubellat n'avaient eu aucun
fertilisant. Vu la nature de l'espèce (fabacée), aucun engrais
azoté (minéral ou organique) n'a été
apporté.
Concernant la fertilisation biologique sous forme rhizobiale,
les agriculteurs de ces stations ont confirmé n'avoir jamais
effectué d'apport d'inoculum exogène.
La gestion des adventices n'a pas été
homogène dans toutes les stations. En effet, 57 % des stations ont
effectué un désherbage chimique en pré et post semis avec
un anti- dicotylédone et un anti-graminée spécifiques. Les
sites Ghézala et Ben Arous ont de plus été
concernés par un second passage d'herbicide de type
anti-dicotylédone spécifique. Alors qu'un binage manuel a
été effectué à Tunis et El Fahs. Les sites de
Goubellat, Mateur Jalta et Téboursouk n'ont par ailleurs subis aucun
traitement herbicide.
3. Caractérisation agronomique et symbiotique du
sulla cultivé
Les premières mesures ont été
réalisées au stade floraison. A ces dates, le nombre de
jours depuis le semis jusqu'à la floraison, la
densité de peuplement du couvert végétal (sulla et
adventices) ont été déterminés. Cette
dernière a été réalisée par un quadra
métallique de 1 m2, lancé aléatoirement dans
les différentes parcelles à raison de 5 lancées par site.
Le contenu du quadra en sulla et adventices (toutes espèces confondues)
est dénombré sur place.
3. 1. Hauteur de végétation
Dix plantes entières ont été choisies
d'une manière aléatoire de chaque parcelle pour
l'évaluation de la croissance en hauteur du couvert
végétal en cm. Les mesures ont été
réalisées par un mètre ruban.
3. 2. Biomasse sèche
Au stade floral, un quadra de 1m2 a
été lancé de manière aléatoire dans les
différentes parcelles à raison de 5 lancées. Le contenu du
quadra a été fauché et pesé immédiatement au
moyen d'une balance mobile. Au laboratoire, un échantillon de 500 g de
plantes/quadra fraîchement coupées a été
placé dans une étuve ventilée de marque Jouan à
70°C pendant 72 h. Cet échantillon a servi à la
détermination des poids secs par une balance de marque Mettler.
3. 3. Semences en gousses
En fin de cycle et à maturation complète des
gousses, le même quadra de 1 m2 a servi à l'estimation
des rendements en graines de chaque parcelle. La lancée du quadra a
été réalisée arbitrairement à raison de 3
fois pour chaque parcelle. Les plants délimités par le quadra ont
été récoltés manuellement à l'aide d'une
faucille et placées dans des sachets. Au laboratoire, les gousses ont
été séparées des fanes, puis pesées au moyen
d'une balance de marque Mettler.
3. 4. Protéines brutes
Le dosage de l'azote total a été
réalisé selon la méthode Kjeldahl (Bremner, 1965). Le
principe de cette méthode consiste à minéraliser 0,1 g de
la poudre végétale sèche avec de l'acide sulfurique
concentré (5 ml); lequel, par son action oxydante, détruit les
matières organiques, libérant ainsi l'azote sous forme d'ammonium
(NH4 +). Cette minéralisation a été effectuée
à une température de 350 à 400°C, pendant 30 à
60 minutes et accélérée par l'emploi d'un catalyseur
(sulfate de sélénium). Cette opération a été
suivie par la distillation, avec ajout au contenu du matras de 20 ml d'eau
distillée et 20 ml d'une solution de soude 10 N. L'azote a
été ensuite récupéré dans une solution
d'acide borique en présence d'un indicateur coloré.
Enfin, la titration de l'ion ammonium a été
faite avec l'acide chlorhydrique (0,1 N) jusqu'au virage de l'indicateur du
vert au rose. Sachant que l'élément azote représente 16 %
de la matière azotée totale, les protéines brutes ont
été déduites après multiplication du taux de
l'azote obtenu par le facteur 6,25.
3. 5. Paramètres de nodulation et collecte des
rhizobiums
L'arrachage aléatoire au stade pleine floraison de 10
plantes avec racines et par parcelle a servi à l'évaluation de la
nodulation du sulla ainsi qu'à la collecte du matériel
rhizobial.
Le protocole adopté est celui préconisé par
Vincent (1970) et Somasegaran et al. (1994) qui consiste à:
- creuser à environ 15 cm autour de la plante et 20 cm
dans le sol pour extraire la plante et son système racinaire;
- enlever soigneusement le sol lié au niveau des racines
sans abîmer les nodules;
- placer délicatement la plante avec la motte racinaire
dans un sachet de plastique;
- laver délicatement au laboratoire les racines et les
nodules à l'eau courante; et
- détacher les nodules à 1 ou 2 mm du site
d'attache, les rincer, puis les sécher avec du
papier filtre.
Les nodules collectés sont ainsi détachés de
leurs racines puis pesées. La masse sèche de ces derniers a
été estimée après dessiccation dans une
étuve à 70°C pendant 72 h.
3. 6. Conservation des Rhizobiums
3. 6. 1. Conservation des nodules par
déshydratation
La conservation des nodules a été
réalisée par déshydratation dans des flacons en verre
contenant du CaCl2 (Figure 5). Le flacon en verre est rempli au deux tiers de
son volume par du CaCl2. Les nodules ont été par la suite
déposés entre deux couches de coton (Vincent, 1970). Sur chaque
flacon on a noté le lieu et la date de prise de l'échantillon.
Figure 5: Conservation des nodules par
déshydratation.
3. 6. 2. Conservation des isolats bactériens
3. 6. 2. 1. Isolement et purification des
rhizobiums
L'isolement a été réalisé à
partir de nodules fraîchement récoltés et d'autres
conservés par déshydratation dans du CaCl2. Au total 10 nodules
par site ont été isolés. La réhydratation des
nodosités a été réalisée en condition
stérile par imbibition à l'eau distillée
stérilisée pendant 4 heures. Une fois les nodosités ont
repris leur volume initial; celles-ci ont été
désinfectées par l'alcool 95° pendant 15 secondes puis par
le HgCl2 (0,1%) pendant 45 secondes. Après une série de 10
rinçages à l'eau distillée stérile, les
nodosités ont été aseptiquement écrasées
à l'aide d'une pince stérilisée puis étalée
par striation directement sur des boîtes contenant le milieu YMA/RC
(Vincent, 1970) (Annexe 1) additionné du rouge Congo à 2,5%. Ces
différentes boîtes ont été par la suite
placées dans un incubateur à 28°C.
Après une série de repiquages, et en se basant sur
les caractéristiques morphologiques des colonies représentant le
type majoritaire, un nombre de 50 isolats a finalement été
retenu.
3. 6. 2. 2. Conservation sur gélose
inclinée
L'ensemble des 50 isolats sélectionnés a
été ensemencé (Figure 6) dans des tubes contenant du
milieu Yeast Extract-Mannitol (YEM) (Annexe 1) dépourvu du
rouge Congo à gélose inclinée puis maintenu à
4°C. Sur chaque tube, le nom de la souche et la date de conservation ont
été indiqués.
Figure 6: Ensemencement des souches sur milieu
YEM.
3. 6. 3. Conservation dans le glycérol
Ces isolats ont été également
conservés dans des congélateurs à -20°C et à
-80°C dans des ependorfs stériles contenant 200 ul de
glycérol et 800 ul de pré culture bactérienne
fraîche (Vincent, 1970).
3.7. Analyse des données
Une analyse factorielle (SAS, 1985) par correspondance a servi
à la caractérisation des différentes stations à
travers l'étude des paramètres climatiques et édaphiques
afin de les classer en groupes selon les caractères les plus
discriminants.
Dans un premier temps, une analyse de variance (ANOVA) (SAS,
1985) pour l'ensemble des paramètres de croissance et de rendement
relatifs à la culture dans les différentes stations a
été réalisée. Cette méthode permet une
comparaison des moyennes en utilisant le test LSD (Low Significance
Difference) au seuil 5 %. Une analyse en composantes principales (ACP) a
permis dans un second temps d'établir deux diagrammes de dispersion dans
les quels apparaissent les cultures relatives à chaque site et les
variables étudiées. Cette analyse a été
complétée par la méthode de classification
hiérarchique basée sur tous les scores de l'ACP en utilisant
l'algorithme Unweighted Pair Group Method Average (UPGMA) (Sneath et
Sokal, 1973).
4. Etude de la diversité des microsymbiotes du
sulla
Dans le but d'étudier la diversité des
microsymbiotes du sulla, nous avons procédé à une
caractérisation phénotypique puis moléculaire des isolats
de la collection.
4. 1. Caractérisation phénotypique
Les caractères phénotypiques permettent de
sélectionner des souches efficientes, compétentes et
indifférentes aux divers stress environnementaux.
4. 1. 1 Infectivité des isolats
La capacité d'induire la formation de nodosités
sur les racines de la légumineuse hôte est un critère de
base pour l'authentification des isolats. De ce fait, la capacité
infective des 50 isolats a été évaluée par la
présence de nodosités sur les racines du sulla
variété Bikra 21.
4. 1. 1. 1. Désinfection des graines et
semis
Les graines ont été stérilisées
par lavage à l'hypochlorite de sodium à 1% pendant 8 minutes
suivie d'un lavage de 15 secondes avec de l'alcool à 95° puis d'une
série de 7 rinçages à l'eau distillée
stérile. Les graines ont été mises sur milieu de
germination gélosé agar-agar 0,9 % et placées à
l'obscurité à 4°C pendant 48 heures; puis elles ont
été déplacées dans un incubateur à
l'obscurité et à 25°C pendant 3 à 5 jours.
Les graines ayant une radicule d'environ 0,5 cm (Figure 7) ont
été transférées aseptiquement dans des pots de
volume 33 cl remplis de sable stérile (stérilisation à
l'étuve: 200°C pendant 48 h) à raison d'une graine par
pot.
Les pots ont été ensuite placés dans une
chambre de culture à température, humidité et
photopériode contrôlées respectivement 25°C, 36%, et
16 h lumière /8 h obscurité.
Radicule
Figure 7: Germination des graines de sulla sur
milieu gélosé agar-agar 0,9 %.
4. 1. 1. 2. Inoculation des plantes et conduite de la
culture
Une colonie bactérienne de chaque isolat a
été introduite dans un milieu YEM liquide et mise en agitation
à 150 tr/min à 28°C dans des conditions d'obscurité.
Après 48 h, quand la solution est devenue trouble (108
bactéries/ml); chaque plante a été inoculée par 1
ml de la suspension bactérienne. Trois pots contenant chacun une seule
plante ont été utilisés pour chaque souche. Après
inoculation, les pots ont été couverts avec du papier aluminium
stérile pour éviter d'éventuelles contaminations (Figure
8).
Des plantes non inoculées ont été
utilisées comme témoin (T0). Les plantes ont été
arrosées 3 fois par semaine alternativement avec de la solution
nutritive dépourvue d'azote (Vadez et al., 1996) (Annexe 2) et
de l'eau distillée stérile.

Figure 8: Test d'infectivité des souches
de la collection en association avec Hedysarum coronarium L. et en
conditions contrôlées.
Après 8 semaines de culture, l'infectivité des
souches a été évaluée par la présence de
nodules sur les racines de l'ensemble des 3 plantes. Les plantes ayant au moins
une nodulation positive sur l'ensemble des 3 répétitions sont
maintenues pour une ultérieure caractérisation morphologique et
moléculaire.
4. 1. 2. Critères morphologiques
4. 1. 2. 1. Coloration Gram
Afin d'identifier les bactéries isolées, on a
procédé à une coloration Gram permettant de mettre en
évidence les propriétés de la paroi bactérienne. Le
principe de cette méthode consiste en la fixation de la solution
bactérienne à la chaleur à environ 40°C pendant 10
minutes puis à la réalisation d'une série de colorations
(Coloration par le violet de gentiane (1 min); mordançage au lugol (20
sec); décoloration à l'alcool (20 sec); et recoloration à
la fuchsine (1 min)). Enfin l'observation du frottis au microscope
(grossissement 1000) permet selon la couleur de la paroi de différencier
entre les bactéries Gram + et Gram-.
4. 1. 2. 2. Caractérisation morphologique des
colonies
Après purification des bactéries selon la
technique de Vincent (1970) et incubation à 28°C pendant 4 à
5 jours, une analyse visuelle de l'aspect des colonies a été
faite comme celle décrite par Jordan (1982). Les critères choisis
sont relatifs à la forme, la taille et la consistance des colonies.
4. 1. 3. Critères physiologiques des
colonies
Les critères physiologiques testés se sont
limités aux plus importants facteurs de stress abiotique en Tunisie.
Parmi ces facteurs la tolérance aux stress hydrique, salinité, pH
et calcaire a été évaluée pour l'ensemble des
souches de la collection ayant présenté au moins une nodulation
positive par répétition.
Les tolérances aux facteurs de stress ont
été effectuées par culture des souches en milieu liquide
dans des flacons contenant 5 ml d'une solution YEM liquide et inoculée
par une pré-culture en phase exponentielle. Trois
répétitions ont été réalisées pour
chaque type de stress.
Après une incubation à 28°C pendant 5 jours
en agitation (150 rpm), la limite de tolérance aux différents
stress a été évaluée par mesure de la
densité optique (DO) à 620 nm.
4. 1. 3. 1. Tolérance à la
salinitéLa tolérance des souches au sel a
été effectuée sur milieu YEM gélosé et
liquide en
augmentant la concentration en NaCl par palier de 50 mM. Les
teneurs ont varié de 100 à 1000 mM.
4. 1. 3. 2. Tolérance au stress
hydrique
La méthodologie suivie pour l'évaluation de la
tolérance au stress hydrique osmotique des bactéries est la
même que celle appliquée pour la tolérance au sel (Buss
et al., 1989). Le produit utilisé à ce propos est le
polyéthylène glycol (PEG 6000). Les potentiels osmotiques
testés sont -0,25 ; -0,5 ; -0,9 ; -0,95 et -1MPa.
4. 1. 3. 3. Tolérance au pH basique
Hedysarum coronarium L. est une plante adaptée
aux sols argilo-calcaires. Ces sols se distinguent par un pH basique
d'où l'initiative d'étudier la tolérance des souches aux
pH alcalins.
Les souches ont été évaluées pour
leur tolérance aux pH alcalins sur YEM liquide additionné d'une
solution NaOH 5N. Le pH a été ajusté aux valeurs
suivantes: 7; 7,5; 8 ; 8,5 ; 9; 9,5; 10 ; 10,5; 11; 11,5 et 12.
4. 1. 2. 3. Tolérance au calcaire
La capacité des souches à tolérer le
stress calcaire a été évaluée sur milieu
gélosé YEM additionné de rouge Congo (RC), renfermant des
teneurs croissantes en CaCO3: 0,5 M ; 1M ; 1,5M et 2M.
4. 1. 4. Analyse numérique
L'analyse numérique des résultats de l'ensemble
des tests phénotypiques a été indiquée par 1 pour
tout résultat positif et 0 pour le négatif. Ainsi, les
caractères relatifs aux stress abiotiques (pH, salinité, PEG), et
les caractères morphologiques liés aux colonies ont
été rapportés sur deux matrices différentes puis
réunies sur une seule. La comparaison entre les souches prises deux
à deux a été réalisée par la méthode
UPGMA. Sur la base de cette méthode, trois phénogrammes ont
été construit par le logiciel Statistica version V.
4. 2. Caractérisation moléculaire
4. 2. 1. Extraction de l'ADN bactérien
A partir d'une boîte de pétri, contenant des
colonies pures de chaque isolat, une colonie a été
repiquée sur milieu Yeast Extract-Tryptone (TY) (Beringer, 1974)
gélosé incliné (Annexe 1) et incubée à
28°C pendant 48 heures. Après avoir ajouté 8 ml d'eau
Milli-Q stérile, les bactéries ont été mises en
suspension. Une centrifugation de 7 minutes a été
effectuée et le culot est re-suspendu dans 50ul d'eau Milli-Q et soumis
à une deuxième centrifugation de 3 minutes. Au culot, il a
été ajouté 100 ul de tampon tris HCl 10 mM à pH
8,3; 100 ul d'eau distillée stérile; et 17ul de PK
(Protéinase K 1 mg/ml). Le mélange a été ensuite
incubé à 55°C pendant 12 heures. L'arrêt de la
digestion a été provoqué après ébullition
pendant 10 min.
4. 2. 2. Evaluation de la diversité
génétique des isolats de la collection par Rep-
PCR
Dans la technique Rep-PCR, les amorces sont conçues
pour s'hybrider d'une façon complémentaire aux
extrémités des séquences répétitives
inversées; de telle manière que la PCR permet l'amplification de
toute la séquence localisée entre les sites d'hybridation des
amorces. L'amplification génère ainsi différents fragments
d'ADN de tailles variables.
Par séparation électrophorètique, ces
fragments permettent la révélation d'une empreinte
génétique spécifique (Versalovic et al., 1991; De
Bruijn, 1992) à chacune des 45 isolats de la collection.
Les réactions d'amplification ont été
réalisées selon une optimisation du protocole décrit
initialement par De Bruijn (1992). L'amplification a été
effectuée dans des micro-tubes de 100 pl contenant 30
pl de volume final de réaction. Le mélange
réactionnel comprend le tampon de réaction au 1/10 du volume
final et qui contient 10 mM Tris-HCl, 50 mM KCl, et 0,1 % Triton X-100; 1 mM de
chaque desoxyribonucléoside triphosphate (dNTP); 5 mM MgCl2; 3
pl de diméthylsulfoxyde (DMSO) à 10 %; 1
pl de bovine serum albumin (BSA) à 10 mg/ml;
30 pmol de chaque amorce; 2U de la Taq polymérase et 2
pl du lysat d'ADN. Les deux amorces palindromiques
utilisées pour amplifier les séquences répétitives
Rep sont Rep 1 et Rep 2.
Après addition des échantillons d'ADN des 45
isolats, les micro-tubes ont été placés dans un
thermocycleur. Un micro tube dont l'ADN a été remplacé par
de l'eau bi-distillée stérile est utilisé en tant que
témoin négatif.
Les mélanges ont été alors soumis au
processus d'amplification établi par Grundmann et al. (1997)
selon le programme Rep-PCR (Tableau 5).
A la fin de l'amplification, un aliquote de 15
jtl de chaque amplifiat a été
mélangé avec 2jil de bleu de Bromophénol
(BBE). Les différents mélanges ont été soumis
à une électrophorèse horizontale sur gel d'agarose (Sigma
Ultra Pure) à 1,5% dans le tampon Tris, Acétate, EDTA (TAE)
(Annexe 4) pendant trois heures à 80V. Le 100 pb et le 1Kb step
ladder (Promega) ont été utilisés comme marqueurs de
poids moléculaire lors de chaque migration effectuée. Le gel a
été coloré dans une solution de bromure d'éthidium
à 1 mg/ml pendant 20 à 25 min, rincé dans de l'eau
distillée pendant 3 min, puis placé sous UV au Biodoc pour
être photographié.
La taille en paire de base des différentes bandes
obtenues a été évaluée par comparaison à
celles des marqueurs moléculaires utilisés à l'aide du
logiciel PM, Macintoch, Vs 4,0.
4. 2. 3. Identification moléculaire par PCR-RFLP
de l'ADNr 16S
L'amplifiat a été préparé dans un
volume final de 25 ul en utilisant les amorces rd et fd selon le prototole
mentionné dans le tableau 5. L'amplification a été
réalisée dans un thermocycleur (Biometra TRIO-Thermoblock) selon
le programme approprié (Tableau 6).
La vérification de l'amplification a été
réalisée par électrophorèse horizontale sur un gel
d'agarose 0,9 % (Sigma medium EEO type II) à 100V pendant 30 min dans le
tampon TAE 1X (Tris Acétate EDTA). Le gel a été
coloré au BET (1ug/ml d'eau distillée) et visualisé sous
UV (312 nm) au Biodoc (Biodoc 2NT/Biometra). Le Felix-500 pb Ladder a
été utilisé comme marqueur standard de taille (Annexe
3).
Les fragments amplifiés ADNr 16S avec des amorces non
marquées, ont été digérés par l'enzyme de
restriction MspI (Invitrogen) dans un volume de 15 pl
à 37 °C pendant 3 h. La discrimination a été
réalisée aussi par NdeII (Invitrogen). La digestion a
été réalisée sur 8 ul de l'amplifiat
mélangé avec 1 ul d'une enzyme de restriction à site de
coupure tetranucléotidique (5U/ul), dans un volume équivalent de
tampon (0,9 tampon + 0,1ul BSA (10mg/ml)). La réaction a
été arrêtée après incubation à
65°C pendant 10 min pour inactiver l'enzyme de restriction. La
séparation des fragments d'ADN digérés a été
réalisée par migration électrophorétique sur gel
d'agarose (QA-Agarose, Q-Biogène), à une concentration
de 3 % (m/v) dans un tampon TAE 1X (Tris-acétate 40 mM, EDTA 1 mM).
Tableau 5: Quantités et réactifs
utilisés pour l'amplification de l'ADNr 16S et de la séquence
Rep-PCR.
|
Réactifs
|
ADNr 16S
|
Rep-PCR
|
|
Amorce 1
|
0,1 uM
|
0,5 (50mM)
|
|
Amorce 2
|
0,1 uM
|
0,5 (50mM)
|
|
Tampon 10x
|
1x
|
-
|
|
Tampon Giescher (5 mM)
|
-
|
1,5ul
|
|
dNTP
|
20 uM
|
0,625 (25 mM)
|
|
MgCl2 (50 mM)
|
1,5 mM
|
1,75 ul
|
|
Taq pol
|
0,025U/ul
|
0,025U/ul
|
|
ADN
|
3 ul
|
3 ul
|
|
H2O Milli-Q stérile
|
25 ul
|
0,5ul
|
|
BSA (1,7mg)
|
-
|
1,25ul
|
Le marqueur de poids moléculaire Smart ladder
(échelle de 200 à 10000 pb) ou Smart ladder low 20 pb
(échelle de 20 à 1000 pb, Eurogentec) a été
utilisé comme standard de taille. Les ADNs ont été
visualisés par fluorescence aux UV après imprégnation au
BET (1 cg/ml). La taille en paire de base des
différentes bandes obtenues a été évaluée
par comparaison à celles des marqueurs moléculaires
utilisés à l'aide du logiciel PM, Macintoch, Vs 4,0.
Tableau 6: Cycles de variation des
températures au cours de l'amplification des différents
gènes.
Réactions ADNr16S Rep-PCR
|
Dénaturation Dénaturation Hybridation Extension
Extension finale
|
1x: 95°C, 3mn
35x: 94°C, 1mn
55°C,
1mn
72°C, 2mn
1x: 72°C, 3mn
|
1x: 94°C, 3 min
35x: 94°C, 3 min
40°C, 1
min
65°C, 8 min
1x: 65°C, 8 min
|
4. 2. 4. Séquençage du gène de
l'ADNr 16S
La détermination du statut taxonomique des souches de
sulla étudiées par le séquençage du gène de
l'ADNr 16S précisera si ces souches constituent une nouvelle
espèce parmi les rhizobiums.
L'ADN 16S est purifié avec le kit Gene Elute PCR
cleaning up Kit, et le gène est préparée pour le
séquençage en mélangeant 8 à 10 pmol/100 pb d'ADN
avec 3 ul du Sequencing reaction mix (Big Dye Terminator v3.1
Cycle Sequencing Kit (Applied Biosystems)) et 3,2 pmol du
primer et le volume est ajusté à 10 ul avec de l'eau
Milli-Q stérile.
Les réactions de séquençage de l'ADN ont
été réalisées selon la méthode de Sanger,
à l'aide du kit Big Dye Terminator v3.1 Cycle Sequencing Kit
(Applied Biosystems) selon les recommandations du fournisseur. Les
produits des réactions de séquence ont été ensuite
purifiés sur des colonnes Sephadex AutoSeq G-50 (Amersham Pharmacia
Biotech). L'électrophorèse capillaire a été
effectuée sur un séquenceur automatique ABI PRISMTM 310
Genetic Analyzer (Applied Biosystems).
Les séquences nucléotidiques ont
été ensuite comparées aux séquences contenues dans
les banques de données à l'aide du logiciel Blast (Basic
Local Alignment Search Tool,
www.ncbi.nlm.gov/blast). Le
logiciel Clustal W (
www.infobiogen.fr) a permis
l'alignement des séquences.
4. 2. 5. Analyse numérique
Les similarités entre les différentes souches
analysées ont été évaluées par comparaison
des profils de restriction prises deux à deux. Une matrice
bidimensionnelle a été construite sur la base de ces profils. Les
distances génétiques calculées selon UPGMA ont
permis la construction d'un dendrogramme mettant en évidence les
relations génétiques existantes entre les différentes
souches analysées.
5. Evaluation de l'efficience symbiotique des isolats
de la collection
Dans le but d'évaluer les performances symbiotiques des
isolats de la collection, 30 souches ont été testées pour
leur efficience.
5. 1. Conduite de l'essai
L'évaluation de l'efficience symbiotique des souches a
été réalisée en association avec Hedysarum
coronarium L. variété Bikra 21. Les graines ont
été désinfectées par imbibition à
l'hypochlorite de sodium (1 %) et à l'alcool (95°) respectivement
pendant 8 min et 15 secondes.
Ces dernières ont été ensuite
rincées 8 fois à l'eau distillée stérile et
immédiatement semées le 12 novembre 2007 dans des gobelets de 33
Cl, à raison d'une graine par gobelet. L'ensemble des gobelets a par la
suite été placé sous serre vitrée. A l'apparition
des cotylédons, les plants ont été inoculés avec 1
ml d'une solution bactérienne fraîchement préparée
(108 bactéries/ml). Des plantes non inoculées ont
été utilisées comme témoins : un premier
témoin absolu (T0) et un deuxième (TN) avec un apport
azoté de 60 unités fractionné en deux. Le premier apport a
été réalisé au stade cotylédonaire et le
second au stade 3 feuilles uni-foliolées. Quatre
répétitions ont été réalisées pour
chaque traitement.
Les plantes ont été arrosées 3 fois par
semaine alternativement avec de la solution nutritive dépourvue d'azote
(Vadez et al., 1996) (Annexe 2) et de l'eau distillée
stérile.
5. 2. Paramètres mesurés
Douze semaines après inoculation, et au stade
6ème feuille pluri foliée du sulla, les
paramètres de nodulation (nombre et poids) ont été
évalués selon les techniques précitées. La
croissance en hauteur a été réalisée à
l'aide d'une règle graduée. La surface foliaire cumulée
pour l'ensemble des feuilles constituant une seule plante a été
estimée en Cm2/ plante et déterminée au moyen
d'un planimètre de marque LICOR.
Les rendements en biomasse sèche par plant de sulla ont
été estimés après dessiccation de la partie
aérienne des plantes à l'étuve ventilée à
70°C pendant 72 h puis mesure des poids secs par une balance.
Le dosage des protéines brutes aériennes par
plante a été réalisé par la méthode
Kjeldhal, à partir de la poudre végétale des plants
desséchés, selon le même protocole préalablement
cité.
6. Evaluation de l'efficience symbiotique du couple
Hedysarum coronarium L./R. sullae en conditions de stress hydrique
Dans le présent essai, on se propose de tester les
performances symbiotiques de 3 souches rhizobiales (HC1, HC5 et HC14) en
association avec Hedysarum coronarium L. variété Bikra
21 dans quatre régimes hydriques (100 % RU, 75 % RU, 50 % RU et 25 % RU)
correspondant aux volumes d'eau additionnés respectivement de 300 mm;
225 mm; 150 mm et 75 mm). Deux témoins (T0 et TN) ont été
introduits dans le dispositif expérimental comprenant trois
répétitions par traitement. Le TN comprend un apport de 90
unités d'azote réparties en trois apports selon les stades
biologiques cotylédonaire, 3 feuilles uni-foliolées et
ramification.
6. 1. Installation de l'essai
La culture a été réalisée en pots
désinfectés par rinçage à l'eau de javel puis
essuyés
avec du coton imbibé d'alcool 95°. Ces pots de
diamètre 16 cm ont été remplis avec du sable de
carrière préalablement stérilisé à
l'étuve à 120°C pendant 24h à raison de 3,8 Kg par
pot. Le semis a été effectué le 2 Décembre 2008
après désinfection des graines à raison d'une graine par
pot. Ces derniers ont par la suite été placés sous serre
vitrée (Figure 9).

Figure 9: Essai d'évaluation de
l'efficience symbiotique des souches rhizobiales, en condition de stress
hydrique, sous serre vitrée.
6. 3. Conduite de l'irrigation
La réserve totale RT a été estimée
sur la base de 4 échantillons de substrat (sable de carrière)
ramenés à la capacité au champ, pesés, puis
séchés à 105°C pendant 48 h, et enfin
repesés.
La différence entre le poids sec à la
capacité au champ (3813 g) et le poids sec après séchage
(2740 g) correspond à la réserve totale (Ducroq, 1990):
RT : réserve totale
RU = 1/2 RT RU : réserve utile
Tous les pots ont été maintenus à 100% de
la réserve utile (RU) durant la période semis-inoculation. La
date de l'inoculation a été le point de départ de
l'application du stress hydrique. Afin d'éviter tout risque de carence
minérale et pour bien observer l'effet souches, l'irrigation des pots a
été faite par une solution nutritive carencé en azote
(Annexe 2).
6. 4. Paramètres mesurés
L'essai a été maintenu 80 jours après
l'inoculation, au terme desquelles, la nodulation (nombre et poids nodulaire),
la croissance (croissance en hauteur et surface foliaire), et le rendement
(biomasses aériennes et racinaires; et teneur en protéines brutes
aériennes) du sulla ont été évalués.
7. Evaluation de l'activité symbiotique des
souches en plein champ
L'efficience symbiotique dessouches rhizobiales HC5 et HC14 a
été testée durant la campagne agricole 2008-2009, à
régime pluvial et dans deux stations expérimentales
différentes Tunis et Goubellat respectivement favorable et
défavorable à la culture du sulla sans inoculation par le
rhizobium spécifique.
7. 1 Caractéristiques climatiques des sites
Les deux sites Goubellat et Tunis appartiennent à
l'étage bioclimatique du semi aride respectivement inférieur
à hiver doux et supérieur à hiver tempéré.
Les diagrammes ombrothermiques ont été déterminés
en rapport avec le cycle de développement du sulla du semis à la
floraison (Figure 10).
A
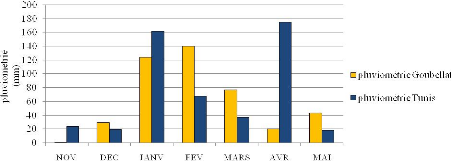
B
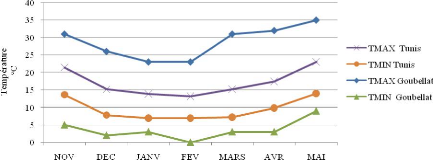
Figure 10: Variation des pluviométries
(A) et des températures minimales et maximales (B) mensuelles
receuillies durant la campagne agricole 2008-2009 dans les stations Tunis et
Goubellat.
7. 2. Caractéristiques chimiques des sols
Les caractéristiques chimiques des sols relatifs aux
deux sites expérimentaux sont présentées dans le tableau
7. La mesure du pH du sol est un paramètre important puisqu'il
contrôle la disponibilité des éléments nutritifs
dans les sols par les cultures. Ce paramètre a un effet direct sur la
croissance et le développement du couvert végétal. Les
mesures des pH révèlent que les sols de Tunis et Goubellat sont
de type sub-alcalin (Sanaa et Robbez-Masson, 1986).
Tableau 7: Caractéristiques chimiques des
sols dans les stations d'essai.
Sites pH MO Nt CA CE P2O5 ass K2O éch
% mS.cm-1 ppm
Tunis 7,9 1,4 0,11 13,25 0,9 25 526
Goubellat 7,89 2,4 0,23 14 1,1 16 342
MO: matière organique; Nt : azote total; CE:
conductivité électrique; CA: calcaire actif; P2O5:
phosphore assimilable; K2O: potassium échangeable.
7. 3. Dénombrement des populations natives de
rhizobium nodulant le sulla dans les stations d'essai
L'analyse de la densité de la population rhizobiale:
Most Probable Number (MPN)
spécifique au sulla du nord a été
réalisée dans les deux stations avant l'installation de l'essai
et au moment du démarrage de la végétation en cours de la
deuxième année de culture du sulla uniquement dans le site
Goubellat vu que celui de Tunis a été inondé. Cette
expérience a pour but d'estimer la densité bactérienne des
rhizobiums spécifiques au sulla. Cette technique est basée sur le
piégeage des bactéries du sol par la plante hôte par
inoculation de celle ci par des solutions de sol préparées de la
manière suivante: Dans un Erlen Meyer stérile, 10 g de sol ont
été solubilisés par agitation dans 90 ml de solution
stérile de NaCl 0,9 %. Puis, des suspensions-dilutions de sol de
concentration 10-1 jusqu'à 10-10 ont servi comme
inoculum. L'inoculation a été faite avec 100 ul de chaque
dilution et les répétitions sont à raison de quatre
plantes par dilution. A la fin de la culture qui dure 60 jours, les plantes
nodulées pour toutes les dilutions ont été
dénombrées.
Le MPN a été calculé selon la formule
suivante:
MPN (rhizobium/g de sol) = m x
d/v
m: constante, en fonction du nombre de plantes nodulées
(Vincent, 1970) (Annexe 5 ), d: dilution minimale = 10-1 , et v:
volume d'inoculation = 100 ul.
7. 4. Installation et conduite des essais
Pour les deux stations, le dispositif expérimental est
en Bloc complètement randomisé à 3
répétitions, chaque bloc a été divisé en 4
unités expérimentales représentées par des lignes
individuelles de 2 m de long. L'écartement entre les unités
expérimentales a été de 3 m (Figure11).
3m
3 m
HC5 HC14 T0 TN

T0 HC14 TN HC5

2m
Figure 11: Dispositif expérimental dans
les stations Tunis et Goubellat.
Le semis du sulla (variété Bikra 21) a
été effectué manuellement les 26 et 27 novembre 2008
respectivement dans les sites Tunis et Goubellat, à une profondeur de
1cm. A la levée, un éclaircissage a été
réalisé sur l'ensemble des lignes en respectant un espacement de
2 cm entre les plants.
L'inoculation a été réalisée avec
les souches HC5 et HC14 au stade cotylédonaire soit 15 et 30 jours
après le semis respectivement à Tunis et Goubellat.
L'inoculation sous forme liquide a été
réalisée par un arrosoir désinfecté à l'eau
de javel puis lavé à l'eau distillée stérile.
Chaque ligne a été inoculée par une préparation
composée de 500 ml d'une suspension bactérienne fraîchement
préparée (108 bactéries/ml) diluée dans
10 l d'eau distillée stérile (Figure 12).
Matériel et méthodes

A
B
Figure 12 : Dilution de la pré culture
rhizobiale (A) et inoculation du sulla au champ (B)
Les plantes non inoculées ont été
utilisées comme témoin non azoté (T0). Le témoin
azoté (TN) a été représenté par des plantes
non inoculées mais recevant de l'azote sous forme d'ammonitrate 33,5%.
Ce dernier a été dilué dans l'eau à raison de 30
unités au stade cotylédonaire, 30 unités au stade 3
feuilles uni-foliolées et 30 unités à la ramification.
Le désherbage a été effectué
manuellement entre les lignes et moyennant un motoculteur entre les
unités expérimentales dans les deux stations. Cette
opération a été effectuée au stade 3 feuilles
uni-foliolées et au stade ramification.
En deuxième année de culture le témoin
azoté dans le site Goubellat a également été
fertilisé avec de l'ammonitrate 33,5% à raison de 60
unités fractionnées en deux apports espacés de 30
jours.
7. 5. Paramètres mesurés sur le sulla de
1ère année
En première année de la culture et au stade
floraison, une évaluation des paramètres de croissance
(croissance en hauteur, surface foliaire), de nodulation (nombre et poids
nodulaire) et de production (biomasse aérienne sèche et rendement
en protéines brutes) a été réalisée dans les
stations après arrachage de plantes entières.
7.6. Paramètres mesurés sur le sulla de
2ème année
L'essai a été maintenu durant la campagne
agricole 2009-2010 uniquement dans la station Goubellat. A Tunis les
pluviométries printanières excessives ont occasionné une
asphyxie du système racinaire causant la sénescence de la
culture.
L'analyse de la nodulation du sulla de deuxième
année dans le site Goubellat a été réalisée
au stade bouton floral par arrachage et observation des racines de 10 plants
pris au hasard au niveau de chaque traitement.
Un mois après le démarrage de la
végétation une première coupe a été
effectuée et dix plantes par unités expérimentales ont
été pesées, séchées à l'étuve
puis broyées. Au stade bouton floral, la croissance en hauteur a
été mesurée in situ. Dix plantes par unité
expérimentale ont été choisies au hasard puis
coupées manuellement à l'aide d'une faucille à un niveau
de 5 cm du sol. Le rendement en matière sèche a été
obtenu par pesée de ces plantes après séchage dans une
étuve ventilée à 70°C pendant 72 h. Les plantes
représentant un même traitement sont mélangées,
broyées. La poudre végétale a servie à la
détermination des protéines brutes.
8.Analyses statistiques
L'ensemble des mesures réalisées dans les essais
d'évaluation de l'efficience du couple symbiotique R.
sullae/Hedysarum coronarium a fait l'objet d'une analyse de la
variance (ANOVA) (SAS, 1985) par comparaison des moyennes en utilisant le test
LSD (Low Significance Difference) au seuil 5 %.
RESULTATS ET DISCUSSIONS
1. ETUDE DE LA VARIABILITE AGRONOMIQUE DU SULLA
PORTE-GRAINES EN REGIONS NORD DORSALIENNES
Ce chapitre traite les états aussi bien agronomiques
que symbiotiques de diverses cultures de sulla destinées à
produire des semences. Une évaluation des potentialités
symbiotiques des populations rhizobiales autochtones a été
nécessaire en vue d'une caractérisation de ce matériel
biologique.
1. 1. Caractéristiques édapho-climatiques
des sites géographiques prospectés
La zone de prospection couvre les latitudes 36 et 37° N
et les longitudes 9 et 10° E, et comprend les gouvernorats de Bizerte,
Béja, Jendouba, Tunis, Zaghouan et Nabeul. Ces régions sont
réparties selon l'échelle bioclimatique d'Hemberger entre
l'étage semi aride inférieur à hiver doux (Menzel
Bouzelfa, Goubellat) et l'étage humide à hiver doux (Mateur
Jalta). Les différents sites varient en altitude de 10 à 484 m et
en pluviométrie moyenne annuelle de 380 à 800 mm (Tableau 4).
Le pH du sol dans les sites de prospection varie de 7,2
à 8,5. Concernant la matière organique, 78 % des stations
présentent de faibles teneurs variant de 0,5 à 1 %. Seules les
stations Menzel Bouzelfa, Methline et Oued Zarga présentent des teneurs
importantes en MO (4,2 - 4,7 %).
Les valeurs enregistrées au niveau du calcaire montrent
que 64 % des sols sont très riches en calcaire actif (Ca > 19 %).
Les teneurs en phosphore assimilable révèlent
une bonne richesse des sols en cet élément pour la
totalité des sites (> 20 ppm). Seul le site El fahs présente
une richesse moyenne en cet élément (15 ppm).
Les sites prospectés sont moyennement à riches
en potassium assimilable, ceci ne justifie pas les apports en engrais
potassique.
L'analyse factorielle par correspondance
réalisée pour l'ensemble des données climatiques et
édaphiques a permis d'expliquer 87,89 % de la variation totale à
travers les axes 1 et 2.
L'axe 1 absorbe 59,58 % de la variation totale. Cet axe est
défini de son coté positif par l'altitude, alors qu'il est
représenté du côté négatif par la
pluviométrie.
L'axe 2 absorbe 28,31 % de la variation totale (Figure 13).
Cet axe est représenté essentiellement par les paramètres
édaphiques (phosphore assimilable, potassium échangeable,
matière organique, carbone, calcaire total, calcaire actif).
Dim 1 (59,58 %)
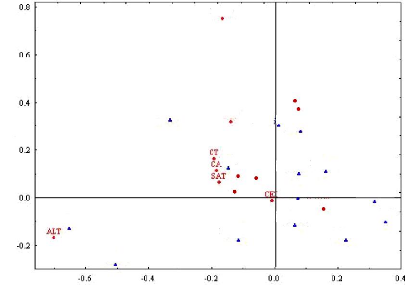
Dim 2 (28,31 %)
A. Chalou
Téboursouk
Smadah
P2O5
K2O
Medjez ElBab
El Fahs
Long Lat pH
Oued Zarga
Methline
Badrouna
Menzel Bouzelfa
Goubellat
MO
C
Ben Arous
P
M. Jalta
Tunis
Ghzéla
Figure 13: Projection plane des 2 principaux
axes 1 et 2 discriminants avec les sites et données
pédoclimatiques relatives. Lat: latitude; Long: longitude; Alt:
altitude; SAT: saturation en eau; CE: conductivité électrique;
CT: calcaire total; CA: calcaire actif; MO: matière organique; C:
carbone; P2O5: phosphore assimilable; K2O: potassium
échangeable; P: cumul pluviométrique.
Les sites Téboursouk et Ain Chalou se distinguent par
les altitudes les plus importantes respectivement 484 et 318 m. Alors que les
stations Tunis et Ghzéla sont caractérisées par les plus
faibles altitudes respectivement 10 et 27 m.
Les sites Smadah, Oued Zarga, et Goubellat forment un groupe
qui se distingue essentiellement par la richesse de leurs sols en phosphore
assimilable, et de façon moins importante par la teneur en
matière organique.
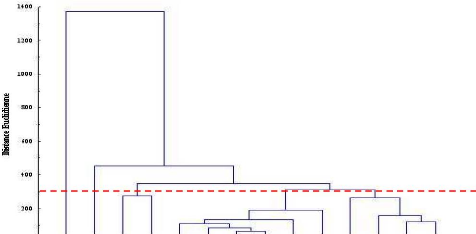
Mateur Jalta Ghzéla Téboursouk Smadah Menzel
Badrouna Methline El Khir Oued Inat A Chalou El Fahs Goubellat Medjez El Bab
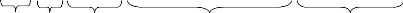
Bouzelfa Zarga
Groupe1 Groupe2 Groupe3 Groupe4 Groupe 5
Figure 14: Dendrogramme de similarité des
sites selon les paramètres pédoclimatiques (méthode
UPGMAdistance euclidienne).
La comparaison des paramètres édaphiques et
climatiques en utilisant l'indice de similarité selon la méthode
UPGMA à une distance euclidienne de 300 fait apparaître 5 groupes
distincts (Figure 14):
- groupe 1: ce groupe ressort le site Mateur
Jalta en solitaire. Cette station se distingue par une abondante
pluviométrie (1560 mm), et des sols à faible saturation en eau
(42 %) avec des teneurs importantes en carbone;
- groupe 2: il engendre la station Ghzéla
qui se distingue par une faible altitude (27 m), et des sols pauvres en
matière organique;
- groupe 3: il est représenté
par 2 sites Téboursouk et Smadah, à topographie montagneuse,
altitude moyenne de 401 m, terres riches en calcaire actif (24 %), saturation
élevée (60 %), et pluviométrie moyenne de 468 mm;
- groupe 4: Les stations Tunis, Oued Zarga,
Menzel Bouzelfa, Methline, Ben Arous et Badrouna forment ce
groupe et se caractérisent par les sols les plus riches en
matière organique ( 2,87 %); et
- groupe 5: les stations Ain Chalou, El Fahs,
Goubellat et Medjez El Bab spécifiques à ce groupe se distinguent
par une faible pluviométrie de 334 mm (Tableau 8).
Tableau 8: Caractéristiques
pédoclimatiques des groupes spécifiques aux sites à une
distance euclidienne de 300.
|
Groupes
|
Alt
|
pH
|
SAT
|
CE
|
CT
|
CA
|
MO
|
C
|
P2O5
|
K2O
|
P
|
|
|
|
%
|
mS.cm-1
|
%
|
%
|
%
|
%
|
ppm
|
ppm
|
(mm)
|
|
1
|
270
|
7,9
|
45
|
0,9
|
33
|
20
|
2,3
|
1,4
|
66
|
450
|
1560,1
|
|
2
|
27
|
8,2
|
52
|
1,5
|
56
|
23
|
0,7
|
0,4
|
25
|
300
|
751,3
|
|
3
|
401
|
7,7
|
60
|
0,75
|
54
|
24
|
0,95
|
0,55
|
130
|
620
|
468,0
|
|
4
|
109
|
7,8
|
48,3
|
0,85
|
36,5
|
14,8
|
2,87
|
1,65
|
91,3
|
470
|
534,5
|
|
5
|
172
|
8,1
|
52
|
1,05
|
49,3
|
21
|
0,9
|
0,53
|
58,5
|
308,3
|
334,2
|
Alt: altitude; SAT: saturation en eau; CE: conductivité
électrique; CT: calcaire total; CA: calcaire actif; MO: matière
organique; C: carbone; P2O5: phosphore assimilable; K2O: potassium
échangeable; P: cumul pluviométrique.
1. 2. Caractérisation agronomique des sullas
La croissance et la production du sulla cultivé varient
significativement d'un site à un autre. Au stade floraison, la meilleure
croissance en hauteur a été de 137,4 cm, enregistrée dans
le site Ben Arous. Alors que, les plus faibles couverts végétaux
ont été de 11,2 cm de haut à Goubellat.
Concernant les paramètres de production du sulla, les
meilleurs rendements en fourrage sec ont été enregistrés
à Tunis, Ain Chalou, Badrouna et Methline respectivement de 10,73;
10,27; 10,01; et 9,91 t/ha. Dans ces sites, la culture atteint et
dépasse même le potentiel productif moyen de la
variété Bikra 21 de première année estimé
à 6,5 t/ha. Bien que les rendements en biomasse sèche dans ces
sites soient comparables, la qualité du fourrage sous forme de
protéines brutes a été de 18 ,41% à Tunis, mais
très faible à Badrouna (7,85 %) (Tableau 9).
De point de vue production grainière, les stations Oued
Zarga et Téboursouk se distinguent par les meilleurs rendements
respectivement 2114 et 2032 kg/ha. Dans les stations Menzel Bouzelfa, ces
rendements diminuent pour atteindre 620 kg/ha; alors qu'à Goubellat les
rendements grainiers sont nuls.
Tableau 9: Variables quantitatives et
qualitatives relatives à la culture du sulla dans les stations
prospectées.
|
Paramètres Sites
|
NOD (nodules /plante)
|
PSN
(mg/ plante)
|
PMN (mg/ nodule)
|
H
(cm)
|
|
BSA
(t/ha)
|
PB
(% MS)
|
R
(kg/ha)
|
SUL ADV
|
JSF
|
|
(plant/m2)
|
|
Medjez El
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Bab
|
28
|
f
|
25,38
|
h
|
0,85
|
ef
|
64,5
|
def
|
4,96
|
d
|
9,49
|
de
|
1146
|
f
|
75
|
102
|
177
|
|
Smadah
|
64
|
a
|
68,1
|
bc
|
1,1
|
d
|
71,1
|
cde
|
6,69
|
bc
|
17,13
|
a
|
1410
|
e
|
62
|
57
|
173
|
|
Ghzéla
|
48
|
c
|
76,62
|
b
|
1,62
|
c
|
75,8
|
cd
|
5,63
|
bcd
|
12,92
|
c
|
1662
|
cd
|
103
|
67
|
180
|
|
Téboursouk
|
48
|
c
|
59,25
|
cd
|
1,24
|
d
|
61,1
|
ef
|
6,26
|
bcd
|
17,4
|
a
|
2032
|
ab
|
49
|
27
|
200
|
|
Tunis
|
53
|
bc
|
94,43
|
a
|
1,76
|
bc
|
110, 5
|
b
|
10,73
|
a
|
18,41
|
a
|
1826
|
bc
|
121
|
35
|
168
|
|
Oued zarga
|
18
|
g
|
40,93
|
g
|
2,32
|
a
|
82,5
|
c
|
6,81
|
b
|
16,79
|
ab
|
2114
|
a
|
58
|
58
|
177
|
|
A Chalou
|
68
|
a
|
72,18
|
b
|
1,08
|
de
|
112
|
b
|
10,01
|
a
|
11,46
|
cd
|
1505
|
de
|
79
|
53
|
193
|
|
El Fahs
|
32
|
ef
|
48,22
|
fg
|
1,59
|
c
|
71,7
|
cde
|
6,13
|
bcd
|
13,97
|
bc
|
1593
|
de
|
72
|
74
|
167
|
|
Ben Arous
|
36
|
de
|
52,12
|
de
|
1,54
|
c
|
137,4
|
a
|
6,93
|
b
|
12,94
|
c
|
1521
|
de
|
44
|
23
|
175
|
|
Mateur Jalta
|
54
|
b
|
86,83
|
a
|
1,62
|
c
|
73,5
|
cd
|
5,29
|
cd
|
12,45
|
c
|
1059
|
f
|
94
|
85
|
168
|
|
Menzel
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Bouzelfa
|
18
|
g
|
15,34
|
i
|
0,84
|
f
|
57,4
|
f
|
2,44
|
e
|
13,6
|
c
|
620
|
g
|
31
|
34
|
165
|
|
Methline
|
29
|
f
|
53,9
|
de
|
1,91
|
b
|
64,6
|
def
|
9,91
|
a
|
10,46
|
de
|
1530
|
de
|
98
|
32
|
169
|
|
Badrouna
|
38
|
d
|
49,47
|
efg
|
1,29
|
d
|
121,5
|
b
|
10,27
|
a
|
7,85
|
ef
|
1685
|
c
|
112
|
54
|
178
|
|
Goubellat
|
0
|
h
|
0
|
j
|
0
|
g
|
11,2
|
g
|
0,21
|
f
|
5,86
|
f
|
0
|
h
|
54
|
112
|
160
|
|
Moyenne
générale
|
38
|
|
53,48
|
|
1,34
|
|
79,72
|
|
6,59
|
|
12,82
|
|
1407
|
|
75,14
|
58,1
|
175
|
|
LSD 5 %
|
6
|
|
9,169
|
|
0,237
|
|
12,06
|
|
1,41
|
|
1,423
|
|
250,84
|
|
|
|
|
SUL: densité de sulla; ADV: densité des
adventices; JSF: nombre de jours entre le semis et la floraison; H: hauteur de
la végétation; BSA: biomasse sèche aérienne; PB:
teneur en protéines brutes; R: Rendement en graines; NOD: nombre de
nodules; PSN: poids sec nodulaire; PMN: poids moyen d'un nodule.
L'analyse des paramètres de nodulation
révèle un nombre particulièrement élevé des
nodules dans les racines de sulla de Ain Chalou et Smadah respectivement 68 et
64 nodules par plant. Contrairement à ces sites, le sulla de Menzel
Bouzelfa est nettement moins nodulé (18 nodules/plante). Alors
qu'à Goubellat, aucune formation nodulaire n'a été
observée, ce qui témoigne d'une absence de symbiose
sulla/rhizobium dans cette région.
La nodulation dans ces stations varie en nombre, mais aussi en
poids. Le poids moyen de nodules par plante le plus faible est
enregistré à Menzel Bouzelfa (15,34 mg/plante). Cette masse est
5,6 à 6,1 fois plus élevée respectivement à Mateur
Jalta (86,83 mg/plante) et Tunis (94,43 mg/plante). La forme, la taille, et la
couleur des nodules sont aussi variables selon les sites. Oued Zarga se
caractérise par des nodules particulièrement gros et
rassemblés en amas (Figure 15). En effet, le poids moyen d'un nodule est
significativement plus important dans ce site (2,32 mg/nodule).
Paradoxalement, les nodules de Menzel Bouzelfa sont
particulièrement petits (0,84 mg/nodule) et de couleur verdâtre
signe d'inefficience symbiotique.
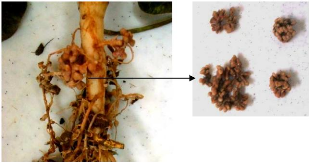
Figure 15: Morphologie de nodules rhizobiales
sur racines de sulla dans le site Oued Zarga.
1. 3. Etude de la variabilité des sullas
L'analyse en composantes principales relative aux variables
quantitatives et qualitatives mesurées dans les parcelles à sulla
révèle que les 2 premières composantes regroupent 67,5 %
de la variation totale (53,53 et 13,97 % respectivement pour la première
et la deuxième composante principale):
- l'axe 1 première composante principale est
corrélé positivement aux paramètres rendement en graines,
biomasse sèche aérienne, hauteur de végétation,
poids sec nodulaire, poids moyen d'un nodule et nombre de nodules/plante; et
- l'axe 2 est représenté positivement par les
densités de sulla et adventices. Du côté négatif,
cet axe résume une tendance pour les valeurs élevées de la
teneur en protéines brutes ainsi que le nombre de jours entre le semis
et la floraison.
Le côté positif de l'axe 1 absorbe 71 % des sites
traduisant une bonne nodulation et une importante production en fourrage et en
graines du sulla dans ces stations. Alors que le côté
négatif de cet axe est représenté par les sites à
faible productivité de sulla et à densité d'adventices
élevée (Goubellat, Medjez El Bab) (Figure 16).
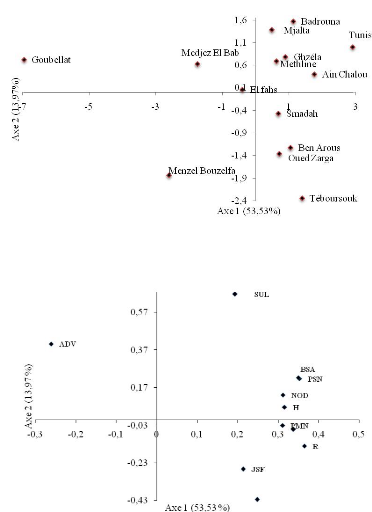
A
B
Figure 16: Projections planes des deux
principaux axes discriminants avec les 14 sites prospectés (A) et les
paramètres mesurés (B).
A une distance euclidienne de 60, le dendrogramme de
similarité a mis en évidence cinq groupes régionaux de
culture de sulla (Figure 17).
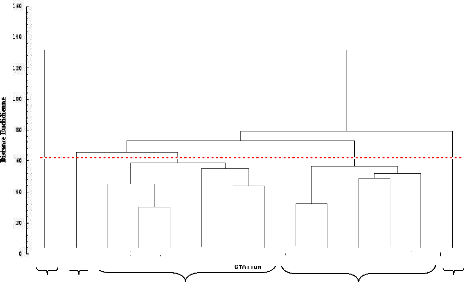
Tunis
Ghzéla Badrouna Ain
Chalou
Goubellat Menzel
Bouzelfa
El Fahs Oued
Zarga
Methline Smadah Téboursouk Mateur
Jalta
Medjez
El Bab
Ben
Arous
Groupe 1 Groupe 2 Groupe 3 Groupe 4 Groupe 5
Figure 17: Dendrogramme de similarité des
sullas cultivés dans les stations prospectées (méthode
UPGMA selon la distance euclidienne).
- groupe 1: Ce groupe englobe une seule
culture de sulla (Goubellat) caractérisée par une croissance en
hauteur au stade floraison limitée à 11 cm et une absence de
nodulation. La culture dans ce site se distingue aussi par les plus faibles
rendement en biomasse sèche aérienne (0,21 t /ha); teneur en
protéines brutes (5,86 %); ainsi qu'une absence de production de graines
(0 kg/ha).
- groupe 2: dans ce groupe une seule station
est représentée (Menzel Bouzelfa) qui se distingue par la plus
faible densité de peuplement en sulla (31 plant/m2) et une
faible croissance en hauteur des plants (57,4 cm). Au niveau racinaire les
plants de sulla présentent une nodulation limitée en nombre (18,4
nodules/plant) et en poids (15,34 mg/plant). Concernant la productivité
de la culture, ce groupe présente de faibles rendements de biomasse
sèche (2,4 t/ha) et graines (621 kg/ha).
- groupe 3: il est représenté
par la culture de sulla dans les sites de Medjez El Bab, El Fahs, Oued Zarga,
Methline, Smadah et Téboursouk. Ce groupe se caractérise par des
densités de peuplement de sulla relativement faibles (69
plants/m2) et par les teneurs en protéines brutes ainsi que
les rendements en graines les plus élevés respectivement 14,2 %
et 1630 kg/ha.
- groupe 4: ce groupe englobe les sullas des
stations de Ghzéla, Tunis, Ain Chalou, Mateur Jalta et Badrouna. Il se
distingue par une densité élevée de sulla (102
plantes/m2), une importante nodulation en nombre (52 nodules/plant)
et en poids (76 mg/plant); ainsi que des rendements élevés en
biomasse sèche aérienne (8,38 t/ha).
- groupe 5: seulement une culture de sulla du
site de Ben Arous constitue ce groupe qui se caractérise par la plus
faible densité d'adventices (23 plants/m2) et la meilleure
croissance en hauteur du sulla (137,4 cm) (Tableau 10).
Tableau 10: Répartition en groupes des
cultures de sulla selon la moyenne des paramètres mesurés.
|
Groupes
|
SUL
|
ADV
|
JSF
|
H
cm
|
BSA
t/ha
|
PB
%
|
R
kg/ ha
|
NOD
nodules/plant
|
PSN
mg/plant
|
PMN
mg/plant
|
|
Groupe 1
|
54
|
112
|
160
|
11,2
|
0,22
|
5,78
|
0
|
0
|
0
|
0
|
|
Groupe 2
|
31
|
34
|
165
|
57,4
|
2,45
|
13,6
|
621
|
18
|
15,34
|
0,84
|
|
Groupe 3
|
69
|
58
|
177
|
69,3
|
6,8
|
14,2
|
1630
|
37
|
49,7
|
1,5
|
|
Groupe 4
|
102
|
59
|
177
|
98,7
|
8,38
|
12,61
|
1547
|
52
|
76
|
1,47
|
|
Groupe 5
|
44
|
23
|
175
|
137,4
|
6,93
|
12,94
|
1521
|
36
|
52,12
|
1,55
|
SUL: densité de sulla; ADV: densité des
adventices; JSF: nombre de jours entre le semis et la floraison; H: hauteur de
la végétation; BSA: biomasse sèche aérienne; PB:
teneur en protéines brutes; R: Rendement en graines; NOD: nombre de
nodules; PSN: poids sec nodulaire; PMN: poids moyen d'un nodule.
1. 4. Discussions
L'analyse des corrélations montre que la croissance et
la productivité du sulla dépendent essentiellement de
l'activité symbiotique dans les sites prospectés. En effet, la
croissance en hauteur, la teneur en protéines brutes ainsi que les
productions de fourrage sec et de graines sont significativement
corrélés aux paramètres de nodulations mesurés
(NOD, PSN, PMN) (Tableau 11). Ce résultat met en évidence l'effet
bénéfique de la nodulation dans les stations du groupe 4 sur les
rendements en fourrages et en graines respectivement 8,38 t /ha et 1630 kg/ha
et explique la faible productivité fourragère dans les sites
Menzel Bouzelfa et Goubellat où la nodulation est respectivement faible
et absente.
Cette variation de la nodulation dans ces sites est en
relation avec la fréquence d'introduction du sulla dans ces sites. En
effet, l'historique des parcelles montre que les stations n'ayant pas
introduits cette fabacée dans le passé comme Menzel Bouzelfa et
Goubellat ont présenté une déficience de nodulation dans
la culture de sulla. Alors que tous les autres sites ayant déjà
introduit cette espèce dans la rotation culturale ont
présenté une bonne nodulation en poids et nombre. Ce
résultat peut être expliqué par la présence ainsi
que l'abondance des souches bactériennes spécifiques. Dans ce
sens, Peoples et al. (1995) et Sturz et al. (1997) ont
montré que la probabilité d'existence du rhizobium
spécifique à une culture de légumineuse augmente avec la
fréquence de son introduction dans un système de culture.
Le poids moyen d'un nodule est positivement
corrélé au rendement en graines (r = 0,80). Cet effet est
particulièrement visible au site Oued Zarga où on a
enregistré le meilleur rendement en graines (2114 kg/ha). Dans ce site,
les nodules particulièrement gros (2,32 mg/nodule) ont une
activité symbiotique qui dure plus longtemps que celle des nodules de
petites tailles assurant par conséquent les besoins en azote pour la
culture pendant la période de remplissage des graines (L'taief et
al., 2009). Paradoxalement, les nodules de petite taille perdent
rapidement leur pouvoir fixateur affectant négativement les rendements
grainiers (Menzel Bouzelfa).
La corrélation significative entre le poids sec
nodulaire et la densité de sulla par m2 peut être expliquée
par l'accroissement dans ces sites de la densité racinaire responsable
de la libération des flavonoïdes. La concentration de ces derniers
dans le sol conduit à la stimulation des nodules en nombre et en masse
(Hopkins 2003; Macheix et al., 2005).
Les rendements du sulla sont aussi influencés par les
densités des plants et adventices. La biomasse sèche
aérienne est corrélée positivement à la
densité de sulla (r = 0,64), alors que la présence d'adventices
est corrélée négativement avec les rendements en fourrage
(r = -0,54) et graines (r = -0,55). En effet, la parcelle
désherbée deux fois de Ben Arous s'est caractérisée
par les densités d'adventices les plus faibles, engendrant ainsi un
effet positif sur la croissance et la production du sulla. Ce désherbage
ne semble par ailleurs pas affecter la nodulation. Rennie et al.
(1984) ont montré que l'application de 5 herbicides
différents n'avait aucun effet ni sur la fixation symbiotique, ni sur la
production des graines d'une culture d'haricot. Contrairement à
Lindström (1985) qui a rapporté une altération de la
morphologie des racines ainsi qu'une réduction du nombre de nodules et
de l'activité de la nitrogénase des plants suite à une
application d'herbicide sur Trifolium pratense L..
Parmi les caractères environnementaux, l'altitude est
significativement corrélée (r = 0,64) à la durée du
cycle de la plante depuis le semis jusqu'à la floraison donc la
précocité. Cet effet a été observé dans les
stations Smadah et Téboursouk situées en zone montagneuse
où l'altitude serait responsable de l'allongement du cycle du sulla et
influencerait ainsi positivement les rendements de la culture en graines. Dans
ce sens, Sarno et al. (1978) ont constaté qu'en altitude, le
sulla tend à fleurir tardivement et à produire plus de fourrage.
Parmi les paramètres édaphiques, le pH basique a un effet positif
(r = 0,55) sur la densité du couvert végétal en sulla, ce
qui confirme l'adaptation de cette culture aux sols alcalins (Moore et al.,
2006). Par contre, une corrélation négative a
été observée avec les teneurs en matière organique
(r = -0,69) et phosphorée (r = -0,8) du sol confirmant les observations
de réalisées par Bordeleau et Prévost (1994).
A propos de la pluviométrie totale annuelle, son effet
n'a pas été corrélé significativement aux
paramètres de rendements. Les fortes pluviosités ne sont pas
toujours à l'origine des bons rendements. Avec une hauteur de pluie de
1560 mm, Mateur Jalta n'a pas eu les meilleures biomasses fourragères et
grainières respectivement 5,29 t/ha et 1059 kg/ha. Alors qu'Ain Chalou,
des rendements meilleurs ont été obtenus de l'ordre de 10 t/ha et
1146 kg/ha de fourrage sec et graines, et ce avec seulement 243 mm de pluie par
an. Ces observations confirment celles de Ben jeddi (2005) et de Martiniello
(2000) relatives aux potentialités de production du sulla en condition
de pluviométrie limitante.
1. 5. Conclusion
Une variabilité significative de croissance et production
du sulla a été démontrée entre les divers sites de
production de semences. Cette variabilité est liée aux:
- paramètres environnementaux tels que
l'altitude et le pH;
- densités des adventices et plants de
sulla; et
- nodulation et fixation de l'azote.
En conséquence, une collection de nodosités
racinaires a été réalisée en vue d'une
caractérisation des bactéries nodulant le sulla.
2. ETUDE DE LA DIVERSITE DES MICROSYMBIOTES DU
SULLA
L'isolement des bactéries à partir des nodules
du sulla collectés des différents sites prospectés a
permis de constituer une collection de 50 isolats. Dans ce chapitre, on se
propose d'étudier la diversité phénotypique et
génétique de ces isolats.
2. 1. Caractérisation phénotypique des
rhizobiums
La caractérisation phénotypique des
différentes souches nodulant le sulla permet d'une part de
démontrer les variations phénotypiques entre les souches
rhizobiales et d'autre part sélectionner celles qui présentent
une bonne capacité de fixation de l'azote atmosphérique en
condition de culture stressante, comme le pH, la salinité, le calcaire
et la sècheresse.
2. 1. 1. Evaluation de l'infectivité des
isolats
Le contrôle de la capacité infective de la
collection rhizobiale exige le passage par un test de nodulation. Parmi les 50
isolats retenus, 45 ont été capables d'induire des nodules sur
les racines du sulla. Alors que les plants inoculés par les cinq isolats
restants se sont comportés comme les témoins non
inoculés.
2. 1. 2. Critères morphologiques
2. 1. 2. 1. Description des isolats
La coloration Gram a révélé la
présence d'une seule souche Gram+ (Hc12) parmi l'ensemble des
isolats testés. Le reste des isolats sont des gram- en forme
de bâtonnets de l'ordre de à 0,5 à 1 um de long (Figure
18).
|
Bactéries en forme
de bâtonnet
|
|
Figure 18: Observation sous microscope (x
103) des souches rhizobiales Gram-.
Ces isolats ont formé sur le milieu YEM/RC solide,
après 5 jours d'incubation à 28°C des colonies circulaires
à ovoïdes de diamètre variable et d'aspect différents
(Figure 19). La vitesse de prolifération est variable et les
premières colonies apparaissent au bout de 2 jours. Un mucus de
consistance coulante et d'aspect translucide a été observé
chez les souches à croissance rapide; alors que celles à
croissance plus lente avaient développé une consistance
épaisse et visqueuse avec une teinte blanchâtre.
A B C
Figure 19: Aspect des colonies
bactériennes sur milieu de culture YEMA/RC. A: diamètre 1-2mm, B:
diamètre 3-4 mm, C: diamètre 5-6 mm.
2. 1. 2. 2. Tolérance à la
salinité
La limite de tolérance sur milieu TY liquide des isolats
testés a été limitée à 700 mM,
alors que sur milieu gélosé, les seuils de
tolérance à la salinité ont été de 850 mM
(Figure 20). Ce résultat suggère une meilleure fiabilité
des tests en milieu liquide.
0 Mm 150 Mm 700mM 850mM
Souches sensibles
Souches tolérantes
Figure 20: Croissance des souches rhizobiales
à des teneurs croissantes en NaCl sur milieu gélosé.
L'évaluation de la tolérance des souches
à la salinité (150 mM) sur milieu liquide a montré que la
totalité des isolats bactériens présente une croissance
similaire au témoin (0 mM). A 200 mM de NaCl, la majorité des
isolats (84 %) arrivent à se développer. A partir de 400 Mm de
sel dans le milieu, 44 % de souches arrive à croitre. A une
concentration élevée de la salinité dans le milieu de
culture (700 mM), seulement 16 souches arrivent à se développer
(Tableau14). Tandis qu'aucune souche n'arrive à supporter la
concentration de 800 mM de NaCl (Figure 21).
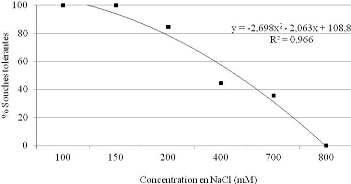
Figure 21: Cinétique de tolérance
des souches rhizobiales de sulla selon la salinité (NaCl) du milieu de
culture liquide.
Avec des souches R. sullae, El Boutari (2009) a
rapporté des niveaux de tolérance au sel entre 170 à 850
mM NaCl. Cependant, Squartini et al. (2002) ont trouvé des
spectres de tolérance plus limités, compris entre 290 à
548 mM de NaCl. Des niveaux de tolérance à la salinité
beaucoup plus élevés (1190-1700 mM NaCl) ont été
notés avec souches rhizobiales nodulant le Lupin (Zahran et al.,
1994; Raza et al., 2001).
2. 1. 2. 3. Tolérance au pH basique
Toutes les souches arrivent à croître normalement
dans des milieux à pH variant entre 7 et 8. A partir d'un pH de 8,5,
deux souches parmi les 45 testées cessent de se développer.
Tandis que 82,2 % des souches ont été capables de croître
normalement jusqu'à un de pH 9,5. Ce n'est qu'à partir d'un pH de
10 que le pourcentage des souches tolérantes baisse à 55,6%.
Le pH 10,5 représente ainsi une limite de tolérance
des rhizobiums collectés (Tableau 12). En effet aucune souche n'a
été capable de croitre à un pH de 11 (Figure 22).
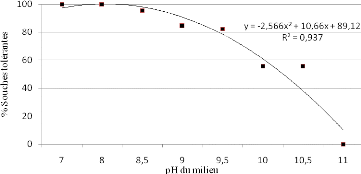
Figure 22: Cinétique de tolérance
des souches rhizobiales de sulla selon la variation du pH du milieu de culture
liquide.
Sur 62 souches isolées de l'espèce Hedysarum
coronarium L., El Boutari (2009) a rapporté une tolérance au
pH des rhizobiums spécifiques variante entre 9 et 9,5. Ce
résultat concorde avec les seuils de tolérance aux pH
trouvés. Cette tolérance se trouve aléatoire d'une
espèce à une autre (Jordan, 1984). En effet, Glenn et Dilworth
(1994) ont rapporté que le groupe des souches bactériennes
à croissance rapide a tendance à tolérer des milieux
basiques allant jusqu'à un pH de10. Dans ce sens, Rao et al.
(1994) ont isolé des rhizobiums de pois pouvant tolérer des
pH supérieurs à 11,5. Quant à Diatloff (1970), il a
rapporté que la le Bradyrhizobium japonicum présente une
croissance limitée à pH 8,5.
2. 1. 2. 4. Tolérance au stress hydrique
L'ensemble des souches de la collection a supporté le
stress hydrique jusqu'à -0,5 MPa. Ce niveau de stress a
été la limite de tolérance pour 31 % des souches, alors
que la majorité des isolats de la collection (60 %) ont
présenté une tolérance jusqu'à -0,9 MPa. Uniquement
quatre souches ont pu supporter le niveau -0,95 Mpa de stress hydrique (Figure
23, Tableau 12). Ce niveau a largement été dépassé
par des souches isolées de nodosités de sulla par El Boutari
(2009), qui a trouvé une marge de tolérance au stress hydrique
entre 0 et - 1,5 MPa.
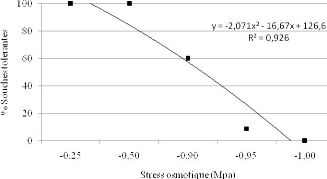
Figure 23: Cinétique de tolérance
des souches rhizobiales de sulla selon la variation de stress osmotique du
milieu de culture liquide.
2. 1. 2. 5. Tolérance au stress calcaire
L'analyse de la tolérance des souches de la collection
au stress calcaire engendré par le CaCO3 a révélé
une croissance normale de l'ensemble des 45 souches à des niveaux de
calcaire variables de 0 à 2 M (Figure 24). En milieu liquide, l'addition
progressive du CaCO3 provoque rapidement une saturation empêchant la
lecture par spectrophotométrie.
La variation du calcaire jusqu'à 2 M n'a pas
engendré d'effet inhibiteur sur la croissance des souches à
l'état libre. Cette faculté de croissance à de fortes
teneurs en calcium pourrait être en relation avec la nature des
protéines Ca2+ dépendante et constituant la membrane
bactérienne (Gobat, 1998; Dardanelli et al., 2003).
0 M 0,5 M 1M 1,5M 2 M
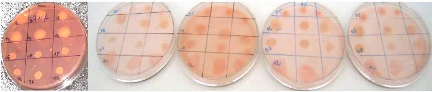
Figure 24: Croissance des souches sur milieu
YEM/RC solide enrichi en calcaire.
Tableau 12: Origine des souches nodulant le
sulla avec leurs limites de tolérance aux stress abiotiques.
|
Sites
|
Souches
|
pH
|
NaCl
|
PEG
|
|
|
|
(mM)
|
(Mpa)
|
|
HC1
|
9,5
|
150
|
-0,50
|
|
Medjez El
|
H
|
10,0
|
200
|
-0,90
|
|
Bab
|
HC3
|
9,0
|
200
|
-0,90
|
|
HC4
|
10,0
|
200
|
-0,90
|
|
HC5
|
8,5
|
400
|
-0,95
|
|
HC6
|
9,0
|
200
|
-0,90
|
|
Smadah
|
HC7
|
8,5
|
400
|
-0,95
|
|
HC8
|
9,0
|
200
|
-0,90
|
|
HC9
|
9,0
|
200
|
-0,90
|
|
HC10
|
10,5
|
700
|
-0,90
|
|
HC11
|
10,5
|
700
|
-0,90
|
|
Ghzéla
|
|
|
|
|
|
HC12
|
10,5
|
700
|
-0,90
|
|
HC13
|
10,5
|
700
|
-0,90
|
|
HC14
|
10,0
|
200
|
-0,90
|
|
HC15
|
10,0
|
200
|
-0,90
|
|
Oued Zarga
|
|
|
|
|
|
HC16
|
10,0
|
200
|
-0,90
|
|
HC17
|
10,5
|
700
|
-0,90
|
|
HC18
|
10,0
|
200
|
-0,90
|
|
HC19
|
10,0
|
200
|
-0,90
|
|
H0
|
10,0
|
200
|
-0,90
|
|
Téboursouk
|
H1
|
10,0
|
200
|
-0,90
|
|
H2
|
10,0
|
200
|
-0,90
|
|
H3
|
10,0
|
200
|
-0,90
|
|
H4
|
10,0
|
200
|
-0,90
|
|
H5
|
10,5
|
150
|
-0,50
|
|
H6
|
10,5
|
200
|
-0,90
|
|
H7
|
10,5
|
150
|
-0,50
|
|
H8
|
10,5
|
150
|
-0,50
|
|
Tunis
|
H9
|
10,5
|
200
|
-0,90
|
|
HC30
|
10,5
|
150
|
-0,50
|
|
HC31
|
10,5
|
150
|
-0,50
|
|
HC32
|
10,5
|
150
|
-0,50
|
|
HC33
|
10,5
|
400
|
-0,95
|
|
Ain Chalou
|
HC34
|
10,5
|
700
|
-0,90
|
|
HC35
|
9,0
|
400
|
-0,95
|
|
HC36
|
10,5
|
700
|
-0,50
|
|
HC37
|
10,5
|
700
|
-0,50
|
|
HC38
|
10,5
|
700
|
-0,50
|
|
HC39
|
10,5
|
700
|
-0,50
|
|
El Fahs
|
HC40
|
10,5
|
700
|
-0,90
|
|
HC41
|
10,5
|
700
|
-0,50
|
|
HC42
|
10,5
|
700
|
-0,50
|
|
HC43
|
10,5
|
700
|
-0,50
|
|
HC44
|
10,5
|
700
|
-0,90
|
|
HC45
|
10,5
|
700
|
-0,90
|
2. 1. 3. Analyse des critères phénotypiques
par UPGMA
La caractérisation phénotypique des 45 souches
bactériennes isolées des racines de sulla a été
basée sur 27 caractères. Les résultats ont
été traités par UPGMA, le dendrogramme qui en
dérive est représenté par la figure 25. Les
caractères les plus discriminants de cette analyse ont été
groupés et représentés dans le tableau 13.
A 65 % de niveau de similitude, les souches se trouvent
réparties en trois groupes:
- le groupe1 est formé par des souches isolées
essentiellement de deux stations (Tunis et El Fahs); seule la souche HC1 est
originaire de la station Medjez El Bab. Ces souches ont des critères
morphologiques communs relatifs aux colonies particulièrement au niveau
de la présence de relief, de la consistance épaisse et de
l'absence du noyau. Dix souches parmi les 13 de ce groupe forment des colonies
à diamètre variable de 3 à 4 mm après 5 jours
d'incubation. Concernant les critères physiologiques, les souches de ce
groupe sont caractérisées par un niveau de tolérance au
stress hydrique de -0,5 MPa, un pH majoritairement élevé (10,5)
et un niveau de tolérance au stress salin (NaCl) variable de 150
à 700 mM;
- le groupe 2 englobant 55 % des souches, est le plus
hétérogène de la collection avec des souches appartenant
à 6 stations différentes; et
- le groupe 3 renferme les souches ayant induit une nodulation
non reproductible. Elles sont originaires de 3 stations différentes. Ces
souches forment des colonies transparentes, majoritairement (6/7 colonies) non
visqueuses, sans relief et absorbent le rouge Congo. Ces isolats sont
particulièrement tolérants au stress salin (700 mM) et aux pH
élevés (10,5).
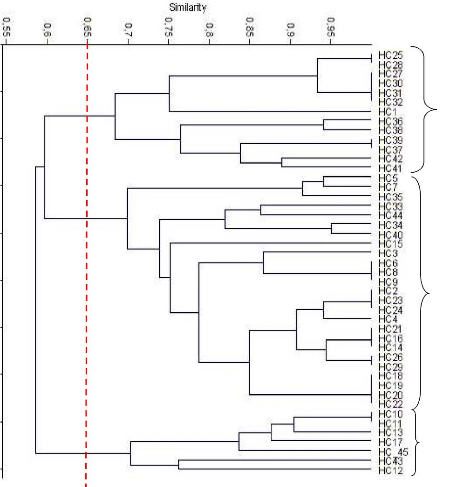
Groupe 1 Groupe 2 Groupe 3
Figure 25: Dendrogramme de similarité
entre les souches de la collection pour l'ensemble des caractères
phénotypiques (méthode UPGMA selon l'indice de Jaccard).
Tableau 13: Caractéristiques
phénotypiques des groupes de souches nodulant le sulla selon l'analyse
UPGMA.
|
Groupe 1
|
Groupe 2
|
Groupe 3
|
|
Nombre de souches
|
13
|
25
|
7
|
|
Infectivité:
|
|
|
|
|
Répétitive
|
10
|
24
|
0
|
|
Non répétitive
|
3
|
1
|
7
|
|
Diamètre des colonies:
|
|
|
|
|
1 à 2 mm
|
2
|
0
|
4
|
|
3 à 4 mm
|
10
|
20
|
2
|
|
5 à 6 mm
|
1
|
5
|
1
|
|
Absorption Rouge Congo:
|
|
|
|
|
absorbe
|
1
|
0
|
6
|
|
n'absorbe pas
|
12
|
25
|
1
|
|
Forme de la colonie:
|
|
|
|
|
circulaire
|
11
|
24
|
4
|
|
ovoïde
|
2
|
1
|
3
|
|
Présence de noyau:
|
|
|
|
|
avec noyau
|
0
|
1
|
3
|
|
sans noyau
|
13
|
24
|
4
|
|
Transparence:
|
|
|
|
|
transparente
|
8
|
4
|
7
|
|
opaque
|
5
|
21
|
0
|
|
Consistance:
|
|
|
|
|
Coulante
|
0
|
2
|
2
|
|
épaisse
|
13
|
23
|
5
|
|
Relief:
|
|
|
|
|
sans relief
|
0
|
0
|
6
|
|
avec relief
|
13
|
25
|
1
|
|
Viscosité:
|
|
|
|
|
non visqueuse
|
5
|
15
|
1
|
|
visqueuse pH:
|
8
|
10
|
6
|
|
8,5
|
0
|
2
|
0
|
|
9
|
0
|
5
|
0
|
|
9,5
|
1
|
0
|
0
|
|
10
|
0
|
12
|
0
|
|
10,5
|
12
|
6
|
7
|
|
NaCl:
|
|
|
|
|
150 mM
|
7
|
0
|
0
|
|
200 mM
|
0
|
18
|
0
|
|
400 mM
|
0
|
4
|
0
|
|
700 mM
|
6
|
3
|
7
|
|
PEG 6000:
|
|
|
|
|
-0,5
|
13
|
0
|
1
|
|
-0,9
|
0
|
21
|
6
|
|
-0,95
|
0
|
4
|
0
|
2. 2. Caractérisation moléculaire des
souches nodulant le sulla
L'étude de la diversité génétique
entre les 45 isolats issus de nodosités de sulla porte graines
originaires de huit stations a été analysée par
différentes techniques.
2. 2. 1. Analyse de la diversité intra
spécifique par Rep-PCR
La Rep-PCR est utilisée pour l'étude de la
variabilité intra spécifique des rhizobiums. Par cette
méthode, les variations génétiques sont
détectées au niveau chromosomique. Utilisée avec
succès pour le typage d'isolats de grandes collections, cette technique
s'est révélée d'un bon pouvoir de résolution (Judd
et al., 1993; Leung et al., 1994; Louws et al.,
1996; Versalovic et al., 1994).
La séparation électrophorétique des produits
de l'amplification a montré une abondance de séquences dont le
nombre varie de 9 à 20 bandes par profil (Figure 26).
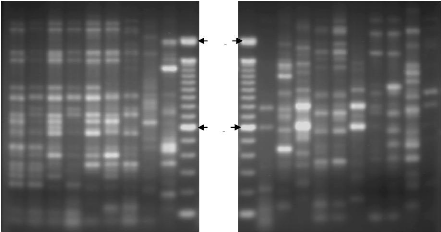
HC28 HC29 HC30 HC31 HC32 HC33 HC35 HC36 HC45 M M HC38 HC39 HC40
HC41 HC42 HC44 HC14 HC15 HC16 HC10
1500 pb
600 pb
Figure 26: Electrophorèse des amplifias
obtenus par Rep-PCR de quelques souches nodulant le sulla. M: marqueur
moléculaire 100pb.
La comparaison des différents profils a permis
d'établir un dendrogramme illustrant les relations
phylogénétiques entre les différentes souches (Figure 27).
Ce dernier a révélé l'existence d'une importante
diversité intra spécifique entre les souches de la collection.
Similarity
20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 95 100
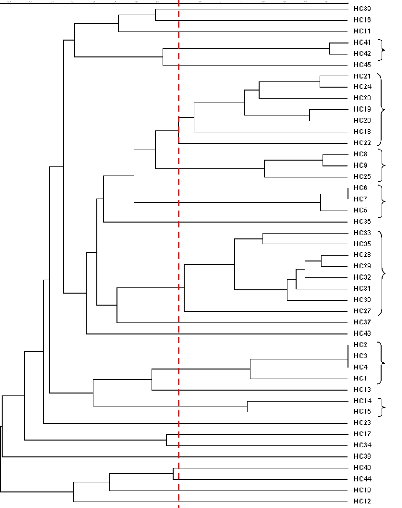
Groupe 1 Groupe 2 Groupe 3 Groupe 4 Groupe 5 Groupe 6 Groupe 7
Figure 27: Dendrogramme (UPGMA) illustrant les
relations génétiques estimées par l'indice de Dice
résultant de l'analyse par Rep-PCR des souches nodulant le sulla.
Un niveau de similitude de 100 % a été
noté entre deux souches originaires de Smadah et 3 autres de Medjez El
Bab; réduisant ainsi le nombre de génotypes de la collection
à 43. Ces isolats bien que représentés par des
génotypes similaires ont des caractéristiques
phénotypiques différentes (Tableau12), ce qui exclue
l'hypothèse de la présence de clones parmi les isolats.
En se situant à un niveau de similarité de 60 %,
on obtient 7 groupes et 15 lignages indépendants (Figure 27). Ces
groupes englobent les isolats à nodulation efficiente alors que les
endophytes non spécifiques à la culture sont
représentés par des lignages indépendants. L'analyse de
ces groupements révèle une corrélation entre la
diversité intra spécifique, la diversité
phénotypique et les origines géographiques des souches
(Tableau14).
De même, un regroupement de la majorité des
souches originaires de la station Téboursouk dans les mêmes
groupes a été observé; aussi bien pour les
caractères phénotypiques que génotypiques. Ce regroupement
concerne aussi les souches H, HC3 et HC4 de la station Medjez El Bab; ainsi que
6 souches parmi 9 de la collection de Tunis.
Tableau 14: Origines géographiques et
limites de tolérance au stress osmotique des souches dans chacun des
groupes délimités par l'analyse Rep-PCR à 60 % de
similitude.
|
Groupes
|
Nombre de
souches
|
Site d'origine
|
NaCl
(mM)
|
PEG
(Mpa)
|
pH
|
|
Groupe 1
|
2
|
El Fahs
|
700
|
-0,50
|
10,5
|
|
Groupe 2
|
7
|
Téboursouk
|
200
|
-0,90
|
10-10,5
|
|
Groupe 3
|
2
1
|
Smadah
Tunis
|
200-400
|
-0,9-0,95
|
8,5-9
|
|
Groupe 4
|
3
|
Smadah
|
150-200
|
-0,5-0,9
|
9-10,5
|
|
Groupe 5
|
7
1
|
Tunis
El Fahs
|
150-400
|
-0,5-0,95
|
9-10,5
|
|
Groupe 6
|
4
|
Medjez El Bab
|
150-200
|
-0,5-0,9
|
9 -10,0
|
|
Groupe 7
|
2
|
Oued Zarga
|
200
|
-0,90
|
10
|
2. 2. 2. Analyse de la diversité
intra-spécifique par PCR-RFLP de l'ADNr 16S
L'analyse du polymorphisme de la longueur des fragments de
restriction du gène de l'ADNr 16S amplifié par PCR a
été utilisée dans un second temps.
Cette méthode, qui est l'une des plus utilisées
pour l'identification des rhizobiums (Young et al., 2001) permet de
regrouper les souches bactériennes à un niveau de
résolution taxonomique qui s'étend de l'espèce au genre
(Heyndrickx et al., 1996).
Le gène ribosomique de l'ADNr 16S des 45 souches de
sulla a été amplifié. L'amplification a donné lieu
à une bande unique révélée par
électrophorèse chez l'ensemble des souches. La taille de la bande
a été évaluée visuellement par comparaison au
marqueur et correspond approximativement à 1500 pb (Figure 28).

1500 pb
Figure 28: Amplification de l'ADNr 16S de
quelques souches nodulant le sulla.
Le gène de l'ADNr 16S amplifié par PCR des 45
souches a été sujet à une digestion par 2 enzymes de
restriction (MspI, NdeII) (Figure 29). Les profils obtenus
par chaque enzyme et pour chaque souche ont été
désignés par des lettres alphabétiques (Tableau 15). Les
mêmes profils ont été comparés par paire afin
d'établir le ribotype correspondant à chaque souche.
Les profils obtenus montrent une variation des bandes en
nombre de 2 à 8 et en tailles (de 70 à 1300 pb) selon la souche
et l'enzyme. Un profil majoritaire (AA) représente 32 parmi les 45
souches de la collection. Le reste des isolats a donné des ribotypes
différents les uns des autres. Ce travail a été
complété par un séquençage de l'ADNr 16S des
souches ayant des profils différents ainsi que de 7 souches
représentatives du profil majoritaire (AA).
A B
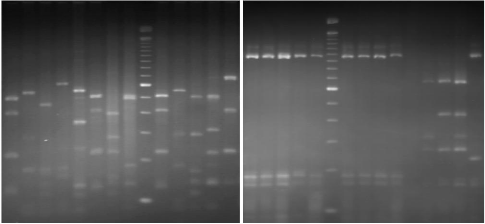
HC8 HC11 HC12 HC13 HC17 HC29 HC34 HC36 M HC14 HC16
HC45 HC38 HC39 HC24 HC25 HC26 HC27 HC28 M HC30 HC31 HC32 HC33 HC36
HC45 HC38 HC39
Figure 29: Profils
électrophorétiques de la restriction par RFLP de l'ADNr 16S
obtenus pour quelques souches de la collection après digestion par les
endo-nucléases MspI (A) et NdeII (B).
Tableau 15: Ribotypes des souches isolées
du sulla et déterminés par PCR/RFLP du gène de l'ADNr
16S
|
Profil
MspI
|
Profil
NdeII
|
Ribotype
|
Souches
|
|
A
|
A
|
AA
|
HC1, H, HC3, HC4, HC5, HC6, HC7, HC8, HC9, HC14, HC16, HC18,
|
|
|
|
HC19, H0, H1, H2, H3, H4, H5, H6, H7, H8,
H9, HC30, HC31,
HC32, HC33, HC35, HC37, HC41, HC42, HC44
|
|
B
|
B
|
BB
|
HC10
|
|
B
|
D
|
BC
|
HC11
|
|
C
|
D
|
CD
|
HC12
|
|
D
|
E
|
DE
|
HC13
|
|
E
|
F
|
EF
|
HC15
|
|
F
|
G
|
FG
|
HC17
|
|
G
|
H
|
GH
|
HC34
|
|
H
|
I
|
HI
|
HC36
|
|
I
|
J
|
IJ
|
HC38
|
|
J
|
K
|
JK
|
HC39
|
|
K
|
L
|
KL
|
HC43
|
|
L
|
M
|
LM
|
HC45
|
2. 2. 3. Séquençage du gène 16S
Le séquençage du gène de l'ADNr 16S a
révélé une similarité de plus de 99 % des souches
(Tableau 16) représentatives du ribotype AA avec R. sullae
souche IS 123T (Squartini et al., 2002). Les autres
ribotypes sont plutôt apparentés à des genres non
Rhizobium.
Tableau 16: Séquençage du
gène de l'ADNr 16S de quelques souches de la collection.
Ribotypes souches
AA R.sullae
BB S. melilotiBC ND
CD Cellulomonas sp.
DE ND
EF ND
FG Stenophomonassp.
GH Aurantimonas campestris
HI Xanthomonas campestris
IJ ND
JK Agrobacterium
KL ND
LM Enterobacter
*ND: non déterminé (séquençage en
cours de réalisation)
2. 3. Discussions
Une importante diversité phénotypique des
isolats qui semble dépendante des origines géographiques des
isolats a été trouvée (Tableau 12). Les souches les plus
tolérantes aux pH élevés (10 - 10,5) ont toutes
été isolées depuis les sites à pH de sols alcalins
(8,2 - 8,5). De même, les souches les plus tolérantes au stress
salin (700 mM) ont été isolées à partir des sites
de Ghzéla et El Fahs qui se caractérisent par les
conductivités électriques les plus élevées (1,4 -
1,5). L'existence de souches tolérantes à la salinité dans
les sites halomorphes peut être une indication de leur adaptation au
stress osmotique conséquente d'une augmentation de la concentration
d'ions et de la variation de l'humidité du sol durant les
périodes sèches (Mpepereki et al., 1997).
Cette diversité phénotypique est aussi
corrélée à la diversité génétique
intra spécifique révélée par la Rep-PCR qui semble
elle aussi dépendante de la distribution géographique des
isolats.
Ces résultats concordent bien avec ceux trouvés
par Richardson (2002) qui a noté une corrélation entre les
groupements génotypiques et l'origine géographique des isolats.
Dans le même sens, Zghan et al. (1999) ont aussi noté, en
utilisant la Rep-PCR, que les souches isolées à partir d'un
même cultivar et d'une même région ont appartenu au
même groupe génotypique. Contrairement à ces auteurs, il a
été souvent rapporté que la distribution des rhizobiums
est indépendante du site d'origine (Khbaya, 1998; Rejili, 2009; El
Boutari, 2009). Dans notre situation, il est possible que les
propriétés physico-chimiques des sols ainsi que l'exposition des
rhizobiums à l'activité agricole dans les stations soient
à l'origine de la diversité phénotypique et
génotypique des souches de la collection (Palmer et Young 2000; Andrade
et al., 2002; Laguerre et al., 2006). Dans ce sens, Giongo
et al. (2008) ont rapporté l'existence d'un haut niveau de
similarité génotypique entre des isolats nodulant le haricot
collecté depuis des champs cultivés dans le sud du Brésil.
Il est toute fois à noter que certaines souches tels que HC1 (Medjez El
Bab), HC5 (Smadah), ou encore H3 (Téboursouk) présentent des
caractéristiques phénotypiques et /ou génotypiques
différentes de celles des autres isolats des mêmes stations. Cette
distinction est probablement due à l'exposition de ces souches à
différentes niches ayant des propriétés physico-chimiques
variables.
L'analyse de la diversité génétique par
PCR-RFLP de l'ADNr 16S associé au séquençage du
gène 16 S confirme la haute spécificité symbiotique entre
H. coronarium L. et R. sullae (Glatzle et al.,
1986; Kishinevsky et al., 1996; 2003; Squartini et al.,
2002). Concernant les autres souches, il est possible qu'un transfert
horizontal de gènes de nodulation entre ces isolats soit à
l'origine de leur capacité infective (Moulin et al., 2001). Il
a été rapporté que les nodules de certaines
fabacées peuvent être colonisés par des bactéries
non fixatrices de l'azote. Ces microorganismes appelés aussi endophytes
ont même été décris dans le xylème des
racines de plants de luzerne (Gagné et al., 1987). Recuenco
et al. (2000) ont découvert que Pantoea agglomerans et
Pseudomonas fluorescens sont les endophytes les plus communs des
cultivars de petit pois. Tokala et al. (2002) ont signalé la
présence de Streptomyces lydicus dans les nodules de pois et
Bai et al. (2003) ont montré que Bacillus subtilis et
B. thuringiensis peuvent naturellement cohabiter les nodules du
haricot avec le symbiote Bradyrhizobium japonicum, et améliorer
ainsi la productivité de la culture.
Plus récemment, Benhizia et al. (2004) et
Mureso et al. (2008) ont signalé la présence de
bactéries non fixatrices de l'azote (Enterobacter cloacae,
Enterobacter kobei, Escherichia vulneris, Pantoea
agglomerans et Leclercia adecarboxylata) dans les nodules
racinaires du genre Hedysarum.
Ces souches qui ont temporairement nodulé le sulla
peuvent contenir des gènes de nodulations (Nif, Nod), d'où
l'intérêt de vérifier dans un travail ultérieur
l'existence de ces gènes.
2. 4. Conclusion
L'étude de la diversité des microsymbiotes
isolées des nodosités racinaires du sulla a
révélé une importante diversité phénotypique
en relation avec l'origine géographique des isolats. De point de vue
génétique, la caractérisation montre une importante
diversité intra spécifique entre les isolats, une dominance de
l'espèce R. Sullae (71%), et une présence d'endophytes
non spécifiques au sulla.
Des souches hautement, moyennement tolérantes et
sensibles au stress abiotique (salinité, sécheresse et pH
alcalin) sont identifiées. Ces souches constituent un matériel
biologique devrant être testé en association avec le sulla du nord
afin de sélectionner parmi ces inoculums ceux qui présentent les
meilleures performances symbiotiques.
3. EVALUATION DE L'EFFICIENCE SYMBIOTIQUE DES
BACTERIES NODULANT LE SULLA
L'évaluation de l'efficience symbiotique entre le sulla et
30 souches de la collection dont 28 appartenant à l'espèce R.
sullae a été réalisée en condition de culture
stérile.
L'analyse des paramètres de croissance, nodulation, et
rendement des plantes inoculées avec ces différentes souches a
été effectuée au stade 6ème feuille
pluri foliée, en comparaison avec deux témoins: TN (témoin
fertilisé avec 60 unités d'ammonitrate 33,5 %) et T0
(Témoin non fertilisé).
3. 1. Evaluation des paramètres de
croissance
L'analyse des paramètres de croissance des plantes montre
une large variabilité de la croissance en hauteur et de la surface
foliaire selon les souches (Tableau 17).
Contrairement aux plantes témoins non
fertilisées (T0) marquées par une petite taille et peu de
feuillage, celles inoculées par R. sullae souche H8 (INAT) se
distinguent par la croissance en hauteur et la surface foliaire les plus
élevées. En effet, cette souche offre des améliorations
par rapport au témoin T0 de 325 et 894 % respectivement pour la hauteur
et la surface foliaire. Néanmoins, en présence de HC1, cette
amélioration n'est que de 203 et 563,7 % respectivement pour la hauteur
et la surface foliaire.
Des améliorations de la croissance en hauteur ainsi que
de la surface foliaire ont été de même enregistrées
en présence d'endophytes non spécifiques au sulla HC10 et HC17.
Ces souches bien que nettement moins efficientes que leurs analogues R.
Sullae ont amélioré la croissance en hauteur par rapport aux
témoins non fertilisés de 191 et 166 % respectivement avec HC10
et HC17. Ces dernières ont amélioré la surface foliaire du
sulla respectivement de 295 et 235 %.
Tableau 17: Effets de l'inoculation, du sulla
cultivé en pot, par différentes souches de la collection sur la
croissance en hauteur et la surface foliaire.
|
Souches
|
Croissance en hauteur
(cm)
|
Surface foliaire
(cm2/plant)
|
|
H8
|
19,05 a
|
69,75 a
|
|
HC14
|
18,57 ab
|
54,22 efghijk
|
|
H4
|
17,90 abcd
|
66,21 abc
|
|
HC35
|
17,56 bcde
|
63,71 abcde
|
|
H3
|
17,25 bcdef
|
61,18 abcdef
|
|
H0
|
17,22 bcdef
|
60,70 abcdefg
|
|
H7
|
16,95 cdefg
|
55,90 defgij
|
|
H1
|
16,82 cdefgh
|
64,70 abcde
|
|
H5
|
16,77 cdefgh
|
57,02 cdefgi
|
|
H6
|
16,77 cdefgh
|
68,95 a
|
|
HC16
|
16,48 defghi
|
57,34 cdefg
|
|
HC6
|
16,20 efghij
|
68,52 ab
|
|
H2
|
16,00 fghij
|
66,52 abc
|
|
HC18
|
15,90 fghij
|
59,35 abcdefgh
|
|
HC5
|
15,70 fghij
|
60,04 abcdefgh
|
|
HC19
|
15,47 ghij
|
50,43 hijk
|
|
HC30
|
15,42 hij
|
68,51 ab
|
|
HC33
|
15,20 ijk
|
57,26 cdefghi
|
|
HC7
|
15,15 ijkl
|
56,78 cdefgi
|
|
HC8
|
14,97 jkl
|
55,13 efghij
|
|
HC4
|
14,92 jkl
|
49,74 hijk
|
|
HC9
|
13,92 klm
|
57,96 bcdefgh
|
|
H9
|
13,92 klm
|
50,67 fghijk
|
|
HC3
|
13,67 jkl
|
45,47 jk
|
|
HC32
|
13,40 mno
|
56,96 cdefgi
|
|
HC31
|
13,22 mno
|
46,89 ijk
|
|
H
|
12,35 nop
|
45,65 jk
|
|
HC1
|
11,90 opq
|
43,93 k
|
|
HC10
|
11,20 pqr
|
23,03 l
|
|
HC17
|
9,75 rs
|
18,40 l
|
|
T0
|
5,85 t
|
7,80 m
|
|
TN
|
18,40 abc
|
43,65 k
|
|
LSD 5 %
|
1,41
|
10,84
|
3. 2. Analyse de la nodulation du sulla
L'examen du système racinaire de l'ensemble des plantes
après 12 semaines de culture (stade ramification) de sulla a
montré une variabilité significative de distribution des
nodules.
En effet, les nodosités de 6 mm de diamètre ou
plus ont été majoritairement localisées au dessous du
collet; alors que les nodosités de moindre taille ont été
plus denses sur les racines latérales. De pareilles constatations ont
été rapportées par El Hilali (2006) lors des essais
d'inoculation du lupin par différentes souches rhizobiales.
L'analyse de l'infectivité des souches
évaluée par le nombre (3 à 71 par plante) et la masse des
nodules est significativement variable. Toutes les souches appartenant à
l'espèce R. sullae ont engendré des nodules à
aspect caractéristique des rhizobiums du sulla (forme allongée,
bi à trilobée, de couleur vermeille et de taille variant de 2
à 9 mm) (Figure 30).
Figure 30: Formes et tailles des nodules issues
de la symbiose entre quelques souches de la collection et le sulla.
Parmi ces souches, seul l'isolat HC33 se distingue par le
nombre et le poids nodulaire le plus important, contrairement à HC1
(Tableau 18). Concernant les souches HC17 et HC10 non spécifiques au
sulla, on a constaté que ces dernières engendrent des
excroissances non reproductibles marquées par leurs faible nombre,
importante taille (5 - 11 mm), et couleur blanche (Figure 31).
Figure 31: Système racinaire d'un plant
de sulla avec un amas nodulaire inefficient.
Tableau 18: Effet de l'inoculation, du sulla
cultivé en pot, par différentes souches de la collection sur la
nodulation (nombre de nodules et masse sèche nodulaire par plante).
souches Nombre de nodules Poids nodulaire
(nodules/plante) (g/plante)
H2 71,0 a 0,472 ab
HC14 70,8 a 0,410 bcd
HC33 70,3 a 0,480 a
HC7 68,3 ab 0,398 cd
HC5 63,8 abc 0,389 cde
H4 63,8 abc 0,367 de
HC6 63,5 abc 0,400 cd
HC35 61,8 abcd 0,364 def
HC30 61,0 abcd 0,443 abc
H5 60,5 abcd 0,402 cd
H6 58,3 bcde 0,367 de
HC16 58,3 bcde 0,332 ef
H1 58,0 bcde 0,414 bcd
H0 56,8 cde 0,367 de
H8 53,3 bcde 0,480 a
HC8 52,0 defg 0,204 h
HC4 52,0 defg 0,265 gh
HC3 49,3 efgh 0,224 h
H7 45,0 fgh 0,409 bcd
H9 44,5 fgh 0,221 h
H 44,5 fgh 0,224 h
HC9 44,0 fgh 0,232 h
HC32 43,8 fgh 0,207 h
HC18 42,0 ghi 0,251 gh
H3 41,5 ghi 0,380 cde
HC19 40,8 hi 0,302 fg
HC31 40,5 hi 0,240 gh
HC1 32,5 i 0,213 h
HC10 4,0 Klm 0,099 ij
HC17 3,2 Klm 0,078 ijk
TN 0 m 0 l
T0 0 m 0 l
LSD 5 % 11,253 0,0638
3. 3. Evaluation des paramètres de rendement du
sulla
3. 3. 1. Biomasse sèche aérienne
L'inoculation du sulla par les différentes souches
rhizobiales a significativement amélioré la production de
biomasse sèche aérienne par rapport au témoin absolu
(Tableau 19). Cette amélioration dépend toute fois de la souche
utilisée. En effet, le maximum de production a été
enregistré en présence de la souche HC14 qui a produit 10,46 fois
plus de matière sèche aérienne que le témoin non
fertilisé (T0). A l'exception de HC10 et HC17, toutes les autres souches
testées ont occasionné une amélioration au moins
équivalente à celle du témoin azoté TN soit 7,29
fois plus que T0.
3. 3. 2. Teneur en protéines brutes
Comparativement au témoin non fertilisé (T0),
l'ensemble des 28 souches R. sullae améliorent
significativement la teneur en protéines brutes du sulla (Tableau 19).
Parmi ces souches, les isolats HC14, HC16 et HC5 assurent la meilleure
amélioration de la teneur en protéines brutes aériennes
variante entre 3,54 et 2,46 points par rapport au témoin azoté.
Paradoxalement, les isolats HC10 et HC17 non spécifiques à la
culture produisent des teneurs équivalentes à celles du
témoin T0.
Tableau 19: Effets de l'inoculation, du sulla
cultivé en pot, par différentes souches de la collection sur la
production de biomasse sèche et la teneur en protéines brutes
aériennes.
|
Souches
|
Biomasse sèche aérienne
(g/plante)
|
Teneur en protéines brutes
(% MS)
|
HC14 0,734 a 31,22 a
HC5 0,691 abc 30,14 c
H5 0,679 abcd 26,72 fg
H1 0,708 ab 24,82 mno
HC16 0,561 hijk 30,62 b
H8 0,679 abcd 25,16 klm
H4 0,657 bcde 25,66 ij
HC35 0,620 defgh 27,00 ef
H6 0,634 cdefg 25,16 klm
HC7 0,622 defgh 25,42 jkl
HC6 0,640 bcdef 24,70 mno
HC33 0,603 efghi 24,68 no
H0 0,674 abcd 21,62 r
H3 0,589 fghij 24,44 o
HC30 0,528 jkl 26,28 gh
HC9 0,498 klm 27,34 de
H7 0,504 klm 26,46 gh
HC8 0,501 klm 25,18 klm
H2 0,551 ijk 22,50 q
H9 0,429 n 26,04 hij
HC32 0,419 n 26,56 fg
HC18 0,461 nm 23,56 p
HC31 0,407 n 25,66 ijk
HC19 0,451 mn 21,28 r
HC4 0,465 klm 17,44 t
H 0,422 n 18,36 s
HC1 0,464 lmn 14,88 u
HC3 0,458 mn 14,92 u
HC10 0,171 o 10,12 v
HC17 0,142 o 9,94 v
T0 0,064 p 8,92 v
TN 0,403 n 27,68 d
LSD 5 % 0,068 0,475

3. 4. Discussions
L'inoculation du sulla par différentes souches de la
collection a occasionné la formation de nodosités racinaires,
dont le nombre et le poids sont positivement corrélés aux
rendements en protéines brutes par plante (Annexe 6). Cette symbiose a
assuré une amélioration des paramètres de croissance
(Tableau18) et de rendement (Tableau 19) par rapport au témoin non
inoculé (T0) avec l'ensemble des souches de la collection. Dix neuf
souches sont particulièrement intéressantes à retenir
puisqu'elles ont induit une meilleure fixation de protéines brutes par
plante que le témoin fertilisé avec 60 unités d'azote
chimique. Parmi ces souches HC14 et HC5 ont induit des améliorations par
rapport témoin azoté (TN) respectivement de 103 et 85% (Figure
32).
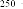

LSD 5%: 2,576
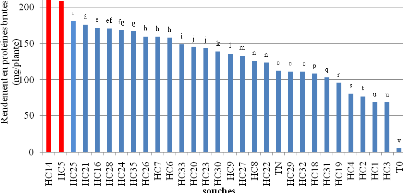
Figure 32: Rendement des protéines brutes
fixées par le sulla cultivé en pot et inoculé avec
différentes souches rhizobiales.
La variation de l'efficience entre souches rhizobiales est
expliquée par l'effet PGPB, en plus de leur capacité de fixation
symbiotique de l'azote atmosphérique (Loper and Schroth 1986; Amellal,
1998; Antoun et al., 1998; Bezzate et al., 2000; Ferguson and
Lessenger 2006; Solano et al., 2008). L'amélioration due
à la PGPB est aussi notée en présence de souches non
spécifiques au sulla HC10 et HC17. De pareilles améliorations ont
été rapportées par Fauzia et al. (2006) sur un
blé inoculé par une souche de Bacillus pumilus.
L'efficience des souches semble aussi variable selon leur
origine géographique. En effet les souches originaires du site Medjez El
Bab (HC1, H, HC3, HC4) sont particulièrement de faible efficience
comparativement à HC14 et HC5 provenant respectivement des stations Oued
Zargua et Smadah. Ce résultat corrobore avec les résultats de
l'évaluation au champ de la productivité du sulla et confirme
l'intérêt de sélectionner des souches rhizobiales à
partir de plantes cultivées (Fettell et al., 1997; Young et
al., 1998; Handley et al., 1999).
3. 5. Conclusion
Le test d'efficience des souches a permis l'identification de
souches à haut pouvoir fixateur de l'azote. Parmi celles-ci, HC14 et HC5
produisent des biomasses sèche et protéique équivalentes
à une culture de sulla fertilisée par respectivement 122 et 111
unités d'azote chimique.
L'efficience symbiotique complétée par l'analyse de
la diversité phénotypique permet de sélectionner les bons
candidats pour des essais d'inoculation de sulla en pots et au champ.
4. EFFET DE LA CONTRAINTE HYDRIQUE SUR LA SYMBIOSE
RHIZOBIUM/SULLA
En Tunisie, les régions arides occupent près du
1/3 du pays, et sont marquées par une insuffisance pluviométrique
chronique limitant la production végétale (Le Houerou, 1969;
Chaieb et al., 1992; Neffati et al., 1994). Cet effet est
d'autant plus perceptible que la fixation symbiotique de l'azote est sensible
à la contrainte osmotique (Zahran 1999b). Néanmoins,
l'inoculation par des souches tolérantes au stress hydrique peut
apporter un gain significatif à la symbiose en condition hydrique
stressante (Athar et Johnson, 1996) à condition que la souche
utilisée soit sélectionnée pour son efficience (Jahansooz
et al., 2007; Mnasri et al., 2007; Mhadhbi et al.,
2008; Ben Romdhane et al., 2009) et sa tolérance au stress
osmotique (Athar et Johnson, 1996).
Trois souches R. sullae HC1, HC14, et HC5 et
caractérisées à l'état libre par 3 niveaux de
tolérance au stress osmotique respectivement faiblement, moyennement, et
hautement tolérantes ont été testées dans le
présent chapitre en symbiose avec le sulla du nord sous
différents régimes hydriques (100, 75, 50, et 25 % RU).
4. 1. Effet de la contrainte hydrique sur la
croissance et la nodulation du sulla
Avec un faible apport d'eau 25 % RU, la croissance du sulla
est bloquée, ne dépassant pas le stade 3ème
feuille au moment de la récolte (Figure 33). Alors qu'avec des niveaux
de 100 et 75 % RU, les plants ont atteint les stades reproducteurs (bouton
floral et floraison).

Figure 33: Effet du stress hydrique sur le
développement du sulla cultivé en pot.
4. 1. 1. Croissance en hauteur
Les niveaux 100 et 75 % RU sont favorables à la
croissance du sulla pour l'ensemble des traitements, et particulièrement
en présence des souches HC5 et HC14. A ces niveaux d'humidité, la
souche HC1 offre une croissance similaire au témoin azoté.
A 50 % RU, la souche HC14 assure la meilleure croissance en
hauteur (15,8 cm) contrairement à HC1 et HC5 avec lesquelles, la
croissance diminue respectivement à 8,9 et 8,6 cm (Figure 34).
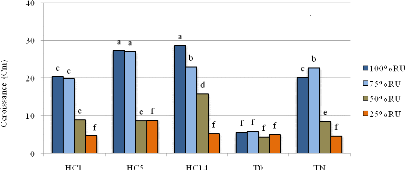
LSD 5%: 2,581
Figure 34: Effet du stress hydrique sur la
croissance du sulla cultivé en pot et inoculé par les souches
HC1, HC5 et HC14.
4. 1. 2. Surface foliaire
Quelle que soit la souche utilisée, les meilleures
surfaces foliaires sont enregistrées en condition d'humidité
favorable (100 % RU).
LSD 5% : 4,192
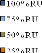
Figure 35: Effet du stress hydrique sur la
surface foliaire du sulla cultivé en pot et inoculé par les
souches HC1, HC5 et HC14.
Dans ces conditions, les souches HC5 et HC14 assurent une
amélioration de la surface foliaire par rapport au témoin
azoté respectivement de 143 et 157 %. A 75 % RU, la souche HC5 offre la
meilleure surface foliaire (53,5 cm2/plante) avec une
amélioration de 134 % par rapport au témoin azoté (TN).
Les souches HC5 et HC14 développent des surfaces
foliaires 2 fois plus importantes que celles enregistrées avec le
témoin TN à 50 % RU. En condition d'aridité extrême
(25 % RU), l'effet souche n'est plus visible et la surface foliaire
enregistrée pour toutes les plantes est à sa plus faible valeur
moyenne de 4,08 cm2/plante (Figure 35).
4. 1. 3. Nodulation du sulla
Les nodules présents au niveau des plants de sulla sont
de forme cylindrique en bâtonnet caractéristiques des rhizobiums
à croissance indéterminée (Gorenflot, 1975). Aucune
différence de forme n'a été observée entre les
nodules des 3 souches. Par contre, un nombre visiblement plus
élevé d'amas a été noté avec la souche HC14
(Figure 36).
HC14 HC5
Figure 36: Morphologie des nodules des sullas
cultivés en pot et inoculés par HC14 et HC5.
La meilleure nodulation en nombre est enregistrée en
présence de la souche HC14 (230 nodules/plante) à 100 % RU contre
66 nodules/plante avec HC1. L'application du stress hydrique à 75 % RU
affecte la nodulation par la diminution du nombre de nodules de 86,5; 62, et 11
% respectivement avec les souches HC1, HC14, et HC5.
A 50 % RU, HC5 présente le nombre de nodules le plus
élevé (60 nodules/plante) contrairement à HC1 qui ne donne
que 6 nodules/plante. A 25 % RU, la souche HC5 assure la meilleure nodulation
(11 nodules/plante) contre 3 en présence de HC14. Aucune formation
nodulaire n'est par ailleurs observée sur les racines du sulla
inoculé par HC1 (Figure 37 B).
A B
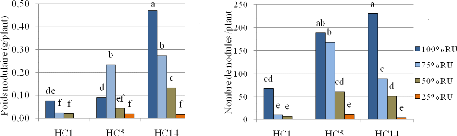
LSD 5% : 23,96
LSD 5% :0,041
Figure 37: Effet du stress hydrique sur la
nodulation du sulla cultivé en pot et inoculé par les souches
HC5, HC14 et HC1 exprimée en poids sec nodulaire (A), et nombre de
nodules par plant (B).
Pour l'ensemble des niveaux d'humidités testées,
la souche HC14 donne les poids nodulaires les plus élevés. Alors
que les plus faibles poids sont notés en présence de HC1 (Figure
37 A).
4. 2. Effet de la contrainte hydrique sur les
rendements du sulla inoculé
4. 2. 1. Biomasse sèche aérienne des
sullas
Les meilleures productions de biomasses sèches sont
enregistrées à 100 % RU avec la souche HC14 (4,7 g/plante) suivie
de la souche HC5 (2,8 g/plante). Ces souches donnent aussi les meilleures
biomasses sèches à 75% et 50 % RU qui dépasse les
rendements du témoin azoté (TN) et de la souche HC1. A 25 % RU,
l'effet souche n'est plus observé et tous les traitements sont
similaires au témoin non fertilisé T0 (Figure 38).

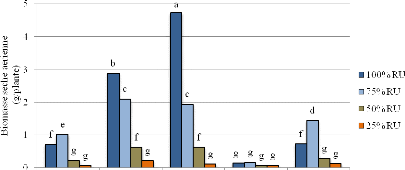
LSD 5% : 23,96
Figure 38: Effet du stress hydrique sur la
biomasse sèche aérienne du sulla cultivé en pot et
inoculé par les souches HC1, HC5 et HC14.
4. 2. 2. Rapport partie racinaire sur partie
aérienne du sulla
En condition hydrique normale (100 % RU), l'inoculation
rhizobiale favorise le développement du système racinaire au
détriment de la partie aérienne, alors que la fertilisation
azotée est en faveur de la croissance aérienne.
De même sous un stress hydrique de 75 % RU, un effet
bénéfique sur le développement de la biomasse
aérienne au détriment de la partie racinaire a été
obtenu avec le traitement azoté et avec les souches HC5 et HC14.
Paradoxalement, la souche HC1 a significativement été
affectée par ce stress occasionnant une augmentation des racines au
détriment de la partie aérienne. A 50 % RU, le rapport partie
racinaire sur partie aérienne (PR/PA) est maintenu avec les souches HC5
et HC14 alors qu'il diminue de 82 % en présence de HC1. A 25 % RU, un
déséquilibre du développement se fait en faveur de la
partie racinaire avec l'ensemble des souches (Figure 39).
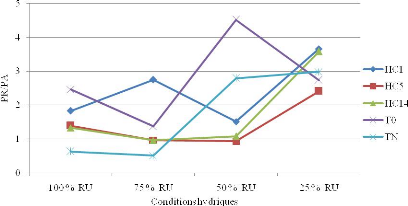
Figure 39: Variation du rapport PR/PA du sulla
inoculé selon les traitements hydriques.
4. 2. 3. Protéines brutes aériennes
fixées par le sulla
Au stade bourgeonnement, le maximum de teneur en
protéines brutes (PB) aériennes est noté en
présence de la souche HC14 à 100 % RU, soit 32,38 % de la
matière sèche. Le niveau 50 % RU, affecte HC14 à un taux
de PB de 20,39 % (Tableau 20). Contrairement à HC14, la souche HC5
améliore la teneur en protéines brutes aérienne à
75 et 50 % RU.
Ce niveau de stress représente le seuil de
tolérance de la plante. En effet, à 25 % RU, l'inoculation par
des souches rhizobiales n'a plus aucun effet sur la teneur en protéines
brutes et l'apport d'azote entraîne une diminution de cette teneur
à 7,2 %.
Tableau 20: Effet du stress hydrique sur la
teneur en protéines brutes aériennes du sulla cultivé en
pot et inoculé par les souches HC1, HC5 et HC14.
100 % RU 75 % RU 50 % RU 25 % RU
HC1 22,03 c 21,07 c 14,32 de 14,71 de
HC5 21,65 c 26,45 c 28,25 ab 15,14 de
HC14 32,38 a 30,37 a 20,39 c 14,50 de
T0 12,31 e 14,31 de 12,41 e 11,76 e
TN 20,31 c 18,21 cd 14,49 de 7,25 f
LSD 5% 2,05
Le meilleur rendement en protéines brutes est
assuré à 100 % RU par la souche HC14 (1532 mg/plante) suivi de la
souche HC5 (624 mg/plante). A 75 % RU, HC14 est aussi la plus efficiente, mais
à 50 % RU, c'est HC5 qui assure la meilleure fixation de
protéines brutes (177 mg/plante) contre 127 mg/plante en présence
de HC14 et seulement 31 mg/plante avec HC1. En passant à 25 % RU, une
réduction des rendements en protéines brutes est notée
avec l'ensemble des souches. Néanmoins, HC5 assure dans ces conditions
les meilleurs rendements (33 mg/plante) (Figure 40).

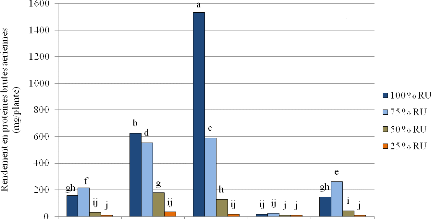
LSD 5%: 30,4
Figure 40: Effet du stress hydrique sur le
rendement en protéines brutes fixées (mg/plante) du sulla
cultivé en pot et inoculé avec les souches HC1, HC5 et HC14.
4. 3. Discussions
Les conditions de déficit hydrique variant de 75
à 25% RU engendrent une réduction des paramètres de
croissance et de rendements du sulla d'une manière aléatoire
selon la nature des souches rhizobiales. De même, une diminution de la
nodulation en nombre et poids a été notée selon
l'accroissement du niveau du stress hydrique. Cette réaction serait due
à une diminution de l'infection des poils absorbants des racines
(Robson, 1969; Zahran et al., 1986; Saadallah et al., 2001),
et le nombre de poils racinaires (Zahran et al., 1986).
Selon Williams et al. (1984), un faible niveau de
stress hydrique diminue seulement le nombre de nodules formés sur les
racines de soja, tandis qu'un stress hydrique modéré ou
sévère réduit à la fois le nombre mais aussi la
taille des nodules.
La variation de la nodulation est étroitement
liée à la souche utilisée. En effet, la souche HC14 donne
le nombre le plus élevé de nodules (230 nodules/plante) à
100 % RU. Alors qu'en augmentant le stress hydrique à 75% RU, la souche
HC5 induit le nombre de nodules le plus important (Figure 37 B). Ces
mêmes constatations ont été rapportées par
Krasova-Wade (2006), signalant une variation de la nodulation du haricot en
condition de stress hydrique selon la souche. Dans cette situation, la souche
ORS 3257 nodule plus en condition d'humidité favorable, alors que ORS
3260 le serait en condition hydrique limitante.
La capacité de nodulation des souches HC5 est HC14
à 25 % RU est en relation avec la tolérance des rhizobiums
à l'environnement; qui serait selon Zahran (2001) étroitement
liée à leurs origines. Ainsi Mnasri (2007b) a isolé une
souche rhizobiale efficiente et hautement tolérante au stress hydrique
depuis des oasis tunisiennes. Il est aussi probable que les nodules volumineux
occasionnés par la souche HC14 sont en partie responsables de son
adaptation au stress hydrique sévère (Sprent, 1981; Sanchez-Diaz
et al., 1995). Selon Figueiredo et al. (1998), les gros
nodules possèdent un parenchyme cortical plus épais qui
empêche ou réduit leur déshydratation, alors que les
nodules de petite taille perdent rapidement leur réserve en eau.
L'accroissement du stress hydrique de 100 à 50 % RU a
occasionné, en présence de HC14 et HC5, la réduction du
développement racinaire au détriment du système
aérien. De pareilles constatations ont été décrites
par Ghidhaoui et al. (2008) avec deux souches de R. sullae
qui tendent à minimiser l'effet néfaste du stress salin par
une diminution du rapport PR/PA.
Contrairement à ces souches, en présence de HC1,
le rapport PR/PA augmente à 75 % puis diminue à 50 % RU. Selon
Kafkai (1991), l'augmentation du rapport PR/PA sous contrainte osmotique est
due à l'allongement des racines en vue la de la recherche de l'eau,
alors qu'en conditions de stress hydrique plus sévères, le
transport des photo-assimilats vers les racines est spécifiquement
affecté et l'alimentation des parties aériennes est à son
tour réduite (Bayuelo-Jiménez et al., 2002; Figueiredo
et al., 2008 a).
Entre 100 et 75 % RU, la souche HC14 assure les meilleurs
rendements en biomasse sèche et protéines brutes
aériennes. Celle-ci semble être affectée par le stress
hydrique à partir de 50 % RU puisqu'elle diminue la teneur en
protéines brutes de 10 points. Contrairement à HC14, la souche
HC5, améliore les teneurs en protéines brutes aériennes
avec l'accroissement du stress hydrique de 100 à 50 % RU. Ces
résultats sont en accord avec ceux obtenus par L'taief et al.
(2009) qui ont trouvé une bonne adaptation de la souche S1 à
différents régimes hydriques suite à l'amélioration
de la teneur en azote total du pois chiche contrairement à d'autres
souches.
La capacité de HC5 à fixer l'azote en condition
de stress hydrique sévère serait en relation avec l'efficience de
la souche, mais aussi sa tolérance au stress hydrique (Zahran, 1999). Il
est aussi probable que la souche HC5 ait la capacité de libérer
des phytohormones directement ou indirectement responsables de la
modération des effets du stress hydrique sur la plante (Boiero et
al., 2007; Figueiredo et al., 2008a; Cohen et al., 2009;
Yang et al., 2009; Belimov et al., 2009).
L'inoculation du sulla par son rhizobium spécifique a
donné des améliorations similaires (HC1) sinon meilleures (HC5 et
HC14) que celles enregistrées par le témoin azoté (90
unités). Ce résultat pourrait être expliqué, d'une
part, par la capacité de fixation symbiotique des souches qui
dépasse manifestement ce niveau de fertilisation azoté; et
d'autre part, par l'action directe des microorganismes sur la plante, à
travers des phytohormones produites par ces rhizobiums (Juszczuk et
al., 2004); ou par l'action indirecte, de l'amélioration des
propriétés physiques de la rhizosphère suite à la
libération des exo-polysaccharides (EPS). Dans ce sens, Kaci (2005) a
rapporté que la souche R. sullae (KYGT207) isolée depuis
une région aride du sud de l'Algérie, aurait par l'inoculation du
sol, la capacité d'améliorer des propriétés
physiques de la rhizosphère des céréales.
4. 4. Conclusion
En condition d'humidité favorable (100 % RU), la souche
rhizobiale HC14 moyennement tolérante aux stress abiotiques (200 mM NaCl
et -0,9 MPa), assure les meilleures biomasses sèche (4,75 g/plante) et
protéique (1531 mg/plante). A 75 % RU, cette souche est aussi efficiente
que celle hautement tolérante HC5 (400 mM NaCl et -0,95 MPa).
En augmentant le stress hydrique à 50 % RU, HC5 produit
le maximum de protéines brutes (177 mg/ plante) dépassant HC14 de
39 %. En conditions extrêmes (25 % RU), HC5 et HC14 ont été
capables d'induire des nodules, contrairement à la souche sensible au
stress osmotique HC1 (150 mM NaCl et -0,5 MPa).
Les souches HC5 et HC14 sont par conséquent
intéressantes à retenir pour des essais d'inoculation en plein
champ.
5. ETUDE DE L'EFFICIENCE SYMBIOTIQUE DES SOUCHES
RHIZOBIALES SELECTIONNEES AU CHAMP
Les effets de l'inoculation rhizobiale par les souches
sélectionnées HC5 et HC14 sur la croissance et la production du
sulla dans deux sites favorable et défavorable à la culture de
sulla respectivement Tunis et Goubellat sont traités dans le
présent chapitre.
5. 1. Evaluation de la densité rhizobiale
autochtone spécifique au sulla dans les sites expérimentaux
La méthode MPN (Most probable Number) a mis en
évidence la présence d'une importante densité rhizobiale
spécifique au sulla dans le site Tunis évaluée à
3,2 x 104 bactéries/g de sol. En revanche, dans le site de
Goubellat, cette densité a été nulle.
5. 2. Effet de l'inoculation rhizobiale sur la culture
de sulla de 1ère année dans les sites Tunis et Goubellat
5. 2. 1. Croissance en hauteur du sulla première
année
Au stade floraison, la hauteur de végétation du
sulla est en moyenne 2 fois plus élevée à Tunis
qu'à Goubellat. La meilleure croissance est enregistrée au site
de Tunis en présence de la souche HC14, suivie de HC5 assurant un gain
de croissance par rapport à T0 respectivement de 23 et de 7 % (Figure
41).
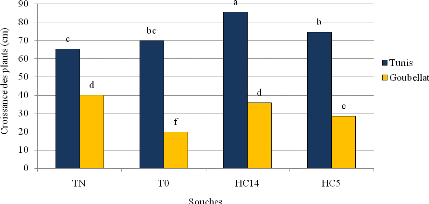
LSD 5%: 5,62
Figure 41: Effet de l'inoculation rhizobiale au
champ sur la croissance en hauteur du sulla de 1ère
année dans les sites de Tunis et Goubellat au stade floraison.
A Goubellat, l'inoculation avec HC14 est particulièrement
favorable à la croissance du sulla assurant une amélioration de
80 % par rapport à T0 (Figure 42).
A B

Figure 42: Cultures de sulla non inoculée
A, et inoculée B par la souche HC14 dans le site de Goubellat (mai
2009).
5. 2. 2. Surface foliaire du sulla de première
année
Au stade floraison, La surface foliaire moyenne du sulla est
de 1233 cm2/plante à Tunis, contre 688 cm2/plante
à Goubellat. La fertilisation azotée est, dans les 2 sites, plus
favorable à l'accroissement de la surface foliaire que l'inoculation
rhizobiale (Figures 43).
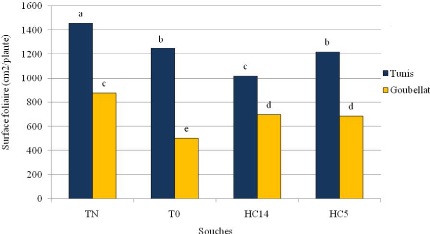
LSD 5%: 161,38
Figure 43: Effet de l'inoculation rhizobiale au
champ sur la surface foliaire du sulla de 1ère année
dans les sites de Tunis et Goubellat au stade floraison.
5. 2. 3. Nodulation du sulla de première
année
L'apport d'un inoculum exogène n'a pas eu le même
effet sur la nodulation dans les deux sites. En effet, à Tunis tous les
traitements ont développé des nodosités racinaires avec un
maximum en présence de HC5 (31,4 nodules/plantes). Cette dernière
a aussi présenté le nombre de nodosités le plus important
à Goubellat (12,7 nodules/plantes). Les témoins non
inoculés n'ont par ailleurs présenté aucune formation
nodulaire dans ce site (Tableau 21).
A Tunis la fertilisation chimique (TN) a significativement
affecté la nodulation par la diminution du nombre mais aussi du poids
nodulaire.
L'inoculation rhizobiale à Tunis a
amélioré, par rapport au témoin non fertilisé T0,
le poids nodulaire de 56 à 71% respectivement avec HC14 et HC5. Cette
dernière a aussi développé le poids nodulaire le plus
élevé à Goubellat (56,15 mg/plante) (Tableau 21).
Tableau 21: Effet de l'inoculation au champ du
sulla avec les souches HC14, HC5 sur le nombre et le poids des nodules dans les
sites de Tunis et Goubellat au stade floraison.
Nombre de nodules Poids sec nodulaire
(nodules/plante) (mg/plante)
Tunis Goubellat Tunis Goubellat
TN 11,9 c 0,0 e 9,1 e 0,00 f
T0 20,8 b 0,0 e 17,3 d 0,00 f
HC14 23,2 b 8,3 d 27,1 c 39,36 b
HC5 31,4 a 12,7 c 29,7 c 56,15 a
LSD 5 % 2,51 4,08
5. 2. 4. Biomasse sèche aérienne du sulla de
première année
Au stade floraison, l'inoculation et la fertilisation
azotée n'ont eu aucun effet sur la biomasse sèche aérienne
à Tunis. Alors qu'à Goubellat, cette technique a assuré
des rendements en fourrage sec similaires à ceux produits par
fertilisation azotée (Figure 44), assurant ainsi des
améliorations par rapport au témoin non fertilisé (T0) de
161 à 185 % respectivement avec HC5 et HC14.
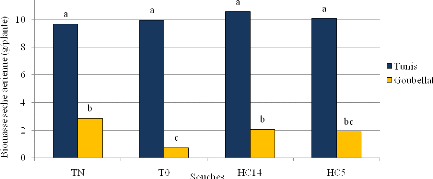
LSD 5%: 1,21
Figure 44: Effet de l'inoculation rhizobiale au
champ sur la biomasse sèche aérienne du sulla de
1ère année dans les sites de Tunis et Goubellat au
stade floraison.
5. 2. 5. Protéines brutes aériennes du sulla
de première année
Dans le site de Tunis et au stade floraison du sulla, ni
l'inoculation rhizobiale, ni la fertilisation azotée n'ont d'effet sur
la teneur en protéines brutes. Paradoxalement, à Goubellat,
l'inoculation rhizobiale améliore de 3,5 à 6,54 points les taux
de protéines brutes fixées par la plante respectivement avec HC14
et HC5 par rapport au témoin non fertlisé (T0). La fertilisation
azotée assure dans ces conditions la meilleure teneur en
protéines brutes que l'inoculation du sulla avec HC5 (Tableau 22).
Tableau 22: Effet de l'inoculation rhizobiale au
champ du sulla sur sa teneur en protéines brutes aériennes dans
les sites de Tunis et Goubellat au stade floraison.
TN
T0
HC14 HC5
Teneurs en protéines brutes aériennes
(%
MS)
|
|
|
Tunis
|
|
Goubellat
|
|
|
15,34
|
abc
|
18,37
|
a
|
|
15,16 bc
|
11,31
|
d
|
|
15,92
|
abc
|
14,81
|
bc
|
|
15,61
|
abc
|
17,85
|
ab
|
LSD 5 % 3,01
A Tunis, les rendements protéiques sont semblables pour
l'ensemble des traitements. Alors qu'à Goubellat, l'inoculation
rhizobiale améliore ces rendements par rapport au témoin non
fertlisé (T0) de 272 à 311% respectivement avec HC14 et HC5, sans
toute fois dépasser significativement la production issue d'une
fertilisation azotée (Figure 45, Annexe 10).
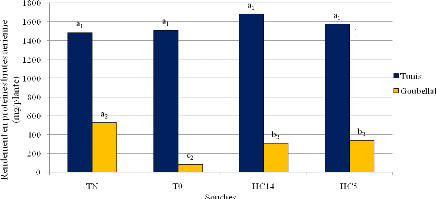
LSD2 5%: 33,22
LSD1 5%: 388,27
Figure 45: Effet de l'inoculation rhizobiale au
champ sur les rendements en protéines brutes aérienne du sulla de
1ère année dans les sites Tunis et Goubellat au stade
floraison.
5. 3. Evaluation des croissances et nodulation du
sulla de deuxième année dans la station de Goubellat
En deuxième année de culture, la croissance en
hauteur et la surface foliaire des plants de sulla sont significativement
homogènes pour l'ensemble des traitements (Figure 46, Annexe 11).
Cependant, la nodulation des plants a été observée sur
l'ensemble des traitements (Tableau 23).
Tableau 23: Effet de l'inoculation rhizobiale au
champ sur la croissance en hauteur, la surface foliaire et la nodulation du
sulla de 2ème année au stade bouton floral.
|
Hauteur de végétation
(cm)
|
Surface foliaire
(cm2/plante)
|
Nombre de nodules
(Nodules/plante)
|
|
TN
|
63
|
a
|
827
|
a
|
22
|
a
|
|
T0
|
61
|
a
|
827
|
a
|
20
|
a
|
|
HC14
|
58
|
a
|
888
|
a
|
24
|
a
|
|
HC5
|
61
|
a
|
789
|
a
|
19
|
a
|
|
LSD 5 %
|
|
8
|
118
|
|
6
|
|

5. 5. Discussions
L'inoculation rhizobiale du sulla en plein champ entraîne
des effets aléatoires sur les paramètres de croissance,
nodulation et rendements selon le site et la nature de l'inoculum.
Comparé à Goubellat, le site de Tunis se
caractérise par une supériorité de la croissance et de la
nodulation du sulla de 1ère année
indépendamment de la souche utilisée. La croissance en hauteur
est en moyenne 2 fois plus élevée à Tunis qu'à
Goubellat. En conséquence, les rendements en biomasses sèches
aériennes et protéiques se trouvent affectés. La
différence du comportement agronomique du sulla dans les deux stations
et selon les traitements serait liée à la présence d'une
population rhizosphérique efficiente dans le site Tunis (Fitouri Dhane,
2011). De plus, l'irrégularité des pluviosités,
combinée à une amplitude thermique plus importante à
Goubellat durant la période d'installation et de croissance du sulla en
première année de culture pourraient contribuer à une
croissance limitée de la plante (Lapeyronie, 1982).
Dans les deux stations, et au stade floraison du sulla, la
souche HC14 entraîne les meilleures croissances en hauteur. Concernant
les paramètres de nodulation, l'inoculation avec les souches HC5 et HC14
dans le site de Tunis a permis d'améliorer le nombre (de 12 à 51
%) et le poids (de 57 à 72%) nodulaire. A Goubellat, l'inoculation avec
la souche HC5, a assuré au stade floraison, la nodulation la plus
élevée en nombre (12,7 nodules/plantes) et en poids (56,15
mg/plante).
De point de vue efficience symbiotique, la souche HC14,
moyennement tolérante au stress abiotique, a assuré une
amélioration des rendements protéiques par rapport au
témoin non fertilisé (T0) de 11,4% à 272% respectivement
à Tunis et Goubellat. En présence de HC5 qui est plus
tolérante au stress abiotique, ces améliorations ont
augmenté à 312 % dans le site Goubellat. L'adaptation des souches
rhizobiales à la variation des conditions édaphiques et
climatiques du milieu dépend des caractéristiques
phénotypiques de celles-ci (Zahran 1999, Vinuesa et al.,
2003).
Les souches HC5 et HC14 semblent aussi particulièrement
compétitives dans le site Tunis où la densité rhizobiale
spécifique au sulla se trouve déjà suffisante (3,2
104 bactéries/g de sol). Il a été
rapporté dans ce sens que l'introduction de souches efficientes de
Rhizobium favorisait la nodulation et par conséquent la
fixation biologique de l'azote (Sultan et al., 2002); mais à
condition, que la souche introduite soit compétitive (Graham 1994).
Cette compétitivité des souches est toute fois
tributaire des sources d'énergie disponibles dans le sol (Bromfield
et al.,1985; Streit et al., 1996; Murphy et al.,
1987) ainsi que des interactions entre les souches de Rhizobium
(Robleto et al., 1998; Oresnik et al., 1999),
bactéries et champignons rhizosphériques autochtones qui peuvent
être positives (Dashti et al., 1998) ou négatives (Mrabet
et al., 2006).
En deuxième année de culture, la présence
de nodosités racinaires fixatrices de l'azote sur l'ensemble des plants
de sulla du site Goubellat ainsi que l'accroissement de la densité
rhizobiale spécifique au sulla de 0 en première année
à 1,7 x 102 bactéries/g de sol témoigne d'une
bonne dispersion de l'inoculum dans la rhizosphère et d'une adaptation
des souches introduites aux conditions environnementales de la station. En
effet, après deux années de culture à Goubellat, la
biomasse sèche et les protéines brutes cumulées sont
semblables entre tous les traitements.
L'effet néfaste de la fertilisation azotée sur
la nodulation du sulla dans le site de Tunis a été observé
au stade floraison. Cet effet de l'azote sur la nodulation, a
déjà été rapporté par plusieurs auteurs (El
Mili, 1983; Vance et al., 1987; L'taief et al., 2008).
L'augmentation de la quantité d'azote sous forme de NH4 + et NO3 - dans
le sol aurait pour conséquence une inhibition de l'infection racinaire
(Abdel-Wahab et al., 1996) et du développement nodulaire
(Atkins, et al., 1984; Imsande, 1986; Timmers et al., 2000).
Dans ce sens, Tibaoui et Zouaghi (1989) ont rapporté une
réduction hautement significative de la nodulation provoquée par
la fertilisation azotée, particulièrement pendant la fin du cycle
végétatif du sulla.
5. 6. Conclusion
L'inoculation rhizobiale du sulla en plein champ avec HC5 et HC14
a selon le site stabilisé ou amélioré les rendements
fourragers et protéiques.
En condition favorable à la culture du sulla (Tunis),
l'inoculation avec les souches HC14 et HC5 a maintenue une production
fourragère et protéique semblable à celle du témoin
non fertilisé.
Mais à Goubellat, où le milieu édaphique
est considéré comme défavorable, les souches HC5 et HC14
ont assuré à travers la fixation symbiotique de l'azote, une
production de fourrage sec équivalente à une culture de sulla qui
aurait été fertilisée par respectivement 59 et 64
unités d'azote chimique.
Après deux années de culture, l'inoculum est
préservé dans le site de Goubellat, et a assuré des
productions fourragère et protéique équivalente à
celles produites par un sulla qui aurait reçu 140 unités d'azote
chimique.
Conclusions générales et
perspectives
Conclusions générales et
perspectives
La prospection des potentialités symbiotiques du sulla
cultivé dans divers sites du nord de la dorsale tunisienne et la
collecte de matériel rhizobial autochtone ont permis de déceler
d'une part différentes caractéristiques d'intérêt
fonctionnel des souches et d'autre part une diversité biologique bien
développée. Une variabilité de la productivité de
la plante hôte a été observée en relation avec
l'environnement physique, et la population rhizobiale autochtone en
symbiose.
L'étude de la diversité phénotypique des
isolats collectés a révélé une influence du site
géographique sur les groupements phénotypiques. Cette
diversité est aussi corrélée à la diversité
génétique intra spécifique révélée
par Rep-PCR. L'analyse de la diversité génétique par
PCR-RFLP de l'ADNr 16S associée au séquençage du
gène 16S a confirmé la haute spécificité
symbiotique entre H. coronarium L. et R. sullae, et mis en
évidence la présence de certains endophytes non
spécifiques à cette plante à effet PGPB (Plant Growth
Promoting Bacteria).
Trois niveaux de tolérance aux stress abiotiques
(salinité, sécheresse, pH) ont été mis en
évidence entre les souches de R. sullae: souches hautement
tolérantes (400 mM NaCl et - 0,95 MPa); moyennement tolérantes
(200 mM NaCl et -0,9 MPa); et sensibles (150 mM NaCl et -0,5 MPa).
L'évaluation de l'efficience symbiotique sous quatre
régimes hydriques (100, 75, 50 et 25 % RU) des souches HC5, HC14 et HC1
classées respectivement comme hautement, moyennement tolérantes,
et sensible au stress osmotique a montré que la souche moyennement
tolérante (HC14) donne les meilleures biomasses sèches (4,75
g/plante) et protéiques (1531 mg/plante) à 100 % RU. A 75 % RU,
les souches HC14 et HC5 en symbiose avec le sulla permettent une production de
biomasses sèches similaires et équivalentes à celles
produites en condition de fertilisation azotée respective à 125
unités d'azote chimique. En condition de stress plus
sévère (50 % RU), la souche hautement tolérante au stress
HC5 a produit le maximum de protéines brutes (177 mg/ plante)
dépassant HC14 de 39 %.
Conclusions générales et
perspectives
L'inoculation du sulla par HC14 et HC5, dans deux sites,
favorable (Tunis) et défavorable (Goubellat) à la culture, a
montré l'adaptation de ces souches aux deux conditions
environnementales:
- A Tunis, où le rhizobium spécifique au sulla
est présent, l'inoculation a significativement amélioré la
masse nodulaire de 52 à 71 % respectivement avec HC14 et HC5. Cette
amélioration de la nodulation n'a toute fois pas affecté les
rendements fourragers et protéiques.
- A Goubellat, où le rhizobium spécifique au
sulla est absent, l'inoculation a fourni en première année de
culture et au stade floraison une production de biomasse sèche
équivalente à celle produite par une fertilisation chimique de 59
à 64 unités d'azote respectivement avec HC14 et HC5. En
deuxième année, la densité rhizobiale spécifique au
sulla à Goubellat est passée de 0 à 1,7 x 102
bactérie/g de sol et la production de fourrage de sulla cumulée a
été équivalente à celle d'une culture sous
régime de fertilisation chimique avec 140 unités d'azote.
En conséquence, l'efficience symbiotique des souches
HC14 et HC5 a été vérifiée et couronnée par
l'inscription d'un brevet intitulé Bio-fertilisant à base d'une
souche locale de rhizobium spécifique au sulla du nord Hedysarum
coronarium L. sous le numéro TN 2010/0310 du 02 Juillet 2010.
Du point de vue taxonomique, la recherche sur la
diversité génétique des souches nodulant le sulla
utilisant d'autres techniques moléculaires, en l'occurrence le
séquençage des gènes atpD et recA, permettrait une
meilleure classification de ces souches (analyse en cours).
Dans une étape ultérieure, l'évaluation
de l'efficience des souches testées sous de nouvelles formes de stress
biotique (champignons telluriques) ou abiotique (température) serait
particulièrement intéressante dans une conjoncture de changement
climatique.
Références bibliographiques
REFERENCES BIBLIOGRAPHIQUES
Références bibliographiques
Aarons S. R. et Graham P. H. 1991. Response of Rhizobium
leguminosarum bv. phaseoli to acidity. Plant Soil. 134:
145-151.
Abaidoo R. C., Keyser H. H., Singleton P.W., Dashiell K. E.,
Sanginga, N., 2007. Population size, distribution, and symbiotic
characteristics of indigenous Bradyrhizobium spp. that nodulate TGx
soybean genotypes in Africa. Appl. Soil Ecol. 35 : 57-67.
Abdelguerfi A., Abdelguerfi-laouar M. 2002. Les ressources
génétiques d'intérêt fourrager et/ou pastoral :
diversité, collecte et valorisation au niveau du bassin
méditerranéen. In proceeding of rehabilitation des
pâturages et des parcours en milieux méditerranéens.11
meeting of the mediterranean sub-network of the fao-ciheam. 29 Oct -1 Nov ,
2002, Djerba, Tunisie.
Abdelly C., Lachaâl M., Grignon C., Soltani A., Hajji M.
1995. Association épisodique d'halophytes strictes et de glycophytes
dans un écosystème hydromorphe salé en zone semiaride.
Agronomie 15: 557-568.
Abdel-Wahab H. H., Zahran H. H. et M. H. Abd-Alla. 1996.
Root-hair infection and nodulation of four grain legumes as affected by the
form and the application time of nitrogen fertilizer. Folia Microbiol. 41:
303-308.
Acevedo E. 1991. Improvement of winter cereal crops in
mediterranean environment. Use of yield, morphological and physiological
traits. Coll. Physiology breeding of winter cereals for stressed mediterranean
environment, 55. Paris : Inra éditions.
Aftab A., Asghari B., Mussarat F. 2010. Higher soybean yield by
inoculation with N-fixing and P-solubilizing bacteria. Agron. Sustain. Dev. 30:
487-495.
Afnor. 1981. Qualité des sols : Mesure du pH
(H2O).méthode électrométrique. AFNOR 81 197.
Afnor. 1982. Qualité des sols : Détermination du
calcaire actif. AFNOR 82 083.
Afnor. 1983. Soils quality-Determination of total organic carbon
by sulfochromic oxidation. AFNOR 83274
Afnor. 1984. Qualité des sols : Détermination du
phosphore. Méthode Olsen. AFNOR 84 454.
Aguirreolea J. and Sanchez-Dýaz M. 1989. CO2 evolution by
nodulated roots in Medicago sativa L. under water stress. J Plant Physiol. 134:
598-602.
Amager N. 1974. Aspect micro biologique de la culture de
féverole en France. C.R. Académie de l'Agriculture. 60:
105-112.
Amarger N. 2001. Rhizobia in the field. Adv. Agron.
73:109-168.
Références bibliographiques
Amellal N., Burtin G., Bartoli F., Heulin T. 1998.
Colonization of wheat roots by an exopolysaccharide-producing Pantoea
agglomerans strain and its effect on rhizosphere soil aggregation. Appl.
Environ. Microbiol. 64 :3740-3747.
Andrade D.S., Murphy P.J., Giller K.J. 2002. The diversity of
Phaseolus-nodulating rhizobial populations is altered by liming of acid soils
planted with Phaseolus vulgaris L. in Brazil. Appl. Environ.
Microbiol. 68:4025-4034.
Angers D. A., Mehuys G. R. 1989. Effects of cropping on
carbohydrate content and water stable aggregation of a clay soil. Can. J. Soil
Sci. 69: 373-380.
Ann M. H., Dietz B. W., David B. M., Julie C., Brett T. and
John I. Y. 2003. Molecular signals and receptors: controlling rhizosphere
interactions between plants and other organisms. Ecological Society of America.
84 (4):858- 868.
Antoun H., Beauchamp J., Goussard N., Chabot R., Lalande R.
1998. Potential of Rhizobium and Bradyrhizobium species as
plant growth promoting rhizobacteria on non-legumes: effect on radishes
Raphanus sativus L.. Plant Soil. 204: 57-67.
Arreseigor C., Minchin F. R., Gordon A. J., and Nath A. K.
1997. Possible cause of the physiological decline in soybean nitrogen fixation
in response to nitrate. J. Exp. Bot. 48: 905-913.
Arvieu J.C. 1980. Réaction des phophates minéraux
en milieu calcaire, conséquences sur l'état et la
solubilité du phosphore. Science du Sol. 3: 179-189.
Athar M. and Johnson D.A. 1996. Effects of drought on the
growth and survival of Rhizobium
meliloti strains from Pakistan and
Nepal. Journal of Arid Environment. 35: 335-340.
Athar M. 2000. Drought tolerance by lentil rhizobia
(Rhizobium leguminosarum) from arid and semiarid areas of Pakistan.
Lett. Appl. Microbiol. 26: 38-42.
Atkins C. A., Shelp B. J., Kuo J., Peoples M. B., and Pate T.
S. 1984. Nitrogen nutrition and
the development and senescence of nodules on
cowpea seedlings. Planta. 162:316-326.
Aubertot J.N., Barbier J.M., Carpentier A., Gril J.N.,
Guichard L., Lucas P., Savary S., Voltz M. et Savini I. 2005. Pesticides,
agriculture, environnement. Réduire l'utilisation des pesticides et en
limiter les impacts environnementaux, Expertise scientifique collective,
Ministère de l'Agriculture et de la Pêche. Ministère de
l'Ecologie et du Développement Durable de France: 702 p.
Baccouche M. 1998. Le système fourrager de
l'Agro-combinat Ghézala: étude technique et proposition
d'amélioration. Mémoire de Fin d'études du Cycle de
Spécialisation. INA Tunisie : 98p.
Bailey L. D. 1983 Effects of Potassium fertilizer and fall
harveste on Alfafa grown on the eastern Canadian prairies. Canadian Journal of
Soil Science. 63: 211-219.
Références bibliographiques
Ballatore G. P. 1963. La cultivazione della sulla: le sulla en
Tunisie. In "L'Informatore agrario", Verona, Italie. 741p.
Balabel-Naglaa MA. 1997. Silicate bacteria as biofertilizers.
MSc Thesis, Agriculture
Microbiology Department, Faculty of Agriculture, Ain
Shams University, Egypt. 130p.
Barnani K. 1984. Analyse de l'intéraction
Rhizobium-cultivar chez le sulla (Hedysarum coronarium
L.). Mémoire de 3 ème cycle Agronomie,
IAV. Hassan II, Rabat.
Bayuelo-Jiménez J. S., Craig R. and Lynch J. P. 2002.
Salinity tolerance of Phaseolus species during germination and early
seedling growth. Crop Sci. 42: 2184-2192.
Becker A., Berges H., Krol E., Bruand C., Ruberg S., Capela
D., Lauber E., Meilhoc E., Ampe F., de Bruijn FJ., Fourment J., Francez-Charlot
A., Kahn D., Kuster H., Liebe C., Puhler A., Weidner S., Batut J. 2004. Global
changes in gene expression in Sinorhizobium meliloti 1021 under
microoxic and symbiotic conditions. Mol. Plant Microbe Interact. 17:
292-303.
Belimov A. A., Dodd I. C., Hontzeas N., Theobald J. C.,
Safronova V. I., Davies W. J. 2009. Rhizosphere bacteria containing
1-aminocyclopropane-1-carboxylate deaminase increase yield of plants grown in
drying soil via both local and systemic hormone signaling. New Phytol. 181:
413-423.
Ben Jeddi F., Zouaghi M., Harrabi M., Strobel G. A., et.
Hannaway D. B. 1989. nodulation of Lupinus albus and Vicia
faba by Rhizobium spp. as influenced by Agrobacterium rhizogenes.
FEMS Microbiology. 59: 77-82.
Ben Jeddi F. et Zouaghi M. 1995. Biodiversité et
amélioration génétique des génotypes
spontannés du Sulla du Nord Hedysarum coronarium L.. In
Actes des deuxièmes journées sur les acquis de la recherche
agronomique et vétérinaire. 8-10 décembre 1995,
Hammamet, Tunisie.
Ben Jeddi F., Zouaghi M., et Behaeghe T. 1998. Le sulla
sauvage: biodiversité et création variétale. In Actes
du premier séminaire international sur la mobilisation, l'exploitation
et la conservation des ressources naturelles. pp.387-397.
Ben Jeddi F. 1996. Le sulla ensilage: possibilités et
limites. Journée d'information sur les ensilages. In rapport
Ministère de l'Agriculture. IRESA. 28 mars 1996, Pôle de
développment du Nord-Ouest, Bousalem,Tunisie.
Ben jeddi F. 2004. Amélioration du sulla du nord
spontanné : création variétale et et progrès
génétique. In 1ère session de formation des
ingénieurs de nord sur le sulla Bikra 21 dans les systèmes de
culture. Ministère de l'agriculture, de l'environnement et des
ressources hydrauliques-DGPA., 29 mars-02 avril 2004, Sidi thabet,
Tunisie.
Références bibliographiques
Ben Jeddi F. 2005. Hedysarum coronarium L. :
Variation génétique, création variétale et place
dans les rotations tunisiennes. Thèse de doctorat en sciences
biologiques appliquées. Faculté des sciences en
bio-ingénierie. Université de Gen Belgique. 216 p.
Ben Rebah F., Prévost D., Yezza A., Tyagi R. D., 2007.
Agro-industrial waste 588 materials and wastewater sludge for rhizobial
inoculant production: A review. Bioresource Technology 18, 3535-3546.
Ben Romdhane S., Trabelsi M., Aouani M. E., De Lajudie P. and
Mhamdi R. 2009. The diversity of rhizobia nodulating chickpea (Cicer
arietinum) under water deficiency as a source of more efficient
inoculants. Soil Biol. Biochem. 41: 2568-2572.
Benhizia Y., Benhizia H., Benguedouar A., Muresu R., Giacomini
A., Squartini A. 2004. Gammaproteobacteria can nodulate legumes of the genus
Hedysarum. Syst. Appl. Microbiol. 27: 462-468.
Bentham G. et Hooker J. D. 1865. Genera Plantarum, 1-40. London
Reeve.
Berge O., Lodhi A., Brandelet G., Santaella C., Roncato M.A.,
Christen R., Heulin T.and Achouak W. 2009. Rhizobium alamii sp. nov.,
an exopolysaccharide-producing species isolated from legume and non-legume
rhizospheres Int. J. Syst. Evol. Microbiol. 59: 367- 372.
Beringer J. E., Bisseling T. A. and La Rue, T. A. 1988.
Improving symbiotic nitrogen fixation through the genetic manipulation of
Rhizobium and legume host plants. In: R. J. Summerfield, (ed). World
Crops: Cool Season Food Legumes. Dordrecht: Kluwer Academic Press, 691-702.
Bertrand H., Plassard C., Pinochet X., Touraine B., Normand P.
and Cleyet-Marel J. C. 2000. Stimulation of the ionic transport system in
Brassica napus by a plant growth- promoting rhizobiums
(Achromobacter sp). Can. J. Microbiol. 46: 229- 36.
Beyerinck M. W. 1888. Die Bacterien der
Papilionaceen-Knöllchen. Bot. Zeitung 46, 725- 804.
Beyerinck M. W. 1890. Künstliche Infection von Vicia
Faba mit Bacillus radicicola. Ernährungsbedingungen dieser
Bacterie. Bot. Zeitung. 52: 837-843.
Bezzate S., Aymerich S., Chambert R., Czarnes S., Berge O.,
Heulin T. 2000. Disruption of the Paenibacillus polymyxa levansucrase
gene impairs its ability to aggregate soil in the wheat rhizosphere. Environ.
Microbiol. 2: 333-342.
Bhagwat A. A., K. C. Gross R. E. Tully, and D. Keister. 1996.
Glucan synthesis in Bradyrhizobium japonicum: characterization of a
new locus (ndvC) influencing linkages. J. Bacteriol. 178:
4635-4642.
Références bibliographiques
Billeter R., Liira J., Bailey D., Bugter R., Arens P.,
Augenstein I., Aviron S., Baudry J., Bukacek R., Burel F., Cerny M., De Blust
G., De Cock R., Diekotter T., Dietz H., Dirksen J., Dormann C., Durka W.,
Frenzel M., Hamersky R., Hendrickx F., Herzog F., Klotz S., Koolstra B., Lausch
A., Le Coeur D., Maelfait J.P., Opdam P., Roubalova M., Schermann A., Schermann
N., Schmidt T., Schweiger O., Smulders M.J.M., Speelmans M., Simova P., Verboom
J., van Wingerden W.K.R.E. and Zobel M. 2008. Indicators for biodiversity in
agricultural landscapes: a pan-European study. Journal of Applied Ecology
45(1): 141-150.
Biswasun J. C., Ladhaun J.K. et F.B. Dazzo. 2000. Rhizobia
inoculation Améliore nutrient uptake and growth of Lowland Rice Soil
Science Society of America Journal 64:1644- 1650.
Bladergroen M.R and Spaink H.P. 1998. Genes and signal molecules
involved in the rhizobia-Leguminoseae symbiosis. Curr. Opin. Plant Biol.
1(4): 353-359.
Blondeau R. 1980. Importance de la fixation de l'azote et
méthodes de mesure. Fixation biologique de l'azote atmosphérique.
Vuibert Paris. 38 : 5-9.
Boncompagni E., M. Osteras, M.C. Poggi, and D. Le Rudulier.
1999. Occurence of chomine and glycine betaine uptake and metabolisme in the
family of rhizobiaceae and their roles in omoprotection. Appl. Environ.
Microbiol. 65:2072-2077.
Boonkerd R.J. 1991. Some factors influencing the growth and
survival of the root nodule bacteria in peat culture. Journal of Applied
Bacteriolgy 31: 295-265.
Bordeleau L. M. and D. Prevost. 1994. Nodulation and nitrogen
fixation in extreme environments. Plant Soil 161:115-124.
Borreani G., Roggero P.P., Sulas L. and Valente M. E. 2003.
Quantifying morphological stage to predict the nutritive value in sulla
(Hedysarum coronarium L.). Agronomy journal 95: 1608-1617.
Botha W.J., Baftha J.B., Bloem J.F., Habig J.H. and Law I. J.
2004. Effect of soil bradyrhizobia on the success of soybean inoculant strain
CB 1809. Microbiol Res. 159: 219-231.
Botsford L., and Lewis T. 1990. Osmoregulation in
Rhizobium meliloti production of glutamic acid in response to osmotic
stress. Appl. Env. Microbiol. 56: 488-494.
Bounejmate M., Buirchell B. J., Birouk A., Bouizgaren A. et
Saïdi N. 1993. Distribution naturelle au Maroc de trois espèces de
lupin en relation avec certains facteurs du milieu. Al Awamia. 84:
29-42.
Références bibliographiques
Breedveld M. W., Dijikema C., Zevenhuizen L. P. T. M., and A.
J. B. Zehender. 1993. Response of intracellular carbohydrates to a NaCl shock
in Rhizobium leguminosarum biovar trifolii TA-1 and
Rhizobium meliloti SU-47. J. Gen. Microbiol. 139: 3157-3163.
Breedveld M. W., Spaink H.P., Kondorosi A., Hooykaas J. J. and
Miller K. J. 1998. Cell-surface â-glucans. In The
Rhizobiaceae. Kluwer Academic Publishers, Dordrecht (eds.) The
Netherlands, pp 81-96.
Bremner JM. 1965. Total nitrogen. Methods of Soil Analysis
Chemical and Microbiological Properties part 2, American Society of Agronomy:
Madison. 1149-1178.
Brhada F., Poggi M.C. and Le Rudulier D. 1997. Choline and
Glycine betaine uptake in various strains of Rhizobia isolated from nodules of
Vicia faba var. major and Cicer arietinum L.: Modulation by
salt, choline and glycine betaine. Current Microbiol. 34: 167- 172.
Brockwell, J. et Whalley, M.D.B. 1962. Incorporation of peat
inoculant in seed pellets of inoculation of Medicago tribloïdes,
sown in to dry soils. Australian journal Science 24(11): 458-460.
Brockwell, J., A. Pilka, and Holliday R. A. 1991. Soil pH is a
major determinant of the numbers of naturally-occurring Rhizobium meliloti
in non-cultivated soils of New South Wales. Aust. J. Exp. Agric. 31:
211-219.
Brockwell J., Bottomley P. J, Thies J. E. 1995. Manipulation of
rhizobia microflora for improving legume productivity and soil fertility. Plant
Soil 174: 143-180.
Bromfield ESP., Lewis D. M. and Barran L. R. 1985. Cryptic
plasmid and rifampin resistance in Rhizobium meliloti influencing
nodulation competitiveness. J. Bacteriol. 164:410-413.
Broughton W. J. and Dilworth M. J. 1971. Control of
leghaemoglobin synthesis in snake beans. Biochemical Journal 125:1075-1080.
Broughton W.J., Jabbouri S. and Perret X. 2000. Keys to Symbiotic
Harmony. J.Bacteriol. 182(20): 5641-5652.
Brun A. 1980. Effets comparés de différentes
concentrations de NaCl sur la germination, la croissance et la composition
minérale de quelques populations de luzernes annuelles
d'Algérie, Thèse de spécialité, U.S.T.L.,
Montpellier, France. 113 p.
Burgos P.A., Castellanos J., Mora Y., Mora J. 1999. Field
inoculation of common bean (Phaseolus vulgaris L.) with high
efficiency Rhizobium strains. In: Martinez E, Hernandez G (eds)
Highlights of nitrogen fixation research. Kluwer Academic/Plenum Publishers,
New York, pp 255-257.
Références bibliographiques
Buss M. D., Bottomley P. J. 1989. Growth and nodulation
responses of Rhizobium meliloti to water stress induced by permeating
and non permeating solutes. Appl. Environ. Micrbiol. 55: 431-2436.
Cabrera E., Villa A., Ruiz-Argüeso T. 1979. Diversidad y
caracterizacion de la flora nativa de
rizobios que nodulan en zulla.VII
Congreso National de Microbiologia.Cadiz. 294 p.
Cadisch G., Sylvester-Bradley R., Boller B. C. and
Nösberger J. 1993. Effects of phosphorus and potassium on N2 fixation
(15N-dilution) of field-grown Centrosema acutifolium and
C. macrocarpum. Field Crops Research. 31: 329-340.
Cartoux G. et Lagacherie B. 1977. Méthodologies de
sélection des souches de rhizobium. In Rapport final du contact de
la recherche N°411, INRA Dijon. France.
Casella S., Gault R. R., Reynolds K. C., Dyson J. R.,
Brockwell J. 1984. Nodulation studies on legumes exotic to Australia
(Hedysarum coronarium L.) FEMS Microbiol. Letters 22: 37- 45.
Casella S., Shapleigh J.P., Toffanin A, Basaglia M. 2006.
Investigation into the role of the truncated denitrification chain in
R. sullae strain HCNT1. Biochem. Soc. Trans. 34(1):
130-132.
Catroux G. and Amarger N. 1992. Rhizobia as soil inoculants in
agriculture. In M. J.Day and J. C. Fry, (eds). Environmental Release of
Genetically Engineered and other Micro organisms. Cambridge: Cambridge
University Press, 1-13.
Catroux G., Hartmann A. and Revellin C. 2001. Trends in rhizobial
inoculant production and use. Plant and Soil 230: 21-30.
Chabot R., Antoun H., Kloepper J.W. and Beauchamp C.J. 1996.
Root colonization of maize and lettuce by bioluminescent Rhizobium
leguminosarum biovar phaseoli. Appl. Environ. Microbiol. 62:
2767-2772.
Chaieb M., Floret C., Le Floch E. and Pontanier R. 1992. Life
History strategies and water-resource allocation in 5 pasture species of the
Tunisian arid zone. Arid Soil Research and Rehabilitation 6: 1-10.
Chamalet A., Audergon J. M., Maître J. P. and Domenach
A. M. 1987. Study of influence of potassium on the trifolium protense fixation
by 15N method Plant and soil 98(9): 347- 352.
Chaves M. M. and Oliveira M. M. 2002. Mechanisms underlying
plant resilience to water deficits: prospects for water-saving agriculture.
Journal of Experimental Botany 55:2365- 2384.
Références bibliographiques
Chen H., Richardson A. E. and Rolfe B. G. 1993. Studies on the
physiological and genetic basis of acid tolerance in Rhizobium
leguminosarum biovar trifolii. Appl. Environ. Microbiol. 59:
1798-1804.
Chen W.M., Laevens S., Lee T.M., Coenye T., De Vos P., Mergeay
M. and Vandamme P. 2001. Ralstonia taiwanensis sp. nov. isolated fromm
root nodules of Mimosa species and sputum of cystic fibrosis patients. Int. J.
Syst. Evol. Microbiol. 51: 1729-1735.
Chen W. X., Tan Z .Y., Gao J .I., Li Y. and Wang E. T. 1997.
Rhizobium Hainanense sp. Nov. isolated from tropical legumes. Int. J.
Syst. Bacteriol. 47: 870-873.
Chen W. X., Wang E., Wang S., Li Y., Chen X. and Li Y.1995.
Characterization of Rhizobium tianshanense sp. nov. a moderatly and
slow growing root nodule bacterium isolated from arid saline environment in
Xinjiang, People's Republic of China. Int. J. Syst. Bacteriol. 45: 153-159.
Chen W X., Yang G H. and Li J L. 1988. Numerical taxonomic
study of fast growing soybean rhizobia and a proposal that Rhizobium
fredii be assigned to Sinorhizobium gen. nov. Int. J. Syst.
Bacteriol. 38: 392-397.
Chen J.L., Lin S. and Lin L. P. 2006. Rhizobial surface
biopolymers and their interaction with lectin measured by atomic force
microscopy. World J. Microbiol. Biotechnol. 22: 565- 570.
Chisci G.C., Bazzoffi P., Pagliai M., Papini R., Pellegrini S.
and Vignozzi N. 2001. Association of sulla and atriplex shrub for the physical
improvement of clay soils and environmental protection in central Italy
Agriculture, Ecosystems and Environment 84: 45-53.
Cingolani A.M., Noy-Meir I. and Díaz S. 2005. Grazing
effects on rangeland diversity: a synthesis of contemporary models. Ecological
Applications 15(2): 757-773.
Clatzle A, Schultc-Butenbrock T, Brockwell J. 1986. Symbiotic
incompatibility between two forage species of Hedysarum, grown on Morocco and
their homologous rhirobia. FEMS Microbiology Letters 3: 39-43.
Collavino M., Riccillo P.M., Grasso D.H., Crespi M., Aguilar
OM. 2005. GuaB activity is required in Rhizobium tropici during the
early stages of nodulation of determinate nodules but is dispensable for the
Sinorhizobium meliloti - Alfalfa symbiotic interaction. Mol. Plant
Microbe Interact. 18:742-750.
Corbière H.L.F. 2002. The importance of sucrose synthase
for AM symbiosis in maize, in pea and in Medicago . Thèse de doctorat
Andriankaja, 200p.
Références bibliographiques
Coutinho H.L.C., Oliveira V.M., Lovato A., Maia A.H.N. and
Manfio G.P. 1999. Evaluation of diversity of rhizobia in Brazilian agricultural
soils cultivated with soybeans. Appl. Soil Ecol 13: 159-167.
Cronk Q., Ojeda I. and Pennington R.T. 2006. Legume comparative
genomics: progress in phylonenetics and phylogenomics. Current Opinion in plant
biology 9: 99-103.
Crowley D.E., Wang Y.C., Reid C.P.P and Szansiszlo P.J. 1991.
Mechanism of iron
acquisition from siderophores by microorganisms and
plants. Plant Soil. 130:179-198.
Crowley D.E. and Kraemer S.M. 2007. Function of siderophores
in the plant rhizosphere. p.73-109. In: Pinton R et al (eds) The rhizosphere,
biochemistry and organic substances at the soil-plant interface. CRC Press,
FL.
Coventry D. R., Hirth J. R., Reeves T. G. and Jones H. R.
1985. Development of populations of Rhizobium trifolii and nodulation
of subterranean clover following the cropping phase in crop-pasture rotation in
southeastern Australia. Soil Biology and Biochemistry 17: 17- 22.
Dardanelli M., Angelini J. and Fabra A. 2003. A
calcium-dependent bacterial surface protein is involved in the attachment of
rhizobia to peanut roots. Canadian journal of microbiology 49:
399-405.
Dart P. J. 1975. Legume root nodule initiation and
development. p. 467-506. In J. G. Torrey and D. T. Clarkson (ed.), The
development and function of roots. Academic Press, London, United Kingdom.
Dashti N., Zhang F., Hynes R.K., Smith D.L. 1998. Plant growth
promoting rhizobacteria accelerate nodulation and increase nitrogen fixation
activity by field grown soybean Glycine max (L.) under short season
conditions. Plant Soil. 200: 205-213.
Date R. A. 2000. Inoculated legumes in cropping systems of the
tropics. Field Crops Research 65: 123-136.
Dazzo F. B. and Truchet G. L. 1884. Attachment of nitrogen
fixing bacteria to roots of host plants. p. 65-99. In: N. S. Subba
Roa, (ed). Current Developments in Biological Nitrogen Fixation.London: Edward
Arnold Publishers.
Deakin WJ. And Broughton W.J. 2009. Opinion: symbiotic use of
pathogenic strategies: rhizobial protein secretion systems. Nat. Rev.
Microbiol. 7: 312-320.
De Bruijn F. J. 1992. Use of repetitive (repetitive extragenic
palindromic and enterobacterial repetitive intergenic consensus) sequences and
the polymerase chain reaction to fingerprint the genomes of Rhizobium
meliloti isolates and other soil bacteria. Appl. Environ. Microbiol. 58:
2180-2187.
Références bibliographiques
De Lajudie P., Laurent-Fufele E., Willems A., Torck U.,
Coopman R., Collins M. D., Kersters K., Dreyfus B. and Gillis M. 1998a.
Allorhizobium unicola gen. nov; sp. nov. nitrogenefixing
bacteria that efficiently nodulate Neptuna natans in Senegal. Int. J.
Syst. Bacteriol. 48: 1277-1290.
De Lajudie P., Willems A., Nick G., Moreira E., Molouba F.,
Hoste B., Torck U., Neyra M., Collins M. D., Lindstöm K, Dreyfus B. and
Gillis M. 1998b. Characterization of tropical tree rhizobia and description of
Mesorhizobium plurifarum sp. nov. Int. J. Syst. Bacteriol. 48:
369-382.
De Lajudie P., Willems A., Nick G., Mohamed SH, Torck U.,
Coopman R., Filali-Maltouf A., Kersters K., Dreyfus B., Lindström K. and
Gillis M. 1999. Agrobacterium bv.1 strains isolated from nodules of
tropical legumes. Syst. Appl. Microbiol. 22: 119-132.
De Lajudie P., Willems A., Pot B., Dewettnick D., Maestrojuan
G., Neyra M., Collins M. D., Dreyfus B., Kersters K. and Gillis M.. 1994.
Poplyphasic taxonomy of rhizobia: emendation of the genus Sinorhizobium
meliloti comb.nov., S. Saheli sp. nov. and Sinorhizobium
terangae sp. nov. Int. J. Syst. Bacteriol. 44: 715-733.
De Olivera L.A. and Graham P.H. 1990. Speed of nodulation and
competitive ability among strains Rhizobium leguminosarum bv
phaseoli. Arch. Microbiol. 153:311-315.
Deaker R.., Roughley R. J. and Kennedy I. R. 2004. Legume seed
inoculation technology - a review. Soil Biology and Biochemistry 36:
1275-1288.
Denarié et Truchet, 1979. Physiologie
Végétale 17 (4): 643-667.
Denarié J., Debell E.F. and Prome J.C. 1996. Rhizobium
lipo-chitooligosaccharide nodulation factors: signaling molecules mediating
recognition and morphogenesis. Ann. Rev. Biochem. 65: 503-535.
Denarié Prome J.C. and Broughton W.J. 1992.
Broad-host-range Rhizobium species strain NGR234 secretes a family of
carbamoylated, and fucosylated, nodulation signals that are O-acetylated or
sulphated. Mol.Microbiol. 6: 3575-3584.
Denton M.D., Pearce D.J., Ballard R.A., Hannah M.C., Mutch,
L.A., Norng S. and Slattery J.F. 2009. A multi-site field evaluation of
granular inoculants for legume nodulation. Soil Biol. Biochem. 41:
2508-2516.
Deschamps M. et Wery J., 1985. Influence de l'eau et de
l'azote sur la croissance et la nutrition azotée de 2
légumineuses à graines. p. 271-280. In Nutrition
azotée des légumineuses. Les colloques de l'INRA.
DGPA. 2009. Note de service. Département des grandes
cultures. Direction générale de la production agricole.
Ministère de l'Agriculture, de l'Environnement et des Ressources
Hydrauliques, Tunis, Tunisie.
Références bibliographiques
Dhane S. 2001. Elaboration et exécution du programme de
lancement de la nouvelle variété de sulla Hedysarum
coronarium L. « Bikra 21 ». Mémoire de fin
d'études. Institut National Agronomique de Tunisie. 75p.
Dhane S. 2004 Tolérance au calcaire actif du couple
symbiotique Rhizobium/Sulla. Mémoire de master. 92p.
Dianou D. et Thiombiano L. 1995. Variabilité de
l'activité biologique des états de surface des
sols de Katchari en milieu désertifi é au Burkina Faso. INERA.
Documents techniques 39 p.
Douglas G.B., and Foote A.G. 1985. Dry matter and seed yield of
Sulla (Hedysarum coronarium L.). N.Z. J. Exp. Agric. 13: 97-99.
Dreyfus B. L., Garcia J. L. and Gillis M. 1988.
Characterization of Azorhizobium caulinodans gen. Nov; sp.
Nov; a stem-nodulating nitrogen-fixing bacterium isolated from Sesbania
rostrata. Int. J. Syst. Bacteriol. 38: 89-98.
Ducroq M. 1990. Les bases de l'Irrigation. Paris, 350 p.
Dupuy N., Willems A., Pot B., Dewettinck D., Vandenbruaene I.,
Maestrojuan G., Dreyfus B., Kersters K., Collins M. D. and Gillis M. 1994.
Phenotypic and genotypic characterization of bradyrhizobia nodulating the
leguminous tree Acacia albida. Int. J. Syst.Bacteriol. 44 : 461-473.
Duthil J. 1973. Eléments d'écologie et d'agronomie
- Tome 2 - Collection des Ingénieurs des Techniques Agricoles. 265p.
Egamberdiyeva D., Isalm KR. 2008. Salt-tolerant rhizobacteria:
plant growth promoting traits and physiological characterization within
ecologically stressed environments. In:Ahmad I, Pichtel J, Hayat S (eds)
Plant-bacteria interactions: strategies and techniques to promote plant growth.
WILEY-VCH Verlag Gmbh & Co. KGaA, Weinheim, pp 257- 281.
El Amri I., 2001. Fiche technique du Sulla. Journée de
lancement variétale du Sulla « Bikra 21 ». ESTER.
El Boutari N. 2009. Etude phénotypique et
génotypique d'une collection de Sinorhizobium meliloti et de
Rhizobium sullae. Thèse de doctorat en biologie.
Université Mohammed VAgdal, Faculté des Sciences, Rabat.
Available at :
http://hdl.handle.net/123456789/3635.
El Boutari N., Thami-Alami I., Zaïd, E. and Udupa S.
2009. Genotypic characterization of Indigenous Sinorhizobium meliloti
and Rhizobium sullae by rep-PCR, RAPD and ARDRA analyses African
Journal of Biotechnology 8 (6):979-985.
Références bibliographiques
El Mili, T.1983. Modification de la production de semences de
la luzerne de Gabès par le bore et les insectes pollinisateurs.
Mémoire du cycle de spécialisation de l'I.N.A. Tunisie, 130p.
El Sheikh E. A. and Wood M. 1989 a. Response of chickpea and
soybean rhizobia to salt:
influence of carbon source, temperature and pH.
Soil Biol. Bjochem., 21 : 883-887.
El-sheikh, E. A. E., and Wood M. 1989 b. Response of chickpea and
soybean rhizobia to salt: osmotic and specific ions effects of salts. Soil.
Biol. Biochem. 21: 889-895.
Embalomatis A., Papacosta D.K. et Katinakis P. 1994.
Evaluation of Rhizobium meliloti strains isolated from indigenous
populations in northern Greece. J. Agric. Crop. Sci. 172: 37-80.
Esseling J.J., Lhuissier FGP. and Emons AMC. 2003. Nod
Factor-Induced Root Hair Curling: Continuous Polar Growth towards the Point of
Nod Factor Application. Plant Physiology 132: 1982-1988.
Ewing M., Poole C., Skinner P. and Bennett A. 2001. Sulla and
other forage species for southern Australia. A report for the Rural Industries
Research and Development Corporation. 190 p.
Fares F. 1976. Contribution à l'étude du phosphore
associé à la matière organique des sols. Th. Doct. Etat,
INPL, 219 p.
Fauzia Y., Hafeeza, Sumera Y., Dini A., Mehboob u.R., Yusuf Z.
and Kauser A. M. 2006 Plant growth-promoting bacteria as biofertilizer. Agron.
Sustain. Dev. 26: 143-150
Ferguson L . and Lessenger J.E. 2006. Plant growth regulators.
In: Lessenger JE (ed) Agricultural medicine. Springer, New York, pp 156-166
Fettell N.A, O'Connor, G.E., Carpenter,D.J., Evans,J.,
Bamflorth, I., Oyi-Boateng, C., Hebb, D.M. and Brockwell, J. 1997. Nodulations
studies on legumes exotic to Australia : the influence of soil populations and
inocula of Rhizobium leguminosarum bv. Viciae on nodulation and
nitrogen fixation by field peas. Appl. Soil Eccol. 5 :197-210.
Figueiredo M.V.B., Burity H.A., De França F.P. and Vilar
J.J. 1998. Soil-water response in
cowpea at different development stages of
N2 fixation. Agrochimica XLII: 200-207.
Figueiredo M.V.B., Vilar J.J., Burity H.A. and De França
F.P. 1999. Alleviation water stress effects in cowpea by Bradyrhizobium
spp. inoculation. Plant Soil. 207: 67-75.
Figueiredo M.V.B., Burity C.R. Martýnez, Chanway C. P.
2008 a. Alleviation of drought stress in the common bean (Phaseolus vulgaris
L.) by co-inoculation with Paenibacillus polymyxa and Rhizobium
tropici. Applied Soil Ecology 40:182 -188.
Références bibliographiques
Figueiredo M.V.B., Martinez C.R., Burity H.A. and Chanway C.P.
2008 b. Plant growth promoting rhizobacteria for improving nodulation and
nitrogen fixation in the common bean (Phaseolus vulgaris L.). World.
J. Microbiol. Biotechnol. 24:1187-1193.
Fonder N., Heens B. and Xanthoulis D. 2010. Optimisation de la
fertilisation azotée de cultures industrielles légumières
sous irrigation Biotechnol. Agron. Soc. Environ. 14: 103-111.
Forsberg L. S. and R. W. Carlson. 1998. The structures of the
lipopolysaccharides from Rhizobium etli strains CE358 and CE359. The
complete structure of the core region of R. etli lipopolysaccharides.
J. Biol. Chem. 273: 2747-2757.
Foucher F. and Kondorosi E. 2000. Cell cycle regulation in the
course of nodule organogenesis in Medicago. Plant Molecular Biology
43:773-786.
Fox Jennifer E. 2004. "Chemical communication menacées
par les produits chimiques perturbant le système endocrinien.
Environmental Health Perspectives, vol. 112, no. 6, 648-653.
Franche C., Lindstro·m K. and Elmerich C. 2009.
Nitrogen-fixing bacteria associated with leguminous and non-leguminous plants.
Plant Soil. 321:35-59.
Fujihara S., and Yoneyama T. 1993. Effects of pH and osmotic
stress on cellular polyamine contents in the soybean rhizobia Rhizobium
fredii p220 and Bradyrhizobium japonicum A 1017. Appl. Environ.
Microbiol. 59:1104-1109.
Gage D. and Margolin W. 2000. Hanging by a thread: invasion of
legume plants by rhizobia. Current Opinion in Microbiology 3(6): 613-7.
Gage D. J. 2004. Infection and invasion of roots by symbiotic,
nitrogen-fixing rhizobia during nodulation of temperate legumes»
Microbiology and Molecular Biology Reviews 68(2): 280-300.
Gao J.L., Sun J.G., Li Y., Wang E.T. and Chen W.X. 1994.
Numerical taxonomy and DNA relatedness of tropical rhizobia isolated from
Hainan province, China. Int. J. Syst. Bacteriol. 44: 151-158.
Geurts R., Fedorova E. and Bisseling T. 2005. Nod factor
signaling genes and their function in the early stages of Rhizobium
infection. Curr. Opin. Plant. Biol. 8: 346-352.
Germida, J. J., Siciliano S. D., de Freitas J. R. and Seid A.
M. 1998. Diversity of root-associated bacteria associated with held-grown
canola (Brassica napus L.) and wheat (Triticum aestivum L.)
FEMS Microbiol. Ecol. 26: 43- 50.
Références bibliographiques
Ghidhaoui J., Ben Jeddi F., Dhane Fitouri S., Ben Ahmed H.,
Bizid E. et Drevon J.J. 2008. Effet de la salinité en milieu
hydroponique sur le sulla inoculé par deux souches de Rhizobium
sullae. In 13ème congrès de l'association
africaine pour la fixation biologique de l'azote. 15-18 décembre 2008
Hammamet. Tunisie.
Giongo A., Ambrosini A. and Vargas L. K. 2008. Evaluation of
genetic diversity of bradyrhizobia strains nodulating soybean Glycine
max L. isolated from South Brazilian fields. Appl. Soil. Ecol. 38:
261-269.
Glatzle A., T. Schulte B. and Brockwell J. 1986. Symbiotic
incompatibility between two forage species ofHedysarum, grown in
Morocco, and their homologous rhizobia. FEMS Microbiol. Lett. 30: 177-182.
Glenn A. R., and Dilworth M. J. 1994. The life of root nodule
bacteria in the acidic underground. FEMS Microbiol. Lett. 123:1-10.
Gobat JM., Aragno M. et Matthey W. 1998. Le sol vivant. Bases de
pédologie, biologie des sols. pp 458-463. Presses polytechniques et
universitaires romandes.
Gonzalez, E.M., Gordon, A.J., James, C.L. and Arrese-Igor, C.
1995. The role of sucrose
synthase in the response of soybean nodules to
drought. J. Exp. Bot. 46: 1515-1523.
Gouffi K., Pica N., Pichereau V. and Blanco C. 1999.
Disaccharides as a new class of non accumulating osmoprotectants for
Sinorhisobium meliloti. Appl. Environ. Microbiol. 65:1491-1500.
Graham P H and Parker C A. 1964. Diagnostic features in
characterization of the root-nodule bacteria of legumes. Plant and Soil 3:
383-396.
Graham P.H., Sadowsky M.J., Keyser H.H., Barnet Y.M., Bradley
R.S., Cooper J.E.,Deley D.J., Jarvis B.D.W., RoslyCcky E.B., Strijdom B.W. and
Young J.P.W. 1991. Proposed minimal standards for the description of new genera
and species of root-and stemnodulating bacteria. Int. J. Syst. Bacteriol. 41:
582-587.
Graham P H., Draeger K, Ferrey M L., Conroy M J., Hammer B E.,
Martinez E., Naarons S R . and Quinto C. 1994. Acid pH tolerance in strains of
Rhizobium and Bradyrhizobium, and initial studies on the
basis for acid tolerance of Rhizobium tropici UMR1899. Can. J.
Microbiol. 40: 198-207.
Graham PH. 1998. Symbiotic nitrogen fixation. pp 325-347. In
Sylvia D et al. eds. Principles and Applications of Soil Microbiology.
Prentice Hall, UK.
Graham P. H. et Vance C P. 2003. Legumes : Importance and
constraints to Greater Use. Plant Physiol. 131: 872-877.
Références bibliographiques
Grundmann H. J., K. J. Towner, L. Dijkshoorn, P. Gerner-Smidt,
M. Maher, H. Seifert, and M. Vaneechoutte. 1997. Multicenter study using
standardized protocols and reagents for evaluation of reproducibility of
PCR-based fingerprinting of Acinetobacter spp. J. Clin. Microbiol. 35:
3071-3077.
Guckert A. et Laperriere C., 1985. Effet du stress hydrique sur
la fixation d'azote par le trèfle blanc. Nutrition azotée des
légumineuses. Les colloques de l'INRA : 245-250.
Guignard J.L., Dupont F., 2005. Botanique. 13ème Edition
Masson.Sprent : 164-179.
Gurfel D, Lobel R and Schiffmann J. 1982. Symbiotic
nitrogen-fixing activity and yield potential of inoculated Hedysarum coronarium
in Israel. Isr. J. Bot. 31: 296-304.
Gutierrez-Mas JC. 1983. La Zulla. La reina de las forrajeiras de
secano. Agricultura 11: 576- 677.
Hagedon C. 1978. Effectiveness of Rhizobium trifolii population
associated with Trifolium subterraneum in south west oregon soil. Soil
sci. Soc. 42, 447-451.
Handley B.A., Hedges A. J., Beringer J. E. 1998 Importance of
host plants for detecting the population diversity of Rhizobium
leguminosarum bv. Viciae in soil. Soil Biol. Biochem. 30 (2): 241-249.
Harrison S.P., Jones D.G. and Young J.P.W. 1989. Rhizobium
population genetics: genetic variation within and between populations from
diverse locations. J. Gen. Microbiol. 135: 1061-1069.
Hebbar K.P., Gueniot B., Heyraud A., Colin-Morel P., T.
Heulin, Balandreau J. and Rinaudo M.1992. Characterization of
exopolysaccharides produced by rhizobacteria, Appl. Microbiol. Biotechnol. 38 :
248-253.
Hellriegel H., and Wilfarth H. 1888. Untersuchungen über
die stickstoffnahrung der gramineon und leguminosen. Beilageheft zu der ztschr.
Ver Rübenzucker - Industrie Deutchen Reichs.
Herdina and J. H. Silsbury. 1989. Nodulation and early growth
of faba bean (Vicia faba L.) and pea (Pisum sativum L.) as affected by strain
of Rhizobium, NO3 2 supply, and growth temperature. Aust. J. Agric. Res.
40:991-1001.
Heulin T. 2007. Une bactérie pour lutter contre le stress
hydrique.CEA Techno(s) no 86.
Hiltbold A. E., Thurlow D. L. and Skipper H. D. 1980. Evaluation
of commercial soybean inoculants by various techniques. Agronomy Journal 72:
675-681.
Hirsch A. M., Lum M. R. and Downie J. A. 2001. What makes the
rhizobial-legume symbiosis so special? Plant Phisiol. 127: 1484-
1492.
Références bibliographiques
Hopkin W.G. 2003 . Physiologie végétale.
Université des Sciences et Technologie de Lille. Edition de boeck.
pp.99-120.
Hu X.F., Chen J. and Guo J.F. 2006. Two phosphate-and
potassium-solubilizing bacteria isolated from Tianmu Mountain. World J.
Microbiol. Biotechnol. 22:983-990.
Huston M.A. 1994. Biological Diversity. The Coexistence of
Species in changing landscapes, Cambridge University Press, 681 p.
Hynes R. K., Craig K. A., Covert D., Smith R. S. and Rennie, R.
J. 1995. Liquid rhizobial inoculants for lentil and field pea. Journal of
Production Agriculture 8: 547-552.
Imsande J. 1986. Inhibition of nodule development in soybean by
nitrate or reduced nitrogen. J. Exp. Bot. 37: 348-355.
Isoi T., and Yoshida S. 1990. Growth, nodulation and nitrogen
fixation of soybean plants with seeds treated with kasugamycin. Soil Sci. Plant
Nutr 36: 283-288.
Jahansooz M.R., Yunusa I.A.M., Coventry D.R., Palmer A.R. and
Eamus D., 2007. Radiation- and water-use associated with growth and yields of
wheat and chickpea in sole and mixed crops. European Journal of Agronomy 26:
275-282.
Jarvis B. D. W., Pankhurst C. E. and Patel J.J. 1982.
Rhizobium loti, a new species of root nodule bacteria. Int. J. Syst.
Bacteriol. 32: 378-381.
Jarvis B. D., van Berkum W. P., Chen W. X., Nour S., Fernandez
M. P., Cleyet-Marrel J. C., and Gillis M. 1997. Transfet of Rhizobium
loti, Rhizobium huakuii, Rhizobium ciceri, Rhizobium
mediterraneum, and Rhizobium tianshanense to Mesorhizobium
gen. nov. Int. J. Syst. Bacteriol. 47: 895-898.
Jebara M., Drevon J.J., Aouani M.E. 2001. Effects of
hydroponic culture system and NaCl on interactions between common bean lines
and native Rhizobia from Tunisian soils. Agronomie 21: 601-605.
Jordan D.C. 1982. Transfer of Rhizobium japonicum
Buchanan 1980 to 681 Bradyrhizobium gen. nov., a genus of
slow-growing root nodule bacteria from leguminous plants, Int. J. Syst. Evol.
Microbiol. 32:136-139.
Jordan D.C. 1984. Rhizobiaceae. In: Kreig, N R (ed) Bergey's
manuel of systematic Bacteriology 1: 234-256.
Journet E.P. 2004. symbioses racinaires. Fiche 4. L'agriculture
peut-elle utiliser moins d'engrais . www .crdp-toulouse.fr.
Références bibliographiques
Judd AK, Schneider M., Sadowsky M.J. and De Bruijn F.J. 1993.
Use of repetitive sequences
and the polymerase chain reaction technique to classify
genetically related
Bradyrhizobium japonicum serocluster 123 strains. Appl.
Environ. Microbiol. 59: 1702-
1708.
Judd W.S., Campbell C.S., Jules Bouharmont., Kellogg E.A. et
Stevens P. 2001. Botanique systématique : une perspective
phylogénétique. Edition de boeck.
Juszczuk I.M., Wiktorowska A., Malusa, E. and Rychter A.M.
2004. Changes in the concentration of phenolic compounds and exudation induced
by phosphate deficiency in bean plants (Phaseolus vulgaris L.). Plant
Soil 267:41-49.
Kaci Yahia A., Alain Heyraud B., Mohamed Barakat C and Thierry
H. 2005. Isolation and identification of an EPS-producing Rhizobium
strain from arid soil (Algeria): characterization of its EPS and the
effect of inoculation on wheat rhizosphere soil structure Research in
Microbiology 156: 522-531.
Kafkai U. 1991. Root growth under stress. In: Waisel Y.,
Eshel A. and Kafkafi U., eds. pp.375-391. Plant roots: the hidden half. New
York, USA: Marcel Dekker.
Khan M.S., Zaidi A., Wani P.A., Ahemad M. and Oves M. 2009.
Functional diversity among plant growth-promoting rhizobacteria: current
status. In: Khan MS, Zaidi A, Musarrat J (eds). pp 105-132. Microbial
strategies for crop improvement. Springer, Germany.
Khan MS., Zaidi A., Ahemad M., Oves M, Wani PA. 2010. Plant
growth promotion by phosphate solubilizing fungi- current perspective. Arch.
Agro. Soil. Sci. 56:73-98.
Kijne, J.W. 1992. The rhizobium infection process. In: G. Stacey
and R. H. Burris, (eds). pp.349-398. Biological Nitrogen Fixation. New York.
Kishinevsky B., Dipankar S. and Guang Y. 1996. Diversity of
Rhizobia isolated from various Hedysarum species Plant and Soil 186: 21-28.
Kishinevsky B.D., Nandasena K.G., Yates R.J., Nemas C. and
Howieson J.G. 2003. Phenotypic and genetic diversity among rhizobia isolated
from three Hedysarum species: H. spinosissimum, H. coronarium and H.
flexuosum. Plant Soil 251: 143-153.
Kinkema M., Scott P.T. and Gresshoff M. 2006. Legume nodulation:
successful symbiosis through short and long distance signaling. Func. Plant
Biol. 33:707-721.
Klimek S., Richter G., Kemmermann A., Hofmann M. and
Isselstein J. 2007. Plant species richness and composition in managed
grasslands: The relative importance of field management and environmental
factors. Biological Conservation 134(4): 559-570.
Krasova-Wade T;, Diouf O., Ndoye I., Elimane-Sall C.,
Braconnier S. and Neyra M. 2006. Water-condition effects on rhizobia
competition for cowpea nodule occupancy. Afr. J. Biotechnol. 5: 1457-1463.
Références bibliographiques
Kucey R. M. N. 1989. The influence of rate and time of mineral N
application on yield and N2 fixation by field bean. Canadian Journal of Plant
Science 69: 427-436.
Laguerre G., Courde L., Nouaim R., Lamy I., Revellin C.,
Breuil M.C. and Chaussod R. 2006. Response of rhizobial populations to moderate
copper stress applied to an agricultural soil. Microbiol Ecol 52:426-435.
L'Taief B., Bouaziz S., Manasara Z.A., Hajji M. et Lachaal M.
2009. Effet de la fertilisation azotée, de l'inoculation par
Rhizobium
sp. et du régime des pluies
sur la production et la teneur en azote du pois chiche. Biotechnol. Agron. Soc.
Environ. 13 (4) :537- 544.
Labat J.N. 1996. Biogéographie, endémisme et
origine des legumineuses papilionacées de Madagascar.
Biogéographie de Madagascar: pp 95-108.
Laguerre G., Allard M. R., Revoy F. and Amarger N.1994. Rapid
identification of rhizobia by restriction fragment length polymorphism analysis
of PCR- amplified 16S rRNA genes. Appl. Environ. Microbiol. 60: 56-63.
Laguerre G., Mavingui P., Allard M. R., Charnay M. P.,
Louvrier P., Mazurier S. I., RigottierGois L., and Amarger N. 1996. Typing of
rhizobia by PCR DNA fingerprinting and PCR- restriction fragment length
polymorphism analysis of chromosomal and symbiotic gene regions: application to
Rhizobium leguminosarum and its different biovars. Appl. Environ.
Microbiol. 62 : 2029-2036.
Lapeyronie A. 1982. "Les productions fourragères
méditerranéennes: généralités,
caractères
botaniques et biologiques". (Maisonneuve g. p et la rose,
eds.). Paris, France, 425 p.
Larpent J.P., Larpent M.G. 1985. Manuel pratique de Microbiologe,
Collection Hermann, Paris, France, p. 230.
Le Houerou H. N. 1965. Forage and fuel plants in the arid zone
of north Africa, the near and the middle east: plants for arid lands. (G. E.
Wickens, J. R. Goodin, et D. V. Fields, eds.) pp 117-119.
Le Roux X., Barbault R., Baudry J., Burel F., Doussan I.,
Garnier E., Herzog F., Lavorel S., Lifran R., Roger-Estrade J., Sarthou J.P. et
Trommetter M. 2008. Agriculture et biodiversité. Valoriser les
synergies.Expertise scientifique collective, synthèse du rapport, INRA,
France.
Lerouge I., Laeremans T., Verreth C., Vanderleyden J., Van
Soom C., Tobin A., and Lévêque C., Mounoulou J.C. 2001.
Biodiversité, Dynamique biologique et conservation. Edition Dunod,
Paris, 248p.
Li B., Perabekam S., Liu, G., YIin N., Song S. and Larson A.
2002. Experimental and bioinformatics comparison of gene expression between T
cells from TIL of liver cancer and T cells from UniGene. Journal of
Gastroenterology 37(4): 275-282.
Références bibliographiques
Limpens E. et Bisseling T. 2003. Signaling in symbiosis. Current
Opinion in Plant Biology 6: 343-350.
Lindström K., Terefework Z., Suominen L., and Lortet G.
2002. Signalling and development of Rhizobium-legume symbiosis. biology and
environment: Royal I rish Academy 102 (1): 61-64.
Lindström K., Polkunen J. and Kansanen P. 1985. Effect of
dinoseb on nitrogen fixation of red clover (Trifolium pratense). Soil Biol.
Biochem. 17: 865-869.
Liu J., Wang E., Ren D. and Chen W. 2010. Mixture of
endophytic Agrobacterium and Sinorhizobium meliloti strains could induce
nonspecific nodulation on some woody legumes. Arch. Microbiol. 192: 229-234.
Llyod D., De Koning C., Hughes S., Johnson B.and McLachlan D.
2003. Solutions for a better environment. In Proceedings of the 11th
Australian Agronomy conference, 2-6 Feb.2003, Geelong, Victoria.
Australian society of Agronomy.
Lohar D., Stiller J., Kam J., Stacey G. and Gresshoff P.M.
2009. Ethylene insensitivity conferred by a mutated Arabidopsis ethylene
receptor gene alters nodulation in transgenic Lotus japonicus. Ann. Bot. 104:
277-285.
Loper J.E. et Schroth M.N. 1986. Influence of bacterial sources
of indole-3-acetic acid on root elongation of sugar beet. Phytopathology
76:386-389.
Lynch M.1990. The similarity index and DNA fingerprinting.
Mol.Bio. Evol. 7: 478-484.
Macheix J.J., Fleuriet A. et Jay-allemand C. 2005. Les
composés phénoliques des végétaux. Un exemple de
métabolites secondaires d'importance économique. pp 67-70.
Edition Presses polytechniques et universitaires romandes. Lausanne.
Mallik M. A. B. and K. Tesfai. 1985. Pesticidal effect on
soybean-rhizobia symbiosis. Plant Soil. 85: 33-41.
Mallik M. A. B. and Tesfai K. 1993. Compatibility of
Rhizobium japonicum with commercial pesticides in vitro.
Bull. Environ. Contam. Toxicol. 31:432-437.
Marghali S., Ghariani S., Marrakchi M. et Trifi-Farah N. 2003.
Diversité génétique révélée par des
marqueurs AFLP entre populations d'Hedysarum coronarium L. Fourrages
176 : 493-504.
Marie C., Broughton W.J.and Deakin W.J. 2001. Rhizobium type III
secretion systems: legume charmers or alarmers? Curr. Opin. Plant. Biol. 4:
336-342.
Références bibliographiques
Martens M., Dawyndt P., Coopman R., Gillis M., De Vos P. and
Willems A. 2008. Advantages of multilocus sequence analysis for taxonomic
studies: a case study using 10 housekeeping genes in the genus Ensifer
(including former Sinorhizobium). Int. J. Syst. Evol. Microbiol. 58:
200-214.
Martens M., Delaere M., Coopman R., De Vos P., Gilli M. and
Willems A . 2007. Multilocus sequence analysis of Ensifer and related taxa.
Int. J. Syst. Evol. Microbiol. 57: 489-503.
Martýnez-Romero E. 2003. Diversity of
Rhizobium-Phaseolus vulgaris symbiosis: overview and perspectives.
Plant Soil. 252:11-23.
Martiniello P. and Ciola A. 1994. The effect of agronomic
factors on seed and forage production in perennial legumes sainfoin
(Onobrychis viciifolia Scop.) and French honeysuckle (Hedysarum
coronarium L.). Grass Forage Sci. 49: 121-129.
Martiniello P. 1998. "L'importanza della produzione sementiera
della sulla (Hedysarum coronarium L.) in ambiente
mediterraneo(eds)Studio Editoriale Fiorentino. pp117-120. Firenze, Italy.
Martiniello P., Laudadio V., Pinto V. et Ciruzzi B. 2000.
Influence des techniques de culture sur la production du sulla et du sainfoin
en milieu méditerranéen. Fourrages 161 : 53-59.
Masson-Boivin C., Giraud E., Perret X. and Batut J. 2009.
Establishing nitrogen-fixing
symbiosis with legumes: how many rhizobium
recipes? Trends Microbiol. 17:458-466.
Metson A.J., 1956. Methods of chemical analysis for soil survey
samples. NZ Soil Bur Bull n°12.
Mezni M., Albouchi A., Bizid A. et Hamza M. 2002. Effet de la
salinité des eaux d'irrigation sur la nutrition minérale chez
trois variétés de luzerne pérenne (Medicago sativa
L.). Agronomie 22: 283-291.
Mhadhbi H., Jebara M., Zitoun A., Limam F. and Aouani M.E.
2008. Symbiotic effectiveness and response to mannitol-mediated osmotic stress
of various chickpea-rhizobia associations. World Journal of Microbiology and
Biotechnology 24: 1027-1035.
Mhamdi R., Jebara M., Aouani M.E., Ghrir R. et Mars M. 1999.
Genotypic and symbiotic effectiveness of rhizobia isolated from root nodules of
Phaseolus vulgaris L. grown in Tunisian soils. Biol. Fertil. Soil. 28:
313-320.
Mhamdi R., Laguerre G., Aouani M.E, Mars M. and Amarger N.
2002. Different species and symbiotic genotypes of field rhizobia can nodulate
Phaseolus vulgaris L. in Tunisian soils. FEMS Microbiol. Ecol. 41:
77-84.
Mnasri B., Aouani M.E. and Mhamdi R. 2007a. Nodulation and
growth of common bean
(Phaseolus vulgaris L.) under water
deficiency. Soil Biol. Biochem. 39: 1744-1750.
Références bibliographiques
Mnasri B., Mrabet M., Laguerre G., Aouani M.E. and Mhamdi R.
2007b. Salt-tolerant rhizobia isolated from a Tunisian oasis that are highly
effective for symbiotic N2-fixation with Phaseolus vulgaris constitute
a novel biovar (bv. mediterranense) of Sinorhizobium meliloti. Arch.
Microbiol. 187: 79-85.
Mohammad R.M., Akhavan-Kharazian M., Campbel W.F. and Rumbaugh
M.D. 1991. Identification of salt-and drought tolerant Rhizobium meliloti
strains. Plant Soil. 134: 271-276.
Moore G., Sanford P. and Wiley T. 2006. Perennial pastures for
Western Australia. Department of Agriculture and Food Western Australia,
Bulletin 4690, Perth.
Moreira F. M. S., Gillis M., Pot B., Kersters K. and Franco A.
A. 1993. Characterisation of rhizobia isolated from different groups of
tropical leguminosae by comparative polyacrylamide gel electrophoresis of their
total proteins. Syst. Appl. Microbiol. 16: 135- 146.
Mottareale G. 1898. Di alcuni organi particolari delle radici
tubercolifere dello Hedysarum coronarium in relazione al Bacillus
radicicola e alla Phytomyxa leguminosarum. Atti R. Ist. incoragg.
Napoli. 11: 1-7.
Moulin L., Munive A., Dreyfus B. and Boivin-Masson C. 2001.
Nodulation of legumes by members of the beta-subclass of Proteobacteria.
Nature. 411: 948-950.
Mrabet M., Mnasri B., Laguerre G., Aouani M.E. and Mhamdi R.
2006. Agrobacterium strains isolated from root nodules of common bean
specifically reduce nodulation by Rhizobium gallicum. FEMS Microbiol. Ecol. 56:
304-309.
Mrabet M., Mhamdi R., Tajini F., Tiwari R., Trabelsi M. and
Aouani E.A. 2005. Competitiveness and symbiotic effectiveness of a R.
gallicum strain isolated from root nodules of Phaseolus vulgaris
European Journal of Agronomy 22: 209-216.
Mulder L., Hogg B, Bersoult A, Cullimore JV. 2005. Integration of
signaling pathways in the establishment of the legume-rhizobia symbiosis.
Physiol. Plant 123: 207-218.
Muller S., Pereira P. A. A. and Martin P. 1993. Effect of
different levels of mineral nitrogen on nodulation and N2 fixation of two
cultivars of common bean (Phaseolus vulgaris L.). Plant and Soil 152:
139-143.
Muller S. H. and Pereira P. A. A. 1995. Nitrogen fixation of
common bean (Phaseolus vulgaris L.) as affected by mineral nitrogen
supply at different growth stages. Plant and Soil 177, 55-61.
Munns D. N. 1977. Soil acidity and related factors. In
J. M. Vincent, A. S. Whitney and J. Bose (eds.) pp. 211-236.
Références bibliographiques
Muresu R., Polone E., Sulas L., Baldan B., Tondello A., Delogu
G., Cappuccinelli P., Alberghini S., Benhizia Y., Benhizia H., Benguedouar A.,
Mori B., Calamassi R., Dazzo F. B. and Squartini A. 2008. Coexistence of
predominantly non culturable rhizobia with diverse endophytic bacterial taxa
within nodules of wild legumes. FEMS Microbiol. Ecol. 63: 383-400.
Murphy P.J., Heycke N., Banfalvi Z., Tate M.E., de Brujin F.,
Kondorosi A., Tempe J. and Schell J. 1987. Genes for the catabolism and
synthesis of an opine-like compound in Rhizobium meliloti are closely linked on
the Sym plasmid. Proc. Natl. Acad. Sci. USA 84: 493-497.
Nannipieri P., Ciardi C., Plazzi T. and Badalucco L. 1990.
Short-term nitrogen reaction following the addition of urea to a grass-legume
association. Soil Biol. Biochem. 22: 549-553.
Nebout C. N., Bout-Roumazeilles V., Dormoy I. and Peyron O. 2009.
Sécheresse récurrente en méditerranée au cours desw
derniers 50 000 ans. Sécheresse 20 (2) : 210-6.
Neffati M., 1994. Caractérisation morphologique de
certaines espèces végétales nordafricaines. Implications
pour l'amélioration pastorale. Thèse de doctorat en sciences
biologiques appliqués section agronomie .Université Gent. 264
pp.
Newcomb W., Sippell D. and Peterson R. L. 1979. The early
morphogenesis of Glycine max and Pisum sativum root nodules.
Can. J. Bot. 57: 2603-2616.
Nick G. and Lindström K. 1994. Use of repetitve sequences
and the polymerase chain reaction to fingerprint the genomic DNA of Rhiobium
galegae strains and to identify the DNA obtained by sonicating liquid cultures
and root nodules. Systematic and Applied Microbiology 17: 265-273.
Niehaus K., Lagares A., and Pühler A. 1998. A
Sinorhizobium meliloti lipopolysaccharide mutant induces effective
nodules on the host plant Medicago sativa (alfalfa) but fails to
establish a symbiosis with Medicago truncatula. Mol. Plant-Microbe
Interact. 11: 906- 914.
Noel T.C., Sheng C., Yost K., Pharis R. P. and Hynes M. F.
1996. Rhizobium leguminosarum as plant growth-promoting
rhizobacterium: Direct growth promotion of canola and lettuce, Can. J.
Microbiol. 42 :279-283.
Nour S. M., Cleyet-Mar E. J. L. C., Norman D. P. and Fernande
M. P. 1995. Genomic heterogeneity of strains nodulating Chickpeas (Cicer
arietinum L.) and description of Rhizobium mediterraneum sp. nov. Int. J.
Syst. Bacteriol. 45: 640-648.
O'Hara G. W., and Glenn A. R. 1994. The adaptive acid tolerance
response in root nodule bacteria and Escherichia coli. Arch.
Microbiol. 161: 286-292.
Références bibliographiques
Olsen S.R. 1954. Estimation of available phosphorous in soils by
extraction with sodium bicarbonate. Cir. U.S. Dep. Agr . 939:1-19.
Oresnik I.J., Twelker S.and Hynes M.F. 1999. Cloning and
characterization of a Rhizobium leguminosarum gene encoding a bacteriocin with
similarities to RTX toxins. Appl. Environ. Microbiol. 65: 2833-2940.
Palmer K.M. and Young JPW. 2000. Higher diversity of
Rhizobium leguminosarum biovar viciae populations in arable soils than
in grass soils. Appl. Environ. Microbiol. 66: 2445 2450.
Parthipan S. and Kulasooriya S. A. 1989. Effect of nitrogen-
and potassium-based fertilizers on nitrogen fixation in the winged bean,
Psophocarpus tetragonolobus journal of applied microbiology and biotechnology
5(3): 335-341.
Patriarca E.J., Tate R., Ferraioli S. and Iaccarino M. 2004.
Organogenesis of legume root nodules. Int. Rev. Cytol. 234: 201-62.
Pauwels, J. M., Van Ranst E. et Verloo M. 1992. Manuel de
laboratoire de pédologie: méthodes d'analyse de sols et de
plantes, équipement, gestion de stocks de verrerie et de produits
chimiques Ed. AGCD. 265p.
Pawlowski K. and Bisseling T., 1996. Rhizobial and Actinorhizal
Symbioses: What Are the Shared Features? Plant Cell. 8: 1899-1913.
Payakapong W., Tittabutr P., Teaumroong N., Boonkerd N.,
Singleton P.W. and Borthakur D. 2006. Identification of Two Clusters of Genes
Involved in Salt Tolerance in Sinorhizobium sp. Strain BL3. Symbiosis
41: 47-51.
Pelmont J. 1995. Bactéries et environnement: Adaptation
physiologique. Office des Publications Universitaires 2: 541-572.
Peoples M. B., Ladha J. K. and Herridge D. F. 1995. Enhancing
legume N2 fixation through plant and soil management. Plant and Soil 174:
83-101.
Perret X., Staehelin C. and Broughton W.J. 2000. Molecular basis
of symbiotic promiscuity. Microbiol. Mol. Biol. Rev. 64:180-201.
Perry J.J., Stalex J.T. et Lory S. 2004. Microbiologie cours et
questions de revision. Edition Dunod. Paris. France.
Pierson L.S. and Pierson E.A. 2000. Microbial gossiping:
signaling. In the rhizosphere proceedings of 5th PGPR Workshop.
Pinto P.A., Barradas G.J. and Tenreiro P.C. 1993. Growth
analysis and chemical composition of sulla (Hedysarum coronarium L.).
In: Proc. of the XVII International Rangeland Congress, New Zealand,
pp. 587-589.
Références bibliographiques
Pinto Pereira P., Paiva E., Purcina H., Passos Magalhaes P.V.
and Horta M.N. 2004. Caracterisation of rhizobia that nodulate arachis pintoi
by RAPD analysis. Brazilian Journal of microbiology 35: 219-233.
Pointereau P. et Bisault L. 2007. La monoculture et ses dangers
pour l'environnement, trente ans de paysages agricoles, Solagro.
http://www.solagro.org/site/im_user/206okles_dangers_de_la_monoculture1.pdf
Poschold P., Bakker J.P. and Kahmen S. 2005. Changing land use
and its impact on biodiversity. Basic and Applied Ecology 6(2): 93-98.
Powell W., Machray G. and Provan J. 1996. Polymorphism revealed
by simple sequence repeats. Trends Plant Sci. 1: 215-222.
Price N.P.J., Relic B., Talmon TF., Lewin A., Prome D., Pueppk
G., Maillet F., Denarie J., Prome J.C. and Broughton W. J. 1992.
Broad-host-range Rhizobium species strain NGR234 secretes a family of
carbamoylated, and fucosylated, nodulation signals that are O-acetylated or
sulphated. Mol. Microbiol. 6: 3575-3584.
Pueppke S. G. and Broughton W. J. 1999. Rhizobium sp.
NGR234 and R. fredii USDA257 share exceptionally broad, nested
host-ranges. Mol. Plant-Microbe Interact. 12 : 293-318.
Pugnaire F.I., Endolz L.S., Pardos J. 1994. Constraints by
water stress on plantgrowth. In: Pessarakli, M. (Ed.) pp. 247-259. Handbook of
Plant and Crop Stress. Marcel Dekker, New York, NY.
Purcell L. C., and Sinclair T. R. 1990. Nitrogenase activity and
nodule gas permeability response to rhizospheric NH3 in soybean. Plant Physiol.
92:268-272.
Rai R. 1983. The salt tolerance of Rhizobium strains and
lentil genotypes and the effect of salinity on the aspects of symbiotic
N-fixation. J. Agric. Sci. 100, 81-86.
Rao DLN, Giller K.E., Yeo A.R. and Flowers T.J. 2002. The
effect of salinity and sodicity upon nodulation and nitrogen fixation in
chickpea (Cicer arietinum). Ann. Bot. 89: 563- 570.
Rasanen L. 2002. Biotic and abiotic factors infl uencing the
development of N2-fixing symbioses between rhizobia and the woody legumes
Acacia. Thèse de doctorat de l'université de Helsinki.
Finlan Oldroyd. 220p.
Raven P. H., Evert R. F. et Eichlorn S. E. 2000. Biologie
végétale. 6ème Edition de boeck, Paris.
Raza S., Jornsgard Abou-Taleb, B. H. and Christiansen J.L.
2001. Tolerance of Bradyrhizobium sp. (Lupini) strains to salinity,
pH, CaCO3 and antibiotics. Letters in Applied Microbiology.
Références bibliographiques
Rennie R. J., and Dubetz S. 1984. Multistrain vs single strain
Rhizobium japonicum inoculants for early maturing soybean cultivars:
N-fixation quantified by 15N isotope dilution. Agron. J. 76 :498-502.
Ribeiro RA., Barcellos FG., Thompson F.L., Hungria M. 2009.
Multilocus sequence analysis of Brazilian Rhizobium microsymbionts of common
bean (Phaseolus vulgaris L.) reveals unexpected taxonomic diversity.
Res. Microbiol. 160: 297-306.
Rinaudo M. 1992. Characterization of exopolysaccharides produced
by rhizobacteria. Appl. Microbiol. Biotechnol. 38: 248-253.
Rivas R., Laranjo M., Mateos P.F., Oliveira S.,
Martinez-Molina E. and Velazquez E. 2007. Strains of Mesorhizobium amorphae and
Mesorhizobium tianshanense, carrying symbiotic genes of common chickpea
endosymbiotic species, constitute a novel biovar (ciceri) capable of nodulating
Cicer arietinum. Lett. Appl. Microbiol. 44:412-418.
Robleto E.A., Kmiecik K., Oplinger E.S., Nienhuis J. and
Triplett E.W. 1998. Trifolitoxin production increases nodulation
competitiveness of Rhizobium etli CE3 under agricultural conditions.
Appl Environ. Microbiol. 64:2630-2633.
Robson A.C. 1969. Competition between effective and infective
strains of Rhizobium trifolii in the nodulation of Trifolium
subterraneum. Australian Journal of agricultural research. 20 (5):
827-849.
Robson A. D. and Bottomley P. J. 1991. Limitations in the use
of legumes in agriculture and forestry, p. 320-349. In M. J. Dilworth
and A. R. Glenn (ed.), Biology and biochemistry of nitrogen fixation. Elsevier
Publishers, Amsterdam, The Netherlands.
Rondia G., Deker A., Jabbar M. et Antoine A. 1985. Produire
plus de grains et de lait en Afrique du nord. Projet ferme modèle de
Frétissa: rapport final. Publications agricoles n: 5. Ministère
de l'Agriculture de Tunisie et Administration Générale de la
Coopération au Développement Belge. Bruxelles. 389 p.
Saadallah, K; Drevon J.J. et Abdelly C. 2001. Nodulation et
croissance nodulaire chez le haricot (Phaseolus vulgaris) sous
contrainte saline. Agronomie 21 : 627-634. INRA, EDP Sciences.
Sadowsky MJ. 2000. Prokaryotic nitrogen fixation: a model
system for analysis of a biological process, Horizon Scientific Press In: E.W.
Triplett (Ed.), Wymondham. p 279- 293.
Sadowsky MJ. 2005. Soil stress factors influencing symbiotic
nitrogen fixation. In: Werner D, Newton WE (eds) Nitrogen fixation in
agriculture, forestry, ecology, and the environment. Springer, The Netherlands,
pp 89-112.
Références bibliographiques
Saleena, L. M., Loganathan, P., Rangarajan, S. and Nair, S. 2001.
Genetic diversity of Bradyrhizobium strains isolated from Arachis
hypogea. Can. J. Microbiol. 47 : 118-122.
Sanaa, M. 1993 Dynamique et bilan de l'azote minéral dans
quelques sols calcaires en Tunisie. Thèse de Doctorat. Université
de Gent, Belgique. 175p.
Sanaa, M., Robebez, M., 1986. Prise d'échantillons et
analyse du sol. Séminaire sur la fertilisation.
Sanchez-Diaz M., Aguirreolea J., Goicochea N. and Antolin M.C.
1995. Limitation de la Fixation symbiotique d'azote et autres aspects
physiologiques des légumineuses des zones
méditerranéennes. In : Actes du colloque, Facteurs
limitant la fixation symbiotique de l'azote dansle bassin
méditerranéen, 6-8 avril 1994, Montpellier, France. Paris :
INRA.
Sanginga N., Wirkom L. E., Okogun A., Akobundu I. O., Carsky
R. J. and Tian G. 1996. Nodulation and estimation of symbiotic nitrogen
fixation by herbaceous and legumes in Guinea savanna in Nigeria. Biol. Fertil.
Soils 23:441-448.
Santos M.A., Nicola's M.F. and Hungria M. 2006. Identification
of QTL associated with the symbiosis of Bradyrhizobium japonicum,
B. elkanii and soybean. Pesq. Agrop. Bras. 41: 67-75.
SAS Institute Inc. 1996. SAS/STAT Software: Changes and
enhancements through release 6.11 Cary, NC: SAS Institute Inc.
Schaller B., Nemecek T., Streit B., Zihlmann U., Chervet A.
and Sturny W.G. 2007. Bilan écologique comparatif du semis direct et du
labour Revue Suisse d'Agriculture 39 (2): 73- 79.
Scherer H.W. and Lange A. 1996. N2 fixation and growth of legumes
as affected by sulphur fertilization. Biol. Fertil. Soils. 23: 449-453.
Scherer H.W., Pacyna S. and Spoth K.R. 2008. Low levels of
ferrodoxin, ATP and leghaemoglobin contribute to limited N2 fixation in peas
(Pisum sativum L.) and alfalfa(Medicago sativa L.) under S
deficiency conditions. Biol. Fertil. Soils 44: 909-916.
Schlöter M., Wiehe W., Assmus B., Steindl H., Becke H.,
Hoflich G. and Hartmann A. 1997. Root colonization of different plants by
plant-growthpromoting Rhizobium leguminosarum bv. trifolii R39 studied
with monospecific polyclonal antisera, Appl. Environ. Microbiol. 63:
2038-2046.
Selenska-Pobell S., Evguenieva-Hackenberg E., Radeva G. and
Squartini A. 1996. Characterization of Rhizobium `hedysari'
by RFLP analysis of PCR-amplied rDNA and by genomic PCR fngerprinting. J.
Appl. Bacteriol. 80: 517-528.
Semadeni A. 1976. Le sulla en Tunisie. 741p.
Références bibliographiques
Serraj R., Vadez V. et Sinclair T. 2001. Feedback regulation of
symbiotic N2 fixation under drought stress. Agronomie 21: 621-626.
Shaharoona B., Arshad M. et Zahir Z.A. 2006. Effect of plant
growth promoting rhizobacteria containing ACC-deaminase on maize (Zea
mays L.) growth under axenic conditions and on nodulation in mung bean
(Vigna radiata L.). Lett. Appl. Microbiol. 42:155-159.
Shahzad M.S., Khalid A., Arshad M., Khalid M. and Mehboob I.
2008. Integrated use of plant growth promoting bacteria and P-enriched compost
for improving growth, yield and nodulation of chickpea. Pak. J. Bot.
40:1735-144.
Shamseldin A., Nyalwidhe J., Werner D. 2006. A proteomic
approach towards the analysis of salt tolerance in Rhizobium etli and
Sinorhizobium meliloti strains. Curr. Microbiol. 52: 333-339.
Sharma H.C., Sharma K.K. and Crouch J.H. 2004. Genetic
transformation of crops for insect resistance: Potential and limitations.
Critical Reviews in Plant Sciences 23:47-72.
Shoushtari N.H. and Pepper I.L. 1985. Mesquite rhizobia isolated
from the Sonoran desert: physiology and effectiveness. Soil Biol Biochem 17:
797-802.
Simms E.L and Taylor D.L. 2002. Partner Choice in
Nitrogen-Fixation Mutualisms of Legumes, and Rhizobia1. Comp. Biol. 42:
369-380.
Sinclair T.R., Purcell L.C., Vadez V. and Serraj R., 2001.
Selection of soybean (Glycine max) lines for increased tolerance of N2
fixation to drying soil. Agronomie 21: 653-657.
Slattery J. F., Coventry D. R. and Slattery W. J. 2001. Rhizobial
ecology as affected by soil environment. Australian Journal of Experimental
Agriculture 41: 289-298.
Slim S., 2004. Amélioration fourragère et
protection des terres par le Sulla "Bikra21" dans les gouvernorats de Zaghouan
et de Siliana. Projet de Fin d'Etudes. INAT. 81p.
Slim S., 2011. Protection des sols en zones montagneuses du Nord
de la Tunisie par le sulla du nord Hedysarum coronarium L. Secheresse.
(In press)
Sneath P. H. A. and Sokai R. R. 1973. Numerical taxonomy. The
principles and practice of numerical classification. V. H. Freeman and Co., San
Francisco, USA.
Solano B. R., Maicas J. B. and Mahero F. J. G. 2008.
Physiological and molecular mechanisms of plant growth promoting rhizobacteria
(PGPR). pp 41-52. In: Ahmad I, Pichtel J, Hayat S (eds) Plant bacteria
interactions: strategies and techniques to promote plant growth. Wiley,
Weinheim, Germany.
Somasegaran P. and Hoben H. J. 1994. Handbook for Rhizobia:
Methods in legume-Rhizobia technology. In Springer-Verlag. New York. 450 p.
Références bibliographiques
Soussi M., Ocana A. and Lluch C. 1998. Effects of salt stress on
growth, photosynthesis and nitrogen fixation in chickpea (Cicer
arietinum L.). J. Exp. Bot. 49: 1329-1337.
Spaink H. P., Wijffelman C. A., Pees E., Okker R. J. H., and
Lugtengerg B. J. J. 1987. Rhizobium nodulation gene nodD as a
determinant of host specificity. Nature. 328:337- 340.
Spaink H.P. 2000 .Root nodulation and infection factors produced
by rhizobial bacteria. Annus.Rev. Microbiol. 54: 257-88
Spehn E. M., Scherer-Lorenzen M., Schmid B., Hector A.,
Caldeira M. C., Dimitrikopoulus P. G., Finn J. A., Jumpponen A., O'Donnovan G.,
Pereira J. S., Schulze E. D., Troumbis A.Y. and Körner C. 2002. The role
of legumes as a component of biodiversity in a cross-European study of
grassland biomass nitrogen. Oikos 98: 205-218.
Sprent J. I. 1981. Nitrogen fixation. In: Paleg L.G.
& Aspinall D., eds. The physiology and biochimistry of drought
resistance in plants. Sydney, Australia Academic Press. pp131- 151.
Sprent J.I., 1995. Legume trees and shrubs in the tropics: N2
fixation in perspective. Soil Biol. Biochem 27: 401-407.
Squartini A., Dazzo F. B., Casella S. and Nuti M. P. 1993. The
root nodule symbiosis between Rhizobium `hedysari' and its
drought-tolerant host Hedysarum coronarium. Symbiosis 15: 227-238.
Squartini A., Struffi P., Do-ring H., Seleska-Pobell S., Tola
E., Giacomini A., Vendramin E., Velazquez E., Mateos P. F., Martinez-Molina E.,
Dazzo F. B., Casella S. and Nuti M. P. 2002. Rhizobium sullae sp.
nov. (formerly Rhizobium hedysari): The root-nodule microsymbiont
of Hedysarum coronarium L. Int J Syst Evol Microbiol 52: 1267-1276.
Stephens J. H. G. and Rask H. M. 2000. Inoculant production and
formulation Field crops Res. 65: 249-258.
Streit W. R., Joseph C.M. and Philips D. A. 1996. Biotin and
other water-soluble vitamins are key growth factors for alfalfa root
colonization by Rhizobium meliloti 1021. Mol Plant-Microbe Interact. 9
:330-338.
Stringi L. et Amato G. 1998. La Sulla nell'ambiente siciliano:
utilizzazione e prospettive di valorizzazione. I Georgofili, Firenze.
Struffi P., Corich V., Giacomini A., Benguedouar A., Squartini
A., Casella S. and Nuti M. P. 1998. Metabolic proprieties, stress tolerance and
macromolecular profiles of rhizobia nodulating Hedysarum coronarium. J. Appl.
Microbiol. 84: 81-89.
Références bibliographiques
Sturz A.V., Carter M.R. and Johnston A.W. 1997. A review of
plant disease, pathogen interactions and microbial antagonism under
conservation tillage in temperate humid agriculture. Soil Till. Res. 41:
169-189.
Sulas L. 2006. La sulla (Hedysarum coronarium L.):
foraggera per ambient marginali o specie strategicca? pp. 19-28.In Atti del III
convegno internazionale: l'ossidiana del Monte Arci nel Mediterraneo, Pau
Manias, Italia.
Sulas L., Seddaiu G., Muresu R. et Roggero P.P. 2009. Fixation de
l'azote du sulla en conditions méditerranéennes. Agronomy Journal
101: 1470-1478.
Sultan T., Aslam M., Mahmood I.A., Ahmad S. and Zahid M.A.
2002. Growth and yield response of chickpea (Cicer arientinum) to
various rhizobium strains fertilized with different phosphorus levels.
International Journal of agriculture Biology 2: 89-91.
Sy A, Giraud E, Jourand P, Garcia N, Willems A, de Lajudie P,
Prin Y, Neyra M, Gillis M, Boivin-Masson C and Dreyfus B. 2001. Methylotrophic
Methylobacterium bacteria nodulate and fix nitrogen in symbiosis with legumes.
J. Bacteriol. 183: 214-220.
Tak T., van Spronsen P. C., Kijne J.W., van Brussel A. A. N.
and Kees Boot J. M. 2004. Accumulation of lipochitin oligosaccharides and
NodD-activating compounds in an efficient plantRhizobium nodulation assay. Mol.
Plant. Interac. 17: 816-823.
Talamucci P., Staglianò N., Sabatini S. I. et Georgofili
Q. 1998. La zulla: possibili ruoli nella foraggicoltura mediterranea, pp 7-28.
Studio Editoriale Fiorentino, Firenze, Italy.
Taller B. J. et Wong T. Y. 1989. Cytokinins in Azotobacter
vinelandii culture medium. Appl. Environ. Microbiol. 55 : 266-267.
Thami-Alami I. et El Mzouri E. D. 2000. Etude de
l'efficacité et de la persistance des souches de rhizobium de Sulla.
Cahiers Options Méditerranéennes. CIHEAM 15: 321-325.
Thami-Alami I. Papineau J., Huyghe C. and Al Faiz C. 2004.
Collection of the genus Lupinus in Morocco Dans le
développement des cultures fourragères; une
nécessité pour améliorer les productions animales et
atténuer la degradation des resources naturelles, INRA Proceeding. Mars
2004. INRA. Rabat.
Thies J. E., Singleton P. W. and Bohloo1 B. B. 1991. Influence
of the size of indigenous rhizobial populations on establishment and symbiotic
performance of introduced rhizobia on field-grown legumes. App. Environ.
Microbio1. 57: 19-28.
Thiombiano L. et Dianou D. 1999. Activité biologique
globale dans trois états de surface des sols sahéliens. A.U.O,
série B VII, pp. 179-187.
Thompson J. A. 1988. Survival of root-nodule bacteria on
inoculated seed. pp:67-80.In: Murrell WG,Kennedy IR, eds, Microbiology in
action, Research Studies Press Letchworth.
Références bibliographiques
Tibaoui G. 1986. Amélioration de la production des
légumineuses fourragères par l'inoculation et la fertilisation.
Mémoire de fin d'études du cycle de spécialisation de
l'INA Tunisie, 156p.
Tibaoui G. et Zouaghi M. 1989. Rôle de l'inoculation dans
l'amélioration des rendements des légumineuses fourragères
dans la région de Mateur. Revue de l'I.N.A.T 4 : 2.
Tighe S. W., Amarger N., Squartini A. and Jarvis, B. D. W.
1994. Identification of new and emerging species of Rhizobium using
cellular fatty acid analysis. pp23-27. In Abstracts of the 94th General
Meeting of the American Society for Microbiology May 1994, Las Vegas, NV,
USA.
Timmers A.C.J., Soupene E., Auriac M.C., De Billy F., Vasse
J., Boistard P. and Truchet G. 2000. Saprophytic intracellular rhizobia in
alfalfa nodules. Mol. Plant-Microbe Interact. 13: 1204-1213.
Toffanin A., Wu Q., Maskus M., Casella S., Abruna H. D. and
Shapleigh J. P. 1996. Characterization of the gene encoding nitrite reductase
and the physiological consequences of its expression in the nondenitrifying
Rhizobium `hedysari' strain HCNT1. Appl Environ. Microbiol.
62 :4019-4025.
Tortora G.J., Funk B.R. and Case C.L. 2003. Introduction à
la microbiologie. Edition du Renouveau Pédagogique Inc. 945p.
Trabelsi D., Mengoni A., Aouani M.E., Bazzicalupo M. and
Mhamdi R. 2010. Genetic diversity and salt tolerance of Sinorhizobium
populations from two Tunisian soil. Ann Microbiol. 60 : 541-547.
Trifi-Farah N., Chatti W. S., Marrakchi M., et Pernest J.
1989. Analyse de la variabilité morphologique et enzymatique des formes
cultivées et spontanées de Hedysarum coronarium L. en
Tunisie. Agronomie 9 : 591- 598.
Trifi-Farah N., Baatout H., Boussaid M., Combes D., FigierJ.,
Hannachi-Salhi A. et Marrakchi M. 2002. Evaluation des ressources
génétiques des espèces du genre Hedysarum dans le
bassin méditerranéen. Plant Genetic Resources Newsletter 130:
1-6.
Triplett E. and Sadowsky M. 1992. Genetic of competition for
nodulation for nodulation of legumes. Annu. Rev. Microbiol. 46: 399-428.
Tscharntke T., Bommarco R., Clough Y., Crist T.O., Kleijn D.,
Rand T. A., Tylianakis J. M., van Nouhuys S. and Vidal S. 2007. Conservation
biological control and enemy diversity on a landscape scale. Biological Control
43(3): 294-309.
Tzedakis P. C. 2005. Towards an understanding of the response of
southern Euroean vegetation to orbital and suborbital climate variability.
Quat. Sci. Rev. 24:1585-99.
Références bibliographiques
Vadez V., Rodier F., Payre H. and Drevon J. J. 1996. Nodule
permeability to O2 and nitrogenase-linked respiration in bean genotypes varing
in the tolerance of N2 fixation to P deficiency. Plant Physiol. Biochem. 34:
871-878.
Van Berkum P. and Eardly B.D. 2002. The aquatic budding
bacterium Blastobacter denitrificans is a nitrogen fixing symbiont of
Aeschynomene indica. Appl. Environ. Microbiol. 68: 1132-1136.
Van Berkum P., Elia P. and Eardly B.D. 2006. Multilocus sequence
typing as an approach for population analysis of Medicago-nodulating rhizobia.
J. Bacteriol. 188:5570-5577.
Van Berkum P., Beyene D. and B. D. Eardly. 1996. Phylogenetic
relationships among Rhizobium species nodulating the common bean
Phaseolus vulgaris L. Int. J. Syst. Bacteriol. 46: 240-244.
Van de Wiel C., Scheres B., Franssen H., Van Lierop MJ., Van
Kammen A. and Bisseling T. 1990. The early nodulin transcript ENOD2 is located
in the nodule parenchyma (inter cortex) of pea and soybean nodules.EMBO Journal
9:1-7.
Vance E.D., Brookes P.C. and Jenkinson D.S. 1987. An extraction
method for measuring soil microbial biomass C. Soil Biology et Biochemistry 19:
703-707.
Varin S., Lemauviel-Lavenant S., Cliquet J.B., Diquelou S.,
Padraic T. and MichaelsonYeates T. 2009. Functional plasticity of Trifolium
repens L. in response to sulphur and nitrogen availability. Plant Soil.
317: 189-200.
Velazquez E., Garcýa-FraileP., Ramýrez-Bahena
M.H., Rivas R. and Martýnez-Molina E. 2010. Bacteria Involved in
Nitrogen-Fixing Legume Symbiosis: Current Taxonomic Perspective. M.S. Khan et
al. (eds.). Microbes for Legume Improvement. Springer-Verlag Wien. Germany. DOI
10.1007/978-3-211-99753-6.
Versalovic, J., T. Koeuth, and Lupski J. R. 1991. Distribution
of repetitive DNA sequences in eubacteria and application to fingerprinting of
bacterial genomes. Nucleic Acids Res. 19: 6823-6831.
Vessey J.K. 2003. Plant growth promoting rhizobacteria as
biofertilizers. Plant Soil. 255: 571- 586.
Vincent J. M. 1970. A manual for practical study of root nodule
bacteria. IBP Handbook 15. Blackwell Scientific Publications, Oxford.
Vincent Y. H. 1982. Nitrogen fixation in legumes. Ed. Academic /
Res. Australia. 1-11.
Vinuesa P., Neumann-Silkow F., Pacios-Bras C., Spaink H.P.,
Martinez-Romero E. and Werner D. 2003. Genetic analysis of a pH-regulated
operon from Rhizobium tropici CIAT899 involved in acid tolerance and
nodulation competitiveness. Mol. PlantMicrobe Interact. 16:159-168.
Références bibliographiques
Vinuesa P., Rojas-Jime'nez K., Contreras-Moreira B, Mahn S.K.,
Prasad B.N., Moe H., Selvaraju SB., Thierfelder H. and Werner D. 2008.
Multilocus sequence analysis for assessment of the biogeography and
evolutionary genetics of Four Bradyrhizobium species that nodulate soybeans on
the asiatic continent. Appl. Environ. Microbiol. 74: 6987-6996.
Vlassak K.M. and Vanderleyden J. 1997. Factors influencing nodule
occupancy by inoculant rhizobia. Crit. Rev. Plant. Sci. 16:163-229.
Vriezen JAC., De Bruijn F.J. and Nusslein K. 2006. Desiccation
responses and survival of Sinorhizobium meliloti USDA 1021 in relation
to growth phase, temperature, chloride and sulfate availability. Lett. Appl.
Microbiol. 42:172-178.
Vriezen JAC., De Bruijn F.J. and Nusslein K. 2007. Responses
of rhizobia to desiccation in relation to osmotic stress, oxygen and
temperature. Appl. Environ. Microbiol. 73:3451- 3459.
Wadoux P. 1991. Inoculant production in industry using sterile
carriers. In: V. A. Thompson, (ed). Expert Consultation on Legume
Inoculant Production and Use. Rome: FAO
Watson M.J. 1982. Hedysarum coronarium, a legume with
potential for soil conservation and forage. N. Z. J. Agric. Sci. 16:
189-193.
Watt M.M., McCully M.E. and Jeffree C.E. 1993. Plant and
bacterial mucilages of the maize rhizosphere: Comparison of their soil binding
properties and histochemistry in a model system, Plant Soil 151: 151-165.
Wayne L.G., Brenner D.J., Colwell R.R., Grimont P.A.D.,
Kandler P. Krichevsky M.I., Moore L.H., Moore L.H., Murray R. G. E.,
Stackebrandt E., Starr M. P. and Trüper H. G. 1987. Report of the ad hoc
committee on reconciliation of approaches to bacterial systematics. Int. J.
Syst. Bacteriol. 37: 463-464.
Weisburg W. G., Barns S.M., Pelletier D.A., Lane D.J. 1991. 16S
ribosomal DNA amplification for phylogenetic study. J. Bacteriology 173:
697-703.
Welsh D. T. 2000. Ecological significance of compatible solute
accumulation by micro-
organisms: from single cells to global climate. FEMS
Microbiol. Rev. 24: 263-290.
Werner D. 1992. Symbiosis of plants and microbes. Edition chapman
and Hall.Germany.Burton 1985.
Willems A. and Collins M. D. 1993. Phylogenetic analysis of
rhizobia and agrobacteria based on 16S rRNA gene sequences. Int. J. Syst.
Bacteriol. 43: 305-315.
Williams P. M. and De Mallorca M. S. 1984. Effect of
osmotically induced leaf moisture
stress on nodulation and nitrogenase
activity of Glycine max. Plant Soil. 80: 267-283.
Références bibliographiques
Woronin M. S. 1866. Über die bei der Schwarzerle
(Alnus glutinosa) und bei der gewöhnlichen Gartenlupine
(Lupinus mutabilis) auftretenden Wurzelanschwellungen. Mémoires
de l'Academie Impériale des Sciences de St. Pétersbourg, VII
Series, vol. X.
Yadav N. K. and Vyas S. R. 1973. Salt and pH tolerance of
rhizobia. Folia Microbiologica 18: 242-247.
Yanagi M., and Yamasato K. 1993. Phylogenetic analysis of the
family Rhizobiaceae and related bacteria by sequencing of 16S rRNA
gene using PCR and DNA sequence. FEMS Microbiol. Lett. 107: 115-120.
Yang J., Kloepper J. W. and Choong-Min R. 2009. Rhizosphere
bacteria help plants tolerate abiotic stress. Trends Plant. Sci. 14:1-4.
Young C. C. and Cheng K. T. 1998. Genetic diversity of fast
and slow-growing soybeaan rhizobia determineted by random amplified polymorphic
DNA analysis. Biol. Fertil. Soils. 26: 254-256.
Young J. M., Kuykendall L. D., Martinez-Romero E., Kerr A. and
Sawada H. 2001. A revision of Rhizobium Frank 1889, with an emended
description of the genus, and the inclusion of all species of Agrobacterium
Conn 1942 and Allorhizobium undicola de Lajudie et al.
(1998) as new combinations: Rhizobium radiobacter, R.
rhizogenes, R. rubi, R.undicolaand R. vitis . Int. J. Syst. Bacteriol. 51:
89-103.
Zablotowicz R. M. and D. D. Focht. 1981. Physiological
characteristics of cowpea rhizobia evaluation of symbiotic efficiency in
Vigna unguiculata. Appl. Environ. Microbiol. 41: 679-685.
Zahran H. H. 1986. Effect of sodium chloride and polyethylene
glycol on rhizobial root hair infection, root nodule structure and symbiotic
nitrogen fixation in Vicia faba L. plants. Ph.D.thesis. Dundee,
Scotland: Dundee University.
Zahran H. H. 1999. Rhizobium-legume symbiosis and
nitrogen fixation under severe conditions and in an arid climate. Microbiol.
Mol. Biol. Rev. 63: 968-989.
Zahran H H. 2001. Rhizobia from wild legumes: diversity,
taxonomy, ecology, nitrogen fixation and Biotechnology. J. Biotechnol. 91:
143-153.
Zahran H. H., Sprent J. I. 1986. Effects of sodium chloride
and polyethylene glycol on root-hair infection and nodulation of Vicia faba L.
plants by Rhizobium leguminosarum. Planta 167: 303-309.
Zahran H H,, Rasanen L A., Karsisto M. and Lindström K.
1994. Alteration of lipopolysaccharide and protein profiles in SDS-PAGE of
rhizobia by osmotic and heat stress.World J. Microbiol. Biotechnol. 10:
100-105.
Références bibliographiques
Zahran H. H., Mohammad E. M., Emam M. M. and Ismael S. S., 1997.
The chemical
composition, structure, and ultrastructure of a halotolerant
rhizobia isolated from Egypt.
In: Proceedings of the 9th Microbiology Conference, 25-27
March, pp. 121-148, Cairo,
Egypt.
Zahran H.H., Abdel-Fattah M., Ahmad M.S. and Zaki A.Y. 2003.
Polyphasic taxonomy of symbiotic rhizobia from wild leguminous plants growing
in Egypt. Folia Microbiol. 48:510-520.
Zaidi A., Khan M.S, Ahemad M. and Oves M. 2009. Plant growth
promotion by phosphate solubilizing bacteria. Acta Microbiol. Immunol. Hung.
56: 263-284.
Zengeni R., Mpepereki S., Giller K. E. 2006. Manure and soil
properties affect survival and persistence of soyabean nodulating rhizobia in
smallholder soils of Zimbabwe. Appl.Soil Ecol. 32: 232-242.
Zhang X. X., Harper R., Karsisto M. and Lindström K. 1991.
Diversity of Rhizobium bacteria isolated from root nodules of leguminous trees.
Int. J. Syst. Bacteriol. 41: 104-113.
Zhao F.J., Wood A.P., McGrath S.P. 1999. Effects of sulphur
nutrition on growth and nitrogen fixation of pea (Pisum sativum L.).
Plant Soil. 212: 209-219.
Zombre P. N. 2006. Variation de
l'activité biologique dans les zipella (sols nus) en
zone subsahélienne du Burkina Faso et impact de la technique du zaï
(techniques des poquets) Biotechnol. Agron. Soc. Environ. 10 (2) :139- 148.
Zouaghi M. 2001. Rôle du sulla du nord (Hedysarum
coronarium L.) dans les systèmes de culture selon les principes de
base d'une agriculture durable. Journée d'étude sur les
nouveautés dans la recherche. 5 Avril 2001: l'amélioration du
sulla local comme source durable pour l'alimentation animale. INAT- CCSPS.
Medjez El Bab. Tunisie..
Zuanazzi J. A. S., Clergeot P. H., Quirion J.-C., Husson H.
P., Kondorosi A., and Ratet P. 1998. Production of Sinorhizobium meliloti
nod gene activator and repressor flavonoids from Medicago sativa
roots. Mol. Plant-Microbe Interact. 11:784-794.
ANNEXES
Annexe1 : Milieux de culture pour les
bactéries
YEM (Yeast Extract-Mannitol, Vincent, 1970)
K2HPO4 0,5g/l
MgSO4, 7 H2O 0,2g/l
NaCl 0,1g/l
Extrait de levure 0,6g/l
Mannitol 10g/l
YEMA R-C
Il s'agit du milieu YEM +15g/l Agar agar + Rouge Congo à
0,025g/l.
Le rouge congo permet à la fois de neutraliser les
actinomycètes et de déceler certains
contaminents qui absorbent le colorant.
TY (Yeast Extract-Tryptone ; Beringer, 1974)
tryptone 5g/l
extrait de levure 3g/l
CaCl2 7mM
Annexe2 : Milieu de culture et solution nutritive de base
des plantes Milieu Fahraeus
|
Composé Macroéléments
|
Concentration dans la solution stock 1,18M
|
Volume/litre de milieu final 1ml
|
|
CaCl2
|
0,48M
|
1ml
|
|
MgSO4, 7H2O
|
0,73M
|
1ml
|
|
KH2PO4
|
0,42M
|
2ml
|
|
Na2HPO4,7H2O
|
20,34
|
1ml
|
|
Citrate de fer,H2O
|
|
|
|
Microéléments
|
7,93mM
|
2 gouttes
|
|
MnCl2,4H2O
|
6,24mM
|
2 gouttes
|
|
CuSO4,5H2O
|
7,33mM
|
2 gouttes
|
|
ZnSO4,7H2O
|
16,17mM
|
2 gouttes
|
|
H3BO3
|
4,83mM
|
2 gouttes
|
|
Na2MoO4,2H2O
|
|
|
Le milieu est ajusté à pH 7,5, additionné de
15g/l d'agar puis stérilisé à 120°C et un bar durant
24 minutes
Solution nutritive de base des plantes (Vadez et
al., 1996)
|
Macroéléments CaCl2
MgSO4, 7H2O KH2PO4
K2SO4,7H2O Oligoéléments H3BO3
MnSO4,H2O CuSO4,5H2O ZnSO4,7H2O Na2MoO4,7H2O CoSo4,7H2O
Fer (Séquestrène) Concentration finale
(mM)
|
|
1,65 1
036
0,7
Concentration finale (uM)
4
6,6
1,56 1,55 0,12 0,12 1,26mg/l
|
Annexe 3 : Marqueurs de poids moléculaire

Composé Concentration
Tris 40mM
Acétate de sodium 4mM
Na2 EDTA 1mM
pH 7,9
Annexe 5 Nombre de rhizobium estimé par la
méthode MPN (Vincent, 1970) Dilution par un facteur de dix.

La gamme approximative 109 107
105 103
Annexe 6 : corrélation entre les paramètres
de nodulation et le rendement en protéines brutes aériennes du
sulla inoculé par les souches de la collection
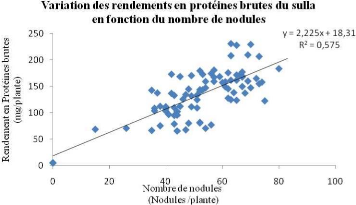
A
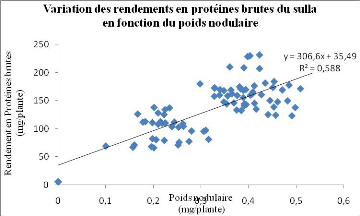
Annexe 7 : Carrés moyens et coefficients de
variation des variables quantitatives et
qualitatives relatives à la
culture de sulla dans les stations prospectées
|
Source de variation
|
Carré moyen
|
CV
|
|
Nbr N (Nodules /plante)
|
3618,64**
|
18,17
|
|
Pds N (mg/ plante)
|
7114,293**
|
19,35
|
|
Pds Nmoy (mg/ nodule)
|
1,84**
|
18,49
|
|
HAUT (cm)
|
6125,128**
|
17,074
|
|
BSA (T/ha)
|
45,01**
|
16,95
|
|
PB (% MS)
|
35.8246**
|
12.558
|
|
RDT (kg/ha)
|
124.676**
|
12.49
|
* ;** différences significatives au seuil de
p=0.05 et p=0.01 respectivement ; ns :
différences non significatives au seuil de p<0.05
Annexe 8 : Carrés moyens et coefficients de
variation relatifs à l'essai test d'efficience
des souches en
conditions contrôlées
|
Source de variation
|
Carré moyen
|
CV
|
|
Nombre de nodules
|
1183,98**
|
15,31
|
|
Poids nodulaire
|
61056,8**
|
14,56
|
|
Croissance en hauteur
|
26,18**
|
6,54
|
|
Surface foliaire
|
569,52**
|
14,32
|
|
Biomasse sèche aérienne
|
0,0745**
|
9,33
|
|
Teneur en protéines brutes
|
71,70**
|
1,21
|
|
Rendement en protéines brutes
|
6385,03**
|
1,18
|
* ;** différences significatives au seuil de
p=0.05 et p=0.01 respectivement ; ns :
différences non significatives au seuil de p<0.05
Annexe 9 : Carrés moyens relatifs au test
d'efficience des souches sous contraintes hydriques
|
Source de variation
|
ddl
|
PSR/PSA
|
Croissance
en hauteur
|
Surface
foliaire
|
Nombre de
nodules
|
Poids sec
nodulaire
|
Poids sec
aérien
|
|
Souche
|
4
|
3.77**
|
332,90**
|
1357,026**
|
32089,89**
|
0 ,106**
|
6,17**
|
|
Stress hydrique
|
3
|
9,38**
|
830,41**
|
2311,53**
|
25080,57**
|
0,047**
|
9,821**
|
|
Souche x stress
hydrique
|
12
|
2,48 **
|
59,68**
|
242,86**
|
7066,75**
|
0,024**
|
2,32**
|
* ;** différences significatives au seuil de
p=0.05 et p=0.01 respectivement ; ns :
différences non significatives au seuil de p<0.05
Annexe 10 : Carrés moyens des paramètres
mesurés au champ sur le sulla de 1ère année
|
Source de
|
ddl
|
Croissance
|
Surface
|
Nombre de
|
Poids sec
|
Poids sec
|
Teneur en
|
Rendement en
|
|
variation
|
|
en hauteur
|
foliaire
|
nodules
|
nodulaire
|
aérien
|
Protéines
brutes
|
Protéines
brutes
|
|
Site
|
1
|
51244,45**
|
8355691,294**
|
7705,72**
|
262,54**
|
1881,9**
|
0,02ns
|
9402218,47**
|
|
Souche
|
3
|
1190,77**
|
558710,067**
|
1353,0**
|
9770,84**
|
5,58**
|
16,79**
|
55540,91ns
|
|
Site x Souche
|
3
|
969,37**
|
216793,736**
|
108,74**
|
2782,07**
|
7,25*
|
14,93*
|
66438,12ns
|
* ;** différences significatives au seuil de
p=0.05 et p=0.01 respectivement ; ns :
différences non significatives au seuil de p<0.05
Annexe 11 : Carrés moyens des paramètres
mesurés au champ sur le sulla de 2ère année
à Goubellat
Source de ddl Hauteur Nombre de Surface foliaire Rendement en
Biomasse sèche
variation nodules protéines brutes aérienne
aériennes
Souche 3 21,6778ns 516,631ns 278163ns 83782* 543*
* ;** différences significatives au seuil de
p=0.05 et p=0.01 respectivement ; ns :
différences non significatives au seuil de p<0.05
PUBLICATIONS SCIENTIFIQUES ET
PRESENTATIONS
RELATIVES A CE TRAVAIL
PUBLICATIONS
Dhane S., Zribi K., Jeddi F., Aouani M.E. et
Zouaghi M. 2006. Enquête sur la nodulation de Hedysarum coronarium L.
(Variété Bikra 21) en Tunisie. In Proceedings of the workshop
international sur la diversité des fabacées fourragères et
de leurs symbiotes : Applications Biotechnologiques, Agronomiques et
Environnementales. Alger, 19-22 Février 2006.
Dhane Fitouri s., Zribi k., Ben jeddi F.,
Aouani MA., M'hamdi R. 2008. Characterisation of Hedysarum coronrium
L. (var. bikra 21) nodulating rhizobia in Tunisia. In the abstract's book
of the 13th congress of African Association for Biological Nitrogen
Fixation. December 15th-18th 2008 Hammamet. Tunisia.
Dhane Fitouri S., Trabelsi D., Saïdi S.,
Zribi K., Ben Jeddi F. and Mhamdi R. 2011. Diversity of rhizobia nodulating
sulla (Hedysarum coronarium L.) and selection of inoculant strains for
semi-arid Tunisia. Annals of Microbiology.
PRESENTATIONS ORALES
Dhane Fitouri S. 2009. Valorisation des
ressources rhizobiologiques locales (Cas Sulla/Rhizobium). Salon International
de l'Agriculture du Machinisme Agricole et de la Pêche "SIAMAP 2009".
25-29 Novembre 2009. Le Kram. Tunisie.
Dhane Fitouri S., Ben Jeddi F. et Mhamdi R. 2011.
Sélection de souches rhizobiales pour l'inoculation du sulla
(Hedysarum coronarium L.) en condition de stress hydrique. In the
abstract's book of the 22nd international forum of the Tunisian
Association of Biological Sciences. March 28-31. Mehdia. Tunisia.
INVENTION SCIENTIFIQUE
Juillet 2010 : Brevet de Bio-fertilisant
à base d'une souche locale de rhizobium spécifique au sulla du
nord Hedysarum coronarium L. dénommée RSU9 sous le
numéro TN 2010/0310 du 02 Juillet 2010.
| 


