|
I
TABLE DES MATIERES
DEDICACE . III
REMERCIEMENTS IV
LISTE DES ABREVIATIONS VI
LISTE DES FIGURES VII
LISTE DES TABLEAUX IX
RESUME . X
ABSTRACT . XI
INTRODUCTION 1
1. Contexte général 1
2. Problématique 2
3. Questions de recherche 3
3.1 Question principale 3
3.2 Questions spécifiques 3
4. Hypothèses 4
4.1 Hypothèse principale 4
4.2 Hypothèses spécifiques 4
5. Objectifs 4
5.1 Objectif principal 4
5.2 Objectifs spécifiques 4
6. Intérêt de l'étude 4
7. Subdivision du travail 5
Chapitre premier :
CONSIDERATIONS GENERALES SUR LES BANANIERS ET LA
MALADIE DU SOMMET TOUFFU DE BANANIERS (BBTD)
6
1.1 Bananiers 6
1.1.1 Origine, description botanique et
systématique 6
1.1.1.2. Systématique 8
1.1.1.3 Description botanique 8
1.1.2 Distribution et diversité
génétique 11
1.1.3 Importance alimentaire, socioéconomique et
culturelle 12
1.1.3.2 Importance socio-économique de bananier
14
1.1.3.3. Importance culturelle de bananier 15
1.1.4 Production bananière 16
1.1.4.1 Production Mondiale ...15
II
|
1.1.4.2 Production en RDC
|
..15
|
|
1.1.4.3 Production au Maniema
|
16
|
|
1.1.4.4 Aire de culture et exigences écologiques
.
|
16
|
|
1.1.4.4.1 Aire de Culture
|
16
|
|
1.2. Maladie du sommet touffu de Bananier (BBTD)
|
25
|
|
1.2.1 Origine et distribution de la maladie
|
25
|
|
1.2.2 Symptômes de BBTD
|
26
|
|
1.2.3 Agent vecteur : Pentalonia nigronervosa C.
|
27
|
|
1.2.4 Lutte contre le BBTD
|
29
|
|
Chapitre deuxième : MATERIELS
ET METHODES
|
31
|
|
2.1. Milieu d'étude
|
31
|
|
2.1.1. Localisation de la zone d'étude
|
31
|
|
2.1.2. Subdivision administrative
|
32
|
|
2.1.3. Le climat
|
32
|
|
2.1.4. Le sol
|
32
|
|
2.1.5. Végétation et Hydrographie
|
32
|
|
2.1.6. Economie
|
34
|
|
2.2 Matériels
|
35
|
|
2.2.1 Matériels Biologiques
|
35
|
|
2.3 Méthodes
|
36
|
|
2.3.3. Les conditions culturales de bananeraies dans la
zone d'étude
|
39
|
|
2.4 Analyse des données
|
39
|
|
Chapitre troisième : RESULTATS ET DISCUSSIONS
|
40
|
|
3.1 Conditions culturales et connaissances relatives au
BBTD par les agriculteurs
|
40
|
|
3.2. Connaissances relatives au BBTD par l'agriculteur
|
44
|
|
3.3. Paramètres de maladie du sommet touffu de
bananier (BBTD)
|
49
|
3.4. Analyse de différents paramètres
épidémiologiques en fonction de cultivars de bananiers
et plantains dans la zone d'étude. 55
3.4.1. Corrélation entre les facteurs (cultivars
et champs) et les variables (incidence,
sévérité
de BBTD, présence et importance de vecteur)
55
3.4.2. Influence de facteur cultivars de bananiers et
bananeraies sur la prévalence à la
maladie du sommet touffu de bananier (BBTD)
57
3.5. Répartition des cultivars de bananiers dans
les différents groupes en fonction de leur
sensibilité au BBTD dans les différents
territoires de Maniema 62
CONCLUSION ET SUGGESTIONS 66
REFERENCES BIBLIOGRAPHIQUES 68
ANNEXES 78
III
DEDICACE
A tous les agriculteurs de la Province du Maniema qui
travaillent sans relâche pour leur survie en
dépit des
multiples contraintes et tous ceux qui soutiennent l'agriculture comme socle
du
développement, je dédie ce modeste travail
To all farmers of the Province of Maniema who work tirelessly
for their survivol despite the many
contraints and all those who support
agriculture as being the foundation of developpement, I
dedicate this modest
work
IV
REMERCIEMENTS
L'aboutissement du présent travail a été
possible grâce à la contribution de plusieurs personnes. Il ne
peut avoir son pesant d'or que lorsqu'on reconnait à juste titre les
éfforts fournis et les sacrifices concentis par chacun des acteurs qui
constitue cette équipe. Il nous est difficile de trouver des mots justes
pour exprimer notre reconnaissance et nos sentiments.
Nos premiers remerciements vont à l'endroit du
Professeur Docteur Ingénieur Faustin NGAMA BOLOY
promoteur de ce travail, qui a bien voulu nous encadrer, du fond de
son coeur en traduisant tous son savoir, son savoir faire et son savoir
être tout au long de ce périple combat qui n'ont fait que nous
amener à la victoire.
Nos sentiments de gratitude s'adressent également au
Professeur Docteur Ingénieur Jean-pierre MUKANDAMA NDOLANDOLA,
notre premier co-promoteur, sa disponibilité, sa bonne
volonté, son amour et ses conseils ont orienté positivement nos
recherches.
Envolé vers d'autres cieux, Professeur Docteur
Ingénieur BABOY LONGANZA Louis, notre second co-promoteur a su
être dans le temps recore quelque soit la distance, apporter sa
contribution scientifique dans l'accomplissement de cette oeuvre d'esprit.
Nous sommes également très reconnaissant envers
les membres de notre comité d'accompagnement dont la composition a
évolué au fil du travail pour aboutir au jury final qui fût
tout simplement idéal ; Professeur Docteur ingénieur EBUY
ALIPADE, Professeur Docteur Ingénieur OKANGOLA et
Professeur Docteur Ingénieur PYAME, trois scientifiques
issus des disciplines différentes et pour qui nous avons l'estime
profonde. Ils se sont penchés sur notre travail pour en reconnaitre
l'essence et y apporter des remarques constructives. Merci à vous
d'avoir été là.
Il nous est impossible de lister les personnes formidables que
nous avons rencontrées durant ces deux années de formation et qui
ont contribué parfois même sans s'en rendre compte à cette
étude. Parmi celles-ci, il y a eu des sages à l'image du
Professeur Docteur Ingénieur Albert OKUNGO LOTOKOLA,
Professeur Docteur Ingénieur BONDOMBE, Professeur Docteur
Ingénieur Jean-Claude MONZENGA LOKELA, qui nous ont
inspiré un profond respect par leur force tranquille et leur
cohérance dans les actions, nous vous disons merci du fond de notre
coeur pour votre contribution.
V
Nous exprimons encore notre profonde gratitude envers nos
amis, lesquels nous avons concouru ensemble dans cette lutte à savoir
: Ass Ir DIEUDONNE BANGBAMBINGO et Ir Serge BAGWE
RUHEBUZA de l'INERA MULUNGU.
Nous pensons à toute l'équipe qui travaille dans
le laboratoire de Phytopathologie et Biotechnologie végétale de
l'IFA-YANGAMBI, bureau WAVE, pour nos amitiés ; entre autres CT
Ir JÖEL EBWA, Ass Ir BEDIDJO, Ass. Ir Geremie ANGAFHUNE, Ass. Ir. DIKO,
pour ne citer que ceux-là. Merci également à
notre ainé Gaston LIMBA de l'INERA YANGAMBI pour votre
soutien matériel et scientifique.
Nous avons l'obligation d'adresser très
particulièrement nos remerciements à l'Ass. Ir SALUMU
DJUMAA de l'Université de Kindu et notre jeune frère
RAMAZANI SEFU Franck pour leur participation à la
récolte sur le terrain, des données de ce travail.
Nous ne saurons nous arrêter là sans pour au tant
placer une mention spéciale à notre très chère
épouse Henriette KALOMBO et nos enfants
RAMAZANI SHADARI Baba Idi, SHEDA SHADARI Charlie, SAFI SHADARI Ange,
SALAMA SHADARI Saldice, ANNIFA SHADARI, ISMAILA SHADARI, SALUMU SHADARI, ARIDJA
SHADARI, Bienvenue SHABANI SHADARI, ISIAKA SHADARI Gerard, MUSOMBO SHADARI
Baudouin, MASHAKA SHADARI Raymond et Ausgustin AMISI SHADARI, vous
avez enduré des sacrifices et des privations dans une vie de
prières incessantes pour lesquels nous restons toujours rédevable
envers vous.
Nous disons encore plus merci à Monsieur Gaston
KISANGA et son épouse Nathalie SHEDA KABALA,
sans oublier Monsieur ZEPHIRIN BUNGIASI et son
épouse Elisabeth BIKITA KABALA pour l'amour et le
soutien que vous n'avez cessé de nous témoigner.
Merci à la famille RAMAZANI KABEBE,
nous pensons ici à Bwa RAMO et notre
ainé Docteur BARON, pour les multiples assistances de
votre part.
Nous remercions infiniment notre tente maternelle ZODE
ARIDJA, les mots nous manquent pour exprimer notre reconnaisssance.
Nous disons aussi merci à notre oncle matérnel, Monsieur
FATAKI MAJALIWA Pychen, pour le soutien et l'encouragement.
Enfin, nous disons merci à tous ceux qui ont
porté leur pierre à cette édifice, pour ne citer que :
Papa RAMAZANI SHADARI et Maman MOZA MISADI
Géorgette, nos parents qui ne se fatiguent jamais de nous. A
vous nos parents et frères spirituels : Papa DIKUWA YUMA Daniel,
Maman ZAINA KATAMBWE, nous disons merci pour votre soutien
spirituel.
SHADARI SALUMU Al hadid
VI
LISTE DES ABREVIATIONS
B.P : Boîte Postale
% : Pourcentage
°C : Degré celcius
AAA : genome triploïde de musa
acuminata
AAB : genome triploïde de musa acuminata et
Balbisiana
ADN : Acide desoxyribonucleique
ARN : Acide ribonucleique
AW : Activity of Water
BBTD : Banan Bunchy Top Desease
BBTV : Banan Bunchy Top Virus
C.T : Chef de Travaux
CEC : Capacité d'echange
cationique
FAO : Food and Agricultur Organisation
GPS : Global Positionning System
ha : Hectare
IPAPEL : Inspection Provinciale de l'Agriclture
Pêche et élevage
J.C : Jésus Christ
Kb : Kilo barre
Mg : Magnesium
N : Nombre
NPK : Azote, phosphore, potassium
ONGD : Organisation Non Gouvernementale de
Développement
pH : Potentiel en
hydrogène
P.I.F : Plants issus de la fragmentation de bulbe
R.D.C : République Démocratique du
Congo
TAS-ELISA: Triple Antibody Sandwish Enzyme Linked
Immuno Sorbant Assy
VII
LISTE DES FIGURES
Figure 1 : Description schématique du
bananier, 10
|
Cavendish .23
Figure 3 : Carte de la distribution de BBTV dans
le bassin du Congo en RDC, ..25
Figure 4 : Puceron du bananier Pentalonia
nigronervosa (forme aptère) (c)IAC - D.
|
|
Paulaud
.27
|
|
|
Figure 5 : Puceron du bananier (forme
ailée) (c)IAC - D. Paulaud
|
27
|
|
Figure 6 : La carte administrative de la zone
d'étude (Province de Maniema)
|
.30
|
|
Figure 7 : Forêt dense humide de Kailo
|
..32
|
|
Figure 8 : Galeries forestières de
Kabambare
|
..32
|
Figure 2 : Echelle colorimétrique
standard pour les bananes dessert du sous-groupe
Figure 9 et 10 : Systèmes de cultures
dans les différentes zones d'étude en Province
deManiema 33
Figure 11 : Quelques cultivars de
bananes et plantains inspectés dans le territoire de
Kabambare 34
Figure 12 : Interview avec les fermiers 38
Figure13 : Diagnostic visuel de
paramètres dela maladie .38
Figure 14 : Source de matériels de
plantation ..39
Figure 15 : Age de la bananeraie dans la zone
d'étude .41
Figure 16 : Système de cultures dans la
zone ...42
Figure 17 : Identification des symptômes
de BBTD par les agriculteurs .44
Figure 18 : Origine probable de la maladie
dans la zone d'étude .45
Figure 19 : Durée de production de la
souche après observation des symptômes 46
Figure 20 : Connaissance du mode de
transmission de BBTD par l'agriculteur 47
Figure 21 : Présence ou absence du
vecteur sur chaque touffe de bananiers enquêtés ..48
Figure 22 : Importance du vecteur sur les
touffes choisies suivant l'échelle de cotation de BBTD
(0-5) .50
Figure 23 : Incidence de BBTD sur au moins un
plant de touffe de
bananiers ...52
Figure 24 : Sévérité de
BBTD sur les cultivars de bananiers par
territoire 53
Figure 25 : Distribution des cultivars dans
les différents groupes par rapport au BBTD .56
Figure 26 : Distribution spatiale des
cultivars dans les différents groupes par rapport au
BBTD 57
VIII
? Figure 27 : Distribution spatiale des
cultivars dans les différents champs par rapport au 58
? Figure 28 : Distribution des cultivars dans
les différents champs en fonction de leur prévalence
au BBTD 59
? Figure 29 : Distribution
spatiale des cultivars dans les différents champs par rapport au
BBTD 59
? Figure 30 : Distribution
spatiale des cultivars dans les différents champs par rapport au
BBTD 60
? Figure 31 : Influence de
différents cultivars de bananiers en fonction de leur sensibilité
au
BBTD. 61
IX
LISTE DES TABLEAUX
- Tableau 1 : caractéristiques
génétiques des variétés de bananiers 9
- Tableau 2 : Groupes génomiques et
usages de certains bananiers très répandus en
Afrique centrale et orientale 11
- Tableau 3
: Composition chimique de la banane dessert et de la banane plantain
(Pour
100 gdepulpe) ..13
- Tableau 4 : Répartition mondiale de la
production bananière en 2011 14
- Tableau 5 : Quelques noms vernaculaires des
Cultivars inspectés en Province de
Maniema 34
- Tableau 6 : Contribution des
facteurs à la variabilité observée et leur
corrélation avec
les variables évaluées 55
- Tableau 7
: Différents groupes de cultivars de bananiers en fonction de
leur sensibilité
au BBTD à Kailo, Pangi, Kibombo, Punia, Lubutu, Kasongo et
Kabambare 62
Mots-clés : Distribution, spatiale, BBTD,
Bananiers, Maniema, R.D. Congo.
X
RESUME
Une étude relative à la distribution spatiale de
la maladie du sommet touffu de bananiers (BBTD), dans les zones de production
bananière de Maniema a été menée, dans l'objectif
de déterminer les conditions culturales de la culture de bananier, dans
les différentes zones de production bananière en Province de
Maniema. L'incidence et la sévérité de BBTD, la
présence et l'importance du vecteur Pentalonia nigronervosa sur
les différents cultivars de bananiers et plantains cultivés dans
ces zones ont été aussi étudiées.
Sept territoires de la Province de Maniema où 1890
touffes de bananiers ont été inspectées en raison 30
touffes de bananiers par champ, 3 champs par villages et 3 villages par
territoires. Les touffes selectionnées étaient analysées
à partir des indicateurs principaux tels que : l'incidence de la
maladie, la sévérité de la maladie (BBTD), la
présence et l'importance du vecteur Pentalonia nigronervosa, et
l'état des lieux de connaissance des agriculteurs par rapport à
la gestion de BBTD.
De l'analyse des résultats, il a été
trouvé que 100% de bananiers sont cultivés en association avec le
riz, le manioc, le maïs ou autres culture ; 95,24% des agriculteurs
utilisent des rejets en provenance des champs des voisins ; l'âge des
bananeraies enquêtées a varié de moins de 3 ans à
plus de 10 ans soit 42,86% des bananeraies sont âgées de plus de
10 ans ; 38,10% de bananeraies sont agés de 5-7 ans et 8,33% de
bananeraies sont agés de moins de 3 ans.
Le BBTD est présente à travers toute la zone
d'étude avec une incidence variant de 78,52 à 88,15% où le
taux élevé est trouvé sur les bananiers dans le territoire
de Kibombo (88,15%) et 87,05% à Pangi, La decoloration des feuilles avec
taille normale est le symptôme le plus fréquent et aussi
élevé sur les bananiers avec une moyenne de 31,90%. Le vecteur
P. nigronervosa est largement répandu avec une moyenne de
94,85% où une forte présence était trouvée sur les
bananiers à Pangi (97,41%). Toutes les colonies de P. nigronervosa
sont présentes sur les touffes de bananiers. Une grande colonie
avec des insectes ailés est la forme la plus rependue avec une moyenne
de 40,31%.
De l'analyse de différents paramètres
épidémiologiques, il a été trouvé que les
conditions culturales des bananiers (systèmes de culture et autres
pratiques) favorisent l'incidence et la sévérité de la
maladie aussi bien que, la présence et l'importance du vecteur P.
nigronervosa. A partir des analyses factorielles multivariées, il a
été classé dans chaque territoire de Maniema, les
différents groupes de cultivars de bananiers sensibles et moins
sensibles à la maladie BBTD où, les groupes constitués des
cultivars moins sensibles se caractérisent par l'absence des
symptômes (incidence et sévérité nulle) mais,
généralement avec présence et importance du vecteur
(Pentalonia nigronervosa) du niveau 2 et 3 de l'échelle de
cotation de puceron dans tous les territoires de Maniema.
XI
ABSTRACT
A study on the spatial distribution of banana bunchy top
disease (BBTD) in the banana production areas of Maniema was carried out, with
the aim of determining the growing conditions of the banana crop, in the
different areas in the Province of Maniema. The incidence and severity of BBTD,
the presence and importance of the vector Pentalonia nigronervosa on
the different banana and plantain cultivars grown in these areas were also
studied.
Seven territories of the Province of Maniema where 1890 clumps
of banana trees were inspected due to 30 clumps of banana trees per field, 3
fields per village and 3 villages per territory. Selected clumps were analyzed
based on key indicators such as : disease incidence, disease severity (BBTD),
presence and importance of the vector Pentalonia nigronervosa, and the
state of knowledge of farmers compared to the management of BBTD.
From the analysis of the results, it was found that 100% of
banana trees are intercropped with rice, cassava, maize or other crops ; 95.24%
of farmers use suckers from neighbors' fields ; the age of the banana
plantations surveyed varied from less than 3 years to more than 10 years, i.e.
42.86% of the banana plantations are over 10 years old ; 38.10% of banana
plantations are 5-7 years old and 8.33% of banana plantations are less than 3
years old.
BBTD is present throughout the study area with an incidence
varying from 78.52 to 88.15% where the high rate is found on banana trees in
the territory of Kibombo (88.15%) and 87.05% In Pangi, discoloration of leaves
with normal size is the most common symptom and also high on banana trees with
an average of 31.90%. The vector P. nigronervosa is widespread with an
average of 94.85% where a strong presence was found on banana trees in Pangi
(97.41%). All the colonies of P. nigronervosa are present on the
clumps of banana trees. A large colony with winged insects is the most common
form with an average of 40.31%.
From the analysis of different epidemiological parameters, it
was found that the growing conditions of banana plants (cropping systems and
other practices) favor the incidence and severity of the disease as well as the
presence and importance of the vector P. nigronervosa. From
multivariate factorial analyses, it was classified in each territory of
Maniema, the different groups of banana cultivars susceptible and less
susceptible to the BBTD disease where, the groups made up of the less
susceptible cultivars are characterized by the absence of symptoms (zero
incidence and severity) but, generally with the presence and importance of the
vector (Pentalonia nigronervosa) of level 2 and 3 of the aphid rating
scale in all the territories of Maniema.
Keywords : Distribution, spatial, BBTD, Banana
trees, Maniema, D.R. Congo.
1
INTRODUCTION
1. Contexte général
Les bananes et les plantains figurent parmi les produits de
base de l'alimentation des populations en Afrique centrale avec 35% d'apports
en calories. La culture de banane en Afrique centrale occupe plus de 50% de la
population active rurale et contribue significativement au produit
intérieur brut agricole des pays de cette sous-région. Elle joue
donc un rôle important dans la sécurité alimentaire des
populations, dans la nutrition et assure également une partie des
revenus aux petits producteurs (FAO, 2010). Son importance est d'autant plus
marquée dans le bassin du Congo où l'on note une grande
diversité de cultivars, la zone étant considérée
comme un second foyer de diversification de plantains après l'Asie du
Sud-Est. Tous les types de plantains y sont observés : les French, les
French-Cornes, les Faux cornes, les vraie-corne, (Ganry et al.,
2012).
La production bananière mondiale s'élève
à 74 millions de tonnes par an. Environs 25 millions de tonnes,
principalement des bananes plantains sont produites en Afrique, (Swennen et
Vuylsteke, 2001). En 2010, l'Afrique avait réalisé une production
de 10.311.554,00 tonnes de bananes contre 26.900.250,00 tonnes de bananes
plantains, à la même année ; en R.D.C, on avait produit
316.472,00 tonnes de bananes, contre 1.250.000,00 tonnes de bananes plantains,
(FAOSTAT, 2012).
En R.D.C, les Bananes et plantains constituent une nourriture
de base pour la population du Nord-Est et du Centre du Pays. Après la
récolte, près de 70% de la production bananière s'y
consomment directement par les producteurs locaux, (ruraux et urbano-ruraux),
30% pour la commercialisation, (Bakelena et al., 1996). Dans les zones
de production bananière, l'économie des agriculteurs est
dépendante de celle-ci. Pour les zones à faible production, les
revenus des ménages sont faibles alors que, dans les régions
où la production est forte, les revenus sont plus élevés.
Cependant, les systèmes de production de l'Afrique tropicale sont
hétérogènes par l'écologie, les densités,
les espèces végétales et animales, les outils aratoires,
les techniques culturales, les combinaisons ou dissociations de productions (De
Lapeyre, 2015). Les comportements des cultivateurs sont d'une extrême
richesse, variable d'une région à l'autre, d'un village à
l'autre, d'une habitation à l'autre et d'une intense souplesse adaptable
à toutes les modifications de l'environnement physique et humain,
(FAOSTAT, 2009).
Cette culture, conduite le plus souvent en agriculture
familiale, présente souvent d'assez faibles rendements par rapport
à la terre et au travail. Cette production vivrière familiale est
en effet
2
peu encadrée techniquement et bénéficie
de peu d'innovations scientifiques et techniques (Moïse et Ludovic,
2019).
Cependant, des lourdes menaces parasitaires pèsent sur
la production des bananes et plantains (Ngama, 2014). Parmi ces menaces, il
faudra noter les maladies virales, fongiques, bactériennes, les
nématodes, et les insectes ravageurs dont le charançon
Cosmopolites sordidus (Tixier et al., 2010) signalés
un peu partout dans les zones de production bananière avec un impact
très considérable sur la production (Baudouin et al.,
2002). Des nombreux documents et traditions orales témoignent
différemment de nombreuses souffrances endurées par
différents peuples à la suite des maladies des plantes et qui ont
été à la base des famines et exodes des populations
(Camara et al., 2010).
2. Problématique
Ces dernières années, la production des bananes
et plantains a globalement diminué dans plusieurs territoires en
province de Maniema. Ceci pour plusieures raisons, notamment l'incidence de la
maladie du sommet touffu de bananier (Banana Bunchy Top Disease)
signalée dès lors dans d'importants foyers de production
bananière impactant significativement les revenus des ménages. Ce
qui pourrait compromettre la durabilité du système agricole de
cette Province particulièrement dans les territoires où les
plantains servent d'aliment de base (CIRAD, 2011 ; ISF et CTA, 2011).
Cette maladie appelée encore "sommet buissonnant du
bananier" est due au virus Marmor abaca HOLMES appelé Banana
Bunchy Top Virus (BBTV). Ce virus est transmis par un puceron surtout
Pentalonia nigronervosa C. (Ngama, 2010). Elle affecte essentiellement
la croissance et rend improductif les sujets atteints en phase
végétative. Cette maladie est typique des conditions de basse et
moyenne altitude. Les symptômes se manifestent par un rabougrissement
excessif de la plupart des plants atteints précocement, un fort
engorgement des pétioles et une réduction de la longueur des
limbes. Par ailleurs, les rejets provenant des souches virosées sont
inévitablement porteurs de ce virus et leur utilisation favorise
l'extension de la maladie. Cette maladie a été signalée et
confirmée en Asie et aux îles du Pacifique ainsi que dans les pays
africains et sa gestion demande des études détaillées au
préalable nécessitant la connaissance des moyens de propagation,
la cartographie et la détection des foyers (FAO, 2010). Le BBTD est
déjà signalé surtout dans les Provinces du Congo Central,
du Nord et Sud Kivu ainsi que dans la Province de la Tshopo. Cependant,
plusieurs autres provinces de la R.D.C sont également touchées,
notamment le Maniema, le Bandundu, l'Equateur, les deux Kasaï ainsi que le
Katanga, particulièrement dans sa partie Nord (Ngama et al.,
2015).
3
Selon les enquêtes menées par Ngama (2014) en
collaboration avec CIALCA-BIOVERSITY sur 9000 touffes de bananiers
évaluées dans 300 fermes à raison de 30 touffes par ferme,
les moyennes de l'incidence de BBTD obtenues dans les jardins de case et les
plantations de bananiers étaient comprises entre 96,0 % et 98,7 % et la
présence des pucerons était de 95,8 %. Cette étude a
révélé que le BBTD est l'une des plus importantes maladies
qui affectent le bananier dans cette zone de production bananière et de
grande diversité génétique de la Province Orientale
démembrées et ses environs. Alors, il a été
suggéré d'élargir le champ d'étude compte tenu de
l'incidence très élevée observée dans cette zone,
bien qu'encore à de faibles niveaux de sévérité.
Mis à part les enquêtes ci-haut
évoquées ; très peu de travaux ont été
orientés dans le sens de poser le diagnostic de la distribution de BBTD
en Province de Maniema qui fait partie de la zone de production
bananière du bassin du Congo. En effet, le manque d'informations
scientifiques sur les contraintes biologiques de la culture bananière
liée à la maladie du sommet touffu de bananier (BBTD) dans les
différents territoires en province de Maniema, constitue une
préoccupation majeure et suscite notre curiosité scientifique qui
se traduit par des questions de recherche ci-dessous.
3. Questions de recherche 3.1 Question
principale
Existe-t-il une distribution spatialement des contraintes
biologiques de la culture de bananiers liées au BBTD dans les
différentes zones de production bananière en Province de Maniema
?
3.2 Questions spécifiques
1. Quelles sont les conditions culturales de bananiers et
plantains dans les différentes zones de production bananière de
Maniema ?
2. Que peuvent être l'incidence et la
sévérité de BBTD sur les différents cultivars de
bananiers et plantains dans les zones de production bananière de Maniema
?
3. Que peuvent être aussi la présence et
l'importance du vecteur Pentalonia nigronervosa dans la zone
d'étude ?
4
4. Hypothèses
4.1 Hypothèse principale
Il existe une variation dans la distribution spatiale des
contraintes biologiques de la culture de bananièrs liées au BBTD
dans les différentes zones de production bananière en Province de
Maniema.
4.2 Hypothèses spécifiques
L'étude part des hypothèses spécifiques
selon lesquelles :
1. Les conditions culturales varient dans les
différentes zones de production bananière en province de Maniema
;
2. L'incidence et la sévérité de BBTD
peuvent être relativement vaiables en fonction de différents
cultivars trouvés dans cette zone de production bananière de la
Province de Maniema ;
3. La présence et l'importance du vecteur
Pentalonia nigronervosa peuvent être aussi variables dans ces
différentes zones d'étude en Province de Maniema.
5. Objectifs
5.1 Objectif principal
Mettre en évidence la distribution spatiale des
contraintes biologiques de la culture de bananiers liées au BBTD dans
les différentes zones de production bananière en Province de
Maniema.
5.2 Objectifs spécifiques
De manière spécifique, cette étude est
entreprise dans le but de :
1. Déterminer les conditions culturales de la culture
de bananier dans les différentes zones de production bananière en
Province de Maniema ;
2. Déterminer l'incidence et la
sévérité de BBTD sur les différents cultivars de
bananiers et plantains cultivés dans cette zone d'étude ;
3. Déterminer la présence et l'importance du
vecteur Pentalonia nigronervosa dans les différentes zones
d'étude en Province de Maniema.
6. Intérêt de l'étude
L'intérêt de l'étude est d'abord
scientifique, car elle contribue à la connaissance de l'incidence et
sévérité de BBTD ainsi qu'à la présence et
l'importance du vecteur Pentalonia nigronervosa dans les zones de
production bananières de la Province de Maniema.
5
Sur le plan pratique, cette étude permettra aux
partenaires et aux décideurs de la R.D.C en matière d'agriculture
et aux institutions de recherche d'élaborer un programme de bonne
gestion de la maladie et d'opérer un choix judicieux dans les
stratégies de lutte contre le vecteur P. nigronervosa de
manière à réduire la dissémination de la
maladie.
7. Subdivision du travail
Ce travail comprend trois chapitres hormis l'introduction et
la conclusion ; le premier chapitre traite des considérations
générales sur les bananiers et la maladie du sommet touffu de
bananier (Banana Bunchy Top Disease) ; le deuxième chapitre
décrit les matériels et méthodes de travail et le
troisième chapitre présente et discute les résultats.
6
Chapitre premier : CONSIDERATIONS GENERALES SUR LES
BANANIERS ET LA MALADIE DU SOMMET TOUFFU DE BANANIERS (BBTD)
1.1 Bananiers
1.1.1 Origine, description botanique et
systématique
1.1.1.1 Origine
Origine de la diversité génétique
La sous-espèce Musa acuminata banskii serait à
l'origine de la plupart des bananiers cultivés aujourd'hui (Carreel,
1994). Les bananiers de Musa acuminata banskii présentant un
début de parthénocarpie ont été
sélectionnés par l'homme en Papouasie-Nouvelle-Guinée il y
a près de 7000 ans (Jenny et al., 1999). Ils ont été
transportés en Indonésie (sur l'île de Java) par les
Austronésiens où ils se sont hybridés avec d'autres
sous-espèces de Musa acuminata (Perrier et al., 2011). Ces hybridations
ont permis l'émergence de diploïdes AA puis de triploïdes AAA
par hybridations intraspécifiques. Une partie des diploïdes AA
générés seraient rentrés en contact avec des
bananiers de l'espèce Musa balbisiana aux Philippines ce qui aurait
permis l'apparition des triploïdes AAB et ABB (Perrier et al., 2011). Les
bananiers du sous-groupe plantain (AAB) auraient été introduits
sur la côte orientale de l'Afrique par les Austronésiens il y a
plus de 3000 ans (Blench, 2009). Des travaux sur les phytolithes (particules
siliceuses microscopiques présentes sur les feuilles des plantes)
indiquent la présence de bananier plantain au Cameroun il y a 2500 ans
(Lassoudière 2010 ; Perrier et al., 2011). Les bananiers du sous-groupe
plantain auraient été diffusés jusqu'en Afrique de l'Ouest
par les migrations de populations des ethnies de langues bantoues
(Lassoudière, 2010). 18 Certains cultivars de bananier du sous-groupe
plantain présents en Afrique auraient suivi le flux du commerce des
esclaves vers les Caraïbes et l'Amérique centrale et du sud
(Lassoudière, 2010). La banane plantain serait présente en
Guadeloupe dès le 17ème siècle où elle aurait
été consommée par les esclaves (Lassoudière,
2010).
Les plus anciennes références aux bananiers
datent de 500 ans avant Jésus-Christ. Le Grec ancien consigne la
campagne d'Alexandre le Grand en Inde en 327 avant J.C. et on y mentionne la
banane. Pline l'ancien parle sur les bananiers dans son livre d'histoire
naturelle ; plus tard la banane apparait tant chez les musulmans que chez les
chrétiens comme le fruit défendu du paradis terrestre. Une
légende indienne affirme que la banane est le fruit qu'Eve a tendu
à Adam. Cela explique son appellation de « fruit du paradis ».
Par ailleurs, cette croyance est à l'origine du nom «
Paradisiaca » donné à la banane plantain (Haicour
et al., 1998).
7
L'origine supposée des bananes comestibles reste
incertaine. Cependant, l'hypothèse la plus généralement
acceptée suppose qu'à l'origine, les bananiers se trouvaient dans
l'espace englobant la péninsule malaisienne, l'Indonésie, les
Philippines, la Papouasie et la Nouvelle Guinée. La seconde zone de
dispersion et de diversification se situerait dans la vaste région
indo-asiatique (Kervegant, 1935 ; Lassoudière, 2010) ; la dispersion
hors de l'Asie se serait faite à travers les migrations humaines.
La Polynésie est ainsi devenue un autre centre de
diversification secondaire des bananes, notamment les cultivars `Maia
Maoli/Popoulu' ; ils sont identifiés comme des hybrides triploïdes
AAB et appelés couramment les plantains du Pacifique. Ces plantains
seraient venus des Philippines pour être dispersés en
Polynésie il y a plus de 4 000 ans (Adheka, 2014). L'Afrique de l'Est,
du Centre et de l'Ouest comprend aussi des zones très importantes de
domestication secondaire ; le Bassin du Congo par exemple en Afrique centrale
avec plus de 110 cultivars (AAB) de plantains connus, tandis que beaucoup
restent à découvrir. Plus de 60 cultivars de bananes
spécifiques (tous des triploïdes AAA) ont été
découverts dans les zones d'altitude de l'Afrique de l'Est (Karamura,
1999).
Le genre Musa est donc originaire de l'Asie du
Sud-Est (Aire géographique entre l'Inde, la Papouasie-nouvelle
guinée et Iles du Pacific). Dans cette région du monde, on trouve
les espèces sauvages Musa acuminata et Musa balbisiana
(Swennen et Vuylsteke, 2001).
Il n'existe pas de variétés sauvages de bananier
en Afrique (sauf dans des collections). L'existence de nombreux cultivars de
bananiers d'altitude en Afrique de l'Est et de plantains laisse supposer qu'ils
sont cultivés depuis très longtemps en Afrique (Alistair,
2010).
La période d'introduction des bananiers plantains en
Afrique n'est pas totalement établie. Cependant, les recherches les plus
récentes la situent, selon les sources, à au moins 3 000 ans
avant notre ère. Des auteurs s'appuyant sur des études
linguistico-taxonomiques situent l'introduction des Musa après
le Vième siècle de notre ère (Julie, 2013).
Certains autres chercheurs, prenant en compte le grand nombre de «
cultivars » africains et des études historico-linguistiques,
soutiennent que le genre Musa a été introduit en Afrique
orientale il y a au moins trois millénaires (De Langhe et al.,
1996).
Il existe aussi des travaux qui indiquent la présence
de plantains en Ouganda 4 000 ans avant JC. Des découvertes
archéologiques récentes, effectuées sur le site de Nkang
au Sud Cameroun ont mis à jour des phytolithes de bananiers (structures
siliceuses fossiles caractéristiques des espèces de plantes)
incrustés dans les restes carbonisés d'aliments dans une poterie
et dans le sol de comblement d'une fosse (Mbida et al.,
2000).
8
La datation de ce matériel remonte pour l'instant au
premier millénaire avant notre ère. D'autres études, par
contre, signalent la présence des plantains au Cameroun 2.500 ans avant
JC. La culture des plantains se serait développée en raison de sa
richesse en amidon de la souche et de l'apport en fibres plutôt que pour
les fruits qui ne sont généralement pas consommés
mûrs comme les bananes desserts. La cuvette congolaise serait le plus
important centre secondaire africain de diversification des plantains
(Moïse, 2019).
1.1.1.2. Systématique
Les bananiers appartiennent au genre Musa crée
par Linné, dont on ne saura sans doute jamais s'il
avait voulu le dédicacer au médecin de l'empereur Auguste
(Antonius Musa) ou si son origine se trouve dans la désignation arabe de
la plante ("maouz" ou "moz") (Champion, 1963). Le genre a donné
son nom aux Musacées, famille généralement incluse dans
l'ordre des Scitaminales. Mais parfois les Musacées sont
considérées comme une sous-famille de la famille des
Scitaminées. Si l'on tient compte des travaux du systématicien
Emberger et de plusieurs spécialistes contemporains du
bananier comme Simmonds, la position la plus satisfaisante du
genre Musa dans les Monocotylédones serait la suivante : Ordre
des Scitaminales (ou des Zingibérales pour certains auteurs) :
> Royaume : Plantae ;
> Division : Magnoliophyta ;
> Classe : Liliopsida ;
> Ordre : Zingiberales
> Familles : Musaceae ou Musacées
;
> Sous familles : Musoideae ;
> Genres : Musa ;
> Espèces : Musa spp
Le genre Musa comprend plus de 1500
variétés dont les plantains, est le plus important et le plus
diversifié (Kagy, 1999). La section des Eumusa concentre
pratiquement toutes les variétés de bananiers cultivés.
Dans les années 1940, la classification des bananiers, alors
basée sur le nombre de chromosomes et les caractéristiques
morphotaxonomiques, répartissait les bananiers en quatre sections :
Australimusa (n = 10), Callimusa (n = 10), Rhodochlamys
(n = 11) et Eumusa (n = 11) (Cheesman, 1947). Dans les
années 2000, une nouvelle classification basée sur l'AFLP
(Amplified Fragment Length Polymorphism) a proposé deux groupes
pour le genre Musa. Le premier comprend les sections Rhodochlamys
et Eumusa et le second les sections Australimusa et
Callimusa (Wong et al., 2002).
9
Il existe plusieurs espèces de bananes dont les unes
sont alimentaires. Certaines produisent de la fibre (Musa textilis)
d'autres enfin sont simplement ornementales (Musa ensete). Le genre
Ensete (ancien Musa ensete), qui est présent en Asie, en
Afrique et en Amérique latine, ne rejetonne pas naturellement ; n'est
cultivée qu'en Ethiopie (pour la consommation du rhizome fermenté
et surtout de la pulpe du pseudo tronc, (Camara et al., 2010).
Le genre Musa, qui se divise en espèces
séminifères à fruits non comestibles et
variétés à fruits charnus sans graines (parthenocarpie).
Les espèces à graines se répartissent en cinq sections :
Australimusa avec 2n=20 chromosomes dont (M. textilis qui est
une espèce à fibre), Calimusa avec 2n=20 chromosomes dont (M.
coccinea, qui, est une espèce ornementale), Rhodochlamys dont
(M. ornata, qui est une espèce ornementale aussi), Ingentimusa
dont (M. ingens, bananier sauvage géant) et Eumusa
avec 2n=22 chromosomes. Dans la section Eumusa se trouvent Musa
acuminata (génome A) et M. balbisiana (génome B),
espèces qui sont à l'origine des variétés
cultivées, (Dhed'a, et al., 2011). Les caractéristiques
génétiques de différentes variétés de
bananiers sont présentées dans le tableau 1.
Tableau 1 : caractéristiques
génétiques des variétés de bananiers
|
Groupe Sous- groupe
|
Cultivars
|
Type de fruits
|
|
AA
|
Sucrier
|
Pisang Mas/Frayssinette/Figue sucrée
|
Dessert-sucrée
|
|
|
Pisang lilin
|
Dessert
|
|
|
Pisang Beragan/Lakatan
|
Dessert
|
|
AAA
|
Canvendish
|
Lacata/Poyo/Williams/Grande naine/Petite
naine
|
Dessert
|
|
Gros-michel
|
Gros-michel/Highgate/ Cocos
|
Dessert
|
|
Figue-Rose
|
Figue-Rose rose/Figue- Rose verte
|
Dessert
|
|
Lijugira
|
Intuntu/mujuba
|
A bière/à cuire
|
10
|
Ibota
|
Yangambi Km5
|
Dessert
|
|
AB
|
Ney Poovan
|
Safetvelchi/sukari
|
Dessert-acidulé
|
|
AAB
|
Figue-Pomme
|
Maca/Silk
|
Dessert-acidulé
|
|
Pomme
|
Prata
|
Dessert-acidulé
|
|
Mysore
|
Pisang Ceylan
|
Dessert- acidulé
|
|
PisangKelat
|
PisangKelat
|
Dessert
|
|
Pisang Rajah
|
Pisang Rajah Bulu
|
A cuire
|
|
Plantain
|
French/Corne/faux corne
|
A cuire
|
|
Popoulou
|
Popoulou
|
A cuire
|
|
Laknao
|
Laknao
|
A cuire
|
|
PisangNangka
|
PisangNangka
|
A cuire
|
|
AAB
|
Bluggoe
|
Bluggoe/Matavia/Poteau/Cacambou
|
A cuire
|
|
Pelipita
|
Pelipita
|
A cuire
|
|
PisangAwak
|
Fougamou
|
Dessert
|
|
Peyan
|
Saba
|
A cuire
|
|
Saba
|
|
A cuire
|
Source : (FAO, 2012)
1.1.1.3 Description botanique
Le bananier est une herbe géante monocotylédone
de grande taille sans tige végétative aérienne. La tige
souterraine est le centre vital du bananier, lieu de formation des racines, des
feuilles et de l'inflorescence. C'est à ce niveau que se
différentient les rejets assurant la pérennité de
l'espèce. Le système radiculaire est de type fasciculé
(sans pivot). L'émission de racines se fait pendant toute la phase
végétative. Le pseudo-tronc n'est pas une vraie tige. Il
résulte de l'imbrication des graines foliaires les unes dans les autres
(Jenny et al., 1999).
Le cigare foliaire monte au centre, comme par la suite,
l'inflorescence. Le système foliaire est très
développé et sa structure présente des
particularités liées aux contraintes de l'alimentation hydrique.
L'inflorescence se forme au niveau de la tige souterraine et parcourt tout le
faux tronc avant son apparition à l'extérieur de la plante. La
fleur femelle donne le régime de bananes
De nouvelles variétés de bananiers, notamment de
bananes à cuire, ont été créées pour faire
face à la pression parasitaire et pour satisfaire la demande des
consommateurs. Cependant, des
11
consommables et commercialisables (Lassoudière, 2007).
La description schematique de bananier est donnée par la figure 1.
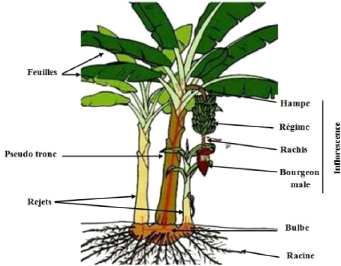
Figure 1 : Description schématique du
bananier, (Adheka, 2014).
1.1.2 Distribution et diversité
génétique
Le genre Musa compte plus de 1000
variétés de bananes parmi lesquelles les cultivars les plus
importants sont les bananes de type dessert (AAA pour la plupart) et les
bananes à cuire (AAA, AAB et AAB). Les variétés AA sont
majoritairement rencontrées en Asie du Sud-Est. Quelques
variétés AB ont été répertoriées en
Afrique de l'Est et en Inde. Les variétés triploïdes AAA
(bananes dessert et à cuire), AAB (plantains et bananes à cuire)
et AAB (bananes à cuire) sont largement distribuées dans le
monde, notamment en Amérique latine et centrale, aux Caraïbes, en
Asie du Sud et du Sud-Est et en Afrique (Jones, 2000 ; Lassoudière,
2007).
12
progrès restent à faire sur les qualités
culinaires et gustatives en comparaison avec les variétés
traditionnelles. Le besoin en nouvelles variétés concerne aussi
bien la banane dessert que la banane à cuire, qu'elles soient
destinées à l'exportation, à l'autoconsommation ou aux
marchés nationaux (Abadie et al., 2003 ; Cirad, 2001). Le
tableau 2 donne les groupes génomiques et leurs usages.
Tableau 2 : Groupes génomiques et
usages de certains bananiers très répandus en Afrique centrale et
orientale
|
Groupe génomique
|
Nom du cultivar
|
Usage
|
|
AAA
|
Gros Michel Muraru, Mushale
|
Dessert
A cuire, à rôtir, dessert
|
|
AAA-EAHB
|
Nakitembe Kabula
|
A cuire vert Bière
|
|
AAB
|
Nakatansese, French plantain
|
A cuire mûr, à rôtir
|
|
AAB
|
Kivuvu
Kayinja (Musa)
|
A cuire mûr Bière
|
|
AB
|
Kisubi
|
Bière
|
|
AAB
|
Sukali Ndiizi
|
Dessert
|
|
AAAB
|
Série de bananiers FHIA
|
Dessert, à cuire, bière, chips, fruits
séchés
|
Source : (Karamura et al, 1999)
1.1.3 Importance alimentaire, socioéconomique et
culturelle 1.1.3.1. Importance alimentaire
Bien que le bananier et les bananiers plantains soient connus
aujourd'hui pour leur grande importance dans l'alimentation, toutes les parties
de la plante peuvent être utilisées d'une manière ou d'une
autre (Cirad, 2002).
Le bananier est une plante facile à cultiver. Il en
existe de nombreuses variétés directement exploitables au niveau
des familles avec ou sans transformation préalable. Ce qui en fait une
plante au potentiel économique immense. Plus de 60% des bananiers
produites en Afrique sont consommés localement. Près de 50% de la
production africaine se composent de bananes à cuire et à
bière, le plantain représente 32% et les bananes dessert 18%.
L'Afrique est le seul continent à produire de grandes quantités
de bananes d'altitude et 46% de la production mondiale de plantains y sont
réalisés (Lepoivre, 2003).
13
Il existe de très nombreuses variétés de
bananiers cultivées pour leurs fruits. Il est rare de cultiver le
bananier pour une valorisation prioritaire d'autres organes. La production de
fruits (bananes plantains, bananes à cuire et banane dessert)
dépasse légèrement 100 millions de tonnes depuis 2003
(Jones, 2000).
La banane partage avec l'ananas le titre de « Roi »
ou « Empereur des fruits ». Pline l'ancien (naturaliste gastronome)
vantait les mérites gustatifs de la banane « fière et
orgueilleuse ». Produit exotique par excellence, la banane est le fruit le
plus vendu au monde et le plus consommé notamment par les populations
indigènes en raison de ses propriétés
énergétiques (Lescot, 2013). La composition chimique de la banane
est donnée par le tableau 3.
Tableau 3 : Composition chimique de la banane
dessert et de la banane plantain (Pour 100 g de pulpe).
|
Eléments Banane dessert
|
Banane plantain
|
|
Eau (g)
|
74
|
65
|
|
Potassium (g)
|
380 - 400
|
500
|
|
Calcium (mg)
|
6 - 9
|
3
|
|
Magnésium (mg)
|
30 - 45
|
35
|
|
Sodium (mg)
|
1
|
4
|
|
Phosphore (mg)
|
30
|
30
|
|
Fer (mg)
|
0,3 - 0,7
|
0,6
|
|
Energie (kcal)
|
82 - 92
|
122
|
|
Protéines (g)
|
1
|
1,3
|
14
|
Lipides (g)
|
0,48
|
0,37
|
|
Glucides (g)
|
19 - 23
|
32
|
|
Fibres (g)
|
2,0 - 3,4
|
2,0 - 3,4
|
Source : (Lassoudière, 2007)
1.1.3.2 Importance socio-économique de
bananier
Les bananes et bananes plantains font partie des principaux
aliments de base dans les pays producteurs et constituent une source
considérable d'emploi et de revenus à travers les marchés
locaux et internationaux (Frison et Sharrock, 1999). Le bananier constitue le
quatrième produit agricole en termes de production mondiale après
le riz, le blé et le maïs. Il occupe le premier rang de la
production fruitière, avec un peu plus de 145 millions de tonnes
produites en 2011 à l'échelle mondiale (Ganry et al.,
2012). La répartition mondiale de la production bananière est
donnée par le tableau 4.
La valeur culturelle des bananes est considérable dans
plusieurs régions. Dans la légende hindoue en Inde, la banane
était considérée comme le fruit interdit du jardin d'Eden.
Elle est le
15
Tableau 4 : Répartition mondiale de la
production bananière en 2012
Continent Pays Banane Banane plantain
|
Afrique
|
Cameroun
|
1.376.000 3.400.000
|
|
RCA
|
162.799 109.265
|
|
Côte d'Ivoire
|
317.727
|
1.559.210
|
|
RDC
|
408.900 1.552.060
|
|
Ghana
|
60.000 3.619.830
|
|
Kenya
|
1.197.990 31.000
|
|
Rwanda
|
44 3.036.270
|
|
Uganda
|
522.945 10.547.400
|
|
Angola
|
2.646.070 -
|
|
Burundi
|
1.848.730 -
|
|
Amérique
|
Costa Rica
|
1.937.120 90.000
|
|
Guadeloupe
|
58.00 7.620
|
|
Guatemala
|
2.680.390 188.755
|
|
Panama
|
340.342 97.432
|
|
Pérou
|
- 1.967.920
|
|
Venezuela
|
415.693 488.878
|
|
Brésil
|
7.329.470 -
|
|
Asie
|
Chine
|
10.705.740 -
|
|
Inde
|
29.667.000 -
|
|
Thaillande
|
2.036.430 -
|
|
Viet Nam
|
1.523.430 -
|
|
Philippines
|
9.165.040 -
|
|
Europe
|
Italie
|
351 -
|
|
Portugal
|
30.181 -
|
|
Espagne
|
346.500 -
|
|
Turquie
|
206.501
|
-
|
Source : (FAOSTAT, 2012)
1.1.3.3. Importance culturelle de bananier
Dans la province de Maniema, le Bananier constitue un aliment
par excellence, il se consomme cuit avec les poissons frais. On coupe les
fruits en morceaux puis bouillir au feu, si à l'état
mûr,
16
symbole de la fertilité et de la
prospérité dans des nombreuses communautés d'Asie du sud,
et est fréquemment exposée dans les cérémonies
nuptiales (Frison et Sharrock, 1999).
Dans la Province de Maniema, le bananier est utilisé
comme plante ornemental, mais aussi dans les rites coutumiers, usage des
feuilles comme matelas, les feuilles sont ramollies au feu pour servir la
nourriture à la fête ou au deuil. Le tronc de bananier est
coupé jeté dans l'eau en cas de naufrage, un rituel qui permet de
retrouver le corps du disparu au même lieu de naufrage (Shadari S. et
Ngama, 2022).
1.1.4 Production bananière
1.1.4.1 Production Mondiale
La production bananière mondiale s'élève
à 74 millions de tonnes par an. Environs 25 millions de tonnes (soit 34%
de production mondiale), principalement les bananes plantains sont produites en
Afrique (Swennen et Vuylsteke, 2001). Elle a peu varié au cours des
quinze dernières années entre 28,05 Mt et 32,61 Mt. Au moins 52
pays et îles (dont 18 pays africains) sont concernés par cette
production. L'Afrique, l'Amérique du Sud, les Antilles et les îles
de l'Atlantique concentrent 96 % de la production mondiale de plantains. Huit
pays (six en Afrique et deux en Amérique du Sud) produisent plus d'un
million de tonnes de plantains/an. Ils concentrent environ 78 % de la
production mondiale (FAOSTAT, 2012).
1.1.4.2 Production en ROC
En République Démocratique du Congo, le bananier
et le bananier plantain, comparativement à d'autres cultures occupent la
deuxième place dans la production nationale après le manioc selon
les statistiques nationales avec une production annuelle de 1.960.960 tonnes en
2011, (FAOSTAT, 2012). Les bananiers et les bananiers plantains en particulier
représentent les cultures alimentaires parmi les plus importantes en
R.D.C. Dans le bassin du Congo de la cuvette centrale du Nord-Est ; les
bananiers plantains constituent aussi la deuxième culture après
le manioc et jouent de ce fait un rôle très important dans la
sécurité alimentaire et le revenu de la population (Dhed'a et
al., 2009).
1.1.4.3 Production au Maniema
17
on fabrique le LITUMA en mélange avec le manioc.
Cependant, sa production se situe à la quatrième position
après le riz, le maïs et le manioc. Dans cette zone, les bananiers
se cultivent principalement dans le système extensif, en association
avec d'autres cultures vivrières ou maraichères ; ce qui rend sa
production faible (Shadari et al., 2021).
1.1.4.4 Aire de culture et exigences
écologiques
1.1.4.4.1 Aire de Culture
Différents types de bananier sont cultivés dans
diverses écorégions d'Afrique. Les bananiers d'altitude sont
surtout cultivés dans les régions d'altitude de l'Afrique de
l'Est (Nord-Kivu et Sud-Kivu (R.D.C), Ouganda, Rwanda, Tanzanie, et Ouest du
Kenya) près des villages et dans des champs permanents (Lescot,
2013).
Les bananiers à fruits desserts et les plantains se
plaisent sur les basses terres, ils ne se développent que lentement en
altitude. Les bananiers produisant des bananes à cuire et à
bière préfèrent par contre les altitudes entre 1200 et
1800 m au-dessus du niveau de la mer. Les bananiers tolèrent un peu
d'ombre. Les intensités lumineuses optimales ne sont pas connues (Lahav,
1995).
1.1.4.4.2 Exigences écologiques
Les plantains sont produits dans des jardins familiaux ou
associés à d'autres cultures vivrières, dans des
systèmes des cultures itinérantes. Ils prédominent sur les
basses terres des tropiques humides en RDC, au Congo-Brazzaville, au Gabon, au
Cameroun, au Nigéria, au Ghana, en Côte d'ivoire, en Guinée
et au Libéria (Swennen et Vuylsteke, 2001).
Les bananiers sont généralement cultivés
entre 19° C et 33° C. Une température supérieure
n'empêche pas leur culture si l'apport d'eau est adéquat. La
croissance s'arrête cependant au-delà de 38°C. La
température idéale pour la fructification est supérieure
à 2°C environ à celle pour la formation des feuilles. Une
température trop basse ralentit l'émission des feuilles et
allonge le cycle de croissance. La croissance est nulle en dessous de 14°C
et le refroidissement endommage les fruits. Exposés à moins de
0°C, les bananiers périssent (Jenuwein, 1988).
Les bananiers à fruits desserts et plantains sont
cultivés dans un environnement humide à hygrométrie
élevée de 60 à 100%. Les bananiers requièrent 25
à 70 mm d'eau par semaine (ou 1300 à 3600 mm par an) en fonction
du taux d'évapotranspiration. Une humidité du sol égale
à 80 à 100% de la capacité au champ est requise. Ceci
correspond à une pluviosité minimale de 100 mm par mois (Jenny et
al., 1999). Les sols profonds, limoneux et bien drainés
conviennent
18
les mieux pour la culture du bananier. Les
éléments N.P.K, Ca et Mg sont indispensables pour atteindre un
bon niveau de développement et une production élevée. Le
pli peut varier de 4,0 à 8,0 (Carlier, et al., 2002).
1.1.4.5 Système de culture dans la Province de
Maniema
Le système de culture intègre la combinaison des
cultures en présence, leur ordre d'introduction et leur position dans le
dispositif de la parcelle, et les techniques culturales mises en oeuvre. Les
producteurs ont des gestes techniques qui attestent une certaine logique et la
maîtrise des espèces plantées et des itinéraires
culturaux qui leur sont familiers. Plusieurs systèmes de cultures
peuvent se retrouver au sein d'une exploitation (Moïse, 2019).
L'économie de la province du Maniema est fondée
essentiellement sur la production agricole qui occupe la majorité de la
population. Il s'agit en grande partie d'une agriculture de subsistance
caractérisée par une absence de mécanisation. On y produit
le riz, l'arachide, le manioc, le maïs et la banane comme principales
cultures vivrières. Quant aux cultures industrielles
héritées de la colonisation et qui concernaient principalement le
coton, le café et l'huile de palme, elles sont à l'arrêt
depuis plusieurs années (Meunier et al., 2011).
1.1.4.5.1 En forêt primaire
C'est une pratique assez répandue dans les
systèmes traditionnels de culture du bananier plantain. Le planteur
laisse se développer plusieurs rejets sur chaque souche. Les touffes
semblent plus stables en comparaison des chutes multiples observées dans
les bananeraies oeilletonnées malgré le tuteurage ou haubanage.
Les densités pratiquées dans les champs sont plus faibles
à la plantation (400-500 pieds/ha). Plus tard, elles peuvent atteindre
ou dépasser 3 000 à 4 000 pieds/ha suite au développement
des touffes (Moïse, 2019).
Les touffes ont un retour cycle plus rapide, plusieurs
rejets-frères pouvant produire à la suite. De plus, une
légère fertilisation permet d'avoir des régimes normaux,
le rendement global par pied étant assez élevé. En outre,
les espacements des touffes permettent les cultures intercalaires qui
contribuent à l'amélioration du rendement de la parcelle. Pour le
moment, ce système est largement valorisé dans les jardins de
case où les bananiers reçoivent régulièrement les
déchets organiques des ménages ainsi que dans les grandes
plantations avec de faibles densités au démarrage, dans une
optique de sécurisation des terres (Verheij et Coronel, 1991).
1.1.4.6 Techniques culturales
1.1.4.6.1. Choix du Matériel de
plantation
19
Le matériel végétal employé pour
la mise en place d'une bananeraie qu'elle soit en culture conventionnelle ou en
association avec d'autres productions doit être de la meilleure
qualité possible. Cela implique de travailler avec du matériel
végétal (plants, rejets) indemnes de parasites comme par exemple
les nématodes et les charançons. En assurant la qualité du
matériel végétal, on prévient la contamination des
champs ou des parcelles, et on augmente leur potentiel de rendement. La
meilleure garantie sanitaire que l'on puisse avoir vient de l'utilisation de
vitro-plants certifiés (Rennes, 2016).
1.1.4.6.2. Vitro-plants
La culture in-vitro est un moyen de produire rapidement (en 4
à 6 mois) des milliers de nouvelles plantules de bananiers qui sont :
y' Saines : sans maladie et sans insecte ;
y' Uniformes ;
y' Plus vigoureuses que des rejets traditionnels ;
y' Facilement transportables, donc facilement
commercialisables.
Les paysans peuvent se procurer de ces vitro-plants
directement au laboratoire. Les vitro-plants sont produits dans un
environnement stérile dans des laboratoires spécialisés
(Israeli, et al., 1995). Des morceaux de bulbes sont
prélevés d'une plante mère saine et amenés au
laboratoire, où ils sont désinfectés ; multipliés
sur un milieu de multiplication (4 semaines) ; enracinés sur un milieu
d'enracinement (4 semaines). Ensuite, les petites plantules sont
transférées dans une pépinière pour être
endurcies (Verheij et Coronel, 1991).
1.1.4.6.3. Plants issus de la macro
propagation
Les rejets sélectionnés pour la technique des
plants issus de fragments du pseudo tronc (P.I.F), doivent avoir une hauteur
comprise entre cinq (5) et quarante (40) centimètres, (Moïse,
2019). De plus, la partie basale (bulbe) doit être assez
représentative (sept à dix centimètres de
diamètres, pour une hauteur de cinq à sept centimètres),
car c'est elle qui contient la réserve en éléments
nutritifs, indispensables à la nutrition des futurs vivo-plants. Elle
doit être exempte des galeries de Cosmopolites sordidus d'une
part et d'autre part, les racines ne doivent pas présenter les
symptômes d'attaques des nématodes (coloration rougeâtre de
la partie lignifiée des racines ou des racines nécrosées)
(Mayeki et al., 2010).
1.1.4.6.4. Installation d'une bananeraie
Le choix et la préparation du terrain dépendent
de l'objectif dans la production de bananiers et plantains, des contraintes
liées au terrain pressenti, connues à travers l'histoire de la
parcelle
En lignes jumelées en quinconce : ce dispositif
comprend un grand rang d'au moins 3,6 m et un petit rang de 1,8 ; bon
système sauf pour la régularité du couvert. Dans le cas de
mécanisation
20
(pratiques ancestrales communautaires, successions culturales),
des contraintes de moyens et des choix et techniques du producteur,
(Haïcour, et al., 1998).
Pour un bon choix du terrain, il faut vérifier les points
suivants :
> Accès facile aux moyens de transport (pour
évacuer la récolte en tout temps et sans difficulté, et
diminuer les temps de travaux en cas de récolte surtout pour les
bananeraies d'une superficie importante) ;
> Pente faible ou nulle (terrain plutôt plat ou avec
une pente ne dépassant pas 5 % pour éviter les effets liés
au vent et à l'érosion par les eaux de surface) ;
> Sol avec bonne texture et structure correcte ;
> Terrain avec ensoleillement suffisant et ombrage
modéré (inférieur à 30 %) ;
> Terrain non inondable (nappe phréatique à
plus d'un mètre en dessous de la zone limite de prospection des racines)
;
> Zone non soumise aux vents ou avec peu de vent (sinon il
faudra construire des brise-vent et faire du tuteurage pour éviter les
chutes de bananiers) (Dhed'a et al.,2011).
1.1.4.6.5. Densité de plantation
L'Objectif est d'assurer une bonne implantation des plants,
donc de réaliser la mise en place avec le maximum de soins. Il faut
veiller en particulier à la qualité et à
l'homogénéité du matériel végétal,
à la qualité de la mise en terre. Comme pour de nombreuses autres
espèces, la qualité de la mise en place a une incidence sur toute
la durée de la culture, sur plusieurs années, Il faut replanter
parce que le rendement décroit et la rentabilité n'est plus
assurée, la plupart du temps en raison d'une baisse importante de la
densité de peuplement (nombre de bananiers productifs à
l'unité de surface). Cependant, il faudrait replanter le moins souvent
possible, pour des raisons de coût de remise en culture, mais aussi de
préservation de la fertilité des sols (Ngama, 2015).
Il existe plusieurs schémas de plantation possibles. Le
plus courant est la plantation en 2 m x 3 m qui permet d'atteindre une
densité de 1670 pieds/ha. Une autre possibilité est celle du
double rang. Elle a l'avantage de faciliter les opérations de soins aux
fruits et les opérations d'haubanage (Ex : 2 m x 2 m x 4 m). En lignes
simples : 3,0 m X 1,9 m dans le sens de la pente. Ce dispositif procure une
bonne couverture et un bon développement du rejet mais haubanage est
plus difficile (Meunier et al., 2011).
21
des travaux, un grand intervalle de 4 m et plus est à
envisager. En quinconce : il faut tenir compte de la facilité de travail
des ouvriers dans la parcelle (déplacement, repérage des
régimes, coupe et transport des fruits, ...), de la facilité
d'haubanage et de la mécanisation. Ce dispositif offre la
possibilité de diminuer l'intervalle entre deux récoltes
grâce à l'amélioration de la croissance du rejet. Les trous
de plantations doivent être profonds (minimum 40 cm x 40 cm x 40 cm et
maximum 60 cm x 60 cm x 60 cm), pour constituer un volume de terre
travaillé, suffisant et important, qui facilitera le
développement des plants (Adheka, 2014).
1.1.4.7 Matériel de plantation
Le matériel végétal employé pour
la mise en place d'une bananeraie qu'elle soit en culture conventionnelle ou en
association avec d'autres productions doit être de la meilleure
qualité possible. Cela implique de travailler avec du matériel
végétal (plants, rejets) indemnes de parasites comme par exemple
les nématodes et les charançons (ISF et CTA, 2011). En assurant
la qualité du matériel végétal, on prévient
la contamination des parcelles, et on augmente leur potentiel de rendement. La
meilleure garantie sanitaire que l'on puisse avoir vient de l'utilisation de
vitroplants certifiés (Lescot, 2013).
Les plantations de bananier pour l'exportation sont
établies en plantant des rejets baïonnettes, dont le cormus est
pelé et le pseudo-tronc coupé à quelques
centimètres au-dessus du cormus, de manière à ramener la
taille du rejet à 25 cm environ. Cette pratique contribue à la
lutte phytosanitaire. En effet, elle réduit la population de
nématodes et permet d'écarter les rejets infestés par les
charançons (dont la présence est signalée par des galeries
noire-brunes dans les cormus pelés). Avant leur plantation, les rejets
ainsi préparés sont plongés dans de l'eau chaude (50°
à 55°C) pendant 20 minutes environ ou dans un mélange aqueux
de nématicide et d'insecticide (Brun, 1994).
Le prélèvement doit se faire avec beaucoup de
précaution pour d'une part obtenir des rejets complets et d'autre part
ne pas trop endommager le bulbe du pied-mère. La base du
pied-mère doit être au préalable dégagée pour
bien visualiser la partie du bulbe où l'on procède à la
séparation du rejet. Il est souhaitable d'éviter de
prélever des rejets dans de vieilles parcelles car les anciens
pieds-mères et leurs rejets sont plus susceptibles d'être
contaminés par des maladies (Menuier et al., 2011).
1.1.4.8 Plantation
Avant de placer le rejet, remplissez au fond du trou la terre
de surface, si possible mélangée avec du compost. La terre de
surface (souvent appelée terre noire) et le compost sont riches en
22
nutriments et permettront une excellente croissance du
bananier lors des premiers mois, favorisant son établissement, et par la
suite sa production (Brenda et al., 2008). Placez ensuite le rejet au
contact de cette première couche puis remplissez le trou avec de la
terre de surface et complétez avec la terre de profondeur. Enterrez le
rejet de sorte qu'il y ait environ 10 cm entre la surface du sol et le collet.
Il ne faut pas enterrer la partie aérienne (au-dessus du collet) qui
risquerait de rapidement pourrir. Veillez enfin à pailler tout autour du
rejet fraîchement planté (Menuier et al., 2011).
1.1.4.9 Entretien
1.1.4.9.1 Paillage :
Dans le champ, il est rare d'utiliser des herbicides, les
mauvaises herbes y sont généralement coupées. Les
paillages et les cultures intercalaires sont deux autres moyens de lutte contre
les mauvaises herbes. On coupe généralement tous les rejets, sauf
un, pour qu'ils ne concurrencent pas la plante principale. Quand le bananier
porte des fruits, il ploie sous le poids du régime. Le bananier
n'étant pas une plante ligneuse, il casse facilement lorsqu'il est
exposé à des vents violents ou stressé par la
sécheresse. C'est pourquoi, il est courant dans les bananeraies de
soutenir l'inflorescence par une perche en bois ou bambou étayant le
pédoncule (Bouwmeester et al., 2009).
1.1.4.9.2 Fumure
Les fumures organiques ont pour objectif d'améliorer
durablement les caractéristiques du sol aussi bien chimiques (taux des
matières organiques, CEC, pouvoir tampon), que physique
(stabilité structurale, conductivité hydrique et rétention
en eau) et biologique (activités biologiques) et les apports sont faits
en fonction des analyses de sol, plus souvent juste avant la plantation
(Cornack, 2004). Les quantités sont de l'ordre de 30 à 60 tonnes
par hectares (produits frais). L'épandage est à faire sur toute
la surface. Il doit être suivi d'un apport d'azote (45 à 60 kilos
d'urée par hectare) pour activer la vie microbienne et éviter le
risque de carence temporaire en azote de la plante (Lassoudière,
2012).
Les fumures minérales ont pour objectifs
d'éviter l'acidification du sol (risque de toxicité en aluminium,
en manganèse dans certains sols) en maintenant le pH au-dessus de
5,2-5,4. Les épandages sont à faire sur toute la surface. Les
doses, les fréquences et la nature des produits sont à
préciser obligatoirement selon l'analyse de sol. Les quantités
d'engrais appliquées sont fonction de la qualité du sol et des
conditions climatiques et peuvent atteindre des taux de 600 kg de N, 320 kg de
P, 600 kg de K par hectare. L'application d'azote (N) et de potassium (K)
23
est fractionnée (6 à 10 applications par an)
pour éviter le lessivage. L'engrais est appliqué dans un cercle
de 50 à 100 cm de diamètres autour de la touffe et n'est pas
enfoui dans le sol pour ne pas endommager le système racinaire
superficiel (Swennen et Vuylsteke, 2001).
1.1.4.9.3 Désherbage
Il est indispensable de régulièrement retirer
toutes les mauvaises herbes de la plantation, afin d'éviter la
compétition avec les bananiers et d'améliorer la
productivité de la plantation. Le désherbage, manuel ou à
la houe, s'effectue tous les 2 à 4 mois en fonction de leur
prolifération, qui dépend des saisons. Les herbes et autres
végétaux arrachés sont de préférence
laissés sur place et serviront pour le paillage de la plantation (Brun,
1994).
1.1.4.9.4. Elimination de la fleur
mâle
L'opération a pour objectif de concentrer les
nutriments dans les fleurs femelles, afin de faciliter le grossissement des
fruits. Elle permet également de détruire un foyer de
contamination potentiel pour prévenir la propagation de certains
nuisibles (thrips, anthracnose, mélipones) (Champion, 1963). Les fleurs
mâles peuvent être éliminées au stade «
dernière main », c'est-à-dire une fois que la
dernière main femelle est sortie de la popote. La hampe florale doit
faire l'objet d'une coupe franche à 30 cm des dernières fleurs
femelles avec un sabre propre pour éviter le développement de
pourritures à l'extrémité du régime (Nyabyenda,
2006).
1.1.4.9.5. Oeilletonnage
L'oeilletonnage est une opération culturale qui
consiste à supprimer les premiers rejets apparus et sélectionner
ceux qui permettront le renouvellement de la bananeraie. Elle consiste à
sélectionner les rejets qui permettront le renouvellement de la
bananeraie, sa pérennisation ainsi qu'à contrôler la
densité de plantation et maintenir le potentiel de production de la
parcelle (Cirad, 2001).
L'oeilletonnage est à effectuer toutes les 6 à 8
semaines. Aucun rejet ne doit dépasser 20 cm. Plus l'oeilletonnage est
effectué tard, plus l'opération sera difficile et perturbante
pour le pied mère (destruction de racines, etc.) (Brun, 1994).
1.1.4.9.6. Récolte et transport des
rejets
La récolte des régimes ne s'improvise pas. Les
fruits en entrée de murisserie ne doivent pas dépasser le stade
vert tournant (stade 3 de l'échelle colorimétrique qui commence
par les stades 1, 2, 3, 4, 5, 6 et 7). L'objectif est de récolter au
grade le plus élevé possible (gain de poids) compatible avec
l'absence de mûrs d'arrivage à l'entrée en murisserie
(Adheka, 2014). La figure 2 présente l'échelle
colorimétrique de maturation de banane.

24
1 2 3 4 5 6 7
Aux Etats-Unis d'Amérique, un extrait naturel du
pseudo-tronc est commercialisable en tant que complément alimentaire et
comme pilule préventive contre le cancer. Le jus de la banane
Figure 2 : Echelle colorimétrique
standard pour les bananes dessert du sous-groupe Cavendish (
http://www.promusa.org).
La récolte des régimes intervient 8 à 12
mois après la mise en place des rejets. Le temps de production varie en
fonction de la vigueur des bananiers et de la saison.
Le prélèvement du régime s'effectue
simplement en entaillant le pseudo-tronc pour que ce dernier fléchisse
lentement. Le régime est réceptionné délicatement
puis coupé avec une machette au niveau de la hampe. Les résidus
du bananier producteur sont ensuite débités en morceaux et
laissés sur place (ou ajoutés à votre compost). La plus
grosse partie du pseudo-tronc qui n'a pu être débitée en
petits morceaux peut quant à elle être emportée hors de la
plantation, car elle constitue un foyer privilégié pour les
parasites. Elle peut aussi etre conservée pour fabriquer des
pièges à charançons (Cirad, 2001).
1.1.4.9.7. Usage et transformation
La banane (surtout le plantain) est utilisée plus pour
l'autoconsommation, Dans certaines régions, la banane est souvent la
principale denrée cultivée et purée des paysans, mais
aussi comme le premier aliment solide donné aux nourrissons (Camara,
2010). Les fruits verts et les gaines foliaires servent partout pour
l'alimentation du bétail. La banane produit de la farine ; celle-ci
s'utilise dans la fabrication des beignets, biscuits et gâteaux ; la
purée de la banane peut être congelée pour une utilisation
ultérieure lors de la fabrication des glaces, des bonbons, le
milk-shake, les chewing-gums, etc. (Baudouin, 2002).
Les utilisations traditionnelles de bananes et bananes
plantains sont multiples ; elles varient selon le pays et les habitudes
alimentaires des consommateurs. La transformation artisanale et industrielle
des plantains en chip constitue une importante activité
génératrice de revenus dans les régions d'Afrique Centrale
et Occidentale (Ndjango, 2021).
25
mure est consommé frais, fermenté pour obtenir
une bière avec une faible teneur en alcool commercialisable ou
médical (Haïcour, 1997). Les bananiers plantains fournissent de
fibres très utilisées dans la fabrication de certains papiers
utilisés dans l'industrie manufacturable de sachets, de thé et
des billets de banque au Japon. Et ces fibres ont d'autres usages dans la
fabrication des cordes, ficelles et de nombreux objets d'artisanat (Cirad,
2001).
1.2. Maladie du sommet touffu de Bananier (BBTD) 1.2.1
Origine et distribution de la maladie
La maladie du sommet touffu de bananier (BBTD) est l'une des
plus importantes maladies de bananier dans plusieurs régions d'Afrique,
d'Asie et du Pacifique Sud. Elle est causée par au moins un virus
contenant de l'ADN simple brin. L'agent pathogène du BBTD est un virus
appelé Banana Bunchy Top Virus (BBTV) ou Virus du Bunchy Top de
Bananiers. Il appartient à la famille de Nanoviridée et au genre
Babuvirus. Le virus se propage d'une plante à l'autre par les pucerons
et d'un endroit à la plantation par des personnes transportant les
matériaux obtenus à partir de plantes infectées (Kallow et
al., 2021).
Le BBTV, comme tout virus, est un parasite obligatoire et
effectue son cycle de multiplication dans la plante hôte qui est le
bananier. Il est préférentiellement localisé dans les
tissus du phloème où il induit une désorganisation
à l'origine du symptôme de traits discontinus vert-foncé.
Il colonise l'ensemble des cellules de la plante et tous les organes ; à
l`exception des cellules du méristème. Ainsi tous les rejets
issus du pied principal ou pied mère sont infestés (Caruana.,
2003).
La maladie existait dès 1879 (Magee, 1927). Elle a
été noté d'abord dans les iles de Fidji en 1889, et a
été identifiée dans la région du Pacifique (y
compris les samoa américaines, l'Australie, Guam, Hawaii, Kiribati,
Ogosowaragunto, Tonga, Tuvalu, Wallis et Samoa occidentales) et en Asie (y
compris la Chine, Inde, Indonésie, Pakistan, Philippines, Sri Lanka,
Taiwan et Viet Nam) et en Afrique (y compris le Burundi, le Congo Brazzaville,
la Republique Centre Africaine, l'Egypte, le Rwanda, le Gabon et la R.D.C)
(Ngama, 2015). La distribution de BBTV en RDC est donnée par la figure
3.
26
Figure 3 : Carte de la distribution
de BBTV dans le bassin du Congo en RDC (Ngama et al.,
2014).
L'impact sur le rendement est dépendant de la date
d'infection. Les plants infectés où les symptômes se
manifestent en début de cycle de culture ne produisent pas de
régime, tandis que les plants infectés où les
symptômes se manifestent tardivement ont une production réduite.
Par la suite tous les plants ne produiront aucune récolte (Caruana,
2003).
La maladie du Bunchy Top de bananier (BBTD) est l'une des
graves maladies car la plante contaminée ne produit pas des fruits
(Mirko et al., 1997).
1.2.2 Symptômes de BBTD
Le symptôme typique de la maladie de Bunchy Top de
bananier est très précis, clairement identifiable de ceux
causés par les autres virus des bananiers et a été
décrit en détails par Magee (1936). Les plants infestés
par le puceron, les symptômes apparaissent habituellement sur la seconde
feuille émergeante après l'inoculation et consistent à
quelques tirets ou pointillés vert-foncés sur les nervures
secondaires de la partie inférieure du limbe. Les stries forment des
crosses dès qu'elles entrent en contact avec la nervure principale et
sont plus faciles à distinguer en observant la feuille en contrejour. Le
symptôme « pointillé » peut également
être observé sur le pétiole. Les feuilles suivantes peuvent
manifester des traits blanchâtres le long des nervures secondaires
lorsqu'elles sont encore enroulées. Ces traits deviennent verts
foncés lorsque la feuille se déploie (Kaper et al.,
2004). Les feuilles suivantes sont plus petites en
27
longueur et largeur de limbe, et souvent ont des bordures
chlorotiques et enroulées. Elles deviennent cassantes et dures et ont
une tenue plus érigée que la normale donnant au plant un aspect
touffu à l'extrémité « bunchy top » en forme de
rosette, avec un nanisme prononcé. Sur les plants infectés
très tardivement dans le cycle de culture, le seul symptôme
présent peut être quelques stries vert-foncé à
l'extrémité de la bractée florale, (Thomas et al.,
1999).
Les rejets d'une souche infectée montrent des
sévères symptômes sur la première feuille
émise et ont un nanisme important. Les feuilles sont en forme de
rosette, petites avec des chloroses marginales qui tendent à devenir
nécrotiques. Les stries vert-foncées sont habituellement
évidentes sur les feuilles ; les stries peuvent aussi évoluer et
devenir importantes au niveau du pseudo tronc (FAO, 2018).
Le BBTD est disséminé par deux modes : les
pucerons et les matériels de plantations infectées. Le puceron
Pentalonia nigronervosa est la seule espèce et même le
seul puceron vecteur de BBTD. Le puceron de la forme ailée seul peut
disséminer le virus en migrant de plante infectée vers une
nouvelle plante. Lorsqu'une souche est infectée, tous les rejets et le
plant mère seront infectés (Allen, 1977 ; Thomas, 1994).
1.2.3 Agent vecteur : Pentalonia nigronervosa
C.
Le puceron Pentalonia nigronervosa est la seule
espèce d'insecte vecteur du BBTV chez les bananiers. Il fait partie de
l'ordre des Homoptères et de la famille des Aphididae (Buyckx, 1962). Il
est probablement originaire d'Asie du Sud-Est (Mau et al., 2000). Ses
antennes sont légèrement plus longues que le corps, ses ailes
sont bordées de veines brunes, ses cornicules (petits tubes à
l'arrière de l'abdomen) sont longues et légèrement
enflées à l'extrémité. Les fourmis vivent ensemble
avec les pucerons. Elles récoltent le miellat produit par les pucerons
et semble en échange leur apporter une protection contre les
prédateurs et parasitoïdes (Hill, 1983).
28

|
Figure 4 : Puceron du bananier Pentalonia
nigronervosa (forme aptère)
|
Figure 5 : Puceron du bananier (forme
ailée)
|
Le Puceron de bananier se reconnait grâce à ses
différentes particularités physiques : la taille est très
petite et atteint 1,6 à 1,8 mm lorsque les ailes sont
déployées ; son abdomen est de couleur brun foncé. Les
pucerons forment des colonies, celles-ci se nichent généralement
(Cornack et Venette, 2004) :
? Sur la face inférieure des feuilles, près de la
nervure centrale,
? Sur le pseudo-tronc, de la base de la feuille la plus jeune
jusqu'au sol.
Quand la colonie compte trop d'individus et que si la
qualité de la matière végétale se
détériore (vieillissement, jaunissement), des pucerons
ailés apparaissent et migrent sur de nouvelles plantes situées
à 20 mètres de leur colonie d'origine, sans vent et
jusqu'à plusieurs kilomètres avec du vent (Jones, 2000).
En termes épidémiologiques, seule la forme
ailée des pucerons est un vecteur important et même le seul qui,
migrant vers une nouvelle plante en provoquant une nouvelle infection. La forme
la plus commune non ailée, sédentaire ne peut jouer le rôle
de vecteur entre différents plants. Les fourmis récoltent le
miellat que les pucerons produisent en grande quantité. Elles les
accompagnent toujours et seraient responsables d'une certaine protection contre
les prédateurs et parasites (Caruana., 2003).
Il n'y a pas de mâle chez le puceron du bananier. La
reproduction de cette espèce se fait sans
fécondation (parthénogénèse). Les femelles ne
pondent pas d'oeufs, elles donnent directement naissance aux petits pucerons et
la reproduction est parthénogénétique (sans
fécondation) ; elles sont donc vivipares (Padmalatha et Singh. 2002).
29
A part les bananiers, il existe d'autres plantes-hôte du
puceron du bananier : Taro (Colocasia), Alpinia, Heliconia,
Costus, Zingiber, Palisota sp et la Tomate. Ces plantes peuvent
héberger des colonies de pucerons qui sont susceptibles de transmettre
la maladie à des bananiers à proximité, s'ils sont
infectés (Kagy et al., 2000).
1.2.4 Lutte contre le BBTD
1.2.4.1. Lutte prophylactique
On doit éviter tout déplacement de
matériel contaminé d'une zone infectée vers une zone
saine. Tout plant visiblement infecté doit être détruit. On
peut aussi intercaler quelques plantes pièges dans le champ pour attirer
et capturer les pucerons ou planter les végétaux contenant les
huiles répulsives (ail, citronnelle) aux pieds du bananier (Thomas,
1994).
1.2.4.2. Lutte chimique
Le meilleur moyen de tuer les pucerons est de les empoisonner
par leur mode d'alimentation. Les pulvérisations foliaires à base
de chloropyrifos et acephate ont été efficaces dans la
réduction des populations de pucerons. L'application de ces produits se
fait avant la récolte. Par ailleurs, l'utilisation de prélavage
dans un détergent doux est aussi appliquée à l'ouverture
des bractées dans les cultures de bananier sous serre suivie d'un
trempage pendant 5 minutes dans un savon insecticide pyrethroïde (Ngama,
2014).
1.2.4.3. Lutte culturale
Cette lutte consiste à arracher, détruire et
remplacer régulièrement les plantes atteintes. On doit
éviter tout déplacement de matériel contaminé d'une
zone infectée vers une zone saine. Tout plant visiblement infecté
doit être détruit. On doit éviter les tailles drastiques et
les excès d'engrais riches en azote qui favorisent la
prolifération des pousses tendres et succulentes et choisir des engrais
en libération lente et à teneur modérée en azote
(Cornack et Venette, 2004).
1.2.4.4. Lutte Biologique
La lutte consiste à réaliser un lâcher
inondation d'insectes parasitoïdes qui vont pondre des oeufs dans une
colonie de pucerons ou à proximité. Ces oeufs vont se
développer aux dépens de puceron et les tuer. L'utilisation
d'Ephedrus cerasicola semble être aussi prometteuse (Stary et
al., 1990).
30
1.2.4.5 Protection intégrée en culture des
bananiers
La protection intégrée en culture des bananiers
est la combinaison optimum de toutes les méthodes de la lutte dans
l'objectif de sécuriser et optimiser la protection des bananiers et de
limiter l'impact d'usage excessif des pesticides sur l'environnement et pour
les humains (Regnaut et al., 2005).
31
Chapitre deuxième : MATERIELS
ET METHODES
2.1. Milieu d'étude
Cette étude couvre les 7 territoires de la province de
Maniema qui sont : Kailo, Pangi, Kibombo, Punia, Lubutu, Kasongo, et Kabambare.
Les différents territoires et villages de la Province de Maniema
enquêtés sont représentés par la figure 6 ci-dessus
:
Figure 6 : La carte administrative de la zone
d'étude (Province de Maniema)
Les investigations étaient faites dans 21 villages pour
l'ensemble de la Province de Maniema, située dans la région
Sud-Est de la cuvette centrale congolaise, au cours de la période allant
d'Avril 2021 jusqu'au 25 Février 2022.
2.1.1. Localisation de la zone d'étude
L'étude a été menée dans la
Province de Maniema, située au Centre- Est du pays (R.D. Congo) et
s'étend entre 0° et 5° de latitude Sud et 24° 55' et
28° 8' de longitude Est à 497m d'altitude. Cette Province est
limitée à l'Est par les provinces du Nord- Kivu et du Sud Kivu,
au Nord par la Province de la Tshopo, à l'Ouest par la province de
Sankuru et au Sud par les Provinces de Lomami et de Tanganyika. Sa superficie
totale est de 132.520 Km2 soit 5,6% de la superficie totale du pays
(Makondambuta, 1997).
32
2.1.2. Subdivision administrative
La Province du Maniema a été créée
par l'ordonnance loi n° 88-031 du 20 juillet 1988. Elle est la plus grande
province issue du démembrement de l'ancien Kivu, dont la superficie
couvre quatre fois celle du Nord-Kivu et deux fois et demie celle du Sud-Kivu.
Ce découpage kivutien aurait servi de « cas expérimental
» dans le processus de décentralisation initié par le
Président Mobutu dans les années 1980. Elle est
administrativement subdivisée en sept territoires : Kailo, Kasongo,
Kibombo, Kabambare, Pangi, Punia et Lubutu. La province comprend 19 secteurs,
16 chefferies et 7 Cités ou communes rurales (Makondambuta, 1997).
2.1.3. Le climat
La province du Maniema jouit d'un climat tropical chaud et
humide de type AW selon la classification de Koppen et de Martonne. Ce dernier
évolue vers le type équatorial (AW1) au Nord et vers le type
soudanais (AW4) au Sud. Dans ces deux tendances, la durée de la saison
sèche est respectivement de 2 à 3 mois et de 3 à 4 mois.
Elle comprend deux grandes saisons ; la saison sèche et la saison de
pluie. La température moyenne annuelle est de 27°C et les
précipitations annuelles s'élèvent à 1650mm d'eau
(Makondambuta, 1997 Op.cit.).
2.1.4. Le sol
Le sol étant un édifice d'une extrême
complexité, il varie parfois assez considérablement dans une
même zone. Les varient du type sablonneux (Kibombo) au type argileux
compact (Pangi et Kasongo). En fonction des sols à trois origines :
? Sédimentaire avec de grès tendre, grossier et
rouge, de l'argile et des schistes ;
? Métamorphique avec de calcaire silicifié, de
quartozitz, de gneiss et des roches métamorphiques ;
? Eruptive avec des roches granitiques éruptives
(PAPRBIO,1999).
Effet, le ferralsol du type Yangambi s'identifie au Nord de
Lubutu (Makondambuta, 1997 ; Ctcpm, 2002).
2.1.5. Végétation et
Hydrographie
2.1.5.1. Forêt
En Province de Maniema, la forêt équatoriale
décrit un arc de cercle partant de Kindu en passant par Shabunda et par
Walikale pour rejoindre la forêt équatoriale du Sud de
Béni. Partant du Sud du Maniema au Niveau du Sud d'UVIRA jusqu'à
la limite avec la Province du Tanganyika, on trouve des mosaïques de
savanes boisées et des galeries forestières traduisant la
dégradation de
33
la forêt par l'action de l'homme. La faune est riche et
variée. Deux grandes formations végétales couvrent le
Maniema : la forêt dense humide et la savane. La forêt dense couvre
les territoires de Lubutu, Punia, et Pangi et une partie de Kailo et Kibombo.
Cette forêt est riche en essences forestières de valeurs. Les
galeries forestières couvrent les territoires de Kasongo, de Kibombo
ainsi qu'une partie du territoire de Kabambare où la galerie
forestière s'appelle Nywema, d'où l'origine du nom de Maniema
(Makondambuta, 1997).

Figure 7 : Forêt dense humide
de Kailo Figure 8 : Galeries forestières de
Kabambare
2.1.5.2. Savane
Le sud du Maniema est principalement occupé par une
savane arbustive. Au sein de celle-ci, quelques savanes herbeuses sont
présentes au Sud-Ouest, tandis qu'au Sud-Est, on rencontre
différents types de végétations : savane arbustive,
quelques petites forêts claires, une savane boisée de petite
superficie, quelques savanes arborées et des surfaces agricoles de
moindre ampleur. Ces deux écosystèmes caractéristiques de
forêt dense et savane sont relativement bien délimités et
s'expliquent par les climats distincts que connaissent le Nord et le Sud de la
province. Les conditions climatiques variant du Nord au Sud au fur et à
mesure qu'on s'éloigne de l'équateur (Makondambuta, 1997).
34
2.1.5.3. Hydrographie
Le fleuve Congo traverse la province du Sud au Nord. Il est
navigable de Kindu à Ubundu (Province de la Tshopo). Il est
arrosé par plusieurs affluents dont les plus importants sont : Lulindi,
Musukuyi, Mulongoy, Ulindi, Kasuku, Kunda, Lufubu, Lowa, Lweki et Elila, etc.
(Makondambuta, 1997).
2.1.6. Economie
L'économie de la province du Maniema est fondée
essentiellement sur la production agricole qui occupe la majorité de la
population. Il s'agit en grande partie d'une agriculture de subsistance
caractérisée par un faible degré de mécanisation.
On y produit le riz, l'arachide, le manioc, le maïs et la banane comme
principales cultures vivrières (Makondambuta, 1997).

Figure 9 et 10. Systèmes de cultures dans
les différentes zones d'étude en Province deManiema
Quant aux cultures industrielles héritées de la
colonisation et qui concernaient principalement le coton, le café et
l'huile de palme, elles sont à l'arrêt depuis plusieurs
années. Seules subsistent encore quelques rizeries dont le
décorticage s'effectue désormais de manière artisanale,
faute d'usines de transformation abandonnées progressivement par leurs
propriétaires. L'élevage de type traditionnel s'y pratique comme
partout, essentiellement axé sur le petit bétail et la volaille
mais qui suffit à peine à combler les besoins de la population.
La pêche, de type artisanale, s'effectue dans le fleuve Lualaba, ses
affluents et sur le Lac Ndjale dans le territoire de Kibombo (Mrac, 2011).
35
2.2 Matériels
2.2.1 Matériels Biologiques
Les matériels biologiques utilisés dans cette
étude sont les différents cultivars de bananiers et plantains
(Musa spp.) inspectés dans les champs et en jardins des cases
des paysans. Le tableau 6 présente les différents cultivars de
bananiers et plantains, leurs génotypes et leurs noms vernaculaires dans
la zone d'étude. Et le tableau 6 en bas, illustre quelques cultivars de
bananes et plantains inspectés dans les différentes zones de
production bananière de Maniema.
Tableau 5 : Les différents cultivars
de bananiers et plantains inspectés dans la zone d'étude en
|
Province de Maniema
|
|
|
N°
|
Noms vernaculaires
|
Génotypes
|
|
01
|
Mbijaonde ou Mukokoonde
|
AAB
|
|
02
|
Mbudi ou Mbuzi
|
AAB
|
|
03
|
Muyaudi ou Bisamunyi
|
AAA
|
|
04
|
Kibubu ou Kebobo
|
AAB
|
|
05
|
Bonjilo ou Bunzilo
|
AAB
|
|
06
|
Ibota
|
AAA
|
|
07
|
Bambote
|
AAA
|
|
08
|
Kamera
|
AAA
|
|
09
|
Atili
|
AAB
|
|
10
|
Amamundu
|
AAB
|
Légende :
A : Acuminata
B : Balbussiana

Figure 11 : Quelques cultivars de bananes et
plantains inspectés dans
le territoire de Kabambare
36
2.2.2 Matériels techniques
Les matériels techniques utilisés étaient
composés d'une fiche d'enquête constituée des questions
(Bioversity-CIALCA, Ngama 2010), d'une loupe pour visualiser les pucerons, d'un
carnet, d'un stylo, et d'une moto AG100.
2.3 Méthodes
Une étude relative à l'incidence et la
sévérité de la maladie du sommet touffu de bananier (BBTD)
a été réalisée dans les sept territoires de la
Province de Maniema région située au Centre- Est du pays. Cette
étude a consisté en évaluation de l'incidence et la
sévérité de BBTD, la présence et l'importance de
puceron Pentalonia nigronervosa sur les bananiers dans la zone
d'étude. Les conditions culturales (source de matériels de
plantation, âge de la bananeraie et le système cultural) et les
connaissances relatives au BBTD par l'agriculteur (identification des
symptômes par les agriculteurs, origine probable de BBTD dans la zone
d'étude, dispersion de BBTD dans la région et connaissance du
mode de transmission de BBTD) ont été aussi analysées.
2.3.1. Conditions culturales et connaissance de la
maladie
Pour recueillir les informations, en rapport avec les
conditions culturales des champs de bananiers (source de matériels de
plantation, âge de la bananeraie et le système cultural) et les
connaissances relatives au BBTD par les agriculteurs (identification des
symptômes par les agriculteurs, origine probable de BBTD dans la zone
d'étude, dispersion de BBTD dans la région et connaissance du
mode de transmission de BBTD) dans les zones de production bananière de
Maniema, nous avons enquêté les agriculteurs pratiquant la culture
de bananiers dans ces différentes zones d'étude.
2.3.2. Paramètres de maladie
Les observations relatives aux paramètres de maladie
(l'incidence, la sévérité, la présence et
l'importance de P. nigronervosa) étaient faites sur les
différents cultivars de bananiers et plantains en culture dans les
champs et jardin de cases des agriculteurs.
2.3.2.1. Evaluation de l'incidence de la maladie
(BBTD)
Pour évaluer l'incidence de la maladie, nous nous
sommes servis de questionnaire de Bioversity-CIALCA (en annexe) pour obtenir
les informations sur l'incidence et la sévérité de la
maladie. L'incidence de BBTD a été évaluée à
partir de symptomes de la maladie BBTD sur
37
au moins un plant de la touffe inspectées par champ ou
jardins de case. Au total, 30 touffes de bananiers étaient
analysées par champ ou jardin de cases.
Les niveaux moyens d'incidence de BBTD ont été
calculés en proportion de plantes infectées sur un nombre total
touffe enquêtées. Elle a été obtenue à partir
de la relation mathématique suivante :
Incidence (%) = Nombre des touffes
infectées
Nombre total des touffes ×100
2.3.2.2. Evaluation de la sévérité
de la maladie (BBTD)
Les symptomes typiques de la maladie du sommet touffu des
bananiers sont très bien précis, clairement identifiables de ceux
causés par les autres virus des bananiers. Les différents niveaux
de sévérité de la maladie sur les touffes infectées
ont été determinés à partir des observations
visuelles de différents aspects (deformations de feuilles) et
colorations des feuilles. Cette évaluation était faite à
l'aide d'une échelle de cotation ordinaire allant de 0 à 5, avec
les cotes plus élevées indiquant la gravité croissante de
la maladie. L'échelle de cotation (Cialca, 2008 ; Ngama et al.,
2014 et Ngama, 2015) utilisée pour évaluer la gravité
de la maladie du Bunchy top de bananier se présente comme suit :
- Niveau 0 : sans symptômes,
- Niveau 1 : stries sur les feuilles,
- Niveau 2 : stries foncées jusqu'au pseudo - tronc,
- Niveau 3 : décoloration des feuilles avec taille
normale,
- Niveau 4 : taille réduite de feuilles
décolorées,
- Niveau 5 : aspect touffu au sommet « Bunchy top ».
2.3.2.3. Evaluation de la présence du vecteur
Pentalonia nigronervosa
Le puceron noir du bananier P. nigronervosa se
localise entre la vieille gaine et la jeune gaine foliaire. Il peut même
se localiser au niveau des feuilles, cigare et fruit. Pour observer la
présence de puceron, les bananiers de chaque touffe était
inspectés à l'aide d'une loupe. L'observation consistait à
degainer le faux tronc du bananier pour visualiser ce puceron. La
présence du puceron P. nigronervosa a été
évaluée à partir du rapport entre le nombre total des
touffes portant les pucerons sur l'ensemble des touffes observées et
exprimé en pourcentage.
2.3.2.4. Evaluation de l'importance du vecteur
Pentalonia nigronervosa
Comme les différentes colonies de P. nigronervosa
se localisent généralement entre la gaine de la plus
récente feuille et la vieille gaine, nous avons observé les
différentes colonies de ce
38
puceron sur les différents organes de bananier. Les
différentes formes de puceron (larves, nymphes, alatés ou
adultes) formant les différentes colonies étaient
observbées sur le cigare, les feuilles deployées et les gaines
foliaires de bananier. L'importance du vecteur sur les touffes choisies a
été évaluée à l'aide de l'échelle du
BBTD allant de 0 à 5 avec les cotes plus élevées indiquant
l'augmentation des populations de pucerons P. nigronervosa.
L'échelle de cotation des pucerons P. nigronervosa se
présente de la manière suivante (Cialca, 2008 et Ngama et
al., 2014) :
- Niveau 0 : sans vecteur sur la touffe,
- Niveau 1 : une colonie simple sans insectes ailés,
- Niveau 2 : plusieurs colonies simples,
- Niveau 3 : une grande colonie avec des insectes
ailés,
- Niveau 4 : plusieurs grandes colonies,
- Niveau 5 : colonies généralisées au niveau
des feuilles et du pseudo-tronc.
2.3.3. Echantillonnage
Au total 7 territoires ont été
enquêtés en raison de 3 villages par territoires. En effet, 1890
touffes des bananes et plantains ont été inspectées dans
63 champs à raison de 30 touffes par champs, 3 champs par village dans
l'ensemble de la Province du Maniema. Quant à l'échantillonnage,
nous avons utilisé la méthode de diagonale où, nous avons
établi dans chaque champ les diagonales pour selectionner les touffes de
bananiers pouvant constituer nos échantillons représentatifs sur
lesquels ont porté nos observations.
Les villages étaient selectionnés en fonction de
l'existence et abondance de bananeraies dans la zone d'étude. Les
agriculteurs étaient aussi à leurs tours selectionnés
à partir de la taille de leurs bananeraies. Pour l'entretien, le chef de
ménage seul ou accompagné de membres de sa famille
répondait aux questions (interview) en rapport avec les conditions
cutirales de sa bananeraie et sur la connaissance de la maladie du sommet
touffu de bananier (BBTD). La figure 15 et 16 présente l'interview et
l'observation de paramètres de maladie BBTD avec les agriculteurs.
39

2
2 Fi diti
12 I t lt i l d
l b f i d l Diagnostic
visuel de paramètres de la
one détude
maladie
2.4 Analyse des données
Les données obtenues ont été
analysées par les méthodes multivariées. La méthode
factorielle, nous a permis de faire la distribution spatiale des cultivars,
tandis que celle de cluster, nous a servi à la classification des
cultivars en groupes selon leurs sensibilités à la maladie du
sommet touffu de bananier à l'aide du logiciel
STATGRAPHICS_Centurion_XVI version 16.20.04 (32bits).
L'analyse des résultats inscrits dans la figure 14
montre que, dans la province de Maniema ; 100% de bananiers sont
cultivés en polyculture, soit en association avec le riz, le manioc,
le
40
Chapitre troisième : RESULTATS ET
DISCUSSIONS
Ce chapitre présente les résultats et les
discussions en rapport avec les conditions culturales (source de
matériels de plantation, âge de la bananeraie, le système
cultural), les connaissances relatives au BBTD par l'agriculteur
(l'identification des symptômes de la maladie par les agriculteurs,
l'origine probable de BBTD dans la zone d'étude, la dispersion de BBTD
dans la région et connaissance du mode de transmission de BBTD) et les
paramètres de la maladie (l'incidence et la
sévérité de BBTD, la présence et l'importance de
P. nigronervosa) dans les zones de production bananière en
Province de Maniema.
3.1 Conditions culturales et connaissances relatives au
BBTD par les agriculteurs 3.1.1. Système de cultures de bananiers dans
la zone d'étude
La figure 14 présente les valeurs en rapport avec le
système de cultures de bananiers dans la zone d'étude et les
valeurs brutes sont consignées dans le tableau 3 en annexe.

A B C D E F G Système de cultures
Pourcentage moyen
100
40
20
60
80
0
Figure 14 : Système de cultures dans la
zone
Légende :
A : Bananier en monoculture ;
B : Bananier en association avec le riz ;
C : Bananier en association avec le manioc ;
D : Bananier en association avec la patate douce ;
E : Bananier en association avec le haricot ;
F : Bananier en association avec le maïs ;
G : Autres
41
maïs ou autres cultures, l'association bananier-patate
douce représente 76,19%, suivi de l'association bananier-haricot 33,33%.
Cependant, il n'existe pas de bananeraie en monoculture.
En R.D. Congo, le bananier est cultivé à
différentes altitudes et sa production est distribuée à
travers tout le pays, sur de grandes et petites exploitations. Dans le pays et
dans la Province de Maniema en particulier, la culture se pratique en trois
systèmes : dans les périphéries, les bananiers sont
cultivés dans les champs paysans souvent en association avec d'autres
cultures (riz, manioc...), en forêt secondaire vieille ou en
jachère et dans le centre-ville, le bananier est
en culture de case. Les bananiers et les plantains sont
produits dans les jardins familiaux ou associés à d'autres
cultures vivrières dans les systèmes des cultures
itinérantes. Ils sont plantés sur des terrains dont la
végétation naturelle où la culture de couverture a
été coupée et ou brulée. Selon Ngama (2015), la
production bananière est faite sous différents systèmes de
culture, à savoir les cultures de case, les cultures en champs, en
association ou en monoculture. La culture mixte n'est pratiquée que sur
des petites exploitations en forêt secondaire vieille qui se
régénère naturellement ou artificiellement à partir
d'une végétation forestière autochtone âgée
et qui dénote des différences marquées dans la structure
de la forêt. Il poursuit en disant que, ces
associations sont complexes et sont fonction du régime
alimentaire et importance économique de chaque contrée.
Toutefois, ces champs ne constituent pas des grandes plantations. Le paillage
et l'application de fumure ne sont cependant pas pratiqués. Les maladies
et ravageurs ne sont pas aussi contrôlés. Peu de soins sont
accordés au choix du terrain pour installer une culture de bananier.
Selon Dhed'a et al. (2011), la plupart des bananiers
sont cultivés dans l'arrière-cour ou dans les jardins de case
d'une superficie variant entre 0,5 à 4 ha où plusieurs cultures
sont pratiquées ensemble pour l'autosuffisance alimentaire. Onautshu
(2013) rapporte que, ces jardins de case sont des systèmes
d'exploitation permanents de culture et d'élevage, stratifiés et
très diversifiés, situés autour des maisons et où
l'accent est mis sur les espèces végétales domestiques
à usages multiples, ligneuses et herbacées. Ces champs ne
constituent pas de grandes plantations de cultures pures, bien
fertilisées et protégées contre les maladies et les
ravageurs soulignent le même auteur. Ce système est
pratiqué par les paysans en utilisant tout ce qui est comme
déchets de cuisine, déchets de récolte, matières
fécales et autres sous forme de matières organiques servant
à la nutrition des plantes.
42
3.1.2. Sources du matériel de
plantation
Les valeurs relatives à la source de matériels
de plantation dans la zone d'étude sont présentées par la
figure 15. Les valeurs détaillées par contre, sont
consignées dans le tableau 1 en annexe.
|
100,00
|
|
|
|
|
|
|
|
|
Poucentage moyen
|
80,00 60,00 40,00 20,00
|
|
|
|
|
|
0,00
|
|
|
A B C D E F Provenance de materiel de
plantation
Figure 15 : Source de matériels de
plantation
Légende :
A : Rejets issus de la même plantation ;
B : Rejets en provenance des champs de voisins ;
C : Rejets issus des plantations situées loin de la zone
;
D : Vitro-plants distribués par les services de
l'état (IPAPEL, Recherche, ONGD) ;
E : Vitro-plants achetés chez les privés ;
F : Autres à préciser.
L'analyse des résultats inscrits dans la figure 15
renseigne que dans la province de Maniema ; 95,24% des agriculteurs utilisent
des rejets en provenance des champs des voisins ; suivi de 90,48% qui utilisent
des rejets issus des plantations situées loin de leurs zones ; de 52,38%
d'agriculteurs utilisant les rejets issus de la même plantation.
Cependant, 9,52% d'agriculteurs évoquent plusieurs autres raisons. Et
pourtant, les vitro-plants ne sont pas distribués par les services de
l'état (IPAPEL, Recherche, ONGD) sur toute l'étendue de la
Province et moins encore les vitro-plants achetés chez les
privés.
L'analyse de l'ensemble de ces résultats
révèle que, les agriculteurs de la Province de Maniema utilisent
les matériels de plantation nos contrôlés et non assainis
provenant de champs de voisins ou de leurs propres champs et aucune sources
d'approvisionnement de rejets ou vitro-plants sains n'existe dans cette zone
d'étude.
43
Selon Dhed'a et al. (2011), le matériel de
plantation utilisé par les agriculteurs est constitué
essentiellement des rejets provenant d'anciens champs ou des champs voisins ne
subissant aucun traitement. En pratique, le meilleur matériel de
plantation est constitué de 3 sources principales (les rejets
baïonnettes, les vitro plants et les rejets issus de la macropropagation)
rappelle le même auteur. Le rejet est choisi sur un plant sain se
trouvant dans un champ de bananier exempt de maladie souligne t-il. Les
plantations de bananiers sont établies en plantant des rejets
sevrés et des rejets baïonnettes, dont les cornus sont pelés
et le pseudo-tronc coupés à quelques centimètres au-dessus
de cormus. Cette pratique contribue à la lutte phytosanitaire rapportent
Swennen et Vuylsteke (2001). Tandis que, Rennes (2006) rapporte que, le
matériel végétal employé pour la mise en place
d'une bananeraie qu'elle soit en culture conventionnelle ou en association avec
d'autres productions doit être de la meilleure qualité.
Le plus souvent les pieds ou touffes destinés à
fournir les matériels de plantation sont choisi sur base de la plante
qui les porte (vigueur, productivité, absence de symptômes de
maladies) rapporte Ngama (2015). De même, Lassoudière (2007)
recommande d'utiliser exclusivement du matériel sain et
homogène.
3.1.3. Age de la bananeraie dans la zone
d'étude
La figure 16 présente les valeurs relatives à
l'âge de bananeraies des agriculteurs de la zone d'étude et les
données détaillées sont consignées dans le tableau
2 en annexe.
50
|
Age moyen des bananeraies
|
40 30 20 10
0
|
|
|
|
|
|
|
|
|
|
A B C D E
Bananeraies
Figure 16 : Age de la bananeraie dans la zone
d'étude
Légende :
A : Plantation de moins de 3 ans ;
44
B : Plantation de 3-5 ans ;
C : Plantation de 5-7 ans ;
D : Plantation de 7-9 ans ;
E : Plantation de plus de 10 ans.
L'analyse des résultats inscrits dans cette figure 16
montre en général que, l'âge des bananeraies varie de 3
à 10 ans dans les zones de production bananière de Maniema
où 42,86% des bananeraies enquêtées sont âgées
de plus de 10 ans, suivi de bananeraies de 5-7 ans (38,10%), bananeraies de 3-5
ans (14,29%), bananeraies de moins 3 ans (8,33%) et de bananeraies de 7-9 ans
(4,76%).
Ces résultats par ailleurs, sont contradictoires
à ceux de Ngama et al. (2014) dans les conditions paysannes
similaires où plus de 55% des bananeraies étaient
âgées de 3 à 7 ans. D'après Dhed'a (2011),
l'âge des bananeraies des agriculteurs est d'environ 3 ans suivi de son
abandon pour permettre à la forêt de se reconstituer et de
favoriser ainsi la fertilisation du sol.
En principe, les souches de bananiers produisent pendant 5
ans, au-delà, il faut replanter à partir d'un rejet
latéral prélevé sur un plant sain. Selon le même
auteur précité, il est rare de trouver dans les milieux paysans
les installations de bananeraies ayant quelques hectares en dehors des villages
dans l'optique d'obtenir de hauts rendements pendant plus de 7 ans de culture.
C'est aussi ce que démontre le même auteur, pour qui, les
bananiers sont des plantes monocotylédones vivaces qui se
succèdent à elles-mêmes. De sa tige souterraine
(appelé aussi bulbe, souche ou rhizome) vont pousser des rejets (ou
rejetons) qui assureront, par voie végétative, la
pérennité du bananier. Chaque rejet peut donner un plant de
bananier qui peut succéder au pied-mère sur la même souche
ou être détaché pour être planté et
cultivé ailleurs suggère Dhed'a (2011 Op.cit.).
3.2. Connaissances relatives au BBTD par
l'agriculteur
3.2.1. Identification de symptômes de BBTD par les
agriculteurs
Les valeurs relatives à l'identification de
symptômes de BBTD par les agriculteurs dans la zone d'étude sont
présentées par la figure 17. Les données
détaillées sont consignées dans les tableaux 4 en
annexe.
45
|
Pourcentage moyen
|
90,00 80,00 70,00 60,00 50,00 40,00 30,00 20,00 10,00
|
|
0,00
Identification des symptômes de BBTD
A
B
C
D
E
F
Figure 17 : Identification de symptômes de
BBTD par les agriculteurs dans la zone d'étude. Légende
:
A : connaissance de BBTD
B : Observation des symptômes sur les feuilles
C : Observation des symptômes sur le pseudo-tronc
D : Aspect touffu des plants infectés
E : Système d'enracinement non fonctionnel
F : Autres précisions
L'analyse des résultats de la figure 17 indique que
76,19% des agriculteurs de la zone d'étude connaissent la maladie du
sommet touffu de bananier, par contre 80,95% identifient la maladie en
observant les symptômes sur les feuilles ; suivi de 61,90% qu'identifient
les symptômes par l'aspect touffu au sommet ; de 52,38% qu'identifient la
maladie par les symptômes au pseudo-tronc. Tandis que, 47,62%
suggèrent autrement l'identification, contre 4,76% qui identifient la
maladie à partir du système d'enracinement non fonctionnel.
Le symptôme typique de la maladie de Bunchy Top de
bananier est très précis, clairement identifiable de ceux
causés par les autres virus des bananiers (Ngama et al., 2014 ;
Magee, 1927 ; Kavino et al., 2007). Malgré cette clarté
dans l'expression de la maladie, les symptômes dans les champs des
agriculteurs ne sont pas assez bien définis par ces derniers pour un
diagnostic visuel. C'est ce qui complique la gestion de cette maladie (BBTD)
dans les champs, augmentant ainsi le risque de propagation de l'agent
pathogène (BBTV) (Ngama, 2015 ; Allen, 1927).
46
3.2.2. Origine probable de la maladie (BBTD) dans la zone
d'étude
Les valeurs relatives à l'origine probable de BBTD dans
la zone d'étude sont présentées par la figure 18. Les
données détaillées sont consignées dans les
tableaux 5 en annexe.
0,00
L'endroit où l'on a observé pour la 1ere
fois le BBTDT
Pourcentage Moyen
40,00
25,00
20,00
35,00
30,00
15,00
10,00
5,00
ABC
Figure 18 : Origine probable de la maladie dans
la zone d'étude Légende :
A : Dans sa propre plantation ;
B : Chez les voisins (moins de 10 Km) ;
C : Pas connu par l'agriculteur.
Il ressort de l'analyse de la figure 18 que dans la zone
d'étude, l'origine probable de BBTD n'est pas clairement connue de
manière précise par les agriculteurs (28,57%). Par contre, une
bonne moyenne des agriculteurs l'attribue aux voisins de moins de 10Km de leurs
villages (38,10%) contre seulement 33,33% qui l'attribue dans leurs propres
champs.
La maladie BBTD a été enregistrée pour la
première fois en Afrique continentale, plus précisément en
Egypte vers les années 1901 (Fahmy, 1927), où les dommages
économiques se sont produits en 1953 (Dale, 1927). En Afrique centrale,
dans la région de Kisangani (R.D. Congo), elle a été
observée dans les années 1950 (Ngama, 2014 ; Wardlaw, 1961). Par
contre, en R.D. Congo, cette maladie est déjà signalée,
surtout dans les Provinces du Bas Congo, du Sud et Nord Kivu ainsi que dans
l'ex Province orientale démembrée et ses environs (Province de
Maniema) (Ngama et al., 2014 ; Ngama, 2015 et FAO, 2010).
L'entrée tardive en Afrique vers les années 1958, plus
précisément à Yangambi, dans la Province de la Tshopo
serait
47
introduite par des rejets contaminés offerts en cadeaux
au Roi Albert Ier. De ce fait, il est fort possible que les
mêmes matériels de plantation qui circulent entre les agriculteurs
de la zone et ses environs soient à la base de la dissémination
de la maladie (BBTD), étant donné que la contamination à
des grandes distances est due au déplacement des matériels par
l'homme et à courte distances par le puceron Pentalonia
nigronervosa.
3.2.3. Dispersion de BBTD dans la Zone
d'étude
Les valeurs relatives à la dispersion de BBTD dans la
région (durée de production de la souche après observation
des symptômes) sont présentées par la figure 19. Les
données détaillées sont consignées dans les
tableaux 6 en annexe.
|
Pourcentage Moyen
|
50,00 40,00 30,00 20,00 10,00
0,00
|
|
|
A B C D E
Années de production
Figure 19 : Durée de production de la
souche après observation des symptômes Légende
:
A : 2 ans de production
B : 3 ans de production
C : 5 ans de production
D : Plus de 5 ans
E : Moins d'une année
Les résultats de la figure 19 indique que, dans la zone
d'étude, 47,62% de bananiers infectés par le BBTD restent
productifs moins d'une année ; 33,33% de bananiers restent productifs
jusqu'à 2 ans, 9,52% vont jusqu'à 3 ans et 4,76% de bananiers
peuvent encore produire jusqu'à 5 ans et plus. Ces résultats se
confirment par Faure G., et al., (2018) qui stipule que, la maladie
affecte essentiellement la croissance et rend improductif les sujets atteints
au cours de leur végétation.
48
Comme les rejets des touffes de bananiers sont presque
toujours infectés, Magee (1927) pense que la maladie est censée
être systémique. Cependant, Caruana (2003) signale que le BBTD est
transmis à travers toutes les formes végétatives du
matériel utilisé pour la plantation incluant les rejets et les
plants issus des cultures in vitro.
Cependant, les études de Lokana et al., (2016)
sur la systémicité de BBTD à Kisangani ont établi
que, lorsqu'une souche est infectée, tous les rejets et les
plants-mères seront infectés même si l'infection n'est pas
initialement présente dans toutes les parties de la souche. Par
ailleurs, les rejets provenant des souches virosées sont
inévitablement porteurs de virus BBTV et ainsi l'extension de la maladie
est généralement due à l'utilisation du matériel
végétal contaminé signale le même auteur. Et
pourtant, dans les différentes régions de production
bananière, l'homme joue apparemment un rôle important comme agent
de dispersion du vecteur Pentalonia nigronervosa et indirectement du
virus BBTV rapporte Thomas et al., (2003).
3.2.4. Connaissance du mode de transmission de BBTD par
l'agriculteur
Les valeurs relatives à la connaissance du mode de
transmission de BBTD par les agriculteurs dans la zone d'étude sont
présentées par la figure 20. Les données
détaillées sont consignées dans les tableaux 7 en
annexe.
|
Pourcentage Moyen
|
100 80 60 40 20
|
|
0
Mode de transmission de BBTD
A B C D
Figure 20 : Connaissance du mode de
transmission de BBTD par l'agriculteur de Maniema
Légende :
A : Transmission par le sol
B : Transmission par les rejets
C : Transmission par un vecteur
D : Transmission par outils (houes, machettes, etc.)
49
La lecture des résultats sur la figure 20,
révèle que, 100% des agriculteurs dans cette zone confirme une
transmission de la maladie par les rejets ; par contre 90,48% disent que le
BBTD se transmet par un vecteur ; 85,71% pensent que la maladie est
véhiculée par les outils de travail (houes, machettes, etc.) et
afin une probable transmission de BBTD par le sol n'est pas reconnue par les
agriculteurs.
Le BBTD est causée par le virus BBTV qui est
principalement transmis par le matériel de plantation infecté et,
d'autre part, par un puceron vecteur Pentalonia nigronervosa. Le
mouvement du matériel de plantation infecté est le principal
mécanisme de propagation de la maladie sur de longues distances à
travers les différentes zones de production bananière renseignent
Thomas et Caruana (2000) et Ngama et al., (2014). Cependant, les
résultats de l'étude de Ngama (2015) sur
l'épidémiologie de BBTD au champ et la jachère sans
puceron, indiquent que la dissémination de la maladie à des
longues distances est faite par l'homme qui utilise des rejets provenant de
plantations infectées. Le virus se propage d'une plante à l'autre
par les pucerons infectés et d'une plantation à l'autre par des
personnes transportant les matériels infectés, de pucerons
infectés sur les habits et voire même le transport de pucerons
infectés par les fourmis rapporte le même auteur. Toutefois, le
virus BBTV n'est pas transmis mécaniquement.
3.3. Paramètres de maladie du sommet touffu de
bananier (BBTD) 3.3.1. Incidence de BBTD dans la zone
d'étude
Les résultats des observations de l'incidence de BBTD
obtenus sur au moins un plant de la touffe de bananiers sont illustrés
par la figure 21. Les valeurs brutes sont consignées dans le tableau 8
en annexe.
50
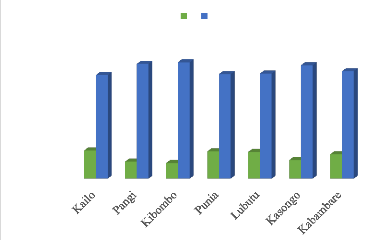
0 1
80,00
60,00
40,00
20,00
0,00
Incidence de BBTD (en %J
100,00
Territoires
Figure 21. Incidence de BBTD sur au moins un
plant de touffe de bananiers Légende :
0 : Absence ; 1 : Présence.
Il ressort de la figure 21 que, l'incidence de BBTD a
varié de 78,52% à 88,15% dans les zones de production
bananière de Maniema. En moyenne 82,85% de touffes
enquêtées ont porté les symptômes de BBTD. Cependant,
le taux le plus élevé est enregistré dans le territoire de
Kibombo (88,15%) suivi de Pangi (87,05%), Kasongo (85,93%), Kabambare (81,48%),
Lubutu (79,63%), Punia (79,26%) et Kailo (78,52%).
Numériquement, ces valeurs sont élevées
dans les différentes zones de production bananières de Maniema et
restent comparables à celles trouvées par Ngama (2014) dans la
région Nord-Est du bassin du Congo où l'incidence de BBTD allant
de 70,2% à 96,5% a été observée dans les
différentes Localité enquêtées. De même, ces
valeurs sont en fait largement supérieures à celles
trouvées en jardins de case et en plantation (5 à 30%) par Magee
(1927) lors de sa première enquête sur la maladie de BBTD. Les
valeurs relativement faibles observées dans le territoire de Kailo,
Punia, Lubutu et Kabambare pourraient aussi être justifiées par
des valeurs hautes d'altitude étant donné que cette maladie est
typique de conditions de basse et moyenne altitude (FAO, 2010). C'est aussi ce
que démontrent Thomas et Dietzgen (1991) qui déclare que
l'incidence de BBTD fluctue avec l'altitude. Les différents niveaux
élevés d'altitude peuvent donc être un
élément pouvant en partie expliquer la moindre incidence de la
maladie
51
dans certains territoires de la Province de Maniema.
Toutefois, ce paramètre n'est pas le seul à avoir une influence
sur le développement de la maladie BBTD souligne Caruana (2007).
En plus, ces résultats ont aussi montré que la
maladie de BBTD est largement rependue à travers toute la zone de
production bananière de Maniema et a varié en fonction de
territoire. Si l'on se fonde sur ces observations telles que documentée
dans les années 1950 pour la R.D. Congo (Wardlaw, 1961 ; Ngama et
al., 2014), il est fort possible que les facteurs critiques pour la
première diffusion de BBTD dans les nouvelles régions aient
été les pratiques traditionnelles des agriculteurs, les
préférences à certains types de cultivars de bananiers, la
demande du matériel de plantation et la direction du mouvement de ce
matériel à partir des zones touchées par la maladie
(BBTD).
3.3.2 Sévérité de la maladie (BBTD)
dans la zone d'étude
Les valeurs relatives à la gravité de la maladie
du sommet touffu (BBTD) dans les différents territoires de Maniema sont
présentées par la figure 22. Les données
détaillées sont consignées dans le tableau 9 en annexe.
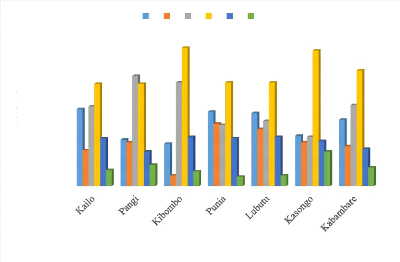
Sévérité
40,00
25,00
20,00
35,00
30,00
15,00
10,00
0,00
5,00
0 1 2 3 4 5
Territoires
Figure 22. Sévérité de
BBTD sur les cultivars de bananiers par territoire
Légende :
0 : sans symptômes,
1 : stries sur les feuilles,
2 : stries foncées jusqu'au pseudo - tronc,
52
3 : décoloration des feuilles avec taille normale,
4 : taille réduite de feuilles
décolorées,
5 : aspect touffu au sommet « Bunchy top ».
L'analyse de résultats présentés
pâr la figure 22 en rapport avec la sévérité de BBTD
partant de l'échelle de cotation allant de 0 à 5 renseigne que,
les différents niveaux de symptômes de BBTD sont présents
sur la majorité de bananiers dans cette zone de production
bananière. Cependant, la décoloration des feuilles avec taille
normale (niveua 3) est fréquente et plus élevée sur
l'ensemble de bananiers et plantains dans les différents territoires. En
moyenne, 31,90% des bananiers ont porté des feuilles decolorées
avec taille normale (niveau 3). Les stries foncées jusqu'au pseudo-tronc
(niveau 2) sont aussi relativement élevées avec une moyenne de
21,90% par rapport aux niveaux 1, 4 et 5 respectivement stries sur les
feuilles, taille réduite de feuilles decolorées et aspect touffu
au sommet qui, restent moins élevés. En général,
les symptômes ont été apparents sur les touffes de
bananiers observées dans la zone d'étude. Au moins les plantes
présentant les symptômes typiques de la maladie (taille
réduite des feuilles décolorées et un aspect touffu au
sommet) ont été observées à travers les
différents territoires de Maniema. Toutefois, pour l'ensemble de la
Province, c'est dans le territoire de Punia et Lubutu que l'on trouve le moins
de bananiers ayant atteint les niveaux 4 et 5 de ladite maladie.
Ces valeurs obtenues sur la gravité de la maladie de
BBTD dans cette zone d'étude, sont généralement moins
élevées mais restent comparables à celle trouvées
par Ngama et al., (2014) dans son étude sur la distribution de
BBTD dans le bassin du Congo, en région Nord-Est, où en moyenne
37% des touffes de bananiers enquêtés avaient
présenté les stries sur les feuilles (stade 1), suivi des
feuilles décolorées avec taille normale (20,5%) et les stries
jusqu'au pseudotronc (19,7%). La taille réduite de feuilles
décolorées (stade 4) et l'aspect touffu au sommet (stade 5)
étant faiblement représentés.
Les différents niveaux d'altitude (400 à 800m)
et les conditions du milieu (température, pluviométrie, ...)
peuvent aussi en partie expliquer la moindre sévérité de
BBTD dans les zones de production bananière de Maniema. En effet, il
existe une grande variation dans les symptômes de BBTD chez les
différents cultivars de bananiers et plantains, ceci peut aussi
être imputable à des différences génétiques
des bananiers souligne Magee (1953). Le même auteur suggère que,
les bananiers dans leurs phases initiales de récupération,
affichent les symptômes de stries (niveau 1) sur quelques feuilles
seulement et toujours dans une grande partie de la forme réduite de
feuilles (niveaux 4 et 5). La surface du développement de premier
symptôme sur la feuille est variable. Dans certains cas, les premiers
symptômes sont bénins et sont constitués uniquement d'une
légère chlorose marginale. Selon Magee (1948), il n'y a aucun
53
symptôme unique ni un groupe de symptômes, sur
lesquels un diagnostic définitif pourrait
reposer.
3.3.3. Présence du vecteur Pentalonia
nigronervosa sur les touffes de bananiers
La présence du vecteur P. nigronervosa sur
chaque touffe de bananier dans la zone d'étude est
représentée par la figure 23. Les données brutes non
détaillées sont consignées dans le tableau 10 en
annexe.
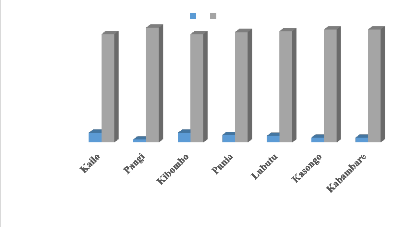
0 1
Territoires
Présence et absence du Puceron (en %)
100,00
80,00
60,00
40,00
20,00
0,00
Figure 23 : Présence ou absence du
vecteur sur chaque touffe de bananiers enquêtés
Légende :
0 : Absence ;
1 : Présence
Au regard des valeurs figurées ci-dessus, il ressort
que le vecteur P. nigronervosa est largement répandu dans les
différents territoires de Maniema ; ce qui correspond à des
valeurs assez élevées, témoignant la présence de
puceron avec une moyenne de 94,44%. Ces valeurs ont différemment
fluctué dans la Province de Maniema dans l'intervalle de 91,85% à
97,41% avec le taux le plus élevé au territoire de Pangi
(97,41%).
Ces valeurs obtenues dans les conditions de moyenne et haute
altitude de la zone de production bananière de Maniema sur la
présence de vecteur P. nigronervosa sont
généralement très élevées et restent
comparables à celles trouvées par Ngama et al., (2014)
dans les régions de basse et moyenne altitude du bassin du Congo. Le
taux élevé de puceron P. nigronervosa pourrait
certainement être dû à la présence de certaines
plantes hôtes de ce puceron, l'altitude et l'importance de la plantation
des bananiers qui, peut donner lieu à un taux élevé de ce
vecteur.
54
Toutefois, ce puceron probablement originaire du Sud-Est
asiatique, est présent dans la plupart des régions du monde
où la culture de bananier est pratiquée. En effet, cette culture
constitue l'hôte principal pour ce puceron qui est aujourd'hui
pantropical, puisqu'il est pratiquement présent sur tous les tropiques
(Mau et al., 1994 et Waterhouse, 1987).
3.3.4. Importance du vecteur Pentalonia
nigronervosa sur les touffes de bananiers (en %)
La figure 24 indique l'importance du vecteur Pentalonia
nigronervosa sur les touffes de bananiers choisies suivant
l'échelle de BBTD (0-5). Les données détaillées
sont présentées en annexe, dans le tableau 11 en annexe.
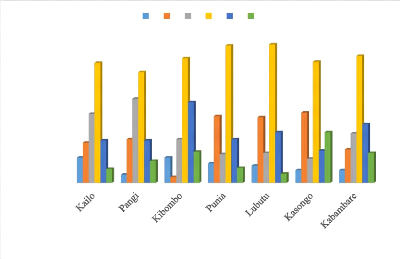
Importance du vecteur (en %)
45,00
40,00
25,00
20,00
35,00
30,00
15,00
10,00
0,00
5,00
0 1 2 3 4 5
Territoires
Figure 24 : Importance du vecteur sur
les touffes choisies suivant l'échelle de cotation de BBTD (0-5)
Légende :
0 : Sans vecteur sur la touffe,
1 : Une colonie simple sans insectes ailés,
2 : Plusieurs colonies simples,
3 : Une grande colonie avec des insectes ailés,
4 : Plusieurs grandes colonies,
5 : Colonies généralisées au niveau des
feuilles et du pseudo-tronc.
La figure 24 indique que toutes les colonies de P.
nigronervosa sont présentes sur les touffes de bananiers à
travers la zone d'étude. Cependant, une grande colonie avec des insectes
ailés est la forme la plus rependue à des taux
élevés dans le milieu d'étude où le taux le plus
élevé est trouvé dans le territoire de Lubutu (44,44%)
suivi de Punia (44,07%), Kabambare (40,74%),
55
Kibombo (40,0%), Kasongo (38,89%), Kailo (38,52%) et Pangi
(35,56%). En moyenne 40,31% représente une grande colonie avec des
insectes ailés dans l'ensemble de lazone d'étude.
Ces valeurs obtenues dans cette zone de moyenne et haute
altitude de Maniema, sont cependant comparables à celles trouvées
par Niyongere dans les zones de grands Lacs (Burundi, Rwanda et R.D. Congo)
où les pucerons aptères dans des colonies simples ont
été plus fréquemment observés (36%) ; tandis que
les individus ailés ont été observés sur une
moyenne de 9% de touffes de bananiers enquêtées. Par contre, ces
valeurs sont moins comparables à celles de Ngama et al. (2014)
où en moyenne, une colonie simple de P. nigronervosa
était la forme la plus représentée (37,8%), suivi de
plusieurs colonies simples sans insectes ailés (28,8%) et une grande
colonie avec des insectes ailés (12,7%).
Le taux relativement moins élevé de certaines
colonies pourrait être attribué à des températures
plus basses et aux altitudes plus élevées. D'autre part, le
manque d'entretien de la culture de bananiers par les agriculteurs et le
couvert végétal dense pourrait également favoriser
l'augmentation de la population du vecteur P. nigronervosa dans les
autres territoires de la Province de Maniema.
3.4. Analyse de différents paramètres
épidémiologiques en fonction de cultivars de bananiers et
plantains dans la zone d'étude.
3.4.1. Corrélation entre les facteurs
(cultivars et champs) et les variables (incidence,
sévérité de BBTD, présence et importance de
vecteur)
Les résultats de la corrélation entre les
facteurs (cultivars et champs) et les variables (incidence,
sévérité de BBTD, présence et importance du
vecteur) dans la zone d'étude sont consignés dans le tableau
6.
56
Tableau 6 : Contribution des facteurs
(cultivars et champs) à la variabilité observée et leur
corrélation avec les variables (incidence, sévérité
de BBTD, présence et importance de vecteur) évaluées
|
Facteurs
Territoires
|
Kailo
|
Pangi
|
Kibombo
|
Punia
|
Lubutu
|
Kasongo
|
Kabambare
|
|
Fa
FI
|
FII
|
FI
|
FII
|
FI
|
FII
|
FI
|
FII
|
FI
|
FII
|
FI
|
FII
|
FI
|
FII
|
|
Valeurs propres
|
2,32
|
1,05
|
1,93
|
1,09
|
2,36
|
1,11
|
2,31
|
0,94
|
2,30
|
0,95
|
2,26
|
0,85
|
2,63
|
0,73
|
|
Variance relative
|
58,05
|
58,05
|
48,31
|
48,31
|
59,00
|
59,00
|
57,76
|
57,76
|
57,45
|
57,45
|
56,39
|
56,39
|
65,77
|
65,77
|
|
Variance cumulée
|
26,19
|
84,24*
|
27,49
|
75,80*
|
27,63
|
86,63*
|
23,57
|
81,33*
|
23,73
|
81,18*
|
21,31
|
77,70*
|
18,31
|
84,08*
|
|
Incidence
|
0,82
|
-0,46
|
0,79
|
-0,44
|
0,77
|
-0,53
|
0,82
|
-0,46
|
0,83
|
-0,42
|
0,83
|
-0,43
|
0,85
|
-0,19
|
|
Sévérité
|
0,80
|
-0,50
|
0,81
|
-0,39
|
0,79
|
-0,50
|
0,82
|
-0,42
|
0,81
|
-0,45
|
0,82
|
-0,35
|
0,88
|
-0,37
|
|
Présence ou absence du vecteur
|
0,72
|
0,52
|
0,58
|
0,57
|
0,72
|
0,59
|
0,74
|
0,43
|
0,73
|
0,43
|
0,71
|
0,33
|
0,65
|
0,75
|
|
Importance du vecteur
|
0,70
|
0,56
|
0,54
|
0,63
|
0,79
|
0,47
|
0,66
|
0,61
|
0,64
|
0,62
|
0,62
|
0,66
|
0,85
|
-0,00
|
Légende :
FI : facteur 1
FII : facteur 2
* : Cumul de deux facteurs (cultivars et champs)
Il ressort du tableau 6 que, les cultivars de bananiers et les
différentes bananeraies ont été extraits avec une variance
moyenne de 81,56% où, de façon positive les cultivars de
bananiers ont influencé à 57,53% l'incidence, la
sévérité de la maladie du sommet touffu, la
présence et l'importance du vecteur (Pentalonia nigronervosa).
Ces valeurs sont illustrées par les graphiques 25, 26, 27, 28, 29, 30 et
31 en bas.
Le genre Musa compte plus de 1000
variétés de bananes parmi lesquelles les cultivars les plus
importants sont les bananes de type dessert (AAA pour la plupart) et les
bananes à cuire (AAA, AAB et AAB) (Dhed'a, 2011). Selon le même
auteur, les variétés AA sont majoritairement rencontrées
à l'Est. Les variétés triploïdes AAA (banane dessert
et à cuire), AAB (plantain et banane à cuire) et AAB (banane
à cuire) sont largement distribuées dans le monde, notamment en
Amérique latine et centrale, aux Caraïbes, en Asie du Sud et du
Sud-Est et en Afrique ajoute Dhed'a (2009). Par ailleurs, Karamura et
al., (2004) rapportent qu'on trouve un grand éventail
57
de variétés de bananier en Afrique centrale dont
certains sont spécifiquement adaptées à ces
différentes régions agro-écologiques et cultivées
pour différents usages. Sur les hauts plateaux à l'Est, les
bananiers à cuire AAA et les bananiers à bière dominent le
paysage et la région est considérée comme un centre de
diversité secondaire des bananiers. D'autres types comme les bananiers
plantains (AAB), les variétés dessert (Gros Michel et Cavendish
AAA), Kahinja et Kivuvu (AAB) et des diploïdes AB sont aussi largement
distribuées. En plus des variétés locales, de nouveaux
cultivars développés par les programmes internationaux
d'amélioration du bananier ont été introduits dans les
différentes zones de production bananière et plusieurs d'entre
eux ont déjà été diffusés auprès des
agriculteurs. Dernièrement, les tendances du marché dans les
zones de production ont amené les agriculteurs à
sélectionner et cultiver seulement des variétés
répondant immédiatement aux besoins des consommateurs. Par
ailleurs, la pression démographique n'a pas permis l'observance des
périodes de jachère ni restauration de la fertilité des
sols. Ces deux phénomènes couplés aux effets
sélectifs des maladies et ravageurs, ont conduit à
l'accroissement de l'érosion génétique de la
diversité de Musa dans les régions productrices (Ngama,
2015).
3.4.2. Influence de facteur cultivars de bananiers et
bananeraies sur la prévalence à la maladie du sommet touffu de
bananier (BBTD)
3.4.2.1. Dans le territoire de Kailo
Le graphique 25 présente l'influence de facteur
cultivars de bananiers et facteur champ sur la sensibilité de bananiers
à la maladie du sommet touffu (BBTD) dans le territoire de Kailo. Tandis
que les valeurs détaillées de cette répartition sont
consignées dans le tableau 19 en annexe.
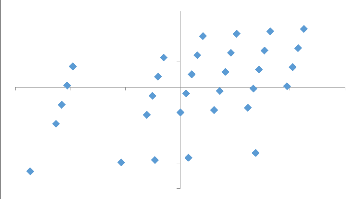
3
FII (26,19%)
2
1
0
-3 -2 -1 0 1 2 3
FI (58,05%)
-4
-1
-2
-3
Figure 25 : Distribution des cultivars dans les
différents groupes par rapport au BBTD
58
De la figure 25, il ressort que les différents
cultivars de bananiers ont plus influencé à 58,05% la
sensibilité à la maladie du sommet touffu de bananiers (BBTD).
Contrairement à l'influence apportée par le facteur champ
(26,19%). De ce fait, une dispersion de points (cultivars) dans les zones
négatives indique la moindre sensibilité de ces cultivars de
bananiers. La zone positive quant à elle comprend les cultivars plus
sensibles à la maladie (BBTD).
3.4.2.2. Dans le territoire de Pangi
L'influence du facteur cultivars de bananiers et facteur
bananeraies sur la sensibilité au BBTD dans le territoire Pangi est
illustrée par le graphique 26. Tandis que les valeurs
détaillées de cette répartition sont consignées
dans le tableau 20 en annexe.
1
0
|
0 1
|
2
|
3
|
|
-1
|
|
|
|
|
-2
|
|
FI (48,31%)
|
|
|
-3
|
|
|
|
|
-4
|
|
|
|
|
-5
|
|
|
|
|
-6
|
|
|
|
|
-7
|
|
|
|
|
-8
|
|
|
|
-4 -3 -2 -1

2
FII (27,50%)
Figure 26 : Distribution spatiale des
cultivars dans les différents groupes par rapport au BBTD
L'analyse de la figure 26 montre que, les cultivars de
bananiers (FI) ont relativement influencé à 48,31% la
sensibilité à la maladie (BBTD), contrairement au facteur
bananeraies (FII), qui à son tour l'a moins influencé (27,50%).
De ce fait, une dispersion de points (cultivars) dans les zones
négatives indique la moindre sensibilité de ces cultivars de
bananiers. La zone positive quant à elle comprend les cultivars plus
sensibles au BBTD.
3.4.2.3 Dans le territoire de Kibombo
L'influence du facteur cultivars de bananiers et facteur
bananeraies sur la sensibilité au BBTD dans le territoire Kibombo est
illustrée par le graphique 27. Tandis que les valeurs
détaillées de cette répartition sont consignées
dans le tableau 21 en annexe.
59
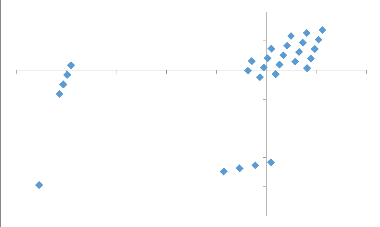
2
FII (27,63 %)
1
0
-5 -4 -3 -2 -1 0 1 2
-1
-2
-3
-4
-5
FI (59,00 %)
Figure 27 : Distribution des cultivars de
bananiers dans les différents champs par rapport au BBTD
L'analyse de la figure 27 montre que, les cultivars de
bananiers (FI) ont plus influencé à 59,0% la sensibilité
à la maladie (BBTD), contrairement aux bananeraies (FII), qui l'a
influencé à 27,63%. Graphiquement, la dispersion des cultivars
dans les zones négatives indique leur moindre sensibilité
à la maladie. Cependant, les zones positives quant à elles
comprennent les cultivars plus sensibles au BBTD.
3.4.2.4. Dans le territoire de Punia
Le graphique 28 présente l'influence de facteur
cultivars de bananiers et facteur champ sur la sensibilité de bananiers
à la maladie du sommet touffu (BBTD) dans le territoire de Punia. Tandis
que les valeurs détaillées de cette répartition sont
consignées dans le tableau 22 en annexe.
BBTD
60
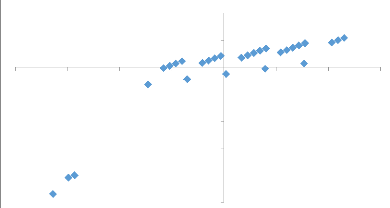
-1
-2
-3
-4
-5
FII (23,57 % )
1
0
-4 -3 -2 -1 0 1 2 3
FI (57,76 %)
2
Figure 28 : Distribution des cultivars dans les
différents champs en fonction de leur prévalence au BBTD
De la figure 28, il ressort que les différents
cultivars de bananiers ont plus influencé à 57,76% la
sensibilité à la maladie du sommet touffu de bananiers (BBTD).
Contrairement au facteur bananeraie (FII), qui l'a moins influencé
à 23,57%. Graphiquement, la dispersion des cultivars dans les zones
négatives indique leur moindre sensibilité à la maladie.
Cependant, les zones positives quant à elles comprennent les cultivars
plus sensibles au BBTD.
3.4.2.5. Dans le territoire de Lubutu
Le graphique 29 présente l'influence de cultivars de
bananiers et bananeraie sur la sensibilité de bananiers à la
maladie du sommet touffu (BBTD) dans le territoire de Lubutu. Les valeurs
détaillées sont consignées dans le tableau 23 en
annexe.
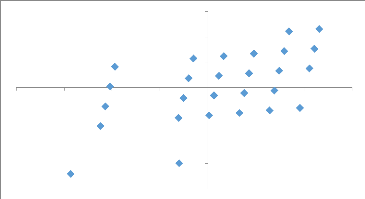
3
FII (23,73 %)
-3
1
0
-4 -3 -2 -1 0 1 2 3
-1
FI (57,45 %)
2
-2
-4
Figure 29 : Distribution spatiale des
cultivars dans les différents champs par rapport au
61
L'analyse de la figure 29, indique que les différents
cultivars de bananiers ont influencé à 57,45% la
sensibilité à la maladie du sommet touffu de bananiers (BBTD).
Contrairement au facteur champ de bananiers (FII), qui l'a moins
influencé à 23,73%.
3.4.2.6. Dans le territoire de Kasongo
Le graphique 30 illustre l'influence de facteur cultivars de
bananiers et facteur champ sur la sensibilité à la maladie (BBTD)
dans le territoire de Kasongo. Les valeurs détaillées sont
consignées dans le tableau 24 en annexe.
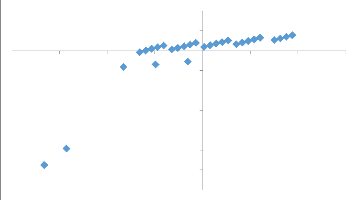
-2
-3
-4
-5
-6
-7
1
0
-4 -3 -2 -1 0 1 2 3
-1
FI (56,39 %)
2
FII (21,31 %)
Figure 30 : Distribution spatiale des cultivars
dans les différents champs par rapport au BBTD
Il ressort du graphique 33 que les deux facteurs ont
différemment influencé la sensibilité de la maladie (BBTD)
dans le territoire de Kasongo. Les cultivars de bananiers ont plus
influencé l'infection à 56,39%. Quant au facteur champ de
bananier, son influence était moyennement faible dans l'ordre de
21,31%.
3.4.2.7. Dans le territoire de Kabambare
Le graphique 31 illustre l'influence de différents
cultivars de bananiers en fonction de leur sensibilité au BBTD. Tandis
que les valeurs détaillées de cette répartition sont
consignées dans le tableau 25 en annexe.
62

FII (18,31 %)
0
2
1
-5 -4 -3 -2 -1 0 1 2
-1
FI (65,77 %)
-2
-3
-4
-5
-6
-7
Figure 31 : Influence de différents
cultivars de bananiers en fonction de leur sensibilité au BBTD.
L'analyse de la figure 31 renseigne que les cultivars de
bananiers ont plus influencé à 65,77% la sensibilité
à la maladie du sommet touffu de bananiers (BBTD). Le facteur champ
(FII) quant à son tour l'a moins influencé à 18,31%.
3.5. Répartition des cultivars de bananiers dans
les différents groupes en fonction de leur sensibilité au BBTD
dans les différents territoires de Maniema
Le regroupement de différents cultivars de bananiers en
fonction de leur sensibilité à la maladie du sommet touffu du
bananier (BBTD) est présenté dans le tableau 7 et la repartition
detaillée par groupe de sensibilité suivant la méthode
Cluster (STATGRAPHICS-CENTURION-XVI) se trouve dans les tableaux 12, 13, 14,
15, 16, 17 et 18 en annexe.
63
Tableau 7 : Différents groupes de
cultivars de bananiers en fonction de leur sensibilité au BBTD dans les
territoires de Maniema.
|
Groupes
|
Nombre
|
Fréquence
|
|
Moyenne
|
|
|
Incidence de BBTD
|
Sévérité de BBTD
|
Présence ou absence du vecteur
|
Importance du vecteur
|
|
G1/Kailo
|
42
|
15,61
|
0,00
|
0,00
|
1,00
|
3,00
|
|
G2/Kailo
|
205
|
76,21
|
1,00
|
3,00
|
1,00
|
3,00
|
|
G3/Kailo
|
22
|
8,18
|
0,27
|
0,73
|
0,00
|
0,00
|
|
G1/Pangi
|
232
|
85,93
|
1,00
|
3,00
|
1,00
|
3,00
|
|
G2/Pangi
|
31
|
11,48
|
0,00
|
0,00
|
1,00
|
3,00
|
|
G3/Pangi
|
7
|
2,59
|
0,43
|
0,57
|
0,00
|
0,00
|
|
G1/Kibombo
|
22
|
8,15
|
0,29
|
1,40
|
0,00
|
0,00
|
|
G2/Kibombo
|
23
|
8,52
|
0,00
|
0,00
|
1,00
|
3,00
|
|
G3/Kibombo
|
130
|
48,15
|
1,00
|
3,00
|
1,00
|
3,00
|
|
G4/Kibombo
|
95
|
35,13
|
1,00
|
3,00
|
1,00
|
4,00
|
|
G1/Punia
|
17
|
6,30
|
0,12
|
1,00
|
0,00
|
0,00
|
|
G2/Punia
|
212
|
78,52
|
1,00
|
3,00
|
1,00
|
3,00
|
|
G3/Punia
|
41
|
15,19
|
0,00
|
0,00
|
1,00
|
3,00
|
|
G1/Lubutu
|
214
|
79,26
|
1,00
|
3,00
|
1,00
|
3,00
|
|
G2/Lubutu
|
41
|
15,19
|
0,00
|
0,00
|
1,00
|
3,00
|
|
G3/Lubutu
|
15
|
5,56
|
0,07
|
0,13
|
0,00
|
0,00
|
|
G1/Kasongo
|
11
|
4,07
|
0,09
|
1,00
|
0,00
|
0,00
|
|
G2/Kasongo
|
81
|
30
|
1,00
|
4,00
|
1,00
|
4,00
|
|
G3/Kasongo
|
150
|
55,56
|
1,00
|
3,00
|
1,00
|
2,00
|
|
G4/Kasongo
|
28
|
10,37
|
0,00
|
0,00
|
1,00
|
3,00
|
|
G1/Kabambare
|
220
|
81,48
|
1,00
|
3,00
|
1,00
|
3,00
|
|
G2/Kabambare
|
39
|
14,44
|
0,00
|
0,00
|
1,00
|
2,00
|
|
G3/Kabambare
|
11
|
4,07
|
0,00
|
0,00
|
0,00
|
0,00
|
Légende:
G: Groupe
BBTD: Banana Bunchy Top Disease
Il ressort du tableau 7 que, les analyses factorielles
multivariées ont classé dans chaque territoire de Maniema, les
différents groupes cultivars de bananiers sensibles et moins sensibles
à la maladie de Banana Bunchy Top Disease. Les groupes constitués
des cultivars moins sensibles se caractérisent par l'absence des
symptômes (incidence et sévérité nulle) mais,
généralement
64
avec présence et importance du vecteur (Pentalonia
nigronervosa) du niveau 2 (Plusieurs grandes colonies) et niveau 3 (une
grande colonie avec des insectes ailés) de l'échelle de cotation
de puceron dans tous les territoires de Maniema.
De ce fait, les analyse en rapport avec les groupes des
bananiers selon leur sensibilité au BBTD ressortent que ; dans le
territoire de Kailo, les bananiers moins sensibles au BBTD sont classés
dans le groupe I selon la méthode de Cluster où, le type AAA
(bananes) représente 35,71% contre 64,28 % de plantains (AAB). Dans le
territoire de Pangi, il sied de signaler que les bananiers moins sensibles
à la maladie sont classés dans le groupe II où la
majorité de cultivars (90,32%) sont des plantains (AAB) contre 9,67% de
bananes (AAA). A Kibombo par contre, nous trouvons les cultivars de bananiers
moins sensibles au BBTD dans le groupe II où les bananes (AAA)
représentent 26,08 %, contre 73,91 % de plantains (AAB). Cependant, il
est indiqué qu'à Punia, les bananiers moins sensibles à la
maladie sont signalés dans le groupe III où le type AAA (bananes)
représente 24,39%, contre 75,60% de plantains (AAB). Il a
été demontré également qu'à Lubutu les
cultivars moins sensibiles au BBTD sont consignés dans le groupe II
où les bananes (AAA) représentent 21,95%, contre 78,04% de
plantains (AAB). A Kasongo, les cultivars de bananiers moins sensibles à
la maladie se trouvent classés dans le groupe IV où les bananiers
du type AAA (bananes) représentent 28,57%, contre 71,42% de plantains
(AAB). Par conséquent, à Kabambare les cultivars de bananiers
moins sensibles sont classés dans le groupe II et III. Dans ces deux
groupes 66% sont des plantains (AAB) et 34% représente les bananes
(AAA).
En moyenne générale sur l'ensemble des
territoires de la Province de Maniema, il se révèle que les
bananiers moins sensibles sont du génotype AAB (plantains) avec
(74,22%), contre (25,76%) du type AAA (bananes).
En effet, cette disproportion fréquentille de plantains
(AAB) par rapport aux bananes (AAA) est due par le faite que, la
majorité de bananiers inspectés dans les champs et en jardins de
cases des agriculteurs étaient des plantains.
En Afrique centrale et de l'ouest, environ 120
variétés des plantains sont connues contre seulement 10 en
Afrique du Sud-est. En Afrique de l'Est environ 70 variétés sont
répertoriées. En Asie du Sud-Est, plus de 1000
variétés de bananiers sauvages et cultivés sont
inventoriées. Cependant, Reynolds (1927) et Kervégant (1935),
postulent que l'introduction de bananiers et plantains en Afrique de l'Est a
été faite par les Arabes. La Province de Maniema étant le
berceau de la communauté Arabe musulmane qui, considéraient la
banane comme une plante sacrée du Coran, il est fort possible que la
grande majorité des types de bananiers et plantains cultivés
65
soient trouvés et utilisés dans cette Province
avec des dénominations variables selon les zones de production et les
dialectes. Ainsi, la situation de la variabilité des bananiers plantains
et dessert s'avère-t-elle très complexe rappellent Dhed'a et
al., (2011).
Cependant, la production de ces cultivars de bananiers est
limitée par les contraintes biotiques et abiotiques. Les
problèmes phytosanitaires les plus couramment rencontrés sont les
charançons noirs, le Bunchy Top de bananier et la Cercosporiose.
L'exposition de bananeraies (au vent, pluie, soleil) influence la distribution
spatiale de la maladie BBTD (Lepoivre, 2003). La proportion des individus
infectés d'une variété varie grandement suivant la
dynamique de transmission du virus, dynamique influencée par des
facteurs comme la densité d'individus susceptibles, la saison de
l'année, la pression infectieuse du virus, et des pucerons
infectés (Smith et al., 1998). Dans les régions de
production bananière, le mouvement de la maladie est surtout
facilité par les hommes et les pucerons noirs du bananier Pentalonia
nigronervosa qui peuvent être apportés par des vols
accompagnés, par les hommes et les fourmis (Thomas et Dietzgen, 1991).
Selon les mêmes auteurs toujours ; les facteurs environnementaux jouent
nécessairement aussi un rôle déterminant dans la dynamique
de la maladie du sommet touffu de bananiers. L'intensification et la
propagation de la maladie sont liées au vol aléatoire du vecteur
qui est influencé par les changements saisonniers et la
température de l'air.
66
CONCLUSION ET SUGGESTIONS
Cette recherche sur la distribution spatiale de la maladie du
sommet touffu de bananiers dans les différentes zones de production
bananière de Maniema s'est fixée l'objectif principal de mettre
en évidence la distribution spatiale des contraintes biologiques de la
culture de bananiers liées au BBTD dans les différentes zones de
production bananière en Province de Maniema, afin d'envisager le
contrôle de cette virose qui, contribuerait à la baisse de la
production bananière et à la disparition de ressources
génétiques bananières dans la Province de Maniema et ses
environs.
Partant de questions études, nous nous sommes servi
d'un total de 1890 touffes de bananiers et plantains analysés dans 63
champs, à raison de 3 champs par village et 3 villages par territoire
dans l'ensemble de la Province.
Les conditions culturales (source de matériels de
plantation, âge de la bananeraie et le système cultural) aussi
bien que les connaissances relatives au BBTD (identification des
symptômes par les agriculteurs, origine probable de BBTD dans la zone
d'étude, dispersion de BBTD dans la région et connaissance du
mode de transmission de BBTD par l'agriculteur) ont été
analysées.
De cette étude, les résultats obtenus ont
montré que :
La maladie du sommet touffu de bananiers est largement
rependue à travers toute la zone de production bananière de la
Province de Maniema ;
Les conditions culturales varient relativement en fonction de
territoires de cette Province où 100% de bananiers sont cultivés
en association avec le riz, le manioc, le maïs ou autres culture ; 95,24%
des agriculteurs utilisent des rejets en provenance des champs des voisins. En
moyenne 42,86% des bananeraies sont âgées de plus de 10 ans,
38,10% de bananeraies sont agés de 5-7 ans et 8,33 bananeraies sont
agés de moins 3 ans.
L'incidence de la maladie a été très
élevée dans tous les territoires et a varié de 78,52% dans
le territoire de Kailo à 88,15% dans le territoire de Kibombo avec une
moyenne de 82,85% d'incidence sur toute l'étendue de la Province de
Maniema.
Quant à la sévérité de BBTD
partant de l'échelle de cotation (0 à 5), les différents
niveaux de symptômes sont présents sur la majorité de
bananiers dans les territoires de Maniema. La décoloration des feuilles
avec taille normale (niveau 3) est plus remarquable et plus
élevée avec une moyenne de 31,90% sur les bananiers ;
67
La présence du vecteur sur les touffes des bananiers a
été en moyenne de 94,44% et avec une importance moyenne de 40,31%
de grande colonie avec des insectes ailés dans l'ensemble de la zone
d'étude ;
Les cultivars de bananiers et champs de bananiers contribuent
significativement à la variation de la maladie de BBTD dans cette zone
d'étude, avec une moyenne de 81,56% où les cultivars de bananiers
ont en moyenne influencé à 57,53% l'incidence, la
sévérité de BBTD, la présence et l'importance du
vecteur Pentalonia nigronervosa ;
A partir des analyses factorielles multivariées, il a
été classé dans chaque territoire de Maniema, les
différents groupes de cultivars de bananiers sensibles et moins
sensibles à la maladie BBTD où, les groupes constitués des
cultivars moins sensibles se caractérisent par l'absence des
symptômes (incidence et sévérité nulle) mais,
généralement avec présence et importance du vecteur
(Pentalonia nigronervosa) du niveau 2 et 3 de l'échelle de
cotation de puceron dans tous les territoires de Maniema.
La majorité des bananiers et plantains dans les
différents territoires sont affectés par le BBTD tandis que,
certains parmi eux sont asymptomatiques ou moins sensibles. En
général, les bananiers moins sensibles sont du génotype
AAB (plantains) avec 74,22% de moyenne, contre 25,76% du type AAA (bananes) sur
l'ensemble de cette Province.
De l'ensemble de ces résultats, il ressort que le BBTD
est largement rependu dans la zone de production bananière de Maniema
mais encore avec une faible sévérité dans la plupart des
territoires prospectés. Ceci indique qu'une bonne sensibilisation des
agriculteurs en matière de la gestion de la maladie du sommet touffu de
bananiers, l'éradication de touffes de bananiers infectés de
BBTV, l'utilisation des matériels de plantation sains, l'adoption de
bonnes pratiques culturales visant à contrôler la population de
puceron Pentalonia nigronervosa sont des facteurs déterminants
pour une gestion durable de cette maladie. En outre, la mise en quarantaine de
matériels de plantation provenant des zones infectées vers des
zones non encore touchées peuvent contribuer à empêcher la
propagation de BBTD vers les autres zones non encore touchées.
68
REFERENCES BIBLIOGRAPHIQUES
ABADIE, C., ZAPATER, M.F., PIGNOLET, L., CARLIER, J.,
MOURICHON, X. 2003. Artificial inoculation on plants and banana leaf pieces
with Mycosphaerella spp., responsible for Sigatoka leaf spot disease.
Fruits 63, 319-323.
ADHEKA GIRIA J., 2014. Contribution to the characterization
and classification of the Congo basin African plantains (Musa AAB) in the
Democratic Republic of Congo. PhD thesis, Department of Biotechnological
Sciences, Faculty of Sciences, University of Kisangani, DRC, 119 p.
ALISTAIR SMITH, 2010. La Saga de la banane, éditions
Charles Léopold Mayer, Août.
ALLEN. R. N., 1987. Further studies on epidemiological factors
influencing control of Banana bunchy top disease and evaluation of control
measures by computer simulation. Australian journal of agricultural research 38
: 373 - 382.
ANACLET NIBASUMBA, 2013. Evaluation agronomique de
l'association Bananiers-Caféiers : Application au Burundi, thèse
de doctorat, Louvain-la-Neuve, juin, Université Catholique de
Louvain.
BAKELENA, K., et MANKANGIDILA, K., 1996 : La production
bananière au Zaïre, Info-musa, vol 5, N° 2. pp. 20-22.
BAUDOUIN J. P., DEMOL J., LOUANT B. P., MARECHAL R., MERGEAI
G., et OTOUL E., 2002. Amélioration des plantes. Application aux
principales espèces cultivées en régions tropicales. Les
presses agronomiques de Gembloux. 252p.
BIOVERSITY-CIALCA,2008. Final report phase I. Available online
[`
http://www.cialca.org/files/CIALCAI_fnal_technical_report.pdf.'].
BONTE E., VERDONCK R., GREGOIRE L.,1995. La multiplication
rapide du bananier et du plantain au Cameroun. Tropicultura,
p109-116.
BOUWMEESTER, H. VAN ASTEN, P. OUMA, E. 2009. Mapping key
variables of banana based cropping systems in the Great Lakes Region Partial
out comes of the baseline and diagnostic surveys. Technical report 11,
CIALCA-IITA 42p.
BOYER J., TEMPLE L., SCUTT R., 2014. Etude de cas : la
technique Minisett en Haïti, une innovation co-construite entre chercheurs
et producteurs dans le respect des
69
conditions locales et des enjeux agro-écologiques.
Field Actions Science Reports, Special Issue 9.
http://factsreports.revues.org/2779
BRENDA B. L., PERFECTO, I. VANDERMEER, J. 2008. Synergies
between agricultural intensification and climate Change Could Create surprising
vulnerabilities for crops. BioScience 58 (9) :847-854.
BRUN, J., 1994. Etude préliminaire sur l'utilisation
des variétés de bananiers resistantes dans la lutte contre la
cercosporiose. Fruits 17 (3) : 113-119.
BUYCKX, E. J. E. 1962. Précis des maladies et insectes
nuisibles rencontrés sur les bananiers. CAMARA A., DUGUE P., KALMS J.M.,
SOULARD C.T., 2010. Systèmes de culture,
habitudes alimentaires et durabilité des
agrosystèmes forestiers en Afrique,
Montpellier, France.
CARLIER, J., D. De WAELE, and J.-V. ESCALANT. 2002. Global
evaluation of Musa gerplasm for resistance to Fusarium wilt,
Mycosphaerella leaf spot diseases and nematodes. INIBAP
TechnicalGuidelines. InternationalNetwork for the Improvement of Banana and
Plantain, Montpellier, France.
CARUANA M. L., 2003. Analyse du risque phytosanitaire (ARP).
Bananiers. Banana Bunchy Top babuvivus. CIRAD. P31.
CARUANA M.-L., 2007. Molecular characterization of banana
streak acuminata Vietnam virus isolated from Musa acuminata Siamea
(banana cultivar). Archives of Virology, 152, 1409-1416
CHAMPION J., 1963. Le bananier G-P Laisonneux et Larousse,
Paris, 263p.
CHAUVIN C., 2015. Influence de l'utilisation de plantes de
services sur les communautés de nématodes et les fonctions du sol
dans un agroécosystème bananier en phase d'interculture.
Thèse de doctorat, Ecosystèmes et sciences agronomiques,
Université de Montpellier, Montpellier, France, 287 p.
CIRAD et IT2, 2001. Note technique. Cercosporiose :
Assainissement mécanique. 2 p. Disponible sur :
http://cultures-tropicales.ecophytopic.fr
(consulté le 12/11/2021)
CIRAD-GRET, 2002. Mémento de l'agronome
Ministère français des affaires étrangères, Centre
de coopération internationale en recherche agronomique pour le
développement (CIRAD), Groupe de recherche et d'échanges
technologique (GRET) 1700p.
70
CIRAD-GRET, 2011. Mémento de l'agronomie. Ministère
des affaires étrangères, Paris, pp960- 974.
CORNACK, B. P., D. W. RAGSDALE, AND R. C. VENETTE. 2004.
Demography of soybean aphid (Homoptera: Aphididae) at summer
temperatures. J. Econ. Entomol. 97 : 854Ð861.
CTCPM, 2002. Mineralogie de la RDC et son Histoire, Archive :
Cellule Technique de Coopération et de plannification Minière
(ctcpm.minimnes@ic.cd, consulté le 27/05/2022)
DAMOUR G., DOREL M., TRAN QUOC H., MEYNARD C., RISEDE J.M.,
2014. A trait-based characterization of cover plants to assess their potential
to provide a set of ecological services in banana cropping systems. Eur. J.
Agron., 52, 218228
DAN KEPPEL, 2008. Banana, Hudson Stress Press, p44
DAVIES G. 1995. Banana and plantain in the East African
highlands in Banana
DE LAPEYRE DE BELLAIRE L., 2015. Comprendre les effets des
pratiques culturales sur le fonctionnement des agrosystèmes : une
étape vers la protection intégrée des cultures. Le cas des
maladies fongiques des bananiers. HDR, Sibaghe, Université Montpellier
2, Montpellier, France, 109 p. Editions Quae, Versailles, 260 p.
DHED'A, D., SWENNEN, R., MOANGO, M. ET BLOME, G., 2009.
Enquête diagnostique sur la culture des bananiers et bananiers plantains
dans les zones périphériques de la ville de Kisangani et quelques
villages du district de la Tshopo (RDC), Rapport N° ZRD008MP056, Fac.Sc.,
UNIKIS, 101p.
DHED'A, D., MOANGO, M. ET SWENNEN, R., 2011. La culture des
bananiers et bananiers plantains en République Démocratique du
Congo, Support didactique, Saint Paul, Kinshasa, 85p.
FAO, 2010. Prévention et gestion de la maladie de
Bunchy Top du bananier en Afrique centrale ; Projet d'appui au Gabon et
Cameroun.
FAO., 2010. Enquête sur les maladies des bananiers :
BBTD et Bxw en Province du Nord Kivu. P26.
FAO, 2012. Système d'alerte précoce, surveillance
de la sécurité alimentaire
71
FAO, 2018. Prévention et gestion de la maladie du Bunchy
Top du bananier en Afrique Centrale, éd. Rome, Italy 36p.
FAOSTAT, 2009. Food and agricultural commodities by country. FAO,
Rome. Availabe online [`http: //
www.faostat.fao.org/site/339/default.aspx.
FAOSTAT. 2012. Food and agriculture Organization of the United
Nations.
FAURE G., CHIFFOLEAU Y., GOULET F., TEMPLE L., TOUZARD J.M.,
2018. Innovation
et development dans les systèmes agricoles et
alimentaires.
FREDON, 2009. Fiches "Ravageurs de la banane" et "maladies de
la banane". 6p
FRISON, E., SHARROCK, S., 1999. The economic, social and
nutritional importance of banana in the world. In: Picq C., Fouré E.,
Frison E.A. (Eds.), Bananas and Food Security. Proceedings of the International
Symposium, Cameroon, 1014 Nov 1998. The International Network for the
Improvement of Banana and Plantain, Montpellier, pp 21- 35.
GANRY, J., FOURÉ, E., DE LAPEYRE DE BELLAIRE, L. AND
LESCOT, T., 2012. An integrated approach to control the Black leaf streak
disease (BLSD) of bananas, while reducing fungicide use and environmental
impact. In Dhanasekaran, D. Thajuddin, N. Panneerselvam, A. Fungicides for
Plant and Animal Diseases, pp. 193-226.
GOLD, C.S. ET MESSIEAEN, S., 2000. Charançon du
bananier Cosmopolites Sordidus. Parasites et ravageurs de Musa. Infomusa 6 (2)
: 19-21.
HAÏCOUR, R., TRANG, V.B., DHED'A, D., ASSANI, A. et
CÔTE, F.X.1997. La sécurité alimentaire : perspective
d'amélioration des bananiers par voie biotechnologique. Cahiers
Agricultures; 7: 468-75.
HANSEN J. D., HARA A. H. and TENBRINK V. L., 1992.
Insecticidal dips fordisinfesting
commercial tropical cut flowers and foliage. Trop.Pest. Manag.
38: 245 - 249. HATA T. Y. and HARA. A. H., 1992. Evolutions of insecticides
against pests of redginger in
Hawaii. Trop. Pest Management. 38: 234 - 236.
HILL D. S., 1983.Agricultural insects and pests of the tropics
and their control. Cambridge university press.2nd Edition, 203p.
HU, J.M., FU, H.C., LIN, C.H., SU, H.J. and YEH, H.H., 2007.
Reassortment and concerted evolution in Banana bunchy top virus
genomes. The Journal of Virology 81, pp1746-1761.
72
IAC, 2020. Puceron du bananier, Institut
Néo-Calédonien ; (htt/
www.iac.nc) ISF et CTA, 2011. Production
améliorée du bananier plantain.
ISRAELI, Y. PLAUT, Z. SCHWARTZ, A. 1995. Effect of shade on
banana morphology,
growth and production. Scientia Horticulturae 62:
pp45-56.
JENNY, CH., CARREEL, F., TOMEKPE, K., PERRIER, X., DUBOIS,
C., 1999. Diversité génétique des plantes
tropicales cultivées, ed. P. Hamon, M. Seguin, X. Perrier, J. C.
Glaszmann. p. 113-139. Repères. Montpellier: CIRAD
JENUWEIN, H., 1988. Avocado, Banana, Coffee. How to grow useful
exotic plants for fun. British Museum Natural History.
JONES D., 2000. Diseases of banana, abacá and enset.
CAB International, Wallingford, Oxon, UK.
JOSETTE A., SOUZANNE A., HERVE L., 2001. Principe de virologie
végétale : pouvoir pathogène, écologie des virus.
INRA. Editions, 408 p.
JULIE VAN DAMME, 2013. Analyse systémique des processus
d'innovation dans les systèmes agraires de la region des grands lacs
basés sur la culture de la banane, thèse, Université
Catholique de Louvain, Faculté d'ingénierie biologique,
Agronomique et environnementale, availabe at :
http://hdl.handle.net/2078.1/127405.
KAGY V. 1999. Importance alimentaire, socio-économique
et culturelle de la banana dans la société Kanak
Nouvelle-Calédonie. In C. Picq, E. Fouré et E.A. Frison,
eds. Bananas and foodsecurity/ Les productions bananières : un enjeu
économique majeur pour la sécurité alimentaire. Proceeding
of an international Symposium held in Douala, Cameroon.INIBAP, Montpellier. pp
437-443
KAGY VALERIE, MILLE CHRISTIAN, MADEMBA-SY FRANCOIS, 2000. Le
puceron du bananier Pentalonia nigronervosa Coquerel (Homoptera
Aphididae), l'insecte vecteur de la maladie virale du Bunchy Top. Paita :
Institut Agronomique Néocalédonie, 2p (
Https://agritrop.cirad.fr/478562/).
KALLOW, S. DAVIES, R., BIN MOHAD NORDIN A. R., DICKIE, J.,
2021. Regulation of seed germination by diurnally alternating temperatures in
the distrurbance-
73
adapated banana crop wild relatives (Musa accuminata) Seed Sci
Doi.org/10.1017/SO
960258520000471
KAPER J. B., NATARO J.P. and MOBLEY H. L. T., 2004. Pathogenic
Escherichia Cli. Nature Reviews Microbiology 2 : 123-140.
KARAMURA, E.B., TURYAGYENDA, F.L., TINZAARA, W., BLOMME, G.,
SSEKIWOKO, F., Eden-GREEN, S., MOLINA, S. ET MARKHAM, R. 1999. Xanthomonas wilt
of bananas in East and Central Africa. Diagnostic and Management Guide.
Bioversity International, Uganda. 60p.
KERVEGANT, D., 1935. Le bananier et son exploitation.
Société d'Editions Géographiques, Maritimes et Coloniales,
Paris, p578.
LAHAV, E. 1995: Banana nutrition in Banana and plantains.
INIBAP, Chapman. LASSOUDIERE A., 2010. L'histoire du bananier. Editions Quae.
351p.
LASSOUDIERE A., 2012. Le bananier : Un siècle
d'innovations techniques. Editions Quae. 352p.
LASSOUDIERE, A, 2007. Le bananier et sa culture, Edition Quae
Rd 10, 778026, Versailles, Cedex, France, 384 p.
LEPOIVRE P., 2003. Phytopathologie, éditions De
Boeck, 427 p.
LESCOT, 2013. Evaluation agronomique des hybrides de bananiers
CIRAD : FLHORBAN 916, 918, 920 et 924. 5p
MAGEE C.J.P., 1953. Some aspects of the bunchy top disease of
banana and other Musa spp. Journal and Proceedings of the Royal Society of New
South Wales, 87, 3-18.
MAGEE, C.J., 1948. Transmission of bunchy top to banana
varieties. The Journal of the Australian Institute of Agricultural Science
14, 18-24.
MAGEE, C.J.P. 1927. Investigation on the bunchy top disease of
the banana. Commonwealth of Australia Council for ScientiÞc and
Industrial Research, Melbourne, MAKONDAMBUTA E., 1997. Les types de climat.
Congoneline. Afriqu'Info asbl, Bruxelles,
Belgique.
MAU RFL, KESSING J.L.M, TEMBRICK and HARA A.H., 1994.
Pentalonia nigronervosa University of Hawaii.30
MAYEKI JEAN-PAUL, 2010. Influence de la composition des substrats
sur le sevrage des vitro-plants des plantains (Musa spp), revue scientifique
science Sud, n°3
74
MEUNIER, Q., LASSOIS, L., DOUCET, J-L., 2011. Guide de
plantation et de conduite d'une bananeraie agroforestière en milieu
rural au Gabon.
MIRKO K. HARDING M.R, DALE J.L. 1997. Banana bunchy virus DNA.
Queenshand, Australie. P17.
MOÏSE KWA, 2019. Fiche technique ; techniques horticoles
de production de masse de plants de bananiers, (PIF) CARBAP, njombé,
cameroun, 4p.
MRAC, 2011 : Maniema. « Espace et vies » sous la
direction de J. Omasombo Tshonda, Edition Buku / Le Cri /New York,
pp493-508.
NDJANGO NDJIMANI E., 2021. Potentialités
nutritionnelles, antioxydants et antimicrobienne de la poudre des pulpes des
fruits de calcutta 4 (Musa accuminata ssp.
Burmanicoïdes), un bananier sauvage acclimaté dans la
region deYangambi, Province de la Tshopo (RDC) ; thèse inédit
/UNIKIS/FGRNR.
NGAMA B.J.F., 2010. Etude diagnostique de banana Bunchy
top disease (BBTD) dans la région forestière du bassin du
Congo en district de la Tshopo dans la province orientale en RDC.
Mémoire de DES, inédit IFA Yangambi.
NGAMA B.J.F., IBANDA N.B., KOMOY L.J., LEBISABO B.C., MUHINDO
S.H., WALUNKONKA B.F., WEMBONYAMA LO.J., DHED'A D.B., LEPOINT P., SIVIRIHAUMA
C., And BLOMME.G., 2014. Assessing incidence, development and distribution of
banana bunchy top disease across the main plantain and banana growing regions
of the Democratic Republic of Congo. African Journal of Agriculture Research.
Vol.9 (34). pp.2611-2623.
http://www.academicjournals.org/AJAR
NGAMA B.J.F., 2015. Distribution et
épidémiologie de la maladie virale du sommet touffu de bananier
(BBTD) dans le bassin du Congo en Province Orientale (R.D. Congo).
Thèse, Inédit, UNIKIS. P.64.
NGAMA B.J.F., BENOÎT DHED'A DJAILO, JUNIOR LOKANA,
BONAVENTURE IBANDA NKOSI and GUY BLOMME, 2016. Systemicity of banana bunchy top
viral infection in the Kisangani region of the Democratic Republic of Congo.
African Journal of Agriculture Research. Vol. 11 (7). pp. 527532,
http://www.academicjournals.org/AJAR
75
NYABYENDA. P. 2006. Les plantes cultivées en
régions tropicales d'altitude d'Afrique. Cultures industrielle et
exploitation, cultures fruitières, cultures maraîchères.
Les presses Agronomiques de Gemboux. 238p.
ONAUTSHU O., 2013. Caractérisation des populations de
Mycosphaerella fijiensis et épidemiologie de la cercosporiose noire du
bananier dans la région de Kisangani (RDC). Université catholique
de Louvain, 309p.
PADMALATHA C. RANJISINGH A.J.A, 2002. Tropical Ecology (IND), 39
(2), P239242.
PADMALATHA, C., and A.J.A. RANJIT SINGH. 2002. Life table and
survivorship curve of Pentalonia nigronervosa Coq. (Homoptera:
Aphididae). J. Appl. Zool. Res. 13: 156Ð 159.
PAPRBIO, 1999. Plans d'action Provinciaux de la
Biodiversité (Appendice du plan d'action national), Ministère des
Affaires foncières, environnement, conservation de la nature,
pêche et forêts, RDC.
RENNES, 2006. Structural change in agri-food chains: new
relations between farm sector, food industry and retail sector, p27-28,
octobre, France.
REYNOLDS, P.K., 2005. The banana. Its history, cultivation and
place among staple foods.
The Riverside Press, Cambridge. p.181.
SHADARI et NGAMA, 2022. Evaluation du pouvoir rejetonnant de
bananier (Busamunyo) et Plantains (Kebobo et Mbudi) en macropropagation par la
méthode PIF à Kindu, R.D. Congo, Article scientifique, JECET,
Février, Sec. A ; Vol.11. N°1, 116-124 Avalaible online at
www.jecet.org
SHADARI S., MWEMEDE S. C., SOSTHENE K., et MUBWANA C., 2021.
Analyse de l'incidence et sévérité de la maladie du sommet
touffu (BBTD) de bananiers cultivés en cases dans la ville de Kindu et
ses interlands, Article scientifique, JECET, Septembre, Sec. A; Vol.10.
N°4, 611-622 Avalaible online at
www.jecet.org
STARY P., STECHMANN D.H, 1990. Ephedruscerasicolastary (Hym.,
Aphididae), a new bio central agent of the banana aphid,
Pentalonianigronervosacoq (Honnology, 109 (5): 457462.4 pp
SWENNEN R et VUYLSTEKE D., 2001. Bananier. In: Raemarkers, H.R
(éd.) Agriculture en Afrique Tropicale. DGCI, Bruxelles, 611-636.
76
TEZENAS DE MONTCEL, H., 1985. Le bananier plantain. Le
technitien d'agriculture tropical. Maisonneuve et Larose. 143p.
THOMAS J.E. ISKARA, M.L. CARUANA, Bunchy Top; In JONES D.R
1991. Disease of banana, Abaca and Ensete. London, CABI, Tropical Pest
Management, pp36-37: 249257.
THOMAS J.E., 1994. La maladie du Bunchy Top du bananier.
Maladie Musa, Fiche technique n°4-INIBAP.
TIXIER P., VINATIER F., CABRERA CABRERA J., PADILLA CUBAS A.,
OKOLLE J., CHABRIER C., GUILLON M., 2010. Lutte intégrée contre
le charançon noir dans les systèmes de culture bananière.
From science to field, Guide n°3, 8 p.
TSAI, J. H., AND J.-J. WANG. 2001. Effects of host plants on
biology and life table parameters: of Aphis spiraecola (Homoptera:
Aphididae). Environ. Entomol. 30: 44Ð50. University of Arizona Center
for Insect Science Education
VADENPUT, 1981. Les principales cultures en Afrique Centrale.
Presse de l'imprimerie Lesafre, B7500, Belgique.
VALERIE K, MILLE C, MADEMBA -SY, 2000. Le puceron du bananier
Pentalonia
VAN REGENT MORTEL M.H.V. FAUQUET C.M. BISHO D.H.L., CARSTENS
E. B, ESTES M.K., LEMON S.M. MANILOFF J. MAYO M.A. Mc GEOCH D.J. PRINGLE C.R.
WICKNER R.B., 2000. Virus Taxonomy: san Diego. San Francisco, New york, Boston,
London, Sydney and Tokyo, Academic Press.
VANGU G.H., 2007. Développer une stratégie du
secteur Banane et Banane plantain pour améliorer la
sécurité alimentaire et les revenus agricoles. Atelier
organisé par Bioversity et INERA, Kinshasa 12 juin 2007.
VERHEIJ, E.W.M., CORONEL, R.E., 1991. Plant resources of
South-East Asia vol. 2 Edible fruits and nuts. Pudoc Wageningen.
VÖLK W, STECHMANN D.H. et STARY P, 1990. Suitability of
five species of the banana aphid Pentalonia nigronervosa coq (Homoptere,
Aphididae) in the south pacific.
WARDLAW C.W., 1961. The Virus Diseases: Bunchy Top. Banana
Diseases, Including
Plantains and Abaca, pp. 68-115. London, UK: Longman.
WATERHOUSE, D. F., 1987. Nigronervosa Pentalonia
Coquerel. pp42-49. Waterhouse & DF Norris KR, Ed. InkataPress:
Melbourne. 454 p.
77
WONG, J. J., and J. H. TSAI. 2002. Development, survival and
reproduction of black citrus aphid, Toxoptera aurantii (Hemiptera:
Aphididae), as a function of temperature. Br. Entomol. Res. 91:
477Ð487.
ZIMMERMAN, E. C. 1948. Insects of Hawaii: a manual of the
insectsof theHawaiianIslands, including anenumerationof the species and notes
on their origin, distribution, hosts, parasites, etc. University of Hawaii
Press, Honolulu, HI.
WEBOGRAPHIE
https://www.sifee.org/home 2015
: climat et secrétariat international francophone pour
l'évaluation de l'environnement/ Kindu Maniema 12p.
http://www.academicjournals.org
/ajar,
http://www.bananeguadeloupemartinique.com,
http://www.cialca.org,
http://www.promusa.org/,
http://www.afd.be
78
ANNEXES
Tableau 1 : Sources de matériels de
plantation (en %)
|
Territoires
|
A
|
B
|
C
|
D
|
E
|
F
|
|
Kabambare
|
33,33
|
100
|
66,67
|
0
|
0
|
0
|
|
Kailo
|
100
|
100
|
66,67
|
0
|
0
|
0
|
|
Kasongo
|
66,67
|
66,67
|
100
|
0
|
0
|
0
|
|
Kibombo
|
0
|
100
|
100
|
0
|
0
|
33,33
|
|
Lubutu
|
100
|
100
|
100
|
0
|
0
|
0
|
|
Pangi
|
33,33
|
100
|
100
|
0
|
0
|
33,33
|
|
Punia
|
33,33
|
100
|
100
|
0
|
0
|
0
|
|
Moyenne
|
52,38
|
95,24
|
90,48
|
0,00
|
0,00
|
9,52
|
Légende :
A : Rejets issus de la même plantation ;
B : Rejets en provenance des champs de voisins ;
C : Rejets issus des plantations situées loin de la
zone ;
D : Vitro-plants distribués par les services de
l'état (PIPAPEL, Recherche, ONGD) ;
E : Vitro-plants achetés chez les privés
;
F : Autres à préciser.
Tableau 2 : Age de la bananeraie dans la zone
d'étude (par année en %)
|
Territoires
|
A
|
B
|
C
|
D
|
E
|
|
Kabambare
|
0
|
0
|
33,33
|
0
|
66,67
|
|
Kailo
|
0
|
0
|
66,67
|
0
|
33,33
|
|
Kasongo
|
0
|
0
|
33,33
|
33,33
|
33,33
|
|
Kibombo
|
0
|
0
|
33,33
|
0
|
66,67
|
|
Lubutu
|
0
|
0
|
33,33
|
0
|
66,67
|
|
Pangi
|
0
|
66,67
|
33,33
|
0
|
0
|
|
Punia
|
0
|
33,33
|
33,33
|
0
|
33,33
|
|
Moyenne
|
0
|
14,29
|
38,10
|
4,76
|
42,86
|
Légende :
A : Plantation de moins de 3 ans ;
B : Plantation de 3-5 ans ;
C : Plantation de 5-7 ans ;
D : Plantation de 7-9 ans ;
E : Plantation de plus de 10 ans.
79
Tableau 3 : Système cultural dans la zone
d'étude (en %)
|
Territoires
|
A
|
B
|
C
|
D
|
E
|
F
|
G
|
|
Kabambare
|
0
|
100
|
100
|
100
|
100
|
100
|
100
|
|
Kailo
|
0
|
100
|
100
|
66,67
|
66,67
|
100
|
100
|
|
Kasongo
|
0
|
100
|
100
|
66,67
|
66,67
|
100
|
100
|
|
Kibombo
|
0
|
100
|
100
|
66,67
|
0
|
100
|
100
|
|
Lubutu
|
0
|
100
|
100
|
100
|
0
|
100
|
100
|
|
Pangi
|
0
|
100
|
100
|
33,33
|
0
|
100
|
100
|
|
Punia
|
0
|
100
|
100
|
100
|
0
|
100
|
100
|
|
Moyenne
|
0
|
100
|
100
|
76,19
|
33,33
|
100
|
100
|
Légende :
A : Bananier en monoculture ;
B : Bananier en association avec le riz ;
C : Bananier en association avec le manioc ;
D : Bananier en association avec la patate douce ;
E : Bananier en association avec le haricot ;
F : Bananier en association avec le maïs ;
G : Autres
Tableau 4 : Identification des
symptômes de BBTD
|
Territoires
|
A
|
B
|
C
|
D
|
E
|
F
|
|
Kabambare
|
100
|
100
|
0
|
100
|
0
|
100
|
|
Kailo
|
100
|
100
|
66,67
|
100
|
0
|
0
|
|
Kasongo
|
33,33
|
33,33
|
0
|
0
|
0
|
66,67
|
|
Kibombo
|
66,67
|
66,67
|
33,33
|
66,67
|
0
|
66,67
|
|
Lubutu
|
100
|
100
|
100
|
100
|
33,33
|
0
|
|
Pangi
|
33,33
|
66,67
|
66,67
|
66,67
|
0
|
66,67
|
|
Punia
|
100
|
100
|
100
|
0
|
0
|
33,33
|
|
Moyenne
|
76,19
|
80,95
|
52,38
|
61,90
|
4,76
|
47,62
|
Légende :
· A : connaissance de BBTD
· B : Observation des symptômes sur les
feuilles
· C : Observation des symptômes sur le
pseudo-tronc
· D : Aspect touffu des plants
infectés
· E : Système d'enracinement non
fonctionnel
· F : Autres précisions
80
Tableau 5 : Origine probable de la maladie dans
la zone d'étude (en %)
Territoires
|
A B C
|
|
D
|
E
|
F
|
G
|
Kabambare
|
0
|
100
|
100
|
100
|
100
|
100
|
100
|
Kailo
|
0
|
100
|
100
|
66,67
|
66,67
|
100
|
100
|
Kasongo
|
0
|
100
|
100
|
66,67
|
66,67
|
100
|
100
|
Kibombo
|
0
|
100
|
100
|
66,67
|
0
|
100
|
100
|
Lubutu
|
0
|
100
|
100
|
100
|
0
|
100
|
100
|
Pangi
|
0
|
100
|
100
|
33,33
|
0
|
100
|
100
|
Punia
|
0
|
100
|
100
|
100
|
0
|
100
|
100
|
Moyenne
|
0
|
100
|
100
|
76,19
|
33,33
|
100
|
100
|
|
Légende :
· A : Dans sa propre plantation ;
· B : Chez les voisins (moins de 10 Km) ;
· C : Pas connu par l'agriculteur.
Tableau 6 : Dispersion de BBTD dans la
région (endroit où on a observé pour première fois
symptômes de BBTD)
Territoires
|
A
|
B
|
C
|
D
|
E
|
Kabambare
|
66,67
|
33,33
|
0
|
0
|
0
|
Kailo
|
33,33
|
0
|
0
|
0
|
66,67
|
Kasongo
|
0
|
33,33
|
33,33
|
0
|
33,33
|
Kibombo
|
33,33
|
0
|
0
|
33,33
|
33,33
|
Lubutu
|
0
|
0
|
0
|
0
|
100
|
Pangi
|
66,67
|
0
|
0
|
0
|
33,33
|
Punia
|
33,33
|
0
|
0
|
0
|
66,67
|
Moyenne
|
33,33
|
9,52
|
4,76
|
4,76
|
47,62
|
|
Légende :
· A : 2 ans de production
· B : 3 ans de production
· C : 5 ans de production
· D : Plus de 5 ans
· E : Moins d'une année
81
Tableau 7 : Connaissance du mode de
transmission de BBTD par l'agriculteur
Territoires
|
A
|
B
|
C
|
D
|
Kabambare
|
0
|
100
|
66,67
|
100
|
Kailo
|
0
|
100
|
66,67
|
66,67
|
Kasongo
|
0
|
100
|
100
|
100
|
Kibombo
|
0
|
100
|
100
|
33,33
|
Lubutu
|
0
|
100
|
100
|
100
|
Pangi
|
0
|
100
|
100
|
100
|
Punia
|
0
|
100
|
100
|
100
|
|
Légende :
A : Transmission par le sol
B : Transmission par les rejets
C : Transmission par un vecteur
D : Transmission par outils (houes, machettes,
etc.)
Tableau 8 : Incidence de BBTD (en %)
Présence ou
Absence
des
symptômes
|
Kailo Pangi Kibombo Punia Lubutu Kasongo
Kabambare
|
|
0
|
21,48
|
12,96
|
11,85
|
20,74
|
20,37
|
14,07
|
18,52
|
1
|
78,52
|
87,04
|
88,15
|
79,26
|
79,63
|
85,93
|
81,48
|
|
Légende :
0 : Absence des symptômes 1 : Présence des
symptômes
Tableau 9 : Sévérité de
BBTD (en %)
Echelle
de
cotation
|
Kailo
|
Pangi
|
Kibombo
|
Punia
|
Lubutu
|
Kasongo
|
Kabambare
|
0
|
21,48
|
12,96
|
11,85
|
20,74
|
20,37
|
14,07
|
18,52
|
1
|
10
|
12,22
|
2,96
|
17,41
|
15,93
|
12,22
|
11,11
|
2
|
22,22
|
30,74
|
28,89
|
17,04
|
18,15
|
13,70
|
22,59
|
3
|
28,52
|
28,52
|
38,52
|
28,89
|
28,89
|
37,78
|
32,22
|
4
|
13,33
|
9,63
|
13,70
|
13,33
|
13,70
|
12,59
|
10,37
|
5
|
4,44
|
5,93
|
4,07
|
2,59
|
2,96
|
9,63
|
5,19
|
Légende :
|
|
|
|
|
|
|
|
|
0 : sans symptômes,
1 : stries sur les feuilles,
82
2 : stries foncées jusqu'au pseudo -
tronc,
3 : décoloration des feuilles avec taille
normale,
4 : taille réduite de feuilles
décolorées,
5 : aspect touffu au sommet « Bunchy top
».
Tableau 10 : Présence et absence du
vecteur Pentalonia nigronervosa (en %)
Oui=1 et Kailo Pangi Kibombo Punia Lubutu Kasongo
Kabambare
Non=0
0
|
8,15
|
2,59
|
8,15
|
6,30
|
5,56
|
4,07
|
4,07
|
1
|
91,85
|
97,41
|
91,85
|
93,70
|
94,44
|
95,93
|
95,93
|
|
Légende :
0 : Absence ; 1 : Présence
Tableau 11 : Importance du vecteur
Pentalonia nigronervosa (en %)
Echelle de cotation
|
Kailo
|
Pangi
|
Kibombo
|
Punia
|
Lubutu
|
Kasongo
|
0
|
8,15
|
2,59
|
8,15
|
6,30
|
5,56
|
4,07
|
1
|
12,96
|
14,07
|
1,85
|
21,48
|
21,11
|
22,59
|
2
|
22,22
|
27,04
|
14,07
|
9,26
|
9,63
|
7,78
|
3
|
38,52
|
35,56
|
40
|
44,07
|
44,44
|
38,89
|
4
|
13,70
|
13,70
|
25,93
|
14,07
|
16,30
|
10,37
|
5
|
4,44
|
7,04
|
10
|
4,81
|
2,96
|
16,30
|
|
Légende :
0 : Sans vecteur sur la touffe,
1 : Une colonie simple sans insectes ailés,
2 : Plusieurs colonies simples,
3 : Une grande colonie avec des insectes
ailés,
4 : Plusieurs grandes colonies,
5 : Colonies généralisées au niveau des
feuilles et du pseudo-tronc.
83
Tableau 12 : Principaux cultivars de bananiers
et plantains moins sensibles au BBTD classés dans le groupe I selon la
méthode de cluster dans le territoire de Kailo
Cultivars
|
Génotypes
|
Fréquences absolues
|
Fréquences relatives
|
Abote
|
AAA
|
4
|
9,52
|
Bisamuni
|
AAA
|
1
|
2,38
|
Bonjilo
|
AAB
|
3
|
7,14
|
Bosinda
|
AAB
|
2
|
4,76
|
Botabota
|
AAA
|
1
|
2,38
|
Kamera
|
AAA
|
4
|
9,52
|
Kaumba
|
AAB
|
1
|
2,38
|
Kebobo
|
AAB
|
3
|
7,14
|
Kemesi
|
AAB
|
3
|
7,14
|
Kiteka
|
AAA
|
1
|
2,38
|
Kondo
|
AAB
|
5
|
11,90
|
Loleya kao
|
AAB
|
1
|
2,38
|
Mbudi
|
AAB
|
7
|
16,67
|
Mogogo
|
AAB
|
1
|
2,38
|
Mosipa
|
AAA
|
1
|
2,38
|
Mwasi zoba
|
AAA
|
3
|
7,14
|
N'kubagonde
|
AAB
|
1
|
2,38
|
Total
|
|
42
|
100
|
|
Tableau 13 : Principaux cultivars de bananiers
et plantains moins sensibles au BBTD classés dans le groupe II selon la
méthode de cluster dans le territoire de Pangi.
Cultivars
|
Génotypes
|
Fréquences absolues
|
Fréquences relatives
|
Bunzilo
|
AAB
|
5
|
16,13
|
Kagomagoma
|
AAB
|
3
|
9,68
|
Kakolo
|
AAB
|
2
|
6,45
|
Kambelekete
|
AAB
|
3
|
9,68
|
Kambelekete
|
AAB
|
1
|
3,23
|
Kebobo
|
AAB
|
2
|
6,45
|
Limbulu
|
AAB
|
1
|
3,23
|
Mbuzi
|
AAB
|
7
|
22,58
|
Mungombe
|
AAB
|
1
|
3,23
|
Mwasi zoba
|
AAA
|
2
|
6,45
|
Nsoka
|
AAB
|
1
|
3,23
|
Nyakoko
|
AAB
|
1
|
3,23
|
Saka
|
AAB
|
1
|
3,23
|
Sola
|
AAA
|
1
|
3,23
|
Total
|
|
31
|
100
|
|
84
Tableau 14 : Principaux cultivars de bananiers
et plantains moins sensibles au BBTD classés dans le groupe II selon la
méthode de cluster dans le territoire de Kibombo
Cultivars
|
Génotypes
|
Fréquences
absolues
|
Fréquences
relatives
|
Bisamunyo
|
AAA
|
1
|
4,35
|
Bitika
|
AAA
|
2
|
8,70
|
Ibota
|
AAB
|
3
|
13,04
|
Kamera
|
AAA
|
2
|
8,70
|
Kitika asili
|
AAA
|
1
|
4,35
|
Mbalimbali
|
AAB
|
2
|
8,70
|
Mbuzi
|
AAB
|
2
|
8,70
|
Ndizi sokomutu
|
AAB
|
1
|
4,35
|
Papulu
|
AAB
|
3
|
13,04
|
Saba
|
AAB
|
3
|
13,04
|
Tuumpu
|
AAB
|
2
|
8,70
|
Utanga
|
AAB
|
1
|
4,35
|
Total
|
|
23
|
100
|
|
Tableau 15 : Principaux cultivars de bananiers
et plantains moins sensibles au BBTD classés dans le groupe III selon la
méthode de cluster dans le territoire de PUNIA
Cultivars
|
Génotypes
|
Fréquences
|
Fréquences
|
|
|
absolues
|
relatives
|
Abolo
|
AAB
|
11
|
26,83
|
Alua
|
AAB
|
2
|
4,88
|
Amaambonge
|
AAB
|
4
|
9,76
|
Amaiganga
|
AAB
|
2
|
4,88
|
Bitika murefu
|
AAA
|
1
|
2,44
|
Bonjilo
|
AAB
|
2
|
4,88
|
Ikosa
|
AAB
|
3
|
7,32
|
Kamera
|
AAA
|
4
|
9,76
|
Kengwekengweke
|
AAB
|
1
|
2,44
|
Kitika banana
|
AAA
|
1
|
2,44
|
Kitika mushipa
|
AAA
|
2
|
4,88
|
Kola
|
AAB
|
2
|
4,88
|
Mobingele
|
AAB
|
1
|
2,44
|
Mogogo
|
AAB
|
1
|
2,44
|
Moyaudi
|
AAA
|
1
|
2,44
|
Nkumonkumo
|
AAB
|
1
|
2,44
|
Nyuki
|
AAB
|
1
|
2,44
|
Okondima
|
AAA
|
1
|
2,44
|
Total
|
|
41
|
100
|
|
85
Tableau 16 : Principaux cultivars de bananiers
et plantains moins sensibles au BBTD classés dans le groupe II selon la
méthode de cluster dans le territoire de LUBUTU
Cultivars
|
Génotypes
|
Fréquences absolues
|
Fréquences relatives
|
Abolo
|
AAB
|
1
|
2,44
|
Akoto
|
AAB
|
5
|
12,20
|
Alua
|
AAB
|
2
|
4,88
|
Amaakoko
|
AAB
|
1
|
2,44
|
Amaiganga
|
AAB
|
1
|
2,44
|
Amambunge
|
AAB
|
1
|
2,44
|
Amamundu
|
AAB
|
1
|
2,44
|
Banana
|
AAA
|
4
|
9,76
|
Bibotabota
|
AAA
|
1
|
2,44
|
Bonjilo
|
AAB
|
4
|
9,76
|
Gase
|
AAB
|
4
|
9,76
|
Kainganya
|
AAB
|
1
|
2,44
|
Kamera
|
AAA
|
3
|
7,32
|
Katutu
|
AAB
|
1
|
2,44
|
Kaumbo
|
AAB
|
1
|
2,44
|
Mabonga
|
AAB
|
4
|
9,76
|
Mayayi
|
AAB
|
1
|
2,44
|
Mbeu
|
AAB
|
1
|
2,44
|
Mokombe
|
AAB
|
3
|
7,32
|
Mukandili
|
AAA
|
1
|
2,44
|
Total
|
|
41
|
100
|
|
Tableau 17 : Principaux cultivars de bananiers
et plantains moins sensibles au BBTD classés dans le groupe IV selon la
méthode de cluster dans le territoire de Kasongo
Cultivars
|
Génotypes
|
Fréquences
|
Fréquences
|
|
|
absolues
|
relatives
|
Atili
|
AAB
|
1
|
3,57
|
Bambote
|
AAA
|
1
|
3,57
|
Kakumbi
|
AAB
|
1
|
3,57
|
Kamera
|
AAA
|
4
|
14,29
|
Kangindi
|
AAB
|
1
|
3,57
|
Kavava
|
AAB
|
3
|
10,71
|
Kibubu
|
AAB
|
1
|
3,57
|
Lwizi
|
AAB
|
3
|
10,71
|
Mbole
|
AAB
|
2
|
7,14
|
Mbudi
|
AAB
|
7
|
25,00
|
Merenge
|
AAA
|
1
|
3,57
|
Muke muyaudi
|
AAA
|
1
|
3,57
|
Mukokoonde
|
AAB
|
1
|
3,57
|
Sola
|
AAA
|
1
|
3,57
|
Total
|
|
28
|
100
|
|
86
Tableau 18 : Principaux cultivars de bananiers
et plantains moins sensibles au BBTD classés
|
dans le groupe II et III selon la méthode de cluster
dans le territoire de Kabambare
|
Cultivars
|
Génotypes
|
Fréquences absolues
|
Fréquences relatives
|
Bitika
|
AAA
|
2
|
4,0
|
Kamera
|
AAA
|
5
|
10,0
|
Mbijaonde
|
AAB
|
5
|
10,0
|
Mbudi
|
AAB
|
15
|
30,0
|
Muyaudi
|
AAA
|
5
|
10,0
|
Kabindi
|
AAB
|
2
|
4,0
|
Kiemba
|
AAB
|
1
|
2,0
|
Mulioko
|
AAB
|
1
|
2,0
|
Sola
|
AAA
|
5
|
10,0
|
Mukokoonde
|
AAB
|
1
|
2,0
|
Ondeonde
|
AAB
|
1
|
2,0
|
Katulu
|
AAB
|
3
|
6,0
|
Kibubu
|
AAB
|
2
|
4,0
|
Kangungu
|
AAB
|
1
|
2,0
|
Kaumba
|
AAB
|
1
|
2,0
|
Total
|
|
50
|
100,00
|
|
Tableau 19 : Villages enquêtés par
territoire et leurs coordonnées géographiques en Province de
Maniema
Territoires
|
Villages
|
Coordonnees géographiques
|
|
Latitude
|
Altitude
|
Kailo
|
Kailo
|
26° 05' E
|
2° 38'
|
S
|
457m
|
|
25° 56' E
|
2° 57'
|
S
|
448m
|
|
25° 45' E
|
2° 52'
|
S
|
504m
|
Pangi
|
Kalimbangoma
|
26° 19' E
|
3° 36'
|
S
|
653m
|
|
26° 27' E
|
3° 35'
|
S
|
655m
|
|
26° 37' E
|
2° 34'
|
S
|
856m
|
Kibombo
|
Lokenye
|
26° 30' E
|
3° 26'
|
S
|
660m
|
|
25° 47' E
|
3° 25'
|
S
|
517m
|
|
25° 47' E
|
3° 26'
|
S
|
522m
|
Punia
|
Amangobo
|
26° 28' E
|
1° 31'
|
S
|
520m
|
|
26° 37' E
|
1° 44'
|
S
|
556m
|
|
26° 39' E
|
1° 43'
|
S
|
558m
|
Lubutu
|
Amakonyola
|
26° 34' E
|
0° 42'
|
S
|
548m
|
|
26° 35' E
|
0° 44'
|
S
|
546m
|
|
26° 35' E
|
0° 83'
|
S
|
517m
|
Kasongo
|
Mungomba
|
26° 57' E
|
4° 14'
|
S
|
638m
|
|
27° 03' E
|
4° 33'
|
S
|
650m
|
|
26° 07' E
|
4° 19'
|
S
|
633m
|
Kabambare
|
Mwatunda
|
27° 05' E
|
4° 09'
|
S
|
655m
|
|
27° 06' E
|
4° 11'
|
S
|
661m
|
|
27° 05' E
|
4° 12'
|
S
|
665m
|
|
87
Tableau 20 : Cultivars de bananiers
identifiés dans le territoire de KAILO
Villages
|
cultivars
|
Individus
|
Cluster
|
Kailo
|
Bonjilo( AAB)
|
1
|
1
|
|
Kondo (AAB)
|
2
|
2
|
|
Kamera ( AAA)
|
3
|
2
|
|
Katutu (AAB)
|
4
|
2
|
Jardin de cases
|
Katutu (AAB)
|
5
|
2
|
|
Ilonga (AAB)
|
6
|
2
|
|
Bikombe (AAA)
|
7
|
2
|
|
Yomabene(AAB)
|
8
|
2
|
|
Yomabene(AAB)
|
9
|
2
|
|
Kamera ( AAA
|
10
|
2
|
|
Bosinda ( AAB)
|
11
|
2
|
|
Bisamuni (AAA
|
12
|
2
|
|
Bonjilo (AAB)
|
13
|
1
|
|
Kondo (AAB)
|
14
|
2
|
|
Mogogo (AAB)
|
15
|
1
|
|
Kondo (AAB)
|
16
|
2
|
|
Mogogo (AAB)
|
17
|
2
|
|
Bisamuni (AAA
|
18
|
3
|
|
Bonjilo(AAB)
|
19
|
2
|
|
Molebwa (AAB)
|
20
|
2
|
|
Kamera ( AAA
|
21
|
2
|
|
Botabota (AAA
|
22
|
2
|
|
Botabota (AAA
|
23
|
1
|
|
Kamera ( AAA
|
24
|
2
|
|
Yomabene(AAB)
|
25
|
2
|
|
Mbolo (AAB)
|
26
|
2
|
|
Katutu (AAB)
|
27
|
2
|
|
Kamera ( AAA
|
28
|
2
|
|
Kondo (AAB)
|
29
|
1
|
|
Kondo (AAB)
|
30
|
1
|
|
Kiteka (AAA
|
31
|
2
|
Champ2
|
Bosinda (AAB)
|
32
|
2
|
|
Kondo (AAB)
|
33
|
1
|
|
Bonjilo(AAB)
|
34
|
1
|
|
Bonjilo(AAB)
|
35
|
2
|
|
Bonjilo(AAB)
|
36
|
2
|
|
88
|
Kamera ( AAA
|
37
|
2
|
|
Mogogo (AAB)
|
38
|
2
|
|
Yomabene(AAB)
|
39
|
2
|
|
Kamera ( AAA
|
40
|
2
|
|
Mbuli (AAB)
|
41
|
2
|
|
Kondo (AAB)
|
42
|
2
|
|
Kiteka (AAA
|
43
|
1
|
|
Bonjilo (AAB)
|
44
|
2
|
|
Kamera ( AAA
|
45
|
1
|
|
Kiteka (AAA
|
46
|
2
|
|
Kamera ( AAA
|
47
|
2
|
|
Botabota (AAA
|
48
|
2
|
|
Kamera ( AAA
|
49
|
3
|
|
Kamera ( AAA
|
50
|
2
|
|
Kondo (AAB)
|
51
|
1
|
|
Botabota (AAA
|
52
|
3
|
|
Botabota (AAA
|
53
|
2
|
|
Kamera ( AAA
|
54
|
1
|
|
Bongilo(AAB)
|
55
|
2
|
|
Kamera ( AAA
|
56
|
2
|
|
Kondo (AAB)
|
57
|
3
|
|
Yomabene(AAB)
|
58
|
2
|
|
Kondo (AAB)
|
59
|
2
|
|
Kamera ( AAA
|
60
|
1
|
|
Bosinda (AAB)
|
61
|
1
|
|
Kamera ( AAA
|
62
|
2
|
|
Kondo (AAB)
|
63
|
1
|
|
Kondo (AAB)
|
64
|
2
|
|
Bonjilo(AAB)
|
65
|
2
|
Champ3
|
Bitika (AAA
|
66
|
3
|
|
Mogogo (AAB)
|
67
|
2
|
|
Kamera ( AAA
|
68
|
2
|
|
Yomabene(AAB)
|
69
|
2
|
|
Iyongalukutchu (AAB)
|
70
|
2
|
|
Bosinda (AAB)
|
71
|
2
|
|
Iyongalukutchu (AAB
|
72
|
2
|
|
Kekole (AAA
|
73
|
2
|
|
Mbuli (AAB)
|
74
|
2
|
|
Bosinda (AAB)
|
75
|
1
|
|
Yomabene(AAB)
|
76
|
2
|
|
Ngwekengweke (AAB)
|
77
|
2
|
|
Bonjilo (AAB)
|
78
|
2
|
|
Lowa (AAB)
|
79
|
2
|
|
89
|
Kamera ( AAA
|
80
|
3
|
|
Mogogo (AAB)
|
81
|
2
|
|
Kamera ( AAA
|
82
|
2
|
|
Yomabene(AAB)
|
83
|
2
|
|
Katchutchu (AAB)
|
84
|
2
|
|
Kaololi (AAB)
|
85
|
2
|
|
Kaololi (AAB)
|
86
|
3
|
|
Mbuli (AAB)
|
87
|
1
|
|
Kamera ( AAA
|
88
|
2
|
|
Lowa (AAB)
|
89
|
2
|
|
Mbuli (AAB)
|
90
|
2
|
Muyengo
|
Kemesi (AAB)
|
91
|
2
|
Jardin de cases
|
Kondo (AAB)
|
92
|
2
|
|
Bisamuni (AAA)
|
93
|
1
|
|
Kaumba (AAB)
|
94
|
1
|
|
Kaumba (AAB)
|
95
|
2
|
|
Kemesi (AAB)
|
96
|
2
|
|
Mwasi zoba (AAA)
|
97
|
2
|
|
Ketota (AAB))
|
98
|
3
|
|
Ketota (AAB)
|
99
|
2
|
|
Mwasi zoba (AAA)
|
100
|
2
|
|
Mosipa (AAA)
|
101
|
2
|
|
Lompema (AAA)
|
102
|
2
|
|
Lompema (AAA)
|
103
|
2
|
|
Bonjilo (AAB)
|
104
|
3
|
|
Bonjilo (AAB)
|
105
|
2
|
|
Mbuzi (AAB)
|
106
|
2
|
|
N'kubagonde (AAB)
|
107
|
2
|
|
N'kubagonde (AAB)
|
108
|
2
|
|
N'kubagonde (AAB)
|
109
|
1
|
|
Kebobo (AAB)
|
110
|
1
|
|
Bisamuni (AAA)
|
111
|
2
|
|
Kamera (AAA)
|
112
|
2
|
|
Kebobo (AAB)
|
113
|
2
|
|
Mbuzi (AAB)
|
114
|
2
|
|
Mbuzi (AAB)
|
115
|
1
|
|
Kondo (AAB)
|
116
|
2
|
|
Kondo (AAB)
|
117
|
2
|
|
Kondo (AAB)
|
118
|
2
|
|
Kaumba (AAB)
|
119
|
2
|
|
Mwasi zoba (AAA)
|
120
|
2
|
Champ 2
|
Mwasi zoba (AAA)
|
121
|
2
|
|
Mbuzi (AAB)
|
122
|
2
|
|
90
|
Kondo (AAB)
|
123
|
2
|
|
Mwasi zoba (AAA)
|
124
|
3
|
|
Kebobo (AAB)
|
125
|
2
|
|
Kebobo (AAB)
|
126
|
2
|
|
Kebobo (AAB)
|
127
|
1
|
|
Kebobo (AAB)
|
128
|
2
|
|
Mwasi zoba (AAA)
|
129
|
2
|
|
Mwasi zoba (AAA)
|
130
|
2
|
|
Bonjilo (AAB)
|
131
|
2
|
|
Kebobo (AAB)
|
132
|
1
|
|
Mosipa (AAA)
|
133
|
2
|
|
Mosipa (AAA)
|
134
|
2
|
|
Mbuzi (AAB)
|
135
|
2
|
|
Mbuzi (AAB)
|
136
|
2
|
|
Mbuzi (AAB)
|
137
|
2
|
|
Mwasi zoba (AAA)
|
138
|
2
|
|
Bonjilo (AAB)
|
139
|
2
|
|
Bonjilo (AAB)
|
140
|
2
|
|
Kondo (AAB)
|
141
|
2
|
|
Mosipa (AAA)
|
142
|
1
|
|
KOndo (AAB)
|
143
|
2
|
|
Kondo (AAB)
|
144
|
2
|
|
Mosipa (AAA)
|
145
|
2
|
|
Mosipa (AAA)
|
146
|
2
|
|
Mbuzi (AAB)
|
147
|
2
|
|
Mbuzi (AAB)
|
148
|
2
|
|
Mwasi zoba (AAA)
|
149
|
2
|
|
Kebobo (AAB)
|
150
|
2
|
Champ3
|
Mwasi zoba (AAA)
|
151
|
1
|
|
Kemesi (AAB)
|
152
|
1
|
|
Bonjilo (AAB)
|
153
|
2
|
|
Mbuzi (AAB)
|
154
|
2
|
|
N'kubagonde (AAB)
|
155
|
2
|
|
N'kubagonde (AAB)
|
156
|
2
|
|
Bonjilo (AAB)
|
157
|
2
|
|
Mosipa (AAA)
|
158
|
2
|
|
Mosipa (AAA)
|
159
|
2
|
|
Kambelekete (AAB)
|
160
|
2
|
|
Limbulu (AAB)
|
161
|
2
|
|
Kamera (AAA)
|
162
|
2
|
|
Kambelekete (AAB)
|
163
|
2
|
|
Bonjilo (AAB)
|
164
|
2
|
|
Kankese (AAB)
|
165
|
2
|
|
91
|
Kamera (AAA)
|
166
|
2
|
|
Kebobo (AAB)
|
167
|
2
|
|
Kondo (AAB)
|
168
|
2
|
|
Kondo (AAB)
|
169
|
2
|
|
Bisamuni (AAA)
|
170
|
2
|
|
Kaumba (AAB)
|
171
|
2
|
|
Kaumba (AAB)
|
172
|
2
|
|
Kemesi (AAB)
|
173
|
2
|
|
Mwasi zoba (AAA)
|
174
|
2
|
|
Ketota (AAB)
|
175
|
2
|
|
Mwasi zoba (AAA)
|
176
|
2
|
|
Mosipa (AAA)
|
177
|
3
|
|
Lompema (AAA)
|
178
|
2
|
|
Lompema (AAA)
|
179
|
2
|
|
Mosipa (AAA)
|
180
|
2
|
Kimbembe3
|
Kemesi (AAB)
|
181
|
2
|
Jardin de cases
|
Kamera (AAA)
|
182
|
2
|
|
Kamera (AAA)
|
183
|
2
|
|
Karingondo (AAB)
|
184
|
2
|
|
Loleya kao (AAB)
|
185
|
2
|
|
Loleya kao (AAB)
|
186
|
2
|
|
Kemesi (AAB)
|
187
|
2
|
|
Kemesi (AAB)
|
188
|
1
|
|
Kemesi (AAB)
|
189
|
3
|
|
Kamera (AAA)
|
190
|
2
|
|
Abote (AAA)
|
191
|
1
|
|
Abote (AAA)
|
192
|
1
|
|
Bonjilo (AAB)
|
193
|
2
|
|
Bisamuni ( AAA)
|
194
|
2
|
|
N'kubagonde (AAB)
|
195
|
2
|
|
Bonjilo (AAB)
|
196
|
2
|
|
Abote (AAA)
|
197
|
2
|
|
Abote (AAA)
|
198
|
2
|
|
Mwasi zoba (AAA)
|
199
|
2
|
|
Atiri (AAB)
|
200
|
2
|
|
Mbudi (AAB)
|
201
|
2
|
|
Mbudi (AAB)
|
202
|
1
|
|
Kebobo (AAB)
|
203
|
2
|
|
Kamera (AAA)
|
204
|
2
|
|
Mwasi zoba (AAA)
|
205
|
2
|
|
Nyemena bisasa (AAB)
|
206
|
2
|
|
Kakumbi (AAB)
|
207
|
2
|
|
Dikondo (AAB)
|
208
|
2
|
|
92
|
Mwasi zoba (AAA)
|
209
|
2
|
|
Nyemena bisasa (AAB)
|
210
|
2
|
Champ2
|
Dikondo (AAB)
|
211
|
2
|
|
Kamera (AAA)
|
212
|
2
|
|
Kalingondo (AAB)
|
213
|
2
|
|
Atiri (AAB)
|
214
|
2
|
|
Mwasi zoba (AAA)
|
215
|
2
|
|
Mwasi zoba (AAA)
|
216
|
1
|
|
Dikondo (AAB)
|
217
|
2
|
|
Dikondo (AAB)
|
218
|
2
|
|
Bisamuni ( AAA)
|
219
|
2
|
|
Mbudi (AAB)
|
220
|
2
|
|
Kebobo (AAB)
|
221
|
2
|
|
Mwasi zoba (AAA)
|
222
|
2
|
|
Kamera (AAA)
|
223
|
2
|
|
Loleya kao (AAB)
|
224
|
2
|
|
Loleya kao (AAB)
|
225
|
2
|
|
N'kubagonde (AAB)
|
226
|
2
|
|
Kebobo (AAB)
|
227
|
2
|
|
Bonjilo (AAB)
|
228
|
3
|
|
Kebobo (AAB)
|
229
|
3
|
|
Abote (AAA)
|
230
|
1
|
|
Abote (AAA)
|
231
|
1
|
|
Abote (AAA)
|
232
|
2
|
|
Kemesi (AAB)
|
233
|
2
|
|
Loleya kao (AAB)
|
234
|
2
|
|
Atiri (AAB)
|
235
|
3
|
|
Kakumbi (AAB)
|
236
|
2
|
|
Dikondo (AAB)
|
237
|
2
|
|
Dikondo (AAB)
|
238
|
2
|
|
Bisamuni ( AAA)
|
239
|
2
|
|
Mbudi (AAB)
|
240
|
2
|
Champ 3
|
Mbudi (AAB)
|
241
|
1
|
|
Abote (AAA)
|
242
|
3
|
|
Abote (AAA)
|
243
|
2
|
|
Dikondo (AAB)
|
244
|
3
|
|
Kakumbi (AAB)
|
245
|
3
|
|
Mbudi (AAB)
|
246
|
1
|
|
Mbudi (AAB)
|
247
|
3
|
|
Mbudi (AAB)
|
248
|
1
|
|
Nyemena bisasa (AAB)
|
249
|
3
|
|
Mbudi (AAB)
|
250
|
2
|
|
Kebobo (AAB)
|
251
|
2
|
|
93
|
Atiri (AAB)
|
252
|
2
|
|
Mwasi zoba (AAA)
|
253
|
2
|
|
Mwasi zoba (AAA)
|
254
|
1
|
|
Kemesi (AAB)
|
255
|
1
|
|
Kamera (AAA)
|
256
|
1
|
|
Kalingondo (AAB)
|
257
|
2
|
|
Loleya kao (AAB)
|
258
|
3
|
|
Bisamuni ( AAA)
|
259
|
2
|
|
Bisamuni ( AAA)
|
260
|
2
|
|
N'kubagonde (AAB)
|
261
|
2
|
|
Bonjilo (AAB)
|
262
|
2
|
|
Abote (AAA)
|
263
|
2
|
|
Dikondo (AAB)
|
264
|
2
|
|
Karingondo (AAB)
|
265
|
3
|
|
Mwasi zoba (AAA)
|
266
|
2
|
|
Kamera (AAA)
|
267
|
2
|
|
Mbudi (AAB)
|
268
|
1
|
|
Kemesi (AAB)
|
269
|
2
|
|
Loleya kao (AAB)
|
270
|
1
|
|
Tableau 21 : Cultivars de bananiers
identifiés dans le territoire de PANGI
Villages
|
Cultivars
|
Individus
|
Groupes
(Cluster)
|
Kalimbangoma
|
N'tondo (AAB)
|
1
|
1
|
Jardin de cases
|
Bunzilo (AAB)
|
2
|
1
|
|
Limbulu (AAB)
|
3
|
1
|
|
Kambelekete (AAB)
|
4
|
1
|
|
Kitika asili (AAA)
|
5
|
1
|
|
Ingindi (AAB)
|
6
|
1
|
|
Kitika asili (AAA)
|
7
|
1
|
|
Musisa (AAB)
|
8
|
1
|
|
Mungombe (AAB)
|
9
|
1
|
|
Mbalimbali (AAB)
|
10
|
1
|
|
Mungombe (AAB)
|
11
|
1
|
|
Mungombe (AAB)
|
12
|
1
|
|
Ingindi (AAB)
|
13
|
1
|
|
94
|
Ingindi (AAB)
|
14
|
1
|
|
Mbalimbali (AAB)
|
15
|
1
|
|
Mbuzi (AAB)
|
16
|
1
|
|
Mbuzi (AAB)
|
17
|
1
|
|
Ingindi (AAB)
|
18
|
1
|
|
Kagomagoma (AAB)
|
19
|
1
|
|
Mbuzi (AAB)
|
20
|
2
|
|
Mbuzi (AAB)
|
21
|
1
|
|
Saka (AAB)
|
22
|
1
|
|
Saka (AAB)
|
23
|
2
|
|
Saka (AAB)
|
24
|
1
|
|
Kamera (AAA)
|
25
|
1
|
|
Mokamata (AAA)
|
26
|
1
|
|
Mokamata (AAA)
|
27
|
1
|
|
Kamera (AAA)
|
28
|
1
|
|
Kamera (AAA)
|
29
|
1
|
|
Saka (AAB)
|
30
|
1
|
Champ 2
|
Mungombe ( AAB)
|
31
|
1
|
|
Mungombe (AAB)
|
32
|
1
|
|
Mbalimbali (AAB)
|
33
|
1
|
|
Mungombe (AAB)
|
34
|
1
|
|
Ingindi (AAB)
|
35
|
1
|
|
Kamera (AAA)
|
36
|
1
|
|
Kamera (AAA)
|
37
|
1
|
|
Mokamata (AAA)
|
38
|
1
|
|
Mokamata (AAA)
|
39
|
1
|
|
Saka (AAB)
|
40
|
1
|
|
Kamera (AAA)
|
41
|
1
|
|
Saka (AAB)
|
42
|
1
|
|
Mungombe (AAB)
|
43
|
1
|
|
Mungombe (AAB)
|
44
|
1
|
|
Limbulu (AAB)
|
45
|
2
|
|
Kitika asili (AAA)
|
46
|
1
|
|
Mbuzi (AAB)
|
47
|
1
|
|
Mbuzi (AAB)
|
48
|
1
|
|
Saka (AAB)
|
49
|
1
|
|
Kagomagoma (AAB)
|
50
|
1
|
|
Ingindi (AAB)
|
51
|
1
|
|
Kamera (AAA)
|
52
|
1
|
|
Sola (AAA)
|
53
|
1
|
|
Sola (AAA)
|
54
|
1
|
|
N'tondo (AAB)
|
55
|
1
|
|
Mungombe (AAB)
|
56
|
1
|
|
95
|
Mungombe (AAB)
|
57
|
1
|
|
Kebobo (AAB)
|
58
|
1
|
|
Kebobo (AAB)
|
59
|
2
|
|
Kitika asili (AAA)
|
60
|
1
|
Champ 3
|
Kebobo (AAB)
|
61
|
1
|
|
Kebobo (AAB)
|
62
|
1
|
|
Ingindi (AAB)
|
63
|
1
|
|
Mungombe (AAB)
|
64
|
2
|
|
Kebobo (AAB)
|
65
|
1
|
|
Kamboti ( AAA)
|
66
|
1
|
|
Kamboti ( AAA)
|
67
|
1
|
|
Mbuzi (AAB)
|
68
|
1
|
|
Kebobo (AAB)
|
69
|
1
|
|
Mbuzi (AAB)
|
70
|
1
|
|
Ingindi (AAB)
|
71
|
1
|
|
N'tondo (AAB)
|
72
|
3
|
|
N'tondo (AAB)
|
73
|
1
|
|
Saka (AAB)
|
74
|
1
|
|
Kamera (AAA)
|
75
|
1
|
|
Kamera (AAA)
|
76
|
1
|
|
Ingindi (AAB)
|
77
|
1
|
|
Mokamata (AAA)
|
78
|
1
|
|
Kamera (AAA)
|
79
|
1
|
|
Ingindi (AAB)
|
80
|
1
|
|
Mbuzi (AAB)
|
81
|
1
|
|
Mbuzi (AAB)
|
82
|
1
|
|
Kagomagoma (AAB)
|
83
|
1
|
|
Kamera (AAA)
|
84
|
1
|
|
N'tondo (AAB)
|
85
|
1
|
|
Bunzilo (AAB)
|
86
|
1
|
|
Kambelekete (AAB)
|
87
|
2
|
|
Limbulu (AAB)
|
88
|
1
|
|
Limbulu (AAB)
|
89
|
1
|
|
Bunzilo (AAB)
|
90
|
1
|
Moyo
|
Mbuzi (AAB)
|
91
|
2
|
Jardin de cases
|
N'tondo (AAB)
|
92
|
1
|
|
Mbuzi (AAB)
|
93
|
1
|
|
Mbuzi (AAB)
|
94
|
1
|
|
N'tondo (AAB)
|
95
|
1
|
|
Kambelekete (AAB)
|
96
|
2
|
|
Kambelekete (AAB)
|
97
|
1
|
|
Kambelekete (AAB)
|
98
|
1
|
|
96
|
Mbuzi (AAB)
|
99
|
2
|
|
Mwasi zoba ( AAA)
|
100
|
2
|
|
Mwasi zoba ( AAA)
|
101
|
2
|
|
Kambelekete (AAB)
|
102
|
1
|
|
Bunzilo (AAB)
|
103
|
1
|
|
Bunzilo (AAB)
|
104
|
3
|
|
Bunzilo (AAB)
|
105
|
1
|
|
Bunzilo (AAB)
|
106
|
2
|
|
Kagomagoma (AAB)
|
107
|
1
|
|
Kagomagoma (AAB)
|
108
|
1
|
|
Kamera (AAA)
|
109
|
1
|
|
N'tondo (AAB)
|
110
|
1
|
|
N'tondo (AAB)
|
111
|
1
|
|
Mbuzi (AAB)
|
112
|
2
|
|
Kamera (AAA)
|
113
|
1
|
|
Kamera (AAA)
|
114
|
1
|
|
Mbuzi (AAB)
|
115
|
1
|
|
Mbuzi (AAB)
|
116
|
2
|
|
Mbuzi (AAB)
|
117
|
1
|
|
N'tondo (AAB)
|
118
|
1
|
|
Mwasi zoba ( AAA)
|
119
|
1
|
|
Mwasi zoba ( AAA)
|
120
|
1
|
Champ 2
|
Kamera (AAA)
|
121
|
1
|
|
Limbulu (AAB)
|
122
|
1
|
|
Limbulu (AAB)
|
123
|
1
|
|
Limbulu (AAB)
|
124
|
1
|
|
Limbulu (AAB)
|
125
|
1
|
|
Limbulu (AAB)
|
126
|
1
|
|
Bunzilo (AAB)
|
127
|
2
|
|
Bunzilo (AAB)
|
128
|
1
|
|
Bunzilo (AAB)
|
129
|
2
|
|
Kamera (AAA)
|
130
|
1
|
|
Kamera (AAA)
|
131
|
3
|
|
Mwasi zoba ( AAA)
|
132
|
1
|
|
Mbuzi (AAB)
|
133
|
1
|
|
Mbuzi (AAB)
|
134
|
1
|
|
Bunzilo (AAB)
|
135
|
1
|
|
Bunzilo (AAB)
|
136
|
1
|
|
Bunzilo (AAB)
|
137
|
2
|
|
Limbulu (AAB)
|
138
|
1
|
|
Kamera (AAA)
|
139
|
1
|
|
97
|
Mwasi zoba ( AAA)
|
140
|
1
|
|
Mbuzi (AAB)
|
141
|
1
|
|
Mbuzi (AAB)
|
142
|
1
|
|
Mbuzi (AAB)
|
143
|
1
|
|
Limbulu (AAB)
|
144
|
1
|
|
Limbulu (AAB)
|
145
|
1
|
|
Bisamuni (AAA)
|
146
|
1
|
|
Kagomagoma (AAB)
|
147
|
2
|
|
Bisamuni (AAA)
|
148
|
3
|
|
Kagomagoma (AAB)
|
149
|
1
|
|
Kagomagoma (AAB)
|
150
|
1
|
Champ 3
|
Sola (AAA)
|
151
|
3
|
|
Sola (AAA)
|
152
|
1
|
|
N'tondo (AAB)
|
153
|
1
|
|
N'tondo (AAB)
|
154
|
1
|
|
N'tondo (AAB)
|
155
|
1
|
|
Mwasi zoba ( AAA)
|
156
|
1
|
|
Mwasi zoba ( AAA)
|
157
|
1
|
|
Mbuzi (AAB)
|
158
|
2
|
|
Mbuzi (AAB)
|
159
|
1
|
|
Bunzilo (AAB)
|
160
|
1
|
|
Bunzilo (AAB)
|
161
|
1
|
|
Kamera (AAA)
|
162
|
1
|
|
Kamera (AAA)
|
163
|
1
|
|
Kamera (AAA)
|
164
|
3
|
|
Kagomagoma (AAB)
|
165
|
1
|
|
N'tondo (AAB)
|
166
|
1
|
|
N'tondo (AAB)
|
167
|
1
|
|
N'tondo (AAB)
|
168
|
1
|
|
N'tondo (AAB)
|
169
|
1
|
|
Sola (AAA)
|
170
|
2
|
|
Sola (AAA)
|
171
|
1
|
|
Bunzilo (AAB)
|
172
|
1
|
|
Bunzilo (AAB)
|
173
|
1
|
|
Mwasi zoba ( AAA)
|
174
|
1
|
|
Mwasi zoba ( AAA)
|
175
|
1
|
|
Mbuzi (AAB)
|
176
|
1
|
|
Mbuzi (AAB)
|
177
|
1
|
|
Mbuzi (AAB)
|
178
|
1
|
|
Bunzilo (AAB)
|
179
|
3
|
|
Kamera (AAA)
|
180
|
1
|
|
98
Kwankenye
|
Mbuzi (AAB))
|
181
|
1
|
Jardin de cases
|
Mbuzi (AAB)
|
182
|
1
|
|
Mokamata (AAA)
|
183
|
1
|
|
Nsoka (AAB)
|
184
|
2
|
|
Mokamata (AAA)
|
185
|
1
|
|
Nsoka (AAB)
|
186
|
1
|
|
Kambelekete (AAB)
|
187
|
1
|
|
Kambelekete (AAB)
|
188
|
1
|
|
Musisa (AAB)
|
189
|
1
|
|
Musisa (AAB)
|
190
|
1
|
|
Musisa (AAB)
|
191
|
1
|
|
Kamera (AAA)
|
192
|
2
|
|
Mbuzi (AAB)
|
193
|
1
|
|
Nyakoko (AAB)
|
194
|
1
|
|
Nyakoko (AAB)
|
195
|
1
|
|
Lokamata (AAA)
|
196
|
1
|
|
Lokamata (AAA)
|
197
|
1
|
|
Munkomba (AAB)
|
198
|
1
|
|
Mbuzi (AAB)
|
199
|
1
|
|
Nsoka (AAB)
|
200
|
1
|
|
Kambelekete (AAB)
|
201
|
1
|
|
Nyakoko (AAB)
|
202
|
2
|
|
Kambelekete (AAB)
|
203
|
1
|
|
Nyakoko (AAB)
|
204
|
1
|
|
Nyakoko (AAB)
|
205
|
1
|
|
Munkomba (AAB)
|
206
|
1
|
|
Kamera (AAA)
|
207
|
1
|
|
Mokamata (AAA)
|
208
|
1
|
|
Mokamata (AAA)
|
209
|
1
|
|
Nsoka (AAB)
|
210
|
1
|
Champ 2
|
Kakolo (AAB)
|
211
|
2
|
|
Kakolo (AAB)
|
212
|
1
|
|
Kebobo (AAB)
|
213
|
1
|
|
Kebobo (AAB)
|
214
|
1
|
|
Mwabi (AAB)
|
215
|
1
|
|
Kitika asili (AAA)
|
216
|
1
|
|
Bunzilo (AAB)
|
217
|
1
|
|
Bunzilo (AAB)
|
218
|
1
|
|
Bunzilo (AAB)
|
219
|
1
|
|
Nyakoko (AAB)
|
220
|
1
|
|
Kambelekete (AAB)
|
221
|
1
|
|
Kambelekete (AAB)
|
222
|
1
|
|
Kakolo (AAB)
|
223
|
2
|
|
99
|
Mokamata (AAA)
|
224
|
1
|
|
Mokamata (AAA)
|
225
|
1
|
|
Kambelekete (AAB)
|
226
|
2
|
|
Kambelekete (AAB)
|
227
|
1
|
|
Mbuzi (AAB)
|
228
|
1
|
|
Mbuzi (AAB)
|
229
|
1
|
|
Bunzilo (AAB)
|
230
|
1
|
|
Mbuzi (AAB)
|
231
|
1
|
|
Kakolo (AAB)
|
232
|
1
|
|
Kebobo (AAB)
|
233
|
1
|
|
Nyakoko (AAB)
|
234
|
1
|
|
Bunzilo (AAB)
|
235
|
2
|
|
Bunzilo (AAB)
|
236
|
1
|
|
Sola (AAA)
|
237
|
1
|
|
Sola (AAA)
|
238
|
1
|
|
Kebobo (AAB)
|
239
|
1
|
|
Kebobo (AAB)
|
240
|
1
|
Champ 3
|
Bunzilo (AAB)
|
241
|
1
|
|
Sola (AAA)
|
242
|
1
|
|
Sola (AAA)
|
243
|
1
|
|
Kebobo (AAB)
|
244
|
1
|
|
Limbulu (AAB)
|
245
|
1
|
|
Limbulu (AAB)
|
246
|
1
|
|
Mbuzi (AAB)
|
247
|
1
|
|
Kagomagoma (AAB)
|
248
|
2
|
|
Bunzilo (AAB)
|
249
|
1
|
|
Bunzilo (AAB)
|
250
|
1
|
|
Mokamata (AAA)
|
251
|
1
|
|
Sola (AAA)
|
252
|
1
|
|
Kambelekete (AAB)
|
253
|
1
|
|
Kebobo (AAB)
|
254
|
2
|
|
Kebobo (AAB)
|
255
|
1
|
|
Kebobo (AAB)
|
256
|
1
|
|
Limbulu (AAB)
|
257
|
1
|
|
Limbulu (AAB)
|
258
|
1
|
|
Kagomagoma (AAB)
|
259
|
1
|
|
Kagomagoma (AAB)
|
260
|
2
|
|
Mbuzi (AAB)
|
261
|
2
|
|
Mbuzi (AAB)
|
262
|
1
|
|
Mokamata (AAA)
|
263
|
1
|
|
Mokamata (AAA)
|
264
|
1
|
|
Limbulu (AAB)
|
265
|
1
|
|
Kebobo (AAB)
|
266
|
1
|
|
100
|
Mbuzi ( AAB)
|
267
|
1
|
|
Mbuzi ( AAB)
|
268
|
1
|
|
Kamera (AAA)
|
269
|
1
|
|
Kamera (AAA)
|
270
|
1
|
|
Tableau 22 : Cultivars de bananiers
identifiés dans le territoire de KIBOMBO
Villages
|
Cultivars
|
Individus
|
Groupes
(Cluster)
|
Lokenye
|
Mwasi zoba (AAA)
|
1
|
1
|
Jardin de cases
|
Papulu (AAB)
|
2
|
2
|
|
Papulu (AAB)
|
3
|
2
|
|
Mbalimbali (AAB)
|
4
|
2
|
|
Utanga (AAB)
|
5
|
3
|
|
Mbuzi (AAB)
|
6
|
3
|
|
Mbuzi (AAB)
|
7
|
3
|
|
Kitika asili (AAA)
|
8
|
3
|
|
Kamera (AAA)
|
9
|
2
|
|
Mwasi zoba (AAA)
|
10
|
3
|
|
Ngumi (AAA)
|
11
|
4
|
|
Ngumi (AAA)
|
12
|
4
|
|
Ngumi (AAA)
|
13
|
3
|
|
Utanga (AAB)
|
14
|
3
|
|
Utanga (AAB)
|
15
|
3
|
|
Papulu (AAB)
|
16
|
3
|
|
Mbuzi (AAB)
|
17
|
2
|
|
Mbuzi (AAB)
|
18
|
3
|
|
Utanga (AAB)
|
19
|
3
|
|
Mbuzi (AAB)
|
20
|
3
|
|
Papulu (AAB)
|
21
|
3
|
|
Kamera (AAA)
|
22
|
3
|
|
Mwasi zoba (AAA)
|
23
|
1
|
|
Utanga (AAB)
|
24
|
3
|
|
Mbuzi (AAB)
|
25
|
4
|
|
Utanga (AAB)
|
26
|
3
|
|
Mbuzi (AAB)
|
27
|
3
|
|
Papulu (AAB)
|
28
|
3
|
|
Papulu (AAB)
|
29
|
3
|
|
Papulu (AAB)
|
30
|
3
|
Champ 2
|
Ibota (AAB)
|
31
|
3
|
|
Ibota (AAB)
|
32
|
3
|
|
Ibota (AAB)
|
33
|
1
|
|
Utanga (AAB)
|
34
|
3
|
|
101
|
Saba (AAB)
|
35
|
3
|
|
Saba (AAB)
|
36
|
3
|
|
Utanga (AAB)
|
37
|
3
|
|
Utanga (AAB)
|
38
|
3
|
|
Mbuzi (AAB)
|
39
|
3
|
|
Mbuzi (AAB)
|
40
|
3
|
|
Papulu (AAB)
|
41
|
3
|
|
Papulu (AAB)
|
42
|
3
|
|
Mwasi zoba (AAA)
|
43
|
3
|
|
Mwasi zoba (AAA)
|
44
|
1
|
|
Kamera (AAA)
|
45
|
3
|
|
Ibota (AAB)
|
46
|
3
|
|
Papulu (AAB)
|
47
|
3
|
|
Ibota (AAB)
|
48
|
3
|
|
Ibota (AAB)
|
49
|
3
|
|
Utanga (AAB)
|
50
|
3
|
|
Mwasi zoba (AAA)
|
51
|
4
|
|
Mbuzi (AAB)
|
52
|
3
|
|
Mbuzi (AAB)
|
53
|
3
|
|
Utanga (AAB)
|
54
|
3
|
|
Utanga (AAB)
|
55
|
3
|
|
Kamera (AAA)
|
56
|
3
|
|
Kamera (AAA)
|
57
|
1
|
|
Papulu (AAB)
|
58
|
1
|
|
Papulu (AAB)
|
59
|
4
|
|
Mbuzi (AAB)
|
60
|
3
|
Champ 3
|
Kitika asili (AAA)
|
61
|
3
|
|
Utanga (AAB)
|
62
|
4
|
|
Utanga (AAB)
|
63
|
4
|
|
Mbalimbali (AAB)
|
64
|
3
|
|
Mbalimbali (AAB)
|
65
|
3
|
|
Mbalimbali (AAB)
|
66
|
3
|
|
Kitika asili (AAA)
|
67
|
3
|
|
Kitika asili (AAA)
|
68
|
3
|
|
Kamera (AAA)
|
69
|
3
|
|
Utanga (AAB)
|
70
|
3
|
|
Mbuzi (AAB)
|
71
|
3
|
|
Mbuzi (AAB)
|
72
|
3
|
|
Saba (AAB)
|
73
|
2
|
|
Saba (AAB)
|
74
|
3
|
|
Utanga (AAB)
|
75
|
3
|
|
Utanga (AAB)
|
76
|
1
|
|
Mbuzi (AAB)
|
77
|
3
|
|
102
|
Kitika asili (AAA)
|
78
|
3
|
|
Kitika asili (AAA)
|
79
|
2
|
|
Mbuzi (AAB)
|
80
|
3
|
|
Mbuzi (AAB)
|
81
|
3
|
|
Utanga (AAB)
|
82
|
3
|
|
Utanga (AAB)
|
83
|
3
|
|
Utanga (AAB)
|
84
|
3
|
|
Utanga (AAB)
|
85
|
3
|
|
Kamera (AAA)
|
86
|
3
|
|
Mbalimbali (AAB)
|
87
|
3
|
|
Mbalimbali (AAB)
|
88
|
1
|
|
Mbalimbali (AAB)
|
89
|
2
|
|
Kamera (AAA)
|
90
|
3
|
Bilundu
|
Mbudi (AAB)
|
91
|
3
|
Jardin de cases
|
Papulu (AAB)
|
92
|
2
|
|
Utanga (AAB)
|
93
|
1
|
|
Utanga (AAB)
|
94
|
4
|
|
Mbudi (AAB)
|
95
|
3
|
|
Mbudi (AAB)
|
96
|
3
|
|
Mwasi zoba (AAA)
|
97
|
3
|
|
Mwasi zoba (AAA)
|
98
|
1
|
|
Mwasi zoba (AAA)
|
99
|
1
|
|
Ibota (AAB)
|
100
|
3
|
|
Ibota (AAB)
|
101
|
4
|
|
Papulu (AAB)
|
102
|
3
|
|
Papulu (AAB)
|
103
|
3
|
|
Papulu (AAB)
|
104
|
3
|
|
Saba (AAB)
|
105
|
3
|
|
Saba (AAB)
|
106
|
3
|
|
Saba (AAB)
|
107
|
2
|
|
Utanga (AAB)
|
108
|
2
|
|
Papulu (AAB)
|
109
|
4
|
|
Kamera ( AAA)
|
110
|
3
|
|
Kamera ( AAA)
|
111
|
3
|
|
Utanga (AAB)
|
112
|
1
|
|
Utanga (AAB)
|
113
|
4
|
|
Utanga (AAB)
|
114
|
3
|
|
Saba (AAB)
|
115
|
3
|
|
Kamera ( AAA)
|
116
|
4
|
|
Mwasi zoba (AAA)
|
117
|
4
|
|
Mwasi zoba (AAA)
|
118
|
3
|
|
Mwasi zoba (AAA)
|
119
|
3
|
|
Saba (AAB)
|
120
|
3
|
|
103
Champ 2
|
Kebobo (AAB)
|
121
|
3
|
|
Kebobo (AAB)
|
122
|
3
|
|
Kebobo (AAB)
|
123
|
4
|
|
Kebobo (AAB)
|
124
|
1
|
|
Mukokia (AAB)
|
125
|
4
|
|
Mukokia (AAB)
|
126
|
3
|
|
Mwasi zoba (AAA)
|
127
|
4
|
|
Mwasi zoba (AAA)
|
128
|
4
|
|
Mwasi zoba (AAA)
|
129
|
4
|
|
Muumpu (AAB)
|
130
|
4
|
|
Muumpu (AAB)
|
131
|
3
|
|
Bitika ( AAA)
|
132
|
3
|
|
Kamera ( AAA)
|
133
|
3
|
|
Bitika ( AAA)
|
134
|
4
|
|
Saba (AAB)
|
135
|
2
|
|
Saba (AAB)
|
136
|
4
|
|
Saba (AAB)
|
137
|
3
|
|
Papulu (AAB)
|
138
|
4
|
|
Ibota (AAB)
|
139
|
2
|
|
Kebobo (AAB)
|
140
|
3
|
|
Ibota (AAB)
|
141
|
4
|
|
Ibota (AAB)
|
142
|
3
|
|
Mukokia (AAB)
|
143
|
4
|
|
Mukokia (AAB)
|
144
|
3
|
|
Muumpu (AAB)
|
145
|
3
|
|
Muumpu (AAB)
|
146
|
4
|
|
Ibota (AAB)
|
147
|
2
|
|
Kamera ( AAA)
|
148
|
4
|
|
Ibota (AAB)
|
149
|
4
|
|
Papulu (AAB)
|
150
|
4
|
Champ 3
|
Kamera ( AAA)
|
151
|
3
|
|
Kamera ( AAA)
|
152
|
1
|
|
Muumpu (AAB)
|
153
|
3
|
|
Mbudi (AAB)
|
154
|
3
|
|
Mbudi (AAB)
|
155
|
3
|
|
Bitika ( AAA)
|
156
|
4
|
|
Kebobo (AAB)
|
157
|
4
|
|
Muumpu (AAB)
|
158
|
4
|
|
Muumpu (AAB)
|
159
|
4
|
|
Kamera ( AAA)
|
160
|
4
|
|
Ibota (AAB)
|
161
|
2
|
|
Kamera ( AAA)
|
162
|
3
|
|
Mbudi (AAB)
|
163
|
3
|
|
104
|
Mbudi (AAB)
|
164
|
1
|
|
Mbudi (AAB)
|
165
|
4
|
|
Kebobo (AAB)
|
166
|
4
|
|
Bitika ( AAA)
|
167
|
2
|
|
Bitika ( AAA)
|
168
|
3
|
|
Ibota (AAB)
|
169
|
3
|
|
Bisamunyo ( AAA)
|
170
|
3
|
|
Kebobo (AAB)
|
171
|
4
|
|
Kebobo (AAB)
|
172
|
4
|
|
Mbudi (AAB)
|
173
|
4
|
|
Bitika ( AAA)
|
174
|
4
|
|
Muumpu (AAB)
|
175
|
4
|
|
Muumpu (AAB)
|
176
|
3
|
|
Ibota (AAB)
|
177
|
1
|
|
Kamera ( AAA)
|
178
|
2
|
|
Kamera ( AAA)
|
179
|
3
|
|
Kebobo (AAB)
|
180
|
4
|
Otshiko (Difuma II)
|
Kamera ( AAA)
|
181
|
3
|
Jardin de cases
|
Kamera ( AAA)
|
182
|
3
|
|
Kamera ( AAA)
|
183
|
3
|
|
Ndizi sokomutu (AAB)
|
184
|
4
|
|
Tuumpu (AAB)
|
185
|
4
|
|
Tuumpu (AAB)
|
186
|
4
|
|
Bisamunyo (AAA)
|
187
|
1
|
|
Bisamunyo (AAA)
|
188
|
2
|
|
Mbudi (AAB)
|
189
|
4
|
|
Mbudi (AAB)
|
190
|
4
|
|
Tuumpu (AAB)
|
191
|
4
|
|
Ibota (AAB)
|
192
|
4
|
|
Ibota (AAB)
|
193
|
4
|
|
Ibota (AAB)
|
194
|
4
|
|
Ndizi sokomutu (AAB)
|
195
|
4
|
|
Ndizi sokomutu (AAB)
|
196
|
4
|
|
Kebobo (AAB)
|
197
|
4
|
|
Kebobo (AAB)
|
198
|
4
|
|
Mbudi (AAB)
|
199
|
1
|
|
Mbudi (AAB)
|
200
|
4
|
|
Mbudi (AAB)
|
201
|
3
|
|
Kamera ( AAA)
|
202
|
3
|
|
Kamera ( AAA)
|
203
|
3
|
|
Tuumpu (AAB)
|
204
|
3
|
|
Tuumpu (AAB)
|
205
|
2
|
|
Tuumpu (AAB)
|
206
|
2
|
|
105
|
Mbudi (AAB)
|
207
|
4
|
|
Bitika ( AAA)
|
208
|
4
|
|
Bitika ( AAA)
|
209
|
4
|
|
Bitika ( AAA)
|
210
|
4
|
Champ 2
|
Limbulu (AAB)
|
211
|
4
|
|
Limbulu (AAB)
|
212
|
4
|
|
Limbulu (AAB)
|
213
|
4
|
|
Mukokia (AAB)
|
214
|
4
|
|
Mukokia (AAB)
|
215
|
4
|
|
Kimpenepene (AAB)
|
216
|
4
|
|
Limbulu (AAB)
|
217
|
4
|
|
Limbulu (AAB)
|
218
|
4
|
|
Bitika ( AAA)
|
219
|
1
|
|
Bitika ( AAA)
|
220
|
4
|
|
Mukokia (AAB)
|
221
|
3
|
|
Limbulu (AAB)
|
222
|
4
|
|
Kamera ( AAA)
|
223
|
4
|
|
Kamera ( AAA)
|
224
|
3
|
|
Kimpenepene (AAB)
|
225
|
1
|
|
Mukokia (AAB)
|
226
|
4
|
|
Tuumpu (AAB)
|
227
|
4
|
|
Tuumpu (AAB)
|
228
|
3
|
|
Tuumpu (AAB)
|
229
|
3
|
|
Kimpenepene (AAB)
|
230
|
4
|
|
Kimpenepene (AAB)
|
231
|
4
|
|
Kamera ( AAA)
|
232
|
4
|
|
Limbulu (AAB)
|
233
|
4
|
|
Limbulu (AAB)
|
234
|
3
|
|
Bitika ( AAA)
|
235
|
4
|
|
Bitika ( AAA)
|
236
|
2
|
|
Bitika ( AAA)
|
237
|
4
|
|
Mukokia (AAB)
|
238
|
4
|
|
Kimpenepene (AAB)
|
239
|
3
|
|
Kimpenepene (AAB)
|
240
|
4
|
Champ 3
|
Mbudi (AAB)
|
241
|
2
|
|
Saba (AAB)
|
242
|
1
|
|
Saba (AAB)
|
243
|
3
|
|
Saba (AAB)
|
244
|
1
|
|
Mukokia ( AAB)
|
245
|
3
|
|
Mukokia ( AAB)
|
246
|
4
|
|
Kamera ( AAA)
|
247
|
4
|
|
Kamera ( AAA)
|
248
|
4
|
|
Mbudi (AAB)
|
249
|
4
|
|
106
|
Mbudi (AAB)
|
250
|
4
|
|
Ndizi sokomutu (AAB)
|
251
|
3
|
|
Mbudi (AAB)
|
252
|
4
|
|
Bitika ( AAA)
|
253
|
4
|
|
Bitika ( AAA)
|
254
|
4
|
|
Ndizi sokomutu (AAB)
|
255
|
3
|
|
Ndizi sokomutu (AAB)
|
256
|
3
|
|
Tuumpu ( AAB)
|
257
|
3
|
|
Tuumpu ( AAB)
|
258
|
4
|
|
Tuumpu ( AAB)
|
259
|
4
|
|
Mbudi (AAB)
|
260
|
4
|
|
Mbudi (AAB)
|
261
|
3
|
|
Mbudi (AAB)
|
262
|
3
|
|
Mbudi (AAB)
|
263
|
3
|
|
Ndizi sokomutu (AAB)
|
264
|
2
|
|
Ndizi sokomutu (AAB)
|
265
|
4
|
|
Mbudi (AAB)
|
266
|
3
|
|
Mbudi (AAB)
|
267
|
3
|
|
Mbudi (AAB)
|
268
|
4
|
|
Kamera ( AAA)
|
269
|
4
|
|
Kamera ( AAA)
|
270
|
4
|
|
Tableau 23 : Cultivars de bananiers
identifiés dans le territoire de PUNIA
Villages
|
Cultivars
|
Individus
|
Groupes (Cluster)
|
Amangobo
|
Alua (AAB)
|
1
|
1
|
Jardin de cases
|
Kitika murefu (AAA)
|
2
|
2
|
|
Kamera ( AAA)
|
3
|
3
|
|
Abolo (AAB)
|
4
|
2
|
|
Bonjilo ( AAB)
|
5
|
2
|
|
Amaiganga (AAB)
|
6
|
2
|
|
Abolo (AAB)
|
7
|
2
|
|
Kamera ( AAA)
|
8
|
2
|
|
Abolo (AAB)
|
9
|
2
|
|
Kamera ( AAA)
|
10
|
3
|
|
Abolo (AAB)
|
11
|
2
|
|
107
|
Okondima (AAA)
|
12
|
3
|
|
Bitika mushipa ( AAA)
|
13
|
2
|
|
Mogogo ( AAB)
|
14
|
2
|
|
Abolo (AAB)
|
15
|
2
|
|
Kanjiko ( AAB)
|
16
|
2
|
|
Abolo (AAB)
|
17
|
1
|
|
Bonjilo ( AAB)
|
18
|
2
|
|
Abolo (AAB)
|
19
|
3
|
|
Kamera ( AAA)
|
20
|
2
|
|
Kamera ( AAA)
|
21
|
2
|
|
Alua (AAB)
|
22
|
3
|
|
Amaiganga (AAB)
|
23
|
2
|
|
Abolo (AAB)
|
24
|
3
|
|
Kengwekengweke (AAB)
|
25
|
3
|
|
Kengwekengweke (AAB)
|
26
|
2
|
|
Bonjilo ( AAB)
|
27
|
1
|
|
Ikosa ( AAB)
|
28
|
1
|
|
Alua (AAB)
|
29
|
2
|
|
Alua (AAB)
|
30
|
3
|
Champ 2
|
Leke (AAB)
|
31
|
2
|
|
Abolo (AAB)
|
32
|
2
|
|
Bonjilo ( AAB)
|
33
|
1
|
|
Kengwekengweke (AAB)
|
34
|
2
|
|
Mobingele (AAB)
|
35
|
2
|
|
Abolo (AAB)
|
36
|
2
|
|
Abolo (AAB)
|
37
|
2
|
|
Abolo (AAB)
|
38
|
3
|
|
Nkumonkumo (AAB)
|
39
|
3
|
|
Bonjilo ( AAB)
|
40
|
2
|
|
Kamera ( AAA)
|
41
|
2
|
|
Kanjiko ( AAB)
|
42
|
2
|
|
Kitika sukari (AAA)
|
43
|
2
|
|
Kitika sukari ( AAA)
|
44
|
2
|
|
Bonjilo ( AAB)
|
45
|
2
|
|
Alua (AAB)
|
46
|
2
|
|
Akoto ( AAB)
|
47
|
2
|
|
Amakodekeke (AAB)
|
48
|
2
|
|
Akoto ( AAB)
|
49
|
2
|
|
Amaiganga (AAB)
|
50
|
3
|
|
Alua (AAB)
|
51
|
2
|
|
Amakodekeke (AAB)
|
52
|
2
|
|
Ikosa ( AAB)
|
53
|
2
|
|
Mogogo ( AAB)
|
54
|
3
|
|
108
|
Ikosa ( AAB)
|
55
|
2
|
|
Ikosa ( AAB)
|
56
|
2
|
|
Kamera ( AAA)
|
57
|
2
|
|
Kisamuni ( AAA)
|
58
|
2
|
|
Kamera ( AAA)
|
59
|
2
|
|
Amaiganga (AAB)
|
60
|
2
|
Champ 3
|
Ikosa ( AAB)
|
61
|
3
|
|
Ikosa ( AAB)
|
62
|
2
|
|
Leke (AAB)
|
63
|
2
|
|
Abolo (AAB)
|
64
|
2
|
|
Abolo (AAB)
|
65
|
2
|
|
Kamera ( AAA)
|
66
|
2
|
|
Kanjiko ( AAB)
|
67
|
2
|
|
Kanjiko ( AAB)
|
68
|
2
|
|
Abolo (AAB)
|
69
|
2
|
|
Ikosa ( AAB)
|
70
|
2
|
|
Abolo (AAB)
|
71
|
2
|
|
Kanjiko ( AAB)
|
72
|
2
|
|
Kengwekengweke (AAB)
|
73
|
2
|
|
Abolo (AAB)
|
74
|
2
|
|
Abolo (AAB)
|
75
|
2
|
|
Ikosa ( AAB)
|
76
|
3
|
|
Kitika sukari ( AAA)
|
77
|
2
|
|
Bonjilo ( AAB)
|
78
|
2
|
|
Bonjilo ( AAB)
|
79
|
2
|
|
Kitika sukari ( AAA)
|
80
|
2
|
|
Abolo (AAB)
|
81
|
3
|
|
Bisamuni (AAA)
|
82
|
2
|
|
Banana ( AAA)
|
83
|
2
|
|
Abolo (AAB)
|
84
|
2
|
|
Kitika sukari ( AAA)
|
85
|
2
|
|
Abolo (AAB)
|
86
|
2
|
|
Mogogo ( AAB)
|
87
|
2
|
|
Kanjiko ( AAB)
|
88
|
2
|
|
Abolo (AAB)
|
89
|
2
|
|
Mogogo ( AAB)
|
90
|
2
|
Bakasubi
|
Abolo ( AAB)
|
91
|
2
|
Jardin de cases
|
Kamera ( AAA)
|
92
|
1
|
|
Kamera ( AAA)
|
93
|
2
|
|
Kamera ( AAA)
|
94
|
2
|
|
Kamera ( AAA)
|
95
|
2
|
|
Kitika murefu ( AAA)
|
96
|
2
|
|
Kitika mushipa ( AAA)
|
97
|
1
|
|
109
|
Abolo ( AAB)
|
98
|
2
|
|
Bonjilo ( AAB)
|
99
|
2
|
|
Kitika mushipa ( AAA)
|
100
|
3
|
|
Bonjilo ( AAB)
|
101
|
2
|
|
Bonjilo ( AAB)
|
102
|
2
|
|
Abolo ( AAB)
|
103
|
1
|
|
Bonjilo ( AAB)
|
104
|
2
|
|
Abolo ( AAB)
|
105
|
2
|
|
Bonjilo ( AAB)
|
106
|
2
|
|
Abolo ( AAB)
|
107
|
3
|
|
Abolo ( AAB)
|
108
|
3
|
|
Bonjilo ( AAB)
|
109
|
2
|
|
Kamera ( AAA)
|
110
|
2
|
|
Kamera ( AAA)
|
111
|
2
|
|
Kamera ( AAA)
|
112
|
2
|
|
Amaambonge ( AAB)
|
113
|
3
|
|
Abolo ( AAB)
|
114
|
3
|
|
Muyaudi ( AAA)
|
115
|
1
|
|
Bonjilo ( AAB)
|
116
|
2
|
|
Bonjilo ( AAB)
|
117
|
2
|
|
Abolo ( AAB)
|
118
|
2
|
|
Abolo ( AAB)
|
119
|
2
|
|
Kamera ( AAA)
|
120
|
3
|
Champ 2
|
Bonjilo ( AAB)
|
121
|
3
|
|
Bonjilo ( AAB)
|
122
|
2
|
|
Abolo ( AAB)
|
123
|
2
|
|
Abolo ( AAB)
|
124
|
2
|
|
Bonjilo ( AAB)
|
125
|
3
|
|
Kamera ( AAA)
|
126
|
2
|
|
Abolo ( AAB)
|
127
|
1
|
|
Abolo ( AAB)
|
128
|
2
|
|
Kitika mushipa ( AAA)
|
129
|
3
|
|
Kamera ( AAA)
|
130
|
2
|
|
Amaiganga ( AAB)
|
131
|
2
|
|
Amaambonge ( AAB)
|
132
|
2
|
|
Amaambonge ( AAB)
|
133
|
3
|
|
Bisamuni ( AAA)
|
134
|
2
|
|
Kitika mushipa ( AAA)
|
135
|
2
|
|
Abolo ( AAB)
|
136
|
2
|
|
Bonjilo ( AAB)
|
137
|
2
|
|
Amakakamuchi (AAB)
|
138
|
2
|
|
Bonjilo ( AAB)
|
139
|
2
|
|
Kitika sukari ( AAA)
|
140
|
2
|
|
110
|
Kitika sukari ( AAA)
|
141
|
2
|
|
Amaambonge ( AAB)
|
142
|
3
|
|
Kitika murefu ( AAA)
|
143
|
2
|
|
Kitika murefu ( AAA)
|
144
|
2
|
|
Abolo ( AAB)
|
145
|
2
|
|
Abolo ( AAB)
|
146
|
2
|
|
Bonjilo ( AAB)
|
147
|
2
|
|
Kitika sukari ( AAA)
|
148
|
2
|
|
Kamera ( AAA)
|
149
|
2
|
|
Abolo ( AAB)
|
150
|
2
|
Champ 3
|
Abolo ( AAB)
|
151
|
2
|
|
Kabako ( AAB)
|
152
|
2
|
|
Kitika sukari ( AAA)
|
153
|
2
|
|
Mobingele ( AAB)
|
154
|
3
|
|
Amangwenda (AAB)
|
155
|
2
|
|
Abolo ( AAB)
|
156
|
2
|
|
Amaambonge ( AAB)
|
157
|
3
|
|
Mobingele ( AAB)
|
158
|
2
|
|
Kanjiko (AAB)
|
159
|
2
|
|
Gbeke gbeke ( AAB)
|
160
|
2
|
|
Busamuni (AAA)
|
161
|
1
|
|
Kitika sukari ( AAA)
|
162
|
2
|
|
Ikosa (AAB)
|
163
|
2
|
|
Kabako ( AAB)
|
164
|
2
|
|
Bonjilo ( AAB)
|
165
|
2
|
|
Bisamuni ( AAA)
|
166
|
2
|
|
Kitika murefu ( AAA)
|
167
|
2
|
|
Kabako ( AAB)
|
168
|
2
|
|
Ikosa (AAB)
|
169
|
2
|
|
Kitika sukari ( AAA)
|
170
|
2
|
|
Abolo ( AAB)
|
171
|
3
|
|
Gbeke gbeke ( AAB)
|
172
|
2
|
|
Bonjilo ( AAB)
|
173
|
2
|
|
Abolo ( AAB)
|
174
|
2
|
|
Mobingele ( AAB)
|
175
|
2
|
|
Ikosa (AAB)
|
176
|
2
|
|
Abolo ( AAB)
|
177
|
2
|
|
Ikosa (AAB)
|
178
|
2
|
|
Kitika murefu ( AAA)
|
179
|
2
|
|
Kitika sukari ( AAA)
|
180
|
2
|
Gbonga
|
Bonjilo ( AAB)
|
181
|
2
|
Jardin de cases
|
Kanjiko ( AAB)
|
182
|
2
|
|
Kamera (AAA)
|
183
|
2
|
|
111
|
Kitika sukari ( AAA)
|
184
|
2
|
|
Kola (AAB)
|
185
|
3
|
|
Kanjiko ( AAB)
|
186
|
2
|
|
Amaiganga ( AAB)
|
187
|
3
|
|
Nyuki (AAB)
|
188
|
3
|
|
Nyuki (AAB)
|
189
|
2
|
|
Kitika sukari ( AAA)
|
190
|
2
|
|
Chanja ( AAB)
|
191
|
2
|
|
Chanja ( AAB)
|
192
|
2
|
|
Kanjiko ( AAB)
|
193
|
2
|
|
Kitika sukari ( AAA)
|
194
|
2
|
|
Kola (AAB)
|
195
|
2
|
|
Kamera (AAA)
|
196
|
2
|
|
Kamera (AAA)
|
197
|
2
|
|
Kitika murefu ( AAA)
|
198
|
2
|
|
Amaambonge ( AAB)
|
199
|
2
|
|
Kamera (AAA)
|
200
|
2
|
|
Kitika banana (AAA)
|
201
|
2
|
|
Ikosa (AAB)
|
202
|
2
|
|
Moyaudi (AAA)
|
203
|
3
|
|
Ikosa (AAB)
|
204
|
2
|
|
Abolo ( AAB)
|
205
|
1
|
|
Abolo ( AAB)
|
206
|
2
|
|
Nyuki (AAB)
|
207
|
2
|
|
Kola (AAB)
|
208
|
2
|
|
Amaiganga ( AAB)
|
209
|
2
|
Champ 2
|
Nyuki (AAB)
|
210
|
2
|
|
Kamera (AAA)
|
211
|
2
|
|
Kamera (AAA)
|
212
|
2
|
|
Abolo ( AAB)
|
213
|
3
|
|
Nyuki (AAB)
|
214
|
2
|
|
Kitika sukari ( AAA)
|
215
|
2
|
|
Amaambonge ( AAB)
|
216
|
2
|
|
Amaambonge ( AAB)
|
217
|
2
|
|
Ikosa (AAB)
|
218
|
2
|
|
Abolo ( AAB)
|
219
|
2
|
|
Bandombo ( AAB)
|
220
|
1
|
|
Kamera (AAA)
|
221
|
2
|
|
Ikosa (AAB)
|
222
|
2
|
|
Abolo ( AAB)
|
223
|
2
|
|
Kengwekengweke
|
224
|
2
|
|
Kola (AAB)
|
225
|
2
|
|
Kola (AAB)
|
226
|
2
|
|
112
|
Chanja ( AAB)
|
227
|
2
|
|
Abolo ( AAB)
|
228
|
2
|
|
Ikosa (AAB)
|
229
|
2
|
|
Nyuki (AAB)
|
230
|
2
|
|
Ikosa (AAB)
|
231
|
2
|
|
Amaiganga ( AAB)
|
232
|
2
|
|
Kamera (AAA)
|
233
|
3
|
|
Kanjiko ( AAB)
|
234
|
2
|
|
Kanjiko ( AAB)
|
235
|
2
|
|
Amaambonge ( AAB)
|
236
|
2
|
|
Ikosa (AAB)
|
237
|
2
|
|
Kitika Banana ( AAA)
|
238
|
2
|
|
Amaambonge ( AAB)
|
239
|
2
|
|
Kitika banana (AAA)
|
240
|
3
|
Champ 3
|
Maungu ( AAB)
|
241
|
2
|
|
Amakakamuchi (AAB)
|
242
|
2
|
|
Nyuki (AAB)
|
243
|
2
|
|
Abolo ( AAB)
|
244
|
3
|
|
Bitika murefu (AAA)
|
245
|
3
|
|
Nyuki (AAB)
|
246
|
1
|
|
Bandombo ( AAB)
|
247
|
1
|
|
Amebu (AAB)
|
248
|
2
|
|
Abolo ( AAB)
|
249
|
2
|
|
Amakakamuchi (AAB)
|
250
|
1
|
|
Bonjilo ( AAB)
|
251
|
2
|
|
Kamera (AAA)
|
252
|
2
|
|
Bonjilo ( AAB)
|
253
|
2
|
|
Kola (AAB)
|
254
|
3
|
|
Muyaudi (AAA)
|
255
|
2
|
|
Amaambonge ( AAB)
|
256
|
2
|
|
Chanja ( AAB)
|
257
|
2
|
|
Abolo ( AAB)
|
258
|
3
|
|
Bisamuni (AAA)
|
259
|
1
|
|
Ikosa (AAB)
|
260
|
3
|
|
Kamera (AAA)
|
261
|
2
|
|
Bitika sukari (AAA)
|
262
|
2
|
|
Amaambonge ( AAB)
|
263
|
2
|
|
Bitika sukari (AAA)
|
264
|
2
|
|
Kengwekengweke
|
265
|
2
|
|
Abolo ( AAB)
|
266
|
2
|
|
Abolo ( AAB)
|
267
|
2
|
|
Abolo ( AAB)
|
268
|
2
|
|
Kamera (AAA)
|
269
|
2
|
|
113
Bitika murefu (AAA)
|
270
|
2
|
|
Tableau 24 : Cultivars de bananiers
identifiés dans le territoire de LUBUTU
Villages
|
Cultivars
|
Individus
|
Groupes
(Cluster)
|
Amakonyola
|
Bitika sukari ( AAA)
|
1
|
1
|
Jardin de cases
|
Banana (AAA)
|
2
|
1
|
|
Bitika sukari ( AAA)
|
3
|
2
|
|
Gase (AAB)
|
4
|
1
|
|
Akoto (AAB)
|
5
|
1
|
|
Kambewa (AAB)
|
6
|
2
|
|
Amai kongo ikongo (AAB)
|
7
|
1
|
|
Gase (AAB)
|
8
|
1
|
|
Akoto (AAB)
|
9
|
1
|
|
Akoto (AAB)
|
10
|
1
|
|
Amai kongo ikongo (AAB)
|
11
|
1
|
|
Abonga ( AAA)
|
12
|
1
|
|
Abonga ( AAA)
|
13
|
2
|
|
Banana (AAA)
|
14
|
1
|
|
Gase (AAB)
|
15
|
1
|
|
Gase (AAB)
|
16
|
1
|
|
Amamundu ( AAB)
|
17
|
1
|
|
Mokombe ( AAB)
|
18
|
1
|
|
Alua (AAB)
|
19
|
1
|
|
Alua (AAB)
|
20
|
2
|
|
Mabonga ( AAB)
|
21
|
1
|
|
Mabonga ( AAB)
|
22
|
1
|
|
Bitika sukari ( AAA)
|
23
|
2
|
|
Amaakoko (AAB)
|
24
|
1
|
|
Banana (AAA)
|
25
|
1
|
|
Jaikonde (AAB)
|
26
|
3
|
|
Bitika sukari ( AAA)
|
27
|
1
|
|
Mabonga ( AAB)
|
28
|
1
|
|
Akoto (AAB)
|
29
|
1
|
|
Akoto (AAB)
|
30
|
1
|
Champ 2
|
Mokombe ( AAB)
|
31
|
2
|
|
Amaiganga (AAB)
|
32
|
1
|
|
Mokombe ( AAB)
|
33
|
1
|
|
Bitika sukari ( AAA)
|
34
|
1
|
|
Amaakoko (AAB)
|
35
|
1
|
|
Mabongo (AAA)
|
36
|
1
|
|
Mukandili (AAA)
|
37
|
2
|
|
114
|
Mukandili (AAA)
|
38
|
1
|
|
Eke (AAB)
|
39
|
1
|
|
Mokombe ( AAB)
|
40
|
1
|
|
Basika babingi (AAA)
|
41
|
1
|
|
Botabota (AAA)
|
42
|
1
|
|
Mabonga (AAA)
|
43
|
1
|
|
Amachimbechimbe (AAB)
|
44
|
1
|
|
Djoona ( AAB)
|
45
|
1
|
|
Kinjiko (AAB)
|
46
|
1
|
|
Kainganya (AAB)
|
47
|
3
|
|
Botabota (AAA)
|
48
|
1
|
|
Djoona ( AAB)
|
49
|
1
|
|
Mabonga (AAB)
|
50
|
1
|
|
Jaikonde (AAB)
|
51
|
1
|
|
Mokombe ( AAB)
|
52
|
1
|
|
Mabonga (AAA)
|
53
|
2
|
|
Amaiganga (AAB)
|
54
|
3
|
|
Amaiganga (AAB)
|
55
|
1
|
|
Eke (AAB)
|
56
|
3
|
|
Banana (AAA)
|
57
|
1
|
|
Alua (AAB)
|
58
|
1
|
|
Amamundu ( AAB)
|
59
|
2
|
|
Amamundu ( AAB)
|
60
|
1
|
Champ 3
|
Amaiganga (AAB)
|
61
|
3
|
|
Kitika sukari ( AAA)
|
62
|
1
|
|
Basika babingi (AAA)
|
63
|
1
|
|
Mbeu ( AAB)
|
64
|
3
|
|
Banana (AAA)
|
65
|
1
|
|
Eke (AAB)
|
66
|
2
|
|
Kitika sukari ( AAA)
|
67
|
1
|
|
Jaikonde (AAB)
|
68
|
1
|
|
Bisamuni (AAA)
|
69
|
1
|
|
Amai kongo ikongo (AAB)
|
70
|
2
|
|
Bitika sukari ( AAA)
|
71
|
3
|
|
Seko (AAB)
|
72
|
1
|
|
Mabonga (AAB)
|
73
|
1
|
|
Basika babingi (AAA)
|
74
|
3
|
|
Alua (AAB)
|
75
|
2
|
|
Mabonga (AAB)
|
76
|
1
|
|
Kainganya (AAB)
|
77
|
1
|
|
Konjiko (AAB)
|
78
|
1
|
|
Gase (AAB)
|
79
|
1
|
|
Amamundu ( AAB)
|
80
|
1
|
|
115
|
Banana (AAA)
|
81
|
1
|
|
Amachimbechimbe (AAB)
|
82
|
1
|
|
Bisamuni (AAA)
|
83
|
1
|
|
Amachimbechimbe (AAB)
|
84
|
1
|
|
Gase (AAB)
|
85
|
1
|
|
Mabonga (AAB)
|
86
|
2
|
|
Djoona ( AAB)
|
87
|
1
|
|
Akoto (AAB)
|
88
|
1
|
|
Amakakamuti (AAB)
|
89
|
1
|
|
Akoto (AAB)
|
90
|
1
|
Tingitingi
|
Akoto (AAB)
|
91
|
1
|
Jardin de cases
|
Kamera (AAA)
|
92
|
1
|
|
Bibotabota (AAA)
|
93
|
2
|
|
Kamera (AAA)
|
94
|
1
|
|
Bibotabota (AAA)
|
95
|
1
|
|
Akoto (AAB)
|
96
|
1
|
|
Gase (AAB)
|
97
|
2
|
|
Kamera (AAA)
|
98
|
1
|
|
Kamera (AAA)
|
99
|
1
|
|
Abolo (AAB)
|
100
|
1
|
|
Kamera (AAA)
|
101
|
1
|
|
Banana (AAA)
|
102
|
1
|
|
Abolo (AAB)
|
103
|
2
|
|
Mabonga (AAB)
|
104
|
1
|
|
Amakoko (AAB)
|
105
|
1
|
|
Gase (AAB)
|
106
|
2
|
|
Mabonga (AAB)
|
107
|
1
|
|
Mabonga (AAB)
|
108
|
1
|
|
Mabonga (AAB)
|
109
|
1
|
|
Banana (AAA)
|
110
|
1
|
|
Akoto (AAB)
|
111
|
1
|
|
Gase (AAB)
|
112
|
1
|
|
Kamera (AAA)
|
113
|
1
|
|
Gase (AAB)
|
114
|
1
|
|
Amamundu (AAB)
|
115
|
3
|
|
Amaiganga (AAB)
|
116
|
1
|
|
Akoto (AAB)
|
117
|
1
|
|
Kamera (AAA)
|
118
|
1
|
|
Bonjilo (AAB)
|
119
|
1
|
|
Bonjilo (AAB)
|
120
|
1
|
Champ 2
|
Gase (AAB)
|
121
|
1
|
|
Amaakoko (AAB)
|
122
|
1
|
|
Amaakoko (AAB)
|
123
|
1
|
|
116
|
Kamera (AAA)
|
124
|
1
|
|
Bonjilo (AAB)
|
125
|
2
|
|
Bonjilo (AAB)
|
126
|
2
|
|
Mayayi (AAB)
|
127
|
1
|
|
Bonjilo (AAB)
|
128
|
3
|
|
Kamera (AAA)
|
129
|
1
|
|
Mayayi (AAB)
|
130
|
1
|
|
Muyaudi (AAA)
|
131
|
1
|
|
Mayayi (AAB)
|
132
|
1
|
|
Bonjilo (AAB)
|
133
|
1
|
|
Kamera (AAA)
|
134
|
1
|
|
Gase (AAB)
|
135
|
1
|
|
Bibotabota (AAA)
|
136
|
1
|
|
Akoto (AAB)
|
137
|
1
|
|
Akoto (AAB)
|
138
|
1
|
|
Mabonga (AAB)
|
139
|
2
|
|
Akoto (AAB)
|
140
|
1
|
|
Gase (AAB)
|
141
|
1
|
|
Gase (AAB)
|
142
|
1
|
|
Amaakoko (AAB)
|
143
|
1
|
|
Banana (AAA)
|
144
|
3
|
|
Kamera (AAA)
|
145
|
1
|
|
Amaiganga (AAB)
|
146
|
1
|
|
Amaiganga (AAB)
|
147
|
1
|
|
Mabonga (AAB)
|
148
|
1
|
|
Gase (AAB)
|
149
|
1
|
|
Banana (AAA)
|
150
|
1
|
Champ 3
|
Bonjilo (AAB)
|
151
|
2
|
|
Amaakoko (AAB)
|
152
|
1
|
|
Bonjilo (AAB)
|
153
|
1
|
|
Mayayi (AAB)
|
154
|
1
|
|
Bibotabota (AAA)
|
155
|
1
|
|
Abolo (AAB)
|
156
|
1
|
|
Akoto (AAB)
|
157
|
2
|
|
Bonjilo (AAB)
|
158
|
1
|
|
Kamera (AAA)
|
159
|
1
|
|
Mabonga (AAB)
|
160
|
1
|
|
Bibotabota (AAA)
|
161
|
1
|
|
Abolo (AAB)
|
162
|
3
|
|
Abolo (AAB)
|
163
|
2
|
|
Amamundu (AAB)
|
164
|
1
|
|
Gase (AAB)
|
165
|
1
|
|
Akoto (AAB)
|
166
|
2
|
|
117
|
Mabonga (AAB)
|
167
|
1
|
|
Kamera (AAA)
|
168
|
1
|
|
Mabonga (AAB)
|
169
|
1
|
|
Akoto (AAB)
|
170
|
2
|
|
Gase (AAB)
|
171
|
1
|
|
Banana (AAA)
|
172
|
1
|
|
Bibotabota (AAA)
|
173
|
1
|
|
Amaiganga (AAB)
|
174
|
2
|
|
Amamundu (AAB)
|
175
|
1
|
|
Amaiganga (AAB)
|
176
|
1
|
|
Banana (AAA)
|
177
|
1
|
|
Bonjilo (AAB)
|
178
|
1
|
|
Akoto (AAB)
|
179
|
1
|
|
Banana (AAA)
|
180
|
1
|
Omoyaki
|
Akoto (AAB)
|
181
|
1
|
Jardin de cases
|
Kitika sukari (AAA)
|
182
|
1
|
|
Amaiganga (AAB)
|
183
|
2
|
|
Banana (AAA)
|
184
|
2
|
|
Akoto (AAB)
|
185
|
1
|
|
Akoto (AAB)
|
186
|
2
|
|
Dobodobo ( AAA)
|
187
|
1
|
|
Dobodobo ( AAA)
|
188
|
1
|
|
Amakakamuti (AAB)
|
189
|
1
|
|
Kaumbo (AAB)
|
190
|
1
|
|
Akoto (AAB)
|
191
|
1
|
|
Amaiganga (AAB)
|
192
|
1
|
|
Amaiganga (AAB)
|
193
|
2
|
|
Banana (AAA)
|
194
|
1
|
|
Banana (AAA)
|
195
|
1
|
|
Dobodobo ( AAA)
|
196
|
1
|
|
Banana (AAA)
|
197
|
1
|
|
Gase (AAB)
|
198
|
2
|
|
Banana (AAA)
|
199
|
1
|
|
Akoto (AAB)
|
200
|
1
|
|
Akoto (AAB)
|
201
|
1
|
|
Mabonga (AAA)
|
202
|
1
|
|
Mabonga (AAA)
|
203
|
1
|
|
Dobodobo ( AAA)
|
204
|
1
|
|
Kitika sukari ( AAA)
|
205
|
1
|
|
Amamundu (AAB)
|
206
|
1
|
|
Amamundu (AAB)
|
207
|
3
|
|
Dobodobo ( AAA)
|
208
|
1
|
|
Akoto (AAB)
|
209
|
1
|
|
118
|
Mabonga (AAA)
|
210
|
1
|
Champ 2
|
Mabonga (AAA)
|
211
|
1
|
|
Bonjilo (AAB)
|
212
|
1
|
|
Abolo (AAB)
|
213
|
2
|
|
Abolo (AAB)
|
214
|
1
|
|
Mabonga (AAA)
|
215
|
2
|
|
Bonjilo (AAB)
|
216
|
1
|
|
kisamuna (AAA)
|
217
|
3
|
|
Kamera (AAA)
|
218
|
1
|
|
Mongwekengweke (AAB)
|
219
|
1
|
|
Amambunge (AAB)
|
220
|
1
|
|
Kalolo (AAB)
|
221
|
1
|
|
Ikosa (AAB)
|
222
|
1
|
|
Amaiganga (AAB)
|
223
|
1
|
|
Kamera (AAA)
|
224
|
1
|
|
Katutu (AAB)
|
225
|
1
|
|
Ikosa (AAB)
|
226
|
1
|
|
Kalolo (AAB)
|
227
|
1
|
|
Amambunge (AAB)
|
228
|
1
|
|
Ikosa (AAB)
|
229
|
1
|
|
Banana (AAA)
|
230
|
1
|
|
Aloba (AAB)
|
231
|
1
|
|
Kalolo (AAB)
|
232
|
1
|
|
Kitika sukari ( AAA)
|
233
|
1
|
|
Ikosa (AAB)
|
234
|
1
|
|
Kanjiko ( AAB)
|
235
|
1
|
|
Kalolo (AAB)
|
236
|
1
|
|
Mongwekengweke (AAB)
|
237
|
1
|
|
Bosinda (AAB)
|
238
|
1
|
|
Bosinda (AAB)
|
239
|
1
|
|
Kamera (AAA)
|
240
|
2
|
Champ 3
|
Eke ( AAB)
|
241
|
2
|
|
Mukandili (AAA)
|
242
|
1
|
|
Mukandili (AAA)
|
243
|
1
|
|
Amakakamuti (AAB)
|
244
|
3
|
|
Akobo (AAB)
|
245
|
1
|
|
Amaiganga (AAB)
|
246
|
1
|
|
Amaiganga (AAB)
|
247
|
1
|
|
Kajiko (AAB)
|
248
|
1
|
|
Kitika sukari (AAA)
|
249
|
1
|
|
Mabonga (AAB)
|
250
|
1
|
|
Amebu (AAB)
|
251
|
1
|
|
Dobodobo ( AAA)
|
252
|
1
|
|
119
|
Dobodobo ( AAA)
|
253
|
1
|
|
Kajiko (AAB)
|
254
|
1
|
|
Mungomba ( AAB)
|
255
|
1
|
|
Akoto (AAB)
|
256
|
1
|
|
Kabiye (AAB)
|
257
|
1
|
|
Amamundu (AAB)
|
258
|
1
|
|
Amamundu (AAB)
|
259
|
1
|
|
Alua (AAB)
|
260
|
1
|
|
Dobodobo ( AAA)
|
261
|
1
|
|
Akoto (AAB)
|
262
|
1
|
|
Amaiganga (AAB)
|
263
|
1
|
|
Mobingele (AAB)
|
264
|
1
|
|
Kitika sukari (AAA)
|
265
|
1
|
|
Banana (AAA)
|
266
|
1
|
|
Gase (AAB)
|
267
|
2
|
|
Gase (AAB)
|
268
|
2
|
|
Banana (AAA)
|
269
|
1
|
|
Akoto (AAB)
|
270
|
1
|
|
Tableau 25 : Cultivars de bananiers
identifiés dans le territoire de KASONGO
Villages
|
Cultivars
|
Individus
|
Groupes
(Cluster)
|
Mungomba
|
Mbundi ( AAB)
|
1
|
1
|
Jardin de cases
|
Mbundi ( AAB)
|
2
|
2
|
|
Sola (AAA)
|
3
|
2
|
|
Kamera (AAA)
|
4
|
2
|
|
Kamera (AAA)
|
5
|
3
|
|
Kamera (AAA)
|
6
|
2
|
|
Lwizi (AAB)
|
7
|
2
|
|
Muke muyaudi (AAA)
|
8
|
4
|
|
Kangindi (AAB)
|
9
|
4
|
|
Kangindi (AAB)
|
10
|
3
|
|
Sola (AAA)
|
11
|
2
|
|
Sola (AAA)
|
12
|
3
|
|
Kangindi (AAB)
|
13
|
2
|
|
Kangindi (AAB)
|
14
|
3
|
|
Kavava (AAB)
|
15
|
2
|
|
Kavava (AAB)
|
16
|
1
|
|
Mukokoonde (AAB)
|
17
|
2
|
|
Kamera (AAA)
|
18
|
2
|
|
Lwizi (AAB)
|
19
|
3
|
|
Kabindi (AAB)
|
20
|
2
|
|
120
|
Kabindi (AAB)
|
21
|
3
|
|
Kibubu (AAB)
|
22
|
3
|
|
Kamera (AAA)
|
23
|
2
|
|
Kamera (AAA)
|
24
|
2
|
|
Kibubu (AAB)
|
25
|
3
|
|
Mbundi ( AAB)
|
26
|
3
|
|
Mbundi ( AAB)
|
27
|
2
|
|
Kavava (AAB)
|
28
|
2
|
|
Lwizi (AAB)
|
29
|
2
|
|
Muke muyaudi (AAA)
|
30
|
3
|
Champ 2
|
Muke muyaudi (AAA)
|
31
|
3
|
|
Mbundi ( AAB)
|
32
|
3
|
|
Kamera (AAA)
|
33
|
4
|
|
Kangindi (AAB)
|
34
|
3
|
|
Kakumbi (AAB)
|
35
|
2
|
|
Kamera (AAA)
|
36
|
4
|
|
Kibubu (AAB)
|
37
|
2
|
|
Mukokoonde (AAB)
|
38
|
3
|
|
Kamera (AAA)
|
39
|
2
|
|
Lwizi (AAB)
|
40
|
3
|
|
Kamera (AAA)
|
41
|
3
|
|
Lwizi (AAB)
|
42
|
4
|
|
Kakomakoma (AAB)
|
43
|
3
|
|
Lwizi (AAB)
|
44
|
2
|
|
Kamera (AAA)
|
45
|
2
|
|
Kibubu (AAB)
|
46
|
2
|
|
Lwizi (AAB)
|
47
|
3
|
|
Kibubu (AAB)
|
48
|
3
|
|
Kamera (AAA)
|
49
|
3
|
|
Kibubu (AAB)
|
50
|
1
|
|
Lwizi (AAB)
|
51
|
3
|
|
Kamera (AAA)
|
52
|
3
|
|
Muke muyaudi (AAA)
|
53
|
3
|
|
Kangindi (AAB)
|
54
|
1
|
|
Kakomakoma (AAB)
|
55
|
3
|
|
Sola (AAA)
|
56
|
3
|
|
Sola (AAA)
|
57
|
3
|
|
Mbundi ( AAB)
|
58
|
1
|
|
Lwizi (AAB)
|
59
|
2
|
|
Kangindi (AAB)
|
60
|
3
|
Champ 3
|
Mukokoonde (AAB)
|
61
|
4
|
|
Kakumbi (AAB)
|
62
|
3
|
|
Bisamuni (AAA)
|
63
|
1
|
|
121
|
Kakumbi (AAB)
|
64
|
4
|
|
Kakumbi (AAB)
|
65
|
1
|
|
Kakumbi (AAB)
|
66
|
2
|
|
Kakumbi (AAB)
|
67
|
2
|
|
Sola (AAA)
|
68
|
3
|
|
Kakumbi (AAB)
|
69
|
2
|
|
Sola (AAA)
|
70
|
2
|
|
Sola (AAA)
|
71
|
2
|
|
Kamera (AAA)
|
72
|
3
|
|
Mbundi ( AAB)
|
73
|
4
|
|
Mbundi ( AAB)
|
74
|
4
|
|
Muke muyaudi (AAA)
|
75
|
3
|
|
Lwizi (AAB)
|
76
|
3
|
|
Kamera (AAA)
|
77
|
3
|
|
Kangindi (AAB)
|
78
|
3
|
|
Kangindi (AAB)
|
79
|
2
|
|
Mbundi ( AAB)
|
80
|
3
|
|
Mukokoonde (AAB)
|
81
|
3
|
|
Mukokoonde (AAB)
|
82
|
3
|
|
Kibubu (AAB)
|
83
|
3
|
|
Kangindi (AAB)
|
84
|
3
|
|
Kangindi (AAB)
|
85
|
3
|
|
Kangindi (AAB)
|
86
|
2
|
|
Kibubu (AAB)
|
87
|
3
|
|
Kamera (AAA)
|
88
|
2
|
|
Lwizi (AAB)
|
89
|
3
|
|
Mbundi ( AAB)
|
90
|
3
|
Ndaradi
|
Mbole ( AAB)
|
91
|
3
|
Jardin cases
|
Atili ( AAB)
|
92
|
4
|
|
Mbole ( AAB)
|
93
|
3
|
|
Mbole ( AAB)
|
94
|
1
|
|
Kebobo (AAB)
|
95
|
3
|
|
Bambote (AAA)
|
96
|
4
|
|
Kebobo (AAB)
|
97
|
3
|
|
Mbole ( AAB)
|
98
|
3
|
|
Kamera (AAA)
|
99
|
2
|
|
Kalingondo (AAB)
|
100
|
3
|
|
Molebwa na nyama (AAB)
|
101
|
3
|
|
Molebwa na nyama (AAB)
|
102
|
2
|
|
Mbole ( AAB)
|
103
|
3
|
|
Kebobo (AAB)
|
104
|
3
|
|
Moyoni (AAA)
|
105
|
3
|
|
Moyoni (AAA)
|
106
|
3
|
|
122
|
Mbole ( AAB)
|
107
|
3
|
|
Kalingondo (AAB)
|
108
|
3
|
|
Moyoni (AAA)
|
109
|
2
|
|
Bambote (AAA)
|
110
|
3
|
|
Atili ( AAB)
|
111
|
2
|
|
Atili ( AAB)
|
112
|
3
|
|
Kalingondo (AAB)
|
113
|
3
|
|
Kamera (AAA)
|
114
|
2
|
|
Kamera (AAA)
|
115
|
4
|
|
Mbole ( AAB)
|
116
|
3
|
|
Mbole ( AAB)
|
117
|
3
|
|
Kamera (AAA)
|
118
|
2
|
|
Kebobo (AAB)
|
119
|
3
|
|
Kebobo (AAB)
|
120
|
3
|
Champ 2
|
Mbole ( AAB)
|
121
|
4
|
|
Molebwa na nyama (AAB)
|
122
|
2
|
|
Mbole ( AAB)
|
123
|
2
|
|
Bambote (AAA)
|
124
|
3
|
|
Bambote (AAA)
|
125
|
2
|
|
Moyoni (AAA)
|
126
|
1
|
|
Kalingondo (AAB)
|
127
|
3
|
|
Kalingondo (AAB)
|
128
|
3
|
|
Kalingondo (AAB)
|
129
|
3
|
|
Mbole ( AAB)
|
130
|
2
|
|
Atili ( AAB)
|
131
|
3
|
|
Atili ( AAB)
|
132
|
3
|
|
Kamera (AAA)
|
133
|
3
|
|
Kamera (AAA)
|
134
|
2
|
|
Atili ( AAB)
|
135
|
3
|
|
Mbole ( AAB)
|
136
|
3
|
|
Kalingondo (AAB)
|
137
|
3
|
|
Bambote (AAA)
|
138
|
3
|
|
Bambote (AAA)
|
139
|
2
|
|
Inamombo ( AAB)
|
140
|
3
|
|
Inamombo ( AAB)
|
141
|
3
|
|
Inamombo ( AAB)
|
142
|
2
|
|
Mbole ( AAB)
|
143
|
2
|
|
Kalingondo (AAB)
|
144
|
3
|
|
Kalingondo (AAB)
|
145
|
3
|
|
Bambote (AAA)
|
146
|
2
|
|
Atili ( AAB)
|
147
|
3
|
|
Bambote (AAA)
|
148
|
3
|
|
Kalingondo (AAB)
|
149
|
3
|
|
123
|
Kamera (AAA)
|
150
|
2
|
Champ 3
|
Molebwa na nyama (AAB)
|
151
|
2
|
|
Inamombo ( AAB)
|
152
|
3
|
|
Mbole ( AAB)
|
153
|
4
|
|
Mbole ( AAB)
|
154
|
3
|
|
Kebobo (AAB)
|
155
|
2
|
|
Mbole ( AAB)
|
156
|
3
|
|
Bambote (AAA)
|
157
|
3
|
|
Mbole ( AAB)
|
158
|
2
|
|
Mbole ( AAB)
|
159
|
2
|
|
Mbole ( AAB)
|
160
|
3
|
|
Atili ( AAB)
|
161
|
3
|
|
Atili ( AAB)
|
162
|
3
|
|
Kamera (AAA)
|
163
|
3
|
|
Kamera (AAA)
|
164
|
3
|
|
Bambote (AAA)
|
165
|
3
|
|
Bambote (AAA)
|
166
|
2
|
|
Kamera (AAA)
|
167
|
3
|
|
Kemesi (AAB)
|
168
|
2
|
|
Kalingondo (AAB)
|
169
|
3
|
|
Kalingondo (AAB)
|
170
|
3
|
|
Kalingondo (AAB)
|
171
|
2
|
|
Atili ( AAB)
|
172
|
3
|
|
Kamera (AAA)
|
173
|
3
|
|
Moyoni (AAA)
|
174
|
3
|
|
Mbole ( AAB)
|
175
|
2
|
|
Bambote (AAA)
|
176
|
3
|
|
Bambote (AAA)
|
177
|
3
|
|
Atili ( AAB)
|
178
|
3
|
|
Mbole ( AAB)
|
179
|
3
|
|
Mbole ( AAB)
|
180
|
1
|
Kasongo (limangaa)
|
Mbudi ( AAB)
|
181
|
3
|
Jardin de cases
|
Bitika pigme ( AAA)
|
182
|
3
|
|
Merenge ( AAA)
|
183
|
3
|
|
Kavava (AAB)
|
184
|
3
|
|
Kavava (AAB)
|
185
|
3
|
|
Mbudi ( AAB)
|
186
|
4
|
|
Mbudi ( AAB)
|
187
|
4
|
|
Kibubu (AAB)
|
188
|
2
|
|
Kibubu (AAB)
|
189
|
3
|
|
Sola (AAA)
|
190
|
3
|
|
Sola (AAA)
|
191
|
3
|
|
Lwizi (AAB)
|
192
|
2
|
|
124
|
Kibubu (AAB)
|
193
|
3
|
|
Kibubu (AAB)
|
194
|
2
|
|
Kamera (AAA)
|
195
|
3
|
|
Kamera (AAA)
|
196
|
3
|
|
Kamera (AAA)
|
197
|
3
|
|
Mbudi ( AAB)
|
198
|
3
|
|
Mbudi ( AAB)
|
199
|
3
|
|
Kavava (AAB)
|
200
|
2
|
|
Mbudi ( AAB)
|
201
|
3
|
|
Merenge ( AAA)
|
202
|
3
|
|
Merenge ( AAA)
|
203
|
3
|
|
Mbudi ( AAB)
|
204
|
1
|
|
Merenge ( AAA)
|
205
|
2
|
|
Kavava (AAB)
|
206
|
4
|
|
Kavava (AAB)
|
207
|
2
|
|
Sola (AAA)
|
208
|
3
|
|
Sola (AAA)
|
209
|
3
|
|
Merenge ( AAA)
|
210
|
3
|
Champ 2
|
Lwizi (AAB)
|
211
|
4
|
|
Lwizi (AAB)
|
212
|
3
|
|
Lwizi (AAB)
|
213
|
2
|
|
Mbudi ( AAB)
|
214
|
2
|
|
Mbudi ( AAB)
|
215
|
3
|
|
Mbudi ( AAB)
|
216
|
3
|
|
Kavava (AAB)
|
217
|
2
|
|
Kavava (AAB)
|
218
|
2
|
|
Mbudi ( AAB)
|
219
|
3
|
|
Sola (AAA)
|
220
|
3
|
|
Kibubu (AAB)
|
221
|
3
|
|
Lwizi (AAB)
|
222
|
4
|
|
Lwizi (AAB)
|
223
|
2
|
|
Kibubu (AAB)
|
224
|
3
|
|
Sola (AAA)
|
225
|
2
|
|
Sola (AAA)
|
226
|
3
|
|
Kibubu (AAB)
|
227
|
3
|
|
Kibubu (AAB)
|
228
|
3
|
|
Mbudi ( AAB)
|
229
|
3
|
|
Mbudi ( AAB)
|
230
|
2
|
|
Merenge ( AAA)
|
231
|
2
|
|
Merenge ( AAA)
|
232
|
4
|
|
Bitika pigme ( AAA)
|
233
|
3
|
|
Mbudi ( AAB)
|
234
|
3
|
|
Kibubu (AAB)
|
235
|
2
|
|
125
|
Bitika pigme ( AAA)
|
236
|
3
|
|
Kibubu (AAB)
|
237
|
2
|
|
Mbudi ( AAB)
|
238
|
2
|
|
Kamera (AAA)
|
239
|
3
|
|
Kamera (AAA)
|
240
|
4
|
Champ 3
|
Kavava (AAB)
|
241
|
4
|
|
Mbudi ( AAB)
|
242
|
3
|
|
Kavava (AAB)
|
243
|
3
|
|
Kibubu (AAB)
|
244
|
4
|
|
Kibubu (AAB)
|
245
|
3
|
|
Kabindi (AAB)
|
246
|
2
|
|
Kamera (AAA)
|
247
|
3
|
|
Mbudi ( AAB)
|
248
|
3
|
|
Mbudi ( AAB)
|
249
|
4
|
|
Kavava (AAB)
|
250
|
4
|
|
Sola (AAA)
|
251
|
3
|
|
Mbudi ( AAB)
|
252
|
4
|
|
Sola (AAA)
|
253
|
3
|
|
Kamera (AAA)
|
254
|
2
|
|
Sola (AAA)
|
255
|
2
|
|
Kibubu (AAB)
|
256
|
2
|
|
Mbudi ( AAB)
|
257
|
2
|
|
Mbudi ( AAB)
|
258
|
3
|
|
Kavava (AAB)
|
259
|
3
|
|
Mbudi ( AAB)
|
260
|
3
|
|
Lwizi (AAB)
|
261
|
3
|
|
Sola (AAA)
|
262
|
3
|
|
Lwizi (AAB)
|
263
|
2
|
|
Lwizi (AAB)
|
264
|
3
|
|
Mbudi ( AAB)
|
265
|
3
|
|
Mbudi ( AAB)
|
266
|
4
|
|
Kibubu (AAB)
|
267
|
2
|
|
Sola (AAA)
|
268
|
4
|
|
Kamera (AAA)
|
269
|
2
|
|
Kamera (AAA)
|
270
|
2
|
|
Tableau 26 : Cultivars de bananiers
identifiés dans le territoire de KABAMBARE
Villages
|
Cultivars
|
Individus
|
Groupes (Cluster)
|
Mwatunda
|
Mbijaonde (AAB)
|
1
|
1
|
Jardin de cases
|
Mbijaonde (AAB)
|
2
|
1
|
|
Musisa ( AAB)
|
3
|
1
|
|
126
|
Musisa ( AAB)
|
4
|
1
|
|
Kamera (AAA)
|
5
|
2
|
|
Kamera (AAA)
|
6
|
1
|
|
Kamera (AAA)
|
7
|
1
|
|
Mbudi (AAB)
|
8
|
1
|
|
Mbudi (AAB)
|
9
|
1
|
|
Mbudi (AAB)
|
10
|
1
|
|
Kiemba (AAB)
|
11
|
1
|
|
Kibubu (AAB)
|
12
|
1
|
|
Kibubu (AAB)
|
13
|
1
|
|
Kamera (AAA)
|
14
|
1
|
|
Kamoja (AAA)
|
15
|
1
|
|
Kamoja (AAA)
|
16
|
2
|
|
Kamoja (AAA)
|
17
|
1
|
|
Kisoko (AAB)
|
18
|
1
|
|
Molebwa na nyama (AAB)
|
19
|
1
|
|
Kisoko (AAB)
|
20
|
1
|
|
Kisoko (AAB)
|
21
|
1
|
|
Kabindi (AAB)
|
22
|
1
|
|
Sola (AAA)
|
23
|
1
|
|
Sola (AAA)
|
24
|
1
|
|
Molebwa na nyama (AAB)
|
25
|
1
|
|
Molebwa na nyama (AAB)
|
26
|
1
|
|
Muyaudi (AAA)
|
27
|
1
|
|
Muyaudi (AAA)
|
28
|
2
|
|
Kabindi (AAB)
|
29
|
1
|
|
Kabindi (AAB)
|
30
|
1
|
Champ 2
|
Muyaudi (AAA)
|
31
|
3
|
|
Kamera (AAA)
|
32
|
1
|
|
Sola (AAA)
|
33
|
1
|
|
Kabindi (AAB)
|
34
|
2
|
|
Mbudi (AAB)
|
35
|
1
|
|
Kiemba (AAB)
|
36
|
2
|
|
Mulioko (AAB)
|
37
|
1
|
|
Mukokonde (AAB)
|
38
|
1
|
|
Kabindi (AAB)
|
39
|
2
|
|
Kabindi (AAB)
|
40
|
1
|
|
Mbudi (AAB)
|
41
|
3
|
|
Mbudi (AAB)
|
42
|
3
|
|
Mbudi (AAB)
|
43
|
3
|
|
Kamera (AAA)
|
44
|
1
|
|
Kamera (AAA)
|
45
|
1
|
|
Kabindi (AAB)
|
46
|
1
|
|
127
|
Mbudi (AAB)
|
47
|
1
|
|
Mbudi (AAB)
|
48
|
2
|
|
Kamera (AAA)
|
49
|
1
|
|
Mulioko (AAB)
|
50
|
2
|
|
Soko (AAB)
|
51
|
1
|
|
Kabindi (AAB)
|
52
|
1
|
|
Bitika ( AAA)
|
53
|
1
|
|
Kibubu (AAB)
|
54
|
1
|
|
Mbudi (AAB)
|
55
|
1
|
|
Mbudi (AAB)
|
56
|
1
|
|
Kamera (AAA)
|
57
|
2
|
|
Sola (AAA)
|
58
|
1
|
|
Sola (AAA)
|
59
|
1
|
|
Sola (AAA)
|
60
|
1
|
Champ 3
|
Sola (AAA)
|
61
|
1
|
|
Kabindi (AAB)
|
62
|
1
|
|
Sola (AAA)
|
63
|
1
|
|
Sola (AAA)
|
64
|
1
|
|
Sola (AAA)
|
65
|
1
|
|
Mbijaonde (AAB)
|
66
|
1
|
|
Kabindi (AAB)
|
67
|
1
|
|
Mbijaonde (AAB)
|
68
|
1
|
|
Kabindi (AAB)
|
69
|
1
|
|
Mbijaonde (AAB)
|
70
|
3
|
|
Kabindi (AAB)
|
71
|
1
|
|
Sola (AAA)
|
72
|
1
|
|
Kamoja (AAA)
|
73
|
2
|
|
Kamera (AAA)
|
74
|
1
|
|
Kisoko (AAB)
|
75
|
1
|
|
Mulibwa na nyama (AAB)
|
76
|
1
|
|
Mulibwa na nyama (AAB)
|
77
|
1
|
|
Kabindi (AAB)
|
78
|
1
|
|
Kabindi (AAB)
|
79
|
1
|
|
Mbijaonde (AAB)
|
80
|
3
|
|
Sola (AAA)
|
81
|
2
|
|
Sola (AAA)
|
82
|
1
|
|
Mbijaonde (AAB)
|
83
|
1
|
|
Kabindi (AAB)
|
84
|
1
|
|
Mulimbwa na nyama (AAB)
|
85
|
1
|
|
Kabindi (AAB)
|
86
|
1
|
|
Kamera (AAA)
|
87
|
2
|
|
Mujaudi (AAA)
|
88
|
1
|
|
Mbudi (AAB)
|
89
|
1
|
|
128
|
Muyaudi (AAA)
|
90
|
2
|
Mbumbilungu
|
Ondeonde (AAB)
|
91
|
1
|
Jardin de cases
|
Mbijaonde (AAB)
|
92
|
2
|
|
Ondeonde (AAB)
|
93
|
2
|
|
Bitika (AAA)
|
94
|
3
|
|
Musisa (AAB)
|
95
|
1
|
|
Sola (AAA)
|
96
|
1
|
|
Mbudi (AAB)
|
97
|
1
|
|
Mukokonde (AAB)
|
98
|
1
|
|
Kibubu (AAB)
|
99
|
1
|
|
Kamera (AAA)
|
100
|
1
|
|
Sola (AAA)
|
101
|
1
|
|
Muyaudi (AAA)
|
102
|
1
|
|
Muyaudi (AAA)
|
103
|
1
|
|
Mwamba nyenge (AAA)
|
104
|
1
|
|
Mbudi (AAB)
|
105
|
2
|
|
Mbudi (AAB)
|
106
|
1
|
|
Mbijaonde (AAB)
|
107
|
1
|
|
Sola (AAA)
|
108
|
2
|
|
Mbudi (AAB)
|
109
|
3
|
|
Kibubu (AAB)
|
110
|
1
|
|
Mbijaonde (AAB)
|
111
|
1
|
|
Kibubu (AAB)
|
112
|
1
|
|
Kamera (AAA)
|
113
|
1
|
|
Kibubu (AAB)
|
114
|
1
|
|
Mwamba nyenge (AAA)
|
115
|
1
|
|
Kibubu (AAB)
|
116
|
1
|
|
Mukokonde (AAB)
|
117
|
1
|
|
Mukokonde (AAB)
|
118
|
1
|
|
Musisa (AAB)
|
119
|
1
|
|
Musisa (AAB)
|
120
|
1
|
Champ 2
|
Mbudi (AAB)
|
121
|
1
|
|
Kaumba (AAB)
|
122
|
1
|
|
Kaumba (AAB)
|
123
|
1
|
|
Mulioko (AAB)
|
124
|
1
|
|
Mbijaonde (AAB)
|
125
|
1
|
|
Mbijaonde (AAB)
|
126
|
1
|
|
Sola (AAA)
|
127
|
1
|
|
Shangi (AAB)
|
128
|
1
|
|
Shangi (AAB)
|
129
|
1
|
|
Kibubu (AAB)
|
130
|
1
|
|
Kibubu (AAB)
|
131
|
1
|
|
Mbudi (AAB)
|
132
|
2
|
|
129
|
Mbudi (AAB)
|
133
|
1
|
|
Mbudi (AAB)
|
134
|
1
|
|
Mulioko (AAB)
|
135
|
1
|
|
Kamera (AAA)
|
136
|
1
|
|
Muyaudi (AAA)
|
137
|
2
|
|
Shangi (AAB)
|
138
|
1
|
|
Shangi (AAB)
|
139
|
1
|
|
Muyaudi (AAA)
|
140
|
3
|
|
Mukokonde (AAB)
|
141
|
1
|
|
Mukokonde (AAB)
|
142
|
1
|
|
Sola (AAA)
|
143
|
1
|
|
Sola (AAA)
|
144
|
1
|
|
Sola (AAA)
|
145
|
1
|
|
Mbudi (AAB)
|
146
|
1
|
|
Mbudi (AAB)
|
147
|
1
|
|
Mwamba nyenge (AAA)
|
148
|
1
|
|
Mwamba nyenge (AAA)
|
149
|
1
|
|
Kamera (AAA)
|
150
|
1
|
Champ 3
|
Sola (AAA)
|
151
|
1
|
|
Mbijaonde (AAB)
|
152
|
1
|
|
Kamera (AAA)
|
153
|
1
|
|
Mbijaonde (AAB)
|
154
|
1
|
|
Mbijaonde (AAB)
|
155
|
2
|
|
Sola (AAA)
|
156
|
1
|
|
Sola (AAA)
|
157
|
2
|
|
Kamera (AAA)
|
158
|
1
|
|
Mbijaonde (AAB)
|
159
|
1
|
|
Kiemba (AAB)
|
160
|
1
|
|
Mbijaonde (AAB)
|
161
|
1
|
|
Mbijaonde (AAB)
|
162
|
1
|
|
Mulioko (AAB)
|
163
|
1
|
|
Kaumba (AAB)
|
164
|
1
|
|
Kaumba (AAB)
|
165
|
1
|
|
Kaumba (AAB)
|
166
|
1
|
|
Mbudi (AAB)
|
167
|
2
|
|
Mbudi (AAB)
|
168
|
2
|
|
Mbudi (AAB)
|
169
|
1
|
|
Sola (AAA)
|
170
|
1
|
|
Mbudi (AAB)
|
171
|
1
|
|
Bitika (AAA)
|
172
|
2
|
|
Mukokonde (AAB)
|
173
|
2
|
|
Mulioko (AAB)
|
174
|
1
|
|
Shangi (AAB)
|
175
|
1
|
|
130
|
Sola (AAA)
|
176
|
1
|
|
Shangi (AAB)
|
177
|
1
|
|
Shangi (AAB)
|
178
|
1
|
|
Kibubu (AAB)
|
179
|
1
|
|
Kibubu (AAB)
|
180
|
1
|
Fataki
|
Bitika (AAA)
|
181
|
1
|
Jardin de cases
|
Mbijaonde (AAB)
|
182
|
2
|
|
Mbijaonde (AAB)
|
183
|
1
|
|
Bitika (AAA)
|
184
|
1
|
|
Mbudi (AAB)
|
185
|
1
|
|
Mbijaonde (AAB)
|
186
|
1
|
|
Bitika (AAA)
|
187
|
1
|
|
Bitika (AAA)
|
188
|
1
|
|
Mbudi (AAB)
|
189
|
1
|
|
Mbudi (AAB)
|
190
|
2
|
|
Sola (AAA)
|
191
|
1
|
|
Sola (AAA)
|
192
|
1
|
|
Kibubu (AAB)
|
193
|
1
|
|
Bitika (AAA)
|
194
|
1
|
|
Bitika (AAA)
|
195
|
1
|
|
Mbudi (AAB)
|
196
|
2
|
|
Bitika (AAA)
|
197
|
1
|
|
Mbudi (AAB)
|
198
|
3
|
|
Mbijaonde (AAB)
|
199
|
1
|
|
Kamera (AAA)
|
200
|
1
|
|
Bisamuni ( AAA)
|
201
|
1
|
|
Mbudi (AAB)
|
202
|
2
|
|
Katulu (AAA)
|
203
|
2
|
|
Mbijaonde (AAB)
|
204
|
1
|
|
Mbijaonde (AAB)
|
205
|
1
|
|
Mbudi (AAB)
|
206
|
1
|
|
Bitika (AAA)
|
207
|
1
|
|
Kiemba (AAB)
|
208
|
1
|
|
Mbudi (AAB)
|
209
|
1
|
|
Sola (AAA)
|
210
|
2
|
Champ 2
|
Kamera (AAA)
|
211
|
1
|
|
Kibubu (AAB)
|
212
|
1
|
|
Kibubu (AAB)
|
213
|
1
|
|
Kibubu (AAB)
|
214
|
2
|
|
Mbudi (AAB)
|
215
|
2
|
|
Mbijaonde (AAB)
|
216
|
1
|
|
Mbijaonde (AAB)
|
217
|
1
|
|
Mbijaonde (AAB)
|
218
|
1
|
|
131
|
Mbijaonde (AAB)
|
219
|
1
|
|
Bitika (AAA)
|
220
|
1
|
|
Sola (AAA)
|
221
|
1
|
|
Sola (AAA)
|
222
|
1
|
|
Kangungu (AAA)
|
223
|
1
|
|
Kangungu (AAA)
|
224
|
1
|
|
Mbudi (AAB)
|
225
|
1
|
|
Katulu (AAA)
|
226
|
2
|
|
Kiemba (AAB)
|
227
|
1
|
|
Kiemba (AAB)
|
228
|
1
|
|
Sola (AAA)
|
229
|
1
|
|
Sola (AAA)
|
230
|
2
|
|
Kabindi (AAB)
|
231
|
1
|
|
Kabindi (AAB)
|
232
|
1
|
|
Kibubu (AAB)
|
233
|
1
|
|
Katulu (AAA)
|
234
|
1
|
|
Katulu (AAA)
|
235
|
1
|
|
Kaumba (AAB)
|
236
|
1
|
|
Mukokonde ( AAB)
|
237
|
1
|
|
Mukokonde ( AAB)
|
238
|
1
|
|
Mukokonde ( AAB)
|
239
|
1
|
|
Mukokonde ( AAB)
|
240
|
1
|
Champ 3
|
Bisamuni ( AAA)
|
241
|
1
|
|
Mbijaonde (AAB)
|
242
|
1
|
|
Bitika (AAA)
|
243
|
1
|
|
Kamera (AAA)
|
244
|
3
|
|
Kangungu (AAA)
|
245
|
2
|
|
Mbijaonde (AAB)
|
246
|
1
|
|
Kabindi (AAB)
|
247
|
1
|
|
Mbijaonde (AAB)
|
248
|
1
|
|
Mbudi (AAB)
|
249
|
1
|
|
Kibubu (AAB)
|
250
|
1
|
|
Kibubu (AAB)
|
251
|
1
|
|
Kabindi (AAB)
|
252
|
1
|
|
Katulu (AAA)
|
253
|
2
|
|
Kiemba (AAB)
|
254
|
1
|
|
Kabindi (AAB)
|
255
|
1
|
|
Mukokonde ( AAB)
|
256
|
1
|
|
Mbudi (AAB)
|
257
|
2
|
|
Bitika (AAA)
|
258
|
1
|
|
Katulu (AAA)
|
259
|
1
|
|
Mbudi (AAB)
|
260
|
1
|
|
Musombo (AAB)
|
261
|
1
|
|
132
|
Mbudi (AAB)
|
262
|
1
|
|
Mbudi (AAB)
|
263
|
1
|
|
Bitika (AAA)
|
264
|
1
|
|
Kiemba (AAB)
|
265
|
1
|
|
Kaumba (AAB)
|
266
|
1
|
|
Kaumba (AAB)
|
267
|
1
|
|
Kaumba (AAB)
|
268
|
2
|
|
Mukokonde ( AAB)
|
269
|
1
|
|
Kamera (AAA)
|
270
|
1
|
|
Tableau 27 : Valeurs nutritionnelles de la
Banane
Banane crue
(valeur nutritive pour 100 g)
|
Eau : 74,91 g
|
Cendres totales : 0,82 g
|
Fibres : 2,6 g
|
Valeur énergétique : 89 kcal
|
Protéines : 1,09 g
|
Lipides : 0,33 g
|
Glucides : 22,84 g
|
sucres simples : 12,23 g
|
Oligo-éléments
|
Potassium : 358 mg
|
Magnésium : 27 mg
|
phosphore : 22 mg
|
Calcium : 5 mg
|
Sodium : 1 mg
|
Cuivre : 78 tg
|
Fer : 26 tg
|
zinc : 15 tg
|
vitamines
|
Vitamine C : 8,7 mg
|
Vitamine B1 : 31 tg
|
Vitamine B2 : 73 tg
|
Vitamine B3 : 665 tg
|
Vitamine B5 : 334 ug
|
Vitamine B6 : 367 tg
|
Vitamine B9 : 0 tg
|
Vitamine B12 : 0 tg
|
Vitamine A : 64 UI
|
Rétinol : 0 tg
|
Vitamine E : 0,10 tg
|
Vitamine K : 0,5 tg
|
Acides gras
|
Saturés : 112 mg
|
Mono-insaturés : 32 mg
|
Poly-insaturés : 73 mg
|
Cholestérol : 0 mg
|
|
Source : (Alistair Smith, 2010)
133 SERIE 1
QUESTIONNAIRE D'ENQUETE 2021-2022 Les questions
à compléter
· Numéro de la fiche d'enquête : / /
/
· Mettre la réponse proposée entre les
crochets par type de question
1. Coordonnées de l'enquêteur
· Nom et prénom :
· Adresse complète :
· Date : .. / /
· Heure du remplissage du questionnaire : début :
Fin :
2. Coordonnées du producteur/
Interlocuteur
· Nom et prénom :
· Territoire /Secteur/Chefferie :
· Village :
· Province :
Coordonnées GPS :
· Altitude :
· Longitude :
· Latitude : ..
Chaque fois mettez entre crochet : 0=Non et 1=Oui
Questionnaire d'enquête sur Bananas Bunchy Top
Virus (BBTV) ? Les objectifs de l'enquête :
1. Déterminer les conditions culturales de la culture
de bananier dans les différentes zones de production bananière en
Province de Maniema ;
2. Déterminer l'incidence et la
sévérité de BBTD sur les différents cultivars de
bananiers et plantains cultivés dans cette zone d'étude ;
3. Déterminer la présence et l'importance du
vecteur Pentalonia nigronervosa sur les touffes de bananiers dans les
différentes zones d'étude en Province de Maniema.
1. Les conditions culturales dans la zone
enquêtée 1.1. Source du matériel de plantation
:
Chaque fois mettez entre crochet : 0=Non et 1=Oui
1. Rejets issus de la même plantation [ I
2. Rejets en provenance des champs des voisins proches (moins
d'1 Km) [ I
3. Rejets issus des plantations d'amis situés loin de
votre zone E ]
134
4. Vitro-plants distribués par les services de
l'état (IPAPEL, Recherche, ONGs) [ ]
5. Vitro-plants achetés chez les privés [ ]
6. Autres à préciser
1.2. Age de la bananeraie dans le site
enquêté :
Mettre entre crochets le numéro correspondant
à la réponse donnée
1=Plantation de moins de 3 ans
2= Plantation de 3-5 ans 3= Plantation de 5-7 ans 4=Plantation
de 7-9 ans 5=Plantation de plus de 10ans
1.3. Système cultural dans la zone de
l'étude
a. Bananier en monoculture (sans association) Oui=1 Non=0 [ ]
b. Bananier en association ave : Mettez entre
crochets : 0=Non et 1=Oui
1. Riz [ ]
2. Manioc [ ]
3. Patate douce [ ]
4. Haricot [ ]
5. Maïs [ ]
6. Autres à préciser (3plus importants) :
1.4 Connaissances relative s au BBTV dans la
zone
1.4.1. Identification des symptômes de BBTV par les
Agricultures ? Quels symptômes observés selon
l'agriculteur
Chaque fois mettez entre crochets : 0=Non et
1=Oui
a) Observation des symptômes sur la feuille ? [ ]
b) Observation des symptômes sur le pseudo-tronc ? [ ]
c) Aspect touffu des plants infectés ? [ ]
d) Le système d'enracinement non fonctionnel ? [ ]
e) Autres informations :
1.4.2. Origine probable du BBTV dans la zone
considérée
L'endroit où l'agriculteur a observé pour la
première fois les symptômes de BBTV Mettez entre
crochets le numéro correspondant à la réponse
donnée
1=dans sa propre plantation
2= chez les voisins (moins de 10 Km)
135
3= pas connu par l'agriculteur
1.4.3 La dispersion de BBTV
dans la région :
Mettez entre crochets le numéro correspondant
à la réponse donnée
? Après observation des symptômes la souche reste
productive combien d'années :
1=2 ans de production
2=3 ans de production
3=5 ans de production
4= plus de 5 ans
5= Moins d'une année
1.4.4. Connaissance du monde de transmission de BBTV par
l'agriculteur Chaque fois mettez entre crochets : 0=Non et
1=Oui
1. Transmission par le sol ? [ ]
2. Transmission possible par rejets ? [ ]
3. Y a-t-il possibilité de transmission par un vecteur ?
[ ]
4. Transmission par outils (houes, coupe-coupe) ? [ ]
5. Autres modes de transmission proposées selon
l'agriculteur :
FIN
136 SERIE 2
|
N°
|
A. Nom de la
variété
|
B. Evaluation de
l'incidence symptôme de BBTD sur au
moins un plant de la touffe
0=NON
1=OUI
|
C. Cotation de la sévérité sur
la
touffe infectée suivant
l'échelle
de BBTD (5-6) :
0= sans symptôme
1= Strie sur les feuilles
2= stries foncées jusqu'au
pseudo-tronc,
3=décoloration des feuilles
avec
taille normale
4=taille réduite de
feuilles
décolorées,
5=aspec t touffu au sommet
« Bunchy top »
|
D. Présence du
vecteur sur chaque touffe
|
E. Importance du vecteur
dur les touffes choisies suivant l'echelle de
BBTD (0-5) :
0= sans vecteur 1= une
colonie simple sans vecteur
2= Plusieurs colonies
simples 3=une grande colonie avec des insectes
alliés 4=Plusieurs grandes colonies 5.
Colonies généralisée au niveau des
feuilles et du pseudo-tronc
|
|
1
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
5
|
|
|
|
|
|
|
6
|
|
|
|
|
|
|
7
|
|
|
|
|
|
|
8
|
|
|
|
|
|
|
9
|
|
|
|
|
|
|
10
|
|
|
|
|
|
|
11
|
|
|
|
|
|
|
12
|
|
|
|
|
|
|
13
|
|
|
|
|
|
|
14
|
|
|
|
|
|
|
15
|
|
|
|
|
|
|
16
|
|
|
|
|
|
|
17
|
|
|
|
|
|
|
18
|
|
|
|
|
|
|
19
|
|
|
|
|
|
|
20
|
|
|
|
|
|
|
21
|
|
|
|
|
|
|
22
|
|
|
|
|
|
|
23
|
|
|
|
|
|
|
24
|
|
|
|
|
|
|
25
|
|
|
|
|
|
|
26
|
|
|
|
|
|
|
27
|
|
|
|
|
|
|
28
|
|
|
|
|
|
|
29
|
|
|
|
|
|
|
30
|
|
|
|
|
|
|
|



