|
UNIVERSITE MARIEN N'GOUABI
|
|
|
Institut Supérieur d'Education Physique et
Sportive
|
Année : 2023 - 2024 N° d'ordre :
004
MEMOIRE
Pour l'obtention du diplôme de Master
Domaine : Sciences et Techniques
des Activités Physiques et Sportives
Mention : Motricité et
Intervention
Spécialité :
Entrainement Sportif, Préparation Physique, Mentale et
Nutritionnelle
Parcours : Master
Option : Sport
Présenté et soutenu
publiquement
À l'Institut Supérieur d'Education
Physique et Sportive
Le 07 /03/ 2025
Par
NGOMA SOLO Estime Farèse
Titulaire d'une Licence professionnelle en
Sport
TITRE

Match de football et réponses des
cellules
immunitaires et de la protéine C- réactive chez
les
étudiants actifs réhydratés en milieu chaud et
humide
DIRECTEUR DE MEMOIRE
NSOMPI Florent, Maître de
Conférences CAMES, Université Marien NGOUABI
COMPOSITION DU JURY
Président : BOUHIKA Eddie Janvier,
Maître de Conférences CAMES, Université Marien
NGOUABI
Rapporteur : NSOMPI Florent, Maître de
Conférences CAMES, Université Marien NGOUABI Examinateur:
MOUSSOKI Jean Martin, Maître-Assistant CAMES, Université
Marien NGOUABI
Membre : MABOUNDA KOUNGA Paul Roger,
Maître-Assistant CAMES, Université Marien NGOUABI
IN MEMORIUM
A
Mon petit frère NGOMA SOLO MFOUTOU Fridrey Prévu,
que ton âme repose en paix.
DEDICACES Je dédie ce travail :
? À mon père Serge Wilfrid NGOMA SOLO
? À mon oncle paternel Heidy Endulrich NGOMA SOLO
REMERCIEMENTS
Nous nous rendons grâce à cet Être qui
était et qui sera, de nous avoir fait venir surtout nous en octroyer un
équilibre de l'esprit et la stabilité de corps ; bref : la
fécondité du mental qui nous a permis l'accomplissement du
présent bouquet.
J'adresse tous mes remerciements :
? À mon directeur de mémoire Docteur
Florent NSOMPI, Maitre de Conférences CAMES, qui en
dépit de ses multiples occupations administratives, pédagogiques
et scientifique a consacré assez de temps dans la conduite de ce travail
;
? À tous les personnels enseignants et non enseignants
de l'ISEPS pour leur formation adéquate ainsi qu'aux membres du jury
;
? À toute ma famille de près ou de loin de
m'avoir assisté par les conseils et contributions dans
l'élaboration de ce présent travail ;
? Je remercie enfin mes collègues, étudiants de
la 9ème promotion Master Sport et EPS.
LISTE DES SIGLES ET ABREVIATIONS
APMV : activité physique modérée à
vigoureuse ;
ATP : adénosine triphosphate ;
BCR : récepteur membranaire des lymphocytes B ;
CMH : complexe majeur d'histocompatibilité ;
CPA : cellules présentatrices d'antigènes ;
CRP : protéine C-réactive ;
DAMPs : Danger Associated Molecular Pattern ;
DC : cellules dendritiques ;
FC max : fréquence cardiaque maximale ;
Fc : Fragment cristallisable ;
Ig : immunoglobuline ;
IgG : immunoglobulines G ;
IL : interleukine ;
IL-1f3 : interleukine-1f3 ;
IL-6 : interleukine-6 ;
ILC : cellule lymphoïde innée ;
ISEPS : Institut Supérieur d'Éducation Physique
et Sportive ;
LDL : lipoprotéines de basse densité.
MAC : complexe d'attaque membranaire ;
MAIT : mucosal associated invariant t cells ;
NFS : numération formule sanguine ;
NK: natural killer;
PAMPs: pathogen associated molecular patterns;
PC: phosphocholine;
PRR : Pathogen Recognition Receptor ;
PRRs : Pattern Recognition Receptors ;
RNPs : petite protéine ribonucléaire
nucléaire ;
RNS : les espèces réactives de l'azote ;
ROS : espèces réactives de l'oxygène ;
SAP : Sérum amyloïde P component ;
SNC : système nerveux central ;
TCR : récepteur d'antigène des lymphocytes T
;
LISTE DES TABLEAUX
TLRs: toll-like receptors;
TNF-á : facteur de nécrose tumorale-á ;
Tableau I : Comparaison des caractéristiques
anthropométriques chez les étudiants actifs
réhydratés et non réhydratés en
milieu chaud et humide 36
Tableau II : Comparaison des valeurs moyennes des cellules
immunitaires enregistrées avant, après et 2h après effort
chez les étudiants actifs réhydratés et non
réhydratés en milieu chaud et
humide 37
Tableau III : Comparaison des valeurs moyennes des cellules
immunitaires enregistrées avant
et après effort chez les étudiants actifs
réhydratés et non réhydratés 38
Tableau IV : Comparaison des valeurs moyennes des cellules
immunitaires enregistrées avant et 2h après effort chez les
étudiants actifs du groupe réhydratés et non
réhydratés en milieu
chaud et humide 39
Tableau V : Comparaison des valeurs moyennes de la
protéine C-réactive (CRP) enregistrées avant et
après effort chez les étudiants actifs du groupe
réhydratés (GR) et du groupe non
réhydraté (GNR) .. 40
Tableau VI : Température ambiante et humidité
relative lors du test d'effort 41
LISTE DES FIGURES
Figure 1 : vue générale des cellules du
système immunitaire 7
Figure 2 : les composant du système immunitaire 8
Figure 3 : défense de l'immunité innée
10
Figure 4 : granulocyte neutrophile 11
Figure 5 : granulocyte éosinophile 11
Figure 6 : granulocyte basophile 12
Figure 7 : monocyte 12
Figure 8 : macrophage 12
Figure 9 : cellule dendritique 13
Figure 10 : cellules NK .. 13
Figure 11 : organisation de l'immunité adaptative
15
Figure 12 : cellules du système immunitaire 17
Figure 13 : la protéine C-réactive 22
Figure 14 : Structure de la CRP 23
Figure 15: toise en bois sur socle .. 30
Figure 16: impedance mètre . 31
Figure 17: automate Sinothinker SK8800 32
Figure 18: électrophotomètre 32
LISTE DES PHOTOS
Photo 1 : Mesure de la taille . 62
Photo 2 : Mesure de la masse corporelle .. 62
Photo 3 : Prise de sang . 62
Photo 4 : Déroulement du match test à l'ISEPS
62
SOMMAIRE
Introduction 1
Chapitre I : Revue de la Littérature 7
Chapitre II : Matériel et méthodes .. 30
Chapitre III : Résultats 36
Chapitre IV : Discussion 42
Conclusion .. 47
Perspectives 48
Références bibliographiques . 49
Annexes .. 62
Table des matières .. 75
INTRODUCTION
Contexte et justification
L'exercice pratiqué dans un environnement chaud peut
augmenter considérablement la production de sueur pour faciliter le
refroidissement par évaporation et aider à maintenir la
température corporelle. L'apport hydrique pendant l'exercice ne suit pas
le rythme de la perte de liquide par la transpiration (Cheuvront et Haymes,
2001 ; Rollo et al., 2021). Le football est un sport intermittent
caractérisé par des mouvements soutenus incorporant de
fréquentes périodes d'activité de haute intensité
entrecoupées de périodes de récupération
régulières (Omar et al., 2013).
Lors de ce jeu, plusieurs modifications peuvent subvenir chez
le joueur afin que son organisme supporte et s'adapte à cette charge
externe. Ces modifications dépendent grandement du type, de la
durée et l'intensité de l'activité ainsi que les
conditions environnementales (chaudes et humides) (Stachenfeld, 2014 ; Hammouda
et al., 2018). Pour ces auteurs un match de football pratiqué dans un
environnement chaud ou humide peut entrainer des modifications physiologiques
importantes et affecter la performance sportive. Les travaux de Jentjen et
Timpmann (2014) suggèrent que les altérations dues à
l'environnement sont plus accentuées sur le système immunitaire.
La majorité de ces exercices sont effectués à des
intensités qui sollicitent le fonctionnement des cellules immunitaires
pendant les périodes intenses du jeu. La réaction
coordonnée de ces cellules et molécules porte le nom de
réponse immunitaire. Sur le plan physiologie, le système
immunitaire joue un rôle important pour parvenir les infections
éradiquer les infections déclarées et empêcher la
prolifération tumorale (François et al., 2018).
Le système immunitaire protège notre corps
contre les agents pathogènes externes et les envahisseurs. Le
système immunitaire s'attaque aux agents pathogènes par des
barrières physiques et biochimiques, des cellules immunitaires et des
anticorps formés par les cellules immunitaires (Noor et al., 2021). Il
est très réactif à l'exercice, l'étendue et la
durée reflétant le degré de stress physiologique
imposé par la charge de travail (David et Laurel, 2018). L'augmentation
ou diminution des paramètres telle que le lymphocyte et le monocyte ont
été liés à la fois à l'intensité et
à la durée de l'exercice (Omar et al., 2013).
D'une part, les exercices d'endurance à haute
intensité ont été associés à une
modification du nombre de globules blancs des athlètes, telle qu'une
augmentation des granulocytes et des monocytes, une diminution des lymphocytes
et une augmentation des neutrophiles et des éosinophiles (Olga et al.,
2021). L'inflammation impliquant les systèmes immunitaires innés
et adaptatifs est connue pour être la réponse immunitaire
protectrice pour maintenir l'homéostasie
En effet, il a été démontré que
l'exercice de longue durée à haute intensité supprime la
production de cytokines immunomodulatrices (Katsuhiko et Harumi, 2021). En
revanche, les
tissulaire en éliminant les stimuli nocifs, y compris
les cellules endommagées, les irritants, les agents pathogènes et
les lésions stériles (Huakan et al., 2021).
Bien qu'une multitude de protéines soient
impliquées dans l'inflammation, la plupart d'entre elles ne participent
pas activement à l'élimination des pathogènes ou des
cellules humaines. L'un des médiateurs de la phase aiguë
directement impliqué dans ces processus pro-inflammatoires est la
protéine C-réactive (CRP) qui a été
découverte pour la première fois en 1930 par Tillett et Francis.
La CRP est bien établie comme l'un des marqueurs les plus fiables de
l'inflammation, augmentant considérablement pendant tout type
d'inflammation (Ahmed et al., 2021). Elle est un réactif de phase
aiguë largement utilisé dans la pratique clinique comme marqueur
d'infection et/ou d'inflammation en raison du fait que sa synthèse
augmente rapidement et considérablement (jusqu'à 10 000 fois)
après une lésion tissulaire ou une infection (Caroline et al.,
2022).
De plus, la CRP peut se dissocier physiologiquement en
monomères, bien qu'il soit encore question de savoir si elle exerce
ainsi des fonctions moléculaires différentes de celles de la
forme pentamérique (Magdalena et al., 2019). La transition de la CRP
pentamérique à la CRP monomère a été
décrite dans des microenvironnements inflammatoires spécifiques
(Braig et al., 2017 et McFadyen et al., 2018). La CRP peut également
activer le système du complément et se localise avec le complexe
d'attaque membranaire (MAC) dans les plaques athéroscléreuses
(Karin et al., 2022). La CRP régule l'expression des molécules
d'adhésion dans l'endothélium, ce qui suggère que la CRP
favorise l'inflammation dans la lésion athéroscléreuse
(Karin et al., 2022). En considérant ce qui précède, nous
nous sommes proposé de mener l'étude suivante : «
Match de football et réponses des cellules immunitaires et de la
protéine C- réactive chez les étudiants actifs
réhydratés en milieu chaud et humide ».
Problématique
Au cours d'exercices aérobies d'intensité
modérée et vigoureuse d'une durée supérieure
à 60 minutes, l'activité antipathogène des macrophages
tissulaires se produit parallèlement à une recirculation accrue
des immunoglobulines, des cytokines anti-inflammatoires, des neutrophiles, des
cellules Natural Killer (NK), des cellules T cytotoxiques et des cellules B
immatures. Cellules, qui jouent toutes un rôle essentiel dans
l'activité de défense immunitaire et la santé
métabolique (David et Laurel, 2018).
exercices d'endurance prolongés et de haute
intensité produisent des changements importants dans le nombre de
globules blancs, ce qui se traduit par des augmentations transitoires du nombre
de granulocytes circulants (principalement des neutrophiles) et de monocytes,
ainsi que des diminutions des populations de lymphocytes (Nieman, 2000),
l'exercice d'endurance provoque une augmentation et une activation des
neutrophiles sanguins ; cependant, cela pourrait être
considéré comme une réaction biologique excessive qui
conduit à des lésions musculaires et organiques et à une
inflammation systémique plutôt qu'à l'activation de
l'immunocompétence (Katsuhiko et Harumi, 2021).
Une analyse plus détaillée indique que les
sous-ensembles de globules blancs, tels que les lymphocytes (16 à 45 %),
les granulocytes (45 à 75 %) et les monocytes (4 à 10 %),
répondent différemment, en particulier dans les heures qui
suivent l'arrêt de l'exercice. Le nombre et les proportions des
lymphocytes circulants, et en particulier le sous-ensemble des cellules tueuses
naturelles, montrent un schéma diphasique. Les lymphocytes augmentent
immédiatement après l'arrêt de l'exercice avant de diminuer
fortement jusqu'à 36 heures après l'exercice, tandis que les
diminutions des lymphocytes T et B sont moins prononcées et reviennent
généralement au niveau de base dans les 6 heures. Bien que moins
prononcés, les monocytes augmentent également après
différents types d'exercice et reviennent aux niveaux de base dans les 2
heures suivant l'exercice (Simpson, 2015 ; Galun et al., 1987 ; Comassi et al.,
2015).
D'autre part, l'hyperactivité du système
immunitaire entraîne une « tempête de cytokines »,
caractérisée par la libération de niveaux
élevés de cytokines, en particulier l'interleukine-6 (IL-6) et le
facteur de nécrose tumorale-á (TNF-á), dans la circulation
sanguine et induit une inflammation locale et systémique (Maryam et al.,
2023). Il est vrai que les monocytes/macrophages agissent comme un
médiateur central de l'athérosclérose inflammatoire.
Après accumulation de lipoprotéines dans la paroi vasculaire, les
monocytes circulants migrent à travers les cellules endothéliales
vasculaires activées puis se différencient en macrophages qui
absorbent ensuite des lipoprotéines modifiées telles que les
lipoprotéines de basse densité oxydées (Chao et al.,
2020).
Par ailleurs, La CRP est la principale médiatrice en
aval de la réponse de phase aiguë suite à un
événement inflammatoire et est principalement
synthétisée par la biosynthèse hépatique
dépendante de l'IL-6 (Nicola et Jason, 2018). La CRP est une
protéine synthétisée par les hépatocytes, dont les
niveaux circulants sont fortement influencés par les stimuli
inflammatoires aigus (Black et al., 2004). Le niveau de CRP augmente pendant
l'état
d'inflammation, c'est-à-dire après un exercice
intense (Margeli et al., 2005 et Martín-Sánchez et al., 2011).
À cet effet, l'exercice intense entraîne une
augmentation transitoire de l'activité de la CRP produite par une
réponse inflammatoire en phase aiguë médiée par
l'IL-6 et l'IL-1â (Zhang et al., 1995 et Kasapis et Thompson, 2005). Les
perturbations physiologiques produites lors des matchs de football semblent
déclencher une réponse inflammatoire en phase aiguë
dénotée par une augmentation des niveaux de CRP (Duarte et al.,
2022). La réponse post-match des cytokines telles que l'IL-6 semble
refléter des changements adaptatifs et la tentative du muscle de
rétablir l'homéostasie après un exercice intensif, tandis
que des augmentations des niveaux de CRP peuvent caractériser le
processus inflammatoire secondaire comme une conséquence des dommages
musculaires induits par le match (Íñigo et al., 2023).
L'augmentation de la CRP après un exercice intensif
pourrait être le résultat de mécanismes, tels que la
réponse inflammatoire à des blessures ou à des agents
(l'interleukine-6, c'est-à-dire le principal stimulateur de la
sécrétion de CRP) qui pourraient être associés
à une inflammation élevée chez les athlètes
(Souglis et Antonios, 2015). Des études antérieures ont
démontré que la concentration de CRP diminuait en raison de
l'effet anti-inflammatoire de l'exercice après un exercice intense
prolongé (Kostrzewa-Nowak et al., 2015 et Kasapis et Thompson, 2005).
L'études récente mené par Becker et al., (2020) ont
révélé qu'un entraînement intense aigu provoquait
des augmentations provisoires du niveau de CRP, et ces augmentations
étaient dues aux cytokines, telles que l'interleukine-6 en grande
partie.
Une augmentation de la CRP indique la présence d'une
affection inflammatoire. Il n'existe pas de faux positif car il n'y a pas de
déficience congénitale ou acquise de la CRP. Elle
s'élève dans les affections inflammatoires, quelle que soit leur
étiologie (Coulibaly, 2019). Bien que la CRP puisse initier les voies de
la phase fluide de la défense de l'hôte en activant la voie du
complément, elle peut également initier des voies à
médiation cellulaire en activant le complément ainsi qu'en se
liant aux récepteurs Fragment cristallisables (Fc) des immunoglobulines
G (IgG) (Pradhan et al., 2001). La CRP se lie aux récepteurs Fc avec
l'interaction résultante conduisant à la libération de
cytokines pro-inflammatoires (Du Clos, 2000). Elle a également la
capacité de reconnaître les molécules du soi et
étrangères sur la base de la reconnaissance de formes, ce que
d'autres activateurs du complément tels que les IgG ne peuvent pas
réaliser, car ces molécules ne reconnaissent que des
épitopes antigéniques distincts (Nicola et Jason, 2018).
Question principale :
Le match de football, peut-il influencer la réponse des
cellules immunitaires et de la protéine C-réactive chez les
étudiants actifs ?
Questions secondaires :
> Le match de football influence-t-il la réponse des
cellules immunitaires chez les étudiants actifs réhydratés
?
> Le match de football en milieu chaud et humide induit-il
des variations de la protéine C-réactive chez les
étudiants actifs ?
Hypothèse principale
Le match de football induit les variations des cellules
immunitaires et de la protéine C-réactive chez les
étudiants actifs réhydraté en milieu chaud et humide.
Hypothèses secondaires
> Le match de football influence la réponse des
cellules immunitaires chez les étudiants actifs
réhydratés.
> Le match de football en milieu chaud et humide induit des
variations de la protéine C-réactive chez les étudiants
actifs.
Objectif général
Montrer les variations induites par le match de football sur
les cellules immunitaires et la protéine C-réactive chez les
étudiants actifs.
Objectifs spécifiques
> Évaluer les variations des cellules immunitaires
induites par le match de football chez les étudiants actifs
réhydratés en milieu chaud et humide.
> Évaluer les variations de la protéine
C-réactive induites par le match de football chez les étudiants
actifs.
Intérêt de l'étude
C'est de mettre en évidence la mobilisation des
cellules immunitaires et la réponse de la CRP induite par le match de
football chez les étudiants actifs réhydraté en milieu
chaud et humide.
La réalisation de ce travail nécessite la
clarification des concepts dans la revue de la littérature.
Structuration du Travail
La deuxième partie intitulée méthodologie
adoptée consistera à présenter la démarche
d'investigation. La troisième partie sera consacrée à la
présentation et l'analyse des résultats d'une part et la
discussion basée sur la nature. La quatrième partie constituant
la conclusion. Ce travail sera bouclé par la bibliographie et des
annexes.
Chapitre I : Revue de la Littérature
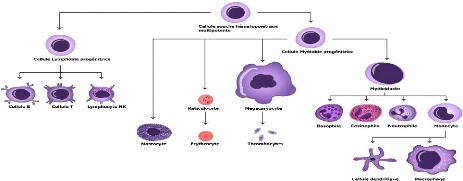
Figure 1 : vue générale des cellules du
système immunitaire (
www.monsystemeimmunitaire.fr).
I.1. Système Immunitaire
Le système immunitaire contribue au maintien de
l'intégrité de l'organisme par l'exclusion des constituants
étrangers (microorganismes, greffes) et de constituants du « soi
» modifiés. Il assure cette fonction en étroite relation
avec les autres systèmes nerveux et endocriniens, avec lesquels il
communique par l'intermédiaire de médiateurs solubles
(neurotransmetteurs, hormones, cytokines) et de récepteurs
spécifiques communs à ces systèmes (Kouassi et al., 2003).
L'activation du système immunitaire entraîne la libération
de cytokines qui peuvent être classées en anti-inflammatoires.
L'exercice physique chronique peut guider la réponse du système
immunitaire en favorisant un statut anti-inflammatoire, qui semble être
le facteur clé de l'amélioration de la santé,
principalement dans les maladies chroniques. L'activation du système
immunitaire est une réponse à un facteur de stress, visant
à rétablir l'homéostasie cellulaire. Le processus
inflammatoire joue un rôle crucial dans l'homéostasie,
principalement par la défense active contre divers stimuli nocifs tels
que les infections virales neurotropes et/ou les dommages traumatiques,
favorisant le rétablissement de la fonction cellulaire et tissulaire
(Débora et al., 2020).
L'inflammation implique plusieurs types de cellules
immunitaires, y compris les macrophages et les neutrophiles, et est un
médiateur important du stress oxydatif. Les espèces
réactives de l'oxygène (ROS) ou les espèces
réactives de l'azote (RNS) sont des molécules à double
tranchant. Les ROS/RNS peuvent jouer le rôle d'effecteurs inflammatoires
importants en soutenant l'élimination des agents pathogènes par
le système immunitaire et la réparation des tissus musculaires
endommagés, ou ils peuvent amplifier l'inflammation chronique (par
exemple, pendant l'obésité) et induire des lésions
tissulaires (David et al., 2018).
I.1.1. Définition
Selon le dictionnaire Larousse (2024), le système
immunitaire est l'ensemble des organes, tissus, cellules et molécules
assurant l'immunité d'un organisme. Il fonctionne grâce à
un ensemble de cellules hétérogènes dans leur forme, leurs
fonctions, leur capacité à se multiplier (division cellulaire) et
à se transformer (différenciation), ainsi que dans la
durée de leur vie : ce sont les globules blancs, ou leucocytes, qui
naissent dans la moelle des os, puis circulent dans tout l'organisme,
transportés par le sang et par la lymphe. Pour François et al.,
(2018), le système immunitaire fait référence aux
mécanismes de défense d'un organisme vivant contre des agents
étrangers, notamment infectieux, ou contre des agressions internes,
notamment transformation tumorale, susceptibles de menacer son bon
fonctionnement ou sa survie.
I.1.2. Composant du Système immunitaire
Le système immunitaire est constitué d'un
ensemble complexe d'organes individualisés et de tissus entre lesquels
circulent en permanence des cellules de l'immunité innée et de
l'immunité adaptative. Le système immunitaire à trois
propriétés essentielles : une importante capacité
d'échange d'informations, par contacts membranaires intercellulaires ou
par libération de médiateurs solubles. Ces échanges ont
lieu entre des acteurs du système immunitaire (par exemple des
interactions entre les cellules de l'immunité innée et celles de
l'immunité adaptative), mais également avec d'autres
systèmes (par exemple des échanges neuro-immuno-endocriniens) ;
un bras effecteur performant, capable de protéger
l'intégrité de l'organisme ; une forte régulation qui est
cruciale pour préserver, à tout moment et à tout endroit,
l'équilibre du système immunitaire ou homéostasie et
garantir une réponse immunitaire adaptée (Jonathan et al., 2018).
Le système immunitaire comporte deux types de défense :
l'immunité innée ou naturelle et l'immunité acquise ou
adaptative (Olivier, 2005).
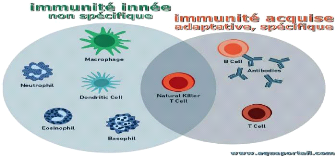
Figure 2 : les composants du système
immunitaire.
I.1.2.1. Immunité innée ou naturelle
Cellule immunitaire innée conditionnelle et
système de capteurs métaboliques. L'immunité
innée est la première ligne de défense de l'hôte,
fournissant une défense initiale non-spécifique contre les
signaux de danger. Les cellules immunitaires innées professionnelles
comprennent les cellules dendritiques (DC), les monocytes, les macrophages et
les lymphocytes B (Lizhe et al., 2020).
Des structures moléculaires communes à de
très nombreux microorganismes vont interagir avec des molécules
complémentaires préformées de l'hôte (en solution ou
à la surface de cellule) pour déclencher un signal de «
danger » conduisant à l'exclusion du pathogène. Lors de
l'infection d'une cellule par des virus, des modifications membranaires (telles
que la diminution de l'expression des molécules de classe I du complexe
majeur d'histocompatibilité [CMH]) vont permettre la destruction de la
cellule infectée par des lymphocytes cytotoxiques NK (« natural
killer » : cellules tueuses de l'immunité naturelle). Au total,
l'immunité naturelle est caractérisée par sa mise en jeu
rapide et par le développement de réactions inflammatoires
(bactéries, parasites) ou cytotoxique (virus) conduisant souvent
à l'exclusion du pathogène (Kouassi et al., 2003). Lizhe et al.,
(2020) ajoute que, l'inflammation est un processus pathologique tissulaire dont
le but principal est de résoudre l'infection et de réparer les
tissus.
En outre, Débora et al., (2020) à leurs tours,
on dit que « Les cellules tueuses naturelles et les phagocytes, y compris
les neutrophiles, les monocytes et les macrophages, représentent la
première ligne du système immunitaire inné contre les
infections virales et sont très sensibles à l'exercice
aérobie aigu ».
Cavaillon (2010) a aussi ajouté l'inflammation et
l'immunité innée sont deux processus qui se chevauchent et, qui,
depuis la découverte des récepteurs des pathogènes et des
signaux endogènes de danger, ont reçu une attention nouvelle. En
effet, notre vision de la réponse immunitaire a évolué, et
la recherche sur l'immunité innée est dans une période de
renaissance. Pendant de nombreuses années, l'immunologie était
divisée en deux grands thèmes : l'immunité «
spécifique » et l'immunité « non-spécifique
», avec forcément moins d'attention pour l'immunité qui
était définie par une négation. Depuis que l'expression
« immunité non-spécifique » a été
remplacée par le concept d'immunité innée ou
d'immunité naturelle, celle-ci est maintenant sous les projecteurs. Avec
la découverte des toll-like receptors (TLRs). Les TLRs reconnaissent
spécifiquement des déterminants microbiens nommés pathogen
associated molecular patterns (PAMPs). Il est clair que l'immunité
innée n'est certainement pas un processus non spécifique de
défense de l'hôte.
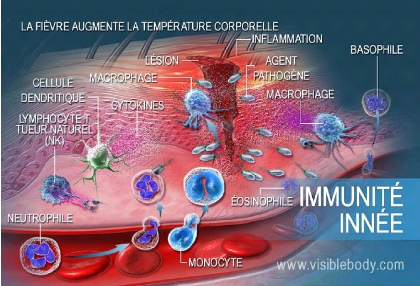
Figure 3 : l'immunité innée.
I.1.2.1.1. Les acteurs de l'immunité innée
Parmi les cellules de l'immunité innée, les
granulocytes neutrophiles, monocytes/macrophages et cellules dendritiques
phagocytent et détruisent des éléments étrangers
sur lesquels elles reconnaissent des molécules représentatives
des grandes familles d'agents microbiens, les PAMPs (Pathogen Associated
Recognition Pattern), mais aussi des molécules associées au
stress cellulaire, les DAMPs (Danger Associated Molecular Pattern), grâce
à leurs immunorécepteurs appelés PRRs (Pattern Recognition
Receptors). Les lymphocytes NK font également partie de
l'immunité innée et détruisent les cellules
infectées par des virus ou les cellules tumorales (Jonathan et al.,
2018).
? Les granulocytes
Les granulocytes se divisent en trois lignées distinctes :
neutrophiles, éosinophiles et basophiles.
Les granulocytes neutrophiles sont les plus
nombreux dans la circulation sanguine et sont reconnaissables par leur noyau
polylobé. Ils jouent un rôle majeur dans la défense
antimicrobienne et dans l'inflammation aiguë par leur fonction de cellules
phagocytaires et le contenu de leurs granules cytoplasmiques (plus de 100
enzymes différentes). Sous l'effet de
facteurs chimiotactiques, les granulocytes neutrophiles sont
les premières cellules de l'immunité innée à
être recrutées dans les tissus en cas d'infection
bactérienne, où elles y auront une durée de vie
très brève (Jonathan et al., 2018).
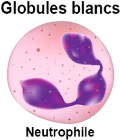
Figure 4 : granulocyte neutrophile (
www.docteurclic.com)
Les granulocytes éosinophiles ont un
noyau bilobé et des granulations colorées spécifiquement
en rouge orangé par les techniques habituellement utilisées. Ceci
est dû au caractère basique des composants cytotoxiques et
pro-inflammatoires qu'elles contiennent. Ces cellules sont retrouvées
principalement dans les tissus et possèdent un rôle capital dans
les défenses antiparasitaires et certaines réactions
d'hypersensibilité (Guislaine et al., 2018).
Figure 5 : granulocyte éosinophile (
www.docteurclic.com)
Les granulocytes basophiles ont un noyau
bilobé peu visible du fait de l'abondance de leurs granulations
métachromatiques contenant de l'histamine ainsi que des
éléments très acides, cytotoxiques et pro-inflammatoires.
Leur équivalent tissulaire est le mastocytes, présent en
abondance dans les muqueuses, et ils ont un rôle anti-infectieux. Les
basophiles et les mastocytes ont aussi un rôle important dans les
hypersensibilités immédiates (Michelle et al., 2018).

Figure 6 : granulocytes basophile (
www.docteurclic.com)
? Les monocytes / macrophages
Les monocytes ont également un cytoplasme granuleux
contenant de nombreuses enzymes. Moins nombreux que les granulocytes, ils
circulent dans le sang et adhèrent aux parois vasculaires avant de
migrer dans les tissus en réponse à certains facteurs
chimiotactiques, où ils s'y différencieront en macrophages.
Historiquement, les macrophages tissulaires ont été
désignés sous de nombreux noms en fonction des organes où
ils étaient observés : cellules de Küpffer dans le foie,
microglie dans le cerveau, cellules mésangiales dans le rein,
ostéoclastes dans l'os. Ce sont des cellules essentiellement
phagocytaires, capables de capter des éléments de tailles
diverses (antigènes particulaires, macromolécules, agents
microbiens, cellules ou débris cellulaires) avant de les détruire
puis de les présenter aux cellules de l'immunité adaptative. Ils
produisent également de nombreuses cytokines importantes à toutes
les étapes de la réponse immunitaire, y compris dans la phase de
réparation tissulaire (Jonathan et al., 2018).

Figure 7 : monocyte (
www.shutterstock.com)
Figure 8 : macrophage (
www.britannica.com)
? Les cellules dendritiques
Les cellules dendritiques sont localisées dans de
nombreux tissus et organes dans un état immature ayant une importante
capacité de capture d'antigènes. À l'inverse, lorsqu'elles
quittent
Figure 10 : cellule Natural Killer (
www.mdpi.com)
les tissus et migrent vers les tissus lymphoïdes, elles
subissent un processus de maturation qui leur fait perdre cette capacité
au profit de l'acquisition d'une propriété de présentation
des antigènes aux lymphocytes T. Ce sont les Cellules
présentatrices d'antigènes (CPA) les plus importantes car elles
sont capables d'activer des lymphocytes T naïfs, et jouent ainsi un
rôle majeur dans l'initiation de la réponse immunitaire
adaptative. Il existe plusieurs types de cellules dendritiques qui
possèdent des propriétés différentes (Michelle et
al., 2018).
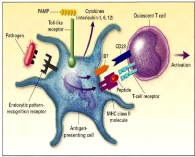
Figure 9 : cellule dendritique (
www.biologie-maroc.com)
? Les cellules NK
Les lymphocytes NK ou cellules Natural Killer sont des
cellules cytotoxiques localisées dans le sang et les organes
lymphoïdes périphériques. Ils reconnaissent et
détruisent les cellules infectées, endommagées ou
ciblées par des anticorps de type IgG. Ils ont également une
grande capacité de sécrétion de cytokines comme l'IFN-y
(Guislaine et al., 2018).
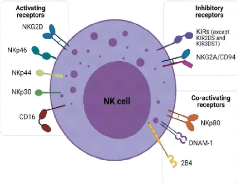
? Les cellules lymphoïdes non
conventionnelles
Ces cellules appartiennent à l'immunité
innée ou sont à l'interface entre immunité innée et
adaptative. Les lymphocytes T ã/ä sont très proches des
cellules NK, mais possèdent la particularité d'exprimer un TCR
reconnaissant des ligands variés différents du CMH. Les cellules
NK- T présentes dans les épithéliums et les tissus
lymphoïdes reconnaissent des lipides microbiens associés à
la molécule CD1 via leur TCR semi-invariant. Les MAIT (Mucosal
Associated Invariant T cells) sont une sous-population de lymphocytes T
à TCR semi-invariant localisés dans les muqueuses et
possédant des propriétés antimicrobiennes. Les cellules
lymphoïdes innées (ILC) sont des effecteurs tissulaires jouant un
rôle important dans la défense contre les micro-organismes ainsi
que dans l'homéostasie tissulaire et les phénomènes
inflammatoires (Jonathan et al., 2018).
I.1.2.2. Immunité adaptative ou spécifique
Intervient secondairement après une phase de
reconnaissance de l'antigène, de prolifération lymphoïde et
de différenciation en cellules productrices d'anticorps (lymphocytes B /
plasmocytes) et de cytotoxicité (lymphocytes TCD3+). Cette
immunité adaptative est douée de mémoire et un
deuxième contact avec l'antigène permet une réponse rapide
et puissante de type secondaire (Olivier, 2005). L'immunité adaptative,
antérieurement qualifiée d'immunité spécifique, est
nécessaire pour le contrôle des infections de longue durée
et pour la mise en place d'une mémoire immunologique sur laquelle
s'appuie la vaccination (Cavaillon, 2010).
Kouassi et al., (2003) intitule que, l'immunité
spécifique est apparue lors de la divergence entre
vertébrés et invertébrés. Elle est
caractérisée par un ensemble de molécules de structure
extrêmement diversifiée appartement toutes à la
superfamille des immunoglobulines (Ig) : les anticorps, les récepteurs
d'antigène des lymphocytes T (TCR) et les molécules CMH. Les
molécules d'Ig existent sous forme soluble (les anticorps
répartis en cinq classes de fonctions biologiques différentes
chez l'homme : IgM, IgG, IgA, IgD et IgE) et sous forme de récepteurs
membranaires des lymphocytes B (BCR). La molécule d'anticorps,
formée en général de 2 chaînes
légères, interagit par son site de liaison ou paratope avec une
zone de l'antigène appelée épitope. Chaque épitope
correspond à une zone de 2 à 3 nm de diamètre (soit
environ 15 acides aminés).
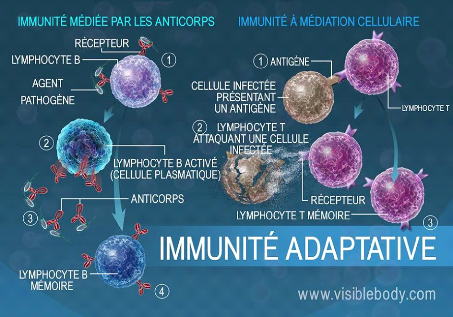
Figure 11 : organisation de l'immunité
adaptative.
I.1.2.2.1. Les acteurs de l'immunité adaptative
Il s'agit principalement des lymphocytes B et T, les
lymphocytes B étant responsables de la réponse immunitaire
humorale (production d'anticorps) et les lymphocytes T des réponses
cellulaires (auxiliaire, cytotoxique ou régulatrice). Les lymphocytes B
et les lymphocytes T ont une morphologie similaire, avec un rapport
nucléo-cytoplasmique élevé sans granulation. Ils sont
capables de reconnaître spécifiquement des antigènes via
leurs immunorécepteurs de type BCR ou TCR. Le BCR se lie à
l'antigène natif alors que le TCR se lie à des antigènes
apprêtés et présentés sous forme de peptide
associé aux molécules du CMH. Il existe des sous-populations
fonctionnelles de lymphocytes T et B définies par leur phénotype,
c'est-à-dire un ensemble de caractéristiques moléculaires
membranaires, et des propriétés fonctionnelles
différentes. Par exemple, parmi les lymphocytes T, on distingue deux
sous-populations majeures : les lymphocytes T auxiliaires ou helpers (Th) et
les lymphocytes T cytotoxiques. Les lymphocytes T auxiliaires
sécrètent des cytokines et sont responsables de l'organisation
des réponses immunitaires innées et adaptatives. Les lymphocytes
T cytotoxiques provoquent la mort des cellules présentant des
antigènes étrangers (dans le cas d'une infection virale ou
d'autres pathogènes intracellulaires) ou des
antigènes du soi anormal en termes qualitatif et/ou quantitatif (dans le
cas d'une cellule tumorale) (Jonathan et al., 2018).
Il existe également des lymphocytes T
régulateurs exerçant des fonctions de régulation et
d'inhibition des réponses immunitaires. Au-delà de leur
rôle de précurseur des plasmocytes, cellules principalement
présentes dans la moelle osseuse ayant pour fonction la production des
anticorps en grande quantité et pendant une longue durée, les
lymphocytes B ont également un rôle de CPA aux lymphocytes T.
Cette propriété est à la base de la coopération
cellulaire entre les lymphocytes T et B afin de réguler l'activation de
ces derniers et ainsi la production des anticorps. Au décours des
réponses immunitaires, les lymphocytes B comme les lymphocytes T donnent
naissance à des cellules mémoires à durée de vie
longue dont le rôle est de répondre plus efficacement à une
nouvelle exposition à un antigène donné (réponse
secondaire) (Jonathan et al., 2018).
I.1.3. Cellules immunitaires
Le système immunitaire est composé d'organes et
de tissus dits lymphoïdes dévolus à la production de
lymphocytes et aux fonctions immunitaires. Ils sont connectés par les
vaisseaux sanguins et lymphatiques. Le foie foetal est le premier organe de
différentiation des cellules immunitaires, relayé à la
naissance par la moelle osseuse. Les Cellules souches lymphoïdes
poursuivent leur maturation en lymphocytes B ou T au sein des organes
lymphoïdes primaires (ou centraux) où ils acquièrent, entre
autres, un récepteur propre à chaque cellule : c'est la
constitution des répertoires T et B (Jonathan et al., 2018).
Les cellules lymphoïdes innées (ILC) orchestrent
les réponses immunitaires aux signaux tels que les cytokines, les
alarmines, les neuropeptides et les hormones, interagissant avec les cellules
hématopoïétiques et non hématopoïétiques.
Les ILC manquent de récepteurs antigéniques
réarrangés et bien qu'ils résident principalement dans les
tissus, ils sont également observés dans la circulation et les
tissus lymphoïdes secondaires où ils présentent des
fonctions spatiales et temporelles distinctes. En dehors des rôles dans
l'immunité, les ILC jouent un rôle clé dans le maintien de
l'homéostasie tissulaire, la promotion de la réparation
tissulaire et la régulation de l'inflammation. Alors que le
système nerveux central (SNC) est considéré comme un site
privilégié sur le plan immunitaire avec un infiltrat immunitaire
minimal, des ILC ont été identifiées dans le SNC d'humains
et de souris en bonne santé, représentant environ 2,5 % des
leucocytes par séquençage (Julia et al., 2022).
Les ILC humains présentent une plasticité
importante, définie comme la capacité d'une population ILC mature
à acquérir les caractéristiques associées à
une autre population ILC mature. Cette caractéristique dynamique des ILC
humaines pourrait être un moyen efficace d'adapter rapidement
l'immunité aux conditions prédominantes dans les tissus sans
recrutement de cellules provenant d'autres sources tissulaires. Les
mécanismes sous-jacents à la plasticité de l'ILC servent
évidemment de cibles thérapeutiques intéressantes
(Mazzurana et al., 2018).
Les caractéristiques distinctes des ILC et des
lymphocytes T permettent une complémentarité et une redondance
entre ces systèmes immunitaires innés et adaptatifs. Alors que
les lymphocytes T sont activés par des interactions MHC-peptide-TCR et
des signaux de costimulation, les ILC manquent généralement
d'expression de récepteurs antigéniques réarrangés.
Au lieu de cela, ces cellules sont amorcées par les cytokines, les
hormones et les médiateurs lipidiques environnants et peuvent en outre
être sensibles aux stimuli environnementaux. Dans le milieu humain, les
ILC servent sans aucun doute de sources importantes de cytokines qui
entraînent la pathologie. De plus, en agissant dans un réseau
d'autres cellules immunitaires, l'ILC peut propager leurs fonctions
au-delà de celles directement médiées par les ligands de
surface et les cytokines effectrices sécrétées (Mazzurana
et al., 2018).
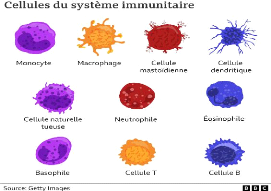
Figure 12 : les cellules du système
immunitaire.
I.1.3.1. Rôle et fonction des cellules
immunitaires
À l'état basal, l'épiderme joue une
barrière physique naturelle empêchant la pénétration
de la bactérie pathogène. Cette protection est renforcée
par une compétition pour les nutriments avec la flore commensale
cutanée ainsi que la présence de peptides et enzymes
antibactériens. Une rupture de cette barrière (coupure,
piqûre...) est donc nécessaire afin que la bactérie
pénètre
dans l'organisme. À ce moment-là, les cellules
immunitaires innées résidentes du tissu sous-cutané,
macrophages et cellules dendritiques immatures, vont pouvoir reconnaître
comme anormale (PAMPs et signal « danger ») la présence de ces
bactéries via leurs immuno récepteurs, les internaliser par
phagocytose puis initier une réponse inflammatoire. La principale
conséquence est une modification de la perméabilité
vasculaire permettant aux cellules et aux protéines sanguines de
traverser l'endothélium, en particulier les granulocytes neutrophiles
jouant un rôle crucial dans l'élimination des bactéries,
les immunoglobulines et le complément (Jonathan et al., 2018).
En parallèle, les cellules dendritiques immatures,
suite aux signaux dangers reçus, entament un processus de maturation et
migrent vers les organes lymphoïdes secondaires. C'est ici qu'elles
interagiront avec les cellules du système immunitaire adaptatif, les
lymphocytes B et les lymphocytes T CD4+, capables de reconnaître les
antigènes bactériens via leur immuno-récepteur de surface.
Cette interaction tripartite est indispensable afin d'engendrer une activation
efficace du lymphocyte B et du lymphocyte T qui vont alors proliférer de
manière clonale et donner naissance à des lymphocytes
mémoires qui joueront un rôle crucial dans le cas d'une
deuxième infection (Jonathan et al., 2018).
Les lymphocytes B activés générés
poursuivent également leur maturation afin de devenir des plasmocytes,
cellules productrices d'anticorps dirigés contre les protéines
bactériennes qui diffuseront dans l'ensemble de l'organisme via la
circulation sanguine. Au niveau du site de l'infection, ces anticorps auront la
capacité de détruire directement les bactéries par
activation du complément ou bien de favoriser leur phagocytose par les
macrophages. Une fois que l'ensemble des bactéries est
éliminé, un certain nombre de processus permettent la
réparation tissulaire, étape importante afin que
l'intégrité de l'épithélium soit retrouvée
et sa protection restaurée (Jonathan et al., 2018).
Grâce à leur capacité à faire
avancer la cascade de réactions inflammatoires, les ILC sont
impliquées dans une myriade d'interactions avec d'autres cellules
immunitaires. Les cellules myéloïdes sont capables de
détecter les signaux de danger provenant d'agents pathogènes
envahissants ou de tissus endommagés et sécrètent des
cytokines qui instruisent par conséquent les ILC. Les réseaux de
cytokines impliqués dans l'interaction entre les ILC et les cellules
myéloïdes ont récemment fait l'objet d'une revue approfondie
par Mortha et Burrows. Ainsi, dans la présente revue, nous
résumerons la compréhension actuelle de la façon dont les
ILC interagissent avec d'autres cellules d'origine lymphoïde (Mazzurana et
al., 2018).
Les paires de molécules de point de contrôle
immunitaire jouent un rôle essentiel dans la connexion des cellules
immunitaires innées et adaptatives pour une réponse immunitaire
stimulatrice ou inhibitrice, et dirigent la réponse immunitaire vers
l'une ou l'autre des cellules par des réactions de point de
contrôle immunitaire unidirectionnelles ou bidirectionnelles. Il est
important de noter que, les cellules immunitaires subissent une reprogrammation
métabolique au cours des réponses immunitaires, qui se
caractérise par une altération de la production d'énergie,
de la biosynthèse et de la reprogrammation
épigénétique (Lizhe et al., 2020).
Pour répondre aux demandes énergétiques
et biosynthétiques accrues de réponse de défense et de
réparation des dommages, les cellules immunitaires activées ont
tendance à augmenter l'activité de glycolyse mais à
diminuer la phosphorylation oxydative pour une production rapide
d'adénosine triphosphate (ATP) afin d'adopter un statut
prolifératif et des fonctions effectrices pro-inflammatoires (Lizhe et
al., 2020).
Comme l'une des conséquences des changements du
métabolisme cellulaire, une reprogrammation
épigénétique distincte a également
été trouvée dans les cellules immunitaires activées
en raison de l'accessibilité altérée du donneur de groupe
acétyle/méthyle et de l'activité modulée par les
métabolites des enzymes épigénétique. Une
acétylation élevée mais une méthylation
supprimée est souvent associée à un statut
pro-inflammatoire dans les cellules immunitaires dans de nombreux cas (Lizhe et
al., 2020).
I.2. Exercice physique et cellules immunitaires
La pratique du sport entraîne des modifications non
négligeables de la répartition des populations cellulaires
circulantes impliquées dans la réponse immunitaire innée
et adaptative. Ces changements passent par une production de cytokines
pro-inflammatoires et la libération des hormones du stress, conduisant
à des redistributions cellulaires. La nature des interactions est
complexe et passe en partie par l'expression de molécules
d'adhésion, le recrutement de lymphocytes matures plus que de
lymphocytes naïfs ainsi que par des altérations des
phénomènes d'apoptoses du potentiel mitotique. En pratique
quotidienne le médecin peut recommander la pratique de l'exercice
régulier en excluant les entraînements exténuants pour le
muscle et le système lymphoïde d'immuno-surveillance (Olivier,
2005).
La pratique de l'exercice physique peut provoquer des
réponses biochimiques et physiologiques aiguës ou chroniques en
fonction de la fréquence, du volume et de l'intensité de
l'exercice. Les réponses physiologiques aiguës sont
associées, par exemple, aux effets immédiats d'une seule
séance d'exercice, qui induisent des altérations de
l'homéostasie de l'ensemble du corps. La
pratique de l'exercice physique consomme
intrinsèquement de l'énergie, génère des ROS et
active le système immunitaire, ayant à la fois des effets
positifs et éventuellement nocifs selon le type et le degré des
réponses du système immunitaire activé (Débora et
al., 2020).
L'activation du système immunitaire est une
réponse à un facteur de stress, visant à rétablir
l'homéostasie cellulaire. Le processus inflammatoire joue un rôle
crucial dans l'homéostasie, principalement par la défense active
contre divers stimuli nocifs tels que les infections virales neurotropes et/ou
les dommages traumatiques, favorisant le rétablissement de la fonction
cellulaire et tissulaire (Débora et al., 2020).
Au cours d'exercices aérobies d'intensité
modérée et vigoureuse d'une durée inférieure
à 60 minutes, l'activité anti pathogène des macrophages
tissulaires se produit parallèlement à une recirculation accrue
des immunoglobulines, des cytokines anti-inflammatoires, des neutrophiles, des
cellules NK, des lymphocytes T cytotoxiques et des lymphocytes B immatures.
Cellules, qui jouent toutes un rôle essentiel dans l'activité de
défense immunitaire et la santé métabolique. L'exercice
intense stimule l'échange de cellules et de composants du système
immunitaire inné entre les tissus lymphoïdes et le compartiment
sanguin. Bien que transitoire, un effet de sommation se produit au fil du
temps, avec une amélioration de l'immuno-surveillance contre les agents
pathogènes et les cellules cancéreuses et une diminution de
l'inflammation systémique (David et al., 2018).
En général, l'exercice intensif est maintenant
considéré comme un adjuvant important du système
immunitaire pour stimuler l'échange continu de leucocytes entre la
circulation et les tissus. Le contraste des réponses immunitaires
aiguës à un effort intense (par exemple, une course de marathon) et
à une marche de 30 à 45 minutes. L'activation immunitaire est
associée aux demandes d'oxygène et de biosynthèse, et les
cellules immunitaires doivent s'engager dans une reprogrammation
métabolique pour générer suffisamment d'énergie
pour alimenter ces demandes. Bien que des recherches supplémentaires
soient nécessaires, des données préliminaires confirment
que la capacité métabolique des cellules immunitaires est
réduite pendant la récupération après des
périodes d'exercice intensif exigeantes sur le plan physiologique,
entraînant un dysfonctionnement immunitaire transitoire (David et al.,
2018).
La plupart des études sur les effets de l'exercice sur
le système immunitaire ont été réalisées en
évaluant certains paramètres avant et après la performance
physique. Des séances uniques d'exercices d'intensité
modérée sont "immuno-améliorantes" et, en fait, sont
responsables d'une
réduction de l'inflammation, du maintien de la masse
thymique et d'une immuno-surveillance améliorée. D'autre part,
certaines études montrent des changements négatifs dans les
niveaux et la fonction de nombreux composants du système immunitaire en
réponse à un exercice intense et prolongé (Olga et al.,
2021).
Durant cette phase, appelée « fenêtre
ouverte », l'hôte est plus sensible aux micro-organismes tels que
les virus et les bactéries avec un plus grand risque de contracter des
infections. Différents mécanismes contribuent à ces
altérations, tels que le stress résultant d'un exercice intense,
les modifications de la concentration des hormones, des cytokines et de la
température corporelle, l'augmentation du flux sanguin, l'apoptose
lymphocytaire et la déshydratation. En particulier, les exercices
d'endurance à haute intensité ont été
associés à une modification du nombre de globules blancs des
athlètes, telle qu'une augmentation des granulocytes et des monocytes,
une diminution des lymphocytes et une augmentation des neutrophiles et des
éosinophiles. Un rôle intéressant semble être
joué par les cellules « natural killer », dont
l'activité semble exaltée lors de l'effort physique, avec une
augmentation des cellules CD16+ (Olga et al., 2021).
De plus, après un exercice physique intense, la
protection immunitaire des voies respiratoires supérieures est plus
faible en raison d'une diminution des sécrétions nasales et
salivaires avec de faibles niveaux d'IgA, d'une augmentation du transit du
mucus ciliaire nasal et d'une fonction nasale compromise des neutrophiles (Olga
et al., 2021).
Cependant, la modulation du système immunitaire
inné à l'exercice physique peut changer en fonction du type, de
l'intensité et du volume d'exercice, voire du moment de la mesure par
rapport à la séance d'entraînement. Par exemple,
après un exercice vigoureux aigu se produit un afflux spectaculaire de
cellules tueuses naturelles et de lymphocytes T CD8 + qui présentent une
cytotoxicité élevée et un potentiel de migration
tissulaire (Débora et al., 2020).
Bien que l'hypothèse de la « fenêtre ouverte
» immunologique après un exercice physique intense soit largement
diffusée dans la littérature, certains aspects concernant la
dynamique immunologique après un exercice physique aigu restent
controversés. L'hypothèse de la "fenêtre ouverte"
suggère qu'une altération du système immunitaire
après un exercice vigoureux augmente le risque de contracter une
infection des voies respiratoires supérieures (Débora et al.,
2020). Au cours d'un exercice aérobie vigoureux, on observe une
augmentation des lymphocytes du sang périphérique,
suggérant une activation du système immunitaire induite
par l'exercice. Cependant, 1 heures ou 2 heures après
l'exercice, une diminution des lymphocytes du sang périphérique
est observée, représentant pour l'athlète une
période de risque de contracter des infections et renforçant
l'hypothèse selon laquelle l'exercice favorise une fenêtre
d'immunosuppression à court terme (Débora et al., 2020).
I.3. Protéine C-Réactive
Bien qu'une multitude de protéines soient
impliquées dans l'inflammation, la plupart d'entre elles ne participent
pas activement à l'élimination des pathogènes ou des
cellules humaines. L'un des médiateurs de la phase aiguë
directement impliqué dans ces processus pro-inflammatoires est la
protéine C-réactive qui a été découverte par
Tillett et Francis. La CRP est bien établie comme l'un des marqueurs les
plus fiables de l'inflammation, augmentant considérablement pendant tout
type d'inflammation (Ahmed et al., 2021). Le CRP a été
affiné par Mac Leod et Avery en 1941. Mac Leod et Avery ont
découvert que la substance responsable de la réaction de
précipitation avec le fragment C'était une protéine, et
que le calcium était également essentiel pour la réaction
de précipitation (Ablij, 2002). Ils ont développé un
anticorps anti-CRP de lapin et l'ont cristallisé à partir de
McCarthy en 1947. La séquence complète d'acides aminés de
la CRP a été publiée par Oliveira et al en 1977.
Établi et ne montre pas d'homologie avec les immunoglobulines (Oliveira
et al., 1977).
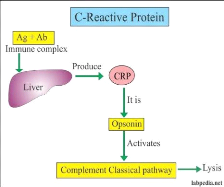
Figure 13 : La protéine C-réactive
(CRP).
I.3.1. Définition
La CRP est un réactif de phase aiguë largement
utilisé dans la pratique clinique comme marqueur d'infection et/ou
d'inflammation en raison du fait que sa synthèse augmente
Figure 14 : Structure de la CRP.
rapidement et considérablement (jusqu'à 10 000
fois) après une lésion tissulaire ou une infection (Caroline et
al., 2022).
La CRP est une glycoprotéine
sécrétée pendant la phase aiguë de la
réaction. Dont le taux augmente à la suite d'un processus
inflammatoire, en particulier en présence d'infection bactérie
(pneumocoque), maladies histolytiques et de nombreuses autres conditions
pathologique (Beau et Partouche, 2000).
La protéine C-réactive est une protéine
inflammatoire homopentamérique de phase aiguë, une protéine
plasmatique hautement conservée qui a été initialement
découverte en 1930 par Tillet et Francis lors d'une enquête sur le
sérum de patients souffrant du stade aigu de l'infection à
Pneumococcus et a été nommée pour sa réaction avec
le polysaccharide capsulaire de Pneumococcus (Nicola et Jason, 2018).
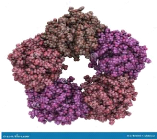
I.3.2. Structure
La structure cristallographique de la protéine C
réactive a été déterminée au rayon X avec
une résolution de 3 angströms (Volanakis, 2001). Elle est
constituée de cinq (5) monomères identiques comportant chacune
207 acides aminés qui s'organisent en anneau et constituent un port
central. Son poids moléculaire est de 120 KDa. Elle appartient à
la famille des pentraxines : un ensemble de molécules possédant
des homologies dans la séquence des acides aminés, la
configuration pentamérie et les propriétés (Baumann et
Gauldie, 1994). Le SAP (Sérum amyloïde P component) en fait
également partie. Le gène de la CRP est situé sur le
chromosome 1 (en 1q21 - 1q23).
I.3.3. Synthèse et localisation de la CRP
La CRP est synthétisée dans le foie
principalement par les hépatocytes puis il a été
libéré dans le plasma. La synthèse de CRP par les cellules
est également décrite. Cependant, il existe également des
muscles lisses et des macrophages dans l'athérosclérose,
neurones, macrophages alvéolaires et les lymphocytes (Calabro et al.,
2003).
La protéine est détectable à la forme de
l'endomètre d'une artère, d'un pentamère ou d'un
monomère dans un vaisseau sanguin bien qu'associé aux tissus
sains (Diehl et al., 2000), il est également aux premiers stades du
développement de l'athérome et il s'accumule au fur et à
mesure de la progression de la lésion (Yasojima et al., 2001).
I.3.4. Les fonctions de CRP
La CRP est une partie importante de l'immunité
innée. Elle est la première représentante Pathogen
Recognition Receptor (PRR) grâce à sa capacité à
reconnaître les pathogènes en se liant à des structures
telles que la phosphorylcholine présente à leur surface (Le Gall
et Desideri-Vaillant, 2011). La CRP possède une affinité
dépendante du calcium pour de nombreux autres ligands. Cette liaison
initie l'activation de différents systèmes de défense de
l'hôte.
? Fixation à des ligands
La phosphorylcholine représente le site de liaison de
la CRP à son ligand Référence : Streptococcus pneumoniae
polysaccharide C. Chaque monomère CRP a un site de liaison à la
phosphorylcholine. Ceci n'est pas révélé par les cellules
c'est un organisme normal et se produit uniquement dans les membranes
cellulaires altérées. Cellules blessées. Cela se fait en
liant CRP à un composant central tel que : B. Chromatine, histones,
petite protéine ribonucléaire nucléaire (RNPs). La CRP
reconnaît également la phosphorylcholine dans les
lipoprotéines de basse densité (LDL) s'oxyde. Ceci explique sa
présence dans les lésions d'athérosclérose. La
liaison de ligands à la CRP permet sa reconnaissance par les
récepteurs des immunoglobulines G, ce qui favorise la phagocytose des
éléments bactériens ou cellulaires porteurs de ces ligands
(Le Gall et Desideri-Vaillant, 2011).
? Activation du système du
complément
Lors de la liaison à un ligand, la CRP peut activer le
système du complément, la voie classique après liaison
directe à C1q, comme c'est le cas avec les complexes immuns. Cette
activation entraîne la formation des anaphylatoxines C3a et C4a, et des
opsonines C4b et C3b. Cependant, contrairement aux IgG et aux complexes immuns,
La supplémentation en CRP ne semble pas
affecter la convertase C5 et n'a aucun effet. Il est efficace
dans la formation du complexe d'attaque membranaire du complément (C5C9)
et donc dans la lyse de bactéries ou de cellules (Du Clos, 2013). Cela
peut être dû à l'affinité de la CRP pour le facteur
H, un inhibiteur de la convertase C5 (Okemefuna et al., 2010).
I.3.5. CRP marqueur d'inflammation
Une augmentation de la CRP indique la présence d'une
affection inflammatoire. Il n'existe pas de faux positif car il n'y a pas de
déficience congénitale ou acquise de la CRP. La CRP
s'élève dans les affections inflammatoires, quelle que soit leur
étiologie.
? Causes de l'augmentation de la CRP :
La CRP est augmentée suite à certaines pathologies
inflammatoires tel que :
? Les maladies inflammatoires (rhumatisme articulaire aigu,
polyarthrite rhumatoïde, maladie de Horton, maladie de Crohn) ;
? Les infections bactériennes (pneumonies, abcès
profond, méningite, infection urinaire) ? Les nécroses
tissulaires (pancréatite, IDM) ;
? Certains cancers (carcinomes, sarcomes, lymphome).
La CRP peut également augmenter de manière
systémique après une situation non morbide Grossesse, utilisation
d'oestrogène, inhalation de fumée de cigarette et en
Postopératoire (Mauris et al., 2005).
I.3.6. Rôle de la protéine
C-Réactive
La protéine C-réactive, nommée pour sa
capacité à se lier et à précipiter le
C-polysaccharide pneumococcique, est la protéine classique de la phase
aiguë. Bien qu'il circule à de faibles concentrations chez les
individus en bonne santé, ses niveaux augmentent considérablement
en réponse aux infections, aux lésions tissulaires et à
l'inflammation (Magdalena et al., 2019).
Le rôle principal de la CRP dans l'inflammation tend
à se concentrer autour de l'activation de la molécule C1q dans la
voie du complément conduisant à l'opsonisation des agents
pathogènes. La CRP est un membre de la superfamille des protéines
hautement conservées de la pentraxine et est composée de cinq
protomères identiques disposés dans une configuration
pentamérique, appelée CRP pentamérique (pCRP) (McFadyen et
al., 2020).
Le rôle de la CRP dans la défense de l'hôte
est en grande partie dû à sa capacité à lier la
phosphocholine (PC), à activer la cascade classique du complément
et à améliorer la phagocytose (Pepys, 1981 ; Gewurtz et al., 1982
; Du Clos, 2003).
Les caractéristiques de liaison au ligand de la CRP
semblent également importantes pour comprendre son rôle dans
l'inflammation. En plus de la reconnaissance des antigènes microbiens,
la CRP réagit avec les cellules sur les sites de lésion
tissulaire. Comme le composant P amyloïde sérique (SAP), la
protéine C-réactive se lie aux antigènes
nucléaires, aux membranes endommagées et aux cellules
apoptotiques, et est impliquée dans la clairance des cellules
blessées ou apoptotiques, ainsi que du matériel
libéré par ces cellules endommagées (Du Clos, 2003).
I.4. Sport et Réhydratation
La réhydratation est une fonction de la vidange
gastrique, de l'absorption du liquide intestinal et de la rétention de
liquide pour restaurer les compartiments des fluides corporels. Une mesure
complète de ces processus est le pourcentage de liquide retenu
après une période de récupération définie
après l'ingestion d'un volume spécifié de fluide (Nhu et
al., 2023).
Pour restaurer l'euhydratation après l'effort, il a
été recommandé d'ingérer de 125 à 150% du
volume perdu pour compenser les pertes urinaires lors de la
récupération précédant l'exercice suivant (Evans et
al., 2017 ; Thomas et al., 2016). Pour une réhydratation complète
et rapide entre les séances d'exercice, le facteur nutritionnel le plus
important est le volume de la boisson, la recherche démontrant que le
volume ingéré doit être supérieur à celui
perdu pour tenir compte des pertes de liquide continues dans la période
post-exercice (Donald et al., 2023).
Les perturbations du volume et de la concentration d'eau dans
l'ensemble du corps sont surveillées par le cerveau, la soif et les
sensations oropharyngées qui en résultent modulent la
consommation d'alcool et les réponses neuroendocriniennes
régulent l'excrétion ou la rétention d'eau et
d'électrolytes par les reins (Lawrence, 2021).
Au cours d'activités quotidiennes typiques qui
n'incluent pas d'exercice, ces interactions complexes agissent pour maintenir
le volume total d'eau corporelle et la concentration sérique entre 1 et
3 % de la ligne de base chaque jour (Cheuvront, et Kenefick, 2016 ; Greenleaf,
1992 ; Bartoli et al., 1993). Secondaire au volume, il y a la concentration de
sodium dans la boisson, dont il a été démontré de
manière constante qu'elle améliore la réhydratation
(Shirreffs et al., 1996 ; Maughan et Leiper, 1995 ; Shirreffs et Maughan, 1998
; Merson et al., 2008), avec des
concentrations de sodium de 40 à 100 mmol/L
signalées pour maximiser la réhydratation après
l'exercice. Cette concentration correspond aux concentrations moyennes de
sodium dans la sueur humaine (Barnes et al., 2019), certaines preuves
suggérant que le rétablissement de l'équilibre sodique est
nécessaire pour faciliter le rétablissement de l'équilibre
hydrique (Donald et al., 2023).
Cependant, des concentrations de sodium plus faibles (~20
à 30 mmol/L) produisent des avantages moins constants pour la
réhydratation (Wijnen et al., 2016) ; Il s'agit d'un
élément clé à prendre en compte pour les
stratégies de réhydratation, étant donné que la
plupart des boissons pour sportifs disponibles sur le marché contiennent
une concentration de sodium de ~20 mmol/L de sodium. Une réhydratation
rapide et adéquate entre les séances d'entraînement et les
compétitions est importante, en particulier lorsque la période de
réhydratation est brève avant de reprendre les défis
physiques et environnementaux (Evans et al., 2017 ; Montain et al., 1999).
I.5. Sport et Déshydratation
Le maintien d'un équilibre hydrique approprié
est important pour optimiser les performances physiques et soutenir la
santé (El-Sharkawy et al., 2015 ; Adams et al., 2017). Par exemple, la
déshydratation affecte négativement la puissance, la force et
l'équilibre, mais les résultats d'études avec des
protocoles différents (par exemple, comment la déshydratation est
induite) et des variables de résultat (par exemple, sélection de
variables représentatives, méthode de mesure) présentent
des résultats mitigés (Savoie et al., 2015 ; McKinney et al.,
2013). Il est important de comprendre comment l'hypohydratation affecte les
déterminants de la performance physique tels que la puissance, la force
et l'équilibre pour prendre en compte les recommandations pratiques pour
les protocoles de réhydratation. En particulier, il existe peu de
recherches sur les effets de l'hypohydratation sur les mesures de performance
dans les situations de la vie quotidienne.
Un apport hydrique insuffisant pendant la pratique et
l'entraînement sportif peut entraîner une déshydratation.
Une déshydratation persistante égale ou supérieure
à 2 % de la masse corporelle a un impact négatif sur les
performances lors des efforts ultérieurs et augmente les risques de
maladie due à la chaleur (Evans et al., 2017 ; McDermott et al.,
2017).
L'entraînement et le jeu peuvent entraîner une
déshydratation due à l'ingestion de moins de liquides perdus par
la transpiration (Maughan et al., 2004). Ce bilan négatif impacte non
seulement les performances physiques des athlètes, mais
aussi leurs performances mentales et cognitives (Nuccio et al., 2017) notamment
chez les joueurs de football (Oliveira et al., 2017).
De plus, le niveau de fatigue qui affecte les athlètes
semble être lié à certains facteurs. Parmi eux, le
degré d'hypohydratation présenté à la fin d'un
match (Mohr et al., 2010). Cette diminution des performances liée
à la déshydratation peut avoir plusieurs causes, telles que
l'augmentation de la température corporelle ou l'utilisation accrue de
glycogène et la diminution conséquente des réserves
musculaires (Maughan, 1999 ; Périard et al., 2021). Pour cette raison,
une différence dans le modèle d'activité des
athlètes a également été observée, car la
distance parcourue lors de mouvements de haute intensité est plus petite
lorsque les températures sont plus élevées et la
déshydratation est plus importante (Nassis et al., 2014 ; Watanabe et
al., 2017 ; Nobari et al., 2021).
La déshydratation volontaire se produit lorsque
l'apport hydrique ad libitum est insuffisant pour compenser les pertes de
liquide, entraînant une perte cumulative d'eau corporelle (Baker et
al.,2016). Le seuil diminue le volume sanguin (hypovolémie) et augmente
l'osmolalité plasmatique (hyperosmolalité), stimulant
généralement la soif et l'apport hydrique ultérieur
(Hughes et al., 2018 ; James et al., 2019).
L'hypohydratation avec une perte de masse corporelle de =2%
est souvent associée à de graves altérations des fonctions
thermorégulatrices, métaboliques et cardiovasculaires,
entraînant souvent des effets néfastes sur les performances et la
santé (Casa et al., 2012 ; Cheuvront et Kenefick, 2014 ; Sawka et al.,
2015).
I.6. Football
Selon Wikipédia, Le football est un sport collectif qui
se joue avec un ballon sphérique entre deux équipes de onze (11)
joueurs. Elles s'opposent sur un terrain rectangulaire équipé
d'un but à chaque extrémité. L'objectif de chaque
équipe est de mettre le ballon dans le but adverse plus de fois que
l'autre équipe, sans que les joueurs utilisent leurs bras à
l'exception des gardiens de buts. Pour Yang et al., (2013), le football est
l'un des sports les plus populaires au monde. Il est pratiqué à
différentes catégories d'âge. C'est un sport balistique
opposant deux équipes de 11 joueurs et le match se joue pendant au moins
90 minutes dans les compétitions officielles. Le football est un sport
intermittent caractérisé par des mouvements explosifs
répétés. Durant un match de football, le joueur parcourt
entre 8 et 12 km avec une fréquence cardiaque proche
de 90 % de la fréquence cardiaque maximale (FC max) et
exécute 10 à 20 sprints, 8 têtes et 11 tacles (Khanfir et
al., 2013).
Les actions décisives en football sont des mouvements
explosifs qui sont généralement réalisés sur un
fond d'endurance (Khanfir et al., 2013). Un match de football est
constitué de deux périodes de quarante-cinq (45) minutes chacune
et entre la première et la deuxième période, il y'a une
pause de quinze (15) minutes. D'autres périodes de pause sont
observées lors des arrêts de jeu suite aux infractions aux
règles et à l'occasion des changements (Jacquet et al., 2002).
Le football est pratiqué par des millions de personnes
dans le monde (César et al., 2022). Il peut être
caractérisé comme un sport intermittent de haute
intensité, sporadique et impliquant une infinité d'actions
physiques qui se reflètent dans l'exécution compétente de
diverses actions techniques (Rampinini et al., 2008 ; Bradley et al., 2009 ;
Nobari et al., 2021).
Au fil des ans, de nombreux changements se sont produits, avec
un impact significatif sur ses exigences physiques (Bush et al., 2015 ; Wallace
et Norton, 2014). Aujourd'hui, la capacité d'effectuer non seulement des
exercices de faible intensité, mais aussi (et surtout) des exercices de
haute intensité et de l'explosivité est un élément
fondamental d'une bonne performance des athlètes (Bush et al., 2015 ;
Wallace et Norton, 2014 ; Nobari et al., 2021). De plus, au plus haut niveau,
le nombre de matchs a augmenté, ce qui signifie que l'encombrement
hebdomadaire des moments de compétition augmente également
(Anderson et al., 2017 ; Nobari et al., 2022).
Chapitre II : Matériel et Méthodes
II.1. Matériel
II.1.1. Mesure de la taille
La mesure de la taille en position debout est une des mesures
physiques fondamentales pour quantifier la taille du corps humain. Elle a
été effectuée à l'aide d'une toise en bois sur
socle (figure 13) installée sur une surface dure, horizontale et stable,
tout en maintenant l'angle de la toise perpendiculaire au sol. Lors de la prise
de la mesure, le sujet était en position verticale, dos à la
toise afin que la tête, les épaules, les fesses et les talons
soient appuyés sur la barre verticale de la toise, tout en maintenant
une courbure lombaire naturelle. Le sujet était pieds nus. Il devait
avoir les mains le long du corps, paumes face aux cuisses, jambes tendues et
maintenir la tête droite en regardant droit devant lui. Avant la mesure,
le sujet devait prendre une grande inspiration et la maintenir jusqu'à
ce que la partie mobile de la toise soit descendue sur sa tête et que la
mesure soit terminée.

Figure 15 : Toise en bois sur socle
II.1.2. Mesure de la masse corporelle
La mesure de la masse corporelle a été
effectuée à l'aide d'une impédance mètre
électronique de marque TANITA BC-545N (JAPAN) d'une portée
maximale de 150 kg et ayant une précision de 0,1 kg près,
installée sur une surface dure, horizontale, stable et exempte de
vibrations. Avant toute mesure, les données de l'année de
naissance, mois et jour ont été insérées suivi de
la taille. Après insertion des données, le sujet se met debout en
plaçant les pieds sur les électrodes et en tenant les
électrodes avec les deux mains. En moins d'une minute un bip sonore
déclare la fin de l'opération et tous les résultats ont
été affichés sur l'écran.

Figure 16 : Impédance mètre
Figure 18 : L'électrophotomètre, CYAN Start
(Chine)
II.1.3. Sinothinker SK8800
L'appareil Sinothinker SK8800, a été
utilisé pour une analyse hématologique automatique du sang via la
numération formule sanguine (NFS).

Figure 17 : Automate Sinothinker SK8800, hematology
analyzer (Chine)
II.1.4. L'électrophotomètre
Encore appelé spectrophotomètre, est un appareil
qui a permis de déterminer la concentration des espèces chimiques
du sang via au test de CRP.

II.2. Méthodes
II.2.1. Type et cadre d'étude
C'est une étude expérimentale, menée
auprès des Etudiants de la première année des licences EPS
et Sport, dans la période allant du 31 mai 2023 au 14 mai 2024 dans la
ville de Brazzaville précisément à l'Institut
Supérieur d'Education Physique et Sportive (ISEPS), Arrondissement 1
Makélékélé. Il est limité au nord par le
croisement des avenues ex OUA et Matsoua, la station totale, la Banque UBA ; au
sud par l'hôpital de base de Makélékélé ;
à l'est par le marché total et l'école primaire et
collège de l'Amitié et à l'ouest par l'unité des
agents de sécurité civile (sapeurs-pompiers).
II.2.2. Population
La population de cette étude a été
portée sur 30 étudiants footballeurs dont 15 joueurs de la
première année de Licence EPS (L1 EPS) et 15 joueurs de la
première année de Licence Sport (L1 Sport) de l'ISEPS qui ont
pris part à la coupe interclasse de football organisée par la
direction dudit Institut.
II.2.3. Echantillon
Des 30 étudiants footballeurs, 22 soit 11 joueurs de la
L1 EPS et 11 de la L1 Sport ont participé à cette
étude.
II.2.4. Critères d'inclusion
Pour faire partir de l'échantillon d'étude,
chaque sujet devrait satisfaire aux critères d'inclusion suivants :
Être Etudiants à l'ISEPS et être inscrit en L1 EPS et L1
Sport ; avoir participé au tournoi interclasse de football ; avoir
signé le consentement éclairé ; avoir participé
à tous les tests.
II.2.5. Critères de non inclusion
Etaient non inclus à cette étude, les
étudiants n'ayant pas participés au tournoi interclassent de
football et les étudiants non-inscrits en L1 EPS et L1 Sport.
II.2.6. Critères d'exclusion
Les sujets n'ayant pas réalisés tous les tests
et ceux étant malades le jour des tests a été exclus de
l'étude.
II.2.7. Protocole expérimental
Procédures
Le match de football a été réalisé
dans une ambiance chaude et humide notamment de 12 heures et 14 heures à
l'ISEPS. Les prélèvements sanguins ont été
effectués avant effort, après et 2 heures après effort. La
température ambiante et l'humidité relative ont été
mesurées avant et après la première période, avant
et après la deuxième période du match aux abords du
terrain de football. Pendant la rencontre, l'une des deux équipes
étaient réhydraté toutes les 15 minutes. La
quantité d'eau minérale prise était de 33 cl par sujet.
Les tests ont été réalisés 4 semaines après
le tournois interclasse de football.
Test d'effort
Le test d'effort a consisté en un match de football de
90 minutes (2x45 minutes avec une pause de 15 minutes) dans un environnement
chaud et humide.
Numération formule sanguine ou
hémogramme
Les examens d'hémogramme étaient
réalisés à partir des échantillons de sang
prélevés avant, après et 2 heures après effort. Ces
examens ont permis de déterminer les concentrations de leucocytes,
lymphocytes, monocytes, neutrophiles et éosinophiles. Le
prélèvement sanguin a permis également d'évaluer
des concentrations de la CRP avant et après le test d'effort. Ces
examens ont été réalisés au laboratoire d'analyse
de biologie médical et de toxicologie « SOS LABORANTINS » de
Brazzaville. Les prélèvements des échantillons de sang ont
été effectués par des agents de santé.
II.2.8. Variables étudiées
Trois types de variables ont été
répertoriés à savoir : la variable indépendante, la
variable dépendante et la variable confondante. Le match de football a
constitué la variable indépendante de l'étude. Les
cellules inflammatoires notamment les leucocytes, lymphocytes, monocytes,
neutrophiles, éosinophiles et la protéine C-réactive ont
constituées les variables dépendantes. La température
ambiante, l'humidité relative et la réhydratation ont
constituées les variables confondantes.
II.2.9. Considération éthique
La présente étude a été
réalisée conformément à la déclaration
d'Helsinki de 1975 relatives à l'éthique et approuvée par
le Conseil Scientifique au N°005/UMNG/Dir/DA/SP/CS de l'Institut
Supérieur d'Education Physique et Sportive de l'Université Marien
NGOUABI (voir annexe).
II.2.10. Analyse statistique
Les statistiques descriptives ont été
utilisées pour générer les moyennes et les
écart-types des variables anthropométriques, cellules
inflammatoires et de la CRP. La normalité et
l'homogénéité n'étant pas vérifiées,
le test non paramétrique de Friedman a été utilisé
pour comparer les variables de cellules inflammatoires enregistrées
avant, après et 2 heures après effort. Lorsque le test de
Friedman a montré une différence significative, la comparaison
binaire a été faite à partir du test non
paramétrique de Wilcoxon. Lorsque le test de Friedman n'a pas
présenté de différence significative, la comparaison
binaire des variables par le test de Wilcoxon n'est pas possible. Le test de
Wilcoxon a été également utilisé pour comparer les
valeurs moyennes de la CRP enregistrées avant et après effort au
sein de chaque groupe. Le test U de Whitney a été utilisé
pour comparer les valeurs moyennes des variables anthropométriques entre
les sujets du GR et GNR. Les données ont été
traitées par le logiciel IBM SPSS (v.22.0, SPSS Inc., Chicago, Illinois,
États-Unis). Le niveau de significativité a été
fixé à p ? 0,05.
Chapitre III : Résultats
Les résultats de la comparaison des
caractéristiques anthropométriques des étudiants actifs
réhydratés et non réhydratés en milieu chaud et
humide sont représentées dans le Tableau I.
Tableau I : Comparaison des
caractéristiques anthropométriques des étudiants actifs
réhydratés et non réhydratés en milieu chaud et
humide.
|
GR
(n=11)
|
GNR
(n=11)
|
p
|
|
Âge (an)
|
21,091 #177; 2,256
|
21,636 #177; 1,433
|
0,504
|
|
Taille (cm)
|
173,455 #177; 5,336
|
171,000 #177; 4,919
|
0,187
|
|
Poids (Kg)
|
65,455 #177; 9,459
|
59,000 #177; 5,865
|
0,052
|
|
IMC (Kg/m2)
|
21,697 #177; 2,305
|
20,138 #177; 1,230
|
0,076
|
IMC : Indice de masse corporelle ; GR : Groupe
Réhydraté ; GNR : Groupe non Réhydraté.
Les résultats du tableau I n'ont
révélé aucune différence significative du point de
vue de l'âge, la taille, le poids et l'indice de masse corporelle
(Tableau I).
La comparaison des valeurs moyennes des cellules immunitaires
obtenues avant le match, après et 2 heures après le match sont
représentées dans le Tableau II.
Tableau II : Comparaison des valeurs moyennes
des cellules immunitaires enregistrées avant, après et 2 heures
après effort chez les étudiants actifs réhydratés
et non réhydratés en milieu chaud et humide.
|
Paramètres
|
Avant effort
|
Après effort
|
2h après effort
|
p
|
|
Leu (109/L)
|
|
|
|
|
|
GR GNR
|
7,291 #177; 1,014
5,891 #177; 0,534
|
10,646 #177; 1,017
8,173 #177; 1,033
|
13, 473 #177; 2,324
10,273 #177; 1,344
|
0,000
0,000
|
|
Lym (109/L)
|
|
|
|
|
|
GR GNR
|
3,316 #177; 0,652
2,249 #177; 0,579
|
4,280 #177; 0,664
2,621 #177; 0,798
|
4,356 #177; 1,114
2,727 #177; 0,703
|
0,011
0,441
|
|
Mon (109/L)
|
|
|
|
|
|
GR GNR
|
1,056 #177; 0,494
1,161 #177; 0,328
|
1,535 #177; 0,393
1,166 #177; 0,466
|
2,159 #177; 1,125
1,466 #177; 0,503
|
0,000
0,290
|
|
Neu (109/L)
|
|
|
|
|
|
GR GNR
|
2,736 #177; 0,388
2,326 #177; 0,301
|
4,610 #177; 1,019
4,177 #177; 0,810
|
6,636 #177; 2,491
5,786 #177; 1,131
|
0,000
0,000
|
|
Eos (109/L)
|
|
|
|
|
|
GR GNR
|
0,183 #177; 0,078
0,154 #177; 0,046
|
0,220 #177; 0,020
0,210 #177; 0,071
|
0,325 #177; 0,079
0,288 #177; 0,099
|
0,002
0,000
|
Leu : Leucocyte ; Lym : Lymphocyte ; Mon : Monocyte ; Neu :
Neutrophile ; Eos : Eosinophile ; GR : Groupe Réhydraté ; GNR :
Groupe non Réhydraté.
Les valeurs moyennes de leucocytes, lymphocytes (GR),
monocytes (GR), neutrophiles et éosinophiles enregistrées avant
effort, après et 2 heures après effort physique ont
présenté une différence significative entre les trois
moyennes enregistrées. Cependant les lymphocytes (GNR) et les monocytes
(GNR) enregistrés avant effort, après et 2 heures après
effort n'ont pas présenté de différence significative
(Tableau II). Lorsque le test de Friedman a montré une différence
significative, la comparaison binaire a été faite à partir
du test non paramétrique de Wilcoxon. Cependant, lorsque le test de
Friedman n'a pas présenté de différence significative, la
comparaison binaire des variables par le test de Wilcoxon n'est pas
possible.
Les résultats de la comparaison des valeurs moyennes
des cellules immunitaires enregistrées avant et après effort chez
les étudiants actifs réhydratés et non
réhydratés en milieu chaud et humide sont
représentés dans le Tableau III.
Tableau III : Comparaison des valeurs
moyennes des cellules immunitaires enregistrées avant et après
effort chez les étudiants actifs réhydratés et non
réhydratés.
|
Paramètres
|
Avant effort
|
Après effort
|
p
|
|
Moy #177; SD
|
Moy #177; SD
|
|
Leu (109/L)
|
|
|
|
|
GR GNR
|
7,291 #177; 1,014
5,891 #177; 0,534
|
10,646 #177; 1,017
8,173 #177; 1,033
|
0,003
0,003
|
|
Lym (109/L)
|
|
|
|
|
GR
|
3,316 #177; 0,652
|
4,280 #177; 0,664
|
0,004
|
|
Mon (109/L)
|
|
|
|
|
GR
|
1,056 #177; 0,494
|
1,535 #177; 0,393
|
0,003
|
|
Neu (109/L)
|
|
|
|
|
GR GNR
|
2,736 #177; 0,388
2,326 #177; 0,301
|
4,610 #177; 1,019
4,177 #177; 0,810
|
0,003
0,003
|
|
Eos (109/L)
|
|
|
|
|
GR GNR
|
0,183 #177; 0,078
0,154 #177; 0,046
|
0,220 #177; 0,020
0,210 #177; 0,071
|
0,135
0,013
|
Leu : Leucocyte ; Lym : Lymphocyte ; Mon : Monocyte ; Neu :
Neutrophile ; Eos : Eosinophile ; GR : Groupe Réhydraté ; GNR :
Groupe non Réhydraté.
Les valeurs moyennes de leucocytes, lymphocytes, monocytes,
neutrophiles et éosinophiles (GNR) obtenues immédiatement
après effort étaient significativement augmentées par
rapport à celles enregistrées avant effort (Tableau III).
Les résultats de la comparaison des valeurs moyennes
des cellules immunitaires enregistrées avant et 2 heures après
effort chez les étudiants actifs du groupe réhydratés et
non réhydratés en milieu chaud et humide sont
présenté dans le tableau IV.
Tableau IV : Comparaison des valeurs moyennes
des cellules immunitaires enregistrées avant et 2 heures après
effort chez les étudiants actifs du groupe réhydratés et
non réhydratés en milieu chaud et humide.
|
Paramètres
|
Avant effort
|
2h après effort
|
p
|
|
Moy #177; SD
|
Moy #177; SD
|
|
Leu (109/L)
|
|
|
|
|
GR GNR
|
7,291 #177; 1,014
5,891 #177; 0,534
|
13, 473 #177; 2,324
10,273 #177; 1,344
|
0,003
0,003
|
|
Lym (109/L)
|
|
|
|
|
GR
|
3,316 #177; 0,652
|
4,356 #177; 1,114
|
0,021
|
|
Mon (109/L)
|
|
|
|
|
GR
|
1,056 #177; 0,494
|
2,159 #177; 1,125
|
0,006
|
|
Neu (109/L)
|
|
|
|
|
GR GNR
|
2,736 #177; 0,388
2,326 #177; 0,301
|
6,636 #177; 2,491
5,786 #177; 1,131
|
0,003
0,003
|
|
Eos (109/L)
|
|
|
|
|
GR GNR
|
0,183 #177; 0,078
0,154 #177; 0,046
|
0,325 #177; 0,079
0,288 #177; 0,099
|
0,008
0,003
|
Leu : Leucocyte ; Lym : Lymphocyte ; Mon : Monocyte ; Neu :
Neutrophile ; Eos : Eosinophile ; GR : Groupe Réhydraté ; GNR :
Groupe non Réhydraté.
Les valeurs moyennes de leucocytes, neutrophiles et
éosinophiles enregistrés 2h après effort ont
augmentée significativement par rapport à celle obtenue avant
effort chez les sujets de deux groupes. Au niveau de lymphocytes et monocytes
enregistrés 2h après effort ont augmentée
significativement par rapport à celle obtenue avant effort chez les
sujets du groupe réhydraté (Tableau IV).
Les résultats de la comparaison des valeurs moyennes de
la protéine C-réactive enregistrées avant et après
effort chez les étudiants actifs du groupe réhydratés (GR)
et du groupe non réhydraté (GNR) sont présentés
dans le tableau V.
Tableau V : Comparaison des valeurs moyennes
de la protéine C-réactive (CRP) enregistrées avant et
après effort chez les étudiants actifs du groupe
réhydratés (GR) et du groupe non réhydraté
(GNR).
|
Avant effort
|
Après effort
|
p
|
|
GR
|
n = 11
|
n = 11
|
|
|
CRP (mg/L)
|
5,100 #177; 2,573
|
5,218 #177; 2,571
|
0,238
|
|
GNR
|
n = 11
|
n = 11
|
|
|
CRP (mg/L)
|
8,418 #177; 2,839
|
7,964 #177; 2,598?
|
0,019
|
CRP : Protéine C-Réactive ; GR : Groupe
Réhydraté ; GNR : Groupe non Réhydraté.
Les valeurs moyennes de la CRP du groupe réhydraté
enregistré avant effort et après effort ne présentaient
aucune différence significative. Par contre les valeurs moyennes de la
CRP du groupe non réhydraté ont présenté une
différence significative (Tableau V).
Les résultats de la température ambiante et
humidité relative enregistré lors du test d'effort sont
présentées dans le tableau VI.
Tableau VI : Température ambiante et
humidité relative lors du test d'effort.
Mini Maxi Moyenne #177; SD
|
TA (°C)
|
32,4
|
35,3
|
34,225 #177; 1,384
|
|
HR (%)
|
48,3
|
59,3
|
52,2 #177; 4,971
|
TA : Température Ambiante ; HR : Humidité
Relative.
Les valeurs moyennes de la température ambiante et de
l'humidité relative enregistrée pendant le test d'effort
étaient respectivement de 34,255 #177; 1,384 °C et 52,2 #177; 4,971
% (Tableau VI).
Chapitre IV : Discussion
L'objectif de cette étude était d'évaluer
les variations induites par le match de football sur les cellules immunitaires
et la protéine C-réactive chez les étudiants actifs. Du
point de vue statistique, les sujets de deux groupes avaient pratiquement les
mêmes paramètres anthropométriques (âge, taille,
poids et l'IMC) (Tableau I).
Les principaux résultats de notre étude se
présentent comme suit :
- Des variations significatives de leucocytes, neutrophiles et
éosinophiles enregistrées avant effort, après et 2h
après effort ont été observé chez les sujets du
groupe réhydraté (GR) et du groupe non réhydraté
(GNR), alors que les lymphocytes et les monocytes ont significativement
varié que chez les sujets GR ;
- Une augmentation significative des valeurs moyennes de
leucocytes, neutrophiles et éosinophiles enregistrées
après effort par rapport à celles obtenues avant effort a
été observée chez les sujets GR et GNR ;
- Une augmentation significative des valeurs moyennes de
leucocytes, neutrophiles et éosinophiles enregistrées 2h
après effort par rapport à celles obtenues avant effort a
été également observée chez les sujets GR et GNR
;
- Une diminution significative post effort de la CRP a
été observée chez les sujets GNR. Dans la présente
étude, il a été observé des variations
significatives entre les concentrations moyennes de leucocytes, neutrophiles et
éosinophiles enregistrées avant, après et 2h après
le test d'effort (Tableau II). Le match de football à induit des
modifications significatives des concentrations des cellules inflammatoires
chez les sujets GR et GNR. Ces variations pourraient s'expliquer par
l'intensité et la durée de l'effort qui activent le processus de
la synthèse des cellules immunitaires (Débora et al., 2020).
De même, un match de football à intensité
très élevé peut entrainer une leucocytose. Celle-ci peut
s'expliquer par une forte augmentation des concentrations des
polynucléaires neutrophiles et de lymphocyte qui constituent la
première ligne de défense. Signalons qu'une augmentation de ces
cellules permettrait d'assurer l'équilibre et la sécurité
du corps car le nombre de leucocytes reflète l'immunité
spécifique (Sagud et al., 2023). Les travaux de Bernardo et al., (2019)
ont observé des modifications significatives des concentrations de
cellules sanguines après une séance d'exercices par intervalles
de haute intensité de Jiu-Jitsu brésilien. Le travail mené
par Kakanis et al., (2016) ont observé une modification du nombre de
leucocytes des athlètes, telle qu'une augmentation des granulocytes et
des monocytes, une diminution des lymphocytes et une augmentation des
neutrophiles et des éosinophiles. Des études antérieures
ont rapporté que la leucocytose était les résultats d'un
nombre de neutrophiles et de
lymphocytes, tandis que les autres types de cellules sont
restées stables tout le long de la période d'observation (solberg
et al., 2004).
D'autres travaux ont révélé une
augmentation post effort des valeurs des paramètres de leucocytes
causée par la non déshydratation mais liée à la
réponse immunologique à l'exercice effectué
(Kostrzewa-Nowak et al., 2019 et Kostrzewa-Nowak et al., 2018).
Dans cette étude, il a été observé
une augmentation significative des valeurs moyennes de leucocytes, neutrophiles
et éosinophiles enregistrées après effort par rapport
à celles obtenues avant effort (Tableau III). Ces résultats
montrent une leucocytose, neutrophilie et éosinophilie post effort. La
leucocytose observée dans cette étude peut s'expliquer par le
nombre de lymphocytes circulant (Hansen et al., 1991, MacNeil et al., 1991 et
McCarthy et al., 1987).
Cette variation des leucocytes est due en réponse
à l'effort physique. En effet, les études ont
démontré que l'exercice de longue durée à haute
intensité supprime la production de cytokines immunomodulatrices
(Katsuhiko et Harumi, 2021). L'étude de Simpson et al., (2015) ont
montré des variations de neutrophile et de lymphocytes ces variations
s'expliquent par la mobilisation de cellules immunitaires marginales dans le
foie, la rate, les poumons et sur les parois des vaisseaux via
l'action des catécholamines et une augmentation du stress.
L'étude mené par Suzuki et al., (2018) ont indiqué que
l'augmentation du nombre de neutrophile après l'exercice pourrait
être une réponse inflammatoire au lésions musculaires
induites par l'exercice, dans laquelle les neutrophiles sont recrutés
dans les fibres musculaires endommagées pour éliminer les tissus
morts.
Les résultats de cette étude vont dans le
même sens de ceux de Bernardo et al. (2019) qui ont observé une
augmentation significative de leucocytes sanguins après une
séance d'exercices par intervalles de haute intensité chez les
Jiu-Jitsu brésilien.
Les études ont montré que les séances
d'exercice aiguës mobilisent préférentiellement les cellules
Natural Killers et les lymphocytes T CD8 + qui présentent une
cytotoxicité élevée et un potentiel de migration
tissulaire (Bigley et al., 2014, Lavoy et al., 2015 et Campbell et al.,
2009).
En général, les exercices physique d'endurance
et de résistance représentent jusqu'à 40% du nombre total
de leucocytes dans le sang, les lymphocytes sont constitués des cellules
souches lymphoïde dans la moelle osseuse agissent comme une partie
cruciale du système immunitaire (Kverneland et al., 2016).
Dans cette étude, les concentrations moyennes de
leucocytes, neutrophiles et éosinophiles enregistrées 2h
après effort étaient significativement supérieures
à celles obtenues avant effort (Tableau IV). Ces résultats
montrent une série de réactions biochimiques et physiologiques
qui peuvent expliquer cette augmentation des cellules immunitaires. Des
études ont montré que l'exercice physique intense peut
entraîner une augmentation du flux sanguin, facilitant ainsi la
circulation des leucocytes dans l'ensemble de l'organisme. L'exercice physique
peut stimuler la libération de certaines substances, comme les
cytokines, qui favorisent la mobilisation et l'activation des cellules
immunitaires. Il est également intéressant de noter que cette
élévation des cellules immunitaires est
généralement temporaire, revenant à des niveaux normaux
quelques heures après la cessation de l'effort. Cette dynamique
reflète la capacité de l'organisme à s'adapter à
l'effort physique et à rétablir l'homéostasie (Olivier,
2005 ; Olga et al., 2021).
Des différents mécanismes contribuent à
ces altérations, tels que le stress résultant d'un exercice
intense, les modifications de la concentration des hormones, des cytokines et
de la température corporelle, l'augmentation du flux sanguin, l'apoptose
lymphocytaire et la déshydratation (Pero et al., 2020). Cependant, nos
résultats ne vont pas dans le même sens que ceux rapporté
par Débora et al., (2020) qui ont mis en évidence une diminution
des lymphocytes sanguins observés 1h à 2h après l'exercice
physique. Cette divergence est dû au faite que nous nous avons
travaillé avec des jeunes étudiants actifs qui fréquentent
l'école de sport par contre eux ils ont travaillé avec des
handballeurs professionnels. Les études menées par David et al.,
(2018) ont montré que l'entraînement sportif et l'exercice peuvent
entraîner une augmentation transitoire du nombre total de leucocytes. Nos
résultats corroborent à ceux de Dias et al., (2011) qui ont
montré une augmentation du nombre total de leucocytes et de neutrophiles
chez les volleyeurs.
Les variations des cellules immunitaires sont dues aux
exercices d'endurance prolongés et de haute intensité produisent
des changements importants dans le nombre de leucocyte marqués par des
augmentations transitoires du nombre de granulocytes circulants (principalement
les neutrophiles) et des monocytes, et une diminution des populations de
lymphocytes qui peuvent persister des heures et des jours après le
début du temps de récupération en réponse du match
de football (Íñigo et al., 2023). Bien que l'exercice physique
actif induise une augmentation immédiate du nombre de neutrophiles et de
lymphocytes, la récupération indique la diminution du taux
lymphocytaire circulant après l'arrêt de l'exercice (Kurokawa et
al., 1995, Shek et al., 1995 et Simpson et al., 2007). De même, de
nombreuses études n'indiquent pas de changements dans la fonction
immunitaire au-delà de 2h après la fin de l'exercice (Maryam et
al., 2023).
Par ailleurs, la comparaison des valeurs moyennes de la CRP
enregistrées avant et après effort ont montré une
diminution significative post effort chez les sujets GNR alors qu'aucune
différence significative n'a été observée chez les
sujets GR (Tableau V). Ces résultats montrent qu'avant l'exercice, les
niveaux de CRP étaient similaires entre les deux groupes. Cependant,
après l'effort, une diminution significative de la CRP a
été observée chez les sujets GNR. Ces résultats
suggèrent que la réhydratation pourrait jouer un rôle dans
la modulation de la réponse inflammatoire après un exercice. D'un
point de vue physiologique, cela pourrait indiquer que l'eau et les
électrolytes consommés pendant la réhydratation pourraient
aider à stabiliser les membranes cellulaires ou à diluer les
médiateurs de l'inflammation présents dans le sang. En revanche,
l'absence de changement significatif dans les niveaux de CRP chez les sujets GR
pourrait être interprétée comme une indication que leur
réponse inflammatoire a été efficacement
atténuée par la réhydratation (Gewurtz et al., 1982 et
McFadyen et al., 2020).
Nos résultats corroborent ceux de Kostrzewa-Nowak et
al., (2015) ; Kasapis et Thompson, (2005) qui ont démontré que la
concentration de CRP diminuait en raison de l'effet anti-inflammatoire de
l'exercice après un exercice intense prolongé. Il a
été souligné que l'augmentation de la CRP après un
exercice intensif pourrait être le résultat de mécanismes,
tels que la réponse inflammatoire à des blessures ou à des
agents (l'interleukine-6, c'est-à-dire le principal stimulateur de la
sécrétion de CRP) qui pourraient être associés
à une inflammation élevée chez les athlètes
(Souglis et Antonios, 2015).
Cependant, nos résultats ne vont pas dans le même
sens que ceux de Becker et al., (2020) qui ont révélé des
augmentations provisoires du niveau de CRP. Cette divergence peut être
s'expliquée par le faite que nous avons travaillé avec des sujets
amateurs alors qu'eux ils ont travaillé avec des sujets professionnels.
Il existe encore une controverse concernant l'association entre
l'activité physique et l'inflammation, certaines études cliniques
ne montrant aucun effet anti-inflammatoire (Sjogren et al., 2010 et Yates et
al., 2010) et peu d'études évaluant de manière prospective
l'influence de l'activité physique sur les niveaux de CRP (Plaisance et
Grandjean, 2006). Il a été démontré que les niveaux
de CRP sont inversement liés à la pratique d'une activité
physique d'intensité modérée à vigoureuse dans de
nombreux contextes (Hawkins et al., 2012). L'activité physique
modérée à vigoureuse exerce des effets antagonistes sur
les niveaux de CRP et on pense que la pratique sportive peut affecter
l'inflammation en raison de son impact sur l'adiposité,
caractérisant un rôle de médiation attribué à
la graisse corporelle (Suziane et al., 2019). Ces résultats peuvent
être expliqués par la contrainte environnementale.
De plus, dans notre étude le match de football s'est
déroulé dans un environnement où les températures
ambiantes allaient jusqu'à 35,3°C (Tableau VI). Cette étude
apporte la preuve que le match de football a une influence post exercice sur
les cellules inflammatoires. Un exercice physique intense induit des
réponses du système immunitaire similaires à celles
induites par une infection.
Il sied de noter que les effets de l'exercice physique sur le
système immunitaire et la CRP dépendent de la nature de
l'exercice, de son intensité, de sa durée ainsi que de la forme
physique et de l'âge du sujet. Dans cette étude la
réhydratation aurait influencé l'expression des cellules
immunitaires par contre elle a influencé l'expression de la CRP.
Conclusion
En regard de ce qui précède, la présente
étude a porté sur le match de football et réponses des
cellules immunitaires et de la protéine C- réactive chez les
étudiants actifs réhydratés en milieu chaud et humide.
Pour y parvenir, nous avons montré les variations induites par le match
de football sur les cellules immunitaires et de la CRP chez les
étudiants actifs de l'ISEPS.
La présente étude a été
réalisée sur la base de l'hypothèse principale suivante :
le match de football induit les variations des cellules immunitaires et de la
protéine C-réactive chez les étudiants actifs
réhydraté en milieu chaud et humide.
Les résultats de notre étude ont montré :
- Des variations significatives de leucocytes, neutrophiles et
éosinophiles enregistrées avant effort, après et 2h
après effort ont été observé chez les sujets du
groupe réhydraté (GR) et du groupe non réhydraté
(GNR), alors que les lymphocytes et les monocytes ont significativement
varié que chez les sujets GR ;
- Une augmentation significative des valeurs moyennes de
leucocytes, neutrophiles et éosinophiles enregistrées
après effort par rapport à celles obtenues avant effort a
été observée chez les sujets GR et GNR ;
- Une augmentation significative des valeurs moyennes de
leucocytes, neutrophiles et éosinophiles enregistrées 2h
après effort par rapport à celles obtenues avant effort a
été également observée chez les sujets GR et GNR
;
- Une diminution significative post effort de la CRP a
été observée chez les sujets GNR. Dans cette étude,
le match de football a fortement influencé l'expression des cellules
immunitaires et de la CRP, vue ces résultats, notre hypothèse a
été validé.
PERSPECTIVES
Au regard de nos résultats, nous estimons que
l'objectif que nous nous sommes fixés préalablement se sont
révélés atteints. Dès lors nous espérons que
cette étude contribuera à une bonne imprégnation d'un
Match de football et réponses des cellules immunitaires et de la
protéine C- réactive chez les étudiants actifs
réhydratés en milieu chaud et humide et pourrait aussi être
considérée comme un document non négligeable pour les
chercheurs futurs.
Ainsi, les perspectives de cette étude sont les suivantes
:
- Réaliser la même étude en prenant un
échantillon plus grand ;
- Réaliser la même étude en prenant comme
échantillon les équipes de football de niveau national et
international, les marathoniens, semi-marathoniens ;
- Réaliser la même étude mais en testant
d'autres paramètres tel que la testostérone, l'interleukine-6,
l'interféron gamma, ...
Références Bibliographiques
1. Ablij H. (2002). C-reactive protein: history and revival.
Eur. J. Intern. Med. 13(7):412-22.
2. Adams J.D., Sekiguchi Y., Seal A., et al. (2017).
Dehydration impairs exercise performance independent of thirst perception: a
blinded study. Med Sci Sports Exerc. 49:833. doi:
10.1249/01.mss.0000519236.20188.7b.
3. Ahmed Sheriff, Stefan Kayser, Patrizia Brunner, Birgit
Vogt. (2021). C-Reactive Protein Triggers Cell Death in Ischemic Cells. Immunol
avant. 2021 ; 12 : 630430. doi: 10.3389/fimmu.2021.630430
4. Anderson L., Naughton R., Close G. L., et al. (2017).
Daily distribution of macronutrient intakes of professional soccer players from
the English Premier League. International Journal of Sport Nutrition and
Exercise Metabolism . 27(6):491-498. doi: 10.1123/ijsnem.2016-0265.
5. Baker L.B., Barnes K.A., Anderson M.L., Passe D.H., Stofan
J.R. (2016). Normative data for regional sweat sodium concentration and
whole-body sweating rate in athletes. J. Sports Sci. 34:358-368. doi:
10.1080/02640414.2015.1055291
6. Bangsbo J. (1994). Fitness training in football: a
scientific approch. Bagsvaerd, Denmark: HO+Storm; p. 1-336.
7. Barnes KA, Anderson ML, Stofan JR, Dalrymple KJ, Reimel
AJ, Roberts TJ, et al. (2019). Normative data for sweating rate, sweat sodium
concentration, and sweat sodium loss in athletes: an update and analysis by
sport. J Sports Sci. 37(20):2356- 66. 10.1080/02640414.2019.1633159
8. Bartoli W.P., Davis J.M., Pate R.R., Ward D.S., Watson
P.D. (1993). Weekly variability in total body water using 2H2O dilution in
college-age males. Med. Sci. Sports Exerc. 25:1422-1428. doi:
10.1249/00005768-199312000-00017
9. Baumann H, Gauldie J. (1994). The acute phase response.
Immunol Today. 15(2):74?80.
10. Beau V, Partouche H, membres de SFTG Paris-Nord. (2000).
Exploration de la réaction inflammatoire en médecine
générale. SFTG Paris-Nord 2000 Juin.
11. Becker M., Sperlich B., Zinner C., Achtzehn S. (2020).
Variation intra-individuelle et saisonnière de biomarqueurs
sélectionnés pour la surveillance de la charge interne chez les
joueurs de football U-19. Frontières en physiologie. 2020 ; 11
doi : 10.3389/fphys.2020.00838.
12. Black S., Kushner I., Samols D. (2004). C-Reactive
protein. J. Biol. Chem. 279, 48487- 48490. 10.1074/jbc.R400025200
13. Boris S, Carina P, Kiana K, Matthias B, Andreas F, Stefan
MB. (2018). The Yo-Yo Intermittent Tests: A Systematic Review and Structured
Compendium of Test Results. Avant Physiol. 2018; 9: 870. doi:
10.3389/fphys.2018.00870.
14. Bradley P. S., Sheldon W., Wooster B., Olsen P., Boanas
P., Krustrup P. (2009). High-intensity running in English FA Premier League
soccer matches. Journal of Sports Sciences . 27(2):159-168. doi:
10.1080/02640410802512775.
15. Braig D, Nero TL, Koch HG, Kaiser B, Wang X, Thiele JR,
et al. (2017). Transitional changes in the CRP structure lead to the exposure
of proinflammatory binding sites. Nat Commun 8:14188. 10.1038/ncomms14188
16. Bush M., Barnes C., Archer D. T., Hogg B., Bradley P. S.
(2015). Evolution of match performance parameters for various playing positions
in the English Premier League. Human Movement Science . 39:1-11. doi:
10.1016/j.humov.2014.10.003.
17. Calabro P, Willerson JT, Yeh ET. Inflammatory cytokines
stimulated C-reactive protein production by human coronary artery smooth muscle
cells. Circulation.2003 Oct 21; 108(16):19302.
18. Carlo C, Franco MI, Ermanno R, Stefano O, Vincenzo M.
(2007). Le test de récupération intermittente Yo-Yo chez les
basketteurs. 1440-2440/$ -- voir avant-propos (c) 2007 Sports Medicine
Australia. Publié par Elsevier Ltd. Tous droits réservés.
doi:10.1016/j.jsams.2007.02.013.
19. Caroline. D, Johannes. Z, Hannah. S, Steffen U. E, Karen
S, Cheung T.S, et al. (2022). C-reactive protein, immunothrombosis and venous
thromboembolism. Immunol avant. 2022 ; 13 : 1002652. doi:
10.3389/fimmu.2022.1002652
20. Casa D.J., Armstrong L.E., Kenny G.P., O'Connor F.G.,
Huggins R.A. (2012). Exertional heat stroke: New concepts regarding cause and
care. Curr. Sports Med. Rep. 11:115-123. doi: 10.1249/JSR.0b013e31825615cc.
21. Cavaillon JM. (2010). The immune response to invasion:
the ABCs. The innate immune system. Réanimation (2011) 20:S393-S405. DOI
10.1007/s13546-0100127-9.
22. César Leão, Francisco Tomás
González-Fernández, Halil brahim Ceylan, Filipe Manuel
Clemente, Hadi Nobari, Miguel Camões, José Maria Cancela
Carral. (2022). Dehydration, Wellness, and Training Demands of Professional
Soccer
Players during Preseason. Biomed Res Int. 2022: 8054449. DOI :
10.1155/2022/8054449
23. Cheuvront S.N., Kenefick R.W. (2014). Dehydration:
Physiology, assessment, and performance effects. Compr. Physiol. 4:257-285.
doi: 10.1002/cphy.c130017
24. Cheuvront S.N., Kenefick R.W. (2016). Am I drinking
enough? Yes, no, and maybe. J. Am. Coll. Nutr. 35:185-192. doi:
10.1080/07315724.2015.1067872.
25. Cheuvront SN, Haymes EM. (2001). Thermoregulation and
marathon running: biological and environmental influences. Sports Med.
31(10):743-62. 10.2165/00007256-200131100-00004
26. Comassi M, Vitolo E, Pratali L, Del Turco S, Dellanoce C,
Rossi C, et al. (2015). Acute effects of different degrees of ultra-endurance
exercise on systemic inflammatory responses. Intern Med J. 2015;45(1):74-79.
doi: 10.1111/imj.12625.
27. Coulibaly O. (2019). Apport de la Protéine
C-Réactive dans les pathologies infectieuses chez les enfants de 0
à 15 ans [Thèse de Doctorat en Pharmacie]. [Bamako] :
Faculté de Pharmacie ; 2019.
28. David C. Nieman, Laurel M. Wentz. (2018). The compelling
link between physical activity and the body's defense system. J Sport
Santé Sci. 2019 mai ; 8(3) : 201- 217. doi:
10.1016/j.jshs.2018.09.009.
29. Débora da Luz Scheffer, Alexandra Latini. (2020).
Exercise-induced immune system response: Anti-inflammatory status on peripheral
and central organs. Biochim Biophys Acta Mol Base Dis. 1er octobre 2020 ;
1866(10) : 165823. doi: 10.1016/j.bbadis.2020.165823.
30. Diehl, E.E., et al., Immunohistochemical localization of
modified C-reactive protein antigen in normal vascular tissue. Am J Med Sci,
2000. 319(2): p. 79-83.
31. Donald L.P, Mark P.F, Kirsty M.R, Robert W.K, Samuel N.C,
Stephen A.M et al,. (2023). Post-exercise rehydration: Comparing the efficacy
of three commercial oral
rehydration solutions. Front Sports Act Living. 5: 1158167.
DOI
: 10.3389/fspor.2023.1158167
32. Du Clos T.W. (2003). C - reactive protein as a Regulator
of Autoimmunity and Inflammation. Arthritis Rheum. 48:1475-1477. doi:
10.1002/art.11025
33. Du Clos TW. (2000). Function of C-reactive protein. Ann
Med. 32(4):274-8. 10.3109/07853890009011772.
34. Duarte W., Rodrigues Júnior J. L., Paula L. V.,
Chagas M. H., Andrade A. G. P., Veneroso C. E., et al. (2022). C-Reactive
Protein and Skin Temperature of the lower limbs of
Brazilian elite soccer players like load markers following
three consecutive games. J. Therm. Biol. 105, 103188.
10.1016/j.jtherbio.2022.103188
35. El-Sharkawy A.M., Sahota O., Lobo D.N. (2015). Acute and
chronic effects of hydration status on health. Nutr Rev. 73(2):97-109. doi:
10.1093/nutrit/nuv038.
36. Ertek S, Cicero A. (2012). Impact of physical activity on
inflammation: effects on cardiovascular disease risk and other inflammatory
conditions. Arch Med Sci 8: 794-804. 10.5114/aoms.2012.31614
37. Evans G.H., James L.J., Shirreffs S.M., Maughan R.J.
(2017). Optimizing the restoration and maintenance of fluid balance after
exercise-induced dehydration. J. Appl. Physiol. 122:945-951. doi:
10.1152/japplphysiol.00745.2016
38. François L, Marie CB, Jean DL, Guislaine C.
(2018). Introduction générale au système immunitaire,
chapitre 1 du livre Immunologie fondamentale et immunopathologie. Elsevier
Masson SAS, 65, rue Camille-Desmoulins, 92442 Issy-les-Moulineaux cedex,
France, 2e édition, de l'ASSIM : Collège des Enseignants
d'Immunologie.
39. Galun E, Burstein R, Assia E, Tur-Kaspa I, Rosenblum J,
Epstein Y. (1987). Changes of white blood cell count during prolonged exercise.
Int J Sports Med. 1987;8(4):253-255. doi: 10.1055/s-2008-1025664.
40. Gewurtz H., Mold C., Siegel J., Fiedel B.
(1982).C-reactive protein and the acute
phase response. Adv. Intern. Med.27:345-372.
doi:
10.1080/21548331.1982.11702332.
41. Greenleaf J.E. (1992). Problem: Thirst, drinking
behavior, and involuntary dehydration. Med. Sci. Sports Exerc. 24:645-656. doi:
10.1249/00005768199206000-00007.
42. Hammouda, O ; Chtourou, H ; Chaouachi, A et al. (2018).
Réponses biochimiques au test de récupération intermittent
yo-yo de niveau 1 chez les jeunes footballeurs Tunisiens. Asan Jsports Med 2013
; 4 :23-8
43. Hansen JB, Wilsgard L, Osterud B. (1991). Biphasic
changes in leukocytes induced by strenuous exercise. Eur JAppl Physiol. 62(3) :
157-61.
44. Hawkins M, Belalcazar LM, Schelbert KB, Richardson C,
Ballantyne CM, Kriska A. (2012). The effect of various intensities of physical
activity and chronic inflammation in men and women by diabetes status in a
national sample. Diabetes Res Clin Pract 97: e6-8.
10.1016/j.diabres.2012.03.019
45. Hughes F., Mythen M., Montgomery H. (2018). The
sensitivity of the human thirst response to changes in plasma osmolality: A
systematic review. Perioper. Med. 7:1. doi: 10.1186/s13741-017-0081-4
46. Íñigo M. Pérez-Castillo, Ricardo R,
Hakim B, José López-Chicharro, Niko M. (2023). Biomarkers of
post-match recovery in semi-professional and professional football (soccer).
Front Physiol. 2023 ; 14 : 1167449. 10.3389/fphys.2023.1167449
47. Jacquet A, Morlans JP, Blaquart F, Domenech R, Doyen J,
Dusseau C et al., (2002). Analyses et enseignement de la coupe du monde 2002.
Direction technique nationale de la Fédération française
de football, CTNFS et FFF, Marszalek et le Guillard. 2002.
48. James L.J., Funnell M.P., James R.M., Mears S.A. (2019).
Does Hypohydration Really Impair Endurance Performance? Methodological
Considerations for Interpreting Hydration Research. Sports Med. 49((Suppl.
2)):103-114. doi: 10.1007/s40279-019-01188-5
49. Jonathan V, Guislaine C, Michelle R. (2018). La structure
et l'organisation générale du système immunitaire,
chapitre 2 du livre Immunologie fondamentale et immunopathologie. Elsevier
Masson SAS, 65, rue Camille-Desmoulins, 92442 Issy-les-Moulineaux cedex,
France, 2e édition, de l'ASSIM : Collège des Enseignants
d'Immunologie.
50. Julia MM, Louis N, Arthur M, Sarah QC. (2022).
Tissue-Dependent Adaptations and Functions of Innate Lymphoid Cells. Immunol
avant.13: 836999. doi: 10.3389/fimmu.2022.836999
51. Kakanis M.W., Peake J., Brenu E.W., Simmonds M., Gray B.,
Hooper S.L., et al. (2010). The open window of susceptibility to infection
after acute exercise in healthy young male elite athletes. Exerc. Immunol.
Rev.16:119-137. doi: 10.1016/j.jsams.2010.10.642.
52. Karin F, Carolina P, Anita Hurtig-Wennlöf. (2022).
Les niveaux de CRP sont significativement associés au génotype de
la CRP et à l'utilisation d'oestrogènes dans l'étude
Lifestyle, Biomarker and Atherosclerosis (LBA). Trouble cardiovasculaire BMC.
2022 ; 22 : 170. doi: 10.1186/s12872-022-02610-z
53. Kasapis C., Thompson P.D. (2005). Les effets de
l'activité physique sur la protéine C-réactive
sérique et les marqueurs inflammatoires. Journal de l'American
College of Cardiology. 2005; 45 :1563-1569. doi:
10.1016/j.jacc.2004.12.077.
54. Katsuhiko S et Harumi H. (2021). Effect of Exercise
Intensity on Cell-Mediated Immunity. Sports (Bâle). janv. 2021 ; 9(1): 8.
doi: 10.3390/sports9010008
55. Khanfir MA, Kamoun A, Heubert R, Masmoudi L. (2013).
Concurrent strength and endurance training in young football players.
0765-1597/$ - see front matter (c) 2013
Elsevier Masson SAS. Tous droits réservés.
http://dx.doi.org/10.1016/j.scispo.2013.09.005
56. Kostrzewa-Nowak D., Nowak R., Chamera T., Buryta R.,
Moska W., Ciêszczyk P. (2015). Chances post-effort du niveau de
protéine C-réactive chez les joueurs de football à la fin
de la saison d'entraînement. Le Journal de la recherche sur la
forceet le conditionnement. 2015 ; 29 :1399-1405. doi :
10.1519/jsc.0000000000000753.
57. Kouassi E, Revillard JP, Fournier M, Ayotte P, Roy R,
Brousseau P, Hadji L. (2003). Système immunitaire. In environnement et
santé publique - fondements et pratiques, pp 687 - 698
58. Krustrup P, Mohr M, Amstrup T, Rysgaard T, Johansen J,
Steensberg A, et al. (2003). Le Yo-Yo Test de récupération
intermittente : réponse physiologique, fiabilité et
validité. Med Sci Sport Exer, 2003 ; 35 : 697-705.
59. Lawrence E. Armstrong. (2021). Rehydration during
Endurance Exercise: Challenges, Research, Options, Methods. Nutriments. mars
2021 ; 13(3): 887. DOI : 10.3390/nu13030887
60. Lizhe Sun, Xianwei Wang, Jason Saredy, Zuyi Yuan, Xiao
feng Yang, Hong Wang. (2020). Innate-adaptive immunity interplay and redox
regulation in immune response. Redox Biol. 2020 Oct; 37: 101759. doi:
10.1016/j.redox.2020.101759.
61. MacNeil B, Hoffan, Goetz L, Kendall A, Honston M,
Alumagam Y. (1991). Lymphocite proliferation responses after exercise in men :
fitness, intensity, and
duration effects. JAppl Physiol. 1991; 70: 179-85.
Doi:
10.1152/Jappl.1991.70.1.179.
62. Magdalena B, Yi Wu, Cezary W. (2019). The Multiple Faces
of C-Reactive Protein Physiological and Pathophysiological Implications in
Cardiovascular Disease. Molécules. juin 2019; 24(11): 2062. doi :
10.3390/molécules24112062
63. Margeli A., Skenderi K., Tsironi M., Hantzi E., Matalas
A.L., Vrettou C. Et al. (2005). Dramatic elevations of interleukin-6 and
acute-phase reactants in athletes participating in the ultradistance foot race
Spartathlon: Severe systemic inflammation and lipid and lipoprotein changes in
protracted exercise. J. Clin. Endocrinol. Metab. 2005;90:3914-3918.
doi: 10.1210/jc.2004-2346.
64. Markworth J.F., Vella L., Lingard B.S., Tull D.L.,
Rupasinghe T.W., Sinclair A.J. (2013). Human inflammatory and resolving lipid
mediator responses to resistance exercise and ibuprofen treatment. Am J Physiol
Regul Integr Comp Physiol. 305:R1281-R1296.
65. Martín-Sánchez F.J., Villalón J.M.,
Zamorano-León J.J., Rosas L.F., Proietti R., Mateos-Caceres P.J. et al.
(2011). Functional status and inflammation after preseason training program in
professional and recreational soccer players: A proteomic approach. J.
Sport. Sci. Med. 2011;10:45-51.
66. Maughan R. (1999). Exercise in the heat limitations to
performance and the impact of fluid replacement strategies. Introduction to the
symposium. Canadian Journal of Applied Physiology . 24(2):149-151.
67. Maughan R. J., Merson S. J., Broad N. P., Shirreffs S. M.
(2004). Fluid and electrolyte intake and loss in elite soccer players during
training. International Journal of Sport Nutrition and Exercise Metabolism .
14(3):333-346. doi: 10.1123/ijsnem.14.3.333.
68. Maughan RJ, Leiper JB. (1995). Sodium intake and
post-exercise rehydration in man. Eur J Appl Physiol Occup Physiol.
71(4):311-9. 10.1007/BF00240410
69. Mauris A., Morandi P., Borghini T., Deom A.
L'intérêt clinique de la protéine de la phase aigue. Juin
(2005).
70. Mazzurana L, Rao A, Van AA, Mjösberg J. (2018). The
roles for innate lymphoid cells in the human immune system. Semin Immunopathol.
2018 ; 40(4) : 407-419. doi : 10.1007/s00281-018-0688-7.
71. McCarthey DA, Perry JD, Malson RD, Dale MM. (1987).
Leucocytosis induced by exercise. Med J.1987, 295: 636. Doi:
10.11.36/bmj.295.6599.
72. McDermott B.P., Anderson S.A., Armstrong L.E., Casa D.J.,
Cheuvront S.N., Cooper L., et al. (2017). National athletic trainers'
association position statement: Fluid replacement for the physically active. J.
Athl. Train. 52:877-895. doi: 10.4085/1062-6050-52.9.02.
73. McFadyen JD, Zeller J, Potempa LA, Pietersz GA,
Eisenhardt SU, Peter K. (2020).C-reactive protein and its structural isoforms:
An evolutionary conserved marker and central player in inflammatory diseases
and beyond. Subcell Biochem94:499-520. doi: 10.1007/978-3-030-41769-7_20.
74. McKinney J., Eberman L., Cleary M., Lopez R., Sandler D.
South Florida Education Research Conference. January 22, (2013). Effects of
dehydration on balance as measured by the balance error scoring system; pp.
80-86.
75. Merson SJ, Maughan RJ, Shirreffs SM. (2008). Rehydration
with drinks differing in sodium concentration and recovery from moderate
exercise-induced hypohydration in man. Eur J Appl Physiol. 103(5):585-94.
10.1007/s00421-0080748-0
76. Mohr M., Mujika I., Santisteban J., et al. (2010).
Examination of fatigue development in elite soccer in a hot environment: a
multi-experimental approach. Scandinavian Journal of Medicine & Science in
Sports . 20:125-132. doi: 10.1111/j.1600-0838.2010.01217.x.
77. Montain S.J., Latzka W.A., Sawka M.N. (1999). Fluid
replacement recommendations for training in hot
weather. Mil. Med. 164:502-508. doi:
10.1093/milmed/164.7.502.
78. Nassis G. P., Brito J., Dvorak J., Chalabi H., Racinais
S. (2015). The association of environmental heat stress with performance:
analysis of the 2014 FIFA World Cup Brazil. British Journal of Sports Medicine
. 49(9):609-613. doi: 10.1136/bjsports-2014-094449.
79. Nhu Q.L, Karrie L. Hamstra-Wright,Craig A.H. (2023).
Post-Exercise Rehydration in Athletes: Effects of Sodium and Carbohydrate in
Commercial Hydration Beverages. Nutriments. 15(22): 4759. DOI :
10.3390/nu15224759
80. Nicola R. S et Jason J. A. (2018). Role of C-Reactive
Protein at Sites of Inflammation and Infection. Immunol avant. 2018; 9: 754.
doi: 10.3389/fimmu.2018.00754
81. Nieman D. (2000). Special feature for the olympics:
Effects of exercise on the immune system: Exercise effects on systemic
immunity. Immunol. Cell. Biol. 78, 496-501.
10.1111/j.1440-1711.2000.t01-5-.x
82. Nieman D.C., Gillitt N.D., Sha W. (2018). Identification
of a targeted metabolomics panel for measuring metabolic perturbation in
response to heavy exertion. Metabolomics. 2018; 14:147.
83. Nieman D.C., Groen A.J., Pugachev A., Vacca G. (2018).
Detection of functional overreaching in endurance athletes using proteomics.
Proteomes. 2018;6 pii: E33.
84. Nobari H., Alves A. R., Clemente F. M., et al. (2021).
Associations between variations in accumulated workload and physiological
variables in young male
soccer players over the course of a season. Frontiers in
Physiology . 12 doi: 10.3389/fphys.2021.638180.
85. Nobari H., Chen Y.-S., Kargarfard M., Clemente F. M.,
Carlos-Vivas J., Pérez-Gómez J. (2022). Comparaisons des
variables de l'accelerometre aigue, chronique et ratio charge de travail
aigue/chronique entre les debutants et les non-debutants : une etude sur toute
la saison chez les joueurs de football professionnels. Science & Sports .
37(2):149.e1-149.e12. doi: 10.1016/j.scispo.2021.03.011.
86. Nobari H., Cholewa J. M., Pérez-Gómez J.,
Castillo-Rodríguez A. (2021). Effects of 14-weeks betaine
supplementation on pro-inflammatory cytokines and hematology status in
professional youth soccer players during a competition season: a double blind,
randomized, placebo-controlled trial. Journal of the International Society of
Sports Nutrition. 18(1):1-10. doi: 10.1186/s12970-021-00441-5.
87. Nobari H., Kargarfard M., Minasian V., Cholewa J. M.,
Pérez-Gómez J. (2021). The effects of 14-week betaine
supplementation on endocrine markers, body composition and anthropometrics in
professional youth soccer players: a double blind, randomized,
placebo-controlled trial. Journal of the International Society of Sports
Nutrition . 18(1):1-10. doi: 10.1186/s12970-021-00417-5
88. Nuccio R. P., Barnes K. A., Carter J. M., Baker L. B.
(2017). Fluid balance in team sport athletes and the effect of hypohydration on
cognitive, technical, and physical performance. Sports Medicine .
2017;47(10):1951-1982. doi: 10.1007/s40279-0170738-7.
89. Okemefuna AI, Nan R, Miller A, Gor J, Perkins SJ.
Complement factor H binds at two independent sites to C-reactive protein in
acute phase concentrations. J Biol Chem 2010; 285:1053-65.
90. Olga S, Barbara L, Mariarita B, Cristina M, Arturo C,
Fabio F et al., (2021). Exercise, Immune System, Nutrition, Respiratory and
Cardiovascular Diseases during COVID-19: A Complex Combination. Int J Environ
Res Public Health. 2021 février ; 18(3): 904. doi:
10.3390/ijerph18030904.
91. Oliveira C., Ferreira D., Caetano C., et al. (2017).
Nutrition and supplementation in soccer. Sports . 5(2) doi:
10.3390/sports5020028.
92. Oliveira EB, Gotschlich EC, Liu TV. (1977). Primary
structure of human C-reactive protein.Proceedings of hte National Academy of
sciences, USA 1977; 74: 31483151.
93. Olivier M. (2005). Sports, exercice et système
immunitaire. Service de Rhumatologie. Hôpital Bichat. 46 rue Henri
Huchard 75018 Paris.
94. Omar H, Hamdi C, Anis C, Henda C, Nidhal Z, Abdelhedi et
al., (2013). Biochemical Responses to Level-1 Yo-Yo Intermittent Recovery Test
in Young Tunisian Football Players. Asian J Sports Med. 2013 Mar; 4(1): 23-28.
doi: 10.5812/asjsm.34522.
95. Pepys M.B. (1981). C-reactive protein fifty years on.
Lancet.1:653-657. doi: 10.1016/S0140-6736(81)91565-8.
96. Périard J. D., Eijsvogels T. M. H., Daanen H. A.
M. (2021). Exercise under heat stress: thermoregulation, hydration, performance
implications, and mitigation
strategies. Physiological Reviews . 101(4):1873
1979.doi:
10.1152/physrev.00038.2020.
97. Pero R., Brancaccio M., Mennitti C., Gentile L., Franco
A., Laneri S., et al. (2020). HNP-1 and HBD-1 as Biomarkers for the Immune
Systems of Elite Basketball Athletes. Antibiotics. 9:306. doi:
10.3390/antibiotics9060306.
98. Plaisance EP, Grandjean PW. (2006). Physical activity and
high-sensitivity C-reactive protein. Sports Med 36: 443-458.
99. Pradhan AD, Manson JE, Rifai N, Buring JE, Ridker PM.
(2001). C-reactive protein, interleukin 6, and risk of developing type 2
diabetes mellitus. J Am Med Assoc. 286(3):327-34. 10.1001/jama.286.3.327.
100. Rampinini E., Impellizzeri F. M., Castagna C., Azzalin
A., Bravo D. F., Wisløff U. (2008). Effect of match-related fatigue on
short-passing ability in young soccer players. Medicine and Science in Sports
and Exercise . 40(5):934-942. doi: 10.1249/MSS.0b013e3181666eb8.
101. Rollo I, Randell RK, Baker L, Leyes JY, Leal DM,
Lizarraga A, et al. (2021). Fluid balance, sweat Na+ losses, and carbohydrate
intake of elite male soccer players in response to low and high training
intensities in cool and hot environments. Nutrients. 13(2):401.
10.3390/nu13020401
102. Said, M, Feki Y, Aouni Z, Machghoul S, Hamza M, Amri M.
(2009). Effects of sustained intensive physical activities on immune cells
circulating and pro-inflammatory cytokines production in trained and untrained
humans. Elsevier Masson SAS. 0765-1597/$ - see front matter (c) 2009.
doi:10.1016/j.scispo.2008.12.003.
103. Savoie F.A., Kenefick R.W., Ely B.R., Cheuvront S.N.,
Goulet E.D.B. (2015). Effect of hypohydration on muscle endurance, strength,
anaerobic power and capacity and vertical jumping ability: a meta-analysis.
Sports Med. 45(8):1207- 1227. doi: 10.1007/s40279-015-0349-0.
104. Sawka M.N., Cheuvront S.N., Kenefick R.W. (2015).
Hypohydration and Human Performance: Impact of Environment and Physiological
Mechanisms. Sports Med. 45((Suppl. 1)):S51-S60. doi:
10.1007/s40279-015-03957
105. Shirreffs SM, Maughan RJ. (1998). Volume repletion after
exercise-induced volume depletion in humans: replacement of water and sodium
losses. Am J Physiol. 274(5):F868-75. 10.1152/ajprenal.1998.274.5.F868
106. Shirreffs SM, Taylor AJ, Leiper JB, Maughan RJ. (1996).
Post-exercise rehydration in man: effects of volume consumed and drink sodium
content. Med Sci Sports Exer. 28(10):1260-71.
10.1097/00005768-199610000-00009
107. Simpson RJ, et al. (2015). Exercise and the regulation
of immune functions. Prog Mol Biol Transl Sci. 2015;135:355-380. doi:
10.1016/bs.pmbts.2015.08.001.
108. Sjogren P, Cederholm T, Heimburger M, Stenvinkel P,
Vedin I, Palmblad J, et al. (2010). Simple advice on lifestyle habits and
long-term changes in biomarkers of inflammation and vascular adhesion in
healthy middle-aged men. Eur J Clin Nutr 64: 1450-1456.
10.1038/ejcn.2010.182
109. Souglis A., Antonios T.K. (2015). The influence of
competitive activity on selected biochemical and haematological parameters of
amateur soccer athletes. J. Phys. Educ. Sport. 2015;15:24-31.
110. Stachenfeld, Nina, S. (2014). The Interrelation ship of
Reserarch in the laboratory and the Field to Asses Hydration status and
Determine mechanisme Involved in water regulation During physical Activity 2014
; 44(1) ; 97-104 : doi : 10.1007/S40279-014-0155.
111. Suziane UC, André OW, Jacqueline BU, Bruna C
TuriLynch, Maurício FB, Romulo AF. (2019). La participation sportive est
inversement associée aux niveaux de protéine C-réactive
chez les adolescents : ABCD Growth Study. Scand J Med Sci Sports. 2019 ; 29 :
10001005. DOI : 10.1111/sms.13418
112. Suzuki K. (2018). Involvement of neutrophils in
exercise-induced muscle
damage. Gen Intern. Med. Clin. Innov. 2018; 3:1-8.
doi:
10.15761/GIMCI.1000170.
113. Thomas D.T., Erdman K.A., Burke L.M. (2016). American
college of sports medicine joint position statement. nutrition and athletic
performance. Med. Sci. Sports Exerc 48:543-568. doi:
10.1249/mss.0000000000000852.
114. Tong, T.K., Fu, F.H., Chow, B.C., Quach, B., and Lu, K.
(2003). Increased sensations of intensity of breathlessness impairs maintenance
of intense intermittent exercise. Eur. J. Appl. Physiol. 88: 370-379.
doi:10.1007/s00421-002-0724-z. PMID:12527965.
115. Trochimiak T., Hübner-Wo·niak E. (2012).
Effect of Exercise on the Level of
Immunoglobulin A in Saliva. Biol. Sport.4:255-261.
doi:
10.5604/20831862.1019662.
116. Volanakis J. (2001). Human C-reactive Protein:
Expression, Structure, and Function. Mol Immunol. ; 2?3(38):189?97.
117. Wallace J. L., Norton K. I. (2014). Evolution of World
Cup soccer final games 1966-2010: game structure, speed and play patterns.
Journal of Science and Medicine in Sport . 17(2):223-228. doi:
10.1016/j.jsams.2013.03.016
118. Watanabe N., Wicker P., Yan G. (2017). Weather
conditions, travel distance, rest, and running performance: the 2014 FIFA World
Cup and implications for the future. Journal of Sport Management . 31(1):27-43.
doi: 10.1123/jsm.2016-0077.
119. Wijnen AH, Steennis J, Catoire M, Wardenaar FC, Mensink
M. (2016). Postexercise rehydration: effect of consumption of beer with varying
alcohol content on fluid balance after mild dehydration. Front Nutri. 3:45.
120. Yang SM, Lee WD, Kim JH, Kim MY, Kim J. (2013).
Differences in body components and electrical characteristics between youth
soccer players and non-athletes. Health, 5: 1010-1015.
Doi:10.4236/health.2013.56134
121. Yasojima, K., et al., Generation of C-reactive protein
and complement components in atherosclerotic plaques. Am J Pathol, 2001?
158(3): p. 1039-51.
122. Yates T, Davies MJ, Gorely T, Talbot D, Bull F, Sattar
N, et al. (2010). The effect of increased ambulatory activity on markers of
chronic low-grade inflammation: evidence from the PREPARE programme randomized
controlled trial. Diabet Med 27: 1256-1263. 10.1111/j.1464-5491.2010.03091.x
123. Yusuf Köklü. (2012). A Comparison Of
Physiological Responses To Various Intermittent And Continuous Small-Sided
Games In Young Soccer Players. J Hum Kinet. 2012 Mar ; 31 : 89-96. doi :
10.2478/v10078-012-0009-5.
124. Zhang D., Jiang S. L., Rzewnicki D., Samols D., Kushner
I. (1995). The effect of interleukin-1 on C-reactive protein expression in
Hep3B cells is exerted at the transcriptional level. Biochem. J. 310,
143-148. 10.1042/bj3100143.
ANNEXE

Photo 1 : Mesure de la taille Photo 2 : Mesure de la
masse corporelle

Photo 4 : Déroulement du match test à
l'ISEPS
Photo 3 : Prise de sang
|
UNIVERSITE MARIEN NGOUABI
|
I
IS.E.P.S
|
r
|
|
Institut Supérieur d'Education Physique et
Sportive
|
|
N°...Q.:?...1 UMNG ! Dir / DA 1 SP / CS
CERTIFICAT D'ETHIQUE EN MATIERE DE RECHERCHE
Le Conseil Scientifique de l'Institut Supérieur
d'Education Physique et Sportive réuni en session extraordinaire sous
l'autorisation du président, certifie qu'il a dument
évalué et approuvé le projet de recherche qui lui a
été soumis par :
NGOMA SOLO Estime, MIAMBANZILA Amour, MOUSSIESSI
Franchisnel, SEHOLO BOUEVA
Etudiants en Master professionnel EPS et SPORT à
l'Institut Supérieur d'Education Physique et Sportive (ISEPS),
Université Marien NGOUABI, sous la direction du Docteur NSOMPI Florent,
Maître Assistant CAMES.
Laboratoire de Biologie Moléculaire, Cellulaire,
Activité Physique et Santé Titre du projet de
recherche
Réponses des paramètres
hématologiques, biochimiques et de la fonction pulmonaire, de la
composition corporelle et de la saturation sanguine en oxygène
après un match de football chez les étudiants de l'ISEPS
réhydratés en milieu chaud et humide relativement
pollué
Après examen du projet et en s'appuyant sur le code en
vigueur en République du Congo, le Conseil donne un avis favorable pour
mener la recherche sur les humains.
L'approbation éthique pour ledit projet est valable
jusqu'à la fin de l'expérimentation. En foi de quoi le
présent certificat a été établi pour servir et
valoir ce que de droit.

~
PAAR1
,~ d il Scientifique
Le Rapporteur du Conseil Scientifique
Sylvain MABASSA Dr Alain Marc BOUSSANA
ucn de Conférences CAMES Maitre de Conférences
CAMES / HDR
Fait à Brazzaville, le 17 Janvier 2023
TABLE DES MATIERES
IN MEMORIUM .. i
Dédicace ii
Remerciements . iii
Liste des sigles et abréviations .. iv
Liste des tableaux . vi
Liste des figures vii
Liste des photos viii
Sommaire .. ix
INTRODUCTION 1
Contexte et justification 1
Problématique 2
Question principale .. 5
Questions secondaires .. 5
Hypothèse principale 5
Hypothèses secondaires 5
Objectif général . 5
Objectifs spécifiques . 6
Intérêt de l'étude 6
Structuration du travail . 6
Chapitre I : REVUE DE LA LITTERATURE 7
I.1. Système Immunitaire .. 7
I.1.1. Définition 7
I.1.2. Composant du Système immunitaire 8
I.1.2.1. Immunité innée ou naturelle 8
I.1.2.1.1. Les acteurs de l'immunité innée
10
I.1.2.2. Immunité adaptative ou spécifique ...
14
I.1.2.2.1. Les acteurs de l'immunité adaptative 15
I.1.3. Cellules immunitaires . 16
I.1.3.1. Rôle et fonction des cellules immunitaires
17
I.2. Exercice physique et cellules immunitaires 19
I.3. Protéine C-Réactive 22
I.3.1. Définition 23
Résumé
I.3.2. Structure 23
I.3.3. Synthèse et localisation de la CRP 24
I.3.4. Les fonctions de CRP 24
I.3.5. CRP marqueur d'inflammation 25
I.3.6. Rôle de la protéine C-Réactive .
25
I.4. Sport et Réhydratation 26
I.5. Sport et Déshydratation .. 27
I.6. Football 28
Chapitre II : MATERIEL ET METHODES .. 30
II.1. Matériel 30
II.1.1. Mesure de la taille .. 30
II.1.2. Mesure de la masse corporelle 31
II.1.3. Sinothinker SK8800 32
II.1.4. Electrophotomètre . 32
II.2. Méthodes .. 33
II.2.1. Cadre et type d'étude . 33
II.2.2. Population .. 33
II.2.3. Echantillon 33
II.2.4. Critères d'inclusion 33
II.2.5. Critères de non inclusion 33
II.2.6. Critères d'exclusion 33
II.2.7. Protocole expérimental ... 33
II.2.8. Variables étudiées .. 34
II.2.9. Considération éthique . 34
II.2.10. Analyse statistique 34
Chapitre III : RESULTATS 36
Chapitre IV : DISCUSSION 42
CONCLUSION 47
PERSPECTIVES .. 48
Références bibliographiques . 49
Annexes 62

Objectif : L'objectif de cette étude
était de montrer les variations induites par le match de football sur
les cellules immunitaires et la protéine C-réactive chez les
étudiants actifs. Méthodologie : 22 footballeurs
ont participé à l'étude dont 11 joueurs de la L1 EPS et 11
de la L1 Sport. Les cellules immunitaires et la protéine
C-réactive ont été mesurés avant,
immédiatement après et 2 heures après le match de
football. Les tests statistiques non paramétriques de Friedman et de
Wilcoxon ont été utilisés. Résultats
: Il a été observé chez les sujets GR et GNR des
variations significatives de leucocytes, neutrophiles et éosinophiles
enregistrées avant effort, après et 2h après effort, alors
que les lymphocytes et les monocytes ont significativement varié que
chez les sujets GR. En outre, une diminution significative post effort de la
CRP a été observée chez les sujets GNR. Conclusion
: Le match de football a fortement influencé l'expression des
cellules immunitaires et de la CRP, vue ces résultats, notre
hypothèse a été validé.
Mots clés : Football, cellules
immunitaires, protéine C-réactive, réhydratation.
Abstract
Objective : The objective of this study was
to show the variations induced by the football match on immune cells and
C-reactive protein in active students. Methodology : 22
footballers participated in the study including 11 players from L1 EPS and 11
from L1 Sport. Immune cells and C-reactive protein were measured before,
immediately after and 2 hours after the football match. Friedman and Wilcoxon
non-parametric statistical tests were used. Results :
Significant variations in leukocytes, neutrophils and eosinophils were observed
in GR and GNR subjects recorded before, after and 2 hours after exercise, while
lymphocytes and monocytes significantly varied only in GR subjects. In
addition, a significant post-exercise decrease in CRP was observed in GNR
subjects. Conclusion : The football match strongly influenced
the expression of immune cells and CRP, given these results, our hypothesis was
validated.
Keywords : Football, immune cells, C-reactive
protein, rehydration.



