TLEMCEN
N° D'ORDRE
UNIVERSITE DE TLEMCEN - ABOU BEKR
BELKAID
FACULTE DES SCIENCES - DEPARTEMENT DE BIOLOGIE
MOLECULAIRE ET CELLULAIRE
Laboratoire de Biologie
Moléculaire Appliquée et d'Immunologie
Mémoire Présenté pour obtenir le grade
DE MASTER ACADEMIQUE EN BIOLOGIE MOLECULAIRE ET CELLUAIRE
Option : MICROBIOLOGIE
Par
Amina Bendimerad
Soutenu le 02 Octobre 2010
Intitulé :
EFFET DE LA SUPPLEMENTATION EN SELENIUM SUR LA REPONSE
IMMUNITAIRE
AU COURS DE L'INFECTION A SARM
Jury
Dr. Hafida HASSAINE Maitre de conférences A
Présidente
Dr. Mourad ARIBI Maitre de conférences A
Promoteur
M. Sid-Ahmed REBIAHI Maitre - Assistant A
Examinateur
Résumé
Introduction: Plusieurs données
récentes ont rapporté les effets du sélénium sur
l'amplification de la réponse immune et l'induction de la
prolifération lymphocytaire.
Objectifs : Essayer d'étudier l'effet
de la supplémentation en sélénium sur la réponse
immunitaire au cours de l'infection à Staphylococcus aureus
résistant à la méthicilline (SARM).
But : Montrer que la supplémentation
en sélénium pourrait avoir des effets sur la régulation de
la réponse immune au cours de l'infection à SARM.
Matériels et méthodes : 10
Hamsters infectés par SARM, répartis en deux groupes (groupe 1 ;
supplémenté en sélénium [Se+], n = 5, sexe ; 4
males/1 femelle, âge ; 21 jours, poids ; 68,51 #177; 5,17 g, groupe 2 ;
non supplémenté en sélénium [Se-], n = 5, sexe ; 3
males/2 femelles, âge ; 21 jours, poids ; 64,06 #177; 1,7 g) et de 5
hamsters sains (5 males), ont été soumis à une
étude rétrospective cas/témoins.
Résultats : Les taux sériques
des protéines totales, des alpha-1, des alpha-2 et des gamma globulines
ont été similaires chez les Hamsters infectés par SARM,
supplémentés en sélénium (Se+) et chez les non
supplémentés en sélénium (Se-) (p >
0,05). Cependant, les concentrations sériques en albumine et le rapport
albumine/globulines ont été significativement diminués
chez les Hamsters Se- comparés aux Hamsters Se+ (p < 0,01).
A l'inverse, les concentrations des beta globulines et des globulines totales
ont été significativement élevées chez les Hamsters
Se- par rapport aux Hamsters Se+. Par ailleurs, les taux circulants des
anticorps IgA et IgM ont été significativement
élevés chez les Hamsters Se- comparés aux Hamsters Se+
(respectivement, p = 0,000, p = 0,011). De même, les
concentrations sériques en CRP ont été nettement plus
élevées chez les Hamsters Se- comparés aux Hamsters Se+
(p = 0,002). Toutefois, les taux des IgG on été
similaires dans les deux groupes (p = 0,844). Enfin, les taux
spléniques des lymphocytes totaux et des lymphocytes apoptotiques ont
significativement diminués chez les Hamsters Se- comparés aux
Hamsters Se+ (respectivement, p = 0,015, p = 0,009).
Conclusion : Le sélénium
pourrait jouer un rôle significatif et préventif dans la
prolifération lymphocytaire et la régulation de la réponse
immune à médiation humorale cellulaire ainsi que la
réponse inflammatoire au cours de l'infection à SARM.
Mots dles : anticorps, lymphocyte,
protéines, protéine C-réactive,SARM,
supplémentation en sélénium.
Abstract
Introduction: Many data reported the effects of
selenium on the immune response amplification and on the induction of
lymphocyte proliferation.
Objectives: To study the effects of selenium
supplementation on the immune response during methicilline resistant
Staphylococcus aureus (MRSA) infection.
Materials and methods: Ten (10) Hamsters
infected with MRSA, divided into two groups (group 1; supplemented with
selenium [Se+], n=5, sex; 4 males/1 female, age; 21 days, weight ; 68.51 g
#177; 5.17, group 2; without selenium supplementation [Se-], n = 5, sex ; 3
males/2 females, age ; 21 days, weight; 64.06 g #177; 1.7), were subjected to
case-control, retrospective study.
Results: Levels of serum total proteins,
alpha-1, alpha-2 and gamma globulins were similar in the two groups (p
> 0,05). However, serum albumin concentrations and albumin/globulins ratio
were significantly lower in Hamsters Se- compared with Hamsters Se+ (p
< 0,01). On the contrary, beta globulins and total globulins concentrations
were significantly higher in Hamsters Se- when compared to Hamsters Se+.
Additionally, circulating levels of IgA and IgM antibodies were significantly
higher in Hamsters Se- compared with Hamsters Se+ (respectively, p =
0,000, p = 0,011). Moreover, levels of CRP were significantly higher
in Hamsters Se- compared with Hamsters Se+ (p = 0,002). However, those
of IgG were similar in both groups (p = 0,844). Finally, total splenic
lymphocytes and apoptotic lymphocytes were significantly lower in Hamsters Se-
compared with Hamsters Se+ (respectively, p = 0,015, p =
0,009).
Conclusion: The selenium can play an
important role in lymphocyte proliferation and humoral and cellular immune
response regulation and in inflammatory response during MRSA infection.
Keywords: MRSA, proteins, antibodies,
lymphocyte, C-reactive protein, selenium supplementation.
AVANT - PROPOS
Je voudrais remercier tout particulièrement
:
|
·
|
Docteur Mourad ARIBI, Maitre de conférences A
|
(Directeur de mémoire)
|
|
·
|
Docteur Hafida HASSAINE, Maitre de conférences A
|
(Rapporteur)
|
|
·
|
Monsieur Sid Ahmed REBIAHI, Maitre - assistant A
|
(Rapporteur)
|
Il me faut remercier également :
· Monsieur Mustapha HADDOUCHE, Responsable du module de
Biochimie à la Faculté de Médecine et
Enseignant-associé à la Faculté SNV de l'Université
Abou-Bekr Belkaïd de Tlemcen
· Madame Hafida MERZOUK, Chef de Département de
BMC option. Biologie et santé
· Monsieur Rachid AZZI, Maitre - Assistant A
· Monsieur Fouad BOUAYED, Technicien du laboratoire de
médecine de travail CHU
· Monsieur Abdel Hak HASSANI, Responsable du laboratoire
de Microbiologie
· Monsieur Mounaim KHADIR doctorant en Biologie
Moléculaire option Microbiologie
Je voudrais remercier aussi tous mes enseignants pour leur
soutien et leurs conseils pendant mes 5 ans d'études ainsi que les
techniciens du laboratoire de Microbiologie et d'immunologie pour leur aide
sans oublier les étudiantes de Biologie et santé de
l'Université de SBA pour leur collaboration.
Ce travail a pour objectif d'étudier l'effet du
sélénium sur les SARM au sein du laboratoire d'immunologie du
nouveau pole de l'Université de Tlemcen.
Ce travail a été effectué en
collaboration avec mes chères collègues et amies Melle Merad
Boudia Sarah et Mme Ibrir Soumia qui ont travaillé sur des
thématiques complémentaires à cette étude
(électrophorèse des protéines totales, numération
cellulaire et immunofixation).
Le présent mémoire est structuré en six
parties : introduction, matériels et méthodes résultats et
interprétation discussion conclusion et perspectives et enfin une
bibliographie.
Je dédie mon mémoire et ma
réussite spécialement
Ames parents aux quels je n'aurai pas pu
le mener à bien sans leur soutien, leur amour et leur patience ...Aucun
terme et aucune langue ne peut exprimer mon amour et mes sentiments
envers vous
Ames freres et soeurs Asma, Zineb, Abdessamad et
Abderrahmane
Ames chers neveux Sif Eddine et le chouchou
Mehdi
Ama famille maternelle surtout mes grands
parents, mon oncle Charif et ma tante Nadjia
Ama famille paternelle surtout mes oncles
Amine et Mounir et mes tantes Tema et
Naima
Ames cousins et cousines surtout Mimi,
Batoul,Tema,Wafae, Larbi, Zaki, et Ibrahim
Ames chers cousins et amis Yahia et Malik qui
m'ont aidé pour réaliser ce travail Ames chers
adorables Othmane et Asma aux quels je les souhaite une vie rose
pleine de bonheur, de joie et de réussites.
Atous mes chers amis Amine, Amina Diden Fatéma et
Nesrine
Atoutes les personnes qui me
sont chères
TABLE DES MATIERES
Résumé iii
Abstract iv
Avant propos v
Table des matières vii
Liste des tableaux x
Liste des figures xi
Liste d'abréviations xii
Introduction 1
Chapitre 1. Revue de la littérature 3
1.1 SARM 3
1.1.1 Staphylococcus aureus résistant à
la méthicilline - Généralités 3
1.1.2 Historique 4
1.1.3 Origines et facteurs impliqués dans la
dissémination des SARM 5
1.1.4 Les causes d'infection par SARM 5
1.1.5 Les symptômes de l'infection à SARM 7
1.1.6 Transmission des SARM 8
1.1.7 Contrôle de la propagation des SARM 9
1.1.7.1 Lavage des mains 9
1.1.7.2 Port de gants 9
1.1.7.3 Port d'un masque et d'une blouse 9
1.1.7.4 Lingerie souillée 10
1.1.8 Epidémiologie des SARM 10
1.1.9 Diagnostic des staphylococcus aureus
résistant à la méthicilline 12
1.1.10 Traitement des SARM 12
1.1.11 Evolution de la résistance de Staphylococcus
aureus résistant à la méthicilline 13
1.1.12 Mécanisme d'action 14
1.2 Statut oxydant antioxydant 16
1.3 Effet de sélénium sur le système
immunitaire 17
1.3.1 Définition du Sélénium 17
1.3.2 Historique du sélénium 17
1.3.3 Généralités 18
1.3.4 Le rôle antioxydant du sélénium et la
vitamine E 18
1.3.5 Source alimentaire du sélénium 19
1.3.6 Carence en sélénium 21
1.3.7 Sélénium et système immunitaire 21
1.3.7.1 Effet sur l'immunité à médiation
humorale (réponse des Anticorps) 23
1.3.7.2 Effet sur l'immunité à médiation
cellulaire (fonction phagocytaire et lymphocytaire) 23
1.3.7.3 Effet sur la résistance aux maladies 23
Chapitre 2. Matériels et méthodes
24
2.1 Partie bactériologie 24
2.1.1 Matériels biologiques 24
2.1.2 Méthodes biologiques 24
2.1.2.1 Coloration de Gram 24
2.1.2.2 Ensemencement sur Chapman 25
2.1.2.3 Coagulase libre 25
2.1.2.4 Teste de la catalase 26
2.1.2.5 Identification API 26
2.1.2.6 Screening 27
2.2 Partie immunologique 29
2.2.1 Patients 29
2.2 .2 Organismes 31
2.2.3 Animaux 31
2.2.4 Méthode d'infection 31
2.2.5 Analyses biologiques 32
2.2.5.1 Dosages des protéines totales 32
2.2.5.1.1 Principe 32
2.2.5.1.2 Technique 32
2.2.5.2 Dosage de la CRP par la technique d'agglutination 33
2.2.5.2.1 Principe 33
2.2.5.2.2 Technique 34
2.2.5.3 Electrophorèse des protéines
sériques 34
2.2.5.3.1 Principe 34
2.2.5.3.2 Intérêts cliniques 35
2.2.5.3.3 Technique 35
2.2.5.3.4 Analyses statistiques 37
2.2.5.4 Dosage des anticorps 38
2.2.5.5 Isolement des lymphocytes spléniques et
numération cellulaire 40
Chapitre 3. Résultats et interprétation
41
Chapitre 4. Discussion 45
Chapitre 5. Conclusion 49
Chapitre 6. Bibliographie 50
Annexes 63
Liste des tableaux
Tableau 1.3 : Evolution de la résistance
à la méthicilline de S. aureus 14
Tableau 1.5 : Sources alimentaires du
sélénium 20
Tableau 3.1 : Niveaux des protéines
sériques chez les Hamsters infectés
par SARM supplémentés ou non en
Sélénium 41
Tableau 3.2 : Marqueurs humoraux chez les
Hamsters infectés par SARM
supplémentés ou non en Sélénium
42
Tableau 3.3 : Lymphocytes spléniques
chez les Hamsters infectés par SARM
supplémentés ou non en Sélénium
44
Liste des figures
Figure 1.1 : Taux de patients à SARM+
6
Figure 1.2 : Infections à SARM
7
Figure 1.4 : Introduction et utilisation des
antibiotiques et acquisition
des résistances par S. aureus 15
Figure 2.1 : Les étapes du screening
28
Figure 2.2 : Hamsters nains de Campbell 30
Figure 2.3 : Injection par voie
intrapéritoniale 31
Figure 2.4: Dosage des protéines totales
(méthode de Biuret) 32
Figure 2.5 : Particules de latex fixant les
anticorps, contrôle positif (bleu) et contrôle
négatif (rouge) 33
Figure 2.6 : Cliché présentant
une bande de dis protéinogrammes : Les fractions
protéiques de bas vers le haut : Albumine, á1,
á2, â1, â2, ã. 36
Figure 2.7 : Immunodiffusion radiale et
précipitation de Mancini
exemple du complexe IgA total/anti-IgA 38
Figure 3.1 : Taux circulants des anticorps chez
les hamsters infectés par SARM
supplémentés et non supplémentés en
Sélénium 43
Abréviations
API : Appareillage et procédes
d''identification
BHIB : Bouilon C~ur - Cerveau
CHU : Centre Hospitalier Universitaire
CLSI :Clinical and Laboratory Standards
Institute CRP :C - reactive Protein
DO : Densité Optique
IDR : Immuno Diffusion Radiale
Ig :Immunoglobuline
IN : Infection Nosocomiale
NIT : Nitrate réductase
Ox : Oxacilline
PT : Proteines Totales
PVL :Pentan - Valentine Leucocidine
r.p.m : Rotation par minute
SARM :Staphylococcus aureus
resistants à la méthicilline SASM :
Staphylococcus aureus sensibles à la
méthicilline SARM-C : SARM
Communitaires
SARM-H : SARM Hospitalieres
S.aureus : Staphylococcus aureus
SCC : Staphylococcal Cassette Chromosome
Se+ : Supplementé en sélenium
Se- : Non supplementé en
sélenium
SCN :Staphylocoques à coagulase
negative
VP :Voges Proskauer
Introduction
Le staohylococcus aureus (S.aureus) est une
bactérie commune ou germe qui peut vivre dans le nez, la peau ou dans
l'intestin et causer des infections cutanées légères ou
graves comme la pneumonie ou bactériémie, tandis que certaines
personnes porteuses de cette bactérie ne développent pas des
manifestations cliniques infectieuses (NOUR et al ; 2005).
C'est est un agent pathogène fréquemment
retrouvé dans de multiples infections nosocomiales et communautaires.
Cette espèce bactérienne figure d'ailleurs parmi les trois
premières causes d'infections nosocomiales aux États-Unis selon
que l'on considère les infections de plaies chirurgicales, les
pneumonies ou les bactériémies. Au Québec, le S.
aureus est la première cause de bactériémie
nosocomiale (Honeyman et al ; 2002).
D'abord identifié dans les années 1960,
Staphylococcus aureus résistant à la
méthicilline (SARM) a été initialement
considéré comme un pathogène nosocomial. Toutefois, ces
dernières années, un nombre croissant de souches de SARM ont
été isolés dans le monde entier provenant de patients
atteints d'infections communautaires (NOUR et al ; 2005).
Cette bactérie est maintenant à l'état
endémique dans de nombreux pays en particulier aux Etats Unis ou 4.6%
des patients hospitalisés sont soit colonisés (1.2%) soit
infectés (3.4%) ce qui représente environ 1.600.000 victimes par
an (BRUN et al ; 2001).
Au Québec comme au Canada en l'absence d'un
véritable système de surveillance des IN , le taux de
prévalence du SARM est passé de 16.6% en 2000 à 48% en
2003 dans les centres hospitaliers de courtes durées , et le plus
inquiétant est que 82% des cas de SARM seraient des
bactériémies (infections du sang) dont la mortalité
moyenne est de 30% des cas (Honeyman et al ;2002).
Les données épidémiologiques sur les
SARM en Afrique sont rares. La prédominance des SARM a été
déterminée dans huit pays africains entre 1996 et 1997 et a
été relativement élevée au Nigeria, au Kenya et au
Cameroun (21 à 30%) et inférieur à 10% en Tunisie et en
Algérie (Kesah et al ; 2003).
En Algérie, le taux a augmenté à 14% en
2001 (Ramdani et al ; 2001).
Les hôpitaux Algériens ont prouvé une
augmentation dramatique de staphylococcus aureus methicillin resistant
(MRSA) prédominantes de ces dernières années (Bekkhoucha
et al ; 2008).
Ce clone est caractérisé par sa capacité
à acquérir des mécanismes de résistance à de
nombreux ATB compliquant le traitement des infections sévères et
profondes (DAMON H et a! ; 2000).
L'utilisation de la vancomycine a augmenté dans les
centres hospitaliers, ce qui a favorisé l'apparition de la
résistance à cet antimicrobien. Des isolats humains de S.
aureus exposés in vitro cet antibiotique ont pu développer
une résistance (Leclercq R, 2004).
Le sélénium est un oligo élément
(c'est-à-dire l'organisme n'en a besoin qu'en petite quantité)
indispensable à l'organisme humain. Il est présent à
l'état de traces dans les aliments (Droke et a! ; 1998).
Les nouvelles découvertes concernant le rôle du
sélénium ont démontré son rôle
prépondérant dans l'immunité en particulier dans les
infections virales où il s'avère avoir un effet protecteur (Droke
E.A et a! ; 1998).
L'action immunitaire du sélénium est souvent
conjointe avec celle de la vitamine E, car ces 2 micronutriments ont des effets
antioxydants séquentiels (BEAUVIEUX et a! ; 2002), et peuvent
effectuer l'immunité à médiation humorale et cellulaire et
par conséquent la résistance aux maladies infectieuses (Conley et
Delacroix ,1987).
Par ailleurs, la supplémentation en
sélénium avait des effets immunostimulants marqués
incluant un renforcement de la proliferation des cellules T activées
(expansion clonale), elle a tendance à augmenter la réponse des
anticorps au cours de l'infection à SARM (Stabel et a! ;
1991).
Dans cette optique, l'objectif principal de notre
étude a été d'essayer d'étudier l'effet de la
supplémentation en sélénium sur la réponse
immunitaire au cours de l'infection à Staphy!ococcus aureus
résistant à la méthicilline (SARM).
Le but spécifique a été de montrer que
la supplémentation en sélénium pourrait avoir des effets
sur la régulation de la réponse immune au cours de l'infection
à SARM. Pour cela 10 hamsters ont été recrutés pour
une étude rétrospectives cas-témoins, au sein du
Laboratoire de Biologie Moléculaire Appliquée et d'Immunologie de
l'Université Abou-Bekr Belkaïd de Tlemcen.
Chapitre 1. Revue de la littérature
1.1 SARM
1.1.1 Staphylococcus aureus résistant à la
méthicilline - Généralités
Staphylococcus aureus,
bactérie commensale, est également responsable de graves
infections systémiques telles que des septicémies (empoisonnement
du sang), des endocardites (infection de l'enveloppe du cur), des
ostéomyélites (Infection de la moelle), des pneumonies (infection
des poumons) et des infections de plaies (Lvermore DM, 2000).
Ce staphylocoque est la cause la plus courante des infections
bactériennes et l'une des trois premières causes d'infections
nosocomiales. Malgré l'existence d'antibiotiques efficaces, 10% à
50% des patients atteints de septicémie à staphylocoque en
meurent encore (Mylotte JM et al ; 1987).
L'importance des S. aureus résistants
à la méthicilline (SARM) comparée au S. aureus
sensible à la méthicilline (SASM) tient non seulement
à leur résistance aux bêta-lactamines, mais
également à leur résistance à d'autres
antibiotiques importants. Le problème principal est le fait que les
souches SARM hospitalières ont un potentiel épidémique.
Elles ne se substituent pas aux infections nosocomiales SASM existantes, mais
s'y ajoutent. Les SARM sont disséminés dans le monde entier au
cours des deux dernières décennies et sont devenus des occupants?
endémiques de beaucoup d'hôpitaux (Wagenvoort et al ;
1999).
Le pouvoir pathogène des SARM est similaire à
celui des SASM, mais le nombre croissant d'infections dans les
établissements hospitaliers, la mortalité plus
élevée et les coUts supplémentaires contribuent
également à la charge de la souffrance humaine (Rubin RJ et
al ; 1999).
Le SARM est un élément important dans le profil de
risque des malades hospitalisés.
La vulnérabilité à la colonisation par
les SARM et à l'infection augmente avec la durée de
l'hospitalisation, les traitements en soins intensifs, les
antibiothérapies antérieures, et les séjours
précédents dans un autre hôpital où étaient
présents des SARM. Les plaies chirurgicales et les cathéters sont
des voies d'entrée facile pour les staphylocoques et face à ce
risque, les standards d'hygiène locaux sont importants (Wagenvoort
et al;1996).
Staphylococcus aureus résistant à la
méthicilline est une bactérie multirésistante aux
antibiotiques fréquemment en cause dans les infections nosocomiales
(IN). Malgré les progrès observés depuis 15 ans, la lutte
contre les IN à SARM reste une priorité du programme national de
prévention des IN (Wagenvoort et al;1997).
1.1.2 Historique
D'abord identifié dans les années 1960,
Staphylococcus aureus résistant à la méthicilline
a été initialement considéré comme un
pathogène nosocomial.Toutefois, ces dernières années, un
nombre croissant de souches de SARM ont été isolés dans le
monde entier provenant de patients atteints d'infections communautaires (Lowy
FD, 1998).
Le SARM a d'abord été signalé dans le
milieu hospitalier, mais les souches résistantes se sont
également manifestées au sein de la collectivité. Les
souches responsables de l'évolution de la résistance au sein de
la collectivité sont généralement susceptibles à
une plus large gamme d'antibiotiques, mais au cours des dernières
années, la distinction entre les souches d'origine hospitalière
et d'origine communautaire est plus floue vu le déplacement des
organismes à l'intérieur et à l'extérieur du milieu
des soins de santé. Selon les résultats de 2006 du Programme
canadien de surveillance des infections nosocomiales (PCSIN), le taux
d'incidence global du SARM était de 8,04 par 1000 admissions (2,7 admis
pour infection et 5,34 pour la colonisation). Des 5787 nouveaux cas
signalés en 2006, 77 % étaient associés au milieu des
soins de santé (soit des hôpitaux ou des établissements de
soins de longue durée) et 15 % étaient d'origine communautaire
(Lowy FD, 1998).
Deux principaux types de SARM désormais circulé
dans la communauté: des souches hospitalières (H-SARM) que les
patients infectés avec facteurs de risque tels que l'hospitalisation
récente, la chirurgie, les maladies chroniques sous-jacentes, ou une
immunosuppression et des souches provenant de novo dans la communauté
(C-SARM) et les patients sont infectés sans facteurs de risque
établis (Journal of clinical microbiology , 2002).
SARM-C, souches qui ont tendance à être plus
sensibles aux antibiotiques que les souches de SARM-H, mais les souches SARM-C
des États-Unis ont été signalées pour être
résistantes à l'Erythromycine et aux Fluoroquinolones en 2005.
Ces souches sont également porteuses des gènes de virulence
spécifiques associés à la peau et les infections des
tissus mous, y compris les gènes de la Leucocidine de Panton-Valentine
(PVL) [Journal of clinical microbiology, 2002].
D'Autres facteurs de virulence, comme les toxines super
antigéniques, avaient été détectées aussi
dans certaines souches de SARM-C. Ces même souches SARM-C souches qui ont
une résistance à la méthicilline ont un gène de
résistance petite cassette (CCN type mec IV ou V), tandis que
les souches H-SARM les plus grandes ont une cassette (CSC type mec I
ou II) [Journal of clinical microbiologie, 2002].
1.1.3 Origines et facteurs impliqués dans la
dissémination des SARM
La consommation d'antibiotiques et le mésusage des
antibiotiques font partie des principaux facteurs impliqués dans la
dissémination de bactéries multi résistantes et notamment
du SARM .Les plus forts taux de SARM sont retrouvés dans les pays et les
services hospitaliers les plus prescripteurs d'antibiotiques (Forestier et
a! ; 2006).
- La pression de colonisation exercée par les patients
porteurs colonisés ou infectés par SARM (Muller et al ; 2003).
- Les antécédents d'hospitalisation, les
opérations chirurgicales, l'alimentation parentérale et les
antécédents d'exposition aux antibiotiques ont un impact sur la
distribution de SARM (Graffunder et Venezia, 2002).
- Les patients porteurs de SARM à l'admission
représentent un réservoir pour la transmission aux autres
patients (Eveillard et a! ; 2007).
- La diffusion des gènes de résistance entre
les bactéries par l'intermédiaire de déterminants mobiles
(plasmides, transposons) [Eveillard et a! ; 2002].
Enfin l'hospitalisation prolongée de certains de ces
patients après leur séjour en réanimation fait jouer
à ce service un rôle de plaque tournante dans la diffusion du SARM
à l'hôpital (Lucet et a! ; 2000).
1.1.4 Les causes d'infection par SARM
Généralement, les infections à SARM ne
se développent pas chez les personnes en bonne santé. Elles sont
plus courantes chez celles qui sont déjà hospitalisées car
la bactérie trouve souvent un point d'entrée dans le corps, tel
qu'une plaie chirurgicale ou un tube d'intraveineuse, une brUlure ou une
coupure ouverte ; celles qui ont un problème de peau grave telle que le
psoriasis ; celles qui ont un système immunitaire affaibli (personnes
âgées, personnes ayant une maladie de longue durée telle
que le cancer, etc.) ; celles qui ont un cathéter ou une perfusion ;
celles qui ont été opérées récemment
(Mylotte et al;1987).
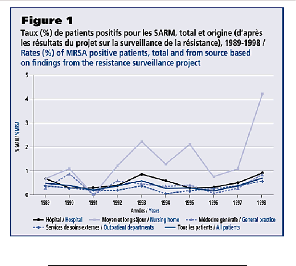
Figure 1.1 Taux des patients à
SARM+
La bactérie SARM se répand habituellement par
contact avec une personne ayant l'infection du SARM ou colonisée par la
bactérie. Elle peut aussi se répandre par contact avec des objets
touchés par une personne infectée par le SARM (Queen's Printer
and Controller of HMSO 2008).
Bien que les infections du SARM se développent
généralement chez les personnes hospitalisées, il peut
arriver que le personnel hospitalier et les visiteurs soient infectés
s'ils font partie de l'un de ces groupes à risque (Stefani et Varaldo ;
2003).
La bactérie SARM se répand habituellement par
contact avec une personne ayant l'infection du SARM ou colonisée par la
bactérie. Elle peut aussi se répandre par contact avec des objets
touchés par une personne infectée par le SARM (Queen's Printer
and Controller of HMSO 2008).
Bien que les infections du SARM se développent
généralement chez les personnes hospitalisées, il peut
arriver que le personnel hospitalier et les visiteurs soient infectés
s'ils font partie de l'un de ces groupes à risque (Stefani et Varaldo ;
2003).
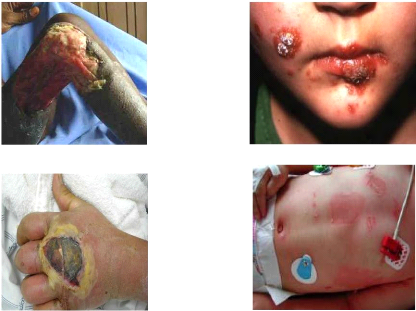
1.1.5 Les symptômes de l'infection à SARM
Les symptômes d'une infection à
Staphylococcus aureus résistant à la méthicilline
sont les mêmes que ceux présents lors d'une infection par un autre
type de Staphylococcus aureus. La peau est rouge et enflammée
autour de la plaie. Dans les cas graves, les symptômes suivants peuvent
être présents : fièvre, léthargie et maux de
tête. Le SARM peut causer des infections urinaires, des pneumonies, le
syndrome du choc toxique et même la mort (Louis Auquier ; Elsevier).
Bien que SARM soit résistant à de nombreux
antibiotiques et que l'infection qu'il provoque puisse être difficile
à traiter, il existe quelques antibiotiques qui peuvent guérir
une infection à SARM. Les patients qui sont uniquement colonisés
par SARM n'ont habituellement pas besoin de traitement (Journal of clinical
microbiology, 2002).
1.1.6 Transmission des SARM
Le SARM se transmet principalement d'une personne à
l'autre par contact ou par
contamination de l'environnement. Il peut
être présent sur les mains du soignant qui a
touchédes matières excrétées ou des
articles contaminés par la personne atteinte, comme des
serviettes, des draps et des pansements. Le SARM peut vivre
dans les mains contaminées du personnel soignant. C'est pourquoi la
meilleure protection est le lavage des mains du personnel soignant (Mesures de
prévention et de contrôle des infections à
staphylococcus aureus résistant à la
méthicilline, 2006).
Le risque de transmission du SARM d'une personne porteuse
à des membres de sa famille, incluant les enfants et les femmes
enceintes, est très faible (Grundmann et al ; 2006).
Le risque de transmission du SARM d'une personne porteuse
à des membres de sa famille, incluant les enfants et les femmes
enceintes, est très faible (Grundmann et al ; 2006).
Les membres du personnel hospitalier représentent un
second réservoir à partir duquel S. aureus peut
être transmis aux patients. Ils peuvent être soit des porteurs
occasionnels, soit des porteurs permanents. Une autre source potentielle de
contamination peut être les blouses du personnel ou les surfaces de
travail. S. aureus peut survivre plusieurs jours sur des surfaces
souillées (Grundmann et al ; 2006).
L'utilisation fréquente et prolongée ou assidue
d'antibiotiques peut accroître le risque d'infection. Ce risque est
également élevé chez les utilisateurs de drogues
injectables et les personnes atteintes de maladies chroniques ou dont le
système immunitaire est affaibli (Grundmann et al ; 2006).
Les contacts familiers, comme les étreintes, ne posent
pas de risques, toutefois, il faut se laver les mains avant de quitter
l'établissement de santé, la chambre ou la maison où se
trouve le patient. Également, avant de manipuler des liquides organiques
ou de toucher des sujets infectées, il importe de mettre des gants et,
après les avoir enlevé, de se laver les mains, avant de quitter
la chambre ou la maison du patient. En outre, avant qu'une personne
infectée ne quitte l'hôpital, il faudrait demander à
l'infirmière ou au médecin quelles sont les précautions
à prendre une fois à la maison (Mesures de prévention et
de contrôle des infections à staphylococcus aureus
résistant à la méthicilline. 2006).
L'utilisation fréquente et prolongée ou assidue
d'antibiotiques peut accroître le risque d'infection. Ce risque est
également élevé chez les utilisateurs de drogues
injectables et les personnes atteintes de maladies chroniques ou dont le
système immunitaire est affaibli (Grundmann et al ; 2006).
Les contacts familiers, comme les étreintes, ne posent
pas de risques, toutefois, il faut se laver les mains avant de quitter
l'établissement de santé, la chambre ou la maison où se
trouve le patient. Également, avant de manipuler des liquides organiques
ou de toucher des sujets infectées, il importe de mettre des gants et,
après les avoir enlevés, de se laver les mains, avant de quitter
la chambre ou la maison du patient. En outre, avant qu'une personne
infectée ne quitte l'hôpital, il faudrait demander à
l'infirmière ou au médecin quelles sont les précautions
à prendre une fois à la maison (Mesures de prévention et
de contrôle des infections à staphylococcus aureus
résistant à la méthicilline, 2006).
1.1.7 Contrôle de la propagation des SARM
Une bonne hygiène est la meilleure façon
d'empêcher le SARM de se répandre. 1.1.7.1 Lavage des
mains
? La façon la plus efficace pour réduire la
propagation de l'infection consiste à bien se laver les mains. Il est
également important d'avoir une bonne hygiène domestique
(Maziade, 2006).
? Les désinfectants antiseptiques pour la peau et une
pommade nasale spéciale peuvent parvenir à éliminer les
SARM du corps (Maziade, 2006).
1.1.7.2 Port de gants
Il faut porter des gants lorsqu'on manipule du sang, des
liquides organiques et des articles contaminés. Les mains doivent
être lavées immédiatement après avoir enlevé
les gants et entre les contacts avec différents patients (Maziade,
2006).
1.1.7.3 Port d'un masque et d'une blouse
Il faut porter un masque, un écran facial et une
blouse, lors des interventions qui risquent de causer des éclaboussures
ou la projection de gouttelettes du sang ou de liquides organiques (Maziade,
2006).
1.1.7.4 Lingerie souillée
Il faut manipuler, transporter et laver la lingerie
souillée de sang ou de liquides organiques, de façon à
éviter tout contact avec la peau, ainsi que la contamination des
vêtements et la transmission de micro-organismes aux autres patients (T
Urth, et a!, 2005).
Il est important de prendre certaines précautions pour
empêcher que le SARM ne se propage à d'autres patients dans
l'hôpital (Journal of clinical microbiology, 2002).
Beaucoup d'hôpitaux appliquent des mesures drastiques
pour réduire la transmission nosocomiale de souches MRSA. Ainsi, les
patients colonisés par des souches MRSA sont répertoriés,
ce qui permet de les identifier plus rapidement lors d'une nouvelle
hospitalisation. Le screening de ces patients se fait par la recherche de
S. aureus au niveau nasal ou inguinal (Lowy et a! ; 1998).
Le lavage des mains avec une solution antiseptique avant et
après les soins est particulièrement recommandé. Le
matériel de diagnostic (radio-, échographie, etc.) doit
être désinfecté avant et après usage. La
prévention implique également une sauvegarde (congélation)
des souches MRSA récoltées sur les patients (Maziade, 2006).
Le typage du MRSA peut être entrepris par la technique
de PFGE (pulsed-field gel electrophoresis) pour déterminer si un clone
de S. aureus est présent sur différents patients, ce qui
offre la possibilité de remonter à la source de la contamination
(Lowy FD et a! ; 1998).
En cas d'infection, l'antibiothérapie
appropriée pour traiter les patients MRSA se limite le plus souvent
à la vancomycine. L'utilisation intensive de la vancomycine peut
contribuer à l'émergence et la dissémination de souches
glycopeptides-résistantes qui sont insensibles à la quasi
totalité des antibiotiques actuellement sur le marché (Lanark
shire NHS Board,
2008).
1.1.8 Epidémiologie des SARM
Staphy!ococcus aureus résistant à la
méthicilline (SARM) représente un défi majeur en
santé publique dans de nombreux établissements de soins à
travers le monde. Les SARM sont une cause fréquente
d'épidémies par transmission inter-humaine et sont devenus
endémiques dans beaucoup de régions où ils alourdissent le
bilan de la morbidité, de la mortalité et le coût des soins
associés aux infections nosocomiales. Les données
rapportées par le système européen de surveillance de la
résistance antimicrobienne (EARSS, European Antimicrobial Resistance
Surveillance System), mis en place récemment,
suggèrent que la résistance des isolats de S.
aureus à la méthicilline est plus fréquente dans les
pays du sud de l'Europe que dans ceux du nord (Mylotte et a! ;
1987).
Deux rapports de surveillance nationaux montrent que le taux
de S. aureus résistants à la méthicilline a
augmenté au cours des dix dernières années (Wagenvoort
et a! ; 1999).
Même dans les pays où l'incidence des SARM est
faible, comme aux Pays-Bas, les hôpitaux de long et moyen séjours
peuvent devenir un réservoir pour les SARM et par là même
favoriser la diffusion dans la population, comme cela a été
rapporté au Royaume-Uni et aux Etats-Unis (Rubin et a! ;
1999).
En Allemagne, la surveillance par typage moléculaire
indique que de nouveaux clones épidémiques de SARM qui,
paradoxalement, sont résistants à un nombre moindre de classes
d'antibiotiques que les clones endémiques précédents, se
diffusent dans un plus grand nombre d'hôpitaux. De même, une
diffusion de souches sensibles à la gentamicine a été
rapportée en Belgique et en France, en dépit d'une
légère baisse de l'incidence des SARM à la suite de la
mise en place de mesures de contrôle au milieu des années
quatrevingt dix (Monnet DL, 2000).
Les populations de SARM évoluent donc rapidement, se
diffusant d'une région à l'autre. L'émergence d'un niveau
élevé de résistance à la mupirocine (un
médicament à usage local efficace pour limiter la colonisation
des sujets porteurs) et d'une sensibilité diminuée aux
glycopeptides (utilisés comme traitement d'attaque dans les infections
à SARM) est
inquiétante. Ces types de résistance ont
récemment fait l'objet d'articles dans plusieurs pays dont la France, le
Royaume-Uni et la Belgique, et risquent d'être sous-reconnues du fait du
manque de sensibilité des méthodes de détection
utilisées en laboratoire (Maziade, 2006).
Ces tendances soulignent la nécessité
d'améliorer et d'harmoniser les méthodes de détection de
résistance aux antibiotiques, les programmes de surveillance et les
politiques de contrôle dans le cadre d'un plan d'action européen
plus large. La position de Jim Wagenvoort en faveur d'une stratégie de
recherche et de destruction des SARM? devrait être applaudie, car cette
approche a permis de tenir les SARM en échec aux Pays-Bas
(Wagenvoort et a! ; 1996).
Les méthodes de confinement donnent également des
résultats encourageants
dans des établissements où les SARM
sévissent à l'état endémique. Les mesures de
maîtrise ne doivent pas se limiter aux seuls SARM. Elles doivent
également répondre à des défis plus larges comme le
bon usage des antibiotiques, le respect par l'ensemble des personnels soignants
des précautions standard pour la prévention des infections, et le
développement d'approches innovatrices (Wagenvoort et a! ;
1996).
Les données épidémiologiques sur les
SARM en Afrique sont rares. La prédominance des SARM a été
déterminée dans huit pays africains entre 1996 et 1997 et a
été relativement élevée au Nigeria, au Kenya et au
Cameroun (21 à 30%) et inférieur à 10% en Tunisie et en
Algérie (Kesah et al ; 2003).
En Algérie, le taux a augmenté à 14% en
2001 (Ramdani et a! ; 2001).
Les hôpitaux Algériens ont prouvé une
augmentation dramatique de staphy!ococcus aureus methicillin resistant
(MRSA) prédominantes de ces dernières années (Bekkhoucha
et a! ; 2008)
1.1.9 Diagnostic des Staphylococcus aureus
résistants à la méthicilline
Les infections par le SARM sont diagnostiquées par des
analyses de sang, d'urine ou d'un échantillon de tissu provenant de la
zone infectée afin d'y détecter la présence de la
bactérie (Maziade, 2006).
Si la bactérie du SARM est trouvée, de nouveaux
tests seront effectués pour savoir à quels antibiotiques la
bactérie ne résiste pas et, par conséquent, lesquels
peuvent être utilisés pour les traiter. Aujourd'hui, de nombreux
hôpitaux testent toutes les personnes hospitalisées pour savoir si
elles sont colonisées par le SARM. Ils peuvent analyser des
prélèvements de peau et de nez, ainsi que des échantillons
d'urine et de sang pour essayer d'y trouver la bactérie (Queen's Printer
and Controller of HMSO 2008).
1.1.10 Traitement des SARM
IL est important de supprimer la bactérie. Une
crème antibiotique spéciale sera appliquée à la
peau ou à l'intérieur du nez pour y retirer la bactérie.
Dans le cas d'infection par le SARM, des antibiotiques encore efficaces
(auxquels la bactérie n'est pas déjà résistante)
seront aussi utilisés [Duckworth ,2003].
La plupart des infections dues au SARM peuvent être
traitées avec les antibiotiques vancomycine ou linézolide, qui
sont généralement administrés par injection intraveineuse
(Tenover et a! ; 2001).
La plupart des infections dues au SARM nécessitent un
traitement à l'hôpital ; le traitement par antibiotiques peut
continuer pendant plusieurs semaines (Auquier; Elsevier).
1.1.11 Evolution de la résistance de Staphylococcus
aureus résistant à la méthicilline
Staphy!ococcus aureus a développé
différent types de résistances aux antistaphylocciques. plus de
80% des souches produisent une pénicillinase. L'oxacilline reste active
contre ces souches, mais des staphylocoques hospitaliers et plus
récemment communautaires ont développé une
résistance crissée entre l'oxacilline et les autres
bêta-lactamines par production d'une protéine liant les
pénicillines (PLP) de faible affinité, la PLP 2a. cette
dernière résistance est plus facilement décelée par
le test de la céfoxitine (Mansouri et a! ; 1997).
Trois enzymes sont responsables de l'inactivation des
aminosides, chacune conférant un spectre spécifique de
résistance. Les glycopeptides, vancomycine et teicoplanine sont des
alternatives à l'oxacilline en cas de résistance ou
d'intolérance (Revue Francophone des laboratoires, 2008).
La résistance aux macrolides est surtout liée
à la production de méthylase qui modifie le ribosome cible de ces
ATB. Deux phénotypes inductibles et constitutifs sont distingués
par la méthode de diffusion en gélose (Revue Francophone des
laboratoires, 2008).
La résistance aux Quinolones est liée à
des mutations de la cible de ces ATB, les topoisomérases. De nouveaux
anti staphylococciques ont été récemment
commercialisés le linézolide, la daptomycine et la
tigécycline. Des résistances encore rares sont déjà
rapportés (Mansouri et a! ; 1997).
Actuellement, la résistance à la
méthiciline est asociée dans environ 90% des cas de SARM
hospitaliers à la résistance aux aminosides
Kanamycine-tobramycine. En revanche, les SARM communautaires sont
résistants aux ATB, et mêle à la methiciline et à la
kanamycine, à l'aide de fusidique et souvent aux tetracyclines (Revue
Francophone des laboratoires, 2008).
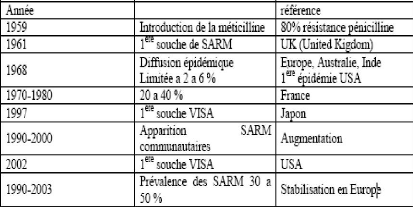
Figure 1.3 Évolution de la résistance
à la méthicilline de S. aureus (Lepelletier, 2004) 1.1.12
Mécanisme d'JF'S4Rn
Une souche est dite « résistante à la
méthiciline » lorsqu'elle présente une résistance aux
pénicillines du groupe M et par extension à toutes les B
lactamines. Elle se définit par une concentration minimale inhibitrice
supérieure à 2 mg/l pour l'oxacilline, la pénicilline M de
référence (Forestier et al ; 2007).Les isolats de SARM sont le
plus souvent résistants à d'autres classes d'antibiotiques
(Speller et al ; 1989), ils sont considérés comme des
bactéries multi résistantes, et la résistance à la
méthicilline est depuis lors utilisée comme marqueur de multi
résistance (Grohs, 2008).
Les antibiotiques appartenant à la classe des
ß-lactamines s'attaquent à des enzymes appelés PBPs
(penicillin binding proteins), qui sont ancrés à la surface
bactérienne et qui participent à la biosynthèse du
peptidoglycane (Enright et a! ;
2000).
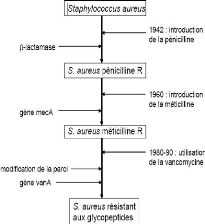
Notions génétiques
L'élément mec confère à
la souche de staphylocoque qui possède la faculté de
résister à l'ensemble des ß-lactamines, dont la
méthicilline. Les souches MRSA se retrouvent principalement en milieu
hospitalier où la pression sélective exercée par l'emploi
massif des antibiotiques est importante. Les souches MRSA ont la
propriété d'accumuler des déterminants de
résistance variés et non reliés (ex: résistance aux
ammoniums quaternaires, aux fluoroquinolones etc.) [Enright, MC et
a! ; 2000].
Le déterminant de résistance mec se
situe sur un élément d'ADN de 30 Kb (l'élément
mec) qui s'est inséré dans le chromosome près du
gène codant la protéine A. Seul environ 10% de
l'élément mec contribue à la résistance
à la méthicilline (Duckworth et a! ; 2003).
L'élément mec est retrouvé dans
les souches de staphylocoques coagulase-négatifs et semble avoir
été transmis aux souches de S. aureus par transfert
horizontal. Le produit majeur du déterminant mec est un enzyme
nommé PBP2' codé par le gène mecA. PBP2' est
caractérisé par une faible affinité pour les
ß-lactamines, par contraste avec les autres PBPs impliquées dans
la biosynthèse du peptidoglycane (Duckworth et a! ; 2003).
Le gène mecA est régulé par
deux gènes appartenant au déterminant mec: le premier
agit comme activateur (mecR1) et le second comme répresseur
(mecI1). Certains gènes appartenant au chromosome de souches
sensibles ou résistantes de S. aureus, peuvent affecter le
niveau de résistance des MRSA. D'autres gènes impliqués
dans la biosynthèse du peptidoglycane influencent fortement la
résistance à la méthicilline: l'inactivation des
gènes femA et femB, qui contribuent au pont
transversal pentaglycine, abolit cette résistance alors que
l'inactivation des gènes femC et femD diminue
partiellement la résistance à la méthicilline
(Enright, et al ; 2000).
Enfin, il existe des souches ne possèdant pas le
déterminant mec, mais qui expriment un bas niveau de
résistance à la méthicilline. Ces souches, aussi
appelées 'borderline', sont soit hyperproductrices de ß-lactamase,
soit expriment des PBPs altérées (Duckworth , 2003).
1.2 Statut oxydant antioxydant
Des radicaux libres et leurs dérivés
activés, que l'on peut regrouper sous le terme ROL (de l'anglais, ROS,
pour reactive oxygen species) sont continuellement produits dans les
cellules, notamment lors du métabolisme oxydatif. Il a été
montré récemment qu'ils pouvaient avoir un rôle dans
diverses voies de signalisation. Cependant, ils sont depuis plus longtemps
considérés comme potentiellement toxiques car ils ont la
capacité d'endommager différents composants cellulaires vitaux,
tels que les lipides, les protéines et l'ADN, et de conduire à la
mort des cellules par stress oxydatif. Ces ROL sont normalement
tamponnés par différents systèmes antioxydants. Une
cellule peut toutefois subir un stress oxydatif lorsque son contenu en ROL
dépasse ses capacités de défense antioxydante, soit par
une augmentation de la production de ROL, soit par une diminution de ses
capacités de défense, soit par les deux mécanismes
combinés (Ré et a! ; 2005).
Comme la plupart des oligoéléments, le
sélénium joue un rôle-clé dans l'ensemble de notre
organisme. Bien qu'on n'ait pas encore totalement élucidé son
mode d'action, voici les propriétés qu'on lui prête (HALENG
et a! ; 2007).
· Antioxydant au niveau intracellulaire, il permet à
notre organisme de produire la glutathion-peroxydase (HALENG et a! ;
2007).
Celle-ci travaille de concert avec la vitamine E pour
protéger les membranes cellulaires contre l'oxydation provoquée
par les radicaux libres, des substances impliquées dans le
vieillissement, l'apparition de certains types de cancer, de maladies
cardiovasculaires ainsi que dans la formation des cataractes (BEAUVIEUX et
a! ; 2002).
· L'effet antioxydant du sélénium agit
aussi en cas d'inflammation arthritique. Une étude récente a
constaté un effet positif dans le cas de sujets souffrant d'inflammation
systémique (BEAUVIEUX et a! ; 2002).
Un rôle biochimique a été récemment
établi pour le sélénium comme un composant d'une enzyme,
GSH-PX, des fonctions avec la vitamine E dans les cellules pour contrôler
la peroxidation (Van ,1980).
La vitamine et le sélénium sont antioxydants
rapproché de fonctions immunisées (Finch and Turner ; 1996), la
vitamine E est antioxydant puissant qui empêche la formation de lipide
hydroperoxides des phospholipides insaturés présents dans des
membranes subcellulaires (Dowell, 1989).
1.3 Effet du Sélénium sur le système
immunitaire
Les éléments traces sont des nutriments sans
valeur énergétique propre, mais essentiels au métabolisme.
Ils constituent moins de 0.01% du poids corporel. Ils sont au nombre de douze
et 17 ayant des fonctions biologiques identifiées chez les
mammifères, et sont considérés comme essentiels chez
l'être humain. Il s'agit de métaux ou de métatalloides : le
bore , le chrome , le cobalt , le cuivre , le fer , le fluor , l'iode , le
molybdène , le manganèse , le sélénium , le
vanadium et le zinc (WHO,1996).
1.3.1 Définition du sélénium
Le sélénium est un oligo-élément
(c'est-à-dire que l'organisme n'en a besoin qu'en très petites
quantités) indispensable à l'organisme humain. Il est
présent à l'état de traces dans les aliments. Autres noms
: sélénite, sélénate,
sélénométhionine, sélénocystéine
(Chandra, 1997).
On utilise différentes techniques pour vérifier
sa présence dans l'organisme, comme l'analyse du sang et des cheveux,
mais, dans plusieurs études épidémiologiques, les
chercheurs ont plutôt vérifié la teneur en
sélénium des ongles des sujets, une mesure
considérée fiable pour évaluer l'apport en
sélénium à long terme. Il est absorbé au niveau du
tube digestif et principalement éliminé dans l'urine (Chandra,
1997).
Le sélénium est un composé biochimique
essentiel de l'enzyme glutathion-peroxydase (GSH-Px). Cette enzyme, en
complémentarité avec la vitamine E, protège les membranes
cellulaires et maintient leur intégrité en s'opposant à la
formation de radicaux libres (effet antioxydant) [Cohan, 1983].
Il existe une interrelation importante entre la vitamine E et
le sélénium : la vitamine E prévient l'oxydation des
acides gras polyinsaturés alors que le sélénium (GSH-Px)
métabolise les peroxydes qui ont déjà été
formés (Berger, 2003).
1.3.2 Historique du sélénium
Le sélénium, symbole Se, est un
métalloïde découvert et baptisé en 1817 par le
chimiste suédois Berzelius dans des résidus d'une
préparation de l'acide sulfurique. Ce corps simple est comparable au
soufre, et, comme celui-ci, présente des variétés
allotropiques: il peut avoir plusieurs états doués de
propriétés différentes, par exemple la forme
cristallisée. Le ton gris de celle-ci lui donne un aspect
métallique (Spears, 2000).
Sa répartition n'est toutefois pas uniforme sur le
globe. Parmi les régions qui en sont pauvres, on compte notamment la
Finlande, la Nouvelle-Zélande et certaines parties de la Chine ainsi
que, dans une moindre mesure, le Royaume-Uni et l'Europe en
général (Spears, 2000).
C'est à partir des années 1950 que des
études sur des animaux ont permis de démontrer l'importance
cruciale de l'action synergique du sélénium antioxydant, bien
connu, dans la prévention de diverses maladies. En 1973, des chercheurs
de l'Université du Wisconsin démontraient que le
sélénium était un cofacteur de la glutathion-peroxydase,
un enzyme clé de l'activité antioxydante dans l'organisme (HALENG
et a! ; 2007).
1.3.3 Généralités
Le sélénium est particulièrement
impliqué dans la prévention et la genèse de plusieurs
types de cancer. De manière générale, les patients
cancéreux ont des concentrations sanguines de sélénium
plus basses que les sujets sains. Les néoplasies sont plus
fréquentes dans les zones géographiques du globe dont les sols
sont pauvres en sélénium, avec une relation inverse entre apports
de sélénium et développement de cancers (Clark et
a! ; 1996).
Une étude grecque a démontré des
concentrations sanguines et capillaires significativement plus basses chez les
patients cancéreux que chez les sujets contrôles, quel que soit le
stade du néoplasie. En ex-Yougoslavie, la faible teneur des sols en
sélénium se répercute sur toute la chaîne
alimentaire et entraîne un statut en sélénium
déficitaire dans la population (Clark et a!, 1996).
ce déficit endémique s'accompagne de deux types
de pathologies, la néphropathie endémique des Balkans et les
tumeurs du tractus urinaire, le sélénium protège les
tissus des lésions oxydatives par le biais de l'activité de la
GSHPx. Chez l'animal, il a été démontré que le
sélénium atténue l'activité mutagénique de
nombreux carcinogènes connus in vitro et in vivo, et ceci est
probablement lié à son rôle dans la thiorédoxine
réductase, une sélénoenzyme qui module l'activation du
NFkB (Clark et a!, 1996).
1.3.4 Rôle antioxydant du sélénium
Comme la plupart des oligo-éléments, le
sélénium joue un rôle clé dans l'ensemble de
l'organisme. Sur le plan intracellulaire, il a un effet antioxydant, car il
permet à l'organisme de produire la glutathion-peroxydase. Cet enzyme
travaille de concert avec la vitamine E pour
protéger les membranes cellulaires contre l'oxydation provoquée
par les radicaux libres. En
excès, ces derniers entraînent un vieillissement
précoce et contribueraient à l'apparition de certains types
de cancers, de maladies
cardiovasculaires ainsi qu'à la formation des
cataractes. Le sélénium joue
également un rôle essentiel dans le fonctionnement du
système immunitaire et de la glande
thyroïde (Hercberg et al ; 1998).
1.3.5 Sources alimentaires de sélénium
La teneur de sélénium des grains et des
légumes dépend directement de la teneur en cet
oligo-élément dans les sols où ils sont cultivés.
De même, la teneur des aliments de source animale varie selon celle de
l'alimentation des animaux (Berger et Chioléro, 2003).
Les produits animaux et les céréales
complètes sont de bonnes sources de sélénium lorsqu'ils
sont produits dans des régions dont le sol est riche en ce
minéral. Les poissons et les fruits de mer contiennent également
de bonnes quantités de sélénium (Berger et
Chioléro, 2003).
|
Aliment
|
Portion
|
Teneur en sélénium
|
|
Noix du Brésil, déshydratées
|
5 g (1 noix)
|
95 ug
|
|
Huîtres du Pacifique, crues ou cuites à la vapeur
|
100 g (3 1/2 oz) (2- 4 moyennes)
|
77-154 ug
|
|
Thon, en conserve
|
100 g (3 1/2 oz)
|
60-80 ug
|
|
Abats de dinde ou de poulet, braisés
|
100 g (3 1/2 oz)
|
58-60 ug
|
|
Hareng de l'Atlantique, mariné
|
100 g (3 1/2 oz)
|
59 ug
|
|
Palourdes, en conserve
|
100 g (3 1/2 oz) (13 moyennes)
|
49 ug
|
|
Champignons shiitakes, séchés
|
10 champignons (36 g)
|
49 ug
|
|
Côtelettes de porc, cuites
|
100 g (3 1/2 oz)
|
48 ug
|
|
Thon, flétan, morue, sébaste, plie, espadon,
saumon, cuits au four ou grillés
|
100 g (3 1/2 oz)
|
40-47 ug
|
|
Crabe ou homard, cuits à la vapeur ou bouillis
|
100 g (3 1/2 oz)
|
32-45 ug
|
|
Saumon, cuit au four ou en conserve
|
100 g (3 1/2 oz)
|
38-43 ug
|
|
Dinde, viande brune, rôtie
|
100 g (3 1/2 oz)
|
41 ug
|
|
Crevettes, crues ou cuites
|
100 g (3 1/2 oz)
|
38-40 ug
|
|
Boeuf, extérieur de ronde, braisé
|
100 g (3 1/2 oz)
|
39 ug
|
|
Agneau, épaule, braisé
|
100 g (3 1/2 oz)
|
37 ug
|
|
Canard domestique, rôti
|
100 g (3 1/2 oz)
|
23 ug
|
Tableau 1.5 Sources alimentaires du
sélénium
1.3.6 Carence en sélénium
En principe, la carence en sélénium ne se produit
que dans les cas suivants :

chez les personnes dont les principaux aliments proviennent de
régions dont les sols sont pauvres en sélénium
(Spears, 2000 ; Finch et Turner, 1996).

chez les personnes qui sont sous alimentation
parentérale non enrichie en sélénium durant
des périodes prolongées (Spears, 2000 ; Finch et
Turner,1996).

chez les personnes souffrant de maladies intestinales graves
comme la maladie de Crohn ou la colite
ulcéreuse (Spears, 2000 ;Finch et Turner,1996).
On soupçonne cependant qu'une carence subclinique -
c'est-à-dire dont les signes sont tellement minimes que le diagnostic
est difficile à poser - peut être associée à
diverses maladies : troubles cardiovasculaires et
inflammatoires, asthme, affaiblissement de
l'immunité, cancer, cataractes (Cipriano et
a! ; 2001).
Les besoins exacts en sélénium des personnes
âgées sont mal connus et les apports nutritionnels
recommandés actuels sont dérivés de ceux des jeunes
adultes. Cependant, on soupçonne qu'une alimentation pauvre en
sélénium entraîne un risque
d'anémie chez les aînés. Un faible
taux sanguin de sélénium est également associé
à une perte de force musculaire ainsi qu'à un risque plus
élevé d'invalidité et de mortalité. Il est donc
essentiel que les personnes âgées s'assurent d'avoir une
alimentation suffisamment riche en sélénium (WHO, 1996).
1.3.7 Sélénium et système
immunitaire
Plusieurs études ont analysé le rôle du
sélénium sur la fonction immunitaire des animaux domestiques. Ce
micronutriment a des interactions complexes avec la vitamine E au niveau du
système de défense de l'animal (Spears, 2000 ;
Finch et Turner,1996).
Le statut en sélénium d'un animal peut affecter
l'immunité à médiation humorale (réponse des
anticorps) et cellulaire (réponse phagocytaire et lymphocytaire) et par
conséquent, la résistance aux maladies infectieuses (Cipriano
et a! ; 2001).
Deux revues de la littérature sur les effets du
sélénium et sur la réponse immunitaire ont
été produites (Spears, 2000 ; Finch et Turner,
1996).
Ce qui ressort clairement de la littérature, c'est que
le statut de base en sélénium, la dose, la voie et le temps
d'administration, le type de supplémentation, l'âge de l'animal,
le choix des antigènes utilisés pour stimuler le système
immunitaire et les pratiques de régie peuvent affecter la réponse
immunitaire (Swecker, 2001).
Étant donné que d'une étude à
l'autre ces paramètres diffèrent, ceci vient sans doute expliquer
en grande partie les résultats inconstants observés dans la
littérature quant à l'effet du sélénium sur le
système immunitaire (Swecker, 2001).
Une grande attention a récemment été
concentrée sur le rôle du sélénium dans la
protection des leucocytes et les macrophages pendant la phagocytose,
précisément le mécanisme où des mammifères
tuent immunologiquement l'envahissement des bactéries. L'ensemble
protège les cellules phagocytaires et les tissus environnants de
l'attaque oxydative contre les radicaux libres produits par l'explosion
respiratoire des neutrophiles et des macrophages pendant la phagocytose
(Baboir, 1984 ; Boulanger et Cohen, 1983) ; (Baboir, 1984 ; Boulanger et Cohen,
1983).
Le système immunitaire s'est développé
comme un système de défense contre des infections et contribue au
maintien en bonne santé. Ces dernières années, l'effet de
régime sur les aspects divers d'immunisés (Chandra, 1997).
Des groupes de recherche typiquement différents ont
étudié des substances nutritives différentes, chaque
modèle d'animaux différents a été utilisé.
La plupart de ces modèles se concentrent sur les aspects choisis de
fonction immunisée sans évaluer d'autres fonctions. Il est donc
difficile de comparer les effets d'immuno modulation plus larges des
régimes ou des substances nutritives individuelles (Chandra, 1997).
Une approche systématique à comparé
l'impact de substances nutritives diverses et des régimes utilisant un
modèle animal pour évaluer une gamme de T-aide inné et
spécifique (Th1) et des réactions immunitaires adaptatives
Th2-conduites serait donc de valeur (Albers et al ; 1998).
La modulation de Th1-et des réponses Th2-conduites peut
aisément être détectée dans ces souris,
malgré leur tendance de développer des réponses
Th2-influencées à de certaines infections (Albers et al
; 1998).
1.3.7.1 Effet sur l'immunité à
médiation humorale (Réponse des anticorps)
De façon générale, un programme de
supplémentation en sélénium aura un effet différent
sur la réponse des anticorps selon les antigènes utilisés,
les stades de la réponse immunitaire (ex. : primaire vs secondaire), les
compartiments humoraux et également selon la forme du
sélénium utilisée (Finch et Turner,
1996).
Une supplémentation en sélénium a tendance
à augmenter la réponse des anticorps lorsque l'animal a un statut
de base déficient envers ce nutriment (Stabel et al ; 1991).
Par contre, cette supplémentation semble moins efficace si
l'animal reçoit déjà un niveau adéquat de
sélénium (Swecker et al ; 2000).
1.3.7.2 Effet sur l'immunité à
médiation cellulaire (Fonctions phagocytaire et lymphocytaire)
De façon générale, une déficience
du sélénium peut réduire l'efficacité des cellules
du système de défense (neutrophiles, macrophages, lymphocytes)
des ruminants en affectant certaines de leurs fonctions comme leur
activité microbicide et leur habileté à migrer au site
d'une infection (Cipriano et al ; 2001).
1.3.7.3 Effet sur la résistance aux maladies
Les études qui ont tenté de déterminer
l'influence du sélénium sur la résistance aux maladies ont
surtout mesuré l'incidence et la survie des cellules. Cependant,
l'incidence des maladies, est tellement sujette à de nombreuses
influences que la contribution des micronutriments peut facilement être
masquée (Cipriano et al ; 2001).
Dans la majorité des études, les auteurs
tentaient de déterminer si l'incidence de « maladies respiratoires
» ou de « maladies entériques » diminuait avec l'apport
en sélénium (Mee, 2004).
Chapitre 2. Matériels et méthodes
2.1 Partie bactériologique
2.1.1 Matériels biologiques
Des prélèvements nasaux ont été
effectués au niveau du service néonatal du CHU de Tlemcen par
technique d'écouvillonnage, puis acheminés au laboratoire de
microbiologie pour être incubés 24H à 37C° dans du
bouillon Giolitti Cantoni en présence de 5 gouttes de Téllurite
de potassium.
L'isolement et la purification de souches ont été
assistés et dirigés par Monsieur REBIAHI au niveau du laboratoire
de Microbiologie du nouveau pole de l'université de Tlemcen.
2.1.2 Méthodes biologiques
La purification s'effectue par repiquage sur bouillon et
gélose de Chapman.
2.1.2.1 Coloration de Gram
Elle permet de mettre en évidence les
propriétés de la paroi bactérienne. L'avantage est de
donner des résultats rapides.
Elle nécessite 2 étapes :
Un frottis : fixation à la chaleur
Sur une lame on a déposé une goutte d'eau , on a
ajouté une goutte de la colonie isolée à l'aide d'une anse
de platine , étaler et fixer à la chaleur environ 10 à 15
min à 40°c .
La coloration
La lame séchée était posée sur le
portoir reposant sur un bac de coloration.
1. Violet de gentiane ou cristal violet 30 sec à 1 min.
Rincer à l'eau.
2. Mordançage au Lugol. C'est un mordant permet la
fixation 20 sec.
3. Rincer à l'eau.
4. Décoloration à l'alcool (méthanol) sur
une lame inclinée 5 à 10 sec.
5. Rincer à l'eau.
6. Recoloration à la safranine ou la Fushine 30 sec
à 1 min.
7. Laver la lame et la sécher sur une platine chauffante
à 40°c 10 minutes.
Observation sur microscope
On a observé que c'est des cocci à G+
assemblés en amas formant grappe de raisin.
2.1.2.2 Ensemencement sur Chapman
- C'est un milieu de culture sélectif (critère de
classification).
- L'ensemencement était fait par la technique
d'épuisement. - Les staphylocoques se développent rapidement
à 37°c.
- La plupart des souches élaborent un pigment jaune
doré.
2.1.2.3 Coagulase libre
L'activité de la coagulase de staphylococcus
aureus sur le plasma humain a été prise comme un
critère principal pour différencier les espèces de genre
staphylococcus à coagulase positif des autres espèces du genre
staphylococcus à coagulase négatif (SCN).
Principe
Le principe de ce test est de mettre en contact du plasma
oxalaté à une culture bactérienne sur un bouillon Cur-
Cerveau.
Technique
Ajouter 0,5 ml du plasma dans un tube contenant 0,5 ml de culture
BHIB additionnée de la souche à testé ensuite
homogénéiser et incuber a 37°C pendant 24h, le
résultat positif se traduit par la formation d'un caillot sur le fond du
tube, le mélange est observé d'heure en heure car le coagulum
peut être suivi d'une redissolution du caillot provoquée par la
fibrinolyse (Denis et al ; 2007).
2.1.2.4 Test de la catalase
La catalase est une enzyme qui permet à la bactérie
de dégrader l'H2O toxique par la réaction suivante :
2H2O2 2H2O + O2
Les staphylocoques (catalase positive) et les streptocoques
(catalase négative) peuvent être différenciés par ce
test. Les germes producteurs de catalase peuvent dissocier le péroxyde
d'hydrogène en oxygène et en eau (Hart et Shears,
1999).
Technique
- Déposer sur une lame une goutte d'H2O2.
- On prélève une colonie isolée à
partir de gélose avec une pipette pasteur et la mettre en contact avec
la goutte de H2O2 , le résultât positif se traduit par
la formation immédiate de bulles gazeuses.
2.1.2.5 Identification API
Apres avoir effectué la coloration de Gram, l'utilisation
de la galerie API nous permet une identification rapide et fiable en utilisant
des plaques API Staph (Biomereux)
Technique
Apres incubation, on ajoute une goutte de chacun des
réactifs suivants : Test VP : VP1 et VP2
Attendre 10 minutes. Une couleur rose franche ou violette indique
une réaction positive.
Une couleur rose pale ou rose claire obtenue après 10
minutes doit être considéré comme négative.
Test NIT 1 et NIT 2
2.1.2.6 Screening / Criblage
Un criblage est une technique du laboratoire visant à
rechercher la résistance d'une souche
bactérienne vis-à-vis d'un ou de
plusieurs antibiotiques supposés ou connus.
Le principe consiste à placer la culture des
bactéries en présence du ou des antibiotiques et à
observer les conséquences sur le développement et la survie de
celle-ci. On peut par exemple placer plusieurs pastilles imbibées
d'antibiotiques sur une souche bactérienne déposée dans
une boîte de Pétri. Il existe trois
types d'interprétation selon le diamètre du cercle qui entoure le
disque d'antibiotique : souche ou bactérie sensible,
intermédiaire ou résistante.
5 pDliWDtiRQ 1d'pQ 1screening
Il a eté realisé selon les normes du Clinical and
Laboratory Standards Institute (CLSI ;2008). Technique
- Repiquer une colonie pure à partir d'une culture
developpée (Chapman) de 24 heures sur milieu solide dans 5 ml du
bouillon cur-cervelle.
- Incuber à 37°c pendant 6 à 7 heures sous
agitation.
- A l'aide d'un colorimètre,on mesure la densité
optique de l'inoculum et on l'ajuste en ajoutant la culture s'il est tres
faible ou l'eau physiologique s'il est tres fort. La densité
optique doit être entre 0.08 et 0.1 à 625nm
équivalente à une culture de 18h (CLSI, 2008).
- Apres 15 minutes et suivant à l'ajustement de la
turbidité de l'inoculum , on trempe un écouvillon dans cette
suspenssion.
- On presse fermement contre la paroi interieure du tube juste au
dessus du niveau du liquide , on fait tourner l'écouvillon pour enlever
les liquides excédentaires.
- On ensemence la surface de la gélose de Muller Hinton
par la technique d'épuisement en tournant la boite environ 60°
apres chaque application pour obtenir une distribution égale de
l'innoculum.
- On écouvillone par tout autour du bord de la surface de
la gélose.
- Puis 0.6g d'antibiotique d'oxacilline (Ox) dilluée dans
100 ml d'eau , 2 ml de cette solution
a été vérsée sur les boites de
pétri en jetant l'excés dès que possible à moins de
15 minutes aprés l'ensemensement à l'aide d'une pince
stérile.
- Enfin , on incube les boites à 35°c pendant 16
à 18h.


A : Racler une colonie B : Ensemencer dans BHIB

C : incubation sous agitation D : calibrer l'appareil par un tube
blanc
E : Mesure de la densité optique
Figure 2.1 Les étapes du
Screening
Le résultat s'est traduit par une croissance de
plusieurs colonies de staphylococcus aureus qui indique la
résistance à l'oxacilline d'où le nom Staphylococcus
aureus résistant à la méthiciline (SARM).
2.2 Partie immunologique 2.2.1 Patients
La population étudiée a été
composée de 10 Hamsters infectés par SARM, répartis en
deux groupes (groupe 1 ; supplémenté en sélénium
[Se+], n = 5, sexe ; 4 mâles/1 femelle, âge ; 21 jours, poids ;
68,51 #177; 5,17 g, groupe 2 ; non supplémenté en
sélénium [Se-], n = 5, sexe ; 3 mâles/2 femelle, âge
; 21 jours, poids ; 64,06 #177; 1,7 g) et de 5 hamsters sains (5
males), admis au niveau du laboratoire d'immunologie Nouveau
pôle de l'Université de Tlemcen.
Ces rongeurs ont été choisis parmi un
échantillonnage d'hamsters disponibles à Tlemcen, ce sont des
animaux types pour toute étude biologique en raison de leur croissance
rapide, leur poids et permettent une installation rapide de la maladie
(très sensibles).
Les 10 hamsters infectés par une dose de 107
bactéries/ml (voie intrapéritoniale) 5 hamsters du groupe 1 ont
reçus une dose de 0.93 g/kg de sélénium (metallicum 3.6 g,
laboratoires BOIRON dolisos -BOIRON 69110 STE Foy - Lyon France voie orale)
quotidiennement et pendent 15 jours.
Le hamster est avant tout granivore, mais il varie volontiers
son alimentation par des compléments végétaux comme des
fruits, légumes, tiges, feuilles ou racines. Certaines espèces
sont cependant omnivores et dévorent des insectes ou de petits
vertébrés, comme par exemple des grenouilles. Il remplie alors
ses abajoues pour rapporter la nourriture dans son terrier. Il existe plus de
10 variétés de hamsters nains, cependant les animaleries en
proposent généralement 4 variétés : le hamster nain
de Russie, de Campbell, de Roborovsky et de Chine (Marshall Cavendish
,1994).
Les hamsters nains de Campbell appartiennent à la
famille des hamsters à queue courte. Ils présentent un corps,
pour ainsi dire, arrondi et ont une queue si petite qu'elle émerge
à peine de leur fourrure. Dans la nature, ces hamsters vivent en groupes
familiaux. Ils savent très bien creuser, mais sont moins agiles
lorsqu'il s'agit de se hisser ou de grimper (LAPIERRE E, 2001).
Ces hamsters nains ont une espérance de vie de 2 ans
environ (Avanzi.M De Vecchi, 2002).
Le hamster nain de Campbell (Phodopus
Campbelli) était le modèle utilisé pour notre
étude.
Il y a aussi le hamster nain de Campbell albinos avec le dos roux
(Marshall Cavendish ,1994).
La mutation Albinos eu lieu en Hongrie en 1988. Le Albinos a
pure fourrure blanche sur le dos, les côtés et à l'estomac.
Les yeux sont rouge clair et les oreilles sont de couleur chair. Dans certains
albinos animaux ont tendance à être plus faible ou moins bonne
santé que d'autres couleurs, mais il n'y a aucune preuve
suggérant que cela est vrai d'Albinos hamsters russes (Hollmann Peter,
2007).
Le hamster devint très vite l'animal
préféré dans plusieurs types e recherche en raison de sa
susceptibilité à plusieurs infections virales et
bactériennes mais surtout en raison du faite qu'il est relativement
exempt d'infections naturelles (Pierre Payment, Michel Trudel. Manuel de
techniques virologiques. Univ de Québec.1989).
Le hamster a été utilisé comme
modèle animal dans l'étude de la pathogénie d'un grand
nombre d'infections (Pierre Payment, Michel Trudel. Manuel de techniques
virologiques. Univ de Québec.1989).

Figure 2.2 Hamsters nains de
Campbell
2.2.2 Organismes
Le staphylococcus aureus est un microbe qui vit sur la
peau et les muqueuses des personnes saines. Il provoque parfois des
infections.
Les SARM sont des types de staphylocoques aureus que la
plupart des antibiotiques sont incapables de détruire.
2.2.3 Animaux
Des jeunes hamsters âgés de 4 à 6 semaines
au début de l'expérience, ont été
élevés et hébergé aux installations animales de
l'Université. Ils ont été gardés dans des cages
dans des conditions standards (la température 26 °C, 50 % à
l'humidité relative de 60 %) avec l'accès libre à la
nourriture et l'eau potable acidifiée (le pH 3).
.
Ils ont été aléatoirement assignés
à 2 groupes expérimentaux (5 / groupe) un groupe alimenté
en sélénium et l'autre non alimenté.
2.2.4 Méthode d'infection
Les hamsters ont été infectés par une dose
de 107 bactéries/ml par voie intrapéritoniale
Figure 2.3 Injection par voie
intrapéritoniale
2.2.5 Analyses biologiques
2.2.5.1 Dosage des protéines totales
Le dosage des protéines totales a été
réalisé à l'aide de la méthode de Biuret (Gormol
,1949) utilisant le réactif Biuret amélioré par (Goodwin
et al ,1965) et (Flack C.P and Woollen ,1984).
2.2.5.1.1 Principe
Ce réactif est prévu pour la quantification in
vitro des protéines totales dans le sérum ou le plasma humain sur
des analyseurs de biochimie automatiques ou manuels.
Le total des protéines sert à suivre des
changements globaux des niveaux de protéines provoqués par
différents états des maladies. Ce dosage est habituellement
effectué en association avec d'autres tests tels que l'albumine du
sérum, les tests fonctionnels du foie ou l'électrophorèse
des protéines. La réaction du biuret est utilisée depuis
la fin du dixneuvième siècle, c'est la méthode
préférée des laboratoires cliniques par sa
simplicité, rapidité et fiabilité.
2.2.5.1.2 Technique
· On met 2.5 ml de biuret dans une cuve ajouté a 50
ìL de serum.
· Melanger la cuve dans le vortex.
· Les cuves ont été mise à l'abri de
la lumiere pendant 30 minutes.
· Enfin mesurer la DO à 520nm sur appareil (Coulour
wave C 07500 colorimeter WPA COMBRIDGE U.K CB40 F).
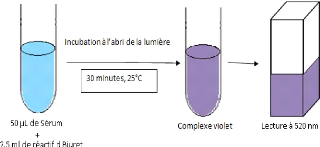
Figure 2.4 Dosage des protéines totales
(méthode de Biuret)
2.2.5.2 Dosage de la CRP par technique
d'immunoagglutination (Kit spin REACT S.A.U., Ctra. Santa Coloma, 7E-17176,
sant estere. De Bas, GL spain)
La proteine C - réactive ( CRP) , proteine
pentamérique synthétisée par le foie sous l'action des
cytikines ( essentiellement IL-6) est un marqueur de la réaction
inflammatoire connu depuis 1930. Cette proteine a la particularité de
precipiter en presence du polysaccharide (proteine C) du pneumocoque . elle
prépare la phagocytose en se fixant sur la bacterie et en activant le
complément ( opsonisation). La CRP est la proteine la plus sensible de
la phase aigue de l'inflammation , sa concenrtion augmentant tres rapidement
dans les processus inflammatoires. Son dosage est réalisé le plus
souvent par des techniques immunonéphélometrique et
immuno-turbidimétriques (Anales de Biologie clinique: 335-339).
2.2.5.2.1 Principe
Le CRP-LATEX est un test d'agglutination de basé sur
la détection quantitative et semi-quantitative de protéine
C-Reactive (CRP) dans le sérum de hamsters. Les particules de latex
couvertes d'IgG humain anti-CRP sont agglutinées quand ils sont
mélangés avec des échantillons contenant CRP (Pepys,
1981).
CRP est présent dans le sérum normal, qui
augmente significativement après la plupart des formes de blessures des
tissus, des infections bactériennes et virales, l'inflammation et
neoplasia malveillant.
La sensibilité de latex CRP est calibrée à
la référence matériel CRM470/RPPHS. Les
échantillons avec la présence de fibrine devraient être
centrifugés avant le test.
CRP Réactif CRP, Control+, Control-
Réactifs
· Particules de latex fixant des anticorps de type IgG
anti-CRP humain (pH 8,2 azide sodium 0,95 g/L).
· Contrôle positif : sérum humain, avec
concentration de CRP > 20 mg/L. Azide de sodium 0,95 g/L.
· Contrôle négatif : sérum animal,
azide sodium 0,95 g/L.
· Les latex de CEP sont calibrés a la
référence du matériel : CRM 470/RPPHS
Technique
Le dosae de la CRP est réalisé sur plasma apres
agitation sur un vortex mécanique à 80- 100 r.p.m pendant 2
minutes (Yeh ET, 2005 ).
Méthode quantitative
La sensibilité du test peut être réduite
à la température basse (Vaishnavi, 1996).
50 ìL de sérum est mis sur les cercle des la
plaque du test, une goutte (50 ìL) de réactif CRP-latex est
ajoutée sur les cercles de la plaque de test. Les gouttes sont
mélangées par une strie, en utilisant toute la surface de cercle
et en utilisant une différente strie pour chaque sérum et un
mouvement de rotation et réalisé à la plaque ; ensuite
l'agglutination est examinée pendant une période
n'excédant pas 2 minutes (Yamamoto S et al ; 1993).
2.2.5.3 Electrophorèse des protéines
sériques
C'est une méthode qui a pour but de séparer les
proteines sériques en fonction de leur charge et leur volume , sous
l'influence d'un courant électique en milieu tamponé et sur
support détérminé « l'Acetate de cellulose »
.
Les bandes réalisées dans ces conditions portent
le nom de Proteinogramme.
2.2.5.3.1 Principe
L'électrophorèse des protéines
sériques permet la séparation des protéines du
sérum en 5 fractions. La répartition de ces différentes
fractions apporte de nombreux renseignements qui aident au diagnostic dans le
cadre de syndromes inflammatoires, cirrhotiques, néphrotiques, certaines
maladies héréditaires, maladies auto-immunes, infections, cancers
et myélomes.
Les sérums obtenus à partir des animaux ont
été soumis à une électrophorèse sur
acétate cellulose (Helena et instrument, Helena Laboratories Beauront,
Texas, USA).
2.2.5.3.2 Intérêts cliniques
- Confirmer le diagnostic de l'immunité humoral en
particulier.
- Mise en évidence des Agammaglobulinémie (absence
de sécrétion des gammaglobulines) et hypo gamma
globulinémie (diminution de la sécrétion des
gammaglobulines).
- Diagnostic de l'hypogammaglobulinémie.
- Diagnostic de l'agammaglobulinémie.
- Diagnostic de gammapathie poluclonales et monoclonales.
2.2.5.3.3 Technique
A l'aide du Kit application super Z , on exécute une
application centrale de l'echantillon et on imprégne les sérums
qui seront appliqués immediatement sur la bande d'acetate de
cellulose.
- On trempe la bande d'acetate de cellulose dans la solution
tampon pendant 20 min.
- En paralléle on distribue dans les huits carités
du support du Kit application super Z , 10 ìL de sérum.
- On retire la bande et on la seche.
- On applique l'applicateur au dessus de la dusupport du Kit.
- Puis on retir doucement.
- On place la bande d'acetate de cellulose dans la chambre de
migration pendant 15 minute à 180 volts ( la bande est placée
vers le bas , de l'anode vers la cathode ) la migration se fait dans le sens -
+.
- On retire la bande apres 15 minutes.
On met par la suite la bande d'acetate de cellulose dans
:
- Un bac contenant le rouge ponceau pendant 6 min(etape de
coloration).
- Trois bains successifs d'acide acétique (5%) , 3 min
dans chaque bain ( etape de decoloration).
· On transparise la plaque dans la solution
méthanol - acide acétrique - solution
éclaircissante ,
en y mettant la bande d'acétate de cellulose pendant 5 à 10
min.
· On égoutte la bande en plaçant
verticallement dans un coin pendant 1 minute.
· On fait secher la bande dans l'etuve en prenant le soin
mettre l'acétate vers le haut pendant 10 min entre 50 °c et
60°c.
· On essuie parfaitement les deux faces de la plaque
à l'aide de papier - buvard. Cathode (-)
|
|
|
|
|
|
Gamma Beta-2 Beta-1 Aplha-2 Alpha-1 Albumin
|
|

Anode (+)
Sélénium (-) Sélénium(+)

Figure 2.6 Cliché présentant une bande
de dis protéinogrammes : Les fractions protéiques de bas vers le
haut : Albumine, á1, á2, â1, â2,
ã.
Dans le cas ou la bande est claire et nette , elle laisse
apparaitre les differentes fractions qui ont migrées.
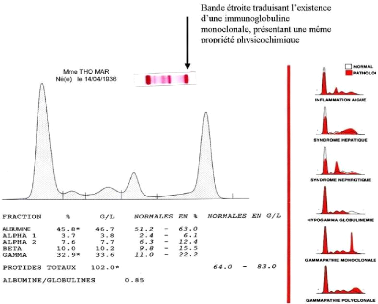
L'intégration des piques a été
réalisée à l'aide du logiciel phoresis (Phoresis rel,
7.4.1, sebia, Parc technologique Leonard de Vinci CP 8010 Lisses, Every,
France).
Chaque pique électrphoretique a été
exprimé en pourcentage et en g/L de proteines totales
présentés dans le sérum.
2.2.5.3.4 Analyses statistiques
Le logiciel SPSS16.0 a été utilisé pour
toutes les analyses statistiques. Les données ont été
présentées sous forme de valeurs #177; erreur standard de la
moyenne. Les moyennes sont comparées à l'aide du test-t de
student et mann-withney. La valeur de p<0.05 a été
considérée statistiquement significative et celle de p<0.01
hautement significative.
|
Anneau de
|
|
|
|
|
précipitation du complexe antigène/anticorps
|
2.2.5.4 Dosage des anticorps IgG, IgM, IgA
Le dosage des anticorps a été
réalisé à l'aide de la téchnique d'immunodiffusion
radiale (IDR) par Mancini et al et ont décrit la relation
existante entre la concentration des antigènes et le diamètre des
anneaux immunoprecipitine formés dans le système gel - anticorps
(Mancini et and Heremans ,1965).
Les sérums a analyser ont étaient
déposés dans des puits creusés dans une couche de gel
d'agarose contenant un antisérum spécifique (IgM, IgA, IgG)
(Cypress diagnostics, Longdorp Belgium).
Au fur et à mesure de la diffusion des protéines
sériques dans le gel, un précipité circulaire de forme
entre les anticorps du sérum et les anticorps anti IgG, IgM ou anti IgA
de l'antisérum.
La surface du cercle délimité par le
précipité est proportionnelle à la concentration en
anticorps tésté.
Dans des boites en plastique de 8.5 cm de diamètre sont
coulés 15 ml de gel d'agarose (Agarose Powder, Bio.RAD Laboratories,
Minimum Gelation, concentration 0.35%, catalog NO 1620100 32nd & GRIFFIN,
RICHROND CALIF) à 1.6% en tampon PBS additionné de 120 ìL
de noir d'amido (afin de poursuivre le processus de diffusion) (Na Cl/ KH2PO4/
NaHPO4 ; 12 H2O/ KCL, PH = 7.2) et contenant une quantité de 2ul/ml
d'antiserum.
Des puits de diamètres de 2 mm sont pratiqués
à l'aide d'une seringue, chaque boite contient 8 puits.
Dans chaque puits est déposé 8 ìL de
sérum à l'aide d'une micropipette (Accumax PRO, 608062 CE).
Des gammes de référence ont été
constitué par des solutions standards d'IgG, IgM et d'IgA de
concentration connue ( IgG ;320mg/dl ;1220mg/dl ;2500 mg/dl, IgM ;30 mg/dl ;130
mg/dl ;280 mg/dl, IgA ;48 mg/dl ;216 mg/dl ;432mg/dl),(Guide KALLESTAD
TM ENDOPLATE TM ;SINGLE RADIAL IMMUNODIFFUSION,SANOFI
DIAGNOSTICS PASTEUR).
Pour le control de qualité un échantillon de
control dans chaque dosage a été conclu (Cypress agnostics,
Longdorp, Belgium).
Les boites sont menies de leur couvercles et incubées
à température ambiante sur une surface plane horizontale dans une
chambre humide. Apres un temps de diffusion au point final (IgG ; = 48h, IgM ;
= 72h, IgA ; = 48h) les diamètres des anneaux d'immunoprécipitine
au 0.1mm au pré ont été mesurés.
La concentration du control et des échantillons
à tester a été déterminée en localisant le
carré du diamètre (en mm2) de l'anneau de chaque
échantillon sur une courbe de référence ajustée en
mieux, tracée à partir de la concentration de chaque sérum
standard sur l'axe des ordonnés en fonction du carré du
diamètre du précipitine sur l'axe des apsis.
Afin de visualiser les anneaux de précipitation, 15 ml de
noir d'amido a été coulé sur le gel et incubé
à température ambiante pendant 10 minutes.
2.2.5.5 Isolement des lymphocytes spléniques et
numération cellulaire
Les animaux ont été splénectomisé
après sacrifice par dislocation cervicale et leur rate a
été collectée dans des conditions d'asepsie (Bishayi B,
2006).
Chaque rate prélevé a été
débarrassé de la graisse, poiles, tissus et sangs
périphérique puis pesée et broyée dans une solution
saline de 0.6% et centrifugée à 3000tours/min pendant
5minutes.
1ml d'eau distillé a était ajouter aux culots
cellulaires afin de provoquer un choc hypnotique, vortexer 10 a 20 secondes,
puis ces culots sont repris dans la solution saline de 0.9% pour arrêter
l'action hypnotique de l'eau.
Une deuxième centrifugation a été
réalisée dans les mêmes conditions, puis 0.5ml d'eau
distillé et 500 ìL de bleu de Trypon ont été
additionné aux culots cellulaires (Bleu Trypon dye exclusion technique)
afin de procéder à la numération lymphocytaire et la
détermination du nombre de cellules non viables (colorées en
bleu) et les cellules viables (non colorées) sur des cellules de
Malassez. (Obj X 40, Malassez DEPTH, TIEFE). (Bishayi B, 2006).
Chapitre 3. Résultats et
interprétation
Les résultats sont présentés aux tableaux
1-3 et figures 1 et 2
Tableau 1. Niveaux des protéines sériques
chez les Hamsters infectés par SARM supplémentés ou non en
Sélénium.
|
Variable
|
Hamsters non
supplémentés en
Sélénium
|
Hamsters supplémentés
en
Sélénium
|
p
|
|
PT (g/L)
|
45,31 #177; 2,98
|
44,59 #177; 13,88
|
0,960
|
|
Albumine (%)
|
44,7 #177; 0,91
|
49,92 #177; 1,23
|
0,009
|
|
Alpha-1 (%)
|
10,66 #177; 0,63
|
11,18 #177; 1,14
|
0,701
|
|
Alpha-2 (%)
|
12,56 #177; 0,74
|
11,64 #177; 0,58
|
0,356
|
|
Bêta (%)
|
22,58 #177; 0,88
|
19 #177; 0,73
|
0,014
|
|
Gamma (%)
|
9,52 #177; 0,68
|
8,25 #177; 0,65
|
0,212
|
|
GT (%)
|
55,3 #177; 0,21
|
50,07 #177; 1,4
|
0,006
|
|
A/G
|
0,81 #177; 0,01
|
1 #177; 0,05
|
0,008
|
Les variables sont présentées sous forme de
moyenne #177; erreur standard. PT : protéines totales. GT : globulines
totales. A/G : rapport albumine/globulines.
Le tableau 1 montre que les taux sériques des
protéines totales, des alpha-1, des alpha-2 et des gamma globulines sont
similaires chez les Hamsters infectés par SARM,
supplémentés en sélénium (Se+) et chez les non
supplémentés en sélénium (Se-) (p >
0,05). Cependant, les concentrations sériques en albumine et le rapport
albumine/globulines sont significativement diminués chez les Hamsters
Se- comparés aux Hamsters Se+ (p < 0,01).
A l'inverse, les concentrations des beta globulines et des
globulines totales sont significativement élevées chez les
Hamsters Se- par rapport aux Hamsters Se+.
Tableau 2. Marqueurs humoraux chez les Hamsters
infectés par SARM supplémentés ou non en
Sélénium.
|
Variable
|
Hamsters non
supplémentés en
Sélénium
|
Hamsters supplémentés
en
Sélénium
|
p
|
|
IgA (D2)
|
134,8 #177; 5,63
|
77,6 #177; 3,4
|
0,000
|
|
IgM (D2)
|
231,2 #177; 6,2
|
191#177; 10,43
|
0,011
|
|
IgG (D2)
|
117,6 #177; 10,18
|
114,2 #177; 13,32
|
0,844
|
|
CRP (mg/L)
|
72 #177; 15,18
|
2,4 #177; 1,47
|
0,002
|
Les variables sont présentées sous forme de
moyenne #177; erreur standard. Ig : Immunoglobuline de classe A (IgA), de
classe M (IgM) ou de classe G (IgG). D2 : diamqtre au carré
d'anneau de précipitation du complexe antigène/anticorps
exprimé en mm2. CRP : C-reactive protein.
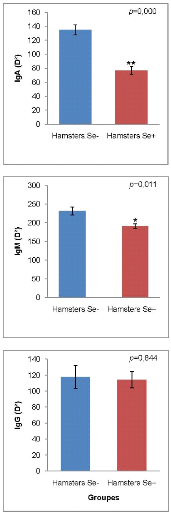
Figure 1. Taux circulants des anticorps chez les
Hamsters infectés par SARM supplémentés ou non en
Sélénium. SARM : Staphylococcus aureus
résistant à la méthicilline, Hamsters Se- : Hamsters
non supplémentés en Sélénium, Hamsters Se+ :
Hamsters supplémentés en sélénium.
Comme indiqué au tableau 2 et à la figure 1, les
taux circulants des anticorps IgA et IgM sont significativement
élevés chez les Hamsters Se- comparés aux Hamsters Se+
(respectivement, p = 0,000, p = 0,011). De même, les
concentrations sériques en CRP sont nettement plus élevées
chez les Hamsters Se- comparés aux Hamsters Se+ (p = 0,002).
Toutefois, les taux des IgG restent similaires dans les deux groupes
(p = 0,844).
Tableau 3. Lymphocytes spléniques chez les
Hamsters infectés par SARM supplémentés ou non en
Sélénium.
|
Variable
|
Hamsters non
supplémentés
en
Sélénium
|
Hamsters
supplémentés
en
Sélénium
|
p
|
|
Lymphocytes (x 105 Cell/mL)
|
177 #177; 4,16
|
198,2 #177; 5,51
|
0,015
|
|
Lymphocytes vivants (x 105
Cell/mL)
|
142,71 #177; 2,73
|
149,89 #177; 2,64
|
0,095
|
|
Lymphocytes apoptotiques (x 105
Cell/mL)
|
34,25 #177; 2,56
|
48,31#177; 3,19
|
0,009
|
Les variables sont présentées sous forme de
moyenne #177; erreur standard.
D'après le tableau 3, les taux spléniques des
lymphocytes totaux et des lymphocytes apoptotiques sont significativement
diminués chez les Hamsters Se- comparés aux Hamsters Se+
(respectivement, p = 0,015, p = 0,009). Il en est de
même pour les lymphocytes vivants, mais la différence n'est pas
statistiquement significative (p > 0,05).
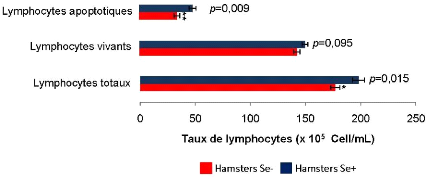
Figure 2. Taux des lymphocytes spléniques chez
les Hamsters infectés par SARM supplémentés ou non en
Sélénium.. SARM : Staphylococcus aureus
résistant à la méthicilline, Hamsters Se- : Hamsters non
supplémentés en Sélénium, Hamsters Se+ : Hamsters
supplémentés en sélénium
Chapitre 4. Discussion
Les infections à Staphylococcus aureus
résistant à la méthicilline (SARM) sont très
polymorphes allant d'infections cutanées bénignes comme les
furoncles et les panaris à des infections mettant en jeu le pronostic
vital comme les états de choc, les endocardites, les pneumonies, les
infections du système nerveux central (Batard et al ; 2007).
Ces infections sont en augmentation régulière et
posent des problèmes thérapeutiques vu l'émergence des
souches multirésistantes. Certaines ont pour origine l'hôpital
(infections nosocomiales IN), d'autres apparaissent d'origine communautaire.
Ces dernières ont acquis des propriétés leur
conférant un potentiel épidémique. Les approches
moléculaires ont été largement utilisées pour
l'étude épidémiologique des SARM (Nour et al ;
2004).
Au cours de ces dernières années, les
bénéfices du sélénium ont été
reconnus par les chercheurs dans le traitement de ces infections et il
manifeste à certaines doses une activité antitumorale qui lui
confére des propriétés preventives du cancer (SCHRAUZER
,1989 ; KOLLER et al ; 1986 ; AZIZ et al 1984) comme le
cancer du sein, du poumon, du foie, urogénital, colorectal, de la
prostate et des ovaires (Micronutrient supplementation and immune function
in the elderly, Clinical Infectious Disease. 1999).
De nos jours, on sait que le sélénium est vital
pour la santé humaine et animale (Xu et al ; 1985).
En outre, dans le domaine de la nutrition, le
sélénium est considéré comme l'étoile
montante qui procure une protection contre une gamme étendue de maladies
et autres problèmes de santé (Xu et al ; 1985).
C'est un oligo-élément dont la carence est
responsable de nombreux troubles pathologiques. A l'opposé, son
excès peut entraîner une toxicité parfois mortelle,
liée à sa capacité à bloquer les processus
d'oxydoréduction cellulaire (Xu et al ; 1985).
Au début des années 70, les scientifiques ont
découvert que le sélénium joue un rôle clé
dans la protection des membranes des cellules humaines contre les
dégâts de la péroxydation, du fait de son inclusion dans le
glutathion peroxydase, une enzyme antioxydante naturelle (Micronutrient
supplementation and immune function in the elderly, Clinical Infectious
Disease. 1999).
Le sélénium est indispensable pour
l'activité de l'enzyme glutathion peroxydase, une substance clé
contre le stress oxydatif qui compte dans sa fonction antioxydante et sa
contribution importante à la prévention des fléaux du
21ème siècle, cancer et maladies cardiovasculaires (TOIVANEN
,1987).
Dans le domaine cardiovasculaire, le taux de
sélénium sanguin est considéré comme un facteur
essentiel pouvant affecter l'évolution des cardiomyopathies, de
l'athérosclérose et de l'insuffisance cardiaque. A juste titre,
les concentrations en sélénium ont été
corrélées au risque d'infarctus du myocarde (IDM) et peuvent
influencer l'agrégation plaquettaire, facteur de risque
cardiovasculaire. Par ailleurs, la sévérité de
l'insuffisance cardiaque a été étroitement
corrélée au statut en sélénium (Le
Sélénium diminue le risque de maladies cardio-vasculaires. Il
participe à la modulation de l'agrégation plaquettaire) [TOIVANEN
,1987].
Il est important de rappeler qu'une infection à SARM
s'accompagne de réactions inflammatoires qui est un processus de
défense naturelle, très utile à l'élimination de
l'agent pathogène (Wisplinghoff, 2001) , cette réaction est
strictement contrôlée par de nombreuses protéines de
l'inflammation (Rebouissou et a!, 2009).
Elle est classiquement définie par l'augmentation de la
vitesse de sédimentation (VS) et par l'élévation des
protéines de l'inflammation dont les principales sont les á1 et
surtout les á2 globulines, traduction
éléctrophorétique de la synthèse par le foie de
protéines de l'inflammation (Rousset et a! ; 1999).
La C reactive protein (CRP) est un marqueur de la
réaction inflammatoire synthétisée par le foie en
réponse rapide à la sécretion par les lymphocytes et les
macrophages de l'interleukine 6 sous l'action des cytokines. Sa
détermination permet une baisse de l'albumine et son diagnostic ainsi
que celui de la réponse à médiation humorale a eté
confirmé par le dosage des anticorps par la technique d'immunodiffusion
radiale (Saranac Lake et a! .2009).
Le syndrome inflammatoire est un facteur déclenchant et
régulateur de la réaction immunitaire adaptative (Weil et
al, 2003).
Ce qui ressort clairement de la littérature, c'est que
le statut de base en sélénium, la dose, la voie et le temps
d'administration, le type de supplémentation, l'âge de l'animal,
le choix des antigènes utilisés pour stimuler le système
immunitaire peuvent affecter la réponse immune (Swecker, 2001).
La déficience en sélénium est liée
à un dysfonctionnement du système immunitaire, une
résistance défectueuse aux infections microbiennes et virales,
une phagocytose et une production d'anticorps inadéquate,
cytodestruction des cellules tueuses naturelles (natural killer cells) la
baisse des CD4 (I Birlouez et a! ; 2001).
Il favorise la prolifération des lymphocytes T
Cytotoxiques (CTL). Les CTL assurent en effet, la «réponse
cellulaire» de l'immunité. Elles ont pour mission de
reconnaître les cellules infectées par un agent pathogène
et de les détruire. La destruction des cellules infectées
empêche l'agent pathogène de se propager et de se reproduire et
permet ainsi d'enrayer l'infection (Z Ernahrungswissenschaft,
1998).
De plus, les cellules T activées régulées
par l'intermédiaire de ses molécules de surface (CD4 et CD25)
montrent une activité de régulation de la synthétase
sélénophosphate, dirigée vers la synthèse de la
sélénocystéine, l'élément essentiel de base
de la sélénoprotéine, soulignant son importance pour
l'activation de la fonction du lymphocyte T et pour le contrôle de la
réponse immunitaire (Constans J et a! ; 1998).
Il est impliqué dans la régulation du
système immunitaire à tous les niveaux ;
immunité humorale, la résistance aux organismes
pathogènes extra-cellulaires est directement influencée par la
consommation de sélénium et immunité cellulaire, Le
déficit en sélénium modifie la capacité des
lymphocytes T et B à répondre aux mitogènes et à
produire des lymphokines (Z Ernahrungswissenschaft, 1998).
Une grande attention a récemment été
concentrée sur le rôle du sélénium dans la
protection des leucocytes et les macrophages pendant la phagocytose,
précisément le mécanisme où des mammifères
tuent immunologiquement l'envahissement des bactéries. L'ensemble
protège les cellules phagocytaires et les tissus environnants de
l'attaque oxydative contre les radicaux libres produits par l'explosion
respiratoire des neutrophiles et des macrophages pendant la phagocytose
(Baboir, 1984 ; Boulanger et Cohen, 1983) ; (Baboir, 1984 ; Boulanger et Cohen,
1983).
D'après nos resultats, on remarque que le nombre des
lymphocytes morts chez les SARM positif suplementés en selenium est plus
elévé par rapport au non supplementés et les taux
circulants des anticorps IgA et IgM sont élevés chez les Hamsters
Se- comparés aux Hamsters Se+. De même, les concentrations
sériques en CRP sont nettement plus élevées chez les
Hamsters Se- comparés aux Hamsters Se+ ce qui impliqe l'effet du
sélenium sur la réponse humorale dans la proliferation
lymphocytaire (Anthony et a! ; 2009).
L'activation des lymphocytes conduit le plus souvent à
leur prolifération, une activation inadéquate peut
entraîner leur mort par un mécanisme de suicide actif nomé
apoptose qui joue un rôle essentiel dans les processus du
développement et de maturation, rétablissement et
régulation du système immunitaire (Conley et Delacroix ,1987).
L'apoptose des lymphocytes est un mécanisme de controle
extrêmement important essentiel au maintien de l'homéostasie
immunitaire chez les individus en bonne santé (Porhan et a! ;
2003).
Comme nous avons vu précédemment, les cellules
de l'immunité assurant la destruction des bactéries par
phagocytose (macrophages et neutrophiles), sont particulièrement
exposées aux composés oxygénés. On comprend alors
l'importance du sélénium dans la protection de ces cellules, et
donc dans l'immunité (Moselio shaechter et Gerald Medoff ; 1999).
Chapitre 5. Conclusion et perspectives
Staphylococcus aureus résistant à la
méthicilline (SARM), est une cause importante d'infections chez les
patients immunodéprimés.
L'étude que nous avions entreprise a montré que
la supplémentation en sélénium, a des effets
immunostimulants fort importants, aboutissant à un renforcement du
système immunitaire.
Le sélénium pourrait avoir un grand rôle
à jouer dans la régulation de la réponse immune
innée et adaptative au cours de l'infection à SARM.
Chapitre 6. Bibliographie
A
Abudu L, Blair I, Fraise A, Cheng KK.
Methicillin-resistant Staphylococcus aureus (MRSA): a community-based
prevalence survey. Epidemiol Infect. 2001;126:351-6.
Alborzi A, BA Pourabbas, H Salehi, Pourabbas BH, B Oboodi, MR
Panjehshahin. Prévalence et les tendances de la sensibilité aux
antibiotiques de Staphylococcus sensibles et Staphylococcus aureus
résistant à Shiraz-Iran. Irn J Med Sci. 2000; 25:1-8.
Albers R, Bol M, Bleumink R, Willems A, Blonk C, Pieters R.
Effects of dietary lipids on immune function in a murine sensitisation model.
Br J Nutr . 2002;88: 291
Albers R, de Heer C, Bol M, Bleumink R, Seinen W, Pieters R.
Selective immunomodulation by the autoimmunity-inducing xenobiotics
streptozotocin and HgCl2. Eur J Immunol. 1998;28:1233.
Amaranie-Mendes G.P,Finucane D.M,Colter R.G,green D.R.
Antiapoptotic oncogene prevent caspase-dependent and independen commitment for
cell death .Diff.1998; 298:306
Anales de Biologie clinique . 2001 ; vol 64 , Numero 4 :
335-339
Ann Dermatol Venereol, 2005;132:8S89-104
ANDREU DE LAPIERRE E. Dictionnaire de pratique de médecine
des Nouveaux. Animaux de Compagnie ; Edition Med'com, Paris. 2001 :157.
Anupurba S, M.Sen, G. Nath, BM Sharma, Gulati AK, TM
Mohapatra. Prévalence du Staphylococcus aureus résistant
à la méthicilline dans un hôpital de soins tertiaires dans
l'Est de l'Uttar Pradesh. Indiens J Med .2003 Microbiol; 21:49-51
AUBRY-DAMON H et SOUSSY C. J , Staphylococcus aureus
résistant à la méticilline : facteurs responsables de
l'endémie. La Revue de médecine interne : (Paris). 2000; vol. 21,
no 4 : 344 - 352.
Avanzi. M De Vecchi. Les hamsters. 2002
B
Baboir B.M. The respiratory burst of phagocytes J.clin.Invest
.1984;73:599.
Bayne.R, Arthur J.F. Alterations of Neutrophil function in
selenium deficient cattle.J.Comp.Pathol.1979; 89:151-58.
BEAUVIEUX Marie-Christine, GIN H, PEUCHANT Evelyne. Le stress
oxydant et ses marqueurs biologiques nutrition et de diététique.
2002; vol. 37, no 1:45 - 51.
Bella Wafaa : Candidoses chroniques de la cavité buccale,
Aspect microbiologique.2009 : 21-22 .
Bekkhoucha .SN ,Cady.A ,Gautier P ,Itim F ,Donnio PY . A
prtrait of Staphylococcus aureus from the other side of the Mediterranean Sea
:molecular characteristics of isolates from Western Algeria Eur JClin Microbiol
Infect Dis Doi 10. 2008;1007//s 10096-008-0660-x
Bert Frederic. Facteurs de risque et traitement des infections
à staphylococcus aureus methiciline-resistant. 2002 ; vol 31 ; No 38 :
1792-96 .
Berger MM, Chioléro RL. Key vitamins and trace elements in
the critically ill. In: Cynober L, Moore F, eds. Nutrition and Critical Care.
2003; Vol. 8. Basel: Karger: 99-118.
Biomereux.API Staph,REF 20 500,074681.2006
Bishayi B, Sengupta M. international immunopharmacology 2006.
Bronson R, Birt D, Meydani SN. Biomarkers as early predictors of
long-term health status and human immune function. Nutr Rev. 1999; 57:S7.
BRUN.BUISSON C. infections nosocomiales à staphylocoque
doré resistant à la meticilline (SARM) :
épidémiologie et prévention .2000 ; vol 9.
Buckley RH. Primary immunodeficiency diseases due to defects in
lymphocytes. N Engl J Med .2000 ; 343 : 1313-24
C
Cavendish. Le hamster, collection Marshall. 1994
Chandra RK. Nutrition and the immune system: an introduction. Am
J Clin Nutr .1997;66:460.
Chetana Vaishnavi.Immunology and Infectious Diseases .1996;
6:139-144.
Cipriano J.E, Morrill J.L, Anderson N.V. Effect of dietary
vitamin E on the immune. Responses of calves. Journal of Dairy Science. 2001;
65: 2357-2365.
Clark LC, Combs GF, Turnbull BW, Slate EH, Chalker DK, Chow J,
et al. Effects of selenium supplementation for cancer prevention in patients
with carcinoma of the skin - A randomized controlled trial. JAMA .1999;
276:1957-63.
CLSI. Clinical and Laboratory Standards Institute.2008
Cohan H.J. Altered oxidative metabolism in selenium.Deficient rat
granulocytes J.Immunol.1983;130:2856.
Conley M, Delacroix D. Intra-vascular and mucosal immunoglobulin
A: two separate but related systems of immune defense? Ann Intern Med
.1987; 106: 892-9.
Constans J, et al. Thromb Haemost. 1998; 80:1015-1017
D
Denis F,Cécile P,Martin C,Bingen E,Quentin
R.Bactériologie Medicale technique usuelle.Masson.2007 :254-60
Droke E.A, Loerch S.C. Effects of parenteral selenium and
vitamin E on performance, health and humoral response of steers new to the feed
lot environment. Journal of Animal Science. 1998; 67: 1350 - 59.
Drugeon Henri B. La colonisation par SARM : Un effet secondaire
de l'utilisation des antibiotiques, Source : M/S. Médecine. Science.
2008 ; vol. 24 ; no HS3 : 18 - 23.
Dr. John E. Dillberger, P.O. Box 2118, Nashville, IN 47448-2118
(812) 988-6175
E
Eveillard M , Schlir, J-L , Biendo M, Canarelli B , Daoudi,
FLaurans G , Rousseau F , Thomas, D . Evaluation de l'efficacité d'une
politique de lutte contre les bacteries multiresistantes dans un centre
hospitalier universitaire par l'etude de l'evolution de l'incidence de
Staphylococcus aureus résistant à la méthicilline
Pthologie Biologie. 2002 ;50 :538-43
Eveillard M ,Lassence Ab ,Branger C , Lancien E , Barnaut Ga ,
Joly Guillouna. Retenir un delai de 48 h entre l'admission des patients et le
premier prélevement positif est-il suffisant pur differencier les
souches acquises à l'hopital et importées de Staphylococcus
aureus résistant à la methicilline ?. Pathologie Biologie.
2007; 55:343-46
F
Faseb Journal. 2001, vol. 15:1777-1779
Finch J.M,Turner RJ. Effet of selenium and vitamine E on immune
responses of domestic animals.Res.Vet.Sci. 1996; 60: 97-106.
Flack C.P , Woollen J.W. Clin Chem . 1984; 559 :1984.
Forestier E, Rémy V ,Mohsen , Zadeha M , Lesens O ,
Jaulhac B, Christmann D. Staphylococcus aureus resisitant à la
méthicilline, aspects épidémiologiques et
thérapeutiques récents.Rev Med Interne. 2006;11:014
Forestier E , Rémy V , Mohsen, Zadeha M , Lesens O ,
Jaulhac B, Christmann D; Hansmanna Y. La Revue de medicine interne.2007 ; 28
:746 -55
G
George Ncohmen. Apoptose en pathologie humaine ; 112:113-14
G.J moran , J MOUNT . Staphylococcus aureus resistant to
vancomycin : united States annas of emmergency medecine . 2003; 2
Goodwin J.F et al. Automation in Anal. Chem, Technicon
Syumpolsia.1965: 315-320.
Graffunder EM, Venezia RA . Risk factors associated with
nosocomial methicillin-resistant Staphylococcus aureus (MRSA) infection
including previous une of antimicrobials.J Antimicrob Chemother.2002 ;
49:999-1005
Grohs P. Evolution de la sensibilité de
Staphylococcus aureus aux Antibiotiques : la methicilline est -elle
encore un marqueur de multiresistance ?, Pathologie Biologie.2008 ;05 :10
Grundmann H, Buenos-de-Sousa M, Boyce J, et al.
L'émergence et la résurgence du Staphylococcus aureus
résistant à la méthicilline comme une menace de
santé publique. Lancet .2006; 368:874-85.
Grundmann H, Tami A, Hori S, Halwani M, Slack R.
Nottingham Staphylococcus aureus population study: prevalence of MRSA
among elderly people in the community. BMJ. 2002;324:1365-6
H
Hart, Tony, Shears, Paul . Atlas de poche de microbiologie.
Medecine - sciences, Flammarion.1999 ; 226
Honeyman, Allen L, Friedman, Herman, Mauro. Staphylococcus
aureus infections and Disease. Kluwer Academic Publishers .2002 :143-44
I
I Birlouez, M.J Cals, G. Covi, A. Dauvergne, H. Faure, V.
Fayol, C. Galabert, J. L, Guéant, J.C Guilland, B. Herbeth, S. Hercberg,
A. Jardel, C. Jeandel, C. Léger, G. Le Moël, A. Lemoine, D.
Rousselot, P. Thérond, M. Vidailhet, Inserm U. Annales de Biologie
Clinique.2001 ; Volume 59, Numéro 2 :198-209.
Infections nosocomiales et hygiène hospitalière :
aspects actuels .1998 ; Vol 2, Numéro 4.
J
Jacquot S. CD27/CD70. interactions regulate T dependent B cell
differentiation. Immunol Res . 2000 ; 21 : 23-30.
Journal of clinical microbiology .2002, vol 40, no 8: 2766 -71
J. P Revillard . Réponse immunitaire : Impact Internat
Hématologie-Immunologie .1996, 5 : 303-15.
K
Kesah C , Ben Redjeb S ,Odugbemi TO , Boye CS ,Dosso M ,
Ndinya Achola JO , KoullaShiro S , Benbachir M , Rahal K and M Borg. Prevalence
of methicillin-resistant Staphylococcus aureus in eibht Africain
hospitals and Malta.clin.Microbial.Infect.2003; 9:153- 56
Klevens et al. Invasive Methicillin Resistant Staphylococcus
aureus Infections in United States.2007; 298 : 15.
KMale et Yvan Roitt. Immunologie. 2001: 390
L
Lanarkshire Board NHSL Infection Control and Health Protection
.2008.
Lanark Shire , NHS Board . 2008
Lars - Olof Hanson et al. Current Opinion in infectious diseases
.1997; 10: 196-201
Lawler T.L, Talor J.B, Finley J.W, Caton J.S. Effect of
supranutritional and organically bound selenium on performance, carcass
characteristics, and selenium distribution in finishing beef steers. Journal of
Animal Science. 2004; 82:1488-93.
Le Carrer D. Profils éléctrophoretiques ou
profils protéiques ?, intérêt respectifs et limites
d'utilisation ; 1ère partie : les profils électrophoretiques.
Revue française des laboratoires. 1995 ; N°279.
Leclercq R. Le diagnostic rapide des mécanismes de
résistance aux antibiotiques. 2004; 6:180-84
Les effets du sélénium sur la santé,
Geneviève Côté, dmv, M.Sc , Expertise
vétérinaire en santé des bouvillons d'abattage ,
Fédération des producteurs de bovins du Québec.2005 ;4
:5
Levander, O.A. Selenium: biochemical actions, interactions,
and some human health implications. Dans: Clinical, biochemical, and
nutritional aspects of trace elements. A.S. Prasad (dir. de publ.). Alan R.
Liss, New York, NY.1982 : 345
Lim T.S, Putt N, Safranski D ,Chung C, Watson R.R. Effect of
vitamine E on cell-mediated immune response and serum corticosteron in young
and maturing mice.Immunology .1981 ;44: 289-95.
Louis AuquierGuy De Thé David Challoner. Confronting
infections, antibiotic resistance and biotetorism around the world. Elsevier :
212.
Lowy FD. Staphylococcus aureus
infections. N Engl J Med. 1998;339:520-32 Lucet,J. Les
mesures d'isolement en reanimation:Pour . Réan Urg.2000 ;9 :70-4
M
Mancini .Carbonara A.O et Heremans J.F. immunochemical
quantitation of antigens by single radial immunodiffusion.
Immmunochemistry.1965 ; vol 2 : 235 - 54.
M. Aribi .Magister biologie de la cellule Normale et
Pathologique. Université Djilali Bel abés de Sidi Bel
Abbés, Electrophores de zone des protéines sériques sur
acétate de cellulose : méthode densimétrique (HELENA)
.2007
Mansouri S, M Khaleghi. Profil de résistance
antibactérienne et la fréquence des Staphylococcus
aureus résistant à la méthicilline. Irn J
Med .1997; 22:93.
Maziade P.J. Réduction des infections au SARM par un
projet systématique de lavage des mains des patients du Centre
Hospitalier Pierre Le Gardeur. Mesures de Performances en Santé
2ème édition ;2006 :19-20.
Mc Dowell L.R. Vitamins in Animal Nutrition. Comparative Aspects
to Human Nutrition. Academic Press.1989 ; 93-131.
Mesures de prévention et de contrôle des infections
à staphylococcus aureus résistant à la
methicilline, 2006, vol 12, numéro 5 ISSN 2-893-42-027-7).
Micronutrient supplementation and immune function in the
elderly, Clinical Infectious Disease.1999; 28/4 : 717-722
M.M Pepys. The Lancet .1981; 21:653-56
Morbidity and Mortality Weekly Report ,1991 ;40 (22) : 358-359
Moselio shaechter,Gerald Medoff.Microbiologie et pathologies
infectieuses.1999 :128
Muller A , M Thouverez ,Talon D, BertrandX. Contribution de la
pression de sélection antibiotique dans l'acquisition de
staphylococcus aureus resistant à la méthicilline (SARM)
dans un centre hospitalier universitaire . Pathologie Biologie .2003 ; 51
:454-59 Mylotte JM, McDermott C, Spooner JA. Prospective study of 114
consecutive episodes of Staphylococcus aureus bacteremia. Rev
Infect Dis .1987; 9: 891-907
N
Nadjia Ramdani-Bouguessa , Michéle Bes , Helene
Meugnier , Françoise Forey , Marie-Elisabeth Reverdy , Gerard lina ,
François Vandenesch , Mouhamed Tazir and Jerome Etieme, Detection of
methicilin resistant staphylococcus aureus strains resistant to multiple
anibiotics and carrying the Panton - valentine leukocidin genes in an Algiers
hospital, service de microbologie , centre hospitallo-universitaire Mustapha
Pascha 16000 Algiers - Algeria and centre national de reference des
staphylocoques FNSERME 0230 , IFR 62 , faculté de medicine Lanne c,69008
Lyon . 2002
NEVE J. Les oligo-éléments en nutrition et en
thérapeutique de P. Chappuis et A. Favier. 1995 :189 - 231.
Nockels C.F. Antioxidants inproved Cattle immunity Following
stress.Anim.Feed Sci.Techol.1996;62:59-68.
Nosocomial Transmission of Methicillin-Resistant
Staphylococcus aureus : Possible Role of Environmental Contamination.
Med Microbiol Lett .1995 ; 4 : 189-190.
Nour Mohamed , MASTOURI Maha , BEN NEJMA Mouna . Le
staphylocoque doré résistant à la méticilline :
émergence et bases moléculaires de la résistance
Pathologie et biologie : (Paris). 2005 ; vol. 53 , no 6 : 334 - 40 .
Nutrition clinique et métabolisme.1999 ; vol 13, issue 3
:177-86
P
Pathologie Biologie .2006 ; Volume 54, Issues 8-9 : 506-09
Peter Porhan, Pierre L. Le système immunitaire. 2003
Pierre Payment, Michel Trudel. Manuel de techniques virologiques.
Univ de Québec.1989.
Prévalence du Staphylococcus aureus
résistant à la méthicilline dans huit hôpitaux
africains et à Malte. Clin Infect Microbiol. 2003 ,9
(2) :153-6.
Q
Queen's Printer and Controller of HMSO. 2008; 2:3
R
Ramdani-Bouguessa N, Bes M, Meugnier H, et al. La
détection de souches résistant à la méthicilline
Staphylococcus aureus résistantes à plusieurs
antibiotiques et l'exercice de Panton-Valentine leucocidine de gènes
dans un hôpital d'Alger. Antimicrob Agents Chemother . 2006; 50:
1083-5.
Reddy P.G , Morrill J.L, Minocha H.C. Vitamine E is
immunostimulatory in calves.J.Dairy Sci.1987,70: 993-99.
Ré D.B, Nafia I, Nieoullon A, Kerkerian Le Goff L,
Had-Aissouni L. Stress oxydatif cérébral. Annales
Françaises d'Anesthésie et de Réanimation. 2005; 24:
502-9
Reimund Jean-Marie.Stress oxydant au cours des syndromes
inflammatoires chroniques Nutrition clinique et métabolisme .2002 ; vol
16 , no 4 : 275 - 284.
Remdani-Bougessa,N ; Bensafar, N, Denine, R. Susceptibilities
of Staphylococcus aureus,Staphylococcus coagulase negative and Enterococcus
sp.isolated from an Algerian hospital , abstr. 11th European
Congress of Clinical Microbiology and infectious Diseases. 2001: 547.
Revue Francophone des laboratoires.2008; vol 38, N° 407 :
81-90
Revillard , Réponse immunitaire ,1996, 5 : 303-15
Rotruck J.T, Pope A.L, Ganther H.E, Swanson D.G, Hafe man.D.G,
Hoexstra W.G . Selenium, biochemical role as a componemt of glutathione
peroxidase.Science.1973; 179:588-90.
Rubin RJ, Harrington CA, Poon A, Dietrich K, Green JA,
Moiduddin A. The economic impact of Staphylococcus aureus infection in New York
City hospitals. Emerg Infect Dis .1999; 5: 9- 17.
S
Saranac Lake, NY. Le système immunitaire et
vaccins . Biologie / Biochimie, University of Rochester, Rochester
NY, David P. Harris.Trudeau Institue.2009.
SCHRAUZER G.N. Selenium in Medecine and Biology, NEVE. FAVIER A.
Eds W. DE GRUYTER, Berlin-New-York.1989 ; 251.
Selenium and immune function: the biological basis of
altereted resistance to infection, American Journal of Clinical Nutrition.1998;
68 (2 Suppl): 447S-63S.
Selenium deficiency: changes in cytokine production and
T-cell subpopulations in patients with head and neck cancer and in non cancer
subjects, Proc. Assoc. Ame. Physicians. 1997; 109 (1):68-77
Serfass R.E.,Ganther H.E .Detective microbicidal activity in
glutathione peroxydase-deficient neurophils of selenium-deficient
rats.Nature.1975; 255: 640-41.
Silverman JA, Perlmutter NG, Shapiro HM. Correlation of
daptomycin bactericidal activity and membrane depolarization in
Staphylococcus aureus. Antimicrob Agents Chemother.
2003;47:2538-44.
Smith P A, Prieskorn D M, Knutsen C A, Ensminger W D . A Method
for Frequent Blood Sampling in Rabbits. Laboratory Animal Science .2000;38(5):
623-25.
Spears J. Micronutrients and immune function in cattle.
Proceedings of the Nutrition Society. 2000 ;59: 587-94.
Strausbaugh LJ, Jacobson C, Sewell DL, Potter S, Ward TT.
Methicillin-resistant Staphylococcus aureus in extend-care facilities:
experiences in a Veterans'Affairs nursing home and a review of the literature.
Infect Control Hosp Epidemiol .1999; 12: 36-45.
Swecker W.S, Thatcher C.D, Eversole D.E, Blodgett D.J, Schurig
G.G. Effect of selenium supplementation on colostral IgG concentration in cows
grazing selenium deficient pastures and on post-suckles serum IgG concentration
in their calves. American. Journal of Veterinary Research. 2001;56:450-53.
Swecker W.S., Eversole D.E., Thatcher C.D., Blodgett D.J.,
Schurig G.G., Meldrum J.B. Influence of supplemental selenium on humoral immune
response in weaned beef calves. American Journal of Veterinary Research. 2000;
50(10):1760-63.
T
Tenover FC, Biddle JW, Lancaster MV. Increasing
resistance to vancomycin and other glycopeptides in Staphylococcus
aureus. Emerg Infect Dis. 2001;7:327-32.
Tiemersma EW, Bronzwaer SL, Lyytikäinen O, et al.
Methicillin-resistant Staphylococcus aureus en Europe. 1999-2002;
Emerg Infect Dis .2004; 10:1627-34.
V
Van Vleet J.F . Current Knowledge of selenium . vitamine E
deficiency in dometic animals.J.Amer.Vet.Med.Assoc.1980; 176:321-25.
Voss A, Milatovic D, Wallrauch-Schwarz C, Rosdahl VT, Braveny
I. Methicillin-resistant Staphylococcus aureus in
Europe. Eur J Clin Microbiol Infect Dis. 1994;13:50-5.
W
Wagenvoort JHT, Werink TJ, Gronenschild JMH, Davies BJ.
Optimization of detection and yield of methicillin-resistant Staphylococcus
aureus Phage type III-29. Infect Control Hosp Epidemiol .1996,
17: 208-9.
Wagenvoort JHT, Kepers-Rietrae M. Methicillin resistant
Staphylococcus aureus (MRSA) as a community strain. Eurosurveillance.
1997; 2: 96-7.
WHO.Trace elements in humain nutrition and health. In WHO, Ed. Ed
Geneva.1996
Wagenvoort JHT. Resistente Bakterien: ein schwerwiegendes Problem
fur die Krankenhaushygiene im vereinten Europa. Hygiene Medizin .1999;
24: 65-70.
William Reymond , Flammarion,confronting infections . Antibiotic
resistance and biotetorism around the world . Elsevier. 2008 ; 3 : 212
X
Xu, G.-L., Hong, S.-Y, Song, H.-B, J.-K. Keshan disease and
selenium deficiency. Nutr. Res., Suppl.1985 : 187.
Y
Yamamoto S et al. Veterinary Immunology and Immunopathology
.1993; 36: 257 - 64
Yeh ET. High'sensitivity C-reactive protein as a risk assessment
tool for cardiovascular disease.clin Cardiol .2005 ; 28 : 408-1
Z
Z Ernahrungswissenschaft. Selenium and immune function.
1998;37: 50-60
Annexes
Annexes A
1. Praparation du Kit Biuret
|
>
|
Sulfate de cuivre II CuSO4
|
1.92 g
|
|
>
|
Tartrate sodique potassique
|
9.03 g
|
|
>
|
Hydroxyde de sodium
|
2.4 g
|
|
>
|
Iodide de potassium KI
|
4.98 g
|
2. Préparation du gel
> On pèse 0.24g d'agarose.
> On la met dans un bécher.
> On ajoute 12 ml de PBS tampon.
> Et on ajoute 30 ìL de noir amido.
> On mélange et le met sur la plaque chauffante.
> Apres qu'il se dissous on laisse refroidir à
56°c.
> Puis on ajoute 30 ìL d'anticorps .
> On mélange et on coule les boites (3 boites chacune
contient un anticorps spécifique). > Apres séchage du gel on
met des puits puis on les rempli par 8 ìL du sérum.
> On incube pendant 72 heures au contact de l'humidité
et on mesure le diamètre .
3. Bouillon Coeur-Cerveau (BHIB) G/L
> Protéose -peptone 10
> Infusion de cervelle de cervelle de veau 2.5
> Infusion de cur de buf 5
> Glucose 2
> Chlorure de sodium 5
> Hydrogenophosphate de sodium 2.5
pH : 7.5
4. Gélose Chapman
> Peptone 11
> Extrait de viande 01
> Chlorure de sodium 15
> Manitol 10
> Agar 15
> Rouge de phénol 0.025
5. Gélose nutritive
> Peptone 15
> Extrait de viande 10
> Extrait de levure 02
> Chlorure de sodium 05
> Agar 20
6. PBS tampon
> Na Cl 2 g
> KH2PO4 0.05
> NaHPO4 0.72
> KCL 0.05
Annexes B
Matériels biologiques
Milieux de cultures solides
Gélose nutritive Gélose Chapman
Milieux de culture liquides
Bouillon cur cerveau (BHIB) Eau physiologique
Equipements
Boites de pétri Tubes à essai Micropipette
Tube à hémolyses
Plasma
Eau oxygénée
Oxacilline en poudre (Ox)
Plaque API Staph (Biomereux)
Calculs des protéines totales
Les résultats sont calculés directement par
l'analyseur selon la formule suivante:
Absorbance de l'inconnu
Protéines totales = x Valeur de l'étalon
Absorbance de l'étalon
EFFETS DE LA SUPPLEMENTATION EN SELENIUM SUR LA REPONSE
IMMUNITAIRE AU COURS
DE L'INFECTION A SARM
Effects of selenium supplementation on immune
response during MRSA infection
Amina BENDIMERAD. Master 2 BMC,
Microbiologie, UABB-TLM, 2010
RESUME
Introduction
Objectif
Matériels et méthodes
Résultats
Conclusion
Mots clés
ABSTRACT
Plusieurs données récentes ont rapporté les
effets du sélénium sur l'amplification de la réponse
immune et l'induction de la prolifération lymphocytaire.
Essayer d'étudier l'effet de la supplémentation en
sélénium sur la réponse immunitaire au cours de
l'infection à Staphylococcus aureus résistant à
la méthicilline (SARM).
Dix (10) Hamsters infectés par SARM, répartis en
deux groupes (groupe 1 ; supplémenté en sélénium
[Se+], n = 5, sexe ; 4 males/1 femelle, âge ; 21 jours, poids ; 68.51 g
#177; 5.17, groupe 2 ; non supplémenté en sélénium
[Se-], n = 5, sexe ; 3 males/2 femelle, âge ; 21 jours, poids ; 64.06 g
#177; 1.7) et de 5 hamsters sains (5 males), ont été soumis
à une étude rétrospective cas/témoins.
Les taux sériques des protéines totales, des
alpha-1, des alpha-2 et des gamma globulines ont été similaires
chez les Hamsters infectés par SARM, supplémentés en
sélénium (Se+) et chez les non supplémentés en
sélénium (Se-) (p > 0,05). Cependant, les
concentrations sériques en albumine et le rapport albumine/globulines
ont été significativement diminués chez les Hamsters Se-
comparés aux Hamsters Se+ (p < 0,01). A l'inverse, les
concentrations des beta globulines et des globulines totales ont
été significativement élevées chez les Hamsters
Se-par rapport aux Hamsters Se+. Par ailleurs, les taux circulants des
anticorps IgA et IgM ont été significativement
élevés chez les Hamsters Se- comparés aux Hamsters Se+
(respectivement, p = 0,000, p = 0,011). De même, les
concentrations sériques en CRP ont été nettement plus
élevées chez les Hamsters Se- comparés aux Hamsters Se+
(p = 0,002). Toutefois, les taux des IgG on été
similaires dans les deux groupes (p = 0,844). Enfin, les taux
spléniques des lymphocytes totaux et des lymphocytes apoptotiques ont
significativement diminués chez les Hamsters Se- comparés aux
Hamsters Se+ (respectivement, p = 0,015, p = 0,009).
Le sélénium pourrait jouer un rôle
significatif dans la prolifération lymphocytaire et la régulation
de la réponse immune à médiation humorale et cellulaire
ainsi que la réponse inflammatoire au cours de l'infection à
SARM.
SARM, protéines, anticorps, lymphocyte, protéine
C-réactive, supplémentation en sélénium
Introduction
Objectives
Materials and methods
Results
Conclusion
Keywords
Many data reported the effects of selenium on the immune response
amplification and on the induction of lymphocyte proliferation.
To study the effects of selenium supplementation on the immune
response during methicillin resistant Staphylococcus aureus (MRSA)
infection.
Ten (10) Hamsters infected with MRSA, divided into two groups
(group 1; supplemented with selenium [Se+], n=5, sex; 4 males/1 female, age; 21
days, weight ; 68.51 g #177; 5.17, group 2; without selenium supplementation
[Se-], n = 5, sex ; 3 males/2 females, age ; 21 days, weight; 64.06 g #177;
1.7), were subjected to case-control, retrospective study
Levels of serum total proteins, alpha-1, alpha-2 and gamma
globulins were similar in the two groups (p > 0,05). However, serum
albumin concentrations and albumin/globulins ratio were significantly lower in
Hamsters Se- compared with Hamsters Se+ (p < 0,01). On the
contrary, beta globulins and total globulins concentrations were significantly
higher in Hamsters Se-when compared to Hamsters Se+. Additionally, circulating
levels of IgA and IgM antibodies were significantly higher in Hamsters Se-
compared with Hamsters Se+ (respectively, p = 0,000, p =
0,011). Moreover, levels of CRP were significantly higher in Hamsters
Se-compared with Hamsters Se+ (p = 0,002). However, those of IgG were
similar in both groups (p = 0,844). Finally, total splenic lymphocytes
and apoptotic lymphocytes were significantly lower in Hamsters Se- compared
with Hamsters Se+ (respectively, p = 0,015, p = 0,009).
The selenium can play an important role in lymphocyte
proliferation and humoral and cellular immune response regulation and in
inflammatory response during MRSA infection.
MRSA, proteins, antibodies, lymphocyte, C-reactive protein,
selenium supplementation
ÕÎ~~
È ËíÐÛ Çòì4
É~ã~ ó å~~~~~Íã~á
É1óÇÞ. S.aureus
Úõæ å~
Çí~~Í~ËÊ Ë~Þá
hamster Úõæ å~
É.Ëí~~Ì ÊÇæ~õ~Í
~ÔÚ
|
ìiÚ
ÉíóÇ~ã~á~
Çí~Îá~ Öí~~Ì í
~~~Ëß ~ÑóÏ É~~í ä~
ðì~ãí selenium
|
äÇÊ
ÉÓ1ÑÐá~ íÐñ
Ëì~Ê ÐÞá ÈÑÇ~Ì
Çò~1Ú Ëí~Ì~
|
selenium
|
|
É~õË~~á~
íÐòÊ ÉÊ Ç~áÇ~
|
ÁÇìË~
É~ÊÇòÍááÇ~
ÉÊÇaÍÓáÇ~ ìá~
ÉÇ~~ Éíõ~Îá~ ó
É4Ø~Îá~
É~ÚÇìãá~
ÉÊÇaÍÓáÇ~
ã~ÙìÌ ó
.ËÇSÍá~
|



