|


UNIVERSITE DE DOUALA THE UNIVERSITY OF
DOUALA
REPUBLIQUE DUCAMEROUN REPUBLIC OF CAMEROON
Paix-Travail-Patrie
FACULTE DES SCIENCES THE FACULTY OF
SCIENCE
THE ABDUS SALAM INTERNATIONAL CENTRE FOR THEORETICAL
PHYSICS
CENTRE DE PHYSIQUE ATOMIQUE MOLECULAIRE ET OPTIQUE
QANTIQUE CENTRE FOR ATOMIC MOLECULAR PHYSICS AND QUANTUM
OPTICS
Matricule : 13O11307
SPECTROSCOPIE MOLECULAIRE DES
ETATS DE VALENCE ET EXCITES DE
L'ION
SiH+
MEMOIRE
Présenté et soutenu le
01 Octobre 2014
En vue de l'obtention du
DIPLOME
DE MASTER II DE PHYSIQUE
Option
PHYSIQUE DE LA MATIERE ET DU
RAYONNEMENT
Par
MBIBA TOUEDEBE Christian
Maître ès
Sciences
Sous la direction de
NKEM
Christophe
Chargé de Cours
Université de Douala
Sous la supervision de
OWONO OWONO Luc
Calvin
Maître de Conférences
Université de
Yaoundé I
Année académique 2013 - 2014
iii
Dédicace
A mon père BENGKERE Henri A ma
mère MERCIE Suzanne A mes grands frères
MAGUERNAN Innocent et OUEIDENG Modeste A ma
grande soeur KERETEGUE LOUENAN Lumière
A mes cadettes KOUMASENE Angéline ,
Clémantine, Brya et Sandrine A tous
ceux qui me sont chers, . . .
iv
Remerciements
Ce travail d'initiation à la recherche a
été réalisé au Centre de Physique Atomique
Moléculaire et Optique Quantique (CEPAMOQ) et n'aurait pas
été possible sans l'aide et le soutien de nombreuses personnes,
à qui je tiens à exprimer toute ma gratitude.
Je dis très grand MERCI à Dieu, Le Tout
Puissant, qui m'a accordé la santé et la vie durant ce
travail.
Je tiens à exprimer mon profond respect et ma
reconnaissance à mon encadreur, Dr NKEM Christophe,
enseignant à l'université de Douala et chercheur au
CEPAMOQ qui m'a initié au calcul ab initio. Pour sa confiance,
sa disponibilité et son soutien constant durant ma formation et la
préparation de ce mémoire. Qu'il sache que sans lui ce travail
n'aurait pas été possible. J'ai surtout apprécié
son enthousiasme qui m'a parfois aidé à me rappeler pourquoi je
voulais faire ce métier, pendant les jours sombres où tout dans
mes résultats me laissait penser que je travaillais pour rien . Son
optimisme communicatif m'a été fort précieux.
Je remercie sincèrement le Professeur OWONO
OWONO Luc Calvin, Maître de Conférences à
l'université de Yaoundé I et chercheur associé au CEPAMOQ
qui a bien voulu superviser ce travail.
Mes remerciements s'adressent également au
coordonnateur du CEPAMOQ, le Professeur KWATO NJOCK Moïse
Godfroy. Le culte de l'excellence et du mérite que vous avez
toujours prôné ont eu un effet considérable sur
l'édification de ma personnalité. Trouvez ici le
témoignage de toute ma gratitude.
J'exprime ma profonde gratitude à mes enseignants du
CEPAMOQ, je pense ici au Pr. KWATO NJOCK Moïse Godfroy,
au Dr NKEM Christophe, au Dr TETCHOU Hugues,
au Dr BOURI Celsus, au Dr MOHAMADOU Ballo,
au Dr Marius SILE-NOU MENGOUE au Dr
Nicodème DJIEDEU. Qu'ils trouvent ici l'expression de
ma reconnaissance pour l'instruction que je tiens de leurs compétences
pédagogiques.
Ma reconnaissance va également au Dr Daniel
BONGUE, Dr Robert MBIAKE, au Dr Cyril
KENFACK, au Dr Alexandre NGWA EBONGUE et tout
le personnel du
v
CEPAMOQ.
Je tiens à remercier Pr YACOUB Idriss
de l'université de N'Djamena pour avoir accepté de faire
partie du jury et d'apporter ses observations sur ce travail. J'adresse aussi
mes remerciements à tous les enseignants de la faculté des
sciences exactes et appliquées de l'université de N'Djamena, pour
la qualité des enseignements reçus tous au longs de ma
formation.
Je remercie également le Centre International Abdus
Salam de Physique Théorique (ICTP) pour son soutien au CEPAMOQ à
travers le projet OEA-AC-71.
Je tiens également à exprimer mes
sincères remerciements à NAINDOUBA Alain qui m'a
assisté de loin ou de près.
A mon grand frère MAGUERNAN Innocent
pour tout son aide.
Je remercie tous mes camarades de la
6`eme promotion et les doctorants.
Je dis un grand MERCI à mes chers parents, qui ne
cessent de me soutenir sur tous les plans dans mes études.
Que tous ceux qui pensent que leurs noms auraient dû
figurer ici, ne se sentent pas oublié.
vi
Summary / Résumé
Summary
This manuscript is devoted to the study of the molecular
spectroscopy of the valence and excited states of the SiH+.
We are interested more particularly to determine potential energy curves (PECs)
and spectroscopic constants for SiH+. PECs are genereted by
ab initio calculations using Restricted Hartree-Fock (RHF), Complete
Active Space Self Consistent Field (CASSCF) and multireference Configuration
Interaction (MRCI) techniques implemented in the code for molecular
calculations MOLPRO.
Using these PECS, spectroscopique constants are obtained by
fitting a Morse potential. With respect to our basis set, our results are found
to be in reasonable agreement with reference data and theoretical numbers by
other authors. It is obvious from our computations that electron correlation is
better included at the MRCI level of theory than in CASSCF and RHF
approximation.
Résumé
Ce manuscrit est consacré à l'étude de la
spectroscopie moléculaire des états de valence et excité
de l'ion SiH+. Nous nous sommes intéressés
plus particulièrement à la détermination des courbes
d'énergie potentielle et des constantes spectroscopiques de cet ion
moléculaire. Les courbes d'énergie potentielle ont
été calculées par une méthode ab initio
basée sur une procédure incluant la technique MRCI du code
de calcul MOLPRO.
Les constantes spectroscopiques sont obtenues par un fit du
potentiel de Morse. Les résultats obtenus dans la limite des bases
d'orbitales atomiques utilisées sont en bon accord avec les valeurs de
référence et celles d'autres auteurs. Ils montrent par ailleurs
une meilleure prise en compte de la corrélation électronique dans
le calcul MRCI par rapport au CASSCF et au RHF.
vii
Table des matières
Dédicace iii
Remerciements iv
Summary /Résumé vi
Table des matières vii
Liste des tableaux ix
Table des figures x
liste des abréviations xi
Introduction générale 1
1 Méthodes de calcul de structure
électronique 3
1.1 Introduction 3
1.2 Équation de Schrödinger. 3
1.3 Approximation de Born-Oppenheimer 5
1.4 Approximation de Hartree-Fock 5
1.5 Méthode de Roothaan-Hall : Approximation LCAO 7
1.6 Méthodes Post Hartree-Fock 8
1.6.1 La méthode MRCI 10
1.7 Le choix des bases d'orbitale 11
1.8 Logiciel de calcul MOLPRO 12
1.9 Conclusion 12
2 Courbes d'énergie potentielle 13
TABLE DES MATIÈRES viii
2.1 Introduction 13
2.2 Présentation de l'ion moléculaire SiH 13
2.3 Diagramme de corrélation 14
2.4 Choix de la base d'orbitales atomiques et de la
méthode de calcul 14
2.5 Résultats et discussions 16
2.6 Conclusion 19
3 Spectroscopie de l'ion moléculaire SiH
20
3.1 Introduction 20
3.2 Rotation moléculaire 20
3.3 Vibration moléculaire 23
3.3.1 Modèle mécanique de l'oscillateur harmonique
23
3.3.2 Modèle quantique de l'oscillateur anharmonique
25
3.4 Mouvement rotovibrationel des molécules diatomiques
26
3.5 Constantes Spectroscopiques 27
3.5.1 Représentation mathématique des courbes de
potentiel 27
3.6 Résultats et Discussions 27
3.7 Conclusion 31
Conclusion générale 32
Bibliographie 33
ix
Liste des tableaux
2.1 Diagramme des états moléculaires du
système SiH+ dans l'intervalle < 10 eV
à
partir de l'état fondamental 14
2.2
Constantes spectroscopiques de l'état électronique
fondamental X1y+de la molé-
cule SiH+ 15
3.1 Constantes spectroscopiques de l' état fondamental
X1y+ obtenues par le fit du
potentiel de Morse 28
3.2 Constantes
spectroscopiques des états 1H, 5y-
et 5H obtenues par le fit du potentiel
de Morse 29
3.3 Constantes spectroscopiques des
états 3H ,3y+et 3y-
obtenues par le fit du poten-
tiel de Morse 30
X
Table des figures
1.1 Diagramme des déterminants de Slater
excité généré à partir de la
référence HF. 9
2.1 Comparaison des courbes de potentielle de RHF, CASSCF
et MRCI obtenues pour
l'état électronique fondamental
X1Ó de la molécule SiH . 16
2.2 Courbe de potentiel MRCI des états singulets de
la molécule SiH 17
2.3 Courbes de potentiel MRCI des états triplets de
la molécule SiH 18
2.4 Courbes de potentiel MRCI des états quintets de
la molécule SiH 18
2.5 Courbe de potentiel MRCI des états les plus bas
de la molécule SiH . 19
xi
Liste des abréviations
- Aug-cc-pVXZ (ou encore aVXZ) : Signifie »Correlation
consistent polarized augmented
valence» X renvoie à D (double), T (triple), Q
(quadruple), etc.
- B-O : Born-Oppenheimer.
- CI : Configuration interaction; qui signifie Interaction
de configuration (IC).
- HF : Hartree-Fock.
- LCAO : Linear combination of atomic orbital.
- SCF : Self-Consistent Field; Champ
auto-cohérent
- MCSCF : Multiconfiguration Self- Consistent
Field.
- MRCI : Multireference Configuration Interaction;
méthode d'interaction de configura-
tion multiréférence
- CCSD(T) : Coupled Cluster with single, double and
non-iterative triple excitation; mé-
thode de calcul ab initio itérative.
- OM : Orbitale Moléculaire
- OA : Orbitale atomique
- SEP : Surface d'Energie Potentielle. (en anglais, PES :
Potential Energy Surface).
1
Introduction générale
La molécule SiH+ est le tout
premier ion moléculaire dont l'identification a été
confirmée dans le spectre photosphérique du soleil [1, 2]. Cette
molécule joue un rôle important dans la chimie du nuage
interstellaire et constitue avec les espèces telles que : SiO, SiS, SiN,
SiH4 et SiC4 les principales sources de Silicium (Si) dans le
milieu interstellaire. En raison de son importance astrophysique[3, 4, 5], elle
a été l'objet de plusieurs travaux théoriques [6, 7] et
expérimentaux [8, 9, 10] . Les constantes spectroscopiques de
l'état fondamental (X1i+) et du premier
état excité A1H de la molécule
SiH+ ont été déterminées
expérimentalement [5, 7, 11].
Bruna et Peyerimhoff [8] ont déterminés les
courbes d'énergie potentielle de l'état fondamental et de
plusieurs états excités. Cependant, les constantes
spectroscopiques de ces états ainsi que les détails de la
méthode utilisée pour effectuer les calculs n'ont pas
été donnés par ces auteurs. Les courbes de potentiel de
quatre états (X1i+, a3H,
A1H et 3i+) se dissociant toutes
suivant l'asymptote Si+(2Pu)
+ H(2Sg) ont été
déterminées par Hirst [9] et les constantes spectroscopiques
qu'il a trouvé pour l'état fondamental sont en très bon
accord avec les valeurs expérimentales. Pour l'état
A1H, Hirst a déterminé la seule constante
De qui est aussi en bon accord avec la valeur
expérimentale. Ahlrichs et al. [12], Matos et al. [10], ont
utilisés la base gaussienne GTO/CGTO et la méthode CPF
(»coupled pair functional») pour déterminer les
paramètres spectroscopiques de l'état A1H de
la molécule SiH+avec une assez bonne
précision.
Pour aider les expérimentateurs dans leur recherche sur
la molécule SiH+, il est indispensable de
déterminer avec une assez bonne précision les courbes de
potentiel des états de valence et excité de cette
molécule. Nous avons à cet effet, utilisé la
méthode d'interaction de configuration multiréférence
(MRCI) et une base gaussienne très étendue aug-cc-pV6z pour
caractériser l'état fondamental et quelques états
excités de la molécule SiH+.
Dans ce mémoire, il s'agit pour nous, d'utiliser les
méthodes ab initio de prise en compte de la corrélation
électronique pour déterminer avec une très bonne
précision les courbes de potentiel, solution de l'équation de
Schrödinger électronique. Partant de l'approximation de
Table des figures 2
Hartree-Fock (HF), les fonctions d'onde MCSCF et MRCI sont
obtenues comme combinaisons linéaires de déterminants de Slater
obtenus par excitation des électrons des orbitales occupées vers
les orbitales virtuelles de la fonction d'onde HF. Notre objectif est
d'améliorer quelques résultats existant en reproduisant au mieux
les résultants expérimentaux.
Notre dissertation est organisée ainsi qu'il suit :
Dans le chapitre 1, nous présentons les méthodes de calcul de
structure moléculaire utilisées dans ce travail. Le chapitre 2
est consacré à la détermination des courbes de potentiel.
Ces résultats sont ensuite utilisés au chapitre 3 pour le calcul
des constantes spectroscopiques. La conclusion résume ce travail et en
dégage les perspectives.
3
Chapitre 1
Méthodes de calcul de structure
électronique
1.1 Introduction
Dans ce chapitre, nous présentons les méthodes
de calcul de structure qui sont implémentées dans la plupart des
codes de calcul utilisés dans la détermination des grandeurs
caractéristiques des molécules. De nos jours, plusieurs
méthodes sont disponibles à cet effet et ne peuvent donner les
mêmes résultats. Certaines ne servent qu'à des fins
qualitatives car elles ne prennent pas en compte la corrélation
électronique. Par contre pour obtenir des résultats plus
précis, il faut inclure cette corrélation dans le traitement.
Dans ce chapitre, nous présentons en particulier les méthodes
RHF, CASSCF, et MRCI qui sont utilisées dans ce travail.
1.2 Équation de Schrödinger.
Toute l'information que l'on peut obtenir sur un
système moléculaire est contenue dans la fonction d'onde
ø(R, r), solution de l'équation de Schrödinger
indépendant du temps[13, 14, 15]
Hø(R, r) = Eø(R, r) (1.1)
où R et r représentent
respectivement l'ensemble des coordonnées des noyaux et des
électrons par rapport au centre de masse de la molécule, H
est le hamiltonien du système et E son énergie.
CHAPITRE 1. MÉTHODES DE CALCUL DE STRUCTURE
ÉLECTRONIQUE 4
Le hamiltonien totale H non relativiste
représentant un système à n électrons et
N noyaux peut s'écrire :
H(R, r) = TN(R) + Te(r) +
VNN(R) + VNe(R, r) + Vee(r)
(1.2)
Dans le système d'unité atomique
(me = e = ú = 4ðåo
= 1). Les différents termes constituant le hamiltonien
ont la signification et la forme définie comme suit :
>N
1
TN(R) = -
2 á=1
qui est l'énergie cinétique des noyaux,
1 V2 á = V2 (1.3)
N
Má
|
Xn
1
Te(r) = -2
i=1
qui est l'énergie cinétique des
électrons,
|
V2 i = V2 (1.4)
e
|
|
VNN(R) =
|
Xn á=1
|
XN â>á
|
ZáZâ (1.5)
Ráâ
|
qui est le terme d'interaction noyau-noyau,
VNe(R,r) = -
Zá (1.6)
Rái
XN á=1
Xn i=1
qui est le terme d'interaction électron-noyau,
Vee(r) =
1 (1.7)
rij
Xn i=1
Xn j<i
qui est le terme d'interaction
électron-électron. Avec Má la masse du noyau
á; Ráâ la distance entre le noyau
á et le noyau â de charges respectivement
Zá et Zâ ; Rái la distance entre le
noyau á et l'électron i; rij
la distance entre l'électron i et j ; les
indices N et e sont liés respectivement aux noyaux et
aux électrons.
En général, l'équation de
Schrödinger n'a de solution analytique que pour des systèmes
moléculaires ayant un ou deux électrons au plus. Dans les autres
cas, il faut recourir aux techniques numériques et faire appel à
des approximations à l'effet de simplifier la technique de
résolution. Parmi les plus couramment utilisées figure
l'approximation de Born-Oppenheimer qui est d'ailleurs fondamentale dans les
méthodes de calcul ab initio.
CHAPITRE 1. MÉTHODES DE CALCUL DE STRUCTURE
ÉLECTRONIQUE 5
Le potentiel d'interaction électron-électron
rend impossible la résolution de l'équation de Schrödinger
pour un nombre d'électron supérieur à un. Pour contourner
cette difficulté,
1.3 Approximation de Born-Oppenheimer
L'une des approximations que nous pouvons effectuer afin de
simplifier l'équation de Schrödinger (1.1) est celle
proposée en 1927 par Max Born et Robert Oppenheimer connue sous le nom
de l'approximation de Born-Oppenheimer (B-O) [15, 16]. Elle consiste à
séparer les mouvements des noyaux et des électrons. Elle est
basée sur le fait que la masse des noyaux d'un système
moléculaire est beaucoup plus grande que celle des électrons
(Mp 1836 me) ce qui suppose
que les noyaux se déplacent plus lentement et peuvent par
conséquent être considérés comme fixes.
L'énergie cinétique TN est donc négligée
en comparaison avec Te et le potentiel d'interaction
noyau-noyau (V NN) ne dépend plus que de la position
des noyaux et joue le rôle de paramètre dans cette
équation. Le hamiltonien total du système peut donc
s'écrire sous la forme d'une somme d'un hamiltonien électronique
He et d'un opérateur énergie cinétique
du noyau TN :
H = He + TN (1.8)
Avec :
He = Te(r) +
Vee(r) + VNe(R, r) + VNN(R)
(1.9)
La fonction d'onde totale peut s'écrire sous la forme
d'un développement en série sur une base complète de
fonctions électroniques.
ø(R, r) = X8
øNi(R)øi(R, r) (1.10)
i=1
telle que :
He(R)øi(R,r) =
Ei(R)øi(R,r) (1.11)
où les coefficients øNi(R)
dépendent des coordonnées des noyaux.
L'approximation de B-O est une très bonne
approximation, car dans la plupart des systèmes moléculaires,
elle introduit une erreur très négligeable. Toutefois, cette
approximation cesse d'être valable lorsque la molécule est dans un
état électronique, vibrationnel et rota-tionnel trop
excité car les noyaux sont rapides et leurs vitesses ne sont pas
négligeables.
1.4 Approximation de Hartree-Fock
CHAPITRE 1. MÉTHODES DE CALCUL DE STRUCTURE
ÉLECTRONIQUE 6
Hartree [17] puis Fock [18] ont proposé de
résoudre cette équation de Schrödinger électronique
en décrivant la fonction d'onde électronique sous la forme d'un
déterminant de Slater [19] composé de spin-orbitales
mono-électriques de type á ou â. Pour un système
à n électrons, ce déterminant s'écrit :
|
ö1(1) ö1(2)
1
~~~~~~~~~~~~~
Öe
|
ö2(1) ...
ö2(2) ...
... ...
... ...
ö2(N) ...
|
... öN(1)
... öN(2)
... ...
... ...
... öN(N)
|
|
,(1.12)
|
|
= ...
CAN!
... ö1(N)
|
où
v1N!est le facteur de
normalisation, une colonne représente une spin orbitale et une ligne
représente les coordonnées des électrons suivants la base
d'ordre N. La fonction d'onde décrite sous cette forme est
antisymétrique, conséquence directe du principe d'exclusion de
Pauli. L'énergie électronique Ee s'écrit sous
la forme :
Ee = (öe|
He |öe) (1.13)
où
h(i) +
1
(1.14)
He = Xn
i=1
rij
Xn i=1
n
E
j>i
L'hamiltonien électronique avec
XN
1
h(i) = -2?2i
-
Zá
(1.15)
Rái
á=1
un opérateur mono-électronique et,
|
gij =
|
1
=
rij
|
1 (1.16)
| ri-rj |
|
|
Ee =
|
Xn i=1
|
h(i) +
|
Xn i=1
|
n
E
j>i
|
(Jij - Kij)(1.17)
|
où
l'opérateur a deux électrons associé
à la répulsion Coulombienne entre un électron i et un
électron j.
L'énergie HF totale du système va donc
s'écrire :
CHAPITRE 1. MÉTHODES DE CALCUL DE STRUCTURE
ÉLECTRONIQUE 7
Jij =
höi(i)öj(j)| gij
|öi(i)öj(j)i (1.18)
qui est l'intégrale de Coulomb et
Kij =
höi(i)öj(j)| gij
|öj(i)öi(j)i (1.19)
qui est l'intégrale d'échange. Pour
obtenir l'énergie HF, on minimise l'énergie calculée en
utilisant la technique de variation à l'aide des multiplicateurs de
Lagrange. Ainsi la variation de l'énergie au premier ordre pour un
système à couches fermées s'écrit :
äEe = 2 XN
häöi| hi + XN (Jj -
Kj) |öii (1.20)
i=1 j=1
On définit l'opérateur de Fock pour un
électron par :
|
Fi = hi +
|
Xn j
|
(Ji - Kj) (1.21)
|
où les Jj et Kj sont respectivement
l'opérateur de coulomb et d'échange qui se définissent par
leur action sur les spinorbitales de la manière suivante :
Ji |öj(j)i =
höi(i)| gij
|öi(i)öj(j)i , (1.22)
Ki |öj(j)i =
höi(i)| gij
|öj(i)öi(j)i . (1.23)
Les équations de Hartree-Fock prennent la forme :
|
Fi |öii =
|
XN j
|
Àij |öji . (1.24)
|
Roothaan et Hall ont démontrés de manière
indépendante qu'en introduisant un jeu de fonction spatiales connues,
les équations intégro-différantielles peuvent être
transformées en
Les équations de HF forment un ensemble
d'équations intégrodifférentielles couplées et
peuvent être résolues par la méthode du champ
auto-cohérent (SCF) qui est une méthode itérative. La
résolution numérique de l'équation (1.24) de HF s'effectue
en utilisant l'approxi-mation LCAO proposée par Roothaan et Hall
[20].
1.5 Méthode de Roothaan-Hall : Approximation
LCAO
CHAPITRE 1. MÉTHODES DE CALCUL DE STRUCTURE
ÉLECTRONIQUE 8
un système d'équations algébriques et
être résolu en utilisant la méthode des matrices. Dans
cette approximation, les OMsøi sont exprimées comme
une combinaison linéaire de M fonctions atomiques appelées
»orbitales atomiques»
öi = XM cpi÷p. (1.25)
p
où M est la dimension de la base et les facteurs
cpi sont les coefficients des OMs développées sur les
fonctions de base ÷p.
En combinant les équations (1.24) et (1.25) et en
multipliant de chaque côté par ÷q puis en
intégrant, on obtient les équations de HAll-Roothaan :
FC = SCå (1.26)
Ici F est la matrice de Fock dont les éléments sont
:
Fpq = h÷p| F |÷qi,
(1.27)
S est la matrice de recouvrement avec
Spq = h÷p |÷qi.
(1.28)
C est la matrice carrée des coefficients du
développement et å est le vecteur des énergies
d'orbitales.
Les équations de Roothan-Hall (1.26) ne sont valables
que pour des systèmes à couches fermées avec un nombre
pair d'électrons. Les électrons sont appariés et l'un
d'entre eux a un spin á et l'autre un spin â. La fonction d'onde
correspondante est du type Restricted Hartree-Fock (RHF). La technique
correspondante est illustrée dans la référence [14], ainsi
que d'autres détails.
1.6 Méthodes Post Hartree-Fock
L'approximation de Hartree-Fock donne la meilleure
représentation d'une fonction d'onde décrite par un seul
déterminant de Slater. Cependant, les électrons interagissent
relativement à un champ moyen. Par conséquent, l'énergie
calculée n'est pas très précise et ne représente
qu'environ ~ 99 % de l'énergie totale. La différence
(c'est-à-dire ~ 1 % restant) entre l'énergie exacte et
celle de Hartree-Fock (HF) porte le nom d'énergie de corrélation
[21] :
CHAPITRE 1. MÉTHODES DE CALCUL DE STRUCTURE
ÉLECTRONIQUE 9
Ecorr = Eexacte - EHF. (1.29)
C'est pour récupérer cette énergie de
corrélation qu'on a recours aux méthodes dites Post-HF. Il existe
deux types méthodes de corrélation électronique :
- Les méthodes variationnelles telles que l'Interaction
de configuration (CI), l'Interaction de configuration
multiréférence (MRCI), et la méthode du champ
autocohérent multiconfi-gurationnelle (MCSCF),
- Les méthodes de perturbation telles que la
Théorie des perturbations multicorps (MBPT) et la méthode des
Clusters couplés (CC).
Dans le cadre de ce travail, nous allons utiliser la
première classe de ces méthodes qui offre l'avantage de pouvoir
traiter les états excités. Il est important de rappeler que le
point de départ de toutes ces méthodes de corrélation est
par principe la fonction d'onde de HF. Par conséquent, pour tout
traitement de la corrélation, la fonction d'onde s'écrira :
>2 W = a0ÖHF +
ajÖj, (1.30)
j=1
avec a0 ~ 1. Les méthodes de
corrélation diffèrent dans la manière de calculer les
coefficients aj. Les déterminants additionnels Öj
sont obtenus par excitation des électrons des orbitales
occupées de la fonction d'onde HF vers les orbitales virtuelles suivant
le diagramme de la figure 1.1. Les Öj s'appellent encore
déterminants de Slater excités
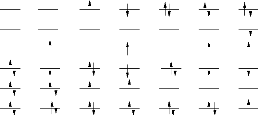
HF S-type S-type D-type D-type T-type Q-type
FIGURE 1.1: Diagramme des déterminants de Slater
excité généré à partir de la
référence HF.
CHAPITRE 1. MÉTHODES DE CALCUL DE STRUCTURE
ÉLECTRONIQUE 10
Les différentes méthodes Post Hartree-Fock sont
détaillées dans les références [14]. Nous
insisterons sur la méthode MRCI, qui est celle que nous avons
utilisée dans ce mémoire et qui offre l'avantage de pouvoir
traiter les états excités.
1.6.1 La méthode MRCI
La méthode MRCI est celle que nous utilisons dans ce
travail, c'est une méthode d'inter-action de configuration qui utilise
comme référence, la fonction d'onde MCSCF [22] à partir de
laquelle on n'autorise que les simples et doubles excitation. La fonction
d'onde ØMRCI est décrite par :
|
EØMRCI = ØMCSCF +
S
|
a
|
Eca SÖa S +
D
|
E
ab
|
cab D Öab D . (1.31)
|
öo = E CRöR (1.33)
R
où a et b constituent les orbitales de l'espace
externe, S et D sont les excitations simple et double des configurations de
référence, øi correspondant aux configurations internes (
incluant la fonction d'onde de référence et les configurations
obtenues par excitation d'un ou deux électrons à partir des
couches fermées dans les couches internes)
øas et øabD sont
associés respectivement aux configurations issues d'excitation simples
et doubles des orbitales internes vers les orbitales externes.
Dans l'espace de référence, il y a trois types
d'orbitales : les orbitales de coeur doublement occupées et non
corrélées, les orbitales de valence qui sont occupées par
0, 1 ou 2 électrons et corrélées au niveau CI et les
orbitales externes qui sont non occupées dans la fonction d'onde de
référence. Cette méthode de calcul engendre un très
grand nombre de configurations à traiter et demande beaucoup de temps de
calcul. Pour y remédier, une technique a été
implémentée dans le code MOLPRO par Werner et Knowles,
nommée « internally contracted ». Il s'agit de faire des
combinaisons linéaires de configurations qui ont la même partie
externe, mais des parties internes différentes. La contraction des
configurations est obtenue par des combinaisons linéaires entre elles
avec des coefficients fixes qui ne seront pas optimisés. Les
configurations contractées avec des excitations doubles dans l'espace
externe sont définies par :
ab 1
øijp = 2(Eai,bj +pEaj,bi)öo (1.32)
où p correspond au facteur de spin (il prend la valeur
+1 pour un couplage singulet entre les orbitales externes a et b et la valeur
-1 pour un couplage triplet). Eai,bj sont des opérateurs
biélectroniques et öo est la fonction d'onde de
référence MCSCF :
CHAPITRE 1. MÉTHODES DE CALCUL DE STRUCTURE
ÉLECTRONIQUE 11
En remplaçant öo par son expression,
l'équation (1.32) devient
|
X
øab
ijp =
R
|
XCR(Eai,bj + pEaj,bi)öR =
R
|
CRöab (1.34)
ijp,R
|
Après contraction, la fonction d'onde MRCI s'écrit
donc:
|
XøMRCI =
i
|
>
Ciøi +
s
|
X
a
|
XCa s øa s +
i=j
|
X
b
|
X
ab
|
Cijp
ab øab (1.35)
ijp
|
où lesøab
ijp sont les configurations contractées obtenues
après orthonormalisation et C les coefficients obtenus par un calcul CI
direct.
Ceci permet de réduire d'un facteur 30 les CSFs
à considérer avec très peu d'effet sur la qualité
des résultats. Cependant, malgré ces contractions, le nombre de
configurations à prendre en compte reste toujours trop
élevé. Afin de réduire encore ce nombre, il ne faut
considérer que les configurations dont les coefficients C
dépassent un certain seuil de référence. Cette
méthode CI tronquée n'est pas extensive en taille.
L'énergie de corrélation est donc mal décrite lorsque le
nombre de particules augmente. On peut la corriger grâce à
l'approximation de Davidson [23] où la contribution de l'énergie
de corrélation des configurations quadri-excitées est
estimée à partir des configurations doublement excitées.
La correction de l'énergie se calcule de la manière suivante :
ÄEQ = ÄESD(1 - X
C2 R) (1.36)
R
où ÄSD représente la
contribution à l'énergie de corrélation des excitations
simples et doubles prisent en compte dans la fonction de
référence MCSCF. Grâce à cette correction, cette
méthode est plus souvent privilégiée par rapport au calcul
Full CI pour la même base.
1.7 Le choix des bases d'orbitale
Une base est une description mathématique des orbitales
au sein d'un système [24]. Son choix est fonction de la précision
recherchée et du temps de calcul. En effet, une base contenant un nombre
infini d'orbitales moléculaires permettrait d'obtenir l'énergie
la plus précise par rapport à une méthode donnée.
Mais ceci rendrait les calculs impossibles compte tenu de la taille de la
matrice d'IC. Pour cela, elle doit obéir aux deux critères
essentiels suivants :
- La base doit être telle que l'erreur de superposition
soit le plus faible possible,
- La base doit reproduire avec une bonne précision les
grandeurs caractéristiques de la molécule, telles que les
constantes spectroscopiques.
CHAPITRE 1. MÉTHODES DE CALCUL DE STRUCTURE
ÉLECTRONIQUE 12
Il est à noter, qu'on utilise principalement deux types de
fonctions de base pour les calculs
numériques :
- les orbitales de type Slater (STOs)
- les orbitales de type gaussienne (GTOs)
Pour réaliser ce présent travail, nous avons
utilisé le logiciel MOLPRO [25].
1.8 Logiciel de calcul MOLPRO
Molpro[25] est un système complet de programme ab
initio pour le calcul de structure électronique des
molécules. Il a été conçu par H.-J. Werner et P. J.
Knowles et contient aussi les contributions de beaucoup d'autres auteurs. Il se
distingue des autres programmes utilisés en chimie quantique parcequ'il
donne avec la plus grande exactitude les résultats concernant le calcul
sur des petites molécules.
1.9 Conclusion
Les méthodes Post H-F ont pour point de départ,
la méthode H-F. Nous constatons que, malgré leurs
différences aucune d'entre elles n'est parfaite. Car toutes ces
méthodes présentent des limites et, au fur et à mesure
qu'on corrige ces défauts, on obtient des résultats plus
meilleurs.
13
Chapitre 2
Courbes d'énergie potentielle
2.1 Introduction
L'énergie potentielle de la molécule SiH+
résulte des interactions entre l'ion silicium Si+ et
l'atome d'hydrogène qui la composent. Par ailleurs, cette interaction
étant une fonction de la distance entre ces atomes, il parait alors
naturel que l'énergie potentielle de cette molécule dépend
de sa géométrie. Les solutions de l'équation de
Schrödinger électronique étudiées dans le chapitre 1,
seront présentées dans ce chapitre sous forme de courbes
d'énergie potentielle. Ces courbes sont obtenues en utilisant la
méthode MRCI et la base aV6Z. Avant de discuter nos résultats, il
est important de présenter l'ion moléculaire SiH+.
2.2 Présentation de l'ion moléculaire
SiH+
C'est une molécule diatomique
hétéronucléaire, appartenant au groupe de symétrie
C2v. Ses orbitales sont construites à partir des orbitales atomiques de
l'ion silicium et de l'atome d'hydrogène. Les orbitales atomiques de
type s et pz sont associées aux orbitales moléculaires
de type ó, et les orbitales px et py
respectivement aux orbitales ðx et ðy.
L'ion silicium Si+ a 13 électrons et sa structure
électronique
[1s22s22p6]3s23p1 donne
lieu à 5 orbitales ó, 2 orbitales ðx et 2
orbitales ðy. L'atome H à 1 seul électron, sa
structure électronique est 1s1 et correspond à 1
orbitale ó. On dispose donc d'un espace complet de valence comportant 6
orbitales ó, 2 orbitales ðx et 2 orbitales ðy
(6ó, 2ðx , 2ðy) associé
à la molécule SiH+ dans son état fondamental.
La configuration électronique correspondante est donc :
[1ó22ó23ó21ð2
x1ð2
y]4ó25ó2
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE 14
La qualité des résultats du calcul
moléculaire est intimement liée au choix des orbitales atomiques
(OA) ou moléculaires (OM) utilisées pour les décrire. La
base doit représenter le
La molécule SiH+ a un spin spin s = o, ce
qui donne une multiplicité 2s + 1 = 1. L'état fondamental
correspondant est un état de symétrie
1E+.
2.3 Diagramme de corrélation
Nous présentons dans cette partie, la construction du
diagramme de corrélation de l'ion moléculaire SiH+. Ce
diagramme de corrélation nous permet de déterminer les
différents états de la molécule. Ce diagramme est
construit à partir des configurations électroniques des atomes
séparés de Si+ et de H. Pour déterminer les
termes électroniques d'une molécule diatomique linéaire
(cas de SiH+), on a souvent recours aux éléments de
symétries, tels que : - la symétrie axiale, - la
réflexion. Pour plus détails lire la référence
suivante [26].
Le Diagramme de corrélation de la molécule
SiH+ obtenu à partir de l'état fondamental est
présenté dans le tableau 2.1.
TABLE 2.1: Diagramme des états moléculaires
du système SiH+ dans l'intervalle < 10
eV à partir de l'état fondamental
|
Configurations /Termes
Si H
|
Energie
(cm-1)
|
Energie (eV)
|
Etats moléculaires
|
|
3s3p2
|
2Pg
|
1s
|
2Sg
|
83903.105
|
10.4027
|
1,3E-, 1,3Ð
|
|
3s24p 2Pu
|
1s
|
2Sg
|
81221.33
|
10.0702
|
1,3E+, 1,3Ð
|
|
3s23d2Du
|
1s
|
2Sg
|
79346.76
|
9.8377
|
1,3E-, 1,3Ð, 1,3Ä
|
|
3s3p2
|
2Sg
|
1s
|
2Sg
|
76665.35
|
9.5053
|
1,3E+
|
|
3s24s
|
2Su
|
1s
|
2Sg
|
65500.47
|
8.1210
|
1,3E-
|
|
3s3p2
|
2Dg
|
1s
|
2Sg
|
55317.265
|
6.8585
|
1,3E+, 1,3Ð, 1,3Ä
|
|
3s3p2
|
4Pg
|
1s
|
2Sg
|
42954.94
|
5.3257
|
3,5E-, 3,5Ð
|
|
3s23p
|
2Pu
|
1s
|
2Sg
|
0
|
0
|
1,3E+, 1,3Ð
|
2.4 Choix de la base d'orbitales atomiques et de la
méthode de calcul
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE 15
système considéré et être
relativement peu étendue pour que les temps de calcul restent
raisonnables. Quant au choix de la méthode, elle est d'autant meilleure
qu'elle prend en compte la corrélation électronique. Pour
réaliser le choix de la méthode de calcul et la base d'orbitale
atomique, nous avons fait une série de tests en utilisant plusieurs
méthodes (RHF, MCSCF, CCSD(T) et MRCI) et les bases aug-cc-pVXZ souvent
notées aVXZ (avec X= T, Q, 5, 6), pour calculer les constantes
spectroscopiques telles que : la distance internucléaire à
l'équi-libre (Re); la constante de rotation-vibration
(áe); la constante rotationnelle à l'équilibre
(Be); la fréquence harmonique (We); la constante
de distorsion centrifuge (De); la constante d'anharmonicité
au premier ordre (Wexe). Les résultats obtenus
sont comparés aux valeurs expérimentales. Les résultats
sont résumés dans le tableau 2.2.
TABLE 2.2: Constantes spectroscopiques de l'état
électronique fondamental
X1Ó+de la molécule
SiH+
|
Méthodes
|
Bases
|
Re(Å)
|
We(cm-1)
|
áe(cm-1)
|
De(eV)
|
Be(cm-1)
|
Wexe(cm-1)
|
|
aV6Z
|
1.506
|
2154.107
|
0.201
|
3.741
|
7.590
|
38.445
|
|
|
0.13 %
|
0.13%
|
0.24 %
|
2.58 %
|
0.88 %
|
10.96 %
|
|
aV5Z
|
1.506
|
2153.566
|
0.195
|
3.855
|
7.587
|
37.292
|
|
CCSD(T)
|
|
0.13 %
|
0.16 %
|
3.33 %
|
1.16 %
|
0.93 %
|
8.21 %
|
|
aVQZ
|
1.508
|
2148.592
|
0.210
|
3.526
|
7.569
|
40.578
|
|
|
0.26 %
|
0.39%
|
4.04 %
|
8.05 %
|
1.72 %
|
15.64 %
|
|
aV6Z
|
1.517
|
2108.160
|
0.200
|
3.623
|
7.479
|
38.027
|
|
|
0.85 %
|
2.321 %
|
0.75 %
|
5.16 %
|
2.38 %
|
9.98 %
|
|
aV5Z
|
1.507
|
2107.802
|
0.196
|
3.624
|
7.477
|
37.995
|
|
MCSCF
|
|
0.199 %
|
2.28%
|
2.80 %
|
9.81%
|
2.35%
|
10.99%
|
|
aVQZ
|
1.519
|
2103.733
|
0.210
|
3.409
|
7.459
|
40.245
|
|
|
0.98 %
|
2.53 %
|
4.04 %
|
11.76 %
|
2.66 %
|
14.94 %
|
|
aV6Z
|
1.506
|
2149.516
|
0.201
|
3.714
|
7.582
|
38.566
|
|
|
0.13 %
|
0.35 %
|
0.24 %
|
2.58 %
|
0.99 %
|
11.24 %
|
|
aV5Z
|
1.507
|
2148.515
|
0.196
|
3.827
|
7.579
|
37.392
|
|
MRCI
|
|
0.199 %
|
0.39 %
|
2.80 %
|
0.44 %
|
1.03 %
|
8.45 %
|
|
aVQZ
|
1.508
|
2145.544
|
0.202
|
3.681
|
7.560
|
38.766
|
|
|
0.26 %
|
0.53 %
|
0.24 %
|
3.50 %
|
1.29 %
|
11.70 %
|
|
Exp
|
|
1.499
|
2157
|
0.2096
|
3.33
|
7.6603
|
34.21
|
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE 16
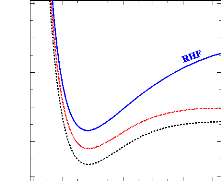
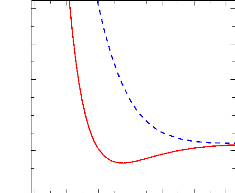
FIGURE 2.1: Comparaison des courbes de potentielle de RHF,
CASSCF et MRCI obtenues pour l'état électronique fondamental
X1Ó+ de la molécule
SiH+.
Il en ressort que la méthode MRCI et la base aug-cc-V6Z
sont appropriées pour le calcul des courbes de potentiel de la
molécule SiH+.
2.5 Résultats et discussions
Notons que tous les résultats présentés
dans cette discussion sont obtenus avec la méthode MRCI et la base aV6Z,
qui ont été choisi et validées dans le paragraphe
précédent. L'approche utilisée ici, consiste à
faire varier la distance interatomique entre les atomes Si+
et H et on calcule l'énergie potentielle à chaque
position. Nous avons ainsi choisi une grille de 45 distances
intranucléaires qui nous ont permis de tracer toutes les courbes.
La fig 2.1 représente une comparaison des courbes
d'énergie potentielle des méthodes RHF, CASSCF et MRCI obtenues
pour l'état électronique fondamental
X1Ó+ de la molécule
SiH+. On remarque que la courbe RHF est au-dessus de la
courbe CASSCF qui elle aussi est au-dessus de la courbe MRCI. Ceci s'explique
par le fait que, la corrélation est mieux prise en compte dans la
méthode MRCI comparé à RHF et CASSCF. Chacune de ces
courbes présentent un minimum, ce qui indique qu'il s'agit d'un
état stable.
1.00 2.00 3.00 4.00 5.00 6.00 7.00
Energie (hartree)
-288.80
-288.90
-289.00
-289.10
-289.20
-289.30
MCSCF MRCI
R (bohr)
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE 17
L'analyse des autres courbes permet de dégager les
faits suivants :
· La figure 2.2 représente les états
singulets calculés. Il est claire dans cette figure que l'état
fondamental X1Ó+ est totalement attractif. Les
états (A1Ð et B1Ð) présentent des
puits de potentiel, mais avec les profondeurs très faibles.
· Dans la figure 2.3, a l'exception de l'état
13Ó+ qui est un état globalement
répulsif, tous les autres états calculés sont attractifs,
puisqu'ils présentent des puits de potentiel, mais avec les profondeurs
variées.
· L'état fondamental X1Ó+
(figure 2.5) présente un puits de potentiel d'une profondeur de
-289.266 hartree localisé à la distance intranucléaire R =
2.86 bohr. Tous les autres puits sont situés au-dessus de celui de
l'état fondamental.
· En comparant nos courbes d'énergie à
celles de la référence [8], on constate que celles-ci ont la
même allure. Cette régularité des courbes prouve la bonne
précision avec laquelle elles ont été
déterminées.
1.00 2.00 3.00 4.00 5.00 6.00 7.00
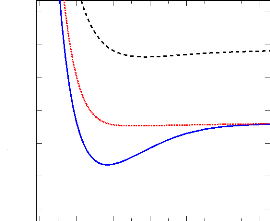
Energie (hartree)
-288.80
-288.90
-289.00
-289.10
-289.20
-289.30
-289.40
X1Ó+
A1Ð
B1Ð
R (bohr)
FIGURE 2.2: Courbe de potentiel MRCI des états
singulets de la molécule SiH+
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE
18
Energie (hartree)
-288.80
-288.85
-288.90
-288.95
-289.00
-289.05
-289.10
-289.15
-289.20
c3Ó-
a3Ð
d3Ð
b3Ó+
1.00 2.00 3.00 4.00 5.00 6.00 7.00
FIGURE 2.4: Courbes de potentiel MRCI des états
quintets de la molécule SiH+
R (bohr)
FIGURE 2.3: Courbes de potentiel MRCI des états
triplets de la molécule SiH+
1.00 2.00 3.00 4.00 5.00 6.00 7.00
Energie (hartree)
-288.80
-288.84
-288.88
-288.92
-288.96
-289.00
5Ó-
5Ð
R (bohr)
·
CHAPITRE 2. COURBES D'ÉNERGIE POTENTIELLE 19
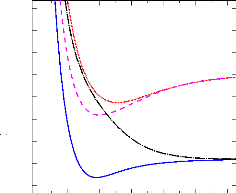
La figure de synthèse (figure 2.5) qui présente
la superposition de toutes les courbes MRCI, montre que les courbes obtenues
sont en accord avec les données du diagramme des états
moléculaires (cf. 3.1). En effet, les états 1,3Ó+
et 1,3H corrèlent à l'asymptote
2Pu + 2Sg ;
tandis que les états 3,5Ó- , 3,5H
corrèlent à l'asymptote 4Pg +
2Sg.
1.00 2.00 3.00 4.00 5.00 6.00 7.00
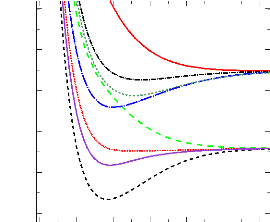
Energie (hartree)
-288.80
-288.90
-289.00
-289.10
-289.20
-289.30
c3 -
X1 +
a3H
A1H
e5 -
d3H
f5H
b3 +
Si+(2Pu) +
H(2Sg)
Si+(4Pg) +
H(2Sg)
R (bohr)
FIGURE 2.5: Courbe de potentiel MRCI des états les
plus bas de la molécule SiH+.
2.6 Conclusion
Dans ce chapitre nous avons présenté les
résultats de calculs des courbes d'énergie potentielle. Les
énergies de dissociation asymptotique sont obtenues. Il apparaît
bien que nos SEPs obtenues sont en accord avec l'allure générale
des courbes expérimentales et celles données par les valeurs
théoriques existantes. Nous utilisons ces résultats au chapitre
suivant pour déterminer les constantes spectroscopiques.
20
Chapitre 3
Spectroscopie de l'ion moléculaire
SiH+
3.1 Introduction
Le calcul des constantes spectroscopiques des systèmes
moléculaires permet d'obtenir de précieux renseignement sur les
grandeurs caractéristiques des molécules tels que: les distances
d'équilibre, les énergies de dissociation à
l'équilibre et les fréquences de vibration. Tous ces
éléments s'obtiennent en résolvant l'équation de
Schrödinger nucléaire.
{Tn + Vj (R)} ?nj (R) =
Etot?ni (R) (3.1)
dans laquelle Tn est l'opérateur
associé au mouvement nucléaire et Vj (R) le
potentiel subit par les noyaux durant leur mouvement.
Cette équation est très difficile à
résoudre. Pour le faire, on effectue des approximations. La
première de ces approximations consiste à séparer les
mouvements de vibration et de rotation des noyaux. Ainsi le problème se
réduit à la détermination des valeurs propres d'un
rotateur.
3.2 Rotation moléculaire
Cette première approximation consiste à
considérer les positions des noyaux fixes. On admet que la
molécule ne se déforme pas au cours de la rotation.
L'énergie potentielle due à la déformation interne est
nulle et la position d'équilibre de chaque noyau est donnée par
un vecteur constant - Ri ?= - ái ?: c'est
l'approximation du rotateur rigide. L'équation de Schrödinger
relative à cette approximation s'écrit donc :
CHAPITRE 3. SPECTROSCOPIE DE L'ION MOLÉCULAIRE
SIH+ 21
HRØR = TRØR = ERØR (3.2)
avec
X2TR =
i
mi (-? ù? -?ái)2 (3.3)
TR est l'énergie cinétique et ù est le
vecteur vitesse angulaire.
En introduisant les composantes ùx,
ùy et ùz de ù , et
áei , âei et
ãei de â dans le repère
mobile (O, x, y, z) et en développant l'équation (3.3), il vient
que :
2TR = Iexxù2x + Ieyyù2y + Iezzù2 z -
2Iexyùxùy -
2Iexzùxùz -
2Ieyzùyùz (3.4)
où
X X ~áe2
Ie xx = mi ~âe2 X
i + ãe2~ , Ie i + âe2~
(3.5)
yy = mi ~áe2 zz =
i + ãe2~ , Ie mi
i i i
i i i
sont les moments d'inertie par rapport aux axes
respectifs et
|
Ie xy
|
X=
i
|
Xmiáe i âe i , Ie xz =
i
|
Xmiáe i ãe i , Ie yz =
i
|
miâei ãe (3.6)
i
|
sont les produits d'inertie.
Dans le système de coordonnées (G, x, y, z) de
référence tel que les axes Gx, Gy, Gz coïncident avec les
axes principaux d'inertie de la molécule (G est le centre de
gravité), Iexy =
Iexz = Ieyz = 0. D'où
2TR = Iexxù2x + Ieyyù2y + Ie zzù2 (3.7)
z
L'équation (3.7) peut se mettre sous la forme :
M2
x
2TR = Ie
xx
|
+
|
M2 y
Ie yy
|
+
|
M2 z
Ie zz
|
(3.8)
|
où Mx, My, et Mz sont les
composantes du vecteur moment angulaire -? M défini par :
?T
Mi = = Ieiiùi, i = x, y, z
(3.9)
?ùi
Pour les molécules diatomiques linéaires qui
nous intéressent dans ce travail, Iezz = 0 et Iexx
+ Ieyy = Ie. Le problème se
réduit donc à l'étude de la rotation d'une masse
ponctuelle u fixée à une distance R de l'axe de rotation,
correspondant à un simple rotateur rigide.
Le hamiltonien du mouvement rotationnel s'écrit
alors
CHAPITRE 3. SPECTROSCOPIE DE L'ION MOLÉCULAIRE
SIH+ 22
B = Be - DeJ (J
+ 1) (3.17)
M2
HR = TR = (3.10)
2Ie
où
M2 = M2 x + M2 y +
M2 (3.11)
z
Les valeurs propres de M2sont
h2J(J + 1) où J est le moment
angulaire total. On déduit alors les niveaux d'énergie de
rotation
h2
ER = EJ = J (J + 1) =
hcBeJ (J + 1) (3.12)
2Ie
avec
h
Be = (3.13)
4ðIec
Be est la constante rotationnelle à
l'équilibre ;
Ie est le moment d'inertie à l'équilibre (Ie
= uR2e) ;
J est le nombre quantique rotationnel qui doit satisfaire la
condition J > |M| et prend
les valeurs 0, 1, 2, ...
La fréquence rotationnelle associée à
l'énergie ER est donnée par [27]
íR = 2rI V (J + 1) ti
2~Ie J = 2cBeJ (3.14)
Dans le traitement ci-dessus, nous avons supposé que la
distance internucléaire est fixe durant le mouvement rotatoire, ce qui
n'est pas entièrement vrai. Pour prendre en compte les
déformations du rotateur, l'énergie donnée par
l'équation (3.12) doit être corrigée.
Au second ordre de la théorie des perturbations, cette
énergie pour une molécule linéaire s'écrit [27,
28]
EJ = hcBeJ (J + 1) -
hcDeJ2 (J + 1)2
(3.15)
De est la constante de distorsion centrifuge.
Nous pouvons définir EJ de façon commode en
utilisant les termes rotationnels :
EJ
F(J) = = BeJ (J + 1) -
DeJ2 (J + 1)2
(3.16)
hc
= BJ (J + 1)
avec
CHAPITRE 3. SPECTROSCOPIE DE L'ION MOLÉCULAIRE
SIH+ 23
L'équation (3.17) montre que dans la
réalité, la constante rotationnelle doit être
corrigée par le caractère non rigide du rotateur.
3.3 Vibration moléculaire
Les vibrations moléculaires peuvent être
traitées en utilisant la mécanique classique afin de calculer les
fréquences de vibrations. Le postulat de base est que chaque vibration
peut être traitée comme si elle correspondait à un ressort.
Dans l'approximation harmonique, un ressort obéit à la loi de
Hooke : la force requise pour étirer le ressort est proportionnelle
à son extension.
3.3.1 Modèle mécanique de l'oscillateur
harmonique
Le modèle le plus simple pouvant représenter la
vibration d'une molécule est l'oscilla-teur harmonique. Un tel
oscillateur est défini comme point de masse m, rappelé
vers une position d'équilibre par une force, appelée force de
rappel, proportionnelle à la distance du point à sa position
d'équilibre (loi de HOOKE). Plus précisément, si
k est la constante de proportionnalité, appelée
constante de rappel, la loi fondamentale de la mécanique
(deuxième loi de NEWTON) permet d'écrire :
|
d2x
F = -mdt2
|
= -kx (3.18)
|
La solution de l'équation différentielle du
mouvement est bien connue:
x = x0 sin (2ðut +
è) (3.19)
u est la fréquence des oscillations donnée
par
Un système moléculaire diatomique peut se ramener
à ce schéma mécanique.
Nous supposons maintenant que les deux atomes ne sont plus
liés de façon rigide, mais peuvent osciller autour de leur
position d'équilibre le long de l'axe inter-nucléaire. Nous
supposons également que la force de rappel est proportionnelle à
l'élongation ce qui n'est qu'une première approximation.
CHAPITRE 3. SPECTROSCOPIE DE L'ION MOLÉCULAIRE
SIH+ 24
Si Re est la distance
inter-nucléaire à l'équilibre (de vibration) et R la
distance réelle des deux atomes au temps t on a, en appliquant la loi
fondamentale de la mécanique à chacun des atomes :
d2R1 m1 dt2
d2R2
= -k (R - Re)
, m2 dt2 = -k (R - Re)
(3.21)
R1 et R2 étant les positions, au même temps t,
des atomes 1 et 2 par rapport au centre de masse G de la
molécule. Or, d'après la définition du centre de masse, on
peut écrire :
m2
R1 =
m1
R, R2 =
R (3.22)
m1 + m2
m1 + m2
V =1
2
k (R -
Re)2 =
2ð2í2u (R -
Re)2 (3.27)
Les équations (3.21) et (3.22) peuvent être
combinées pour former une seule équation :
m1m2 d2R m1 + m2 dt2
= -k (R - Re)
(3.23)
Cette équation peut également s'écrire :
d2 (R - Re)
u dt2
= -k (R - Re)
(3.24)
Cette équation a une forme analogue à
l'équation (3.18). On peut donc considérer la molécule
comme un oscillateur harmonique (c'est-à-dire un point matériel
oscillant sous l'effet d'une force de rappel proportionnelle à
l'élongation) dont la masse est la masse réduite de la
molécule.
Si l'on compare les équations (3.18) et (3.24), on voit
que la fréquence angulaire d'oscil-lation ù (exprimé en
rad/s) et la fréquence í (en Hz ou en s-1) sont
données par :
ù = ~, ù = 2ðí =
í = 2ð u (3.25)
Dans un tel mouvement, il y a continuellement transformation
de l'énergie potentielle en énergie cinétique. On peut
donc caractériser l'énergie du système par son
énergie potentielle V . Celle-ci est liée à la force F par
la relation :
|
F = -
dV dx
|
= -k (R -
Re) (3.26)
|
L'expression de l'énergie potentielle est obtenue par
intégration de cette relation, ce qui donne si l'on suppose que V =
0, quand R = Re :
CHAPITRE 3. SPECTROSCOPIE DE L'ION MOLÉCULAIRE
SIH+ 25
C'est l'équation d'une parabole avec un minimum nul
pour R = Re. L'énergie totale est égale
à l'énergie potentielle pour une vitesse nulle,
c'est-à-dire lorsque la masse atteint les positions d'élongation
minimum ou maximum.
Selon la mécanique quantique, le mouvement de la
molécule est décrit par l'équation de Schrödinger qui
dans ce cas s'écrit :
|
d2Ø dR2 +
|
8ð2u h
|
~ ~
E- 1
2k(R-Re)2 Ø =0 (3.28)
|
E est l'énergie totale de la molécule et
Ø (R) la fonction d'onde, dont le carré du module donne la
distribution de probabilité de la distance internucléaire R. La
solution de cette équation fournit les valeurs possibles de
l'énergie totale :
E =s
(+) hí(v + I (3.2)
2ð u 2 2
í est la fréquence de vibration et v est un
nombre quantique de vibration pouvant prendre les valeurs : v = 0, 1, 2,....
L'énergie de la molécule ne peut posséder que certaines
valeurs bien définies ; on parle alors de valeurs discrètes.
3.3.2 Modèle quantique de l'oscillateur
anharmonique
Lorsque la représentation de la courbe de potentielle
n'est pas une parabole, la branche droite doit tendre asymptotiquement vers une
valeur finie. La branche gauche suit à peu près la forme
parabolique. En première approximation on a montré
théoriquement que l'on pouvait représenter la courbe par la
formule :
V (R) = f(R - Re)2 + g(R
- Re)3 (3.30)
g étant un coefficient beaucoup plus petit que f. Dans
un tel oscillateur, la force de rappel n'est plus proportionnelle à la
distance. La nouvelle valeur du potentiel portée dans l'équation
de Schrödinger donne les niveaux d'énergie. Ces niveaux
correspondent à un développement en série de la forme :
2 3
1 1 1
Ev = hí v + 2 -
híxe v + 2 +
híye v + 2 + (3.31)
xe est une constante sans dimension
beaucoup plus petite que l'unité ; les termes suivants, en puissance
croissante de (v + 1/2) et qui font intervenir des constantes analogues
ye, ze, . . . de plus en plus petites
(ze « ye «
xe), deviennent rapidement négligeables. En
pratique, les
CHAPITRE 3. SPECTROSCOPIE DE L'ION MOLÉCULAIRE
SIH+ 26
dans lesquelles l'anharmonicité est prise en compte. La
constante rotationnelle Be est corrigée et rend
compte de la vibration :
deux premiers termes suffisent à représenter les
résultats expérimentaux avec une précision acceptable.
L'expression qui donne la valeur en cm-1 des
niveaux d'énergie est appelée terme spectral noté
G(v) :
Ev hc
( ) ( )2
v + 1 v + 1
= G(v) = ùe - ùexe
(3.32)
2 2
Le diagramme de niveaux d'énergie de l'oscillateur
anharmonique est donc composé d'une série de lignes qui ne sont
pas tout à fait équidistantes. L'intervalle entre les lignes
décroît progressivement d'une petite quantité chaque fois
que l'on passe d'un niveau à un niveau supérieur.
La quantité ùexe
est appelée constante d'anharmonicité et le terme qui
la contient est nommé correction d'anharmonicité.
3.4 Mouvement rotovibrationel des molécules
diatomiques
Nous avons traité les mouvements de rotation et de
vibration de manière complètement indépendante. En
réalité ces deux types de mouvements ne peuvent pas être
traités séparément l'un de l'autre. Le problème
doit donc être traité en négligeant le couplage entre les
mouvements de vibration et de rotation, l'excitation de la molécule
diatomique doit être considérée en première
approximation comme une somme d'excitation d'un oscillateur harmonique et d'un
rotateur rigide. Dans ce cas, l'énergie des niveaux rotationnels
s'écrit :
1
E(õ,j) = Eõ + Ej =
hù(õ + 2) + hcBj(j + j) (3.33)
Avec les règles de sélections : Äõ =
#177;1 et Äj = #177;1.
En prenant en compte le couplage des mouvements rotatoire et
vibratoire, et en procédant à une correction à un ordre
supérieur à 2 dans la théorie des perturbations. On
obtient les valeurs propres suivantes :
( ) ( )2
v + 1 v + 1
Ev = ~ùe
- hùexe +
hcBvj (j + 1) - hcDvj2 (j +
1) (3.34)
2 2
CHAPITRE 3. SPECTROSCOPIE DE L'ION MOLÉCULAIRE
SIH+ 27
( ~
v + 1
Bv = Be -
áe = B0 - áev,
(3.35)
2
avec
áe
B0 = Be + 2 . (3.36)
áe est un nombre positif
spécifique de la molécule (áe «
Be). De même la constante de distorsion centrifuge
due à l'allongement de la liaison est aussi corrigée par la
vibration et s'écrit :
( )
v + 1
Dv = De + â
(3.37)
2
le facteur de correction â «
De.
3.5 Constantes Spectroscopiques
3.5.1 Représentation mathématique des
courbes de potentiel
Plusieurs formules théoriques ont été
proposées pour représenter de manière adéquate la
courbe de potentiel. La formule à deux termes déjà
citée (3.30) n'est pas satisfaisante lorsqu'on s'écarte trop du
minimum. La formule la plus utilisée est la formule de
Morse,
V (R - Re) = De (1 -
e-â(R-Re))2 (3.38)
avec
s~2ðcu ~
â = ùe (3.39)
Deh
où c est la vitesse de la lumière, u la masse
réduite et h la constante de PLANCK. On calcule â à partir
des valeurs expérimentales de ùe et
De .
3.6 Résultats et Discussions
Nous calculons les constantes spectroscopiques en utilisant le
potentiel de Morse donné par l'équation (3.38). Le choix de cette
forme de potentiel est dû au fait qu'elle représente au mieux les
courbes de potentiel.
CHAPITRE 3. SPECTROSCOPIE DE L'ION MOLÉCULAIRE
SIH+ 28
TABLE 3.1: Constantes spectroscopiques de
l' état fondamental X1Ó+
obtenues par le fit du potentiel de Morse
|
Const.
|
CASSCF
|
Méthodes
MRCI
|
Ecart (%)
|
Auteurs
Réf.[29]
|
Réf.[9]
|
Exp.[7]
|
|
Re(Å)
|
1.517
|
1.506
|
0.13
|
1.505
|
1.507
|
1.499
|
|
Be(cm-1)
|
7.479
|
7.582
|
0.99
|
-
|
7.6283
|
7.6603
|
|
áe(cm-1)
|
0.200
|
0.201
|
0.24
|
-
|
0.2139
|
0.2096
|
|
ùe(cm-1)
|
2108.160
|
2149.516
|
0.35
|
2172
|
2139.19
|
2157.10
|
|
ùexe(cm-1)
|
38.027
|
38.566
|
11.24
|
-
|
34.22
|
34.21
|
|
De(eV)
|
3.623
|
3.714
|
2.58
|
3.40
|
2.984
|
3.20
|
Le tableau 3.1 présente les constantes spectroscopiques
de l'état fondamental
X1Ó+. On remarque que,
l'écart entre nos résultats et ceux expérimentaux est
très faible, ce qui prouve la bonne précision avec laquelle nos
résultats ont été déterminées.
Les constantes spectroscopiques des autres états les
plus bas de la molécule SiH+ sont
présentées dans les tableaux ci-dessous.
CHAPITRE 3. SPECTROSCOPIE DE L'ION MOLÉCULAIRE
SIH+ 29
TABLE 3.2: Constantes spectroscopiques des états
1H, 5Ó- et
5H obtenues par le fit du potentiel de Morse
|
Etat
|
Const.
|
Méthodes
CASSCF MRCI
|
Ecart (%)
|
Auteurs
Réf.[29]
|
Exp.[7]
|
|
A1H
|
Re(Å)
|
2.594
|
1.856
|
0.80
|
1.865
|
1.871
|
|
Be(cm-1)
|
2.557
|
4.993
|
1.63
|
-
|
4.9125
|
|
áe(cm-1)
|
-0.132
|
1.165
|
51.94
|
-
|
0.7667
|
|
ùe(cm-1)
|
296.082
|
532.575
|
13.67
|
451
|
468.60
|
|
ùexe(cm-1)
|
0
|
132.338
|
-
|
-
|
-
|
|
De(eV)
|
-
|
0.066
|
-
|
0.16
|
-
|
|
B1H
|
Re(Å)
|
-
|
3.876
|
-
|
-
|
-
|
|
Be(cm-1)
|
-
|
4.090
|
-
|
-
|
-
|
|
áe(cm-1)
|
-
|
0.236
|
-
|
-
|
-
|
|
ùe(cm-1)
|
-
|
812.647
|
-
|
-
|
-
|
|
ùexe(cm-1)
|
-
|
34.703
|
-
|
-
|
-
|
|
De(eV)
|
-
|
0.590
|
-
|
-
|
-
|
|
5Ó-
|
Re(Å)
|
2.061
|
1.987
|
-
|
-
|
-
|
|
Be(cm-1)
|
4.049
|
4.358
|
-
|
-
|
-
|
|
áe(cm-1)
|
0.271
|
0.240
|
-
|
-
|
-
|
|
ùe(cm-1)
|
770.113
|
918.039
|
-
|
-
|
-
|
|
ùexe(cm-1)
|
39.393
|
37.595
|
-
|
-
|
-
|
|
De(eV)
|
0.467
|
0.695
|
-
|
-
|
-
|
|
5H
|
Re(Å)
|
6.445
|
7.769
|
-
|
-
|
-
|
|
Be(cm-1)
|
0.414
|
1.018
|
-
|
-
|
-
|
|
áe(cm-1)
|
3.605
|
0.246
|
-
|
-
|
-
|
|
ùe(cm-1)
|
2.450
|
103.874
|
-
|
-
|
-
|
|
ùexe(cm-1)
|
38.015
|
26.519
|
-
|
-
|
-
|
|
De(eV)
|
0
|
0.013
|
-
|
-
|
-
|
CHAPITRE 3. SPECTROSCOPIE DE L'ION MOLÉCULAIRE
SIH+ 30
TABLE 3.3: Constantes spectroscopiques des états
3II ,3E+et 3E-
obtenues par le fit du potentiel de Morse
|
Etats
|
Const.
|
CASSCF
|
Méthodes
MRCI
|
Auteurs
Réf.[29] Réf. [9]
|
|
a3II
|
Re(Å)
|
1.553
|
2.917
|
1.538
|
1.540
|
|
Be(cm-1)
|
7.136
|
7.222
|
-
|
7.3553
|
|
áe(cm-1)
|
0.418
|
0.394
|
-
|
0.5179
|
|
ùe(cm-1)
|
1691.031
|
1739.559
|
1793
|
1729.79
|
|
ùexe(cm-1)
|
78.413
|
73.447
|
-
|
103.68
|
|
De (eV )
|
1.130
|
1.277
|
1.14
|
0.985
|
|
b3II
|
Re(Å)
|
-
|
1.889
|
-
|
-
|
|
Be(cm-1)
|
-
|
4.822
|
-
|
-
|
|
áe(cm-1)
|
-
|
0.118
|
-
|
-
|
|
ùe(cm-1)
|
-
|
1345.596
|
-
|
-
|
|
ùexe(cm-1)
|
-
|
22.145
|
-
|
-
|
|
De(eV)
|
-
|
2.534
|
-
|
-
|
|
3E+
|
Re(Å)
|
4.508
|
4.229
|
-
|
-
|
|
Be(cm-1)
|
0.847
|
0.962
|
-
|
-
|
|
áe(cm-1)
|
0.263
|
0.249
|
-
|
-
|
|
ùe(cm-1)
|
67.283
|
94.011
|
-
|
-
|
|
ùexe(cm-1)
|
22.209
|
26.137
|
-
|
-
|
|
De(eV)
|
0.006
|
0.010
|
-
|
-
|
|
3E-
|
Re(Å)
|
1.623
|
1.587
|
-
|
-
|
|
Be(cm-1)
|
6.529
|
6.812
|
-
|
-
|
|
áe(cm-1)
|
0.245
|
0.237
|
-
|
-
|
|
ùe(cm-1)
|
1564.660
|
1669.164
|
-
|
-
|
|
ùexe(cm-1)
|
40.836
|
39.856
|
-
|
-
|
|
De(eV)
|
1.858
|
2.167
|
-
|
-
|
CHAPITRE 3. SPECTROSCOPIE DE L'ION MOLÉCULAIRE SIH
31
3.7 Conclusion
Dans ce chapitre, nous avons déterminé les
constantes spectroscopiques à partir de l'ana-lyse de Morse. Pour
obtenir ces valeurs, nous avons assimilé la molécule à un
rotateur dans les approximations harmonique et anharmonique. Les aspects
vibratoire et rotatoire de la molécule ont été
également pris en compte.
32
Conclusion générale et perspectives
Dans ce travail, la motivation principale était de
déterminer les courbes d'énergie potentielle et les constantes
spectroscopiques de l'ion moléculaire SiH+. Pour mener
à bien cette étude, nous avons utilisé la base aV6Z et
nous nous sommes servi de la méthode de corrélation
électronique MRCI qui prend pour fonction d'onde de
référence, la fonction d'onde CASSCF.
Au regard de nos résultats, on constate bien qu'il y a
un bon accord avec les résultats expérimentaux ainsi que ceux des
autres auteurs. L'analyse de ces résultats montre que la méthode
MRCI donne de très bons résultats parmi les autres
méthodes que nous avons utilisées dans ce travail. En effet les
résultats obtenus par cette méthode sont nettement meilleurs.
Ceci est dû au fait que dans l'approximation MRCI la fonction d'onde
utilisée permet une bonne prise en compte de la corrélation
électronique.
En perspective du travail entamé dans le présent
mémoire, nous envisageons poursuivre cette étude en
déterminant un plus grand nombre d'états excités. Nous
souhaitons aussi étudier les états de Rydberg qui sont hautement
excité.
33
Bibliographie
[1] J. A. Pople, M. Head-Gordon et K. Raghavachari, J.
Chem.Phys., 87, 5968 (1987).
[2] K. Raghavachari, Trucks, J. A. Pople et M. Head-Gordon,
Chem. phys. Lett., 157, 479 (1989).
[3] N. Grevesse and A. Sauval, Astron. Astrophys., 9, 232
(1970).
[4] N. Grevesse and A. Sauval, J. Quant. Spectrosc. Radiation
Transfer 11, 4231 (1971).
[5] A. A. de Almeida and P.D. Sing, Astrophys. Space Sci. 56,
415 (1978).
[6] A. E. Douglas and B.L. Lutz, Can. J. Phys. 48, 247
(1970).
[7] T. A. Carlson, J. Copley, N. Duric, N. Elander, P. Erman, M.
Larsson, M. Lyra, Astron. Astrophys., 83, 238 (1980).
[8] P.J. Bruna and S.D. Peyerimhoff, Bull. Soc. Chim. Belg. 92,
525 (1983).
[9] D.M. Hirst, Chem. Phys. Letters 128, 504 (1986).
[10] J. M. O. Matos, V. Kello, B.O. Roos and A.J. Sadlej, J.
Chem. Phys. 89, 423 (1988).
[11] K.P. Huber and G. Herzberg, Molecular spectra and molecular
structure, Vol. 4. Constants of diatomic molecules (Van Nostrand Reinhold, New
York, (1979).
[12] R. Ahlrichs, P. Scharf and C. Erhardt, J. Chem. Phys. 82,
890 (1985).
[13] E. Schrödinger, Ann. der Phys. 79, 361 (1926); ibid.
79, 734 (1926).
[14] C. Nkem, Thèse de Doctorat/Ph.D, Excitation
rotationnelle des molécules d'intéret astrophysique : Sections
efficaces et de taux de collisions de SiH++He, HCP + para-H2 et HCNH
+ He (2011).
[15] C. Nkem, cours de Physique moléculaire Master 2,
Université de Douala (2014).
[16] M. Born and J. R. Oppenheimer, Ann. Phys. 84, 457
(1927).
[17]
BIBLIOGRAPHIE 34
D. R. Hartree. Proc. Cambridge Phil. Soc. Math. Phys. Sci.,
24, 328, (1928).
[18] V. A. Fock. Z. Phys., 61, 126, (1930).
[19] J. C. Slater. Phys. Rev, 34, 1293, (1929), Ibid.
35, 210 (1930)
[20] C. C. J. Roothaan, Rev Mod. Phys, 32, 179
(1960).
[21] A. Szabo and N. S. Osthund, Modern Quantum Chimistry, Mc
Graw-Hill, 1982; R. Mc Weeny, Methodes of Molecular Quantum Mechanics,
Academic Press, (1992)
[22] Werner H. J and Knowles P. J, J. Chem. Phys, 73, 2342
(1980).
[23] S. R. Langhoff and E. R. Davidson, int. J. Quantum
Chem. 8, 61 (1974).
[24] Werner H. J and Knowles P. J., J. Chem. Phys, 89, 5803
(1988)
[25] MOLPRO is a package of ab initio programs written
by H.-J. Werner and P. J. Knowles. Molpro, version 2002.6 (2002). For
detailed informations, see
http://www.molpro.net.
[26] C. Nkem, Mémoire du Diplôme
d'étude approfondie (DEA), CEPAMOQ - Université de Douala
(2005)
[27] G. Herzberg, molecular Spectra and molecular Structure, I.
Spectra of diatomic molecules, Second Edition, VNR New-York
[28] L. Landau and E. Lifchitz, Mécanique Quantique,
Edition Mir, Moscou (1967)
[29] Abani B. Annigrahi, Robert J. Buenker, Gerhard Hirsch,
Jian-ping Gu., Chem. Phys. Lett., 237, 204 (1995).
| 


