|
É?ÈÚÔáÇ
É?ØÇÑÞã?ÏáÇ
É?ÑÆÇÒÌáÇ
É?ÑæãÌáÇ
République Algérienne démocratique
et populaire
Ministère de l'enseignement et de la recherche
scientifique
Université Djillali LIABES de Sidi Bel
Abbès
Faculté des sciences
Département de
biologie
|
De fin d'étude pour l'obtention du
diplôme
d'Ingénieur d'état en
Biologie
Option : contrôle de qualité et
analyses
Thème:
Profil calcique chez les
femmes ménopausées
Présenté par: Mr.
LATAB Mohamed Reda Mr. MEZOUARI Bouazza
Soutenu le: 19-0 7-2006
Président: Mr. BENALI. M
M-C
Examinateur I: Mr. MISSOURI. M
M-A
Examinateur II: Mme. BEKEKCI. K
M-C
Promoteur: Mr. BENINE. A
M-A
LISTE DES ABREVEATIONS
F. S. H : Follicle-stimulating Hormone.
L. H : Hormone lutéinisante.
VLDL : Very low-density lipoprotein
LDL : Low-density lipoprotein.
HDL : High Density Lipoproteins.
ApoB : Apoprotéine B.
THS : Traitement Hormonal Substitutif.
Pyr : Pyridinoline.
Dpyr : Déoxypyridinolin.
PTH : La parathormone.
AMPc : Adénosine monophosphate
cyclique.
BAAH : Branche ascendante de l'anse de
Henlé.
DMO : Mesure de densité minérale
osseuse.
IMC : Indice de Masse Corporelle.
HPT I : Hyperparathyroïdie primitive.
HPT 2 : Hyperparathyroïdie secondaire.
HTA : Hypertension artérielle.
ECG : Electrocardiogramme.
HHF : L'hypercalcémie-hypocalciurie
familiale.
TNF : Tumor necrosis factor.
CSF : Colony stimulator factor.
TGF : Transforming growth factor.
PTHrP : PTH related peptide.
EDTA : Acide
éthylènediaminotétraacétique.
RÉSUMÉ
La ménopause est une étape incontournable de la
vie des femmes, survient avec la baisse de production par les ovaires
principalement des deux hormones régissant la vie génitale et
sexuelle de la femme : La Progestérone et les oestrogènes .Tout
au long de sa vie, la femme est protégée par ces deux hormones
des maladies cardio-vasculaires et de l'ostéoporose. Après la
ménopause, la situation s'inverse et au bout de 10 à 15 ans
apparaît l'ostéoporose avec son cortège de douleurs et de
fractures.
L'étude a concerné un échantillon 60
femmes ménopausées d'ages différents habitants la ville de
Sidi Bel Abbés et Ain Témouchent. Plusieurs couches sociales ont
été touchés par l'enquête ce qui garantie la
représentativité de l'échantillon.
Les résultats trouvés ont mis en évidence un
état de carence d'apport alimentaire en calcium donc des besoins
insuffisamment recouverts
Il est plus que certain de revoir la qualité et la
quantité des apports alimentaires chez les femmes
ménopausées, Insister sur une supplémentation calcique
pouvant réduire les risques de fracturaires.
Le maintien d'une alimentation riche en calcium est primordial
à tous les âges de la vie ; en son absence, une
supplémentation médicamenteuse s'avère utile
Mots clés
Summary
The menopause is an inescapable stage of the life of the
women, arises with the decline of production by ovaries mainly both hormones
governing the genital and sexual life of the woman. Progestérone and
oestrogens .Tout during its life, the woman is protected by these two hormones
of the cardiovascular diseases and the osteoporosis. After the menopause, the
situation is reversed and at the end of 10 - 15 years appears the osteoporosis
with its procession of pains and fractures.
The study concerned a sample 60 ménopausées
women of ages various inhabitants the city of Sidi Bel Abbés and Ain
Témouchent. Several sectors of society were got(touched) by the inquiry
what guaranteed the representativeness of the sample.
The found results put in evidence a state of deficiency of
food(dietary) contribution in calcium thus insufficiently covered needs .
It is more than someone to see again(to revise) the quality
and the quantity of the food(dietary) contributions at the
ménopausées women, to Insist on a supplémentation calcique
which can reduce the risks of fracture.
The preservation of a food rich in calcium is essential at all
the ages of the life; in its absence, a medicinal supplémentation turns
out useful.
Keywords :
SOMMAIRE
PAGES
INTRODUCTION GENERALE 01
PARTIE I: PARTIE BIBLIOGRAPHIQUE
CHAPITRE I: LA MENOPAUSE
I. Définition 03
II. Diagnostique 03
III. Physiopathologie et endocrinologie de la
ménopause 06
IV. Risque lié à la ménopause
08
IV.1. Risque cardio-vasculaire et ménopause
08
IV.2. Incidence de la ménopause 09
IV.3. Effets de la ménopause sur l'appareil
génito-urinaire 11
V. Les bilans biologiques 11
V.1. Le bilan hormonal 11
V.2. Bilan phosphocalcique 12
V.2.1. Marqueurs de la formation de l'os
12
V.2.1.1. Les phosphatases alcalines
12
V.2.1.2. L'ostéocalcine ou Bone Gla
Protein (BGP) 12
V.2.2. Marqueurs de la résorption de l'os
13
V.2.2.1. L'index de NORDIN
13
V.2.2.2. Hydroxyproline 13
V.2.2.3. Pyridinoline 13
V.2.2.4. Cross laps 14
VI. Le traitement hormonal substitutif 15
VI.1. Contre-indications du THS 17
VI.2. Surveillance du THS 18
VI.3. Les différentes formes galéniques de THS
19
Conclusion 21
CHAPITRE II: LE METABOLISME PHOSPHOCALCIQUE
I. Métabolisme du calcium 23
I.1. Rôle du calcium 23
I.2. Répartition du calcium dans l'organisme
23
I.2.1. Secteur extracellulaire
24
I.2.2. Secteur intracellulaire
26
I.2.3. Teneur en calcium du squelette
26
I.3. Absorption du calcium 26
I.4. Élimination du calcium 27
I.5. Besoins en calcium 27
I.5.1. Besoins quotidien
27
I.5.2. Teneur en calcium des aliments
29
I.5.3. Mouvements calciques journaliers
30
I.6. Régulation du calcium 31
I.6.1. La parathormone 31
I.6.1.1. Effets de la parathormone sur le rein
31
I.6.1.2. Effets de la parathormone sur l'os
33
I.6.1.3. Effets de la parathormone sur
l'intestin 33
I.6.2. Vitamine D 33
I.6.2.1. Effet du calcitriol sur le grêle
34
I.6.2.2. Effet du calcitriol sur l'os
34
I.6.3. Calcitonine . 34
II. Metabolisme du phosphore 35
II.1. Rôle du phosphore 35
II.2. Distribution dans l'organisme 35
II.2.1. Plasma 35
II.3. Absorption du phosphore 36
II.4. Excrétion du phosphore 36
Conclusion 37
CHAPITRE III : MENOPAUSE ET ALIMENTATION
I. L'OSTÉOPOROSE 40
I.1. Définition 40
I.2. Facteurs de risques 41
I.2.1. Ostéoporose secondaire
41
I.2.2. Ostéoporose primitive
41
I.3. Epidémiologie 42
I.4. Attitude clinique 43
I.4.1. Place de
l'ostéodensitométrie dans cette stratégie
43
I.4.2. Ex biologiques 45
I.4.2.1. Bilan sanguin de 1ère intention
45
I.4.3. Arbre décisionnel dans
l'ostéoporose 45
I.4.4. Les marqueurs biologiques du remodelage
osseux 46
I.5. Les traitements 46
I.5.1. Prévention primaire
46
I.5.1.1. Pour augmenter le capital osseux
47
I.5.1.2. Freiner la perte osseuse
47
I.5.1.2.1. Traitement hormonal substitutif
47
I.5.1.2.2. Traitement en 2004 - ANAES
48
II. L'HYPERCALCÉMIE 51
II.1. Introduction 51
II.2. Manifestation cliniques et conséquences
physiologiques de
l'hypercalcémie aiguë 51
II.2.1. Action sur le coeur
51
II.2.2. Action sur les muscles lisses
53
II.2.3. Action sur le rein
54
II.2.4. Action sur la plaque neuromusculaire
54
II.3. Étiologies des hypercalcémies aiguës
55
II.3.1. Hypercalcémie et
parathyroïde 55
II.3.1.1. Hyperparathyroïdie primaire
55
II.3.1.2. Hypercalcémie-hypocalciurie
familiale . 58
II.3.1.2.1. Traitement par le lithium .
59
II.3.2. Hypercalcémie et
néoplasie 60
II.3.3. Hypercalcémie et vitamine D .
62
II.4. Hypercalcémie associée à une
élévation du turn over osseux 63
II.4.1. Hyperthyroïdie
63
II.4.2. Immobilisation 63
II.4.3. Intoxication à la vitamine A
64
II.5. Hypercalcémie associée à une
insuffisance rénale 64
II.5.1. Hyperparathyroïdie secondaire
sévère 64
II.5.2. Hyperparathyroïdie tertiaire
66
II.5.3. Syndrome des buveurs de lait et
d'alcalins ou syndrome de
Burnett 67
II.6. Traitement des hypercalcémies aiguës
67
II.6.1. Correction de la déshydratation
68
II.6.2. Augmentation de l'excrétion
urinaire de calcium 68
II.6.3. Inhibition de la résorption
osseuse 68
II.6.3.1. Biphosphonates
69
II.6.3.2. Calcitonine 70
II.6.3.3. Plicamycine 71
II.6.4. Autres traitements
71
II.6.5. Traitement de l'étiologie
72
Conclusion 72
III. L'HYPOCALCÉMIE 73
III.1. Définition
73
III.2. Manifestations cliniques
73
III.2.1. Manifestations neuromusculaires
73
III.2.2. Manifestations cutanées
74
III.2.3. Manifestations cardio-vasculaires
74
III.3. Etiologies des hypocalcemies
75
III.3.1. Hypocalcémies
parathyrodïdiennes 75
III.3.2 Déficits en vitamine D
76
III.3.3. Insuffisance rénale
77
III.3.4. Transfert de calcium ionisé
78
III.4. Traitement 78
III.4.1. Hypocalcémie aiguë
79
III.4.2. hypocalcémies chroniques
79
PARTIE II: PARTIE EXPERIMENTALE
Matériel et méthodes 81
I. Introduction 81
II. Présentation du service 81
III. Matériel utilisé au sein du service
81
IV. Méthode du prélèvement d'un
échantillon de sang 82
IV.1. But 82
IV.2. Matériels utilisé 82
IV.3. Emplacement de la ponction 82
IV.4. Technique 82
IV.4.1. Service de biochimie
83
IV.4.2. Service de l'hématologie
83
IV.4.3. Service de sérologie
83
IV.5. Dosage de Calcium 84
IV.5.1. Généralités ..
84
IV.5.2. Principe 84
IV.5.3. Matériel et réactifs
84
IV.5.4. Mode opératoire
85
IV.5.5. Valeur normales
86
IV.5.6. Interprétations .
86
IV.5.6.1. Variations physiologiques
86
IV.5.6.2. Variations pathologiques
86
IV.6. Dosage automatique 87
IV.6.1. Condition de prélèvement
87
IV.6.2. Matériel 87
IV.6.3. Mode opératoire
87
IV.6.4. Discussion 88
V. L'enquête alimentaire 88
V.1. Description de l'échantillon étudiée
88
V.2. Définition 89
V.3. Journal alimentaire 89
V.4. Recueil des informations 89
V.5. Traitement des résultats de l'enquête
89
V.6. Préparation psychologique des sujets
90
VI. Les analyses biologiques 90
Résultats 91
Interprétations et discussions 100
Conclusion générale
103
Annexes
INTRODUCTION GÉNÉRALE
Ethymologiquement, le terme ménopause signifie
"cessation des règles". La ménopause ou climatère est un
processus physiologique normal qui marque la fin de la période
féconde. L'arrêt de la fonction ovarienne et de la
sécrétion des hormones féminines - les estrogènes
et la progestérone - entraîne une disparition des
règles.
La ménopause est un phénomène naturel qui
ce produit chez la femme, se situant normalement entre 50 et 55 ans,
caractérisée par l'extinction des fonctions ovariennes et la
disparition totale de la menstruation. On admet que la ménopause est
installée lorsqu'il n'y a pas eu de règles depuis un an.
La ménopause est précédée par une
longue période de transition qui commence dès l'âge de 40
ans et au cours de laquelle apparaissent les premières modifications
biologiques. Cette période de transition correspond à la
préménopause et la périménopause.
Tout au long de sa vie, la femme est protégée
par ces hormones des maladies cardio-vasculaires et de l'ostéoporose.
Après la ménopause, la situation s'inverse et au bout de 10
à 15 ans apparaîtront ostéoporose avec son cortège
de douleurs et de fractures, maladies cardio-vasculaires avec infarctus et
accidents vasculaires cérébraux.
Le paysage du traitement hormonal substitutif de la
ménopause s'est considérablement modifié ces 5
dernières années. Ce qui apparaissait presque comme une faute
médicale (ne pas prescrire de THS estroprogestatif chez une femme
ménopausée), il y a quelques années... est maintenant
devenu une position raisonnable dans bon nombre de cas ! La raison en est une
ré-évaluation du rapport bénéfice/risques du
THS.
Chez nous la prise de poids ne semble pas
intéressée l'esthétique des femmes et partant, aucun
changement dans les habitudes alimentaires n'est observé, si ceux n'est
une alimentation aliénée due au pouvoir d'achats des familles.
Notre travail était effectué prés d'une
population de femme ménopausée au chef lieu de la wilaya de S B A
et A Temouchent, et a pour objectif de mieux connaître la relation entre
La ménopause et Alimentation,comprendre les risques courus pour
sensibiliser les femmes concernées,savoir si les femmes
ménopausées aboutisse a une suffisance ou insuffisance des
besoins alimentaires demandé en cours de ce stade de vie, savoir quel
est l'intérêt de faire des bilans biologiques comme c'est le cas
pour le bilant phosphocalcique et de proposé des traitements pour les
maladies causés par ce phénomène en relation avec
l'alimentation.
I. Définition
La ménopause est une étape incontournable de la
vie des femmes qui correspond à la baisse de production par les ovaires,
principalement de deux hormones qui régissent la vie génitale et
sexuelle de la femme : La « Progestérone » et les
« Oestrogènes ».
Ces hormones sont produites par les ovaires de la
façon suivante : Une glande située à la base du cerveau et
qui s'appelle l'Hypophyse produit principalement deux hormones
appelées F.S.H. et L.H. Ces hormones agissent sur les
ovaires et leur font produire, pour l'une des oestrogènes, et
pour l'autre de la progestérone. C'est la production de ces
hormones et leurs variations tout au long du cycle qui provoquent l'ovulation
puis les règles en l'absence de fécondation. Deux autres hormones
plus accessoires sont produites mais varient d'une manière moins
importante au moment de la ménopause.
Après un certain âge, variable selon les femmes,
mais surtout après un certain nombre de cycles, les fonctions de
sécrétions hormonales des ovaires s'altèrent : ceux-ci
répondent de moins en moins bien aux stimulations de la glande
hypophyse, qui se trouve à la base du cerveau. Cette ménopause
évolue en plusieurs étapes de durée variable, parfois
tellement brèves chez certaines femmes qu'elles passent
inaperçues. (ROZENBAUM , 1991)
II. Diagnostic
· La ménopause est un phénomène
naturel défini par la disparition des règles
(aménorrhée) depuis au moins un an, associée à un
syndrome climatérique bouffées vasomotrices). La majorité
des symptômes sont liés à une carence oestrogénique
qui est secondaire à l'épuisement du capital folliculaire
ovarien.
· La ménopause survient en moyenne vers l'âge
de 50 ans. Elle est précédée d'une phase dite de «
pré-ménopause » qui est caractérisée
par un
raccourcissement des cycles, une dysovulation puis une
anovulation, qui s'installe environ 5 ans avant l'interruption
définitive des règles.
· Au niveau clinique, la carence oestrogénique
est associée aux bouffées de chaleur et à une
sécheresse vaginale. Du fait de l'absence d'imprégnation
oestrogénique, l'endomètre utérin ne peut
proliférer, ce qui conduit à l'absence d'hémorragies de
privation, spontanées ou après administration de progestatifs.
· Au plan biologique, la ménopause se
caractérise par une diminution de l'estradiol plasmatique,
associée à une élévation des
gonadotrophines, en particulier de la FSH.
À ces manifestations secondaires aux profondes
modifications hormonales s'ajoutent des conséquences liées
à l'âge, qu'il est souvent difficile de dissocier des
conséquences hormonales. De plus, le retentissement psychologique de la
perte de la fertilité et du changement de l'image corporelle des femmes
entre aussi pour une part importante dans les symptômes qu'elles
ressentent au moment de cette étape importante de la vie.
(LERIDON , 1992)
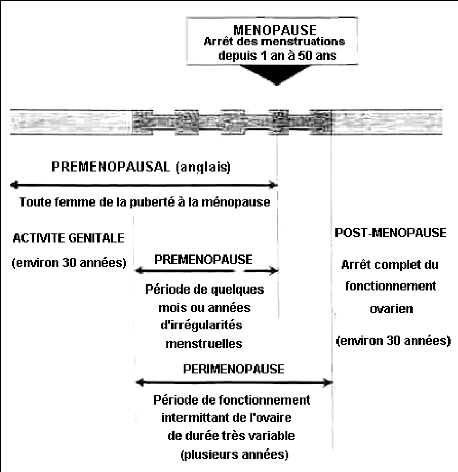
Figure 1 : Définitions :
calendrier de survenue de la ménopause.
(LERIDON , 1992)
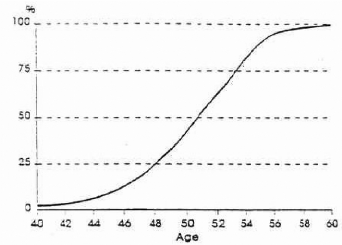
Figure 2 : Pourcentage de femmes
ménopausées (naturellement) selon l'âge
(LERIDON, 1992)
III. Physiopathologie et endocrinologie de la
ménopause
Les mécanismes régulateurs de la fonction
génitale féminine mettent en jeu l'axe
hypothalamo-hypophyso-ovarien. Les acteurs intervenant sur cet axe
sont nombreux : stéroïdes sexuels et peptides du liquide
folliculaire au niveau ovarien, gonadotrophines au niveau hypophysaire,
peptides hypothalamiques et neurotransmetteurs centraux.
L'origine exacte du dérèglement de la fonction
ovulatoire aboutissant à la ménopause n'est pas connue.
La ménopause est généralement
précédée par plusieurs mois à plusieurs
années d'irrégularités menstruelles où le tableau
hormonal est dominé par une insuffisance en progestérone.
Parallèlement à l'épuisement du stock folliculaire,
l'activité inhibine ovarienne se tarit progressivement. Il en
résulte une levée du rétrocontrôle négatif
exercée sur la sécrétion de FSH ; peu à peu le taux
de FSH s'élève et ceci malgré des taux normaux ou
élevés d'estradiol. Le taux de FSH peut s'élever dans le
plasma plusieurs années avant la ménopause. Après la
ménopause, la production quotidienne de FSH est
généralement multipliée par 10 avec un taux relativement
stable d'un jour à l'autre. Ce taux reste élevé de
très nombreuses années après la
ménopause. La LH voit son taux plasmatique
s'élever plus tardivement que la FSH et souvent seulement à
l'installation de la ménopause. Le taux est multiplié par 5.
Encore totalement dépendante de la pulsatilité du Gn-RH son taux
peut varier dans une même journée et d'un jour à
l'autre.
L'élévation du taux de FSH plasmatique est
responsable d'une maturation folliculaire accélérée et
donc de cycles plus courts (phase folliculaire raccourcie). Ces cycles,
d'abord, ponctués d'une ovulation, mais avec une phase lutéale
très souvent inadéquate, perdent progressivement leur
caractère ovulatoire. Peu à peu apparaissent des
hémorragies de privation irrégulières en l'absence de
décalage thermique lorsque le taux sérique des estrogènes
baisse. Des périodes parfois prolongées,
d'aménorrhée totale peuvent donner une fausse impression de
ménopause confirmée alors qu'il existe une hyperestrogénie
relative.
Globalement, la période préménopausique
coïncide avec une diminution progressive des estrogènes (estradiol)
avec parallèlement une diminution du rapport estradiol/estrone. Quand la
ménopause est installée, l'insuffisance estrogénique est
la règle. L'estrogène majeur est alors l'estrone dont l'origine
est essentiellement périphérique par aromatisation des
androgènes surrénaliens ou ovariens. En effet, malgré
l'extinction du capital folliculaire, les ovaires ne sont pas
complètement au repos et le stroma ovarien conserve la faculté de
synthétiser des androgènes (androstènedione et
testostérone). Par ailleurs, les surrénales ont"entamé un
ralentissement de leur production stéroïdienne.
De ce fait malgré la diminution de la production
androgénique, plusieurs facteurs concourent à l'instauration d'un
état d'hyperandrogénie relative plus ou moins important
selon les femmes : insuffisance estrogénique, diminution de la
production de la protéine porteuse SBP (Sex Binding Protein) et
augmentation du taux d'aromatisation qui passe de 1,4 % à 2,7 %
après la ménopause. L'aromatisation de l'androstènedione
en estrogène ayant lieu essentiel-lement au niveau des adipocytes, ceci
explique les taux d'estrogènes plus importants trouvés chez les
femmes obèses et donc la disparité observée dans les
manifestations cliniques majeures de l'hypo-estrogénie
post-ménopause : l'ostéoporose et le risque cardio-
vasculaire.
Selon l'A. F.E.M (Association française pour
l'étude de la ménopause), les principaux
désagréments rencontrés par les femmes lors de la
ménopause sont les:
- Bouffées de chaleur 67 %. - Etat dépressif 38,5
%.
- Transpirations excessives 31 %. - Insomnie 26 %.
- Atrophie vaginale 20 %. - Asthénies 18,5 %.
- Céphalées 11 %.
- Altération de la chevelure 6,5 %. - Modification du
poids 7 %.
Modification de la poitrine 5,5 % . (RUF H,
1991)

IV. Risque de la ménopause
IV.1. Risque cardio-vasculaire et ménopause
En période d'imprégnation estrogénique,
la femme possède un profil lipidique "favorable" différent de
celui de l'homme : triglycérides, VLDL et
LDL-cholestérol et ApoB plus bas,
HDL-cholestérol et ApoA1 plus élevés.
Après l'installation de la ménopause, on observe une augmentation
des triglycérides et du cholestérol, une baisse
modérée des HDL mais surtout une augmentation importante du
LDLcholestérol et de l'ApoB. Ces perturbations contribuent à
l'augmentation du risque athéromateux, principale cause de
mortalité chez les femmes ménopausées. Globalement, le
taux des accidents cardio-vasculaires chez la femme ménopausée on
traitée rejoint celui observé chez l'homme.
(Framingham. BONITHON-KOPP , 1989)
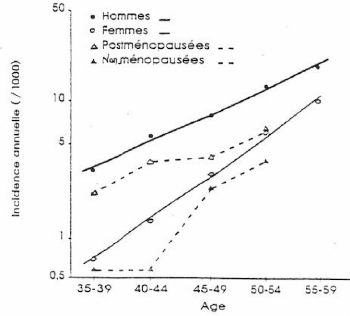
Figure 3 : Incidence des maladies
cardio-vasculaires par âge, sexe et statut
ménopausique.(BONITHON-KOPP. 1989)
IV.2. Ménopause et cancer
Dans tous les pays, la fréquence des cancers mammaires et
gynécologiques augmente avec l'âge, avec une incidence maximale
après la ménopause :
Le cancer du sein atteint une femme sur onze environ en
France avec 2 pics de fréquence (45 - 50 ans et 65 - 70 ans). Il est
plus fréquent chez les femmes précocement pubères, celles
qui sont ménopausées tardivement et chez les obèses, en
relation avec l'imprégnation estrogénique. Le risque relatif des
thérapeutiques substitutives estrogéniques sur l'incidence du
cancer du sein est en relation avec la posologie. Les doses utilisées en
France actuellement, proches des valeurs physiologiques, semblent inoffensives
(études à 10 ans). Néanmoins, la prudence reste de
règle : abstention thérapeutique ou évaluation
risque/bénéfice avec un suivi rapproché lors
d'antécédents personnels de mastopathies bénignes et
d'antécédents familiaux de cancers du sein.
En moyenne, 90 % des cancers de l'endomètre, 75 % des
cancers de l'ovaire et 65 % des cancers du col surviennent après 50 ans.
La fréquence du cancer du col justifie impérativement le
dépistage par frottis du col chez toute femme ménopausée.
Les cancers du col et de l'ovaire ne semblent pas être
hormonodépendants. L'incidence du cancer de l'endomètre est par
contre corrélée avec une ménopause tardive, parfois avec
l'obésité. Aux Etats Unis, l'administration d'estrogènes
seuls à fortes doses aux femmes ménopausées dans les
années 1970, a entraîné une augmentation de la
fréquence des hyperplasies et des cancers de l'endomètre (20 %
des femmes traitées). Ce risque semble toutefois relatif lorsque le
traitement substitutif hormonal associe aux estrogènes un progestatif,
ce dernier pendant 12 jours. (DUPAIGNE , MARES . HEDON ,
1998)
|
Figure 4 : Incidence des cancers du sein, de
l'endomètre, du col et de l'ovaire chez la femme en fonction de
l'âge.
(DUPAIGNE, MARES . HEDON ,-1998)
|
|
IV.3. Effets de la ménopause sur l'appareil
génito-urinaire
- Atrophie de l'urothélium de l'urètre et de la
vessie. - Atrophie du vagin.
- pH vaginal augmenté.
50 % des femmes âgées de plus de 60 ans signalent
un trouble génito-urinaire (incontinence urinaire : 30 %). Ces troubles
sont estrogéno-dépendants.
V. Les bilans biologiques
V.1. Le bilan hormonal
Directement dépendants de la fonction ovulatoire, les
taux circulants de stéroïdes sexuels trouvés pendant la
période périménopausique sont extrêmement
variables.
En présence d'une irrégularité des
cycles menstruels, le dosage de la FSH, s'il est élevé,
témoigne de l'entrée en période de
périménopause de la femme mais il n'est absolument pas
prédictif de la chronologie des évènements
ultérieurs. La conséquence majeure de ces
irrégularités demeure malgré tout l'insuffisance en
progestérone, mise en évidence par des taux bas ou
effondrés en deuxième partie du cycle. Ce taux effondré
explique les symptômes rencontrés pendant cette période et
fournit également les bases physiopathologiques nécessaires au
traitement hormonal de la périménopause. Parallèlement, on
observe, assez souvent, un taux d'estradiol normal ou élevé et
une LH normale ou peu augmentée.
Après un an d'aménorrhée, l'association
typique de gonadotrophines élevées (FSH et LH) et d'un estradiol
bas témoigne d'une ménopause définitivement
installée dans 90 % des cas.
Les résultats des dosages de FSH et d'estradiol
effectués en périménopause, parfois paradoxaux,
témoignent de l'extrême variabilité du fonctionnement
ovarien pendant cette période intermédiaire.
Si le taux d'estradiol diminue progressivement au cours de
ces années, le taux d'estrone reste identique et peut même
s'élever du fait de l'augmentation progressive du taux d'aromatisation
périphérique de l'androstènedione d'origine
surrénalienne.
V.2. Bilan phosphocalcique
Au cours de la ménopause, la balance calcique est
négative (-30 à -150 mg/j) en relation avec une résorption
osseuse accrue malgré une formation osseuse inchangée ou
même augmentée. On note une légère augmentation de
la calcémie qui reste cependant dans les valeurs normales. La carence
estrogénique diminue l'absorption digestive du calcium ainsi que sa
réabsorption tubulaire, favorisant également l'hypercalciurie :
un traitement substitutif estrogénique corrige rapidement ces fonctions.
La parathormone est inchangée avant et après la ménopause,
de même que la vitamine D en l'absence de carence.
(LIGNERES et Coll. 1986)
V.2.1. Marqueurs de la formation de l'os
V.2.1.1. Les phosphatases alcalines
Ils représentent un marqueur peu sensible, et peu
spécifique du métabolisme osseux au cours de l'exploration de
l'ostéoporose. Une augmentation modérée est à
interpréter en fonction d'une rétention hépatique, un
défaut de minéralisation osseuse ou un remodelage excessif.
L'iso-enzyme spécifique de l'os peut être évaluée
par électrophorèse (technique semi-quantitative). Depuis peu, un
dosage radiométrique a été commercialisé,
spécifique de la fraction osseuse de la phosphatase alcaline.
V.2.1.2. L'ostéocalcine ou Bone Gla Protein
(BGP)
Est synthétisée par les ostéoblastes en
présence de vitamine D. Elle est incorporée dans la trame
protéique non encore minéralisée. Une faible partie de
l'ostéocalcine néo-synthétisée est
libérée dans la circulation, rendant possible son dosage
(radio-immunologique). C'est une protéine non collagénique,
fragile, nécessitant une centrifugation immédiate après le
prélèvement et congélation rapide du sérum. Les
concentrations sériques (valeurs usuelles : 3,0 à 9,0 mg/l) sont
corrélées spécifiquement à la formation osseuse et
son augmentation (environ 50 %) est nette en post-ménopause : un
traitement hormonal substitutif permet un retour à la normale en
quelques mois.
V.2.2. Marqueurs de la résorption de
l'os
V.2.2.1. L'index de NORDIN
Permet de quantifier l'excrétion urinaire calcique
tout en étant indépendant de l'apport alimentaire, de
l'absorption digestive, du sexe et de la taille. La calciurie est le reflet de
l'activité ostéoclastique.On détermine l'excrétion
urinaire du calcium et de la créatinine sur un recueil urinaire
minuté (2 heures) chez un sujet à jeûn. La calciurie ainsi
déterminée est alors indépendante des apports alimentaires
à la différence de la calciurie de 24 heures. Les valeurs
usuelles sont inférieures à 0,30 mmol / mmol créat. permet
de quantifier l'excrétion urinaire calcique tout en étant
indépendant de l'apport alimentaire, de l'absorption digestive, du sexe
et de la taille. La calciurie est le reflet de l'activité
ostéoclastique.On détermine l'excrétion urinaire du
calcium et de la créatinine sur un recueil urinaire minuté (2
heures) chez un sujet à jeûn. La calciurie ainsi
déterminée est alors indépendante des apports alimentaires
à la différence de la calciurie de 24 heures. Les valeurs
usuelles sont inférieures à 0,30 mmol / mmol créat.
V.2.2.2. Hydroxyproline
C'est un aminoacide non essentiel, libéré lors
de la dégradation du collagène et non réutilisé
pour sa synthèse. Toutefois, 15 à 50 % de l'excrétion
urinaire journalière d'hydroxyproline ne provient pas de l'os.
Sa détermination doit être effectuée après un
régime pauvre en collagène. On évalue de
préférence le rapport hydroxyproline / créatinine sur un
recueil urinaire minuté sur 2 heures (conditions identiques à
l'index de Nordin). Le rapport, normalement inférieur à 30
pmol/mmol, est augmenté dans les résorptions osseuses dont
l'ostéoporose. Ce rapport se modifie rapidement vers les valeurs
normales au cours de Traitement Hormonal Substitutif (THS) de la
ménopause.
V.2.2.3. Pyridinoline
La pyridinoline (Pyr.) est présente dans le
collagène de type I de l'os et dans le collagène de type II du
cartilage, mais est absente du collagène de la peau. La
déoxypyridinoline (DPyr.) est trouvée
spécifiquement dans le collagène de type I de l'os. Ces deux
nouveaux marqueurs sont donc plus spécifiques de la résorption
osseuse que l'hydroxyproline, d'autant que leur
excrétion est urinaire sans métabolisation. Une augmentation de
60 à 90 % est notée lors des carences estrogéniques avec
retour à la normale en 6 mois après THS. : La
pyridinoline (Pyr.) est présente dans le collagène de
type I de l'os et dans le collagène de type II du cartilage, mais est
absente du collagène de la peau. La déoxypyridinoline (DPyr.) est
trouvée spécifiquement dans le collagène de type I de
l'os. Ces 2 nouveaux marqueurs sont donc plus spécifiques de la
résorption osseuse que l'hydroxyproline, d'autant que leur
excrétion est urinaire sans métabolisation. Une augmentation de
60 à 90 % est notée lors des carences estrogéniques avec
retour à la normale en 6 mois après THS.
V.2.2.4. Cross laps
Le Cross laps est un peptide de séquence commun de
huit aminoacides sur la chaîne du collagène de type I
située sur le télopeptide en C terminal. Ce peptide est
libéré dans les urines au moment de la dégradation du
collagène d'origine osseuse. Le stade ostéoporotique est
significativement corrélé avec l'ancienneté de la
ménopause, le capital osseux de départ et la rapidité du
turnover. Si les deux premiers points sont aisés à établir
respectivement par l'interrogatoire et les investigations
ostéodensitométriques, le turnover est plus
délicat à évaluer en fonction de la
spécificité des différents marqueurs. Les marqueurs
traditionnels (phosphatase alcaline, excrétion urinaire du calcium et de
l'hydroxyproline, ostéocalcine) augmentent globalement chez les femmes
ménopausées par rapport aux femmes non ménopausées
et régressent en relation avec l'instauration du traitement hormonal
substitutif. Les taux de la Deoxypyridinoline et du Cross laps sont très
bien corrélés avec la résorption osseuse et
régressent dans les 6 mois suivant l'instauration du THS, permettant
d'évaluer l'observance thérapeutique à long terme. Ces
nouveaux marqueurs devraient permettre de sélectionner, au moins dans un
premier temps, les femmes à haut risque d'ostéoporose
post-ménopausique. Une carence en vitamine D, entraînant parfois
une hyperparathyroïdie secondaire et contribuant ainsi à la perte
osseuse, doit aussi être systématiquement écartée.
(Am.
J. Med. 1991)
MARQUEURS DE FORMATION
|
MARQUEURS DE RESORPTION
|
- Phosphatase alcaline osseuse
- Ostéocalcine
|
- Hydroxyprolinurie à jeûn
- Calciurie à jeûn
- Déoxypyridinoline
- "Cross laps"
|
|
Tableau 1: Principaux marqueurs du
métabolisme phospho-calcique Am. J. Med.
1991)
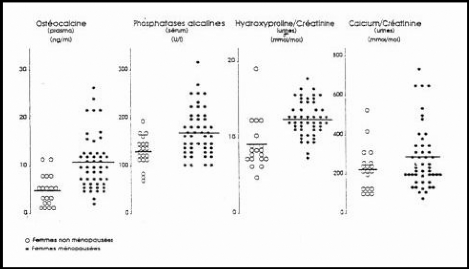
Figure 5 : Evolution des principaux marqueurs
osseux à la ménopause.
(RISS ,Am Med. 1991)
VI. Le traitement hormonal substitutif
Les études les plus récentes mettent en
évidence l'effet bénéfique des traitements substitutifs
hormonaux (THS) de la ménopause.
On note une amélioration rapide des signes
fonctionnels : suppression des bouffées de chaleur, meilleur confort
cutanéo-muqueux, ...etc. Les THS au long cours améliorent la
tolérance au glucose, diminuent le risque vasculaire et surtout
ostéoporotique.
L'estrogénothérapie est le seul traitement
efficace de l'ostéoporose post- ménopausique, le taux plasmatique
moyen d'estradiol devant atteindre au minimum 50 pg/ml. L'efficacité est
optimale si le traitement substitutif débute dans les 3 ans qui suivent
la ménopause et s'il est poursuivi plusieurs années. Le THS peut
être néanmoins instauré 10 ans après la
ménopause, avec une efficacité moindre. L'estriol est
dénué d'activité dans la prévention de
l'ostéoporose.
Actuellement, les recommandations des experts sont d'utiliser
un estrogène naturel (le 17 ß-estradiol) 21 jours par mois et d'y
associer les douze derniers jours du pseudo cycle ainsi réalisé
de la progestérone ou un progestatif dénué d'effet
androgénique, de manière à prévenir un cancer
endométrial sans annuler le bénéfice cardio-vasculaire.
En pratique, le traitement sera adapté à chaque
femme individuellement, en fonction de son vécu et de ses
caractéristiques médicales propres : antécédents
d'hystérectomie, contre-indication connue au THS, ... etc.
Le bilan médical doit être très complet
avant toute thérapeutique pour préciser le stade de la
ménopause, les facteurs de risque cardio-vasculaires, thromboemboliques,
cancéreux ainsi que la déminéralisation
débutante.
Le choix du mode d'administration de
l'estrogénothérapie sera orienté par les facteurs de
risque cardio-vasculaires et par la préférence de la patiente.
L'administration per os peu contraignante, corrige le profil lipidique de la
ménopause non traitée (augmentation du cholestérol des
HDL, diminution du cholestérol des LDL). Par contre la voie orale
provoque un embol massif d'estradiol au niveau hépatique,
accompagné notamment d'une synthèse accrue de la SBP, du
cholestérol VLDL, des triglycérides, de l'estrone et de son
sulfate.
Les gels ou patchs d'estradiol évitent la
métabolisation hépatique, et conduisent à des taux
d'estradiol proches des taux physiologiques. Les doses nécessaires sont
plus faibles. Les traitements sont discontinus et entraînent le retour
des règles. Ils semblent efficaces sur la perte osseuse.
(BASDE VANT A ; GOMPEL A 1995)
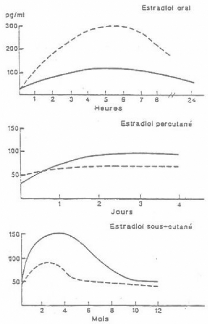
Figure 6 : Représentation
schématique de l'évolution des concentrations
d'estradiol et d'estrone après administration orale, percutanée
et sous-cutanée, intramusculaire d'estradiol (en trait plein :
estradiol, en pointillé: estrone).
(BASDEVANT ; GOMPEL , 1995)
- Absolues
· Cancers du sein ou de l'utérus
· Tumeurs hypophysaire
· Grossesse
· Hémorragies génitales
- Relatives
· Fibromes utérins
· Tumeurs bénignes du sein
· Mastopathies bénignes
· Porphyries
· Affections hépatiques
· Maladie thromboembolique
VI.2. Surveillance du THS
Bilan
|
Avant
traitement
|
Au 3ème
mois
|
Tous les
6 mois
|
Tous les 12-
18 mois
|
Tous les
2 à 4 ans
|
Clinique
|
|
|
|
|
|
Poids, tension artérielle, seins, utérus
|
+
|
+
|
+
|
+
|
+
|
Fottis de dépistage (col)
|
#177;
|
|
|
#177;
|
#177;
|
Investigation endométriale
|
|
|
|
|
|
Biologique (a minima)
|
|
|
|
|
|
-Glycémie à jeun
|
+
|
#177;
|
|
#177;
|
+
|
-Glycémie postprandiale
|
#177;
|
|
|
#177;
|
|
-Cholestérol +
|
|
|
|
|
|
HDL-cholestérol
|
+
|
#177;
|
|
#177;
|
+
|
-Antithrombine III
|
#177;
|
|
|
|
|
-Estradiol
|
#177;
|
+
|
|
+
|
#177;
|
-FSH
|
#177;
|
|
|
|
|
Tomodensitométrie
|
|
|
|
|
|
osseuse
|
#177;
|
|
|
#177;
|
#177;
|
Mammographie
|
+
|
|
|
#177;
|
+
|
|
Tableau 2 : Surveillance du THS.
(GOMPEL, 1995)

DERIVES DE LA 17- METHYLPROGESTERONE COLPRO
DERIVES DE LA 19 NORTESTOSTERONE ORGAM ETRI
L
PROGESTERONE DUPHASTON UTROGESTAN
20 cp
20 cp
30 cp
30
DYDROGESTERONE
PROGESTERONE
MEDROGESTONE
LYNESTRENOL
VI.3. Les différentes formes galéniques de
THS
PRE MARIN
|
30 cp
|
EST
|
0,625 mg / 1,25 mg
|
OESTRO-FEMINAL
|
20 cp
|
EST
|
1,25 mg
|
TRANSANNON
|
28 cp
|
EST
|
0,625 mg / 1,25 mg
|
CONJUGEN
|
20 cp
|
EST
|
2 mg/]
|
PROGYNOVA MITE
|
20 cp
|
VE2
|
1 mg/2 mg
|
ESTROFEM
|
28 cp
|
E2
|
2 mg/]
|
OESTROGEL
|
GEL
|
E2
|
0,75 à 3 mg/]
|
OESTRO-GYNAEDRON
|
GEL
|
EST
|
|
OVESTIN
|
GEL
|
E3
|
0,5 mg/]
|
ESTRADERM
|
TTS
|
E2
|
25 mg/50 mg/1 00 mg/24 h
|
ESTRADURIN
|
im
|
E2
|
1 amp/mois
|
|
Tableau 3: Formes galéniques de THS de
la ménopause : estrogènes seuls.
(GOMPEL, 1995)

(ESTRADERM/ESTRAGEST)
GYNODIAN DEPOT
PREMARIN PLUS
PREMELLA ST
TRISEQUENS
ESTRACOMB
CYCLACUR
KLIOGEST
CLIMENE
28 cp
|
E2 (2 mg) NE (1 mg)
|
12 cp
10 cp
6 cp
|
E2 (2 mg)
E2 (2 mg) + NE (1 mg)
E2 (1 mg)
|
11 cp
10 cp
|
VE2 (2 mg)
VE2 (2 mg) + Nogestrel (0,5 mg)
|
28 cp
12 cp
|
EST (0,625 mg/1 ,25 mg) Medrogestone (5 mg)
|
28 cp
|
EST (0,625 mg) Medroxyprogesterone (2,5/5,0 mg)
|
11 cp
10 cp
|
VE2 (2 mg)
VE2 (2 mg) + AC (1 mg)
|
TTS
|
E2 (50 mg/24 h) NE (0,25 mg/24 h)
|
Im
|
VE (4 mg) + progesterone (200 mg) 1 amp/mois
|
|
Tableau 5 : Associations. (GOMPEL,
1995)
Le paysage du traitement hormonal substitutif de la
ménopause s'est considérablement modifié ces 5
dernières années. Ce qui apparaissait presque comme une faute
médicale (ne pas prescrire de THS estroprogestatif chez une femme
ménopausée), il y a quelques années, est maintenant devenu
une position raisonnable dans bon nombre de cas. La raison en est une
ré-évaluation du rapport bénéfice/risques du THS,
au vu des larges études prospectives randomisées, contre placebo,
publiées ces toutes dernières années et qui ont
bouleversé un certain nombre de dogmes établis sur les
études d'observation et la conviction militante d'un certain nombre de
leaders d'opinion.
Si la ménopause se caractérise par une carence
physiologique en estrogénes, toutes les conséquences
observées après l'âge de 50 ans chez la femme, ne sont
certainement pas uniquement le fait de la carence estrogénique. Surtout,
la substitution en estrogènes (même s'il s'agit de
l'estrogène naturel, l'estradiol-1 7ß) n'est probablement pas sans
effets délétères sur l'organisme, peut-être du fait
de la voie d'administration ou des concentrations obtenues (qui ne remplaceront
jamais la sécrétion physiologique par l'ovaire) ou aussi
peut-être parce qu'après 50 ans, l'organisme de la femme (ou de
certaines femmes prédisposées) répondent à cette
administration d'estrogénes de façon différente de celle
dont répondrait un organisme plus jeune. Il ne faut néanmoins pas
perdre de vue que le THS est actuellement le plus efficace des traitements en
cas de bouffées de chaleur ou de sécheresse vaginale,
symptômes qui« empoisonnent » la vie d'un certain nombre de
femmes. En l'absence de contre-indications et à condition de
ré-évaluer la justification du traitement après quelques
années, en surveillant attentivement la survenue éventuelle d'un
cancer du sein, un THS peut être proposé chez des femmes
récemment ménopausées et très gênées
par le syndrome climatérique, en lui expliquant les
bénéfices et le risque du THS et en prenant la décision
avec elle. On est donc loin de la prescription systématique (pour
prévenir les problèmes cardiovasculaires, éviter la
maladie d'Alzheimer et éviter l'ostéoporose et les fractures...)
du THS à toutes les femmes de la fin du siècle dernier.
C'est souligner encore l'intérêt majeur de
promouvoir toutes les autres méthodes (exercice physique, apport
suffisant de calcium et de vitamine D...) qui, elles, ont apporté la
preuve qu`elles prévenaient les problèmes cardio-vasculaires,
l'ostéoporose ou la démence, chez les femmes, après la
ménopause.
CHAPITRE II: le métabolisme phosphocalcique
23
I. Métabolisme du calcium
I.1. Rôle du calcium
- Sous forme de sels complexes : fonctions mécaniques
dans le squelette.
- sous forme ionisée Ca ++ : actions métaboliques
multiples dont les principales sont :
· La transmission des influx nerveux.
· La contraction musculaire.
· Les changements de perméabilité des
membranes cellulaires.
· La régulation des processus de
sécrétion en particulier hormonaux.
· La médiation de l'action cellulaire de nombreuses
hormones.
· La participation à des réactions en
chaîne telle que la coagulation sanguine et l'activité
musculaire.
· L'activation enzymatique.
Les propriétés de contraction du muscle cardiaque.
(Vallotton M. 1998)
I.2. Répartition du calcium dans l'organisme
Le calcium existe dans l'organisme vivant soit à
l'état lié, soit à l'état libre. La majeure partie
du calcium est liée et associée aux structures osseuses.
Le calcium libre ou ionisé se trouve dans les milieux
intra- et extracellulaires. C'est un cation divalent de masse atomique 40, de
sorte que 2 mEq = 1 mmol = 40 mg.
Le calcium joue un rôle crucial dans de nombreux
processus biologiques et exerce
également une importante fonction
mécanique dans le squelette. (Mihai R, Farndon
J
2000)
|
Forme du calcium
|
Localisations
|
Masse (% du total)
|
|
Soluble intracellulaire
|
Cytosol, noyau cellulaire, mitochondrie, réticulum
endoplasmique
|
0,2 mg
|
|
Insoluble
intracellulaire
(séquestré)
|
Cytosol, noyau cellulaire, mitochondrie, réticulum
endoplasmique
|
9 g/(0,9)
|
|
Soluble extracellulaire
|
Volumes extracellulaires
|
1 g/(0,1)
|
|
Insoluble extracellulaire
|
Os, dents
|
~1,2 kg (99)
|
Tableau 1 : Localisation du calcium chez
l'homme. Farndon J 2000)
I.2.1. Secteur extracellulaire1

Figure 1: Secteur extracellulaire
Farndon J 2000)
Dans le plasma, la concentration physiologique du calcium est
normalement située entre 2,25 et 2,65 mmol/1. La calcémie totale
se répartit en une fraction liée aux protéines
plasmatiques ou non diffusible (de l'ordre de 45 p. 100) et une fraction non
liée aux protéines plasmatiques ou diffusible (de l'ordre de 55
p. 100).
La fraction non diffusible du calcium est liée surtout
à l'albumine. La fraction diffusible, appelée fraction
ultrafiltrable, se décompose:
- en calcium ionisé (approximativement 50p.100 du calcium
total).
- en calcium complexé, sous forme de sels de phosphate, de
citrate et de bicarbonate.
La calcémie totale varie avec la protidémie: la
moitié du calcium total est normalement liée aux protéines
plasmatiques.
Ceci veut dire qu'il faut toujours tenir compte du
taux de protides (ou de l'albuminémie dans certains cas) dans
l'interprétation d'une valeur de calcium total
plasmatique.
Ceci est important car seule la concentration du calcium
ionisé libre plasmatique représente la fraction "biologiquement
active" de ce cation.
La mesure du calcium ionisé plasmatique est possible
mais reste chère: en pratique courante on se contente du taux de calcium
total. Mais il faut se souvenir qu'une calcémie totale
élevée peut n'entraîner aucune manifestation pathologique
si elle est la conséquence d'une protidémie élevée
et que la calcémie ionisée ne s'en trouve pas modifiée.
Le degré d'ionisation et de liaison aux
protéines du calcium dépend également du pH du milieu, et
à un moindre degré aussi des autres électrolytes
plasmatiques. C'est ainsi que l'acidose augmente et que l'alcalose diminue la
fraction ionisée du calcium, et qu'une hyperphosphorémie
entraîne une baisse de celle-ci. (Peacock M,
1996)
I.2.2. Secteur intracellulaire
Os Cellules LEC
Figure 2 : Secteur intracellulaire
Le calcium intracellulaire total représente avec le
calcium moins de 1% du calcium de l'organisme entier. La plus grande partie du
calcium intracellulaire est sous forme liée, principalement sous forme
de sels de phosphate localisés dans les mitochondries. La concentration
du calcium cytosolique libre ([Ca2+],) à l'état basal est
estimée à des valeurs de l'ordre de 5 à 10 x
10-9 M.
I.2.3. Teneur en calcium du squelette
La majeure partie du calcium se trouve essentiellement
stockée dans l'os et s'élève à une valeur d'environ
1200g) chez un homme de 70 kg. (Figure2)
L'os est composé de deux phases : une phase organique
ou matrice et une phase inorganique ou minérale. Les minéraux
sont essentiellement des cristaux d'hydroxyapatite avec un rapport Ca/P variant
entre 1,3 et 2,0.
I.3. Absorption du calcium
- Les besoins sont de 1 g/jour.
- L'absorption se fait dans le duodénum surtout et le
jéjunum de façon active. Elle est proportionnelle à la
consommation de lait et de produits laitiers. 50 à 60 % du calcium
ingéré est absorbé. Le reste est éliminé
dans les selles au - quel s'ajoute le calcium sécrété par
les sucs digestifs.
L'absorption est diminuée en présence d'oxalate
(épinards, oseille) et des bases. Elle est augmentée par le Ph
acide de l'intestin ,est augmentée par la vitamine D, la parathormone,
la GH, diminuée par le cortisol. Le transport actif du calcium est
augmenté par la vitamine D. (Rizzoli R, Bonjour J
1998)
I.4. Élimination du calcium
- Intestinale : 500 à 800 mg/jour : il s'agit du calcium
non absorbé ou du calcium sécrété dans la
lumière intestinale.
- Urinaire : 150 mg/jour. Il y a une filtration
glomérulaire mais la majeure partie est réabsorbée au
niveau tubulaire distal. L'élimination rénale reflète la
calcémie . La réabsorption augmente si la calcémie diminue
sous l'effet de la parathormone et de la vitamine D. Inversement,
l'excrétion du calcium est favorisée par l'hypercalcémie,
l'acidose, la thyroxine, la calcitonine, le cortisol.
I.5. Besoins en calcium I.5.1. Besoins
quotidien

Figure 3: Besoins quotidien en Ca
(Peacock M, 1996)
partie, environ 4 grammes, est rapidement mobilisable pour les
besoins de notre métabolisme. Le reste du calcium contribue à la
solidité et à la résistance de nos os qui sont soumis
à des contraintes importantes tout au long de la vie. L'essentiel du
capital calcique des os est constitué pendant la croissance,
c'est-à-dire dans l'enfance et l'adolescence. Il est donc très
important d'avoir des apports de calcium suffisants pendant cette
période. Or, comme le montrent les résultats d'une enquête
nutritionnelle réalisée en France par l'Institut National de la
Recherche Agronomique en 1996, les apports calciques sont souvent insuffisants
dans la population française (figure 3). Cette carence d'apport concerne
notamment les adolescents et plus particulièrement les jeunes filles. En
effet, les 3/4 d'entre elles ont des apports inférieurs aux 2/3 des
apports quotidiens recommandés (AQR), c'est-à-dire des apports
nettement insuffisants comparativement à leurs besoins physiologiques.
Cette situation les expose, 40 ans plus tard, à un risque aggravé
d'ostéoporose.
Les besoins quotidien varient en fonction de l'âge:
- Adulte jeune : 800mg
- Femme enceinte ou allaitante : 1200mg - Adolescent
: 1500mg - Femme en post ménopause : 1500mg - Sujet
âgé : 1500mg
I.5.2. Teneur en calcium des aliments

Figure 4 : Teneur en calcium des aliments
(Peacock M, 1996)
les principales sources de calcium sont assurées par
les produits laitiers et les fromages. La grande variété des
fromages disponibles dans notre pays et leur grande diversité en ce qui
concerne leur teneur en calcium offrent la possibilité à chaque
sujet lithiasique d'adapter ses apports de calcium en fonction de ses
goûts. Mais, il convient de prendre en compte également les
apports calciques liés à d'autres sources, en particulier
certains poissons , légumes , fruits secs et akènes comme les
pistaches, les figues, les amandes et les noisettes ou encore les graines de
sésame utilisées dans certaines cuisines traditionnelles. En
revanche, les viandes sont très pauvres en calcium.
I.5.3. Mouvements calciques journaliers
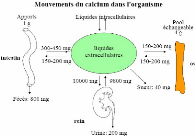
Figure 5: Mouvement calcique journalier
(Bonjour, 1998)
Ils sont résumés
dans la figure n°5, on voit très bien que les organes effecteurs
sont :
- Le rein.
- L'intestin.
- Le tissu osseux.
A l'état d'équilibre si 1000 mg de calcium sont
apportés par l'alimentation, il y aura:
· 800 mg seront éliminés dans les selles.
· 200 mg seront éliminés dans les urines.
- 300 mg de calcium sont chaque jour libérés de
l'os par résorption ostéoclastique une quantité
équivalente est apposé dans l'os par minéralisation de la
matrice organique nouvellement formée (Cf cours PCEM1 : remodelage
osseux).
- 400mg sont absorbés par l'intestin.
- 200 mg sont sécrétés dans l'intestin.
- 10 000mg seront filtrés par le glomérule
rénal.
- 9800 mg seront réabsorbés par le tubule
rénal.
(Mihai R, Farndon J. 2000)
I.6. Régulation du calcium
Le maintien de la calcémie dans des valeurs
étroites se fait par l'intermédiaire de trois hormones, la
parathormone (PTH) sécrétée par les glandes
parathyroïdes, la forme dihydroxylée active de la
vitamine (D1 .25 (OH)2 Vit D 3) appelée calcitriol et la
calcitonine. (Rizzoli R, Bonjour J)
I.6.1. La parathormone
La PTH joue un rôle central dans le
contrôle rapide de l'homéostasie du calcium. Le
polypeptide monocaténaire de 84 acides aminés est la principale
forme active secrétée et présente dans la circulation. Sa
demi-vie est de 5 minutes avant d'être clivé dans le foie et dans
le rein en deux fragments, l'un amino-terminal restant actif et le
deuxième carboxy-terminal sans effet. La production de PTH est
régulée par la concentration extracellulaire de calcium
grâce au récepteur membranaire du calcium de la cellule
parathyroïdienne. Il s'agit d'une protéine apparentée aux
récepteurs membranaires couplés aux protéines G. On
retrouve ce récepteur sur les cellules parathyroïdiennes, les
cellules c de la thyroïde, les cellules épithéliales des
portions corticale et médullaire du néphron et dans le
système nerveux central. Ainsi en réponse à une
hypocalcémie, la synthèse et l'exocytose de PTH sont
augmentées et inversement en cas d'hypercalcémie.
La production de PTH est également
contrôlée par le magnésium, dont des concentrations
plasmatiques élevées peuvent inhiber la sécrétion
de PTH À l'inverse, une carence marquée en magnésium peut
conduire paradoxalement à une hypoparathyroïdie fonctionnelle par
résistance du tubule rénal à la PTH. Mais comme
l'affinité du récepteur calcium pour le magnésium est
moindre que pour le calcium, les changements de concentration de
magnésium n'ont finalement que peu d'influence sur la
sécrétion de la PTH
I.6.1.1. Effets de la parathormone sur le rein
La PTH possède des récepteurs membranaires sur
tous les segments du néphron et son action intracellulaire est
médiée par l'adénosine monophosphate cyclique (AMPc) dont
l'excrétion urinaire sert de marqueur biochimique de l'activité
de la PTH.
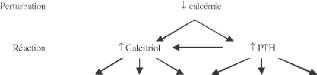
Figure 6: Réponse à une
hypocalcémie
(D'après Rizzoli R, Bonjour J,
2000)
La résultante de l'action physiologique de la PTH est
l'augmentation de la réabsorption du calcium. Cet effet relève
d'un triple mécanisme:
- Au niveau de la BAAH, l'augmentation du gradient
électrique transépithélial induit une entrée de
calcium dans la cellule.
- Au niveau du tube contourné distal, l'activation des
canaux calcium préformés
sur la surface de la cellule augmente
la pénétration intracellulaire du calcium.
- Au niveau du tubule collecteur en décuplant
l'activité de l'échangeur Na+/Ca2 +.
En dépit de ces effets directs sur l'augmentation de
la réabsorption du calcium, l'hypersécrétion de PTH
augmente la calciurie du fait de l'augmentation de la charge de Ca
filtré résultant de l'hypercalcémie. Pour un niveau de
calcémie donné, la clairance du calcium est diminuée en
présence de PTH alors qu'elle est augmentée en l'absence de
PTH.
La PTH augmente la phosphaturie en inhibant au niveau du tube
proximal le cotransport sodium-phosphate.
La PTH intervient en majorant la clairance des bicarbonates
par diminution de leur réabsorption au niveau du tube proximal avec pour
conséquence la production d'urines alcalines. En cas
d'hyperparathyroïdie prolongée, on voit apparaître des
acidoses tubulaires proximales de type II avec glycosurie, pertes urinaires
d'acides aminés et diabète insipide.
La PTH augmente la clairance de l'eau libre. Enfin la PTH
favorise l'activité de l'enzyme 25 (OH)-1- hydroxylase qui est
responsable de la synthèse de la forme biologiquement active de la
vitamine D. (Anast C, Winnacker J 1996)
I.6.1.2. Effets de la parathormone sur l'os
Elle agit de manière directe en mobilisant le calcium
osseux rapidement échangeable vers le milieu extracellulaire.
Elle agit de façon plus retardée en accroissant
le nombre d'ostéoclastes. La PTH agit de manière indirecte sur
les ostéoclastes car ceci ne semblent pas posséder de
récepteurs à la PTH. Seuls les ostéoblastes ont ces
récepteurs à la PTH et ce sont eux une fois stimulée par
la PTH qui libèrent des cytokines activant les ostéoclastes
Récemment, la PTH, administrée de manière
discontinue chez des hommes atteints d'ostéoporose idiopathique, a
montré des capacités anabolisantes majeures. (Rizzoli
R, Bonjour J , 1998)
I.6.1.3. Effets de la parathormone sur l'intestin
La PTH n'agit pas directement sur l'absorption digestive du
calcium. Ses effets sont indirects, par l'intermédiaire de la
synthèse de la vitamine D activée par le rein. (Mihai
R, Farndon J 2000)
I.6.2. Vitamine D
La vitamine D3 précurseur commun vient de 2 sources
L'alimentation assure 20 % des besoins quotidiens et la peau sous l'effet de
l'irradiation ultraviolette du rayonnement solaire représente 80 % des
besoins quotidiens. Sa forme active se fait par 2 hydroxylations successives
dans le foie, qui crée la 25 (OH) vit D3 ou calcifédiol, puis
dans le rein qui aboutie à la forme finale active, la 1.25 (OH) vit D3
ou calcitriol. Cette dernière conversion est sous la dépendance
directe de la PTH et des besoins de l'organisme en calcium et en phosphore. Par
contre, il existe un rétrocontrôle négatif du calcitriol
sur la sécrétion de la PTH. (Rizzoli R, Bonjour
J
1998)
I.6.2.1. Effet du calcitriol sur le grêle
Le calcitriol permet une absorption intestinale
accrue du calcium alimentaire et secondairement celle des phosphates. Le
calcitriol agit de deux façons. D'une part, il exerce une action sur la
bordure en brosse des cellules intestinales où elle favorise
l'entrée du calcium à l'intérieur de la cellule. D'autre
part, après s'être lié à son récepteur
cytosolique, il agit au niveau du noyau des cellules intestinales pour
augmenter la synthèse de la protéine calcipexique. Cette
protéine va favoriser le transport du calcium contre un gradient de
concentration entre les cellules duodénales et le plasma.
I.6.2.2. Effet du calcitriol sur l'os
La vitamine D3 active de façon directe la
résorption osseuse en favorisant la différentiation et
l'activation des cellules souches mésenchymateuses de l'os en
ostéoclastes. (Rizzoli R, Bonjour J, 1998)
I.6.3. Calcitonine
La calcitonine est un polypeptide de 32 acides aminés
produit par les cellules parafolliculaires C de la thyroïde en
réponse à une augmentation de la calcémie. Elle agit
directement sur les ostéoclastes en diminuant la résorption
osseuse. Cette inhibition permet à l'activité continue des
ostéoblastes d'augmenter la fixation du calcium dans l'os. À
doses pharmacologiques, elle favorise aussi l'excrétion urinaire de
calcium, de sodium, de magnésium et de phosphate. Toutefois, son
rôle physiologique n'est pas clairement établi puisqu'un
excès ou un manque chronique de calcitonine n'est pas accompagné
d'altérations du métabolisme phosphocalcique.
(Vallotton M; 1998)
II. Metabolisme du phosphore
II.1. Rôle du phosphore
- Au niveau du squelette, le phosphore forme avec le calcium
les cristaux d'hydroxyapatite déposés sur la matrice du
collagène. Cette forme représente 85% du phosphore de
l'organisme.
- De plus, le phosphore exerce plusieurs fonctions
indispensables à l'organisme en général et au
métabolisme cellulaire en particulier.
· Les phosphates représentent le principal tampon
intracellulaire et urinaire.
· Ils entrent dans la composition des acides
nucléiques et des phospholipides de la membrane cellulaire.
· Sous forme de mono, di et triphosphates
d'adénine et de guanine, ils sont une source d'énergie chimique
permettant le stockage et la libération d'énergie ou l'activation
d'enzymes par l'intermédiaire des protéines kinases.
· Ils participent à la régulation de la
glycolyse et donc à celle du métabolisme
énergétique en formant avec les hydrates de carbone des liaisons
riches en énergie dont la formation à partir de l'ATP est
catalysée par les kinases tandis que leur scission avec formation d'ATP
est catalysée par les phosphatases.
· Les besoins sont de 800-1200 mg/jour.
(Rizzoli R , Bonjour J 1998)
II.2. Distribution dans l'organisme
II.2.1. Plasma
a) Sous forme ionisée, au Ph physiologique de 7,4 :
·
|
Forme divalente
|
: HPO4 ---
|
: 80%
|
·
|
Forme monovalente
|
: H2PO4-
|
: 20%
|
·
|
Forme trivalente
|
: PO4 ---
|
= traces 25 à 45 mg/l = 1 à 2 mmoles/l
|
|
b) Sous forme de phospholipides et de phosphoprotéines :
90 mg/l
La concentration des phosphates présente des variations
liées à l'apport alimentaire et à l'excrétion
rénale ainsi qu'à un rythme nycthéméral, les
valeurs les plus basses étant observées le matin et étant
suivies d'une élévation au cours de la journée avec un
maximum vers 20 H.
L'excrétion urinaire suit fidèlement ces
fluctuations qui sont indépendantes de l'action de la parathormone mais
dépendent probablement du cortisol.
c) Squelette
· cristaux d'hydroxyapatite
· 85% du phosphore de l'organisme
II.3. Absorption du phosphore
Elle représente environ 70% des phosphates
ingérés et se fait dans la partie moyenne de l'intestin.
Elle est augmentée par la vitamine D, la parathormone et
la GH.
II.4. Excrétion du phosphore
- Intestinale : 30% des phosphates sont éliminés
dans les selles.
- Urinaire : 600 mg sont éliminés par jour,
résultant de la filtration glomérulaire et de la
réabsorption tubulaire proximale. 85% du phosphore filtré est
réabsorbé. Le phosphore est une substance à seuil ;
au-dessous d'une concentration de 22mg/l on ne trouve plus de phosphates dans
les urines.
L'excrétion des phosphates est augmentée par la
parathormone et la calcitonine et diminuée par la GH. (Anast
C, Winnacker J 1996)
Le calcium et les phosphates forment ensemble les cristaux
d'hydroxyapatite : (Ca) 3(PO4)2)3. Ca (OH) 2, qui est déposés sur
la matrice du collagène, assurent la texture du tissu osseux des
vertébrés.
Le cation divalent Ca++ joue de son côté un
rôle crucial dans le fonctionnement cellulaire en intervenant entre
autres dans la structure et les propriétés de
perméabilité des membranes des cellules et de leurs organelles
ainsi que dans la régulation de l'activité de nombreuses
enzymes.
L'anion phosphate exerce à l'intérieur de la
cellule le rôle de tampon que le Bicarbonate exerce dans l'espace
extracellulaire, tous deux formant les tampons urinaires principaux.
La régulation phosphocalcique s'effectue par la
calcitonine, la vitamine D et la Parathormone. Ces 3 hormones ont leur point
d'impact dans les intestins, les reins et les os contrôlant ainsi
l'entrée, la sortie, les stocks de calcium et de Phosphore. Le seul
signal régulateur perçu est la variation de la
calcémie.
Une autre particularité consiste en l'absence de
contrôle de la sécrétion des hormones par des centres
supérieurs tels que l'hypophyse, l'hypothalamus ou le système
nerveux central.
CHAPITRE III : Ménopause et alimentation.
I La qualité des apports alimentaires:
Les produits laitiers jouent un rôle important dans
l'alimentation en raison de leur contribution aux besoins nutritionnels et
à la santé globale. D'après les données, les
produits laitiers sont non seulement la source principale de calcium dans
l'alimentation, mais ils sont également notre principale source
alimentaire de magnésium, de phosphore, de potassium, de riboflavine et
de vitamine B12. Ils sont aussi une source majeure de zinc, de niacine, de
vitamines A et B6. Sans compter que le lait représente notre principale
source de vitamine D. la quantité minimale (deux portions) est
suggérée par le Guide alimentaire.
A la ménopause, la hausse du risque de maladies
cardiovasculaires et la prise de poids se soldent souvent par une modification
des habitudes alimentaires. Ainsi, dans l'optique de perdre du poids, les
femmes éliminent souvent, à tort, des aliments qui pourraient les
aider à atteindre leurs objectifs; les produits laitiers en sont un
exemple. En effet, des études récentes ont démontré
que le calcium, plus particulièrement celui provenant des produits
laitiers, peut aider à atteindre un poids santé et à
maintenir celui-ci. Selon ces études, les diètes riches en
calcium augmentent l'efficacité du corps à dépenser
l'énergie sous forme de gras. Il est d'autant plus important pour les
femmes suivant un régime amaigrissant d'inclure les produits laitiers en
raison de la perte osseuse pouvant accompagner une perte de poids.
Le rôle des produits laitiers dans la prévention
de l'ostéoporose est reconnu et démontré par de nombreuses
études scientifiques. Une revue de la littérature par le Dr
Robert HEANEY, un expert de renommer dans le domaine, incluant 139
études menées depuis 1975 a conclu que l'ensemble des
études démontre que le calcium et les produits laitiers aident
à prévenir l'ostéoporose et à maintenir une bonne
masse osseuse.
A la lumière des plus récents résultats de
recherche, il est clair que les produits
laitiers procurent davantage de
bienfaits nutritionnels que de désavantages. De
l'ostéoporose,
en passant par différents types de cancers, les calculs rénaux,
le
syndrome prémenstruel et l'hypertension, les produits
laitiers contribuent à l'amélioration de l'état de
santé globale ainsi qu'aux plaisirs de la table.
Les recommandations diététiques visent depuis
plusieurs années à augmenter l'apport calcique afin de lutter
contre la perte osseuse, phénomène « normal »
entraîné par le vieillissement (0,5 % à 1 % par
année à partir approximativement du milieu de la vie) ainsi que
ses conséquences : ostéopénie, ostéoporose, avec
leurs séquelles en fractures diverses. Deux verres de lait par jour
seraient sensés nous assurer de solides vieux os! Comme si on
établissait les équivalences suivantes, d'une part, lait =
calcium, d'autre part, + de lait bu = + de calcium absorbé.
La plupart des études portant sur le métabolisme
ostéocalcique suggèrent qu'une augmentation de la consommation de
calcium est associée à une augmentation de la masse osseuse.
Cette hypothèse semblent être devenue une croyance puisque bon
nombre d'entre-nous sommes persuadés qu'une diète riche ou
supplémentée en calcium aide à neutraliser la perte de
calcium associée à l'âge.
Mais alors, comment concilier ces résultats avec les
données épidémiologiques qui depuis 1990 sont de plus en
plus nombreuses à suggérer le contraire : plus les gens
consomment de calcium, plus ils semblent susceptibles aux fractures de la
hanche.
Il semblerait que plus on consomme de protéines
animales, plus on perd de calcium. Les Inuits qui consomment le plus de calcium
au monde - 2200 mg par jour provenant des arêtes de poisson - mais dont
la diète est composée de 100 % de protéines d'origine
animale, sont aussi ceux qui ont le plus haut taux d'ostéoporose. Ceci
pourrait s'expliquer par le fait que le métabolisme des protéines
animales libère des déchets acides. Les reins utilisent alors des
minéraux alcalinisants, comme le calcium, pour neutraliser cet
excès d'acide et ce faisant augmente la solubilité des sels de
calcium donc leur élimination par l'urine. Doubler l'apport de
protéines animales de la diète augmente certes le calcium
ingéré mais le calcium urinaire augmente en même temps de
50 %. Ce qui fait dire que plus on consomme du calcium, moins notre absorption
est efficace. En fait, pour être plus précis, plus on consomme du
calcium provenant de sources animales, plus on en élimine. Pour
contrebalancer ce phénomène de perte calcique il faudrait inclure
dans un régime
très protéiné de grandes quantités
de fruits et de légumes qui contiennent des minéraux pouvant
aussi neutraliser l'excès d'acide, tels le magnésium et le
potassium. Une diète riche dans ces deux derniers éléments
augmente la densité minérale osseuse et prévient les
fractures.
L'absorption du calcium est directement lié à la
présence de vitamines D (métabolisée en présence de
soleil) et K. Si ces vitamines manquent le calcium ne se
fixera pas ou peu au niveau des os. Les Inuit souffrent d'un déficit de
vitamine D causé par un manque d'ensoleillement. (Mihai ,
Farndon .
2000)
Le rapport qui existe entre la ménopause et l'alimentation
peux entraîner les maladies suivantes:
I. L'OSTÉOPOROSE
I.1. Définition
Maladie diffuse du squelette caractérisée par
une diminution de la masse osseuse et par des altérations
micro-architecturales du tissu osseux, ayant pour conséquence une
augmentation de la fragilité osseuse et du risque fracture " L'os est un
tissu vivant avec un équilibre entre ostéoblastes et
ostéoclastes.
Au moment de la puberté, il existe une croissance
très rapide pour atteindre vers l'age de 20 ans la masse osseuse
maximale.
A partir de 35/40 ans la décroissance est lente et
régulière par la diminution des ostéoblastes.
La ménopause aggrave la perte osseuse liée au
vieillissement par la carence oestrogénique associée ainsi que
par déficit vitamino calcique qui s'accentue chez les sujets plus
âgés. (RIBOT , 1995)
I.2. Facteurs de risques
I.2.1. Ostéoporose secondaire
a) Endocrinopathies
HyperparaT, hyperT, hypogonadisme, adénomes hypophysaires
à prolactine, hypercorticisme, acromégalie, diabète.
b) Maladies digestives
Gastrectomies, résections intestinales étendues,
malabsorptions,
malnutritions, hépatopathies chroniques
sévères.
c) Mal inflammatoires et systémiques
Rhumatismes inflammatoires chroniques ( PR,
spondylarthropathies), mastocytose.
d) Mal genotypiques
M de Lobstein, mal du tissu collagène ou élastique
( Ehlers-Danlos, Marfan, élastorrhexie), homocystinurie,
hémochromatose.
e) Mal néoplasiques
Myélome multiple, cancers métastatiques,
chimiothérapies anticancéreuses. I.2.2.
Ostéoporose primitive
a) Vie génitale
Ménopause : naturelle précoce ou ovariectomie,
puberté tardive, anorexie mentale, absence de CO, grossesses multiples,
allaitements prolongés.
b) ATCD familiaux
Ostéoporose, fractures, mal génétique
c) Données anthropométriques
Races blanche et jaune plus fréquent que race noire,
faible index masse corporelle.
d) Facteurs nutritionnels
Apports calciques faibles, carence vit D, anorexie mentale.
e) Facteurs environnementaux
Alcool, tabac, faible exposition solaire, vie citadine.
f) Activité physique
Vie sédentaire sans efforts physiques, immobilisation
prolongée.
g) Médicaments
Corticoides, hormones thyroidiennes, héparine, agonistes
Gh Rh, chimiothérapie anti cancéreuse.
I.3. Epidémiologie
Les études épidémiologiques sont un peu
difficile à faire mais il s'agit d'un problème de santé
publique majeur : recommandations européennes de prévention et de
traitement.
40% des femmes et 13% des hommes de plus de 50 ans feront dans
les années qui leur restent à vivre une fracture
ostéoporotique. En 1995, 414 000 fractures du col du fémur ont
été recensées dans l'union européenne / en France,
en 1990, 48 000 FESF ; tout ceci avec un coût annuel trés
important : environ 2.5 milliards de Frs et 4 milliards si on rajoute le cout
de réhabilitation chez les patients de plus de 70 ans. Tous ces chiffres
devraient doubler dans les 50 prochaines années avec le vieillissement
de la population.
L'ostéoporose entraîne toutes les formes de fracture
mais 3 sites sont essentiellement atteints :
44% fractures vertébrales, 19% FESF, 14% ext distale avt
bras.
Mais la fracture n'atteint pas tous les patients
ostéoporotiques et toutes les fractures ne sont pas imputables en tout
ou rien à l'ostéoporose.
Plusieurs facteurs sont intriqués avec relation entre
fragilité osseuse et traumatisme. Plus l'age avance, plus le trauma est
minime face à la fragilité.
On a surtout étudié les FESF car
conséquences sévères chez les P. âgées. Elles
sont plus fréquentes chez les femmes 3 pour 1, croit exponentiellement
avec l'age avec une majorité entre 80 et 90 ans. Il existe un gradient
décroissant Nord- Sud lié à l'ensoleillement, plus milieu
urbain que rural et plus en milieu institutionnel.
(BAUDOIN, 1997)
I.4. Attitude clinique
Maladie indolore en dehors de ses complications fracturaires,
sinon évoquer l'ostéomalacie
(Carence vit D). Il s'agit donc essentiellement d'une
stratégie de prévention et il faut l'évoquer de
manière systématique chez la femme de la cinquantaine et plus ou
chez les descendance des femmes présentant des fractures - tassements ou
encore au moment de la ménopause et de la mise en route du THS.
I.4.1. Place de l'ostéodensitométrie dans
cette stratégie
Mesure de la densité minérale osseuse (DMO) par
absiorptiométrie biphotonique à rayons X au niveau du rachis
lombaire, de l'extrémité supérieure du fémur,
radius ou autre .On note une densité exprimée en g/cm
correspondant à la quantité d'hydroxyapatite par unité de
surface de projection osseuse. Cette mesure est interprétée
comparativement aux valeurs normales définies pour le sexe et l'age
(Z-score) ou par rapport à la valeur maximale atteinte à l'age
adulte (T-score).
Pour chaque diminution d'un écart-type de DMO ( 10
à 30% de moins ) le risque fracturaire est multiplié par 1,5
à 3.
- Normale : T-score > - 1 DS.
- Ostéopénie : - 1 DS > T-score
> - 2,5 DS.
- Ostéoporose : T-score < - 2, 5
DS.
- Ostéoporose sévère :
T-score < - 2, 5 DS + fractures.
Cela permet d'identifier la population à risque
fracturaire élevèe : 30% des femmes occidentales de 50 ans sont
ostéoporotiques selon la définition densitométrique.
Il existe cependant des critiques à la densito:
- La DMO est une variable continue.
- Elle n'est pas le seul déterminant du risque
fracturaire.
- Des fractures peuvent survenir avec des DMO nles.
- Ces valeurs sont valables seulement pour la population
féminine blanche nord américaine et ouest européenne.
Les indications de l'ostéodensitométrie sont bien
établies:
- Détection de l'ostéoporose en cas de fracture
tassement vertébral.
- Evaluation des patients porteurs de troubles
métaboliques affectant le squelette.
- Surveillance thérapeutiqe ( biphosphonates ).
Il s'agit d'un examen non remboursé par la
sécurité sociale, qui coute cher en dehors
de certains centres
hospitaliers où les patients ne déboursent que 50 Frs.
(POUILLES
J,1995)
I.4.2. Ex biologiques
S'il existe un tassement vertébral ou une
ostéoporose densitométrique, un bilan minimum est
nécessaire afin de compléter l'enquête clinique qui est
bien entendue indispensable pour éliminer les affections tumorales et
rechercher les causes d'ostéoporose secondaire et de préciser les
facteurs de risque.
I.4.2.1. Bilan sanguin de 1ère intention
NFS / VS, bilan phosphocalcique avec calcémie,
phosphorémie, calciurie des 24 h, PA, créatinine,
Electrophorése des protides sériques.
En fonction de ces premiers résultats et de la clinique,
on adapte et on rajoute : Rx, scintigraphie ou IRM, dosages hormonaux.
Dans l'ostéoporose primitive, il n'ya pas d'anomalies du
bilan phosphocalcique : si anomalie calcique, faire dosage de PTH et de 25 OH
D3.
En cas d'ostéopénie sévère
à la densito par rapport aux facteurs de risque, la question du dosage
de PTH peut se poser pour le Dg de l'hyperparaT normocalcique ainsi que le
dosage de Vit D pour l'ostéomalacie. La prévalence de
l'insuffisance vitaminique D est importante en France : 50% aprés 50 ans
et 70% après 80 ans.
I.4.3. Bilans de l'ostéoporose
NFS / VS / Plaquettes
Electrophorèse proteines
Proteinurie 24 heures
Créatinine
Calcium, phosphates sanguins et urinaires
I.4.4. Les marqueurs biologiques du remodelage
osseux
Pour l'instant pas trés bien codifié en clinique
avec un intérêt surtout en recherche afin de mieux comprendre la
physiopathologie. Permet de quantifier la formation et la dégradation de
la matrice osseuse.
a) Formation
Ostéocalcine et phosphatases alcalines ; ces 2
marqueurs apportent le même genre de renseignements sauf dans
l'ostéomalacie où les PA augmentent et l'ostéocalcine
baisse.
b) Résorption
Peu spécifiques comme la calciurie (urines de jeune
rapportés à la créatinine) ou l'hydroxyprolinurie.
D'autres plus récents sont plus intéressants comme la
Pyridinoline (PY/R) et la Déoxypyridinoline (DPY/R) qui sont plus
spécifiques de l'os surtout DPY/R. Il s'agit pour l'instant d'une
technique un peu lourde qui pêche par absence de standard
synthétique.
Intérêts des marqueurs comme facteurs
prédictifs :
- Absence de corrélation avec la masse osseuse.
- Efficace pour prédire la FESF.
L'association de ces paramêtres augmente la
prédiction des fractures. Ces marqueurs diminuent après
administration de substances anti résorptives : cette diminution
étant dose dépendante.
I.5. Les traitements
I.5.1. Prévention primaire
A 2 buts essentiels :
- vise à augmenter le capital osseux acquis au cours de la
croissance. - cherche à freiner la perte osseuse à l'age
adulte.
I.5.1.1. Pour augmenter le capital osseux
- Augmenter les apports calciques des adolescents et des
personnes agées. - Pratique sportive tout au long de la vie.
- Freiner la consommation alcool et tabac.
Cette prévention de masse s'avère limitée
car faible participation et impact faible sur le risque
ostéoporotique.Il faut donc lui préférer une
prévention ciblée avec dépistage des sujets à
risque qui a un rendement bien meilleur.
N.B : supplémentation en vitamine D si
carence.
I.5.1.2. Freiner la perte osseuse
I.5.1.2.1. Traitement hormonal substitutif
L'oestrogénothérapie freine la perte osseuse en
diminuant l'activité de résortion et le remodelage osseux post
ménopausique ; elle diminue de 50% l'incidence des fractures
ostéoporotiques. Pour une meilleure efficacité, le début
du traitement doit être le plus précoce possible et d'une
durée minimale de 7 ans. Mais il n'est de toute façon jamais trop
tard pour commencer car il garde son efficacité sur la DMO 15 ans
aprés la ménopause.
Il existe une dose minimale efficace sur la prévention de
la perte osseuse post ménopausique :
|
Oestrogènes
conjugués
équins
|
PREMARIN
|
0,625 mg/j
|
|
Oestradiol gel percutané
|
ESTREVA /OETROGEL
|
1.5 à 2 mg
|
|
Oestradiol transdermique
|
ESTRADERM
|
50ug/j
|
|
Oestradiol voie orale
|
ESTROFEM/OROMONE
|
2 mg/j
|
|
Oestradiol valérate VO
|
DIVINA/PROGYNOVA
|
2 mg/j
|
Tableau 1: Traitement hormonal substitutif
(BAUDOIN, 1997) I.5.1.2.2. Traitement en 2004.
Les traitements de l`ostéoporose sont discutés
en fonction de l`âge, de l`existence d`une fracture, du résultat
de la densitométrie, et du nombre des facteurs de risque de fracture
associés. Seules les indications de première intention sont
proposées ici. En cas de difficulté ou d'échec de ce
traitement, l'avis d'un spécialiste (rhumatologue...) doit être
pris (Accord professionnel).
La durée de ce traitement est à adapter en
fonction du risque fracturaire individuel et
de l`éventuel effet
rémanent du traitement ; les durées habituelles sont de 3
à 5 ans.
(DEL MAS PD, BJARNASON NH 1997)
- Facteurs de risque à prendre en
considération pour l'indication de la densitométrie
- L'âge.
- Les populations blanche ou asiatique.
- Les antécédents personnels de fracture
après 40 ans.
- Les antécédents familiaux de fracture ou
d'ostéoporose. - Immobilisation prolongée.
- Facteurs de risque à prendre en
considération pour l'estimation du risque fracturaire, et la
décision thérapeutique
- Un indice de masse corporelle bas (< 19 kg/m 2).
- Un déficit estrogénique.
- La consommation de tabac et d'alcool.
- De faibles apports en calcium et vitamine D. - La prise de
glucocorticoïdes au long cours. - L'hyperthyroïdie.
- L'hyperparathyroïdie
- Une perte de poids. (LIBERMAN U.A. 1995) a)
Avec fracture
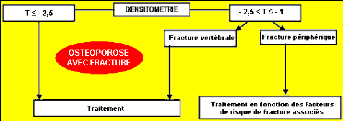
Figure 1: Osteoporose avec fracture.
(BAUDOIN, 1997)
|
Traitements médicamenteux en plus d'un apport de
calcium et de vitamine D
|
Raloxifène
|
Biphosphonates (1)
|
Tériparatide
|
|
Une fracture vertébrale et risque de fracture
périphérique faible (ostéoporose à
prédominance rachidienne)
|
Oui
|
Oui
|
-
|
|
Une fracture vertébrale et risque fracturaire
vertébral et périphérique
|
-
|
Oui
|
-
|
|
Deux fractures vertébrales ou plus (maladie
sévère)
|
-
|
Oui
|
Oui
|
|
Au delà de 80 ans
|
-
|
Oui
|
-
|
Tableau 2 : Traitement d'osteoporose avec et
sans fracture
L'alendronate et le risédronate peuvent être
utilisés dans tous les cas, y compris quand le risque de fracture
périphérique (par exemple de l'extrémité
supérieure du fémur) est au 1er plan. L'étidronate est une
alternative si la fracture est vertébrale (BAUDOIN,
1997)
b) En l'absence de fracture
Un apport de calcium et de vitamine D est systématiquement
associé
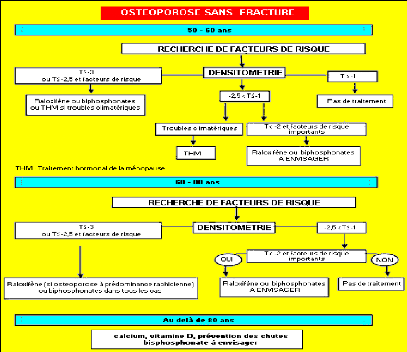
Figure 2 : Ostéoporose avec absence de
fracture (BAUDOIN, 1997)
II. L'HYPERCALCÉMIE
II.1. Introduction
Normalement la calcémie est une constante. En fait ses
valeurs normales vont de 90 à 105 mg/l. Une calcémie
supérieure à 105 mg/l (2,63 mmol/l) définit
l'hypercalcémie. Le calcium ionisé représente la fraction
métaboliquement active, la plus intéressante en pratique, mais
son dosage est complexe, réservé à certains laboratoires
spécialisés.
La calcémie totale varie avec la protidémie, et
son taux doit être corrigé en fonction de l'albuminémie. La
formule la plus souvent utilisée pour cette correction est :
Calcémie corrigée [mg/l] = calcémie mesurée [mg/l]
+ (40 - albuminémie [g/l])
II.2. Manifestation cliniques et conséquences
physiologiques de l'hypercalcémie aiguë
II.2.1. Action sur le coeur
Le calcium ionisé joue un rôle physiologique
capital dans la dépolarisation de la cellule cardiaque. Sa variation de
concentration peut avoir un retentissement majeur sur l'activité
cardiaque mettant en jeu le pronostic vital. Pendant la phase 0 du potentiel
d'action, la dépolarisation de la membrane de la cellule myocardique est
due à l'entrée rapide du sodium dans le cytoplasme. Cette phase
de dépolarisation est suivie d'une brève phase de repolarisation
rapide (phase 1) en rapport avec une sortie de potassium dans le milieu
extracellulaire. La phase 2 du potentiel d'action correspond à
l'ouverture des canaux calciques voltage-dépendants (canaux dont
l'ouverture et la fermeture sont commandées par la dépolarisation
membranaire due à l'entrée rapide du sodium dans la cellule)
situé sur la membrane du myocite qui deviennent perméables et
permettent la pénétration cellulaire du calcium. La phase 2
résulte d'un équilibre entre une dépolarisation maintenue
et une repolarisation débutante. Cet afflux de calcium
intracytoplasmique provoque la libération du calcium stocké dans
le réticulum sarcoplasmique qui en se fixant sur la troponine C permet
l'interaction actine-myosine responsable de la contraction myocardique.
(Aguilera M, Vaughan R 2000)
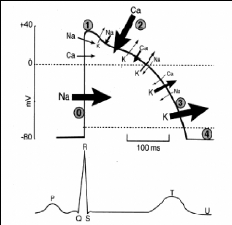
Figure 3 : Représentation
schématique du potentiel d'action d'une cellule
myocardique
ventriculaire contractile, avec ses différentes phases et
les
principaux mouvements ioniques transmembranaires correspondants.
(Hashiba K 1988)
En cas d'hypercalcémie, il existe une diminution de la
durée de la phase II du potentiel d'action L'hypercalcémie, en
augmentant le gradient de concentration entre le calcium intra- et
extracellulaire, accélère l'entrée du calcium pendant
l'ouverture des canaux calciques ce qui conduit à une
dépolarisation plus rapide. Cela se traduit à l'ECG par un
raccourcissement du segment ST La durée du segment ST est difficile
à mesurer. En revanche, l'intervalle QT corrigé (QTc) est simple
à utiliser et parfaitement représentatif des variations du
segment ST pour évaluer les effets de l'hypercalcémie.
Le calcium antagonise les effets de l'hyperkaliémie sur
le myocarde sans la diminuer. L'hyperkaliémie entraîne un
ralentissement de la conduction intracardiaque et une élévation
de l'excitabilité des cellules myocardiques. Elle diminue le gradient
potassium intra cellulaire-potassium extracellulaire. Ceci conduit à un
potentiel de repos membranaire moins négatif. La différence entre
ce nouveau potentiel de repos et le seuil d'excitabilité étant
moindre ceci induit une augmentation de l'excitabilité myocardique. Le
traitement par les sels de calcium (10 à 30 mL de calcium à 10 %
en IVL de 3 min) restaure de manière rapide les troubles de la
conduction intracardiaque ainsi que l'excitabilité en corrigeant le
potentiel de repos.
L'hypercalcémie chronique modérée (Ca =
2,82 mmol·L-1) chez des patients ayant une
hyperparathyroïdie primitive (HPT I) n'a pas d'effets sur la conduction
cardiaque. En revanche, pour des calcémies plus sévères
(Ca > 3 mmol·L-1) chez des patients atteints HPT I, des
blocs auriculoventriculaires qui disparaissent après
parathyroïdectomie ont été décrit. Quelques cas
d'AC/FA ont aussi été mis en évidence chez des HPT I
modérées.
L'hypercalcémie aiguë (Ca entre 3,5 et 4
mmol·L-1) dans la crise hyperparathyroïdienne est à
l'origine des troubles du rythme ventriculaires (ESV, TV, FV) qui peuvent
mettre en jeu le pronostic vital
L'hypercalcémie chez des HPT I s'accompagne d'une
stimulation du système sympathique cardiaque qui peut être
liée à l'hypercalcémie modérée ou
l'excès de PTH. En tous les cas, la chirurgie parathroïdienne
corrige ce désordre Les valvulopathies, le dépôt de calcium
dans le myocarde et l'hypertrophie ventriculaire gauche sont décrits
uniquement au cours des hypercalcémies chroniques
modérées.
(Hashiba 1988)
II.2.2. Action sur les muscles lisses
La contraction de toutes les cellules musculaires lisses est
sous la dépendance des changements de la concentration intracellulaire
de calcium. L'hypercalcémie entraîne une contraction des cellules
musculaires lisses artérielles par augmentation du calcium
intracytosolique. Une augmentation du calcium intracellulaire permet de majorer
la liaison Ca-calmoduline, activant la protéine kinase qui phosphoryle
la myosine. Cette protéine phosphorylée possède une grande
affinité pour l'actine. Ce complexe est responsable de la contraction
des muscles lisses. Dans des études expérimentales,
l'augmentation du calcium intracellulaire majore la contraction des cellules
myocardiques et musculaires lisses.
La perfusion intraveineuse de calcium chez l'homme est
à l'origine d'une hypertension artérielle (HTA) par augmentation
des résistances vasculaires systémiques sans augmentation du
débit cardiaque L'association d'un inhibiteur calcique ou de sulfate de
magnésium prévient l'HTA induite par le Ca intraveineux
En clinique, les effets de l'hypercalcémie sur le tonus
des fibres musculaires lisses sont illustrés par la mise en
évidence d'épisodes d'ischémie myocardique par vasospasme
chez des HPT I et par la fréquence élevée de l'HTA dans
cette pathologie.
II.2.3. Action sur le rein
L'hypercalcémie altère la fonction rénale
par plusieurs mécanismes directs ou indirects en rapport avec
l'hypertension.
Au niveau du tube proximal, l'hypercalcémie inhibe
l'hydroxylation en 1 de la
vitamine D. Dans la branche ascendante de l'anse de
Henlé (BAAH), l'augmentation du calcium ou de magnésium
péritubulaire diminue la réabsorption de ces 2 cations. Ce
phénomène s'explique par le fait que le niveau de concentration
de ces 2 ions dans le liquide interstitiel leur permet d'autoréguler
leur propre réabsorption. L'hypercalcémie exerce une action
diurétique qui explique la déshydratation globale
fréquemment associée dans ce tableau. La perte de sel
résulte d'une diminution de la réabsorption du Na dans BAAH par
inhibition du cotransporteur Na/K/Cl2 secondaire à l'activation du
récepteur calcium présent en grand nombre sur la surface
basolatérale de la cellule épithéliale de la BAAH. Du fait
de l'inhibition de ce cotransporteur, on assiste à une baisse du
potentiel positif dans la lumière intratubulaire ce qui conduit à
une baisse de la réabsorption de Ca++ et Mg++. De
plus, l'hypercalcémie réduit la capacité rénale
à concentrer les urines en inhibant la création du gradient
osmotique corticomédullaire indispensable pour l'action de l'ADH sur le
tube collecteur. (Bianchetti ,1983)
II.2.4. Action sur la plaque neuromusculaire
L'augmentation du calcium ionisé in vitro produit une
diminution de la sensibilité de la jonction neuromusculaire à la
d-tubocurarine et au pancuronium. Dans des études animales
expérimentales, in vivo, l'augmentation du calcium ionisé
plasmatique a montré une action antagoniste à celle des
curares.
dose pour maintenir un bloc constant La durée d'action
du vécuronium chez les HPT I et chez les patients anéphriques
avec une hyperparathyroïdie secondaire (HPT 2) a été
retrouvée raccourcie indépendamment de toute
élévation de la concentration de calcium ionisé
plasmatique et néoplasique peuvent être dosés.
(Gramstad, Hysing
1990)
II.3. Étiologies des hypercalcémies
aiguës II.3.1. Hypercalcémie et parathyroïde II.3.1.1.
Hyperparathyroïdie primaire
Dans ces étiologies de la PTH est
hypersecrétée de façon inappropriée et non
freinable par du tissu parathyroïdien pathologique. Il s'agit le plus
souvent d'une hypercalcémie chronique bien tolérée puisque
dans une série de 1 200 cas d'HPT I, l'incidence de la crise
d'hypercalcémie aiguë a été évalué
à 6 % La PTH en excès favorise la résorption osseuse,
l'absorption intestinale et la réabsorption rénale de calcium
empêchant le rein d'excréter la surcharge calcique
filtrée.
L'HPT I se rencontre essentiellement entre 40 et 65 ans, elle
affecte 2 fois plus les femmes que les hommes tout âge confondu et plus
particulièrement les femmes dans les 10 ans après la
ménopause. Le facteur le plus souvent associé à l'HPT I
est l'irradiation. En Angleterre, l'incidence de l'HPT I est d'environ 25 pour
100 000 habitants. Il existe des formes asymptomatiques et d'autres
entraînant des manifestations rénales (lithiase rénale et
néphrocalcinose), articulaires (chondrocalcinose, calcifications
péri-articulaire ou péri-capsulaire), neuropsychique (faiblesse,
dépression, mémoire défaillante), digestive (anorexie,
constipation, vomissements, nausées, ulcère, pancréatite)
et cardiovasculaire (hypertension)
La crise aiguë parathyrotoxique a une expression polymorphe
marquée par:
a) Des signes rénaux (polyurie, déshydratation
globale, polydypsie).
b) Des signes digestifs (nausées, vomissements,
constipation, inappétence, simulant parfois une urgence chirurgicale
d'autant que la crise peut se compliquer de pancréatite aiguë et
d'ulcères gastro-duodénaux.).
c) Des signes neuropsychiques (agitation puis somnolence,
confusion mentale, hypotonie musculaire avec aréflexie, et au maximum
coma sans signe de localisation).
d) Des signes cardiaques parfois vitaux: hypertension
artérielle et à l'ECG un raccourcissement de l'espace QT et du
PR, des troubles du rythme cardiaque tels que des extrasystoles ventriculaires,
tachycardie ou fibrillation ventriculaire ou des troubles de la conduction
bradycardie à type de bloc sino-auriculaire ou auriculo-
ventriculaire.
Dans 80 à 85 % des cas d'HPT I, il s'agit d'un
adénome bénin d'une seule glande. Dans 1 % des cas on
découvre un carcinome parathyroïdien d'une seule glande. Dans 15 %
des cas on découvre une hyperplasie des 4 parathyroïdes et dans les
cas restants plus d'une glande est impliquée sans qu'elles ne le soient
toutes. On appelle ces cas adénome double ou multiple.
L'HPT I se retrouve sporadiquement dans le cadre des
néoplasies endocriniennes multiples (NEM). Le type I de Wermer (NEM I)
est la combinaison variée de tumeurs hypophysaires,
pancréatiques, parathyroïdiennes et d'autres glandes. À
partir de 40 ans, chez les patients atteints de NEM I on retrouve 85 % d'HPT I,
25 % d'adénomes à prolactine, 35 % de syndrome de
Zollinger-Ellison et moins fréquemment des insulinome Le traitement
chirurgical est efficace dans 90 % des HPT I, mais il existe à distance
beaucoup de récidives.
Le type IIa de Sippel est caractérisé
principalement par l'association d'une HPT I, d'un phéocromocytome et
d'un cancer médullaire de la thyroïde. À partir de 70 ans,
la fréquence d'une HPT I dans ce syndrome est de 70 % et
l'hypercalcémie est habituellement minime. (Stephen J, Marx
M.)
|
Absorption
intestinale
de calcium
|
Résorption
osseuse
nette
|
Réabsorption
tubulaire
de
calcium
|
Médiateur
|
[Ca]s
|
[Ca]u
|
PTH
|
Calcitriol
sanguin
|
|
HPT I
|
|
|
|
PTH
Calcitriol
|
|
|
|
|
|
Intoxication à la
vitamine D
|
|
|
|
25(OH)D
|
|
|
N,
|
N,
|
|
Hypercalcémie
humorale
des
néoplasies
|
|
|
|
PTHrP
|
|
|
|
|
|
Ostéolyse
locale maligne
|
|
|
|
IL-1 IL-6
TNF
|
|
|
|
|
|
Production
ectopique
de calcitriol
|
|
|
|
Calcitriol
|
N
|
|
N,
|
|
|
Hyperthyroïdie
|
|
|
|
T3
|
N
|
|
N,
|
|
|
Immobilisation
prolongée
|
|
|
|
?
|
N
|
|
N,
|
N,
|
|
Hypercalcémie
hypocalciurique
familiale
|
|
|
|
Mutation
du Ca
récepteur
|
|
|
N
|
|
|
Intoxication au
lithium
|
|
|
|
Lithium
|
|
|
|
|
|
Hypercalcémie
idiopathique
de
l'enfant
|
|
|
|
Sensibilité
accrue à
la
vitamine D
|
|
|
|
|
|
Syndrome des
buveurs de lait
|
|
|
|
|
|
|
|
N,
|
|
HPT II sévère
|
|
|
|
|
|
|
|
|
Tableau 3: Étiologie des
hypercalcémies. (Hashiba 1988)
La biologie est caractéristique: calcémie totale
supérieure à 2,6 mmol·L-1 ou une
élévation du calcium ionisé; hypophosphorémie et
hyperphosphaturie; acidose hyperchlorémique; hypercalciurie
supérieure à 10 mmol·L-1; augmentation de la
concentration de PTH active non adaptée à l'hypercalcémie
; augmentation des PAT sériques et de l'excrétion urinaire de
l'AMPc et de l'hydroxyprolinurie témoignant d'une participation
osseuse.
L'augmentation généralisée de la
transparence du squelette est le signe essentiel avec notamment un
amincissement des corticales et des lacunes bien visibles le long des
métaphyses et au niveau des deuxièmes et troisièmes
phalanges. Des images géodiques plus ou moins volumineuses et des
aspects de tumeur viennent compléter ce tableau, donnant l'aspect
typique d'ostéite fibrokystique.
L'exploration radiologique par échographie cervicale,
scintigraphie parathyroïdienne ou imagerie par résonance
magnétique ne permet pas de répondre formellement aux deux
questions qui reste après le diagnostic biologique. Où se situe
le tissu parathyroïdien anormal? S'agit-il d'une hyperplasie des
parathyroïdes ou d'un adénome? En effet il existe 15 à 20 %
de faux positifs (imagerie positive non confirmé par la chirurgie) et
seulement 60 % de vrais positifs avec ces techniques Un chirurgien
entraîné reconnaît le tissu pathologique dans 97 % des cas.
De plus, cette imagerie n'a pas démontré d'amélioration
sur la qualité du geste opératoire et accentue le coût de
la prise en charge, il n'est donc pas recommandé lors d'une
première cervicotomie de les réaliser En revanche, elle devient
nécessaire quand une première cervicotomie est négative
alors que le diagnostic d'HPT I est certain.
II.3.1.2. Hypercalcémie-hypocalciurie familiale
L'hypercalcémie-hypocalciurie familiale (HHF) est une
maladie congénitale autosomique dominante à haut degré de
pénétrance. Les anomalies chromosomiques sont situées sur
le chromosome 3 codant pour le récepteur sensible au calcium. Ces
mutations entraînent un degré variable de perte de fonction de ce
récepteur pouvant aller d'une modeste réduction de
l'affinité du récepteur pour le calcium à une
complète inactivation. La réduction ou la perte de la fonction de
ce récepteur produit une résistance légère ou
totale au calcium ionisé des tissus exprimant ce récepteur. L'HHF
correspond à la mutation hétérozygote (un seul
allèle), la forme homozygote où les deux
allèles sont mutés définie l'hyperparathyroïd ie
primitive néonatale
L'hypercalcémie dure toute la vie et reste paradoxalement
chez la plupart des patients peu symptomatiques ou asymptomatiques.
La maladie est caractérisée biologiquement par:
- Une hypercalcémie modérée associée
quelquefois à une hypermagnésémie dans un contexte
familial.
- Une PTH « anormalement » normale.
- Une calciurie des 24 heures normale mais l'excrétion
rénale de calcium comparativement à la calcémie est basse,
une valeur inférieure ou égale à 0,01 du ratio clairance
du calcium/clairance de la créatinine est très en faveur d'une
HHF en l'absence d'autres facteurs réduisant l'excrétion urinaire
de calcium (déficit en vitamine D, carence alimentaire en calcium, prise
de diurétique thiazidiques ou de lithium).
- Aucune amélioration de la calcémie après
chirurgie lorsque le diagnostic d'HPT I a été posé
à tort.
- Analyse moléculaire de l'ADN quand il existe un doute
persistant avec une
HPT I modérée qui peut avoir une PTH normale et une
calciurie normale.
II.3.1.2.1. Traitement par le lithium
L'hypercalcémie est présente chez 5 à 10
% des patients traités par lithium. Chez ces patients, on retrouve des
taux élevés de PTH. Le lithium in vitro stimule la
prolifération des cellules parathyroïdiennes In vivo, le lithium
augmente la synthèse d'ADN de la PTH par les cellules
adénomateuses ou hyperplasiques mais pas par des cellules
parathyroïdiennes saines. Le lithium ne fait qu'amplifier le tissu
pathologique existant c'est pourquoi l'hypercalcémie ne disparaît
pas après 8 semaines d'arrêt du traitement psychotrope. De plus,
l'hypercalcémie peut s'expliquer par la capacité du lithium
à augmenter la réabsorption du calcium au niveau de la BAAH.
II.3.2 Hypercalcémie et néoplasie
L'hypercalcémie due au cancer est fréquente,
souvent sévère, mettant en jeu le pronostic vital et difficile
à traiter. Une maladie tumorale est la cause la plus fréquente
des hypercalcémies observées en milieu hospitalier. La
prévalence de l'hypercalcémie tumorale varie entre 6 et 14 % des
tumeurs. L'hypercalcémie néoplasique a deux mécanismes.
Elle peut être induite par la destruction de l'os par les cellules
tumorales provoquée par des facteurs protéolytiques locaux
(prostaglandines de la série E, Tumor necrosis factor ou TNF,
Transforming growth factor ou TGF, Colony stimulator factor
ou CSF, Interleukine 1) ou dans les autres cas, par des facteurs humoraux
sécrétés par les cellules cancéreuses «)
». Les facteurs identifiés à ce jour, sont la PTH, le
calcitriol et le PTH related peptide (PTHrP). Seulement 5 cas de
production ectopique de PTH authentique ont été clairement
documentés Si la vitamine D bioactive a été
incriminée dans le cadre des lymphomes, il semble que le PTHrP soit plus
souvent responsable. La PTHrP est un peptide de 141 acides aminés qui
présente une homologie courte avec la PTH. Cette analogie structurelle
lui permet de se fixer sur les récepteurs de la PTH et d'en mimer les
effets. Néanmoins, une large divergence du reste de la molécule
explique qu'elle n'est pas reconnue par les anticorps spécifiques
anti-parathormone. Par ailleurs, la présence de cette molécule
n'est détectable de manière physiologique qu'au cours de la
lactation et pendant la vie foetale. (Rizzoli,
1996)
|
- Hypercalcémie par destruction osseuse locale (les
facteurs d'activation des ostéoclastes: interleukine 1, TNF, CSF,
TGF).
|
|
Hémopathies malignes
|
|
|
- Myélome multiple.
|
|
- Lymphome.
|
|
- Hypercalcémie par médiation humorale
|
|
(1 ,25(OH)2 vit D, PTHrP).
|
|
- Lymphome.
|
|
- Hypercalcémie par destruction osseuse locale
(prostaglandines de la série E)
|
|
- Cancer du sein
|
|
- Hypercalcémie par médiation humorale
|
|
Tumeurs solides
|
(PTHrP, autres médiateurs)
|
|
- Cancer spinocellulaire du poumon
|
|
- Cancer du rein
|
|
- Cancer du tractus urogénital
|
|
- Autres tumeurs spinocellulaires
|
Tableau 4: Étiologies et
mécanismes de l'hypercalcémie maligne. (Rizzoli,
1996)
Les signes cliniques vont regrouper ceux de
l'hypercalcémie et ceux de la maladie tumorale causale. Les signes
d'hypercalcémie sont ceux décrits précédemment mais
du fait de leurs installations brutales, on retrouve un tableau franc, mal
toléré qui en fait une véritable urgence
thérapeutique. Les signes tumoraux sont une asthénie, une perte
de poids, une anorexie, des rashs cutanés inexpliqués et des
signes spécifiques de la tumeur.
Au niveau biologique, on trouve des signes communs à
l'HPT I tels qu'une hypercalcémie, une excrétion urinaire d'AMPc
néphrogénique élevée, une hypophosphorémie
et une hyperphosphaturie. Mais à la différence de l'HPT I, il n'y
a pas d'élévation de la PTH active, la clairance rénale du
calcium est plus élevée (rapporté à la
calcémie), les taux de calcitriol sont normaux ou bas pour les
tumeurs
solides ou augmentés dans le cadre des lymphomes et les
taux sanguin de PTHrP sont augmentés.
II.3.3. Hypercalcémie et vitamine D
L'hypercalcémie est due à un excès en
vitamine D, qui provient soit d'un apport exogène, c'est l'intoxication
par la vitamine D, soit d'une production endogène dans le cadre des
maladies granulomateuses. Lors d'une intoxication à la vitamine D, on ne
retrouve pas d'augmentation significative du taux circulant de calcitriol Ce
phénomène peut s'expliquer soit par l'action du
calcifédiol (précurseur du calcitriol ou 25 OH vit D) sur le
récepteur nucléaire spécifique du calcitriol, soit par le
déplacement du calcitriol de sa protéine porteuse par le
calcifédiol. Ce mécanisme entraîne une augmentation de la
fraction libre du calcitriol sans augmenter la concentration plasmatique
totale. Cette fraction libre est la forme bioactive, mais elle n'est
habituellement pas sélectivement dosée.
Dans les maladies granulomateuses, la production du calcitriol
par le macrophage des tissus granulomateux est d'autant plus importante que les
apports de vitamine D ou l'exposition au soleil sont grands. Ainsi chez ces
patients, la régulation de la production des métabolites actifs
est déviée et des apports excessifs en calcium ne reduisent pas
les taux sériques de calcitriol.
Dans le cadre de l'intoxication par la vitamine D, les signes
cliniques sont ceux de l'hypercalcémie. En général il
n'existe pas de forme aiguë car le mécanisme est lent et
régulier mais par contre la calcémie peut être franchement
élevée. Chez un sujet normal, l'ingestion chronique de doses
élevées de vitamine D doit être au moins 50 à 100
fois supérieure aux besoins pour produire une hypercalcémie
(doses journalières dépassant 50 000 à 100 000
unités).
Dans le cadre des maladies granulomateuses, le tableau
associé à l'hypercalcémie est celui de la maladie de
fond.
Les étiologies sont multiples: intoxication à la
vitamine D; maladie granulomateuse (sarcoïdose, tuberculose, silicose);
lymphome hodgkinien et non hodgkinien ; hypercalcémie idiopathique
néonatale (maladie congénitale dans laquelle on trouve une
sensibilité accrue à la vitamine D).
Les signes biologiques associent: hypercalcémie;
hypercalciurie; l'augmentation du calcifédiol (25 OH vit D3); taux
normaux compris entre 20 et 90 nmol·L-1; taux normaux de
calcitriol (1.25 OH vit D3) entre 50 et 180 pmol·L-1 dans
l'intoxication à la vitamine D ou augmenté dans les maladies
granulomateuses; diminution de la 1 84 PTH. (Pettifor and all ,
1995)
II.4. Hypercalcémie associée à une
élévation du turn over osseux
Le tissus osseux est en permanence le siège d'un
remodelage ou la destruction des travées osseuses est associée
à une ostéogenèse simultanée. Le
déséquilibre entre la résorption osseuse et la
reconstruction peut entraîner une libération de calcium et une
hypercalcémie lorsque l'élimination rénale ne suffit pas
à maintenir la valeur du calcium dans les limites normales.
II.4.1. Hyperthyroïdie
Les hormones thyroïdiennes sont de puissants stimulateurs
de la résorption osseuse. Des récepteurs de ces hormones ont
été mises en évidence sur des cultures de cellules
osseuses. Néanmoins seulement 20 % des hyperthyroïdies
présentent une hypercalcémie associée
L'hypercalcémie survient lorsque le rein n'arrive pas à
excréter la surcharge calcique produite. L'hypercalcémie reste
modérée et le signe le plus fréquent est la
présence d'une hypercalciurie. L'hypercalcémie se corrige avec le
traitement de l'hyperthyroïdie. (Gopal and all
200)
II.4.2. Immobilisation
Chez le volontaire sain, l'immobilisation entraîne une
hypercalciurie et une mobilisation du calcium squelettique mais habituellement
sans hypercalcémie car le rein élimine la production de calcium
Par contre l'immobilisation chez l'enfant et chez l'adolescent peut
entraîner des hypercalcémies particulièrement en cas de
para- ou tétraplégie. La calcémie se normalise
progressivement lorsque le malade reprend une rééducation.
II.4.3. Intoxication à la vitamine A
Il s'agit d'une cause rare d'hypercalcémie le plus
souvent secondaire à une supplémentation nutritionnelle.
L'hypercalcémie peut être sévère (3 à 3,5
mmol·L-1 après injection de 50 000 à 100 000 UI
de vitamine A par jour) et serait provoquée par une augmentation de la
résorption osseuse dont le mécanisme n'est pas
complètement élucidé Le diagnostic se fait par
l'interrogatoire et dosage de la vitamine A.
|
Calcifédiol
|
Calcitriol
|
|
Hyperparathyroïdie
|
normal
|
haut/normal
|
|
Hypercalcémie maligne
|
|
|
|
Tumeur solide
|
normal
|
bas/normal
|
|
Lymphome
|
normal
|
haut/normal
|
|
Intoxication à la vitamine D
|
Haut
|
normal
|
|
Granulomatose
|
normal
|
haut
|
Tableau 5: Concentrations de
calcifédiol et de calcitriol en cas
d'hypercalcémie.
(Gopal and all 200)
II.5. Hypercalcémie associée à une
insuffisance rénale II.5.1. Hyperparathyroïdie secondaire
sévère
La réduction de la production de vitamine D active dans
l'insuffisance rénale chronique (IRC) induit une hypocalcémie par
défaut d'absorption associée à une
hyperphosphorémie par défaut d'élimination. Dans la
majorité des cas, l'hyperproduction d'hormone parathyroïdienne qui
en résulte n'induit pas d'élévation significative de la
calcémie du fait de la réduction franche de l'absorption
intestinale du calcium. Il existe cependant des formes sévères
où la sécrétion de PTH aboutit à une
hypercalcémie par résorption osseuse brutale. Mais, même
dans ces formes sévères, l'hypercalcémie n'est
qu'exceptionnellement aiguë et très élevée. Le
mécanisme invoqué est que l'hyperphosphorémie
provoquée par l'insuffisance rénale majore la réduction de
synthèse de la 1.25 (OH)2 vit D, elle-même diminuée par la
réduction néphronique. Cependant récemment, il a
été démontré qu'au stade
précoce d'insuffisance rénale (clairance < 70
mL·min-1), il existait déjà des signes
biologiques (augmentation de la PTH - diminution de la calcémie) et
paracliniques (hyperostéoclastie, apparition d'os fibreux) d'HPT II sans
qu'il y ait jamais eu d'hyperphosphorémie Ceci pourrait être
expliqué par l'accumulation intracellulaire de phosphore provoquant une
baisse de la production de 1,25 OH vitamine D3 qui est déjà
compromise par la réduction néphronique et l'acidose. Cette
augmentation de phosphate dans les cellules tubulaires rénales serait
secondaire à la charge filtrée de phosphates répartit sur
un nombre de néphrons plus petits restant encore fonctionnels. D'autres
études démontrent qu`il existe d'autres facteurs contribuant
à la baisse de synthèse du calcitriol au cours de l'IRC:
diminution du calcifédiol par une carence lactée par la prise
d'anticonvulsivants ou par la perte dans les urines en cas de syndrome
néphritique
La baisse du calcitriol aggrave l'HPT II par l'effet
inhibiteur direct du calcitriol sur la synthèse de PTH et la
prolifération cellulaire parathyroïdienne et par la
réduction de l'absorption intestinale de calcium.
Au stade plus avancé d'IRC, l'hyperphosphorémie
apparaît et celle-ci pourrait contribuer à l'augmentation de la
PTH, d'autant qu'il existe une hypocalcémie associée à une
baisse supplémentaire de calcitriol La sécrétion excessive
de PTH est également imputable à la diminution de l'expression du
récepteur calcium sur les cellules parathyroïdiennes. Il existe une
diminution plus marquée des récepteurs calcium sur les zones
nodulaires que sur les zones d'hyperplasie. Au cours de l'HPT II, les glandes
parathyroïdiennes évoluent d'une hyperplasie diffuse vers une
hyperplasie nodulaire. Il est donc probable que ce type de transformation
aboutit à un échappement progressif du contrôle de la
synthèse et de la sécrétion de la PTH.
Les signes cliniques associent des calcifications, un prurit et
des douleurs osseuses relevant de deux mécanismes différents:
- Ostéomalacie ou ostéofibrose par baisse de
calcitriol. La biopsie montre une bande de tissu osseux non
minéralisé (grande épaisseur ostéoïde).
- Ostéopathie adynamique par un bas niveau de
remodelage osseux (baisse des ostéoblastes et ostéoclastes).
Histologiquement l'épaisseur ostéoïde est normale ou petite.
Initialement, l'ostéopathie adynamique se rencontrait dans les
intoxications aluminiques chez les patients dialysés chroniques.
À l'heure
actuelle elle s'inscrit dans le cadre d'une
hypoparathyroïdie secondaire iatrogénique (surcharge en calcium ou
vitamine D soit par voie orale ou pendant la dialyse notamment en cas de
dialyse péritonéale continue ambulatoire).
Les calcifications ectopiques sont péri-articulaires,
vasculaires (média, intima), cutanées ou sous-cutanées et
oculaires. Leur développement seulement chez certains malades
malgré un profil biologique similaire s'expliquerait par l'augmentation
prolongée du produit phosphore-calcium. Certains suggèrent que de
hautes concentrations de phosphore et de calcium soient une indication à
la parathyroïdectom ie.
Le prurit, attribué à une augmentation de calcium
dans la peau peut être très invalidant et incessant
Les signes biologiques à un stade avancé
associent la calcémie plutôt normale ou basse très rarement
augmentée, une hyperphosphorémie, calcitriol diminué, PTH
et phosphatases alcalines augmentés et insuffisance rénale.
Le traitement est principalement médical, il a pour but
de maintenir des concentrations de phosphate et de calcium entre des valeurs
normales pour supprimer la sécrétion de PTH et améliorer
la maladie osseuse préexistante. Ce traitement regroupe un régime
alimentaire pauvre en phosphate (recours au carbonate de calcium qui est
chélateur du phosphore), riche en calcium, et supplémenté
en vitamine D active. Pour 5 à 10 % des patients dialysés au long
cours, le traitement médical est un échec. Dans ces cas, la
parathyroïdectomie subtotale ou la parathyroïdectomie totale avec
auto-greffe d'un moignon parathyroïdien devient nécessaire car 80 %
de ces patients vont améliorer leur symptomatologie osseuse et
prurigineuse. (Drueke . 1998)
II.5.2. Hyperparathyroïdie tertiaire
hyperparathyroïdie secondaire. Cinq pour cent des
patients transplantés rénaux conservent une hypercalcémie
modérée qui est le résultat d'une
hypersécrétion autonome de PTH C'est dans ce cadre que l'on parle
d'HPT III. Beaucoup de ces troubles se normalisent dans les 12 mois
après la transplantation sinon une parathyroïdectomie subtotale ou
une parathyroïdectomie totale plus autotransplantation offrent
d'excellents résultats sur cette hypercalcémie chronique.
II.5.3. Syndrome des buveurs de lait et d'alcalins ou
syndrome de Burnett
Ce syndrome peut être aigu, subaigu ou chronique, il
comprend l'association d'une hypercalcémie, d'une alcalose et d'une
insuffisance rénale. Ce phénomène est secondaire à
l'ingestion excessive de calcium et d'antiacides absorbables tel que le lait,
le bicarbonate de calcium ou d'anciens traitements anti-acides. La
physiopathologie demeure incertaine. Il semble que ce syndrome dépende
beaucoup de facteurs individuels favorisant l'absorption d'une fraction plus ou
moins importante de calcium lors d'un apport alimentaire excessif. Il en
résulte une hypercalcémie post-prandiale, qui
génère une alcalose de contraction par la polyurie. Cette
hypercalcémie inhibe la sécrétion de PTH ce qui favorise
la réabsorption rénale de bicarbonates, eux-mêmes
apportés en excès. Si les apports continuent, l'alcalose se
majore et entraîne une augmentation de la réabsorption du calcium
au niveau du tube distal et donc une élévation de la
calcémie et l'installation d'un cercle vicieux. L'altération de
la fonction rénale associe une perte du pouvoir de concentration des
urines et une tubulopathie par hypovolémie
Le cercle vicieux peut être interrompu par l'arrêt
des apports calciques et alcalins. Néanmoins la forme très
évoluée (syndrome de Burnett) peut aboutir à une
insuffisance rénale terminale irréversible. (Orwoll
1982)
II.6. Traitement des hypercalcémies
aiguës
Les indications du traitement dépendent essentiellement
du chiffre de la calcémie adaptée à l'albuminémie
et des symptômes associés. Pour une calcémie
supérieure à 3,5 mmol·L-1, le traitement doit
être agressif même s'il n'existe pas de signes cliniques car c'est
une urgence vitale. Quand la calcémie est comprise entre 3
et 3,5 mmol·L-1, le retentissement clinique
doit servir de guide pour la thérapeutique à employer. Si la
calcémie est inférieure à 3 mmol·L-1, le
traitement initial peut être réduit à la correction de la
déshydratation au traitement de la maladie causale.
Le traitement de l'hypercalcémie repose sur quatre
objectifs: la correction de la déshydratation, l'augmentation de
l'excrétion urinaire de calcium, l'inhibition de la résorption
osseuse et le traitement de l'étiologie. (Bilezikian ,
1992)
II.6.1. Correction de la
déshydratation
C'est une mesure générale à prendre
devant toutes les hypercalcémies (aiguës ou chroniques).
L'administration de sérum isotonique est la première étape
du traitement. La quantité nécessaire est basée sur la
sévérité de l'hypercalcémie, l'état de
déshydratation et la tolérance cardiaque de l'expansion
volémique ce qui aboutit en moyenne vers des apports de 2,5 à 4
L·j-1. La restauration de l'état volémique
entraîne une baisse de la calcémie par: dilution, augmentation de
la masse de calcium filtré par augmentation de la filtration
glomérulaire, diminution de la réabsorption de Na et Ca au niveau
du tube contourné proximal et augmentation de la diurèse et de la
calciurèse.
II.6.2. Augmentation de l'excrétion urinaire de
calcium
Après la réhydratation, les diurétiques
de l'anse peuvent être utilisés pour deux raisons. D'une part, ils
augmentent la calciurie en inhibant la réabsorption du calcium au niveau
de la branche ascendante de l'anse de Henlé, mais ceci doit être
précédé d'une expansion volémique. D'autre part,
ils protègent contre une surcharge hydrosodée chez les patients
insuffisants cardiaques. Les posologies de furosémide utilisées
peuvent entraîner une majoration des pertes urinaires nécessitant
une compensation hydroélectrolytique, d'où l'importance du
ionogramme urinaire au cours de la surveillance du traitement.
II.6.3. Inhibition de la résorption
osseuse
Le troisième axe du traitement est la correction de la
résorption osseuse. Il est recommandé d'introduire des
inhibiteurs des ostéoclastes, chez des patients dont la calcémie
dépasse 3.5 mmol·L-1 ou chez des patients symptomatiques
dont la calcémie reste supérieure à 3
mmol·L-1 après normalisation de leur volémie
Ces médicaments sont essentiellement regroupés en
trois familles: les biphosphonates, la calcitonine et la plicamycine.
II.6.3.1. Biphosphonates
Les biphosphonates possèdent une analogie structurelle
avec le pyrophosphate lequel est un produit naturel du métabolisme. Ces
produits ont une haute affinité pour l'hydroxyapathite osseuse. Cette
liaison inhibe la dissolution des cristaux minéraux par les enzymes
ostéoclastiques. Les propriétés communes des
biphosphonates sont leur effet inhibiteur sur la fonction des
ostéoclastes et aussi leur capacité à diminuer la
viabilité des ostéoclastes. Il existe 3 molécules
disponibles : l'étidronate, le pamidronate et le clodronate. Leur
absorption digestive étant inférieure à 10 %, leur
administration est intraveineuse. Leur durée d'action est très
variable d'un patient à l'autre, certains normalisent leur
calcémie pour plusieurs mois après une injection unique tandis
que d'autres ont besoin de plusieurs doses répétées pour
la stabiliser. Parmi les effets secondaires recensés, on retrouve une
fièvre modérée en relation avec une
sécrétion de cytokines à partir des ostéoclastes,
des monocytes et des macrophages. Sont notés par ailleurs une
hypocalcémie (10 %), une hypophosphatémie (10 à 30 %), une
hypomagnésémie (10 %) et une baisse transitoire des
lymphocytes
L'étidronate est un biphosphonate de première
génération, la dose recommandée est de 7,5
mg·kg-1 intraveineux sur 4 heures pendant 3 à 7 jours.
La calcémie commence à diminuer dans les 2 premiers jours et se
normalise dans 60 à 100 % des cas dans les sept premiers jours. Le
traitement peut être interrompu si la baisse de la calcémie est
supérieure à 0,5 à 0,75 mmol·L-1
après les 2 ou 3 premières doses ou si le niveau de la
calcémie est presque normal. La poursuite du traitement jusqu'à
la normalisation complète de la calcémie expose à une
hypocalcémie. L'action anti-
résorption osseuse est mise en évidence par la
chute de l'excrétion urinaire de calcium et de l'hydroxyprolinurie. Les
effets secondaires du traitement de courte durée sont très
faibles, on rapporte juste une élévation transitoire de la
créatininémie et de la phosphorémie.
Le clodronate a été un des premiers
biphosphonates à être utilisé dans l'hypercalcémie
néoplasique. Il peut être administré à la dose de 4
à 6 mg·kg-1 en IVL de 2 à 5 heures, pendant 3
à 5 jours ou en injection unique sur 2 à 9 heures. La
réponse au traitement survient durant les 2 premiers jours pour une
normalisation de la calcémie en 7 jours. Le clodronate, comme le
pamidronate, a la capacité de réduire la progression des
métastases et de prévenir l'hypercalcémie des patients
cancéreux
Le pamidronate a une action antirésorption osseuse plus
puissante que l'étinodrate. Trois protocoles d'administration ont
été utilisés: a) perfusion lente de 15 à 45
mg·j-1 pendant 6 jours; b) perfusion lente et unique de 90 mg ;
c) prise orale de 1 200 mg·j1 pendant cinq jours. La dose unique semble la
plus performante car elle normalise 70 à 100% des hypercalcémies.
Les effets secondaires sont limités à une fièvre jamais
supérieure à 39°C, à une leucopénie
transitoire et à une hypophosphorémie modérée.
Dans une étude comparant l'efficacité de ces 3
molécules, le pamidronate était le plus rapide à agir,
celui qui donnait la plus forte et la plus longue baisse de
l'hypercalcémie.Dans un autre essai thérapeutique pamidronate
versus étidronate, le pamidronate normalisait la
calcémie chez 70 % des patients alors que l'étinodrate ne la
corrigeait que chez 40 %.
II.6.3.2. Calcitonine
La calcitonine est une hormone naturelle qui inhibe la
résorption osseuse et augmente l'excrétion rénale de
calcium. La calcitonine utilisée provient du saumon, la dose
recommandée est de 2 à 8 UI·kg-1 toutes les 6
à 12 heures en intraveineux, en sous-cutanée ou en
intramusculaire. C'est la drogue qui agit le plus vite contre
l'hypercalcémie, la baisse de la calcémie s'observe dès
les premières heures de traitement grâce à la majoration de
l'excrétion urinaire. Les deux problèmes majeurs
de cette agent sont l'existence d'un phénomène
d'échappement après les 12 premières heures, malgré
la poursuite du traitement et sa faible efficacité (baisse de la
calcémie d'environ 0,5 mmol·L-1). La tolérance
est bonne, néanmoins des nausées, des crampes abdominales, des
bouffées vasomotrices ainsi que des réactions anaphylactiques ont
été décrites pour la calcitonine saumonée. La
calcitonine humaine est moins puissante que celle du saumon. La calcitonine a
sa place dans les hypercalcémies menaçant le pronostic vital car
son action est très rapide. En revanche dans ce cadre, il est
intéressant de faire une association avec les biphosphonates plus longs
à agir mais dont la durée d'action et la puissance lui sont
supérieures.
II.6.3.3. Plicamycine
La plicamycine est à l'origine un antibiotique qui
possède une propriété hypocalcémiante. Son
mécanisme d'action repose sur l'inhibition de la synthèse d'ARN
dans l'ostéoclaste et interfère avec la différentiation
des précurseurs des ostéoclastes en ostéclastes matures.
La dose recommandée est comprise entre 15 à
25 g·kg-1 en perfusion intraveineuse lente de
4 à 6 heures. La dose peut être répétée
plusieurs fois en respectant un intervalle de 24 à 48 heures. La chute
de la calcémie s'observe dès la 12e heures
après l'initiation du traitement. Le problème majeur de cette
drogue est l'existence de nombreux effets secondaires graves. On note des
hépatites aiguës médicamenteuses chez 20 % des patients, une
néphrotoxicité, une thrombocytémie et un risque de
cellulite en cas d'extravasation. Devant cette toxicité il n'est plus
recommandé d'utiliser cette molécule. (Gucalp
and
all 1992)
II.6.4. Autres traitements
Les glucocorticoïdes sont en général
inactifs contre l'hypercalcémie. Cependant, leur propriété
d'inhiber la croissance du tissu lymphoïde néoplasique dans les
lymphomes ou dans les myélomes justifient leur utilisation. De plus,
leur capacité à agir contre l'effet hypercalcémiant de la
vitamine D en fait un traitement adapté dans les intoxications à
la vitamine D et dans les granulomatoses. La dose recommandée est de 200
à 300 mg d'hydrocortisone intraveineux pendant 3 à 5 jours.
Le phosphore peut diminuer rapidement la calcémie
lorsque celui ci est prescrit en intraveineux mais ce traitement est à
récuser car il entraîne la précipitation de complexes
phosphocalciques qui se déposent dans les vaisseaux sanguins, dans le
rein ou les poumons pouvant engendrer des défaillances organiques
majeures mettant en jeu le pronostic vital.
La dialyse péritonéale ou l'hémodialyse
sont utilisable notamment chez les patients insuffisants rénaux
chroniques. Ces techniques sont très efficaces si on utilise des bains
de dialyse pauvre en calcium. L'hémodialyse est la plus efficace des
deux méthodes puisqu'on peut épurer jusqu'à 6
g·j-1 contre 0,5 à 2 g·j-1 pour la
dialyse péritonéale.
II.6.5. Traitement de l'étiologie
C'est la partie la plus importante du traitement, car cette
correction va permettre d'éviter de façon définitive la
récidive de l'hypercalcémie. Ce traitement repose sur la
parathyroïdectomie qui préviendra d'une crise aiguë ou sur une
éventuelle chimiothérapie en cas de néoplasie. Le
contrôle médicamenteux sert à fournir du temps pour
planifier le traitement de la maladie sous-jacente.
Le maintien de l'homéostasie de la calcémie,
indispensable à la vie, est sous la dépendance de trois hormones
calciotropes: la PTH et le calcitriol hypercalcémiants et la calcitonine
hypocalcémiante. Elles agissent sur les sites d'absorption (grêle)
et d'élimination (rein) mais également au niveau du tissu osseux.
L'hypercalcémie résulte d'un déséquilibre entre les
flux entrants et sortants au niveau
de ces organes. L'hypercalcémie a de multiples
étiologies, mais dans la majorité des cas un interrogatoire et un
dosage de la PTH doivent permettre d'orienter le diagnostic. En dehors de la
crise hypercalcémique, l'anesthésie a peu d'interférences
avec le calcium par contre l'anesthésie doit prendre en compte le
terrain particulier de certains patients (HPT II). Le traitement de
l'hypercalcémie aiguë repose sur l'association de 4 objectifs. La
réhydratation, la diurèse entraînée
compensée, les inhibiteurs de la résorption osseuse et le
traitement de la cause. L'hypercalcémie aiguë interfère avec
la fonction cardiaque et rénale et peut mettre en jeu le pronostic
vital. Son traitement doit donc être instauré le plus rapidement
possible et en réanimation.
III. L'HYPOCALCÉMIE
III.1. Définition
L'hypocalcémie se définit par une
calcémie < 2,25 mmol/l, la baisse du calcium ionisé <
1,1mmol/l jouant le rôle essentiel dans la sémiologie. La mesure
de ce calcium ionisé est donc souhaitable, - mais pas toujours
disponible techniquement - surtout si le patient a une hypoalbuminémie
qui peut faire baisser le taux de calcémie : la concentration du calcium
total sérique baisse de 0,2 mmol/l pour chaque baisse de 10g/l de
l'albumine sérique, et on peut calculer, à partir de la
calcémie totale, la calcémie ionisée en utilisant des
abaques qui corrigent la calcémie en fonction de l'albumine et du pH
plasmatiques. (Vaughan ,2000)
III.2. Manifestations cliniques
Elles dépendent du taux du calcium ionisé, et
elles se présentent de manière variée en fonction de
l'importance et de la chronicité de l'hypocalcémie :
tétanie, oedème papillaire, convulsion surviennent au cours des
hypocalcémies aigues, alors que dans les formes chroniques on observe
surtout des altérations cutanées, dentaires et
extra-pyramidales.
III.2.1. Manifestations neuromusculaires
La tétanie est le signe majeur de
l'hypocalcémie aigue, caractérisée par une
irritabilité neuromusculaire. Les symptômes peuvent être
modérés (parésthésies des mains, des
extrémités, péribucales, fasciculations
musculaires,crampes musculaires pouvant donner au niveau des mains la classique
"main d'accoucheur"), ou plus importants (spasme carpopédal,
laryngospame). On recherchera les signes de Trousseau ( spasme du carpe
apparaissant après 3 ' de prise de pression artérielle,
l'appareil étant gonflé au delà de la systolique) et de
Chvostek (contraction du muscle facial ipsilatéral provoqué par
la percussion du nerf facial juste en avant de l'oreille)..
L'électromyographe montre l'aspect caractéristique
d'hyperexcitation neurogène, surtout au niveau des neurones
périphériques, mais cette hyperexcitabilité peut
être notée à tous les niveaux du système nerveux,y
compris le
système central. La tétanie correspond à un
calcium ionisé < 1,1 mmol/l, correspondant à un calcium total
du 1,8 à 1,9 mmol/l.
Les convulsions, du type grand mal, petit mal ou
focalisées, peuvent être une manifestation de la tétanie,
mais peuvent également se voir de manière isolée : il est
possible que la concentration basse du calcium ionisé dans le liquide
céphalorachidien puisse avoir un effet convulsivant.
Ces manifestations neuromusculaires sont favorisées par
plusieurs facteurs :
· alcalose métabolique ou respiratoire
(hyperventilation)
· hypokaliémie, souvent associée à une
alcalose
· hypomagnésémie
D'autres manifestations neurologiques peuvent survenir,
quelque soit l'étiologie de l'hypocalcémie, et réversibles
sous traitement :
· oedème papillaire, parfois associé à
une hypertension intracrânienne
· manifestations psychiatriques : instabilité
émotionnelle, anxiété, dépression, parfois
hallucinations, confusion, psychoses
III.2.2. Manifestations cutanées
Elles sont notées au cours des hypocalcémies
chroniques: peau sèche, chute des cheveux, ongles cassants,
eczéma, hyperpigmentation, cataracte. Toutes ces manifestations peuvent
être améliorées par le traitement de
l'hypocalcémie.
III.2.3. Manifestations cardio-vasculaires
Une hypotension artérielle peut compliquer une
hypocalcémie aigue induite rapidement par l'apport d'EDTA ou de sang.
citraté. L'hypocalcémie entraîne un allongement de
l'intervalle QT.Elle peut diminuer la force contractile du myocarde et
favoriser une insuffisance cardiaque.
D'autres manifestations cliniques peuvent être
notées, soit au cours des déficits en vitamine D, soit surtout au
cours de l'hypoparathyroidisme idiopathique. (Bianchetti, 1983
)
III.3. Etiologies des hypocalcemies
Le diagnostic étiologique implique de pouvoir disposer
des examens suivants : calciurie/24h, activité phosphatase alcaline,
magnésémie, PTH intacte 1-84, AMPc néphrogénique,
métabolites de la vitamine D : calcidiol (25-OH)D et calcitriol (1
,25(OH)2D3).
III.3.1. Hypocalcémies parathyroïdiennes
Le déficit de sécrétion ou d'action de
la PTH entraîne une diminution de l'entrée de calcium dans la
circulation, donc l'hypocalcémie, qui peut être très
importante, secondaire à la diminution de l'ostéolyse
ostéocytaire et de la réabsorption tubulaire du calcium. La
phosphorémie est élevée (> 2mmol/l). La diminution de
la sécrétion de PTH et l'hyperphosphorémie diminuent la
synthèse de 1 ,25(OH)2D3, d'où la diminution de l'absorption
digestive du calcium et la diminution de la calciurie/24h.
- Hypoparathyroïdisme acquis :
L'étiologie post-chirurgicale est la plus fréquente, après
chirurgie sur les parathyroïdes, thyroïde, ou chirurgie radicale
cervicale pour cancer; elle survient dans 1 à 2% des
thyroïdectomies totales pour cancer de la thyroïde.
L'hypoparathyroïdisme peut être transitoire ou permanent. Egalement
acquis sont les cas très rares d'infiltration des parathyroïdes
avec défaut de production de PTH : amylose, hémochromatoses,
maladie de Wilson, cancer métastatique.
- Hypoparathyroïdisme idiopathique :
Syndrome rare, familial dans la moitié des cas, il s'agit en
général d'un état autoimmun polyglandulaire (insuffisance
surrénale, hypothyroïdie), une anémie de Biermer, une
candidose cutanée chronique; des anticorps dirigés contre le
récepteur calcium-sensible des cellules parathyroïd ien nes ont
été décrits.
- Hypoparathyroïdisme congenital : La
forme la mieux identifiée est l'hypocalcémie autosomale
dominante, caractérisée par une hypocalcémie
modérée, une excrétion urinaire de calcium
élevée par rapport à la calcémie, et une PTH
normale, en fait inappropriée au taux de calcémie. Inverse de
l'hypercalcémie hypocalciurique familiale, il
s'agirait également de mutations dans le gêne calcium-recepteur,
de telle façon que la sécrétion de PTH n'augmente pas
comme ceci devrait être le cas devant une hypocalcémie.
- Pseudohypoparathyroïdisme : Ces
enfants présentent une hypocalcémie et une
hyperphosphorémie, mais le taux de PTH est élevé,
témoin d'un résistance à l'action de la PTH. Deux types
ont été décrits :
· Type 1 : Il comporte une diminution
de la réponse de l'AMPc à la PTH, et plusieurs variations
génétiques sont décrites intéressant le gêne
GNAS1 (gêne codant la Gs-alpha-1-protéine du complexe anenylyl
cyclase).Il s'accompagne de l'ostéodystrophie héréditaire
d'Albright : face ronde, taille courte, raccourcissement d'un ou plusieurs
métacarpiens, épaississement de la voûte
crânienne.
· Type 2 : Affection très rare,
voire discutée, l'AMPc répond normalement à
la PTH, et
il s'agirait d'une résistance à l'effet intracellulaire de
l'AMPc.
Déplétion sévère en
magnésium : Lorsque la magnésémie est < 0,5
mmol/l, une hypocalcémie peut survenir du fait de la diminution de la
sécrétion de PTH et de la résistance des organes cibles
à la PTH. Les causes les plus fréquentes
d'hypomagnésémie chronique sont l'alcoolisme, les malabsorptions,
les traitements au cisplatine, diurétiques, aminoglycosides.
(Stephen J, Marx M ,2000)
III.3.2 Déficits en vitamine D
Comme dans le cas d'hypoparathyroïdisme, le
déficit en VD entraîne une diminution de l'entrée de
calcium dans la circulation, avec diminution de l'absorption intestinale du
calcium. La calcémie est basse, ou à la limite inférieure
de la normale, la calciurie toujours diminuée,
l'hypersécrétion de PTH est constante. La phosphorémie est
le plus souvent abaissée. Le taux de 25(OH)D est très bas, la
concentration de 1 ,25(OH)2D3 est abaissée, entraînant une
certaine résistance osseuse à la PTH. L'activité
phosphatasique alcaline est élevée et l'hydoxyprolinurie
sont élevées dans la quasi totalité des
cas, témoins d'une activité métabolique osseuse
élevée.
Les causes de déficit en VD sont variées :
· carence d'apport alimentaire
· défaut d'exposition solaire
· syndromes de malabsorptions intestinales: des graisses
(stéatorrhée), entéropathies exsudatives, résection
gastrique ou intestinale, insuffisance pancréatique externe,abus de
laxatifs
· affections hépato-biliaires : cholostase
chronique,cirrhose biliaire primitive
· perte urinaire de la protéine transportant la VD
et la 25(OH)D dans le syndrome néphrotique
On en rapproche les rares cas d'affections familiales
où le taux de 25(OH)D circulante est normal mais où il existe
soit une diminution primitive de la production rénale de 1 ,25(OH)2D3 (
rachitisme vitamino-résistant), soit une résistance à
l'action de la 1 ,25(OH)2D3. (Pettifor and all,
1995)
III.3.3. Insuffisance rénale
Les taux de phosphorémie et PTH sont
élevés, le taux de 1 ,25(OH)2D3 est abaissé. La diminution
de production rénale de 1 ,25(OH)2D3 entraîne une diminution des
entrées de calcium dans le plasma, une résistance osseuse
à l'action de la PTH à l'origine en partie de
l'hypocalcémie (cf. métabolimse phospho-calcique et insuffisance
rénale chronique), et une diminution de la réabsorption tubulaire
du calcium. L'hyperplasie parathyroïdienne secondaire maintient longtemps
la calcémie à un taux normal. Il existe une hypocalciurie,
l'activité phosphatase alcaline est augmentée, la
phosphatémie est normale ou élevée en fonction du
degré de réduction néphronique.
On rappelle que l'hypercalciurie, dans le cadre d'une
tubulopathie ou de la prise abusive de diurétiques, peut entraîner
une balance négative de calcium, mais pas d'hypocalcémie du fait
de l'augmentation compensatoire de la sécrétion de PTH
III.3.4. Transfert de calcium ionisé
Le calcium ionisé peut diminuer dans le liquide
extracellulaire en se déposant dans les tissus mous, le tissu osseux, ou
en se fixant dans l'espace vasculaire. C'est le cas de
l'hyperphosphorémie au cours de laquelle le calcium se fixe dans les
tissus mous, situation notées dans l'insuffisance rénale aigue,
les destructions tissulaires massives (lyse tumorale, rabdomyolyse),
administration de phosphate. L'hypocalcémie est ainsi fréquente
au cours de la pancréatite aigue, du fait de la formation de savons
calciques dans la cavité abdominale.
La fixation de calcium peut se faire dans les os, comme au
cours des métastases ostéoblastiques (cancer du sein, prostate),
ou dans le "hungry syndrome" qui survient chez des sujets après
parathyroïdectom ie pour hyperparathyroïd isme primaire,plus rarement
thyroïdectomie.
La fixation de calcium peut se faire dans l'espace
intravasculaire : l'hypocalcémie est rare au cours des"transfusions de
sang ou plasma citraté, les sujets normaux métabolisant
rapidement dans le foie et rein le citrate; cependant, une chute rapide du
calcium ionisé peut se produire si l'apport de sang citraté est
massif, rapide, ou si le sujet présente une défaillance
hépatique. L'EDTA peut réduire le calcium ionisé, la
calcémie totale restant normale. Le foscarnet, utilisé dans le
traitement du cytomegalovirus et herpès peut se complexer avec le
calcium ionisé, d'où la nécessité de mesurer le
calcium ionisé en fin de perfusion.
Les situations critiques, réanimation
post-chirurgicale, septicémies, brûlés, au cours desquelles
une hypocalcémie est fréquente avec une hypoalbuminémie et
un calcium ionisé normal, combinent plus ou moins tous ces
mécanismes : diminution de sécrétion de PTH et de
calcitriol, hypomagnésémie, action de cytokines inflammatoires
sur les parathyroides, reins et tissu osseux. (Rizzoli
,1996)
III.4. Traitement
III.4.1. Hypocalcémie aiguë
Les signes de tétanie apparaissent lorsque le calcium
ionisé est < 1,1 mmol/l, et le calcium total < 1,8 mmol/l. Le
traitement comporte l'administration de calcium par IV, 100 à 200 mg de
calcium, en général sous forme de gluconate de calcium (1
à 2 gr), en 10 à 20 minutes. L'administration ne doit pas
être trop rapide pour éviter des troubles cardiaques, et elle doit
être ultérieurement entretenue par une perfusion lente,0,5
à 1,5 mg/kg/heure. On utilise en général le gluconate de
calcium à 10% (90 mg [2,25mmol] de calcium pour 10 ml), ou le chlorure
de calcium à 10% (360 mg [9mmol] pour 10 ml). Certaines
précautions doivent être prises : * diluer le calcium dans une
solution glucosé ou salé, les solutions trop concentrées
risquant d'irriter les veines; * éviter le bicarbonate ou phosphate, qui
peuvent former des sels insolubles, et si ces anions sont nécessaires,
on utilise une autre ligne veineuse. L'apport IV de calcium est continué
jusqu'à ce que le patient reçoive per os du calcium et de la
vitamine D :
III.4.2. hypocalcémies chroniques :
En dehors du traitement étiologique, le traitement
comporte un apport de calcium per os associé à un apport de VD
:
· calcium per os : carbonate de calcium
(Calcidia®)), gluconolactate + carbonate de calcium (Calcium Sandoz
Forte®), calcium citrate ou calcium lactate. La posologie varie selon les
sujets, le but étant d'améliorer les symptômes et de
maintenir le calcium sérique entre 2,0 et 2,1 mmol/l. L'obtention de
valeurs plus élevées est en général inutile, et
limitée par l'apparition d'une hypercalciurie qui, si elle perdure, peut
entraîner une lithiase rénale, d'où la
nécessité de surveiller la calciurie. Le régime
alimentaire doit également apporter du calcium et être
limité en phosphore
· vitamine D: différentes formes sont disponibles
: *le calcitriol (Un-Alfa®), capsules de 0,25 à 1ug, avec une
posologie de 0,5 à 3ug/j, est le plus actif, ne nécessitant pas
d'activation endogène, avec une demi-vie de 4 à 6 heures : comme
une hypercalcémie est souvent notée, elle disparaîtra
rapidement après arrêt du traitement. Le calcitriol est surtout
utile lorsque la synthèse rénale est altérée, comme
dans l'insuffisance rénale chronique. *Les autres
analogues de la VD sont le calcifédiol ou 25(OH)D3
(Dedrogyl®) 50 à 200ug/j et le dihydrotachysterol, de 0,25à
1 mg/j.
Le traitement doit être adapté à chaque
malade, les doses variant considérablement de sujet à sujet. Il
est important d'éviter les risques d'hypercalcémie et
d'hypercalci u rie avec lithiase. (Bilezikian
,1992)
1 Population étudiée
Critère de choix des sujets
Cette étude a portée sur 60 femmes de l'ouest
algérien, regroupant un quota de 36 femmes recruté au niveau du
CHU de la wilaya de sidi bel abbés, et 24 femmes au niveau de
l'hôpital de la wilaya de Aïn Temouchent.
Les sujets présentant une pathologie chronique
(diabète, HTA, rhumatisme) ont était d'emblés
écarter, les sujets présentant une obésité
modérée, ont étaient incluse dans cette étude, la
surcharge pondérale est définie selon la classification
actuellement acceptée au niveau international, IMC (indice de masse
corporelle) variant de 25 à 29.9 Kg/m2 (WHO, 1998).
L'étude a débuté après approbations responsables
des laboratoires d'une part, et après consentement éclairé
de toutes les femmes.
1 -1 Age des sujets: la
ménopause est une phase incontournable dans la vie d'une femme et peut
survenir à n'importe qu'elle âge, notre échantillon
fût constituer des femmes dont l'âge varier de 47 à 66
ans.
1-2 Indice de masse corporelle: le
poids corporel (P) et la taille (T) son mesurer, l'indice de masse corporelle
(IMC) est calculer ( P/T2), des groupes ont étaient
créer selon l'IMC, ceux ayant un poids normal (PN), ou un surpoids
(SP).
Tableau 1 : caractéristique anthropométrique des
femmes ménopausées
|
Age ( ans)
|
Poids (kg)
|
Taille (cm)
|
IMC (Kg/m2)
|
|
Femmes de poids normal N=26
|
56
|
#177;5
|
73
|
#177; 11
|
160
|
#177; 6
|
24.68
|
#177; 0.43
|
|
Femmes en surpoids N=34
|
57
|
#177; 6
|
75
|
#177; 9
|
164
|
#177; 7
|
28.16
|
#177;1.85
|
1-3 Autres caractéristique de la
population: aucune femme n'est sous traitement hormonal
substitutif ( THS).
Méthodologie de l'enquête
L'approche de la population concernées s'est
réaliser selon les étapes de l'organigramme fig. 1.
Enquête socio-économique et nutritionnelle.
Un formulaire est dûment remplit auprès de chaque
femme, portant sur l'activité professionnelle, le niveau scolaire, le
logement, la taille du ménage etc.
Evaluation de la consommation et des habitudes alimentaires.
Il nous a pas été possible d'aller plus loin
dans le temps ( 7 jours), pour la méthode du semainier et ceci en raison
des perdus de vues. La durée par conséquent été
écourté et s'intéressa seulement à la prise
alimentaire de 3 journées, jour précédent la rencontre, le
jour de la rencontre et enfin pour le troisième jours celui de la
récupération des résultats d'analyses sanguines.
Consentement et adhésion
des sujets à
l'étude
Application des
critères d'inclusions

Codification: assignation d'un
code anonyme
Mesures des paramètres anthropométriques et
cliniques
Poids et taille et pression artérielle
|
|
|
|
Remplissage du formulaire de l'étude et distribution
d'un
feuillet modèle pour la transcription des données
alimentaires
|
|
|
|
Prise d'un échantillon sanguin en vue des dosages
des
paramètres biologique sanguin
|
|
|
|
Collecte et traitement des données
|
|
|
|
|
Analyse statistique
|
|
RESULTATS
Oui Non
Ctrcp
|
Pourcentage
|
|
Oui
|
96.667
|
|
Non
|
3.333
|
|
Total
|
100.000
|
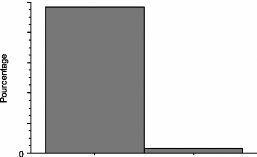
100
80
60
40
20
Favorable Défavorable
Sterilet
|
Pourcentage
|
|
Favorable
|
5.000
|
|
Défavorable
|
95.000
|
|
Total
|
100.000
|
100
90
80
70
40
60
50
30
20
10
0

Figure 1 : Pourcentage de réponse
vis-à-vis de la prise de contraception.
PARTIE EXPERIMENTALE : Résultats 85
Avoir Fait N'avoir jamais fait
Bil _Bio
|
Pourcentage
|
|
Avoir Fait
|
43.333
|
|
N'avoir jamais fait
|
56.667
|
|
Total
|
100.000
|
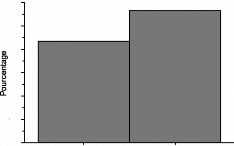
60
50
40
30
20
10
0
Figure 3: Pourcentage ayant fait ou pas un
bilan biologique routinier.
Analphabet Primaire Moyen Secondaire
Niv_Scolaire
|
Pourcentage
|
|
Analphabet
|
36.667
|
|
Primaire
|
31.667
|
|
Moyen
|
20.000
|
|
Secondaire
|
11.667
|
|
Total
|
100.000
|
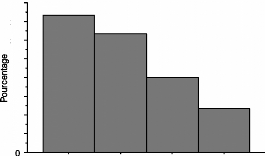
40
35
30
25
20
15
10
5
Figure 4: Histogramme de fréquence
concernant les niveaux d'études des femmes.
PARTIE EXPERIMENTALE : Résultats 86
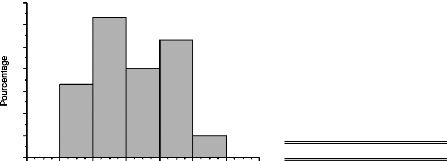
5.817 2.198
N_Enfants
35
30
25
10
5
0
20
15
Moy. Dév. Std
0 2 4 6 8 10 12 14
N_Enfants
Figure 5: Distribution de fréquence du
nombre d'enfant.
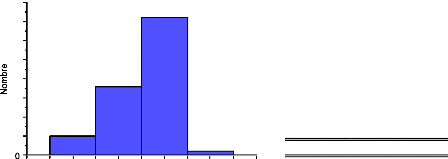
49.167 3.211
Age_meno
40
35
30
25
20
15
10
5
Moy. Dév. Std
37.5 40 42.5 45 47.5 50 52.5 55 57.5 60 62.5
Age_meno
Figure 6: Distribution des moyennes de
l'âge de survenu de la ménopause.
PARTIE EXPERIMENTALE : Résultats 87
|
Pourcentage
|
|
Sein exclusif
|
30.000
|
|
Artificiel exclusif
|
23.333
|
|
Mixte
|
46.667
|
|
Total
|
100.000
|
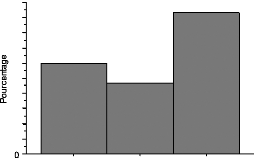
50
45
40
35
25
20
30
15
10
5
Sein exclusif Artificiel exclusif Mixte
Allaitement
Figure 7: Histogramme de fréquence
relative au type d'allaitement.
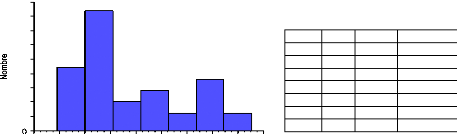
22.5
20
17.5
15
12.5
10
7.5
5
2.5
De(>=) à(<) Nombre Pourcentage
|
23.910
|
25.000
|
11
|
18.333
|
|
25.000
|
26.090
|
21
|
35.000
|
|
26.090
|
27.180
|
5
|
8.333
|
|
27.180
|
28.270
|
7
|
11.667
|
|
28.270
|
29.360
|
3
|
5.000
|
|
29.360
|
30.450
|
9
|
15.000
|
|
30.450
|
31.540
|
3
|
5.000
|
|
Total
|
59
|
98.333
|
23 24 25 26 27 28 29 30 31 32
IMC(Kg/m2)
PARTIE EXPERIMENTALE : Résultats 88
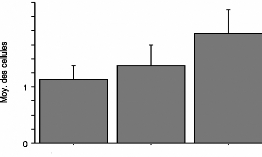
2.5
Glu_Sg (g/l) TG_Sg (g/l) Chol_Sg (g/l)
2.25
2
1.75
1.5
1.25
.5
.25
.75
|
Moy.
|
Dév. Std
|
|
Glu_Sg (g/l)
|
1.130
|
.245
|
|
TG_Sg (g/l)
|
1.377
|
.371
|
|
Chol_Sg (g/l)
|
1.958
|
.407
|
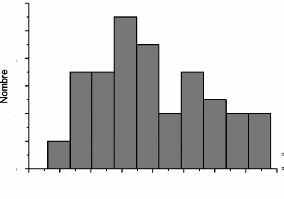
12
10
6
4
2
8
0
70 75 80 85 90 95 100 105 110
Calcémie ( mg/l)
Calcémie ( mg/l)
89.875 9.004
Moy. Dév. Std
Figure 9: Histogrammes des moyennes des
paramètres biologique sanguin.
|
14 12 10 8 6 4
|
|
|
|
|
2
|
|
Moy. Dév. Std
|
|
0
|
AET (Kcal/j)
|
1729.413 140.805
|
|
|
|
1300 1400 1500 1600 1700 1800 1900 2000 2100
AET
Figure 11: Distribution d'effectifs concernant
les niveaux d'apports énergétique total AET.
70



Cal_lipidique cal_glucidique Cal _Protid ique
60
50
30
20
10

40
|
Moy.
|
Dév. Std
|
|
Cal_lipidique
|
33.936
|
6.110
|
|
cal_glucidique
|
54.683
|
6.211
|
|
Cal_Protidique
|
11.381
|
2.221
|
PARTIE EXPERIMENTALE : Résultats 90
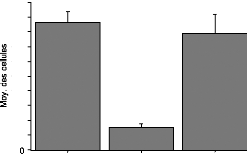
Glu_Alim (g/j) Sucre Amidon
250
225
200
175
150
125
100
75
50
25
|
Moy.
|
Dév. Std
|
|
Glu_Alim (g/j)
|
216.205
|
17.619
|
|
Sucre
|
38.269
|
6.346
|
|
Amidon
|
198.057
|
32.237
|
Figure 13: Histogramme des apports moyens en
glucides.
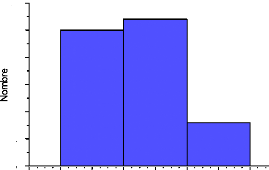
25
20
30
15
10
5
0
300 400 500 600 700 800 900 1000
Ca_Alim mg/j
De(>=) à(<) Nombre Pourcentage
|
400.000
|
600.000
|
25
|
41.667
|
|
600.000
|
800.000
|
27
|
45.000
|
|
800.000
|
1000.000
|
8
|
13.333
|
|
Total
|
60
|
100.000
|
PARTIE EXPERIMENTALE : Résultats 91
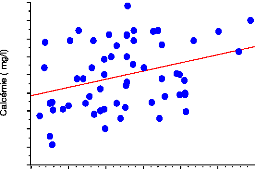
110
105
100
95
90
85
80
75
70
65
400 500 600 700 800 900 1000
Ca_Alim mg/j
Figure 15: Graphe de régression entre
calcémie vs calcium alimentaire (r=0.40).
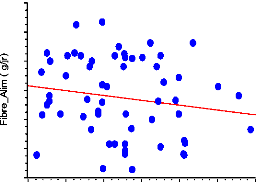
30
28
26
24
22
20
18
400 500 600 700 800 900 1000
Ca_Alim mg/j
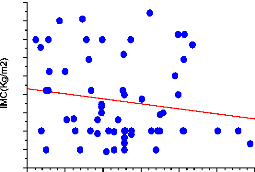
32
31
30
29
28
27
26
25
24
23
400 500 600 700 800 900 1000
Ca_Alim mg/j
Figure 17: Graphe de régression entre IMC
vs Calcium alimentaire (r=-0.30).
INTERPRETATIONS ET DISCUSSIONS
Sur le plan des facteurs de risques, nous avons
constaté un manque total d'informations vis-à-vis de certaines
questions relatives à l'hygiène de vie sanitaire de la femme, aux
conséquences de l'adoption d'un certain nombre de contraceptions
chimique plutôt que la pose des stérilets.
Nous relevons un taux de réponses significatives
élevées, 96% ont déclarées avoir pris une
contraception ovale (fig. 1) et 95% avoir été défavorables
aux stérilets (fig. 2).
Encore que plus de la moitié des femmes 57% n'ont pas
fait l'objet d'investigation routinière, en terme de bilans biologiques
(fig. 3). Dés lors pas moins de 68,32% des femmes de notre
échantillon ne sont pas allé au-delà du primaire dans leur
scolarité et parmi ces femmes un peu plus de la moitié 53% n'ont
pas, pour une raison ou une autre, fréquenté l'école (fig.
4).
A cette insuffisance s'ajoute et pour plus de la moitié
51% ont un nombre d'enfants situé entre 6 et 12 (fig.5).
Concernant l'âge de survenue de la ménopause 95%
l'ont eu entre 45 et 54 ans, seulement 2 d'entres elles (3%) ont eu une
ménopause précoce (à 40 ans) et l'on enregistre
auprès d'une seule femme un cas de ménopause tardive (fig.6).
Concernant l'histoire de l'allaitement, prés de la
moitié ont pratiqué un allaitement mixte et seulement 30%
concerne un allaitement exclusif au sein contre 23% ayant opté pour un
allaitement artificiel exclusif (fig.7).
Concernant l'indice de corpulence des femmes, 20% d'entres
elles ont un rapport Poids/Taille normal, 58,32% présentent un surpoids
et 18,66% sont obèses (fig .8).
L'analyse sanguine a révélé des chiffres
s'écartant des valeurs normales; pour la glycémie, 40% des bilans
dénotent une hyperglycémie variant de 1,3 à 1,7 g/l contre
60% ayant une glycémie normale entre 0,8 et 1,2 g/l (fig.9).
Concernant la triglycéride ,65% des femmes ont des
valeurs naturelles variant entre 0,8 et 1,5 g/l, le reste des femmes 35%
présentent une hypertriglycéridemie variant entre 1,51 et 2,53
g/l (fig. 9, 13).
Les résultats issus de l'exploitation des feuillets
alimentaires révèlent dans leur ensemble un chiffre moyen de
l'apport énergétique total AET (1729,41 #177; 140,8) (fig.1
1).
Où les glucides participent dans 38% dans un taux de
couverture préconisé par les normes 55% de l'apport calorifique
total, 23% ont une alimentation leur apportant trop de glucides dont 91% sont
représentées par l'amidon et seulement 9% sous forme de sucres
simples (fig.13).
La couverture alimentaire en calcium pour cette
catégorie de population de femmes reste au-dessous des recommandations
(fig.14)qui sont évaluées entre 1000 et 1500 mg/j et de vitamines
D (400 à 800 ui/j).
La calcémie étant dans les limites de
normalité qui est en moyenne de 9O #177; 9
mg/l.
La calcémie, bien que normale, a été
retrouvée en augmentation chez les femmes de poids normal 95 #177; 9
mg/l par rapport aux femmes présentant un surpoids 86 #177; 7 mg/l
(fig.15) et une corrélation inverse entre les deux paramètres (r
= 0,40).
Cette interprétation reste à établir en
fonction de la protidémie des sujets (paramètre non
dosé)
La négativité du bilan calcique (calcium sanguin
de l'organisme) et l'apport alimentaire insuffisant stimule les
résorptions osseuses afin de maintenir l'homéostasie du calcium
plasmatique.
Une corrélation négative était retrouver
entre la corpulence des femmes et la quantité de calcium apporté
par l'alimentation.( r=-0.30).
En effet, si l'apport en calcium alimentaire persiste à
des chiffres bas, la situation traduirait une baisse de la concentration
plasmatique de calcium, se qui stimule la sécrétion des hormones
calciotropes; celles-ci induirait une augmentation de la concentration intra
adipositaire de calcium, qui elle-même agirait sur le métabolisme
lipidique en favorisant le stockage (Zemel MB et al, 2000).
Une enquête reprise avec un effectif plus important,
pourrait laisser voir se renforcer cette relation entre calcium alimentaire et
l'indice de QUETELET.
Le surpoids a-t-il un effet protecteur contre
l'ostéoporose des femmes? C'est une question qui reste à explorer
ou bien peut être que la discordance du résultat obtenu repose sur
des erreurs méthodologiques au niveau des relevés alimentaires;
des études longitudinales sur de grands effectifs sont
nécessaires pour évaluer l'effet de la ration calcique sur la
perte osseuse post ménopausique.
CONCLUSION
Il est plus que certain de revoir la qualité et la
quantité des apports nutritionnelles chez les femmes
ménopausées; la situation engendrant un risque de sur leurs
santés à cet âge de leur vie demeure multifactorielle.
Néanmoins, il faudrait oeuvrer vers la
prévention qui est peu coûteuse par des conseils
diététiques appropriés, sur le choix des aliments et leurs
équivalents nutritionnels et énergétiques, la pratique
d'une activité physique afin de lutter contre les surpoids et ses
corollaires métaboliques avérés.
Insister sur une supplémentation calcique pouvant
réduire le risque de fracture du col de fémur.
Le maintien d'une alimentation riche en calcium est primordial
à tous les âges de la vie ; en son absence, une
supplémentation médicamenteuse s'avère utile.
BIBLIOGRAPHIE
- Aguilera M, Vaughan R. Calcium and the anasthetist. Anaesthesia
2000 ; 55 : 779-90.
- Anast C, Winnacker Impaired release of parathyroid hormone in
magnesium defiency. J Clin Endocrinol Metab 1996 ; 42 : 707-1 7.
- BASDEVANT A. ; GOMPEL A 1995 Endocrinologie - Nutrition,
10-035-B-10, 1995, 9 p.
- Bianchetti M,, Calcium and blood pressure regulation in normal
and hypertensive subject. Hypertension 1983 ; 5 (part 2) : 1157-65.
- Bilezikian J. Management of cute hypercalcemia. N Engl J Med
1992 ; 326 : 1196-203.
- CUMMINGS S.R., NEVITT M.C., BROWNER W.S. et coll. - Risk
factors for hip fracture in white women. N. Engl. J. Med., 1995,
- DELMAS PD, BJARNASON NH,. Effects of raloxifene on bone
mineral density, serum cholesterol concentrations, and uterine endometrium in
postmenopausal women N Engl J Med 1997 Dec.
- Drueke T. Anomalies of phosphate and calcium metabolism in
chronic renal insufficiency. Rev Prat 1998 ; 48 : 1207-12.
- DUPAIGNE D., MARES P. HEDON B. Ménopause, diagnostic,
conséquences et principes du traitement. Rev. Prat. 1990, 40/21,
1976-1998.
- Framingham. BONITHON-KOPP C. Ménopause et risque
cardio-vasculaire, Gynécologie 1989, 40/supplt au no 2, 31-38.
- GARNERO P. ; DELMAS P.D. JCEM, 1993, Vol; 77, n° 4, p
1046-1053. LIGNERES et Coll. JCEM 1986, vol 62, 3.
- Gopal H, Sklar A, Sherrard D. Symptomatic hypercalcemia of
immobilization in
a patient with endstage renal disease. Am J Kidney Dis
2000 ; 35 : 969-72.
- Gramstad L, Hysing E. Effect of ionized calcium on the
neuromuscular blocking actions of atracurium and vecuronium in the cat. Br J
Anaesth 1990 ; 64 : 199-206.
- Gucalp R, Ritch P, Wiernik PH, Sarma PR, Keller A, Richman
SP, et al. Comparative study of pamidronate disodium and etidronate didodium in
the treatment of cancer-related hypercalcemia. J Clin Oncol 1992 ; 10 :
134-42.
- Hashiba K. Reliability of QT intervals as indicators of
clinical hypercalcemia. Clin Cardiol 1988.
- Kurland E, Cosman F,. Parathyroid hormone as a therapy for
idiopathic osteoporosis in men: effects on bone mineral density and bone
markers. J Clin Endocrinol Metab 2000 ; 85 : 3069-76.
- LERIDON H, L'âge de la ménopause. Gyn Obst 1992,
n° spécial mars, 4.
- LIBERMAN U.A- Effect of oral alendronate on bone mineral
density and the
incidence of fractures in postmenopausal osteoporosis. N. Engl.
J. Med.,
1995, 333.
- Mihai R, Farndon J. Parathyroid disease and calcium metabolism.
Br J Anaesth 2000 ; 85 :29-43.
- Orwoll E. The milk-alkali syndrome: current concepts. Ann
Intern Med 1982 ; 97 : 242-8.
- Peacock M Relation between serum and urinary calcium with
particular reference to parathyroid activity. Lancet 1996 ; 1 : 384-6.
- Pettifor J, Bikle D, Cavaleros M, Zachen D, Kamdar M, Ross
F. Serumlevels of free 1,25- dihydroxyvitamin D in vitamin D toxicity. Ann
Intern Med 1995 ; 22 : 511-3.
- POUILLES J.M - Prevalence and incidence of vertebral
deformities.
Osteoporosis Int, 1993.
- RIBOT C.. - densitométrique de l'ostéoporose.
Rev. Rhum. (Ed. Fr.), 1995, BAUDOIN -C Epidémiologie de
l'ostéoporose. Rev. Rhum., 1997,64,193S- 201S.
- Rizzoli R, Bonjour J. Calciotropic hormones and integrated
regulation of calcemia and calcium balance. Rev Prat 1998 ; 48 : 1178-84.
- Rizzoli R. Parathyroid hormone-related protein. An analog of
parathyroid hormone involved in regulation of growth, development, and
gestation. Rev Rhum Engl 1996 ; 63 : 79- 82.
- ROZENBAUM H. Ménopause et risque vasculaire.
(deuxième partie). Reproduction humaine et hormones 1991 ; 4/2 : 67-1
20.
- RUF H. Physiopathologie clinique de la ménopause.
Feuillets Biol. 1991 ; 32/n°182 : 45-48.
- Stephen J, Marx M. Hyperparathyroid and hypoparathyroid
disorders. N Engl J Med 2000 ; 343 : 1863-75.
- Vallotton M. Métabolisme phosphocalcique :
parathormone, calcitonine et vitamines D. In : Meyer PH, Ed. Flammarion
Médecine Sciences. Paris : Physiologie Humaine ; 1977. p. 370-85.
- Zemel MB, shi H, Greer B, Dirienzo D, Zemel PC. Regulation of
adiposity by dietary calcium.FASEB J, 2000; 14 :1132-1138.
Pages Web
1.
http://www.frm.org.
2.
http://www.cidilait.com.
3.
http://www.uvp5.univ-paris5.fr/Campus-gyneco-obst.
4.
http://www.hscm.ca/gyneco/menopause.html.
5.
http://www.esculape.com/gynecologie.
6.
http://www.caducee.net/DossierSpecialises/gyneco-obstetrique/menopause.asp.
7.
http://sante-az.aufeminin.com/w/sante/s257/maladies/menopause.html.
8.
http://www.sfdial.org.
9.
http://www.oncorea.com/SyllUrgences/Hypocalcemie.html.
10.
http://www.intox.org.
11.
http://www.zometa.com.
12.
http://www.tech-quimper.fr.
13.
http://lyon-sud.univ-lyon1.fr/P2/Physio-LK/Metabolisme.pdf.
ANNEXE I
Régime alimentaire Ménopause,
périménopause et alimentation
La ménopause désigne le moment où les
menstruations cessent définitivement. Cette étape marque la fin
des fonctions de reproduction de la femme. Elle est
précédée d'une période appelée
périménopause.
L'adaptation à un rythme hormonal qui cesse
d'être cyclique pour devenir constant (ou basal) produit divers malaises
qui débutent généralement à la
périménopause et qui se poursuivent souvent pendant les
premières années de la ménopause. Les hormones sont
à la base de tous ces processus. Il est important de se rappeler que,
bien que la femme ménopausée fabrique moins d'oestrogènes
que le taux nécessaire pour la reproduction, ce taux est loin
d'être nul et peut être déterminant sur les symptômes
associés à la ménopause.
Voici donc des recommandations nutritionnelles qui, entre
autres, peuvent aider à conserver un bon équilibre hormonal.
Chacune est susceptible d'apporter plusieurs bienfaits, mais nous les avons
regroupées en fonction de la prévention de quatre
problèmes spécifiques reliés à la ménopause:
prise de poids, bouffées de chaleur, perte de la masse osseuse et cancer
du sein.
1. Prévenir la prise de poids excessive 1 .a.
Éviter les régimes draconiens
Le poids est une donnée « programmée »
dans l'organisme, et les régimes sévères perturbent ce
programme, rendant l'atteinte du poids santé de plus en plus
difficile.
· Attention aux « allégés
». Il faut se méfier des aliments dits
allégés parce qu'on peut être porté à en
manger davantage.
· De plus petits repas. Le
métabolisme ralentit à partir de la
périménopause,
ce qui devrait se traduire par une consommation
moins élevée de calories.
· Ne jamais sauter un repas. Le
déclin de la production hormonale amène une baisse de la
sérotonine, un neurotransmetteur qui régularise l'appétit.
Le fait
de manger des repas équilibrés trois fois par jour
à des heures régulières évite les crises de
faim.
? Petites collations. Les collations contenant
des protéines permettent d'aborder le repas suivant de façon plus
raisonnable.
1.b. Consommer beaucoup de fibres
Le régime équilibré d'une femme à
la ménopause et à la périménopause devrait
comprendre 30 g de fibres alimentaires par jour. Les fibres régularisent
le taux de glucose dans le sang, ce qui permet d'être rassasiée
plus longtemps en plus de contribuer à prévenir le cancer du
sein.
1.b.1. Quantité de fibres alimentaires dans les
aliments
|
Sources
|
Portions
|
Quantité moyenne de
fibres
alimentaires
|
|
Légumes
|
125 ml (1/2tasse)
|
2g
|
|
Légumineuses
|
125 ml (1/2tasse)
|
8g
|
|
Pains et céréales à grains entiers
|
Une tranche de pain Céréales froides 160 ml (2/3
tasse)
|
2 g
|
|
Fruits, noix diverses et graines
|
Un fruit
Noix et graines diverses 60 ml (1/4 tasse)
|
3 g
|
1 .c. Consommer des protéines à chaque
repas
Les protéines aident à maintenir un poids
santé parce qu'elles stabilisent la glycémie et augmentent la
sensation de satiété.
|
À PRIVILÉGIER
|
À ÉVITER
|
|
OEufs (2)
|
|
|
Poisson non pané, fruits de mer (90 g ou 3 oz)
|
Poisson pané ou en sauce
|
|
Volaille sans la peau (90 g ou 3 oz)
|
Peau de la volaille
|
|
Fromage à moins de 20 % de matières grasses (2 oz
ou 60 g), fromage ricotta ou cottage (125 ml ou 1/2 tasse)
|
Fromage à plus de 20 % de matières grasses
|
|
Viandes maigres et dégraissées (90 g ou 3 oz)
|
Viandes grasses et non parées
|
|
Charcuteries végétariennes, cretons de veau ou de
poulet (portions variables)
|
Charcuteries, pâté de foie gras, pâté
de campagne, viandes froides, cretons de porc
|
|
Légumineuses (1 tasse), tofu ferme (90 g ou 3 oz), beurre
d'arachide sans huile hydrogénée ni sucre ajouté (30 ml ou
2 c. à table)
|
Beurre d'arachide avec huile hydrogénée et sucre
|
2. Réduire les bouffées de
chaleur
2.a. Consommer des aliments riches en
phytoestrogènes tous les jours
Les phytoestrogènes peuvent réduire les
bouffées de chaleur, prévenir la perte osseuse, aider à
prévenir certains cancers et, en conjonction avec un régime
faible en gras, réduire le taux de cholestérol sanguin. On
recommande de consommer deux portions d'aliments riches en
phytoestrogènes par jour. Toutefois, les femmes aux prises avec un
cancer du sein, ou qui en ont déjà souffert, doivent
éviter de consommer des aliments riches en phytoestrogènes.
|
BONNES SOURCES DE
PHYTOESTROGÈNES
|
SOURCES FAIBLES
DE
PHYTOESTROGÈNES
|
|
Tofua (100 g ou 3 1/2 oz)
|
Huile de soya
|
|
Fèves de soya cuites (125 ml ou 1/2 tasse)
|
Miso
|
|
Fèves de soya rôties (30 g ou 4 c. à
table)
|
Sauce soya et tamari
|
|
Boisson de soyab (250 ml ou 8 oz)
|
Crème dessert de soya
|
|
Yogourt de soya (175 g ou 3/4 tasse)
|
Huile de lin
|
|
Tempeh (100g ou 31/2 oz)
|
|
|
Soya fermenté en poudre (30 g ou 3 c. à table)
|
|
|
Protéines de soyac (10 g ou 1 c. à
table)
|
|
|
Edamane (fèves soya vertes, fraîches ou
congelées) (60 ml ou 1/4 tasse)
|
|
|
Farine de soya (60 ml ou 1/4 tasse)
|
|
|
Graines de lin moulues, brunes ou dorées (15 ml ou 1 c.
à table)
|
|
|
Germes de trèfle (125 ml ou 1/2 tasse)
|
|
a. Le tofu ferme renferme plus de phytoestrogènes que le
tofu mou.
b. Choisir une boisson de soya qui contient des isoflavones
(sorte de phytoestrogènes).
c. Le taux de phytoestrogènes varie selon les
méthodes de fabrication.
2.b. Limiter les excitants
Éviter de prendre des boissons contenant de l'alcool
ou de la caféine à jeun ou entre les repas, car cela fait
diminuer le taux de glucose sanguin et peut provoquer des bouffées de
chaleur.
2.c. Limiter les sucres concentrés
PRIVILÉGIER
|
À LIMITER
|
|
Desserts sans sucre ajouté (sucrés aux fruits),
faits de farine complète
|
Desserts sucrés : gâteaux, tartes, biscuits,
beignes, muffins, poudings
|
|
Lait de vache ou de chèvre, boisson de soya nature,
yogourt nature
|
Crème glacée, yogourt glacé, yogourt aux
fruits ou à la vanille, lait au chocolat, boisson de soya à la
vanille ou au chocolat, boisson de riz
|
|
Fruits et légumes frais ou surgelés, jus de
légumes sans sucre, jus de fruits sans sucre, marinades sans sucre,
moutarde
|
Jus de fruits ou de légumes sucrés, pois en
conserve sucrés, maïs en crème, cornichons, marinades,
relish, ketchup, sauces sucrées
|
|
Caroube et brisures de caroube sans sucre;
avec modération : miel, produits de l'érable, sirop
de malt, sirop de riz; avec parcimonie : succédané de sucre
|
Sucre blanc, sucre brut, sucre de canne, cassonade, fructose,
bonbons, chocolat, mélasse, caramel, sirop de maïs, confitures,
gelées, marmelades, boissons gazeuses
|
Remarque
Dans la liste d'ingrédients d'un produit alimentaire,
les mots dextrose, glucose,
fructose, saccharose,
maltose ou sucre inverti
indiquent des sucres ajoutés.
3. Réduire la perte de la masse
osseuse
3.a. S'assurer d'apports suffisants en calcium et en
vitamine D
On retrouve 99 % du calcium dans les os et 1 % dans le sang.
Le calcium aide à la prévention de l'ostéoporose. Les
besoins en calcium après 50 ans sont de 1 200 mg par jour et de 1 500 mg
par jour en cas d'ostéoporose.
|
Excellentes sources
de calcium
275 mg et
plus de
calcium
|
Bonnes sources de calcium
de 165 mg
à 274 mg de
calcium
|
Autres sources de calcium
de 55 mg à
164 mg de
calcium
|
|
1 tasse (250 ml) de lait de vache ou de chèvre ou de
boisson de soya enrichie
|
30 ml (2 c. à table) de graines de sésame non
décortiquées
|
30 ml (2 c. à table) de beurre d'amande ou 1/4 tasse
d'amande
|
|
3/4tasse (175 ml) de yogourt de lait de vache ou de
chèvre
|
90 g (3 oz) de saumon en conserve avec arêtes
|
1 artichaut
|
|
50 g (2 oz) de fromage à pâte dure
|
125 ml (1/2 tasse) de
fromage ricotta ou 50 g (2 oz) de feta ou 50g (2oz) de fromage de
chèvre semiferme
|
125 ml (1/2 tasse) de bok choy, de brocoli, de chou frisé
(kale), de chou cavalier
|
|
100 g de tofu avec sulfate de calcium
|
|
60 ml (1/4 tasse) de figues séchées
|
|
|
125 ml (1/2 tasse) de légumineuses cuites (haricots
blancs, pois chiches, fèves noires, fèves soya)
|
|
|
60 ml (1/4 tasse) d'algues: hijiki, wakamé ou varech
|
|
|
5 à 8 huîtres moyennes
|
La vitamine D favorise non seulement
l'absorption du calcium, mais aussi une meilleure rétention de celui-ci
par le système osseux et une meilleure utilisation. Les besoins en
vitamine D sont de 400 UI par jour après 50 ans, et de 600 UI
après 70 ans. En cas d'ostéoporose, les besoins atteignent 800 UI
par jour.
Les meilleures sources alimentaires de vitamine D sont le
saumon, le maquereau, les sardines en conserve, le foie (boeuf, veau, poulet),
le jaune d'oeuf, le lait de vache ou de chèvre et la boisson de soya
enrichie.
3.b. Consommer des aliments riches en bore
Le bore est un minéral qui réduit
l'élimination du calcium et du magnésium. Il aide aussi
indirectement à soulager les bouffées de
chaleur.
|
Excellentes sources de bore
|
Bonnes sources de bore
|
|
Avocat
|
Raisins rouges
|
|
Pruneau
|
Poire
|
|
Pêche
|
Prune
|
|
Jus de pruneau
|
Dattes
|
|
Raisins secs
|
Amandes
|
|
Haricots rouges cuits
|
Beurre d'arachide
|
|
Pois chiches cuits
|
|
|
Lentilles cuites
|
|
|
Noisettes
|
|
3.c. Remplir la moitié de l'assiette avec des
fruits et des légumes
En plus de leurs propriétés anticancer, les
fruits et légumes contiennent des minéraux alcalins (du potassium
et du magnésium notamment), ce qui permet de neutraliser les acides et
de diminuer la perte urinaire de calcium.
3.d. Éviter les excès de sodium et de
protéines animales
Elles augmentent les pertes de calcium urinaire. Utilisez les
fines herbes et les épices et moins de sel, consommez davantage de
légumineuses et de tofu et moins de viande rouge.
4. Prévenir le cancer du sein
Tandis que certaines femmes manquent d'oestrogènes
à la ménopause, d'autres en produisent trop, c'est le cas
notamment des femmes qui ont un surplus de poids. Un excès
d'oestrogènes (qui proviennent des cellules adipeuses) peut
précipiter un cancer du sein. Une raison de plus de chercher à
atteindre et à maintenir un poids santé.
4.a. Consommer des aliments riches en
phytostérols
Ils pourraient exercer un effet protecteur sur le cancer du
sein, les maladies cardiovasculaires et l'ostéoporose. Les
phytostérols se retrouvent dans tous les aliments du règne
végétal: légumes, noix et graines, céréales
à grains entiers et légumineuses. L'huile de sésame en est
une excellente source (délicieuse pour la vinaigrette). Une alimentation
à tendance végétarienne procure beaucoup de
phytostérols.
4.b. Consommer beaucoup de crucifères
On pense que ces légumes pourraient prévenir
l'apparition de certains cancers hormonodépendants (comme peuvent
l'être les cancers du sein et de l'endomètre). La famille des
crucifères comprend: brocoli, chou, chou chinois, chou- fleur,
chou-rave, chou de Bruxelles, cresson, moutarde, navet, radis, raifort, rapini,
roquette et rutabaga. On les mange crus ou légèrement cuits.
4.c. Limiter et bien choisir ses matières
grasses
Dangereux pour le cancer du sein, mais également pour
le système cardiovasculaire, les gras saturés et trans sont
à éviter: fritures, produits laitiers gras, viandes grasses,
huiles hydrogénées, etc. Privilégiez l'huile d'olive ou de
canola et limitez les huiles riches en oméga-6 comme l'huile de
carthame, de soya et de maïs qui, en excès, peuvent aussi
être dommageables.
» Source journal de la santé canadien
2005
Recommandations alimentaires du pour les femmes
ménopausées
D'après OMS
|
Groupes
alimentaires
|
Portions par jour
|
|
Commentaires
|
|
Fruits et
légumes
|
·
·
|
5-10
1 portion =
|
·
|
Riches en anti-oxydants, vitamines et en fibres
|
|
·
|
1 fruit ou légume de dimensions moyennes
|
·
|
Légumes et fruits vert foncé ou orangers
|
|
·
|
250 ml (1 tasse) de laitue
|
|
|
|
·
|
125 ml (1/2 tasse) de jus
|
|
|
|
Produits
|
·
|
5-12
|
·
|
Les fibres entraînent une
|
|
céréaliers
|
·
|
1 portion =
|
|
réduction du risque de
|
|
·
|
1 tranche de pain; 1/2 pita ou
|
|
maladies cardiaques et de cancer
|
|
|
brioche
|
·
|
Produits céréaliers
|
|
·
|
30 g (1/4 tasse) de céréales
|
|
entiers ou enrichis
|
|
·
|
250 g (1 tasse)
de riz ou pâtes
|
|
|
|
Viandes et
|
·
|
2-3
|
·
|
Viandes, volailles et
|
|
substituts
|
·
|
1 portion =
|
|
poissons maigres
|
|
·
|
50-100 g (2-4 oz) de boeuf, de
|
·
|
Pois secs, fèves, lentilles et produits de soja
|
|
|
volaille et de poisson
|
·
|
Poissons d'eaux froides riches en omega-3
|
|
·
|
250 g (1 tasse) de légumes
|
|
|
|
·
|
100 g (1/3 tasse) de tofu
|
|
|
|
·
|
30 ml (2 c.a.s.) de beurre d'arachides
|
|
|
|
Produits
|
·
|
2-4
|
·
|
Source élevée de calcium
|
|
laitiers
|
·
|
1 portion =
|
·
|
Addition de vitamine D
|
|
·
|
250 ml (8 oz) de lait
|
·
|
Faible teneur en matières grasses
|
|
·
|
175 g (3/4 tasse) de yogourt
|
|
|
|
·
|
50 g (2 oz) de fromage
|
|
|
|
Sucre
|
|
|
·
|
Confitures, sirop, miel, bonbons à éviter
|
|
Huiles et
matières
|
|
|
·
|
10% des calories en gras saturés
|
|
grasses
|
|
|
·
|
Huile d'olive et de colza
|
|
|
|
?
|
Éviter les gras animaux, les huiles
hydrogénées et les acides gras trans
|
|
Alcool
|
·
|
1-2
|
·
|
1-2 verres pour un effet
|
|
·
|
1 verre =
|
|
protecteur cardiaque
|
|
·
|
150 (5 oz) de vin
|
·
|
Plus de 2 verres
|
|
·
|
350 (1 bouteille) de bière
|
|
augmentent le risque de cancer du sein
|
|
·
|
50 ml (11/2 oz) d'alcool
|
|
|
|
Caféine
|
·
|
2-3
|
·
|
2-3 boissons caféinées par jour permises
|
|
|
|
·
|
La caféine augmente la perte osseuse chez les personnes
souffrant d'une carence en calcium.
|
ANNEXE II
Régal micro pour Windows version
2001
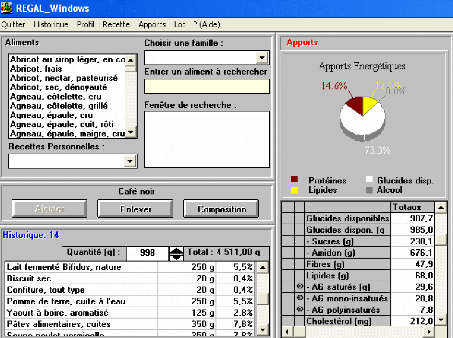
ANNEXE III




ANNEXE IV
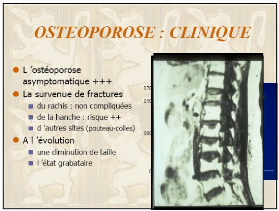
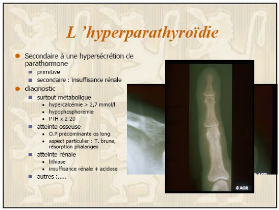
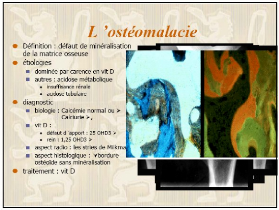
HYPERCALCEMIE
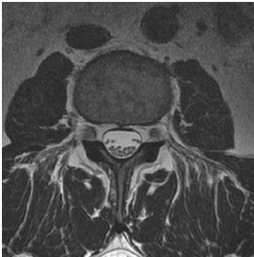
OSTEOPOROSE
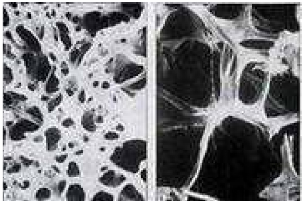
Source ;http ://
lyon-sud.univ-lyon1
.fr/D4/Module_5/osteoporose.pdf



