CHAPITRE II :
MISE EN OEUVRE POUR LA MOLECULE DE NO
2.1 Introduction
Les solutions de l'équation de Schrödinger
électronique seront présentées sous forme de courbes de
potentielle. Elles seront obtenues en faisant varier la distance
internucléaire entre les atomes d'azote et d'oxygène. Nous
commencerons par présenter la molécule du monoxyde
d'azote à laquelle nous appliquerons la méthode de MCSCF qui
prend en compte les corrélations électroniques. Enfin, nous
analyserons les résultats obtenus.
2.2 Présentation de la molécule
NO
2.2.1 Etats électroniques de NO
La molécule de NO est une
molécule diatomique hétéronucléaire. Ses orbitales
sont construites à partir des orbitales atomiques de l'azote et de
l'oxygène, selon la méthode LCAO (Linear combination of atomic
orbitals).Les fonctions d'onde moléculaires sont des combinaisons
linéaires des orbitales atomiques de même symétrie. Le
double intérêt de cette méthode vient du fait que l'on est
certain d'obtenir des orbitales moléculaires appartenant à des
représentations irréductibles et ainsi d'avoir une
réduction du nombre de coefficients intervenant dans les exposants des
orbitales moléculaires.
L'atome d'azote a 7 électrons et sa
configuration électronique fondamentale est 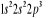 elle donne lieu aux états électroniques elle donne lieu aux états électroniques 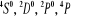 les orbitales de valence sont les orbitales de valence sont 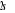 et et 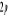 . Les orbitales de Rydberg sont . Les orbitales de Rydberg sont 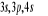 ,... ,...
L'atome d'oxygène a 8 électrons et sa
configuration électronique fondamentale est 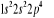 donnant ainsi lieu à trois états électroniques donnant ainsi lieu à trois états électroniques
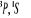 et et 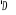 . Les orbitales de valence sont . Les orbitales de valence sont 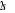 et et 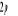 .Les orbitales de Rydberg sont .Les orbitales de Rydberg sont 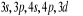 ,...Lorsqu'on rapproche ces deux atomes , on obtient la structure
moléculaire suivante : ,...Lorsqu'on rapproche ces deux atomes , on obtient la structure
moléculaire suivante :
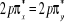
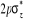
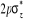
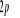
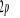
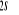
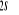
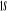
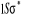
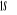
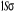
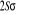
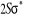
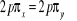
N
O
Fig : 2.1 Configuration
électronique de NO
Ce qui donne NO :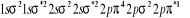 qui a pour état fondamental qui a pour état fondamental 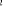 . .
2.3 Diagramme de corrélation
Le diagramme de corrélation nous permet d'identifier
les états qui convergent vers une asymptote donnée. Il est
constitué des différentes configurations électroniques
possibles, des atomes constituant la molécule. Des états
moléculaires, résultant du couplage des états atomiques
quelconques, et des énergies qui pourront être obtenues à
partir de la table de MOORE.
Pour la construction de ce diagramme nous nous sommes servi
des règles d'addition des moments. Dans le cas des atomes, la
classification des termes d'énergie est essentiellement basée sur
la loi de la conservation du moment orbital total  .Cependant, pour les molécules, le champ électrique ne
jouit pas de la symétrie centrale ; mais plutôt de la
symétrie axiale donc cette loi n'est plus respectée. Par
conséquent .Cependant, pour les molécules, le champ électrique ne
jouit pas de la symétrie centrale ; mais plutôt de la
symétrie axiale donc cette loi n'est plus respectée. Par
conséquent  ne commute plus avec ne commute plus avec 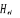 . .
La projection de 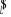 sur l'axe internucléaire est sur l'axe internucléaire est 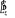 qui elle, commute avec qui elle, commute avec 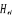 . Les valeurs propres de . Les valeurs propres de 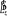 sont sont 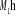 tels que tels que 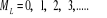 on définira donc un nouveau nombre quantique on définira donc un nouveau nombre quantique 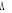 tel que tel que 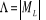 . Les valeurs 0, 1, 2, 3,...de . Les valeurs 0, 1, 2, 3,...de 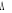 correspondront respectivement aux termes correspondront respectivement aux termes  , ,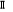 , , 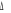 , , 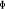 ,....on remarque donc que les valeurs de ,....on remarque donc que les valeurs de 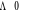 sont doublement dégénérées. Ce qui permet
de réaliser une combinaison linéaire des fonctions propres des
deux états dégénérés. Ces combinaisons ayant
la même énergie, on se dispensera des signes (+) et (-). Ce qui ne
sera pas le cas de l'état sont doublement dégénérées. Ce qui permet
de réaliser une combinaison linéaire des fonctions propres des
deux états dégénérés. Ces combinaisons ayant
la même énergie, on se dispensera des signes (+) et (-). Ce qui ne
sera pas le cas de l'état  qui n'est pas dégénéré. On aura qui n'est pas dégénéré. On aura 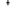 et et 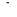 qui correspondront respectivement aux termes dont la fonction d'onde ne
change pas de signe dans une réflexion et ceux dont la fonction d'onde
change de signe. qui correspondront respectivement aux termes dont la fonction d'onde ne
change pas de signe dans une réflexion et ceux dont la fonction d'onde
change de signe.
Toutefois l'interaction entre le moment angulaire orbital et
le moment angulaire dû à la rotation moléculaire peut
provoquer une légère déviation ; ce qui engendre une
levée de dégénérescence sur les états 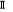 , , 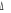 , , 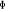 ,...dans ce cas, on pourra utiliser les signes + et - sur ces termes
là. Les indices g et u indiquent respectivement la parité paire
et impaire correspondant aux états pairs et impairs. S
caractérise le spin total et la multiplicité est définie
par la quantité 2S+1.la terminologie singlet, doublet,
triplet,...correspondent respectivement aux valeurs 2S+1=1 ,2 ,3 ,... ,...dans ce cas, on pourra utiliser les signes + et - sur ces termes
là. Les indices g et u indiquent respectivement la parité paire
et impaire correspondant aux états pairs et impairs. S
caractérise le spin total et la multiplicité est définie
par la quantité 2S+1.la terminologie singlet, doublet,
triplet,...correspondent respectivement aux valeurs 2S+1=1 ,2 ,3 ,...
L'état fondamental de la molécule est
précédé du préfixe X alors que les termes des
états excités ayant la même multiplicité que le
fondamental sont généralement précédés des
lettres A , B , C , D .. et a , b , c ,d ....pour les termes de
multiplicité différente.
En utilisant ces différents résultats, on
obtient le diagramme des états moléculaires donné par le
tableau suivant :
Diagramme des états moléculaires de la
molécule du monoxyde d'azote NO dans l'intervalle  10 eV à partir de l'état fondamental. 10 eV à partir de l'état fondamental.
Configuration électronique Energie
d'excitation à partir
Etats moléculaires
Des atomes du fondamental
des atomes
O N
eV cm-1
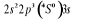 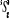 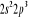 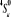 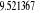 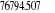 
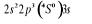  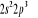 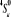 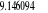 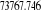 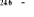
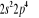 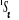 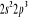 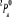 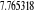 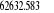  , , 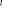
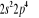 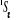 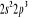 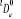 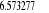 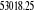  , , 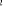 , , 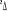
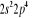 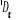 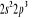 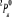 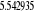 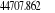 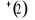 , ,  , ,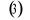 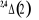
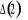 , , 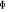 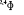
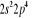 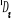 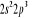 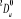 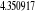   , ,  , ,
 , , 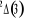 , , 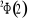 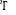
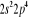 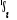 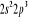 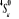 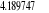 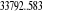 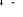
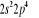 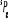 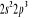 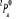 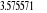 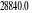 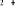 , ,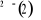 , ,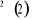 , , 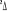
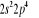 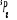 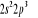 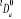 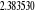 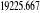  , ,  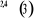 , ,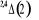 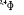
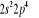 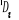 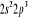 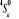 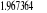 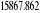  , ,  , , 
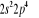 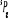 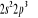 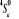   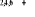 , , 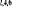
2.4 Choix de la base
Comme nous l'avons dit au premier chapitre le choix de la
base est déterminant pour la qualité et le temps de calculs de
résultats. Dans nos calculs nous avons utilisé la base vtz
(valence triple zéta) qui est une base étendue. elle set
représentée par trois orbitales atomiques.
2.5 Résultats
Toutes les courbes que nous tracerons sont
générées à partir des calculs MCSCF.
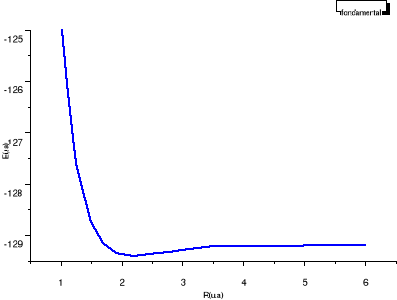
Fig : 2.2 Courbe de l'état fondamental  du NO du NO
On remarque que celle-ci à la même allure que la
courbe de référence, c'est-à-dire attractive et
présente un minimum local aux alentours de 2.2 u.a. On remarque
également qu'elle est au déssus car dans les calculs MCSCF , on
prend juste en compte une partie de la corrélation électronique.
Tout ceci nous permet d'être confiant de nos calculs
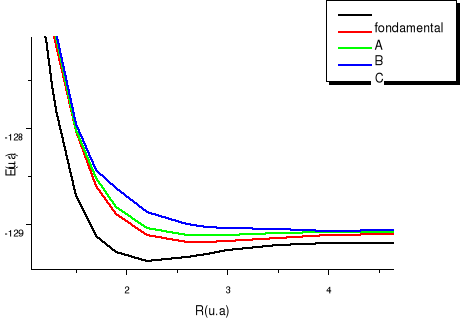
Fig : 2.3 Courbes du fondamental de quelques
états excités  , , 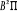 , , 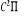
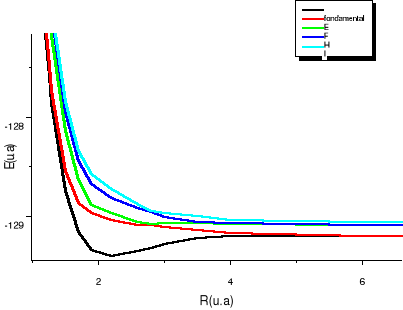
Fig : 2.4 Courbes du fondamental et des
états excités 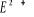 , , 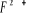 , , 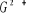 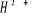
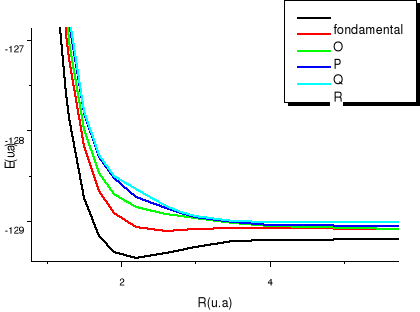
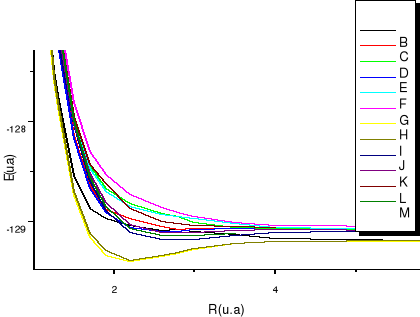
Fig :2.5 courbes du fondamental et des
états 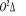 , , 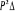 , , 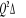 , , 
Fig :2.6 Courbes du fondamental et premiers
états excités
Les courbes B, C, D correspondent aux premiers états
 . Les courbes E, F, G correspondent aux premiers états
excités . Les courbes E, F, G correspondent aux premiers états
excités . Les courbes I, J, K, L correspondent aux premiers états
excités . Les courbes I, J, K, L correspondent aux premiers états
excités , la courbe M elle, correspondant au premier état , la courbe M elle, correspondant au premier état 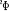 , et la courbe H correspondant à l'état fondamental. , et la courbe H correspondant à l'état fondamental.
On observe des croisements évités pour les
courbes des états de même symétrie, ce qui est normal car
nous sommes dans le cas de l'approximation adiabatique. La figure de
synthèse, elle est en accord avec notre diagramme des états
moléculaires qui nous informait au préalable, vers quelle
asymptote convergerait chaque état aux grandes distances
internucléaires.
2.6 Conclusion
Dans ce chapitre, après une brève étude
de la molécule du NO, nous avons tracé les courbes
d'énergie potentielle de l'état fondamental et de quelques
états excités les plus bas. Les constantes spectroscopiques
obtenues, c'est-à-dire la distance d'équilibre, la
fréquence de vibration et l'énergie de dissociation sont en
accord avec celles obtenues par d'autres auteurs.
CONCLUSION GENERALE
ET PERSPECTIVES
Le but de ce travail était de déterminer les
courbes d'énergie potentielle et quelques constantes spectroscopiques du
monoxyde d'azote NO, dans l'optique de faire une étude sur la
photodissociation de ladite molécule. Pour obtenir ces résultats,
on s'est servi de la méthode MCSCF (Multiconfigurationnelle self
Consistent Field) qui est une méthode d'interaction de configuration
prenant en compte les corrélations électroniques. A la fin de
notre travail nous avons eu une énergie de dissociation de 5,44 ev au
lieu de 5,29 ev valeur expérimentale. Une distance internucléaire
à l'équilibre de 2.20 u.a au lieu de 2.17 u.a valeur
expérimentale. Une fréquence de vibration de 2093.12
cm-1 au lieu de 1904.03 cm-1 valeur expérimentale.
Nous constatons donc que la différence entre nos résultats et les
résultats expérimentaux est bien faible. Nous pouvons poursuivre
notre étude.
REFERENCES
(1) G. Herzberg Molecular spectra and molecular structure (Ottawa
1950 )
(2) De Vito, D, ;J ; Merbach, A.E à soumettre
à Inorg. Chem (2003)
(3) Ikhlas Drira thèse Université paris-sud
10 (1996)
(4) P. Chaquin (UPMC) Pratique de la chimie théorique
Chapitre 1 15
(5) A. G. Gaydon, Dissociation Energies and Spectra of Diatomic
Molecules (Chapman and Hall, London, 1932).
ANNEXES Annexe 1 :
Détermination de quelques constantes spectroscopiques
Le modèle le plus simple pouvant représenter la
vibration d'une molécule aux alentours de sa position d'équilibre
est l'oscillateur harmonique.
L'expression de son énergie potentielle sera sous la
forme :
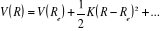
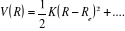 Car Car 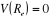
= 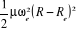
* Fréquence de vibration 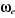
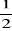 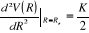
Or dans l'intervalle [1,9 ; 2,6] nous avons
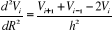 avec avec 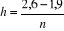 le pas et n le nombre de segments le pas et n le nombre de segments
Donc 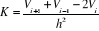
Connaissant que 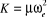
 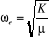 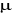 étant la masse réduite c'est-à-dire étant la masse réduite c'est-à-dire 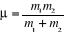
* Energie de dissociation Do
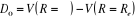
* Energie de dissociation exacte De
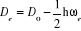
Annexe 2
Résultats des courbes de la figure 2.5
X²Ð ; O²Ä ; P²Ä ;
Q²Ä ; R² Ä
|
R(u.a)
|
X² Ð
|
O²Ä
|
P²Ä
|
Q²Ä
|
R² Ä
|
|
1.00
|
-124,542369
|
-123,812859
|
-123,577097
|
-123,196730
|
-123,173626
|
|
1.10
|
-126,052798
|
-125,342711
|
-125,119764
|
-124,819227
|
-124,805152
|
|
1.20
|
-127,113919
|
-126,434089
|
-126,227323
|
-125,978326
|
-125,961060
|
|
1.26
|
-127,592340
|
-126,932833
|
-126,733809
|
-126,507151
|
-126,486908
|
|
1.30
|
-127,859149
|
-127,213788
|
-127,018805
|
-126,804342
|
-126,782205
|
|
1.50
|
-128,746448
|
-128,171712
|
-127,984377
|
-127,808380
|
-127,779282
|
|
1.70
|
-129,165719
|
-128,671449
|
-128,472559
|
-128,298733
|
-128,267905
|
|
1.90
|
-129,345875
|
-128,912152
|
-128,705774
|
-128,531145
|
-128,500784
|
|
2.20
|
-129,409194
|
-129,064583
|
-128,852814
|
-128,734247
|
-128,647067
|
|
2.60
|
-129,358779
|
-129,109000
|
-128,930712
|
-128,863214
|
-128,839325
|
|
2.80
|
-129,321076
|
-129,101527
|
-128,952723
|
-128,914711
|
-128,905311
|
|
3.00
|
-129,285682
|
-129,090247
|
-128,971907
|
-128,557711
|
-128,955710
|
|
3.50
|
-129,226805
|
-129,075584
|
-129,024847
|
-129,014751
|
-128,999630
|
|
4.00
|
-129,207954
|
-129,081301
|
-129,062395
|
-129,043046
|
-129,009887
|
|
6.00
|
-129,202585
|
-129,095813
|
-129,093697
|
-129,060124
|
-129,015244
|
|
8.00
|
|
-129,096563
|
-129,094008
|
-129,060465
|
-129,015888
|
Annexe 3 :
Résultats des courbes de la figure 2.4 X²
Ð ; E²Ó+ ; F²
Ó+ ; G² Ó+ ; H²
Ó+
|
R(u.a)
|
X² Ð
|
O²Ä
|
P²Ä
|
Q²Ä
|
R² Ä
|
|
1.00
|
-124,542369
|
-124,501921
|
-123,785974
|
-123,716974
|
-123,603143
|
|
1.10
|
-126,052798
|
-125,999731
|
-125,311973
|
-125,194289
|
-125,096493
|
|
1.20
|
-127,113919
|
-127,033621
|
-126,403076
|
-126,212893
|
-126,199278
|
|
1.26
|
-127,592340
|
-127,490941
|
-126,901781
|
-126,706904
|
-126,662295
|
|
1.30
|
-127,859149
|
-127,742246
|
-127,182744
|
-126,991355
|
-126,911289
|
|
1.50
|
-128,746448
|
-128,542625
|
-128,14134
|
-127,954,905
|
-127,854209
|
|
1.70
|
-129,165719
|
-128,872800
|
-128,643024
|
-128,442604
|
-128,344695
|
|
1.90
|
-129,345875
|
-128,976511
|
-128,885534
|
-128,675822
|
-128,577853
|
|
2.20
|
-129,409194
|
-129,043998
|
-128,971243
|
-128,823795
|
-128,727112
|
|
2.60
|
-129,358779
|
-129,091321
|
-129,058264
|
-128,922021
|
-128,884660
|
|
2.80
|
-129,321076
|
-127,090715
|
-129,083719
|
-128,958063
|
-128,947300
|
|
3.00
|
-129,285682
|
-129,109464
|
-129,075685
|
-129,010044
|
-128,967006
|
|
3.50
|
-129,226805
|
-129,140898
|
-129,074017
|
-129,062430
|
-129,004804
|
|
4.00
|
-129,207954
|
-129,171060
|
-129,087020
|
-129,072853
|
-129,041247
|
|
6.00
|
-129,202585
|
-129,199858
|
-129,096622
|
-129,093732
|
-129,060138
|
|
8.00
|
|
-129,200545
|
-129,097157
|
-129,094010
|
-129,060463
|
Annexe 4 :
Résultats des courbes de la figure 2.3
X²Ð ; A² Ð ; B² Ð ; C² Ð
|
R(u.a)
|
X²Ð
|
A² Ð
|
B² Ð
|
C² Ð
|
M²Ö
|
|
1.00
|
-124,542369
|
-124,486431
|
-123,811179
|
-123,749854
|
-123,170399
|
|
1.10
|
-126,052798
|
-126,000663
|
-125,322981
|
-125,232650
|
-124,842562
|
|
1.20
|
-127,113919
|
-127,066731
|
-126,385949
|
-126,284242
|
-126,045820
|
|
1.26
|
-127,592340
|
-127,547799
|
-126,865654
|
-126,763382
|
-126,599393
|
|
1.30
|
-127,859149
|
-127,816135
|
-127,133418
|
-127,032360
|
-126,912628
|
|
1.50
|
-128,746448
|
-128,707698
|
-128,033961
|
-128,019140
|
-127,993,994
|
|
1.70
|
-129,165719
|
-129,123708
|
-128,602377
|
-128,522448
|
-128,562065
|
|
1.90
|
-129,345875
|
-129,298345
|
-128,897694
|
-128,819249
|
-128,857303
|
|
2.20
|
-129,409194
|
-129,392984
|
-129,119083
|
-129,039371
|
-129,074476
|
|
2.60
|
-129,358779
|
-129,348372
|
-129,187514
|
-129,113856
|
-129,145095
|
|
2.80
|
-129,321076
|
-129,312473
|
-129,189009
|
-129,118649
|
-129,148244
|
|
3.00
|
-129,285682
|
-129,278602
|
-129,181544
|
-129,114751
|
-129,143038
|
|
3.50
|
-129,226805
|
-129,222910
|
-129,148096
|
-129,095256
|
-129,121219
|
|
4.00
|
-129,207954
|
-129,204836
|
-129,117604
|
129,084736
|
-129,105500
|
|
6.00
|
-129,202585
|
-129,200155
|
-129,096192
|
-129,093254
|
|
|
8.00
|
|
|
|
|
|
|
|



