|
UNIVERSITE
KONGO
FACULTE DE MEDECINE
ETUDE EPIDEMIOLOGIQUE DE LA BILHARZIOSE A
SCHISTOSOMA MANSONI EN MILIEU SCOLAIRE: CAS DU
GROUPEMENT DE KIYANIKA
Par SERGE MAYAKA MA-NITU
Travail présenté en vue
de l'obtention du titre
de Docteur en Médecine, chirurgie et
accouchement
Septembre 2001
O. INTRODUCTION
1. Problématique
La schistosomiase est l'une des infestations
parasitaires affectant l'homme les plus répandues dans le monde. Seul le
paludisme la précède par ordre d'importance sur le plan des
répercussions sanitaires et socio-économiques majeures dans le
pays en développement(1).
Maladie chronique insidieuse, elle est peu reconnue à
ses stades précoces et menace le développement, puisqu'elle
touche les hommes et les femmes pendant leurs années les plus
productives.
Selon l'O.M.S., malgré les efforts de
lutte menés par divers pays, on estime à 600 millions le nombre
des personnes exposées à cette maladie, avec 200 à 300
millions d'individus actuellement infectés dont 120 millions
présentant les symptômes et 20 millions atteints d'une forme
grave et invalidante(2).
On signale chaque année, dans le monde, 8 à 10
millions de nouveaux cas, et entre 200 et 400.000 décès par
an(3).
A l'heure actuelle, quelques 85% de l'ensemble des cas, et la
plupart des cas graves, se trouvent en Afrique.
La schistosomiase est un problème de
santé publique important, mais sa lutte sur le continent le plus
atteint, l'Afrique, ne suscite plus guère d'intérêt. Elle
est diluée à l'échelle nationale suite à la
détérioration de la situation socio-économique ou à
l'apparition des problèmes de santé plus visibles.
Au Congo Démocratique, les études
récentes sur ce sujet sont très localisées si bien que la
cartographie actuelle n'est plus à jour. Par conséquent, les
aires endémiques ont dû progresser et il n'en demeure pas moins
que plus de la moitié des zones décrites semblent non indemnes.
Au Bas-Congo, particulièrement, 85% des aires
endémiques demeurent encore non évaluées(1). Pour le cas
spécifique de Lemfu, foyer décrit au cours d'une
épidémie en 1923 par A.Duren cité par P.G. Janssens et
al(4) avec une prévalence de 48,7 % en milieu scolaire, l'une des
dernières études remonte à 1984 (5). Cette étude
démontra une prévalence globale de 45,5% après un seul
examen de selles, avec une fréquence très élevée
pour les garçons de 15 à 19 ans (91,6%) et pour les femmes de 20
à 24 ans (70%)
A cela s'ajoutent les répercussions de la maladie sur
les organes nobles et l'altération de l'état de santé des
victimes compte tenu de ses conséquences très graves, lourdement
incapacitantes, voire mortelles.
Vu l'ampleur de la situation, diverses solutions furent alors
proposées pour contrôler et éradiquer cette endémie.
Étant donné que le temps s'est
écoulé depuis, nous nous proposons d'évaluer la situation
sur le terrain. A cette fin, nous allons redéfinir les
caractéristiques de l'infection à Schistosoma Mansoni,
maladie plus en voie d'extension que de régression, à Lemfu et
dans les autres localités environnantes et retraiter les études
épidémiologiques quantitatives antérieures sur ce foyer.
2. Hypothèses de travail
Depuis que Lemfu a été décrit comme
foyer endémique de schistosomiase, plusieurs facteurs peuvent plaider en
faveur de l'hypothèse selon laquelle le foyer a pris de l'ampleur
à travers tout le groupement de Kiyanika dont il fait partie, à
savoir : l'explosion démographique, la multiplication des
écoles sans système adéquat d'approvisionnement en eau ou
de gestion des excréta , l'existence de répercussions cliniques
graves de la maladie sur l'ensemble de la population et en particulier sur la
population de notre étude(les élèves) qui est
exposée à de nombreux facteurs de risque, l'apparition de
nouveaux points de transmission à travers la contrée.
3. Objectifs
a)Objectif général
L'objectif général de notre étude
consiste à : évaluer l'ampleur de la bilharziose à
Schistosoma mansoni dans la population de Lemfu.
b) Objectifs spécifiques
Pour atteindre cet objectif général, nous nous
sommes assignés comme objectifs spécifiques, ce qui suit :
d'abord identifier les principaux facteurs de risque liées à la
transmission de la maladie et les points de transmission ou de contamination de
l'infestation, déterminer la prévalence de la bilharziose
à Schistosoma mansoni en milieu scolaire de Lemfu, puis
décrire les répercussions cliniques de cette pathologie sur
l'état de santé des victimes et enfin proposer des
recommandations efficaces et adaptées pour une prise en charge
intégrée de l'endémie.
4. Intérêt du travail
L'intérêt de notre étude
dans la perspective de la mise à jour de la situation
épidémiologique de l'endémie à S. mansoni au sien
de la population scolaire de Lemfu.
Ainsi, une estimation de son ampleur et des différents
facteurs de risque permettra l'élaboration des stratégies de
lutte réalistes, rapides et adaptées.
De plus, les résultats de notre étude pourront
servir de point de départ pour la surveillance
épidémiologique en orientant judicieusement les activités
de lutte.
1. PREMIERE PARTIE : GENERALITES SUR
LA SCHISTOSOMIASE
CHAPITRE 1 : APERCU HISTORIQUE
1.1. Découverte des bilharzioses dans le
monde
Selon les papyrus Ebers (1550 av. J.C.)
découverts à Louxor, une maladie caractérisée par
l'hématurie régnait en Égypte. Leur valeur
d'interprétation sera confirmée par la découverte d'oeufs
calcifiés de schistosomes, trouvés dans le cortex rénal
des momies sauvées par Ruffer avant la mise sous eau du premier
barrage d'Assouan.
Au moyen Age, les médecins arabes,
portugais et espagnols firent également des observations analogues dans
leurs comptoirs établis dans des régions actuellement reconnues
endémiques. Plus tard, les boers et les chirurgiens
français accompagnant Bonaparte en Égypte en firent de
même.
En 1852, Théodore Bilharz
découvre dans la veine porte d'un fellah égyptien, lors d'une
autopsie, de petits vers blancs. Il dénomme ce nouveau
trématode : Distomum haematobium. Ayant constaté
une différence anatomique avec le distomum, Cobbold (1857)
propose le nom de Bilharzia.
En 1858, Weiland parlera de Schistosoma sur
la fausse impression que le trématode se présente fendu en
deux ; suite à une application formaliste des règles de la
commission internationale de nomenclature zoologique, cette décision
erronée ne sera jamais corrigée.
En 1902, P. Manson découvre dans un examen de
selles, des oeufs de schistosoma à éperon latéral
et défend l'hypothèse d'une espèce différente de
Schisostoma. Avant lui, on ne considérait qu'une seule
espèce de Schistosoma comme responsable des infections vésicales
et intestinales.
En 1907, Sambon confirme cette hypothèse et
dénomme le deuxième trématode Schistosoma
Mansoni. Schistosoma Japonicum est découvert au Japon par
Fujiro Katsurada en 1904. Schistosoma intercalatum
est individualisé, en 1934, au Congo par Fisher. Schistosoma
mekongi sera isolé au Laos en 1978.
1.2. Découverte de la bilharziose en
R.D.C.
La première observation de la
présence de la bilharziose en Afrique Centrale a été faite
par Firket (1897) cité par P.G. Janssens et al(4) parmi un
contingent de soldats congolais venus en Belgique à l'occasion de
l'exposition universelle.
Dans son rapport de 1900-1905, Broden cité par
P.G. Janssens signale l'existence de la bilharziose intestinale. La
bilharziose urinaire n'est signalée au Congo qu'après 1925.
Quant à la bilharziose à S.
intercalatum, elle sera décrite en 1934 par Fisher dans la
région de la Cuvette Centrale
Plusieurs auteurs, cités par P.G.JANSSENS(4), ont
permis de décrire les foyers endémiques de bilharziose en R.D.C.,
nous citerons par exemple : Gillet, Wolfs, Schwetz, Fain, Van Den
Berghe, Janssen, Duren, Rodhain, etc.
CHAPITRE 2 : LES PARASITES.
2.1. Les parasites et leurs oeufs
Les vers mesurent respectivement 6 à 20
mm de long pour le mâle et 7 à 20 mm pour la femelle. Le
mâle est cylindrique et ses bords latéraux se replient
ventralement pour délimiter le canal gynécophore
où se loge la femelle qui est cylindrique, filiforme et plus longue
que le mâle.
Sauf au moment de la ponte, la femelle est placée dans
le canal gynécophore, les organes génitaux mâles
et femelles étant situés face à face, permettant ainsi une
copulation quasi permanente, au cours des déplacements du couple
à contre courant sanguin.
Les oeufs ont une forme caractéristique
pour le genre et l'espèce. Les oeufs de S. mansoni et de S.
haematobium sont ovalaires. Mais ceux de S. haematobium portent,
à l'un des pôles, un éperon terminal et la ponte
journalière de chaque femelle est d'environ 200 oeufs. Ils sont
éliminés dans les urines.
Par contre ceux de S. mansoni présentent un
éperon proéminent et la ponte journalière de chaque
femelle est d'environ 250 à 350 oeufs. Ils sont éliminés
dans les selles.
La ponte journalière de la femelle de S.
japonicum dépasse 3.500 oeufs par jour. Ces oeufs retrouvés
dans les selles, sont légèrement arrondis avec une petite
protubérance latérale. Ceux de S. mekongi sont plus
petits et plus arrondis que ceux de japonicum et porteurs
également d'un petit éperon latéral. Les deux types
d'oeufs sont retrouvés dans les selles.
Les oeufs de S. intercalatum se distinguent des
autres par leur forme losangique avec l'existence d'un éperon terminal.
La ponte journalière est estimée entre 20 à 300
oeufs ; ils sont retrouvés dans les selles.
Une partie seulement des oeufs sont viables, moins de 50% en
général. Les oeufs contiennent des embryons
(miracidium).
2.2. Les hôtes
intermédiaires
Les hôtes intermédiaires des
schistosomes sont des mollusques gastéropodes. Ces mollusques
préfèrent en général les eaux tièdes (22
à 28° C), ombragées, stagnantes ou à courant
modéré et à végétation abondante(les cours
d'eau, les marigots, les mares, les lacs naturels et artificiels, les
réseaux d'irrigation) et ils vivent en général à 20
ou 30 cm de profondeur sur les tiges des plantes, les feuilles mortes ou dans
la boue du fond.
Parmi les principaux hôtes intermédiaires, nous
citerons :
· Le genre Biomphalaria pour S. mansoni
(Synonyme : « Planorbes », «
Tropicorbis », « Australorbis »)
· Le genre Bulinus pour S. haematobium et
S. intercalatum
· Le genre Oncomelania pour S.
japonicum
· Le genre Lithoglyphopsis aperta pour S.
mekongi.
2.3. Le cycle évolutif et
l'infection chez l'homme :
2.3.1. Dans l'eau et le
mollusque :
Une à trois semaines après la
ponte, une quantité variable d'oeufs parvient dans la lumière de
l'organe et ainsi dans le monde extérieur avec les urines ou les selles.
Ces oeufs vont éclore dans l'eau douce si les
conditions favorables (une température à 25 - 30°C,
l'ensoleillement, un pH neutre) sont réunies, libérant ainsi une
petite larve ciliée et mobile : le miracidium.
Ce dernier cherchera à la nage un
mollusque réceptif, aidé par le chimiotropisme du mucus de ce
mollusque. Il ne dispose que de 24 Heures au maximum pour se fixer à cet
hôte intermédiaire très spécifique et y entrer par
un mécanisme enzymatique.
La suite du développement s'effectue dans
l'hépatopancréas du mollusque et aboutit à la formation
de furcocercaires. Un seul miracidium peut produire plus de 100.000 cercaires.
Leur émergence des mollusques est périodique et
soumise à l'influence de la lumière : entre 9h et 14h. On
notera toutefois que les cercaires ne sont pas excrétées
uniformément durant le nycthémère, mais selon un rythme
journalier.
Les cercaires peuvent survivre pendant 24 à 72 heures.
2.3.2. Dans l'organisme humain :
L'homme s'infecte par le contact avec l'eau
infestée par les cercaires. Ces derniers s'attachent à sa peau et
lorsqu'elle sèche, ils pénètrent activement dans
l'épiderme grâce aux secrétions protéolytiques
produites par les glandes qu'elles possèdent.
A ce moment, ces larves perdent leur queue et seront
nommées schistosomules. En une demi-heure l'épiderme est donc
traversé ; les schistosomules migrent dans les tissus
sous-cutanés et parviennent dans les veinules et les capillaires
lymphatiques qui ouvrent la voie à la grande circulation veineuse et aux
poumons qu'ils atteignent en 4 jours. De là, ils vont gagner le foie par
la voie sanguine ou par effraction (trajet trans-tissulaire). La phase
migratoire dure au total 10 à 21 jours.
Ces schistosomules qui atteignent les veinules
portes intrahépatiques vont pouvoir poursuivre leur développement
jusqu'à la différenciation et à la maturité
sexuelle (en 3 semaines environ) et vont s'accoupler.
Dans les veinules portes intrahépatiques, les vers
adultes accouplés se déplacent à contre- courant vers les
lieux de ponte (plexus péri-vésical ou plexus
hémorroïdal). Arrivée dans les veinules des plexus, la
femelle quitte le mâle pour s'engager dans les fines ramifications
veineuses des parois vésicales ou intestinales, et remonter
jusqu'à la sous-muqueuse où elle commence sa ponte. La femelle
dépose ses oeufs dans une veinule distendue : ils y restent
emprisonnés lorsque la femelle se retire.
Ces oeufs percent, à l'aide d'enzymes
lytiques, la paroi veineuse et les tissus péri vasculaires, puis passent
activement dans les tissus de la paroi intestinale ou
urétéro-vésicale pour atteindre la lumière
intestinale ou la cavité vésicale, et être
disséminés dans la nature avec les selles ou les urines 1
à 3 mois après l'infestation.
La durée de vie de schistosomes chez l'homme a
été estimée de 2 à 18 années ; voire
jusqu'à 20 ou 30 ans selon certains auteurs(3).
2.4.
Épidémiologie :
La prévalence de l'infection, la charge
parasitaire individuelle et la charge moyenne dans la population sont
directement proportionnelles à la durée, à la
répétition, et à l'importance des contacts avec l'eau
contaminée.
Le groupe le plus fortement infecté est
constitué par les enfants d'âge scolaire de 5 à 19 ans. Il
y a des contacts dès la naissance, mais les charges parasitaires sont
alors généralement légères.
En région endémique, la prévalence
augmente à partir de 3-5 ans pour atteindre un maximum vers 10-19 ans.
Elle se stabilise en plateau pour S. mansoni et japonicum mais tend à
diminuer rapidement pour S. haematobium. L'excrétion moyenne des oeufs
diminue par contre à l'âge adulte pour toutes les espèces
(à l'exception de certains groupes exposés professionnellement).
Ces courbes peuvent cependant refléter non seulement les fluctuations
des contacts avec l'eau mais aussi l'acquisition d'une immunité(3).
Pour des raisons culturelles, les garçons sont plus
fortement infectés que les filles. Les facteurs particulièrement
favorables à la création des biotopes facilitant la
multiplication des mollusques, et à la contamination du milieu par les
oeufs, lors des contacts homme - eau et à la transmission de la
bilharziose sont notamment :
· l'aménagement des réseaux d'irrigation et
de drainage, de lacs artificiels (barrages hydro-électriques) ou
d'autres travaux hydrauliques;
· certaines activités économiques
entraînant des contacts intenses homme-eau tels que: la pêche, la
riziculture inondée, les exploitations minières
alluvionnaires;
· l'absence d'eau domestique salubre, d'infrastructure
sanitaire, d'hygiène fécale et urinaire ;
· certaines activités sportives (nage, etc.)
· l'obligation de traverser des collections d'eau
à gué, de puiser de l'eau ou de laver du linge dans une eau
contaminée, etc.
Il en résulte que les bilharzioses se situent au point
de contact de la politique économique et de la gestion de
l'hydrosphère, ainsi qu'au niveau des conflits potentiels entre la
sauvegarde environnementale et les contraintes socio-économiques.
2.5. Répartition géographique dans le
monde et en R.D.C.
2.5.1. La bilharziose à S.
mansoni.
Ce type de bilharziose atteint environ 60 millions
d'individus. Les principales zones d'endémies sont : toute
l'Afrique au sud du Sahara, la côte orientale de Madagascar,
l'Amérique du sud, les Antilles.
En R.D.C., les principaux foyers sont : le Katanga, le
Kasaï oriental, le Kivu, (Maniema, Kasongo), l'Ituri-Uele, la
région des grands lacs, et les quelques foyers isolés du
Bas-Congo (Kwilu-Ngongo, Lemfu, Mayombe) et de Kinshasa (Bandal).
2.5.2. La bilharziose à S.
haematobium :
La bilharziose à S. haematobium atteint une centaine de
millions de personnes sans le monde. Les principales zones d'endémie
sont : toute l'Afrique, le Madagascar, le Moyen- Orient.
Les principaux foyers en R.D.C. sont : Katanga,
Kindu(Maniema), Kimpese, Mayombe.
2.5.3. La bilharziose à S.
intercalatum :
La bilharziose à S. intercalatum, quant à elle,
est uniquement africaine et se rencontre : au Congo, en R.C.A., au Gabon,
au Tchad, au Cameroun.
Les foyers importants en R.D.C. sont : Kisangani et ses
environs, Lubulu, Kindu.
2.5.4. La bilharziose à S. japonicum et à
S. mekongi.
Ces deux espèces réunies atteignent près
de 100 millions d `individus.
Elles sont rencontrées : au Japon, en Chine, aux
Philippines, en Indonésie, au Sud-est asiatique (Thaïlande, Laos,
Cambodge, Malaisie), à Formose, en Corée.
CHAPITRE 3 : DESCRIPTION DE LA
MALADIE
3.1. Pathogénie et anatomie
pathologique :
3.1.1. Les vers :
Les vers adultes n'induisent pas de réactions
inflammatoires des vaisseaux mais seulement l'apparition progressive d'une
immunité relative limitant la charge vermineuse comme dans d'autres
helminthiases.
Ils forment dans leur intestin au moins deux antigènes
qui passent dans la circulation de l'hôte : l'antigène
anodique circulant (C.A.A.) et l'antigène cathodique circulant (C.C.A.)
qui ne sont apparemment pas toxiques mais bien antigéniques et donnant
lieu à la formation d'immuns complexes circulants partiellement
responsables après dépôts au niveau des glomérules
rénaux, d'une glomérulonéphrite membraneuse
proliférative (avec syndrome néphrotique associé)
rencontrée au cours de la bilharziose à S. mansoni avec
atteinte hépato-splénique (3).
3.1.2. Les oeufs :
Ce sont les éléments pathogènes par
excellence. Après leur ponte, les oeufs vont subir trois sorts
différents :
- l'excrétion au dehors avec les urines et les
matières fécales ;
- la rétention locale dans les tissus près de
l'endroit de la ponte ;
- l'embolisation avec le courant sanguin dans le
système porte (foie), dans la grande
circulation (avec arrêt dans les poumons).
Ces oeufs sont responsables de la plupart des lésions
anatomo-pathologiques et induisent la formation d'un granulome bilharzien et
plus tard d'un bilharziome (accumulation locale de granulomes). L'ensemble
évolue vers la sclérose et la calcification.
Les lésions siègent dans la muqueuse, la
sous-muqueuse et parfois la musculeuse de la vessie, des uretères et des
organes génitaux pour S. haematobium ; de l'intestin pour
les quatre autres schistosomes.
Les 5 espèces de schistosomes sont responsables des
lésions au niveau du foie (surtout S. mansoni, japonicum,
mekongi), des poumons, du système nerveux, de la peau, etc.
3.2. Symptomatologie et
complications :
Les différentes manifestations cliniques seront
décrites à ce niveau, en tenant compte des différentes
espèces de Schistosoma mais en insistant sur la bilharziose
à S. mansoni, objet de nos recherches.
3.2.1. Symptomatologie commune :
3.2.1.1. Phase initiale ou dermatite
cercarienne :
Elle est la conséquence de la réaction
d'immunité immédiate ou retardée sur les cercaires qui
pénètrent par la peau.
Il s'agit d'une éruption précoce, endéans
une heure après la sortie de l'eau contaminée, maculaire ou
papulaire, prurigineuse et érythémateuse sur les parties
exposées ; et pouvant s'accompagner d'oedèmes et de
vésicules qui se surinfectent éventuellement par grattage.
Les papules disparaissent, en moyenne, en deux semaines mais
la pigmentation peut persister longtemps.
3.2.1.2. Phase d'invasion ou phase aiguë :
Elle correspond à la phase de migration et de
transformation des schistosomules.
Les troubles qui en résultent sont consécutifs
aux réactions de l'organisme mis en contact avec les substances
antigéniques et toxiques des vers.
Cela se traduit cliniquement par des phénomènes
allergiques avec de la fièvre, des céphalées, des sueurs.
Il s'y associe des phénomènes urticariens, des arthralgies et
myalgies, des oedèmes fugaces, de la toux et de la diarrhée.
Le nom donné à ce syndrome d'infection
précoce est : le syndrome de Katayama, plus prononcé par
l'infection à S. japonicum, moins pour S. mansoni et
moins encore pour S. haematobium ou intercalatum.
Ces symptômes débutent de manière
explosive après une période silencieuse de 3 à 8 semaines.
Objectivement, on peut trouver une hépato-splénomégalie
légère et des adénopathies.
La numération de la formule sanguine montre une
hyperleucocytose avec hyper-éosinophilie.
3.2.2. Infection à S. mansoni
3.2.2.1. Manifestations intestinales :
Elles sont caractérisées essentiellement
par :
- La diarrhée à selles fréquentes, molles
ou franchement liquides, parfois glaireuses et sanguinolentes, voire
dysentériformes.
- Une entéropathie exsudative peut s'ensuivre,
accompagnée d'anémie importante et d'hypo-albuminémie.
- De vagues malaises abdominaux sans caractère, ni
localisation propre dans les cas légers et s'accompagnant parfois
d'anorexie et de nausées.
- De douleurs abdominales intéressant le cadre colique
parfois de type crises coliques.
- Un ténesme, des épreintes (rares).
- Un prolapsus rectal
- L'état général est habituellement
conservé.
La rectosigmoïdoscopie révèle des
lésions variables : oedème ou hyperhémie de la
muqueuse, varicosités, ulcérations, granulations
blanchâtres (des bilharziomes) et des pseudo-polypes inflammatoires
(adénopapillomateux)
Des complications peuvent survenir : sub-occlusion (suite
aux tumeurs péri-intestinales importantes ou bilharziomes),
hémorragie intestinale, adhérences péritonéales
(suite aux granulomes sous- séreux), syndromes de malabsorption avec
stéatorrhée (suite à l'obstruction des voies lymphatiques
par les bilharziomes.
3.2.2.2. Manifestations hépatospléniques
Elles compliquent une bilharziose à S. mansoni
avec ou sans manifestations intestinales et résultent d'une
embolisation des oeufs au niveau du foie, en périphérie des
espaces portes, immédiatement avant que les ramifications
intrahépatiques terminales aillent se jeter dans les sinusoïdes du
foie.
La fibrose entraînée par des infections massives
aura comme stade ultime, l'aspect pathognomonique de la
fibrose « en tuyaux de pipe » de Symmers (1897).
Cliniquement le foie est gros, ferme, lisse, parfois sensible.
L'hypertension portale qui se sera installée,
entraînera à son tour une splénomégalie (rate
volumineuse) avec circulation collatérale et varices
oesophagiennes ; l'ascite est aussi fréquente.
Dans les cas compensés, une histoire
d'hématémèse ou de mélaena peut parfois s'ajouter
à l'hépato-splénomégalie tandis que dans les cas
des compensés, on aura également les signes suivants :
hépatalgies, fatigabilité, amaigrissement, hémorragies
digestives accrues, oedèmes, ascite, circulation collatérale
très évidente et au stade ultime, encéphalopathie avec
ictère.
Le pronostic de la bilharziose hépatosplénique
est réservé : des hémorragies digestives par rupture
de varices oesophagiennes peuvent emporter le malade à tout moment.
L'hypersplénisme est responsable d'anémie, de
leucopénie, de thrombopénie.
N.B. :
L'hépatomégalie est fréquente lorsque la
charge ovulaire dépasse 100 oeufs /g de selles et, toujours
fréquente au -dessus de 800 oeufs /g ; elle est le signe le plus
courant de la bilharziose endémique à S. mansoni.
Dans certains groupes HLA, le risque de fibrose de Symmers est
significativement augmenté par rapport aux témoins à
charge ovulaire égale. L'hyper réactivité des lymphocytes
T. a été confirmée chez les sujets atteints de fibrose
sévère.
Dans ce groupe, les haplotypes HLA A2 et B12 sont
très dominants alors que le groupe DR2 est
sous-représenté.
Parmi les autres complications liées à S.
mansoni, nous citerons aussi : une glomérulonéphrite et
une myélite transverse(3).
3.2.3. Infections aux autres espèces de
schistosomes
3.2.3.1. Infection à S.
haematobium
La symptomatologie sera fonction de la localisation des
schistosomes. Ainsi nous aurons des manifestations cliniques en rapport avec
des atteintes : vésicale, urétérale, rénale,
urétrale, génitale.
D'autres localisations ectopiques (rectum, foie, poumon,
coeur) sont aussi signalées.
3.2.3.2. Infection à S.
intercalatum
La symptomatologie est essentiellement rectale et
associée aux mêmes signes généraux que la
bilharziose intestinale. Il y a lieu de noter la possibilité de
localisations génitales.
S. intercalatum est considéré comme le
moins pathogène des schistosomes humains.
3.2.3.3. Infection à S. japonicum et
à S. mekongi
Pour autant qu'on sache, les conséquences
anatomo-cliniques sont identiques pour les deux espèces. D'une
façon générale, la pathologie est la même que dans
l'infection à S. mansoni, mais les symptômes seraient
plus sévères.
La symptomatologie sera dominée ici par des
atteintes : hépatosplénique, intestinale, cardio-pulmonaire,
cérébrale ou neurologique.
3.2.4. Complications communes aux bilharzioses
humaines
Nous citerons comme complications :
- la bilharziose cardio-pulmonaire ;
- la bilharziose du système nerveux ;
- la bilharziose cutanée ;
- l'association de la salmonellose à la bilharziose.
3.3. Immunité dans les
bilharzioses :
La bilharziose est l'exemple idéal de cette situation
curieuse où une forme du parasite est responsable de l'immunité
(les vers adultes) alors qu'une autre forme est responsable de la pathologie
(les oeufs).
En ce qui concerne l'immunité protectrice, il faut
spécifier d'emblée qu'il n'existe pas d'immunité
stérile dans la bilharziose (état où le sujet
infecté sera guéri et protégé contre une nouvelle
infection ; comme dans la rougeole par exemple). Il s'agit plutôt
d'une immunité dite concomitante car la surinfection est
évitée tant qu'il y a des vers adultes vivants dans l'organisme,
même si ces vers ne pondent pas d'oeufs(3).
Dans cette immunité, le mécanisme effecteur
consiste dans la destruction des schistosomules par une réaction
d'immunité cellulaire dont les cellules effectrices sont surtout, selon
J.P Revillard (6), les lymphocytes, les éosinophiles, mais aussi les
macrophages, les plaquettes sanguines et même les neutrophiles et les
basophiles agissant toutes sous le contrôle de cytokines
spécifiques. Cette réaction est déclenchée par la
présence d'anticorps létaux induits par ces vers adultes :
il s'agit d'une réaction dite ADCC (Antibody Dependent Cellular
Cytotoxicity).
Bien que les vers adultes soient intra-vasculaires et par
conséquent entourés d'anticorps dressés contre eux, il
existe des mécanismes d'évasion, qui leur permettent d'esquiver
l'attaque immunitaire.
Parmi ces mécanismes d'échappement et
d'adaptation des parasites, J.P Revillard cite : la résistance au
complément par le captage et l'incorporation dans leur cuticule de DAF
(Decay Accelarating Factor) de l'hôte(glycoprotéine des globules
rouges qui inhibe l'hémolyse en détruisant le
complément) ; l'échappement à la reconnaissance suite
au développement, par les parasites, de différents
procédés de dissimulation, de diversion ou de modifications
séquentielles de leurs antigènes ; l'action sur les
réponses immunitaires de l'hôte par des mécanismes de
suppression ou d'inactivation de la réponse immunitaire de
l'hôte.
Ces différents mécanismes de déguisement
immunologique des schistosomes ne seront efficaces que 4 jours après
l'infection par les cercaires.
La survie de ces vers à long terme, ne semble donc pas
compromise dans les infections chroniques, mais leur fertilité
diminue.
Ces anticorps circulants, appartenant aux diverses classes
d'immunoglobulines, apparaissent tôt dans l'infection et persistent
longtemps après l'élimination des parasites.
Dans les stades précoces, ce sont surtout des IgM et
IgE ; les titres d'IgE étant élevés et proportionnels
à l'éosinophilie comme dans les autres helminthiases.
Ces différents anticorps seront dressés contre
tous les stades parasitaires présents chez l'hôte :
cercaires, schistosomules, antigènes somatiques et
sécrétoires des vers adultes (CAA et CCA), oeufs,
antigènes solubles des oeufs (SEA), etc. On voit aussi apparaître
des anticorps contre des antigènes de l'hôte intermédiaire
(le mollusque), dans le sang de l'hôte définitif ; ce qui
montre l'existence de « communautés
antigéniques » entre les vers et leurs hôtes.
Ce n'est que vers 1985 qu'on a pu confirmer la
réalité de l'immunité chez l'homme.
C'est ainsi que les courbes particulières de
prévalence de la bilharziose en fonction de l'âge ont
été interprétées comme témoignant de cette
immunité concomitante.
On a cependant fait remarquer que ces courbes de
prévalence en fonction de l'âge suivaient fidèlement les
courbes de contact avec l'eau et pouvaient donc par conséquent tout
aussi bien être expliquées par une diminution des contacts
infectants(3).
Des études ultérieures ont montré que les
sujets résistants ont des taux élevés
d'éosinophiles, mais surtout d'IgE, d'IgA et, dans une moindre mesure,
d'IgG1 et d'IgG3. Ces Immunoglobulines ont un effet protecteur, alors qu'un
taux élevé d'IgG4 a un effet contraire (1).
Les premiers anticorps qui apparaissent lors d'une
primo-infection sont des IgM dressés contre les polysaccharides des
oeufs des schistosomes.
Ces IgM, de même que les IgG2 et les IgG4, ont un effet
bloquant, c'est à dire que leur fixation sur le schistosomule
empêche la fixation des anticorps létaux, surtout des IgE, qui
sont dressés, eux, contre les vers adultes.
Ce n'est que plus tard dans l'existence que les anticorps
létaux prennent le dessus et qu'une immunité relative, jamais
stérile, s'installe, suivie de la diminution des charges parasitaires.
L'immunité n'apparaît que vers l'âge de
12-13 ans, d'autant plus tôt que la transmission est intense et les
infections massives.
Le développement d'un vaccin est basé sur ce qui
précède. En effet, des résultats positifs ont pu
être obtenus chez le bétail, en provoquant chez les animaux des
infections avec des cercaires soit d'un même sexe, soit exposées
à une irradiation préalable. Ce qui conduira à la longue
à une infection par des vers suffisamment adultes pour donner un certain
degré d'immunité mais incapables de provoquer des lésions
car ne pondant pas d'oeufs.
En outre, on a pu isoler, des schistosomules adultes, les
fractions antigéniques qui induisent la formation d'anticorps
létaux. Une de ces fractions, une séquence de la 28 kD
glutathione S-transférase des schistosomes, a été
clonée. Le vaccin recombinant ainsi obtenu entraine une réduction
d'environ 66% de la quantité d'oeufs excrétés chez le
babouin et est à l'essai chez l'homme depuis 1991.
A ce sujet, Lane A. et al (7), signalent qu'une forte
réponse, chez la souris, en IgG et en IgA apparaît après
vaccination par la rSh28GST (vaccin recombinant cloné du Schistosoma
haematobium).
Boulanger D. et al(8) font également le même
constat chez les singes après injection de rSh28GST ; de plus, ils
font remarquer que le vaccin permet de réduire fortement la
fécondité du ver femelle.
CHAPITRE 4 :
DIAGNOSTIC DE LA SCHISTOSOMIASE
Le diagnostic de la schistosomiase sera posé
grâce à différents procédés :
4.1. Diagnostic
parasitologique :
Le diagnostic de la bilharziose est en principe
parasitologique. Les oeufs de schistosomes sont recherchés
dans :
v les urines : après concentration par
sédimentation simple, centrifugation ou filtration.
v les selles : par examen des selles à frais
(frottis simple), par la technique de KATO-KATZ, par la méthode de
RITCHIE.
v la biopsie rectale : après
prélèvement sous rectoscopie.
v les biopsies de provenance diverse (biopsie hépatique
ou vésicale).
v les autres liquides biologiques (crachats,
sécrétions vaginales, sperme, L.C.R).
4.2. Diagnostic
immunologique :
Il a pour but d'objectiver la présence
d'antigènes bilharziens, des modifications immunologiques non
spécifiques ou encore des réactions spécifiques
d'immunité humorale (anticorps) ou cellulaire.
Pour ce faire, différents tests sérologiques
sont utilisés, à savoir : l'immunofluorescence,
l'immunoélectrophorèse, l'hémagglutination passive, le
R.I.A. et surtout l'ELISA qui atteint un degré élevé de
sensibilité et de spécificité à condition
d'utiliser l'antigène approprié(3,9).
Il est important de signaler que les titrages d'anticorps ne
conviennent pas, selon l'O.M.S. (2), pour le diagnostic de l'infection
évolutive dans les zones d'endémie, ni pour le suivi de la
chimiothérapie. Par contre, le diagnostic fondé sur la
détection des antigènes, reflète directement la charge
parasitaire et fournit donc des données quantitatives.
A ce sujet, les tests les plus étudiés et les
plus largement évalués, sont ceux qui reposent sur la
détection des deux antigènes circulants : le C.A.A. et le
C.C.A.
De nombreuses études ont maintenant confirmé le
fait que la mesure du C.A.A. sérique constitue actuellement le marqueur
le plus direct et le plus fiable de la charge en vers (3, 2,10).
L'utilisation des tests sérologiques est jugée
assez décevante en régions endémiques, pour certains
auteurs, si on les compare aux données parasitologiques(3).
M. Ziado Satti et al(11) ont montré la
possibilité d'utiliser une méthode basée sur la mesure du
taux d'histamine libérée par l'homme en réponse à
l'infection, et selon les différents degrés d'exposition.
4. 3. Diagnostic
biologique.
Il nous permet de révéler :
- une hyper-éosinophilie ;
- des tests hépatiques peu troublés et des
transaminases normaux ;
- des taux abaissés d'albumines et augmentés de
gammaglobulines (électrophorèse) ;
- des phosphatases alcalines et l'alpha-foeto-protéine
modérément augmentés(en cas atteinte hépatique
franche) ;
- une possible hématurie, albuminurie ou pyurie.
4.4. Examens
endoscopiques
On aura recours ici à la rectosigmoïdoscopie ou
à la cystoscopie. Le matériel à prélever servira
pour des examens parasitologiques et histopathologiques.
4.5. Examens radiologiques et
sonographiques.
Les manifestations ou complications de la bilharziose peuvent
être objectivées par des examens radiologiques (radiographie de
l'abdomen à blanc, urographie intraveineuse, urographie
rétrograde voire radiographie du thorax) ainsi que l'échographie.
CHAPITRE 5. : PRISE
EN CHARGE DE LA SCHISTOSOMIASE
5.1. Prise en charge
médicale et chirurgicale :
5.1.1. Traitement médical.
Actuellement, des médicaments plus efficaces et ayant
moins d'effets secondaires, sont commercialisés. Il s'agit de :
- le Métrifonate (Bilharcil R) :
efficace uniquement sur S. haematobium.
- l'Oxamniquine (Vansil R) : efficace
uniquement sur S. mansoni.
- le Praziquantel (Biltricide R) : actif sur
les 3 schistosomes majeurs de l'homme, d'où son nom, et aussi sur S.
mekongi, intercalatum, mattheei ; très actif aussi sur la plupart
des cestodes et des trématodes.
5.1.2. Traitement chirurgical :
Il paraît moins important suite aux excellents
schistosomicides dont on dispose, mais on y recourt dans des cas tels
que : les cancers de la vessie, les cas d'uropathie obstructive (ne
répondant pas au traitement médical), la fibrose hépatique
de Symmers accompagnées d'hématémèse.
5.2. Contrôle et
prophylaxie :
En principe, le contrôle et la prophylaxie devraient
pouvoir rompre un ou plusieurs chaînons dans la transmission.
Pour ce faire, il faudrait selon P.G. JANSSENS et Al (4)
:
a) éliminer le réservoir par le dépistage
et le traitement des porteurs :
Selon l'OMS (2), les analyses coût / efficacité
peuvent également être utilisées pour évaluer
différentes approches de diagnostic et stratégies de traitement
pour les services de santé.
Le dépistage sur un étalement de KATO - KATZ de
25 mg suivi d'un traitement, a donc été jugé l'approche la
plus rentable dans tous les groupes d'âge et centres de santé,
compte tenu du coût du Praziquantel en 1991, soit 1 USD par dose moyenne
(5,12).
L'abaissement du prix du médicament augmente cependant
le rapport coût / efficacité du traitement présomptif par
rapport au dépistage selon la méthode de KATO - KATZ. Au
coût actuel du Praziquantel, soit 0,35 USD par traitement, le traitement
présomptif serait plus rentable dans les centres de santé ayant
un taux de détection supérieur à 35 %.
Toutefois, l'OMS (2) recommande de procéder au
traitement de masse des enfants dans les écoles lorsque la
prévalence de la schistosomiase dépasse 50%.
b) empêcher l'infection des mollusques :
Cela suppose l'introduction d'une hygiène fécale
ou urinaire ; d'où la nécessité d'une bonne
éducation sanitaire afin d'obtenir la participation communautaire dans
la construction et l'utilisation des latrines ;
c) détruire l'hôte intermédiaire :
Pour y arriver, on peut procéder par l'application dans
les cours d'eau des produits molluscicides soit d'origine chimique (Niclosamide
ou Bayluscide) soit d'origine végétale tel que l'Endod
(3,13) ; par des méthodes physiques comme l'assèchement
périodique des biotopes pour le nettoyage périodique des cours
d'eau ; des méthodes biologiques comme l'introduction de
prédateurs naturels (autre mollusque ou écrevisse) ;
d) éliminer ou réduire les contacts humains avec
l'eau infectante :
Par des mesures d'approvisionnement en eau potable avec
installation des adductions d'eau (système d'adduction directe dans les
habitations, constructions de lavoirs ou douches publiques ou encore de bassins
de natation), par l'éducation sanitaire permettant de décourager
le type de comportement qui semble comporter le plus de risques pour la
transmission.
2. DEUXIEME
PARTIE : TRAVAIL PERSONNEL
CHAPITRE 1 : MATERIEL
ET METHODES
1.1
Matériel :
1.1.1. Description du site de l'étude :
Le site choisi pour notre étude est le groupement de
Kiyanika. Ce groupement administratif est situé sur la route nationale
Inkisi-Kimvula et plus particulièrement dans la collectivité de
Ngeba à 150 km de Kinshasa, commune de Madimba, district de la Lukaya
dans la province du Bas-Congo.
Il s'étend du village de Kindona (7 km avant Lemfu)
jusqu'au village de Kipasa (6 km après Lemfu) et il se compose de 33
villages, de l'agglomération de Lemfu (située à 33 km
d'Inkisi), de la mission catholique de Kiela.
La population est d'environ de 15.072 habitants (Bureau du
district de la Lukaya ; statistiques, 2000) et vit essentiellement de
l'agriculture, de l'élevage et du commerce.
Du point de vue ethnique, le site d'étude est une aire
anthropologique des Bakongo et on y trouve principalement le sous-groupe
Bantandu, avec comme dialecte le Kintandu.
1.1.2. Population de l'étude :
Notre étude s'est déroulée en
milieu scolaire avec une population totale de 466 élèves
provenant d'une des 9 écoles (4 primaires et 5 secondaires) du
groupement de Kiyanika ; depuis la première année primaire
jusqu'en sixième secondaire.
Les critères d'inclusion des élèves dans
l'étude étaient les suivants :
- élève né et habitant dans le
groupement de Kiyanika ;
- élève du groupement de Kiyanika dont
l'émigration ancienne (supérieure à 1 an) est suffisante
pour avoir vécu les conditions épidémiologiques du milieu.
Par contre, les critères d'exclusion des
élèves étaient :
- élève n'habitant pas dans le groupement de
Kiyanika
- élève habitant le groupement de Kiyanika mais
dont l'émigration est récente (inférieur à 1
an).
1.1.3. Matériel pour la collecte des
données :
Pour faciliter sa réalisation, la collecte des
données a nécessité le matériel suivant :
a) L'usage d'un questionnaire dont la fiabilité a
déjà été démontrée par NGIMBI N.P(14)
et confirmé par l'OMS(15) pou la détection des zones à
haut risque de schistosomiase.
Certains éléments furent ajoutés à
cette fiche de renseignement, à savoir : les éléments
d'un examen physique succinct (palpation du foie et de la rate,
évaluation de l'état général, etc.), les
résultats des examens de selles selon la technique standard (examen de
selles à frais ou frottis simple) et selon la technique
spécialisée de KATO-KATZ, la prise antérieure d'un
traitement antibilharzien (Annexe).
b) Des équipements, matériel de laboratoire et
réactifs :
Des équipements et matériel de laboratoire
usuels ainsi que des réactifs, ont été utilisés
pour : le prélèvement et la conservation des selles ;
les différents examens de selles (à frais et selon la
technique de KATO-KATZ ; la récolte des mollusques, leur
dissection et l'examen microscopique des cercaires.
1.2. Méthodes :
1.2.1. Type d'étude et période
d'étude :
Nous avons opté en ce qui nous concerne pour une
étude analytique transversale dont la collecte des données fut
étalée sur une période allant de Janvier à Avril
2000.
1.2.2. Échantillonnage :
Des 9 écoles (4 primaires et 5 secondaires) du
groupement avec un total de 2.665 élèves (année scolaire
1999-2000), 466 élèves ont été retenus en tenant
compte du pourcentage des élèves dans chaque école par
rapport au total général.
La taille de l'échantillon a été
déterminée en appliquant la formule :
n = Z 2. p. q , avec Z (coefficient de
confiance) = 1,96.
d 2 d
(degré de précision) = 0,05.
p
(prévalence antérieure) = 45,5% soit 0,455
q = 1-
p = 0,545
Sur base d'une liste générale établie au
préalable, un échantillonnage proportionné tenant compte
de l'importance relative de chacune des écoles, a été
réalisé.
Au niveau de chaque école, une sélection des
élèves fut faite par tirage au sort, en retenant un nombre
égal d'élèves au niveau de chacune des classes.
1.2.3. Collecte des données :
a) Auprès des élèves :
Une équipe de trois personnes (l'étudiant
chercheur et deux infirmiers du C.S.R de Lemfu préalablement
formés pour l'enquête) descendit dans toutes les écoles du
groupement de Kiyanika afin d'interroger et d'examiner les élèves
répondant aux critères d'inclusion à l'étude, et
choisis de façon aléatoire.
Après remplissage du questionnaire et examen physique
succinct, un échantillon de selles a été collecté
pour chaque élève.
Du formol à 10% était alors ajouté
à chacun des flacons bien étiquetés afin d'assurer la
conservation en attendant l'acheminement de tous ces échantillons, dans
des boites en carton ordinaires, vers l'unité de parasitologie du
laboratoire de l'hôpital Saint Luc de Kisantu(H.S.L.K) pour analyse
microscopique(16,17).
b) Récolte, identification et dissection des
mollusques :
La récolte des mollusques fut effectuée par
l'étudiant chercheur assisté par le superviseur des
endémies et laboratoires du B.C.Z.S de Kisantu, essentiellement pendant
la saison des pluies.
Les mollusques récoltés furent conservés
dans des bocaux contenant un peu d'eau des rivières prospectées
(fig. ) et dont les couvercles étaient percés de petits
orifices pour l'aération. 24 à 48 heures après la
récolte, ils étaient ramenés au laboratoire pour la
dissection, après avoir déterminé le genre
prédominant, afin de déterminer les rivières avec
mollusques infectés par les furcocercaires.
Les mollusques étaient disséqués à
l'aide d'une paire de ciseaux, en cassant la coquille. Le tube digestif et
l'hépatopancréas sont recueillis sur une lame porte-objet pour
une observation directe au microscope(18).
Quant à la classification taxonomique des mollusques,
elle fut réalisée par l'unité d'entomologie et de
malacologie du professeur Mandiangu au service de parasitologie /IMT des
cliniques universitaires de Kinshasa ; en se basant essentiellement sur
les critères de Mandahl-Barth(19) et d'autres documents
analogues(18,20).
c) Examens coprologiques :
Ils ont été réalisés dans le but
de rechercher la présence d'oeufs de schistosomes dans les selles des
sujets de notre étude. A ce sujet, différentes techniques
d'examen furent utilisés, à savoir :
Le frottis simple : il s'agit ici de diluer une
parcelle de matière fécale dans une goutte d'eau sur une lame
porte-objet qu'on recouvre ensuite d'un couvre-objet, de façon à
obtenir une couche suffisamment mince pour être transparente et permettre
la recherche des oeufs(3).
La technique de KATO-KATZ : recommandée par
l'OMS(2,21) et par d'autres auteurs (3, 4, 14, 22, 23, 24,25), elle consiste
à :
- Tremper les lamelles de cellophane dans la solution de
glycérol vert de malachite à 50% pendant au moins 24 heures avant
usage ;
- Déposer une petite quantité de matière
fécale sur un morceau de papier (papier journal) ;
- Appuyer le tamis sur l'échantillon ;
- Au moyen d'un bâtonnet applicateur à bord
plat, racler la surface supérieure du tamis pour recueillir la
matière fécale qui sort des mailles ;
- Disposer une moule perforée sur une lame propre et
déposer un peu de matière fécale tamisée dans la
partie évidée, en la remplissant soigneusement ; le
bâtonnet applicateur arrivera pour lisser ;
- Enlever soigneusement le moule de façon que toute la
matière fécale reste sur la lame et que rien ne reste
accroché à la plaque ; puis recouvrir avec une lamelle de
cellophane imbibée de glycérol ;
- S'il y a trop de glycérol sur la face sur la face
supérieure de la cellophane, l'essuyer avec un morceau de papier
hygiénique ; retourner ensuite la lame et appuyer
l'échantillon contre la cellophane sur une surface lisse, pour
l'étaler de manière uniforme ;
- La lame sera alors retournée doucement pour ne pas
détacher la cellophane. La préparation est
terminée ;
- La lame est conservée pendant au moins 24 heures
à la température ambiante avant l'examen microscopique. on
comptera tous les oeufs à l'objectif 10 et on multipliera le
résultat par 40 pour obtenir le nombre d'oeufs par gramme de selles.
N.B :
L'échantillon de selles pour chaque sujet devait subir
les 2 types d'examens, c'est-à-dire la préparation de 2 lames
différentes (l'une pour le frottis simple et l'autre pour le
KATO-KATZ).
Chacune de ces lames fut examinée par 2 microscopistes
différentes et la transcription des résultats nécessitait
au préalable une harmonie et un accord dans leurs observations.
1.2.4. Traitement et analyse statistique des
données :
L'analyse statistique fut informatisée grâce aux
logiciels : Epi-info 6.04, SPSS, Excel, EPED.
Elle fut essentiellement axée sur les mesures de
tendance centrale et de dispersion, l'utilisation de tableaux croisés et
de tests référentiels tels que : le chi-carré, la
comparaison des moyennes géométriques.
L'estimation du risque a été effectuée
grâce au calcul du Odds Ratio(O.R) et pour lequel l'intervalle à
95% a été construit afin d'en estimer le niveau de signification.
La présentation des résultats utilisa des
tableaux basés sur : les caractéristiques de
l'échantillon, les caractéristiques des sujets malades (en
relevant les principaux facteurs de risque), les caractéristiques du
milieu (les principaux points de contact hydrique avec un taux d'infestation
élevé, les zones du groupement de Kiyanika pouvant être
considérées comme à risque).
On signalera aussi l'utilisation des programmes Adobe
Photoshop et Microsoft Publisher pour les figures relatives à la
cartographie de la région de l'étude et à la typologie des
espèces de mollusques collectés dans les rivières
prospectées. CHAPITRE 2 :
PRESENTATION DES RESULTATS
2 .1. Caractéristiques de
l'échantillon
Les différentes caractéristiques de notre
échantillon (âge, sexe, niveau d'étude, durée de
résidence dans le groupement, etc.) sont décrites dans les
tableaux suivants :
Tableau I : Répartition des
sujets selon l'âge
|
Groupe d'âge (ans)
|
Fréquence
|
Pourcentage
|
|
5 - 9
|
68
|
14,6
|
|
10 - 14
|
184
|
39,5
|
|
15 - 19
|
159
|
34,3
|
|
20 et plus
|
55
|
11,6
|
|
Total
|
466
|
100
|
184 élèves de notre étude (soit 39.5%)
ont un âge qui varie entre 10 à 14 ans ; c'est le groupe
d'âge qui prédomine.
L'âge moyen est situé entre14 +/- 4 ans, avec un
minimum à 5 ans et un maximum à 25 ans.
Tableau II : Répartition des
sujets selon le sexe
|
Sexe
|
Fréquence
|
Pourcentage
|
|
F
|
214
|
45,9
|
|
M
|
252
|
54,1
|
|
Total
|
466
|
100
|
La majorité des sujets de notre étude sont du
sexe masculin, soit 252 élèves (54%).
Tableau III : Répartition des
sujets selon le niveau d'étude
|
Niveau d'étude
|
Fréquence
|
Pourcentage
|
|
Primaire
|
318
|
68
|
|
Secondaire
|
148
|
32
|
|
Total
|
466
|
100
|
La majorité de nos élèves sont d'un niveau
d'étude primaire, soit 318 élèves (68%).
Tableau IV : Répartition des
sujets selon la durée de résidence dans le milieu
|
Durée de résidence
|
Fréquence
|
Pourcentage
|
|
0 - 4
|
92
|
19,7
|
|
5 - 9
|
102
|
21,9
|
|
10 - 14
|
154
|
33
|
|
15 - 19
|
92
|
19,7
|
|
20 et plus
|
26
|
5,6
|
|
Total
|
466
|
100
|
Les sujets dont la durée de résidence dans le
milieu varie de 10 à 14 ans sont prédominants, soit 154
élèves (33%).
La durée de résidence moyenne étant
située entre 10 +/- 5 ans, avec un minimum à 1 an et un maximum
à 25 ans.
Tableau V : Fréquence des
symptômes subjectifs et objectifs présentés
par
les sujets
|
Symptômes
|
OUI
|
NON
|
n
|
|
Fréquence
|
Pourcentage
|
Fréquence
|
Pourcentage
|
|
1. Démangeaison
|
247
|
53
|
219
|
47
|
466
|
|
2. Douleur abdominale
|
371
|
79,6
|
95
|
20,4
|
466
|
|
3. Toux
|
314
|
67,5
|
151
|
32,5
|
465
|
|
4. Sang en urinant
|
18
|
4
|
448
|
96
|
466
|
|
5. Sang dans les selles
|
224
|
48
|
242
|
52
|
466
|
|
6. Amaigrissement
|
106
|
23
|
360
|
77
|
466
|
|
7. Douleur en urinant
|
105
|
22,6
|
360
|
77,4
|
465
|
|
8. Diarrhée
|
220
|
47,6
|
242
|
52,4
|
462
|
|
9. Hépatomégalie
|
135
|
29
|
331
|
71
|
466
|
|
10. Splénomégalie
|
106
|
23
|
360
|
77
|
466
|
|
11. Pâleur conjonctivale
|
4
|
0,9
|
455
|
99,1
|
459
|
|
12. Altération de l'état
général
|
42
|
9,1
|
419
|
90,9
|
461
|
|
13. Douleurs articulaires
|
145
|
31,1
|
321
|
68,9
|
466
|
Le mal de ventre est le symptôme le plus signalé
par les sujets examinés, soit 371 (79,6%) tandis que la pâleur
conjonctivale est le symptôme le moins remarqué, soit pour 4
élèves seulement (0.9%).
Tableau VI : Effectif des sujets
ayant bénéficié ou non d'un traitement
antérieur
antibilharzien
|
Traitement antérieur
|
Fréquence
|
Pourcentage
|
|
OUI
|
121
|
33
|
|
NON
|
247
|
67
|
|
Total
|
368
|
100
|
De tous les sujets interrogés, 121(33%) affirment avoir
déjà bénéficié d'un traitement
antibilharzien antérieurement.
Tableau VII : Effectif des sujets
infectés par S. mansoni après examen
de selles
à frais
|
Infection à S. mansoni
|
Fréquence
|
Pourcentage
|
|
+
|
266
|
57
|
|
-
|
199
|
43
|
|
Total
|
465
|
100
|
Selon les résultats des examens de selles à frais,
266 sujets (soit 57%) sont infectés par S. mansoni.
Tableau VIII a :
Effectif des sujets infectés par S. mansoni après KATO-KATZ
|
Infection à S. mansoni
|
Fréquence
|
Pourcentage
|
|
+
|
392
|
84
|
|
-
|
74
|
16
|
|
Total
|
466
|
100
|
Selon les résultats de la technique de KATO-KATZ, 392
élèves (soit 84%) sont infectés par S. mansoni.
Tableau VIII b : Fréquence de
la charge ovulaire chez les sujets infectés
|
Charge ovulaire (oeufs)
|
Fréquence
|
Pourcentage
|
|
1-100
|
223
|
56.6
|
|
101-400
|
161
|
40.9
|
|
401et plus
|
10
|
2.5
|
|
Total
|
394
|
100
|
Parmi les sujets infectés, 223(soit 56.6%) ont des
charges ovulaires qui varient entre1et100 oeufs.
La charge ovulaire moyenne est estimée à +/- 129
oeufs par gramme de selles ; avec un minimum à 40 oeufs et un
maximum à 2200 o.p.g de selles.
Tableau IX : Présence
d'autres helminthiases associées à S. mansoni après
examen de selles à frais
|
Helminthiases
|
Fréquence
|
Pourcentage
|
|
Ascaris
|
56
|
37,8
|
|
Anguillule
|
1
|
0,6
|
|
Ankylostome
|
63
|
42,5
|
|
Oxyure
|
1
|
0,6
|
|
Trichocéphale
|
27
|
18,5
|
|
Total
|
148
|
100
|
L'ankylostomiase est l'helminthiase associée à
S. mansoni, avec la plus grande fréquence soit 37,8% de cas.
2.2 Caractéristiques des sujets
infectés par S. mansoni
Notre étude a cherché à mettre en
évidence l'existence de différents facteurs de risque
associés à l'infection à S. mansoni, en essayant de faire
la relation entre l'infestation et les facteurs incriminés.
Les croisements réalisés dans Les tableaux
ci-dessous nous aideront à atteindre cet objectif :
Tableau X : Relation entre
l'infestation à S. mansoni et l'âge
|
Groupe d'âge
|
Infection à S. mansoni
|
Total
|
|
+
|
-
|
|
5 - 9
|
55
80.8%
14.0%
|
13
19.1%
18.1%
|
68
14.6%
|
|
10 - 14
|
153
83.2%
38.8%
|
31
16.8%
43.1%
|
184
39.5%
|
|
15 - 9
|
135
84.9%
34.3%
|
24
15.1%
33.3%
|
159
34.1%
|
|
20 et +
|
51
92.7%
12.9%
|
4
7.3%
5.6%
|
55
11.8%
|
|
Total
|
394
84.5%
|
72
15.5%
|
466
100%
|
De tous les sujets infectés par S. mansoni, la
majorité (38, 8%) est âgée de 10 à 14 ans.
Il n'y a pas de relation entre l'âge et le fait
d'être infecté par S. mansoni (X2=3.81 ;
ddl=3 ; p >0,05).
Cette relation reste statistiquement non-significative
même lorsque l'on croise l'âge avec la charge
ovulaire(X2=8.75 ; ddl=6 ; p=0.188) ; comme nous
l'indique la figure 1 ci-dessous.
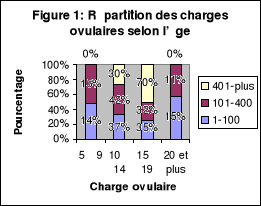
![]()
Cette figure nous indique aussi que les charges ovulaires
importantes de 401 oeufs et plus par gramme de selles se retrouvent chez les
élèves dont l'âge varie entre 10 et 19 ans.
Tableau XI : Relation entre
l'infestation à S. mansoni et le sexe
|
Sexe
|
Infection à S. mansoni
|
Total
|
|
+
|
-
|
|
F
|
180
84.1%
45.7%
|
34
15.9%
47.2%
|
214
45.9%
|
|
M
|
214
84.9%
54.3%
|
38
15.1%
52.8%
|
252
54.1%
|
|
Total
|
394
84.5%
|
72
15.5%
|
466
100%
|
De tous les sujets infectés par S. mansoni, la
majorité soit 214 élèves (54.3%), est du sexe masculin.
Il n'y a pas de relation entre le sexe et le fait d'être
infecté par S. mansoni
[X2=0.058 ; ddl=1 ; p=0.81 ; OR=1.064 (0.64 - 1.76)].
Cette relation reste statistiquement non-significative même en croisant
la variable sexe avec la charge ovulaire (X2=3.3 ; ddl=2 ;
p=0.19).
La figure 2 ci-dessous nous montre que les sujets avec charge
ovulaire plus importante sont aussi du sexe masculin.
| 


