II.2.5.c. Pourcentage fréquence
Le pourcentage fréquence est le pourcentage des
individus d'une espèce étudiée qui consomme un ordre
donné (Whitaker et al., 2009). La formule étant :
PF= f X 100
??
PF= pourcentage fréquence (%)
f= nombre de pelotes fécales d'un individu contenant un
ordre donné F= nombre de pelotes fécales d'un individu
analysés
II.2.5.d. Test de normalité de Shapiro-Wilk
(Dytham, 2011)
Appelé aussi test de Shapiro-Wilk, ce test est une des
étapes à faire pour pouvoir réaliser le choix d'un test
statistique. Il permet de connaitre si la distribution de la fréquence
observée
18
correspond à la distribution de la fréquence
attendue. L'hypothèse nulle H0 est que les données sont
normalement distribuées, si la probabilité p est supérieur
à 0,05, H0 est acceptée, par contre si p est inférieur
à 0,05, H0 est rejetée.
II.2.5.e. Etude de la distribution
géographique
Pour connaitre la proximité biogéographique
entre les localités, l'indice de Jaccard a été
calculé. Tsimembo-Manambolomaty Il permet d'évaluer la
similarité entre les localités en tenant compte des
espèces qu'ils ont en commun et compare les sites deux à deux.
Plus le résultat se rapproche de 1, plus les deux sites sont
similaires.
II.2.5.f. Etude du dimorphisme sexuel (Dytham,
2011)
Le test de Wilcoxon Mann-Whitney est utilisé pour
connaitre s'il y a un dimorphisme sexuel ou non chez une espèce. C'est
un test de comparaison qui est utilisé pour les échantillonnages
non apparié et pour les données qui ne sont pas normalement
distribuées (non paramétrique). L'hypothèse nulle H0
étant que les mâles et les femelles ne présentent pas de
dimorphisme. Si p est inférieure à 0,05, H0 est rejetée et
si la probabilité p est supérieure à 0,05, H0 est
acceptée.
19
III. RESULTATS ET INTERPRETATIONS III.1.
Résultats d'inventaire
III.1.1. Effort de capture
Pendant les 26 jours d'étude, neuf espèces de
chiroptères ont été identifiées dont huit
capturées et une observée. Les pièges utilisés ont
tous aboutit à l'obtention des individus mais le taux de capture varie
selon le type de piège. Les filets japonais ont permis de capturer plus
d'individus avec un effort d'échantillonnage total de 2 556
filet-heure-mètre. Au premier jour de capture, une espèce a
été capturée. Ce nombre a augmenté de quatre
espèces au deuxième jour jusqu'au 4ème jour. Du
5èmeau 8ème jour, au total cinq espèces ont
été identifiées et au 9ème jusqu'au
13èmejour ce nombre a atteint de six espèces. Au
14ème jour, le nombre d'espèce a augmenté de
huit, et à partir du 15ème jour jusqu'au dernier jour
d'étude (26ème jour), neuf espèces ont
été identifiées. Le plateau de saturation a
été atteint, ce qui signifie que la durée de
l'étude est suffisante pour l'inventaire de la faune
chiroptérologique de l'AP (Figure 8). Cependant, étant
donnée l'étendue de la zone et la diversité d'habitats,
d'autres espèces pourraient s'ajouter à cette liste.
|
10 9 8 7 6 5 4 3 2 1 0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nombre cumulé des espèces recensées
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 2 3 4 5 6 7 8 9 1011121314151617181920212223242526 Nombre de
jours
Figure 8. Courbe cumulative des espèces
capturées durant la période d'étude.
III.1.2. Richesse spécifique du
site
Au total 72 individus appartenant à neuf espèces
de chauves-souris ont été identifié dans l'AP Complexe
Tsimembo-Manambolomaty : deuxespèces appartenant au sous-ordre des
20
Yinpterochiroptera (Pteropus rufus et Rousettus
madagascariensis)et sept espèces appartenant au sous-ordre des
Yangochiroptera (Taphozous mauritianus, Myotis goudoti,
Pipistrellus spp., Scotophilus marovaza, Scotophilus
robustus, Mops leucostigma et Chaerephon leucogaster).
Seule Pteropus rufus n'a pas été capturée mais
observée (Tableau 1). Les espèces Taphozous mauritianus
et Mops leucostigma sont les plus abondants du faite que leur
gîte sont nombreuses dans l'AP (abondance de Cocos nucifera) et
que l'AP pourrait posséder les conditions nécessaires pour leur
survie et leur développement comme l'abondance de nourriture et le
climat, tandis que Myotis goudoti, Pipistrellus spp., S.
marovaza et S. robustus sont des espèces
considérées comme rares au sein de l'aire protégée
vue qu'il y a peu de leur gîte qui existe.
Tableau 1. Liste des espèces de
chauves-souris dans l'AP Complexe Tsimembo-Manambolomaty
|
Sous-ordres
|
Familles
|
Genres et espèces
|
Nombre
d'individus
capturés
|
|
YINPTEROCHIROPTERA
|
PTEROPODIDAE
|
Pteropus rufus
|
*
|
|
Rousettus madagascariensis
|
10
|
|
YANGOCHIROPTERA
|
EMBALLONURIDAE
|
Taphozous mauritianus
|
21
|
|
VESPERTILIONIDAE
|
Myotis goudoti
|
1
|
|
Pipistrellus spp.
|
2
|
|
Scotophilus marovaza
|
1
|
|
Scotophilus robustus
|
1
|
|
MOLOSSIDAE
|
Mops leucostigma
|
32
|
|
Chaerephon leucogaster
|
4
|
|
TOTAL
|
|
|
72
|
* : Espèce observée
III.2. Affinité biogéographique
Les localités sont regroupées selon la
présence et l'absence des espèces dans chaque site, plus les
sites présentent des espèces en commun, plus ils sont similaires.
Ici, les localités sont regroupées en deux: le premier groupe est
constitué par deux sous-unités, le PN d'Ankarana se trouvant au
nord-ouest de l'île est la première sous-unité, et la
deuxième sous-
21
unité qui est constituée par la zone d'Anjohibe
au sud-ouest d'une part, et le PN de Namoroka au nord-ouest et le PN de
Bemaraha au centre-ouest d'autre part. Le deuxième groupe est aussi
composé de deux sous-unités qui sont le PN de l'Isalo au
sud-ouest et le PN de Tsimanampetsotsa au centre-ouest pour la première
sous-unité, et pour la deuxième sous-unité, elle
possède encore deux regroupements qui sont le PN de Zombitse Vohibasia
au sud-ouest d'une part, l'AP Tsimembo-Manambolomaty, la concession
forestière de Kirindy CNFEREF au centre-ouest et le PN de Kirindy Mitea
d'autre part au sud-ouest (Figure 9).
Dans le premier groupe, le PN de Namoroka et le PN de Bemaraha
partagent 17 espèces en commun, ces deux derniers sites sont les plus
similaires pour ce groupe, avec une indice de similarité de 0,87 (Annexe
6), et partage 11 espèces avec Ankarana et 12 espèces avec
Anjohibe. Le PN d'Ankarana et le zone d'Anjohibe partagent 12 espèces en
commun
Pour le deuxième groupe, Isalo et Tsimanampetsotsa
hébergent 13 et six espèces dont 99% des espèces
rencontrées à Tsimanampetsotsa se trouvent à Isalo. Dans
ce groupe encore, il y a le PN de Zombitse Vohibasia et l'AP
Tsimembo-Manambolomaty qui partagent trois espèces en commun. D'autre
part, Kirindy CNFEREF et Kirindy Mitea sont assez similaires avec neuf
espèces en commun et une indice de similarité de 0,62 (Annexe 6),
et partage quatre espèces avec Zombitse Vohibasia et
Tsimembo-Manambolomaty .
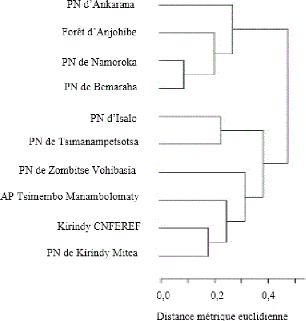
22
Figure 9. Dendrogramme de dissimilarité
de certaines localités de l'ouest.
III.3. Dimorphisme sexuel en relation avec les
paramètres morphométriques
Le dimorphisme sexuel est ici basé sur les
données morphométriques obtenues après les diverses
mensurations (Annexe 4). Les espèces capturées possédant
à la fois des individus mâles et femelles capturées ont
été prises en compte, dont Mops leucostigma,
Chaerephon leucogaster, Taphozous mauritianus et
Rousettus madagascariensis.
Chaerephon leucogaster et Rousettus
madagascariensis ne présente pas de dimorphisme sexuel au niveau
des paramètres morphometriques (p>0,05).
Mops leucostigma présente un dimorphisme
notable au niveau de la longueur de l'avant-bras (Mann-Whitney : W= 28,5,
p=0,017). Les mâles étant plus grands que les femelles.
23
Taphozous mauritianus présente un dimorphisme
au niveau de l'avant-bras (Mann-Whitney : W=60, p=0,020) et du poids
(Mann-Whitney : W=60,5, p=0,019). Les femelles étant plus grandes que
les mâles.
III.4. Reproduction
Les études sur la reproduction ont été
faites sur les individus possédant des caractères sexuels
secondaires (Annexe 5). Chez les femelles de Chaerephon leucogaster,
un individu femelle était en période de gestation, la
présence d'un embryon a été identifiée. Pour
Mops leucostigma, un individu femelle aussi était en phase de
gestation, celle-ci a été confirmée par la présence
d'un embryon. Pour les mâles, il y en a un en phase de reproduction. Les
testicules étaient en position scrotale et l'épididyme
était contourné. Ces espèces étaient donc en phase
de reproduction pendant la saison sèche (septembre-octobre), tandis que
les individus de Taphozous mauritianus et de Rousettus
madagascariensis n'ont montré aucun signe de reproduction.
III.5. Régime alimentaire des chiroptères
du site
III.5.1. Variation des proies entre les
sites
Quatre ordres d'arthropodes ont été
identifiés dans les sites d'étude, avec un total de 130
individus, y compris l'ordre des Diptères (96,15%), des
Homoptères (1,54%), des Coléoptères (1,54%) et des
Hyménoptères (0,77%) (Tableau 2).
Tableau 2.Répartition des arthropodes
dans deux sites de capture (Ankivahivahy 1 et 2)
|
Taxon
|
Localités
|
Total
|
|
Ankivahivahy 1
|
Ankivahivahy 2
|
|
HYMENOPTERES
|
1
|
0
|
1
|
|
DIPTERES
|
71
|
54
|
125
|
|
COLEOPTERES
|
1
|
1
|
2
|
|
HOMOPTERES
|
0
|
2
|
2
|
|
TOTAL
|
73
|
57
|
130
|
III.5.2. Pourcentage volume et pourcentage
fréquence
Les résultats ont montré que dans 46 pelotes
fécales provenant de cinq espèces de chiroptères
(Myotis goudoti, Pipistrellus. spp, Scotophilus
marovaza, S. robustus, Taphozous mauritianus),
10 taxa d'arthropodes sont répertoriées, mais la proportion et la
présence de ces derniers varient pour chaque espèce. L'ordre des
Coléoptères sont toujours présent dans les pelotes
fécales lors des analyses (Annexe 5).
24
III.5.2.a. Taphozous mauritianus (n=
3)
Pendant l'analyse fécale, quatre ordres d'arthropodes
ont été identifiés dans les pelotes fécales des
individus analysés : 68% pour les Lépidoptères, 5% pour
les Hémiptères, 25,2% pour les Coléoptères et 1,7%
pour les Diptères dont 100% des individus consomment les
Lépidoptères, 27,8% mangent les Hémiptères, 72,2%
se nourrissent des Coléoptères et 16,7% des Diptères
(Figure 10).
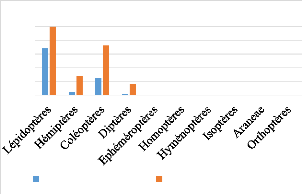
(%)
100
40
20
60
80
0
Pourcentage volume Pourcentage fréquence
Ordres
Figure 10. Pourcentage volume et pourcentage
fréquence par ordres d'arthropodes
consommés par Taphozous mauritianus.
III.5.2.b. Scotophilus marovaza (n=
1)
Les analyses montrent que Scotophilus marovaza
consomme trois ordres d'arthropodes : 88,3% pour les
Coléoptères, 1,7% pour les Ephéméroptères et
10% pour les Homoptères. Le pourcentage fréquence permet de dire
que 100% des individus consomment les Coléoptères, 16,7% des
Ephéméroptères et 66,7% des Homoptères (Figure
11).
(%)
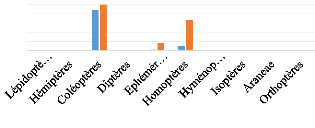
100
80
60
40
20
0
Ordres
Pourcentage volume Pourcentage fréquence
25
Figure 11. Pourcentage volume et pourcentage
fréquence par ordres d'arthropodes
consommés par Scotophilus marovaza.
III.5.2.c. Scotophilus robustus (n=
1)
Le résultat des analyses montrent que Scotophilus
robustus mangent 3 ordres d'Insectes : 99% pour les
Coléoptères dont 100% des individus les consomment, 0,5% chacun
pour les Diptères et les Hyménoptères dont 10% des
individus se nourrissent des Diptères et 10% des
Hyménoptères (Figure 12).
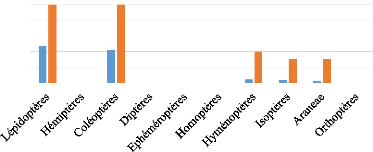
III.5.2.d. Myotis goudoti (n= 1)
Au total, cinq ordres d'arthropodes ont été
identifiés dans les pelotes fécales de Myotis goudoti
dont 47,5% pour les Lépidoptères, 41,5% pour les
Coléoptères, 4,5% pour les Homoptères, 4% pour les
Isoptères et 2,5% pour les Araneae, avec 100% des individus qui mangent
des Lépidoptères, 100% des Coléoptères, 40% des
Hyménoptères, 30% des Isoptères et 30% des Araneae (Figure
13).
(%)
100
80
60
40
20
0
Pourcentage volume Pourcentage fréquence

Ordres
26
Figure 12. Pourcentage volume et pourcentage
fréquence par ordres d'arthropodes consommés par Scotophilus
robustus.
(%)
100
40
20
60
80
0
Ordres
Pourcentage volume Pourcentage fréquence
Figure 13. Pourcentage volume et pourcentage
fréquence par ordres d'arthropodes consommés par Myotis
goudoti.
27
III.5.2.e. Pipistrellus spp. (n = 2)
Au total, 6 ordres d'arthropodes ont été
identifiés dans les pelotes fécales de Pipistrellus spp.
dont 11% de Lépidoptères, 4,67% d'Hémiptères, 54%
de Coléoptères, 2% d'Homoptères, 20,7%
d'Hyménoptères et 7% d'Araneae (Figure 14).
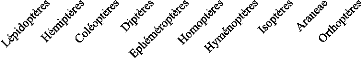
Ordres
Pourcentage volume Pourcentage fréquence
Figure 14. Pourcentage volume et pourcentage
fréquence par ordres d'arthropodes
consommés par Pipistrellus spp.
III.5.3. Variabilité des proies en fonction de
la longueur de l'avant-bras
Dans cette étude, la consommation des proies en
relation avec la longueur de l'avant-bras est aussi prise en compte (Annexe 8)
pour l'étude du régime alimentaire. La longueur de l'avant-bras
varie en fonction de la taille de l'individu, plus l'avant-bras est longue,
plus l'individu est de grande taille, et inversement.
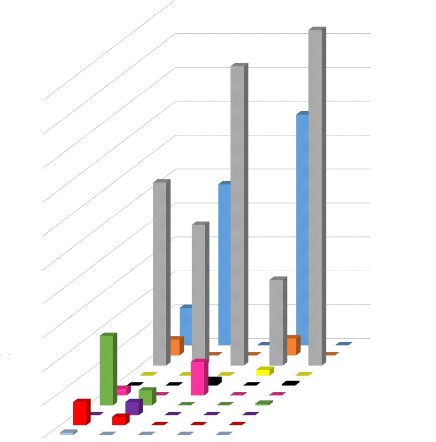
En se basant sur la longueur de l'avant-bras, les
Coléoptères sont les proies les plus consommées car les
individus de tout type de taille se nourrissent de cette proie. Suivi des
Lépidoptères qui sont consommées par les individus de
grandes tailles et de petites tailles. Tandis que les Diptères, les
Homoptères, les Isoptères et les Orthoptères sont les
moins consommés (Figure 15). Ces dernières sont donc des proies
mineures et seuls les Coléoptères et Lépidoptères
constituent les proies majeures des chiroptères. De plus, les individus
de petite taille consomment divers types de proies mais de faible
quantité pour chaque type consommé, tandis que les individus de
grande taille ne consomment que quelques types de proies mais de
28
quantité élevé. Cette variation de
consommation, de proies est dû à la taille de l'individu (car la
grandeur du corps nécessite une plus grande quantité de
nourriture à consommer), par la préférence et par la
disponibilité des proies.
Pourcentage volume des proies (%J
100
40
90
70
20
60
50
30
80
10
0
Orthoptères
Lépidoptères Hémiptères
Coléoptères Diptères
Ephéméroptères Homoptères
Hyménoptères Isoptères
Araneae
30,5 39 43 60,9 63
Longueur de l'avant-bras (mm)
Figure 15. Variation du régime
alimentaire en fonction de la taille
29
IV. DISCUSSION
IV.1. Richesse spécifique
Neuf espèces de chauves-souris ont été
identifiées dans l'AP Complexe Tsimembo-Manambolomaty. La
diversité y est moyenne par rapport aux autres localités de
l'ouest, car certaines en possède des dizaines d'espèces, comme
le cas du PN de Namoroka par exemple qui contient 19 espèces de
chauves-souris, mais la richesse spécifique du PN de Tsimanampetsotsa
est encore faible en comparant à celle de Tsimembo-Manambolomaty avec
six espèces seulement. Cette moyenne diversité en
chiroptère est dû au fait que cette AP ne présente pas des
grottes vue que la plupart des espèces sont cavernicoles, et qu'elle
possède une forêt sèche sur formation sableuse et aussi que
ce site est abrité par plusieurs espèces d'oiseaux dont la
plupart consomment des chauves-souris comme nourriture (Goodman et al.,
2015c).Alors que certaines localités (cas du premier groupe)
possèdent des formations karstiques offrant ainsi des gîtes
propices pour de nombreuses espèces de chauves-souris.
IV.2. Variabilité des habitats
Tsimembo-Manambolomaty Deux espèces de chauves-souris
frugivores ont été recensées lors de cette étude.
Vue que Pteropus rufus ont comme gîtes les arbres (Jenkins
et al., 2007 ; Rahaingodrahety et al., 2008 ; Johnson et
al., 2010), 12 individus de Pteropus rufus ont été
observés dans les branches de deux pieds de Cocos nucifera
situé en plein village. Concernant Rousettus
madagascariensis, elle se repose dans des caves, dans des crevasses
(Goodman et al., 2010), mais leurs gîtes n'étaient pas
identifiés durant cette étude.
Pour les espèces animalivores, sept espèces ont
été inventoriées :
Durant les études antérieures, Taphozous
mauritianus a été rencontrée dans des arbres, sur des
fissures de rochers et sur des murs de bâtiments (Kofoky et al.,
2007 ; Goodman & Ramasindrazana, 2013). Dans cette AP, deux individus de
cette espèce ont été vues sur le tronc d'un Cocos
nucifera durant le jour où elle change de pied à un autre
lorsqu'elle est dérangée, mais des dizaines d'individus ont
été capturé pendant l'heure de piégeage.
A propos des Vespertilionidae : Scotophilus marovaza
se gîte dans les toits de maison fabriqué en palmiers
(Ratrimomanarivo, 2005) mais leur dortoir n'était pas identifié
lors de cette inventaire, elles ont été capturé dans des
forêts de Musa sinensis. De même pour
30
Scotophilus robustus qui a été aussi
capturé dans des forêts de Musa sinensis, Myotis
goudoti capturés en plein forêts et Pipistrellus
spp. piégés dans des forêts
dégradées, leurs dortoirs n'étaient pas
identifiés. Selon Ratrimomanarivo (2005), Scotophilus robustus
est une espèce synanthropique vivant dans les toits des
bâtiments. Pour le cas de Myotis goudoti, elle se gîte sur
des rochers (Jenkins et al., 2007), et pour Pipistrellus spp.
certaines espèces comme Pipistrellus raceyi est une
espèce synanthropique qui a comme gîte les toits des
bâtiments (Rasoanoro et al., 2015).
Concernant les Molossidae, Mops leucostigma abrite
les toits des bâtiments et dans les Cocos nucifera, même
que celle rencontrées dans le PN de Mantadia et dans la Réserve
Spéciale (RS) d'Analamazotra par Randrianandrianina et ses
collaborateurs (2006), mais cette espèce peut vivre dans le tronc
d'Andansonia madagascariensis avec Miniopterus manavi, dans
Cocos nucifera (Andriafidison et al., 2006) et dans un
Commiphora (Burseraceae) avec Mops midas (Rakotondramanana &
Goodman, 2011). Cette espèce vit aussi en sympatrie avec Mormopterus
jugularis, Chaerephon pumilus et Chaerephon leucogaster
(Andrianaivoarivelo et al., 2006). L'espèce Chaerephon
leucogaster utilise les bâtiments comme gîtes.
IV.3. Dimorphisme sexuel
Dans cette étude, la longueur de l'avant-bras des
individus de Mops leucostigma permet de différencier les
mâles des femelles de cette espèce à part le sexe.
Ramasindrazana (2008) affirme la présence de dimorphisme pour tous les
paramètres mesurés sauf pour l'avant-bras, tandis que
(Rakotonandrasana, 2008) montre une différence entre les deux sexes pour
tous les caractères mesurés. Cette absence au niveau des
résultats peut-être dû au fait que les individus proviennent
des populations différentes ou à une grande différence
entre les nombres des mâles et des femelles capturées.
L'espèce Taphozous mauritianus présente
un dimorphisme sexuel au niveau de la longueur de l'avant-bras et du poids. Par
contre, la recherche faite par Dengis (1996) montre que cette
espèce ne présente aucun dimorphisme sexuel et que la taille des
individus varie d'un pays à un autre. A part les caractères
morphométriques, la présence de sac gulaire permet de distinguer
les mâles des femelles. Cette différence est due à la
variation du milieu et à la différence entre le nombre des
individus mâles (quatre individus) et femelles (17 individus).
IV.4. 31
Reproduction
Un individu de Mops leucostigma et unindividu de
Chaerephon leucogaster étaient en période de gestation
lors de l'étude, et un individu mâle de Mops leucostigma
possédait un épididyme contourné. C'est-à-dire
que pendant la saison sèche (septembre-octobre), ces espèces sont
en pleine période de reproduction. Pourtant la recherche faite par
(Rasoanoro, 2014) affirme que Mops leucostigma est en période
de gestation pendant la saison des pluies (janvier-février).Mops
leucostigma pourrait alors se reproduire à n'importe quelle
saison.
Parmi les individus de Taphozous mauritianus
étudiés, aucun d'entre eux n'a montré un signe de
reproduction. Mais d'autres recherches montrent que la période de
reproduction varie selon les pays. A titre d'exemple, au Zambie et au
Zaïre du sud-ouest, la naissance se passe au mois de février,
tandis qu'au Tanzanie, au Kenya et au nord du Zaïre, la mise bas se passe
au mois d'avril et mai et au Zanzibar, le mois d'octobre et novembre (Anciaux
de Faveaux, 1983).
Pendant la descente sur terrain, aucun signe de reproduction
n'a été observé chez les individus de Rousettus
madagascariensis capturés, la saison sèche serait une
période qui n'est pas favorable pour la procréation de cette
espèce. De plus, le résultat de (Andrianaivoarivelo, 2012) montre
que les femelles allaitantes sont nombreuses en saison de pluie, mais
néanmoins il y a quelques individus allaitants pendant les autres
saisons.
IV.5. Régime alimentaire
Les analyses montrent que les espèces dont les pelotes
fécales qui ont été étudiées consomment tous
des Coléoptères mais avec une proportion variée.
Pour Taphozous mauritianus, les individus sont
capturées juste durant leur sortie dans leur gite, c'est-à-dire
avant la chasse, ce qui explique le faible nombre des pelotes
collectées, et probablement que ces dernières sont les restes du
repas de la dernière chasse. Le résultat de l'analyse a
montré que la majorité des fèces est composé de
Coléoptères. Par rapport aux autres espèces de même
genre comme Taphozous melanopogon, une espèce existant en Inde,
en Thaïlande et en Chine d'une part, et Taphozous longimanus qui
se trouve en Thaïlande d'autre part, la consommation des
Lépidoptères, des Hémiptères et des
Coléoptères est un point commun chez eux mais avec des
quantités différentes (Srinivasulu & Srinivasulu, 2005 ; Wei
et al., 2008 ; Weterings et al., 2015). En comparant avec
Taphozous melanopogon, Taphozous mauritianus ne consomme que
peu d'ordres, vu que cette espèce de l'Inde mange
32
11 ordres d'Arthropodes et que le Taphien collecté
à Madagascar ne mange que quatre ordres. Cette différence est due
à la différence au niveau de l'espèce et du milieu.
Dans cette recherche, l'analyse fécale montre que
Scotophilus robustus consomme plus les Coléoptères,
résultat qui est à peu près le même que celui obtenu
par Rasoanoro et ses collaborateurs (2015) à Kianjavato. La
différence avec cette étude réside dans le fait que
Scotophilus robustus ne mange que des Coléoptères, des
Diptères et des Hyménoptères alors que celle de la
population de Kianjavato, en plus de ces taxa l'espèce mange en plus des
Araneae, des Lépidoptères et des Orthoptères. La
différence au niveau du régime alimentaire est Ce qui est due
à la variation saisonnière, à la variation de l'habitat et
aux conditions du milieu (température, types de forêts).
Rakotondramanana et ses collaborateurs (2015) ont aussi fait des études
sur le régime alimentaire de cette espèce à Kirindy
CNFEREF. Et même si Tsimembo-Manambolomaty, se trouve aussi dans la
région de Menabe, les résultats sont très
différents car la recherche menée à Kirindy montre que
Scotophilus robustus a une préférence pour les
Lépidoptères et en plus consomment des Blattes et des
Homoptères mais ne mange pas de Diptères. Cette différence
est due à la variation saisonnière, car la présente
étude a été faite pendant la saison sèche alors que
l'étude antérieure a été faite pendant la saison
humide, alors que les arthropodes sont abondants pendant la saison humide.
Les pelotes fécales de Myotis goudoti
contenaient, avec une proportion qui est à peu près la
même pour les Lépidoptères et les
Coléoptères. Par contre, le résultat d'analyse
menée par Rakotoarivelo et ses collaborateurs (2007) dans le PN de
Bemaraha montre une préférence pour les Coléoptères
et où M. goudoti ne mange pas de Lépidoptères et
d'Isoptères (comme le cas de cette étude). Seuls les
Coléoptères et les Hyménoptères sont les proies en
commun qui sont à la fois identifiés dans les pelotes
fécales des individus provenant du PN de Bemaraha et de la forêt
de Tsimembo-Manambolomaty. Ceci est dû à la variation de
l'habitat. L'étude faite par Rakotondramanana et ses collaborateurs
(2015) à Kirindy montre une proportion élevée pour les
Lépidoptères, suivi de Coléoptères et une faible
consommation pour les Hyménoptères ; résultat causé
par la variation saisonnière. Celle réalisée par Rasoanoro
et ses collaborateurs (2015) à Kianjavato montre que M. goudoti
consomme les mêmes proies que celle des individus de
Tsimembo-Manambolomatymais de quantité différentes. Cela est
probablement causé par la variation saisonnière.
33
Pour Pipistrellus spp., le résultat
de l'analyse fécale montre une grande proportion pour les
Coléoptères. En comparant cette étude avec celle de
Ramasindrazana (2008), les individus capturés lors de la présente
étude semblent exploiter une grande variété de proies mais
ne consomme pas de Dictyoptères. Ceci s'explique par l'absence de cet
ordre dans l'environnement, car durant l'inventaire il n'y avait pas de
Dictyoptères capturées. Comparé à celui de
Rasoanoro et ses collaborateurs (2015), le résultat est à peu
près la même mais la quantité identifiée les
différencie. Cette différence est due à la disposition et
à la quantité des proies dans la nature.
34
| 


