Introduction
· Synthèse bibliographique qui met en exergue
quelques notions sur les moustiques et la jacinthe d'eau.
· Matériel et méthodes qui retracent les
milieux d'étude et la méthodologie adoptée.
· Résultats et discussion où les
résultats obtenus sont présentés et commentés. Une
conclusion assortie de quelques suggestions vient finaliser notre
étude.

La recherche documentaire est une étape
préliminaire à tous travaux de recherche. Ainsi pour notre
étude, nous avons été amenés à parcourir des
bibliothèques, des centres de documentation et des centres de recherche.
Nous avons trouvé judicieux d'orienter nos premières recherches
sur la jacinthe d'eau. Ce qui nous a conduit, vers la bibliothèque de la
Faculté des Sciences et
Techniques (FAST) section hydrobiologie et à visiter
les sites web sur internet avec des moteurs de recherche comme
www.google.fr,
www.yahoo.fr, etc.
A cet effet, plusieurs documents (rapports, articles, livres,
mémoires) ont été exploités. Parallèlement
à ces recherches documentaires, le Centre de
Recherche Entomologique de
Cotonou (CREC) et le Centre de
Documentation du Ministère de la
Santé (CDMS) ont été explorés pour
avoir des informations relatives aux moustiques d'une part et au paludisme
d'autre part. Des mémoires du département de
Génie de l'Environnement (Gen) ont
également été lus et synthétisés.
A l'issue de cette recherche bibliographique, nous avons pu
faire le point de la majorité des travaux dans le domaine d'étude
et recueillir des informations susceptibles d'éclairer le sujet de
recherche et d'en dégager les pistes d'investigations.
1.1 MOUSTIQUES
Ici sont présentés la systématique, la
morphologie externe et le cycle de développement du moustique, puis la
différence entre mâle et femelle, les caractères
distinctifs des genres Anophelinae et Culicinae.
1.1.1 SYSTEMATIQUE
Les moustiques sont des arthropodes appartenant à la
classe des insectes dans le règne animal. Ils forment le sous-ordre des
Nématocères dans l'ordre des Diptères. Avec les
pièces buccales de type piqueur suceur, les moustiques appartiennent
à la famille des Culicidae.
Généralement la famille des Culicidae est
divisée en trois sous-familles: Toxororhynchitinae, Anophelinae
et Culicinae. Cette division se base sur différents
critères morphologiques visibles tant au niveau des oeufs que des stades
larvaire et imaginal (RODHAIN et PEREZ, 1985).
Les moustiques forment une grande famille homogène et
spécifiquement très diversifiée
comprenant 2.800
à 3.000 espèces, réparties dans le monde entier (RODHAIN
et PEREZ, 1985).
Parmi ces espèces, certaines sont vectrices de la
fièvre jaune et de la dengue (Aedes aegypti), de la filariose
lymphatique (Culex) et du paludisme (GUILLAUMOT, 2006).
Le paludisme est une maladie parasitaire qui se transmet par
la femelle d'une espèce de Anopheles meigen : Anopheles
gambiae. En Afrique, Anopheles gambiae a donné naissance
à six espèces différentes (AGOSSOU et al.,
2006):
O Anopheles gambiae s.s., Gilles, 1902;
O Anopheles arabiensis, Palton, 1905;
O Anopheles quadriannulatus, Théobald, 1911;
O Anopheles bwanbae, White, 1985;
O Anopheles melas, Théobald, 1903;
O Anopheles merus, Doenitz, 1902;
Le tableau 1.1 expose de façon synthétique la
classification des moustiques.
Tableau 1.1 : Systématique des
moustiques
Sous-familles des
Culicidae
|
Genres
|
Sous-genres
|
Toxorhynchitinae
|
Toxorhynchites
|
Toxorhynchites s.s.,
Ankylorhynchus, Lynchiella
|
Anophelinae
|
Bironella
(9 espèces malésiennes)
Chagasia
(4espèces n éotrop ica
les)
Anopheles
(près de 400 espèces)
|
Six sous-genres de Anopheles:
Lophopodomyia,
Nyssorhynchus,
Cellia Stethomyia, Kertzia,
Anopheles.
|
Culicinae
|
Une trentaine de genres dont les
plus connus sont :
Aedes, Mansonia,
Culex, Tripteroides, Trichoprosopon,
Ficalbia,
Psorophora
|
|
|
1.1.2 MORPHOLOGIE EXTERNE D'UN MOUSTIQUE
Les moustiques sont de petits insectes (taille de 5
à 20 mm) à ailes longues et fines. Ils
diffèrent des autres diptères comme les mouches par, la
présence de petites écailles sur la plupart des nervures et des
ailes. Leur corps est ténu et élancé, leurs pattes ont une
coloration variant de brun pâle à noir, parfois marquées de
taches et de bandes (WIKIPEDIA, 2008).
Le moustique adulte a le corps divisé en trois parties
distinctes: la tête, le thorax et l'abdomen avec chacune, ses
éléments constitutifs (Figure 1.1).
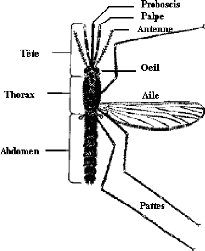
Figure 1.1: Principales parties d'un moustique
adulte Source: OMS, 2003
Comme tout insecte à métamorphose complète
(holométabole), le développement du moustique se
caractérise par deux phases distinctes (RODHAIN et PEREZ, 1985) :
- la phase aquatique regroupant: l'oeuf, les quatre stades
larvaires et la nymphe; - la phase aérienne qui concerne l'adulte
ailé ou imago.
1.1.3 CYCLE DE DEVELOPPEMENT DU MOUSTIQUE
Le cycle de développement des moustiques dure environ
douze (12) à vingt (20) jours (ADISSO et ALIA, 2005) et comprend quatre
(4) stades: l'oeuf, la larve, la nymphe (pupe) et l'adulte. Cette
métamorphose se déroule en deux (2) phases à savoir:
1.1.3.1 PHASE AERIENNE
Les sujets des deux (2) sexes s'accouplent en vol ou dans la
végétation et ont une distance de vol de un (1) à deux (2)
km. Grâce aux longs poils dressés sur leurs antennes, les
mâles peuvent percevoir le bourdonnement produit par le battement rapide
des ailes des femelles, qui s'approchent des essaims lors du vol nuptial. A ce
moment, le mâle féconde la femelle en lui laissant un stock de sa
semence. La femelle dotée d'un caractère particulier, celui du
maintien en vie jusqu'à la mort des
spermatozoïdes, conserve la semence du mâle dans une ampoule
globulaire ou vésicule d'entreposage (spermathèque). Elle ne
s'accouple donc qu'une seule fois (DARRIET, 1998).
Les adultes mâles et femelles se nourrissent de jus
sucrés, de nectars et d'autres secrétions
végétales. Pourtant, une fois fécondées, les
femelles partent en quête d'un repas sanguin duquel, elles retirent les
protéines et leurs acides aminés, nécessaires pour la
maturation des oeufs. Ce repas sanguin prélevé sur un
vertébré (mammifère, amphibien, oiseau), est ensuite
digéré dans un endroit abrité (GUILLAUMOT, 2006).
Dès que la femelle est gravide, elle se met en
quête d'un gîte de ponte adéquat pour le
développement de ses larves. La ponte a lieu généralement
au crépuscule. Le gîte larvaire est une eau stagnante ou à
faible courant, douce ou salée (AYITCHEDJI, 1990). Selon IROKO (1994),
le sang, l'eau et une température d'au moins 18 °C sont les trois
conditions nécessaires, pour la reproduction et le développement
de certains moustiques d'Afrique noire.
Le cycle de développement du moustique est
schématiquement représenté par la figure 1.2.
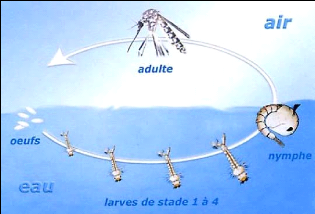
Figure 1.2 : Cycle biologique du moustique
Source:
http://pagesperso-
orange.fr/SVT.ocean-Indien/cyclemoustique/cycle_moustique.htm
(DELACROIX), consulté le 20.06.2008
1.1.3.2 PHASE AQUATIQUE
Quelques jours après la fécondation, suivant
les espèces, les oeufs de diverses formes (fusiformes, allongés,
renflés dans leur milieu et parfois munis de minuscules flotteurs
latéraux) sont pondus par la femelle dans différents milieux. La
ponte est souvent de l'ordre de 100 à 400 oeufs et le stade ovulaire
dure deux (2) à trois (3) jours dans les conditions de:
température du milieu, pH de l'eau, nature et abondance de la
végétation aquatique de même que la faune associée.
La taille d'un oeuf est d'environ 0,5 mm (RODHAIN et PEREZ, 1985).
A maturité, les oeufs s'éclosent et donnent des
larves de stade 1 (1 à 2 mm) qui, jusqu'au stade 4 (1,5 cm) se
nourrissent de matières organiques, de microorganismes et même des
proies vivantes (pour les espèces carnassières). Malgré
leur évolution aquatique, les larves de moustiques ont une respiration
aérienne qui se fait à l'aide de stigmates respiratoires ou d'un
siphon. La larve stade 4 est bien visible à l'oeil nu par sa taille.
Elle a une tête, qui porte latéralement les taches oculaires et
les deux antennes. Viennent ensuite le thorax et l'abdomen.
Au bout de six (6) à dix (10) jours et plus, selon la
température de l'eau et la disponibilité en nourriture, la
quatrième mue donne naissance à une nymphe: c'est la nymphose
(GUILLAUMOT, 2006). Généralement sous forme de virgule ou d'un
point d'interrogation, la nymphe, mobile, ne se nourrit pas durant tout le
stade nymphal (phase de métamorphose) qui dure un (1) à cinq (5)
jours. Elle remonte de temps à autre à la surface de l'eau pour
respirer et plonge vers le fond, dès qu'elle est dérangée.
A la fin de ce stade, la nymphe s'étire, son tégument se fend
dorsalement et, très lentement, le moustique adulte (imago) s'extirpe de
l'exuvie : c'est l'émergence, qui dure environ quinze (15) minutes au
cours desquelles l'insecte se trouve exposé sans défense face
à de nombreux prédateurs de surface (RODHAIN et PEREZ, 1985).
1.1.4 DIFFERENCE ENTRE MALE ET FEMELLE
La femelle du moustique est généralement plus
grosse que le mâle avec des antennes discrètes et ornées
d'un petit nombre de soies. Celles du mâle sont plumeuses, touffues et
munies de soies longues. Les moustiques mâles pour la plupart du temps se
déplacent moins du gîte larvaire, à l'opposé des
femelles hématophages qui sont très mobiles vers les habitations
(OMS, 2003).
1.1.5 CARACTERES DISTINCTIFS DES GENRES ANOPHELINAE ET
CULICINAE
Les moustiques sont morphologiquement différents les
uns des autres. Il existe des différences entre les deux sous-familles
Anophelinae et Culicinae, qui portent sur les oeufs, les
larves, les nymphes, les palpes maxillaires, les antennes et la position au
repos (Figure 1.3). Ainsi, selon l'OMS (2003):
- Les oeufs de Anophelinae portent des flotteurs
latéraux et flottent dans le gîte séparément. Ceux
de Culicinae sont pondus isolément (Aedes) ou en
radeaux (Culex).
- Les larves de Anophelinae respirent par des
spiracles dorsaux, ce qui leur impose la position parallèle à la
surface de l'eau, tandis que celles de Culicinae respirent par le
siphon et ont de ce fait, une position oblique à la surface de l'eau.
- Les nymphes de Anophelinae en forme de virgule sont
nettement plus petites que celles de Culicinae.
- Les palpes maxillaires de Anophelinae femelles
sont aussi longs que la trompe, alors que ceux de Culicinae sont
très réduits. Les mâles de Anophelinae ont des
palpes massés à l'extrémité, tandis que ceux de
Culicinae sont effilés.
- Les antennes des deux mâles sont plumeuses mais
celles de Anophelinae sont majestueuses et moins longues que les
palpes. Celles de Culicinae s'incurvent en rejoignant les palpes. Les
femelles de Anophelinae ont des antennes plus discrètes que
celles de Culicinae.
- Les ailes de Anopheles ont des taches
caractéristiques brun foncé sur les bords antérieurs.
Celles du genre Culex sont gris brun sans aucune tache sur les ailes.
Le genre Aedes est facilement reconnaissable par son corps très
foncé avec des taches blanches.
- Les femelles de Anopheles adoptent la position
oblique à leur support au repos. Mais celles du genre Culex se
tiennent parallèlement au support.
La figure 1.3 présente les différences entre ces
deux genres.
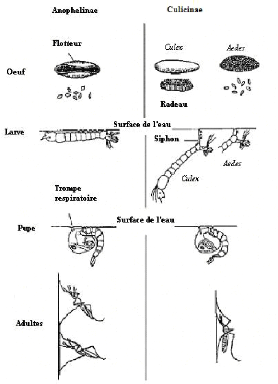
Figure 1.3: Différences entre
Anopheles et Culex Source: OMS, 2003
1.2 JACINTHE D'EAU : EICHHORNIA CRASSIPES
1.2.1 SYSTEMATIQUE
En 2005, Qaiser et al., présentent la
systématique de la jacinthe d'eau comme suit:
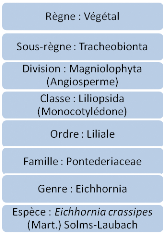
1.2.2 HISTORIQUE
Selon BARRET et al., (1982, cités par DAGNO
et al., 2007), la jacinthe d'eau serait originaire du bassin
amazonien. Mais très tôt, elle a été introduite en
Asie et en Afrique pour ses vertus ornementales. Ses larges feuilles d'un vert
luisant, ses fleurs violettes ont certainement été des indices de
choix dans les jardins d'eau et pour les fleuristes. Elle prolifère dans
les plans d'eau douce, sur les terres humides en Amérique, en Afrique et
en Asie (HOLM et al., 1991, cités par AYIHONSI, 2006).
La présence de la jacinthe d'eau sur les plans d'eau
béninois a été notée pour la première fois
en 1977 (TOSSOU, 2004). Une étude faite par LEITE et al.,
(2004) sur les stratégies de gestion durable des Ecosystèmes
Aquatiques en Afrique (le cas du complexe lac Nokoué-lagune de
Porto-Novo au Bénin) apporte un éclaircissement
intéressant sur l'apparition de la jacinthe d'eau au Bénin. Selon
eux, « les parties fertiles de la plante auraient été
jetées dans les ordures et comme celles-ci servent le plus souvent
à colmater les bas-fonds, la plante s'était retrouvée dans
un milieu favorable à sa germination et à son
développement. Elle aurait alors envahi les cours d'eau à la
faveur des eaux de ruissellement».
1.2.3 DISPERSION DE LA JACINTHE D'EAU EN AFRIQUE ET AU BENIN
La jacinthe d'eau est un adventice, introduite en Afrique
pour son aspect esthétique. Son extension a commencé au
Bénin depuis le nord du lac Nokoué (la rivière Sô,
le fleuve Ouémé, le lac Azili, le lac Célé),
(ANONYME, 2006). Cependant AKOEGNINOU et AGBANI (1998), rapportent qu'on
retrouve cette plante depuis le sud jusqu'au nord, sauf dans la lagune
côtière, le lac Ahémé et les basses vallées
des fleuves Mono et Sazué, dans la partie sud-ouest du territoire.
1.2.4 DESCRIPTION DE LA PLANTE
Du point de vue morphologique, la jacinthe d'eau peut avoir
une variabilité considérable dans la forme, la couleur de ses
feuilles et de ses fleurs, et selon l'âge de la plante (DAGNO et al.,
2007). Elle a une taille variant de quelques centimètres à
plus d'un mètre de haut (TOSSOU, 2004). Les feuilles d'un vert luisant
forment la base de la fleur et s'attachent à des pétioles
gonflés d'air. Sous cette architecture, se trouve le système
racinaire, qui permet à la plante de capter les nutriments
nécessaires à sa croissance dans l'eau. Mais le plus attrayant
des éléments constitutifs de cette herbacée est sa fleur,
qui attire par sa couleur mauve tirant sur le lilas. Un des pétales
porte habituellement une tache jaune d'or, encadrée par une ligne bleue
(DAGNO et al., 2007). Le pétiole (5 cm de diamètre et 30
à 50 cm de longueur) a une forme bulbeuse dans les conditions ouvertes,
effilée dans les conditions de forte densité de la plante. Ces
deux formes végétatives sont des adaptations morphologiques. Pour
bénéficier au maximum de la lumière solaire, les plants de
la jacinthe d'eau sont obligés de changer de formes (TOSSOU, 2004).
1.2.5 ECOLOGIE DE LA PLANTE
La jacinthe d'eau est décrite par plusieurs auteurs
comme étant la peste verte. Elle est dotée d'un pouvoir
phénoménal de reproduction. En combinant deux mécanismes
de reproduction (sexué et asexué) très efficaces, elle
colonise et peuple une grande diversité d'écosystèmes
aquatiques. Ainsi, la jacinthe d'eau s'installe dans les fleuves, lacs,
lagunes, étangs, marécages et bas-fonds.
Elle se reproduit de deux manières dont une
principale, la multiplication végétative, qui permet sa
prolifération sur une grande superficie du cours d'eau. La seconde
multiplication dite sexuée assure la pérennité de
l'espèce.
1.2.5.1 MULTIPLICATION ASEXUEE OU VEGETATIVE
Elle se fait par clonage à partir des rhizomes. Les
nouvelles plantes sont produites à partir de l'élongation de
stolons due à la division des méristèmes axillaires de la
plante mère (CENTER et al., 2005, cités par DAGNO et
al., 2007). Les clones très fragiles restent fixés à
la plante mère par le stolon, puis se détachent sous la pression
des courants d'eau, permettant à de nouveaux individus de coloniser
d'autres zones (WILSON et al., 2005). D'après certaines
études, deux (2) plants de jacinthe peuvent par clonage, produire 1.200
plants en quatre (4) mois (ANONYME, 2006). BABU et al., (2003)
prouvent aussi que, dix (10) plants en huit (8) mois peuvent produire 655.330
individus, soulignant ainsi le potentiel invasif de la plante. Certains auteurs
ont démontré que la durée de clonage de la jacinthe est
d'environ six (6) à dix-huit (18) jours et dépend des conditions
climatiques, chimiques et de la disponibilité en nutriments de l'eau. A
une température optimale de 18 °C, la jacinthe d'eau double son
poids et sa productivité est de 200 tonnes de masse
sèche/hectare/année (ANONYME, 2006).
1.2.5.2 MULTIPLICATION SEXUEE
La reproduction sexuée conduit à la formation
des graines dont la longévité est de 15 ans (HOU INSOU, 1999).
D'après AYIHONSI (2006), UEKI et OKI (1979), ont montré que les
graines mûres peuvent être collectées 30 jours après
la pollinisation. La floraison dure environ quinze (15) jours. Une fleur
produit plusieurs capsules renfermant des graines, dont seulement un maximum de
trente-quatre (34) sont viables par capsule (WILSON et al., 2005). Un
plant de jacinthe produit environ 5.000 graines, qui sont dispersées par
l'eau ou le vent, et vont coloniser les berges où le niveau d'eau est
faible.
1.2.6 CONDITIONS DE DEVELOPPEMENT DE LA JACINTHE D'EAU
La jacinthe d'eau est une espèce très
compétitive vis-à-vis des autres plantes aquatiques. Elle
s'installe dans des milieux où ses ennemis naturels sont absents
(lamantin par exemple). C'est une plante qui ne supporte pas une très
forte salinité du milieu colonisé. Elle évolue et
prolifère normalement en périodes de crues (saison pluvieuse),
mais meurt à l'étiage quand la salinité du cours d'eau
augmente. Une autre contrainte à la prolifération de cet
adventice est la température. Il prolifère dans tous les pays
chauds. Le vent par les courants de surface, contribue à son expansion
rapide (BODO, 2005). On remarque néanmoins, la présence
d'autres plantes flottantes (Pistia stratioites,
Nénuphea varie gata, Azolla pinnata, Lemna minor) dans le
même biotope que la jacinthe d'eau.
La figure 1.4 montre l'envahissement de la jacinthe d'eau sur le
fleuve Ouémé à Gangban (avril-mai, 2008).

Clichés: KPONDJO,
2008
Figure 1.4: Envahissement de la jacinthe d'eau
à Gangban
1.2.7 IMPACTS DE LA PROLIFERATION DE LA JACINTHE D'EAU
C'est une plante qui crée des
désagréments de divers ordres, quand la prolifération est
très rapide sur le plan d'eau, par la formation des tapis verts quasi
impénétrables. Les conséquences de cette
prolifération sont diverses:
1.2.7.1 PROBLEMES ECOLOGIQUES
Elle altère le fonctionnement des
écosystèmes aquatiques et provoque des pertes d'espèces.
Les tapis denses de cette espèce invasive empêchent, la
pénétration dans l'eau des rayonnements solaires et diminuent
donc, la photosynthèse des producteurs primaires à la base des
chaînes alimentaires (phytoplanctons). En période d'étiage,
la décomposition de ses feuilles mortes rend le milieu anoxique, privant
d'oxygène, les espèces du milieu. La jacinthe d'eau augmente
également les pertes en eau par le phénomène
d'évapotranspiration.
1.2.7.2 PROBLEMES DE NAVIGATION ET DE PECHE
Les tapis denses entravent la navigation en empêchant
les transports fluviaux et l'accostage.
Les pirogues ou autres moyens de
déplacement n'arrivent à passer que lorsque, le piroguier
débarrasse sur son chemin, au fur et à mesure les
plants de la jacinthe d'eau. La plante bloque ainsi les hélices des
engins de transport et de pêche. Elle endommage également les
filets.
1.2.7.3 PROBLEMES SANITAIRES
Sa présence favorise le développement de
certains vecteurs de maladies comme la malaria, la bilharziose, la filariose...
Certaines larves de moustiques prospèrent dans l'environnement
créé par la présence de mauvaises herbes comme la jacinthe
d'eau (DAGNO et al., 2007).
1.2.8 LUTTE CONTRE LA PROLIFERATION DE E. CRASSIPES
Dans le monde, cette plante a fait l'objet de beaucoup
d'études dans l'optique de contrôler sa prolifération et si
possible sa destruction définitive. Ainsi, il y a les luttes physique,
chimique et biologique.
· La lutte physique (mécanique et manuelle) contre
la plante fournit un meilleur contrôle à court terme à sa
prolifération (PIETERSE et al., 1996, cités par DAGNO
et al., 2007).
· La lutte chimique: plusieurs herbicides efficaces contre
la jacinthe d'eau sont appliqués par traitement aérien ou
terrestre. Mais ces deux moyens ont des insuffisances:
- en favorisant toujours la dispersion de la jacinthe
à travers les fragments de la plante délaissés dans l'eau
après le ramassage pour la lutte physique (HARLEY et al., 1997
cité par DAGNO et al., 2007);
- en entraînant la destruction de
l'écosystème aquatique, mais aussi les effets néfastes
des
résidus d'herbicide sur l'environnement et la santé de la
population (DAGNO et al., 2007).
· La lutte biologique est basée sur l'utilisation
des ennemis naturels de la plante, dans le but de créer une pression
permanente sur elle. Il y a l'usage:
- de quelques espèces d'insectes, en l'occurrence
Neochetina spp. (charançon) qui a réduit de 5 à
100 % la biomasse de la jacinthe d'eau de 1991 à 1993 sur le Fleuve
Ouémé (AJUONU et al., 2003, cités par DAGNO
et al., 2007);
- des phytopathogènes (microorganismes
pathogènes sur la plante). La mort de la plante a été
obtenue quelques semaines après pulvérisation avec Acremonium
Zonatum, alternaria Eichhornia et Cercospora rodmanii (DAGNO
et al., 2007). Selon BABU et al. (2003), un contrôle
efficace de la jacinthe d'eau est obtenu avec Alternaria Alternata.
D'après ADJALIAN (2006), les traitements visant
à réduire les taux de sels nutritifs dans le milieu aquatique
peuvent constituer un moyen de maîtrise de la prolifération de la
jacinthe d'eau.

2.1 MATERIEL
Il présente les milieux d'études (sites et
laboratoires) et le matériel utilisé.
2.1.1 MILIEUX D'ETUDE
Le Bénin est une bande de terre allongée,
située sur la côte ouest-africaine entre 6°15' et 12°25'
de latitude Nord et entre 0°45' et 4°00 de longitude Est (FAO,
CENATEL, 1998, cités par TOSSOU, 2004). Il est limité au nord par
le fleuve Niger, au nord-ouest par le Burkina Faso, à l'ouest par le
Togo, à l'est par le Nigeria et au sud par l'océan Atlantique.
Il bénéficie d'un important réseau
hydrographique constitué de cours d'eau, qui sont répartis sur
l'ensemble du pays en cinq bassins hydrographiques. Celui de
l'Ouémé (510 km) forme le plus important bassin et est
caractérisé par deux (2) saisons de pluies d'inégale
importance. La plus grande s'étale d'avril à juillet et la plus
petite d'octobre à novembre. De même, ce bassin se
caractérise par deux saisons sèches dont la plus grande va de
décembre à mars et la plus petite d'août à septembre
(ADAM et BOKO, 1993, cités par TOSSOU, 2004).
2.1.1.1 LAGUNE DE PORTO-NOVO
La situation géographique de la lagune de Porto-Novo
montre qu'elle est située au sud-est du Bénin (6°25' N,
2°36' E), entre la commune de Porto-Novo et celle de Sèmè.
Elle occupe la bordure sud de la ville de Porto-Novo et communique à
l'ouest avec le lac Nokoué par l'intermédiaire du canal de
Totchè et à l'est avec la lagune de Lagos (Nigeria) par un canal
(GNOHOSSOU, 2006). La lagune communique également avec le fleuve
Ouémé. Sa superficie est de 50 km2 (BONOU &
GNONLONFIN, 1999, cités par AYIHONSI, 2006).
En ce qui concerne les conditions climatiques, il faut
souligner que la lagune de Porto-Novo constitue la partie méridionale du
delta de l'Ouémé. Elle est aussi sous le climat
subéquatorial avec la moyenne de la salinité des eaux qui se
situe autour de 9,5 %o. Pendant la saison sèche, elle
s'élève jusqu'à atteindre un pic de 16,4 %o (en avril)
dans l'ensemble (TOSSOU, 2004). Ce taux de salinité est
contrôlé par les crues du fleuve Ouémé qui se
déversent dans la lagune (KIKI, 2003).
2.1.1.2 FLEUVE OUEME
Le Fleuve Ouémé est situé entre
6°30' et 10° de latitude Nord. Il prend sa source au nord du pays
dans les massifs de l'Atacora et débouche dans le système
lagunaire du lac Nokoué et de la lagune de Porto-Novo (GNOHOSSOU,
2006).
Le climat et les précipitations sont les principaux
facteurs qui influencent l'hydrologie de l'Ouémé. Son
régime de type tropical (ADAM et BOKO, 1993, cités par TOSSOU,
2004), se caractérise par une seule période de basses eaux qui
dure en général sept (7) mois, de décembre à juin,
et par une seule période de crues de trois à quatre (4) mois
environ. Les crues commencent habituellement vers fin juillet et finissent
avant le mois de novembre.
2.1.2 STATIONS D'ETUDE
Pour notre étude, nous avons choisi la station de
Louho, située dans la commune de Porto- Novo et le site de Gangban dans
la commune d'Adjohoun avec trois stations: Ayidégbé, Mandja et
Akloukpa.
Ces quatre stations ont été choisies car la
jacinthe d'eau, l'un des éléments constitutifs du sujet y est
bien développé, même dans la période d'avril-mai qui
coïncide avec la fin de la grande saison sèche et le début
de la grande saison pluvieuse.
2.1.2.1 STATION DE LOUHO
Louho est un quartier du troisième arrondissement de
Porto-Novo (Djassin). Il est situé au nord de la lagune de Porto-Novo et
par voie lacustre entre les embarcadères de Honvié et de Vakon.
Les coordonnées géographiques de cette station sont: 2°35'
10» de longitude et 6°29'51» de latitude. Durant toute
l'étude, Louho est considéré à la fois comme un
site et une station.
La figure 2.1 montre la situation géographique des deux
sites de d'étude.
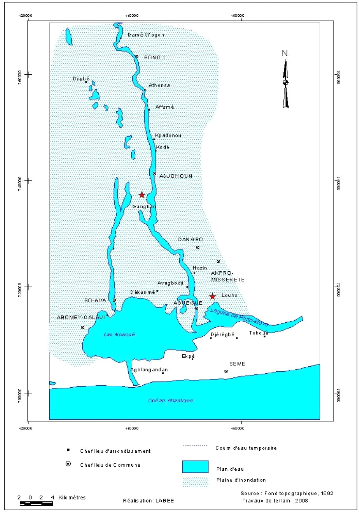
Figure 2.1 : Situation géographique
des sites prospectés
Louho, notre station est un canal artificiel qui
débouche sur la lagune de Porto-Novo. Ce canal est utilisé par la
population pour ses multiples besoins. Sa position par rapport à la
lagune explique la très faible salinité de l'eau (Figure 2.1).
La population de Louho exerce plusieurs activités: le
commerce des poissons fumés, les cultures maraîchères, la
pisciculture, l'élevage des bovins, volailles... Mais la plus importante
des activités est le commerce de l'essence frelatée. Les
commerçants s'organisent et transportent les bidons d'essence par voie
lacustre, en empruntant l'un des canaux artificiels de la lagune de
Porto-Novo.
2.1.2.2 SITE DE GANGBAN
Gangban est un arrondissement de la commune d'Adjohoun. Il
regroupe plusieurs quartiers dont Ayidégbé, Mandja et Akloukpa,
qui sont les trois dernières stations d'échantillonnage pour
notre étude.
Gangban se trouve dans le moyen delta (plaine longue de 50 km
environ) de l'Ouémé, qui s'étend de Bonou à
Azowlissè en passant par Adjohoun. Dans cette zone le lit du fleuve
Ouémé est sablonneux; l'eau est peu profonde en saison
sèche et les berges sont assez hautes. On note la présence de la
jacinthe d'eau et d'autres plantes flottantes comme Pistia
stratioites, Lemna minor et Azolla pinata.
Les figures 2.2 et 2.3 présentent la situation de la
prolifération de la jacinthe d'eau sur les différentes stations
de l'étude.
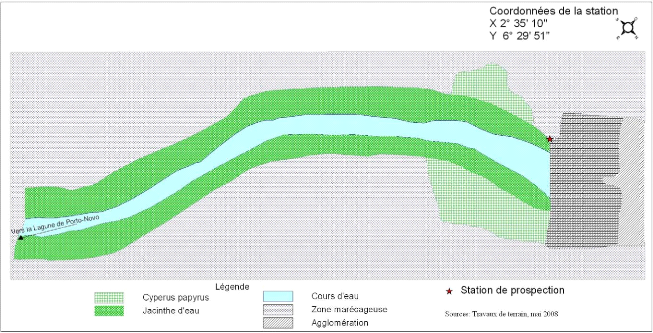
Figure 2.2: Développement de la Jacinthe
d'eau à Louho et ses environs
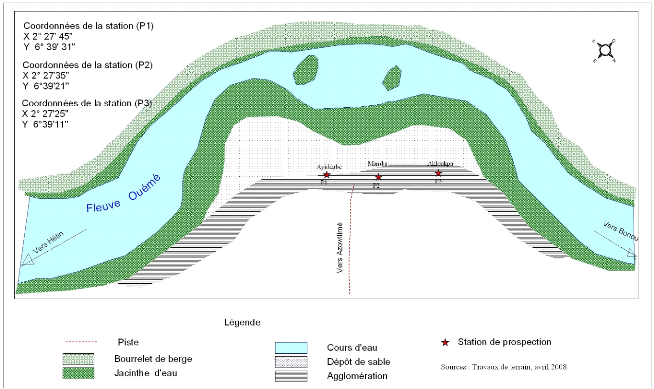
Figure 2.3: Parcellaire à Gangban
Les habitants de Ayidégbé, Mandja et Akloukpa,
pour la plupart des Wéménou, pratiquent plusieurs
activités génératrices de revenues telles que : la
pêche, l'agriculture, la pisciculture, l'élevage, le commerce et
autres. En agriculture, ils cultivent les denrées alimentaires comme le
maïs, le gombo, les légumes verts, la banane, etc. Quant à
la pisciculture, ils créent des étangs artificiels du
côté de la rive gauche, pour l'élevage des espèces
de poissons tels que clarias gariepinus. Le commerce est assuré
par les femmes qui fument les poissons élevés et les
revendent.
2.1.3 PRESENTATION DES LABORATOIRES D'ACCUEIL Les deux
laboratoires d'accueil sont l'URZH et le CREC.
2.1.3.1 URZH
La station de diversification de la pisciculture de l'URZH
(Unité de Recherche sur les Zones Humides) est située sur le
campus d'Abomey-Calavi à soixante-quinze (75) mètres de la
seconde entrée principale de l'UAC. Son laboratoire se trouve dans le
département de Zoologie et Génétique de l'UAC.
L'URZH s'occupe de:
· l'évaluation biologique de la qualité de
l'eau à partir d'indices biotiques basés sur les algues, macro
invertébrés et poissons;
· l'évaluation des paramètres
physico-chimiques des eaux de surface;
· la diversification de la pisciculture dans les zones
humides;
· l'inventaire de la faune et de la flore aquatique.
2.1.3.2 CREC
Le Centre de Recherche Entomologique de Cotonou (CREC) est un
centre qui fait des recherches sur les moustiques en général et
surtout sur les vecteurs du paludisme en particulier. La majeure partie de nos
travaux de laboratoire s'est déroulée dans ce centre.
Situé dans la zone industrielle de Cotonou, le CREC est
installé dans la même enceinte que le laboratoire nationale de
santé. Il est limité :
- au nord par le Centre National de
Télédétection (CENATEL);
- au sud par la Centrale d'Achats des Médicaments
Essentiels (CAME); - à l'est par la Société
Béninoise des Peintures et Colorants (SOBEPEC); - à l'ouest par
le Ministère de la Santé (MS);
Les travaux réalisés au CREC sont axés
sur l'épidémiologie du paludisme. Ce centre dispose de cinq
laboratoires, tous équipés pour faire des travaux de recherche
sur le paludisme. Deux insectariums (larvaire et adulte) et une animalerie sont
également disponibles pour l'élevage et la reproduction des
moustiques.
Ilya donc:
· un laboratoire de cytogénétique;
· un laboratoire d'identification des espèces de
moustiques et surtout des vecteurs;
· un laboratoire de parasitologie;
· un laboratoire de biologie moléculaire;
· un laboratoire de contrôle de qualité des
outils de lutte antivectorielle;
· un laboratoire de chimio-sensibilité du
Plasmodiumfalciparum aux antimalariques.
En dehors de ces activités, le CREC travaille en
partenariat avec plusieurs structures étrangères dont l'Institut
de Recherche pour le Développement (IRD) et London School of Hygien and
Tropical Medecine (LSHTM), toujours dans l'optique de réduire le taux de
prévalence du paludisme au Bénin. A l'insectarium du CREC, deux
genres de moustiques sont séparément élevés :
Anopheles et Culex.
Les photos présentées par la figure 2.4 montrent
les insectariums où sont élevés les larves et les adultes
de moustiques.

Clichés: KPONDJO,
2008
Figure 2.4: Insectariums des larves de moustiques et
leurs adultes
Pour les mesures des paramètres de l'eau et les
échantillonnages, nous avons utilisé le matériel qui
suit:
9 un GPS (Global Positionning System) pour la prise des
coordonnées géographiques des stations d'étude;
9 un oxythermomètre WTW, un pH-mètre WTW, un
conductimètre WTW, une sonde multiparamètre Combo pH & EC de
marque HANNA, pour les mesures physico-chimiques de l'eau;
9 une paire de bottes, un rouleau de papier adhésif,
un marqueur, une louche, un tamis à mailles très fines, une
pipette et des plastiques (récipient, petit seau à couvercle)
pour le prélèvement des larves et nymphes de moustiques.
2.2 METHODOLOGIE
Le travail a été réalisé en
plusieurs phases:
> la documentation (écrite et orale)
: elle a permis de mieux comprendre le sujet et d'avoir quelques informations
abordées sus lacto.
> la collecte des données: elle a
été réalisée par des échantillonnages d'eau
sur chacune des stations dans les arrondissements de Djassin et de Gangban.
> le traitement des données: il a
été fait avec le logiciel Excel sous windows 2007.
2.2.1 COLLECTE DES DONNEES
Cette étape du travail a consisté à
recueillir des données après une visite exploratoire des stations
d'étude.
2.2.1.1 VISITE EXPLORATOIRE DES STATIONS D'ETUDE
Il a été nécessaire de cibler en premier
lieu, les zones humides où la jacinthe d'eau est retrouvée en
abondance dans la période d'avril à mai. Ceci permet d'identifier
les stations d'échantillonnage, qui sont repérées au moyen
du GPS.
Le site de Gangban a été choisie pour les
prospections car le fleuve à cet endroit n'est pas tellement
influencé par la salinité en période de basses eaux.
Louho, situé au nord de la lagune de Porto-Novo est également un
milieu favorable à notre étude.
Après cette étape préalable, nous avons
fait une première sortie le 30 avril 2008 sur Louho et Gangban, pour
faire l'état des lieux et prendre les coordonnées
géographiques avec un GPS. Les échantillonnages
(échantillons, paramètres physico-chimiques, nutriments) ont
réellement commencé à partir du mois de mai.
Pour des raisons financières et matérielles, le
travail n'a pas été effectué au même moment sur les
quatre stations. Nos sorties ont eu lieu les 15, 22 et 29 mai 2008 à
Louho dans la matinée (8 h-10 h) et les 16, 23 et 30 mai 2008 à
Gangban dans l'après midi (12 h-14 h).
2.2.1.2 ECHANTILLONNAGES ET MESURES DES PARAMETRES
PHYSICO-CHIMIQUES
Le travail axé sur la mesure des paramètres, a
été fait en bordure du cours d'eau (au niveau des berges) car le
courant et le mouvement de l'eau emmènent les plants de la jacinthe
d'eau. Ces plants se sont donc développées et même, en
quelques endroits, sur la terre ferme (humide) et dans certaines barques
délaissées avec de l'eau. Les paramètres pris en compte
pour l'étude sont:
· la température (°C) qui est un facteur
écologique, mais aussi cinétique pour tous les processus
chimiques et biologiques se déroulant dans les milieux naturels. Elle a
été mesurée avec un oxythermomètre WTW;
· le potentiel d'hydrogène (pH) qui permet
d'apprécier l'acidité ou l'alcalinité du milieu. Sa mesure
est faite à l'aide d'un pH-mètre WTW;
· la conductivité électrique (mS) qui permet
d'apprécier la capacité de l'eau à conduire le courant
électrique. Elle a été prise à l'aide d'un
conductimètre WTW;
· le TDS (ppt) qui permet de connaître la
quantité de Total Solides Dissous dans l'eau. Il a été
apprécié avec une sonde multiparamètre Combo pH & EC
de marque HANNA;
· les sels nutritifs: ions nitrite, nitrate, ammonium et
phosphate, ont été analysés au laboratoire.
Toutes ces mesures sont prises sous les nappes de la jacinthe
d'eau. Comme les nutriments nécessitent des traitements chimiques
(dosages), ils ont été conservés dans des bouteilles
maintenues au froid (4 °C) pour les analyses au laboratoire
d'écologie de l'eau de l'URZH. La méthode par
spectrophotométrie a été pour ce faire utilisée.
Pour la mesure de la densité larvaire, nous avons suivi la
méthode de collecte de larves et de pupes de l'OMS, 2003.
Après la mesure des paramètres du milieu, nous
avons procédé à la collecte des larves ou nymphes sous la
jacinthe d'eau de la manière suivante:
) plonger la louche (350 ml) doucement sous la jacinthe d'eau,
inclinée à 45° par rapport à la verticale;
) prélever vingt fois l'eau sous jacinthe (contenant
probablement des larves) en diversifiant les points de
prélèvement;
) verser à chaque fois le contenu de la louche dans un
récipient;
) filtrer le contenu du récipient à l'aide d'un
tamis, dans de petits seaux à couvercle pour réduire la
quantité d'eau;
) Etiqueter les seaux.
Pour éviter des erreurs de comptage, les larves (dans
le plastique légèrement fermé) sont transportées
dans les conditions normales de température (25 °C) vers
l'insectarium larvaire du CREC, une fois la prospection terminée. En
effet, les larves prélevées sont à différents
stades larvaires, y compris celui du premier stade. Il faudrait donc les
élever, jusqu'au moment où, elles seront bien visibles à
l'oeil nu (stades 3 et 4). Généralement le passage du stade 1 aux
stades 2 et 3 dure deux (2) jours.
Après toute cette opération, il est essentiel de
densifier la population larvaire du gîte. Ainsi sur chaque site, la
densité larvaire est appréciée par le nombre de larves et
de nymphes récoltées par prélèvement. La formule de
la densité larvaire est la suivante :
Avec: L le nombre total de larves obtenues; N le nombre de
prélèvements; V le volume de la louche.
2.2.1.3 ELEVAGE ET DENOMBREMENT DES LARVES ET NYMPHES
Les larves des stades 1 et 2 sont séparées de
celles des stades 3 et 4. Les nymphes sont mises dans un petit gobelet avec une
petite quantité d'eau. Le gobelet est alors déposé dans
une cage étiquetée.
Les larves maintenues dans l'eau de gîte sont
filtrées dans des bacs étiquetés, contenant de l'eau du
robinet. Tous les matins, nous procédons au tri des nymphes et à
l'alimentation des larves aux croquettes de chat, mélangés
à la levure. Après le stade nymphal qui dure au moins 48 heures,
les nymphes éclosent et donnent des adultes appelés imagos qui
sont nourris au jus de miel (1 %). Les larves et les nymphes sont
élevées dans l'insectarium où les bacs sont alignés
sur des étagères illuminées. Après
l'émergence, les adultes sont récoltés dans des cages
cubiques voilées, qui sont déposées dans l'insectarium
réservé aux adultes.
Les larves des stades 3 et 4 sont dénombrées
aussitôt après le retour du terrain. Mais celles des stades 1 et 2
sont élevées à l'insectarium dans des bacs
identifiés au préalable. A l'aide d'une pipette compte-goutte,
nous évaluons le nombre de larves et nymphes obtenues sur chaque
station. Notons que les larves et nymphes sont comptées une à
une.
2.2.1.4 IDENTIFICATION DES GENRES DE MOUSTIQUES
Dans la même journée, après la récolte
des adultes, ceux-ci sont identifiés à la loupe binoculaire dans
la salle d'identification.
Pour l'identification, les moustiques sont aspirés de
leur cage, avec un tube d'aspiration dans
de petits gobelets en plastique
voilés. Pour éviter que les moustiques s'envolent
durant
l'observation, nous les avons endormis avec de l'éther. Ils
sont ensuite mis dans des boites
de pétri et placés sur la platine. La clé
d'identification taxonomique des espèces de moustiques est
utilisée, pour l'identification des moustiques obtenus lors de nos
différentes prospections.
La figure 2.5 présente deux photos a et b illustrant la
méthode utilisée pour compter les larves et celle adoptée
pour l'indentification des genres ou espèces de moustiques.
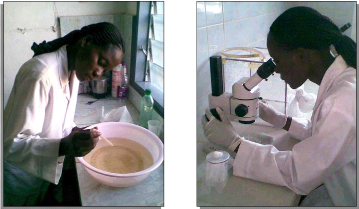
Clichés: GOVOETCHAN,
2008
a) Dénombrement des larves ou nymphes b) Identification des
genres de moustiques
Figure 2.5: Décompte des larves ou
nymphes de moustiques et Identification des genres de
moustiques
2.2.2 TRAITEMENT DES DONNEES
Toutes nos données sont traitées avec le
logiciel Excel sous windows 2007, pour une meilleure exploitation. Les
résultats sont présentés sous forme d'histogrammes et de
courbes.

3.1 RESULTATS
Les résultats obtenus suite à l'analyse des
données collectées sont relatifs : à la
température; au potentiel d'hydrogène (pH); à la
conductivité électrique; au Total Solides Dissous; aux sels
nutritifs; au développement des larves de moustiques sous la jacinthe
d'eau; aux corrélations possibles entre la densité larvaire et
certains paramètres du milieu sous la jacinthe d'eau.
3.1.1 TEMPERATURE
Le graphe de la figure 3.1 montre l'évolution de la
moyenne des températures en eau libre et en eau sous jacinthe sur les
quatre (4) stations échantillonnées.
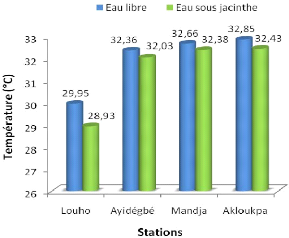
Figure 3.1: Moyenne des températures en
eau libre et en eau sous jacinthe sur les
différentes stations
d'échantillonnage
Il y a une certaine constance de la variabilité de la
moyenne des températures à Louho, Ayidégbé, Mandja
et Akloukpa. Cette moyenne augmente progressivement suivant chaque station. Sa
faible valeur est enregistrée au niveau de chaque type d'eau à
Louho avec des valeurs de : 29,95 °C en eau libre et de 28,93 °C en
eau sous jacinthe. Soit une différence non négligeable de 1,02
°C méritant d'être prise en considération. Pour
Ayidégbé et Mandja,
cette différence est de 0,33 °C et 0,28 °C
respectivement. Sur la station 4 (Akloukpa), la moyenne des températures
marque une variation en eau libre et en eau sous jacinthe avec des valeurs
respectivement de 32,85 °C et de 32,43 °C. Ici la différence
est de 0,42 °C, soit deux (2) fois plus faible que celle
enrégistrée à Louho.
Les résultats ainsi obtenus, montrent que la
température est fonction du temps.
3.1.2. POTENTIEL D'HYDROGENE (PH)
La figure 3.2 présente la moyenne des pH mesurés en
eau libre et en eau sous jacinthe sur chacune des stations
d'échantillonnage.
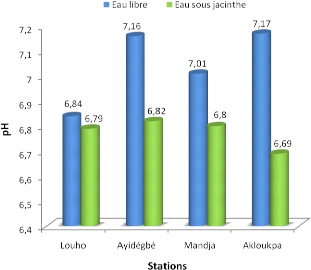
Figure 3.2: Moyenne des potentiels
d'hydrogène (pH) en eau libre et en eau sous jacinthe
sur les
différentes stations d'échantillonnage
En eau libre, le pH atteint sa valeur moyenne minimale
à Louho qui est de 6,84. Celle maximale de 7,17 est enregistrée
à Akloukpa. Le pH sous jacinthe n'a pas connu une grande variation d'une
station à une autre (entre 6,69 à louho et 6,82 à
Ayidégbé). Certes, sa valeur sur toutes les stations est toujours
inférieure à celle de l'eau libre. De plus à Louho,
contrairement aux autres stations, la population pratique le trafic de
l'essence frelatée par
voie lagunaire. Le non entretien des moyens de transport
archaïques, laisse souvent observer des déversements de cet
hydrocarbure dans l'eau. L'essence avec une densité inférieure
à celle de l'eau, occupe la surface de celle-ci. Ce qui favorise ainsi
le phénomène de réflexion des rayons solaires à la
surface de l'eau, d'où une diminution de la quantité
d'énergie solaire. Le pH d'un milieu étant en corrélation
avec la température, la diminution de cette dernière pourrait
influencer le pH. Par conséquent ce phénomène pourrait
également justifier l'observation faite sur la station de Louho.
3.1.3 CONDUCTIVITE ELECTRIQUE
La figure 3.3 nous présente la moyenne des
conductivités électriques en eau libre et en eau sous jacinthe
à Louho, Ayidégbé, Mandja et Akloukpa.
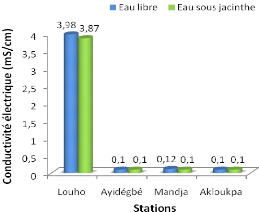
Figure 3.3: Moyenne des conductivités
électriques en eau libre et en eau sous jacinthe sur
les
différentes stations d'échantillonnage
La valeur moyenne de la conductivité électrique
atteint son maximum à Louho dans les deux (2) types d'eau : eau libre et
eau sous jacinthe. Ses valeurs sont de 3,98 mS/cm en eau libre et 3,87 mS/cm en
eau sous jacinthe. Sur les trois autres stations, la conductivité
électrique est très faible. Sa valeur minimale est de 0,10 mS/cm
en eau libre et en eau sous jacinthe à Ayidégbé et
Akloukpa.
Les fortes valeurs de conductivité électrique
à Louho, comparativement à celles des autres stations,
dénoteraient d'une forte minéralisation de la matière
organique.
3.1.4 TOTAL SOLIDES DISSOUS
La figure 3.4 montre la variation du TDS sur chaque station et au
niveau des deux types d'eau.

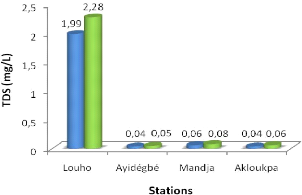
Figure 3.4: Moyenne du Total Solides Dissous
en eau libre et en eau sous jacinthe sur les
différents stations
d'échantillonnage
Le TDS est plus remarquable à Louho qu'à
Ayidégbé, Mandja et Akloukpa, soit 1,99 mg/L pour l'eau libre et
2,28 mg/L pour l'eau sous jacinthe. Ces valeurs sont très faibles sur
les trois dernières stations, soit respectivement à
Ayidégbé : 0,04 mg/l et 0,05mg/l.
Les fortes valeurs du TDS notées à Louho
montrent que les solides dissous sont très importants dans l'eau en
général, mais diminuent sous la jacinthe d'eau.
Nous constatons que pour les quatre (4) paramètres
physico-chimiques, le temps est un facteur influant sur les mesures au niveau
des différentes stations d'une part, sur leur variabilité en eau
libre et sous jacinthe d'autre part. Les paramètres mesurés
à Louho laissent entrevoir la pollution de l'eau, due aux apports en
éléments nutritifs.
3.1.5 SELS NUTRITIFS
La moyenne des sels nutritifs mesurés à louho et
à Gangban est présentée par la figure 3.5.
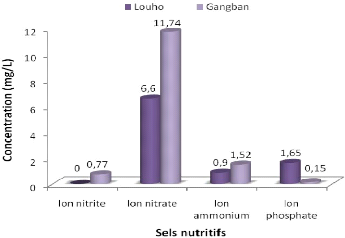
Figure 3.5: Moyenne des sels nutritifs dissous
sur les deux sites d'échantillonnage
En général, les nitrates représentent les
sels nutritifs les plus abondants. Les concentrations des ions nitrite, nitrate
et ammonium atteignent leur maximum à Gangban avec des valeurs de 0,77
mg/l; 11,74 mg/l et 1,52 mg/l respectivement. Cependant, à Louho nous
notons une forte concentration en ion phosphate, soit une valeur de 1,65 mg/l
contre 0,15 mg/l à Gangban.
La forte concentration des nitrates à Gangban pourrait
s'expliquer par des apports de la population en nutriments azotés. La
concentration en ion phosphate observée à Louho semble provenir
des rejets d'origine domestique, commerciale, des eaux de ruissellement venant
des habitations environnantes ainsi que des champs de culture où des
engrais chimiques à base de phosphate seraient utilisés.
3.1.6 DEVELOPPEMENT DES LARVES DE MOUSTIQUES SOUS LA JACINTHE
D'EAU
L'étude du développement des larves de moustiques
sous la jacinthe d'eau a permis de déterminer la densité de leurs
larves et d'identifier leurs genres.
3.1.6.1 DENSITE DES LARVES DE MOUSTIQUES SOUS LA JACINTHE
D'EAU
L'effectif de larves ou nymphes, obtenu après les
différentes prospections sur les quatre stations
d'échantillonnage, est représenté par l'histogramme de la
figure 3.6.
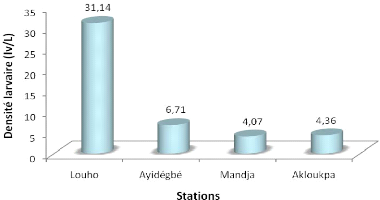
Figure 3.6: Densité larvaire sous la
jacinthe d'eau après les prospections sur les
différentes
stations d'échantillonnage
L'analyse de cette figure révèle que sur toute
la période des prospections, la population des larves de moustiques est
plus dense à Louho qu'à Gangban. Nous avons récolté
sur la station 1 en moyenne 218 larves (lv). Par contre sur les trois autres
stations, nous avons obtenu en moyenne 47 lv à Ayidégbé;
28,5 lv à Mandja et 30,5 lv à Akloukpa. La densité est
donc de 31,14 lv /L à Louho 6,71 lv /L à Ayidégbé.
Notons également que cette densité est faible en
général à Gangban, où les prospections ont
démarré après 12 h 30 mn contrairement à Louho
où tous les prélèvements ont eu lieu dans la
matinée.
Les larves de moustiques, d'après la revue
bibliographique se développent sous la jacinthe d'eau. Elles sont
très mobiles de nature. Mais déjà à partir de midi
où la température est élevée (plus de 31 °C),
l'eau sous jacinthe est ensoleillée et claire. Ces minuscules
êtres sont donc menacés et préfèrent se cacher entre
les racines de cette plante, fuyant ainsi leurs prédateurs. Ceci
explique alors la forte densité larvaire à Louho.
3.1.6.2 GENRES DE MOUSTIQUES IDENTIFIES SOUS LA JACINTHE D'EAU
La figure 3.7 présente les genres de moustiques
après leur élevage au laboratoire.
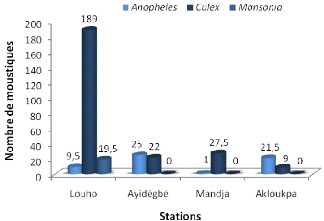
Figure 3.7: Les genres de moustiques obtenus
après émergence des larves récoltées sous
la
jacinthe d'eau sur les différentes stations
L'élevage des larves récoltées sur les
stations nous a permis d'identifier très aisément les genres de
moustiques (Anopheles, Culex, Mansonia) se
développant sous la jacinthe d'eau.
En général, nous remarquons plus la
présence du genre Culex sur les stations que des deux autres
genres. L'effectif moyen de Culex est de 189 lv à Louho. Par
contre à Ayidégbé le genre Anopheles est plus
représentatif avec en moyenne 25 individus. Le genre Mansonia
n'a été obtenu qu'à Louho avec 19,5 lv.
La dégradation de la qualité de l'eau
dénotée à Louho expliquerait la forte présence de
Culex et de Mansonia.
La figure 3.8 montre les photos de deux espèces de
moustiques parmi celles identifiées au laboratoire.
Culex quinquefasciatus Anopheles gambiae
Clichés : AYIPKON, 2008
Figure 3.8: Exemple de deux espèces de
moustiques se développant sous la jacinthe d'eau
3.1.7 CORRELATIONS POSSIBLES ENTRE LA DENSITE LARVAIRE ET
CERTAINS PARAMETRES DU MILIEU SOUS LA JACINTHE D'EAU
Il a été calculé les corrélations
entre: la température sous la jacinthe d'eau et la densité
larvaire; la conductivité électrique de l'eau sous jacinthe et la
densité larvaire.
3.1.7.1 CORRELATION ENTRE LA TEMPERATURE SOUS LA JACINTHE D'EAU
ET LA DENSITE LARVAIRE
Dans le tableau 3.1 sont résumées les
corrélations obtenues entre les paramètres physico- chimiques
(température, pH, conductivité électrique, TDS) sous la
jacinthe d'eau et la densité larvaire.
Tableau 3.1 : Corrélations entre les
paramètres physico-chimiques sous la jacinthe d'eau et
la
densité larvaire
|
Température
(°C)
|
pH
|
Conductivité
électrique
(mS/cm)
|
TDS
(mg/L)
|
Densité
larvaire
(lv/L)
|
|
Température
(°C)
|
1
|
- 0,058
|
- 0,989
|
- 0,987
|
- 0,999
|
|
pH
|
|
1
|
+ 0,029
|
+ 0,029
|
+ 0,048
|
|
Conductivité
(mS/cm)
|
|
|
1
|
+ 0,999
|
+ 0,991
|
|
TDS
(mg/L)
|
|
|
|
1
|
+ 0,990
|
|
Densité
larvaire
(lv/L)
|
|
|
|
|
1
|
De ce tableau se dégage deux parfaites
corrélations: une, entre la densité larvaire et la
température du milieu sous jacinthe d'eau et l'autre entre cette
densité et la conductivité électrique.
La figure 3.9 traduit la courbe de tendance entre la
température sous la jacinthe d'eau et la densité larvaire.
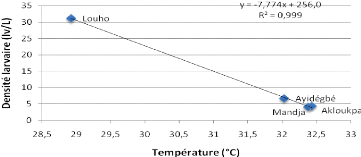
Figure 3.9 : Courbe de tendance entre la
température sous la jacinthe d'eau et la densité
larvaire
Ce graphe montre qu'il existe une parfaite corrélation
négative entre la température et la densité larvaire. Le
coefficient de corrélation R2 est de 0,999.
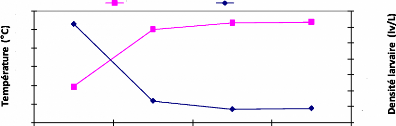
La figure 3.10 montre l'évolution de la température
sous la jacinthe d'eau et suivant celle de la densité larvaire.
Température Densité larvaire
33
35
32
30
0
27
31
25
20
30
15
29
10
28
5
Louho Ayidégbé Mandja Akloukpa
Stations
Figure 3.10: Corrélation entre la
température sous la jacinthe d'eau et celle de la
densité
larvaire
Il y a une parfaite corrélation entre la
température de l'eau sous jacinthe et la densité larvaire.
La densité larvaire augmente quand la température
diminue. Lorsque la valeur de la
température sous jacinthe est de
28,93 °C, celle de la densité est de 31,14 lv/L à Louho.
Par
contre sur les stations à Gangban en
général, la densité larvaire est faible avec une valeur de
6,71 lv/L à Ayidégbé pour une température de 32,03
°C.
De l'analyse de cette figure, il ressort que les larves de
moustiques sont plus appréhendées dans la matinée. Elles
préfèrent se cacher dès que la température de l'eau
est supérieure à 30°C.
3.1.7.2 CORRELATION ENTRE LA CONDUCTIVITE ELECTRIQUE DE L'EAU
SOUS JACINTHE ET LA DENSITE LARVAIRE
La figure 3.11 présente la courbe de tendance entre la
conductivité électrique sous la jacinthe d'eau et la
densité larvaire.
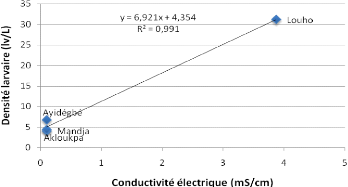
Figure 3.11: Courbe de tendance entre la
conductivité électrique sous la jacinthe d'eau et
la
densité larvaire
Cette courbe de tendance entre la conductivité
électrique sous la jacinthe d'eau et la densité larvaire montre
une forte corrélation positive entre elles avec R2: +
0,991.
La figure 3.12 illustre la corrélation entre la
conductivité électrique sous la jacinthe d'eau et la
densité larvaire.

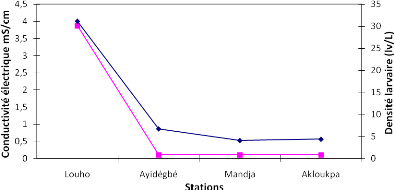
Figure 3.12 : Corrélation entre la
conductivité électrique sous la jacinthe d'eau et la
densité
larvaire
Sur les différentes stations d'échantillonnage,
nous observons une certaine synchronisation entre la conductivité
électrique de l'eau sous jacinthe et la densité larvaire.
De ces résultats, nous constatons en
général que les larves de moustiques préfèrent des
milieux riches en éléments nutritifs. A Louho où la valeur
moyenne de la conductivité électrique est maximale, soit 3,87
ms/cm, la densité larvaire est à sa valeur maximale. De plus la
forte présence de Culex ne fait que confirmer la pollution de
l'eau à Louho qu'à Gangban.
3.2 DISCUSSION
Les mesures des paramètres physico-chimiques montrent
les conditions sous lesquelles, la jacinthe d'eau évolue dans la
période d'avril à mai à Louho et à Gangban. Mis
à part son pouvoir de multiplication qu'on lui reconnaît, cette
plante est aussi un indicateur de pollution chimique. Selon AHOUNOU (2007),
elle provoque l'eutrophisation des eaux, entraînant ainsi leur pollution
par désoxygénation. Les concentrations des ions nitrate et
phosphate respectent les normes de l'OMS qui fixe respectivement pour ces
paramètres, une teneur seuil dans les eaux naturelles de 50 mg/L; 0,5
mg/L (KIKI, 2003). Néanmoins la forte teneur des ions nitrates
enregistrée à Gangban en général (11,74 mg/L),
pourrait faire soupçonner la richesse du milieu en matières
organiques. Les causes possibles de cette richesse sont la décomposition
de la matière végétale morte (jacinthe d'eau), aux
ruissellements des terres agricoles fertilisées. Mais la mesure de la
conductivité électrique montre que c'est plutôt à
Louho qu'on note une dégradation de la qualité de l'eau. La
teneur de l'eau libre en ions phosphate obtenue à Louho confirme une
fois de plus la qualité dégradante de l'eau de cet site par
rapport à celui de Gangban. Les résultats sur les sels nutritifs
confirment que l'on peut contrôler la prolifération de la jacinthe
d'eau en agissant sur les concentrations des nutriments (ADJALIAN, 2006). Par
ailleurs, les valeurs de la conductivité électrique
observées sur les différents sites sont indicatrices d'eaux
polluées à eaux très polluées car selon BELAUD
(1987) rapporté par KIKI (2003), une eau de surface dont la
conductivité électrique est supérieure à 0,5 mS/cm
est soit une rivière séléniteuse (riche en sulfate de
calcium) ou une eau polluée ou très polluée. La forte
moyenne de la conductivité électrique à Louho pourrait
traduire une forte minéralisation de la matière organique
contenue dans l'eau ou une intrusion saline due aux eaux marines. Cette
dégradation de la qualité de l'eau à Louho pourrait
également être attribuée à la présence
d'essence (hydrocarbure) dans l'eau et aux rejets des déchets liquides
(eaux usées et de ruissellement). Les valeurs relativement fortes des
moyennes de températures sur les trois dernières stations de
prélèvements seraient dues à l'effet de l'insolation qui
est plus intense à ces heures de prospections à Gangban. Ainsi,
il exixte une variation de 0,4 à 1,1 °C entre la température
en eau libre et celle sous jacinthe. Il en est de même pour le pH qui
tourne autour de 6 en eau sous jacinthe et de 7 en eau libre. Ce que confirme
l'assertion de
AYIHONSI (2006) selon laquelle le pH varie sous la jacinthe
d'eau. Nos résultats sur le pH répondent d'une façon
générale aux valeurs admises par les normes pour les eaux
naturelles (6,5 à 9 : NFT 90008) qui sont rapportées par KIKI
(2003).
Une fois après son installation, la jacinthe d'eau
donne naissance à des tapis denses qui, selon certains auteurs comme
NSHIMIRIMANA (2008) et DAGNO (2007), favorisent le développement des
larves de moustiques. Nos recherches et résultats obtenus sur la
présence de larves et leur densité, ne font que confirmer cette
assertion et qu'affirmer l'hypothèse émise par l'OEPP (2006).
Cette plante qui menace l'équilibre du milieu (TOSSOU, 2004), sert de
gîte larvaire d'après nos résultats à une
diversité spécifique. Les espèces qui pullulent sous la
jacinthe d'eau d'après notre étude sont: Mansonia africana,
Culex quinquefasciatus, Culex nébulosus, Culex descens, Anopheles
ziemanni, Anopheles pharoensis et même Anopheles gambiae,
vecteur du paludisme. Les genres Culex, Mansonia, vivent
dans des milieux sales, pollués et leurs femelles pondent de
préférence dans un cours d'eau à plantes flottantes, en
l'occurrence la jacinthe d'eau (RHODAIN et PEREZ, 1985).
La première caractéristique de la jacinthe d'eau
étant sa polyvalence (ANONYME, 2006), elle prolifère dans un
écosystème humide et pollué où le courant est
très lent. D'après GUILLAUMOT (2006), la femelle moustique
après son repas sanguin pond des oeufs (50 à 400), dans un
gîte adéquat au développement de ses larves. Ce gîte
larvaire doit être une eau stagnante ou au courant très lent, mais
elle peut être douce ou salée, claire ou boueuse, propre ou
chargée en matière organique. Il peut être également
ombragé ou en plein soleil, permanent ou temporaire et peu profond. Sur
les quatre stations d'échantillonnage, comme le prouvent nos
résultats, la qualité de l'eau répond à ces
caractéristiques.
La dominance de Culex sous la jacinthe d'eau
s'explique par les conditions essentielles que leur offre ce microclimat. Selon
RODHAIN et PEREZ (1985), les larves des moustiques comme: Mansonia,
Culex, se fixent aux racines de la jacinthe d'eau. Malgré leur vie
aquatique, elles respirent l'oxygène de l'air grâce à la
possibilité d'une association bénéfique, qu'offrent les
tiges de la plante aux larves. Elles prélèvent l'oxygène
qui est nécessaire avec leur siphon. Aussi, les paramètres
physico-chimiques du milieu ont beaucoup favorisé ce
développement. La population de Culex obtenue à Louho
apparaît
comme un traceur de pollution de l'eau, dénotée
par les mesures des paramètres tels que la conductivité, les sels
nutritifs (N03 -, P043-). Ce qui est conforme à ADISSO et
ALIA (2005), rapportant que le genre Culex préfère les
eaux sales, polluées. Aussi, la présence de A. ziemanni, A.
gambiae, A. pharoensis sous la jacinthe d'eau ne
confirmerait-elle pas le rôle épurateur de cette plante comme l'a
rapporté DAGNO (2007), d'autant plus que le genre Anopheles
préfère les eaux claires (ADISSO et ALIA ,2005). La
densité larvaire observée sur chaque station montre que, les
tapis quasi-impénétrables de cet adventice permettent aux larves
de moustiques de proliférer sans être atteintes ou
dérangées, par la faune aquatique (poissons et autres
prédateurs). Celle-ci n'arrive pas à pénétrer sous
ces denses touffes. La variation de cette densité sur les quatre (4)
stations pose certainement un problème de photosensibilité. Les
résultats montrent que les larves sont vite interceptées sous la
jacinthe d'eau dans la matinée que dans l'après midi. Il y a donc
un moment de forte activité des larves, qui d'après nos
recherches est assurément dans la matinée.
L'étude sur le développement des larves de
moustiques sous la jacinthe d'eau Eichhornia crassipes (Mart.)
Solms-Laubach qui est un milieu dans un écosystème
particulier, nous a permis d'apprécier la densité larvaire de
moustiques et leur diversité spécifique sous cette plante.
Les mesures des paramètres du milieu
(température, pH, conductivité électrique, TDS, sels
nutritifs) prises en eau libre et en eau sous jacinthe diffèrent. Ces
paramètres pour la plupart diminuent sous les touffes de la plante.
Les analyses faites des différents échantillons
d'eau prélevés, ont montré que le milieu sous jacinthe
d'eau est un lieu de prédilection pour le développement de
plusieurs genres de moustiques : Anopheles, Culex, Mansonia. La
densité larvaire rapportée aux paramètres du milieu sous
jacinthe d'eau tels que: la température et la conductivité
électrique, montre qu'il y existe une parfaite corrélation. De
nos résultats, il ressort également que le temps est un
paramètre influant sur l'activité larvaire. En effet, on constate
que les larves très mobiles, sont plus vite interceptées dans la
matinée. Pourtant, dans l'après midi, elles sont moins actives
dans l'eau. La densité larvaire est de 31,14 lv/L pour une
température de 28,93 °C en eau sous jacinthe. Cette étude
confirme que la jacinthe d'eau, surnommée "la peste verte?
par plusieurs auteurs, occasionne le développement des larves de
moustiques. Ce qui fait d'elle, un élément favorisant la
propagation du paludisme.
Notre travail ne représente qu'une étude
préliminaire sur les interactions écologiques entre la jacinthe
d'eau, E. crassipes et les moustiques. Compte tenu des
problèmes constants de la prolifération de E. crassipes
sur les plans d'eau béninois et de la prévalence du
paludisme, il est nécessaire de poursuivre et d'affiner l'étude
afin de confirmer et de généraliser les conclusions auxquelles
nous sommes parvenus. Pour ce faire, nous suggérons d'approfondir les
recherches sur:
. la corrélation possible entre la jacinthe d'eau et les
sels nutritifs, afin de trouver un autre moyen pour contrôler la
prolifération de la jacinthe d'eau;
. les conditions de développement qu'offre la jacinthe
d'eau aux larves de moustiques, pour apprécier réellement la
potentialité de ce nouveau gîte par rapport à ceux naturels
connus;
. l'étude comparée entre la dynamique des
populations de moustiques sous la jacinthe d'eau et celle dans les eaux sans
jacinthe.
Nous suggérons également que des études
ultérieures soient réalisées à la fois pendant les
deux saisons (saison des pluies et saison sèche); ce qui permettra de
comparer la dynamique des populations de moustiques par rapport à
l'apparition et la disparition saisonnière de la jacinthe d'eau sur les
plans d'eau (fleuve Ouémé, lac Nokoué et lagune de
Porto-Novo). Il serait aussi souhaitable d'orienter les recherches
ultérieures sur d'autres plantes flottantes comme Nymphea lotus,
Pistia stratioites, etc., qui pourraient aussi abriter les larves de
moustiques.
La prise en compte de toutes ces mesures contribuerait à
la réussite d'une lutte efficace intégrée contre les
moustiques vecteurs, sans impacts néfastes sur l'environnement.

ADISSO, D. N., ALIA, A.R. 2005. Impact des
fréquences de lavage sur l'efficacité et la durabilité des
moustiquaires à longue durée d'action de types Olyset Net ®
et Permanet ® dans les conditions de terrain. Mémoire de fin de
formation en. ABM-DITEPAC-UAC, Cotonou. 79p.
ADJALIAN, E. J. N. 2006.
Etude de la distribution du plomb dans les systèmes aquatiques et
sédimentaires du Sud Bénin: cas du lac Nokoué.
Mémoire de fin de formation enAPEDIT-EPAC-UAC, Cotonou. 110
p.
AGOSSOU, N.C., SOURADJOU, M. M., YESSOUFOU, M. S.
2006. Impact des habitudes de lavage sur l'efficacité et la
durabilité des moustiquaires imprégnées d'insecticide
à longue durée d'action de types Permanet®.
Mémoire de fin de formation en ABM-DITEPAC-UAC, Cotonou. 81
p.
AHOUNOU, H. 2007. Ecosystèmes
menacés. Zatyah. Article. Site : BLOG de zatyah sur Requiem
pour la Jacinthe. Date de consultation : 02.04.2008. Hyperlien (url) :
http://zatyah.centerblog.net/2021007-
Ecosystèmes-menacés.
AKOUEGNINOU, A., AGBANI, P. 1998. Quelques
aspects écologiques de la distribution de Eichhornia crassipes
au Bénin. Annales de l'université de Ouagadougou,
Série b, vol iii, p. 223-236.
ANONYME. 2006. Rapport
?Problématique sur la jacinthe d'eau?. Projet d'un
Fleuve à l'autre. 15p. Site :www.usgl-glu.org. Date de
consultation : 12.05.2008. Hyperlien (url):
http://www.usgl-glu.org/myfiles/Proliferation.
pdf
AYIHONSI, S. 2006. Effets des stocks d'azote
et de phosphore sur la distribution des plantes flottantes sur les eaux du lac
Nokoué: cas de la jacinthe d'eau (République du Bénin).
Mémoire de fin de formation en APE-DIT-EPAC-UAC, Cotonou. 73
p.
AYITCHEDJI, A.M. 1990. Bioécologie de
Anopheles melas et de Anopheles gambiae s.s. Comportement des
adultes vis-à-vis de la transmission du paludisme en zone
côtière lagunaire, République du Bénin.
Mémoire de fin de formation en TLM-DETS-CPU-UNB, Cotonou.
76p.
BABU, R.M., SAJEENA, A. SEETHARAMAN, K.
(2003). Bioassay of the potentiality of Alternaria alternata
(Fr.) Keissler as a bioherbicide to control water hyacinth and other
aquatic weeds. Cro p. Prot. 22, p. 1 005-1013
BODO, R. 2005. Développement d'une
approche environnementale pour l'exploitation rationnelle des plantes
envahissantes à des fins de valorisation. Application à la
jacinthe d'eau ou Eichhornia crassipes. Résumé de
Thèse de Doctorat, Université de Québec à
Montréal. 2 p. Site : UQAM. Date de consultation :
02.04.2008. Hyperlien (url) :
http://doctoratenv.uqam.ca/cgi-bin/these.cgi?these=BODR
28086903
DAGNO, K., LAHLALI, R., FRIEL, D., BAJJI, M., JUAKLI,
H. 2007. Synthèse bibliographique: problématique de la
jacinthe d'eau, Eichhornia crassipes, dans les zones tropicales et
subtropicales du monde, notamment son éradication par la lutte
biologique au moyen des phytopathogènes. Vol 11(2007), n°4:
299-311. Article. Date de consultation : 03.04.2008. Hyperlien (url):
http://popups.ulg.ac.be/Base/document.php?id=1706
DARRIET, F. 1998. La lutte contre les moustiques
nuisants et vecteurs de maladies, Khartala- orstom, Paris. 91 p.
DELACROIX, P. Cycle de reproduction du
moustique. Site :ARDA. Date de consultation : 20.06.2008. Hyperlien (url) :
http://pagesperso-
orange.fr/SVT.ocean
indien/cyclemoustique/cycle_moustique.htm
FIOGBE, E., D. 2008. Recensement des plans
d'eau infestés par les plantes aquatiques proliférantes.
Rapport d'étape N°2. Projet Gestion Intégrée des
Plantes Aquatiques Flottantes en Afrique, 36 p.
GNOHOSSOU, P.M. 2006. La faune benthique
d'une lagune ouest africaine (le lac Nokoué au Bénin),
diversité, abondance, variations temporelles et spatiales, place dans
sla chaîne trophique. Thèse de doctorat, Institut National
Polytechnique de Toulouse, 169 p.
GUILLAUMOT, L. 2006. Les moustiques et la
dengue. Institut Pasteur de
Nouvelle Caledonie. 15 p. Article.
Site: Institut Pasteur. Date de consultation : 04.07.2008. Hyperlien (url)
:
http://www.institutpasteur.nc/article.php3?id_article=78
HOUINSOU, F. 1999. La jacinthe d'eau. Bulletin
occasionnel d'information N° 001. Division de phitiatrie IITA -
Bénin. 2p.
IROKO, F. A. 1994. Une histoire des hommes et
des moustiques en Afrique. Côte des esclaves (XVIe -
XIXe siècle). L'harmattan, 1994. Racines du
présent. 169 p.
KIKI, P. 2003. Pollution azotée et
phosphatée dans les zones humides du sud-Bénin et impact sur la
diversité zooplanctonique: cas de la lagune de Porto-Novo.
Mémoire de fin de formation en APE-DIT- CPU-UAC, Cotonou. 71
p.
LEITE, E., KASISI, R., JACOBS, P.
2004: Stratégies de gestion durable des
écosystèmes aquatiques en Afrique : le cas du complexe lac
Nokoué- lagune de Porto-Novo au Bénin. Faculté de
l'Aménagement, Université de Montréal, Canada. 1
p.
http://syfia-grands
lacs.info/index.php5?view=articles&action=voir&idArticle=889&PHPSESSID=4106930e
012 bba97e3f2 5eb5ccc812b5
:
NSHIMIRIMANA, D. 2008. Le lac Tanganyika :
lutte inégale entre la jacinthe d'eau et les Burundais. 1 p.
Article. Site : syfia grand lac. Date de consultation : 04.07.2008.
Hyperlien (url)
OEPP, 2006. Eichhornia crassipes dans
la région OEPP. Service d'information no. 11. pp. 23- 25
OMS, 2003. Entomologie du paludisme et
contrôle des vecteurs: Guide du stagiaire. Provisoire, OMS,
Genève. 102 p.
PHETSOUVANH, R., SIDAVONG, B. 2003.
Moustiques et Santé Publique, éléments d'entomologie
générale et principes de base de la démoustication.
Rattanaxy. IFMT- 2003. 59 p.
QAISAR, M., ZHENG, P., SIDDIQI, MR., ISLAM, E., AZIM,
MR., YOUSAF, H. 2005. Anatomical studies on water hyacinth
(Eichhornia crassipes (Mart.) Solms) under the influence of textile
waste water. J. Zhejiang Univ. 6B (10), p. 991-998.
RODHAIN, F., PEREZ, C. 1985.
Précis d'Entomologie Médicale et Vétérinaire.
Maloine, s.a. 114 p.
TOSSOU, Y. 2004. Evaluation des nuisances
causées par la prolifération de la jacinthe d'eau (Eichhornia
crassipes) (Mart.) Solms-Laubach sur le lac Nokoué et la lagune de
Porto
Novo et la pollution par le dépôt des
déchets urbains sur le chenal de Cotonou (République du
Bénin). Mémoire de fin de formation en APE-DIT-EPAC-UAC,
Cotonou. 53 p.
WIKIPEDIA. Site : wikipédia. Date de
consultation : 16.06.2008. Hyperlien (url) :
http://fr.wikipedia.org/wiki/Culicidae
WILSON, J.R., HOLST, N., REES, M. 2005.
Determinants and patterns of population growth in water hyacinth. Aquatic.
Bot. 81, pp. 51-67.

Annexe 1 : Tableaux des paramètres
physico-chimiques Station de Louho
|
Eau libre
|
|
Dates
|
Température (°C)
|
pH
|
Conductivité électrique (mS/cm)
|
TDS (mg/l)
|
|
15/05/2008
|
30,8
|
6,9
|
3,72
|
1,87
|
|
22/05/2008
|
29,1
|
6,78
|
4,24
|
2,12
|
|
29/05/2008
|
29,95
|
6,84
|
3,98
|
1,99
|
|
Moyennes
|
28,93
|
6,79
|
3,87
|
2,28
|
|
Eau sous jacinthe
|
|
15/05/2008
|
29,3
|
6,93
|
3,27
|
1,83
|
|
22/05/2008
|
28,2
|
6,72
|
4,22
|
2,11
|
|
29/05/2008
|
29,3
|
6,74
|
4,13
|
2,9
|
|
Moyennes
|
29,95
|
6,84
|
3,98
|
1,99
|
Station de Ayidégbé
|
Eau libre
|
|
Dates
|
Température (°C)
|
pH
|
Conductivité électrique (mS/cm)
|
TDS (mg/l)
|
|
16/05/2008
|
30,7
|
7,02
|
0,11
|
0,04
|
|
23/05/2008
|
33,63
|
6,95
|
0,14
|
0,1
|
|
30/05/2008
|
33,67
|
7,05
|
0,1
|
0,03
|
|
Moyennes
|
32,03
|
6,82
|
0,10
|
0,05
|
|
Eau sous jacinthe
|
|
16/05/2008
|
30,5
|
6,83
|
0,11
|
0,08
|
|
23/05/2008
|
33,33
|
6,6
|
0,1
|
0,12
|
|
30/05/2008
|
33,3
|
6,98
|
0,08
|
0,04
|
|
Moyennes
|
32,03
|
6,82
|
0,10
|
0,05
|
Station de Mandja
|
Eau libre
|
|
Dates
|
Température (°C)
|
pH
|
Conductivité électrique (mS/cm)
|
TDS (mg/l)
|
|
16/05/2008
|
30,7
|
7,02
|
0,11
|
0,04
|
|
23/05/2008
|
32,8
|
7,01
|
0,1
|
0,04
|
|
30/05/2008
|
33,6
|
7,46
|
0,1
|
0,04
|
|
Moyennes
|
32,66
|
7,01
|
0,12
|
0,06
|
|
Eau sous jacinthe
|
|
16/05/2008
|
30,5
|
6,83
|
0,11
|
0,04
|
|
23/05/2008
|
32,3
|
6,73
|
0,09
|
0,05
|
|
30/05/2008
|
33,3
|
6,9
|
0,1
|
0,05
|
|
Moyennes
|
32,38
|
6,80
|
0,10
|
0,08
|
Station de Akloukpa
|
Eau libre
|
|
Dates
|
Température (°C)
|
pH
|
Conductivité électrique (mS/cm)
|
TDS (mg/l)
|
|
16/05/2008
|
32,7
|
7,02
|
0,11
|
0,04
|
|
23/05/2008
|
32,6
|
7,6
|
0,08
|
0,04
|
|
30/05/2008
|
33,25
|
6,89
|
0,1
|
0,04
|
|
Moyennes
|
32,85
|
7,17
|
0,10
|
0,04
|
|
Eau sous jacinthe
|
|
16/05/2008
|
31,89
|
6,83
|
0,11
|
0,06
|
|
23/05/2008
|
32,9
|
6,71
|
0,09
|
0,07
|
|
30/05/2008
|
32,5
|
6,53
|
0,1
|
0,06
|
|
Moyennes
|
32,43
|
6,69
|
0,10
|
0,06
|
Annexe 2 : Tableau des sels nutritifs
|
Paramètres
|
|
|
|
|
|
NH4 +
|
NO3 -
|
NO2 -
|
PO4 3-
|
|
Sites
|
|
|
|
|
|
Louho
|
0,90
|
6,60
|
0
|
1,65
|
|
Gangban
|
1,52
|
11 ,74
|
0,77
|
0,15
|
| 

