INTRODUCTION GENERALE
INTRODUCTION
L'eau côtière n'est pas un bien marchand comme
les autres mais un patrimoine qu'il faut protéger, défendre et
traiter comme tel. Le Maroc possède une richesse maritime
considérable à haute productivité biologique, qui
contribue à son développement socioéconomique. Ce domaine
marin si riche en faune et en flore impose un engagement pour la protection et
la préservation de ses ressources naturelles inestimables pour les
générations futures.
Ces dernières années le littoral subit
l'influence d'une pression démographique croissante et d'une
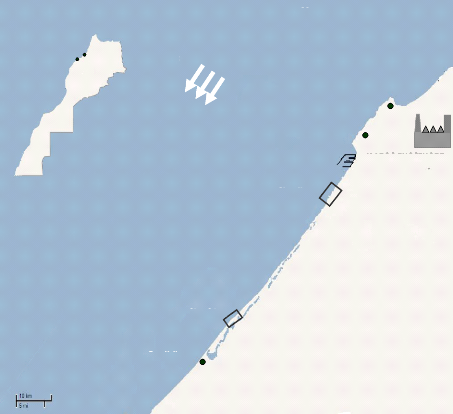
concentration industrielle importante. La région de Jorf Lasfar abritant
une industrie de traitement de minerais des phosphates (figure 1) qui
contiennent des métaux toxiques (Al, Cd, Cr, Cu, Hg, Pb etc...) connus
par leurs effets néfastes, notamment mutagènes,
cancérigènes, génotoxiques et cytotoxiques (Arisa et
Wiliams 1996 ; Bernier et al., 1995). Ces polluants divers sont rejetés
directement dans la mer et sans aucun traitement préalable, ils peuvent
induire à une eutrophisation de l'environnement marin et favoriser les
croissances des microalgues productrices de toxines marines. L'ensemble des
éléments toxiques, notamment les métaux et les toxines
marines peut avoir un impact sur la faune marine et provoquer des effets
toxiques. Par l'effet du courent du nord vers le sud (figure 1), ces polluants
rejetés dans le site JL peuvent être entraînés et
contaminer d'autre région comme celle d'Oualidia (OL) (figure 1), zone
touristique, maraîcher et d'ostréiculture connue à
l'échelle nationale et internationale. Ces déchets nocifs
rejetés dans la mer peuvent être concentrés par les animaux
filtreurs et plus particulièrement par les moules (Mytilus
galloprovincial is). Plusieurs épisodes d'intoxication voir même
des décès qui ont été déjà
observées suite à la consommation de fruits de mer en 1971
à Casablanca, Safi, Mohammedia, Rabat, etc. (Taber, 1986), en 1975
à Casablanca, Safi et Kenitra, en 1982 à Agadir (51 cas
d'intoxication et deux décès) (Bourhili, 1984), puis
récemment, plusieurs intoxications ont entraîné 23
hospitalisations et quatre décès (Tagmouti, et al., 2000).
DESA MBI Introduction générale
Casablanca El Jadida
Oualidia
Sens du courant
Site OL
Site JL
N
?
Jorf Lasfar
El Jadida
MAROC PHOSPHORE
III ET IV
Figure 1 : localisation des sites d'études (Jorf
Lasfar et Oualidia) sur la côte atlantique Marocaine
OBJECTIFS
L'objectif de cette étude est d'une part,
caractériser le danger par dosage des métaux toxiques (Al, Cd,
Cr, Cu et Pb) dans les moules séchées issues de deux sites
situés sur la côte atlantique Marocaine : Jorf Lasfar, Site
potentiellement pollué par les rejets chimiques des traitements des
phosphates bruts, situé à 125 km au sud de Casablanca et
Oualidia, site agricole et touristique situé à 45 km au sud de JL
(figure 1). D'autre part, tester in vivo sur des rats la toxicité
subchronique, en fonction des quantités des moules séchées
ingérées par intubation gastrique et pendant 28 jours, tout en
évaluant :
La masse corporelle des rats ;
Le taux des métaux toxiques (Cd, Cr et Pb) dans les
organes cibles (foie et reins) ; Le taux des différentes lignées
de la moelle osseuse hématopoïétique
REVUE BIBLIOGRAPHIQUE
I. LES MOULES
I.1. Choix des moules
Les organismes marins plus particulièrement les moules,
concentrent les contaminants, en particulier les métaux, en fonction des
concentrations présentes dans le milieu (Goldberg, 1975; Philips, 1977;
Philips et Segar, 1986). C'est dans cette optique que Goldberg (1975) a
proposé de suivre, à l'échelle internationale, les
concentrations des contaminants dans les organismes vivants pour surveiller le
milieu marin. En effet, ces bivalves présentent des
caractéristiques, qui en font de bons bioindicateurs très
largement utilisés dans divers programmes de surveillance de la
pollution des milieux marins. Elles ont été choisies pour les
raisons suivantes :
) Large répartition géographique allant des
régions tempérées aux régions subarctiques; ? Mode
de vie sessile et euryhalin ;
? Faculté d'accumuler des métaux présents
dans le milieu récepteur
? Tolérance à différents stress ;
? Possibilité de les transplanter ;
? Consommation par l'homme donc elles sont un vecteur de
contamination.
I.2. Anatomie
Les moules contiennent deux valves lisses ou coquilles
extérieures protectrices (figure 2), ces coquilles sont sous forme
subconique de couleur noire bleuâtre et sont maintenues ensemble par une
petite charnière droite. Elles possèdent deux muscles adducteurs
inégaux qui leurs permettent d'ouvrir et de fermer leur coquille (figure
3). La moule se déplace lentement à l'aide de son pied pour
trouver le meilleur emplacement de fixation. Le byssus est faisceau de
filaments soyeux secrétés par une glande situés au dessous
du pied, il permet la fixation de la moule sur un support.
I.3. Mode de vie
La respiration chez les moules (figure 4) se fait en filtrant
activement l'oxygène dans l'eau a l'aide des branchies, les mollusques
filtreurs se nourrit principalement de phytoplancton et d'autres
matières organiques, la croissance de moule est optimale dans un milieu
où la nourriture est riche et abondante. Les moules vivent partout dans
le monde, dans les eaux polaires, tempérées, peu profonds et
légèrement saumâtres, elles se trouvent également
dans des milieux très profonds a forte salinité en haute mer.
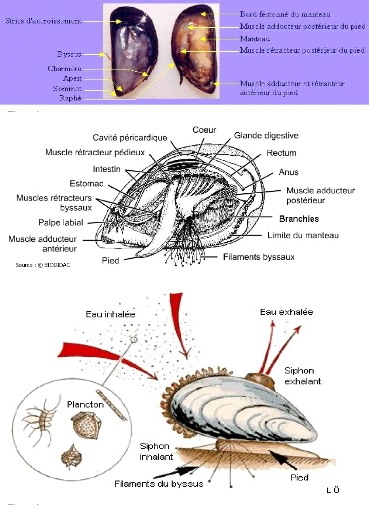
Figure 2 : Chaire et coquille d'une moules
(Mytilus).
Figure 3 : Principaux
éléments anatomiques interne d'une moules.
Figure 4 : Mode de vie des
moules.
II. DONNES TOXICOLOGIQUES
II.1. Pollution de la côte Atlantique
Marocaine
La côte atlantique marocaine contribue en grande partie
à l'économie nationale, du fait de la concentration industrielle
(80 % des effectifs permanents des industries), touristique (50 % de la
capacité d'accueil) et commercial (92 % du commerce extérieur)
(REEM, 1999).
En effet cette industrialisation croissante a
été accompagnée d'une pollution inquiétante et
représente une menace pour la préservation de la richesse en
faune et en flore marine (Chafik et al., 2001). Quant à
l'appauvrissement biologique, les pertes de la biodiversité, les
problèmes de la pêche, la dégradation des sites
d'intérêt biologique, historique et culturel, ne peuvent
être, que des signes alarmants de l'état critique du littoral
atlantique marocain.
Certaines substances polluantes telles que les pesticides, les
hydrocarbures et les déchets issues de traitement des minerais de
phosphate (métaux, phosphate, sulfate, nitrates, chlorures...)
(Kaimoussi et al., 2001) sont souvent, déversées dans la
mer et accumulées par les organismes marins, leurs concentration
s'amplifient à travers les maillons de la chaîne trophiques. La
qualité des eaux côtières atlantiques marocaines a
été suivie de 1993 à 1996, dans le carde d'un programme de
surveillance, visant à évaluer l'état des lieux du
littoral atlantique marocain, par Chafik et al., (2001), Ce qui a pu
montrer des concentrations importantes en nitrates, en oxygène dissous,
matière en suspension, révélant ainsi la trace des
émissaires d'eaux usées urbaines et industrielles, notamment
à Mohammedia, Casablanca, Kenitra, Jorf Lasfar et Safi. Dans l'axe El
Jadida-Safi des teneurs élevées en métaux ont
été mesuré chez M. galloprovincialis, d'origine
industriels (traitement de minerais de phosphate) (Chafik et al., 2001
; Kaimoussi et al., 2001). Cette contamination par les métaux
toxiques (Al, Cd, Cr, Cu...) est accentuée ces dernières
années, et les concentrations mesurées dépassent
largement les normes internationales (Moustaid et al., 2005).
Dans certaines conditions de pollution marine, des
micro-algues peuvent produire des toxines qui se concentrent dans les moules,
dont la consommation engendre des intoxications chez l'homme (Yasumoto et
al., 1984 ; Wright et al., 1989). Les toxines marines (l'acide
okadaïque et ses dérivés) sont impliquées dans la
peroxydation lipidique et l'inhibition de la synthèse d'ADN et des
protéines (Matias et al., 1999 ; Traoré et al.,
2001). Des études de cytotoxicité sur des cellules intestinales
humaines (Caco-2) (Traoré et al., 1999 et 2000) ont
montré que des métaux lourds, en particulier le Cd, et des
toxines marines ont un effet synergique dans la peroxydation lipidique et dans
la modification des bases puriques et pyrimidiques (m5dC, 8-OH-dG).
Au Maroc, en 1999, date à la quelle une eau
colorée à Lingulodinium polyedrum est survenue le long
des côtes marocaines atlantiques. Observée au début dans la
région de Kenitra, elle s'est étendue avec la dérive
littorale jusqu'au sud de Safi et a touché, au passage, une zone soumise
à une surveillance sanitaire. Cette zone comprend d'importants gisements
naturels de moules et de palourdes, ainsi que les sites exploités
d'Oualidia et de Sidi Moussa. Cette efflorescence est apparue pour des
températures des eaux superficielles (17-18 °C) propices au
désenkystement et au développement du dinoflagellé. Le
schéma observé de deux à trois bandes parallèles
à la côte a suggéré une agrégation du
phytoplancton générée par des vagues internes
engendrées par les vents modérés de direction et de
vitesse constantes. Les toxines de type diarrhéique trouvées dans
certains coquillages (moules, huîtres) ne peuvent être le produit
de L. polyedrum mais plutôt d'espèces accompagnatrices
telles Dinophysis acuminata et D. acuta qui ont
été dénombrées par Joutei, (2002).
II.2. Les métaux toxiques
Si les métaux sont souvent indispensables au
déroulement des processus biologiques (oligoéléments),
nombre d'entre eux peuvent s'avérer toxiques, lorsque leur concentration
dépasse un seuil, c'est le cas du Fe, Cu, Zn, Ni, Se, Mo et Mn (Miquel,
2001). D'autres ne sont pas nécessaires à la vie et peuvent
être même néfastes comme As, Cd, Cr, Hg, Pb et Sb,
(Chiffoleau et al., 2001)
II.2.1. Le Cadmium
Le cadmium est toxique pour l'homme et une exposition
excessive pourrait causée la mort (Othumpangat et al., 2005),
Il s'introduit dans les cellules et s'accumule en grande concentration dans
l'espace cytoplasmique et nucléaire (Beyersmann et al., 1997;
Satoh et al., 2003). Il a une forte affinité pour le foie et
les reins (Cai et al., 2001), Chez l'homme, le phénomène
de toxicité aiguë est connu depuis 1950 sous le nom de syndrome
d'Itai-Itai défini par l'association d'une insuffisance rénale
avec ostéoporose (déminéralisation et fragilisation des
os) et ostéomalacie (déminéralisation et
déformation des os). Il est cancérigène (Satoh et
al., 2002; Banerjee et al., 2005) et tératogène
(Hovland et al., 2000). L'effet génotoxique et apoptotique a
été observé dans plusieurs type de cellules (Fahmy et
al., 2000; Kim et al., 2005; Mondal et al., 2005). Le
comité mixte FAO/OMS, a recommandé chez l'homme une dose
hebdomadaire tolérable (DHT) de Cd, de 7 ìg/ kg de poids corporel
et par semaine.
II.2.2. Le Plomb
Le seuil de qualité sanitaire réglementaire est
de 1,5 mg/kg dans l'alimentation selon le règlement européen CE
221/2002. C'est un élément toxiques (Le Roux et al.,
2005). Plusieurs recherches ont prouvé que le plomb peut causer des
troubles neurologiques, hématologiques, gastro-intestinales,
reproductives, immunologiques et apoptotiques (Patrick, 2006 ; Xu et
al., 2008). En outre, l'acétate et le phosphate de plomb sont
classés parmi les agents concérigènes (NIEHS, 1994),
l'agence internationale de la recherche sur le cancer a classé aussi cet
élément dans la liste des composés inorganiques 2B
(l'agent est peut-être cancérogène pour l'homme) des
produits chimique (IARC, 1987; Pulido et Parrish, 2003). Des études
récentes, ont montré que le Plomb inhibe l'activité des
enzymes impliquées dans le stress oxydatif (glutathione peroxidase,
catalase et desuperoxide dismutase) (Bolin et al., 2006; Ercal et
al., 2001). D'autres études in vitro ont montré
l'augmentation de la production des radicaux libres après traitement
avec le Plomb inorganiques (Aykin-Burns et al., 2005, Chen et
al., 2003). Risom et al. (2005) ont démontré que
les radicaux libres sont responsables, d'une manière directe ou
indirecte, de nombreux dommages oxydatifs (figure 5) au niveau des
macromoléculaire (acides nucléiques, protéines,
lipides...), les résidus acides gras polyinsaturés de
phospholipides membranaires et des lipoprotéines, sont extrêmement
sensibles à l'oxydation, initiant ainsi des chaînes de
peroxydation lipidique en produisant des aldéhyde et principalement le
malonyle dialdehyde (M DA). Ces deux produits notamment les radicaux libres et
le MDA induit d'irréversible dommages dans l'ADN, ainsi qu'un
dysfonctionnement mitochondrial (Xu et al., 2008).
II.2.3. Le Chrome
Le chrome s'accumule principalement dans les poumons, il est
hautement toxique. Une intoxication aiguë peut provoquer une
tubulonéphrite et une intoxication chronique au chrome développe
des lésions cutanées et des muqueuses avec des atteintes
respiratoires allant jusqu'à des cancers broncho-pulmonaires (Rodier
et al., 1996). Le Cr (VI) pénètre les cellules a travers
le système de transport des ions, une fois à l'intérieur
de la cellule il est réduit en Cr (III) (Goodale et al., 2008).
Cette forme réduite du Cr et/ou un ou plusieurs des
intermédiaires,est probablement un ultime agent génotoxique et
susceptible d'inciter des cassures au niveau du double brin d'ADN (Xie et
al., 2005 ; Goodale et al., 2008).
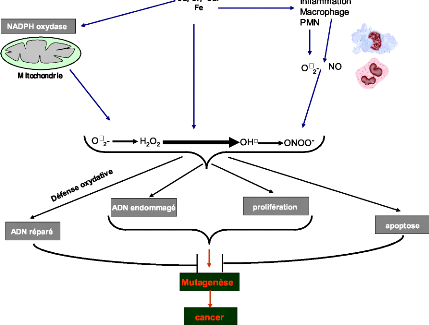
Figure 5 : Mécanismes d'induction du stress
oxydatif par les métaux toxiques. Proposé par Risom et al.
2005.
II.3. Les toxines marines
Si les efflorescences phytoplanctoniques toxiques ou non, ne
sont pas des phénomènes d'origine récente, leur
implication dans la mortalité massive de poissons et dans les
problèmes de la consommabi lité des coquillages, est une
préoccupation majeure de ces dernières années.
Les algues microscopiques planctoniques constituent la
nourriture de base pour un bon nombre d'organismes vivants des océans,
notamment pour les bivalves filtreurs commercialisés (moules,
huîtres, coquilles Saint-jacques, palourdes) ainsi que pour les larves de
crustacés et de poissons. Dans la plupart des cas, les
proliférations ou les efflorescences algales sont
bénéfiques pour la faune et l'aquaculture. Toutefois sous
certaines conditions hydrologiques et climatologiques, des espèces
peuvent se développer si intensément qu'elles en arrivent
à modifier la couleur apparente de la surface des mers et à
conduire à des épisodes d'eaux colorées (Reizopoulou
et al., 2008). L'origine algale de certaines intoxications faisant
suite à la consommation de produits de la mer n'a été
découverte qu'en 1937 par Sommer et Meyer pour les toxines paralysante
PSP (parlytic Shllfish poisoning) et en 1979 pour la ciguatera (Yasumoto et
al., 1979). Au cours de ces dernières années les eaux rouge
comme les épisodes phytoplanctoniques néfastes sont en expansion
tant par leur nombre, que par leur fréquence et intensité
(Anderson, 1989 ; hallegraeff, 1993). Certains scientifiques pensent que la
multiplication de ces épisodes nuisibles, est reliée ces
dernières années dans certains cas à des processus
d'eutrophisation et/ou des conditions climatiques anormales. Les
activités de transports (eaux de ballast contenant des kystes
d'espèces toxiques) et d'aquacultures ont également
été mises en cause dans l'extension géographique des
efflorescences.
II.3.1. Les toxines diarrhéiques (DSP) (figure
6)
Il s'agit de polyéthers linéaires qui sont
produits par les genres Dinophysis et Prorocentrum. L'acide Okadaïque (AO)
est la phycotoxine la plus répandue, mais selon l'espèce algale
en cause, l'AO est substitué en DTX1 (dinophysistoxine) ou DTX2. L'AO
est un inhibiteur de phosphatases, enzymes impliquées dans les processus
de la multiplication cellulaire, l'inhibition de ces dernières
entraîne une accumulation de protéines phosphorylées dans
le cytoplasme, ce qui peut résulter d'une contraction des muscles lisses
et expliquer l'activité de promotion tumorale démontrée
chez la souris (Arendt et al., 1995 et Chen et al., 2006).
II.3.2. Les toxines paralysantes (PSP) (figure 7)
Elles comprennent les saxitoxines et les gonyautoxines dont on
dénombre aujourd'hui un peu plus d'une vingtaine de molécules
dont le squelette moléculaire commun est la saxitoxine (STX) produite
par des Dinoflagellés du genre Alexandrium (Lassus et al. 1994,
Amzil et Motteau 2000). Ces intoxications entraînent une paralysie
musculaire et, dans les cas les plus graves, peuvent être mortelles
lorsque le système respiratoire est atteint. La STX agit en bloquant les
canaux Na+, empêchant la naissance d'un potentiel d'action au
niveau des cellules excitables, ce qui peut entraîner la mort par
paralysie des muscles respiratoires quand la dose est suffisante (Cheun et
al., 1996). La DL50 sur souris de la STX est de 10
ìg.kg-1. (Cheun et al., 1998).
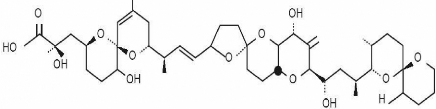
Figure 6 : Structure chimique de L'acide
okadaique
Figure 7 : Structure chimique de la
Saxitoxine
III. LA MOELLE OSSEUSE
HEMATOPOÏTIQUE
La majorité des cellules sanguines matures sont
destinées à vivres quelque heures (polynucléaires), voir
quelques semaines (globules rouges) avant d'être détruites. A fin
de compenser cette destruction rapide, la moelle osseuse hematopoïtique,
chez un homme de 60 kg doit assurer 2.1011globules rouges et
1,6.109 polynucléaires par jours. Cette intense production
journalières a lieu dans la moelle osseuse hematopoïtique et
réglée par un système très complexe, de facteurs de
croissances et d'inhibitions, le tout dans un écosystème
très adapté (microenvironnement médullaire), on distingue
quatre compartiments, d'importance inégale, dans un système
hematopoïtique (figure 8) :
? Le compartiment des cellules souches
hematopoïtiques : Dans la moelle osseuse des cellules
mères dites cellules souches hematopoïtiques destinées
à assurer le renouvellement de l'ensemble des cellules sanguines,
myéloïdes et lymphoïdes, ces cellules souches
hematopoïtiques ont une capacité d'autorenouvellement et de
différenciation, elles sont identifiées comme cellules souches
hematopoïtiques totipotentes.
? Le compartiment des progénitures
engagés : Ces cellules sont engagées dans une ou
plusieurs voies de différenciation, leurs capacité
d'autorenouvellement est réduite, ce processus d'engagement aboutit
finalement a des progénitures totalement
prédéterminées, différenciées en une seules
lignée, on distingue :
· Des progénitures myéloïdes.
· Des progénitures lymphoïdes.
? Le compartiment des précurseurs
hematopoïtiques : Ce sont des cellules morphologiquement
reconnaissables engagées vers une ou l'autre des lignées
sanguines, ces cellules sont encore capables d'un nombre limité de
mitose.
Le compartiment des cellules matures : Le
processus de différenciation et de maturation des cellules
médullaires, se déroulent sur plusieurs générations
cellulaires et aboutit à la formation des cellules matures
médullaires, qui résident dans la moelle osseuse, il s'agit des
lignées érythroblastiques, mégacaryocytaires,
granulo-moncytaires et lymphoïdes visibles. Cependant le taux de chaque
lignée différent d'un individu à l'autre et de grandes
variations peuvent apparaître chez les sujets sains (tableau I). Elles
sont dues à un facteur de subjectivité. C'est notamment le cas de
la classification cellulaire. Elles peuvent aussi être inhérentes
aux variations individuelles (Guelfi, 1993 ; Tyler et al., 2000). Le
terme hématopoïèse désigne l'ensemble des
mécanismes, qui assurent le remplacement continu et régulé
des éléments
Tableau I : Répartition normale des
cellules médullaires chez le chien et le chat. A (Jain, 1993), B
(Guelfi, 1993), C (Jain, 2000) et D (Meinkoth, 2000).
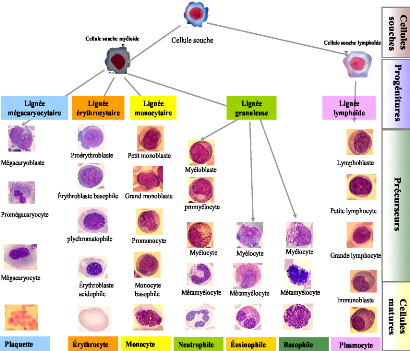
Figure 8 : les différents compartiments de la
moelle osseuse hématopoïétique.
figurés dans le sang (globules rouges, globules blancs
et plaquettes). Le sang est essentiellement un milieu de rencontre de ces
éléments qui ont des fonctions différentes, leur mode de
fabrication n'est pas homogène et l'on doit bien distinguer, dans la
moelle osseuse hematopoïtique, les éléments du tissu
lymphoïde et les éléments de tissu myéloïdes.
III.1. La lignée lymphoïde
Les lymphocytes sont morphologiquement de petites cellules
à fort rapport nucléocytoplasmique (figure 8). Sur un
myélogramme, la classification morphologique des lymphocytes est la
suivante :
? Petit lymphocyte : C'est une cellule
arrondie de 7 à 10 .jm de diamètre, il est
caractérisé par un noyau volumineux, arrondi, excentré
présentant parfois une encoche et une chromatine dense, mottée et
violet foncé. Il a un cytoplasme bleuté.
? Lymphocyte moyen à grand : C'est
une cellule de 10 à 15 .jm de diamètre au rapport
nucléocytoplasmique moins élevé que celui du petit
lymphocyte. son noyau est arrondi ou ovalaire, avec une chromatine en mottes
mal délimitées et un nucléole parfois visible. Le
cytoplasme est incolore à bleu clair et un peu plus abondant que dans
les petits lymphocytes.
? Lymphoblaste : C'est une cellule d'environ
20 .jm de diamètre, son noyau est volumineux parfois indenté ou
irrégulier, avec une chromatine fine, poussiéreuse ou
réticulée, et de nombreux nucléoles proéminents. Le
cytoplasme bleu clair à bleu soutenu.
? Plasmocyte : C'est une cellule ovalaire de 15 à 20
.jm de diamètre. Son noyau est excentré, avec une chromatine en
grosses mottes disposées souvent en rayons de roue. Le cytoplasme est
fortement basophile à l'exception d'une zone claire
périnucléaire représentant l'emplacement de l'appareil de
Golgi. Parfois, le cytoplasme contient des structures vacuolaires, claires,
arrondies, appelées corps de Russell qui représentent les aires
du réticulum endoplasmique granuleux dilaté par des
immunoglobulines (AbellaBourgès et al., 2005).
III.2. La lignée myéloïde
Les éléments du tissu myéloïde ont
entre eux de nombreux points communs (figure 8). Ils sont produits à
partir de précurseurs uniques : les cellules souches
myéloïdes. Dans la moelle, tous ces éléments
subissent deux types essentiels de modifications : d'une part elles se
multiplient, d'autre part elles se différencient, c'est-à-dire
qu'ils acquièrent une spécialisation adapté à leur
fonction.
III.2.1. La lignée Erythroïde
De façon synthétique, la lignée
érythroïde correspond à l'ensemble des cellules
précurseur des hématies (figure 8). Morphologiquement, au cours
de leur évolution du stade le plus immature au stade le plus proche
d'une hématie, on observe une réduction de taille de la cellule,
une réduction du rapport nucléocytoplasmique, une condensation de
la chromatine nucléaire et une acidophile progressive du cytoplasme
consécutive à la synthèse d'hémoglobine. Dans la
moelle osseuse, les cellules de la lignée rouge sont regroupées
en îlots érythroblastiques, centrés le plus souvent sur un
macrophage. Quatre stades successifs sont morphologiquement définis : le
proérythroblaste, cellule la plus jeune; l'érythroblaste
basophile; l'érythroblaste polychromatophile; l'érythroblaste
acidophile. Ces quatre stades morphologiques peuvent aussi être
répartis en deux compartiments en fonction de l'activité de
division ou de maturation des cellules. Le compartiment de multiplication ou de
prolifération comprend proérythroblaste, érythroblaste
basophile et érythroblaste polychromatophile. La phase de maturation qui
suit est caractérisée par l'arrêt de mitoses et correspond
au passage du stade érythroblaste acidophile à celui de
réticulocyte. L'érythroblaste acidophile ne se divise plus; il
expulse les reliquats condensés du noyau et se transforme en
réticulocyte (Jain et al., 1986 ; Tyler et al.,
1999).
III.2.3. La lignée granulocytaire
Les polynucléaires sont caractérisées
par leur noyau plurilobé (figure 8). Ils sont tous riches en
granulations lysosomiales. On distingue trois types, en fonction de la
coloration des grains de leur cytoplasme : les polynucléaires
neutrophiles, éosinophiles et basophiles. Ces trois types de
polynucléaires sont issus en fait, de trois lignées bien
distinctes de la moelle osseuse.
III.2.3.1. Les polynucléaires neutrophiles
Caractérisés par l'aspect de leurs
granulations, ce sont quantitativement les plus nombreux et les mieux connus
(figure 8). Ils jouent un rôle essentiel dans la destruction des
bactéries et l'inflammation tissulaire. Morphologiquement, on distingue
dans la moelle osseuse, par ordre de maturation croissance : le
myéloblaste, le promyélocyte, le myélocyte, le
métamyélocyte et le polynucléaire neutrophile. La
lignée neutrophile représente le taux le plus élevé
des éléments de la moelle osseuse hematopoïtique. Le
pourcentage des différents éléments est d'autant plus
élevé qu'ils sont plus mûrs. La durée de la
granulopoïèse neutrophile n'est pas connue avec certitude. Elle est
d'environ 10 jours.
III.2.3.2. Les polynucléaires
éosinophiles
La lignée granulocytaire éosinophile est une
lignée indépendante des granulations neutrophiles,
caractérisée par des granulations cytoplasmiques
différentes (figure 8). La première cellule de la lignée
granulocyte éosinophile, qui contient des granulations,est en effet
distinguable du myéloblaste de la lignée neutrophile, on trouve,
dans la lignée granulocyte éosinophile, comme dans la
lignée granulocyte neutrophile, un promyélocyte, un
myélocyte, un métamyélocyte et un polynucléaires
éosinophile.
III.2.3.3. Les polynucléaires basophiles
Les polynucléaires basophiles sont les plus rares des
trois lignées types polynucléaires (figure 8), ressemblent
beaucoup aux mastocytes, dont ils semblent cependant indépendant. Leur
fonction, est la libération de l'histamine qui entraîne, à
l'intérieur du corps, un état de choc anaphylactique.
III.2.3. La lignée monocytaire
Les cellules de la lignée monocytaire
représentent un faible pourcentage des cellules médullaires
totales (figure 8). Les monoblastes ne peuvent être
différenciés des myéloblastes en microscopie photonique;
les promonocytes sont morphologiquement semblables aux myélocytes et aux
métamyélocytes neutrophiles sur des myélogrammes
colorés par le MGG. Le monocyte est en revanche assez facile à
identifier et présente une cytologie semblable au monocyte sanguin :
· Assez grande cellule (15 à 20 tm) à
contours souvent festonnés, mal délimités ;
· Cytoplasme légèrement basophile, contenant
de fines granulations azurophiles ;
· Noyau moins lobé que celui des granulocytes et
à chromatine moins dense
MATERIEL ET METHODES
I. SITES DE PRELEVEMENT
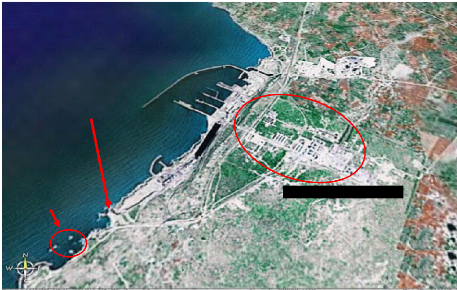
I.2. Site Jorf Lasfar (figure 9).
Situé sut le littoral atlantique Marocain, à 25
km au sud-ouest d'EL Jadida, le site JL est la future seconde zone industrielle
au Maroc, il abrite principalement le complexe chimique d'industrie
Maroc-Phosphore III et IV de phosphate, la centrale thermique ainsi que le
port.
I.2. Site Oualidia (figure 10)
Le site Oualidia est situé sur le littoral atlantique
Marocain, à 45 km au sud de JL et à 10 km au nord de la ville
Oualidia, c'est un site agricole et touristique réputé pour ses
lagunes d'ostréiculture.
II. LES MOULES
II.1. Systématique
Les moules que nous avons utilisé lors de cette
étude appartiennent aux systématiques suivantes :
V' Embranchement : Mollusques.
V' Classe : Bivalves.
V' Ordre : Lamellibranches.
V' Super famille : Mytilidae.
V' Famille : Mytilidae.
V' Genre : Mytilus.
V' Espèce : Mytilus galloprovincialis
II.2. Prélèvement des
échantillons
Sur les deux sites, les moules de tailles similaires (5
à 6 cm) sont prélevées à la main à
marrée basse, à différentes périodes (juin à
octobre 2004). Elles sont rincées délicatement à l'eau de
mer sur les lieux de prélèvement, puis placées dans des
sachets de polyéthylène puis transportées au laboratoire
dans des glacière à 4 °C et stockées à
-28°C jusqu'à utilisation.
II.3. préparations des doses
les moules congelées sont décortiquées
égouttées, pesées puis séchées de
façon à former une préparation stable dans une
étuve portée à 60°C, pendant des intervalles de temps
réguliers (12h), les échantillons sont pesés
jusqu'à l'obtention d'une masse constante. On prépare une
suspension mère (SM) comme suit : 600 mg de moules séchées
et finement broyées dans un mortier, sont mises en suspension dans 10 ml
d'eau ultra pure et thuraxés à l'ultra thurax, deux fois pendant
2 min puis la SM est diluée au 1/2 et au 1/1 0.
Site de prélèvement
Emissaire des rejets
Maroc Phosphore III et IV
Figure 9 : photo prise par satellite du site de
prélèvement : Jorf Lasfar.

Oualidia
Site du prélèvement
Figure 10 : photo prise par satellite du
site de prélèvement : Oualidia.
III. DOSAGE DES METAUX
III.1. Minéralisation des
échantillons
0,5 g de moules séchées ou à 1 g
d'organes des rats (foie, rein), on ajoute 10 ml d'acide nitrique (HNO3)
concentré Merck (Parc tertiaire de la Meinau, Strasbourg ;
qualité Suprapur) et 4 ml d'acide sulfurique (H2SO4) concentré
Merck (Parc tertiaire de la Meinau, Strasbourg ; qualité Suprapur) dans
un matras. Le mélange est mis au repos pendant 12 h, puis placé
dans un digesteur à micro-ondes (Maxidigest, Prolabo, France), muni d'un
système d'addition d'eau oxygénée pour
minéralisation. Le volume de chaque minéralisât est
complété à 20 ml avec de l'eau ultra pure (Moustaid et
al., 2005 ; Vaidya et Rantala, 1996). Un essai à blanc sans moule
est traité puis analysé dans les mêmes conditions.
III.2. Dosage des métaux
Les métaux (Al, Cd, Cr, Cu et Pb) ont
été analysés comme décrit par Vaidya et Rantala
(1995) à l'aide d'un spectromètre d'Absorption Atomique
électrothermique (SAAE), avec un four graphite GTA et d'un injecteur
automatique, en utilisant un modèle Varian A 300 équipé
d'un système de correction Zeeman et un logiciel
d'autocontrôle.
IV. LES RATS
IV.1. Traitement des animaux
Les rats utilisés (35 rats) de souche Wistar (centre
d'élevage DEPRE, Saint-Doulchard, France), de masse moyenne 74,47 #177;
3 g, sont répartis en 7 lots de cinq rats (figure 11). Un contrôle
parsitologique, bactériologique et virologique a été
réalisé par l'unité vétérinaire et
agroalimentaire du laboratoire de Touraine (France), sur trois rats s'est
révélé négatif. Les rats ont été
acclimatés aux conditions expérimentales du laboratoire pendant 5
jours avant le gavage. Le traitement des rats a été fait par
intubation gastrique à l'aide d'une sonde spéciale. Des
homogénats ont été préparé à des
quantités équivalentes de différents échantillons
de moules prélevées à différentes périodes
(mai à octobre 2004) issues de chaque site OL et JL, Chaque lot est
ensuite traité avec la dose 6, 30 et 60 mg/ 100 g de poids vif, 1 fois
toutes les 24 heures pendant 28 jours. Le lot témoin a été
gavé dans les mêmes conditions avec de l'eau ultra pure.
IV.2. Prélèvement des organes
Après le dernier jour de traitement, les rats sont
placés dans des cages métaboliques pendant 24 h afin de collecter
les urines sans contamination fécale. Les animaux sont alors
pesés et sacrifiés par décapitation. Les organes (coeur,
rein, foie et cerveau) sont prélevés et pesés. Les
échantillons (urine et organes) sont immédiatement stockés
à -28 ?C jusqu'à utilisation.
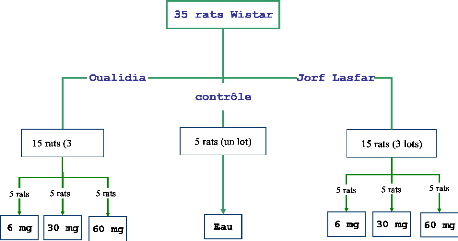
Figure. 11 : Répartition des rats destinés
au gavage avec la poudre de moules JL et OL
V. ETUDE CYTOLOGIQUE
V.1. Prélèvement des cellules et
préparation des lames
L'os fémur a été coupé aux
extrémités immédiatement, puis le tissu médullaire
est récupéré le plus vite possible dans un milieu de
culture de type RPMI1640, le culot est récupéré
par centrifugation à 4000 rpm ensuite, le culot est repris dans minimum
de milieu de culture. Sur des lames dégraissées, la suspension
cellulaire précédemment préparé est
déposé puis étalé sans écrasement des
cellules, après séchage à température ambiante,
elles sont ensuite colorées avec Giemsa diluée au 1/10.
V.2. Lecture des lames
La lecture a été réalisée sur 1000
cellules par lame au microscope photonique à l'objectif 1 00X. Puis on
réalise une formule complexe en comptant tout d'abord le taux respectif
de chaque lignée (figure 8, page 15) :
La lignée granulocytaire (neutrophile,
éosinophile et basophile): le myéloblaste, le
promyélocyte, le myélocyte, le métamyélocyte, le
granulocyte non segmenté et le granulocyte neutrophile.
La lignée lymphoïde : le
lymphoblaste, le petit lymphocyte; le grand lymphocyte et le plasmocyte.
La lignée monocytaire : le monoblaste, le
promonocyte et le monocyte.
La lignée érythrocytaire :
Proérythroblaste, Erythroblaste basophile, Erythroblaste
plychromatophile, Erythroblaste acidiphile et Erythrocyte.
VI. L'ANALYSE STATISTIQUE
Les résultats sont présentés sous forme
de moyennes #177; SEM (erreur standard sur la moyenne) et analysés pour
les différences significatives en utilisant un test non
paramétrique de :
· Wilcoxon Rank Sum Test pour p <0,05.
pour le dosage des métaux toxiques dans les moules.
· Friedman, pour p <0,05 pour
déterminer la significativité globale (résultats du dosage
des métaux dans les organes et ceux de la moelle osseuse) et avec des
comparaison multiple on utilisant la correction de Bonferroni qui permet de
repousser le seuil à partir duquel on considère que deux
échantillons sont significativement différents, en
réduisant le seuil alpha.
RESULTATS ET DISCUSSION
I. DOSAGE DES METAUX DANS LES MOULES :
Le dosage des métaux toxiques et plus
particulièrement celui d'Al, Cd, Cr, Cu et Pb a été
réalisé sur une période de six mois courent mai à
octobre 2004, sur des moules séchées prélevées au
hasard dans deux sites. JL (site potentiellement pollué par les rejets
chimiques des traitements de minerais de phosphate) situé à 120
km au sud de Casablanca et OL (site agricole et touristique situé
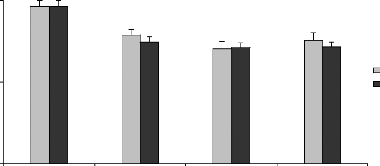
à 45 km au sud du site JL). Les résultats obtenus (figure 12)
montrent des teneurs en Al, Cd Cr et Cu chez M. galloprovincialis
nettement plus élevées, par rapport à celles obtenues dans
la littérature, quelque soit la période et le site de
prélèvement. Par ailleurs ces teneurs sont plus
élevées dans le site JL par rapport au site OL à
l'exception de l'Al et du Cu.
L'étude de l'évolution temporelle de la
concentration en Cadmium chez M. galloprovincialis est
représentée sur la figure 12A. Le dosage du Cd dans les moules
séchées issues du site JL montre des teneurs qui varient de 75
à 118,7 .ig/g de poudre de moules, correspondant aux mois de mai et de
septembre respectivement. Quant aux moules du site OL, les teneurs en Cd sont
de 6 à 26 .ig/g de poudre de moules, prélevées au cours
des mois août et mai respectivement. Ces teneurs sont significativement
très faibles par rapport à celles trouvées dans les moules
JL, montrant ainsi une forte contamination des moules JL par rapport aux moules
OL (4 à 12 fois plus forte). Les normes du règlement
européen (CE) n° 266/2001, précisent que le seuil de
qualité sanitaire réglementaire en Cd est fixé à 5
.ig/g du poids sec de mollusques. Ainsi nos dosages montrent une concentration
21 fois supérieurs dans le cas des moules JL et deux fois
supérieurs chez celles de OL.
Les concentrations en Aluminium dans la poudre de moules
issues des deux sites JL et OL (figure 12B) sont très
élevées. Elles augmentent du moi de mai à octobre, en
passants de 197 à 417,2 .ig/g de poudre de moules issues du site JL.
Alors que pour le site OL, une fluctuation mensuelle a été
observée avec deux pics de forte concentration en Al, le premier en mai
et le deuxième en août avec des taux de 115 et 317 .ig/g des
moules séchées respectivement. Les teneurs en Al sont très
élevées dans le site JL et dans le site OL, bien que ce dernier
est loin de toute sorte de pollutions industrielles. Ces teneurs
élevées pourraient avoir une origine aussi bien naturelle
qu'anthropique. Cependant, seul le dosage de ce métal dans des zones
continentales, proche de nos sites, pourrait le confirmer.
B (Al)
A (Cd)*

C (Cr) *
D (Pb)*
E (Cu)


Figure 12 : Teneurs en métaux toxiques dans les
moules séchées issues des sites JL et OL. Cd (A), Al (B), Cr (C),
Cu (D), Pb (E)
Les histogrammes représentent les teneurs mensuelles en
métaux toxiques dans la poudre des moules, n = 1
*Supériorité significative des teneurs en métaux obtenues
dans le site JL par à OL pour P < 0,05
Le dosage du Chrome dans la poudre de moules issue des site JL
et OL (figure 12C), a montré que les taux de contaminations des moules
est significativement plus importants dans le site JL que dans le site OL (2
à 5 fois plus supérieur). En effet, durant toute la
période d'étude la concentration en Cr dans les moules OL est
relativement stable autour d'une moyenne de 4,8 #177; 0,9 .ig/g de poudre de
moules. Dans le site JL une variation mensuelle a été
observée avec des teneurs en Cr qui varient entre 7,5 et 23,7 .ig/g de
poudre de moules prélevées aux mois juillet et août
respectivement. Les concentrations en Cr dans les moules OL sont
inférieurs a celles trouvées au cours de la période allant
d'août 2001 à février 2002 par Moustaid et al.,
(2005), elles restes également inférieurs a celles trouvés
par Maanan, (2008) (tableau II), par contre les teneurs trouvés dans
moules JL sont pratiquement similaires a celles trouvés auparavant par
Moustaid et al., (2005).
Les teneurs en Plomb dans les moules issues de JL et OL
prélevées à différentes période sont
représentées sur la figure 12D. Le Pb est sous forme de trace,
les taux mesurés en ce métal ne dépassent pas 0.12 et 014
.ig/g de poids secs des moules OL et JL respectivement. Ces teneurs en Pb
restent très faibles par rapport à celles obtenues dans les
moules issues des mêmes sites (OL et JL), prélevées au
cours de la période allant d'août 2001 à février
2002 (Moustaid et al., 2005). Elles sont également
inférieurs au seuil de qualité sanitaire réglementaire qui
est de 7,5 .ig/g poids sec des mollusques, du règlement européen
CE 266/2001.
Les taux en Cuivre (figure 12E) sont très
élevés dans la poudre des moules issues des deux sites JL et OL.
Ils vont de 168 à 583 .ig/g de poudre de moules issues du site OL
correspondant aux mois d'août et de septembre respectivement. Pour le
site JL ils varient entre 260 et 689 .ig/g de poudre de moules et pour les mois
juin et juillet respectivement. Ces teneurs sont très
élevées par rapport a celles mesurées chez les moules
issues des côtes de la ville El Jadida (tableau II), obtenues notamment
par Chafik et al., (2001) et par Maanan, (2008).
Les teneurs en métaux trouvées dans les moules
issues des deux site OL et JL, notamment celles du Al, Cd, Cu et Cr sont
très élevées par rapport à celles
déjà obtenues auparavant dans des moules issues des mêmes
sites par Kaimoussi et al., (2001) et par Chafik et al.,
(2001). Elles sont très élevées aussi par rapport à
celles obtenues au cours de la période août 2004 à mai 2005
par Maanan, (2008), (tableau II). Cette différence de concentrations
pourrait s'expliquer, par la procédure de minéralisation
utilisée en particulier par Chafik et al., (2001), qui ne
détruit pas complètement les matières organiques et qui
sous-estime donc largement
les concentrations en métaux. Contrairement à la
technique de minéralisation utilisée par ces auteurs qui donne
une suspension, notre méthode de minéralisation dans un four
à micro ondes permet d'obtenir une solution limpide qu'on analyse sans
filtration.
Les teneurs en Al, Cd, Cu et Cr sont très
élevés dans les moules issues du site JL que dans celles issues
du site OL et dépassent les normes décrites dans la
littérature, elles sont très élevées a celles
trouvées au nord de la cote atlantique de l'Espagne par Besada et
al., (2002) (tableau II). Cependant les variations mensuelles des teneurs
en métaux toxiques pourraient s'expliquer soit par le rythme des
activités industrielles et les apports d'eau de pluie qui peuvent mettre
en suspension les sédiments contenant des ions métalliques
toxiques. En outre, le processus de bioaccumulation des éléments
métalliques chez les moules est lié à des facteurs
biotiques (cycle biologique, age, nutritions...) ainsi qu'aux conditions
physicochimiques de leurs milieu aquatique, peuvent influencer
considérablement la variation des taux des métaux (Buestel, 1997
; Saha et al., 2006). Cette contamination des moules par les
métaux toxiques confirme la pollution du site JL principalement par les
rejets du traitement des minerais de phosphate du complexe Jorf Lasfar
Phosphore, les rejets de la centrale thermique qui utilise le charbon comme
source d'énergie, le port Jorf Lasfar et sans oublier les rejets
urbaines de la ville d'El Jadida. Ces rejets industriels et urbains sont
souvent drainés plus loin par le courant Nord-Sud, en contaminant
d'autres eaux côtières. Le site OL situé à 45 km au
sud de JL se trouve ainsi contaminé par les charges polluantes du site
JL.
II. EVALUATION DE TOXICITE DES MOULES SUR LES RATS
Lors du traitement des rats par les moules
récoltées sur le site OL, plusieurs effets directs visibles ont
été observé, notamment dressement des poils,
diarrhées et stress. Nous avons aussi observé lors des essais de
prélèvement du sang que ce dernier avait une couleur
légèrement noirâtre et qu'il coagulait rapidement par
rapport au sang des rats témoins.
II.1. Taux des métaux toxiques dans le foie et les
reins
Des travaux récents réalisés par Nasser
et al., (2008) ont montrés que les extraits de moules
(lipophiles et hydrophiles), contaminées par des métaux toxiques
issues des sites JL et OL et tester in vitro sur des cellules humaines
intestinales type caco 2, perturbent la biosynthèse des
macromolécule, la viabilité cellulaire par inhibition de la
fonction mitochondriale et provoquent la fragmentation de l'ADN. Compte tenus
des teneurs très élevés en métaux toxiques dans les
moules notamment celles du Cd, sachant que ces métaux ne jouent aucun
rôle biologique et du fait que ces métaux sont
hépatotoxiques (Li et al., 2007), néphrotoxiques(Cai
et al., 2001), génotoxiques (Kim et al.,2005 ; Nasser
et al., 2008) et apoptotiques (Tersago et al., 2004 ; Mondal
et al., 2005 ; Jung et al., 2007). Nous avons étudié
l'effet du traitement par des moules contaminées par des métaux
toxiques sur la concentration en Cd, Cr et Pb dans les organes cibles à
savoir le foie et les reins des rats traités avec différentes
doses de poudres de moules issues des deux sites, une fois toute les 24 heurs.
Après 28 jours de traitement les animaux ont été
sacrifiés, le foie et les reins ont été
récupérés pour doser les métaux (Cd, Cr et Pb)
comme décrit dans le paragraphe (dosage des métaux, pages 23).
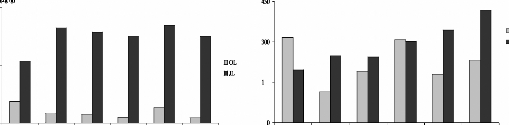
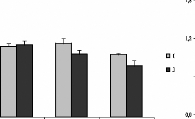
L'analyse statistique a montré une différence
significative des concentrations du Cd dans les organes des rats traités
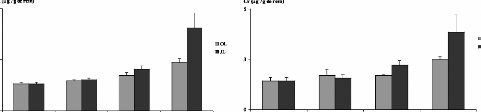
avec la poudre des moules issues des deux sites JL et OL (figures 1 3A et 14A).
En effet, les teneurs en Cd accumulées dans le foie et les reins des
rats augmentent avec la quantité de poudre de moules
administrées. Ces teneurs sont toutefois très
élevées dans les reins que dans le foie, elles sont de l'ordre de
7,3 #177; 1,3 et 4,3 #177; 0,33 .ig/g des reins des rats gavés avec 60
mg de poudre de moules issues des sites JL et OL respectivement, par 100g de
poids vifs. Dans le foie, elles sont de 2,85 #177; 0,9 et de 1,7 #177;
0,37.ig/g de foie des rats gavés avec 60 mg de poudre de moules issues
des sites JL et OL respectivement, par 100g de poids vifs. Chez le lot des rats
témoins les teneurs hépatiques et rénales ne
dépassent pas 0,97 #177; 0,14 et 2,3 #177; 0,3 .ig/g respectivement.
Dietrich et al., (2006) ont traité des souris par voie orale,
avec 1.ig de CdCl2/g/jour et pendant cinq jours, les résultats obtenus
ont montré une accumulation hépatique et rénales du Cd.
DESA MBI Résultats et Discussion
*
*
B (Cr)
A (Cd)
*
*
*
C (Pb)
*
*
*
*
Figure 13 : Teneurs en métaux
toxiques dans les reins des rats traités avec la poudre des moules JL et
OL
Cd (A), Cr (B) et Pb (C)
Les histogrammes représentent la moyenne #177; SEM en jtg
de métaux par g des reins, n = 3.
*Différence significative par rapport aux témoins
pour P < 0,05
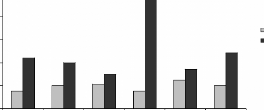
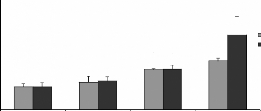
A (Cd)
B (Cr)
*
*
C (Pb)
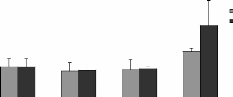
Figure 14 : Teneurs en métaux toxiques dans le
foie des rats traités avec la poudre des moules JL et OL. Cd (A), Cr (B)
et Pb (C)
Les histogrammes représentent la moyenne #177; SEM en tg
de métaux par g de foie frais, n = 3. *Différence significative
par rapport aux témoins pour P < 0,05
Toutefois ces teneurs en Cd restent inférieur a celles
que nous avons trouvés dans notre étude, cela pourrait être
expliqué par le fait que le moules utilisées pour gaver les rats
contiennent des teneurs très élevées en Cd (548,03 tg/g/
28 jours) (tableau III), ainsi que la longue durée de traitement (28
jours).
L'analyse statistique montre une variation significative des
teneurs en Cr dans les reins des rats traités par les moules issues des
deux sites JL et OL (figure 12B). D'une manière générale,
le dosage a montré des fortes concentrations rénales et
hépatiques en ce métal, elles varie aussi selon la
quantité et l'origine des moules ingérées. En effet les
teneurs en Cr sont de 3,85 #177; 0,84 et 2,5 #177; 0,15 .ig/g des reins des
rats gavés avec 60 mg de moules JL et OL respectivement, par 100g de
poids vifs. En ce qui concerne le Cr dans le foie (figure 14B) aucune variation
significative n'est observé chez les rats traités par intubation
gastrique avec les moules issues des deux sites.
Les teneurs en Pb dans le foie et les reins des rats
traités avec les moules de JL et OL sont respectivement
représentées sur les figures 13C et 14C. Les taux en Pb dans les
reins augmentent d'une manière significative avec les quantité et
l'origine des moules ingérées, ils sont de l'ordre de 4,1#177; 1,
et 2,67 #177; 0,24 15 .ig/g des reins frais des rats gavés avec 60 mg de
moules de JL et OL respectivement, par 100g de poids vifs. Dans le foie les
taux en Pb ne varient pas d'une manière significative. Les taux en Pb
dans les organes sont supérieurs a la quantités totales en Pb
dans les moules ingérés pendant les 28 jours du gavage, ceci est
surprenant (tableau III). L'explication la plus probable est une contamination
soit au niveau de la nourriture, soit nos animaux ont été
déjà contaminés.
Les teneurs en métaux toxiques (Cd, Cr et Pb) sont
supérieurs dans le foie et les reins des rats traités avec les
moules séchées issues des deux sites, par rapport aux rats
témoins, ces teneurs sont toutefois plus élevées dans les
reins que dans le foie. Les métaux tels que le Cd possèdent une
très forte affinité pour le foie et les reins, son accumulation
s'effectue principalement dans ces deux organes (Cai et al., 2001 ; Li
et al., 2007). La distributions et la retentions de ce métal
est étroitement liées à la biosynthèse des
métallothionéines. Lors d'une longue exposition aux métaux
tels que le Cd, il y a induction des métallothionéines dans le
foie et dans les reins, qui se fixent sur les métaux, le complexe
formé est ensuite éliminé par les reins, jusqu'à ce
que la capacité de ces derniers a synthétisé cette
protéines soit dépassée, les métaux vont alors
s'accumuler et entraîner une lésions dans les organes (Dietrich
et al., 2006).
Tableau III : teneurs des métaux (Cd, Cr et Pb) en
tg/g de foie et des reins frais des rats traités avec les moules JL et
OL
|
Jorf Lasfar
|
|
Oualidia
|
|
Poudre
de moules*
|
Reins
|
Foie
|
Poudre
de moules*
|
Reins
|
Foie
|
|
Cd
|
0
38,38
254,75
548,03
|
2,36 #177; 0,13
0
2,75 #177; 0,1
3,6 #177; 0,3*
7,3#177; 1,3*
|
0,97 #177; 0,14
1 #177; 0,12
1,4 #177; 0,2
2,85 #177; 0,9 *
|
0
3,13
15,70
32,00
|
2,36 #177; 0,13
2,65 #177; 0,8
3 #177; 0,26
4,3 #177; 0,34 *
|
0,8 #177; 0,2 0,83 #177; 0,16 1,28 #177; 0,08 1,7 #177; 0,37
*
|
|
0
|
1,43#177; 0,17
|
1,3 #177; 0,3
|
0
|
1,43#177; 0,17
|
1,3 #177; 0,3
|
|
1,19
|
1,57 #177; 0,16
|
1,7 #177; 0,2
|
|
1,6 #177; 0,2
|
2#177; 0,03
|
|
Cr
|
|
|
|
2,97
|
|
|
|
5,99
|
2,2 #177; 0,23
|
1,4 #177; 0,4
|
15,03
|
1,7 #177; 0,05
|
1,97 #177; 0,09
|
|
11,72
|
3,85 #177; 0,84 *
|
1,5 #177; 0,7
|
29,39
|
2,5 #177; 0,15*
|
1,5 #177; 0,1
|
|
0
|
1,25 #177; 0,22
|
0,71 #177; 0,2
|
0
|
1,25 #177; 0,22
|
0,8 #177; 0,2
|
|
0,02
|
1,58 #177; 0,21
|
0,72 #177; 0,13
|
0,01
|
1,5 #177; 0,26
|
0,7 #177; 0,2
|
|
Pb
|
0,11
|
2,21#177; 0,23*
|
0,75 #177; 0,05
|
0,05
|
2,2 #177; 0,47
|
0,73 #177; 0,26
|
|
0,21
|
4,1 #177; 1,3 *
|
1,87 #177; 0,6
|
0,10
|
2,67 #177; 0,24 *
|
1,2 #177; 0,09
|
* Calculé a partir de quantité totale de
poudre de moules ingérées au cours des 28 jours de gavage. *
Différenoe significative par rapport aux témoins pour P < 0,05
avec n= 3.
*
*
*
*
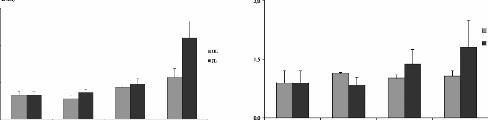
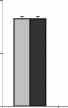
Figure 15 : Gain de poids corporel (%) des rats
traités avec la poudre de moules issues de JL et OL
L'histogramme représente la moyenne de gain de masse
corporelle #177; SEM en % * Différence significative par rapport aux
témoins pour P < 0,05 avec n= 5
Le gain de la masse est calculé selon la formule suivante
:
|
Gain de masse (%) =
|
Masse corporelle initiale - Masse corporelle finale *
100
|
|
Masse corporelle initiale du contrôle - Masse
corporelle finale du contrôle
|
II.2. Effet des moules sur la masse corporelle des
rats.
La figure 15 représente le gain de la masse corporelle
chez les rats gavés avec moules séchées (M.
galloprovincialis) issues des site JL et OL, ceci en fonction des
quantités 6,30 et 60 mg par 100 g de poids vif, administrées tout
au long des 28 jours du traitement par rapport aux rats témoins. Les
résultats obtenues montrent une baisse significative dépendante
aux doses administrée, elle est de 17,57 #177; 3,39 %, 25,75 #177; 4,23
% et de 20,70 #177; 4,81 % chez les rats traités avec les
quantités 6, 30 et 60 mg de poudres des moules OL respectivement par 100
g de poids vif, et de 21,72 #177; 3,25%, 25,03 #177; 3,01 % et de 24,79#177;
3,12% chez les rats traités avec les quantités 6, 30 et 60 mg de
poudres des moules JL respectivement, par 100g de poids vifs. Chez des souris
traitées avec des moules contaminées par des métaux
toxiques, une baisse de la masse corporelle a été observée
avec des taux élevés en créatinine dans les urines
(Moustaid et al., 2005). Sachant que la créatinine
résulte du métabolite de substance azotée non
protéique au cours du métabolisme musculaire (Whitby et
al., 1984), ces résultats concordent avec ceux observés dans
l'évolution du poids corporel des souris traitées. L'explication
la plus probable est l'existence d'une protéolyse provoquée par
l'ingestion des moules toxiques. Une telle situation provoquerait une
libération d'acides aminés libres (arginine et glycocolle),
transformés en créatine puis en créatinine, qui est
éliminée dans les urines (Kaneko, 1989).
II.3. Influence de la poudre de moules sur
l'hématopoïèse chez le rat
Plusieurs auteurs ont déjà montrés que
les métaux toxiques ont des effets néfastes sur les tissus osseux
et le système immunitaire (Burns et al., 1995 ; Tersago et
al., 2004 ; Hemdan et al., 2006). Ces polluants
métalliques sont capable de moduler le système immunitaire, cette
immunomodulation est soit une immunosuppression, soit immunopotentialisation et
qui dépend entre autres, de la nature du métal, de sa
concentration et de sa biodisponibilité (Lawrence et al., 2002
; Tersago et al., 2004 ; Lynes et al., 2006). Les
métaux toxiques ont également un effet néfaste sur le
développement des cellules souches, mais on sait peut de chose sur leur
réponse toxicologiques. Etant donné que la moelle osseuse
hématopoïétique contient des cellules matures, des
précurseurs, des progénitures et des cellules souches
multipotentes. Ces deux dernières sont également dotées
d'une capacité d'autorenouvellement et de différenciation (Rando,
2006), et elles sont impliquées dans des maladies inflammatoires
chroniques ainsi que le cancer (Reya et al., 2001 ; Dietrich et
al., 2006 ; Dalerba et al., 2007). Ces cellules peuvent
représenter une cible clé de substances toxiques en raison de la
faiblesse éventuelle de leur système de réparation de
l'ADN, ce qui pourrait faciliter la mutagenèse après expositions
toxiques (Trosko et Tai, 2006 ; Gioacchino et al., 2008). Les
réponses
toxicologiques des cellules souches sont relativement peu
connues, et différentes de celles des autres cellules en raison de leurs
propriétés biologiques uniques liées a leurs rôles
de rénovation et la répartition des tissus (Rando, 2006), de
leurs processus biochimiques ainsi que de leurs compartiments intracellulaires
(Inoue et al., 2002). Pour ces multiples raisons nous avons choisi de
déterminer l'effet de moules contaminées par des métaux
toxiques sur la moelle osseuse hématopoïétique.
Durant cette étude nous avons compté au
microscope photonique (X100) 1000 cellules du tissu médullaire sur lame
colorées au Geimsa. La lignée granulocytaire neutrophile
(myéloblaste, promyélocyte, myélocyte,
métamyélocyte, et polynucléaire neutrophile), la
lignée granulocytaire éosinophile, la lignée basophile,
lignée Monocytaire (petit monoblaste, grand monoblaste promonocyte,
monocyte basophile et monocyte) et la lignée lymphoïde
(lymphoblaste, petit lymphocyte, grand lymphocyte).
II.3.1. Evolutions de la lignée granulocytaire
neutrophile
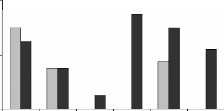
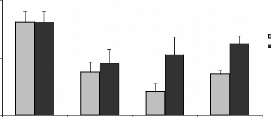
La numération de la lignée neutrophile (figure
16A), montre une baisse significative inversement proportionnelle à la
quantité des moules administrées, elle est plus accentuée
chez les rats gavés avec les moules JL que chez ceux gavés avec
les moules OL. En effet le taux de la lignée neutrophile est de 57,8
#177; 2,1 %, 47,7 #177; 2,8 %, 41,6 #177; 2,6 % et 33,98 #177; 3,6 %
respectivement pour les doses 0, 6, 30 et 60 mg de moules séchées
issues du site JL par 100 g de poids vif des rats. Chez les rats traités
avec les mêmes doses des moules séchées issues du site OL
le taux de la ligné est de 57,8 #177; 2,1 %, 46,8 #177; 2,1%, 48,7 #177;
3,5% et 41 #177; 1,1% respectivement. Cette baisse pourrait être le
début d'une neutropénie notamment chez les rats traités
avec la poudre de moules JL. Des études immunotoxicologiques sur des
souris de bois exposées au métaux lourds ont montrées une
corrélation négative entre les teneurs des métaux dans le
foie des rats et aux taux des leucocytes (Tersago et al., 2004). La
baisse des taux des leucocytes a été observée aussi chez
des cellules souches hématopoïétiques, issues du sang du
cordon ombilical, exposées au Cr et au Cd, cette baisse est due au
déclenchent de la mort cellulaire par autophagie (Gioacchino et
al., 2008).
II.3.2. Evolutions de la lignée granulocytaire
basophile.
En ce qui concerne la lignée granulocytaire basophile
(figure 16B), la plus rare des lignées
hématopoïétiques, La numération au microscope
photonique (X100) a montré une absence quasiment totale des basophiles
chez les rats témoins. Par contre, les basophiles sont présentes
chez les rats traités avec les moules issues des deux sites. En effet,
on a obtenu des taux de

*
*
*
A
* ée
*
*

C
*
*
*
*
*

D E
Figure 16 : Effets de la poudre de moules issues des
sites JL et OL sur les l'hématopoïèse.
Lignée neutrophile (A), basophile (B),
éosinophile (C), monocytaire (D) et lymphocytaire (E), L'histogramme
représent la moyenne #177; SEM en %
* Différence significative par rapport aux
témoins pour P < 0,05 avec n= 5
ADN réparé
Le taux de chaque lignée est calculé selon
la formule suivante :
|
Lignée médullaire (%) =
|
Nombre total de la lignée * 100
|
|
Nombre total des autres lignées
|
l'ordre de 0,55 #177; 0,05 et 1,28 #177;0,38% chez les rats
traités avec 30 et 60 mg de poudre de moules OL respectivement, par 100g
de poids vifs. Chez les rats traités avec la poudre de moules JL les
taux des basophiles sont de l'ordre de 0,71#177;0,18, de 1,3#177; 0,4 et de
0,82 #177; 0,24 % pour les doses 6, 30 et 60 mg par 100g de poids vifs. Etant
donné que le faible taux des granulocytes basophiles est responsable des
réactions d'hypersensibilités (choc anaphylactique), leur
biosynthèses peut s'expliqué par la présence de(s)
allergène(s) dans les moules OL et JL.
II.3.3. Evolutions de la lignée granulocytaire
éosinophile.
L'évolution de la lignée granulocytaire
éosinophiles en fonctions des quantités des moules
administrées (figure 16C), montre une baisse significative du taux de
lignée éosinophile chez les rats traités avec la poudre de
moules OL. Cette baisse est de 3 #177; 0,71, 1,61 #177; 0 ,6 et 2,8 #177; 0,2 %
(contre 6 % chez le témoin) chez les rats traités avec les doses
6, 30 et 60 mg de poudre de moules OL respectivement, par 100g de poids vifs.
Chez les rats traités avec les moules JL, seule la dose 6 mg de moules
par 100g de poids vifs a entraîné une baisse (3,6 #177; 0,9 %) de
la lignée éosinophile, cependant les doses 30 et 60 mg/100g de
poids vif n'ont entraîné aucune variation significative. Cela
suggère que la baisse de cette lignée ne dépend pas de la
dose administrée. Les éosinophiles sont cellules immunitaires
indispensable au défense antiparasites, une étude chez le souri
de bois exposé au métaux lourds dans une fonderie a montré
que la résistance aux parasites augmente avec la distance qui
sépare les souris de la fonderie (Tersago et al., 2004).
II.3.4. Evolutions de la lignée
myéloïde monocyte.
La numération de la lignée monocytaire (figure
16D) des rats traités avec moules récoltées sur le site
JL, montre que les taux de cette lignée augmentent avec les doses des
moules administrées, toutefois l'analyse statistique montre que cette
augmentation est significative seulement chez les rats traités avec 60
mg de poudre de moules par 100 g de poids vifs, par rapport au rats
témoins. Aucune variation significative n'est observée chez les
rats traités avec les moules OL par rapport au rats contrôle.
II.3.5. Evolutions de la lignée
lymphoïde
Aucune variation significative n'a été
observé dans la lignée lymphoïde (figure 16E) chez les rats
traités avec les différentes doses des moules de OL et de JL par
rapport aux rats témoins à l'exception du lot traité avec
la dose 60 mg de poudre de moules de JL par 100 g de poids vifs (27 #177; 3,2 %
contre 33,2 #177; 2,9 % chez le témoin).
L'évaluation de la cytotoxicité subchronique sur
la moelle osseuse hématopoïétique des rats traités
par intubations gastrique par les doses 6, 30 et 60 mg de poudre de moules
contaminées par des métaux toxiques, a été
réalisé sur une période de 28 jours. A notre connaissance,
il n'existe pas de données publiées sur la cytotoxicité
des moules contaminées par les métaux toxiques sur
l'hématopoïèse. Notre étude a montré une
baisse de la principale lignée granulocytaire (lignée des
neutrophiles) et une augmentation de la lignée basophile chez les rats
traités avec la poudre de moules issues des sites JL et OL. Cependant la
relation de la dose des moules avec le niveau de perturbation de
l'hématopoïèse est difficile à établir.
Beaucoup d'auteurs ont montré que les métaux toxiques notamment
le Cd, Cr, et Pb sont capables de moduler le système immunitaire (Burns
et al., 1995 ; Tersago et al., 2004 ; Hemdan et al.,
2006). Cette immunomodulation est soit une immunosuppression ou
immunopotentialisation et qui dépend de la nature du métal, de sa
concentration, sa biodisponibilité, ainsi que d'autre facteurs (Lawrence
et al., 2002 ; Tersago et al., 2004 ; Lynes et al.,
2006). Des faibles doses en Cd ont causé une altération
intracellulaire, notamment dilatation du réticulum endoplasmique rugueux
et des dommages mitochondriaux chez les cellules souches
hématopoïétique humaine isolées de sang du cordon
ombilical (Gioacchino et al., 2008). Ces modifications constituent la
preuve d'un certain niveau de toxicité pour la moelle osseuse
hématopoïétique et suggèrent, que les cellules
progénitures sont très sensibles aux métaux toxiques
même à des très faibles doses qui ne sont pas toxiques pour
d'autres systèmes cellulaires (Burastero et al., 2006 ;
Mazzotti et al., 2002).
CONCLUSION ET PERSPECTIVES
Conclusion
Cette étude avait pour objectifs, d'une part la
détermination des concentrations de cinq métaux (Al, Cd, Cr, Cu
et Pb) dans les moules séchées issues du site : Jorf Lasfar (JL)
(site potentiellement pollué par les rejets chimiques des traitements
des minerais des phosphates bruts) et Oualidia (OL) (site situé a 45 km
au sud de JL et réputé par ces lagunes d'ostréicultures)
(figure 1) sur une période de six mois courent mai à octobre
2004. D'autre part l'évaluation de l'effet de ces moules in vivo chez le
rat.
Les résultats obtenus montrent des concentrations
très élevées en Al, Cd, Cr et Cu dans les moules du site
JL et OL par rapport à celles indiquées dans la
littérature. Par ailleurs ces teneurs son nettement plus
élevées dans le site JL que dans le site OL a l'exception d'Al et
du Cu. Elles varient aussi en fonction du moi de prélèvement.
Ceci pourrait s'expliquer soit par le rythme de l'activité industrielle,
soit par l'influence des facteurs biotiques et abiotiques du processus de
bioaccumulation des éléments métalliques chez les moules.
La contamination des moules par les métaux toxiques confirme la
pollution du site JL principalement par les rejets du traitement des minerais
de phosphate du complexe Jorf Lasfar Phosphore, les rejets de la centrale
thermique qui utilise le charbon comme source d'énergie, le port Jorf
Lasfar et sans oublier les rejets urbaines de la ville d'El Jadida. Ces rejets
industriels et urbains sont souvent drainés plus loin par le courant
Nord-Sud, en contaminant d'autres eaux côtières. Le site OL
situé à 45 km au sud de JL se trouve ainsi contaminé par
les charges polluantes du site JL.
Le dosage des métaux toxiques (Cd, Cr et Pb), dans les
organes cible (foie et reins) des rats traitées avec la poudre des
moules JL et OL a montré une forte accumulation des métaux dans
les reins par rapport au foie notamment celle du Cd. Elle est plus
accentuées chez les rats gavées avec les moules JL par rapport a
OL. Cependant, les teneurs en métaux trouvé dans ces deux organes
restent très faible part rapport aux quantités totales
trouvées dans la poudres de moules utilisées dans le traitement
des rats, a l'exception du Pb, dont les teneurs trouvées dans le foie et
les reins sont supérieurs a celles dosées dans la poudre des
moules JL et OL.
Le gavage des rats avec les moules issues des deux sites a
entraîné une baisse du poids corporel par rapport aux
contrôles traités avec de l'eau. Au cours de traitement des
animaux avec la poudre des moules OL, des effets directs visibles ont
été observés notamment dressement des poils de la fourrure
des animaux, diarrhée et le sang avait une couleur « brun chocolat
» et coagulait rapidement par rapport au sang des rats témoins.
Compte tenu que site OL est si riche en faune et en flore, l'hypothèse
de l'existence des toxines marines (DSP,
PSP etc...) a été émise. Leurs
identifications et proportions relatives n'ont pas été
déterminées.
La numération des différentes lignées
cellulaires de la moelle osseuse chez les rats montre, d'une manière
générale une perturbation de l'hématopoïèse,
incarnée par une augmentation du taux de la lignés basophile et
une baisse du taux de la lignée neutrophile et lymphoïde des
animaux traités avec les moules de JL. Ceux traités avec la
poudre de OL, ont augmenté aussi le taux de la lignée basophile
et ont baissé légèrement le taux de la lignée
neutrophile ainsi que celle de monocyte. Ces résultats, selon notre
étude bibliographique ont montré pour la première fois le
phénomène observé à savoir la
myélotoxicité chez le rat causé par l'ingestion de la
poudre de moules issues des sites d'étude.
L'ensemble des résultats obtenus nous poussent à
émettre l'hypothèse que la consommation des moules JL et OL, peut
entraîner une toxicité chez le consommateur. Cependant,
l'extrapolation à l'homme des résultats de cette étude, ne
peut être permise, que si des investigations
épidémiologiques à grande échelle et sur une longue
période soient réalisées.
Pour que l'eau côtière ne soit pas un bien
marchand comme les autres mais un patrimoine qu'il faut protéger,
défendre et traiter comme tel. Nous soulignons sur la
nécessité d'une action législative basée sur une
politique rationnelle, efficace et cohérente, dont les acteurs seront
l'état, l'industrie, les communautés locales et sans oublier le
public, et doit être fondée sur les principes de précaution
et d'action préventive et sur le principe de la correction, par
priorité à la source, des atteintes à l'environnement
ainsi que sur le principe du pollueur- payeur.
Perspectives
Au terme de cette étude, certains aspects se sont
révélés très intéressants a poursuivre. Il
s'agit :
V' D'élargir la zone d'étude
d'échantillonnage surtout dans le site OL afin de pouvoir
déterminer la source de pollution.
V' Du traitement des rats avec les moules issues des sites
d'étude sur de longues périodes (90 jours), du dosage des
métaux dans les organes cibles (foie et reins), de l'étude des
enzymes marqueurs de la pollution et de l'étude de l'effet des moules
sur l'état de l'ADN.
V' D'une étude in vitro sur des cellules humaines des
extraits hydrophiles et lipophiles afin d'évaluer leurs effets
cytotoxiques et génotoxiques.
V' De l'extraction des toxines hydrophiles et lipophiles des
moules, de l'identification et purification par chromatographie liquide a haute
pression accouplée au spectromètre de masse (HPLC-SM).
V' Enfin d'une étude épidémiologiques sur
une longue échelle et a long terme chez les population cibles.
REFERENCES BIBLIOGRAPHIQUES
Abella-Bourgès N., Trumel C., Chabanne L., Diquélou
A. Myélogramme et biopsie de moelle osseuse. EMC-Vét 2005. 2 :
74-95.
Amzil Z., Motteau L.Toxines amnésiantes en France. Rapport
interne IFREMER/DEL/MP /RST/00/07 Nantes 2000. 37.
Anderson D.M. Toxicalgal blooms and red tides: A global
perspective. In: T. Okaichi, D.M. Anderson and T. Nemoto, Editors, Red Tides:
Biology. Environ. Sci. Tox, Elsevier, New York 1989. 11-21.
Arendt T., Holzer M., Fruth R., Bruckner M.K., Gartner U.
Paired helical filament-like phosphorylation of tau, deposition of
beta/A4-amyloid and memory impairment in rat induced by chronic inhibition of
phosphatase 1 and 2A. Neurosci 1995. 69 : 691 -698.
Arisa M.F., Wiliams M.V. Mutagenesis of AS 52 cells by low
concentraton lead (II) and mercury (II). Environ. Mol. Mutagen 1996. 27 :
30-35.
Aykin-Burns N., Franklin, E.A., Ercal N. Effects of
N-acetylcysteine on lead-exposed PC-12 cells. Arch. Environ. Contam. Toxicol
2005. 49: 119-123.
Banerjee S., Flores-Rozas H. Cadmium inhibits mismatch repair by
blocking the ATPase activity of the MSH2-MSH6 complex. Nucleic. Acids. Res
2005. 33: 1410-1419.
Bernier J., Brouseau P., Krystyniak K., Tryphonas H., Fournier M.
Immunotoxicity of heavy metals in relation to great Lakes. Environ. Health.
Persp 1995. 9 : 23-34.
Besada V., Fumega J., Vaamonde A. Temporal trends of Cd, Cu, Hg,
Pb and Zn in mussel (Mytilus galloprovincialis) from the Spanish
North-Atlantic coast 1991-1999. Sci. Tot. Environ 2002. 288: 239-253.
Beyersmann D., Hechtenberg S. Cadmium, gene regulation, and
cellular signalling in mammalian cells. Toxicol. Appl. Pharmacol 1997. 144 :
247-61.
Bolin C.M., Basha R., Cox D., Zawia N.H., Maloney B., Lahiri
D.K., Cardozo-Pelaez F. Exposure to lead and the developmental origin of
oxidative DNA damage in the aging brain. Faseb. J 2006. 20 : 788-790.
Bourhili E.H. Intoxication alimentaire par les moules (51 cas,
épidémie d'Agadir), octobre et novembre 1982, thèse n? 33,
FMP. Rabat 1984. 84.
Buestel D. Croissance et conditions des moules Mytilus
galloprovincialis dans quelques sites caractéristiques de
Méditerranée. Atelier RINBIO. Ifremer, DEL/DRV 1997.
Burastero S. E., Paolucci C., Breda D., Ponti J., Munaro B.,
Sabbioni E. Chromium (VI)-induced immunotoxicity and intracellular accumulation
in human primary dendritic cells. Int. J. Immunopathol. Pharmacol 2006. 19 :
581-91.
Burns L.A., Meade B.J., Munson A.E. Toxic responses of the immune
system. In: Klaassen, C.D. (Ed.), Cassaret and Doull's Toxicology: Basic Sci.
Pois. McGraw-Hill, New York 1995. 355-402.
Cai Y., Aoshima K., Katoh T., Teranishi H., Kasuya M. Renal
tubular dysfunction in male inhabitants of a cadmium-polluted area in Toyama,
Japanan, eleven-year follow-up study. J. Epidemiol 2001. 11:180-189.
Chafik A., Cheggour M., Cossa D., Sifeddine M. Quality of
Moroccan Atlantic coastal waters: water monitoring and mussel watching. Aquat.
Living. Resour 2001. 14 : 239-249.
Chen B., Cheng M., Hong D., Sun F., Zhu C. Okadaic acid induced
cyclin B1 expression and mitotic catastrophe in rat cortex. Neurosci. Lett
2006. 406 : 178-182.
Chen L., Yang X., Jiao H., Zhao B. Tea catechins protect
against lead-induced ROS formation, mitochondrial dysfunction, and calcium
dysregulation in PC12 cells. Chem. Res. Toxicol 2003. 16 : 1155- 1161.
Cheun B., Endo H., Hayashi T., Nagashima Y., Watanabe E.
Development of an ultra high sensitive tissue biosensor for determination of
swellfish poisoning, tetrodotoxin. Biosens. Bioelectron. 1996. 11 :
1185-1191.
Cheun B.S., Loughran M., Hayashi T., Nagashima Y., Watanabe E.
Use of a channel biosensor for the assay of paralytic shellfish toxins Toxicon
1998. 36 : 1371 -1381.
Chiffoleau J.C. (coord), La contamination métallique,
IFREMER, Région Haute Normandie, Programme scientifique Seine- Aval
2001. 8 -39.
Cohen T., Que Hee S.S., Ambrose R.F. Trace metals in fish and
invertebrates of Three California coastal Wetlands. Mar Pollut Bul. 2001. 42 :
224-232.
Dalerba P., Cho RW., Clarke MF. Cancer stem cells: models and
concepts. Annu. Rev. Med 2007. 58 : 267-284.
Dietrich J., Kempermann G. Role of endogenous neural stem cells
in neurological disease and brain repair. Adv. Exp. Med. Biol 2006. 557:
191-220.
Ercal N., Gurer-Orhan H., Aykin-Burns N. Toxic metals and
oxidative stress part I: mechanisms involved in metal induced oxidative damage.
Curr. Top. Med. Chem 2001. 1 : 529-539.
Fahmy M.A., Aly F.A. In vivo and in vitro studies on the
genotoxicity of cadmium chloride in mice. J. Appl. Toxicol 2000. 20 : 231
-238.
Gioacchino M.D., Petrarcaa C., Perrone A., Farina M., Sabbioni
E., Hartung T., Martino S., Esposito D.L., Lotti L.V., Mariani-Costantini R.
Autophagy as an ultrastructural marker of heavy metal toxicity in human cord
blood hematopoietic stem cells. Sci. Environ 2008. 392 : 50-58.
Goldberg E.D. The Mussel Watch. Mar. Pollut. Bull 1975. 6 :
111-113.
Goodale B.C., Walter R., Pelsue S.R., Thompson W.D., Wise S.S.,
Winn R.N., Mitani H., Wise Sr. J.P. The cytotoxicity and genotoxicity of
hexavalent chromium in medaka (Oryzias latipes) cells. Aquatic. Toxicol 2008.
87 : 60-67.
Guelfi JF. Le myélogramme : technique et valeurs usuelles.
Pt. Vét 1993. 26 : 500-502.
Hallegraeff G.M. A review of harmful algal blooms and their
apparent global increase. Phycol 1993. 32 :279-99
Hemdan N.Y.A., Emmrich F., Sack U., Wichmann G., Lehmannd,J.,
Adham K., Lehmann I. The in vitro immune modulation by cadmium depends on the
way of cell activation. Toxicol 2006. 222 : 37-45.
Hovland D.N., Cantor R.M., Lee G.S., Machado A.F., Collins M.D.
Identification of a murine locus conveying susceptibility to cadmium-induced
forelimb malformations. Genom 2000. 63: 193-201.
IARC Overall evaluations of carcenogenecity to humans. IARC
scientific publications, Lyon 1999. 1-73.
IARC. Monographs on the Evaluation of the Carcinogenic Risk to
Human-Genetic and Related Effects: An Updating of Selected IARC Monographs
1987. 6 : 1-42.
Inoue A., Seidel MG., Wu W., Kamizono S., Ferrando AA.,
Bronson RT., Slug A, a highly conserved zinc finger transcriptional repressor,
protects hematopoietic progenitor cells from radiation-induced apoptosis in
vivo. Cancer Cells 2002. 2 : 279-288.
Jain NC, editors. Schalm' s veterinary haematology. Philadelphia:
Lippincott-Williams and Wilkins 2000. 1057-1063.
Jain NC. Examination of the blood and the bone marrow. In:
Essentials of veterinary haematology. Philadelphia: Lea and Febiger 1993.
1-18.
Joutei L.T., Beatriz R., El Marrakchi A., Seasonal dynamics of
Gymnodinium catenatum blooms off the northern west coast of Morocco. Book of
abstracts, Xth International Conference on Harmful Algae, Florida, USA,
2002.
Jung Y.S., Jeong E.M., Moon C.H., Cadmium induces
apoptotic cell death through p38 MAPK in brain microvessel endothelial cells.
E. j. Pharmacol 2007. 8-49
Ka imoussi A., Chafik A., Mouzdahir A., Bakkas S. The impact
of industrial pollution on the Jorf Lasfar coastal zone (Morocco, Atlantic
Ocean): the mussel as an indicator of metal concentration. Earth Planet. Sci
2001. 333: 337-341.
Kaneko J.J. Clinical Biochemistry of Domestic Animals, fourth
ed., Academic Press, New York, 1989.
Kim S.D., Moon C.K., Eun S.Y., Ryu P.D., Jo S.A.
Identification of ASK1, MKK4, JNK, c-Jun, and caspase-3 as a signalling cascade
involved in cadmium-induced neuronal cell apoptosis. Biochem. Biophy. Res.
Commun 2005. 328: 326-334.
Lassus P., Ledoux M., Bardouil M., Bohec M., Erard E. Kinetics of
Alexandrium minutum halim toxin accumulation in mussels and clams.
Nat. Toxins1 994. 2 (5): 329-333.
Lawrence D.A., McCabe M.J., Immunomodulation by metals. Int.
Immunopharmacol 2002. 2 : 293-302. Le Roux G., Shotyk, W. Biogeochemistry and
cycling of lead. Met. Ions Biol. Syst 2005. 43: 239-275.
Li Y., Lim S.C. Cadmium-induced apoptosis of hepatocytes is not
associated with death receptor-related caspase-dependent pathways in the rat.
Environ. Toxicol. Pharmacol. 2007. 24 : 231-238
Locatelli C. Heavy metal determinations in algae, mussels and
clams. Their possible employment for assessing the sea water quality criteria.
J. Physiq IV 2003.107 : 785-788.
Lynes M.A., Fontenot A.P., Lawrence D.A., Rosenspire A.J.,
Pollard K.M. Gene expression influences on metal immunomodulation. Toxicol.
Appl. Pharmacol 2006. 210 : 9-16.
Maanan, M., Heavy metal concentrations in marine molluscs from
the Moroccan coastal region. Environ. Pollut 2008. 153 :176-183.
Mazzotti F., Sabbioni E., Ponti J., Ghiani M., Fortaner S.,
Rossi G L. In vitro setting of dose-effect relationships of 32 metal compounds
in the Balb/3T3 cell line, as a basis for predicting their carcinogenic
potential. Altern. Lab. Anim 2002. 30:209-21 7.
Matias W.G., Traoré A., Bonini M., Creppy E.E., Oxygen
reactive radical production in cell culture by okadaïc acid and their
implication in protein synthesis inhibition. Hum. Exp. Toxicol 1999. 18 :
634-639. Meinkoth JH, Clinkenbeard KD. Normal hematology of the dog. In:
Feldman BF, Zinkl JG, Crespeau F. Myélogramme chez le chat. In: Les
indispensables de l'animal de compagnie, Cancérologie. Paris: PMCAC
editor 2000. 101-106.
Miquel M. Les effets des métaux lourds sur l'environnement
et la santé. Rapport Office Parlementaire d'évaluation des choix
scientifiques et technologiques (Dir.). Rapport Sénat 2001 n°261:
360.
Mondal T.K., Li D., Swami K., Dean J.K., Hauer C., Lawrence D.A.
Mercury impairment of mouse
thymocyte survival in vitro: involvement of
cellular thiols. J. Toxicol Enviro
n Health A 2005. 68 : 535-556.
Moustaid K., Nasser B., Baudrimont I., Anane R., El Idrissi
M., Bouzidi A., Creppy E. E. Évaluation comparée de la
toxicité des moules (Mytilus galloprovincialis) de deux sites
du littoral atlantique marocain sur des souris. C. R. Biol 2005. 328 : 281
-289.
Nasser B., Moustaid K., Moukha S., Mobio T.A., Essamadi A.,
Creppy E.E. Evaluation of the cytotoxicity and genotoxicity of extracts of
mussels originating from Moroccan Atlantic coast, in human colonic epithelial
cells Caco-2. Environ. Toxicol 2008. 23: 521-536.
National Institute of Environmental Health Sciences(NIEHS).
Annual Report on Carcinogens. National Toxicology Program. Research Triangle
Park, N.C 1994.
OSPAR, C. Quality status report 2000: Region IV Bay of Biscay and
Iberian Coast, OSPA Commission, London 2000.
Othumpangat, S., Kashon M., Joseph P. Eukaryotic translation
initiation factor 4E is a cellular target for toxicity and death due to
exposure to cadmium chloride. J. Biol. Chem 2005. 280 : 162-169.
Patrick L. Lead toxicity part II: the role of free radical damage
and the use of antioxidants in the pathology and treatment of lead toxicity.
Altern. Med. Rev 2006. 11 : 114-127.
Philips D.J.H. The use of biological indicator organisms to
monitor trace metal pollution in marine and estuarine environments - a review.
Environ. Pollut 1977. 13 : 281-317.
Philips, D.J.H. et Segar D.A. Use of indicators in monitoring
conservative contaminants. Mar. Pollut. Bull 1986. 17 : 10-17.
Pulido M.D., Parrish A.R. Metal-induced apoptosis: mechanisms.
Mutat. Res 2003. 533 : 227-241.
Rando T.A. Stem cells, ageing and the quest for immortality. Nat
2006. 441 : 1080-1096.
Rapport de l'état de l'environnement au Maroc (REEM).
Ministère de l'Aménagement du Territoire de l'Eau et de
l'Environnement Direction de l'Observation des Etudes et de la Coordination
1999. 2-4.
Reizopoulou S., Strogyloudi E., Giannakourou A., Pagou K.,
Hatzianestis I., Pyrgaki C., Graneli E. Okadaic acid accumulation in
macrofilter feeders subjected to natural blooms of Dinophysis acuminate.
Harmful. Algae 2008. 7 : 228-234.
Reya T., Morrison S.J., Clarke M.F., Weissman I.L. Stem cells,
cancer, and cancer stem cells. Nat 2001. 414 : 105-111.
Risom L., Møller P., Loft S. Oxidative stress-induced DNA
damage by particulate air pollution. Mutat. Res 2005. 592 : 119-137.
RODIER J.L'analyse de l'eau - eaux naturelles, eaux
résiduaires, eau de mer, 8ème édition, Paris, Dunod 1996.
1394.
Saha, M., Sarkar, S.K., Bhattacharya, B. Interspecific variation
in heavy metal body concentrations in biota of Sunderban mangrove wetland,
northeast India. Environ. Int 2006. 32 : 203-207.
Satoh M., Kaji T., TohyamaC. Lowdose exposure to cadmium and its
health effects. Part 3. Toxicity in laboratory animals and cultured cells.
Nippon Eiseigaku Zasshi 2003. 57: 615-623.
Satoh M., Koyama H., Kaji T., Kito H., Tohyama C. Perspectives on
cadmium toxicity research. Tohoku J. Exp. Med 2002. 196 : 23-32.
Shulkin, V .M., Presley, B.J., Kavun, V .I. Metal concentrations
in mussel Crenomytilus grayanus and oyster Crassostrea gi gas in
relation to contamination of ambient sedi ments. Environ. Inter 2003. 29,
493-502. Silva, C.A.R., Rainbow, P.S., Smith, B.D. Biomonitoring of trace metal
contamination in mangrove lined Brazi lian coastal systems usi ng the oyster
Crassostrea rhizophorae: comparative study of regions affected by oil,
salt pond and shrimp farming activities. Hydrobiol 2003. 501: 199-206.
Sournia A., Red tide and toxic marine phytoplankton of the
world ocean: An inquiry into biodiversity. In: P. Lassus, G. Arzul, E. Erard-Le
Denn, P. Gentien and C. Marcaillou-Le Baut, Editors, Harmful Marine Algal
Blooms, Lavoisier, Paris 1995. 103-112.
Sommer H.; Meyer, K.. F. Arch. Pathol 1937. 24 : 560-598.
Szefer P., Kim B.S., Kim C.K., Kim E.H., Lee, C.B.
Distribution and coassociations of trace elements in soft tissue and byssus of
Mytilus galloprovincialis relative to the surrounding seawater and
suspended matter of the southern part of the Korean Peninsula. Environ. Pollut
2004. 129 : 209-228.
Taber A., Intoxication biologique : Cas de mytilotoxine
(phénomène des eaux rouges), Magh. Vétér 1986. 2 :
15-19.
Tagmouti F., Akalay D., Blaghen M., Talbi M., Motaouakil S.,
Mikou A., Fellat-Zarrouck K., Drissi L., Intoxications alimentaires mortelles
par les moules au Maroc. Cah. Rech 2000. 2 : 37-49.
Tersago K., W. De Coen, R.Verhagen Immunotoxicology in wood mice
along a heavy metal pollution gradient. Environ. Pollut 2004.132 : 385-394.
Traoré A., Bonini M., Dano S.D., Creppy E.E., Syneristic
effects of some metals contaminating mussels on the cytotoxicity of the marine
toxin okadaic acid, Arch. Toxicol 1999. 73 : 289-295.
Traoré A., Ruiz S., Baudrimont I., Sanni A., Dano S.D.,
Guarigues P.H., Narbone J.F., Creppy E.E., Combined effects of okadaic acid and
cadmium on lipid peroxidation and DNA bases modifycations (m5 dC and 8-(OH)-dG)
in Caco-2 cells, Arch. Toxicol 2000. 74 : 79-84.
Traoré A., Baudrimont I., Ambaliou S., Dano S.D., Creppy
E.E., DNA breaks and cell cycle arrest induced by okadaïc acid in Caco-2
cells, a human colonic epithelial cell line, Arch. Toxicol 2001. 75 :
289-295.
Trosko J.E., Tai MH. Adult stem cell theory of the multi-stage,
multi-mechanism theory of carcinogenesis: role of inflammation on the promotion
of initiated stem cells. Contrib. Microbiol 2006. 13 : 45-65.
Tyler RD, Cowell RL, Meinkoth JH. Bone marrow. In: Cowell RL,
Tyler RD, Meinkoth JH, editors. Diagnostic cytology and hematology of the dog
and cat. St Louis: C.V. Mosby 1999. 284-304.
Ugur, A., Yener G., Bassary A. Trace metals and 210Po
(210Pb) concentrations in mussels (Mytilus
galloprovincialis) consumed at western A natoli a. A ppl. Rad. Isotop
2002. 57 : 565-571.
Vaidya O.C., Rantala R.T.T., A comparative study of analytical
methods determination of heavy metal in mussels (Mytilis edulis) from eastern
Canada. Int. J. Environ. Anal. Chem 1996. 63 (3): 179-185.
Whitby L.G., I. Percy-Robb W., Smith A.F., Lecture Notes on
Clinical Chemistry, third ed., Blackwell Sci. Pub, Oxford, London, Edinburgh
1984.
Wright J.L.C., Boyd R.K., Defreitas A.S.W., Identification of
domoic acid, a neuroexitatory amino acid in toxicmussels from eastern PEI, Can.
J. Chem 1989. 67 : 481-485.
Xie, H., Wise, S.S., Holmes, A.L., Xu, B., Wakeman, T.P.,
Pelsue, S.C., Singh, N.P., Wise Sr., J.P. Carcinogenic lead chromate induces
DNA double-strand breaks in human lung cells. Mutat. Res 2005. 586 :
160-172.
Xu J., Lian L., Wu C., Wang X.F., Fu W.Y., Xu L.H. Lead induces
oxidative stress, DNA damage and alteration of p53, Bax and Bcl-2 expressions
in mice. Food and Chem. Toxicol 2008. 46 :1488-1494.
Yasumoto T., Murata M., Oshima Y., Matsumoto G.K., Clardy J.
Diarrhetic shellfish toxin poisoning, in: E.P. Regelis (Ed.), Seafood toxins,
in : ACS Symp. Ser 1984. 262 : 207-214.
Yasumoto T., Nakajima I., Oshima Y. and Bagnis R., A new toxic
dinoflagellate found in association with ciguatera. In: D.L. Taylor and H.
Selinger, Editors, Toxic Dinoflagellate Bloom, Elsevier 1979. 65-70.



