|

jÈ~~Ç
ÉÆíåÊ æ JAÈ~Ç
ãìáÚ1 ÈíáÚ1Ç
ÉíäØì~Ç
ÉÓÑÏã1Ç
Ecole Nationale
Supérieure des Sciences de la Mer et de l'Aménagement du
Littoral
MEMOIRE DE FIN D'ETUDES EN VUE DE L'OBTENTION DU
DIPLÔME D'ETUDES UNIVERSITAIRES APPLIQUEES (D.E.U.A.)
EN SCIENCES DE LA
MER
Sujet :
Contribution à l'étude des parametres
physicochimiques et bactériologiques des eaux du port d'Alger.
Préparé par : LAAMA Chahinez
Présenté à la commission de jury
suivante:
Melle Ait Ameur N Examinateur
Mme Boubechiche Z Promotrice
-Session 2009-


Seigneur dieux Le tout puissant, ne me considère
pas parmi Les
égares; ni parmi Les orgueiLLeux si je réussis
par ta grâce .ne me
compte pas non pLus parmi Les insensés en
cas d'échec.
pLutôt faites en sorte que je me rappeLLe que cet
échec est une
épreuve et une expérience qui
précède La réussite .
OH! Mon dieu si je réussis
considère- moi toujours faibLe
créature modeste, l toi,
L'orgueiL et La vanité.

Remerciement

À Mon père Ahmed et Ma mère
Kheira
Mes soeurs Ahlem et Radaia
Mon Frère Yousef
Mes ami(s)
/(es)

Introduction 1
Chapitre I : généralités
1.1. Présentation de la zone d'étude 2
1.1.1. Situation géographique 2
1.1. 2. Historique du port 2
1. 1. 3. Infrastructure de port 3
1. 1. 4. les conditions climatiques 4
1.1.4.1. L'ensoleillement 4
1.1. 4. 2. Température et précipitation 5
1.1.5. Hydrodynamismes 6
1.1.5.1. Les courants 6
1.1.5.1.1. Courant général 6
1.1.5.1. 2.Les courants dus à la houle 6
1.1.5.1.3. Circulation des eaux dans le port 7
1.1. 5.2. Les houles 7
1.1. 5.3. Les vents 7
1.2. Etat de pollution et environnement 7
1.2.1. Définition de la pollution 7
1.2.2. Etat de pollution du port d'Alger 9
Chapitre II: Matériel et Méthodes
1.2.3. Les points de rejets dans le port d'Alger 10
2.2. Les Prélèvements 12
2. 3. Méthode analytique 13
2.3.1. Etude paramétrique 13
2.3.1.1. Le pH 13
2.3.1.2. Salinité 13
2.3.1.3. Température et Oxygène dissous 13
2.3.1.4. Les Matières en suspension 13
2.3.1.5. La demande biochimique en oxygène (DBO) 5 14
2.3.1. 6. Les sels nutritifs 15
a) Dosage Nitrite (NO-2) 16
b) Dosage Nitrate (NO3 -) 16
c) Dosage de l'ammonium (NH 4 +) 16
d) Dosage d'OrthoPhosphate (PO- 4 ) 16
e) Dosage Silicium (SiO2) 16
2.4. L'analyse microbiologique 16
2 .4.1. Recherche et dénombrement des germes 16
2.4.1.1. Les méthodes de dénombrement 17
2.4.1.2. Dénombrement des coliformes 17
2.4.1.3. Dénombrement des Streptocoques fécaux
20
2.4. 1.4.Dénombrement des bactéries
Sulfito-réducteurs 22
2.4.1.5. La recherche de La flore mésophile total 22
2.4.1.6. Recherche des Staphylocoques fécaux 23
2.4.1.7. La recherche des Salmonelles 24
2.4.2. Les techniques de caractérisation des germes
recherchées 26
a) Coloration de Gram 26
b) Test de catalase 26
c) Les galeries Api. 27
Chapitre III: Résultats et discussions
3.1. Les paramètres physico-chimiques 29
3.1.1. La Température 29
3.1.2. La Salinité 29
3.1.3. Le potentiel d'hydrogene pH 30
3.1.4. Oxygène dissous 31
3.1.5. La demande biochimique en oxygène (DBO) 5 31
3.1.6. Les Matières en suspension 32
3.1.7. Les sels nutritifs 33
a) L'ammonium 33
b) Nitrite et Nitrate 33
c) Orthophosphate 34
d) Silicium 35
3.2. Les paramètres microbiologiques 35
3.2.1. La flore totale mésophile 35
3.2.2. Les coliformes 36
3.2.3. Les Streptocoques fécaux 38
3.2.4. Les bactéries Sulfitoréducteurs 39
3.2.5. Les Staphylocoques 40
3.2.6. Les salmonelles. 42
Conclusion 44
Bibliographies 45
Annexes
APPL : Agence de la Promotion et de la
Protection du Littoral.
BL : Bouillon lactosé.
CF : Les streptocoques
fécaux.
DBO : Demande Biologique en Oxygène.
E .coli : Escherichia .coli .
FMT : La Flore Total Mésophile.
GESAMP : Groupe des experts scientifique et
aspect de protection de l'environnement marin.
L .E.M : laboratoire d'étude maritime.
M.E.S : Les matières en
suspension.
NPP : Nombre le plus probable.
OMS : Organisation Mondial de La
Santé.
ONM : Office National
Météorologique.
ONS : Office National des Statistiques.
PCA : Plate Count Agar.
PSU : Unité pratique de
salinité.
ST : Les staphylocoques.
VBL: bouillon lactosé au vert brillant.
.
VBL: bouillon lactosé au vert
brillant..
WTW : Wissenschaftlish Technische
Werkstatten.
Figure 1 : carte du port d'Alger 2
Figure 2 : Histogramme de l'ensoleillement
pendant l'année 2004 (ONM ; 2004) 5
Figure 3: Diagrammes embro-thermiques de port
d'Alger pendant 2004(ONM ; 2004) 5
Figure 4 : représentation de la
courantologie dans le port d'Alger (LEM ., 1999) 6
Figure 5: Représentation de la
circulation des eaux dans le port d'Alger Rebzani-Zahaf (1999) 8
Figure 6: représentation des points de
rejets dans le port d'Alger selon LEM (2007) 11
Figure 7: Positionnement des stations
d'étude dans le port d'Alger (Google earth) 12
Figure 8: technique de recherche des coliformes
totaux « test présomptif » 18
Figure 9: technique de recherche des coliformes
fécaux « test confirmatifs» 19
Figure 10: technique de recherche des
Streptocoque fécaux« Test présomptif» 20
Figure 11 : technique de recherche des
Streptocoque fécaux « Test confirmatif » 21
Figure 12: technique de recherche des spores de
bactéries sulfitoréductrices 22
Figure 13: les étapes de recherche de la
flore mésophile totale 23
Figure 14 : les étapes de recherche des
staphylocoques par technique de filtration 24
Figure 15: technique de recherche et des
Salmonelles 25
Figure 16: Prélèvement d'une
souche à partir de milieu EL 27
Figure 17: représentation du mode de
remplissage d'une galerie Api 20 E 28
Figure 18 : variation de la température
en fonction des stations 29
Figure 19: les variations de la salinité
en fonction des stations 30
Figure 20 : variation du pH en fonction des
stations 30
Figure 21: variation des teneurs en
oxygène dissous en fonction des stations 31
Figure 22: variation de la DBO5 en fonction des
stations 32
Figure 23: variation des teneurs en MES en
fonction des stations 32
Figure 24: variation des concentrations en
ammonium en fonction des stations 33
Figure 25:variation de la concentraions en
Nitrite et Nitrate en fonction des stations 34
Figure 26: variation des concentrations en
Orthophosphate en fonction des stations. 34
Figure 27: Variation des concentrations en
Silicates en fonction des stations 35
Figure 28: observation des colonies de la flore
totale mésophile à la loupe binoculaire 36
Figure 29 : Concentrations moyennes des
Coliformes totaux, fécaux et E. coli 37
Figure 30: isolement et observation des
coliformes à la loupe binoculaire 37
Figure 31: variation des concentrations en
Streptocoques en fonction des stations 39
Figure 32 : présentation des spores de
sulfitoréducteurs 39
Figure 33: isolement et observation des
Staphylocoques à la loupe binoculaire 40
Figure 34: isolement et observation des
salmonelles à la loupe binoculaire 42
Tableau 1 : Représente la superficielle,
la profondeur et le sédiment pour chaque bassin. 4
Tableau 2 : représente trafic maritime
dans le port d'Alger entre (ONS ; 2003 -2005) 9
Tableau 3 : les points de rejets dans le port
d'Alger selon LEM (2007) 10
Tableau 4: les concentrations moyennes de la
flore totale mésophile des stations 36
Tableau 5: Concentrations moyennes des
Coliformes totaux, fécaux et E. coli 36
Tableau 6 : Résultat des tests
biochimique des Coliformes 38
Tableau 7 : les galeries d'identifications des
espèces étudiées 38
Tableau 8: résultat de tests biochimiques
des staphylocoques 41
Tableau 9: les galeries d'identifications des
espèces étudiées 41
Tableau 10 : résultat de tests
biochimiques des salmonelles 43
INTRODUCTION
D'après Organisation des Nations unies pour
l'éducation, la science et la culture (UNESCO),
la pollution marine est définit comme étant :
« tout rejet à la mer direct ou indirect , de substance ou
d'énergie d'origine humaine qui a un effet nuisible sur les organismes
vivants , dangereuse pour la santé humaine , empeche l'utilisation de la
mer ,en altérant la qualité de l'eau de mer ou qui réduit
les possibilités de son utilisation aux fins de loisirs »
osphériques, industrielles et
ent des eaux domestiques et
En effet, un des problèmes liés aux rejets
domestiques reste les maladies qui en découlent. Selon l'Organisation
Mondial de la Santé (OMS), 80% des maladies qui affectent la population
de la planète sont liées en partie à l'insuffisance de
l'évacuation des matières fécales. Effectivement la
plupart des microorganismes qui sont à l'origine des grandes
épidémies historiques d'origine hydrique, ont pour habitat normal
les intestins de l'homme et certaines animaux à sang chaud .c'est pour
quoi le contrôle de qualité de l'eau parait de plus en plus
indispensable.
Dans la présente étude, on se propose
d'étudier la qualité physico-chimique et
bactériologique
des eaux du port d'Alger car ce dernier est
actuellement dans un état grave et constitue de ce
Fait un danger
sérieux pour la santé publique et une source de contamination
permanente de
l'environnement à cause de l'ensemble de rejets des eaux
usées urbaines et industrielles.
A fin d'atteindre ce but, une campagne de
prélèvement a eu lieu du mois d' avril au mois de mai 2009 ,une
étude physico-chimiques (température, salinité ,pH,
oxygène dessous , DBO , et sels nutritifs ) et une étude
bactériologique représentée par les indicateurs de
contaminations fécales (coliformes et streptocoques fécaux ) ,
des germes pathogènes ( sulfitoréducteurs et Salmonelles) ainsi
que les staphylocoques connu par les indicateurs de proximités .
Ce mémoire s'articule autours de trois grands volets :
Chapitre 1 : introduit la présentation de la zone
d'étude ainsi que son état de pollution. Chapitre 2 :
représente les principales méthodes utilisées.

2
1.1. Présentation de la zone
d'étude 1.1.1. Situation géographiqu
Le port d'Alger est située dans la partie ouest de la
baie d'Alger, ouvert sur la méditerranée sur une longueur de 15
Km. Ses coordonnées Lambert sont 03°03'44"et 03°04' 60"
Longitude Est et 36°45'44"et 36°47'43" Latitude Nord.
Le port s'étale du nord au sud sur 3km, il se dresse au
pied du massif de Bouzeréah, délimité par la jetée
de Mustapha au Nord - Est à 160 m de la côte et par la Bris Lames
Est au Sudouest et par la ville d'Alger à l'Ouest (APPL., 2007).
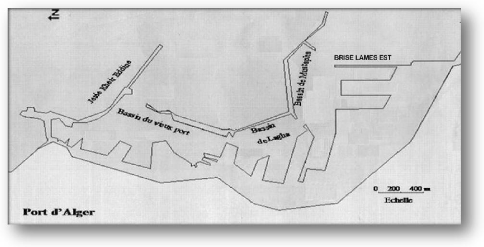
Figure 1: carte du port d'Alger (LEM
1.1.2. Historique du p
Selon Poirel (2008), Le port d'Alger à trouvé
son origine dans un mouillage naturel mal abrité entre la côte et
les ilots (El ~Djazair).La première amélioration de ce mouillage
semble remonter au XVI siècle, sous la domination turque.
Cest le Dey Khaïr-Ed-Dinn qui en 1529, après avoir
chassé les Espagnols du fort "le Penon", construit sur un îlot
faisant face à la ville arabe et turque, décida de le relier
à la terre ferme par un amas de blocs naturels.
En 1830 le port n'offrait qu'une superficie de 3 hectares, 50
aires avec une passe de 130 m au Sud.et Après la prise d'Alger, les
services techniques français entreprirent l'amélioration de la
darse.
en 1870 : les travaux ci-après avaient été
réalisés :
· Jetée Nord sur 500 m.
· Deux formes de radoub.
· Gare et voies ferrées construites en 1865.

De 1870 à 1914 : Les travaux suivants furent
exécutés.
· Fermeture de la passe Est.
· Prolongement de la jetée Nord sur 40 m.
· Elargissement de la jetée Nord allongement sur 100
m de la Jetée Est.
· Agrandissement du port vers le Sud-Est.
· Construction de voies d'accès reliant à la
ville.
· Achèvement des travaux du nouveau bassin.
· Construction du môle reliant l'îlot Al-Djefna
au rivage.
· Construction d'un escalier passerelle d'accès du
Boulevard Carnot aux terre-pleins du Vieux Port.
· Elargissement du môle Amiral-Mouchez et
construction d'un musoir à la passe Sud du Vieux Port.
- De 1897 à 1912 : construction du bassin de l'Agha.
- De 1927 à 1954 : construction du bassin Mustapha qui
est séparé du bassin de l'Agha par la grande môle
Bouloghine et par un passe de 100 m.
- De 1950 à 1953 : construction de la gare
maritime au môle El-Djazair.
- De 1961 à 1963 : construction du môle de
Skikda.
Selon Ait Younes A., Ait Younes R (2008), L'ouvrage en 1982
et 1988 a monté une carapace très dégarnie et une
superstructure très érodé, à cause de
franchissement de la houle. - De 1987 à 1988 : comblement de la darse de
Calvi et réalisation d'un appontement en dues d'Albe et de six rampes
RO-RO.
- De 1992 à 1999 : construction du terminal à
conteurs d'une superficie de 17,5 hectares qui comprend :
· Un bâtiment administratif.
· Un Hangar d'empotage et de dépotage.
· Un parc à engin.
· Un atelier de maintenance, un poste de control.
1.1.3. Infrastructure de port
Selon Sefsaf (2008), afin de faire muter le port d'Alger à
un stade structurellement supérieure, un plan de développement et
de modernisation s'étalant jusqu'à 2015 initiés par
l'entreprise qui est en cours de mise en ouvre. Les actions projetées
concernent notamment : -Un parc pour le trafic roulant en R+4.
-L'aménagement d'une deuxième gare maritime.
-La réalisation d'un deuxième terminal à
conteur.
-La réalisation d'un deuxième silo
jà céréales, l'équipement du premier
terminal à conteneur en portique.
- L'acquisition d'engins navale de servitude.
- Un btiment d'exploitation équipé d'une info-
centre.

4
1) Jetées et brise Lames
Le port est doté de 4 jetées de 4000 m qui sont
:
m Brise Lames s'étendant parallèlement à la
côte.
m Jetée de Kheir #177;Eddine.
m Jetée de l'Agha.
m Jetée de Mustapha.
2) Bassins
L'espace entre les jetées et les quais forme trois bassins
qui sont représentés dans le tableau 1.
Tableau 1 : Représentation de la superficielle, la
profondeur et le sédiment de chaque bassin.
|
Bassin
|
Superficielle
|
Profondeur
|
Le sédiment
|
|
Vieux port
|
70ha
|
7-20m
|
Vase sableuse
|
|
Agha
|
35ha
|
6,5-15m
|
Vase sableuse
réduite
|
|
Mustapha
|
37ha
|
7m
|
Vase noire
gluante et fétide
|
3) Accès maritime : se fait par deux
entrées Passe nord : 176 m de largeur et 22 m
de profondeur. Passe sud : 240 m de largeur et 16 m
de profondeur.
4) Accès terrestre
Un réseau routier important complète la liaison du
port d'Alger avec l'intérieur. 1.1.4. Les
conditions climatiques
1.1.4.1. L'ensoleillement
La baie d'Alger est influencée par un climat
Méditerranée avec un été sec et chaud et un hiver
doux et pluvieux.
Selon l'office national météorologique ONM
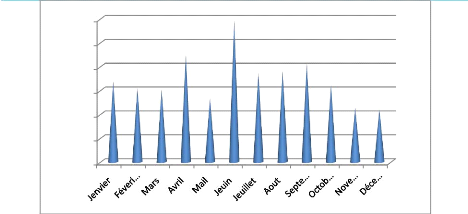
(2004), le port d'Alger est caractériser par un été
ensoleillé car il attient son maximum dans le mois de juin contrairement
en hiver il est nuageux dont l'ensoleillement est minimum dans le mois de
décembre.
L'Histogramme ci-dessous représente les variations de
l'ensoleillent en heures entières dans le port d'Alger durant
l'année 2004.
Chapitre I Généralités
l'ensolillement en herure entiere
300
250
200
150
100
50
0
mois

Figure 2: Histogramme de l'ensoleillement pendant
l'année 2004 (ONM., 2009).
1.1.4.2. Température et
précipitation
Le diagramme embro-thermique qui représente une
relation parfaite entre les températures et les précipitations
durant l'année montre que L'amplitude dans le port d'Alger est longue,
elle s'étale sur sept (07) mois à partir de mois de Mai
jusqu'à mois de novembre.
Cette longue durée de l'amplitude est du au fait que la
baie d'Alger est située dans la plaine de Mitidja et elle est
influencée par un climat Méditerranéen.
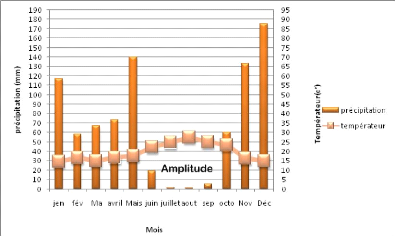
Figure 3: Diagrammes embro-thermiques de port d'Alger
pendant 2004(ONM., 2009) .

6
1.1.5. Hydrodynamismes 1.1.5.1. Les courants
1.1.5.1.1. Courant général
L'écoulement des eaux d'origine Atlantique le long des
côtes Algériennes par le détroit de Gibraltar,
appelé courant Algérien (Benzohra ., 1993).
Le courant Algérien est large car il s'étale sur
plusieurs mille nautique parallèlement à la côte, son
influence se fait sentir jusqu'à l'isobathe 200 m. Sa vitesse attient
quelque dizaines de cm.s-1 , Il suit généralem ent la
pente et génère des petits tourbillons de 10 à 100 km de
diamètres, vivant de quelques semaines à quelques mois .de parts
à d'autres ,ce courant formes un méandre croissant jusqu'a 50
à 100 km , il peut alors se détacher formant un tourbillon
anticyclonique de 100 à 200 km de diamètres (GUY .,2006).
1.1.5.1.2. Les courants dus à la houle
Dans le cas général des houles de petites ou
moyennes amplitude, les coutants ne
sont pas significatifs que dans la zone de déferlement
(LEM ., 1999).
Pour les houles de forte amplitude, elles pourraient agir en
fonction de l'amplitude jusqu'aux fond de - 40 à -60 m et jusqu'à
des fond de -100 m par des grandes tempêtes (Leclaire ., 1972).
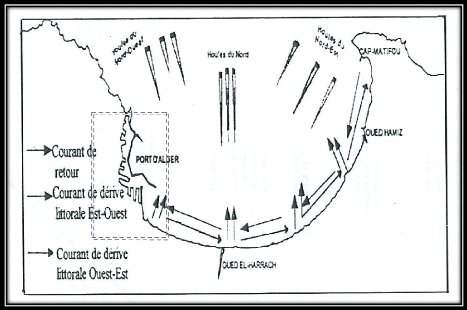
Figure 4 C LIELIMIADABn SRIDIRKLDnAIOUBBSDIs leMLA
S15 lUeL T ( 0 MEE99).

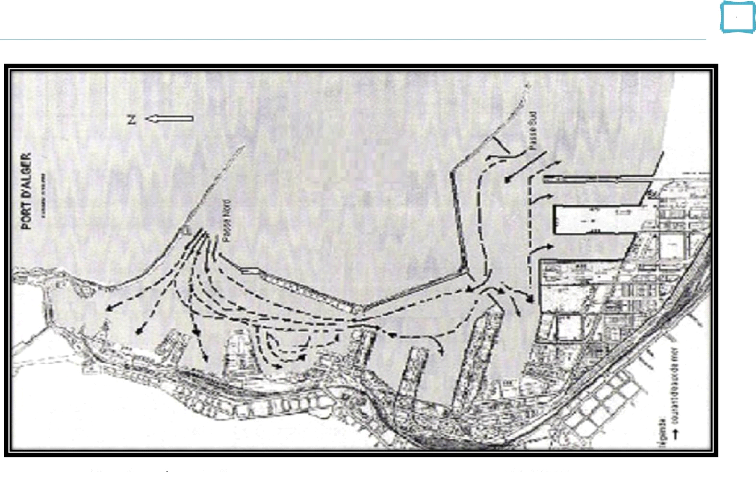
1.1.5.1.3. Circulation des eaux dans le port
La circulation des eaux portuaires a ete etablie par
Rebzani-Zahaf (1999) in (Ait Younes A., Ait Younes R ., 2008),
présentée dans la figure (5) montre des entrées d'eaux
dans l'enceinte portuaire qui viennent de la baie, et se
localisent au niveau des passes Nord et Sud du port. Les eaux circulent dans
les bassins du Nord vers le sud et vice versa.
1.1.5.2. Les houles
La houle est un système d'oscillation plus ou moins
régulier correspond à une déformation de la surface de
l'eau induite par le vent (Guilcher ., 1979 in Ait Younes A et Ait
Younes R .,2008).
Une periode hivernale avec predominance au large des houles de
secteur Nord - Est à l'Est, les houles de secteur Nord étant
régulièrement réparties tout au long de l'année.
Les temprtes les plus frequentes proviennent neanmoins du secteur Nord, mais
celle de Nord - Est, plus rares sont plus destructrices, la direction la plus
défavorables étant N 30°.L'occurrence du telle temprtes peut
~tre située entre Décembre et Mars et occasionnellement jusqu'
à juin. Les houles d'été atteignent cette zone d'une
manière frontale (LEM ., 2007).
1.1.5.3. Les vents
Selon les études du laboratoire d'étude maritime
LEM (2007), les vents du secteur Nord - Est (N60°) sont les plus frequents
avec pres de 30 % des observations. Les vents sont mieux marques en ete .leur
vitesse se repartit entre 1 et 30 noeuds toute foie pour prés de 20% de
ces observations .la vitesse est de 6 à 10 noeuds.
Le vent secteur Ouest - Sud - Ouest (N260°) sont bien
representes avec plus de 20% des observations ils soufflent principalement en
hiver, la vitesse de ces vents est de 6 à10 noeuds
pour 17% des observations en hiver .la vitesse de ces observations peut
atteindre 30 noeuds à 0 ,23 %.
Vent secteur Sud - Sud - Ouest (N180°), les moins
representes avec moins de 10% des observations, sont mieux marqués en
automne et hiver, leurs vitesse et de 6 à 10 noeuds pour pres de 9 % des
observations.
1.2. Etat de pollution
1.2.1. Définition de la pollution
Selon (Brisou et Denis .,1978) , le Groupe des Experts
Scientifiques et Aspect de Protection de l'Environnement Marin
(GESAMP) definit la pollution marine comme « introduction par
l'homme directement ou indirectement ,de substance ou d'énérgie
dans le millieu marin y compris les estuaires occasionnant des effets nefastes
tels que nuisance envers les ressources biologiques ,risques pour la
santé de l'homme ,entraves aux activites maritimes y compris la prche
,altération de la qualité de l'eau de mer , du
point de vue de son utilisation et dégradation des valeurs
d'agréments»

8

9
1.2.2. Etat de pollution du port d'Alger
La pollution dans le port d'Alger se caractérise par
deux gradients décroissants, le premier affecte tous les fonds de darses
en s'étalant graduellement vers le bassin d'évolution, le second
part du bassin de Mustapha (plus pollué) à travers le bassin Agha
pour atteindre le bassin du vieux port (LEM ., 2007).
Cette pollution est due essentiellement à :

L'influence directe de la ville d`Alger et sa banlieue,
où convergent les rejets urbains d'une ville de prés de 3000
habitats et le siège d'activité industrielle, commercial, de
pêche et de plaisance (LEM ., 2007).
Décharges directe des bateaux.
L'impotence et la densité des activités
industrielles, trafic terrestre et le trafic maritime.
Le trafic maritime dans le port d'Alger est enregistré
par un flux entrant et un autre sortant augmente d'une année à
une autre. Ces flux sont représentés dans le tableau 4 par le
nombre des navires qui arrivent et qui sont en départs.
Tableau 2 : représente trafic maritime dans le
port d'Alger entre (ONS ; 2003 -2005).
|
Ammée
|
2003
|
2004
|
2005
|
|
Arrivées
|
180.616
|
220.264
|
197.257
|
|
Départs
|
144.108
|
178.783
|
159.289
|
|
La concentration importante en polluant métallique et
un nombre impressionnant des rejets aboutissant dans le port, sans station
d'épuration font du port une zone à risque (APPL., 2007).
|
1.1.7. Les points de rejets dans le port
d'Alger
Selon laboratoire d'études maritime LEM (2007), La
canalisation d'eaux usées et d'autres au niveau de port d'Alger sont au
nombre de 25 citez dans le tableau 3.
(03) rejets
(02) rejets
(2) rejets
(4) rejets
(2) rejets
(01) rejets
(01) rejets
(01) de la central électrique « Souelgaz »
(4) rejets
(6) concernant les huiles, savonneries et eaux usées
(01) de E .N.C.G *
Tableau 3 : les points de rejets dans le port d'Alger
selon LEM (2007).
Numéro de quai Nombre de rejets
|
N° 4 N°8
N°12
N°21
N°24
N°25
N°26
N°27
N°28
N°32
N°36
|

10
*L'Entreprise nationale des corps gras
Il y a également (08) rejets d'origine domestique
situés au niveau de la darse de l'Amirauté. Les points de rejets
pour chaque quai sont représentés dans la figure 6.
CHAPITRE I Généralités
Figure 5: représentation de la circulation des
eaux dans le port d'Alger Rebzani-Zahaf (1999).
8
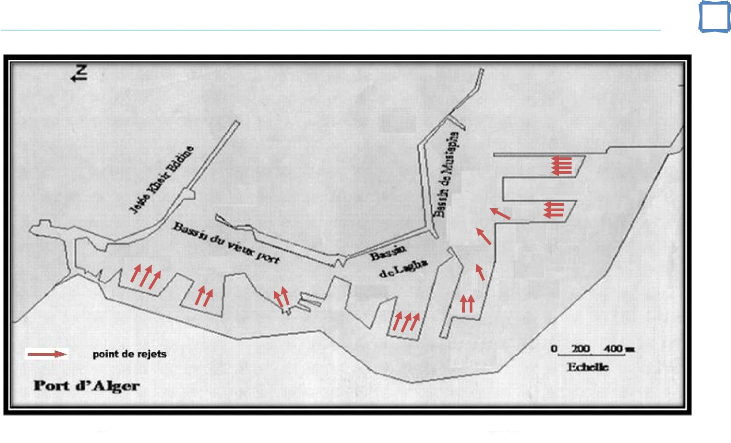
Chapitre I
Généralités
Figure 6: représentation des points de rejets dans
le port d'Alger selon LEM (2007).
11

12
2.1. Le choix des stations
L'objectif de notre étude est d'évaluer la
qualité des eaux du port d'Alger en analysant les paramètres
physico-chimiques et bactériologiques.
Trois stations ont été choisies dans la zone
d'étude en fonction de l'intensité de la pollution :
présence du jeté d'Agha (S1), plus éloigne de
l'égout de la première station (S2) et stationnement des grands
bateaux de marchandise (S3).
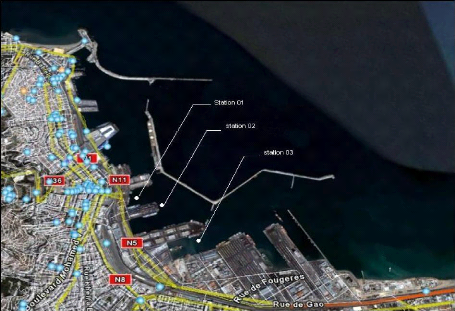
Figure 7: Positionnement des stations d'étude dans
le port d'Alger (Google earth). 2.2. Les prélèvements
Les prélèvements se sont étalés sur
une période de deux mois, le rythme d'échantillonnage
était d'un prélèvement par mois. Ils ont été
réalisés entre 9h et 11h .
Le prélèvement e
heure à 170°c.
Deux flacons d'eaux ont été remplis ; l'un est
destiné à l'analyse des sels nutritifs, la matière en
suspension et la DBO5 et l'autre est destiné à l'analyse
microbiologique.
Afin d'éviter tout changement chimique de l'eau et
d'inhiber l'activité bactérienne, Les échantillons sont
transportés dans une glacière isotherme (4°c), l'analyse se
fait le meme jour.
Les mesures de la température, salinité, pH et
l'oxygène dissous ont été faites sur place.

2. 3. Méthodes analytiques 2.3.1. Etude
paramétrique 2.3.1.1. Le pH
Le pH de l'eau a été mesuré par la
méthode électrochimique à l'aide d'un pH-mètre de
terrain
d e marque WTWtypepH 315 i/Set avec précision #177; 001
Il permet de mesuré la différence
L'électrode en verre est rincée après chaque
manipulation avec l'eau distillée.
L'étalonnage de l'appareil est effectué avec des
solutions étalons à pH connu ( acide , neutre , base
).
2.3.1.2. La Salinité
La mesure de la salinité in situ a
été réalisée à l'aide d'un
salinomètre de marque Cond 197i (WTW) avec une précision de #177;
01%
L'étalonnage a été effectué à
partir d'eau de mer que l'on introduit après l'avoir amenée
à la température ambiante dans la cellule de mesure. Le salinom
ètre est réglé pour donner la
conductivité
correspondant à la chlorinité de l'eau de
mer normale.
2.3.1.3. La température et l'Oxygène
dissous
L'utilisation de la méthode électrochimique nous a
permis l'estimation simultanée de la
t empérature et de l'oxygène dissous. L'appareil
utilisé est un oxymètre de terrain de marque OXI 197i (WTW) qui a
une précision de #177; 01%
La sonde électrolytique est plongée dans l'eau
prélevée immédiatement dès le remplissage des
flacons.
2.3.1.4. Les matières en suspension
(M.E.S)
n Principe de la méthode
La méthode consiste à filtrer l'eau de mer sur
membrane filtrante afin de retenir toutes les particules de taille
supérieure à 05 um environ La membrane est rincée
séchée et pesée avant et après filtration La
différence de poids permet de connaitre la masse sèche totale de
m atière en suspension dans le volume filtré correspondant
(Aminot et Kérouel ,2004).
n Mode opératoire
Le dispositif de filtration est constitué d'une base
support-filtre surmontée d'un entonnoir amovibl e entre lesquels est
pincé le disque membrane filtrant
Un volume représentatif de l'eau (500 ml) de chaque
échantillon est filtré à travers un filtre (Wattman GF/F,
diamètre : 47 mm) préalablem ent conditionné et
pesé Pour éviter tout éclatement des mailles des filtres
ou des cellules vivantes la filtration est toujours effectuée avec des
dépressions inférieures à 300 mm de mercure (Aminot et
Chaussepied, 1983).
Avant la filtration le disque filtrant est laver (avec l'eau
distillée), sécher pendant 2h à l'étuve et peser

14
Calcul et expression des résultats
Les concentrations sont calculées selon la formule
suivante :
[M.E.S] (mg/l) = (P2 - P1) / V
[M.E.S] : concentration de la matière en
suspension (mg/l).
P1 : poids du filtre sec avant filtration
(mg).
P2 : poids du filtre sec
après filtration (mg).
V : volume d'eau filtré (l).
2.3.1.5. La demande biochimique en oxygène
(DBO5)
Elle est représentée par la quantité
d'oxygène nécessaire aux microorganismes pour dégrader la
matière organique dans l'eau (Aminot et Chaussepied ., 1983).
C'est une méthode manométrique avec des
manomètres de marque OxiTop à affichage numérique qui se
fixe directement sur le flacon de DBO.
Il permet de mesurer la quantité d'oxygène
consommée et qui est induite par la production de CO2 absorbé par
un piège à soude créant ainsi une dépression
enregistrée par le manomètre. Cette dépression est
liée par corrélation à la DBO en fonction du volume de
l'échantillon (annexe X).
Le mode opératoire est décrit dans le catalogue de
l'appareil :
> La prise d'essai est de 250 ml.
> Introduire 250ml dans un flacon brun en verre contenant un
baromagnétique.
> Mettre deux pastilles de soude (NaOH) dans un ruban en
caoutchouc dans le goulot de la bouteille.
> Fermer les flacons par les têtes et mettre à
0.
> La température est équilibrée par un
thermostat réglé à 20°C.
> Les échantillons sont incubés à
l'obscurité dans une armoire thermorégulatrice fermée
à clef pendant cinq jours.
> La lecture des résultats se fait selon la formule
suivante :
DBO5 (mg d'O2/L) = Valeur lu * Facteur
Valeur lu : afficher sur la tête
de chaque flacon.
Facteur : un coefficient en relation
avec le volume incubé (annexe X).

2.3.1.6. Les sels nutritifs
Principe des dosages des sels nutritifs
La méthode du dosage des sels nutritifs (ammoniums,
nitrites, nitrates, orthophosphates et silicates) est basée sur une
réaction de la coloration. Ces sels réagissent dans des
conditions (présence de catalyseurs, température, pH,...) avec
des réactifs spécifiques (annexe V) pour donner une coloration
absorbant la lumière à une certaine longueur d'onde
(ë).
L'absorption de la lumière dépend de
l'intensité de la coloration et cette coloration est
plus forte si l'eau est concentrée en sel dosé. La
quantité de la lumière absorbée par la solution
(absorbance A) ou bien densité optique (D .O) est calculée selon
la loi BEER-LAMBERT qui est la suivante :
A = D. 0 = In(
) = E. L. C
Io

I
Io et I : sont respectivement l'intensité lumineuse
incidente et émergente du milieu absorbant.
E: Le coefficient
d'extinction molaire variant en fonction de la température et de la
longueur
d'onde.
L : La longueur du milieu traversé exprimé en
cm.
C : concentration de la solution absorbante
exprimée en mol/l. A : absorbance de la solution.
D.O : densité optique de la solution.
Analyse automatique des sels nutritifs dans
l'eau
L'analyse est réalisée automatiquement
vis-à-vis des manipulations nécessaires au dosage manuel :
prélèvements, analyse et lecture (Rodier et al. 2005).
Pour notre étude, l'analyse des sels nutritifs est
faite par colorimétrie à flux continu sur une chaine
automatisée « Auto-Analyzer SAN PLUS » en suivant les
protocoles définis par le fabricant (Skalar, 2000).
L'appareil fonctionne selon un principe dynamique simple, celui
de l'analyse liquide en milieu continu :
Par l'intermédiaire d'une pompe péristaltique,
une veine liquide progresse en continu, ce qui permet une polyvalence et une
grande souplesse. Toutes les réactions chimiques se déroulent
dans la veine en progression. L'analyse des échantillons est faite par
séquence, donc une grande cadence de travail.
a)

16
Dosage de Nitrite (NO-2)
Les nitrites sont dosés par une méthode
colorimétrique basée sur la réaction de Griess oil les
NO2- réagissent avec une première amine aromatique
pour former un diazoïque qui est couplé à une seconde amine
aromatique pour produire un colorant rose (annexe VI) (Bendschneider et
Robinson .,1952) in (Aminot et kerouel ., 2004) .
b) Dosage de Nitrate (NO3-)
Une méthode colorimétrique du composé de
Griess obtenu avec le nitrite après réduction du nitrate en
nitrite (annexe VI). Cette réduction se fait à l'aide d'une
colonne réductrice de Cadmium (Wood et al ., 1967)
in (Animot et kerouel ., 2004).
c) Dosage de L'ammonium (NH 4+)
Une méthode colorimétrique du bleu
d'indophénol basé sur la réaction de BERLTELOT où
l'ammoniac, en milieu basique, réagit tout d'abord avec l'hypochlorite
pour former un monochloramine , puis successivement avec deux molécules
de phénol pour former le bleu d'indophénol (annexe V) (Aminot et
Kéroul ., 2004).
d) Dosage d'Orthophosphate (PO-4
)
En milieu acide et en présence de molybdate d'ammonium
se forment un complexe phosphomolybdique qui est réduit par l'acide
ascorbique (annexe VII) et il se traduit par une coloration bleu (Rodier et al
., 2005).
e) Dosage de Silicium(SiO2)
Le silicium dissous (représenté dans l'eau par
95% sous forme d'acide orthosilicique (Aminot et Chaussepied ., 1983) .Il
réagit avec le molybdate d'ammonium en milieu acide pour former un
complexe silicomolybdique qui sera réduit par l'acide ascorbique (annexe
VIII) en un composé coloré en bleu absorbant à 810 nm
(Mullin et Riley .,1955in Aminot et Kéroul ., 2004).
2.4. Analyse microbiologique
2.4.1 Recherche et dénombrement des
germes
Les germes recherchés sont les coliformes totaux, les
coliformes fécaux, Escherichia coli et les streptocoques
fécaux .ces germes sont peu ou pas pathogène, ils sont
révélateur de contamination fécale et entrainent par leur
abondance la présomption de contamination plus dangereuse (Figrella et
al ,2001).

Les germes supplementaires recherches sont les staphylocoques,
les sulfitoreducteurs et les salmonelles.
2.4.1.1 Les méthodes de
dénombrement
Dans la presente etude, nous avons utilise deux methodes de
denombrement :
La methode de fermentation en tubes multiples appelee aussi
methode du nombre le plus probable (NPP) pour les coliformes totaux, fecaux et
les streptocoques.
La methode de filtration sur membrane pour les staphylocoques.
n méthode du nombre le plus probable
(NPP)
La methode de determination du nombre le plus probable (NPP) est
une estimation statistique du nombre de germes dans un milieu liquide (Joy et
Raynaud., 2003).
La determination du nombre caracteristique (le nombre de
tubes positifs) permettra l'établissement du nombre le plus probable
à l'aide de la table de Mc Grady (annexe III) (Brisou et Denis .,1980
in Rodier et al .,2005)
La méthode de filtration
La technique de filtration est une estimation plus exacte sur
la charge bacterienne, elle consiste à faire passer des produits
liquides sur une paroi poreuse ou sur une membrane qui retient les bacteries
(Dellarras., 2007).
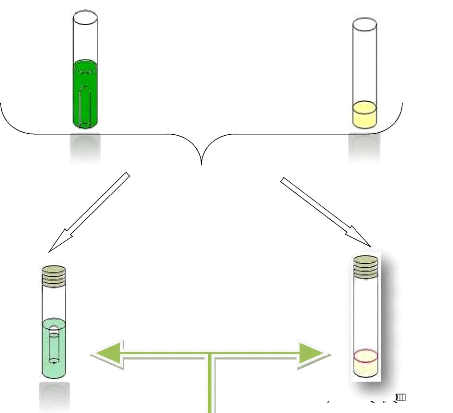
2.4.1.2 Dénombrement des coliformes
Le denombrement des coliformes a ete effectue par la methode de
NPP (Rodier et al, 2005). Il fait appel à deux tests consecutifs
à savoir :
n Test présomptif : reserve la
recherche des coliformes totaux. fait sur un milieu selectif (bouillon
lactose), sa fermentation se traduit par un degagement de gaz dans la cloche de
Durham et un trouble après une incubation à 37°c (figure
8).
n Test confirmatif : reserve pour la
recherche des coliformes fecaux et Escherichia coli sur un milieu plus
selectif (VBL) à une temperature de 44°c, à partir des tubes
positifs du test presomptif (figure 9).

18
Effectuer des dilutions dans 9ml d'eau physiologique de
l'ordre de 10-6
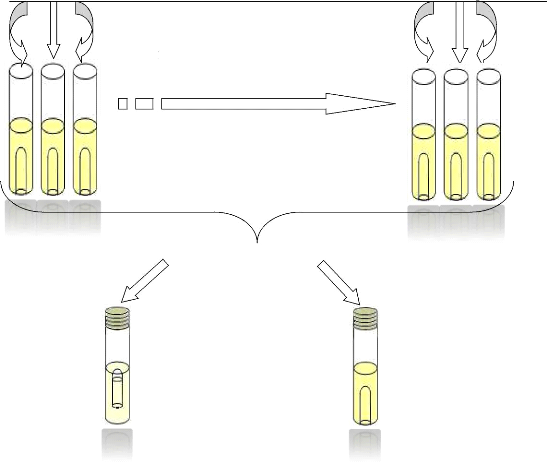
Incubation à 37°c pendant 24h
Positive Négative
Bouillon lactosé [D/C] +cloche de
Durham
Trouble ou production de gaz Aucun changement ne traduit
Présence des coliformes totaux
Figure 8 : technique de recherche des coliformes totaux
« test présomptif »
Tube positive
Présence des coliformes fécaux
Présence de E .coli
Figure 9: technique de recherche des coliformes
fécaux « tests confirmatifs »

4à5goutes dans 10ml de VBL + cloche 2à3 goutes dans
5ml de EPI
Incubation à44°c pendant 24h
2à3 gouttes de Réactif de Kovacs
Formation d'un
Trouble et gaz dans la cloche anneau rouge

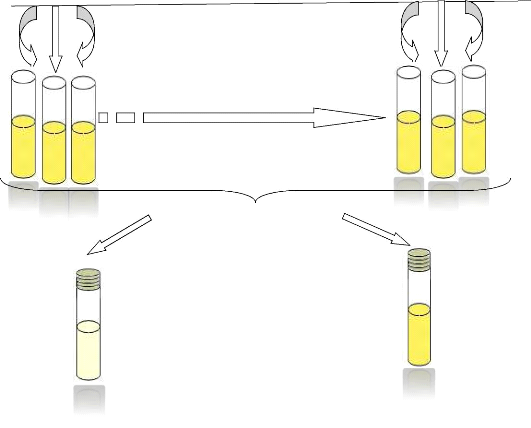
Tube positive (formation de
trouble) Tube négative (aucun changement)
Figure 10: Technique de recherche des Streptocoques
fécaux « Test présomptif»
Incubation à37°c pendant 24 à
48h
Bouillon de Rothe (D/c)

20
2.4.1.3. Dénombrement des
streptocoques
La technique de recherche des Streptocoques fécaux
nécessite deux tests :
· Test présomptif :
réalisé sur le milieu de Rothe (figure 10).
· Test confirmatif : se fait par repiquage
des tubes positifs sur le milieu d'Eva Litsky (figure 11).
Effectuer des dilutions dans 9ml l'eau physiologique de
l'ordre 10-6

Tube positive
Prélèvement de 4 a 5 goutes
°ouORnId'E9 $ III BANy
Incubation à 37°c pendant 24h
Tube positive Tube négative
(Trouble +formation de pastille violette (aucun
changement)
Au fond de tube)

Présence de streptocoques
fécaux
Figure 11: technique de recherche des Streptocoques
fécaux « Test confirmatif »
Les tubes contenant 2ml de la solution mère ou des
dilutions sont maintenus au
Bains à 80° C pendant 10 minutes
Ajouter 18 ml TSC mélanger et éviter les bulles
d'aires. Solidification à 30 minutes.

22
2.4.1.4. La recherche des bactéries
Sulfito-réductrices
Les colonies typiques des bactéries
sulfito-réductrices sont issues de spore de Clostridium (Dellarras .,
2000) oil cette forme est beaucoup plus résistante que les formes
végétatives des coliformes et des Streptocoques. Ce test permet
de mettre en évidence une pollution fécale ancienne (Rodier et al
.,2005).
La recherche des bactéries sulfito-réductrices se
fait principalement en trois étapes (REJSEK ., 2002) :
· Destruction de la forme végétative.
· Préparation de milieu de culture.
· Ensemencement et incubation.
Le mode opératoire est schématisé dans la
figure 12.

|
|
|
|
Assurer la fusion d'un flacon du milieu Tryptone
Sulfite
Cyclosérine (TSC) + Alun de Fer + solution de Sulfite de
|


Incubation à 37°c pendant 24h
Figure 12: Technique de recherche des spores de
bactéries sulfitoréducrices .
2 .4.1.5. La recherche de la flore totale
mésophile (FMT)
Ces bactéries aérobies mésophiles,
hétérotrophes, ne sont pas des germes indicateurs de
contamination fécale, cependant ils sont recherchés dans
certaines eaux à 22°c et à 37°c, car ils peuvent par
fois exprimer un risque de contamination microbienne au delà d'un
certain seuil (Dellarras ., 2007)
Le dénombrement de la flore totale a été
fait par ensemencement du milieu gélosé Plat Count Agar (PCA) en
profondeur (figure13).

A partir des dilutions décimales de l'ordre de
10-6

Répartir 1ml de chaque dilutions dans les boites de
pétri
Ajouter jusqu'à 15 ml du milieu PCA
Homogénéisation solidification



Incubation à 22°c pendant 5jours

Lecture des résultats
Figure 13: les étapes de recherche de la flore
totale mésophile
2.4.1.6. La recherche des Staphylocoques
fécaux
Un volume de 50 ml et des dilutions d'échantillon ont
été filtrés. La membrane a été
déposée sur la gélosé de Chapman coulée dans
des boites de pétri.
Ce milieu est caractérisé par sa forte
concentration en chlorure de Sodium ce qui permet un isolement sélectif
des Staphylocoques (Rodier et al ., 2005).
Les étapes de recherche des Staphylocoques sont
schématisées dans la figure14.
Filtration d'un volume d'eau à partir de
l'échantillon ou des dilutions
|
|
|
Mettre les filtres dans la gélose de Chapman
|

24
Incubation à 37 °c pendant 48 h

Aspect du milieu après développement des
staphylocoques
Figure 14: les étapes de recherche des
staphylocoques par technique de filtration.
2.4.1.7. La recherche des Salmonelles
La recherche des salmonelles à été
effectuées en trois étapes successives :
pré-enrichissement, enrichissement et l'isolement (figure 34) (Rodier et
al ., 2005) .
Le mode opératoire est schématisé dans la
figure 15.
|
100 ml d'eau peptonée tamponnée +
100ml de l'é
|
|
Pré -enrichissement
|
Production d'un trouble
10ml de SFB+ Pastille
'Additif SFB
2 à 3 goutes
Incubation à 37°c pendant
48heures
Changement de couleur
Tube positive
Figure 15: Technique de recherche des
Salmonelles.
enrichissement


Incubation à 37°c pendant 16h à 20
heures.

26
Chapitre II Matériel et
Méthodes
2.4.2. Les techniques de caractérisation des
germes recherchées
Afin de mieux caractériser le profil biochimique et
morphologique des bactéries recherchées, qui appartiennent aux
groupes des coliformes, des staphylocoques et des salmonelles.
Une séries de tests a été effectuée,
il s'agit de :
a) Coloration de Gram
Elle est reliée principalement à la
différence de structure chimique des parois cellulaire des
bactéries (Dellarras et Bernard., 2003).
Le protocole de coloration de Gram selon Dellarras (2007) est le
suivant :
> Préparer un frottis d'une culture bactérienne
pure.
> Recouvrir le frottis de violet de Gentiane ; laisser agir
une minute ; rincer à l'eau distillée.
> Verser du Lugol et le laisser agir pendant une minute ;
rincer à l'eau distillée.
> Décolorer jà l'alcool à 95%, entre 15
et 30 seconde ; rincer à l'eau distillée.
> Recolorer avec la Fushine pendant 10 à 30 secondes ;
rincer à l'eau distillée.
> Sécher au -dessus de la flamme d'un bec
benzène.
Avec cette coloration double, les bactéries Gram positif
apparaissent en violet foncé tandis que les bactéries Gram
négatif sont colorées en rose ou en rouge.
b) Test de catalase
La catalase est une enzyme présente chez la plus parts
des bactéries aérobies strictes et anaérobies
facultatives. Elle permet de détruire des peroxydes formés au
cours de réaction de l'oxydation ( Dellarras et Bernard ., 2003) .

L'eau oxygénée formée est
décomposée en présence de cette enzyme, en eau et en
oxygène qui se dégage suivant la réaction.
2112O2 2112O + O2
Selon (Dellarras et Bernard .,2003), le mode opératoire
est le suivant :
Sur une lame porte - objet, déposer une goute de
112O2 à10 V.
Ajouter une anse de bactéries prélevée
d'une culture.
Le dégagement des bulles de gaz signifie que le test est
positif.
c) Les galeries Api
La Galerie API est formé de 20 microtubes, prIts à
l'emploi permettant de réaliser 23 tests biochimiques (Joy et Reynaud.,
2003 )
Chaque tubule contient un substrat différent sur lequel
le micro-organisme recherché va réagir. Ils sont remplis d'une
suspension bactérienne calibrée (de densité
différente selon la galerie).
Le mode opératoire suivi est :
n Préparation de la galerie
ü Mettre de l'eau distillée sur le fond de la
boîte (partie alvéolée), toutes les alvéoles doivent
~tre remplies, éliminer l'excès d'eau en renversant la
boîte au dessus de l'évier.
ü Placer la galerie sur le fond de la boîte elle doit
être manipulée avec la pince.
ü Recouvrir la boîte avec son couvercle.
n Préparation de l'inoculum
Réalisez une suspension de la souche à
étudier. La suspension doit avoir une densité suffisante (1
colonie dans 5 ml) figure 16.
Prélèvement d'une souche pure
|
Une colonie dans 5ml d'eau physiologique
|
|

27
Figure 16: Prélevement d'une souche a partir de
milieu EL.
n Ensemencement de la galerie API
Introduire la suspension bactérienne dans chaque tube
à l'aide d'une pipette Pasteur stérile, pointe appuyée
à l'intérieur et sur le côté pour éviter la
formation des bulles.
n Mode de remplissage
ü Les substrats dont le sigle est encadré, la cupule
doit aussi être remplie de manière à créer un
ménisque (A) .
ü Les substrats dont le sigle est soulignés, la
cupule doit être remplie d'huile de paraffine (B ) soit pour créer
l'anaérobiose (absence d'oxygène), soit pour maintenir en
solution les ions volatils produits par la réaction et ainsi assurer le
virage de l'indicateur coloré de pH.
v' Les creux du support de la galerie doivent être remplis
d'eau pour former une chambre humide, puis la galerie est posée dans le
support et le couvercle par dessus.
v' L'ensemble est incubé à une température
adaptée pendant 24 à 48h.

Remplir de suspension le tube et la cupule Remplir le tube de
suspension et recouvrir
CIT, VP, GEL d'huile de paraffine
ADH, LDC, ODC, H2S, URE
Figure 17: représentation du mode de remplissage
d'une galerie Api 20 E.
? Lecteur galerie API
La Lecteur des galeries se fait par détermination d'un
code, ceci est représenter par la somme des tests positifs pour chaque
séries.
La série est représentée par trois tests
(annexe IV).
3.1. Les paramètres physico-chimiques 3.1.1. La
température
Les valeurs de la température mesurées dans les
trois stations sont représentées dans la figure 18.
Les températures moyennes enregistrées pendant la
période de prélèvement varient entre une valeur minimale
de 19,8°C (S1) et une valeur maximale de 20,55°C (S3).
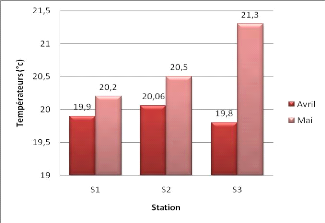
Figure 18: variation de la température en fonction
des stations.
Cette légère différence est liée
aux conditions métrologiques car la couche superficielle est soumise
à l'influence directe des conditions météorologiques (une
situation typique à la période printanière).
3.1.2. La salinité
Les valeurs de la salinité mesurées dans
l'ensemble des stations sont représentées dans la figure 19.
Les valeurs moyennes de salinité trouvées lors
de cette étude sont tout à fait attendues ; en effet une baisse
de salinité dans S1 (28,8psu) et S3 (29,15psu) peut s'expliquer par un
apport local d'eau douce par l'égout qui diverse directement dans (S1)
et vidange des bateaux, déballastages dans (S3). La salinité de
la station S2 (36,25psu) est caractéristique de la salinité des
côtes Algériennes.

Figure19: les variations de la salinité en
fonction des stations. 3.1.3. Le potentiel d'- \ drRJqnJI(pH)
Le pH est considéré comme étant l'un des
paramètres les plus importants de la qualité des eaux ; il est
étroitement surveillé au cours de toute la période de
prélèvement. (Brisou et Denis ., 1980).
On remarque que le pH dans l'ensemble des stations se situe
entre 6,87 et 6,89 (figure 20). Ces valeurs sont inferieur aux valeurs du pH de
l'eau de mer qui est de 8,3 (Aminot et kérouel.,2004) .
Cette diminution est probablement due aux apports d'eaux douces
ainsi que les produits chimiques rejetés par les unités
industrielles.
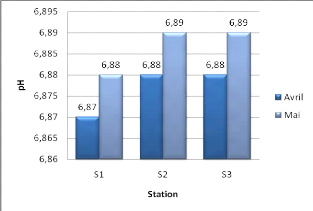
Figure 20: variation du pH en fonction des
stations.
3.1.4. L'oxygène dissous
Des variations importantes de l'oxygène dissous ont
été observées entre S3 (1,2 mg/l) et S2 (5,3 mg/L) (figure
21).
La variation de ce paramètre est due aux mélange
des masses d'eaux, échange air-mer, la respiration de la biomasse
(ensemble de la faune et de la flore aquatique) et la photosynthèse (Le
pimpec et al ., 2002).
.
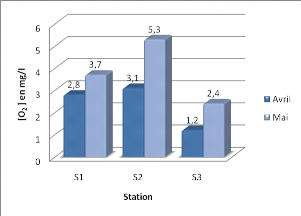
Figure 21: variation des teneurs en oxygène
dissous en fonction des stations. 3.1.5. La Demande biochimique en
oxygène DBO5
La demande biologique en oxygène est la quantité
d'oxygene utilisé par voie biologique pour la dégradation de la
matière organique dans des conditions d'essai 20°c
à l'obscurité pendant cinq jours (Rodier et al ., 2005).
La DBO donne une indication sur l'activité
microbiologique dans l'eau de mer. Elle est utilisée pour les
contrôles de la pollution. (Guiraud, 1998).
L'interprétation de nos résultats nous a permis
de constater que les teneurs moyennes les plus élevées de la DBO5
sont enregistrées dans la station S1 (20 mg d'O2/l) et la station S3
(15mg d'O2/l) et une très basse valeur de (0 mg d'O2/l) dans la station
S2 peut être due à une faute de matériel ou de manipulation
(figure 22).
Ces valeurs sont liée a la dégradation de la
charge organiques polluantes par le biais d'agent biologique (Brisou et Denis
.,1978) . Les résultats obtenus sont confirmés par l'étude
microbiologique.
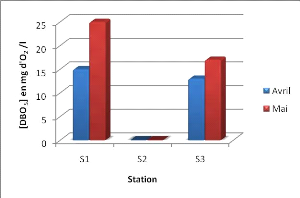
Figure 22: variation de la DBO5 en fonction des
stations. 3.1.6. Les matières en suspension
(M.E.S)
D'après la figue 23, Un maximum de MES est
enregistré dans la troisième station S3 (155,84 mg/l) tandis
qu'un minimum dans la deuxième station S2 (62,85 mg/l). Globalement, il
n'existe pas une large différence entre les trois stations.
Les teneurs de MES obtenues dépassent largement les
normes (Rodier et al ., 2005).elles sont probablement causés par le
vidange des bateaux, déversement d'égouts et des rejets
domestiques urbains qui sont riches en matière colloïdale d'origine
minérale ou organique.
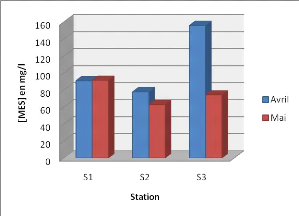
Figure 23: variation des teneurs en MES en fonction des
stations.
3.1.7. Les sels nutritifs
a) L'ammonium
Les concentrations d'NH+4 observées dans la
figure 24 varient entre 155,67umol/l (S1) et 20,60umol/l (S2). La valeur
élevée dans la S1 est due à un apport terrigène.
Selon (Aminot et Chaussepied ., 1983 ) les concentrations
décelées dans nos sites sont très élevées ce
qui peut s'expliquer par la dégradation incomplète de la
matière organique. Nous concluons donc que notre site d'étude est
pollué.
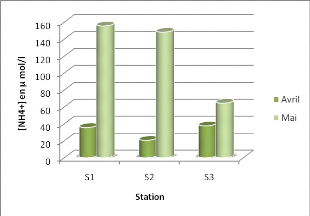
Figure 24 : variation des concentrations en ammonium en
fonction des stations.
b) Nitrite et nitrate
D'après la figure 25 on remarque que les valeurs de
nitrate se situent entre 47,96 umol/l (S3) et 3,21 umol/l (S2). Ce qui est le
cas aussi pour les nitrites 0,55 umol/l (S3) et 0,063umol/l (S2).
Les concentrations élevées de nitrate dans les
stations (S1) et (S3) peuvent être liées par le
faites que la salinité est faible (Aminot et Chaussepied
.,1983 ) et cela est du à un apport terrigène important dans ces
dernières .
De même des taux élevés de nitrates ont
été observées par rapport aux nitrites et ceci est
expliquer par la réduction des ions nitrites en nitrates par une action
bactérienne
« dénitrification » (Rodier et al ., 2005).
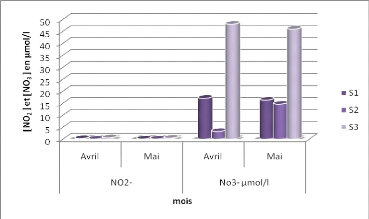
Figure 25: variation des concentrations en Nitrites et
Nitrates en fonction des stations. c) Orthophosphate
La figure 26 montre que les teneurs en orthophosphate varient
entre 1,33 umol/l (S3) et 0,34 umol/l (S2).
Il provient de la dégradation de la matière
organique ou des polyphosphates (utilisés pour le traitement des eaux ou
comme adjuvants actifs dans les détergents).sa présence dans
l'eau est également liée à l'utilisation des engrais (Le
pimpec et al .,2002).
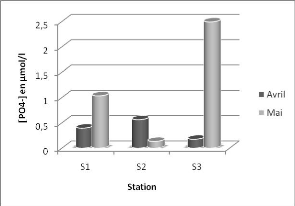
Figure 26: variation de concentrations en Orthophosphate
en fonction des stations.
d) Silicium
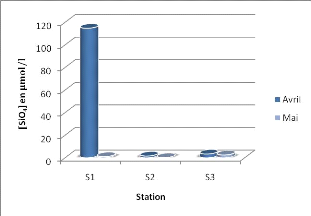
La figure 27 montre que les teneurs en silicate
enregistrées dans cette étude sont élevées dans la
station S1 (68,63 umol/l) et cela est probablement du à la silice
d'origine des teste de Diatomées.
D'après Rodier et al (2005), la présence de
silicate dans l'eau de mer est due à la dissolution des sels
minéraux, notamment les aluminosilicates mais aussi de la
dégradation du silicium organique particulaire.
Figure 27 : Variation des concentrations en silicates en
fonction des stations. 3.2. Les paramètres microbiologiques
3.2.1. La Flore Totale Mésophile (FMT)
La totalité des boites ensemencées ont
été indénombrables car le nombre de colonies
dépasse largement les 300 colonies par boite ce qui montre la richesse
de nos échantillons en microorganismes.
Les dilutions des échantillons ont permis de
déduire les concentrations de la flore totale dans 100 ml (tableau 4).
La station (S1) représente les concentrations moyennes les plus
élevées.
Tableau 4: les concentrations moyennes de la flore totale
mésophile des stations.
|
station
|
FMT /100ml
|
|
S1
|
11159300
|
|
S2
|
33000000
|
|
S3
|
187000
|
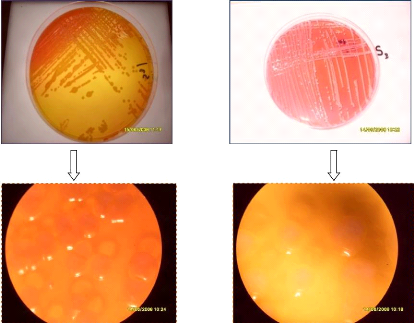
La figure 28 montre des colonies de la flore totale
mésophile encemencés en profondeur sur le milieu PCA,
observées par la loupe binoculaire.
Figure 28: observation des colonies de la flore totale
mésophile à la loupe binoculaire.
3.2.2. Les coliformes
Le tableau 5 montre les concentrations moyennes des Coliformes
totaux, fécaux et E. coli. Tableau 5: Concentrations
moyennes des Coliformes totaux, fécaux et E. coli .
|
station
|
Concentration moyenne Npp /1ooml
|
|
CT
|
CF
|
E.coli
|
|
S1
|
757500
|
705500
|
80500
|
|
S2
|
250
|
95
|
17
|
|
S3
|
925000
|
700100
|
762 ,5
|
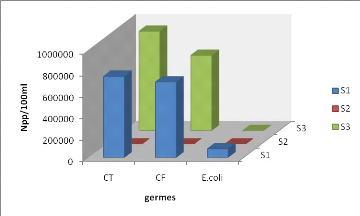
Figure 29: Concentrations moyennes des Coliformes totaux,
fécaux et E. coli.
Les résultats illustrés dans la figure 29 à
savoir les coliformes totaux, fécaux et E .coli montrent que la
concentration dans la station (S3) est élevée comparant aux
autres stations. Ceci est due essentiellement au rapport continu en
matière fécale par l'égout.
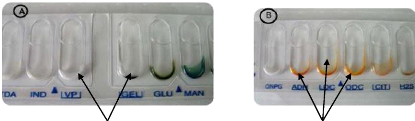
Avant de caractériser le profil biochimique des
Coliformes, on a procédé à un isolement et plusieurs
repiquages sur le milieu EL (annexe II) à partir des tubes positifs de
VBL (figure 30).
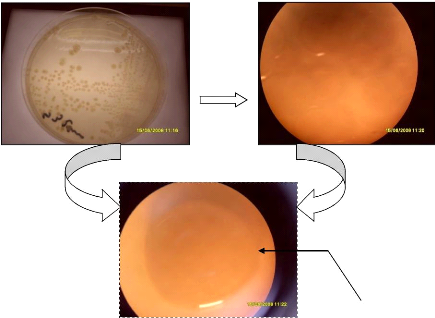
une colonie de coliformes
Figure 30: isolement et observation des coliformes
à la loupe binoculaire.
La caractérisation du profil biochimique des coliformes
nous a permis de constater que ce sont des bacilles Gram négatives avec
un catalase positif (tableau 6)
Tableau 6 : Résultat des tests biochimique des
Coliformes.
Catalase
Coloration de Gram

Ces résultats sont confirmés par les galeries API
20 E (tableau 7). Tableau 7 : les galeries d'identifications des
espèces étudiées.
|
Résultats d'incubation de la galerie
API
|
|
Le code*
|
L'espèce
|
|
3
7
|
714
704
|
513
572
|
Citro. braakii
Salmonella.choler.arizonae
|
|
|
|
|
|
* Les sommes des séries du test positif (Annexe IV).
3.2.3. Les streptocoques fécaux (CF)
La figure ci-dessous (31) montre que les variations des
concentrations en Streptocoques fécaux dans (S3) est largement
élevée (9500Npp /100 ml) .L'abondance des streptocoques
fécaux dans le milieu est selon OMS(2002), ils résistent dans le
milieu marin et cela grâce à leurs caractéristiques
physiologiques qui leur confèrent une meilleure adaptation par rapport
aux autres germes indicateurs (les coliformes et les streptocoques).
La non abondance des streptocoques fécaux dans les
stations (S1) et (S2) peut s'expliquer par la présence de la chaux dans
les eaux d'égout.
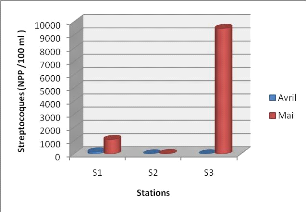
Figure 31: variation des concentrations en Streptocoques
en fonction des stations. 3.2.4. Les bactéries
sulfitoréductrices
Dans cette étude, on a pu uniquement déterminer la
concentration des sulfitoréducteurs, après dilution, dans la
station (S2) et qui est d'ordre de 200 sp/100ml.
La première et la troisième station
présentes une richesse importante en spores. La figure 32 montre les
résultats de recherche des bactéries
sulfitoréductrices.

S1 S2 S3
Figure 32 : présentation des spores de
sulfitoréducteurs.
3.2.5. Les staphylocoques (ST)
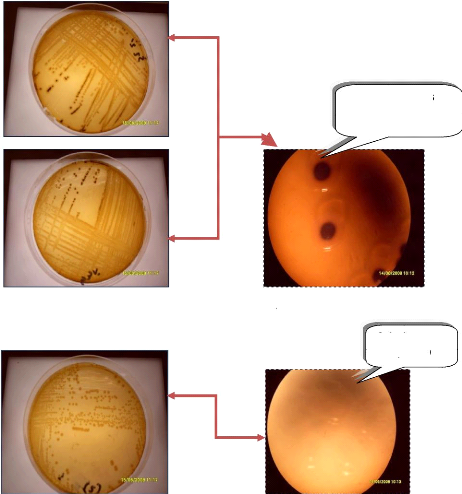
un isolement et plusieurs repiquages sur le milieu Chapman
(annexe II) a permis de distinguer deux aspects de colonies blanchâtre et
jaunâtre (figure 33 ) .
Colonies jaunes colonies blanches
Figure 33 : isolement et observation des Staphylocoques
à la loupe binoculaire.
Après une série de tests biochimiques les colonies
sont des cocci Gram positif et catalase positif (tableau 8).
Tableau 8: résultat de tests biochimiques des
staphylocoques.
Test de Catalase
coloration de Gram

Ces résultats sont confirmés par les galeries API
Staph (tableau 9)
Tableau 9: les galeries d'identifications des
espèces étudiées.
|
Résultat de l'incubation à
37°c
|
|
Code*
|
L'espéce
|
|
6
7
7
|
330 010
330 010
765770
|
Staphylococcus
sturi
Staphylococcus
lenpus
|
|
|
|
|
|
|
|
|
|
|
* Les sommes des séries du test positif (Annexe IV).
3.2.6. Les Salmonelles
L'isolement des salmonelles a été fait par
l'ensemencement en surface du milieu sélectif SS (annexe II) à
partir du bouillon de l'enrichissement. Après l'incubation à
37°c pendant 24 heures, les résultats obtenus sont
montrés dans la figure 34.
Des colonies noires avec contour transparent
Salmonella à H2S+
Colonie transparente
Salmonella à H2S-
Figure 34: isolement et observation des salmonelles
à la loupe binoculaire.
Les colonies de Salmonelles sur milieu SS ont un aspect rond
transparent (Salmonella à H2S- ) ou transparent avec un
centre noire (Salmonella à H2S+ ) ( Rodier et al.,2005) .
Ainsi
les tests biochimiques montrent que se sont des bacilles Gram
négatif et catalase positif (tableau 10).
Tableau 10 : résultat de tests biochimiques des
salmonelles.
Test de Catalase
Coloration de Gram

CONCLUSION
Cette étude a pour objectif l'évaluation d'une
éventuelle pollution bactérienne introduite directement dans le
port d'Alger.
Les résultats obtenus ont montré que le port
d'Alger est exposé à des rejets d'eaux usées non
traités, au vidange des bateaux et déballastage qui ont conduit
à une pollution marine flagrante.
L'analyse des paramètres physico-chimiques a permis de
constater que La zone d'étude présente :
· une température moyenne variant de 20,05°c
(S1) et 20,55°c (S3).
· La salinité moyenne variant entre 28,8psu (S1)
et 36,25psu (S2), cette diminution est expliquer par le fait que le port
d'Alger constitue le point de convergence des eaux usées da la ville
d'Alger.
· Un pH acide due aux natures des rejets (des produits
chimiques).
· Des concentrations moyennes importantes en MES variant
entre 70,46mg/l (S2) et 115,06 mg/l (S3).
· Des taux en oxygène faible sauf pour (S2) ce qui
favorisent la croissance des germes anaérobies stricts et
anaérobies facultatifs (Aminot, 1983).
· Des teneurs en DBO élevées qui laisse
supposer qu'il ya une forte teneurs en matière organique (Karib et al .,
1993 ) .
· des concentrations moyennes importantes de sels nutritifs
surtout nitrate, nitrite et l'ammonium.
Une appréciation de la qualité
bactériologique des eaux du port d'Alger, montre que ces eaux
possèdent une charge bactériologique très importante
concernant :
· les coliformes totaux, fécaux et les streptocoques
qui sont des espèces que l'on rencontre exclusivement dans les
matières fécales (Rejsek ., 2002) .
· Les bactéries Sulfitoréducteurs, ne sont
pas caractéristiques d'une pollution fécale ; par contre, ils
peuvent indiquer une contamination ancienne (Rejesk ., 2002) .
· Les staphylocoques présumés
pathogènes qui sont des indicateurs de contamination récente du
milieu car leurs présence dans le milieu marin est attribuée aux
manoeuvres effectuée occasionnellement « la pêche et
l'aquaculture » (Karib et al ., 1993) .
? Des germes pathogènes comme les Salmonelles sont
détecté dans les trois stations.
Les tests biochimiques ont permis l'identification deux
espèces de Coliformes : Citro. Braakii
et Salmonella.choler.arizonae et deux
espèces de Staphylocoques : Staphylococcus sturi
et Staphylococcus lenpus.
La synthèse de ces résultats nous ramène
à distinguer deux aires :
· Une aire polluée par excellence, correspond aux
quai 17 et 23.
· Une aire moins polluée qui correspond au quai
21.
L'état du port d'Alger nécessite en
matière de pollution une prise en charge qui doit être rapidement
mise en oeuvre pour assurer le développement durable de la façade
maritime de notre pays et cela en mettant en place plusieurs stations
d'épurations dans le port et en contrôlant le déballastage
et vidange des bateaux.

45
Ait Younes A., Ait Younes R ., 2008 .Etude de
la qualité bactériologique de l'eau de mer au niveau de littoral
Algérois .mém en fin d'obtention de l'ingénieure
d'état en océanographie .USTHB, Alger : 85 p .
Aminot A .,Chaussepied M
.,1983.Manuel des analyses chimiques en milieu
marin .Ed. CNEXO, paris : 395 p.
Aminot A ., kerouel R., 2004.hydrologie des
écosystèmes marins : paramètres et analyses .Éd.
IFREMER, paris : 336p.
Belkessa R ., 2007 .Etat de la plage Est de
Sidi Fredj : diagnostic morphosédimentaire et microbiologique
.mém en fin d'obtention du diplôme d'étude
universitaire appliqué .ISMAL, Alger : 52 p .
Benzohra M ., 1993 . Les structures
hydrodynamiques le long des côtes Algériennes. centre
d'océanographie de Marseille, France : 35 - 45.
BRISOU J.F ., DENIS F .,1978 . Hygiene de
l'environnement maritime. Edit. Masson.248p.
BRISOU J.F., 1968. La pollution microbienne,
virale et parasitaire des eaux littorales et ses conséquences sur la
santé publique. Bulletin. O.M.S : 79-118 p .
Dellarras C ., 2000 .Microbiologie de
l'environnement avec législation : travaux pratiques commentés
.Ed .Gaëtan Morin éditeur, paris: 231p.
Dellarras C ., Bernard A., 2003 .Surveillance
sanitaire et microbiologie des eaux .Ed.Lavoisier, paris , : 246 p .
Dellarras C., 2007.Microbiologie pratique pour
laboratoire : d'analyse ou de contrôle sanitaire .Ed Médicales
internationales .Lavoisier, paris: 476p.
Figarella J ., Leyral G., Terret M., 2001.
Microbiologie générale et appliquée. Ed. Jacques
Lanore : 285p.
Gaujous D ., 1995. la pollution des milieux
aquatiques : aide mémoire. 2ème Ed .Lavoisier,

Guiraud JP., 1998 .Microbiologie alimentaire. Ed
. Dunod.652 p. Guy J ., 2006 .écologie de plancton
.Ed .Lavoisier ,paris :283 p.
Joy B., Reynaud A., 2003.
Entérobactéries : systématiques et
méthodes d'analyses. Ed. Techniques et Documentation. Paris : 356 p.
Karib H ., Belemlih A ., Shfee M.S., Bahhoun
J ., 1993 .Contribution à l'étude bactériologique
des eaux marine littorales du Nord du Maroc . Département d'Hygiene et
Industrie des denrées alimentaire d'origine Animal. Rabah, Maroc : 227-
23 .
Le Pimpec P .,Linénard A.,Bonnard R .,Lafont M
., Cazin B .,Bossard Ph ., Hubert B., Bray M .,2002 .Guide pratique de
l'agent préleveur : chargé de la police des milieux aquatiques
.Ed Maurice Merlin :159p.
Leclaire L ., 1972 . La
sédimentation holocène sur le versant méridionale du
bassin Algérobaléare, these d'état, faculté des
sciences de Paris, Mémoire du Muséum National d'Histoire
Naturelle. Paris : 217p.
Poirel M ., 2008 . Mémoire sur les
travaux à la mer. Ed .Carilian -Goury, université de Gand :
152p.
Rejsek F ., 2002. Analyse de l'eau : Aspects et
règlementaire et technique .Ed CRDP d'Aquitaine .France : 358 p .
Rodier J., Bazin C., Broutin J.-P., Chambon P., Champsaur
H., Rodi L., 2005.l'analyse de l'eau : eaux naturelle, eau
résiduaires et l'eau de mer. 8éme Ed. Dounod, paris :
1383p.
Sefsaf B ., 2007 .état de pollution du
port d'Alger par les navires : cas du bassin pétrolier (Darse 8et 9 )
.mém de fin d'étude pour l'obtention du diplôme
d'ingénieur d'état .ISMAL, Alger: 85 p.
SKALAR ANALYTICAL.,2000. Manuel san plus
analyser : SA 1050 (Random Access Auto sampler). Breda (Netherlands), 23p.
Vilaginés R ., 2003 . Eau, environnement
et sante publiques.2ème Ed .Lavoisier, paris : 198 p.

47
·
http://fr.wikipedia.org/wiki/Salmonella
·
www.lhl.fr/cms/index.php?option=com_content&task=view&id=750&Itemid=1
- 18k
·
http://alaintruong.canalblog.com/archives/2009/
04/15/13389709.html .
· Http :
perso.wanadoo.fr/bernard
.venis .
·
pedagogie.acmontpellier.fr/Disciplines/sti/biotechn/presentations/LA_GALERIE_Api20e.
·
http://www.portalger.com.dz/carte_port.htm
.
· La Direction des aliments (Santé Canada) à
l'adresse
http://www.hc-sc.gc.ca/food-aliment.
Annexe I

Le matériel
utilisé

Conteur des colonies Une loupe Bec
Benzène
Microscope optique Oxymètre

Conductimètre pH-mètre

Autoclave l'étuve à 37 °c
L'étuve à 40°c Agitateur
tube
Agitateur Agitateur chouffant

Balance numérique Bain marée

Verreries utilisées
Annexe II
Milieux de culture et
réactifs
Bouillon Lactose (BL):
|
Composition
|
S/C (g/1)
|
D/C (g/1)
|
|
Extait de viande de boeuf
|
3
|
6
|
|
Peptone
|
5
|
10
|
|
Lactose
|
5
|
10
|
|
Eau pemutée
|
1000ml
|
1000ml
|
S/C et D/C : Simple et double concentration respectivement . pH
finle : 6.7, autoclaver à 120C° Pendant 20minutes.
Bouillon lactosé bilié au vert brillant
(VBL):
|
Composition
|
g/1
|
|
Peptone de viande
|
10
|
|
Lactose
|
10
|
|
Bile de beouf desséchée
|
20
|
|
Vert brillant
|
0.0133
|
|
Eau permutée
|
1000 ml
|
PH final : 7.2, autoclaver à 120C° pendant 20 minutes
Eau peptonée exempte d'indole(EPI):
|
Composition
|
g/1
|
|
Peptone trypsique de caséine
|
10
|
|
NaC1
|
5
|
|
Eau permutée
|
1000 ml
|
Milieu de Rothe:
|
Composition
|
S/C g/1
|
D/C g/1
|
|
Poptone
|
20
|
40
|
|
Glucose
|
5
|
10
|
|
NaC1
|
5
|
10
|
|
Monohydrogenophosphate de potassium
|
2.7
|
5.4
|
|
Dihydrogenophospahte de potassium
|
2.7
|
5.4
|
|
Azide de sodium
|
0.2
|
0.4
|
|
Eau permutée
|
1000ml
|
1000ml
|
pH final : 6.8- 7 , autoclaver à 120C° pendant 20
minutes.
Milieu d' Eva Litsky
|
Composition
|
g/1
|
|
Peptone
|
20
|
|
Glucose
|
5
|
|
NaC1
|
5
|
|
Monohydrogenophosphate de potassium
|
2.7
|
|
Dihydrogenophospahte de potassium
|
2.7
|
|
Azide de sodium
|
0.3
|
|
Ethyl violet
|
0.0005
|
|
Eau permutée
|
1000ml
|
pH final : 6.8- 7 , autoclaver à 120C° pendant 20
minutes. Gélose Plat Count Agar
PCA:
|
Composition
|
g/1
|
|
Tryptone
|
5g
|
|
Extrait de levure
|
2.5g
|
|
Glucose
|
1g
|
|
Agar
|
15g
|
PH final : 7.2 , autoclaver à 120C° pendant 20
minutes.
Gélose Salmonella-Shigella (SS) :
|
composition
|
g/l
|
|
peptone pancréatique de caséine
|
10g
|
|
lactose
|
10g
|
|
sels biliaires
|
6g
|
|
extrait de viande
|
5g
|
|
citrate de sodium
|
8,5g
|
|
citrate de fer ammoniacal
|
1g
|
|
thiosulfate de sodium
|
8,5g
|
|
rouge neutre
|
0,0025g
|
|
vert brillant
|
0,00033g
|
|
eau permutée
|
1000ml
|
Gélose avec Extrait de Levure
|
composition
|
g/l
|
|
|
Tryptone
|
|
6
|
|
Extrait de levure
|
|
3
|
|
Agar bactériologique
|
|
15
|
|
eau permutée
|
1000 ml
|
|
pH final : 7.2+- 0.2 à 25 °c
Milieu tryptone sulfite cyclosérine TSC en g/L
d'eau distillée est :
|
Peptone
|
15
|
|
Peptone de soja
|
5
|
|
Extrait de levure
|
5
|
|
Métabisulfite de sodium anhydre (Na2SO5)
|
1
|
|
Citrate de fer III ammoniacal
|
1
|
|
Agar
|
15
|
PH final 7,6 #177; 0,2 à 25°C
Stérilisation à l'autoclave : 121#177; 1°C
Pendant 15 minutes.
Milieu Chapman
|
composition
|
g/l
|
|
extrait de viande
|
5g
|
|
peptone
|
10g
|
|
extrait de levure
|
6g
|
|
lactose
|
20g
|
|
bleu de bromothymol
|
0,05g
|
|
agar
|
20g
|
Annexe III
EXPLOITATION BACTERIOLOGIQUE
Tableau de Mc GRADY
3 tubes /
dilution
|
Nombre caractéristique
|
Nombre de microbes
|
Nombre caractéristique
|
Nombre de microbes
|
Nombre caractéristique
|
Nombre de microbes
|
|
0
|
0.0
|
201
|
1.4
|
302
|
6.5
|
|
1
|
0.3
|
202
|
2.0
|
310
|
4.5
|
|
10
|
0.3
|
210
|
1.5
|
311
|
7.5
|
|
11
|
0.6
|
211
|
2.0
|
312
|
11.5
|
|
20
|
0.6
|
212
|
3.0
|
313
|
16.0
|
|
100
|
0.4
|
220
|
2.0
|
320
|
9.5
|
|
101
|
0.7
|
221
|
3.0
|
321
|
15.0
|
|
102
|
1.1
|
222
|
3.5
|
322
|
20.0
|
|
110
|
0.7
|
223
|
4.0
|
323
|
30.0
|
|
111
|
1.1
|
230
|
3.0
|
330
|
25.0
|
|
120
|
1.1
|
231
|
3.5
|
331
|
45.0
|
|
121
|
1.5
|
232
|
4.0
|
332
|
110.0
|
|
130
|
1.6
|
300
|
2.5
|
333
|
140.0
|
|
200
|
0.9
|
301
|
4.0
|
|
|
*
|
Nombre caractéristique
|
Nombre de microbes
|
Nombre caractéristique
|
Nombre de microbes
|
Nombre caractéristique
|
Nombre de microbes
|
Nombre caractéristique
|
Nombre de microbes
|
|
0
|
0.0
|
203
|
1.2
|
400
|
1.3
|
513
|
8.5
|
|
1
|
0.2
|
210
|
0.7
|
401
|
1.7
|
520
|
5.0
|
|
2
|
0.4
|
211
|
0.9
|
402
|
2.0
|
521
|
7.0
|
|
10
|
0.2
|
212
|
1.2
|
403
|
2.5
|
522
|
9.5
|
|
11
|
0.4
|
220
|
0.9
|
410
|
1.7
|
523
|
12.0
|
|
12
|
0.6
|
221
|
1.2
|
411
|
2.0
|
524
|
15.0
|
|
20
|
0.4
|
222
|
1.4
|
412
|
2.5
|
525
|
17.5
|
|
21
|
0.6
|
230
|
1.2
|
420
|
20
|
530
|
8.0
|
|
30
|
0.6
|
231
|
1.4
|
421
|
25
|
531
|
11.0
|
|
100
|
0.2
|
240
|
1.4
|
422
|
3.0
|
532
|
14.0
|
|
101
|
0.4
|
300
|
0.8
|
430
|
2.5
|
533
|
17.5
|
|
102
|
0.6
|
301
|
1.1
|
431
|
3.0
|
534
|
20.0
|
|
103
|
0.8
|
302
|
1.4
|
432
|
4.0
|
535
|
25.0
|
|
110
|
0.4
|
310
|
1.1
|
440
|
3.5
|
540
|
13.0
|
|
111
|
0.6
|
311
|
1.4
|
441
|
4.0
|
541
|
17.0
|
|
112
|
0.8
|
312
|
1.7
|
450
|
4.0
|
542
|
25.0
|
|
120
|
0.6
|
313
|
2.0
|
451
|
5.0
|
543
|
30.0
|
|
121
|
0.8
|
320
|
1.4
|
500
|
2.5
|
544
|
35.0
|
|
122
|
1.0
|
321
|
1.7
|
501
|
3.0
|
545
|
45.0
|
|
130
|
0.8
|
322
|
2.0
|
502
|
4.0
|
550
|
25.0
|
|
131
|
1.0
|
330
|
1.7
|
503
|
6.0
|
551
|
35.0
|
|
140
|
1.1
|
331
|
2.0
|
504
|
7.5
|
552
|
60.0
|
|
200
|
0.5
|
340
|
2.0
|
510
|
3.5
|
553
|
90.0
|
|
201
|
0.7
|
341
|
2.5
|
511
|
4.5
|
554
|
160.0
|
|
202
|
0.9
|
350
|
2.5
|
512
|
6.0
|
555
|
180.0
|
Résultats des galeries
API Staph

API 20 E

Les coordonnés géographiques des
stations de prélèvements
|
STATION
|
N° de quai
|
Coordonnées
géographiques
|
|
Latitude
|
longitude
|
|
S1
|
Quai 17
|
3°03'45,57'' E
|
36°46 '15,22'' N
|
|
S2
|
Quai 21
|
3°3'50,97'' E
|
36°46'05,51'' N
|
|
S3
|
Quai 23
|
3°03'52,84'' E
|
36°45'52,09''N
|
Annexe X
Tableau de sélections du volume pour le
DBO
|
Volume (ml)
|
Marge de mesure (mg/l)
|
Facteurs
|
|
432
|
0 - 40
|
1
|
|
365
|
0 - 80
|
2
|
|
250
|
0 - 200
|
5
|
|
164
|
0 - 400
|
10
|
|
97
|
0 - 800
|
20
|
|
43,5
|
0 - 2000
|
50
|
|
22,7
|
0 - 4000
|
100
|
Annexe v
Dosage de l'ammonium
1- Réactifs
1-1 Solution tampon
Produits chimiques exigés :
> Tartrate de potassium et de sodium
C4H406KNa, 4H2O............................................33
g.
> Citrate de sodium C6H507??a3 ,
2H2O.....................24 g.
> Acide sulfurique H2S04
(1N)................................x« ml.
> Eau distillée
H20....................................... 1000 ml.
> Brij 35
(35%)....................................................2ml.
Préparation
Dissoudre le tartrate de potassium et de sodium dans #177; 800
ml d'eau distillée. Ajouter le citrate de sodium et dissoudre. Ajuster
le pH à 5 avec la solution d'acide sulfurique. Ajuster à 1 litre
avec l'eau distillée puis ajouter le Brij 35 et mélanger.
Note :
La solution est stable pendant une semaine. Conserver à
4°C quand la solution n'est pas utilisée.
1-2- Solution de phénol Produits chimiques
exigés :
> Phénol C6H5
OH................................................6 g
> Hydroxyde de sodium NaOH............................... 40
g
> Eau distillée H2
O....................................... 1000 ml
Préparation
Dissoudre le phénol dans #177; 50 ml d'eau
distillée. Ajouter l'hydroxyde de sodium. Ajuster à litre avec de
l'eau distillée et mélanger.
Note :
La solution est stable pendant une semaine. 1-3-
Solution d'hypochlorite de sodium Produits chimiques exigées
:
> Solution d'hypochlorite de sodium NaClO
(13 % de chlore actif).....................................200
m
> Eau distillée
H2O..........................................800 m
Préparation
Diluer la solution d'hypochlorite de sodium dans #177; 700 ml
d'eau distillée. Ajuster à 1 litre avec de l'eau distillée
et mélanger.
1-4- Solution de nitroprussiate de sodium Produits
chimiques exigés :
> Nitroprussiate de sodium Na2 [Fe((CN)5 NO], 2H2O......0,5
g
> Eau distillée
H2O.............................................1000 ml
Préparation
Dissoudre le nitroprussiate de sodium dans #177; 800 ml d'eau
distillée. Ajuster à 1 litre avec de l'eau distillée et
mélanger.
Note :
Conserver dans une bouteille de couleur sombre. La solution est
stable pendant une semaine.
Conserver à 4°C quand la solution n'est pas
utilisée. 1-5- Liquide de rinçage :
Eau fraichement distillée H2O.
2-Préparation des solutions
étalons
2-1 Solution mère de 100 ppm N (*)
Produits chimiques exigés :
Ø Chlorure d'ammonium
??H4CL............................0,3819« g
> Eau distillée
H2O.............................................1000 m
?
Préparation
Dissoudre le chlorure de d'ammonium dans #177; 800 ml d'eau
distillée. Ajuster à 1 litre avec de l'eau de distillée et
mélanger.
Note :
La solution est stable pendant un mois. Conserver à
4°C quand la solution n'est pas utilisée. 2-2- Solution
fille de 10 ppm N
Diluer 10 ml de la solution mgre à 100 ppm N dans 100 ml
d'eau distillée.
Note :
Préparer la solution fille à 10 ppm Si chaque
semaine et les standards chaque jour.
Annexe VI
Dosage des nitrites+nitrates
1-Réactifs :
1-1-Solution tampon :
Produits chimiques exigés :
Chlorure d'ammonium NH4Cl 50g.
Solution d'ammonium NH4OH (25 %) #177; 1ml.
Hydroxyde de sodium NaOH 5 g.
Eau distillée H2O 1000 ml.
Bridj 35 (30 %) 3 ml.
Préparation
:
Dissoudre le chlorure d'ammonium dans 800 ml d'eau
distillée. Ajuster le pH à 8,2 avec la solution d'ammonium.
Ajouter l'hydroxyde de sodium et dissoudre. Ajuster à 1 litre avec de
l'eau distillée et ajouter le Bridj 35 et mélanger.
Note : la solution est stable pendant
une semaine. Quand la solution n'est pas utilisée il faut la conserver
à 4°C.
1-2-Réactif colorant Produits chimiques
exigés :
Acide o-phosphorique H3PO4 (85%) .5 ml.
Sulfanilamide C6H8N2O2S 10 g.
á-Naphtyléthylène diamine dihydrochloride
C12H16Cl2N2 0 ,5g.
Eau distillée H2O 850ml.
Préparation
:
Diluer l'acide o-phosphorique dans #177;750 ml d'eau
distillée. Ajouter le sulfanilamide et le
áNaphtyléthylène diamine dihydrochloride et dissoudre.
Ajuster à 1 litre avec de l'eau distillée et mélanger.
Note : la solution est stable pendant
deux semaines. Conserver dans une bouteille à couleur sombre.
1-3-Liquide de rinçage :
Eau fraichement distillée
(régénérée chaque semaine).
2-Préparation des solutions étalons :
2-1-Solution mère de 100 ppm N (*)
Produits chimiques exigés :
Nitrate de sodium NaNO3 0,6068 g.
Eau distillée H2O ..1000 ml.
Préparation
Dissoudre le nitrate de sodium dans #177;800 ml d'eau
distillée. Ajuster à 1 litre avec de l'eau
distillée et mélanger.
Note : la solution est stable pendant
quatre semaines. Conserver à 4°C quand la solution n'est
pas utilisée.
2-2-Solution fille de 10 ppm N :
Diluer 10 ml de solution mère à 100 ppm N dans 100
ml d'eau distillée.
Note : préparer la solution fille
à 10 ppm chaque semaine et les standards chaque jour.
3-Préparation de la colonne réductrice
3-1-Solution d'acide chlorhydrique (4N)
Produits chimiques exigés :
Acide chlorhydrique HCl (32%) 400 ml.
Eau distillée H2O .600 ml.
Préparation : diluer l'acide
chlorhydrique dans 600 ml d'eau distillée.
3-2-Cadmium :
Produits chimiques exigés :
Granules de cadmium taille 0,3-1,0 mm (tamisé) 2,5
g.
Procédure de remplissage :
1-Les granules de cadmium sont mélangés avec
#177;30 ml de la solution d'acide chlorhydrique (4N).
1- Agiter pendant une minute.
2- Laver avec l'eau distillée.
3- Ajouter environ 50 ml de solution de sulfate de cuivre et
agiter pendant 5 minutes.
4- Laver la saleté entre les granules avec l'eau
distillée.
5- Sécher les granules de cadmium avec un filtre en
papier.
6- Ajouter, à l'aide d'un entonnoir, les granules dans
une colonne sèche, en secouant de temps en temps pour empaqueter la
colonne des deux cotés.
7- Remplir jusqu'à #177;5 mm du sommet.
8- Placer un petit tube de polyéthylène, dans la
colonne pour éviter que les granules ne sortent de la colonne.
9- Remplir la colonne, à l'aide d'une seringue contenant
la solution tampon (réactif 1-1 préparé
précédemment).
10- Placer la colonne dans le système.
Note : éviter que l'air rentre
dans la colonne. Les granules de cadmium activés peuvent être
stockés sec, dans une bouteille fermée.
Annexe VII
Dosage des phosphates
1-Réactifs
1-1-Solution de molybdate d'ammonium
Produits chimiques exigés :
Tartrate de potassium et d'antimoine
K(SbO) C4H4O6 5H2O 230 mg.
Acide sulfurique H2SO4 (97%) 69,4 ml.
Molybdate d'ammonium (NH4) 6Mo7O24 4 H2O 6 g.
Eau distillée H2O 1000 ml.
FFD6 .2 ml.
Préparation :
Dissoudre le tartrate de potassium et d'antimoine dans #177;800
ml d'eau distillée. Ajouter soigneusement l'acide sulfurique en
mélangeant constamment. Ajouter le molybdate d'ammonium et dissoudre.
Ajouter à 1 litre d'eau distillée puis ajouter le FFD6 et
mélanger.
Note :
Ne pas utiliser de cuillères en métal pour le
molybdate d'ammonium. La sensibilité peut être augmentée de
50% en employant 35 ml d'acide sulfurique concentré au lieu de 69,4 ml.
Avec 35 ml l'interférence des silicates est 10% pour 300 ppb Si et 10%
pour 10% pour 10 ppb P.
Le pH final doit être inférieur à 1. La
solution est stable pendant 5 jours. Conserver à 4°C quand la
solution n'est pas utilisée.
1-2-Solution d'acide ascorbique Produits chimiques
exigés :
Acide ascorbique C6H8O6 6 g.
Acétone C3H6O8 .60 ml.
Eau distillée H2O ..1000 ml.
FFD6 2 ml.
(*) : Les concentrations des solutions
étalons sont transformées en umoles/l de PO4 -.
Dissoudre l'acide ascorbique dans #177;800 ml d'eau
distillée. Ajouter l'acétone. Ajuster à 1 litre avec de
l'eau distillée puis ajouter le FFD6 et mélanger.
Note : la solution est stable pendant
cinq jours. Conserver à 4°C quand la solution n'est pas
utilisée.
1-3-Liquide de rinçage :
Eau fraichement distillée H2O
(régénérée chaque semaine).
2-Préparation des solutions étalons :
2-1-Solution mère de 100 ppm P (*) :
Produits chimiques exigés :
Dihydrogène o-phosphate de potassium KH2PO4 0,4394 g.
Eau distillée H2O 1000 ml.
Note : la solution est stable pendant
quatre semaines. Conserver à 4°C quand la solution n'est pas
utilisée.
2-2-Solution fille de 10 ppm P
Diluer 10 ml de la solution mère à 100 ppm P dans
100 ml d'eau distillée.
Note : préparer la solution fille
à 10 ppm P chaque semaine et standards chaque jour.
Annexe VII
Dosage des phosphates
1-Réactifs
1-1-Solution de molybdate d'ammonium
Produits chimiques exigés :
Tartrate de potassium et d'antimoine
K(SbO) C4H4O6 5H2O 230 mg.
Acide sulfurique H2SO4 (97%) 69,4 ml.
Molybdate d'ammonium (NH4) 6Mo7O24 4 H2O 6 g.
Eau distillée H2O 1000 ml.
FFD6 .2 ml.
Préparation :
Dissoudre le tartrate de potassium et d'antimoine dans #177;800
ml d'eau distillée. Ajouter soigneusement l'acide sulfurique en
mélangeant constamment. Ajouter le molybdate d'ammonium et dissoudre.
Ajouter à 1 litre d'eau distillée puis ajouter le FFD6 et
mélanger.
Note :
Ne pas utiliser de cuillères en métal pour le
molybdate d'ammonium. La sensibilité peut être augmentée de
50% en employant 35 ml d'acide sulfurique concentré au lieu de 69,4 ml.
Avec 35 ml l'interférence des silicates est 10% pour 300 ppb Si et 10%
pour 10% pour 10 ppb P.
Le pH final doit être inférieur à 1. La
solution est stable pendant 5 jours. Conserver à 4°C quand la
solution n'est pas utilisée.
1-2-Solution d'acide ascorbique Produits chimiques
exigés :
Acide ascorbique C6H8O6 6 g.
Acétone C3H6O8 .60 ml.
Eau distillée H2O ..1000 ml.
FFD6 2 ml.
(*) : Les concentrations des solutions
étalons sont transformées en umoles/l de PO4 -.
Dissoudre l'acide ascorbique dans #177;800 ml d'eau
distillée. Ajouter l'acétone. Ajuster à 1 litre avec de
l'eau distillée puis ajouter le FFD6 et mélanger.
Note : la solution est stable pendant
cinq jours. Conserver à 4°C quand la solution n'est pas
utilisée.
1-3-Liquide de rinçage :
Eau fraichement distillée H2O
(régénérée chaque semaine).
2-Préparation des solutions étalons :
2-1-Solution mère de 100 ppm P (*) :
Produits chimiques exigés :
Dihydrogène o-phosphate de potassium KH2PO4 0,4394 g.
Eau distillée H2O 1000 ml.
Note : la solution est stable pendant
quatre semaines. Conserver à 4°C quand la solution n'est pas
utilisée.
2-2-Solution fille de 10 ppm P
Diluer 10 ml de la solution mère à 100 ppm P dans
100 ml d'eau distillée.
Note : préparer la solution fille
à 10 ppm P chaque semaine et standards chaque jour.
| 


