INTRODUCTION
La viande de mouton est particulièrement
appréciée dans la plupart des pays car considérée
comme noble, comparée à la viande de bovin. De plus, dans
certaines religions, le mouton joue un rôle très important. En
effet, l'élevage des ovins est très pratiqué dans
plusieurs pays du monde non seulement pour la production de la laine mais
surtout pour la qualité de sa viande beaucoup consommée lors des
fêtes religieuses telles que la « Tabaski ».
Au Sénégal, malgré l'importance du
cheptel ovin, la population à majorité musulmane reste tributaire
des importations de moutons des pays voisins comme le Mali, la Mauritanie, le
Burkina faso, voire le Niger. Cette incapacité à couvrir les
besoins nationaux est liée à des problèmes
inhérents à l'élevage de cette espèce dont le
parasitisme helminthique constitue l'une des contraintes majeures. Le
parasitisme est considéré comme un élément
essentiel de la gestion d'un troupeau de ruminants (CABARET, 2004). Les
helminthoses ont souvent un impact zootechnique difficile à
évaluer car les mortalités sont rares et le diagnostic
précis n'est pas souvent réalisé (CABARET, 2004).
C'est dans le but de contribuer à la connaissance des
helminthoses gastro-intestinales des ovins au Sénégal que nous
avons entrepris ce travail dont l'objectif est de déterminer la
prévalence de ces parasitoses et les espèces en cause à
travers une enquête sur les moutons abattus aux abattoirs de Dakar.
Ce travail comprend deux parties :
- la première partie est une synthèse
bibliographique sur l'élevage des ovins au Sénégal et des
généralités sur les helminthes parasites
gastro-intestinaux des ovins au Sénégal ;
- la deuxième partie est consacrée à
l'étude expérimentale, elle présentera le matériel
et les méthodes, les résultats obtenus, la discussion et enfin
les recommandations.
PREMIERE PARTIE :
SYNTHESE
BIBLIOGRAPHIQUE
Chapitre I : ELEVAGE DES OVINS AU SENEGAL
L'élevage constitue un créneau porteur pour
l'essor du secteur primaire au Sénégal. Ses potentiels divers
contribuent largement à la couverture des besoins alimentaires des
populations. En 1995, sa valeur ajoutée s'est améliorée de
4,1% par rapport à 1994. Il participe ainsi pour 7,4% à la
formation du produit intérieur brut national, soit 3,5% de la valeur
ajoutée du secteur primaire (D.P.S., 1995).
L'exploitation de cet élevage se fait en grande partie
sous forme extensive. L'avènement de la dévaluation en 1994 a
relancé l'intérêt de la production locale pour les
filières viande, lait frais local, cuirs et peaux, mais l'assainissement
du secteur reste à parfaire.
I.
Evolution des effectifs du cheptel
L'évolution des effectifs du cheptel de 2001 à 2003
est consignée dans le tableau I.
Tableau I : Evolution des effectifs du cheptel de
2001 à 2003 (en milliers de têtes).
|
Année
Espèce
|
2001
|
2002
|
2003
|
|
Bovins
|
3.061
|
2.997
|
3.018
|
|
Ovins
|
4.678
|
4.540
|
4.614
|
|
Caprins
|
3.995
|
3.899
|
3.969
|
|
Equins
|
492
|
496
|
500
|
|
Asins
|
407
|
399
|
399
|
|
Porcins
|
280
|
292
|
303
|
|
Camelins
|
4
|
4
|
4
|
|
Volaille industrielle
|
6.115
|
5.174
|
5.262
|
|
Volaille traditionnelle
|
19.543
|
20.207
|
20.813
|
Source ME,
2004.
II.
Place des ovins
Le mouton occupe au Sénégal une place importante
dans la vie religieuse de la population musulmane à cause des
cérémonies réligieuses (Tabaski, baptêmes,
mariages).
Ces raisons, ajoutées à leur rôle
socio-économique de premier plan, expliquent l'engouement qui est
suscité depuis des années de la part des décideurs, des
chercheurs et des agents des organismes de développement.
II.1.
Les races ovines exploitées
Au Sénégal plusieurs races sont exploitées
à savoir : les races maures, la race peul-peul, la race
djallonké, la race bali-bali et les métis.
II.1.1. Les moutons maures
Principale race élevée au Sénégal
en raison de sa préférence pour le sacrifice rituel de l'Aïd
El Kébir, les moutons maures regroupent le mouton à poils ras et
le mouton à poils longs (DIA, 1979).
II.1.1.1. Le mouton à poils ras (Touabire)
Son berceau se trouve en Mauritanie au niveau du Hodh ou du La
Dem (FALL, 2002). Selon DECKA (2003) il ne se rencontre au
Sénégal qu'en petites unités (5 à 10 moutons).
C'est un « mouton de case » car trouvé le plus
souvent à proximité des maisons.
Le Touabire est un mouton hypermétrique, convexiligne
et longiligne (GUEYE, 1990). La taille varie de 0,75 m à 0,90 m chez le
mâle, 0,65 m à 0,80 m chez la brebis et le poids adulte se situe
entre 30 kg à 45 kg (DOUTRESSOULLE, 1947). C'est un animal haut sur
pattes, la têtes est forte, le front est plat, le chanfrein est convexe
avec un museau fin. Il a des oreilles tombantes et moins longues que celles du
Peul-peul. Chez Le mâle, les cornes sont constantes et prismatiques
à la base se dirigeant en arrière et vers le bas. Les pendeloques
sont très rares autant chez les femelles que chez les mâles. La
robe est généralement pie-noire ou pie-grise. L'oeil est
elliptique, bleu, à fente palpébrale horizontale et à
saillie orbitaire accusée. C'est un animal mauvais marcheur.
II.1.1.2. Le mouton maure à poils longs
On le retrouve surtout au niveau du foirail de Dakar. C'est un
animal longiligne, convexiligne. La robe est noire ou noire-brun à poils
inégaux et superposés. Le poids varie de 30 kg à 35 kg.
Ses performances sont voisines de celles du Touabire qui a un format un peu
plus grand (PAGOT, 1985).
II.1.2. Le mouton Peul-peul
Cette race est la plus répandue dans les zones
sahéliennes. Au Sénégal elle se retrouve dans la zone
sylvo-pastorale et la vallée du fleuve Sénégal où
son aire de distribution se superpose à celle du zébu.
C'est un mouton de taille moyenne, longiligne, hyper
métrique et rectiligne. Les oreilles sont longues et tombantes (I.G.N.,
1977). La robe est claire, tachetée de roux et de noir ou brune ou
bicolore noir et blanc ou noir et roux parfois uniformément acajou
(GUEYE, 1990). Chez le bélier les cornes sont constantes, en spires
lâches, horizontales et développées. Ces cornes se
retrouvent sur une tête forte à front plat et chanfrein
busqué. Les membres sont longs et grêles. La taille moyenne va de
0,65 m à 0,75m au garrot pour un poids adulte compris entre 30 kg et 50
kg. Les pendeloques sont inconstantes dans les deux sexes.
II.1.3. Le mouton
Djallonké
Il est retrouvé dans la zone chaude et humide
guinéenne et dans le golf du Bénin. C'est un animal de petite
taille (0,40 m à 0,60 m), trypanotolérant, à robe blanche
ou pie. Le dimorphisme sexuel est très marqué. Le mâle
possède deux manchettes et deux crinières. Le poids adulte est de
20 kg à 30 kg (I.G.N., 1977).
Son mode d'élevage, ses caractères ethniques et
ses origines diffèrent de ceux des moutons du Sahel. C'est le mouton des
sédentaires dont l'élevage familial s'étend au delà
de l'ouest africain (DOUTRESSOULE, 1947).
II.1.4. Le mouton Bali-bali ou
Ouda du Niger
Comme le peul-peul et le Touabire, c'est un mouton du Sahel
pouvant atteindre, voire dépasser 100 kg à l'âge adulte
dans certaines conditions d'alimentation. Dans ses caractéristiques
actuelles, le Bali-bali est le fruit d'une sélection qui a
considérablement améliorée les races dites peulh du bassin
du Sénégal et du Niger (FALL, 2002). Originaire du Mali et du
Niger, son profil est convexe, les cornes sont développées et les
oreilles sont longues et tombantes avec un bourrelet à la nuque. Le cou
est développé mais ne possède ni crinière ni
camail. Le pelage est ras. La robe est blanche ou bicolore. C'est un animal de
grande taille avec une hauteur du garrot de 0,75 m à 0,85 m chez le
mâle contre 0,65 m à 0,75m chez la femelle. Le rendement carcasse
à l'abattage est de 50% (DECKA, 2003).
II.1.5. Les métis
Les métis sont essentiellement
représentés par les Waralé. Il existe aussi d'autres
variétés nouvelles qui sont apparues à partir des
années 1980 dans le marché du mouton de Tabaski.
II.1.5.1. Le Waralé
C'est un métis issu du croisement Touabire/Peul-peul.
Les éleveurs du Ferlo pensent que lorsque le mâle est peul-peul,
les descendants des deux sexes sont armés et quand le mâle est
Touabire, seuls les descendants mâles possèdent des cornes (DIA,
1979).
Tous les moutons ne présentant pas les
caractères des Touabire et des Peul-peul décrits plus haut sont
considérés comme Waralé. Le Waralé est moins haut
que le Touabire et moins trapu que le Peul-peul. La robe est brun-claire,
tachetée de noir et de roux. Les croisements Peul-peul/Djallonké
existent mais sont rares.
En fait, ces types ne sont définis que sur un plan
morphologique à cause des croisements multiples entre les races (MOULIN,
1993).
II.1.5.2. Le Ladoum
Originaire de la Mauritanie, le Ladoum est apparue dans la
ville de Thiès au début des années soixante avant de se
propager à Dakar au début des années quatre-vingt. Le
terme ladoum serait un emprunt à la langue peul où il
signifierait la bête exceptionnelle. En réalité, il ne
s'agit pas d'une race mais d'une variété appartenant au groupe
des moutons dits du sahel de type Touabire. Le Ladoum se distingue des autres
moutons dits du Sahel par son poil ras, sa robe blanche tachetée de noir
ou de marron (DECKA, 2003). Son encolure lui donne une envergure peu commune,
la femelle tout comme le mâle peut porter des cornes qui lui donnent
l'allure d'une antilope.
II.1.5.3. L'Azawat
Le nom Azawat est une déformation servant à
désigner une race de zébu dont l'aire géographique est la
vallée du même nom au Niger. Il n'existe pas de race Azawak chez
les ovins. Cette espèce a été introduite au
Sénégal en 1997 et il en existe actuellement une dizaine de
sujets.
II.2. Les systèmes de
production ovine
Le système de production est défini comme
étant l'ensemble structuré des productions
végétales et animales mises en oeuvre par l'agriculteur dans son
exploitation pour réaliser ses objectifs (DECKA, 2003). Selon le
degré de dépendance du ménage pour le revenu brut ou
l'approvisionnement alimentaire, les différents systèmes de
production rencontrés au Sénégal sont :
- le système pastoral ;
- le système agro-pastoral ;
- le système urbain.
II.2.1. Le système
pastoral
Le système pastoral est un système dans lequel
plus de 50% du revenu brut ou plus de 20% des calories alimentaires domestiques
proviennent de l'élevage ou d'activités annexes. Le revenu brut
est la valeur de la production auto consommée en plus de la valeur
commercialisée. Ce système concerne 35% des petits ruminants
(SENEGAL, 2001).
On le rencontre en zone aride et l'apport en énergie et
en protéines digestibles du tapis herbacé assurant l'alimentation
des animaux ne peut couvrir les besoins d'entretien et de croissance de ceux-ci
que de juillet à novembre (période d'hivernage au
Sénégal). Après cette période, les herbes
deviennent pauvres en matières azotées totales et en
énergie. Les sous-produits agro-industriels deviennent alors, en saison
sèche, la complémentation de choix pour le cheptel ovin et
bovin.
A partir de 1985, les réformes de la nouvelle politique
agricole ont profondément modifié le contexte
socio-économique de l'agriculture dans le delta. Ces réformes
sont les aménagements hydro-agricoles dans la région du delta, la
création de groupements d'intérêts économiques et de
la Caisse Nationale de Crédit Agricole du Sénégal (DECKA,
2003). Les peul du bas delta sont éleveurs principalement de petits
ruminants, et en second lieu de bovins (80 caprins et 20 ovins par
exploitation). Quant aux peul du haut et du moyen delta, leurs
préoccupations premières se rapportent aux bovins, le salariat et
les cultures irriguées. Une partie des revenus issus de la riziculture
est réinvestie dans l'élevage en vue de la réalisation de
l'embouche intensive d'ovins et de bovins en atelier (WILSON, 1986).
II.2.2. Le système
agropastoral
Tout système de production agricole dans lequel les
agents économiques tirent 50% ou plus de leur revenu de l'élevage
est qualifié de système agropastoral (WILSON, 1986).
L'agriculture y est la principale activité.
Les cultures irriguées et le salariat sont pour les
wolof du delta, dans l'agro-industrie, des composantes essentielles des
nouveaux systèmes de production agricole. Peu d'ovins (4 têtes par
exploitation dont 1 bélier) mais également peu de bovins (5
têtes en moyenne par exploitation) sont confiés la plupart du
temps aux bergers peuls ou matures qui les conduisent dans les pâturages.
Contrairement à ce que l'on rencontre dans le système pastoral,
les sous-produits agro-industriels sont peu utilisés car de coût
élevé. Les béliers et les taurillons sont donc
prioritaires. Néanmoins, certains paysans (très peu) en
distribuent à l'ensemble du cheptel. L'intensification des productions
animales se heurte donc finalement, tout comme dans le système
précédent, à un problème d'alimentation.
Dans la zone sylvo-pastorale, la faiblesse des pâturages
situés à proximité des forages, les fortes charges
animales font qu'à l'heure actuelle, la région soit
caractérisée par une grande mobilité des troupeaux
(SANTOIR,1983). Le système de production agropastoral est
pratiqué autour de la localité de Dahra par les wolofs
sédentaires.
L'habitat est fonction des zones climatiques. Parqués
le soir dans des enclos épineux (acacia) en zone sahélienne, les
moutons sont ainsi protégés des prédateurs. En Casamance
par contre, le logement des moutons est fait de véritables abris avec un
toit de chaume et une murette en banco qui protège les animaux des
pluies diluviennes (DIEDHIOU, 1996).
II.2.3. Le système urbain
et péri-urbain
Plusieurs auteurs interviennent dans ce système de
production. On y retrouve de petits exploitants salariés ou non mais
également des professionnels (FADIGA, 1990).
Les effectifs peu élevés caractérisent ce
système et les moutons sont en divagation permanente à la
recherche de la nourriture dans les poubelles et dans les terrains vagues.
Certains éleveurs citadins réservent tout de même à
leurs animaux des restes de cuisine (généralement du riz au
poisson). Mais il s'ensuit le plus souvent des indigestions graves.
L'alimentation est principalement faite de fanes d'arachide et sous-produits
agro-industriels. La nuit, les moutons sont parqués dans les hangars
afin d'être mis hors de portée des voleurs (DIA, 1979).
Le profil social des éleveurs est
généralement le même, mais les objectifs sont
différents d'un éleveur à un autre (DIEDHIOU, 1996). Dans
le système urbain et péri-urbain, certains éleveurs
pratiquent l'embouche ovine en nourrissant de façon intensive les
animaux avec les résidus agricols et les résidus
agro-industriels.
III.
Rôles socio-économiques des ovins
Les petits ruminants font l'objet d'exploitation en vue de la
production de lait et de viande. Ils sont également recherchés
pour les dons et les sacrifices. Au Sénégal, les moutons sont
devenus une source de revenu importante car les producteurs ont une attitude
spéculative vis-à-vis d'eux, surtout à l'approche de la
tabaski (MOULIN, 1993).
III.1. Rôle
socio-réligieux
La demande en moutons de tabaski est très importante au
Sénégal du fait de la forte représentation de la
population musulmane. Le mouton est également impliqué dans
d'autres évènements religieux et renforce les liens sociaux
(DIAW, 1995). Il faut ajouter à cela des croyances religieuses et
traditionnelles telle que la protection contre le mauvais sort par exemple qui
motive souvent la pratique de cet élevage.
III.2. Rôle
économique
La part de petits ruminants commercialisée
représente 70% du cheptel ovin (NGUE, 1997). Les animaux sont
généralement vendus durant la période de soudure, lorsque
le besoin de trésorerie est imminent (achat de céréales
et/ou semences). Cependant, chez les wolofs en particulier, la tabaski fait
exception, dans la mesure où les éleveurs gardent les plus beaux
mâles pour l'embouche afin d'en tirer le maximum de profit à la
vente. Les femelles sont en général traites et leur lait
autoconsommé et vendu en partie. Les femmes, grâce à cet
élevage de mouton possèdent une relative autonomie
financière vis-à-vis du chef de famille qui détient
près de 80 % des petits ruminants (MOULIN, 1993).
IV.
Contraintes de l'élevage ovin au Sénégal
L'élevage ovin au Sénégal contribue de
façon certaine à l'autosuffisance alimentaire en protéines
animales de nombreux ménages. Pour jouer son véritable
rôle, cet élevage mérite d'être rationalisé.
Mais cette rationalisation implique l'élimination de nombreuses
contraintes d'ordre climatiques, socio-économiques, zootechniques et
pathologiques qui constituent les principaux handicaps au développement
de l'élevage ovin au Sénégal.
IV.1. Contraintes climatiques
Le climat au Sénégal est
caractérisé par une longue saison sèche de 6 mois à
8 mois et une courte saison de pluie variable en fonction des zones.
La durée de la saison des pluies varie de 3 mois dans
le Nord à 6 mois dans le Sud. Les hauteurs de pluies passent de 250 mm
à Podor à plus de 1500 mm à Oussouye (THIAM et coll.,
1989).
Les précipitations coïncident avec la
période chaude. Elles vont en augmentant sensiblement vers les
régions méridionales. Les pluies très
irrégulières varient dans l'espace et dans le temps. Il arrive
aussi qu'entre deux pluies consécutives on ait une durée assez
longue de sécheresse, ce qui entraîne des pertes
considérables des jeunes pousses. Le phénomène le plus
important est celui de la sécheresse « cyclique »
qui s'est abattue sur le pays entre 1967 et 1978 et qui a causé
d'importants dommages tant sur les productions végétales que sur
les productions animales (DIA, 1979).
VI.2. Contraintes
socio-économiques
L'élevage ovin qui se fait en grande partie sous forme
extensive, souffre d'un déficit d'investissement ainsi que d'un manque
d'organisation des circuits de commercialisation et de distribution des
produits (D.P.S., 1995).
La production des ovins n'est pas destinée à la
commercialisation, mais plutôt à l'autoconsommation. Certains
utilisent cet élevage pour des raisons de croyances religieuses ou
traditionnelles où le mouton est considéré comme un animal
de compagnie, ce qui explique la faiblesse de la taille des troupeaux
(DIEDHIOU, 1996). Par ailleurs, lors des cérémonies religieuses
(Tabaski, baptêmes, mariages) plus de 500.000 moutons sont abattus chaque
année le jour de la tabaski (FALL, 2002).
IV.3. Contraintes zootechniques et
alimentaires
Une partie du Sénégal étant situé
en zone sahélienne, l'alimentation des animaux pose souvent de graves
problèmes pendant la saison sèche. Il s'ensuit une
sous-alimentation chronique qui affecte la production ovine. Les jeunes en
croissance, les animaux âgés et les femelles gestantes sont les
plus vulnérables. Les coûts élevés
de l'aliment et de la confection d'une bergerie constituent un frein à
l'élevage ovin. L'appréhension des vols incite les exploitants
à rassembler leur bétail à l'intérieur d'une
bergerie, dans la cour, sur la terrasse des maisons et habituellement dans un
endroit mal éclairé sans ouverture sur l'extérieur. Cette
situation n'est pas sans conséquences sur la santé des animaux et
sur leurs performances. En effet, il ne peut être question
d'améliorer le génotype d'un animal que si ce dernier est en
bonne santé et correctement nourri (DIEDHIOU, 1996).
Le ratio femelle/mâle est en général
faible car résultant du faible déstockage des femelles qui sont
rarement réformées d'une part et de l'abattage précoce des
mâles d'autre part. Une telle situation a des conséquences
néfastes sur la productivité du cheptel (DIEDHIOU, 1996).
IV.4. Contraintes
pathologiques
L'élevage des petits ruminants au Sénégal
est confronté au problème de maladies infectieuses,
nutritionnelles et parasitaires. Les principales affections autres que les
parasitoses helminthiques gastro-intestinales pouvant atteindre les troupeaux
au Sénégal feront l'objet de la suite de notre exposé.
IV.4.1. Les maladies
nutritionnelles
Les carences alimentaires survenant en saison sèche
sont à l'origine de divers troubles métaboliques. Ce sont pour la
plupart des carences vitaminiques, phosphocalciques, protéiques et
glucidiques. Le plus souvent elles sont associées et il en est de
même pour les troubles qui en résultent et qui sont par ailleurs
sporadiques et très variable suivant l'âge des animaux. C'est
ainsi que chez les jeunes prédominent des troubles de croissance et chez
les adultes, l'amaigrissement est le signe le plus fréquent.
IV.4.2. Les maladies infectieuses
IV.4.2.1. La peste des petits ruminants (PPR)
Elle sévit à l'état enzootique et pose un
problème médical et économique sérieux à
l'élevage des petits ruminants au Sénégal. La mise en
oeuvre d'un programme de vaccination est justifiée par l'ampleur des
dégâts qu'elle occasionne.
IV.4.2.2. Les pneumopathies
Elles constituent une des causes majeures de mortalité
chez les petits ruminants (NGUE, 1997). L'étiologie de ces affections
est très variée. Sur le plan clinique elles sont l'expression de
maladies virales (PPR, adénomatose pulmonaire, clavelée, ecthyma,
cowdriose) et de parasitoses respiratoires (oestrose ovine en particulier) ou
d'étiologie mal définies.
IV.4.2.3. Le charbon bactéridien
C'est une maladie bactérienne due à Bacillus
anthracis, contagieuse et très virulente. Elle est tellurique et sa
gravité est très variable suivant les régions. Sa
recrudescence est très marquée surtout pendant les années
où il y a des pluies abondantes.
Elle se caractérise sur le plan clinique par des
phénomènes fébriles accompagnés d'une
diarrhée noire et hémorragique. L'issue est toujours fatale pour
tout animal atteint (mort 24 heures après l'apparition des
manifestations cliniques).
IV.4.2.4. L'ecthyma contagieux
C'est une maladie due à un poxvirus et qui survient en
toute saison sur des moutons de tout âge. Elles est très
contagieuse et se traduit cliniquement par l'apparition de papules et de
vésicules au niveau des lèvres. Il s'ensuit des croûtes qui
se dessèchent progressivement, puis un amaigrissement dû à
l'impossibilité pour l'animal atteint de se nourrir facilement.
IV.4.3. Les maladies
parasitaires
IV.4.3.1. Les gales
Ce sont des parasitoses cutanées bénignes, on
les retrouve chez la plupart des espèces animales. Au
Sénégal, les moutons à poils sont particulièrement
affectés par la gale sarcoptique (NGUE, 1997).
La gale sarcoptique ou « noir
museau »
Elle est due à l'espèce Sarcoptes
scabiei variété ovis. Elle est le plus souvent
rencontrée chez les moutons à poils. Elle entraîne des
dépilations surtout au niveau des naseaux, des lèvres et de la
face. Chez les ovins à poils elle peut s'étendre à
d'autres régions du corps et se généraliser.
IV.4.3.2. Les parasitoses gastro-intestinales
- La coccidiose
Elle est très fréquente au Sénégal
et est due à des protozoaires appartenant à la famille des
Emeriidae. Deux espèces sont en cause chez le mouton : Eimeria
ovina et Eimeria ovinoïdalis. Les signes cliniques se
manifestent par une perte d'appétit et une diarrhée
brunâtre, parfois sanguinolente. Les animaux atteints maigrissent et
s'affaiblissent énormément au bout de quelques semaines. La mort
survient en général par suite d'épuisement.
- Les distomatoses
Elles sont provoquées par Fasciola gigantica
et Dicrocelium hospes.
- Les helminthoses
Outre ces différentes pathologies, on rencontre chez
les ovins les helminthes, parasites gastro-intestinaux responsables des
helminthoses que nous allons aborder dans le chapitre suivant.
Chapitre II : GENERALITES SUR LES
HELMINTHES PARASITES GASTRO-INTESTINAUX DES OVINS AU
SENEGAL
Les helminthes ou vers parasites sont des métazoaires
triblastiques dépourvus de coelome véritable. Les helminthes
comprennent trois embranchements : les plathelminthes, les
némathelminthes et les acanthocéphales. Cependant nous ne
parlerons que des plathelminthes et des némathelminthes car ce
sont les deux (2) embranchements qui contiennent les helminthes parasites
gastro-intestinaux des moutons.
I.
Plathelminthes
I.1. Taxonomie
Ce sont des vers plats. Les deux (2) principales classes
sont :
* la classe des trématodes au corps non
segmenté ;
* la classe des cestodes, au corps segmenté.
Ce sont en général des parasites hermaphrodites
à l'exception des schistosomes.
I.1.1. Les Trématodes
Les parasites intéressants les ovins sont
regroupés en trois (3) super-familles :
I.1.1.1. Super-famille des Fasciolidea
Elle appartient à l'ordre des Distomes et deux (2)
familles la composent :
*** Famille des Dicrocoelidés
Ce sont des parasites de très petite taille (1cm
environ) dont l'espèce commune aux ovins au Sénégal est
Dicrocoelium hospes encore appelée petite douve.
*** Famille des Fasciolidés
Ce sont des parasites de grande taille (7 cm environ),
d'où leur nom de grande douve. L'espèce commune aux ruminants en
Afrique tropicale est Fasciola gigantica.
Ces deux (2) parasites se retrouvent dans le foie et sont
localisés dans les canaux biliaires.
I.1.1.2. Super-famille des Paramphistomoïdea
Elle appartient également à l'ordre des
Amphistomes. La seule famille parasite des ruminants est la famille des
Paramphistomidés. Leur corps est conique. La ventouse buccale et la
ventouse ventrale sont en position opposées. Le genre Paramphistomum est
retrouvé dans le rumen et le réseau des ruminants. On
connaît deux (2) espèces chez les ovins :
- Paramphistomum cervi
- Paramphistomum daubneyi
I.1.1.3. Super-famille des Schistosomoïdea
Elle appartient à l'ordre des Schistomatidés
*** Famille des Schistosomidés
Les parasites sont caractérisés par des sexes
séparés. Le mâle est aplati et incurvé, alors que la
femelle est cylindrique. Il existe un canal gynécophore.
Le genre Schistosoma appartient à la
sous-famille des Schistomatinés et est rencontré dans la veine
porte et la veine mésentérique des ruminants. L'espèce
rencontrée chez les ovins est Schistosoma japonicum.
I.1.2. Les Cestodes
** Ordre des Cyclophyloïdea
** *Famille des
Anoplocéphalidés
Dans la classe des cestodes, seule la famille des
Anoplocéphalidés est la cause du Taeniasis des ovins en
général et en particulier au Sénégal.
****Sous-famille des Anoplocéphalinés
Elle appartient à l'ordre des Cyclophyllidea.
Le scolex est interne, les segments sont plus larges que longs. Les pores
génitaux sont marginaux, le cycle est à un hôte
intermédiaire : les acariens oribates ; les larves sont de
type cysticercoïde. Certains genres retrouvés dans cette famille
sont les suivants :
- le genre Moniezia : il possède deux (2)
ovaires en fer de cheval, le système génital est double, les
glandes interproglottidiennes sur le bord postérieur de chaque segment.
C'est un parasite de l'intestin grêle des ruminants. L'espèce
rencontrée chez les ovins est Monieza expansa ;
- le genre Stilesia : chaque segment
ovigère renferme deux (2) organes parutérins. Il possède
un scolex court et étroit avec de larges ventouses. La segmentation est
peu visible, d'où le nom de « ver frisé ». Il
est localisé dans l'intestin grêle et les canaux biliaires des
ruminants. L'espèce rencontrée chez les ovins est
Stilésia globipunctata ;
- le genre Avitelina : chaque segment
ovigère renferme un seul organe parutérin. Le scolex est
volumineux. La segmentation est peu visible et les proglottis sont courts. Une
ligne blanche opaque au centre représente l'utérus rempli
d'oeufs. On le rencontre dans l'intestin grêle des ruminants.
Une espèce est décrite chez les ovins :
Avitellina centripunctata.
I.2. Biologie
I.2.1. Habitat
Les Plathelminthes sont des endoparasites, avec des
localisations variées selon les espèces.
I.2.1.1. Plathelminthes du rumen et du réseau
Un seul genre est connu chez les ovins. Ce sont des parasites
au corps épais, de forme cônique, avec une ventouse ventrale
très developpée et reportée à
l'extrémité postérieur du corps (BUSSIERAS et CHERMETTE,
1988). Les adultes vivent dans le rumen et le réseau fixés
à la paroi par leur ventouse postérieur. L'espèce
Paramphistomum cervi est le parasite du mouton.
I.2.1.2. Plathelminthes de l'intestin grêle
- Le genre Moniezia
Deux espèces sont connues chez les ovins :
Moniezia expansa et Moniezia benedeni mais cette
dernière est plus fréquente chez le boeuf.
- Le genre Thysaniezia
Une seule espèce est connue : Thysaniezia
ovina
- Le genre Stilesia
Stilesia globipunctata est l'espèce connue
chez les moutons.
- Le genre Avitellina
Les moutons sont parasités par Avitellina
centripunctata.
Il est à noter qu'à partir du rumen
jusqu'à l'intestin grêle on rencontre souvent des larves de
Taenia hydatigena (encore appelées « boule
d'eau ») sur la face viscerale de ces viscères. Les moutons
sont simplement des hôtes intermédiaires.
I.2.2. Nutrition
I.2.2.1. Chez les Trématodes
Selon les espèces et selon le stade de
développement ils se nourrissent du sang, des tissus, du contenu du tube
digestif, de la bile et du mucus de l'hôte.
I.2.2.2. Chez les Cestodes
Ils ne possèdent pas de tube digestif ce qui les
obligent à absorber les éléments nutritifs par pinocytose.
La pinocytose est un processus par lequel des microgoutelettes traversent la
membrane externe du tégument, suivi de la formation de petites vacuoles
de syncitium tégumentaire. Les microvillosités ont peut
être pour rôle d'agiter et de renouveler le milieu ambiant.
I.2.3. Cycle de
développement
I.2.3.1. Chez les trématodes
I.2.3.1.1. La fécondation
Chez les rares espèces à sexes
séparés (Shistosomes), l'accouplement est permanent. Dans les
autres cas, l'accouplement est ventro-ventral et la fécondation
réciproque. Il existe également une possibilité
d'auto-fécondation.
I.2.3.1.2. La formation des oeufs
L'oeuf qui se forme dans l'ootype est composé à
la fois d'un zygote et de cellules vitellines produites par les glandes
vitellogènes. Les oeufs sont pondus soit rapidement, soit le plus
souvent, après un début de développement dans
l'utérus. Il y a formation de l'embryon et l'oeuf éliminé
est prêt à éclore. Selon les localisations des vers
adultes, les oeufs sont rejetés avec les selles (tube digestif) ou alors
avec des expectorations.
I.2.3.1.3. Le développement exogène
De l'oeuf sort un petit embryon triangulaire : le
miracidium. En général, le miracidium est une forme nageuse. Elle
meurt en quelques heures sauf si elle rencontre un hôte
intermédiaire convenable qui est toujours un mollusque
gastéropode. Le miracidium pénètre activement dans le
mollusque et se transforme en sporocyste. Ce dernier est un simple sac
dédifférencié dans lequel les cellules germinatives
bourgeonnent et donnent naissance à des larves. Chaque sporocyste donne
naissance à plusieurs rédies. La rédie contient des amas
de cellules germinatives qui se transforment en un stade larvaire
suivant : la cercaire. Une rédie donnant naissance à
plusieurs cercaires (dans certaines espèces le stade rédie
n'existe pas ; dans d'autres au contraire apparaissent des
générations de rédies-filles). La cercaire quitte
activement le mollusque et passe dans l'eau sauf exception. Le
développement exogène se termine selon trois (3)
possibilités, en fonction de l'espèce :
- soit la cercaire traverse activement le tégument de
l'hôte définitif s'il possède un appareil perforateur et/ou
des glandes céphaliques volumineuses ;
- soit la cercaire va se fixer sur un végétal si
elle possède des glandes cystogènes. Elle va alors perdre sa
queue et s'enkyster, donnant une métacercaire. L'hôte
définitif qui est généralement un herbivore s'infestera en
ingérant le végétal portant la
métacercaire ;
- soit elle pénètre dans un
deuxième hôte intermédiaire (poisson, crustacé) et
s'y transforme en métacercaire lorsqu'elle possède des glandes de
deux types. L'hôte définitif, le carnivore ou l'omnivore s'infeste
en consommant le deuxième hôte définitif.
I.2.3.1.4. Développement endogène
Chez l'hôte définitif, la jeune douve
présente généralement une phase de migration dans
l'organisme. Cette phase est suivie d'une phase de maturation. Cette
dernière se termine par l'acquisition de la maturité sexuelle.
I.2.3.2. Chez les cestodes
Les oeufs se développent entièrement dans
l'utérus du ver. En l'absence de ponte, ce sont les anneaux
ovigères complets qui sont éliminés dans les selles. Les
oeufs sont libérés dans le milieu extérieur après
destruction des anneaux.
Chez les Taeniidés, l'embryophore qui est épais
est le seul à subsister et prend un caractère vacuolaire :
deux minces membranes réunie par des fibres à disposition
rayonnante.
Le développement nécessite
généralement le passage chez un seul hôte
intermédiaire. Le plus souvent il s'agit d'un invertébré
arthropode ou mollusque, dans la cavité duquel se forme une larve
cystcercoïde contenant un scolex. Dans la famille des Taeniidés,
l'hôte intermédiaire est un mammifère, chez qui se forme
une larve vésiculaire contenant un ou plusieurs scolex analogues
à celui de l'adulte. L'infestation de l'hôte définitif se
fait dans tous les cas par ingestion de l'hôte intermédiaire. Le
développement du ver adulte se fait à partir du scolex de la
larve dans l'intestin sans aucune migration.
I.3. Epidémiologie
L'épidémiologie des Trématodes et des
Cestodes concernera deux (2) familles : la famille des
Paramphistomidés et la famille des Anoplocéphalidés.
I.3.1. Epidémiologie des
Paramphistomidés
Dans cette famille, les deux espèces rencontrées
chez le mouton sont Paramphistum cervi et Paramphistum
daubneyi. L'épidémiologie sera donc axée sur ces deux
(2) espèces.
Paramphistum cervi est transmis pas des Anisus et
Paramphistum daubneyi par Lymnea truncatula.
L'infestation se fait par ingestion de métacercaires
fixées sur des végétaux précédemment
immergés, si bien que cette épidémiologie rappelle celle
de la fasciolose.
I.3.2. Epidémiologie des
Anoplocéphalidés
Nous parlerons de l'épidemiologie des téniasis
causée par les Taenia. En effet le téniasis est une maladie de
pâturage frappant surtout le jeune. L'infestation directe se fait au
travers des oribatidés et indirectement au travers des animaux
atteints. Chez les mammifères, le parasite peut vivre
de un mois à un an au maximum. Les oeufs libres dans le milieu
extérieur résistent un (1) à deux (2) mois. Chez les
oribatidés, le parasite survit pendant toute la vie de l'acarien. Mais
la destruction de ces acariens survient en quelques semaines par la
dessiccation. L'infestation se fait uniquement par la voie buccale après
ingestion des hôtes intermédiaires. La vie au pâturage
favorise l'infestation des animaux. L'espèce ovine est
particulièrement frappée par cette parasitose. Les jeunes animaux
(moins de 6 mois) sont les plus gravement atteints.
Les animaux malades et mal nourris sont plus exposés
que les animaux saints.
I.4. Etude anatomo-clinique
I.4.1. Symptômes
- Les paramphistomoses
Les symptômes sont le plus souvent inapparents.
Cependant, dans les formes graves on note une perte de l'appétit, une
augmentation de la soif et une diarrhée fétide contenant les
parasites immatures. Les selles sont très liquides et projetés
à distance, ce qui souille le train postérieur. On note
également un oedème de l'auge.
Dans la forme aiguë, la maladie évolue en 5
à 10 jours et peut conduire soit à la mort, soit à une
longue convalescence.
- Teniasis
Les troubles digestifs sont peu caractéristiques :
poussée diarrhéique et petites coliques. On note également
des troubles de la rumination. Le retentissement de la maladie sur
l'état général se traduit par un amaigrissement et une
anémie. Parfois des troubles nerveux sont observés : une
démarche ébrieuse, des tremblements et des convulsions.
L'évolution est très variable. Parfois elle est
assez grave chez les agneaux. Des complications peuvent survenir, ce sont des
myases cutanées à Calliphoridés favorisés par la
diarrhée elle-même due aux Anoplocéphales ; des
entérotoxémies dues à des clostridies. Ces divers troubles
qui n'ont pas de liens directs avec le teniasis paraissent beaucoup plus rares
après des traitements anthelminthiques systématiques. Cependant
d'autres observations indiquent que le téniasis des agneaux ne provoque
que peu ou pas de diarrhée (ELLIOT, 1984).
I.4.2. Lésions
I.4.2.1. Générales
- Paramphistomose
Selon la durée de l'évolution, la carcasse est
normale ou au contraire, paraît très amaigrie. Dans ce dernier
cas, on note de l'ascite, de l'hydrothorax et de l'hydropéricarde.
-Téniasis
On note de l'anémie et la maigreur.
I.4.2.2. Locales
- Paramphistomose
* Rumen
On y note parfois la présence de parasites adultes,
très nombreux mais non pathogènes. Ces derniers sont de couleur
rosée et fixés à la muqueuse. De petites zones en relief
de 1 mm de diamètre correspondent à d'anciens points de
fixation.
* Caillette et duodénum
On note une congestion et de l'oedème, au point que
parfois, la lumière de la caillette a presque disparue. Dans les cas
où l'on compte plusieurs dizaines de milliers de parasites, on note des
hémorragies, de la nécrose, et des vers enfoncés dans la
muqueuse. Les parasites sont parfois visibles au travers de la séreuse
ou bien ayant passés dans le liquide péritonéal.
-Téniasis
Les lésions locales se traduisent par une inflammation
de l'intestin grêle caractérisée par les ponctuations
hémorragiques aux points de fixation. Des vers très longs et
volumineux sont présents dans la lumière de l'intestin
grêle. Par contre lorsque les parasites sont nombreux, ils restent
courts.
I.5. Pathogénie
Les vers immatures s'enfoncent dans la muqueuse et en
arrachent des fragments avec leurs ventouses, d'où les
hémorragies et la nécrose observées. Si les vers sont
très nombreux la digestion est totalement perturbée.
I.6. Diagnostic
Il est basé sur les symptômes et sur la recherche
minutieuse des vers immatures, de couleur rosée dans les matières
diarrhéiques sur l'animal vivant.
La coprologie n'est pas possible en l'absence d'oeufs (les
troubles graves étant dus à des vers immatures).
Le diagnostic post mortem est facilité par la mise en
évidence des parasites au niveau du rumen pour Paramphistomum et de
l'intestin pour les cestodes et les nématodes.
Le pronostic est grave dans les infestations massives qui sont
rarement rencontrées.
I.7. Méthodes de lutte
I.7.1. Traitement
Il consiste à arrêter l'infestation des animaux
en commençant par le retrait de ces derniers de la zone dangereuse
(pâturage infesté).
Pour la destruction des parasites, trois molécules
seront utilisées :
- Niclosamide : on administre 50 à 80 mg par kg
par voie buccale. Elle est active sur les parasites immatures, et a peu ou pas
d'action sur les adultes du rumen ;
- Bithionol : on administre 25 à 75 mg et 30
à 40 mg de Bithionoloxyde par voie buccale. Ces deux molécules
agissent à la fois sur les vers immatures et adultes ;
- Résorantel : 65 mg par Kg sont
administrés par voie buccale. Il est très actif.
L'ivermectine n'est pas efficace sur les cestodes
(DORCHIES, 1991).
I.7.2. Prophylaxie
Elle consiste à détruire les adultes non
pathogènes, mais ce n'est pas facile. Cependant l'albendazole à
10 mg par kg est actif. A cela il faudra ajouter la destruction des mollusques
hôtes intermédiaires.
II. Les Nemathelminthes
II.1. Taxonomie
Les Nématodes sont des vers cylindriques, non
segmentés, pseudocoelomates. Leur tube digestif est complet et les sexes
sont séparés. Leur cycle est homoxène ou
hétéroxène. Les Nématodes comprennent deux
classes : classe des Secernenta et Classe des
Adenophora.
II.1.1. La classe des Secernenta
Chez les moutons trois ordres sont responsables des
parasitoses observées.
* L'ordre des Ascaridida
Les parasites ici ont une bouche généralement
trilabiée. On a une famille, celle des Oxyuridés qui comprend une
espèce : Skrjabina ovis.
* L'ordre des Rhabditida
La bouche des parasites est non trilabiée. Chez les
moutons on retrouve une famille, celle des Strongylidés. Une seule
espèce est retrouvée chez le mouton : Strongylus
papillosus.
* L'ordre des Strongylida
Les parasites n'ont pas de lèvres. De nombreuses
espèces possèdent une capsule buccale ; certaines ont une
vésicule céphalique (dilatation cuticulaire).
L'extrémité postérieure des mâles est pourvue d'une
bourse copulatrice. Chez les ovins on rencontre deux super-familles.
** La super-famille des
Strongyloïdea
*** Famille des Strongylidés
**** Sous-famille des Oesophagostominés
- Genre Oesophagostomum
Dans ce genre une espèce est rencontrée chez les
moutons : Oesophagostomum columbianum. Ce parasite possède
deux coronules et des ailes cervicales très développées.
Les larves sont très pathogènes.
- Genre Chabertia
Une espèce est rencontrée chez les
moutons : Chabertia ovina. Elle est caractérisée
par un orifice buccal dévié vers la face ventrale et
possède deux coronules.
** La super-famille des
Trichostrongyloïdea
*** Famille des Ankylostomatidés
**** Sous-famille des Bunostominés.
- Genre Bunostomum
Bunostomum trigonocephalum parasite l'intestin
grêle des ruminants. Il possède une seule paire de dents au fond
de la cavité buccale.
*** Famille des Trichostrongylidés
**** Sous-famille des Trichostrongylinés
- Genre Ostertagia
Une seule espèce est parasite des petits
ruminants : Ostertagia circumtata. Les spicules du mâle
sont très rectilignes et terminés par deux (2) branches.
- Genre Haemonchus
Haemonchus contortus possède une
extrémité antérieure avec une ébauche de capsule
conique renfermant une petite dent.
- Genre Trichostrongylus
Trichostrongylus colubriformis est très petit
et le mâle possède des spicules égaux.
Trichostrongylus axei possède un
développement endogène dans les culs-de-sac glandulaires.
- Genre Cooperia.
Cooperia curticei parasite le mouton et est
généralement enroulé en ressort.
**** Sous-famille des Nématodirinés
- Genre Nématodirus
Nématodirus filicolis, Nématodirus
spathiger et Nématodirus battus parasitent le mouton. Le
mâle est caractérisé par des spicules réunis par
leur extrémité distale. Ils ont un diamètre très
réduit en région antérieur et le renflement
céphalique est petit.
II.1.2. Classe des Adenophorea
Les parasites ici possèdent un oesophage réduit
à un tube capillaire enchassé dans un schistosome. Le mâle
possède 0 ou 1 spicule et est dépourvu de ventouse
postérieure.
*** Famille des Trichuridés
- Genre Trichuris
L'extrémité postérieure du mâle est
spiralée dans un plan et terminée par le spicule entouré
d'une gaine spiculaire rétractable et souvent épineuse. Deux (2)
espèces sont rencontrées chez les moutons : Trichuris
ovis et Trichuris globulosa.
*** Famille des Trichinellidés
- Genre Trichinella
Trichinella spiralis encore appelé trichine
parasite le mouton. Le mâle est dépourvu de spicule et porte deux
(2) papilles à l'extrémité postérieure.
II.2. Biologie
II.2.1. Habitat
II.2.1.1. Les parasites de la caillette
La caillette peut être parasitée par les
parasites appartenant aux genres Haemonchus ,Ostertargia,
Trichostrongylus qui appartiennent à l'Ordre des Strongylida et
à la famille des Trichostrongylidae (BUSSIERAS et CHERMETTE,
1995).
II.2.1.1.1. Le genre Haemonchus Cobb, 1898
Ce genre est caractérisé par l'existence d'une
cavité buccale très rudimentaire avec une petite dent
oesophagienne dorsale. L'extrémité antérieure des vers
présente une paire de papilles cervicales proéminentes. Le
mâle possède une bourse caudale large avec deux grands lobes
latéraux et un petit lobe dorsal médian asymétrique
situé à gauche soutenu par une côte en Y renversé.
Les spicules au nombre de deux (2) sont relativement courts. Le gubernaculum
est présent. Chez la femelle, l'orifice vulvaire est recouvert d'un
prolongement cuticulaire linguiforme appelé languette supra-vulvaire ou
clapet vulvaire. Les oeufs à coque mince sont éliminés au
stade de morula avec les matières fécales (YAMAGUTI, 1961 ; DUNN,
1978).
II.2.1.1.2. Le genre Ostertagia Ransom, 1907
Ce genre, rencontré fréquemment chez les animaux
des régions tempérées, n'a pas été
décrit par la majorité des travaux réalisés en
Afrique tropicale.
Les espèces appartenant à ce genre sont des vers
fins. La région antérieure présente un léger
renflement avec des striations transversales. Chez les mâles on note une
bourse caudale possédant un lobe dorsal et un lobe ventral avec
présence d'une membrane accessoire située antérieurement
sur le coté dorsal. Les mâles possèdent deux (2) spicules
divisés en deux ou trois branches à leur extrémité
distale. Ces spicules sont minces et rectilignes. Les vers sont reconnaissables
par leur coloration brunâtre (CHERMETTE, 1981).
Parmi les espèces retrouvées chez les ovins, les
plus importantes sur le plan vétérinaire sont: Ostertargia
circumcincta Stadelmann,1894 ; O.ostertagi Stiles, 1892 et
O. trifurcata Ransom, 1907.
II.2.1.1.3. Le genre Trichostrongylus Loos, 1905
Les espèces de ce genre sont de petite taille,
très fines et sans capsules buccales. Le pore extérieur est
habituellement situé ventralement dans une dépression de la
partie antérieure du corps. La bourse caudale du mâle
possède de longs lobes latéraux tandis que le lobe dorsal n'est
pas bien défini. Les côtes latérales de la bourse caudale
sont séparées. La côte ventrale est plus mince que celle
latérale ventrale qui est parallèle aux côtes
latérales. La côte dorsale est plus fine et se subdivise à
son extrémité en deux branches avec de courtes digitations. Les
spicules courts et trapus sont de couleur brune. Le gubernaculum est
présent. Chez la femelle les deux utérus sont opposés.
Elle est qualifiée d'amphidelphe. La vulve s'ouvre au milieu du corps
(YAMAGUTI, 1961 ; SOULSBY, 1968). Dans ce genre, Trichostrongylus axei
Cobbold, 1879 appelé aussi T. extenatus Railliet, 1898 est
l'espèce rencontrée dans la caillette du mouton.
II.2.1.2. Parasites de l'intestin grêle
Les Nématodes rencontrés dans cette partie de
l'intestin appartiennent à deux (2) ordres :
Ordre des Strongylida (Strongles digestifs)
représentés par deux (2) familles : la famille des
Trichostrongylidae avec les genres Trichostrongylus, Cooperia
et Nematodirus et la famille des Ankilostomodae avec les genres
Bunostomum et Gaigeria.
Ordre des Rhabditida avec une seule famille, celle des
Rhabditidae avec le genre Strongyloides.
II.2.1.2.1. Le genre Trichostrongylus Loos, 1905
Sa description a été faite ci-dessus. Les
principales espèces de ce genre sont : Trichostrongylus
colubriformis GILES, 1892 ; T. facultatus ransom, 1911 ; T.
vitrinus LOOS, 1905 ; T.probolurus RAILLIET, 1896 ; T.
rugatus M(O)NNING, 1925 ; T. longispicularis GORDON, 1933 et
T. retortaeformis ZEDER, 1800.
II.2.1.2.2. Le genre Cooperia ransom, 1907
Les représentants de ce genre sont de petits vers de
l'ordre de 5 à 9 mm de long sur 0,1 à 0,2mm de large. Ils sont
dépourvus de capsule buccale. L'extrémité
antérieure de ces nématodes présente un léger
renflement (ébauche de vésicule céphalique) avec en
arrière une zone de striations cuticulaires marquées. Les
cuticules des mâles sont courtes et pourvus d'une expansion aliforme en
région moyenne. La vulve, chez la femelle, est située un peu en
arrière du milieu du corps (YAMAGUTI, 1961 ; SOULSBY, 1968). Les
espèces rencontrées chez les ovins sont : Cooperia
curticei RAILLIET, 1893 ; C. punctata v. LINSTOW, 1907 ;
C.pectinata RANSOM, 1907 et C.oncophora RAILLIET, 1898.
II.2.1.2.3. Le genre Nematodirus Ransom, 1907
Il comprend des Nématodes relativement longs à
région antérieure filiforme avec un léger renflement
céphalique. Ils sont de coloration blanchâtre, plus ou moins
vrillés sur eux-même et, de ce fait, souvent
agglomérés en petites pelotes ce qui permet de les distinguer
aisément (CHERMETTE, 1981 ; BUSSIERAS et CHERMETTE, 1995).
L'extrémité antérieure montre une petite vésicule
céphalique et quelques striations cuticulaires marquées. La
bourse caudale du mâle a des lobes latéraux allongés. Les
spicules longs et filiformes sont reliés par leur
extrémité distale et se terminent par une petite formation
lancéolée caractéristique de chaque espèce.
L'extrémité postérieure des femelles est tronquée
et se termine par une pointe caudale. L'utérus est rempli d'oeufs
très volumineux (140-260 um x 75-90 um) ovoïdes, à paroi
claire, contenant une morula formée de 4 à 8 gros
blastomères dont la présence permet de reconnaître
facilement les femelles des Nématodirus sp.
Plusieurs espèces ont été décrites
comme étant parasites de l'intestin grêle du mouton. Ce sont :
Nematodirus spathiger RAILLIET, 1896 ; N. filicollis
RUDOLPHI, 1802 ; N. battus CROFTON et THOMAS, 1951 ;
N.Helvetianus May, 1920 ; N. abnormalis May, 1920 et
N.rufaevastitatis DURBIN et HONESS, 1951.
II.2.1.2.4. Le genre Bunostomum Railliet, 1902
Ce genre comprend des espèces de grande taille dont
l'extrémité antérieure est recourbée dorsalement.
La capsule buccale est moins large mais profonde. Cette capsule buccale
présente au niveau de son bord antérieur, une paire de lames
tranchantes ventrales. Au fond de la capsule buccale, il existe une paire de
petites dents (lancettes) subventrales et un tunnel dorsal se transformant en
un cône dorsal pointu. Chez les mâles, on note la présence
d'une bourse caudale à lobe dorsal asymétrique et très
réduit par rapport aux deux lobes latéraux beaucoup plus
développés. La côte externo-dorsale droite est
effilée et se détache précocement du tronc commun de la
côte dorsale. La côte externo-dorsale gauche est plus courte,
arrive à peine à la bifurcation de cette dernière. Les
spicules sont égaux chez les femelles, la vulve s'ouvre un peu en avant
du milieu du corps. Ces parasites présentent des festons cuticulaires
très marqués au niveau de la région antérieure
(YAMAGUTI, 1961 ; SOULSBY, 1968). Le genre Bunostomum porte deux
synonymies. Il s'agit de Monodontus MOLIN, 1861 et Bustomum
LANE, 1917.
L'espèce cosmopolite couramment rencontrée chez
le mouton est Bunostomum trigonocephalus RUDOLPHI, 1808. Toutefois
d'autres espèces comme B. bovis MAPLESTONE, 1931 et B.
phlebotomum RAILLIET et RIZZO, 1900 peuvent parasiter le mouton (YAMAGUTI,
1961).
II.2.1.2.5. Le genre Gaigeria Railliet et Henry, 1910
Il comprend des vers de grandes tailles dont
l'extrémité antérieure est également
recourbée dorsalement. La capsule buccale est infundibuliforme et
présente au niveau de son bord antérieur une paire de lames
tranchantes situées ventralement. Au fond de cette capsule buccale, on
note une paire de petites dents subventrales et un cône dorsal. La
région antérieure des parasites présente également
des festons cuticulaires. Ce genre ressemble beaucoup à
Bunostomum. Mais chez Gaigeria, il existe un petit tubercule
sur chacune des deux (2) lancettes subventrales de la capsule buccale. Aussi,
la bourse caudale chez le mâle présente un (1) lobe dorsal de
grande taille et deux (2) petits lobes latéraux se rejoignant
ventralement. Les spicules sont fins, égaux et sans barbes. Chez la
femelle, la vulve s'ouvre un peu en avant du milieu du corps (YAMAGUTI, 1961 ;
SOULSBY, 1968).
L'espèce couramment rencontrée chez les ovins
est Gaigeria pachyscelis Railliet et Henry, 1910. D'autres
espèces parasitent rarement le mouton .Il s'agit de G. smiti
Notosoediro, 1928 et G. ulissiponensis de Brito, 1952.
II.2.1.2.6. Le genre Strongyloides Grassi, 1879
Il comprend de nombreuses espèces dont certaines sont
parasites d'animaux. Les formes parasites sont
parthénogénétiques et les oeufs rejetés à
l'extérieur par leurs hôtes, donnent soit des larves infestantes,
soit des formes libres avec mâles et femelles de petite taille. Les
formes libres ont des oesophages rhabditoïdes. La vulve est située
dans la région moyenne du corps. Elles peuvent donner une
génération parasite. L'oesophage des formes parasites est non
rhabditiforme, mais plutôt cylindrique sans bulbe postérieur. Les
adultes des formes parasites ont un organe génital femelle
développé et un oesophage relativement long (SOULSBY, 1968). Dans
ce genre, une seule espèce parasite les ovins.
Il s'agit de Strongyloides papillosus WEDL, 1856.
II.2.1.3. Parasites du gros intestin
Dans cette portion du tube digestif, on rencontre des
nématodes appartenant à trois (3) ordres (BUSSIERAS et CHERMETTE,
1995) :
Ordre des Ascarida avec les familles des Oxyuridae
dans laquelle se trouve le genre Skrjabinema ;
Ordre des Strongylida avec la famille des
strongylidae, la sous-famille des Oesophagostominae dans
laquelle se trouvent les genres Oesophagostomum et
Chabertia ;
Ordre des Trichinella avec la famille des
Trichuridae comprenant le genre Trichuris.
II.2.1.3.1. Le genre Skrjabinema Vereschtchagin, 1926
Il comprend des espèces blanchâtres de petites
tailles et de 3 à 8 mm de long qui vivent dans le caecum des ruminants.
Les parasites présentent trois (3) petites lèvres buccales, un
(1) oesophage rhabditoïde et un (1) seul spicule chez le mâle. Les
femelles ont une extrémité postérieure effilée
(SOULSBY, 1968). Deux (2) espèces ont été décrites
chez les ovins. Il s'agit de : Skrjabinema ovis Skrjabin, 1915 et
S. alatum M(O)NNIG, 1932.
II.2.1.3.2. Le genre Oesophagostomum Molin, 1861
Ce genre renferme des nématodes à capsule
buccale cylindrique avec une couronne radiaire ou un coronule. Les vers
présentent ventralement un sillon cervical (à
l'extrémité antérieure) au-dessus duquel on note une
dilatation cuticulaire portant le nom de vésicule céphalique.
L'extrémité antérieure présente également
un bourrelet péristomique appelé encore anneau céphalique
qui est séparé du sillon cervical par la vésicule
céphalique. Généralement, il existe deux (2) coronules :
un coronule interne et un externe. Toutefois, l'un des deux peut être
absent. Chez les mâles, les côtes ventrales, medio-latérales
et postéro-latérales de la bourse caudale, se fusionnent à
leur extrémité proximale. La côte dorsale est
divisée en deux (2) branches divergentes donnant chacune une courte
sous-branche latérale, les spicules sont égaux. Le gubernaculum
est présent. L'extrémité postérieure des femelles
est terminée en pointe et présente l'orifice vulvaire
situé un peu en avant de l'anus (YAMAGUTI, 1961 ; SOULSBY, 1968).
Quelques espèces appartenant à ce genre ont
été décrites chez les ovins. Ce sont :
Oesophagostomum columbianum CURTICE, 1890 et O. venulosum
RUDOLPHI, 1809.
II.2.1.3.3. Le genre Chabertia Railliet et Henry, 1909
Ce genre renferme des vers à capsule buccale globuleuse
et présente une vésicule céphalique très peu
développée. L'orifice buccal est dirigé vers la face
ventrale. Il existe deux (2) coronules. La bourse caudale du mâle
ressemble à celle de Oesophagostomum spp et les spicules
égaux sont fins. Le gubernaculum est présent. Chez la femelle la
vulve s'ouvre au voisinage de l'anus (YAMAGUTI, 1961). Chabertia ovina
GMELIN, 1970 est l'espèce décrite chez le mouton.
II.2.1.3.4. Le genre Trichuris Roederer, 1761
Les espèces appartenant à ce genre ont le corps
divisé en deux (2) parties : une partie antérieure oesophagienne
filiforme et longue et une partie postérieure large et courte, plus ou
moins rectiligne ou légèrement recourbée chez les
femelles. Chez les mâles cette partie postérieure est
enroulée en spirale. Ils possèdent un long spicule
rétractable dans une gaine en partie épineuse (CHERMETTE, 1981).
Deux (2) espèces ont été décrites chez les ovins.
Ce sont : Trichuris ovis ABILGAARD, 1795 et T. globulosa
LINSTOW, 1901.
II.2.2. Nutrition
La nutrition est variable selon le stade évolutif. Ils
sont chymivores, histophages et hématophages (avec diverses
adaptations : pièces perforantes, ou extrémité
antérieure très effilée ; sécrétions
anticoagulants et hémolytiques).
II.2.3. Cycle de
développement
Le cycle de développement ou cycle évolutif des
nématodes, passe par cinq (5) stades larvaires successifs
séparés par quatre mues (MAUPAS, 1899).
Le cycle de développement des nématodes des
ruminants en milieu tropical est généralement monoxéne et
comporte deux phases à savoir une phase exogène et une phase
endogène.
II.2.3.1. Phase exogène
Elle débute par l'expulsion d'oeufs
fécondés dans le milieu extérieur avec les matières
fécales (GRABER et PERROTIN, 1983). Si les conditions de
température, d'humidité et d'oxydation sont favorables, l'oeuf
éclot et libère une larve de premier stade (L1).
Après quelques heures, cette larve (L1) se débarrasse
de sa cuticule et devient une larve de deuxième stade (L2).
Cette larve (L2) à son tour subit une mue qui la fait passer
au stade de larve infestante (L3) contenue en général
dans l'exuvie de la (L2).
La température, l'humidité et l'oxydation
conditionnent l'épidémiologie des nématodoses car elles
sont responsables de l'abondance des (L3) infestantes dans les
pâturages. En effet, l'éclosion des oeufs demande des conditions
de température variant entre 6°C et 36°C avec une
température optimale de 30°C. Par exemple chez Haemoncus
contortus, aucun développement n'a lieu en dessous de (+9C), mais
dans les conditions optimales (22°C-26°C), une semaine seulement est
nécessaire. Cette espèce est adaptée aux climats chauds
(SOULSBY, 1968 ; BUSSIERAS et CHERMETTE, 1995). Les températures
supérieures à 40°C sont néfastes à la survie
des larves (L3). L'optimum d'humidité relative est de 70 à75 %.
C'est ainsi que les nématodes du genre Bunostomum
évoluent dans une hygrométrie de 40% et une température
supérieure à 15% (CHERMETTE, 1981). Cependant, chez les
nématodes les genres Trichuris et Strongyloides, la
phase exogène est différente.
- Chez les Trichuris spp, le développement
larvaire dans le milieu extérieur s'effectue à l'intérieur
de l'oeuf en trois semaines si les conditions sont satisfaisantes. Ce
développement peut être retardé dans les milieux à
température variant entre 6°C et 20°C (SOULSBY, 1968).
- Chez les Strongyloides spp, le cycle
évolutif est complexe. Si ce cycle ne nécessite pas le passage
par un hôte intermédiaire, il doit se réaliser dans des
biotopes particuliers tels que la vase humide recouverte d'une petite couche
d'eau stagnante. Les oeufs renfermant les (L1), les rhabditoïdes
éliminés par les excréments éclosent et
libèrent ces larves qui se transforment en individus sexués
mâles et femelles. Ces petits vers libres s'accouplent pour donner des
oeufs dans le milieu ambiant. A partir de ces oeufs, peuvent naître soit
des individus sexués qui recommencent le cycle en milieu
extérieur ; soit des larves parthénogénétiques qui
disparaîtront au bout d'un certain temps ou infesteront un ruminant par
voie orale ou par voie transcutanée. Arrivées dans l'intestin de
l'hôte, elles se transformeront en femelles
parthénogénétiques.
La survie des larves infestantes dans le milieu
extérieur dépend des espèces. Chez Haemonchus
contortus, les larves sont résistantes mais elles ne survivent pas
au gel et à la sécheresse prolongée. Les larves des
Ostertagia spp ont une grande résistance au froid. Les
larves infestantes de Trichostrongylus spp sont également
résistantes au froid. Quant aux formes infestantes des Cooperia
spp, elles sont peu résistantes au froid et à la
dessication. Chez les Nématodirius spp, les larves
(L1), (L2), (L3), se forment à
l'intérieur de l'oeuf et la résistance au froid et à la
dessication est de ce fait très grande. La persistance sur les
pâturages est de une à deux années (SOULSBY, 1968 ;
CHERMETTE, 1981). Les oeufs infestants des Trichuris spp peuvent
rester viables pendant plusieurs années (SOULSBY, 1968). En
général, bien qu'enveloppées dans une dépouille
exuviale, les larves (L3) sont douées d'une grande
mobilité et sont capables de se déplacer à la surface du
sol ou sur des végétaux. Les mouvements s'effectuent dans le sens
transversal. Les déplacements verticaux sont orientés par divers
tropismes :
- hygrotropisme positif qui pousse les larves à
chercher les zones humides ;
- phototropisme négatif qui leur fait fuir une trop
vive lumière ;
- géotropisme qui les pousse à s'élever
au dessus du sol (CROFTON, 1954).
La combinaison de ces divers tropismes fait que les larves
infestantes occupent, au cours du nychtémère, des parcs
contaminés. Avant neuf (9) heures et après dix huit (18) heures,
on en trouve beaucoup plus sur les végétaux qu'à la
surface du sol car leur géotropisme négatif et leur hygrotropisme
positif ne sont pas contrariés après l'ensoleillement. Au
contraire, aux heures où la lumière est très vive et qui
coïncident avec la disparition de la rosée sur les plantes, les
larves (L3) sont surtout abondantes à la surface du sol et
à la base des végétaux (CROFTON, 1954). De nombreux
facteurs peuvent modifier ces mouvements verticaux :
- l'étiologie des parasites eux-mêmes : les
Nématodirius spp recherchent surtout les parties
inférieures des plantes (BAXTER, 1959) ;
- leur sensibilité à la chaleur : bien que
la température optimale pour le développement larvaire soit
relativement élevée (22°C-26°C), l'activité
maximale des larves L3 ne s'exerce pas toujours à des
températures aussi hautes. Les larves de Haemonchus contortus
sont particulièrement actives aux périodes chaudes (ROGERS,
1940). Dans toutes les espèces, les larves (L3) se
rassemblent à la base des plantes ;
- les facteurs extrinsèques telles que la nature de la
végétation.
Les déplacements transversaux sont plus
limités : 5 à 7 cm pour Haemonchus contortus
(STEWARD et al., 1953) ; 20 cm pour Cooperia spp (TARHIS, 1958).
Les mouvements des larves (L3) sont préjudiciables à
la survie de ces dernières qui sont incapables de se nourrir dans le
milieu extérieur et ne vivent que de réserves faites par les
larves du deuxième stade. Lorsque ces réserves s'épuisent,
les larves (L3) meurent (EUZEBY, 1963).
II.2.3.2. Phase endogène
Elle correspond au développement des vers dans
l'hôte définitif après infestation par la larve
(L3). Cette phase diffère d'une espèce à
l'autre. D'une manière générale on distingue deux formes
principales d'évolution des larves chez leurs hôtes
définitifs : l'évolution directe et l'évolution
indirecte. Mais chez certaines espèces le développement larvaire
peut être momentanément arrêté (GRABER et al.,
1983).
II.2.3.2.1. Evolution directe
Cette forme d'évolution intéresse les
Trichostrongylidae, les Trichuridae et les
Oxyuridae. L'infestation se fait toujours par voie buccale et de
façon passive. Les migrations des larves dans l'hôte sont de
faible amplitude et n'intéressent que la muqueuse digestive. La larve
(L4) une fois formée, regagne la lumière du tube
digestif où elle se transforme en (L5) puis en adulte. Ces
adultes se localisent au niveau de la caillette (Haemonchus,
Trichostrongylus), de l'intestin grêle
(Trichostrongylus, Nématodirius, Cooperia) et
du gros intestin (Skrjabinema, Trichuris).
II.2.3.2.2. Evolution indirecte
Dans ce type d'évolution la larve effectue une
migration de grande amplitude dans l'hôte définitif. Dans la
famille des Ankylostomatidae, les genres Gaigeria et
Bunostomum suivent ce type d'évolution. L'infestation se fait
par voie buccale mais surtout par voie transcutanée. Les larves migrent
par voie sanguine et atteignent les poumons où elles se transforment en
larves (L4), celles-ci se déplacent en remontant dans la
trachée puis redescendent dans l'oesophage puis dans l'intestin
où elles se transforment en (L5) puis en adultes.
Dans la famille des Rhabditidae, le genre
Strongyloïdes suit un cycle presque identique. Mais ici, seules
les femelles parthénogénétiques sont présentes dans
l'intestin grêle et se localisent dans les galéries
creusées dans l'épithélium et la sous-muqueuse de la
région duodénale. Toutefois on note chez ce genre une
possibilité de lacto-transmission. En effet, au cours de l'infestation
d'une brebis, un certain nombre de (L3) peuvent être
stockées dans le tissu adipeux surtout en région
péri-mammaire et au moment de la mise-bas, ces larves sont
remobilisées et apparaissent dans le colostrum et dans le lait
(CHERMETTE, 1981). Chez les jeunes ainsi infestés, les migrations
larvaires sont de nouveau nécessaires.
Dans la famille des Trichostrongylidae
(Haemonchus spp. Trichostrongylus spp.), l'infestation se
fait toujours par voie buccale passive. Les migrations des larves sont de
faibles amplitudes et n'intéressent que la muqueuse digestive. La larve
(L4) une fois formée, regagne la lumière du tube
digestif où elle se transforme en ver adulte. Cette évolution
endogène dure en moyenne trois (3) semaines. La larve (L4)
peut arrêter son développement au niveau de la muqueuse
réalisant ainsi un phénomène d'hypobiose (BLITZ et al.,
1972 ; CHERMETTE, 1981 ; BUSSIERAS et col., 1995).
Dans la famille des Strongylidae (Oesophagostomum
spp.), une fois intégrées par leur hôte, les
larves infestantes gagnent l'intestin grêle et plus rarement le gros
intestin. Elles s'y enfoncent dans la sous-muqueuse. Il se forme aux points de
pénétration de petits kystes à paroi transparente
où se produit la mue de la (L3) en (L4). Ces
larves gagnent la lumière du gros intestin pour s'y transformer en
(L5) et en adultes. Le développement endogène
relativement court en saison de pluie, peut considérablement s'allonger
à la suite de réinfestation de fin d'hivernage (GRABER et
PERROTIN, 1983).
II.2.3.2.3. Arrêt du développement larvaire
Certains nématodes peuvent, lorsqu'ils sont au stade
larvaire (L4) ou (L5) dans l'appareil digestif ou
respiratoire de leur hôte subir, des arrêts de croissance plus ou
moins longs (BLITZ et GIBBS, 1972). Ce phénomène a
été décrit chez Ostertargia spp,
Nématodirus spp, Chabertia ovina, Haemonchus
contortus, Coopéria oncophora et Cooperia
pectinata.
Dans les régions sèches, ce
phénomène est bien marqué. Les populations de
nématodes adultes disparaissent et sont remplacées par des
populations de larves inhibées au stade (L4). Celles-ci
reprennent leur activité les derniers jours de la saison sèche ou
dès les premières pluies et se transforment en parasites adultes
(GRABER et PERROTIN, 1983).
L'étiologie exacte de l'inhibition des larves de
nématodes est obscure, mais des spéculations considérables
sur son mécanisme existent (BORGTEEDE et al., 1978). Les
phénomènes immunitaires dont les mécanismes ne sont pas
encore connus avec précision, peuvent intervenir pour moduler les
populations d'helminthes contribuant à assurer la
pérennité des infestations (CROLL et al., 1977). Ainsi les
nématodes du genre Oesophagostomum ont un cycle évolutif
particulier. Les facteurs climatiques et environnementaux peuvent être
plus importants. Il est en effet possible d'induire l'inhibition du
développement des larves (L4) en leur faisant subir diverses
conditions de stockage (dessiccation, chaleur...) avant de les inoculer aux
animaux susceptibles de les héberger ; ce qui démontre que
les conditions de l'environnement influencent le métabolisme des
étapes de la vie libre (CONNAN, 1971 ; OGUNSUSI et al., 1979).
L'action négative du climat est en quelque sorte
compensée par une réaction de défense des
nématodes. Il est intéressant de remarquer que dans les
régions humides, les larves infestantes survivent plus longtemps que
dans le milieu extérieur (GRABER et col., 1983). On constate
parallèlement que le phénomène d'hypobiose décrit
plus loin est beaucoup moins marqué.
Il semble évident que la dessiccation puisse être
le facteur déterminant dans l'hypobiose des Trichostrongylidae
et des Oesophagostomum spp (ALTAIF et al., 1983).
II.3. Epidémiolgie des
Nématodes
Au Sénégal l'épidémiologie des
Nématodes est principalement attribuée à la
présence de larves au pâturage pendant la saison pluvieuse. Il y a
suffisamment d'humidité à cette période pour le
développement des vers. Les petites infestations ont souvent lieu de
décembre à mai et sont quelquefois associées au
phénomène de self-cure et à l'absence de
réinfestation (VERCRUYSSE, 1983). Trichostrongylus,
Strongyloïdes, Haemonchus, Cooperia, Oesophagostomum, Nématodirus,
Gaigeria, Trichuris, Skrajabinema par ordre de prédominance ont
été retrouvés lors d'études faites au
Sénégal (BELOT et col., 1986).
Les strongyloses digestives sont les nématodoses les
plus graves. Elles sont dues à des strongles parasitant souvent en grand
nombre la caillette ou les intestins. La strongyloïdose est
également une affection très répandue. Comme les
strongyloses digestives, on la rencontre partout au Sénégal
surtout pendant la saison de pluies. En saison sèche (8 mois) il
subsiste des populations adultes et larvaires résiduelles (NDAO et col.,
1995).
Une tendance générale se dessine pour
l'évolution saisonnière de chaque parasite (BELOT et PANGUI,
1986). Le taux d'infestation augmente considérablement en hivernage
(Tableau II).
Tableau II : Taux d'infestation en fonction des
saisons.
|
Espèce parasite
|
Pourcentage d'infestation
|
|
Saison sèche
|
Hivernage
|
|
Haemonchus contortus
|
47
|
95
|
|
Trichostrongylus spp.
|
45
|
90
|
|
Oesophagostumum columbianum
|
20
|
95
|
|
Strongyloïdes papillosus
|
22
|
85
|
Source : VASSILIADES, 1981
L'intensité du parasitisme strongles-strongyloïdes
est en moyenne 8 fois plus élevée en hivernage qu'en saison
sèche surtout dans la moitié du nord Sénégal
zone soudanienne et sahélienne, là où les conditions
d'élevage sont particulièrement défavorables. Dans la
moitié sud une bonne alimentation assure aux animaux une certaine
capacité de résistance à l'agression parasitaire, en
dépit d'un taux de parasitisme élevé (VASSILADES,
1981).
En hivernage, en faveur de la température et de
l'humidité croissante, les helminthes se développent et de
nouvelles infestations se réalisent. Le taux de parasitisme
s'élève considérablement, provoquant de véritables
strongyloses digestives, notamment des cas d'oesophagostomose larvaire et de
strongyloïdose aiguë conduisant à la mort des animaux
affaiblis par une longue période de sécheresse et par
conséquent inaptes à résister à une agression
brutale (VASSILADES, 1981).
Il y a donc deux périodes critiques : l'une en fin
de saison sèche, du fait de l'extrême affaiblissement des
animaux ; l'autre beaucoup plus sévère en hivernage du fait
de la recrudescence du parasitisme digestif.
Quatre (4) genres important peuvent être suivis au cours
de l'année (Tableau III) : Haemonchus, Trichostrongylus,
Strongyloïdes et Oesophagostomum. D'après
RUMEAU-ROUQUETTE cité par BELOT et al., (1988), les variations
d'un animal à un autre au cours d'un même mois sont importantes et
les moyennes sont souvent faibles.
Tableau III : Variations mensuelles du nombre de
parasites récoltés chez les ovins (infestation
minimale-infestation maximale).
|
Mois
|
Haemonchus
|
Trichostrongylus
|
Strongyloïdes
|
Oesophagostumum
|
|
Janvier
|
0
|
16-1360
|
24-1065
|
0-2
|
|
Février
|
0
|
4-7590
|
0-130
|
0-77
|
|
Mars
|
0-11
|
60-850
|
0-1050
|
0-1
|
|
Avril
|
0-10
|
0-2650
|
0-40
|
0
|
|
Mai
|
0-28
|
189-1780
|
0-205
|
0-19
|
|
Juin
|
0-67
|
21-624
|
0-268
|
0-62
|
|
Juillet
|
0-75
|
72-517
|
34-335
|
0-32
|
|
Août
|
0-85
|
62-1434
|
15-320
|
0-20
|
|
Septembre
|
3-110
|
330-350
|
0-170
|
0
|
|
Octobre
|
8-119
|
170-2420
|
70-2210
|
0
|
|
Novembre
|
0-58
|
901-2440
|
30-218
|
0
|
|
Décembre
|
0-23
|
20-780
|
0-992
|
0-9
|
Source : BELOT et al. , 1988.
L'espèce Haemonchus contortus est prolifique
à un intervalle de génération et est capable de prendre
rapidement avantage des conditions environnementales favorables (GRANT, 1981).
Les lourdes infestations (2000-3000 vers adultes) sont communes à la
saison pluvieuse (NDAO et al., 1995). Le nombre moyen d'Haemonchus
contortus adultes compté dans le liquide de lavage de la caillette
de janvier à février était faible (moins de 5%) chez les
ovins (VERCRUYSSE, 1988).
Les larves d'Haemonchus représentaient 61%
à 90% de la charge totale de la caillette en saison sèche. Cela
confirme qu'Haemonchus contortus survit durant la saison sèche
comme larve hypobiotique dans la muqueuse abomasale des ovins. Chez les ovins
du sahel au Sénégal, il est constaté une forte proportion
de charge larvaire et un faible niveau de la population adulte durant la saison
sèche (VERCRUYSSE, 1984-1985).
L'humidité relative basse (11,7% à 50%) et les
fortes températures ne permettent pas la survie des larves infestantes
durant la saison sèche. L'arrêt du développement larvaire
et la non réinfestation des animaux expliquent la diminution du nombre
d'adultes (NDAO et al., 1995).
L'espèce Haemonchus contortus n'est
présente que de mars à décembre. Le taux d'infestation est
faible à nul en saison sèche mais il augmente rapidement en fin
de cette saison pour se maintenir à un niveau moyen pendant la saison
des pluies et jusqu'en décembre (BELOT et al., 1988).
La population parasitaire adulte croît dès la fin
de la saison sèche pour atteindre un maximum en saison de pluies et en
fin de celle-ci. La population larvaire suit une progression inverse et se
trouve élevée en saison sèche. Cette population
fléchit et disparaît dès le début de la saison des
pluies pour dépasser à nouveau le niveau de la population adulte
dès la saison sèche (BELOT et al., 1988).
L'espèce Trichostrongylus colubriformis
apparaît à la seconde moitié des pluies. Les moyennes
mensuelles de ce parasite atteignent un pic en septembre. En saison
sèche, la charge régresse progressivement et augmente
légèrement en novembre. L'augmentation de cette population
pourrait être due à la maturation brusque des larves
(L4). Par contre, la régression durant la saison sèche
pourrait être due à la mort des parasites âgés (NDAO
et al., 1995). Le genre Trichostrongylus est responsable des
pertes importantes de poids chez les ovins (SHUMARD et al., 1957). Il
existe dans les régions à climat tempéré et ne se
développe pas en saison pluvieuse et chaude (GRANT, 1981). Il persiste
pendant toute l'année et même durant une période importante
de la saison sèche. Un léger fléchissement de ce niveau se
remarque en début de saison de pluies en juillet, mais il remonte au
cours de la saison de pluies (août, septembre) et en début de
saison sèche (octobre, novembre). Le niveau de la population adulte de
Trichostrongylus est d'emblée plus élevée que
celle d'Haemonchus est restée assez constante au cours de toute
l'année. Dans tous les cas, la population adulte est plus importante que
la population larvaire qui est faible et inexistante en saison pluvieuse. Ces
larves augmentent en nombre rapidement au début de la saison
sèche et diminuent ensuite au cours de la progression de celle-ci (BELOT
et PANGUI, 1988).
La charge moyenne d'Oesophagostomum columbianum
atteint un maximum en septembre. Mis à part une poussée en
février, Oesophagostomum n'est rencontré qu'à
partir de la fin de la saison sèche (avril) et jusqu'à la fin de
la saison des pluies (septembre). L'importance de l'oesophagostomose larvaire
est évaluée en fonction du nombre de nodules par unité de
surface de la muqueuse de la fin de l'iléon, du cæcum et du colon.
Ces nodules, de 2 mm à 3 mm de diamètre sont très nombreux
tout au long de la saison sèche. Ils disparaissent très
rapidement dès l'apparition des premières pluies. La population
adulte suit une évolution inverse (NDAO, 1991).
La population la plus élevée de
Strongyloïsdes papillosus se retrouve en juin. Ce parasite suit
la même évolution saisonnière que Trichostrongylus,
mais à un degré d'infestation plus faible. On observe une
diminution du nombre de parasites au fur et à mesure que la saison
sèche évolue. Le niveau d'infestation augmente en saison
pluvieuse (BELOT et al., 1988).
Ces différences d'ordre de succession et de pic
d'incidence sont dues aux différences constantes de
fécondité et d'intervalle de génération des
espèces (FABIYI, 1973).
La charge moyenne en nématodes dans l'intestin
grêle, le cæcum, le colon et la caillette atteint un maximum en
août-septembre. Les moyennes mensuelles du nombre d'oeufs par gramme
(OPG) de fèces sont à un niveau bas de décembre à
avril (OPG<400). Les valeurs augmentent progressivement à partir de
mai pour atteindre un maximum en septembre (NDAO et al., 1995). La
fertilité des strongles est forte surtout en saison pluvieuse en raison
de la faible densité des femelles (BELOT et PANGUI, 1986).
L'évolution du nombre d'oeufs par nématode
montre une baisse en saison des pluies. En saison sèche ce nombre est
constant et plus élevé. D'après FARIZI cité par
BONFOH (1993), l'augmentation en fin de saison sèche pourrait être
liée à la dépression immunitaire observée en
général sur les animaux à cette période les
parasites produisant alors plus d'oeufs. La baisse de ce nombre d'oeufs
observée en saison pluvieuse est alors liée à un meilleur
état des animaux (BELOT et al., 1988).
Le taux d'infestation moyen est souvent faible en milieu
tropical, où les animaux sont souvent peu parasités et en
équilibre hôte-parasite, permettant une survie de l'animal dans
les meilleures conditions (GRETILLAT, 1981). Il existe des taux d'infestations
différents selon les pays (Tableau IV).
Tableau IV : Taux d'infestation trouvé
chez les ovins (en p. 100)
|
Espèce parasite
|
Localité
|
|
Nigeria
|
Sénégal
|
Tchad
|
|
Haemonchus contortus
|
40
|
94,82
|
50
|
|
Trichostrongylus spp.
|
40
|
93,10
|
0
|
|
Stongyloïdes spp.
|
0
|
10
|
17
|
|
Strongyloïdes papillosus
|
20
|
36,20
|
5
|
|
Gaigeria pachyscelis
|
2
|
12,06
|
0
|
|
Nematodirus spp.
|
0
|
0
|
0
|
|
Oesophagostumum columbianum
|
30
|
58,62
|
37
|
|
Trichonstrongylus globulosa
|
0
|
0
|
0
|
|
Skrajabinema ovis
|
1
|
0
|
37
|
Source : VONDOU,
1989.
Une humidité importante et des températures
élevées sont des facteurs favorables au développement des
nématodes sur les pâturages infestés. Donc en zone
sahélienne, la saison pluvieuse est la période idéale pour
l'évolution massive et rapide de ces parasites. En saison sèche,
cette évolution est ralentie, voire interrompue faute d'une
humidité suffisante dans le milieu extérieur. La survie sera
alors assurée par un développement plus long des larves dans les
muqueuses et par la contamination résiduelle des pâturages par les
oeufs qui selon KERBOEUF (1987), peuvent survivre plusieurs années dans
le milieu extérieur. Pendant cette saison sèche et en zone
tropicale, l'importance des populations adulte et larvaire est énorme,
d'autant plus que les animaux sont affaiblis par manque d'aliments. Les
facteurs importants qui influencent la production du nombre d'oeufs par
nématode (Trichostrongylus et Strongyloïdes) sont
la compétition alimentaire entre parasites et les
phénomènes immunitaires de l'hôte parasité.
II.4. Etude anatomoclinique des
Nématodoses gastro-intestinales
II.4.1. Symptomatologie
L'incubation dure en moyenne 4 à 5 semaines mais elle
peut varier selon l'importance de l'infestation.
- Syndrome lié à
l'anémie
Ce syndrome est essentiellement engendré par
Haemonchus spp et Gaigeria spp. Il s'exprime par une
perte d'appétit, une nonchalance, une adynamie, une pâleur
accusée des régions à peau fine. On note une diminution du
nombre d'hématies ; il s'agit d'une hématie hypochrome de type
microcytaire ou macrocytaire (BAKER et al., 1959).
- Syndrome lié à la
gastro-entérite
Ce syndrome est l'oeuvre des Trichostrongylidae autres que
Haemonchus spp. Aussi bien que Cooperia spp et
Oesophagostomum spp sont hématophages, la spoliation sanguine
dont ils sont responsables demeure peu élevée en comparaison
à leurs actions irritative et perturbatrice du processus digestif.
La gastro-entérite est essentiellement
caractérisée par de la diarrhée profuse et abondante. Son
aspect varie en fonction du parasite mis en cause : mucoïde,
jaunâtre et parfois striée de sang avec Strongyloides
spp ; séreuse, verdâtre, d'odeur nauséabonde
et en jet liquide avec Oesophagostomum spp. La diarrhée peut
également prendre une coloration noirâtre lorsqu'elle contient du
sang digéré. La diarrhée s'accompagne d'un état de
déshydratation très accusée. L'anémie
observée au cours de l'évolution du syndrome
gastro-entérique est donc une anémie de type normochrome et
normocytaire, contrairement à celle engendrée par Haemonchus
spp.
II.4.2. Lésions
II.4.2.1. Au niveau de la caillette
Le genre Haemonchus à l'état larvaire
exerce une action traumatique. L'extrémité antérieure de
la larve pénètre dans la muqueuse au niveau des glandes
gastriques, ce qui provoque une dilatation, une hypertrophie de la muqueuse et
entraîne la formation de petits points blancs en saillie à la
surface. Les larves histotrophiques occasionnent une gastrite aiguë
catarrhale ou hémorragique associée à une destruction de
glandes gastriques et une modification du pH de la caillette qui passe de 2,9
à 6,5 selon GRABER et PERROTIN (1983).
A l'état adulte, la pathogénicité de
Haemonchus est liée en grande partie à l'activité
hématophage du parasite. Les Haemonchus absorbent
également le phosphore, le calcium, le cobalt et le fer dont les
réserves dans le foie peuvent baisser de moitié.
Les Trichostrongylus spp s'enfoncent dans
l'épaisseur de la paroi digestive et exercent une action
mécanique et traumatique. Ceci est particulièrement marqué
avec T. axei qui occasionne une érosion de la muqueuse
abomasale (CHERMETTE, 1981), entraînant une inflammation de la caillette
et de l'intestin grêle. On observe une gastrite aiguë catarrhale
avec congestion exsudative, infiltration de la muqueuse par des monocytes et
des éosinophiles. Ces lésions peuvent être diffuses et sont
surtout marquées à la base des plis de la caillette (OSBORNE et
al.,1960).
Les Trichostrongylus entraînent une diminution
de la concentration en ions potassiques et une augmentation du pH de la
caillette (SHUMARD et al., 1957).
II.4.2.2. Au niveau de l'intestin grêle
Les parasites localisés dans l'intestin grêle
provoquent le plus souvent des lésions inflammatoires,
oedémateuses et exsudatives. Ce sont des entérites le plus
souvent chroniques. Le rôle le plus important revient aux
Gaigeria spp qui, au cours de la migration des larves (L4),
provoquent des foyers hémorragiques accompagnés d'une forte
congestion au niveau du duodénum. Les vers immatures et adultes se
fixent sur la muqueuse duodénale à l'aide de leur capsule
buccale. Ils sont hématophages et les quantités de sang
ponctionnées sont souvent importantes. Ils se déplacent et aux
points ou ils viennent de quitter, coulent de petites gouttes de sang (GRABER
et PERROTIN, 1983). Il en résulte une forte anémie qui se
manifeste même si le nombre de parasites recueillis à l'autopsie
est relativement peu élevé. En outre, la concentration
plasmatique en cuivre diminue.
Les Strongyloïdes entraînent des lésions
d'entérite aiguë qui peuvent être quelque fois
hémorragiques. Elles sont dues à l'action
térébrante des femelles parthénogénétiques
qui s'enfoncent dans l'épaisseur de l'épithélium. Il en
résulte des brèches servant de portes d'entrée à
diverses infections bactériennes ou autres comme les coccidies (DAVIS et
al., 1960).
II.4.2.3. Au niveau du gros intestin
Ici, les Oesophagostomum spp occupent la place la
plus importante. Les adultes ont une action pathogène
négligeable. Les larves (L4) par contre déterminent
des actions très caractéristiques (TRONCY et al., 1981).
Ces lésions sont provoquées par la pénétration des
larves dans la sous muqueuse cæcale où elles demeurent un temps
plus ou moins long. Les larves se développent comme de véritables
corps étrangers et la réaction de l'hôte se traduit par la
formation de nodules. Au début, les nodules sont de petite taille, leur
diamètre est inférieur à 1mm. Ils ne déforment pas
la muqueuse intestinale. Ils sont noirs et à la coupe on trouve une
larve dans un magma hémorragique (GRABER et RECEVEUR, 1958).
Après plusieurs semaines d'évolution, ils sont toujours noirs
mais leur diamètre atteint 2 à 3 mm et ils déforment la
muqueuse intestinale. A la coupe, on trouve une larve au sein d'un magma
blanchâtre. Les nodules très anciens sont
généralement percés au centre et ne contiennent
généralement plus de larves. Leur diamètre atteint 4
à 5 mm. Ils sont blanchâtres et contiennent un magma
caséeux. Ces lésions nodulaires s'abcèdent
fréquemment par suite de complications bactériennes (OSBORNE et
al., 1960).
Les adultes des nématodes du genre Trichuris
fixés dans le cæcum avec une grande partie de leur
extrémité antérieure enfoncée dans la muqueuse sont
hématophages. Les lésions siégeant surtout au sein du
cæcum sont celles d'une typhlite parfois hémorragique (BUSSIERAS
et CHERMETTE, 1995).
II.5. Pathogénie
La pathogénie est axée autour de quatre (4)
actions :
* l'action irritative résulte de la fixation des
scolex et des mouvements des vers ;
* l'action bactérifère est liée à
la présence de petits abcès ;
* l'action spoliatrice est à l'origine de
l'anémie observée ;
* l'action toxique résulte d'une résorption du
produit de désintégration des anneaux, ce qui expliquerait les
troubles nerveux.
II.6. Diagnostic
Sur l'animal vivant on retrouve les anneaux dans les
excréments. La possibilité d'observer des oeufs libres
trouvés par la coprologie (oeufs de Moniezia) est
envisagée. Les lésions et la présence des vers orientent
la suspicion.
II.7. Pronostic
Il est très variable et assez grave chez les jeunes
ovins en mauvais état.
II.8. Méthodes de
lutte
a) Traitement
|
RU CV
|
|
1) Cestodicides spécifiques
Niclosamide
+ +
|
|
2) Anthelminthiques polyvalents
a- Nématodicides
Fenendazole
+ +
Oxfendazole
+ (+)
Fébantel
+ +
Albendazole
+ (+)
Pamoate de pyrantel
+
b- Fasciolicides
Bithionol
#177;
Bithionoloxyde
#177;
|
|
3) Anciennes thérapeutiques
Sulfate de cuivre
#177;
Nicotine
#177;
Arséniate diplombique
#177;
|
Source : BUSSIERAS et
CHERMETTE, 1988
RU : Ruminants
CV : Cheval
Les principaux anthelminthiques utilisables dans le
téniasis des herbivores sont :
- Niclosamide : on administre 50 à 75 mg par Kg.
Elle est active sur Moniezia ;
- Benzimidazole : seuls certains sont actifs, il faut
augmenter un peu les posologies ;
- strongylicides (Fébendazole chez le mouton 10 mg par
Kg) ;
- Albendazole : il est actif sur Moniezia, mais
inactif sur Thysaniezia.
Les avermectines notamment l'ivermectine sont également
utilisées comme anthelminthiques mais ils sont inefficace sur les
cestodes (DORCHIES, 1991).
b) Prophylaxie
- Mesures offensives
Elles consistent à traiter les animaux et à la
destruction des oribatidés. Cette dernière option est
difficile.
- Mesures défensives
Elles consistent à recueillir les excréments
pendant les 2 ou 3 jours qui suivent le traitement et cela grâce au
maintien du troupeau dans les locaux.
L'élevage ovin occupe une place non
négligeable dans la vie socio-économique des populations
sénégalaises. Cet élevage est confronté outres les
problèmes d'alimentation, à des pathologies notamment celles
liées aux helminthes.
Ce
travail est entrepris dans le but de déterminer les espèces
responsable du parasitisme helminthique gastro-intestinal des moutons abattus
aux abattoirs de Dakar et les prévalences.
DEUXIEME
PARTIE :
ENQUETE SUR LE PARASITISME HELMINTHIQUE
GASTRO-INTESTINAL DES MOUTONS ABATTUS
AUX ABATTOIRS DE DAKAR
Chapitre I : MATERIEL ET
METHODES
I. Période et lieux de
l'enquête
L'enquête a été réalisée
pendant la période allant de Novembre à Décembre 2005. Le
travail s'est réalisé d'une part aux abattoirs de Dakar (plus
précisément à l'abattoir des ovins) où nous avons
prélevé les viscères des moutons abattus et d'autre part
au Laboratoire de Parasitologie de l'Ecole Inter-Etats des Sciences et de
Médecine Vétérinaires où ont été
effectués les examens coprologiques et les autopsies helminthologiques.
Les viscères ont été choisis au hasard lors de l'achat.
L'étude analytique a consisté à
évaluer qualitativement les oeufs d'helminthes contenus dans les
fécès d'une part et à identifier d'autre part la
population parasitaire dans les viscères.
II. Matériel et Méthodes
II.1. Autopsies
helminthologiques
II.1.1. Le matériel
II.1.1.1. Matériel biologique
Le choix des abattoirs de Dakar est lié au fait que les
animaux qui y sont abattus sont d'origines diverses. En effet, les moutons
abattus dans ces abattoirs proviennent aussi bien du nord du
Sénégal que du Mali et de la Mauritanie.
Nous avons travaillé sur un échantillon de cent
(100) tractus gastro-intestinaux de moutons abattus aux abattoirs de Dakar au
Sénégal.
II.1.1.2. Matériel de laboratoire
La réalisation de l'autopsie helminthologique et la
conservation des parasites ont nécessité matériel
suivant :
- une paire de ciseaux
- une pince mousse
- une série de cinq tamis de mailles
différentes (2 mm, 1 mm, 0,5 mm, 0,25 mm et 0,125 mm)
- un microscope photonique
- une loupe binoculaire
- l'alcool 70°
- une solution de formol 10%
- des lames et lamelles
- des pots de prélèvements pour conservation des
parasites
- Le lactophénol (acide
phénique : 1 g, acide lactique 1 cm, glycérine : 2 cm,
eau distillée : 1 cm)
II.1.2. Méthodes
II.1.2.1. Technique de l'autopsie helminthologique
L'autopsie helminthologique est faite le jour de l'achat des
boyaux de moutons pour éviter l'altération des parasites due
à la putréfaction.
Technique
L'ensemble du tractus gastro-intestinal a été
prélevé et acheminé au laboratoire pour l'autopsie
helminthologique. Le tractus gastro-intestinal est étalé et
observé sur toute sa longueur, les intestins complètement
déroulés, afin d'identifier les différentes portions.
Ainsi ont été isolées les différentes
portions : Rumen + réseau + feuillet, caillette, intestin
grêle (duodénum, jéjunum + iléon), gros intestin
(cæcum + côlon). Chacune des portions est examinée
séparément.
- Le rumen, le réticulum (réseau) et
l'omasum (feuillet)
Ils sont incisés longitudinalement et leur contenu est
rejeté. Ils sont rincés abondamment à l'eau du robinet. La
muqueuse de chaque portion est minutieusement examinée à l'oeil
nu puis à la loupe binoculaire. Le contenu de chaque portion est
également examiné. Les parasites trouvés ont
été récupérés et conservés dans du
formol à 10 %.
- la caillette
La caillette a été ouverte dans le sens de la
longueur au dessus de la série de tamis, puis l'organe est rincé
sous un mince filet d'eau en dépliant les plis de la muqueuse au dessus
du récipient. Un grattage de chaque pli est effectué toujours
sous un filet d'eau. Ensuite le contenu du récipient a été
versé au-dessus de la série de tamis. Les différentes
mailles ont été disposées par ordre décroissant, le
tamis à grosses mailles étant en haut. Le contenu de chaque tamis
est examiné à l'oeil nu, puis à la loupe binoculaire et
les parasites retrouvés sont récoltés à l'aide
d'une pince fine puis conservés dans des flacons contenant de
l'éthanol 70°.
- L'intestin grêle
L'intestin grêle a été
libéré de ses attaches mésentériques sur toute sa
longueur. Chaque portion est identifiée et isolée par une double
ligature. Elles sont ensuite séparées par section entre les
doubles ligatures. Le jéjunum, compte tenu de sa longueur, a
été découpé en cinq (5) portions dans le but de
faciliter son ouverture et l'examen de la muqueuse.
Ainsi, chaque portion de l'intestin (duodénum,
jéjunum, iléon) a été ouverte et le contenu
récupéré dans un seau. Cette opération a
été complétée par le rinçage et le grattage
soigneux de la muqueuse sous un mince filet d'eau afin de détacher les
parasites qui sont accrochés à la muqueuse. Les parasites encore
fixés sur la muqueuse sont récupérés à
l'aide d'une pince, après examen à l'oeil nu et à la loupe
binoculaire et conservés dans de l'alcool 70°. Les résidus
des tamis ont été versés dans un bac additionné
d'eau dans le but de la recherche des vers à partir des suspensions
homogénéisées du mélange. Cette recherche s'est
faite également à l'oeil nu, puis sous une loupe binoculaire. Les
parasites retrouvés ont été alors récoltés
et conservés dans de l'alcool 70° pour les nématodes et dans
une solution de formol à 10 % pour les cestodes.
- le cæcum et le côlon
Après ouverture sur toute la longueur, les contenus
digestifs ont été mis dans un seau, puis nous avons
procédé à un rinçage de la muqueuse. Le contenu du
seau a été versé au dessus de la série de tamis. La
recherche des parasites s'est effectuée comme ci-dessus. Nous avons
procédé également à la recherche des nodules
larvaires d'Oesophagostomum spp en hypobiose.
II.1.2.2. La conservation des
parasites
Après dénombrement, les parasites ont
été conservés dans des flacons renfermant une solution de
formol à 10% pour les cestodes et dans l'éthanol 70° pour
les nématodes. Sur chaque flacon ont été inscrits,
à l'aide d'un marqueur, le numéro d'ordre de l'animal, la date de
prélèvement, la portion dans laquelle le parasite a
été récolté. Les flacons sont hermétiquement
fermés afin d'éviter l'évaporation ou la perte du liquide
de conservation.
II.1.2.3. La préparation
et l'observation des parasites
- Nématodes
Les parasites sont sortis de l'éthanol et montés
entre lame et lamelle avec quelques gouttes de liquide
éclaircissant : le polyvinyl de lactophénol. La
préparation est ensuite observée au microscope photonique
après avoir passé 24 heures à la température
ambiante. Nous nous sommes servis de la micro règle du microscope pour
mesurer la taille des parasites.
- Cestodes
Les parasites sont au préalable éclaircis au
lactophénol entre lame et lamelle pendant 24 heures à la
température ambiante afin de bien observer les structures internes. Pour
cela les parasites sont sortis du formol et on prélève sur chaque
ver, trois portions différentes du corps (portion antérieure,
médiale et postérieure). Ces portions sont déposées
entre lame et lamelle avec quelques gouttes de liquide
éclaircissant : le polyvinyl lactophénol. Ensuite quelques
gouttes d'éclaircissant sont ajoutées sur les bords de la lamelle
pour que le parasite soit bien immergé. L'Observation est faite 24
heures ou 48 heures après. Les parasites ont été
mesurés à l'aide de la micro règle du microscope pour les
petits parasites et d'une règle graduée pour les grands
parasites.
II.1.2.4. Méthode d'analyse des résultats
L'analyse statistique des résultats a été
réalisée en calculant les taux d'animaux (T) infestés pour
les différentes espèces parasitaires suivant la formule :
Nombre d'animaux infestés
Nombre d'animaux examinés
T =
X 100.
II.2. Examen coproscopique
II.2.1. Matériel biologique
Le choix des abattoirs de Dakar est lié au fait que les
animaux qui y sont abattus sont d'origines diverses. En effet, les moutons
abattus dans ces abattoirs proviennent aussi bien du nord du
Sénégal que du Mali et de la Mauritanie.
L'analyse coproscopique uniquement qualitative a
porté sur cent (100) échantillons de matières
fécales prélevés dans le rectum des tractus digestifs de
moutons choisis au hasard.
II.2.2. Matériel de
laboratoire
Le matériel utilisé pour les examens
coprologiques comprend :
- des boîtes en plastiques ;
- un mortier muni d'un pilon ;
- des béchers, des tubes à centrifuger, des
pipettes Pasteur ;
- une balance ;
- un tamis (passoire à thé) ;
- des lames porte-objets et lamelles ;
- une centrifugeuse
- un microscope équipé d'un oculaire 4 et des
objectifs 10, 40 et 100 ;
- une solution sursaturée de chlorure de sodium (35% de
NaCl).
II.2.3. Méthodologie
II.2.3.1. Les prélèvements
Les tractus gastro-intestinaux sont achetés au niveau
de l'abattoir des ovins de Dakar. Ils ont ensuite été
immédiatement acheminés au laboratoire dans des sachets
plastiques le tout, conditionnés dans un seau munis d'un couvercle.
II.2.3.2. Méthode
d'analyse coproscopique qualitative
Deux (2) techniques de coproscopie qualitative ont
été utilisées lors de notre enquête : la
technique d'enrichissement par flottation et la technique de
sédimentation.
La technique d'enrichissement par
flottation
Le principe de cette technique, utilisée pour les oeufs
de nématodes qui sont peu lourds, consiste à diluer le
prélèvement dans une solution de densité
élevée (le liquide de flottation) afin de concentrer les
éléments parasitaires, de densité inférieure,
à la surface du liquide.
L'opération a consisté donc à
prélever 5 g de matières fécales, à les triturer
dans le mortier. Ensuite elles ont été diluées et
homogénéisées dans un ver à pied gradué dans
70ml d'une solution sursaturée de chlorure de sodium. Le mélange,
après tamisage à l'aide d'une passoire à thé, a
été versé dans les tubes à essai jusqu'à
obtention d'un ménisque supérieur convexe. Une lamelle a
été ensuite déposée délicatement sur chaque
tube et laissé au repos pendant 20 à 30 minutes. La lamelle a
été ensuite récupérée à l'aide d'une
pince et déposée délicatement sur une lame porte-objet.
L'observation des oeufs a été faite au microscope photonique aux
l'objectifs 4, 10 et 40.
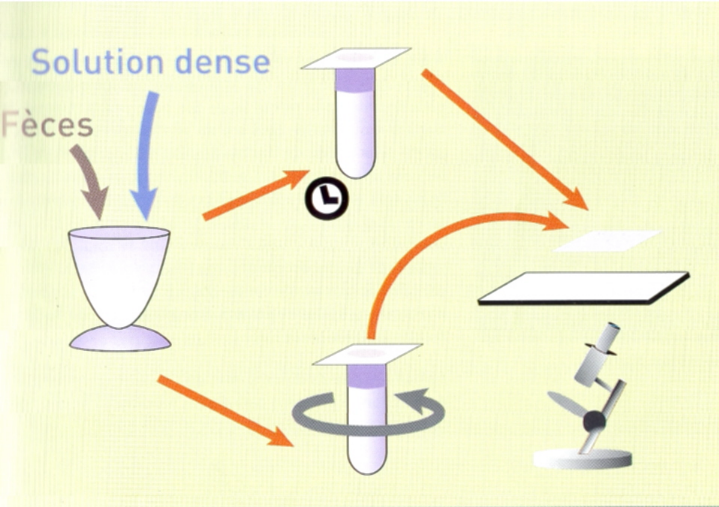
La technique de sédimentation
Le principe de cette méthode est de diluer le
prélèvement dans une solution aqueuse de densité faible
afin de concentrer les éléments parasitaires, de densité
supérieure, dans le culot du tube à essai. Cette technique permet
d'obtenir des oeufs de toutes les espèces de parasites, en particulier
les oeufs de Trématodes qui sont de grande taille.
Cette technique a consisté donc à
prélever cinq (5) grammes de matières fécales puis
à les diluer dans 10 volumes dans un verre à pied. Après
homogénéisation, le mélange est tamisé à
l'aide d'une passoire à thé, puis centrifugé pendant 5
minutes à 2000 trs/mn pendant 5 minutes. Après avoir
rejeté le surnageant, quelques gouttes du culot sont observées au
microscope photonique, entre lame et lamelle, aux grossissements 4 et 10.
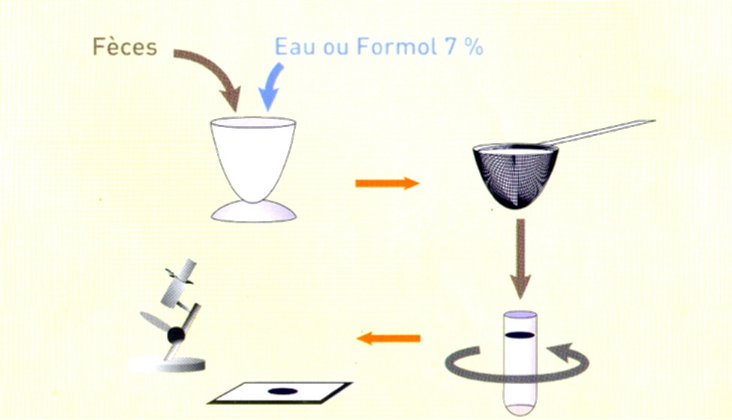
II.2.3. Identification des
oeufs
L'identification des oeufs a été faite
conformément aux caractères décrits par KAUFMANN (1996) et
EUZEBY (1982).
II.2.4. Méthode d'analyse des résultats
L'analyse statistique des résultats a été
réalisée en calculant les taux d'animaux (T) infestés pour
les différents types d'oeufs suivant la formule :
Nombre d'animaux infestés
Nombre d'animaux examinés
T =
X 100
Chapitre II : RESULTATS ET DISCUSSION
I. Résultats
I.1. Les autopsies helminthologiques
I.1.1. Taux d'infestation
Les autopsies helminthologiques nous ont permis d'isoler de
nombreuses espèces de parasites, aussi bien les Nématodes que les
Cestodes et les Trématodes. Les résultats obtenus montrent que
sur 100 moutons dont les tractus digestifs ont été
examinés, 96 étaient porteurs d'helminthes soit un taux
d'infestation de 96% (annexe 1). Les pourcentages d'infestation helminthique en
fonction des groupes sont consignés dans la figure
1.
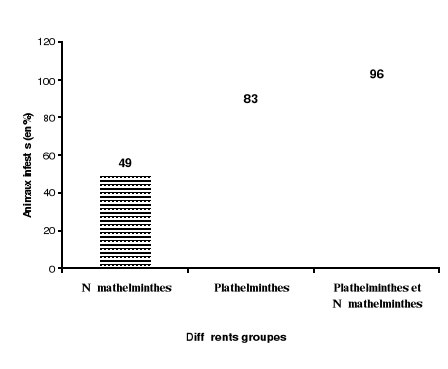 Figure 1 : Les taux d'infestation des animaux en fonction
des différents groupes Figure 1 : Les taux d'infestation des animaux en fonction
des différents groupes
I.1.2. Taux d'infestation global en fonction des portions du
tractus digestif
Les vers ont été rencontrés dans les
portions du tube digestif (Rumen, caillette, intestin grêle et gros
intestin) et à des taux différents (annexe 2). Le feuillet, le
réseau et le duodenum n'ont révélé la
présence d'aucun parasite au cours de notre étude.
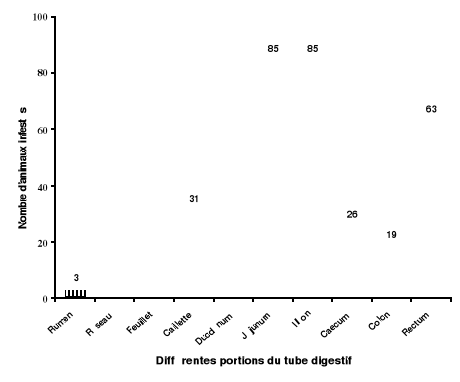
Figure 2 : Nombre d'animaux infestés en
fonction des différentes portions du tractus digestif
Les portions les plus parasitées sont le
jéjunum, l'iléon et le rectum avec respectivement 85 % pour le
deux (2) premiers et 63 %. Le réseau et le feuillet ont
été indemnes d'infestation chez tous les animaux examinés
(figure2).
I.1.3. Taux d'infestation
Les taux d'infestation des animaux en fonction des
différentes espèces parasites sont mentionnés dans la
figure 3.
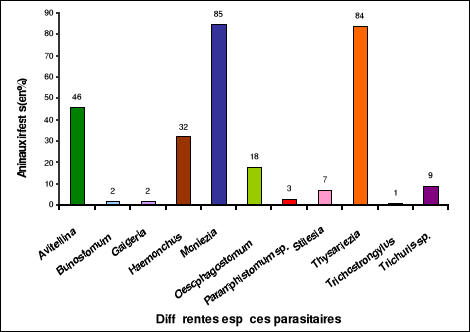
Figure 3: Nombre d'animaux infestés en
fonction des différentes espèces parasitaires
Parmi les animaux examinés, Moniezia et
Thysaniezia ont les taux d'infestation les plus élevées
avec respectivement 85% et 84%. Par contre, peu de moutons étaient
infestés par Trichuris ovis et Trichuris globulosa (9%),
Stilesia(7%), Paramphistomum (3 %), Bunostomum
(2%), Gaigeria(2%) et Trichostrongylus (1%).
Pour Avitellina, Haemonchus et Oesophagostomum,
l'infestation a été moyenne avec respectivement des taux de 46%,
32% et 18% (annexe 4). Quatre vingt dix pour cent (90 %) des animaux sont
porteurs de larves d' Oesophagostomum columbianum en hypobiose.
I.2. Description des helminthes
rencontrés
I.2.1. Les Plathelminthes
Cinq (5) plathelminthes dont un (1) dans le rumen et quatre
(4) dans l'intestin grêle ont été observés et
identifiés.
I.2.1.1. Au niveau du rumen
Paramphistomum sp.
Les vers adultes récoltés ont un corps
épais, de forme conique. La ventouse est en position ventrale,
très développée et reportée à
l'extrémité postérieure du corps.
Ces parasites mesurent en moyenne 9 mm de long sur 4 mm de
diamètre. Leur coloration est rouge claire. Ils sont piriformes.
I.2.1.2. Au niveau de l'intestin
grêle
Les parasites rencontrés dans cette portion de
l'intestin se retrouvent tous aussi bien au niveau du jéjunum que de
l'iléon.
I.2.1.2.1. Moniezia expansa
Ces parasites récoltés ont en moyenne 4 m de
long sur une largeur maximale de 15 mm. Le scolex est petit et porte 4
ventouses saillantes. Les segments sont toujours beaucoup plus larges que
longs. Les segments mûrs ont été observés avec deux
ovaires en fer de cheval, deux glandes vitellogènes, de nombreux
testicules, deux pores génitaux, une rangée de glandes
interproglotidiennes sur le bord postérieur de chaque segment. Dans
chaque segment ovigère un utérus réticulé a
été observé.
I.2.1.2.2. Stilesia globipunctata
Les vers observés mesurent en moyenne 5 cm de long, sur
une largeur maximale de 3 mm. Ces vers ont une segmentation externe peu
visible et ils sont frisés. Chaque segment ovigère renferme deux
(2) organes parutérins.
I.2.1.2.3. Avitellina centripunctata
Les vers observés mesurent en moyenne 2 m de long sur 3
mm de large. Ils possèdent un scolex volumineux et la segmentation
externe est peu visible. La portion ovigère est cylindrique et renferme
un seul organe parutérin.
I.2.1.2.4. Thysaniezia ovilla
Les vers observés mesurent en moyenne 3 m de long sur
une largeur maximale de 12 mm. Les segments mûrs renferment des pores
génitaux irrégulièrement alternes. L'utérus est
transversal, sinueux et les testicules sont latéraux. Chaque segment
ovigère renferme de très nombreux organes parutérins.
I.2.2. Les
némathelminthes
I.2.2.1.Au niveau de la
caillette
Haemonchus contortus
Les vers adultes récoltés ont été
observés à la loupe et au microscope photonique.
Les vers adultes que nous avons récoltés sont filiformes
en général et de couleur rouge. Leur taille varie en fonction du
sexe. Les mâles mesurent environ 18 mm tandis que la longueur des
femelles est en moyenne de 27 mm.
a) Le mâle
Il présente dans sa région antérieure, au
niveau cervical, une paire de papilles cervicales déirides
situées latéralement et de façon symétrique sur le
corps. La bouche s'ouvre à l'extrémité du corps en
position terminale. L'orifice buccal est suivi d'une petite cavité dans
laquelle se projette une dent oesophagienne dorsale. A cette capsule buccale
rudimentaire, fait suite un oesophage cylindrique de type musculaire sans
bulbe. L'intestin fait suite à l'oesophage.
L'extrémité postérieure présente
trois (3) lobes : deux (2) grands lobes latéraux et un petit lobe
dorsal asymétrique. L'ensemble porte le nom de bourse caudale ou bourse
copulatrice. Le petit lobe dorsal est soutenu par une côte (raie) en Y
renversé. On note également deux (2) spicules égaux de
longueur moyenne de 0,5 mm portant chacun un bouton terminal et une dent
subterminale. Le gubernaculum est présent.
b) La femelle
Elle présente une région antérieure
identique à celle du mâle. La région moyenne contient
l'intestin de couleur rouge entouré de deux (2) cordons blancs
spiralés. Ce sont des cordons génitaux. Au niveau du milieu du
corps et sur la face ventrale, on observe une boursouflure cuticulaire
linguiforme recouvrant plus ou moins l'orifice vulvaire : c'est la
languette supra-vulvaire. Cet élément est encore appelé
clapet vulvaire. A ce niveau, on remarque par transparence la structure
caractéristique de l'ovéjecteur.
L'extrémité postérieur va en s'effilant
progressivement pour se terminer en pointe. Elle se porte dans l'anus
situé sur la face ventrale à environ 0,75 mm de
l'extrémité distale.
I.2.2.2. Au niveau de l'intestin
grêle
Les parasites rencontrés dans cette portion de
l'intestin se retrouvent tous aussi bien au niveau du jéjunum que de
l'iléon.
I.2.2.2.1.Trichostrongylus colubriformis
Ces vers sont très fins. La femelle mesure en moyenne 6
mm de long tandis que le mâle a environ en moyenne 5 mm de long.
a) Le mâle
La région antérieure porte la bouche qui s'ouvre
à l'extrémité terminale. Cette bouche est suivie d'un
oesophage cylindrique de type musculaire à bulbe très
réduit. Sur la face ventrale, à la hauteur de l'oesophage, se
trouve une dépression de la cuticule indiquant la zone où
s'ouvre le pore excréteur. A ce niveau, la face dorsale est
légèrement bombée. Il n'y a pas de capsule buccale.
La région moyenne contient l'intestin.
L'extrémité postérieure porte une bourse
caudale bien développée avec deux (2) grands lobes
latéraux et un lobe dorsal réduit. Ces lobes sont soutenus par
des côtes. Les spicules égaux (0,2 mm chacun) et le gubernaculum
(0 ,1 mm) sont courts et de couleur brune. L'extrémité
proximale des spicules porte un petit renflement et la pièce
intermédiaire présente une échancrure tandis que la partie
distale forme un appendice triangulaire. Le gubernaculum est fusiforme et
constant.
b) La femelle
La région antérieure présente les
mêmes caractéristiques que celle du mâle. La région
moyenne contient l'intestin. Au milieu du corps, se trouve l'orifice vulvaire
en position ventrale. Cet orifice est précédé des deux
ovéjecteurs et de deux utérus opposés. Un tel appareil est
dit amphidelphe (EUZEBY, 1969 ; SOULSBY, 1968). Les utérus portent
des oeufs dont les plus évolués se trouvent aux portes des
ovéjecteurs.
L'extrémité postérieure se termine en
pointe et porte l'anus situé à environ 0,1 mm de
l'extrémité distale.
I.2.2.2.2. Gaigeria pachyscelis
Observation en microscope photonique et à la
loupe.
a) le mâle
L'extrémité antérieure, recourbée
sur sa face dorsale porte une capsule buccale globuleuse peu profonde à
ouverture large et ovalaire. A l'intérieur de la cavité buccale,
existent deux (2) dents subventrales pointues. Un oesophage musculaire fait
suite à cette cavité où réside un cône
dorsal. A environ 0 ,9 mm de l'extrémité antérieure,
on a une paire de papilles cervicales latérales. La région
moyenne est dominée par l'intestin. La région postérieure
porte une bourse caudale moyenne soutenue par des côtes. Le lobe dorsal
est toujours plus grand tandis que les lobes latéraux de petite taille
qui se rejoignent ventralement. On observe également deux (2) spicules
égaux mesurant chacun 1 mm de long en moyenne. Le gubernaculum est
présent. Le mâle mesure en moyenne 17 mm de long.
b) la femelle
L'extrémité antérieure présente
les mêmes caractéristiques que chez le mâle. Dans la
région moyenne, se trouvent l'intestin et l'utérus rempli
d'oeufs. La vulve s'ouvre ventralement au milieu du corps. La femelle de grande
taille mesure en moyenne 28 mm.
I.2.2.2.3. Bunostomum trigonocephalum
Observation au microscope
photonique
Ce parasite ressemble beaucoup à Gaigeria. En
effet, il présente à peu près les mêmes
caractéristiques. Cependant, il existe quelques caractères
différentiels :
- le parasite est plus court. Le mâle mesure en moyenne
14 mm de long. Quant à la femelle elle mesure en moyenne 15 mm de
long ;
- l'extrémité antérieure montre la
cavité buccale globuleuse mais plus profonde ;
- il n'y a pas de papilles cervicales ;
- le lobe dorsal de la bourse caudale du mâle est
asymétrique et réduit par rapport aux deux lobes latéraux
beaucoup plus développés ;
- il n'y a pas de tubercule sur chaque lancette subventrale de
la capsule.
I.2.2.3. Au niveau du gros
intestin
I.2.2.3.1. Oesophagostomum columbianum
Ce parasite a été rencontré dans le colon
lors de notre étude.
Observation au microscope photonique et à la
loupe
Ces vers sont blanchâtres. Les mâles mesurent en
moyenne 16 mm de long, tandis que les femelles 17 mm. Ces nématodes ont
un diamètre moyen de 5 mm.
a) le mâle
La région antérieure présente une capsule
buccale peu profonde qui s'ouvre en position terminale. Cet orifice buccal
porte à son bord, de petits éléments foliacés
à disposition radiaire, connus sous le nom de coronule. On distingue
une coronule externe et une coronule interne. Cette région
antérieure porte un bourrelet péristomique limité par un
sillon et qui forme une sorte de cône au niveau du bout apical du ver. Il
existe une dilatation cuticulaire antérieure appelée
vésicule céphalique limitée par une rainure
latéro-ventrale qui sépare l'extrémité
antérieure du reste du corps. Cette rainure porte le nom de sillon
cervical ou sillon ventral. Immédiatement en arrière de ce sillon
ventral, partent deux (2) expansions cuticulaires aliformes latérales.
Ce sont les ailes latérales. Notons que le sillon se situe à 0,5
mm environ de l'extrémité apicale. On note également une
paire de papilles cervicales situées latéralement de façon
symétrique à 0,5 mm du bout apical. A la bouche, fait suite un
oesophage musculaire cylindrique qui présente à sa partie
postérieure une boursouflure connue sous le nom de bulbe. La jonction
oesophago-intestinale est nette. Cet intestin est un tube rectiligne. La
région moyenne renferme l'intestin.
L'extrémité postérieure présente
un développement cuticulaire en forme d'entonnoir appelé bourse
caudale ou bourse copulatrice soutenue par plusieurs côtes ou raies.
Cette bourse caudale mesure environ 1 mm de long et qui débouchent dans
le cloaque. Le gubernaculum est présent.
b) la femelle
La région antérieure présente les
mêmes caractères morphologiques. La région moyenne renferme
l'intestin et est largement occupée par l'utérus rempli d'oeufs.
L'extrémité postérieure est effilée. Elle porte
l'anus et la vulve sur la face ventrale. La vulve est située à 1
mm de l'anus qui est situé à 0,5mm de l'extrémité
distale. L'orifice vulvaire est précédé d'un vagin et d'un
ovéjecteur caractéristique donnant l'aspect de 3 anneaux
disposés bout à bout.
I.2.2.3.2. Trichuris globulosa et Trichuris ovis
Observation au microscope photonique et à la
loupe
Ces parasites présentent aussi bien chez les
mâles que chez les femelles, une partie amincie très longue et une
partie postérieure plus large et courte.
L'extrémité de la partie antérieure
présente chez Trichuris globulosa, une paire d'ailes cervicales
latérales. Chez Trichuris ovis, l'extrémité
apicale porte plutôt deux (2) petits lobes cuticulaires. La partie
antérieure montre également un oesophage qui est un tube
capillaire formé de colonnes de cellules superposées
appelées stichocytes. Cet oesophage très mince occupe toute la
portion antérieure.
La partie postérieure présente des
différentes morphologiques chez le mâle et la femelle. Mais dans
les deux (2) sexes elle renferme l'intestin.
a) le mâle
L'extrémité postérieure est
généralement enroulée en crosse. Elle est terminée
par une gaine spiculaire dans laquelle se rétracte un seul spicule
long. Cette gaine, moins large et tubulaire est parcourue par de nombreuses
épines.
Chez Trichuris globulosa, la gaine spiculaire est
formée de deux (2) parties : une partie tubulaire longue qui se
termine par une boursouflure. Au niveau de la boursouflure, les
éléments épineux portés par la gaine sont plus
longs et plus espacés. Chez T. ovis, la gaine spiculaire n'est
formée que de la partie tubulaire.
a) la femelle
La partie postérieure, plus large est arrondie à
son bout terminal. Elle est légèrement recourbée sur la
face ventrale. Dans la zone de jonction avec la partie antérieure se
trouve l'orifice vulvaire. En plus de l'intestin, cette partie
postérieure renferme l'utérus bourré d'oeufs. L'anus se
situe en position terminale. Les caractères ainsi décrits chez la
femelle, sont identiques chez les deux (2) espèces.
I.3. Résultats
généraux des examens coprologiques
I.3.1. Les différents taux d'infestation
Parmi les tractus digestifs examinés 63 se sont
révélés positifs aux oeufs d'helminthes, soit un taux de
parasitisme de 63%. Les différents taux d'infestation sont
mentionnés dans la figure 4.
Les oeufs de parasites suivant ont été
identifiés :
- les Trématodes : Paramphistomum sp
- les Cestodes : Monniezia
- les Nématodes : Strongyloïdes et
Strongles (annexe 3).
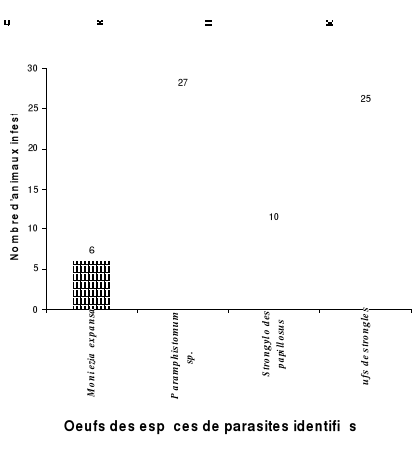
Figure 4 : Taux d'infestation des animaux en
fonction des oeufs des espèces de parasites
identifiés.
I.3.2. Description des oeufs d'helminthes
rencontrés
Lors
de notre étude, les techniques de coproscopie qualitative
utilisées nous ont permis d'identifier les oeufs de cinq (5)
espèces d'helminthes : Moniezia, Paramphistomum,
Strongyloïdes et de strongles.
I.3.2.1. Les oeufs de Moniezia expansa
L'oeuf
est de taille moyenne avec une forme triangulaire. Sa paroi est épaisse
et lisse. L'oeuf contient un embryon hexacanthe nettement visible situé
dans un appareil piriforme.
I.3.2.2. Les oeufs de Paramphistomum sp
Les
oeufs sont ovoïdes, de grande taille, operculés à un
pôle et à coque lisse. Les oeufs contiennent chacun un syncitium
vert pâle, non homogène et présentant des
« mottes » occupant tout l'oeuf.
I.3.2.3. Les oeufs de « strongles »
Ces
oeufs ont la coque mince et sont incomplètement emplis par une morula.
Le terme « strongle » désigne l'ensemble
constitué par les nématodes de l'ordre des Strongylidea.
La
présence d'oeufs de strongles se rapporte à la diversité
des nématodes adultes Strongylidea que nous avons rencontrés lors
des séances d'autopsie. Cependant, le caractère de ces oeufs ne
permet pas d'identifier à partir de ces derniers, les vers
caractéristiques.
I.3.2.4. Les oeufs de Strongyloides papillosus
Ils
sont embryonnés ou contiennent une larve pas toujours nettement visible
et recouverts par une coque mince. Les oeufs de Stongyloides
papillosus ont été facilement reconnus par leur aspect et
par leur taille. Les oeufs sont de petite taille, quadrangulaire, à
bords parallèles à coque mince et de coloration claire. L'embryon
que contient l'oeuf de Strongyloides sp continue de bouger à
l'intérieur de la coque au cours des examens coproscopiques.
II. Discussion
II.1. Autopsies
helminthologiques
II.1.1. Taux d'infestation
Les résultats montrent que 96% des moutons abattus aux
abattoirs de Dakar sont infestés d'helminthes pour la période
allant de Novembre à Décembre.
Les associations parasitaires sont fréquentes, ce qui
explique une disproportion par excès lorsqu'on se rapporte aux
compartiments gastro-intestinaux infestés.
Les formes nodulaires larvaires en hypobiose
d'Oesophagostumum columbianum ont une prévalence
élevée (90%) et ceci se rapproche des observation faites par
VASSILIADES (1975) chez les moutons au Sénégal et par SALIFOU
(1996) chez les moutons du Sud du Bénin. Selon ces observations,
l'oesophagostomose nodulaire représente l'affection la plus
fréquemment rencontrée aux abattoirs de Dakar.
Nos résultats montrent que les taux d'infestation les
plus élevés concernent :
- pour les Plathelminthes : Moniezia (85 %),
Thysaniezia (84 %) et Avitellina (46 %). Les résultats
sur Moniezia sont conformes à ceux observés par NDAO et
al., (1995) qui ont réalisé une enquête
épidémiologique des helminthoses des petits ruminants dans la
zone sylvo-pastorale du Sénégal. Nous n'avons pas pu avoir des
informations sur les autres parasites faute d'études spécifiques
déjà faites à propos. Les études déjà
réalisées sur le parasitisme gastro-intestinal au
Sénégal ne signalent pas la présence de Stilesia
qui a été trouvé lors de notre étude ;
Paramphistomum sp. est le seul trématode qui a
été trouvé lors de notre étude et les
données que nous avons trouvées chez ce dernier sont
inférieures de moitié à ceux trouvées par NDAO et
al., ( 1995 ) ;
- pour les Némathelminthes : Haemonchus
contortus (32 %) et Oesophagostomum columbianum (18 %). Ce
résultat se rapproche de ceux obtenus par VONDOU (1989) qui a
travaillé sur les nématodes gastro-intestinaux des petits
ruminants du Cameroun Septentrionale. Nos résultats sont
également proches de ceux de BONFOH et col. (1995) sur
l'épidémiologie des nématodes gastro-intestinaux chez les
petits ruminants dans la région des plateaux au Togo et de BASTIAENSEN
et al. (2003) sur le parasitisme de petits ruminants dans la zone
périurbaine de Sokodé au Togo.
Les résultats obtenus peuvent s'expliquer de plusieurs
manières :
- les prévalences chez Moniezia sont plus
élevées que celles des autres parasites. Au Sénégal
généralement les éleveurs déparasitent les animaux
en fin de saison de pluies. La molécule qui est couramment
utilisée au Sénégal est l'Ivermectine. Or certaines
études ont montré que cette molécule détruit la
majorité des helminthes au profit de Moniezia (DORCHIES, 1991).
Ces données élevées seraient donc dues à cette
sélection et non à une infestation massive par les
Moniezia ;
- les nombreux nodules larvaires en hypobiose
d'Oesophagostomum sont liés à la saison. En effet, en
saison sèche le pâturage se fait rare et les animaux sont moins
bien nourris qu'en saison de pluies ce qui diminuent considérablement la
charge parasitaire adultes et les larves présentes ne pouvant continuer
leur évolution elles sont alors emprisonnées dans la muqueuse du
gros intestin (TEMBELY et col., 1985)
- les conditions climatiques et la faible quantité
d'aliment expliqueraient le pourcentage assez faible des
nématodes ;
- le polyparasitisme explique que certaines portions soient
plus parasitées que d'autres.
- Les oeufs de Moniezia confirment la présence
des vers adultes trouvés lors de l'autopsie helminthologique.
II.1.2. Description des helminthes rencontrés
II.1.2.1. Les plathelminthes
II.1.2.1.1. Les plathelminthes rencontrés dans le
rumen
Paramphistomum sp.
L'identification que nous avons faite de ce parasite se
rapproche de celle faite par EUZEBY (1982) et KAUFFMAN (1996).
II.1.2.1.2. Les plathelminthes rencontrés dans
l'intestin grêle
Moniezia expansa
Les caractères décrits chez ce parasite se
rapprochent de ceux décrits par EUZEBY, (1982) et KAUFFMAN (1996).
Avitellina, Thysaniezia et Stilesia.
Aucune étude au Sénégal n'a
révélé la présence de ces parasites auparavant. Les
caractères décrits chez eux se raprochent de ceux décrits par KAUFFMANN (1996).
II.1.2.2. Les némathelminthes
II.1.2.2.1. Les némathelminthes rencontrés dans
la caillette : Haemonchus contortus
Les observations faites en microscopie photonique et à
la loupe nous ont permis de mettre en évidence chez cette espèce
les caractères de diagnose déjà décrits par :
DUNN (1978) ; GRABER et PERROTIN (1983).
Nous avons pu observé au microscope la languette
supra-vulvaire et l'ovéjecteur ont à peu près les
mêmes aspects que ce qui a été observé et
décrit par FUKUMOTO (1986) chez Obeliscoides pentagali qui est
un nématode Trichostrongylidae qui vit dans l'estomac du lapin.
Cependant chez cette espèce, le lobe dorsal de la bourse caudale est
plutôt symétrique et les spicules sont généralement
plus longs.
II.1.2.2.2. Les némathelminthes rencontrés dans
l'intestin grêle
a) Trichostrongylus colubriformis
Les caractères observés en microscope photonique
chez cette espèce se rapprochent de ceux décrits par :
BONFOH (1994) et SALIFOU (1996).
b) Gaigeria
pachyscelis
Les observations faites chez cette espèce se
rapprochent des éléments de diagnose fournis par SOULSBY (1968)
et PISSANG (1994). PISSANG (1994 ), en étudiant cette espèce chez
les ovins au Sénégal n'avait pas pu mettre en évidence la
présence d'un petit tubercule sur chaque dent sub-ventrale au fond de la
cavité buccale, ce que nous avons pu observer. Or pour plusieurs auteurs
SOULSBY (1968) et SALIFOU (1996) ; c'est l'un des caractères qui
distinguent Gaigeria pachyscelis de Bunostomum trigonocephalum
que nous avons rencontrés dans le jéjunum et dans
l'iléon des ovins. Les études faites par BASTIAENSEN et coll.
(2003) n'ont pas révélé la présence de ce parasite.
b) Bunostomum trigonocephalum
L'extrémité antérieure de ce parasite
montrant la cavité buccale globuleuse mais plus profonde a
été décrite également par EUZEBY (1982) mais les
autres caractères n'ont pas été décrits par cet
auteur. SALIFOU (1996) a également trouvé les mêmes
caractères que ceux décrits lors de notre étude.
II.1.2.2.3. Némathelminthes rencontrés dans le
gros intestin
a) Oesophagostomum columbianum
Cette espèce, récoltée au niveau du colon
et du cæcum, a été reconnue grâce aux
caractères morphologiques observés et qui se rapprochent à
ceux décrits par SOULSBY (1968).
b) Trichuris globulosa et Trichuris
ovis
Ces deux espèces ont été
rencontrées dans le cæcum des animaux.
EUZEBY (1963) avait considéré l'aspect de la
gaine spiculaire comme étant l'un des éléments de diagnose
de Trichuris spp. Pour SOULSBY (1968), les caractères
distinctifs entre Trichuris globulosa et Trichuris ovis, sont
la longueur du parasite et la forme de la gaine spiculaire. Les
caractères distinctifs ont été trouvés au cours de
notre étude et se rapprochent de ceux décrits par KAUFMANN,
(1996).
II.2. Examens coprologiques
II.2.1. Taux d'infestation
Le
nombre d'animaux porteurs d'oeufs d'helminthes est inférieur au nombre
d'autopsies helminthologiques révélées positives. Cette
constatation se comprend facilement dans la mesure où un animal peut
n'héberger que des vers mâles ou mêmes des adultes n'ayant
pas atteint leur maturité sexuelle ou encore des vers dont les femelles
sont dans les conditions d'inhibition de ponte (immunisées). C'est l'une
des preuves qui montre que l'émission des oeufs n'a pas toujours de
rapport avec la population de vers hébergés.
De
plus, la prolificité des femelles de Nématodes varie selon les
espèces.
II.2.2. Description des oeufs d'helminthes
rencontrés
II.2.2.1. Moniezia expansa
Le
contour triangulaire et la taille trouvés lors de notre étude ont
été décrits aussi par KAUFMANN (1996).
II.2.2.2. Paramphistomum sp.
La
forme ovoïde et la présence d'un syncitium dans l'oeuf ont
été également décrites par EUZEBY (1982) et
KAUFMANN (1996).
II.2.2.3. OEufs de strongle
Nous
avons retrouvés beaucoup d'oeufs de strongles lors de cette
étude. Ces oeufs proviennent des strongles retrouvés lors de
l'autopsie helminthologique à savoir : Trichostrongylus
colubriformis, Bunostomum trigonocephalum, Gaigeria
pachyscelis et OEsophagostomum columbianum.
Les
caractères décrits pour ces oeufs, lors de notre étude se
rapprochent de ceux décrits par EUZEBY, (1982) et KAUFMANN (1996).
II.2.2.4. Strongyloides papillosus
Les
caractères décrits pour cet oeuf, lors de notre étude se
rapprochent de ceux décrits par KAUFMANN, (1996).
CONCLUSION GENERALE
Les
petits ruminants en Afrique tropicale et au Sénégal
particulièrement souffrent d'un polyparasitisme endémique. Le
Sénégal étant un pays d'élevage, ce polyparasitisme
constitue un frein à l'élevage ; d'où la
nécessité d'en mesurer l'ampleur afin d'y apporter les solutions
adéquates.
Notre
étude a révélé que 96% des moutons abattus aux
abattoirs de Dakar sont infestés par les helminthes. La
prévalence, pour les plathelminthes qui sont les plus nombreux est de
83%, pour les némathelminthes elle s'élève à 49% et
les oeufs appartenant aux deux (2) groupes à 63%. Au total cinq (5)
espèces de plathelminthes ont été identifiées
à savoir : Avitellina centripunctata (46%), Moniezia
expansa (85%), Paramphistomum sp. (3%), Stilesia
globipunctata (7%) et Thysaniezia ovilla (84%) ; six
(6)espèces de némathelminthes ont été
identifiées à savoir : Bunostomum trigonocephalum
(2%), Gaigeria pachyscelis (2%), Haemonchus contortus (32%),
Oesophagostomum columbianum (18%), Trichostrongylus colubriformis
(1%) et Trichuris ovis et Trichuris globulosa (9%). Des
oeufs ont été également récoltés à
savoir : Moniezia expansa (6%), Paramphistomum (27%),
oeufs de strongle (25%) et Strongyloides papillosus (10%).
Les portions les plus parasitées sont l'iléon (85%) et le
jéjunum (85%). Les portions les moins parasitées sont le
cæcum (26%), le colon (19%) et le rumen (3%). Les portions qui
n'étaient pas du tout parasitées sont le réseau, le
feuillet et le duodénum. Quatre vingt dix pour cent (90%) des animaux
ont révélé la présence des nodules larvaires
hypobiotiques d'Oesophagostomum columbianum. Lors de notre
étude nous avons trouvé trois espèces qui n'avaient pas
encore été citées dans les études faites
précédemment à savoir Thysaniezia ovillas,
Stilesia globipunctata et Avitellina centripunctata. Les
helminthes en cause appartiennent à plusieurs espèces parmi
lesquelles certaines sont dangereuses par leurs diverses actions
pathogènes. Ces dernières sont à l'origine des lourdes
pertes liées à la morbidité importante qui se traduit le
plus souvent par une chute de poids voire de la reproduction mais
également de la mortalité.
La
présente étude nous a permis de faire la connaissance des
différents parasites rencontrés d'une part et d'autre part
d'avoir une idée sur l'état sanitaire des animaux
(prévalence). Ce qui nous permet d'avoir une idée sur l'attitude
des éleveurs, par rapport aux conseils qui leur sont prodigués
par les vétérinaires sur le terrain, afin d'améliorer
l'état sanitaire de leurs animaux et par conséquent la
productivité de leurs animaux, ainsi que la qualité du produit
fini qu'ils mettent à la disposition du consommateur. Les
résultats obtenus nous permettent de dire que les animaux abattus aux
abattoirs de Dakar sont infestés par les helminthes et les
prévalences sont assez élevées.
Pour
pallier au polyparasitisme révélé par notre étude
nous recommandons :
- aux
vétérinaires sur le terrain de conseiller aux éleveurs des
anthelminthiques à large spectre ou alors d'associer les
Benzimidazolés à l'Ivermectine ;
- une
bonne utilisation des anthelminthiques par les vétérinaires sur
place si possible ;
-
éviter l'utilisation d'une même molécule pendant
longtemps ;
-
l'utilisation de molécules structures très différentes et
à effets pharmacologiques très éloignées pour
lutter contre les problèmes de résistances acquises.
PERSPECTIVES
Dans le but d'avoir une vue plus complète du
parasitisme gastro-intestinal des ruminants domestiques au
Sénégal nous proposons :
-
d'étendre cette étude aux autres régions afin de couvrir
tout le pays ;
-
d'étudier le degré d'infestation des pâturages ce qui
permettra d'établir un lien s'il existe entre la charge parasitaire des
pâturages et celle des animaux ;
-
d'apprécier l'influence des saisons sur le développement des
helminthes et ceci à travers des expériences sur le terrain.
BIBLIOGRAPHIE
1 -
ALTAIF K. I. et ISSA W. H., (1983). Seasonal fluctuation and
hypobiosis of gastro-intestinal nematodes of Awasse lamb in Iraq. J.
Parasitol., 86 : 301-310.
2 -
BAKER N. F. ; COOK E. F. ; DOUGLAS J. R. et coll.,
(1959). The pathogenisis of Trichostrongyloid parasites III. Some
physiogical observations in lamb suffering from accute parasitic
gastro-enteritis. Inter. J. Parasitol., 45 : 643-651.
3
- BASTIAENSEN P. ; DORNY P. ; BATWUI K. et col., (2003).
Parasitisme des ruminants dans la zone périurbaine de
Sokodé, Togo (I. ovins). Rev. d'Elev. et de Med. Vet. des pays
tropicaux, tome LVI, n° 1-2 : 43-49.
4 -
BAXTER J. T., (1959). Mixed grazing and Nematodirus disease of
lamb. Vet. Res. 71 : 820-830.
5 -
BELOT J. et PANGUI L. J., (1986). Observation sur la
fertilité des strongles digestifs du mouton dans le cadre d'une
étude ponctuelle aux abattoirs de Dakar : remarques
préliminaires et nodules. Rev. Med. Vet., 137 : 533-536.
6 - BELOT J. ;
PANGUI L. J. et SAMB F., (1988). Données écologiques sur
les Nématodes gastro-intestinaux chez les ovins au
Sénégal. Communication au 3e Congrès de la
Société Ouest Africaine de Parasitologie. Saly Portugal
(Sénégal). - 16 p.
7 -
BLITZ N. M. et GIBBS H. C., (1972). Studies on the arrested
development of Haemonchus contortus in sheep I. The induction of
arrestesd development. Inter. J. Parasitol., 2 : 5-12.
8 -
BLITZ N. M. et GIBBS H. C., (1972). Studies on the arrested
development of Haemonchus contortus in sheep II. Termination of the
arrested development the spring rise phenomen on Inter J. Parasitol, 2 :
13-22.
9
- BONFOH B., (1993). Epidémiologie des némaodes
gastro-intestinaux chez les petits de la race Djallonké au Togo
(régions des plateaux). Thès. Med. Vet. : Dakar,1. 120 p.
10 -
BORGSTEEDE F. H. ; ARMOUR J. et JANSEN J., (1978). Facts and
reflections III. Workshop on arrested development of nematodes in sheep and
cattle. Lebystad, London, 162p.
11 -
BUSSIERAS J. et CHERMETTE R., (1988). Abrégé de
parasitologie vétérinaire, Fascicule III : Helminthologie.
Ecole Nationale Vétérinaire d'Alfort, service de parasitologie,
Paris, 267 p.
12 -
BUSSIERAS J. et CHERMETTE R., (1995). Abrégé de
parasitologie vétérinaire, Fascicule III : Helminthologie
(2è édition). Ecole Nationale Vétérinaire d'Alfort,
service de parasitologie, Paris, 79 p.
13 -
CABARET J., (2004). Parasitisme helminthique en
élevage bioogique ovin : réalités et moyens de
contrôle. INRA Prod. Anim., 17 (2) :
145-154.
14 -
CHERMETTE R., (1981a). Les helminthes du mouton et leur
rôle pathogène ( première partie) le point
vétérinaire, 12 : 11-21.
15 -
CHERMETTE R., (1981b). Les helminthes du mouton et leur
rôle pathogène (deuxième partie) le point
vétérinaire, 12 : 35-57.
16 -
CROFTON H. D., (1954). The vertical migration of infective
larvae of strongyloid nematodes. J. Helmintholo., 28 : 35-38.
17
- CROLL N. A. et MATTHEWS B. E., (1972). Biology of nematodes.
Thomson Litho. Ltd, Glasgow : 201p.
18 -
CROLL N. A. et MATTHEWS B. E., (1977). Biology of nematodes.
Thomson Litho. Ltd, Glasgow : 201p.
19 -
DAVIS L. R. ; HERLICH H. et BOWMAN G. W., (1960). Studies on
experimental concurent infections of dairy calves with coccidia and nematodes
III Eimeria spp and the tread-worm, strongyloides papillosus, IV Eimeria spp
and small hairworm Trichostrongylus colubriformis. Am. J. Vet. Res.,
20 : 181-194.
20 -
DIA P. I., (1979). L'élevage au
Sénégal : Situation actuelle et perspective d'avenir.
Thès. Med. Vet. : Dakar, 4. 189 p.
21 -
DIAW A., (1995). Commercialisation des petits ruminants au
Sénégal : le cas de l'axe nord-Dakar. Thès. Med.
Vet. : Dakar 4. 126 p.
22 -
DECKA F. S., (2003). Commercialisation du mouton de Tabaski
à Dakar en 2003. Thès. Med. Vet. 21 : Dakar. 89 p.
23 -
DELAUNE E. T. et MATTHEW B. R., (1943). Studies on
gastro-intestinal parasites IV. The blood picture in stomach worm (Haemonchus
contortus) infections. Trans amer. Micr. Soc., 62 : 179-193.
24 -
DIEDHIOU M., (1996). Le mouton à Dakar :
Production et commercialisation à la tabaski, Thès. Med.
Vet. : Dakar 7. 88 p.
25
- DIRECTION DE LA PREVISION ET DE LA STATISTIQUE (SENEGAL), (1995).
Situation économique et sociale du Sénégal :
élevage-pêche. Dakar D.P.S.- 298 p.
26 -
DORCHIES P., (1991). Résistance aux antiparasitaires.
Journées tolousaines de parasitologie vétérinaires :
98 p.
27 -
DOUTRESSOULE G., (1947). L'élevage au soudan
français-Paris : Ed. Larose - 292 p.
28 -
DUNN, (1978). Veterenary helminthol. Heineman Medical Books.
Second edition - London : Butler and Tanner Ltd . - 323p.
29 -
ELLIOT in BUSSIERAS J. et CHERMETTE R., (1988).
Abrégé de parasitologie vétérinaire, Fascicule
III : Helminthologie. Ecole Nationale Vétérinaire d'Alfort,
service de parasitologie, Paris, 267 p.
30 -
EUZEBY J., (1963). Les maladies vermineuses des animaux et
leur incidence en pathologie humaine. Tome I : maladies dues aux
némathelminthes. Fascicule III. Paris : . Vigot-Frères
Editeurs. - 843 p.
31-
EUZEBY J., (1982). Diagnostic expérimental des
helminthoses animales. Livre 2 : Diagnostic post-mortem, diagnostic indirect
(diagnostic biologique) : 364 p.
32 -
FABIYI J. P. (1973). Seasonal fluctuation of nematodes
infestations in goats in the seasonal belt of Nigeria. Bull. Epizoo.
Dis. Afr., 21 : p. 277-286.
33 -
FADIGA M. A.,(1990). Approvisionnement et commercialisation du
mouton de Tabaski au Sénégal : étude du marché
de Dakar. Thès Med. Vet. : Dakar 42. 157 p.
34 -
FALL P. D., (2002). « Le mouton des villes » ou
l'élevage urbain à Dakar. Notes africaines IFAN/UCAD,
(202) : 1-9.
35 - FAUGERE O. ; GAERE B.
; Merlin P. et coll., (1988). L'élevage des petits ruminanats
dans la zone de Kolda. Dakar : I.S.R.A. - 187 p.
36-
FUKUMOTO S. I., (1986). Anew stomachal worm, Obeliscoides
pentagali n. Sp. (Nematodea, Trichostrongydea) of Ryuku rabbits,
Pentagalus furnessi (Stone,1900). Systematic Parasitology, 8 :
267-277.
37 -
GRABER M. et PERROTIN C. H., (1983). Helminthes et
helminthoses domestiques des ruminants domestiques d'Afrique tropicale.
Editions du point vétérinaire. IEMVT, Paris, 378 p.
38-
GRABER M. et RECEVEUR, (1958). Parasitose interne du mouton en
zone sahélienne oesophagostomose nodulaire en particulier. Rev.
Elev. Med. Vet. Pays trop., 11 (3) : 257-264.
39 -
GRANT J. L. (1981). The
epizoology of nematodes parasites of sheep in a high rainfall area of
Zimbabwe. J.S. Afr. Vet. Assoc. 52 : 33-37.
40 -
GUEYE M. V., (1990). Crédit agricole et production
ovine dans le bassin archidier Sénégalais. Thès. Med.
Vet. : Dakar 36. 91 p.
41 -
INSTITUT GEOGRAPHIQUE NATIONAL, (1977). Atlas national du
Sénégal. Paris : I.G.N., 147 p.
42 -
GRETILLAT S., (1981). Inter-action dans le polyparasitisme
gastro-intestinal des animaux d'élevage en Afrique de l'Ouest :
conséquences et précautions à prendre lors d'une
thérapeutique en masse. Rev. Elev. Med. Vet. Pays tropicaux, 34
(3) : 313-317.
43-
KAUFMANN J., (1996). Parasitic infections of domestic animals:
a diagostic manual, 423p.
44-
KERBOEUF D., (1987). La résistance des
anthelminthiques : données générales. Journées
Toulousaines de parasitologie. Rev. Med. Vet. (n°
spécial) : 61-67.
45 -
MAUPAS E. P., (1899). La mue et l'enkystement chez les
nématodes. Zoologie expérimentale et générale
(France) 8 : 463-624.
46 -
MAUPAS E. P., (1900). Modes et formes de reproductions des
nématodes. Zoologie expérimentale et générale
(France) 8 : 463-624.
47 - MINISTERE DE
L'ELEVAGE, (2003). Plan cadre d'action pour le développement de
l'élevage 2003-2014 : DIREL 26 p.
48 - MOULIN
Performances animales et pratiques d'élevage en
Afrique sahélienne. La diversité du fonctionnement des troupeaux
de petits ruminants dans la communauté rurale de Ndiane
(Sénégal). Thès. Agron., Paris-Grignon.
49 - NDAO M.,
(1991). Contribution à l'étude des nématodes
gastor-intestinauxdes ruminants de la zone sylvo-pastorale du
Sénégal. Thès.Med. Vet., Dakar 35.p.
50 -
NDAO M. ; BELOT J. et coll., (1995).
Epidémipologie des helminthoses gastro-intestinales des petits ruminants
dans la zone sylvo-pastorale du Sénégal. Vet. Res.
26 : 132-139.
51 -
NGUE MEYIFI KOMBE Rose, (1997). Contribution à la lutte
contre les nématodes gastro-intestinaux chez les ovins au
Sénégal : utilisation de la Doramectine (Dectomax).
Thès. Med. Vet., Dakar 5. 80 p.
52 -
OGUNSUSI R. A. et EYSKER M., (1979). Inhibited development of
Trichostrongylids in sheep in northel Nigeria. Res. Vet. Sci., 26 :
108-110.
53- OSBORNE J. C., BATHE E. G. et BELL R. R.,
(1960). The pathologie following single infection of Oestertagia
ostertagi in calves. Cornell. Vet. 50 : 223-224.
54-
PAGOT J., (1985). L'élevage en pays tropicaux :
Techniques agricoles et productions tropicales. Paris : 526 p.
55 -
PISSANG T. D., (1994). Contribution à l'étude
des Nématodes Bunostominae parasites des ovins au
Sénégal : morphologie, niche écologique et phase
externe du cycle évolutif. Mém. DEA de Biologie Animale, Dakar
16 : 26 p.
56-
ROGERS W. P., (1940). The effects of environnement conditions
of the accessibility to third state Trichostrongle larvae grazing animal. J.
Parasitol. 32 : 208-225.
57-
SALIFOU Sahidou, (1996). Nematodes et nématodoses du
tube digestif des petits ruminants du Sud-Bénin : taxonomie,
épidémiologie et facteurs de variation. Thès Doct.
3ème cycle Bio. Ani., Dakar, 018 : 162 p.
58-
SANTOIR C., (1983). Raison pastorale et développement.
Les problèmes des peuls Sénégalais face aux
aménagements. Paris, 185p.
59 - SENEGAL, (2001a).
Notes sur la tabaski 2001. Dakar : DIREL. - 6
p.
60-
SENEGAL, (2001b). La situation et les perspectives de
l'élevage au Sénégal.- Dakar : MAE-72 p.
61-
SHUMAR R. F. ; BOLIN D. W. et EVELETH D. P., (1957).
Physiological and nutrition change in lambs infected with the nematodes
Haemonchus, Trichostrongylus colubriformis and
Nematodirus spathigen. Am. J. Vet. Res., 18 :
330-337.
62-
SOULSBY, (1968). Helminths, Arthropod and Protozoa of
domestical animals Sixth edition of Mönnig's Veteranary helmintology and
entomology, London, p. 176-325.
63-
STEWART D. F. et GORDON J. M., (1953). Studies on resistance
of sheep to infestation with Haemonchus contortus and
Trichostrongylus spp and the immunological reactions of sheep exposed
to infestation. IV. The influence of age and nutrition on resistance of
Trichostrongylus colubriformis. Aust. J. Agric. Res., 4 :
340-347.
64-
TAHRIS I. B., (1958). A preliminary state of lateral migration
by infective larvae of some cattle nematodes on experimentally contaminate
forage plats. Proc. Helm. Soc. Wash. 25: 99-106.
65 - TEMBELY S., GALVIN T. J., KOUYATE B., et
coll., (1985). Parasitisme gastro-intestinal des petits ruminants au
Mali : Epidémiologie et contrôle. [http : //
WWW.Google]. Page consultée le 16 Avril
2006.
66 -
THIAM I. D., MAGANE S. et SOW S., (1989). Géographie du
Sénégal. Dakar : N.E.A-63 P.
67 - TOURE S. M.,
(1981). Les contraintes de l'intensification des productions animales
au Sénégal et les essais de solution. Dakar : ISRA/LNERV.
68 - TRONCY R. M., ITARD J. et MOREL P. C.,
(1981). Précis de parasitologie vétérinaire
tropicale. IEMVT, Paris, 715p.
69 -
VASSILIADES G., (1975). Essai de traitements des strongyloses
digestives du mouton en zone tropicale par le tartrate de morantel.
70 - VASSILIADES G.,
(1981). Parasitisme gastro-intestinal cdhez le mouton au
Sénégal. Rev. Elev. Med. Vet. Pays trop., 34 (2) : 169-177.
71 -
VERCRUYSSE J., (1980). A survey of seasonal changes in
nematodes feacal egg count levels of sheep and goat in Sénégal.
Vet. Parasitol., 13: 239-244.
72 -
VERCRUYSSE J., (1984-1985). The seasonal prevelance of
inhibited development of Haemonchus contortus in sheep in
Sénégal. Vet. Parasitol., 17: 159-163.
73 -
VONDOU D., (1989). Contribution à l'étude du
parasitisme gastro-intestinal chez les petits ruminants au Cameroun
septentrional (cas des nématodes). Thes. Med. Vet., Dakar 37. 125 p.
74 -
WILSON R. I., (1986). Système de production des petits
ruminants en Afrique, méthodes pour la recherche sur les systèmes
d'élevage en Afrique intertropicale. Maison Alfort :
IEMVT-ISRA ; (20) : 61-98.
75
- YAMAGUTI S., (1961). Systema helminthum. Vol III. The
nematodes of Vertebrates, Part I. Interscience Publishers Inc., New-york,
331-679.
SOMMAIRE
i
INTRODUCTION
1
PREMIERE PARTIE :
2
SYNTHESE BIBLIOGRAPHIQUE
2
Chapitre I : ELEVAGE DES OVINS AU
SENEGAL
3
I. Evolution des effectifs du cheptel
3
II. Place des ovins
4
II.1. Les races ovines
exploitées
4
II.1.1. Les moutons maures
5
II.1.1.1. Le mouton à poils ras
(Touabire)
5
II.1.1.2. Le mouton maure à poils
longs
5
II.1.2. Le mouton Peul-peul
6
II.1.3. Le mouton Djallonké
6
II.1.4. Le mouton Bali-bali ou Ouda du
Niger
6
II.1.5. Les métis
7
II.1.5.1. Le Waralé
7
II.1.5.2. Le Ladoum
7
II.1.5.3. L'Azawat
8
II.2. Les systèmes de production
ovine
8
II.2.1. Le système pastoral
8
II.2.2. Le système agropastoral
9
II.2.3. Le système urbain et
péri-urbain
10
III. Rôles socio-économiques
des ovins
11
III.1. Rôle
socio-réligieux
11
III.2. Rôle économique
11
IV. Contraintes de l'élevage ovin au
Sénégal
12
IV.1. Contraintes climatiques
12
VI.2. Contraintes
socio-économiques
13
IV.3. Contraintes zootechniques et
alimentaires
13
IV.4. Contraintes pathologiques
14
IV.4.1. Les maladies nutritionnelles
14
IV.4.2. Les maladies infectieuses
14
IV.4.2.1. La peste des petits ruminants
(PPR)
14
IV.4.2.2. Les pneumopathies
14
IV.4.2.3. Le charbon bactéridien
15
IV.4.2.4. L'ecthyma contagieux
15
IV.4.3. Les maladies parasitaires
15
IV.4.3.1. Les gales
15
ii
IV.4.3.2. Les parasitoses
gastro-intestinales
16
Chapitre II :
GENERALITES SUR LES HELMINTHES PARASITES
GASTRO-INTESTINAUX DES OVINS AU SENEGAL
17
I. Plathelminthes
17
I.1. Taxonomie
17
I.1.1. Les Trématodes
17
I.1.1.1. Super-famille des Fasciolidea
17
I.1.1.2. Super-famille des
Paramphistomoïdea
18
I.1.1.3. Super-famille des
Schistosomoïdea
18
I.1.2. Les Cestodes
19
I.2. Biologie
20
I.2.1. Habitat
20
I.2.1.1. Plathelminthes du rumen et du
réseau
20
I.2.1.2. Plathelminthes de l'intestin
grêle
20
I.2.2. Nutrition
21
I.2.2.1. Chez les Trématodes
21
I.2.2.2. Chez les Cestodes
21
I.2.3. Cycle de développement
21
I.2.3.1. Chez les trématodes
21
I.2.3.1.1. La fécondation
21
I.2.3.1.2. La formation des oeufs
21
I.2.3.1.3. Le développement
exogène
22
I.2.3.1.4. Développement
endogène
22
I.2.3.2. Chez les cestodes
23
I.3. Epidémiologie
23
I.3.1. Epidémiologie des
Paramphistomidés
23
I.3.2. Epidémiologie des
Anoplocéphalidés
24
I.4. Etude anatomo-clinique
24
I.4.1. Symptômes
24
I.4.2. Lésions
25
I.4.2.1. Générales
25
I.4.2.2. Locales
26
I.5. Pathogénie
26
I.6. Diagnostic
27
I.7. Méthodes de lutte
27
I.7.1. Traitement
27
I.7.2. Prophylaxie
28
II. Les Nemathelminthes
28
II.1. Taxonomie
28
II.1.1. La classe des Secernenta
28
II.1.2. Classe des Adenophorea
30
iii
II.2. Biologie
31
II.2.1. Habitat
31
II.2.1.1. Les parasites de la caillette
31
II.2.1.1.1. Le genre Haemonchus
Cobb, 1898
31
II.2.1.1.2. Le genre Ostertagia
Ransom, 1907
32
II.2.1.1.3. Le genre
Trichostrongylus Loos, 1905
32
II.2.1.2. Parasites de l'intestin
grêle
33
II.2.1.2.1. Le genre
Trichostrongylus Loos, 1905
33
II.2.1.2.2. Le genre Cooperia
ransom, 1907
33
II.2.1.2.3. Le genre Nematodirus
Ransom, 1907
34
II.2.1.2.4. Le genre Bunostomum
Railliet, 1902
34
II.2.1.2.5. Le genre Gaigeria
Railliet et Henry, 1910
35
II.2.1.2.6. Le genre Strongyloides
Grassi, 1879
36
II.2.1.3. Parasites du gros intestin
36
II.2.1.3.1. Le genre Skrjabinema
Vereschtchagin, 1926
37
II.2.1.3.2. Le genre
Oesophagostomum Molin, 1861
37
II.2.1.3.3. Le genre Chabertia
Railliet et Henry, 1909
38
II.2.1.3.4. Le genre Trichuris
Roederer, 1761
38
II.2.2. Nutrition
38
II.2.3. Cycle de développement
38
II.2.3.1. Phase exogène
39
II.2.3.2. Phase endogène
42
II.2.3.2.1. Evolution directe
42
II.2.3.2.2. Evolution indirecte
42
II.2.3.2.3. Arrêt du
développement larvaire
44
II.3. Epidémiolgie des
Nématodes
45
II.4. Etude anatomoclinique des
Nématodoses gastro-intestinales
51
II.4.1. Symptomatologie
51
II.4.2. Lésions
52
II.4.2.1. Au niveau de la caillette
52
II.4.2.2. Au niveau de l'intestin
grêle
53
II.4.2.3. Au niveau du gros intestin
53
II.5. Pathogénie
54
II.6. Diagnostic
55
II.7. Pronostic
55
II.8. Méthodes de lutte
55
iv
DEUXIEME PARTIE :
58
ENQUETE SUR LE PARASITISME HELMINTHIQUE
58
GASTRO-INTESTINAL DES MOUTONS ABATTUS
58
AUX ABATTOIRS DE DAKAR
58
Chapitre I : MATERIEL ET METHODES
59
I. Période et lieux de
l'enquête
59
II. Matériel et Méthodes
59
II.1. Autopsies helminthologiques
59
II.1.1. Le matériel
59
II.1.1.1. Matériel biologique
59
II.1.1.2. Matériel de
laboratoire
59
II.1.2. Méthodes
60
II.1.2.1. Technique de l'autopsie
helminthologique
60
II.1.2.2. La conservation des parasites
62
II.1.2.3. La préparation et
l'observation des parasites
62
II.1.2.4. Méthode d'analyse
statistique
63
II.2. Examen coproscopique
63
II.2.1. Matériel biologique
63
II.2.2. Matériel de laboratoire
64
II.2.3. Méthodologie
64
II.2.3.1. Les
prélèvements
64
II.2.3.2. Méthode d'analyse
coproscopique qualitative
65
II.2.3. Identification des oeufs
67
II.2.4. Méthode d'analyse
statistique
67
Chapitre II : RESULTATS ET
DISCUSSION
68
I. Résultats
68
I.1. Les autopsies helminthologiques
68
I.1.1. Taux d'infestation
68
I.1.2. Taux d'infestation global en
fonction des portions du tractus digestif
69
I.1.3. Taux d'infestation
70
I.2. Description des helminthes
rencontrés
71
I.2.1. Les Plathelminthes
71
I.2.1.1. Au niveau du rumen
71
I.2.1.2. Au niveau de l'intestin
grêle
71
I.2.1.2.1. Moniezia expansa
71
I.2.1.2.2. Stilesia
globipunctata
72
v
I.2.1.2.3. Avitellina
centripunctata
72
I.2.1.2.4. Thysaniezia ovilla
72
I.2.2. Les némathelminthes
72
I.2.2.1.Au niveau de la caillette
72
I.2.2.2. Au niveau de l'intestin
grêle
73
I.2.2.2.1.Trichostrongylus
colubriformis
73
I.2.2.2.2. Gaigeria
pachyscelis
75
I.2.2.2.3. Bunostomum
trigonocephalum
75
I.2.2.3. Au niveau du gros intestin
76
I.2.2.3.1. Oesophagostomum
columbianum
76
I.2.2.3.2. Trichuris globulosa et
Trichuris ovis
77
I.3. Résultats
généraux des examens coprologiques
78
I.3.1. Les différents taux
d'infestation
78
I.3.2. Description des oeufs d'helminthes
rencontrés
80
I.3.2.1. Les oeufs de Moniezia
expansa
80
I.3.2.2. Les oeufs de Paramphistomum
sp
80
I.3.2.3. Les oeufs de
« strongles »
80
I.3.2.4. Les oeufs de Strongyloides
papillosus
80
II. Discussion
81
II.1. Autopsies helminthologiques
81
II.1.1. Taux d'infestation
81
II.1.2. Description des helminthes
rencontrés
83
II.1.2.1. Les plathelminthes
83
II.1.2.1.1. Les plathelminthes
rencontrés dans le rumen
83
II.1.2.1.2. Les plathelminthes
rencontrés dans l'intestin grêle
83
II.1.2.2. Les némathelminthes
83
II.1.2.2.1. Les némathelminthes
rencontrés dans la caillette : Haemonchus contortus
83
II.1.2.2.2. Les némathelminthes
rencontrés dans l'intestin grêle
84
II.1.2.2.3. Némathelminthes
rencontrés dans le gros intestin
85
II.2. Examens coprologiques
85
II.2.1. Taux d'infestation
85
II.2.2. Description des oeufs d'helminthes
rencontrés
86
II.2.2.1. Moniezia expansa
86
II.2.2.2. Paramphistomum sp.
86
II.2.2.3. OEufs de strongle
86
II.2.2.4. Strongyloides
papillosus
86
CONCLUSION GENERALE
87
PERSPECTIVES
89
BIBLIOGRAPHIE
90
vi
| 


