|
Le fer est un oligo-élément présent dans
l'organisme avec une quantité comprise entre 4 et 5 g sous forme de
composés héminiques ou non héminiques. Dans le sang, il
est l'un des constituants de l'hémoglobine et de la myoglobine qui
interviennent dans le transport des gaz. Le fer joue également un
rôle central dans toute une série de réactions enzymatiques
d'oxydoréductions impliquées dans le métabolisme et la
production d'énergie (Dallman, 1986). Il est indispensable à la
respiration cellulaire. Ce micronutriment contribue ainsi aux performances
physiques, cognitives et à la résistance aux infections (Dallman,
1987 ; Cook, 1990).
Selon des institutions internationales telles que
l'Organisation Mondiale de la Santé et le Fonds des Nations Unies pour
l'Enfance (UNICEF/UNU/WHO, 2005), 4 à 5 milliards de personnes sont
touchées par la carence en fer à travers le monde. Ce
déficit en fer est dû essentiellement au
déséquilibre entre les apports et les besoins en fer de
l'organisme. De ce fait, le fer est apparu, parmi tous les micronutriments,
comme un de ceux dont la couverture des besoins pose dans l'espèce
humaine le plus de problèmes pratiques à résoudre. Le taux
de prévalence de la carence martiale est estimé entre 60 et 80 %
dans les pays en développement et entre 15 et 20 % dans les pays
industrialisés (UNICEF/WHO/UNI/MI, 1999 ; Berger et al.,
2005). Le déficit en fer est, à 80 %, la principale cause des
anémies qui constituent un véritable problème de
santé publique dans le monde en général et en particulier
dans les pays en développement (Dillon, 2000). Ainsi en Afrique,
d'après le rapport des institutions internationales (UNICEF / UNU / WHO,
2001), l'anémie touche 58 millions de femmes en âge de
procréer avec 11 millions de femmes enceintes.
En effet, les besoins en fer au cours de la grossesse sont
très élevés compte tenu des modifications physiologiques.
Ce sont :
- l'augmentation du volume plasmatique ;
- l'expansion de la masse érythrocytaire ;
- la formation du placenta ;
- la croissance du foetus (Huddle et al., 1999 ;
Beaton, 2000 ; Makoutode et al., 2004).
Pour le bon déroulement de la grossesse, environ 1290
mg de fer sont requis pour l'organisme de la mère (Beard, 1994 ;
Bernard et al., 1996 ; Bothwell, 2000).
Le déficit martial au cours de la grossesse provoque un
retard de développement intra-utérin du foetus, des accouchements
prématurés, des insuffisances pondérales à la
naissance, des souffrances foetales et des décès maternels durant
la grossesse, pendant ou après l'accouchement (Allen, 2000 ;
Stoltzfus, 2001 ; Fall et al., 2003 ; Scholl, 2005).
Chez les femmes en âge de procréer non enceintes,
les demandes sont également augmentées au regard :
- de la perte mensuelle de sang qui correspond à un
besoin de 1,5 mg de fer par jour au cours de cette période de
menstruation ;
- des pathologies gynécologiques et digestives qui
entraînent des saignements chroniques aux causes variables
(Carpenter et Mahoney, 1992 ; Bernard et al., 1996).
Dans les pays en développement, plusieurs
déterminants tels que l'alimentation, les parasitoses, les syndromes
infectieux et inflammatoires, les hémoglobinopathies et les grossesses
multiples seraient en faveur de l'augmentation des taux de prévalence de
la carence martiale et des anémies (Dillon, 2000).
Malgré l'existence de la supplémentation en fer,
de la prophylaxie antipaludique et des déparasitants, la carence
martiale et les anémies persistent au sein des populations des pays en
développement (Djanhan et al., 1992 ; Beaton,
2000 ; Bothwell, 2000 ; Fall, 2003 ; Aguayo et
al., 2004 ; Ramakrishnan et al., 2004 ; Berger et
al., 2005 ; Scholl, 2005).
En Côte d'Ivoire, très peu d'études
scientifiques ont été consacrées au statut en fer des
femmes en âge de procréer, au cours des 3 trimestres de grossesse
à l'aide des indicateurs biologiques permettant un dépistage
précoce de la carence martiale et des anémies par déficit
en fer (Ramon et al., 1999 ; Carré et al.,
2003 ; Sakandé et al., 2004 ;
Bléyéré et al., 2007).
C'est pourquoi, l'objectif général du
présent travail vise à mesurer et à décrire la
prévalence des carences martiales et des anémies au sein de 2
populations de femmes non enceintes mais en âge de procréer et
enceintes dans, 3 communes de la ville d'Abidjan.
Les objectifs spécifiques étant :
1- évaluer les éventuelles modifications du
statut en fer survenues tout au long de la grossesse ;
2- comparer ces modifications du statut en fer entre les
différents états physiologiques de la grossesse ;
3- comparer la prévalence des anémies par
carence martiale entre les 2 groupes de femmes
sélectionnées ;
4- déterminer les différents facteurs
anthropométriques liés à la carence martiale et aux
anémies par déficit en fer.
Pour y parvenir, nous avons procédé par la
détermination des données anthropométriques, des
paramètres globulaires, des indices érythrocytaires et des
paramètres sériques liés au statut en fer.
1. Globules rouges
1-1. Définition et structure du globule rouge
La figure 1 présente
le globule rouge formé, qui au cours de
l'érythropoïèse, est une cellule anucléée
d'environ 7,5 um de diamètre et 3 um d'épaisseur. Sa structure
est adaptée à sa fonction essentielle, le transport du dioxyde de
carbone hors de l'organisme et la délivrance de l'oxygène aux
tissus (Bernard et al, 1996),.
Le globule rouge comporte plusieurs constituants à
savoir :
- une membrane comportant une double couche de phospholipides,
stabilisée par du cholestérol, dans laquelle s'intercalent des
protéines ;
- un cytoplasme composé d'eau, d'ions (ions potassium
essentiellement), du glucose, des enzymes (pyruvate kinase, glucose 6 phosphate
déshydrogénase : G6PD) et surtout de
l'hémoglobine (Figure 2). Chaque globule rouge contient
300 millions de molécules d'hémoglobine soit le tiers du poids
des globules rouges. Dans l'organisme, les globules rouges subsistent dans la
circulation environ 120 jours et ils se protègent contre 2 principaux
dangers : l'oxydation de ses constituants (fer et globine) et
l'hyperhydratation (Wajcman et al, 1992 ; Bernard et al,
1996; Silbernage et Despopoulos, 2001).
Erythroblastes polychromatophiles
Erythroblastes basophiles
Proérythroblastes
Précurseurs
Cellule souche
Erythroblastique
Hématies
Réticulocytes
Erythroblastes acidophiles
CFU-E
BFU-E
Compartiment
des précurseurs
médullaires
Sang
24 heures
Moelle
Erythropoïétine
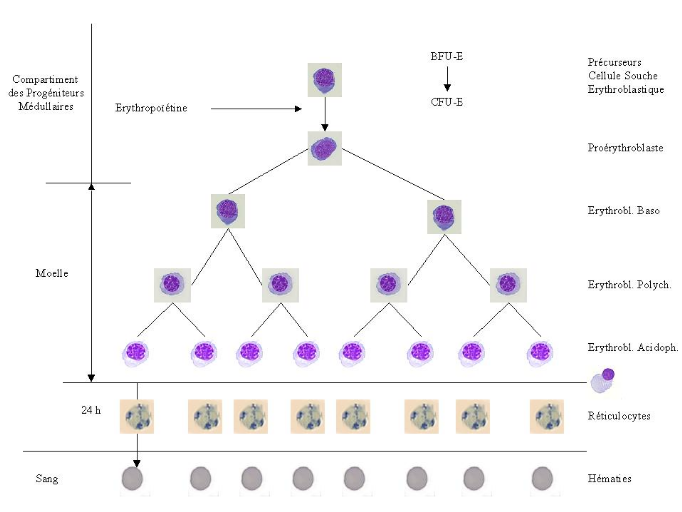

Figure 1 : Différentes étapes
de l'érythropoïèse
Figure 2 : Globules rouges de l'organisme
humain (Vander et al., 2001)
1-2. Hémoglobine
1-2-1. Définition de l'hémoglobine
Hoppe-Seyler en 1862 a introduit le terme, hémoglobine
pour désigner le pigment respiratoire du globule rouge.
L'hémoglobine caractérise l'aspect moléculaire du globule
rouge et est responsable de la fonction principale des globules rouges de
l'organisme. C'est un hétérotétramère chez tous les
vertébrés du monde vivant. A chaque stade d'évolution de
la vie, cette protéine voit son contenu modifié au niveau de la
nature des différentes chaînes qu'elle porte (Najman et
al., 1994 ; Bernard et al., 1996).
1-2-2. Structure et fonction de l'hémoglobine
L'hémoglobine humaine avec un poids moléculaire
de 64500 daltons, comporte 4 chaînes de globine et 4 molécules
d'hème (Figure 3). Synthétisé dans les
mitochondries, l'hème est une porphyrine contenant un atome de fer
ferreux (Fe2+). La porphyrine ou protoporphyrine III comprend 4
noyaux pyrrol et 8 chaînes latérales. Le fer est au centre,
fixé sur 4 azotes des noyaux pyrrol et garde 2 valences libres
(Figures 3 et 4). La globine est un polypeptide composé
de 2 chaînes á et de 2 chaînes non á. Les
chaînes á et non á comportent respectivement 141 et les 146
acides aminés (Najman et al., 1994 ; Vander et
al., 2001).
Le rôle physiologique des globules rouges est en partie
assuré par l'hémoglobine. L'hémoglobine fixe
l'oxygène permettant ainsi son transport par le globule rouge des
poumons vers les tissus de l'organisme. Mais elle facilite également
l'élimination par le globule rouge du dioxyde de carbone des tissus aux
poumons. En effet, chaque molécule d'hémoglobine fixe 4
molécules d'oxygène sur le fer et constitue
l'oxyhémoglobine (Genetet, 1989).
2. Distribution du fer dans l'organisme
L'organisme de l'Homme adulte contient environ 2,5 à 5
g de fer. Soit environ 40 à 50 mg de fer par kilogramme de poids
corporel chez l'homme et 36 à 50 mg chez la femme (Withney et Rolfes,
1993). La moyenne des réserves en fer de l'homme est estimée
à 1000 mg et celle de la femme à 300 mg. Le fer est
contenu dans l'organisme sous 2 formes. Il s'agit de la forme héminique
et de la forme non héminique (Shills et al., 1994).
2-1. Fer héminique
Environ 60 à 70 % du fer total de l'organisme sont
contenus dans l'hémoglobine sous forme héminique
précisément au niveau de l'hème (Bernard et al.,
1977). La myoglobine qui constitue le pigment respiratoire du
muscle comporte 3 à 5 % de fer sous forme héminique. Environ 0,3
% du fer total sous forme héminique est contenu dans
les cytochromes et plusieurs enzymes (Carpenter et Mahoney, 1992). Les
cytochromes a, b et c, qui contiennent une molécule d'hème
identique à celle de l'hémoglobine, participent au transport
d'électrons dans la chaîne respiratoire des mitochondries et sont
essentiels à la production d'énergie, sous forme d'ATP
(Hercberg et Rouaud, 1981; Dallman, 1986).
|
|
|
Hémoglobine humaine en sphères colorées par
type d'atomes (oxygène en rouge, carbone en gris, azote en bleu) et les
hèmes en vert.
|
Hémoglobine humaine en sphères colorées par
chaînes (alpha en vert et bleu foncé; bêta en jaune et cyan;
l'eau en rouge).
|
|
|
|
Hémoglobine humaine : affichage en rubans colorés
par chaînes et les hèmes en sphères.
|
Hémoglobine humaine : affichage en rubans colorés
par chaîne et les hèmes en bâtonnets rouges et les atomes de
fer en sphères pourpres.
|
Figure 3 : Structure
complète de la molécule d'hémoglobine (Vander et
al., 2001)
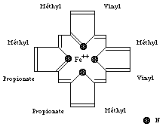
Figure 4 : Structure de la
molécule d'hème (Bernard et al., 1996)
Des enzymes telles que la catalase et les peroxydases
formées de fer héminique sont impliquées dans des
réactions de destruction de peroxydes (Hercberg, 1990). Le fer
héminique joue aussi un rôle important dans le
système immunitaire, comme constituant de plusieurs
autres enzymes dont la myéloperoxydase essentielle au pouvoir
bactéricide des polynucléaires neutrophiles (Turgeon-O'Brien
et al., 1985a, 1985b; Carpenter et Mahoney, 1992). Cette enzyme
s'associe à certains produits du métabolisme leucocytaire, pour
détruire les microorganismes phagocytés (Reinett et al.,
1988; Cook, 1990; Galan et al., 1992).
2-2. Fer non héminique
Le fer non héminique correspond aux
formes de transport et de réserves du fer. Trente pour cent (30 %) du
fer total corporel est stocké dans les tissus sous 2 formes:
l'hémosidérine (10 %) et la ferritine (20 %)
(Carpenter et Mahoney, 1992). Le fer contenu dans la ferritine est disponible
et facilement mobilisable en cas de besoin pour la synthèse de
1'hémoglobine et le maintien des diverses fonctions cellulaires
(Hercberg Galan, 1985). La plupart des tissus de l'organisme
contiennent du fer, mais c'est le foie, la rate et la moelle osseuse qui
constituent les principaux organes de stockage du fer (Withney et Rolfes,
1993). Lorsque les réserves en fer augmentent, la ferritine forme des
agrégats nommés hémosidérine. Environ 0,1 % du fer
total sous forme non héminique se retrouve en circulation au niveau du
plasma sanguin lié à une glycoprotéine, la
transferrine ou la
sidérophiline (Hercberg et Rouaud, 1981). Le fer est ainsi
transporté aux différents sites de stockage et d'utilisation. La
transferrine permet aussi de récupérer le fer
libéré par l'hémolyse des globules rouges. Elle aurait
aussi un rôle bactériostatique d'une part ; et d'autre part,
un groupe important d'enzymes a besoin du fer non héminique
pour réaliser des réactions oxydatives (Hercberg et
Galan, 1985). Il s'agit de la monoamineoxydase, de la ribonucléotide
réductase, de la xanthine oxydase, de la nicotinamide adénine
dinucléotide déshydrogénase (NADH), etc ... Ces enzymes
participent au métabolisme des catécholamines, à la
synthèse d'acides aminés et de l'ADN, à
la production d'énergie, ainsi qu'à d'autres réactions
vitales de l'organisme (Hercberg, 1990).
3-. Métabolisme du fer
3-1. Absorption du fer
L'organisme doit absorber une certaine quantité de fer
pour compenser les pertes obligatoires de fer et pour maintenir un niveau de
réserves capables de répondre à des pertes pathologiques
plus importantes. La régulation physiologique de l'absorption du fer
constitue une excellente protection contre la toxicité de celui-ci. Le
fer existe sous 2 formes dans les aliments, ce qui influence
son degré et son mode d'absorption.
Le fer héminique constitue 40 % du fer total de la
viande et du poisson. Les soixantes (60 %) restants sont sous forme non
héminique. Tout le fer contenu dans les aliments d'origine
végétale est sous forme non héminique
(Hercberg et Galan, 1985). L'absorption du fer se fait par les
cellules de la muqueuse intestinale dans la partie proximale du petit intestin,
surtout dans le duodénum et à un moindre degré
jusqu'au milieu du jéjunum (Wintrobe, 1981),
(Figure 5). A l'intérieur de la cellule de la muqueuse
intestinale, le fer est séparé de la porphyrine
par une enzyme, l'oxygénase héminique. À ce stade, le fer
d'origine héminique est identique au fer d'origine non héminique
(Cook, 1990). Le fer absorbé est stocké sous forme de ferritine
si son utilisation n'est pas nécessaire. Il est transporté
par la transferrine de la muqueuse jusqu'au sang. Le fer
stocké dans les cellules intestinales et celui qui
est non utilisé sont excrétés par les
fèces lors de l'exfoliation des cellules de la muqueuse
intestinales (Hallberg et al., 1989).
Le seul facteur qui semble influencer le degré
d'absorption du fer héminique est la quantité de fer contenue
dans les réserves de l'organisme. La nature du repas n'influence pas son
absorption, car le fer absorbé, est relié au complexe porphyrique
de l'hémoglobine qui le protège (Cook, 1990).
Lorsque les réserves en fer sont
épuisées, le taux d'absorption augmente jusqu'à 35 %
contre 15 % quand les réserves sont adéquates (Monsen et
al., 1978). Cette procédure d'absorption générale
concerne le fer sous la forme héminique qui constitue la forme
réduite du fer.
Au niveau du fer non héminique, qui
apparaît dans la nourriture principalement sous forme
d'ions ferriques, il doit être réduit en fer ferreux avant
d'être absorbé. L'absorption du fer non héminique est
influencée par des facteurs d'ordre physiologique et alimentaire (Hazell
et al., 1978). En effet, le degré d'acidité de l'estomac
et de la partie supérieure de l'intestin favorise la réduction du
fer ferrique en fer ferreux. Ce qui accélère donc son
absorption. En outre, des déterminants alimentaires comme l'acide
ascorbique, l'acide citrique et le facteur VVP (viande, volaille et poisson)
stimuleraient l'absorption du fer inorganique en permettant sa réduction
(Carpenter et Mahoney, 1992;). Cependant, les phytates, les oxalates, les
phosphates, les tannins et certaines fibres forment des complexes insolubles
qui empêchent l'absorption du fer (Cook, 1990; Carpenter et Mahoney,
1992).
L'homéostasie du fer au niveau de l'organisme repose
sur une régulation de l'absorption intestinale du fer alimentaire. Cette
absorption se fait par les entérocytes matures situés au sommet
de la villosité du duodénum (partie proximale de l'intestin) et
met en jeu un grand nombre de protéines. L'expression de ces
différentes protéines dépend de signaux envoyés par
l'organisme en fonction, soit du niveau des réserves en fer tissulaires,
soit de l'activité de fabrication des globules rouges. Ainsi, dans des
conditions physiologiques normales, les entérocytes en recevant ces
signaux s'adaptent à la demande en fer de l'organisme. L'une des
molécules clé participant à cette régulation est
l'hepcidine, une protéine synthétisée
dans le foie sous la forme d'un précurseur et excrétée
dans la circulation sous la forme d'un peptide mature très court de 25
acides aminés (Nicolas et Vaulont, 2002 ; Viatte
et Vaulont, 2006).
3-2. Pertes et estimation des besoins en fer
Le métabolisme du fer fonctionne
presque comme un circuit fermé. Presque la quantité (99
%) du fer de l'organisme est réutilisée (Figure
6). En effet, la destruction des globules rouges, dont la durée
de vie est d'environ 120 jours, entraîne la libération du fer qui
est réutilisé pour la synthèse de l'hémoglobine ou
mis en réserve dans l'organisme (Najman et al., 1994 ;
Bernard et al., 1996). Cependant, l'organisme subit des pertes
obligatoires de fer relativement faibles provenant de l'exfoliation des
cellules superficielles internes et externes. Ces pertes se retrouvent dans
l'urine, la sueur et les liquides menstruels ainsi que la
quantité de fer utilisée pour la croissance (Figure
7). Les pertes normales chez la femme adulte sont en moyenne de 0,78
mg par jour (Hazell et al., 1982). Au niveau de la grossesse, une
forte élévation des besoins en fer a lieu du fait des
modifications physiologiques. En effet, la mère doit combler les besoins
du foetus, ceux dus à la formation du placenta et doit établir
des réserves suffisantes pour l'allaitement. Au cours de la
deuxième moitié de la grossesse, le fer est
transféré au foetus en croissance et au placenta (Bentley, 1985).
Une quantité de 1290 mg de fer est requise pour un bon
déroulement de la grossesse. Toutefois, une supplémentation en
fer est recommandée au cours de la grossesse, au cas où les
réserves en fer de la mère seraient inadéquates (Allen,
2000 ; Fall et al, 2003 ; Rasmussen et Stoltzfus, 2003).
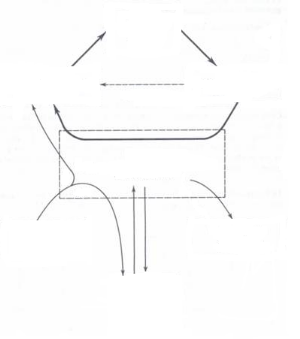
Figure 5: Absorption du fer dans
l'organisme (Bernard et al., 1996)
Selles
80-90 %
10-20 %
Lumière intestinale
Cellules intestinales
Circulation
Transferrine saturée
ou
désaturée
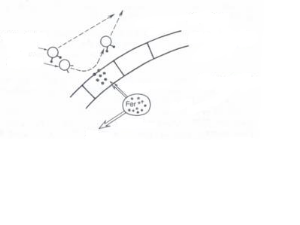 3-3. Carence nutritionnelle en fer 3-3. Carence nutritionnelle en fer
3-3-1. Définition de la déficience en
fer
La déficience en fer peut être définie
comme étant le moment où les réserves de fer corporel
s'épuisent à cause d'un apport restreint en fer dans les
différents tissus de l'organisme. Ce processus d'épuisement peut
se produire rapidement ou assez lentement selon l'apport alimentaire et les
besoins en fer (Beard, 1994).
3-3-2.. Etiologie de la déficience en fer
Les causes d'une déficience en fer peuvent
être :
- un apport en fer insuffisant dû
à une alimentation pauvre en fer ;
- une absorption inadéquate en fer en
raison d'une diarrhée, d'une atrophie gastrique, d'une gastrectomie
partielle ou totale, de maladies intestinales, ainsi que l'interférence
de certains médicaments utilisés ;
- une augmentation de la demande en fer
pendant la grossesse et l'allaitement pour combler l'augmentation du volume
sanguin ;
- des pathologies gynécologiques et
digestives qui entraînent des saignements ;
- une libération
défectueuse du fer des réserves
au plasma ainsi qu'une utilisation inefficace provenant d'une
inflammation chronique (Hercberg et Galan, 1985 ).
3-3-3. Etapes du développement de la carence en
fer
La carence nutritionnelle en fer apparaît lorsque les
besoins physiologiques normaux ne sont plus satisfaits, résultant soit
d'une ingestion insuffisante de fer, soit de pertes trop abondantes de fer. La
carence en fer se développe graduellement autour de 3 phases :
- la première phase de la carence
martiale correspond à la déplétion des réserves en
fer du foie, de la rate et de la moelle osseuse, et à une augmentation
compensatoire de l'absorption intestinale, le taux de ferritine sérique
est abaissé. Il est associé à une augmentation du taux de
récepteurs de la transferrine, à ce stade, la carence est
prélatente, l'apport de fer au niveau de la moelle osseuse est suffisant
pour couvrir l'érythropoïèse ;
- la deuxième phase se caractérise par une
insuffisance des apports de fer aux tissus
érythropoïétiques. Ce qui entraîne une diminution de
la synthèse de l'hémoglobine, mais sans modification
significative de l'hémoglobine circulante. Certaines anomalies
biochimiques telles que l'augmentation de la capacité de fixation en fer
du sérum, la diminution du fer sérique et du pourcentage de
saturation de la transferrine apparaissent. La carence en fer est alors
latente ;
- la troisième phase
correspond à l'anémie ferriprive. Les taux
d'hémoglobine et d'hématocrite baissent et le volume des globules
rouges diminue (microcytose), ce qui entraîne une diminution de la teneur
et de la concentration corpusculaire moyennes en hémoglobine
(hypochromie) (Hercberg, 1988 ; Dillon, 2000), (Tableau
I).
4. Conséquences de la déplétion
des réserves en fer sur le déroulement de la grossesse.
Pendant la grossesse, le volume plasmatique augmente de 50 %
environ par rapport au volume prégravidique et atteint son maximum entre
24 et 34 semaines de grossesse (Pirani et al., 1973 ; Hytten,
1985; Knight, 1994). Cette augmentation du volume plasmatique
est aussi plus importante lors de plusieurs grossesses rapprochées,
celle-ci est plus grande avec un nombre important d'accouchements (Rovinsky et
Joffin, 1965).
Tableau I: Carence en fer à
l'anémie (SNDLF, 2001)
|
Carence infra-clinique
|
Carence mineure
|
Carence majeure
|
Anémie carentielle
|
|
Fer médullaire ?
|
|
|
|
|
Ferritine sérique ?
|
Ferritine sérique?
|
Ferritine sérique ?
|
Ferritine sérique ?
|
|
CST ?
|
CST ?
|
CST ?
|
|
|
TCMH ?
|
TCMH ?
|
|
|
CTF ?
|
CTF ?
|
|
|
Transferrine ?
|
Transferrine ?
|
|
|
Ferritine érythrocytaire?
|
Ferritine érythrocytaire ?
|
|
|
|
Fer sérique ?
|
|
|
|
Hémoglobine ?
|
|
|
|
VGM ?
|
CST : Coefficient de saturation ; TCMH : Teneur
corpusculaire moyenne en hémoglobine ;
CTF : Capacité totale de fixation ;
VGM : Volume globulaire moyen
h : hommes
f : femmes
Fer des globules rouges circulants
Hémolyse : libération des globules rouges, 15
à 30 mg/jour
Erythropoïèse : incorporation dans les globules
rouges 15 à 30 mg/jour
Apport alimentaire :
1 mg/jour (h)
2-3 mg/jour (f)
Réserves diffuses
Ferritine
Hémosidérine (0,6 à 1,2 mg)
Pertes moyennes
1 mg (h)
2-3 mg (f)
80 %
20%
Rophéocytose
Fer sérique
11 umol/l (h)-12,5 umol/l (f) à 34 umol/l sur la
transferrine
20 %
Figure 6: Cycle physiologique du fer
dans l'organisme (Bernard et al., 1996)
Le mécanisme par lequel le volume
plasmatique augmente, est fonction de quelques éléments
physiologiques. Ainsi, des faibles taux de vasodilatateurs tels que la
kallicréine, la prostacycline, certaines hormones telles que
l'aldostérone et le peptide natriurétique,
pourraient interférer avec l'expansion du volume plasmatique (Salas
et al., 1993). Au cours de la grossesse, les oestrogènes
placentaires entraînent une augmentation de la production
d'aldostérone qui provoque la réabsorption de sodium par
le rein et la rétention d'eau. La kallicréine
participerait à la régulation du volume extracellulaire, de la
pression sanguine, à l'excrétion du sodium, de l'eau et
à la résistance vasculaire rénale. De ce fait, un
taux diminué de kallicréine ou de prostacycline altèrerait
la vasodilatation normale en début de grossesse affectant ainsi
l'expansion du volume plasmatique.
De même, la masse des globules rouges augmente pendant
la grossesse environ de 18% chez les femmes qui ne prennent pas de
suppléments de fer et de 30% chez celles qui en prennent (Hytten,
1985 ; Puolakka, 1990). Elle diminue très faiblement dès le
début du premier trimestre (Taylor et Lind, 1979). La masse des globules
rouges augmente graduellement depuis la fin du premier
trimestre jusqu'à l'accouchement (Hytten, 1985; Williams et Wheby,
1992). Ceci est accru lors des grossesses multiples et
répétées (Hytten, 1985).
L'augmentation plus importante du volume plasmatique et de la
masse érythrocytaire provoque une dilution des paramètres
biochimiques ainsi qu'un abaissement des concentrations sanguines (Goodlin
et al., 1983).
5. Paramètres biologiques d'évaluation du
statut en fer
Plusieurs paramètres biologiques sont disponibles pour
évaluer l'état en fer d'un organisme humain. Cette
évaluation se fait dans plusieurs compartiments selon la
sensibilité, la spécificité et la faisabilité des
différents indicateurs biologiques.
5-1. Compartiment de réserves en fer
5-1-1. Ferritine sérique
La ferritine sérique détermine
la taille des réserves en fer et la forme de stockage
la plus facilement mobilisable du fer. On la trouve dans l'intestin, le foie,
la rate, la moelle osseuse et le plasma sanguin. Dans le plasma sanguin, la
ferritine représente une forme de dépôt temporaire de fer
qui correspond pour les dosages biochimiques à la quantité de
réserves en fer d'un organisme (Walter et al., 1989; Cook,
1990 ; Beard, 1994).
Un taux de ferritine sérique situé entre 12 et
20 ug/l indique que les réserves sont abaissées, tandis qu'un
taux inférieur à 12 ug/l signifie un épuisement complet
des réserves en fer (Cook, 1990; Gibson, 1990). En présence
d'anémie, un taux de ferritine sérique situé entre 12 et
15ug/l met en évidence la présence de déficience en fer
(Cook, 1990; Beard, 1994; Scholl et Hediger, 1994), alors que des valeurs
supérieures à 110 ug/l traduisent une surcharge en fer (Cook,
1990). Dans des conditions de syndromes inflammatoires ou en présence
d'infection, la sensibilité de la ferritine est affectée (Blake
et al., 1981 ; Yip et Dallman, 1988 ). Ainsi le taux de
ferritine sérique pourrait être normal ou augmenté.
Toutefois, ce paramètre biochimique est considéré comme le
plus fiable et le plus spécifique pour dépister la carence en fer
chez tout individu (Warren et Thompson, 1988).
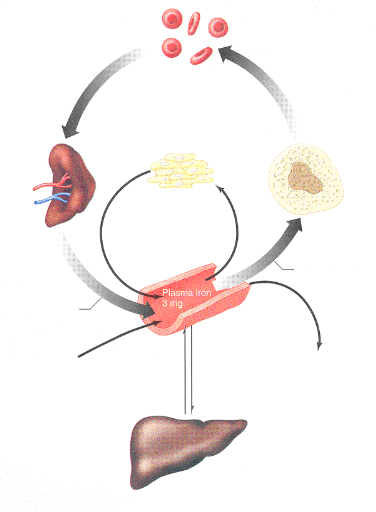
Globules rouges
Recirculation du fer
Recirculation du fer
Moelle osseuse
Toutes autres cellules
Vaisseau sanguin
Absorption alimentaire
Réserves du fer (Foie)
Formation de nouveaux globules rouges
Pertes (Urines, cellules cutanées, sueur, menstrues)
1-3 mg/jour
Rate et foie
Destruction de globules rouges sénescents
Figure 7: Métabolisme du fer
dans l'organisme (Vander et al, 2001)
5-1-2. Hémosidérine
L'hémosidérine représente la partie
très peu mobilisable des réserves en fer de l'organisme. Elle se
retrouve essentiellement dans les tissus lorsque les réserves globales
en fer sont importantes. Comme la ferritine, ce composé contient du fer
trivalent. Son contenu en fer est en général supérieur
à celui de la ferritine. L'hémosidérine se trouve à
l'état de dépôt soit extracellulaire, soit à
l'intérieur des cellules réticulo-endothéliales. Elle
coexiste également en association avec la ferritine dans certains
érythroblastes, érythrocytes et en faible quantité dans le
foie. Lorsque les concentrations de fer tissulaire augmentent, la proportion
relative d'hémosidérine et de ferritine dans les tissus
n'augmente pas parallèlement.
5-2. Compartiment plasmatique et d'alimentation
tissulaire
5-2-1. Récepteurs solubles de la transferrine
Toutes les cellules en croissance ou ayant une fonction
métabolique ont besoin de fer. Le mécanisme par lequel le fer
rentre dans les cellules est depuis quelques années mieux cerné
(Carriaga et al., 1991). Le fer est lié à sa
protéine de transport dans le sang, la transferrine, qui possède
un récepteur glycoprotéique spécifique sur la surface des
cellules. Pour le transport du fer à travers la membrane cellulaire, la
transferrine se lie à son récepteur cellulaire et elle est
ensuite internée par endocytose. Quand le pH de la vésicule
endocytaire chute, le fer est libéré dans le
cytoplasme. La transferrine liée à son récepteur, est
relâchée (Baynes et al., 1994).
Sa détermination revêt une importance
particulière au niveau clinique et nutritionnel car c'est un indicateur
sensible des réserves en fer de l'organisme. En effet, sa concentration
varie selon l'état en fer de l'individu. Elle est augmentée par
la déficience en fer (Baynes et al., 1994; Beard, 1994). Elle
ne semble pas être affectée par l'infection,
l'inflammation ou les maladies chroniques.
5-2-2.Transferrine sérique
Encore appelée la sidérophiline, la transferrine
de poids moléculaire de 79570 daltons, est une glycoprotéine
synthétisée par le foie. Son principal rôle est le
transport du fer dans le plasma et dans les liquides extracellulaires en
général et singulièrement vers le système
érythropoïétique où sont produits les globules
rouges. La transferrine est également chargée d'assurer la
récupération du fer libéré par l'hémolyse et
la dégradation de l'hémoglobine.
Sa synthèse au niveau du foie est réduite (en
dessous de 2 g/l) en cas de graves carences protéiniques car, la
transferrine constitue un des indicateurs biologiques utilisés dans le
diagnostic de l'état de malnutrition protéinique (SNDLF, 2001).
Cependant, elle est élevée (au dessus de 4 g/l) en cas de carence
martiale (Vernet et al., 2001). Du fait de ces 2 sites de fixation du
fer, la transferrine n'est saturée chez le sujet normal qu'au tiers de
sa capacité (Finch et Huebers, 1982).
Dans le plasma, la transferrine possède plusieurs
formes moléculaires selon sa liaison avec le fer. Il s'agit de la forme
monoferrique (n'ayant fixé le fer sur l'un ou l'autre des 2 sites), la
forme diferrique (ayant fixé le fer sur les 2 sites) et la forme
apotransferrine (n'ayant pas fixé de fer) (Wagner, 2000).
5-2-3. Capacité totale de fixation (CTF) et
coefficient de saturation (CST)
La capacité totale de fixation du fer correspond
à la quantité totale de fer qui peut être
liée par la transferrine présente dans le
sérum. Le coefficient de saturation de la transferrine est le rapport du
fer sérique sur la capacité totale de fixation du fer.
L'augmentation de la capacité totale de fixation du fer entraîne
une diminution du coefficient de saturation de la transferrine. La
capacité totale de fixation du fer est moins affectée
comparativement au coefficient de saturation par les variations biologiques
d'un individu (Gibson, 1990).
Une diminution du pourcentage de saturation de la transferrine
est un indicateur de la déficience en fer si et seulement si elle est
associée à une augmentation de la capacité totale de
fixation du fer (Cook, 1982). La capacité totale de fixation du fer est
diminuée comme la transferrine sérique en présence d'un
syndrome inflammatoire (Gibson, 1990).
5-2-4. Fer sérique
Le fer sérique est le fer circulant dans l'organisme.
Il est lié à la transferrine pour son transport.
Au cours de l'épuisement des réserves en fer, on voit
apparaître lors de la deuxième phase de la carence martiale, une
érythropoïèse déficiente en fer qui se traduit par
l'abaissement du fer sérique. Le fer sérique comme le pourcentage
de saturation de la transferrine est très affecté par les
variations biologiques de l'organisme (Bernard et al., 1977 ;
Fielding, 1980).
6. Anémie
6-1. Définition
L'anémie se définit comme étant la baisse
du taux d'hémoglobine en dessous de la limite inférieure à
la normale. Les organismes internationaux tels que l'OMS, le centre de
contrôle des maladies aux états unis d'Amérique (CDC/USA)
et l'Institut de médecine aux Etats Unis d'Amérique
(IOM/USA), ont établi le critère d'anémie à
partir des valeurs de l'hémoglobine selon les trimestres de la
grossesse. Ce qui se traduit par un taux d'hémoglobine inférieur
à 11 g/dl au premier trimestre et au
troisième trimestre de la grossesse, à 10,5 g/dl
au deuxième trimestre, comparativement à 12
g/dl chez les femmes en âge de procréer
non enceintes (Graitcer et al., 1981). Pour l'hématocrite, les
limites normales sont de 33 % au premier et au troisième trimestre, de
32 % au deuxième, comparativement à 35 % chez les femmes en
âge de procréer non enceintes (CDC/USA, 1989 ; IOM, 1990 ;
Williams et Wheby, 1992; Beard, 1994 ; UNICEF/WHO/UNU/MI, 1999).
6-2. Mécanisme de constitution d'une
anémie
L'anémie est provoquée soit par une insuffisance
de production médullaire (mécanisme central), soit une
hémolyse ou enfin par une perte d'hématies au cours d'une
hémorragie (mécanisme périphérique) (Vander et
al., 2001).
6-2-1. Anémies de cause centrale
L'indice biologique de l'anémie d'indication centrale,
est le taux de réticulocytes. On distingue 2 types d'anémies de
causes centrales :
- l'insuffisance médullaire quantitative par
défaut de cellules souches et qui peut soit être portée sur
la seule lignée érythrocytaire soit sur l'ensemble de toutes les
cellules hématopoïétiques ;
- l'insuffisance médullaire qualitative ; dans ce
cas la moelle osseuse est normale, voire hypercellulaire, mais les cellules
produites sont qualitativement anormales (drépanocytose) (Najman et
al., 1994 ; Bernard et al., 1996 ; Vander et
al., 2001).
6-2-1-1. Anémie par insuffisance
médullaire quantitative
Cette forme d'anémie pourrait être liée
à :
- une baisse du taux d'érythroblastes au niveau de la
moelle osseuse ;
- une aplasie médullaire qui est l'appauvrissement de
la moelle osseuse en cellules hématopoïétiques ;
- un défaut de production de
l'érythropoïétine, hormone stimulant
l'érythropoïèse,
- un envahissement de la moelle osseuse par les cellules
hématopoïétiques anormales (leucémies, lymphome), ou
par les cellules non hématopoïétiques telles les cellules
métastasiques (Bernard et al., 1996 ; Vander et
al., 2001).
6-2-1-2. Anémie par insuffisance
médullaire qualitative
Dans ce cas de figure, la moelle osseuse présente un
état normal, cependant le mécanisme
érythropoïétique enregistre un déficit en
matériaux de synthèse. Il peut s'agir de :
- une carence en fer, en folates, en vitamine B12
et en B6 ;
- un détournement ou d'un défaut d'utilisation
de fer dans les anémies inflammatoires et les
thalassémies ;
- une myélodysplasie qui traduit les anémies
réfractaires.
Pour les anémies de cause centrale, le taux de
réticulocytes est abaissé, on parle alors d'anémie
arégénérative (Wacjman et al., 1992 ;
Bernard et al., 1996).
6-2-2. Anémie de cause
périphérique
La production de globules rouges n'est pas mise en cause, mais
il y a simplement une destruction des globules rouges en
périphérie pour ce type d'anémie. Le taux de
réticulocytes est en hausse traduisant la
régénération médullaire. Il s'agit dans ce cas,
d'anémie régénérative repartie sous 2
groupes :
6-2-1-1. Anémie par hémorragies
Les hémorragies aigues et abondantes entraînent
des anémies (Bernard et al., 1996). Dans un premier temps,
l'hémorragie provoque une perte équivalente de plasma et
d'éléments figurés. Les paramètres de
l'hémogramme ne sont donc pas perturbés. Secondairement, il se
produit un afflux de liquide du compartiment extravasculaire. Une
hémodilution survient et les paramètres de l'hémogramme
sont alors modifiés. Après quelques heures, la synthèse
d'érythropoïétine est augmentée, à l'origine
d'une hyperréticulocytose. L'origine de l'anémie est
généralement évidente et ne nécessite pas de bilan
particulier (Wacjman et al., 1992).
6-2-1-2. Anémie par hémolyses
pathologiques
Les hémolyses pathologiques sont d'origine
corpusculaire et extracorpusculaire. Elles entraînent des anémies
hémolytiques caractérisées par une destruction
précoce et intense des globules rouges. Les hémolyses d'origine
extracorpusculaire sont de causes multiples généralement
acquises. Il s'agit d'hémolyses d'origine mécanique, infectieuse,
toxique et immunologique. Pour les hémolyses d'origine corpusculaire,
les causes sont également multiples, l'origine héréditaire
étant la règle. Elles concernent les anomalies de la membrane du
globule rouge et de l'hémoglobine et par défaut enzymatique
(Bernard et al., 1996).
6-3. Classification des anémies
La classification des anémies peut être
basée sur l'établissement de l'hémogramme qui correspond
au diagnostic biologique. L'hémogramme est l'étude quantitative
et qualitative des éléments figurés du sang
périphérique. Ce diagnostic biologique doit être
méthodique et passer obligatoirement par 3 étapes essentielles
à savoir :
- l'affirmation de l'anémie à partir du taux
d'hémoglobine selon le sexe et l'âge ;
- la précision du mécanisme central ou
périphérique de l'anémie en fonction des indices
érythrocytaires ;
- la détermination de la cause de l'anémie.
Lorsque les 3 indices érythrocytaires sont
abaissés (accompagnés d'une réduction
d'hémoglobine), on parle d'anémie microcytaire et hypochrome.
Celle-ci résulte d'un trouble du métabolisme du fer qui aboutit,
d'une part à un défaut de production
d'hémoglobine observé dans la carence en fer. D'autre part,
ce trouble métabolique du fer peut conduire à un défaut
d'utilisation du fer rencontré dans les inflammations. Si le VGM est
élevé, la TCMH et la CCMH normales (taux d'hémoglobine
bas), alors l'anémie est macrocytaire normochrome. Celle-ci traduit un
défaut de synthèse du matériel génétique
dû essentiellement à plus de 95 % à une carence vitaminique
(acide folique, vitamine B12 et vitamine B6) (Wajcman
et al., 1992). Quand ces 3 indices
érythrocytaires sont normaux et le taux d'hémoglobine
réduit, il s'agit d'anémie normocytaire et normochrome. Dans ce
cas, il est indispensable de déterminer le taux de réticulocytes
dans le sang périphérique. Si ce taux est élevé,
nous sommes en présence d'une anémie normocytaire normochrome
régénérative due à une hémolyse importante
ou une hémorragie aigue et abondante. Dans le cas contraire, nous avons
une anémie normocytaire normochrome arégénérative,
de cause centrale (Tableau II).
6-4. Conséquences de l'anémie sur le
déroulement de la grossesse
Selon plusieurs études, une anémie maternelle
légère ou modérée n'a pas d'impact sur
l'hémoglobine foetale et sur les valeurs de la ferritine sérique
(Bhargava et al., 1989 ; King, 2000 ; Chang et al.,
2003a). Toutefois, on remarque qu'une anémie maternelle
sévère serait associée à une augmentation de la
concentration du niveau d'hémoglobine et de ferritine chez le foetus et
à une diminution du temps de gestation ainsi que du poids à la
naissance (Bhargava et al., 1989). D'autres travaux ont
également indiqué que l'anémie maternelle en début
et en fin de grossesse, est associée à une réduction du
poids du placenta, un taux élevé de naissances
prématurées, d'un petit poids à la naissance et d'une
augmentation de morbidité et de mortalité foetales et maternelles
(Allen, 1997 ; Msolla et Kinabo, 1997). Par conséquent, il semble
évident que l'anémie maternelle pendant la grossesse affecte
négativement la croissance foetale et l'organisme de la mère. De
plus, l'apport en oxygène peut avoir un lien direct avec le
développement placentaire et le poids à la
naissance. Comme la concentration maternelle en hémoglobine chute
pendant la grossesse, le transport de l'oxygène au placenta peut
être compromis, affectant ainsi le développement du foetus
(Johnson et al., 1992; Toohey et al., 1995).
Tableau II: Classification
hématologiques des anémies tropicales (Vander
et al., 2001)
Anémies
hypochromes ou
microcytaires
Hémoglobinoses
Déficit en G6PD
Globulaires
Régénératives
Hémorragies aigues
Thalassémies, Hémoglobinoses C
Ferriprive
Inflammatoire
Carence d'apport (nourrisson)
Carence d'absorption
Carence relative (grossesse)
Hémorragies chroniques
Ankylostomiases
Arégénératives
hyposidérémiques
Régénératives
hypersidérémiques
Anémies normochromes
non macrocytaires
Hémolyses
Paludisme
Bartonellose
Infections
Intoxication (venin de serpents) immunologiques
Extraglobulaire
Normocytaires
Carence en folates
Arégénératives
Macrocytaires
Insuffisance rénale
Hémopathies
Aplasies
1. Matériel
1-1. Sujets
Sept cent cinquante six (756) femmes, âgées de 15
à 48 ans, ont participé volontairement à l'étude.
L'étude s'est déroulée sur une période allant du
1er juin 2004 au 30 juin 2006 dans 4 formations sanitaires et
urbaines et dans des ménages de 3 communes de la ville d'Abidjan
(Côte d'Ivoire). Ces communes sont : Abobo, Cocody et
Port-Bouët. Elles sont réparties en 2 groupes selon qu'elles
étaient enceintes ou non.
IMC (kg.m-2) =
Masse du sujet (kg)
[Taille du sujet (m)]2
Le statut pondéral des différentes femmes est
établi sur la base de l'indice de masse corporelle (IMC) défini
selon les critères du centre de contrôle des maladies des Etats
Unis d'Amérique (CDC/USA, 1989).
Selon les recommandations du centre de contrôle des
maladies (CDC/USA), 4 classes de statut pondéral de femmes sont
définies. Mais le cadre notre étude, 3 classes sont retenues pour
une exploitation adéquate des résultats. Il s'agit de la
classe:
- des femmes au statut pondéral insuffisant avec un
IMC < 19,8 kg.m-2 ;
- des femmes au statut pondéral normal avec un IMC
compris entre 19,8 et 26 kg.m-2 ;
- des femmes ayant une surcharge de poids avec un IMC > 26
kg.m-2.
1-1-1. Groupe de femmes en âge de procréer non
enceintes
Le groupe de femmes en âge de procréer non
enceintes considérées comme le groupe témoin est
constitué de 225 femmes et âgées de 15 à 48 ans avec
une moyenne de 24,5 #177; 0,5 an. Elles sont recrutées dans des
ménages des mêmes communes de la ville d'Abidjan que celles des
femmes enceintes. Ces communes, au nombre de 3 sont : la commune de
Cocody, la commune de Port-Bouët et la commune d'Abobo.
Un tiers (33,3 %) de la population témoin était
des adolescentes (entre 15 et 19 ans). D'un indice de masse corporelle (IMC)
moyen de 22,4 #177; 0,3 kg.m-2, 57,7 % des femmes ont
présenté un statut pondéral normal, 25,8 % avaient un
déficit pondéral et 16,9 % ont présenté une
surcharge de poids. Les femmes témoins ont présenté une
parité comprise entre 0 et 7 avec 64 % de nullipares
(Tableau III).
Le tableau IV a résumé les
caractéristiques anthropométriques des femmes en âge de
procréer non enceintes selon les différentes communes
sélectionnées pour ce travail.
1-1-2. Groupe de femmes enceintes
Le groupe de femmes enceintes est composé de 531 femmes
âgées de 15 à 43 ans (25,1 #177; 0,3 an) sur un effectif
total de 805 femmes enceintes en consultation durant la période
d'étude (Figure 8). Ces femmes enceintes sont
recrutées dans 4 formations sanitaires, communautaires et urbaines des
mêmes communes de la ville d'Abidjan que celles des femmes en âge
de procréer non enceintes. Il s'agit des: Formation Sanitaire et
Urbaine Sud d'Abobo, Formation Sanitaire et Urbaine Sud de Cocody, Formation
Communautaire Sanitaire et Urbaine « les HORTENSIAS » de
Vridi-SIR (Port-Bouët) et l'Hôpital Municipal de Vridi-Cité
(Port-Bouët).
Le nombre de grossesse de ces femmes est situé entre 1
et 10 (3 #177; 0,1), la dernière étant prise en compte dans
cette étude. Pour le groupe de femmes enceintes, 22,4 % étaient
primigestes contre 77,6 % de multigestes. Leur parité est comprise
entre 0 et 8 (1,3 #177; 0,1) et l'espace entre les 2 dernières
grossesses est situé entre 10 et 168 mois (14 ans). Les femmes
enceintes ont présenté 40,1 % de nullipares contre 27,3 % de
primipares et 32,6 % de multipares. Une proportion de 71,4 % de femmes
enceintes a observé moins de 3 ans entre la grossesse
précédente et celle qui était en cours.
Les valeurs moyennes de l'indice de masse corporelle au cours
de la grossesse sont représentées dans le
tableau III. Sur la base de l'indice de masse corporelle,
29,8 % ; 13,6 % et 8,3 % des femmes ont présenté un
déficit pondéral contre 18,2 % ; 25,2 % et 35,2 % de femmes
enceintes qui avaient une surcharge de poids respectivement aux premier, second
et troisième trimestres (Tableau IV).
1-1-3. Critères d'inclusion et d'exclusion des
sujets
Les femmes en âge de procréer non enceintes
apparemment saines sont sélectionnées dans les ménages des
3 communes choisies de la ville d'Abidjan. En ce qui concerne les femmes
enceintes, les sujets, au premier trimestre de la grossesse apparemment sains
sont recrutés dans les 4 formations sanitaires des 3 communes choisies
de la ville d'Abidjan. Toutefois, sur la base des documents fournis par les
agents de santé et des fiches d'enquêtes, les femmes qui ont
présenté des complications de l'hypertension artérielle,
de diabète, de rhumatisme articulaire sont exclues de la population
étudiée. Il en était de même pour les sujets
récemment transfusés et ceux qui ont indiqué des
pathologies gynécologiques, digestives et d'hémoglobines
anormales.
Dans le même sens, la prise de suppléments en
fer, vitamines ou autres suppléments nutritionnels n'était pas
prise en compte chez les femmes de notre étude.
Par ailleurs, les femmes en âge de procréer non
enceintes, en période de menstruation et d'allaitement sont exclues de
ce groupe de femmes témoins.
Cette étude a été approuvée par le
Ministère de l'Enseignement Supérieur et de la Recherche
Scientifique et le Ministère de la Santé et de l'Hygiène
publique de la République de Côte d'Ivoire.
Hort.- Port-Bouët
137
Premier trimestre de la grossesse (N = 805)
Deuxième trimestre de la grossesse (N =
623)
Troisième trimestre de la grossesse (N =
531)
FSU-Sud Abobo
212 (146)
FSU-Sud Cocody
187 (121)
HM-Port-Bouët
193 (127)
Hort.- Port-Bouët
203 (137)
FSU-Sud Abobo
166 (146)
FSU-Sud Cocody
141 (121)
HM-Port-Bouët
147 (127)
Hort.- Port-Bouët
158 (137)
FSU-Sud Abobo
146
FSU-Sud Cocody
121
HM-Port-Bouët
127
PHASE 1
PHASE 2
PHASE 3
Figure 8: Différents effectifs des
femmes sélectionnées selon les phases de l'étude
N : Effectif retenu pour chaque phase de
sélection des sujets ; FSU : Formation sanitaire
urbaine ; HM : Hôpital municipal ; Hort :
Hortensia ; les effectifs retenus dans le cadre de l'étude sont en
parenthèses
Tableau III: Proportions (%) des valeurs
anthropométriques des femmes sélectionnées dans les 3
communes de la ville d'Abidjan
|
Variables anthropométriques
|
Femmes non enceintes
N = 225
|
Femmes enceintes
N = 531
|
|
|
|
|
Age (ans)
|
24,5 #177; 0,5
|
25,1 #177; 0,3
|
|
15 - 19 ; n' = 75 ; n = 112
|
33,3
|
21,1
|
|
20 - 48 ; n' = 150 ; n = 419
|
66,7
|
73,9
|
|
IMC (kg.m-2)á
|
22,4 #177; 0,3
|
22,5#177; 0,2 ; 23,8 #177; 0,2 ; 25,1 #177; 0,2
|
|
< 19,8 ; n' = 58 ; n = 158 ; n1 = 72 ;
n2 = 44
|
25,8
|
29,8 ; 13,6 ; 8,3
|
|
19,8 - 26 ; n' = 129 ; n = 276 ; n1 = 330 ; n2
= 300
|
57,3
|
52 ; 62,2 ; 56,5
|
|
> 26 ; n' = 38 ; n = 97 ; n1 = 134 ; n2
= 187
|
16,9
|
18,2 ; 25,2 ; 35,2
|
|
Gestité
|
2 #177; 0,1
|
3 #177; 0,1
|
|
Primigestes ; n' = 70 ; n = 119
|
31,1
|
22,4
|
|
Multigestes ; n' = 155 ; n = 412
|
68,9
|
77,6
|
|
Parité
|
1 #177; 0,1
|
1,3 #177; 0,1
|
|
Nullipares ; n' = 144 ; n = 213
|
64
|
40,1
|
|
Primipares ; n' =46 ; n = 145
|
20,4
|
27,3
|
|
Multipares ; n' = 35 ; n = 173
|
15,5
|
32,6
|
|
Espace Intergénésique (Mois)
|
57,6 #177; 2,7
|
38,4 #177; 1,8
|
|
< 36 ; n' = 51 ; n = 294
|
22,7
|
71,4
|
|
= 36 ; n' = 104 ; n = 118
|
46,2
|
28,6
|
N : Effectif total des femmes
sélectionnées selon les différents groupes;
á: Proportions et moyennes des femmes respectivement au
premier, au second et au troisième trimestres de la grossesse ;
n' : Effectifs des femmes en âge
de procréer non enceintes recrutées pour chaque classe
épidémiologique ; n ;
n1 ;
n2 : Effectifs des femmes
sélectionnées pour chaque classe épidémiologique
respectivement au premier, au second et au troisième de la grossesse.
Tableau IV : Proportions (%) des valeurs
anthropométriques des femmes en âge de procréer selon les
différentes communes
|
Données anthropométriques
|
Abobo
(N = 95)
|
Cocody
(N = 60)
|
Port-Bouët
(N = 70)
|
|
Age (ans)
|
19,6 #177; 1
|
28,7 #177; 1
|
27,6 #177; 1
|
|
15 - 19 ; n = 42 ; n1 = 20 ; n2
= 10
|
43,7
|
33,3
|
14,3
|
|
20 - 48 ; n = 53 ; n1 = 40 ; n2 =
60
|
56,3
|
66,7
|
85,7
|
|
IMC ( kg.m-2)
|
21,5 #177; 0,4
|
23 #177; 0,5
|
23,2 #177; 0,4
|
|
< 19,8 ; n = 32 ; n1 = 17 ; n2 =
9
|
33,7
|
28,3
|
12,9
|
|
19,8 - 26 ; n = 55 ; n1 = 28 ; n2 =
49
|
57,9
|
46,7
|
70
|
|
> 26 ; n = 8 ; n1 = 15 ; n2 = 12
|
8,4
|
25
|
17,1
|
|
Gestité
|
|
|
|
|
Primigestes ; n = 30 ; n1 = 15 ;
n2 = 25
|
13,3
|
6,7
|
11,1
|
|
Multigestes ; n = 65 ; n1 = 45 ; n2 =
45
|
28,9
|
20
|
20
|
|
Parité
|
0,3 #177; 0,1
|
1 #177; 0,1
|
0,4 #177; 0,1
|
|
Nullipares ; n = 45 ; n1 = 24 ; n2 =
22
|
46,8
|
39,8
|
31
|
|
Primipares ; n = 6 ; n1 = 12 ; n2 =
33
|
6,8
|
20,5
|
47,3
|
|
Multipares ; n = 44 ; n1 = 24 ; n2 =
15
|
46,4
|
39,7
|
21,7
|
|
Espace Intergénésique (Mois)
|
|
|
|
|
< 36 ; n = 25 ; n1 = 12 ; n2 =
14
|
11,1
|
5,3
|
6,2
|
|
= 36 ; n = 40 ; n1 = 33 ; n2 = 31
|
17,8
|
14,7
|
13,8
|
N : Effectif total des femmes
sélectionnées selon les différentes communes ;
n ; n1 ;
n2 : Effectifs des femmes
sélectionnées en âge de procréer pour chaque classe
épidémiologique respectivement dans les communes d'Abobo, de
Cocody et de Port-Bouët.
Tableau V : Proportions (%) des valeurs
anthropométriques et du suivi de la grossesse des femmes selon les
différentes formations sanitaires
|
Données anthropométriques
|
FSU-Sud d'Abobo
N = 146
|
FSU-Sud de Cocody
N = 121
|
Hortensias de Port-Bouët
N = 137
|
Vridi-Cité de Port-Bouët
N = 127
|
|
Age (ans)
|
24,9 #177; 0,5
|
26,2 #177; 0,6
|
21,3 #177; 0,4
|
24,7 #177; 0,4
|
|
15 - 19
|
35,1
|
20,9
|
38,2
|
34,8
|
|
20 - 43
|
64,9
|
79,1
|
61,8
|
65,2
|
|
IMC (kg.m-2) á
|
|
|
|
|
< 19,8
|
15,1 ; 4,8 ; 3,4
|
10,7 ; 3,3 ; 0,8
|
37,7 ; 41,2 ; 49
|
33,7 ; 21,6 ; 13,6
|
|
19,8 - 26
|
66,4 ; 67,1 ; 56,8
|
65,3 ; 62,8 ; 51,2
|
43 ; 46,4 ; 51
|
53 ; 59,1 ; 59,5
|
|
> 26
|
18,5 ; 28,1 ; 39,8
|
24 ; 33,9 ; 47,9
|
19,3 ; 12,4 ; -
|
13,3 ; 19,3 ; 26,9
|
|
Gestité
|
2,7 #177; 0,1
|
2,9 #177; 0,2
|
3,8 #177; 0,2
|
3,1 #177; 0,1
|
|
Primigestes
|
24
|
41,5
|
13,4
|
22
|
|
Multigestes
|
76
|
58,5
|
86,6
|
78
|
|
Parité
|
1,1 #177; 0,1
|
1,1 #177; 0,1
|
2,3 #177; 0,2
|
1,5 #177; 0,1
|
|
Nullipares
|
24
|
40
|
10,8
|
23,4
|
|
Primipares
|
16
|
35,2
|
21,2
|
36,4
|
|
Multipares
|
60
|
24,8
|
68
|
40,2
|
|
Espace
Intergénésique
(mois) 27,3 #177; 2,7
26,8 #177; 2,8
|
15,7 #177; 1,3
|
18, 5 #177; 1,3
|
|
< 36
|
63,7
|
44,5
|
78,6
|
57
|
|
= 36
|
36,3
|
55,5
|
21,4
|
43
|
N : Effectif total des femmes enceintes
sélectionnées,
á: Proportions et moyennes des femmes
respectivement au premier, au second et au troisième trimestres de la
grossesse ; - : Aucune observation n'a été faite.
1-2. Matériel technique
Pour les besoins de nos manipulations, plusieurs appareils
sont utilisés, à savoir :
- Une centrifugeuse de marque « SELECTA »
et de type « Mixtasel » ;
- Un compteur analyseur hématologique de marque
« SYSMEX » et de type « Poch 100 i »
(1-5-1 Wakinohama-Kaigandori, Chuo-Ku, Kobe 651-0073, Japon) ;
- Un automate, « LisaBio 300 » (Hycel
groupe, Pouilly en Auxois, France).
1-3. Produits chimiques
Les réactifs de dosage des échantillons sanguins
ont constitué l'essentiel des produits chimiques utilisés dans
cette étude. Ce sont des réactifs des dosages
hématologiques et biochimiques. Les réactifs de dosages
hématologiques sont composés de diluant,
« pocH-pack-D » et de lyse,
« pocH-pack-L ». Ceux des dosages biochimiques ont
comporté les kits « Iron FerroZine »,
« Transferrin Immunoturbidimetric » et « Ferritin
Turbilatex » fournis par la compagnie SPINREACT S.A (Ctra.Santa
Coloma, Espagne).
2. Méthodes
2-1. Prélèvements des échantillons
sanguins
Chez chacune des femmes recrutée, un
prélèvement de sang par ponction veineuse franche recueilli sur
un tube sec et sur un tube avec anticoagulant (EDTA) de 5 ml chacun, est
effectué à jeûn au pli du coude le matin. Par ailleurs, il
est réalisé chez les femmes enceintes à chaque trimestre
de la grossesse (entre 8 et 15 semaines d'aménorrhée pour le
premier trimestre, entre 16 et 28 semaines d'aménorrhée pour le
second trimestre, enfin 29 et 36 semaines d'aménorrhée pour le
troisième trimestre). La détermination des paramètres
hématologiques est effectuée immédiatement à partir
des prélèvements sur les tubes EDTA par un analyseur
hématologique automatique Sysmex-Poch 100 i (1-5-1
Wakinohama-Kaigandori, Chuo-Ku, Kobe 651-0073, Japon). Les
prélèvements contenus dans les tubes secs, sont
centrifugés à 3000 tours/min pendant 5 min et le sérum est
aliquoté, puis conservé à - 20° C pour le dosage des
paramètres biochimiques. Les concentrations sériques de fer sont
déterminées par la méthode colorimétrique tandis
que les teneurs sériques de transferrine et de ferritine sont mises en
évidence par la méthode immunoturbidimétrique. La
capacité totale de fixation du fer par la transferrine
(CTF) et le coefficient de saturation de la transferrine par
le fer (CST) sont déduits par le calcul (Vernet et
al., 1981).
Chaque dosage d'échantillon sanguin du même
prélèvement est dupliqué pour réduire les
éventuelles erreurs de manipulations. Et la moyenne des 2 valeurs
obtenues est utilisée pour la suite de l'étude.
2-2. Dosages des paramètres biologiques
Les dosages des échantillons sanguins sont
effectués selon les techniques de dosages hématologiques et
biochimiques. Ainsi 11 paramètres biologiques comprenant 6 variables
hématologiques et 5 indicateurs biochimiques sont analysés.
2-2-1. Techniques hématologiques
Les échantillons sanguins prélevés sur
anti-coagulant EDTA, ont permis directement de réaliser la
numération globulaire (le nombre de globules rouges, les taux
d'hémoglobine et d'hématocrite) et à estimer les indices
érythrocytaires (VGM, TCMH et CCMH) par un analyseur
hématologique automatique Sysmex-Poch 100 i. En effet, le sang obtenu
sur anti-coagulant EDTA, est dilué avec du pocH-pack-D (diluant) dans un
bac de comptage de l'automate dans lequel est déterminé le nombre
de globules rouges par la méthode de détection cellulaire. Un
volume fixe de la lyse, pocH-pack-L (un volume de lyse pour 2 volumes du
diluant) est ensuite ajouté automatiquement pour obtenir une dilution
finale au 1/500. L'adjonction du pocH-pack-L, lyse les globules rouges et
réduit le stroma cellulaire résiduel à un niveau non
détectable par l'appareil. L'hémoglobine est
libérée pendant la lyse des globules rouges et convertie en
méthémoglobine. Une partie de cet échantillon
dilué, est automatiquement transférée vers le
photomètre de l'appareil dans lequel l'absorption du pigment
respiratoire est mesurée pour déterminer sa concentration.
L'autre partie de l'échantillon dilué, est utilisée par le
microprocesseur de l'automate pour déterminer les indices
érythrocytaires.
2-2-2. Techniques biochimiques
Les méthodes biochimiques utilisées dans cette
étude sont issues des techniques de dosages des kits fournis par la
compagnie SPINREACT S.A (Ctra.Santa Coloma, Espagne). L'automate LisaBio 300
(Hycel groupe, Pouilly en Auxois, France) a permis la lecture de valeurs des
concentrations sériques de fer, de transferrine et de ferritine.
2-2-2-1. Dosage du fer sérique
La mesure des concentrations sériques du fer est
réalisée par dosage colorimétrique qui a utilisé le
kit « Iron FerroZine ».
2-2-2-1-1. Principe du dosage du fer
Dans le sang, le fer est lié à la transferrine
sous la forme trivalente (forme oxydée ou forme ferrique ou
Fe3+). L'utilisation d'un milieu acide a favorisé la rupture
de la liaison transferrine-fer. Nous obtenions donc la forme ferreuse ou forme
réduite du fer (Fe2+).
En présence du chromogène (FerroZine), les ions
ferreux ont formé un complexe coloré qui est mesuré par
l'automate Lisa Bio 300. L'intensité de coloration de ce complexe
était proportionnelle à la concentration du fer dans
l'échantillon de sérum.
2-2-2-1-2. Détermination des concentrations
sériques de fer
Le chromogène et l'étalon (fer aqueux standard
de niveau fondamental ou « IRON Calibrator ») sont
conditionnés par le fabricant pour un usage direct. Cependant, le tampon
et le réducteur sont associés pour obtenir le réactif de
travail. Selon les recommandations du kit « Iron
FerroZine », nous avons dissout le contenu d'un tube R2
(Réducteur) dans celui d'une boite de R1 (Tampon) pour
former le réactif de travail (RT). Pour les besoins des manipulations,
nous avons préparé le contenu de chaque tube avant la lecture
à l'automate LisaBio 300 suivant également les recommandations
du kit « Iron FerroZine » (Tableau VI). Le
contenu de chaque tube est modérément mélangé puis
incubé pendant 10 minutes à la température du laboratoire.
La mesure des concentrations sériques de fer associant leur
contrôle est réalisée automatiquement par l'automate
LisaBio 300. Pour les valeurs normales selon ce kit, les concentrations
sériques du fer sont entre 7,16 et 26,85 umol/l.
Tableau VI: Mode opératoire pour
la lecture des concentrations sériques du fer
|
Réactifs
|
Tube
Blanc réactif
de travail
|
Tube
étalon de fer
|
Tube
échantillon
de sérum
|
Tube témoin échantillon
|
|
Réactif de travail (ml)
|
1
|
1
|
1
|
1
|
|
Chromogène (gouttes)
|
1
|
1
|
1
|
-
|
|
Eau distillée (ul)
|
200
|
-
|
-
|
-
|
|
Etalon de fer (ul)
|
-
|
200
|
-
|
-
|
|
Echantillon de sérum (ul)
|
-
|
-
|
200
|
200
|
- : Le tube à analyser n'a pas reçu le
réactif concerné
2-2-2-2. Dosage de la transferrine sérique
La transferrine dans les échantillons de sérum
est analysée par la technique immunoturbidimétrique en fonction
du kit « Transferrin Immunoturbidimetric ».
2-2-2-2-1. Principe du dosage de la transferrine
La transferrine est une â-globuline, une
glycoprotéine de poids moléculaire de 75000 daltons
synthétisée par le foie. Dans le sang, son dosage consiste
à mettre en présence d'un échantillon de sérum, un
anticorps antitransferrine. La présence dans le sérum de
transferrine a entraîné la formation d'un complexe trouble
transferrine-antitransferrine. Ce complexe trouble est mesuré par
l'automate Lisa Bio 300. L'intensité de turbidité de ce complexe
était proportionnelle à la concentration de la transferrine dans
l'échantillon de sérum.
2-2-2-2-2. Détermination des concentrations
sériques de transferrine
Le tampon « Tris » et l'anticorps
antitransferrine sont associés pour former le réactif de travail
dans les proportions 1/41. L'étalon est préparé selon la
double dilution proposée par le fabriquant à partir du
kit « Transferrin
Immunoturbidimetric » (Figure 9). Selon cette
technique, 6 tubes à hémolyse numérotés de 1
à 6 sont utilisés pour effectuer les manipulations. Le premier
tube contenait 600 ul de soude 9 g/l et 100 ul d'étalon de fer. Les
autres tubes en contenaient 300 ul de soude 9 g/l et aucun étalon.
Trois cents ul du tube 1 sont ajoutés au contenu du
tube 2. La même méthode de dilution successive est
répétée jusqu'au tube 5. Des dilutions au 1/7, 1/14, 1/28,
1/56 et 1/112 sont donc réalisé respectivement dans les tubes 1,
2, 3, 4 et 5. Ces dilutions sont associées respectivement aux facteurs
3 ; 1,5 ; 0,75 ; 0,38 et 0,19 (Figure 9). Les
concentrations des différentes solutions étalonnées sont
obtenues en multipliant la valeur de la concentration type de l'étalon
de fer (7 g/l) par les différents facteurs. L'échantillon de
sérum et le contrôle sont dilués au 1/21 avec de la soude 9
g/l et le contenu de chaque tube est préparé en fonction du mode
opératoire décrit dans tableau VII. Dix minutes
après l'adjonction du réactif de travail, le contenu de chaque
tube est mélangé de façon modérée. La
détermination des différentes teneurs de transferrine est
effectuée par l'automate LisaBio 300 (Hycel groupe, Pouilly en Auxois,
France) après la construction de la courbe d'étalonnage. Le
contrôle des concentrations sériques de transferrine est
réalisé selon le kit de contrôle de sérum,
« Protein Serum ». Les valeurs limites de contrôle
des concentrations sériques de transferrine sont comprises entre 0,9 et
1,34 g/l et celles de référence entre 2 et 3,6 g/l selon le kit
« Transferrin Immunoturbidimetric ».
Figure 9: Méthode de dilution de
l'étalon de transferrine
Tubes : 1 2
3 4 5
6
NaCl (ul) : 600 300
300 300 300
300
Etalon (ul) : 100 -
- - -
-
Dilution : 1/7 1/14
1/28 1/56 1/112
-
Facteurs : 3 1,5
0,75 0,38 0,19
-
Conc. (g/l) : 21 10,50
5,25 2,66 1,33
-
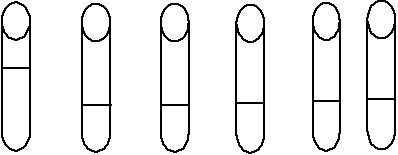
300 ul 300 ul
300 ul 300 ul
Tableau VII: Mode opératoire pour
la lecture des concentrations sériques de transferrine
|
Réactifs
|
Tube
blanc réactif
de travail
|
Tube
étalon de transferrine
|
Tube
échantillon
de sérum
ou de contrôle
|
|
NaCl 9 g/l (ul)
|
50
|
-
|
-
|
|
Etalon de transferrine (ul)
|
-
|
50
|
-
|
|
Echantillon de sérum ou de contrôle dilué
(ul)
|
-
|
-
|
50
|
|
Réactif de travail (ul)
|
1000
|
1000
|
1000
|
- : Le tube à analyser n'a pas reçu le
réactif concerné
2-2-2-3. Dosage de la ferritine sérique
La mesure des concentrations sériques de ferritine des
différents échantillons de sang est effectuée selon la
technique immunoturbidimétrique du kit « Ferritin
Turbilatex ».
2-2-2-3-1. Principe du dosage de la ferritine
La ferritine a constitué la forme de réserve en
fer la plus mobilisable. Lorsque cette protéine de réserve
était en présence de particules de latex recouvertes d'anticorps
anti-ferritine humains, un complexe trouble s'est formé.
L'intensité de turbidité de ce complexe mesurée par
l'automate Lisa Bio 300, était proportionnelle à la concentration
de la ferritine dans l'échantillon de sérum.
2-2-2-3-2. Détermination des concentrations
sériques de ferritine
Le tampon Tris et les particules de latex sont directement
utilisés selon le fabricant du kit « Ferritin
Turbilatex ». Cependant, l'étalon est dissous dans 3 ml d'eau
distillée. Dans le but d'effectuer les lectures des concentrations
sériques de ferritine, le contenu de chaque tube est
préparé selon le mode opératoire consigné dans le
tableau VIII. Les tubes sont modérément
mélangés avant les mesures des concentrations sériques de
ferritine. Les concentrations sériques de ferritine sont obtenues
automatiquement à partir de l'appareil LisaBio 300 (Hycel groupe,
Pouilly en Auxois, France). Le contrôle des concentrations
sériques de ferritine s'est fait selon les valeurs limites
imposées par le kit « Ferritin Turbilatex » (15
à 300 ug/l).
Selon ce kit, les valeurs de référence des
concentrations sériques de ferritine étaient entre 20 et 110
ug/l.
Tableau VIII: Mode opératoire
pour la lecture des concentrations sériques de ferritine
|
Réactifs
|
Tube échantillon de sérum
|
Tube étalon de ferritine
|
|
Tampon (ul)
|
900
|
900
|
|
Particules de latex (ul)
|
100
|
100
|
|
Etalon (ul)
|
-
|
100
|
|
Echantillon (ul)
|
100
|
-
|
- : Le tube à analyser n'a pas reçu le
réactif concerné
2-3. Calculs des autres indicateurs biochimiques
2-3-1. Capacité totale de fixation du fer par la
transferrine (CTF)
CTF (umol/l) =
25 [Transferrine] (g/l)
La capacité totale de fixation du fer par la
transferrine est déterminée par la formule suivante (Vernet
et al., 2001):
Selon Vernet et al. (2001), les valeurs
normales de la capacité totale de fixation
(CTF) sont comprises entre 50 et 90 umol/l.
2-3-2. Coefficient de saturation de la transferrine par le
fer (CST)
CST (%) =
CTF
100 [Fer sérique]
Le coefficient de saturation de la transferrine par le fer est
obtenu par le calcul de la manière suivante (Vernet et
al., 2001):
Selon Vernet et al. (2001), les valeurs
normales du coefficient de saturation (CST)
sont consignées dans l'intervalle de 15
à 35 % (Vernet et al., 2001).
2-4. Analyse des variables biologiques
Pour mieux apprécier les paramètres de nos
analyses biologiques, des critères conventionnels sont retenus
(Tableau IX). Ils ont associé les recommandations des
organisations internationales (OMS), de la Société
Française de Biologie Clinique (SFBC/France), de la
Société Française d'Hématologie (SFH/France-groupe
d'hématologie cellulaire), de la Société de Nutrition et
de Diététique de Langue Française (France), du Centre de
Contrôle des Maladies (CDC/USA) et de l'Institut de Médecine
(IOM/USA) (Vernet-Nyssen, 1981; CDC/USA, 1989; IOM/USA, 1990 ;
UNICEF/WHO/UNU/MI, 1999 ; SNDLF, 2001).
Tableau IX: Diagnostic des
anémies hypochromes (SNDLF, 2001)
|
Paramètres
biologiques
|
Carence
martiale
|
Anémie
ferriprive
|
Anémie
inflammatoire
|
CM
+ Anémie
inflammatoire
|
Thalassémies
|
Anémie
sidéroblastique
|
|
Ferritine
|
?
|
??
|
N ou ?
|
N
|
N ou ?
|
?
|
|
Transferrine
|
N
|
?
|
?
|
?
|
N ou ?
|
N ou ?
|
|
CST
|
N
|
?
|
N ou ?
|
?
|
?
|
?
|
|
Fer sérique
|
N
|
?
|
N ou ?
|
?
|
N ou ?
|
?
|
|
Hémoglobine
|
N
|
?
|
?
|
?
|
?
|
?
|
|
TCMH
|
N
|
?
|
N ou ?
|
N ou ?
|
?
|
?
|
|
VGM
|
N
|
?
|
N
|
N ou ?
|
?
|
?
|
?: Bas ; ? : Elevé ; N : Normal ;
?? : Très bas ; ?? : Très
élevé
2-5. Exploitation statistique des paramètres
biologiques et anthropométriques des sujets
Les résultats sont exprimés par les moyennes
associées à leur erreur standard sur les moyennes (ESM). Pour
l'exploitation des différents paramètres de l'étude,
plusieurs tests statistiques sont utilisés. Une significativité
des analyses est définie pour un seuil de probabilité p
inférieur à 5 %.
2-5-1. Test t de Student
Pour comparer les moyennes des paramètres biologiques
entre le groupe de femmes en âge de procréer non enceintes et
celui des femmes enceintes, le test t de Student pour les échantillons
indépendants par variables, est utilisé. Les 2 groupes de femmes
sont considérés comme étant des variables
indépendantes (Variables explicatives) et les paramètres
biologiques comme étant des variables dépendantes (Variables
expliquées).
2-5-2. Analyses de variances (Anova)
Les analyses de variances sont réalisées
conformément au modèle linéaire général
(GLM).
2-5-2-1. Analyses de variances à mesures
répétées
La comparaison des moyennes des paramètres biologiques
entre les différents trimestres de la grossesse est
réalisée par des analyses de variances (Anova) à mesures
répétées pour des échantillons appariés.
Elles ont mis en évidence une probable influence de l'âge
gestationnel sur les données biologiques appariées
recherchées chez les femmes enceintes. Dans ces analyses, les variables
dépendantes (Données expliquées) sont tous les 11
paramètres biologiques testés chez les femmes enceintes. Les 3
trimestres de la grossesse ont constitué les données
indépendantes (Variables explicatives).
2-5-2-2. Analyses factorielles de variances
Dans le but de comparer d'une part, les moyennes des 11
paramètres biologiques non appariées des femmes en âge de
procréer non enceintes entre les différentes communes
sélectionnées, nous avons utilisé une analyse factorielle
de variances (un facteur). Les 3 communes étaient les variables
indépendantes et les différents paramètres biologiques des
femmes ont représentés les variables dépendantes. Et
d'autre part, la dynamique des 11 paramètres biologiques des femmes au
cours des 3 trimestres de la grossesse selon les différentes formations
sanitaires est évaluée par les analyses de variances factorielles
(2 facteurs). Les différents centres de santé et les trimestres
de la grossesse ont constitué les variables explicatives (Variables
indépendantes), tandis que tous les paramètres biologiques sont
considérés comme étant les variables expliquées
(Variables dépendantes).
Toutes les analyses de variances effectuées, ont
associé comme test multivarié post hoc celui de
Newman-Keuls pour préciser les éventuels groupes de femmes
significativement différents.
2-5-3. Tests de corrélations de Pearson
Pour évaluer les relations entre la carence martiale,
les anémies et la taille des réserves en fer des femmes en
âge de procréer de l'étude, des coefficients de
corrélations (r) de Pearson sont déterminés.
Les 3 premières analyses classiques ont
été effectuées par le programme
statistique Statsoft Statistica version Windows 7.1 (Statsoft, 2005).
2-5-4. Tests de comparaison des proportions (Test G ou Test
log Likehood ratio)
Le test G, un test de vraisemblance qui a permis de comparer
les proportions des principaux paramètres biologiques estimés
chez les 2 de groupes femmes en âge de procréer de notre
étude. Cette comparaison de proportions d'une part, est effectuée
entre les femmes témoins et les femmes enceintes. Et d'autre part, le
test G a permis d'exprimer la dynamique des taux de prévalences du
statut martial normal, de la carence martiale et des anémies au cours
des 3 trimestres de la grossesse. Ce traitement statistique est
réalisé par le programme statistique R.2.0.1 version Windows
(Ihaka et Gentleman, 1996).
2-5-5. Régressions logistiques
Pour déterminer chez l'ensemble des femmes
sélectionnées, les prédicteurs du statut en fer, des
rapports de côtes (Odds Ratio) associant leur intervalle de confiance
à 95 % (IC à 95) sont estimés selon les
régressions logistiques.
La régression logistique est définie comme
étant une technique de modélisation permettant d'ajuster une
surface de régression à des données lorsque la variable
dépendante (variable expliquée) est dichotomique (donnée
binaire) (Desjardins, 2007). Cette technique est utilisée pour des
études ayant pour but de vérifier si des variables
indépendantes (variables explicatives) peuvent prédire une
variable dépendante dichotomique. Les variables indépendantes ou
les probables prédicteurs peuvent être des variables dichotomiques
ou continues. Cette technique de prédiction n'exige pas une distribution
normale ni l'homogénéité des variances.
Elle a abouti à la détermination des rapports de
côte (probabilités ou les « log chances ») qui
étaient les exponentiels des coefficients de régression
définit par l'équation suivante :
Ln [Y / (1 - Y)] = Ó BjXij + A
Y: La probabilité de la variable indépendante
pour que la variable dépendante X se réalise.
B : Le coefficient de régression ; A :
La constante ; i et j : Les modalités que peuvent prendre les
variables dépendantes et indépendantes (Howell, 1998 ;
Tabachnick et Fidell, 2000).
Pour l'étude effectuée dans les ménages
et dans les différents centres de santé de la ville d'Abidjan, 3
variables dépendantes (statut martial normal, carence martiale et
anémie ferriprive) et le groupe de variables indépendantes (les
paramètres anthropométriques) sont transformées en des
données dichotomiques. Toutes ces données définies chez
ces femmes ont donc subi d'une part, une série de tests univariés
(Tests de comparaison de proportions) pour déterminer les groupes de
variables indépendantes ayant une influence sur les variables
expliquées. Et d'autre part, une étude de
multicollinéarité (Test d'autocorrélation) est
effectuée pour exclure les variables indépendantes redondantes,
à savoir celles ayant un coefficient de corrélation
supérieur à 0,6 avec une autre variable indépendante
(Morgan et al., 2003). Après la sélection des variables
explicatives selon la pertinence des objectifs de l'étude, le
modèle logistique est réalisé.
Ce test de prédiction est appliqué dans un
premier temps à une série d'analyses univariées pour la
détermination de groupes de variables qui ont contribué au statut
martial anormal et celles favorisant un meilleur statut martial. Il s'agissait
dans ce cas de régression logistique simple. Les variables
indépendantes atteignant un degré de signification de p < 0,05
par la régression simple, sont retenues pour l'analyse
multivariée polynomiale du modèle logistique. Elles sont donc
introduites dans une série de modèles de régression
logistiques multiples, pour déterminer l'apport de chaque
modalité des variables indépendantes à la survenue de la
carence martiale, des anémies et surtout du statut normal en fer.
La modélisation du statut en fer des femmes en
âge de procréer des 3 communes de la ville d'Abidjan est
effectuée à l'aide du programme informatique Spss 12.0.1 version
Windows (Spss Inc, Chicago/ USA).
CHAPITRE I : PROFIL GENERAL DU STATUT MARTIAL CHEZ
LES FEMMES EN AGE DE PROCREER NON ENCEINTES
1. Résultats
1-1. Distribution des paramètres biologiques du
statut martial
Les moyennes de tous les paramètres biologiques
d'évaluation du statut en fer sont résumées et
consignées dans le tableau X. Ces moyennes
observées chez les femmes en âge de procréer non enceintes
étaient similaires aux valeurs de références des
institutions internationales (Vernet-Nyssen M, 1981; UNICEF/ WHO/UNU/MI.,
1998 ; SNDLF, 2001).
Tableau X: Valeurs moyennes des
paramètres biologiques du statut en fer des femmes en âge de
procréer non enceintes
|
Paramètres biologiques du statut en
fer
|
Moyennes observées
|
Valeurs de référence
|
|
Numération globulaire
|
|
|
|
Globules rouges (1012/l)
|
4,3 #177; 0,04
|
4 - 5,4
|
|
Taux d'hémoglobine (g/dl)
|
12,4 #177; 0,1
|
12 - 16
|
|
Taux d'hématocrite (%)
|
38,8 #177; 0,4
|
35 - 47
|
|
Indices érythrocytaires
|
|
|
|
VGM (fl)
|
85,2 #177; 0,6
|
80 - 100
|
|
TCMH (pg)
|
27,4 #177; 0,1
|
27 - 31
|
|
CCMH (g/dl)
|
31,6 #177; 0,2
|
32 - 36
|
|
Compartiment plasmatique
|
|
|
|
Fer sérique (umol/l)
|
12,3 #177; 0,4
|
7,16 - 26,85
|
|
Transferrine sérique (g/l)
|
2,8 #177; 0,1
|
2 - 3,6
|
|
CTF (umol/l)
|
70,2 #177; 1,5
|
50 - 90
|
|
CST (%)
|
18,7 #177; 0,5
|
15 - 35
|
|
Compartiment de réserves en fer
|
|
|
|
Ferritine sérique (ug/l)
|
53,7 #177; 2,5
|
20 - 110
|
1-2. Répartition des proportions de principaux
paramètres biologiques du statut martial
L'évaluation des paramètres biologiques du
statut en fer chez les femmes en âge de procréer non enceintes, a
révélé que :
- 42 % de ces femmes ont présenté une baisse du
taux d'hémoglobine contre 58 % de femmes au taux d'hémoglobine
normal (Figure 10A) ;
- le taux d'hématocrite était normal chez 73 %
des femmes contre 27 % des sujets au taux anormal (Figure
10B) ;
- 35 % des femmes ont indiqué une microcytose contre 5
% des femmes qui ont présenté une macrocytose (Figure
11A) ;
- 67 % des femmes en âge de procréer ont
présenté une hypochromie contre 33 % aux TCMH normales
(Figure 11B) ;
- le fer circulant a chuté chez 27 % des femmes contre
2 % des femmes aux concentrations augmentées de fer (Figure
12A) ;
- 26 % et 19 % des femmes en âge de procréer ont
indiqué respectivement une diminution et une augmentation des
concentrations sériques de transferrine contre 55 % des sujets aux
valeurs normales (Figure 12B) ;
- 57 % de femmes ont présenté des valeurs
pathologiques de la capacité totale de fixation (CTF) contre 43 %
des sujets aux valeurs normales de CTF (Figure 13A) ;
- 24 % des sujets ont présenté une baisse des
coefficients de saturation (CST) contre 75 % des sujets aux CST
normaux (Figure 13B) ;
- les concentrations sériques de ferritine ont
diminué chez 35 % des femmes contre 65 % de femmes aux réserves
normales (Figure 14).
Pour les différents compartiments étudiés
chez les femmes en âge de procréer non enceintes, le compartiment
érythrocytaire a indiqué que la TCMH était le
paramètre aux valeurs pathologiques les plus modifiées. Nous
avons également observé une proportion importante (42 %) de
femmes anémiques.
Au niveau du compartiment plasmatique, de fortes valeurs
pathologiques sont observées chez les femmes pour la capacité
totale de fixation (57 %).
En outre, le compartiment de réserves en fer a
indiqué une baisse importante de la taille du fer chez les femmes en
âge de procréer non enceintes de la ville d'Abidjan.
A
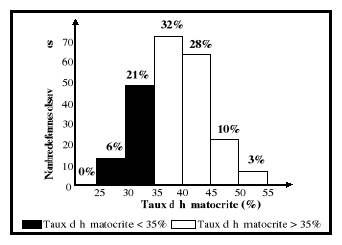
B
Figure 10 (A, B): Distribution des
proportions des taux d'hémoglobine (A) et des
d'hématocrite (B) chez les femmes en âge de
procréer non enceintes
Les bandes noires du graphique indiquent les proportions des
femmes aux valeurs pathologiques et celles qui sont blanches correspondent aux
valeurs normales.
A
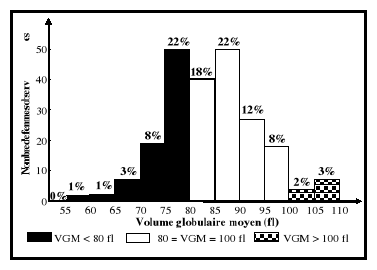
B
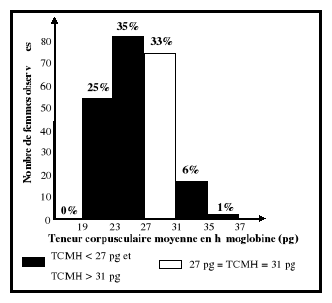
Figure 11 (A, B): Distribution des
proportions de VGM (A) et de TCMH (B) chez
les femmes en âge de procréer non enceintes
Les bandes noires du graphiques et quadrillées
indiquent les proportions des femmes aux valeurs pathologiques et celles qui
sont blanches correspondent aux valeurs normales.
A
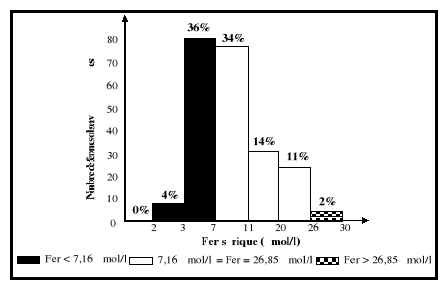
B
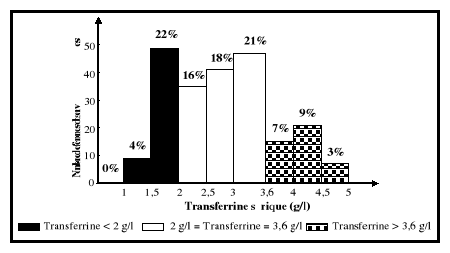
Figure 12 (A, B): Distribution des
proportions des concentrations sériques de fer (A) et
de transferrine (B) chez les femmes en âge de
procréer non enceintes
Les bandes noires et quadrillées du graphique indiquent
les proportions des femmes aux valeurs pathologiques et celles qui sont
blanches correspondent aux valeurs normales.
A
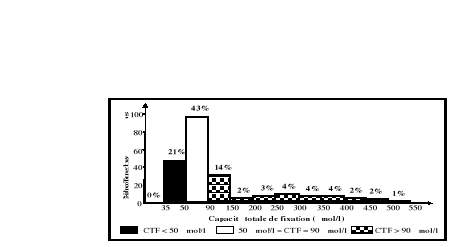
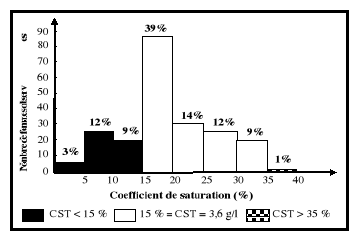
B
Figure 13 (A, B): Distribution des
proportions de CTF (A) et de CST (B) chez les
femmes en âge de procréer non enceintes
Les bandes noires et quadrillées du graphique indiquent
les proportions des femmes aux valeurs pathologiques et celles qui sont
blanches correspondent aux valeurs normales.
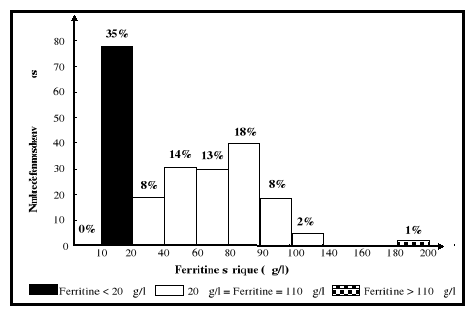
Figure 14 : Distribution des proportions
des concentrations de ferritine chez les femmes en âge de procréer
non enceintes
Les bandes noires du graphique indiquent les proportions des
femmes aux valeurs pathologiques et celles qui sont blanches correspondent aux
valeurs normales.
1-3 Prévalence de la carence martiale et des types
d'anémies
A partir des variations de l'ensemble des paramètres
hématimétriques, 4 types d'anémies sont observées
chez les femmes en âge de procréer non enceintes. Il s'agit de
l'anémie hypochrome microcytaire, de l'anémie hypochrome
normocytaire, de l'anémie normochrome normocytaire et de
l'anémie normochrome microcytaire (Tableau XI). Les
résultats de l'étude ont montré que la proportion de
l'anémie hypochrome microcytaire était significativement plus
élevée comparativement aux autres types d'anémies (p <
0,01).
Le bilan martial des femmes en âge de procréer
non enceintes a fait ressortir dans ce travail les données
suivantes :
- 63,8 % des sujets avaient un statut martial anormal contre
36,2 % des femmes au statut normal en fer ;
- ce statut martial anormal est composé respectivement
de 21,8 % de carence martiale, de 13,2 % d'anémie ferriprive, de 11,1 %
d'anémie inflammatoire simple et de 17,7 % d'anémie inflammatoire
associée à la carence martiale (Figure 15).
L'anémie ferriprive était le seul type
d'anémie d'origine nutritionnelle notée dans ce travail. De plus,
nous avons observé 2 types d'anémies d'origine inflammatoire
(Figure 15) .
Tableau XI : Types d'anémies
selon les variations des paramètres hématimétriques
|
AHM
|
AHN
|
ANN
|
ANM
|
p
|
|
Effectifs observées des femmes
|
78
|
15
|
1
|
1
|
|
|
Proportions observées des femmes (%)
|
82,1
|
15,8
|
1,1
|
1,1
|
< 0,001
|
AHM : Anémie hypochrome
microcytaire ; AHN : Anémie hypochrome
normocytaire
ANN : Anémie normochrome
normocytaire ; ANM : Anémie normochrome
microcytaire
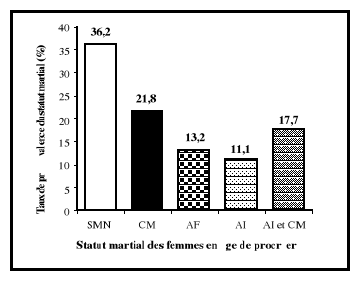
Figure 15: Taux de prévalence du
statut martial chez les femmes en âge de procréer non enceintes
SMN : Statut martial normal ; CM : Carence
martiale ; AF : Anémie ferriprive ; AI :
Anémie inflammatoire ;
AI et CM : Anémie inflammatoire et carence
martiale ; La bande blanche du graphique correspond à la proportion
de femmes aux valeurs biologiques normales et les autres bandes indiquent les
pourcentages de femmes aux valeurs biologiques pathologiques.
1-4. Relations entre la taille des réserves en fer,
la carence martiale et les anémies
Pour mieux comprendre les différentes modifications
entre les compartiments choisis de l'organisme pour l'évaluation du
statut en fer des femmes en âge de procréer, des tests de
corrélation de Pearson sont effectués entre leurs
paramètres biologiques.
Dans le tableau XII, ces coefficients de
corrélations de Pearson (r) ont indiqué qu'une éventuelle
diminution significative des paramètres hématologiques est
accompagnée de celle du fer sérique, du coefficient de saturation
de la transferrine (CST) et de la ferritine sérique.
Au niveau de la transferrine sérique et de la
capacité totale de fixation, les valeurs des coefficients de
corrélation ont indiqué qu'une probable augmentation de ces 2
paramètres du compartiment plasmatique est associée à une
diminution du taux d'hémoglobine (Tableau XII).
Selon les tests de corrélation de Pearson
réalisés, les variations observées dans le compartiment
érythrocytaire sont strictement liées à celles des
compartiments plasmatiques et de réserves en fer.
Tableau XII : Coefficient de
corrélation de Pearson (r) entre les données biologiques des
femmes en âge de procréer non enceintes
|
Paramètres biologiques
|
Fer
(umol/l)
|
Transferrine
(g/l)
|
CTF
(umol/l)
|
CST (%)
|
Ferritine
(ug/l)
|
|
Hémoglobine (g/dl)
|
0,51***
|
- 0,19**
|
- 0,16*
|
0,23**
|
-
|
|
Hématocrite (%)
|
0,37***
|
-
|
-
|
-
|
0,15*
|
|
VGM (fl)
|
0,45***
|
-
|
-
|
0,23**
|
-
|
|
TCMH (pg)
|
0,49***
|
-
|
-
|
0,22**
|
-
|
* : p < 0,05 ; ** : p < 0,01 ;
*** : p < 0,001 ; - : Les coefficients de corrélation
observés ne sont pas significatifs pour p < 0,05.
1-5. Dynamique des paramètres biologiques du statut
en fer selon les différentes communes de la ville d'Abidjan
Les résultats de l'étude ont montré que
les valeurs moyennes observées des paramètres
hématologiques chez les femmes des 3 communes de la ville d'Abidjan
étaient normales (Figure 16). Selon la comparaison des
moyennes de ces paramètres hématologiques par les analyses de
variances, seul le taux de globules rouges a révélé une
différence significative entre les ménages des 3 communes de la
ville d'Abidjan. Ce paramètre globulaire était significativement
bas chez les femmes de la commune d'Abobo comparativement à ceux de
Cocody et de Port-Bouët (p < 0,05). Cependant, les taux de globules
rouges élevés à Cocody et à Port-Bouët,
étaient comparables chez les femmes de ces 2 dernières communes
(Figure 16).
Au niveau des paramètres biochimiques du statut en
fer, nous avons observé que toutes les valeurs moyennes
étaient normales. A partir des analyses de variances, la ferritine
sérique était le seul paramètre biochimique qui a
présenté une différence significative entre les femmes des
ménages des 3 communes de la ville d'Abidjan. Les taux de ferritine
sériques étaient significativement plus élevés chez
les femmes d'Abobo que chez celles des communes de Cocody et de Port-Bouët
(p < 0,05). Les sujets de ces 2 dernières communes ont
statistiquement présenté les mêmes moyennes de ferritine
sérique (Figure 17).
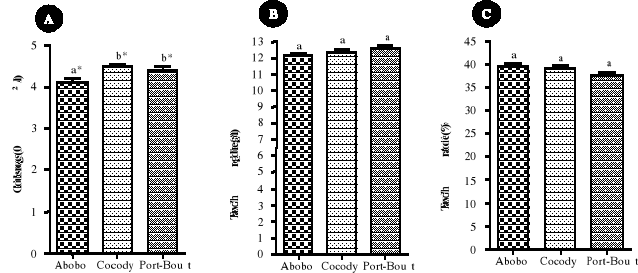
Figure 15 (A, B, C, D, E, F) :
Evolutions des paramètres hématologiques selon les
différentes communes
A : Nombre de globules rouges,
B : Taux d'hémoglobine, C :
Taux d'hématocrite, D : Volume globulaire moyen,
E : Teneurs corpusculaires moyennes en
hémoglobines, F : Concentrations corpusculaires
moyennes en hémoglobines ; a et b : Groupes de femmes
significativement différents pour p < 0,05 ; * : p <
0,05
Figure 16 (A, B, C, D, E, F) :
Evolutions des paramètres hématologiques selon les
différentes communes
A : Nombre de globules rouges,
B : Taux d'hémoglobine, C :
Taux d'hématocrite,
D : Volume globulaire moyen,
E : Teneurs corpusculaires moyennes en
hémoglobines,
F : Concentrations corpusculaires
moyennes en hémoglobines ; a et b : Groupes de femmes
significativement différents pour p < 0,05 ; * : p <
0,05
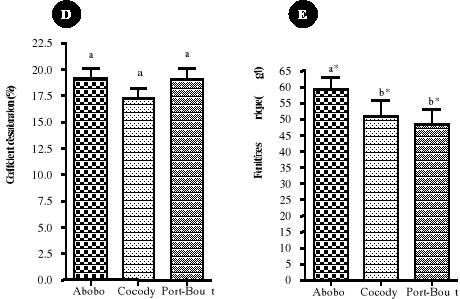
Figure 17 (A, B, C, D, E) : Evolutions
des paramètres biochimiques selon les différentes communes
A : Fer sérique,
B : Transferrine sérique,
C : Capacité totale de fixation,
D : Coefficient de saturation, E :
Ferritine sérique ; a et b : Groupes statistiquement
différents pour p < 0,05
1-6. Distribution des proportions des principaux
paramètres biologiques du statut entre les différentes communes
de la ville d'Abidjan
Les analyses de comparaison des proportions des
paramètres biologiques par le test G entre les ménages des 3
communes de la ville d'Abidjan ont montré que :
- les proportions d'anémies, de microcytose et
d'hypochromie sont plus élevées chez les femmes d'Abobo et de
Port-Bouët que celles de Cocody (Tableau XIII) ;
- le taux d'hématocrite a moins chuté chez les
femmes d'Abobo (23 %) et de Cocody (20 %) comparativement aux sujets de
Port-Bouët (39 %) ;
- les proportions de fer et de coefficient de saturation
(CST) diminués, sont plus augmentées chez les femmes d'Abobo et
plus faibles chez celles de Port-Bouët (Tableau
XIII) ;
- plusieurs femmes d'Abobo respectivement 38 % et 34 % ont
présenté des valeurs abaissées de transferrine
sérique et de capacité totale de fixation (CTF) que les sujets
de Port-Bouët et de Cocody. Les femmes de Cocody ont indiqué les
proportions les plus faibles. Cependant, les sujets de Cocody ont
présenté la plus forte proportion de transferrine
augmentée. Pour la CTF, il s'agissait des femmes d'Abobo qui ont
indiqué la proportion la plus élevée que celles de Cocody
et de Port-Bouët (Tableau XIII) ;
- les fréquences des femmes aux concentrations
diminuées de ferritine sont élevées chez les sujets de
Cocody comparativement à celles d'Abobo et de Port-Bouët
(Tableau XIII).
Au regard de ces résultats, les femmes en âge de
procréer non enceintes de la commune d'Abobo ont présenté
en général les proportions de valeurs pathologiques de
paramètres biologiques du statut en fer les plus élevées.
En revanche, celles de Cocody ont indiqué les faibles fréquences
comparativement aux sujets d'Abobo et de Port-Bouët.
Tableau XIII : Comparaison des
fréquences de paramètres biologiques entre les différentes
communes
|
Paramètres biologiques
|
Abobo
N = 95
|
Cocody
N = 60
|
Port-Bouët
N = 70
|
|
|
Numération globulaire
|
|
|
|
|
|
Taux d'hémoglobine (g/dl)
|
n %
|
n %
|
n %
|
p
|
|
9,3 - 12
|
45 47
|
22 36
|
29 42
|
< 0,0001
|
|
12 - 16,8
|
50 53
|
38 64
|
41 58
|
< 0,0001
|
|
Taux d'hématocrite (%)
|
|
|
|
|
|
26,1 - 35
|
22 23
|
12 20
|
27 39
|
< 0,05
|
|
35 - 54,7
|
73 77
|
48 80
|
43 61
|
< 0,05
|
|
Indices érythrocytaires
|
|
|
|
|
|
VGM (fl)
|
|
|
|
|
|
63 - 80
|
39 41
|
12 19
|
28 40
|
< 0,01
|
|
80 - 100
|
48 51
|
47 79
|
39 56
|
< 0,01
|
|
100 - 114
|
8 8
|
1 2
|
3 4
|
< 0,05
|
|
TCMH (pg)
|
|
|
|
|
|
20 - 27 et 31 - 32,9
|
44 46
|
18 30
|
32 45
|
< 0,05
|
|
27 - 31
|
51 54
|
48 70
|
39 55
|
< 0,05
|
|
Compartiment plasmatique
|
|
|
|
|
|
Fer sérique (umol/l)
|
36 38
|
15 25
|
11 16
|
< 0,01
|
|
2,4 - 7,16
|
58 61
|
45 75
|
57 82
|
< 0,05
|
|
7,16 - 26,85
|
1 1
|
- -
|
2 2
|
> 0,05
|
|
26,85 - 29,9
|
|
|
|
|
|
Transferrine sérique (g/l)
|
|
|
|
|
|
1,2 - 2
|
32 34
|
9 15
|
16 23
|
< 0,05
|
|
2 - 4
|
54 57
|
37 61
|
44 63
|
> 0,05
|
|
4 - 5
|
9 9
|
14 24
|
10 14
|
< 0,05
|
|
Capacité totale de fixation (umol/l)
|
|
|
|
|
|
30,8 - 50
|
31 32,6
|
9 15
|
16 22,9
|
< 0,05
|
|
50 - 90
|
12 12,6
|
40 67,3
|
44 62,8
|
< 0,0001
|
|
90 - 134
|
52 54,8
|
11 17,7
|
10 14,3
|
< 0,0001
|
|
Coefficient de saturation (%)
|
|
|
|
|
|
2,3 - 15
|
29 31
|
14 24
|
11 15
|
< 0,05
|
|
15 - 35
|
66 69
|
46 76
|
57 82
|
< 0,05
|
|
35 - 69,5
|
- -
|
- -
|
2 3
|
< 0,05
|
|
Compartiment de réserves en fer
|
|
|
|
|
|
Ferritine sérique (ug/l)
|
|
|
|
|
|
8,9 - 20
|
31 33
|
26 43
|
21 30
|
< 0,0001
|
|
20 - 110
|
61 64
|
34 57
|
45 64,3
|
< 0,0001
|
|
110 - 196,1
|
3 3
|
- -
|
4 5,7
|
> 0,05
|
N : Effectif total des femmes enceintes
sélectionnées à chaque trimestre de grossesse ;
n : Effectifs observés chez les
femmes pour chaque classe de paramètres biologiques.
- : Aucune observation n'était faite
1-7. Prévalence de la carence martiale et des
anémies selon les communes
La figure 18 a présenté les
différentes prévalences du statut en fer des femmes en âge
de procréer non enceintes dans les 3 communes de la ville d'Abidjan. A
cette figure 17, les résultats de l'étude ont montré
que les femmes d'Abobo (29 %) ont présenté la
prévalence la plus significativement faible du statut martial normal
contre 37,3 % chez celles de Port-Bouët (p < 0,05). La fréquence
la plus significativement élevée est enregistrée chez les
sujets de Cocody (43,7 %).
Au niveau de la carence martiale, les résultats de la
comparaison de ces proportions ont révélé que les sujets
de Port-Bouët (14,3 %) ont indiqué le taux le plus
significativement faible de carence martiale (p < 0,001). Cependant, les
fréquences de carence martiale des femmes d'Abobo (24,2 %) et de Cocody
(26,7 %) étaient statistiquement semblables et les plus
élevées (p > 0,05) (Figure 18).
Pour l'anémie ferriprive, le taux de prévalence
était significativement plus élevé chez les femmes de
Cocody et de Port-Bouët (16,3 % et 15,7 % respectivement) et plus bas chez
celles d'Abobo (8,8 %) (p < 0,01) (Figure 18).
L'anémie inflammatoire était présente
chez 9,8 %, 8,3 % et 14,9 % des femmes respectivement dans les communes
d'Abobo, de Cocody et de Port-Bouët. La comparaison de ces taux de
prévalence d'anémie inflammatoire a indiqué que les femmes
de Port-Bouët ont présenté la fréquence la plus
élevée comparativement aux femmes des autres communes (p <
0,05) (Figure 18).
En ce qui concerne l'anémie inflammatoire
accompagnée de la carence martiale, nous avons observé une
prévalence significativement plus élevée chez les sujets
de commune d'Abobo (28,4 %) (p < 0,0001). Les sujets de Cocody et de
Port-Bouët ont présenté exactement les mêmes
fréquences (11,4 %) et les plus faibles d'anémie inflammatoire
associée à la carence martiale (Figure 18).
Au total, les femmes en âge de procréer non
enceintes de la commune d'Abobo ont indiqué un statut martial fortement
altéré (71 %). Cette altération était beaucoup plus
considérable au niveau des anémies inflammatoires (38,2 %).
Toutefois, les sujets de Port-Bouët ont présenté le statut
en fer le moins dégradé (56,3 %) comparativement aux femmes des
autres communes. Par ailleurs, celles de Cocody ont indiqué un statut
martial moyennement altéré (62,7 %) que les sujets des 2 autres
communes.
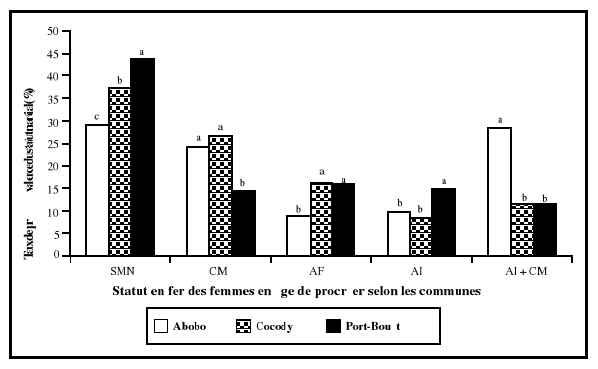
Figure 18 : Répartition des
fréquences de carence martiale et des types d'anémies chez les
femmes en âge de procréer selon les différentes communes
SMN : Statut martial normal; CM : Carence
martiale ; AF : Anémie ferriprive ; AI :
Anémie inflammatoire ; AI + CM : Anémie inflammatoire
associée à la carence martiale ; abc : Groupes femmes
statistiquement différents pour p < 0,05
1-8. Modélisation du statut en fer des femmes en
âge de procréer non enceintes
Les proportions observées du statut martial des femmes
en âge de procréer non enceintes selon les modalités des
paramètres anthropométriques sont consignées dans le
tableau XIV. A partir des tests de comparaison de proportions
de Log Likelihood ratio, tous les paramètres anthropométriques
des femmes avaient une influence significative sur leur statut normal en fer (p
< 0,05 ; p < 0,00001 ; p < 0,00001 respectivement)
(Tableau XIV).
Les tests de modélisation à partir des
régressions logistiques ont indiqué que :
- l'âge a significativement participé 4,3 fois au
statut normal en fer (p < 0,001). Ainsi, les femmes dont l'âge a
varié entre 20 et 48 ans avaient hautement 2,6 fois plus de chance de
présenter un statut martial normal que les adolescentes (p < 0,01)
(Tableau XIV) ;
- la parité a hautement contribué 2,8 fois au
statut martial normal (p < 0,01). Après les tests multivariés
de régression logistique, les nullipares étaient
significativement 1,3 fois plus susceptibles d'indiquer un meilleur statut en
fer par rapport aux primipares et aux multipares (Tableau
XIV) ;
- les rapports de côte (OR = 3,7 ; OR = 6,4
respectivement) au niveau de l'espace intergénésique
étaient hautement significatifs pour le statut martial normal et la
carence en fer (p < 0,01 ; p < 0,001 respectivement). Dans ce cadre,
la probabilité était significativement multipliée par 2
pour les femmes non enceintes qui avaient observé une période
supérieure ou égale à 3 ans entre les grossesses en ce qui
concerne le statut normal en fer (p < 0,05). Celles qui avaient un espace
intergénésique inférieur à 3 ans étaient 3,3
fois hautement susceptibles de présenter une carence martiale
comparativement aux autres femmes (p < 0,01) (Tableau
XIV) ;
- la gestité a hautement constitué 2,5 fois un
facteur de risque pour la carence en fer chez les femmes non enceintes (p <
0,01). Ainsi les multigestes avaient significativement 1,2 fois plus de risque
d'indiquer la carence martiale par rapport aux primigestes (p < 0,05)
(Tableau XIV) ;
- aucun paramètre anthropométrique
n'était un facteur de risque pour l'anémie ferriprive chez les
femmes non enceintes (Tableau XIV).
Au total, l'âge (les adultes), la parité (les
nullipares) et l'espace intergénésique (= 3 ans) ont
constitué des véritables prédicteurs pour un statut normal
en fer chez les femmes en âge de procréer non enceintes.
Cependant, la gestité (les multigestes) et l'espace
intergénésique (< 3 ans) étaient des facteurs de risque
de la carence martiale.
Tableau XIV: Proportions
comparées et les rapports de côte (OR) du statut martial selon les
paramètres anthropométriques
|
Paramètres
épidémiologiques
|
SMN
|
CM
|
AF
|
|
n % OR (IC à 95
%)
|
n % OR (IC à 95
%)
|
n % OR (IC à 95
%)
|
|
Age (ans)
|
4,3 (1 -
5,6)***
|
|
|
|
15 - 19 ; n1 = 75
|
10 4,4 -
|
20 8,9
|
12 5,2
|
|
20 - 48 ; n1 = 150
|
71 31,6 2, 6 (1,1 -
4,3)**
|
29 13,9
|
18 8
|
|
P
|
< 0,0001
|
> 0,05
|
> 0,05
|
|
IMC (kg.m-2)
|
-
|
|
|
|
< 19,8 ; n1 = 58
|
17 7,7
|
18 8
|
10 4,4
|
|
19,8 - 26 ; n1 = 129
|
51 22,7
|
18 8
|
14 6,2
|
|
> 26 ; n1 = 38
|
13 5,8
|
13 5,8
|
6 2,6
|
|
P
|
< 0,00001
|
> 0,05
|
> 0,05
|
|
Gestité
|
-
|
2,5 (1,3 - 5,8)**
|
|
|
Primigestes ; n1 = 70
|
20 9,1
|
17 5,5 -
|
12 5,1
|
|
Multigestes ; n1 = 155
|
61 27,1
|
32 16,3 1,2 (0,8 -
1,9)*
|
18 8,1
|
|
p
|
< 0,01
|
< 0,05
|
> 0,05
|
|
Parité
|
2,8 (1 -
7,8)**
|
|
|
|
Nullipares ; n1 = 144
|
51 22,7 1,3 (0,5 -
3,5)*
|
24 10,7
|
16 7,1
|
|
Primipares ; n1 = 46
|
16 7,1 -
|
12 5,3
|
10 4,4
|
|
Multipares ; n1 = 35
|
14 6,4 -
|
13 5,8
|
4 1,7
|
|
p
|
< 0,00001
|
> 0,05
|
> 0,05
|
|
Espace intergénésique (Mois)
|
3,7 (2,1 - 6,4)**
|
6,4 (3 - 9,4)***
|
|
|
< 36 ; n1 = 51
|
26 11,7 -
|
12 5,4 3,3 (2,1 -
6,2)**
|
14 6
|
|
= 36 ; n1 = 104
|
55 24,5 2 (1,2 -
5,4)*
|
37 16,4 -
|
16 7,2
|
|
p
|
< 0,05
|
< 0,05
|
> 0,05
|
SMN : Statut martial normal,
CM : Carence martial, AF :
Anémie ferriprive ; - : Aucune observation
n'était faite ; OR : Odds ratios,
IC : Intervalle de confiance, p : Seuil de
probabilité du test Log Likelihood ratio ; * : p <
0,05 ; ** : p < 0,01 ; *** : p < 0,001
2. Discussion
2-1. Indicateurs biologiques du statut martial des femmes
en âge de procréer non enceintes des 3 communes de la ville
d'Abidjan
Sur la base des recommandations et des critères
d'évaluation les plus significatifs que nous avons choisis, une
proportion importante des femmes en âge de procréer
présentent un statut martial anormal, comportant un taux
considérable de déficit en fer associé à une
prévalence prononcée d'anémies inflammatoires.
La carence en fer est un concept dynamique qui se traduit par
une succession de stades allant de la simple déplétion des
réserves en fer jusqu'au stade évolué de l'anémie
(Preziosi et al., 1994 ; Scholl et Hediger, 1994 ;
Hercberg et al., 1998 ; Duport et al., 2003).
Les femmes en âge procréer non enceintes
indiquent une diminution considérable des réserves en fer. Cette
réduction de réserves, caractérisée par une baisse
des concentrations de ferritine, a conduit à un effondrement du fer de
transport plasmatique et d'alimentation tissulaire, ce qui explique les
réductions des coefficients de saturation, des concentrations
sériques du fer d'une part et d'autre part les augmentations des
concentrations sériques de la transferrine (la protéine de
transport) et des capacités totales de fixation.
Lorsque le fer circulant du compartiment plasmatique est bas,
les réductions du fer fonctionnel du compartiment érythrocytaire
surviennent (Lipschitz et al., 1974 ; Beard et al.,
1996). C'est pourquoi, nous avons observé chez les sujets de notre
étude des baisses du taux d'hémoglobine, du volume globulaire
moyen (VGM) et de la teneur corpusculaire moyenne en hémoglobine (TCMH).
Ces relations qui existent entre les indicateurs biologiques
d'évaluation du statut martial, depuis longtemps
démontrées (Hercberg, 1988), sont mises en évidence dans
notre étude. Selon nos travaux, l'effondrement de la taille des
réserves en fer et la diminution des coefficients de saturation de la
transferrine entraînent les diminutions du VGM, de la TCMH, de
l'hématocrite et surtout des taux d'hémoglobine. La principale
raison de l'anémie chez ces femmes en âge de procréer est
donc le déficit en fer. Cela explique également que la
capacité totale de fixation du fer par la transferrine (CTF) soit le
paramètre biologique le plus augmenté par rapport aux autres
indicateurs biologiques dans notre étude.
Les différentes composantes du statut martial anormal
observées chez les femmes en âge de procréer des 3 communes
de la ville d'Abidjan sont semblables à ceux rapportées par
Asobayire et al. (2001).
Des études menées dans des pays tels que la
Tunisie (anémie : 28,8 %), le Népal (carence martiale :
20 %) et Vietnam (carence martiale : 8,6 %) ont indiqué des taux de
prévalence de statut martial anormal moins élevés que
ceux des femmes à Abidjan (Khosrof-Ben et al., 2004 ;
Berger et al., 2005 ; Strand et al., 2007). En revanche,
des travaux en Afrique du Sud et en Tanzanie ont révélé
respectivement des taux de prévalence du statut normal en fer (40 %) et
d'anémie (49 %) plus accentués comparativement à celle
observée chez les sujets de notre étude (Massawe et al.,
2002 ; Wolmarans et al., 2003).
Il ressort de toutes ces études que les insuffisances
des réserves en fer constituent la véritable cause des
anémies des différents sujets. Ces résultats sont
similaires à ceux de nos travaux.
De plus, sur 65 % des femmes qui ont des concentrations
sériques de ferritine apparemment normales, 38,2 % sont
anémiques. Au regard de ces résultats, le statut martial anormal
chez les femmes des 3 communes de la ville d'Abidjan n'est pas le seul fait
d'une insuffisance en fer de l'organisme. D'autres facteurs tels que les
parasitoses, les syndromes infectieux et inflammatoires pourraient expliquer la
présence des autres types d'anémies telles que les anémies
inflammatoires. Plusieurs travaux ont rapporté que le paludisme, les
parasitoses intestinales, les infections bactériennes et les syndromes
inflammatoires constituent des facteurs de risques associés aux
anémies (Fleming, 1981 ; Yip et Dallman, 1988 ; Asobayire
et al. 2001 ; Massawe et al. 2002). Cela pourrait
expliquer la présence des 2 types d'anémies inflammatoires chez
les femmes en âge de procréer non enceintes des 3 communes de la
ville d'Abidjan.
Selon Hercberg et Galan (1985), l'identification de la carence
martiale et des anémies est fonction de la sensibilité, de la
spécificité, de la faisabilité et de la variabilité
des indices d'exploration du statut en fer. Notre étude indique que les
paramètres biologiques d'évaluation du statut en fer pris
individuellement ne diffèrent pas en général. Cela
s'expliquerait par la variabilité inter-individuelle qui expose les
caractéristiques de plusieurs populations différentes. Cette
variabilité inter-individuelle s'exprime mieux sur la base de la
coexistence d'au moins 2 critères anormaux parmi les indicateurs
biologiques utilisés (Cook et Finch, 1979). C'est pourquoi aucune
différence significative en général n'a été
indiquée entre les populations des femmes en âge de
procréer des communes d'Abobo, de Cocody et de Port-Bouët,
malgré les différences observées entre les
caractéristiques des populations. En revanche, lorsque des
critères multiples sont utilisés dans le dépistage de la
carence martiale et des types d'anémies, des différences entre
plusieurs populations sont mises en évidence (Hercberg, 1988).
Cette observation est similaire à celle de notre
étude indiquant que les taux de prévalence du statut martial
normal, de la carence martiale et des types d'anémie ferriprive
diffèrent entre les femmes des différentes communes
étudiées. La commune d'Abobo, au regard des proportions
d'adolescentes, des sujets ayant plus de 2 parités et des femmes avec un
déficit pondéral qu'elle présente, expliquent le fait que
les femmes d'Abobo soient les plus exposées au statut martial anormal
par rapport à celles des 2 autres communes.
Pour conclure, la carence martiale et les anémies ont
des causes multiples et la première origine des anémies est le
déficit en fer (Beard et al., 1996).
2-2. Déterminants anthropométriques
associés au statut en fer des femmes en âge de procréer non
enceintes des 3 communes de la ville d'Abidjan
Les résultats de notre étude ont
révélé l'influence de plusieurs paramètres
anthropométriques des sujets sélectionnés sur leur bilan
martial. Dans ce cadre, notre étude indique que l'âge des femmes
est un déterminant qui favorise un statut normal en fer. Les femmes dont
l'âge varie entre 20 et 48 ans ont plus de chance de présenter un
bilan martial normal comparativement aux adolescentes. Leur taux de
prévalence de statut martial normal est 7 fois plus important que ceux
des adolescentes.
Le bon fonctionnement de l'organisme de la femme en âge
de procréer non enceinte requiert une quantité importante de fer
d'environ 1,5 mg de fer par jour (Beard et al., 1996 ; UNICEF,
2001). La différence hautement significative observée entre ces 2
classes d'âge se justifie par des besoins physiologiques en fer pour la
croissance de l'organisme. Ils sont plus élevés chez les
adolescentes comparativement aux adultes (Wajcman et al., 1992 ;
Najman et al., 1994 ; Galan et al., 1998).
Tout comme l'âge des femmes, la parité et
l'espace intergénésique constituent des prédicteurs du
statut martial normal. Des organismes internationaux recommandent aux femmes en
âge de procréer de respecter un intervalle d'au moins 2 ans entre
les naissances, car la grossesse conduit à une perte du fer de
l'organisme (UNICEF/WHO/UNU/MI, 1999). C'est pourquoi, les femmes qui n'ont
aucun accouchement (nullipares) et celles qui ont observé une
période supérieure ou égale à 3 ans ont plus de
chance de présenter un statut martial normal, comparativement aux autres
femmes.
Par ailleurs, des rapports de ces institutions ont
indiqué que les multigestes et les femmes qui ont un espace
intergénésique inférieur à 2 ans sont plus
confrontées à un statut anormal en fer (UNICEF/ WHO/UNU/MI.,
1998). Ce résultat est semblable à celui que nous avons obtenu au
niveau de la carence martiale.
3. Conclusion
Au terme de l'étude du bilan martial, une
prévalence importante du statut martial anormal est observée chez
les femmes en âge de procréer des 3 communes de la ville
d'Abidjan. Ce statut anormal comprend de fortes prévalences de carence
martiale, d'anémie ferriprive et d'anémies inflammatoires. Dans
le même sens, la capacité totale de fixation de la transferrine
(CTF) constitue le paramètre biologique le plus modifié chez ces
femmes. La principale cause de la dégradation prononcée du statut
en fer est l'insuffisance de la taille des réserves en fer chez nos
sujets étudiés.
Les sujets de la commune d'Abobo, au regard de leurs
caractéristiques anthropométriques, sont les plus exposés
à l'altération du statut martial, comparativement aux femmes des
autres communes. Toutefois, les femmes en âge de procréer de la
commune de Port-Bouët présentent les meilleurs indices
d'évaluation du statut en fer.
En outre, des caractéristiques anthropométriques
tels que l'âge, la gestité, la parité et l'espace
intergénésique des femmes en âge de procréer
constituent des prédicteurs du statut en fer.
CHAPITRE II : VARIABILITE DU STATUT MARTIAL CHEZ
LES FEMMES AU COURS DE LA GROSSESSE
1. Résultats
1-1. Distribution des proportions des principaux
paramètres biologiques du statut martial au cours de la grossesse
1-1-1. Proportions des paramètres biologiques du
statut martial au premier trimestre de la grossesse
L'évaluation des paramètres biologiques du
statut en fer chez les femmes au premier trimestre de la grossesse a
montré que :
- 71 % des femmes ont présenté une baisse du
taux d'hémoglobine contre 29 % de femmes aux taux normaux. Cette
proportion de femmes anémiques est constituée de 22 %
d'anémie fruste, 41 % d'anémie modérée et 8 %
d'anémie sévère (Figure 19A) ;
- le taux d'hématocrite était bas chez 91 % des
femmes contre 9 % des sujets aux taux d'hématocrite normaux
(Figure 19B) ;
- 72 % des femmes ont indiqué une microcytose contre 28
% de femmes aux VGM normaux (Figure 20A) ;
- 61,4 % des femmes avaient une hypochromie contre 38,6 % de
femmes aux TCMH normales (Figure 20B) ;
- le fer circulant a diminué chez 52 % des femmes
contre 48 % des sujets aux concentrations sériques de fer normales
(Figure 21A) ;
- 14 % et 40 % des femmes ont présenté
respectivement une diminution et une augmentation des concentrations
sériques de transferrine contre 46 % des sujets aux valeurs normales de
transferrine (Figure 21B) ;
- 54,2 % de femmes ont présenté des valeurs
pathologiques de la capacité totale de fixation (CTF) contre 45,8
% des sujets aux valeurs normales de CTF (Figure
22A) ;
- 72 % des sujets ont présenté une baisse des
coefficients de saturation (CST) contre 28 % des sujets aux CST
normaux (Figure 22B) ;
- les concentrations sériques de ferritine ont
diminué chez 57 % des femmes contre 43 % de femmes aux réserves
normales (Figure 23).
Au premier trimestre de la grossesse, notre étude a
montré au total que tous les compartiments évalués du
statut en fer ont présenté de véritables modifications.
A
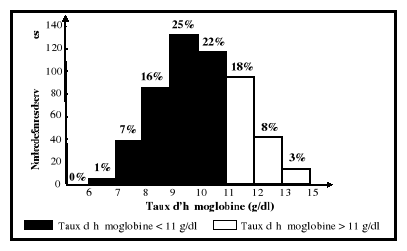
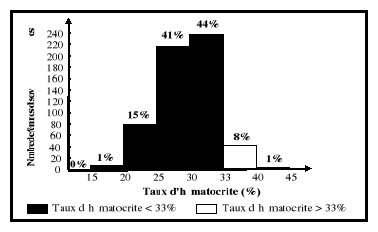
B
Figure 19 (A, B): Distribution des
proportions des taux d'hémoglobine (A) et
d'hématocrite (B) chez les femmes au premier trimestre
de la grossesse
Les bandes noires du graphique correspondent aux valeurs
biologiques pathologiques et celles en blanc indiquent les valeurs biologiques
normales.
A
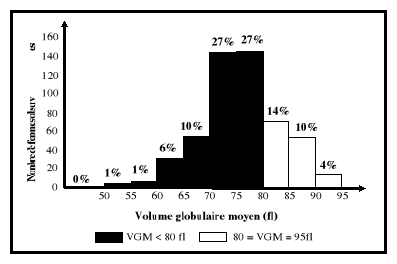
B
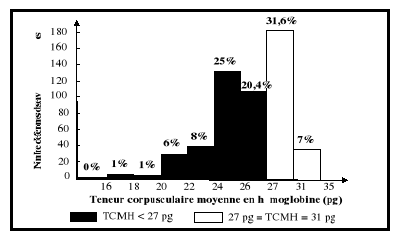
Figure 20 (A, B): Distribution des
proportions de VGM (A) et de TCMH (B) au
premier trimestre de la grossesse
Les bandes noires du graphique correspondent aux valeurs
biologiques pathologiques et celles en blanc indiquent les valeurs biologiques
normales.
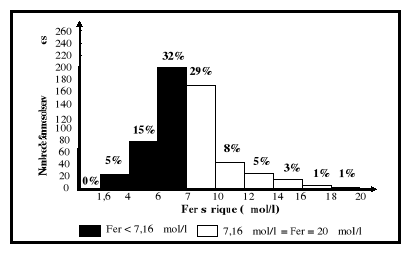
A
B
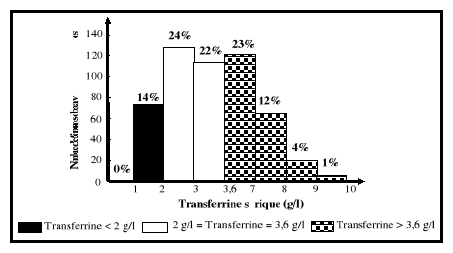
Figure 21 (A, B): Distribution des
proportions des concentrations sériques du fer (A) et
de la transferrine (B) chez les femmes au premier trimestre de
la grossesse
Les bandes noires et quadrillées du graphique
correspondent aux proportions de femmes aux valeurs biologiques pathologiques
et celles en blanc désignent les proportions de femmes aux valeurs
biologiques normales.
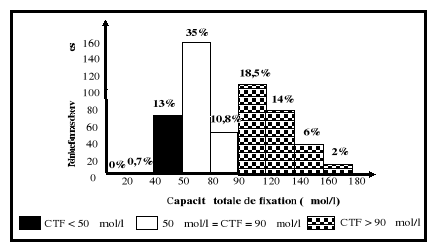
A
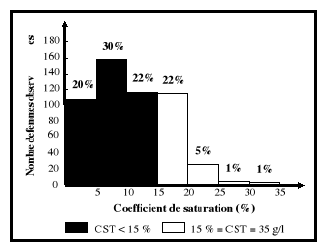
B
Figure 22 (A, B): Distribution des
proportions de CTF et de CST chez les femmes
au premier trimestre de la grossesse
Les bandes noires et quadrillées du graphique
correspondent aux proportions de femmes aux valeurs biologiques pathologiques
et celles en blanc désignent les proportions de femmes aux valeurs
biologiques normales.
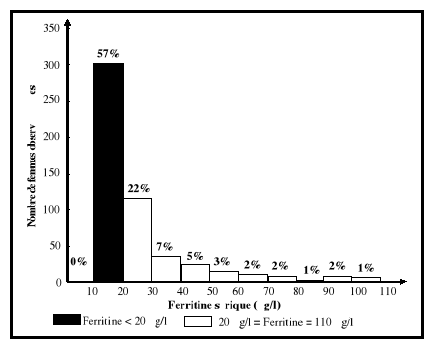
Figure 23: Distribution des proportions
des concentrations sériques de la ferritine chez les femmes au premier
trimestre de la grossesse
Les bandes noires du graphique indiquent aux proportions de
femmes aux valeurs biologiques pathologiques et celles en blanc
désignent les proportions de femmes aux valeurs biologiques normales.
1-1-2. Proportions des paramètres biologiques du
statut en fer au second trimestre de la grossesse
L'évaluation des paramètres biologiques du
statut en fer chez les femmes au second trimestre de la grossesse a
révélé que :
- 58,4 % des femmes avaient une baisse du taux
d'hémoglobine contre 41,6 % de femmes aux taux normaux. Cette proportion
de femmes anémiques est constituée de 21,4 % d'anémie
fruste, 13 % d'anémie modérée et 24 % d'anémie
sévère (Figure 24A) ;
- le taux d'hématocrite était bas chez 62,9 %
des femmes contre 37,1 % des sujets aux taux d'hématocrite normaux
(Figure 24B) ;
- 70 % des femmes ont présenté une microcytose
contre 30 % de femmes aux VGM normaux (Figure 25A) ;
- 68 % des femmes avaient une hypochromie contre 32 % de
femmes aux TCMH normales (Figure 25B) ;
- le fer circulant a diminué et a augmenté
respectivement chez 52 % et 2 % des femmes contre 46 % des sujets aux
concentrations sériques de fer normales (Figure
26A) ;
- 10 % et 57 % des femmes ont présenté
respectivement une diminution et une augmentation des concentrations
sériques de transferrine contre 33 % des sujets aux valeurs normales de
transferrine (Figure 26B) ;
- 67,4 % de femmes ont présenté des valeurs
pathologiques de la capacité totale de fixation (CTF) contre 32,6
% des sujets aux valeurs normales de CTF (Figure
27A) ;
- 84 % des sujets ont présenté une baisse des
coefficients de saturation (CST) contre 16 % des sujets aux CST
normaux (Figure 27B) ;
- les concentrations sériques de ferritine ont
diminué chez 65 % des femmes contre 35 % de femmes aux réserves
normales (Figure 28).
Au second trimestre de la grossesse, les différents
compartiments évalués du statut martial ont également
indiqué une altération de l'ensemble des paramètres
biologiques mesurés.
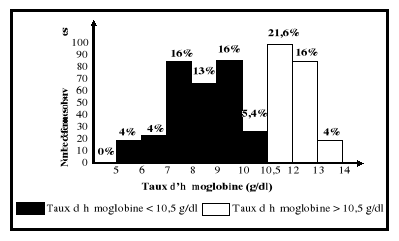
B
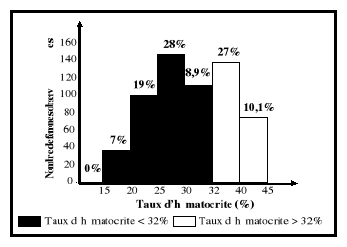
A
Figure 24 (A, B): Distribution des
proportions des taux d'hémoglobine (A) et
d'hématocrite (B) chez les femmes au second trimestre
de la grossesse
Les bandes noires du graphique indiquent aux proportions de
femmes aux valeurs biologiques pathologiques et celles en blanc
désignent les proportions de femmes aux valeurs biologiques normales.
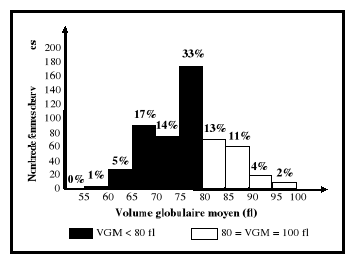
A
B
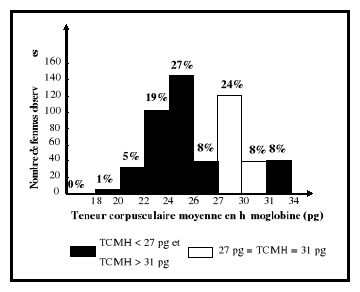
Figure 25 (A, B): Distribution des
proportions de VGM (A) et de TCMH (B) chez
les femmes au second trimestre de la grossesse
Les bandes noires du graphique indiquent aux proportions de
femmes aux valeurs biologiques pathologiques et celles en blanc
désignent les proportions de femmes aux valeurs biologiques normales.
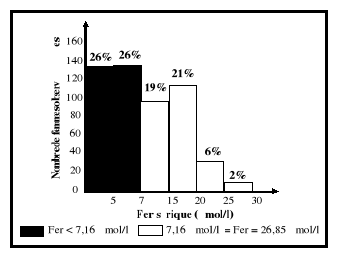
A
B
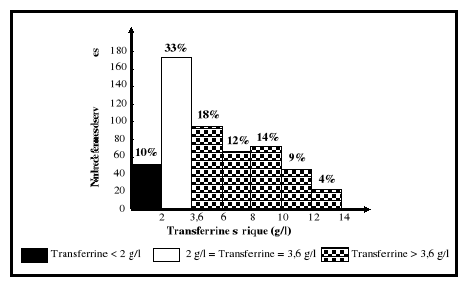
Figure 26 (A, B): Distribution des
proportions des concentrations sériques du fer (A) et
de la transferrine (B) chez les femmes au second trimestre de
la grossesse
Les bandes noires et quadrillées du graphique indiquent
aux proportions de femmes aux valeurs biologiques pathologiques et celles en
blanc désignent les proportions de femmes aux valeurs biologiques
normales.
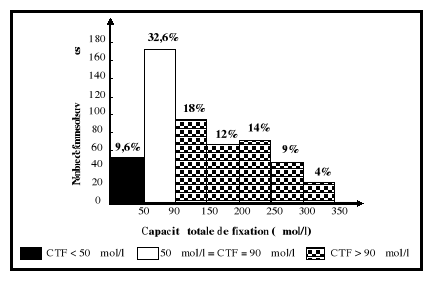
A
B
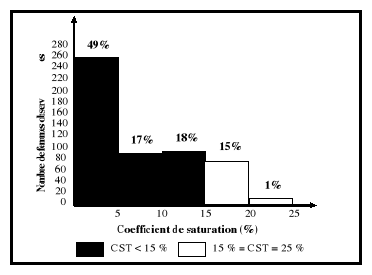
Figure 27 (A, B): Distribution des
proportions de CTF (A) et de CST (B) chez les
femmes au second trimestre de la grossesse
Les bandes noires et quadrillées du graphique indiquent
aux proportions de femmes aux valeurs biologiques pathologiques et celles en
blanc désignent les proportions de femmes aux valeurs biologiques
normales.
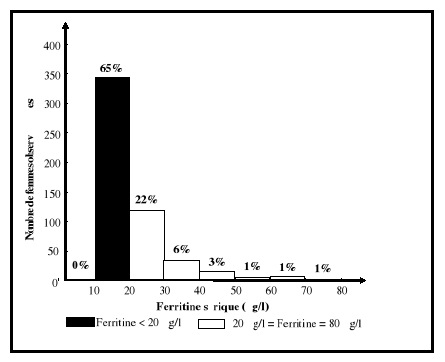
Figure 28: Distribution des proportions des
concentrations sériques de la ferritine chez les femmes au second
trimestre de la grossesse
Les bandes noires du graphique indiquent aux proportions de
femmes aux valeurs biologiques pathologiques et celles en blanc
désignent les proportions de femmes aux valeurs biologiques normales.
1-1-3. Proportions des paramètres biologiques du
statut en fer au troisième trimestre de la grossesse
L'évaluation des paramètres biologiques du
statut en fer chez les femmes au troisième trimestre de la grossesse a
indiqué que :
- 81 % des femmes ont présenté une baisse du
taux d'hémoglobine contre 19 % de femmes aux taux normaux. Cette
proportion de femmes anémiques a comporté 16 % d'anémie
fruste, 23 % d'anémie modérée et 42 % d'anémie
sévère (Figure 29A) ;
- le taux d'hématocrite était bas chez 80,8 %
des femmes contre 19,2 % des sujets aux taux d'hématocrite normaux
(Figure 29B) ;
- 85 % des femmes ont présenté une microcytose
et 1 % de macrocytose contre 14 % de femmes aux VGM
normaux (Figure 30A) ;
- 86,1 % des femmes avaient une hypochromie contre 13,9 % de
femmes aux TCMH normales (Figure 30B) ;
- le fer circulant a diminué chez 74 % des femmes
contre 26 % des sujets aux concentrations sériques de fer normales
(Figure 31A) ;
- 3 % et 74 % des femmes ont présenté
respectivement une diminution et une augmentation des concentrations
sériques de transferrine contre 23 % des sujets aux valeurs normales de
transferrine (Figure 31B) ;
- 77,2 % de femmes ont présenté des valeurs
pathologiques de la capacité totale de fixation (CTF) contre 22,8
% des sujets aux valeurs normales de CTF (Figure
32A) ;
- 95,6 % des sujets ont présenté une baisse
des coefficients de saturation (CST) contre 4,4 % des sujets aux CST
normaux (Figure 32B) ;
- les concentrations sériques de ferritine ont
diminué chez 85 % des femmes contre 15% de femmes aux réserves
normales (Figure 33).
Au troisième trimestre de la grossesse, les
différents compartiments évalués du statut en fer ont
également présenté un effondrement de l'ensemble des
paramètres biologiques mesurés.
A
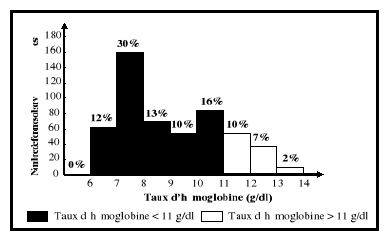
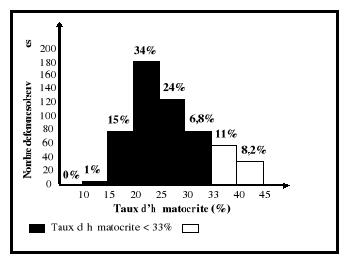
B
Figure 29 (A, B): Distribution des
proportions des taux d'hémoglobine (A) et
d'hématocrite (B) chez les femmes au troisième
trimestre de la grossesse
Les bandes noires du graphique indiquent aux proportions de
femmes aux valeurs biologiques pathologiques et celles en blanc
désignent les proportions de femmes aux valeurs biologiques normales.
A
B
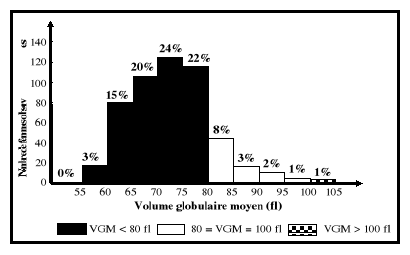
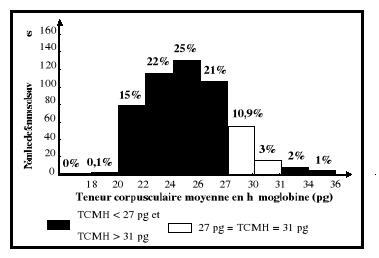
Figure 30 (A, B): Distribution des
proportions de VGM (A) et de TCMH (B) chez
les femmes au troisième trimestre de la grossesse
Les bandes noires et quadrillées du graphique indiquent
aux proportions de femmes aux valeurs biologiques pathologiques et celles en
blanc désignent les proportions de femmes aux valeurs biologiques
normales.
A
B
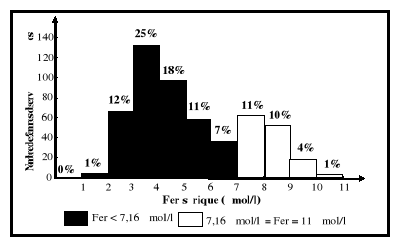
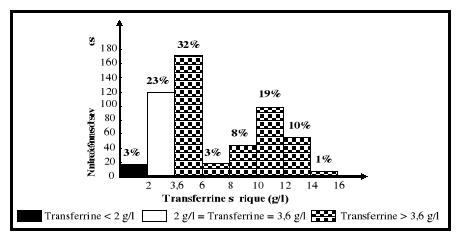
Figure 31 (A, B): Distribution des
proportions des concentrations sériques du fer (A) et
de la transferrine (B) chez les femmes au troisième
trimestre de la grossesse
Les bandes noires et quadrillées du graphique indiquent
aux proportions de femmes aux valeurs biologiques pathologiques et celles en
blanc désignent les proportions de femmes aux valeurs biologiques
normales.
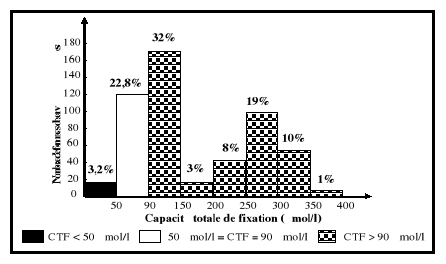
A
B
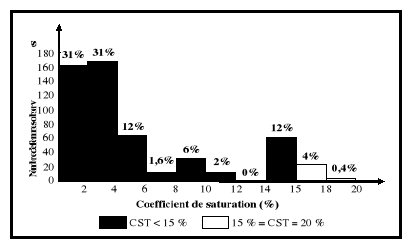
Figure 32 (A, B): Distribution des
proportions de CTF (A) et de CST (B) chez les
femmes au troisième trimestre de la grossesse
Les bandes noires et quadrillées du graphique indiquent
aux proportions de femmes aux valeurs biologiques pathologiques et celles en
blanc désignent les proportions de femmes aux valeurs biologiques
normales.
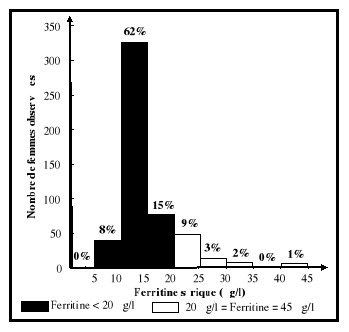
Figure 33: Distribution des proportions
des concentrations sériques de la ferritine chez les femmes au
troisième trimestre de la grossesse
Les bandes noires du graphique indiquent aux proportions de
femmes aux valeurs biologiques pathologiques et celles en blanc
désignent les proportions de femmes aux valeurs biologiques normales.
1-2. Hétérogénéité du
statut en fer chez la femme au cours de la grossesse en
Côte-d'Ivoire
Cette partie des résultats a fait l'objet d'une
publication parue dans les annales de Biologie Clinique de Paris, une revue
indexée avec comité de lecture et facteur d'impact.
1-2-1. Etat des paramètres hématologiques
au cours de la grossesse
Les résultats ont montré une baisse hautement
significative des taux de globules rouges, d'hématocrite, du volume
globulaire moyen (VGM) et de la concentration corpusculaire moyenne en
hémoglobine au dernier trimestre de la grossesse comparativement aux
deux premiers trimestres (p < 0,001). En revanche, le taux
d'hémoglobine et la teneur corpusculaire moyenne en hémoglobine
(TCMH) ont significativement diminué depuis le premier trimestre
jusqu'au troisième trimestre de la grossesse chez la femme en Côte
d'Ivoire par rapport aux valeurs de référence (p < 0,001)
(Tableau XV).
Tableau XV: Comparaison des moyennes des
données hématologiques au cours des 3 trimestres de grossesse
chez l'ensemble des femmes de l'étude
|
Stades de la grossesse
(Trimestres)á
|
|
Données hématologiques
|
Premier
N = 531
|
Second
N = 531
|
Troisième
N = 531
|
|
Numération globulaire
|
|
|
|
|
Globules rouges (1012/l)
|
3,9 #177; 0,02a***
|
3,8 #177; 0,02a***
|
3,6 #177; 0,03b***
|
|
Hémoglobine (g/dl)
|
10,1 #177; 0,1a**
|
9,8 #177; 0,1b**
|
9,1 #177; 0,1c**
|
|
Hématocrite (%)
|
29,2 #177; 0,2a**
|
29,3 #177; 0,3a**
|
26,2 #177; 0,3b**
|
|
Indices érythrocytaires
|
|
|
|
|
VGM (fl)
|
76,1 #177; 0,3a***
|
77 #177; 0,3a***
|
73 #177; 0,4b***
|
|
TCMH (pg)
|
26,4 #177; 0,1a***
|
25,9 #177; 0,1b***
|
25 #177; 0,1c***
|
|
CCMH (g/dl)
|
33,8 #177; 0,1a***
|
33,6 #177; 0,09a***
|
32,8 #177; 0,1b***
|
á : Moyennes #177; Erreurs types
(ESM) ; a, b et c : Groupes de femmes enceintes significativement
différents pour p < 0,05 ; ** : p < 0,01 ;
*** : p < 0,001 ; N : Effectif de l'échantillon de
femmes sélectionnées à chaque trimestre de
grossesse
1-2-2. Profil du statut en fer au cours de la
grossesse
L'étude a révélé qu'au niveau du
compartiment plasmatique, les concentrations sériques de fer et les
coefficients de saturation ont significativement chuté par rapport aux
valeurs de référence aux premier, second et troisième
trimestres de la grossesse chez la femme en Côte d'Ivoire (p < 0,01).
Cependant, les concentrations sériques de transferrine et les
capacités totales de fixation du fer ont présenté une
augmentation hautement significative aux différents trimestres de la
grossesse (p < 0,01). Dans le compartiment de réserve en fer, les
résultats obtenus, ont montré que les concentrations
sériques de la ferritine ont diminué du premier trimestre
jusqu'au troisième trimestre de la grossesse. Cette réduction de
la ferritine sérique a été hautement significative au
cours de la grossesse (p < 0,01) (Figure 34A-E).
A
C
B
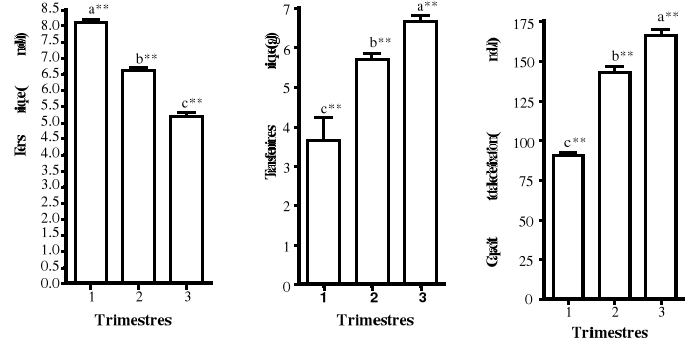
7,16
3,6
90
E
D
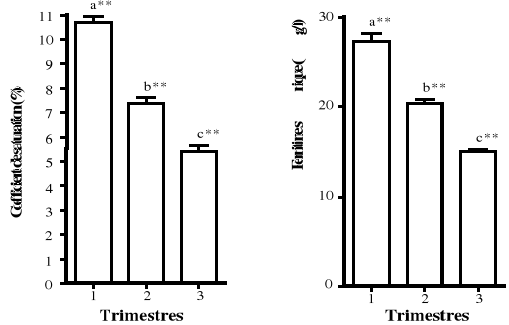
Figure 34 (A, B, C, D, E) : Comportement
du fer circulant au cours de la grossesse
A : Concentrations sériques du
fer ; B : Concentrations sériques de la
transferrine ; C : Capacités totales de
fixation; D : Coefficients de saturation de la
transferrine; E : Concentrations sériques de
ferritine ;
abc : Groupes dont les différences sont
significatives pour p < 0,05 ; ** : p < 0,01 ; Les traits
fournissent les valeurs de référence selon les kits
utilisés.
1-2-3. Fréquences des principaux
paramètres biologiques au cours de la grossesse
Selon le tableau XVI, les taux de
prévalence d'anémie observés chez les femmes et les
proportions de femmes dont les taux d'hématocrite ont été
inférieurs à 33 % (premier et troisième trimestres de la
grossesse) ou 32 % (deuxième trimestre de la grossesse), ont
significativement diminué au second avant de présenter une
augmentation hautement significative au troisième trimestre de la
grossesse (p < 0,05 ; p < 0,01 respectivement). Les résultats
ont montré que les fréquences de femmes enceintes qui
étaient porteuses d'une microcytose (VGM < 80 fl) et d'une
hypochromie (TCMH < 27 pg et TCMH > 31 pg) ont significativement
baissé au dernier trimestre de la grossesse alors qu'il n'était
noté que 1 % de macrocytose (VGM > 100 fl) (p < 0,05)
(Tableau XVI). Dans ce même tableau 2, les
proportions de femmes enceintes dont les concentrations sériques de fer
et de transferrine ont été respectivement inférieures
à 7,16 umol/l et supérieures à 3,6 g/l ont
significativement augmenté tout au long de la grossesse (p < 0,05).
En revanche, les fréquences des sujets dont les concentrations de
transferrine et les capacités totales de fixation du fer ont
été respectivement inférieures à 2 g/l et à
90 umol/l, ont significativement diminué au dernier trimestre de la
grossesse (p < 0,05).
En ce qui concerne le coefficient de saturation de la
transferrine (CST), les proportions ont présenté une augmentation
significative au second trimestre de la grossesse contre une diminution non
significative au troisième trimestre (p < 0,05 ; p > 0,05
respectivement). Au niveau du compartiment de réserves en fer, 57
% ; 65 % et 85 % de femmes ont présenté des concentrations
sériques de ferritine en dessous de 20 ug/l. Ces proportions ont
significativement augmenté tout au long de la grossesse (p < 0,05).
Cette augmentation a été hautement significative au dernier stade
de la grossesse (p < 0,01) (Tableau XVI).
Tableau XVI: Proportions
comparées des principaux paramètres biologiques du statut en fer
au cours de la grossesse
|
Stades de la grossesse (Trimestres)
|
|
|
Données biologiques
|
Premier
(N = 531)
|
Second
(N = 531)
|
Troisième
(N = 531)
|
p
|
|
Numération globulaire
|
n %
|
n %
|
n %
|
|
|
hémoglobine (g/dl)a
|
|
|
|
|
|
6 - 10,5/11
|
154 29
|
221 41,6
|
101 19
|
< 0,05
|
|
10,5/11 - 14,4
|
377 71
|
310 58,4
|
430 81
|
< 0,01
|
|
hématocrite (%)b
|
|
|
|
|
|
11,5 - 33/32
|
97 9
|
197 37,1
|
102 19,2
|
< 0,05
|
|
32/33 - 43
|
434 91
|
334 62,9
|
429 80,8
|
< 0,01
|
|
Indices érythrocytaires
|
|
|
|
|
|
VGM (fl)
|
|
|
|
|
|
80 - 100
|
149 28
|
159 30
|
80 15
|
< 0,05
|
|
51,5 - 80
|
382 72
|
372 70
|
446 84
|
< 0,05
|
|
100 - 110
|
- -
|
- -
|
5 1
|
> 0,05
|
|
TCMH (pg)
|
|
|
|
|
|
15,9 - 27 et 31 - 37,6
|
205 38,6
|
170 32
|
74 13,9
|
< 0,05
|
|
< 27 et 31
|
326 61,4
|
361 68
|
457 86,1
|
< 0,01
|
|
Compartiment plasmatique
|
|
|
|
|
|
Fer sérique (umol/l)
|
|
|
|
|
|
7,16 - 26,85
|
255 48
|
245 46
|
138 26
|
< 0,05
|
|
1,6 - 7,16
|
276 52
|
276 52
|
393 74
|
< 0,05
|
|
26,85 - 29,2
|
- -
|
10 2
|
- -
|
> 0,05
|
|
Transferrine sérique (g/l)
|
|
|
|
|
|
2 - 3,6
|
244 46
|
175 33
|
122 23
|
< 0,05
|
|
1,2 - 2
|
75 14
|
53 10
|
16 3
|
< 0,01
|
|
3,6 - 19
|
212 40
|
303 57
|
393 74
|
< 0,01
|
|
Capacité totale de fixation (umol/l)
|
|
|
|
|
|
50 - 90
|
243 45,8
|
173 32,6
|
121 22,8
|
< 0,05
|
|
30,5 - 50
|
73 13,7
|
51 9,6
|
17 3,2
|
< 0,01
|
|
90 - 475,7
|
215 40,5
|
307 57,8
|
393 74
|
< 0,01
|
|
Coefficient de saturation (%)
|
|
|
|
|
|
15 - 33
|
149 28
|
85 16
|
87 4,4
|
< 0,01
|
|
0,5 - 15
|
382 72
|
446 84
|
444 95,6
|
< 0,001
|
|
Compartiment de réserves en fer
|
|
|
|
|
|
Ferritine sérique (ug/l)
|
|
|
|
|
|
20 - 109,5
|
228 43
|
186 35
|
80 15
|
< 0,0001
|
|
6,2 - 20
|
303 57
|
345 65
|
451 85
|
< 0,00001
|
a : Valeurs normales des taux d'hémoglobine des
femmes aux premier et troisième trimestres (11 g/dl) d'une part et
d'autre part au second trimestre (10,5 g/dl) de la grossesse; b : Valeurs
normales des taux d'hématocrite des femmes aux premier et
troisième trimestres (33 %) d'une part et d'autre part au second
trimestre (32 %) de la grossesse; NB : les taux
d'hémoglobine sont identiques aux premier et troisième trimestres
de la grossesse ; il en est de pour les taux d'hématocrite.
N : Effectif total des femmes enceintes
sélectionnées à chaque trimestre de grossesse ;
n : Effectifs observés chez les femmes pour chaque
classe de paramètres biologiques.
1-2-4. Prévalence de la carence martiale et des
anémies au cours de la grossesse
A partir des variations de l'ensemble des paramètres
hématimétriques, 4 types d'anémies sont observées
chez les femmes en âge de procréer enceintes. Il s'agit de
l'anémie hypochrome microcytaire, de l'anémie hypochrome
normocytaire, de l'anémie normochrome normocytaire et de
l'anémie normochrome microcytaire (Tableau XVII). Les
résultats de l'étude ont indiqué que la proportion de
l'anémie hypochrome microcytaire était significativement plus
élevée tout au long de la grossesse comparativement aux autres
types d'anémies (p < 0,01)
L'étude a révélé que 14,5 %
des femmes ont présenté un statut en fer normal au premier
trimestre la grossesse. Cette fréquence n'a pas significativement (p
> 0,05) diminué au second trimestre (10,9 %). Aucune femme n'a
présenté un statut martial normal au troisième trimestre
de la grossesse.
La simple déplétion en fer chez les femmes a
présenté des taux de prévalence de 14,5 %, de 30,7 % et de
19 % respectivement aux premier, second et troisième trimestres. La
fréquence de carence martiale a significativement (p < 0,05)
augmenté au second trimestre avant de diminuer significativement au
troisième trimestre de la grossesse (p < 0,01 ; p < 0,05
respectivement) (Tableau XVIII). L'anémie
ferriprive est observée chez 42,2 % ; 34,3 % et 66 % des femmes
respectivement au premier, au second et au troisième trimestre de la
grossesse. Ces fréquences d'anémie ferriprive ont
significativement diminué au second trimestre avant de présenter
une augmentation hautement significative au dernier stade de la grossesse (p
< 0,05 ; p < 0,01respectivement). L'anémie inflammatoire
était présente seulement au début de la grossesse avant de
disparaître au second et au troisième trimestres. Cette
anémie associée à la carence martiale a indiqué des
proportions de 18,5 % ; 24,1 % et 15 % au cours de la grossesse.
L'augmentation et la diminution respectivement aux second et troisième
trimestres n'étaient pas significatives (p > 0,05)
(Tableau XVIII).
Tableau XVII: Types d'anémies selon
les variations des paramètres hématimétriques
|
AHM
|
AHN
|
ANN
|
ANM
|
|
|
n %
|
n %
|
n %
|
n %
|
p
|
|
Premier trimestre
|
270 71,6
|
16 4,2
|
47 12,5
|
15 4,8
|
< 0,001
|
|
Deuxième trimestre
|
217 70
|
15 4,8
|
38 12,3
|
40 12,9
|
< 0,001
|
|
Troisième trimestre
|
415 96,5
|
6 1,4
|
6 1,4
|
3 0,7
|
< 0,001
|
|
p
|
< 0,01
|
> 0,05
|
< 0,01
|
< 0,01
|
|
n: Effectif observé pour chaque type d'anémie
selon le trimestre de la grossesse
AHM : Anémie hypochrome
microcytaire ; AHN : Anémie hypochrome
normocytaire
ANN : Anémie normochrome
normocytaire ; ANM : Anémie normochrome
microcytaire
Tableau XVIII: Comparaison des
proportions (%) de carence martiale et des types d'anémies au cours de
la grossesse
|
Stades de la grossesse (Trimestres)
|
|
Carence martiale et anémies
|
Premier
(n = 531)
|
Deuxième
(n = 531)
|
Troisième
(n = 531)
|
|
Sujets au statut en fer normal (%)
|
14,5
|
10,9
|
-
|
|
Carence martiale (%)
|
14,5
|
30,7**
|
19*
|
|
Anémies nutritionnelles
|
|
|
|
|
Anémie ferriprive (%)
|
42,2
|
34,3*
|
66**
|
|
Autres types d'anémies
|
|
|
|
|
Anémie inflammatoire (%)
|
10,3
|
-
|
-
|
|
Carence martiale +
|
|
|
|
|
Anémie inflammatoire (%)
|
18,5
|
24,1
|
15
|
* : Différence statistiquement significative (p
< 0,05) ; ** : Différence statistique hautement
significative (p <0,01) ; - : Aucune prévalence n'est
observée.
1-3. Relations entre la taille des réserves en fer
et les anémies au cours de la grossesse
Au cours de la grossesse les analyses de corrélations
de Pearson entre les paramètres biologiques ont montré qu'une
baisse significative du fer circulant et du coefficient de saturation (CST) est
associée à celle des paramètres hématologiques. A
l'inverse, une augmentation significative de la transferrine sérique et
de la capacité totale de fixation (CTF) est accompagnée d'une
baisse des paramètres hématologiques. Au niveau de la ferritine
sérique, les corrélations de Pearson étaient
significatives au premier trimestre de la grossesse. A ce stade de la
grossesse, une baisse significative de la ferritine sérique est
associée à celle des paramètres hématologiques
(Tableau XIX).
Au regard de ces résultats, l'anémie des femmes
est observée lorsque la taille des réserves en fer est
abaissée au cours de la grossesse.
Tableau XIX: Coefficients de
corrélation de Pearson (r) entre les données biologiques au cours
de la grossesse
Les valeurs des coefficients de corrélation en gras ont
été les plus significatives pour p < 0,05 ; * : p
< 0,05 ; * : p < 0,01 ; * : p < 0,001 ;
- : Coefficient de corrélation non significatif pour p < 0,05
|
Premier trimestre
|
|
Paramètres biologiques
|
Fer
|
Transferrine
|
CTF
|
CST
|
Ferritine
|
|
Hémoglobine
|
0,35***
|
- 0,39***
|
- 0,39***
|
0,42***
|
0,23***
|
|
Hématocrite
|
0,35***
|
- 0,38***
|
- 0,38***
|
0,41***
|
0,28***
|
|
VGM
|
0,25***
|
- 0,16***
|
- 0,16***
|
0,25***
|
0,19***
|
|
TCMH
|
0,25***
|
- 0,22***
|
- 0,22***
|
0,29***
|
0,17***
|
|
Second trimestre
|
|
Hémoglobine
|
0,28***
|
- 0,25***
|
- 0,25***
|
0,3***
|
-
|
|
Hématocrite
|
0,26***
|
- 0,23***
|
- 0,23***
|
0,28***
|
-
|
|
VGM
|
0,23*
|
- 0,13*
|
- 0,13*
|
0,22*
|
-
|
|
TCMH
|
0,27***
|
- 0,19***
|
- 0,19***
|
0,28*
|
-
|
|
Troisième trimestre
|
|
Hémoglobine
|
0,47***
|
- 0,57***
|
- 0,57***
|
0,65***
|
-
|
|
Hématocrite
|
0,45***
|
- 0,46***
|
- 0,46***
|
0,61***
|
-
|
|
VGM
|
0,42***
|
- 0,3***
|
- 0,3***
|
0,51***
|
-
|
|
TCMH
|
0,38***
|
- 0,49***
|
- 0,49***
|
0,55***
|
-
|
1-4. Distribution au cours de la grossesse des
paramètres biologiques selon les différentes formations
sanitaires
Dans le but d'observer les interactions entre les formations
sanitaires et les périodes gestationnelles sur les paramètres
biologiques des sujets de notre étude, des analyses factorielles sont
réalisées. De plus, une évaluation des proportions des
paramètres biologiques est menée aux fins d'indiquer la
distribution de ces indicateurs biologiques du statut en fer au cours de la
grossesse en fonction des centres de santé.
1-4-1. Evolution des paramètres biologiques du
statut en fer des femmes enceintes selon les différentes formations
sanitaires
A partir des analyses factorielles de variances (2 facteurs),
les taux de globules rouges étaient significativement bas chez les
femmes des 2 centres de santé de la commune de Port-Bouët au
premier trimestre de la grossesse (p < 0,001). Toutefois, à ce
même stade de la grossesse, le nombre de globules rouges est
élevé chez les sujets des formations sanitaires des communes
d'Abobo et de Cocody (p < 0,001). Au second trimestre, nous avons
observé une baisse significative des taux de globules rouges chez les
femmes des centres de santé des communes d'Abobo et celles de
Port-Bouët (p < 0,001). Pour le troisième trimestre, les taux de
globules rouges ont significativement augmenté chez les sujets de la
commune de Cocody (p < 0,001). En revanche, ils étaient bas chez les
femmes des 2 formations sanitaires de Port-Bouët (p < 0,001) à
cette période de la grossesse (Figure 35A).
Au niveau des taux d'hémoglobine, des valeurs
significativement élevées sont indiquées chez les sujets
des communes d'Abobo et de Cocody au premier trimestre (p < 0,01). Elles
l'étaient seulement chez les femmes de Cocody au second et au
troisième trimestre de la grossesse (p < 0,01 ; p < 0,01
respectivement). Cependant, les taux d'hémoglobine ont diminué
chez les femmes des 2 centres de santé de Port-Bouët au premier et
au troisième trimestres (p < 0,01 ; p < 0,01 respectivement).
Au second trimestre de la grossesse, ils l'étaient chez les sujets
d'Abobo et chez ceux des 2 formations sanitaires de Port-Bouët (p <
0,01) (Figure 35B).
En ce qui concerne les taux d'hématocrite et les
volumes globulaires moyens (VGM), les valeurs les plus significativement
augmentées sont observées chez les femmes du centre de
santé de Cocody pendant les 3 trimestres de la grossesse (p <
0,001 ; p < 0,001 ; p < 0,001 respectivement)
(Figures 36A et 36B). Les taux d'hématocrite
étaient significativement bas chez les sujets des 2 centres de
santé de Port-Bouët au premier et au troisième trimestre de
la grossesse (p < 0,001 ; p < 0,001 respectivement). Au second
trimestre, ils l'étaient chez les femmes d'Abobo et chez celles des 2
centres de santé de Port-Bouët (p < 0,001)
(Figure 36A). Pour les volumes globulaires moyens, une
diminution significative est indiquée chez les femmes des centres de
santé d'Abobo et de Port-Bouët durant les 3 trimestres de la
grossesse (p < 0,001 ; p < 0,001 ; p < 0,001 respectivement)
(Figures 36B).
Au niveau des teneurs corpusculaires moyennes en
hémoglobine (TCMH), l'ensemble des femmes de notre étude ont
présenté les mêmes valeurs de TCMH au premier trimestre de
la grossesse. Ces valeurs ont significativement augmenté au second et au
troisième trimestres de la grossesse chez les sujets de la formation
sanitaire de Cocody (p < 0,001 ; p < 0,001 respectivement). En
revanche, ces TCMH ont significativement chuté chez les femmes enceintes
du centre de santé d'Abobo et chez celles de Port-Bouët au second
trimestre (p < 0,001). Au troisième trimestre de la grossesse, elles
l'étaient seulement chez les sujets des centres de santé de
Port-Bouët (p < 0,001) (Figure 37A).
Pour les concentrations corpusculaires moyennes en
hémoglobine (CCMH), une augmentation significative des valeurs est
indiquée chez les femmes des centres de santé d'Abobo, de
Port-Bouët au premier trimestre de la grossesse (p < 0,001). Au second
trimestre, les CCMH étaient significativement basses chez les sujets de
Cocody et de Port-Bouët (p < 0,001). Au troisième de la
grossesse, une augmentation significative des valeurs de CCMH est
observée chez les femmes des centres de santé d'Abobo et de
Cocody (p < 0,001). En revanche, les CCMH ont significativement
diminuées à ce même stade de la grossesse chez les femmes
de la formation sanitaire « les Hortensias » (p < 0,001)
(Figure 37B).
Au niveau du compartiment plasmatique, les concentrations
sériques du fer étaient similaires chez l'ensemble des femmes de
notre étude au premier trimestre de la grossesse. Toutefois, le fer
circulant était significativement bas au second et au troisième
trimestre de la grossesse chez les sujets des centres de santé d'Abobo
et de Port-Bouët (p < 0,001 ; p < 0,001 respectivement).
Pendant ces 2 derniers trimestres de la grossesse, les concentrations
sériques du fer ont significativement augmenté chez les femmes du
centre de santé de Cocody (p < 0,001 ; p < 0,001
respectivement) (Figure 38A).
En ce qui concerne les concentrations sériques de
transferrine et les capacités totales de fixation du fer par la
transferrine (CTF) au premier trimestre de la grossesse, une augmentation
significative est observée chez les femmes des centres de santé
de Cocody et de Port-Bouët (p < 0,01). En revanche, elles
l'étaient au second et au troisième trimestres chez les femmes
enceintes des 2 formations sanitaires de Port-Bouët (p < 0,01 ; p
< 0,01 respectivement). Ces 2 indicateurs biochimiques étaient
significativement bas chez les femmes enceintes d'Abobo et de Cocody au second
trimestre (p < 0,01).
Au troisième trimestre de la grossesse, cette baisse
était significative seulement chez les sujets de Cocody (p < 0,01)
(Figures 38B et 39A).
Les coefficients de saturation de la transferrine par le fer
(CST) ont significativement chuté chez les femmes de Cocody et de
Port-Bouët au premier trimestre, chez les sujets de Port-Bouët au
second et au troisième trimestre de la grossesse (p < 0,001 ; p
< 0,001 ; p < 0,001 respectivement). Cependant, ils ont
augmenté au premier et au troisième trimestres de la grossesse
chez les femmes de Cocody (p < 0,001 ; p < 0,001 respectivement). Au
second trimestre, les femmes d'Abobo et de Cocody ont présenté
une augmentation significative des valeurs de CST (p < 0,001)
(Figure 39B).
Dans le compartiment de réserves en fer, les
concentrations sériques de ferritine étaient significativement
basses chez les femmes d'Abobo au premier trimestre de la grossesse (p <
0,01). Toutefois, elles ont augmenté chez les femmes de Port-Bouët
à cette même période de la grossesse (p < 0,01). Aux 2
derniers trimestres de la grossesse, aucune différence significative
n'est indiquée entre les concentrations sériques de ferritine de
l'ensemble des femmes de notre étude (Figure 39).
La dynamique au cours de la grossesse des paramètres
biologiques au sein des 4 formations sanitaires de la ville d'Abidjan est
altérée chez l'ensemble des femmes de notre étude.
Toutefois, cette altération est beaucoup plus prononcée chez les
sujets de la commune de Port-Bouët précisément chez ceux de
la formation sanitaire « les Hortensias ». Elle
était moindre chez les femmes enceintes du centre de santé de
Cocody. Il a existé donc une interaction des 3 trimestres et des
différentes formations sanitaires sur les paramètres biologiques
du statut en fer des sujets sélectionnés.
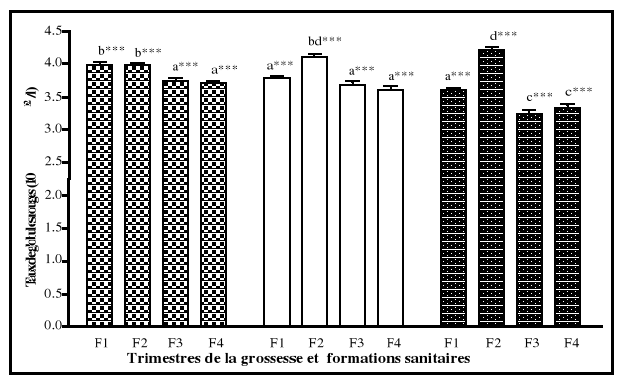
A
B
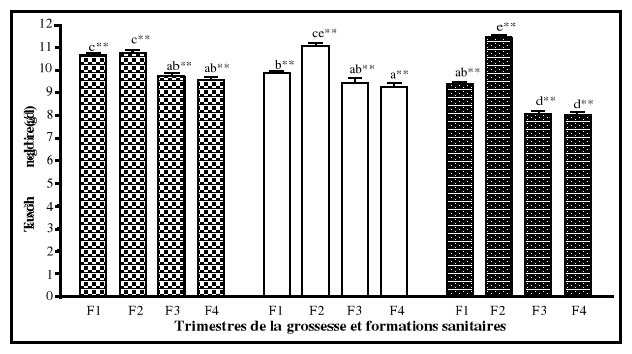
Figure 35 (A, B) : Variation des taux de
globules rouges (A) et d'hémoglobine
(B) selon les formations sanitaires au cours des trois
trimestres de grossesse
F2 : Formation sanitaire et urbaine de Cocody Sud ;
F3 : Hôpital municipal de Vridi-Cité (Port-Bouët) ;
F4 : Formation sanitaire communautaire et urbaine
« les Hortensias » de Vridi-SIR (Port-Bouët) ;
Les barres indiquent les valeurs de référence ; ** : p
< 0,01 ; *** : p < 0,001 ; a, b, c, d et e : Groupes
de femmes dont les différences sont significatives pour <
0,05 ;
Premier trimestre
Troisième trimestre
Second trimestre
A
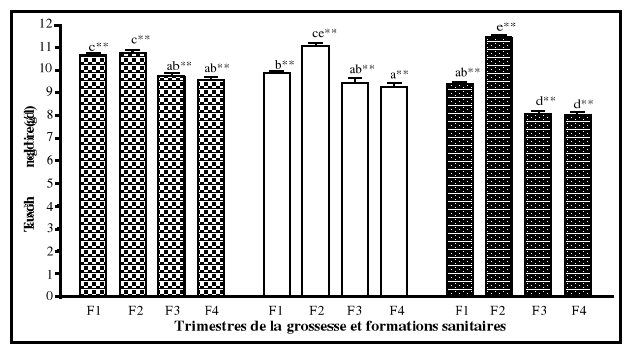
B
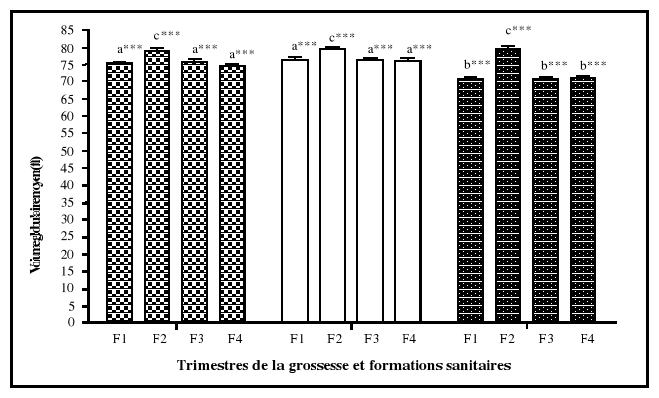
Figure 36 (A, B) : Variation des taux
d'hématocrite (A) et des volumes globulaires moyens
(B) selon les formations sanitaires au cours des trois
trimestres de grossesse
F2 : Formation sanitaire et urbaine de Cocody Sud ;
F3 : Hôpital municipal de Vridi-Cité (Port-Bouët) ;
F4 : Formation sanitaire communautaire et urbaine
« les Hortensias » (Port-Bouët) ; Les barres
indiquent les valeurs de référence ; *** : p <
0,001 ; a, b, c, d, e et f : Groupes de femmes dont les
différences sont significatives pour < 0,05 ;
Premier trimestre
Troisième trimestre
Second trimestre
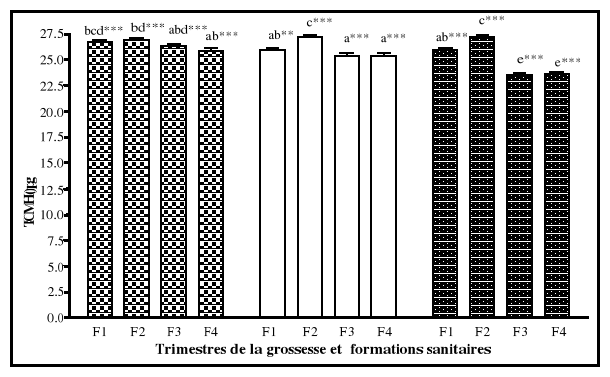
A
B
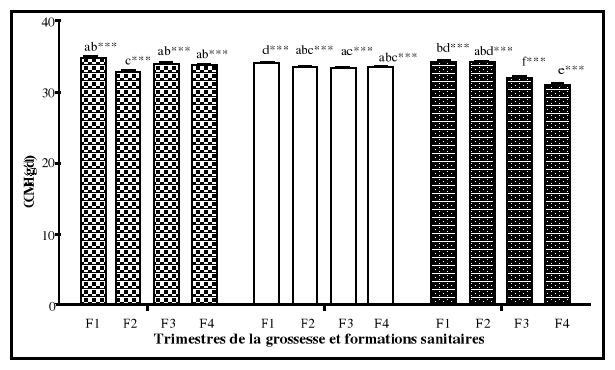
Figure 37 (A, B) : Variation des teneurs
(A) et des concentrations corpusculaires moyennes en
hémoglobine (B) selon les formations sanitaires au
cours des trois trimestres de grossesse
F1 : Formation sanitaire et urbaine d'Abobo Sud ;
F2 : Formation sanitaire et urbaine de Cocody Sud ;
F3 : Hôpital municipal de Vridi-Cité
(Port-Bouët) ; F4 : Formation sanitaire communautaire et urbaine
« les Hortensias » (Port-Bouët) ; *** : p
< 0,001 ; Les barres indiquent les valeurs de
références ; a, b, c, d, e et f : Groupes de femmes
dont les différences sont significatives pour < 0,05
Premier trimestre
Troisième trimestre
Second trimestre
A
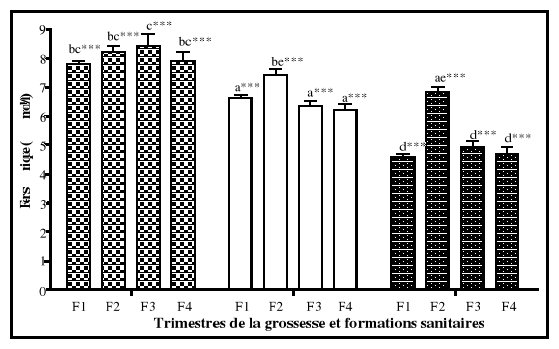
B
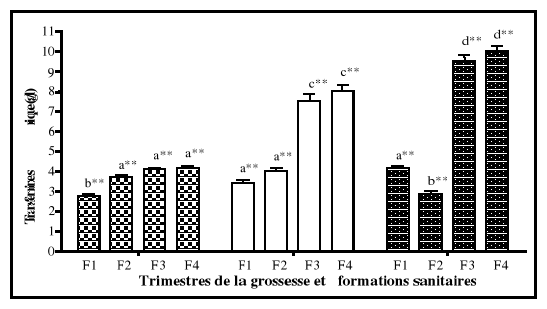
Figure 38 (A, B) : Variation des
concentrations sériques du fer (A) et de la
transferrine (B) selon les formations sanitaires au cours des
trois trimestres de grossesse
F1 : Formation sanitaire et urbaine d'Abobo Sud ;
F2 : Formation sanitaire et urbaine de Cocody Sud ; F3 :
Hôpital municipal de Vridi-Cité (Port-Bouët) ; F4 :
Formation sanitaire communautaire et urbaine « les
Hortensias » (Port-Bouët) ; ** : p < 0,01 ;
*** : p < 0,001 ; a, b, c, d et e : Groupes de femmes dont
les différences significatives pour < 0,05; Les barres indiquent les
valeurs de référence ;
Premier trimestre
Troisième trimestre
Second trimestre
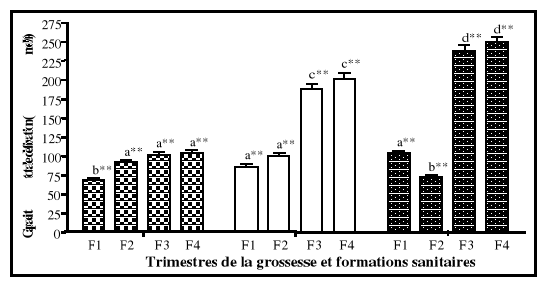
A
B
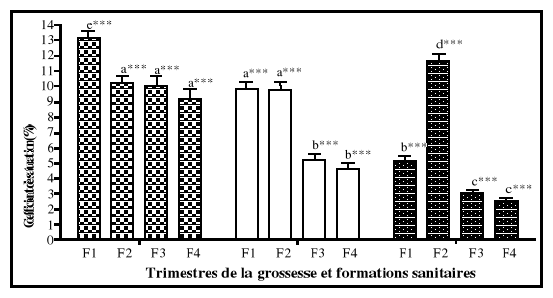
Figure 39 (A, B) : Variation des
capacités totales de fixation (A) et des coefficients
de saturation (B) selon les formations sanitaires au cours des
trois trimestres de grossesse
F1 : Formation sanitaire et urbaine d'Abobo Sud ;
F2 : Formation sanitaire et urbaine de Cocody Sud ; F3 :
Hôpital municipal de Vridi-Cité (Port-Bouët) ; F4 :
Formation sanitaire communautaire et urbaine « les
Hortensias » (Port-Bouët) ; ** : p < 0,01 ;
*** : p < 0,001 ; a, b, c, d et e : Groupes de femmes dont
les différences sont significatives pour < 0,05
Premier trimestre
Troisième trimestre
Second trimestre
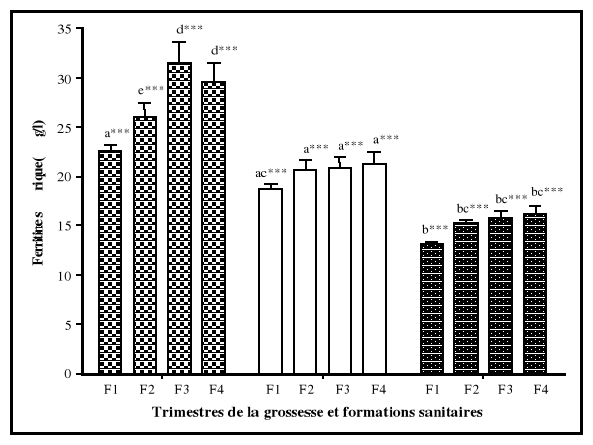
Figure 40: Variation des concentrations
sériques de ferritine selon les formations sanitaires au cours des trois
trimestres de grossesse
Premier trimestre
Troisième trimestre
Second trimestre
F1 : Formation sanitaire et urbaine d'Abobo Sud ;
F2 : Formation sanitaire et urbaine de Cocody Sud ; F3 :
Hôpital municipal de Vridi-Cité (Port-Bouët) ; F4 :
Formation sanitaire communautaire et urbaine « les
Hortensias » (Port-Bouët) ; *** : p < 0,001 ;
a, b, c, d et e : Groupes de femmes dont les différences sont
significatives pour < 0,05 ; La barre indique la valeur de
référence ;
1-4-2. Comparaison des proportions des principaux
paramètres biologiques au cours de la grossesse des femmes selon les
différentes formations sanitaires
Les tableaux XX, XXI et
XXII ont résumé la distribution des proportions
des principaux paramètres biologiques d'évaluation du statut en
fer chez l'ensemble des femmes des 4 formations sanitaires au cours des 3
trimestres de la grossesse.
Selon ces tableaux, les taux de prévalence de
l'anémie, de microcytose, d'hypochromie et des sujets dont les valeurs
d'hématocrite étaient inférieures à 32 % (second
trimestre) et à 33 % (troisième trimestre) étaient
significativement bas chez les femmes du centre de santé de Cocody
durant les 3 trimestres de la grossesse (Tableaux XX,
XXI et XXII). Pour ces paramètres
hématologiques, les femmes de Port-Bouët au premier trimestre de la
grossesse ont présenté les taux de prévalence de
l'anémie, des sujets dont les valeurs d'hématocrite
étaient inférieures à 33 % et de microcytose les plus
significativement élevés (p < 0,000001 ; p <
0,001 respectivement). Le taux d'hypochromie à cette même
période de grossesse chez les femmes d'Abobo est augmenté (p <
0,05). Ces dernières ont indiqué au second trimestre de la
grossesse les taux d'anémie et des femmes dont les valeurs
d'hématocrite étaient inférieures à 32 % les plus
significativement élevés (p < 0,05 ; p < 0,00001
respectivement). Au troisième trimestre de la grossesse, les taux de
prévalence de l'anémie, de microcytose, d'hypochromie et des
femmes dont les valeurs d'hématocrite étaient inférieures
à 33 % ont augmentés chez ces mêmes femmes d'Abobo et
celles de Port-Bouët (Tableaux XX, XXI
et XXII).
Au niveau des paramètres biochimiques du statut en fer,
les femmes enceintes des centres de santé d'Abobo et de Port-Bouët
au second et au troisième trimestres ont indiqué des
concentrations sériques du fer les plus significativement
élevées (p < 0,05 ; p < 0,00001 respectivement). En
revanche, au premier trimestre de la grossesse, aucune différence
significative de concentrations sériques du fer n'est
révélée entre les femmes des différentes formations
sanitaires (p > 0,05) (Tableaux XX, XXI et
XXII).
Pour les concentrations sériques de transferrine, les
proportions de femmes aux valeurs inférieures à 2 g/l
étaient significativement basses chez les sujets de Cocody et
élevées chez ceux d'Abobo au premier et au second trimestres de
la grossesse (p < 0,00001 ; p < 0,001 respectivement). Toutefois,
aucune différence significative de proportions n'est observée
entre ces femmes enceintes au troisième trimestre (p > 0,05). Par
ailleurs, aucune femme de Port-Bouët n'a présenté des
valeurs de transferrine sérique en dessous de 2 g/l pendant les 3
périodes choisies de la grossesse (Tableaux XX,
XXI et XXII).
Avec les capacités totales de fixation (CTF), les
fréquences de femmes dont les valeurs étaient inférieures
à 50 umol/l, ont significativement augmenté au premier et au
second trimestres de la grossesse chez les sujets d'Abobo (p <
0,00001 ; p < 0,001 respectivement). Elles étaient basses chez
les femmes enceintes de Port-Bouët au premier trimestre et chez celles de
Cocody au second trimestre (p < 0,00001 ; p < 0,001 respectivement)
(Tableaux XX, XXI et XXII).
Pour ces 2 indicateurs biochimiques, les proportions de femmes aux valeurs
supérieures à 3,6 g/l et à 90 umol/l respectivement pour
la transferrine et la CTF, ont significativement chuté chez les sujets
d'Abobo au premier trimestre, chez ceux de Cocody (CTF seulement) et d'Abobo
(transferrine et CTF) au second trimestre et chez les femmes de Cocody au
troisième trimestre de la grossesse (Tableaux XX,
XXI et XXII).
Pour les CST, les proportions de femmes dont les valeurs
étaient inférieures à 15 % étaient
significativement basses chez les sujets d'Abobo au premier trimestre et chez
ceux de Cocody durant les 2 derniers trimestres (p < 0,05 ; p <
0,05 ; p < 0,00001 respectivement). Elles sont élevées
chez les femmes de « les Hortensias » au premier trimestre
et chez l'ensemble des femmes de Port-Bouët pendant les 2 derniers
trimestres (p < 0,05 ; p < 0,05 ; p < 0,00001
respectivement) (Tableaux XX, XXI et
XXII).
Au niveau des concentrations sériques de ferritine, les
proportions de femmes aux valeurs inférieures à 20 ug/l ont
significativement diminué chez les sujets d'Abobo au premier trimestre
et chez ceux de Port-Bouët au troisième trimestre (p <
0,05 ; p < 0,05 respectivement). Elles ont augmenté chez les
femmes de Cocody et de Port-Bouët au premier trimestre et chez celles
d'Abobo au troisième trimestre (p < 0,05 ; p < 0,05
respectivement). En revanche, aucune différence significative de
proportions n'est observée entre les femmes au second trimestre de la
grossesse (p > 0,05) (Tableaux XX, XXI et
XXII).
Au cours de la grossesse, les taux de prévalence des
paramètres biologiques aux valeurs anormales sont plus prononcés
chez l'ensemble des femmes enceintes de Port-Bouët plus
précisément chez celles de la formation sanitaire « les
Hortensias ». Ils étaient meilleurs chez les femmes enceintes
de Cocody comparativement aux 2 autres communes.
Au total, nous avons noté un effet interactif des
différentes formations sanitaires et des stades choisis de grossesse sur
les 11 paramètres biologiques mesurés chez l'ensemble des femmes
enceintes de notre étude.
Tableau XX : Répartition des
proportions des paramètres biologiques au premier trimestre de la
grossesse selon les formations sanitaires
|
Différentes formations sanitaires
|
|
|
Principales données
biologiques
|
Abobo
N = 146
|
Cocody
N = 121
|
Hortensias
N = 137
|
Vridi-Cité
N = 127
|
p
|
|
Numération globulaire
|
n %
|
n %
|
n %
|
n %
|
|
|
Taux d'hémoglobine (g/dl)
|
|
|
|
|
|
|
6,3 - 11
|
91 62
|
63 52
|
117 85,4
|
106 83,5
|
< 0,00001
|
|
11 - 14,1
|
55 38
|
58 48
|
20 14,6
|
21 16,5
|
< 0,01
|
|
Taux d'hématocrite (%)
|
|
|
|
|
|
|
17,2 - 33
|
123 84,2
|
78 64,5
|
120 87,6
|
113 89
|
< 0,001
|
|
33 - 42,8
|
23 15,8
|
43 35,5
|
17 12,4
|
14 11
|
< 0,01
|
|
Indices érythrocytaires
|
|
|
|
|
|
|
VGM (fl)
|
|
|
|
|
|
|
51,7 - 80
|
118 81
|
80 66
|
105 76,6
|
93 73,2
|
< 0,05
|
|
80 - 100
|
28 19
|
41 34
|
32 23,4
|
33 26
|
< 0,05
|
|
100 - 104,5
|
- -
|
- -
|
- -
|
1 0,8
|
> 0,05
|
|
TCMH (pg)
|
|
|
|
|
|
|
15,9 - 27 et 31 - 37,6
|
102 70
|
67 55,4
|
94 68,6
|
76 59,8
|
< 0,05
|
|
27 - 31
|
44 30
|
54 44,6
|
43 31,4
|
51 40,2
|
< 0,05
|
|
Compartiment plasmatique
|
|
|
|
|
|
|
Fer sérique (umol/l)
|
|
|
|
|
|
|
2,2 - 7,16
|
80 55
|
58 48
|
74 54
|
60 47,2
|
> 0,05
|
|
26,85 - 24,6
|
66 45
|
63 52
|
63 46
|
67 52,8
|
> 0,05
|
|
Transferrine sérique (g/l)
|
|
|
|
|
|
|
1,4 - 2
|
58 40
|
24 20
|
- -
|
- -
|
< 0,00001
|
|
2 - 3,6
|
50 34
|
58 48
|
66 48,2
|
65 51,2
|
< 0,05
|
|
3,6 - 7,2
|
38 26
|
39 32
|
71 51,8
|
62 48,8
|
< 0,01
|
|
CTF (umol/l)
|
|
|
|
|
|
|
35,5 - 50
|
57 39,1
|
15 12,4
|
2 1,5
|
1 0,8
|
< 0,00001
|
|
50 - 90
|
51 34,9
|
66 54,4
|
64 46,7
|
64 50,4
|
> 0,05
|
|
90 - 198
|
38 26
|
40 33,2
|
71 51,8
|
62 48,8
|
< 0,01
|
|
CST (%)
|
|
|
|
|
|
|
1,7 - 15
|
85 58,2
|
80 66
|
111 81
|
87 68,5
|
< 0,05
|
|
15 - 33
|
61 41,8
|
41 34
|
26 19
|
40 31,5
|
< 0,05
|
|
Compartiment de réserves en fer
|
|
|
|
|
|
|
Ferritine sérique (ug/l)
|
|
|
|
|
|
|
10,4 - 20
|
73 50
|
71 59
|
86 62,8
|
70 55,1
|
< 0,05
|
|
20 - 109,5
|
73 50
|
50 41
|
51 37,2
|
57 44,9
|
< 0,05
|
N : Effectif total des femmes enceintes
sélectionnées à chaque trimestre de grossesse ;
n : Effectifs observés chez les
femmes pour chaque classe de paramètres biologiques
Tableau XXI : Répartition des
proportions des paramètres biologiques 4 formations sanitaires au second
trimestre de la grossesse
|
Différentes formations sanitaires
|
|
|
Principales données
biologiques
|
Abobo
N = 146
|
Cocody
N = 121
|
Hortensias
N = 137
|
Vridi-Cité
N = 127
|
p
|
|
Numération globulaire
|
n %
|
n %
|
n %
|
n %
|
|
|
Taux d'hémoglobine (g/dl)
|
|
|
|
|
|
|
6 - 10,5
|
108 74
|
35 29
|
90 65,7
|
80 63
|
< 0,05
|
|
10,5 - 14,4
|
36 26
|
86 71
|
47 34,3
|
47 37
|
< 0,05
|
|
Taux d'hématocrite (%)
|
|
|
|
|
|
|
17 - 32
|
117 80
|
47 39
|
95 69,3
|
82 64,6
|
< 0,00001
|
|
32 - 43
|
29 20
|
74 61
|
42 30,7
|
45 35,4
|
< 0,00001
|
|
Indices érythrocytaires
|
|
|
|
|
|
|
VGM (fl)
|
|
|
|
|
|
|
57 - 80
|
105 72
|
71 59
|
97 70,8
|
91 71,7
|
< 0,05
|
|
80 - 100
|
39 27
|
48 40
|
40 29,2
|
36 28,3
|
< 0,05
|
|
100 - 110
|
1 1
|
1 1
|
- -
|
- -
|
> 0,05
|
|
TCMH (pg)
|
|
|
|
|
|
|
17,2 - 27 et 31 - 34,4
|
112 76,7
|
61 50,4
|
97 70,8
|
95 74,8
|
< 0,05
|
|
27 - 31
|
34 23,3
|
60 49,6
|
40 29,2
|
32 25,2
|
< 0,01
|
|
Compartiment plasmatique
|
|
|
|
|
|
|
Fer sérique (umol/l)
|
|
|
|
|
|
|
2,7 - 7,16
|
104 71
|
56 46
|
101 73,7
|
84 66,1
|
< 0,05
|
|
7,16 - 16,3
|
42 29
|
65 54
|
36 26,3
|
43 33,9
|
< 0,01
|
|
Transferrine sérique (g/l)
|
|
|
|
|
|
|
1,6 - 2
|
42 29
|
8 7
|
- -
|
- -
|
< 0,001
|
|
2 - 3,6
|
64 44
|
62 51
|
34 24,8
|
39 30,7
|
< 0,01
|
|
3,6 - 19
|
39 27
|
51 42
|
103 75,2
|
88 69,3
|
< 0,00001
|
|
CTF (umol/l)
|
|
|
|
|
|
|
39,8 - 50
|
43 29,5
|
8 6,6
|
- -
|
- -
|
< 0,001
|
|
50 - 90
|
38 26
|
62 51,3
|
34 24,8
|
39 30,7
|
< 0,01
|
|
90 - 475,7
|
65 44,5
|
51 42,1
|
103 75,2
|
88 69,3
|
< 0,01
|
|
CST (%)
|
|
|
|
|
|
|
0,6 - 15
|
110 75,3
|
82 67,8
|
132 96,4
|
124 97,6
|
< 0,05
|
|
15 - 31,2
|
36 24,7
|
39 32,2
|
5 3,6
|
3 2,4
|
< 0,00001
|
|
Compartiment de réserves en fer
|
|
|
|
|
|
|
Ferritine sérique (ug/l)
|
|
|
|
|
|
|
9,7 - 20
|
89 61
|
77 64
|
93 67,9
|
85 66,9
|
> 0,05
|
|
20 - 89,6
|
57 39
|
44 36
|
44 32,1
|
42 33,1
|
> 0,05
|
N : Effectif total des femmes enceintes
sélectionnées à chaque trimestre de grossesse ;
n : Effectifs observés chez les
femmes pour chaque classe de paramètres biologiques
Tableau XXII : Répartition des
proportions des paramètres biologiques entre les 4 formations sanitaires
au troisième trimestre de la grossesse
|
Différentes formations sanitaires
|
|
|
Principales données
hématologiques
|
Abobo
N = 146
|
Cocody
N = 121
|
Hortensias
N = 137
|
Vridi-Cité
N = 127
|
p
|
|
Numération globulaire
|
n %
|
n %
|
n %
|
n %
|
|
|
Taux d'hémoglobine (g/dl)
|
|
|
|
|
|
|
6 - 11
|
136 93
|
52 43
|
127 92,7
|
113 89
|
< 0,000001
|
|
11 - 14,2
|
10 7
|
69 57
|
10 7,3
|
14 11
|
< 0,00001
|
|
Taux d'hématocrite (%)
|
|
|
|
|
|
|
11,5 - 33
|
139 95
|
50 41,3
|
127 92,7
|
113 89
|
< 0,000001
|
|
33 - 42,6
|
7 5
|
71 58,7
|
10 7,3
|
14 11
|
< 0,00001
|
|
Indices érythrocytaires
|
|
|
|
|
|
|
VGM (fl)
|
|
|
|
|
|
|
54,1 - 80
|
128 88
|
70 58
|
127 92,7
|
111 87,4
|
< 0,05
|
|
80 - 100
|
16 11
|
50 41
|
10 7,3
|
16 12,6
|
< 0,00001
|
|
100 - 103,6
|
1 1
|
1 1
|
- -
|
- -
|
> 0,05
|
|
TCMH (pg)
|
|
|
|
|
|
|
19,6 - 27 et 31 - 36,6
|
142 97,3
|
75 62
|
118 86,1
|
112 88,2
|
< 0,05
|
|
27 - 31
|
4 2,7
|
46 38
|
19 13,9
|
15 11,8
|
< 0,00001
|
|
Compartiment plasmatique
|
|
|
|
|
|
|
Fer sérique (umol/l)
|
|
|
|
|
|
|
1,6 - 7,16
|
133 91
|
45 37
|
103 81,1
|
120 87,6
|
< 0,00001
|
|
7,16 - 10,3
|
13 9
|
76 63
|
24 18,9
|
17 12,4
|
< 0,000001
|
|
Transferrine sérique (g/l)
|
|
|
|
|
|
|
1,2 - 2
|
7 5
|
10 8
|
- -
|
- -
|
> 0,05
|
|
2 - 3,6
|
13 9
|
70 58
|
23 18,1
|
14 10,2
|
< 0,000001
|
|
3,6 - 15,8
|
126 86
|
41 34
|
104 81,9
|
123 89,8
|
< 0,00001
|
|
CTF (umol/l)
|
|
|
|
|
|
|
30,5 - 50
|
7 4,8
|
9 7,4
|
- -
|
- -
|
> 0,05
|
|
50 - 90
|
12 8,2
|
72 59,7
|
23 18,1
|
14 10,2
|
< 0,000001
|
|
90 - 394,2
|
127 87
|
41 33,9
|
104 81,9
|
123 89,8
|
< 0,00001
|
|
CST (%)
|
|
|
|
|
|
|
0,5 - 15
|
133 91,1
|
48 39,7
|
127 100
|
137 100
|
< 0,000001
|
|
15 - 19,8
|
13 8,9
|
73 60,3
|
- -
|
- -
|
< 0,000001
|
|
Compartiment de réserves en fer
|
|
|
|
|
|
|
Ferritine sérique (ug/l)
|
|
|
|
|
|
|
6,2 - 20
|
136 93
|
104 86
|
100 78,7
|
106 77,4
|
< 0,05
|
|
20 - 58,6
|
10 7
|
17 14
|
27 21,3
|
31 22,6
|
< 0,05
|
N : Effectif total des femmes enceintes
sélectionnées à chaque trimestre de grossesse ;
n : Effectifs observés chez les
femmes pour chaque classe de paramètres biologiques
1-4-3. Comparaison au cours de la grossesse des
prévalences de la carence martiale et des anémies
1-4-3-1. Comparaison au premier trimestre de la grossesse
Selon les différents critères choisis pour
évaluer le statut martial chez les femmes au cours de la grossesse, les
taux de prévalence du statut normal en fer au premier trimestre sont
significativement élevés chez les femmes de Cocody (p > 0,05).
Ils étaient significativement bas chez les sujets d'Abobo et de
Port-Bouët (p < 0,05) (Figure 41).
A ce même stade de la grossesse, les proportions ont
chuté chez les femmes de Port-Bouët et augmenté chez celles
d'Abobo et de Cocody au premier de la grossesse (p < 0,00001)
(Figure 41).
L'anémie ferriprive était présente chez
28,1 %, 33,1 %, 52 % et 56,9 % des femmes respectivement à Abobo,
à Cocody, à Vridi-Cité et à Vridi-SIR. Les taux de
prévalence de cette anémie ferriprive ont diminué chez les
femmes enceintes d'Abobo et de Cocody au premier trimestre (p < 0,0001). Ils
sont élevés chez les femmes de Port-Bouët au premier
trimestre de la grossesse (p < 0,0001) (Figure 41).
L'anémie inflammatoire a représenté 6,9
%, 2,5 %, 22,8 % et 17,5 % chez les femmes au premier trimestre de la grossesse
respectivement à Abobo, à Cocody, à Vridi-Cité et
à Vridi-SIR. Les taux de prévalence de l'anémie
inflammatoire associée à la carence martiale étaient de 27
%, 16,4 %, 8,7 % et de 10,9 % respectivement à Abobo, à Cocody,
à Vridi-Cité et à Vridi-SIR. Ces taux de prévalence
des anémies inflammatoires sont élevés chez les femmes
enceintes de Port-Bouët pour l'anémie inflammatoire simple et chez
celles d'Abobo pour l'anémie inflammatoire associée à la
carence martiale (p < 0,0001 ; p < 0,001 respectivement). Ils ont
diminué chez les femmes d'Abobo et de Cocody pour l'anémie
inflammatoire simple et chez celles de Port-Bouët au premier trimestre de
la grossesse pour l'anémie inflammatoire associée à la
carence martiale (p < 0,0001 ; p < 0,001 respectivement)
(Figure 41).
Au premier trimestre de la grossesse, 83,9 %, 77,9 %, 86,6 %
et 89,1 % des femmes respectivement les femmes enceintes à Abobo,
Cocody, à Vridi-Cité et à Vridi-SIR ont
présenté un statut martial anormal. Selon ces taux de
prévalence, l'ensemble des femmes de notre étude a indiqué
un statut en fer fortement dégradé. Toutefois, les sujets du
centre de santé de la commune de Cocody ont présenté un
meilleur statut martial comparativement aux femmes des autres communes de la
ville d'Abidjan. Les femmes enceintes des formations sanitaires de la commune
de Port-Bouët en général et celles du centre de santé
« les Hortensias » ont indiqué un statut en fer
considérablement altéré.
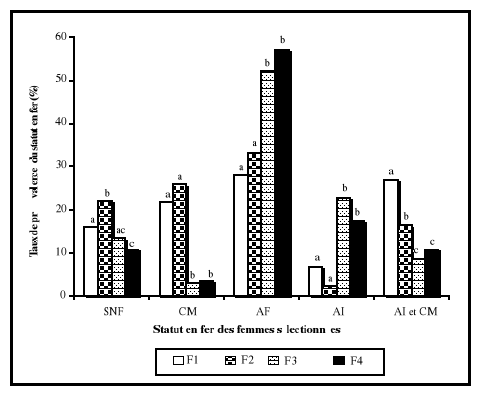
Figure 41 : Distribution au premier
trimestre de la grossesse des proportions de la carence martiale et des types
d'anémies selon les différentes formations sanitaires
SNF : Statut normal en fer ; CM : Carence
martiale ; AF : Anémie ferriprive ; AI :
Anémie inflammatoire ; AI et CM : Anémie inflammatoire
accompagnée de carence martiale ;
F1 : Formation sanitaire et urbaine d'Abobo Sud ;
F2 : Formation sanitaire et urbaine de Cocody Sud ; F3 :
Hôpital municipal de Vridi-Cité (Port-Bouët) ; F4 :
Formation sanitaire communautaire et urbaine « les
Hortensias » (Port-Bouët) ;
a, b, c et d : Groupes de femmes dont les
différences sont significatives pour p < 0,05.
1-4-3-2. Comparaison au second trimestre de la
grossesse
Au second trimestre de la grossesse, les prévalences du
statut martiale normal, chez les femmes sélectionnées
étaient de 19,5 %, 31,1 %, 13,4 % et 11,7 % respectivement à
Abobo, à Cocody, à Vridi-Cité et à Vridi-SIR
(Figure 42).
Ces taux de prévalence du statut en fer normal au
second trimestre de la grossesse sont significativement bas chez les sujets de
Port-Bouët et élevés chez les femmes de Cocody (p < 0,05)
(Figure 42). Au niveau des taux de prévalence de
carence martiale au second trimestre de la grossesse, 16,5 %, 40,9 %, 23,6 % et
21,9 % des femmes de notre étude sont observées respectivement
à Abobo, à Cocody, à Vridi-Cité et à
Vridi-SIR. La proportion de carence martiale des sujets du centre de
santé de Cocody a significativement augmenté et celles des femmes
enceintes d'Abobo a significativement diminué (p < 0,01)
(Figure 42).
L'anémie ferriprive a représenté au
deuxième trimestre de la grossesse, 44,5 %, 23,1 %, 43,3 % et 46 % chez
les femmes respectivement à Abobo, à Cocody, à
Vridi-Cité et à Vridi-SIR. Les sujets de Cocody à ce stade
de grossesse, ont indiqué le taux de prévalence de
l'anémie ferriprive le plus significativement bas (p < 0,01).
Cependant, les proportions de l'anémie ferriprive des femmes enceintes
des 3 autres centres de santé ont significativement augmenté au
second trimestre (p < 0,01) (Figure 42). Au second
trimestre de la grossesse, aucune femme de notre étude n'a
présenté une anémie inflammatoire simple. Le seul type
d'anémie inflammatoire observée chez les femmes enceintes au
deuxième trimestre était l'anémie inflammatoire
associée à la carence martiale. Elle a représenté
29,5 %, 5,9 %, 19,7 % et 20,4 % respectivement à Abobo, à Cocody,
à Vridi-Cité et à Vridi-SIR. Les femmes de la formation
sanitaire de Cocody ont indiqué le taux de prévalence le plus
significativement diminué et celles de la formation sanitaire d'Abobo la
fréquence la plus significativement augmentée au second trimestre
de la grossesse (p < 0,001) (Figure 42).
Au second trimestre de la grossesse, 80,5 %, 68,9 %, 86,6 %
et 88,3 % des femmes ont présenté un statut martial anormal
respectivement à Abobo, à Cocody, à Vridi-Cité et
à Vridi-SIR. Selon ces taux de prévalence, l'ensemble des femmes
de notre étude a indiqué un statut martial
considérablement dégradé au second trimestre de la
grossesse dans les 4 centres de santé choisis de la ville d'Abidjan. Par
ailleurs, les sujets de la formation sanitaire de la commune de Commune de
Cocody, comparativement aux femmes enceintes des autres communes de la ville
d'Abidjan ont présenté le meilleur statut en fer au second
trimestre. En revanche, les femmes enceintes des 2 formations sanitaires de la
commune de Port-Bouët en général et plus
particulièrement celles du quartier de Vridi-SIR (centre de santé
« les Hortensias ») ont indiqué un statut en fer le
plus altéré au deuxième trimestre.
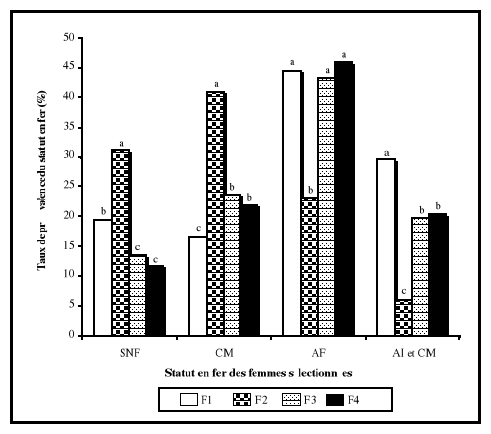
Figure 42: Distribution au second trimestre
de la grossesse des proportions de la carence martiale et des types
d'anémies selon les différentes formations sanitaires
SNF : Statut normal en fer ; CM : Carence
martiale ; AF : Anémie ferriprive ;
AI : Anémie inflammatoire ; AI et CM :
Anémie inflammatoire accompagnée de carence martiale ;
F1 : Formation sanitaire et urbaine d'Abobo Sud ; F2 :
Formation sanitaire et urbaine de Cocody Sud ; F3 : Hôpital
municipal de Vridi-Cité (Port-Bouët) ; F4 : Formation
sanitaire communautaire et urbaine « les Hortensias »
(Port-Bouët) ; a, b et c : Groupes de femmes dont les
différences sont significatives pour p < 0,05.
1-4-3-3. Comparaison au troisième trimestre de la
grossesse
Au troisième trimestre de la grossesse, aucune femme de
notre étude n'a présenté un statut martial normal dans les
4 formations sanitaires sélectionnées de la ville d'Abidjan. Par
conséquent, plusieurs proportions du statut en fer anormal ont
été observées chez ces femmes enceintes au
troisième (Figure 43).
Au niveau de la carence martiale, les taux de
prévalence sont de 4,1 %, de 52,1 %, de 7,9 % et de 4,4 % respectivement
à Abobo, à Cocody, à Vridi-Cité et à
Vridi-SIR. Les analyses de comparaison des proportions de carence martiale
entre les femmes des formations sanitaires ont montré que les sujets de
Cocody ont présenté le taux de prévalence le plus
significative augmenté au troisième trimestre (p < 0,000001).
En revanche, les femmes enceintes des centres de santé des communes
d'Abobo et de Port-Bouët ont indiqué les taux de prévalence
de carence en fer les plus significativement bas au troisième (p <
0,000001) (Figure 43).
En ce qui concerne l'anémie ferriprive, nos
investigations ont révélé que les taux de
prévalence observés chez les femmes enceintes étaient de
88,9 %, de 33,9 %, de 70,9 % et de 73 % respectivement à Abobo, à
Cocody, à Vridi-Cité et à Vridi-SIR. Les résultats
de l'étude ont indiqué que les femmes du centre de santé
d'Abobo ont présenté la fréquence de prévalence
d'anémie ferriprive la plus significativement élevée au
troisième trimestre de la grossesse (p < 0,00001). A l'inverse, les
sujets de la formation sanitaire de Cocody ont présenté le taux
de prévalence le plus significativement bas (p < 0,00001) au
troisième de la grossesse (p < 0,00001)
(Figure 43).
Pour l'anémie inflammatoire associée à la
carence martiale, les femmes ont présenté des taux de
prévalence de 7 %, de 14 %, de 29,1 % et de 22,6 % au troisième
trimestre de la grossesse respectivement à Abobo, à Cocody,
à Vridi-Cité et à Vridi-SIR. La comparaison de ces
proportions a montré que les femmes enceintes des centres de
santé d'Abobo et de Cocody ont présenté les taux de
prévalence les significativement bas au troisième trimestre (p
< 0,05). En revanche, les sujets des 2 formations sanitaires de
Port-Bouët ont significativement augmenté au troisième
trimestre de la grossesse (p < 0,05) (Figure 43).
Au dernier trimestre de la grossesse, toutes les femmes
enceintes de notre étude ont présenté un statut en fer
fortement altéré. Aucune femme n'a donc indiqué un statut
martial normal à ce stade de la grossesse. A cette période de la
grossesse, les sujets de la formation sanitaire de la commune de Cocody
comparativement à ceux des autres centres de santé des communes
choisies de la ville d'Abidjan ont présenté le meilleur statut en
fer au regard des proportions de carence martiale et des anémies.
En revanche, selon les taux de prévalence des
anémies, l'ensemble des femmes enceintes des centres de santé
d'Abobo et de Port-Bouët a indiqué le statut martial le plus
dégradé au dernier trimestre.
Au cours des 3 trimestres de la grossesse, les femmes
enceintes ont présenté les taux de prévalence du statut
martial anormal de 88,1 %, de 82,3 %, de 91,1 %et de 92,5 % respectivement
à Abobo, à Cocody, à Vridi-Cité et à
Vridi-SIR (Figures 41, 42 et 43). Au regard de ces taux
de prévalence, l'ensemble des sujets de notre étude pendant les 3
trimestres de la grossesse a présenté un statut martial fortement
dégradé. Toutefois, les femmes enceintes du centre de
santé de Cocody comparativement aux autres femmes ont indiqué un
statut en fer le moins altéré. En outre, les sujets des
formations sanitaires de Port-Bouët en général et
singulièrement ceux du quartier de Vridi-SIR ont présenté
un statut en fer considérablement dégradé au cours de la
grossesse.
Figure 43 : Distribution au
troisième trimestre de la grossesse des proportions de la carence
martiale et des types d'anémies selon les différentes formations
sanitaires
SNF : Statut normal en fer ; CM : Carence
martiale ; AF : Anémie ferriprive ;
AI : Anémie inflammatoire ; AI et CM :
Anémie inflammatoire accompagnée de carence martiale ;
F1 : Formation sanitaire et urbaine d'Abobo Sud ; F2 : Formation
sanitaire et urbaine de Cocody Sud ; F3 : Hôpital municipal de
Vridi-Cité (Port-Bouët) ; F4 : Formation sanitaire
communautaire et urbaine « les Hortensias »
(Port-Bouët) ; a, b et c : Groupes de femmes dont les
différences sont significatives pour p < 0,05.
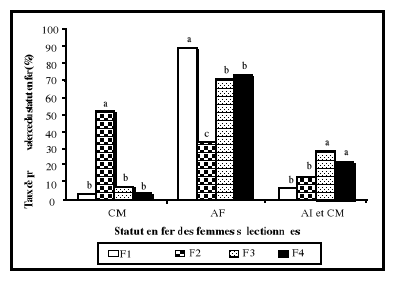
1-5. Modélisation du statut martial des femmes au
cours de la grossesse
La modélisation du statut en fer a consisté dans
cette étude à rechercher l'ensemble des prédicteurs
associés au statut en fer des femmes au cours des 3 trimestres de la
grossesse au regard de leurs caractéristiques
anthropométriques.
1-5-1. Corrélations entre le statut martial et
les paramètres anthropométriques au cours de la grossesse
Au cours de la grossesse, les coefficients de
corrélation obtenus entre les paramètres biologiques et
l'âge des femmes enceintes n'étaient pas significatifs à
l'exception de celui observé au troisième trimestre entre ce
paramètre anthropométrique et le fer sérique. A ce stade
de la grossesse, l'augmentation de l'âge des sujets est associée
à une baisse significative (p < 0,05) du taux de fer sérique
(Tableau XXIII).
Pour l'indice de masse corporelle (IMC), une diminution
hautement significative des taux d'hémoglobine, d'hématocrite, de
fer, de CST et de ferritine au premier trimestre de la grossesse est
accompagnée de celle de l' IMC. A cette période de la grossesse,
une baisse hautement significative de l'indice de masse corporelle est
associée à une augmentation de la transferrine et de la CTF. Au
second et au troisième trimestres de la grossesse, seules les
augmentations significatives respectives du fer et du VGM sont
accompagnées de celle de l'indice de masse corporelle (p < 0,05 et p
< 0,05 respectivement) (Tableau XXIII).
Au niveau de la gestité, des corrélatives
significatives sont observées aux premier et troisième
trimestres de la grossesse (p < 0,05 et p < 0,05 respectivement). Ainsi,
une diminution significative de la ferritine sérique est associée
à une élévation du nombre de grossesses des femmes
étudiées (Tableau XXIII).
En ce qui concerne la parité, seules les diminutions
significatives des taux d'hémoglobine, d'hématocrite et de
ferritine sont accompagnées d'une augmentation du nombre d'accouchements
au premier trimestre de la grossesse chez les sujets étudiés
(Tableau XXIII).
Pour l'espace intergénésique, les augmentations
significatives de la transferrine, de la CTF aux 2 derniers trimestres de la
grossesse sont associées aux diminutions de la période entre les
grossesses. A ces stades de la grossesse, des taux élevés de CST
des femmes sont accompagnés d'une augmentation de leur espace
intergénésique. Par ailleurs, au dernier trimestre de la
grossesse, les augmentations des taux d'hémoglobine et
d'hématocrite sont associées à celle de la période
entre les grossesses des femmes étudiées
(Tableau XXIII).
Tableau XXIII: Corrélation (r) au
cours de la grossesse entre les paramètres biologiques et les
paramètres anthropométriques
|
Premier trimestre de la grossesse
|
|
Age
|
IMC
|
Gestité
|
Parité
|
Espace
intergénésique
|
|
Hémoglobine
|
-
|
0,15***
|
-
|
- 0,11**
|
-
|
|
Hématocrite
|
-
|
0,17***
|
-
|
- 0,11*
|
-
|
|
VGM
|
-
|
-
|
-
|
-
|
-
|
|
TCMH
|
-
|
-
|
-
|
-
|
-
|
|
Fer
|
-
|
0,12**
|
-
|
-
|
-
|
|
Transferrine
|
-
|
- 0,13**
|
-
|
-
|
-
|
|
CTF
|
-
|
- 0,13**
|
-
|
-
|
-
|
|
CST
|
-
|
0,15**
|
-
|
-
|
-
|
|
Ferritine
|
-
|
0,04
|
- 0,10*
|
- 0,11*
|
-
|
|
Deuxième trimestre de la grossesse
|
|
Hémoglobine
|
-
|
-
|
-
|
-
|
-
|
|
Hématocrite
|
-
|
-
|
-
|
-
|
-
|
|
VGM
|
-
|
-
|
-
|
-
|
-
|
|
TCMH
|
-
|
-
|
-
|
-
|
-
|
|
Fer
|
-
|
0,10*
|
-
|
-
|
-
|
|
Transferrine
|
-
|
-
|
-
|
-
|
- 0,10*
|
|
CTF
|
-
|
-
|
-
|
-
|
- 0,10*
|
|
CST
|
-
|
-
|
-
|
-
|
0,11*
|
|
Ferritine
|
-
|
-
|
-
|
-
|
-
|
|
Troisième trimestre de la grossesse
|
|
Hémoglobine
|
-
|
-
|
-
|
-
|
0,12**
|
|
Hématocrite
|
-
|
-
|
-
|
-
|
0,10*
|
|
VGM
|
-
|
0,10*
|
-
|
-
|
-
|
|
TCMH
|
-
|
-
|
-
|
-
|
-
|
|
Fer
|
- 0,10*
|
-
|
-
|
-
|
-
|
|
Transferrine
|
-
|
-
|
-
|
-
|
- 0,13**
|
|
CTF
|
-
|
-
|
-
|
-
|
- 0,13**
|
|
CST
|
-
|
-
|
-
|
-
|
0,12**
|
|
Ferritine
|
-
|
-
|
- 0,10*
|
-
|
-
|
* : p < 0,05 ;
** : p < 0,01 ; *** : p <
0,001 ; IMC : Indice de masse corporelle
- : Aucun coefficient de corrélation de Pearson
significatif n'était pas observé.
1-5-2. Facteurs contribuant au statut martial normal
pendant la grossesse
Le tableau XXIV a présenté
les proportions comparées du statut normal en fer des femmes au cours de
la grossesse.
Les tests de comparaison de ces proportions ont montré
que l'âge des femmes enceintes avait une influence significative sur leur
statut normal en fer au premier et au second trimestres de la grossesse (p <
0,01 et p < 0,05 respectivement). En outre, l'âge a également
constitué 13 fois et 1,3 fois un déterminant qui a
significativement contribué au meilleur statut en fer chez les femmes
étudiées (p < 0,01 et p < 0,05 respectivement). Dans ce
sens, les femmes qui avaient entre 20 et 43 ans, étaient
significativement 9,4 fois et 1,1 fois plus susceptibles de présenter un
statut martial normal que les adolescentes (p < 0,001 et 0,05
respectivement) respectivement aux 2 premiers trimestres de la grossesse
(Tableau XXIV).
Au niveau de la gestité, les analyses de comparaison et
de modélisation étaient seulement significatives au premier
trimestre de la grossesse (p < 0,01). Ainsi, le nombre de grossesses des
femmes de notre étude était un déterminant qui a
significativement participé 2,8 fois au statut normal en fer au premier
trimestre de la grossesse (p < 0,01). Dans ce cadre, les primigestes ont
significativement indiqué 2,3 fois plus de chance de présenter un
statut martial normal par rapport aux multigestes (p < 0,01)
(Tableau XXIV).
L'indice de masse corporelle, la parité et l'espace
intergénésique n'étaient pas des déterminants pour
un statut martial normal au cours de la grossesse chez les sujets de notre
étude (Tableau XXIV).
Pour conclure, l'âge aux 2 premiers trimestres de la
grossesse et la gestité au premier trimestre, étaient des
déterminants qui ont favorisé le statut normal en fer chez les
femmes enceintes des 4 formations sanitaires de la ville d'Abidjan.
Tableau XXIV: Proportions
comparées et les rapports de côte (OR) du statut martial normal
chez les femmes enceintes selon les données anthropométriques
|
Stades de la grossesse (Trimestres)
|
|
Données épidémiologiques
|
Premier (N = 531)
|
Second (N = 531)
|
|
n % OR
(IC à 95 %)
|
n %
OR (IC à 95 %)
|
|
Age (ans)
|
13 (4 -
42,1)***
|
1,3 (1 - 1,7)*
|
|
15 - 19 ; n1 = 112
|
13 2,4
-
|
11 2,1
-
|
|
20 - 43 ; n1 = 419
|
64 12,1
9,4 (3,7- 13,1)***
|
47 8,8
1,1 (0,1 - 1,4)*
|
|
p
|
< 0,01
|
< 0,05
|
|
IMC (kg.m-2)
|
|
|
|
< 19,8 ; n1 = 158 ; n2 = 72 ;
n3 = 44
|
18 3,4
|
8 1,5
|
|
19,8 - 26 ; n1 = 276 ; n2 = 330 ;
n3 = 300
|
36 6,8
|
34 6,4
|
|
> 26 ; n1 = 97 ; n2 = 134 ;
n3 = 187
|
23 4,3
|
16 3
|
|
p
|
> 0,05
|
> 0,05
|
|
Gestité
|
2,8
(1,6 - 3,2)**
|
|
|
Primigestes ; n1 = 119
|
12 2,3
2,3 (1,9 - 2,7) **
|
16 3
|
|
Multigestes ; n1 = 412
|
65 12,5
-
|
42 7,9
|
|
p
|
< 0,01
|
> 0,05
|
|
Parité
|
|
|
|
Nullipares ; n1 = 213
|
29 5,5
|
22 4,1
|
|
Primipares ; n1 = 145
|
23 4,3
|
17 3,2
|
|
Multipares ; n1 = 173
|
25 4,7
|
19 3,6
|
|
p
|
> 0,05
|
> 0,05
|
|
Espace Intergénésique (Mois)
|
|
|
|
< 36 ; n1 = 379
|
48 9,1
|
32 6
|
|
= 36 ; n1 = 152
|
29 5,4
|
26 4,9
|
|
p
|
> 0,05
|
> 0,05
|
N : Effectif de l'échantillon de femmes
sélectionnées à chaque trimestre de grossesse ;
n : Effectifs observés chez les femmes de statut
martial normal pour chaque classe de données
épidémiologiques ; n1 et n2: Effectifs de
femmes recrutées pour chaque classe des paramètres
épidémiologiques respectivement au premier et au second
trimestres de la grossesse ; * : p
< 0,05 ; ** : p < 0,01 ;
*** : p < 0,001 ; OR (Odds Ratio) : Rapports de côte
associant leur intervalle de confiance (IC) à 95 % ; - :
Aucune observation significative
1-5-3. Facteurs de risque associés à la
carence martiale au cours de la grossesse
La comparaison des proportions de carence martiale selon les
différentes modalités des paramètres
anthropométriques, est résumée dans le
tableau XXV. Les résultats de l'étude ont
montré que :
- la gestité était un paramètre
anthropométrique qui a significativement favorisé la carence
martiale chez les femmes tout au long de la grossesse (p < < 0,05 ;
p < 0,01 et p < 0,01 respectivement). Ainsi, les primigestes
étaient les plus susceptibles de présenter la carence martiale
comparativement aux multigestes (Tableau XXV) ;
- la parité avait significativement une influence sur
la carence martiale tout au long de la grossesse (p < < 0,05 ; p
< 0,001 et p < 0,001 respectivement). Cependant, les tests de
prédiction ont indiqué que le nombre d'accouchements était
significativement un facteur de risque pour la carence en fer au premier et au
troisième trimestres de la grossesse
(Tableau XXV) ;
- au niveau de l'âge, de l'indice de masse corporelle et
de l'espace intergénésique des femmes avaient un impact
significatif sur la carence martiale. Toutefois, les analyses de
modélisation ont montré que ces 3 paramètres
anthropométriques n'ont pas constitué des facteurs de risque pour
la carence martiale chez les sujets de notre étude
(Tableau XXV).
Au total, nous avons observé que 2 paramètres
anthropométriques (la gestité et la parité) étaient
des véritables prédicteurs de la carence martiale chez les
femmes au cours de la grossesse.
Tableau XXV: Proportions
comparées et les rapports de côte (OR) de la carence martiale
selon les données anthropométriques
|
Stades de la grossesse (Trimestres)
|
|
Données épidémiologiques
|
Premier (N = 531)
|
Second (N = 531)
|
Troisième (N = 531)
|
|
n % OR (IC à 95
%)
|
n % OR (IC à 95
%)
|
n % OR (IC à 95
%)
|
|
Age (ans)
|
|
-
|
-
|
|
15 - 19 ; n1 = 112
|
27 5,1
|
40 7,5 -
|
25 4,7 -
|
|
20 - 43 ; n1 = 419
|
50 9,7
|
123 23,1 -
|
74 14,2 -
|
|
p
|
> 0,05
|
< 0,01
|
< 0,05
|
|
IMC (kg.m-2)
|
|
-
|
-
|
|
< 19,8 ; n1 = 158 ; n2 = 72 ;
n3 = 44
|
27 5,1
|
48 9 -
|
6 1,1 -
|
|
19,8 - 26 ; n1 = 276 ; n2 = 330 ;
n3 = 300
|
37 7
|
77 14,5 -
|
51 9,6 -
|
|
> 26 ; n1 = 97 ; n2 = 134 ;
n3 = 187
|
13 2,5
|
38 7,1 -
|
44 8,3 -
|
|
p
|
> 0,05
|
< 0,05
|
< 0,05
|
|
Gestité
|
7,1 (3,2-
15,8)***
|
3 (2,4
- 3,9)*
|
4,2 (2,2
- 8,1)**
|
|
Primigestes ; n1 = 119
|
23 4,3 6,4 (4,7 -
8,7)***
|
60 11,3 2,8 (1,6 -
5)*
|
23 4,3 4,2 (2,6 -
6,6)**
|
|
Multigestes ; n1 = 412
|
53 10 -
|
103 29,4 -
|
78 16,7 -
|
|
p
|
< 0,05
|
< 0,01
|
< 0,01
|
|
Parité
|
6,4 (3,8- 10,9)***
|
-
|
8,7(5,1-
14,8)***
|
|
Nullipares ; n1 = 213
|
50 9,4 4 (1,8 -
8,7)**
|
87 16,4 -
|
44 20,7 6,4 (4,7 -
8,7)***
|
|
Primipares ; n1 = 145
|
12 2,3 -
|
33 6,2 -
|
20 3,8 -
|
|
Multipares ; n1 = 173
|
15 2,8 -
|
43 8,1 -
|
37 37,3 -
|
|
p
|
< 0,05
|
< 0,001
|
< 0,001
|
|
Espace Intergénésique (Mois)
|
|
-
|
-
|
|
< 36 ; n1 = 379
|
52 9,8
|
121 22,8 -
|
67 12,6 -
|
|
= 36 ; n1 = 152
|
25 4,7
|
42 7,9 -
|
34 6,4 -
|
|
p
|
> 0,05
|
< 0,00001
|
< 0,01
|
N : Effectif de l'échantillon de femmes
sélectionnées à chaque trimestre de grossesse ;
n : Effectifs observés chez les femmes de carence
martiale pour chaque classe de données épidémiologiques ;
n1, n2, et n3 : Effectifs de femmes
recrutées pour chaque classe des paramètres
épidémiologiques respectivement au premier, au second et au
troisième trimestres de la grossesse ;
** : p < 0,01 ;
*** : p < 0,001 ; OR (Odds Ratio) : Rapports
de côte associant leur intervalle de confiance (IC) à 95 % ;
- : Aucune observation significative
1-5-4. Facteurs de risque associés à
l'anémie ferriprive au cours de la grossesse
Les proportions comparées de l'anémie ferriprive
des femmes au cours de la grossesse, sont représentées dans le
tableau XXVI.
Les comparaisons de ces proportions ont montré que tous
les paramètres anthropométriques avaient une influence
significative sur l'anémie ferriprive des femmes tout au long de la
grossesse (Tableau XXVI).
En outre, nous avons observé avec les analyses de
prédiction que :
- l'âge, la parité et l'espace
intergénésique des femmes ont constitué des facteurs de
risque pour l'anémie ferriprive tout au long de la grossesse. Ainsi,
les adolescentes, les multipares et les femmes qui ont observé une
période inférieure à 3 ans avaient plus de risque de
présenter l'anémie ferriprive que les autres sujets de notre
étude (Tableau XXVI) ;
- l'indice de masse corporelle était hautement1,6 fois
un facteur de risque pour l'anémie ferriprive chez les femmes
sélectionnées au premier trimestre de la grossesse (p < 0,01).
A ce stade de la grossesse, les sujets qui avaient une insuffisance
pondérale, étaient significativement 1,1 fois plus susceptibles
d'indiquer une anémie ferriprive par rapport aux autres femmes (p <
0,01) (Tableau XXVI) ;
- la gestité était hautement 5 fois et 9,4 fois
un prédicteur pour l'anémie ferriprive respectivement au premier
et au second trimestres de la grossesse (p < 0,01 et p < 0,001
respectivement). A ces différentes périodes de la grossesse, les
multigestes avaient respectivement 3,5 fois et 3,8 fois plus de risque de
présenter une anémie ferriprive comparativement aux primigestes
(Tableau XXVI).
Pour conclure, tous les paramètres
anthropométriques des femmes à divers degré ont
constitué des prédicteurs au cours de la grossesse.
Tableau XXVI: Proportions
comparées et les rapports de côte (OR) de l'anémie
ferriprive selon les données anthropométriques
|
Stades de la grossesse (Trimestres)
|
|
Données épidémiologiques
|
Premier (N = 531)
|
Second (N = 531)
|
Troisième (N = 531)
|
|
Age (ans)
|
n % OR (IC à 95
%)
|
n % OR (IC à 95
%)
|
n % OR (IC à 95
%)
|
|
3,2 (1,7 - 4,9)***
|
5,5 (2,3 - 7,1)***
|
7,5 (4,7 -
11,8)***
|
|
15 - 19 ; n1 = 112
|
65 12,2 2,3 (2 - 4,5)**
|
61 11,5 3,8 (2,8 - 5,4)**
|
86 16,2 6,4 (3,2 - 13)***
|
|
20 - 43 ; n1 = 419
|
159 29,9 -
|
121 22,8 -
|
264 49,8 -
|
|
p
|
<0,05
|
< 0,00001
|
< 0,000001
|
|
IMC (kg.m-2)
|
1,6 (0,9 - 3)**
|
-
|
-
|
|
< 19,8 ; n1 = 158 ; n2 = 72 ;
n3 = 44
|
90 19,6 1,1 (0,9 - 1,4)**
|
12 2,3 -
|
37 7 -
|
|
19,8 - 26 ; n1 = 276 ; n2 = 330 ;
n3 = 300
|
100 18,8 -
|
105 19,8 -
|
231 43,5 -
|
|
> 26 ; n1 = 97 ; n2 = 134 ;
n3 = 187
|
34 6,4 -
|
65 12,3 -
|
82 15,4 -
|
|
p
|
< 0,00001
|
< 0,001
|
< 0,000001
|
|
Gestité
|
5 (0,6 - 8,1)**
|
9,4 (3,7-11,6)***
|
-
|
|
Primigestes ; n1 = 119
|
72 13,6 -
|
43 8,1 -
|
92 17,3 -
|
|
Multigestes ; n1 = 412
|
152 28,9 3,5 (2,6 -4,8)**
|
139 26,2 3,8 (2,6 - 5,7)**
|
258 40,1 -
|
|
p
|
< 0,01
|
< 0,01
|
< 0,00001
|
|
Parité
|
1,3 (1 - 1,6)*
|
1,5 (1,1 - 2)*
|
2,7 (3,6 - 6,1)**
|
|
Nullipares ; n1 = 213
|
109 20,5 -
|
80 15,1 -
|
163 30,7 -
|
|
Primipares ; n1 = 145
|
14 2,6 -
|
4 0,8 -
|
56 10,5 -
|
|
Multipares ; n1 = 173
|
101 19 1,1 (0,9 -
1,5)*
|
98 17,4 1,1 (0,9 - 1,3)*
|
131 24,7 1,8 (1,3 -
2,5)*
|
|
p
|
< 0,00001
|
< 0,00001
|
< 0,00001
|
|
Espace Intergénésique (Mois)
|
10,1 (6,6 - 12,1)**
|
7 (6,5-10,9)**
|
12 (9,5 - 18,9)***
|
|
< 36 ; n1 = 379
|
198 37,3 8,7 (5,1 - 14,8)**
|
149 37,5 5,4 (3,6-8,1)**
|
305 57,4 9,4 (3,7 - 13,6)***
|
|
= 36 ; n1 = 152
|
26 4,9 -
|
33 6,2 -
|
45 8,5 -
|
|
p
|
< 0,000001
|
< 0,000001
|
< 0,000001
|
N : Effectif de l'échantillon de femmes
sélectionnées à chaque trimestre de grossesse ;
n : Effectifs observés chez les femmes
d'anémie ferriprive pour chaque classe de données
épidémiologiques ; n1, n2, et
n3 : Effectifs de femmes recrutées pour chaque classe
des paramètres épidémiologiques respectivement au premier,
au second et au troisième trimestres de la grossesse ;
* : p < 0,05 ;
** : p < 0,01 ;
*** : p < 0,001 ; OR (Odds Ratio) : Rapports
de côte associant leur intervalle de confiance (IC) à 95 % ;
- : Aucune observation significative
2. Discussion
2-1. Statut en fer au cours de la grossesse
L'étude effectuée dans les 4 formations
sanitaires de la ville d'Abidjan montre que les données globulaires et
les indices érythrocytaires sont effondrés pendant les 3
trimestres de la grossesse avec une altération beaucoup plus
prononcée au troisième trimestre. En effet, il est
généralement admis 3 stades de carence martiale pour
décrire le déficit du fer dans l'organisme (Hercberg et
al., 1998). D'abord, la simple déplétion des
réserves tissulaires en fer sans déficit de
l'érythropoïèse qui se caractérise par une baisse
isolée de la ferritine sérique en dessous de 20 ug/l. Ensuite, la
déplétion des réserves en fer avec déficience de
l'érythropoïèse, qui s'accompagne d'une diminution du
coefficient de saturation de la transferrine, d'une augmentation de la
transferrine et de la capacité totale de fixation du fer, d'une baisse
de la sidérémie et d'une perturbation des paramètres
érythrocytaires classiques (VGM, TCMH). Enfin, le dernier stade
correspond à l'anémie ferriprive où la chute du taux
d'hémoglobine en dessous du seuil limite fait reconnaître
l'anémie (Preziosi et al., 1994).
Les valeurs moyennes observées chez les femmes
enceintes sont largement abaissées comparativement aux normes
définies par l'OMS (UNICEF/WHO/UNU/MI, 1998). Cette baisse s'explique
par l'augmentation du volume plasmatique et l'expansion de la masse des
globules rouges au regard des taux d'hématocrite et des concentrations
d'hémoglobine (Fleming, 1989b ; Marti-Carvajal et al.,
2002). L'hémodilution est moindre au début de la grossesse, elle
s'accentue au second trimestre et dans la moitié du troisième
trimestre avant de retrouver des valeurs normales vers la fin de la grossesse
(Hytten, 1985). Les femmes enceintes ont présenté des taux
moyens d'hématocrite qui sont inférieurs à ceux
trouvés chez des Belges et des Sud-Coréennes enceintes (Beguin
et al., 1991 ; Lee et al., 2002). Ceci
permet de conclure que l'hémodilution est plus prononcée chez les
sujets d'Abidjan depuis le début jusqu'au troisième trimestre de
la grossesse.
La baisse des taux d'hématocrite et
d'hémoglobine par l'hémodilution ne devrait pas être
considérable si les réserves en fer et autres nutriments
nécessaires à la production de nouveaux globules rouges avaient
été suffisants pour les besoins de la grossesse (Kaufer et
Casanueva, 1990 ; Knight et al., 1994 ; Dillon, 2000). Dans
cette étude, les diminutions remarquables du VGM et de la TCMH au
troisième trimestre ont montré que les femmes enceintes ont
présenté un véritable déficit en fer au cours de la
grossesse. Ce résultat est similaire aux études chez les
Sud-Coréennes et chez les adolescentes noires américaines (Lee
et al., 2002 ; Iannotti et al.,
2005).
En ce qui concerne la taille des réserves en fer
évaluée par la ferritine sérique, son effondrement depuis
le début de la grossesse a conduit à des taux de carence martiale
et des anémies très significatifs au dernier trimestre. Deux
femmes enceintes sur 3 soit 66 % présentent une anémie
nutritionnelle (anémie ferriprive) plus prononcée que les autres
anémies observées. En outre, aucune femme n'a
présenté un statut normal en fer au troisième trimestre de
grossesse. Ces taux de prévalence de carence martiale et
d'anémies (Bléyéré et al., 2007) sont
supérieurs à ceux obtenus chez des Sud-Coréennes et des
Chinoises enceintes (Liao, 2004 ; Lee et al., 2002).
En revanche, les fréquences observées chez les
femmes enceintes de la ville d'Abidjan sont similaires à celles obtenues
chez les adolescentes noires américaines (Bléyéré
et al., 2007 ; Iannotti et al., 2005).
En Afrique, les travaux menés chez des malawites
enceintes ont montré que 60 % et 19 % des femmes ont
présenté respectivement une anémie ferriprive et une
anémie inflammatoire (Broek et Letsky, 2000). Ce dernier type
d'anémie est provoqué en général par les
parasitoses et des syndromes infectieux (Dillon, 2000), ce qui expliquerait les
proportions de 18,5 % ; 24,1 % et de 15 %, respectivement au premier, au
second et au troisième trimestres de la grossesse de l'anémie
inflammatoire. Par ailleurs, des études au Malawi et au Nigeria, ont
montré que de nombreuses femmes en âge de procréer, ont une
alimentation qui contient très peu ou pas de protéine animales.
Elles ont un régime alimentaire à base de végétaux
(Broek et Letsky, 2000 ; Oguntona et al., 2002 ;
Vanderjagt
et al., 2007). Or, le fer des végétaux est non
héminique, donc peu absorbable (Galan et al., 1990 ;
Dillon, 2000). Cela pourrait justifier l'insuffisance de la taille des
réserves en fer, en rapport avec le présent travail. Cette
insuffisance martiale s'est aggravée au troisième trimestre de la
grossesse avec pour conséquence, l'altération des indicateurs
biologiques qui évaluent le statut en fer.
En outre, l'anémie ferriprive est la seule
anémie d'origine nutritionnelle observée chez les femmes
enceintes sélectionnées dans les 3 communes. Il ressort donc que
la principale raison de l'anémie des femmes au cours de la grossesse est
liée au déficit en fer des sujets de la ville d'Abidjan.
Plusieurs études confirment nos résultats (Bondevik et
al., 2000 ; Achidi et al., 2005 ; Khan et al.,
2006 ; Agarwal et al., 2007).
En outre, ce taux d'anémie ferriprive que nous avons
enregistré est considérablement au-dessus de ceux
enregistrés dans plusieurs pays africains tels qu'en Algérie
(37,4 %) par Moulessehoul et al. (2004) ; au Bénin (48 %)
par Makoutodé et al. (2004), au Niger (43,3 %) par Nayama
et al. (2006) et au Malawi (60 %) par Broek et Letsky (2000).
En revanche, cette fréquence d'anémie d'origine
nutritionnelle de notre étude est inférieure à celles
observées au Kenya (76 %) par Gneissler et al. (1998) ; au
Mali (73 %) par Aguayo et al. (2003) et au Sénégal (72,6
%) par Touré-Fall et al. (2004).
Aussi les études de Méda et al. (2000)
ont-elles rapporté une prévalence (66 %) des femmes enceintes au
Burkina Faso semblable à celle notre étude.
De plus, la prévalence de l'anémie d'origine
nutritionnelle que nous avons obtenue, est plus élevée que celles
indiquées en Australie (11 %) par Makrides et al. (2003) ;
au Bangladesh (50 %) par Hyder et al. (2004) ; en Corée du
Sud (34 %) par Lee et al. (2002) ; par Liao et al.
(2004) en Chine (33,8 %) et en Thaïlande (19,9 %) par Chotnopparatpattara
et al. (2003). Cependant, les fréquences
d'anémie ferriprive obtenues dans notre étude sont
significativement plus faibles que celle observée en Inde (69,5 %), Abel
et al. (2001).
D'autres résultats obtenus au Bangladesh, au Kenya, au
Malawi et au Niger ont montré, tout comme notre travail, que des
réserves insuffisantes en fer, au départ de la grossesse,
s'accompagnent de taux d'anémie ferriprive supérieurs aux taux de
carence martiale (Hyder et al., 2004 ; Gneissler et al.,
1998 ; Broek et Letsky, 2000 ; Nayama et al., 2006). En
revanche, des études au cours desquelles des femmes présentent
des réserves en fer suffisantes en début de la grossesse
indiquent des taux de prévalence de carence martiale au-dessus de ceux
de l'anémie ferriprive. Il s'agit des femmes enceintes en Algérie
(60,2 % et 37,4 %), en Australie (67,5 % et 11 %), en Corée du Sud
(65 % et 34 %) (Moulessehoul et al., 2004 ; Makrides et
al., 2003 ; Lee et al., 2002) et en Guyane française
(92,7 et 6,4 %) (Guindi et al., 2004).
2-2. Différence entre les formations sanitaires
sélectionnées et facteurs de risques associés à la
carence martiale et à l'anémie ferriprive
Les différences observées au niveau des
formations quant aux taux de prévalences de carence martiale et des
anémies pourraient être expliquées par les
caractéristiques des sujets étudiés. Dans la formation
sanitaire de Vridi-SIR (« les Hortensias »), nous avons
observé, à l'inverse de celle de Cocody, de grandes
fréquences de multigestes, de multipares et de femmes ayant un faible
espace intergénésique. Cela pourrait justifier leur forte
exposition au statut martial anormal comparativement aux femmes des autres
centres de santé sélectionnés dans la ville d'Abidjan
(Bléyéré et al., 2007). Une étude
récente en Inde a fait les mêmes observations tout comme notre
étude (Agarwal et al., 2007).
En plus de l'impact de l'âge gestationnel, certains
facteurs tels que l'âge, l'indice de masse corporelle, la gestité,
la parité et l'espace intergénésique participent à
l'altération du statut en fer des femmes enceintes.
Dans notre étude, les adolescentes sont plus
concernées au cours de la grossesse par les anémies ferriprive
comparativement aux femmes adultes. D'après les travaux de Scholl et
al. (1990 ; 1994 ; 2000), les adolescentes enceintes continuent
leur croissance physiologique pendant la grossesse. Pour cette raison, Beard
et al. (1996) et Moran (2007a) indiquent que les adolescentes
présentent une double demande en fer au cours de la grossesse. De
même, pour Gadowsky et al. (1995), les réserves en fer
sont positivement corrélées à l'âge des femmes
durant la grossesse. Les raisons de cette influence de l'âge sur le
statut en fer au cours de la grossesse sont, entre autres, l'immaturité
gynécologique et la compétition de nutriments entre la
mère et le foetus (Naeye, 1981 ; King, 2000 et 2003). Cette demande
martiale considérable va au-delà de1290 mg de fer normalement
requis pour toute la période de grossesse (Allen, 1997 ; Viteri,
1997b).
Pour le nombre de grossesses, d'accouchements et le temps
observé entre les grossesses, les femmes ayant plusieurs grossesses
rapprochées et répétées et celles qui ont un espace
intergénésique de moins de 3 ans sont, dans notre étude,
les plus susceptibles de présenter de fortes prévalence de statut
martial anormal. Avoir de nombreuses grossesses détériore
l'état de santé de la femme (Chang et al., 2003a ;
Achidi et al. 2005). Au Ghana, des études expérimentales
ont révélé que les multipares avaient 8,9 fois plus de
risque de présenter une anémie comparativement aux primigestes
(Geelhoed et al., 2006).
En ce qui concerne la période à observer entre
les grossesses, des organisations internationales recommandent au moins 2 ans,
afin que l'organisme de la femme soit favorable à recevoir une autre
grossesse. En dessous de cet intervalle de repos de l'organisme de la femme,
des complications pourraient survenir au cours de la grossesse (UNICEF / UNU /
WHO, 2001). Dans ce sens, nous avons indiqué dans nos travaux que les
femmes qui ont un espace intergénésique strictement
inférieur à 3 ans sont beaucoup plus susceptibles de
présenter une anémie ferriprive. Ces observations sont semblables
à celles indiquées en Ethiopie (
Belachew
et
Legesse,
2006).
Pour l'indice de masse corporelle, ce sont les femmes avec un
déficit pondéral qui sont touchées par les anémies.
Selon Fondu et al. (1978a), l'insuffisance
protéo-énergétique a une influence sur le statut en fer au
Kivu (République démocratique du Congo), en relation avec la
taille et le poids des sujets. Cela pourrait expliquer dans notre étude
l'impact de l'indice de masse corporelle sur le statut en fer des femmes
enceintes.
Au vu de tout ce qui précède, il est
justifié que les femmes adultes et les primigestes aient plus de chance
d'indiquer un statut martial normal.
2-3. Aggravation des taux de
prévalence de carence martiale et des anémies par les pathologies
infectieuses
En plus de la carence martiale et de l'anémie
ferriprive que les femmes enceintes de la ville d'Abidjan présentent,
nous avons observé des anémies inflammatoires simples et
associée au défit en fer. La présence de ces types
d'anémies observés dans notre étude s'explique par des
facteurs dits confondants tels que les parasitoses, des infections intestinales
(trichocéphaloses, ankylostomiases, helminthiases, infections à
hélicobacter pylori), d'autres syndromes infectieux (infections
bactériennes et VIH) et des inflammations. Dans des pays à haute
endémicité palustre comme la Côte d'Ivoire, la
prévalence d'anémie au cours de la grossesse est importante
(Penali et al., 1993 ; Ramon et al., 1999 ;
Antelman et al., 2000 ; Carré et al., 2003 ;
Abrams et al., 2005 ; Farag et al., 2007).
En outre, selon les travaux de Broek et Letsky en 2000 au sud
du Malawi, des femmes anémiques présentent une
élévation du taux de protéine C-réactive. Cet
indicateur biochimique de l'inflammation indique que l'inflammation chronique
constitue un facteur qui contribue à l'aggravation de l'anémie au
cours de la grossesse. Les maladies parasitaires et les syndromes infectieux
provoquent des inflammations (Bondevik et al., 2000 ; BroeK et
Letsky, 1998, Achidi et al., 2005 ;
Belachew
et
Legesse,
2006 ; Cottrell et al., 2007). Au cours des inflammations, le fer
est dévié hors de ces fonctions dans l'organisme. Cela
entraîne, soit une augmentation prononcée du fer circulant et de
la ferritine sérique, soit des taux apparemment normaux de la ferritine
sérique en présence d'une diminution de la transferrine
sérique conduisant aux anémies inflammatoires (Dillon,
2000 ; Broek et Letsky, 2000). Ces mêmes observations sont faites
dans notre étude chez les femmes enceintes.
3. Conclusion
L'étude du statut en fer au cours de la grossesse chez
les femmes indique une altération profonde de tous les paramètres
biologiques choisis à chaque stade de la grossesse. Cette
altération est considérablement prononcée au dernier stade
de la grossesse. Sur les 11 paramètres biologiques mesurés chez
les femmes enceintes, le coefficient de saturation de la transferrine (CST)
représente l'indicateur biologique le plus diminué. Cette
diminution de la donnée du compartiment plasmatique est associée
à celle de la ferritine sérique surtout à la fin de la
grossesse. A ce stade de la grossesse, aucune femme enceinte
sélectionnée dans les 4 formations sanitaires de la ville
d'Abidjan ne présente un statut martial normal. Le statut anormal en fer
est dominé par les forts taux de prévalences d'anémie
ferriprive au cours de la grossesse. Deux femmes sur 3 au troisième
trimestre de la grossesse présentent une anémie d'origine
nutritionnelle. L'insuffisance de la taille des réserves en fer est la
véritable cause essentielle de la carence martiale qui aboutit aux
anémies. D'autres types d'anémies sont associés au seul
type d'anémie nutritionnelle de notre étude. Il s'agit de
l'anémie inflammatoire simple et de l'anémie inflammatoire
accompagnée de la carence martiale. Les femmes enceintes de la formation
sanitaire communautaire et urbaine « les Hortensias » dans
la commune de Port-Bouët présentent les taux de prévalence
les plus augmentés de statut martial anormal au cours de la grossesse.
En revanche, celles de la formation sanitaire urbaine de Cocody sud indiquent
les meilleurs taux de statut normal en fer. Tous les paramètres
anthropométriques des femmes de notre travail, sont à des
degrés divers des facteurs de risque associé à
l'altération du statut martial. Tous ces déterminants
susceptibles de dégrader le comportement du fer chez les femmes
enceintes sont très accentués au troisième trimestre de la
grossesse. Il serait donc souhaitable chez les femmes enceintes d'entreprendre
une supplémentation en fer aux fins d'éviter une installation
précoce de la carence martiale.
CHAPITRE III : PREVALENCE DES CARENCES MARTIALES
ET DES ANEMIES CHEZ DES FEMMES EN AGE DE PROCREER NON ENCEINTES ET DES FEMMES
ENCEINTES A ABIDJAN (COTE D'IVOIRE)
1. Résultats
Cette partie des résultats est acceptée
pour publication au mois de Décembre 2008 dans une revue internationale
(Annales de Biologie Clinique de Québec/CANADA) indexée avec
comité de lecture.
1-1. Paramètres biologiques du statut en fer
Les distributions des caractéristiques des
paramètres biologiques des 2 populations de femmes sont
résumées dans le tableau XXVII.
Les résultats de l'étude ont montré que les valeurs
moyennes globulaires observées chez les femmes non enceintes
étaient normales. Cependant, contrairement aux femmes témoins,
toutes ces valeurs moyennes observées chez les femmes enceintes
étaient en dessous du seuil de définition (Tableau
XXVII).
Au niveau des valeurs moyennes des paramètres
biochimiques du statut en fer, nous avons observé que :
- chez les femmes témoins, ces valeurs moyennes des
paramètres biochimiques du statut en fer étaient
normales ;
- chez les femmes enceintes, à l'exception de la CTF
et du CST, les autres paramètres biochimiques du statut en fer
étaient normaux (Tableau XXVII).
La figure 44 a
présenté les profils comparés des paramètres
hématologiques des femmes témoins et des femmes enceintes. Les
valeurs moyennes globulaires du statut en fer sont significativement plus
élevées chez les femmes témoins que chez les femmes
enceintes (Figure 44A-F).
Les résultats de l'étude concernant les
paramètres biochimiques du statut en fer des femmes témoins et
des femmes enceintes sont indiqués à la figure
45. Nous avons observé que comparativement aux femmes
témoins pour lesquelles les concentrations sériques de fer, de
CST et de ferritine sont significativement plus élevées par
rapport aux femmes enceintes ; la transferrine sérique et la CTF
étaient significativement plus basses chez les femmes témoins
que chez les femmes enceintes (Figure 45A-E).
Tableau XXVIIA: Caractéristiques
anthropométriques et distributions des valeurs biologiques des femmes
non enceintes
|
Paramètres anthropométriques et biologiques
|
Moyenne
|
ESM
|
Médiane
|
Minimum
|
Maximum
|
Etendue
|
Intervalle interquartiles
|
|
Age (ans)
|
24,5
|
0,5
|
23
|
15
|
48
|
33
|
11
|
|
IMC (kg.m-2)
|
22,4
|
0,3
|
22,04
|
14,8
|
39,1
|
24,2
|
4,8
|
|
Parité
|
0,7
|
0,1
|
0
|
0
|
7
|
7
|
1
|
|
Globules rouges (1012/l)
|
4,3
|
0,04
|
4,4
|
2,3
|
6,1
|
3,8
|
0,6
|
|
Hémoglobine (g/dl)
|
12,4
|
0,1
|
12,4
|
9,4
|
16,8
|
7,5
|
2,1
|
|
Hématocrite (%)
|
38,8
|
0,4
|
39,02
|
26,1
|
54,7
|
28,6
|
8
|
|
VGM (fl)
|
85,2
|
0,6
|
85
|
63
|
114
|
51
|
13
|
|
TCMH (pg)
|
27,4
|
0,1
|
27,4
|
20
|
32,9
|
12,9
|
2,7
|
|
CCMH (g/dl)
|
31,6
|
0,2
|
32,2
|
20,7
|
38,2
|
17,6
|
3,4
|
|
Fer sérique (umol/l)
|
12,3
|
0,4
|
11,6
|
2,4
|
29,4
|
27,01
|
8,6
|
|
Transferrine sérique (g/l)
|
2,8
|
0,1
|
2,8
|
1,2
|
5,01
|
3,8
|
1,3
|
|
CTF (umol/l)
|
70,2
|
1,5
|
70
|
30,8
|
134
|
103,2
|
30,3
|
|
CST (%)
|
18,7
|
0,5
|
17,9
|
2,3
|
36,1
|
33,8
|
8
|
|
Ferritine sérique (ug/l)
|
53,7
|
2,5
|
48,1
|
8,9
|
196,1
|
187,2
|
67,7
|
Tableau XXVIIB : Caractéristiques
anthropométriques et distributions des valeurs biologiques des femmes
enceintes
|
Paramètres anthropométriques et
biologiques
|
Moyenne
|
ESM
|
Médiane
|
Minimum
|
Maximum
|
Etendue
|
Intervalle interquartiles
|
|
Age (ans)
|
25,1
|
0,3
|
25
|
15
|
43
|
28
|
8
|
|
IMC (kg.m-2)
|
22,5
|
0,2
|
21,9
|
12,7
|
43,4
|
30,6
|
5,3
|
|
Gestité
|
3
|
0,1
|
2
|
1
|
10
|
9
|
2
|
|
Parité
|
1,3
|
0,1
|
1
|
0
|
8
|
8
|
2
|
|
Espace intergénésique (mois)
|
22,8
|
1,2
|
24
|
0
|
168
|
168
|
36
|
|
Globules rouges (1012/l)
|
3,9
|
0,02
|
3,9
|
2,2
|
5,3
|
3,1
|
0,7
|
|
Hémoglobine (g/dl)
|
10,1
|
0,1
|
10,1
|
6,3
|
14,1
|
7,8
|
2,1
|
|
Hématocrite (%)
|
29,2
|
0,2
|
29
|
17,2
|
42,8
|
25,6
|
6
|
|
VGM (fl)
|
76,1
|
0,3
|
76,1
|
51,7
|
104,5
|
52,8
|
8,8
|
|
TCMH (pg)
|
26,4
|
0,1
|
26,4
|
15,9
|
37,6
|
21,7
|
3,2
|
|
CCMH (g/dl)
|
33,8
|
0,1
|
34,5
|
20,4
|
36,3
|
15,9
|
2,5
|
|
Fer sérique (umol/l)
|
8,1
|
0,2
|
7,1
|
2,2
|
24,6
|
22,4
|
2,6
|
|
Transferrine sérique (g/l)
|
3,6
|
0,1
|
3,5
|
1,4
|
7,9
|
6,5
|
2,6
|
|
CTF (umol/dl)
|
91
|
1,5
|
88
|
35,5
|
198
|
162,5
|
64,5
|
|
CST (%)
|
10,7
|
0,3
|
10
|
1,7
|
33
|
31,3
|
10,1
|
|
Ferritine sérique (ug/l)
|
27,3
|
0,8
|
19,3
|
10,4
|
109,5
|
99,1
|
10,6
|
ESM : Erreur standard sur la moyenne
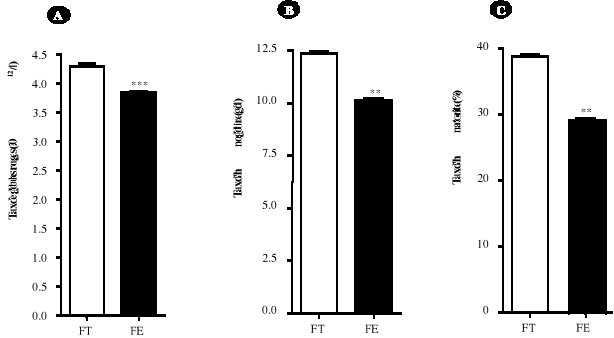
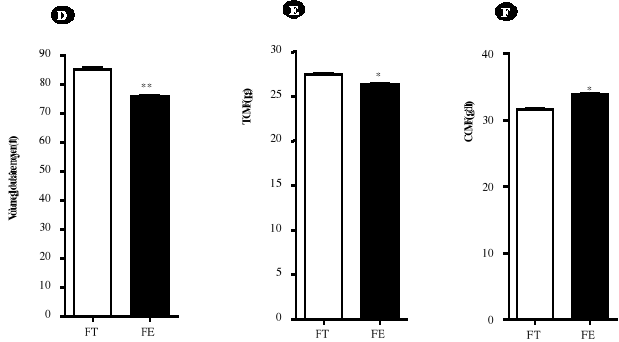
Figure 44 (A, B, C, D, E, F): Profils
comparés des données hématologiques entre les femmes non
enceintes et les femmes enceintes
A : Taux de globules rouges ;
B : Taux d'hémoglobine ;
C : Taux d'hématocrite ;
Femmes témoins (FT)
Femmes enceintes (FE)
D : Volume globulaire moyen (VGM) ;
E : Teneur corpusculaire moyenne en hémoglobine
(TCMH) ; F : Concentration corpusculaire moyenne en
hémoglobine (CCMH) ;
* : p < 0,05 ; ** : p < 0,01 ;
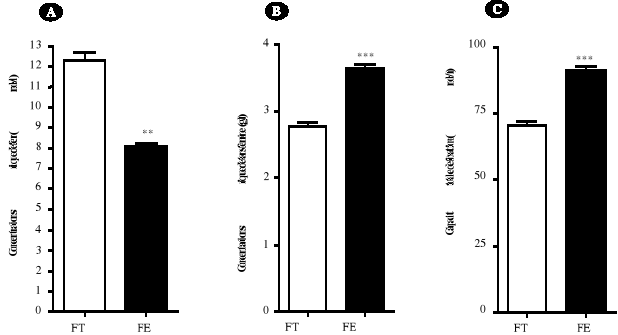
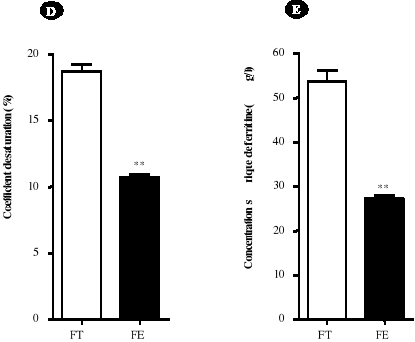
Figure 45 (A, B, C, D, E): Profils
comparés des données biochimiques entre les femmes non enceintes
et les femmes enceintes
A : Fer sérique,
B : Transferrine sérique,
C : Capacité totale de fixation,
D : Coefficient de saturation ;
E : Ferritine sérique ; ** : p <
0,01 ; *** : p < 0,001
Femmes témoins (FT)
Femmes enceintes (FE)
1-2. Proportions des principaux paramètres
biologiques du statut en fer
L'évaluation du statut martial des sujets est
effectuée avec 4 variables hématologiques et 5 données
biochimiques.
Sur la base du taux d'hémoglobine, la proportion de
femmes enceintes anémiques (71 %) est significativement plus
élevée que celle des femmes témoins (42 %)
(Tableau XXVIII).
Les proportions de VGM et de TCMH sont hautement plus
élevées chez les femmes enceintes par rapport aux sujets
témoins (p < 0,05 ; p < 0,001 respectivement) (Tableau 4).
Ces 2 paramètres ont entraîné respectivement une
microcytose (72 % et 35 % respectivement) pour un VGM inférieur à
80 fl associée à une hypochromie pour une TCMH inférieure
à 27 pg et une TCMH supérieure à 31 pg (61,4 % et 41 %
respectivement) (Tableau XXVIII).
Au niveau du compartiment plasmatique, les proportions des
femmes qui avaient des concentrations de fer en dessous de 7,16 umol/l sont
significativement plus prononcées chez les femmes enceintes
comparativement aux femmes non enceintes (p < 0,05). Cependant, aucune femme
enceinte n'a présenté une surcharge en fer (> 26,85 umol/l)
contrairement aux femmes non enceintes (Tableau
XXVIII). La différence de proportions des femmes
témoins et des femmes enceintes qui avaient des concentrations
sériques de transferrine en dessous de 2 g/l n'étaient pas
significative (p > 0,05) (Tableau XXVIII).
Au niveau des réserves en fer, la ferritine
sérique pour des concentrations inférieures à 20 ug/l,
nous avons des proportions significativement élevées (p <
0,05) chez les femmes enceintes (57 %) comparativement à celles des
femmes témoins (35 %). Cependant, seuls 5,3 % chez les femmes
témoins ont présenté une concentration de ferritine
sérique supérieure à 110 ug/l (Tableau
XXVIII).
Tableau XXVIII: Comparaison des
proportions (%) des paramètres biologiques entre les 2 groupes de femmes
sélectionnées selon le test Log Likelihood ratio (Test
« G »)
|
Principales données
hématologiques
|
Femmes témoins
N = 225
|
Femmes enceintes
N = 531
|
p
|
|
n % (IC à 95 %)
|
n % (IC à 95 %)
|
|
|
Taux d'hémoglobine (g/dl)a
|
|
|
|
|
< 11 et < 12
|
95 42 (38,7-45,3)
|
377 71 (69-73)
|
< 0,05
|
|
> 11 et > 12
|
130 58 (54,1-61,9)
|
154 29 (27,7-30,3)
|
< 0,05
|
|
Taux d'hématocrite (%)b
|
|
|
|
|
< 33 et < 35
|
61 27 (24,4-29,6)
|
434 81,7 (79,6-8 3,8)
|
< 0,00001
|
|
> 33 et > 35
|
164 73 (68,6-77,3)
|
97 18,3 (17,3-19,3)
|
< 0,00001
|
|
VGM (fl)
|
|
|
|
|
< 80
|
77 35 (32-38)
|
382 72 (70-74)
|
< 0,001
|
|
80 - 100
|
137 60 (56,1-63,9)
|
149 28 (26,8-29,2)
|
< 0,001
|
|
> 100
|
11 5 (3,9-6,1)
|
- -
|
< 0,01
|
|
TCMH (pg)
|
|
|
|
|
< 27 et > 31
|
92 41 (37,7-44,3)
|
326 61,4 (59,6-63,2)
|
< 0,05
|
|
27 - 31
|
133 59 (55,1-62,9)
|
205 38,6 (37,1-40,1)
|
< 0,05
|
|
Fer sérique (umol/l)
|
|
|
|
|
< 7,16
|
61 27 (24,4-29,6)
|
276 52 (50,3-53,7)
|
< 0,05
|
|
7,16 - 26,85
|
159 71 (66,7-75,3)
|
255 48 (46,4-49,6)
|
< 0,05
|
|
> 26,85
|
5 2 (1,3-2,7)
|
- -
|
> 0,05
|
|
Transferrine sérique (g/l)
|
|
|
|
|
< 2
|
59 26 (23,4-28,6)
|
74 14 (13,1-14,9)
|
> 0,05
|
|
2 - 3,6
|
137 55 (51,2-58,8)
|
244 46 (44,4-47,6)
|
> 0,05
|
|
> 3,6
|
29 19 (16,8-21,2)
|
212 40 (38,5-41,5)
|
< 0,001
|
|
Capacité totale de fixation (umol/l)
|
|
|
|
|
< 50
|
56 21 (18,7-23,3)
|
73 13,7 (12,8-14,6)
|
< 0,05
|
|
50 - 90
|
134 43 (39,7-46,3)
|
243 45,8 (44,2-47,4)
|
> 0,05
|
|
> 90
|
33 36 (33-39)
|
215 40,5 (39-42)
|
< 0,001
|
|
Coefficient de saturation (%)
|
|
|
|
|
< 15
|
54 24 (21,5-26,5)
|
382 72 (70-74)
|
< 0,00001
|
|
15 - 35
|
169 75 (70,6-79,4)
|
149 28 (26,8-29,2)
|
< 0,00001
|
|
> 35
|
2 1 (0,5-1,5)
|
- -
|
> 0,05
|
|
Ferritine sérique (ug/l)
|
|
|
|
|
< 20
|
79 35 (32-38)
|
303 57 (55,2-58,8)
|
< 0,05
|
|
20 - 110
|
134 59,7 (55,8-63,6)
|
228 43 (41,5-44,5)
|
> 0,05
|
|
> 110
|
12 5,3 (4,1-6,5)
|
- -
|
< 0,01
|
a : Valeurs de référence des taux
d'hémoglobine respectivement chez les femmes enceintes (11 g/dl) et les
femmes témoins (12 g/dl); b : Valeurs de référence
des taux d'hématocrite respectivement chez les femmes enceintes (33 %)
et les femmes témoins (35 %);
N : Effectif total pour
chaque groupe de femmes sélectionnées ;
n : Effectifs observés chez les
femmes pour chaque classe de paramètre hématologique ;
IC : Intervalle de confiance ; - : Aucune
observation n'était faite
1-3. Prévalence de la carence martiale et des types
d'anémies
L'analyse des différents indicateurs
hématologiques et biochimiques du statut martial sur la base des
critères choisis, a permis de déterminer les taux de
prévalence de la carence martiale et des anémies. Ces taux de
prévalence comparés entre les 2 populations de femmes, sont
décrits à la figure 46. Au vu de ces
résultats, 21,8 % de femmes témoins ont présenté
une carence martiale contre 14,5 % chez les femmes enceintes (Figure
46). En ce qui concerne la prévalence de l'anémie
ferriprive, chez les femmes enceintes était 3 fois supérieure
à celle des femmes témoins (Figure 46). Aussi
avons-nous observé que les 2 types d'anémies inflammatoires
étaient comparables entre les 2 groupes de sujets étudiés
(p > 0,05) (Figure 46).
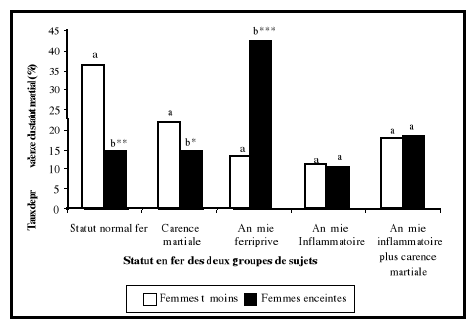
Figure 46 : Comparaison des taux de
prévalence du statut en fer des femmes témoins et des femmes
enceintes
a et b : Groupes de femmes dont les différences sont
significatives pour p < 0,05 ;
* : p < 0,05 ; ** : p < 0,01 ;
*** : p < 0,001
1-4. Modélisation comparée du statut martial
des femmes non enceintes et des femmes enceintes
Les résultats de l'étude de comparaisons des
proportions du statut en fer normal associées à leurs rapports de
côte entre les femmes témoins et les femmes enceintes sont
présentés dans le tableau (Tableau XXIX).
Nous avons observé que l'âge a constitué un
prédicteur commun chez les 2 populations de femmes
étudiées pour le statut normal en fer. Dans ce sens, les femmes
dont l'âge a varié entre 20 et 48 ans avaient plus de chance de
présenter un statut martial normal par rapport aux adolescentes
(Tableau XXIX). Cependant, la
gestité était seulement un déterminant qui a
favorisé un statut martial normal chez les femmes enceintes. La
parité et l'espace intergénésique n'étaient des
prédicteurs du statut martial normal que chez les femmes témoins
(Tableau XXIX). En revanche, l'indice de masse corporelle
n'était pas un déterminant pour le statut normal en fer chez les
2 populations de femmes étudiées
(Tableau XXIX).
Le tableau XXX a présenté
les proportions comparées de carence martiale accompagnées des
rapports de côte chez les femmes témoins et chez les femmes
enceintes. Les résultats observés ont indiqué que la
gestité était le seul facteur de risque de la carence en fer au
sein des 2 groupes de femmes sélectionnées. En outre, le rapport
de côte des femmes enceintes (OR = 7,1) était plus
élevé comparativement à celui des femmes témoins
(OR = 2,5). Au niveau des femmes témoins, les multigestes avaient plus
de risque d'indiquer une carence martiale. Alors que chez les femmes, il
s'agissait des primigestes (Tableau XXX).
Nous également observé que :
- la parité n'a constitué un prédicteur
que chez les femmes enceintes (Tableau XXX) ;
- l'espace intergénésique était un
facteur de risque seulement chez les femmes témoins
(Tableau XXX).
Les proportions comparées par le test
« G » au niveau de l'anémie ferriprive des 2 groupes
de femmes avec leurs rapports de côte sont résumées dans le
tableau XXXI. Les résultats de l'étude ont
indiqué que tous les paramètres anthropométriques ont
constitué des facteurs de risque pour l'anémie ferriprive chez
les femmes enceintes contrairement aux femmes témoins
(Tableau XXXI).
Tableau XXIX: Proportions
comparées et les rapports de côte (OR) du statut martial normal
des 2 groupes de femmes
|
Groupes de femmes
|
|
Variables anthropométriques
|
Témoins (N = 225)
|
Grossesse (N = 531)
|
|
n % OR (IC
à 95 %)
|
n %
OR (IC à 95 %)
|
|
Age (ans)
|
4,3 (1 - 5,6)***
|
13 (4 - 42,1)***
|
|
15 - 19 ; n1 = 75 ; n2 = 112
|
10 4,4
-
|
13 2,4
-
|
|
20 - 48 ; n1 = 150 ; n2 = 419
|
71 31,6 2,
6 (1,1 - 4,3)**
|
64 12,1
9,4 (3,7- 13,1)***
|
|
p
|
< 0,00001
|
< 0,01
|
|
IMC (kg.m-2)
|
-
|
|
|
< 19,8 ; n1 = 58 ; n2 = 158
|
17 7,7
|
18 3,4
|
|
19,8 - 26 ; n1 = 129 ; n2 = 276
|
51 22,7
|
36 6,8
|
|
> 26 ; n1 = 38 ; n2 = 97
|
13 5,8
|
23 4,3
|
|
p
|
< 0,00001
|
> 0,05
|
|
Gestité
|
-
|
2,8 (1,6 - 3,2)**
|
|
Primigestes ; n1 = 70 ; n2 = 119
|
20 9,1
|
12 2,3
2,3 (1,9 - 2,7) **
|
|
Multigestes ; n1 = 155 ; n2 = 412
|
61 27,1
|
65 12,5
-
|
|
p
|
< 0,01
|
< 0,01
|
|
Parité
|
2,8 (1 -
7,8)**
|
|
|
Nullipares ; n1 = 144 ; n2 = 213
|
51 22,7
1,3 (0,5 - 3,5)*
|
29 5,5
|
|
Primipares ; n1 = 46 ; n2 = 145
|
16 7,1
-
|
23 4,3
|
|
Multipares ; n1 = 35; n2 = 173
|
14 6,4
-
|
25 4,7
|
|
p
|
< 0,00001
|
> 0,05
|
|
Espace intergénésique
|
3,7 (2,1 -
6,4)**
|
|
|
< 36 ; n1 = 51 ; n2 = 379
|
26 11,7
-
|
48 9,1
|
|
= 36 ; n1 = 104 ; n2 = 152
|
55 24,5
2 (1,2 - 5,4)*
|
29 5,4
|
|
p
|
< 0,05
|
> 0,05
|
N : Effectif de l'échantillon de femmes
sélectionnées à chaque trimestre de grossesse ;
n : Effectifs observés chez les femmes de statut
martial normal pour chaque classe de données
anthropométrique ; n1 et n2 : Effectifs
pour chaque de paramètre épidémiologique respectivement
des femmes sélectionnées en âge de procréer et des
femmes enceintes ; * : p < 0,05 ;
** : p < 0,01 ;
*** : p < 0,001 ; OR (Odds Ratio) : Rapports
de côte associant leur intervalle de confiance (IC) à 95 % ;
- : Aucune observation significative
Tableau XXX: Proportions
comparées et les rapports de côte (OR) de la carence martiale des
2 groupes de femmes
|
Groupes de femmes
|
|
Variables anthropométriques
|
Témoins (N = 225)
|
Grossesse (N = 531)
|
|
n % OR (IC
à 95 %)
|
n % OR
(IC à 95 %)
|
|
Age (ans)
|
|
|
|
15 - 19 ; n1 = 75 ; n2 = 112
|
20 8,9
|
27 5,1
|
|
20 - 48 ; n1 = 150 ; n2 = 419
|
29 13,9
|
50 9,7
|
|
p
|
> 0,05
|
> 0,05
|
|
IMC (kg.m-2)
|
|
|
|
< 19,8 ; n1 = 58 ; n2 = 158
|
18 8
|
27 5,1
|
|
19,8 - 26 ; n1 = 129 ; n2 = 276
|
18 8
|
37 7
|
|
> 26 ; n1 = 38 ; n2 = 97
|
13 5,8
|
13 2,5
|
|
p
|
> 0,05
|
> 0,05
|
|
Gestité
|
2,5 (1,3 -
5,8)**
|
7,1 (3,2- 15,8)***
|
|
Primigestes ; n1 = 70 ; n2 = 119
|
17 5,5
-
|
23 4,3
6,4 (4,7 - 8,7)***
|
|
Multigestes ; n1 = 155 ; n2 = 412
|
32 16,3
1,2 (0,8 - 1,9)*
|
53 10
-
|
|
p
|
< 0,05
|
< 0,05
|
|
Parité
|
|
6,4 (3,8- 10,9)***
|
|
Nullipares ; n1 = 144 ; n2 = 213
|
24 10,7
|
50 9,4
4 (1,8 - 8,7)**
|
|
Primipares ; n1 = 46 ; n2 = 145
|
12 5,3
|
12 2,3
-
|
|
Multipares ; n1 = 35; n2 = 173
|
13 5,8
|
15 2,8
-
|
|
p
|
> 0,05
|
< 0,05
|
|
Espace intergénésique (Mois)
|
6,4 (3 -
9,4)***
|
|
|
< 36 ; n1 = 51 ; n2 = 379
|
12 5,4
3,3 (2,1 - 6,2)**
|
52 9,8
|
|
= 36 ; n1 = 104 ; n2 = 152
|
37 16,4
-
|
25 4,7
|
|
p
|
< 0,05
|
> 0,05
|
N : Effectifs de chaque groupe de femmes
sélectionnées ; n : Effectifs
observés chez les femmes de carence martiale pour chaque classe de
données anthropométrique ; n1 et n2 :
Effectifs pour chaque de paramètre épidémiologique
respectivement des femmes sélectionnées en âge de
procréer et des femmes enceintes ;
** : p < 0,01 ;
*** : p < 0,001 ; OR (Odds Ratio) : Rapports
de côte associant leur intervalle de confiance (IC) à 95 % ;
- : Aucune observation significative
Tableau XXXI: Proportions
comparées et les rapports de côte (OR) de l'anémie
ferriprive des 2 groupes de femmes
|
Groupes de femmes
|
|
Variables anthropométriques
|
Témoins (N = 225)
|
Grossesse (N = 531)
|
|
n % OR (IC
à 95 %)
|
n % OR (IC
à 95 %)
|
|
Age (ans)
|
|
3,2 (1,7
- 4,9)***
|
|
15 - 19 ; n1 = 75 ; n2 = 112
|
12 5,2
|
65 12,2
2,3 (2 - 4,5)**
|
|
20 - 48 ; n1 = 150 ; n2 = 419
|
18 8
|
159 29,9
-
|
|
p
|
> 0,05
|
< 0,01
|
|
IMC (kg.m-2)
|
|
1,6 (0,9 - 3)**
|
|
< 19,8 ; n1 = 58 ; n2 = 158
|
10 4,4
|
90 19,6
1,1 (0,9 - 1,4)**
|
|
19,8 - 26 ; n1 = 129 ; n2 = 276
|
14 6,2
|
100 18,8
-
|
|
> 26 ; n1 = 38 ; n2 = 97
|
6 2,6
|
34 6,4
-
|
|
p
|
> 0,05
|
< 0,00001
|
|
Gestité
|
|
5
(0,6 - 8,1)**
|
|
Primigestes ; n1 = 70 ; n2 = 119
|
12 5,1
|
72 13,6
-
|
|
Multigestes ; n1 = 155 ; n2 = 412
|
18 8,1
|
152 28,9
3,5 (2,6 -4,8)**
|
|
p
|
> 0,05
|
< 0,01
|
|
Parité
|
|
1,3 (1 - 1,6)*
|
|
Nullipares ; n1 = 144 ; n2 = 213
|
16 7,1
|
109 20,5
-
|
|
Primipares ; n1 = 46 ; n2 = 145
|
10 4,4
|
14 2,6
-
|
|
Multipares ; n1 = 35; n2 = 173
|
4 1,7
|
101 19
1,1 (0,9 - 1,5)*
|
|
p
|
> 0,05
|
< 0,00001
|
|
Espace intergénésique (Mois)
|
|
10,1 (6,6 -
12,1)**
|
|
< 36 ; n1 = 51 ; n2 = 379
|
14 6
|
198 37,3
8,7 (5,1 - 14,8)**
|
|
= 36 ; n1 = 104 ; n2 = 152
|
16 7,2
|
26 4,9
-
|
|
p
|
> 0,05
|
< 0,000001
|
N : Effectif de l'échantillon de femmes
sélectionnées à chaque trimestre de grossesse ;
n : Effectifs observés chez les femmes de carence
martiale pour chaque classe de données épidémiologiques ;
n1, n2, et n3 : Effectifs de femmes
recrutées pour chaque classe des paramètres
épidémiologiques respectivement au premier, au second et au
troisième trimestres de la grossesse ;
** : p < 0,01 ;
*** : p < 0,001 ; OR (Odds Ratio) : Rapports
de côte associant leur intervalle de confiance (IC) à 95 % ;
- : Aucune observation significative
2. Discussion
2-1. Paramètres biologiques du statut en fer des
femmes en âge de procréer non enceintes et des femmes
enceintes
L'étude menée dans les 3 communes de la ville
d'Abidjan, a montré l'altération en général des
données biologiques d'évaluation du statut en fer dans la
population des femmes en âge de procréer et plus
particulièrement chez les femmes enceintes. Cette altération a
concerné les prévalences de microcytose, d'hypochromie, de la
carence martiale et des types d'anémies. Ces résultats confirment
l'influence de l'état de grossesse sur le statut en fer (Hercberg et
al., 1998). En effet, au cours de la grossesse, l'augmentation du volume
plasmatique, de la masse érythrocytaire et la croissance du foetus
constituent les principaux facteurs responsables de l'altération du
statut martial chez les femmes enceintes (Hytten, 1885 ; Beguin et
al., 1991). Pour Rovinsky et Joffin, les grossesses multiples et
répétées accentuent les modifications physiologiques
observées au cours de la grossesse (Rovinsky et Joffin, 1965). Nos
investigations chez les femmes enceintes des 3 communes de la ville d'Abidjan
indiquent que 77,6 % des femmes ont plus d'une grossesse et 71,4 % de ces
femmes ont un espace intergénésique en dessous de 3 ans. Cela
expliquerait une forte expansion du plasma des femmes étudiées.
En outre, chez ces femmes, les diminutions précoces d'hémoglobine
et d'hématocrite indiquent des véritables changements
physiologiques au cours de la grossesse. De même, les fortes demandes en
fer associées à une forte hémodilution chez les femmes
enceintes justifiant les taux augmentés de microcytose et d'hypochromie
sont conformes aux changements physiologiques. Ces modifications physiologiques
peuvent expliquer le faible taux de femmes présentant un statut martial
normal chez les femmes enceintes. Les valeurs moyennes des données
biologiques des sujets étudiés sont largement en dessous des
valeurs normales de référence (Williams, 1983). Chez les femmes
témoins en âge de procréer, considérées comme
des sujets sains, les résultats de l'étude révèlent
un important taux de prévalence du statut martial anormal. Cela pourrait
être expliqué par l'existence d'un certain nombre de facteurs tels
les syndromes infectieux et inflammatoires responsables de la déviation
et de la séquestration du fer circulant dans l'organisme (Liao,
2004 ; Broek et Letsky, 2000 ; Asobayire et
al., 2001). Des travaux réalisés en Belgique ont
révélé des résultats contraires à ceux
obtenus chez nos sujets sauf le taux d'hématocrite des femmes enceintes
de la ville d'Abidjan (36,3 #177; 3,4 % et 29,2 #177; 0,2 % respectivement).
Cependant, les valeurs des taux d'hématocrite des
femmes non enceintes en Belgique et à Abidjan (36,3 #177; 3,4 % ;
38,8 #177; 3,4 % respectivement) sont semblables (Bégin et al,
1991).
Nos travaux montrent également que les femmes enceintes
présentent un taux de prévalence du statut en fer anormal
(carence martiale et les types d'anémies) plus important que celui des
femmes non enceintes. En Chine, des travaux ont montré de fortes
proportions de carence martiale et d'anémie ferriprive chez les femmes
enceintes que celles chez les femmes témoins (Liao, 2004). Cette
étude confirme la prédominance des taux de prévalence de
carence martiale et de l'anémie ferriprive élevés chez les
femmes enceintes comparativement aux femmes non enceintes. La forte
prévalence du statut martial anormal chez nos femmes témoins
évoque un important effondrement de la taille des réserves en fer
dans la population des femmes en âge de procréer non enceintes.
Cette insuffisance des réserves en fer s'accentue pendant la grossesse,
ce qui justifie le taux de prévalence d'anémie ferriprive 3 fois
plus élevé chez les femmes enceintes. Ces résultats sont
similaires à ceux effectués dans quelques localités de la
Côte d'Ivoire, au Malawi et en Tanzanie (Massawe et al.,
1999 ; Broek et Letsky, 1998 ; Asobayire et al., 2001). Les
syndromes infectieux et surtout l'alimentation au regard des proportions de
transferrine sérique et des capacités totales de fixation
pourraient justifier la présence de l'anémie d'origine
nutritionnelle et des anémies inflammatoires (Dillon, 2000 ; Vernet
et al., 2001 ; Abrams et al., 2006). A cela nous
pourrions associer le fait que plus d'un tiers des femmes non enceintes avaient
au moins un enfant. Par ailleurs, des études réalisées, au
cours du dernier trimestre, chez les femmes enceintes en Côte d'Ivoire,
une supplémentation en fer est prescrite (Sess et al., 1997).
Toutefois, au regard des résultats obtenus dans notre étude, il
est préférable que les femmes enceintes ou non soient
supplémentées en fer afin d'éviter ces taux
élevés de prévalence de carence martiale et des
anémies.
2-2. Facteurs de risques associés à la
carence martiale et à l'anémie ferriprive des 2 groupes de femmes
en âge de procréer
En plus des déterminants qui interagissent avec le
comportement du fer dans l'organisme des femmes, nous avons mis en
évidence d'autres facteurs aussi fondamentaux que les premiers pour
prédire le comportement du statut en fer chez les femmes en âge de
procréer.
Dans le cadre de notre étude, l'âge, l'indice de
masse corporelle, la gestité, la parité et l'espace
intergénésique des 2 groupes prédisent le bilan martial
des femmes en âge de procréer. Ainsi les femmes adultes des 2
groupes de sujets étudiés à l'inverse des adolescentes ont
plus de chance de présenter un statut martial normal.
Cela pourrait être expliqué chez ces sujets par
une moindre modification physiologique (croissance et maturité
gynécologique) par rapport aux adolescentes (Massawe et al.,
2002 ; Moran, 2007a).
Les nullipares témoins, qui ont observé une
bonne période entre les grossesses et les sujets qui sont à leur
première grossesse, ont beaucoup plus de chance d'indiquer un statut
normal en fer. Ce résultat est conforme aux rapports de plusieurs
organismes internationaux concernant l'impact de l'état de grossesse sur
le bilan martial des femmes enceintes (UNICEF/WHO/UNU/MI, 1999). Cependant, les
sujets témoins multigestes et ceux avec un espace
intergénésique inférieur à 3 ans sont plus
susceptibles de présenter une carence martiale. C'est pour quoi les
grossesses multiples et répétées constituent un
véritable problème de santé publique pour les femmes en
âge de procréer non enceintes.
Pour l'anémie ferriprive, les adolescentes et les
femmes ayant un déficit pondéral ont plus de risque d'indiquer ce
type d'anémie nutritionnelle au niveau des femmes de notre étude.
Les adolescentes et surtout les sujets avec un indice de masse corporelle
diminué (< 19,8 kg/m2) selon plusieurs études,
elles sont confrontés à une double demande en fer et à un
besoin protéo-énergétique élevé au cours de
la grossesse comparativement aux femmes non enceintes (Zucherman et
al., 1984 ; Beard, 1994 ;
Thame et al., 1999 ; Reifsnider et Gill, 2000 ;
Massawe et al., 1996 ; Casanueva et al., 2003 ;
Iannotti et al., 2005 ; Moran, 2007a et 2007b).
Le nombre d'accouchements et la période observée
entre les grossesses chez les femmes enceintes prédisent l'anémie
ferriprive contrairement aux sujets témoins. Notre étude
démontre une fois encore l'impact de la parité et l'espace
intergénésique sur le statut en fer des femmes au cours de la
grossesse. Il est depuis longtemps révélé que les
grossesses répétées et rapprochées conduisent
à la carence martiale et aux anémies (Fleming, 1989b). Dans ce
sens, une étude en Belgique entre les femmes non enceintes et les sujets
en gestation confirme l'exposition des grandes multipares à
l'anémie ferriprive comparativement aux sujets avec peu d'accouchements (
Massot
et
Vanderpas,
2003).
3. Conclusion
La comparaison des paramètres biologiques
d'évaluation du statut en fer entre les femmes témoins et les
femmes enceintes a mis en évidence dans l'ensemble une altération
des indicateurs biologiques au sein de la population des femmes en âge de
procréer. Toutefois, la dégradation du statut martial des femmes
en âge de procréer est beaucoup plus considérable chez les
femmes enceintes. Cette altération concerne toutes les proportions des
principaux indices biologiques du statut en fer en général et
plus particulièrement celles de la carence martiale et des types
d'anémies. Les taux de prévalence des anémies sont plus
élevés chez les femmes enceintes alors que les sujets
témoins présentent la forte prévalence de carence
martiale. La principale raison commune de la dégradation du statut
martial chez les 2 groupes de femmes est l'insuffisance de la taille des
réserves en fer au sein de la population des femmes en âge de
procréer. Ce déficit en fer des femmes pourrait être
expliqué par un faible apport du fer contenu dans l'alimentation. En
outre, les syndromes infectieux et inflammatoires plus fréquentes dans
les pays en développement justifieraient la présence des
anémies inflammation au sein de la population des femmes en âge de
procréer.
Les analyses comparées de modélisations par les
régressions logistiques indiquent que les paramètres
anthropométriques communs choisis constituent des prédicteurs
associés au comportement du fer chez les 2 groupes de femmes en
âge de procréer.
Au terme de l'étude menée sur 756 femmes en
âge de procréer sélectionnées dans 4 formations
sanitaires et dans les ménages de 3 communes de la ville d'Abidjan, il
ressort que le statut en fer de ces sujets est significativement
dégradé.
Les moyennes des paramètres biologiques
d'évaluation du statut martial en général sont conformes
aux normes définies chez les femmes non enceintes. A contrario, ces
mêmes paramètres sont fortement dégradés chez les
femmes enceintes. En outre, les différents taux de prévalence de
la carence martiale puis d'anémie ferriprive et des anémies
inflammatoires sont plus bas que les valeurs seuils indiquées par l'OMS
au sein des 2 populations étudiées.
A partir des critères d'évaluation choisis des
indicateurs biologiques, seulement une femme en âge de procréer
non enceinte sur 3 a un statut martial normal. Puis, aucune femme au
troisième trimestre de la grossesse n'a présenté de statut
normal en fer.
Par ailleurs, une étude comparée entre les
différentes communes, a permis de mettre en évidence
l'altération du statut en fer des femmes en âge de procréer
non enceintes de la commune d'Abobo comparativement à celles de Cocody
et de Port-Bouët.
Pour les femmes enceintes, les sujets du centre de
santé « les HORTENSIAS » de la commune de
Port-Bouët ont indiqué des forts taux de prévalence du
statut martial anormal. Toutefois, le taux de prévalence du statut
normal en fer est élevé chez les femmes enceintes de la formation
sanitaire urbaine de Cocody Sud.
L'insuffisance des réserves en fer et les pathologies
infectieuses et inflammatoires justifient l'altération prononcée
du statut martial dans la population des femmes en âge de
procréer.
En plus de ces déterminants fondamentaux qui influent
sur le bilan martial des femmes, d'autres facteurs d'ordre
anthropométrique ont eu un impact sur le statut en fer. Ainsi, les
adolescentes enceintes ou non, les multipares, les multigestes et les sujets
qui observent moins de 3 ans entre les grossesses ont plus de risque de
présenter une carence martiale et des anémies.
Au regard du fort taux de prévalence du statut martial
anormal au sein des 2 groupes de femmes sélectionnées, nous
suggérons une supplémentation en fer à l'effet de
prévenir de façon précoce l'installation de la carence
martiale et des anémies et pour envisager des traitements
thérapeutiques adaptés.
Nous préconisons également une étude
d'enquêtes démographiques et de santé (EDS) en Côte
d'Ivoire.
Abel R., Rajaratnam J., Gnanasekaran V.J., Jayaraman
P, (2001). Prevalence of anaemia and iron deficiency in three
trimesters in rural Vellore district, South India. Trop Doct; 31 (2):
9-86
Abrams E.T., Kwiek J.J, Mwapasa V., Kamwendo D.D.,
Tadesse E., Lema V.M., Molyneux M.E., Rogerson S.J., Meshnick S.R.,
(2006). Malaria during pregnancy and foetal haematological status in
Blantyre, Malawi. BMC Malaria Journal; 4: 39/ doi:
1186/1475-2875-4-39
Achidi E.A., Kuoh A.J.,
Minang J.T., Ngum B., Achimbom
B.M., Motaze S.C., Ahmadou M.J.,
Troye-Blomberg M., (2005). Malaria infection in pregnancy and
its effects on haemoglobin levels in women from a malaria endemic area of Fako
Division, South West Province, Cameroon. J Obstet Gynaecol; 25 (3):
235-40
Agarwal K.N., Agarwal D.K.,
Sharma A., Sharma K., Prasad
K., Kalita M.C, Khetarpaul N.,
Kapoor A.C., Vijayalekshmi L.,
Govilla A.K., Panda S.M., Kumari
P., (2007). Prevalence of anaemia in pregnant
and lactating women in India. Indian J Med Res; 125(1) : 99-101
Aguayo V.M., Kone D., Bamba S.I., Diallo B., Sidibe
Y., Traore D., Signe P., Baker S.K., (2004). Acceptability of multiple
micronutrient supplements by pregnant and lactating women in Mali. Public
Health Nutr; 8 (1): 33-37
Allen L.H., (1997). Pregnancy and iron
deficiency: unresolved issues. Nutr Rev; 55:91-101.
Allen L.H., (2000). Anemia and iron
deficiency: effects on pregnancy outcome. Am J Clin Nutr; 17(5):
1280s-1284s
Antelman G., Msamanga G.I., Spiegelman D.,
(2000). Nutritional factors and infectious disease contribute to
anemia among pregnant women with human immunodeficiency virus in Tanzania.
J Nutr; 130:1950-7.
Asobayire S.F., Adou P., Davidsson l., Cook D.J.,
Hurrell F., (2001). Prevalence of iron deficiency
with and without concurrent anemia in population groups with high prevalence of
malaria and other infections: a study in Côte d'Ivoire. Am J Clin
Nutr; 74: 776-82
Baynes R.D., Skikne B.S., Cook J.D., (1994).
Circulating transferrin receptors and assessrnent of iron status.
J Nutr Biochem; 5: 322-30.
Beard J.L., (1994). Iron deficiency:
assessrnent during pregnancy and its irnporrance in pregnant adolescents.
Am J Clin Nutr; 59: 502S-IOS
Beard J.L., Dawson H., Pinero D., (1996).
Iron metabolism: a comprehensive review. Nutr Rev; 54:
295-317
Beaton H.G. ,(2000). Iron
needs during pregnancy: do we need to rethink our target? Am J Clin
Nutr; 72: 265S-71S
Beguin Y., Lipscei G., Thoumsin H., Fillet G.,
(1991). Blunted erythropoietin production and decreased erythropoiesis
in early pregnancy. Blood; 78 (1): 89-935
Belachew T., Legesse Y.,
(2006). Risk factors for anemia among pregnant women attending
antenatal clinic at Jimma University Hospital, southwest Ethiopia. Ethiop
Med J; 44(3):211-20.
Bentley, D.P, (1985). Iron
metabolisrn and anemia in pregnancy. Clin Haematol;
l4 (3):613-629.
Berger J., Thanh H.T.K., Cavalli-Sforza T., Smitasiri
S., Khan N.C., Milani S., Thuyhoa P., Quang N.D., Viteri E.F., (2005).
Community mobilization and social marketing to promote weekly iron-folic acid
supplementation in women of reproductive age in Vietnam: Impact on anemia and
iron status. Nutr Rev; 63 (12): S95-S108.
Bernard E., Statland M.D., Per Winkel M.D.,
(1977). Relationship of day-to-day variation of serum iron
concentrations to iron binding capacity in healthy young women. Am J Clin
Patholo; 67: 84-90.
Bernard J., Lévy J.P, Varet B., Clauvel J.P.,
Rain J.D., Sultan Y., (1996). Abrégés
d'hématologie. In : le globule rouge : physiologie et
pathologie. 8e édition Masson, Paris, 21-84.
Bhargava M., Kurnar R., Lyer P.U., Ramji S., Kapani
V., Bhargava S.K., (1989). Effect of materna1 anaemia
and iron Depletion on Foetal iron stores. Birth weight and gestation. Acta
Pediatr Scand; 78:321-322
Blake D.R., Waterworth R.F., Bacon P.A.,
(1981). Assessrnent of iron stores in inflammation by assay of serum
ferritin concentrations. Br Med J; 283: 1 147-48.
Bléyéré N.M., Joulia-Ekaza D.,
Yapo A.P., Yao D.J., Banga N.B., Neil C.A.M., Vanga O.M., Koné M.,
Ehilé E.E., (2007).
Hétérogénéité du statut en fer chez
la femme au cours de la grossesse en Côte d'Ivoire. Ann Biol
Clin-Paris ; 65 (5) : 525-32
Bondevik G.T., Eskeland B.,
Ulvik R.J., Ulstein M., Lie
R.T., Schneede J., Kvåle G.,
(2000). Anaemia in pregnancy: possible causes and risk
factors in Nepali women. Eur J Clin Nutr; 54:3-8.
Bothwell T.H., (2000). Iron requirement in
pregnancy and strategies to meet them. Am J Clin Nutr; 72:
64S-257S.
Broek N.R., Letsky E.A., (2000). Etiology of
anemia in pregnancy in south Malawi. Am J Clin Nutr; 72:247S-56S.
Broek N.R., Letsky E.A., White S.A., Shenkin A.,
(1998). Iron status in pregnant women: which measurements are valid?
Br J Haematol; 103:817-24
Broek N.R., White S.A., Neilson J.P., (1998).
The relationship between asymptomatic human immunodeficiency virus infection
and the prevalence and severity of anemia in pregnant Malawian women. Am J
Trop Med Hyg; 59:1004-7.
Carpenter C.E., Mahoney W., (1992).
Contributions of heme and non heme iron to human nutrition. Crit
Rev Food Sci; 3l (4): 333-324
Carré N., Eono P., Kouakou K., Duponchel J.L.,
Marquis M., Zahui K.H., (2003). Iron supplementation associated with
malaria prevention among pregnant women in Abidjan. Rev epidémiol
Santé Publique; (51): 31-38
Carriaga M.T., Skikne B.S., Finley B., Cutler B., Cook
J.D., (1991). Serum transferrin receptor for the detection of iron
deficiency in pregnancy. Am J Clin Nutr; 54 (6): 1077-8 1.
Casanueva E., Jimenez J., Meza-Camacho C., Mares M.,
Simon L., (2003) Prevalence of nutritional
deficiencies in Mexican adolescent women with early and late prenatal care.
Arch Latinoam Nutr; 53: 35-38.
Centers for Desease Control (C.D.C./U.S.A.),
(1989). CDC criteria for anaemia in children and
childbearing age women. MMWR Morb. Mortal. Wkly. Rep; 38: 400-404
Chang S.C., O'Brien K.O., Schulman Nathanson M.,
Caulfield L.E., Mancini J., Witter F.R., (2003a). Hemoglobin
concentrations influence birth outcomes in pregnant African-American
adolescents. J Nutr; 133: 2348-2355.
Chotnopparatpattara P.,
Limpongsanurak S., Charnngam P.,
(2003). The prevalence and risk factors of anemia in pregnant
women. J Med Assoc Thai; 86(11):1001-7.
Cook J.D., Finch C.A., (1979). Assessing
iron status of population. Am J Clin Nutr; 32: 2115-2119
Cook J.D., (1982). ClinicaI evaluation of
iron deficiency. Sem Hematol; 19: 6-18.
Cook M., (1990). Adaptation in iron
metabolism. Am J Clin Nutr; 5 1: 301- 25
Cottrell G., Mary J.Y., Barro D., Cot M.,
(2007). The Importance of the Period Of Malarial Infection
During Pregnancy On Birth Weight In Tropical Africa Am J Trop Med Hyg;
76(5): 849-854
Dallman P.R. (1986). Iron deficiency in the
Weanling : a nutritionnal problem on the way to resolution. Acta
Paediat Scand ; 323: 59-67
Dallman P.R., (1987). Iron deficiency and the
immune response. Am J Clin Nutr; 46: 329-314
Desjardins J., (2007). L'analyse de
régression logistique. Tut Quant Meth Psychol ; 1
(1) : 35-45
Dillon J-C., (2000). Prévention de la
carence en fer et des anémies ferriprives en milieu tropical.
Méd Trop; 60: 83-91
Duport N., Preziosi P., Boutron-Ruault M-C., Bertrais
S., Galan P., Favier A., Lafond J.L., Hercgerg S., (2003).
Consequences of iron depletion on health in menstruating women. Eur J Clin
Nutr; 57: 1169-1175.
Fall H.D.C., Yajnik C.S., Rao S., Davies A.A., Brown
N., Farrant J.W.H., (2003). Nutrition as a preventive strategy against
adverse pregnancy outcome: Micronutrient and fetal growth. J Nutr;
133: 1747S-1756S.
Farag T.H., Stoltzfus R.J., Khalfan S.S., Tielsch
J.M., (2007). Helicobacter pylori infection is associated
with severe anemia of pregnancy on Pemba Island, Zanzibar. Am J Trop Med
Hyg; 76: 541-548.
Fielding J., (1980). Serum iron and iron
binding capacity. In: Cook JD. Methods in hematology: iron. New York. Churchill
Livingstone: 15-43.
Finch C.A., Huebers H., (1982). Perspectives
in iron metabolism. N Engl J Med; 306: 1520-8.
Fleming A.F., (1981). Haematological
manifestations of malaria and other parasitic diseases. Clin Haematol;
10: 19-28.
Fleming A.F., (1989b). Tropical obstetrics
and gynaecology: Anaemia in pregnancy in tropical Africa. Trans R Soc Trop
Med Hyg; 83:441-448.
Fondu P., Hariga-Muller C., Mozes N., Neve J., Van
Steirteghem A., Mandelbaum I.M., (1978a). Protein-energy malnutrition
and anemia in Kivu. Am J Clin Nutr; 31: 46-56.
Galan P., Cherouvrier F., Zohoun I., Zohoun T.,
Chauliac M., Hercberg S., (1990). Iron absorption from typical West
African meals containing contaminating iron. Br J Nutr; 64:
541-546.
Galan P., Hercberg S., Cook J.D., (1992).
Interleukine 2 production in iron deficient children.
Biol Trace Elem Res; 32: 421-417.
Galan P., Yoon H.C., Preziosi P., Viteri F.E., Valeix
P., Fieux B., Briancon S., Malvy D., Roussel A.M., Favier A., Hercberg S.,
(1998). Determining factors in the iron status of adult women in the
SU.VI.MAX study. Supplémentation en vitamines et minéraux
antioxydants. Eur J Clin Nutr; 52:383-388.
Gadowsky S., Gale k., Wolfe S.A., Jory J., Gibson R.,
O'Connor D.L., (1995). Biochemical folate, Vitamin B12, and
iron status of a group of pregnant adolescents accessed through the public
health system in southern Ontario. J Adolesc Health; 16 (6):
465-74.
Geelhoed D., Agadzi F.,
Visser L., Ablordeppey E., Asare
K., O'Rourke P., van Leeuwen J.S.,
van Roosmalen J. (2006). Severe anemia in
pregnancy in rural Ghana: a case-control study of causes and management.
Acta Obstet Gynecol Scand ; 85(10):1165-71.
Genetet B., (1989). Hématologie.
Technique et documentation. 6e édition Masson, Paris,
98-124.
Gibson R.S., (1990). Principles of
nutritional assessment. Oxford University Press, New York, Oxford; 5-12.
Gneissler P.W., Shulman C.E., Prince R.J., Mutemi W.,
Mnazi C., Friisis H., Lowe B., (1998). Geophagy, iron status and
anemia among pregnant women on the coast of Kenya. Trans R Soc Trop Med
Hyg; 92, 549-553.
Goodlin R.C., Dobry C.A., Anderson J.C., Woods
R.E., Quaife M., (1983). Clinical
signs of maternal plasma volume expansion during pregnancy. J Obstet
Gynecol; 145: 1001-7.
Guindi W.E., Pronost J., Carles G., Largeaud M., Gareh
N.E., Montoya Y., Arbeille P., (2004). Anémie
maternelles sévères et issues de grossesse. J Gynocol Obstet
Biol Reprod; 33: 506-509.
Graitcer P., GodIsby B., Nichaman M.Z.,
(1981). Hemoglobins and hematocrits: are they equally sensitive in
detecting anemias? Am J Clin Nutr; 34 : 61-64.
Hallberg L., Brune M., Rossander-Hultén L.,
(1989). Iron absorption in man : ascorbic acid and dose-dependent
inhibition by phytatsb. Am J Clin Nutr; 49: 140-144.
Hazell T., Ledward D.A., Neale R.I., (1982).
Hemoglobin and meat iron absorption [letter]. Am
J Clin Nutr; 36 (1): 187-9.
Hazell T., Ledward D.A., Neale M., (1978).
Iron availability from meat. Br J Nutr; 39
(3): 631-8.
Hercberg S., (1988). La carence en fer et la
nutrition humaine. Paris: Editions médicales internationales ;
66-97.
Hercberg S., (1990). La carence en fer en
nutrition humaine : un problème d'actualité dans le
monde. Dans Hercberg S. et Galan P. Aspects actuels des
carences en fer et en folates dans le monde. Colloque INSERM; 197: 7-16
Hercberg S, Galan P, (1985). Assement of iron
deficiency in population. Rev Epidem et Santé Pub;
33:228-239
Hercberg S., Galan P., Prual A., Preziosi P.,
(1998). Epidémiologie de la déficience en fer et de
l'anémie ferriprive dans la population française. Ann Biol
Clin-Paris; 56: s49-52
Hercberg S., Rouaud C., (1981). Le
métabolisme du fer. Cah Nutr Diet; 16: 189-95
Howell C.D., (1998). Méthodes
statistiques en sciences humaines. Québec : Edition Deboek;
14-27
Huddle J.M., Gibson R.S., Cullinan T.R.,
(1999). The impact of malaria infection and diet on the anaemia status
of rural pregnant Malawian women. Eur J Clin Nutr; 53 (10):
792-801
Hyder S.M., Persson L.A., Chowdhury M., Lonnerdal
B.O., Ekstrom E.C., (2004). Anaemia and iron deficiency during
pregnancy in rural Bangladesh. Health Nutr; 7 (8): 1065-70
Hytten F., (1985). Blood volume changes in
normal pregnancy. Clin Haematol; 14: 601-12
Iannotti L.L., O'Brien K.O., Chang S-C., Mancini J.,
Schulman-Nathanson M., Liu S., Harris Z.L., Witter R.F., (2005).
Iron deficiency anemia and depleted body iron reserves are prevalent
among pregnant African-American adolescents. J Nutr; 135:
2572-2577.
Ihaka R., Gentleman R., (1996). R: a language
for data analysis and graphics. J comput graphi statistics; 5:
299-314
Institute of Medicine (I.O.M./U.S.A), (1990).
Comitte on nutritional status during pregnancy and lactation.
Nutrition during pregnancy: Weight gain and nutrient supplements. Washington
DC. National Academy Press.
Isah H.S., Fleming A.F., Ujah I.A., Ekwempu C.C.,
(1985). Anaemia and iron status of pregnant and non-pregnant women in
the guinea savanna of Nigeria. Ann Trop Med Parasitol; 79:485-93.
Johnson J.W., Laugrnate J.A., Frentzen B.,
(1992). Excessive maternal weight and pregnancy outcome.
Am J Obstet Gynecol; 167(2): 353-70.
Kaufer M., Casanueva E., (1990). Relation of
pregnancy serum ferritin levels to hemoglobin levels throughought pregnancy.
Eur J Clin Nutr; 44 (10): 709-15.
Khan K.S., Wojdyla D., Say L., Gulmezoglu A.M., Van
Look P.F. (2006). WHO, analysis of causes of maternal death: a
systematic review. Lancet; 367: 1066-1074.
Khosrof-Ben J.S., Najoua G., Fazaa S.E.L.,
Chiraz B., Farhat A., Cherif S., Samira H.,
Abdelaziz K., (2004). L'anémie ferriprive et le statut
proteino-énergétique chez la femme de 15 à 49 ans en
Tunisie. Rev Tun Biol ; 82 (3) : 263-270
King J.C., (2000) Physiology of pregnancy and
nutrient metabolism. Am J Clin Nutr 71;1218S-12125S.
King J.C, (2003). The risk of maternal
nutritional depletion and poor outcomes increases in early or closely spaced
pregnancies. J Nutr; 133: 1732S-1736S.
Knight E.M., Spurlock B.G., Edwards C.H., Johnson
A.A., Oyemade U.J., Cole O.J., West W.L., Manning M., James H., Laryea H.,
Westney O.E., Jones S., Westney L.S., (1994). Biochemical profile of
african american women during trimesters of pregnancy and at delivery. J
Nutr; 124: 53S-943S
Lee J-I., Kang S.A., Soon-Ki K., Hyeon-Sook L.,
(2002). A cross sectional study of maternal iron status of Korean
women during pregnancy. Nutr Res; 22: 1377-1388
Liao Q.K., (2004).
Prevalence of iron deficiency in pregnant and premenopausal women in
China: a nationwide epidemiological survey. Zhonghua Xue Ye Xue Za
Zhi; 25 (11): 653-7
Lipschitz D.A., Cook I.D., Finch C.A., (1974).
A clinical evaluation of serum ferritin as an index
of iron stores. N Eng J Med; 290: 12 13-6.
Makoutode M., Agboton M.A., Zoumenou E., Mouendo M.,
Paraiso N., Kiniffo I.R., (2004). Prévalence de l'anémie
chez la femme enceinte à porto-Novozon III au Bénin.
Méd Afr Noire ; 51 (1) : 487-498.
Makrides M., Crowther C.A., Gibson R.A., Skeaff
C.M., (2003). Efficacy and tolerability of low-dose
iron supplements during pregnancy: a randomized controlled trial. Am J Clin
Nutr; 78: 145-53
Martí-Carvajal A., Peña-Martí G.,
Comunian G., Muñoz S., (2002). Prevalence of anemia during
pregnancy: results of Valencia (Venezuela) anemia during pregnancy study.
Arch Latinoam Nutr ; 52(1): 5-11.
Massawe S.N., Urassa E., Lindmark G., Möller B.,
Nyström L., (1996). Anaemia in pregnancy: a major health problem
with implications for maternal health care. Afr J Health
Sci;3:126-132.
Massawe S.N., Urassa E.N.J., Mmari M., Ronquist G.,
Lindmark G., Nyström L., (1999). The complexity of pregnancy
anemia in Dar es Salaam. Gynaecol Obstet Invest; 47:76-82.
Massawe S.N., Urassa E.N., Nyström L., Lindmark
G., (1999). Anaemia a chronic health problem in women of reproductive
age in Dar es Salaam. Acta Obstet Gynecol Scand;78 :573-579.
Massawe S.N., Ronquist G., Nyström L., Lindmark
G., (2002). Iron status and iron deficiency anaemia in adolescents in
a Tanzanian suburban area. Gynecol Obstetric Invest; 54: 137-144.
Massot C., Vanderpas J., (2003). A survey of
iron deficiency anaemia during pregnancy in Belgium: analysis of routine
hospital laboratory data in Mons. Acta Clin Belg; 58(3):169-77.
Meda N., Mandelbrot L., Cartoux M., Dao B., Ouangre
A., Dabis F., (2000). Anémie de grossesse au Burkina Faso
(Afrique de l'Ouest), 1995-1996 : Prévalence et facteurs
associés. B World Health Organ; 77 (11): 916-922.
Meda N., Cousens S., Kanki B., (1996).
Anaemia among women of reproductive age in Burkina Faso. World Health
Forum;17:369-72.
Monsen E.R, Hallberg L., Layrisse M., Hegsted D.M.,
Cook J.D., Mertz W., Finch C.A., (1978). Estimation of available
dietary iron. Am J Clin Nutr; 31:
134-141.
Moran H.V., (2007a). Nutritional status in
pregnant adolescents: a systematic review of biochemical markers Matern
Child Nutr; 3 (2) : 74-93.
Moran H.V., (2007b) A
systematic review of dietary assessments of pregnant adolescents in
industrialised countries. Brit J Nutr; 97: 411-425.
Morgan G.A., Vaske J.J., Gliner J.A., Harmon R.,
(2003). Logistic regression and discriminant analysis: Use and
interpretation. Am J Child Adolest Psychiat; 42 (8): 994-997
Msolla M.J., Kinabo J.L., (1997). Prevalence
of anemia in pregnant women during the last trimester. Int J Food Sci
Nutr; 48:265-270
Moulessehoul S., Demmoulh A., Chafi Y., Benali M.,
(2004). Impact de la supplémentation en fer chez des femmes
enceintes au centre de protection maternelle et infantile de Sidi Bel
Abbèss (Ouest Algérien). Cah études Rech Fr
Santé ; 14 (1) : 21-9
Nayama M., Garba D-K. M., Idi N., Marafa A., Diallo
F.Z., Toure A., Djibril B., Illa-Souley A., (2006). Mortalité
maternelle au niveau d'une maternité de référence du
Niger : Etude prospective à propos de 104 cas. Med Afr
Noire; 53 (12): 396-401.
Najman A., Verdy E., Potron G., Isnard F.,
(1994). Hématologie, Précis des maladies du sang.
In : RAIN JC. Métabolisme du fer, édition Ellipses
Paris, 88-95
Naeye R.L., (1981). Teenage and pre-teenaged
pregnancies: consequences of the fetal-maternal competition for nutrients.
Pediatrics; 67: 146-159.
Nicolas G, Vaulont S., (2002). L'hepcidine,
un contrôle essentiel de l'absorption du fer.
M/S ; (3) 18 : 270-271
Oguntona R.B.C., Akinyele O.I., (2002). Food
and nutrient intakes by pregnant Nigerian adolescents during the third
trimester. Nutr; 18: 673-679
Penali L.k., Broalet E.Y., Kone M., (1993).
Helminthiases et protozooses intestinales de la femme enceinte en cote
d'ivoire. Med Afr Noire ; 40 (5) : 451-512
Preziosi P., Hercberg S., Galan P., Devanlay M.,
Cherouvrier F., Dupin H., (1994). Iron status of a healthy French
population: factors determining biochemical markers. Ann Nutr Metab;
38 (4): 192-202
Pirani B.B.K., Campbell D.M., MacGillivray L.,
(1973). Plasma volume in normal first pregnancy.
J Obstet Gynaecol Brit Cornmonw; 80: 884-887.
Puolakka J., (1990). Serum ferritin as a
mesure of iron stores in pregnancy. Acta Obstet Gynecol Scand ; 95:
63p.
Ramakrishnan U., Neufeld M.L., Gonzalez-Cossio T.,
Villalpando S., Garcia-Guerra A., Rivera J., Martorell R., (2004).
Multiple micronutrient supplements during pregnancy do not reduce
anemia or improve iron status compared to iron only supplements in semi rural
Mexcico. J Nutr; 134: 898-903
Ramon R., Sawadogo D., Koko F.S., Noba V., Likikouet
R., Gourvellee G., Viho I., Mandelbrot L., Dabis F., Ekra C.W., Msellati P.,
(1999). Haematological characteristics and HIV status of pregnant
women in Abidjan, Côte d'Ivoire, 1995-96. Trans Soc Trop Med; 93
(4): 22-412
Rasmussen M.K., Stoltzfus R., (2003). New
evidence that iron supplementation during pregnancy improves birth weight: new
scientific question. Am J Clin Nutr; 78: 673-674
Reifsnider E., Gill S.L., (2000) Nutrition
for the childbearing years. J Obstet Gynecol Neonatal Nurs; 29:
43-55.
Reinett M.P., (1988). Carence en fer et
immunité. Cah Nutr Diet; 13: 275-231
Rovinsky J.J., Joffin H., (1965).
Cardiovascular hemodynamics in pregnancy. Blood and plasma volumes in multiple
pregnancy. Am J Obstet Gynecol; 93: 1-13
Salas S.P., Rosso P., Espinoza R., Robert I.A.,
Valdés G., Donoso E., (1993). Maternal plasma volume expansion
and hormonal changes in women with idiopathic fetal growth retardation.
Obstet Gynecol; 8 1: 1029-33.
Sakandé J., Sawadogo D., Nacoulma E.W.C.,
Tiahou G., Gnagne A.C., Sess E.D., Sangaré A., Yapo A.E., (2004).
Métabolisme du fer et valeurs érythrocytaires du
nouveau-né Ivoirien: relation avec le statut en fer de la mère.
Cah études Rech Fr Santé ; 14 (1) : 17-20
Sess D.E., Tiahou G., Gnagne A.C., (1997).
Statut en fer, en folates et en vitamine B12 chez la femme
Ivoirienne en fin de grossesse. Comm. 1er congrès du
GRET-CI ; 31 p.
Scholl TO, Hediger M.L., (1994). Anernia and
iron deficiency anemia: compilation of data on pregnancy outcome. Am J Clin
Nutr; 59: 492s-50 IS.
Scholl T.O., Hediger M.L., Ances I.G.,
(1990). Maternal growth during pregnancy and decreased birth weight.
Am J Clin Nutr; 51: 790-793.
Scholl T.O., Hediger M.L., Schall J.I., Khoo C.S.,
Fischer R.L., (1994). Maternal growth during pregnancy and competition
for nutrients. Am J Clin Nutr; 60: 183-188.
Scholl T.O., Reilly T., (2000). Anemia, iron
and pregnancy outcome. J Nutr; 130: 443S-447S
Scholl T.O., Stein T.P., Smith W.K., (2000).
Leptin and maternal growth during adolescent pregnancy. Am J Clin
Nutr; 72: 1542-1547.
Scholl O.T., (2005). Iron status during
pregnancy: setting for mother and infant. Am J Nutr; 81: 1218S-22S.
Shills M.E., Olson I.A., Shike M., (1994).
Modern nutrition in health and disease. Eight edition. Lea and Febiger;
14-31.
Silbernage S., Despopouls A., (2001). Atlas
de poche de physiologie. Médecine-Sciences-Flammarion, 3 e
édition, Paris ; 88-92
Société de Nutrition et de
Diététique de Langue Française. Anémies
nutritionnelles (S.N.D.L.F.), (2001). Cah Nutr
Diét ; 36 (1) hors série : 76 - 81.
Statsoft, (2005). Statistica (Data Analysis
Software System). Version 7.1 available at www. Statsoft.com
Stoltzfus R.J., (2001). Defining Iron
deficiency Anemia in Public Health terms : A time for reflection. J
Nutr; 131:565S-567S.
Strand A., Chandyo R.K., Ulvik T.R.
J., Adhikari R.K., Ulak M., Dixit H., Sommerfelt H.,
(2007). Prevalence of iron deficiency and anemia among healthy women
of reproductive age in Bhaktapur, Nepal. Eur J Clin Nutr; 61: 262-269.
Tabachnick B.G., Fidell L.S., (2000). Using
multivariate statistics, fourth edition. United States of America: Allyn and
Bacon; 5-13
Taylor D.J., Lind T., (1979). Red cell mass
during and after normal pregnancy. Br J Obstet Gynaecol; 86:
364-70.
Thame M., Wilks R., Matadial L., Forrester T.E.,
(1999). A comparative study of pregnancy outcome in teenage girls and
mature women. W Indian Med J; 48: 69-72.
Toohey J.S., Keegan K.A., Morgan M.A., Francis J.,
Task S., DeVeciana M., (1995). The dangerous multipara: Fact or
function? Am J Obstet Gynecol; 172: 683-6.
Toure-Fall A.O., Gadji M., Diop S., Dieye T., Thiam
D., Diakhate L., (2004). Maternal anaemia: effect on the new born.
Dakar Med; 49 (3): 172-6
Turgeon O'Brien H., (1985b). Pouvoir
phagocytaire et bactéricide des polynucléaires neutrophiles d'un
groupe de sujets atteints d'anémie ferriprive ou d'anémie
inflammatoire. Méd Nutr; 12: 4 15-20
Turgeon O'Brien H., Hediger M.L., Scholl T.O.,
(1985a). Myeloperoxidase activity of polymorphonuclear leukocytes in
iron deficiency anemia of chronic disorders. Acta Haematol; 74: 15
1-4.
U.N.I.C.E.F./ W.H.O./U.N.U./M.I., (1998).
Preventing iron deficiency in women and children: technical consensus on key
issues and Ressources for programme advocacy, planning, and implementation. New
York: Unicef
U.N.I.C.E.F./W.H.O./U.N.U./M.I., (1999).
Preventing iron deficiency in women and children: Background and consensus on
key technical issues and resources for advocacy, planning and implementation
national programmes. International nutrition foundation Boston; MA.
U.N.I.C.E.F., (2001) A League Table of
Teenage Births in Rich Nations. Innocenti Report Card No. 3, UNICEF
Innocenti Research Centre, Florence. Available at: http://
www.unicef-cdc.org/publications/index.html (accessed 10 July 2006)
U.N.I.C.E.F./U.N.U./W.H.O., (2001). Iron
deficiency anemia: assessment, prevention, and control. WHO/ NHD/01.3 Geneva,
Switzerland: WHO.
http://www.who.int/nut/documents/ida_assessment_prevention_control.pdf.
U.N.I.C.E.F./U.N.U./W.H.O., (2005).
Déclaration conjointe de l'Organisation Mondiale de la Santé et
du Fonds de Nations Unies pour l'Enfance : Focaliser sur
l'anémie ; vers une approche intégrée pour un
contrôle efficace de l'anémie: Available at:
http :/www.who.org/publications/index.html (accessed 5 april 2005)
Vander A., Sherma J., Luciano D., (2001).
Human physiology, the mechanism of body function. Mc Graw Hill
8e edition, 375-381
Vanderjagt D.J., Brock
H.S., Melah G.S., El-Nafaty
A.U., Crossey M.J., Glew R.H.,
(2007). Nutritional factors associated with anaemia in pregnant women
in northern Nigeria. J Health Popul Nutr; 25: 75-81.
Vernet-Nyssen M., (1981). Recent findings
concerning serum iron, the iron binding capacity of serum, and transferrin
saturation suggested terminology. Ann Biol Clin-Paris; 39 (5): 301-7
Vernet M., Corberand J., David V., Deugnier Y., Frey
J., Giraudet P., Renversez J-C., Sebahoun G., (2001). Algorithmes de
prescription recommandés pour le diagnostic d'un déficit et d'une
surcharge en fer. Ann Biol Clin-Paris ; 59 (2) : 55-149
Viatte L., Vaulont S., (2006).
Prévenir et guérir les surcharges en fer, les espoirs de
l'hepcidine. M/S ; 22 (8) : 696-698.
Viteri F.E., (1997b). Iron supplementation
for the control of iron deficiency in populations at risk. Nutr Rev;
55:195-209.
Wagner A., (2000). Le rôle du
laboratoire dans l'exploratoire du métabolisme du fer. Rev
ACOMEN; 6 (1) :23-27
Wajcman H., Lantz B., Girot R., (1992). Les
maladies du globule rouge. Paris, INSERM,
Médecine-Sciences, 81-456
Walter T., de Andraca I., Chadud P., Perales C.G.,
(1989). Iron deficiency anemia:adverse effects on Infant Psychomotor
Developement. Pediatrics ; 84 (1):7-l7.
Warren G., Thornpson M.D., (1988).
Comparition of tests for diagnosis of iron depletion in pregnancy. Am J
Obstet Gynecol; 159 (1): 132-4.
WiIliarns M.D., Wheby M.S., (1992). Anemia in
pregnancy. Med Clin N Am; 76 (3): 63 1-47.
Williams W.J., (1983). Examination of blood.
In: Hematology. Williams WJ, Beutler E, Erslev AJ, Lichtman
MA. Ed., McGraw-Hill, New York, 3rd edition; 9 p.
Wintrobe M.M.. (1981). Clinical
hematology. 8th edition, Philadelphia, PA: Lea and
Fediger 53 p.
Withney E.N., Rolfes S.R., (1993).
Understanding Nutrition. West Publishing Company. Sixth edition. 85 p.
Wolramarans P., Dhansay M.A., Mansvelt E.P., Laubscher
J.A., Benade A.J., (2003). Iron status of South Africa women working
in fruit-packing factory. Public Healh Nutr; 6 (5): 45-439
Yip R., Dallman P., (1988). The roles of
inflammation and iron deficiency as causes of anemia. Am J Clin Nutr;
48: 1295-300.
Zucherman B.S., Walker D.K. Frank D.A., Chase C.,
Harnburg B., (1984). Adolescent pregnancy: biohevioral
determinants of outcorne. J Pediatr; 105: 857-63.
|
|



