EPIGRAPHE
Recommande à Dieu tes oeuvres, Et tes projets
réussiront.
Proverbes 16 :3
DEDICACE
A mes respectueux parents, BAKULU MUSEMA et
Espérance VUMILIA BYAKASI ;
A mes estimés frères et Soeurs ;
A mes intimes amies et amis ;
C'est avec émotion profonde et sans cesse que je vous
dédie ce mémoire.
REMERCIEMENTS
Plus par conviction personnelle que par l'esprit de
conformisme, nous saisissons cette précieuse opportunité pour
exprimer notre profonde gratitude aux personnes qui ont contribué
à notre formation et à la réalisation du présent
travail.
Chef de Travaux Fabrice MUVUNDJA AMISI, vous
avez dirigé ce travail avec bienveillance malgré vos multiples
obligations. Grâce à vos efforts et remarques pertinents, ce
travail a pu voir le jour. Votre disponibilité et dévouement nous
ont permis de travailler dans un climat de confiance et d'harmonie. Cher
Directeur, nous vous prions de trouver ici notre profonde reconnaissance et
vous souhaitons plein succès dans vos recherches doctorales.
Tous mes vifs remerciements vont à l'Assistant de
Recherche Georges LUFUNGULA qui, sans tenir compte d'autres
occupations qu'il avait, nous a accompagné durant la récolte et
l'analyse des échantillons au laboratoire.
Nous ne pouvons pas nous passer de remercier les laborantins
BAREGE et Papa KITOKO qui ne nous avaient
jamais résisté de nous servir du matériel de leurs
laboratoires toutes les fois que nous en avions besoin.
Nous pensons aussi à l'Assistant
BASHAMUKA et au camarade BALOL'EBWAMI avec qui il
nous fallait passer plus de 72h au labo en se privant du droit de
sommeiller.
Durant ce moment le plus difficile de notre parcours
académique, nous avons reçu de message d'encouragement de la part
du Professeur BASHWIRA,
d'Elisée BULONZA, du Professeur
BAPOLISI, de Freddy KAHIMANO, de l'Honorable
MWAMI NTAMBUKA, des frères et soeurs de l'Aumônerie
Protestante de l'ISP Bukavu en l'occurrence Pépin MUGISHO,
NYAKASANE, ...
Nous remercions vivement tous les enseignants de l'ISP ayant
concourus à notre formation et en particulier ceux du département
de chimie ; nous vous serons toujours reconnaissants pour vos efforts qui
n'ont pas été vains.
Nous ne manquerons pas de citer les Eminents scientifiques
nous ayant marqués et inspirés par leur manière et
connaissances tout au long de notre formation universitaire : Le
Professeur KAPAJIKA, Le Professeur Pius MPIANA, Le Professeur BASHWIRA, Le
Docteur Martial KANYONYO, Le CT MUVUNDJA, Le CT Maman WIMBA et Le CT
MUSAFIRI.
Durant notre formation, nous avons
bénéficié du soutien tant moral que matériel de nos
parents, de Maman Rahel KASSA, Maman July,
Maman ZAWA, Maman Josée KININGA, Papa SADIKI,
Elisée BULONZA NDAKALALWA, Akili KINABO,
M.M. Mathos, Chance IRAGI,
BYAMUNGU MUSEMA et, de tant d'autres à qui nous
demandons de considérer notre expression de profonde reconnaissance en
leur égard.
Que dirions-nous de Askofu DIDO
MUTUNWA KASAMBI et MUHINDO RUSANGIZA
Gédéon ; camarades et compagnons de lutte depuis la
L1 ? Vos efforts n'ont pas été vains.
Que mes reconnaissances aillent directement auprès de
vous mes Soeurs Nadia MAOMBI et Rachel N'SIMIRE
pour votre amour fraternel manifesté envers moi durant tous les
5 ans que j'ai passé aux études universitaires.
Du fond du coeur, nous disons grand merci à tous ceux
qui de près ou de loin ont contribué à notre
édification.
Que Dieu vous bénisse !
LISTE DES TABLEAUX
Tableau 1. Caractéristiques limnologiques du
lac Kivu
3
Tableau 2. concentrations des ions majeurs dans les
eaux de surface du lac Kivu (Modifié à partir de Pasche et al.,
2011).
3
Tableau 3. Apports en nutriments dans
l'épilimnion du lac Kivu (Modifié à partir de Muvundja et
al., 2009).
3
Tableau 4. Physico-chimie des rivières du
bassin de Bukavu (Modifié à partir de Muvundja, 2010)
3
Tableau 5. Concentration moyenne en nutriments des
rivières du bassin de Bukavu (Modifié à partir de
Muvundja, 2010)
3
LISTE DES FIGURES
Figure 1. Profil vertical de température(T),
salinité (S) et des gaz dissous dans le lac Kivu en Février 2OO4
(Modifié à partir de Schmid et al., 2005).
3
Figure 2. Carte géographique du lac Kivu
(ISUMBISHO et al., 2006 à gauche et
http://mhalb.pagesperso_oragngr.fr/kivu/fr/ki_1c_structure.htm à droite)
et sites d'échantillonnage
3
Figure 3. Paramètres limnologiques de la
colonne d'eau du lac Kivu à Ishungu durant la saison sèche et la
saison de pluie en 2003 et en 2004 (Isumbisho et al., 2006)
3
Figure 4. Origine du méthane du lac Kivu
(Tietze et al., 1974 et 1975)
3
Figure 5. Structures de la chlorophylle a à
gauche et de la chlorophylle b à droite.
3
Figure 6. Evolution des concentrations de
différentes pigments sédimentaires de la carotte de
sédiment (Kivu 09-4/Kibuye). La détermination des zones se basent
sur l'analyse de groupement des assemblages de diatomées (Knops, 2010).
3
Figure 7. Photos du carotteur utilisé (Modifie
à partir de Knops 2009).
3
Figure 8. Profils des paramètres
physico-chimiques réalisés dans le bassin de Bukavu (DO (mg/l)
à gauche, pH au centre et la température (°C) à
droite).
3
Figure 9. Profils des paramètres
physico-chimiques réalisés dans le bassin de Bukavu (DO (mg/l)
à gauche, pH au centre et la température (°C) à
droite).
3
Figure 10 : Concentrations en Phosphore total
(mgTP.g-1de sédiment) en fonction de la profondeur (cm) dans
la carotte d'Ishungu (à gauche) et dans la carotte de Bukavu (à
droite).
3
Figure 11 : Concentrations (mgTN.g-1)
de TN en fonction de la profondeur (cm) dans la carotte d'Ishungu (à
gauche) et dans la carotte de Bukavu (à droite).
3
Figure 12. Rapports molaires TN :TP dans le
bassin d'Ishungu (à gauche et de Bukavu (à droite).
3
Figure 13. Concentrations de la chlorophylle a (en
ug/g de sédiment) en fonction de la profondeur (cm) dans la carotte
d'Ishungu à gauche et de Bukavu à droite
3
Figure 14. Concentration des phéopigments (en
ug/g de sédiment) dans la carotte d'Ishungu (à gauche) et de
Bukavu (à droite).
3
GLOSSAIRE
Av. JC : Avant Jésus-Christ
Chl.a : Chlorophylle a
COT ou TOC : Carbone Organique Total
DIN : Azote Organique Dissous
DO : Oxygène dissous
Er : Erreur relative
HAP : Hydrocarbures Aromatiques Polycycliques
MES : Matières en Suspension
Phéo.a : Phéopigments a
RDC : République Démocratique du Congo
Séd. : Sédiment
SPR : Phosphore Réactionnel Soluble
SRSi : Silicium Réactionnel Soluble
T : Température
TN : Azote Total
TP : Phosphore Total
RESUME
En date du 1er au 22 août 2012, des carottes
à sédiments étaient respectivement
échantillonnées dans les bassins d'Ishungu et de Bukavu en vue de
la comparaison de leur composition chimique (nutriments et pigments totaux).
Les profils de paramètres physico-chimiques montrent
que dans les 65 premiers mètres de la colonne d'eau, le DO, le pH et la
T diminuent progressivement avec la profondeur dans le bassin d'Ishungu avec
des valeurs respectives en surface de 5,02 mg/l ; 9,19 et 23,3°C.
Dans celui de Bukavu par contre, ces paramètres diminuent aussi avec la
profondeur avec des valeurs maximales de 6,29 mg/l de DO ; 9, 43 de pH et
23,74 pour la température en surface de la colonne d'eau.
Les bassins de Bukavu et d'Ishungu étant
limnologiquement différents, les résultats montrent que le bassin
de Bukavu est très riche en P avec une valeur moyenne de 29,066 mgP/g de
séd. par rapport au bassin d'Ishungu où la valeur moyenne est de
2,062 mgP/g de séd.
Le TN par contre montre une augmentation de déposition
qui se fait remarquer en général de bas en haut. Les
sédiments récents sont ainsi plus riche en N que les
sédiments plus anciens.
La moyenne du rapport TN :TP de la baie de Bukavu s'est
montrée supérieure d'un facteur 3 par rapport à celle
d'Ishungu.
La chlorophylle a, dans les deux bassins, semble
évoluer de la même façon si on considère uniquement
les 13 premiers centimètres de chaque carotte. Les valeurs moyennes
étant 4,281 et 4,90 ug/g de séd., respectivement à Ishungu
et à Bukavu. La variation observée dans le profil de
phéoigments reflète l'effet des changements occasionnés
dans la chaine trophique par l'introduction du Limnothrissa miodon.
Les majeures modifications observées dans le recyclage
des nutriments du lac Kivu peuvent être expliquées par un ou
l'ensemble de 3 changements environnementaux survenus sur le lac Kivu :
l'introduction de Limnothrissa miodon, la forte anthropisation de la
partie sud du bassin versant et les changements hydrologiques dans le bassin
versant.
ABSTRACT
On the 1st an 22nd august 2012, sediment
cores were sampled in Ishungu an Bukavu basins so as to compare the nutrient
and pigment composition in both Bukavu an d ishungu basins.
Above 65 m of the water column, the DO, pH and T decrease with
depth in Ishungu basin, the values are respectively 5.02 mg/l; 9.19 and
23.3°C. while in Bukavu basin, the profiles show decreasing tends also
with depth, high values are 6.29 mg/l for DO; 9.43 for the pH and 23.74 for the
t at the top of the water column.
As far as limnological profiles are concerned, Bukavu and
Ishungu basins are different. Referring to the results, the Bukavu sedimentary
basin is high in TP concentrations. The average value is 29.066 mgTP/g of sed.
for Bukavu basin while it's 2.062 mgTP/g of sed. For Ishungu basin.
About TN, the concentration increases upward to the sediment
core. The latest sediments are less concentrated than the recent ones.
The average molar ratio TN:TP of Bukavu basin is higher for 3
times than at Ishungu.
In both basins, chl.a varies equally if considering only the
first 13 centimeters of each basin. The average is 4.281 and 4.90 ug/g of sed.
in Ishungu and Bukavu basins respectively.
The major modifications in the nutrients cycling in Ishungu
and Bukavu basins as well as the rest of the catchment might be explained by
one or a combination of three environmental changes occurred in the Lake : the
introduction of Limnothrissa miodon, an increase nutrients inputs due
to the fast-growing population in the southern part of the catchment and
increased upwelling due to high rainfall.
INTRODUCTION GENERALE
Le lac Kivu est l'un des 4 grands lacs de la branche
occidentale du rift Est Africain. Actuellement, il est relié au lac
Tanganyika par la Ruzizi, après avoir été forcée,
à changer de direction de son écoulement par les éruptions
volcaniques des volcans de la chaine de Virunga. Ainsi, sa connexion avec les
autres lacs du nord fut totalement coupée et ses eaux furent
retranchées du bassin du Nil pour le bassin du Congo (Beadle, 1981).
Il est situé à 1463 m d'altitude entre
1°34' et 2°30' de latitude sud. D'ouest à l'Est, il est
compris entre 28°50' et 29°25' de longitude Est (Capart, 1960) en
frontière entre la République Démocratique du Congo et la
République du Rwanda.
Le lac Kivu est différent des autres lacs africains par
son origine tecto-volcanique, son altitude, sa morphologie et sa permanente
stratification due à ses propriétés physico-chimiques
(Degens et al., 1973).
Le socle précambrien est couvert sous le lac Kivu par
plus de 500 mètres de sédiments dans la partie profonde (environ
485 m) septentrionale du lac, suggérant ainsi un âge plus
avancé (pliocène si on tient compte de la vitesse de
sédimentation estimée à 30 cm pour 1000 ans) (Degens et
al. 1974, Hamilton, 1982).
Le mélange des eaux ne concerne que les premiers 60 m
des eaux du lac ; sauf dans les baies peu profondes telles que la baie de
Bukavu. C'est donc un lac méromictique. Il présente une teneur
élevée en sels dissous qui se manifestent par une
conductivité élevée, une stratification thermique
verticale des eaux et la présence d'importantes quantités de gaz
méthane qui étaient estimées à 60 milliards de
m3 contre 300 milliards de m3 de dioxyde de carbone en
1978 (Fig. 1) (Tietze, 1978 ).
La température de l'eau du lac Kivu diminue au fur et
à mesure qu'on descend en profondeur (jusqu'à environ 100 m).
Cette diminution de la température avec la profondeur dépend des
mouvements de mélange de l'eau du lac lié à
l'intensité du vent. Les profils verticaux de la température
permettent de déterminer la profondeur de la zone de mélange. La
Figure 1 montre qu'à partir de 100 m, le lac Kivu présente une
thermocline dans laquelle ; la température et la salinité
augmentent avec la profondeur (Degens et al. 1973, Schmid et al. 2005). La
cendre volcanique y est détectée entre 75 et 78 cm des
carottes.
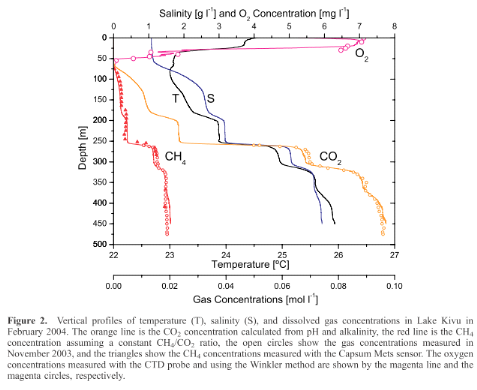
251671552Les eaux profondes du lac Kivu contiennent une
quantité considérable dissoute de CO2 et de
CH4 (Schmid et al., 2005, Fig.1). Des récentes études
montrent que la concentration du lac Kivu en CH4 a augmenté
de 15% de plus qu'il y a 30 ans (Schmid et al., 2005) et que cette accumulation
peut conduire à une catastrophe liée à l'éruption
de gaz aux environs des années 2100 (Pasche et al., 2010). Et selon les
estimations de la production du CH4, la concentration de ce gaz en
eaux profondes du lac va approcher la saturation au courant de ce
siècle, car présentement le CH4 cause environ 80% de
la pression des gaz dans ce lac (Schmid et al., 2005).
Figure
1. Profil vertical de température(T), salinité (S) et des gaz
dissous dans le lac Kivu en Février 2OO4 (Modifié à partir
de Schmid et al., 2005).
Le lac Kivu connait un gradient des températures tel
qu'en dessous de 100 m, la température croit avec la profondeur (Degens
et al., 1973). Ce lac volcanique est stratifié et sans oxygène
dans ses eaux profondes (Damas, 1937). Une concentration en P et un rapport
Ca:Na élevés ont été signalés par Schmid et
al. (2005) dans les eaux profondes du lac Kivu, ce qui indique une production
accrue en sédiments. La récente augmentation de la
quantité de CH4 dans le lac Kivu (Schmid et al., 2005) est
considérée comme fonction de la disponibilité des
nutriments.
Une quantité de matières organiques est
certainement déposée par sédimentation depuis la zone
oxique dans les eaux profondes (Boltz et al., 1988) où elles sont
dégradées en méthane par les bactéries
méthanogéniques (Schoell et al., 1988). Selon Hecky et al.
(1996), les sédiments des lacs africains constituent une importante
source qui renseigne sur leur production primaire et sur leur biomasse
algale.
Comme tous les autres lacs africains, le lac Kivu peut
probablement être vulnérable des activités humaines ;
tel est le cas du lac Victoria où l'agriculture et la
déforestation ont causé une augmentation des concentrations en
nutriments et l'eutrophisation (Hecky, 1993).
Les vastes plans d'eau superficiels comme les lacs surtout
les moins profonds sont très sensibles et réagissent
immédiatement aux changements environnementaux (climat, hydrologie,
pollution, activités anthropiques) (Perga, 1901 ; Matzinger et al.,
2006 ; Descy et Sarmento 2008).
Les lacs étant relativement fermés, ils sont
vulnérables à certaines espèces invasives quand elles y
ont été introduites (volontairement ou non). Ils sont
également pour cette raison plus sensibles à certains
micro-polluants (médicaments, antibiotiques, biocides, pesticides,
perturbateurs endocriniens, ...) qui peuvent s'y accumuler ou se
dégrader à une vitesse différente que dans les cours d'eau
(Papon, 2007).
Dans le but d'exploiter le milieu pélagique du lac
Kivu, Collart y a introduit en 1959, un poison pélagique et
planctonophage du lac Tanganyika, le Limnothrissa miodon (Collart,
1960 ; cité par NZAYISENGA, 2007). Après analyse des
échantillons de 1984, Dumont (1986) a rapporté d'importantes
perturbations écologiques et parle d'un « désastre
écologique » car la plus grande espèce brouteuse de
Zooplancton à savoir la daphnie avait été
considérée comme ayant disparu (Isumbisho et al., 2006 ;
Nzayisenga, 2007).
L'introduction des nouvelles espèces perturbant
l'écosystème, les facteurs environnementaux conditionnent la
limnologie physique et chimique d'un écosystème lacustre et
certainement la qualité des sédiments aussi. Cependant, la
différence entre la limnologie de différents bassins d'un
même lac doit également avoir des répercussions sur la
qualité des sédiments qui constituent des importantes archives
pour les études paléolimnologiques.
Dans cette étude nous nous intéressons a
comparer les profils en nutriments (TN et TP) ainsi que les concentrations en
pigments totaux (Chl.a et phéo.a) dans les carottes à
sédiments du bassin d'Ishungu (assez profond, interface
eau-sédiment anoxique) et du bassin de Bukavu (peu profond, interface
eau-sédiment oxique) afin de contribuer à l'évaluation de
la différence entre ces deux bassins par rapport au recyclage des
nutriments et de la matière organique.
0.1. OBJECTIFS
0.1.1. Objectif
général
L'objectif général de ce travail est de comparer
la qualité chimique des sédiments lacustres des bassins d'Ishungu
et de Bukavu afin d'en dégager l'influence des conditions limnologiques
et environnementales prédominantes.
0.1.2. Objectifs
spécifiques
Les objectifs spécifiques poursuivis par cette
étude consistent à comparer:
- Les profils des nutriments totaux (TP et TN) dans les
sédiments du bassin d'Ishungu et du bassin de Bukavu ;
- Les concentrations en pigments totaux (chlorophylle a et
phéopigments) dans ces sédiments.
0.2. Question de
recherche
Le bassin d'Ishungu et le bassin de Bukavu sont deux bassins
limnologiquement différents. Pendant certaines périodes telle que
la saison sèche, les eaux se mélangent jusqu'en profondeur dans
le bassin de Bukavu (Kaningini et al. 1999) ; ce qui n'est pas le cas pour
le bassin d'Ishungu.
Cette étude vise à répondre à la
question de savoir si les conditions limnologiques différentes ainsi que
les différences environnementales immédiates de ces deux bassins
pourraient avoir des incidences sur la composition chimique de leurs
sédiments respectifs.
0.3. Justification
Cette étude contribuera à comprendre l'impact
des conditions limnologiques et environnementales sur la qualité
chimique des sédiments par rapport à la séquestration des
nutriments et de la biomasse algale morte.
0.4. Subdivision du
travail
En plus de l'introduction et de la conclusion, cette recherche
s'articule sur trois chapitres à savoir :
1. La revue de la littérature sur cette
étude ;
2. Les méthodes et matériels utilisés
pour l'atteinte de nos objectifs ;
3. Les résultats et leur interprétation.
Chapitre I. REVUE DE LA
LITTERATURE
1.1. PRESENTATION ET
ORIGINE DU LAC KIVU
Le lac Kivu est situé à la frontière
entre le Rwanda et la République démocratique du Congo et
atteint une profondeur maximale de ~500 mètres et une superficie de
2370 km2. Quelques 300 milliards de mètres cubes de dioxyde
de carbone et 60 milliards de mètres cubes de méthane sont
dissous dans ses eaux rendant le lac potentiellement dangereux car susceptible
de connaitre des éruptions de gaz à l'instar de deux lacs
camerounais (Nyos et Monoun) (Kling et al. 1987 ; Kling et al. 2006). Ces
dernières années, des chercheurs suisses ont rapporté une
augmentation d'environ 15% de la concentration en méthane de telle
manière que les concentrations en gaz du lac approcheraient la
saturation (Schmid et al. 2004).
251648000

251646976Le lac Kivu forme une grande partie de la
frontière naturelle entre le Rwanda et la RDC. La zone littorale est
très réduite par rapport au milieu pélagique qui couvre
90% de la surface du lac et qui s'étend jusqu'à proximité
des rives (Beadle, 1981). A l'extrémité sud du bassin de Bukavu
se forme la rivière Ruzizi, exutoire qui déverse les eaux du lac
Kivu dans le lac Tanganyika

251645952
251643904

251644928
Figure 2. Carte
géographique du lac Kivu (ISUMBISHO et al., 2006 à gauche et
http://mhalb.pagesperso_oragngr.fr/kivu/fr/ki_1c_structure.htm
à droite) et sites d'échantillonnage.
1.2. CARACTERISTIQUES
LIMNOLOGIQUES DU LAC KIVU
Le tableau 1 présente les principales
caractéristiques limnologiques du lac Kivu.
Dans le lac Kivu, le mélange des eaux ne concerne
qu'une couche superficielle limitée. C'est donc un lac
méromictique. Il présente une teneur élevée en sels
dissous qui se manifestent par une conductivité élevée,
une stratification thermique verticale des eaux et la présence
d'importantes quantités de gaz méthane qui était
estimées à 60 milliards de m3 en 1978 (Tietze, 1978).
Il présente des eaux profondes dépourvues d'oxygène
surmontées par une « biozone »
oxygénée comme l'indique la figure 1.
La température des eaux de surface varie très
peu au cours de l'année. Elle oscille entre 23,1°C et 24,5°C
(moyenne de 23°C). Le profil thermique est uniforme dans les
différentes couches d'eau. La température décroit de la
surface jusqu'à environ 50m et puis s'élève à
nouveau dans l'hypolimnion pour atteindre 25°C à 400m (Kaningini,
1995) et parfois 26°C au point le plus profond du lac.
Tableau 1. Caractéristiques limnologiques du lac Kivu
|
Paramètre
|
Valeur
|
|
Altitude (m)(1)
|
1463
|
|
Longueur (km)(2)
|
100
|
|
Largeur maximale (km)(1)
|
45
|
|
Profondeur maximale (m)(1)
|
485
|
|
Profondeur moyenne (m)(1)
|
245
|
|
Surface (km2) (excluant les
îles)(2)
|
2370
|
|
Volume (km3)(1)
|
580
|
|
Surface du bassin (km2) (moins le
lac)(1)
|
5100
|
|
Précipitation
(km3.année-1)(1)
|
3,3
|
|
Affluents
(km3.année-1)(2)
|
2,0
|
|
Evaporation
(km3.année-1)(2)
|
3,6
|
|
Exutoire
(km3.année-1)(2)
|
3,0
|
|
Température (°C)
épilim.(3)
|
23,0-24,5
|
|
pH(3)
|
9,1-9,5
|
|
Transparence (m)(3)
|
3,5-6,0
|
|
Limite oxygène (m)(3)
|
70
|
|
Conductivité
(us.cm-1)(3)
|
1240
|
|
Salinité
(g.L-1)(3)
|
1,115
|
(1)MUVUNDJA (2009) (2)SCHMID et al.
(2010) (3)KANINGINI (1995)
La répartition des propriétés physiques
(lumière, chaleur, densité, turbulence) et chimiques
(concentration en solutés) impose aux lacs une structure physique
très liée à leur morphologie et dont dépend
l'organisation des communautés biologiques (Guyard, 2010). C'est ainsi
que le lac Kivu étant méromictique, sa biozone s'étend au
maximum jusqu'à 70 m de profondeur au-delà de laquelle toute vie
aérobie est impossible. Seulement 12% de son volume total est habitable
par les poissons (Beadle, 1981 et Kaningini, 1995). Dans les lacs
méromictiques, la couche profonde, le monimolimnion, stagnant est vite
dépourvue d'oxygène et riche en espèces chimiques
réduites (Mn2+, NH4+, Fe2+,
H2S, voire CH4) (Guyard, 2010).
251649024
251650048
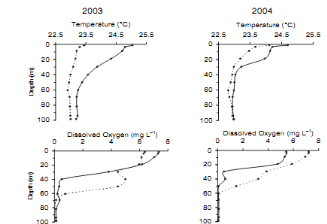
Figure
3. Paramètres limnologiques de la colonne d'eau du lac Kivu à
Ishungu durant la saison sèche et la saison de pluie en 2003 et en 2004
(Isumbisho et al., 2006)
Le lac Kivu se distingue par ses particularités
physico-chimiques notamment la teneur élevée en sels de 1.115 g/L
(Tableau 1), se manifestant par une conductivité élevée,
la stratification thermique des eaux (Figure 1) et la présence
d'importantes quantités de gaz dissous dans les eaux profondes
spécialement le CH4, le CO2 et le
H2S (Kaningini, 1995).
D'après Degens et al. (1973), les sels minéraux
proviennent surtout des sources hydrothermales qui émanent du fond du
lac et que les teneurs en gaz dissous dans l'eau du lac Kivu restent
inférieures à la saturation (salinité voisine à
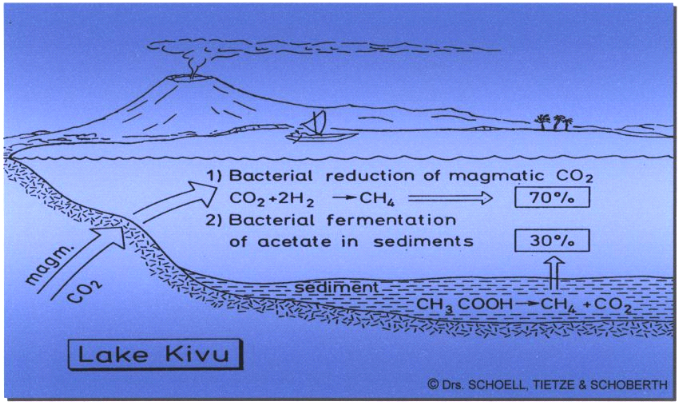
4%0). Le méthane a par contre une double origine (Fig.4). Une
partie est formée par la décomposition bactérienne du
plancton en conditions anaérobies, l'autre partie est le résultat
de la transformation diagénétique (Tietze, 1978 ; Schoell et
al. 1988). Les eaux de surface du lac Kivu ont une salinité
considérable et les cations majeurs y sont présents en
concentrations significatives (Tableau 2). L'oxycline varie d'environ 30m
durant la saison de pluie à environ 65 m au maximum durant la saison
sèche (Pasche et al., 2010)
Tableau 2. concentrations des ions majeurs dans les eaux de
surface du lac Kivu (Modifié à partir de Pasche et al.,
2011).
|
Paramètres
|
Concentration (mmol L-1)
|
|
Na+
|
4,1
|
|
Mg2+
|
3,8
|
|
K+
|
1,9
|
|
Ca2+
|
0,18
|
|
Alcalinité
|
13,3
|
|
Cl-
|
0,72
|
Tous les bassins du lac, excepté celui de Bukavu,
contiennent une quantité en gaz dissous associées à des
conditions anaérobiques entre leurs différentes profondeurs et la
surface (Isumbisho, 2006).
Damas (1935, 1937) et Capart (1960) divisent le lac Kivu en 5
grands bassins : le bassin Nord, le bassin de Kabuno-Kashanga, le bassin
d'Ishungu, le bassin de Kalehe et le bassin de Bukavu (Kaningini, 1995).
Le bassin de Bukavu constitue la partie extrême sud du
lac Kivu. Il est bordé au Nord-Ouest par l'isthme de Birava et au
Nord-Est par les îles Nkombo et Ibindja. Il couvre une superficie de 96
hectares. La profondeur maximale de ce bassin est de 105 m avec une moyenne de
75 m (Kaningini, 1995).
251651072Quant au bassin d'Ishungu, il est situé dans
la partie sud du lac (2°33,94'S et 28°97,65'E) et au Nord de celui de
Bukavu (Fig. 2 Isumbisho, 2000). Il a une profondeur d'environ 180 m (Schmid,
2011).
Figure
4. Origine du méthane du lac Kivu (Tietze et al., 1974 et 1975)
1.3. PRODUCTION PRIMAIRE ET
NUTRIMENTS LIMITANTS DU LAC KIVU
Dans le lac Kivu, jusqu'à environ 70 m (profondeur
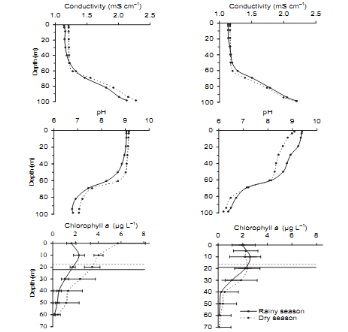
maximale de mixolimnion), les valeurs de la chlorophylle a sont comprises entre
0,63 et 3ug.L-1 avec une moyenne de 1,37ug.L-1 (Figure
3). Le tableau 3 reprend l'ensemble des apports en nutriments dans
l'épilimnion du lac Kivu.
Sarmento et al. (2008) avait mesuré les rapports
élémentaires du carbone, phosphore et de l'azote pour le
phytoplancton du lac Kivu et ont trouvé 256,3 pour C :P ; 9,6
pour C :N et 26,8 pour N :P. Il a été trouvé que
la production primaire dans le lac Kivu était fortement limitée
par le P (Sarmento et al. 2009 ). Cette limitation serait moindre dans la
baie de Bukavu où les rapports Si :P mesurés sont
relativement bas (Kaningini, 1995).
Les apports de nutriments à un lac sont hautement
corrélés aux phases de crues et maxima durant la première
crue. Ils sont majoritairement entrainés sous forme particulaire
liés aux matières en suspension pour le phosphore et sous forme
dissoute pour l'azote (Château et al. ; 2010).
L'utilisation actuelle des terres dans le bassin du lac Kivu
est dominée par l'agriculture de subsistance avec les fumiers comme
engrais et très rarement les engrais chimiques (Muvundja et al., 2009).
La déforestation dans le bassin versant due à un besoin du bois
de chauffage est un problème majeur pour le devenir du lac Kivu
(Martineau, 2003 ; cité par Muvundja et al., 2009). Cette
déforestation a comme conséquence les érosions et
éboulements des terres (Moeyersons et al., 2004) avec dépositions
des boues dans le lac.
A coté des nutriments issus des affluents et des
dépositions atmosphériques, les apports internes des eaux
profondes constituent la source principale de phosphate aux eaux de surface du
lac Kivu (Muvundja et al., 2009 ; Pasche et al. 2010, Pasche et al. 2012).
Au cours des siècles, les eaux méromictiques, anoxiques et
profondes du lac Kivu ont accumulé aussi bien des gaz que des nutriments
(Halbwachs et al., 2002).
Tableau 3. Apports en nutriments dans l'épilimnion du
lac Kivu (Modifié à partir de Muvundja et al., 2009).
|
Apport en nutriment
|
SRP (t.an-1)
|
TP (t.an-1)
|
NH4+(t.an-1)
|
NO3- (t.an-1)
|
TN (t.an-1)
|
SRSi (t.an-1)
|
|
Dépositions atmosphériques
|
118
|
2940
|
2220
|
1230
|
3450
|
1340
|
|
Affluents
|
111
|
1650
|
370
|
1550
|
1920
|
23300
|
|
Apports internes
|
1800
|
~0
|
18500
|
0
|
18500
|
29500
|
Le phosphore est reconnu comme étant le nutriment qui
contrôle la production primaire du lac mais l'azote peut jouer le
même rôle pendant les périodes de forte stratification,
principalement en saison pluvieuse (Sarmento et al. 2009).
Tableau 4. Physico-chimie des rivières du bassin de
Bukavu (Modifié à partir de Muvundja, 2010)
|
Rivière
|
pH#177;Er
|
T°#177;Er (°C)
|
Conductivité (us.cm-1)
|
|
Kawa
|
7,4#177;0,4
|
21,5#177;2,1
|
638#177;324
|
|
Bwindi
|
6,8#177;0,9
|
22,4#177;2,6
|
184#177;131
|
|
Murhundu
|
6,4#177;0,7
|
21,2#177;2,3
|
176#177;109
|
|
Kakumbu
|
7,1#177;0,6
|
23,1#177;2,6
|
278#177;106
|
|
Mushuva
|
6,7#177;0,4
|
19,4#177;1,9
|
161#177;059
|
|
Mpungwe
|
6,7#177;0,6
|
19,1#177;2,0
|
144#177;066
|
Le bassin de Bukavu, présente une grande fluctuation
des températures parce qu'affecté par les activités
anthropogéniques (Schmid et al., 2010).
Tableau 5. Concentration moyenne en nutriments des
rivières du bassin de Bukavu (Modifié à partir de
Muvundja, 2010)
|
Rivière
|
SRP (ugL-1)
|
TP (ugL-1)
|
NH4+
(ugL-1)
|
NO3-
(ugL-1)
|
|
Kawa
|
686
|
7960
|
9850
|
510
|
|
Mugaba
|
42
|
1346
|
166
|
440
|
|
Murhundu
|
23
|
2000
|
106
|
440
|
|
Kakumbu
|
51
|
925
|
150
|
540
|
|
Mpungwe
|
34
|
301
|
47
|
110
|
|
Mushuva
|
80
|
417
|
65
|
120
|
Les grandes concentrations en ions NH4+
et en TP s'expliqueraient par les activités anthropiques qui affectent
ce bassin.
1.4. COMPOSITION CHIMIQUE
DES EAUX PROFONDES DU LAC KIVU
L'enrichissement en éléments nutritifs des eaux
qui, trouve son origine dans les apports des bassins versants et qui peut
être relayé par la minéralisation à l'interface
eau-sédiment, conduit généralement à un
accroissement de la production primaire globale de l'écosystème.
Les rejets domestiques et les effluents agricoles sont les deux principales
sources d'apport en sels nutritifs (azote et phosphore) par le bassin versant
(Château et al., 2010).
En dessous de 65 m, le profil des concentrations de la plus
part des paramètres dans le lac Kivu était
caractérisé par l'augmentation avec la profondeur (Pasche et al.,
2010). Le profil de l'alcalinité est le même que pour les ions
majeurs et atteint un niveau maximum de 72,6 mmol.L-1 dans la
profondeur maximale (Pasche et al., 2010).
Selon Pasche et al. (2010), les concentrations en phosphore
inorganique dissous (DIP) et en ions ammonium (NH4+)
étaient fortement rencontrées en profondeur (respectivement 0,19
mmol/L et 4,26 mmol/L). En-dessous de l'oxycline, le
SO42- décroît avec la profondeur
jusqu'à se situer en-dessous de la limite de détection
(<0,05mmol/L) déjà à 90 m (Pasche et al., 2010).
Les cations les plus abondants dans le lac Kivu sont le
Na+ et le Mg2+ suivis du K+ et Ca2+.
(Pasche et al., 2010)
Le N et le P sont les nutriments essentiels pour la croissance
des phytoplanctons. La matière organique morte est en partie
minéralisée et recyclée en surface. Mais c'est durant son
transport dans les eaux profondes et à l'interface eau-sédiment
que la matière organique est largement minéralisée et les
nutriments sont libérés dans l'eau. Les apports externes sont
conditionnés par les dépositions atmosphériques, les
rivières et les sources internes (Guyard, 2007). Environ 1,0 kg de P et
0,8 kg de N par personne et par an sont produits et déposés par
les activités humaines dans les affluents de Bukavu pour finir au lac
Kivu (Muvundja, 2009). Cependant, les apports externes actuels de ces
nutriments dans le lac Kivu sont encore trop bas pour causer l'eutrophisation
dans moins de quelques décennies, ajoutent-ils.
Dans les bassins méromictiques du lac Kivu, le N et le
P sont principalement générés à l'interface
eaux-sédiments. A cette interface, 92% de N et 88% de P sont
minéralisés et régénérés dans la
colonne d'eau. Seulement 8% de N et 12% de P sont enfuis dans les
sédiments. (Pasche et al., 2010).
1.5. LA SEDIMENTATION AU
LAC KIVU
Les études sur la réflexion sismique
révèlent que les sédiments non consolidés sont
épais dans le bassin nord du lac Kivu (Wong and Herzen 1974 ;
cité par Descy et al., 2012). Les différences d'épaisseurs
des sédiments reflètent une différence d'âges des
bassins du lac.
Particulièrement, l'épaisseur est limitée
au-delà de 300 m, probablement parce que le lac a été peu
profond par rapport à sa profondeur à travers l'histoire (Degens
et Kulbicki, 1973).
Les matériaux sous les sédiments dont
l'épaisseur est inconnue ont une grande densité ;
probablement constitués des granites ou des roches
métamorphiques.
Harberyan and Hecky (1987) ont divisé le coeur de
sédiment du lac Kivu en trois différentes zones ; la zone A
(14000-9400 av. JC) : le lac était peu profond avec un grand taux
de sédimentation par accumulation des matières organiques.
L'alcalinité du lac était modérément
élevée. La dominance du Stephanodiscus astraea
a indiqué un rapport Si :P bas. Cette zone était
séparée de la zone B par une couche de cendres qui indique une
probable éruption volcanique interne (Descy et al., 2012).
Dans la zone B (9400-5000 av. JC) le lac devient plus profond
avec un taux de sédimentation réduit. C'est pendant cette
période qu'est née la Ruzizi comme exutoire (Stoffers and Hecky,
1978). Le rapport Si :P croît durant cette période à
cause du P comme facteur limitant et la dominance des diatomées dans la
biomasse algale.
La zone C, aux environs de 5000 av. JC, révèle
des changements dramatiques de l'histoire du lac. La précipitation des
carbonates cesse brusquement, alors que le carbone organique et l'azote total
augmentent de façon accentuée. Ces changements dramatiques ont
été attribués au volcanisme et aux activités
hydrothermales. (Descy et al., 2012)
Haberyan and Hecky (1987) pensent qu'une éruption
limnique similaire à celle qui a eu lieu au lac Nyos doit avoir eu lieu
au lac Kivu avec pour conséquence d'avoir causé une extinction
en masse de poissons. L'analyse de la zone C montre que dès 5000 ans av.
JC, le lac est devenu stratifié (Haberyan and Hecky, 1987).
Au début des années 1200 av. JC, le lac Kivu
devient méromictique à cause du climat chaud humide (Stoffers and
Hecky, 1987) ; la présente stratification observée au lac
Kivu date de cette époque (Degens and Kulbicki ; 1987)
Les caractéristiques physiques et le rythme de
sédimentation ont révélé des changements majeurs
dans la sédimentation à dater d'environ 50 ans derniers (Pasche
et al. 2010, Pasche 2012). La majeure partie des paramètres
physico-chimiques du lac ont nettement changé après 1960. Depuis
1960, il y a une augmentation massive de CaCO3 et des sels
dissous.
Le changement brusque dans le coeur de sédiments note
le début de précipitation des carbonates, à partir des
années 1960. Dans les 50 dernières années, le flux de
matières organiques a augmenté de 50%. Plus
précisément, le TOC a augmenté de 40% et le TN de
80% ; mais le TP c'est presque le triple (Descy et al., 2012).
L'augmentation des proportions des sols dans les sédiments
reflète une forte érosion dans le bassin versant comme
résultat des activités anthropiques (déforestation,
agriculture et exploitation minière) (Descy et al., 2012).
Les majeures modifications d'il y a 50 ans peuvent être
expliquées par une ou l'ensemble de 3 changements environnementaux du
lac Kivu à savoir les changements dans la chaine trophique
causés par l'introduction de la sardine zooplanctonophage
Limnothrissa miodon, la forte densité des populations dans le
bassin versant du lac qui augmente les apports externes en nutriments. La forte
production primaire explique la forte accumulation de TOC, TN, TP et la
précipitation des carbonates (Descy et al., 2012).
1.6. INFLUENCE DES
CONDITIONS ENVIRONNEMENTALES SUR LA QUALITE ET LA FORMATION DES SEDIMENTS
LACUSTRES
Des particules plus ou moins grosses, ou des matières
précipitées qui ont, séparément, subi un certain
transport (par le vent, l'eau, ...), peuvent se rassembler et constituer un
ensemble appelé « sédiment » (
http://www.geoforum.fr/). Leurs
matériaux peuvent provenir de l'érosion de roches plus anciennes,
de transports de divers matériaux meubles ou fluides, ou être les
résultats d'activités organiques diverses. Selon son origine, le
sédiment peut être marin, fluvial, lacustre ou glaciaire.
Après son dépôt, il peut subir une diagenèse et
devenir une roche sédimentaire (
http://www.geoforum.fr/)
La turbidité des rivières et des lacs due
à une forte sédimentation peut aller jusqu'à rendre l'eau
nocive pour les animaux et les végétaux de ces milieux
aquatiques. L'augmentation du niveau des rivières par le
dépôt de sédiments (phénomène d'envasement)
peut aussi renforcer le risque d'inondation (Encyclopedie Encarta 2009). De
plus, la diminution de la profondeur de l'eau peut également être
dangereuse pour la navigation des bateaux, d'où la
nécessité de draguer régulièrement le fond des
cours d'eau.
Dans la zone littorale à forte énergie
dissipée, éolienne, avec érosion des berges situées
sous les vents dominants, ou fluviale, il y a formation de deltas et
dépôts des matériaux les plus grossiers (de
granulométrie supérieure ou égale aux sables fins). Sur
les flancs des cuvettes lacustres, les processus de transport et de tri
(vannage) des matériaux fins (argiles) et moyens (sablons) dominent
(Guyard, 2010). Dans les parties les plus profondes des cuvettes, s'accumulent
des matériaux en général très fins dont le
dépôt est parfois perturbé par des apports catastrophiques
de particules grossières (glissements, courants de turbidité)
(Guyard, 2010).
En pleine eau (zone pélagique), la
pénétration des tributaires lors des crues s'effectue sous forme
de panaches chargés en Matières en Suspension (MES), à des
profondeurs variables selon leur densité et où les particules
fines peuvent limiter la pénétration de la lumière
(Guyard, 2010). Les observations in situ par néphélométrie
peuvent également mettre en évidence les fortes densités
de particules dans les zones trophogènes superficielle (phytoplancton)
ou profonde (bactéries, hydroxydes de manganèse) et
l'augmentation générale des concentrations en particules dans les
couches profondes des lacs (Guyard, 2010).
Par ailleurs, les eaux de surface peuvent
transporter des sédiments pollués et toxiques (engrais,
pesticides) qui altèrent la qualité de l'eau. Un
déboisement intensif peut également accélérer
l'érosion des sols qui est dramatique pour l'agriculture. Enfin, les
sédiments présents dans les eaux courantes usent les pompes et
les turbines des barrages et tendent à remplir leurs réservoirs
(Microsoft Encarta 2009).
Les phosphates stockés dans les sédiments
peuvent être relayés en quantité dans les conditions
réductrices, lorsque la température de l'eau augmente. Ce
phénomène de relargage est favorisé dans les zones
profondes d'un lac par la formation d'une stratification thermique qui limite
les échanges gazeux entre les eaux de surface et celles de fond
(Château et al. ; 2010).
Les contaminants des sédiments sont essentiellement de
deux natures : organique et minérale. Les contaminants organiques
sont modérément reliés au Carbone organique total (TOC).
Ceci parce que les contaminations sont essentiellement d'origine humaine et non
liée à la capacité de rétention du sédiment
(argile, matière organique). Une corrélation s'observe souvent
entre les hydrocarbures aromatiques polycycliques (HAP) et le TOC marquant une
pollution par les HAP plus largement disséminés. Ainsi donc, ce
n'est pas parce qu'un sédiment est argileux ou riche en carbone qu'il
est contaminé. Les contaminants de deuxième catégorie sont
les métaux lourds (Pb, Cd, Hg,...) (Mouvet et al. ; 2009).
Les géologues distinguent trois types de
sédiments lacustres:
- les sédiments pélagiques,
formés à partir d'éléments transportés par
les vents et les eaux de surface ; ils sont souvent riches en
débris fossiles et s'accumulent dans les régions
éloignées des régions continentales ; ils recouvrent
par exemple l'océan Pacifique (Encyclopédie Encarta
2009);
- les turbidités, sédiments
provenant de la dégradation des roches continentales, formés sur
les talus continentaux ou en bordure des continents ; les
turbidités sont transportées par de rapides courants dits de
turbidité (Encyclopédie Encarta 2009);
- les sédiments homogènes,
très fins, qui proviennent des mouvements des eaux profondes
chargées de particules du fond lacustre et qui se déposent
lorsque les courants faiblissent. Les sédiments lacustres sont d'autant
plus fins qu'ils se forment loin des côtes continentales (les vases, par
exemple) (Encyclopédie Encarta 2009).
Les sédiments des zones envasées sont
caractérisés par les teneurs maximales en matière
organique et en azote total. La répartition du phosphore total fait par
contre apparaître un gradient croissant dans les étangs et lacs
dû aux apports par le bassin versant de phosphore particulaire
adsorbé aux sédiments fins (Château et al., 2010).
1.7. LES PIGMENTS
Un pigment est une substance colorée, naturelle ou
artificielle, d'origine minérale ou organique. On distingue aussi les
pigments photosynthétiques ou pigments assimilateurs qui sont des
composés chimiques permettant la transformation de l'énergie
lumineuse en énergie chimique chez les organismes qui effectuent la
photosynthèse (
www.chem.qmul.ac.uk).
Il existe deux grands types de pigments
photosynthétiques : les pigments actifs, capables d'effectuer les
trois modes de libération de l'énergie accumulée (la
fluorescence, la transmission de l'état d'excitation et la conversion de
l'énergie) et les pigments accessoires incapables d'effectuer la
conversion de l'énergie (
www.chem.qmul.ac.uk).
Les pigments actifs
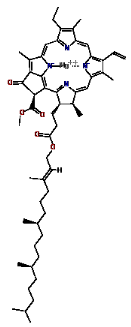
1. Chlorophylle a : pigment
bleu-vert
La chlorophylle a est la principale forme de chlorophylle
présente chez les organismes qui mettent en oeuvre la
photosynthèse. On en trouve également en petite quantité
chez les bactéries sulfureuses vertes (
www.chem.qmul.ac.uk).
La chlorophylle a présente, en milieu aqueux, deux
maximums d'absorption spectrale, aux environs de 430-440 nm dans le bleu et de
670 nm dans le rouge (les valeurs exactes varient en fonction de la composition
du solvant). Il s'agit d'un pigment photosynthétique essentiel pour la
photosynthèse chez les eucaryotes, les cyanobactéries et les
prochlorophytes en raison de son rôle de donneur d'électron
initial dans la chaîne respiratoire (
www.chem.qmul.ac.uk).
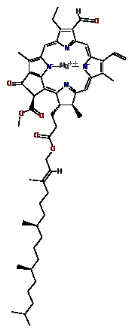
2. La chlorophylle b : pigment
jaune-vert
La chlorophylle b est une forme de chlorophylle de couleur
jaune qui absorbe essentiellement la lumière bleue et qui est davantage
soluble en milieu aqueux de la chlorophylle a en raison de son groupe carbonyle
(
www.chem.qmul.ac.uk).
Elle n'est pas un donneur d'électrons initial dans la
chaîne respiratoire mais accroît le rendement
énergétique de la photosynthèse en augmentant la
quantité d'énergie lumineuse absorbée par les plantes et
autre organismes photosynthétiques. Son spectre d'absorption est en
effet décalé par rapport à celui de la chlorophylle a, de
sorte que ces deux chlorophylles se complètent (
www.chem.qmul.ac.uk).
En effet, les pigments chlorophylliens au cours du transit
digestif chez les brouteurs de phytoplancton, sont progressivement
dégradés en phéophytines (perte du Mg2+ du
tétrapyrole), puis en phéophorbides, suite à l'action
d'estérases. Les phéophytines, les phéophorbides et les
pyrophaephytines étant des phéopigments (Knops, 2010)
251655168
251656192
Figure 5. Structures de la chlorophylle a à
gauche et de la chlorophylle b à droite.
3.
Les bactériochlorophylles
Les Bactériochlorophylles sont des pigments
photosynthétiques présents chez différentes
bactéries autotrophes. Elles sont proches des chlorophylles, les
pigments primaires chez les plantes, les algues et les cyanobactéries.
Les bactéries contenant des bactériochlorophylles effectuent la
photosynthèse, mais ne produisent pas de dioxygène, elles
utilisent des longueurs d'ondes de la lumière différentes de
celles utilisées par la photosynthèse fondée sur les
chlorophylles a et b. Les bactériochlorophylles diffèrent selon
les groupes bactériens ; on en distingue ainsi les
bactériochlorophylles a à g (
www.chem.qmul.ac.uk).
Des pigments accessoires, on distingue la
carotène : pigment orange, le xanthophylle : pigment jaune et
les phycobiliprotéines (pigments hydrosolubles de la
photosynthèse) qui comprennent à leurs tour ;
l'allophycocyanine, la phycocyanine, la phycoérythrine et la
phycoérythrocyanine (
www.chem.qmul.ac.uk).
Les sédiments du lac Kivu sont domines par plusieurs
types des pigments comme le montre la Figure 6.
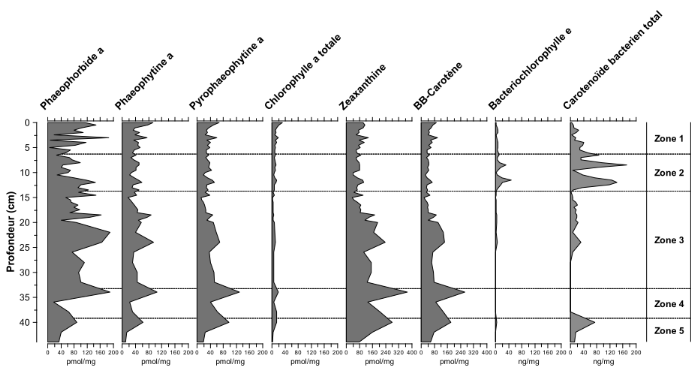
251657216
Figure
6. Evolution des concentrations de différentes pigments
sédimentaires de la carotte de sédiment (Kivu 09-4/Kibuye). La
détermination des zones se basent sur l'analyse de groupement des
assemblages de diatomées (Knops, 2010).
Chapitre II. MATERIELS ET
METHODES
2.1. SITES
D'ECHANTILLONNAGE
Le bassin d'Ishungu et celui de Bukavu font parties du bassin
sud du lac dont les sites d'échantillonnages pour cette étude se
situent respectivement à 2°16,134' latitude Sud et 28°59,456'
de longitude Est pour le bassin d'Ishungu. Pour le bassin de Bukavu, le site
d'échantillonnage se situe entre 2°20' et 2°30' latitude Sud
et 25°30' et 29° de longitude Est. La figure 2 représente le
bassin de Bukavu et celui d'Ishungu.
2.2. ECHANTILLONNAGES DES
CAROTTES
La carotte d'Ishungu et celle de Bukavu ont été
échantillonnées respectivement en dates du 1er et du
22 août 2012 grâce à un système de carottage
gravitaire (Fig.7)


Figure
7. Photos du carotteur utilisé (Modifie à partir de Knops
2009).
Les coordonnées géographiques des sites
d'échantillonnages ainsi que la navigation sur le lac ont
été assurées par un GPS (Garmin Olathe 72).
La carotte d'Ishungu, recueillie à environ 170 m de
profondeur a été découpée de haut en bas en 23
échantillons de 2 cm chacun et ce, en utilisant le dispositif vertical
représenté sur la partie gauche de la Figure 7. La carotte de
Bukavu quant à elle, elle a été découpée en
13 échantillons. Les 2 cm d'échantillons ont été
recueillis sur des boites à pétri dont des
prélèvements ont séchés à l'étuve
(Incubator cl-011) pendant au moins 24h à 70°C pour des analyses
des nutriments. Avant le séchage, quelques échantillons pris
comme références ont été pesés sur une
balance de précision (AND FR-200 MK II, Japan) afin de pouvoir suivre
l'évolution du séchage.
Les échantillons ont été
considérés comme complètement secs lorsque les
témoins ont acquis des masses constantes pendant au moins 6 heures. Un
autre prélèvement sur l'échantillon frais a
été réservé aux analyses des pigments
chlorophylliens.
2.3. MESURE DES
PIGMENTS TOTAUX
De chaque échantillon de 2 cm, il était
prélevé à l'aide d'une spatule, une masse d'environ 1g
dans des tubes à essai auquel il était ajouté 5 ml
d'acétone 90% pour l'extraction des pigments. Tous les
prélèvements des volumes utilisés étaient
assurés par des micropipettes.
Après ajout de l'acétone, ces
échantillons étaient gardés à froid et sous
obscurité au congélateur pendant 1 h avant de passer à la
première sonication de 15 minutes à l'aide d'un sonicateur
(Bandelin electronic Sonorex RK 100, Germany). La deuxième sonication
n'est intervenue que 24 h après. Avant cette deuxième sonication,
les échantillons étaient agités pour une durée de 2
h sur agitateur à plateau (Mini Rock Bio MR-1).
La centrifugation, pendant 20 minutes, nous a permis de
séparer l'acétone contenant les pigments du résidu ;
ce qui facilitait le transvasement à l'aide d'une pipette pasteur vers
des nouveaux tubes Falcon. La lecture spectroscopique sur un
spectrophotomètre (Spectronic unicam 4001/4, USA) nous a alors permis,
à partir des absorbances lues à une longueur d'onde de 665 nm, de
calculer les concentrations en chlorophylle a et en phéopigments des
échantillons par la méthode de Lorenzen (1967) (Descy ;
1992).
Méthode de Lorenzen et estimation des
phéopigments
Cette méthode a l'avantage d'être très
spécifique du phytoplancton ; elle peut s'appliquer à tout
échantillon, même si de matières organiques ou
minérales sont présentes. Les poudres de sédiments
(échantillons) sont aspergées dans 5 ml de solvant
(acétone 90%) et passées aux ultra-sons (sonication)
(Descy ; 1992).
Les extraits sont alors mesurés au spetro à une
longueur d'onde de 665nm avant et après acidification par HCl 0.1N.
Cette acidification dégrade les pigments chlorophylliens en
phéopigments. La concentration en phéopigments (ou en
chlorophylle « active ») est déterminée par
différence, d'après les équations de Lorenzen (pour
l'acétone 90%) (Descy ; 1992).
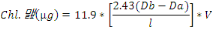
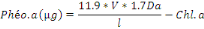
Avec :
· Db : La densité optique avant
acidification
· Da : La densité optique après
acidification
· V : Le volume de solvant en ml
· L : L'épaisseur de la cuvette de spetro en
cm
· Phéo. : Phéopigments a
· Chl.a : Chlorophylle a
La concentration de la Chl.a en ug/g de sédiment est
alors déterminée par [Chl.a] en ug/masse d'échantillon en
gramme.
2.4. ANALYSE DES NUTRIMENTS
TOTAUX
Les échantillons de sédiments déjà
secs étaient broyés à l'aide d'un mortier en porcelaine et
conservés dans des emballages en plastique et gardés au
dessiccateur en attendant les analyses prochaines. Toutes les méthodes
d'analyse utilisées sont brièvement décrites
ci-après et sont conformes aux méthodes standards (APHA 2005).
De chaque échantillon broyé, il était
prélevé environ 50 mg dans des flacons et transvasés dans
de bouteilles en Duran auxquelles 50 ml de solution alcaline oxydante de
persulfate de potassium étaient ajoutés. La digestion des
échantillons ainsi traités, de même qu'une partie de la
solution alcaline se déroulait dans une marmite à pression (Wolf
Sano Clav KL-12-2, Germany). La matrice de digestion était
préparée en dissolvant 40 g de
K2S2O8 et 6 g de NaOH dans 2 l d'eau
distillée.
a. Analyse du phosphore total
Pour l'analyse du phosphore total, deux réactifs
étaient utilises (R1 et R2). Le R1 était constitué de
l'acide ascorbique, tandis que le R2 était obtenu grâce à
la dissolution dans l'eau du molybdate d'ammonium et du tartrate d'antimonyle
de potassium. La description de la méthode est contenue dans Bisimwa
(2009).
La lecture spectrophotométrique des échantillons
intervient après avoir lu les solutions standards qui permettent de
trouver la courbe d'étalonnage. Les absorbances obtenues pour les
échantillons nous ont alors permis avec la courbe d'étalonnage de
déterminer les différentes concentrations en TP dans les
échantillons par l'équation suivante :
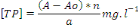
Avec : x=[TP]=Concentration en phosphore total (mg/l)
A : absorbance de l'échantillon
Ao et a : ordonnée à l'origine et pente de
la droite représentant la courbe d'étalonnage
n : nombre de dilutions opérées sur les
échantillons dosés.
b. Analyse de l'azote total
Comme pour le TP, l'analyse du TN commence par la digestion
selon la même procédure. Les réactifs pour cette analyse
étant R1 préparé par dissolution dans l'eau
distillée de la sulfanilamide et du N-1(naphthyl)-éthylène
diamine dihydrochloride et R2 préparé par dissolution
NH4Cl et NaOH dans l'eau distillée.
Avant de passer à la lecture
spectrophotométrique, aux échantillons de TN ainsi qu'aux
solutions étalons, on ajoute environ 2 g de Cadmium afin de
réaliser la réduction des nitrates en nitrites. Celle-ci
était facilitée par agitation vigoureuse sur une plaque agitante
pendant 2 h. La lecture au spectrophotomètre se faisant à une
longueur d'onde de 540 nm dans une cellule de 50 mm. Tenant compte de la courbe
d'étalonnage qui nous a permis de trouver l'ordonné à
l'origine et la pente de la courbe, les différentes concentrations en TN
se sont calculées par l'équation suivante :
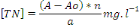
Avec x=[TN]=Concentration en azote total (mg/l)
A : absorbance de l'échantillon
Ao et a : ordonnée à l'origine et pente de
la droite représentant la courbe d'étalonnage
n : nombre de dilutions opérées sur les
échantillons dosés
Plus détails sur le protocole d'analyse sont
donnés par Bisimwa (2009).
La compilation des données statistiques, les calculs et la
représentation des graphiques nous ont été
facilités par Office 2007.
Chapitre III. PRESENTATION ET INTERPRETATION DES RESULTATS
3.1. PRESENTATION DES
RESULTATS
1. Physico-chimie des bassins
étudiés
1.a. Bassin d'Ishungu
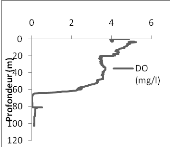
Dans le bassin d'Ishungu, la concentration de l'oxygène
dissous décroit avec la profondeur (fig. 7 à gauche). Nous
constatons qu'à partir de la surface jusqu'à 63 m de profondeur,
les concentrations de DO dans la colonne d'eau varient entre 1,06 et 4,89 mg/l.
A partir de 65 m, les concentrations chutent jusqu'à être
en-dessous de la limite de détection à partir du
103ème m de profondeur.
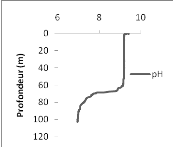
Le pH de la colonne d'eau à Ishungu évolue
constamment de 0 à 64 m de profondeur avec des valeurs = 9 avant de
décroitre à partir du 65ème m de profondeur
(Fig. 7 au centre).
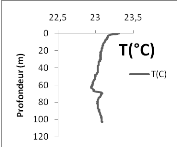
Quant à la température, elle décroit
progressivement avec la profondeur avec des valeurs comprises entre 23,3 et
22,98°C de la surface jusqu'à 65 m, puis elle commence à
augmenter avec la profondeur (Fig. 7 à droite).
Figure
8. Profils des paramètres physico-chimiques réalisés dans
le bassin de Bukavu (DO (mg/l) à gauche, pH au centre et la
température (°C) à droite).
1.b. Bassin de Bukavu
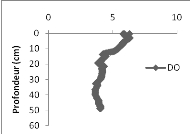
La concentration en oxygène dissous varie de 6,29
à 3,85 mg/l dans la colonne d'eau du bassin de Bukavu entre 0 et 43 m de
profondeur (Fig. 8 à gauche).
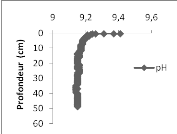
Le pH quant à lui, il évolue avec des valeurs
environnant 9,43 de la surface à 2 m avant de garder une valeur
constante de 9,15 jusqu'à 43 m de profondeur.
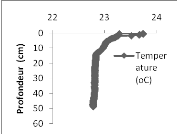
La température décroit de 23,74 à
22,93°C de la surface à 11 m et garde une valeur constante de
22,93°C jusqu'à 43 m de profondeur.
251659264
251658240
251660288
Profils des paramètres physico-chimiques
réalisés dans le bassin de Bukavu
Figure
9. Profils des paramètres physico-chimiques réalisés dans
le bassin de Bukavu (DO (mg/l) à gauche, pH au centre et la
température (°C) à droite).
2. Composition en
nutriments
La composition en nutriments et en pigments de
sédiments du lac Kivu peut subir des variations importantes selon qu'on
se trouve dans l'un ou l'autre bassin (bassins d'Ishungu et Bukavu pour notre
cas). Dans ce chapitre seront présentés les résultats
comparés des données de la carotte d'Ishungu et celle de Bukavu
(Le TP, le TN, la Chl.a, le TN:TP et les Phéo.a).
2.a. Le phosphore total
Les résultats obtenus montrent que la concentration du
phosphore dans la carotte de sédiment varie de 0,726 à 5,515
mgP.g-1de sédiment avec une moyenne de 2,062
mgP.g-1de sédiment pour le bassin d'Ishungu (Figure 10
à gauche) alors que dans la Baie de Bukavu, la concentration en TP varie
de 0,099 à 92,343 mgP.g-1de sédiment avec une moyenne
de 29,266 mgP.g-1de sédiment (Figure 10 à droite).
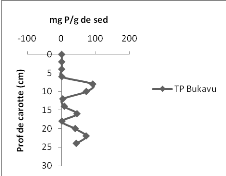
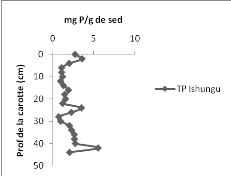
Les fluctuations s'observent dans les deux bassins ; mais
pour la baie de Bukavu, on constate qu'à la surface (0-6 cm) les
concentrations en TP sont proches de 0 alors qu'à Ishungu, elles sont
situées entre 2 et 4 mg P/g. Le constat est que la baie de Bukavu
contient environ 14 (=29,266/2,062) fois plus de phosphore que n'en contient le
bassin d'Ishungu dans l'ensemble ; sauf que jusqu'à 6cm, la carotte de
sédiments de Bukavu présente un déficit en TP par rapport
au bassin d'Ishungu.
Figure
10 : Concentrations en Phosphore total (mgTP.g-1de sédiment) en
fonction de la profondeur (cm) dans la carotte d'Ishungu (à gauche) et
dans la carotte de Bukavu (à droite).
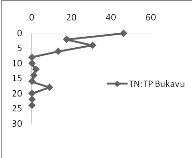
2.b. L'Azote total
Le bassin d'Ishungu présente des concentrations en TN
comprises entre 0,954 et 9,849 mgN.g-1 de sédiment (Figure 11
à gauche); par contre dans la baie de Bukavu, les concentrations en TN
varient de 0,.806 à 7,318 mgN.g-1 (Figure 11 à
droite). Nous avons constaté que malgré quelques
différences des valeurs, l'allure générale des
concentrations de TN en fonction de la profondeur est
caractérisée par une forte fluctuation dans les deux carottes.
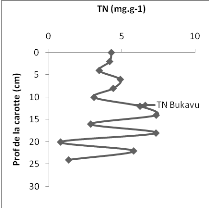
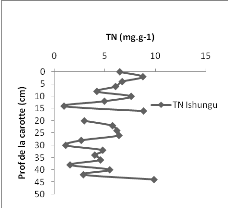
Les valeurs moyennes de concentration en TN étant de
5.118 et 4.304 mg de TN/g de sédiment, respectivement dans le bassin
d'Ishungu et dans la baie de Bukavu. Pour Ishungu, une augmentation de la
déposition de phosphore se fait remarquer en général de
bas en haut. Les sédiments récents (0-10 cm) sont plus riches en
N que les sédiments plus anciens (10-45 cm)
Figure
11 : Concentrations (mgTN.g-1) de TN en fonction de la profondeur (cm)
dans la carotte d'Ishungu (à gauche) et dans la carotte de Bukavu
(à droite).
Les sédiments récoltés à Bukavu
montrent une assez faible concentration en N que ceux récoltés
à Ishungu (Fig. 11). Les sédiments récents sont aussi
relativement plus concentrés que les sédiments plus anciens
malgré une très forte fluctuation (Fig.11 à gauche)
2.c. Le rapport molaire TN :TP
En surface, le rapport TN :TP est plus
élevé qu'en profondeur dans les deux bassins
étudiés (Figure 12). Au niveau de la profondeur, la moyenne du
rapport de Bukavu semble se rapprocher de celle d'Ishungu. Cependant, la
moyenne globale du rapport TN :TP de la baie de Bukavu est
supérieure à la moyenne du bassin d'Ishungu d'un facteur 3.
En comparant les deux moitiés de chaque carotte, nous
avons constaté que le rapport TN:TP a augmenté d'un facteur 10.41
à la surface plus qu'en profondeur pour la carotte de la baie de
Bukavu ; alors que pour celle d'Ishungu, ce rapport n'a augmenté
que d'un facteur 1.58. C'est ainsi que le rapport molaire TN :TP diminue
sensiblement en fonction de la profondeur à Bukavu, alors que dans le
bassin d'Ishungu, on observe plus des fluctuations.
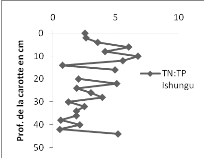
251665408
251666432
Figure
12. Rapports molaires TN :TP dans le bassin d'Ishungu (à gauche et
de Bukavu (à droite).
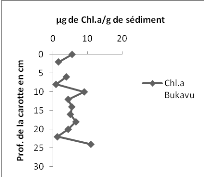
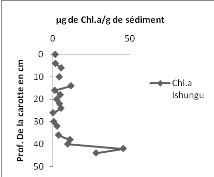
3. La chlorophylle a
En comparant les résultats de la carotte d'Ishungu
à ceux de la carotte de Bukavu, on constate qu'en tenant uniquement
compte des 13 premiers points de chaque courbe, l'allure est presque la
même avec une moyenne de 4,281 ug/g de sédiment (pour les 13
premiers points à Ishungu) et de 4,90 ug /g de sédiment dans la
carotte de Bukavu.
Dans l'ensemble, la valeur minimale en chlorophylle a dans la
carotte d'Ishungu est de 0,133 ug/g de sédiment (Fig. 13 à
gauche) alors qu'elle est de 0,864ug/g de sédiment pour la carotte de
Bukavu (Fig. 13 à droite). Les points maximaux quant à eux, sont
de 45,484 ug/g de sédiment et 10,93 ug/g de sédiment
respectivement pour la carotte d'Ishungu et de Bukavu.
Le constat global est que les sédiments de la carotte
du bassin d'Ishungu sont environ deux fois plus riches en chlorophylle a que
dans la baie de Bukavu avec une moyenne de 8,013 ug de Chl.a/g de
sédiment à Ishungu (n=23) et 4,906 ug/g à Bukavu
(n=13).
251668480
251667456
Figure
13. Concentrations de la chlorophylle a (en ug/g de sédiment) en
fonction de la profondeur (cm) dans la carotte d'Ishungu à gauche et de
Bukavu à droite
4. Les phéopigments
La teneur en pigments actifs autres que la chlorophylle a
varié de 6,156 à 92,281 ug/g de sédiment dans la carotte
de sédiment d'Ishungu, avec une moyenne de 50,404 ug/g de
sédiment (Fig. 14 à gauche). Pour la carotte de sédiment
de la baie de Bukavu, les phéopigments a ont des valeurs de
concentration variant entre 14,593 et 63,129 ug/g de sédiment avec une
valeur moyenne de 36,464 ug/g de sédiment (Fig. 14 à droite).
On constate qu'à Ishungu, de 0 à 8 cm, la
concentration en phéopigments a est décroissante. A partir de 12
cm, l'allure de la courbe croit spectaculairement jusqu'à atteindre sa
valeur maximale à 18 cm à partir d'où elle décroit
encore lentement.
A Bukavu cependant, à partir de 0 cm, la fluctuation
est grande jusqu'à la fin ; avec un écart- type de
15,026.
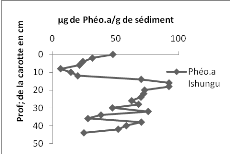
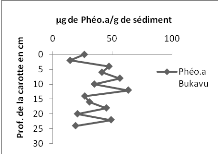
Figure
14. Concentration des phéopigments (en ug/g de sédiment) dans la
carotte d'Ishungu (à gauche) et de Bukavu (à droite).
3. 2. INTERPRETATION DES
RESULTATS
Les nutriments dans les sédiments varient
raisonnablement, avec des fluctuations maximales pendant la saison sèche
(entre juin et septembre) et durant la période de grands vents (Pasche
et al., 2010). Les fluctuations observées dans les profils des
nutriments peuvent être liés à des taux différents
de leurs dépositions selon la productivité de la période
de déposition en question.
Dans le bassin de Bukavu, les apports externes
dépendent de l'intensité des activités de l'eau. Durant
cette période, les courants de conviction influencent la
productivité du lac (Pasche et al., 2010). Dans un bassin moins profond
comme celui de Bukavu, le taux de TP ne peut qu'être faible à
cause d'une production primaire élevée.
Lors de mélange des eaux dans le bassin de Bukavu, il
est possible que les matières dissoutes à l'interface
eau-sédiment soient relarguées dans la colonne d'eau alimentant
la production primaire ; et, cela explique la faible transparence de l'eau
de la baie de Bukavu (2,60 m) par rapport celle d'Ishungu (5,20 m) durant la
même période d'échantillonnage.
Ce phénomène de rélargage ne sera pas
d'application pour le bassin meromictique d'Ishungu qui, lui étant
très profond (~170 m), ce ne sont que les couches superficielles de la
colonne d'eau qui se mélangent sans atteindre la surface des
sédiments.
Il est ainsi raisonnable que la composition en nutriments des
sédiments d'un bassin profond et meromictique soit
caractérisée par un faible recyclage des nutriments
sédimentaires.
Les bassins dominés par les érosions sont
caractérisés par une concentration en TP élevée
à cause des apports du bassin versant (Müller et al., 2007). Le
taux de concentration de TP est plus élevé dans les
sédiments de Bukavu par rapport à ceux d'Ishungu. Muvundja et al.
(2009) ont trouvé que les rivières de la partie sud du lac Kivu
sont caractérisées par un flux des nutriments dû aux
activités anthropiques suite aux fortes densités
démographiques (Ville de Bukavu) dans le bassin versant.
Les raisons de fluctuations pour le TP sont aussi valables
pour le TN. On constatera que même pour le TN, dans le bassin de Bukavu,
il diminue en surface de la carotte, mais pas sensiblement comme le TP ;
pourtant à Ishungu, la distribution semble être homogène.
Cela fait alors penser à l'azote comme facteur co-limitant de la
production primaire tel que l'ont observé Sarmento et al. (2009).
La proportion molaire TN :TP qui décroit dans
les sédiments du bassin d'Ishungu (Fig. 12 à gauche) et
sensiblement dans ceux de Bukavu (Fig. 12 à droite) en fonction de
la profondeur, fait penser à une autre source de nutriments à
part les autochtones. Cette nouvelle source est bien sûr le bassin
versant (Muvundja et al., 2009). Le rapport TN :TP élevé
ainsi que la grande fluctuation de TP dans la carotte de Bukavu s'expliquerait
par une forte anthropisation du bassin versant immédiat
(déposition des matières terrestres).
Le profil de Chl a (Fig. 13) ne fait que corroborer cette
observation. La faible concentration en TP dans les sédiments
récents de Bukavu est certainement lié à une forte demande
en P par les microorganismes dans des conditions oxydantes plus favorables (4
mg O2/l au fond du lac) conduisant à une
régénération quasi-totale de phosphate soluble à
partir du phosphore organique déposé à la surface des
sédiments.
A Ishungu, le recyclage du phosphore sédimentaire
serait réduit par le déficit en demandeurs d'électrons
étant donnée les conditions réductrices
élevées qui y prévalent au fond du lac (Pasche et al.
2011). Cirhuza (2009) avait observé qu'à l'interface
eau-sédiment, la demande chimique en oxygène était la plus
élevée qu'à toute autre profondeur de la colonne d'eau du
lac.
En surface des carottes, on trouve moins de TP que de TN. En
profondeur, le TN est majoritaire à Bukavu comme à Ishungu. Ceci
prouve qu'il y a eu une grande modification dans le recyclage des nutriments au
lac Kivu.
Les majeures modifications observées dans le cycle des
nutriments du Lac Kivu peuvent être expliquées par un ou
l'ensemble de 3 changements environnementaux effectués sur le lac
Kivu : l'introduction de Limnotrissa miodon, la surpopulation et
les changements hydrologiques dans le bassin versant (Muvundja et al.
2009 ; Pasche et al. 2010 ; Pasche et al. 2012; Wüest et al.
2012 ; Descy . et al., 2012.
Le taux très élevé de chl.a dans le
bassin d'Ishungu par rapport à la baie de Bukavu se justifie par le
déficit des conditions anoxiques de l'interface eau-sédiment qui
permettent leur préservation d'une part, et les conditions
méromictiques, d'autre part, facilitant leur accumulation alors que dans
le bassin de Bukavu les sédiments sont constamment exposés
à l'oxygène, d'où leur dégradation facile et
avancée. Bianchi et al. (2000) avaient observé une plus grande
dégradation en pigments sédimentaires dans les conditions oxiques
de la Mer baltique par rapport à ceux exposés aux conditions
anoxiques confirmant ainsi que la préservation de la matière
organique pigmentaire des sédiments est favorisée par l'anoxie. A
Bukavu, le chl. a serait dilué par des apports allochtones accrus suite
à l'urbanisation et l'érosion (Muvundja et al. 2009).
L'allure du profil des phéopigments à Ishungu
montre un shift spectaculaire à partir de 12 cm de profondeur de la
carotte. Cette partie de la carotte coïncide à la partie où
des changements spectaculaires s'observent dans les autres paramètres
chimiques tels que le carbone organique et inorganique (Pasche et al. 2010&
2012 ; Muvundja, données non publiées). Par contre à
Bukavu, ce changement n'est pas aussi net qu'a Ishungu. La différence
est tout de même remarquable entre les phéopigments des
sédiments anciens comparés à ceux des sédiments
plus récents (Fig. 14 à droite).
Dans le domaine des biormaqeurs organiques, les
phéopigments trouvés dans les sédiments sont
considérés comme marqueurs de grazing zooplanctonique. Carpenter
et al.(1986) suggèrent que les phéopigments peuvent être
utilisées comme proxy de l'abondance du zooplancton ou de sa
prédation. La tranche de la carotte où survient le changement
spectaculaire coïncide avec l'introduction de Limnothrissa miodon
qui a eu lieu au lac Kivu à la fin des années 1950 et qui est
reconnu d'avoir soumis le zooplancton à une forte prédation
(Dumont 1986, Isumbisho et al. 2006). Cependant, la dégradation rapide
et facile des chloropigments dans les eaux aérées du bassin de
Bukavu peut également être accrue par la bioturbation au moyen des
macroorganismes benthiques (Bianchi et al. 2000).
CONCLUSION
Dans cette étude, l'attention était
focalisée sur la comparaison de la composition des sédiments du
lac Kivu en nutriments totaux (TP et TN) et en pigments totaux ; cas
spécifique des bassins d'Ishungu et de Bukavu. Les conditions oxiques
de la colonne d'eau à Bukavu comparées aux conditions anoxiques
du bassin d'Ishungu ainsi que la susceptibilité à subir un
turn-over des eaux ; d'une part et la proximite du bassin de Bukavu
à un bassin versant fortement anthropisé constituent des
différences limnologiques importantes capables d'influencer la
qualité chimique des sédiments d'un lac.
C'est ainsi que cette étude a
débouché aux conclusions suivantes :
· Dans la carotte d'Ishungu, les concentrations en TP et
TN ont varié entre 0,73 et 5,52 mg P/g de séd. et entre 0,95 et
9,85 mg N/g de séd. respectivement. Cependant à Bukavu, ces
concentrations varient entre 0,1 et 92 mg P/g de séd. et entre 0,8 et
7,3 mg N/g des séd.
· En moyenne, les sédiments de Bukavu contiennent
plus de phosphore que les sédiments d'Ishungu, ce qui traduit une
conséquence nette d'une forte anthropisation à la suite de
laquelle les apports allochtones en nutriments surtout particulaires sont
élevés par rapport au bassin d'Ishungu.
· Dans les deux bassins étudiés, le rapport
TN :TP est plus élevé dans les sédiments
récents (de surface) que dans les sédiments anciens (de
profondeur). En effet, ils diffèrent d'un facteur de 10,4 pour Bukavu et
1,6 pour Ishungu indiquant ainsi un changement considérable dans la
sédimentation et/ou dans le recyclage des nutriments au lac Kivu.
· Les profiles de Chl a ont montré que les
sédiments déposés à Ishungu contiennent plus de
Chlorophylle a que les sédiments déposées à Bukavu.
Quatre raisons complémentaires peuvent être
considérées, à savoir : (i) la dégradation
rapide et efficiente des pigments dans les eaux oxiques de Bukavu contrairement
à celles d'Ishungu où les pigments sont mieux
préservés suite aux conditions anoxiques (réductrices)
à l'interface eau-sédiment ; (ii) la dilution des pigments
en masse à Bukavu est relativement considérable par des
matières terrestres déposées en provenance du bassin
versant ; (iii) le brassage des eaux dans le bassin de Bukavu qui peut
être complet pendant les périodes de forts vents (saisons
sèches) est susceptible de rendre inefficiente l'accumulation et la
préservation des matières organiques dégradables dans les
sédiments tels que les pigments ; contrairement à ce qui se
passe dans le bassin d'Ishungu où la stratification permanente ne
permet pas la remontée des matières particulaires dans la colonne
d'eau ; (iv) les microorganismes benthiques sont aussi de nature à
augmenter le rejet des nutriments dans la phase dissoute par bioturbation pour
une colonne d'eau complètement aérobie.
· Le shift intervenu dans la distribution verticale des
phéopigments dans les 2 carottes différentes peut être
interprété comme étant une conséquence du
changement survenu dans la chaine alimentaire rapporté au lac Kivu par
plusieurs études suite à la forte prédation du zooplancton
causée par l'introduction volontaire du Limnothrissa miodon
dans le lac à la fin des années 1950.
En perspective, il serait important dans les recherches
à venir de s'intéresser à l'étude du cycle du
carbone ainsi qu'à la caractérisation moléculaire des
pigments biomarqueurs dans ces deux bassins afin de faire ressortir la
comparaison par rapport à l'histoire de la productivité du lac
ainsi qu'au peuplement des eaux par les communautés phytoplanctoniques.
BIBLIOGRAPHIE
André G., 2010. Notions de limnologie :
Différents types de lacs, Zonation limnétique, Lion. J.
Echoaquatc. 02.1007/978-94-4243
Anonyme, Encyclopédie Encarta, Microsoft Encarta
2009.
APHA (American Public Health Association) , 2005. Standard
methods for the examination of water and waste water, 21st edition (Centennial
edition). Eaton et al. (Eds.), APHA, AWWA and WEF. Washington DC, USA.
Beadle, L. C., 1981. The Inland Waters of Tropical Africa, an
Introduction to Tropical Limnology, 2nd ed. Longman, London, England, UK,
475p.
Bisimwa, C.J.-P. 2009. contribution à l'étude
limnologique du lac de barrage de la Ruzizi Ier. Mémoire de
Licence, Département de Chimie-Physique, ISP/Bukavu, Inédit,
Bukavu, RDC.
Château L. et Vaillant P. (2010). Acceptabilité
de matériaux alternatifs en techniques routières, Laboratoire
environnemental Ressources-LR. 16. 65-70
Cirhuza, M.G. 2010. La stratification de la matière
oxydable totale dans les eaux du lac Kivu (Cas du bassin d'Ishungu).
Mémoire de licence, inédit, Département de
Chimie-physique, ISP/Bukavu, Bukavu.
Collart, A., 1960. L'introduction du Stolothrissa tanganyikae
(Ndagara) au Lac Kivu. Bulletin Agriculture Congo Belge, 60 : 975-985
Damas, H., 1937. La stratification thermique et chimique des
lacs Kivu, Edouard et Ndalaga (Congo Belge), Verh. Int. Ver. Limnol. 8(3): 51 -
67.
Degens, E. T., Herzen R. P. V., Wong H. K., Deuse W. G. &
Jannasch H. W., 1973, Lake Kivu: Structure, Chemistry and Biology. Geol.
Rundsch 62, 245- 275.
Descy J.-P, Darchambeau F. and M. Schmid 2012. Limnology and
biochemistry of tropical great lake, Springer Dordrecht Heidelberg New York
London, J.-P Descy et al. (eds), Lake Kivu: Limnology and biochemistry of a
tropical great lake, Aquatic series 5, DOI 10.1007/978-94-4243-7_1, Springer
science+Business Media B.V. 2012
Descy, J.-P. and Sarmento, H. 2008. Microorganisms of the East
African Great lakes and their response to the environmental changes. Freshwater
Reviews (2008) 1:59-73.
Dumont, H. J., 1986. The Tanganyika Sardine in Lake Kivu:
another Ecodisaster for Africa? Environmental Conservation. 13, 143-148
Eawag: 2002. Lac Kivu: bombe à retardement ou source
d'énergie? (disponible sur
http://mhalb.pagesperso-orange.fr/kivu/index.htm)
Guard A., 2010. Notions de limnologie : Différents
types de lacs, Zonation limnique, Lion. J. Echoaquatc. 02.1007/978(2010) :
46-65
Haberyan, K.A. and Hecky, R.E., 1987. The late pleistocene and
holocene stratigraphy and paleolimnology of Lakes Kivu and Tanganyika,
Palaeogeogr. Palaeoclimatol. Palaeoecol.61: 169- 197.
Halbwachs, M., Tietze K., Lorke A. and Mudaheranwa, C., 2002.
Investigations in Lake Kivu (East Central Africa) after the Nyiragongo eruption
of January 2002. Solidarités, Aide Humanitaire d'Urgence, F-Paris, 2_
Hecky R.E, Bootsma, H.A , Mugidde, R.M and Bugenyi, F.W.B.,
1996. Phosphorus pumps, Nitrogen sinks and Silicon drains: PLumbing Nutrients
in the African Great Lakes. In:T.C. Johnson and E. Odada (eds.) The limnology,
Climatology and Paleoclimatology of the East African Lakes. Gordon and
Breach,Toronto, p 205-224.
Hecky, R.E., 1993. The eutrophication of Lake Victoria. Verh.
Internat. Verein. Limnol. 25: 39-48
Isumbisho M., Sarmento, H., Kaningini, B., Micha J.C. and
Descy, J.P., 2006. Zooplankton of Lake Kivu, East Africa: half a century after
the Tanganyika sardine introduction. J. Plankton Research 28(11): 1 -989.
Kaningini, J. Cl. Micha,, J Vandenhaute,, JP plateau, H.
Watongoka, C. Melard, MK. Wilondja et M. Isumbisho. 1999. pêche de
Sambaza au filet maillant dans le Lac Kivu. CERUKI, FUCID, UNECED, CCE.
Kaningini, M., 1995, Etude de la croissance, de la
reproduction et de l'exploitation de Limnothrissa miodon du lac Kivu, Bassin de
Bukavu (Zaïre). Thèse de doctorat, UNECED, Namur, 21p.
Kling, G. W., MacIntyre, S., Steenfelt, J. S. and Hirslund,
F., 2006. Lake Kivu gas extraction. Report on Lake stability, World Bank
Project.
Kling, G. W.,Clark,M. A., Compton, H. R., Devine, J. D.,
Evans, W.C., Humphrey, A,.M., Koenigsberg, E. J., Lockwood, J. P., Tuttle, M.
L. and Wagner, G. N., 1987. The 1986 lake Nyos gas disaster in Cameroon, West
Africa. Science 236:169-175.
Knops S. 2010. Contribution à l'étude
paléolimnologique du lac Kivu (Afrique de l'Est), Msc thesis,
Departments of Biology, FUNDP-UCL, Belgium.
Locat, J., Étude de la formation des sédiments
fins glacio-lacustres du lac Barlow-Ojibway : le site d'Olga.
2011,Département de géologie, Université Laval,
Sainte-Foy, 2011. Québec G1K 7P4 Matagami, Québec, 12/07 :
12-26
Matzinger, A., Spirkovski, Z.,Patceva, S., and Alfred
Wüest, A., 2006. Sensitivity of Ancient Lake Ohrid to Local Anthropogenic
Impacts and Global Warming. J. Great Lakes Res. 32:158-179.
Moeyersons, J., Tréfois, P., Lavreau, J., Alimasi, D.,
Badriyo, I., Mitima, B., Mundala, M.,Munganga, D.O., and Nahimana, L., 2004. A
geomorphological assessment of landslide origin at Bukavu, Democratic Republic
of the Congo. Elsevier, Engineering Geology 72: 73 - 87.
Mouvet C., Vaillant P., Babut M. et Pandard P., 2009.
Dangerosité des sédiments, Laboratoire environnemental,
Ressources-LR, 6: Q07009, doi:10.1029/2004GC000892.
Müller, B., Finger, D., Sturm, M., Prasuhn, V.,
Haltmeier, T., Bossard, P., Hoyle, C., Wüest, A., 2007. Present and past
bio-available phosphorus budget in the ultra-oligotrophic Lake Brienz. Aquat
42:W10414, doi:10.1029/2005WR004778.
Muvundja A. F., 2010. Riverine nutrients inputs to lake Kivu,
Aquatic sciences zoology, Makerere university, Reg. No. 2007/HD13/11068X
Muvundja F., Pasche N., Bugenyi F. W.B., Isumbisho M.,,
Namugize B., Rinta P., Schmid M., Stierli R., Wüest A., 2009. Balancing
nutrient inputs to lake Kivu, Journal of great lakes reseachs, INS 0380-1330.8.
DOI: 10.1016/j.jglr.2009.06.002
Nzayisenga T., 2007. Contribution à l'étude du
zooplancton du lac Kivu : cas du bassin Est au large de Kibuye,
Université Nationale du Rwanda Bachelor of Science in Biology 2007,
Biologie et Médecine, 5-7p.
Pasche N, Alunga G, Mills K, Muvundja F, Ryves DB, Schurter M,
Wehrli B, Schmid M., (2010.) Abrupt onset of carbonate deposition in Lake Kivu
during the 1960s: response to recent environmental changes. J. Paleolimnol. 44:
931-946.. DOI 10.1007/s10933-010-9465-x
Pasche N., Muvundja A. F., Schmid M., Wüest A. and
Müller B. Descy J.-P., 2012. (eds.), Lake Kivu: Limnology and
biogeochemistry of a tropical great lake, Aquatic Ecology Series 5, DOI 10.
1007/978-94-007-4244-7_4, Springer science+Busiiness Media B.V. 2012, 31-44
Pasche, N., Dinkel, C., Müller, B., Schmid, M.,
Wüest, A., and Wehrli, B., 2009. Physical and biogeochemical limits to
internal nutrient loading of meromictic Lake Kivu. Limnol. And Oceanogr. 54
(6):1863-1873.
Pasche, N., Schmid, M.,Vazquez, F., Schubert, C., Wüest,
A., Kesler J.D., Pack, M., A., Reeburgh, W.S., and Bürgman, H. 2011.
Methane sources and sinks in Lake Kivu. J. Geophys. Res.116, G03006,
doi:10.1029/2011JG001690.
Pasche, N., Wehrli, B., Alunga, G., Muvundja, F.A., Schurter,
M., and Schmid, M., 2010. Abrupt onset of carbonate deposition in Lake Kivu
during the 1960s: response to food 77 web alteration and hydrological
change. J. Paleolimnol 44:931-956.doi: 10.1007/s10933-010-9465-x
Sarmento, H., Isumbisho, M., Stenuite, S., Darchambeau, F.,
Leporcq, B. and Descy, J P., 2008. Phytoplankton ecology of Lake Kivu (eastern
Africa): biomass, production and elemental ratios.Verh. Internat. Verein.
Limnol. 30 :479-488
Sarmento, H., Isumbisho, M., Stenuite, S., Darchambeau, F.,
Leporcq, B. and Descy, J.-P. 2009. Phytoplankton ecology of Lake Kivu (Eastern
Africa): biomass, production and elemental ratios Verh. Internat. Verein.
Limnol. 2009, vol. 30, Part 5, p. 709-713
Schmid M., and Wüest A., Stratification, Mixing and
Transport Processes in Lake Kivu J.-P. Descy et al. (eds.), Lake Kivu:
Limnology and biogeochemistry of a tropical 31 great lake,
Aquatic Ecology Series 5: Q07009, doi:10.1029/2004GC000892.
Schmid, M., Tietze K., Halbwachs, M., Lorke, A., McGinnis, D.
and Wüest, A., 2004. How hazardous is the gas accumulation in Lake Kivu?
Arguments for a risk assessment in light of the Nyiragongo Volcano eruption of
2002. Acta Volcanologica 14/15 (2002-2003): 115 - 121.
Tietze, K., Geyh, M., Muller H., Schroder, L., Stahl, W. &
Wehner, M., 1980, The genesis of the methane in Lake Kivu (Central Africa).
Geologische Rundschau 69:452-472
http://mhalb.pagesperso_oragngr.fr/kivu/fr/ki_1c_structure.htm
http://www.eawag.ch/index_FR
http://www.geoforum.fr/
www.chem.qmul.ac.uk
TABLE DES MATIERES
EPIGRAPHE
I
DEDICACE
II
REMERCIEMENTS
III
LISTE DES TABLEAUX
V
LISTE DES FIGURES
VI
GLOSSAIRE
VII
RESUME
VIII
ABSTRACT
IX
INTRODUCTION GENERALE
1
0.1. OBJECTIFS
4
0.1.1. Objectif général
4
0.1.2. Objectifs spécifiques
4
0.2. Question de recherche
5
0.3. Justification
5
0.4. Subdivision du travail
5
Chapitre I. REVUE DE LA LITTERATURE
6
1.1. PRESENTATION ET ORIGINE DU LAC KIVU
6
1.2. CARACTERISTIQUES LIMNOLOGIQUES DU LAC
KIVU
7
1.3. PRODUCTION PRIMAIRE ET NUTRIMENTS LIMITANTS DU
LAC KIVU
12
1.4. COMPOSITION CHIMIQUE DES EAUX PROFONDES DU LAC
KIVU
14
1.5. LA SEDIMENTATION AU LAC KIVU
15
1.6. INFLUENCE DES CONDITIONS ENVIRONNEMENTALES SUR
LA QUALITE ET LA FORMATION DES SEDIMENTS LACUSTRES
17
1.7. LES PIGMENTS
20
1. Chlorophylle a : pigment
bleu-vert
21
2. La chlorophylle b : pigment
jaune-vert
21
3. Les bactériochlorophylles
22
Chapitre II. MATERIELS ET METHODES
24
2.1. SITES D'ECHANTILLONNAGE
24
2.2. ECHANTILLONNAGES DES CAROTTES
24
2.3. MESURE DES PIGMENTS TOTAUX
25
2.4. ANALYSE DES NUTRIMENTS TOTAUX
27
a. Analyse du phosphore total
27
b. Analyse de l'azote total
28
Chapitre III. PRESENTATION ET INTERPRETATION DES
RESULTATS
29
3.1. PRESENTATION DES RESULTATS
29
1. Physico-chimie des bassins
étudiés
29
2. Composition en nutriments
30
3. La chlorophylle a
33
4. Les phéopigments
34
3. 2. INTERPRETATION DES RESULTATS
35
CONCLUSION
39
BIBLIOGRAPHIE
41
TABLE DES MATIERES
46



