Chapitre II. MATERIELS ET
METHODES
2.1. SITES
D'ECHANTILLONNAGE
Le bassin d'Ishungu et celui de Bukavu font parties du bassin
sud du lac dont les sites d'échantillonnages pour cette étude se
situent respectivement à 2°16,134' latitude Sud et 28°59,456'
de longitude Est pour le bassin d'Ishungu. Pour le bassin de Bukavu, le site
d'échantillonnage se situe entre 2°20' et 2°30' latitude Sud
et 25°30' et 29° de longitude Est. La figure 2 représente le
bassin de Bukavu et celui d'Ishungu.
2.2. ECHANTILLONNAGES DES
CAROTTES
La carotte d'Ishungu et celle de Bukavu ont été
échantillonnées respectivement en dates du 1er et du
22 août 2012 grâce à un système de carottage
gravitaire (Fig.7)
 
Figure
7. Photos du carotteur utilisé (Modifie à partir de Knops
2009).
Les coordonnées géographiques des sites
d'échantillonnages ainsi que la navigation sur le lac ont
été assurées par un GPS (Garmin Olathe 72).
La carotte d'Ishungu, recueillie à environ 170 m de
profondeur a été découpée de haut en bas en 23
échantillons de 2 cm chacun et ce, en utilisant le dispositif vertical
représenté sur la partie gauche de la Figure 7. La carotte de
Bukavu quant à elle, elle a été découpée en
13 échantillons. Les 2 cm d'échantillons ont été
recueillis sur des boites à pétri dont des
prélèvements ont séchés à l'étuve
(Incubator cl-011) pendant au moins 24h à 70°C pour des analyses
des nutriments. Avant le séchage, quelques échantillons pris
comme références ont été pesés sur une
balance de précision (AND FR-200 MK II, Japan) afin de pouvoir suivre
l'évolution du séchage.
Les échantillons ont été
considérés comme complètement secs lorsque les
témoins ont acquis des masses constantes pendant au moins 6 heures. Un
autre prélèvement sur l'échantillon frais a
été réservé aux analyses des pigments
chlorophylliens.
2.3. MESURE DES
PIGMENTS TOTAUX
De chaque échantillon de 2 cm, il était
prélevé à l'aide d'une spatule, une masse d'environ 1g
dans des tubes à essai auquel il était ajouté 5 ml
d'acétone 90% pour l'extraction des pigments. Tous les
prélèvements des volumes utilisés étaient
assurés par des micropipettes.
Après ajout de l'acétone, ces
échantillons étaient gardés à froid et sous
obscurité au congélateur pendant 1 h avant de passer à la
première sonication de 15 minutes à l'aide d'un sonicateur
(Bandelin electronic Sonorex RK 100, Germany). La deuxième sonication
n'est intervenue que 24 h après. Avant cette deuxième sonication,
les échantillons étaient agités pour une durée de 2
h sur agitateur à plateau (Mini Rock Bio MR-1).
La centrifugation, pendant 20 minutes, nous a permis de
séparer l'acétone contenant les pigments du résidu ;
ce qui facilitait le transvasement à l'aide d'une pipette pasteur vers
des nouveaux tubes Falcon. La lecture spectroscopique sur un
spectrophotomètre (Spectronic unicam 4001/4, USA) nous a alors permis,
à partir des absorbances lues à une longueur d'onde de 665 nm, de
calculer les concentrations en chlorophylle a et en phéopigments des
échantillons par la méthode de Lorenzen (1967) (Descy ;
1992).
Méthode de Lorenzen et estimation des
phéopigments
Cette méthode a l'avantage d'être très
spécifique du phytoplancton ; elle peut s'appliquer à tout
échantillon, même si de matières organiques ou
minérales sont présentes. Les poudres de sédiments
(échantillons) sont aspergées dans 5 ml de solvant
(acétone 90%) et passées aux ultra-sons (sonication)
(Descy ; 1992).
Les extraits sont alors mesurés au spetro à une
longueur d'onde de 665nm avant et après acidification par HCl 0.1N.
Cette acidification dégrade les pigments chlorophylliens en
phéopigments. La concentration en phéopigments (ou en
chlorophylle « active ») est déterminée par
différence, d'après les équations de Lorenzen (pour
l'acétone 90%) (Descy ; 1992).
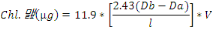
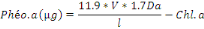
Avec :
· Db : La densité optique avant
acidification
· Da : La densité optique après
acidification
· V : Le volume de solvant en ml
· L : L'épaisseur de la cuvette de spetro en
cm
· Phéo. : Phéopigments a
· Chl.a : Chlorophylle a
La concentration de la Chl.a en ug/g de sédiment est
alors déterminée par [Chl.a] en ug/masse d'échantillon en
gramme.
| 


