
ÉíÑÆÇÒáÌÇ
ÉíÑæåãáÌÇ
ÉíÈÚÔáÇ
ÉíØÇÑÞíãÏáÇ
République Algérienne Démocratique et
Populaire
íãáÚáÇ
ËÍÈáÇ æ
áíÇÚáÇ
ãíÜáÚÊáÇ
ÉÑÇÒæ
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
ÉÈÇäÚ
ÑÇÊãÎ íÌÈÇ
ÉÜÚãÇÌ
Université Badji Mokhtar - Annaba
ãæáÚáÇ
Éíáß
Faculté des Sciences
ÉíæíáÍÇ
ÁÇíãíßáÇ
ãÓÞ
Département de Biochimie
MÉMOIRE
En vue de l'obtention du diplôme de
Master
Domaine : Sciences de la Nature et de la Vie
Filière
: Sciences Biologiques
Spécialité: Biochimie
Appliquée
Optimisation des conditions de culture des lipases
chez une souche bactérienne de type Actinomadura Keranitilytica
par
RSM
Présenté par :
Mlle MANSOURI Rayane Mlle HADJI Khaoula
Soutenu publiquement le : 29 Juin 2019 Devant le jury :
A. Habbeche M.C.B
Université Badji Mokhtar - Annaba Président
F. Benamia Professeur
Université Badji Mokhtar - Annaba Encadreur
A. Ladjama D. Chekireb
Co-Encadreur Examinateur
Professeur Professeur
Université Badji Mokhtar - Annaba Université Badji
Mokhtar - Annaba
Année universitaire : 2018/2019
|
|
|
|
|
Remerciements
Nous tenons tout d'abord à remercier Dieu le Tout
Puissant et Miséricordieux, qui nous a
donné la force et la
patience d'accomplir ce modeste travail.
La première personne que nous tenons à
remercier est notre encadreur madame Benamia
Fatiha Professeur
à l'université Badji Mokhtar-Annaba pour son
dévouement encadrement
continu, pour les remarques constructives
qu'elle a fournies ainsi que pour ses précieux
conseils durant toute
la période de notre travail. Ses conseils nous ont été
d'une grande aide.
Qu'elle trouve dans ce travail un hommage vivant à
sa haute personnalité.
Particulièrement, nous tenons à remercier
notre co-encadreur monsieur Ladjama Ali
Professeur à
l'université Badji Mokhtar-Annaba pour l'orientation, la
confiance, la patience
qui ont constitué un apport
considérable sans lequel ce travail n'aurait pas pu être
mené à
bon port.
Nos vifs et chaleureux remerciements vont également
à madame Habbeche Amina M.C.B
à l'université
Badji Mokhtar-Annaba de nous avoir fait l'honneur de présider
le jury.
Mes remerciements vont également à monsieur
Chekireb Djamel Professeur à l'université
Badji
Mokhtar-Annaba pour l'intérêt qu'il a porté
à notre recherche en acceptant
d'examiner et juger notre travail,
aussi de l'enrichir par ses propositions.
C'est avec un grand plaisir que nous témoignons ici
toute notre reconnaissance à la
doctorante Semache Noura
pour vous remercier beaucoup pour votre contribution à
ce
travail qui était fructueux, et pour vos idées et vos
remarques que vous n'avez jamais hésité
à nous les
donner avec un grand coeur généreux, vous méritez tout
notre profond respect et
toute notre reconnaissance.
|
|
|
|
|
|
|
|
Dédicace
,fie dédie ce modeste travail à
Ma très chère mère Drabna
Saliha
Source inépuisable de tendresse, de patience
et de sacrifice.
Quoique je puisse dire et écrire, je ne pourrais
exprimer ma grande affection et ma profonde reconnaissance.
Aucune
dédicace ne saurait être assez éloquente pour exprimer ce
que tu mérites pour tous les sacrifices que
tu n'as cessé de
me donner depuis ma naissance, durant mon enfance et même à
l'âge adulte.
Ta prière et ta Bénédiction m'ont
été d'un grand secours tout au long de ma vie.
Puisse Dieu
Tout Puissant, te préserver et t'accorder santé, longue vie
etBonheur
Mon très cher père Mansouri
Djilani
De tous les pères, tu es le
meilleur.
Tu as été et tu seras toujours un exemple pour
moi par tes qualités humaines, ta persévérance et
perfectionnisme.
Tes conseils ont toujours guidé mes pas vers la
réussite. Ta patience sans fin, ta compréhension et
ton
encouragement sont pour moi le soutien indispensable que tu as toujours
su m'apporter.
,fie te dois ce que je suis aujourd'hui et ce que je serai
demain et je ferai toujours de mon mieux pour rester ta
fierté et ne
jamais te décevoir. Aucune dédicace ne saurait exprimer mes
respects, ma reconnaissance et mon
profond amour.
Puisse Dieu vous préserver et vous procurer
santé et bonheur.
Mes frères &
soeurs
Aucune dédicace ne peut exprimer la profondeur des
sentiments fraternels et d'amour,
d'attachement que j'éprouve
à vos égards. ,fie vous dédie ce travail en
témoignage de ma profonde affection
en souvenirs de notre
indéfectible union qui s'est tissée au fil des jours. Puisse dieu
vous protéger, garder et
renforcer notre fraternité.
Mes neveux : Nassim ,jad, ferial ,
amir ,adam ,younes , et assil
A tous ceux que j'aime et qui m'aimentJe dédie ce
travail espérant avoir répondu à leur souhait de me voir
réussir.
Rayane Mansouri.
|
|
|
|
|
|
|
|
Dédicace
Je dédie ce modeste travail à
Ma très chère mère Maouche
Assia
Affable, honorable, aimable : Tu représentes pour
moi le
symbole de la bonté par excellence, la source de tendresse
et
l'exemple du dévouement qui n'a pas cessé de m'encourager
et
de prier pour moi.
Tu as fait plus qu'une mère puisse faire
pour que ses
enfants suivent le bon chemin dans leur vie et leurs
études.
Je te dédie ce travail en témoignage de mon
profond
amour. Puisse Dieu, le tout puissant, te préserver et
t'accorder santé, longue vie et bonheur.
Mon très cher père Hadji
Djamel
De tous les pères, tu es le meilleur.
Aucune
dédicace ne saurait exprimer l'amour, l'estime, et le respect que j'ai
toujours eu pour
vous.
Rien au monde ne vaut les efforts fournis jour et
nuit pour mon éducation et mon bien être.
Ce travail est le
fruit de tes sacrifices que tu as consentis pour mon éducation et
ma
formation.
Mes soeurs Soumia & Hadjer
Je vous dédie ce travail en témoignage de ma
profonde affection en souvenirs de notre
indéfectible union qui s'est
tissée au fil des jours. Puisse dieu vous protéger, garder
et
renforcer notre fraternité.
Hadji khaoula.
|
|
|

áßÔÊ
ÊÇãíÒäÅ íå
ÒÇÈíááÇ íæÞ
æãä æå
ÉíæíÍáÇ
ÉíÌæáæäßÊáÇ
ÊÇÞíÈØÊáá
ÉíÑÇÑÍáÇ
ÊÇãíÒäáÅÇ
ìáÚ ÈáØáÇ
äÅ
ÉáÆÇÚ äã
ÇðÁÒÌ
áÖÈ
äííãáÚáÇ
äíËÍÇÈáÇ
åÇÈÊäÇ
ÒÇÈíááÇ
ÊÈÐÌ
ÊÇãíÒäáÇ
ÒáÇæÑÏíåáÇ
åÐå ÚæäÊ
ÁæÖ í .äæåÏáá
íÆÇãáÇ
ááÍÊáÇ í
ÉßÑÇÔãáÇ
ÇåíØ
.ÉíÚÇäÕáÇ
ÊÇÚÇØÞáÇ
áÊÎã í
ÞíÈØÊáÇ äã
ÚÓÇæáÇ
äã ÉíÑÈ
ÉááÇÓ äã
ÌÑÎÊÓãáÇ
ÒÇÈíááÇ
ÌÇÊäÅ ÇåíáÚ
íæØäí íÊáÇ
ÉáÊÎãáÇ
ÑííÇÚãáÇ
äíÓÍÊ ìáÅ
ÇäíÚÓ áãÚáÇ
ÇÐå ááÇÎ
ÉÑÇÑÍáá
ÉÈÍãáÇ
actinomycète
ãÇãÖäáÇÇ
ãÞÑÈ
ÑÈÊÎãáÇ
ÉááÇÓ(
Actinommadura keritiniltytika Cpt29
.)KC447297
RSM ÉÞíÑØ äã
ÉíáÇËãáÇ
æÑÙáÇ äÚ
ËÍÈáÇ ä
ÇåíáÚ
áæÕÍáÇ ãÊ
íÊáÇ
ÌÆÇÊäáÇ
ÊÑåÙ
ÉãíÞáÇ
ÏíÏÍÊ
äßããáÇ äã
áÚÌ
ÉÑÇÑÍáá
ÉÈÍãáÇ
ÉááÇÓ
ÊíÓíãæäíÊßáÇ
ÉááÇÓ í
ÌÊÇäáÇ
ÒÇÈíááá
íãíÒäá Ç
ØÇÔäáá
ìáËãáÇ
ãÊ íÊáÇ
ìáËãáÇ
ÉãíÞáÇ .Cpt29
70(
ÌÇÑÎÊÓáÇÇ
ÏÚÈ ÇåíáÚ
áæÕÍáÇ ãÊ
íÊáÇ ÉãíÞáÇ
äã ÊÇÑã
ËáÇËÈ ÑÈß )áã
/ ÉÏÍæ
182( ÇåíáÚ
áæÕÍáÇ
.)áã / ÉÏÍæ
ÒÇÈíááÇ
Actinommadura keritiniltytika Cpt29
:ÉíÍÇÊãáÇ
ÊÇãáßáÇ
.äíÓÍÊáÇ
ÉÑÇÑÍáá
ÉÈÍãáÇ
RESUME
Résumé
La demande en thermo-enzymes pour des applications
biotechnologiques est de forte croissance. Les lipases sont des enzymes qui
font partie de la famille des hydrolases qui interviennent dans l'hydrolyse des
lipides. Vue la polyvalence de ces enzymes, les lipases ont attiré
l'attention des chercheurs scientifiques grâce à leur large
spectre d'application dans divers secteurs industriels.
Au cours de ce travail, nous avons cherché à
optimiser différents paramètres impliqués dans la
production de lipase extraite d'une souche sauvage d'actinomycète
thermophile Actinommadura keritiniltytika Cpt29 (souche de laboratoire
avec numéro d'accession KC447297).
Les résultats obtenus montrent que la recherche des
conditions optimales, à partir de la méthode RSM, a permis de
localiser la valeur optimale de l'activité enzymatique des lipases
produites chez la souche d'actinomycète thermophile Cpt29. La valeur
optimale obtenue (182 U/ml) est trois fois plus grande que celle prise
après extraction (70U/ml).
Mots clés : Actinommadura
keritiniltytika Cpt29, Lipase, Thermophiles, Optimisation.
ÕÎáã
|
RESUME
Abstract
The demand for thermo-enzymes for biotechnological
applications is strong growth. Lipases are the enzymes that are part of the
family of hydrolases involved in the hydrolysis of lipids. In view of the
versatility of these enzymes, lipases have attracted the attention of
scientific researchers thanks to their broad spectrum of application in various
industrial sectors. In this work, discrib the optimization process of various
parameters involved in the production of lipase extracted from a wild-type
Actinommadura keritiniltytika thermophilic actinomycete strain Cpt29
(laboratory strain with accession number KC447297). The obtained results show
that the search for optimal conditions, from the RSM method, made it possible
to locate the optimal value of the enzymatic activity of the lipases produced
in the thermophilic actinomycete strain Cpt29. The obtained optimum value (182
U / ml) is three fold greater than the one taken before optimization (70 U /
ml).
Key words: Actinommadura keritiniltytika Cpt29,
Lipase, Thermophiles, Optimization
|
|
Sommaire
|
I
II
02
05
06
06
07
08
09
09
11
12
12
13
13
13
13
14
15
16 18 18 20
SOMMAIRE
Liste des tableaux
Liste des figures
Introduction générale . .
CHAPITRE 1. ETUDE BIBLIOGRAPHIQUE
1.1. Généralités sur les
Actinomycètes
1.1.1. Classification des Actinomycètes
1.1.2. Morphologie des Actinomycètes
1.1.3. Physiologie des Actinomycètes
1.1.4. Matériel génétique
des actinomycètes
1.1.5. Cycle de
développement des Actinomycètes
1.1.6. Ecologie des Actinomycètes
1.1.7. Intérêt des actinomycetes
1.2. Généralités sur les
lipases
1.2.1. Définition et
caractéristiques
1.2.2. Origines des lipases ..
1.2.2.1. végétale .
1.2.2.2 Animale
1.2.2.3Microorganismes ....
1.2.3. Propriétés
physico-chimiques des lipases ..
1.2.4. Mécanisme d'action des lipases
.
1.2.5. Les microorganismes producteurs des
lipases
1.2.6. Applications des lipases et aspect
biotechnologique ..
12.6.1. Applications ..
12.6.2. Aspect biotechnologique
CHAPITRE 2. MATERIELS ET METHODES
|
2.1. Matériels
|
|
23
|
|
|
2.1.1. Produits chimiques
|
23
|
23
23
24
24
25
25
25
26
26
26
29
30
30
32
34 34 36 38
45
48
SOMMAIRE
2.1.2. Microorganismes
2.1.3. pH-stat
2.2. Méthodes
2.2.1. Extraction des lipases à partir de
la souche d'Actinomycète Cpt29
2.2.2. Dosage de l'activité lipasique par
titration des AG
..
2.2.3. Récupération et
purification de la lipase
2.3. Optimisation des paramètres de
culture de la lipase .
2.3.1.Présentation de la
méthode des plans d'expériences
2.3.1.1. Méthode classique
.
2.3.1.2. Méthode de plans d'expériences
2.3.1.3. Choix du plan d'expériences
2.3.1.4. Analyse des résultats de calcul
2.3.1.5. La technique d'analyse de variance
2.3.1.6. Acquisition progressive des
connaissances
CHAPITRE 3. RESULTATS ET DISCUSSION
|
3.1. Résultats et discussion .
3.1.1 Préparation du plan de criblage
3.1.2 Résultats du plan de criblage et
interprétation
3.1.3 Plan d'optimisation
|
|
|
|
.
|
CONCLUSION GENERALE ..
REFERENCES BIBLIOGRAPHIQUES
LISTE DES TABLEAUX
|
Tableau
|
Titre
|
Page
|
|
01
|
Classe Actinobacteria.
|
6
|
|
02
|
Habitats de certains actinomycètes.
|
10
|
|
03
|
Caractéristiques physico-chimique des microorganismes
producteur des lipases
|
14
|
|
04
|
Micro-organismes producteurs de lipasess.
|
17
|
|
05
|
Aperçu des applications
|
18
|
|
06
|
Facteurs et domaines du plans de criblage
|
34
|
|
07
|
Matrice des expériences de criblage
|
35
|
|
08
|
Effet et coefficient estimés pour la réponse
|
36
|
|
09
|
Analyse de variance pour l'activité lipasique.
|
37
|
|
10
|
Facteurs et domaine d'élude du plan de Box-Behnken.
|
38
|
|
11
|
Plan de Box-Behnken et les résultas expérimentaux
obtenus.
|
39
|
|
12
|
Coefficients estimés pour l'activité U/ml.
|
40
|
|
13
|
Analyse de variance pour l'activité U/ml.
|
40
|

LISTE DES FIGURES
|
Figure
|
Titre
|
Page
|
|
01
|
Observation au microscope électronique à
balayage illustrant les types fragmentaire et permanent du mycélium des
actinomycètes. (A) Bactéries du genre Nocardia
en fragmentation, (B) Bactéries du genre Streptomyces
en sporulation.
|
7
|
|
02
|
Cycle de développement des actinomycètes sur milieu
solide .
|
9
|
|
03
|
Présentation de la réaction enzymatique, qui
catalyse l'hydrolyse ou la synthèse de triglycéride.
|
13
|
|
04
|
Mécanisme d'intervention de la triade (Ser-Hist-Asp) et
formation de l'acyl-enzyme.
|
15
|
|
05
|
pH-stat piloté par un micro ordinateur ( SI
ANALYTICS Titroline® 7000).
|
23
|
|
06
|
Aspect morphologique d'actinomycète thermophile strain
cpt29.
|
24
|
|
07
|
La courbe y = f(x) .
|
26
|
|
08
|
L'établissement du plan d'expériences
.
|
28
|
|
09
|
Graphique de comparaison de réponse mesurée et
estimée.
|
30
|
|
10
|
Diagramme de Pareto des effets des variables explicatives.
|
37
|
|
11
|
Diagramme des réponses mesurées en fonction de
celles estimées.
|
41
|
|
12
|
Diagrammes de contours présentant les effets des
différents facteurs sur l'activité.
|
42
|
|
13
|
Optimisation de l'activité par la fonction
Désirabilité.
|
43
|
II
INTRODUCTION
Les enzymes sont des protéines qui allient la
capacité de reconnaitre très spécifiquement des
molécules au pouvoir de catalyser efficacement leur transformation en
composées utiles au métabolisme des organismes vivants. Les
réactions chimiques dans les systèmes biologiques se font
rarement en l'absence d'enzymes et celles-ci ne favorisent pas seulement une
réaction chimique donnée, elles empêchent aussi la
présence de réactions secondaires gênantes. Une enzyme est
une protéine, qui de par sa séquence et sa structure tertiaire ou
quaternaire, possède la capacité d'interagir avec une autre
molécule et de la modifier chimiquement.
C'est ainsi qu'au cours de ces dernières années,
les enzymes se retrouvent dans de nombreux domaines : chimie fine,
agro-alimentaire, secteur biomédical, etc. Pour cela beaucoup de
recherches s'orientent maintenant vers l'étude de la
spécificité et l'exploitation du potentiel synthétique
d'enzymes produites à partir de souches de micro-organismes. Divers
microorganismes, notamment différentes espèces
d'actinomycètes présentent des capacités de
biodégradation des molécules organiques aussi variées que
récalcitrantes. Cette fonction de biodégradation est due à
la variété d'enzymes qu'elles peuvent synthétisé
telles que les cellulases, les xylanases, les amylases et les lipases
(A.J.Mc Carthy et al.,1992). Ces dernières
années, il a été rapporté que des enzymes
thermoactives ont été extraites des souches bactériennes
du type Actinomycètes thermophiles, parmi ces enzymes on cite les
keratinases d'Actinomadura keratinilytica (A.Habbeche et
al., 2014).
C'est dans ce contexte que nous nous sommes
intéressés à la recherche d'enzymes lipasiques produites
par des souches bactériennes d'Actinomycètes autochtones
thermophiles issues du compost de poulet qui est connu pour abriter des
microorganismes thermophiles. Dans le présent travail, une souche
d'actinomycète isolée à partir d'échantillons de
déchets de volailles riches en matières organiques, ont fait
l'objet d'un criblage dans cette optique.
La première partie de ce manuscrit est consacrée
à une présentation bibliographique sur les actinomycètes
en général ainsi qu'un aperçu sur les enzymes lipasiques.
La seconde partie du document développe les méthodes
utilisées et les résultats obtenus relatifs aux
différentes étapes de ce travail à savoir l'extraction et
l'isolement de l'enzyme lipidique, l'optimisation de production de l'enzyme.
2
INTRODUCTION
Le plan de ce mémoire sera le suivant :
Chapitre 1 : Etude bibliographique Chapitre 2 : Méthodes
et matériels Chapitre 3 : Résultats et discussion
3
|
Chapitre1
Etude bibliographique
|
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE 1.1.
Généralités sur les Actinomycètes
Les microorganismes sont omniprésents dans notre
environnement (le sol, l'air et les eaux)
et ne cessent d'occuper une place de plus en plus importante
dans notre vie et sont actuellement à l'origine de l'essor du domaine de
la biotechnologie (S.Smaoui,2010)
Parmi ces microorganismes, les actinomycètes ont acquis
une importance particulière, car ils sont la source la plus importante
pour la productions d'antibiotiques et d'autres métabolites secondaires
(K.Sudo et al.,1995; J.J.Sanglier et al.,1996 ;
Y.Takahashi et S.Omura,2003 et M.Kitouni et al.,2005 ; A.M.Valan et
al.,2008) , ils sont connus pour être à
l'origine de la production d'environ 80% des antibiotiques
commercialisés (J.Bérdy,2005).
Etymologiquement, le mot actinomycète a
été dérivé des mots grecs «Aktis» qui
veut dire rayon et «mykes» qui veut dire champignon «Champignons
à rayons» ou «Champignons rayonnants». Les
actinomycètes ont été considérés comme un
groupe intermédiaire entre bactérie et champignons. Maintenant,
ils sont reconnus comme des organismes procaryotes. Pourtant, ces
microorganismes présentent des similitudes à la fois avec les
bactéries et avec les champignons (H.Merizig,2015).
Les actinomycètes, ou Actinobacteria, sont des
bactéries dont la croissance donne lieu à des colonies
circulaires à la morphologie complexe (H.Merizig,2015).
Ce sont des bactéries Gram-positives aérobies qui
forment des filaments ramifiés ou hyphes et de spores asexuées.
Bien qu'ils constituent un groupe diversifiés, les actinomycètes
partagent de nombreuses propriétés (L.M.Prescott et
al., 2003). Ces bactéries constituent l'ordre des
Atinomycetales. Ce sont des bactéries formant des filaments minces et
ramifiés, septées, bacilles à Gram positive;
possédant un coefficient de Chargaff (GC%) élevé compris
entre 60-70%, la majorité saprophytes. La plupart des espèces
sont immobiles, hétérotrophes mais certaines sont
chimio-autotrophes (H.Merizig, 2015).
Les actinomycètes sont très répandues
dans la nature, surtout dans les sols ou leurs capacités
métaboliques très étendues leurs font jouer un rôle
majeur dans le recyclage de la matière organique. Divers
microorganismes, notamment différentes espèces
d'actinomycètes présentent des capacités de
biodégradation des molécules organiques aussi variées que
récalcitrantes.
Cette fonction de biodégradation est due à la
variété d'enzymes qu'elles peuvent synthétisé
telles que les cellulases, les xylanases, les amylases et les
lipases (A.J.Mc Carthy et al.,
5
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
1992). Ces dernières années, il a
été rapporté que des enzymes thermoactives ont
été extraites des souches bactériennes du type
Actinomycètes thermophiles, parmi ces enzymes on cite les keratinases
d'Actinomadura keratinilytica (A.Habbeche et
al.,2014) .
1.1.1. Classification des
Actinomycètes
Les actinomycètes appartiennent au règne des
Procaryotes, à la division des Firmicutes et à
la classe des Thalobacteria, contenant l'ordre des
Actinomycetales (J.P.Larpent,2000). La classe des
Actinobacteria se présente comme suit (tableau 1) :
Tableau 1 : Classe des Actinobacteria
|
Sous-classe
|
Ordre
|
Famille
|
|
Acidimicrobidae
|
Acidimicrobiales
|
Acidimicrobiaceae
|
|
Rubrobacteridae
|
Rubrobactérales
|
Rubrobacteraceae
|
|
Coriobacteridae
|
Coriobactérales
|
Coriobacteriaceae
|
|
Sphaerobacteridae
|
Sphaerobactérales
|
Sphaerobacteraceae
|
|
Actinobacteridae
|
Actinomycétales
|
|
1.1.2. Morphologie des Actinomycètes
La plus part des genres sont des bâtonnets, non
sporulant, de forme irrégulière, Ces bâtonnets peuvent
être droits ou légèrement
incurvés(L.M.Prescott,2003).
Morphologiquement, on peut les classés en deux groupes
:
- Le premier forme seulement une masse de filaments
ramifiés (mycélium).
- Le second comprend des organismes qui sont morphologiquement
plus complexes que le premier (H.Merezig,2015).
Le mycélium des actinomycètes présente
une grande diversité de morphologies. On rencontre des espèces
dont le mycélium est rudimentaire au point d'être inexistant (la
plupart des Mycobacterium), d'autres au mycélium fugace, qui se
fragmente (certaines Nocardia), et enfin des espèces au mycélium
développé et persistant comme dans le genre Streptomyces. Les
mycéliums fragmentaires et permanents sont illustrés sur la
(figure 1).
6
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE

Figure 1. Observation au microscope
électronique à balayage illustrant les types fragmentaire et
permanent du mycélium des actinomycètes. (A)
Bactéries du genre Nocardia en fragmentation, (B)
Bactéries du genre Streptomyces en sporulation
(L.Belyagoubi, 2014).
Les conidies peuvent, suivant les groupes, être
produites isolément (Micromonospora), deux à deux
longitudinalement (Microbispora), en courtes chaînes (Actinomadura), en
longues chaînettes (Streptomyces). Les chaînettes de spores peuvent
être ramifiées ou non, droites, sinuées ou en spirales. De
plus, elles peuvent être rayonnantes autour d'hyphes sporophores
(Streptoverticillium) (http: // www
.universalis.fr/encyclopedie/actinomycetes, mai 2018).
Les actinomycètes sont reconnus depuis plus de cent ans
principalement sur des critères morphologiques. Ils sont
généralement considérés comme des bactéries
capables de ramifier les hyphes à un stade de leur développement
(https: // doi . org / 10. 1146 / annurev. Mi . 37
.100183.001201, mai 2018). Pour la plus part des
actinomycètes ne sont pas mobiles et lorsque qui il y a une
mobilité, elle est limité aux spores flagellés qui
permettent la dispersion dans les habitats aquatiques
(L.M.Prescott,2003).
1.1.3. Physiologie des Actinomycètes
La croissance des actinomycètes est influencée
par plusieurs paramètres physiologiques en particulier :
l'oxygène, le pH, la température...etc. ces paramètres se
présentent comme suit :
? Oxygène : On peut deviser les
actinomycètes selon leurs types respiratoires en deux grands groupes :
Les formes fermentatives anaérobies strictes ou facultatives,
représentées par le genre type Actinomyces, et les formes
oxydatives aérobies, telles que les Streptomyces.
7
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
? pH: Pour le pH, la plupart des
actinomycètes se comportent comme des bactéries neutrophiles, et
font une croissance optimale dans un intervalle de pH compris entre 7 et 8.
Mais on peut observer une croissance à des valeurs de pH
inférieurs à 4 (R.E.McKinney,2004), telle est le
cas pour les souches acidophiles comme le genre Streptacidiphilus
(L.Wang et al.2006).
? Température: La température
optimale de croissance est entre 25 à 30°C, mais les espèces
thermophiles peuvent croitre à des températures entre 55 et
65°C (G.Rangaswami et al.,2004).
? Tolérance en NaCl: Selon leurs
exigences en NaCl, les microorganismes sont divisés en deux groupes :
? Les halophiles : Ce sont ceux qui ont besoin de sel (NaCl)
pour leurs croissances, cette concentration peut varier de 1 à 6 %
(Poids/Volume) pour les faiblement halophiles, jusque 15 à 30 % pour les
bactéries halophiles extrêmes.
? Les halotolérants : Acceptent des concentrations
modérées de sels mais non obligatoires pour leurs croissances. On
distingue, ceux qui sont : légèrement tolérants
(tolère de 6 à 8 % de NaCl (Poids/Volume) ; les
modérément tolérants (tolère de 18 à 20 % de
NaCl (P/V) ; et les extrêmement tolérants (se développe de
0 % jusqu'à saturation en NaCl) (H.Merizig,2015).
1.1.4. Matériel génétique des
actinomycètes
Le matériel génétique des
actinomycètes est constitué d'ADN (Acide
désoxyribonucléique) chromosomique ainsi que chez certaines
souches par l'ADN plasmidique ou de l'ADN phagique. La plus part des
actinomycètes sont caractérisées par une proportion
élevée en (G/C) environ 70 %.
Elles possèdent un remarquable degré de
variabilité génétique due à des
réarrangements du
génome à cause de plusieurs types de mutations
essentiellement chromosomiques, les plasmides peuvent aussi être sujets
à des réarrangements. (H.Merizig, 2015).
8
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE 1.1.5. Cycle de
développement des Actinomycètes
Le cycle de vie de nombreux actinomycètes commence par
la germination des spores (Figure 2). Ce processus
nécessite la présence des ions de calcium. Cette germination
donne naissance à un mycélium primaire ramifié
(R.O'Gara et al., 2008). Un mycélium
aérien vient s'installer au-dessus du mycélium de substrat. Ce
dernier s'autolyse et les produits de la lyse sont utilisés par le
mycélium aérien. C'est généralement, à ce
moment-là que les composés dit métabolites secondaires
sont synthétisés (S.Smaoui, 2010). A
l'extrémité du mycélium aérien se forme des spores
asexuées à paroi fine appelées conidies ou conidiospores.
Ces spores naissent par séptation du mycélium primaire
habituellement en réponse à un stresse environnemental comme le
manque de nutriment par exemple. Si les spores sont enveloppées dans un
sac, on les appelle des sporongiospores.
Généralement ces spores ne sont pas
résistantes à la chaleur, mais résistent bien à la
dessiccation et sont donc doués de capacités adaptatives
importantes. Les actinomycètes sont immobiles, excepté pour les
spores de certains genres (Actinoplan, Spirillospora....etc.)
(L.M.Prescott et al,2010).
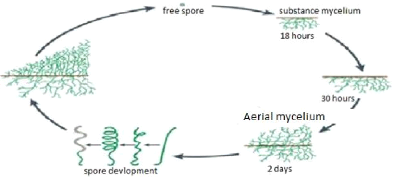
Figure 2: Cycle de développement des
actinomycètes sur milieu solide (A. Breton et al
.,1989).
1.1.6. Ecologie des Actinomycètes
Historiquement, les actinobactéries étaient
largement considérées comme des bactéries du
sol, mais sont maintenant reconnues comme étant
cosmopolites. On les trouve dans pratiquement tous les
écosystèmes, avec une distribution couvrant la plus grande partie
de la
9
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
planète. En tant que microbes vivant en liberté,
ils sont abondants dans les milieux pédologiques, en particulier ceux
qui ont un pH plus élevé et dans les écosystèmes
marins et d'eau douce. Les actinobactéries sont également
associées à des hôtes eucaryotes dans diverses niches,
telles que l'exosquelette de certaines fourmis tropicales, les poumons et la
peau des mammifères, ainsi que les racines et les tissus internes des
plantes. Certains genres, y compris Streptomyces, Kineococcus et Mycobacterium,
s'étendent sur divers écosystèmes du sol au milieu marin
en eau douce. D'autres, comme Atopobium, Bifidobacterium, Kocuria et Rothia, se
trouvent principalement dans les associations hôtes. Leurs
présences dans les niches les plus divers montre leur capacité
physiologique à croître dans différentes et grande gamme de
conditions physico-chimique. Ces capacités extraordinaires sont
d'ailleurs exprimées dans le patrimoine génétique de ces
bactéries. Cependant plusieurs rôles écologiques de ces
bactéries sont encore méconnus (R.L.Gina Lewin et
al., 2016).
Les actinomycètes ont une importance pratique
considérable. Ils peuvent dégrader un
nombre et une variété énorme de
composés organiques et ils sont extrêmement importants pour la
minéralisation de la matière organique (L.M.Prescott et
al., 2003).
Ils sont généralement saprophytes, mais peuvent
vivre à l'état libre ou en association. Les associations
établies sont : la symbiose avec les plantes non légumineuses
comme le genre Frankia (fixation de l'azote atmosphérique) ou
l'endophytisme dans les tissus de plantes où ils stimulent leur
croissant (H.Merizig, 2015).
Tableau 2 : Habitats de certains
actinomycètes (R.Grigorova et J.R.Norris, 1990).
|
Actinomycètes
|
Habitats
|
|
Actinoplanes
|
L'eau douce, la litière végétale, le sol.
|
|
Frankia
|
Les nodules racinaires des non légumineuses.
|
|
Micromonospora
|
L'eau douce, les sédiments, les sols humides.
|
|
Nocardia amarae
|
Les boues activées.
|
|
Rhodococcus coprophilus
|
Les déjections animales, l'eau, le sol.
|
|
Saccharopolyspora rectivirgula
|
Moisi du foin.
|
|
Streptomyces
|
Le sol, la litière végétale, l'eau.
|
|
Thermoactinomyces
|
Le compost
|
10
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE 1.1.7.
Intérêts des actinomycètes
Les actinomycètes possèdent une importance dans
divers domaines tels que :
a) le secteur médical, pharmaceutique et
vétérinaire
Les actinobactéries du milieu marin sont
considérés comme des bactéries prometteuses de
composés pharmaceutiques importants en raison d'un
différent type de caractéristiques d'adaptation uniques
(W.Fenical, et P.R.Jensen,2006).
Elles sont le pilier des industries d'antibiotiques. Ils
jouent un rôle important dans la production de variété de
ces molécules extrêmement importants pour notre santé
(H.S.Chaudhary et al., 2013). Les antibiotiques ont
aussi trouvé une application dans les élevages industriels
d'animaux et des pantes. Ils sont utilisés non seulement pour combattre
les maladies des animaux et des plantes, mais aussi dans l'alimentation pour
accroître les rendements zootechniques (H.Merezig,
2015).
b) le domaine agronomique
Ces bactéries ont un rôle important dans les
processus de recyclage et de biodégradation de la matière
organique et des éléments minéraux et contribuent ainsi
à la fertilisation des sols. Un grand pouvoir de transformation des
substances organiques complexes difficilement ou non dégradables par les
autres microorganismes, tels que les polymères complexes, les
polysaccharides, la chitine ... etc (N.Zergan, 2016).
c) les enzymes
Les enzymes sont les produits industriels les plus importants
des actinomycètes (J.Theilleux, 1993) après les
antibiotiques. En effet, les actinobactéries sont d'excellents
producteurs d'enzymes à utilisation industrielle telle que des
protéases, des chitinases (Y.Tanaka et S.Omura, 1990 ;
G.Vonothini et al., 2008), des amylases, des cellulases, des
xylanases et des lipases (J.O.Park et al., 2002).
11
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
1.2. Généralités sur les
lipases
1.2.1. Définition et
caractéristiques
Les lipases font partie de la classe des hydrolases d'esters
carboxyliques, largement présentes chez les plantes et chez les animaux
ainsi que chez les microorganismes (F. Pabai, 1997). Ces
enzymes appartiennent au groupe des sérines hydrolases et exigent la
présence d'aucun cofacteur pour leur activité. Il a
été rapporté que les lipases sont définies comme
étant des carboxyles estérases qui catalysent l'hydrolyse et la
synthèse d'esters formés de glycérine et des acides gras
de longues chaînes (M. Gargouri et
al.,2008).
Ces enzymes présentent une grande
spécificité au substrat et dégradent souvent des esters du
p-nitrophenyl de l'acyle, Tweens et phospholipides avec une
sélectivité vis-à-vis de la position stéréo
de la longueur de chaîne.
Les lipases constituent un groupe d'enzymes très
largement utilisées en biotechnologie qui trouve de nombreuses
applications dans différents secteurs industriels tels que l'industrie
pharmaceutique, l'industrie alimentaire, l'agrochimie (pesticides), l'industrie
des détergents, l'industrie des cosmétiques et des parfums,
etc...(A. Ghanem,2007). Elles jouent un rôle important
dans le métabolisme des graisses et sont présentes dans la
plupart des tissus animaux et végétaux, et aussi dans de nombreux
micro-organismes (S. Gupta et al.,2008)
La fonction biologique des lipases est de catalyser
l'hydrolyse d'esters comme les triglycérides. Elles reconnaissent
différemment les acides gras selon leur degré d'insaturation et
la longueur de la chaîne carbonée. Cependant, elles sont capables
d'hydrolyser une très grande variété de substrats naturels
et non-naturels et de réaliser en milieu organique des réactions
de synthèse. Dans cette classe d'enzymes, on trouve les lipases (EC
3.1.1.3) qui sont les plus employées par les chimistes organiciens
(V. Gotor-Fernandez et al.,2006).
L'étude de cette classe d'enzyme a contribué
à l'élaboration d'une enzymologie interfaciale, dont la
réaction est produite en milieu hétérogène à
l'interface huile-eau. Les propriétés biochimiques de cette
classe d'enzymes dépendent particulièrement de certains
paramètres tels que le pH ou la force ionique (R.
Verger,1985).
Les lipases comme les estérases
caractérisées par leur stabilités et leur activité
dans des
solvants organiques sont des biocatalyseurs importants,
particulièrement adaptés pour des applications industrielles
(B.M. Schmidt et al.,2004).
12

CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
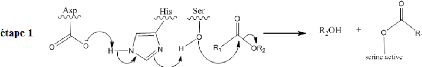
Figure 3 : Présentation de la
réaction enzymatique, qui catalyse l'hydrolyse ou la synthèse de
triglycéride (K.E. Jaeger et al., 1994 ; S. Benjamin et
A. Pandey,1998).
1.2.2. Origines des lipases
Les lipases sont omniprésentes dans la nature et
peuvent être obtenues à partir de nombreuses sources, telles que
les plantes, les micro-organismes et les animaux (A. Salihu et
al., 2012).
1.2.2.1. Végétale
Les lipases se trouvent au sein de la plante, principalement
dans les graines où les trilycérides sont stockés dans des
structures intracellulaires appelées oléosomes (P.
Fickers et al.,2007 ; L. Casas -Goday et al.,2012).
Ces derniers contiennent des lipases capables d'être utilisées
dans la biotransformation des lipides dans les domaines suivants la papeteries,
l'oléochimie, la farine de blé et les huiles essentielle
(R.Wilfried et al.,2011).
1.2.2.2. Animale
La plupart des lipases d'origine animale sont obtenues
à partir du pancréas des bovins, d'ovins, de porcs et de cochons.
Malheureusement, les lipases extraites du pancréas des animaux sont
rarement pures pour être utilisées dans l'industrie alimentaire.
En effet, la lipase pancréatique du porc est polluée par des
traces de trypsine. D'autres impuretés comprennent des virus et des
hormones animales peuvent coexister avec ces enzymes (L. Casas- Godoy
et al., 2012).
1.2.2.3. Microorganismes
Les lipases sont largement répondues chez les
bactéries, les levures et les champignons filamenteux ;
L'intérêt des lipases microbiennes n'a cessé de s'accroitre
au cours de ces dernières années principalement en raison du
grand nombre d'application qu'elles offrent dans les domaines très
variée (A.Rihani,2012). Ces lipases possèdent
des procédés de
13
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
fabrication simples avec une grande stabilité
vis-à-vis la température, les détergents et les enzymes
protéolytiques (K.E. Jaeger et al.,1994).
? Origine bactérienne
Les bactéries répondues dans la production de
lipases sont plusieurs, et vu que la classification des microorganismes peut
changer à l'issue de nouvelles découvertes taxonomique ; le nom
des lipases microbiennes souvent été modifié à
titre d'exemple la lipase de Pseudomonas fluorescens est devenue
lipase de Pseudomonas cepaci ; la lipase de Candida cylindracea
est devenue lipase de Candida rugosa (A. Najjar,2010).
La lipase de Serratia marcescens est utilisée pour la
production de Méthyl-glycidate, employée dans la synthèse
d'un antagoniste du calcium (A.Rihani,2012).
? Origine fongique
La lipase de Yarrowia lipolytica est en cours de
développement au centre wallon de biologie industrielle et son
application qui intéresse le secteur clinique (W.A.M.Alloue et
al., 2008). La lipase de Mucor javanicus,
utilisée dans l'extraction et le fractionnement des huiles marines
extraites à partir des poissons et des algues, conduit à une
diversité de molécule d'acylglycéroles et trouvent de
nombreuses applications dans le domaine agroalimentaire et de la santé
(M.Linder et al.,2004).
1.2.3. Propriétés physico-chimiques des
lipases
Des études quantitatives sur la production de lipase et
les facteurs modifiant la libération
de l'enzyme dans le milieu de croissance, ont
été décrites chez de nombreux microorganismes
(tableau 3).
Tableau 3 : caractéristiques
physico-chimiques des microorganisme producteurs des lipases
|
Source
|
pH
|
Température(C O)
|
Références
|
|
Staphylococcus hominis MTCC 898
|
7,9
|
33,1
|
(AL. Behera et al., 2019)
|
|
Pseudomonas reinekei
|
5,0-9,0
|
40
|
(P. Priyanka et al., 2019)
|
|
Amycolatopsis sp AS9
|
7-24
|
30
|
(R. Balachandar et al., 2019)
|
|
Streptomyces griseochromogenes LE-11
|
7,0
|
55
|
(B. Gunalakshmi et al., 2008)
|
|
|
Aspergillusniger MTCC
|
6
|
40
|
(N. Ashutosh et al., 2019)
|
14
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
1.2.4. Mécanisme d'action des lipases
Les lipases diffèrent entre elles par le nombre
d'acides aminés constituant leur structure primaire. Par exemple, la
lipase de Candida rugosa contient plus de 500 acides aminés
tandis que la lipase de Candida antarctica B en contient 317.
Cependant, la caractéristique commune de toutes les lipases est que
leurs sites actifs sont constitués de trois acides aminés,
appelés la triade : sérine, aspartate ou glutamate et histidine
(A.Ghanem,2007).
Cette triade d'acides aminés, ajoutée à
quelques autres résidus, constitue le site actif de l'enzyme. Celui-ci
est protégé par un « couvercle » qui en bloque
l'accès et ne s'ouvre qu'au contact d'une phase hydrophobe pour
permettre la complexation du substrat, lipide hydrophobe, et faciliter ainsi la
catalyse de la réaction. Cette activation interfaciale du biocatalyseur
constitue la caractéristique principale des lipases. Le mécanisme
d'intervention de la triade (Ser, Hist et Asp) lors de l'hydrolyse d'un ester
est donné par le schéma suivant (R.D. Schmid et
al.,1998):
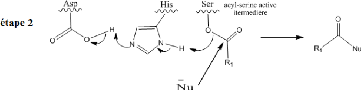
Figure 4 : Mécanisme d'intervention de
la triade (Ser-Hist-Asp) et formation de l'acyl-
enzyme.
Comme le montre le schéma ci-dessus, la disposition
particulière des trois résidus formant
la triade permet, dans une première étape,
l'attaque nucléophile du substrat R1CO2R2 pour donner un complexe
appelé acyl-enzyme avec libération de l'alcool R2OH.
Dans une seconde étape, cet intermédiaire
acyl-enzyme subit une attaque nucléophile par
l'eau présente dans le milieu,
régénérant ainsi l'enzyme par expulsion de l'acide R1CO2H,
produit de la réaction.
15
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
L'idée de l'utilisation des lipases en synthèse
organique était basée sur l'hypothèse que d'autres
nucléophiles que l'eau pourrait attaquer l'acyl-enzyme, en particulier
dans un milieu pauvre en eau comme le milieu organique. C'est ainsi que depuis
le début des années quatre vingt et les travaux d'A.M. Klibanov
(A. Z. Klibanov et al., 1985) s'est
développée toute une chimie autour de l'utilisation des lipases
en synthèse organique qu'on peut résumer comme suit :
? Estérification: RCOOH + R'OH ? RCOOR' + H2O
? Interestérification: R1COOR'1 + R2COOR'2 ? R1COOR2' +
R2COOR1' ? Alcoolyse: R1COOR1' + R2OH ? R1COOR2 + R1'OH
? Acidolyse: R1COOR1' + R2COOH ? R1COOR2 + R1'COOH
1.2.5. Les microorganismes producteurs de
lipases
De nombreux microorganismes sécrètent des
lipases dans le milieu de culture. Janda et ces collaborateurs (2005) ont
criblés 1229 bactéries, levures, actinomycètes et
champignons sur des plaques d'agar contenant de l'huile de Soja et de la
rhodamine B et ils ont trouvé qu'environ 25 % de ces microorganismes
présentent une activité lipolytique. Quelques exemples de
microorganismes lipolytiques sont rassemblés et regroupés dans
le Tableau 4.
La présence de lipases chez de nombreux
micro-organismes leur permet d'utiliser des «sources
non-conventionnelles» de carbone comme les triglycérides ou
d'autres lipides
16
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE Tableau 4 :
microorganismes producteurs des lipases
|
La source de la lipase
|
Genre
|
Espèce
|
Référence
|
|
Bactéries (grame +)
|
Bacillus Geobacillus Staphylococcus Clostridium Myxococcus
|
Bacillus sp.
Geobacillus zalihae
S. saprophyticus
C .tetanomorphum
Myxococcus xanthus
|
(K.M. Heravi et al.,2008)
(R. Rahman et al.,2007)
(Y. Fang et al.,2006)
(M. Petersen & R. Daniel, 2006)
(A.Moraleda-Munoz & J. Shimkets, 2007)
|
|
Bactéries (gram -)
|
Burkholderia
Pseudomonas
|
Burkholderia sp
P. monteilli
|
(Y. Matsumiya et al.,2007)
(S.L. Wag et al.,2009)
|
|
Actinomycètes
|
Streptomyces
|
Str. Coelicolor
|
(A. Côté et al.,2008)
|
|
Champignons
|
Penicillium Aspergillus Rhizopus Candida
|
Pe. Cyclopium
A. niger
Rhizopus
oligosporus C. rugosa
|
(R. Vardanega et al.,2008)
(A.G. Brito-Madurro et al.,2008)
(T. Iftikhar et al.,2008)
(A. K. Singh & M. Mukhopadhyay , 2012)
|
|
Levures
|
Yarrowia Humicola
|
Y. lipolytica H. lanuginosa
|
(A. Najjar, 2010)
(A. K. Singh & M. Mukhopadhyay, 2012)
|
17
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE 1.2.6. Applications
des lipases et aspect biotechnologique
1.2.6.1. Applications
Les lipases extraites de souches bactériennes thermophiles
sont les plus demandé dans le
domaine industriel, à cause de leur grande
stabilité thermique et leur résistance aux températures
élevées (M.Berekaa et al.,
2009).
Le domaine d'application des lipases industrielles couvre
diverses industries et
applications telles que les oléochimiques, les
détergents,polymères, agro-alimentaire, pharmaceutique,
déchets, cosmétiques et biodiesel (tableau
5).
Tableau 5 : Aperçu des applications
industrielles des lipases (H.S.Chaudhary,2015)
|
Secteurs industriels
|
Applications
|
|
Matières grasses et oléochimie
|
la tendance actuelle dans l'industrie oléochimique est
de faire appel à la lipase immobilisée pour catalyser
l'hydrolyse, l'estérification et l'interestérification des huiles
et des matières grasses au lieu des procédés
physico-chimiques (économie de réactions)
|
|
Détergents
|
Après les protéases en tant qu'additifs
détergents, les lipases
constituent le deuxième groupe le plus important
d'enzymes
détergentes. contribuer à l'élimination des
taches et des traces d'huile et de graisse. Les lipases sont utilisées
à la fois en lessive et en vaisselle formulations de détergents
commerciaux où ils ont été
optimisés pour fonctionner sous divers pH et conditions
de
température. Lipex® et Lipolase® de Novozymes
sont deux
exemples de lipases vendues aux industries des
détergents
|
|
Produits de beauté et
parfumerie
|
Les lipases sont utilisées dans la production d'agents de
surface (par
exemple, les mono-acylglycérols et les
diacylglycérols) par
l'estérification contrôlée de
glycérols. Dans les industries des
cosmétiques et des parfums,
les lipases peuvent être utilisées pour la synthèse de
citronellyl butyrate et de valérate.
|
18
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
|
Polymères
|
les lipases peuvent être utilisées pour aider
à la production de polymères, tels que le polyester, le PLA
(polylactide), le PCL (polycaprolactone) et bien d'autres, en alternative aux
réactions catalysées chimiquement (Pollet,
2015).
|
|
Transformation des aliments
|
les lipases sont utilisées dans les produits laitiers
pour le
développement des arômes, mais également
dans la transformation d'autres aliments, tels que les produits carnés,
les aliments cuits au four, la transformation du beurre de cacao, etc.
|
|
Pâtes et papiers
|
Pâtes et papiers: La présence de composants
hydrophobes
(principalement des triglycérides et des cires) dans le
bois est préjudiciable à de nombreux processus de production de
papier et de
pâte, et les lipases peuvent être utilisées
pour éliminer ces
triglycérides indésirables.
|
|
Secteurs médical et
pharmaceutique
|
En raison de leur grande spécificité, les
lipases peuvent être utilisées pour produire des composés
pharmaceutiques actifs. Par exemple, les
enzymes énantiosélectives sont utilisées
comme technologie
alternative à la chromatographie chirale
(D.Gerard, 2015). Les
lipases sont également utilisées dans la
production de
lysophospholipides à partir de phospholipides et dans
l'extraction et la production de lipides fonctionnels (B.Lennon,
2015).
|
|
Traitement des déchets /
effluents / eaux
usées
|
Traitement des déchets / effluents / eaux usées:
des lipases sont ajoutées pour éliminer les fines couches de
graisses formées à la surface des réservoirs d'eaux
usées et ainsi rétablir les conditions de transport de
l'oxygène actif nécessaires au maintien d'une croissance optimale
de la biomasse
|
|
Biodiesel
|
Les lipases sont utilisées pour produire du biodiesel
à partir de diverses matières premières telles que l'huile
de palme ou les graisses
animales. Des lipases thermostables ont été
développées pour
optimiser l'application d'enzymes dans la
production de biodiesel (P.M.Nielsen, 2016)
|
19
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
1.2.6.2.Aspect biotechnologique
L'aspect biotechnologique de la production des lipases
s'oriente aussi bien la biotechnologie blanche que vers la biotechnologie
moderne , cependant dans les deux cas , l'objectif est d'une part augmenter le
niveau de production ( optimisation de la culture ou par clonage de
gènes) et d'autre part , cibler un caractère donné ( pH
extrême ) pour s'adapter aux conditions de l'industrie pour
répondre aux besoins du marché mondial des enzymes.
Du point biotechnologie moderne, nous citons quelques exemples
d'applications réalisées par de nombreux chercheurs. Ainsi, la
farine de graine de coton est un co-produit de l'industrie du coton, produit en
grande quantité dans le monde entier. Le but est de valoriser ce
sous-produit par la production de lipases Rhizomucormiehei
et l'application du solide fermenté sec dans des réactions
d'estérification entre l'acide oléique et l'éthanol ou le
méthanol et la Trans estérification d'une huile
végétale. Le solide fermenté séché
était également capable de catalyser la production d'esters
d'éthyle et de méthyle par des réactions
simultanées de transestérification / estérification de
l'huile d'acide macaúba (Macauba est une espèce de palmier
oléagineux d'Amérique latine. C'est une riche source d'huile
végétale avec divers avantages), avec production d'une teneur
en ester d'environ 76% après 24 h. C'est la première fois que
des solides fermentés produits dans la farine de graine de coton sans
aucune supplémentation sont utilisés comme biocatalyseur dans les
réactions d'estérification et de
transestérification.(E.CG.Aguieiras et
al.,2019).Egalement un autre travail de biotechnologie
enzymatique (S.Hua et al.,2019) a pu isoler un
gène de lipase, lipPN1, a été cloné
à partir de Proteus sp. NH 2-2 et exprimé dans E.
coliBL21 (DE3) pour obtenir des lipases actives pour la production de
biodiesel en repliant Proteus sp. corps d'inclusion de lipase
exprimés dans E. coli . De même qu'un gene lipase a
été cloné à partir de Bacillus cereus et
exprimé dans Escherichia coliBL21. Les résultats ont
montré que L' Escherichia coli exprimant le recombinant
Bacillus cereus protéine lipase qui donne une importante
activité de la lipase plus élevée et la capacité
dégradation de l' huile. Ces résultats suggèrent que la
lipase de Bacillus cereus XN12 constitue une solution potentielle pour
diminuer la pollution par les huiles alimentaires (W.Haiyan et
al., 2019).
D'autres travaux de recherche (fatma et al.,2019)
sur une culture bactérienne mésophile, produisant une
lipase alcaline extracellulaire, a été isolée des eaux
usées de lavage des gaz générées par l'usine de
phosphate de Sfax du groupe chimique tunisien et identifiée comme
étant la souche Staphylococcus capitis . La lipase,
nommée S. capitis lipase (SCL), a été
20
CHAPITRE 1 : ETUDES BIBLIOGRAPHIQUE
purifiée jusqu'à
homogénéité à partir du milieu de culture. Le SCL a
montré une stabilité significative en présence de
détergents et de solvants organiques. En outre, SCL était
compatible avec les détergents disponibles dans le commerce et son
incorporation augmentait les performances de dégradation des lipides, ce
qui en faisait un candidat potentiel dans la formulation de
détergent.
Récemment (15 février 2019) une souche
tunisienne Serratia sp ( W3) a été isolé
et purifié. Il a été démontré que la souche
W3 sécrétait une lipase non induite dans le milieu de
culture. L'activité lipolytique a été
optimisée à l'aide de de la méthode de Box-Behnken
(BBD) de la méthodologie de surface de réponse (RSM). Le
SmL purifié peut être considéré comme une lipase
thermoactive. En contraste avec d'autres décrits lipases, Sml a
été trouvée comme étant stable à une grande
échelle de pH compris entre pH 5 et pH 12. Sml a également pu
hydrolyser son substrat en présence de divers agents oxydants,
ainsi que dans la présence d' agents tensio- actifs et certains
commerciale détergents. Ensuite, compte tenu de l'ensemble des
propriétés biochimiques du SmL, celui-ci peut être
considéré comme un candidat potentiel pour des
applications industrielles et biotechnologiques, telles que la synthèse
de biodiesel et dans l'industrie des détergents (A.Eddehech et
al.,2019) .
C'est dans ce contexte que nous nous sommes
intéressés à la production d'enzymes lipidiques extraites
des souches bactériennes du type Actinomycètes thermophiles.
L'objectif de notre travail porte sur l'optimisation des conditions de
production de ces lipases. La partie expérimentale de cette étude
sera développé dans les chapitres 2 et 3.
21
|
Chapitre 2
Matériels et Méthodes
|

CHAPITRE 2 : MATERIELS ET METHODES
2.1. Matériels
2.1.1. Produits chimiques
En dehors de la protéine extraite de souche
bactérienne, préparé au laboratoire et dont le processus
d'extraction est décrit ci-dessous, les autres produits chimiques
utilisés dans la production de l'enzyme lipasique, sont d'origine
commerciale (FLUKA, SIGMA ALDRICH).
2.1.2. Microorganisme
Dans le cadre de la recherche de lipases microbiennes
thermostables, nous avons utilisé la souche d'Actinomycète
thermophile Cpt29 (Compost poulet, thermophile, isolat numéro 29), dont
le gène est déposée dans la banque des gènes avec
numéro d'accession KC447297,qui a été isolée dans
notre laboratoire à partir d'échantillons de compost de poulet
prélevés en février 2008 au niveau de l'Unité de
Chaire engraissement Poulet appartenant au Groupe Avicole de l'Est (G.A.E) et
la Société des Abattoirs de l'Est (S.A.E) Algérien (Wilaya
d'Annaba) (S.Haberra et al.,2013) et conservée
sur milieu ISP2(International Streptomyces Project) à 4°C.
2.1.3. pH-stat
L'activité lipasique a été mesurée
automatiquement par l'intermédiaire d'un pH-stat piloté par un
micro ordinateur ( SI ANALYTICS Titroline®
7000).
Figure 5 : pH-stat piloté par un micro
ordinateur ( SI ANALYTICS Titroline® 7000).
23

CHAPITRE 2 : MATERIELS ET METHODES
2.2. Méthodes
2.2.1. Extraction des lipases à partir de la
souche d'Actinomycète Cpt29
Une souche d'Actinomycète thermophile (cpt29) a
été utilisée pour la production des lipases du type
keratinase d'Actinomadura keratinilytica strain cpt29 (figure
6). Cette souche a été précédemment
identifiée et isolée dans le Laboratoire de Biochimie et de
Microbiologie Appliquées (LBMA).
Figure 6 : Aspect morphologique
d'actinomycète thermophile strain cpt29.
La souche d'Actinomycète Cpt29 est cultivée sur
milieu liquide à base de tween 80. Le pH de milieu est ajusté
à 8 avant stérilisation et l'incubation se fait dans des
erlenmeyers stériles de 500ml contenant 100ml d'un milieu exclusivement
minéral composé de : K2HPO4 (0.8g/L), KH2PO4 (6g/L), (NH4)2SO4
(1g/L), MgSO4, 7H2O (0.2g/L), CaCl2 (0.05 g/L), NaCl (3g /L) et FeSO4 (0.0001
g/L). Après ensemencement, l'incubation se fait dans un shaker
thermostaté à 45°C sous agitation (150rpm) pendant 5
jours.
Après 5 jours d'incubation sur milieu liquide à
base de tween80, l'activité lipolytique est mesurée dans le
surnageant de culture obtenu par centrifugation à 10000×g et
filtration.
24
CHAPITRE 2 : MATERIELS ET METHODES
2.2.2. Dosage de l'activité lipasique par
titration des AG
L'activité lipasique a été
déterminée, à l'aide d'un pH-stat (SI ANALYTICS
Titroline® 7000), à pH= 8 par titration des
acides gras libérés avec une solution de NaOH (0,1N). Le substrat
utilisé est une émulsion d'huile d'olive à 10 % (10 ml
d'huile d'olive dans 90 ml de gomme arabique à 10
%).
L'activité enzymatique est exprimée en
unité internationale (UI). Une unité d'activité
lipasique correspond à la libération d'une
micromole d'acide gras par minute (umol/min). La cinétique et le calcul
de l'activité enzymatique sont donnés automatiquement par
l'appareil.
2.2.3. Récupération de la lipase
La précipitation est utilisée pour purifier
partiellement et concentrer les protéines solubles dans le surnageant.
L'acétone entre en compétition avec les protéines pour
réagir avec les molécules d'eau. Ceci entraîne une
désolvatation suivie d'une précipitation. La précipitation
fractionnée des protéines a été
réalisée par l'addition de l'acétone froid en faible
quantité au surnageant de culture, sous agitation douce à
4°C jusqu'à de saturation (3v/v) ; après les
protéines précipités sont récupérées
par centrifugation à 12000×g pendant 25min, Le culot est remis
immédiatement en suspension dans le minimum de tampon tris-Hcl
20mmol.
2.3. Optimisation des paramètres de cultures de la
lipase
Dans toute recherche expérimentale, comme c'est le cas
en biochimie, le chercheur essaye toujours de trouver la meilleure
stratégie pour conduire ses expériences. Les plans
d'expériences sont une méthodologie de choix pour répondre
à cette préoccupation. Ils sont, en effet, applicables à
toutes les disciplines expérimentales où l'on recherche le lien
existant entre un gradeur mesurée, y, et des variables, xi, qui peuvent
modifier sa valeur, c'est-à-dire l'étude et l'analyse de la
relation y = f (xi).
Avec la méthodologie des plans d'expériences, on
obtient les informations les plus fiables en un minimum d'essais. Les effets
des différents facteurs intervenant dans le processus
étudié, sont alors quantifiés et les conditions optimales
définies. Avec le développement de l'outil informatique et
l'apparition de logiciels performants, cette tache est rendue encore plus
facile.
25
CHAPITRE 2 : MATERIELS ET METHODES
2.3.1. Présentation de la méthode des plans
d'expériences
Lors de l'étude d'un phénomène,
c'est-à-dire celle de la relation y = f (xi), le chercheur effectue des
plans des expériences. Celles-ci peuvent être conduites de
manière classique ou de manière planifiée, comme c'est le
cas des plans d'expérience. Nous allons dans ce qui suit,
présenter la méthode classique puis celle des plans
d'expériences.
2.3.1.1. Méthode classique
Une méthode classique consiste à fixer le niveau de
tous les facteurs sauf un, et l'on
mesure la réponse y en fonction de différents
valeurs du facteur non fixée. A la fin de l'expérimentation sur
cette première variable, on peut tracer la courbe : y = f (xi),
(figure 7).
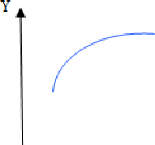
Figure 7 : La courbe y = f(x)
(J.Goupy,2017)
Si l'on veut étudier toutes les variables il faut
recommencer chacune des expériences (J.Goupy,2017).
Cette méthode est coûteuse en nombre d'essai et inefficace : elle
ne permet pas d'optimiser le processus ni de trouver d'éventuelles
interactions entre les facteurs. Pour cette raison les expérimentateurs
font appel à la méthode des plans d'expériences.
2.3.1.2. Méthode des plans d'expériences
Les plans d'expériences constituent, essentiellement,
une stratégie de planification d'expériences afin d'obtenir des
conclusions solides et adéquates, de manière efficace et rapide.
La méthodologie des plans d'expérience se base sur le fait qu'une
expérience convenablement organisée, conduira
nécessairement à une analyse et à une
interprétation statistique relativement simple des résultats
(K.Sandrine, 2004).
26
CHAPITRE 2 : MATERIELS ET METHODES
La démarche de cette méthodologie peut se
décomposer en trois étapes :
1) choix d'une méthode d'expérimentation
2) l'analyse des résultats
3) l'acquisition progressive des connaissances
Choix d'une méthode
d'expérimentation
Le choix d'une méthode d'expérimentation est
tributaire d'une bonne définition de la
problématique à traiter. Tous les facteurs
pouvant avoir une influence sur la réponse doivent être pris en
compte dans l'établissement du plan d'expériences.
Description de problème
D'une manière générale, la description
d'un problème, quel qu'il soit, consiste à répondre
à
un certain nombre de questions que résument la
méthode de SADO connue sous le nom de méthode de
?QQCQQP?( G.Sad et al.,1991).
Ces questions sont les suivantes :
> Q : En quoi consiste le problème ?
> Q : Qui est gêné par le problème ? Qui
est le demandeur de l'étude ?
> C : Combien de cas ? Combien ça coûte ?
> Q : Où cela se passe-t-il ?
> Q : Quand cela arrive-t-il ?
> P : Pourquoi est un problème ?
L'établissement du plan d'expériences
(J.Goupy,2017) afin d'optimiser la réponse consiste en
la démarche suivante (figure 8):
27
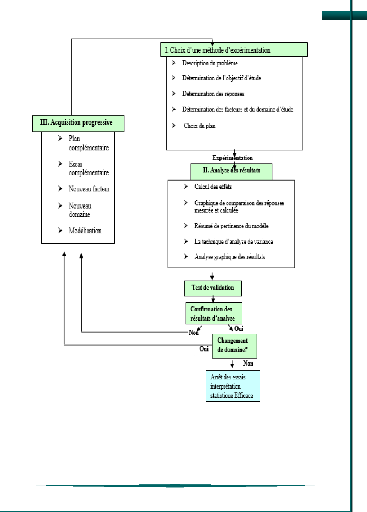
CHAPITRE 2 : MATERIELS ET METHODES
Figure 8 : L'établissement du plan
d'expériences (J.Goupy,2017).
28
CHAPITRE 2 : MATERIELS ET METHODES 2.3.1.3. Choix du plan
d'expérience
Le choix du plan sera guidé par l'analyse de tous les
points précédents. On distingue plusieurs types de plans :
Les plans factoriels complets à deux
niveaux
Pour ces plans le nombre de niveaux de chaque facteur est
restreint à deux et le nombre des
essais réalisés est égal à
2n (n représente le nombre de facteurs). Le modèle
mathématique postulé relatif à ce plan est le suivant :
y=b0+?bixik+??bijxikxjk+4k
Où,
y : réponse xi, xj : niveau attribuer au facteur i, j
b0 : valeur de réponse au centre du domaine d'étude
bi : l'effet du facteur i
bij : l'interaction entre i et j
åk : résidu (écart)
b- les plans de surface de réponse
Ces plans permettent d'établir des modèles
mathématiques de second degré (modèle quadratique
complet).
y=b0+?bixik+??bijxikxjk+?bikxik2+ 4k
Parmi les plans de seconds degrés les plus employés
citons
> les plans composites centrés
> Les plans de Box-Behnken
> les plans hybrides
29
CHAPITRE 2 : MATERIELS ET METHODES
2.3.1.4. Analyse des résultats de
calcul
De nombreux logiciels commerciaux sont spécialement
conçus pour les plans d'expérience (JMP, Minitab, Statisca,
etc...). Ces logiciels permettent dans un premier temps, de définir la
matrice d'expérience et dans un deuxième temps le traitement des
données expérimentales obtenues. Pour l'analyse des
résultats de nombreuses rubriques existent dans les logiciels traitant
des plans d'expériences (sommaire d'ajustement, analyse de variance,
etc...) qui donnent les informations nécessaires avec une bonne
appréciation des résultats (modèles obtenus).
Graphique de comparaison des réponses
mesurées et réponses estimées
Plus les points du graphique sont proche de la première
bissectrice, plus le modèle rend assez
bien compte des réponses, et vice-versa (figure
9).

s
Réponse (mesurée)
s
s
s
s
s
s
s
ss
s
s
s
Réponse (estimée)
Figure 9 : Graphique de comparaison de
réponse mesurée et estimée
b. Résumée de la pertinence du
modèle (qualité descriptif)
La pertinence de modèle est généralement
vérifiée par le coefficient de détermination
(R2). Ce coefficient varie entre 0 et 1, plus il
est proche de 1 plus les réponses calculées seront fortement
corrélées avec les réponses expérimentales
(J.Goupy, 2017).
2.3.1.5. La technique d'analyse de variance
L'analyse de variance (ANOVA) permet de comparer les variances
des valeurs calculées
par le modèle et les résidus. Cette analyse
constitue un test statistique (test de Fisher-Snedecor) et elle fournit les
réponses aux questions suivantes (K.Sandrine, 2004):
30
CHAPITRE 2 : MATERIELS ET METHODES
? Est-ce que le modèle nous apporte quelque chose ? la
régression est elle significative ?
? Est que le modèle représente bien le
phénomène ? Test de validation
préliminaire
Bien que les écarts entre les valeurs observées
et les valeurs calculées par le modèle aient été
minimisés par le choix de la méthode des moindre carrés,
il faut s'assurer que localement, les résidus ne soit pas anormalement
important. Tout d'abord on calcule à partir de l'équation du
modèle les différents yi on obtient alors la valeur de
résidus :
Ci = yi - yi'
En résumé un meilleur ajustement du modèle
est obtenu s'il rempli les conditions suivantes :
? R2 proche à 1
? Probabilité de signification P = á <
0,05
? Coefficient F de Fisher le plus grand possible
Validation des résultats
L'analyse de résultats des essais permet d'identifier
une combinaison optimale des facteurs qui n'a pas forcément fait l'objet
d'un essai dans le plan. Il faudra alors tester la combinaison optimale, qui
n'a pas été faite dans le plan d'expérience, ce qui arrive
fréquemment avec cet essai final, on rejettera ou pas le modèle
proposé.
De plus, quand on arrive à l'étape de l'analyse
finale, il faut vérifier le résultat obtenu par
l'analyse est plausible ou non. Dans l'essai de validation,
soit l'essai confirme les informations
? Si oui, le plan d'expériences aura joué son
rôle et permis de mettre en évidence les facteurs influents et/ou
d'optimiser et la réponse, c'est-à-dire trouver les valeurs des
facteurs qui donnent la réponse optimale
? Si non, il faudra alors examiner les conditions dans
lesquelles a été oublié ou s'il ne se cache pas un effet
d'interaction entre deux facteurs ou encore d'autres choses.
31
CHAPITRE 2 : MATERIELS ET METHODES
2.3.1.6. Acquisition progressive des
connaissances
A ce stade, l'expérimentateur désire de
l'information supplémentaire et en fonction de l'analyse du premier
résultat obtenu ; il choisira sa stratégie
? Plan complémentaire : pour désaliaser les
effets principaux et les interactions qui pouvaient présenter des
ambiguïtés.
? Essai complémentaire
? Niveaux de facteur : lorsque les facteurs
préfixées deviennent actifs
? Nouveau domaine : le choix d'un nouveau domaine
d'étude peut provenir de plus raison le domaine initial était
trop grand ou il était trop petit, le domaine initial ne contient pas
des résultats intéressants.
Au cours de ce travail, nous avons cherché à
optimiser les conditions de culture de la lipase extraite de la souche
d'Actinomycète Cpt29. L'objectif principale de cette étude est
amélioré significativement la production de l'enzyme lipasique.
Pour cela nous avons fait appel à la méthodologie des plans
d'expériences. Dans un premier temps nous avons testés onze
paramètres expérimentaux de culture et ceci dans un but
d'identifier les plus influents. La seconde étape de cette partie
d'étude est l'optimisation et la modélisation de la production de
cette lipase en fonction des facteurs expérimentaux de culture. Pour
l'optimisation nous avons choisi la méthodologie des surfaces de
réponses (RSM). Les résultats obtenus de cette étude
seront interprété et discuté dans le chapitre 3.
32
|
Chapitre 3
Résultats et Discussion
|
CHAPITRE 3 : RESULTATS ET DISCUSSION
3.1. Résultats et discussion
3.1.1. Préparation du plan de criblage
L'optimisation des conditions de culture pour obtenir une
meilleure production de la lipase à partir de la souche locale Cpt29, a
été mise au point à partir d'un plan de surface de
réponse (RSM). Cette étude d'optimisation utilisant une approche
chimiométrique a été élaborée après
une étape de criblage. Cette dernière étape nous a permis
de mettre en évidence les facteurs influents des conditions de cultures
qui mèneront à une meilleure production de la lipase. L'approche
statistique a été réalisée La démarche
expérimentale se présente comme suit :
? Détermination des facteurs et domaine
d'étude du plan de criblage
Afin de ressortir les facteurs de culture les plus influents,
nous avons décidé de faire appel dans un premier temps à
un plan de criblage. C'est un plan de premier degré utile pour
évaluer la pertinence d'un modèle de premier degré et
identifier les variables explicatives significatives qui permettent une
meilleure réponse. Pour cela nous avons choisi le plan de Plackett
-Burman en raison de son économie en termes de nombre d'essais. Dans
notre travail nous avons décidé de prendre en compte onze
facteurs potentiellement influents sur le cours de la production de la lipase.
Ces facteurs ainsi que le domaine de variation, sont précisés
dans le (tableau 6).
Tableau 6 : Facteurs et domaine d'étude
du plan de criblage.
|
Facteur
|
Unité
|
Niveau bas (-1)
|
Niveau haut (+1)
|
Symbole
|
|
Température
|
°C
|
40
|
50
|
X1
|
|
Temps
|
joures
|
2
|
5
|
X2
|
|
Ph
|
/
|
7
|
9
|
X3
|
|
Tween 80
|
%
|
2
|
4
|
X4
|
|
[FeSO4]
|
g/l
|
0,001
|
0,01
|
X5
|
|
[CaCl2]
|
g/l
|
0,01
|
1
|
X6
|
|
[NaCl]
|
g/l
|
3
|
4
|
X7
|
|
[MgSO4]
|
g/l
|
0,1
|
0,2
|
X8
|
|
[K2HPO4]
|
g/l
|
0,7
|
0,8
|
X9
|
|
[KH2PO4]
|
g/l
|
5
|
6
|
X10
|
|
[(NH2)4SO4]
|
g/l
|
1
|
1,5
|
X11
|
34
|
CHAPITRE 3 : RESULTATS ET DISCUSSION ? Construction du
plan de criblage et réalisation des essais
? Matrice des expériences
Afin de mieux cerner le problème nous fait varié
onze facteurs des paramètres expérimentaux de culture
(température, temps, pH, source de carbone (Tween80), [CaCl2], [MgSO4],
[K2HPO4], [KH2PO4], [NaCl], [(NH2)4SO4]). Le plan de Plackett-Burman pour onze
facteurs, comprend quinze essais, dont trois au centre du domaine. Il a
été l'aide du logiciel Minitab, version 16 (tableau
7).
Tableau 7 : Matrice des expériences du
plan de criblage.
|
|
|
[FeSO4],
réalisé à
|
|
|
Essai
|
X1
|
X2
|
X3
|
X4
|
X5
|
X6
|
X7
|
X8
|
X9
|
X10
|
X11
|
Activité (U/ml)
|
|
1
|
40
|
2,0
|
9
|
4
|
0,0100
|
0,010
|
4
|
0,3
|
0,7
|
7
|
0,5
|
48
|
|
2
|
50
|
5,0
|
9
|
2
|
0,0100
|
1,000
|
2
|
0,3
|
0,7
|
5
|
0,5
|
89
|
|
3
|
40
|
5,0
|
7
|
2
|
0,0010
|
1,000
|
4
|
0,3
|
0,7
|
7
|
1,5
|
21
|
|
4
|
50
|
5,0
|
7
|
4
|
0,0100
|
0,010
|
4
|
0,1
|
0,7
|
5
|
1,5
|
101
|
|
5
|
48
|
3,5
|
8
|
3
|
0,0055
|
0,505
|
3
|
0,2
|
0,8
|
6
|
1,0
|
121
|
|
6
|
50
|
2,0
|
9
|
2
|
0,0010
|
0,010
|
4
|
0,3
|
0,9
|
5
|
1,5
|
31
|
|
7
|
50
|
2,0
|
7
|
2
|
0,0100
|
1,000
|
4
|
0,1
|
0,9
|
7
|
0,5
|
29
|
|
8
|
40
|
2,0
|
7
|
2
|
0,0010
|
0,010
|
2
|
0,1
|
0,7
|
5
|
0,5
|
12
|
|
9
|
50
|
2,0
|
9
|
4
|
0,0010
|
1,000
|
2
|
0,1
|
0,7
|
7
|
1,5
|
59
|
|
10
|
45
|
3,5
|
8
|
3
|
0,0055
|
0,505
|
3
|
0,2
|
0,8
|
6
|
1,0
|
103
|
|
11
|
40
|
5,0
|
9
|
2
|
0,0100
|
0,010
|
2
|
0,1
|
0,9
|
7
|
1,5
|
41
|
|
12
|
40
|
2,0
|
7
|
4
|
0,0100
|
1,000
|
2
|
0,3
|
0,9
|
5
|
1,5
|
24
|
|
13
|
40
|
5,0
|
9
|
4
|
0,0010
|
1,000
|
4
|
0,1
|
0,9
|
5
|
0,5
|
64
|
|
14
|
45
|
3,5
|
8
|
3
|
0,0055
|
0,505
|
3
|
0,2
|
0,8
|
6
|
1,0
|
118
|
|
15
|
50
|
5,0
|
7
|
4
|
0,0010
|
0,010
|
2
|
0,3
|
0,9
|
7
|
0,5
|
93
|
|
|
|
35
|
CHAPITRE 3 : RESULTATS ET DISCUSSION
3.1.2. Résultats du plan de criblage et
interprétation ? Traitement et analyse statistique des
données
Le traitement des données a été
effectué par régression linéaire multiple à l'aide
du
logiciel Minitab. Les valeurs des effets et les coefficients de
régression du modèle sont donnés dans le (tableau
8).
Tableau 8: Effets et coefficients estimés
pour la réponse
|
Terme
|
Effet
|
Coefficient
|
Probabilité (P S á = 0.05)
|
|
Constante
|
-
|
51
|
0,003
|
|
X1
|
32,00
|
16
|
0,029
|
|
X2
|
34,33
|
17
|
0,025
|
|
X3
|
08,67
|
4
|
0.260
|
|
X4
|
27,67
|
13
|
0,038
|
|
X5
|
08,67
|
4
|
0,260
|
|
X6
|
- 06,67
|
-3
|
0,354
|
|
X7
|
- 04,00
|
-2
|
0,547
|
|
X8
|
00,00
|
0
|
1,000
|
|
X9
|
- 08,00
|
- 4
|
0,287
|
|
X10
|
- 05,00
|
- 2
|
0,464
|
|
X11
|
- 09,67
|
- 4
|
0,225
|
Les résultats du traitement du plan de Plackett-Burman
obtenus montrent que parmi tous les facteurs étudiés, seule la
température, le temps et le Tween 80 qui ont une influence
36
t
T°
TWEEN 80
(NH2)4SO4
pH
FeSO4
K2HPO4
CaCL2
KH2PO4
NaCl
MgSO4
0
1
2
3
4
5
6
7
CHAPITRE 3 : RESULTATS ET DISCUSSION
significative sur la réponse au niveau de confiance
choisi (á = 0,05). L'effet de cette influence schématisée
par le diagramme de Pareto (figure 10).
Figure 10 : Diagramme de Pareto des effets des
variables explicatives.
L'examen du tableau d'ANOVA (tableau 9)
montre que les effets principaux ne sont pas significatifs. Le
modèle de premier degré ne peut être donc utilisé
comme un modèle d'optimisation car les facteurs ne peuvent pas expliquer
la réponse de façon linéaire. Le test du défaut
d'ajustement qui est significatif au niveau á = 0,05 confirme cette non
linéarité (Courbure avec P = 0,01 < á = 0,05 et valeurs
résiduelles importantes).
Tableau 9 : Analyse de variance pour
l'activité lipasique
|
Source
|
DL
|
SC
|
CM
|
F P
|
|
Effets principaux
|
11
|
10084
|
918
|
10
|
0,096
|
|
Erreur résiduelle
|
2
|
3072
|
3072
|
|
|
Courbure
|
1
|
9526
|
9526
|
102,43
|
0,010
|
|
Erreur pure
|
2
|
0,1
|
0,04
|
|
|
Total
|
14
|
21532,9
|
|
|
En conclusion, nous avons trouvé un modèle
significatif qui permet d'avoir une idée préliminaire sur
l'influence des différents facteurs. Cependant, les valeurs
résiduelles importantes et le manque d'ajustement observé,
montrent que le modèle linéaire ne peut pas décrire
correctement le phénomène étudié et que d'autres
termes importants, comme des
37
CHAPITRE 3 : RESULTATS ET DISCUSSION
interactions ou des termes quadratiques ne doivent pas être
exclus. Par conséquent, nous avons décidé de passer
à un modèle du second degré du type :
y=b0+?bixik+??bijxikxjk+?bikxik2+ îk... (2)
La question qui se pose alors, concerne le plan de second
degré à utiliser et le choix des facteurs qu'il faut maintenir
dans l'étude. Parmi les nombreux plans d'expériences du second
degré, nous avons choisi le plan de Box-Behnken qui ne nécessite
pas un grand nombre d'essais. Nous avons choisi aussi ce plan pour la
facilité de sa mise en oeuvre. Concernant le choix des facteurs, nous
nous sommes basés sur les résultats du plan de criblage mais
également sur des critères expérimentaux. Il ne faut pas
perdre de vue que le critère expérimental, basé sur des
considérations techniques et scientifiques, est toujours
privilégié par rapport aux critères purement statistiques
(J.Goupy, 2005).
Ainsi, parmi les onze facteurs introduits au départ
dans le plan de criblage, les valeurs de
huit d'entre eux ont été fixées et les
trois autres significatifs sont conservés dans le plan de
Box-Behnken.
En conclusion, les trois facteurs retenus pour le plan de
Box-Behnken sont la température,
le temps (t) et la source de carbone (Tween 80). Ces facteurs
ainsi que le domaine de variation, sont précisés dans le
(tableau 10) :
Tableau 10 : Facteurs et domaine d'élude
du plan de Box-Behnken.
|
Facteurs
|
Niveau bas (-1)
|
Niveau haut (+1)
|
|
Température (X1)
|
40
|
50
|
|
Temps (X2)
|
2
|
5
|
|
Tween 80 (X3)
|
2
|
4
|
3.1.3. Plan d'optimisation
Le plan de Box-Behnken pour trois facteurs, composés de
quinze essais dont trois au
centre du domaine, ainsi que la réponse
expérimentale «Activité U/ml », sont donnés dans
le (tableau 11) :
38
CHAPITRE 3 : RESULTATS ET DISCUSSION Tableau 11 :
Plan de Box-Behnken et les résultats expérimentaux
obtenus.
|
Essai
|
X1
|
X2
|
X3
|
Activité U/ml
|
|
1
|
50
|
5,0
|
3
|
112
|
|
2
|
45
|
5,0
|
4
|
138
|
|
3
|
40
|
3,5
|
2
|
73
|
|
4
|
45
|
5,0
|
2
|
107
|
|
5
|
45
|
2,0
|
4
|
62
|
|
6
|
45
|
3,5
|
3
|
149
|
|
7
|
50
|
3,5
|
2
|
84
|
|
8
|
45
|
3,5
|
3
|
144
|
|
9
|
45
|
2,0
|
2
|
53
|
|
10
|
40
|
2,0
|
3
|
25
|
|
11
|
50
|
2,0
|
3
|
45
|
|
12
|
40
|
3,5
|
4
|
75
|
|
13
|
45
|
3,5
|
3
|
159
|
|
14
|
50
|
3,5
|
4
|
87
|
|
15
|
40
|
5,0
|
3
|
95
|
Le plan de Box-Behnken pour trois facteurs, composés de
quinze essais dont trois au centre du domaine, ainsi que la réponse
expérimentale «Activité U/ml », sont donnés dans
le (tableau 11).
Le traitement statistique des données du
(tableau 11) à l'aide du logiciel Minitab, permet
d'estimer les coefficients du modèle (cf. eq.1) (tableau
12).
39
|
CHAPITRE 3 : RESULTATS ET
Tableau 12 : Coefficients estimés pour
l'activité U/ml
|
|
|
DISCUSSION
|
|
Terme
|
Symbole
|
Coefficient
|
Probabilité
|
|
Température
|
X1
|
39,96
|
0,000***
|
|
Temps
|
X2
|
126,77
|
0,004***
|
|
Tween 80
|
X3
|
282,54
|
0,008***
|
|
Température*Température
|
X12
|
- 0,070
|
0,000***
|
|
Temps*Temps
|
X22
|
- 7,03
|
0,000***
|
|
Tween 80 * Tween 80
|
X32
|
0,0027
|
0,002***
|
|
Température*Temps
|
X1?X2
|
-0,01
|
0,854 NS
|
|
Temperature*Tween 80
|
X1? X3
|
0,01
|
0,951 NS
|
|
Temps* Tween 80
|
X2? X3
|
2,44
|
0,251 NS
|
*** : corrélation très hautement significative
au niveau de confiance de 99% (P<0.001). NS : non significative.
R2 = 98,7%, R2aj. = 96,3 %.
Nous remarquons à travers l'analyse du (tableau
12) et celle de l'ANOVA (tableau 13), que les
facteurs principaux et quadratiques ont des effets hautement significatifs,
contrairement aux effets d'interactions entre facteurs. La non signification
des interactions entre facteurs montre que l'effet d'un facteur ne
dépend pas du niveau de l'autre.
Tableau 13 : Analyse de variance pour
l'activité U/ml
|
Source
|
DL
|
SC
|
MS
|
F P
|
|
Régression
|
9
|
22700
|
22700
|
42 0,000***
|
|
Linéaire
|
3
|
9614
|
7978
|
44 0,001***
|
|
Carré
|
3
|
12960
|
12960
|
72 0,000***
|
|
Interaction
|
3
|
124
|
124
|
0,7
|
0,599 NS
|
|
Erreur résiduelle
|
5
|
300
|
300
|
|
|
Inadéquation de l'ajustement
|
3
|
184
|
184
|
1,05
|
0,522 NS
|
|
Erreur pure
|
2
|
117
|
117
|
|
|
Total
|
14
|
23000
|
|
|
*** : corrélation très hautement significative au
niveau de confiance de 99% (P<0.001). NS : non significative.
40
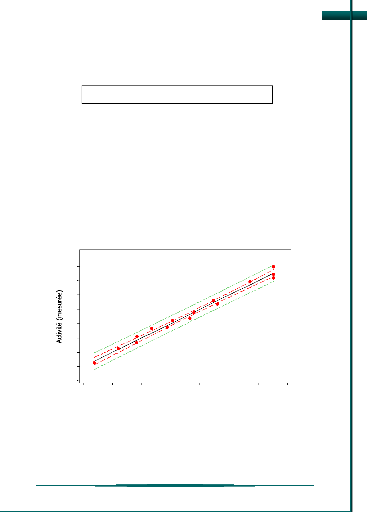
20
40
60
80
100
120
140
160
CHAPITRE 3 : RESULTATS ET DISCUSSION
A partir des résultats obtenus ci-dessus
(tableau13), nous avons obtenu un modèle très
hautement significatif qui met en évidence la relation entre les
facteurs expérimentaux et la réponse. Le modèle obtenu
après extraction des variables non significatives et négligeable,
se présente comme suit :
Activité = 6770 + 39,96 X1 + 126,77 X2 + 282,54
X3
La probabilité d'inadéquation de l'ajustement
augmente de 0,522 montre que le modèle obtenu explique bien le
phénomène étudié. A partir de ces résultats
on procède à la validation du modèle et l'optimisation des
variables explicatives.
? Validation primaire du modèle
La validation primaire du modèle consiste à
s'assurer que les réponses calculées et mesurées se
corrèlent significativement. Le diagramme des réponses
mesurées, en fonction des réponses estimées, montre une
forte corrélation entre celles-ci (figure 11). Le
modèle rend, donc, bien compte du phénomène
étudié.
R2 = 99%
Activité (estimée)
Figure 11 : Diagramme des réponses
mesurées en fonction de celles estimées.
41
180
160
140
120
100
80
60
40
20
0
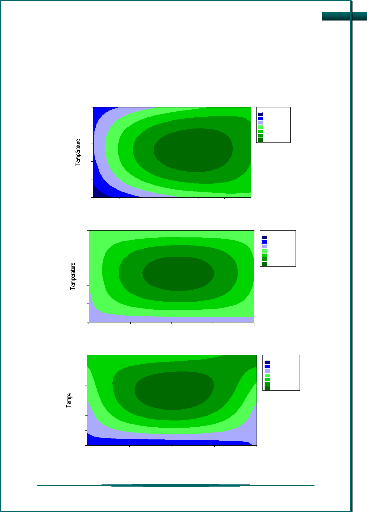
CHAPITRE 3 : RESULTATS ET DISCUSSION
? Optimisation de l'activité
La recherche des conditions optimales, qui permettant
d'aboutir à une meilleure activité enzymatique, a
été réalisée par l'analyse des diagrammes de
contour (figure 12) qui sont les projections des courbes
tridimensionnelles des surfaces de réponse. Ces dernières sont
générées par le logiciel Minitab par la combinaison des
trois facteurs.
50
y
48
< 40 40 -
60 60 -
80 80 -
100 100 -
120 120 -
140
46
44
42
40
2,0
4,5 5,0
3,5 4,0
2,5 3,0
Temps
50
y
140
48
>
< 40 40 -
60 60 -
80 80 -
100 100 -
120 120 -
140
>
46
44
42
40
4,0
3,5
3,0
2,5
Tween 80
5,0
2,0
y
140
4,5
< 40
40 -
60 60 -
80 80 -
100 100 -
120 120 -
140
4,0
>
140
3,5
3,0
2,5
2,0
2,0
4,0
3,5
3,0
2,5
Tween 80
Figure 12: Diagrammes de contours
présentant les effets des différents facteurs sur
l'activité
42
CHAPITRE 3 : RESULTATS ET DISCUSSION
D'après les diagrammes de contour obtenus
(figure 11), il apparaît clairement que les plus fortes
valeurs de l'activité lipasique (Activité > 140), sont
atteintes lorsque les facteurs sont fixés à des valeurs proches
de leur niveau haut de l'espace expérimental. La valeur précise
de l'optimum théorique, correspondant à la valeur maximale de
l'activité. Les valeurs des facteurs permettant de l'atteindre ont
été déterminées à l'aide de la fonction
«désirabilité» du logiciel (figure
13).
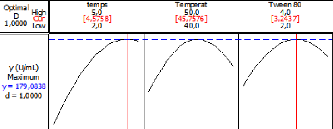
Figure 13: Optimisation de l'activité
par la fonction Désirabilité.
Comme le montre la (figure 13), la valeur de
l'activité maximale estimée par le modèle (A = 179),
correspond aux valeurs des facteurs suivants :
- T = 45,76 °C
- Temps = 4,56 joures - Tween 80 = 3,24 g/l
Ces conditions expérimentales de cultures
déterminées théoriquement pour la production de la lipase
issue de souche locale Cpt29 ont été par la suite
appliquées expérimentalement. La valeur de l'activité
trouvée expérimentalement (A = 182 U/ml) est nettement
supérieure à la valeur théorique. Ce résultat
valide donc le modèle obtenu.
Ces résultats obtenus montrent que la lipase extraite
de souches d'Actinomycète thermophile Cpt29 est plus thermostable (Top
46°C) en comparaison la lipase Yarrowia sp. ATCC 8661 issue de
souches bactériennes type Pseudomonas strains dont la
température optimale de culture est évaluée à
37°C (L.Tcacenco et al .,2010 ).
Les activités de ces deux lipases ont été
aussi comparées et nous avons trouvé que
l'activité hydrolytique de la Cpt 29 (182 U/mL) est
relativement deux fois supérieure à celle de la lipase
Yarrowia sp. ATCC 8661(106U/mL) (L.Tcacenco et al
.,2010 ) .
43
CONCLUSION
Au cours de ce travail, nous avons étudié
l'activité enzymatique d'une lipase bactérienne issue de souche
locale d'Actinomadura keratinilytica strain cpt 29) extraite au
laboratoire de Biochimie et Microbiologie Appliquée (LBMA) et dont la
caractérisation chimique a été réalisé au
sein du laboratoire de Chimie Organique Appliquée (LCOA).
La première partie de ce manuscrit est consacrée
à une présentation bibliographique sur les actinomycètes
en général ainsi qu'un aperçu sur les enzymes lipidiques.
La seconde partie du document développe les méthodes
utilisées et les résultats obtenus relatifs aux
différentes étapes de ce travail à savoir l'extraction,
l'isolement de l'enzyme lipidique et l'optimisation de la production de
l'enzyme.
La deuxième partie de ce travail consiste à
décrire les méthodes expérimentales utilisées ainsi
qu'a exposé les résultats et les discussions de cette
étude. La première étape concerne l'exploitation de la
souche bactérienne productrice de lipases d'Actinomadura
keratinilytica strain cpt29. L'opération d'identification et
d'extraction d'enzyme de cette souche, est réalisée au
laboratoire de Biochimie et Microbiologie Appliquée
(LBMA)-université Badji Mokhtar-annaba. La seconde étape,
concerne la recherche et l'étude de l'activité lipasique de cette
enzyme ainsi que l'optimisation des conditions expérimentales de culture
qui donne le meilleur taux de production. Cette partie du travail a
été réalisé au sein du laboratoire de Chimie
Organique Appliquée (LCOA), groupe Biocatalyse et Synthèse
Organique (BCSO).
Au cours de ce travail, nous avons réussi à
extraire des lipases de souches locales d'Actinomadura keratinilytica strain
cpt29. Pour bien mener notre étude, nous avons fait appel à la
méthodologie des plans d'expériences qui nous a permis d'aboutir
aux résultats recherchés de manière efficace.
Les facteurs influençant potentiellement la production
de cette lipase (température, temps, pH, source de carbone (Tween80),
[FeSO4], [CaCl2], [MgSO4], [K2HPO4], [KH2PO4], [NaCl], [(NH2)4SO4]) et leur
impact sur le fonctionnement de l'enzyme, ont été
étudiés dans un premier temps avec un plan de criblage, le plan
de Plackett et Burman qui nous a permis de dégager les facteurs les plus
influents sur l'activité enzymatique, à savoir la
température, le temps et la source de carbone (Tween 80). Les
résultats de ce plan préliminaire ont également
montré qu'un modèle de second degré est nécessaire
en particulier pour l'optimisation de la réponse.
45
CONCLUSION
Nous avons alors, dans un deuxième temps, introduit les
trois facteurs dégagés précédemment dans le plan
Box-Behnken qui est basé sur un modèle de second degré.
Nous avons pu ainsi obtenir un modèle de second degré
statistiquement satisfaisant. Les valeurs des réponses estimées
par le modèle sont corrélées à 99 % avec les
valeurs expérimentales.
Par la suite, la recherche des conditions optimales,
effectuée par la méthode des surfaces de
réponse, a permis de localiser la valeur optimale de
l'activité. Celle-ci correspond aux valeurs des facteurs : T = 45,76
°C, Temps = 4,56 heures, Tween 80 = 3,24 g/l.
Ce résultat théorique a été
validé par l'expérience. La valeur de l'activité
enzymatique
trouvée expérimentalement dans les conditions
optimales, est nettement supérieure à celle estimée par le
modèle.
En conclusion, l'application de la discipline de
chimiométrie utilisant la méthode des plans
d'expériences, nous a permet d'extraire de
l'information pertinente et utile pour une meilleure production de la lipase
issue d'Actinomadura keratinilytica strain cpt29.
A travers cette méthodologie nous avons pu
définir la région du domaine expérimental où la
réponse satisfait une contrainte, optimiser l'organisation des essais en
déterminant les facteurs influents à partir d'un modèle et
obtenir la meilleure précision possible sur la modélisation des
résultats.
Ces résultats nous ont aussi permis d'évaluer la
stabilité thermique et l'activité enzymatique de cette lipase en
comparaison avec celles obtenues dans la littérature. La Cpt 29 se
trouve plus thermostable et relativement deux fois plus active que la lipase
Yarrowia sp. ATCC 8661 (L.Tcacenco et al .,2010
).
46
|
Références
bibliographiques
|
LISTE DES REFERENCES

A
A.Breton, J.Theilleux, J.J.Sanglier, G.Viobis.(1989).
Organismes producteurs: biologie, Ctaxonomie et écologie. In
«Biotechnologie des Antibiotiques». Larpent J.P. et Sanglier
J.J., Masson : Paris ,33-70.
A.Côté , F.Shareck .(2008).
Cloning, purification and characterization of two lipases from
Streptomyces coelicolor A3 (2). Enzyme and Microbial Technology
(42): 381-388.
A.Eddehech, Z. Zara, F.Aloui, N.Smichi, A.Noiriel,
A.Abousalham, Y.Gargouri.(2019). Production, purification and
biochemical characterization of a thermoactive, alkaline lipase from a
newlyisolated Serratia sp.W3 Tunisian strain. Journal international des
macromolécules biologiques (123) : 792-800.
A.G.Brito-Madurro, R.A.Prade, J.M.Madurro, M.A.Santos
,N.T.A.Peres, J.R.Cursino-Santos, N.M.Martinez-Rossi, A.Rossi . (2008).
A Single Amino Acid Substitution in One of the Lipases of
Aspergillus nidulans Confers Resistance to the Antimycotic Drug Undecanoic
Acid. Biochemical Genetics (46): 557-565.
A.Ghanem.(2007). Tetrahedron (63):
1721-1754.
A.Habbeche .(2014). Purification et
caractérisation d'une kératinase thermostable KERAK-29 chez une
nouvelle souche d'Actinomycète. Thèse de doctorat de biochimie
appliquée. Université Badji Mokhtar, Faculté des sciences,
Annaba : 120.
A.J.McCarthy, S.T.Williams.(1992).
Actinomycetes as agents of biodegradation. Environmental Review
(115) : 189-192.
A.K.Singh, M.Mukhopadhyay. (2012). Overview
of Fungal Lipase: A Review. Applied Biochemistry and Biotechnology
(166) : 486-520.
A.M.Valan, U.Duraipandiyan, P.Agastian,
S.Lgmacimuthu.(2008). Antimicrobial activity of
Streptomyces SPP.ERL-26 recovered from Western Ghats of Tamil Nadu.
Journal de Mycologie Médicale (18): 147-153.
A.Moraleda-Munoz & L.J.Shimkets. (2007).
Lipolytic Enzymes in Myxococcus xanthus. Journal of
bacteriology (183): 3072-3080.
48
LISTE DES REFERENCES
A.Najjar .(2010). Etude quantitative de la
sécrétion de lipase, de la lipolyse et du stockage de lipides
chez Yarrowia lipolytica lors de sa croissance en présence d
huile d olive. Thèse Microbiologie et Biotechnologies.
A.Rihani. (2012). Screening de
microorganismes producteurs de lipases : application dans la
biodécontamination de surface. Magister: Microbiologie. Annaba :
Université Badji mokhtar : 55.
A.Salihu, Md. Z.Alam, M.IAbdulkarim, H.Salleh.(2012).Lipase
production: An insight in the utilization of renewable agricultural residues.
Resources Conservation and Recycling (58): 36-44.
A.R .Behera, A.Veluppal, K.Dutta.(2019).
Optimisation des paramètres physiques pour une production
accrue de lipase à partir de Staphylococcus hominis à
l'aide de la méthodologie de surface de réponse.
Environmental Science and Pollution Research (26): 1-8.

B
B.Gunalakshmi , M.Kumarsahu , K.Sivakumar , T.Thangaradjou ,
S.Sudha ,L.
Kannan.(2008). Enquête sur la souche
d'actinomycète productrice de lipase LE-11, isolée d'un
étang à crevettes. Journal de recherche en microbiologie
(3): 73-81.
B.Lennon.(2015). Les lipases au coeur de
l'industrie des omega-3. Lipinov. Romainville, FR : Adebiotech.
B.M.Schmidt, M.Baumann, E.Henke, M. Konarzycka-Bessler, U.T.
Bornscheuer.(2004).Directed evolution of
Lipases and Esterases. Methods in enzymology
(388) : 199-207.

D
D.Gerard.(2015).Lipinov. Romainville,
FR:Adebiotech.
E
E.CG. Aguieiras, D.SN.de Barros, R.Fernandez-Lafuente, D.
MG.Freire.(2019). Production of lipases in cottonseedmeal and
application of the fermentedsolid as biocatalyst in esterification and
transesterificationreactions. Renewable Energy (130) : 574-581.
49
LISTE DES REFERENCES

F
F.O'Gara, D.N.Dowling, B.Boesten.(2008).
Molecular Ecology of Rhizosphere Microorganisms: Biotechnology and the
Release of GMOs. John Wiley& Sons: Weinheim : 192.
F.Pabai.(1997).Production, Purification,
Characterization of selected microbial lipases and their application for
interesterification of better fat. Department of food science &
agricultural chemistry. McGill University : 179.
F.Rmili, N.Achouri, N.Smichi, N.Krayem, A.Bayoudh, Y. Gargouri,
M.Chamkha,
A.Fendri.(2019).Purification and biochemical
characterization of an organic solvent- tolerant and detergent- stable lipase
from Staphylococcus capitis. Biotechnology progress (203) :
7027660.

G
G.Rangaswami, D.J.Bagyaraj, D.G.Bagyaraj.(2004).
Agricultural Microbiology : 440.
G.Sad, M.C.Sado.(1991).Les plans
d'expériences de l'expérimentation à l'assurance
qualité, Collection AFNOR.
G.Vonothini, M.Murugan, K.Sivakumar, S.Sudha.(2008).
Optimization of protease production by an actinomycete Strain, P.S-18A
isolated from an estuarine shrimp pond. African journal of Biotechnology
(7) : 3225-3230.

H
H.Merizig, F.NAAMI. (2015). Etude taxonomique
de quelques souches d'actinomycètes isolées de la région
de Ouargla. Mémoire Master Academique.Microbiologie fondamentale et
appliquée. Université Kasdi Merbah Ourgla : 65.
H.S.Chaudhary, B.Soni A.R. Shrivastava, A. R,
S.Shrivastava.(2013). Diversity and versatility of
actinomycetes and its role in antibiotic production. Journal of Applied
Pharmaceutical Science: 3
50
LISTE DES REFERENCES
H.S.Chaudhary, B.Soni, A.R.Shrivastava,
S.Shrivastava.(2013). Diversity and versatility of
actinomycetes and its role in antibiotic production. Journal of Applied
Pharmaceutical Science: 3

J
J.Bérdy.(2005). Bioactive microbial
metabolites. J.Antibiot (58): 1-26. J.Goupy.(2005).
Pratiquer les plans d'expériences, édition DUNOD.
J.Goupy.(2017).la méthode du plan
d'expérience, Optimisation du choix des essais et de
l'interprétation des résultats. 5ème
édition DUNOD : 416
J.J.Sanglier, H.Haag, T.A.Huck, T.Fehr.(1996).
Review of actinomycetes compounds 19901995. Expert Opinion on
Investigational Drugs (5): 207-223.
J.O.Park, K.A.El-Tarabily, E.L.Ghisalberti,
K.Sivasithamparam.(2002). Pathogenesis of
Streptoverticillium albireticuli on caenorhabditis elegans
and its antagonism to soil-borne fungal pathogens. Letters in Applied
Microbiology (35): 361-365.
J.P.Larpent.(2000). Introduction à la
nouvelle classification bactérienne et les principaux groupes
bactériens. Lavoisier.(4): 183-212.
J.Theilleux.(1993).les actinomycètes
in Microbiologie industrielle : Les microorganismes d'intérêt
industriel, Leveau. J.Y et Mouix. M. Lavoisier (612) : 425.

K
K.E Jaeger, S.Ransac, B.W.Dijkstra, C.Colson, M.V.Heuvel,
O.Misset.(1994).Bacterial lipases. FEMS Microbiology
reviews (15): 29-63.
K.M.Heravi ,F.Eftekhar , B.Yakhchali ,
F.Tabandeh.(2008).Isolation and identification of a lipase
producing Bacillus sp. fromsoil. Pakistan Journal of Biological
Science (11): 740-745.
K.Sandrine.(2004).Application de la
méthodologie des plans d'expériences et de l'analyse de
données à l'optimisation des processus de dépôt,
thèse de Doctorat, école doctorale science -
technologie-santé, université de Limoges.
51
LISTE DES REFERENCES
K.Sudo, K.Konno, T.Yokota, S.A.Shigeta.(1995).
Screening system for antiviral compounds againts Herpes simplex virus
type 1 using the MTT method with L 929 cells.Tohuku.
Journal of Experimental Medicine (176): 163-071.

L
L.Belyagoubi. (2014). Antibiotiques produits
par des bactéries (actinomycètes et bactéries lactiques)
issus de différents écosystèmes naturels Algériens.
Thèse de doctorat. Université AboubakrBelkaïd-Tlemcen :
43.
L.Casas- Godoy, S.Duquesne, F.Bordes, G.Sandoval, A.Marty.
(2012). Lipases and Phospholipases: Methods and Protocols.
Methods in Molecular Biology: 861.
L.M.Prescott, J.P.Harley,
D.A.Klein.(2003).Microbiologie. De Boeck : Bruxelles. 2eme
édition : 537-542.
L.M.Prescott, J.P.Harley,
D.A.Klein.(2010).Microbiologie. De Boeck : Bruxelles. 2eme
édition : 1088.
L.Wang, Y.Huang, Z.Liu, M.Goodfellow,
C.Rodriguez.(2006).Sreptacidiphilus oryzae sp.
nov.anactinomycete isolated from rice-field soil in Thailand. International
Journal of Systematic and Evolutionary Microbiology (56): 1257-1261.

M
M.Berekaa, T.Zaghloul, Y.Abdel-Fattah, H.Saeed,
M.Sifour.(2009). Production of a novel glycerol inducible
lipase from thermophilic Geobacillus stearothermophilus strain-5.
World Journal of Microbiology and Biotechnology (25): 287-294.
M.Gargouri, N.B Akacha, F. Kotti, I. Ben Rajeb
.(2008).Voie de la lipoxygénase valorisation d huiles
végétales et biosynthèse de flaveurs. Biotechnology,
Agronomy, Society and Environment (12): 185-202.
M.Kitouni, A.Boudemagh, L.Oulmi, S.Reghioua, F.Boughachiche,
H.Zerizer, H.Hamdiken, A.Couble, D.Mouniee, A.Boulahrouf,
P.Boiron.(2005). Isolation of actinomycetes producing
bioactive substances from water, soil and tree bark samples of the notheast of
Algeria. Journal de Mycologie Médicale (15): 45-51.
M.Linder, J.Fanni, M.Parmentier. (2004).
Extraction, fractionnement et concentration des huiles marines.
oliseeds and fats crops and lipides (11) : 123-130.
52
LISTE DES REFERENCES
M.Petersen&R.Daniel. (2006).Purification and
characterization of an extracellular lipase from Clostridium
tetanomorphom. World journal of microbiology&Biotechnology
(22): 431-435.

N

N.Ashutosh , P. Sai Haritha, M.Venkatesh ; K.Sobha ,D.Santhosh
Kumar.(2019). Production and optimization of lipase using
Aspergillus niger MTCC 872 by solid-state fermentation. Bulletin of the
National Research Centre (43): 82.
N.Zergane, R.Bouhidel.(2016). Étude de
l'activité antibactérienne et antifongique d'une collection
d'actinomycètes. Mémoire de Master. Écologie microbienne.
Université des Frères Mentouri Constantine : 60.

P
P. Priyanka, K.Gemma, T.G .Henehan , J.R. Barry
.(2019).Isolation, purification and characterization of a
novelsolvent stable lipase from Pseudomonas reinekei .Protein Expression
and Purification (153) : 121-130.
P.Fickers, J.Destain, P.Thonart.(2007). Les
lipases sont des hydrolases atypiques : principales caractéristiques et
applications. Biotechnology, Agronomy, Society and Environment (12) :
119-130.
PM.Nielsen.(2016). Enzyme assisted biodiesel
production. Enzyme technology in oilseeds, oils and fats congress,
Belgium
Pollet.(2015).Lipinov. Romainville,
FR:Adebiotech.

R
R,D. Schmid and R. Verger. (1998),Lipases
interfacial enzymes with attractive applications. Angewandte Chemie
International Edition (37): 1608-1633.
R,Grigorova, J.R.Norris.(1990). Techniques in
microbial ecology. Methods in Microbiolog. Academic Press (22):
627.
R. Balachandar,N. Karmegam ,R. Subbaiya,P. Boomi, D. Karthik
,M.Saravanan.(2019). Optimization of culture medium for
improved production of antimicrobial compounds by Amycolatopsissp. -AS9
isolated from vermicasts. Biocatalysis and Agricultural Biotechnology
(19) :
https://doi.org/10.1016/j.bcab.2019.101186.
53
LISTE DES REFERENCES
R.E.McKinney.(2004). Environmental Pollution
Control Microbiology. CRC Press : New York : 448.
*R.L.Gina, C.Carlos, M.Chevrette, H.Horn, B.McDonald,
R.Stankey, B.Fox, C.R.Currie.(2016). Evolution and Ecology of
Actinobacteria and Their Bioenergy Applications. Annual Review of
Microbiology (70): 235-254.
R.Rahman, L.C.Leow, A.B.Salleh, M.Basri
.(2007).Geobacillus zalihaesp. nov.,athermophilic
lipolytic bacterium isolated from palm oil mill effluent in Malaysia. BMC
Microbiology (7): Pp 77.
R.Vardanega, D.Remonatto, F.Arbter, A.Polloni ,E.Rigo ,
J.L.Ninow , H.Treichel, D.Oliveira, M.Diluccio.(2008). A
systematicstudy on extraction of lipase obtained by solid state fermentation of
soybeanmeal by a newlyisolatedstrain of Penicillium sp. World journal of
chemistry (3) : 55-60.
R.Verger .(1985). Les enzymes lipolytiques.
In Mouranche A. & Costes C. Hydrolases et dépolymérases.
Enzymes d intérêt industriel. Paris, Edition : Gauthier
Villars : 313-329.
R.Wilfried, M.Moussavou, CH. Brunschwig, P.Villeneuve, J.Blin.
(2011).Screening de l'activité lipasique dans des
extraits végétaux de la biomasse burkinabé pour la
synthèse d'esters éthylique d'huile végétale
(EEHV). 6ème édition des Journées Scientifiques du
2iE: 6

S
S.Benjamin A.Pandey. (1998). Candida
rugosa Lipases: Molecular Biology and Versatility in Biotechnology.
Yeast (14): 1069-1087.
S.Gupta.S.YogeshJaviya,M.Bhambi,C.S.Pundi,K.Singh,A.Bhattacharya.(2008).International
Journal of Biological Macromolecules (42): 145-151.
S.Haberra,A.Habbeche,S.Saoudi,B.Kerouaz,S.Slimani,M.Boudelaa,A.Ladjama.(2013).Optimi
zation of xylanase production by a new lythermophilic actinomycete strain
Cpt29 isolated from poultry compost. European Journal of Scientific
Research (108) : 227-239.
S.Hua, H.Xianmei, S.Liping, Z.Wenshan
.(2019).Gene cloning, expression in E. coli, and in
vitro refolding of a lipase from Proteus sp. NH 2-2 and its
application for biodiesel production . Lettres Biotechnologiques (41)
:159-169.
54
LISTE DES REFERENCES
S.L.Wag , Y. T.Lin, T.W.Liang , S. H.Chio, L. J.Ming , P.C.Wu .
(2009). Purification and characterization of extracellular
lipases from Pseudomonas monteilii TKU009 by the use of soybeans as
the substrate. Journal of Industrial Microbiology & Biotechnology
(36) : 65-73.
S.Smaoui.(2010). Purification et
Caractérisation de Biomolécules à partir de
Microorganismes nouvellement isolés et identifiés. Thèse
doc : Institut National Polytechnique de Toulouse : 207.

T
T.Iftikhar, M.Niaz, M.Afzal, I.Haq , M.I.Rajoka
.(2008).Maximization of Intracellular
Lipase Production in a Lipase-Overproducing Mutant Derivative of
Rhizopus oligosporus DGM 31: A Kinetic Study. Food Technology and
Biotechnology (46) : 402-412.

V
V. Gotor-Fernandez, R. Brieva, V. Gotor.(2006).Molecular
Catalysis B: Enzymatic (40): 111-120.

W
W.A.M.Alloue, M.Aguedo, J.Destin, H.Ghalfi, C.Blecker,
J.P.Wathelet ,P.Thonart.(2008). Les lipases
immobilisées et leur application. Biotechnologie, Agronomie,
Société et Environnement (12) : 57-68.
W.Fenical, and P.R.Jensen.(2006). Developing
a new resource for drug discovery: marine actinomycetes bacteria. Nature
Chemical Biology (2) : 666-673.
W.Haiyan ,L.Wei, H.Ruixia.(2019). Lipase from
Bacilliuscereus: A potential solution to alleviatedietaryoil
pollution. Earth and Environmental Science (237) :
doi:10.1088/1755-1315/237/5/052067.

Y
Y. Fang Y, Z.Lu, F.Lv, X.Bie, S.Liu ,Z. Ding, W.Xu.
(2006). A newly isolated organic solvent tolerant
Staphylococcus saprophyticus M 36 produced organic solvent stable
lipase. Current Microbiology (53) : 510-515.
55



