INTRODUCTION
Problématique et
Intérêt du sujet.
En République Démocratique du Congo, l'avifaune
est particulièrement riche et diversifiée. La presque
totalité des ordres de la classe des Oiseaux présents en Afrique
s'y trouve, soit plus de 1000 espèces dont 128 sont migratrices
(Anomyne, 1997). Le centre d'endémisme guinéo congolais compte
655 espèces d'oiseaux dont 36 % d'endémiques, ce qui fait du pays
une des régions les plus riches de l'Afrique subsaharienne. Parmi ces
espèces, seules les espèces soumises à un commerce
international lucratif retiennent l'attention des gestionnaires et des
scientifiques pour le suivi de leurs populations. Il s'agit de :
Afropavo congensis (Paon congolais), Balaeniceps rex (Bec en
sabot), Sagittarius serpentarius (Grand serpentaire), Bucorvus
abyssinicus (Calao d'Abyssinie), Psittacus erithacus (Perroquet
gris) et quelques autres, notamment les vautours.
Sur toute l'étendue du territoire congolais et
même à l'intérieur des zones protégées (parcs
nationaux, réserves et domaines de chasse) où toutes les
espèces sont supposées être protégées,
aucune espèce n'a fait l'objet d'une étude de grande envergure.
La présente étude contribue donc à
acquérir des connaissances sur l'avifaune congolaise et constituera une
base pour des études ultérieures, en particulier des
études sur l'écoéthologie comparée des tous les
Alcedinidae de la région de Kinshasa.
Choix du sujet
Notre choix s'est porté sur le petit
Martin-pêcheur huppé (Alcedo cristata) et le
Martin-chasseur du Sénégal (Halcyon senegalensis) de la
famille des Alcedinidae pour plusieurs raisons.
D'une part l'extraction de sable sur leurs talus, ravins ou
berges de nidification pour les constructions anarchiques des maisons dans la
périphérie de Kinshasa, constitue une menace importante pour la
survie de ces oiseaux et pourrait à la longue entraîner leur
disparition, si des mesures de protection ne sont pas immédiatement
prises par notre gouvernement. Dès lors d'éventuelles mesures de
protection de ces espèces (et autres Alcedinidae) ne peuvent être
proposées et comprises que si elles sont fondées sur des
informations scientifiques de qualité.
D'autre part, ces oiseaux (aussi bien que les autres
Alcedinidae à tendance piscivore) sont fréquemment
considérés comme concurrents indésirables par les
pêcheurs et ils sont de ce fait piégés et tués.
Différents auteurs ont montré qu'ils ne mangent que des petits
poissons et qu'il semblerait donc qu'ils ne soient pas les ogres que l'on dit.
Douthwaite(1976), Whitfield & Blaber(1978) cités par Draulaus et
al.(1981) déclarent avoir trouvé dans les pelotes de
Alcedo cristata du lac Victoria seulement des Haplochromis sp
de taille variant de 5,5 à 10,5cm et dans les pelotes de Ceryle
rudis du lac Sainte Lucia, des Cichlidae de 10 à 15 cm.
Tjomlid (1973) et Pring-Mill (1974), Rensen (1978) cités par Reyer
et al. (1988) constatent aussi que les martins pêcheurs
sont très sélectifs surtout pour la taille des proies
capturées, 20-25 mm pour Alcedo cristata et 40 mm pour
Ceryle rudis dans le lac Nakuru au Kenya.
Et enfin, en dehors de Ceryle rudis qui a
été plus étudié en Afrique de l'Est, la biologie
des autres espèces demeure encore mal connue. Les informations sur leur
régime alimentaire sont très fragmentaires, voire
anecdotiques.
Objectifs
L'objectif principal de la présente étude est de
décrire et de comparer différents aspects de l'écologie et
du comportement des Alcedinidae de la région de Kinshasa. Il est
primordial de quantifier la consommation des martins-pêcheurs. Cela nous
permet d'aborder différents problèmes tels que l'importance de la
prédation de l'oiseau sur les populations de poissons et les
fluctuations de la consommation au cours de la période de reproduction
chez les petits Martins-pêcheurs huppés et Martins chasseurs du
Sénégal. Et enfin, nous allons faire une description de
différents stades du développement et du patron de croissance
chez les poussins de petits Martins pêcheurs huppés.
Subdivision du
travail
Précédé d'une introduction, ce travail
comprend trois chapitres. Le premier chapitre traite des
généralités sur les Alcedinidae de la région de
Kinshasa ; le deuxième présente le milieu d'étude, le
troisième décrit le matériel et les méthodes
utilisés et le quatrième présente les résultats
obtenus. Une discussion et une conclusion terminent notre contribution.
CHAPITRE I. GENERALITES SUR
LES ALCEDINIDAE DE LA REGION DE KINSHASA.
1.1. Systématique
Woodall (2001) classe le petit Martin-pêcheur,
Alcedo cristata dans la famille des Alcedinidae de l'ordre des
Coraciiformes. Dans cet ordre, il y aussi les Meropidae (guêpiers), les
Upupidae (huppe), Phoeniculidae (moqueurs), Bucerotidae (calaos), Todidae
(todiers), Motmotidés (motmots), les Coraciidés (rolliers), les
Brachyptéraciidés (brachyptérolles) et les
Leptosomatidés (courol).
Au cours de leur expédition en République
démocratique du Congo (excluant la partie Ouest du pays), Lippens &
Wille (1976) ont inventorié 14 espèces de Martins dont 8
Martins-pêcheurs (martin-pêcheur géant, Megaceryle
maxima ; Martin-pêcheur pie, Ceryle rudis, petit
Martin-pêcheur à demi-collier, Alcedo semitorquata ;
petit Martin pêcheur huppé, A. cristata ; petit
Martin-pêcheur à ventre bleu, A. leucogaster ;
Martin-pêcheur azuré, A. quadribrachys ;
Martin-pêcheur pygmée à tête marron, Ceyx
picta) et 6 Martins-chasseurs à tendance omnivore (Martin-chasseur
à poitrine bleue, Halcyon malimbica ; halcyon
strié, Halcyon chelicuti ; halcyon à tête
brune, Halcyon albiventris ; halcyon à tête
grise, Halcyon leucocephala ; halcyon marron,
Halcyon badia et halcyon du Sénégal, Halcyon
senegalensis.
1.1.1. Le petit
Martin-pêcheur huppé
1.1.1.1. Identification
Chez le petit Martin-pêcheur huppé, le bec est
noir chez les immatures (pied brunâtre) et rouge chez les adultes de deux
sexes (pieds rougeâtres). Comme souvent chez les Coraciiformes, le petit
Martin-pêcheur huppé ne présente pas de dimorphisme sexuel.
Sa tête est ornée d'une huppe composée de longues plumes
d'un vert malachite rayé de noir. Sur les côtés du cou un
trait blanc tranche sur le cou marron et la tête bleue ; le dessous
est châtain orangé ( Bouet, 1961 ; Fry &
al.1988 ; Serle & Morel,1994).
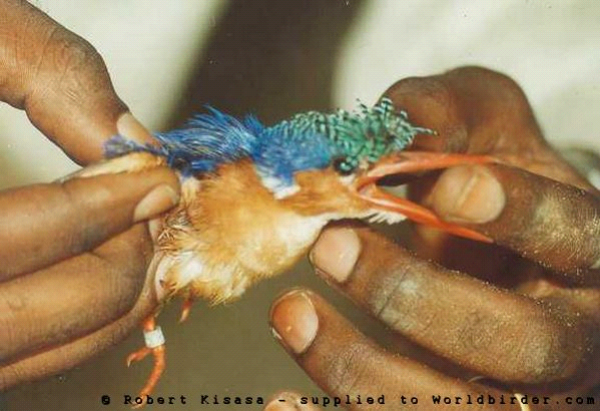
Figure-1.
Martin-pêcheur huppé de la région de Kinshasa (Photo R.
Kisasa)
En plus de sa taille plus grande, son sourcil bleu (au lieu de
noir) et sa face rousse (au lieu de violette) le distinguent du
martin-pêcheur pygmée (Ceyx picta).
1.1.1.2. Répartition et
habitat
Le petit Martin-pêcheur huppé occupe toute
l'Afrique intertropicale (Fig.2). Il est absent des zones arides et est
abondant surtout près de rivières poissonneuses à
végétation ouverte.
Le petit Martin-pêcheur huppé est partiellement
migrateur en plusieurs endroits de son aire de répartition (en
République démocratique du Congo, au Nord du Nigeria, Soudan,
Kenya, Sud Angola, au Gabon, Botswana, Afrique du Sud, Uganda, Nord Namibie,
Zimbabwe, Sud Congo Brazzaville (Woodall, 2001).
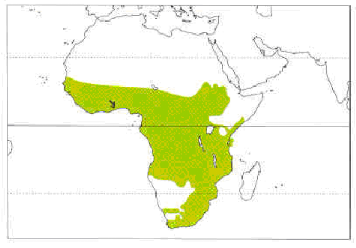
Figure-2.
Répartition de A. cristata (Woodall, 2001)
1.1.1.3. Régime
alimentaire
Les informations concernant le régime alimentaire du
petit Martin-pêcheur huppé sont particulièrement
fragmentaires. Celui-ci est composé de coléoptères
aquatiques, notonectes, larves d'insectes aquatiques, libellules, insectes
terrestres, crevettes, crabes, têtards, grenouilles, lézards et
poissons (Brian, 1977 ; Lippens & Wille, 1976 ; Fry et
al., 1992). Dans des cas extrêmes, le Martin-pêcheur
huppé peut être totalement insectivore, si les poissons
disparaissent du milieu (Meadows, 1977, in Laudelout et Libois, 2003) ou
totalement piscivore avec une préférence pour les
cichlidés en présence de plusieurs types de proies (Reyer
et al., 1988 ; Fry et al., 1992).
Reyer et al., 1988 ; Fry et
al., 1992 ont comparé les différentes proies
consommées par deux Alcedinidae, Alcedo cristata et Ceryle
rudis du lac Nokoué, au sud du Bénin enfin d'évaluer
le niveau de chevauchement de leur niche écologique. Ils ont
constaté que les deux oiseaux consommaient en grande partie des poissons
dans la végétation flottante du lac notamment Kribia
sp., Hemichromis fasciatus et Sarotherodon melanotheron
et que Ceryle rudis pouvait étendre sa chasse vers la zone
pélagique, au contraire de l'autre espèce. Son régime
alimentaire est ainsi plus diversifié (14 espèces proies) que
celui d'Alcedo cristata (4 espèces proies). Le chevauchement de
niche alimentaire des deux espèces est relativement bas (O=0,181).
1.1.1.4. Reproduction
Alcedo cristata, pont 3 petits oeufs blancs ovales et
brillants dans un terrier situé le long de berges poissonneuses. La
ponte a été observée en République
Démocratique du Congo en saison sèche (au sud Katanga) et
pluvieuse par Lippens & Wille (1976).
1.1.2. Le Martin-chasseur
du Sénégal
1.1.2.1. Identification
Le Martin-chasseur du Sénégal mesure 21cm. Il a
un dessus (à l'exception de la tête et du cou gris clair) bleu
clair brillant ; sa queue est bleue, mais le bout des ailes et le poignet
sont noirs. Le dessous est très clair, grisâtre sur la poitrine et
plus blanc sur l'abdomen. Le bec a la mandibule supérieure rouge et la
mandibule inférieure noire. Ce dernier caractère est commun avec
le Martin-chasseur à poitrine bleue. Sa voix est typique et facile
à reconnaître ; trille éclatant qui commence par une
note élevée et détachée suivie d'une cascade de
notes descendantes (parfois comparées à un rire).

Figure-3.
Martin-chasseur du Sénégal de la région de Kinshasa
1.1.2.2. Répartition et
Habitat
Le Martin-chasseur est un habitant de différents types
de savane, pourvu qu'il y ait des arbres d'une certaine taille (le voisinage de
l'eau n'étant pas requis), Il migre dans les pays suivants :
Ethiopie, Sud de l'Angola, Nord Namibie, N-E Botswana, Transvaal, N Swaziland
et N Natal, Bioko, République Démocratique du Congo, Ruanda,
Burundi, Tanzanie, Rép. Populaire du Congo, Gabon et Cameroun (Serle
& Morel, 1994 ; Sinclair & Ryan, 2003).
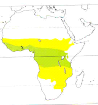
Figure-4. Répartition de Halcyon
senegalensis (Woodall, 2001) : la couleur verte correspond a
à la présence de l'espèce tout au long de l'année
et la couleur jaune présente uniquement au cours de la période
de reproduction.
A Kinshasa, nous avons, durant notre étude,
observé le martin-chasseur du Sénégal près des
étangs, aux alentours de la forêt et en plein centre ville dans
les dépotoirs hébergeant insectes, lézards, crapauds et
vers de terre.
1.1.2.3. Régime
alimentaire
Woodall, 2001 trouve dans le régime alimentaire du
Martin-chasseur du Sénégal les proies suivantes : insectes
tels que Sauterelles,(Orthoptères, Acrididés), scarabées
(Buprestidés, Carabidés, Cerambycidés, Cetoniidés,
Cicindelidés, Tenebrionidés) et libellules (Odonates), Cigales
(Cicadidés), Cancrelats (Blattidés), mantes (Mantodea), mites,
papillons, larves de fourmis (Formicidés) et termites
(Isoptères); d'autres arthropodes incluant les scorpions, les
mille-pattes (Diplopodes); crabes, poissons, lézards(Agamidés),
serpents, petits oiseaux et petits mammifères (Muridés).
1.1.2.4. Reproduction
Le Martin-chasseur pond 3-4 oeufs déposés dans
un terrier creusé dans un talus, une berge, une termitière ou un
tronc d'arbre mort (Fig-5)

Figure-5. Nid de Martin-chasseur aux
Symphonies naturelles de Kinshasa (Photo R.Kisasa)
Cette ponte est observée en saison de pluies, soit en
octobre et février dans le sud de la République
Démocratique du Congo (Lippens et Wille, 1976)
CHAPITRE II : MILIEU
D'ETUDE
2.1. Choix du milieu
Elle a été choisie comme zone d'étude non
seulement en fonction de la facilité d'accès mais aussi parce que
cette zone connaît une dégradation alarmante de son environnement
naturel consécutivement à son explosion démographique. La
pêche de subsistance y est fortement développée et la
pression qui s'exerce sur les oiseaux ichtyophages a tendance à
augmenter.
2.2. Cadre géographique
& distribution des terriers
2.2.1. Cadre
géographique
Kinshasa, la capitale de la République
Démocratique du Congo est comprise entre 4° et 5° de latitude
Sud, 15° et 16° 30' de longitude Est. Elle est limitée au
Nord-Est par la province de Bandundu, au Sud par la province du Bas Congo et
à l'Ouest par la République Populaire du Congo. La ville couvre
une superficie de 9.965 Km2 (Ministère des Affaires
Foncières, Environnement, Conservation de la Nature, Pêche et
Forêts, 1999).
Les données climatiques des températures
moyennes journalières et précipitations mensuelles fournies par
METTELSAT (Agence Nationale de Météorologie et de
Télédétection par satellite) de la République
Démocratique du Congo pour la période de Janvier 2004 à
Septembre 2005 sont représentées à la figure-6.
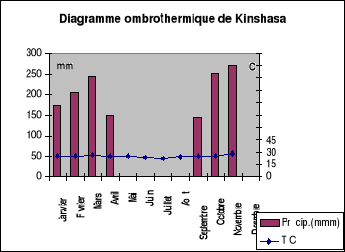
Figure-6.Données climatiques de la
ville de Kinshasa de Janvier à Novembre 2004 et Janvier à
Septembre2005. Source, METTELSAT/Kinshasa/Ngaliema
Il
faudra noter qu'au mois de décembre, il y avait de pluies mais le
service de Mettelsat ne pouvait pas nous fournir les données.
2.2.2. Description
topographique de la ville de Kinshasa
Les berges du fleuve Congo appelées `Kinsuka' dans sa
partie Nord-Ouest sont très caillouteuses et sont des sites d'extraction
de cailloux utilisés dans toute la région pour les constructions
de maisons et de routes. En plus le bief est non navigable et le courant d'eau
est très fort, l'installation des terriers ou la capture des poissons
par les martins-pêcheurs semble être très difficile.
En effet c'est dans cette partie que sont focalisées
les activités agricoles, piscicoles et on y trouve encore quelques
lambeaux forestiers.
Le Nord-Est est une vaste plaine herbeuse et
marécageuse qui s'étend du fleuve jusqu'à la commune de
Limete (Kingabwa), Masina Pétro-Congo ou Mapela et Kimbaseke. Le centre
est caractérisé par des constructions anarchiques, des caniveaux
bouchés entraînant la pullulation des espèces commensales
telles que les rats (Rattus rattus, R. norvegicus) et souris
(Mus domesticus).
2.3. Sites de nidification et
terriers
Les martins-pêcheurs huppés et d'autres
Alcedinidae notamment le martin-chasseur du Sénégal, le
martin-chasseur à ventre blanc, le martin- pêcheur pie et le
martin-pêcheur pygmée ont été observés dans
toute la région de Kinshasa voire même dans des mares
transformées en dépotoirs d'ordures hébergeant des vers de
terre, des insectes, des grenouilles et des gambusies. Cependant la
nidification a été observée uniquement à deux
endroits, dans la concession des prieurés du monastère Notre Dame
de l'Assomption (notée S1) et dans la concession
(notée S2) de monsieur NDA-GYE (Figure 4).
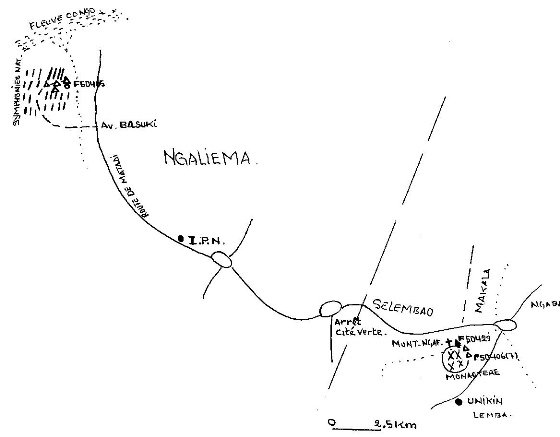
Figure-7 Localisation des sites de
nidification de petits Martins-pêcheurs huppés de la région
de Kinshasa.
2.3.1. Monastère Notre
Dame d'Assomption (notée S1)
1° Description
Le site 1 est une concession forestière
protégée, adjacente à des savanes défrichées
et aménagées pour les cultures. Cependant, il y a des
sablières qui créent des talus et ravins offrant des berges
artificielles propices à l'établissement des martins
pêcheurs. Une forte concentration de nids a été
observée à 328m d'alt, S 04° 25' 06,3'' ; E 15° 17'
54,8''

Figure-8. Vue du monastère Notre Dame
de l'Assomption (S1) prise du campus de l'Unikin.

Figure-9. Terriers de petits Martins
pêcheurs huppés F50425CM, F50429TM, Ter55MonTa, Ter58/MonTa,
Ter57/MonTa, Ter56MonTa et Ter59MonTa
concentrés sur ce talus au Monastère à environ 100 m de
l'étang le plus proche (R.Kisasa & A.Laudisoit)


Figure-10. Ravin dans la vallée du
monastère : observation Figure-11. Exploration du
terrier Ter52MonBr au Monastère du nid Ter55/MonRA par le Prof. J.Cl.
Palata R. Kisasa
2° Richesse faunique
Le Tilapia (Oreochromis niloticus) y est
élevé depuis la création des étangs. D'autres
poissons tels Clarias sp. et Parachana insignis ont
été introduits au mois de janvier 2005 par l'équipe de
l'Unité de recherches hydro -biologiques de l'Université de
Kinshasa. En plus le site héberge de nombreux insectes, des reptiles,
des batraciens et des petits mammifères.
3° Caractéristiques des terriers
Sur le talus de 15 m de haut et 20 m de large, une dizaine des
terriers distants l'un de l'autre d'environ 1,5 m ont été
explorés. La profondeur du terrier varie de 42 à 70 cm, la
section du tunnel d'envol est ovale et mesure environ 8 sur 6 cm. Tous les
terriers sont creusés dans un sol argilosablonneux, sans racines et
à ciel ouvert. Les terriers non occupés sont secs à
l'entrée par contre ceux qui sont occupés sont humides et aux
alentours, on peut observer les restes des poissons digérés.

Figure-12.
L'entrée du Terrier F50429TM.
2.3.2. Symphonies naturelles
(S2)
1° Description
Le deuxième site noté S2 est une
forêt secondaire de 500 ha nommée « Symphonies
naturelles » (aussi appelée, Zamba ya Nda-Ngye, forêt
portant le nom de son propriétaire). Une forte concentration de nids a
été observée à 295m d'altitude, S 04° 21'
56,4" et E 15° 13' 47,4".
2° Richesse faunique
Des étangs y ont été
aménagés et leurs eaux regorgent de poissons Cichlidae et
Clariidae, tandis que les zones stagnantes sont propices au
développement d'insectes divers.Le site héberge aussi des
reptiles, des batraciens, de petits et de grands mammifères notamment
divers singes et antilopes (Kambamba, 2003 ; Muleka,2003 ;
Molulu,2004 ; Malula(2004).
3° Caractéristiques des terriers
Une trentaine de terriers sont très
concentrés sur un talus de 40m de large donnant l'impression d'une
colonie. Ces terriers sont creusés sous les racines enfouies dans le sol
argilosablonneux ou à ciel ouvert. Leur profondeur varie de 37 à
48 cm, la section d'envol est ovale et mesure environ 8 sur 6cm.
La présence des jeunes est détectée
grâce à la présence de restes de poissons
digérés à l'entrée du terrier.


Figure-13. Localisation et ouverture du
terrier Ter47SyE1 Figure-14. Localisation et
ouverture du terrier Ter37SyE2
Symphonies naturelles
Symphonies naturelles
CHAPITRE III :
MATERIEL ET METHODES
3.1. Opérations de
terrain
Les sites occupés par les petits Martins-pêcheurs
huppés et Martins-chasseurs du Sénégal sont
repérés pendant la saison des pluies, généralement
à partir de la mi-janvier à mi-mai puis de mi-septembre à
octobre. Ils font ensuite l'objet d'une surveillance (régulière
tout au long de l'année) qui consiste à compter les oeufs,
à baguer les jeunes au nid, à baguer ou contrôler leur
envol et, dans la mesure du possible, à baguer ou contrôler les
adultes nicheurs. Le comptage des oeufs s'effectue au moyen d'un tube muni,
à son extrémité, d'un petit miroir incliné à
45° éclairé par une ampoule Les jeunes sont comptés
au moment de l'ouverture du nid qui est pratiquée en vue du baguage.
Celui-ci a normalement lieu entre le 2ème et le
17ème jour après l'éclosion. Le bec des jeunes
est alors mesuré, ce qui, chez le martin-pêcheur d'Europe, permet
une estimation de l' âge à un jour près (Hallet-Libois,
1985).
3.2. Étude de la
croissance des poussins
Au total 64 poussins dont 34 dans le site S1 et 30
dans S2 ont été déterrés,
mesurés, bagués et remis au nid avec d'infinies
précautions. Comme l'indique le tableau 1, les différents jeunes
n'ont pas été étudiés au même moment. Un peu
plus de la moitié (54,7%) des jeunes seulement ont été
suivis de l'éclosion à l'envol.
Tableau 1. Détails sur le suivi de la
croissance des oisillons de petits Martins pêcheurs huppés au
Monastère et aux Symphonies naturelles.
|
Début du suivi
Sites
|
naissance
|
5 jours
|
10 jours
|
+ 13 jours
|
Bagués non mesurés
|
TOTAL
|
|
Monastère
|
25
|
3
|
3
|
0
|
3
|
34
|
|
Symphonies
|
10
|
0
|
3
|
14
|
3
|
30
|
|
TOTAL
|
35
|
3
|
6
|
14
|
6
|
64
|
La masse corporelle ainsi que diverses mensurations ont
été relevées à intervalles réguliers (1 ou 2
jours) :
- longueur de la mandibule supérieure, de
l'extrémité antérieure de la narine à la pointe du
bec ;
- longueur de la mandibule inférieure de la pointe du
bec à la base ;
- longueur de la première rémige primaire
de la base à l'extrémité;
- longueur de la première rémige
secondaire de la base à l'extrémité;
- longueur de la rectrice externe gauche de la base
à l'extrémité;
- longueur du tarse gauche de la base à
l'extrémité;
- taille du corps (de l'extrémité du bec
à l'extrémité du croupion sans rectrices
Les mesures sont réalisées à l'aide d'un
peson (100g, précision de 1gr) pour le poids, d'une latte
(précision 1mm) pour la longueur alaire et d'un pied à coulisse
(précision 0,1 mm) pour les autres mensurations.
À l'occasion de l'ouverture des nids, les pelotes de
régurgitation tapissant le fond de la chambre du terrier ont
été récoltées
3.3. Étude du
régime alimentaire
Les techniques appliquées ont été
largement inspirées de celles mises au point pour l'étude du
martin pêcheur d'Europe (Alcedo atthis) par Hallet-Libois (1985)
pour les aspects alimentaires et la croissance des jeunes. Il est à
noter que leur transfert à des espèces africaines est tout
à fait possible puisqu'il a été réalisé avec
succès au Bénin sur le martin-pêcheur pie et sur le petit
martin-pêcheur huppé (Laudelout & Libois, 2003 ;
Libois& Laudelout, 2004).
3.3.1. Choix et fondement de la
méthode
Le régime alimentaire d'un animal peut s'étudier
de plusieurs manières. La méthode idéale est celle qui
permet un grand nombre d'observations sans pour autant mettre en danger
l'espèce étudiée surtout si cette dernière est peu
fréquente.
En général, l'observation directe est
malaisée et, dans le cas du martin-pêcheur, elle s'avère
impraticable en raison de la vélocité de l'oiseau et de la
petitesse de ses proies.
L'analyse systématique des contenus stomacaux se
révèle peu intéressante car elle ne permet qu'un nombre
fort restreint d'observations et surtout parce qu'elle est incompatible avec la
protection d'espèces peu abondantes.
La détermination des restes de proies contenus dans les
réjecta (fèces ou pelotes de réjection) a retenu notre
attention. Cette technique a été utilisée avec
succès chez des mammifères et chez de nombreux oiseaux tels les
martins-pêcheurs (Hallet-Libois, 1985), les cormorans (Vanderlinden,
2005) etc...
3.3.2.
Prélèvement et traitement des échantillons
Les pelotes de réjection des martins-pêcheurs et
des martins-chasseurs sont essentiellement constituées des restes non
digérés de leurs proies, os de poissons et d'autres petits
vertébrés, débris d'insectes ou de crustacés. Une
fois émises, elles se désagrègent rapidement et les
constituants s'éparpillent. Une étude quantitative et qualitative
précise implique cependant une récolte complète de toutes
les pelotes émises par un nombre connu d'individus pendant une
période déterminée. Cela s'avère possible pendant
la nidification car, à ce moment, les pelotes sont
régurgitées dans le terrier et s'accumulent au niveau de la
chambre du nid.
Pour atteindre cette chambre, il est nécessaire de
creuser un accès indépendant du tunnel d'envol à l'aide
d'une pelle appropriée. L'accès est pratiqué, soit
latéralement, soit derrière le nid en fonction de la disposition
des lieux. Les opérations une fois terminées, il est
soigneusement rebouché de manière à ne pas attirer
l'attention d'éventuels curieux ou de prédateurs.
Au cours de notre étude, une poignée de pelotes
a été récoltée dans le nid avant chaque
manipulation des jeunes de l'éclosion jusqu'à l'envol. Ces
pelotes proviennent des poussins mais aussi, selon toute vraisemblance, des
adultes, du moins tant qu'ils couvrent les jeunes une partie du
nycthémère au moins, soit jusqu'au moment où ces derniers
atteignent l'âge de 8 -10 jours.
3.3.3. Identification des
proies
3.3.3.1. Les poissons
Les restes osseux trouvés dans les pelotes ont
été identifiés en les comparant avec des pièces
provenant de squelettes dissociés préparés à partir
de poissons récoltés dans nos deux sites d'étude et
préalablement identifiés au moyen de la clé de
Lévêque et al.(1992).
3.3.3.2. Les batraciens
Les fémurs, les tibias, les humérus et les
mâchoires de batraciens sont conservés. La détermination
taxonomique n'est pas approfondie mais nous avons eu le privilège
de surprendre un couple de martins-pêcheurs attrapant de petites
grenouilles de 5 cm de long à leur sortie de l'eau.
3.3.3.3. Les insectes
Nous avons déterminé les insectes
consommés par nos Alcedinidae à partir de restes trouvés
dans leurs pelotes. Pour ce faire les clés d'identification de Arnett,
2000 et de Lema (2001) ont été
utilisées.
Les différentes proies de l'Embranchement des insectes
ont été identifiées à partir des restes
suivants : élytres (Coléoptères), ailes membraneuses
à grosses nervures (Hyménoptères), Antennes longues et
portant de nombreux articles (Orthoptères, Ensifères), Antennes
courtes, avec peu d'articles(Orthoptères, caelifères) et
présence de ptérostigma sur le bord antérieur de l'aile
(Odonates).
3.3.4. Comptage des proies
3.3.4.1. Les poissons
Les os gauches et droits appartenant à une même
espèce sont comptés séparément et le c'est le
nombre de pièces le plus élevé qui est
considéré dans le calcul de la proportion de différents
taxons dans le régime.
3.3.4.2. Les autres proies
Pour les proies mises en évidence par des pièces
anatomiques symétriques (os iliaques de batraciens ; crochets
mandibulaires, pattes et élytres d'insectes, par exemple), on divise le
nombre d'éléments trouvés par deux et on arrondit à
l'unité supérieure.
3.3.5. Détermination de
la taille des poissons capturés
La connaissance de la taille des proies capturées par
un animal permet de déterminer pour chaque espèce la fraction de
la population soumise à la prédation. Disposant des os
caractéristiques des poissons consommés, nous cherchons à
établir s'il existe une bonne relation entre leurs dimensions et la
taille des individus. Cette étude a été
réalisée pour 35 Tilapias (Oreochromis niloticus), la
seule espèce élevée dans les étangs de nos deux
sites d'étude.
Pour chaque poisson, nous avons mesuré la longueur
totale du corps à l'aide d'un pied à coulisse. Après
l'ébouillantage de la tête, nous avons prélevé ses
os caractéristiques, en l'occurrence les dentaires,
prémaxillaires, préoperculaires et operculaires.
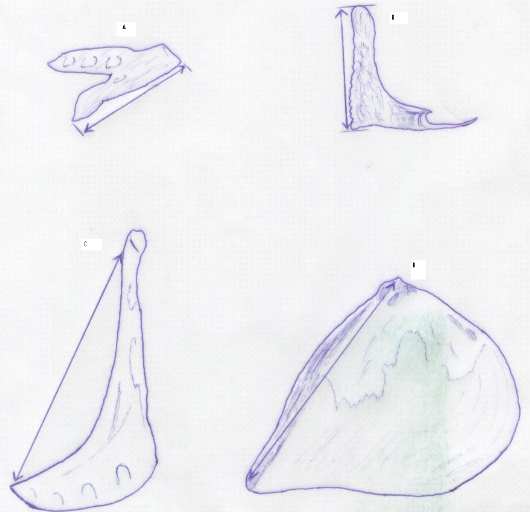
Figure-15. Mensurations des os
caractéristiques d'Oreochromis niloticus : A.
Dentaire ; B. Prémaxillaire ; C. Préopercule ; D.
Opercule
Les os prélevés ont été
nettoyés, séchés puis mesurés au
1/10ème mm près à l'aide d'un Projecteur de
profil de marque NIKON Model 6C n° 8631. Des corrélations ont
ensuite été recherchées entre la longueur totale des
poissons d'une part et la longueur de leurs différents os
caractéristiques, d'autre part (voir graphiques de l'annexe 1). Les
différentes équations sont reprises au tableau 2.
Tableau 2. Caractéristiques des
relations : longueur des os (Operculaire, Préoperculaire,
Prémaxillaire, Dentaire en cm) - longueur totale des poissons (LT, cm)
pour 35 Oreochromis niloticus au risque d'erreur á égal
à 0,05.
.
|
Oreochromis niloticus
|
|
Os caractéristiques
|
Equations
|
Coefficients de corrélation
|
|
Opercule
|
LT (cm) poisson = 7,4 X + 0,46
|
0,97
|
|
Prémaxillaire
|
LT (cm) poisson = 13,8 X + 0, 87
|
0,99
|
|
Pré operculaire
|
LT (cm) poisson = 6,32 X - 0,18
|
0,96
|
|
Dentaire
|
LT (cm) poisson = 7,4 X + 0,46
|
0,97
|
3.3.6. Analyse des
données.
1° Régime alimentaire
Pour vérifier l'homogénéité des
distributions d'abondance des proies en fonction des sites ou de l'âge
des poussins, le G-test selon Sokal et Rohlf (1981) a été
appliqué. Le test repose sur la transformation logarithmique des
effectifs observés et se calcule de la manière suivante :
G = 2 Ó (Xpq*lnXpq) + N*lnN -
ÓCp*lnCp -
ÓLq*lnLq
Où Cp représente le total marginal de
la colonne p,
Lq, le total marginal de la ligne q,
N représente le nombre total d'observations et
Xpq est l'effectif observé dans la ligne q
à la colonne p.
Le
résultat du G-test s'apprécie comme un ÷2
à (ligne-1) x (colonne-1) degrés de liberté. Il est
significatif indiquant donc une
hétérogénéité lorsque sa valeur
observée est supérieure à la valeur théorique pour
un nombre de degrés de liberté et probabilité
donnés.
Son
intérêt par rapport au ÷2 réside notamment
dans le fait que le calcul du Gglobal s'accompagne aussi du calcul
des Gpartiels, que ce soit sur les lignes ou sur les colonnes du
tableau. Ces valeurs partielles de G permettent immédiatement de savoir
à quelle(s) ligne(s) ou colonne(s) est due l'éventuelle
hétérogénéité.
Le
logiciel STATISTICA (version 7.1) nous a permis de recourir aux
tests d'ANOVA (Fischer-Snedecor) et ANOVA de Kruskal-Wallis. Ces deux
tests ont été appliqués pour comprendre l'évolution
de la taille des poissons capturés en fonction de l'âge des
poussins de petits Martins-pêcheurs huppés.
2° Croissance
Le
modèle des variations linéaires a été
appliqué pour une étude comparative de la croissance
pondérale, staturale et de différentes structures anatomiques
notamment le tarse, les plumes (rémiges et rectrices), mandibules
(primaire et secondaire) de poussins de petits Martins-pêcheurs
huppés d'un même terrier en fonction de l'âge et du site.
Le modèle est formulé de la manière
suivante :
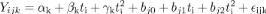
Où  k, k,  k, et k, et  k sont des effets spécifiques fixés ou
différentes mensurations à l'origine (2 jours après
l'éclosion) pour le tarse, plumes, mandibules et poids); k sont des effets spécifiques fixés ou
différentes mensurations à l'origine (2 jours après
l'éclosion) pour le tarse, plumes, mandibules et poids);
bj0, bj1 et bj2 sont des valeurs prédites;
ijk : représente le terme d'erreur de mesure.
.t est le temps.
L'évaluation et l'inférence d'effets tant
fixés qu'aléatoires ont été exécutées
utilisant le logiciel SAS (SAS Institute, Cary, NC).
L'estimation de ce modèle a été faite
grâce à une statistique F dont le niveau de signification a
été précisé par le programme.
CHAPITRE IV :
RESULTATS
4.1. Évolution au cours
de la période de nourrissage
Dans ce chapitre, nous présentons la variation de la
proportion et de la composition des proies au cours de la période de
nourrissage et leur impact sur la croissance et le développement des
jeunes de petits Martins pêcheurs huppés et Martins chasseurs du
Sénégal.
4.1.1. Le petit
Martin-pêcheur huppé (Alcedo cristata)
4.1.1.1. Données
démographiques et phénologie de la reproduction
Les adultes bagués ont été
relâchés et leurs terriers ont été surveillés
régulièrement à raison de 2 jours par semaine durant toute
l'année (pendant les 8 mois de saison des pluies et 4 mois de saison
sèche). Lorsqu'une nidification était constatée, nous
avons tenté de capturer les adultes au nid afin d'en contrôler
l'identité, ce qui nous a permis de constater que plusieurs couples
avaient entrepris plus d'une nichée au cours de la saison.
Les dates de début et fin de séjour au nid, le
succès de la reproduction (nombre de jeunes éclos par rapport aux
jeunes qui s'envolent après 16 à 17ème jour) et
les caractéristiques de différents nids explorés sont
présentés dans le tableau ci-dessous :
Tableau 3. Caractérisation des
terriers et succès reproducteur chez les petits Martins pêcheurs
huppés
|
N° Terrier
|
Séjour au nid
|
Nombre de nichées/ an
|
Nombre de jeunes éclos
|
Durée du séjour au nid (jours)
|
Nombre de jeunes à l'envol
|
Libellé
|
|
F50425CM
|
23 sept- 8 oct. 2004
|
2
|
3
|
16
|
3
|
Prés d'un champ, découvert
|
|
|
15 jan - 31 jan 2005
|
3
|
16
|
3
|
|
|
F50429TM
|
11Jan- 27 jan 2005
|
2
|
3
|
16
|
4
|
Sur talus, découvert
|
|
|
25avri- 13mai 2005
|
4
|
16 -17
|
2
|
|
|
F50406 (7) EM.
|
29mars- 15 avril 2005
|
1
|
4
|
16 -17
|
3
|
Près des Etangs, découvert
|
|
Ter55/MonRA
|
5 avril- 21avr 2004
|
1
|
2
|
16
|
2
|
Ravins, découvert
|
|
Ter52MonBr
|
avr-04
|
1
|
3
|
*
|
3
|
dans la brousse, découvert
|
|
Ter55MonTa
|
avr-04
|
2
|
3
|
*
|
3
|
Sur talus, découvert et menacé
|
|
|
16oct-01nov-04
|
3
|
16
|
3
|
|
Ter58/MonTa
|
27mars- 12 avril 2004
|
1
|
3
|
16
|
2
|
Sur talus, découvert et menacé
|
|
Ter57/MonTa
|
27mars-avril 2004
|
1
|
3
|
*
|
3
|
|
Total Monastère
|
34
|
|
31
|
|
|
Ter51SyE1
|
27mars- 13avril 2004
|
1
|
2
|
17
|
2
|
Sur talus, sous racine
|
|
Ter51SyE4
|
27mars- 12avril 2004
|
1
|
3
|
16
|
3
|
Sur talus sous racine, découvert
|
|
Ter56SyE4
|
27mars-12avril 2004
|
1
|
3
|
16
|
3
|
Sur talus sous racine, découvert
|
|
Ter60SyE4
|
29mars-14avril 2004
|
1
|
3
|
16
|
3
|
Sur talus sous racine, découvert
|
|
Ter47SyE1
|
29mars-15avril 2004
|
1
|
3
|
17
|
1
|
|
|
Ter37SyE2
|
29mars- 14avril 2004
|
1
|
3
|
16
|
3
|
Sur talus, découvert
|
|
F50412TSE1
|
21fév- 10 mars 2005
|
2
|
4
|
16-17
|
4
|
Berge de l'Etang1, découvert.
|
|
|
Fin avril- mai 2005
|
3
|
16
|
3
|
|
F50405TSE2
|
27 fév-12 mars 2005
|
2
|
3
|
16
|
3
|
Sur talus, sous racine
|
|
|
26 avril- 12mai 2005
|
3
|
16 -17
|
3
|
|
Total Symphonies
|
30
|
|
28
|
|
|
TOTAL GENERAL
|
64
|
|
59
|
|
Au total 16 terriers aisément repérables (8 au
Monastère et 8 aux Symphonies naturelles) ont été
prospectés dont la profondeur a varié de 47,5 à 58,2cm et
les diamètres vertical et horizontal étaient respectivement de
8 et 6cm. Nous y avons observé 64 oisillons durant toute la
période de nourrissage. Sur 64 oisillons 59 (92,2 %) se sont
envolés soit un taux de mortalité de 7,8% avant l'envol.
Les pontes sont observées à Kinshasa
exclusivement pendant la saison pluvieuse et elles ont été
observées au même moment dans les deux sites. Quand bien
même, il y avait des pluies au mois de décembre, aucune ponte n'a
été signalée dans les deux sites. Cependant, sept couples
de petits Martins pêcheurs huppés y ont été surpris
uniquement en train de creuser les terriers sur le talus du Monastère.
Ces terriers ont malheureusement été tous détruits
après le passage d'un tracteur
Une femelle peut avoir 1 à 2 pontes par an de 2
à 4 oeufs (mode = 3). Aucune différence significative
n'apparaît dans la distribution du nombre de nichées ou de jeunes
par nichée en fonction du site (G = 0,29 NS et G =1,62 NS,
respectivement) et la durée du séjour des jeunes au nid est
de 16 à 17 jours.
4.1.1.2. Régime
alimentaire
4.1.1.2.1 Le
régime : aspect général
L'examen des pelotes de régurgitation
récoltées dans les deux sites de Kinshasa a
révélé les proies suivantes : poissons (avec l'unique
espèce, Oreochromis niloticus), des insectes (odonates,
coléoptères et orthoptères), des reptiles et des
batraciens notamment des grenouilles. Les différentes proportions de
chaque catégorie de proie sont rapportées dans le tableau-4 ci
dessous :
Tableau-4. Régime alimentaire
d'Alcedo cristata dans la région de Kinshasa. .
Proies
|
Symphonies : terrier F50405TSE2
|
Monastère : terrier F50406 (7)
|
Monastère : terrier F50429TM
|
|
Abondance
|
Ab. rel (%)
|
Abondance
|
Ab. rel (%)
|
Abondance
|
Ab. rel (%)
|
|
Poissons (O. niloticus)
|
18
|
23
|
146
|
89
|
3
|
4
|
|
Reptiles
|
1
|
1
|
0
|
0
|
0
|
0
|
|
Batraciens (Anoures )
|
22
|
29
|
3
|
2
|
20
|
27
|
|
Odonates (libellules)
|
27
|
36
|
2
|
1
|
11
|
15
|
|
Odonates
|
7
|
9
|
8
|
5
|
33
|
45
|
|
Coléoptères
|
1
|
1
|
1
|
1
|
1
|
1
|
|
Orthoptères (Gryllotalpa)
|
0
|
0
|
0
|
0
|
6
|
8
|
|
Insectes non identifiés
|
1
|
1
|
3
|
2
|
0
|
0
|
|
TOTAL PROIES
|
77
|
|
163
|
|
74
|
|
Comme l'indique le tableau ci-dessus pour les trois terriers
étudiés, les poissons ont représenté 53,2 % des
proies contre 32,2 % pour les insectes. Le reste est essentiellement
constitué par des batraciens et reptiles (14,6%). Au monastère,
les deux terriers où les échantillons ont été
prélevés ont livré des résultats très
différents. Le premier montre un régime quasi exclusivement
fondé sur les poissons alors que le second a surtout livré des
restes d'Odonates et de batraciens.
Un test d'homogénéité de proportions (G
test) dont les résultats sont présentés dans le tableau-5,
confirme bien les différences énormes existant entre le
régime observé à ces trois terriers (G = 224,2 et G
corrigé = 113,2 ; 6 ddl ; p<0,0001).
L'hétérogénéité porte sur toutes les
catégories de proies à l'exception des « autres
insectes » et sur les trois échantillons analysés.
Tabeau-5. Résultats du test
d'homogénéité de proportions entre les régimes des
trois terriers
|
Proies
|
F50405
|
F50406 (7)
|
F50429
|
G-partiel
|
Décisions(à p<0,001)
|
|
Poissons
|
18
|
146
|
3
|
107,2
|
Hétérogène
|
|
Odonates
|
34
|
10
|
44
|
66,7
|
Hétérogène
|
|
Batraciens & reptiles
|
23
|
3
|
20
|
44,8
|
Hétérogène
|
|
Autres insectes
|
2
|
4
|
7
|
5,5
|
variation non signif.
|
|
G-partiel
|
32,3
|
105,2
|
86,8
|
|
|
|
probabilité
|
<0,001
|
<0,001
|
<0,001
|
|
|
4.1.1.2.2. Le
régime en fonction de l'âge des poussins
Dans la mesure où, d'un endroit à l'autre, le
régime varie énormément, c'est terrier par terrier que
nous avons analysé ses variations en fonction de l'âge des jeunes.
Deux périodes ont été considérées :
avant que les pulli n'aient atteint l'âge de 8 jours et après. La
première période peut en effet comporter des pelotes
émises au nid par les adultes alors qu'ils réchauffent leurs
jeunes.
Tableau-6. Evolution de la proportion des
proies en fonction de l'âge des poussins au terrier F50405TE2.
|
Terriers
|
Proies
|
=8J
|
>8J
|
G-partiel
|
Décisions(à p<0,01)
|
G-global(à p<0,01,ddl=3)
|
|
|
Insectes
|
2
|
1
|
1,466
|
variation non signif.
|
|
|
|
Poissons (O. niloticus)
|
15
|
3
|
19,883
|
Hétérogène
|
34,323
|
|
F50405TE2
|
Odonates
|
7
|
27
|
2,373
|
variation non signif.
|
Test global significatif
|
|
|
Batraciens+ Reptile
|
1
|
21
|
10,602
|
Hétérogénéité
|
|
Avec un ddl égal à 3, le G calculé pour
le terrier F50405 est égal à 34,323, le test est significatif
à p<0,01. En regardant les G partiels, on peut s'apercevoir qu'il y a
hétérogénéité uniquement au niveau de
poissons. Pour les autres proies la différence n'est pas
significative.
Le
G-test a été aussi appliqué pour voir la variation en
fonction de l'âge des poussins, la proportion de chaque proie par rapport
aux autres d'une même nichée. Nous avons analysé les proies
de la nichée du terrier F50429 et celles de F50406 (7). Les
résultats obtenus sont présentés dans le tableau-8
ci-dessous :
Tableau -7. Evolution de la proportion des
proies en fonction de l'âge des poussins.
|
Terriers
|
Proies
|
=8Jours
|
>8Jours
|
G-partiel
|
Décisions(à p<0,01)
|
G-global(à p<0,01,ddl=3)
|
|
F50429
|
Insectes
|
1
|
6
|
0,048
|
variation non signif.
|
|
|
Poissons (O. niloticus)
|
1
|
2
|
0,447
|
variation non signif.
|
0,693
|
|
Odonates
|
7
|
38
|
0,102
|
variation non signif.
|
Test global non significatif
|
|
Batraciens+ Reptile
|
4
|
16
|
0,096
|
variation non signif.
|
|
|
F50406(7)
|
Insectes
|
2
|
1
|
0,375
|
variation non signif.
|
|
|
Poissons (O. niloticus)
|
61
|
85
|
3,175
|
variation non signif.
|
25,083
|
|
Odonates
|
19
|
1
|
20,416
|
Hétérogène
|
Test global significatif
|
|
Batraciens+ Reptile
|
3
|
1
|
1,117
|
variation non signif.
|
|
Le G- test effectué indique une variation non
significative dans le terrier F50429 (G=0,693) et significative dans le terrier
F50406 (7) (G=25,083) à p< 0,01. En regardant
toutes les valeurs de Gp, on peut s'apercevoir qu'il y a
homogénéité au niveau de toutes les proies à
chaque tranche d'âge (=8Jrs et >8Jrs) dans les deux terriers sauf pour
les Odonates dans le terrier F50406 (7).
4.1.1.2.3. Taille des
proies capturées : le cas d'Oreochromis
niloticus.
Pour toute la période de nidification dans le trois
terriers (du Monastère : F50429, F50406 (7) et des
Symphonies naturelles : F50405), 167 poissons Oreochromis
niloticus ont été capturés par les adultes
(Tableau-4).
Comme l'indique la figure-16, les petits
Martins-pêcheurs huppés ont capturé des poissons de taille
allant de 2 à 7cm, ceux de taille comprise entre 3 et 4cm étant
prédominants.
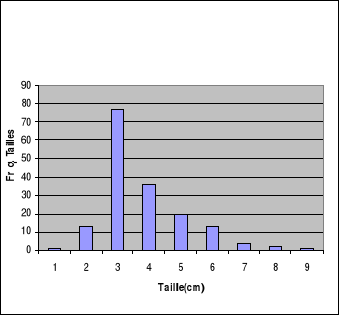
Figure-16. Distribution de fréquence
de la taille des Oreochromis niloticus capturés par Alcedo
cristata dans la région de Kinshasa
4.1.1.2.4. Relation
longueur des proies capturées -âge des poussins
Comme l'indique la figure-17, la longueur moyenne des poissons
consommés est variable d'un jour à l'autre. Dès le
deuxième jour après l'éclosion des oeufs, la taille des
poissons capturés est très variable, allant de 3 à 5,4cm.
Du quatrième au douzième jour la taille des poissons
capturés varie entre 3,5 et 5,2cm. Au quatorzième jour la taille
la plus élevée est enregistrée soit 5,2 à 6,3cm
puis elle décroît jusqu'à l'envol. La valeur de F (8,
288) est égale à 5,96, ce qui indique une
hétérogénéité significative à
p<0,00001. En fait, ce sont les jours 12 et 14 qui introduisent cette
hétérogénéité. En effet, une nouvelle
analyse omettant ces deux jours ne montre plus de différences
significatives (F6; 262 = 1,371, p = 0,226)
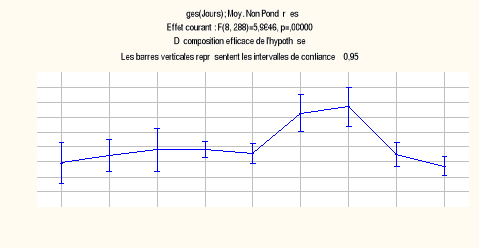
Figure-17.
Évolution de la taille moyenne des poissons capturés en fonction
de l'âge des poussins.
Notons qu'une analyse non paramétrique de la variance
aboutit aux mêmes conclusions.
4.1.1.3 Croissance et
Développement
4.1.1.3.1
Observations
Les poussins sont nus à l'éclosion, de couleur
entièrement rose et restent au nid jusqu'à l'envol
définitif, lorsque leur plumage est complètement
développé, soit 16 à 17 jours après
l'éclosion. Au cours de la première phase du séjour au
nid, c'est à dire jusqu'à l'émergence des fourreaux, ils
restent couverts par un des adultes au moins une partie du
nycthémère. Leur développement passe par les étapes
suivantes:
- 1er jour : Les jeunes sont aveugles, le corps est nu et
rose, les deux mandibules sont aussi roses mais l'inférieure est plus
longue que la supérieure;
- 3 jours : les mandibules sont noires sauf (les
extrémités sont toujours roses);
- 5 jours : à cet âge, il n'y a pas encore
de plumes : on voit simplement poindre les fourreaux en certains endroits
(une rangée au milieu du dos) ;
-7 jours : apparition des fourreaux des rémiges
primaires, des ptéryles huméraux et ventraux (4
rangées);
- 9
jours : ouverture des yeux,les rémiges secondaires, les rectrices,
les plumes de la face dorsale de la tête et des ptéryles
fémoraux émergent des fourreaux;
- 11 jours : tout le corps est couvert à la fois
des fourreaux et des plumes ;
-13 jours à 17 jours : tout le corps est
enfin couvert des plumes
4.1.1.3.2 Modèle de
croissance dans les deux sites d'étude
Les résultats de l'analyse longitudinale de la
croissance de différentes structures morphologiques chez les petits
Martins pêcheurs huppés se présentent comme suit :
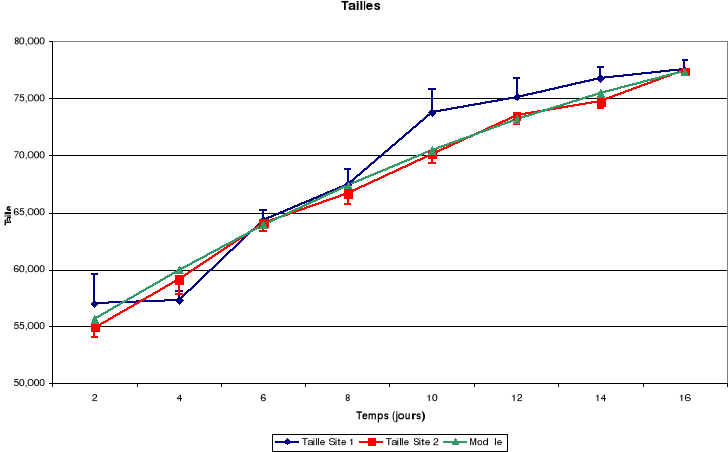
a. Taille
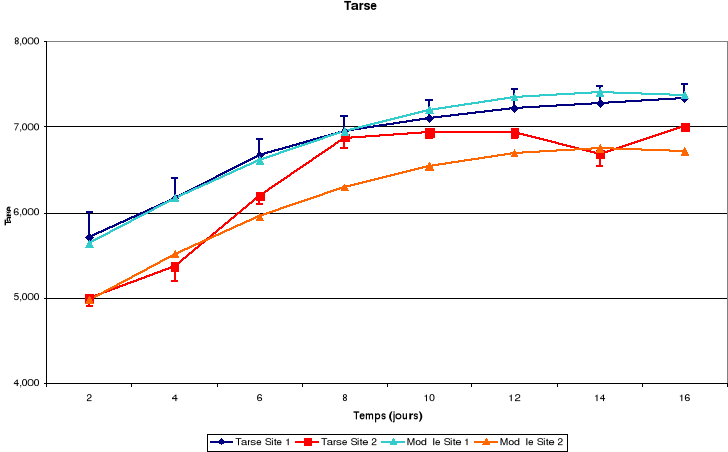
b. Tarse
c. Plumes
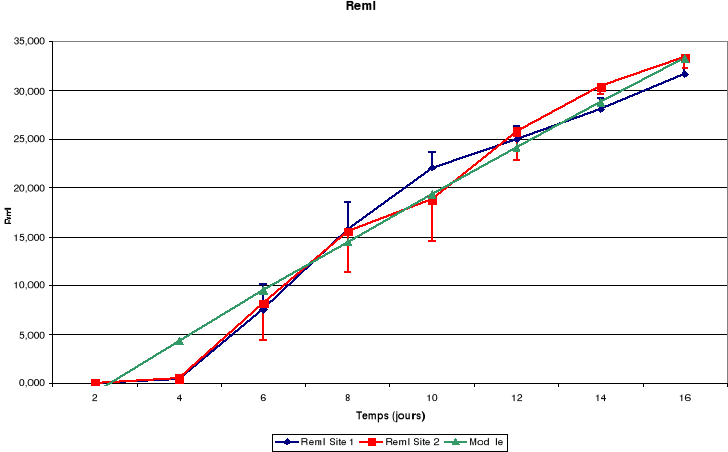
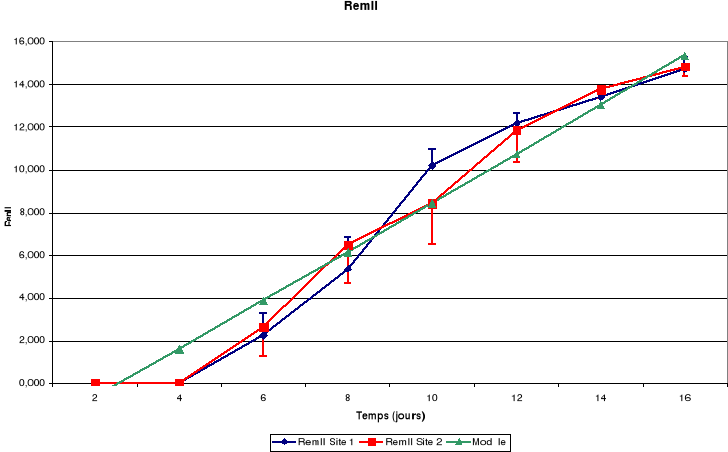
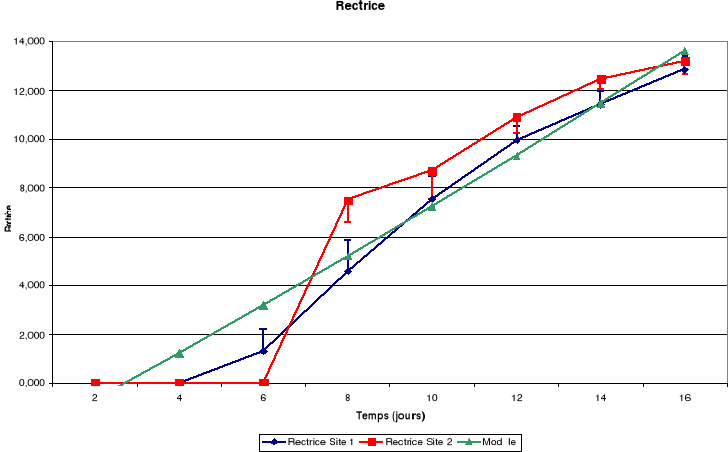
Légende
RemI : Rémiges primaires
RemII : Rémiges secondaires
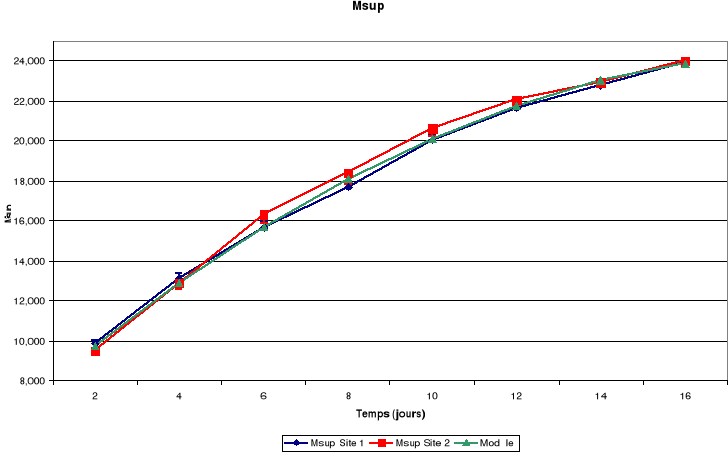
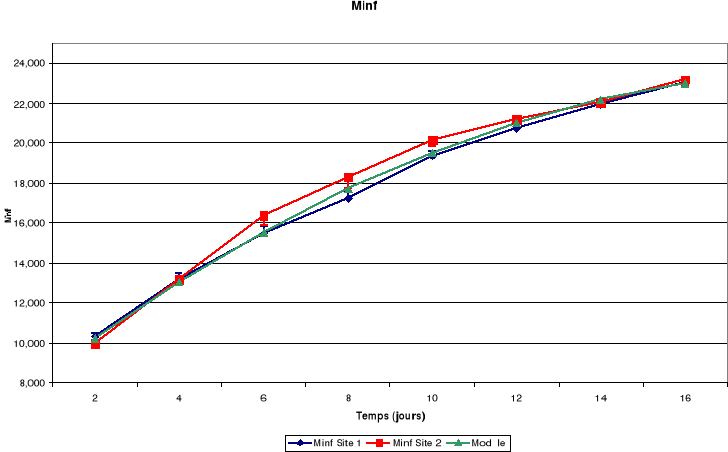
d. Mandibules
Légende
Msup : Mandibules
supérieures
Minf : Mandibules
inférieures
e. Poids
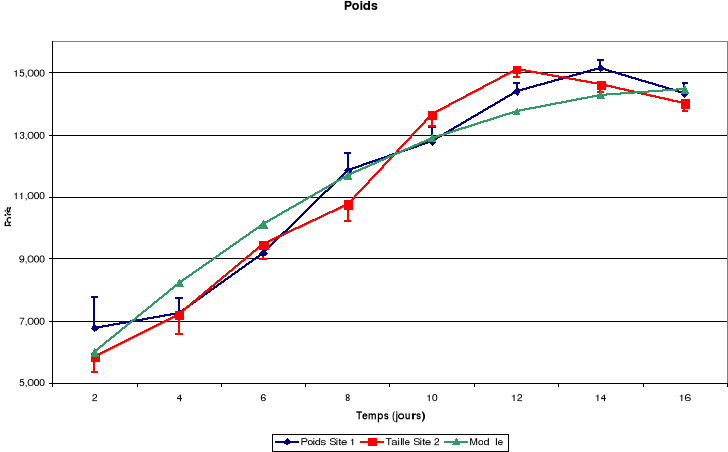
Figure-18. Evolution de la croissance des
jeunes de petits Martins pêcheurs huppés de la région de
Kinshasa.
Il découle de ces figures que la taille corporelle
croît continuellement jusqu'à l'envol mais le tarse a une
croissance staturale exponentielle de la naissance au 10ème
jour puis, elle commence à prendre l'allure d'un plateau.
La croissance des plumes (rémiges et rectrices) et des
mandibules est aussi continue jusqu'à l'envol des poussins.
La masse corporelle est croissante du 4ème
au 14ème jour puis elle décroît remarquablement
jusqu'à l'envol.
Chaque point des différentes courbes représente
plusieurs mesures. En fait, ce sont des courbes de croissance moyenne pour
toutes les nichées étudiées qui sont
représentées, en distinguant le site du Monastère de celui
des Symphonies.
Le tableau-8 a été construit afin de voir
à quel point de développement les jeunes en sont lorsqu'ils
quittent le nid. Ceci permet de voir les structures qui ont terminé leur
croissance et celles qui continuent encore à grandir après
l'envol.
Tableau-8 Données biométriques
des jeunes prises un jour avant l'envol.
|
Structure anatomique
|
Taille (masse) au sortir du nid
|
Dimensions adultes
|
Rapport taille jeune/ taille adulte
|
|
Taille
|
77,5mm
|
120mm
|
0,65
|
|
Tarse
|
7,2mm
|
8mm
|
0,9
|
|
Rémige primaire
|
33mm
|
39mm
|
0,85
|
|
Rémige secondaire
|
15mm
|
22mm
|
0,68
|
|
Rectrice
|
13mm
|
19mm
|
0,68
|
|
Mandibule supérieure
|
24mm
|
35mm
|
0,69
|
|
Mandibule inférieure
|
23mm
|
33mm
|
0,70
|
|
Poids
|
14g
|
17g
|
0,82
|
Toutes les structures continuent à croître
après l'envol. Cependant les différents rapports de tailles
obtenus montrent que cette croissance varie d'une structure à l'autre.
Le tarse et la rémige primaire ont pratiquement leur
taille adulte tandis que les mandibules, les rectrices et les rémiges
secondaires doivent encore croître de manière substantielle. Ce
fait a également été observé chez A.
atthis (Hallet-Libois, 1985) et pourrait constituer un patron de
croissance commun aux espèces du genre. Pourrait-on en déduire,
comme le faisait Hallet-Libois que l'aptitude au vol et au percher sont plus
essentielles au moment de la sortie du nid que les outils nécessaires
à la capture des poissons ?
Chez A. atthis, Hallet-Libois constate que les jeunes
sont encore nourris quelques jours après la sortie du nid. Il est
cependant difficile de confirmer le nourrissage de jeunes de A.
cristata quelques jours après l'envol. En fait, aucun jeune
bagué n'a été recapturé dans son nid ou dans son
site même. Et il faudra retenir que tous nos nids étaient
très secs, ne présentaient aucun signe de vie après
l'envol des poussins.
La comparaison des courbes (Fig-18) de croissance
pondérale et des différentes structures anatomiques que nous
avons effectuée entre les deux sites ne révèle aucune
différence significative, tant en ce qui concerne l'ordonnée
à l'origine des courbes que leur pente (p>0,05) (tab. 9) sauf pour le
tarse mais il s'agit d'une mesure assez délicate à prendre et le
fait que nous ayons observé une décroissance de sa longueur au
site 2 est indiscutablement l'indice d'une erreur de manipulation. Les jeunes
A. cristata ont le même patron de croissance.
Tableau-9. Comparaison de l'émergence
et de la croissance des structures anatomiques chez les poussins de petits
Martins pêcheurs huppés du Monastère et des Symphonies
naturelles.
|
Variable
|
Différence à l'origine
|
Différence entre les sites
|
|
|
p
|
p
|
|
Msup
|
0,0686
|
0,1791
|
|
Minf
|
0,0940
|
0,1028
|
|
RemI
|
0,8628
|
0,7335
|
|
RemII
|
0,9103
|
0,9883
|
|
Rectrice
|
0,5336
|
0,3319
|
|
Taille
|
0,5376
|
0,5758
|
|
Poids
|
0,1549
|
0,9367
|
|
Tarse
|
0,0062
|
0,3558
|
4.1.2. Le Martin chasseur du
Sénégal
4.1.2.1 Composition des pelotes
de régurgitation
Le régime alimentaire de deux nichées
différentes, chacune de 3 jeunes trouvées dans un même nid
d'un même couple bagué, a été étudié
respectivement d'Avril à Mai et en Octobre 2004. Neuf catégories
de proies au total ont été identifiées en proportions
différentes pour ces deux nichées (Tableau-10). Il s'agit de:
Taupins, Hannetons, Tilapias, Batraciens (grenouilles), Charançons,
Sauterelles, Coccinelles, petits chiroptères et libellules.
Tableau-10. Régime alimentaire de
Halcyon senegalensis dans la périphérie de la région
de Kinshasa.
|
Proies
|
1ère
Nichée : Avril à Mai
|
2ème
Nichée : Octobre
|
|
Abondance
|
Ab rel.(%)
|
Abondance
|
Ab rel.(%)
|
|
Mammifères (Chiroptères)
|
0
|
0
|
1
|
3
|
|
Batraciens
|
4
|
17
|
1
|
3
|
|
Poissons (Tilapias)
|
6
|
27
|
9
|
26
|
|
Coléoptères (Elaterides:Taupins)
|
2
|
9
|
3
|
9
|
|
Coléoptères (Scarabéidé;
Hannetons)
|
4
|
17
|
14
|
39
|
|
Coléoptères (Coccinelle)
|
1
|
4
|
0
|
0
|
|
Coléoptères (Charançons)
|
1
|
4
|
0
|
0
|
|
Odonates
|
0
|
0
|
4
|
11
|
|
Orthoptères (Sauterelle)
|
3
|
13
|
3
|
9
|
|
Insectes non identifiés
|
2
|
9
|
0
|
0
|
Comme l'indique le tableau ci-dessus pour les deux
nidifications, les insectes ont représenté 63,8 % des proies
contre 25,7 % pour les poissons de taille variant de 6,5 à 11,5cm. Les
10,3% restant sont essentiellement constitués par une chauve-souris et
des batraciens. Dans l'ensemble, les échantillons ont livré des
résultats semblables.
La distribution de fréquence des proies n'a pas
varié significativement d'une nichée à l'autre
(G4ddl = 5,16 NS).
4.2. DISCUSSION
Au monastère comme aux Symphonies naturelles, les
petits Martins pêcheurs huppés creusent leur terrier en des
endroits facilement repérables. Les terriers sont concentrés sur
un talus ou dans un ravin d'environ 50m de large avec plus de 20 terriers
espacés l'un de l'autre d'environ 2m. Cette particularité qui
peut faire penser à une colonie n'est pas observée chez
Alcedo atthis chez qui la plupart des terriers étudiés
sont généralement situés dans des sites différents
(Libois, 1994 ; 2001). En revanche, la nidification en colonies est un
trait comportemental courant chez Ceryle rudis (Lippens et Wille,
1976 ; Reyer, 1990)
Le Martin-chasseur par contre, établit son nid
généralement dans des cavités d'arbre. Tel est le cas du
nid qui a fait objet de notre étude. Ce nid est difficilement
repérable et parfois se situe à des endroits difficilement
accessibles par l'observateur.
Chez Alcedo cristata, la période de ponte est
très étalée. À Kinshasa, elle couvre au moins cinq
mois (Janvier, Mars, Avril, Septembre, mi-Octobre). Au sud Katanga en
République Démocratique du Congo, Lippens et Wille (1976) ont
observé la ponte chez Alcedo cristata en saison sèche
comme en saison pluvieuse (déjà à partir de Janvier).
Chez Halcyon senegalensis, elle a été observée en
Avril et en Octobre. L'étalement de la période de ponte semble
être une caractéristique chez les Alcedinidae. La
disponibilité de la nourriture serait un facteur déterminant
leurs activités reproductrices. C'est probablement lorsque les
disponibilités alimentaires sont les plus importantes que les oiseaux se
reproduisent. En fait, à chaque saison sèche, les feux de brousse
sont mis dans les savanes herbeuses entourant nos deux sites pour
préparer le sol à l'agriculture sur brûlis et les
étangs sont vidangés (une des techniques les plus
utilisées habituellement pendant la saison sèche pour capturer
les poissons et nettoyer les étangs). Ces pratiques contribueraient
à la diminution des ressources, tant en insectes qu'en poissons
exploités par nos deux Alcedinidae et justifieraient l'absence
de pontes pendant cette saison à Kinshasa. Chez Alcedo atthis,
la période de ponte est aussi très étalée. En
Belgique, Libois (1994) a pu montrer que le début des pontes
était d'autant plus précoce que le mois de mars était
chaud mais qu'il était aussi influencé par la stabilité
hydrologique du milieu, les oiseaux ne s'installant pas aussi vite sur les
rivières sujettes à d'éventuelles crues
printanières que sur les cours d'eau à régime
régularisé. La reproduction de petits Martins-pêcheurs
huppés est fortement influencée par la qualité de son
environnement.
Le régime observé aux deux sites présente
une différence énorme.
L'hétérogénéité porte sur toutes les
catégories de proies à l'exception des « autres
insectes ». Nous ne disposons pas de données sur la
disponibilité et la répartition des proies dans les deux sites
étudiés. Ce pendant les études faites par Davies(1977) sur
la sélection des proies chez A. cristata et par Jan &
Keeps(1994) sur l'impact de l'introduction de la perche du Nil sur le
régime alimentaire de C. rudis montrent que ces
Alcedinidae ajustent leur comportement alimentaire en fonction du site
et de la disponibilité de ressource. L'adaptation du régime
alimentaire des oiseaux aux ressources du milieu a été aussi
signale chez les rapaces (Saint Girons, 1973)
La proportion de proies a varié significativement avec
l'âge des oisillons dans les terriers prospectés. Dans le terrier
F50405, il y a eu augmentation de batraciens et diminution des poissons. Dans
le terrier F50406 (7), la proportion des poissons a augmenté par rapport
aux autres proies, odonates notamment. Enfin, dans le terrier F50429, aucune
différence significative n'est observée. Seuls les
résultats relatifs au terrier F50406 corroborent ceux de Hallet-Libois
(1985) pour Alcedo atthis, de Laudelout & Libois (2003) pour
Ceryle rudis et de Libois & Laudelout (2004) pour A. cristata
qui montrent que des proies plus grandes sont apportées aux jeunes
dès qu'ils atteignent un certain stade de développement
correspondant pratiquement à l'acquisition d'une
« homéothermie de groupe ». Cependant, les
résultats relatifs aux deux autres terriers ne les contredisent pas. En
effet, pour le terrier F50429, les effectifs de proies récoltées
avant que les jeunes n'atteignent l'âge de 8 jours sont très
faibles et justifient probablement l'absence de significativité du test.
Enfin , pour le nid F50405, la modification du régime est flagrante mais
nous ne disposons pas d'informations nous permettant de conclure que les
batraciens prélevés dans la seconde période de
l'élevage étaient des proies énergétiquement plus
avantageuses que les poissons apportés au nid pendant la première
période.
En ce qui concerne l'estimation quantitative de la
consommation par les nichées, 163 proies ont été
dénombrées dans le terrier F50406-7 (4 jeunes), 77 proies dans
F50405 (3 jeunes) et 74 proies dans F50429 (3jeunes). Ce nombre paraît
très faible en regard de ce que l'on pourrait attendre en comparaison
avec Alcedo atthis (Hallet-Libois, 1985). Nous pouvons imputer ce fait
à deux raisons non exclusives l'une de l'autre :
a. lors de la récolte de nos échantillons,
l'ensemble des restes présents au terrier n'a pas été
complètement prélevé ;
b. certaines proies ont pu ne laisser aucun reste, ce serait
p. ex. le cas de têtards d'amphibiens ou d'oligochètes (Alcedo
atthis a été vu mangeant des lombrics :
Thonnérieux, 1982).
La taille des poissons capturés présente aussi
une hétérogénéité significative. En fait, ce
sont les jours 12 et 14 qui introduisent cette
hétérogénéité. Avant le
8ième jour, les différentes pelotes pourraient
être un mélange des proies consommées par les parents et
les jeunes ou uniquement constituées de proies des jeunes. On peut
s'étonner qu'au 2ème jour, il y ait des poissons de 6
cm de longueur. Cette observation rejoint celles faites chez A. atthis,
en Belgique ou A. cristata et C.rudis dans le
lac Nokoué (Hallet-Libois, 1985 ; Laudelout & Libois,
2003 ; Libois & Laudelout, 2004). En effet, les pulli de
martins-pêcheurs peuvent ingurgiter des proies bien plus longues
qu'eux : une fois tué, le poisson est engouffré dans le bec
du jeune, tête en avant. La tête atteint l'estomac, commence
à être digérée alors que le corps dépasse le
bec. Le poisson avance dans le tube digestif au fur et à mesure de sa
« dissolution » dans l'estomac. En revanche, un adulte ne
peut pas se permettre ce genre d'exercice : il ne volera pas la bouche
pleine sauf s'il transporte une proie pour ses jeunes. Les adultes ont
donc tendance à consommer de petites proies alors que, sans doute pour
des raisons d'efficience énergétique, ils apportent des proies
plus grosses à leurs jeunes. Lorsque les jeunes grandissent, cela a
été vu chez A. atthis, C. rudis et aussi A.
cristata (Bénin), les proies apportées au nid ont tendance
à être plus grosses (Hallet-Libois, 1985, Laudelout & Libois,
2003 ; Libois & Laudelout, 2004).
Le poids de poussins de Alcedo cristata est croissant
du 4ème au 14ème jour puis, il
décroît jusqu'à l'envol (16 à 17 jours après
l'éclosion) concomitamment avec la quantité de proies dans le
terrier. Cette diminution de poids est aussi observée chez A.
atthis. Selon Hallet-Libois (1985), elle serait liée à la
réduction de fréquence de nourrissage des poussins. Elle est
caractérisée par la perte d'eau dans les tissus et au niveau des
fourreaux alaires, structures fortement irriguées mais qui disparaissent
progressivement au fur et à mesure qu`émergent les plumes.
CHAPITRE V. CONCLUSION GENERALE ET PERSPECTIVES
L'objectif de cette étude était d'une part de
quantifier la consommation de petits Martins-pêcheurs huppés
(Alcedo cristata) et des Martins-chasseurs du Sénégal
(Halcyon senegalensis) et d'autre part, de caractériser la
croissance et le développement de jeunes petits Martins-pêcheurs
huppés pendant la période de nourrissage. Il ressort de nos
recherches que :
Ø Le petit Martin-pêcheur huppé
(Alcedo cristata) pond 2 à 4oeufs (le mode est égal
à 3) pendant la saison des pluies,
Ø La durée du séjour des jeunes au nid
est de l'ordre de 16 à 17 jours,
Ø Les deux Alcedinidae étudiés
se nourrissent des proies suivantes : les poissons, les insectes
(Coléoptères, Orthoptères, Odonates) et les batraciens
(grenouilles). Les reptiles et les petits mammifères ont
été trouvés en plus dans les pelotes de
Martin-chasseur,
Ø Le régime alimentaire de petit
Martin-pêcheur huppé est constitué de 53,2% de poisson
Oreochromis niloticus dont la taille varie de 3 à 6,3cm.
L'hétérogénéité est significative pour la
taille de proies. La proportion de proies consommées par A.
cristata tantôt ne varie pas, tantôt varie significativement
avec l'âge de la nichée. Cette variation est remarquable pour les
poissons et les odonates.
Ø La croissance et le développement des jeunes
Alcedo cristata sont semblables d'un terrier à l'autre dans les
deux sites étudiés. Cette croissance est continue pour toutes les
structures anatomiques observées aussi bien pendant la période de
nourrissage qu'après l'envol mais le degré de
développement atteint au moment de l'envol n'est pas le même,
Ø Aux environs du 14ème jour
après l'éclosion, les poussins de A.cristata perdent
environ de 0,5 à 0,7 gr (annexe1),
Ø Chez le Martin-chasseur du
Sénégal le régime alimentaire est dominé par
les insectes (63,8%) Les poissons Oreochromis niloticus d'une taille
variant de 6,5 à 11,5cm ont représenté 25,7 %. La
proportion des proies dans les pelotes récoltées n'a pas
changé significativement pour les deux nichées.
A ce stade, nous avons étudié les pelotes de
régurgitation de petit Martin-pêcheur huppé et du
Martin-chasseur dans deux sites. Le nombre de nids exploités nous
paraît insuffisant pour une approche fine du problème lié
à la stratégie alimentaire notamment l'influence du milieu
sur la composition du régime alimentaire, le degré de
compétition entre les Alcedinidae et les pisciculteurs ou
pêcheurs et aussi les interactions entre les Alcedinidae de la
région de Kinshasa (comment les espèces partagent les ressources,
se tolèrent, se présentent leurs niches
écologiques ?). Il sera question de prospecter davantage de sites
et nids des espèces de cette famille.
Des dégâts ont été constatés
sur les deux espèces étudiées : destruction
volontaire par des pisciculteurs bouchant leur nid, une fois
repéré aux alentours d'un étang poissonneux ou
involontaire lors de l'extraction de sable sur les sites de nidification tel
que le talus du Monastère. Cependant, aucune étude
démographique ne nous permet de confirmer si leurs populations sont
réellement menacées de disparition. Une estimation des
populations nicheuses et de leurs fluctuations dans le temps par le comptage
régulier de terriers occupés et des individus bagués est
envisagée.
Une étude approfondie sur la reproduction compte parmi
nos objectifs. En fait, le résultat attendu dans notre étude sur
les Alcedinidae de la région de Kinshasa est de réunir des
informations scientifiques de qualité lesquelles nous permettront de
maintenir les conditions du milieu favorable aux activités
reproductrices des oiseaux. Cela sous-entend avoir une idée sur le
nombre de nichées, d'oeufs pondus, de jeunes à l'envol, la
fidélité au site, la formation de couple, la
longévité et la dispersion des jeunes.
BIBLIOGRAPHIE
ANONYME (1997) -État de la diversité biologique
dans la République Démocratique du Congo : niveau de
connaissances, gestion et menaces. Monographie nationale de la
Biodiversité. Min. Aff. Foncières, Env. Cons. Nature,
Pêche & Forêts, Kinshasa, 213 p.
Bouet, G., 1961 : Oiseaux de l'Afrique tropicale
(deuxième partie). ORSTOM, 421-798.
Brian, S. M., 1977 : The food of a malachite
kingfisher Alcedo cristata holding a territory on a fishless
river. Scopus, 1 : 24- 25.
Davies, N.B., 1977: Prey selection and the search strategy of
spotted flycatcher (Muscicapa striata): a field study on optimal
foraging. Anim. Behav., 25: 1016-1033.
Douthwaite,R.J., 1976: Fishing techniques and foods of the
pied kingfisher on lake Victoria in Uganda. Ostrich, 47 (4): 153-
160.
Draulaus, D., Van Vessen, J. & Coenen, E.,1981: Notes on
piscivorous birds around lake Kivu, Rwanda. Le Gerfaut, 71: 443-455
Fry, C.H., Fry, K. & Harris, A., 1992: Kingfishers:
Bee-Eaters and Rollers. Christopher Helm, London, 324 pp.
Hallet-Libois, C., 1985 : Modulations de la
stratégie alimentaire chez le martin-pêcheur (Alcedo atthis).
Cahiers Ethol. Appl., 5 (4): 1-206.
Jan,H.W.& Keeps(P.C.), G., 1994: Effets of Nile
perch(Lates niloticus) introduction into lake Victoria, East Africa, on the
diet of Pied Kingfishers(Ceryle rudis). J.J. Kerekes(ed), Aquatic Birds in
the Tropic Web of Lakes. Hydrobiologia 279/280: 367-376.
Kambamba, A., 2003 : Avifaune de la forêt de
Symphonies naturelles à Kinshasa /Binza. TFE inédit,
ISP-G, Kinshasa, 23 p.
Laudelout,A. & Libois,R.,2003: On the feeding ecology of
the Pied Kingfisher, Ceryle rudis, at Lake Nokoué, Benin. Is
there a competition with fishermen? pp. 167-185 in I.G. Cowx (ed.)
Interactions between fish and birds. Implications for management.
Blackwell, London.
Lema, A., 2002 : Note de cours d'Entomologie
générale, Univ-Kin, Kinshasa, 53 p,
Inédit.
Libois,R.M.,1993 : Réussite de quatre
nichées successives chez le Martin-pêcheur d'Europe (Alcedo
atthis) au cours de la même saison. Aves,
30(1) :31-36.
Libois, R.M., 1994 : Eléments de la
démographie du martin-pêcheur (Alcedo atthis). Incidences
climatiques sur le succès reproducteur. Le Gerfaut,
84 : 19-38.
Libois, R.M, 1994b : Le Martin-pêcheur : une
cohabitation difficile. L'Homme et l'Oiseau, 30(4):263-269.
Libois, R., 2001 : Le martin-pêcheur (Alcedo
atthis) va-t-il bientôt manquer de sites de nidification. Aves,
38 (4) : 161-178.
Libois, R., 2002 : Introduction à
l'Ornithologie. Notes de cours, DESS, Univ. Abomey-Calavi
(Bénin) :1-35.
Libois, R. & Laudelout, A., 2004: Food niche segregation
between the Malachite Kingfisher; Alcedo cristata, and the Pied
Kingfisher, Ceryle rudis, at Lake Nokoué, Bénin.
Ostrich- 75 (1-2) : 32-38.
Lippens, L. et Wille, H., 1976 : Les oiseaux du
Zaïre. Lannoo. Tielt, 435-456.
Malula, M.L.,2004 :Etude de quelques
caractéristiques physico-chimiques et Invertebrés des
étangs de Symphonies naturelles. TFE inédit, ISP-G,
Kinshasa, 23 p.
Monadjem, A. & Owen-Smith, R.N., 1994: Perch-site
selection by three species of kingfishers. Ostrich, 65:
342-343.
Muleka, N.R., 2003: Inventaire des vertébrés
terrestres de la forêt des Symphonies naturelles à Kinshasa/Binza.
TFE, ISP-G, Kinshasa, 25 p. Inédit.
Ngalula, M.J., 2004 : Caractéristiques
physico-chimiques et ichtyologiques des ruisseaux de Symphonies naturelles
à Kinshasa TFE inédit, ISP - G, Kinshasa, 23 p.
Reyer, H.-U., Migongo-Bake, W. & Schmidt, L., 1988: Field
studies and experiments on distribution and foraging of pied and malachite
kingfishers at Lake Nakuru (Kenya). Journal of Animal Ecology, 57:
595-610.
Reyer, H.U., 1990: Pied Kingfishers: ecological causes and
reproductive consequences of cooperative breeding. Stacey P. &
Koenig W. (eds) Cooperative breeding in Birds: long term studies of ecology
and behaviour. Cambridge University Press, Cambridge. Pp. 529-557.
Saint Girons, M-C., 1973 : Adaptation du régime
alimentaire de quelques rapaces nocturnes au paysage rural. Les
proies de l'Effraie et du moyen Duc dans le Département de la Somme.
Bull. Ecol., 4 (2) : 95-120.
Schwartz, D., 1969 : Méthodes statistiques
à l'usage des médecins et des Biologistes, 3ième
Ed. Flammarion., Paris.
Serle,W. & Morel,G-Y., 1994 : Les oiseaux de
l'ouest africain. Delachaux et Niestlé, Paris 331 p.
Sinclair, I. & Ryan, P., 2003: A comprehensive
illustrated field guide: Birds of Africa south of the Sahara. Struik, 759
p.
Sokal, R. & Rohlf, J., 1981- Biometry. 2nd ed.,
Freeman & Co., New-York, 859 p
Thonnerieux Y., 1982 - Capture d'un lombric par un
martin-pêcheur, Alcedo atthis . Le Bièvre,
4 : 155.
Tjomlid, S.A., 1973: Food preferences and Feeding habits of
the pied kingfisher Ceryle rudis. Ornis scand., 4 : 145-151.
Vanderlinden S., 2005 : Étude du régime
alimentaire du Grand Cormoran (Phalacrorax carbo sinensis). I.S.I
HUY-GEMBLOUX. Mémoire Ingénieur Industriel, 79 p.
Inédit.
Woodall,P.F., 2001: Alcedinidae Pp. 127-147 in
«Handbook of the birds of the world. Vol. 6» Ed. Del Hoyo,
J. Elliott, A. & Sargatal, J. Lynx Edicions, Barcelona.
WEBOGRAPHIE
http://www.worldbirder.com/photo/photo.asp?PID=2286
VI. ANNEXES
Annexe 1: - Tableau11. Données
relatives à la croissance staturale des structures anatomiques,
pondérale des jeunes Alcedo cristata au monastère
|
Time
|
Site
|
Msup
|
Minf
|
RemI
|
RemII
|
Rectrice
|
Taille
|
Poids
|
Tarse
|
|
2
|
1
|
9,881
|
10,310
|
0,000
|
0,000
|
0,000
|
57,000
|
6,778
|
5,711
|
|
4
|
1
|
13,119
|
13,214
|
0,417
|
0,000
|
0,000
|
57,222
|
7,278
|
6,167
|
|
6
|
1
|
15,690
|
15,524
|
7,583
|
2,250
|
1,333
|
64,333
|
9,188
|
6,678
|
|
8
|
1
|
17,714
|
17,262
|
15,750
|
5,375
|
4,625
|
67,389
|
11,833
|
6,944
|
|
10
|
1
|
20,048
|
19,357
|
22,092
|
10,217
|
7,542
|
73,750
|
12,778
|
7,100
|
|
12
|
1
|
21,638
|
20,738
|
25,050
|
12,167
|
9,958
|
75,125
|
14,389
|
7,222
|
|
14
|
1
|
22,800
|
21,950
|
28,042
|
13,400
|
11,417
|
76,813
|
15,144
|
7,278
|
|
16
|
1
|
23,921
|
23,026
|
31,667
|
14,708
|
12,833
|
77,500
|
14,333
|
7,333
|
- Tableau12. Erreur-type de
moyennes de croissance au Monastère :
|
Time
|
Site
|
Msup
|
Minf
|
RemI
|
RemII
|
Rectrice
|
Taille
|
Poids
|
Tarse
|
|
2
|
1
|
0,138
|
0,156
|
0,000
|
0,000
|
0,000
|
2,555
|
0,986
|
0,293
|
|
4
|
1
|
0,276
|
0,277
|
0,417
|
0,000
|
0,000
|
0,858
|
0,480
|
0,236
|
|
6
|
1
|
0,248
|
0,321
|
2,615
|
1,025
|
0,899
|
0,866
|
0,353
|
0,184
|
|
8
|
1
|
0,260
|
0,262
|
2,796
|
1,473
|
1,237
|
1,476
|
0,589
|
0,176
|
|
10
|
1
|
0,299
|
0,252
|
1,629
|
0,748
|
0,946
|
2,024
|
0,434
|
0,207
|
|
12
|
1
|
0,249
|
0,233
|
1,275
|
0,458
|
0,579
|
1,684
|
0,261
|
0,222
|
|
14
|
1
|
0,193
|
0,223
|
1,139
|
0,434
|
0,543
|
0,977
|
0,256
|
0,188
|
|
16
|
1
|
0,246
|
0,237
|
1,251
|
0,559
|
0,558
|
0,845
|
0,333
|
0,167
|
Tableau13. Données relatives à la
croissance staturale des structures anatomiques, pondérale des
jeunes Alcedo cristata aux Symphonies naturelles.
|
Time
|
Site
|
Msup
|
Minf
|
RemI
|
RemII
|
Rectrice
|
Taille
|
Poids
|
Tarse
|
|
2
|
2
|
9,500
|
10,000
|
0,000
|
0,000
|
0,000
|
54,900
|
5,850
|
5,000
|
|
4
|
2
|
12,900
|
13,200
|
0,500
|
0,000
|
0,000
|
59,150
|
7,200
|
5,375
|
|
6
|
2
|
16,350
|
16,400
|
8,200
|
2,650
|
0,000
|
64,100
|
9,450
|
6,188
|
|
8
|
2
|
18,400
|
18,300
|
15,590
|
6,500
|
7,500
|
66,700
|
10,750
|
6,875
|
|
10
|
2
|
20,600
|
20,150
|
18,760
|
8,410
|
8,700
|
70,100
|
13,650
|
6,938
|
|
12
|
2
|
22,050
|
21,200
|
25,800
|
11,850
|
10,900
|
73,500
|
15,100
|
6,938
|
|
14
|
2
|
22,923
|
22,038
|
30,346
|
13,746
|
12,462
|
74,692
|
14,615
|
6,682
|
|
16
|
2
|
24,000
|
23,200
|
33,350
|
14,820
|
13,200
|
77,400
|
14,000
|
7,000
|
Tableau14. Erreur-type de moyennes de croissance au
Monastère :
|
Time
|
Site
|
Msup
|
Minf
|
RemI
|
RemII
|
Rectrice
|
Taille
|
Poids
|
Tarse
|
|
2
|
2
|
0,197
|
0,197
|
0,000
|
0,000
|
0,000
|
0,823
|
0,506
|
0,094
|
|
4
|
2
|
0,348
|
0,327
|
0,500
|
0,000
|
0,000
|
1,325
|
0,611
|
0,183
|
|
6
|
2
|
0,500
|
0,521
|
3,758
|
1,374
|
0,000
|
0,737
|
0,462
|
0,091
|
|
8
|
2
|
0,542
|
0,578
|
4,248
|
1,790
|
0,913
|
1,041
|
0,534
|
0,125
|
|
10
|
2
|
0,371
|
0,308
|
4,173
|
1,900
|
1,191
|
0,823
|
0,409
|
0,063
|
|
12
|
2
|
0,252
|
0,186
|
3,009
|
1,498
|
0,662
|
0,703
|
0,245
|
0,063
|
|
14
|
2
|
0,211
|
0,223
|
0,767
|
0,436
|
0,433
|
0,559
|
0,248
|
0,139
|
|
16
|
2
|
0,333
|
0,300
|
1,033
|
0,449
|
0,569
|
0,306
|
0,247
|
0,000
|
Annexe 2: Illustration de différentes
phases de développement des jeunes petits Martins-pêcheurs
huppés de l'éclosion à l'envol (Photos, R.Kisasa& A.
Laudisoit, 2004-2005)
Oeufs

15-16-17ème j
13ème j
11ème j
9ème j
7ème j
5ème j
3ème j
1er j







SOMMAIRE
INTRODUCTION
1
Problématique et
Intérêt du sujet.
1
Choix du sujet
1
Objectifs
2
Subdivision du travail
2
CHAPITRE I. GENERALITES SUR LES ALCEDINIDAE
DE LA REGION DE KINSHASA.
3
1.1.
Systématique
3
1.1.1. Le petit Martin-pêcheur
huppé
3
1.1.1.1. Identification
3
1.1.1.2. Répartition et
habitat
4
1.1.1.3. Régime
alimentaire
4
1.1.1.4. Reproduction
5
1.1.2. Le
Martin-chasseur du Sénégal
5
1.1.2.1. Identification
5
1.1.2.2. Répartition et
Habitat
5
1.1.2.3. Régime
alimentaire
6
1.1.2.4. Reproduction
7
CHAPITRE II : MILIEU D'ETUDE
8
2.1. Choix du milieu
8
2.2. Cadre géographique &
distribution des terriers
8
2.2.1. Cadre
géographique
8
2.3. Sites de nidification et terriers
9
2.3.1. Monastère Notre Dame
d'Assomption (notée S1)
10
2.3.2. Symphonies naturelles
(S2)
12
CHAPITRE III : MATERIEL ET
METHODES
13
3.1. Opérations de terrain
13
3.2. Étude de la croissance des
poussins
13
3.3. Étude du régime
alimentaire
14
3.3.1. Choix et fondement de la
méthode
14
3.3.2. Prélèvement et
traitement des échantillons
14
3.3.3. Identification des
proies
15
3.3.3.1. Les poissons
15
3.3.3.2. Les batraciens
15
3.3.3.3. Les insectes
15
3.3.4. Comptage des proies
15
3.3.4.1. Les poissons
15
3.3.4.2. Les autres proies
15
3.3.5. Détermination de la taille
des poissons capturés
15
3.3.6. Analyse des
données.
17
CHAPITRE IV : RESULTATS
18
4.1. Évolution au cours de la
période de nourrissage
18
4.1.1. Le petit Martin-pêcheur
huppé (Alcedo
cristata)
18
4.1.1.1. Données
démographiques et phénologie de la reproduction
18
4.1.1.2. Régime
alimentaire
20
4.1.1.2.1 Le régime : aspect
général
20
4.1.1.2.2. Le régime en fonction de
l'âge des poussins
21
4.1.1.2.3. Taille des proies
capturées : le cas d'Oreochromis
niloticus.
21
4.1.1.2.4. Relation
longueur des proies capturées -âge des poussins
22
4.1.1.3 Croissance et
Développement
23
4.1.1.3.1 Observations
23
4.1.1.3.2 Modèle de croissance dans
les deux sites d'étude
24
4.1.2. Le Martin chasseur du
Sénégal
29
4.1.2.1 Composition des pelotes de
régurgitation
29
4.2. DISCUSSION
29
CHAPITRE V. CONCLUSION GENERALE ET
PERSPECTIVES
32
BIBLIOGRAPHIE
34
WEBOGRAPHIE
35
VI. ANNEXES
36
|
|



