|

REPUBLIQUE AL
GERIENNE DEMOCRATIQUE ET
POPULAIRE
UE
CHERCHE
fraîche
'ENSEIGN sécur it E
SCIENTIFIQ
MINISTERE DE L
MENT SU
é sanit aire
PERIEUR E
des T DE LA RE viandes
UNIVE
RSITE MOULOUD
Facult é
s Biologique s Biochimie e t
MAMMERI DE TIZI OUZOU (UMM TO)
et Agrono miques Microbiolo gie
de
n d'étu
Mémoire de fi
En
vue d'ob
Alimentaire au
robiologie
Promotion 2007-2008
Optio
tention du diplôme
Sciences Biol o
n : Cont rôle de Q u
d'Ingé nieur d'E t
giques
alité et Analyses
at en
D étermin ation "i n vitro " du pou v
ess entielles d'Eucalyptus, Myrte, C l
l eur application à la conservation
haché e
oir anti bactérie n
ous de girofle e t
de la viande fr
des h uiles
Sarrie tte, et
aîche type
Président: Mr DJERBAL
Promoteur: Mr D J
Examin ateur: Mr
Examin atrice: Mm
Invité e d'honneur
M.: Dr v é
Dr
âa
D., Maîtr e
., Maître a s
Z., Maître
ALKI O
Laborato
s
l'UM M
travaux pr
a
rvice de Mi c
t
de Drâa
e KOLL I
: Melle M
ENAN E
YESLI A
térinaire, Directeur
Ben Khedda, charg
de conférences à
l'UMM
sistant, chargé de
cour
assistant, chargée de Respon
sable du se
ire Régional Vétérin
a
iredu L
é de
UMMTO
TO
iques à l'
aborat oire Régional Vétérinaire de
Cours à l'UMM TO
TO
.
Ben Khedda
des Science
Département de
REMERCIEMENTS
Au terme de ce travail, nous tenons à remercier tout
particulièrement:
- Notre promoteur, Docteur DJENANE Djamel, Maître de
Conférences à l'Université Mouloud Mammeri de Tizi-Ouzou
de nous avoir permis de découvrir un domaine de recherche passionnant et
de nous avoir guidé tout au long de notre trajet d'investigation
scientifique; qu'il trouve ici le témoignage de notre haute
considération et profond respect.
- Notre co-promoteur, Docteur AMROUCHE Tahar, Maître de
Conférences à l'Université Mouloud Mammeri de Tizi-Ouzou
pour son aide précieuse et ses conseils de rigueur et d'humilité
qu'il nous a dispensés. Ce fut un grand plaisir de travailler avec vous
!
Nos vifs remerciements vont aussi au Professeur PEDRO RONCALES
de l'Université de Zaragoza (Espagne) ainsi que le Ministère
Espagnol des Affaires Extérieures (Agencia Española de
Cooperación Internacional) pour le financement de notre Travail.
Nous adressons également nos sincères
remerciements à Mr. DJERBAL Mouloud, Docteur vétérinaire,
Directeur du Laboratoire Régional Vétérinaire de
Drâa Ben Khedda (Tizi-Ouzou) et chargé de cours à
l'Université Mouloud Mammeri de Tizi-Ouzou, pour nous avoir accueillis
dans son laboratoire et qui nous a fait l'honneur d'accepter de présider
le jury de notre soutenance, qu'il trouve ici le témoignage de notre
haute considération et profond respect.
Aussi, nos plus sincères reconnaissances à:
- Tout le Personnel du Laboratoire Vétérinaire
Régionale de DBK en particulier Melle MALKI Ouiza; Mr BELHADJ
Hcène, Melle DADI Nadia, Mr BALOUL Saïd et Mr
ALLEM Rachid pour tout leur soutien logistique;
- Docteur HAOUALI Karim, Maître de Conférences
à l'Université Mouloud Mammeri TIZI OUZOU) pour nous avoir
procuré les souches bactériennes;
- Mme NASSER BEY, chef du Laboratoire Huiles
essentielles de SAIDAL (Mohammadia, el Harrach, Alger) pour nous avoir
accueillis dans son laboratoire pour l'extraction des huiles essentielles;
- Mr ASLA Tarik, Maître assistant
chargé de cours (Département de Biologie et Physiologie
Végétale et Animale, Faculté des sciences Biologiques et
Agronomiques à l'UMMTO), d'avoir mis à notre disposition le
matériel de son laboratoire pour les opérations d'extraction des
huiles essentielles.
Mme KOLLI ZOHRA, Maître assistant chargée de TP
(Département de Biochimie Microbiologie, Faculté des sciences
Biologiques et Agronomiques à l'UMMTO) d'avoir accepté d'examiner
notre travail.
Mr YESLI Abdennour, Maître assistant, chargé de
cours (Département d'Agronomie, Faculté des sciences Biologiques
et Agronomiques à l'UMMTO) qui nous a fait l'honneur d'accepter de faire
partie du jury de notre travail.
DEDICACES
Je dédie ce modeste travail :
Au Bon Dieu qui nous a donné foi, santé et le
courage de mener ce travail;
À mes parents que je remercierai éternellement pour
leur amour et leur appui inconditionnel durant toutes ces années;
À mes frères Mohammed, Boubekeur, Kouceîla et
ma soeur Amina; À Moumouh, un grand merci pour ton soutien moral;
À tous mes amis(es) notamment Siham, Thiziri, Nora, Lynda,
Zahra et Safia pour leur intarissable soutien, en souvenir de toutes ces
années passées ensemble;
À ma grande famille;
À l'âme de ma tante Dehbia;
À mon binôme Nafaa et sa famille, sans oublier la
promotion 5ème A CQA (2007-2008).
SOUHILA
Je dédie ce modeste travail:
Au Bon Dieu, le père tout puissant pour m'avoir
donné la santé et la force de mener ce travail;
À mes parents pour leurs dévouements, leurs amours,
leurs sacrifices et leurs encouragements. Que ce travail soit, pour eux, un
faible témoignage de ma profonde affection et tendresse;
À mes frères : Madani, Omar et surtout Yanis pour
sa grande contribution dans la réalisation de ce travail;
À mes soeurs, en particulier Nouara et Nabila pour leur
soutien moral et financier;
À mes deux amis Larbi et Amar pour leur
disponibilité et leur pardon ainsi que pour leurs familles;
À mes camarades de la promotion 5ème
A CQA (2007/ 2008); À mon binôme Souhila, ainsi qu'à
sa famille.
SOMMAIRE
RESUME INTRODUCTION
Première partie : données
bibliographiques
CHAPITRE I : Les huiles essentielles
1- Historique des huiles essentielles 03
2- Terminologie et définition des huiles essentielles
04
3- Répartition botanique et localisation des huiles
essentielles dans la plante 04
3.1- Répartition botanique 04
3.2- Localisation 05
4- Les huiles essentielles dans la plante 06
5- Modes d'extraction des huiles essentielles 06
5.1- Entraînement à la vapeur d'eau 06
5.2- Extraction par expression 07
5.3- Extraction par solvant 07
5.4-Procédés utilisant les huiles et les graisses
07
5.5- Extraction par gaz supercritique 08
6- Propriétés physicochimiques des huiles
essentielles 09
7- Qualité et caractérisation chimique des huiles
essentielles 09
7.1- Méthodes d'analyses physiques et chimiques 10
7.2- Méthodes de détermination des constituants de
l'huile 10
8- Composition chimique des huiles essentielles 10
8.1- Terpénoïdes 11
8.2- Composés aromatique 13
8.3- Composés d'origines diverses 13
9- Paramètres influençant la composition
quantitative et qualitative
des plantes aromatiques 14
10- Stabilité des huiles essentielles 15
11- Autooxydation des huiles essentielles 15
12- Photooxydation des huiles essentielles 16
13- Chémotypes 16
14- Toxicité des huiles essentielles 17
15- Applications thérapeutiques 17
16- Description des plantes utilisées 17
16.1- Girofle 17
16.2- Eucalyptus 19
16.3- Myrte commun 20
|
16.4- Sarriette
CHAPITRE II: Activités Biologiques des huiles
essentielles
1- Activité antibactérienne
1.1- Bactéricide et bactériostase
1.2- Huiles essentielles et bactéries résistantes
aux antibiotiques
1.3- Mécanismes d'action des huiles essentielles sur les
bactéries
1.4- Résistance des bactéries Gram- à
certaines huiles essentielles
|
21
...23 24 24 24
26
|
|
2- Activité antifongique
|
|
|
27
|
|
2.1- Mode d'action des huiles essentielles sur les levures
|
|
|
28
|
|
2.2- Les principales huiles ayant un pouvoir antifongique
|
|
|
28
|
|
3- Activité antivirale
|
|
|
28
|
|
4- Activité antioxydante
|
|
|
29
|
|
5- Combinaison entre les huiles essentielles
|
|
|
29
|
|
6- Activité liée à la composition chimique
|
|
|
30
|
|
7- Les principales techniques de détermination
|
de
|
l'activité
|
|
|
antimicrobienne des huiles essentielles
|
|
|
32
|
|
6.1- Aromatogramme
|
|
|
32
|
|
6.2- Technique de microatmosphère
|
|
|
33
|
|
6.3- Technique par contact direct
|
|
|
34
|
|
6.4- Méthode de diffusion en puits ou en cylindre
|
|
|
35
|
|
6.5- Méthode de dilution
|
|
|
35
|
CHAPITRE III : Application des huiles essentielles dans
le domaine
agroalimentaire
1- Systèmes de sécurité sanitaire des
aliments en Algérie 37
2- Quelques évènements récents sur les
intoxications alimentaires en
Algérie 39
3- Les applications alimentaires des huiles essentielles 39
4- Facteurs influencent les propriétés
antimicrobiennes des huiles essentielles
dans les aliments 40
5- Bactéries responsables des toxi-infections
alimentaires 41
5.1- Staphylococcus aureus 41
5.2- Bacillus cereus 42
5.3- Pseudomonas aeruginosa 42
5.4- Salmonella paratyphi A 43
5.5- Escherichia coli 44
5.6- Shigella flexneri 45
Deuxième partie : Etude
expérimentale
Matériel et méthodes
1- Matériel 46
1.1- Matériel végétal 46
1.2- Milieux de culture 47
2- Extraction et conservation des huiles essentielles 47
2.1- Clous de girofle 47
2.2- Myrte et Eucalyptus 50
2.3- Calcul du rendement 51
2.4- Conservation des huiles essentielles 51
3- Tests d'activité antimicrobienne des huiles
essentielles 51
3.1 - Critères de sélection des souches 51
3.2- Souches bactériennes 51
3.3- Confirmation des souches 52
3.4 - Préparation des précultures 54
3.5- Tests antimicrobiens "in vitro 54
3.5.1- Aromatogramme 55
3.5.2- Microatmosphère 55
3.5.3- Diffusion en puits 56
3.5.4- Nature de l'activité antibactérienne des
huiles essentielle 56
3.5.5- Détermination des concentrations minimales
inhibitrices 57
3.5.6- Combinaison entre les huiles essentielles 59
3.6- Activité antimicrobienne des huiles essentielles en
présence des pathogènes
inoculées dans la viande hachée bovine 59
3.6.1- Préparation de la viande 59
3.6.2- Optimisation de la CMI appliquée à la viande
par des tests Sensoriels 59
3.6.3- Préparation des échantillons 61
3.6.4- Analyses Microbiologiques 63
Résultats et discussion
1- Rendement en huiles essentielles 65
2- Tests de sensibilité microbienne envers les huiles
essentielles 66
2.1- Essais aves les Clous de Girofle 67
2.2- Essais avec la Sarriette 70
2.3- Essais avec l'Eucayptus 73
2.4- Essais avec le Myrte 76
3- Interprétation de la nature de l'activité des
huiles essentielles 79
4- Concentrations minimales inhibitrices (CMI) 80
3.1- Clous de Girofle 80
3.2- Sarriette 81
3.3- Eucalyptus 82
3.4- Myrte 83
5- Combinaison entre les huiles essentielles 84
6- Application des huiles essentielles dans la viande
85
6.1- Optimisation de la quantité d'huile appliquée dans la
viande par des tests
préalables de dégustation 86
6.2- Effet des huiles essentielles appliquées dans la
viande sur la flore pathogène 88
6.2.1- S. aureus 88
6.2.2- S. paratyphi A 90
6.2.3- E. coli 91
6.2.4- S. flexneri 93
Conclusion et perspectives 96
Références bibliographiques
Annexe
Liste des tableaux
· Tableau I : Avantages et
inconvénients de l'extraction par CO2 supercritique.
· Tableau II : Bioactivité de
quelques principaux terpènes rencontrés dans les H.E.
· Tableau III : Présentation des
plantes employées pour l'extraction des H.E.
· Tableau IV : Coloration de Gram et
morphologie des souches bactériennes utilisées.
· Tableau V : Répertoire des
résultats obtenus par la méthode des aromatogrammes.
· Tableau VI : Valeurs des dilutions (ul
d'H.E./mL d'eau).
· Tableau VII : Le rendement (%) en H.E.
des différentes plantes utilisées.
· Tableau VIII : Halos d'inhibition (mm)
provoqué par l'H.E. des Clous de girofle.
· Tableau IX: Halos d'inhibition (mm)
provoqués par l'H.E. pure de la Sarriette.
· Tableau X : Diamètres (mm) des
halos entourant les disques exprimant la sensibilité à l'H.E.
d'Eucalyptus (état pur et dilué à 1/2) des
bactéries pathogènes.
· Tableau XI : Halos d'd'inhibition (mm)
en présence d'H.E. de Myrte.
· Tableau XII : Récapitulatif des
aromatogrammes des H.E. avec six souches bactériennes
pathogènes.
· Tableau XIII : Nature de
l'activité antimicrobienne des différentes H.E. testées
après repiquage sur BHIB puis sur gélose nutritive.
· Tableau XIV : Récapitulatif des
valeurs de CMI des H.E. testées sur les 6 souches
pathogènes (en ul/Ml d'eau).
· Tableau XV : Résultats des
interactions entre les différentes H.E. testées par la
méthode des aromatogrammes (zones d'inhibition en mm).
· Tableau XVI : Résultats du test
de dégustation selon le critère du goût.
· Tableau XVII : Résultats du test
de dégustation selon le critère d'odeur.
· Tableau XVIII : Résultats du
dénombrement de S. aureus dans chaque échantillon (log10
ufc/g).
· Tableau IXX : Résultats du
dénombrement de S. paratyphi A. dans chaque échantillon
(Log/temps).
· Tableau XX : Résultats du
dénombrement d' E. coli dans chaque échantillon
(Log/temps).
· Tableau XXI : Résultats du
dénombrement de S. flexneri dans chaque échantillon
(Log/temps).
Liste des figures
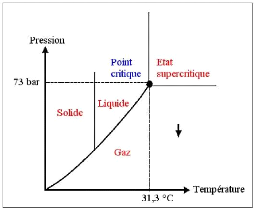
· Fig. 1 : Etas du CO2 en fonction du
T° et de la pression.
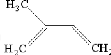
· Fig. 2 : Structure de quelques
monoterpènes rencontrés dans les H.E.
· Fig. 3 : Structure de quelques
sesquiterpènes rencontrés dans les H.E.
· Fig. 4 : Structures de quelques
arènes dérivées du phénylpropane.
· Fig. 5 : Quelques composés
d'origines diverses.
· Fig. 6 : Illustration simplifiée
de CPG de 4 chémotypes différents de thym.
· Fig. 7 : Clous de Girofle.
· Fig. 8 : Feuilles d'Eucalyptus.
· Fig. 9 : Feuilles de Myrte commun.
· Fig. 10: Sarriette des jardins.
· Fig. 11 : Structure de la paroi
bactérienne Gram+.
· Fig. 12 : Structure de la paroi
bactérienne Gram-.
· Fig. 13 : Illustration de la
méthode d'aromatogramme.
· Fig. 14 : Illustration de la
méthode de microatmosphère.
· Fig. 15 : Schéma
représentant la technique de contact direct.
· Fig. 16 : Montage de l'hydrodistillateur
réalisé au département de Biologie et Physiologie
Végétale à l'UMMTO.
· Fig. 17 : Distillat.
· Fig. 18 : Étapes de
séparation des phases du distillat.
· Fig. 19 : Montage de l'hydrodistillateur
semi-pilote du Groupe SAIDAL.
· Fig. 20 : Aspect des souches
bactériennes repiquées sur milieux spécifiques.
· Fig. 21 : Préparation de
l'inoculum.
· Fig. 22 : Détermination de la
nature de l'activité antimicrobienne des H.E.
· Fig. 23 : Schéma du test de
l'activité antibactérienne des H.E. sur une viande
contaminée par les souches pathogènes.
· Fig. 24 : Test de l'effet des H.E. sur
la conservation de la viande hachée.
· Fig. 25 : Rendement en H.E.obtenues par
hydrodistillation.
· Fig. 26 : Photos montrant les
témoins réalisés par la méthode d'aromatogramme.
· Fig. 27 : Photos montrant
l'activité antimicrobienne de l'H.E. à l'état pur des
Clous de Girofle par la méthode d'aromatogramme.
· Fig. 28 : Photos montrant
l'activité antimicrobienne de l'H.E. des Clous de Girofle diluée
à 1/2 par la méthode de puits.
· Fig. 29 : Photos montrant l'effet
antimicrobien de l'H.E. de sarriette par la méthode d'aromatogramme.
· Fig. 30 : Photos montrant l'effet
antimicrobien de l'H.E. de Sarriette par la méthode de
microatmosphère.
· Fig. 31 : Représentation
graphique des deux tests antimicrobiens de l'H.E. de Sarriette.
· Fig. 32 : Photos montrant
l'activité antimicrobienne de l'H.E. d'Eucalyptus par la méthode
d'aromatogramme.
· Fig. 33 : Photos montrant l'effet
antimicrobien de l'H.E. d'Eucalyptus par la méthode de diffusion en
puits.
· Fig. 34 : Photo montrant l'effet
antimicrobien de l'H.E. d'Eucalyptus par la méthode de
microatmosphère.
· Fig. 35 : Photos montrant l'effet
antimicrobien de l'H.E. du Myrte par la méthode d'aromatogramme.
· Fig. 36 : Photo montrant l'effet
antimicrobien de l'H.E. du Myrte par la méthode de diffusion en
puits.
· Fig. 37 : Représentation
graphique des effets antimicrobiens des H.E. vis-à-vis de 6 souches
bactériennes pathogènes par la méthode d'aromatogramme.
· Fig. 38 : Photos montrant les CMI de
l'H.E. des Clous de Girofle vis-à-vis de certaines bactéries
pathogènes.
· Fig. 39 : Photos montrant les CMI de
l'H.E. de Sarriette vis-à-vis de certaines bactéries
pathogènes.
· Fig. 40 : Photos montrant les CMI de
l'H.E. d'Eucalyptus.
· Fig. 41 : Photos montrant les CMI de
l'H.E. du Myrte.
· Fig. 42 : Représentation
graphique des valeurs de CMI des quatre H.E. sur 4 souches bactériennes
testées.
· Fig. 43 : Effets dans la viande des H.E.
des Clous de girofle et d'Eucalyptus vis -à -vis de S.
paratyphi.
· Fig. 44 : Évolution de la
croissance de S. paratyphi A. en présence et en absence
d'H.E.
· Fig. 45 : Effets dans la viande des H.E.
des Clous de Girofle et de Sarriette vis-à-vis de E. coli.
· Fig. 46 : Effets dans la viande de
l'H.E. de Sarriette vis-à-vis de S. flexneri.
· Fig. 47 : Exemple d'un effet antioxydant
des H.E. appliquées dans la viande hachée.
Liste des abréviations
Les abréviations retenues sont:
- H.E. : Huile(s) Essentielle(s);
- CG : Clous de Girofle;
- CPG : Chromatographie en Phase Gazeuse;
- SM : Spectroscopie de Masse;
- ° C : degré Celsius; - T °:
température;
- h : heure;
- ISO : International Organisation for Standardisation;
- CMI : Concentration Minimale Inhibitrice;
- CMB : Concentration Minimale Bactéricide;
- PM : poids moléculaire;
- mn : minute;
- cm : centimètre; - um : micromètre; - nm :
nanomètre; - BHIB : Brain Heart Infusion;
- RLO : radicaux libres oxygénés;
- ? : diamètre ;
- AFNOR : Association Française de Normalisation ;
Résumé
Les huiles essentielles et leurs constituants ont une longue
histoire comme agents antimicrobiens, cependant leur utilisation comme additifs
antimicrobiens dans le domaine agroalimentaire a été rarement
rapportée. Ce travail a pour but d'apporter une contribution à la
mise en évidence de l'activité antimicrobienne des huiles
essentielles. Dans un premier temps, cette étude est axée
à l'extraction de ces métabolites à partir de plantes
autochtones de Kabylie à savoir l'Eucalyptus et le Myrte commun, et
d'une épice importée « Clous de Girofle » par le
procédé d'hydrodistillation à deux échelles
(hydrodistillateur type Clavenger, et semi-industriel). La quatrième
huile testée est celle de Sarriette des jardins certifiée
extraite en France.
Dans un second temps, le travail est orienté vers la
mise en évidence de l'activité antibactérienne de ces
huiles sur les souches bactériennes pathogènes, les plus
incriminées dans les empoisonnements alimentaires (S. aureus, B.
cereus, S. paratyphi A., S. flexneri, P. aeruginosa et E. coli)
en employant trois méthodes : méthode d'aromatogramme, de
microatmosphère et celle de diffusion en puits. Les huiles faisant
l'objet de l'étude ont montré une forte activité
antibactérienne sur l'ensemble des souches testées, parmi
lesquelles S. aureus s'est révélée être la
plus sensible tandis que P. aeruginosa est la plus résistante.
Les concentrations minimales inhibitrices sont déterminées par la
méthode de dilutions en milieu solide. La plus faible CMI étant
exercée par l'huile essentielle de Sarriette avec 10,1 ul / mL sur la
totalité des souches testées. Tandis que celle de Myrte exerce un
effet antibactérien non significatif.
Ces résultats, laissent entrevoir une issue favorable
dans le domaine de la sécurité sanitaire du consommateur. On
évoquera l'application de ces propriétés dans le maintien
de la salubrité d'une viande hachée conservée à une
température de réfrigération.
Mots-clés : huiles essentielles,
activité antibactérienne, hydrodistillation, pathogène,
CMI, viande.

INTRODUCTION
INTRODUCTION
La viande peut être le siège d'une contamination
et d'une prolifération microbienne, car elle constitue un excellent
milieu de croissance pour un grand nombre d'espèces
bactériennes (LABIE, 1993). La qualité hygiénique
des viandes dépend, d'une part de la contamination pendant les
opérations d'abattage et de la découpe, et d'autre part du
développement et de la croissance des flores de contamination pendant le
refroidissement, le stockage, distribution et préparation des viandes et
produits carnés (ZWEIFEL et al., 2005). En effet, l'abattoir
constitue l'un des points critiques majeurs de l'hygiène des viandes. Il
est considéré comme l'étape où les plus grandes
opportunités de contamination (80 à 90%) de la microflore des
viandes parvenant aux consommateurs (JOUVE, 1990).
Parmi les micro-organismes rencontrés dans la viande,
on peut citer les bactéries qui peuvent toucher la santé du
consommateur en lui causant des toxi-infections alimentaires et celles qui
peuvent altérer les caractères organoleptiques de la viande
(KOOHMARAIE, 2005).
En Algérie, les maladies d'origine alimentaire qui
résultent des viandes contaminées avec des bactéries
pathogènes constituent une grande préoccupation pour les pouvoirs
publics. Généralement, ce genre de problème touche des
populations massives. Près de 6000 cas ont été
enregistrés par exemple en 2008 à l'échelle nationale. Les
intoxications alimentaires collectives surviennent notamment des restaurations
collectives en raison du non-respect des conditions d'hygiène lors de la
préparation des produits. Un chiffre qui pourrait être
multiplié par 4 ou 5 du fait qu'il n'y a que les cas d'hospitalisation
et de consultations médicales qui sont déclarés et
notifiés par les services concernés. Il est utile de signaler que
près de 40 % des cas d'intoxication sont dus à l'ingestion de
viandes et dérivés impropres à la consommation. Selon une
étude de l'Organisation Mondiale de la Santé (OMS), on compterait
quelque 500 décès par an en Algérie dus à des
intoxications alimentaires, 3600 hospitalisations et 4000 intoxications par
défaut d'étiquetage. En outre, "chaque cas d'hospitalisation
coûtera entre 3000 et 4000 dinars algériens".
Aujourd'hui, différentes stratégies sont
appliquées dans le but de contrôler les pathogènes dans la
viande. Un intérêt particulier a été
manifesté ces dernières années pour les huiles
essentielles (DEMIRCI et al., 2008), considérées comme
des produits naturels et sains et, qui constituent une alternative effective
pour les produits de conservation chimique. Pour mieux appuyer cette
hypothèse, voici une vive déclaration d'un citoyen
algérien victime d'une intoxication alimentaire : "C'est après
avoir consommé des pâtisseries que je fus pris de malaises suivis
de vomissements accompagnés de dysenterie; ce qui a forcé mon
transfert aux Urgences où je fus traité au Spasfon.
C'était tout dire le soulagement ressenti sur le coup. Malheureusement,
il n'en fut rien. La seule issue était de me retourner vers les plantes
médicinales qui, dès leur absorption, m'ont soulagé".
L'évolution des esprits et le refus du "tout chimique"
qui se manifeste de plus en plus, ouvrent un peu plus la porte au "retour au
naturel". La gravité des toxi-infections alimentaires collectives,
couplée à la tendance des bactéries à
résister aux agents antimicrobiens nous a
conduit à nous intéresser à
l'inépuisable source de produits naturels à vertu antimicrobien:
les plantes médicinales.
Les huiles essentielles (H.E.) sont des substances qui
occupent une place particulière dans leur utilisation en
médecine, en aromathérapie et en agroalimentaire (ROTA et
al., 2008). Nos ancêtres utilisaient des huiles essentielles de
certaines plantes comme le lentisque pistachier (Pistacia lentiscus),
pour la désinfection des carcasses de certains animaux de chasse.
Très peu d'études ont été réalisées
jusqu'à présent sur les propriétés
antibactériennes des plantes et herbes aromatiques d'Algérie.
L'objectif de notre travail est basé sur
l'évaluation "in vitro" de l'activité antimicrobienne de
quelques huiles essentielles extraites par hydrodistillation à partir
des espèces végétales de la région Kabyle et
d'autres régions du monde. La concentration minimale inhibitrice (CMI) a
été déterminée pour chaque huile essentielle
vis-à-vis de certaines bactéries pathogènes entre autres:
Staphylococcus aureus (S. aureus), Salmonella
paratyphi A. (S. paratyphie A.), Bacillus
cereus (B. cerues), Pseudomonas aeruginosa (P. aeruginosa);
Escherichia coli (E. coli) et Shigella flexneri (S. flexneri).
Les huiles qui s'avèrent avoir une significative activité
antimicrobienne "in vitro", seront appliquées directement dans
la viande fraîche bovine conservée à 2 #177; 1°C.
L'optimisation des doses appliquées à la viande est
estimée par des analyses sensorielles.

DONNEES
BIBLIOGRAPHIQUES
effe dernirevtiliation rév ré
Les huiles essentielles HE
HAPITRE I: Les huiles essentielles (H.E.)
Il 1 Historique de des
huiles standard essentielles
Dprèspeut varier BOUZOUITA et
lde (006 vue l'histoe se des
plante desaromatiques personnes et
deméicinales est associée à
l'évoltion aussi des civilisations humaine des botanistes,
des physico-chimistes, des L'homme des préhistorique
quiou des avait très peu de mo
Les ueilltte et onte la étéhase
initialement En assimint la flor
végéta"esprit" localpuis il a
décovert Durant les unlanes utiles international et
indispensables avait pour survivre en 1983 Ceau régime
essentiellement une végétarien deétait le
berceau d'utilsation denomination des produits naturls a été
À cette époue au bien quede celleles hus d' "huile
essntielles ne soient seul pas en signalées nommémen
Déj mo 40 000 an avant rai JsusChrist du (av
soit J-C les aborigènes a laautralien vapeur
utilisaient ou san le
presence plantes aromatiques soit parpour traiter
les infections des par fumigation de fruits ou cataplasme citrals et dans
lesque l'eu l'argile des et les pantes les montraient aux huiles
leur efficacité table synergique Les Mais c'est autour
du debasice huiles rendent leur extraction a la
méditerranéen que la science médicale va vraiment
s'établir avc On les les grandes appelle
civilisation Egyptienne comme Babyloniennel'essence elles puis
Grecque Onet lesRomaine Ce d'ailleurs sont cependant
parfois essences.les texte
Les ui apportent les descriptions les plus avec
détaillées d'autres Les procédés
plantes étaient ceux utiliséecites dans tousne so
le
domaines de l lavie pour abriqued'huile
les parfums donnée de coméiques maide l'Associatio:aussi pou
l'embaumement de des défunts Cette dernièr
Ceux-ci utilisation alors révèle les nomsla
parfate maîtrise par le
Égyptiens des vertus absolue
antibactérienne et antiputrides de certaines 2000; huiles essentie
2007).
pres TURGEON (2001), on distingue trois v JC les Perse semble
avoir inventé la ditillation mai il faudra les attendrhuiles
2000 que ce les procédé rectifiéessoit
sensblement les huiles perfectionné
fractionnées. C'
Les huiles brutes ou naturelles sont obtenues par
distillation une man (9801037) qui produit la première HE de roses Pour
cela il met auquan point 1 e matieres c Il écrit
de nombeux végétales ouvrages médicaux dans aiguilles,
lesquels il fait une large pace Elles a sont ssentielles (FREE
ae is 918 RenéMaurice Gattefossé chimiste i
entramement et parfumeu a is frança
Enfin, explosion dans sonde laboratoire Par
éflexe i huiles plongeait sa main dansOn les
un obtient récipient en d'HE d leslavande
(Lavndula hybrda) en diverses Le soulagement fractions, selon
était leursimmédiat la guérison de e et sa
cica
Pour rprenant l'ncitait certaines à
mauvaisesse consacer à l'étud lesdes es propriétés
antibactérienns des on huiles pent :traire directement
sentielles Il crée en 1928 la sontnotion les
«aromathérapie» et publie en 1931 un
ouvrage mandarins du même om Cettedans
extractionequel il décrit s'effectue la relaion
entreexpression la strucure a froid bochimique
zestes
frais.de l'huile On
essentielle dans ceet soncas essence
tivité biologique (FREEMAN de et CAREL 2006) Pour les autres plantes
aromatiques, 1'extraction
o D' è CAILLET
f dun remède naturel Il existe aujourd'hui
approximativement 3000 HE d sont réellement commercialisées
rfums.
2- Terminologie et défnition des huiles
essentielle
Il n'existe pas de définition standard pour l'huile
essentielle «la notion d'huile essentielle peut
a varier avec
rofessionnelles aussi dissemblablement
· usels des parfumeurs ou des
pharmacologues» Thyms (Thymus vulgaris) ;
Romarins HE ont été initialement appelées "esprit" pui
ü ional qui avai lieu en 1983 au Singapour et pour une
considération de n e lesnomination essences a été
aandonnée au profit de clle d' hue essenelle» seul
n usage actuel
· les Lauracees
· el TREINER (999) « l' H.E
représente l'ensemble des sub
d moléculaire extaites du végétal soit par
ntraînement la vapeur (avec ou sans e d'eau)
es rendent leur extra
ue, comme l'essence elles s'enflamment. On les appelle d'ailleurs
p
e roduits obtenus par extraction avec d'autres
procédés que ceux cit
· pris dans la défnition d'huile essentie
n se de Normaisation (AFNOR). Ce
a résinoïde, absolue (BRUNETON,
1993; AF
· baies (genevrier : Juniperus communis);
· ès TURGEON (2001), on distingue trois
catégories d'H urles, les huiles rectifiées et les huiles fr
- Les huiles brutes ou naturelles
sont pas raffinées parties dune plante contiennent ces
huiles, mais elles sont souvent
- Les huiles rectifiées sont des huiles brutes
purifiées, c'es-à-dire que cetains résidus de la
distilltion ont éliminés par 'entraînement à la
vapeur.
- Enfin, es H.E. de qualité supérieure sont des
huiles fractionnées. On les obtient en sépaant les
composés volatils en dive
ou éviter certaines mauvaises définitions, es
seules planes aromatiques dont on peut directem
. tte extraction seffectue par expresson à froid des
zestes frais On parle d
· ssce dorange, dessence de citron, et. Pour les
«huiles essentielles».
3- Répartition botanique et localisation des HE
da
armi les 800.000 espèces végétals
environ,
ynthtiser une HE. sont peu nombreuses(VERRECK, 2007). Seuls 10 %
du règneal., végéta en a la
possibilité
Qu
attractif, vis-à-vis Les Lamiacees: Lavandes
(Lavandula favoriser hybrida),
Thyms (Thym
de barriere contre 1"
(Roarprotecteur par
ffina), action antiseptiqueà en g
p p )
l Mt Elt (El lbl) l d
pig
i
l Abi Pi (Pi it)
·
·
comme Si aes sources(Abi ibiicae
|
Pde controler ou Cit reguler sont
l environnementCb (role ii)
ecologiq Pl .
r r
|
. .
|
a H.E. possed
HE pe entre êles plantesxa pour
fsla germination parti etd lal
pncroissance) ores ides et peuvent servir de 1 t bioactifs des ur
(pé r om jmn Jminm gfrm)I
' (ROBERT et al..199
?orces
de frt
(tron
o es
ex rac
ion aes nuiies essentielles
urs baies (genévrier : Juniperus communs);
boutons floraux : (clous de girofle : Syzygium
aromaticumextraits n fruits (persil a
Petroselinum Chaque sativum);
En principe toutes les parties d'une plante contiennent ces
huiles mais eles sont asouvent majoritairement dans l'une d'elles La
synthèse et l'accumulaion des HE dans les végétaux sont
généralement lies à l'existece de structres histolgiques
spéciaisées localisées en certains points des
TREINER 1999)a Ce structures peuvent être:
internes;
des poils sécréteurs internes (labiées,
géraniacées) ou externes (eucalyptus); i des canaux
sécréteurs (ombelifère conifères)
ebullition. Les vapeurs heterogenes sont condens
elon TRENER (1999) la teneur des plantes en HE est
généralement considérée faible e est de l'ordre de
1 à 3 % à l'exception du clou de girofle (14 à 19 %) du
macis (10 à 13 de la noix de muscade (8 à 9 %) et de la cdamon (4
à 10 %)
4- Les huiles essentielle dan la plante
es rôles biologiques des HE son souvent ma connus
(SLUSARENKO t al 1993)
rtains des auteurs PARIS (1981) et MAINEBLAU (1994) ont
suggéré qu'elles auraie _
cteur attracif visàvis despar
unnsectes afin dede favoriser la pollinsation;
de bè solubles t l'ét; idissement de c
s spécialistes considèrent le
L plante de contrôler ou réguler sont
deenvironnement (rôle écologique): attraction desa insectes a
pollinisateurs la action répulsive sur le prédateurs
le bas. inhibition de la des germination des graines est voire communication
entre les végétaux de(mision e sinaux chimiques sgnalnt par a
présence d'animaux herbivores par exemple) (HURTEL 2006) et un certain
Hombre de produits plus
Les HE possèdent des popriétés
anifongiquesles anibacériennes ce alllopathiques ne
(compétition entre a les plantes pour la un germination et
la croissance) chez les plantes des
région
égétau (ROBERT e al 1993) (2002), cette
technique comporte toutefois certains
Entînt~mpie sans ie cas
à la expression apu d'
s aromatiques s'effectuera simple
d d
ssence, lors de l'expression a froid. On obtientainsi
uneg leme bteue p imp pn à fr
méthd ti ps enn e l pu e s prochedunaturel(le
codificationparvoieenzymatiquelieeal'oxydationparfairtaemnt
illt
9 oj dtu,
.1!ernisé, le prmet dextrire le
é t ft itnip
mp
i
.
, on obtient une mass
.
y
h d di
l
et ,,
- ,, pour les gommes, les grains, les baumes et les resins.
Cette ma;
cires
(ether de pet ,, y p g g
eent oy) dns n bic9 rmp ,,
du quifiltration st ue
dissolute
prée
'ethanol ex.
mimosa: Acacia sp.).
ulit L p égès
di C
les graisses
p
'll d fi d d "builli" à
l'H
es plantes Elle pe
ette isomérisation etc)est le mileu la pouvant avoir un
pH a relativement acide (BRUNETTON
1999)
grans p
il
till
Pendant l'hydrodistillation, l'eau, l'acidité et la
température peuvent provoquer la formation de produits
indésirable vore même la destruction des produis labiles sans
oublier des réarrangements que peuvent subir ces produits
(NÉPOMUSCÈNE 1995).
- Le matériel végétal est
séparé de l'eau: la plante est placée sur la grille
perforée dun extracteur et traverée par un courant de vapeur
deau. Les H.E. entraînées par la vapeur d'eau, peu solubles dans
l'eau, sont alors séparées du distillat par décantation,
après refroidissement de ce dernier. Cette méthode est
industrielement la plus
52 Hydrodiffusion
essence L'hydrodiffusion consisteest alors à pulser d
la vapeur d'au à trè desfaible presson grasses (002
à 015a bar) travers la masse
cettevégétale du hautest trésvers
delicate, le bas La compostion et des produits obtenus estau ant
alitativement sensibleme 2004).
urds non volatils tels que les flavonoï
Il orrespond plus à une H.E Le procédé
permet un gain de temps et d'énergie (BRUNETTON 1999)
Selon LIQUET et WEYNANS (2002) cette echnique
comporte toutfois certains inconvénients majeurs: a haute
température de fonctionnement le (100-120a °C) entraîne la
destruction aou la etmodification d'un it grand nombre de produits thermolabies
et la etgenèse d'artefacts.
52 Extraton
presente pr
isxpresiparncu
ivants lsans d risquer l de laisser d'
d P
i
-
auparavant de l'huile végéale ou un mélange
de graisse de porc et de graisse de boeuf, épuré et
stabilisé avec d
|
soit saturé
|
vée à lalcool é
|
|
drnir condui à une pommade appelée
"abo
|
lue (ex. jasmin: Jasminum;
|
|
Lenfeurage à chaud st dentique, mais ave
|
de la graisse chauffée au bain-marie et après
|
|
filtration et évaporation de léthanol, on o
|
une crème parfumée (H
|
|
- le CO2 est bon marché, abondant, fmam2mable etch
inerte ;
|
|
|
- Dans ce procédé, les végétaux sont
imm
|
|
|
Lessence absolue ;
|
|
|
Malheureusement, cette méthode est t solvant (BOUSBIA,
20
|
|
|
-absence de reaction avec les autres solvants.
|
|
sagit dun nouveau procédé d'extraction des
matières premières
es extraits « coeur de la nature » souvent proches
de lodeur de la matère premère traitée et exemts e solvant
organiques (BOUSBIA, 204). Elle utilise une propriété
sngulière du gaz carboniqueen orsqu'il ateint un état
supercritique (lorsque le CO2 est une tmpérature supérieue
à 31C et sous-pressio, il présente u éta
intermédiaire entre gazeux e le liquide figur 1).
liposolubles (solubles daps les corps gras): quand on conserve
des plantes aromatiques (ou un
Danflacon cet éat, i présente
la partcularité de pouvoir comme undssoudre de nomreux
composésou de
tissus vvants sns risquer e laisser de aces de prouits
indsirables come les solvnts.
bleau I: Avantages et inconvénients de
l'extraction par
ENNAR, 2002).
Avantages Inconvénients
- La capacité d
rieure à celle des solvants habituels
saux extraits classiques1'
et cmquemnt ne
'e sd' hi nt
tion avec les autres ae
solvantsmasse
eiie 6 Prpiétés ie aomame
aappphysicochimiques ion est
dse p hules e en
essentielles u. i in ertet,
iformations concernant la composition élémentaire
d'un éch , la structw
Lolécules jité inorganiques, d HE
organiquest d liuid et biologiques; tè lé la composition l HE
qualitative loé et quanti g
e HE d Cnell Cinmu licum) e bl (HE de Mtii
Mi
hill) vt (HE d
tmpérature ambiante ell
énéal plus légères que l'eau dans
laquelle elles ne se mélangent pas car elles ont liposolubles (solubles
dans es corps gras): uand on cnserve de plntes aromatiques (u un flacon d'HE ma
bouché) dans un endroit fermé comme un
réfrigérateur les fromages ou le beurre voisin prendront
rapidement l'odeur de lhuile essentielle (HURTEL 2006)
La grande majorité des HE sont généralement
deinsolubles dans l'eau mais soubles dans
les liquies orgniques comme
l'alcol l'éther e le huiles végétaes (JOCTEUR 2006) la
Ce sont des molécules légères qui sont
entraînées par la vapeur d'eaula lors de la distillation; l'huile
se sépare de leau du distillat ma
illée aromatisée) à laquelle on aoute
parfois de l'alcool, de
onservateurs (HURTEL, 2006)
riferant et non pour indiquer leur structure chimique, c
7- Qualité
ifférnts essai, cmme le tst de miscibilité
à l'thanol e certaines meures phsiques comme la détermination de
l'indice de rfraction du pouvoi roatoire et de la densité elative La
couleur et 'odeur sont aussi considérées comme des
paramètres mportants (PIBIRI 2006)
71- Méthodes d'analyses physiques et
chimiques
Ces méthodes permettent d'obtenir le
caractéristiques physiques et chimiques propres à chaque hulele
ssentiee On peut citer: la densité indic de réfraction le
etpouvoir rotatoire le point de congélation les indices dacide d'ester
et de carbonyle la solubilité dans l'éthanol (AFNOR 1989 produits
sont les monoterpenes qui repondent a la formule brute de C10
72 Méthodes de détermination
des C nstituants it de
l'huil
hi
epoxyaes
aues. g (C
·
·
·
·
9dan
dans Spectroscopie de masse
une (SM)
el CHIHOUNE (2005), l SM es sans dout, parm toutes es techniues
analytiques, ont le domaine dapplication est le plus
rations concernant la composition élémentaire dun
échantillon; la structure de les inorganiques, organiques et biolo
8.1- - Coupla
développement impo
nstituants des
HE. es rendu possible grâce au couplage
du CPG directement à la spectrmétrie de masse (GARNERO, 1978).
Lors du coupge, la chromaographie (CPG) permet dans un premier niveau de
séparer et d'isoler chacun des contituants du mélange qui est
injecté séparément dans la chambre d'io
veau). Grâce à cette innovation importante, la
spectroscopie de masse est devenue la technique la plus sensible pour obtenir
des données importantes sur la structure de composés organiques
nconnus (PEYRON et alC, 1992) r
eprésent
Dans ompoés présents des en tace
possèdent un rôle lesimportant du fait qu'ls augmentent le pouvoir
ceux antimicobien de l'huile grâce à leurs activités mono
synergiques avec les compsés De majeurs (MAHMOUD
2004
Les H.E.= non seulement sont des
mélanges complexes de constituants hétérogènes,
elles appartiennent de façon exclusive à deux groupes
caractér
ditinctes, le goupe des terpnoïdes d'une part et le groupe
aromtique et aliphatique (alcanes, alcènes, alcénols
phénols, etc.) d'aure part
umt, ngde quelques d j, i d
3: les hi
es cqs (UEL, sont6).
8.1- Terpénoïdes est represents
8.1.1 Généralités en
espagnol) et qui sont importants en pharmacognosie en raison de
Ves le milieu du XIXe siècle, les ravaux sur lesnce de
térébnthine sont à lrigine du terme terpènes
donné aux hydrocarbures de formule brute C10H16. On les
trouve fréquemment dans les huiles vlatles des plante, nommées
H.E., cr elles renfermnt la
Quinta essentia, la fragrance de la plante
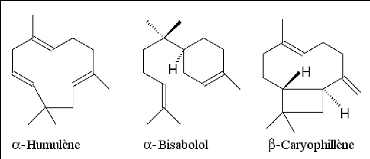
Dans e cas des H.E., seuls seront rencontrés es
terpènes les plus volatils, c'est-à-dire ceu
8.2- Composés aromatiques
Les composés aromatiques sont moins fréquents, mais
néanmoins très importants: eugénol, anéthole,
etc.
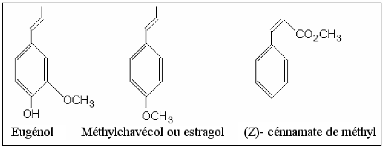
Fig. 4: Structures de quelques arènes
dérivées du phénylpropane (HURTEL, 2006).
Ces composés aromatiques constituent un ensemble
important, car ils sont généralement responsables des
caractères olfactifs et organoleptiques des H.E.: par exemple,
l'eugénol est responsable de l'odeur du clou de girofle (Syzygium
aromaticum) (HURTEL, 2006).
8.3- Composés d'origines diverses
Il s'agit là de produits résultants de la
transformation de molécules non volatiles. Ces composés
contribuent aux aromes de fruits. Compte tenu de leur mode de
préparation, les concrètes(1) et les
absolues(2) peuvent en renfermer. Il en est de même pour les
H.E. lorsqu'ils sont entraînables par la vapeur d'eau (BRUNETON,
1999).
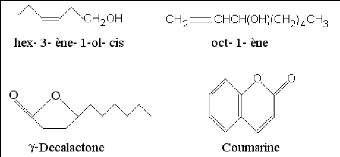
Fig. 5: Quelques composés d'origines diverses
(OCHOA, 2005).
(1) Concrète: produit solide ou semi-solide obtenu
après l'extraction au solvant (éther de pétrole) des
principes odorants de certaines matières premières
végétales (jasmin, rose, mousse de chêne, etc.,) (PIBIRI,
2006).
(2) Absolue: les absolues sont des essences obtenues à
partir de concrètes ou de résinoïdes par lavage de
concrète à l'alcool éthylique. Après glaçage
et filtrations pour éliminer les cires, elles sont concentrées
par distillation sous pression réduite afin d'éliminer l'alcool
(PIBIRI, 2006).
Il est important de signaler que parmi les H.E., on peut
rencontrer des huiles que l'on pourrait qualifier de simples (riches en un
composé prépondérant), de complexes (ne possédant
aucun composé prépondérant) et tous les
intermédiaires sont possibles.
L'un des exemples typiques d'une huile simple est celui de
l'huile de girofle qui contient au moins 80 % d'eugénol et de petites
quantités d'autres produits. Le cas extrême de complexité
peut être illustré par l'huile de vétiver (Vetiveria
zizanoides) qui contient une centaine de composants (JOUHANNEAU, 2000).
9- Paramètres influençant la composition
quantitative et qualitative des
plantes aromatiques
Selon VERRECK (2007), la composition d'une H.E. peut varier
fortement en fonction de: - L'origine de la plante;
- l'ensoleillement;
- la nature du sol;
- la source botanique;
- période de récolte;
- la technique d'extraction des H.E.
Le premier paramètre influençant la composition
chimique est sa biosynthèse et donc son profil génétique.
C'est la raison pour laquelle, une même espèce peut
présenter plusieurs chémotypes(1) de profils chimiques
différents (BENINI, 2007).
Les H.E. contiennent un nombre considérable de familles
biochimiques, dont on vérifiera la présence, par le biais d'un
Chromatogramme qui nous donnera la composition chimique exacte d'une H.E.
(JOCTEUR, 2006). Si tous les organes d'une même espèce peuvent
renfermer une H.E., la composition de cette dernière peut varier selon
sa localisation (NÉPOMUSCÈNE, 1995).
Selon COLETTE (2004), la plante change d'aspect et voit sa
composition chimique se modifier. Ceci se traduit par un changement d'odeur et
de couleur. C'est le cas, par exemple, pour les racines de valériane
(Valeriana officinalis) inodores à l'état frais et qui
deviennent nauséabondes en séchant par dégagement d'acide
valérianique.
La composition varie aussi suivant les organes de la plante
concernée. Les biosynthèses y sont différentes. Par
exemple, l'H.E. d'écorce de cannelle (Cinnamomum zeylanicum)
sera riche en cinnamaldéhyde, alors que l'H.E. de feuille le sera en
eugénol (BENINI, 2007).
(1): La composition chimique de l'H.E. de certaines plantes peut
varier à l'intérieur d'une même espèce; ces
variétés chimiques sont communément appelées
chémotypes.
Le chémotype, également appelé
chimiotype, permet de définir la ou les molécules biologiquement
actives majoritairement présentes dans l'H.E. Associé à la
dénomination latine, la précision du chémotype permet la
compréhension précise du mode d'action des H.E.
Les conditions environnementales influencent aussi la
composition. La température, la quantité de lumière, la
pluviométrie, les conditions édaphiques représentent
autant de causes potentielles de variations de la composition chimique d'une
plante aromatique donnée (CURADO et al., 2006).
Les conditions culturales telles que la date de semis, date de
récolte, les traitements phytosanitaires, l'emploi d'engrais, ainsi que
les techniques de récolte... influencent aussi la composition (ANTON
et al., 2005). Peut-être faut-il, à ce stade, s'attarder
sur la notion de chémotype qui sera utilisée à de
nombreuses reprises dans cette étude. Un chémotype est une race
chimique. En fait, une même espèce végétale peut
fournir des H.E. de compositions chimiques différentes. Ces
différences sont dues à la période de récolte des
plantes, au mode d'extraction utilisé, aux facteurs environnementaux
(altitude, ensoleillement, nature du sol, ...). Prenons l'exemple du basilic
(Ocimum basilicum) (DE MASI et al., 2005). On dira qu'il
s'agit d'un Ocimum basilicum à méthyl chavicol,
sous-entendu de chémotype méthyl chavicol.
On utilise également la notion de chémotype pour
établir une classification des H.E. et les caractériser (MOCKUTE
et al., 2006).
Le nombre des molécules chimiquement différentes
qui constituent une H.E. est variable (jusqu'à 500 molécules
différentes dans l' H.E. de Rose) (PIBIRI, 2006).
10- Stabilité des huiles essentielles
Les H.E. sont volatiles et généralement
très sensibles aux phénomènes d'oxydation. Elles sont
souvent associées à d'autres substances, telles que les gommes et
les résines et tendent même à se résinifier par
exposition à l'air. Ces phénomènes d'altération
modifient fortement la composition chimique des H.E. Les procédés
qui conduisent à l'altération naturelle sont en
général les activités causées par la chaleur et
l'oxygène (O2) de l'air et sont catalysées par la lumière
et la présence de certains métaux (CHIRON, 1996).
- Conservation des huiles essentielles
Les H.E. sont fragiles et volatiles (ANTON et LOBSTEIN,
2005). Elles doivent êtres conservées dans des flacons
colorés, hermétiquement fermés, à l'abri de l'air,
lumière et variations de température.
Si les conditions citées ci-dessus sont
respectées, les H.E. peuvent être conservées jusqu'à
2 à 5 ans en maintenant les flacons en position verticale.
11- Autooxydation des huiles essentielles
L'autooxydation des H.E. est spontanée dont font
l'objet certains solides ou liquides par l'oxygène moléculaire
dans son état fondamental triplet (3O2), à la
température ambiante ou à son voisinage et à la pression
atmosphérique (760 mm Hg) (ANONYME, 2005).
12- Photooxydation des huiles essentielles
La photooxydation est une action conjuguée de
l'oxygène et de la lumière en présence de sensibilisateurs
efficaces (bleu de méthylène, chlorophylle, rose de Bengale,
dicyanoanthracène, oxyde de titane....). Le rôle du
sensibilisateur est d'exciter l'oxygène afin de le faire passer de son
état fondamental triplet à son état excité singulet
(1O2)dans le cas de la sensibilisation par les colorants et de son
état fondamental triplet à son état de superoxyde dans le
cas de la sensibilisation par les composés pauvres en électrons
(e-). Ces deux états excités sont
moins stables, mais plus réactifs (ANONYME, 2005).
13- Chémotypes
Dans ce contexte, la science moderne nous fournit un outil
fondamental et incontournable, le "chémotype" (ou race biochimique de
l'H.E.). Il permet de définir avec précision les composants
biochimiques présents dans une H.E., et donc d'en déduire ses
propriétés thérapeutiques. Biochimiquement
différents, deux chémotypes issus d'une même plante
présenteront non seulement des activités thérapeutiques
différentes, mais aussi des toxicités variables. Les techniques
utilisées pour la détermination du chémotype permettent
également de contrôler la qualité d'une H.E. dans la mesure
où elles permettent de mettre en évidence les traces de
dénaturation par ajout de molécules de synthèse ou
d'autres H.E. ou la présence de résidus d'engrais ou de
pesticides (CHASSAING, 2006).
Le chémotype indique le ou les composants qui
confèrent à l' H.E. une action thérapeutique
particulière sans que ceux-ci soient nécessairement majoritaires
(JOCTEUR, 2006).
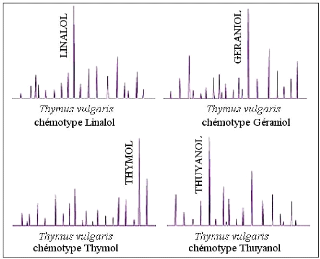
Fig. 6: Illustration simplifiée de CPG de 4
chémotypes différents de thym (PIBIRI,
2006).
14- Toxicité des huiles essentielles
Alors que de nombreux ouvrages font référence
à la toxicité de nombreux produits sur le marché, la
toxicité des H.E. est moins investiguée. Les interactions de ces
produits avec les médicaments ne sont pas bien connues (PIBIRI,
2006).
Les H.E. restent toujours notoires grâce à leurs
diverses propriétés médicinales en l'occurrence les
propriétés anti-inflammatoires, antiseptiques, antivirales,
stimulantes, toniques, calmantes, etc. (KABERA et al., 2002).
D'autres parts, elles peuvent être toxiques. Cette
toxicité est liée à la présence de certains sites
oxygénés (VIAUD, 1993). Parmi les propriétés
indésirables, on peut souligner entre autres : les
propriétés vésicantes, nécrosantes, allergiques,
hépatotoxiques, neurotoxiques, etc. (KABERA et al., 2002).
15- Applications thérapeutiques
Selon la plante dont elles proviennent, les H.E. sont
recommandées en usages antibiotiques, antiviraux, antiseptiques,
fongicides, cicatrisants, digestifs, anti-inflammatoires, sédatifs... on
les utilise par voie orale, à la manière d'un médicament,
usage en inhalation, en diffusion dans l'atmosphère avec un diffuseur
d'essence, en massage (mélangée à une huile de
base) (ODOUL, 2003).
16- Description des pantes utilisées
La flore méditerranéenne occupe une vaste aire
de répartition. Elle s'étend autour de la
Méditerranée, de l'Espagne à la Turquie en passant par les
côtes d'Afrique du Nord et plus particulièrement l'Algérie.
Ce qui caractérise ces plantes, c'est l'adaptation à leur
environnement et au climat méditerranéen
caractérisé par un été chaud et sec et hiver doux
et humide (MACAIRE, 2004).
- Classification des plantes utilisées
Embranchement: Spermatophytes;
Sous-embranchement: Angiospermes; Classe:
Magnoliopsides (Dicotylédones).
Les trois plantes suivantes (le girofle, l'eucalyptus et le
myrte) appartiennent à la famille des Myrtaceae.
16.1- Girofle
Espèce: Syzygium aromaticum.
Synonymes: Caryophyllus aromaticus,
Eugenia aromatica, E. caryophyllata, E.
caryophillus. Dénominations vernaculaires
- Français: clous de girofle, giroflier;
- Anglais: Clove tree.

Fig. 7: Clous de girofle
16.1.1- Caractéristiques
Le giroflier est un arbre petit à moyen, au feuillage
persistant et dense, originaire des petites îles volcaniques de
l'archipel des Moluques en Indonésie (HURTEL, 2001). Le fruit est une
baie appelée « anthofle » allongée de 2,5 à 3 cm
de long sur 1,3 à 1,5 cm le large, de couleur rouge foncé
à maturité. Le clou de girofle a un aspect caractéristique
brun foncé, à saveur chaude, brûlante,
légèrement amère et fortement aromatique (LAREDJ,
2004).
La floraison se déroule du mois de septembre au mois de
Mars (TEUSCHER et al., 2005).
Propriétés
thérapeutiques
Selon LAREDJ (2004), cette plante peut manifester plusieurs
activités entre autres: analgésique dentaire;
antiseptique; stimulant; stomachique.
16.1.2 - Composition chimique de l'H.E. des clous de
girofle
Selon BRUNETON (1999), la composition chimique de l'H.E. du
girofle est caractérisée par la présence d'un
propénylphénol largement prépondérant,
l'eugénol. Majoritairement libre et en partie sous forme
d'acétate d'eugényl, sa teneur oscille entre 70 et 85 %.
L'eugénol est accompagné de plusieurs dizaines de composés
terpéniques:
- des sesquiterpènes: á et â
caryophyllènes (de 7 à 10%), á et â
humulènes, á amorphène, á murolène,
calaménène, calacorène.
- des esters: hexanoates d'éthyle, acétates de
2-heptanyle, de 2-nonalyle, de styralyle, de benzyle, de terpényle et
d'éthylphényle;
- des oxydes: oxyde de caryophyllène, époxyde
d'humulène.
L'H.E. des clous de girofle, extraite par hydrodistillation,
contient principalement deux composés: l'eugénol et
l'acétyleugénol (TREINER, 1999).
D'après (TREINER, 1999), l'une des
caractéristiques fondamentales de l'H.E. des clous de girofle est sa
densité élevé (d= 1,066 > d eau = 1.00), ce qui nous
permet de les séparer par simple décantation: même
caractéristique partagée avec les huiles de cannelle et de
sassafras.
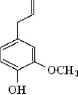
Eugénol
16.2- Eucalyptus 16.2.1-
Caractéristiques
Parmi les 4000 espèces de Myratceae, le genre
Eucalyptus en regroupe au moins 600 disséminées un peu partout
dans le monde (HURTEL, 2001). L'Eucalyptus globulus Labill. (du nom de
Labillardière qui le découvrit en 1800 lors d'un voyage en
Australie) est une espèce très cultivée. Il a
été introduit dans le sud de la France par Ramel, en 1860. Il
s'est très bien acclimaté dans l'ensemble des pays
méditerranéens.
Ses longues racines font qu'il joue un rôle important
dans la fixation des sols (retard à la désertification) et dans
le drainage des terrains marécageux (il a été introduit en
1857 en Algérie pour drainer les terrains de régions
touchées par la malaria) (TREINER, 2000).

Fig. 8: Feuilles d'eucalyptus.
16.2.3- Constituants de l'huile essentielle
D'après TREINER (2000) et HURTEL (2001), la teneur en
H.E. varie entre 0,5 et 3,5%. En 1870, le français CLOËZ donne au
principal constituant de l'huile d'Eucalyptus globulus Labill. le nom
d'eucalyptol. En 1884, JAHNS l'identifie comme étant le
1,8-cinéole (constituant majoritaire: environ 60 % à 80 %), le
pourcentage restant représente plus de vingt-cinq composés de
nature terpénique ont été identifiés,
principalement de á-pinène, puis de l'aromadendrène, du
globulol, viennent ensuite le limonène, le p-cymène, le
lédol....
Eucalyptol (1,8-cinéole)
16.2.4- Utilisations
L'H.E. possède des propriétés
bactéricides, antiseptiques (efficace contre les puces, elle est
utilisée dans les colliers insecticides pour animaux). Mais elle a pour
principal débouché l'industrie pharmaceutique en raison de
propriétés antiasthmatique, expectorantes et stimulantes de
l'épithélium bronchique et mucolytique. On l'utilise aussi comme
aromatisant pour masquer le goût de certaines préparations
pharmaceutiques (TREINER, 2000).
16.3- Myrte commun
Le myrte commun (Rihane en Kabyle) forme le genre
Myrtus de la famille des myrtacées. Il a pour nom latin
Myrtus communis (MICROSOFT ENCARTA, 2008). Deux
variétés sont utilisées: l'une donnant une H.E. rouge et
l'autre une H.E. verte. Les feuilles donnent une huile jaune-orangée au
parfum frais et doux (HURTEL, 2001).
16.3.1- Caractéristiques
Le myrte commun est un arbuste persistant de 1 à 3 m de
haut, caractéristique des formations végétales de type
maquis(1). Il est originaire du bassin méditerranéen.
Les fleurs sont blanches et très odorantes, de même que les
fruits, de petites baies vertes devenant à maturité noire
violacées au parfum prononcé. Il est odorant, aux feuilles vert
vif, ovales, lisses, brillantes et petites (2 à 4 cm). Très
utilisé jusqu'au XVIIIème siècle, il est
maintenant un peu oublié (HURTEL, 2001).
D'après TEUSCHER (2005), Myrtus communis peut
vivre plus de 300 ans, comme le lentisque (Pistacia lentiscus) qui
sont des plantes qui poussent à l'état spontané en
Algérie. Contrairement aux autres espèces de sa famille
(myrtacées), pour la plupart originaires des zones tropicales de
l'hémisphère sud, le myrte se rencontre dans les régions
tempérées chaudes de l'hémisphère nord (MICROSOFT
ENCARTA, 2008).
(1) Zone de formation végétale dense,
caractéristique des sols siliceux, composée de petits arbustes
adaptés à la sécheresse, souvent épineux et pouvant
atteindre 3 à 4 m de haut.

Fig. 9: Myrte commun.
16.3.2- Composition chimique et
propriétés
Le myrte contient 0,3 à 0,5 % d'une H.E. aromatique,
composée d'un alcool primaire, le myrténol, et d'une substance
complexe, le myrtol, renfermant entre autres de l'eucalyptol. Il est
astringent, antiseptique, stimulant, le myrte a des emplois voisins de ceux de
l'eucalyptus (ENCYCLOPEDIA UNIVERSALIS, 2008).
16.3.3- Utilisations
Selon HURTEL (2001), l'huile en inhalation est utile dans les
infections bronchiques et des voies respiratoires supérieures. Elle est
aussi préconisée dans les infections urinaires.
Traditionnellement, l'infusion des feuilles (30 g par litre d'eau) est
utilisée comme cicatrisant antiseptique.
16.4- Sarriette
Cette plante appartient à la Famille des
Lmiaceae.
Dénominations vernaculaires
- Français: sarriette des jardins, sarriette commune,
sarriette annuelle, savourée, herbe aux pois, herbe aux haricots, herbe
de Sain-Julien.
- Anglais: savory, summer savory.
16.4.1- Caractéristiques
C'est une plante annuelle de 30 cm de haut (plus rarement 60
cm), à racine fuselée et fibreuse. Elle ne comprend qu'une seule
tige érigée qui se ramifie en de nombreux rameaux
étalés, ce qui lui confère une allure touffue rappelant le
thym (ex. Thymus vulgaris). Les rameaux rougeâtres sont
recouverts d'un fin duvet et se lignifient à la base avec l'âge
(TEUSCHER, 2005).
Les feuilles, de couleur vert cendré, ont 4 cm de long
sur 0,5 cm de large; elles sont opposées, entières,
linéaires, elles dégagent une odeur puissante et agréable
et une saveur aromatique, légèrement
poivrée (LINDBERG, 1996).
Les pays d'origine sont répartis de l'est des
régions méditerranéennes jusqu'à l'ouest, l'Iran et
au Caucase, l'ouest de l'Asie, l'Inde, l'Afrique du sud et l'Amérique du
Nord.

Fig. 10: Sarriette des jardins.
16.4.2- Composition chimique
Le rendement en H.E. est de l'ordre de 0,3 à 4,2 %; ses
principaux constituants sont le carvacrol (20 à 85 %), le
ã-terpinène (10 à 40 %) et le p-cymène (5
à 25 %); ils sont accompagnés de â-caryophyllène, de
myrcène, d'á-pinène, d'eugénol,
d'á-terpinène et de thymol; dans une H.E. provenat de
l'ex-Yougoslavie, le thymol domine ( 40 % ). Les dérivés d'acide
hydroxycinnamique (principe amer des Labiées) constituent environ 3,4 %
avec essentiellement de l'acide rosmarinique (0,4 à 2,6 %) (LAWRENCE,
1992). Selon LINDBERG (1996), les flavonoïdes, les triterpènes et
les sérols constituent aussi une partie de cette H.E.
16.4.3- Propriétés
MENPHINI (1993), ont rapporté que les H.E.
présentent des propriétés antimicrobiennes.
Les extraits de sarriette sont des accepteurs d'O2 et des capteurs de
radicaux libres, à cause de leur richesse en acide rosmarinique et en
flavonoïdes diphénoliques. Ce sont de bons antioxydants et peuvent
considérablement allonger la durée de conservation des produits
carnés (LINDBERG, 1996).

CHAPITRE II
Activités Biologiques des
H.E.
Introduction
Ces derniers temps, plusieurs questions se sont
soulevées concernant la sécurité des produits chimiques
conservateurs utilisés en industrie alimentaire. En effet, la
peroxydation des lipides produite au cours des processus de fabrication et de
stockage des aliments sous l'effet des radicaux libres oxygénés
(RLO) conduit à des modifications de goût, d'odeur et de couleur
et parfois constituent un risque pour la santé du consommateur et, par
conséquent à la perte de la qualité et de la
sécurité des aliments (MAU et al., 2004). Les
antioxydants de synthèse sont généralement utilisés
en industrie alimentaire pour retarder l'oxydation des lipides se sont
avérés responsables d'effets indésirables. En effet,
l'hydroxyanisole butylé (BHA) et l'hydroxytoluène butylé
(BHT) sont suspectés avoir des effets négatifs sur la
santé du consommateur (NAMIKI, 1990). D'un autre côté,
l'usage extensif des agents antibactériens chimiques dans la
médication humaine ainsi que dans les élevages animaux conduit
à la sélection de souches bactériennes
résistantes.
Ainsi, les H.E. commencent à avoir beaucoup
d'intérêt comme source potentielle de molécules naturelles
bioactives (BOUHDID et al., 2006).
Les H.E. possèdent de nombreuses activités
biologiques. Selon les travaux de OCHOA (2005); FREEMAN et CAREL
(2006), ces activités sont liées essentiellement
à la composition chimique, aux groupes fonctionnels des composés
majoritaires de ces extraits et à leurs effets synergiques.
Empiriquement reconnue depuis des siècles, la
confirmation scientifique de l'activité antimicrobienne des H.E. est
récente. Elle ne date que du début du siècle dernier avec
les travaux du Dr Gattefossé, le père de l'aromathérapie
en France (PIBIRI, 2005).
Beaucoup d'études ont été
réalisées au sujet de l'activité antimicrobienne des
extraits de plantes et de leurs H.E. (BOUSBIA, 2004) qu'elles soient
citées dans des ouvrages, dans des journaux spécialisés de
microbiologie ou présentées lors de congrès
d'aromathérapie scientifique. Cette activité a été
utilisée dernièrement pour la conservation du patrimoine
bibliographique des musées évitant ainsi l'altération des
ouvrages par des petits animaux nuisibles, et elle est naissante pour traiter
la qualité de l'air dans les bâtiments (PIBIRI, 2005).
On attribue aux extraits de plantes aromatiques et notamment
aux H.E. un certain nombre d'activités biologiques potentielles
susceptibles de trouver des applications en agroalimentaire (ALITONOU et
al., 2005).
1- Activité antibactérienne
Les activités antimicrobiennes des plantes aromatiques
et médicinales sont connues depuis l'antiquité. Toutefois, il
aura fallu attendre le début du XXe siècle pour que les
scientifiques commencent à s'y intéresser. Ces
propriétés sont dues à la fraction d'H.E. contenue dans
les plantes (CAILLET et al., 2007 ; BOUAOUN, 2007).
1.1- Bactéricide et
bactériostase
À la manière des agents chimiques, on distingue
deux sortes d'effets des H.E. sur les microorganismes: une activité
létale (bactéricide et fongicide) (CARSON et RILEY, 1995) et une
inhibition de la croissance (bactériostatique) (FREEMAN et CAREL,
2006).
Au cours d'un travail au laboratoire, DORMAN et DEANS (2000)
ont démontré que l'activité bactéricide des H.E.
vis-à-vis des cellules bactériennes pourrait être
expliquée par une dénaturation des protéines
provoquée par le rôle solvant et déshydratant des
huiles.
Une étude réalisée par COSENTINO et ses
collaborateurs (1999) pour la détermination des Concentrations Minimales
Inhibitrices (CMI) et des Concentrations Minimales Bactéricides (CMB)
pour 4 variétés de Thym (Thymus vulgaris) portant sur 14
souches bactériennes (dont Staphylococcus aureus) ont
montré que dans la majorité des cas, les valeurs des CMI sont
identiques aux CMB. Les mêmes auteurs ont conclu que les H.E.
testées dans cette étude sont bactéricides.
D'autre part, certaines études ont été
réalisées par BILLERBECK (2000) dans le but d'illustrer les
dommages provoqués par certaines H.E. sur des cibles bactériennes
à travers des images de haute résolution en utilisant la
microscopie électronique.
1.2- Huiles essentielles et bactéries
résistantes aux antibiotiques
Face au problème soulevé depuis plusieurs
années par la résistance des bactéries aux antibiotiques,
la seule alternative fiable à l'usage des antibiotiques semble
être celle des H.E. Connue de façon empirique depuis des
siècles, leur efficacité anti-infectieuse a été
scientifiquement démontrée "in vitro" et "in
vivo" (CAREL, 2006).
De nombreux chercheurs de l'université de Manchester
(Royaume-Uni) ont montré que ces produits sont actifs contre des germes
pathogènes résistants aux antibiotiques tels que S.
aureus résistant à la méthicilline (MRSA),
Streptococcus pneumoniae résistant à la
pénicilline, Enterococcus faecium résistant à la
vancomycine, Candida albicans résistant à l'azolé
et Herpes simplex résistant à l'acyclovir. Ceci est
dû au mécanisme original des H.E. (AVERTIT, 2004; BOUAOUN et
al., 2007). Selon INOUYE et ABE (2007), l'efficacité des
antibiotiques dépend de la dose et du temps de contact. Des
expérimentations sur des animaux de laboratoire a permet de savoir que
l'efficacité des antibiotiques reste toujours limitée. Les H.E.,
contrairement aux antibiotiques, sont constituées de si nombreuses
molécules que les bactéries ne peuvent y résister en
mutant (ENRICO et al., 2004).
1.3- Mécanismes d'action des huiles essentielles
sur les bactéries
Les mécanismes d'action des H.E. et leur
sélectivité envers certaines bactéries restent
jusqu'à présent mal élucidés (HAMMER et al.,
1999; DORMAN et al., 2000; BAGAMBOULA et al., 2004).
Selon ces auteurs, cette sélectivité est le résultat de la
composition variée des fractions actives des huiles, qui
présentent souvent des actions synergiques. Il semble que le
mécanisme d'action de ces huiles est lié essentiellement à
la structure de la paroi et à la perméabilité membranaire
des bactéries à Gram+ et
Gram-.
RAYOUR (2003) a examiné le mécanisme d'action
des H.E. des Clous de girofle et d'origan (Origanum vulgare)
simultanément avec ceux de deux de leurs composants, le thymol et
l'eugénol, sur des bactéries: E. coli et Bacillus
subtilis et qui ont été utilisées
respectivement comme modèles de bactérie
Gram+ et Gram-. Les deux H.E. tout comme
leurs deux composants ont été capables d'induire une lyse
cellulaire. Cette action a été démontrée par la
libération de substances absorbantes à 260 nm. Cette
libération de substances associée à la rapide
mortalité bactérienne pourrait être la conséquence
de lésions sur les enveloppes induites par les agents
antibactériens. L'utilisation d'un microscope électronique a
permis de montrer que les H.E. attaquaient en même temps les membranes et
les parois cellulaires.
Les travaux de BURT (2004) ont montré qu'une H.E.
active exercera son pouvoir antimicrobien par son interférence avec la
bicouche lipidique de la cellule cible grâce à sa
propriété hydrophobe, ce qui entraîne une perturbation de
la perméabilité et perte des constituants de la cellule. En plus,
cette réaction varie en fonction de la nature de la bicouche lipidique,
ce qui explique la résistance des bactéries
Gram- (MAHMOUD et al., 2004). En outre, DABBAH et ses
collaborateurs (1970) ont mis en évidence la grande sensibilité
des bactéries Gram+ par rapport aux
Gram- et aux champignons. Dans la même démarche
d'étude, GORDON et ses collaborateurs (1973) et MAHMOUD et ses
collaborateurs (2004) ont suggéré que l'effet antimicrobien
qu'exercent les H.E. pourrait être expliqué par la destruction de
certains systèmes enzymatiques incluant ceux qui participent dans la
production d'énergie cellulaire et la production des composés
structuraux. MAHMOUD et ses collaborateurs (2004), GUESMI et BOUDABOUS (2006)
quant à eux, ont avancé l'hypothèse d'inactivation et
destruction du matériel génétique et, enfin CAILLET et ses
collaborateurs (2007) ont signalé que les H.E. empêchent la
multiplication des bactéries, leur sporulation et la synthèse de
leurs toxines.
Dans une autre étude qui a été
réalisée par FREEMAN et CAREL (2006), l'H.E. d'arbre à
thé (Leptospermum citratum) a provoqué des fuites d'ions
potassium (K+) au niveau des membranes cellulaires d'E. coli et S.
aureus. Cette fuite de K+ est la toute première preuve de
l'existence de lésions irréversibles au niveau de la membrane de
la bactérie. Le thymol, le carvacrol, des composants actifs d'H.E.,
rendent perméable la membrane des bactéries, un effet
précurseur de leur mort. Les H.E. ont donc bien des
propriétés bactéricides.
D'après CAILLET et ses collaborateurs (2007), l'action
antimicrobienne des H.E. se déroule en trois phases:
- Attaque de la paroi bactérienne par l'H.E., provoquant
une augmentation de la perméabilité puis la perte des
constituants cellulaire;
- acidification de l'intérieur de la cellule, bloquant la
production de l'énergie cellulaire et la synthèse des composants
de structure;
- destruction du matériel génétique,
conduisant à la mort de la bactérie.
1.4- Résistance des bactéries
Gram- à certaines huiles essentielles
Chez les bactéries à Gram+, le peptidoglycane est
très épais et associé à des protéines
pariétales exposées et à des structures polyosidiques
(acides lipoteichoïques, acides
teichoïques...). Par contre chez les bactéries
à Gram-, le peptidoglycane est très fin et
associé à une enveloppe externe complexe définissant un
espace périplasmique. Cette membrane externe est une bicouche lipidique
asymétrique hydrophobe constituée de phospholipides, de
protéines (porines...) et lipopolysaccharides (LPS). L'espace
périplasmique est rempli d'enzymes qui dégradent les substances
complexes pour qu'ils puissent traverser la membrane cytoplasmique, et
inactivent les produits chimiques toxiques (antibiotiques, métaux
lourds...) (BERCHE, 2003).
La résistance des bactéries à Gram- aux
glycopeptides et aux macrolides est due à l'incapacité de ces
molécules de franchir la membrane externe (BERCHE, 2003).
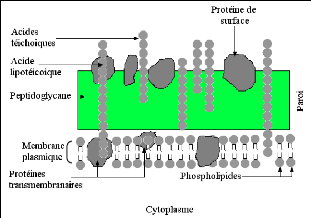
Fig. 11: Structure de la paroi bactérienne Gram+
(d'après LAVIGNE, 2007).
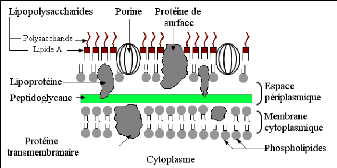
Fig. 12: Structure de la paroi bactérienne Gram-
(d'après LAVIGNE, 2007).
2- Activité antifongique
FREEMAN et CAREL (2006), ont signalé que les groupes
moléculaires avec les plus puissantes actions antibactériennes
sont également des antifongiques efficaces, mais ils doivent être
utilisés sur de plus longues périodes. Expérimentalement,
les H.E. des plantes aromatiques et médicinales ont fait preuve de leur
efficacité antifongique parfois même supérieure à
celle des agents antifongiques commerciaux.
Une étude a porté sur les effets antifongiques
de l' H.E. de thym (RASOOLI et al., 2006), et plus
particulièrement sur les conséquences de cette huile sur
l'ultrastructure du champignon Aspergillus niger. Elle a tout d'abord
permis de déterminer grâce à la microscopie
électronique, que lorsque A. niger était exposé
à l'H.E., celle-ci provoquait des dommages irréversibles sur la
membrane cellulaire ainsi que sur les organites du champignon (BARRAL et
al., 2007). Alors qu'elles inhibent la germination des spores,
l'élongation du mycélium, la sporulation et la production de
toxines chez les moisissures (CAILLET et LACROIX, 2007).
L'action fongicide des H.E. des clous de girofle et d'origan a
été testée sur un modèle de levure
Saccharomyces cerevisiae. La lyse des cellules de levure a
été montrée par la libération de substances
absorbant à 260 nm. Des analyses au microscope électronique ont
montré que la surface des cellules traitées par les H.E. d'origan
et de clous de girofle était significativement endommagée (CHAMI,
2005).
L'huile de la Menthe pouliot (Mentha pulegium) dont
le composé majoritaire est la R (+) pulégone (82%) est
dotée d'un fort pouvoir antifongique contre Pénicillium
et Mucor (BELGHAZI et al., 2002).
Une étude a évalué l'activité
antifongique de l'huile des clous de girofle sur toute une
variété de champignons pathogènes, incluant ceux
responsables d'infections urogénitales (AHMAD et al., 2005).
Selon CHAMI (2006), l'huile des clous de girofle a démontré une
puissante activité antifongique contre des champignons pathogènes
opportunistes tels que Candida albicans, Cryptococcus
neoformans et Aspergillus fumigatus.
2.1- Mode d'action des huiles essentielles sur les
levures
GIORDANI et KALOUSTIAN (2006) ont souligné que les
composés terpéniques des H.E. et plus
précisément leurs groupements fonctionnels tels que les
phénols et les aldéhydes réagissent avec les enzymes
membranaires et dégradent la membrane plasmique entraînant une
fuite du contenu cytoplasmique et donc la mort de la levure (COX, 2000).
2.2- Les principales huiles ayant un pouvoir
antifongique
D'après GIORDANI et KALOUSTIAN (2006), les principales
espèces botaniques productrices d'H.E. dotées d'un pouvoir
inhibiteur de la croissance des levures sont les suivantes:
- Melaleuca alternifolia (arbre à thé)
;
- diverses espèces de Cinnamomum (cannelier);
- Sassafras albidum (sassafras), Laurus nobilis
(laurier-sauce), Aniba rosaeodora; - Artemisia absinthium
(armoise amère ou absinthe);
- nombreuses espèces de Thymus (thym);
- diverses espèces d'Origanum (origan);
- diverses espèces de Pinus (pin);
- diverses espèces de Mentha (menthe);
- Agastache rugosa (Agastache coréenne);
- Juniperus communis (genévrier);
- diverses espèces de Lavandula (lavande);
- Citrus bergamia (bergamotier);
- Salvia fructicosa (sauge).
Les résultats expérimentaux de ces deux derniers
auteurs ont montré que les huiles présentant un fort pouvoir
antifongique, telles que celles de thym et de cannelle, pourraient constituer
une solution alternative intéressante dans les thérapies
antimycosiques.
Le carvacrol et le thymol, deux composés
rencontrés dans la majorité des espèces botaniques
possèdent une activité antifongique contre les mycètes
phytopathogéne (SCHWAMMLE et al., 2001).
3- Activité antivirale
De nombreuses familles de molécules chimiques
rencontrées dans les extraits végétaux ont montré
"in vivo" une activité antivirale et, parmi elles, les
monoterpénols et les monoterpénals (FREEMAN et CAREL, 2006).
Selon les travaux d'INOUYE et ABE, (2007), il existe des H.E. de
plantes exotiques très puissantes qui ont un fort pouvoir antiviral et
qui sont connues pour leur efficacité.
Les H.E. sont sélectivement absorbées et
perturbent les fonctions des membranes biologiques de la cellule, sur la
mitochondrie et autres organites vitales pour tous les organismes hormis les
virus (les H.E. ne sont actives que sur les virus à enveloppe comme
celui de la grippe et du VIH (virus de l'immunodéficience humaine).
4- Activité antioxydante
L'utilisation des molécules antioxydantes de
synthèse étant actuellement remise en cause en raison des risques
toxicologiques potentiels. Ainsi, de nouvelles sources végétales
d'antioxydants naturels (carvacrol, eugénol, tocophérol,
thymol...) sont recherchées par les industriels (BELHADJ et al.,
2006). DJENANE et ses collaborateurs (2002), ont rapporté que les
viandes traitées avec des antioxydants naturels d'origine
végétale, emballées sous atmosphère modifiée
(en présence de O2, CO2, N2) et postérieurement exposées
dans des vitrines frigorifiques illuminées par des tubes fluorescents
standards ont montré une stabilité chimique et microbiologique
durant une longue période d'exposition par rapport aux viandes non
traitées. Les travaux de HELME et ses collaborateurs (2004) ont
confirmé la nature antioxydante des H.E. extraites d'épices et
d'herbes: thym, carvi, cumin, clou de girofle, romarin, sauge. Selon FARAGF et
ses collaborateurs (1989), le pouvoir antioxydant, déterminé par
oxydation en émulsion aqueuse du p-carotène par l'acide
linoléique, de ces extraits serait par ordre décroissant: carvi
> sauge > cumin > romarin > thym > clou de girofle. Pour ces
extraits naturels, certains travaux (FARAGF et al., 1989; CHEVOLLEAU,
1990) font état de pouvoir antioxydant supérieur à celui
du BHT (butylhydroxytoluène ou E 321). D'après GHEDIRA (2006), la
thymoquinone (composé majoritaire dans l'H.E. de Nigella
sativa) inhibe la lipoperoxydation lipidique non enzymatique dans les
liposomes. La thymoquinone, le carvacrol, le t-anéthole et le
4-terpinéol (composés de cette même huile) exercent un
important effet piégeur des radicaux libres.
Une étude de SCHWAMMLE (2001) a exploré que le
carvacrol est un des composants principaux des H.E. de certaines
Lamiaceae, comme l'origan, thym dont la teneur peut atteindre
jusqu'à 86%. L'activité antioxydante de ces herbes est due au
carvacrol, thymol et autres phénols.
5- Combinaison entre les huiles essentielles
Certaines études ont montré que
l'activité biologique des H.E. est supérieure à celle de
ses composés majoritaires testés séparément. Les
composés purs, le thymol et le carvacrol ont un net effet synergique, ce
qui expliquerait les différentes activités des chémotypes
de Thyms. L'aldéhyde cinnamique est généralement
indifférent aux deux phénols (LAHLOU, 2004).
Les effets antimicrobiens des associations d'H.E., comme pour les
associations d'antibiotiques, sont définis selon quatre interactions
possibles:
- Indifférence: l'activité d'une
H.E. n'est pas affectée par l'autre: (A + B) = effet A ou effet B.
- Addition: l'effet de l'association est
égal à la somme des effets de chaque H.E. étudiée
isolément, à la même concentration que dans l'association:
(A + B) = effet A + effet B.
- Synergie: l'effet est significativement
supérieur à la somme de chaque H.E. étudiée
isolément, à la même concentration: (A + B) > effet A +
effet B.
- Antagonisme: l'association diminue
l'activité de l'une ou l'autre des H.E. Elle est inférieure
à la somme des effets de chaque H.E. prise séparément: (A
+ B) < effet A ou effet B.
Cependant, une étude réalisée par
SKANDAMI et ses collaborateurs (2001) ne corrobore pas les effets de synergie
mentionnés. Une combinaison de concentrations comparables en thymol et
en carvacrol reproduit bien l'inhibition de l'H.E. mais les autres
composés minoritaires ont pour effet de diminuer l'effet des principaux
composés actifs phénolés.
Dans une étude réalisée par PIBIRI
(2005), il a été observé que des associations d'H.E. de
cannelle et de thym sont synergiques vis-à-vis de S. aureus. En
revanche, elles sont indifférentes sur le genre Bacillus; par
contre sur P.aeruginosa et E. coli (Gram-) de telles
associations ne sont pas plus efficaces et sont souvent
indifférentes. En revanche la cannelle testée individuellement
est plus efficace que celle de thym, contrairement aux cas de présence
de bactéries à Gram+.
6- Activité liée à la composition
chimique
De récentes études (CAILLET et LACROIX, 2007)
montrent qu'une H.E. contient souvent de 50 à 100 molécules
différentes et peut à l'extrême en comprendre
jusqu'à 500. Sa composition biochimique n'est par ailleurs jamais
rigoureusement identique. Il est impossible de reproduire en laboratoire cette
complexité présente à l'état naturel. C'est ce qui
explique notamment la grande efficacité des H.E. dans le cadre de la
lutte contre les bactéries, les champignons ou les virus.
Selon BOUAOUN et ses collaborateurs (2007), la plupart des
composés chimiques des H.E. sont dotés de
propriétés antimicrobiennes, mais ce sont les composés
volatils majeurs qui présentent les propriétés
antimicrobiennes les plus importantes, et en particulier les phénols,
les alcools et les aldéhydes (voir tableau II): carvacrol (origan,
sarriette), eugénol (feuille de cannelle de Ceylan, clou de girofle),
linalool (coriandre), cynnamaldéhyde (cannelle de Chine), thymol
(thym).
L'activité des H.E. est souvent réduite à
l'activité de ses composés majoritaires, ou ceux susceptibles
d'être actifs. Évalués séparément sous la
forme de composés synthétiques, ils confirment ou infirment
l'activité de l'H.E. de composition semblable. Il est cependant probable
que les composés minoritaires agissent de manière synergique. De
cette manière, la valeur d'une H.E. tienne à son "totum", c'est
à dire dans l'intégralité de ses composants et non
seulement à ses composés majoritaires (LAHLOU, 2004).
Les phénols sont responsables des altérations
irréversibles au niveau de la membrane bactérienne. Le thymol et
l'eugénol sont responsables de l'activité fongicide (BENNIS
et al., 2004) et bactéricide des H.E. qui en contiennent
(COX et al., 2000). La molécule de thymol a un effet inhibiteur
et létal sur diverses souches, dont E. coli et S.
aureus, sur lesquelles elle provoque des fuites d'ions potassium (K+). En
revanche elle n'est pas active sur P. aeruginosa (WALSH et al.,
2003). Plus les teneurs en phénols sont élevées, plus
les H.E. sont efficaces (COSENTINO et al., 1999).
Tableau II: Bioactivité de quelques principaux
terpènes rencontrés dans les H.E.
(HERNANDEZ et OCHOA, 2005).
|
Composés
aromatiques
|
Formules développées
|
Caractères
physicochimiques
|
Teneur de
quelques plantes
|
Propriétés
|
|
Exemples
|
|
|
|
|
|
Densité: 0,98g/ml
|
-Thym (T. vulgaris)
|
|
|
|
PM: 150,2
|
33%
|
|
|
|
|
-Origan (origanum
vulgare) 76%
|
-Stimulantes;
|
|
|
|
|
-Toniques;
|
|
|
|
|
-Antiseptiques;
|
|
|
|
|
-Bactéricides;
|
|
carvacrol
|
|
-Girofle
|
-Fongicides;
|
|
|
|
(S. aromaticum)
|
-Antivirale;
|
|
|
|
82%
|
-Antiparasitaires;
|
|
Phénols
|
|
|
-Bay St Thomas
|
-Irritantes
|
|
(P. racemosa) 60%
|
|
|
|
-Poivre (P. dioica)
|
|
|
|
Densité: 1.07g/ml
PM: 164.2
|
54%
|
|
|
Eugénol
|
|
|
|
|
|
Densité: 0.88g/ml
|
-Palmarosa
|
|
|
|
PM: 154.3
|
(C. martinii) 75-
|
|
|
|
|
95%
(C. helichrysum
|
-Anti-inflammatoire;
|
|
|
|
spp.) 80-90%
|
-Antiseptiques; -Bactéricides;
|
|
Alcools
|
Géraniol
|
|
-Citronelle
|
-Fongicides; -Antivirale;
|
|
Terpéniques
|
|
|
(C. winterianus) 12-
18%
|
-Neurotoniques
|
|
|
Densité: 0.86 g/ml
|
-Citronelle
|
|
|
|
PM: 156,3
|
(C. winterianus)
|
|
|
|
|
11-15%
|
|
|
Citroneiol
|
|
|
|
|
Aldéhydes Terpéniques
|
|
Citronellal
|
|
Densité: 0.89 g/ml
PM: 154,30
|
-Citronelle
(C. winterianus)
35-
45%
-Eucalyptus
citronne
(E. Citriodora)
90
%
|
-Antifongiques; -Toxicité liée à la
présence du groupe
aldéhyde; -Insecticide.
|
|
Cétones
|
|
Carvone
|
|
Densité: 0,96 g/ml
PM: 150,2
|
-Carvi (Carum
carvi), 50%
|
-Calmantes;
-Antivirales; -Antifongiques; -Neurotoxiques;
-Antiépileptique.
|
|
Hydrocarbures
aliphatiques,
sesquiterpènes
|
Limonène
|
|
Densité: 0,96 g/ml
PM: 150,2
|
-Carvi (Carum
carvi), 45%
|
-Fongistatique; -Bactériostatique; -Insecticides;
-Nematicide; -Herbicide.
|
7- Les principales techniques de détermination de
l'activité
antimicrobienne des H.E.
La technique de détermination du pouvoir antimicrobien
des H.E. a une grande influence sur les résultats. Les
difficultés pratiques viennent de l'insolubilité des constituants
des H.E. dans l'eau, de leur volatilité, de la
nécessité de les tester à de faibles concentrations et,
des problèmes de standardisation des méthodes (BOUSBIA, 2004).
6.1- Aromatogramme
L'aromatogramme est basée sur une technique
utilisée en bactériologie médicale, appelée
antibiogramme ou méthode par diffusion en milieu gélosé ou
encore méthode des disques. Cette méthode a l'avantage
d'être d'une grande souplesse dans le choix des H.E. testées, de
s'appliquer à un très grand nombre d'espèces
bactériennes, et d'avoir été largement
évaluée
par 50 ans d'utilisation mondiale (FAUCHERE et AVRIL,
2002). Il s'agit d'une méthode en milieu gélosé
à l'agar1 réalisée dans une boîte de
Pétri.
Le contact se fait par l'intermédiaire d'un disque de
papier sur lequel on dispose une quantité donnée d' H.E. (Figure
13).
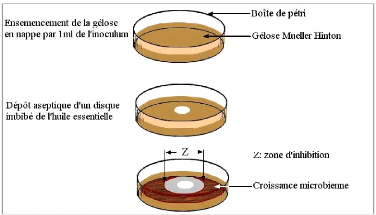
Fig. 13: Illustration de la méthode
d'aromatogramme (ZAIKI, 1988).
6.2- Technique de microatmosphère
Le protocole des microatmosphères est techniquement
proche de celui des aromatogrammes. Cette méthode en boîte de
Pétri constitue une première approche pour l'étude de
l'activité antimicrobienne des vapeurs de produits volatils (BILLERBECK,
2003).
Selon BOUSBIA (2004), cette méthode consiste à
déposer un disque de papier filtre imprégné d'H.E. au
centre du couvercle d'une boîte de Pétri (figure 14), sans que
l'H.E. entre en contact avec la gélose ensemencée par les
micro-organismes. La boîte est hermétiquement fermée. Il se
produit une évaporation des substances volatiles dans l'enceinte de la
boîte et les cellules sensibles de l'inoculum sont inhibées. La
lecture du test porte donc sur la croissance ou non de l'inoculum se traduisant
par un halot qui sera mesuré par un pied à coulisse.
Cette méthode ne quantifie pas l'activité
antimicrobienne réelle des H.E. elle montre seulement la
sensibilité du microorganisme présent aux constituants volatils
à la température d'incubation (BOUSBIA, 2004).
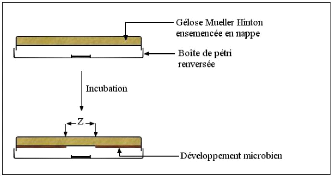
Fig. 14: Illustration de la méthode de
microatmosphère (BOUSBIA, 2004).
6.3- Technique par contact direct
La technique par contact direct consiste à mettre en
présence l'H.E. et les micro-organismes, puis à observer la
croissance de ces derniers. Le contact peut avoir lieu en milieu
gélosé ou liquide (BOUSBIA, 2004).
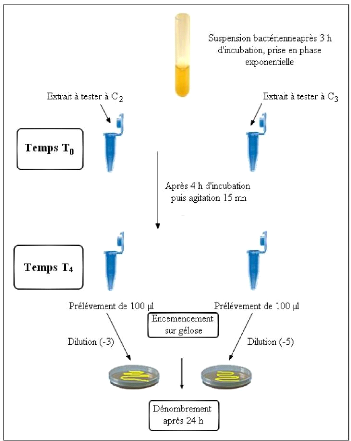
Fig. 15: Schéma représentant la technique
de contact direct (MEZAOUR, 2006).
6.4- Méthode de diffusion en puits ou en
cylindre
C'est une méthode qui a été
proposée par Cooper et Woodman en 1946, et reprise par la suite par
Schroder et Messing en 1949, elle assure une diffusion radiale de l'H.E.
à partir d'un puits en donnant une zone d'inhibition claire et
facilement mesurable. La méthode consistait à découper un
trou circulaire vertical dans la gélose et à y verser une
solution d'H.E. de concentration connue. L'H.E. diffuse radialement
créait une zone d'inhibition circulaire à la surface de la
gélose préalablement ensemencée avec la suspension
bactérienne (DORMAN et DEANS, 2000).
6.5- Méthode de dilution
Les H.E. à tester peuvent également être
directement mélangées en concentration connue au milieu de
culture, qu'il soit solide ou liquide sans oublier que les techniques de
dilution
exigent une dispersion homogène. Le milieu est ensuite
inoculé à un taux déterminé de microorganismes et,
après incubation, on note la présence ou l'absence de culture; la
lecture peut être visuelle ou spectrophotométrique, car le
degré d'inhibition est en rapport avec la turbidité du milieu
(BOUSBIA, 2004).

CHAPITRE III
Application des H.E.
dans le domaine agroalimentaire
Introduction
Parmi les micro-organismes inertes, il y a ceux qui
participent à l'élaboration d'aliments fermentés (yaourt,
saucisson, fromage, etc.) et ceux qui, s'ils peuvent se multiplier dans
l'aliment, l'altèrent c'est-à-dire lui confèrent des
goûts, des odeurs ou des aspects inacceptables. Quelques espèces
pathogènes sont responsables des troubles divers, allant de
problèmes digestifs bénins à des maladies graves
provoquant jusqu'à 30 % de décès ou des séquelles
invalidantes (AFSSA, 2006).
La tendance actuelle des consommateurs à rechercher une
alimentation plus naturelle, a entraîné un regain
d'intérêt des scientifiques pour ces H.E. Cependant, c'est
seulement récemment que beaucoup d'attention a été
donnée à leur application potentielle comme conservateurs dans le
domaine agroalimentaire (PALMER, 1998).
Les H.E. et leurs composants, actuellement employés
comme arômes alimentaires, pourraient donc servir d'agents de
conservation alimentaire, d'autant plus qu'ils sont pour la plupart
classés "généralement reconnus comme sains:
Generally Recognized As Safe (GRAS) " ou approuvés comme additifs
alimentaires par la Food and Drug Administration Américaine (FDA). Ils
n'ont, par conséquent, pas besoin d'autorisation d'emploi dans les
aliments, mais des études préalables sont nécessaires pour
mieux cerner leur activité antimicrobienne (CAILLET et LACROIX,
2007).
L'évaluation des propriétés
antimicrobiennes des H.E. demeure très importante pour les exploiter
dans l'industrie comme étant des conservateurs naturels (GUESMI et
BOUDABOUS, 2006).
1- Systèmes de sécurité sanitaire
des aliments en Algérie
La disponibilité d'aliments sains et nutritifs est l'un
des droits fondamentaux de la personne et un facteur essentiel pour un
état de santé adéquat. Le problème de la
consommation d'aliments contaminés et de ses effets
préjudiciables à la santé humaine, n'a pas
été étudié de façon suffisamment approfondie
en Algérie. Le gouvernement devrait toutefois prendre les mesures
nécessaires pour garantir à sa population une alimentation saine
et en soutenir ainsi la santé et le développement
économique.
À l'échelon mondial, la sécurité
sanitaire des aliments est une question de santé publique de plus en
plus importante, centrée sur la participation des consommateurs et de
leurs associations aux processus décisionnels. Les maladies d'origine
alimentaire affectent lourdement la santé des gens et leur
bien-être et qu'elles ont des conséquences économiques non
seulement pour les individus, mais aussi pour les communautés et les
pays.
Les données de la surveillance des maladies devraient
permettre d'estimer le pourcentage des cas ayant une origine alimentaire et
plus spécifiquement, le nombre de ceux qui peuvent être
attribués à des aliments spécifiques. Cette information
est nécessaire pour la gestion des risques pour la
sécurité sanitaire des aliments, étant donné qu'il
existe également d'autres voies de transmission pour la plupart des
pathogènes que l'on trouve dans les aliments, par exemple à
travers l'eau, le contact avec les animaux ou l'environnement. Les
gestionnaires des
risques peuvent également cibler les contrôles avec
davantage de précision lorsque le lien spécifique entre le
pathogène et l'aliment peut être établi.
En Algérie, les toxi-infections alimentaires
accompagnées de symptômes tels que la diarrhée et parfois
la fièvre, sont monnaie courante et généralement
considérées comme sans gravité et spontanément
résolutives. Les médicaments, lorsqu'ils sont utilisés,
sont achetés au comptoir et les cas de maladie ne sont pas
déclarés.
Certaines coutumes régionales ou locales, comme la
consommation des viandes hachées (hamburgers, merguez, boulettes, etc.),
et certaines techniques de préparation spécifiques, telles que
les conditions de hachage et de conservation multiplient les risques de
contamination microbiologique et donc la diffusion des maladies d'origine
alimentaire.
De nombreux facteurs contribuent à la forte incidence
des maladies transmises par les aliments en Algérie. Des systèmes
de bonnes pratiques de fabrication (BPF) et d'assurance qualité comme
l'Analyse des Dangers-Points Critiques pour leur Maîtrise (ADPCM) , ont
été introduits dans le secteur de la production alimentaire et de
la restauration, mais leur mise en application est généralement
limitée voire même inexistante.
La vente de viandes fraîches exposées en
carcasses entières et parfois coupées en quartiers sur la voie
publique dans différentes villes d'Algérie à des
températures abusives et parfois mêmes des viandes issues d'un
abattage clandestin constitue une importante source de nourriture pour une
grande partie de la population algérienne et les vendeurs n'ont souvent
aucune formation spécifique aux risques qui peuvent découler de
ces pratiques.
L'impact des systèmes de sécurité
sanitaire des aliments sur la santé humaine en Algérie est
difficile à déterminer. Il n'existe pas d'études
comparatives; aucune vue d'ensemble des agents pathogènes, ni de
l'incidence des maladies d'origine alimentaire n'est disponible; et en
général les tendances de l'incidence de ces maladies ne sont pas
encore connues du fait du démarrage relativement récent de la
collecte de données. L'Algérie doit poursuivre ses efforts pour
que la sécurité sanitaire des aliments soit solidement inscrite
dans ses programmes nationaux de santé publique. La mise en place de
systèmes intégrés de contrôle des aliments et de
surveillance des maladies d'origine alimentaire, requiert une collaboration et
une coordination efficaces avec l'ensemble des parties prenantes dans les
secteurs de la santé, de l'agriculture et du commerce. Le renfort des
capacités scientifiques et techniques pour prévenir,
maîtriser et gérer les risques reste indispensable. La charge des
maladies d'origine alimentaire est encore très lourde dans la
région et des efforts doivent être déployés afin de
réduire l'impact de ces affections sur la santé humaine.
Les Algériens consomment de plus en plus la viande et
sous différentes formes. Sa qualité est d'une importance vitale
sur un marché, mais les conditions hygiéniques de sa
préparation et manipulation ainsi que celles de sa conservation sont peu
respectées.
L'arrivée de la saison estivale est
généralement à l'origine de plusieurs cas d'intoxications
alimentaires dues essentiellement à la consommation de produits
avariés, devenus impropres
pour le non-respect de la chaîne de froid ou défaut
d'hygiène notamment quand il s'agit de restauration publique.
Selon le bilan établi par la direction de la
Santé (DSP) et la direction du commerce, la capitale de l'Est
(Constantine) a enregistré durant cette année 4 115 interventions
assorties de 43 fermetures de différents commerces. La nature des
contraventions a touché beaucoup plus les viandes avec près de 9
tonnes saisies.
2- Quelques évènements récents sur
les intoxications alimentaires en Algérie
Au cours du premier semestre 2007, 1400 fermetures des
établissements alimentaires pour non-respect des conditions
d'hygiène sur des produits alimentaires et mettant en danger la
santé des consommateurs ont été enregistrées
(Ministère du Commerce: Alger). L'Algérie enregistre des cas
d'intoxications alimentaires de plus en plus fréquents et coûteux.
Près de 6000 cas ont été enregistrés par exemple en
2008 à l'échelle nationale et le risque est plus que jamais
présent avec l'arrivée de la saison estivale. Il est utile de
signaler que près de 40% des cas d'intoxication sont dus à
l'ingestion de viandes et dérivés impropres à la
consommation. Cette pathologie s'est développée à grands
pas en raison de la prolifération de la restauration collective, de la
libre circulation des denrées alimentaires et aussi du
développement de l'industrie agroalimentaire celle-ci s'est
aggravée à cause de l'absence et du non-suivi d'impératifs
d'hygiène, rupture de la chaîne de froid et de
sécurité alimentaire.
3- Les applications alimentaires des H.E.
Les études qui ont été
réalisées jusqu'à maintenant, montrent que les H.E.
peuvent être appliquées à tous les aliments. Ainsi, les
H.E. d'origan, de thym, de cannelle ou de coriandre sont efficaces pour les
viandes, les volailles, les charcuteries et les légumes; l' H.E. de
menthe pour les produits frais (salades, yaourts...); les H.E. à base de
cavarcrol ou de citral pour les poissons; les H.E. de thym, de noix de muscade
ou de gingembre pour les céréales (plus particulièrement
celles riches en carvacrol pour le riz); et les H.E. à base de carvacrol
ou de cinnamaldéhyde pour les fruits (CAILLET et LACROIX, 2007).
Les H.E. sont aussi utilisées pour apporter de la saveur
et un arôme raffiné au café, au thé, aux vins et aux
liqueurs distillées (MICROSOFT ENCARTA , 2008).
Les études de CAILLET et LACROIX (2007) ont
montré que l'incorporation d' H.E. dans la viande hachée du boeuf
a contribué au maintien de la qualité microbiologique et à
la réduction de l'oxydation des gras au-delà de sa durée
normale d'entreposage. Ils ont aussi démontré que l'utilisation
des H.E. pouvait augmenter la sensibilité des bactéries à
différents procédés de conservation des aliments
(chauffage, pasteurisation, atmosphère modifiée). Selon la
bactérie et le procédé utilisé, la sensibilisation
augmente de 2 à 10 fois. Par exemple, l'H.E. mélangée
à des carottes hachées, emballées sous air ou sous
atmosphère modifiée (AM ou MAP: Modified Atmospheres Packaging en
anglais) permet de multiplier par trois la sensibilité de Listeria
sp., de même que pour de la viande hachée emballée
sous les mêmes
conditions, une augmentation très significative de la
sensibilité d'E. coli (2.5 fois) et de Salmonelle (4.5 fois)
est constatée en présence d' H.E. Aussi, l'H.E. combinée
à un chauffage doux (55 °C pendant 1 minute) a permis d'inhiber
totalement Salmonelle, alors qu'en absence d'huile, un chauffage de plus d'une
heure était nécessaire pour arriver au même
résultat. Cependant, le seuil d'efficacité des huiles les plus
efficaces étant très bas, souvent inférieur à 0.1%,
leur ajout en très faibles quantités n'altère pas les
qualités organoleptiques de l'aliment.
D'après BOUSBIA (2005) des investigations ont
été effectuées pour évaluer l'efficacité de
quatre H.E. de plantes: Laurier, clou de girofle, cannelle et thym en tant que
conservateurs normaux. L'effet d'H.E. aux concentrations de 0,1 de 0,5 et de 1
% a été étudié en fromage à pâte molle
à faible teneur en matière grasse et à matière
grasse naturelle contre Listeria monocytogenes et Salmonella
enteritidis à 4°C et à 10°C respectivement, sur
une période de 14 jours. Ils ont conclu que les H.E. des plantes
choisies agissent comme inhibiteurs potentiels contre L. monocytogenes
et S. enteritidis dans ce produit alimentaire (PALMER et al.,
2001).
Les traitements du pâté tout
préparé de foie de porc avec le romarin retardent la croissance
de Listeria monocytogenes (BOUSBIA, 2005). Aeromonas hydrophila
et Listeria monocytogenes ont été inhibées
sur la viande cuite (poitrine de poulet) par des extraits d'eugénol et
de piment.
4- Facteurs influencent les propriétés
antimicrobiennes des H.E. dans
les aliments
D'après CAILLET et LACROIX (2007), certains facteurs
comme la température, les conditions de stockage, le pH ou la
composition de l'aliment, peuvent avoir une influence sur l'action des H.E. Il
est établi que l'efficacité de l'huile augmente avec la
diminution du pH de l'aliment, de la température de stockage ou encore
de la quantité d'oxygène dans l'emballage. Cela est d'autant plus
intéressant que les quantités d'huiles nécessaires pour le
contrôle de la croissance bactérienne dans les aliments
conservés à basse température pourraient être
réduites. Il est également prouvé qu'une même huile
sera plus efficace dans un aliment pauvre en gras et/ou en protéines.
Les fortes teneurs en eau et en sels d'un aliment vont aussi favoriser l'action
de l'H.E., alors qu'une structure gélatineuse va au contraire la
limiter.
L'incorporation des H.E. directement dans les aliments ou
l'application par vaporisation en surface de l'aliment (pièce de viande,
charcuterie, poulet, fruits et légumes entiers...) contribue à
contrôler la flore microbienne et à préserver l'aliment des
phénomènes d'oxydation (CAILLET et LACROIX, 2007).
5- Bactéries responsables de toxi-infections
alimentaires 5.1- Staphylococcus aureus
Nom commun: Staphylocoque doré (staph.=
grappe de raisin, aureus= doré). 5.1.1- Caractères
bactériologiques
Le genre Staphylococcus appartient à la famille des
Micrococcaceae et se compose de 34 espèces et 13
sous-espèces. Staphylococcus aureus en est l'espèce la
plus fréquente et la plus connue (LARPENT, 1997).
C'est un coque à Gram+ de 0,5 à
1 um de diamètre, non sporulé, immobile, aéro-anaerobie
facultatif, catalase+, fermentant le glucose, T° optimale: 37, pH optimum: 6-7,
aw optimale > 0,99. C'est une bactérie ubiquitaire,
présente dans tous les milieux naturels (air, poussière, sol,
eau, égouts, vêtements) mais également chez les animaux et
chez les hommes. Contrairement à la bactérie S. aureus,
ces entérotoxines sont très résistantes à la
chaleur (30 mn/120°C), aux variations de pH (entre 4 - 11) et aux enzymes
protéolytiques (papaïnes, trypsine). Ces caractéristiques
permettent aux toxines ingérées d'atteindre le tube digestif sans
modification de leur toxicité. Chez l'homme, les symptômes se
traduisent soit par des syndromes gastrointestinaux de types crampes
abdominales, vomissements, nausées, diarrhées. Dans le cadre des
intoxications alimentaires staphylococciques, les symptômes apparaissent
très rapidement après l'ingestion de l'aliment contaminé
(2 - 6 h) et les douleurs peuvent être très violentes, mais les
personnes récupèrent en 24 heures. Les aliments dits à
risque, c'est-à-dire souvent impliqués dans ces cas d'infections
à entérotoxine de staphylocoque, sont les produits
laitiers, les salades, les préparations à base de viande,
volailles et poissons, les oeufs et ovoproduits (DELARRAS, 2007).
5.1.2- Habitat et pouvoir pathogène
C'est le plus régulièrement pathogène,
d'origine humaine, animale (volaille, bovin, ovin, caprin...), environnementale
ou non spécifique (DELARRAS, 2007). C'est une bactérie
présente chez les humains, lesquels sont à 95% responsables des
contaminations alimentaires. 50% des humains sont porteurs de ce germe
(cavité nasale), ceci même chez un individu en santé. On
peut le retrouver en particulier dans les préparations alimentaires
à cause d'un manque d'hygiène du personnel (porteur sain ou
blessures). Il se retrouve facilement dans les aliments (LARPENT, 1997).
La présence de S. aureus dans les aliments
constitue un risque pour la santé humaine parce que certaines souches
sont capables de produire des entérotoxines (protéines
globulaires de poids moléculaire 25000-28000 Dalton) dont l'ingestion
provoque une intoxication (AFSSA, 2003). Cette bactérie peut provoquer
la staphylococcitose rarement mortelle chez l'homme (DELARRAS,
2007).
Les intoxications à S.aureus (la plus
fréquente) sont plus répandues que celles des Clostridium
botulinum. L'entérotoxine est produite dans chacune des phases de
croissance de la bactérie. Elle présente une grande
thermorésistence malgré que S. aureus est
détruite par un traitement de pasteurisation. Même les traitements
Ultra Hight Temperature (U.H.T.) (143°C/10½) n'activent pas les toxines.
Généralement, les symptômes indicateurs d'une intoxication
par S. aureus sont les suivantes: Période d'incubation de
quelques heures; les
entérotoxines agissent au niveau des nerfs du tube
digestif qui stimulent le centre des vomissements; douleurs abdominales;
diarrhées; crampes. On parle souvent de gastroentérites dues aux
Staphylococcies. Dans certains cas graves, l'individu infecté peut
manifester du sang dans les selles. Souvent, la maladie dure au maximum 2 jours
et la récupération est complète sans cas graves de
mortalité (AFSSA, 2006).
5.2- Bacillus cereus
5.2.1- Caractères
bactériologiques
Les Bacillus sont des bacilles Gram+,
à spore terminale, subterminale ou centrale. Ils sont
aéro-anaérobies facultatifs ou parfois aérobies stricts
(LARPENT, 1997).
Les souches de Bacillus cereus sont
constituées de bacilles, aux extrémités arrondies,
généralement mobiles grâce à une ciliature
péritriche, d'une longueur supérieure à 3 um et d'un
diamètre moyen de 1,4 um, souvent groupés en chaînes
(EUZEBY, 2008).
Appartient à la famille de Bacillaceae,
bacilles formant des spores ovoïdes thermorésistantes
(résistant à 100 °C et donc à la pasteurisation), de
1 à 1.2 um de large sur 3 à 7 um de long, catalase+. C'est une
bactérie anaérobie facultative. B. cereus est un fort
producteur d'enzymes, il possède une phospholipase très active.
Il peut réduire le nitrate en nitrite. Il peut métaboliser
l'arabinose et le mannitol (PEIFFER, 2000).
Aucune croissance n'est obtenue à pH 4,5 et pour des
températures de 50 °C ou de 60 °C. Les colonies ont un
diamètre compris entre 2 et 7 mm, elles sont soit circulaires soit de
forme irrégulière avec des bords ondulés,
crénelés ou filamenteux, leur aspect est crémeux et lisse
ou mat ou granuleux (EUZEBY, 2008).
5.2.2- Habitat et pouvoir pathogène
B. cereus est un germe ubiquiste. Bactérie
vivant dans les sols et dans les eaux, peut survivre dans l'environnement sous
forme de spores. Elle peut contaminer surtout des aliments d'origine
végétale (riz, épices) et de nombreux plats
cuisinés. B. cereus se comporte comme un pathogène
opportuniste et cette espèce est également responsable de
toxi-infections alimentaires (PEIFFER, 2000). La présence de spores de
B. cereus pose de sérieux problèmes dans les industries
agroalimentaires (notamment les industries laitières). B.
cereus est également un contaminant des drogues
(héroïne) et de médicaments tels que les topiques qui
peuvent alors contaminer des plaies (EUZEBY, 2008).
5.3- Pseudomonas aeruginosa
5.3.1- Caractères
bactériologiques
Bâtonnets droits ou incurvés à Gram-,
mobiles, les flagelles sont polaires, aérobies stricts.
En général catalase +, oxydase +,
métabolisme respiratoire, mais jamais fermentaire, ne fixe pas
N2. La plupart des milieux peptonés conviennent pour la
culture des Pseudomonas sp. Certaines espèces sont capables
d'accumuler l'acide poly-â-hydroxybutyrique (PHB) comme matériel
de réserve en fin de phase exponentielle de croissance. La
température optimale de croissance se situe entre 4 °C et 42
°C (LARPENT, 1997).
Les souches de cette espèce sont constituées de
bacilles de 0,5 à 0,8 um de diamètre sur 1,5 à 3,0 um de
longueur, se présentant de manière isolée ou
groupée par deux ou en courtes chaînes, mobiles grâce
à une ciliature monotriche (quelques rares cellules portent cependant
plusieurs flagelles polaires). P. aeruginosa ou bacille pyocyanique
exprime un pigment vert nommé pyocyanine (EUZEBY, 2008).
5.3.2- Habitat et pouvoir pathogène
Selon PALLERONI (1984), P. aeruginosa est une
espèce bactérienne ubiquitaire. Elle vit à l'état
saprophyte dans l'eau et les sols humides (elle résiste mal à la
dessiccation) ou à la surface des végétaux. Elle vit
également à l'état commensal dans l'intestin de l'homme et
des animaux (MERENS, 2008). Elle est caractéristique des milieux
hospitaliers et colonise souvent le tube digestif humain.
P. aeruginosa constitue une cause majeure
d'infections nosocomiales diverses chez des personnes fragilisées ou
immunodéprimées comme les grands brûlés, les
personnes âgées ou les nouveau-nés ainsi que les
cancéreux (DELARRAS, 2007).
Le pathogène opportuniste qu'est P. aeruginosa
peut engendrer des infections urinaires, oculaires ou pulmonaires et
infecter des plaies profondes en entraînant un choc septique. En fait,
P. aeruginosa représente l'une des trois plus grandes causes
d'infections opportunistes chez l'homme (AVRIL, 2000).
5.4- Salmonella paratyphi A.
5.4.1- Caractères bactériologiques
Le genre Salmonella, qui appartient à la
famille des Enterobacteriaceae, doit son nom au Dr.
Vétérinaire Salmon, bactériologiste américain du
IXXe siècle (EUZEBY, 2008). Ce genre est
caractérisé par des bacilles à coloration Gram
-, non sporulants, la plupart du temps doués d'une
mobilité propre grâce à des flagelles péritriches
(à l'exception de Salmonella gallinarum). Elles sont catalase
+, glucose +, oxydase -, H2S + et lactose +/-, mobiles et présentent une
ciliature péritriche. La taille des bâtonnets varie entre 2 et 5
um de longueur sur 0,7 à 1,5 um de largeur (DELARRAS, 2007). Ils sont
aéro-anaérobies, réduisant les nitrates en nitrites,
peuvent utiliser le citrate comme seule source de carbone, fermentent le
glucose, mais pas le lactose ni le sucrose. Salmonella est une
bactérie mésophile: son optimum de croissance est proche de la
T° corporelle des animaux à sang chaud (35-43 °C). La limite
de croissance inférieure se situe aux environs de 5° C. Les
salmonelles sont réputées être peu thermorésistantes
puisqu'elles sont tuées rapidement lorsque la T° dépasse 70
°C (JOLY et REYNAUD, 2002).
5.4.2- Habitat et pouvoir pathogène
Les Salmonelles sont des bactéries de l'intestin. Chez
de nombreux sujets, elles peuvent être présentes sans
entraîner de symptômes (porteurs sains). Quelques sérovars
sont spécifiquement humains: Typhi et Paratyphi. D'autres ne se
rencontrent que chez l'animal
(AVRIL, 2005). Chez l'homme, elles colonisent la muqueuse
intestinale et l'iléum. Le principal réservoir des salmonelles
est le tractus gastro-intestinal des hommes et des animaux, en particulier les
porcs et les volailles. Elles sont excrétées dans les
déjections animales et se retrouvent ainsi libérées dans
l'environnement. Les aliments représentent le principal vecteur des
salmonelles à l'homme en particulier les viandes crues et les oeufs. Les
symptômes apparaissent environ 24 - 48 h après digestion de
l'aliment contaminé et se traduisent par des nausées, des
vomissements, des maux de tête et des diarrhées (DELARRAS,
2007).
Les fièvres typhoïdes et paratyphoïdes,
maladies très sévères qui s'accompagnent dans 90% des cas
d'une hospitalisation des patients, dues à des sérovars
strictement humains: Salmonella typhi, S. paratyphi A. et, à un
degré moindre, S. paratyphi B. La transmission est
essentiellement interhumaine et se fait par l'eau et les aliments
souillés. Les salmonelles hébergent fréquemment des
plasmides porteurs de facteurs de résistance aux antibiotiques (JOLY et
REYNAUD, 20021).
5.5- Escherichia coli5.5.1- Caractères
bactériologiques
Escherichia coli est l'espèce type du genre
Escherichia des entérobactéries. Appelée
communément "colibacille" c.-à-d. "bacille à côlon",
cette espèce qui a fait l'objet d'un très grand nombre
d'études constitue le modèle des bacilles à Gram-
aérobies. La plupart des E. coli se multiplient rapidement (18
à 24 h) sur les milieux habituels. Les colonies ont en moyenne 2 mm de
diamètre, elles sont rondes, plastes et à bords réguliers
(JOLY et REYNAUD, 2002).
5.5.2- Habitat et pouvoir pathogène
C'est l'une des espèces bactériennes les plus
souvent rencontrées en pathologie humaine (BERCHE, 2003).
Cette bactérie est connue depuis longtemps comme
commensale du tube digestif (présente à raison de 107
à 109 corps bactériens/g de selle des
anaérobies) et pathogène pour l'appareil urinaire et qui se
transmet par voie orofécale. Certaines souches d'E. coli sont
capables de causer des dommages au niveau de la muqueuse digestive se
traduisant par un syndrome infectieux (AVRIL, 2000).
Les aliments incriminés sont: l'eau (dans certains
pays), les viandes et le lait cru. La durée d'incubation est de 3
à 9 jours pour provoquer des gastro-entérites peu graves,
diarrhées abondantes et liquides (turista) (JOLY et REYNAUD, 2002).
L'espèce E. coli regroupe plusieurs
sérotypes dont certains sont pathogènes pour l'homme et, qui sont
répartis en six groupes: E.coli entérotoxigène
(ETEC); E.coli entéro-invasif (EIEC); E. coli
entéropathogène (EPEC); E. coli
entéroagrégant (EaggEC); E. coli
entéroadhérant diffus (DAEC); E. coli
entérohémorragique (EHEC). Les sérotypes E. coli
O157:H7, O111, O26, O103 sont caractérisés par leur potentiel
à provoquer le syndrome hémolytique urémique chez les
personnes par leur production de vérotoxines. Depuis la première
toxi-infection alimentaire aux États-Unis en 1982, impliquant
E.coli O157:H7, ce sérotype a été isolé
dans d'autres évènements toxi-infectieux humains dans de nombreux
pays
(Japon, Canada, Royaume-Uni, etc.). Les symptômes
observés chez l'homme sont généralement des
diarrhées précédées de violentes douleurs
abdominales et suivies généralement de diarrhées
sanglantes. Les aliments impliqués sont les viandes hachées crues
ou peu cuites, les eaux de distribution et certains jus de fruits, les produits
laitiers non pasteurisés et les végétaux crus. Les
principaux réservoirs de ces sérotypes sont les tractus
intestinaux des bovins et des ovins qui contaminent les sols et les eaux via
leurs déjections. (DELARRAS, 2007).
5.6- Shigella flexneri5.6.1- Caractères
bactériologiques
Selon BERCHE (2003), les shigelles sont découvertes il
y a plus de 100 ans (1886) par Shiga (Japon). Ce sont des
entérobactéries à tropisme exclusivement digestif,
très proches d'E. coli. Le genre Shigella appartient à
la famille des Enterobacteriaceae. Quatre (04) espèces sont
recensées: S. dysenteriae, S. flexneri, S.
boydii et S. sonnei. Les Shigella sont des
entérobactéries à Gram-, immobiles, qui
provoquent des dysenteries bacillaires. Les plus rencontrées sont
Shigella flexneri responsable des formes endémiques et S.
sonnei (AVRIL, 2000).
5.6.2- Habitat et pouvoir pathogène
Ce sont des bactéries strictement humaines à
transmission féco-orale (BRANGER, 2007). Agents d'une maladie
diarrhéique aigue à transmission direct (mains sales, porteurs
sains...) ou indirect (aliment ou eau de boisson contaminés par les
matières fécales) (DELARRAS, 2007).
La Shigellose ou dysenterie bacillaire endémique en
région tropicale. L'incubation est très courte: 24-48h
après exposition et ingestion, elle cause une intense inflammation
tissulaire et détruit la muqueuse avec ulcérations et
hémorragies (BERCHE, 2003).
Les espèces les plus importantes sont Shigella
flexneri, responsable des formes endémiques, et S. dysenteriae
sérotype 1, responsable des épidémies brutales et
graves dans les pays en voie de développement ; Shigella sonnei,
moins virulente, est prévalente dans les pays
développés (DELARRAS, 2007).

ETUDE
EXPERIMENTALE

Matériel
&
Méthodes
Ce travail de recherche (rentrant dans le cadre d'un projet de
collaboration entre l'Espagne et l'Algérie dont le chef du projet est
Mr. Djenane Djamel de l'Université de Tizi Ouzou) a été
réalisé pendant une période de sept (07) mois. Il est
subdivisé en trois (03) parties principales : extraction des H.E. par
hydrodistillation (à l'échelle de laboratoire et à
l'échelle semi-industrielle); évaluation de leur activité
antibactérienne in vitro (aromatogramme, CMI...) et enfin
application pratique sur des viandes hachées inoculées avec des
bactéries pathogènes.
Ce travail a été mené grâce à
la contribution des laboratoires suivants:
- Laboratoire commun N° 2 de la Faculté des Sciences
Biologiques et des Sciences Agronomiques - Université Mouloud Mammeri,
Tizi Ouzou;
- Laboratoire de Physiologie Végétale du
Département de Physiologie Animale et Végétale.
Faculté des Sciences Biologiques et des Sciences Agronomiques -
Université Mouloud Mammeri, Tizi Ouzou ;
- Groupe Pharmaceutique SAIDAL Filiale BIOTIC Usine EL Harrach,
ALGER; -
- Laboratoire Vétérinaire Régional de
Drâa Ben Khedda-Service Microbiologie
Alimentaire, Tizi Ouzou.
1- Matériels et
Méthodes
1.1- Matériel végétal
Un certain nombre de critères ont été pris
en compte pour sélectionner les plantes utilisées dans cette
étude:
- des ressources naturelles à exploiter;
- utilisation des plantes en médecine traditionnelle;
- les apports de la littérature et des publications
scientifiques.
Les critères que nous venons d'évoquer ayant
permis d'établir une liste préliminaire de plantes
potentiellement intéressantes pour une éventuelle étude
sur l'activité antibactérienne. En plus de notre travaille qui a
porté sur le Myrte, Eucalyptus, Sarriette et Clous de girofle, un autre
binôme d'Ingénieur a travaillé sur d'autres espèces
végétales (Thymus vulgaris, Thymus satureiodes,
Mentha peripita et Mentha spicata), deux (02) autres
étudiants en Magisters travaillent actuellement sur d'autres
espèces sélectionnées (lavande, lentisque, citron...).
Des parties aériennes (feuilles fraîches) de
myrte et d'eucalyptus ont été collectées dans les
régions de Bouzeguène et de Fréha (800 et 383 m d'altitude
respectivement du niveau de la mer méditerranée, Wilaya de Tizi
Ouzou) pendant la période de Juin-Juillet 2008. Après
récolte, ces deux espèces végétales ont
été transportées vers les laboratoires de
Département de Biologie, Université Mouloud Mammeri de Tizi
Ouzou. Elles ont été authentifiées par des enseignants du
même Département. Les feuilles fraîches appartenant à
ces deux espèces ont été intensément
nettoyées avec de l'eau distillée à 20 °C,
égouttées à l'aide d'un tamis puis séchées
à l'air libre et conservées pendant toute la nuit à une
température ambiante de (? 30 °C). La troisième plante
utilisée dans ce travail a été directement
approvisionnée chez un
herboriste de la ville de Tizi Ouzou. Il s'agit d'une
épice dénommée clous de girofle originaire des îles
volcaniques de l'archipel des Moluques en Indonésie (importée de
Madagascar).
Tableau III : Présentation des plantes
employées pour l'extraction des H.E.
|
NOM BOTANIQUE
|
NOM COMMUN
|
FAMILLE
|
|
Eugenia caryophyllus
Myrtus
communis
Eucalyptus sp.
Satureja hortensis
|
Girofle clous
Myrte commun
Eucalyptus
Sarriette des
jardins
|
Myrtacées Myrtacées Myrtacées
Labiées
|
1.2- Milieux de culture
Suivant les méthodes employées et selon les
souches, nous avons principalement utilisé comme milieux de culture:
- La Gélose Nutritive (Himedia Laboratories Pvt. Ltd.
Mumbai India), gélose Mueller Hinton Agar (Himedia Laboratories Pvt.
Ltd. Mumbai India), gélose Hektoen (Himedia Laboratories Pvt. Ltd Mumbai
India), gélose lactosée au bromocrésol pourpre (BCP)
(Biomérieux® SA- France), gélose Chapman
(Biomérieux® SA- France) et Salmonella- Shigella Agar
(Himedia Laboratories Pvt. Ltd. Mumbai India) et Milieu Brain Heart Infusion
(BHIB) (Biomérieux® SA- France).
La composition chimique de chaque milieu est décrite dans
l'annexe 1.
2- Extraction des huiles essentielles 2.1- Clous de
girofle
L'extraction de l'H.E. de cette plante a été
réalisée par un hydrodistillateur (cf. figure 16) que nous avons
monté avec l'aide précieuse de Mr ASLA Tarik (Maître
assistant chargé de cours à l'Université Mouloud Mammeri
de Tizi Ouzou) au laboratoire de Physiologie Végétale
(Département de Biologie et Physiologie Végétale de
l'Université de Tizi Ouzou).
L'hydrodistillation consiste à mettre la plante dans
l'eau et à faire bouillir le mélange. Sep cent millilitres (700
mL) d'eau distillée sont versés dans un ballon en verre d'un (01)
litre puis l'eau est laissée bouillir sur un chauffe ballon. Trente
grammes (30 g) de graines sèches de clous de girofle ont
été pesés avec une balance de précision, puis
broyés finement avec le pilon et le mortier. Le broyat obtenu est
directement versé à l'aide d'un entonnoir dans les 700 mL d'eau
bouillante. Le mortier et le pilon ont été soigneusement
rincés avec de l'eau distillée pour bien récupérer
le reste de broyat, ensuite cette eau de rinçage est directement
versée dans le ballon. Quelques billes de verre ou quelques grains de
pierre ponce ont été rajoutés dans le ballon dans le but
de réguler la température du système. Un courant d'eau
de
robinet traverse le tube réfrigérant de
l'appareil. La vapeur d'eau entraîne avec elle l'huile, passe dans le
tube réfrigérant où l'ensemble se condense. À la
sortie du réfrigérant, le liquide de condensation est
récupéré dans un flacon en verre. Le distillat obtenu est
formé d'eau dans laquelle sont dissoutes très peu
d'espèces odorantes; et de l'H.E. qui est constituée
d'espèces odorantes. L'opération de distillation dure environ 3
heures. Les deux phases doivent faire l'objet d'une séparation.

Fig. 16: Montage de l'hydrodistillateur
réalisé au département de Biologie et
Physiologie
Végétale à l'UMMTO.
La séparation des deux phases a été
réalisée par deux méthodes différentes:
A. Séparation directe
Cette méthode et très simple, elle consiste
à laisser décanter le distillat pendant 24 h ce qui provoque le
dépôt de l'H.E. de girofle sous l'effet de différence des
densités. L'H.E. ainsi séparée de la phase aqueuse est
récupérée par aspiration à l'aide d'une seringue
stérile.
B. Séparation indirecte (extraction par
solvant)
- Relargage
Il consiste à stimuler la séparation de l'huile
de l'eau. Vingt grammes (20 g) de chlorure de sodium (NaCl) anhydre ont
été pesés à l'aide d'une balance de
précision, puis mélangés avec le distillat obtenu par
hydrodistillation. Le mélange est placé dans un erlenmeyer. Un
agitateur électrique a été utilisé pour bien
homogénéiser ce mélange (cf. figure 17). Le contenu est
ensuite mis dans une ampoule à décanter. Afin d'améliorer
le rendement de l'extraction, une
seconde extraction a été réalisée,
cette fois-ci par un solvant (éther). Le distillat a été
transvasé dans une ampoule à décanter et y ajouter 20 mL
d'éther diéthylique. L'ampoule à décanter a
été hermétiquement fermée puis, le contenu est
agité pendant 3 mn en dégazant de temps en temps (cf. figure 18 a
et b). L'ampoule est ensuite déposée sur un support pendant
quelques minutes pour laisser décanter le contenu. Après
décantation, deux phases apparaissent dans l'ampoule (cf. figure 18 c).
Celles-ci sont recueillies séparément dans des flacons
différents (cf. figure 18 d). Le séchage de la phase organique a
été effectué à l'aide d'un évaporateur
rotatoire. Cette opération aboutit à l'élimination de
l'éther de l'H.E.

Fig. 17: Distillat : [eau salée (NaCl)] + H.E. du
giroflier.

Fig. 18 : Étapes de séparation des phases
du distillat. (a) et (b) : agitation et
dégazage du contenu de l'ampoule ;
(c) : séparation des deux phases [x = la phase organique
(H .E. + éther) ; y = la phase aqueuse (eau distillée + traces
d'huile)];
(d) : récupération de la phase organique (H.E.)
dans un flacon et élimination de la phase aqueuse (H2O).
2.2- Myrte et Eucalyptus
En raison du faible rendement en H.E. de myrte et d'eucalyptus
lorsque l'hydrodistillation a été pratiquée par l'appareil
que nous avons, nous même monté au Laboratoire de Biochimie et
Microbiologie (Université Mouloud Mammeri Tizi Ouzou) - le même
utilisé pour extraire l'H.E. des C.G., l'extraction des H.E. de ces deux
plantes a été enfin réalisée par un
hydrodistillateur semi-pilote [référence N° 229 (2000) P.P. 18.
23 (E.H.BEN Youcef et COLC) Rivista : Italiana. EPPOSN° 30 (2001) PP 15-19
(E.H.B.E)] (cf. figure 19) au niveau du complexe pharmaceutique SAIDAL Filiale
BIOTIC (Usine El Harrach, Alger) à partir des feuilles fraîches (
20 Kg / plante). Les 40 Kg du matériel végétal ont
été conditionnés dans des sacs en plastique de contenances
différentes qui ont été bien nettoyés avec de l'eau
distillée avant remplissage puis séchés à l'air
libre. Les sacs qui contiennent les matériaux végétaux
étaient transportés de Tizi Ouzou vers El Harrache (Alger) dans
les conditions suivantes: voiture particulière climatisée;
T° de transport ? 22°C. Les extractions des H.E. ont
été réalisées approximativement une (01) semaine
après réception des espèces végétales par
SAIDAL. Pendant la période séparant la
réception-extraction, les végétaux ont été
conservés dans leurs emballages originaux dans des conditions
idéales de T°, d'humidité relative et d'aération.

Fig. 19: Montage de l'hydrodistillateur semi-pilote du
Groupe SAIDAL.
Concernant la 4ème espèce
végétale, nous avons directement opté par l'utilisation
d'une H.E. 100% pure et naturelle de la Sarriette en flacon de 5 mL (Florame-
St Rémy de Provence- France) qui nous a été aimablement
fournie par Dr Djenane Djamel. Cette H.E. a été obtenue en France
à partir d'un matériel végétal biologique
(certifié par Ecocert SAS F32600) originaire de l'Afrique du Nord.
2.3- Calcul du rendement en huile essentielle
Le rendement en H.E. est le rapport entre le poids de l'huile
extraite et le poids du matériel végétal utilisé
(AKROUTE, 2001). Le rendement est exprimé en pourcentage (%) est
calculé par la formule suivante:
R = (Ph / Pv) ?100
ou
R = [?Ph /
?Pv] x 100
R: rendement de l'huile en %; Ph: poids de l'huile en g;
Pv: poids du matériel végétal en
g.
2.4- Conservation des huiles essentielles
Les H.E. extraites ou bien approvisionnées de
l'extérieur sont placées dans des tubes à essai et
conservées à des T° de réfrigération ( 4
°C), à l'abri de la lumière et de l'oxygène au niveau
de Laboratoire Vétérinaire de Draa Ben Khedda (Tizi Ouzou).
3- Tests d'activité antimicrobienne des H.E.
3.1- Critères de sélection des
souches
Le choix des souches est basé sur plusieurs
paramètres:
- Les souches sont d'origine hospitalière, responsables de
Toxi-infections Alimentaires (TIA) (S. aureus, S. paratyphi A.);
- pour leurs fréquences élevées à
contaminer les denrées alimentaires et particulièrement la viande
et produits carnés;
- les souches sont choisies pour leur résistance
naturelle à divers types d'agents antimicrobiens. (S. aureus
est souvent retenu comme bactérie-test dans les normes
d'évaluation de l'activité des antiseptiques et
désinfectants (AFSSA, 2003).
3.2- Souches bactériennes
Six souches bactériennes ont été
utilisées dans notre travail. Des bactéries Gram-positif (G+):
S. aureus et B. cereus, et des bactéries
Gram-négatif (G-): S. paratyphi A., S. flexneri,
E. coli et P. aeruginosa. Cinq (05) de ces souches
bactériennes ont été isolées cliniquement à
l'Hôpital Universitaire de Tizi Ouzou tandis que la souche P.
aeruginosa a été isolée directement à partir
de la viande et produit carnés au niveau du Laboratoire
Vétérinaire Régional de Draa Ben Khedda (Tizi Ouzou).
Les souches qui ont été testées, nous ont
été en partie, aimablement fournies par Dr HOUALI Karim,
Maître de conférences (Département de Biochimie
Microbiologie, Faculté des Sciences Biologiques et des Sciences
Agronomiques, Université Mouloud Mammeri Tizi Ouzou). Les souches ont
été reçues dans des tubes à gélose
inclinée, conservés à une T° de
réfrigération (2#177;1 °C). La souche de P. aeruginosa
nous a été également, aimablement fournie par
Melle MALKI Ouiza du Laboratoire Vétérinaire
Régional de Drâa Ben Khedda (Tizi Ouzou).
3.3- Confirmation des souches
Pour chacune des souches un pré-enrichissement a
été effectué sur le milieu d'isolement sélectif
(cf. figure 20) puis une coloration de Gram a été
réalisée selon le modèle suivant :
- Préparer un frotti ;
- recouvrir le frotti avec de violet de Gentiane ; laisser agir
1mn ; rincer à l'eau distillée ;
- verser du Lugol et le laisser agir pendant 1 mn ;
- décolorer à l'alcool à 95°, entre 15
et 30 secondes ; rincer à l'eau distillée ;
- fixation avec de la fuchsine pendant 10 à 30 secondes ;
rincer à l'eau distillée ; - sécher au-dessus de la flamme
d'un bec Bunsen ;
- observation au microscope optique à l'objectif x 100
à immersion, les Gram+ se colorent en violet tandis que les Gram-
apparaissent colorés en rose.
Tableau IV : Coloration de Gram et morphologie des
souches bactériennes utilisées.
|
Souches
|
Milieu de culture
|
Gram
|
Morphologie microscopique
|
|
S. aureus
|
Gélose Chapman
|
+
|
Coccobacilles en grappes de
raisin
|
|
B. cereus
|
Gélose lactosée
au
bromocrésol
pourpre (BCP)
|
+
|
Bacilles
|
|
S. paratyphi A
|
Gélose Hektoen
|
_
|
Coccobacilles
|
|
S. flexneri
|
Shigelles
Salmonelles (SS)
|
_
|
Coccobacilles
|
|
E. coli
|
Gélose Hektoen
|
_
|
Bacilles
|
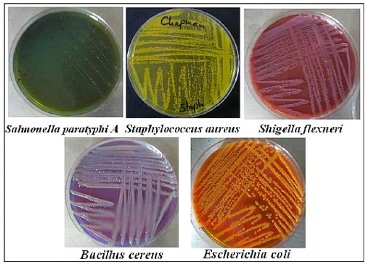
Fig. 20: Aspect des souches bactériennes
repiquées sur milieux spécifiques. -
Confirmation des souches de S. aureus
Test catalase
Ensemencer des boîtes de gélose Chapman par
l'inoculum. Incuber entre 33 et 37 °C pendant 24 à 48 h. Les
colonies jaunes entourées d'une zone jaune, sont des Staphylocoques.
Colonies jaunes + H2O2 Effervescence (Catalase +)

H2O2 CATALASE H2O + 1/2 O2
L'effervescence se traduit par un dégagement gazeux, ce
qui signifie que cette souche est à catalase +.
Le deuxième test qui confirme la souche de S.
aureus fait appel au test coagulase libre. Test coagulase libre
(ou épreuve de la coagulase)
Parmi les cocci à Gram+ et catalase+, les souches de
S. aureus provoquent la coagulation du plasma oxalaté de lapin
en 24 h, les autres espèces et sous-espèces de staphylocoques
d'origine humaine ne possèdent pas la coagulase libre sauf S.
schleiferi subsp. coagulans (DELARRAS,
2007).
Mélanger dans un tube à hémolyse
stérile 0,1 mL de plasma de lapin et 0,3 mL de la culture en bouillon de
la souche. Incuber le mélange incliné à l'étuve 37
°C. Les lectures se font après 6 h, 8 h et 24 h d'incubation.
Il a été remarqué qu'après 6 h
d'incubation, le plasma a été entièrement coagulé
avec prise de masse. Selon les résultats obtenus (coloration de Gram,
tests de catalase et coagulase), la souche de Staphylococcus était bel
et bien S. aureus.
La confirmation du reste des souches bactériennes n'a pas
été effectuée car on ne dispose pas de réactifs
nécessaires pour réaliser la galerie biochimique.
3.4- Préparation des précultures
Ces souches ont été identifiées aux
laboratoires et, utilisées comme souches de références
pour des études préliminaires de sensibilité
vis-à-vis des différentes H.E. Les différentes souches
bactériennes ont été repiquées dans des tubes de
gélose de conservation (en piqûre centrale) puis incubées
à 37#177;1 °C. Après 24 h d'incubation, ces tubes sont
conservés à la T° de réfrigération (2#177;1
°C). Dans le but de garder toujours la disponibilité en souches,
chaque 15 jours, des opérations de repiquage sont
réalisées.
Avant la réalisation des tests antibactériens,
deux repiquages consécutifs sont effectués pour chaque souche
(cf. figure 21): en premier lieu, elles ont été inoculées
dans de BHIB liquide et incubées pendant 24 h à 37#177;1 °C.
Le deuxième repiquage est effectué sur milieu solide
(gélose nutritive) la veille de la réalisation du test
antibactérien. L'ensemble a été incubé à
37#177;1 °C pendant 18 h pour avoir des cellules bactériennes
à leur phase exponentielle de croissance. À partir de cette
culture bactérienne fraîche, on prélève quelques
colonies que l'on mélange avec de l'eau physiologique stérile.
Pour la standardisation de la charge de l'inoculum de départ, la
méthode de comparaison de la densité bactérienne à
celle d'un tube de référence (0,5) Mc Farland dont la charge est
supposée être 105 ufc/mL a été
employée.
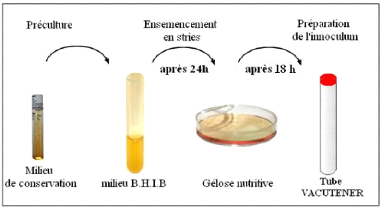
Fig. 21: Préparation de l'inoculum.
3.5- Tests antimicrobiens 'in vitro'
Trois méthodes ont été retenues pour tester
l'effet antimicrobien des H.E.: - Méthode de diffusion sur disques
(aromatogrammes) ;
- méthode de diffusion en puits ;
- méthode de microatmosphère.
Il est à noter que ces tests sont réalisés
en duplicata.
3.5.1- Méthode de diffusion sur disques
(aromatogrammes)
Cet examen se fait de la même manière qu'un
antibiogramme où les antibiotiques sont remplacés par des
essences aromatiques, préalablement sélectionnées et
reconnues.
L'aromatogramme ou méthode par diffusion en milieu
gélosé ou encore méthode de disques est une technique
qualitative permettant de déterminer la sensibilité des
microorganismes vis-à-vis d'une substance réputée
antimicrobienne. Cette méthode repose sur le pouvoir migratoire des H.E.
à l'intérieur d'une boîte de Pétri, dans un milieu
nutritif solide (Mueller Hinton).
Le protocole de base des aromatogrammes qu'on a adopté
est celui qui a été proposé par le laboratoire de
microbiologie de l'École Polytechnique Fédérale de
LAUSANNE (Faculté Environnement Naturel, Architectural et Construit
Institut des infrastructures, des ressources et de l'environnement, Section
D'architecture, Suisse) auquel quelques modifications ont été
apportées.
L'ensemencement de l'inoculum de 1 mL est
réalisé en surface du milieu Mueller Hinton préalablement
coulé dans des boîtes de Pétri. Après 1/4 d'h, le
surplus est éliminé dans la hotte à flux laminaire
jusqu'à ce que la gélose soit sèche. Des disques
stériles (6 mm de ?; papier Wattman N°1) imprégnés d'une
quantité d'H.E. à l'état pur (5 ul) sont
déposés au centre des boîtes. Celles-ci sont ensuite
fermées et laissées diffuser pendant 20 mn puis incubées
à 37 °C pendant 24 h. Après incubation, l'absence de
croissance bactérienne exprimant une activité antimicrobienne se
traduit par un halo translucide autour du disque, de même couleur que la
gélose stérile et dont le diamètre est mesuré
à l'aide d'un pied à coulisse (exprimé en mm). Il est
important de noter que la quantité d'H.E. déposée sur le
disque varie selon les auteurs, excluant toute comparaison des valeurs des
diamètres mesurés (PIBIRI, 2006).
La sensibilité des différentes souches
vis-à-vis des H.E. étudiées est classée selon le
diamètre d'inhibition selon les critères suivants: non sensible
(-) pour ?<8 mm; sensible (+) pour j
compris 9-14 mm; très sensible (++) pour ?15-19 mm et
extrêmement sensible (+++) pour ?>20 mm (PONCE et
al., 2003). Des témoins négatifs utilisant uniquement des
disques placés sur gélose inoculée sans l'H.E.
Des disques d'antibiotiques Kanamycine, Pénicilline et
Ticarcilline de références médicales (GROUPE Glaxo Smith
Kline Algérie) ont été utilisés pour le
contrôle de l'activité des souches tests. Ce produit nous a servi
de standard de référence (témoins positifs) pour
l'évaluation de la sensibilité des microorganismes testés
dans ce travail et de s'assurer de l'état et de la conservation. Chaque
essai expérimental a été réalisé en
duplicata.
3.5.2- Microatmosphère (ou méthode en phase
vapeur)
La technique consiste à déposer des disques
stériles (6mm de ?; papier Wattman N°1) imbibés d'une
quantité déterminée (5 ul) d'H.E. au milieu des couvercles
des boîtes de Pétri et non en contact direct avec la gélose
ensemencée. Les boîtes sont fermées avec leurs
couvercles en bas puis, incubées à 37 °C
pendant 24 h. Après incubation, l'absence de la croissance
bactérienne se traduit par une zone translucide sur la gélose de
contour plus ou moins nette, à tendance circulaire lorsque le disque est
bien centré. Les résultats se lisent avec un pied à
coulisse et s'expriment par un diamètre en mm (cf. figure 14)
Les boîtes contrôles sont des boîtes de
Pétri ensemencées selon les conditions expérimentales.
3.5.3- Technique de diffusion en puits
L'activité antibactérienne des
différentes huiles diluées à 50 % a été
étudiée pour chaque souche bactérienne. À partir
d'une culture de 18 à 20 h (105-106 UFC/mL).
L'ensemencement de l'inoculum de 1 mL est réalisé en surface du
milieu Mueller Hinton préalablement coulé dans des boîtes
de Pétri. Après 15 mn, des puits ont été
découpés à l'aide de pipettes Pasteur
(l'extrémité épaisse de 6 mm de ?). Le fond des puits est
obturé par une goutte de gélose Mueller Hinton pour limiter la
diffusion des huiles sous la gélose. Ensuite, 50 ul de l'huile
diluée est distribuée dans chaque puits. Après diffusion
(? 20 mn), les cultures sont incubées dans des étuves à la
température de 37 °C pendant 24 h, et les auréoles
d'inhibition sont mesurées par un pied à coulisse. Le
diamètre du puits (8 mm) est inclus dans les tableaux des
résultats.
3.5.4- Nature de l'activité
antibactérienne (bactériostatique ou
bactéricide)
des huiles essentielles
La nature de l'activité de chacune des H.E.
testées a été déterminée par la
méthode de PIBIRI (2006). À partir des aromatogrammes de 48 h,
les zones translucides entourant les disques ont été
repiquées à l'aide d'une anse stérile dans des tubes
à essai contenant le milieu B.H.I.B. Les tubes sont ensuite
incubés à 37#177;1 °C pendant 24 h (cf. figure 22).
Un deuxième repiquage à l'aide d'une anse
stérile est effectué sur milieu Gélose Nutritive (en
stries) à partir des tubes à B.H.I.B. après 24 h
d'incubation.
Au bout de 24 h d'incubation à 37#177;1 °C, l'absence ou
présence de colonies est observée. L'absence de
développement bactérien indique un effet bactéricide de
l'H.E. en question, tandis que la présence de colonies
bactériennes nous renseigne sur un effet bactériostatique.
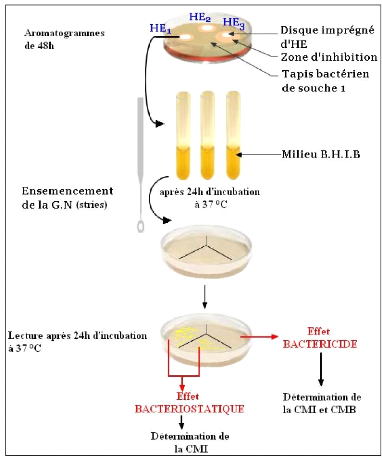
Fig. 22: Détermination de la nature de
l'activité antimicrobienne des H.E.
3.5.5- Détermination de la concentration minimale
inhibitrice (CMI) par méthode de dilutions en milieu solide
Même si les H.E. sont considérées comme
des additifs salubres (LAMBERT et al., 2001), leur utilisation est
souvent limitée par les critères organoleptiques de l'aliment.
Pour cette raison, il sera nécessaire de déterminer la CMI (c'est
à dire la plus faible concentration en huile capable d'inhiber toute
croissance bactérienne sans affecter la qualité sensorielle de
l'aliment), car selon l'effet recherché et les bactéries
ciblées, la concentration ne sera pas la même (CAILLET et LACROIX,
2007).
Le protocole de base utilisé dans notre
expérimentation est celui rapporté par BILLERBECK (2003). Les
modifications suivantes ont été apportées selon les
conditions expérimentales:
- L'intervalle des concentrations en H.E. choisi comporte 10
dilutions citées ci-dessus; - la gélose Trypcase-soja est
remplacé par la gélose Mueller Hinton;
- l'inoculation en surface de la gélose Mueller Hinton est
réalisée par 2 ul au lieu de 1ul pour bien visualiser le
développement microbien;
- pour ce qui est de la nature de l'activité
antibactérienne, la méthode citée
précédemment a été choisie.
La CMI est déterminée pour les huiles
présentant une activité antibactérienne intense sur les
souches bactériennes les plus sensibles. Le tableau suivant regroupe les
bactéries sélectionnées pour le calcul des CMI pour chaque
H.E. Uniquement les souches présentant une sensibilité accrue
sont retenues pour le calcul de la CMI (+++).
Tableau V : Répertoire des résultats
obtenus par la méthode des aromatogrammes.
|
Souche
H.E.
|
S. aureus
|
E. coli
|
S. flexneri
|
S.paratyphi A
|
B. cereus
|
|
Sarriette
|
++
|
+++
|
+++
|
+++
|
++
|
|
CG
|
+++
|
+++
|
++
|
+++
|
++
|
|
Eucalyptus
|
+++
|
+++
|
+++
|
-
|
-
|
+++ : très sensible ; ++ : sensible ;
- : résistante.
Du fait de la non miscibilité des H.E. à l'eau
et donc au milieu de culture, la mise en émulsion a été
réalisée grâce à une solution d'agar à 0,2 %
afin de favoriser le contact germe/composé. Chaque type d'huile est
dilué avec l'eau distillée stérile afin d'obtenir les
dilutions suivantes : 1/2 ; 1/4 (0,25) ; 1/5 (0,2) ; 1/10 (0,1) ; 1/20 (0,05) ;
1/40 (0,025) ; 1/50 (0,02) ; 1/60 (0,0166) ; 1/80 (0,0125) ; 1/100 (0,01).
Tableau VI : Valeurs des dilutions (ul d'HE/mL
d'eau).
|
Rapport
(HE/eau)
|
1/2
|
1/4
|
1/5
|
1/10
|
1/20
|
1/40
|
1/50
|
1/60
|
1/80
|
1/100
|
|
ul / mL
(HE/ eau)
|
1000
|
333,3
|
250
|
111,1
|
62,5
|
25,64
|
20,4
|
16,94
|
12,66
|
10,1
|
Pour pouvoir comparer les CMI de différents
micro-organismes, il est indispensable de travailler sur des cellules à
des stades de croissance (de 18 à 20 h d'incubation) et à des
concentrations similaires. Pour cela, les mesures de CMI doivent être
réalisées sur des biomasses microbiennes fraîches (en phase
exponentielle de croissance).
Les boîtes de Pétri sont remplies à
moitié par le milieu Mueller Hinton et laissées solidifier sous
la hôte à flux laminaire. Différentes concentrations d'H.E.
(cf. tableau VI) sont incorporées en masse dans le milieu de culture en
surfusion : 45 °C (Mueller Hinton Agar) avec les proportions suivantes : 1
mL de l'H.E. diluée et 3 mL du milieu en surfusion, puis on agite
convenablement les tubes à l'aide d'un vortex avant de les verser sur la
première couche. Après solidification, l'inoculation
bactérienne des géloses est effectuée en surface à
l'aide d'une micropipette automatique, sous forme de dépôts de 1
ul à partir de suspensions bactériennes de 105 ufc/mL.
L'ensemble est incubé à une T° de 37#177;1 °C pendant
24 h. La CMI est définie comme étant la plus faible concentration
en H.E. où on n'observe aucune croissance bactérienne.
3.5.6 - Combinaison entre les huiles essentielles
Dans le but de mise en valeur d'un éventuel effet
synergique entre les H.E., différents rapports d'H.E. sont
effectués à savoir : [HE1/HE2] = 1/1; 1/2; 1/3. Puis les rapports
sont inversés [HE2/HE1] = 1/1; 1/2; 1/3. Des aromatogrammes ont
été réalisés en imprégnant des disques des
mélanges d'H.E. précédemment préparés que
l'on dépose au centre des boîtes du milieu Mueller Hinton
préalablement inoculé avec la bactérie test et on les
laisse diffuser pendant environ 20 mn. Après 24 h d'incubation à
une T° de 37#177;1 °C, on mesure les auréoles d'inhibition
à l'aide d'un pied à coulisses et on les compare à celles
obtenus avec les H.E. testées toutes seules.
3.6- Activité antimicrobienne des H.E. en
présence des pathogènes inoculées dans la viande
hachée bovine
Dessin Expérimental
3.6.1- Préparation de la viande
Des muscles (Longissimus dorsi) ont été obtenus
directement à partir d'une carcasse bovine 04 jours post-mortem
(Boucherie et Volaille Khatir, coopérative immobilière des
frères Haddad, Draa Ben Khedda, Tizi-Ouzou). La viande a
été transportée dans une enceinte
réfrigérante (Mobicool, UK) à 2#177;1°C, puis
acheminée vers le Laboratoire Régional Vétérinaire
de Draa Ben Khedda pendant les 30 mn qui suivent son achat.
Une fois au Laboratoire, les muscles sont aseptiquement
débarrassés de leurs couches périphériques,
constituées par du tissu conjonctif et de matière grasse.
Plusieurs morceaux de viande ( 8 kg) ont été
découpés à l'aide d'un couteau Inox stérile, puis
placés dans un hachoir stérile (ENIEM, Algérie) pour
être transformés en viandes hachées.
3.6.2- Optimisation de la CMI appliquée à
la viande par des tests sensoriels
Il a été bien établi que les doses
effectives d'H.E. approuvées dans des tests antibactériens
"in vitro", ne pourraient être les mêmes quand il s'agit
d'une matrice alimentaire. BURT (2004) a suggéré que les CMI
devraient être multipliées par un coefficient qui peut osciller
entre 2 et 100, si on veut les appliquer dans un aliment pour obtenir des
résultats satisfaisants.
Selon les résultats des CMI des différentes
huiles que nous avons obtenu, nous avons jugé utile de multiplier ces
valeurs par un coefficient de 2, du moment que nous considérons que les
valeurs obtenus sont relativement supérieures: les valeurs des CMI
correspondant aux H.E. des clous de girofle, de sarriette ainsi que
d'eucalyptus après multiplication fois le facteur 2 sont respectivement
: 110 ul / mL ; 10,1 ul / mL ; et 20,4 ul / mL d'eau distillée.
La CMI relative au Myrte n'a pas été
déterminée car les études préliminaires "in
vitro" ont montré que les souches bactériennes
testées n'ont présenté qu'une relative faible
sensibilité à l'H.E. extraite de cette plante.
Afin d'établir un protocole pour tester
l'efficacité des H.E. sur la conservation de la viande ; il convient
d'abord de déterminer le plus faible volume en H.E. qui n'altère
pas les qualités organoleptiques de cette dernière, à
savoir le goût et l'odeur. C'est pourquoi on a procédé pour
un test préalable de dégustation durant lequel on a
rajouté des volumes différents à 100 g de viande
hachée et faire une approche sensorielle.
Pour les tests sensoriels préalables, quatre (04)
échantillons de 100 g chacun ont été
préparés pour être inoculés avec des volumes de
10-30-40 et 50 tl de chacune des H.E. testées dans cette étude et
qui ont révélé dans des tests "in vitro" une
activité antimicrobienne considérable, en l'occurrence les Clous
de girofle, Sarriette et Eucalyptus.
Les échantillons de viande hachée contenant les
différents volumes en H.E. correspondantes ont été
mélangés manuellement en utilisant des gants latex. Les
différents échantillons ont été cuits dans un four
à gaz butane (ENIEM, Algérie) puis servis aux dégustateurs
dans des petits plats en plastiques jetables. Le panel des dégustateurs
est constitué par cinq (05) personnes âgées entre 23 et 25
ans (4 filles et 1 garçon), l'ensemble des dégustateurs sont des
étudiants (es) de l'Université de Tizi-Ouzou. Les tests de
dégustation ont été réalisés dans les
conditions du laboratoire (température ambiante, lumière de
jour...) de Microbiologie de Centre Vétérinaire Régional
de Draa Ben Khedda selon la méthode décrite par DJENANE et
al. (2001). Les cinq dégustateurs ont été
entraînés au départ par des tests préalables.
Plusieurs sessions dirigées par Dr Djenane ont été
organisées afin de permettre aux étudiants de se familiariser
avec les attributs mesurés selon les échelles choisies.
Les attributs sensoriels déterminés sont le
goût et l'odeur. Le critère d'odeur a été
structuré sur une échelle de 6 valeurs: 1=odeur
très forte; 2=odeur forte; 3=odeur
moyenne; 4= odeur ni faible ni forte; 5=odeur
faible; 6=odeur inaperçue. Par contre le critère
goût a été structuré sur une échelle de 9
valeurs: 1=extrêmement mauvais;
2=très mauvais; 3=mauvais;
4=moyennement mauvais; 5=ni bon, ni mauvais;
6=moyennement bon; 7=bon;
8=très bon ; 9=extrêmement
bon.
À travers ces tests, il conviendra d'abord de
déterminer le plus faible volume d'H.E. qui n'altère pas les
qualités organoleptiques du produit, à savoir le goût et
l'odeur. C'est pourquoi des tests préalables de dégustation dans
ce genre de travail sont indispensables.
3.6.3- Préparation des échantillons
Pour chaque combinaison de paramètres
étudiés (H.E. + bactérie pathogène), 200 grammes
(g) de viande hachée ont été préparés dans
un récipient Inox stérile et ensuite mélangés avec
de l'H.E. donnée. Ensuite, la viande contenant de l'H.E. a
été inoculée par la bactérie pathogène
correspondante (? 5 log ufc/g). L'ensemble a été
homogénéisé à l'aide d'un
homogénéisateur pour bien répartir la distribution de
l'huile et de la bactérie à travers la viande. Au total trois
(03) échantillons de 50 g chacun ont été
préparés pour chaque combinaison (cf. figure 24). Les
échantillons sont ensuite placés dans des boîtes de
conserve Inox stériles de 6 cm de ? (03 boîtes/germe/H.E.) et
conservés à une T° de réfrigération: 2#177;1
°C.
Les échantillons témoins (contrôles) ont
été traités avec de l'eau distillée stérile
en présence de la souche pathogène et, conservés dans les
mêmes conditions (cf. figure 23 étape II).
- Dessin expérimental du test sur la viande
fraîche
Étape I :
Viande + HE + Bactéries

Syzygium
aromaticum

E. coli
Eucalyptus
sp.

Satureja
hortensis


E. coli
S. paratyphi A. S. aureus

S. paratyphi A


S. aureus Shigella flexneri

3 échantillons pour chaque espèce
bactérienne
Étape II :
Viande + Bactéries


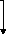
|
Staphylococcus
aureus
|
|
Escherichia
coli
|
|
Salmonella paratyphi A
|
|
Shigella flexneri
|
3 échantillons 3 échantillons 3 échantillons
3 échantillons
Fig. 23: Schéma du test de l'activité
antibactérienne des H.E. sur une viande contaminée
par les
souches pathogènes.
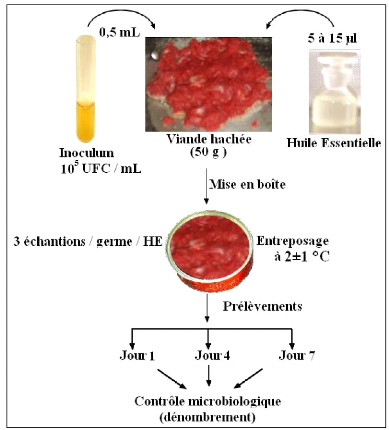
Fig. 24: Test de l'effet des H.E. sur la conservation de
la viande hachée. 3.6.4- Analyses Microbiologiques
Pour déterminer l'efficacité inhibitrice des
H.E. sur les bactéries pathogènes présentes dans la
viande, des analyses microbiologiques sont effectuées pour suivre la
cinétique microbienne de chaque espèce en présence et en
absence d'H.E. Toutes les analyses ont été
réalisées en duplicata.
La cinétique microbienne de chaque espèce a
été mesurée au 1er , 4ème et
7ème jour pendant une durée globale de conservation de
sept (07) jours. Les échantillons ont été conservés
à 2#177;1 °C à l'air libre. Pour chaque
prélèvement, 25 g de viande de chaque échantillon
étudié sont placés puis dilués dans 225 mL d'eau
peptonée (0.1%). Chaque échantillon est
homogénéisé à l'aide d'un stomacher Lab Blender
(model BA 6021; Seward Laboratory, London, UK) pendant 1 minute. Des dilutions
décimales sont préparées par dilution de 1 mL dans 9 mL
d'eau peptonée stérile (0.1%). Deux boîtes de pétri
sont ensemencées pour chaque dilution en
versant 1 mL de chaque suspension dans de la gélose en
surfusion, chaque germe a été ensemencé sur son milieu
sélectif:
Le dénombrement de S. paratyphi A et d'E.
coli a été déterminés en comptant les
boîtes dans un milieu Hektoen (Himedia Laboratories Pvt. Ltd Mumbai
India), incubées à 37 °C pendant 24 h. Celui de S.
aureus a été déterminé dans un milieu Chapman
(Biomérieux® SA- France) incubées à 37 °C
pendant 48 h, et S. flexneri a été
dénombrée dans un milieu SS (Himedia Laboratories Pvt. Ltd.
Mumbai India) incubées à 37 °C pendant 24 h. Le nombre de
bactéries est exprimé en Log10 d'unité formant
colonie/g (Log ufc/g).
4. Analyse statistique
L'analyse de la variance (anova) a été
utilisée pour déterminer les différences significatives
entre les échantillons aux diférents jours de stockage (logiciel
Stat box version 6.0.). La différence entre les moyennes est
considérée significative à un niveau p<0.05.

Resultats
&
Discussion
1. Rendement en huiles essentielles
Durant notre travail, les parties des végétaux
faisant l'objet d'extraction sont constituées par un matériel
végétal sec (boutons floraux séchés du giroflier)
et frais (myrte et eucalyptus).
Tableau VII : Le rendement (%) en H.E. des
différentes plantes utilisées.
|
H.E.
|
Clous de Girofle (C.G.)
|
Eucalyptus
|
Myrte
|
|
Rendement
|
3,5
|
0,048
|
0,056
|
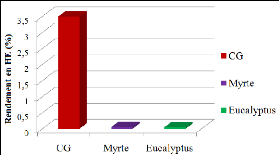
Fig. 25: Rendement en H.E.obtenues par
hydrodistillation.
La figure 25 montre les résultats des différents
rendements en H.E. des différentes espèces
végétales utilisées dans cette étude.
D'après cette figure, il s'avère que le rendement en H.E.
extraite par hydrodistillation à l'échelle de laboratoire
à partir des Clous de girofle est de 3,5 %. Ce résultat ne
coïncide pas avec les résultats obtenus par d'autres auteurs qui
ont procédé par la même technique d'hydrodistillation.
ANDREA (2004) a obtenu un résultat de (14 à 20 %) en utilisant la
même technique d'hydrodistillation.
Cette différence de rendement est probablement due
à une perte d'huile dans la phase aqueuse du distillat et la
simplicité de notre dispositif d'hydrodistillation. Cependant, les
rendements en H.E. de Myrte et de l'Eucalyptus ont été presque
nuls quand l'extraction se faisait à l'échelle de laboratoire,
cependant les rendements en H.E. de ces deux plantes ont été
améliorés de 0.056 % et 0.048 %, respectivement quand
l'extraction est de type semiindustriel. On peut dire qu'en terme de
quantité et, malgré que ces pourcentages semblent
inférieurs mais dans la pratique restent satisfaisants pour mener
à bien une telle étude, car les quantités en H.E.
nécessaires sont de l'ordre des tl. En termes de valeurs, le rendement
en H.E. de Clous de Girofle est significativement (P<5%) meilleur par
rapport aux rendements obtenus en H.E. avec les deux autres plantes à
savoir le Myrte et l'Eucalyptus. Selon certains auteurs, la composition
chimique et le rendement en H.E. varient suivant diverses conditions :
la méthode employée, les parties
végétales utilisées et les produits et réactifs
utilisés pendant l'extraction, l'environnement, le génotype de la
plante, son origine géographique, la période de récolte de
cette plante, le degré de séchage, les conditions de
séchage, la température et la durée de séchage,
présence de parasites, de virus et mauvaises herbes (BAJPAI et
al., 2008; KELEN et al., 2008).
2. Tests de sensibilité microbienne envers les
H.E.
Ces tests consistent à déterminer la
sensibilité des microorganismes vis-à-vis des H.E. Nous avons
testé l'activité de quatre H.E par les méthodes de
diffusion sur gélose, diffusion en puits et microatmosphère. Les
mesures des halos d'inhibitions nous ont permis de classer les bactéries
suivant leur degré de sensibilité à l'H.E.
donnée.
Les résultats des témoins sont
représentés dans la figure 26.
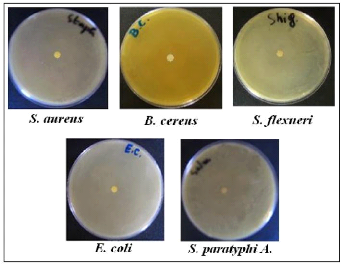
Fig. 26: Photos montrant les témoins
réalisés par la méthode d'aromatogramme.
Les figures ci-dessous montrent les zones d'inhibition
observées avec l'ensemble des bactéries pour chaque H.E. par les
trois méthodes adoptées. Les tableaux renseignent sur les
diamètres des zones d'inhibition en mm qui sont la moyenne des deux
essais.
2.1- Essais avec les Clous de Girofle -
Méthode d'aromatogramme
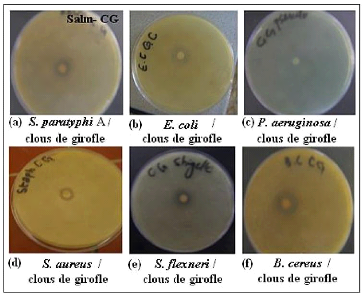
Fig. 27: Photos montrant l'activité
antimicrobienne de l'H.E. à l'état pur des CG par
la
méthode d'aromatogramme.
- Méthode de diffusion en puits
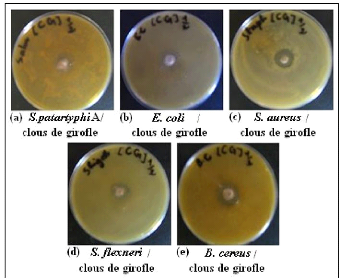
Fig. 28: Photos montrant l'activité
antimicrobienne de l'H.E. des CG diluée à 1/2 par
la
méthode de puits.
Le tableau suivant représente les résultats des
moyennes de deux essais pour chacune des méthodes testées.
Tableau VIII: Halos d'inhibition (mm)
provoqués par l'H.E. des Clous de girofle.
|
Méthodes
Souches
|
Méthode de
diffusion sur
disque
(huile pure)
|
Méthode de
diffusion en
puits
(huile diluée à 1/2)
|
|
S. aureus
|
10,29 (sensible: +)
|
09,03 (sensible: +)
|
|
E. coli
|
16,31 (très
sensible:++)
|
10,96 (sensible: +)
|
|
S. flexneri
|
12,41 (sensible: +)
|
9,66 (sensible: +)
|
|
S. paratyphi A
|
12,47 (sensible: +)
|
12,36 (sensible: +)
|
|
B. cereus
|
15,34 (très sensible:++)
|
20,43 (extrêmement
sensible: +++)
|
|
P. aeruginosa
|
00,00 (résistante)
|
Non déterminée
|
Les valeurs obtenues en puits diffèrent des
résultats des aromatogrammes. Vis-à-vis du S.
paratyphi A, les résultats obtenus par les deux méthodes
ne sont pas significativement différents. Cependant, on notera une
grande signification entre les valeurs obtenues vis-à-vis des autres
espèces. On peut en conclure que la méthode de diffusion en puits
ne pourrait raisonnablement se substituer à celle des aromatogrammes
pour le cas des Clous de girofle. Il faut noter que pour B. cereus, la
méthode de diffusion en puits, l'huile des Clous de girofle est la plus
active avec un halo d'inhibition de 20,43 mm de ~ devant celui de diffusion sur
disque égale à 15,34 mm. D'après les résultats
d'aromatogrammes, nous pouvons dire que toutes les espèces
testées présentent une certaine sensibilité
vis-à-vis de l'H.E. des Clous de girofle. Cependant E. coli et
B. cereus se sont révélées très sensibles,
tandis que S. aureus, S. flexneri et S. paratyphi A
se sont révélées sensibles à l'exception de P.
aeruginosa qui se révèle résistante.
Nous observons également que même lorsque l'H.E.
est diluée à 50% pour la méthode en puits, toutes les
espèces ont montré une sensibilité envers cette huile
excepté la souche B. cereus qui a montré une très
grande sensibilité.
Après 24 h d'incubation des boîtes du test de
diffusion en puits, on s'est rendu compte que leur fond (en plastique) qui
était en contact avec l'H.E. des C.G. avait fondu. Pour cela, nous
émettons une hypothèse : certaines molécules des huiles
des C.G. auraient un pouvoir corrosif (l'eugénol). Ceci a
été confirmé par les travaux de BACHELOT et ses
collaborateurs (2006), ayant conservé cette H.E. dans des tubes en
plastiques et qui ont observé le même phénomène.
De récentes études (PALMER et al.,
2000), ont démontré que les H.E. des C.G. se sont fortement
antimicrobiennes. Cette activité pourrait être attribuée
à son composé majoritaire qui est "l'eugénol" . Les
travaux de VALERO et GINER (2006), ont prouvé que l'eugénol parmi
d'autres composés a provoqué l'inhibition complète de la
croissance de B. cereus. Les mêmes auteurs ont constaté
également qu'aucune croissance n'était observée
après 60 jours en présence de 150 ul d'eugénol/100 mL de
bouillon. THOROSKI et al. (1989), ont démontré que
l'eugénol à faible concentration empêchait la production
d'amylase et de protéase par B. cereus, ils ont
également noté que l'activité inhibitrice de ce
composé est due à son action directe sur la
détérioration de la membrane cellulaire de la bactérie
cible. BURT, (2004) et OUSSALAH et al. (2005) ont
démontré que l'H.E. des Clous de girofle contenant 78%
d'eugénol était effective contre quatre bactéries
pathogènes (E. coli O157:H7, Listeria monocytogenes
(L. monocytogenes), S. Typhimurium et S.
aureus). À une concentration de 1% : vol/vol, l'H.E des Clous de
girofle exerce une action bactéricide (LEUSCHNER et LELSCH, 2003). Selon
ces mêmes auteurs, la charge initiale de L. monocytogenes
égale à 6.77 Log ufc/mL passe à 1 log ufc/mL en
présence de cette H.E. à une température d'incubation
égale à 37 °C, cependant lorsque la température
d'incubation était de 4 °C, la réduction de la charge
bactérienne a atteint une valeur de 3 Log ufc/mL.
MOLEYAR et NARASIMHAM (1992), ont observé qu'un
mélange de cinnamaldéhyde et d'eugénol à 250 et 500
ug/mL, respectivement empêchait complètement la croissance de
Staphylocoque sp., Micrococcus sp., Bacillus sp., et
Enterobacter sp. pendant plus de 30 jours, alors que les substrats
appliqués individuellement n'ont pas empêché le
développement microbien.
A la lumière de tous ces travaux, l'extrait des Clous
de Girofle présente un large spectre d'activité antimicrobienne
d'où l'importance de cette huile comme étant un conservateur,
très efficace pour empêcher le développement microbien
surtout quand il s'agit de protéger la santé vis-à-vis de
la présence des pathogènes.
2.2- Essais avec la Sarriette
- Méthode d'aromatogramme
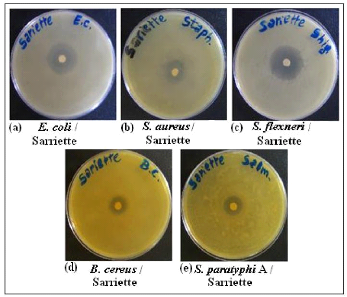
Fig. 29: Photos montrant l'effet antimicrobien de
l'H.E. de sarriette par la méthode
d'aromatogramme.
- Méthode de microatmosphère
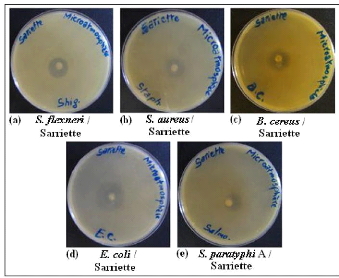
Fig. 30: Photos montrant l'effet antimicrobien de
l'H.E. de Sarriette par la méthode
de
microatmosphère.
Tableau IX : Halos d'inhibition (mm) provoqués
par l'H.E. pure de la Sarriette.
|
Méthodes
Souches
|
Méthode de
diffusion sur
disque
(aromatogrammes)
|
Méthode de
Microatmosphère
|
|
S. aureus
|
14,23 (sensible:+)
|
15,71 (très sensible:++)
|
|
E. coli
|
23,32 (extrêmement
sensible:+++)
|
21,59 (extrêmement
sensible:+++)
|
|
S. flexneri
|
25,87 (extrêmement
sensible:+++)
|
16,18 (très sensible:++)
|
|
S. paratyphi A
|
13,61(sensible:+)
|
15,52 (très sensible:++)
|
|
B. cereus
|
13,54(sensible:+)
|
11,29 (sensible:+)
|
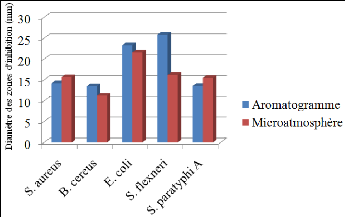
Fig. 31: Représentation graphique des deux tests
antimicrobiens de l'H.E. de Sarriette.
La figure 31 représente les résultats des deux
tests d'inhibition réalisés avec les deux méthodes
(l'aromatogramme et la microatmosphère). Elle montre que l'H.E. de
Sarriette est dotée d'une activité antibactérienne sans
exception sur l'ensemble des bactéries testées. Toutes les
souches ont présenté des degrés de sensibilité
vis-à-vis de cette huile. Les résultats des aromatogrammes sont
très proches de ceux des microatmosphères (Tableau IX). On peut
en conclure que la méthode de Microatmosphère pourrait
raisonnablement se substituer à celle des aromatogrammes pour le cas de
la Sarriette. D'après ces résultats, nous pouvons remarquer que
l'huile de Sarriette exerce une activité antimicrobienne
extrêmement remarquable vis-à-vis de E. coli et S.
flexneri avec un halo d'inhibition de Ø=23.32 et 25.87mm,
respectivement pour la méthode d'aromatogramme. Cependant, à
travers la méthode de microatmosphère, toutes les souches ont
présenté presque une grande sensibilité. S.
aureus: L1=15.71mm; E.coli: L1=21.59mm; S. flexneri:
L1=16.18mm; S. paratyphi A: L1=15.52mm. En revanche, P.
aeruginosa a manifesté une résistance totale
vis-à-vis de l'huile de Sarriette.
Nous pouvons dire que, grâce aux profils chromatiques
des H.E. de Sarriette, publiés dans la littérature (LAWRENCE
et al., 1997), il a été identifié les proportions
des phénols (49.3%), thymol (49.3%) et carvacrol (47.1%), responsables
de l'effet antimicrobien de l'huile de Sarriette. PIBIRI (2006) a montré
que 790 ppm d'H.E. de Sarriette ont un effet bactéricide sur S.
aureus.
OUSSALAH et ses collaborateurs (2007) ont rapporté que
l'H.E. de deux espèces de sarriette : S. hortensis (sarriette
des jardins) et S. Montana (sarriette des montagnes) avec une
concentration de carvacrol de 41% et de 43%, respectivement ont montré
une forte activité antibactérienne contre toutes les
bactéries pathogènes examinées (E. coli O157:H7,
S. typhimurium, S. aureus et L. monocytogenes).
HELANDER et ses collaborateurs (1998), ont montré que
des changements morphologiques au niveau de la membrane externe d'E. coli
sont observés suite à son exposition au carvacrol, un
composé majoritaire de la Sarriette.
Il est à préciser que cette essence est
caractérisée par la dominance de l'á-pinène connu
pour son effet inhibiteur. En effet, une étude réalisée
par BOURKHISS et ses collaborateurs (2007) sur les H.E. des feuilles de
Juniperus oxycedrus a montré qu'elle présente une bonne
activité inhibitrice de S. aureus. Cette H.E. est
caractérisée par l'abondance de l'á-pinène.
De même, au cours de leurs travaux sur l'H.E. de
Croton stellulifer, MARTIN et ses collaborateurs (2000), ont
rapporté que l'activité observée contre les
bactéries et champignons étudiés est attribuée
particulièrement à la présence de l'á-pinène
parmi les composés majoritaires de cette essence. Une autre étude
réalisée par ANGIONI et al (2003) sur les H.E. des
feuilles de Juniperus oxycedrus a montré qu'elle
présente une bonne activité inhibitrice de Candida
albicans et S. aureus. L'H.E. de sarriette est
caractérisée par l'abondance de l'ápinène (environ
86 % d'après LAWRENCE, 1992; MIKUS et al.,1997 ).
2.3- Essais avec l'Eucalyptus
- Méthode d'aromatogramme

Fig. 32: Photos montrant l'activité
antimicrobienne de l'H.E. d'Eucalyptus par la
méthode
d'aromatogramme.
- Méthode de diffusion en puits
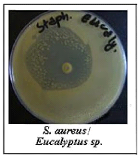
Fig. 33: Photo montrant l'effet antimicrobien de l'H.E.
d'Eucalyptus par la
méthode de diffusion en puits.
- Méthode de Microatmosphère
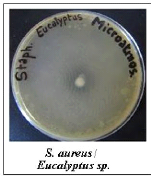
Fig. 34: Photo montrant l'effet antimicrobien de l'H.E.
d'Eucalyptus par la
méthode de microatmosphère.
Tableau X : Diamètres (mm) des halos entourant
les disques exprimant la sensibilité à
l'H.E. d'Eucalyptus
(état pur et dilué à 1/2) des bactéries
pathogènes.
|
Méthodes
Souches
|
Aromatogramme
(huile pure)
|
Méthode de
diffusion en puits
(huile
diluée à 1/2)
|
Microatmosphère
(huile pure)
|
|
S. aureus
|
29 (extrêmement
sensible: +++)
|
47,17 (extrêmement
sensible: +++)
|
11,7 (sensible : +)
|
|
E. coli
|
12,84 (sensible: +)
|
00 (résistante : -)
|
00 (résistante : -)
|
|
S. flexneri
|
10,3 (sensible : +)
|
00 (résistante : -)
|
00 (résistante: -)
|
|
S. paratyphi A
|
00 (résistante : -)
|
00 (résistante : -)
|
00 (résistante: -)
|
|
B. cereus
|
00 (résistante : -)
|
00 (résistante : -)
|
00 (résistante: -)
|
Tout comme l'H.E. des Clous de girofle et celle de Sarriette,
l'huile d'Eucalyptus a manifesté une activité très
importante vis-à-vis de S. aureus par rapport aux autres
microorganismes testés. DORMAN et DEANS (2000), ont observé une
tendance semblable quant à la sensibilité de S. aureus
en présence de l'extrait d'Eucalyptus.
D'après le tableau ci-dessus, l'H.E. d'Eucalyptus
exerce un pouvoir antibactérien très prononcé sur cette
souche à l'état dilué: le diamètre de la zone
d'inhibition obtenu par la méthode de diffusion en puits à 1/2
d'H.E. est supérieur à celui obtenu par l'aromatogramme
(47,17 et 29 mm respectivement). Probablement, l'opération de dilution
favorise mieux son activité antimicrobienne par une meilleure diffusion
de son principe actif.
Toutefois, à travers la méthode d'aromatogramme,
cette H.E. possède une activité antimicrobienne
intermédiaire vis-à-vis d'E. coli et S.
flexneri ([1=12,84, 10,3 mm, respectivement), par contre, S.
paratyphi A et B. cereus se sont révélées
très résistantes vis-à-vis de cette H.E. ([1=0mm).
L'huile d'Eucalyptus à l'etat pure a montré une
activité antimicrobienne relativement moyenne ([1=11,7 mm) par la
méthode de microatmosphère vis-à-vis de S. aureus,
cependant et, toujours par la même méthode, les autres
espèces pathogènes ont exprimé une résistance
considérable vis-à-vis de cette huile ([1=00 mm). De même
pour la méthode de diffusion en puits, mais cette fois-ci avec une huile
diluée à 1/2, la sensibilité vis-à-vis de cette
huile a été manifesté uniquement par S. aureus
avec un degré extrêmement sensible ([1=47,17 mm).
Selon BOUAOUN et al. (2007), l'activité
antimicrobienne de l'H.E. d'Eucalyptus est attribuée à
l'eucalyptol, ou 1.8-cinéole qui est un monoterpène appartenant
à la classe des éthers. Il a des propriétés
antioxydantes (AMAKURA et al., 2002) et antibactériennes et
donc explique l'origine de l'activité antimicrobienne de cette huile.
Plusieurs travaux ont déjà
démontré l'activité antimicrobienne des composés
d'Eucalyptus dans différents domaines des sciences de la vie (OSAWA
et al., 1998; MURATA et al., 1990, 1992).
2.4- Essais avec le Myrte
- Méthode d'aromatogramme
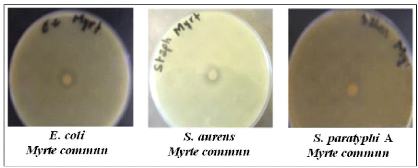
Fig. 35: Photos montrant l'effet antimicrobien de
l'H.E. du Myrte par la méthode
d'aromatogramme.
- Méthode de diffusion en puits

Fig. 36: Photo montrant l'effet antimicrobien de l'H.E.
du Myrte par la méthode
de diffusion en puits.
Tableau XI : Halos d'd'inhibition (mm) en
présence d'H.E. de Myrte.
|
Méthodes
Souches
|
Aromatogramme
(huile pure)
|
Méthode de
diffusion en puits
(huile
diluée à 1/2)
|
|
S. aureus
|
10,69 (sensible : +)
|
11,5 (sensible : +)
|
|
E. coli
|
14,79 (très sensible :
++)
|
00 (resistante: -)
|
|
S. flexneri
|
8,55 (non sensible :-)
|
00 (resistante: -)
|
|
S. paratyphi A
|
8,83
|
00 (resistante: -)
|
|
B. cereus
|
00 (resistante: -)
|
00 (resistante: -)
|
L'aromatogramme réalisé avec l'H.E. du Myrte
montre que E. coli présente une grande sensibilité
(L1=14,79mm) envers cette huile en comparaison avec les autres espèces
bactériennes (L1=10,69, 8,55 et 8,83 mm, respectivement pour
S.aureus, S. flexneri et S. paratyphi A.).
Dans une étude réalisée par SAGDIÇ et al.
(2002), l'extrait de Myrte a démontré une activité
antimicrobienne considérable, spécialement vis-à-vis
E. coli.
B. cereus a démontré une résistance
accrue vis-à-vis de l'huile de Myrte même lorsque les deux
méthodes (aromatogramme et diffusion en puits) sont
appliquées.
Nos résultats ont montré que P. aeruginosa
est l'espèce la plus résistante vis-à-vis des
H.E. testées et ceci n'est pas surprenant ! Selon la
littérature et les travaux menés sur les souches de cette
espèce, plusieurs hypothèses ont été
supposées quant à leur résistance. Selon PIBIRI, (2006),
cette dernière a la réputation d'être très
résistante à toutes sortes d'agents antimicrobiens et
antibiotiques en général. Il est établi que l'inhibition
de cette bactérie par des agents antimicrobiens, nécessite des
concentrations considérables.
Des bactéries Gram - se sont montrées
généralement plus résistantes que les Gram + aux effets de
diverses H.E. en raison des lipopolysaccharides présents dans la
membrane externe, mais ce n'était pas toujours vrai (OUSSALAH et
al., 2007). Il semble que le mécanisme d'action de ces huiles est
lié essentiellement à la structure de la paroi (BERCHE , 2003).
Les mécanismes d'action des H.E. et leur sélectivité
envers certaines bactéries restent jusqu'à présent mal
élucidés. Selon plusieurs auteurs (DORMAN et DEANS, 2000), cette
sélectivité est le résultat de la composition
variée des fractions actives des huiles, qui présentent souvent
des actions synergiques.
La méthode de microatmosphère n'a pas
été concluante pour la plupart des H.E. testées, ceci est
probablement dû aux conditions expérimentales défavorables
(T° très élevée) ce qui favorise l'évaporation
des huiles.
Au fil du temps, on a remarqué une perte progressive de
l'efficacité des H.E. sous l'effet des conditions du travail
(période estivale) : chaque ouverture des flacons induit à un
renouvellement de l'O2 (oxydation) ainsi que l'évaporation des huiles
sous l'effet de la chaleur.
2.5- Récapitulatif des aromatogrammes
Les résultats des tests d'inhibition de l'activité
microbienne sont regroupés dans le tableau suivant.
Tableau XII : Récapitulatif des aromatogrammes
des H.E. avec six souches bactériennes
pathogènes.
|
H.E.
souches
|
Clous de
girofle
|
Eucalyptus
|
Myrte
|
Sarriette
|
|
S. aureus
|
10,29 (sensible :
+)
|
29 (extrêmement
sensible : +++)
|
10,69 (sensible : +)
|
14,23 (sensible : +)
|
|
E. coli
|
16,31 (très
sensible: ++)
|
12,84 (sensible :
+)
|
14,79 (très sensible :
++)
|
23,32(extrêmement
sensible : +++)
|
|
S. paratyphi A
|
12,47 (sensible:
+)
|
00 (resistante: -)
|
8,83(resistante: -)
|
13,61 (sensible : +)
|
|
S. flexneri
|
12,41(sensible :
+)
|
10,3 (sensible : +)
|
8,55 (resistante: -)
|
25,87
(extrêmement
sensible :
+++)
|
|
B. cereus
|
15,34 (très
sensible : ++)
|
00 (resistante: -)
|
00 (resistante: -)
|
13,54 (sensible : +)
|
|
P. aeruginosa
|
00 (resistante: -)
|
00 (resistante: -)
|
00 (resistante: -)
|
Non réalisés
|
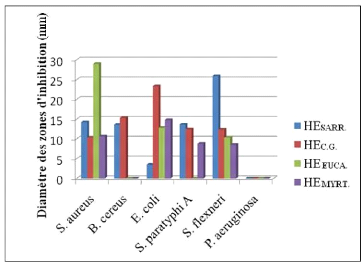
Fig. 37: Représentation graphique des effets
antimicrobiens des H.E. vis-à-vis de 6
souches bactériennes
pathogènes par la méthode d'aromatogramme.
3- Interprétation de la nature de l'activité
des H.E.
Les résultats de l'activité des H.E. sont
répertoriés dans le tableau suivant:
Tableau XIII: Nature de l'activité
antimicrobienne des différentes H.E. testées
après
repiquage sur BHIB puis sur gélose
nutritive.
|
H.E.
Souches
|
Clous de girofle
|
Eucalyptus
|
Sarriette
|
|
S. aureus
|
+ (effet
bactériostatique)
|
- (effet bactéricide)
|
- (effet bactéricide)
|
|
E. coli
|
+ (effet
bactériostatique)
|
+ (effet
bactériostatique)
|
+ (effet
bactériostatique)
|
|
S. flexneri
|
+ (effet
bactériostatique)
|
- (effet bactéricide)
|
+ (effet
bactériostatique)
|
|
S. paratyphi A.
|
- (effet bactéricide)
|
Non déterminée
|
+ (effet
bactériostatique)
|
|
B. cereus
|
- (effet bactéricide)
|
Non déterminée
|
+ (effet
bactériostatique)
|
(+): développement bactérien ; (-) : absence de
développement bactérien.
H.E. à effet bactéricide: Un
prélèvement sur la surface de la gélose ne montre aucun
développement lorsqu'il est repiqué ce qui signifie que l'H.E.
semble exercer un effet bactéricide sur le germe. C'est le cas pour:
l'H.E. de Sarriette vis-à-vis de S. aureus; l'H.E.
d'Eucalyptus vis-à-vis de S. flexneri et S.
aureus; l'H.E. des Clous de girofle vis-à-vis de B. cereus
et S. paratyphi A.
H.E. à effet bactériostatique: cas
de toutes les autres H.E.
4- Concentrations minimales inhibitrices (CMI)
Les figures suivantes regroupent les CMI en H.E. correspondant
à chaque souche bactérienne testée. Sur l'ensemble des
dilutions effectuées (10 pour chaque huile), ne sont
présentées que les boîtes où les CMI sont
impliquées.
4.1- Clous de Girofle
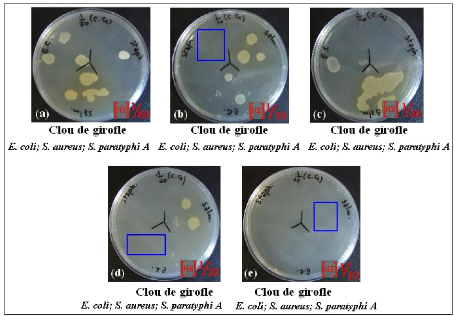
Fig. 38: Photos montrant les CMI de l'H.E. des CG
vis-à-vis de certaines
bactéries
pathogènes.
L'H.E. des Clous de girofle montre un effet inhibiteur
très prononcé. Les CMI sont comprises entre 1/10 et 1/50
(c.-à-d. 111,1 et 20,4 ul/mL).
Toutes les boîtes dont la concentration en H.E.
est comprise entre 1/60 et 1/100 développent des colonies
résistantes, ceci pour les trois souches bactériennes
testées.
La valeur de CMI de l'H.E. des Clous de girofle
vis-à-vis de S. aureus est de 1/50 (première boîte
dans laquelle on n'observe aucun développement microbien) (cf. figure
38-b) ; aucune colonie n'est visible à partir de 1/20 pour E. coli
(cf. figure 38-d) ; et de1/10 pour S. paratyphi A (cf. figure
38-e).
4.2- Sarriette

Fig. 39: Photos montrant les CMI de l'H.E. de Sarriette
vis-à-vis de certaines
bactéries
pathogènes.
L'extrait de Sarriette est très actif sur l'ensemble
des souches bactériennes choisies pour la détermination de la CMI
à savoir : S. aureus, S. paratyphi A. S. flexneri
et E. coli. Il conserve son activité jusqu'à une
dilution de 1/100 (10,1 ul / mL).
4.3- Eucalyptus

Fig. 40: Photos montrant les CMI de l'H.E.
d'Eucalyptus.
La valeur de la CMI de l'H.E. d'Eucalyptus pour S.
aureus est de 1/50 c'est-à-dire 20,4 ul / mL d'eau distillée
(première boîte dans laquelle on n'observe aucun
développement microbien) (cf. figure 40-d);
La valeur de CMI de l'H.E. de l'Eucalyptus pour E. coli
et S. flexneri est de 1/2 (1000 ul / mL) (cf. figure 40-a).
4.4- Myrte

Fig. 41: Photos montrant les CMI de l'H.E. du
Myrte.
La valeur de la CMI de l'H.E. du Myrte pour S. aureus
est de 1/4 (cf. figure 41-b); au bout de 48h d'incubation, on a observé
un développement bactérien dans les deux premières
boîtes (a et b). Ce qui signifie que cette huile perd son activité
après la moindre dilution.
Les valeurs des concentrations minimales inhibitrices sont
reportées dans le tableau suivant :
Tableau XIV : Récapitulatif des valeurs de CMI
des H.E. testées sur les 6 souches
pathogènes (en ul/mL
d'eau).
|
H.E. souches
|
Clous de Girofle
|
Eucalyptus
|
Myrte
|
Sarriette
|
|
S. aureus
|
20,4
|
20,4
|
333,3
|
10,1
|
|
E. coli
|
62,5
|
1000
|
non déterminée
|
10,1
|
|
S. paratyphi
A
|
111,1
|
non déterminée
|
non déterminée
|
10,1
|
|
S. flexneri
|
non déterminée
|
1000
|
non déterminée
|
non déterminée
|
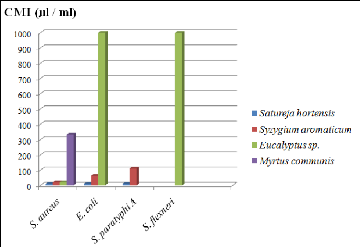
Fig. 42: Représentation graphique des valeurs de
CMI des quatre H.E. sur 4 souches
bactériennes
testées.
Dans l'ensemble, les quatre H.E. testées
présentent une activité antibactérienne "in vitro"
sur la plupart des souches tests. La plus faible CMI a été
obtenue avec l'H.E. de Sarriette sur S. aureus, S. paratyphi A et
E. coli (10,1 ul/mL), tandis que les plus hautes CMI ont été
obtenues avec les H.E. de l'eucalyptus sur E. coli (CMI : 1000 ul/mL)
et S. flexneri (1000 ul/mL) et du myrte sur S. aureus (333,3
ul/mL). Il est à noter que l'efficacité d'une H.E. est
inversement proportionnelle à la valeur de sa CMI vis-à vis d'une
souche donnée.
Les valeurs de la CMI sont inversement proportionnelles au
degré d'efficacité des H.E. Les résultats ont
révélé que parmi les quatre huiles étudiées,
l'H.E. de sarriette est celle qui possède le plus grand pouvoir
antibactérien, elle garde son activité même après
une dilution de 1/100 de l'huile pure, cela n'est pas étonnant du faite
qu'elle soit une huile pure et certifiée ; puis vient celle des Clous de
girofle.
5- Combinaison entre les H.E.
Généralement, il est bien admis que les
composés majeurs d'une H.E. donnée reflètent souvent son
activité biologique (IPEK et al., 2005), l'amplitude et les
différences de leur activité dépendent de leur
concentration dans le milieu en présence d'autres composés
minoritaires. Cependant, les actions synergiques entre les molécules
issues de différentes H.E. en comparaison avec l'action individuelle
d'un ou plusieurs composés restent mal élucidées.
Cependant, il serait possible que l'activité d'une
molécule majoritaire soit modulée par d'autres molécules
minoritaires (HOET et al., 2006).
Tableau XV: Résultats des interactions entre les
différentes H.E. testées par la méthode
des
aromatogrammes (zones d'inhibition en mm).
|
Mélange d'H.E.
|
Bactérie
|
Rapports
|
|
1/1
|
1/2
|
1/3
|
|
Eucalyptus/Clous
de Girofle
|
S. aureus
|
09,80
|
12,89
|
10,78
|
|
Clous de Girofle /
Eucalyptus
|
S. aureus
|
09,68
|
07,92
|
|
Clous de Girofle /
Sarriette
|
E. coli
|
18,64
|
24,46
|
21,77
|
|
Sarriette/ Clous
de Girofle
|
E. coli
|
18,23
|
19,05
|
|
Clous de Girofle /
Sarriette
|
S. flexneri
|
19,67
|
24,82
|
26,12
|
|
Sarriette/ Clous
de Girofle
|
S. flexneri
|
16,85
|
18,23
|
En comparant ces valeurs à celles obtenues avec les
H.E. testées séparément, on peut conclure que l'H.E.
d'Eucalyptus exerce un effet d'antagonisme sur celle des Clous de girofle
vis-à-vis de S. aureus c'est-à-dire que l'effet de la
somme des deux huiles est inférieur à l'effet des deux huiles
testées séparément.
De même pour l'H.E. des Clous de girofle avec celle de
Sarriette pour les deux souches bactériennes testées (E. coli
et S. flexneri).
6- Application des huiles essentielles dans la viande
Depuis le moyen âge, les H.E. ont été
utilisées comme des substances bactéricides, virucides,
fongicides, antiparasitaires, insecticides, en médecine et produits
cosmétiques. Actuellement leur usage est étendu vers l'industrie
pharmaceutique et surtout en agroalimentaire. Les nouvelles techniques
d'extraction des H.E. des espèces végétales ont permis
d'obtenir des substances aromatiques volatiles variées qui sont
généralement très riches en terpènes et
terpenoïdes, phénols et des composés aliphatiques divers
(BAKKALI et al., 2008). Les H.E. et leurs composants sont connus pour
posséder des activités antimicrobiennes (MAHBOUBI et HAGHI, 2008
; PAPARELLA et al., 2008) et pourraient donc servir de conservateurs
alimentaires, d'autant plus qu'ils sont pour la plupart classés
« généralement reconnus comme sains » ou
approuvés comme additifs alimentaires par les autorités
sanitaires internationales.
Plusieurs études ont été
réalisées dans le but de sélectionner les H.E. aux
propriétés antibactériennes importantes. Une large gamme
d'huiles et de bactéries ont été testées.
6.1- Optimisation de la quantité d'huile
appliquée dans la viande par des tests préalables de
dégustation
- Critère du goût: Le tableau
suivant regroupe les appréciations des individus qui ont
dégusté la viande hachée cuite avec des volumes d'H.E.
différents.
Tableau XVI: Résultats du test de
dégustation selon le critère du goût.
|
H.E.
|
Volumes
(ul /
1OOg)
|
APPRECIATIONS
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
Clou de
Girofle
|
50
|
1
|
2
|
2
|
|
|
|
|
|
|
|
40
|
1
|
1
|
2
|
1
|
|
|
|
|
|
|
30
|
|
1
|
|
2
|
2
|
|
|
|
|
|
10
|
|
|
|
|
1
|
|
2
|
2
|
|
|
Sarriette
|
50
|
|
|
1
|
2
|
|
2
|
|
|
|
|
40
|
|
|
1
|
2
|
1
|
1
|
|
|
|
|
30
|
|
|
|
|
|
|
2
|
2
|
1
|
|
10
|
|
|
|
|
|
1
|
2
|
1
|
1
|
|
Eucalyptus
|
50
|
|
1
|
1
|
2
|
1
|
|
|
|
|
|
40
|
|
|
1
|
2
|
2
|
|
|
|
|
|
30
|
|
|
|
|
|
1
|
2
|
1
|
1
|
|
10
|
|
|
|
|
|
2
|
1
|
1
|
1
|
1=extrêmement mauvais;
2=très mauvais; 3=mauvais;
4=moyennement mauvais; 5=ni bon, ni mauvais;
6=moyennement bon; 7=bon;
8=très bon ; 9=extrêmement
bon.
Le tableau XVII représente les résultats du test
d'appréciation de la qualité organoleptique (le goût) de la
viande hachée par le jury de dégustation en fonction d'une
série de volumes croissants des différentes H.E. (10 à 50
ul).
Les résultats du test de dégustation ont
indiqué que l'acceptation par le panel de dégustation est
inversement proportionnelle au volume de l'H.E. diluée utilisé
pour l'H.E. des Clous de girofle. Le plus faible volume en cette huile qui
n'altère pas le critère « goût » est celui
rajouté à l'échantillon le plus apprécié par
la majorité des membres du jury (10 ul). Par contre,
l'échantillon traité par un volume de 50 ul a
été jugé de très mauvais goût (niveau 02 et
03). Les échantillons appréciés le plus sont ceux
traités avec 30 ul pour les H.E. de Sarriette et d'Eucalyptus.
- Critère d'odeur : même
démarche que pour le critère du goût.
Tableau XVII: Résultats du test de
dégustation selon le critère d'odeur.
|
H.E.
|
Volumes
(ul /
100g)
|
APPRECIATIONS
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
Clous de Girofle
|
50
|
3
|
2
|
|
|
|
|
|
40
|
1
|
3
|
1
|
|
|
|
|
30
|
|
3
|
2
|
|
|
|
|
10
|
|
|
|
|
2
|
3
|
|
Sarriette
|
50
|
|
3
|
2
|
|
|
|
|
40
|
|
|
1
|
4
|
|
|
|
30
|
|
|
|
|
3
|
2
|
|
10
|
|
|
|
2
|
3
|
|
|
Eucalyptus
|
50
|
2
|
3
|
|
|
|
|
|
40
|
|
1
|
3
|
1
|
|
|
|
30
|
|
|
|
|
2
|
3
|
|
10
|
|
|
|
|
4
|
1
|
1=odeur très forte;
2=odeur forte; 3=odeur moyenne; 4=
odeur ni faible ni forte; 5=odeur faible;
6=odeur inaperçue.
Le tableau XVII montre les résultats du test
d'appréciation du critère d'odeur de la viande hachée
traités par les mêmes volumes que ceux rajoutés
précédemment.
Selon l'appréciation du panel de dégustation, le
plus faible volume en l'H.E. des Clous de girofle qui ne présente pas
une odeur forte à percevoir est de 10 ul, celui de sarriette et
d'eucalyptus est de 30 ul.
6.2- Effet des huiles essentielles appliquées dans
la viande sur la flore pathogène
6.2.1- S. aureus
Tableau XVIII: Résultats du dénombrement de
S. aureus dans chaque échantillon (Log10
ufc/g/temps).
|
JOURS
|
|
|
|
|
|
0
|
1
|
4
|
7
|
|
Echantillons
|
|
|
|
|
|
Contrôle
|
5
|
5,3
|
6,83
|
7,3
|
|
Clous de
Girofle
|
5
|
4,63
|
5,72
|
6,67
|
|
Eucalyptus
|
5
|
0
|
0
|
0
|
0 2 4 6 8 jours
Durée de conservation (jours)
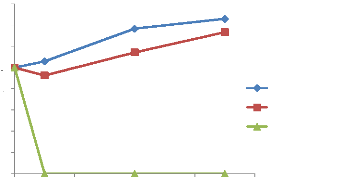
Contrôle
Clous de Girofle Eucalyptus
log ufc/g
8
7
6
5
4
3
2
1
0
Fig. 43: Effets dans la viande des H.E. des Clous de
girofle et d'Eucalyptus vis -à -vis de
S. aureus (à
2#177;1 °C).
La figure 43 montre l'activité antimicrobienne des H.E.
des Clous de girofle et d'Eucalyptus sur S. aureus appliqué
à la viande hachée maintenue à une T° d'entreposage
de réfrigération pendant une période qui ne dépasse
pas les 8 jours. Il s'avère que la présence de ces deux huiles
ont permis une réduction significative du nombre logarithmique de S.
aureus et, ceci pendant toute la durée de conservation. Le graphe
montre que l'huile d'Eucalyptus exerce une activité antimicrobienne plus
considérable que les Clous de girofle, on remarque que, dès les
premières heures d'entreposage, l'huile d'Eucalyptus a permis une
réduction en chute libre du nombre bactérien. Après 24 h
d'entreposage jusqu'au dernier jour, le nombre de S. aureus a atteint
une valeur nulle. Ce qui explique que l'huile d'Eucalyptus exerce une
très forte activité antibactérienne contre
S.aureus une fois qu'elle est en contact avec la bactérie cible
(effet bactéricide). Ce résultat confirme ceux obtenus "in
vitro".
Il est noté à travers ce graphe que le nombre
maximal de S. aureus pendant toute la durée de conservation a
été enregistré dans les échantillons de viande qui
ne contiennent pas d'H.E (contrôle). Ces échantillons
contrôles ont atteint une valeur de 7,3 Log UFC/g à la fin de la
période de conservation (au 7ème jour). La
présence d'H.E. des C.G. a inhibé la croissance de
S. aureus de 12,64, 16,25 et 8,63 % après 24 h, 04 jours et 07
jours de conservation respectivement. DEANS et RITCHIE (1987) ont
étudié l'effet antimicrobien de plusieurs H.E. sur plusieurs
genres de bactéries grâce à une méthode de contact
direct en milieu solide (puits). Sous leur forme non diluée, toutes les
H.E. inhibent au moins un genre bactérien. Parmi les H.E. qui ont
manifesté les propriétés inhibitrices les plus
importantes, on note celles des Clous de girofle, du thym, du laurier...Elles
inhibent plus de 20 genres de bactéries testées. Cette
étude, ainsi que beaucoup d'autres, comme celles de KOTZEKIDOU et
al., (2008) ; RAZZAGHI-ABYANEH et al., (2008) et DORMAN et DEANS
(2000), confirment les propriétés antibactériennes de
certaines H.E. Mais les H.E. de plantes sont souvent des mélanges
complexes de différents composés dont certains, sont dotés
de propriétés antimicrobiennes. La composition des H.E. d'une
même espèce varie selon la localisation géographique, les
conditions climatiques...par conséquent, leurs propriétés
antibactériennes varient également. Il serait donc d'une
importance primordiale de séparer et d'identifier les composants actifs
présents dans une huile à pouvoir antimicrobien. Certains auteurs
ont procédé par des techniques de laboratoire à
l'identification des molécules chimiques qui contiennent les H.E.
BAGAMBOULA et al. (2004) ; BAYDAR et al.
(2004) ont démontré que différents constituants des H.E.
possèdent des activités antibactériennes et que les
constituants volatils majeurs ont les propriétés antimicrobiennes
les plus importantes : carvacrol chez l'origan, eugénol chez les Clous
de girofle, linalool chez le coriandre, thymol chez le thym....
6.2.2- S. paratyphi A.
Tableau IXX : Résultats du dénombrement de
S. paratyphi A. dans chaque échantillon (Log
ufc/g/temps).
|
JOURS
|
|
|
|
|
|
0
|
1
|
4
|
7
|
|
Échantillons
|
|
|
|
|
|
Contrôle
|
5
|
5,91
|
6,83
|
7,3
|
|
Clous de
|
|
|
|
|
|
Girofle
|
5
|
5,13
|
6,51
|
6,83
|
|
Sarriette
|
5
|
5,65
|
6,83
|
7,3
|
2
1
0
0 2 4 6 8
Durée de conservation (jours)



8
log ufc/g
Contrôle
Clous de Girofle Eucalyptus
Fig. 44: Évolution de la croissance de S.
paratyphi A. en présence et en absence d'H.E.
(à 2#177;1
C).
La figure 44 illustre l'activité antimicrobienne des H.E.
des Clous de girofle et de Sarriette sur la croissance de S. paratyphi
A. dans la viande hachée pendant une période de
conservation de 7 jours. À travers ce graphe, on
remarque que l'huile des Clous de girofle exerce une activité
antimicrobienne plus considérable que celle de Sarriette. Cette
dernière a ralenti la croissance de S. paratyphi A. uniquement
durant les premières heures d'entreposage de la viande à une
T° de 2#177;1 °C. Une réduction du nombre logarithmique de
cette souche en présence des H.E. de Sarriette et des Clous de girofle
est réduite d'un facteur de 4,4 et 13,19 % respectivement, jusqu'au
4e jour où la Sarriette perd complètement son
activité antibactérienne, contrairement à celle des Clous
de girofle qui la maintient partiellement jusqu'au dernier jour.
Plusieures études (KIM et al., 1995a) ont
porté sur la sensibilité des salmonelles à
différents composés d'H.E. Le composé le plus efficace est
le carvacrol. KARAPINAR et ARTUG (1987) ont montré en milieu
gélosé que la croissance de Salmonella typhimurium
encemencée à un niveau de 106 ufc/mL est
complètement inhibée par 0,1 g/L d'eugénol.
6.2.3- E. coli
Tableau XX : Résultats du dénombrement d'
E. coli dans chaque échantillon (Logufc/g/temps).
|
JOURS Échantillons
|
0
|
1
|
4
|
7
|
|
Contrôle
|
5
|
6,01
|
6,83
|
8,7
|
|
Clous de
Girofle
|
5
|
4,81
|
6,01
|
7,3
|
|
Sarriette
|
5
|
1,9
|
3,04
|
5,2
|
Résultats et Discussion
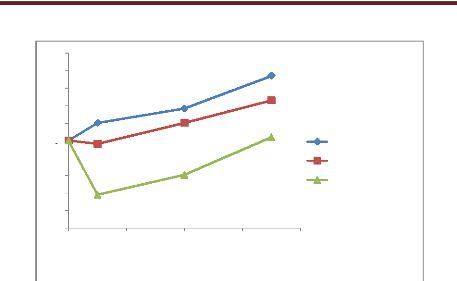
9
8
7
6
Contrôle
Clous de Girofle Sarriette
2
1
0
0 2 4 6 8
10
Log ufc/g
5
4
3
Durée de conservation (jours)
Fig. 45: Effets dans la viande des H.E. de Clou de
girofle et de Sarriette vis-à-vis de E.
coli (à
2#177;1 C).
Pour les échantillons inoculés avec E. coli,
une augmentation exponentielle de la croissance bactérienne est
observée dans ceux qui ne contiennent pas des H.E. pendant la
période d'entreposage. Comme le montre la figure 45, une diminution
très remarquable de la croissance bactérienne de
l'échantillon traité avec l'H.E. des C.G. atteignant une
réduction d'un facteur de à 1,2 cycle logarithmique au bout du
premier jour, et de 0,82 au bout de 4 jours. L'effet de l'H.E. de Sarriette est
très prononcé si on le compare à l'effet de l'huile des
C.G. vis-à-vis d'E. coli. La cinétique de croissance de
cette souche est ralentie de 4 cycles logarithmiques au jour 1 ce qui
correspond à une charge bactérienne de 104 ufc/g, et
une réduction de 3,79 cycles après 4 jours. Au-delà de
cette période, on observe une perte progressive du pouvoir
antibactérien.
KIM et al. (1995 b), se sont intéressés
à E. coli O 157 : H7. Leurs résultats montrent que la
croissance de cette souche est complètement inhibée par le
citral, le carvacrol, le géraniol et le perillaldehyde à 0,5
g/L.
6.2.4- S. flexneri
Tableau XXI : Résultats du dénombrement de
S. flexneri dans chaque échantillon (Log
ufc/g/temps).
|
JOURS
|
|
|
|
|
|
Échantillons
|
0
|
1
|
4
|
7
|
|
Contrôle
|
5
|
6,05
|
6,54
|
8,15
|
|
Sarriette
|
5
|
5,85
|
6,02
|
7,3
|
2
1
0
0 2 4 6 8
Durée de conservation (jours)



9
log ufc/g
Contrôle
Sarriette
Fig. 46: Effets dans la viande de l'H.E. de Sarriette
vis-à-vis de S. flexneri (à 2#177;1 C).
Le graphe illustré par la figure 46 montre l'effet
inhibiteur de la croissance de S. flexneri en présence de
l'H.E. de Sarriette. Cet effet est non significatif durant les premières
24 h de conservation, mais qui augmente au fur et à mesure qu'on avance
dans le temps comparativement aux échantillons témoins: avec une
diminution de 8 % entre le troisième et le cinquième jour. L'H.E.
de Sarriette présente," in vitro", une bonne activité inhibitrice
vis-à-vis de S. flexneri. Cependant, cette souche n'a pas
manifesté la même sensibilité une fois introduite dans la
viande fraîche hachée.
Parmi la totalité des H.E. testées sur la
viande, seule celle d'Eucalyptus a exercé un effet bactéricide
contre S. aureus. Tandis que l'effet bactériostatique est
montré par le reste des H.E. testées.
Il est bien connu que le pouvoir antimicrobien des H.E. dans
des matrices alimentaires est généralement réduit une fois
comparé au travail "in vitro", du fait que la présence
de graisses, des hydrates de carbone, de protéines, de sels et de pH
(facteurs intrinsèques) influence fortement l'efficacité de ces
agents (BURT, 2004).
CUTTER (2000) a supposé que l'activité
antimicrobienne liée aux extraits de fines herbes peut être
diminuée par la présence de composants adipeux dans la viande
hachée. PALMER et ses collaborateurs (2001), ont supposé que la
teneur en protéines constitue un facteur empêchant l'action de
l'H.E. des Clous de girofle sur salmonella enteritidis dans un fromage
à faible teneur en matière grasse.
DORMAN et DOYENS (2000) ont observé l'activité
l'antibactérienne de certaines H.E. de plantes telles que l'origan
(Origanum copactum), contre 25 genres bactériens "in
vitro". Ils ont conclu que l'ajout de ces extraits aux produits
alimentaires, ne causerait aucune modification des propriétés
organoleptiques, et retarderait la contamination microbienne.
Contrairement à cette conclusion, les résultats
de notre étude ont montré que les effets antibactériens
sont différents de ceux qu'on a obtenus "in vitro", ceci
revient à dire que l'activité antimicrobienne des H.E. dans la
viande hachée est influencée par les facteurs intrinsèques
à l'exception de l'H.E. d'Eucalyptus qui a maintenu son pouvoir
antibactérien vis-à-vis de S. aureus.
D'après CAILLET et LACROIX (2007), certains facteurs
comme la T°, les conditions de stockage, le pH ou la composition de
l'aliment, peuvent avoir une influence sur l'action des H.E. Il est
établi que l'efficacité de l'huile augmente avec la diminution du
pH de l'aliment, de la température de stockage ou encore de la
quantité d'oxygène dans l'emballage. Il est également
prouvé qu'une même huile sera plus efficace dans un aliment pauvre
en gras et/ou en protéines et ce n'est pas le cas pour la viande. Les
fortes teneurs en eau et en sels d'un aliment vont aussi favoriser l'action de
l'H.E.
WENDAKOON et SAKAGUCHI (1993), ont démontré que
l'addition du chlorure de sodium (NaCl) aux H.E., augmentant leur
activité antimicrobienne. Le NaCl a montré un effet synergique
avec celle-ci. Le mécanisme suggéré pour son interaction
avec l'eugénol est l'augmentation de la perméabilité de la
membrane cellulaire, et par conséquent inhibition de la croissance
bactérienne en raison de son action sur les enzymes intracellulaires.
BUSATTA et ses collaborateurs (2007) ont examiné l'effet des H.E.
d'Origanum majorana sur la croissance de plusieurs espèces
bactériennes dont E. coli dans une saucisse fraîche.
L'H.E. et la saucisse ont été mélangées avec du
NaCl.
Des mélanges d'H.E. de cannelle et des Clous de girofle
ont été examinés contre S. aureus sous
atmosphère modifiée (AM): O2 (< 0,05 à 10 %) et CO2 (20
ou 40 %) par MATAN et ses collaborateurs (2005). Cette combinaison de
systèmes (H.E. et AM) a augmenté considérablement
l'efficacité antibactérienne.

CONCLUSION
Conclusion et perspectives
La contamination des viandes constitue un énorme
problème pour la santé publique, mais cette situation peut
être mieux contrôlée par l'utilisation de conservateurs
naturels.
Les quatre espèces végétales ayant fait
l'objet de notre étude, à savoir les Clous de Girofle,
l'Eucalyptus, le Myrte et la Sarriette sont fréquemment utilisées
dans la pharmacopée traditionnelle. Cette recherche a permis de mettre
en évidence l'effet antibactérien des H.E. de ces plantes "in
vitro" et dans une matrice alimentaire "la viande".
Le rendement en huile essentielle des plantes
étudiées (Clous de girofle, Eucalyptus et Myrte) est acceptable
et peut être rentable à l'échelle industrielle.
Suivant nos résultats, nous pouvons prédire que
les H.E. étudiées sont des agents antimicrobiens naturels
efficaces et peuvent être une source très importante de
conservateurs utilisés pour limiter les empoisonnements d'origine
bactérienne, notamment l'huile d'Eucalyptus contre S. aureus.
Cependant, il faut signaler que les activités biologiques d'une huile
essentielle ne sont pas seulement dues aux composés majoritaires mais
à l'ensemble des composées de base. Cette étude
mérite une analyse approfondie des mécanismes d'action des ces
composés purifiés, et une recherche plus avancée sur la
synergie de ces derniers. Il faut donc mener une étude
détaillée sur la composition qualitative et quantitative de ces
huiles par le couplage de la CPG/SM.
Des études ultérieures plus approfondies doivent
être effectuées afin de cerner l'activité antimicrobienne
des huiles essentielles dans les aliments. Vérifier leur
innocuité par des tests de toxicité et des tests
d'allergénicité semble d'une grande importance.
Les résultats obtenus "in vitro" ne
constituent qu'une première étape de recherche et qui ne sont pas
tout à fait parallèles à ceux obtenus une fois
appliquée dans la viande. Cependant, les techniques récentes
d'encapsulation en liposomes semblent surmonter de tels problèmes. Ce
procédé permet d'améliorer la stabilité de l'huile
essentielle et son disponibilité biologique. D'autres
procédés plus élaborés, comme l'addition de sel
(NaCl) à l'huile essentielle, ou le couplage avec la méthode de
conservation sous atmosphère modifiée permettent de
bénéficier d'une plus longue conservation.
Cette étude confirme l'intérêt des H.E.
offrant ainsi un patrimoine à préserver, à
développer et à valoriser, dans la mesure où nos
résultats constituent, avec ceux des études
réalisées auparavant, une base essentielle en faveur de leur
exploitation dans l'industrie agroalimentaire.

Références bibliographiques
Références
bibliographiques
· AFSSA (Association Française de
Sécurité Sanitaire des Aliments), (2006). Hy
giène domestique. CHU Bordeaux, (France).
· AFNOR (Agence Française de Normalisation),
(1989). Huile Essentielle 3 ème Edit., Pari s
(France).
· AFNOR (2000). Recueil de norm es : les
huiles es sentielles. Monographies relatives aux huiles essentielles (H
à Y). AFNOR, Paris, 661-663.
· AHMAD N. (2005). Antimicrobial activity
of clove oil and its potential in the treatment of vaginal candidiasis, J.
Drug. Target. 13, 555-61.
· AKROUT A. (2001). Étude des
huiles essentiell es de quelques plantes pastorales de la région de
Matmata (Tunisie).
· ALITONOU G.A., AVLESSI F., SOHOUNHLOUE K.C.
ALLISNET D., (2008). Aromathérapie - Les huiles essentielle s,
un po uvoir antim icrobien avéré. Fondation pour le Libre
Choix.
· AMAKURA Y., UMINO Y., TSUJI S., ITO H., HATANO
T., YOSHIDA T., TONOGAI Y. (2002). Constituents and t heir
antioxidative effects in eucalyptus leaf extract used as a natural food
additive. Food Chemistry. 77, 47-56.
· ANGIONI, A. BARRA, M. T. RUSSO, V. CORONEO, S.
DESSIP, P. CABRAS (2003). Chemical composition of the essential oils
of Juniperus from ripe and unripe berries and leaves and their
antimicrobial activity. J. Agric. Food Chem, 51, 3073-3078.
· ANONYME (2005), Institut Suisse des
Huiles Ess entielles. Plantes Aromatiques et Médici nales, Cahier des
charges SWISSEO, Edition 11.
· ANTON R. et LOBSTEIN A. (2005). Plantes
aromatiques. Épices, aromates, condiments et huiles essentielles. Tec
& Doc, Paris (France).
· AVERTIT P. (2004). Des huiles
essentielles tuent les sta phylocoques dorés résistant s à
la
methicilline.
· AVRIL J.L. (2000). Bactériologie
clinique. 3ème Edition.
· BAGAMBOULA C. F., UYTTENDAELE M. , DEBEVERE J.
(2004). Inhibitory effect of thyme and basil es sential oils, carv
acrol, th ymol, estragol, linalool and p-cymene toward s Shigelle
sonnei and S. flexneri. Food Microbiology. 21, 33-42.
· BAJPAI V.K., RAHMAN A., KANG S.C., (2008).
Chemical co mposition and i nhibitory parameters of essential oil and
extracts of Nandina domestica Thunb. to control food-borne pathogenic and
spoilage bacteria. International Journal of Food Microbiology.
125, 117-122.
· BAKKALI F., AVERBECK S., AVERBECK D., IDAOMAR M.
(2008). Biological effects of essential oils - A review. Food and
Chemical Toxicology. 46, 446-475.
· BARRAL J., BOIVIN J., COUDURIER S.,
DESMAZIERES C., GONZALEZ A., GUIDEZ F., LAPOTRE A., MEGY F. (2007).
Valorisation des effets antim icrobiens de l' huile essentielle de
lavandin Grosso. ONIPPAM, 1- 67.
· BAYDAR H., SAGDIC O., OZKAN G., KARADOGAN T.
(2004). Antibacterial activity and composition of essential oils fro m
Origanum, Thymbra and Satureja species with
commercial importance in Turkey. Food Control. 15,
169-172.
· BEL HADJ S.K., MAHJOUB M.A., AMMAR S., IMED
F., ZINE M., MAHJOUB A. (2006). Propriétés antioxydantes
de l'huile essentielle de Coridothymus capitatus (L.). Les Plantes
à Parfum, Aromatiques et Médicinales. Faculté de
Pharmacie- 5000 Monastir, Tunisie.
· BELGHAZI L., LAHLOU N., ALAOUI I.,
ABOUSAOUIRIA T., HABTI N., TANTAOUI IA., TALBI M., BLAGHEN M., FELLAT-ZARROUK.
(2002). Extraction et analyse par chromatographie en phase gazeuse de
l'huile essent ielle de la menthe pouliot . Test antifongique .
Congrèsde biochimie. Casablanca. Biochimie et santé,
38-40.
· BENINI C. (2007). Contribution
à l'étu de de la divers ification de la prod uction d 'huiles
essentielles aux Com ores. Thèse Bioingénieur. Faculte
Universitaire Des Sciences Agronom iques De Gembloux, Belgique.
· BENNIS S., CHAMI F. S. (2004). Surface
alteration of Saccharomyces cervisiae induced by thymol and eugenol.
Letters in Applied Microbiology. 38, 454-458.
· BERCHE P. (2003).
Bactériologie générale. PCE M 2. Faculté de
médecine Necker-E nfants malades (France). pp 89.
· BERKEL B. M., BOOGAARD B., HEIJNEN C. (2005).
La conservation du poisson et de la viande. Deuxième
édition, Fondation Agromisa, Wageningen, Pays-Bas.
· BESSIERE J.-M., CHANTAL M. (2007).
Étude chimique, activités anti-inflammatoires et
antiradicalaire d e l' huile essentielle extraite des feuilles de
Cymbopogon nardus (Linn.) R endle.
(Poaceae)
récoltées au Benin.
· BILLERBECK V.-G. (2007). Huiles es
sentielles et ba ctéries résist antes aux antibiotiques.
Phytothérapie. 5, 249-253.
· BOUAOUN D., HILAN C., GARABETH F., SFEIR R.
(2007). Etude de l'activité antimicrobienne de l'huile
essentielle d'une plante sauvage Prangos asperula Boiss.
Phytothérapie. 5, 129-134.
· BOUIHDID S., IDAOMAR M., ZHIRI A., BAUDOUX D.,
SKALI N.S., ABRINI J. (2006). Thymus essential oils: chem ical co
mposition and in vitro antioxidant and antibacterial activities.
Département De Biologie, Faculté des Sciences- Université
Abdelmalek Essaâdi. Tétouan (Maroc).
· BOUSBIA N. (2004). Extraction et
identification de quelques huiles e ssentielles (nigelle,
coriandre, origan,
thym, romarin), étu de de leur s activités antimicrobiennes .
Thèse de Magistère, option Sciences Alimentaires, Institut
National Agronomique, Alger (Algérie).
· BOUZOUITA N., FATEN K., BEN HALIMA M., MONCEF
M.C. (2006). Composition chimique, activités antioxydante
antimicrobienne et insecticide de l'huile es sentielle de Juniperus
phoenicea. Revue des Ré gions Arides - Nu méro
spécial - A ctes du sé minaire international « les
Plantes à Parfum, aromatiques et médicinales ».
· BRANGER C., (2007). Enseignement
dirigé de b actériologie. Université PARIS 7
Faculté de médecine Denis DIDEROT (France). pp 81.
· BRUNETON J. (1993). Phytochimie.
Plantes médicinales. Tec. & Doc., Lavoisier, Paris.
· BRUNETTON (1999). Pharmacognosie.
Phytochimie - plantes médicinales. 3ème Dd. Paris.
· BURT S. (2004). Essential oils: their
antibacterial properties and potential applications in foods_a review.
International. Journal. of Food Microbiology. 94,
223-253.
· BUSATTA C., VIDAL R.S., POPIOLSKI A.S., MOSSI
A.J., DARIVA C., RODRIGUES M.R.A., CORAZZA F.C., CORAZZA M.L., VLADIMIR O. J.,.
CANSIAN R.L (2008). Application of Origanum majorana L.
essential oil as an antimicr obial agent in sausage. Food
Microbiology. 25, 207-211.
· CAILLET S., LACROIX M. (2007). Les
huiles essentielles : leurs propriétés antimicrobiennes et leurs
applications potentielles en alime ntaire. Laboratoire de Recherche en Sciences
Appl iquées à l'Alimentation (RESALA) INRS-Institut
Armand-Frappier, Université de Laval (Québec).
· CARSON C.F., RILEY T. V. (1995).
Antimicrobial activity o f the m ajor components of the essential oil of
Malaleuca alternifolia. Journal of Applied Bacteriology.
78, 264-269.
· CHAMI F. (2005). Oregano and clove
essential oils indu ce surface alteration of Saccharom yces cerevisiae.
Phytother. Res. 19, 405-8.
· CHICHOUNE A. (2005). Huiles es
sentielles de Thym et d' Origan : Etude de la co mposition
chimique, de l' activité antioxydante et anti microbienne. Thèse
de Magist ère, Institut National Agronomique, Option Sciences
Alimentaire, El Harrach (Algerie).
· CHIRON (1996). Synthèse d'
hydroperoxydes de te rpènes. Relatio n avec l'
activité
antimicrobienne et applica tion à la synthèse
de poly terpènes hy droperoxydés. Mémoire
d'ingénieur CNAM Paris.
· COSENTINO S., TUBEROSO C. I. G. (1999).
In-vitro antimicrobial activity and chemical composition of Sardinian
Thymus essential oils. Lett Appl Microbiol. 29,
130-135.
· COX S.D., MANN C.M., MARKHAM J.L. (2000).
The m ode of antim icrobial action of the essential oil of
Melaleuca alternifolia (tea tree oil). J Appl Microbiol.
88, 170-175.
· CURADO M.A., OLIEIRA C.B.A, JESUS J.G., SANTOS
S.C., SERAPHIN J.C., FERRI P.H. (2006). Environm ental fators
influence on che mical polym orphism of the essentia l oils of Lychnophora
ericoides. Phytochemistry. 67, 2363-2369.
· CUTTER C. N. (2000). Antimicrobial
effect of herb extracts against Escherichia coli O157:H7, Listeria
monocytogenes, and Salmonella typhimurium associated with beef.
Journal of Food Protection. 63, 601-607.
· DABBAH R., EDWARDS V. M., MOATS W. A. (1970).
Antimicrobial action of som e citrus fruit oils on selected food-borne
bacteria. Applied Microbiology. 19, 27-31.
· DAWIDOWICZ A. L., WIANOWSKA D., BARANIAK B.
(2006).The antioxidant properties of alcoholic extracts fro m Sambucus
nigra L. (anti oxidant properties of extracts).
Lebensmittel-
Wissenschaft und Technologic.
39, 308-315.
· DEANS S. G. et RITCHIE G. A.
(1987). Antimicrobial pr operties of plant essenti al oils.
International Journal of Food Microbiology. 5,
165-180.
· DELARRAS C. (2007), Microbiologie
Pratique pour le laboratoire d' analyses ou de contrôle sanitaire.
Edition Tec & Doc, Lavoisier, Paris.
· DE MASI L., SIVIERO P., ESPOSITO C., CASTALDO
D., SIANO F., LARATTA B. (2005). Assessment of agronomic, chemical and
genetic variability in common basil (Ocimum basilicum L.).
European food research technology. 223, 273-281.
· DEMIRCI F., GUVEN K., DEMIRCI B., DADANDI
M.Y., BASER K.H.C. (2008). Antibacterial activity of two Phlom is
essential oils against food p athogens. Food Control.
19, 1159- 1164.
· DIDRY, N., DUBREUIL L. (1993).
Activité antibactérienne du th ymol, du carvacrol et de
l'aldehyde cinnamique seuls ou associés. Pharmacize.
48, 301-304.
· DJENANE D., SANCHEZ E., BELTRAN J.A., RONCALES
P. (2001). Extraction of the retail display life of fresh beef pack
aged in modified atmosphere by varying lighting conditions. Journal of Food
Sciences. 66, 181-185.
· DJENANE D., MEDDAHI A., RONCALES P. (2006).
Les sy stèmes antioxydants et antimicrobiens pour la
conservation de la viande. Sciences des aliments. 26,
37-73.
· DORMAN H. J. D. et DEANS S. G. (2000).
Antimicrobial agents fro m plants: Antibacterial activity of plant
volatile oils. Journal of Applied Microbiology. 88,
308-316.
· ENRICO V., PAPINI A., BALDO F., ZHAN J. M.
(2004). Étude expérimentale du renfort de
l'immunité par le sirop du père Michel (POE 20). Institut de
Sciences Naturopathiques (ISN) .
C.R.A.O.
· ERKAN N., AYRANCI G., AYRANCI E. (2008).
Anti oxidant acti vities of ro semary (Rosmarinus Officinalis
L.) extract, blackseed ( Nigella sativa L.) es sential oil, carn
osic a cid, rosmarinic acid and sesamol. Food Chemistry.
110, 76-82.
? EUZEBY J.P. (2008). Dictionnaire de
bactériologie vétérinaire.
http://www.bacdico.net.
· FARAG R.S., BADEI A.Z.M.A., ELBAROTY G.S.A.
(1989). Antioxidant Activity of Some Spice Essential Oils on Linoleic
Acid Oxydation in Aqueous Media. J. Am. OU. Chem. Soc. 66, 792.
· FAUCHERE J.-L., AVRIL J.-L. (2002).
Bactériologie générale et médicale. Ellipses
éditent, Paris, pp 365.
· FREEMAN L., CAREL Y. (2006).
Aromathérapie. NUTRA NEWS Science, Nutrition, Prévention
et Santé. http:/
www. nutranews.org
· GARNERO J. (1978). L'évolution
des méthodes et techniques d'analy se dans l' étude de la
composition chimique des huiles essentielles. Labo-pharma Problèmes et
Techniques n° 277.
· GHEDIRA K. (2006). La nigelle
cultivée : Nigeila sativa L. (Ranunculaceae).
Phytothérapie. 5, 220-226.
· GIORDANI R., KALOUSTIAN J. (2006).
Action anticandidosique des huiles es sentielles : leur utilisation
concomitante avec des médicaments antifongiques. Phytotherapie.
3,121-124.
· GORDON R. E., HAYNES W. C., PANG C.H.N.
(1973). The genus Bacillus. Agri culture Handbook. N° 427, ARS-USDA,
Washington (USA).
· GUÉRIN P.J., BRASHER C., BARON E., MIC
D., GRIMONT F., RYAN M. AAVITSLAND P., LEGROS D. (2004). Case
management of a multidrug-resistant Shigella dysenteriae serotype 1
outbreak in a crisis context in Sierra Leone, 1999-2000. Transactions of
the Royal Society of Tropical Medicine and Hygiene.
98,635-643.
· GUESMI A. et BOUDABOUS A. (2006).
Activité antim icrobienne de cinq huiles essentielles associées
dans les produi ts de thalassothérapie- les Plantes à Parfum, aro
matiques et médicinales. Faculté des Sciences de Tunis,
Université Tunis - El Manar, 2092, Tunis.
· HALUK J. P. (2005). Les arbres à
parfums. Bulletin de l'Académie Lorraine des Sciences, Nancy (France)
4-32.
· HAMMER K.A., CARSON C. F., RILEY T.V. (1999).
Antimicrobial activity of essential oils and other plant extracts.
J. Appl. Microbiology. 86, 985-990.
· HAY R., K.M., WATERMAN PETER G. (1993).
Volatile Oil Crops, Their Biology Biochemistry and Production. Longman
Scientific & Technical, U.K.
· HELANDER I. M., ALAKOMI H. L., LATVA-KALA K.,
MATTILA-SANDHOLM, T., POL I., SMID E. J. (1998). Characterization of
the action of sel ected essential oil components on gram-negative bacteria.
Journal of Agricultural and Food Chemistry. 46,
3590-3595.
· HELME J.-P., CHAZAN J.-B., PERRIN J.-L. (2004).
Les antioxydants.
· HERMAL C. (1993). Activité
bactériostatique de sept ém ulsions d'huiles essentielles et de
deux associations d'émulsions d'huiles essentielles, Faculté de
Pharmacie, Université de Montpellier.
· HERNANDEZ R. et OCHOA L. (2005).
Substitution de solvants et matières actives de synthèse
par un combine « solvant/actif » d'origine vé gétale.
Thèse de doctorat- l'institut national
polytechnique de Toulouse
(France), 32-225.
· HOET S., STEVIGNY C., HERENT M.F.,
QUETIN-LECLERCQ J. (2006). Antitrypanosomal compounds from leaf
essential oil of Strychnos spinosa. Planta Med. 72,
480-482.
· HUBERT R. et MULTON J. L. (1992). Les
arômes alimentaires. Tec & Doc. Lavoisier- Paris.
· HURTEL J. (2006). Huiles ess entielles
et médecine. Phytothérapie, pl antes
médicinales, aromathérapie, huiles essentielles.
Phytomania.
· HURTEL J.M. (2001).
Phytothérapie, plantes m édicinales,
aromathérapie, huiles essentielles.
http://www.phytomania.com/index.html.
· INOUYE S. et ABE S. (2007). Nouvelle
approche de l'aromathérapie anti-infectieuse.
Phytothérapie. 1, 2-4.
· IPEK E., ZEYTINOGLU H., OKAY S., TUYLU B.A.,
KURKCUOGLU M., HUSNU C.B.K. (2005). Genotoxi city and anti
genotoxicity of Origanum oil and carv acrol evaluated b y Ames
Salmonella/microsomal test. Food Chem. 93,
551-556.
· JOLY B. et REYNAUD A. (2002).
Entérobactéries : Systématique et Méthode
de diagnostic. Tec & Doc, Lavoisier.
· JOUHANNEAU D.G. (2000). La
médecine des plantes aro matiques : phy to-aromathérapie et les
huiles essentielles de l'océan indien. Azalées Edition, St
Denis.
· JOUVE J. L. (1990). Microbiologie
alimentaire et filière des viandes. Viandes et Produits
Carnés, 11; 6 ; bis 6 ter, 207-213.
· KABERA J, KOUMAGLO K. H., NTEZURUBANZA L.,
INGABIRE MG., KAMAGAJU L. (2002). Caractérisation des huiles
essentielles d' Hyptis spicigera Lam., Pluchea ovalis
(Pers.)
DC. et Laggera aurita
(L.F.) Benth. Ex. C.B. Clarke, plantes aromatiques tropicales. Centre de
Recherche en Pytomédicaments et Sciences de la Vie (Butare -Rwanda).
· KARAPINAR M. et ARTUG S.E. (1987).
Inhibition of f ood borne pa thogens by t hymol, eugenol, menthol.
International Journal of Food Microbiology. 4,
161-166.
· KELEN M. et TEPE B. (2008). Chemical
composition, antioxidant and antimicrobial properties of the essential oils of
three Salvia spe cies from Turkish flora. Bioresource Technology.
99, 4096- 4104.
· KIM J.M., MARSHALL M.R., CORNELL J.A., WEI C.I.
(1995a). Antibacterial activity of carvacrol, cit ral and geran iol
against Salmonella Typhimurium in culture medium and on fish cubs.
Journal of Food Science. 60, 1364-1374.
· KIM J.M., MARSHALL M.R., CORNELL J.A., WEI
C.I. (1995b). Antibacterial activity of some essential oil components
against five food borne pathogens. Journal Of Agricultural and Food
Chemistry.43, 2839-2845.
· KOOHMARAIE M., ARTHUR T.M., BOSILEVAC J.M.,
GUERINI M., SHACKELFORD S.D., WHEELER T.L. (2005). Post-harvest
interventions to reduce/eliminate pathogens in beef. Meat Science.
71, 79-91.
· KOTZEKIDOU P., GIANNAKIDIS P., BOULAMATSIS A.
(2008). Antimicrobial act ivity of some plant extracts and essential
oil s against f oodborne pathogens in vitr o and on t he fate o f inoculated
pathogens in chocolate. LWT. 41, 119-127.
· LABIE C. (1993). Problemas en los
cambios intracommunitarios de la carne. Eurocarne,
21, 19- 28.
· LAMBERT R. J. W., SKANDAMIS P. N., COOTE P.,
NYCHAS G.-J. E. (2001). A study of the m inimum inhibitory
concentration and m ode of action of oregano essential oil, thy mol and
carvacrol. Journal of Applied Microbiology. 91,
453-462.
· LAHLOU M. (2004). Methods to study
phytoc hemistry and bioactivit y of essential oils. Phytotherapy Research.
18, 435-448.
· LAMBERT R. J. W., SKANDAMIS P. N.
(2001). A stud y of the minimum in hibitory concentration and mode of
action of or egano essential oil, thy mol and carvacrol. Journal of Applied
Microbiology. 91- 3, 453-462.
· LAMARTI A., BADOC A., DEFFIEUX G., CARDE J.-P.
(1994). Biogénèse des monoterpènes. Bull.
Soc. Pharm, 13 3, 79 - 9 9. Département de Biologie ,
Faculté des Sciences Mhanach II, Tetouan (Maroc).
· LAREDJ H. (2004). Les plantes
médicinales: Extracti on des huiles essent ielles et acti vités
antibactériennes. Premières journées de pharm acie.
Université, Badji Mokhtar -Faculté de Médecine, Annaba
(Algérie). 17-29.
· LARPENT J.P. (1997). Microbiologie
Alimentaire, Techniques de laboratoire. Tec & Doc, Lavoisier, pp 1074.
· LAVIGNE J.P. (2007). Effet des antib
iotiques, mécanismes de r ésistance. 1er cycle - PCEM
2 - MB7 - Bactériologie- Faculté de Médecine
Montpellier-Nîmes, France.
· LAWRENCE B.M. (1992). Perfumer
Flavorist. 13, 46-52.
· LEUSCHNER, R. G. K., LELSCH V. (2003).
Antimicrobial effects of garlic, clove and red hot chilli on
Listeria monocytogenes in broth model systems and soft cheese.
International Journal of food Sciences and Nutrition.
54, 127-133.
· LEYRAL et VIERLING (2001). Microbiologie
et toxicologie des ali ments, h ygiène et séc urité
alimentaires, 3° édition.
· LIQUET J., WEYNANS B. (2002). Les
différentes visions des arômes alimentaires.52-103.
· LINDBERG M. (1996). Lebensm. Unters.
Forsh. 203, 333-338.
· TURGEON M. (2001). Profil des produits
forestiers. Première transformation : huiles essentielles.
Ministère des Ressources naturelles, Québec (Canada). 5-21.
· MAHBOUBI M. et HAGHI G. (2008). Antim
icrobial activity and chem ical co mposition of Mentha pulegium L. essential
oil. Journal of Ethnopharmacology. 119, 325-327.
· MAHMOUD B. S. M., YAMAZAKI K., MIYASHITA K.,
IL-SHIK S., DONG-SUK C., SUZUKI T. (2004). Bacterial microflora of
carp ( Cyprius carpio) and its shelf-life extension by essential oil
compounds. Food Microbiology. 21, 657-666.
· MAINEBAU P. (1994). La nouvelle
Aromathérapie, 2ème édition Jakin, Paris.
· MAMADOU D.A. (2005). Étude des
plantes médicinales de Niafunke (région T ombouctou), phytochimie
et pharmacologie de maerua crassifolia forsk. (Capparidacée).
Thèse doctorale - Faculté de Médecine, de Pharmacie et
d'Odonto-Stomatologie (Mali). 50-140.
· MARTIN R., SALGUEIRO L.R., GONCALVES M.J.,
VILA R., TOMI F., ADZET T., CASANOVA J. (2000). Activity and chem ical
composition of the bark oil of Croton stellulifer. Planta
Medica. 66, 647-650.
· MATAN N., RIMKEEREE H., MAWSON A.J.,
CHOMPREEDA P., HARUTHAITHANASAN V., PARKER M. (2006). Antimicrobial
activity of cinnamon and clove oils under modified atm osphere conditions.
International Journal of Food Microbiology. 107, 180
- 185.
· MAU J-L., HUANG S-J, CHEN C.-C. (2004).
Antioxidant properties of methanolic extracts fron two kinds of Antrodia
camphorate mycelia. Food Chemistry. 86, 25-31.
· MENPHINI A. (1993). Riv. Ital. EPPOS 4.
566-571.
· MERENS A. (2008). Facteurs de virulence
de Pseudomonas aeruginosa. Saint-Mandé, Lyon. pp
· MEZAOUR N. (2006). Contribution
à l'étude de l'effet antibactérien des polyphénols
et des huiles essentielles d'Allium sativum sur quatre genres bact
éries. Thèse de Magister. Faculté des s ciences de
l'ingénieur, Université Abdelhamid Ibn Badis de Moustaghanem,
(Algérie).
· MICROSOFT ENCARTA (2008).
· MOCKUTE D., BERNITIENE G., JUDZENTIENE A.
(2006). Germacrene D c hemotype of essential oils of Leonurus
cardiaca L. growing wild in Vilnius district (Lithuania). Journal of
essential oil research. 18, 566-568.
· MOLEYAR V., NARASIMHAM P. (1992).
Antibacterial activity of essential oil com ponents. International
Journal of Food Microbiology. 16, 337- 342.
· MOMPON B. (2006). Procédés
d'extr action et de purification des produits d 'origine natu relle,
Québec (Canada).
· MURATA M., YAMAKOSHI Y., HOMMA S., AIDA K.,
HORI K., OHASHI Y. (1990). Macrocarpal A, a novel antibacterial
compound from Eucalyptus globulus. Agricultural and Biological Chemistry.
54, 3221-3226.
· MURATA M., YAMAKOSHI Y., HOMMA S., ARAI K.,
NAKAMURA Y. (1992). Macrocarpals, antibacterial co mpounds from
Eucalyptus, i nhibit aldose reductase. Bioscience,
Biotechnology and
Biochemistry. 56, 2062-2063.
· NAIT SAID N. (2007). Étude phy
tochimique des extraits chloroformiques des plantes: « pituranthos
chloranthus » et « marrubium vulgare ».
Thèse de Magister, Faculté des Sciences, Département de
Chimie, Université El-Hadj Lakhdar - Batna, (Algérie).
· NAMIKI M. (1990). Anti oxydants / a
ntimutagens in food Critic al reviews in Food. Science et nutrition.
29, 273-300.
· NÉPOMUSCÈNE M. J. (1995).
Caractérisation des huiles essentielles du ble uet nain,
vaccinium angustifolium aiton. Thèse Magistrale,
Université du Québec à Chicoutimi (Canada).
· ODOUL M. (2003). La lettre de l'
Institut français de Shiatsu : Les Huiles E ssentielles. Numéro
hors série de l'Institut français de Shiatsu N° 02. 6-12.
· OKE F., ASLIM B., OZTURK S., SENOL A.S.
(2008). Essential oil composition, antimicrobial and antioxidant
activities of Satureja cuneifolia Ten. Food Chemistry.
112, 874-879.
· OSAWA K., SAEKI T., YASUDA H., MORITA H.,
TAKEYA K., ITOKAWA H. (1998). Antibacterial activity of Eucalyptus g
lobulus o n cariogenic bacteria and its inhibitor y effect on
glucosyltransferase. Natural Medicines (Tokyo). 52,
32-37.
· OURAÏNI D., AGOUMI A., ISMAÏLI A.M.,
ALAOUI K., CHERRAH Y., ALAOUI M.A., BELABBAS M.A. (2007).
Activité antifongi que de l' acide ol éique et des huiles
essentielles de Thymus saturejoides L. et de Mentha pulegium
L., com parée aux antifongiques dans les derm atoses mycosiques.
Phytothérapie. 1, 6-14.
· OUSSALAH M., CAILLET S., SAUCIER L., LACROIX
M. (2007), Inhibitory effects of selected plant essential oils on the
gr owth of four pathogenic bacteria: E. coli O157:H7, Salmonella
Typhimurium, Staphylococcus aureus and Listeria
monocytogenes. Food Control. 18, 414-420.
· PALLERONI N.J. (1984). Genus I.
Pseudomonas Migula.
http://www.bacdico.net.
· PALMER S., STEWART A., FYFE J.L.
(1998). Antimicrobial properties of plant essentia l oils and essences
against five i mportant food-borne pathogens. Letters in Food
Microbiology. 26, 118- 122.
· PALMER S., STEWART A., FYFE, L. (2001).
The potential application of plant essential oils as natural food preservatives
in soft cheese. Food Microbiology. 18, 463- 470.
· PAPARELLA A., TACCOGNA L., AGUZZI I.,
CHAVES-LÓPEZ C., SERIO A., MARSILIO F., SUZZI G. (2008). Flow
cy tometric ass essment of the anti microbial ac tivity of essential oils
against Listeria monocytogenes. Food Control. 19,
1174-1182.
· PARIS M. et MURABIELLE H. (1981).
Abrégé de Matière médicale.
Pharmacognosie. Tome I Masson, Paris, 182-194.
· PEDNEAULT K., LEONHART S., ANGERS P., RAMPUTH
A., ARNASON J.T., DORAIS M. (2001). Influence de la culture h
ydroponique de quelques plantes médicinales sur la croissance et la
concentration en composés secondaires des organes
végétaux. Texte de conférence - 5 ème
Colloque sur les produits naturels d'origine végétale.
Université Laval, Québec (Canada).
· PEIFFER B. (2000). Intoxications
causées par bacillus cereus. file
http://www.bacillus cereus.htm
· PEYRON L. et HUBERT R. (1992).
L'extraction des épices et herbes aromatiques et le
s
différents types d'extraits. Epices et aromates. Tec et Doc -
Lavoisier, APRIA., Paris.
· PIBIRI M.C. (2005). Assainissement
microbiologique de l' air et des sy stèmes de ventilation au moyen d'
huiles essentielles. Thèse de doctorale. Ecole poly technique
fédé rale, EPFL. Lausanne
(Suisse).
· PONCE A.G., FRITZ R., DEL VALLE C., ROURA S.I.
(2003). Antimicrobial activit y of essential oils on the native
microflora of organic Swiss chard. 36, 679-684.
· RASOOLI I., BAGHER R.M., ALLAMEH A.,
(2006). Growth inhibition and morphological alterations of Aspergillus
Niger by essential oils from Thymus Eriocalyx and Thymus x-porlock. Food
Control. 17, 359-364.
· RAYOUR (2003). Mechanis m of ba
ctericidal action of oregano and clove essential oils and of their phenolic
major components in Escherichia coli and Bacillus subtilis, The Journal of
Essential oil Research. 86, 985-990.
· RAZZAGHI A. M., SHAMS G.A.M., YOSHINARI T.,
REZAEE M.B., JAIMAND K., NAGASAWA H., SAKUDA S. (2008). Inhibitory
effects of Satureja hortensis L. essential oil on growth and aflatoxin
production b y Aspergillus parasiticus. International Journal of
Food Microbiology. 123, 228-233.
· ROTA R.M., HERRERA A., MARTÍNEZ R.M.,
SOTOMAYOR J. A., JORDÁN M.J. (2008). Antimicrobial act ivity
and che mical co mposition of Thymus vulgaris, Thymus zygis
and Thymus hyemalis essential oils. Food Control.
19, 681-687
· SAGDIÇ O., KUSÇU A., ÖZCAN M.,
ÖZÇELIK S. (2002). Effects of Turkish spice extrac ts at
various concentrations on the growth of Escherichia coli. Food
Microbiology. 19, 473-80.
· SERRANO M., MARTINEZ-R.D., GUILLEN F.,
VALVERDE J. M., ZAPATA P. J., CASTILLO S., VALERO D. (2008), The
addition of essential oils to MAP as a tool to maintain the overall quality of
fruits. Trends in Food Science & Technology. 1-8.
· SCHWAMMLE B., WINKELHAUSEN E., KUZMANOVA S.,
STEINER W. (2001). Isolation of carvacrol assimilating microorganisms.
Biotechnol. 39, 341-345.
· SKOÈIBUIÆ M., BEZIÆ N.,
DUNKIÆ V. (2006). P hytochemical co mposition an d antimicrobial
activities of the essential oils from Satureja subspicata Vis. Growing
in Croatia. Food Chemistry. 96, 20-28.
· SLUSARENKO J., KEVAN A., CROFT P. C., JIITTNER
F. (1993). Volatile Products of Lipoxygenase Pathway Evolved from
Phaseolus vulgaris (L.) Leaves Inocula ted with Pseudomonas
syringae pv phaseolicola. Plant Physiol. 101,
13-24.
· TEPE B., SOKMEN M., SOKMEN A., DAFERERA D.,
POLISSIOU M. (2005). Antimicrobial and antioxidative activity of the
essential oil and various extracts of Cyclotrichium
origanifolium
(Labill.) Manden. and Scheng. J. food engineering.
69, 335-342.
· TEUSCHER E., ANTON R., LOBSTEIN A. (2005).
Plantes aro matiques : épices, aro mates, condiments et huiles
essentielles, Ed. Française Tec & Doc., Lavoisier.
· THOROSKI J., BLANK G., BILIADERIS C.
(1989). Eugenol ind uced inhi bition o f extracellular enzyme
production by Bacillus cereus. Journal of Food Protection.
52, 399- 403.
· TREINER J. (2000). Extrait du Bulletin
officiel n° 6 du 12 août 1999, France. 39-143.
· ULTEE R., SLUMP A., STEGING G., SMID E.J. (2000).
Antimicrobial activity of ca rvacrol toward Bacillus cereus
on rice. Journal of Food Protection. 620-624.
· VALERO M. et GINER M.J. (2006), Effects
of antim icrobial components of essential oils on growth of B acillus cereu s
INRA L2104 i n an d the sensory qualities of carrot broth. International
Journal of Food Microbiology. 106, 90 - 94.
· VERRECK J. (2007).
Journées portes ouvertes à l'ISIa de Gembloux
(Belgique).
· VIAUD H. (1993), Thérapeutiques
naturelles- Cara ctérisation des huiles esse ntielles d' Hyptis
spicigera Lam, Pluchea ovalis - GNOMA .
· WALSH, S. E., J.-Y. MAILLARD et al.,
(2003). Activity and mechanisms of action of selected biocidal
agents on Gram -positive and negative bacteria. Journal of Applied
Microbiology. 94-2, 240- 247.
· WENDAKOON C. N., SAKAGUCHI M. (1993).
Combined effect of sodium chloride and clove on gr owth and b iogenic amine
form ation of Enterobacter aerogenes in m ackerel muscle extract.
Journal of Food Protection. 56, 410-413.
· ZWEIFEL C., BALTZER D., STEPHAN R. (2005).
Microbiological contamination of cattle and pig carcasses at five
abatt oirs determined by swab sampling in accordance with EU Deci sion.
Meat Science. 69, 559-566.
· IX ème congrès International des
Huiles Essentielles de Singapour, Parf. Cosmet., Arômes, 1983,
53,63-73
- Les graphiques sont réalisés au m oyen du
logiciel commercialisé Microsoft® Office Exce l®
2007 (12. 0. 4518 . 1014) MSO (12.0. 4518 . 1014). Partie de Microsoft Office
Professional Plus 2007.
- Le logiciel de traitement d'image qu'on a utilisé est
Photo Filtre 6.3.1 pour Windows. - Le logiciel de statistique
Stat box version 6.0.

ANNEXES
ANNEXE 01: Composition des principaux milieux de
culture utilisés > Milieux liquides
· Eau physiologique stérile
L'eau utilisée pour la préparation de l'eau
physiologique est de l'eau distillée. La concentration de Na Cl est de 9
g/L, et la solution est stérilisée à l'autoclave 15
minutes à 121 °C.
· Milieu BHIB (BRAIN HEART INFUSION) CM
225 La formule théorique de ce milieu de culture en g/L d'eau
purifiée est :
|
|
Culf brain infusion solids
|
12,5 ;
|
Beef heart infusion solids
|
5,0 ;
|
Proteose peptone
|
10,0 ;
|
Glucose
|
2,0 ;
|
Sodium chloride
|
5,0 ;
|
Di-sodium phosphate
|
..2,5.
|
|
> Milieux solides
· Gélose Mueller Hinton La formule
théorique de ce milieu de culture en g/L d'eau purifiée est :
|
Beef, infusion Form
|
300,00 ;
|
Casein acid hydrolysate
|
.17,50 ;
|
Starch
|
.1,50;
|
Agar
|
17
|
|
pH 7,3
· Gélose nutritive
La formule théorique de ce milieu de culture en g/L d'eau
purifiée est :
Peptic digest of animal tissue
|
5,0 ;
|
Beef extract
|
1,50;
|
Yeast extract
|
.1,50;
|
|
Sodium chloride 5,0 ;
Agar 15,00.
pH 7,4
· Gélose Chapman
La formule théorique de ce milieu de culture en g/L d'eau
purifiée est :
Extrait de viande (bovin ou porcin) 01 ;
Peptone de caséine et de viande (bovin et porcin) .10
;
Chlorure de sodium .75;
D-Mannitol ...10;
Agar 15;
Rouge de phénol 0,025.
pH 7,4
· Gélose de Baird-Parker La formule
théorique du milieu complet en g/L d'eau purifiée est :
Peptone de caséine (bovin) 10 ;
Extrait de viande (bovin) 05 ;
Extrait de levure 01 ;
Glycine 12 ;
Chlorure de lithium .05 ;
Pyruvate de sodium 10 ;
Tellurite de potassium 00,01.
Suspension de jaune d'oeuf 10 mL
Agar 17,00.
pH 7,2
|
· Bouillon lactosé au bromocrésol
pourpre : BCP
La formule théorique du milieu complet en g/L d'eau
purifiée est :
|
|
Peptone
|
.5
|
|
Extrait de viande
|
3
|
|
Lactose
|
10
|
|
Agar
|
15
|
|
Pourpre de bromocrésol
|
.0,025
|
pH 7,2
ANNEXE 02
Tableau XXII : Résultats des
antibiogrammes.
|
Souche
ATB
|
S. aureus
|
E. coli
|
S. flexneri
|
S. paratyphi A
|
|
Pénicilline
|
00,00
|
non déterminée
|
non déterminée
|
non déterminée
|
|
Kanamycine
|
non déterminée
|
17,25
|
17,30
|
16,50
|
|
Ticarcilline
|
non déterminée
|
09,47
|
11,07
|
10,30
|
ANNEXE 03

| 


