Des méta-analyses ont permis depuis les années
1970 de définir des souches biologiquement et géographiquement
distinctes de l'espèce originale Trichinella spiralis : T1
découverte par Railliet en 1896.
Les critères qui ont suscité le reclassement des
espèces de Trichinella se basaient sur des caractères
biologiques: différences dans le pouvoir infectieux vis-à-vis des
hôtes éventuels, spécificité de leur
répartition géographique ainsi que la présence ou
l'absence de capsules entourant les larves dans les tissus infestés.
Ainsi, deux nouvelles sous-espèces et une nouvelle
espèce avaient alors été identifiées: T. nativa
: T2 (zone arctique), T. nelsoni : T7 (zone tropicale) et T.
pseudospiralis : T4 (non encapsulée) en 1972. Mais les faibles
différences
morphologiques et la répartition cosmopolite des
parasites rendaient les critères d'identification usuels insuffisants
(Figure n°4).
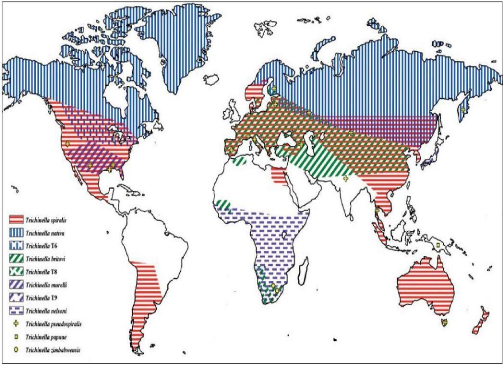
Figure n°4: Répartition
géographique des espèces du genre
Trichinella.
(De Bruyne A., 2006)
Des méthodes enzymatiques se basant sur les
activités fumarate réductase, succinate
déshydrogénase et malate déshydrogénase ont permis
de mettre en évidence les différences entre les espèces et
les sous-espèces.
Ces travaux ont conduit à une nouvelle classification
en huit génotypes distincts : les quatre espèces initiales (soit
T1, T2, T7 et T4), une nouvelle espèce : T. britovi T3, et
trois autres populations T5, T6, T8 (La Rosa G. et al., 1992 ; Pozio E.,
1992).
En 1999, les méthodes de biologie moléculaire ont
permis de caractériser une autre population parasitaire : T9
(Nagano I. et al., 1999).
Deux nouvelles espèces non encapsulées, T.
papuae : T.10 et T. zimbabwensis : T.11 ont été
décrites respectivement en 1999 et 2002 (Pozio E. et al., 2002) et T5
renommée en 2000 T. murelli (Pozio E., La Rosa G., 2000)
(Figure n°4).
En Argentine, une nouvelle population semble avoir
été découverte ; il s'agit de T12. Parmi ces
espèces, six ont été isolées chez l'homme.
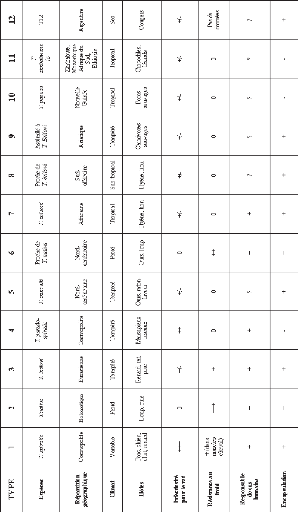
Le tableau ci-dessous (Tableau n°I)
résume l'état actuel de la classification : le genre
Trichinella est classé en huit espèces et quatre
génotypes additionnels (T6, T8, T9 et T12).
Tableau n°1: Re'partition des especes et
genotypes de Trichinella. (d'apres Ripert C., 2007)
Une nouvelle classification a vu le jour (Pozio E., Murrell D.,
2006). Celle-ci est basée sur l'aptitude de la larve à
s'encapsuler ou non, ce qui a aboutit à la dichotomie suivante : les
espèces encapsulées (uniquement chez les mammifères) et
les espèces non encapsulées (chez les mammifères, les
oiseaux et les reptiles).
Les espèces encapsulées sont décrites ainsi
: - Trichinella spiralis (Railliet, 1896) :
T1
C'est la première trichine découverte et la plus
étudiée, du faite de son importance en santé humaine et de
son utilisation comme modèle pour les enquêtes au cours des
recherches biologiques de base, ceci est en grande partie attribuable à
sa fréquence relativement élevée, à la fois, chez
les animaux domestiques et sauvages et à sa forte infectiosité
pour les animaux de laboratoire.
La diffusion du parasite et de ses hôtes a
été particulièrement facilitée par la colonisation
européenne du Nord, l'Amérique centrale et celle du Sud, la
NouvelleZélande, Hawaï, et l'Egypte à partir du 16 au 20 e
siècle. Sa faible résistance aux basses températures de
l'environnement peut avoir inhibé sa propagation parmi les animaux
vivant dans des zones glaciales.
Trichinella spiralis a été
identifiée dans des isolats provenant de porcs domestiques, de sangliers
(Boadella M., et al ; 2012), de chevaux domestiques, de rats synanthropes et
à partir d'isolats provenant de tatous synanthropes (Chaetophractus
villosus) (Pozio et Murrell, 2006), ainsi qu'à partir de chiens
(Sandoval L. O. F., et al ; 2012).
Dans de nombreuses régions du monde, cette espèce a
été transmise à certains animaux de la faune qui sont
devenus hôtes du parasite (p. ex les blaireaux [Meles meles],
les renards [Pseudolopex gracilis, Urocyon cinereoargentatus, Vulpes
vulpes], les loups [Canis lupus], les ours noirs et bruns
[Ursus americanus et Ursus arctos], les lions de montagne
[Puma concolor], le lynx roux [Lynx rufus], ainsi qu'aux
chiens raton laveur [Nyctereutes procyonoides]) du fait de
l'exposition à des dépotoirs, ou la recherche de nourriture
près des lieux de vie des hommes, à partir des restes de viande
de porc et d'abats ou provenant d'animaux abattus qui ont été
dispersés dans la nature (Pozio et Murrell, 2006).
Dans certains pays d'Amérique, d'Europe et d'Asie, T.
spiralis est aussi un parasite de la faune maintenu dans la nature par un
cycle sylvatique (Pozio et Zarlenga, 2005).
Cette espèce est l'agent étiologique de la plupart
des trichinelloses humaines et est responsable de nombreux décès
dans le monde.
- Trichinella nativa (Britov et Boev,
1972) : T2
Cette espèce est connue pour résister au gel de
l'Arctique, elle est très répandue au sein de la faune des
régions arctique et subarctique d'Amérique, d'Europe et
d'Asie.
La limite sud de sa distribution a été
identifiée entre les isothermes -5 ° C à -4 ° C en
Janvier (Pozio et Zarlenga, 2005).
Les principales caractéristiques biologiques de T.
nativa sont un indice de faible capacité reproductive chez les
rongeurs de laboratoire et chez le porc domestique et sauvage ainsi qu'une
grande résistance à la congélation dans les muscles de
carnivores (Pozio et Murrell, 2006).
Les hôtes communs sont des carnivores terrestres et marins
vivant dans les régions arctiques et subarctiques (plusieurs
espèces de mustélidés [Martes pennant, Martes
martes, Martes zibellina, Meles metes, Gulo gulo, Musteta erminea,
Mustela nivalis]; le renard arctique [Alopex lagopus]; le renard
rouge [Vulpes vulpes]; le loup [Canis lupus]; le chien
viverrin [procyonoides Nyctereutes]; les chats domestique et sylvestre
[Felis silvestris, Felis euptilura], le lynx [Lynx lynx], le
tigre de Sibérie [Panthera tigris], l'ours noir [Ursus
americanus], l'ours brun [Ursus arctos], l'ours blanc [Ursus
maritimus], les morses [Odobenus rosmarus] et plusieurs
espèces de phoques [Phoca groenlandica, Phoca fasciata, Erignathus
barbatus, Pusa hispida]).
Cette espèce a rarement été isolée
chez les porcs domestiques ou sauvages.
L'importance des carnivores sylvestres autant que
réservoirs de T. nativa dans la nature, est attestée par
le fait que ce parasite survit dans la musculature de ces hôtes pendant
au moins 20 ans.
Les populations humaines (esquimaux +++) vivant dans ces
régions glaciales s'infestent par T. nativa en consommant de la
viande crue des morses (Odobenus rosmarus), des ours et d'autres
gibiers (Pozio et Murrell, 2006).
Cette trichine a tendance à induire chez l'homme une
affection grave et chronique.
- Trichinella britovi (Pozio et Al,
1992) : T3 (Pozio E., Zarlenga D.S., 2005)
Les isolats européens et asiatiques de cette
espèce ont été précédemment nommés
T. nelsoni par les scientifiques russes: Britov et Boev, 1972;
Shaikenov et Boev, 1983.
Parmi les espèces sylvestres, T. britovi
possède la plus grande aire de répartition géographique,
se répartissant dans la faune des régions tempérées
d'Europe et d'Asie, de la péninsule ibérique à
l'Extrême-Orient et s'étendant vers le sud à l'Afrique du
nord et de l'Ouest. La limite nord de sa distribution est
déterminée par les isothermes -6 ° C à -5 ° C en
Janvier.
Cette espèce est sympatrique avec T. nativa
entre les isothermes -4 ° C et -6 ° C, et il ya plusieurs cas
rapportés, d'infections mixtes au sein d'un même hôte en
Estonie, Finlande et en Lituanie (Pozio et Murrell, 2006).
Cette espèce est répandue chez les carnivores
sylvestres tels que les mustélidés (Meles meles, Martes
foina, Martes martes, Lutra lutra), les Viverridae (Nandinia binotata,
Viverra civetta), le renard roux (Vulpes vulpes), le chacal
(Canis aureus), le loup (Canis lupus) et l'ours brun
(Ursus arctos).
En Europe, elle a été identifiée dans
des isolats provenant de renards roux (Boadella M., et al ; 2012) (Vulpes
vulpes), de sangliers (Sus scrofa) et de porcs domestiques.
L'infestation des rats (Rattus norvegicus) vivant dans des fermes ou
des dépotoirs a été signalée en Italie et en
Estonie, bien que les larves de cette espèce aient un temps de survie
très court au sein de cet hôte.
Cette espèce peut être transmise à l'homme
par la consommation de viande de sanglier (Sus scrofa), de renard roux
(Vulpes vulpes), de chacal (Canis aureus), de cheval et de
porc domestique à partir d'étendus systèmes de
pâturage ou d'alimentation avec des restes de carnivores sylvestres
(Pozio et Murrell, 2006).
Cette trichine a une faible capacité de reproduction et
de résistance à la congélation et s'avère
modérément infestante pour l'homme.
- Trichinella murelli (Pozio et La
Rosa, 2000) : T5
Cette espèce est répartie au sein des carnivores
sylvestres (par exemple le lynx roux [Lynx rufus], l'ours noir
[Ursus americanus], le coyote [Canis latrans], le raton
laveur [Procyon lotor], la martre des pins [Martes americana]
et le renard roux [Vulpes vulpes]) et des animaux domestiques (par
exemple le chien domestique, le cheval et le chat) à travers les
États-Unis d'Amérique (USA) (Californie, Connecticut,
Géorgie, Illinois, Indiana, Maryland, Nouveau-Mexique, Pennsylvanie,
Virginie, Wisconsin et au Texas) et dans la région de Vancouver au
Canada (Pozio et Murrell, 2006).
L'isotherme -6 ° C en Janvier peut être un facteur
déterminant de la limite nord de sa distribution. La limite
méridionale est inconnue en raison de l'absence de données
d'enquêtes suffisantes en provenance du Mexique et d'Amérique
centrale.
Une infestation mixte par les larves de 7'. murrelli et
7'. spiralis a été mise en évidence chez un ours
noir (Ursus americanus) en Californie.
Cette espèce n'a, à priori jamais
été isolée lors d'une infestation naturelle chez le
porc.
7'. murrelli peut être transmise à l'homme
suite à la consommation de viande d'ours noir (Ursus
americanus) et de cheval.
Une grande partie des caractéristiques cliniques sur
cette espèce a été étudiée lors d'une
épidémie en 1985 en France, suite à la consommation de
viande chevaline importée du Connecticut (Ancelle, 1998).
- Trichinella nelsoni (Britov et
Boev, 1972) : T7
Cette espèce se répartit en Afrique de l'Est, du
Kenya à l'Afrique du Sud, mais ceci est basé que sur quelques
enquêtes, de ce fait, son aire de répartition peut être
beaucoup plus large.
La gamme d'hôtes comprend la hyène rayée et
tachetée (Hyène hyène et Crocuta
crocuta), le chacal à flancs rayés (Canis adustus),
le chacal à dos noir (Canis mesomelas), la chauve-souris
à oreilles de renard (Otocyon megalotis), le chien domestique,
le lion (Panthera led), le léopard (Panthera pardus),
le guépard (Acinonyx jubatus), et le serval (Leptailurus
serval), et dans quelques rares cas les potamochères
(Potamochoerus larvatus) et les phacochères (Phacochoerus
aethiopicus), dont certains ont été la source d'infections
pour l'homme (Nelson, 1970).
Cette espèce montre une infectiosité faible pour
les rongeurs de laboratoire et les porcs (Nelson et al, 1966;. Kapel et Gamble,
2000) par rapport à T. spiralis.
T. nelsoni est plus résistante que les autres
aux fortes températures de cuisson.
Moins de 100 cas d'infection humaine ont été
documentés pour cette espèce au Kenya et en Tanzanie.
- Trichinella 6 (Pozio et al. 1992) :
T6 (La Rosa G. et al., 2003).
Ce génotype est très répandue chez les
carnivores (l'ours noir et brun [Ursus americanus et Ursus
arctos]; le loup [Canis lupus]; le renard gris [Urocyon
cinereoargenteus]; le coyote [Canis latrans]; le carcajou
[Gulo gulo]; le pêcheur [Martes pennanti]; le lion de
montagne [Puma concolor]; le lynx roux [Lynx rufus]) de
l'Arctique et des régions subarctiques du Canada et le long des
montagnes Rocheuses et les Appalaches aux Etats-Unis (Alaska, l'Idaho, Montana,
Ohio, la Pennsylvanie, du Wyoming et de l'Ontario) (Pozio et Murrell, 2006).
Ce génotype se distingue de T. nativa par des
caractères biochimiques et moléculaires différents,
malgré leur capacité à se croiser, tant au laboratoire que
dans la nature (des hybrides ont été retrouvés chez les
loups [Canis lupus] de l'Alaska, ce qui suggère une
séparation récente) (La Rosa et al. 2003).
Trichinella T6 et T. nativa sont très
similaires concernant leurs caractéristiques biologiques: la
résistance au gel élevé des larves dans les muscles de
carnivores; ainsi que l'infectiosité faible chez les souris de
laboratoire, les rats et les porcs domestiques et sauvages (Kapel et Gamble,
2000).
- Trichinella 8 (Pozio et al. 1992) :
T8
Trichinella T8 n'a été identifié
qu'à partir d'un lion (Panthera leo) du Parc national de
l'Ethosa en Namibie et d'un autre lion (Panthera leo) et d'une
hyène tachetée (Crocuta crocuta) du Parc national Kruger
de l'Afrique du Sud, où il vit en sympatrie avec T. nelsoni.
Ce génotype peut être facilement distingué
par certains caractères biochimiques et moléculaires de T.
britovi (Pozio et al. 1992).
Aucun cas humain dû à ce génotype n'a
été rapporté.
- Trichinella 9 (Nagano et al. 1999) :
T9
A l'origine identifiée comme étant T.
britovi (Pourtant l'étude génique montre une ressemblance
plus importante avec T. murrelli) de la faune japonaise (chien
viverrin [Nyctereutes procyonoides]; ours noir japonais [Ursus
thibetanus]) il a été maintenant démontré par
des méthodes moléculaires que ce génotype diffère
des souches européennes, et est désigné par
Trichinella T9.
Les larves musculaires de ce génotype ont
été également détectées chez les renards
roux (Vulpes vulpes) de lile d'Hokkaido, où ils vivent en
sympatrie avec T. nativa.
Aucun cas humain dû à ce génotype n'a
été rapporté (Pozio et Murrell, 2006).
- Trichinella 12 :
T12
Uniquement détectée chez des couguars en
Argentine.
C'est le dernier génotype identifié à ce
jour (Dupouy-Camet J. et al., 2010).
Les différentes espèces non encapsulées
sont décrites ainsi :
- Trichinella pseudospiralis (Garkavi,
1972) : T4
T. pseudospiralis est une espèce cosmopolite
infestant les mammifères et les oiseaux. Trois populations, qui peuvent
être distinguées sur une base moléculaire, ont
été isolées en Paléarctique, Néarctiques et
en Australie (Tasmanie) (La Rosa et al, 2001).
Cette espèce est caractérisée par l'absence
de capsule dans les kystes intramusculaires. De plus les larves sont plus
petites que celles de T. spiralis. Elle est aussi pathogène
pour l'homme mais son pouvoir pathogène est nettement moins
marqué que celui de T. spiralis ; la réaction
inflammatoire étant beaucoup moins sévère.
Chez la souris il faut au minimum 20 000 larves pour atteindre
la dose létale, tandis que le même effet est obtenu par une
infestation avec 4 500 larves de T. spiralis.
Ce parasite a été isolé chez 14
espèces de mammifères et 13 espèces aviaires (Pozio,
2005), où le nombre de cas rapportés chez les mammifères
est beaucoup plus élevé que ceux chez les oiseaux.
C'est probablement le résultat d'un biais en faveur de
l'examen de mammifères à la recherche de ce parasite par rapport
au nombre de volailles examinées.
Un seul cas humain, sans doute contracté en Tasmanie,
et trois foyers impliquant 92 personnes, dans le Kamchatka, la Thaïlande
et la France ont été documentées (Pozio et Murrell,
2006).
- Trichinella papuae (Pozio et al,
1999) : T10
Cette espèce a été isolée chez les
truies domestiques, les cochons sauvages (Sus scrotum) et les
crocodiles d'élevage d'eau salée (Crocodylus porosus) de
PapouasieNouvelle-Guinée nourris avec de la chair des porcs sauvages
(Sus scrotum) (Pozio et Murrell, 2006).
Au cours d'infestations expérimentales, cette
espèce montre une grande capacité de reproduction (RC) chez les
crocodiles et les varans (Varanus exanthematicus, Caiman crocodylus),
mais une RC très faible chez les tortues et les pythons (Python
molurus, Pelomedusa subrufa).
La découverte d'espèces de Trichinella
infestant aussi bien les mammifères que les reptiles peut fournir une
explication de cas humains rapportés, en relation avec la consommation
de viande de tortue et de lézard brun (Varanus nebulosus) en
Thaïlande (Khamboonruang, 1991).
- Trichinella zimbabwensis (Pozio et
al. 2002) : T11 (Pozio et al., 2002) Cette espèce est très
similaire à T. papuae, en effet, elle partage avec elle
d'importantes caractéristiques biologiques telles que
l'infectiosité pour les mammifères et les reptiles (Python
molurus, Pelomedusa subrufa, Varanus exanthematicus, Caiman
crocodylus).
Elle a été isolée seulement chez les
reptiles sauvages et d'élevage (Crocodylus niloticus et
Varanus niloticus) d'Afrique (Zimbabwe, Mozambique et Ethiopie) bien
qu'expérimentalement, elle est capable d'infecter des souris, rats,
hamsters, renards (Vulpes vulpes), les porcs et singes (Papio spp,
Cercopithecus aethopis.) (Pozio et Murrell, 2006; Pozio et al, 2007.).
Lors de la première découverte en 1995, les
larves de T. zimbabwensis ont été isolées
à partir de 256 élevages de crocodiles du Nil (Crocodylus
niloticus), et à partir de 18 fermes de crocodiles du Zimbabwe.
Des cas humains n'ont pas encore été
signalés.



