II -1-3) Sources des sulfates :
On distingue deux types
d'attaques : les attaques par les sulfates externes
présents dans l'environnement du béton et les attaques
sulfatiques internes pour lesquelles les sulfates proviennent des composants du
béton lui-même. [1]
-Lorsqu'il s'agit d'une attaque
par les sulfates provenant de l'extérieur, il y a formation de couches
de gypse et d'ettringite secondaire ainsi que la thaumasite à partir de
la surface exposée aux sulfates. L'attaque par les sulfates externes est
souvent combinée avec l'attaque par le cation correspondant, selon la
provenance des sulfates, qui peuvent réagir avec certains granulats ou
fillers, ou avec les C-S-H ou la portlandite, et contribuer davantage à
la dégradation du béton. De plus, l'attaque par les sulfates
externes peut être combinée à une attaque par l'acide ce
qui accélère également la destruction de la pâte
hydratée.
-Lorsqu'il s'agit d'une attaque
interne par les sulfates, ces derniers proviennent presque uniquement des
sulfates de calcium qui se trouvent dans le béton dés sa
confection. Par conséquent, ces sulfates sont uniformément
répartis dans la pâte hydratée et le seul produit expansif
de la réaction est l'ettringite. L'ettringite secondaire qui est le
résultat d'une attaque par les sulfates externes, n'est pas seule
à endommager le béton, c'est plutôt la formation du gypse
qui contribue à la fissuration, la lixiviation et le délaminage
des couches superficielles.[3]
Comme le montre La figure II -3, l'origine des
sulfates peut être : externe (environnement) ou interne (composants
du béton).
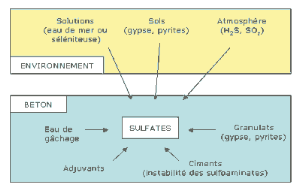
Figure II -3 :
L'origine des sulfates (interne ou externe).
[25]
Les sulfates peuvent avoir différentes
origines:
· Ils peuvent d'abord provenir du régulateur
de prise ajouté au ciment (gypse, hémi-hydrate, anhydrite) auquel
s'ajoutent, en proportions variables, les sulfates contenus dans le clinker
lui-même : sulfates alcalins (arcanite K2SO4,
aphtitalite K3Na(SO4)2, langbeinite
Ca2K2(SO4)3) et solutions solides
dans les silicates de calcium.
· Ils peuvent également provenir de
l'utilisation de granulats pollués par des sulfates d'origine naturelle
ou artificielle (gypse, plâtre, anhydrite ou encore pyrites).
· Ils peuvent venir du milieu extérieur
où ils se trouvent sous forme solide (sols gypseux), liquide (eaux
naturelles percolant à travers les sols et solutions plus ou moins
concentrées d'origine diverses), ou gazeuse (pollution
atmosphérique par le SO2):
- Dans les sols où ils constituent un
élément nutritif des plantes, leur concentration moyenne est
comprise entre 0,01 % et 0,05 % en masse de sol sec.
Des concentrations beaucoup plus importantes (>
5 %) peuvent se rencontrer dans les sols contenant du gypse
CaSO4.2H2O ou de l'anhydrite CaSO4. La
décomposition biologique aérobie des matières organiques
et l'utilisation d'engrais sont également une source possible de
sulfates. Le sulfate d'ammonium SO4(NH4)2, provenant des engrais, est
particulièrement agressif. Les sols peuvent parfois contenir des
sulfures de fer (pyrites) qui, par oxydation, peuvent donner naissance à
l'acide sulfurique H2SO4, puis au gypse s'ils sont en
contact de carbonate de calcium ou de chaux.
- Les eaux d'infiltration
peuvent se charger en ions SO4 2- au contact des sols ou
des remblais contenant des sulfates.
- Dans les environnements
industriels et urbains, l'atmosphère peut contenir de l'anhydride
sulfureux SO2 provenant des gaz de combustion (charbon, carburants
divers). En présence d'humidité ces gaz sont susceptibles de
s'oxyder pour donner de l'acide sulfurique très agressif.
- Les fermentations
anaérobies qui se produisent dans les ouvrages d'assainissement
conduisent également à la formation d'acide sulfurique à
partir de l'hydrogène sulfuré dégagé. [10]
- L'eau de mer contient des
sulfates en solution.
| 


