II -2-4) Mécanisme d'attaque des acides :
Le béton est très alcalin en nature, il est
extrêmement susceptible à l'attaque de l'acide. Le
mécanisme pour ce processus est très simple. De façon
générale, les réactions chimiques et/ou
l'élimination physique n'endommage qu'un ou deux composants de la
pâte de ciment. Le tableau I.1 mentionne les composants du béton
menacés par la corrosion.
|
Composants du béton
|
Désignation
|
Formule chimique
|
|
Pâte de ciment
|
Hydroxyde de calcium (CH)
|
Ca(OH)2
|
|
Silicate de calcium hydraté (CSH)
|
3CaO·2SiO2·3H2O
|
|
Aluminate de calcium hydraté
|
3CaO·Al2O3·6H2O
|
|
Aluminate de calcium ferrique hydraté
|
6CaO·Al2O3·Fe2O3·12H2O
|
|
Granulats
|
Calcaire (Carbonate de calcium)
|
CaCO3
|
|
Dolomite
|
CaMg(CO3)2
|
|
Grès amorphe
|
SiO2·xH2O
|
Tableau I.1 : Composants du
béton menacés par la corrosion.
On distingue deux types de
détérioration:
i- L'agression résolvante ;
ii- Le gonflement.
i- Agression
résolvante :
Lorsqu'il y a suffisamment d'eau en qualité de
fluide de transport, les composants de la pâte de ciment sont
détachés de la surface par l'eau douce ou les substances
chimiques nuisibles qu'elle contient. Les granulats non-solubles et des parties
de la pâte de ciment durcie sont alors mis à nu, ils se forment
une surface en forme de "béton lavé" et la porosité
augmente.
L'attaque par l'acide est provoquée par la
réaction d'un acide et la partie d'hydroxyde de calcium (Ca (OH)
2) de la pâte de ciment qui produite un sous-produit de sel de
calcium fortement soluble. Ces sels de calcium solubles sont facilement
enlevés de la pâte de ciment affaiblissant de ce fait la structure
de la pâte dans l'ensemble. Cette réaction de base est
montrée ci-dessous :
Acide X + CH CX
+ H
acide hydroxyde de calcium sel
de calcium eau
Par exemple :
Ca(OH) 2 + 2HCl ?
CaCl2 + 2H2O
Hydroxyde de calcium + acide chlorhydrique
? chlorure de calcium + eau
Ca(OH) 2 + 2HNO3
? Ca(NO3) 2 +
2H2O
Hydroxyde de calcium + acide nitrique ?
nitrate de calcium + eau
Ca (OH)2 + 2 H3PO4
? Ca (H2PO4)2
+ 2H2O
Hydroxyde de calcium + acide orthophosphorique
? hydrogéno phosphate de calcium
Des acides plus agressifs tels que les acides
chlorhydriques, acétiques, nitriques, et sulfuriques produisent les sels
de calcium qui sont très solubles. Les acides moins agressifs tels que
les acides phosphoriques et humiques produisent des sels de calcium avec une
faible solubilité. Ces sels de basse solubilité peuvent agir en
tant qu'inhibiteur partiel au processus global en bloquant les pores dans la
pâte de ciment par lesquels l'eau passe. Ceci réduit la
quantité de sels de calcium qui entrent dans la solution et retardent le
processus global.
Un cas plus agressif et plus destructif d'attaque par
l'acide se produit lorsque le béton est exposé à l'acide
sulfurique. Le sel de calcium produit par la réaction de l'acide
sulfurique et de l'hydroxyde de calcium est un sulfate de calcium qui cause
alternativement une dégradation accrue due à l'attaque de
sulfate. Ce processus est illustré ci-dessous :
H2SO4 + Ca (OH) 2
Ca (SO4) + 2H2O
Acide sulfurique + hydroxyde de calcium sulfate de calcium
+ eau.
(Le produit de sulfate de calcium contribue à
l'attaque de sulfate).
La dissolution de l'hydroxyde de calcium provoquée
par l'attaque acide procède en deux phases. La première phase
étant la réaction acide-hydroxyde de calcium dans la pâte
de ciment. La deuxième phase étant la réaction
acide-silicate de calcium hydraté, cette phase ne commencera pas
jusqu'à ce que tout l'hydroxyde de calcium soit consommé. La
dissolution de silicate de calcium hydraté, dans les cas les plus
avancés de l'attaque par l'acide, peut endommager
considérablement le béton.
Les attaques acides sont, dans leur principe, similaires
au phénomène de lixiviation. En effet, l'acide réagit avec
la portlandite qui est dissoute, puis avec les autres hydrates qui sont
décalcifiés. On mettra de côté ici l'action des
acides forts comme l'acide chlorhydrique ou l'acide nitrique, qui dissolvent
entièrement le béton, conduisent à un recul de l'interface
matériau-acide, et pour lesquels une protection de surface du
béton est absolument nécessaire.
La nocivité de l'attaque acide dépend
essentiellement de la solubilité du sel formé par réaction
avec la portlandite. Par exemple, pour l'acide oxalique on a:
(COOH) 2 + Ca (OH) 2
Ca (COO) 2 + 2H2O
Le sel formé (oxalate de calcium) est insoluble
dans l'eau et donc le béton n'est pas endommagé. C'est aussi le
cas avec les acides phosphorique et tartrique.
Le cas de l'acide carbonique (solution aqueuse de
CO2) est un peu particulier. En effet, comme dans le cas du
CO2 sous forme gazeuse, l'acide carbonique réagit avec la
portlandite pour former de la calcite. Mais, s'il y a du CO2 en
excès et si l'eau est douce, la calcite va réagir avec l'acide
carbonique pour donner du bicarbonate de calcium très soluble dans l'eau
(165g/l). Il y a alors lixiviation. L'agressivité d'une eau contenant du
gaz carbonique dépend donc de la quantité de gaz dissous et de la
dureté de l'eau. [3]
H2CO3 + Ca(OH)2
CaCO3 + 2H2O
Dioxide de carbon
Calcite
H2CO3 + CaCO3
CaH2 (CO3)2
Bicarbonate de calcium
Le tableau I.2 résume quelques solubilités
des sels de calcium formés à partir différentes attaques
acides :
|
Composés
|
Solubilité en g/100ml H2O
|
|
à basse température
|
à haute température
|
|
Oxalate de calcium (sel cacique)
|
0.00067
|
13 °C
|
0.0014
|
95 °C
|
|
Carbonate de calcium (calcite)
|
0.0014
|
25 °C
|
0.0018
|
75 °C
|
|
Carbonate de calcium (aragonite)
|
0.00153
|
25 °C
|
0.0019
|
75 °C
|
|
Fluorure de calcium
|
0.0016
|
18 °C
|
0.0017
|
26 °C
|
|
Sulfite de calcium
|
0.0043
|
18°C
|
0.0011
|
100 °C
|
|
Sulfure de calcium
|
0.021
|
15 °C
|
0.048
|
60 °C
|
|
Tartrate de calcium (de l'acide tartrique)
|
0.0266
|
0 °C
|
0.0689
|
37 °C
|
|
Phosphate de calcium
|
= 0.03
|
38°C
|
= 0.08
|
100 °C
|
|
Oléate de calcium (de l'acide oléique)
|
0.04
|
25 °C
|
0.03
|
50 °C
|
|
Hydroxyde de calcium
|
0.185
|
0 °C
|
0.077
|
100 °C
|
|
Sulfate de calcium hymihydraté (gypse)
|
0.241
|
20 °C
|
0.22
|
100 °C
|
|
Citrate de calcium (de l'acide citrique)
|
0.85
|
18 °C
|
0.96
|
23 °C
|
|
Lactate de calcium (de l'acide lactique)
|
3.1
|
0 °C
|
7.9
|
30 °C
|
|
Formate de calcium (de l'acide ormique)
|
16.2
|
0 °C
|
18.4
|
100 °C
|
|
Chromate de calcium
|
16.3
|
20 °C
|
18.2
|
45 °C
|
|
Acétate de calcium (de l'acide acétique)
|
37.4
|
0 °C
|
29.7
|
100 °C
|
|
Chlorure de calcium dihydrate
|
74.5
|
20 °C
|
159
|
100 °C
|
|
Thiosulfate de calcium
|
100
|
3 °C
|
---
|
---
|
|
Nitrate de calcium
|
121.2
|
18 °C
|
376
|
100 °C
|
|
Bromure de calcium
|
142
|
20 °C
|
312
|
106 °C
|
|
Chlorure de calcium
|
177.7
177.7
|
8 °C
|
Très sohuble
rès soluble
|
--
---
|
|
Perchlorate de calcium
|
188.6
|
25 °C
|
Très soluble
|
--
|
Tableau I.2 :
Solubilité dans l'eau des sels calciques
sélectionnés. [3]
Les graisses et huiles d'origine végétale et
animale réagissent avec l'hydroxyde de calcium pour former des sels
d'acides gras. L'effet de dégradation sur le béton dépend
principalement de la solubilité dans l'eau des produits de
réaction formés.
La pâte de ciment fortement alcaline (valeur pH env.
12.5) offre une excellente résistance aux bases. Seules des bases
très fortes (hydroxyde de sodium ou potasse caustique, > 20 %)
attaquent l'alumine de la pâte de ciment et les granulats
amorphes.
ii- Effet d'éclatement lié au
gonflement :
Les attaques sous la forme de gonflement sont
provoquées par les réactions des matières
transportées dans la structure susceptibles de donner naissance à
des formations nouvelles très volumineuses. A l'état plastique,
les pressions de cristallisation et d'hydratation sont neutres étant
donné qu'il y a des possibilités de déformation. Ce n'est
qu'après un état de durcissement minimal que les réactions
de gonflement peuvent causer des dommages. (C'est pourquoi une eau contenant
des sulfates peut tout à fait être appropriée en
qualité d'eau de gâchage, bien qu'elle causerait des dommages
ultérieurement au béton durci.)
La figure II -11 peut
résumer l'attaque par les acides.
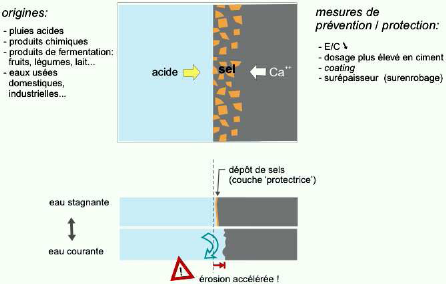
Figure II -11: L'attaque
par les acides. [29]
| 


